Цель урока — дать знания о строении электронной оболочки атомов. | Цель урока — дать знания о строении электронной оболочки атомов. | Цель урока — дать знания о строении электронной оболочки атомов. | Образовательные задачи урока | Образовательные задачи урока | Образовательные задачи урока | 1. Углубить знания о взаимосвязи строения атома и структурой ПСХЭ; 3. Вызвать познавательный интерес к данной теме; развить интеллектуальные и творческие способности учащихся, диалектическое мышление; 4. Развивать умения работать с различными информационными источниками. | 1. Сформировать представления о состоянии электрона в атоме — электронной плотности, энергетическом уровне, подуровне, атомной орбитали. 2. Выработать умения составлять схемы строения атомов, составлять электронные формулы атомов. 3. Сформировать умение работать с периодической системой, логически мыслить и оформлять результаты логических операций в тетради 4. Продолжить выработку у обучающихся рационального общего и индивидуализированного стиля учебного труда. | 1.Познакомить с понятиями «энергетический уровень». Раскрыть особенности строения электронных оболочек на примере атомов элементов 1-3 периода. 2. Дать представление о составлении схемы строения атома. 3. Продолжить формирование умения сравнивать, делать выводы. 4.Развивать умения работать с учебником, работать по алгоритму. | Развивающие задачи урока | Развивающие задачи урока | Развивающие задачи урока | 1. | 1. Развитие коммуникативных навыков через групповую работу. | 1. Развитие памяти через запоминание и многократное воспроизведение материала. | Воспитательные задачи урока | Воспитательные задачи урока | Воспитательные задачи урока | 1.Продолжить формирование у обучающихся научного мировоззрения. | 1. Развить познавательный интерес к устройству окружающего мира. | 1.Воспитание умения работать в коллективе. 2. Используя игровые моменты, развивать интерес учащихся к изучению предмета | Актуализация ЗУН или опрос | Актуализация ЗУН или опрос | Актуализация ЗУН или опрос | 1.Вступительное слово учителя: «На предыдущих уроках мы познакомились со строением атома, доказали наличие элементарных частиц в атоме элемента. Что же мы знаем об атоме? Какие модели строения атомов вам известны?» Планетарная модель строения атома предполагает наличие одного электрона на одной орбитали. Как располагаются электроны атома на орбиталях? Почему, согласно уравнениям квантовой физики, вероятность столкновения электронов в пространстве стремится к нулю? Прежде чем ответить на этот вопрос давайте вспомним главное действующее лицо электронной оболочки – электроном | 1. Фронтальный беседа по вопросам 1. Из каких элементарных частиц состоит атом? 2. Какие элементарные частицы называют протонами? 3. Какие элементарные частицы называют нейтронами? 4. Что такое массовое число? 5. Что такое изотопы? 6. Какие элементарные частицы называют электронами? 7. Почему модель строения атома называют планетарной? 2. Индивидуальная работа у доски. Заполнение таблицы (один учащийся заполняет одну колонку)
| 1. 2. Дайте ответы на вопросы (работа в парах- обсуждение вопросов, индивидуальный опрос) 1. Из каких элементарных частиц состоит атом? 2. Какие элементарные частицы называют протонами? 3. Какие элементарные частицы называют нейтронами? 4.Какие элементарные частицы называют электронами? 5.Отгадайте, о какой элементарной частице идет речь? а) Очень положительный б) Зарядом я похвастать не могу, в) Он бежит по проводам, 6. Почему модель строения атома называют планетарной? | Изучение нового материала | Изучение нового материала | Изучение нового материала | В форме презентации (прием погружения в тему)
По ходу объяснения нового материала учащиеся делают записи в опорном конспекте О П О Р Н Ы Й К О Н С П Е К Т по теме: «Строение электронной оболочки атома». Что мы знаем про атом? Что можно рассказать про атом хлора по его положению в ПСХЭ? Что такое электрон? Электрон – это… Электрон – это… Электронная оболочка – это… Электронное облако – это… Виды электронных облаков: ЭНЕРГЕТИЧЕСКИЙ УРОВЕНЬ ЭНЕРГЕТИЧЕСКИЙ ПОДУРОВЕНЬ
АТОМНАЯ ОРБИТАЛЬ КАК МОЖНО БЫСТРО ОПРЕДЕЛИТЬ ЧИСЛО ПОДУРОВНЕЙ НА УРОВНЕ? 1s2s2p3s3p3d4s4p4d4f5s5p5d5f…6s6p6d6f…7s7p7d7f… ПРАВИЛА ЗАПОЛНЕНИЯ ЭЛЕКТРОНАМИ АО, ПОДУРОВНЕЙ, УРОВНЕЙ 1) На одной АО могут находиться только ДВА электрона, которые вращаются вокруг своей оси в противоположных направлениях (по часовой стрелке и против часовой стрелке) – электроны с противоположными спинами: ↑↓
2) В пределах подуровня атомные орбитали заполняются одиночными электронами с параллельными спинами, и когда все орбитали данного подуровня будут заняты, происходит спаривание последних. 3) Электроны стремятся занять энергетически выгодное положение в электронной оболочке, руководствуясь правилом наименьшей энергии расположим АО в порядке возрастания значений их энергии, которая определяется суммой: ( № УРОВНЯ + число, которое соответствует подуровню) s (0), p (1), d (2), f (3) РЯД НАИМЕНЬШЕЙ ЭНЕРГИИ 1s 2s2p 3s3p 4s3d4p 5s4d5p 6s4f5d6p 7s5f6d7p… СХЕМА СТРОЕНИЯ АТОМА (показывает распределение электронов по энергетическим уровням): ЭЛЕКТРОННАЯ ФОРМУЛА АТОМА (показывает распределение электронов по подуровням): ЭЛЕКТРОННО-ГРАФИЧЕСКАЯ ФОРМУЛА АТОМА (показывает распределение электронов по АО): Выводы:
| 1) Совокупность всех электронов, окружающих ядро, называется электронной оболочкой. Электроны расположены вокруг ядра на различном расстоянии. Каждый электрон характеризуется своей энергией. Электроны располагаются вокруг ядра согласно увеличению их энергии. Чем меньше энергия электрона, чем ближе он расположен к ядру и тем прочнее с ним связан. Чем больше его энергия, тем дальше он располагается от ядра и тем легче его оторвать. Таким образом, каждый электрон в зависимости от своей энергии будет находиться на определенном расстоянии от ядра. Легко представить слои, на которых располагаются электроны с различным запасом энергии. Такие слои называются энергетическими уровнями. Записываем определение. — Как же определить, сколько слоев (энергетических уровней) в атоме того или иного элемента? Число уровней определяется номером периода, в котором располагается элемент. У натрия 2 энергетических уровня, он находится во втором периоде. У азота 3 энергетических уровня, — третий период. У железа 4 энергетических уровня, — четвертый период. — А сколько электронов может находится на каждом энергетическом уровне? Это можно определить при помощи формулы: Вместе рассчитываем максимальное число электронов для каждого уровня. Анализируем схему рис.8 стр 29 Делаем записи в тетрадях. 1 уровень – не более 2 электронов 2 уровень – не более 8 электронов 3 уровень – не более 18 электронов (у элементов 3 периода заполняется до 8 электронов) Каждый уровень вмещает не больше рассчитанного количества электронов. Распределение электронов по энергетическим уровням отражается в схеме строения атома. Задание 1 запишите схему строения атомов натрия, азота, бора, серы, кремния, алюминия, неона. Электроны, находящиеся на одном энергетическом уровне тоже отличаются друг от друга. Каждый электрон движется вокруг ядра по определенной траектории с огромной скорость. И если представить на схеме точками месторасположение электрона в различные моменты времени, получим картину так называемого электронного облака, или орбитали. Электронная формула или электронная конфигурация атома показывает распределение электронов по подуровням Задание 2 Запишите электронную формулу атомов натрия, азота, бора, серы, кремния, алюминия, неона. Существуют завершенные (содержащие максимальное число электронов) и незавершенные (содержащие меньшее число электронов) энергетические уровни. Добавляю, что каждая система стремится к красоте, повышенной устойчивости и стабильности. Задание 3 В задании 1 подчерните элементы, атомы которых имеют завершенный внешний энергетический уровень. (при выполнении заданий 1, 2,3 у доски работают «сильные» обучающиеся, остальные выполняют задания в тетрадях) В ходе объяснений учителя дети конспектируют материал. Учитель демонстрирует таблицы “Форма электронных облаков и последовательность заполнения подуровней электронами”, “Расположение электронов по орбиталям в атомах”. | 1)Планетарная модель строения атома является приблизительной и неточной. На самом деле атом устроен более сложно, но об этом вы узнаете в старших классах. Пока вам нужно знать, что совокупность всех электронов, окружающих ядро, называется электронной оболочкой по аналогии с воздушной оболочкой Земли (записываем определение). И подобно атмосфере, где различают различные слои, в электронной оболочке различают слои, на которых будут располагаться электроны с различным запасом энергии. Каждый электрон характеризуется своей энергией. Электроны располагаются вокруг ядра согласно увеличению их энергии. Чем меньше энергия электрона, чем ближе он расположен к ядру и тем прочнее с ним связан. Чем больше его энергия, тем дальше он располагается от ядра и тем легче его оторвать. Таким образом, каждый электрон в зависимости от своей энергии будет находиться на определенном расстоянии от ядра. Легко представить слои, на которых располагаются электроны с различным запасом энергии. Такие слои называются энергетическими уровнями. Записываем определение. — Как же определить, сколько слоев (энергетических уровней) в атоме того или иного элемента? Число уровней определяется номером периода, в котором располагается элемент. У натрия 2 энергетических уровня, он находится во втором периоде. У азота 3 энергетических уровня, — третий период. У железа 4 энергетических уровня, — четвертый период. — А сколько электронов может находится на каждом энергетическом уровне? 1 уровень – не более 2 электронов 2 уровень – не более 8 электронов 3 уровень – не более 18 электронов (у элементов 3 периода заполняется до 8 электронов) (записать в тетрадь) Распределение электронов по энергетическим уровням отражается в схеме строения атома. Воспользуемся алгоритмом. Что такое алгоритм? Это пошаговая инструкция или план выполнения задания. Прочитайте план в учебнике на странице 30. Перепишите план в тетрадь. По плану составить схемы строения атомов натрия, азота и неон (индивидуальная работа у доски). Найдите в учебнике на странице 31 схемы строения атомов натрия, азота и неона и проверьте правильность выполнения задания. Обращаем внимание ребят, что внешние уровни не всегда бывают полностью завершенными. Существуют завершенные (содержащие максимальное число электронов) и незавершенные (содержащие меньшее число электронов) энергетические уровни. Добавляю, что каждая система стремится к красоте, повышенной устойчивости и стабильности. Для энергетических уровней это состояние полной завершенности. Поэтому атомы стремятся полностью заполнить внешний энергетический слой. По мере объяснения записывается в тетради схема Атом Электронная оболочка Энергетические уровни Ядро 1) протоны 2) нейтроны завершенные незавершенные | Закрепление ЗУН | Закрепление ЗУН | Закрепление ЗУН | 1. 2.Индивидуальные задания по сборнику «Контрольные и проверочные работы» к учебнику О.С.Габриеляна стр 96-103 (задания разноуровневые) 3.Тестовая работа (фронтальная) Вариант-1 1. Наиболее ярко выражены металлические свойства у простого вещества, образованного атомами, которые имеют строение электронной оболочки
6. Назовите химические элементы, имеющие сходные свойства, на основании приведенных ниже схем распределения электронов по энергетическим уровням в атомах этих элементов. 8. Запишите электронно- графическую формулу атома фосфора 9. Правильно составлена электронная формула А) 1s22s23s22p63p5 Б)1s22s22p63s23p5 Вариант-2 1.
6. Назовите химические элементы, имеющие сходные свойства, на основании приведенных ниже схем распределения электронов по энергетическим уровням в атомах этих элементов. 8. Запишите электронно- графическую формулу атома фосфора 9. Правильно составлена электронная формула А) 1s22s23s22p63p5 Б)1s22s22p63s23p5 | 1. Групповая работа (тип «вертушка», в группе 5 человек и 1 консультант) Задания для группы 1. Найдите соответствие Название элемента Состав атома 1) кальций а. 2) бром б. 19р20п 19е 3) калий в. 33р 42п 33е 4) мышьяк г. 20р 20п 20е 2. Найдите соответствие Вид электрона 1) 1s 2) 1 p Форма облака а. б. в. г. 3. Запишите схему строения атома фосфора 4. Запишите электронную формулу атома магния. 5. Определите химический элемент, число протонов и нейтронов в ядре его атома +13 ) ) ) ? ? 3е 2.Индивидуальные задания по сборнику «Контрольные и проверочные работы» к учебнику О.С.Габриеляна стр 96-103 (задания разноуровневые) | 1 Задания для фронтальной работы 1.Составьте схему строения атомов азота, фосфора. 2.Заполните таблицу
2. 1. Найдите соответствие Название элемента Состав атома 1) кальций а. 35р 45п 35е 2) бром б. 19р20п 19е 3) калий в. 33р 42п 33е 4) мышьяк г. 20р 20п 20е 2. Найдите соответствие Вид электрона 1) 1s 2) 1 p Форма облака а. б. в. г. 3. Запишите схему строения атома фосфора 4. Запишите электронную формулу атома магния. 5. Определите химический элемент, число протонов и нейтронов в ядре его атома +13 ) ) ) ? ? 3е | Домашнее задание | Домашнее задание | Домашнее задание | Изучить §8, выполнить упражнения 4-7 к §8 | Изучить §8, изобразить схему строения атома, электронную формулу и электронно- графическую формулу для атома алюминия и атома кислорода. | Изучить §8 до стр. 31, выполнить упражнение 1, 2б |
Строение атома водорода (H), схема и примеры
Общие сведения о строении атома водорода
Относится к неметаллам. Заряд ядра равен 1. Атомный вес может варьироваться: 1, 2, 3, что связано с наличием изотопов дейтерия и трития.
Электронное строение атома водорода
В атоме водорода имеется положительно заряженное ядро (+1), 1 протон и один электрон. Поскольку водород имеет самое простейшее строение атома из всех элементов Периодической системы, он хорошо изучен. В 1913 году Нильс Бор предложил схему строения атома водорода, согласно которой положительно заряженное ядро находится в центре, а вокруг него по единственной орбитали движется электрон (рис. 1). В соответствии с этой схемой он вывел спектр излучения этого химического элемента. Который был позже доказан с помощью квантово-механических расчетов уравнения Шредингера (1925-1930 годы).
Рис. 1. Схема строения атома водорода.
1. Схема строения атома водорода.
Электронная конфигурация атома водорода будет выглядеть следующим образом:
1s1.
Водород относится к семейству s-элементов. Энергетическая диаграмма атома водорода имеет вид:
Единственный электрон, который имеется у водорода является валентным, т.к. участвует в образовании химических связей. В результате взаимодействия водород может как терять электрон, т.е. являться его донором, так и принимать, т.е. быть акцептором. В этих случаях атом превращается либо в положительно, либо отрицательно заряженный ион (H+/Н—):
H0 –e →H+;
H0 +e →H—.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
Урок 7.
 Строение электронных оболочек атомов. | Поурочные планы по химии 8 класс Урок 7. Строение электронных оболочек атомов. 15.06.2013 11344 0
Строение электронных оболочек атомов. | Поурочные планы по химии 8 класс Урок 7. Строение электронных оболочек атомов. 15.06.2013 11344 0 Цель: сформировать у учащихся представление о строении электронных оболочек
атомов; научить составлять схему строения электронных оболочек.
Ход урока
I. Проверка домашнего задания.
а) Химическая разминка.
б) Опрос по упр.1 — 6, стр.27.
II. Изучение нового материала.
а) Вступительное слово учителя.
Быть может, эти электроны —
Миры, где пять материков,
Искусства, званья, войны, троны
И
память сорока веков.
Еще, быть может, каждый атом —
Вселенная, где сто планет;
Там все, что здесь, в объеме сжатом,
Но также то, чего здесь нет.
(В. Брюсов «Мир электрона».)
— Как вы понимаете эти строки?
— Все ли мы с вами знаем о строении атома?
— Что вы можете сказать о строении атома водорода?
— А о строении атома франция или резерфордия?
— Итак, тема урока: «Строение электронных оболочек атома».
б) Лекция.
План лекции:
1. Планетарная модель строения атома.
2.
Электронная оболочка и энергетические уровни.
3. Алгоритм составления схемы строения электронных оболочек атомов.
4. Орбиталь — электронное облако.
Выводы в тетрадях учащихся:
Электроны в атомах химических элементов располагаются на энергетических уровнях. На первом энергетическом уровне могут находится только два электрона, на втором — восемь. Такие уровни называются завершёнными. Число электронов на внешнем уровне атома химического элемента равно номеру его группы (для элементов главных подгрупп). Свойства химических элементов периодически повторяются, так как периодически повторяется строение внешних энергетических уровней у их атомов.
III. Закрепление.
Самостоятельная (групповая) работа.
Цель: закрепить умение изображать схемы строения атомов химических элементов
и определять положение элементов в
периодической системе.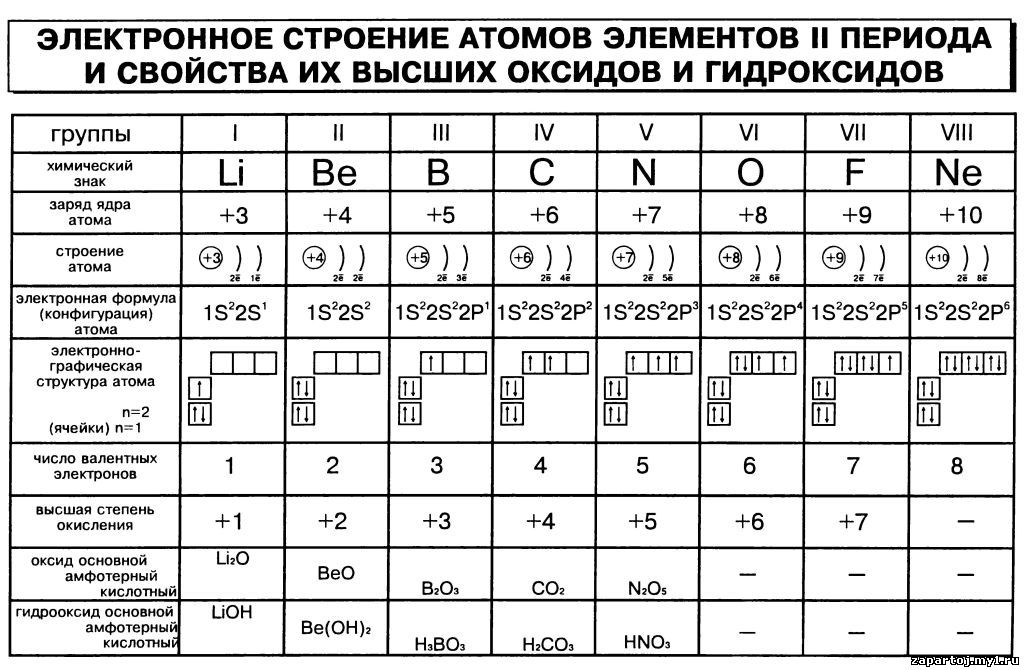
1. Изобразить символ элемента и, указав заряд его атома, составить схемы
расположения электронов по энергетическим уровням в атомах следующих
элементов:
Задание для 1-й группы: химические элементы № 12, 13, 15, 18.
Задание для 2-й группы: химические элементы № 7, 8, 15, 16.
Задание для 3-й группы: химические элементы № 3, 4, 11, 12.
Задание для 4-й группы: химические элементы № 3, 6, 9, 10.
2. По составленным схемам определите положение каждого элемента в
периодической системе (период, группа), характер его свойств.
3. Сделайте вывод: как по схеме расположения электронов на энергетических
уровнях можно определить характер элемента, его положение в
периодической таблице?
IV. Домашнее задание: §8, стр.34, упр.1 — 5.
Строение электронных оболочек атома
Цель урока: Сформировать представления учащихся о строении электронной
оболочки атома на примере химических элементов 1–3
периодов периодической системы. Закрепить понятия “периодический закон” и
“периодическая система”.
Закрепить понятия “периодический закон” и
“периодическая система”.
Задачи урока: Научиться составлять электронные формулы атомов, определять элементы по их электронным формулам, определять состав атома.
Оборудование: Периодическая система химических элементов Д.И. Менделеева, классная доска, мультимедиа-проектор, персональный компьютер, макет и презентация “Составление электронных формул строения атомов”.
Тип урока: комбинированный
Методы: словесный, наглядный.
Ход урока
I. Организационный момент.
Приветствие. Отметка отсутствующих. Активизация класса на усвоение новой темы.
Учитель проговаривает и записывает тему урока на доске “Строение электронных оболочек атома”.
II. Объяснение нового материала
Учитель: В начале XX века была принята планетарная модель строения
атома, предложенная Резерфордом, согласно которой вокруг очень малого по
размерам положительно заряженного ядра движутся электроны, как планеты вокруг
Солнца.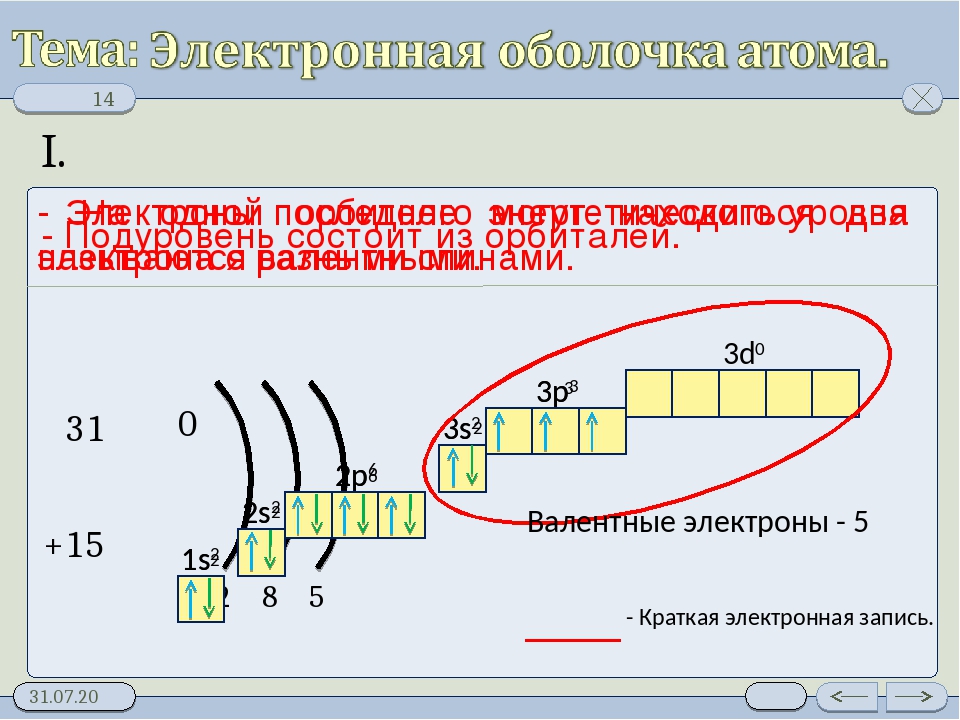 ( Презентация.
Слайд 1. Модель Резерфорда).
( Презентация.
Слайд 1. Модель Резерфорда).
Следовательно, в атоме есть траектории, по которым движется электрон. Однако дальнейшие исследования показали, что в атоме не существует траекторий движения электронов. Движение без траектории означает, что мы не знаем, как электрон движется в атоме, но можем установить область, где чаще всего встречается электрон. Это уже не орбита, а орбиталь. Двигаясь вокруг атома, электроны образуют в совокупности его электронную оболочку.
Давайте выясним, как движутся электроны вокруг ядра? Беспорядочно или в определенном порядке? Исследования Нильса Бора – основоположника современной атомной физики, а также ряда других ученых позволили сделать вывод: электроны в атомах располагаются определенными слоями – оболочками и в определенном порядке.
Строение электронных оболочек атомов имеют важную роль для химии, так как
именно электроны обуславливают химические свойства веществ.
N = 2n2
Где N – максимальное число электронов на уровне;
n – номер энергетического уровня.
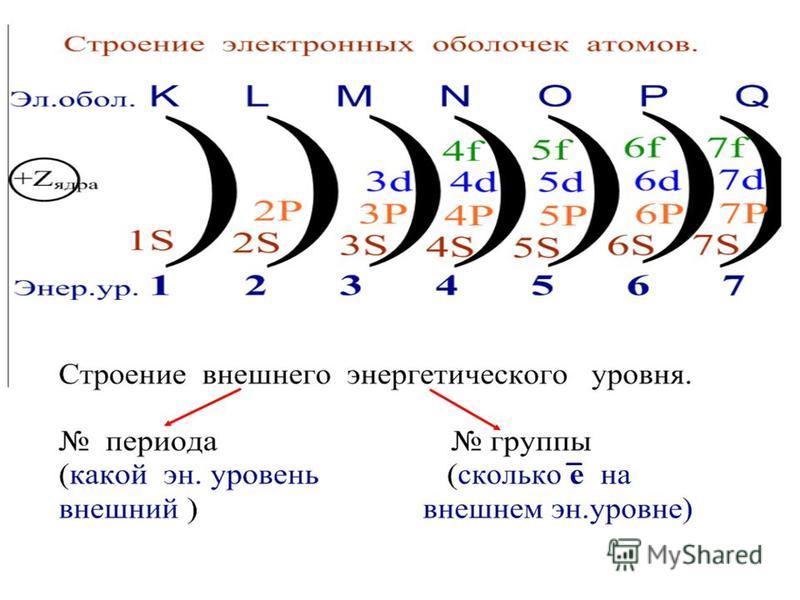
Установлено, что на первой оболочке располагается не более двух электронов, на второй – не более восьми, на третьей – не более 18, на четвертой – не более 32. Заполнение более далеких оболочек мы рассматривать не будем. Известно, что на внешнем энергетическом уровне может находиться не более восьми электронов, его называют завершенным. Электронные слои, не содержащие максимального числа электронов, называют незавершенными.
Как ранее было сказано, электрон движется не по орбите, а по орбитали и не имеет траектории.
Пространство вокруг ядра, где наиболее вероятно нахождение данного электрона, называется орбиталью этого электрона, или электронным облаком.
Орбитали, или подуровни, как их еще называют, могут иметь разную форму, и их
количество соответствует номеру уровня, но не превышает четырех.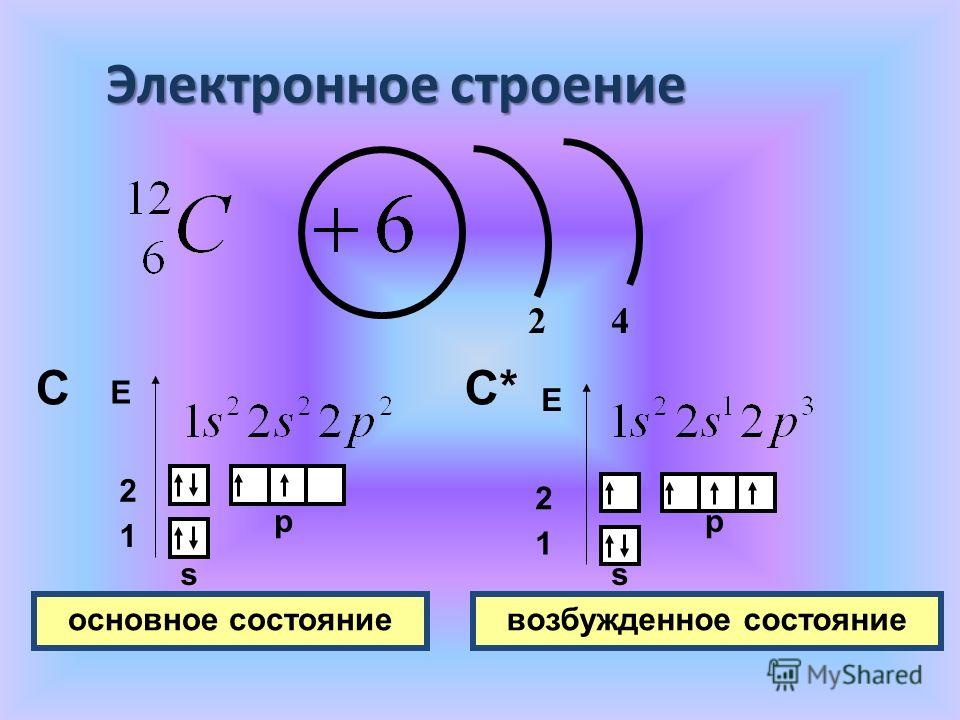 Первый
энергетический уровень имеет один подуровень (s), второй
– два (s,p), третий – три (s,p,d) и т.д. Электроны разных
подуровней одного и того же уровня имеют разную форму электронного облака:
сферическую (s), гантелеобразную (p) и более сложную конфигурацию (d) и
(f). Сферическую атомную орбиталь ученые договорились называть s-орбиталью.
Она самая устойчивая и располагается довольно близко к ядру.
Первый
энергетический уровень имеет один подуровень (s), второй
– два (s,p), третий – три (s,p,d) и т.д. Электроны разных
подуровней одного и того же уровня имеют разную форму электронного облака:
сферическую (s), гантелеобразную (p) и более сложную конфигурацию (d) и
(f). Сферическую атомную орбиталь ученые договорились называть s-орбиталью.
Она самая устойчивая и располагается довольно близко к ядру.
| S – орбиталь |
Чем больше энергия электрона в атоме, тем быстрее он вращается, тем сильнее вытягивается область его пребывания, и, наконец, превращается в гантелеобразную p-орбиталь:
Электронное облако такой формы может занимать в атоме три положения
вдоль осей координат пространства x, y и z. Это легко
объяснимо: ведь все электроны заряжены отрицательно, поэтому электронные облака
взаимно отталкиваются и стремятся разместиться как можно дальше друг от
друга.
Это легко
объяснимо: ведь все электроны заряжены отрицательно, поэтому электронные облака
взаимно отталкиваются и стремятся разместиться как можно дальше друг от
друга.
| Три p – орбитали |
Итак, p-орбиталей может быть три. Энергия их, конечно, одинакова, а расположение в пространстве – разное.
Составить схему последовательного заполнения электронами энергетических уровней
Теперь мы можем составить схему строения электронных оболочек атомов:
- Определяем общее число электронов на оболочке по порядковому номеру элемента.
- Определяем число энергетических уровней в электронной оболочке. Их число равно номеру периода в таблице Д. И. Менделеева, в котором находится элемент.
- Определяем число электронов на каждом энергетическом уровне.

- Используя для обозначения уровня арабские цифры и обозначая орбитали буквами s и p, а число электронов данной орбитали арабской цифрой вверху справа над буквой, изображаем строение атомов более полными электронными формулами. Ученые условились обозначать каждую атомную орбиталь квантовой ячейкой – квадратиком на энергетической диаграмме:
На s-подуровне может находиться одна атомная орбиталь
а на p—подуровне их может быть уже три –
(в соответствии с тремя осями координат):
Орбиталей d– и f—подуровня в атоме может быть уже пять и семь соответственно:
Пример:
Ядро атома водорода имеет заряд +1, поэтому вокруг его ядра движется только один электрон на единственном энергетическом уровне. Запишем электронную конфигурацию атома водорода
Чтобы установить связь между строением атома химического элемента и его
свойствами, рассмотрим еще несколько химических элементов.
Следующий за водородом элемент-гелий. Ядро атома гелия имеет заряд +2, поэтому атом гелия содержит два электрона на первом энергетическом уровне:
Так как на первом энергетическом уровне может находиться не более двух электронов, то он считается завершенным.
Элемент № 3 – литий. Ядро лития имеет заряд +3, следовательно, в атоме лития три электрона. Два из них находятся на первом энергетическом уровне, а третий электрон начинает заполнять второй энергетический уровень. Сначала заполняется s-орбиталь первого уровня, потом s-орбиталь второго уровня. Электрон, находящийся на втором уровне слабее связан с ядром, чем два других.
Далее формирование электронных оболочек у элементов 2-го периода происходит следующим образом:
Для атома углерода уже можно предположить три возможных схемы заполнения электронных оболочек в соответствии с электронно-графическими формулами:
Анализ атомного спектра показывает, что правильна последняя схема. Пользуясь
этим правилом, нетрудно составить схему электронного строения для атома азота:
Пользуясь
этим правилом, нетрудно составить схему электронного строения для атома азота:
Этой схеме соответствует формула 1s22s22p3. Затем начинается попарное размещение электронов на 2p-орбиталях. Электронные формулы остальных атомов второго периода:
У атома неона заканчивается заполнение второго энергетического уровня, и завершается построение второго периода системы элементов.
Найдите в периодической системе химический знак лития, от лития до неона Ne закономерно возрастает заряд ядер атомов. Постепенно заполняется электронами второй слой. С ростом числа электронов на втором слое металлические свойства элементов постепенно ослабевают и сменяются неметаллическими.
Третий период, подобно второму, начинается с двух элементов (Na, Mg), у
которых электроны размещаются на s-подуровне внешнего электронного слоя. Затем
следуют шесть элементов (от Al до Ar), у которых происходит формирование p-подуровня
внешнего электронного слоя. Структура внешнего электронного слоя соответствующих
элементов второго и третьего периодов оказывается аналогичной. Иначе говоря, с
увеличением заряда ядра электронная структура внешних слоев атомов периодически
повторяется. Если элементы имеют одинаково устроенные внешние энергетические
уровни, то и свойства этих элементов подобны. Скажем, аргон и неон содержат на
внешнем уровне по восемь электронов, и потому они инертны, то есть почти не
вступают в химические реакции. В свободном виде аргон и неон – газы, которые
имеют одноатомные молекулы.
Структура внешнего электронного слоя соответствующих
элементов второго и третьего периодов оказывается аналогичной. Иначе говоря, с
увеличением заряда ядра электронная структура внешних слоев атомов периодически
повторяется. Если элементы имеют одинаково устроенные внешние энергетические
уровни, то и свойства этих элементов подобны. Скажем, аргон и неон содержат на
внешнем уровне по восемь электронов, и потому они инертны, то есть почти не
вступают в химические реакции. В свободном виде аргон и неон – газы, которые
имеют одноатомные молекулы.
Атомы лития, натрия и калия содержат на внешнем уровне по одному электрону и обладают сходными свойствами, поэтому они помещены в одну и ту же группу периодической системы.
Далее, учитель вместе с учениками делают выводы по пройденной теме и повторяют материал.
III. Выводы.
1. Свойства химических элементов, расположенных в порядке возрастания заряда
ядра, периодически повторяются, так как периодически повторяется строение
внешних энергетических уровней атомов элементов.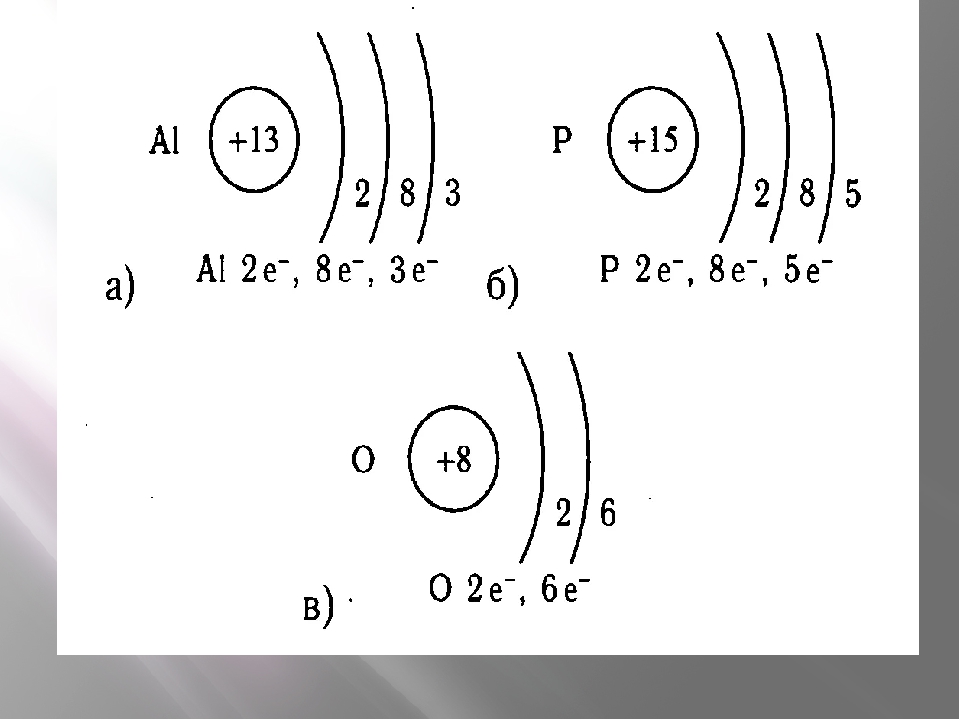
2. Плавное изменение свойств химических элементов в пределах одного периода можно объяснить постепенным увеличением числа электронов на внешнем энергетическом уровне.
3. Причина сходства свойств химических элементов, принадлежащих к одному семейству, заключается в одинаковом строении внешних энергетических уровней их атомов.
IV. Закрепление нового материала.
Задание для класса:
1. Изобразите строение атомов следующих элементов:
а) натрия;
б) кремния
2. Сравните строение атомов азота и фосфора.
3. По данным о распределении валентных электронов найдите элемент:
а) 1s2 2s1
б) 1s2 2s22p63s23p6
в) 1s22s22p63s23p4
г) 1s2 2s22p4
д) 1s22s22p63s23p64s1
4. Используя компьютерную презентацию “Составление электронных формул
строения атомов” составьте электронные формулы атомов а) азота; б) серы.
Используя компьютерную презентацию “Составление электронных формул
строения атомов” составьте электронные формулы атомов а) азота; б) серы.
5. Используя макет “Составление электронных формул строения атомов” электронные формулы атомов: а) магния; б) кислорода.
V. Домашнее задание: § 8, Стр. 28-33.
Нарисуйте схемы строения электронных оболочек атомов: бора, хлора, лития, алюминия.
Приложение.
Новая, Биномиальная Модель Атома, Траектории и Схемы Расщепления Энергетических Уровней Атома
New, Binomial Model of Atom, Trajectories and Schemes
14
Для этого примера:
.
Пример 2. Одна система лучей ,, вторая оболочка атома, , четное число, синглет,
Рис. 18(d-f). В соответствии с выражениями (31, 32) имеем:
Пример 3. Одна система лучей ,, вторая оболочка атома, , нечетное число, дуплет,
Рис.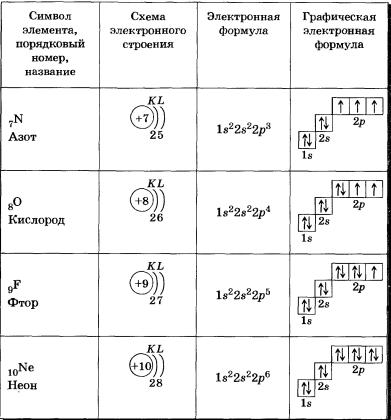 18(g-i). Пример аналогичен Примеру 1, но отличается величиной . В соответствии с
18(g-i). Пример аналогичен Примеру 1, но отличается величиной . В соответствии с
выражениями (31-38) имеем: , ,
,
.
Для этого примера:
. Результат деления уменьшился в раза по
сравнению с Примером 1.
Пример 4. Одна система лучей ,, вторая оболочка атома, , нечетное число,
дуплет. Пример аналогичен Примерам 1 и 2, но отличается величиной . В соответствии с
выражениями (31-38) имеем: , ,
,
.
Для этого примера:
. Результат деления уменьшился в
раза по сравнению с Примером 1 и соответствует по порядку величины выражению (25a).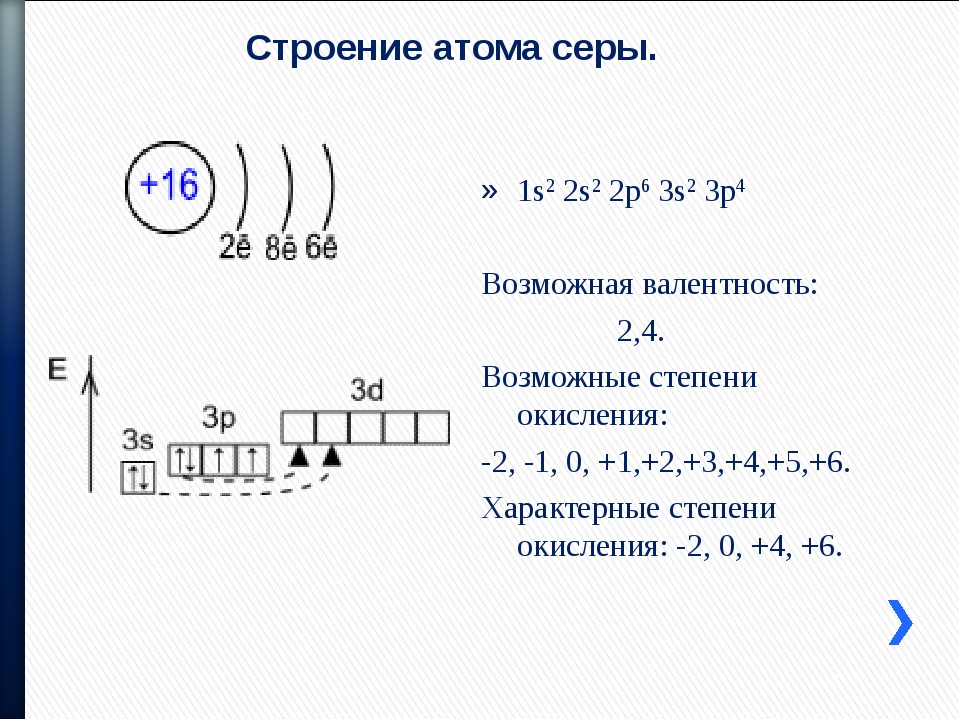
Пример 5. Комбинация из двух систем лучей. Первая система лучей , как в Примере
1, вторая система лучей , как в Примере 2. Имеем одновременно дуплет и синглет, то
есть триплет.
Пример 6. Комбинация из двух систем лучей. Первая система лучей , как в Примере
1, вторая система лучей , как в Примере 3. Имеем одновременно два разных дуплета,
то есть квартет.
Пример 7. Комбинация из трех систем лучей. Первая система лучей , как в Примере
1, вторая система лучей , как в Примере 2, третья система лучей , как в
Примере 3. Имеем одновременно два разных дуплета и синглет, то есть квинтет и т.д.
Аналогичным образом можно привести примеры для других случаев, например, изображенных
на Рис. 9 – 15.
V. ЗАКЛЮЧЕНИЕ
В предложенной работе путем наших геометрических и численных исследований мы показали
соответствие нашей геометрической биномиальной модели атома и энергетических уровней атома,
полученных экспериментально из спектроскопических измерений. Мы показали связь между ядерной
Мы показали связь между ядерной
моделью атома и волнообразными траекториями, расположенными вдоль горизонтальной ленты. В
предыдущей работе [10] мы нашли суммы энергетических уровней. В этой работе мы определили
каждый из множества энергетических уровней, и нашли новые закономерности между ними. Мы
охарактеризовали каждый из энергетических уровней двумя числами — и , которые соответствуют
главному и азимутальному числам квантовой системы, соответственно. Мы показали, что наша новая
приближенная модель во многом соответствует известным моделям траекторий электронов в атоме,
электронным облакам в атоме и Периодической системе. Мы также демонстрируем вычисления
иллюстрирующие расщепление энергетических уровней атома путем ввода дополнительного параметра.
Возможно, нашу предложенную модель, учитывая работы [14 — 17] можно в дальнейшем уточнить,
чтобы она больше соответствовала экспериментальным спектроскопическим результатам, путем
введения дополнительные коэффициентов и методик для более точного расчета значений энергии атома.
VI. БЛАГОДАРНОСТИ
Автор выражает благодарность С. Шнолю, В. Дикусару, В. Михалевичу, В. Смолянинову, М. Мисакяну,
Д. Рабонскому, Д. Петерсу, А. Тоззи, В. Кабанову и В. Якимову за полезную дискуссию и поддержку.
Электронное строение атома. Схема строения атома: ядро, электронная оболочка. Примеры
Так как при химических реакциях ядра реагирующих атомов остаются без изменений (за исключением радиоактивных превращений), то химические свойства атомов зависят от строения их электронных оболочек. Теория электронного строения атома построена на основе аппарата квантовой механики. Так, структура энергетических уровней атома может быть получена на основе квантовомеханических расчетов вероятностей нахождения электронов в пространстве вокруг атомного ядра (рис. 4.5 ).
Рис. 4.5 . Схема подразделения энергетических уровней на подуровни
Основы теории электронного строения
атома сводятся к следующим положениям:
состояние каждого электрона в атоме
характеризуется четырьмя квантовыми
числами: главным квантовым числом n
= 1, 2, 3, ;
орбитальным (азимутальным)l=0,1,2, n–1 ;
магнитнымm l = –l, –1,0,1, l ;
спиновымm s = -1/2, 1/2 .
Согласно принципу Паули , в одном и том же атоме не может быть двух электронов, обладающих одинаковой совокупностью четырех квантовых чиселn, l, m l , m s ; совокупности электронов с одинаковыми главными квантовыми числами n образуют электронные слои, или энергетические уровни атома, нумеруемые от ядра и обозначаемые какK, L, M, N, O, P, Q , причем в энергетическом слое с данным значениемn могут находиться не более, чем2n 2 электронов. Совокупности электронов с одинаковыми квантовыми числамиn иl , образуют подуровни, обозначаемые по мере удаления их от ядра какs, p, d, f .
Вероятностное нахождение положения
электрона в пространстве вокруг атомного
ядра соответствует принципу
неопределенностей Гейзенберга. По
квантовомеханическим представлениям,
электрон в атоме не имеет определенной
траектории движения и может находиться
в любой части пространства вокруг ядра,
а различные его положения рассматриваются
как электронное облако с определенной
плотностью отрицательного заряда. Пространство вокруг ядра, в котором
наиболее вероятно нахождение электрона,
называется орбиталью . В нем заключено
порядка 90% электронного облака. Каждому
подуровню1s,
2s, 2p и т.д. соответствует определенное
количество орбиталей определенной
формы. Например,1s —
и2s- орбитали
имеют сферическую форму, а2p -орбитали
(2p x ,
2p y ,
2p z -орбитали)
ориентированы во взаимно перпендикулярных
направлениях и имеют форму гантели
(рис. 4.6 ).
Пространство вокруг ядра, в котором
наиболее вероятно нахождение электрона,
называется орбиталью . В нем заключено
порядка 90% электронного облака. Каждому
подуровню1s,
2s, 2p и т.д. соответствует определенное
количество орбиталей определенной
формы. Например,1s —
и2s- орбитали
имеют сферическую форму, а2p -орбитали
(2p x ,
2p y ,
2p z -орбитали)
ориентированы во взаимно перпендикулярных
направлениях и имеют форму гантели
(рис. 4.6 ).
Рис. 4.6 . Форма и ориентация электронных орбиталей.
При химических реакциях атомное ядро не претерпевает изменений, изменяются лишь электронные оболочки атомов, строением которых объясняются многие свойства химических элементов. На основе теории электронного строения атома был установлен глубокий физический смысл периодического закона химических элементов Менделеева и создана теория химической связи.
Теоретическое обоснование периодической
системы химических элементов включает
в себя данные о строении атома,
подтверждающие существование связи
между периодичностью изменения свойств
химических элементов и периодическим
повторением сходных типов электронных
конфигураций их атомов.
В свете учения о строении атома становится обоснованным разделение Менделеевым всех элементов на семь периодов: номер периода соответствует числу энергетических уровней атомов, заполняемых электронами. В малых периодах с ростом положительных заряда ядер атомов возрастает число электронов на внешнем уровне (от 1 до 2 в первом периоде, и от 1 до 8 во втором и третьем периодах), что объясняет изменение свойств элементов: в начале периода (кроме первого) находится щелочной металл, затем наблюдается постепенное ослабление металлических свойств и усиление неметаллических. Эта закономерность прослеживается для элементов второго периода в таблице 4.2.
Таблица 4.2.
В больших периодах с ростом заряда ядер заполнение уровней электронами происходит сложнее, что и объясняет более сложное изменение свойств элементов по сравнению с элементами малых периодов.
Одинаковый характер свойств химических
элементов в подгруппах объясняется
сходным строением внешнего энергетического
уровня, как это показано в табл. 4.3 ,
иллюстрирующей последовательность
заполнения электронами энергетических
уровней для подгрупп щелочных металлов.
4.3 ,
иллюстрирующей последовательность
заполнения электронами энергетических
уровней для подгрупп щелочных металлов.
Таблица 4.3.
Номер группы, как правило, указывает на
число электронов в атоме, которые могут
участвовать в образовании химических
связей. В этом заключается физический
смысл номера группы. В четырех местах
периодической системы элементы
расположены не в порядке возрастания
атомных масс: Ar иK ,Co иNi ,T e иI ,Th иPa . Эти отступления считались
недостатками периодической системы
химических элементов. Учение о строении
атома объяснило указанные отступления.
Опытное определение зарядов ядер
показало, что расположение этих элементов
соответствует возрастанию зарядов их
ядер. Кроме того, опытное определение
зарядов ядер атомов дало возможность
определить число элементов между
водородом и ураном, а также число
лантаноидов. Ныне все места в периодической
системе заполнены в промежутке
отZ=1 доZ=114 ,
однако периодическая система не
закончена, возможно открытие новых
трансурановых элементов.
Состав атома.
Атом состоит из атомного ядра и электронной оболочки .
Ядро атома состоит из протонов (p + ) и нейтронов (n 0). У большинства атомов водорода ядро состоит из одного протона.
Число протонов N (p + ) равно заряду ядра (Z ) и порядковому номеру элемента в естественном ряду элементов (и в периодической системе элементов).
N (p +) = Z
Сумма числа нейтронов N (n 0), обозначаемого просто буквой N , и числа протонов Z называется массовым числом и обозначается буквой А .
A = Z + N
Электронная оболочка атома состоит из движущихся вокруг ядра электронов (е -).
Число электронов N (e -) в электронной оболочке нейтрального атома равно числу протонов Z в его ядре.
Масса протона примерно равна массе нейтрона и в 1840 раз больше массы электрона, поэтому масса атома практически равна массе ядра.
Форма атома — сферическая. Радиус ядра примерно в 100000 раз меньше радиуса атома.
Химический элемент — вид атомов (совокупность атомов) с одинаковым зарядом ядра (с одинаковым числом протонов в ядре).
Изотоп — совокупность атомов одного элемента с одинаковым числом нейтронов в ядре (или вид атомов с одинаковым числом протонов и одинаковым числом нейтронов в ядре).
Разные изотопы отличаются друг от друга числом нейтронов в ядрах их атомов.
Обозначение отдельного атома или изотопа: (Э — символ элемента), например: .
Строение электронной оболочки атома
Атомная орбиталь — состояние электрона в атоме. Условное обозначение орбитали — . Каждой орбитали соответствует электронное облако.
Орбитали реальных атомов в основном (невозбужденном) состоянии бывают четырех типов: s , p , d и f .
Электронное облако — часть пространства, в которой электрон можно обнаружить с вероятностью 90 (или более) процентов.
Примечание : иногда понятия «атомная орбиталь» и «электронное облако» не различают, называя и то, и другое «атомной орбиталью».
Электронная оболочка атома слоистая. Электронный слой образован электронными облаками одинакового размера. Орбитали одного слоя образуют электронный («энергетический») уровень , их энергии одинаковы у атома водорода, но различаются у других атомов.
Однотипные орбитали одного уровня группируются в электронные (энергетические) подуровни:
s -подуровень (состоит из одной s -орбитали), условное обозначение — .
p -подуровень (состоит из трех p
d -подуровень (состоит из пяти d -орбиталей), условное обозначение — .
f -подуровень (состоит из семи f -орбиталей), условное обозначение — .
Энергии орбиталей одного подуровня одинаковы.
При обозначении подуровней к символу подуровня добавляется номер слоя (электронного уровня), например: 2s , 3p , 5d означает s -подуровень второго уровня, p -подуровень третьего уровня, d -подуровень пятого уровня.
Общее число подуровней на одном уровне равно номеру уровня n . Общее число орбиталей на одном уровне равно n 2 . Соответственно этому, общее число облаков в одном слое равно также n 2 .
Обозначения: — свободная орбиталь (без электронов), — орбиталь с неспаренным электроном, — орбиталь с электронной парой (с двумя электронами).
Порядок заполнения электронами орбиталей атома определяется тремя законами природы (формулировки даны упрощенно):
1. Принцип наименьшей энергии — электроны заполняют орбитали в порядке возрастания энергии орбиталей.
2. Принцип Паули — на одной орбитали не может быть больше двух электронов.
3. Правило Хунда — в пределах подуровня электроны сначала заполняют свободные орбитали (по одному), и лишь после этого образуют электронные пары.
Общее число электронов на электронном уровне (или в электронном слое) равно 2n 2 .
Распределение подуровней по энергиям выражается рядом (в прядке увеличения энергии):
1s , 2s , 2p , 3s , 3p , 4s , 3d , 4p , 5s , 4d , 5p , 6s , 4f , 5d , 6p , 7s , 5f , 6d , 7p …
Наглядно эта последовательность выражается энергетической диаграммой:
Распределение электронов атома по уровням, подуровням и орбиталям (электронная конфигурация атома) может быть изображена в виде электронной формулы, энергетической диаграммы или, упрощенно, в виде схемы электронных слоев («электронная схема»).
Примеры электронного строения атомов:
Валентные электроны — электроны атома, которые могут принимать участие в образовании химических связей. У любого атома это все внешние электроны плюс те предвнешние электроны, энергия которых больше, чем у внешних. Например: у атома Ca внешние электроны — 4s 2 , они же и валентные; у атома Fe внешние электроны — 4s 2 , но у него есть 3d 6 , следовательно у атома железа 8 валентных электронов. Валентная электронная формула атома кальция — 4s 2 , а атома железа — 4s 2 3d 6 .
Периодическая система химических элементов Д. И. Менделеева
(естественная система химических элементов)
Периодический закон химических элементов (современная формулировка): свойства химических элементов, а также простых и сложных веществ, ими образуемых, находятся в периодической зависимости от значения заряда из атомных ядер.
Периодическая система — графическое выражение периодического закона.
Естественный ряд химических элементов — ряд химических элементов, выстроенных по возрастанию числа протонов в ядрах их атомов, или, что то же самое, по возрастанию зарядов ядер этих атомов. Порядковый номер элемента в этом ряду равен числу протонов в ядре любого атома этого элемента.
Таблица химических элементов строится путем «разрезания» естественного ряда химических элементов на периоды (горизонтальные строки таблицы) и объединения в группы (вертикальные столбцы таблицы) элементов, со сходным электронным строением атомов.
В зависимости от способа объединения элементов в группы таблица может быть длиннопериодной (в группы собраны элементы с одинаковым числом и типом валентных электронов) и короткопериодной (в группы собраны элементы с одинаковым числом валентных электронов).
Группы короткопериодной таблицы делятся на подгруппы (главные и побочные ), совпадающие с группами длиннопериодной таблицы.
У всех атомов элементов одного периода одинаковое число электронных слоев, равное номеру периода.
Число элементов в периодах: 2, 8, 8, 18, 18, 32, 32. Большинство элементов восьмого периода получены искусственно, последние элементы этого периода еще не синтезированы. Все периоды, кроме первого начинаются с элемента, образующего щелочной металл (Li, Na, K и т. д.), а заканчиваются элементом, образующим благородный газ (He, Ne, Ar, Kr и т. д.).
В короткопериодной таблице — восемь групп, каждая из которых делится на две подгруппы (главную и побочную), в длиннопериодной таблице — шестнадцать групп, которые нумеруются римскими цифрами с буквами А или В, например: IA, IIIB, VIA, VIIB. Группа IA длиннопериодной таблицы соответствует главной подгруппе первой группы короткопериодной таблицы; группа VIIB — побочной подгруппе седьмой группы: остальные — аналогично.
Характеристики химических элементов закономерно изменяются в группах и периодах.
В периодах (с увеличением порядкового номера)
- увеличивается заряд ядра,
- увеличивается число внешних электронов,
- уменьшается радиус атомов,
- увеличивается прочность связи электронов с ядром (энергия ионизации),
- увеличивается электроотрицательность,
- усиливаются окислительные свойства простых веществ («неметалличность»),
- ослабевают восстановительные свойства простых веществ («металличность»),
- ослабевает основный характер гидроксидов и соответствующих оксидов,
- возрастает кислотный характер гидроксидов и соответствующих оксидов.
В группах (с увеличением порядкового номера)
- увеличивается заряд ядра,
- увеличивается радиус атомов (только в А-группах),
- уменьшается прочность связи электронов с ядром (энергия ионизации; только в А-группах),
- уменьшается электроотрицательность (только в А-группах),
- ослабевают окислительные свойства простых веществ («неметалличность»; только в А-группах),
- усиливаются восстановительные свойства простых веществ («металличность»; только в А-группах),
- возрастает основный характер гидроксидов и соответствующих оксидов (только в А-группах),
- ослабевает кислотный характер гидроксидов и соответствующих оксидов (только в А-группах),
- снижается устойчивость водородных соединений (повышается их восстановительная активность; только в А-группах).
Задачи и тесты по теме «Тема 9. «Строение атома. Периодический закон и периодическая система химических элементов Д. И. Менделеева (ПСХЭ)».»
- Периодический закон — Периодический закон и строение атомов 8–9 класс
Вы должны знать: законы заполнения орбиталей электронами (принцип наименьшей энергии, принцип Паули, правило Хунда), структуру периодической системы элементов.Вы должны уметь: определять состав атома по положению элемента в периодической системе, и, наоборот, находить элемент в периодической системе, зная его состав; изображать схему строения, электронную конфигурацию атома, иона, и, наоборот, определять по схеме и электронной конфигурации положение химического элемента в ПСХЭ; давать характеристику элемента и образуемых им веществ по его положению в ПСХЭ; определять изменения радиуса атомов, свойств химических элементов и образуемых ими веществ в пределах одного периода и одной главной подгруппы периодической системы.
Пример 1. Определите количество орбиталей на третьем электронном уровне. Какие это орбитали?
Для определения количества орбиталей воспользуемся формулой N орбиталей = n 2 , где n — номер уровня. N орбиталей = 3 2 = 9. Одна 3s -, три 3p — и пять 3d -орбиталей.Пример 2. Определите, у атома какого элемента электронная формула 1s 2 2s 2 2p 6 3s 2 3p 1 .
Для того, чтобы определить, кокой это элемент, надо выяснить его порядковый номер, который равен суммарному числу электронов атома. В данном случае: 2 + 2 + 6 + 2 + 1 = 13. Это алюминий.Убедившись, что все необходимое усвоено, переходите к выполнению заданий. Желаем успехов.
Рекомендованная литература:- О. С. Габриелян и др. Химия 11 кл. М., Дрофа, 2002;
- Г. Е. Рудзитис, Ф. Г. Фельдман. Химия 11 кл. М., Просвещение, 2001.
Понятие атом возникло еще в античном мире для обозначения частиц вещества. В переводе с греческого атом означает «неделимый».
Ирландский физик Стони на основании опытов пришел к выводу, что электричество переносится мельчайшими частицами, сущеетвующими в атомах всех химических элементов. В 1891 г. Стони предложил эти частицы назвать электронами, что по-гречески означает «янтарь». Через несколько лет после того, как электрон получил свое название, английский физик Джозеф Томсон и французский физик Жан Перрен доказали, что электроны несут на себе отрицательный заряд. Это наименьший отрицательный заряд, который в химии принят за единицу (-1). Томсон даже сумел определить скорость движения электрона (скорость электрона на орбите обратно пропорциональна номеру орбиты n. Радиусы орбит растут пропорционально квадрату номера орбиты. На первой орбите атома водорода (n=1; Z=1) скорость равна ≈ 2,2·106 м/с, то есть примерно в сотню раз меньше скорости света с=3·108 м/с.) и массу электрона (она почти в 2000 раз меньше массы атома водорода).
Состояние электронов в атомеПод состоянием электрона в атоме понимают совокупность информации об энергии определенного электрона и пространстве, в котором он находится . Электрон в атоме не имеет траектории движения, т. е. можно говорить лишь о вероятности нахождения его в пространстве вокруг ядра .
Он может находиться в любой части этого пространства, окружающего ядро, и совокупность его различных положений рассматривают как электронное облако с определенной плотностью отрицательного заряда. Образно это можно представить себе так: если бы удалось через сотые или миллионные доли секунды сфотографировать положение электрона в атоме, как при фотофинише, то электрон на таких фотографиях был бы представлен в виде точек. При наложении бесчисленного множества таких фотографий получилась бы картина электронного облака с наибольшей плотностью там, где этих точек будет больше всего.
Пространство вокруг атомного ядра, в котором наиболее вероятно нахождение электрона, называется орбиталью. В нем заключено приблизительно 90 % электронного облака , и это означает, что около 90 % времени электрон находится в этой части пространства. По форме различают 4 известных ныне типа орбиталей , которые обозначаются латинскими буквами s, p, d и f . Графическое изображение некоторых форм электронных орбиталей представлено на рисунке.
Важнейшей характеристикой движения электрона на определенной орбитали является энергия его связи с ядром . Электроны, обладающие близкими значениями энергии, образуют единый электронный слои, или энергетический уровень. Энергетические уровни нумеруют, начиная от ядра, — 1, 2, 3, 4, 5, 6 и 7.
Целое число n, обозначающее номер энергетического уровня, называют главным квантовым числом. Оно характеризует энергию электронов, занимающих данный энергетический уровень. Наименьшей энергией обладают электроны первого энергетического уровня, наиболее близкого к ядру. По сравнению с электронами первого уровня, электроны последующих уровней будут характеризоваться большим запасом энергии. Следовательно, наименее прочно связаны с ядром атома электроны внешнего уровня.
Наибольшее число электронов на энергетическом уровне определяется по формуле:
N = 2n 2 ,
где N — максимальное число электронов; n — номер уровня, или главное квантовое число. Следовательно, на первом, ближайшем к ядру энергетическом уровне может находиться не более двух электронов; на втором — не более 8; на третьем — не более 18; на четвертом — не более 32.
Начиная со второго энергетического уровня (n = 2) каждый из уровней подразделяется на подуровни (подслои), несколько отличающиеся друг от друга энергией связи с ядром. Число подуровней равно значению главного квантового числа: первый энергетический уровень имеет один подуровень; второй — два; третий — три; четвертый — четыре подуровня . Подуровни в свою очередь образованы орбиталями. Каждому значению n соответствует число орбиталей, равное n.
Подуровни принято обозначать латинскими буквами, равно как и форму орбиталей, из которых они состоят: s, p, d, f.
Протоны и нейтроныАтом любого химического элемента сравним с крохотной Солнечной системой. Поэтому такую модель атома, предложенную Э. Резерфордом, называют планетарной .
Атомное ядро, в котором сосредоточена вся масса атома, состоит из частиц двух видов — протонов и нейтронов .
Протоны имеют заряд, равный заряду электронов, но противоположный по знаку (+1), и массу, равную массе атома водорода (она принята в химии за единицу). Нейтроны не несут заряда, они нейтральны и имеют массу, равную массе протона.
Протоны и нейтроны вместе называют нуклонами (от лат. nucleus — ядро). Сумма числа протонов и нейтронов в атоме называется массовым числом . Например, массовое число атома алюминия:
13 + 14 = 27
число протонов 13, число нейтронов 14, массовое число 27
Так как массой электрона, ничтожно малой, можно пренебречь, то очевидно, что в ядре сосредоточена вся масса атома. Электроны обозначают e — .
Поскольку атом электронейтрален , то также очевидно, что число протонов и электронов в атоме одинаково. Оно равно порядковому номеру химического элемента, присвоенному ему в Периодической системе. Масса атома складывается из массы протонов и нейтронов. Зная порядковый номер элемента (Z), т. е. число протонов, и массовое число (А), равное сумме чисел протонов и нейтронов, можно найти число нейтронов (N) по формуле:
N = A — Z
Например, число нейтронов в атоме железа равно:
56 — 26 = 30
ИзотопыРазновидности атомов одного и того же элемента, имеющие одинаковый заряд ядра, но разное массовое число, называются изотопами . Химические элементы, встречающиеся в природе, являются смесью изотопов. Так, углерод имеет три изотопа с массой 12, 13, 14; кислород — три изотопа с массой 16, 17, 18 и т. д. Обычно приводимая в Периодической системе относительная атомная масса химического элемента является средним значением атомных масс природной смеси изотопов данного элемента с учетом их относительного содержания в природе. Химические свойства изотопов большинства химических элементов совершенно одинаковы. Однако изотопы водорода сильно различаются по свойствам из-за резкого кратного увеличения их относительной атомной массы; им даже присвоены индивидуальные названия и химические знаки.
Элементы первого периодаСхема электронного строения атома водорода:
Схемы электронного строения атомов показывают распределение электронов по электронным слоям (энергетическим уровням).
Графическая электронная формула атома водорода (показывает распределение электронов по энергетическим уровням и подуровням):
Графические электронные формулы атомов показывают распределение электронов не только по уровням и подуровням, но и по орбиталям.
В атоме гелия первый электронный слой завершен — в нем 2 электрона. Водород и гелий — s-элементы; у этих атомов заполняется электронами s-орбиталь.
У всех элементов второго периода первый электронный слой заполнен , и электроны заполняют s- и р-орбитали второго электронного слоя в соответствии с принципом наименьшей энергии (сначала s, а затем р) и правилами Паули и Хунда.
В атоме неона второй электронный слой завершен — в нем 8 электронов.
У атомов элементов третьего периода первый и второй электронные слои завершены, поэтому заполняется третий электронный слой, в котором электроны могут занимать 3s-, 3р- и 3d- подуровни.
У атома магния достраивается 3s- электронная орбиталь. Na и Mg — s-элементы.
У алюминия и последующих элементов заполняется электронами 3р-подуровень.
У элементов третьего периода остаются незаполненными 3d-орбитали.
Все элементы от Al до Ar — р-элементы. s- и р-элементы образуют главные подгруппы в Периодической системе.
Элементы четвертого — седьмого периодов
У атомов калия и кальция появляется четвертый электронный слой, заполняется 4s-подуровень, т. к. он имеет меньшую энергию, чем 3d-подуровень.
К, Са — s-элементы, входящие в главные подгруппы. У атомов от Sc до Zn заполняется электронами 3d-подуровень. Это 3d-элементы. Они входят в побочные подгруппы, у них заполняется предвнешний электронный слой, их относят к переходным элементам.
Обратите внимание на строение электронных оболочек атомов хрома и меди. В них происходит «провал» одного электрона с 4s- на 3d-подуровень, что объясняется большей энергетической устойчивостью образующихся при этом электронных конфигураций 3d 5 и 3d 10:
В атоме цинка третий электронный слой завершен — в нем заполнены все подуровни 3s, 3р и 3d, всего на них 18 электронов. У следующих за цинком элементов продолжает заполняться четвертый электронный слой, 4р-подуровень.
Элементы от Ga до Кr — р-элементы.
У атома криптона внешний слой (четвертый) завершен, имеет 8 электронов. Но всего в четвертом электронном слое может быть 32 электрона; у атома криптона пока остаются незаполненными 4d- и 4f-подуровни.У элементов пятого периода идет заполнение по-дуровней в следующем порядке: 5s — 4d — 5р. И так-же встречаются исключения, связанные с «провалом » электронов, у 41 Nb, 42 Мо, 44 Ru, 45 Rh, 46 Pd, 47 Ag.
В шестом и седьмом периодах появляются f-элементы, т. е. элементы, у которых идет заполнение соответственно 4f- и 5f-подуровней третьего снаружи электронного слоя.
4f-элементы называют лантаноидами.
5f-элементы называют актиноидами.
Порядок заполнения электронных подуровней в атомах элементов шестого периода: 55 Cs и 56 Ва — 6s-элементы; 57 La … 6s 2 5d x — 5d-элемент; 58 Се — 71 Lu — 4f-элементы; 72 Hf — 80 Hg — 5d-элементы; 81 Т1 — 86 Rn — 6d-элементы. Но и здесь встречаются элементы, у которых «нарушается» порядок заполнения электронных орбиталей, что, например, связано с большей энергетической устойчивостью наполовину и полностью заполненных f-подуровней, т. е. nf 7 и nf 14 . В зависимости от того, какой подуровень атома заполняется электронами последним, все элементы делят на четыре электронных семейства, или блока:
- s-элементы . Электронами заполняется s-подуровень внешнего уровня атома; к s-элементам относятся водород, гелий и элементы главных подгрупп I и II групп.
- p-элементы . Электронами заполняется р-подуровень внешнего уровня атома; к р-элементам относятся элементы главных подгрупп III- VIII групп.
- d-элементы . Электронами заполняется d-подуровень предвнешнего уровня атома; к d-элементам относятся элементы побочных подгрупп I-VIII групп, т. е. элементы вставных декад больших периодов, расположенных между s- и р-элементами. Их также называют переходными элементами.
- f-элементы . Электронами заполняется f-подуровень третьего снаружи уровня атома; к ним относятся лантаноиды и антиноиды.
Швейцарский физик В. Паули в 1925 г. установил, что в атоме на одной орбитали может находиться не более двух электронов, имеющих противоположные (антипараллельные) спины (в переводе с английского — «веретено»), т. е. обладающих такими свойствами, которые условно можно представить себе как вращение электрона вокруг своей воображаемый оси: по часовой или против часовой стрелки.
Этот принцип носит название принципа Паули . Если на орбитали находится один электрон, то он называется неспаренным, если два, то это спаренные электроны, т. е. электроны с противоположными спинами. На рисунке показана схема подразделения энергетических уровней на подуровни и очередность их заполнения.
Очень часто строение электронных оболочек атомов изображают с помощью энергетических или квантовых ячеек — записывают так называемые графические электронные формулы. Для этой записи используют следующие обозначения: каждая квантовая ячейка обозначается клеткой, которая соответствует одной орбитали; каждый электрон обозначается стрелкой, соответствующей направлению спина. При записи графической электронной формулы следует помнить два правила: принцип Паули и правило Ф. Хунда , согласно которому электроны занимают свободные ячейки сначала по одному и имеют при этом одинаковое значение спина, а лишь затем спариваются, но спины, при этом по принципу Паули будут уже противоположно направленными.
Правило Хунда и принцип Паули
Правило Хунда — правило квантовой химии, определяющее порядок заполнения орбиталей определённого подслоя и формулируется следующим образом: суммарное значение спинового квантового числа электронов данного подслоя должно быть максимальным. Сформулировано Фридрихом Хундом в 1925 году.
Это означает, что в каждой из орбиталей подслоя заполняется сначала один электрон, а только после исчерпания незаполненных орбиталей на эту орбиталь добавляется второй электрон. При этом на одной орбитали находятся два электрона с полуцелыми спинами противоположного знака, которые спариваются (образуют двухэлектронное облако) и, в результате, суммарный спин орбитали становится равным нулю.
Другая формулировка : Ниже по энергии лежит тот атомный терм, для которого выполняются два условия.
- Мультиплетность максимальна
- При совпадении мультиплетностей суммарный орбитальный момент L максимален.
Разберём это правило на примере заполнения орбиталей p-подуровня p -элементов второго периода (то есть от бора до неона (в приведённой ниже схеме горизонтальными чёрточками обозначены орбитали, вертикальными стрелками — электроны, причём направление стрелки обозначает ориентацию спина).
Правило Клечковского
Правило Клечковского — по мере увеличения суммарного числа электронов в атомах (при возрастании зарядов их ядер, или порядковых номеров химических элементов) атомные орбитали заселяются таким образом, что появление электронов на орбитали с более высокой энергией зависит только от главного квантового числа n и не зависит от всех остальных квантовых чисел, в том числе и от l. Физически это означает, что в водородоподобном атоме (в отсутствие межэлектронного отталкивания) орбитальная энергия электрона определяется только пространственной удаленностью зарядовой плотности электрона от ядра и не зависит от особенностей его движения в поле ядра.
Эмпирическое правило Клечковского и вытекающее из него схема очерёдностей несколько противоречатреальной энергетической последовательности атомых орбиталей только в двух однотипных случаях: у атомов Cr, Cu, Nb, Mo, Ru, Rh, Pd, Ag, Pt, Au имеет место “провал” электрона с s-подуровня внешнего слояна d-подуровень предыдущего слоя, что приводит к энергетически более устойчивому состоянию атома, аименно: после заполнения двумя электронами орбитали 6s
Алгоритм составления электронной формулы элемента:
1. Определите число электронов в атоме используя Периодическую таблицу химических элементов Д.И. Менделеева .
2. По номеру периода, в котором расположен элемент, определите число энергетических уровней; число электронов на последнем электронном уровне соответствует номеру группы.
3. Уровни разбить на подуровни и орбитали и заполнить их электронами в соответствии с правилами заполнения орбиталей :
Необходимо помнить, что на первом уровне находится максимум 2 электрона 1s 2 , на втором — максимум 8 (два s и шесть р: 2s 2 2p 6 ), на третьем — максимум 18 (два s , шесть p , и десять d: 3s 2 3p 6 3d 10 ).
- Главное квантовое число n должно быть минимально.
- Первым заполняется s- подуровень, затем р-, d- b f- подуровни.
- Электроны заполняют орбитали в порядке возрастания энергии орбиталей (правило Клечковского).
- В пределах подуровня электроны сначала по одному занимают свободные орбитали, и только после этого образуют пары (правило Хунда).
- На одной орбитали не может быть больше двух электронов (принцип Паули).
Примеры.
1. Составим электронную формулу азота. В периодической таблице азот находится под №7.
2. Составим электронную формулу аргона. В периодической таблице аргон находится под №18.
1s 2 2s 2 2p 6 3s 2 3p 6 .
3. Составим электронную формулу хрома. В периодической таблице хром находится под №24.
1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 5
Энергетическая диаграмма цинка.
4. Составим электронную формулу цинка. В периодической таблице цинк находится под №30.
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10
Обратим внимание, что часть электронной формулы, а именно 1s 2 2s 2 2p 6 3s 2 3p 6 — это электронная формула аргона.
Электронную формулу цинка можно представить в виде.
Давайте рассмотрим, как построен атом. Учитывайте, что речь будет вестись исключительно о моделях. На практике атомы представляют собой гораздо более сложную структуру. Но благодаря современным разработкам мы имеем возможность объяснять и даже успешно предсказывать свойства (пускай даже и не все). Итак, какова схема строения атома? Из чего он «сделаны»?
Планетарная модель атома
Впервые была предложена датским физиком Н. Бором в 1913 году. Это первая теория строения атома, основанная на научных фактах. К тому же она положила основу современной тематической терминологии. В ней электроны-частицы производят вращательные движения вокруг атома по такому же принципу, как планеты вокруг Солнца. Бор высказал предположение, что они могут существовать исключительно на орбитах, находящихся на строго определённом расстоянии от ядра. Почему именно так, учёный с позиции науки не смог объяснить, но такая модель потдтверждалась многими экспериментами. Для обозначения орбит использовались целые числа, начиная с единицы, которой нумеровалась, самая близкая к ядру. Все эти орбиты также называют уровнями. У атома водорода только один уровень, на котором вращается один электрон. Но сложные атомы имеют ещё уровни. Они делятся на составляющие, которые объединяют близкие по энергетическому потенциалу электроны. Так, второй уже имеет два подуровня — 2s и 2р. Третий имеет уже три — 3s, 3р и 3d. И так далее. Сначала «заселяются» более близкие к ядру подуровни, а потом дальние. На каждом из них может быть размещено только определённое количество электронов. Но это ещё не конец. Каждый подуровень делится на орбитали. Давайте проведём сравнение с обычной жизнью. Электронное облако атома сравнимо с городом. Уровни — это улицы. Подуровень — частный дом или квартира. Орбиталь — комната. В каждой из них «проживает» один или два электрона. Все они имеют конкретные адреса. Вот такой была первая схема строения атома. А напоследок про адреса электронов: они определяются наборами чисел, которые называют «квантовыми».
Волновая модель атома
Но со временем планетарная модель подверглась пересмотру. Была предложена вторая теория строения атома. Она более совершенна и позволяет объяснить результаты практических экспериментов. На смену первой пришла волновая модель атома, которую предложит Э. Шредингер. Тогда уже было установлено, что электрон может проявлять себя не только в качестве частицы, но и как волна. А что сделал Шредингер? Он применил уравнение, описывающее движение волны в Таким образом можно найти не траекторию движения электрона в атоме, а вероятность его обнаружения в определённой точке. Объединяет обе теории то, что элементарные частицы находятся на конкретных уровнях, подуровнях и орбиталях. На этом похожесть моделей заканчивается. Приведу один пример — в волновой теории орбиталью называется область, где можно будет найти электрон с вероятностью в 95%. На всё остальное пространство приходится 5%.Но в конечном итоге получилось, что особенности строения атомов изображаются с использование волновой модели, при том, что используется терминология используется общая.
Понятие вероятности в данном случае
Почему был использован этот термин? Гейзенбергом в 1927 г. был сформулирован принцип неопределенности, который сейчас используется, чтобы описывать движение микрочастиц. Он основан на их фундаментальном отличии от обычных физических тел. В чем оно заключается? Классическая механика предполагала, что человек может наблюдать явления, не влияя на них (наблюдение за небесными телами). На основе полученных данных можно рассчитать, где объект будет в определенный момент времени. Но в микромире дела необходимо обстоят по-другому. Так, к примеру, наблюдать за электроном, не влияя на него, сейчас не представляется возможным ввиду того, что энергии инструмента и частицы несопоставимы. Это приводит к тому, что меняется его местоположение элементарной частицы, состояние, направление, скорость движения и другие параметры. И бессмысленно говорить о точных характеристиках. Сам принцип неопределенности говорит нам о том, что невозможно вычислить точную траекторию полёта электрона вокруг ядра. Можно только указать вероятность нахождения частицы в определённом участке пространства. Вот такую особенность имеет строение атомов химических элементов. Но это следует учитывать исключительно ученым в практических экспериментах.
Состав атома
Но давайте сконцентрируемся на всём объекте рассмотрения. Итак, кроме неплохо рассмотренной электронной оболочки, второй составляющей атома является ядро. Оно состоит из позитивно заряженных протонов и нейтральных нейтронов. Все мы знакомы с таблицей Менделеева. Номер каждого элемента соответствует количеству протонов, что в нём есть. Количество нейтронов равняется разнице между массой атома и его количеством протонов. Могут и быть отклонения от этого правила. Тогда говорят о том, что присутствует изотоп элемента. Схема строения атома такова, что его «окружает» электронная оболочка. обычно равняется количеству протонов. Масса последнего примерно в 1840 раз больше, чем у первого, и примерно равна весу нейтрона. Радиус ядра составляет около 1/200000 диаметра атома. Сам он имеет сферическую форму. Таково, в общем, строение атомов химических элементов. Несмотря на различие в массе и свойствах, выглядят они примерно одинаково.
Орбиты
Говоря о том, что такое схема строения атома, нельзя умолчать о них. Итак, есть такие виды:
- s. Имеют сферическую форму.
- p. Являются похожими на объемные восьмерки или веретено.
- d и f. Имеют сложную форму, которая с трудом описывается формальным языком.
Электрон каждого типа можно с вероятностью в 95% найти на территории соответствующей орбитали. К представленной информации необходимо относиться спокойно, поскольку это, скорее, абстрактная математическая модель, нежели физическое реальное положение дел. Но при всём этом она обладает хорошей предсказательной силой относительно химических свойств атомов и даже молекул. Чем дальше от ядра расположен уровень, тем больше электронов можно на нём разместить. Так, количество орбиталей можно подсчитать с помощью специальной формулы: х 2 . Здесь х равно количеству уровней. А поскольку на орбитали можно разместить до двух электронов, то в конечном итоге формула их численного поиска будет выглядеть следующим образом: 2х 2 .
Орбиты: технические данные
Если говорить про строение атома фтора, то он будет иметь три орбитали. Все они будут заполнены. Энергия орбиталей в рамках одного подуровня одинакова. Чтобы их обозначить, добавляют номер слоя: 2s, 4p, 6d. Возвращаемся к разговору про строение атома фтора. У него будет два s- и один p-подуровень. У него девять протонов и столько же электронов. Сначала один s-уровень. Это два электрона. Потом второй s-уровень. Ещё два электрона. И 5 заполняют p-уровень. Вот такое у него строение. После прочтения следующего подзаголовка можно собственноручно проделать необходимые действия и убедиться в этом. Если говорить про к которым относится и фтор, то следует отметить, что они, хотя и в одной группе, полностью различаются по своим характеристикам. Так, их температура кипения колеблется от -188 до 309 градусов Цельсия. Так почему их объединили? Все благодаря химическим свойствам. Все галогены, а в наибольшей степени фтор обладают высочайшей окислительной способностью. Они реагируют с металлами и без проблем могут самостоятельно воспламеняться при комнатной температуре.
Как заполняются орбиты?
По каким правилам и принципам располагаются электроны? Предлагаем ознакомиться с тремя основными, формулировка которых была упрощена для лучшего понимания:
- Принцип наименьшей энергии. Электронам свойственно заполнять орбитали в порядке увеличения их энергии.
- Принцип Паули. На одной орбитали не может располагаться больше двух электронов.
- Правило Хунда. В пределах одного подуровня электроны заполняют сначала свободные орбитали, и только потом образуют пары.
В деле заполнения поможет и строение атома в таком случае станет более понятным в плане изображения. Поэтому при практической работе с построением схем элементов, необходимо держать её под рукой.
Пример
Для того, чтобы обобщить всё сказанное в рамках статьи, можно составить образец, как же распределяются электроны атома по своим уровням, подуровням и орбиталям (то есть, какой является конфигурация уровней). Он может быть изображен как формула, энергетическая диаграмма или как схема слоев. Здесь присутствуют очень хорошие иллюстрации, которые при внимательном рассмотрении помогают понять структуру атома. Так, сначала заполняется первый уровень. В нём имеется только один подуровень, в котором только одна орбиталь. Все уровни заполняются последовательно, начиная с меньшего. Сначала в рамках одного подуровня по одному электрону размещается на каждой орбитали. Потом создаются пары. И при наличии свободных происходит переключение на другой субъект заполнения. А теперь можно самостоятельно узнать, каково строение атома азота или фтора (который рассматривался раньше). Первоначально может быть немного сложно, но можно ориентироваться по картинкам. Давайте для ясности рассмотрим и строение атома азота. Он имеет 7 протонов (вместе с нейтронами составляющих ядро) и столько же электронов (которые составляют электронную оболочку). Сначала заполняется первый s-уровень. На нем 2 электрона. Потом идёт второй s-уровень. На ней тоже 2 электрона. И три остальных размещаются на p-уровне, где каждый из них занимает по одной орбитали.
Заключение
Как видите, строение атома — не такая сложная тема (если подходить к ней с позиции школьного курса химии, конечно). И понять данную тему не составляет труда. Напоследок хочется сообщить про некоторые особенности. К примеру, говоря про строение атома кислорода, мы знаем, что он имеет восемь протонов, и 8-10 нейтронов. И так как все в природе стремится к равновесию, два атома кислорода образуют молекулу, где два непарных электрона образуют ковалентную связь. Подобным же образом образуется другая стойкая молекула кислорода — озон (O 3). Зная строение атома кислорода, можно правильно составлять формулы окислительных реакций, в которых участвует самое распространенное на Земле вещество.
Схемы строения атомов — Справочник химика 21
Схему строения атомов можно изобразить следующим образом [c.376]
Составить электронные схемы строения атомов калия и цезия. Какой из этих элементов является более сильным восстановителем Почему [c.263]
Изобразите электронные схемы строения атомов элементов с порядковыми номерами 15, 20, 36, 40, 47. Укажите расположение этих элементов в периодической системе Д. И. Менделеева и их высшую валентность. [c.44]Изобразите электронные схемы строения атомов натрия, хлора, хрома, кальция и железа. [c.44]
Составить электронные схемы строения атомов щелочных металлов. Какой из них является наиболее сильным восстановителем Почему [c.231]
Нарисуйте схемы строения атомов С и 81. Разъясните, чем сходны и чем отличаются свойства этих элементов [c.357]
Нарисуйте схемы строения атомов элементов с № I по [c.44]
Срисуйте себе в тетрадь эту схему строения атома лития. [c.82]
Изобразить в виде схем строение атомов элементов, имеющих порядковые номера а) 6 б) 11 в) 20. [c.40]
Представить с помощью схем строения атомов процессы образования молекул следующих простых веществ а) водорода б) кислорода в) азота г) фтора. [c.42]
Наиболее проста схема строения атома водорода (порядковый номер равен 1). Его ядро имеет один элементарный положительный заряд и в поле ядра вращается один электрон. [c.41]
В электронных схемах строения атомов следующих элементов подчеркнуть атомные остовы и указать число валентных электронов в атоме каждого элемента [c.36]
Подсчитать общее число электронов в каждом случае, указать положительный заряд ядра представ ить электронные схемы строения атомов подобно тому, как это сделано в задаче 17, Назвать элементы, схемы строения электронных оболочек которых даны выше. [c.37]
Представить схемы строения атомов и отвечающих им ионов следующих элементов с разбивкой электронов по квантовым уровням, атомные остовы подчеркнуть, как это выполнено в примере (а) [c.38]
Начертите электронные схемы строения атомов элементов, имеющих порядковые номера 14, 15, 16 и 17. [c.176]
Изобразите схемы строения атома и иона натрия. [c.44]
Неправильно. Вы только что сами срисовывали схему строения атома водорода и записывали символы составляющих его частиц. [c.73]
Второй учащийся запишите в тетради схемы строения атомов кремния (порядковый № 14) и олова (№ 50). [c.130]
Составить электронные схемы строения атомов бериллия, магния и щелочноземельных металлов. [c.330]
Неправильно. Вы сами только что срисовывали схему строения атома водорода, поэтому должны знать, что он состоит всего из двух частиц. [c.88]
Наиболее проста схема строения атома водорода (порядковый номер равен 1). Его ядро имеет один элементарный положительный заряд, и вокруг ядра вращается один электрон. Ядро атома водорода — элементарная частица, которую называют протоном. [c.67]
Начертите электронные схемы строения атомов первых четырех элементов четвертого периода, укажите наибольшую валентность этих элементов и изобразите символами соответствующие ионы., [c.176]
Цель на основе использования ранее приобретенных знаний о строении атомов составить схемы строения атомов элементов подгруппы углерода, сделать заключение о сходстве и различии строения этих атомов и предположение о свойствах данных элементов. [c.130]
Первый учащийся запишите в тетради схемы строения атомов углерода (порядковый № 6) и германия (№ 32). [c.130]
Изобразить схему строения атома серы. [c.97]
Содержание пособия используют для иллюстрации высказанной мысли, ее конкретизации с целью создания более ясного представления об изучаемом явлении. В этом отношении большое значение имеют экранные пособия, в которых последовательность видеоряда соответствует последовательности содержания изложения. Такие экранные средства особенно эффективны для закрепления и совершенствования знаний учащихся. В их отдельные кадры или графопособия включаются закономерности изменения физических констант веществ, схемы строения атомов и молекул, процессы разрыва и образования новых химических связей, энергетические эффекты химических взаимодействий. [c.120]
При составлении таблицы учащимся разрещается пользоваться учебником. Из него они могут извлечь данные о строении атома хрома. Затем по аналогии, а также с учетом числа электронных слоев и максимального количества электронов для каждого слоя записывают схемы строения атомов молибдена и вольфрама. [c.147]
А1. Еслн химическому элементу соответствует схема строения атома [c.5]
Ц м о л и п ычуг- «. Jтo важное-положение-тгостгг-нгтзва ние правила Хиноа. Из двух приведенных схем строения атома азота устойчивому состоянию (с наименьшей энергией) отвечает первая, где все р-электроны занимают разные орбитали. [c.29]
Наряду с проблемным обучением, постоянно используется в процессе изучения периодического закона работа с карточками, на которых учащиеся записывают известные им сведения о каждом элементе. Работа с карточками не ограничивается только этапом выведения периодического закона. Учащиеся пользуются ими постоянно в ходе изучения темы на разных дидактических этапах. На карточке отмечают химический знак элемента, характер его свойств, высшую валентность в оксидах, формулы оксидов, валентность в летучих водородных соединениях и гидридах, схемы строения атомов, степень окисления элементов и т. д. Карточки позволяют эффективно организовать самостоятельную работу. Они используются как справочные материалы, способствуют выработке умений пользоваться периодической системой. [c.228]
Привести схему строения атомов хрома, молибдена и вольфрама. Какой из этих элементов должен проявлять металлические свойства в меньшей степени Ответ мотивировать. [c.274]
На рис. 20 приведены схемы строения атомов элементов, имеющих заряд ядра от 1 до 18. [c.58]
Привести схемы строения атомов водорода (1), гелия (2), калия (19). В скобках указан заряд ядра атома. [c.59]
На рис. 29, 30 и 31 даны схемы строения атомов гелия, неона и натрия по Бору с орбитами, по которым движутся электроны. Ядро обозначено точкой внутри системы. [c.175]
Изобразить с помош,ьго схем строения атомов образование молекул следующих ветцеств а) фтористого калия КР б) хлористого магиия Mg l2 в) сернистого алюминия А125з г) азотного ангидрида N265. [c.42]
Каждому квадрату (называемому каОнтовой ячейкой) соответствует определенная орбиталь. В первой схеме все р-электроны имеют разные значения /я во второй — у двух р-электронов они одинаковы. Квантовая механика и анализ атомных спектров показывают, что заполнение орбиталей, отвечающее низшему энергетическому состоянию атома, происходит следующим образом. При заполнении подуровня электроны сначала располагаются по орбиталям, отвечающим различным значениям магнитного квантового числа, и только после того как все орбитали подуровня однократно заполнены, в орбиталях появляется по два электрона с противоположно направленными спинами . Иными словами, заполнение энергетических подуровней происходит таким образом, чтобы суммарный спин был максимальным. Это важное положение носит название правила Хунда. Из двух приведенных схем строения атома азота устойчивому состоянию (с наименьшей энергией) отвечает первая, где все р-электроны занимают разные орбитали. [c.32]
Составить э.пектронные схемы строения атомов щелочноземельных металлов. Какая степень окисления характерна для этих элементов Чем объяснить их более низкую восстановительную способность по сравнению со щелочными металлами [c.241]
Диаграммы Бора атомов и ионов
Цели
- Вспомните стабильность, связанную с атомом, который имеет полностью заполненную валентную оболочку
- Построить атом по модели Бора
Ключевые термины
- Правило октета: Правило, согласно которому атомы теряют, приобретают или делятся электронами, чтобы иметь полную валентную оболочку из 8 электронов. (Водород исключен, потому что он может удерживать максимум 2 электрона в своей валентной оболочке.)
- Электронная оболочка : Коллективные состояния всех электронов в атоме, имеющие одинаковое главное квантовое число (визуализированное как орбита, по которой движутся электроны).
Электронные оболочки
Нильс Бор предложил раннюю модель атома как центрального ядра, содержащего протоны и нейтроны, вращающиеся электронами в оболочках. Как обсуждалось ранее, существует связь между количеством протонов в элементе, атомным номером, который отличает один элемент от другого, и количеством электронов, которые он имеет.Во всех электрически нейтральных атомах количество электронов равно количеству протонов. Каждый элемент, когда он электрически нейтрален, имеет количество электронов, равное его атомному номеру.
Ранняя модель атома была разработана в 1913 году датским ученым Нильсом Бором (1885–1962). Модель Бора показывает атом как центральное ядро, содержащее протоны и нейтроны, с электронами на круговых орбиталях на определенных расстояниях от ядра (рис. \ (\ PageIndex {1} \)). Эти орбиты образуют электронные оболочки или уровни энергии, которые позволяют визуализировать количество электронов в различных оболочках.Эти уровни энергии обозначены числом и символом «n». Например, оболочка 1n представляет собой первый энергетический уровень, ближайший к ядру.
Рисунок \ (\ PageIndex {1} \): Модель Бора постулировала, что электрон вращается вокруг ядра в оболочках на фиксированном расстоянии.Электрон обычно существует в оболочке с наименьшей доступной энергией, которая является ближайшей к ядру. Энергия фотона света может подтолкнуть его к более высокой энергетической оболочке, но эта ситуация нестабильна, и электрон быстро распадается обратно в основное состояние.
Диаграммы Бора
Диаграммы Бора показывают электроны, вращающиеся вокруг ядра атома, чем-то вроде планет, вращающихся вокруг Солнца. В модели Бора электроны изображаются движущимися по кругу на разных оболочках в зависимости от того, какой элемент у вас есть. Рисунок \ (\ PageIndex {2} \) противопоставляет диаграммы Бора для атомов лития, фтора и алюминия. Оболочка, ближайшая к ядру, называется K-оболочкой, далее идет L-оболочка, затем M-оболочка.
Рисунок \ (\ PageIndex {2} \): диаграммы Бора для нейтральных атомов лития, фтора и алюминия.Каждая оболочка может содержать только определенное количество электронов. Оболочка K может иметь 2, L может иметь 8, M может иметь 18 электронов и так далее.
- Литий имеет три электрона:
- два идут в оболочку K и
- оставшийся идет в оболочку L.
- Электронная конфигурация — K (2), L (1)
- У фтора девять электронов:
- два идут в оболочку K и
- остальные семь идут в оболочку L.
- Электронная конфигурация — K (2), L (7). Обратите внимание, что L может иметь 8 электронов.
- Алюминий имеет тринадцать электронов:
- два идут на оболочку К,
- восемь идут в оболочку L, а
- оставшихся трех идут в оболочку M.
- Его электронная конфигурация — K (2), L (8), M (3). Обратите внимание, что оболочка M может иметь 18 электронов.
Орбитали в модели Бора
Электроны заполняют оболочки орбиты в последовательном порядке.В стандартных условиях атомы сначала заполняют внутренние оболочки (ближе к ядру), что часто приводит к переменному количеству электронов во внешней оболочке. Самая внутренняя оболочка имеет максимум два электрона, но следующие две электронные оболочки могут иметь максимум восемь электронов. Это известно как правило октета, которое гласит, что, за исключением самой внутренней оболочки, атомы более энергетически стабильны, когда у них есть восемь электронов в их валентной оболочке, самой внешней электронной оболочке.Примеры некоторых нейтральных атомов и их электронных конфигураций показаны на рисунке \ (\ PageIndex {3} \). Как показано, гелий имеет полную внешнюю электронную оболочку с двумя электронами, заполняющими его первую и единственную оболочку. Точно так же неон имеет полную внешнюю 2n-оболочку, содержащую восемь электронов. Напротив, хлор и натрий имеют семь и один электрон на своих внешних оболочках соответственно. Теоретически они были бы более энергетически стабильными, если бы следовали правилу октетов и имели восемь.
Рисунок \ (\ PageIndex {3} \):Диаграммы Бора
Диаграммы Бора показывают, сколько электронов заполняет каждую главную оболочку.Элементы группы 18 (показаны гелий, неон и аргон) имеют полную внешнюю или валентную оболочку. Полная валентная оболочка — наиболее стабильная электронная конфигурация. Элементы в других группах имеют частично заполненные валентные оболочки и приобретают или теряют электроны для достижения стабильной электронной конфигурации.
Атом может приобретать или терять электроны для достижения полной валентной оболочки, наиболее стабильной электронной конфигурации. Периодическая таблица разделена на столбцы и строки в зависимости от количества электронов и их расположения, что позволяет понять, как электроны распределяются во внешней оболочке атома.Как показано на фиг.1, группа из 18 атомов гелия (He), неона (Ne) и аргона (Ar) заполнила внешние электронные оболочки, что делает ненужным приобретение или потеря электронов для достижения стабильности; они очень стабильны как отдельные атомы. — \).Таким образом, столбцы периодической таблицы представляют потенциальное общее состояние внешних электронных оболочек этих элементов, которое отвечает за их схожие химические характеристики.
Символы Льюиса
Символы Льюиса — это упрощенные диаграммы Бора, которые отображают электроны только на внешнем энергетическом уровне.
Сводка
- В модели атома Бора ядро содержит большую часть массы атома в его протонах и нейтронах.
- По орбите положительно заряженного ядра вращаются отрицательно заряженные электроны, которые имеют небольшой вклад в массе, но электрически эквивалентны протонам в ядре.
- В большинстве случаев электроны сначала заполняют орбитали с более низкой энергией, затем следуют орбитали с более высокой энергией, пока она не заполнится, и так далее, пока не будут размещены все электроны.
- Атомы, как правило, наиболее стабильны с полной внешней оболочкой (которая после первой содержит 8 электронов), что приводит к тому, что обычно называют «правилом октетов».
- Свойства элемента определяются его внешними электронами или электронами на орбитали с наибольшей энергией.
- Атомы, у которых нет полных внешних оболочек, будут иметь тенденцию приобретать или терять электроны, в результате чего получается полная внешняя оболочка и, следовательно, стабильность.
Авторы и авторство
Без границ (www.boundless.com)
2.5: Расположение электрона (модель оболочки)
Электронная оболочка — это внешняя часть атома вокруг атомного ядра. Это группа атомных орбиталей с одинаковым значением главного квантового числа \ (n \). Электронные оболочки имеют одну или несколько электронных подоболочек или подуровней. Название электронных оболочек происходит от модели Бора, в которой считалось, что группы электронов обращаются вокруг ядра на определенных расстояниях, так что их орбиты образуют «оболочки».
Введение
Что еще мы могли бы узнать о структуре атома? Мы знаем, что атомы содержат положительно и отрицательно заряженные частицы, и что количество этих зарядов в каждом атоме различно для каждого элемента. Мы также знаем, что положительные заряды сосредоточены в крошечном ядре, и что электроны движутся вокруг ядра в пространстве, которое намного больше ядра.
Однако некоторые из наиболее важных вопросов, которые мы задавали в предыдущем исследовании разработки концепции, все еще остаются без ответа.Помните, что мы видели, что углерод и азот имеют очень похожие атомные массы. Теперь мы можем добавить, что эти элементы имеют очень похожие атомные номера, поэтому их атомы имеют одинаковое количество протонов и электронов. Но углерод и азот в большинстве химических и физических аспектов сильно различаются. Точно так же некоторые элементы, такие как натрий и калий, имеют очень разные атомные номера, но имеют очень похожие химические и физические свойства. Кажется, что сравнение свойств двух разных атомов не очень легко понять, просто сравнивая количество протонов и электронов, содержащихся в атомах.
Чтобы и дальше понимать ответы на эти вопросы, нам нужны еще более подробные сведения о структуре каждого типа атомов. Знание электронной конфигурации различных атомов полезно для понимания структуры периодической таблицы элементов. Эта концепция также полезна для описания химических связей, удерживающих атомы вместе.
Снаряды
Электронную оболочку можно представить как орбиту, по которой следуют электроны вокруг ядра атома. Поскольку каждая оболочка может содержать только фиксированное количество электронов, каждая оболочка связана с определенным диапазоном энергии электронов, и, таким образом, каждая оболочка должна полностью заполниться, прежде чем электроны могут быть добавлены к внешней оболочке.Электроны в самой внешней оболочке определяют химические свойства атома (см. Валентная оболочка). Для объяснения того, почему электроны существуют в этих оболочках, см. Конфигурацию электронов.
Рисунок \ (\ PageIndex {1} \) : Схема оболочки лития (слева) и натрия (справа)
Электронные оболочки обозначены буквами K, L, M, N, O, P и Q; или 1, 2, 3, 4, 5, 6 и 7; идет от самой внутренней оболочки наружу. Электроны во внешних оболочках имеют более высокую среднюю энергию и проходят дальше от ядра, чем электроны во внутренних оболочках.Это делает их более важными при определении того, как атом химически реагирует и ведет себя как проводник, потому что сила притяжения ядра атома на них слабее и легче разрушается. Таким образом, реакционная способность данного элемента сильно зависит от его электронной конфигурации.
Валентные электроны
Валентная оболочка — это самая внешняя оболочка атома в его несоединенном состоянии, которая содержит электроны, которые, скорее всего, объясняют природу любых реакций с участием атома и связывающих взаимодействий, которые он имеет с другими атомами.Валентные электроны — это электроны, которые связаны с атомом и могут участвовать в образовании химической связи; в одинарной ковалентной связи оба атома в связи вносят один валентный электрон для образования общей пары. Присутствие валентных электронов может определять химические свойства элемента и то, может ли он связываться с другими элементами: для элемента основной группы валентный электрон может находиться только во внешней электронной оболочке.
Атом с замкнутой оболочкой валентных электронов обычно химически инертен.Атом с одним или двумя валентными электронами больше, чем закрытая оболочка, очень реактивен, потому что лишние валентные электроны легко удаляются с образованием положительного иона. Атом с одним или двумя валентными электронами меньше, чем закрытая оболочка, также является высоко реактивным из-за тенденции либо получать недостающие валентные электроны (тем самым образуя отрицательный ион), либо делить валентные электроны (тем самым образуя ковалентную связь).
Подобно электрону во внутренней оболочке, валентный электрон обладает способностью поглощать или выделять энергию в виде фотона.Увеличение энергии может заставить электрон переместиться (прыгнуть) на внешнюю оболочку; это известно как атомное возбуждение. Или электрон может даже вырваться из валентной оболочки связанного с ним атома; это ионизация с образованием положительного иона. Когда электрон теряет энергию (тем самым вызывая излучение фотона), он может перемещаться во внутреннюю оболочку, которая не полностью занята.
Число валентных электронов элемента может быть определено группой периодической таблицы (вертикальный столбец), в которой этот элемент отнесен к категории.За исключением групп 3–12 (переходные металлы), цифра единиц номера группы указывает, сколько валентных электронов связано с нейтральным атомом элемента, указанного в этом конкретном столбце.
* Общий метод подсчета валентных электронов обычно не подходит для переходных металлов.
** За исключением гелия, который имеет только два валентных электрона.
Авторы
- Связи (Джон Хатчинсон)
- Википедия
Видео с вопросом: Определение структуры электронной оболочки атома кислорода
Стенограмма видео
На каком изображении показано расположение электронов в атоме кислорода?
Нам дали пять диаграммы электронных оболочек.В середине рисунок ядро, намного, намного больше по сравнению с атомом, чем оно было бы на самом деле жизнь. Красные кружки с p — протоны, а белые кружки с n — нейтроны. Черные кружки — электронные оболочки, в которые может поместиться ограниченное количество электронов. А синие точки — это электроны.
Вопрос, о котором идет речь, рисунок, который показывает расположение электронов в атоме кислорода.Кислород — это элемент, который мы можем найти в периодической таблице. Здесь мы видим, что атомный количество кислорода восемь. Это означает, что каждый атом или ион Кислорода в ядре восемь протонов. Атомы нейтральны, а это значит, что мы нужно равное количество электронов и протонов. Первое, что мы можем сделать, это проверить все наши диаграммы изображают восемь протонов и восемь электронов.
Все ядра выглядят одинаково, и в каждом из них по восемь протонов.Это означает, что мы имеем дело с ядра кислорода, и мы можем перейти к следующему испытанию. Самый простой способ отсчитать электроны должны определить электронную конфигурацию каждой диаграммы. Мы делаем это, считая электроны в каждой оболочке, начиная с первой оболочки.
На первой диаграмме два электронов в первой электронной оболочке, их двое во второй, и есть четыре в третьем.Это правильное количество электроны, но мы вернемся к этому через мгновение. На второй диаграмме конфигурация два, шесть. И третий Диаграмма имеет конфигурацию ноль, восемь. Помните, ноль по-прежнему имеет значение потому что это внутренняя оболочка. На четвертой диаграмме конфигурация восемь. И на последней диаграмме конфигурация четыре, четыре.
Каждая электронная оболочка имеет фиксированную максимальное количество электронов, которое может вместить.Вы можете поместить два электрона в первая электронная оболочка и до восьми во второй. Другой принцип, который мы собираемся Чтобы найти ответ, можно сказать, что электроны занимают наиболее стабильное пространство. Для электронных оболочечных диаграмм это означает самую низкую доступную оболочку.
Итак, на первой диаграмме мы можем видите, что есть два электрона в самой нижней доступной оболочке. Это хорошо. Однако есть четыре электрона в третьей оболочке, когда во второй еще есть место.Значит, это неверно диаграмма. На второй диаграмме есть снова два электрона в первой электронной оболочке. А оставшиеся шесть из восемь электронов заполняют вторую оболочку должным образом. Итак, это правильный диаграмма. Но давайте посмотрим на остальные три так, на всякий случай.
На третьей диаграмме есть восемь электронов во второй оболочке, когда есть два свободных места в первый.Значит, это неверно конфигурация. Для четвертой диаграммы все электроны в первой электронной оболочке, что на шесть больше. И на последней диаграмме есть два слишком много электронов в первой электронной оболочке. Это означает, что на изображении правильное расположение электронов в атоме кислорода — это тот, у которого восемь протонов в ядре, два электрона в первой оболочке и шесть во второй.
Точечные символы Льюиса и структуры Льюиса
Представление валентных электронов в символах Льюиса
В символах Льюиса точки используются для визуального представления валентных электронов атома.
Цели обучения
Вспомните формализм структуры Льюиса для представления валентных электронов
Основные выводы
Ключевые точки
- Электроны существуют вне ядра атома и находятся на основных энергетических уровнях, которые содержат только определенное количество электронов.
- Самый внешний главный энергетический уровень, содержащий электроны, называется валентным уровнем и содержит валентные электроны.
- символов Льюиса — это диаграммы, которые показывают количество валентных электронов определенного элемента с точками, которые представляют неподеленные пары.
- Символы Льюиса не визуализируют электроны на внутренних основных энергетических уровнях.
Ключевые термины
- основные энергетические уровни : различные уровни, на которых могут находиться электроны и которые находятся на определенных расстояниях от ядра атома.Каждый уровень связан с определенным значением энергии электронов внутри него.
- валентный уровень : Самый внешний главный энергетический уровень, который является наиболее удаленным от ядра, которое все еще содержит электроны.
- валентные электроны : электроны атомов, участвующие в образовании химических связей.
- Символы Льюиса : Символы элементов с их количеством валентных электронов, представленные точками
символов Льюиса (также известных как точечные диаграммы Льюиса или электронные точечные диаграммы) — это диаграммы, которые представляют валентные электроны атома.Структуры Льюиса (также известные как точечные структуры Льюиса или структуры с электронными точками) представляют собой диаграммы, которые представляют собой валентные электроны атомов внутри молекулы. Эти символы Льюиса и структуры Льюиса помогают визуализировать валентные электроны атомов и молекул, существуют ли они в виде неподеленных пар или внутри связей.
Основные уровни энергии
Атом состоит из положительно заряженного ядра и отрицательно заряженных электронов. Электростатическое притяжение между ними удерживает электроны «связанными» с ядром, поэтому они остаются на определенном расстоянии от него.Тщательные исследования показали, что не все электроны в атоме имеют одинаковое среднее положение или одинаковую энергию. Мы говорим, что электроны «находятся» на разных основных энергетических уровнях, и эти уровни существуют на разных радиусах от ядра и имеют правила относительно того, сколько электронов они могут вместить.
Основные энергетические уровни золота (Au) : На рисунке показана организация электронов вокруг ядра атома золота (Au). Обратите внимание, что первый энергетический уровень (ближайший к ядру) может иметь только два электрона, в то время как большее количество электронов может «уместиться» в пределах данного уровня дальше.Количество электронов на каждом уровне указано в правом верхнем углу рисунка. Обратите внимание, что на внешнем уровне находится только один электрон.
Например, нейтральный атом золота (Au) содержит 79 протонов в своем ядре и 79 электронов. Первый основной энергетический уровень, ближайший к ядру, может содержать максимум два электрона. Второй главный энергетический уровень может иметь 8, третий — 18 и так далее, пока не будут распределены все 79 электронов.
Самый внешний главный энергетический уровень представляет большой интерес в химии, потому что электроны, которые он удерживает, находятся дальше всего от ядра и, следовательно, наиболее слабо удерживаются его силой притяжения; чем больше расстояние между двумя заряженными объектами, тем меньшую силу они оказывают друг на друга. Химическая реакционная способность всех различных элементов периодической таблицы зависит от количества электронов на последнем, крайнем уровне, называемом валентным уровнем или валентной оболочкой.В случае золота на валентном уровне имеется только один валентный электрон.
Октет валентных электронов
Атомы приобретают, теряют или делят электроны на своем валентном уровне, чтобы достичь большей стабильности или более низкого энергетического состояния. С этой точки зрения связи между атомами образуются так, что связанные атомы находятся в более низком энергетическом состоянии по сравнению с тем, когда они были сами по себе. Атомы могут достичь этого более стабильного состояния, имея валентный уровень, содержащий столько электронов, сколько он может удерживать.Для первого основного энергетического уровня наличие двух электронов на нем является наиболее стабильным расположением, в то время как для всех других уровней, кроме первого, восемь электронов необходимы для достижения наиболее стабильного состояния.
Символы Льюиса
В символе Льюиса для атома записан химический символ элемента (как указано в периодической таблице), а валентные электроны представлены в виде окружающих его точек. В этом обозначении показаны только электроны на валентном уровне.Например, символ углерода Льюиса изображает «C’, окруженный 4 валентными электронами, потому что углерод имеет электронную конфигурацию 1s 2 2s 2 2p 2 .
Символ Льюиса для углерода : Каждый из четырех валентных электронов представлен точкой.
Электроны, не находящиеся на валентном уровне, не отображаются в символе Льюиса. Причина этого в том, что химическая реакционная способность атома элемента составляет исключительно , определяемых числом его валентных электронов, и , а не его внутренних электронов.Символы Льюиса для атомов объединяются для записи структур Льюиса для соединений или молекул со связями между атомами.
Написание символов Льюиса для атомов
Символ Льюиса для атома изображает его валентные электроны в виде точек вокруг символа элемента.
Цели обучения
Запишите символы Льюиса для атомов
Основные выводы
Ключевые точки
- Столбцы или группы в периодической таблице используются для определения количества валентных электронов для каждого элемента.
- Благородные / инертные газы химически стабильны и имеют полную валентность электронов.
- Другие элементы вступают в реакцию, чтобы достичь той же стабильности, что и благородные газы.
- символов Льюиса представляют валентные электроны в виде точек, окружающих элементарный символ атома.
Ключевые термины
- группа : Столбец в периодической таблице, который состоит из элементов с аналогичной химической реакционной способностью, поскольку они имеют одинаковое количество валентных электронов.
- Благородные газы : Инертные или инертные элементы последней группы периодической таблицы, которые обычно находятся в газообразной форме.
- Символ Льюиса : Формализм, в котором валентные электроны атома представлены в виде точек.
Определение количества валентных электронов
Чтобы написать символ Льюиса для атома, вы должны сначала определить количество валентных электронов для этого элемента. Составление таблицы Менделеева может помочь вам разобраться в этой информации.Поскольку мы установили, что количество валентных электронов определяет химическую реакционную способность элемента, таблица упорядочивает элементы по количеству валентных электронов.
Каждый столбец (или группа) периодической таблицы содержит элементы с одинаковым количеством валентных электронов. Кроме того, количество столбцов (или групп) с левого края таблицы сообщает нам точное количество валентных электронов для этого элемента. Напомним, что любой валентный уровень может иметь до восьми электронов, за исключением первого основного энергетического уровня, которого может быть только два.
Периодическая таблица элементов : Номера групп, показанные римскими цифрами (над таблицей), говорят нам, сколько валентных электронов существует для каждого элемента.
В некоторых периодических таблицах номера групп указаны арабскими числами, а не римскими. В этом случае группы переходных металлов включаются в подсчет, а группы, указанные в верхней части периодической таблицы, имеют номера 1, 2, 13, 14, 15, 16, 17, 18. Используемые соответствующие римские цифры — I, II, III, IV, V, VI, VII, VIII.
Обзор групп в периодической таблице
Возьмем первый столбец или группу периодической таблицы (обозначенные «I»): водород (H), литий (Li), натрий (Na), калий (K) и т. Д. Каждый из этих элементов имеет один валентный электрон. Второй столбец или группа (обозначенная «II») означает, что бериллий (Be), магний (Mg), кальций (Ca) и т. Д. Имеют два валентных электрона.
Средняя часть периодической таблицы, которая содержит переходные металлы, пропущена в этом процессе по причинам, связанным с электронной конфигурацией этих элементов.
Переходя к столбцу, обозначенному «III», мы обнаруживаем, что эти элементы (B, Al, Ga, In,…) имеют три валентных электрона на их внешнем или валентном уровне.
Мы можем продолжать эту проверку групп, пока не дойдем до восьмой и последней колонки, в которой перечислены наиболее стабильные элементы. Все они являются газообразными при нормальных условиях температуры и давления и называются «благородными газами». Неон (Ne), аргон (Ar), криптон (Kr) и т. Д. Каждый содержит по восемь электронов на своем валентном уровне.Следовательно, эти элементы имеют полный уровень валентности, который имеет максимальное возможное количество электронов (). Гелий (He) в самом верху этого столбца является исключением, потому что он имеет два валентных электрона; его валентный уровень является первым основным энергетическим уровнем, который может иметь только два электрона, поэтому он также имеет максимальное количество электронов на своем валентном уровне.
Символ Льюиса для гелия : Гелий является одним из благородных газов и содержит полную валентную оболочку.В отличие от других благородных газов в группе 8, гелий содержит только два валентных электрона. В символе Льюиса электроны изображены в виде двух неподеленных пар точек.
Благородные газы представляют собой элементы такой стабильности, что они не обладают химической реакционной способностью, поэтому их можно назвать инертными . Другими словами, им не нужно связываться с какими-либо другими элементами, чтобы достичь более низкой энергетической конфигурации. Мы объясняем это явление, приписывая их стабильность наличию «полного» уровня валентности.
Значение для понимания природы стабильности благородных газов состоит в том, что оно помогает нам предсказать, как другие элементы будут реагировать, чтобы достичь такой же электронной конфигурации, как благородные газы, за счет наличия полного уровня валентности.
Написание символов Льюиса для атомов
символов Льюиса для элементов изображают количество валентных электронов точками. В соответствии с тем, что мы обсуждали выше, вот символы Льюиса для первых двадцати элементов периодической таблицы.Более тяжелые элементы будут следовать одним и тем же тенденциям в зависимости от их группы.
Как только вы можете нарисовать символ Льюиса для атома, вы можете использовать знание символов Льюиса для создания структур Льюиса для молекул.
Валентные электроны и периодическая таблица : Электроны могут населять ряд энергетических оболочек. Разные оболочки находятся на разном расстоянии от ядра. Электроны во внешней электронной оболочке называются валентными электронами и отвечают за многие химические свойства атома.В этом видео рассказывается, как найти количество валентных электронов в атоме в зависимости от его столбца в периодической таблице.
Введение в структуры Льюиса для ковалентных молекул
В ковалентных молекулах атомы разделяют пары электронов для достижения полного валентного уровня.
Цели обучения
Предсказание и построение структуры Льюиса простых ковалентных молекул и соединений
Основные выводы
Ключевые точки
- Правило октетов гласит, что электронная конфигурация благородных газов является особенно благоприятной, что может быть достигнуто за счет образования электронных парных связей между атомами.
- Во многих атомах не все электронные пары, составляющие октет, являются общими для атомов. Эти неподеленные, несвязывающие электроны называются «неподеленными парами» электронов.
- Хотя неподеленные пары не принимают непосредственного участия в образовании связи, они всегда должны отображаться в структурах Льюиса.
- Существует логическая процедура, которой можно следовать, чтобы нарисовать структуру Льюиса молекулы или соединения.
Ключевые термины
- правило октетов : Атомы пытаются достичь электронной конфигурации ближайшего к ним благородного газа в периодической таблице, достигая уровня полной валентности с восемью электронами.
- исключения из правила октетов : водород (H) и гелий (He) нуждаются только в двух электронах, чтобы иметь полный уровень валентности.
- ковалентная связь : два атома имеют общие валентные электроны для достижения электронной конфигурации благородного газа.
- Структура Льюиса : Формализм, используемый для отображения структуры молекулы или соединения, в котором общие пары электронов между атомами обозначены штрихами. Также должны быть показаны несвязывающие неподеленные пары электронов.
Правило октета
Благородные газы, такие как He, Ne, Ar, Kr и т. Д., Стабильны, потому что их валентный уровень заполнен как можно большим количеством электронов. Восемь электронов заполняют валентный уровень для всех благородных газов, кроме гелия, который имеет двух электронов на его полном валентном уровне. Другие элементы в периодической таблице реагируют с образованием связей, в которых валентных электронов, , обмениваются или совместно используются , чтобы достичь заполненного валентного уровня, как и в благородных газах.Мы называем эту химическую тенденцию атомов «правилом октетов», и оно помогает нам предсказать, как атомы объединяются, образуя молекулы и соединения.
Ковалентные связи и диаграммы Льюиса простых молекул
Простейшим примером для рассмотрения является водород (H), который является наименьшим элементом в периодической таблице с одним протоном и одним электроном. Водород может стать стабильным, если он достигнет уровня полной валентности, как благородный газ, ближайший к нему в периодической таблице, гелий (He).Это исключения из правила октетов, потому что им требуется только 2 электрона, чтобы иметь полный уровень валентности.
Два атома H могут объединиться, и совместно используют каждого из своих электронов, чтобы создать «ковалентную связь». Общая пара электронов может считаться принадлежащей любому атому, и, таким образом, каждый атом теперь имеет два электрона на своем валентном уровне. , как он. В результате получается молекула H 2 , и это самая распространенная молекула во Вселенной.
Структура Льюиса двухатомного водорода : Это процесс, посредством которого образуется молекула H 2 .Два атома H, каждый из которых вносит электрон, разделяют пару электронов. Это известно как «одинарная ковалентная связь». Обратите внимание, как два электрона могут находиться в области пространства между двумя атомными ядрами.
Формализм Льюиса, используемый для молекулы H 2 , — это H: H или H-H. Первая, известная как «точечная диаграмма Льюиса», указывает на пару общих электронов между атомными символами, в то время как вторая, известная как «структура Льюиса», использует тире для обозначения пары общих электронов, которые образуют ковалентную связь. .Таким же образом изображаются и более сложные молекулы.
Точечная диаграмма Льюиса для метана : Показан метан с молекулярной формулой CH 4 . Электроны имеют цветовую кодировку, чтобы указать, каким атомам они принадлежали до образования ковалентных связей, красный цвет представляет водород, а синий — углерод. Формируются четыре ковалентные связи, так что C имеет октет валентных электронов, а каждый H имеет два валентных электрона — один от атома углерода и один от одного из атомов водорода.
Теперь рассмотрим случай фтора (F), который находится в группе VII (или 17) периодической таблицы. Таким образом, он имеет 7 валентных электронов, и для получения октета требуется еще 1. Один из способов, которым это может произойти, — это если два атома F образуют связь, в которой каждый атом обеспечивает один электрон, который может быть разделен между двумя атомами. В результате образуется молекула F 2 , а ее структура Льюиса — F-F.
Достижение октета валентных электронов : два атома фтора могут совместно использовать электронную пару, которая становится ковалентной связью.Обратите внимание, что участвуют только внешние (валентный уровень) электроны, и что в каждом атоме F 6 валентных электронов не участвуют в связывании. Это «неподеленные пары» электронов.
После образования связи каждый атом F имеет на своем валентном уровне 6 электронов, которые не используются для образования связи. Эти несвязывающие валентные электроны называются «неподеленными парами» электронов, и на диаграммах Льюиса следует всегда указывать , .
Структура Льюиса уксусной кислоты : Уксусная кислота, CH 3 COOH, может быть записана точками, указывающими общие электроны, или, предпочтительно, штрихами, представляющими ковалентные связи.Обратите внимание, что по-прежнему отображаются неподеленные пары электронов на атомах кислорода. У атома углерода метильной группы есть шесть валентных электронов от его связей с атомами водорода, потому что углерод более электроотрицателен, чем водород. Кроме того, один электрон получается из его связи с другим атомом углерода, потому что электронная пара в связи C-C разделена поровну.
Процедура построения простых структур Льюиса
Мы рассмотрели, как определить структуру Льюиса для простых молекул.Порядок действий следующий:
- Напишите структурную схему молекулы, чтобы четко показать, какой атом с которым связан (хотя существует много возможностей, мы обычно выбираем элемент с наибольшим количеством возможных связей в качестве центрального атома).
- Нарисуйте символы Льюиса отдельных атомов в молекуле.
- Соедините атомы таким образом, чтобы вокруг каждого атома располагалось восемь электронов (или два электрона для H, водорода), где это возможно.
- Каждая пара общих электронов представляет собой ковалентную связь, которую можно обозначить тире.
Альтернативный вид точечной структуры воды Льюиса : Такое расположение общих электронов между O и H приводит к тому, что атом кислорода имеет октет электронов, а каждый атом H имеет два валентных электрона.
Множественные связи могут также образовываться между элементами, когда две или три пары электронов совместно используются для образования двойных или тройных связей соответственно. Структура Льюиса для диоксида углерода, CO 2 , является хорошим примером этого.
Структура Льюиса диоксида углерода : Этот рисунок объясняет связывание в молекуле CO 2 . Каждый атом O начинается с шести (красных) электронов и C с четырьмя (черными) электронами, и каждая связь за атомом O и атомом C состоит из двух электронов от O и двух из четырех электронов от C.
Чтобы получить октет для всех трех атомов в CO 2 , две пары электронов должны быть разделены между углеродом и каждым кислородом.Поскольку в каждой связи участвует четыре электрона, образуется двойная ковалентная связь. Как видите, в этом случае правило октетов выполняется для всех атомов. Когда образуется двойная связь, вам все равно нужно показать все электроны, поэтому двойные черточки между атомами показывают, что четыре электрона являются общими.
Окончательная структура Льюиса для диоксида углерода : Ковалентные связи обозначены штрихами, а неподеленные пары электронов показаны парами точек. в диоксиде углерода каждый атом кислорода имеет две неподеленные пары электронов; каждая ковалентная связь между атомами кислорода и углерода использует два электрона атома кислорода и два электрона углерода.
Структуры Льюиса для многоатомных ионов
Структура Льюиса иона заключена в скобки, а его заряд записан в виде верхнего индекса вне скобок в правом верхнем углу.
Цели обучения
Применить правила рисования структур Льюиса к многоатомным ионам
Основные выводы
Ключевые точки
- Ионы обрабатываются почти так же, как и молекулы без заряда. Однако количество электронов должно быть скорректировано с учетом чистого электрического заряда иона.
- При подсчете электронов отрицательные ионы должны иметь дополнительные электроны, помещенные в их структуры Льюиса, тогда как положительные ионы должны иметь меньше электронов, чем незаряженная молекула.
Ключевые термины
- многоатомный ион : заряженная разновидность, состоящая из двух или более атомов, ковалентно связанных, или металлического комплекса, который действует как единое целое в кислотно-щелочной химии или при образовании солей. Также известен как молекулярный ион.
Общее количество электронов, представленных в структуре Льюиса, равно сумме чисел валентных электронов в каждом отдельном атоме.Невалентные электроны не представлены в структурах Льюиса. После того, как общее количество доступных электронов было определено, электроны должны быть помещены в структуру.
Структуры Льюиса для многоатомных ионов нарисованы теми же методами, которые мы уже изучили. При подсчете электронов отрицательные ионы должны иметь дополнительные электроны, помещенные в их структуры Льюиса; положительные ионы должны иметь меньше электронов, чем незаряженная молекула. Когда записывается структура Льюиса иона, вся структура помещается в скобки, а заряд записывается в виде надстрочного индекса в правом верхнем углу за пределами скобок.Например, рассмотрим ион аммония NH 4 + , который содержит 9 (5 от N и по 1 от каждого из четырех атомов H) –1 = 8 электронов. Вычитается один электрон, потому что вся молекула имеет заряд +1.
Координатная ковалентная связь : Ион аммония, Nh5 + , содержит 9–1 = 8 электронов.
Отрицательные ионы следуют той же процедуре. Ион хлорита, ClO 2 —, содержит 19 (7 от Cl и 6 от каждого из двух атомов O) +1 = 20 электронов.Один электрон добавлен, потому что вся молекула имеет заряд -1.
Ион гипохлорита, структура Льюиса : Ион гипохлорита, ClO — , содержит 13 + 1 = 14 электронов.
Общие правила отнесения электронов к атомным орбиталям
Цель обучения
- Определяет электронную конфигурацию элементов и ионов, определяя связь между электронными оболочками и подоболочками.
Ключевые точки
- Если энергия атома увеличивается, электрон в атоме возбуждается. Чтобы вернуться в основное состояние, электрон высвобождает энергию. Энергия света, высвобождаемого при понижении уровня энергии электрона, равна разнице в энергии между двумя уровнями.
- Если смотреть просто, электроны расположены в оболочках вокруг ядра атома. Ближайшие к ядру электроны будут иметь самую низкую энергию. Электроны, находящиеся дальше от ядра, будут иметь более высокую энергию.Электронная оболочка атома может вместить 2n 2 электронов (где n — уровень оболочки).
- В более реалистичной модели электроны движутся по атомным орбиталям или подоболочкам. Есть четыре различных формы орбиты: s, p, d и f. Внутри каждой оболочки подоболочка s имеет меньшую энергию, чем p. Орбитальная диаграмма используется для определения электронной конфигурации атома.
- Существуют рекомендации по определению электронной конфигурации атома. Электрон переместится на орбиталь с наименьшей энергией.Каждая орбиталь может содержать только одну электронную пару. Электроны будут максимально разделяться внутри оболочки.
Условия
- квантование Процесс аппроксимации непрерывного сигнала набором дискретных символов или целых значений.
- частота — количество повторений повторяющегося события в единицу времени.
Энергия электронов на атомных орбиталях
Центральная структура атома — это ядро, которое содержит протоны и нейтроны.Это ядро окружено электронами. Хотя все эти электроны имеют одинаковый заряд и одинаковую массу, каждый электрон в атоме имеет разное количество энергии. Электроны с наименьшей энергией находятся ближе всего к ядру, где сила притяжения положительно заряженного ядра наибольшая. Электроны с более высокой энергией находятся дальше.
Квантование энергии
Когда энергия атома увеличивается (например, когда вещество нагревается), энергия электронов внутри атома также увеличивается, то есть электроны возбуждаются.Чтобы возбужденный электрон вернулся к своей исходной энергии или основному состоянию, он должен высвободить энергию. Один из способов высвобождения энергии электроном — излучение света. Каждый элемент излучает свет определенной частоты (или цвета) при нагревании, что соответствует энергии электронного возбуждения.
Полезно думать об этом как о подъеме по лестнице. Если вы недостаточно поднимаете ногу, вы наткнетесь на ступеньку и застрянете на уровне земли. Чтобы двигаться дальше, нужно поднять ногу на высоту ступеньки.То же самое касается электронов и количества энергии, которое они могут иметь. Это разделение электронов на единицы энергии называется квантованием энергии, потому что есть только определенные количества энергии, которые электрон может иметь в атоме. Энергия света, высвобождаемого, когда электрон опускается с более высокого энергетического уровня на более низкий энергетический уровень, такая же, как разница в энергии между двумя уровнями.
Электронные оболочки
Мы начнем с очень простого способа показать расположение электронов вокруг атома.Здесь электроны расположены на энергетических уровнях или оболочках вокруг ядра атома. Электроны, которые находятся на первом уровне энергии (уровень энергии 1), находятся ближе всего к ядру и будут иметь самую низкую энергию. Электроны, находящиеся дальше от ядра, будут иметь более высокую энергию. Электронная оболочка атома может вместить 2n 2 электронов, где n — уровень энергии. Например, первая оболочка может вместить 2 x (1) 2 или 2 электрона. Вторая оболочка может вместить 2 x (2) 2 или 8 электронов.
Расположение электронов в атоме лития Литий (Li) имеет атомный номер 3, что означает, что в нейтральном атоме количество электронов будет 3. Уровни энергии показаны в виде концентрических кругов вокруг центрального ядра, и электроны размещены изнутри наружу. Первые два электрона находятся на первом энергетическом уровне, а третий электрон находится на втором энергетическом уровне.Например, фтор (F) имеет атомный номер 9, что означает, что нейтральный атом фтора имеет 9 электронов.Первые 2 электрона находятся на первом энергетическом уровне, а остальные 7 находятся на втором энергетическом уровне.
Атомные орбитали
Хотя электроны можно представить просто как вращающиеся вокруг ядра кольцами, в действительности электроны движутся по гораздо более сложным путям. Эти пути называются атомными орбиталями или подоболочками. Есть несколько различных форм орбит — s, p, d и f, но пока мы сосредоточимся в основном на s- и p-орбиталях. Первый энергетический уровень содержит только одну s-орбиталь, второй энергетический уровень содержит одну s-орбиталь и три p-орбитали, а третий энергетический уровень содержит одну s-орбиталь, три p-орбитали и пять d-орбиталей.В пределах каждого энергетического уровня s-орбиталь имеет более низкую энергию, чем p-орбитали.
Орбитальная диаграмма Положения первых десяти орбит атома на энергетической диаграмме. Обратите внимание, что каждый блок может удерживать два электрона.Орбитальная диаграмма помогает определить электронную конфигурацию элемента. Электронная конфигурация элемента — это расположение электронов в оболочках. Вот несколько рекомендаций по разработке этой конфигурации:
- Каждая орбиталь может содержать только два электрона.Электроны, которые встречаются вместе на орбитали, называются электронной парой.
- Электрон всегда будет пытаться войти на орбиталь с наименьшей энергией.
- Электрон может занимать орбиталь сам по себе, но он предпочел бы занять орбиталь с более низкой энергией вместе с другим электроном, прежде чем занимать орбиталь с более высокой энергией. Другими словами, в пределах одного энергетического уровня электроны заполнят s-орбиталь, прежде чем начнут заполнять p-орбитали.
- Подоболочка s может содержать 2 электрона.
- Р-подоболочки могут содержать 6 электронов.
Электронные конфигурации могут использоваться для рационализации химических свойств как в неорганической, так и в органической химии. Он также используется для интерпретации атомных спектров, метода, используемого для измерения энергии света, излучаемого элементами и соединениями.
Показать источникиBoundless проверяет и курирует высококачественный контент с открытой лицензией из Интернета. Этот конкретный ресурс использовал следующие источники:
Рисование атомов — Монтессори Muddle
В этом году я основывал свое введение в основы химии для учеников средней школы на основе периодической таблицы элементов.Однако первый шаг — научить их рисовать базовые модели атомов.
Я начал это с того, что ученики запомнили первые 20 элементов (от H до Ca) в правильном порядке — по атомным номерам — во время зимних каникул.
Схема атома кислорода.Чтобы у них был некоторый контекст, я рассмотрел основные части атома (протоны, нейтроны и электроны) и пояснил, что название элемента определяется исключительно количеством протонов. Я даже попросил их нарисовать несколько атомов с протонами и нейтронами в центре и электронами в оболочках.Поскольку я вылил все это на них за один урок, это, вероятно, было немного, но поскольку это было просто для того, чтобы дать им какой-то контекст, я не ожидал, что семиклассники, которые не видели этого раньше, вспомнят все это; для восьмиклассников это должен был быть просто обзор.
Большинство студентов хорошо запомнили. Кто-то нашел в Интернете песни, которые помогли, а кто-то просто протиснулся. Две недели зимнего перерыва для работы, вероятно, тоже помогли.
Когда мы вернулись в школу, я первым делом дал им схему верхней части таблицы Менделеева и попросил заполнить ее названиями элементов.
Шаблон для первых 20 элементов таблицы Менделеева. (pdf)После того, как они заполнили свой шаблон периодической таблицы, я более подробно рассмотрел части атомов и попросил их попрактиковаться. Я хотел, чтобы они запомнили следующие ключевые моменты:
- Атомный номер записывается нижним индексом слева от символа элемента.
Атомный номер — это количество протонов. Поскольку они запоминали элементы по порядку, они должны быть в состоянии выяснить это самостоятельно, но они также могут быстро найти это в периодической таблице или посмотреть на символ элемента, где атомный номер иногда написан внизу оставил.
- У атомов такое же количество электронов, что и у протонов. Протоны заряжены положительно, а электроны — отрицательно, поэтому для сбалансированного заряда у атома должно быть одинаковое количество обоих зарядов. Мы не будем говорить об ионах — где больше или меньше электронов — до позднего времени.
- Атомная масса (4) записывается в виде верхнего индекса слева от символа элемента. Атомная масса — это сумма количества протонов (2) и количества нейтронов (2).
Маленькие атомы, которые мы рассматриваем, , как правило, имеют такое же количество нейтронов, что и протоны, но это не обязательно так. Итак, как узнать, сколько нейтронов? Вы должны спросить или посмотреть на атомное массовое число, которое обычно пишется в верхнем левом углу атома. Поскольку атомная масса является суммой количества протонов и нейтронов, если вы знаете атомную массу и количество протонов, вы можете легко вычислить количество нейтронов. (Обратите внимание, что электроны не влияют на массу атома, потому что их массы намного меньше масс нейтронов и протонов.
- У этого атома кислорода 8 электронов в двух оболочках.
Электронные оболочки : Электроны вращаются вокруг ядра в серии оболочек. Каждая оболочка может содержать определенное максимальное количество электронов (2 для первой оболочки, 8 для второй оболочки и 8 для третьей). И чтобы нарисовать атомы, вы сначала заполняете внутренние оболочки, а затем переходите к внешним оболочкам.
Итак, если бы я написал на доске только символ элемента и его атомную массу, учащиеся смогли бы вычислить количество частиц.
Пример: Углерод-12
Например, наиболее распространенная форма (изотоп) углерода-12 записывается как:
- Протоны = 6 : Поскольку мы знаем, что атомный номер равен 6 (потому что мы его запомнили), у атома 6 протонов.
- Нейтронов = 6 : Поскольку атомная масса равна 12 (верхний левый от символа элемента), чтобы найти количество нейтронов, мы вычитаем количество протонов (12-6 = 6).
- Электронов = 6 : Этот атом сбалансирован по заряду, поэтому ему нужно шесть электронов с их отрицательными зарядами, чтобы компенсировать шесть положительных зарядов шести протонов.(Примечание: мы еще не говорили о несбалансированных заряженных атомах, но заряд будет отображаться в виде верхнего индекса справа от символа.)
- Электронные оболочки (2-4) : У нас шесть электронов, поэтому первые два идут на заполнение первой электронной оболочки, а остальные могут переходить во вторую оболочку, которая может содержать до 8 электронов. Это дает электронную конфигурацию 2-4.
Пример: Углерод-14
Углерод-14 — радиоактивный изотоп углерода, который часто используется при углеродном датировании исторических артефактов.Он записывается как:
- Протонов = 6 : Пока это углерод, в нем шесть протонов.
- Электронов = 6 : Этот атом также сбалансирован по заряду, поэтому ему также нужно шесть электронов.
- нейтронов = 8 : с атомной массой 14, когда мы вычитаем шесть протонов, количество нейтронов должно быть 8 (14-6 = 8).
Единственное различие между углеродом-12 и углеродом-14 состоит в том, что последний имеет еще два нейтрона. Следовательно, это два изотопа углерода.
Схема атома углерода-14.Пример: Гелий-4
Схема атома гелия-4.Пример: Натрий-23
Схема атома натрия-23.Примечание: изображение атома водорода можно найти здесь.
Обновление: я создал интерактивное приложение, которое будет рисовать атомы (первых 20 элементов), в дополнение к рабочему листу для студенческой практики.
Электронно-точечные диаграммы Льюиса
9.1 Электронно-точечные диаграммы Льюиса
Цель обучения
- Нарисуйте точечную диаграмму электронов Льюиса для атома или одноатомного иона.
Почти во всех случаях химические связи образуются за счет взаимодействия валентных электронов в атомах. Чтобы облегчить наше понимание того, как взаимодействуют валентные электроны, будет полезен простой способ представления этих валентных электронов.
Электронная точечная диаграмма Льюиса — представление валентных электронов атома с использованием точек вокруг символа элемента. (или электронно-точечная диаграмма, или диаграмма Льюиса, или структура Льюиса) представляет собой представление валентных электронов атома, в котором используются точки вокруг символа элемента.Количество точек равно количеству валентных электронов в атоме. Эти точки расположены справа и слева, а также над и под символом, не более двух точек по бокам. (Не имеет значения, в каком порядке используются позиции.) Например, электронно-точечная диаграмма Льюиса для водорода просто
.Поскольку сторона не важна, электронная точечная диаграмма Льюиса также может быть нарисована следующим образом:
Электронная точечная диаграмма для гелия с двумя валентными электронами выглядит следующим образом:
Помещая два электрона вместе на одной стороне, мы подчеркиваем тот факт, что оба эти электрона находятся в подоболочке 1 s ; это обычная конвенция, которую мы примем, хотя позже будут исключения.Следующий атом, литий, имеет электронную конфигурацию 1 с 2 2 с 1 , поэтому он имеет только один электрон на валентной оболочке. Его электронно-точечная диаграмма напоминает диаграмму водорода, за исключением того, что используется символ лития:
Бериллий имеет два валентных электрона в своей оболочке 2 s , поэтому его электронная точечная диаграмма похожа на диаграмму гелия:
Следующий атом — бор. Его валентная электронная оболочка составляет 2 s 2 2 p 1 , поэтому он имеет три валентных электрона.Третий электрон уйдет по другую сторону символа:
.Опять же, не имеет значения, с какой стороны символа расположены электронные точки.
Для углерода имеется четыре валентных электрона: два в подоболочке 2 s и два в подоболочке 2 p . Как обычно, мы нарисуем две точки вместе на одной стороне, чтобы представить 2 s электронов. Однако условно мы рисуем точки для двух электронов p с разных сторон.Таким образом, электронно-точечная диаграмма углерода выглядит следующим образом:
С N, который имеет три p электронов, мы помещаем по одной точке на каждой из трех оставшихся сторон:
Для кислорода, который имеет четыре электрона p , теперь мы должны начать удваивать точки на одной другой стороне символа. При удвоении электронов убедитесь, что на одной стороне не более двух электронов.
Фтор и неон имеют семь и восемь точек соответственно:
Со следующим элементом, натрием, процесс начинается с одного электрона, потому что у натрия есть единственный электрон в его оболочке с самым большим номером, оболочке n = 3.Просматривая периодическую таблицу, мы видим, что на электронных точечных диаграммах атомов Льюиса никогда не будет более восьми точек вокруг атомного символа.
Пример 1
Что такое электронная точечная диаграмма Льюиса для каждого элемента?
- алюминий
- селен
Решение
Конфигурация валентных электронов для алюминия: 3 с 2 3 p 1 .Таким образом, он будет иметь три точки вокруг символа алюминия, две из которых соединены в пару, чтобы представить 3 s электронов:
Конфигурация валентных электронов селена 4 с 2 4 p 4 . В оболочке с самым большим номером, оболочке n = 4, находится шесть электронов. Его электронная точечная диаграмма выглядит следующим образом:
Проверьте себя
Что такое электронная точечная диаграмма Льюиса для каждого элемента?
- фосфор
- аргон
Ответ
Для атомов с частично заполненными подоболочками d или f эти электроны обычно опускаются на электронных точечных диаграммах Льюиса.Например, электронная точечная диаграмма для железа (конфигурация валентной оболочки 4 s 2 3 d 6 ) выглядит следующим образом:
Элементы в одном столбце периодической таблицы имеют схожие электронные точечные диаграммы Льюиса, потому что у них одинаковая электронная конфигурация валентной оболочки. Таким образом, электронные точечные диаграммы для первого столбца элементов выглядят следующим образом:
Одноатомные ионы — это атомы, которые потеряли (для катионов) или приобрели (для анионов) электроны.Электронно-точечные диаграммы для ионов такие же, как и для атомов, за исключением того, что часть электронов удалена для катионов, а часть электронов добавлена для анионов. Таким образом, сравнивая электронные конфигурации и электронные точечные диаграммы для атома Na и иона Na + , мы отмечаем, что атом Na имеет один валентный электрон на своей диаграмме Льюиса, в то время как ион Na + потерял эту одну валентность. электрон:
Технически валентная оболочка иона Na + теперь представляет собой оболочку n = 2, в которой находится восемь электронов.Так почему бы нам не поставить восемь точек вокруг Na + ? Обычно, когда мы показываем электронные точечные диаграммы для ионов, мы показываем исходную валентную оболочку атома, которая в данном случае является оболочкой n = 3 и пуста в ионе Na + .
При создании катионов электроны сначала теряются из оболочки с наивысшим номером , необязательно из последней заполненной подоболочки. Например, при переходе от нейтрального атома Fe к иону Fe 2+ атом Fe сначала теряет два своих 4 s электронов, а не свои 3 d электронов, несмотря на то, что подоболочка 3 d заполняется последняя подоболочка.Таким образом, мы имеем
Анионы имеют лишние электроны по сравнению с исходным атомом. Вот сравнение атома Cl с ионом Cl — :
Пример 2
Что такое электронная точечная диаграмма Льюиса для каждого иона?
- Ca 2+
- О 2−
Решение
Потеряв два исходных валентных электрона, электронная точечная диаграмма Льюиса представляет собой просто Ca 2+ .
Ca 2+Ион O 2- получил два электрона в своей валентной оболочке, поэтому его электронная точечная диаграмма Льюиса выглядит следующим образом:
Проверьте себя
Валентная электронная конфигурация таллия, обозначенная символом Tl, равна 6 с 2 5 d 10 6 p 1 .Что такое электронная точечная диаграмма Льюиса для иона Tl + ?
Ответ
Основные выводы
- На электронных точечных диаграммах Льюиса точки используются для обозначения валентных электронов вокруг атомного символа.
- На электронных точечных диаграммах Льюиса для ионов меньше (для катионов) или больше (для анионов) точек, чем у соответствующего атома.
Упражнения
Объясните, почему первые две точки на электронной точечной диаграмме Льюиса нарисованы с одной стороны от символа атома.
Обязательно ли, чтобы первая точка вокруг атомного символа располагалась на определенной стороне атомного символа?
В каком столбце периодической таблицы есть электронные точечные диаграммы Льюиса с двумя электронами?
В каком столбце периодической таблицы есть электронные точечные диаграммы Льюиса с шестью электронами?
Нарисуйте электронную точечную диаграмму Льюиса для каждого элемента.
- стронций
- кремний
Нарисуйте электронную точечную диаграмму Льюиса для каждого элемента.
- криптон
- сера
Нарисуйте электронную точечную диаграмму Льюиса для каждого элемента.
- титан
- фосфор
Нарисуйте электронную точечную диаграмму Льюиса для каждого элемента.
- бром
- галлий
Нарисуйте точечную диаграмму электронов Льюиса для каждого иона.
- мг 2+
- С 2−
Нарисуйте точечную диаграмму электронов Льюиса для каждого иона.
- В +
- рублей —
Нарисуйте точечную диаграмму электронов Льюиса для каждого иона.
- Fe 2+
- N 3−
Нарисуйте точечную диаграмму электронов Льюиса для каждого иона.
- H +
- H —
ответов
Первые два электрона в валентной оболочке — это электронов, которые спарены.
второй столбец периодической таблицы
- мг 2+
- Fe 2+


 Развитие пространственного воображения.
Развитие пространственного воображения.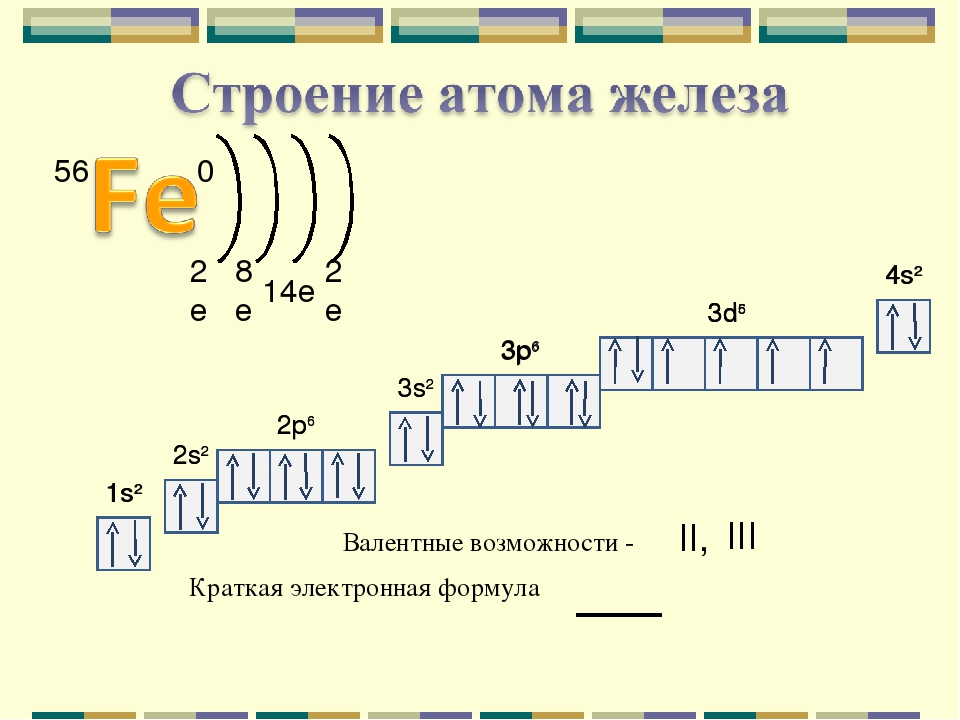 На данный момент известно, что электронная оболочка состоит из семи орбиталей…
На данный момент известно, что электронная оболочка состоит из семи орбиталей… Укажите символы называемых химических элементов (учитель называет элементы, учащиеся поднимают карточки с символами элементов) (фронтальная работа)
Укажите символы называемых химических элементов (учитель называет элементы, учащиеся поднимают карточки с символами элементов) (фронтальная работа) (электрон)
(электрон)

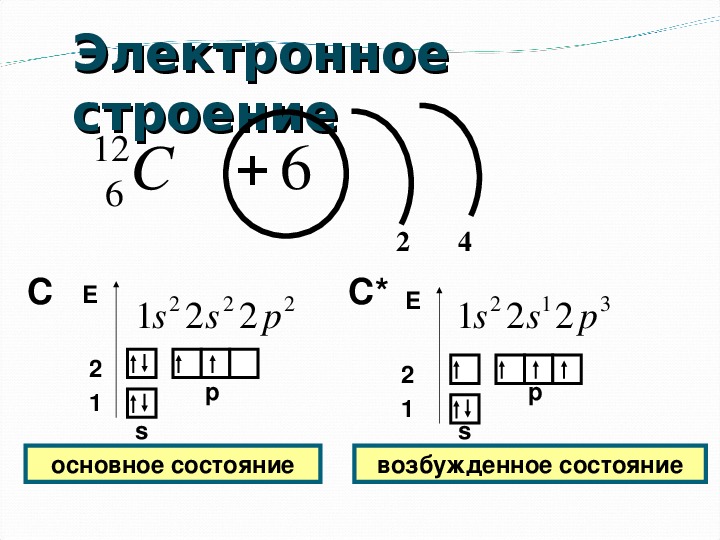
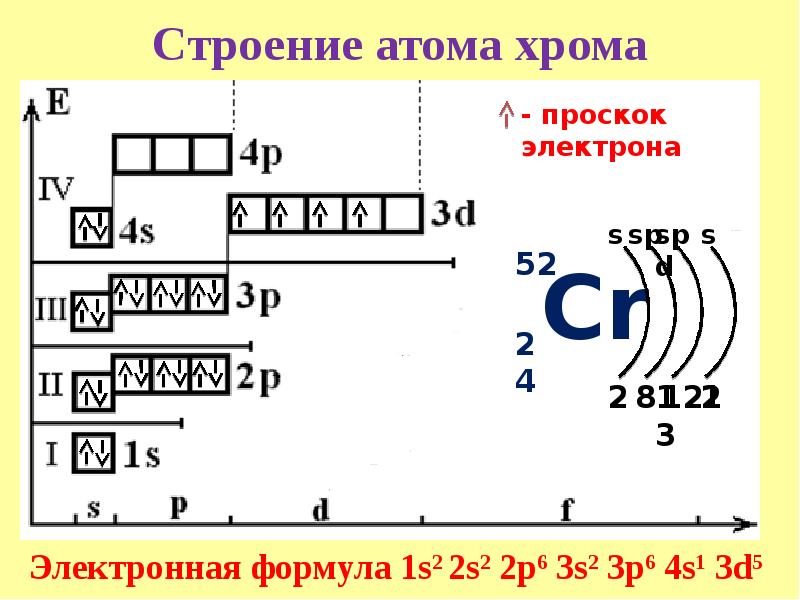 Записываем определение.
Записываем определение.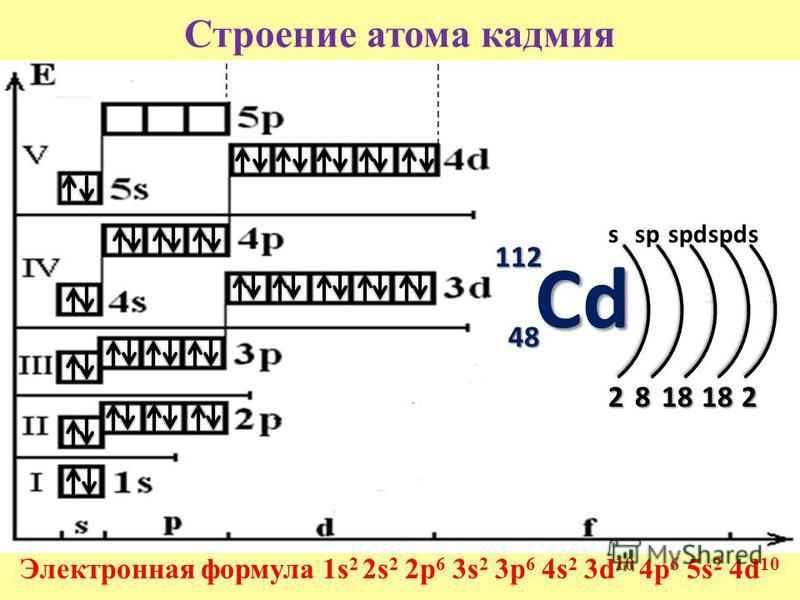
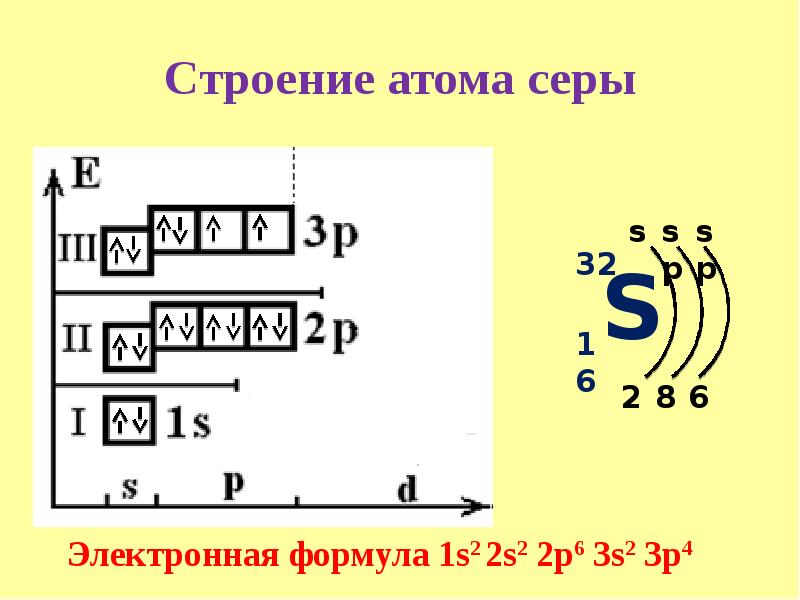 Записываем определение. Электрон может двигаться по сферообразной орбитали, такая орбиталь называется s-орбиталью. С такой орбитали начинается каждый уровень. Также электроны могут двигаться по гантелеообразным орбиталям, р-орбиталям. На каждом уровне обязательно располагается три р-орбитали. Они располагаются со второго уровня после s-орбитали. Каждая орбиталь вмещает максимум 2 электрона. Значит, на первом уровне может находиться только 2 электрона на s-орбитали. Второй уровень начинает заполняться с 2-х s-электронов и продолжит 6-тью р-электронами и т.д.
Записываем определение. Электрон может двигаться по сферообразной орбитали, такая орбиталь называется s-орбиталью. С такой орбитали начинается каждый уровень. Также электроны могут двигаться по гантелеообразным орбиталям, р-орбиталям. На каждом уровне обязательно располагается три р-орбитали. Они располагаются со второго уровня после s-орбитали. Каждая орбиталь вмещает максимум 2 электрона. Значит, на первом уровне может находиться только 2 электрона на s-орбитали. Второй уровень начинает заполняться с 2-х s-электронов и продолжит 6-тью р-электронами и т.д.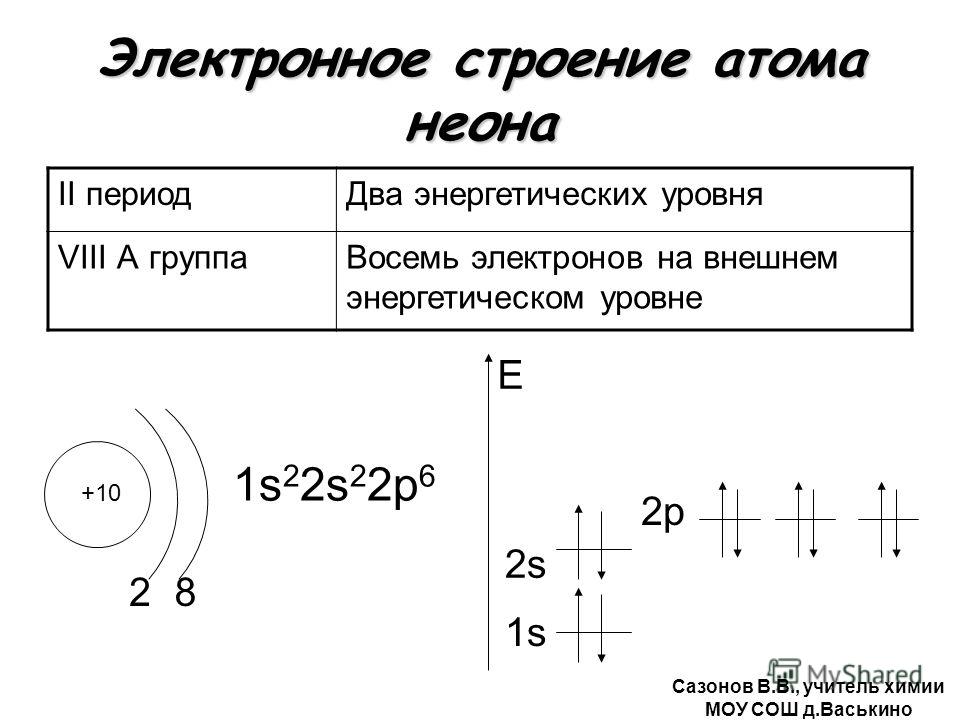 Для энергетических уровней это состояние полной завершенности. Поэтому атомы стремятся полностью заполнить внешний энергетический слой.
Для энергетических уровней это состояние полной завершенности. Поэтому атомы стремятся полностью заполнить внешний энергетический слой.
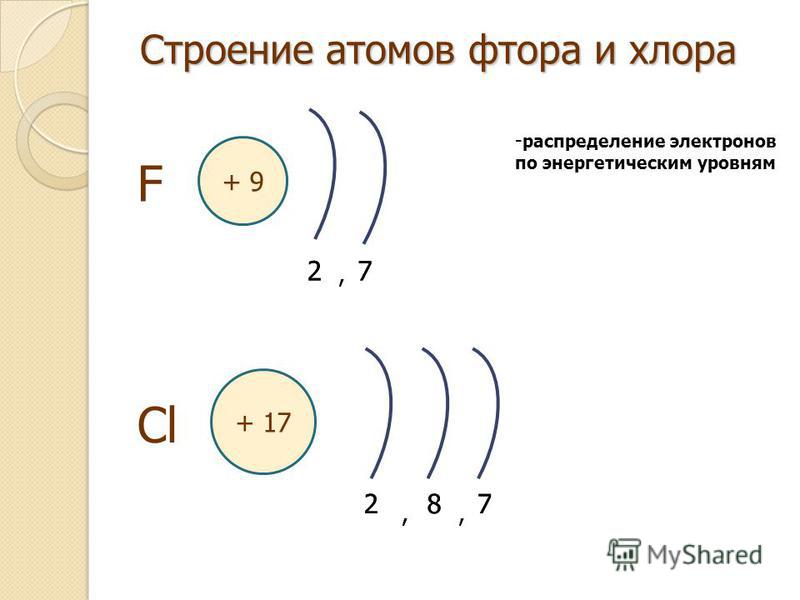 Как правильно составить схему строения атома?
Как правильно составить схему строения атома? Работа в парах по опорному конспекту.
Работа в парах по опорному конспекту. Группа химических элементов периодической системы Д. И. Менделеева, к которой принадлежит этот элемент
Группа химических элементов периодической системы Д. И. Менделеева, к которой принадлежит этот элемент  Наиболее ярко выражены неметаллические свойства у простого вещества, образованного атомами, которые имеют строение электронной оболочки
Наиболее ярко выражены неметаллические свойства у простого вещества, образованного атомами, которые имеют строение электронной оболочки Установите соответствие между массовым числом химического элемента и числом нейтронов в ядре атома этого элемента.
Установите соответствие между массовым числом химического элемента и числом нейтронов в ядре атома этого элемента. 35р 45п 35е
35р 45п 35е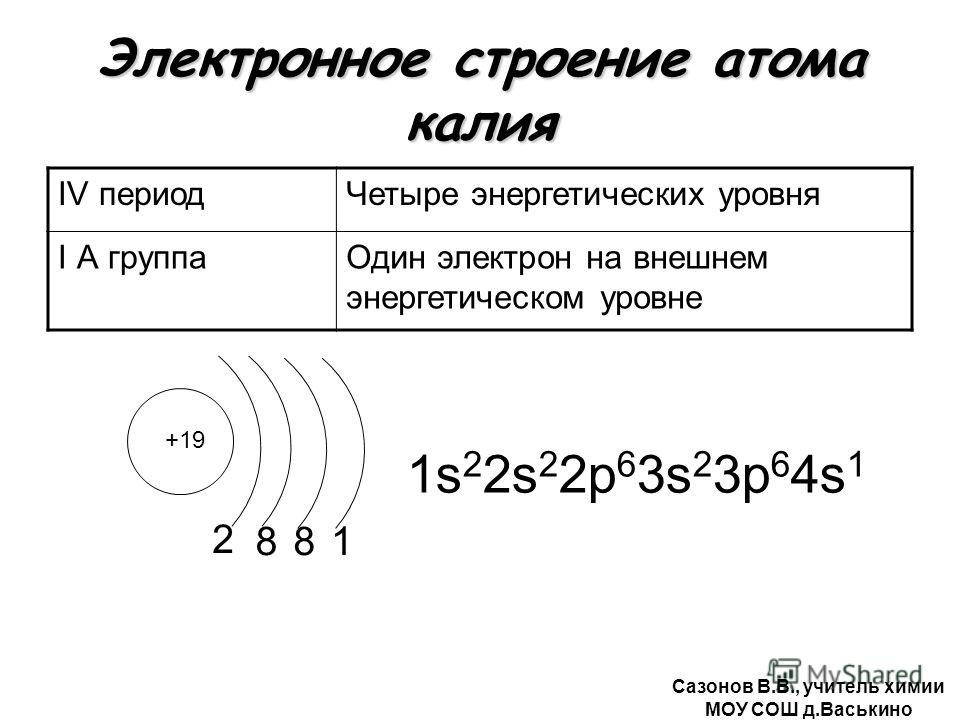 Задания для индивидуальной работы
Задания для индивидуальной работы