Контрольная работа №1 по теме «Строение и классификация органических соединений, химические реакции в органической химии»
Контрольная работа №1 по теме
«Строение и классификация органических соединений,
химические реакции в органической химии»
Вариант 1
1. Тип химической связи между атомами углерода в молекуле веществ, формулы которых С3Н4 и СН4
А. Одинарная и двойная Б. Двойная и одинарная
В. Тройная и двойная Г. Тройная и одинарная
2. Общая формула СnН2n соответствует:
А. Алканам Б. Алкенам. В. Алкинам. Г. Аренам. Д. Циклоалканам
3. Молекулярная формула углеводорода с относительной плотностью по водороду равна 28:
А. С4Н10. Б. С4Н8. В. С4Н6. Г. С3Н8. Д. С3Н6
4. Вещества, формулы которых СН2 = СН2 и СН2 = СН – СН2 – СН3, являются:
Вещества, формулы которых СН2 = СН2 и СН2 = СН – СН2 – СН3, являются:
А. Веществами разных классов. Б. Гомологами.
В. Изомерами. Г. Одним и тем же веществом.
5. Установите соответствие.
Формула соединения | Класс соединения |
А. С17Н35СООН | 1. Алканы |
Б. С6Н6 | 2. Алкены |
В. НСНО | 3. Алкины. |
Г. С2Н5ОН | 4. Арены |
Д. С5Н10 | 5. Альдегиды |
Е. | 6. Карбоновые кислоты |
Ж.С3Н4 | 7. Спирты |
6. Реакция дегидрирования – это….
7. Массовая доля углерода в пропилене С3Н6 равна:
А. 18,8%. Б. 40%. В. 60%. Г. 85,71%.
8. Количество вещества этана массой 1,6 г равно:
А. 1,5 моль. Б. 1 моль. В. 0,05 моль. Г. 0,1 моль.
9. Массовая доля водорода в углероде 14,3%, относительная плотность по водороду равна 21. Определите формулу.
10. Выведите истинную формулу органического соединения, содержащего 40,03% С, 6,67% Н, и 53,30% О. Молярная масса данного соединения равна 180 г/моль. Назовите вещество.
11. К какому типу относят реакцию, уравнение которой приведено ниже?
СН3 –СН3Ch3 =Ch3 + h3
12. Составьте структурные формулы изомеров состава С5Н10. Назовите вещества.
Составьте структурные формулы изомеров состава С5Н10. Назовите вещества.
Контрольная работа №1 по теме
«Строение и классификация органических соединений,
химические реакции в органической химии»
Вариант 2
1. Тип химической связи между атомами углерода в молекуле вещества, формула которого С2Н6 и С2Н4
А. Одинарная и двойная. Б. Двойная и тройная.
В. Тройная и одинарная Г. Одинарная и тройная
2. Общая формула СnН2n–2 соответствует:
А. Алканам. Б. Алкенам. В. Алкинам. Г. Аренам. Д. Алкадиенам
3. Молекулярная формула углеводорода с относительной плотностью по воздуху равна 1,034:
А. С2Н6. Б. С3Н8. В. С4Н8. Г. С5Н12. Д.С2Н2
4. Вещества, формулы которых СН3 – СН2ОН и СН3 – СНО, являются:
Вещества, формулы которых СН3 – СН2ОН и СН3 – СНО, являются:
А. Веществами разных классов. Б. Гомологами.
В. Изомерами. Г. Одним и тем же веществом.
5. Установите соответствие.
Формула соединения | Класс соединения |
А. С2Н2 | 1. Алканы |
Б. СН3СН2СООН | 2. Алкены |
В. СН3ОН | 3. Алкины. |
Г. С3Н8 | 4. Арены |
Д. С6Н6 | 5. Альдегиды |
Е. С2Н4О | 6. |
Ж. С5Н10 | 7. Спирты |
6. Реакция дегидратации это-
7. Массовая доля водорода в ацетилене С2Н2 равна:
А. 7,7%. Б. 83,3%. В. 92,3%. Г. 93,2%.
8. Количество вещества метана массой 16 г. равно:
А. 1 моль. Б. 2,5 моль. В. 0,1 моль. Г. 250 моль.
9. Выведите молекулярную формулу вещества по следующим данным: массовые доли углерода, кислорода и водорода соответственно равны 38,7%, 51,6% и 9,7%. Относительная плотность паров этого вещества по водороду равна 31. Назовите вещество.
10. Массовая доля углерода в углеводороде 90%, относительная плотность по водороду равна 20.
11. Взаимодействие этилена с хлором является реакцией? Напишите ее.
А. Замещения. Б. Изомеризации.
В. Присоединения. Г. Элиминирования.
Г. Элиминирования.
12. Составьте структурные формулы изомеров состава С6Н12. Назовите вещества.
Ответы
Контрольная работа №1 по теме
«Строение и классификация органических соединений,
химические реакции в органической химии»
1 вариант 1. г 2. б, д 3. б 4. б 5. а 6, б 4,в 5,г 7,д 2,е 1,ж 3. 6. отщепление 2-х атомов водорода 7. г 8. в 9. С3Н6 10.С6Н12О6 11. дегидрирования 12. пентен-1, Пентен-2,2-метилбутен1, 3-метилбутен 2 и т.д | 2 вариант 1. а 2. в, д 3. а 4. а 5. 6. отщепление молекулы воды 7. а 8. а 9. С2Н6О2 10. С3Н4 11. в 12. гексен 1,гексен 2, гексен3, 2-метилпентен 1, 3-метил пентен1. и тд. |
Контрольная работа по химии №1 «Строение и классификация органических соединений. Химические реакции в органической химии».
Контрольная работа № 1 по теме: 10 класс
«Строение и классификация органических соединений.
Химические реакции в органической химии».
Определить класс и привести название для веществ, формулы которых:
А) СН3 – СН = СН- СН3 Д) СН2=СН2
Б) СН3 –СН2 –ОН Е) НС = С – СН3
В) СН3 – СООН Ж) Н – С =О
Г) СН3 – СН2 –СН2 –СН3 \ Н
З) СН2 = СН – СН = С Н2
2. Какие из приведённых формул соответствуют изомерам, гомологам, а какие –
одному и тому же веществу? Укажите тип изомерии для изомеров и дайте
названия по систематической номенклатуре всем веществам.
А) СН3 –СН2 – СН2 –СН2 –СН3 Б) СН3 –СН2
В) СН3 –СН –СН3 |
| Ch3 –Ch3 –Ch4
CH2 –CH3 Г) СН3 –СН –СН2 –СН3 |
Д) СН3 –СН2 Ch4 Ch4
| | Е) СН2 =С –СН2 –Ch4
Ch3 –Ch3 |
Ch4
Ж) СН2 З) СН2 =СН –СН2 –СН2 –СН3
/ \ И) СН3 – СН2 –СН2 –СН3
Н2С СН2
| | К) СН2 = СН – СН3
Н2С – СН2
К какому типу относят реакции, уравнения которых приведены ниже?
А) СН3 –СНCl –Ch3 –Ch4 + NaOHCh4 –CH –Ch3 –Ch4 + NaCl
|
OH
Б) С6Н6 + 3Н2C6h22
В) СН3 –СН=СН –СН2 –СН3 + Н2ОСН3 –СН2 –СН –СН2 –СН3
|
OH
Г) СН3 –СН3Ch3 =Ch3 + h3
Д) СН3 –СН2 –ОНCh3 =Ch3 + h3O
4. Напишите структурные формулы:
А) 2,2,4-триметил -3,3 –диэтилгексен-5;
Б) 2,3 – дихлор -2,3 –диметил -4,4 –дипропилпентан.
Допишите фразы: «Изомеры – это вещества…»;
«Функциональная группа – группа атомов, которая…»;
1 положение теории А.М.Бутлерова – «Все атомы в молекуле находятся…»;
2 положение теории А.М.Бутлерова – «Свойства веществ зависят не только…»;
3 положение теории А.М.Бутлерова – «По свойствам веществ можно…, а по…»;
114160 (Система контрольных и зачетных работ по химии для учащихся 10-12 классов трехгодичного обучения вечерней школы) — документ
44
Ульяновский институт повышения квалификации и переподготовки
работников образования
Кафедра естествознания
Выпускная работа слушателя курсов повышения квалификации педагогического факультета, группы Х-1,
учителя химии вечерней (сменной) общеобразовательной школы № 5 Заволжского района г. Ульяновска
Поповой Натальи Анатольевны
Тема работы: «Система контрольных и зачетных работ по химии для учащихся 10-12 классов трехгодичного обучения вечерней школы»
Научный руководитель
зав. кафедрой естествознания
кафедрой естествознания
Ахметов М.А.
Ульяновск, 2003 г.
Содержание
1.Введение.
2.Задания зачетных и контрольных работ по химии
для 10-12 классов вечерней школы.
10 класс. Зачет № 1 по темам «Строение и классификация органических соединений. Химические реакции в органической химии» 10 класс. Контрольная работа № 1 по темам «Строение и классификация органических соединений. Химические реакции в органической химии 10 класс. Зачет № 2 по темам «Алканы и алкены 10
10 класс. Контрольная работа № 2 по темам «Алканы и алкены»
10 класс. Зачет № 3 по темам «Алкины. Диены.Циклоалканы. Арены» 10 класс. Контрольная работа № 3 по темам «Алкины. Диены. Циклоалканы. Арены»
11 класс. Зачет № 1 по темам «Спирты и фенолы. Альдегиды и кетоны» 11 класс. Контрольная работа № 1 по темам «Спирты и фенолы. Альдегиды и кетоны 21
11 класс. Зачет № 2 по темам «Карбоновые кислоты. Сложные эфиры и жиры»
11класс. Контрольная работа № 2 по темам «Карбоновые кислоты. Сложные эфиры и жиры»
11 класс. Зачет № 3 по темам «Углеводы. Азотсодержащие органические соединения»
11 класс. Контрольная работа № 3 по темам «Углеводы. Азотсодержащие органические соединения» 12 класс. Зачет № 1 по темам «Строение атома. ПСХЭ. Строение вещества» 12 класс. Контрольная работа № 1 по темам «Строение атома. ПСХЭ. Строение веществаЦ
12 класс. Зачет № 2 по теме « Химические реакции» 12 класс. Контрольная работа № 2 по теме «Химические реакции»
12 класс. Зачет № 3 по темам «Вещества и их свойства»
12 класс. Контрольная работа № 3 по темам «Вещества и их свойства»
3.Литература
1.Введение
Процесс преподавания химии в вечерней школе имеет свои особенности, обусловленные самой формой обучения. Среднее полное образование учащиеся получают не за два учебных года, а за три (10-12 классы). Учебный год, также как и в дневной школе, длится 34 учебные недели. Химия изучается все три года обучения по 2 часа в неделю. Таким образом, на весь курс химии учебным планом отведено 204 часа. Кроме того, предусмотрены консультационные и зачетные часы.
Таким образом, на весь курс химии учебным планом отведено 204 часа. Кроме того, предусмотрены консультационные и зачетные часы.
В целях обеспечения единства образовательного пространства учителя вечерних школ работают по тем же программам, что и в дневных школах. В 2003-2004 учебном году школа перешла на преподавание химии по программе О.С. Габриеляна 4.
Планирование учебного материала имеет следующие особенности. В 10 классе изучаются темы: строение и классификация органических соединений; химические реакции в органической химии. Углеводороды.
В 11 классе изучается материал о спиртах и фенолах, альдегидах и кетонах, карбоновых кислотах, сложных эфирах и жирах; углеводах и азотсодержащих органических соединениях.
Программа 12 класса соответствует программе 11 класса дневной школы (изучается строение атома, периодическая система химических элементов Д.И. Менделеева, строение вещества, химические реакции; вещества и их свойства).
Специфика обучения в вечерней школе предполагает, что учащиеся не всегда присутствуют на занятиях (ввиду условий труда и прочих причин), но получить оценку за полугодие и учебный год они могут, сдав все необходимые зачеты и выполнив контрольные работы.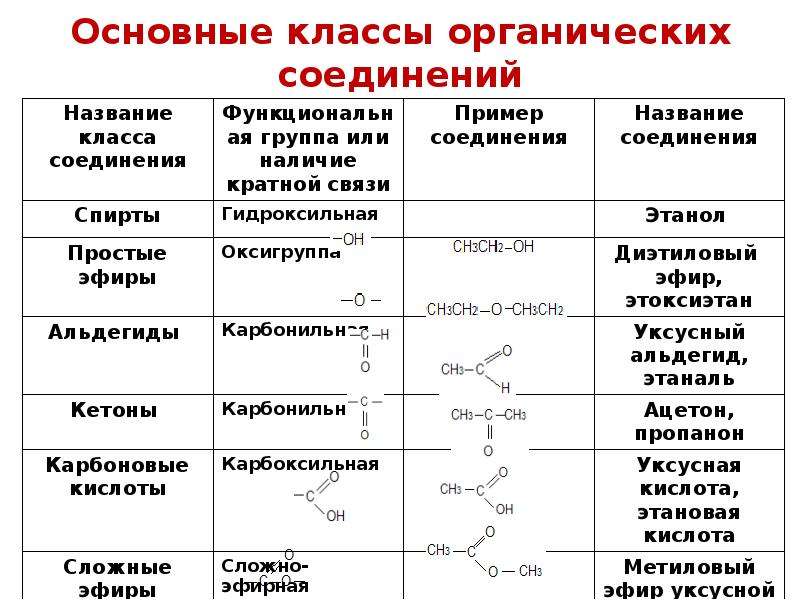 Кроме того, учащиеся имеют право досрочного перевода в выпускной класс (при условии сдачи экстерном всех зачетных и контрольных работ).
Кроме того, учащиеся имеют право досрочного перевода в выпускной класс (при условии сдачи экстерном всех зачетных и контрольных работ).
Таким образом, возникает настоятельная необходимость наличия системы контролирующих заданий, позволяющих определить уровень знания ученика по данной теме и оценить эти знания.
Требованиями к образовательному процессу в вечерней школе определено обязательное выделение в учебном материале каждого года обучения трех больших блоков, по каждому из которых проводится зачетная и контрольная работа.
В программе 10 года такими блоками являются:
-Строение и классификация органических реакций. Химические реакции в органической химии.
-Алканы и алкены.
-Алкины. Диены. Циклоалканы. Арены.
11 класс.
-Спирты и фенолы. Альдегиды и кетоны.
-Карбоновые кислоты. Сложные эфиры и жиры.
-Углеводы. Азотсодержащие органические соединения.
12 класс.
-Строение атома. Периодическая система химических элементов Д. И. Менделеева. Строение вещества.
И. Менделеева. Строение вещества.
-Химические реакции.
-Вещества и их свойства.
В методической литературе имеется много тестов, заданий для контрольных работ по химии 1,2,3,5,8 и др.. Однако они не могут быть использованы учителем вечерней школы, так как не учитывают специфику планирования учебного материала и процесса обучения в вечерней школе. Именно поэтому автором предпринята попытка написания данной работы.
Предлагаемый комплект контролирующих заданий по химии состоит из девяти зачетных и девяти контрольных работ, охватывающих содержание всего курса химии по программе О. С. Габриеляна 4. Каждая из работ в двух вариантах, уровень заданий общеобразовательный.
Задания для зачетов содержат, в основном, теоретические вопросы темы. Задания составлены в тестовой форме (для приучения учащихся к тестовому контролю). Некоторые вопросы тестов заимствованы из известных методических пособий по химии 1,2,3,5,8 ; многие задания оригинальны. Приведены также вопросы на ответы тестов и примерные критерии оценок, исходя из следующих параметров:
% правильных ответов | Оценка |
50-70 | 3 |
71-85 | 4 |
Более 86 | 5 |
Проверка логики изложения учебного материала, способности химически грамотно выражать свои мысли осуществляется при выполнении контрольной работы.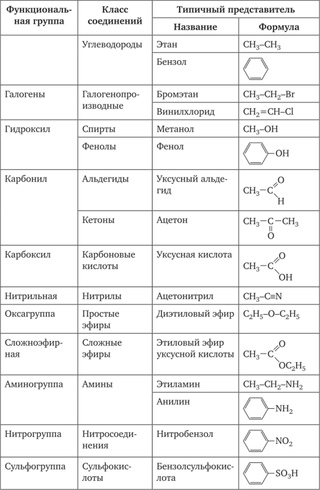 Задания для контрольных работ включают цепочки превращений на знание способов получения, химических свойств и номенклатуры веществ, написание формул гомологов и изомеров органических веществ, расчетные задачи.
Задания для контрольных работ включают цепочки превращений на знание способов получения, химических свойств и номенклатуры веществ, написание формул гомологов и изомеров органических веществ, расчетные задачи.
2.Задания зачетных и контрольных работ по химии для 10-12 классов вечерней школы.
10 класс
Зачет № 1 по темам
« Строение и классификация органических соединений. Химические реакции в органической химии»
Вариант 1
1.Тип гибридизации ключевых атомов углерода в молекуле
СН2 СН СН3
А) sp3 б) spв) sp2
2. Угол между осями углеродного атома для sp- гибридных орбиталей равен а) 109 28 б)120 в) 180
3. В sp2 –гибридизации не участвуют орбитали второго энергетического уровня атома углерода в количестве
а) одного б) двух в)трех
4.К классу алкенов относятся углеводороды с общей формулой
а) Сn Н 2n+2 б) Сn Н 2n в) Сn Н 2n-2
5. Соединения с замкнутой цепью атомов углерода в молекуле называютсяа) ациклическими б)карбоциклическими
Соединения с замкнутой цепью атомов углерода в молекуле называютсяа) ациклическими б)карбоциклическими
6. Все спирты имеют в названии суффикс
а) –ен б) –ол в) –аль
7.У изомеров одинаково
а) количество атомов
б) строение молекул
в) свойства
8.Вещества СН3 СН2 СН2 СН3 и СН3 СН СН3 являются
СН3
а) гомологамиб)изомерами в)ни гомологами, ни изомерами
9.Реакциями замещения называются…..
10.Реакция, уравнение которой СН3 СН2ОН СН2 СН2 + Н2О, относится к реакциям а) замещенияб) присоединения в) элиминирования.
11. Реакция, уравнение которой приведено в п.10,является реакцией
а) дегидрирования б) дегидратациив) дегидрохлорирования.
10 класс
Зачет № 1 по темам
« Строение и классификация органических соединений. Химические реакции в органической химии»
Вариант 2
1. Тип гибридизации атомов углерода в молекуле
Тип гибридизации атомов углерода в молекуле
СН3 СН2 СН2 СН3
А) sp2 б) sp3в) sp
2. Угол между осями углеродного атома для sp3— гибридных орбиталей равен а) 109 28 б)120 в) 180
3. В sp–гибридизации не участвуют орбитали второго энергетического уровня атома углерода в количестве
а) одного б) двух в) трех
4.К классу спиртов относятся органические вещества с функциональной группой
а) С О б) –ОН в) С О
НОН
5.Соединения с незамкнутой цепью атомов углерода в молекуле называютсяа) ациклическими б) карбоциклическими
6. Все спирты имеют в названии суффикс
а) –ен б) –ол в) –аль
7.Изомеры отличаются друг от друга
а) количеством атомов
б) строением молекул
в) свойствами
8.Вещества СН3 СН2 СН3 и СН3 СН2 СН СН3 являются
СН3
а) гомологамиб) изомерами в) ни гомологами, ни изомерами.
9.Реакциями элиминирования называются…..
10.Реакция, уравнение которой
СН3 СНСН2 + Н2 СН3 СН2 СН3, относится к реакциям
а) замещения б) присоединения в) элиминирования.
11. Реакция, уравнение которой приведено в п.10, является реакцией
а) гидрирования б) галогенированияв) полимеризации.
Ключ для проверки теста № 1 для 10 класса
№ вопр. | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
1 вар. | в | в | а | б | б | б | а | б | в | б | |
2 вар. | б | а | б | б | б | в | б, в | в | б | а |
Примерные критерии для выставления оценки
Число правильных ответов | Оценка |
Менее 6 | 2 |
6-7 | 3 |
8-9 | 4 |
10-11 | 5 |
10 класс
Контрольная работа № 1 по темам
« Строение и классификация органических соединений. Химические реакции в органической химии»
Химические реакции в органической химии»
Вариант 1
1.Распределите указанные вещества по классам, назовите эти классы соединений:
А) СН3 СН СН СН3 | Ж) НС С СН3 |
Б) СН4 | З) СН2 СН2 ОНОН |
В) СН3 СН2 ОН | И) СН2 СН СН2 СН3 |
Г) СН3СООН | К ) Н С О Н |
Д) СН3 СН СН3 СН3 | Л)СН3 СН СН2 С О Н СН3 |
Е) СН3 СН2 СН2 СН3 | М) СН3 СН2 СН3 |
2.Дайте названия веществам, обозначенным буквами а, в, г, к, м в задании № 1.
№ | № | Тема урока | Практическая часть программы | Срок прохож-дения | Коррек-ция |
Введение. 5 часов. | |||||
1 | Вводный инструктаж по технике безопасности. Предмет органической химии органические вещества. |
|
|
| |
2 | 2 | Теория строения органических соединений А.М. |
|
|
|
3 | 3 | Строение атома углерода. |
|
|
|
4 | 4 | Валентные состояния атома углерода. |
|
|
|
5 | 5 | Зачёт № 1 «Теория строения органических соединений». |
|
|
|
Тема 1. Строение и классификация органических соединений. | |||||
6 | 1 | Классификация органических соединений по строению углеродного скелета. |
|
|
|
7 | 2 | Классификация органических соединений по функциональным группам. |
|
|
|
8 | 3 | Рациональная и тривиальная номенклатура. |
|
|
|
9 | 4 | Номенклатура ИЮПАК. |
|
|
|
10 | 5 | Структурная изомерия и её виды. |
|
|
|
11 | 6 | Пространственная изомерия и её виды. |
|
|
|
12 | 7 | Решение задач на вывод формул органических веществ по массовым долям. |
|
|
|
13 | 8 | Зачёт № 2 «Строение и классификация органических соединений». |
|
|
|
14 | 9 | Подготовка к контрольной работе. |
|
|
|
15 | 10 | Контрольная работа № 1 по теме «Строение и классификация органических соединений». |
|
|
|
Тема 2. Химические реакции в органической химии. 6 часов. | |||||
16 | 1 | Реакции присоединения и замещения. |
|
|
|
17 | 2 | Реакции элиминирования и изомеризации. |
|
|
|
18 | 3 | Понятие о нуклеофиле и электрофиле. |
|
|
|
19 | 4 | Взаимное влияние атомов в молекулах органических веществ. Индуктивный и мезомерный эффекты. Правило Марковникова. |
|
|
|
20 | 5 | Решение расчётных задач:
|
|
|
|
21 | 6 | Зачёт № 3 «Химические реакции в органической химии». |
|
|
|
Тема 3. Углеводороды. 24 часа. | |||||
22 | 1 | Природные источники углеводородов. Нефть и природный газ, каменный уголь. Крекинг-процесс.
|
|
|
|
23 | 2 | Алканы. Строение молекул. Номенклатура. Получение и физические свойства. | ЛО 1. Построение моделей молекул алканов.
|
|
|
24 | 3 | Химические свойства алканов. | ЛО 2. Сравнение плотности и смешиваемости воды и углеводородов.
|
|
|
25 | 4 | Механизм реакции радикального замещения, его стадии. Алкены. |
|
|
|
26 | 5 | Химические свойства алкенов. | ЛО 3. Построение моделей молекул алкенов. |
|
|
27 | 6 | Зачёт № 4 «Алканы. Алкены». | ЛО 4. Обнаружение алкенов в бензине.
|
|
|
28 | 7 | Инструктаж по технике безопасности. |
|
|
|
29 | 8 | Решение расчётных задач на установление химической формулы вещества по продуктам сгорания. |
|
|
|
30 | 11 | Алкины. Строение, изомерия, номенклатура. |
|
|
|
31 |
| Алкины.Физические свойства, получение. |
|
|
|
32 | 12 | Алкины. | ЛО 5. Получение ацетилена и его реакции с бромной водой и раствором перманганата калия.
|
|
|
33 |
| Реакция Кучерова. |
|
|
|
34 | 13 | Окисление алкинов. |
|
|
|
35 | 14 | Алкадиены. строение молекул, изомерия и номенклатура. |
|
|
|
36 |
| Решение задач. |
|
|
|
37 |
| Решение задач. Вывод формул органических веществ. (С 5). |
|
|
|
38 | 15 | Химические свойства алкадиенов. Каучуки. Резина. Вулканизация каучука. |
|
|
|
39 | 16 | Циклоалканы. Строение, изомерия, номенклатура, свойства. Конформации C6H12. |
|
|
|
40 | 17 | Арены. |
|
|
|
41 | 18 | Химические свойства бензола. Ориентирующее действие групп CH3 в реакциях замещения с участием толуола. Реакции боковых цепей алкилбензолов.
|
|
|
|
42 | 19 | Решение расчётных задач на вывод формул органических веществ по массовой доле и продуктам сгорания. Комбинированные задачи. |
|
|
|
43 | 21 | Инструктаж по технике безопасности. |
|
|
|
44 | 22 | Генетическая связь между классами углеводородов. Подготовка к контрольной работе. | Практическая работа № 2 «Углеводороды». |
|
|
45 | 23 | Контрольная работа № 2 по теме «Углеводороды». |
|
|
|
Тема 4. Спирты и фенолы. 6 часов. | |||||
46 | 1 | Спирты. | ЛО 6. Построение моделей молекул изомерных спиртов. ЛО 7. Растворимость в воде спиртов с различным числом атомов углерода.
|
|
|
47 | 2 | Реакции межмолекулярной и внутримолекулярной дегидратации, этерификации и окисления спиртов. |
|
|
|
48 | 3 | Многоатомные спирты. Расчётные задачи: «Вычисления по термохимическим уравнениям». | ЛО 8. Растворимость многоатомных спиртов в воде. ЛО 9. Взаимодействие многоатомных спиртов с гидроксидом меди (II).
|
|
|
49 | 4 | Фенол: строение, физические и химические свойства, получение. | ЛО 10. Взаимодействие водного раствора фенола с бромной водой. |
|
|
50 | 5 | Инструктаж по технике безопасности. Практическая работа № 3 «Спирты и фенолы». | Практическая работа № 3 «Спирты и фенолы». |
|
|
51 | 6 | Зачёт № 5 «Спирты и фенолы».
|
|
|
|
Тема 5. | |||||
52 | 1 | Альдегиды и кетоны. Строение молекул, изомерия Особенности строения карбонильной группы. Физические свойства. | ЛО 11. Построение моделей молекул изомерных альдегидов и кетонов.
|
|
|
53 | 2 | Нуклеофильное присоединение к карбонильным соединениям. Взаимное влияние атомов в молекулах. |
|
|
|
54 | 3 | Окисление альдегидов. Качественные реакции на альдегиды. | ЛО 12. Реакция «серебряного зеркала». ЛО 13. Окисление альдегидов гидроксидом меди (II). ЛО 14. Окисление бензальдегида кислородом воздуха.
|
|
|
55 | 4 | Химические свойства кетонов. |
|
|
|
56 | 5 | Решение расчётных и экспериментальных задач с участием альдегидов, кетонов. |
|
|
|
57 | 6 | Обобщение и систематизация знаний по теме. |
|
|
|
58 | 7 | Зачёт № 6 «Альдегиды и кетоны». |
|
|
|
Тема 6. Карбоновые кислоты, сложные эфиры и жиры. 11 часов. | |||||
59 | 1 | Классификация карбоновых кислот. Зависимость физических свойств от строения молекулы. | ЛО 15. Построение моделей молекул изомерных карбоновых кислот и сложных эфиров. ЭЗ 1. Распознавание растворов ацетата натрия, силиката натрия, карбоната натрия, стеарата натрия. ЭЗ 2. Распознавание образцов сливочного масла и маргарина. ЭЗ 3. Получение карбоновой кислоты из мыла. ЭЗ 4. Получение уксусной кислоты из ацетата натрия. |
|
|
60 | 2 | Общие свойства органических и неорганических кислот. | ЛО 16. Сравнение силы уксусной и соляной кислот в реакциях с цинком. ЛО 17. Сравнение растворимости в воде карбоновых кислот и их солей. ЛО 18. Взаимодействие карбоновых кислот с металлами, основными оксидами, основаниями, амфотерными гидроксидами и солями. |
|
|
61 | 3 | Свойства высших карбоновых кислот, непредельных кислот. Особые свойства муравьиной кислоты. |
|
|
|
62 | 4 | Инструктаж по технике безопасности. Практическая работа № 4 «Карбоновые кислоты». | Практическая работа № 4 «Карбоновые кислоты». |
|
|
63 | 5 | Сложные эфиры. | ЛО 19. Растворимость жиров в воде и органических растворителях.
|
|
|
64 | 6 | Решение расчётных задач с участием карбоновых кислот и сложных эфиров. |
|
|
|
65 | 7 | Состав и строение молекул жиров. Омыление жиров. |
|
|
|
66 | 8 | Понятие о СМС. |
|
|
|
67 | 9 | Генетическая связь между карбоновыми кислотами, сложными эфирами, жирами и углеводами. |
|
|
|
68 | 10 | Инструктаж по технике безопасности. Практическое занятие. Решение экспериментальных задач. | ЭЗ 1. Распознавание растворов ацетата натрия, силиката натрия, карбоната натрия, стеарата натрия. ЭЗ 2. Распознавание образцов сливочного масла и маргарина. ЭЗ 3. Получение карбоновой кислоты из мыла. ЭЗ 4. Получение уксусной кислоты из ацетата натрия. |
|
|
69 | 11 | Зачёт № 7 «Карбоновые кислоты, сложные эфиры и жиры». |
|
|
|
Тема 7. | |||||
70 | 1 | Классификация углеводов. |
|
|
|
71 | 2 | Глюкоза и фруктоза как изомеры. Сравнение строения молекул и химических свойств. | ЛО 20. Ознакомление с физическими свойствами глюкозы. ЛО 21. Взаимодействие глюкозы с гидроксидом меди (II) при обычных условиях и при нагревании. |
|
|
72 | 3 | Важнейшие представители дисахаридов: сахароза, лактоза, мальтоза. | ЛО 22. Взаимодействие глюкозы и сахарозы с аммиачным раствором оксида серебра. ЛО 23. |
|
|
73 | 4 | Полисахариды: Крахмал и целлюлоза. | ЛО 24. Качественная реакция на крахмал. ЛО 25. Знакомство с коллекцией волокон |
|
|
74 | 5 | Решение расчётных и экспериментальных задач по теме 7. | ЭЗ 1. Распознавание растворов глюкозы и глицерина. ЭЗ. 2. Определение наличия крахмала в мёде, хлебе, маргарине. |
|
|
75 | 6 | Инструктаж по технике безопасности. | Практическая работа № 5 «Углеводы». |
|
|
76 | 7 | Подготовка к контрольной работе. |
|
|
|
77 | 8 | Контрольная работа № 3 «Кислородсодержащие органические соединения». |
|
|
|
Тема 8. Азотсодержащие органические соединения. 8 часов. | |||||
78 | 1 | Амины. Анилин. | ЛО 26. Построение моделей молекул изомерных аминов. ЛО 27. Смешиваемость анилина с водой.
|
|
|
79 | 2 | Химические свойства аминов. Реакция Зинина. | ЛО 28. Образование солей аминов с кислотами.
|
|
|
80 | 3 | Аминокислоты. |
|
|
|
81 | 4 | Белки как природные биополимеры. |
|
|
|
82 | 5 | Химические свойства белков. | ЛО 29. Качественные реакции на белки. |
|
|
83 | 6 | Нуклеиновые кислоты. ДНК. РНК. Генная инженерия и биотехнология. |
|
|
|
84 | 7 | Решение задач по теме 8. |
|
|
|
85 | 8 | Зачёт № 8 «Азотсодержащие органические соединения». |
|
|
|
Тема 9. | |||||
86 | 1 | Витамины. |
|
|
|
87 | 2 | Витамины С, РР, группы В, А, Е. |
|
|
|
88 | 3 | Ферменты. Зависимость активности фермента от температуры и pH среды. |
|
|
|
89 | 4 | Гормоны. |
|
|
|
90 | 5 | Лекарства. |
|
|
|
91 | 6 | Решение задач по теме 9. |
|
|
|
92 | 7 | Обобщение и систематизация знаний по теме 9. |
|
|
|
Тема 10. Практикум. 3 часа. | |||||
93-94 | 1-2 | Инструктаж по технике безопасности. Амины, аминокислоты, белки. |
|
|
|
95 | 3 | Инструктаж по технике безопасности. |
|
|
|
Тема 11. Повторение основных вопросов органической химии. 7 часов. | |||||
96 | 1 | Алканы. Алкены. |
|
|
|
97 | 2 | Алкадиены. Алкины. |
|
|
|
98 | 3 | Циклоалканы. Арены. |
|
|
|
99 | 4 | Спирты. |
|
|
|
100 | 5 | Альдегиды. Кетоны. |
|
|
|
101 | 6 | Карбоновые кислоты. Жиры. Углеводы. |
|
|
|
102 | 7 | Азотсодержащие органические соединения. |
|
|
|
| 1 | Предмет органической химии. Органические вещества. |
| 2 | Теория строения органических соединений А. М. Бутлерова М. Бутлерова |
| 3 | Строение атома углерода |
| 4 | Валентные состояния атома углерода |
| 5 | Классификация органических соединений |
| 6 | Классификация органических соединений |
| 7 | Основы номенклатуры органических соединений |
| 8 | Изомерия и ее виды |
| 9 | Изомерия и ее виды |
| 10 | Обобщение и систематизация знаний о строении и классификации органических соединений |
| 11 | Обобщение и систематизация знаний о строении и классификации органических соединений |
| 12 | Контрольная работа № 1. |
| 13 | Типы химических реакций в органической химии |
| 14 | Типы химических реакций в органической химии |
| 15 | Обобщение и систематизация о типах химических реакций |
| 16 | Природные источники углеводородов |
| 17 | Алканы. Строение, номенклатура, физические свойства. Строение, номенклатура, физические свойства. |
| 18 | Химические свойства алканов |
| 19 | Алкены. Строение, номенклатура, физические свойства. |
| 20 | Химические свойства алкенов |
| 21 | Обобщение и систематизация по темам «Алканы», «Алкены» |
| 22 | Алкины. Строение, номенклатура, физические свойства. Получение |
| 23 | Химические свойства алкинов |
| 24 | Алкодиены. Строение молекул. Номенклатура. |
| 25 | Химические свойства алкадиенов. Резина |
| 26 | Циклоалканы. Изомерия, строение, свойства. |
| 27 | Ароматические углеводороды. Строение молекулы бензола. Физические свойства и способы получения аренов. |
| 28 | Химические свойства бензола. Применение бензола и его гомологов. |
| 29 | Генетическая связь между классами углеводородов. |
| 30 | Обобщение по теме «Углеводороды». Подготовка к контрольной работе. |
| 31 | Контрольная работа № 2. |
| 32 | Спирты. Состав, классификация и изомерия спиртов. |
| 33 | Химические свойства предельных одноатомных и многоатомных спиртов. |
| 34 | Фенолы. Строение, свойства и применение фенола. |
| 35 | Альдегиды. Классификация, изомерия, номенклатура. Строение и физические свойства. |
| 36 | Химические свойства альдегидов. |
| 37 | Систематизация и обобщение знаний о спиртах, фенолах и альдегидах. |
| 38 | Систематизация и обобщение знаний о спиртах, фенолах и альдегидах. |
| 39 | Контрольная работа № 3. |
| 40 | Карбоновые кислоты. Строение, классификация, номенклатура. Физические свойства предельных одноосновных карбоновых кислот. |
| 41 | Химические свойства карбоновых кислот |
| 42 | Сложные эфиры. |
| 43 | Жиры. |
| 44 | Обобщение и систематизация знаний о карбоновых кислотах, сложных эфирах и жирах. |
| 45 | Контрольная работа № 4. |
| 46 | Углеводы. Их классификация. |
| 47 | Моносахариды. Гексозы. Глюкоза и фруктоза. |
| 48 | Полисахариды. Крахмал и целлюлоза. |
| 49 | Систематизация и обобщение знаний об углеводах. |
| 50 | Амины. Строение, классификация, номенклатура, свойства, получение. |
| 51 | Аминокислоты. Состав, строение, свойства, получение. |
| 52 | Белки как биологические полимеры. |
| 53 | Нуклеиновые кислоты. |
| 54 | Обобщение знаний об азотсодержащих соединениях. |
| 55 | Витамины. |
| 56 | Ферменты. |
| 57 | Гормоны. |
| 58 | Лекарства. |
| 59 | Практическая работа № 1 Качественное определение углерода, водорода и хлора в органических веществах |
| 60 | Практическая работа № 2. Получение этилена и его свойства. |
| 61 | Практическая работа № 3. Спиты и фенолы. |
| 62 | Практическая работа № 4. Альдегиды и кетоны. |
| 63 | Практическая работа № 5. Карбоновые кислоты. |
| 64 | Практическая работа № 6. Углеводы. |
| 65 | Практическая работа № 7. Амины, аминокислоты и белки. |
| 66 | Практическая работа № 8. Идентификация органических соединений. |
| 67 | Резервное время |
| 68 | Резервное время |
Глава 7 – Алканы и галогенированные углеводороды – Химия
Глава 7: Алканы и галогенированные углеводороды Этот текст опубликован под лицензией Creative Commons, для ссылки и адаптации нажмите здесь .
 7 Каталожные номера
7 Каталожные номера
Вступительное эссе
Углеводороды — простейшие органические соединения, но они обладают интересными физиологическими эффектами. Эти эффекты зависят от размера молекул углеводородов и от того, где они применяются в организме. Алканы с низкой молекулярной массой, содержащие от 1 до примерно 10 атомов углерода, представляют собой газы или легкие жидкости, которые действуют как анестетики. Вдыхание («вдыхание») этих углеводородов в бензине или аэрозольных пропеллентах из-за их опьяняющего эффекта является серьезной проблемой для здоровья, которая может привести к повреждению печени, почек или головного мозга или к немедленной смерти от удушья при исключении кислорода.Канистры с пропаном и бутаном под давлением, оба из которых предназначены для использования в качестве топлива, используются в качестве ингалянтов.
Рисунок 7.1. Ряд продуктов на основе нефти, которыми можно злоупотреблять в качестве ингалянтов . Фото: Lance Cpl. Мэтью К. Хакер
Фото: Lance Cpl. Мэтью К. Хакер
Проглатывание жидких алканов мало вредит желудку. Однако в легких они вызывают «химическую» пневмонию, растворяя жироподобные молекулы клеточных мембран в крошечных воздушных мешочках (альвеолах).Легкие перестают выталкивать жидкости, как при пневмонии, вызванной бактериями или вирусами. Людей, которые проглатывают бензин или другие жидкие смеси алканов, нельзя вызывать рвоту, так как это увеличивает вероятность попадания алканов в легкие. (Не существует противоядия для домашнего лечения отравления бензином; позвоните в токсикологический центр.)
Жидкие алканы, содержащие примерно 5–16 атомов углерода на молекулу, смывают естественные кожные жиры и вызывают высыхание и растрескивание кожи, в то время как более тяжелые жидкие алканы (содержащие примерно 17 или более атомов углерода на молекулу) действуют как смягчающие средства (смягчители кожи).В качестве защитной пленки можно применять такие смеси алканов, как минеральное масло и вазелин. Вода и водные растворы, такие как моча, не растворяют такую пленку, что объясняет, почему вазелин защищает нежную кожу ребенка от опрелостей.
Вода и водные растворы, такие как моча, не растворяют такую пленку, что объясняет, почему вазелин защищает нежную кожу ребенка от опрелостей.
В этой главе мы будем исследовать алканы, соединения, содержащие только два элемента, углерод и водород, и имеющие только одинарные связи. Мы также будем исследовать алканы, в структуру которых входят галогены. Напомним, что галогены являются элементами семейства 7A в периодической таблице и содержат репрезентативные элементы, такие как хлор, фтор, йод и бром.Существует несколько других видов углеводородов, отличающихся типами связи между атомами углерода и свойствами, возникающими в результате этой связи. В главе 8 мы рассмотрим углеводороды с двойными связями, с тройными связями и с особым типом связи, называемым ароматичностью . Затем в главе 9 мы изучим некоторые соединения, которые считаются производными от углеводородов путем замены одного или нескольких атомов водорода кислородсодержащей группой. Глава 10 посвящена органическим кислотам и основаниям.
7.1 Распознавание органических структур Цель обучения
- Уметь узнавать состав и свойства, характерные для органических и неорганических соединений.
Ученые 18 и начала 19 веков изучали соединения, полученные из растений и животных, и назвали их органическими , потому что они были выделены из «организованных» (живых) систем.Соединения, выделенные из неживых систем, таких как горные породы и руды, атмосфера и океаны, были обозначены как неорганические . Многие годы ученые считали, что органические соединения могут образовываться только живыми организмами, потому что они обладают жизненной силой, присущей только живым системам. Теория жизненной силы начала приходить в упадок в 1828 году, когда немецкий химик Фридрих Вёлер синтезировал мочевину из неорганических исходных материалов. Он провел реакцию с цианатом серебра (AgOCN) и хлоридом аммония (NH 4 Cl), рассчитывая получить цианат аммония (NH 4 OCN). То, что он ожидал, описывается следующим уравнением.
То, что он ожидал, описывается следующим уравнением.
AgOCN + NH 4 Cl → AgCl + NH 4 OCN
Вместо этого он обнаружил, что продукт представляет собой мочевину (NH 2 CONH 2 ), хорошо известное органическое вещество, легко выделяемое из мочи. Этот результат привел к серии экспериментов, в которых большое разнообразие органических соединений было получено из неорганических исходных материалов. Теория жизненной силы постепенно ушла в прошлое, когда химики узнали, что они могут создавать многие органические соединения в лаборатории.
Сегодня органическая химия реклассифицирована как изучение соединений, содержащих углерод, а неорганическая химия — это изучение химии всех других элементов. Может показаться странным, что мы делим химию на две ветви — одну, которая рассматривает соединения только одного элемента, и другую, которая охватывает более 100 остальных элементов. Однако такое деление представляется более разумным, если учесть, что из десятков миллионов охарактеризованных соединений подавляющее большинство составляют соединения углерода.
Слово органический имеет разные значения. Органические удобрения, такие как коровий навоз, являются органическими в первоначальном смысле; он получен из живых организмов. Органические продукты – это продукты, выращенные без синтетических пестицидов или удобрений. Органическая химия – это химия соединений углерода. Углерод уникален среди других элементов тем, что его атомы могут образовывать устойчивые ковалентные связи друг с другом и с атомами других элементов во множестве вариаций.Образовавшиеся молекулы могут содержать от одного до миллионов атомов углерода.
Органические соединения, как и неорганические соединения, подчиняются всем законам природы. Часто нет четкого различия в химических или физических свойствах органических и неорганических молекул. Тем не менее, полезно сравнить типичных членов каждого класса, как в Таблице 7.1 (помните, однако, что в каждой категории в этой таблице есть исключения). Чтобы дополнительно проиллюстрировать типичные различия между органическими и неорганическими соединениями, Таблица 7. 1 также перечислены свойства неорганического соединения хлорида натрия (поваренная поваренная соль, NaCl) и органического соединения гексана (C 6 H 14 ), растворителя, который используется для извлечения соевого масла из соевых бобов (среди прочего). Многие соединения можно классифицировать как органические или неорганические по наличию или отсутствию некоторых типичных свойств, как показано в таблице 7.1.
1 также перечислены свойства неорганического соединения хлорида натрия (поваренная поваренная соль, NaCl) и органического соединения гексана (C 6 H 14 ), растворителя, который используется для извлечения соевого масла из соевых бобов (среди прочего). Многие соединения можно классифицировать как органические или неорганические по наличию или отсутствию некоторых типичных свойств, как показано в таблице 7.1.
Таблица 7.1 Общие сравнительные свойства и примеры органических и неорганических соединений
Упражнения по обзору концепции: нажмите, чтобы ответить на вопросы
Вынос ключей- Органическая химия изучает соединения углерода, почти все из которых также содержат атомы водорода.
Классифицируйте каждое соединение как органическое или неорганическое.

- С 6 Н 10
- CoCl 2
- С 12 Н 22 О 11
Классифицируйте каждое соединение как органическое или неорганическое.
- CH 3 NH 2
- NaNH 2
- Cu(NH 3 ) 6 Cl 2
Какой член каждой пары имеет более высокую температуру плавления?
- CH 3 OH и NaOH
- CH 3 Cl и KCl
Какой член каждой пары имеет более высокую температуру плавления?
- C 2 H 6 и CoCl 2
- CH 4 и LiH
- органический
- неорганический
- органический
(наверх)
7.
 2 Введение в алканы
2 Введение в алканы Алканы представляют собой органические соединения, полностью состоящие из атомов углерода и водорода с одинарной связью и лишенные каких-либо других функциональных групп. Алканы имеют общую формулу C n H 2n +2 и могут быть подразделены на следующие три группы: линейные алканы с прямой цепью, разветвленные алканы и циклоалканы (рис. 7.2). Алканы также являются насыщенными углеводородами, , то есть все атомы углерода «насыщены» атомами водорода и не содержат двойных или тройных углерод-углеродных связей.Алканы — это простейшие и наименее реакционноспособные виды углеводородов, содержащие только углерод и водород. Они очень важны с коммерческой точки зрения, так как являются основным компонентом бензина и смазочных масел и широко используются в органической химии; хотя роль чистых алканов (например, гексанов) отводится в основном растворителям. Отличительной чертой алкана, отличающей его от других соединений, которые также содержат исключительно углерод и водород, является отсутствие ненасыщенности. Другими словами, он не содержит двойных или тройных связей, которые очень реакционноспособны в органической химии. Хотя они не полностью лишены реакционной способности, отсутствие у них реакционной способности в большинстве лабораторных условий делает их относительно неинтересными, хотя и очень важными компонентами органической химии. Как вы узнаете позже, энергия, заключенная в связи углерод-углерод и связь углерод-водород, довольно высока, и их быстрое окисление производит большое количество тепла, обычно в форме огня.
Другими словами, он не содержит двойных или тройных связей, которые очень реакционноспособны в органической химии. Хотя они не полностью лишены реакционной способности, отсутствие у них реакционной способности в большинстве лабораторных условий делает их относительно неинтересными, хотя и очень важными компонентами органической химии. Как вы узнаете позже, энергия, заключенная в связи углерод-углерод и связь углерод-водород, довольно высока, и их быстрое окисление производит большое количество тепла, обычно в форме огня.
Рисунок 7.2. Примеры алканов
Алканы с прямой цепью
Алканы с прямой цепью, метан (CH 4 ), этан (C 2 H 6 ) и пропан (C 3 H 8 ) представляют собой начало ряда соединений, в которых любые два члены в последовательности отличаются одним атомом углерода и двумя атомами водорода, а именно единицей CH 2 (рис. 7.3)
Рис 7. 3 Три простейших алкана
3 Три простейших алкана
Первые 10 членов этого ряда приведены в таблице 7.2. Обратите внимание, что по мере увеличения длины углеродной цепи количество возможных различных структурных изомеров также увеличивается.
Таблица 7.2 Первые 10 алканов с прямой цепью
Начиная с пропана (C 3 H 8) и далее, вы заметите, что единственная разница между углеводородами с более длинной цепью заключается в добавлении СН 2 звеньев по мере продвижения вверх по ряду (рис.7.4). Любое семейство соединений, в котором соседние члены отличаются друг от друга определенным фактором (здесь группа CH 2 ), называется гомологическим рядом и может быть определено математически. Члены такого ряда называются гомологами . В органической химии свойства гомологов изменяются закономерным и предсказуемым образом. Таким образом, принцип гомологии дает организацию органической химии почти так же, как таблица Менделеева дает организацию неорганической химии. Вместо сбивающего с толку множества отдельных соединений углерода мы можем изучить несколько членов гомологического ряда и вывести из них некоторые свойства других соединений этого ряда.
Вместо сбивающего с толку множества отдельных соединений углерода мы можем изучить несколько членов гомологического ряда и вывести из них некоторые свойства других соединений этого ряда.
Рисунок 7.4 Члены гомологичного ряда
На рис. 7.4 обратите внимание, что каждая последующая формула включает на один атом углерода и два атома водорода больше, чем предыдущая формула. Принцип гомологии позволяет записать общую формулу алканов: С n H 2 n + 2 .Используя эту формулу, мы можем написать молекулярную формулу любого алкана с заданным числом атомов углерода. Например, алкан с восемью атомами углерода имеет молекулярную формулу C 8 H (2 × 8) + 2 = C 8 H 18 .
Упражнения по обзору концепцииВ гомологическом ряду алканов, какова молекулярная формула члена чуть выше C 8 H 18 ?
Используйте общую формулу алканов, чтобы написать молекулярную формулу алкана с 12 атомами углерода.
Алканы с разветвленной цепью
Мы можем записать структуру бутана (C 4 H 10 ), нанизав четыре атома углерода в ряд,
–С–С–С–С–
, а затем добавление достаточного количества атомов водорода, чтобы дать каждому атому углерода четыре связи:
Соединение бутана имеет такую структуру, но есть и другой способ соединения 4 атомов углерода и 10 атомов водорода. Поместите 3 атома углерода в ряд, а затем разветвите четвертый от среднего атома углерода:
Теперь добавим столько атомов водорода, чтобы у каждого углерода было четыре связи.
Существует углеводород, который соответствует этой структуре, а это означает, что два разных соединения имеют одинаковую молекулярную формулу (C 4 H 10 ), но разное расположение атомов в пространстве. Напомним, что соединения, имеющие одинаковую молекулярную формулу, но разное расположение в пространстве, называются структурными изомерами . Структурные изомеры обладают разными химическими и физическими свойствами. На рис. 7.5 показана модель шара и стержня для бутана с прямой цепью и разветвленного изомера изобутана.
Структурные изомеры обладают разными химическими и физическими свойствами. На рис. 7.5 показана модель шара и стержня для бутана с прямой цепью и разветвленного изомера изобутана.
Рисунок 7.5 Бутан и изобутан. Шарико-стержневые модели этих двух соединений показывают, что они являются изомерами; оба имеют молекулярную формулу C 4 H 10 .
Обратите внимание, что C 4 H 10 изображен с изогнутой цепью на Рисунке 7.5. Четырехуглеродная цепь может быть изогнута по-разному, поскольку группы могут свободно вращаться вокруг связей С-С. Однако это вращение не меняет идентичности соединения.Важно понимать, что изгиб цепи , а не меняет идентичность соединения; все следующие представляют одно и то же соединение:
Формула изобутана показывает непрерывную цепь только из трех атомов углерода, причем четвертый присоединен как ответвление от среднего атома углерода непрерывной цепи.
В отличие от C 4 H 10 , соединения метана (CH 4 ), этана (C 2 H 6 ) и пропана (C 3 H 3 8 ) не существуют в изомерных изомерах формы, потому что есть только один способ расположить атомы в каждой формуле так, чтобы каждый атом углерода имел четыре связи.
Примечание
Непрерывную (неразветвленную) цепь атомов углерода часто называют прямой цепью , хотя тетраэдрическое расположение каждого атома углерода придает ей зигзагообразную форму. Алканы с прямой цепью иногда называют нормальными алканами , а их именам дают префикс n -. Например, бутан называется n -бутан.
Упражнения по обзору концепцииМожет ли алканы иметь двухуглеродную ветвь от второго атома углерода четырехуглеродной цепи? Объяснять.
Студента просят написать структурные формулы двух различных углеводородов, имеющих молекулярную формулу C 5 H 12 . Она пишет одну формулу со всеми пятью атомами углерода в горизонтальной линии, а другую с четырьмя атомами углерода в линии, с группой CH 3 , идущей вниз от первого присоединенного к третьему атому углерода. Представляют ли эти структурные формулы разные молекулярные формулы? Объясните, почему да или почему нет.

Нет; ответвление составило бы самую длинную непрерывную цепь из пяти атомов углерода.
Нет; обе представляют собой пятиуглеродные непрерывные цепи.
- Алканы с четырьмя и более атомами углерода могут существовать в изомерных формах.
Кратко укажите важные различия между алканом с прямой цепью и алканом с разветвленной цепью.
Нарисуйте структурные изомеры следующих алканов.
Укажите, представляют ли структуры в каждом наборе одно и то же соединение или изомеры.
CH 3 CH 2 CH 2 CH 3 и
CH 3 CH 2 CH 2 CH 2 CH 3 и
Алканы с прямой цепью и алканы с разветвленной цепью имеют разные свойства, а также разную структуру.
Напишите сокращенную структурную формулу для каждой структурной формулы.
Сокращенная структурная формула изогексана может быть записана как (CH 3 ) 2 CHCH 2 CH 2 CH 3 . Нарисуйте формулу угла линии для изогексана.
Нарисуйте формулу линии-угла для соединения CH 3 CH 2 CH(CH 3 )CH 2 CH 2 CH 3 .
Назовите структурную формулу соединения, представленного этой формулой угла линии:
(наверх)
Циклоалканы
Циклоалканы очень важны для компонентов продуктов питания, фармацевтических препаратов и многого другого. Однако, чтобы использовать циклоалканы в таких приложениях, мы должны знать эффекты, функции, свойства и структуру циклоалканов. Циклоалканы представляют собой алканы в форме кольца; следовательно, префикс цикло- используется для обозначения этих алканов. Стабильные циклоалканы не могут быть образованы с углеродными цепями любой длины. Напомним, что в алканах углерод принимает тетраэдрическую геометрию, в которой углы между связями составляют 109,5°.
Однако, чтобы использовать циклоалканы в таких приложениях, мы должны знать эффекты, функции, свойства и структуру циклоалканов. Циклоалканы представляют собой алканы в форме кольца; следовательно, префикс цикло- используется для обозначения этих алканов. Стабильные циклоалканы не могут быть образованы с углеродными цепями любой длины. Напомним, что в алканах углерод принимает тетраэдрическую геометрию, в которой углы между связями составляют 109,5°.
Источник: Википедия
Для образования некоторых циклоалканов угол между связями должен отклоняться от этого идеального угла, эффект, известный как угловая деформация .Кроме того, некоторые атомы водорода могут приблизиться друг к другу ближе, чем желательно (затмить себя), эффект, называемый деформацией кручения . Эти дестабилизирующие эффекты, угловая деформация и деформация при кручении вместе известны как кольцевая деформация . Циклоалканы меньшего размера, циклопропан и циклобутан, имеют особенно высокие деформации кольца, потому что их валентные углы существенно отклоняются от 109,5 °, а их атомы водорода затмевают друг друга. Таким образом, обе эти кольцевые конформации крайне неблагоприятны и нестабильны.Циклопентан представляет собой более стабильную молекулу с небольшой деформацией кольца, в то время как циклогексан может принимать идеальную геометрию циклоалкана, в которой все углы составляют идеальные 109,5 °, и ни один водород не затмевается; у него вообще нет кольцевой деформации. Циклоалканы большего размера, чем циклогексан, имеют кольцевую деформацию и не так часто встречаются в органической химии. На рис. 7.6 приведены примеры структур циклоалканов.
Циклоалканы меньшего размера, циклопропан и циклобутан, имеют особенно высокие деформации кольца, потому что их валентные углы существенно отклоняются от 109,5 °, а их атомы водорода затмевают друг друга. Таким образом, обе эти кольцевые конформации крайне неблагоприятны и нестабильны.Циклопентан представляет собой более стабильную молекулу с небольшой деформацией кольца, в то время как циклогексан может принимать идеальную геометрию циклоалкана, в которой все углы составляют идеальные 109,5 °, и ни один водород не затмевается; у него вообще нет кольцевой деформации. Циклоалканы большего размера, чем циклогексан, имеют кольцевую деформацию и не так часто встречаются в органической химии. На рис. 7.6 приведены примеры структур циклоалканов.
Рисунок 7.6. Репрезентативные циклоалкановые структуры. Указаны средние валентные углы и энергия деформации.
Для вашего здоровья: циклопропан в качестве анестетика
При температуре кипения -33°C циклопропан представляет собой газ при комнатной температуре. Это также мощный, быстродействующий анестетик с небольшим количеством нежелательных побочных эффектов в организме. Однако в хирургии он больше не используется, так как образует с воздухом взрывоопасные смеси практически при любых концентрациях.
Это также мощный, быстродействующий анестетик с небольшим количеством нежелательных побочных эффектов в организме. Однако в хирургии он больше не используется, так как образует с воздухом взрывоопасные смеси практически при любых концентрациях.
Классификация углеродных связей
Атомы углерода, участвующие в химических связях внутри молекулы, можно классифицировать на основе количества образующихся углерод-углеродных связей.
- первичный атом углерода : один соседний атом углерода
- вторичный атом углерода : два соседа углерода
- третичный атом углерода : три соседа углерода
- четвертичный атом углерода : четыре соседа углерода
Число соседей углерода, которое имеет атом углерода, может помочь определить реакционную способность этого положения углерода. Таким образом, важно уметь распознавать, является ли атом углерода первичным, вторичным, третичным или четвертичным по своей структуре (рис. 7.7).
7.7).
Рисунок 7.7. Классификация атомов углерода на первичные, вторичные, третичные и четвертичные. В приведенных выше молекулах центральный углерод оценивается по количеству атомов углерода, которые связаны непосредственно с центральным углеродом. Первичный углерод связан с одним углеродом, вторичный углерод связан с двумя атомами углерода, третичный углерод связан с тремя атомами углерода, а четвертичный углерод связан с четырьмя атомами углерода.
В любой данной молекуле можно классифицировать каждый атом углерода (рис.7.8).
Рисунок 7.8. Классификация атомов углерода в молекуле
(наверх)7.3 Свойства алканов
Алканы — это простейшее семейство углеводородов — соединения, содержащие только углерод и водород только с углерод-водородными связями и углерод-углеродными одинарными связями. Алканы не очень реакционноспособны и обладают небольшой биологической активностью; все алканы бесцветны и не имеют запаха. Поскольку алканы обладают относительно предсказуемыми физическими свойствами и подвергаются относительно небольшому количеству химических реакций, кроме горения, они служат основой для сравнения свойств многих других семейств органических соединений. Сначала рассмотрим их физические свойства.
Поскольку алканы обладают относительно предсказуемыми физическими свойствами и подвергаются относительно небольшому количеству химических реакций, кроме горения, они служат основой для сравнения свойств многих других семейств органических соединений. Сначала рассмотрим их физические свойства.
В таблице 7.3 описаны некоторые свойства некоторых из первых 10 алканов с прямой цепью. Почти все алканы имеют плотность менее 1,0 г/мл и, следовательно, менее плотны, чем вода (плотность H 2 O равна 1.00 г/мл при 20°C).
Таблица 7.3 Физические свойства некоторых алканов
Взгляд ближе: плотность газа и пожароопасность
Таблица 7.3 показывает, что первые четыре члена ряда алканов являются газами при обычных температурах. Природный газ состоит в основном из метана, который имеет плотность около 0,67 г/л. Плотность воздуха составляет около 1,29 г/л. Поскольку плотность природного газа меньше плотности воздуха, он поднимается вверх. Когда утечка природного газа обнаружена и перекрыта в помещении, газ можно удалить, открыв верхнее окно. С другой стороны, баллонный газ может быть либо пропаном (плотность 1,88 г/л), либо бутанами (смесь бутана и изобутана, плотность около 2,5 г/л). Оба вещества намного тяжелее воздуха (плотность 1,2 г/л). Если баллонный газ попадает в здание, он скапливается у пола. Это представляет гораздо более серьезную опасность возгорания, чем утечка природного газа, потому что из комнаты труднее избавиться от более тяжелого газа.
Когда утечка природного газа обнаружена и перекрыта в помещении, газ можно удалить, открыв верхнее окно. С другой стороны, баллонный газ может быть либо пропаном (плотность 1,88 г/л), либо бутанами (смесь бутана и изобутана, плотность около 2,5 г/л). Оба вещества намного тяжелее воздуха (плотность 1,2 г/л). Если баллонный газ попадает в здание, он скапливается у пола. Это представляет гораздо более серьезную опасность возгорания, чем утечка природного газа, потому что из комнаты труднее избавиться от более тяжелого газа.
Температуры плавления и кипения
Как температуры плавления, так и температуры кипения алканов характеризуют межмолекулярные силы, возникающие между молекулами. Разница электроотрицательностей между углеродом и водородом (2,1 – 1,9 = 0,2) невелика; поэтому связь C-H неполярна, а это означает, что единственными притяжениями между одной молекулой и ее соседями будут лондонские дисперсионные силы. Эти силы будут очень малы для такой молекулы, как метан, но будут увеличиваться по мере увеличения размера молекул. Следовательно, температуры плавления и кипения алканов увеличиваются с увеличением размера молекул из-за увеличения лондоновских дисперсионных сил. (т. е. межмолекулярные силы сильнее в более крупных углеводородах, поэтому требуется больше энергии, чтобы вызвать фазовые превращения). На рис. 7.9 показаны тренды температуры плавления и кипения первых 16 углеводородов. Обратите внимание, что первые четыре алкана являются газами при комнатной температуре, а твердые вещества не начинают появляться примерно до C 17 H 36 .
Эти силы будут очень малы для такой молекулы, как метан, но будут увеличиваться по мере увеличения размера молекул. Следовательно, температуры плавления и кипения алканов увеличиваются с увеличением размера молекул из-за увеличения лондоновских дисперсионных сил. (т. е. межмолекулярные силы сильнее в более крупных углеводородах, поэтому требуется больше энергии, чтобы вызвать фазовые превращения). На рис. 7.9 показаны тренды температуры плавления и кипения первых 16 углеводородов. Обратите внимание, что первые четыре алкана являются газами при комнатной температуре, а твердые вещества не начинают появляться примерно до C 17 H 36 .
Рисунок 7.9. Температуры плавления и кипения алканов с прямой цепью
Адаптировано из: Techstepp
Что касается изомеров, чем более разветвлена цепь, тем ниже температура кипения. Лондонские дисперсионные силы меньше для более коротких молекул и действуют только на очень коротких расстояниях между одной молекулой и ее соседями. Коротким громоздким молекулам (со значительным количеством разветвлений) труднее располагаться близко друг к другу (компактно) по сравнению с длинными тонкими молекулами.Циклоалканы похожи на алканы по своим общим физическим свойствам, но имеют более высокие температуры кипения, температуры плавления и плотности, чем алканы. Это связано с более сильными лондонскими силами, потому что форма кольца обеспечивает большую площадь контакта.
Коротким громоздким молекулам (со значительным количеством разветвлений) труднее располагаться близко друг к другу (компактно) по сравнению с длинными тонкими молекулами.Циклоалканы похожи на алканы по своим общим физическим свойствам, но имеют более высокие температуры кипения, температуры плавления и плотности, чем алканы. Это связано с более сильными лондонскими силами, потому что форма кольца обеспечивает большую площадь контакта.
(наверх) Растворимость
Алканы (как нормальные, так и циклоалканы) практически нерастворимы в воде, но растворяются в органических растворителях. Жидкие алканы являются хорошими растворителями для многих других ковалентных соединений.При растворении молекулярного вещества в воде должно происходить следующее:
- нарушение межмолекулярных сил внутри вещества. В случае алканов это лондонские дисперсионные силы.
- разрыв межмолекулярных сил в воде, чтобы вещество могло поместиться между молекулами воды.
 В воде основным межмолекулярным притяжением являются водородные связи.
В воде основным межмолекулярным притяжением являются водородные связи.
Для разрушения любого из этих притяжений требуется энергия, хотя количество энергии, необходимое для разрушения лондонских дисперсионных сил в соединении, таком как метан, относительно незначительно; это не относится к водородным связям в воде.Напомним, что водородные связи намного прочнее.
Проще говоря, вещество растворяется, если при образовании новых связей между веществом и водой высвобождается достаточно энергии, чтобы компенсировать энергию, необходимую для разрушения первоначальных притяжений. Единственным новым притяжением между алканом и молекулами воды являются лондонские дисперсионные силы. Эти силы не выделяют достаточного количества энергии, чтобы компенсировать энергию, необходимую для разрыва водородных связей в воде.Следовательно, алкан не растворяется, как показано на рисунке 7.10.
Рисунок 7.10. Углеводороды с длинной цепью нерастворимы в воде. Ни насыщенные, ни ненасыщенные углеводороды в этом подсолнечном масле не обладают достаточно сильными межмолекулярными силами, чтобы разрушить водородные связи между молекулами воды. Таким образом, масло не растворяется в воде и образует пузырьки масла на поверхности раздела вода/нефть.В этом случае нефть менее плотна, чем вода, и будет плавать поверх водного слоя.
Ни насыщенные, ни ненасыщенные углеводороды в этом подсолнечном масле не обладают достаточно сильными межмолекулярными силами, чтобы разрушить водородные связи между молекулами воды. Таким образом, масло не растворяется в воде и образует пузырьки масла на поверхности раздела вода/нефть.В этом случае нефть менее плотна, чем вода, и будет плавать поверх водного слоя.
В большинстве органических растворителей основными силами притяжения между молекулами растворителя являются лондонские дисперсионные силы. Следовательно, когда алкан растворяется в органическом растворителе, лондонские дисперсионные силы разрушаются и заменяются новыми лондонскими дисперсионными силами между смесью. Два процесса более или менее энергетически компенсируют друг друга; таким образом, нет никаких препятствий для растворимости.
(наверх)Свойства алканов и опасность для окружающей среды: подробный обзор
Из-за растворимости и плотности алканов разливы нефти в океан или другие водоемы могут иметь разрушительные последствия для окружающей среды. Нефть не может растворяться или смешиваться с водой, и поскольку она менее плотная, чем вода, она плавает на поверхности воды, создавая нефтяное пятно, как показано на рис. 7.11. Поскольку нефтяное пятно остается на поверхности воды, от нефтяных пятен больше всего страдают организмы, обитающие на поверхности океана или вблизи береговой линии, включая морских выдр и морских птиц.Химические компоненты масла токсичны при приеме внутрь, вдыхании, раздражении кожи и глаз.
Нефть не может растворяться или смешиваться с водой, и поскольку она менее плотная, чем вода, она плавает на поверхности воды, создавая нефтяное пятно, как показано на рис. 7.11. Поскольку нефтяное пятно остается на поверхности воды, от нефтяных пятен больше всего страдают организмы, обитающие на поверхности океана или вблизи береговой линии, включая морских выдр и морских птиц.Химические компоненты масла токсичны при приеме внутрь, вдыхании, раздражении кожи и глаз.
Рисунок 7.11 Разливы нефти. Сырая нефть покрывает поверхность воды в Мексиканском заливе после того, как нефтяная платформа Deepwater Horizon затонула в результате взрыва. Утечка произошла на милю ниже поверхности, что затрудняет оценку размера разлива. Один литр нефти может создать пятно размером 2,5 га (6,3 акра). Этот и подобные разливы служат напоминанием о том, что углеводороды и вода не смешиваются.
Источник: Фото предоставлено NASA Goddard / MODIS Rapid Response Team.
Не обращаясь к таблице, угадайте, что имеет более высокую температуру кипения — гексан или додекан. Объяснять.
Если к 100 мл воды в стакане добавить 25 мл гексана, что из следующего вы ожидаете? Объяснять.
- Гексан растворяется в воде.
- Гексан не растворялся в воде и всплывал на поверхность.
- Гексан не растворяется в воде и оседает на дно контейнера.
додекан из-за его большей молекулярной массы
б; гексан нерастворим в воде и менее плотен, чем вода.
- Алканы представляют собой неполярные соединения с низкой температурой кипения и нерастворимы в воде.
Не обращаясь к таблице или другой справке, предскажите, какой член каждой пары имеет более высокую температуру кипения.

- пентан или бутан
- гептан или нонан
Для какого члена каждой пары гексан является хорошим растворителем?
- пентан или вода
- хлорид натрия или соевое масло
(наверх) 7.4 Химическая активность алканов Алканы
содержат прочные одинарные связи углерод-углерод и сильные связи углерод-водород. Обе эти связи неполярны. Следовательно, нет части молекулы, которая несет значительное количество положительного или отрицательного заряда, необходимого для притяжения к ней других ионных и полярных молекул. Поэтому алканы обычно не реагируют с ионными соединениями, такими как большинство лабораторных кислот, оснований, окислителей или восстановителей.Рассмотрим бутан в качестве примера:
Ни положительные, ни отрицательные ионы не притягиваются к неполярной молекуле. На самом деле алканы вступают в так мало реакций, что их иногда называют парафинами , от латинского parum affinis , что означает «малое сродство».
В результате алканы обладают очень низкой реакционной способностью и подвергаются только трем основным типам реакций, включая следующие:
- Реакции горения – сжечь их – уничтожить всю молекулу;
- Реакции галогенирования (типа замещения) – вступают в реакцию с некоторыми галогенами, разрывая углерод-водородные связи;
- Реакции крекинга – используют тепло и/или катализатор для крекинга алканов, разрывая углерод-углеродные связи.
Реакции горения
Горение соединений углерода, особенно углеводородов, было самым важным источником тепловой энергии для человеческих цивилизаций на протяжении всей истории человечества. Практическое значение этой реакции нельзя отрицать, но массовые и неконтролируемые химические изменения, происходящие при горении, затрудняют вывод механизмов. Используя в качестве примера горение пропана, мы видим из следующего уравнения, что каждая ковалентная связь в реагентах была разорвана, и в продуктах образовался совершенно новый набор ковалентных связей. Никакая другая обычная реакция не вызывает столь глубоких и всеобъемлющих изменений, а механизм горения настолько сложен, что химики только начинают изучать и понимать некоторые его элементарные особенности.
Никакая другая обычная реакция не вызывает столь глубоких и всеобъемлющих изменений, а механизм горения настолько сложен, что химики только начинают изучать и понимать некоторые его элементарные особенности.
CH 3 CH 2 CH 3 + 5O 2 → 3CO 2 + 4H 2 O + нагрев
Обратите внимание, что в приведенной выше реакции соединения с левой стороны стрелки называются субстратами или реагентами , а соединения с правой стороны стрелки являются продуктами реакции.Энергия, чаще всего выделяющаяся в виде тепла, может быть либо субстратом, либо продуктом реакции, в зависимости от участвующих соединений. Также обратите внимание, что ни один из атомов не теряется в данных химических уравнениях. Закон сохранения массы гласит, что материя не может быть ни создана, ни уничтожена. Таким образом, уравнение должно быть сбалансированным и иметь такое же количество атомов в левой части уравнения, как и в правой. Напомним, что коэффициенты уравнения определяют, сколько молей соединения присутствует, и что если коэффициент не показан, по умолчанию он равен единице.Например, приведенное выше уравнение будет выглядеть так: 1 моль пропана (CH 3 CH 2 CH 3 ) реагирует с 5 молями кислорода (O 2 ) с образованием 3 молей углекислого газа (CO 2 ) и 4 моля воды (H 2 O) и выделяется тепло.
Напомним, что коэффициенты уравнения определяют, сколько молей соединения присутствует, и что если коэффициент не показан, по умолчанию он равен единице.Например, приведенное выше уравнение будет выглядеть так: 1 моль пропана (CH 3 CH 2 CH 3 ) реагирует с 5 молями кислорода (O 2 ) с образованием 3 молей углекислого газа (CO 2 ) и 4 моля воды (H 2 O) и выделяется тепло.
Химические связи также обладают потенциальной энергией. Если вы думаете о природе связи, она удерживается вместе энергией притяжения. Для разрыва связей на стороне реагента в уравнении требуется энергия, в то время как образование связей на стороне продукта высвобождает энергию.Если энергия, выделяемая при образовании связи, выше, чем энергия, необходимая для диссоциации связи, в результате реакции будет выделяться энергия. Эта энергия обычно измеряется как теплота реакции, которая называется энтальпией .
В отношении этой реакции важны два момента:
- Поскольку все ковалентные связи в молекулах реагентов разорваны, количество тепла, выделяющегося в этой реакции, связано с прочностью этих связей (и, конечно, с прочностью связей, образующихся в продуктах).
 Эти теплоты можно оценить с помощью энергий диссоциации/образования связи (энергия, необходимая для разрыва связи на стороне реагента уравнения, и энергия, выделяемая при образовании связи на стороне продукта уравнения).
Эти теплоты можно оценить с помощью энергий диссоциации/образования связи (энергия, необходимая для разрыва связи на стороне реагента уравнения, и энергия, выделяемая при образовании связи на стороне продукта уравнения). - Также важна стехиометрия реагентов. Если подается недостаточно кислорода, некоторые из продуктов будут состоять из менее окисленного газообразного монооксида углерода (СО).
Например, если бы присутствовало только 4 моля кислорода, при сгорании одного моля пропана образовался бы только 1 моль двуокиси углерода и 2 моля моноксида углерода.
CH 3 CH 2 CH 3 + 4O 2 → CO 2 + 2CO + 4H 2 O + тепло
Бонд Энерджис
Атомы соединяются вместе, образуя соединения, потому что при этом они достигают более низких энергий, чем те, которыми они обладают как отдельные атомы. Количество энергии, равное разности энергий связанных атомов и энергий разъединенных атомов, выделяется обычно в виде тепла. То есть связанные атомы имеют более низкую энергию, чем отдельные атомы как отдельные атомы. Когда атомы объединяются в соединение, всегда выделяется энергия, и соединение имеет более низкую общую энергию.
То есть связанные атомы имеют более низкую энергию, чем отдельные атомы как отдельные атомы. Когда атомы объединяются в соединение, всегда выделяется энергия, и соединение имеет более низкую общую энергию.
Когда происходит химическая реакция, молекулярные связи разрываются и образуются другие связи, образующие другие молекулы. Например, связи двух молекул воды разрываются с образованием водорода и кислорода.
2H 2 O → 2H 2 + O 2
Для разрыва связи всегда требуется энергия, известная как энергия связи .Хотя концепция может показаться простой, энергия связи служит очень важной цели при описании структуры и характеристик молекулы. Его можно использовать для определения наиболее подходящей точечной структуры Льюиса при наличии нескольких точечных структур Льюиса.
Основные выводы:- Для разрыва связи всегда требуется энергия.
- Энергия всегда высвобождается при создании связи.

Хотя каждая молекула имеет свою характеристическую энергию связи, возможны некоторые обобщения.Например, хотя точное значение энергии связи C–H зависит от конкретной молекулы, все связи C–H имеют энергию связи примерно одинакового значения, поскольку все они являются связями C–H. Чтобы разорвать 1 моль связи С-Н, требуется примерно 100 ккал энергии, поэтому мы говорим об энергии связи связи С-Н, равной примерно 100 ккал/моль. Связь C – C имеет приблизительную энергию связи 80 ккал / моль, а C = C имеет энергию связи около 145 ккал / моль. Мы можем рассчитать более общую энергию связи, найдя среднее значение энергии связи конкретной связи в разных молекулах, чтобы получить среднюю энергию связи.В таблице 7.2 приведен список средних энергий связи для обычных органических связей. Помните, что энергия может быть выражена в ккал или кДж и что коэффициент преобразования между ними составляет: 4,184 кДж = 1 ккал
.| Одинарные облигации | Множественные облигации | ||||||
|---|---|---|---|---|---|---|---|
| В—В | 432 | Н-Н | 391 | Я—Я | 149 | С = С | 614 |
| Н—Ф | 565 | Н—Н | 160 | I—Кл | 208 | С ≡ С | 839 |
| H—Cl | 427 | Н-Ф | 272 | И—Бр | 175 | О = О | 495 |
| H—Br | 363 | Н—Кл | 200 | С = О* | 745 | ||
| Н—Я | 295 | Н—Бр | 243 | Ш-В | 347 | С ≡ О | 1072 |
| № | 201 | С-Ф | 327 | Н = О | 607 | ||
| С—Н | 413 | О—Н | 467 | S—Cl | 253 | Н = Н | 418 |
| К—К | 347 | О—О | 146 | С—Бр | 218 | Н ≡ Н | 941 |
| C—N | 305 | О-Ф | 190 | С-С | 266 | С ≡ N | 891 |
| К—О | 358 | О—Cl | 203 | С = Н | 615 | ||
| C—F | 485 | О—Я | 234 | Si—Si | 340 | ||
| C—Cl | 339 | Si-H | 393 | ||||
| C—Br | 276 | Ф—Ф | 154 | Si-C | 360 | ||
| С—Я | 240 | F—Кл | 253 | Si-O | 452 | ||
| К—С | 259 | Ф—Бр | 237 | ||||
| Кл—Кл | 239 | ||||||
| Кл—Бр | 218 | ||||||
| Бр—Бр | 193 | ||||||
*C = O в (CO 2 ) = 799 | |||||||
Когда связь прочная, энергия связи выше, поскольку для ее разрыва требуется больше энергии. Это коррелирует с порядком связи и длиной связи. Когда порядок связи выше, длина связи короче, и чем короче длина связи, тем больше энергия связи из-за увеличения электрического притяжения. Как правило, чем короче длина связи, тем больше энергия связи.
Это коррелирует с порядком связи и длиной связи. Когда порядок связи выше, длина связи короче, и чем короче длина связи, тем больше энергия связи из-за увеличения электрического притяжения. Как правило, чем короче длина связи, тем больше энергия связи.
Разрыв и образование связи
Когда происходит химическая реакция, атомы реагентов перестраивают свои химические связи, образуя продукты. Новое расположение связей не имеет такой же полной энергии, как связи в реагентах.Следовательно, когда происходят химические реакции, всегда будет сопровождать изменение энергии . Изменение энергии реакции или теплоты реакции называется энтальпией . Он представлен математическим символом ΔH и рассчитывается как разница между энергией, необходимой для разрыва связей реагентов, и энергией, высвобождаемой при образовании связей в продуктах.
ΔH = энергия реагентов – энергия продуктов
Рисунок 7. 12: Энтальпия реакции. (верхняя реакция) Экзотермические реакции. При экзотермической химической реакции энергия выделяется по мере того, как реагенты превращаются в продукты. (нижняя реакция) Эндотермические реакции. Для эндотермической химической реакции энергия поглощается по мере того, как реагенты превращаются в продукты.
12: Энтальпия реакции. (верхняя реакция) Экзотермические реакции. При экзотермической химической реакции энергия выделяется по мере того, как реагенты превращаются в продукты. (нижняя реакция) Эндотермические реакции. Для эндотермической химической реакции энергия поглощается по мере того, как реагенты превращаются в продукты.
В некоторых реакциях энергия образующихся продуктов ниже энергии реагентов. Таким образом, в ходе реакции избыточная энергия, выделяемая при образовании продукта, будет выделяться в окружающую среду.Такие реакции являются экзотермическими и могут быть представлены диаграммой уровней энергии на рисунке 7.12 (вверху). В большинстве случаев энергия выделяется в виде тепла (хотя в некоторых реакциях энергия выделяется в виде света). В химических реакциях, где продукты имеют более высокую энергию, чем реагенты, реагенты должны поглощать энергию из окружающей среды, чтобы иметь возможность реагировать. Эти реакции являются эндотермическими и могут быть представлены диаграммами энергетических уровней, подобными рис. 7.12 (ниже).
7.12 (ниже).
Экзотермические и эндотермические реакции можно рассматривать как имеющие энергию либо как «продукт» реакции, либо как «реагент» соответственно.Экзотермические реакции высвобождают энергию, поэтому энергия является продуктом. Эндотермические реакции требуют энергии, поэтому энергия является реагентом.
Экзотермические реакции будут иметь отрицательную общую энтальпию, а эндотермические реакции будут иметь положительную общую энтальпию.
ΔH = энергия реагентов – энергия продуктов
Энергия реакции может рассматриваться стехиометрически в рамках реакции точно так же, как любое из соединений в реакции.При сгорании метана CH 4 каждый сожженный моль выделяет 824 кДж энергии. Таким образом, легко подсчитать, сколько энергии высвобождается при сгорании любого количества CH 4 . Мы также можем легко подсчитать, сколько CO 2 образуется на каждый моль сгоревшего CH 4 , поскольку на каждый моль сгоревшего CH 4 производится один моль CO 2 .
Полное сгорание (при достаточном количестве кислорода) любого углеводорода дает диоксида углерода (CO 2 ) и воды (H 2 O) .Очень важно, чтобы вы могли написать правильно сбалансированные уравнения для этих реакций, потому что они часто возникают как часть термохимических расчетов. Некоторые легче, чем другие. Например, алканы с четным числом атомов углерода немного тверже, чем с нечетным!
Пример 1: сжигание пропана
Например, с пропаном (C 3 H 8 ) вы можете сбалансировать углерод и водород, записывая уравнение.Ваш первый черновик будет:
C 3 H 8 + ?O 2 → 3CO 2 + 4H 2 O
Подсчет кислорода приводит непосредственно к окончательной версии:
C 3 H 8 + 5O 2 → 3CO 2 + 4H 2 O
Пример 2: сжигание бутана
С бутаном (C 4 H 10 ) вы можете снова сбалансировать углерод и водород, записывая уравнение.
C 4 H 10 + ?O 2 → 4CO 2 + 5H 2 O
Подсчет кислорода приводит к небольшой проблеме — 13 справа. Наличие нечетного количества кислорода на стороне продукта делает невозможным балансирование с четным числом на стороне реагента. В подобных случаях начните пытаться сбалансировать уравнение, изменив кофактор перед алканом на 2. Затем сбалансируйте углерод и водороды на стороне продукта.В этом случае число кислорода должно стать положительным, и теперь вы сможете сбалансировать уравнение.
2C 4 H 10 + 13O 2 → 8CO 2 + 10H 2 O
Углеводороды труднее воспламеняются по мере того, как молекулы становятся больше. Это связано с тем, что более крупные молекулы не так легко испаряются — реакция идет намного лучше, если кислород и углеводород хорошо перемешаны в виде газов. Если жидкость не очень летучая, только те молекулы, которые находятся на поверхности, могут реагировать с кислородом. Молекулы большего размера имеют большее притяжение Ван-дер-Ваальса, что затрудняет их отрыв от своих соседей и превращение в газ.
Молекулы большего размера имеют большее притяжение Ван-дер-Ваальса, что затрудняет их отрыв от своих соседей и превращение в газ.
При полном сгорании все углеводороды будут гореть синим пламенем. Однако сгорание имеет тенденцию быть менее полным по мере увеличения числа атомов углерода в молекулах. Это означает, что чем крупнее углеводород, тем больше вероятность того, что вы получите желтое дымное пламя.
Неполное сгорание
Неполное сгорание (при недостатке кислорода) может привести к образованию углерода или окиси углерода.Проще говоря, водород в углеводороде получает первый шанс на образование воды в продукте, а углерод получает все, что осталось! Когда образуется только углерод, присутствие светящихся частиц углерода в пламени окрашивает его в желтый цвет, а в дыме часто виден черный углерод. Если некоторое количество кислорода может взаимодействовать с углеродом, но недостаточно для образования двуокиси углерода (CO 2 ), тогда образуется окись углерода (CO) в виде бесцветного ядовитого газа.
Почему угарный газ ядовит: Кислород переносится кровью гемоглобином, белком, содержащимся в красных кровяных тельцах.Углекислый газ также связывается с гемоглобином. Гемоглобин переносит кислород из легких в каждую клетку вашего тела, где он выделяет кислород, собирает углекислый газ и переносит его обратно в легкие. Затем гемоглобин заменяет углекислый газ на кислород в воздухе, которым вы дышите. Когда вы выдыхаете, вы выделяете углекислый газ. Угарный газ также может связываться с гемоглобином. Разница в том, что монооксид углерода связывается необратимо (или очень сильно), что делает эту конкретную молекулу гемоглобина бесполезной для переноса кислорода.Если вы вдохнете достаточно угарного газа, вы умрете от внутреннего удушья!
Теплота сгорания
Теплота сгорания, ΔH c , определяется как полная энергия, выделяемая в виде тепла, когда вещество подвергается полному сгоранию с кислородом при наборе стандартных условий. Он рассчитывается так же, как и энтальпия, однако он специфичен для набора стандартных условий. Теплота сгорания является полезной величиной, поскольку это постоянная величина для типа сжигаемого материала, и ее можно использовать для сравнения эффективности и полезности различных источников топлива, наиболее часто используемых в обществе (нефть, бензин, природный газ, дизельное топливо, уголь). , древесина, водород, этанол и т. д.).В Соединенных Штатах показатели нагрева обычно указываются в британских тепловых единицах (БТЕ) на фунт материала. Обычное преобразование в метрические единицы:
Теплота сгорания является полезной величиной, поскольку это постоянная величина для типа сжигаемого материала, и ее можно использовать для сравнения эффективности и полезности различных источников топлива, наиболее часто используемых в обществе (нефть, бензин, природный газ, дизельное топливо, уголь). , древесина, водород, этанол и т. д.).В Соединенных Штатах показатели нагрева обычно указываются в британских тепловых единицах (БТЕ) на фунт материала. Обычное преобразование в метрические единицы:
БТЕ/фунт = (кДж/кг)*2,326
Теплота сгорания, ΔHc, значения общих источников топлива и связанные с ними выбросы CO2 указаны в таблице 7.5
Таблица 7.5 Профиль теплоты сгорания и выбросов CO2 для обычных видов топливаАдаптировано из: EPA – (2014) и Википедии – Теплота сгорания
Нефть (от греческого: петра: «скала» + олеум : «нефть») — это природная жидкость от желтого до черного цвета, обнаруженная в геологических формациях под поверхностью Земли, которая обычно перерабатывается в различные типы. топлива.Он состоит в основном из алканов, циклоалканов и алкенов различной длины и некоторых дополнительных второстепенных органических соединений. Алканы с пятью или более атомами углерода являются жидкостями и встречаются в качестве обычных компонентов нефти (также называемой сырой нефтью ). Многие циклоалканы также содержатся в нефтепродуктах, включая бензин, керосин, дизельное топливо, моторное масло и многие другие тяжелые масла. С другой стороны, природный газ состоит преимущественно из метана (CH 4 ), но также содержит этан (C 2 H 6 ), пропан (C 3 H 8 ) и бутан ( С 4 Н 10 ).Природный газ также содержит следовые количества азота, двуокиси углерода (CO 2 ) и сероводорода (H 2 S).
топлива.Он состоит в основном из алканов, циклоалканов и алкенов различной длины и некоторых дополнительных второстепенных органических соединений. Алканы с пятью или более атомами углерода являются жидкостями и встречаются в качестве обычных компонентов нефти (также называемой сырой нефтью ). Многие циклоалканы также содержатся в нефтепродуктах, включая бензин, керосин, дизельное топливо, моторное масло и многие другие тяжелые масла. С другой стороны, природный газ состоит преимущественно из метана (CH 4 ), но также содержит этан (C 2 H 6 ), пропан (C 3 H 8 ) и бутан ( С 4 Н 10 ).Природный газ также содержит следовые количества азота, двуокиси углерода (CO 2 ) и сероводорода (H 2 S).
Компоненты нефти разделяют по размеру с помощью метода, называемого фракционной перегонкой. Полученные образцы включают бензин с алканами длиной от пяти до десяти атомов углерода и керосин со смесью алканов длиной от десяти до семнадцати атомов углерода. Алканы с более длинными углеродными цепями встречаются в дизельном топливе, мазуте, вазелине, парафине, моторных маслах, а самая большая длина цепи используется в асфальте.Подсчитано, что в мире ежедневно используется около 95 миллионов баррелей нефти! По оценкам Агентства по охране окружающей среды, каждый баррель нефти производит 0,43 метрических тонны CO 2 . Обратите внимание, что метрическая тонна эквивалентна 1000 кг. Это означает, что 40 850 000 метрических тонн CO 2 или 40 850 000 000 кг CO 2 ежедневно выбрасываются в атмосферу только в результате потребления нефти! Это почти 15 миллиардов метрических тонн CO 2 в год! Этот расчет включает только потребление сырой нефти, а не других распространенных источников топлива, таких как природный газ, уголь, древесина и возобновляемые источники энергии, такие как этанол и биодизель.
Алканы с более длинными углеродными цепями встречаются в дизельном топливе, мазуте, вазелине, парафине, моторных маслах, а самая большая длина цепи используется в асфальте.Подсчитано, что в мире ежедневно используется около 95 миллионов баррелей нефти! По оценкам Агентства по охране окружающей среды, каждый баррель нефти производит 0,43 метрических тонны CO 2 . Обратите внимание, что метрическая тонна эквивалентна 1000 кг. Это означает, что 40 850 000 метрических тонн CO 2 или 40 850 000 000 кг CO 2 ежедневно выбрасываются в атмосферу только в результате потребления нефти! Это почти 15 миллиардов метрических тонн CO 2 в год! Этот расчет включает только потребление сырой нефти, а не других распространенных источников топлива, таких как природный газ, уголь, древесина и возобновляемые источники энергии, такие как этанол и биодизель.
Подсчитано, что в зимние месяцы в Орегоне для обогрева среднего хорошо изолированного дома требуется около 40 БТЕ в час на квадратный фут. Если бы вы владели домом площадью 2000 квадратных футов, сколько БТЕ вам потребовалось бы для обогрева собственного дома в течение 1 месяца? (примерно 31 день в месяце). Если бы у вас был выбор обогрева дома природным газом, углем (лигнитом) или дровами, сколько кг каждого из этих видов топлива потребовалось бы для обогрева вашего дома в течение одного месяца? Сколько CO2 будет производиться каждым топливом каждый зимний месяц?
Если бы вы владели домом площадью 2000 квадратных футов, сколько БТЕ вам потребовалось бы для обогрева собственного дома в течение 1 месяца? (примерно 31 день в месяце). Если бы у вас был выбор обогрева дома природным газом, углем (лигнитом) или дровами, сколько кг каждого из этих видов топлива потребовалось бы для обогрева вашего дома в течение одного месяца? Сколько CO2 будет производиться каждым топливом каждый зимний месяц?
(наверх)
Реакции галогенирования (тип замещения)
В присутствии тепла или света алканы могут реагировать с галогенами с образованием алкилгалогенидов (или галогеналканов). Этот тип реакции называется реакцией замещения , потому что атом галогена занимает место (или замещает) один из атомов водорода в структуре алкана. Следует отметить, что не все галогены одинаково реагируют с алканами.
- Реакция между алканами и фтором: Эта реакция взрывоопасна даже на холоде и в темноте, и вы, скорее всего, получите углерод и фтористый водород, а не желаемую реакцию замещения.
 Для химиков-органиков это не представляет особого интереса, так как реакция может быть очень опасной и не дает желаемого продукта. Например, желаемым продуктом будет алкилфторид:
Для химиков-органиков это не представляет особого интереса, так как реакция может быть очень опасной и не дает желаемого продукта. Например, желаемым продуктом будет алкилфторид:
CH 4 + F 2 → CH 3 F + HF
Но реакция идет так быстро, что вот результат:
CH 4 + 2F 2 → C + 4HF
- Реакция между алканами и йодом: Йод никак не реагирует с алканами – по крайней мере, в нормальных лабораторных условиях.Так что эта реакция тоже бесполезна.
- Реакции между алканами и хлором или бромом: В темноте реакции не происходит, но при наличии света и тепла реакция приведет к образованию желаемых алкилгалогенидов. Таким образом, мы сосредоточим наше обсуждение на реакциях галогенирования с хлором и бромом.
В присутствии пламени реакции подобны реакции с фтором – образуется смесь углерода и галогеноводорода. Интенсивность реакции значительно падает по мере перехода от фтора к хлору и к брому. Интересные реакции происходят в присутствии ультрафиолетового света (подойдет солнечный свет). Это фотохимические реакции, которые происходят при комнатной температуре. Рассмотрим реакции с хлором, хотя реакции с бромом аналогичны, но развиваются медленнее.
Интенсивность реакции значительно падает по мере перехода от фтора к хлору и к брому. Интересные реакции происходят в присутствии ультрафиолетового света (подойдет солнечный свет). Это фотохимические реакции, которые происходят при комнатной температуре. Рассмотрим реакции с хлором, хотя реакции с бромом аналогичны, но развиваются медленнее.
В реакции замещения атом водорода в метане заменяется атомом хлора. Это может происходить несколько раз, пока не будут заменены все атомы водорода.В конечном счете, чем дольше протекает реакция, тем больше атомов водорода в алкане заменяется. Таким образом, вы получите смесь хлорметана (CH 3 Cl), дихлорметана (CH 2 Cl 2 ), трихлорметана (CHCl 3 ) и тетрахлорметана (CCl 4 ).
Исходная смесь бесцветного газа (CH 4 ) и зеленого газа (Cl 2 ) должна производить пары хлористого водорода (HCl) и туман органических жидкостей (смесь хлорированного метана).
Эта реакция замещения является примером радикальной реакции, когда за один раз переносится только один электрон. Тепло или свет инициируют реакцию, разрывая связь между двумя атомами Cl в ионе хлорида. Это образует два радикала . Радикал – это атом, молекула или ион с неспаренными валентными электронами.Таким образом, они очень нестабильны и реактивны. На приведенной ниже диаграмме показана первая стадия реакции галогенирования. Это называется посвящением .
Инициирующая реакция
Как только радикал инициируется, он атакует алкан, в данном случае метан (CH 4 ), и создает новый углеродный радикал. Эта стадия реакции называется размножением , поскольку один вид радикала создает или размножает другой радикал.
Заключительной стадией радикальной реакции является реакция обрыва , которая гасит присутствующие радикальные частицы. Для реакции метан-хлор это образование хлорметана (CH 3 Cl).
Реакция завершенияТаким образом, радикальные реакции протекают в три стадии:
- Инициирование – , при котором образуются радикалы, как правило, под действием тепла, света или другого каталитического процесса.
- Размножение — , когда один вид радикалов взаимодействует с другой молекулой с образованием другого вида радикалов.
- Прекращение – , когда два вида радикалов взаимодействуют и гасят радикальную реакцию, образуя стабильный продукт.
Как видно на примере с метаном, если вы галогенируете более крупные алканы, вы снова получите смесь продуктов замещения, но стоит просто кратко взглянуть на то, что происходит, если замещается только один из атомов водорода (монозамещение) — просто чтобы показать что все не так просто, как кажется! Например, с пропаном можно получить один из двух изомеров:
.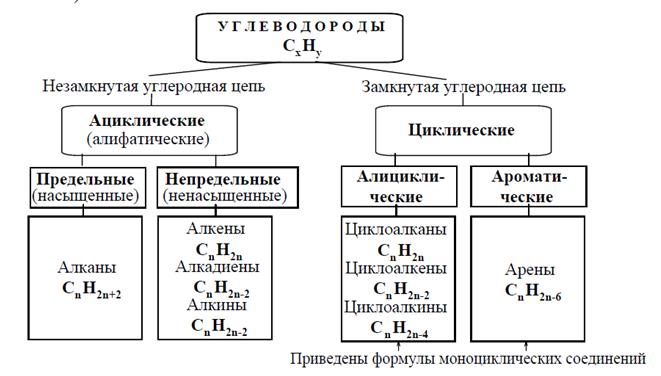
Если бы случай был единственным фактором, вы бы ожидали получить в три раза больше изомера с хлором на конце.Есть 6 атомов водорода, которые могут быть заменены на концевых атомах углерода, по сравнению только с двумя в середине. На самом деле вы получаете примерно одинаковое количество каждого из двух изомеров. Если вы используете бром вместо хлора, большая часть продукта образуется там, где бром присоединен к центральному атому углерода. Почему это происходит?
Это связано со стабильностью промежуточного углеродного радикала, который образуется во время реакции. Углерод, который имеет больше углеродных соседей, будет легче терять водород и образовывать промежуточный углеродный радикал.Соседние атомы углерода, будучи больше, чем соседние атомы водорода, могут помочь стабилизировать образование углеродного радикала. Таким образом, в реакции галогенирования третичные углероды будут наиболее реакционноспособными, за ними следуют вторичные углероды и, наконец, первичные углероды.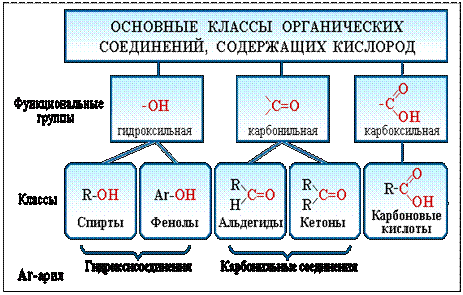 Четвертичные углероды нереакционноспособны, так как у них нет доступных атомов водорода, которые могут быть заменены галогеном.
Четвертичные углероды нереакционноспособны, так как у них нет доступных атомов водорода, которые могут быть заменены галогеном.
Реакции галогенирования с циклоалканами
Реакции циклоалканов, как правило, такие же, как и у алканов, с атомами водорода в циклической кольцевой структуре, замененными атомом галогена.Например, в присутствии УФ-излучения циклопропан будет вступать в реакцию замещения с хлором или бромом точно так же, как нециклический алкан.
Однако небольшие кольцевые структуры, особенно циклопропан, также способны реагировать в темноте. В отсутствие УФ-света циклопропан может вступать в реакции присоединения, в которых цикл разрывается. Например, с бромом циклопропан дает следующее линейное соединение.
Это все еще может происходить в присутствии УФ-излучения, но вы также получите смесь реакций замещения.Кольцо сломано, потому что циклопропан сильно страдает от деформации кольца. Напомним, что валентные углы в кольце составляют 60°, а не обычное значение около 109,5°, когда углерод образует четыре одинарные связи.
Напомним, что валентные углы в кольце составляют 60°, а не обычное значение около 109,5°, когда углерод образует четыре одинарные связи.
Почему алканы иногда называют парафинами?
Какой галоген наиболее легко реагирует с алканами? Что реагирует наименее легко?
Алканы не реагируют со многими обычными химическими веществами.Иногда их называют парафинами, от латинского parum affinis , что означает «мало родства».
наиболее легко: F 2 ; наименее охотно: I 2
Множество интересных и часто полезных соединений содержат один или несколько атомов галогена на молекулу. Например, метан (CH 4 ) может реагировать с хлором (Cl 2 ), заменяя один, два, три или все четыре атома водорода на атомы Cl. Несколько галогенированных продуктов, полученных из метана и этана (CH 3 CH 3 ), перечислены в таблице 7.6 вместе с некоторыми из их применений.
Несколько галогенированных продуктов, полученных из метана и этана (CH 3 CH 3 ), перечислены в таблице 7.6 вместе с некоторыми из их применений.
Для вашего здоровья: галогенированные углеводороды
Когда-то широко использовавшиеся в потребительских товарах, многие хлорированные углеводороды считаются канцерогенами (веществами, вызывающими рак), а также известно, что они вызывают серьезные повреждения печени. Примером может служить четыреххлористый углерод (CCl 4 ), который когда-то использовался в качестве растворителя для химической чистки и в огнетушителях, но больше не рекомендуется ни для того, ни для другого.Даже в небольших количествах его пары могут вызвать серьезное заболевание при длительном воздействии. Более того, он реагирует с водой при высоких температурах с образованием смертоносного газа фосгена (COCl 2 ), что делает использование CCl 4 в огнетушителях особенно опасным.
Этилхлорид, напротив, используется в качестве наружного местного анестетика. При распылении на кожу он быстро испаряется, охлаждая участок настолько, что он становится нечувствительным к боли. Его также можно использовать в качестве экстренного общего анестетика.
Бромсодержащие соединения широко используются в огнетушителях и в качестве антипиренов для одежды и других материалов. Поскольку они также токсичны и оказывают неблагоприятное воздействие на окружающую среду, ученые занимаются разработкой более безопасных заменителей для них, как и для многих других галогенсодержащих соединений.
Для вашего здоровья: хлорфторуглероды и озоновый слой
Алканы, замещенные атомами фтора (F) и хлора (Cl), использовались в качестве диспергирующих газов в аэрозольных баллончиках, в качестве пенообразователей для пластмасс и в качестве хладагентов.Два наиболее известных из этих хлорфторуглеродов (ХФУ) перечислены в таблице 7. 6.
6.
Хлорфторуглероды способствуют возникновению парникового эффекта в нижних слоях атмосферы. Они также диффундируют в стратосферу, где разрушаются ультрафиолетовым (УФ) излучением с высвобождением атомов Cl. Они, в свою очередь, разрушают молекулы озона (O 3 ), которые защищают Землю от вредного ультрафиолетового излучения. Действия во всем мире привели к сокращению использования ХФУ и родственных соединений. ХФУ и другие хлор- или бромсодержащие озоноразрушающие соединения заменяются более безопасными веществами.Одной из альтернатив являются гидрофторуглероды (ГФУ), такие как CH 2 FCF 3 , которые не содержат Cl или Br для образования радикалов. Другим примером являются гидрохлорфторуглероды (ГХФУ), такие как CHCl 2 CF 3 . Молекулы ГХФУ легче разрушаются в тропосфере, и меньше озоноразрушающих молекул достигает стратосферы.
Рисунок 7.13. Истощение озонового слоя в верхних слоях атмосферы. Озон в верхних слоях атмосферы защищает поверхность Земли от солнечного УФ-излучения, которое может вызывать рак кожи у людей, а также вредно для других животных и некоторых растений.Озоновые «дыры» в верхних слоях атмосферы (серые, розовые и фиолетовые области в центре) представляют собой большие области значительного истощения озонового слоя. Они встречаются в основном над Антарктидой с конца августа по начало октября и заполняются примерно в середине ноября. Истощение озонового слоя также было отмечено в арктических регионах. Самая большая из когда-либо наблюдаемых озоновых дыр образовалась 24 сентября 2006 года.
Крекинг-алканы
Что трещит? Крекинг — это название, данное разбиению больших молекул углеводородов на более мелкие и более полезные фрагменты.Это достигается за счет использования высоких катализатора высоких давлений и температур или более низких температур и давлений в присутствии катализатора . Катализатор — это вещество, которое увеличивает скорость химической реакции, не претерпевая при этом каких-либо необратимых химических изменений.
Источником больших молекул углеводородов часто является фракция нафты или фракция газойля, образующаяся при фракционной перегонке сырой нефти (нефти).Эти фракции получают в процессе дистилляции в виде жидкостей, но перед крекингом повторно испаряют в газообразную фазу. В взломщике не происходит ни одной уникальной реакции. Молекулы углеводородов распадаются довольно случайным образом, образуя смеси более мелких углеводородов, некоторые из которых имеют двойные углерод-углеродные связи. Одной из возможных реакций с участием углеводорода C 15 H 32 может быть:
C 15 H 32 → 2C 2 H 4 + C 3 H 6 + C 9 1 8 1 H 190 Или, более ясно показывая, что происходит с различными атомами и связями: Это только один из способов распада данной конкретной молекулы.Обратите внимание, что помимо образования более мелких алканов в результате реакции крекинга также могут образовываться алкены с двойными связями. В этом случае алкены — этен (C 2 H 4 ) и пропен (C 3 H 6 ) — являются важными материалами для производства пластмасс или других органических химикатов. Октан является одной из молекул, обнаруженных в бензине (бензине).
Взгляд ближе: Алкановая основа свойств других соединений
Понимание физических свойств алканов важно, поскольку нефть и природный газ, а также многие продукты, получаемые из них — бензин, газ в баллонах, растворители, пластмассы и т. д. — состоят в основном из алканов.Это понимание важно еще и потому, что оно является основой для описания свойств других семейств органических и биологических соединений. Например, большая часть структур липидов состоит из неполярных алкильных групп. Липиды включают пищевые жиры и жироподобные соединения, называемые фосфолипидами и сфинголипидами, которые служат структурными компонентами живых тканей. Эти соединения имеют как полярные, так и неполярные группы, что позволяет им ликвидировать разрыв между водорастворимыми и водонерастворимыми фазами.Эта характеристика необходима для избирательной проницаемости клеточных мембран.
Рисунок 7.13 Сравнение липидов и алканов. Трипальмитин (а), типичная молекула жира, имеет длинные углеводородные цепи, типичные для большинства липидов. Сравните эти цепи с гексадеканом (б), алканом с 16 атомами углерода.
(наверх)7.5 Краткое содержание главы
Чтобы убедиться, что вы поняли материал этой главы, вам следует просмотреть значения следующих выделенных жирным шрифтом терминов в резюме и спросить себя, как они относятся к темам этой главы.
Органическая химия — химия соединений углерода, а неорганическая химия — химия всех остальных элементов. Атомы углерода могут образовывать прочные ковалентные связи с другими атомами углерода и с атомами других элементов, и это свойство позволяет образовывать десятки миллионов органических соединений. Углеводороды содержат только атомы водорода и углерода.
Углеводороды, в которых каждый атом углерода связан с четырьмя другими атомами, называются алканами или насыщенными углеводородами .Они имеют общую формулу C n H 2 n + 2 . Любой данный алкан отличается от следующего в ряду единицей CH 2 . Любое семейство соединений, в котором соседние члены отличаются друг от друга определенным фактором, называется гомологическим рядом .
Атомы углерода в алканах могут образовывать прямые или разветвленные цепи. Два или более соединений, имеющих одинаковую молекулярную формулу, но разные структурные формулы, являются изомерами друг друга.Для трех самых маленьких алканов нет изомерных форм; начиная с C 4 H 10 , все остальные алканы имеют изомерные формы.
Циклоалканы представляют собой углеводороды, молекулы которых представляют собой замкнутые кольца, а не прямые или разветвленные цепи. Циклический углеводород представляет собой углеводород с кольцом из атомов углерода.
Напомним, что структурная формула показывает все атомы углерода и водорода и то, как они связаны друг с другом. Сокращенная структурная формула показывает атомы водорода рядом с атомами углерода, к которым они присоединены.Формула линия-угол — это формула, в которой атомы углерода подразумеваются в углах и концах линий. Подразумевается, что каждый атом углерода связан с достаточным количеством атомов водорода, чтобы дать каждому атому углерода четыре связи
Физические свойства алканов отражают тот факт, что молекулы алканов неполярны. Алканы нерастворимы в воде и менее плотны, чем вода.
Алканы обычно не вступают в реакцию с лабораторными кислотами, основаниями, окислителями и восстановителями.Они горят (проходят реакции горения ).
Алканы реагируют с галогенами, замещая атомы водорода одним или несколькими атомами галогена с образованием галогенированных углеводородов. Эта реакция называется галогенированием . Алкилгалогенид (галогеналкан) представляет собой соединение, полученное в результате замены атома водорода алкана атомом галогена.
Более крупные алканы можно разбить на более мелкие алканы и алкены с помощью высокой температуры или катализаторов.Эти реакции называются реакциями крекинга .
(наверх)7.6 Упражнения в конце главы
Вы нашли банку без этикетки, содержащую твердое вещество, плавящееся при 48°C. Он легко воспламеняется и легко горит. Вещество нерастворимо в воде и плавает на поверхности. Является ли вещество органическим или неорганическим?
В чем опасность проглатывания жидкого алкана?
- Различают более легкие и более тяжелые жидкие алканы с точки зрения их воздействия на кожу.
Ниже приведена линейная формула алкана. Нарисуйте сжатую структуру.
Напишите уравнения полного сгорания каждого соединения.
- бутан, C 4 H 10 (обычная жидкость для зажигалок)
- октан, C 8 H 18 (типичный углеводород в бензине).
Плотность образца бензина 0,690 г/мл. На основе полного сгорания октана рассчитайте количество в граммах двуокиси углерода (CO 2 ) и воды (H 2 O), образующихся на галлон (3.78 л) бензина при использовании в автомобиле.
Нарисуйте структуры четырех из девяти изомерных гексанов (C 7 H 16 ).
Укажите, представляют ли структуры в каждом наборе одно и то же соединение или изомеры.
Рассмотрите приведенные здесь формулы линейного угла и ответьте на вопросы.
- Какая пара формул представляет изомеры? Нарисуйте каждую структуру.
- Какая формула представляет собой алкилгалогенид? Напишите его сокращенную структурную формулу.
- Какая формула представляет собой циклический алкан?
- Это молекулярная формула соединения, представленного (i)?
(наверх) 7.7 Каталожные номера
Текст для этой главы был адаптирован из ресурсов Creative Commons, перечисленных ниже, если в тексте не указано иное.
- Органическая химия (2016) Libretexts, UC Дэвис, Лицензия: Creative Commons Attribution-Noncommercial-Share Alike 3.0 United States License. Доступно по адресу: https://chem.libretexts.org/Core/Organic_Chemistry .
- Ингалант. (2017, 12 февраля). В Википедии , Свободной энциклопедии . Получено 01:21, 13 февраля 2017 г., с https://en.wikipedia.org/w/index.php?title=Inhalant&oldid=765135147 .
- Аноним. (2012) Введение в химию: общая, органическая и биологическая (V1.0). Опубликовано Creative Commons by-nc-sa 3.0. Доступно по адресу: http://2012books.lardbucket.org/books/introduction-to-chemistry-general-organic-and-biological/index.html .
- Физическая и теоретическая химия (2017) Libretexts, UC Дэвис, Лицензия: Creative Commons Attribution-Noncommercial-Share Alike 3.0 United States License. Доступно по адресу: https://chem.libretexts.org/Core/Physical_and_Theoretical_Chemistry/Chemical_Bonding/General_Principles_of_Chemical_Bonding/Bond_Energies.
- Нефть. (2017, 14 февраля). В Википедии , Свободной энциклопедии . Получено 06:29, 16 февраля 2017 г., с https://en.wikipedia.org/w/index.php?title=Petroleum&oldid=765440823 .
- Болл, Д.В., Хилл, Дж.В., и Скотт, Р.Дж. (2016) КАРТА: Основы общей, органической и биологической химии . Свободные тексты. Доступно по адресу: https://chem.libretexts.org/Textbook_Maps/Introductory_Chemistry_Textbook_Maps/Map%3A_The_Basics_of_GOB_Chemistry_(Ball_et_al.)
2.5 Органические соединения, необходимые для жизнедеятельности человека – анатомия и физиология
Цели обучения
К концу этого раздела вы сможете:
- Определение органических молекул, необходимых для жизнедеятельности человека
- Объясните химию, лежащую в основе сродства углерода к ковалентным связям в органических соединениях
- Приведите примеры углеводов и определите основные функции углеводов в организме
- Обсудите липиды, важные для жизнедеятельности человека
- Описать структуру белков и обсудить их значение для жизнедеятельности человека
- Определите строительные блоки нуклеиновых кислот и роли ДНК, РНК и АТФ в функционировании человека
Органические соединения обычно состоят из групп атомов углерода, ковалентно связанных с водородом, обычно с кислородом, а также часто с другими элементами.Созданные живыми существами, они встречаются по всему миру, в почвах и морях, в коммерческих продуктах и в каждой клетке человеческого тела. Четыре типа наиболее важны для структуры и функции человека: углеводы, липиды, белки и нуклеотиды. Прежде чем исследовать эти соединения, вам нужно сначала понять химию углерода.
Химия углерода
Что делает органические соединения вездесущими, так это химический состав их углеродного ядра. Вспомните, что атомы углерода имеют четыре электрона в своей валентной оболочке и что правило октета диктует, что атомы имеют тенденцию реагировать таким образом, чтобы завершить свою валентную оболочку с восемью электронами.Атомы углерода не завершают свои валентные оболочки, отдавая или принимая четыре электрона. Вместо этого они легко делят электроны через ковалентные связи.
Обычно атомы углерода делятся с другими атомами углерода, часто образуя длинную углеродную цепь, называемую углеродным скелетом. Однако, когда они делятся, они не делят все свои электроны исключительно друг с другом. Скорее, атомы углерода имеют тенденцию делиться электронами с множеством других элементов, одним из которых всегда является водород. Углеродные и водородные группы называются углеводородами.Если вы изучите рисунки органических соединений в оставшейся части этой главы, вы увидите несколько с цепочками углеводородов в одной области соединения.
Возможно множество комбинаций для заполнения четырех «вакансий» углерода. Углерод может делиться электронами с кислородом, азотом или другими атомами в определенной области органического соединения. Более того, атомы, с которыми связаны атомы углерода, также могут быть частью функциональной группы. Функциональная группа представляет собой группу атомов, связанных сильными ковалентными связями и склонных действовать в химических реакциях как единое целое.Вы можете думать о функциональных группах как о тесно связанных «кликах», члены которых вряд ли будут разделены. В физиологии человека важное значение имеют пять функциональных групп: гидроксильная, карбоксильная, амино, метильная и фосфатная группы (табл. 2.1).
| Функциональная группа | Структурный Формула | Важность |
| Гидроксил | —О—Н | Гидроксильные группы полярны. Они являются компонентами всех четырех типов органических соединений, обсуждаемых в этой главе.Они участвуют в реакциях дегидратации и гидролиза. |
| Карбоксил | О—С—ОН | Карбоксильные группы встречаются в жирных кислотах, аминокислотах и многих других кислотах. |
| Амино | —N—H 2 | Аминогруппы находятся в аминокислотах, строительных блоках белков. |
| Метил | —C—H 3 | Метильные группы находятся в аминокислотах. |
| Фосфат | —P—O 4 2– | Фосфатные группы находятся в составе фосфолипидов и нуклеотидов. |
Сродство углерода к ковалентной связи означает, что многие отдельные и относительно стабильные органические молекулы легко образуют более крупные и сложные молекулы. Любая крупная молекула обозначается как макромолекула (макро- = «большая»), и все органические соединения в этом разделе соответствуют этому описанию.Однако некоторые макромолекулы состоят из нескольких «копий» отдельных звеньев, называемых мономерами (моно- = «один»; -мер = «часть»). Подобно бусинкам в длинном ожерелье, эти мономеры соединяются ковалентными связями, образуя длинные полимеры (поли- = «много»). Среди органических соединений много примеров мономеров и полимеров.
Мономеры образуют полимеры, участвуя в дегидратационном синтезе (см. рис. 2.4.1). Как было отмечено ранее, в результате этой реакции выделяется молекула воды. Каждый мономер вносит свой вклад; один отдает атом водорода, а другой отдает гидроксильную группу.Полимеры расщепляются на мономеры путем гидролиза (-лиз = «разрыв»). Связи между их мономерами разрываются за счет отдачи молекулы воды, которая вносит атом водорода в один мономер и гидроксильную группу в другой.
Углеводы
Термин «углевод» означает «гидратированный углерод». Напомним, что корень гидро- указывает на воду. Углевод представляет собой молекулу, состоящую из углерода, водорода и кислорода; в большинстве углеводов водород и кислород находятся в тех же соотношениях два к одному, что и в воде.Фактически, химическая формула «обычной» молекулы углевода (CH 2 O) n .
Углеводы называются сахаридами, что означает «сахара». В организме важны три формы: моносахариды, дисахариды и полисахариды. Моносахариды – это мономеры углеводов. Дисахариды (ди- = «два») состоят из двух мономеров. Полисахариды представляют собой полимеры и могут состоять из сотен и тысяч мономеров.
Моносахариды
Моносахарид представляет собой мономер углеводов. В организме важны пять моносахаридов. Три из них представляют собой гексозные сахара, названные так потому, что каждый из них содержит шесть атомов углерода. Это глюкоза, фруктоза и галактоза, показанные на рис. 2.5.1 a . Остальные моносахариды представляют собой два пентозных сахара, каждый из которых содержит пять атомов углерода. Это рибоза и дезоксирибоза, показанные на рис. 2.5.1 б .
Рисунок 2.5.1 Пять важных моносахаридовДисахариды
Дисахарид представляет собой пару моносахаридов. Дисахариды образуются в результате дегидратационного синтеза, а связывающая их связь называется гликозидной связью (глико- = «сахар»). Три дисахарида (показаны на рис. 2.5.2) важны для человека. Это сахароза, обычно называемая столовым сахаром, лактоза или молочный сахар, и мальтоза, или солодовый сахар.Как вы можете понять из их общих названий, вы потребляете их в своем рационе, однако ваше тело не может использовать их напрямую. Вместо этого в пищеварительном тракте они расщепляются на составляющие их моносахариды путем гидролиза.
Рисунок 2.5.2 – Три важных дисахарида: Все три важных дисахарида образуются путем дегидратационного синтеза.Внешний веб-сайт
Посмотрите это видео, чтобы наблюдать за образованием дисахарида. Что происходит, когда вода сталкивается с гликозидной связью?
Полисахариды
Полисахариды могут содержать от нескольких до тысячи и более моносахаридов.Для организма важны три (рис. 2.5.3):
- Крахмалы представляют собой полимеры глюкозы. Они встречаются в виде длинных цепей, называемых амилозой, или разветвленных цепей, называемых амилопектином, которые содержатся в растительной пище и относительно легко усваиваются.
- Гликоген также является полимером глюкозы, но он накапливается в тканях животных, особенно в мышцах и печени. Он не считается диетическим углеводом, потому что после убоя в тканях животных остается очень мало гликогена, однако человеческий организм запасает избыток глюкозы в виде гликогена, опять же, в мышцах и печени.
- Целлюлоза, полисахарид, который является основным компонентом клеточной стенки зеленых растений, является компонентом пищи для растений, называемой «клетчаткой». У людей целлюлоза/клетчатка не перевариваются, однако пищевые волокна имеют много преимуществ для здоровья. Он помогает вам чувствовать себя сытым, поэтому вы едите меньше, способствует здоровому пищеварительному тракту, а считается, что диета с высоким содержанием клетчатки снижает риск сердечных заболеваний и, возможно, некоторых форм рака.
Функции углеводов
Организм получает углеводы из растительной пищи. Зерновые, фрукты, бобовые и другие овощи обеспечивают большую часть углеводов в рационе человека, хотя лактоза содержится в молочных продуктах.
Хотя большинство клеток организма могут расщеплять другие органические соединения в качестве топлива, все клетки организма могут использовать глюкозу. Более того, нервные клетки (нейроны) в головном, спинном мозге и через периферическую нервную систему, а также эритроциты могут использовать только глюкозу в качестве топлива.При расщеплении глюкозы для получения энергии образуются молекулы аденозинтрифосфата, более известного как АТФ. Аденозинтрифосфат (АТФ) состоит из сахара рибозы, аденинового основания и трех фосфатных групп. АТФ высвобождает свободную энергию, когда его фосфатные связи разрываются, и, таким образом, снабжает клетку готовой энергией. В присутствии кислорода (O2) вырабатывается больше АТФ, чем в путях, не использующих кислород. Суммарную реакцию превращения энергии глюкозы в энергию, запасенную в АТФ, можно записать:
.C 6 H 12 O 6 + 6 O 2 → 6 CO 2 + 6 H 2 O + АТФ
Помимо того, что углеводы являются важным источником топлива, они присутствуют в очень малых количествах в структуре клеток.Например, некоторые молекулы углеводов связываются с белками с образованием гликопротеинов, а другие соединяются с липидами с образованием гликолипидов, которые находятся в мембране, покрывающей содержимое клеток организма.
Липиды
Липид относится к очень разнообразной группе соединений, состоящих в основном из углеводородов. Несколько атомов кислорода, которые они содержат, часто находятся на периферии молекулы. Их неполярные углеводороды делают все липиды гидрофобными.В воде липиды не образуют настоящего раствора, но они могут образовывать эмульсию, что является термином для смеси растворов, которые плохо смешиваются.
Триглицериды
Триглицерид A является одной из наиболее распространенных групп диетических липидов, наиболее часто встречающихся в тканях организма. Это соединение, которое обычно называют жиром, образуется в результате синтеза двух типов молекул (рис. 2.5.4):
- Глицериновая цепь в ядре триглицеридов, состоящая из трех атомов углерода.
- Три жирные кислоты, длинные цепочки углеводородов с карбоксильной группой и метильной группой на противоположных концах, отходящие от каждого из атомов углерода глицерина.
Триглицериды образуются в результате синтеза дегидратации. Глицерин отдает атомы водорода от своих гидроксильных групп при каждой связи, а карбоксильная группа в каждой цепи жирной кислоты отдает гидроксильную группу.При этом высвобождается в общей сложности три молекулы воды.
Цепочки жирных кислот, которые не имеют двойных углеродных связей по всей своей длине и поэтому содержат максимальное количество атомов водорода, называются насыщенными жирными кислотами. Эти прямые, жесткие цепи плотно упакованы и являются твердыми или полутвердыми при комнатной температуре (рис. 2.5.5 a ). Примерами являются масло и сало, а также жир, содержащийся в стейке или в вашем собственном теле. Напротив, жирные кислоты с одной двойной углеродной связью перегибаются по этой связи (рис. 2.5.5 б ). Таким образом, эти мононенасыщенные жирные кислоты не могут плотно упаковываться друг в друга и являются жидкими при комнатной температуре. Полиненасыщенные жирные кислоты содержат две или более двойных углеродных связей, а также являются жидкими при комнатной температуре. Растительные масла, такие как оливковое масло, обычно содержат как моно-, так и полиненасыщенные жирные кислоты.
Рисунок 2.5.5 – Формы жирных кислот: Уровень насыщения жирной кислоты влияет на ее форму. а) Цепи насыщенных жирных кислот прямые. (b) Цепи ненасыщенных жирных кислот перекручены.В то время как диета с высоким содержанием насыщенных жирных кислот увеличивает риск сердечных заболеваний, считается, что диета с высоким содержанием ненасыщенных жирных кислот снижает риск. Это особенно верно для ненасыщенных жирных кислот омега-3, содержащихся в холодноводной рыбе, такой как лосось. Эти жирные кислоты имеют свою первую двойную углеродную связь на третьем углеводороде от метильной группы (называемом омега-концом молекулы).
Наконец, транс жирных кислот, содержащихся в некоторых обработанных пищевых продуктах, в том числе в некоторых маргаринах для батончиков и палочек, считаются еще более вредными для сердца и кровеносных сосудов, чем насыщенные жирные кислоты.Жиры Trans создаются из ненасыщенных жирных кислот (таких как кукурузное масло) при химической обработке для получения частично гидрогенизированных жиров.
Как группа, триглицериды являются основным источником топлива для организма. Когда вы отдыхаете или спите, большая часть энергии, используемой для поддержания вашей жизни, поступает из триглицеридов, хранящихся в ваших жировых (жировых) тканях. Триглицериды также питают длительную, медленную физическую активность, такую как работа в саду или пеший туризм, и обеспечивают скромный процент энергии для активной физической активности.Пищевые жиры также способствуют абсорбции и транспортировке неполярных жирорастворимых витаминов A, D, E и K. Кроме того, накопленный жир защищает и смягчает кости тела и внутренние органы, а также действует как изоляция для сохранения тепла тела.
Жирные кислоты также входят в состав гликолипидов, представляющих собой сахаро-жировые соединения, содержащиеся в клеточной мембране. Липопротеины представляют собой соединения, в которых гидрофобные триглицериды упакованы в белковые оболочки для транспорта в жидкостях организма.
Фосфолипиды
Как следует из названия, фосфолипид представляет собой связь между глицериновым компонентом липида и молекулой фосфора.По своей структуре фосфолипиды сходны с триглицеридами. Однако вместо трех жирных кислот фосфолипид образуется из диглицерида, глицерина всего с двумя цепями жирных кислот (рис. 2.5.6). Третий сайт связывания на глицерине занят фосфатной группой, которая, в свою очередь, присоединена к полярной «головке» молекулы. Напомним, что триглицериды неполярны и гидрофобны. Это по-прежнему справедливо для жирнокислотной части фосфолипидного соединения. Однако головка фосфолипида содержит заряды на фосфатных группах, а также на атоме азота.Эти заряды делают фосфолипидную головку гидрофильной. Поэтому говорят, что фосфолипиды имеют гидрофобные хвосты, содержащие нейтральные жирные кислоты, гидрофильные головки, заряженные фосфатные группы и атом азота.
Рисунок 2.5.6 – Другие важные липиды: (a) Фосфолипиды состоят из двух жирных кислот, глицерина и фосфатной группы. (b) Стерины представляют собой кольцевидные липиды. Здесь показан холестерин. в) Простагландины образуются из ненасыщенных жирных кислот. Простагландин E2 (PGE2) включает гидроксильную и карбоксильную группы.Стероиды
Соединение стероид (называемое стеролом) имеет в своей основе набор из четырех углеводородных колец, связанных с множеством других атомов и молекул (см. рис. 2.5.6 b ). Хотя и растения, и животные синтезируют стеролы, наиболее важный вклад в структуру и функции человека вносит холестерин, который синтезируется печенью человека и животных, а также присутствует в большинстве продуктов животного происхождения. Как и другие липиды, углеводороды холестерина делают его гидрофобным, однако он имеет полярную гидроксильную головку, которая является гидрофильной.Холестерин является важным компонентом желчных кислот и соединений, которые помогают эмульгировать пищевые жиры. На самом деле корень слова холе- относится к желчи. Холестерин также является строительным блоком многих гормонов, сигнальных молекул, которые организм высвобождает для регуляции процессов в отдаленных участках. Наконец, подобно фосфолипидам, молекулы холестерина находятся в клеточной мембране, где их гидрофобные и гидрофильные участки помогают регулировать поступление веществ в клетку и из нее.
Простагландины
Подобно гормону, простагландин является одной из группы сигнальных молекул, но простагландины образуются из ненасыщенных жирных кислот (см. рис. 2.5.6 с ). Одна из причин полезности омега-3 жирных кислот, содержащихся в рыбе, заключается в том, что они стимулируют выработку определенных простагландинов, которые помогают регулировать аспекты артериального давления и воспаления и тем самым снижают риск сердечных заболеваний. Простагландины также повышают чувствительность нервов к боли. Один класс болеутоляющих препаратов, называемый нестероидными противовоспалительными препаратами (НПВП), работает за счет уменьшения действия простагландинов.
Белки
Белки можно ассоциировать с мышечной тканью, но на самом деле белки являются важнейшими компонентами всех тканей и органов.Белок представляет собой органическую молекулу, состоящую из аминокислот, связанных пептидными связями. Белки включают кератин в эпидермисе кожи, который защищает нижележащие ткани, и коллаген, обнаруженный в дерме кожи, костях и мозговых оболочках, покрывающих головной и спинной мозг. Белки также являются компонентами многих функциональных химических веществ организма, включая пищеварительные ферменты в пищеварительном тракте, антитела, нейротрансмиттеры, которые нейроны используют для связи с другими клетками, и гормоны на основе пептидов, которые регулируют определенные функции организма (например, гормон роста). ).Хотя углеводы и липиды состоят из углеводородов и кислорода, все белки также содержат азот (N), а многие содержат серу (S) в дополнение к углероду, водороду и кислороду.
Микроструктура белков
Белки представляют собой полимеры, состоящие из азотсодержащих мономеров, называемых аминокислотами. Аминокислота представляет собой молекулу, состоящую из аминогруппы и карбоксильной группы вместе с вариабельной боковой цепью. Всего 20 различных аминокислот участвуют почти во всех тысячах различных белков, важных для структуры и функций человека.Белки тела содержат уникальную комбинацию от нескольких десятков до нескольких сотен из этих 20 мономеров аминокислот. Все 20 из этих аминокислот имеют сходную структуру (рис. 2.5.7). Все они состоят из центрального атома углерода, к которому присоединены:
- атом водорода
- щелочная (основная) аминогруппа Nh3 (см. табл. 2.1)
- кислая карбоксильная группа СООН (см. Таблицу 2.1)
- переменная группа
Обратите внимание, что все аминокислоты содержат как кислоту (карбоксильную группу), так и основание (аминогруппу) (амин = «азотсодержащий»).По этой причине они являются отличными буферами, помогая организму регулировать кислотно-щелочной баланс. Что отличает 20 аминокислот друг от друга, так это их вариабельная группа, которая называется боковой цепью или R-группой. Эта группа может различаться по размеру и может быть полярной или неполярной, что придает каждой аминокислоте свои уникальные характеристики. Например, боковые цепи двух аминокислот — цистеина и метионина — содержат серу. Сера не так легко участвует в водородных связях, в отличие от всех других аминокислот.Это изменение влияет на способ сборки белков, содержащих цистеин и метионин.
Аминокислоты соединяются путем дегидратационного синтеза с образованием белковых полимеров (рис. 2.5.8). Уникальная связь, связывающая аминокислоты вместе, называется пептидной связью. Пептидная связь представляет собой ковалентную связь между двумя аминокислотами, которая образуется в результате синтеза дегидратации. Пептид, по сути, представляет собой очень короткую цепь аминокислот. Цепи, содержащие менее 100 аминокислот, обычно называют полипептидами, а не белками.
Рисунок 2.5.8 – Структура аминокислоты: Различные аминокислоты соединяются вместе, образуя пептиды, полипептиды или белки посредством синтеза дегидратации. Связи между аминокислотами представляют собой пептидные связи.Организм способен синтезировать большинство аминокислот из компонентов других молекул, однако девять не могут быть синтезированы и должны потребляться с пищей. Они известны как незаменимые аминокислоты.
Свободные аминокислоты, доступные для построения белка, как говорят, находятся в пуле аминокислот внутри клеток.Структуры внутри клеток используют эти аминокислоты при сборке белков. Однако, если конкретная незаменимая аминокислота недоступна в достаточных количествах в аминокислотном пуле, синтез белков, содержащих ее, может замедлиться или даже прекратиться.
Форма белков
Подобно тому, как вилкой нельзя есть суп, а ложкой нельзя протыкать мясо, форма белка важна для его функционирования. Форма белка в основном определяется последовательностью аминокислот, из которых он состоит (рис. 2.5.9 и ). Последовательность называется первичной структурой белка.
Рисунок 2.5.9 – Форма белков: (а) Первичная структура представляет собой последовательность аминокислот, составляющих полипептидную цепь. (b) Вторичная структура, которая может принимать форму альфа-спирали или бета-складчатого листа, поддерживается водородными связями между аминокислотами в разных областях исходной полипептидной цепи. (в) Третичная структура возникает в результате дальнейшего складывания и склеивания вторичной структуры.г) четвертичная структура возникает в результате взаимодействия двух или более третичных субъединиц. Показанный здесь пример — гемоглобин, белок в красных кровяных тельцах, который транспортирует кислород к тканям организма.Хотя некоторые полипептиды существуют в виде линейных цепей, большинство из них скручены или свернуты в более сложные вторичные структуры, которые образуются, когда происходит связывание между аминокислотами с разными свойствами в разных областях полипептида. Наиболее распространенной вторичной структурой является спираль, называемая альфа-спиралью.Если бы вы взяли отрезок веревки и просто скрутили ее в спираль, она бы не держала форму. Точно так же цепочка аминокислот не могла бы поддерживать стабильную форму спирали без помощи водородных связей, которые создают мосты между различными участками одной и той же цепи (см. рис. 2.5.9 b ). Реже полипептидная цепь может образовывать бета-складчатый лист, в котором водородные связи образуют мостики между различными областями одного полипептида, который загибается сам на себя, или между двумя или более соседними полипептидными цепями.
Вторичная структура белков далее складывается в компактную трехмерную форму, называемую третичной структурой белка (см. рис. 2.5.9 c ). В этой конфигурации аминокислоты, которые были очень далеки в первичной цепи, могут быть сближены посредством водородных связей или, в белках, содержащих цистеин, через дисульфидные связи. Дисульфидная связь представляет собой ковалентную связь между атомами серы в полипептиде. Часто два или более отдельных полипептида связываются с образованием еще более крупного белка с четвертичной структурой (см.5.9 г ). Полипептидные субъединицы, образующие четвертичную структуру, могут быть одинаковыми или разными. Например, гемоглобин, белок, содержащийся в красных кровяных тельцах, состоит из четырех третичных полипептидов, два из которых называются альфа-цепями, а два — бета-цепями.
Под воздействием высоких температур, кислот, щелочей и некоторых других веществ белки денатурируют. Денатурация — это изменение структуры молекулы физическими или химическими средствами.Денатурированные белки теряют свою функциональную форму и больше не могут выполнять свою работу. Повседневным примером денатурации белка является свертывание молока при добавлении кислого лимонного сока.
Вклад формы белка в его функцию трудно переоценить. Например, длинная тонкая форма белковых нитей, из которых состоит мышечная ткань, необходима для их способности сокращаться (сокращаться) и расслабляться (удлиняться). В качестве другого примера, кости содержат длинные нити белка, называемого коллагеном, который действует как каркас, на котором откладываются костные минералы.Эти удлиненные белки, называемые волокнистыми белками, прочны, долговечны и обычно гидрофобны.
Напротив, глобулярные белки представляют собой шары или сферы, которые склонны к высокой реакционной способности и являются гидрофильными. Примером могут служить белки гемоглобина, упакованные в эритроциты (см. рис. 2.59). Примерами этого являются ферменты, введенные ранее в качестве белковых катализаторов.В следующем разделе более подробно рассматривается действие ферментов.
Белки функционируют как ферменты
Если вы пытаетесь напечатать статью и каждый раз, когда вы нажимаете клавишу на своем ноутбуке, возникает задержка в шесть или семь минут, прежде чем вы получаете ответ, вы, вероятно, получите новый ноутбук. Точно так же без ферментов, катализирующих химические реакции, человеческое тело было бы нефункциональным. Он функционирует только потому, что функционируют ферменты.
Ферментативные реакции — химические реакции, катализируемые ферментами, — начинаются, когда субстраты связываются с ферментом.Субстрат является реагентом в ферментативной реакции. Это происходит в областях фермента, известных как активные центры (рис. 2.5.10). Любой данный фермент катализирует только один тип химической реакции. Эта характеристика, называемая специфичностью, связана с тем, что субстрат с определенной формой и электрическим зарядом может связываться только с активным центром, соответствующим этому субстрату.
Рисунок 2.5.10 – Этапы ферментативной реакции: (a) Субстраты приближаются к активным центрам фермента.(b) Субстраты связываются с активными центрами, образуя фермент-субстратный комплекс. (c) Изменения внутри фермент-субстратного комплекса облегчают взаимодействие субстратов. (d) Продукты высвобождаются, и фермент возвращается в свою первоначальную форму, готовый способствовать другой ферментативной реакции.При связывании субстрата образуется фермент-субстратный комплекс. Вероятно, ферменты ускоряют химические реакции отчасти потому, что комплекс фермент-субстрат претерпевает ряд временных и обратимых изменений, заставляющих субстраты ориентироваться друг к другу в оптимальном положении для облегчения их взаимодействия.Это способствует увеличению скорости реакции. Затем фермент высвобождает продукт(ы) и принимает свою первоначальную форму. Затем фермент может снова участвовать в процессе, и будет делать это до тех пор, пока остается субстрат.
Другие функции белков
В рекламе протеиновых батончиков, порошков и коктейлей говорится, что белок важен для построения, восстановления и поддержания мышечной ткани, но правда в том, что белки участвуют во всех тканях организма, от кожи до клеток мозга.Кроме того, некоторые белки действуют как гормоны и химические мессенджеры, которые помогают регулировать функции организма. Например, гормон роста, помимо прочего, важен для роста скелета.
Как было отмечено ранее, основные и кислотные компоненты позволяют белкам функционировать как буферы в поддержании кислотно-щелочного баланса, но они также помогают регулировать водно-электролитный баланс. Белки притягивают жидкость, а здоровая концентрация белков в крови, клетках и промежутках между клетками помогает обеспечить баланс жидкости в этих различных «отсеках».Более того, белки в клеточной мембране помогают транспортировать электролиты в клетку и из нее, поддерживая здоровый баланс этих ионов. Как и липиды, белки могут связываться с углеводами. Таким образом, они могут продуцировать гликопротеины или протеогликаны, которые выполняют множество функций в организме.
Организм может использовать белки для получения энергии, когда потребление углеводов и жиров является недостаточным, а запасы гликогена и жировой ткани истощаются. Однако, поскольку нет места хранения белка, кроме функциональных тканей, использование белка для получения энергии вызывает разрушение тканей и приводит к истощению организма.
Нуклеотиды
Четвертый тип органических соединений, важных для строения и функций человека, — это нуклеотиды (рис. 2.5.11). Нуклеотид относится к классу органических соединений, состоящих из трех субъединиц:
.- одна или несколько фосфатных групп
- пентозный сахар: либо дезоксирибоза, либо рибоза
- азотсодержащее основание: аденин, цитозин, гуанин, тимин или урацил
Нуклеотиды могут быть собраны в нуклеиновые кислоты (ДНК или РНК) или в энергетическое соединение аденозинтрифосфат.
Рисунок 2.5.11 – Нуклеотиды: (a) Строительными блоками всех нуклеотидов являются одна или несколько фосфатных групп, пентозный сахар и азотсодержащее основание. (б) Азотсодержащие основания нуклеотидов. (c) Два пентозных сахара ДНК и РНК.Нуклеиновые кислоты
Нуклеиновые кислоты различаются по типу пентозного сахара. Дезоксирибонуклеиновая кислота (ДНК) — это нуклеотид, хранящий генетическую информацию. ДНК содержит дезоксирибозу (называется так потому, что в ней на один атом кислорода меньше, чем в рибозе) плюс одна фосфатная группа и одно азотсодержащее основание.«Выбор» основания для ДНК — это аденин, цитозин, гуанин и тимин. Рибонуклеиновая кислота (РНК) — это нуклеотид, содержащий рибозу, который помогает проявить генетический код в виде белка. РНК содержит рибозу, одну фосфатную группу и одно азотсодержащее основание, но «выбор» основания для РНК — это аденин, цитозин, гуанин и урацил.
Азотсодержащие основания аденин и гуанин относятся к пуринам. Пурин представляет собой азотсодержащую молекулу с двойной кольцевой структурой, в которой размещается несколько атомов азота.Основания цитозин, тимин (встречается только в ДНК) и урацил (встречается только в РНК) являются пирамидинами. Пирамида представляет собой азотсодержащее основание с одинарной кольцевой структурой
.Связи, образующиеся в результате дегидратационного синтеза между пентозным сахаром одного мономера нуклеиновой кислоты и фосфатной группой другого, образуют «остов», из которого выступают азотсодержащие основания компонентов. В ДНК два таких остова соединяются выступающими основаниями посредством водородных связей. Они закручиваются, образуя форму, известную как двойная спираль (рис. 2.5.12). Последовательность азотсодержащих оснований в цепи ДНК образует гены, которые действуют как молекулярный код, инструктирующий клетки по сборке аминокислот в белки. ДНК человека содержит почти 22 000 генов, запертых в 46 хромосомах внутри ядра каждой клетки (за исключением эритроцитов, которые теряют свои ядра в процессе развития). Эти гены несут генетический код для построения тела и уникальны для каждого человека, кроме однояйцевых близнецов.
Рисунок 2.5.12 – ДНК: В двойной спирали ДНК две нити соединяются посредством водородных связей между основаниями составляющих нуклеотидов.РНК, напротив, состоит из одной цепи сахарофосфатного остова, усеянного основаниями. Информационная РНК (мРНК) создается во время синтеза белка для переноса генетических инструкций от ДНК к растениям-производителям клеточных белков в цитоплазме и рибосомах.
Аденозинтрифосфат
Нуклеотид аденозинтрифосфата (АТФ) состоит из сахара рибозы, аденинового основания и трех фосфатных групп (рис. 2.5.13). АТФ классифицируется как высокоэнергетическое соединение, потому что две ковалентные связи, связывающие его три фосфата, хранят значительное количество потенциальной энергии. В организме энергия, высвобождаемая этими высокоэнергетическими связями, помогает питать деятельность организма, от сокращения мышц до транспорта веществ в клетки и из них и анаболических химических реакций.
Рисунок 2.5.13 Структура аденозинтрифосфата (АТФ)Когда фосфатная группа отщепляется от АТФ, образуются аденозиндифосфат (АДФ) и неорганический фосфат (P i ).Эту реакцию гидролиза можно записать:
АТФ + Н 2 О → АДФ + Р i + энергия
Удаление второго фосфата оставляет аденозинмонофосфат (АМФ) и две фосфатные группы. Опять же, эти реакции также высвобождают энергию, которая была запасена в фосфатно-фосфатных связях. Они также обратимы, например, фосфорилирование АДФ. Фосфорилирование — это присоединение фосфатной группы к органическому соединению, в данном случае приводящее к образованию АТФ.В таких случаях тот же уровень энергии, который был высвобожден во время гидролиза, должен быть реинвестирован для обеспечения синтеза дегидратации.
Клетки также могут переносить фосфатную группу с АТФ на другое органическое соединение. Например, когда глюкоза впервые попадает в клетку, фосфатная группа переносится от АТФ, образуя глюкозофосфат (C 6 H 12 O 6 —P) и АДФ. Как только глюкоза фосфорилируется таким образом, она может храниться в виде гликогена или метаболизироваться для получения немедленной энергии.
Обзор главыОрганические соединения, необходимые для жизнедеятельности человека, включают углеводы, липиды, белки и нуклеотиды. Эти соединения называются органическими, потому что они содержат как углерод, так и водород. Атомы углерода в органических соединениях легко делят электроны с водородом и другими атомами, обычно с кислородом и иногда с азотом. Атомы углерода также могут быть связаны с одной или несколькими функциональными группами, такими как карбоксилы, гидроксилы, аминогруппы или фосфаты. Мономеры представляют собой единичные единицы органических соединений.Они связываются путем синтеза дегидратации с образованием полимеров, которые, в свою очередь, могут быть разрушены гидролизом.
Соединения углеводов обеспечивают необходимое топливо для организма. Их структурные формы включают моносахариды, такие как глюкоза, дисахариды, такие как лактоза, и полисахариды, включая крахмалы (полимеры глюкозы), гликоген (форма хранения глюкозы) и клетчатку. Все клетки организма могут использовать глюкозу в качестве топлива. В результате окислительно-восстановительной реакции он превращается в АТФ.
Липиды представляют собой гидрофобные соединения, которые обеспечивают организм энергией и являются важными компонентами многих биологических соединений.Триглицериды являются наиболее распространенными липидами в организме и состоят из глицеринового остова, присоединенного к трем цепям жирных кислот. Фосфолипиды представляют собой соединения, состоящие из диглицеридов с фосфатной группой, присоединенной к голове молекулы. В результате получается молекула с полярными и неполярными областями. Стероиды представляют собой липиды, состоящие из четырех углеводородных колец. Наиболее важным является холестерин. Простагландины представляют собой сигнальные молекулы, полученные из ненасыщенных жирных кислот.
Белки являются важнейшими компонентами всех тканей организма.Они состоят из мономеров, называемых аминокислотами, которые содержат азот, соединенные пептидными связями. Форма белка имеет решающее значение для его функции. Большинство белков организма имеют глобулярную форму. Например, ферменты, катализирующие химические реакции.
Нуклеотиды представляют собой соединения, состоящие из трех строительных блоков: одной или нескольких фосфатных групп, пентозного сахара и азотсодержащего основания. ДНК и РНК представляют собой нуклеиновые кислоты, участвующие в синтезе белка. АТФ является основной молекулой переноса энергии в организме.Удаление или добавление фосфатов высвобождает или вкладывает энергию.
Вопросы по интерактивной ссылкеПосмотрите это видео, чтобы наблюдать за образованием дисахарида. Что происходит, когда вода сталкивается с гликозидной связью?
Вода гидролизует или разрывает гликозидную связь, образуя два моносахарида.
Контрольные вопросы
Вопросы для критического мышления
Если дисахарид мальтоза образован из двух моносахаридов глюкозы, которые представляют собой гексозные сахара, сколько атомов углерода, водорода и кислорода содержит мальтоза и почему?
Мальтоза содержит 12 атомов углерода, но только 22 атома водорода и 11 атомов кислорода, поскольку молекула воды удаляется при ее образовании путем дегидратационного синтеза.
Почему после переваривания и всасывания пищевых жиров они не могут попасть прямо в кровоток?
Все липиды гидрофобны и не могут растворяться в водной среде крови. Они упакованы в липопротеины, внешняя белковая оболочка которых позволяет им транспортировать жиры по кровотоку.
функциональных групп
функциональных группФункциональные группы
Стереоизомеры (только краткосрочные и неоптические!)
Геометрические изомеры — это стереоизомеры, которые являются отдельными и отдельными, поскольку они не могут свободно вращаться из-за кратной связи или кольцевой структуры.Геометрические изомеры, как правило, не являются оптическими изомерами, если они также не имеют хиральных центров. Эти изомеры накладываются на свои зеркальные изображения, если хиральные центры отсутствуют. Изомеры являются диастереомерами в соответствии с данным здесь определением.
Существует два соглашения об именах. В более старом методе используются цис- и транс-, что хорошо работает для примера, приведенного выше, потому что есть два атома H и два атома Cl.Но это не сработает, если будут задействованы четыре разных атома. Более новый метод ранжирует заместители для каждого атома C в соответствии с правилами последовательности Кана-Ингольда-Прелога. (Кэри, Органическая химия, стр. 268-272). Если два с более высоким рангом находятся на одной стороне двойной связи, этот изомер Z (для немецкого слова zusammen , что означает вместе ).
Другим изомером является E (для e ntgegen означает напротив ). Вкратце, правила последовательности ранжируют заместители в порядке убывания атомного номера, и если два или более атомов, связанных с атомом C, одинаковы, второй атом определяет порядок.
Функциональные группы
В органической химии преобладает «подход функциональных групп», согласно которому органические молекулы состоят из:
- Инертный углеводородный скелет, к которому присоединены или наложены функциональные группы (ФГ).
Подход функциональной группы « работает» , потому что свойства и химия реакции конкретной функциональной группы (FG) могут быть в значительной степени независимыми от окружающей среды.
Таким образом, необходимо знать химию лишь нескольких общих функций, чтобы предсказать химическое поведение тысяч реальных органических химических веществ.
Органические молекулы также названы с использованием подхода функциональных групп:
2-гексанон
2-гексанол
2-хлоргексан
Правило состоит в том, что функции приобретают свою отчетливую идентичность, когда они разделены группами –Ch3–.Таким образом, карбонил, C=O, и гидрокси, OH, карбоновой кислоты, RCOOH, являются частью одной функции и НЕ являются «спиртом-плюс-кетоном»:
Несколько слов о функционально-групповом подходе
Функционально-групповой подход на 100 % эмпиричен, поскольку определяется экспериментом и опытом, а не теорией (в отличие, например, от ВСЕПР.)
Многофункциональная сущность, такая как молекула морфина, может иметь несколько функциональных групп и хиральных центров:
Алкан | Алкильные и иногда арильные (ароматические) функции представлены R- метилом: Ch4– Этил: Ch4Ch3– Пропил: Ch4Ch3Ch3– Изопропил: (Ch4)2CH– Фенил: C6H5– и т. д. |
Алкилгалогенид | Алкилгалогениды [галогеналканы] состоят из алкильной группы, присоединенной к галогену: F, Cl, Br, I. Хлор-, бром- и йодо-алкилгалогениды часто подвержены реакциям отщепления и/или реакциям нуклеофильного замещения. |
Первичный спирт | Первичные спирты имеют функцию -ОН, связанную с группой R-Ch3-.Первичные спирты могут окисляться до альдегидов и далее до карбоновых кислот. (Может быть трудно остановить окисление на альдегидной стадии.) Первичные спирты могут быть показаны в тексте как: RCh3OH |
Вторичный спирт | Вторичные спирты имеют функцию -ОН, связанную с группой R2CH-. Вторичные спирты могут окисляться до кетонов. Вторичные спирты могут быть указаны в тексте как: R2CHOH | .
Третичный спирт | Третичные спирты имеют функциональную группу -ОН, связанную с группой R3C-.Третичные спирты устойчивы к окислению подкисленным дихроматом калия(VI), К. Третичные спирты могут быть представлены в тексте как: R3COH |
Альдегид | Альдегиды имеют водород и алкильную (или ароматическую) группу, присоединенную к карбонильной группе. Альдегиды могут быть представлены в тексте как: RCHO Альдегиды легко окисляются до карбоновых кислот и восстанавливаются до первичных спиртов. Альдегиды можно отличить от кетонов по положительному результату теста с раствором Фелингса (кирпично-красный осадок) или реактивом Толленса (серебряное зеркало).Альдегиды дают красно-оранжевые осадки с 2,4-динитрофенилгидразином. |
Кетон | Кетоны имеют пару алкильных или ароматических групп, присоединенных к карбонильной группе. Кетоны могут быть представлены в тексте как: RCOR Кетоны можно отличить от альдегидов, дав отрицательный результат теста с раствором Фелинга (кирпично-красный осадок) или реактивом Толленса (серебряное зеркало). Кетоны дают красно-оранжевые осадки с 2,4-динитрофенилгидразином. |
Карбоновая кислота | Карбоновые кислоты имеют алкильные или ароматические группы, присоединенные к гидроксикарбонильной функции. Карбоновые кислоты могут быть представлены в тексте как: RCOOH Карбоновые кислоты являются слабыми кислотами Бренстеда, и они высвобождают CO2 из карбонатов и гидрокарбонатов. |
Карбонильная функция | Карбонильная группа является суперфункцией, поскольку многие распространенные функциональные группы основаны на карбониле, в том числе: альдегиды, кетоны, карбоновые кислоты, сложные эфиры, амиды, ацилхлориды (кислоты), ангидриды кислот |
Эстер | Сложные эфиры имеют пару алкильных или ароматических групп, присоединенных к карбонильной + кислородной связи.Сложные эфиры могут отображаться в тексте как: RCOOR или (иногда) ROCOR. карбоновая кислота + спирт -> сложный эфир + вода Это равновесие, катализируемое кислотой. |
Амид | Первичные амиды (показаны) имеют алкильную или ароматическую группу, присоединенную к аминокарбонильной функции. Первичные амиды могут быть представлены в тексте как: RCONh3 Вторичные амиды имеют алкильную или арильную группу, присоединенную к азоту: RCONHR Третичные амиды имеют две алкильные или арильные группы, присоединенные к атому азота: RCONR2 |
Первичный амин | Первичные амины имеют алкильную или ароматическую группу и два атома водорода, присоединенные к атому азота.Первичные амины могут быть представлены в тексте как: RNh3 Первичные амины представляют собой основные функциональные группы, которые могут быть протонированы до соответствующего иона аммония. Первичные амины также являются нуклеофильными. |
Вторичный амин | Вторичные амины имеют пару алкильных или ароматических групп и водород, присоединенный к атому азота. Вторичные амины могут быть представлены в тексте как: R2NH Вторичные амины представляют собой основные функциональные группы, которые могут быть протонированы до соответствующего иона аммония.Вторичные амины также являются нуклеофильными. |
Третичный амин | Третичные амины имеют три алкильные или ароматические группы, присоединенные к атому азота. Третичные амины могут быть представлены в тексте как: R3N Третичные амины представляют собой основные функциональные группы, которые могут быть протонированы до соответствующего иона аммония. Третичные амины также являются нуклеофильными. |
Нитрил | Нитрилы (или цианоорганические соединения) имеют алкильную (или ароматическую) группу, присоединенную к тройной связи углерод-азот.Нитрилы могут отображаться в тексте как: RCN Обратите внимание, что существует проблема с номенклатурой нитрилов/цианидов. Если соединение называется нитрилом, то учитывается и включается нитриловый углерод, но когда соединение называется цианидом, это не так. Например: Ch4Ch3CN называют нитрилом пропана или этилцианидом (цианоэтаном). |
Карбоксилат-ион или соль | Карбоксилат-ионы являются сопряженными основаниями карбоновых кислот, т.е.депротонированная карбоновая кислота. Ионы карбоксилата могут быть показаны в тексте как: RCOO– Когда включен противоион, отображается соль. Соли могут отображаться в тексте как: RCOONa |
Аминокислота | Аминокислоты, строго альфа-аминокислоты, имеют карбоновую кислоту, аминогруппу и водород, присоединенный к одному и тому же атому углерода. Существует 20 встречающихся в природе аминокислот. Все, кроме глицина (R = H), являются хиральными, и только энантиомер L встречается в природе.Аминокислоты могут быть представлены в тексте как: R-CH(Nh3)COOH | .
Алкен | Алкены состоят из двойной связи C=C. Алкены могут быть представлены в тексте как: Монозамещенные: RCH=Ch3 1,1-дизамещенный: R2C=Ch3 1,2-дизамещенные: RCH=CHR Алканы плоские, так как нет вращения вокруг связи C=C. Алкены являются реакционноспособными центрами, богатыми электронами, и восприимчивы к электрофильному присоединению. |
трансалкен | транс-алкены представляют собой 1,2-дизамещенные функции с двумя R, X или другими группами на противоположных сторонах функции C=C. Из-за отсутствия вращения связи C = C цис- и транс-геометрические изомеры не [термически] взаимопревращаются. |
цис-алкен | цис-алкены представляют собой 1,2-дизамещенные функциональные группы с двумя R, X или другими группами на одной стороне функции C=C.Из-за отсутствия вращения связи C = C цис- и транс-геометрические изомеры не подвергаются [термически] взаимопревращению. |
Эфир | Простые эфиры имеют пару алкильных или ароматических групп, присоединенных к связывающему атому кислорода. Эфиры могут быть представлены в тексте как: ROR Эфиры на удивление нереакционноспособны и очень полезны в качестве растворителей для многих (но не для всех) классов реакций. |
От Марка Р.Лич 1999-2008
R представляет собой группу на основе углерода.
Подробнее Номенклатура:
Спирты и эфиры: номенклатура
Простые спирты называются производными исходного алкана с использованием суффикса -ол и следующих простых правил:
- Выберите самую длинную непрерывную углеродную цепь, содержащую гидроксильную группу, и получите исходное название, заменив окончание -e на -ol.
- Пронумеруйте углеродную цепь, начиная с конца, ближайшего к гидроксильной группе.
- Пронумеруйте заместители и напишите название, перечислив заместители в алфавитном порядке.
Альдегиды и кетоны: Номенклатура
Простые альдегиды и кетоны названы с использованием стандартных правил номенклатуры, которые мы использовали в прошлом, со следующими специфическими изменениями:
- Альдегиды названы путем замены конца -e исходного алкана суффиксом -al; суффикс для кетонов — один. Выбранная исходная цепь должна содержать карбонильную группу. Пронумеруйте углеродную цепь, начиная с конца, ближайшего к карбонильной группе.
- Пронумеруйте заместители и напишите название, перечислив заместители в алфавитном порядке.
- Когда альдегид является заместителем в кольце, его называют -карбальдегидной группой.
- Когда группа -COR становится заместителем в другой цепи, ее называют ацильной группой, а название образуется с использованием суффикса -ил.
- Когда карбонильная группа становится заместителем в другой цепи, ее называют оксогруппой.
Номенклатура карбоновых кислот
Простые карбоновые кислоты называются производными исходного алкана с использованием суффикса -овая кислота
- Выберите самую длинную непрерывную углеродную цепь, содержащую карбоксильную группу, и получите исходное название, заменив окончание -e на -oic acid.
- Пронумеруйте углеродную цепь, начиная с конца, ближайшего к карбоксильной группе.
- Пронумеруйте заместители и напишите название, перечислив заместители в алфавитном порядке.
- Заместители карбоновых кислот, присоединенные к кольцам, обозначаются суффиксом -карбоновая кислота.
Номенклатура алифатических аминов
Простые амины называются производными исходного алкана с использованием суффикса -амин или с использованием -амино для обозначения пронумерованного заместителя с использованием следующих правил:- Выберите самую длинную непрерывную углеродную цепь, содержащую аминогруппу, и получите исходное название, заменив окончание -e на -амин или назвав азот аминозаместителем .Пронумеруйте углеродную цепь , начиная с конца, ближайшего к аминогруппе , или , чтобы получить наименьшее число в первой точке различия .
- Пронумеруйте заместители и напишите название, перечислив заместители в алфавитном порядке.
Таким образом, для следующего примера вы должны нумеровать с конца, ближайшего к азоту, получая названия 3-метилпентанамин (или 1-амино-3-метилпентан ) и 5-метил-2-гексанамин . (или 2-амино-5-метил-2-гексан ) соответственно.
В этом примере, однако, вы нумеруете , чтобы дать наименьшее число в первой точке различия , получив название 5-амино-2,3-диметилгексан (не 2-амино-4,5-диметилгексан) . Множественные заместители азота называются с использованием простых множителей:Амины далее подразделяются на «первичные, вторичные, третичные и четвертичные» в зависимости от количества заместителей азота:
.

 СН4
СН4 Карбоновые кислоты
Карбоновые кислоты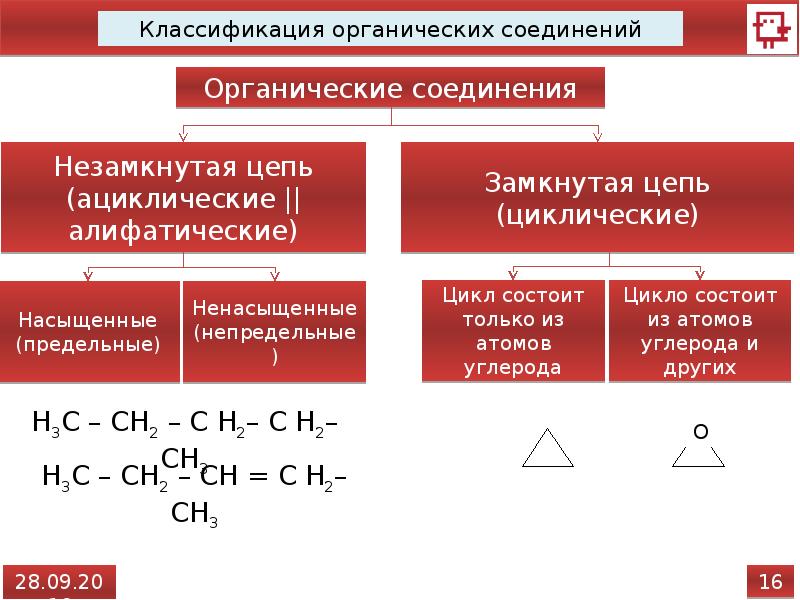 а 3, б 6, в 7, г 1, д 4, е 5, ж 2.
а 3, б 6, в 7, г 1, д 4, е 5, ж 2. Бутлерова.
Бутлерова. 10 часов.
10 часов.

 Классификация реакций по типу реагирующих частиц.
Классификация реакций по типу реагирующих частиц.

 Практическая работа № 1 «Качественный анализ органических соединений».
Практическая работа № 1 «Качественный анализ органических соединений».  Химические свойства.
Химические свойства. Вывод формул органических веществ. (С 5).
Вывод формул органических веществ. (С 5). Строение молекулы бензола. Физические свойства и способы получения.
Строение молекулы бензола. Физические свойства и способы получения. Состав, классификация и изомерия. Межмолекулярная водородная связь. Одноатомные спирты как амфотерные органические соединения. Зависимость скорости реакции от строения молекул спиртов.
Состав, классификация и изомерия. Межмолекулярная водородная связь. Одноатомные спирты как амфотерные органические соединения. Зависимость скорости реакции от строения молекул спиртов.
 Альдегиды. Кетоны. 7 часов.
Альдегиды. Кетоны. 7 часов.


 Факторы, влияющие на смещение равновесия в реакции этерификации.
Факторы, влияющие на смещение равновесия в реакции этерификации.
 Углеводы. 8 часов.
Углеводы. 8 часов. Кислотный гидролиз сахарозы.
Кислотный гидролиз сахарозы. Практическая работа № 5 «Углеводы».
Практическая работа № 5 «Углеводы».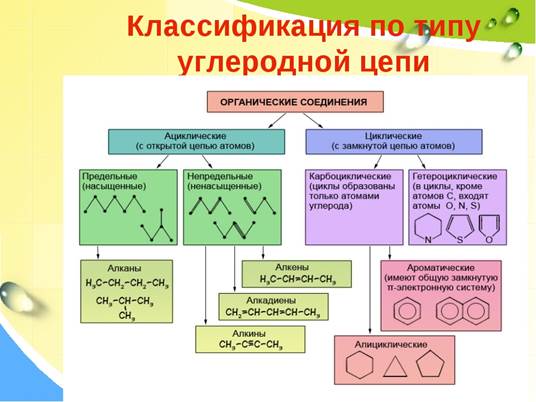
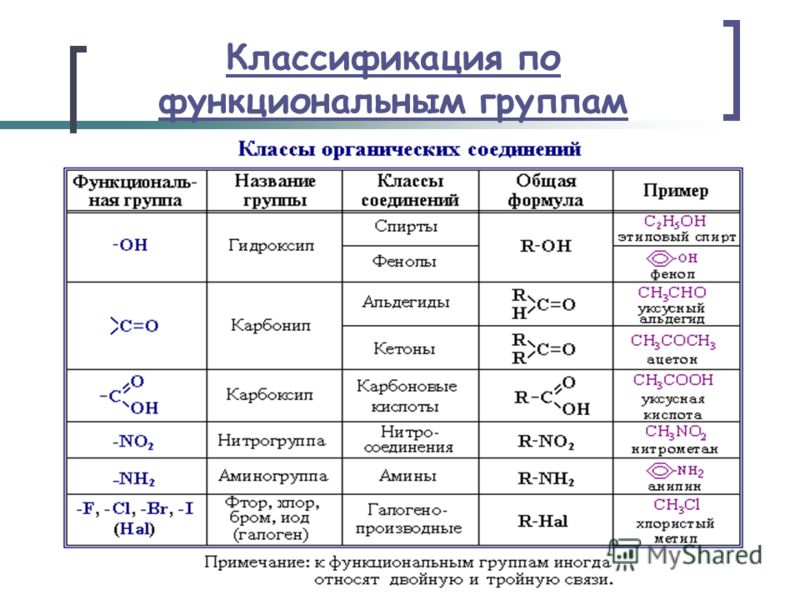 Цветные реакции белков.
Цветные реакции белков. Биологически активные вещества. 7 часов.
Биологически активные вещества. 7 часов.
 Идентификация органических соединений.
Идентификация органических соединений.
 4: Средняя энергия связи (кДж/моль)
4: Средняя энергия связи (кДж/моль)