Химия
ОСНОВАНИЯ
Оглавление:
1. Определение
2. Классификация
3. Электролитическая
диссоциация
4. Получение
5. Важнейшие химические
свойства
6. Задания
7. Ответы
| Основания – это сложные вещества, состоящие из катионов металлов и одного или нескольких гидроксид-анионов (ОН—) |
КЛАССИФИКАЦИЯ
1. По растворимости в воде различают растворимые основания (щёлочи) и нерастворимые основания.
2. По числу гидроксид-анионов различают однокислотные, двухкислотные и трёхкислотные основания.
Растворимые основания при растворении в воде
диссоциируют на катионы металлов и гидроксид-анионы.
NaOH → Na+ +
OH—
KOH → K+ + OH—
Ba(OH)2 → Ba2+
+ 2OH—
ПОЛУЧЕНИЕ
Соль + щёлочь = основание + другая соль
CuSO4 + 2NaOH = Cu(OH)2 +
Na2SO4
K2CO3
+ Ba(OH)2 = 2КОН+BaCO3
Получение щелочей:
1. Активный металл + вода = щёлочь + водород
2Na+2H2O
= 2NaOH + H2↑
2. Основный оксид + вода = щёлочь
Li 2O + H2O
= 2LiOH
ВАЖНЕЙШИЕ ХИМИЧЕСКИЕ СВОЙСТВА
1. Реакция нейтрализации: основание +
кислота = соль + вода
NaOH +
HCl = NaCl + H2O
2. Щёлочь + соль = основание + другая соль
2NaOH + CuSO4 = Cu(OH)2 +
Na2SO4
3. Щёлочь + кислотный оксид = соль + вода
Щёлочь + кислотный оксид = соль + вода
2NaOH +
SO3 = Na2SO4
+ H2O
4. Нерастворимые основания разлагаются при нагревании:
основание = оксид металла + вода
Cu(OH)2
= CuO + H2O
5. Растворы щелочей (благодаря диссоциации на ионы) изменяют
окраску индикаторов:
Лакмус: синий→розовый
Фенолфталеин: бесцветный→малиновый
ЗАДАНИЯ
Задание 1. Из приведённого перечня выберите
основания, назовите их, определите тип.
1) NaOH 2)
Li2O 3) Ba(OH)2 4)
CuSO4 5) P2O5 6) Al(OH)3
7) HCl 8) C2H5OH
Задание 2. С какими из перечисленных веществ
может реагировать а) NaOH б)
Cu(OH)2
1)Na2O 2)SO3 3)H2O
4)NaOH 5)H2SO4 6)Na2SO4
7) HCl 8) AlCl3
ОТВЕТЫ.
Наверх
Общая характеристика оснований — урок. Химия, 8–9 класс.
В \(1754\) году французский химик Г. Руэль (\(1703\)–\(1770\)) ввёл термин «основание», подразумевая, что к соединениям данного класса относится любое вещество, которое способно взаимодействовать с кислотами, образуя соли.
Гийом Франсуа Руэль
\(1703\)–\(1770\)
Позже значение этого термина неоднократно уточнялось. Одно из определений, которым пользуются в настоящее время, звучит так:
Основаниями называют сложные вещества, в состав которых входят металлические химические элементы, соединённые с одной или несколькими гидроксогруппами (группами атомов \(-OH\)).
Исходя из этого, общую химическую формулу оснований можно изобразить следующим образом:
M(OH)n,
где \(M\) — знак металлического химического элемента,
а \(n\) — индекс, численно совпадающий с валентностью металла.
Основания относятся к электролитам, то есть к веществам, растворы и расплавы которых проводят электрический ток.
С точки зрения теории электролитической диссоциации, основания — электролиты, которые, диссоциируя, из отрицательно заряженных ионов образуют только гидроксид-ионы.
Номенклатура оснований
Название основания состоит из слова «гидроксид» и названия металлического химического элемента в родительном падеже. Если металлический элемент имеет переменную валентность, то последняя указывается римскими цифрами в скобках без пробела сразу же после названия металла.Пример:
NaOH — гидроксид натрия,
Fe(OH)2 — гидроксид железа(\(II\)),
Fe(OH)3 — гидроксид железа(\(III\)).
Классификация оснований
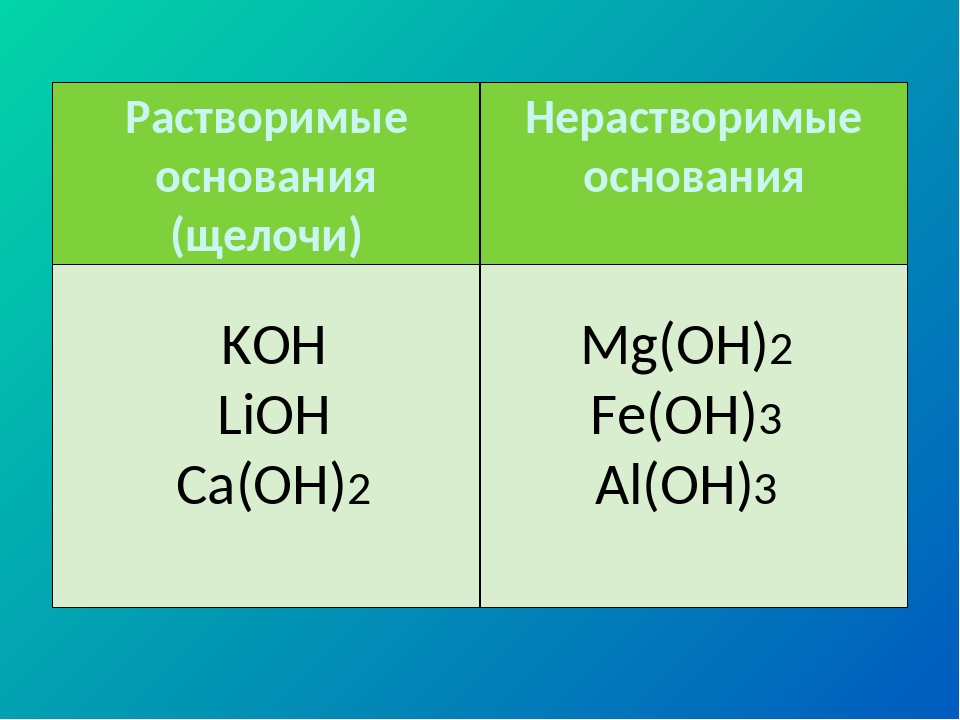
Растворимые в воде основания называют щелочами.
По их способности растворяться в воде основания делят на растворимые и практически нерастворимые.
Примеры: NaOH — гидроксид натрия, KOH — гидроксид калия, Ca(OH)2 — гидроксид кальция. | Примеры: Cu(OH)2 — гидроксид меди(\(II\)), Fe(OH)2 — гидроксид железа(\(II\)), Fe(OH)3 — гидроксид железа(\(III\)). |
Свойства оснований
Основания – сложные вещества, состоящие из атома металла и одной или нескольких гидроксильных групп. Общая формула оснований Ме(ОН)n. Основания (с точки зрения теории электролитической диссоциации) – это электролиты, диссоциирующие при растворении в воде с образованием катионов металла и гидроксид-ионов ОН–.
Классификация. По растворимости
в воде основания делят на щелочи
(растворимые в воде основания) и нерастворимые в воде основания.
Щелочи образуют щелочные и щелочно-земельные металлы, а также
некоторые другие элементы-металлы. По кислотности (числу ионов
ОН–,
образующихся при полной диссоциации, или количеству ступеней
диссоциации) основания подразделяют на
однокислотные (при полной диссоциации получается один ион
ОН–;
одна ступень диссоциации) и многокислотные
(при полной диссоциации получается больше одного иона
ОН–; более одной ступени
диссоциации).
Выделяют группу гидроксидов, которые проявляют химическую двойственность. Они взаимодействую как с основаниями, так и с кислотами. Это амфотерные гидроксиды (см. таблицу 1).
Таблица 1 — Амфотерные гидроксиды
|
Амфотерный гидроксид (основная и кислотная форма) |
Комплексный ион |
|
|
Zn(OH)2 / H2ZnO2 |
ZnO2 (II) |
[Zn(OH)4]2– |
|
Al(OH)3 / HAlO2 |
AlO2 (I) |
[Al(OH)4]–, [Al(OH)6]3– |
|
Be(OH)2 / H2BeO2 |
BeO2 (II) |
[Be(OH)4]2– |
|
Sn(OH)2 / H2SnO2 |
SnO2 (II) |
[Sn(OH)4]2– |
|
Pb(OH)2 / H2PbO2 |
PbO2 (II) |
[Pb(OH)4]2– |
|
Fe(OH)3 / HFeO2 |
FeO2 (I) |
[Fe(OH)4]–, [Fe(OH)6]3– |
|
Cr(OH)3 / HCrO2 |
CrO2 (I) |
[Cr(OH)4]–, [Cr(OH)6]3– |
Физические свойства. Основания —
твердые вещества различных цветов и различной растворимости в воде.
Основания —
твердые вещества различных цветов и различной растворимости в воде.
Химические свойства оснований
1)
Многокислотные основания диссоциируют по нескольким ступеням (в основном диссоциация протекает по первой ступени). Например, двухкислотное основание Fe(OH)2диссоциирует по двум ступеням:
Fe(OH)2FeOH+ + OH– (1 ступень);
FeOH+Fe2+ + OH– (2 ступень).
2) Взаимодействие с индикаторами (щелочи окрашивают фиолетовый лакмус в синий цвет, метилоранж – в желтый, а фенолфталеин – в малиновый):
индикатор + ОН– (щелочь)
окрашенное соединение.
3) Разложение с образованием оксида и воды (см. таблицу 2). Гидроксиды щелочных металлов устойчивы к нагреванию (плавятся без разложения). Гидроксиды щелочно-земельных и тяжелых металлов обычно легко разлагаются. Исключение составляет Ba(OH)2, у которого tразл достаточно высока (примерно 1000 °C).
Zn(OH)2 ZnO + H2O.
Таблица 2 — Температуры разложения некоторых гидроксидов металлов
| tразл, °C | Гидроксид | tразл, °C | Гидроксид | tразл, °C | |
| LiOH | 925 | Cd(OH)2 | 130 | Au(OH)3 | 150 |
| Be(OH)2 | 130 | Pb(OH)2 | 145 | Al(OH)3 | >300 |
| Ca(OH)2 | 580 | Fe(OH)2 | 150 | Fe(OH)3 | 500 |
| Sr(OH)2 | 535 | Zn(OH)2 | 125 | Bi(OH)3 | 100 |
| Ba(OH)2 | 1000 | Ni(OH)2 | 230 | In(OH)3 | 150 |
4) Взаимодействие щелочей с некоторыми металлами (например, Al и Zn):
В растворе: 2Al + 2NaOH + 6H2O ® 2Na[Al(OH)4] + 3H2
2Al + 2OH–+
6H2О
®
2[Al(OH)4]– + 3H2.
При сплавлении: 2Al + 2NaOH + 2H2O 2NaAlО2 + 3H2.
5) Взаимодействие щелочей с неметаллами:
6NaOH + 3Cl2 5NaCl + NaClO3 + 3H2O.
6) Взаимодействие щелочей с кислотными и амфотерными оксидами:
2NaOH + СО2® Na2CO3 + H2O 2OH–+ CO2 ® CO32– + H2O.
В растворе: 2NaOH + ZnO
+ H2O
®
Na2[Zn(OH)4]
2OH–+ ZnO
+ H2О
®
[Zn(OH)4]2–.
При сплавлении с амфотерным оксидом: 2NaOH + ZnO Na2ZnO2 + H2O.
7) Взаимодействие оснований с кислотами:
H2SO4+ Ca(OH)2 ® CaSO4¯ + 2H2O 2H+ + SO42–+ Ca2+ +2OH– ® CaSO4¯ + 2H2O
H2SO4+ Zn(OH)2 ® ZnSO4 + 2H2O 2H+ + Zn(OH)2 ® Zn2+ + 2H2O.
8) Взаимодействие щелочей с амфотерными гидроксидами (см. таблицу 1):
В растворе: 2NaOH + Zn(OH)2 ® Na2[Zn(OH)4] 2OH– + Zn(OH)2 ® [Zn(OH)4]2–
При сплавлении: 2NaOH +
Zn(OH)2
Na2ZnO2 +
2H2O.
9) Взаимодействие щелочей с солями. В реакцию вступают соли, которым соответствует нерастворимое в воде основание:
CuSО4 + 2NaOH ® Na2SO4 + Cu(OH)2¯ Cu2++ 2OH– ® Cu(OH)2¯.
Получение. Нерастворимые в воде основания получают путем взаимодействия соответствующей соли со щелочью:
2NaOH + ZnSО4 ® Na2SO4 + Zn(OH)2¯ Zn2++ 2OH– ® Zn(OH)2¯.
Щелочи получают:
1) Взаимодействием оксида металла с водой:
Na2O + H2O
®
2NaOH
CaO + H2O
®
Ca(OH)2.
2) Взаимодействием щелочных и щелочно-земельных металлов с водой:
2Na + H2O ® 2NaOH + H2 Ca + 2H2O ® Ca(OH)2 + H2.
3) Электролизом растворов солей:
2NaCl + 2H2O H2 + 2NaOH + Cl2.
4) Обменным взаимодействием гидроксидов щелочно-земельных металлов с некоторыми солями. В ходе реакции должна обязательно получаться нерастворимая соль.
Ba(OH)2+ Na2CO3®
2NaOH + BaCO3¯
Ba2+
+ CO32–
®
BaCO3¯.
Л.А. Яковишин
СИНТЕЗ И АДСОРБЦИОННЫЕ СВОЙСТВА НАНОСТРУКТУРИРОВАННЫХ ПОРОШКОВ Mg(OH)2 И MgO | Мацукевич
1. Umar, A. Metal Oxide Nanostructures and their Applications / A. Umar, Y.B. Hahn – American Scientific Publishers. – USA, 2010. – 693 p.
2. Jun, Ch. Catalytic performance of MgO with different exposed crystal facets towards the ozonation of 4-chlorophenol / Ch. Jun, T. Shuanghong, L. Jiang, X. Ya // Applied Catalysis A: General. – 2015. – Vol. 506. – P. 118–125.
3. Comparative study of microwave and conventional methods for the preparation and optical properties of novel MgO-micro and nano-structures / N. C. S. Selvama [et al.] // Journal of Alloys and Compounds. – 2011. – Vol. 509 – P. 9809– 9815.
– 2011. – Vol. 509 – P. 9809– 9815.
4. Synthesis and comparison of the photocatalytic activities of flame spray pyrolysis and sol–gel derived magnesium oxide nano-scale particles / S. Demirci [et al.] // Materials Science in Semiconductor Processing – 2015. – Vol. 34. – P. 154–161.
5. Synthesis and characterization of porous magnesium and oxide nanoplates / J. C. Yu [et al.] // Journal of Physical Chemistry – 2004. – Vol. 108. – P. 64‒70.
6. Synthesis of magnesium oxide nanoparticles by sol-gel process / W. Rizwan [et al.] // Materials Science Forum – 2007. – Vol. 558‒559. – P. 983‒986.
7. Zeyneb, C. Magnesium Oxide Nanoparticles: Preparation, Characterization, and Uranium Sorption Properties / C.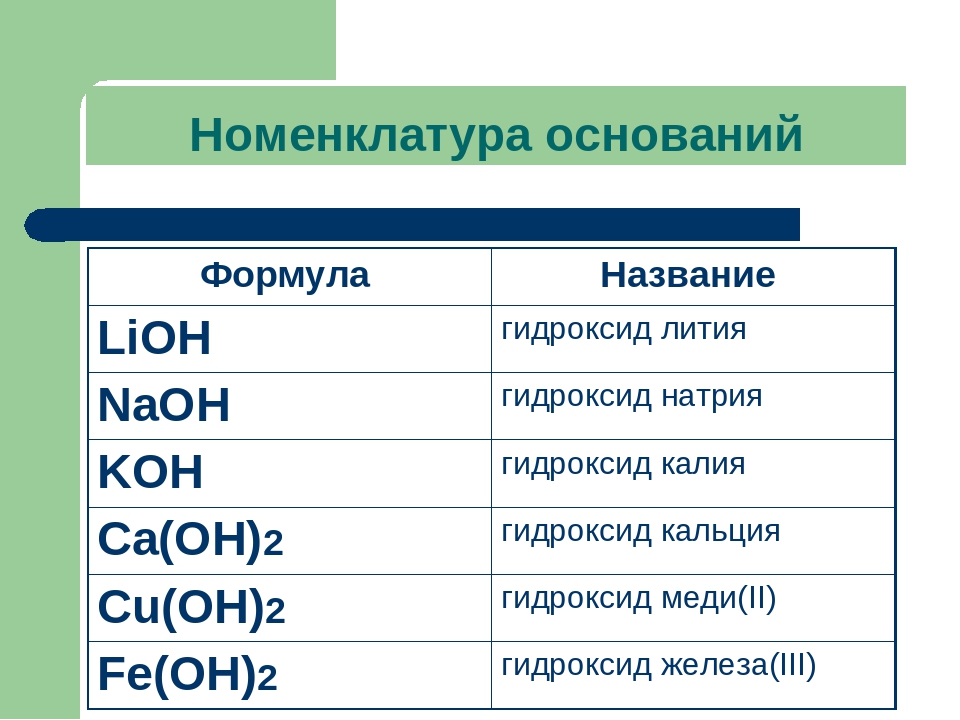 Zeyneb, E. Sema (Akyil), Y. Sabriye (Doyurum) // Environmental Progress and Sustainable Energy – 2012. – Vol. 31, iss. 4. – P. 536–543.
Zeyneb, E. Sema (Akyil), Y. Sabriye (Doyurum) // Environmental Progress and Sustainable Energy – 2012. – Vol. 31, iss. 4. – P. 536–543.
8. Сергеев, Г. Б. Нанохимия / Г. Б. Сергеев. – М.: МГУ, 2003. – 288 с.
9. Structural, morphological and optical properties of MgO nanoparticles for antibacterial applications / M. R. Bindhu1 [et al.] // Materials Letters/ – 2016. – Vol. 166. – P. 19–22.
10. Kumari L. Synthesis, characterization and optical properties of Mg(OH)2 micro-/nanostructure and its conversion to MgO / L. Kumari [et al.] // Ceramics International – 2009. – Vol. 35 – P. 3355‒3364.
11. Saoud Kh. M. Microwave assisted preparation of magnesium hydroxide nano-sheets / Kh. M. Saoud, Sh. Saeed, R. M. AlSoubaihi, M.F. Bertino // American Journal of Nanomaterials. – 2014. – Vol. 2, № 2. – P. 21–25.
M. Saoud, Sh. Saeed, R. M. AlSoubaihi, M.F. Bertino // American Journal of Nanomaterials. – 2014. – Vol. 2, № 2. – P. 21–25.
12. Наночастицы антипирена гидроксида магния и способ их производства: пат. RU 2561379 С2 / Е. П. Гордон, А. В. Коротченко, Н. И. Левченко Т. С. Угновенок. – Опубл. 10.05.2015.
13. Microwave assisted rapid growth of Mg(OH)2 nanosheet networks for ethanol chemical sensor application / F. Al-Hazmi [et al.] // Journal of Alloys and Compounds – 2012. – Vol. 519 – P. 4–8.
14. Powder Diffraction File. Swarthmore: Joint Committee on Powder Diffraction Standard: Card № 00–007–0239.
15. Ghanbari, D. Preparation of flower-like magnesium hydroxide nanostructure and its influence on the thermal stability of poly vinyl acetate and poly vinyl alcohol / D. Ghanbari, M. Salavati-Niasari, M. Sabet // Composites Part B: Engineering. – 2013. – Vol. 45. – P. 550‒555.
Ghanbari, M. Salavati-Niasari, M. Sabet // Composites Part B: Engineering. – 2013. – Vol. 45. – P. 550‒555.
16. The Effect of Flower-Like Magnesium Hydroxide Nanostructure on the Thermal Stability of Cellulose Acetate and Acrylonitrile–Butadiene–Styrene / F. Gholamian [et al.] // Journal of Cluster Science. – 2013. – Vol 24. – P. 73‒84.
17. Комаров, В. С. Научные основы синтеза адсорбентов / В. С. Комаров. – Минск: Беларус. навука, 2013. – С. 93.
18. Synthesizing nanocrystal-assembled mesoporous magnesium oxide using cotton fibres as exotemplate / R.-Q. Sun, L.-B. Sun [et al.] // Microporous and Mesoporous Materials. – 2008. – Vol. 111. – P. 314–322.
Химия
- Подробности
Просмотров: 15733
8 класс
Готовимся к контрольной работе по теме
«Основные классы неорганических соединений»
Написать уравнения реакций с помощью которых можно осуществить превращения:
Zn → ZnO → ZnCl2 →Zn(OH)2 → ZnO → Zn
1) 2Zn + O2 = 2ZnO реакция соединения
2) ZnO + 2HCl = ZnCl2 + H2O реакция обмена
3) ZnCl2 + 2KOH = Zn(OH)2 + 2KCl реакция обмена
4) Zn(OH)2 = ZnO + H2O реакция разложения
ZnO + H2 = Zn + H2O реакция замещения
Ca → Ca(OH)2 → CaSO4 → BaSO4
1) Ca + 2H2O = Ca(OH)2 + H2↑ реакция замещения
2) Ca(OH)2 + H2SO4 = CaSO4 + 2H2O реакцияобмена
3) CaSO4 + BaCl2 = BaSO4↓ + CaCl2 реакцияобмена
S → SO2 → SO3 → H2SO4→ Na2SO4
1) S + O2 = SO2 реакция соединения
2) 2SO2 + O2 = 2SO3 реакция соединения
3) SO3 + H2O = H2SO4 реакция соединения
4) Na2O + H2SO4 = Na2SO4 + H2O реакцияобмена
C → CO2 → CaCO3 → CO2 → CaCO3 → Ca(NO3)2
1) C + O2 = CO2 реакция соединения
2) CO2 + Ca(OH)2 =CaCO3 + H2O реакция обмена или
CO2 + CaO =CaCO3 реакция соединения
3) CaСO3 + 2HСl = CaCl2 + H2O + CO2↑ реакция обмена
4) см. реакцию №2
реакцию №2
5) CaСO3 + 2HNO3 = Ca(NO3)2 + H2O + CO2↑ реакция обмена
Как работать с цепочками превращений.
Цепочки превращений являются важным механизмом проверки знаний и умений, умению применять их на практике, способствуют развитию логического мышления учащихся.
Разберемся с выполнением подобных заданий на конкретном примере:
Mg → MgO → MgCl2 → Mg(OH)2 → MgO → Mg
Итак, первое задание – исходя из магния, получить оксид магния. Анализируя предложенные вещества, видим, что необходимо металл превратить в оксид металла. Различие между двумя веществами в наличии у оксида магния кислорода. Вспомним свойства металлов. Металлы взаимодействуют с неметаллами, в том числе, и с кислородом. Осталось записать уравнение химической реакции и расставить коэффициенты:
2Mg + O2 = 2MgO
Второе задание – исходя из оксида магния, получить хлорид магния. Анализируем: имеем оксид магния, получаем соль – хлорид магния. Из оксида необходимо получить соль. Вспомним свойства оксидов. Основные оксиды взаимодействуют с кислотами с образованием соли и воды. Хлор входит в состав соляной кислоты, значить записываем уравнение реакции между оксидом магния и соляной кислотой и расставляем коэффициенты:
Анализируем: имеем оксид магния, получаем соль – хлорид магния. Из оксида необходимо получить соль. Вспомним свойства оксидов. Основные оксиды взаимодействуют с кислотами с образованием соли и воды. Хлор входит в состав соляной кислоты, значить записываем уравнение реакции между оксидом магния и соляной кислотой и расставляем коэффициенты:
MgO + 2HCl = MgCl2 + H2O
Третье задание – исходя из хлорида магния, получить гидроксид магния. Анализируем: имеем соль, необходимо получить основание. Вспоминаем свойства солей. Соли взаимодействуют с растворимыми основаниями (щелочами) с образованием нового основания и новой соли. Записываем уравнение реакции:
MgCl2 + 2NaOH = Mg(OH)2 + 2NaCl
Четвертое задание – исходя из гидроксида магния, получить оксид магния. Анализируем: имеем основание, необходимо получить основный оксид. Вспоминаем свойства оснований. Нерастворимые основания при нагревании разлагаются на основный оксид и воду. Записываем уравнение химической реакции термического разложения гидроксида магния:
Записываем уравнение химической реакции термического разложения гидроксида магния:
Mg(OH)2 = MgO + H2O
Пятое задание – исходя из оксида магния, получить чистый металл магний. Анализируем: имеем основный оксид, необходимо получить металл. Вспоминаем свойства основных оксидов. Из оксида металла можно получить чистый металл несколькими способами с помощью восстановителей (C, CO, H2, более активный металл, электролиз). Записываем уравнение химической реакции восстановления металла из его оксида:
MgO + H2 = Mg + H2O
Всё! Задание выполнено!
Вы убедились в том, что если хорошо знаешь свойство классов неорганических веществ, выполнить задания цепочек превращений не представляет труда. Ну а если не знаешь, можно воспользоваться следующей шпаргалкой.
Свойства классов неорганических веществ.
(шпаргалка)
Основные оксиды:
1. Взаимодействуют с кислотными оксидами с образованием соли.
Взаимодействуют с кислотными оксидами с образованием соли.
Пример: CaO + CO2 = CaCO3
2. Взаимодействуют с более активными металлами с образованием нового оксида и металла.
Пример: СuO + Mg = Cu + MgO
3. Взаимодействуют с восстановителями (С, CO, H2) с образованием чистого металла и нового оксида.
Пример: Fe2O3 + 3H2 = 2Fe + 3H2O
4. Взаимодействуют с кислотами с образованием соли и воды.
Пример: CaO + 2HCl = CaCl2 + H2O
5. Взаимодействуют с водой (оксиды щелочных и щелочноземельных металлов) с образованием щелочей.
Пример: Na2O + H2O = 2NaOH
Кислотные оксиды:
1. Взаимодействуют с основными оксидами с образованием соли.
Пример: CaO + CO2 = CaCO3
2. Взаимодействуют с основаниями с образованием соли и воды.
Пример: CO2 + 2NaOH = Na2CO3 + H2O
3. Взаимодействуют с солями, образованными более слабой кислотой с образованием новой соли и нового оксида.
Взаимодействуют с солями, образованными более слабой кислотой с образованием новой соли и нового оксида.
Пример: SO3 + Na2SiO3 = Na2SO4 + SiO2
Основания:
1. Взаимодействуют с кислотными оксидами с образованием соли и воды.
Пример: CO2 + 2NaOH = Na2CO3 + H2O
2. Щелочи взаимодействуют с солями с образованием нового основания и новой соли.
Пример: 2NaOH + CuCl2 = Cu(OH)2↓ + 2NaCl
3. Взаимодействуют с кислотами с образованием соли и воды.
Пример: NaOH + HCl = NaCl + H2O
Кислоты:
1. Взаимодействуют с металлами, стоящими в ряду активности перед водородом с образованием соли и водорода.
Пример: Zn + 2HCl = ZnCl2 + H2↑
2. Взаимодействуют с основными оксидами с образованием соли и воды.
Пример: CaO + 2HCl = CaCl2 + H2O
3. Взаимодействуют с основаниями с образованием соли и воды.
Пример: NaOH + HCl = NaCl + H2O
4. Взаимодействуют с солями с образованием новой соли и новой кислоты.
Пример: HCl + AgNO3 = AgCl↓ + HNO3
Соли:
1. Взаимодействуют с солями с образованием новых солей.
Пример: BaCl2 + Na2SO4 = BaSO4↓ + 2NaCl
2. Взаимодействуют с металлами, если в ряду активности металл стоит перед металлом входящим в состав соли с образованием новой соли и металла.
Пример: CuCl2 + Mg = Cu + MgCl2
3. Взаимодействуют с кислотами с образованием новой соли и новой кислоты.
Пример: HCl + AgNO3 = AgCl↓ + HNO3
4. Взаимодействуют со щелочами с образованием нового основания и новой соли.
Пример: 2NaOH + CuCl2 = Cu(OH)2↓ + 2NaCl
5. Взаимодействуют с кислотными оксидами, если оксид образует более сильную кислоту с образованием новой соли и нового оксида.
Взаимодействуют с кислотными оксидами, если оксид образует более сильную кислоту с образованием новой соли и нового оксида.
Пример: SO3 + Na2SiO3 = Na2SO4 + SiO2
Выполнить задания:
Осуществите цепочки превращений:
а Sr →SrO → Sr(OH)2,
б Р → Р2О5 → Н3РО4.
Из перечня формул выпишите отдельно формулы оксидов, оснований, кислот и солей и дайте им названия:
1.К2ОАl(OH)3 HNO3 HCl BaO BaSO4 AlPO4 CO2 H3PО4 Fe(OH)2 Ag Cl NaNO3 Al2O3
2. Дана схема превращений. Составьте уравнения реакций.
Cu ® CuO ® CuCl2 → Cu(OH)2 Укажите тип реакций.
3. С какими из перечисленных веществ будет реагировать соляная кислота: HCl, CaO, CO2, H2O, Mg, Ba(OH)2. Напишите уравнения осуществимых реакций.
Напишите уравнения осуществимых реакций.
4. Напишите формулы следующих солей: сульфата калия, нитрата бария, карбоната натрия, фосфата кальция, сульфата цинка, сульфида железа (II), хлорида меди (II), силиката калия, сульфита натрия, бромида алюминия, иодида калия, гидрокарбоната магния, дигидрофосфата калия.
Домашнее задание.
9АБВГД
| Железо. Нахождение в природе. Свойства железа. |
* 43 у 1-5 с 135 задача 102 с 136 |
| Оксиды, гидроксиды и соли железа (II) и железа (Ш). |
* 44 у 6-11 з 3-4 с 136 |
91
|
Железо. Нахождение в природе. Свойства железа. Оксиды, гидроксиды и соли железа (II) и железа (Ш). |
* 43 у 1-5 с 135 з 102 с 136 * 44 у 6-11 з 3-4 с 136 |
|
Понятие о металлургии. Способы получения металлов. Проблемы безотходных производств в металлургии и охрана окружающей среды. Сплавы. Вычисления по химическим уравнениям массы, объёма или количества вещества одного из продуктов реакции по массе исходного вещества, объёму или количеству вещества, содержащего определённую долю примесей |
* 45 у 1-4 з 1-3 с 147, * 46- *47 у 5-14 з 4-6с147 |
10АБ
|
Одноосновные предельные карбоновые кислоты. Строение молекул. Функциональная группа. Изомерия и номенклатура. Свойства карбоновых кислот. Реакция этерификации. Получение карбоновых кислот и применение. Краткие сведения о непредельных карбоновых кислотах. Генетическая связь карбоновых кислот с другими классами органических соединений |
**27 -29 у 1-4, 11- 18 с 117-118 З 1 с118 |
111
|
Окислительно–восстановительные реакции |
* 11, записи в тетради |
12АБ
| Металлы побочных подгрупп (Б — групп) периодической системы химических элементов |
** 22 – 27 У 1- 12 с 118 з 1-4 с 118 |
| Оксиды и гидроксиды металлов |
*29 у 16-18 с 118 З 6 с 118 |
| Сплавы металлов. Решение расчётных задач. Расчёты по химическим уравнениям, связанные с массовой долей выхода продукта реакции от теоретически возможного. | * 28 у 13- 15 с 118 |
121
|
Генетическая связь неорганических и органических веществ |
* 33 у с 143 |
11. Химические свойства оснований. Химические свойства кислот.
Кислоты — это сложные вещества, состоящие из одного или нескольких атомов водорода и кислотного остатка.
Общая формула кислот НnА, где А — кислотный остаток.
1. Диссоциация
HCl = H+ + Cl–
Многоосновные кислоты диссоциируют по ступеням (в основном по первой):
H2SO4 = H+ + НSO4– (1 ступень)
HSO4– = H+ + SO42– (2 ступень)
2. Взаимодействие с основаниями и амфотерными гидроксидами
H2SO4 + Ca(OH)2 = CaSO4 + 2H2O
H2SO4 + Zn(OH)2 = ZnSO4 + 2H2O
3. Взаимодействие с основными и амфотерными оксидами
H2SO4 + CaO = CaSO4 + H2O
H2SO4 + ZnO = ZnSO4 + H2O
4. Взаимодействие с металлами
а) кислоты-окислители по Н+ (HCl, HBr, HI, HClO4, h3SO4, h4PO4 и др.).
В реакцию вступают металлы, расположенные в ряду активности до водорода:
Li, Rb, K, Ba, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb, H, Sb, Bi, Cu, Hg, Ag, Pd, Pt, Au
2HCl + Fe = FeCl2 + H2
б) кислоты-окислители по аниону (концентрированная серная, азотная любой концентрации):
2Fe + 6H2SO4 (конц.) = Fe2(SO4)3 + 3SO2 + 6H2O
5. Взаимодействие с солями
Реакция происходит, если соль образована более слабой или летучей кислотой, или если образуется осадок:
2HCl + Na2CO3 = 2NaCl + CO2 + H2O
СaCl2 + H2SO4 = CaSO4 + 2HCl
6. Разложение.
При разложении кислородсодержащих кислот получаются кислотный оксид и вода.
H2SiO3 = SiO2 + H2O
Кислоты-окислители разлагаются сложнее:
4НNO3 = 4NO2 + 2H2O + O2
Интернет-источники
Физические и химические свойства оснований
Все неорганические основания классифицируют на растворимые в воде (щелочи) – NaOH, KOH и нерастворимые в воде (Ba(OH)2, Ca(OH)2). В зависимости от проявляемых химических свойств среди оснований выделяют амфотерные гидроксиды.
Химические свойства оснований
При действии индикаторов на растворы неорганических оснований происходит изменение их окраски, так, при попадании в раствор основания лакмус приобретает синюю окраску, метилоранж – жёлтую, а фенолфталеин – малиновую.
Неорганические основания способны реагировать с кислотами с образованием соли и воды, причем, нерастворимые в воде основания взаимодействуют только с растворимыми в воде кислотами:
Cu(OH)2↓ + H2SO4 = CuSO4 +2H2O;
NaOH + HCl = NaCl + H2O.
Нерастворимые в воде основания термически неустойчивы, т.е. при нагревании они подвергаются разложению с образованием оксидов:
2Fe(OH)3 = Fe2O3 + 3 H2O;
Mg(OH)2 = MgO + H2O.
Щелочи (растворимые в воде основания) взаимодействуют с кислотными оксидами с образованием солей:
NaOH + CO2 = NaHCO3.
Щелочей также способны вступать в реакции взаимодействия (ОВР) с некоторыми неметаллами:
2NaOH + Si + H2O → Na2SiO3 +H2↑.
Некоторые основания вступают в реакции обмена с солями:
Ba(OH)2 + Na2SO4 = 2NaOH + BaSO4↓.
Амфотерные гидроксиды (основания) проявляют также свойства слабых кислот и реагируют с щелочами:
Al(OH)3 + NaOH = Na[Al(OH)4].
К амфотерным основаниям относятся гидроксиды алюминия, цинка. хрома (III) и др.
Физические свойства оснований
Большинство оснований – твердые вещества, которые характеризуются различной растворимостью в воде. Щелочи – растворимые в воде основания – чаще всего твердые вещества белого цвета. Нерастворимые в воде основания могут иметь различную окраску, например, гидроксид железа (III)- твердое вещество бурого цвета, гидроксид алюминия – твердое вещество белого цвета, а гидроксид меди (II) – твердое вещество голубого цвета.
Получение оснований
Основания получают разными способами, например, по реакции:
— обмена
CuSO4 + 2KOH → Cu(OH)2↓ + K2SO4;
K2CO3 + Ba(OH)2 → 2KOH + BaCO3↓;
— взаимодействия активных металлов или их оксидов с водой
2Li + 2H2O→ 2LiOH +H2↑;
BaO + H2O→ Ba(OH)2↓;
— электролиза водных растворов солей
2NaCl + 2H2O = 2NaOH + H2 ↑+ Cl2↑.
Примеры решения задач
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Гидроксид | химическое соединение | Britannica
Hydroxide , любое химическое соединение, содержащее одну или несколько групп, каждая из которых содержит по одному атому кислорода и водорода, связанных вместе и функционирующая как отрицательно заряженный ион OH —. Положительно заряженная часть соединения обычно представляет собой ион металла (, например, натрия, магния или алюминия), хотя это может быть органическая группа (, например, гуанидин или тетраметиламмоний).Предпочтительно характеризовать присутствие неионизированной ковалентно связанной гидроксильной группы OH с помощью приставки гидрокси, как в органическом соединении гидроксиуксусной кислоты, CH 2 OHCOOH, или суффиксом ol, как в метаноле, CH 3 OH, а в координационных соединениях с префиксом гидроксо, как в тетрагидроксоаурате калия, KAu (OH) 4 .
Гидроксиды включают щелочи, хорошо известные в лабораторных и промышленных процессах. Гидроксиды щелочных металлов, лития, натрия, калия, рубидия и цезия, являются самыми сильными основаниями, наиболее стабильными и наиболее растворимыми из гидроксидов.Гидроксид натрия, NaOH, также известный как каустическая сода или щелочь, имеет большое промышленное значение. Кальций, барий и стронций — все щелочноземельные металлы — образуют растворимые гидроксиды, которые являются сильными основаниями, но менее стабильны, чем гидроксиды щелочных металлов. Из них гидроксид кальция Ca (OH) 2 , широко известный как гашеная известь, является наиболее распространенным. За исключением гидроксида таллия (TlOH), гидроксиды других металлов, таких как магний, железо, висмут, никель, кобальт и медь, плохо растворяются в воде, но нейтрализуют кислоты.Гидроксиды бериллия, свинца, цинка, алюминия, хрома (трехвалентный), олова (двухвалентный), золота (трехвалентный) и некоторых других металлов проявляют как кислотные, так и основные свойства; , то есть , они растворяются в водных растворах оснований или кислот. Гидроксиды и другие вещества, такие как оксиды и сульфиды, с этими двойными свойствами, называются амфотерными.
Концепция pOH | Химия для неосновных
Цели обучения
- Определите pOH.
- Выполните расчеты pOH.
Может ли вода иметь целебные свойства?
Мыльное озеро издавна является лечебным местом. Индейские племена отказались от соперничества, когда пришли к озеру, чтобы насладиться высоким содержанием минералов в воде. В дни, когда еще не было хороших антибиотиков, тысячи посетителей приходили сюда и наслаждались успокаивающими водами озера. Мыльное озеро щелочное, а качество воды похоже на качество воды на планете Юпитер.
Концепция pOH
Как и в случае с концентрацией ионов водорода, концентрация иона гидроксида может быть выражена логарифмически через pOH. pOH раствора — это отрицательный логарифм концентрации гидроксид-иона.
pOH = -log [OH — ]
pH раствора может быть связан с pOH. Рассмотрим раствор с pH = 4,0. [H + ] решения будет 1,0 × 10 -4 M.Деление на это дает [OH — ] 1,0 × 10 -10 М. Наконец, pOH раствора равно -log (1,0 × 10 -10 ) = 10. Этот пример иллюстрирует следующую взаимосвязь.
pH + pOH = 14
Шкала pOH аналогична шкале pH в том, что pOH, равное 7, указывает на нейтральный раствор. Основной раствор имеет pOH менее 7, в то время как кислотный раствор имеет pOH более 7. pOH удобно использовать при определении концентрации гидроксид-иона в растворе с известным pH.
Пример задачи: использование pOH
Найдите концентрацию гидроксида в растворе с pH 4,42.
Шаг 1. Составьте список известных значений и спланируйте проблему.
Известный
Неизвестно
[OH-] =? M
Сначала рассчитывается pOH, а затем [OH — ].
Шаг 2: Решить.
Шаг 3. Подумайте о своем результате.
Значение pH соответствует кислотному раствору, и результирующая концентрация гидроксид-иона составляет менее 1 × 10 -7 М.Ответ состоит из двух значащих цифр, потому что данное значение pH имеет два десятичных знака.
На рис. 1 показаны все взаимосвязи между [H + ], [OH — ], pH и pOH.
Рис. 1. Зависимость между концентрацией иона водорода, концентрацией гидроксид-иона, pH и pOH.
Сводка
- pOH.
- Описаны расчеты с pOH.
Практика
Выполните все расчеты по приведенной ниже ссылке, которые включают pOH:
http: // www.sciencegeek.net/APchemistry/APtaters/pHcalculations.htm
Обзор
- По какой формуле рассчитывается pOH?
- Какое значение pOH указывает на кислый раствор?
- Значение pOH, равное 3, указывает, какой тип раствора?
Глоссарий
- pOH: Отрицательный логарифм концентрации гидроксид-иона.
Ион гидроксида: определение и формула — стенограмма видео и урока
Формула гидроксида
Формула гидроксида OH-.В этом соединении кислород связывается с водородом, разделяя два электрона. Гидроксид несет отрицательный заряд, потому что он приобрел электрон. Кислород, обозначенный как O, связан с водородом, обозначенным как H, и мы можем видеть, где находится самая отрицательная часть соединения с отрицательным знаком.
Однако если бы вы увеличили масштаб до атомного уровня, гидроксид не выглядел бы как пара букв. Вместо этого вы можете увидеть частицу, похожую на эту модель, где большая красная сфера — это кислород, а меньшая серая полусфера, прикрепленная сбоку, — водород.
Факты об ионах гидроксида
Химические вещества, содержащие гидроксид, который легко растворяется в воде, часто являются одними из самых сильнодействующих коррозионных химикатов. Гидроксид натрия , часто известный как каустическая сода или щелочь, является активным ингредиентом мощных очистителей сточных вод. Ткани человека могут быть серьезно повреждены этим соединением при вдыхании, проглатывании или даже прикосновении. Гидроксид натрия в высоких концентрациях может растворять алюминий или даже стекло!
Растворенные ионы гидроксида — агрессивные химические вещества.Из-за своего отрицательного заряда их очень привлекает все, что даже имеет небольшой положительный заряд. Это притяжение заставляет гидроксиды энергично атаковать положительно заряженные предметы, разрушая химические связи и повреждая структуры.
С другой стороны, нерастворимые соединения, содержащие гидроксиды, весьма полезны для человека. Таблетки антацидов часто используют гидроксид алюминия или гидроксид магния для подавления изжоги. Другие соединения, содержащие гидроксид, могут быть просто красивыми, например, редкий кристалл хенмилита.
Резюме урока
Ион гидроксида — это отрицательно заряженная молекула, состоящая из одного атома водорода, связанного с одним атомом кислорода. Это основание , которое часто образует ионных соединений при связывании с положительно заряженным ионом. Растворенный гидроксид ионы — это агрессивные химические вещества, которые могут быть очень опасными и едкими. Часто они используются в качестве чистящих средств или антацидов.
Расчет гидроксид-иона Учебное пособие по химии
Ключевые понятия
Пожалуйста, не блокируйте рекламу на этом сайте.
Без рекламы = для нас нет денег = для вас нет бесплатных вещей!
[OH
— ] Расчеты с использованием калькулятора Вам нужно будет найти кнопку 10 x на вашем калькуляторе.
Эта кнопка, вероятно, будет иметь маркировку 10 x и будет находиться над кнопкой с надписью «Журнал» или «ЖУРНАЛ».
Для расчетов с использованием pOH НЕ используйте кнопку с меткой e x (над кнопкой с меткой ln или LN)
На калькуляторе AUS-e-TUTE кнопка 10 x находится над кнопкой log , расположенной в верхнем левом углу калькулятора.
Чтобы использовать кнопку 10 x для вычисления [OH — ], вам необходимо:
- Введите число (pOH) в
- Умножьте pOH на -1, чтобы найти -pOH
- Нажмите кнопку INV
- Нажмите кнопку log
На калькуляторе, показанном ниже, мы отключили все кнопки, кроме кнопки INV и log .
Проверьте расчеты ниже:
| pOH | 3 | 2,3 | 2 | 1,3 | 1 | 0,3 | 0 | -0,7 | -1 |
|---|---|---|---|---|---|---|---|---|---|
| [OH — ] моль л -1 | 1 x 10 -3 | 5 x 10 -3 | 1 x 10 -2 | 5 x 10 -2 | 1 x 10 -1 | 5 x 10 -1 | 1 x 10 0 | 5 x 10 0 | 1 x 10 1 |
| (= 0.001) | (= 0,005) | (= 0,01) | (= 0,05) | (= 0,1) | (0,5) | (= 1) | (= 5) | (= 10) | |
| тренд | уменьшение pOH → | ||||||||
| увеличение концентрации гидроксид-иона → | |||||||||
Обратите внимание на следующие отношения между концентрацией гидроксид-ионов и pH:
- При уменьшении pOH увеличивается [OH — ]
- Увеличение pOH снижает [OH — ]
Обратите внимание, что изменение единицы pOH приводит к десятикратному изменению концентрации гидроксид-ионов:
| pOH = 3 | — 1 = | pOH = 2 | — 1 = | pOH = 1 | — 1 = | pOH = 0 | — 1 = | pOH = -1 |
| [OH — ] = 1 x 10 -3 M | x10 = | [OH — ] = 1 x 10 -2 M | x10 = | [OH — ] = 1 x 10 -1 M | x10 = | [OH — ] = 1 x 10 0 M | x10 = | [OH — ] = 1 x 10 1 M |
| pOH = 2.3 | — 1 = | pOH = 1,3 | — 1 = | pOH = 0,3 | — 1 = | pOH = -0,7 |
| [OH — ] = 5 x 10 -3 M | x10 = | [OH — ] = 5 x 10 -2 M | x10 = | [OH — ] = 5 x 10 -1 M | x10 = | [OH — ] = 5 x 10 0 M |
[OH
— ] ГрафикиИспользуя формулу (уравнение) [OH — ] = 10 -pOH , мы можем рассчитать [OH — ] в моль л -1 растворов с различными значениями pOH и нанести эти значения на график.
Пример показан ниже:
| Данные | График | Тенденции | ||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
| Увеличение pOH снижает [OH — ]. Более высокое pOH дает более низкое [OH — ]. Снижение pOH увеличивает [OH — ]. Низкое pOH дает более высокое [OH — ]. |
Если вы наведите указатель мыши на любую из точек на графике, должно появиться небольшое поле, чтобы показать вам значения концентрации гидроксид-иона и pOH в этой точке.
Рабочие примеры
(на основе подхода StoPGoPS к решению задач в химии.)
Вопрос 1. pOH водного раствора основания определено равным 4,4.
Какова концентрация гидроксид-ионов в моль л -1 в этом основном растворе?
- Что вас просили сделать?
Рассчитать концентрацию гидроксид-ионов в моль л -1
[OH — (водн.) ] =? моль л -1 - Какую информацию (данные) вам предоставили?
Извлеките данные из вопроса:
рОН = 4.4 - Какая связь между тем, что вы знаете, и тем, что вам нужно выяснить?
Напишите уравнение (формулу) для нахождения [OH — ] с учетом pOH:
[OH — ] = 10 -pOH - Подставляем значения и решаем:
[OH — ] = 10 -pOH
[OH — ] = 10 -4,4 = 3.98 × 10 -5 моль л -1 - Правдоподобен ли ваш ответ?
Используйте рассчитанное вами значение [OH –], чтобы найти pOH и сравните полученное значение со значением, указанным в вопросе:
pOH = -log 10 [OH — ] = -log 10 [3,98 × 10 -5 ] = 4,4
Поскольку это значение совпадает с указанным в вопросе, мы уверены, что наш ответ правильный. - Назовите свое решение проблемы:
[OH — (водн.) ] = 3.98 × 10 -5 моль л -1
Вопрос 2. pOH водного раствора гидроксида натрия 3,5.
Рассчитайте количество молей гидроксид-ионов в 0,25 л этого раствора.
- Что вас просили сделать?
Рассчитать количество молей гидроксид-ионов
n (OH — (водн.) ) =? моль - Какую информацию (данные) вам предоставили?
Извлеките данные из вопроса:
pH = 3.5
объем = 0,25 л - Какая связь между тем, что вы знаете, и тем, что вам нужно выяснить?
Найдите концентрацию гидроксид-ионов:
[OH — ] = 10 -pOH
= 10 -3,5
= 3,16 × 10 -4 моль л -1Напишите уравнение (формулу), которое связывает моль, объем и концентрацию ( молярность):
молярность = моль ÷ объем (л)Перепишите это уравнение (формулу), чтобы найти родинки:
моль = молярность (моль л -1 ) × объем (л) - Рассчитать количество молей OH — :
молярность = 3.16 × 10 -4 моль л -1
объем = 0,25 лмоль OH — = 3,16 × 10 -4 × 0,25
= 7,9 × 10 -5 моль - Правдоподобен ли ваш ответ?
Используйте рассчитанное вами значение молей OH — , чтобы найти pOH и сравните полученное значение со значением, указанным в вопросе:
[OH — ] = моль ÷ объем = (7.9 × 10 -5 ) ÷ 0,25 = 3,16 × 10 -4 моль л -1
pOH = -log 10 [OH — ] = -log 10 [3,16 × 10 — 4 ] = 3,5
Поскольку это значение совпадает с указанным в вопросе, мы уверены, что наш ответ правильный. - Назовите свое решение проблемы:
n (OH — (водн.) ) = 7.9 × 10 -5 моль
Вопрос 3. Водный раствор гидроксида аммония имеет pOH 6,0.
Рассчитайте количество гидроксид-ионов в 100 мл этого раствора.
- Что вас просили сделать?
Рассчитать количество гидроксид-ионов
N (OH — (водн.) ) =? - Какую информацию (данные) вам предоставили?
Извлеките данные из вопроса:
рОН = 6.0
объем = 100 мл - Какая связь между тем, что вы знаете, и тем, что вам нужно выяснить?
Найдите концентрацию гидроксид-ионов:
[OH — ] = 10 -pOH = 10 -6,0 моль л -1Найдите моль OH —:
Напишите уравнение (формулу), которое связывает моли, объем и концентрацию (молярность):
молярность = моль ÷ объем (л)Перепишите это уравнение (формулу), чтобы найти родинки:
моль = молярность (моль л -1 ) × объем (л)Рассчитайте количество молей OH — :
молярность = 10 -6 моль л -1
объем = 100 мл
Преобразуйте объем в мл в л, разделив на 1000:
объем = 100мл÷ 1000млл -1 = 0.10 лмоль OH — = 10 -6 × 0,10 = 10 -7 моль
- Рассчитайте количество гидроксид-ионов:
1 моль = Число частиц Авогадро = 6,02 x 10 23 частиц
10 -7 моль OH — = 10 -7 × (6,02 × 10 23 )
= 6,0 × 10 16 гидроксид-иона - Правдоподобен ли ваш ответ?
Используйте рассчитанное вами значение количества частиц OH — , чтобы найти pOH и сравните полученное значение со значением, указанным в вопросе:
моль = N ÷ N A = (6.0 × 10 16 ) ÷ (6,02 × 10 23 ) = 10 -7 моль
[OH — ] = моль ÷ объем в литрах = 10 -7 ÷ 100 мл / 1000 мл / л = 10 -6 моль л -1
pOH = -log 10 [OH — ] = -log 10 [10 -6 ] = 6
Поскольку это значение совпадает с указанным в вопросе, мы уверены, что наш ответ правильный. - Назовите свое решение проблемы:
N (OH — (водн.) ) = 6.0 × 10 16
Вопрос 4. Водный раствор гидроксида калия содержит 0,0005 моль гидроксид-ионов и имеет pOH 4,3.
Рассчитайте объем раствора в литрах.
- Что вас просили сделать?
Рассчитать объем раствора в литрах
В =? L - Какую информацию (данные) вам предоставили?
Извлеките данные из вопроса:
рОН = 4.3
моль OH — = 0,0005 моль - Какая связь между тем, что вы знаете, и тем, что вам нужно выяснить?
Найдите концентрацию гидроксид-ионов:
[OH — ] = 10 -pOH
= 10 -4,3
= 5,0 × 10 -5 моль л -1Напишите уравнение (формулу), которое связывает моль, объем и концентрацию ( молярность):
молярность = моль ÷ объем (л)Перепишите это уравнение (формулу), чтобы найти объем:
объем = моль ÷ молярность (моль л -1 ) - Рассчитать объем раствора:
моль OH — = 0.0005 моль
молярность = 5,0 × 10 -5 моль л -1объем раствора = 0,0005 ÷ (5,0 × 10 -5 )
= 10 л - Правдоподобен ли ваш ответ?
Используйте рассчитанное вами значение объема раствора, чтобы найти pOH и сравните полученное значение со значением, указанным в вопросе:
[OH — ] = моль ÷ объем в литрах = 0,0005 ÷ 10 = 5 × 10 -5 моль л -1
pOH = -log 10 [OH — ] = -log 10 [5 × 10 -5 ] = 4.3
Поскольку это значение совпадает с указанным в вопросе, мы уверены, что наш ответ правильный. - Назовите свое решение проблемы:
В = 10 л
Химия и применение ацилирования РНК 2′-OH
Чех, Т. Р. и Стейтц, Дж. А. Революция некодирующих РНК — нарушение старых правил ради создания новых. Cell 157 , 77–94 (2014).
CAS PubMed Google Scholar
Либерман, Дж. Использование мира РНК для терапии. Nat. Struct. Мол. Биол. 25 , 357–364 (2018).
CAS PubMed PubMed Central Google Scholar
Лин, К. и Янг, Л. Длинная некодирующая РНК при раке: схема передачи сигналов. Trends Cell Biol. 28 , 287–301 (2018).
CAS PubMed Google Scholar
Килхерт, С., Виттманн, С. и Васильева, Л. Регуляция и функции комплекса экзосом ядерной РНК. Nat. Rev. Mol. Cell Biol. 17 , 227–239 (2016).
CAS PubMed Google Scholar
La Manno, G. et al. Скорость РНК одиночных клеток. Природа 560 , 494–498 (2018).
PubMed PubMed Central Google Scholar
Хаусли Дж. И Толлервей Д. Множество путей деградации РНК. Cell 136 , 763–776 (2009).
CAS PubMed Google Scholar
Серганов А., Нудлер Э. Десятилетие рибопереключателей. Cell 152 , 17–24 (2013).
CAS PubMed PubMed Central Google Scholar
Серганов А. и Патель Д. Дж. Рибозимы, рибопереключатели и не только: регуляция экспрессии генов без белков. Nat. Преподобный Жене. 8 , 776–790 (2007).
CAS PubMed PubMed Central Google Scholar
Доэрти, Э. А., Дудна, Дж. А. Структуры и механизмы рибозима. Annu. Rev. Biochem. 69 , 597–615 (2000).
CAS PubMed Google Scholar
Берингер М. и Роднина М. В. Рибосомальная пептидилтрансфераза. Mol. Ячейка 26 , 311–321 (2007).
CAS PubMed Google Scholar
Чжао, Б. С., Раундтри, И. А. и Хе, С. Посттранскрипционная регуляция генов с помощью модификаций мРНК. Nat. Rev. Mol. Cell Biol. 18 , 31–42 (2017).
CAS PubMed Google Scholar
Roundtree, I. A., Evans, M. E., Pan, T. & He, C. Динамические модификации РНК в регуляции экспрессии генов. Ячейка 169 , 1187–1200 (2017).
CAS PubMed PubMed Central Google Scholar
Harcourt, E. M., Kietrys, A. M. & Kool, E. T. Химические и структурные эффекты модификаций оснований в матричной РНК. Природа 541 , 339–346 (2017).
CAS PubMed PubMed Central Google Scholar
Куинн, Дж. Дж. И Чанг, Х. Ю. Уникальные особенности биогенеза и функции длинных некодирующих РНК. Nat. Преподобный Жене. 17 , 47–62 (2016).
CAS PubMed Google Scholar
Анастасиаду, Э., Джейкоб, Л. С. и Слэк, Ф. Дж. Некодирующие РНК-сети при раке. Nat. Rev. Cancer 18 , 5–18 (2018).
CAS PubMed Google Scholar
Энгрейц, Дж. М., Олликайнен, Н. и Гуттман, М. Длинные некодирующие РНК: пространственные усилители, которые контролируют ядерную структуру и экспрессию генов. Nat. Rev. Mol. Cell Biol. 17 , 756–770 (2016).
CAS PubMed Google Scholar
Chen, L.-L. Связывание длинной некодирующей локализации и функции РНК. Trends Biochem. Sci. 41 , 761–772 (2016).
CAS PubMed Google Scholar
Adams, D. et al. Патисиран, РНКи-терапевтический препарат для лечения наследственного транстиретинового амилоидоза. N. Engl. J. Med. 379 , 11–21 (2018).
CAS PubMed Google Scholar
Феллманн, К., Гоуэн, Б.Г., Лин, П.-К., Дудна, Дж. А. и Корн, Дж. Э. Краеугольные камни CRISPR – Cas в открытии лекарств и терапии. Nat. Rev. Drug Discov. 16 , 89–100 (2016).
PubMed PubMed Central Google Scholar
Sahin, U., Karikó, K. & Türeci, Ö. Терапия на основе мРНК — разработка нового класса лекарств. Nat. Rev. Drug Discov. 13 , 759–780 (2014).
CAS PubMed Google Scholar
Салленджер Б. А. и Наир С. От мира РНК к клинике. Наука 352 , 1417–1420 (2016).
CAS PubMed PubMed Central Google Scholar
Капранов П. и Сен-Лоран Г. РНК темной материи: существование, функции и противоречия. Фронт. Genet. 3 , 60 (2012).
CAS PubMed PubMed Central Google Scholar
Риддихоу, Г. В лесах РНК темной материи. Наука 309 , 1507 (2005).
CAS Google Scholar
Хентце, М.W., Castello, A., Schwarzl, T. и Preiss, T. Дивный новый мир РНК-связывающих белков. Nat. Rev. Mol. Cell Biol. 19 , 327–341 (2018).
CAS PubMed Google Scholar
Лу З. и Чанг Х. Ю. Расшифровка структур РНК. Curr. Opin. Struct. Биол. 36 , 142–148 (2016).
CAS PubMed PubMed Central Google Scholar
Озсолак Ф. и Милош П. М. Секвенирование РНК: достижения, проблемы и возможности. Nat. Преподобный Жене. 12 , 87–98 (2011).
CAS PubMed Google Scholar
Peer, E., Rechavi, G. & Dominissini, D. Эпитранскриптомика: регулирование метаболизма мРНК посредством модификаций. Curr. Opin. Chem. Биол. 41 , 93–98 (2017).
CAS PubMed Google Scholar
Lu, Z. et al. Карта дуплекса РНК в живых клетках выявляет структуру транскриптома более высокого порядка. Ячейка 165 , 1267–1279 (2016).
CAS PubMed PubMed Central Google Scholar
Hafner, M. et al. Идентификация по всей транскриптоме РНК-связывающего белка и сайтов-мишеней микроРНК с помощью PAR-CLIP. Cell 141 , 129–141 (2010).
CAS PubMed PubMed Central Google Scholar
Weeks, K. M. & Mauger, D. M. Изучение структурных кодов РНК с помощью химии формы. В соотв. Chem. Res. 44 , 1280–1291 (2011).
CAS PubMed PubMed Central Google Scholar
Tijerina, P., Mohr, S. & Russell, R. DMS-футпринтинг структурированных РНК и комплексов РНК-белок. Nat. Protoc. 2 , 2608–2623 (2007).
CAS PubMed PubMed Central Google Scholar
Hulscher, R.M. et al. Исследование структуры промежуточных продуктов сборки рибосом in vivo с использованием DMS и футпринтинга гидроксильных радикалов. Методы 103 , 49–56 (2016).
CAS PubMed PubMed Central Google Scholar
Пейдж, Дж. С., Ву, К. Ю. и Джаффри, С. Р. РНК-имитаторы зеленого флуоресцентного белка. Наука 333 , 683–686 (2011).
Google Scholar
Шин Д., Синкельдам Р. В. и Тор Ю. Эмиссивный алфавит РНК. J. Am. Chem. Soc. 133 , 14912–14915 (2011).
CAS PubMed PubMed Central Google Scholar
Kawai, R. et al. Сайт-специфичное флуоресцентное мечение молекул РНК путем специфической транскрипции с использованием неестественных пар оснований. J. Am. Chem. Soc. 127 , 17286–17295 (2005).
CAS PubMed Google Scholar
Anhäuser, L. & Rentmeister, A. Ферментно-опосредованное мечение РНК. Curr. Opin. Biotechnol. 48 , 69–76 (2017).
PubMed Google Scholar
Soutschek, J. et al. Терапевтическое подавление эндогенного гена путем системного введения модифицированных миРНК. Nature 432 , 173–178 (2004).
CAS PubMed Google Scholar
Джулиано Р. Л. Доставка терапевтических олигонуклеотидов. Nucleic Acids Res. 44 , 6518–6548 (2016).
PubMed PubMed Central Google Scholar
Shabanpoor, F. et al. Би-специфические переключающие сплайсинг олигонуклеотиды PMO, конъюгированные через один пептид, активны в мышиной модели мышечной дистрофии Дюшенна. Nucleic Acids Res. 43 , 29–39 (2015).
CAS PubMed Google Scholar
Анкенбрук Н., Кортни Т., Наро Ю. и Дейтерс А. Оптохимический контроль биологических процессов в клетках и животных. Angew. Chem. Int. Эд. 57 , 2768–2798 (2018).
CAS Google Scholar
Lubbe, A. S., Szymanski, W. & Feringa, B. L. Последние разработки в области обратимой фоторегуляции структуры и функции олигонуклеотидов. Chem. Soc. Ред. 46 , 1052–1079 (2017).
CAS PubMed Google Scholar
Xia, Y., Zhang, R., Wang, Z., Tian, J. & Chen, X. Последние достижения в области высокоэффективных флуоресцентных и биолюминесцентных зондов для визуализации РНК. Chem. Soc. Ред. 46 , 2824–2843 (2017).
CAS PubMed PubMed Central Google Scholar
Гаспар, И., Виппич, Ф. и Эфрусси, А.Ферментативное производство одномолекулярных зондов FISH и захвата РНК. РНК 23 , 1582–1591 (2017).
CAS PubMed PubMed Central Google Scholar
Spitale, R.C. et al. Анализ ФОРМЫ РНК в живых клетках. Nat. Chem. Биол. 9 , 18–20 (2013).
CAS PubMed Google Scholar
Паредес, Э., Evans, M. & Das, S.R. Мечение, конъюгация и лигирование РНК. Методы 54 , 251–259 (2011).
CAS PubMed Google Scholar
Кьюсак С. Аминоацил-тРНК синтетазы. Curr. Opin. Struct. Биол. 7 , 881–889 (1997).
CAS PubMed Google Scholar
Аяди, Л., Гальванин, А., Пичо, Ф., Маршанд В. и Моторин Ю. Метилирование рибозы РНК (2′-O-метилирование): возникновение, биосинтез и биологические функции. Biochim. Биофиз. Acta Gene Regul. Мех. 1862 , 253–269 (2019).
CAS PubMed Google Scholar
Стюарт А. и Хорана Х. Г. Селективное ацетилирование концевых гидроксильных групп в дезоксирибоолигонуклеотидах. J. Am. Chem. Soc. 85 , 2346–2347 (1963).
CAS Google Scholar
Кнорре, Д. Г., Пустошилова, Н. М., Теплова, Н. и Шамовск, Г. Г. Получение транспортной РНК, ацетилированной по ее 2′-гидроксигруппам. Биохимия 30 , 1218–1224 (1965).
CAS Google Scholar
Кочетков, Н. К., Будовский, Е. И. в Органическая химия нуклеиновых кислот: Часть B 449–476 (Springer, 1972).
Кокс, Дж. Р. и Рамзи О. Б. Механизмы нуклеофильного замещения в сложных фосфатных эфирах. Chem. Ред. 64 , 317–352 (1964).
CAS Google Scholar
Велема, В. А., Китрис, А. М. и Кул, Е. Т. Контроль РНК путем фотообратимого ацилирования. J. Am. Chem. Soc. 140 , 3491–3495 (2018).
CAS PubMed PubMed Central Google Scholar
Мерино, Э. Дж., Уилкинсон, К. А., Кофлан, Дж. Л. и Уикс, К. М. Анализ структуры РНК при разрешении одного нуклеотида путем селективного 2′-гидроксилацилирования и удлинения праймера (SHAPE). J. Am. Chem. Soc. 127 , 4223–4231 (2005).
CAS PubMed Google Scholar
Lin, C. et al. Идентификация продуктов ацилирования в химии SHAPE. Bioorg. Med. Chem. Lett. 27 , 2506–2509 (2017).
CAS PubMed Google Scholar
Keith, G. & Ebel, J.-P. Действие акетического ангидрида на основе рибонуклеарных кислот в среде диметилформамида. Biochim. Биофиз. Acta 166 , 16–28 (1968).
CAS PubMed Google Scholar
Meister, EC, Willeke, M., Angst, W., Togni, A. & Walde, P. Запутанные количественные описания кислотно-основных равновесий Бренстеда – Лоури в учебниках химии — критический обзор и разъяснения для преподаватели-химики. Helv. Чим. Acta 97 , 1–31 (2014).
CAS Google Scholar
Thaplyal, P. & Bevilacqua, P. C. в Riboswitch Discovery, Structure and Function Vol. 549 (изд. Берк-Агуэро, Д. Х.) 189–219 (Academic, 2014).
Великян И., Ачарья С., Трифонова А., Фёльдези А. и Чаттопадхьяя Дж. PKa 2′-гидроксильной группы в нуклеозидах и нуклеотидах. Дж.Являюсь. Chem. Soc. 123 , 2893–2894 (2001).
CAS PubMed Google Scholar
Кнорре, Д. Г., Пустоши, Н. М. и Теплова, Н. Действие фосфодиэстераз селезенки и змеиного яда на трансфер-РНК, ацетилированную по 2′-гидроксильной группе рибозы. Биохимия 31 , 666–669 (1966).
CAS Google Scholar
МакГиннис, Дж.Л., Дункл, Дж. А., Кейт, Дж. Х. Д. и Уикс, К. М. Механизмы химии формы РНК. J. Am. Chem. Soc. 134 , 6617–6624 (2012).
CAS PubMed PubMed Central Google Scholar
Мортимер, С. А. и Уикс, К. М. Быстродействующий реагент для точного анализа вторичной и третичной структуры РНК с помощью химии SHAPE. J. Am. Chem. Soc. 129 , 4144–4145 (2007).
CAS PubMed Google Scholar
Парк, Х. С., Киетрис, А. М. и Коул, Э. Т. Простые алканоильные ацилирующие агенты для обратимой функционализации и контроля РНК. Chem. Commun. 55 , 5135–5138 (2019).
CAS Google Scholar
Кадина А., Киетрис А. М. и Кул Е. Т. Маскировка РНК путем обратимого ацилирования. Angew.Chem. Int. Эд. 57 , 3059–3063 (2018).
CAS Google Scholar
Фесслер, А., Гармон, К., Хиви, Т., Фаулер, А. и Огл, С. Водорастворимые реагенты на основе изатинового ангидрида для биоконъюгирования, отслеживаемые под действием УФ-излучения. Org. Biomol. Chem. 15 , 9599–9602 (2017).
CAS PubMed Google Scholar
Фесслер, А.B. et al. Водорастворимые изатиновые ангидриды: платформа для анализа РНК-ФОРМЫ и биоконъюгирования белков. Биоконъюг. Chem. 29 , 3196–3202 (2018).
CAS PubMed Google Scholar
Velema, W. A. & Kool, E. T. Водорастворимая уходящая группа обеспечивает гидрофобную функционализацию РНК. Org. Lett. 20 , 6587–6590 (2018).
CAS PubMed PubMed Central Google Scholar
Nodin, L. et al. Химия ФОРМЫ РНК с ароматическими ацилирующими реагентами. Bioorg. Med. Chem. Lett. 25 , 566–570 (2015).
CAS PubMed Google Scholar
Кучко, К. М. и Лэдерах, А. Преодолевая парадигму предсказания: новые приложения SHAPE к функциям и эволюции РНК. Wiley Interdiscip. РНК 8 , e1374 (2017).
Google Scholar
Бевилаква, П. К., Ричи, Л. Е., Су, З. и Ассманн, С. М. Полногеномный анализ вторичной структуры РНК. Annu. Преподобный Жене. 50 , 235–266 (2016).
CAS PubMed Google Scholar
Штробель, Э. Дж., Уоттерс, К. Э., Лоури, Д. и Лакс, Дж. Б. Системная биология РНК: объединение функциональных открытий и структурных инструментов для понимания глобальных ролей РНК. Curr. Opin. Biotechnol. 39 , 182–191 (2016).
CAS PubMed PubMed Central Google Scholar
Mortimer, S.A. et al. SHAPE-Seq: высокопроизводительный анализ структуры РНК. Curr. Protoc. Chem. Биол. 4 , 275–297 (2012).
PubMed Google Scholar
Lucks, J. B. et al. Характеристика мультиплексной структуры РНК с селективным 2′-гидроксилацилированием анализируется секвенированием удлинения праймера (SHAPE-Seq). Proc. Natl Acad. Sci.USA 108 , 11063–11068 (2011).
CAS PubMed Google Scholar
Зигфрид, Н. А., Пусан, С., Райс, Г. М., Нельсон, Дж. А. Э. и Уикс, К. М. Обнаружение мотивов РНК с помощью SHAPE и мутационного профилирования (SHAPE-MaP). Nat. Методы 11 , 959–965 (2014).
CAS PubMed PubMed Central Google Scholar
Уилкинсон, К. А., Мерино, Э. Дж. И Уикс, К. М. Химия ФОРМЫ РНК показывает, что неиерархические взаимодействия доминируют над равновесными структурными переходами в транскриптах тРНК Asp . J. Am. Chem. Soc. 127 , 4659–4667 (2005).
CAS PubMed Google Scholar
Хирацука Т. Новые флуоресцентные аналоги цАМФ и цГМФ, доступные в качестве субстратов для циклической нуклеотидфосфодиэстеразы. J. Biol. Chem. 257 , 13354–13358 (1982).
CAS PubMed Google Scholar
Хирацука Т. Новые модифицированные рибозой флуоресцентные аналоги нуклеотидов аденина и гуанина, доступные в виде субтратов для различных ферментов. Biochim. Биофиз. Acta 742 , 496–508 (1983).
CAS PubMed Google Scholar
Дейган, К. Э., Ли, Т. У., Мэтьюз, Д. Х. и Уикс, К. М. Точное определение структуры РНК с помощью SHAPE. Proc. Natl Acad. Sci. США 106 , 97–102 (2009).
CAS PubMed Google Scholar
Ding, Y. et al. Профилирование вторичной структуры РНК по всему геному in vivo выявляет новые регуляторные особенности. Природа 505 , 696–700 (2014).
CAS PubMed Google Scholar
Spitale, R.C. et al. Структурные отпечатки in vivo расшифровывают механизмы регуляции РНК. Природа 519 , 486–490 (2015).
CAS PubMed PubMed Central Google Scholar
Sun, L. et al. Карты структуры РНК в клеточных компартментах млекопитающих. Nat. Struct. Мол. Биол. 26 , 322–330 (2019).
CAS PubMed PubMed Central Google Scholar
Bhatt, D. M. et al. Динамика транскриптов провоспалительных генов, выявленная с помощью анализа последовательностей фракций субклеточной РНК. Cell 150 , 279–290 (2012).
CAS PubMed PubMed Central Google Scholar
McGinnis, J. L. et al. Внутриклеточная SHAPE показывает, что свободные 30S субъединицы рибосомы находятся в неактивном состоянии. Proc. Natl Acad. Sci. США 112 , 2425–2430 (2015).
CAS PubMed Google Scholar
Mustoe, A. M. et al. Распространенные регуляторные функции структуры мРНК, выявленные с помощью зондирования SHAPE с высоким разрешением. Ячейка 173 , 181–195.e18 (2018).
CAS PubMed PubMed Central Google Scholar
Уоттерс, К. Э., Эбботт, Т. Р. и Лакс, Дж. Б. Одновременная характеристика структуры и функции клеточной РНК с помощью внутриклеточной SHAPE-Seq. Nucleic Acids Res. 44 , e12 (2016).
PubMed Google Scholar
Lee, B. et al. Сравнение реагентов SHAPE для картирования структур РНК внутри живых клеток. РНК 23 , 169–174 (2017).
CAS PubMed PubMed Central Google Scholar
Смола, М. Дж., Калабрезе, Дж. М. и Уикс, К.М. Обнаружение РНК-белковых взаимодействий в живых клетках с помощью SHAPE. Биохимия 54 , 6867–6875 (2015).
CAS PubMed PubMed Central Google Scholar
Watters, KE, Yu, AM, Strobel, EJ, Settle, AH & Lucks, JB. Характеристика структур РНК in vitro и in vivo с селективным 2′-гидроксилацилированием, анализируемая с помощью секвенирования удлинения праймера (SHAPE-Seq) . Методы 103 , 34–48 (2016).
CAS PubMed PubMed Central Google Scholar
Ursuegui, S. et al. Конъюгированный с биотином N-метилизатовый ангидрид: химический инструмент для разделения нуклеиновых кислот путем селективного 2′-гидроксилацилирования РНК. Chem. Commun. 50 , 5748–5751 (2014).
CAS Google Scholar
Ursuegui, S. et al. Конъюгированный с биотином изатовый ангидрид на основе пиридина, селективный агент ацилирования РНК при комнатной температуре для разделения нуклеиновых кислот. Org. Biomol. Chem. 13 , 3625–3632 (2015).
CAS PubMed Google Scholar
Фернандес-Гарсия, К. и Паунер, М. В. Селективное ацилирование нуклеозидов, нуклеотидов и глицерин-3-фосфохолина в воде. Synlett 28 , 78–83 (2017).
Google Scholar
Пикен, В. А., Олсен, Д. Б., Бенселер, Ф., Aurup, H. & Eckstein, F. Кинетическая характеристика устойчивых к рибонуклеазам 2′-модифицированных рибозимов в форме головки молотка. Science 253 , 314–317 (1991).
CAS PubMed Google Scholar
Спроут Б. С., Ламонд А. И., Бейджер Б., Нойнер П. и Райдер У. Высокоэффективный химический синтез 2′-О-метилолигорибонуклеотидов и тетрабиотинилированных производных; новые зонды, устойчивые к деградации РНК или ДНК-специфическими нуклеазами. Nucleic Acids Res. 17 , 3373–3386 (1989).
CAS PubMed PubMed Central Google Scholar
Garry, D. J. et al. Выход транскрипции полностью 2′-модифицированной РНК может быть увеличен путем добавления термостабилизирующих мутаций к мутантам РНК-полимеразы Т7. Nucleic Acids Res. 43 , 7480–7488 (2015).
PubMed PubMed Central Google Scholar
Оводов, С. Ю. и Алахов, Ю. Б. мРНК, ацетилированная по 2′-ОН-группам остатков рибозы, функционально активна в бесклеточной системе трансляции зародышей пшеницы. FEBS Lett. 270 , 111–114 (1990).
CAS PubMed Google Scholar
Goldsborough, S. Модифицированные полинуклеотиды и их применение. Патент США US20030039985A1 (2003).
Стин, К.-А., Малхотра, А. и Уикс, К.М. Селективное ацилирование 2′-гидроксила анализируют по защите от экзорибонуклеазы. J. Am. Chem. Soc. 132 , 9940–9943 (2010).
CAS PubMed PubMed Central Google Scholar
Steen, K.-A., Siegfried, NA & Weeks, KM. Анализ селективного 2′-гидроксилацилирования с помощью защиты от экзорибонуклеазы (SHAPE, обнаруживаемой РНКазой) для прямого анализа ковалентных аддуктов и гибкости нуклеотидов в РНК . Nat. Protoc. 6 , 1683–1694 (2011).
CAS PubMed PubMed Central Google Scholar
Чин, Дж. У. Расширение и перепрограммирование генетического кода. Природа 550 , 53–60 (2017).
CAS PubMed Google Scholar
Ибба, М. и Солл, Д. Синтез аминоацил-тРНК. Annu. Rev. Biochem. 69 , 617–650 (2000).
CAS PubMed Google Scholar
Робертсон, С. А., Эллман, Дж. А. и Шульц, П. Г. Общий и эффективный путь химического аминоацилирования транспортных РНК. J. Am. Chem. Soc. 113 , 2722–2729 (1991).
CAS Google Scholar
Hecht, S. M., Alford, B. L., Kuroda, Y.И Китано С. «Химическое аминоацилирование» тРНК. J. Biol. Chem. 253 , 4517–4520 (1978).
CAS PubMed Google Scholar
Wagner, A. M. et al. Модификация N-концевого белка с использованием простых субстратов аминоацилтрансферазы. J. Am. Chem. Soc. 133 , 15139–15147 (2011).
CAS PubMed PubMed Central Google Scholar
Yu, X. et al. Исследование CD4-связывающего кармана гликопротеина gp120 ВИЧ-1 с использованием аналогов фенилаланина неприродного происхождения. Bioorg. Med. Chem. Lett. 24 , 5699–5703 (2014).
CAS PubMed Google Scholar
Чен, С., Фахми, Н. Е., Нангрив, Р. К., Мехеллоу, Ю. и Хехт, С. М. Синтез pdCpAs и транспортных РНК, активированных тиотреонином и производными. Bioorg. Med. Chem. 20 , 2679–2689 (2012).
CAS PubMed PubMed Central Google Scholar
Мацубара Т., Иидзима К., Ватанабе Т., Хосака Т. и Сато Т. Включение гликозилированной аминокислоты в белок с помощью системы трансляции in vitro. Bioorg. Med. Chem. Lett. 23 , 5634–5636 (2013).
CAS PubMed Google Scholar
Фахми, Н. Э., Дедкова, Л., Ван, Б., Головин, С. и Хехт, С. М. Сайт-специфическое включение гликозилированных производных серина и тирозина в белки. J. Am. Chem. Soc. 129 , 3586–3597 (2007).
CAS PubMed Google Scholar
Гао Р., Чжан Ю., Чоудхури А. К., Дедкова Л. М. и Хехт С. М. Аналоги ДНК-топоизомеразы I вируса коровьей оспы, модифицированные по тирозину в активном центре. Дж.Являюсь. Chem. Soc. 127 , 3321–3331 (2005).
CAS PubMed Google Scholar
Kwiatkowski, M., Wang, J. & Forster, A. C. Простой синтез N -ациламиноацил-pCpA для получения неправильно заряженной полностью рибо-тРНК. Биоконъюг. Chem. 25 , 2086–2091 (2014).
CAS PubMed Google Scholar
Ли, Н., Бесшо, Ю., Вей, К., Шостак, Дж. У., Шуга, Х. Катализируемое рибозимом аминоацилирование тРНК. Nat. Struct. Биол. 7 , 28–33 (2000).
CAS PubMed Google Scholar
Мураками Х., Сайто Х. и Суга Х. Универсальный катализатор аминоацилирования тРНК на основе РНК. Chem. Биол. 10 , 655–662 (2003).
CAS PubMed Google Scholar
Murakami, H., Ohta, A., Ashigai, H. & Suga, H. Очень гибкий метод ацилирования тРНК для синтеза неприродных полипептидов. Nat. Методы 3 , 357–359 (2006).
CAS PubMed Google Scholar
Ad, O. et al. Трансляция разнообразных арамид- и 1,3-дикарбонил-пептидов рибосомами дикого типа in vitro. ACS Cent. Sci. 5 , 1289–1294 (2019).
CAS PubMed PubMed Central Google Scholar
Effraim, P. R. et al. Природным аминокислотам не требуются их природные тРНК для эффективного отбора рибосомой. Nat. Chem. Биол. 5 , 947–953 (2009).
CAS PubMed PubMed Central Google Scholar
Fleming, S. R. et al. Настольный биосинтез тиопептидов с использованием Flexizyme. J. Am. Chem. Soc. 141 , 758–762 (2019).
CAS PubMed PubMed Central Google Scholar
Огава А., Намба Ю. и Гакумасава М. Рациональная оптимизация тРНК-супрессоров янтаря для эффективного включения неприродной аминокислоты в белок в экстракте зародышей эукариотической пшеницы. Org. Biomol. Chem. 14 , 2671–2678 (2016).
CAS PubMed Google Scholar
Resendiz, M. J. E., Schön, A., Freire, E. & Greenberg, M. M. Фотохимический контроль структуры РНК путем нарушения π-стэкинга. J. Am. Chem. Soc. 134 , 12478–12481 (2012).
CAS PubMed PubMed Central Google Scholar
Mikat, V. & Heckel, A. Светозависимая РНК-интерференция с миРНК, заключенными в нуклеотидные основания. РНК 13 , 2341–2347 (2007).
CAS PubMed PubMed Central Google Scholar
Pothoulakis, G., Ceroni, F., Reeve, B. & Ellis, T. Аптамер РНК шпината как инструмент характеристики для синтетической биологии. ACS Synth. Биол. 3 , 182–187 (2014).
CAS PubMed Google Scholar
Филонов Г. С. и Джаффри С. Р. Визуализация РНК с димерной брокколи в живых клетках бактерий и млекопитающих. Curr. Protoc. Chem. Биол. 8 , 1–28 (2016).
PubMed PubMed Central Google Scholar
Miyamae, T. Дальнейшие поиски низкомолекулярных инактивантов, способных вызывать иммуногенность слизистой оболочки дыхательных путей путем модификации ядер РНК вируса Сендай. Microbiol. Иммунол. 40 , 761–766 (1996).
CAS PubMed Google Scholar
Стюард, Д. Л., Херндон, В. К. и Шелл, К. Р. Влияние 2′-O-ацетилирования на противовирусную активность полирибонуклеотидов. Biochim. Биофиз. Acta 262 , 227–232 (1972).
CAS PubMed Google Scholar
Филд, А. К., Тайтелл, А. А., Лэмпсон, Г. П. и Хиллеман, М. Р. Индукторы интерферона и резистентности хозяина. II. Многоцепочечные синтетические полинуклеотидные комплексы. Proc. Natl Acad. Sci. США 58 , 1004–1010 (1967).
CAS PubMed Google Scholar
Bowler, F. R. et al. Пребиотически вероятное лигирование олигорибонуклеотидов, облегченное хемоселективным ацетилированием. Nat. Chem. 5 , 383–389 (2013).
CAS PubMed PubMed Central Google Scholar
Xu, J., Duffy, C. D., Chan, C. K. W. и Sutherland, J. D. Твердофазный синтез и поведение гибридизации частично 2 ‘/ 3’- O -ацетилированных олигонуклеотидов РНК. J. Org. Chem. 79 , 3311–3326 (2014).
CAS PubMed PubMed Central Google Scholar
Альфонсо, Л., Ай, Г., Спитале, Р. К. и Бхат, Г. Дж. Молекулярные мишени аспирина и профилактика рака. Br. J. Cancer 111 , 61–67 (2014).
CAS PubMed PubMed Central Google Scholar
Лунде, Б. М., Мур, С. и Варани, Г. РНК-связывающие белки: модульная конструкция для эффективного функционирования. Nat. Rev. Mol. Cell Biol. 8 , 479–490 (2007).
CAS PubMed PubMed Central Google Scholar
Jinek, M. et al. Программируемая эндонуклеаза ДНК, управляемая двойной РНК, для адаптивного бактериального иммунитета. Наука 337 , 816–821 (2012).
CAS PubMed PubMed Central Google Scholar
Yan, J. et al. Эффективное разрушение малых РНК экспрессией короткого тандемного миметика-мишени у арабидопсиса. Растительная клетка 24 , 415–427 (2012).
CAS PubMed PubMed Central Google Scholar
Niu, Q.-W. и другие. Экспрессия искусственных микроРНК в трансгенном Arabidopsis thaliana придает устойчивость к вирусу. Nat. Biotechnol. 24 , 1420–1428 (2006).
CAS PubMed Google Scholar
Основы химии: атомы и ионы
Основы химии: атомы и ионыpH : КИСЛОТЫ И ОСНОВАНИЯ
Мера ионов водорода (H +) в растворе: чем больше ионов водорода (H +), тем более кислотных в растворе.
Вода
Откуда берутся ионы водорода (H +)? Что ж, на самом деле это все часть воды …
- Вода (h3O) распадается на ионы водорода (H +) и ионы гидроксила (OH-).
- Когда имеется равных частей ионов водорода (H +) и гидроксильных ионов (OH-), что приводит к соотношению 1: 1 , pH нейтральный (7).
Иногда присутствуют и другие химические вещества, растворенные водой.Полученные в результате кусочки могут содержать ионы водорода (H +) или гидроксильные ионы (OH-). Это изменит pH.
Кислоты
Кислоты добавляют в растворы ионы водорода (H +).
- Соляная кислота (HCl) распадается на ионы водорода (H +) и ионы хлорида (Cl-).
- Extra H + — раствор кислоты (не более равных частей).
- изменено соотношение 1: 1, теперь Н + слишком много, получается кислая.
Базы
Основания добавляют в растворы гидроксил-ион (ОН-).
- Раствор гидроксида натрия (NaOH) разделяется на ионы натрия (Na +) и гидроксильные ионы (OH-).
- Коэффициент сдвигов дополнительных гидроксильных ионов (OH-) (меньше свободного H +, чем обычно).
- изменено соотношение 1: 1, теперь слишком мало водорода (H +) и есть «лишние» ионы OH-.
- Решение становится базовым.
Все, что слишком кислое или слишком щелочное , разлагает органические вещества . Ткани разрушаются, клетки умирают или, по крайней мере, не функционируют должным образом.
.

