Органоиды клетки, функции — Справочник химика 21
Как правило, клетки обладают микроскопическими размерами. Части клетки, выполняющие различные функции, — органоиды — имеют микроскопические н субмикроскопические размеры. [c.21] Органоиды — зто протоплазматические тельца разного размера ядро, пластиды, митохондрии. Ядро содержит нуклеиновые кислоты (ДНК и РНК) оно является центром процессов синтеза, регулирует жизненные функции и служит носителем наследственных свойств клетки благодаря содержащимся в нем хромосомам. Для растений характерно наличие пластид, которые вьшолняют функции, связанные с фотосинтезом, и классифицируются в зависимости от наличия пигментов (см. 8.5.3 и 11.10). Более мелкие тельца митохондрии играют важную роль в дыхательной активности, запасают и передают энергию. В органоидах клетки образуются ферменты — биокатализаторы синтеза органических веществ — и Другие белки возникают в результате клеточного дыхания богатые энергией соединения синтезируются полисахариды и т.
Рибосомы присутствуют в клетках всех организмов, локализуясь в протоплазме и органоидах клетки (ядрах, митохондриях, пластидах и др.). Функцией рибосом является биосинтез белков в клетках. Именно аминоацил — т-РНК переносится на рибосомы, где происходит соединение отдельных аминокислот в полипептиды, образуется первичная молекула белка и, по-видимому, завершается полное формирование вторичной и третичной структур белков. Полипептид остается связанным с рибосомами до тех пор, пока синтез его ке закончится. Сформировавшиеся полипептиды и белки освобождаются из рибосом, после чего рибосомы могут синтезировать новые белковые молекулы. т-РНК осуществляют многократный перенос аминокислотных остатков в рибосомы в процессе биосинтеза. [c.281]
Цитоплазма—вся масса клетки, за исключением ядра. Содержит органоиды, выполняющие различные функции (эидоплазматическая сеть, митохондрии,, рибосомы, пластиды и др.
Действие ферментов живой клетки строго согласовано. Продукты одной ферментативной реакции подготовляют вступление в действие следующей. Это достигается благодаря тому, что ферменты локализованы в определенных участках клетки, а не распределены хаотично. В составе органоидов клетки ферменты располагаются в строгой последовательности, образуя четко структурированные, упорядоченные системы. Только при этих условиях возможна функция фермента. [c.52]
Существование клетки как целостной системы, существование функциональных клеточных органоидов требует компартмента-лизации, пространственного разграничения этих систем мембранами, характеризуемыми регулируемой проницаемостью. Белки-ферменты, входящие в состав мембран в комплексах с липидами, обеспечивают активный транспорт метаболитов в клетку и из нее, идущий в направлении, противоположном градиенту концентрации. Эта функция белков тесно связана с механохимиче-ской. Кроме того, белки катализируют метаболические биоэнергетические процессы, протекающие в мембранах.
Идея синтетического исследования структуры и функции клетки и ее органоидов уже имеет историю. [c.155]
Важнейшие функции клетки (биосинтетическая и биоэнергетическая) заключаются в метаболизме и биосинтезе, в процессах запасания энергии и ее преобразования в работу. Они неразрывно связаны и могут протекать только в открытой термодинамической системе, которой и является клетка. Реализация этих функций в клетке сопряжена с трансмембранными движениями веществ, ионов и электронов как внутри клетки, так и с обменом веществами между клеткой и внеклеточной средой. Компартментация клетки мембранными структурами обеспечивает пространственно-временную организацию ее органоидов, надмолекулярных и молекулярных комплексов. Это обеспечивает строго согласованное в пространстве и во времени протекание огромного числа (вряд ли его можно выразить конкретно) биохимических и физико-химических процессов в чрезвычайно ограниченном объеме клетки.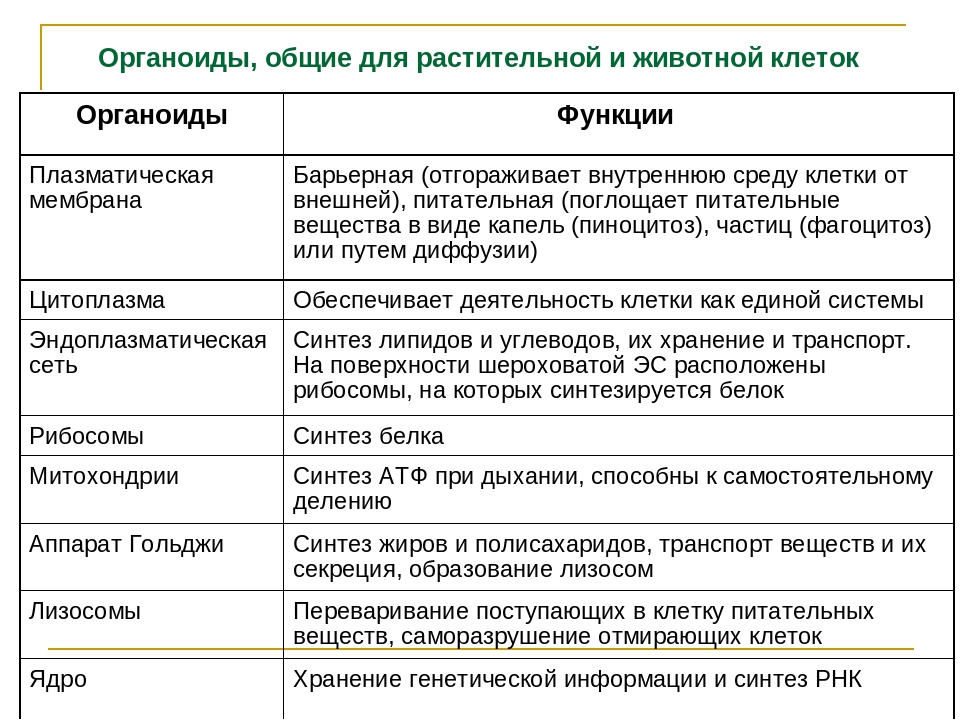
Успехи субмикроскопического и биохимического изучения клетки и ее органоидов делают все более несомненной высказанную в начале этой статьи, в сущности не новую мысль, что дилемма первичности формы (структуры) или первичности функции является мнимой проблемой.
Пока что, правда, нельзя полностью освободиться от сомнений, насколько все описываемые этими методами морфологические и функциональные картины соответствуют прижизненному» состоянию клетки и, следовательно, отражают подлинное суб-микроскопическое ее строение и функцию ее органоидов. Эти сомнения будут разрешены дальнейшим усовершенствованием методов субмикроскопического и биохимического исследования обеих сторон жизненных явлений — структуры и функции. [c.156]
Таким образом, в бактериальной клетке существует глубокая взаимосвязь между цитоплазматической мембраной и клеточной стенкой, с одной стороны, и между цитоплазматической мебраной нуклеоидом и ри-бссомальным аппаратом, с другой, а следовательно, и между процессами, протекающими на этих структурах. Изучение характера этой связи представляет первостепенный интерес для понимания того, как происходит разграничение функций между отдельными органоидами у бактерий и каковы основные отличия бактерий от клеток эукариотов. [c.29]
Изучение характера этой связи представляет первостепенный интерес для понимания того, как происходит разграничение функций между отдельными органоидами у бактерий и каковы основные отличия бактерий от клеток эукариотов. [c.29]
Прокариотические и эукариотические микроорганизмы существенно различаются по строению клетки и функциям отдельных клеточных структур и органоидов. Эти различия накладывают отпечаток на все физиологические отправления микробной клетки. Продуценты белков, аминокислот и жиров относятся как к эукариотам, так и к прокариотам. [c.23]
Таким образом, окисление, сопряженное с фосфорилированием,— это окислительная реакция, при которой перенос электрона в дыхательной цепи сопряжен с синтезом АТФ из АДФ и неорганического фосфата. Окислительное фосфорилирование является одним нз важнейших путей аккумуляции энергии в живых организмах. Синтез АТФ из АДФ в процессе тканевого дыхания, точнее, при переброске электронов и протонов от окисляемого субстрата через цепь дыхательных катализаторов к кислороду, был открыт в.
В жизнедеятельности растительной клетки каждая ее структура органоид) выполняет специфические функции, которые могут быть нарушены вследствие накопления токсических агентов в тех или иных органоидах [1]. Отсюда можно заключить, что при изучении механизма действия на растения мышьякорганических соединений, обладающих высокой гербицидной активностью [2— 4], следует знать, в каких клеточных органоидах локализуется ингибитор после проникновения в живую ткань. [c.118]
Функции биологических мембран. Лабильная структура мембран позволяет выполнять им различные функции барьерные, транспортные, осмотические, электрические, структурные, энергетические, биосинтетические, секреторные, пищеварительные, рецепторно-регуляторные и некоторые другие. Первичным назначением клеточной мембраны было отделение внутренней среды от внешней. Затем в процессе эволюции возникло большое количество специализированных внутриклеточных отсеков (компартментов), что позволило клетке и органоидам удерживать в небольших объемах необходимые Ферменты и метаболиты, создавать гетерогенную физико- [c.15]
Лабильная структура мембран позволяет выполнять им различные функции барьерные, транспортные, осмотические, электрические, структурные, энергетические, биосинтетические, секреторные, пищеварительные, рецепторно-регуляторные и некоторые другие. Первичным назначением клеточной мембраны было отделение внутренней среды от внешней. Затем в процессе эволюции возникло большое количество специализированных внутриклеточных отсеков (компартментов), что позволило клетке и органоидам удерживать в небольших объемах необходимые Ферменты и метаболиты, создавать гетерогенную физико- [c.15]
Мембраны, опоясывающие внещнюю и внутреннюю поверхность протоплазмы и каждого из содержащихся в ней органоидов, играют в жизни клетки весьма важную и притом разностороннюю роль. Они не просто ограничивают внутреннее содержимое протопласта, пластид, митохондрий и других органелл, но и выполняют функции регуляторов процессов поступления в клет-
Изменения физико-химических свойств протопласта в целом, так же как и отдельных его структур, представляют собой результат ряда процессов, катализируемых различными ферментами.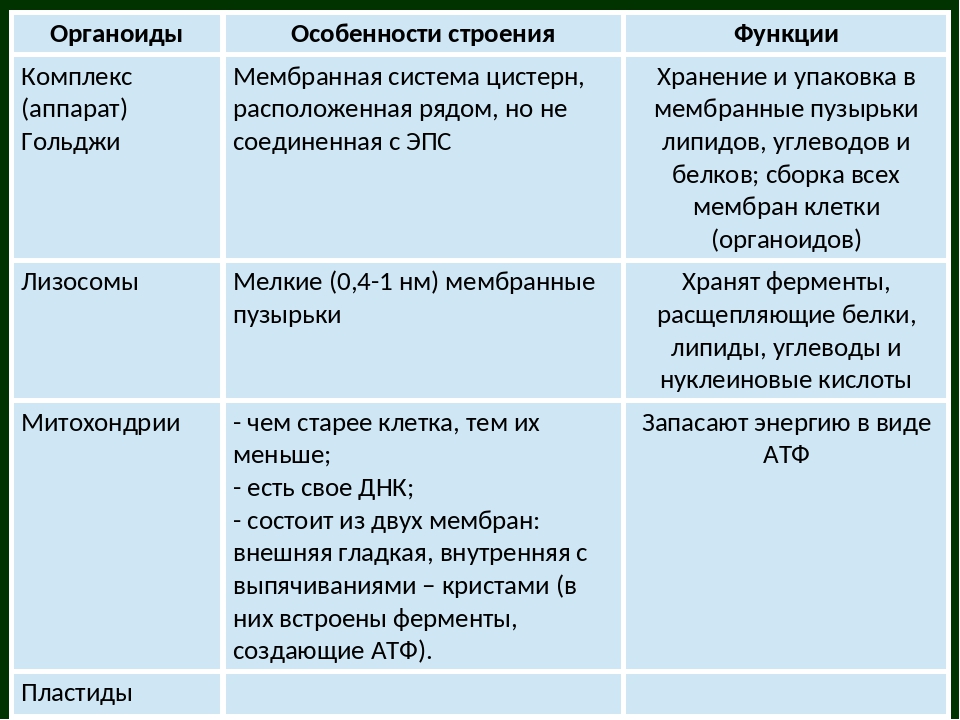 В свою очередь, для деятельности ферментного аппарата клетки одним из решающих факторов являются состояние клеточных органоидов и структура протопласта. Так, активирование энергетического обмена, наблюдаемое на определенных этапах в случае ряда заболеваний, должно быть обусловлено новообразованием органоидов, функции которых связаны с процессами запасания энергии. [c.104]
В свою очередь, для деятельности ферментного аппарата клетки одним из решающих факторов являются состояние клеточных органоидов и структура протопласта. Так, активирование энергетического обмена, наблюдаемое на определенных этапах в случае ряда заболеваний, должно быть обусловлено новообразованием органоидов, функции которых связаны с процессами запасания энергии. [c.104]
Необходимо отметить, что те или иные процессы обмена, приуроченные к определенным структурным элементам, не осуществляются в них вполне самостоятельно, независимо от процессов в других органоидах. Наоборот, доказано, что каждая группа органоидов выполняет свои функции на основе непрерывного взаимодействия со всеми другими центрами физиологической активности клетки. [c.52]
Части тела простейшего, выполняющие различные функции, называют органеллами, или органоидами. Кроме того, клетка простейших имеет те же органоиды общего значения, что и 1слеткн тела многоклеточных рибосомы, комплекс Гольджи, митохондрии и др.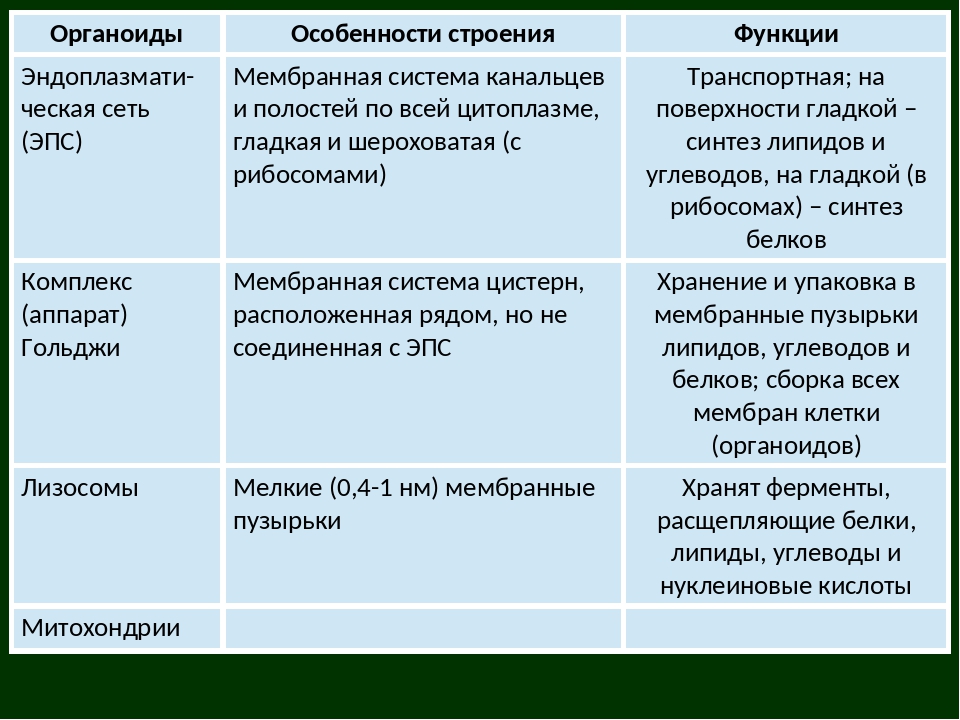 [c.306]
[c.306]
Белки выполняют и транспортную функцию. Различные вещества в организме и внутри клетки находятся в комплексе с белками и только благодаря этому доступны соответствующим органоидам и ферментам. [c.22]
Исследование ультраструктуры органоидов растительной клетки (хлоропластов, митохондрий, рибосом, мембранных структур) дало возможность раскрыть суть процессов фотосинтеза и дыхания, которые определяют возможность самой жизни, иа нашей планете. Изучение строения клеточных оболочек, открытие цитоплазматических мембранных структур способствовали выяснению процессов обмена веществ и энергии в клетке, структуры и функции органоидов растительной клетки.. Большое принципиальное значение имеет электронно-микроскопическое исследование строения РНК и ДНК, локализации их на структурных компонентах клетки. Результаты этих исследований легли в основу раскрытия генетической роли ядра и проблемы наследственности.
Прослеживая этапы развития физиологии растений, можно видеть, что физиологические функции, которые столетие назад только описывались, в настоящее время детально изучены на биохимическом и молекулярном уровнях роль органоидов, энергетика, ассимиляция СО2, многие участки обмена веществ, механизмы регуляции и наследственности. Близки к разрешению такие процессы, как фотохимические реакции фотосинтеза, механизмы транспорта веществ. В то же время в современной физиологии наряду с молекулярно-биохимическим подходом все более возрастает интерес к растительному организму как целостной системе со всеми ее внутренними и внешними взаимосвязями. Поэтому в предлагаемый читателю учебник включена — глава Систе.мы регуляции и интеграции у растений , которая предшествует обсуждению механизмов, лежащих в основе различных сторон функциональной активности растений. Наряду с традиционными разделами (фотосинтез, дыхание, водный режим, минеральное питание и др.) в учебник введена глава по гетеротрофному способу питания растений, так как незеленые ткани и органы, а при отсутствии света клетки всех частей растения питаются гетеротрофно.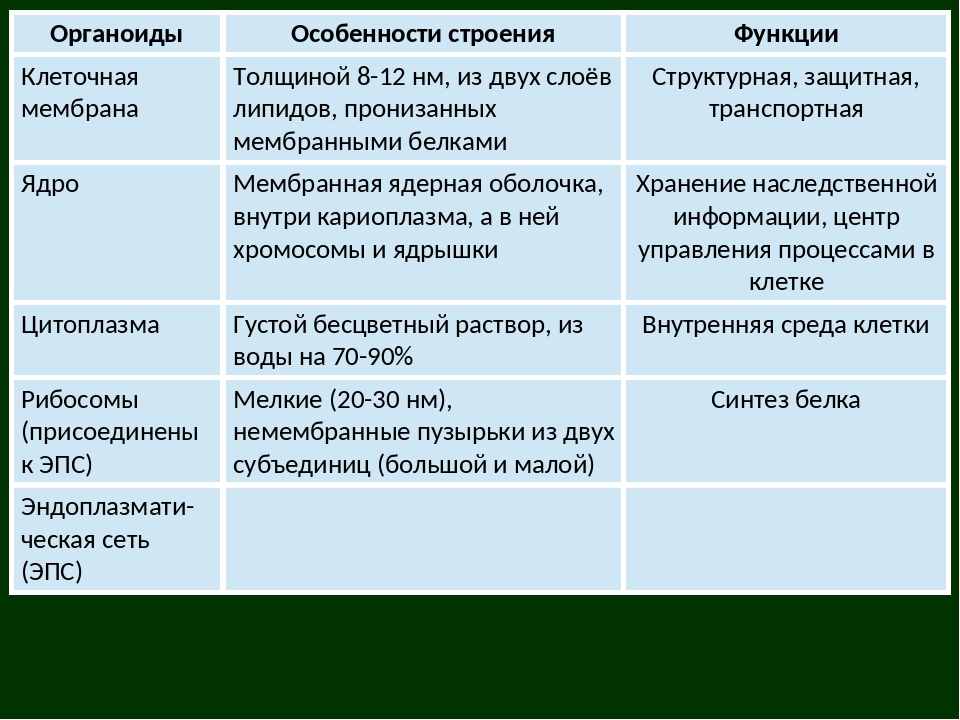 В отдельные главы выделены описания таких физиологических функций, как секреция, дальний транспорт веществ, половое и вегетативное размножение, движение. Рост и развитие растений рассматриваются на клеточном уровне (гл. 10) и на уровне целого организма (гл. 11 и 12). В этих процессах ведущую роль играет взаимодействие клеток между собой. [c.8]
В отдельные главы выделены описания таких физиологических функций, как секреция, дальний транспорт веществ, половое и вегетативное размножение, движение. Рост и развитие растений рассматриваются на клеточном уровне (гл. 10) и на уровне целого организма (гл. 11 и 12). В этих процессах ведущую роль играет взаимодействие клеток между собой. [c.8]
В состав цитоплазмы входят органоиды и включения. Органоиды цитоплазмы — эидоплаз-матическая сеть, митохондрии, комплекс Гольджи, рибосомы и пластиды (имеются только в растительных клетках). Это дифференцированные постоянно встречающиеся структурные образования клетки, они имеют характерное строение и выполняют определенные функции (рис. 1). [c.20]
Это утверждение можно проиллюстрировать на примере современных данных о природе структурных компонентов клетки. На основе электронно-микроскопических и биохимических данных о свойствах ядра, я дрышка, митохондрий, нитей веретена митоза, аппарата Гольджи и т. д. решительно невозможно судить о структуре органоидов клетки отдельно от их функции, т. е. здесь нацело стирается грань между проблемами морфологии и физиологии. [c.156]
д. решительно невозможно судить о структуре органоидов клетки отдельно от их функции, т. е. здесь нацело стирается грань между проблемами морфологии и физиологии. [c.156]
Хлорофилл в фотосинтетических органоидах клетки агрегирован. Большая часть его молекул выполняет функцию светосбор-щиков. Фотохимической активностью обладает только небольшая часть его молекул в агрегатах. [c.6]
Однако биологические молекулы не могли бы функциониро вать и жизнь в известных нам формах не существовала бы, если бы помимо сильных взаимодействий внутри биологических молекул и между ними не действовали бы невалентные, нехимические, слабые силы. Клетки п их органоиды — гетерогенные системы, существование и функционирование которых определяются межмолекулярными взаимодействиями невалентного характера. Исполнители почти всех молекулярных функций в клетках — белки — взаимодействуют с липидами и углеводами, с нуклеиновыми кислотами и с малыми молекулами. Взаимодействия эти преимущественно слабые, так как сильные взаимодействия создавали бы слишком жесткие и устойчивые структуры, лишенные молекулярной подвижности, необходимой для выполнения регуляцию химических реакции, компартментацию, установление градиентов концентрации.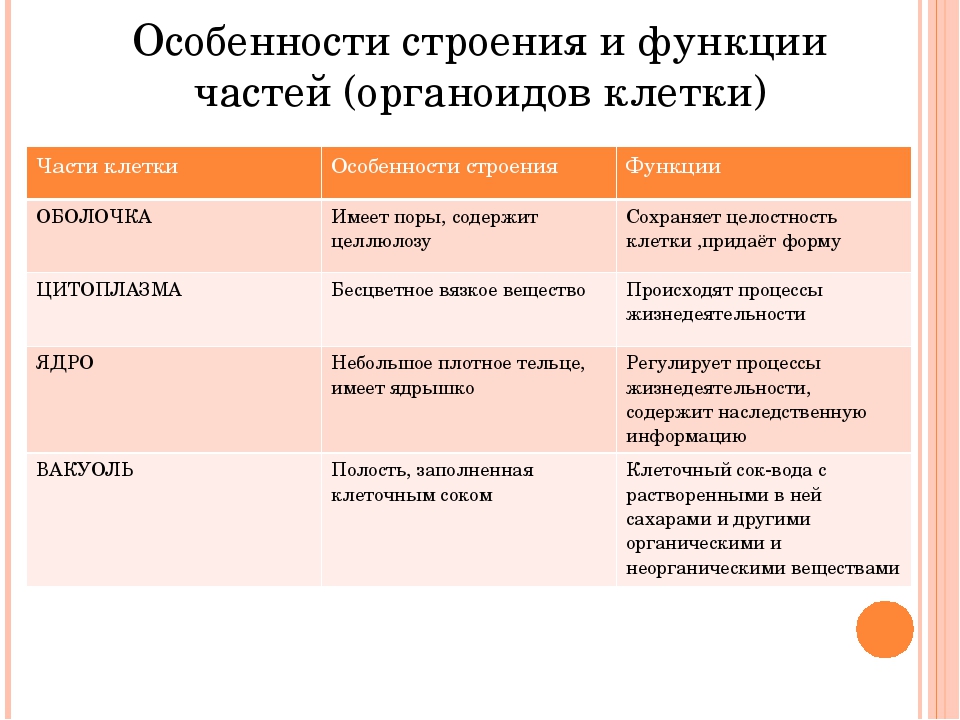 Перечислим виды сла-биологических системах и охарактеризуем их. [c.55]
Перечислим виды сла-биологических системах и охарактеризуем их. [c.55]
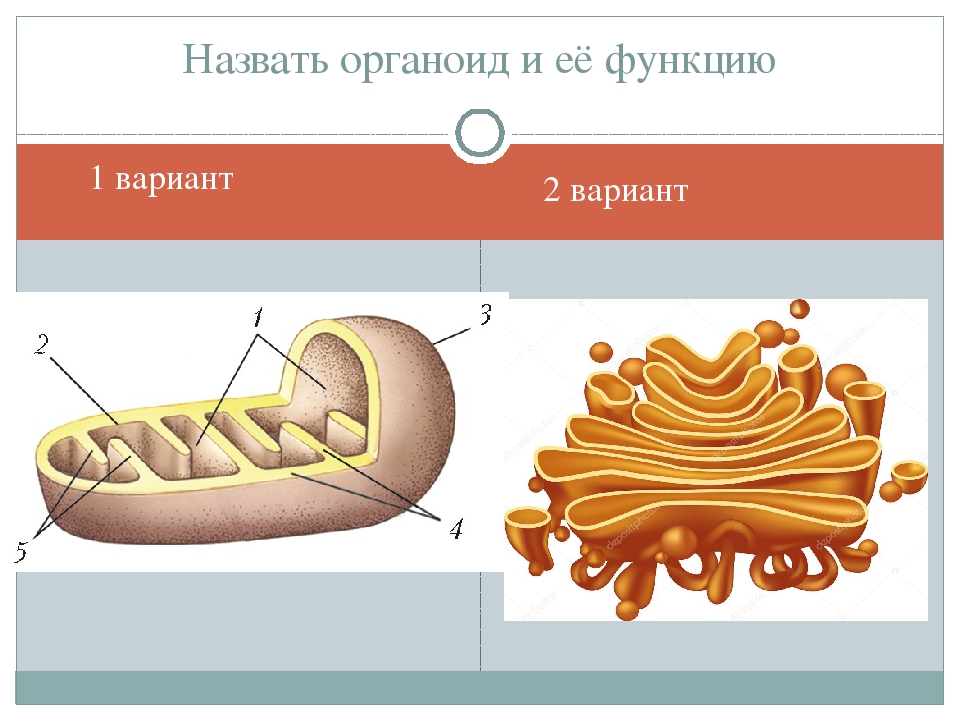
Митохондрии фигурируют во всех аэробных клетках животных и растений, за исключением некоторых примитивных бактерий, в которых функции митохондрий выполняет плазматическая мембрана. Число этих органоидов в клетке различно — от 20—24 в сперматозоидах до 500 ООО в клетке гигантской амебы haos haos. Число митохондрий характерно для клеток данного вида, по-видимому, прн митозе происходит деление митохондрий и их правильное расхождение в дочерние клетки. Во многих клетках митохондрии образуют непрерывную сеть — митохондриальный ретикулум. Форма, структура и размеры митохондрий также варьируют. Они всегда обладают системой внутренних мембран, именуемых кристами. На рис. 13.5 схематически изображена структура митохондрии кз печени крысы. Длина ее примерно [c.429]
Лизосомы (это собирательное понятие) представляют собой различные клеточные структуры и образования, выполняющие различные функции это пищеварительные гранулы, производные периферийных участков диктиосом, центральная вакуоль, где происходит расщепление удаляемых из клетки шлаков, вакуоли звездчатой формы, которые обволакивают (фагоцитируют) поврежденные органоиды цитоплазмы и переваривают их.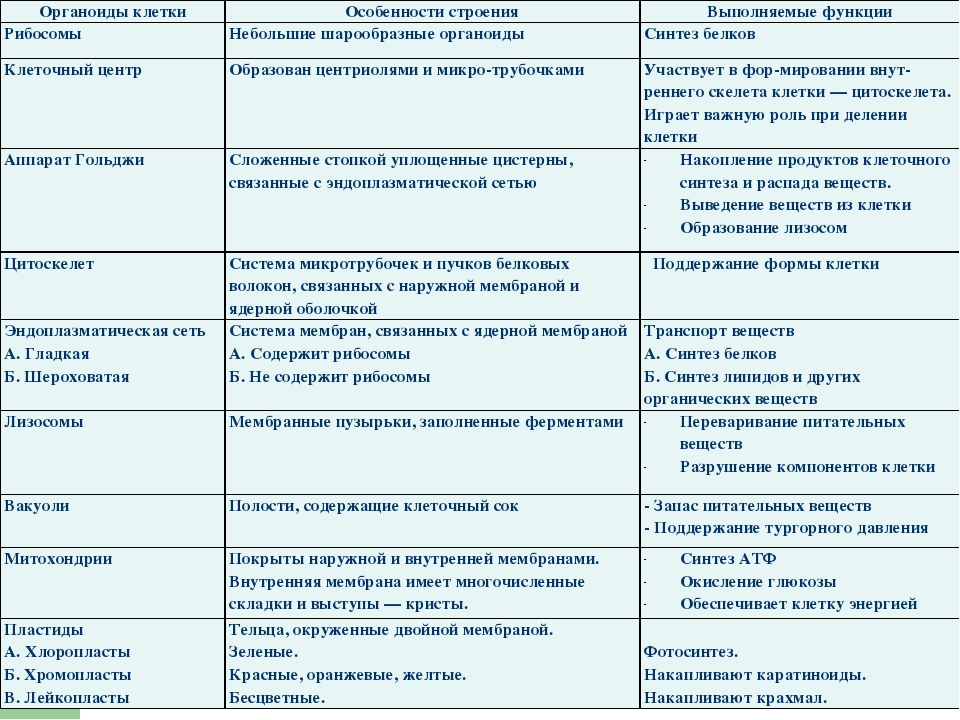 К лизосомам относят сегрегационные гранулы, которые образуются в клетках под действием какого-либо повреждающего фактора. Характерной особенностью всех лизосом является наличие в них протеолитических и лизирующих ферментных систем. [c.27]
К лизосомам относят сегрегационные гранулы, которые образуются в клетках под действием какого-либо повреждающего фактора. Характерной особенностью всех лизосом является наличие в них протеолитических и лизирующих ферментных систем. [c.27]
Изучение структуры и функции мембранного аппарата различных гетеротрофных бактерий убеждает нас в том, что вряд ли существует четкое разграничение функций между цитоплазматической мембраной и мезосомами ламеллярного и трубчато-везикулярного типа. Если бы существовала функциональная специализация мезосом и цитоплазматической мембраны, то при определенных воздействиях наблюдалось бы усиленное развитие или, наоборот, редукция мезосом вообще или мезосом какого-нибудь определенного типа, а этого на самом деле не происходит. По-видимому, мезосомы являются полифункциональным органоидом, и та или иная функция, выполняемая ими, может превалировать в зависимости от физиологического состояния бактериальной клетки в данный момент. Можно думать, что отдельные участки мембраны в мезосомах ответственны за различные звенья обмена бактериальной клетки. В пользу гетерогенности бактериальных мембран свидетельствует обнаруженный нами факт неодинакового отложения диформазана в различных участках цитоплазматической мембраны и мезосом (Торджян, Кац, 1969). [c.38]
В пользу гетерогенности бактериальных мембран свидетельствует обнаруженный нами факт неодинакового отложения диформазана в различных участках цитоплазматической мембраны и мезосом (Торджян, Кац, 1969). [c.38]
Значение белков в лсизиедеятельности клетки огромно. В 1938 г. голландский химик И. Мулдер назвал белки протеинами. Это слово в переводе означает первостепенно валяные. Белки — основной строительный материал всех органов и тканей растений, т. е. они выполняют структурную роль. В состав клеточных органоидов входят специфические белки, определяющие свойства и функции этих структур. [c.22]
Таким образом, пигментная система хлоропластов выполняет, разнообразные функции. Хлоропласты являются чувствительными органоидами растительной клетки. Они реагируют на действие многих факторов и могут служить индикаторами фи-зиолого-биохимического состояния клетки. [c.159]
Строение и функции органоидов клетки. | by Вячеслав Украинцев
Все клетки, будь то прокариотические или эукариотические, имеют некоторые общие черты. Эти общие черты:
Эти общие черты:
ДНК — генетический материал, содержащийся в одной или нескольких хромосомах и расположенный в немембранно связанной нуклеоидной области у прокариот и мембраносвязанное ядро у эукариот.
Плазменная мембрана — фосфолипидный бислой с белками, который отделяет клетку от окружающей среды и функционирует как селективный барьер для импорта и экспорта материалов.
Цитоплазма — остальная часть материала клетки в плазматической мембране, исключая нуклеоидную область или ядро, которая состоит из жидкой части, называемой цитозолем, и органелл и других взвешенных в ней частиц.
Рибосомы — органеллы, на которых происходит синтез белка.
Прокариотические клетки принципиально отличаются по своей внутренней организации от эукариотических клеток. Примечательно, что у прокариотических клеток отсутствует ядро и мембранные органеллы. Прокариотические клетки имеют следующие особенности:
1. Генетический материал (ДНК) локализован в области, называемой нуклеоидом, который не имеет окружающей мембраны.
Генетический материал (ДНК) локализован в области, называемой нуклеоидом, который не имеет окружающей мембраны.
2. Клетка содержит большое количество рибосом, которые используются для синтеза белка.
3. На периферии клетки находится плазматическая мембрана. У некоторых прокариот плазматическая мембрана складывается, образуя структуры, называемые мезосомами, функция которых не совсем понятна.
4. За пределами плазматической мембраны большинства прокариот находится довольно жесткая стенка, которая придает организму свою форму. Стенки бактерий состоят из пептидогликанов. Иногда бывает также наружная капсула. Обратите внимание, что клеточная стенка прокариот химически отличается от клеточной стенки эукариот растительных клеток и протистов.
5. У некоторых бактерий есть жгутики, которые используются для передвижения и / или пили, которые могут использоваться для тесного контакта двух клеток и, возможно, для облегчения передачи генетического материала.
Эукариотические клетки содержат мембраносвязанное ядро и многочисленные мембранно-заключенные органеллы (например, митохондрии, лизосомы, аппарат Гольджи), не обнаруженные у прокариот.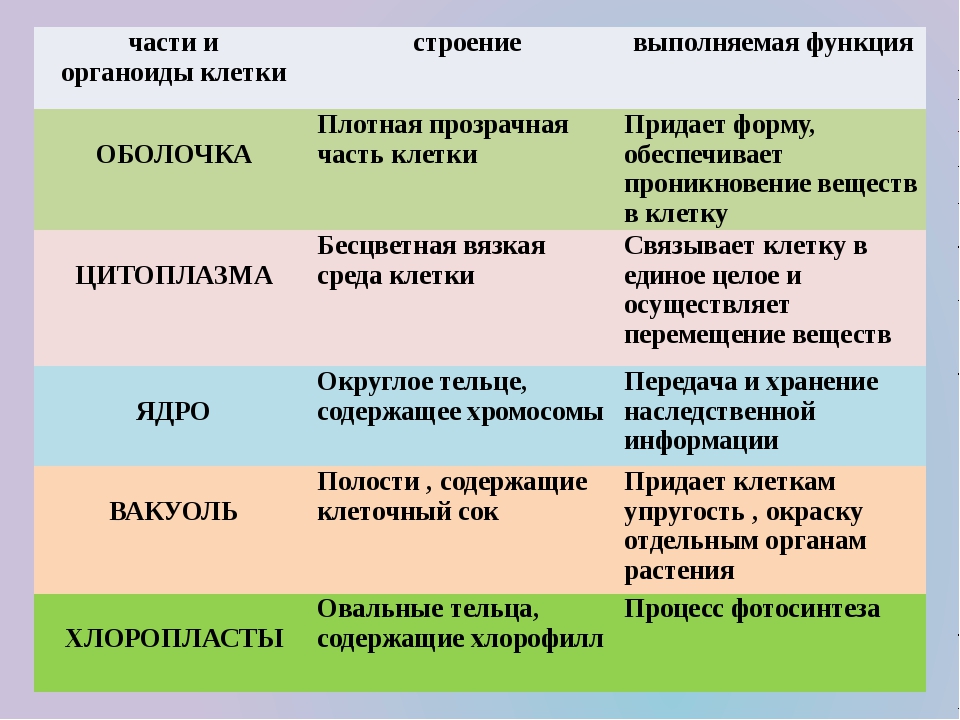 Животные, растения, грибы и протисты — все это эукариоты. Эукариотические клетки являются более сложными, чем прокариотические клетки, и встречаются в самых разных формах.
Животные, растения, грибы и протисты — все это эукариоты. Эукариотические клетки являются более сложными, чем прокариотические клетки, и встречаются в самых разных формах.
Ядро содержит большую часть генетического материала (ДНК) клетки. Дополнительная ДНК находится в митохондриях и (если присутствует) хлоропластах. Ядерная ДНК образует комплекс с белками с образованием хроматина, который организован в виде ряда линейных хромосом. Генетический контроль клетки осуществляется путем продуцирования РНК в ядре (процесс транскрипции) и последующего переноса этой РНК в рибосому в цитоплазме, где направлен синтез белка (процесс трансляции). Полученные белки выполняют клеточные функции. В ядре также находится ядрышко или ядрышки, органеллы, в которых собраны рибосомы. Ядро ограничено ядерной оболочкой, двойной мембраной, перфорированной порами и соединенной с грубой мембранной системой эндоплазматического ретикулума.
Цитоскелет состоит из микротрубочек, промежуточных волокон и микрофиламентов, которые вместе поддерживают форму клеток, закрепляют органеллы и вызывают движение клеток.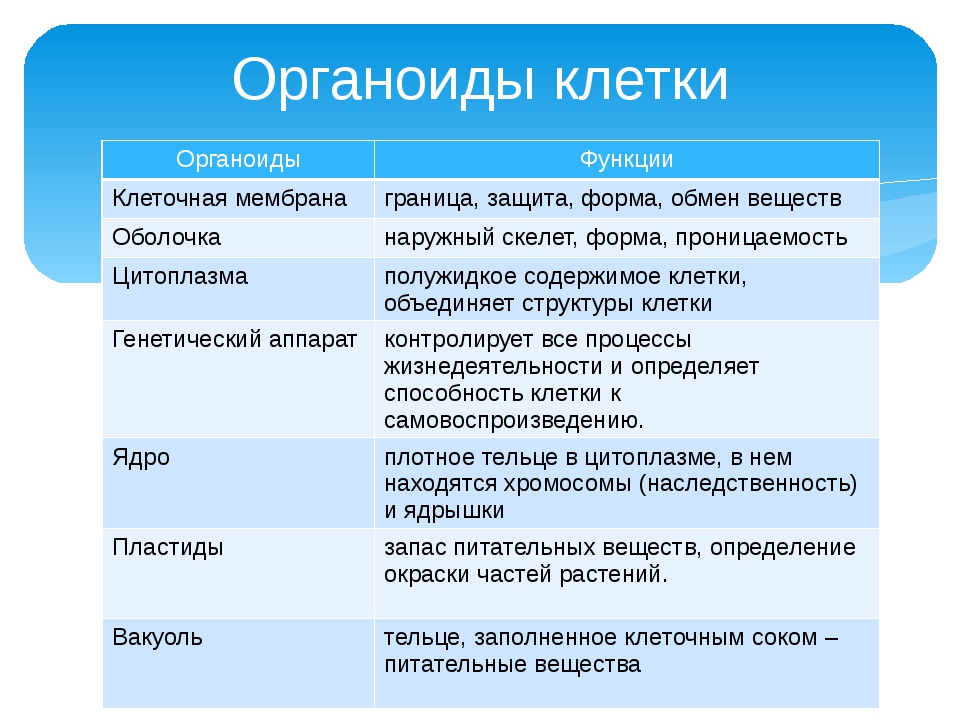 Микротрубочки и микрофиламенты часто собираются и разбираются в соответствии с потребностями клеток в движении и сохранении формы клеток. Промежуточные нити более постоянны, чем микротрубочки и микрофиламенты. Диаграммы клеток, показанные здесь, представляют кишечные эпителиальные клетки с пальцеобразными выступами, микроворсинками. Расположение и внешний вид цитоскелетных волокон в разных типах клеток будут различаться.
Микротрубочки и микрофиламенты часто собираются и разбираются в соответствии с потребностями клеток в движении и сохранении формы клеток. Промежуточные нити более постоянны, чем микротрубочки и микрофиламенты. Диаграммы клеток, показанные здесь, представляют кишечные эпителиальные клетки с пальцеобразными выступами, микроворсинками. Расположение и внешний вид цитоскелетных волокон в разных типах клеток будут различаться.
Рибосома — это место синтеза белка в клетке. Каждая рибосома состоит из большой субъединицы и небольшой субъединицы, каждая из которых содержит рРНК (рибосомную РНК) и рибосомные белки. При синтезе белка иРНК (информационная РНК) проходит через рибосому, а аминокислоты, присоединенные к тРНК (транспортная РНК), доставляются в рибосому. Аминокислоты соединяются, чтобы произвести белок.. Рибосомы существуют свободно в цитоплазме и связаны с эндоплазматическим ретикулумом (ER). Свободные рибосомы синтезируют белки, которые функционируют в цитозоле, в то время как связанные рибосомы создают белки, которые распределяются по мембранным системам, в том числе те, которые секретируются из клетки.
Плазматическая мембрана (также называемая клеточной мембраной) представляет собой фосфолипидный бислой со встроенными белками, который охватывает каждую живую клетку. Эта мембрана блокирует неконтролируемые движения растворимых в воде материалов внутрь или из клетки. Различные белки, содержащиеся в фосфолипидном бислое, проникают в бислой и проходят через него в трехмерном виде. Это белки мембраны, которые отвечают за конкретные функции плазматической мембраны. Эти функции включают в себя управление потоком питательных веществ и ионов в и из клеток, опосредование ответа клетки на внешние раздражители (процесс, называемый передачей сигнала) и взаимодействие с граничащими клетками. Все органеллы мембранных эукариотических клеток имеют общую особенность фосфолипидного бислоя, хотя белки различаются в каждом случае.
Митохондрии являются участниками клеточного дыхания, процесса, который генерирует АТФ из субстратов в реакциях с использованием кислорода. Все эукариотические клетки содержат митохондрии, часто много сотен на клетку. Каждая митохондрия имеет длину около 1-10 мкм. Митохондрии содержат ферменты и другие компоненты, необходимые для комплексов ферментов, которые катализируют дыхание. Основная функция митохондрий заключается в синтезе АТФ (аденозинтрифосфата) из АДФ (аденозиндифосфата) и Pi (неорганического фосфата).
Все эукариотические клетки содержат митохондрии, часто много сотен на клетку. Каждая митохондрия имеет длину около 1-10 мкм. Митохондрии содержат ферменты и другие компоненты, необходимые для комплексов ферментов, которые катализируют дыхание. Основная функция митохондрий заключается в синтезе АТФ (аденозинтрифосфата) из АДФ (аденозиндифосфата) и Pi (неорганического фосфата).
Митохондрии представляют собой крупные органеллы, содержащие ДНК и окруженные двойной мембраной. Внутренняя мембрана очень извитая, с глубокими складками, называемыми кристами. Мембраны делят митохондрию на два отсека: центральный матрикс и межмембранное пространство. ДНК в форме круглой или линейной молекулы находится в матрице. Митохондриальная ДНК кодирует многие из компонентов для митохондриальной функции, в то время как ядерная ДНК кодирует остальные компоненты. Компоненты механизма синтеза белка, специфичные для митохондрий — рибосомы, тРНК и специфические белки и ферменты — также находятся в матрице.
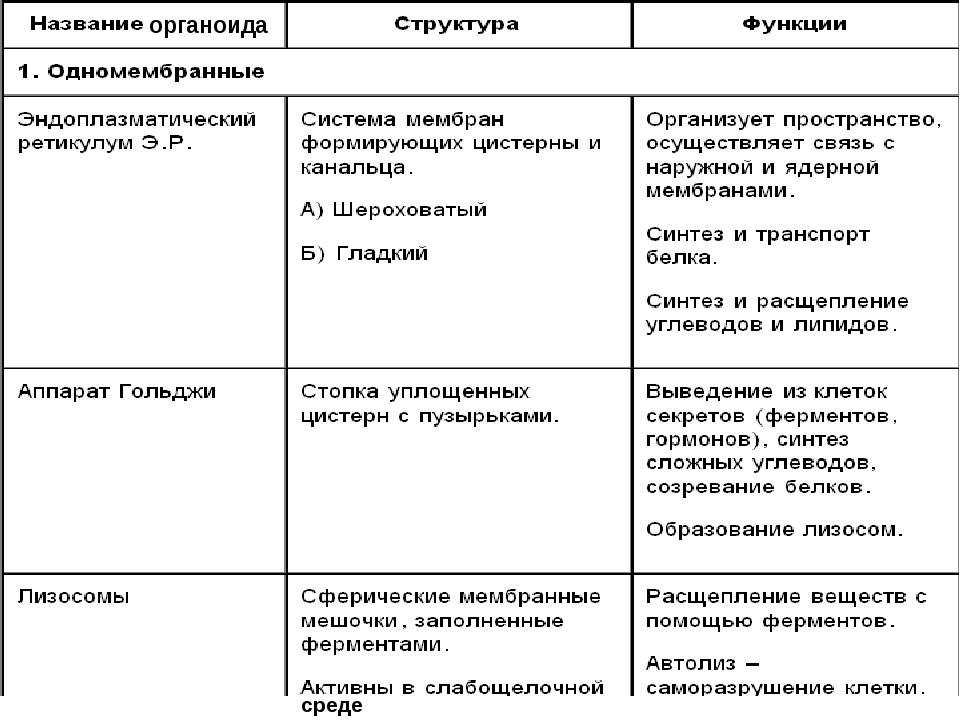
Все эукариотические клетки имеют внутри себя функционально взаимосвязанную мембранную систему, эндомембранную систему, которая состоит из ядерной оболочки, эндоплазматического ретикулума (ER), аппарата Гольджи, везикул и других полученных из них органелл (например, лизосом, пероксисом) и плазмы. мембрана. Многие материалы, в том числе некоторые белки, сортируются по функционально клеточным мембранам эндомембранной системы. Различные вовлеченные мембраны, хотя и взаимосвязаны, отличаются по структуре и функции.
мембрана. Многие материалы, в том числе некоторые белки, сортируются по функционально клеточным мембранам эндомембранной системы. Различные вовлеченные мембраны, хотя и взаимосвязаны, отличаются по структуре и функции.
Эндомембранная система играет очень важную роль в перемещении материалов вокруг клетки, особенно белков и мембран (последнее называется переносом мембран). Например, в то время как многие белки образуются на рибосомах, которые свободны в цитоплазме и остаются в цитоплазме, другие белки образуются на рибосомах, связанных с шероховатой эндоплазматической сетью (RER). Последние белки вставляются в просвет RER, к ним добавляются углеводы для получения гликопротеинов, а затем они перемещаются в цис-зону аппарата Гольджи в транспортных пузырьках, которые выходят из ER мембраны. Внутри Гольджи белок может быть модифицирован в дальнейшем, а затем отослан с транс-формы в новый транспортный пузырь. Эти везикулы перемещаются через цитоплазму к своим окончательным целям, используя цитоскелет. Мы можем думать о системе как о аналоге серии коммутационных станций и железнодорожных путей, где материалы сортируются по назначению на коммутационных станциях и отправляются в эти пункты назначения по определенным маршрутам в цитоскелете.
Мы можем думать о системе как о аналоге серии коммутационных станций и железнодорожных путей, где материалы сортируются по назначению на коммутационных станциях и отправляются в эти пункты назначения по определенным маршрутам в цитоскелете.
Белки, предназначенные для секреции, образуются на рибосомах, связанных с RER. Белки перемещаются через эндомембранную систему и отсылаются от трансфекта аппарата Гольджи в транспортные пузырьки, которые движутся через цитоплазму, а затем сливаются с плазматической мембраной, высвобождая белок наружу клетки. Примерами секреторных белков являются коллаген, инсулин и пищеварительные ферменты желудка и кишечника. (Аналогичным образом белки, предназначенные для конкретной клеточной органеллы, перемещаются к органелле в транспортных пузырьках, которые осаждают свое содержимое в органелле путем слияния мембран.)
Подобно секреторным белкам и некоторым другим белкам, белки, предназначенные для лизосом, образуются на рибосомах, связанных с RER, и проходят через эндомембранную систему. В этом случае лизосомальная белоксодержащая везикула, которая распускается через поверхность аппарата Гольджи, является самой лизосомой.
В этом случае лизосомальная белоксодержащая везикула, которая распускается через поверхность аппарата Гольджи, является самой лизосомой.
Хлоропласты — это органеллы растительных клеток, которые содержат хлорофилл и ферменты, необходимые для фотосинтеза, светозависимого синтеза углеводов из углекислого газа (CO2) и воды (h3O). Кислород (O2) является продуктом процесса фотосинтеза и выделяется в атмосферу. Хлоропласты представляют собой крупные органеллы, ограниченные двойной мембраной и содержащие ДНК. В отличие от митохондриальной двойной мембраны, внутренняя мембрана не складывается. От двойной мембраны отчетливо отделена внутренняя мембранная система, состоящая из сплющенных мешочков и называемых тилакоидами. Пространство между тилакоидом и наружными мембранами называется стромой. Строма содержит хлоропластную ДНК, а также компоненты механизма синтеза белка, специфичные для хлоропласта, а именно рибосомы, тРНК и специфические белки и ферменты. Большинство компонентов фотосинтеза находятся в тилакоидах. Тилакоидные мембраны организованы в стопки, называемые гранами. Внутренняя часть тилакоида — просвет.
Тилакоидные мембраны организованы в стопки, называемые гранами. Внутренняя часть тилакоида — просвет.
2.4 Строение клетки. Взаимосвязь строения и функций частей и органоидов клетки
Видеоурок: Клеточное строение организма
Лекция: Строение клетки. Взаимосвязь строения и функций частей и органоидов клетки — основа её целостности
Клетка является сложной многокомпонентной открытой системой, что значит – она имеет постоянную связь с внешней средой путем обмена энергии и веществ.
Органоиды клеток
Плазматическая мембрана — это двойной слой из фосфолипидов, пронизанный молекулами протеинов. На наружном слое располагаются гликолипиды и гликопротеины. Проницаема избирательно для жидкостей. Функции — защитная, а также связь и взаимодействие клеток меж собой.
Ядро. Функционально – хранит ДНК.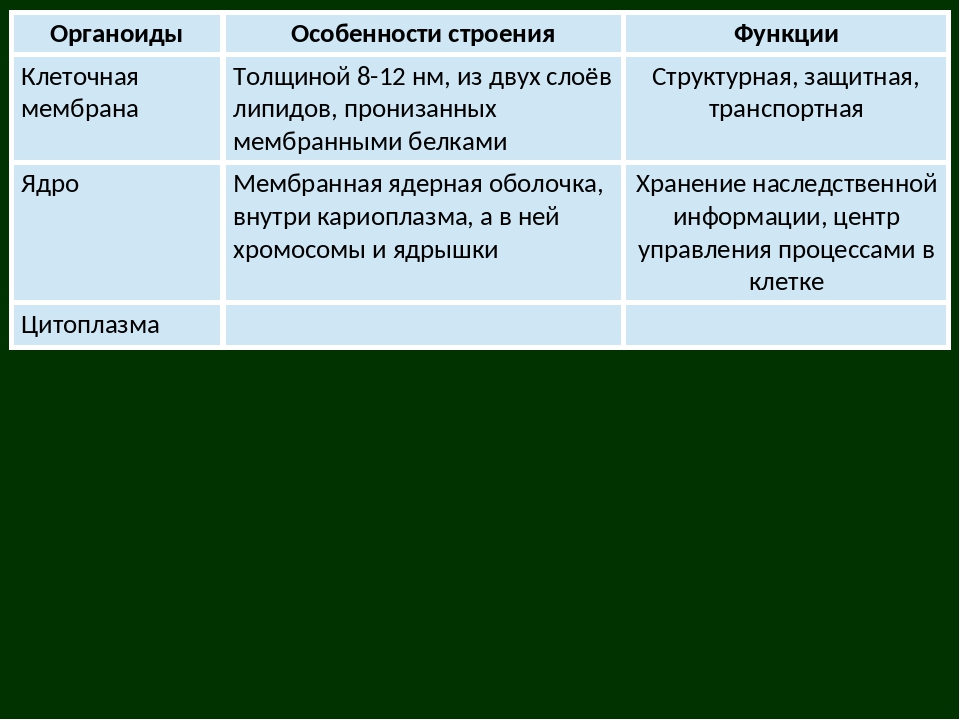 Ограничено двойной пористой мембраной, связанной через ЭПС с наружной мембраной клетки. Внутри ядра находится ядерный сок и располагаются хромосомы.
Ограничено двойной пористой мембраной, связанной через ЭПС с наружной мембраной клетки. Внутри ядра находится ядерный сок и располагаются хромосомы.
Цитоплазма. Представляет собой гелеобразное полужидкое внутреннее содержимое клетки. Функционально – обеспечивает связь органоидов между собой, является средой их существования.
Ядрышко. Это – собранные вместе части рибосом. Округлое, очень мелкое тело, расположенное в ядре. Функция – синтез рРНК.
Митохондрии. Двумембранный органоид. Внутренняя мембрана собрана в складки, называемые кристами, на них располагаются ферменты, участвующие в реакциях окислительного фосфорилирования, то есть синтеза АТФ, что и является основной функцией.
Рибосомы. Состоят из большей и меньшей субъединиц, не имеют мембран. Функционально – участвуют в сборке белковых молекул.
Эндоплазматический ретикулум (ЭПС). Одномембранная структура во всем объеме цитоплазмы, состоящая из полостей сложной геометрии. На гранулярной ЭПС расположены рибосомы, на гладкой – ферменты для синтеза жиров.
На гранулярной ЭПС расположены рибосомы, на гладкой – ферменты для синтеза жиров.
Аппарат Гольджи. Это уплощенные цистернообразные полости мембранной структуры. От них могут отделяться пузырьки с необходимыми для метаболизма веществами. Функции – накопление, преобразование, сортировка липидов и белков, образование лизосом.
Клеточный центр. Это область цитоплазмы, в которой содержатся центриоли – микротрубочки. Их функция – правильное распределение генетического материала при митозе, образование митотического веретена.
Лизосомы. Одномембранные пузырьки с ферментами, участвующие в переваривании макромолекул. Функционально – растворяют крупные молекулы, уничтожают старые структуры в клетке.
Клеточная стенка. Представляет собой плотную оболочку из целлюлозы, осуществляет скелетную функцию у растений.
Пластиды. Мембранные органоиды. Существует 3 вида – хлоропласты, где совершается фотосинтез, хромопласты, содержащие красящие вещества, и лейкопласты, являющиеся хранилищами крахмала.
Вакуоли. Пузырьки, которые в растительных клетках могут занимать до 90% объема клетки и содержать питательные вещества. У животных – вакуоли пищеварительные, сложной структуры, небольшого размера. Отвечают также за выделение ненужных веществ во внешнюю среду.
Микрофиламенты (микротрубочки). Белковые немембранные структуры, отвечающие за движение органоидов и цитоплазмы внутри клетки, появление жгутиков.
Компоненты клетки являются взаимосвязанными пространственно, химически и физически и находятся в постоянном взаимодействии между собой.
A Video Protocol of Retroviral Infection in Primary Intestinal Organoid Culture
Для достижения высокой эффективности трансдукции некоторые аспекты имеют решающее значение. Одним из них является предварительная обработка органоидов с ENRWntNic СМИ, пока они не примут круглую кистозный форму. Это увеличивает количество стволовых клеток и, тем самым, возможность получения стабильной интеграции трансгена, а также увеличение выживаемости по органоидам СИ в течение всей процедуры трансдукции. Другим параметром является время инкубации следующие spinoculation. Слишком короткие или слишком длинные Результаты инкубации в низкой эффективности трансдукции и плохого выживания органоидов, соответственно. Стадию spinoculation не является существенным, хотя это значительно увеличивает процент трансдуцированных органоидам. Наконец, вирус высокого титра является ключевым для успешного трансдукции. Это зависит от типа линии упаковка клеток и вируса. Сочетание Платина-E линии клеток и мышиного вируса стволовых клеток (MSCV), был найден, чтобы произвести титр достаточно высокую для трансдукции органоидов.
Это увеличивает количество стволовых клеток и, тем самым, возможность получения стабильной интеграции трансгена, а также увеличение выживаемости по органоидам СИ в течение всей процедуры трансдукции. Другим параметром является время инкубации следующие spinoculation. Слишком короткие или слишком длинные Результаты инкубации в низкой эффективности трансдукции и плохого выживания органоидов, соответственно. Стадию spinoculation не является существенным, хотя это значительно увеличивает процент трансдуцированных органоидам. Наконец, вирус высокого титра является ключевым для успешного трансдукции. Это зависит от типа линии упаковка клеток и вируса. Сочетание Платина-E линии клеток и мышиного вируса стволовых клеток (MSCV), был найден, чтобы произвести титр достаточно высокую для трансдукции органоидов.
 Смесь из пула PEI-ДНК находится в диапазоне от 20-30 мин. выживание органоидам при трансдукции, сильно зависит от размера фрагмента. Слишком долго трипсинизации вызывает большинство фрагментов, состоит из менее 3 клеток и тем самым уменьшает Органоид живучесть. Другим фактором является деятельность Wnt кондиционированной среды, если деятельность слишком низко повышения его через добавлением CHIR99021 в рабочей концентрации 5 мкМ может увеличить выживаемость. CHIR99021 ингибирует GSK3, что приводит к увеличению Wnt сигнализации. Кроме того, Y-27362, который предотвращает anoikis добавляется к трансдукции средств массовой информации, чтобы улучшить выживаемость Органоид, так как нарушается органоиды фрагментов, содержащих (1-10 клеток) до трансдукции. Как60; упомянуто выше, время инкубации, после spinoculation не должна превышать 6 часов. Наконец, если наблюдается плохое трансдукция вышеупомянутые факторы, влияющие на титр вируса и предельный размер вставки для ретровирусов вектора должны быть рассмотрены.
Смесь из пула PEI-ДНК находится в диапазоне от 20-30 мин. выживание органоидам при трансдукции, сильно зависит от размера фрагмента. Слишком долго трипсинизации вызывает большинство фрагментов, состоит из менее 3 клеток и тем самым уменьшает Органоид живучесть. Другим фактором является деятельность Wnt кондиционированной среды, если деятельность слишком низко повышения его через добавлением CHIR99021 в рабочей концентрации 5 мкМ может увеличить выживаемость. CHIR99021 ингибирует GSK3, что приводит к увеличению Wnt сигнализации. Кроме того, Y-27362, который предотвращает anoikis добавляется к трансдукции средств массовой информации, чтобы улучшить выживаемость Органоид, так как нарушается органоиды фрагментов, содержащих (1-10 клеток) до трансдукции. Как60; упомянуто выше, время инкубации, после spinoculation не должна превышать 6 часов. Наконец, если наблюдается плохое трансдукция вышеупомянутые факторы, влияющие на титр вируса и предельный размер вставки для ретровирусов вектора должны быть рассмотрены.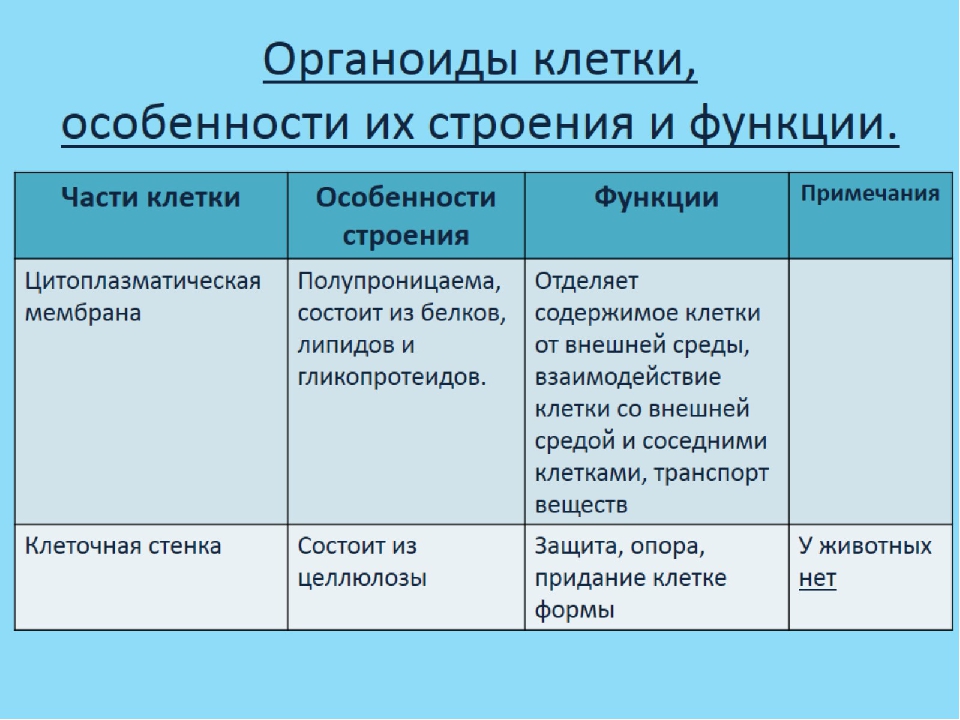 Эффективность нокдауна в значительной степени зависит от миРНК. Поскольку эффективность зависит от комбинации гена-мишени и микроРНК стоит выполнении экрана эффективности, чтобы определить те, которые работают лучше.
Эффективность нокдауна в значительной степени зависит от миРНК. Поскольку эффективность зависит от комбинации гена-мишени и микроРНК стоит выполнении экрана эффективности, чтобы определить те, которые работают лучше.Методика ограничивается эпителиальных явлений Органоид системы. В будущем можно было бы изучать инфекционные или иммунные-опосредованных заболеваний через со-культуры патогенов или восстановления с компонентов, получаемых от иммунной системы, соответственно. Кроме того, ретровирусы могут нести только вставки относительно небольшого размера. Следовательно, должны быть исключены природные регуляторные области и, следовательно, экспрессии трансгена не может имитировать, что изэндогенный ген. Как упоминалось выше, нокдаун эффективность зависит от гена-мишени и миРНК. Если нет микроРНК с подходящей эффективности бросовой не может быть установлено, может быть ограничить использование техники для этого конкретного гена-мишени.
Теоретически, органоиды совместимы со всеми стандартных манипуляционных методов, используемых для клеточных линий.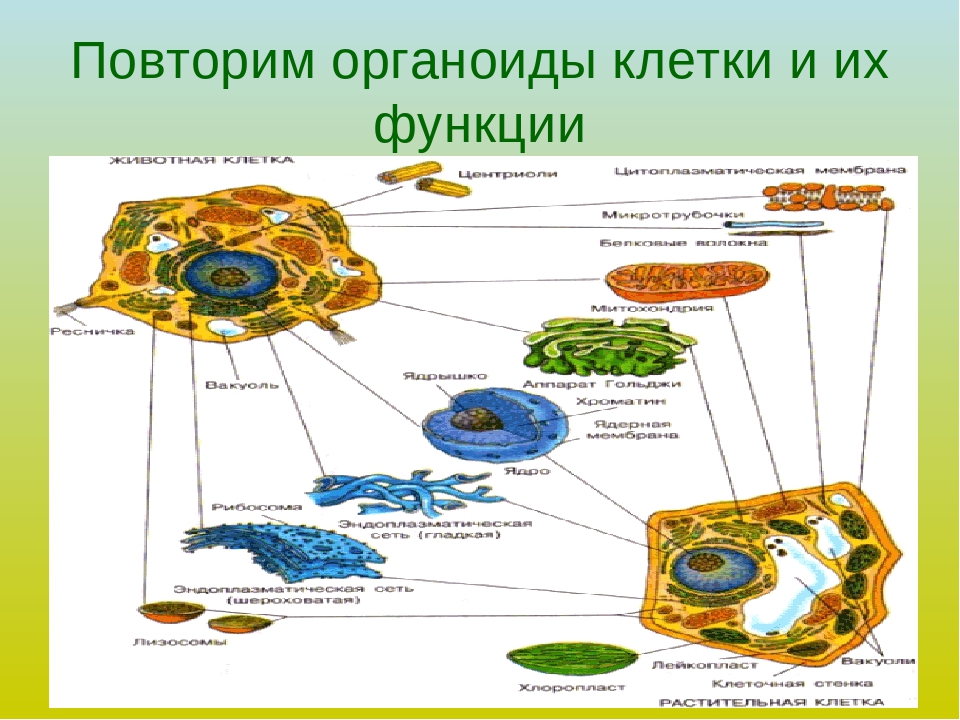 Ретровирусная трансдукции был первый метод, который будет сообщили 4, а в последнее время BAC (бактериальная искусственная хромосома) -transgenesis стал доступен 5. С общим временем генерации 2-3 недель, после трансфекции вирусной плазмиды в упаковочной клеточной линии, то есть значительно быстрее, чем генерации трансгенных (Tg) мыши. Поддерживая в естественных условиях склеп-ворсинок архитектуры в то время как содержащий стволовые клетки, а также все дифференцированные клеточных клонов кишечного эпителия, Органоид система культуры устраняет разрыв между тг животного и ранее используемого клеточной культуре.
Ретровирусная трансдукции был первый метод, который будет сообщили 4, а в последнее время BAC (бактериальная искусственная хромосома) -transgenesis стал доступен 5. С общим временем генерации 2-3 недель, после трансфекции вирусной плазмиды в упаковочной клеточной линии, то есть значительно быстрее, чем генерации трансгенных (Tg) мыши. Поддерживая в естественных условиях склеп-ворсинок архитектуры в то время как содержащий стволовые клетки, а также все дифференцированные клеточных клонов кишечного эпителия, Органоид система культуры устраняет разрыв между тг животного и ранее используемого клеточной культуре.
в пробирке через амплитудно и убыточных функциональных исследований. Это делает возможным для решения физиологически соответствующие вопросы во взрослой биологии стволовых клеток, с минимальной потребностью ТГ мышей. Например, поколение условных мышей с можно было бы избежать с помощью органоиды, полученные из новорожденных мутантов с перинатальной летальности 6. Кроме того, метод может быть применен для органоидов, полученных из ранее установленных мышей с изучать роль паралогов путем дополнительной нокдаун 7,8.
Кроме того, метод может быть применен для органоидов, полученных из ранее установленных мышей с изучать роль паралогов путем дополнительной нокдаун 7,8.
После создания тонкого кишечника органоидов, адаптация оригинального протокола культуры позволило культивирование поджелудочной, печени, толстой кишки и желудка эпителия 9-11. Кроме того, кишечные органоиды человека и опухолевые органоиды были получены из нормальных человеческих биопсии, первичный АденOMA и колоректальный рак биопсии 10. Протокол вирусная инфекция может быть легко расширена на эти типы органоидов и обеспечивает беспрецедентный способ выполнения функциональных исследований в человека происходит тканей.
Взятые вместе, ретровирусная трансдукция тонкого кишечника органоидов является ценным ресурсом для исследования технического обслуживания стволовых клеток, дифференцировку и клеточных судеб решение, а также клеточной сигнализации и клеточно- клеточных взаимодействий.
В лаборатории вырастили мини-мозг с глазами
Команда ученых из нескольких немецких университетов вырастила органоид мозга – мини-версию мозга. Органоид затем сам «сконструировал» зрительные пузырьки, из которых развились клетки тканей глаза. Статью об этом исследователи опубликовали в научном журнале Cell Stem Cell.
Органоид затем сам «сконструировал» зрительные пузырьки, из которых развились клетки тканей глаза. Статью об этом исследователи опубликовали в научном журнале Cell Stem Cell.
Напомним, органоидом называют миниатюризированный и упрощенный вариант органа, выращенный в пробирке в трехмерном виде. Органоиды выращивают из стволовых клеток, которые обладают способностью превращаться в клетки разных тканей и органов.
Для создания органоидов мозга исследователи использовали индуцированные плюрипотентные стволовые клетки. Чтобы их получить, клетки кожи взрослых доноров с помощью «перепрограммирования» генов превращают в стволовые плюрипотентные – то есть те, из которых можно вырастить клетки любого органа.
К примеру, для выращивания мини-мозга плюрипотентные стволовые клетки помещают в культуру, которая имитирует среду развивающегося мозга. Конечным результатом является трехмерная модель мозга размером с горошину, которую можно использовать для изучения развития мозга, его болезней или воздействия лекарств на него.
Органоиды мозга немецкие исследователи вырастили из индуцированных плюрипотентных стволовых клеток от четырех доноров. Таким образом удалось получить 314 органоидов мозга.
Около 72 процентов органоидов мозга образовали зрительные пузырьки – выступающие из переднего мозга эмбриона мешочки, из которых впоследствии развиваются глаза. Эти структуры начали появляться через 30 дней жизни мини-мозга и созревали в течение 60 дней. Они росли симметрично, парой, как в настоящем мозге эмбриона.
Но самое главное, эти зрительные пузырьки имели функции настоящего глаза. Они содержали разнообразные типы клеток сетчатки, которые формировали нейронные сети, реагировали на свет и посылали эти сигналы в мозг. В зрительных пузырьках органоида мозга формировалась также ткань хрусталика и роговицы.
Эти глазоподобные структуры в органоидах мозга исследователи назвали в своей научной статье органоидами глаза.
«Наша работа подчеркивает замечательную способность органоидов мозга генерировать примитивные сенсорные структуры, которые являются светочувствительными и содержат типы клеток, подобные тем, которые находятся в организме, – говорит Джей Гопалакришнан (Jay Gopalakrishnan) из Университета Дюссельдорфа, ведущий автор исследования.
– Эти органоиды могут помочь изучить взаимодействие мозга и глаза во время эмбрионального развития, моделировать врожденные нарушения устройства сетчатки и генерировать специфические для пациента типы клеток сетчатки для персонализированного тестирования лекарств и трансплантационной терапии».
Правда, на пути реализации это прекрасного сценария стоит важное препятствие. Исследования органоидов мозга имеют свои этические ограничения. Пока выращенные в пробирке образцы мини-мозга остаются очень примитивными, считается, что они не обладают каким бы то ни было сознанием. Но если ученые создадут более совершенную структуру, близкую к настоящему человеческому мозгу, вполне возможно, что органоиды будут обладать какими-то формами сознания.
Так, предыдущие исследования уже обнаруживали мозговые волны внутри двухмесячных органоидов, и они оказались примерно эквивалентными таковым у недоношенных детей.
Сенсорная информация, такая как зрение, может быть ключевым компонентом сознания мозга, выращенного в пробирке.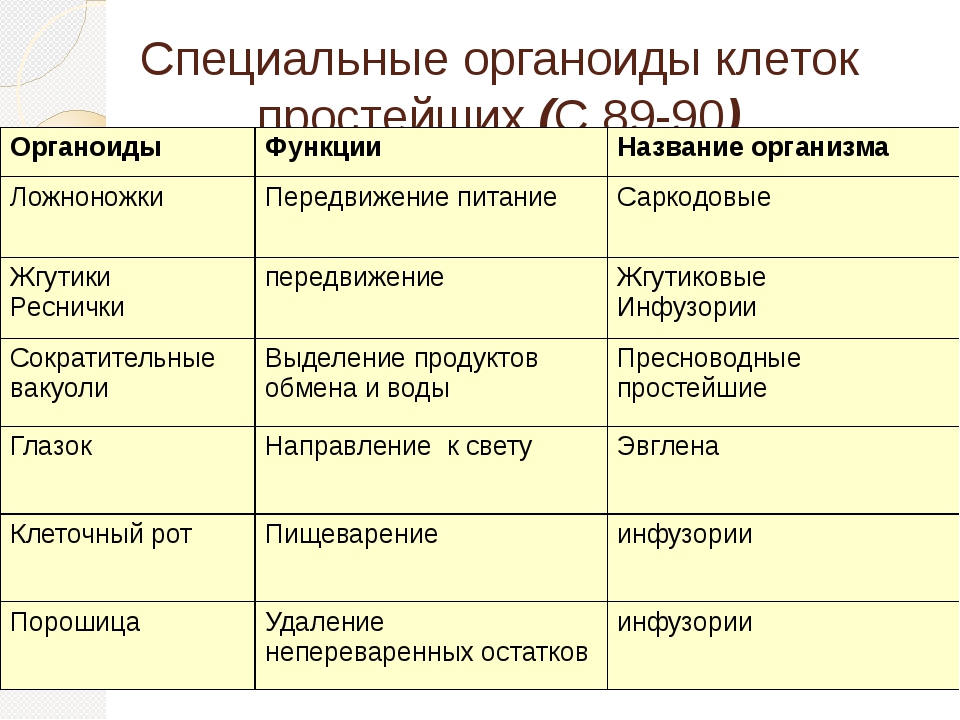 Это проблема, которая выходит за пределы просто научного знания.
Это проблема, которая выходит за пределы просто научного знания.
Добавим, что ранее мы писали, как из стволовых клеток ученые впервые получили мышиный эмбрион с бьющимся сердцем и как здоровые стволовые клетки удалось вырастить «на бумаге». А еще мы рассказывали о том, как стволовые клетки вернули людям подвижность.
Больше интересных новостей науки и медицины вы найдёте в разделе «Наука» и «Медицина» на медиаплатформе «Смотрим».
А1. Строение и функции органоидов клетки изучает наука: генетика,
А1. Строение и функции органоидов клеточки изучает наука:
генетика,
цитология,
селекция,
систематика.
А2. Укажите одно из положений клеточной теории
1) соматические клетки содержат диплоидный набор хромосом
2) гаметы состоят из одной клеточки
3) клетка прокариот содержит кольцевую ДНК
4) клетка меньшая единица строения и жизнедеятельности организмов
А3. Размен веществ меж клеточкой и окружающей средой регулируется:
Размен веществ меж клеточкой и окружающей средой регулируется:
плазматической мембраной,
эндоплазматической сетью,
ядерной оболочкой,
цитоплазмой.
А4. Значение митоза состоит в увеличении числа
хромосом в половых клеточках
молекул ДНК в дочерних клеточках
хромосом в соматических клеточках
клеток с комплектом хромосом, равным материнской клеточке
А5. Какие формы жизни занимают промежуточное положение меж телами живой и неживой природы?
вирусы
бактерии
лишайники
грибы
А6. Бесполым методом нередко плодятся:
земноводные
кишечнополостные
насекомые
ракообразные
А7. 2-ой закон Г. Менделя называется законом
1) расщепления
2) единообразия
3) сцепленного наследования
4) самостоятельного наследования
А8. Тип наследования признака в ряду поколений изучает способ:
близнецовый
генеалогический
цитологический
популяционный
А9. У детей развивается рахит при изъяне:
У детей развивается рахит при изъяне:
марганца и железа
кальция и фосфора
меди и цинка
серы и азота
А10. Появление у отпрысков признаков, хороших от родительских, происходит в итоге:
бесполого размножения
партеногенеза
почкования
полового размножения
А11. Оболочка грибной клетки, в отличие от растительной, состоит из
клетчатки
хитиноподобного вещества
сократительных белков
липидов.
А12. Чем отличается растительная клетка от животной клеточки?
1) комплексом Гольджи
2) вакуолями с клеточным соком
3) митохондриями
4) эндоплазматической сетью
А13. Рибонуклеиновые кислоты в клеточке участвуют в
1) регуляции размена веществ
2) образовании углеводов
3) хранении потомственной инфы
4) биосинтезе белка
А14. В процессе энергетического размена в клеточке идет
1) образование органических веществ
2) расходование АТФ
3) синтез неорганических веществ
4) расщепление органических веществ
Задать свой вопросОрганоиды: новое окно в болезни, разработки и открытия
Ученые нашли способы культивирования органоспецифической ткани из стволовых клеток, которые могут изменить подход к изучению и лечению заболеваний.

Хавьер Барбузано
Представьте себе возможность создания индивидуализированных сложных коллекций клеток, которые имеют сходство с собственными тканями пациента. Эта технология — способность выращивать «органоиды» — становится реальностью и каждый день находит новые применения, отчасти благодаря работе ученых из Гарвардского института стволовых клеток.
Органоиды — это крошечные самоорганизующиеся трехмерные культуры тканей, полученные из стволовых клеток. Такие культуры могут быть созданы для воспроизведения большей части сложного органа или для экспрессии отдельных его аспектов, таких как производство только определенных типов клеток.
Органоиды вырастают из стволовых клеток — клеток, которые могут неограниченно делиться и производить различные типы клеток как часть своего потомства. Ученые научились создавать подходящую среду для стволовых клеток, чтобы они могли следовать своим собственным генетическим инструкциям для самоорганизации, образуя крошечные структуры, напоминающие миниатюрные органы, состоящие из многих типов клеток. Размер органоидов может варьироваться от менее ширины волоса до пяти миллиметров.
Размер органоидов может варьироваться от менее ширины волоса до пяти миллиметров.
Потенциально существует столько типов органоидов, сколько различных тканей и органов в организме. На сегодняшний день исследователи смогли создать органоиды, напоминающие мозг, почки, легкие, кишечник, желудок и печень, и многие другие находятся в процессе разработки.
Этот способ культивирования тканей даст ученым подробное представление о том, как формируются и растут органы, даст им новое представление о развитии человека и болезнях, а также даст им возможность увидеть, как лекарства взаимодействуют с этими «мини-органами», потенциально революционизируя области открытия лекарств и открытия новых подходов к персонализированной медицине.
Некоторые из этих применений освещены ниже в работе четырех лабораторий ИСКЧ.
Понимание себя и моделирование болезни
Большая часть того, что мы знаем об эмбриональном развитии, была получена путем экстраполяции на человеческую биологию того, что наблюдается у мышей и других моделей животных. Теперь, благодаря органоидам, у исследователей есть возможность культивировать крошечные версии каждой ткани, используя человеческие клетки.
Теперь, благодаря органоидам, у исследователей есть возможность культивировать крошечные версии каждой ткани, используя человеческие клетки.
В случае с человеческим мозгом эта технология открывает окно для наблюдения за некоторыми из самых неуловимых аспектов нашей собственной биологии.Это становится особенно важным при попытке изучить сложные, присущие человеку характеристики или болезни. «Некоторые из наиболее известных нейропсихиатрических заболеваний или заболеваний нервной системы нашего времени, такие как шизофрения или расстройство аутистического спектра, являются уникальными человеческими заболеваниями, которые затрагивают весь человеческий геном», — объясняет исследователь ИСКЧ Паола Арлотта, доктор философии.
Лаборатория Арлотты разработала протоколы, которые позволяют органоидам расти в течение длительных периодов времени, достигая большей сложности и зрелости, чем раньше.Эти органоиды содержат тысячи клеток и несколько типов клеток мозга, которые сложным образом взаимодействуют друг с другом, что делает их отличными моделями для изучения того, как нейропсихиатрические патологии или патологии развития нервной системы влияют на то, как клетки мозга общаются друг с другом.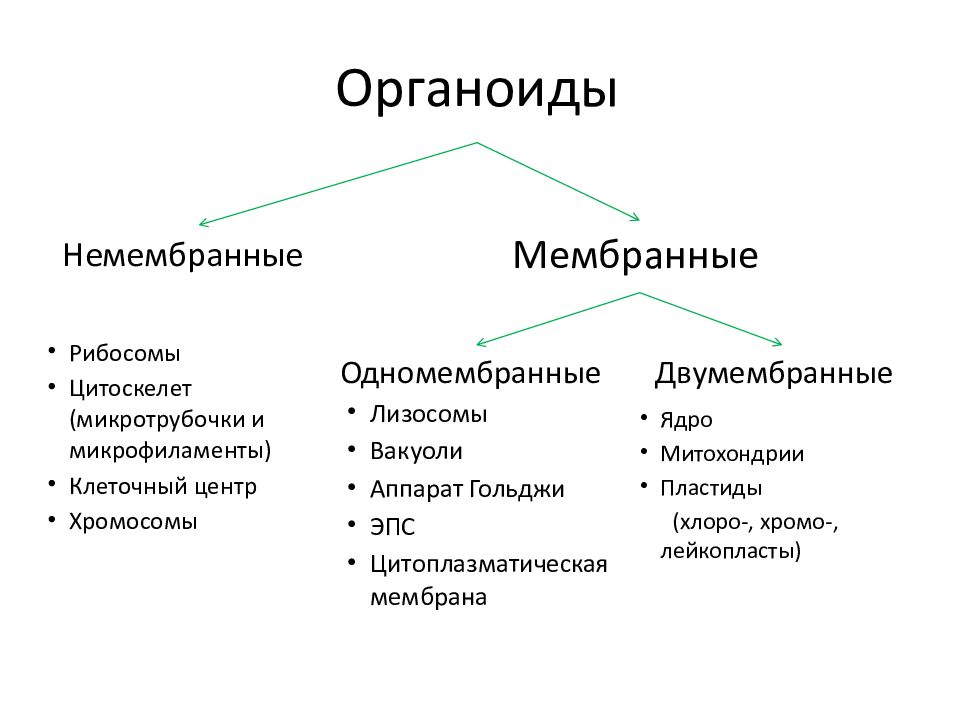
Исследователи уже смогли использовать органоиды, полученные от пациентов с аутизмом, для выявления аномалий в регуляции генов, участвующих в пролиферации клеток. Другие исследователи использовали органоиды, чтобы наблюдать, как вирус Зика ассоциируется с микроцефалией во время раннего развития эмбриона, когда он препятствует нормальному развитию мозга, вызывая преждевременную дифференцировку клеток, продуцирующих нейроны.А другие смотрят на то, как эти органоиды, как «нормальные», так и «больные», реагируют на определенные раздражители.
Органоиды мозга также помогут понять, как мозг формируется на ранних стадиях развития, что изучается уже более века и до сих пор ставит ученых в тупик. «Настоящая цель прямо сейчас — использовать органоиды в качестве моделей болезней, но я предсказываю, что по пути мы многое узнаем о том, как формируется мозг», — сказал Арлотта.
Изучение болезней стволовых клеток и персонализированная медицина
Стволовые клетки имеют большие перспективы в качестве терапевтических инструментов благодаря их неограниченной способности делиться и регенерировать ткани.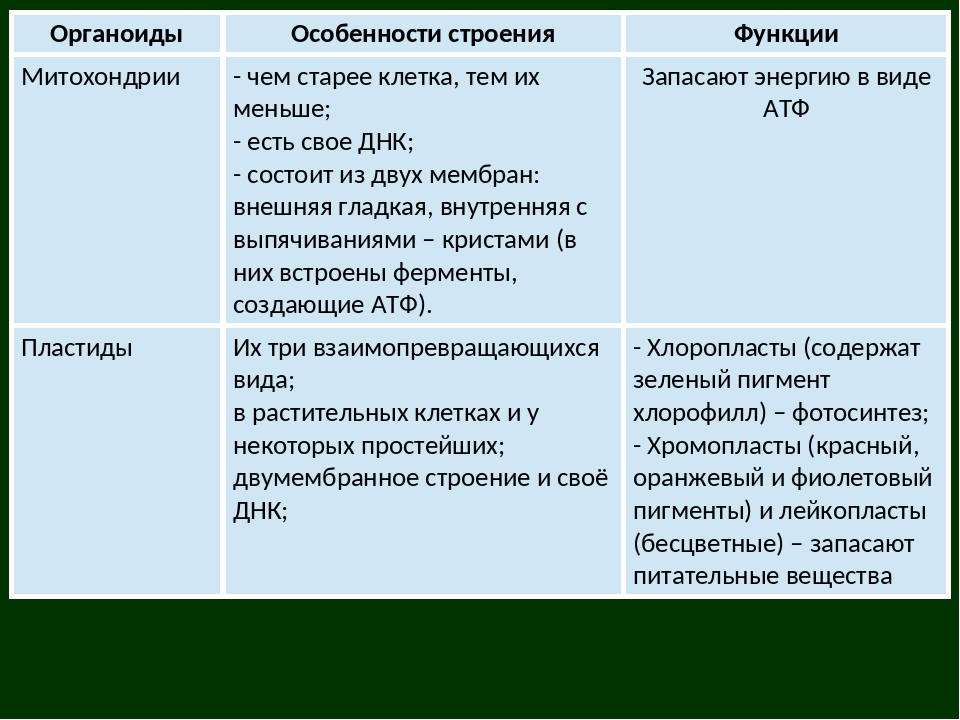 Но исследователи также понимают, что многие заболевания могут быть вызваны аномалиями в самих стволовых клетках или в том, как другие клетки взаимодействуют с ними.
Но исследователи также понимают, что многие заболевания могут быть вызваны аномалиями в самих стволовых клетках или в том, как другие клетки взаимодействуют с ними.
Такие исследователи, как Карла Ким, доктор философии, используют органоиды, чтобы определить роль стволовых клеток в регенерации, поддержании и функционировании тканей, а также понять, как эти клетки взаимодействуют друг с другом.
Ким и ее группа были первыми учеными, которые вырастили органоиды легких, имитирующие две отдельные части легкого: дыхательные пути и альвеолярные мешочки, где происходит газообмен.Они сделали это с помощью специальной установки для культивирования, которая позволяла клеткам контактировать как с воздухом, так и с жидкостью, имитируя среду легких. Их культура также включала вспомогательные клетки, полученные из кровеносных сосудов, для стимуляции роста стволовых клеток.
«Мы хотим знать, как стволовая клетка узнает, какой тип специализированных клеток она должна производить», — сказал Ким.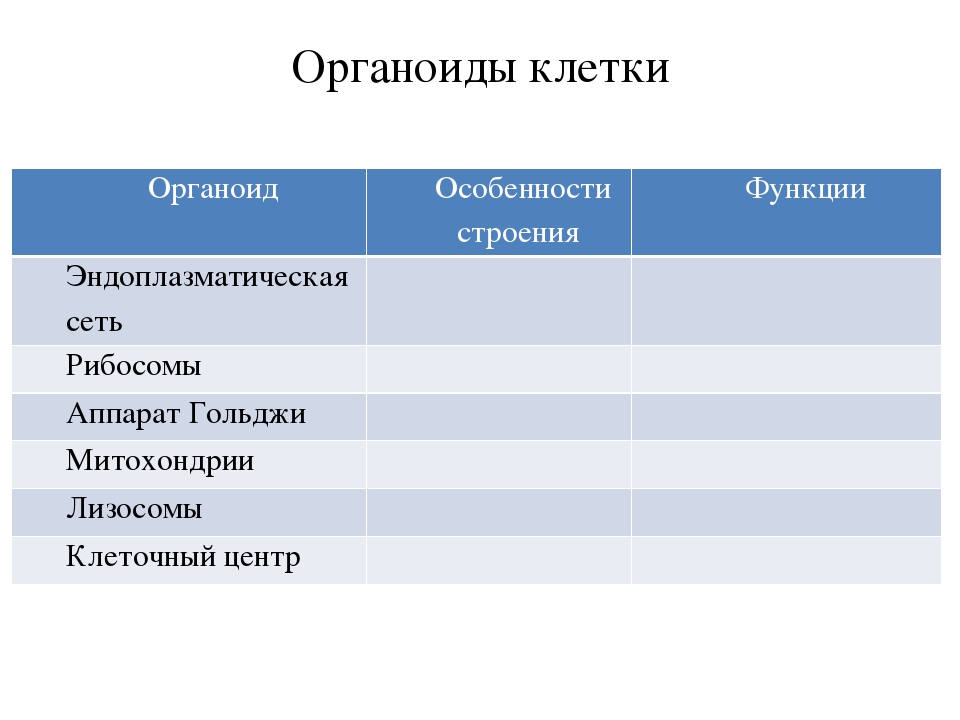 Органоиды помогают ответить на этот вопрос. «Мы спрашиваем, какие факторы и соединения должны присутствовать, чтобы сообщить стволовым клеткам, что им нужно для роста.”
Органоиды помогают ответить на этот вопрос. «Мы спрашиваем, какие факторы и соединения должны присутствовать, чтобы сообщить стволовым клеткам, что им нужно для роста.”
Ким использует аналогичный подход для изучения обратной стороны этого вопроса: что происходит при заболеваниях, когда стволовые клетки либо не справляются со своей задачей, либо создают дефектные клетки?
«Многие болезни легких кажутся нам неисправностью стволовых клеток, когда они не в состоянии восстанавливать повреждения», — сказал Ким. «Долгое время считалось, что такие заболевания, как эмфизема, могут быть вызваны дефектами стволовых клеток, но проверить эту идею не представлялось возможным. Теперь мы можем создавать органоиды из больных клеток и проводить эксперименты, чтобы выяснить, являются ли стволовые клетки или разговаривающие с ними вспомогательные клетки причиной заболевания легких.Если мы сможем понять, что идет не так на уровне стволовых клеток, может появиться совершенно новый тип клеток, который может стать мишенью для лекарств».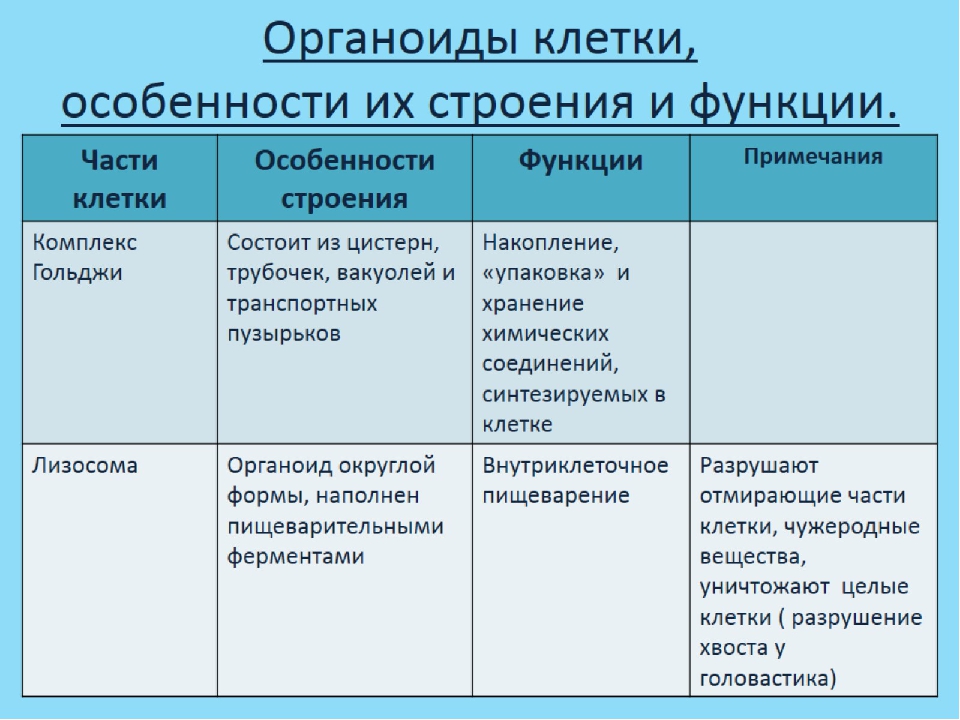
Органоиды также можно использовать для непосредственного скрининга лекарств, которые могут способствовать образованию специализированного типа клеток. Это может помочь найти методы лечения таких заболеваний, как кистозный фиброз, при котором реснитчатые клетки, которые обычно удаляют слизь из легких, не работают должным образом.
«Мы можем создавать органоиды с реснитчатыми клетками, полученными от пациентов, а затем тестировать их на наличие лекарств, которые могли бы заставить эти реснитчатые клетки работать лучше», — сказал Ким.«Мы можем сделать органоиды из ИПСК, полученных из крови пациента, и протестировать эти специфические для пациента клетки легкого, даже не прибегая к биопсии. Возможности органоидов безграничны. Это очень захватывающее время для изучения легких».
Органоиды как терапевтические инструменты
Несколько команд в Гарварде и других местах пытаются придумать способы трансформации и трансплантации клеток или даже тканей, которые могли бы служить лекарством или средством лечения определенных заболеваний.
Это касается ученого ИСКЧ Дэвида Бро, доктора медицины, доктора философии, который вместе с другим исследователем ИСКЧ, Цяо Чжоу, доктором философии, добился новаторских достижений в преобразовании кишечных клеток в бета-клетки, продуцирующие инсулин. Их подход может привести к лечению диабета, большой проблемы общественного здравоохранения.
Диабет — это метаболическое заболевание, связанное с инсулином, гормоном, вырабатываемым поджелудочной железой, который позволяет нашим клеткам поглощать глюкозу из кровотока. Существует два типа диабета: тип 1, при котором иммунная система атакует бета-клетки, вырабатывающие инсулин; и тип 2, при котором клетки становятся устойчивыми к инсулину, поэтому его запаса в организме недостаточно для контроля уровня глюкозы в крови.
Бро и Чжоу разработали метод трансформации эпителиальных клеток кишечника в бета-клетки, продуцирующие инсулин, и протестировали свой метод на кишечных органоидах. Эта трансформация возможна, потому что эти клетки происходят из одного и того же региона во время развития и имеют много общих характеристик.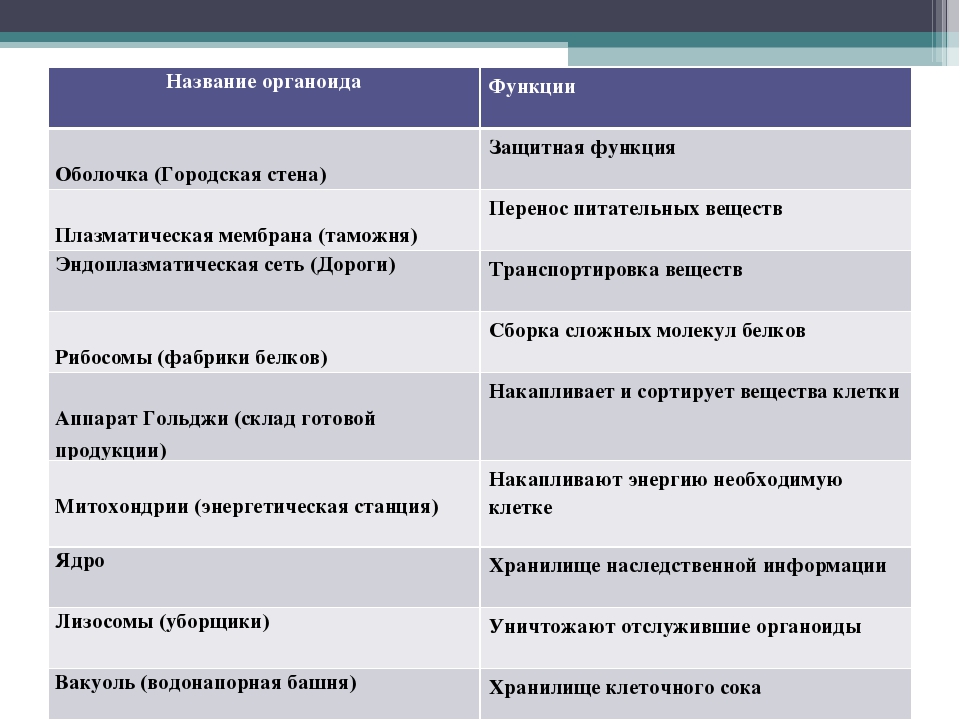
Они также смогли показать, что могут имплантировать матрицу, загруженную этими модифицированными клетками, продуцирующими инсулин, диабетической мыши, которая затем успешно регулирует уровень сахара в крови.
Breault делает еще один шаг вперед и намекает на возможность производства органоидов из иПС-клеток, полученных от пациентов, которые могут быть преобразованы в бета-подобные клетки, продуцирующие инсулин.
«Возможность создавать клетки-предшественники, специфичные для пациента, которые могут быть преобразованы в бета-клетки за один или два этапа, может представлять собой значительный прогресс в лечении диабета», — сказал Бро.
Революция в открытии лекарств
Не на каждый исследовательский вопрос нужно отвечать, используя сложные тканеподобные культуры, состоящие из разнообразных клеток.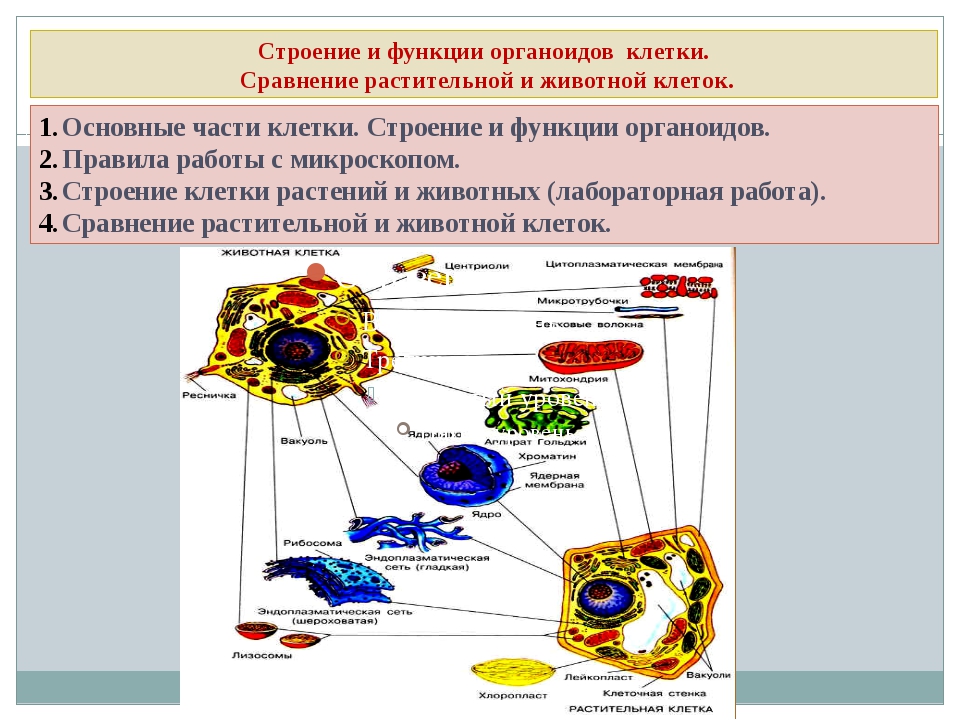
Некоторым ученым нужны только определенные типы клеток, похожие друг на друга. Одним из примеров является процесс открытия лекарств, когда необходимо протестировать множество веществ на клетках, чтобы увидеть, как они работают.
На сегодняшний день для проведения таких тестов фармацевтическая промышленность полагалась на модели животных и линии клеток человека, которые мало похожи на нормальные или больные ткани. По словам члена Исполнительного комитета ИСКЧ Ли Рубина, доктора философии, это может быть одной из причин высокого уровня неудач клинических испытаний, что усугубляет высокую стоимость открытия нового лекарства — в среднем 2 миллиарда долларов за каждое новое лекарство, поступившее в аптеку.
Рубин считает, что использование человеческих клеток, а не животных моделей, может ускорить и повысить эффективность процесса открытия и разработки лекарств.
Лаборатория Рубина работает над сфероидами мозга, плотно населенными шарами нейронов, которые постоянно производят один или несколько типов клеток в больших количествах.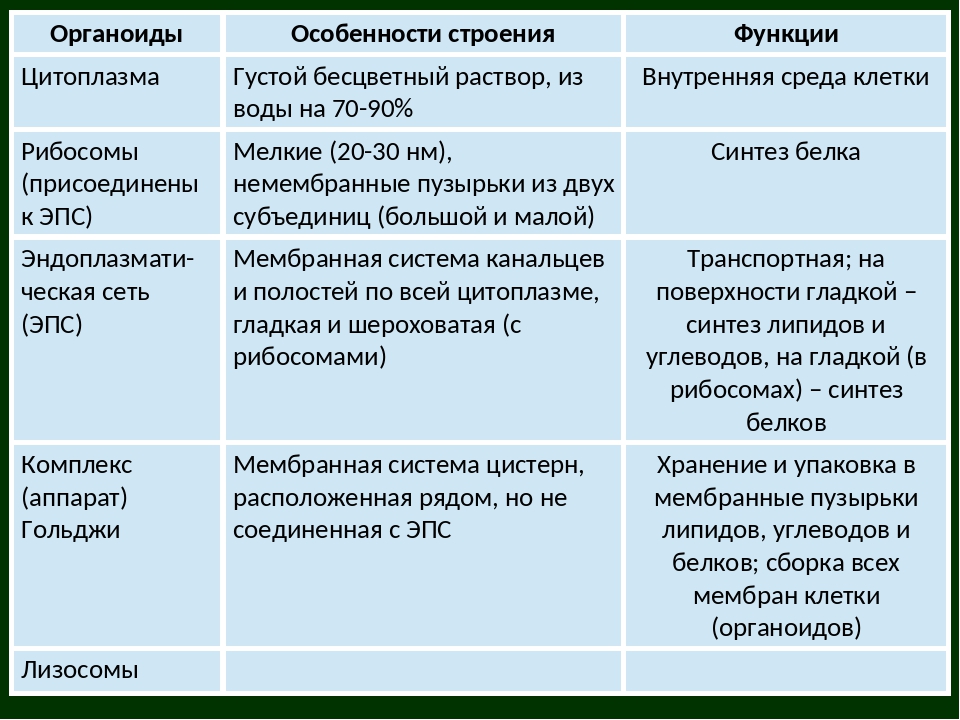 Этот метод дает больше клеток и лучшего качества, чем традиционные плоские культуры на чашке. Это похоже на массовое производство, экономичный подход к культуре клеток.
Этот метод дает больше клеток и лучшего качества, чем традиционные плоские культуры на чашке. Это похоже на массовое производство, экономичный подход к культуре клеток.
Помимо развития из эмбриональных клеток, сфероиды также могут быть получены из собственных клеток пациента и помещены в биобанк клеток, специфичных для пациента. Сочетая такие биобанки с клиническими и геномными данными, можно разработать и протестировать индивидуальные планы лечения для каждого пациента. Этот подход также может позволить идентифицировать группы пациентов, которые лучше реагируют на одни виды лечения, чем на другие.
Возможность производить неограниченное количество тканей от каждого пациента также будет чрезвычайно полезно для изучения и лечения редких заболеваний, когда количество пациентов, на которых можно проводить исследования и тестировать лечение, ограничено.Это позволит исследователям проводить свои исследования в более широком масштабе, ускоряя прогресс в лечении этих часто недостаточно изученных заболеваний.
На пути к органоидной культуре без Matrigel
Lancaster, M.A. & Knoblich, J.A. Органогенез в чашке: моделирование развития и заболевания с использованием органоидных технологий. Наука 345 , 10 (2014).
Google Scholar
Grapin-Botton, A. Трехмерные модели органогенеза поджелудочной железы. Диабет Ожирение. Метаб. 18 , 33–40 (2016).
ПабМед ПабМед Центральный Google Scholar
Boj, S. F. et al. Органоидные модели протокового рака поджелудочной железы человека и мыши. Cell 160 , 324–338 (2015).
Cell 160 , 324–338 (2015).
КАС пабмед Google Scholar
Qian, X.Y., Nguyen, H.N., Jacob, F., Song, HJ, & Ming, G.L. Использование органоидов головного мозга для понимания микроцефалии, вызванной вирусом Зика. Развитие 144 , 952–957 (2017).
КАС пабмед ПабМед Центральный Google Scholar
Чой, Х., Сонг, Дж., Парк, Г. и Ким, Дж. Моделирование аутизма с использованием органоидной технологии. Мол. Нейробиол. 54 , 7789–7795 (2017).
КАС пабмед Google Scholar
ван де Ветеринг, М. и др. Перспективное создание биобанка живых органоидов больных колоректальным раком. Cell 161 , 933–945 (2015).
ПабМед ПабМед Центральный Google Scholar

Schwank, G. et al. Функциональное восстановление CFTR с помощью CRISPR/Cas9 в органоидах стволовых клеток кишечника у пациентов с муковисцидозом. Cell Stem Cell 13 , 653–658 (2013).
КАС пабмед Google Scholar
Такебе, Т. и др. Васкуляризованная и функциональная печень человека из трансплантата зачатка органа, полученного из ИПСК. Природа 499 , 481–48 (2013).
КАС пабмед Google Scholar
Такебе Т. и др. Создание васкуляризированной и функциональной печени человека из трансплантата зачатка органа, полученного из ИПСК. Нац. протокол 9 , 396–409 (2014).
КАС пабмед Google Scholar
Dekkers, J. F. et al. Характеристика ответов на препараты, модулирующие CFTR, с использованием ректальных органоидов, полученных от субъектов с муковисцидозом.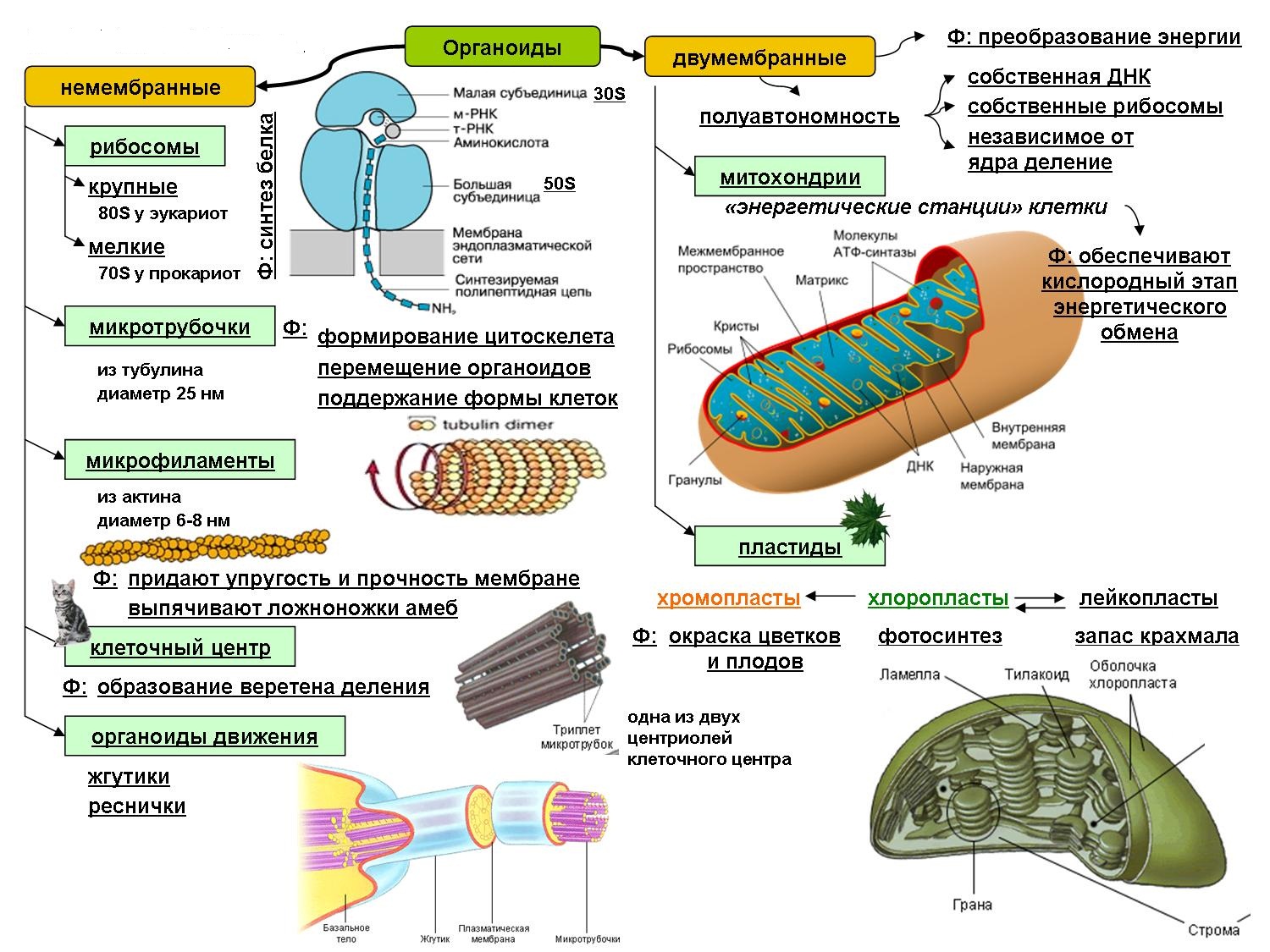 Науч. Перевод Мед. 8 , 12 (2016).
Науч. Перевод Мед. 8 , 12 (2016).
Google Scholar
Чаттерджи С., Басак П., Бухель Э., Мерфи Л. К. и Рауф А. Надежная система культивирования клеток для крупномасштабной бесклеточной экспансии эпителиальных предшественников молочной железы человека. Res.тер. 9 , 264–264 (2018).
КАС пабмед ПабМед Центральный Google Scholar
Дрост, Дж. и Клеверс, Х. Трансляционное применение органоидов, полученных из взрослых стволовых клеток. Развитие 144 , 968–975 (2017).
КАС пабмед Google Scholar
Нуграха Б., Буоно М. Ф., фон Бемер Л., Хёрструп С.П. и Эммерт, М.Ю. Органоиды сердца человека для моделирования заболеваний. клин. Фармакол. Терапия. 105 , 79–85 (2019).
Google Scholar

Миямото М., Нам Л., Каннан С. и Квон С. Органоиды сердца и модели тканей для моделирования развития и заболеваний. Сем. Развитие клеток. биол. https://doi.org/10.1016/j.semcdb.2021.03.011 (2021 г.).
Сидхай Дж. и Кноблих Дж.A. Органоиды головного мозга: совокупность биотестов для исследования развития нервной системы и болезней человека. Гибель клеток Разн. 28 , 52–67 (2021).
ПабМед Google Scholar
Wang, H. Моделирование неврологических заболеваний с помощью органоидов человеческого мозга. Перед. Синаптические нейроны. https://doi.org/10.3389/fnsyn.2018.00015 (2018 г.).
Qian, X., Song, H. & Ming, G.L. Органоиды мозга: достижения, приложения и проблемы. Разработка https://doi.org/10.1242/dev.166074 (2019 г.).
Schneeberger, K. et al. Конвергенция технологий биофабрикации и органоидов: новый рубеж в инженерии тканей печени и кишечника? Биофабрикация 9 , 013001–013001 (2017).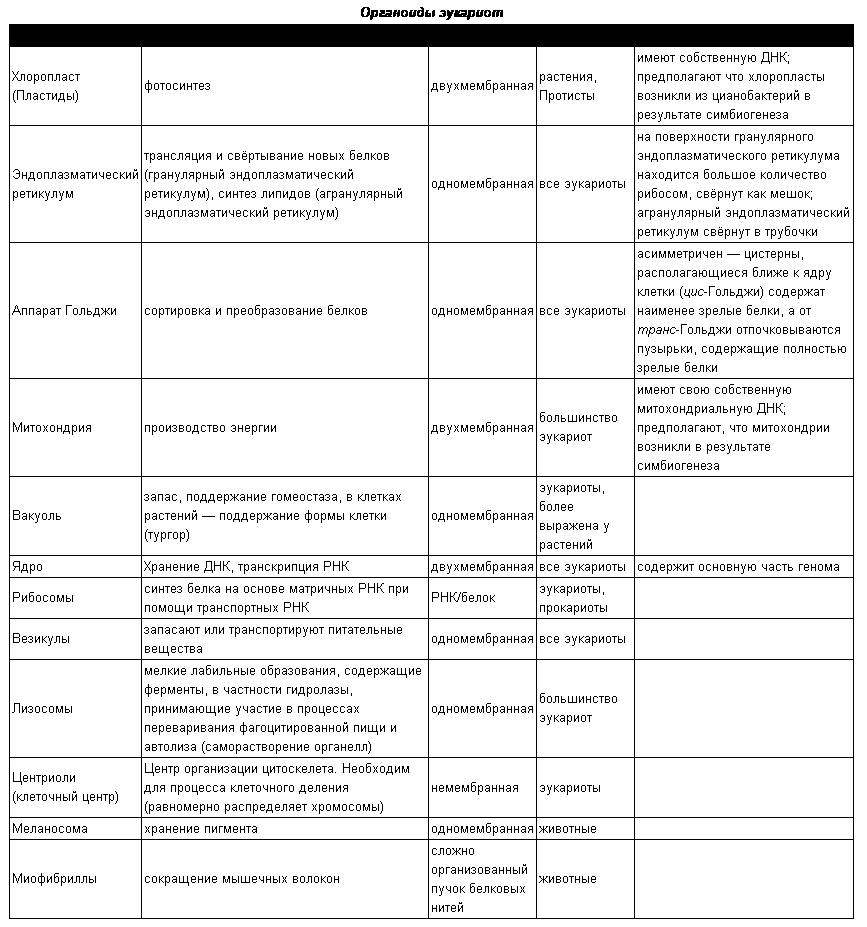
ПабМед ПабМед Центральный Google Scholar
Огоке, О., Малой, М. и Парашурама, Н. Наука и разработка органоидов, полученных из стволовых клеток, — примеры тканей печени, желчных путей и поджелудочной железы. биол. Преподобный Кэмб. Филос. соц. 96 , 179–204 (2021).
ПабМед Google Scholar
Юсеф Йенгей, Ф. А., Янсен, Дж., Рукмаакер, М. Б., Верхаар, М. С. и Клеверс, Х. Органоиды почек и тубулоиды. Ячейки https://doi.org/10.3390/cells
26 (2020).
Little, M.H. & Combes, A.N. Органоиды почек: точные модели или удачные случайности. Гены Дев. 33 , 1319–1345 (2019).
КАС пабмед ПабМед Центральный Google Scholar
Симидзу Т., Ямагата К. и Осафунэ К. Органоиды почек: исследования в области биологии развития и новых приложений. Дев. Разница в росте. 63 , 166–177 (2021).
Дев. Разница в росте. 63 , 166–177 (2021).
ПабМед Google Scholar
Балак Дж.Р.А., Джуксар Дж., Карлотти Ф., Ло Нигро А. и де Конинг Э. Дж. П. Органоиды из поджелудочной железы плода и взрослого человека. Курс. Diabetes Rep. 19 , 160 (2019).
КАС Google Scholar
Морейра, Л. и др. Органоиды поджелудочной железы 3D: текущие и будущие аспекты в качестве исследовательской платформы для персонализированной медицины при раке поджелудочной железы. Сотовый. Мол. Гастроэнтерол. Гепатол. 5 , 289–298 (2018).
ПабМед Google Scholar
Driehuis, E. et al. Органоиды рака поджелудочной железы резюмируют заболевание и позволяют проводить персонализированный скрининг лекарств. Проц. Натл акад. науч. США 116 , 26580 (2019).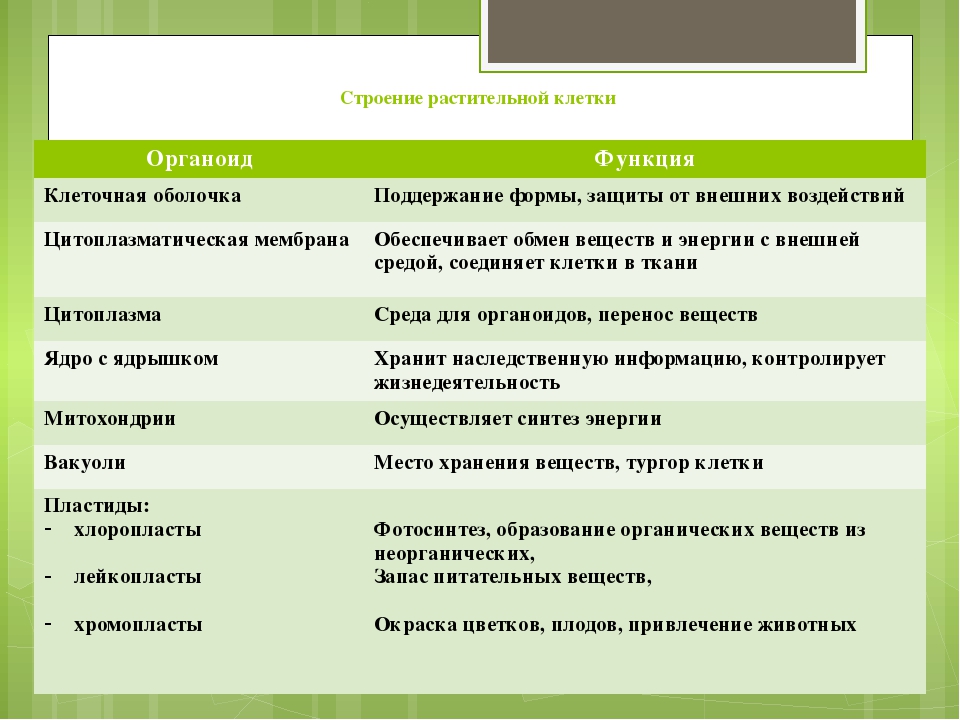
КАС ПабМед Центральный Google Scholar
Чумдури, К. и Турко, М.Ю. Органоиды женского репродуктивного тракта. Дж. Мол. Мед. 99 , 531–553 (2021).
ПабМед Google Scholar
Клейнман, Х.К. и Мартин, Г.Р. Матригель: матрикс базальной мембраны с биологической активностью. Семин. Рак биол. 15 , 378–386 (2005).
КАС пабмед Google Scholar
Сато Т. и др. Отдельные стволовые клетки Lgr5 строят структуры крипт-ворсинок in vitro без мезенхимальной ниши. Природа 459 , 262–U147 (2009).
КАС Google Scholar
Сато Т. и др. Длительное распространение эпителиальных органоидов из толстой кишки человека, аденомы, аденокарциномы и эпителия Барретта. Гастроэнтерология 141 , 1762–1772 (2011).
КАС пабмед Google Scholar
Stange, D. E. et al. Дифференцированные главные клетки Troy(+) действуют как резервные стволовые клетки для образования всех клонов эпителия желудка. Cell 155 , 357–368 (2013).
КАС пабмед ПабМед Центральный Google Scholar
Barker, N. et al. Стволовые клетки Lgr5(+ve) стимулируют самообновление в желудке и создают долгоживущие желудочные единицы in vitro. Cell Stem Cell 6 , 25–36 (2010).
КАС Google Scholar
Dekkers, J. F. et al. Функциональный анализ CFTR с использованием кишечных органоидов первичного кистозного фиброза. Нац. Мед. 19 , 939–93 (2013).
КАС пабмед Google Scholar
Huch, M. et al. Экспансия одиночных стволовых клеток печени Lgr5(+) in vitro, индуцированная регенерацией, управляемой Wnt. Природа 494 , 247–250 (2013).
Природа 494 , 247–250 (2013).
КАС пабмед ПабМед Центральный Google Scholar
Ни Дж., Келер К. Р. и Хашино Э.Направленная дифференцировка эмбриональных стволовых клеток мыши в сенсорный эпителий внутреннего уха в 3D-культуре. Методы Мол. биол. 1597 , 67–83 (2017).
КАС пабмед ПабМед Центральный Google Scholar
Huch, M. et al. Неограниченная экспансия in vitro бипотентных предшественников поджелудочной железы взрослых через ось Lgr5/R-спондин. EMBO J. 32 , 2708–2721 (2013).
КАС пабмед ПабМед Центральный Google Scholar
Тириак, Х. и др. Органоидное профилирование выявляет частых респондентов на химиотерапию при раке поджелудочной железы. Рак Дисков. 8 , 1112–1129 (2018).
КАС пабмед ПабМед Центральный Google Scholar
Tsai, S. et al. Разработка первичных органоидов рака поджелудочной железы человека, согласованных стромальных и иммунных клеток и трехмерных моделей микроокружения опухоли. BMC Рак 18 , 13 (2018).
Google Scholar
Seino, T. et al. Органоиды опухоли поджелудочной железы человека обнаруживают потерю зависимости от фактора ниши стволовых клеток во время прогрессирования заболевания. Cell Stem Cell 22 , 454–45 (2018).
КАС пабмед Google Scholar
Wang, W.W., Jin, S. & Ye, K.M. Разработка островковых органоидов из эмбриональных стволовых клеток человека H9 в биомиметических 3D-каркасах. Разработка стволовых клеток. 26 , 394–404 (2017).
КАС пабмед Google Scholar
Dorrell, C. et al. Органоидные инициирующие клетки в поджелудочной железе и печени мышей фенотипически и функционально сходны. Res. 13 , 275–283 (2014).
Res. 13 , 275–283 (2014).
КАС пабмед ПабМед Центральный Google Scholar
Фатехуллах, А., Тан, С. Х. и Баркер, Н. Органоиды как модель человеческого развития и болезней in vitro. Нац. Клеточная биол. 18 , 246–254 (2016).
ПабМед Google Scholar
Yiangou, L., Ross, A.D.B., Goh, K.J. & Vallier, L. Энтодерма, полученная из плюрипотентных стволовых клеток человека, для моделирования развития и клинических применений. Cell Stem Cell 22 , 485–499 (2018).
КАС пабмед Google Scholar
Ким Дж., Ку Б.К. и Кноблих Дж.А. Органоиды человека: модельные системы для биологии и медицины человека. Нац. Преподобный Мол. Клеточный Биол . https://doi.org/10.1038/s41580-020-0259-3 (2020 г.).
Hughes, C.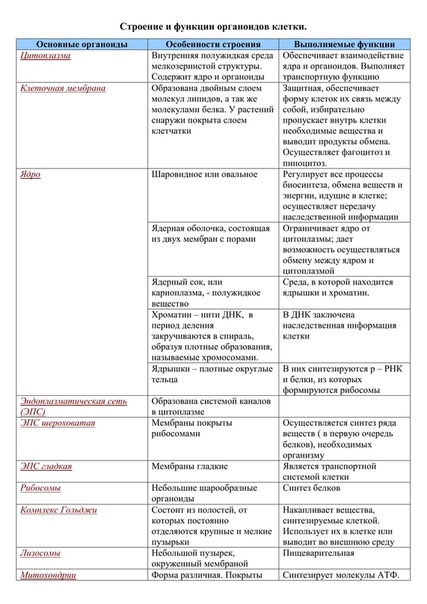 S., Postovit, L.M. & Lajoie, G.A. Matrigel: сложная белковая смесь, необходимая для оптимального роста клеточной культуры. Протеомика 10 , 1886–1890 (2010).
S., Postovit, L.M. & Lajoie, G.A. Matrigel: сложная белковая смесь, необходимая для оптимального роста клеточной культуры. Протеомика 10 , 1886–1890 (2010).
КАС пабмед Google Scholar
Гольдштейн А.С. и др. Очистка и прямая трансформация эпителиальных клеток-предшественников из первичной простаты человека. Нац. протокол 6 , 656–667 (2011).
КАС пабмед ПабМед Центральный Google Scholar
Вукичевич С. и др. Идентификация нескольких активных факторов роста в матригеле базальной мембраны предполагает осторожность в интерпретации клеточной активности, связанной с компонентами внеклеточного матрикса. Экспл. Сотовый рез. 202 , 1–8 (1992).
КАС пабмед Google Scholar
Спенс, Дж. Р. Укрощение дикого запада органоидов, энтероидов и мини-кишек. Сотовый. Мол. Гастроэнтерол. Гепатол. 5 , 159–160 (2018).
Сотовый. Мол. Гастроэнтерол. Гепатол. 5 , 159–160 (2018).
ПабМед Google Scholar
Хуч, М., Кноблих, Дж. А., Лутольф, М. П. и Мартинес-Ариас, А.Надежда и ажиотаж исследований органоидов. Развитие 144 , 938–941 (2017).
КАС пабмед Google Scholar
Mahoney, Z. X., Stappenbeck, T. S. & Miner, J. H. Ламинин альфа 5 влияет на структуру слизистой оболочки тонкого кишечника мыши. J. Cell Sci. 121 , 2493–2502 (2008 г.).
КАС пабмед Google Scholar
Gjorevski, N., Ranga, A. & Lutolf, M.P. Биоинженерные подходы к управлению органогенезом на основе стволовых клеток. Развитие 141 , 1794–1804 (2014).
КАС пабмед Google Scholar
Engler, A. J., Sen, S., Sweeney, H.L. & Discher, D.E. Эластичность матрикса определяет спецификацию стволовых клеток. Cell 126 , 677–689 (2006).
J., Sen, S., Sweeney, H.L. & Discher, D.E. Эластичность матрикса определяет спецификацию стволовых клеток. Cell 126 , 677–689 (2006).
КАС пабмед Google Scholar
Даль-Йенсен, С. и Грейпин-Боттон, А. Физика органоидов: биофизический подход к пониманию органогенеза. Развитие 144 , 946–951 (2017).
КАС пабмед Google Scholar
Nelson, C.M. & Gleghorn, J.P. в Annual Review of Biomedical Engineering Vol. 14 (изд. Ярмуш, М.Л.) (Ежегодные обзоры, 2012 г.).
Мерфи, В. Л., Макдевитт, Т.C. & Engler, AJ Материалы как регуляторы стволовых клеток. Нац. Матер. 13 , 547–557 (2014).
КАС пабмед ПабМед Центральный Google Scholar
Вининг, К. Х. и Муни, Д. Дж. Механические силы управляют поведением стволовых клеток при развитии и регенерации. Нац. Преподобный Мол. Клеточная биол. 18 , 728–742 (2017).
Нац. Преподобный Мол. Клеточная биол. 18 , 728–742 (2017).
КАС пабмед ПабМед Центральный Google Scholar
Chaudhuri, O. Вязкоупругие гидрогели для 3D-культуры клеток. Биоматер. науч. 5 , 1480–1490 (2017).
КАС пабмед Google Scholar
Slater, K., Partridge, J. & Nandivada, H. Настройка упругих модулей матриц Corning® Matrigel® и Collagen I 3D путем изменения концентрации белка: рекомендации по применению https://www. corning.com/catalog/cls/documents/application-notes/CLS-AC-AN-449.pdf (2018).
Немир, С. и Вест, Дж. Л. Синтетические материалы в изучении реакции клеток на жесткость субстрата. Энн. Биомед. англ. 38 , 2–20 (2010).
ПабМед Google Scholar
Мирошникова Ю.А. и др. Инженерные стратегии для повторения морфогенеза эпителия в синтетическом трехмерном внеклеточном матриксе с настраиваемыми механическими свойствами. Физ.биол. 8 , 13 (2011).
Физ.биол. 8 , 13 (2011).
Google Scholar
Soofi, S.S., Last, J.A., Liliensiek, SJ, Nealey, P.F. & Murphy, C.J. Модуль упругости матригеля (TM), определенный с помощью атомно-силовой микроскопии. Дж. Структура. биол. 167 , 216–219 (2009).
КАС пабмед ПабМед Центральный Google Scholar
Рид, Дж., Вальчак В.Дж., Петцольд О.Н. и Гимзевски Дж.К. Механическая интерферометрия пленок матригеля in situ. Ленгмюр 25 , 36–39 (2009).
КАС пабмед ПабМед Центральный Google Scholar
Хасси, Г. С. Д. и Дж. Л.; Бадылак С. Ф. Материалы на основе внеклеточного матрикса для регенеративной медицины. Нац. Преподобный Матер. 3 , 159–173 (2018).
КАС Google Scholar
Кин, Т.Дж., Свинхарт, И.Т. и Бадилак, С.Ф. Методы децеллюляризации тканей, используемые для приготовления биологических каркасов и актуальность in vivo. Методы 84 , 25–34 (2015).
КАС пабмед Google Scholar
Allman, A.J. et al. Трансплантаты ксеногенного внеклеточного матрикса вызывают ограниченный Th3 иммунный ответ. Трансплантация 71 , 1631–1640 (2001).
КАС пабмед Google Scholar
Пармаксиз М., Доган А., Одабас С., Эльчин А.Е. и Эльчин Ю.М. Клиническое применение децеллюляризованных внеклеточных матриксов для тканевой инженерии и регенеративной медицины. Биомед. Матер. 11 , 14 (2016).
Google Scholar
Ю. Ю., Алхаваджи А., Дин Ю. и Мей Дж. Децеллюляризованные каркасы в регенеративной медицине. Oncotarget https://doi. org/10.18632/oncotarget.10945 (2016).
org/10.18632/oncotarget.10945 (2016).
Орландо, Г. и др. Выброшенные человеческие почки как источник каркаса ECM для технологий регенерации почек. Биоматериалы 34 , 5915–5925 (2013).
КАС пабмед Google Scholar
Batchelder, C.A., Martinez, M.L. & Tarantal, A.F. Натуральные каркасы для почечной дифференцировки эмбриональных стволовых клеток человека для инженерии почечной ткани. PLoS ONE 10 , 18 (2015).
Google Scholar
Hong, X. et al. Скелетный внеклеточный матрикс поддерживает сердечную дифференцировку эмбриональных стволовых клеток: потенциальный каркас для сконструированной сердечной ткани. Сотовый. Физиол. Биохим. 45 , 319–331 (2018).
КАС пабмед Google Scholar
Guyette, J. P. et al. Перфузионная децеллюляризация целых органов.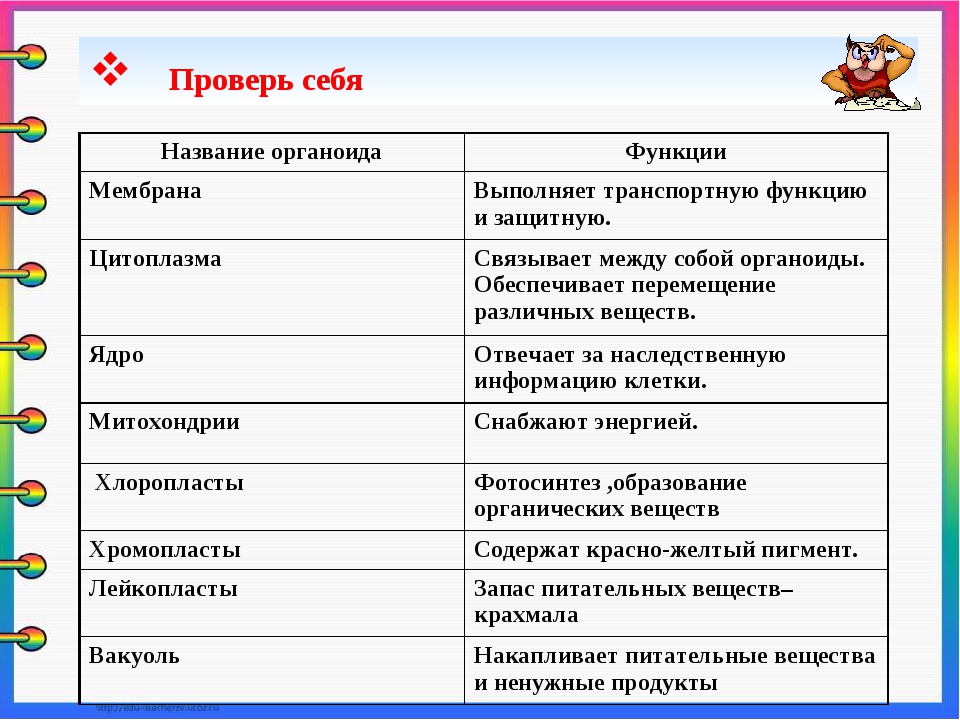 Нац. протокол 9 , 1451–1468 (2014).
Нац. протокол 9 , 1451–1468 (2014).
КАС пабмед Google Scholar
Gilpin, S.E. et al. Перфузионная децеллюляризация легких человека и свиньи: доведение матрицы до клинического масштаба. J. Трансплантация сердца и легких. 33 , 298–308 (2014).
ПабМед Google Scholar
Vermeulen, M.D.V. et al.Генерация организованных свиных тестикулярных органоидов в солюбилизированных гидрогелях из децеллюляризованного внеклеточного матрикса. Междунар. Дж. Мол. науч. 20 , 5476 (2019).
КАС ПабМед Центральный Google Scholar
Lin, P., Chan, W.C.W., Badylak, S.F. & Bhatia, S.N. Оценка биоматрицы, полученной из печени свиньи, для инженерии ткани печени. Ткань Eng. 10 , 1046–1053 (2004).
КАС пабмед Google Scholar

Baptista, P. M. et al. Использование децеллюляризации всего органа для получения васкуляризированного органоида печени. Гепатология 53 , 604–617 (2011).
КАС пабмед Google Scholar
Lee, J.S. et al. Внеклеточный матрикс печени, обеспечивающий двойную функцию двумерного покрытия субстрата и трехмерной гидрогелевой платформы для инъекций для инженерии ткани печени. Биомакромолекулы 15 , 206–218 (2014).
КАС пабмед Google Scholar
Сахели, М. и др. Трехмерный гидрогель внеклеточного матрикса, полученный из печени, способствует функционированию органоидов печени. J. Cell Biochem. 119 , 4320–4333 (2018).
КАС пабмед Google Scholar
Lewis, P.L. et al.Формирование сложной сети желчных протоков в гидрогелях децеллюляризованного внеклеточного матрикса печени.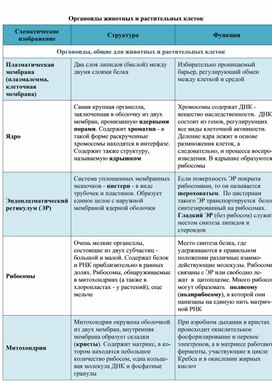 Науч. Респ. 8 , 12220 (2018).
Науч. Респ. 8 , 12220 (2018).
ПабМед ПабМед Центральный Google Scholar
Zachos, N.C. et al. Энтероиды/колоноиды и кишечные органоиды человека функционально повторяют нормальную физиологию и патофизиологию кишечника. Дж. Биол. хим. 291 , 3759–3766 (2016).
КАС пабмед Google Scholar
Finkbeiner, S.R. et al. Создание тканеинженерной тонкой кишки с использованием кишечных органоидов человека, полученных из эмбриональных стволовых клеток. биол. Открыть 4 , 1462–1472 (2015).
КАС пабмед ПабМед Центральный Google Scholar
Giobbe, G.G. et al. Гидрогель внеклеточного матрикса, полученный из децеллюляризованных тканей, позволяет культивировать энтодермальные органоиды. Нац. коммун. 10 , 5658 (2019).
ПабМед ПабМед Центральный Google Scholar
Sackett, S.D. et al. Каркас внеклеточного матрикса и гидрогель, полученные из децеллюляризованной и делипидизированной поджелудочной железы человека. Науч. Респ. 8 , 16 (2018).
Google Scholar
Чаймов Д. и др. Инновационная платформа инкапсуляции на основе внеклеточного матрикса поджелудочной железы обеспечивает существенную доставку инсулина. J. Контролируемое высвобождение. 257 , 91–101 (2017).
КАС Google Scholar
Bi, H., Ye, K. & Jin, S. Протеомный анализ децеллюляризованного матрикса поджелудочной железы идентифицирует коллаген V как критический регулятор органогенеза островков из плюрипотентных стволовых клеток человека. Биоматериалы 233 , 119673 (2020).
КАС пабмед Google Scholar

Деварасетти М., Скардал А., Каудрик К., Марини Ф. и Сокер С. Биоинженерные подслизистые органоиды для моделирования колоректального рака in vitro. Ткань Eng. Часть A 23 , 1026–1041 (2017).
КАС пабмед ПабМед Центральный Google Scholar
Jee, J.H. et al. Разработка трехмерной матрицы на основе коллагена для органоидной культуры желудочно-кишечного тракта. Стволовые клетки Int. 2019 , 8472712–8472712 (2019).
ПабМед ПабМед Центральный Google Scholar
Такедзава, Т., Одзаки, К., Нитани, А., Такабаяси, К. и Шимо-Ока, Т. Коллагеновый витригель: новый каркас, который может облегчить трехмерную культуру для реконструкции органоидов. Пересадка клеток. 13 , 463–473 (2004).
ПабМед Google Scholar
Ван, П. К.& Takezawa, T. Реконструкция почечной гломерулярной ткани с использованием каркаса из коллагенового витригеля. J. Biosci. биоинж. 99 , 529–540 (2005).
Реконструкция почечной гломерулярной ткани с использованием каркаса из коллагенового витригеля. J. Biosci. биоинж. 99 , 529–540 (2005).
КАС пабмед Google Scholar
Broguiere, N. et al. Рост эпителиальных органоидов в определенном гидрогеле. Доп. Матер. 30 , 1801621 (2018).
Google Scholar
Юи, С. Р. и др. Функциональное приживление эпителия толстой кишки, увеличенного in vitro из одной взрослой стволовой клетки Lgr5(+). Нац. Мед. 18 , 618–623 (2012).
КАС пабмед Google Scholar
Оотани, А. и др. Устойчивая культура кишечного эпителия in vitro в нише Wnt-зависимых стволовых клеток. Нац. Мед. 15 , 1–U140 (2009).
Google Scholar
Isshiki, H. et al. Создание усовершенствованного метода культивирования органоидов толстой кишки крысы. Биохим. Биофиз. Рез. коммун. 489 , 305–311 (2017).
et al. Создание усовершенствованного метода культивирования органоидов толстой кишки крысы. Биохим. Биофиз. Рез. коммун. 489 , 305–311 (2017).
КАС пабмед Google Scholar
Streuli, C. H. Интегрины и определение клеточной судьбы. J. Cell Sci. 122 , 171 (2009).
КАС пабмед Google Scholar
Хошнооди Дж., Педченко В. и Хадсон Б.Г. Коллаген млекопитающих IV. Микроск. Рез. Тех. 71 , 357–370 (2008).
КАС пабмед ПабМед Центральный Google Scholar
Fatehullah, A., Appleton, P.L. & Nathke, I.S. Полярность клеток и тканей в кишечном тракте во время онкогенеза: клетки все еще знают правильный путь вверх, но тканевая организация утрачена. Филос. Транс. Р.соц. Лонд. сер. Б, биол. науч. 368 , 20130014 (2013).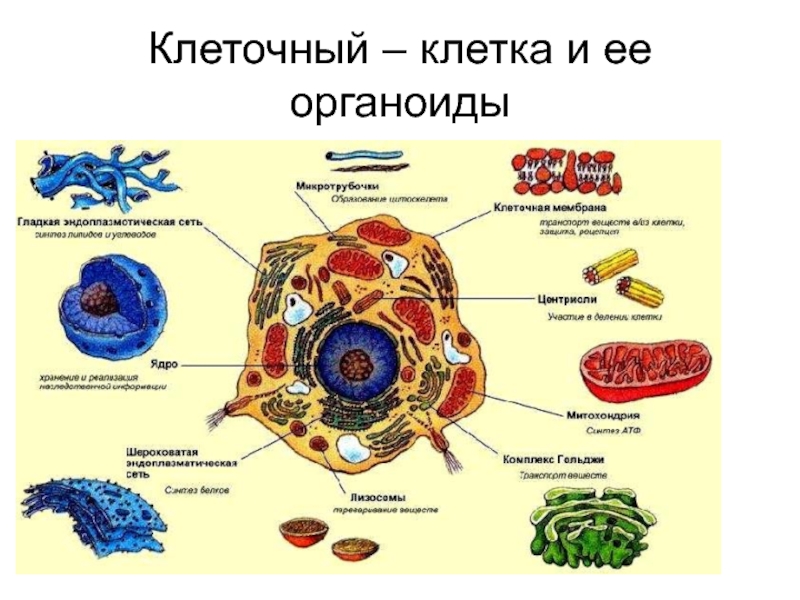
Google Scholar
Lee, J.L. & Streuli, C.H. Интегрины и полярность эпителиальных клеток. J. Cell Sci. 127 , 3217–3225 (2014).
КАС пабмед ПабМед Центральный Google Scholar
Myllymäki, S.M., Teräväinen, T.P. & Manninen, A. Два различных интегрин-опосредованных механизма способствуют образованию апикального просвета в эпителиальных клетках. PLoS ONE 6 , e19453 (2011).
ПабМед ПабМед Центральный Google Scholar
Co, J.Y. et al. Контроль эпителиальной полярности: человеческая энтероидная модель взаимодействия хозяин-патоген. Cell Rep. 26 , 2509–2520.e2504 (2019).
КАС пабмед ПабМед Центральный Google Scholar
Ван Ю.и другие. Функционализация внеклеточного матрикса и совместное культивирование клеток Huh-7.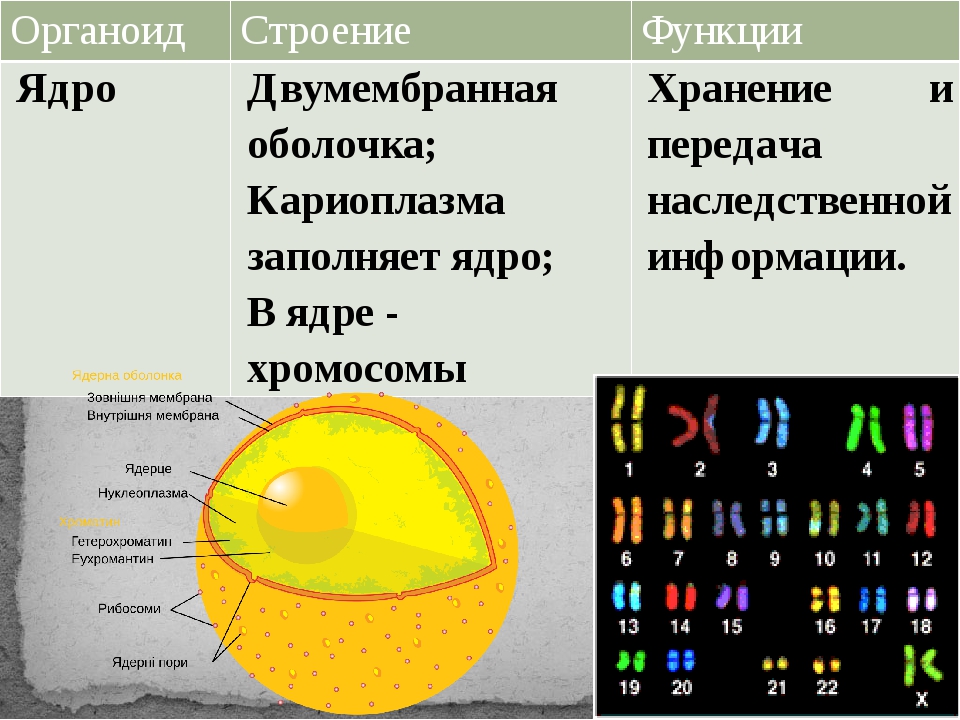 5 способствуют печеночной дифференцировке мезенхимальных стволовых клеток, полученных из жировой ткани человека, в каркасе из гидрогеля 3D ICC. АЦС Биоматер. науч. англ. 2 , 2255–2265 (2016).
5 способствуют печеночной дифференцировке мезенхимальных стволовых клеток, полученных из жировой ткани человека, в каркасе из гидрогеля 3D ICC. АЦС Биоматер. науч. англ. 2 , 2255–2265 (2016).
КАС пабмед Google Scholar
Wilkinson, D.C. et al. Разработка трехмерной биоинженерной технологии для создания легочной ткани для персонализированного моделирования заболеваний. Стволовые клетки Перевод. Мед. 6 , 622–633 (2017).
ПабМед Google Scholar
Wilkinson, D.C. et al. Разработка трехмерной биоинженерной технологии для создания легочной ткани для персонализированного моделирования заболеваний. Курс. протокол Биол стволовых клеток. 46 , e56 (2018).
ПабМед ПабМед Центральный Google Scholar
Zhu, Y.J. et al. Система полых волокон для простого создания органоидов человеческого мозга.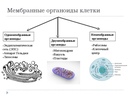 Интегр. биол. 9 , 774–781 (2017).
Интегр. биол. 9 , 774–781 (2017).
КАС Google Scholar
Лу, Ю.-К. и другие. Масштабируемое производство и криохранилище органоидов с использованием капсул из гидрогеля, разделенных ядром и оболочкой. Доп. Биосист. 1 , 1700165 (2017).
ПабМед ПабМед Центральный Google Scholar
Capeling, M.M. et al. Неадгезивные альгинатные гидрогели поддерживают рост плюрипотентных кишечных органоидов, происходящих из стволовых клеток. Stem Cell Rep. 12 , 381–394 (2019).
КАС Google Scholar
Liu, H.T. et al. Капельная микрожидкостная система для изготовления гибридных капсул, обеспечивающая инженерию органоидов стволовых клеток. Доп. науч. 7 , 9 (2020).
Google Scholar
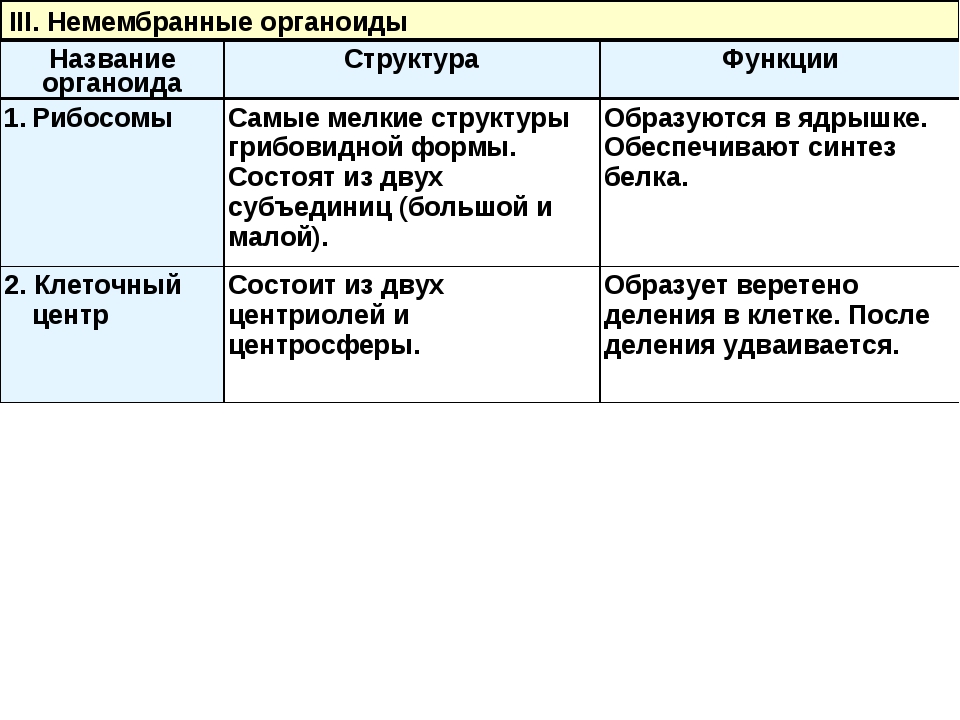
Россен, Н. С. и др. Инъекционные терапевтические органоиды с использованием жертвенных гидрогелей. iScience 23 , 101052 (2020).
КАС пабмед ПабМед Центральный Google Scholar
Chen, X., Zhao, X. & Wang, G. Обзор морских наночастиц золота на основе углеводов, представленных альгинатом и хитозаном, для биомедицинского применения. Углевод. Полим. 244 , 116311 (2020).
КАС пабмед Google Scholar
Фернандо, И. П. С., Ли, В., Хан, Э. Дж. и Ан, Г. Наноматериалы на основе альгината: методы изготовления, свойства и применение. Хим. англ. J. 391 , 13 (2020).
Google Scholar
Cattelan, G. et al. Альгинатные составы: текущие разработки в гонке за регенерацию сердца на основе гидрогеля. Перед. биоинж. Биотехнолог. 8 , 16 (2020).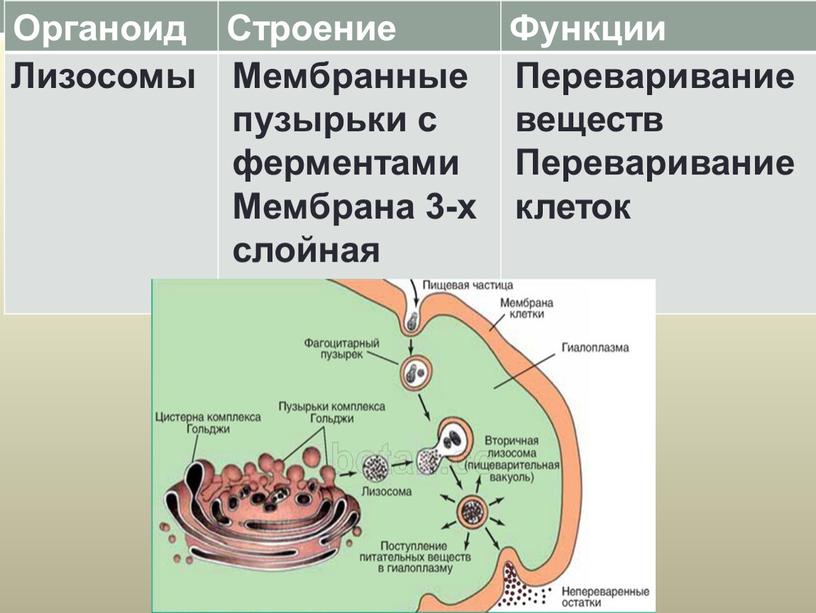
Google Scholar
Kong, H.J., Wong, E. & Mooney, D.J. Независимый контроль жесткости и ударной вязкости полимерных гидрогелей. Макромолекулы 36 , 4582–4588 (2003).
КАС Google Scholar
Fu, S. et al. Реологическая оценка межсортовой и межпартийной изменчивости альгината натрия. AAPS PharmSciTech. 11 , 1662–1674 (2010).
КАС пабмед ПабМед Центральный Google Scholar
Führmann, T. et al. Гидрогель для инъекций способствует раннему выживанию индуцированных олигодендроцитов, происходящих из плюрипотентных стволовых клеток, и ослабляет долговременное образование тератомы в модели повреждения спинного мозга. Биоматериалы 83 , 23–36 (2016).
ПабМед Google Scholar

Линдборг, Б.А. и др. Гидроколлоидный гидрогель на основе хитозана и гиалуроновой кислоты поддерживает культивирование in vitro и дифференцировку мезенхимальных стволовых/стромальных клеток человека. Ткань Eng. Часть A 21 , 1952–1962 (2015).
КАС пабмед Google Scholar
Lindborg, B.A. et al. Быстрая индукция церебральных органоидов из индуцированных человеком плюрипотентных стволовых клеток с использованием химически определенного гидрогеля и определенной среды для культивирования клеток. Стволовые клетки Перевод. Мед. 5 , 970–979 (2016).
КАС пабмед ПабМед Центральный Google Scholar
Ву, С. Х., Сюй, Р. Дж., Дуань, Б. и Цзян, П. Трехмерные модели на основе гидрогеля гиалуроновой кислоты для культивирования и дифференцировки NPC, полученных из иПСК человека in vitro. Дж. Мат. хим. B 5 , 3870–3878 (2017).
КАС Google Scholar
Лам, Дж., Кармайкл, С.Т., Лоури, В.Е. и Сегура, Т. Дизайн методологии экспериментов с гидрогелем для оптимизации гидрогеля для культуры иПСК-НПК. Доп. Здоровьеc. Матер. 4 , 534–539 (2015).
КАС пабмед Google Scholar
Bejoy, J. et al. Дифференциальные эффекты гепарина и гиалуроновой кислоты на формирование нейронов индуцированных человеком плюрипотентных стволовых клеток. АЦС Биоматер. науч. англ. 4 , 4354–4366 (2018).
КАС пабмед ПабМед Центральный Google Scholar
Матарассо, С. Л. Использование инъекционных коллагенов для эстетического омоложения. Семин. Кутан. Мед. Surg. 25 , 151–157 (2006).
КАС пабмед Google Scholar
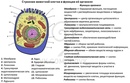
Wagner, D. E. et al. Сравнительная децеллюляризация и рецеллюляризация нормальных и эмфизематозных легких человека. Биоматериалы 35 , 3281–3297 (2014).
КАС пабмед ПабМед Центральный Google Scholar
Бут, А. Дж. и др. Бесклеточный матрикс нормального и фиброзного легкого человека как культуральная система для исследования in vitro. утра. Дж. Дыхание. крит. Уход Мед. 186 , 866–876 (2012).
КАС пабмед ПабМед Центральный Google Scholar
Sullivan, K.E., Quinn, K.P., Tang, K.M., Georgakoudi, I. & Black, L.D. Ремоделирование внеклеточного матрикса после инфаркта миокарда влияет на терапевтический потенциал мезенхимальных стволовых клеток. Res. тер. 5 , 15 (2014).
Google Scholar
Shojaie, S. et al. Бесклеточные каркасы легких направляют дифференцировку энтодермы в функциональные эпителиальные клетки дыхательных путей: потребность в связанных с матриксом протеогликанах HS. Stem Cell Rep. 4 , 419–430 (2015).
Stem Cell Rep. 4 , 419–430 (2015).
КАС Google Scholar
Кин, Т.Дж., Лондоно, Р., Тернер, Н.Дж. и Бадылак, С.Ф. Последствия неэффективной децеллюляризации биологических каркасов для ответа хозяина. Биоматериалы 33 , 1771–1781 (2012).
КАС пабмед Google Scholar
Хайнс, Р.О. и Наба А. Обзор матрисомы — перечень компонентов и функций внеклеточного матрикса. Гавань Колд Спринг. Перспектива. биол. 4 , а004903–а004903 (2012 г.).
ПабМед ПабМед Центральный Google Scholar
Sternlicht, M.D. & Werb, Z. Как матриксные металлопротеиназы регулируют поведение клеток. Анну. Преподобный Cell Dev. биол. 17 , 463–516 (2001).
КАС пабмед ПабМед Центральный Google Scholar

Qi, D.J. et al. Создание системы микрофизиологического гематоэнцефалического барьера на основе иПСК человека и нановолокон. Приложение ACS Матер. Интерфейсы 10 , 21825–21835 (2018 г.).
КАС пабмед ПабМед Центральный Google Scholar
Клоксин А.М., Каско А.М., Салинас С.Н. и Ансет К.С. Фоторазлагаемые гидрогели для динамической настройки физических и химических свойств. Наука 324 , 59–63 (2009).
КАС пабмед ПабМед Центральный Google Scholar
Guvendiren, M. & Burdick, J.A. Придание жесткости гидрогелям для исследования краткосрочных и долгосрочных клеточных реакций на динамическую механику. Нац. коммун. 3 , 9 (2012).
Google Scholar
Qayyum, A. S. et al. Дизайн электрогидродинамически напыляемых микросфер гидрогеля полиэтиленгликоля для инкапсуляции клеток. Биофабрикация 9 , 16 (2017).
Биофабрикация 9 , 16 (2017).
Google Scholar
Скардал, А. и др. Биопечать целлюлярных конструкций с использованием тканеспецифических гидрогелевых биочернил. Дж. Вис. Опыт . https://doi.org/10.3791/53606 (2016 г.).
Tabata, Y. & Lutolf, M.P. Многомасштабное микросредовое возмущение судьбы и самоорганизации плюрипотентных стволовых клеток. Науч. Респ. 7 , 11 (2017).
Google Scholar
Маландрино А., Мак М., Камм Р. Д. и Моеендарбари Э. Сложная механика гетерогенного внеклеточного матрикса при раке. Экстрем. мех. лат. 21 , 25–34 (2018).
Google Scholar
Zhu, J.R., Liang, L., Jiao, Y. & Liu, L.Y., Allianc, U.S.-C. П. С.-О. Усиленная инвазия метастатических раковых клеток через интерфейс внеклеточного матрикса.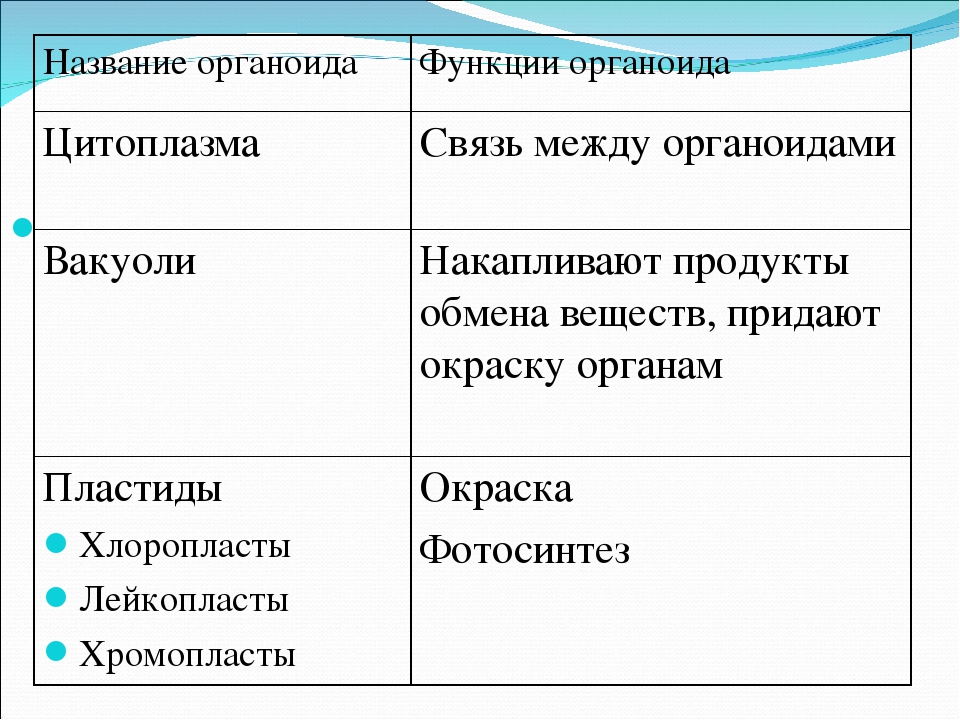 PLoS ONE 10 , 17 (2015).
PLoS ONE 10 , 17 (2015).
Google Scholar
Ekerdt, B.L. et al. Термообратимые гидрогелевые системы гиалуроновой кислоты-PNIPAAm для 3D-культивирования стволовых клеток. Доп. Здоровьеc. Матер. 7 , 12 (2018).
Google Scholar
Qin, X.H., Wang, X.P., Rottmar, M., Nelson, B.J. & Maniura-Weber, K. Фоторезист гидрогеля поливинилового спирта, чувствительный к свету в ближней инфракрасной области, для пространственно-временного контроля трехмерных микроокружений, обучающих клетки. Доп. Матер. 30 , 7 (2018).
Google Scholar
Dye, B.R. et al. Органоиды легких человека развиваются в структуры, подобные дыхательным путям взрослых, в зависимости от физико-химических свойств биоматериала. Биоматериалы 234 , 119757 (2020).
КАС пабмед ПабМед Центральный Google Scholar
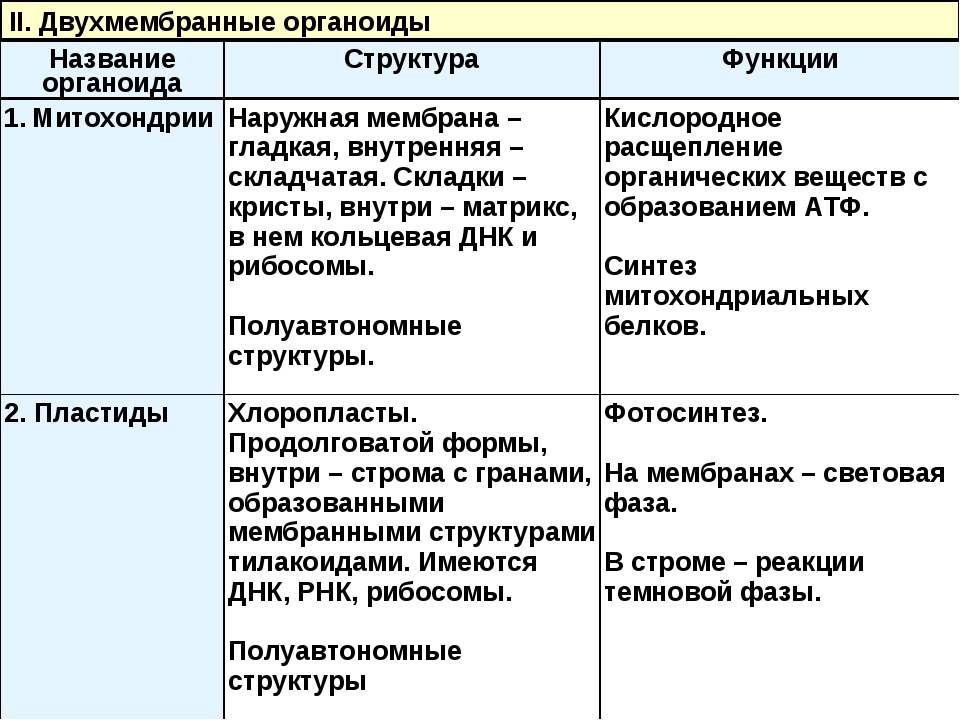
Чой, Дж.-В. и другие.Изготовление трехмерных биосовместимых/биоразлагаемых микрокаркасов с использованием проекционной микростереолитографии с динамической маской. Дж. Матер. Процесс. Технол. 209 , 5494–5503 (2009 г.).
КАС Google Scholar
Li, W., Shepherd, D.E.T. & Espino, D.M. Частотно-зависимые вязкоупругие свойства ткани головного мозга свиньи. Дж. Мех. Поведение Биомед. Матер. 102 , 103460 (2020).
КАС пабмед Google Scholar
Баддей С., Зоммер Г., Хольцапфель Г. А., Штейнманн П. и Куль Э. Идентификация параметров вязкоупругости тканей головного мозга человека. Дж. Мех. Поведение Биомед. Матер. 74 , 463–476 (2017).
КАС пабмед Google Scholar
Чаудхури, О. и др. Гидрогели с настраиваемой релаксацией стресса регулируют судьбу и активность стволовых клеток. Нац. Матер. 15 , 326–334 (2016).
Нац. Матер. 15 , 326–334 (2016).
КАС пабмед Google Scholar
Чаудхури, О., Купер-Уайт, Дж., Джанми, П.А., Муни, Д.Дж. и Шеной, В.Б. Влияние вязкоупругости внеклеточного матрикса на клеточное поведение. Природа 584 , 535–546 (2020).
КАС пабмед ПабМед Центральный Google Scholar
Криспим, Дж. Ф. и Ито, К. Неогиалиновый хрящ De novo из бычьих органоидов в вязкоупругих гидрогелях. Акта Биоматер. 128 , 236–249 (2021).
КАС пабмед Google Scholar
Хофер, М. и Лутольф, М. П. Инженерные органоиды. Нац. Преподобный Матер. 6 , 402–420 (2021).
КАС Google Scholar
Ranga, A. & Lutolf, M.P. Высокопроизводительные подходы к анализу внешних регуляторов судьбы стволовых клеток. Курс. мнение Клеточная биол. 24 , 236–244 (2012).
Курс. мнение Клеточная биол. 24 , 236–244 (2012).
КАС пабмед Google Scholar
Gobaa, S. et al. Искусственные нишевые микрочипы для исследования судьбы отдельных стволовых клеток с высокой пропускной способностью. Нац. Методы 8 , 949–955 (2011).
КАС пабмед Google Scholar
Андерсон, Д. Г., Левенберг, С. и Лангер, Р. Синтез массивных биоматериалов в масштабе нанолитров и применение к эмбриональным стволовым клеткам человека. Нац. Биотехнолог. 22 , 863–866 (2004).
КАС пабмед Google Scholar
Lutolf, M.P. & Hubbell, J.A. Синтетические биоматериалы как поучительные внеклеточные микроокружения для морфогенеза в тканевой инженерии. Нац. Биотехнолог. 23 , 47–55 (2005).
КАС пабмед Google Scholar
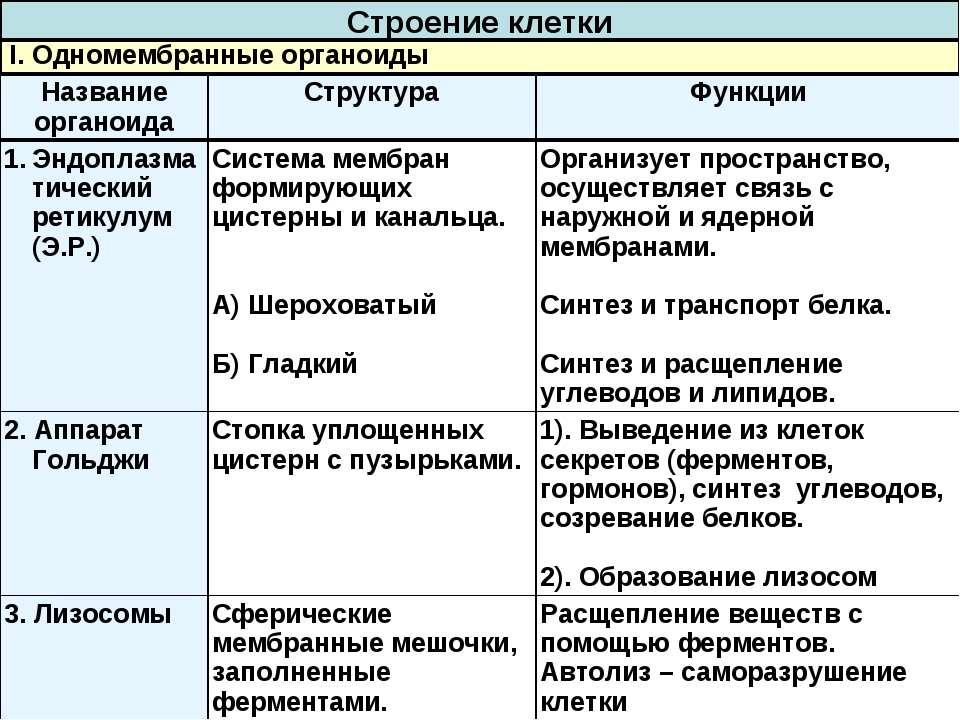
Нгуен, К. Т. и Уэст, Дж. Л. Фотополимеризуемые гидрогели для применения в тканевой инженерии. Биоматериалы 23 , 4307–4314 (2002).
КАС пабмед Google Scholar
Саха К., Поллок Дж. Ф., Шаффер Д. В. и Хили К. Э. Разработка синтетических материалов для контроля фенотипа стволовых клеток. Курс. мнение хим. биол. 11 , 381–387 (2007).
КАС пабмед ПабМед Центральный Google Scholar
Тиббит М. В. и Ансет К. С. Динамическая микросреда: четвертое измерение. Науч. Перевод Мед. 4 , 4 (2012).
Google Scholar
Lutolf, M.P. & Hubbell, J.A. Синтез и физико-химическая характеристика гидрогелей поли(этиленгликоль)-сопептид с концевыми связями, образованных присоединением типа Михаэля. Биомакромолекулы 4 , 713–722 (2003).
КАС пабмед Google Scholar
Лутольф, М. Р. и др. Репарация костных дефектов синтетическими миметиками коллагеновых внеклеточных матриксов. Нац. Биотехнолог. 21 , 513–518 (2003).
КАС пабмед Google Scholar
Wylie, R.G. et al. Пространственно контролируемое одновременное формирование нескольких факторов роста в трехмерных гидрогелях. Нац. Матер. 10 , 799–806 (2011).
КАС пабмед Google Scholar
ДеФорест, К.А. и Ансет, К.С. Фотообратимое формирование биомолекул в гидрогелях на основе щелчков. Анжю. хим. Междунар. Эд. 51 , 1816–1819 (2012).
КАС Google Scholar
Mosiewicz, K.A. et al. Манипуляции с клетками in situ с помощью ферментативного фотопаттерна гидрогеля. Нац. Матер. 12 , 1071–1077 (2013).
Нац. Матер. 12 , 1071–1077 (2013).
Google Scholar
DeForest, C.A. & Tirrell, D.A. Подход к фотообратимому белковому паттерну для управления судьбой стволовых клеток в трехмерных гелях. Нац. Матер. 14 , 523–531 (2015).
КАС пабмед Google Scholar
Ранга А. и др. Трехмерные нишевые микрочипы для системного анализа клеточных судеб. Нац. коммун. 5 , 10 (2014).
Google Scholar
Ранга, А. и др. Морфогенез нервной трубки в синтетических трехмерных микросредах. Проц. Натл акад. науч. США 113 , E6831–E6839 (2016 г.).
КАС пабмед ПабМед Центральный Google Scholar
Нг, С. С. и др. Прогениторы, полученные из человеческого iPS, биоинженерно встраивают в органоиды печени с использованием каркаса из перевернутого коллоидного кристалла поли(этиленгликоля). Биоматериалы 182 , 299–311 (2018).
Биоматериалы 182 , 299–311 (2018).
КАС пабмед ПабМед Центральный Google Scholar
Shirahama, H. et al. Изготовление каркаса из перевернутого коллоидного кристалла полиэтиленгликоля: трехмерная платформа для культивирования клеток для инженерии ткани печени. Дж. Вис. Опыт . https://doi.org/10.3791/54331 (2016 г.).
Нг, С. С. и др. Долгосрочная культура ткани печени человека с развитыми печеночными функциями. JCI Insight 2 , 11 (2017).
Google Scholar
Овадия, Е. М., Колби, Д. В. и Клоксин, А. М. Разработка четко определенных фотополимерных синтетических матриц для трехмерного культивирования и дифференцировки индуцированных плюрипотентных стволовых клеток. Биоматер. науч. 6 , 1358–1370 (2018).
КАС пабмед ПабМед Центральный Google Scholar

Йоревски Н.и другие. Дизайнерские матрицы для культуры стволовых клеток кишечника и органоидов. Природа 539 , 560–56 (2016).
КАС пабмед Google Scholar
Cruz-Acuna, R. et al. Синтетические гидрогели для образования органоидов кишечника человека и заживления ран толстой кишки. Нац. Клеточная биол. 19 , 1326–132 (2017).
КАС пабмед ПабМед Центральный Google Scholar
Круз-Акуна, Р. и др. Гидрогели PEG-4MAL для создания, культивирования и доставки органоидов человека. Нац. протокол 13 , 2102–2119 (2018).
КАС пабмед ПабМед Центральный Google Scholar
Ди Лулло, Э. и Кригштейн, А. Р. Использование органоидов головного мозга для исследования развития нервной системы и заболеваний. Нац. Преподобный Нейроски. 18 , 573 (2017).
18 , 573 (2017).
ПабМед ПабМед Центральный Google Scholar
Блок, М. Л. и Хонг, Дж. С. Микроглия и опосредованная воспалением нейродегенерация: множественные триггеры с общим механизмом. Прог. Нейробиол. 76 , 77–98 (2005).
КАС пабмед Google Scholar
de Groot, M.W.G.D.M., Westerink, R.H.S. & Dingemans, M.M.L. Не судите о нейроне только по его оболочке: функция нейронов в исследованиях нейротоксичности in vitro. Токсикол.науч. 132 , 1–7 (2012).
ПабМед Google Scholar
Lidsky, T.I. & Schneider, J.S. Нейротоксичность свинца у детей: основные механизмы и клинические корреляты. Мозг 126 , 5–19 (2003).
ПабМед Google Scholar
Schwartz, M. P. et al. Нервные конструкции, полученные из плюрипотентных стволовых клеток человека, для прогнозирования нейротоксичности. Проц. Натл акад. науч. США 112 , 12516–12521 (2015 г.).
P. et al. Нервные конструкции, полученные из плюрипотентных стволовых клеток человека, для прогнозирования нейротоксичности. Проц. Натл акад. науч. США 112 , 12516–12521 (2015 г.).
КАС пабмед ПабМед Центральный Google Scholar
Olson, H. et al. Согласованность токсичности лекарственных средств для человека и животных. Регул. Токсикол. Фармакол. 32 , 56–67 (2000).
КАС пабмед Google Scholar
Патра, Б.и другие. Микрожидкостное устройство для формирования клеточных сфероидов одинакового размера, культивирования, сбора и анализа методом проточной цитометрии. Биомикрофлюидика 7 , 054114 (2013).
Центральный пабмед Google Scholar
Lee, G.H. et al. Сетевые вогнутые микролуночные массивы для построения трехмерных клеточных сфероидов. Биофабрикация 10 , 015001 (2017).
Биофабрикация 10 , 015001 (2017).
ПабМед Google Scholar
Юн, С.-Дж. и другие. Надежность генерации корковых органоидов человека. Нац. Методы 16 , 75–78 (2019).
КАС пабмед Google Scholar
Чен, К., Ренгараджан, В., Кьяр, А. и Хуанг, Ю. Метод без матригеля для создания зрелых мозговых органоидов человека с использованием 3D-печатных массивов микролунок. Биоакт. Матер. 6 , 1130–1139 (2021).
КАС пабмед Google Scholar
Кандиелло, Дж. и др. Создание трехмерных гетерогенных островковых органоидов из эмбриональных стволовых клеток человека с использованием новой инженерной гидрогелевой платформы. Биоматериалы 177 , 27–39 (2018).
КАС пабмед Google Scholar

Рорсман, П. и Браун, М. в Annual Review of Physiology Vol. 75 (изд. Юлиус, Д.) (Ежегодные обзоры, 2013 г.).
Hilderink, J. et al. Контролируемая агрегация первичных клеток островков поджелудочной железы человека приводит к образованию чувствительных к глюкозе псевдоостровков, сравнимых с нативными островками. Дж. Сотовый. Мол. Мед. 19 , 1836–1846 (2015).
КАС пабмед ПабМед Центральный Google Scholar
Li, C.Y. et al. Межклеточные взаимодействия с микроструктурой обеспечивают функциональную инкапсуляцию первичных гепатоцитов в гидрогелевых микротканях. Ткань Eng. Часть A 20 , 2200–2212 (2014 г.).
КАС пабмед ПабМед Центральный Google Scholar
Lee, H.J. et al. Разработка на основе эластичности функционально улучшенной многоклеточной трехмерной печени, инкапсулированной в гибридный гидрогель. Акта Биоматер. 64 , 67–79 (2017).
Акта Биоматер. 64 , 67–79 (2017).
КАС пабмед Google Scholar
Nguyen, E.H. et al. Универсальные синтетические альтернативы Matrigel для скрининга сосудистой токсичности и размножения стволовых клеток. Нац. Биомед. англ. 1 , 14 (2017).
Google Scholar
Хагбард, Л. и др. Разработка определенных субстратов для культивирования и дифференцировки стволовых клеток. Филос. Транс. Р. Соц. Б-Биол. науч. 373 , 9 (2018).
Google Scholar
Hof, K. S. & Bastings, M. M. C. Программируемый контроль в полимерных гидрогелях, имитирующих внеклеточный матрикс. Chimia 71 , 342–348 (2017).
КАС пабмед Google Scholar
Hosseini, Z.F. et al. FGF2-зависимая мезенхима и ламинин-111 являются нишевыми факторами в органоидах слюнных желез. J. Cell Sci. 131 , jcs208728 (2018).
J. Cell Sci. 131 , jcs208728 (2018).
ПабМед ПабМед Центральный Google Scholar
Вихола Х., Лаукканен А., Валтола Л., Тенху Х. и Хирвонен Дж. Цитотоксичность термочувствительных полимеров поли(N-изопропилакриламид), поли(N-винилкапролактам) и амфифильно модифицированные поли(N-винилкапролактам). Биоматериалы 26 , 3055–3064 (2005).
КАС пабмед Google Scholar
Лю, В. А. и Бхатия, С. Н. Трехмерное фотоструктурирование гидрогелей, содержащих живые С-клетки. Биомед. Микроустройства 4 , 257–266 (2002).
КАС Google Scholar
Харкар, П. М., Киик, К. Л. и Клоксин, А.М. Разработка разлагаемых гидрогелей для ортогонального контроля клеточного микроокружения. Хим. соц. Ред. 42 , 7335–7372 (2013).
КАС пабмед ПабМед Центральный Google Scholar
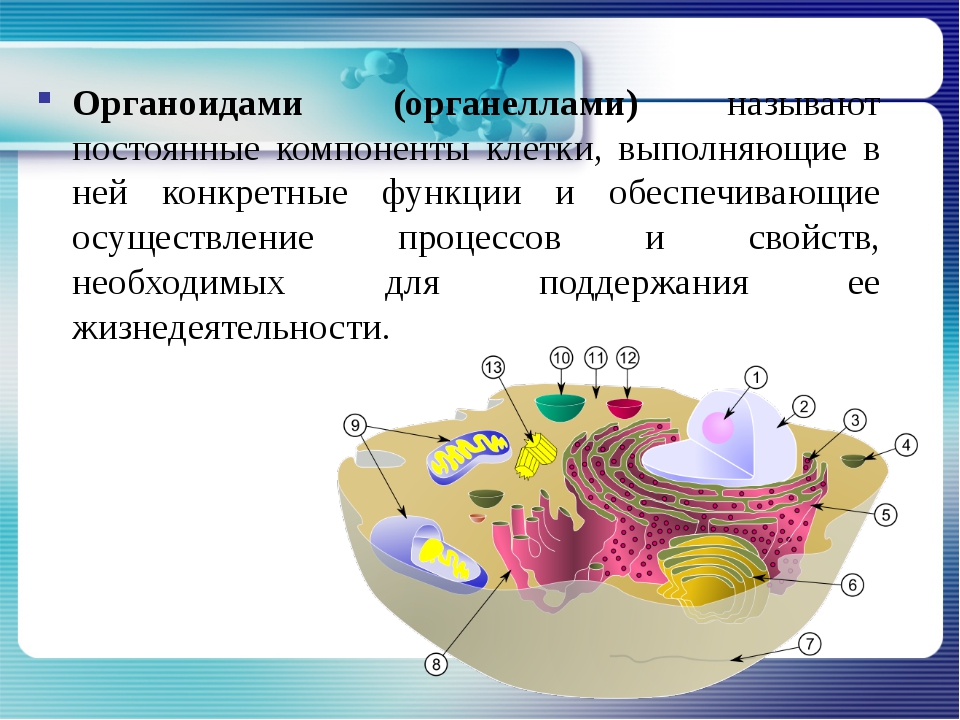
Lowe, A.B. Тиол-еновые «клик-реакции» и недавние применения в синтезе полимеров и материалов. Полим. хим. 1 , 17–36 (2010).
КАС Google Scholar
Андерсон, Дж. М., Родригес, А. и Чанг, Д. Т. Реакция инородного тела на биоматериалы. Семин. Иммунол. 20 , 86–100 (2008).
КАС пабмед Google Scholar
Chung, C., Lampe, K.J. & Heilshorn, S.C. Хлорид тетракис(гидроксиметил)фосфония в качестве ковалентного сшивающего агента для инкапсуляции клеток в гидрогели на белковой основе. Биомакромолекулы 13 , 3912–3916 (2012).
КАС пабмед ПабМед Центральный Google Scholar
Chung, C., Pruitt, B.L. & Heilshorn, S.C. Спонтанная дифференцировка кардиомиоцитов эмбриональных тел мышей, регулируемая плотностью поперечных связей гидрогеля. Биоматер. науч. 1 , 1082–1090 (2013).
Биоматер. науч. 1 , 1082–1090 (2013).
КАС пабмед ПабМед Центральный Google Scholar
ДиМарко, Р.Л., Деви, Р. Э., Бернал, Г., Куок, С. и Хейлсхорн, С. С. Белковые каркасы для трехмерной культуры in vitro первичных кишечных органоидов взрослых. Биоматер. науч. 3 , 1376–1385 (2015).
КАС пабмед Google Scholar
Джин Л. и др. Колониеобразующие клетки в поджелудочной железе взрослых мышей размножаются в матригеле и образуют эндокринные/ацинарные колонии в гидрогеле ламинина. Проц. Натл акад.науч. США 110 , 3907–3912 (2013).
КАС пабмед ПабМед Центральный Google Scholar
Газалли, Н. и др. Постнатальная поджелудочная железа мышей содержит трипотентные предшественники, способные in vitro давать протоковые, ацинарные и эндокринные клетки. Разработка стволовых клеток. 24 , 1995–2008 (2015).
Разработка стволовых клеток. 24 , 1995–2008 (2015).
КАС пабмед ПабМед Центральный Google Scholar
Джин, Л. и др. Колониеобразующие клетки-предшественники в печени и поджелудочной железе постнатальных мышей дают начало морфологически отличным колониям, экспрессирующим инсулин, в 3D-культурах. Рев. Диабет. Стад. 11 , 35–50 (2014).
ПабМед ПабМед Центральный Google Scholar
Джин Л. и др. Клетки с поверхностной экспрессией CD133highCD71low обогащены трипотентными колониеобразующими клетками-предшественниками в поджелудочной железе взрослых мышей. Res. 16 , 40–53 (2016).
КАС пабмед Google Scholar
Zhang, D.W. et al. Трехмерная культуральная модель болезни Альцгеймера и индукция P21-активируемой киназы, опосредованной чувствительностью, в нейронах, полученных из иПСК. Биоматериалы 35 , 1420–1428 (2014).
Биоматериалы 35 , 1420–1428 (2014).
КАС пабмед Google Scholar
Пульезе, Р., Фонтана Ф., Марчини А. и Гелайн Ф. Разветвленные пептиды интегрируются в самособирающиеся наноструктуры и улучшают биомеханику пептидных гидрогелей. Акта Биоматер. 66 , 258–271 (2018).
КАС пабмед Google Scholar
Марчини, А. и др. Многофункциональные гидрогели способствуют созреванию hNSC в 3D-культурах и регенерации нейронов при травмах спинного мозга. Проц. Натл акад. науч.США 116 , 7483–7492 (2019).
КАС пабмед ПабМед Центральный Google Scholar
Edelbrock, A. N. et al. Супрамолекулярная наноструктура активирует передачу сигналов рецептора TrkB нейронных клеток, имитируя нейротрофический фактор головного мозга. Нано Летт. 18 , 6237–6247 (2018).
18 , 6237–6247 (2018).
КАС пабмед ПабМед Центральный Google Scholar
Стефанопулос, Н. и др. Биоактивные ДНК-пептидные нанотрубки усиливают дифференцировку нервных стволовых клеток в нейроны. Нано Летт. 15 , 603–609 (2015).
КАС пабмед Google Scholar
Lee, S. S. et al. Гелевые каркасы из BMP-2-связывающих пептидных амфифильных нановолокон для артродеза позвоночника. Доп. Здоровье. Матер. 4 , 131–141 (2015).
КАС Google Scholar
Berns, E.J. et al. Выровненный рост нейритов и направленная миграция клеток в самособирающихся монодоменных гелях. Биоматериалы 35 , 185–195 (2014).
КАС пабмед Google Scholar
Madl, C.M., Katz, L.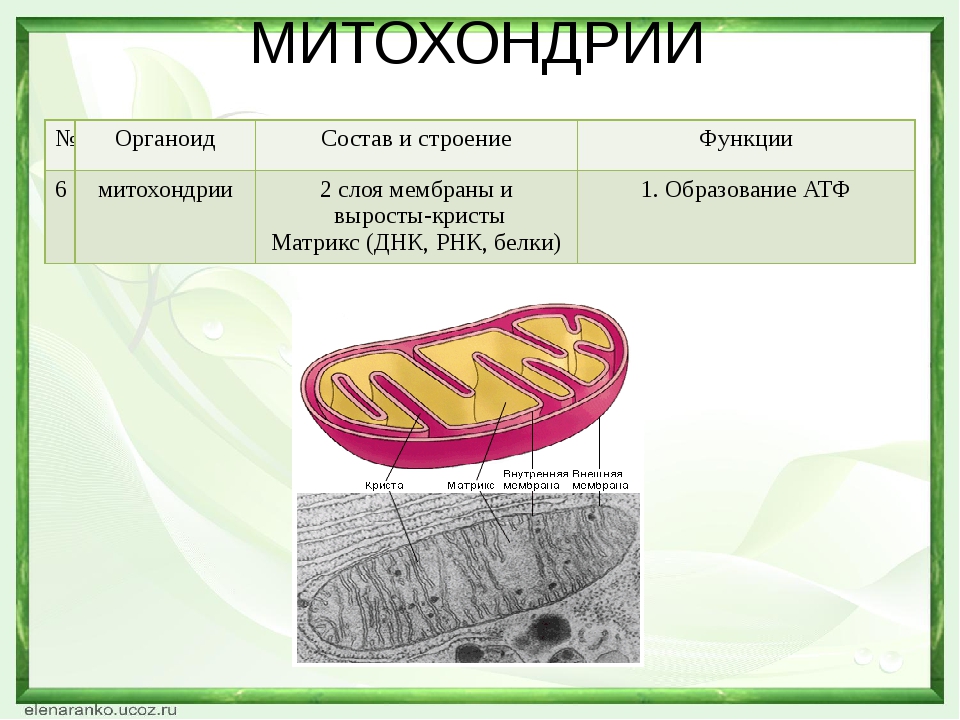 M. & Heilshorn, S.C. Биоортогонально сшитые белковые гидрогели с настраиваемой механикой и биохимией для инкапсуляции клеток. Доп. Функц. Матер. 26 , 3612–3620 (2016).
M. & Heilshorn, S.C. Биоортогонально сшитые белковые гидрогели с настраиваемой механикой и биохимией для инкапсуляции клеток. Доп. Функц. Матер. 26 , 3612–3620 (2016).
КАС пабмед ПабМед Центральный Google Scholar
Liu, X. et al. Универсальные инженерные белковые гидрогели, обеспечивающие несвязанную механическую и биохимическую настройку для клеточной адгезии и роста нейритов. Приложение ACS Нано Матер. 1 , 1579–1585 (2018).
КАС Google Scholar
Дулинг, Л.Дж. и Тиррелл, Д.А. Разработка динамических свойств белковых сетей посредством вариации последовательности. АКЦ Цент. науч. 2 , 812–819 (2016).
КАС пабмед ПабМед Центральный Google Scholar
Galler, K.M., Aulisa, L., Regan, K.R., D’Souza, R.N. & Hartgerink, J. D. Самособирающиеся многодоменные пептидные гидрогели: разработанная восприимчивость к ферментативному расщеплению позволяет улучшить миграцию и распространение клеток. Дж. Ам. хим. соц. 132 , 3217–3223 (2010).
D. Самособирающиеся многодоменные пептидные гидрогели: разработанная восприимчивость к ферментативному расщеплению позволяет улучшить миграцию и распространение клеток. Дж. Ам. хим. соц. 132 , 3217–3223 (2010).
КАС пабмед ПабМед Центральный Google Scholar
Шен, В., Чжан, К. С., Корнфилд, Дж. А. и Тиррелл, Д. А. Настройка скорости эрозии искусственных белковых гидрогелей посредством управления топологией сети. Нац. Матер. 5 , 153–158 (2006).
КАС пабмед Google Scholar
Линк А. Дж., Мок М. Л. и Тиррелл Д. А. Неканонические аминокислоты в белковой инженерии. Курс. мнение Биотехнолог. 14 , 603–609 (2003).
КАС пабмед Google Scholar
Коннор, Р. Э. и Тиррелл, Д. А. Неканонические аминокислоты в дизайне белковых полимеров. Полим. Ред. 47 , 9–28 (2007).
Полим. Ред. 47 , 9–28 (2007).
КАС Google Scholar
Лангер Р. и Тиррелл Д. А. Разработка материалов для биологии и медицины. Природа 428 , 487–492 (2004).
КАС пабмед Google Scholar
Fong, E. & Tirrell, D.A. Коллективная клеточная миграция на белках искусственного внеклеточного матрикса, содержащих домены фибронектина полной длины. Доп. Матер. 22 , 5271–5275 (2010).
КАС пабмед ПабМед Центральный Google Scholar
Ли Н.К., Кирос Ф.Г., Холл С.К., Chilkoti, A. & Yingling, YG. Молекулярное описание поведения LCST эластиноподобного полипептида. Биомакромолекулы 15 , 3522–3530 (2014).
КАС пабмед Google Scholar
MacEwan, S. R. & Chilkoti, A. Эластиноподобные полипептиды: биомедицинские применения перестраиваемых биополимеров. Биополимеры 94 , 60–77 (2010).
R. & Chilkoti, A. Эластиноподобные полипептиды: биомедицинские применения перестраиваемых биополимеров. Биополимеры 94 , 60–77 (2010).
КАС пабмед Google Scholar
Vigneswaran, Y. et al. Эта статья является лауреатом премии SFB в категории стажеров, ординаторов в больницах: пептидные биоматериалы, повышающие адаптивный иммунный ответ в контексте заживления ран. Дж. Биомед. Матер. Рез. Часть A 104 , 1853–1862 (2016 г.).
КАС Google Scholar
Collier, J.H., Rudra, J.S., Gasiorowski, J.Z. & Jung, J.P. Многокомпонентные внеклеточные матрицы на основе самосборки пептидов. Хим. соц. Ред. 39 , 3413–3424 (2010).
КАС пабмед ПабМед Центральный Google Scholar
Розенберг А.С. Эффекты белковых агрегатов: иммунологическая перспектива.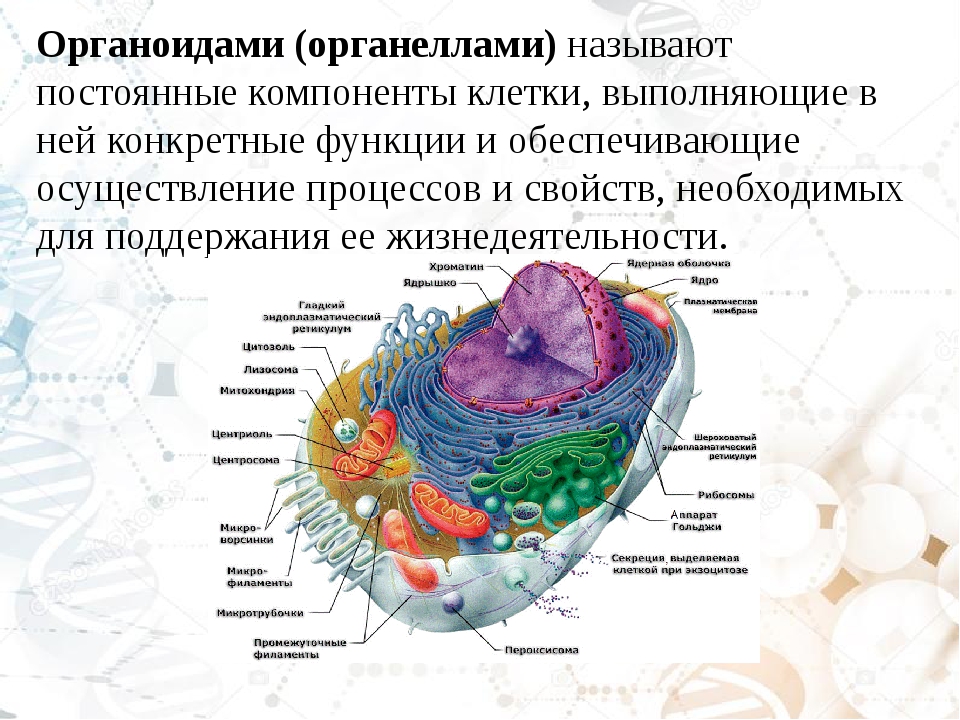 AAPS J. 8 , E501–E507 (2006).
AAPS J. 8 , E501–E507 (2006).
ПабМед ПабМед Центральный Google Scholar
Rudra, J.S. et al. Модулирование адаптивных иммунных ответов на самосборку пептидов. ACS Nano 6 , 1557–1564 (2012).
КАС пабмед ПабМед Центральный Google Scholar
Rudra, J.S., Tian, Y.F., Jung, J.P. & Collier, J.H. Самособирающийся пептид, действующий как иммунный адъювант. Проц. Натл акад. науч. США 107 , 622–627 (2010).
КАС пабмед Google Scholar
Бейкер, М.П., Рейнольдс, Х.М., Лумичиси, Б. и Брайсон, С.Дж. Иммуногенность белковых терапевтических средств: основные причины, последствия и проблемы. Собственный/не свойственный 1 , 314–322 (2010).
ПабМед ПабМед Центральный Google Scholar
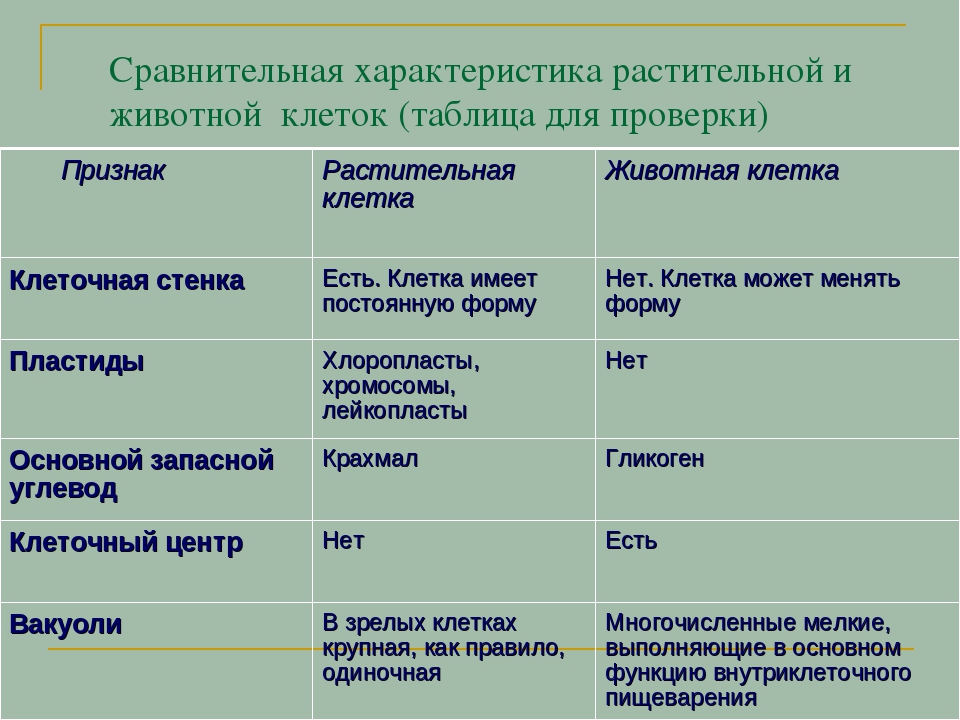
Pagliuca, FeliciaW. и другие. Генерация функциональных β-клеток поджелудочной железы человека in vitro. Cell 159 , 428–439 (2014).
КАС пабмед ПабМед Центральный Google Scholar
Наир, Г.Г. и др. Рекапитуляция кластеров эндокринных клеток в культуре способствует созреванию β-клеток, полученных из стволовых клеток человека. Нац. Клеточная биол. 21 , 263–274 (2019).
КАС пабмед ПабМед Центральный Google Scholar
Organoid – обзор | ScienceDirect Topics
2.1.3 Органоиды
Органоиды представляют собой самоорганизующиеся, самообновляющиеся трехмерные клеточные агрегаты in vitro, полученные из первичной ткани, эмбриональных стволовых клеток или индуцированных плюрипотентных стволовых клеток, которые проявляют органную функциональность (Lancaster and Knoblich, 2014).Органоиды имеют большие перспективы для использования в скрининге лекарств и персонализированной медицине. Количество отчетов по этой теме особенно увеличилось с 2017 года, особенно в области исследований рака. Например, группа Клеверса сообщила об использовании 19 линий органоидов колоректального рака для скрининга 83 препаратов (Van De Wetering et al., 2015), а также об использовании 28 линий органоидов рака молочной железы для скрининга 6 EGFR/AKT/mTOC (эпидермальный ингибиторы пути рецептора фактора роста/протеинкиназы B) (Sachs et al., 2018).Кроме того, органоиды также предлагают технологические платформы для изучения взаимодействия раковых Т-клеток у отдельных пациентов и реакции на иммунотерапию рака. Дейкстра и соавторы продемонстрировали, что совместное культивирование лимфоцитов периферической крови с опухолевыми органоидами, полученными от аутологичных пациентов, является эффективной и беспристрастной стратегией для получения опухоле-реактивных Т-клеток при колоректальном раке с нарушением репарации и немелкоклеточном раке легкого. рак (НМРЛ) (Dijkstra et al., 2018). Эта платформа может быть использована для оценки эффективности опосредованного Т-клетками уничтожения опухоли.
Количество отчетов по этой теме особенно увеличилось с 2017 года, особенно в области исследований рака. Например, группа Клеверса сообщила об использовании 19 линий органоидов колоректального рака для скрининга 83 препаратов (Van De Wetering et al., 2015), а также об использовании 28 линий органоидов рака молочной железы для скрининга 6 EGFR/AKT/mTOC (эпидермальный ингибиторы пути рецептора фактора роста/протеинкиназы B) (Sachs et al., 2018).Кроме того, органоиды также предлагают технологические платформы для изучения взаимодействия раковых Т-клеток у отдельных пациентов и реакции на иммунотерапию рака. Дейкстра и соавторы продемонстрировали, что совместное культивирование лимфоцитов периферической крови с опухолевыми органоидами, полученными от аутологичных пациентов, является эффективной и беспристрастной стратегией для получения опухоле-реактивных Т-клеток при колоректальном раке с нарушением репарации и немелкоклеточном раке легкого. рак (НМРЛ) (Dijkstra et al., 2018). Эта платформа может быть использована для оценки эффективности опосредованного Т-клетками уничтожения опухоли. Оба исследования показывают, что органоиды позволяют проводить скрининг лекарств для проверки концепции и потенциально помогают персонализированной терапии. Тем не менее, вышеупомянутые примеры скрининга лекарств с использованием раковых органоидов имеют относительно низкую пропускную способность, при этом больше внимания уделяется аспекту персонализированной медицины, чем ранней стадии открытия лекарств. Органоиды в принципе поддаются высокопроизводительному скринингу. Однако прогресс был затруднен из-за технических ограничений. Фан и его коллеги представили миниатюрный метод, в котором использовалась упрощенная геометрия путем посева клеток по краям лунок, что позволило проводить автоматический скрининг с высокой пропускной способностью (Фан и др., 2019). В совокупности опухолевые органоидные линии проявляют межпациентную и внутриопухолевую гетерогенность в своих реакциях на лекарства, что позволяет предположить, что органоидная технология может заполнить пробел между генетикой рака и испытаниями на пациентах, дополняя исследования лекарств на основе клеточных линий и ксенотрансплантатов.
Оба исследования показывают, что органоиды позволяют проводить скрининг лекарств для проверки концепции и потенциально помогают персонализированной терапии. Тем не менее, вышеупомянутые примеры скрининга лекарств с использованием раковых органоидов имеют относительно низкую пропускную способность, при этом больше внимания уделяется аспекту персонализированной медицины, чем ранней стадии открытия лекарств. Органоиды в принципе поддаются высокопроизводительному скринингу. Однако прогресс был затруднен из-за технических ограничений. Фан и его коллеги представили миниатюрный метод, в котором использовалась упрощенная геометрия путем посева клеток по краям лунок, что позволило проводить автоматический скрининг с высокой пропускной способностью (Фан и др., 2019). В совокупности опухолевые органоидные линии проявляют межпациентную и внутриопухолевую гетерогенность в своих реакциях на лекарства, что позволяет предположить, что органоидная технология может заполнить пробел между генетикой рака и испытаниями на пациентах, дополняя исследования лекарств на основе клеточных линий и ксенотрансплантатов.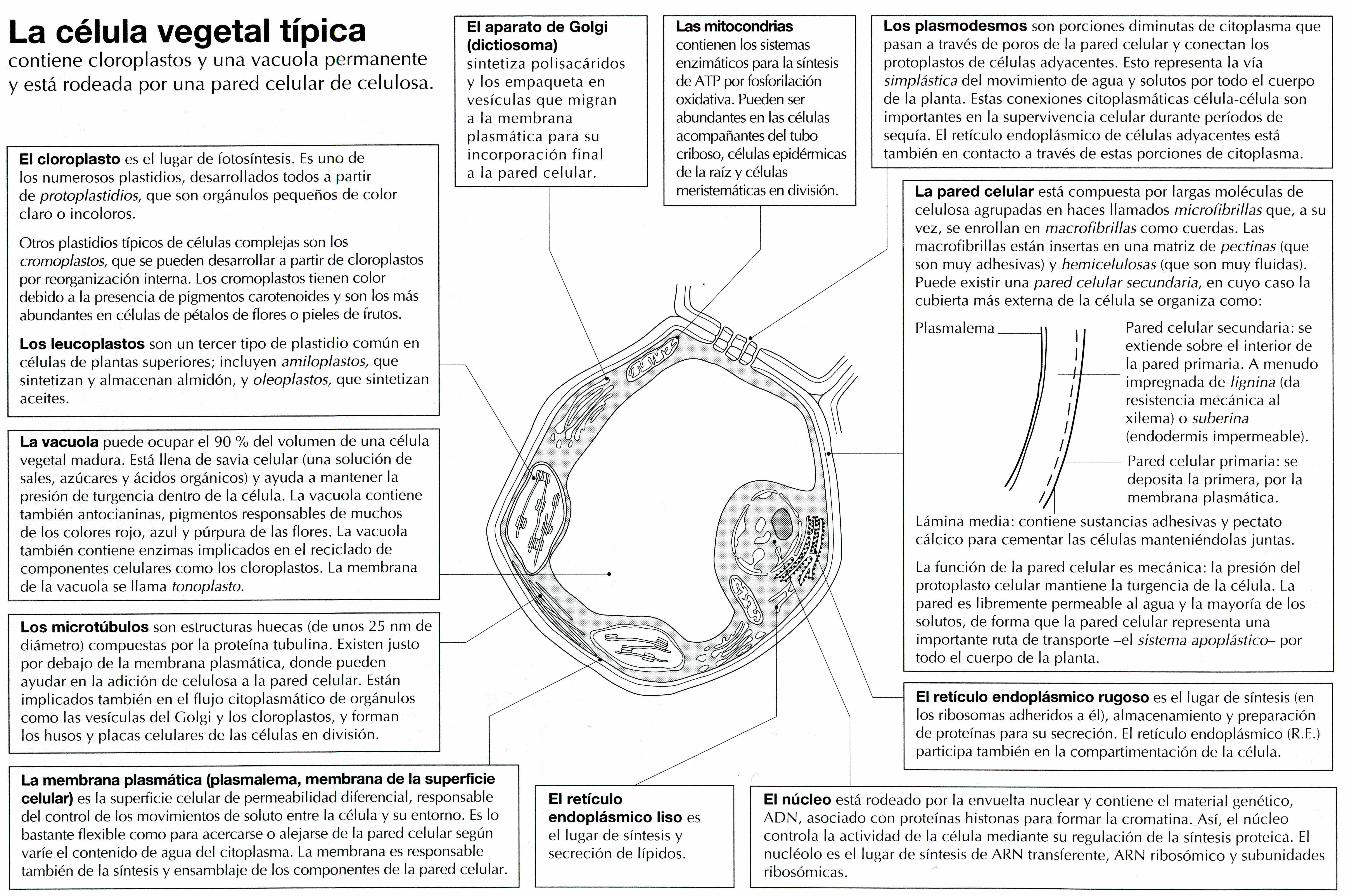
Было также доказано, что органоиды являются полезной экспериментальной вирусологической платформой для изучения инфекционных заболеваний и механизмов, лежащих в основе возбудителей, специфичных для человека. Сопоставимые результаты были получены в отношении способности к репликации, тропизма тканей и продукции цитокинов, вызванных человеческими и птичьими штаммами вируса гриппа А в эксплантатах бронхов и органоидах дыхательных путей человека (Hui et al., 2018). Чжоу и др. сгенерировали долгоживущие органоиды дыхательных путей человека, содержащие реснитчатые клетки, бокаловидные клетки, клубные клетки и базальные клетки, которые подверглись воздействию двух «пар» вирусов, которые, как было показано, обладают аналогичной инфекционностью для пациентов (Zhou et al., 2018). Таким образом, органоиды могут быть полезны для оценки угрозы респираторной пандемии, включая пандемию коронавирусной болезни-19 (COVID-19). Органоиды, инфицированные коронавирусом тяжелого острого респираторного синдрома 2 (SARS-CoV-2), могут моделировать болезнь человека COVID-19 и предоставлять ценный ресурс для скрининга лечения (Clevers, 2020). Органоиды легких, полученные из плюрипотентных стволовых клеток человека (hPSC), использовались для скрининга потенциальных методов лечения COVID-19 и идентифицировали одобренные FDA препараты-кандидаты, включая иматиниб и микофеноловую кислоту, в качестве ингибиторов проникновения SARS-CoV-2, которые могут быть перепрофилированы и рассмотрены. для клинических испытаний COVID-19 (Han et al., 2020). Кроме того, было зарегистрировано три клинических испытания (идентификатор ClinicalTrial.gov: NCT04346147, NCT04357613, NCT04356495) по применению иматиниба для лечения пациентов с COVID-19, что указывает на то, что физиологически значимые органоиды in vitro могут быть полезны. -идущая пандемия.
Органоиды легких, полученные из плюрипотентных стволовых клеток человека (hPSC), использовались для скрининга потенциальных методов лечения COVID-19 и идентифицировали одобренные FDA препараты-кандидаты, включая иматиниб и микофеноловую кислоту, в качестве ингибиторов проникновения SARS-CoV-2, которые могут быть перепрофилированы и рассмотрены. для клинических испытаний COVID-19 (Han et al., 2020). Кроме того, было зарегистрировано три клинических испытания (идентификатор ClinicalTrial.gov: NCT04346147, NCT04357613, NCT04356495) по применению иматиниба для лечения пациентов с COVID-19, что указывает на то, что физиологически значимые органоиды in vitro могут быть полезны. -идущая пандемия.
Кроме того, органоиды могут использоваться для токсикологических испытаний в дополнение, если не частично, вместо испытаний на животных. Например, Такасато и его коллеги разработали почечные органоиды, которые продемонстрировали наибольшую конгруэнтность с человеческой почкой первого триместра и использовались для скрининга токсичности в ответ на цисплатин (Takasato et al. , 2016). Повреждение кишечного эпителия часто связано с различной химиотерапией, лучевой терапией и лекарственной токсичностью. Сообщалось, что кишечные органоиды являются мощными и физиологически значимыми инструментами для изучения клеточной гибели и выживания эпителиальных клеток кишечника, которые служили суррогатной системой для крупномасштабных и средних испытаний лекарств и токсинов in vitro (Grabinger et al., 2014).
, 2016). Повреждение кишечного эпителия часто связано с различной химиотерапией, лучевой терапией и лекарственной токсичностью. Сообщалось, что кишечные органоиды являются мощными и физиологически значимыми инструментами для изучения клеточной гибели и выживания эпителиальных клеток кишечника, которые служили суррогатной системой для крупномасштабных и средних испытаний лекарств и токсинов in vitro (Grabinger et al., 2014).
За последнее десятилетие был достигнут значительный прогресс в области органоидной биологии и ее применения в исследованиях рака, инфекционных заболеваний и токсикологии. Тем не менее, органоиды в значительной степени следует рассматривать как незавершенную работу, потому что большая часть нынешнего энтузиазма вокруг этой технологии основана на их огромном потенциале для доклинических применений, а не на приложениях, для которых они были проверены и показали свое превосходство над альтернативными подходами. (Мид и Карп, 2019).Тем не менее, органоиды, полученные из источников стволовых клеток человека, имеют ряд потенциальных преимуществ, включая более быстрые и надежные результаты; более доступный; и, более анатомически правильно. Несмотря на эти преимущества, у этой технологии все же есть некоторые ограничения. Одним из наиболее актуальных вопросов является изменчивость результатов органоидной технологии. Необходимы стандартизированные протоколы для создания органоидов и контроля качества. Дополнительные соображения, которые необходимо рассмотреть, включают моделирование микроокружения ткани, например межклеточную связь с другими клеточными популяциями и развитие сосудистой сети (Kim et al., 2020).
Несмотря на эти преимущества, у этой технологии все же есть некоторые ограничения. Одним из наиболее актуальных вопросов является изменчивость результатов органоидной технологии. Необходимы стандартизированные протоколы для создания органоидов и контроля качества. Дополнительные соображения, которые необходимо рассмотреть, включают моделирование микроокружения ткани, например межклеточную связь с другими клеточными популяциями и развитие сосудистой сети (Kim et al., 2020).
Органоидная инженерия стволовых клеток
Органоиды были созданы как из плюрипотентных стволовых клеток (ПСК), так и из взрослых стволовых клеток (ИСК) путем имитации биохимических и физических признаков развития тканей и гомеостаза (Lancaster and Knoblich, 2014). В самом упрощенном виде развитие человеческого организма представляет собой точно управляемый процесс ступенчатой дифференцировки из зиготы и последующей самоорганизации образующихся в этом процессе клеток (). Этот процесс может быть частично воспроизведен, когда PSCs формируют тератому, содержащую множество полуорганизованных тканей после неконтролируемой дифференцировки и самоорганизации (Przyborski, 2005).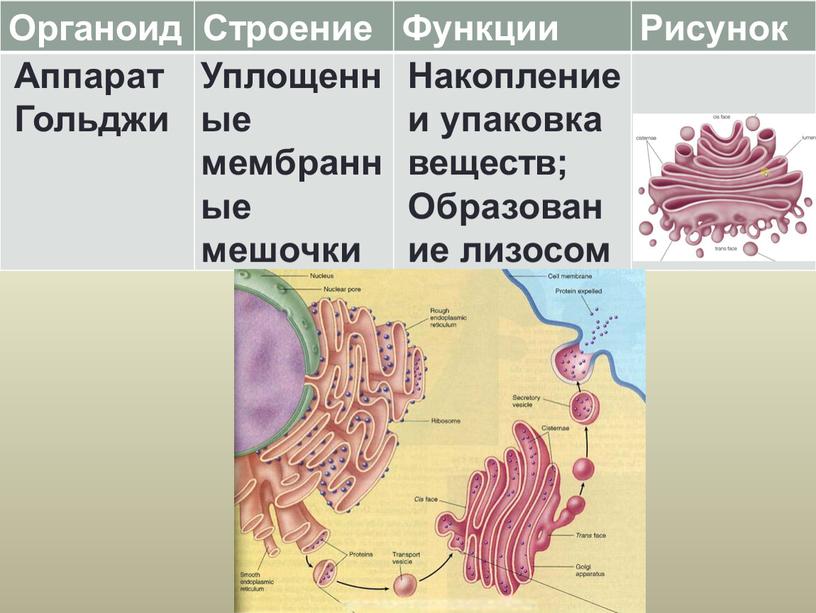 Точно так же этот процесс можно контролировать in vitro с помощью PSCs, индуцированных для дифференциации вниз по специфическим клонам. При наличии надлежащего трехмерного каркаса и биохимических факторов дифференцированные клетки из ПСК будут самоорганизоваться с образованием тканеспецифических органоидов, включая глазной бокал (Eiraku et al., 2011), мозг (Lancaster et al., 2013), кишечник (Spence et al., 2011), печени (Takebe et al., 2013) и почках (Takasato et al., 2014). Кроме того, гомеостаз многих тканей in vivo поддерживается тканеспецифичными ASC посредством самообновления и дифференцировки с последующей самоорганизацией стволовых клеток и их потомства.Этот процесс также может быть воспроизведен in vitro в определенных условиях культивирования для контроля самообновления и дифференцировки, что приводит к самоорганизации тканевых органоидов, включая кишечник (Sato et al., 2009), желудок (Barker et al., 2010), печень ( Huch et al., 2013) и поджелудочной железы (Huch et al., 2013).
Точно так же этот процесс можно контролировать in vitro с помощью PSCs, индуцированных для дифференциации вниз по специфическим клонам. При наличии надлежащего трехмерного каркаса и биохимических факторов дифференцированные клетки из ПСК будут самоорганизоваться с образованием тканеспецифических органоидов, включая глазной бокал (Eiraku et al., 2011), мозг (Lancaster et al., 2013), кишечник (Spence et al., 2011), печени (Takebe et al., 2013) и почках (Takasato et al., 2014). Кроме того, гомеостаз многих тканей in vivo поддерживается тканеспецифичными ASC посредством самообновления и дифференцировки с последующей самоорганизацией стволовых клеток и их потомства.Этот процесс также может быть воспроизведен in vitro в определенных условиях культивирования для контроля самообновления и дифференцировки, что приводит к самоорганизации тканевых органоидов, включая кишечник (Sato et al., 2009), желудок (Barker et al., 2010), печень ( Huch et al., 2013) и поджелудочной железы (Huch et al., 2013).
В процессе формирования органоидов используется ряд общих факторов для контроля самообновления и дифференцировки стволовых клеток или содействия самоорганизации. Факторы роста или малые молекулы используются для манипулирования несколькими сигнальными путями, важными для выживания, пролиферации и самообновления клеток, часто тканеспецифическим образом.В паре с биохимическими сигналами Matrigel является общим и важным компонентом системы, которая обеспечивает каркас и дополнительное дополнение сигнальных сигналов через лиганды базальной мембраны для поддержки прикрепления и выживания клеток, а также образования органоидов (Xu et al., 2001). Часто органоидные системы регулируются микроокружением (или нишей) стволовых клеток, которое они поддерживают, что обеспечивает точку контроля. Ниша стволовых клеток содержит широкий спектр элементов, включая биохимические и биофизические сигналы, межклеточные взаимодействия и взаимодействие внеклеточного матрикса (ECM) (Li and Xie, 2005).Современные органоидные системы в основном полагаются на внутренние или внешние биохимические сигналы (например, факторы роста) и клеточно-автономные или межклеточные взаимодействия для управления судьбой стволовых клеток.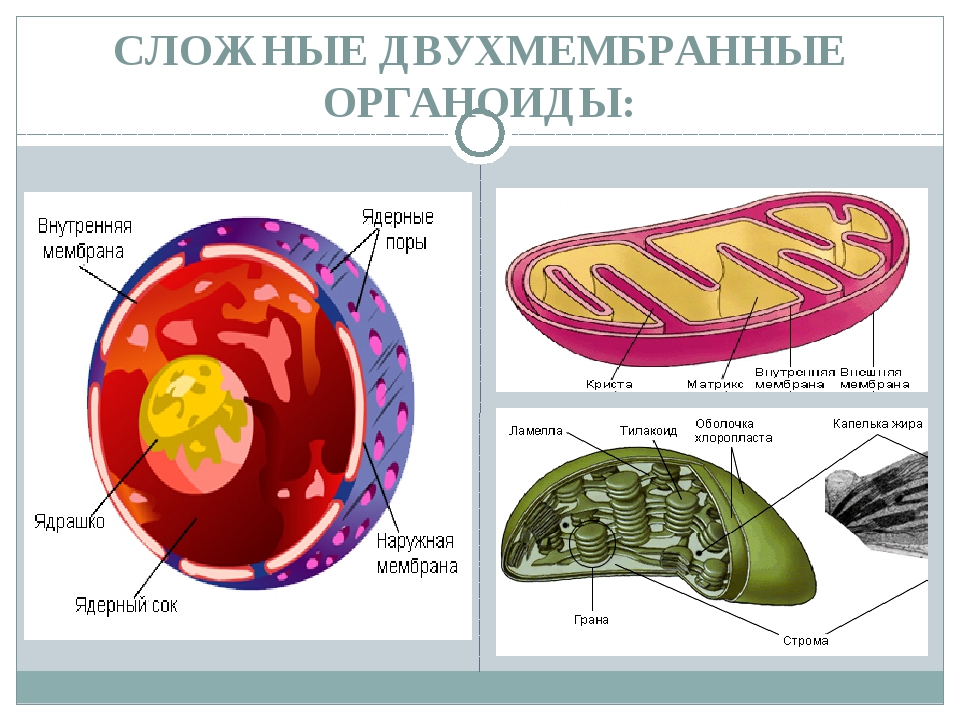 Хотя все это важные факторы для контроля дифференцировки и организации клеток, образование органоидов сильно зависит от клеточно-автономной самоорганизации (Lancaster and Knoblich, 2014), которую еще нелегко контролировать.
Хотя все это важные факторы для контроля дифференцировки и организации клеток, образование органоидов сильно зависит от клеточно-автономной самоорганизации (Lancaster and Knoblich, 2014), которую еще нелегко контролировать.
Во время создания систем моделей органоидов для управления поведением и организацией органоидов стало доступно несколько биоинженерных подходов, которые были разработаны в других областях, включая инженерию ниш стволовых клеток и инженерию тканей.Здесь мы обсудим эти стратегии и приведем примеры того, как биоинженерные подходы могут использоваться для усиления контроля над поведением органоидов, от инструментов на субклеточном уровне до инструментов, влияющих на физиологию систем.
Биоинженерные органоидные системы
Органоидные системы представляют собой одну из наиболее многообещающих платформ для использования стволовых клеток, особенно потому, что они способны воспроизвести многие важные свойства ниши стволовых клеток и полученной из нее ткани.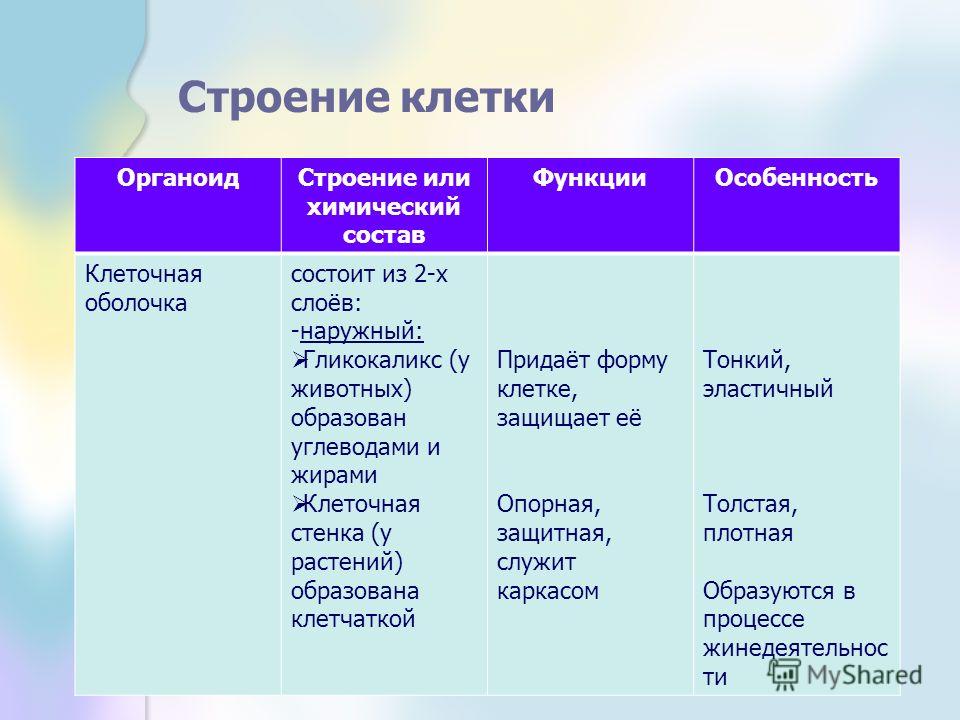 Однако, как и в любой модельной системе, остаются пробелы между in vitro и in vivo, которые можно частично устранить с помощью направленных усилий биоинженерии.Эти усилия могут повысить полезность органоидов при скрининге лекарств, регенеративной терапии или исследованиях физиологических и патологических процессов. Биоинженерные подходы также могут применяться для разработки восходящих синтетических органоидных конструкций или мультиплексных органоидных компонентов, что позволяет улучшить управление системой и разработать дополнительные модели для основных и трансляционных исследований ниши стволовых клеток и органоидов.
Однако, как и в любой модельной системе, остаются пробелы между in vitro и in vivo, которые можно частично устранить с помощью направленных усилий биоинженерии.Эти усилия могут повысить полезность органоидов при скрининге лекарств, регенеративной терапии или исследованиях физиологических и патологических процессов. Биоинженерные подходы также могут применяться для разработки восходящих синтетических органоидных конструкций или мультиплексных органоидных компонентов, что позволяет улучшить управление системой и разработать дополнительные модели для основных и трансляционных исследований ниши стволовых клеток и органоидов.
Органоидные системы используют способность стволовых клеток к самообновлению и дифференцировке, а также внутреннюю способность к самоорганизации для формирования организованных структур.В то время как стволовые клетки являются «рабочей лошадкой» органоидной системы, поведение стволовых клеток контролируется микроокружением. В органоидах нишевые компоненты образуются клетками (например, в случае аутокринных, паракринных или юкстакринных сигналов) или экзогенно добавляются в систему (например, в случае субстратов ВКМ, малых молекул и факторов роста). Их взаимодействие создает динамическую среду по структуре и функциям, которая координируется в пространстве и времени и обеспечивает самообновление/дифференциацию стволовых клеток и самосборку клеток в органоиды.Чтобы улучшить контроль над органоидами и дополнительно модулировать систему для последующих приложений, необходимы систематические инженерные подходы для манипулирования каждым структурным слоем в процессе формирования органоидов. Это может быть достигнуто за счет модуляции клеток, генерируемых за счет контроля самообновления и дифференцировки стволовых клеток, за счет прямой модификации стволовых клеток или за счет косвенного контроля за ними посредством манипулирования микроокружением, а также за счет модуляции организации клеток в системе.Недавние достижения в области биоматериалов, микро/нанотехнологий и сборки тканей, управляемой стволовыми клетками, позволили значительно продвинуться в направлении таких систем. Комбинируя новые подходы из этих областей, можно будет создавать микросреды, которые напоминают структуру и функции in vivo, создавая несколько динамичных и самособирающихся органоидных тканей.
Их взаимодействие создает динамическую среду по структуре и функциям, которая координируется в пространстве и времени и обеспечивает самообновление/дифференциацию стволовых клеток и самосборку клеток в органоиды.Чтобы улучшить контроль над органоидами и дополнительно модулировать систему для последующих приложений, необходимы систематические инженерные подходы для манипулирования каждым структурным слоем в процессе формирования органоидов. Это может быть достигнуто за счет модуляции клеток, генерируемых за счет контроля самообновления и дифференцировки стволовых клеток, за счет прямой модификации стволовых клеток или за счет косвенного контроля за ними посредством манипулирования микроокружением, а также за счет модуляции организации клеток в системе.Недавние достижения в области биоматериалов, микро/нанотехнологий и сборки тканей, управляемой стволовыми клетками, позволили значительно продвинуться в направлении таких систем. Комбинируя новые подходы из этих областей, можно будет создавать микросреды, которые напоминают структуру и функции in vivo, создавая несколько динамичных и самособирающихся органоидных тканей.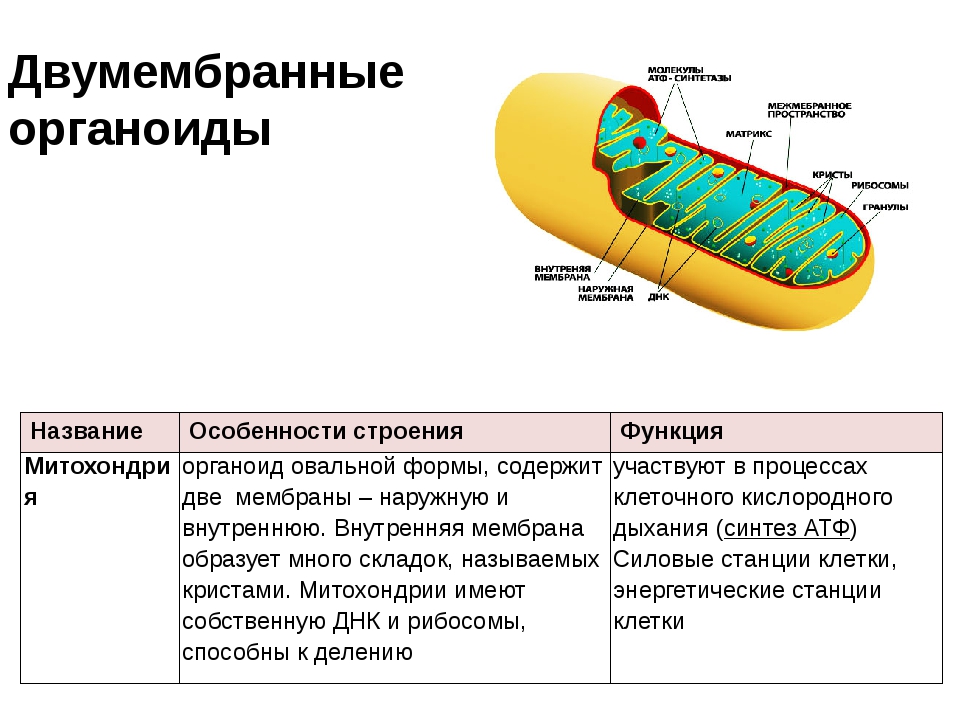
Проектирование ниши
Поведение стволовых клеток in vivo строго регулируется посредством внешних биохимических и биофизических сигналов от специализированных микроокружений.Эти микроокружения состоят из сложного множества сигнальных механизмов от поддерживающих нишу клеток, внеклеточного матрикса и механических сил, а также системных и физико-химических условий, таких как уровни кислорода и рН. Компоненты, составляющие динамическую среду, интегрируют устойчивые и быстрые краткосрочные сигналы, чтобы либо поддерживать состояние покоя стволовых клеток, либо вместо этого индуцировать пути развития или регенеративные ответы. В дополнение к этому, ниша может реконструироваться и управляться составляющими ее стволовыми клетками.Разработка биомиметической системы, которая включает каждый из этих сигнальных путей и взаимодействий, позволит лучше контролировать рост и дифференцировку стволовых клеток in vitro и позволит манипулировать ими в соответствии с предполагаемым применением.
Индивидуальные биомиметические каркасы
ВКМ является одним из основных компонентов ниши стволовых клеток, обеспечивая структурную поддержку и опосредуя инструктивную передачу сигналов для поляризации, удержания и мобилизации клеток (Peerani and Zandstra, 2010).Компоненты ВКМ, такие как ламинин, фибронектин и коллаген, составляют физическую основу тканей и также влияют на поведение клеток, задействуя их интегриновые рецепторы (Vazin and Schaffer, 2010). Несколько подходов могут быть использованы для имитации нативного ECM ниши стволовых клеток или зрелой ткани, включая 3D-каркасы с микро- или наноразмерной топографией, для производства индивидуальных биоматериалов (Peerani and Zandstra, 2010). В качестве альтернативы каркасы ECM также могут быть получены из децеллюляризованных матриц.Напр., при достижении слияния in vitro лежащий в основе ECM матрикс стромальных клеток костного мозга может быть децеллюляризирован и использован для имитации эндостальных или сосудистых ниш вместе с соответствующими факторами роста (Tan and Barker, 2013).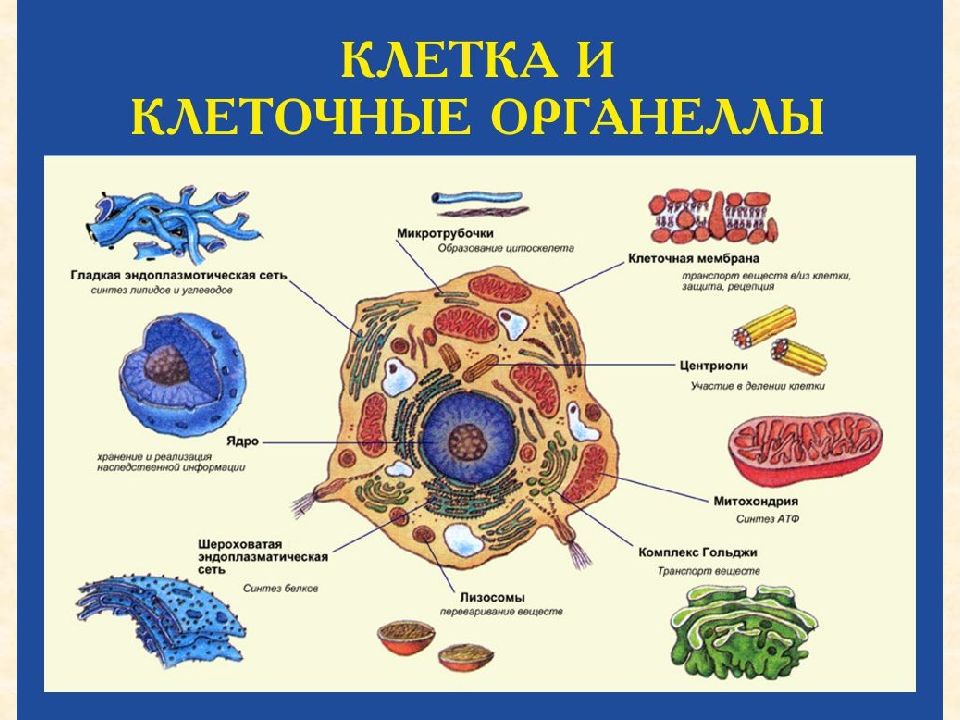
Недавно введенные органоиды, полученные из стволовых клеток, использовались для имитации аспектов органогенеза человека и достигли заметного морфологического сходства с их природными аналогами (Eiraku et al., 2011; Lancaster et al., 2013; Stange et al., 2009). .Матригель часто является важным компонентом органоидной культуры. Однако при использовании Matrigel, который, как правило, не имеет четкого определения, игнорируются специфические сигналы ECM, необходимые для различных типов тканей. Кроме того, учитывая его гетерогенный состав, он не позволяет легко манипулировать морфогенетическими процессами, которые строго регулируются in vivo специфическими пространственно-временными сигналами. В качестве альтернативы, основные сигналы от природных ECM могут быть включены в синтетические полимерные матрицы для создания дизайнерских ECM со специально подобранными составами.Например, гликозаминогликаны, такие как гиалуроновая кислота (ГК), являются важными молекулами ВКМ, которые, как было показано, играют важную роль в модуляции поведения нервных стволовых клеток (НСК) и гемопоэтических стволовых клеток (ГСК) в своей нише (Vazin and Schaffer, 2010).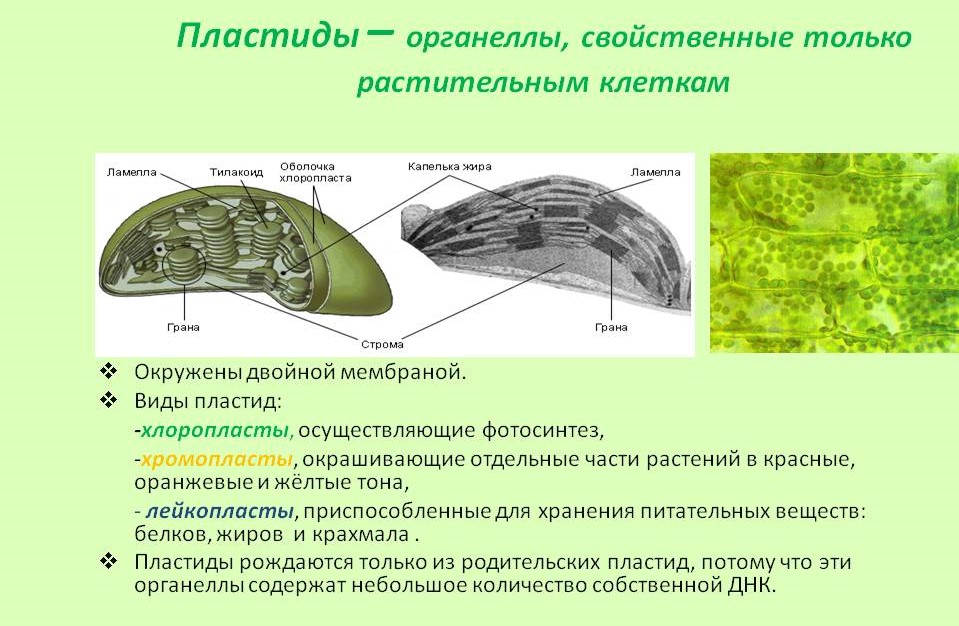 что делает их потенциально подходящими компонентами систем на основе биоматериалов для имитации структуры ниши НСК и ГСК. Биомиметические каркасы могут быть сконструированы либо из синтетических полимеров (таких как полиакриламины и полиэтиленгликоль [ПЭГ]), либо из природных макромолекул (например, агарозы или коллагена), которые затем можно использовать, чтобы сделать их допускающими биологические процессы.Например, биомиметический гидрогелевый каркас, сконструированный из пуллулана (полисахаридного полимера) в комплексе с коллагеном для имитации ECM эпидермальной ниши, был способен усиливать васкуляризацию и заживление при доставке МСК в места ран (Rustad et al., 2012). Несмотря на этот прогресс, синтетические каркасы остаются примитивными по сравнению с такими субстратами, как Matrigel, и им не хватает критического динамического свойства клеточного ремоделирования.
что делает их потенциально подходящими компонентами систем на основе биоматериалов для имитации структуры ниши НСК и ГСК. Биомиметические каркасы могут быть сконструированы либо из синтетических полимеров (таких как полиакриламины и полиэтиленгликоль [ПЭГ]), либо из природных макромолекул (например, агарозы или коллагена), которые затем можно использовать, чтобы сделать их допускающими биологические процессы.Например, биомиметический гидрогелевый каркас, сконструированный из пуллулана (полисахаридного полимера) в комплексе с коллагеном для имитации ECM эпидермальной ниши, был способен усиливать васкуляризацию и заживление при доставке МСК в места ран (Rustad et al., 2012). Несмотря на этот прогресс, синтетические каркасы остаются примитивными по сравнению с такими субстратами, как Matrigel, и им не хватает критического динамического свойства клеточного ремоделирования.
Синтетическая среда может быть сконструирована таким образом, чтобы более точно воспроизвести природный внеклеточный матрикс, путем декорирования биоинертных матриц сигнальными белками посредством химического/ферментативного сшивания через адгезивные или протеолитически расщепляемые участки.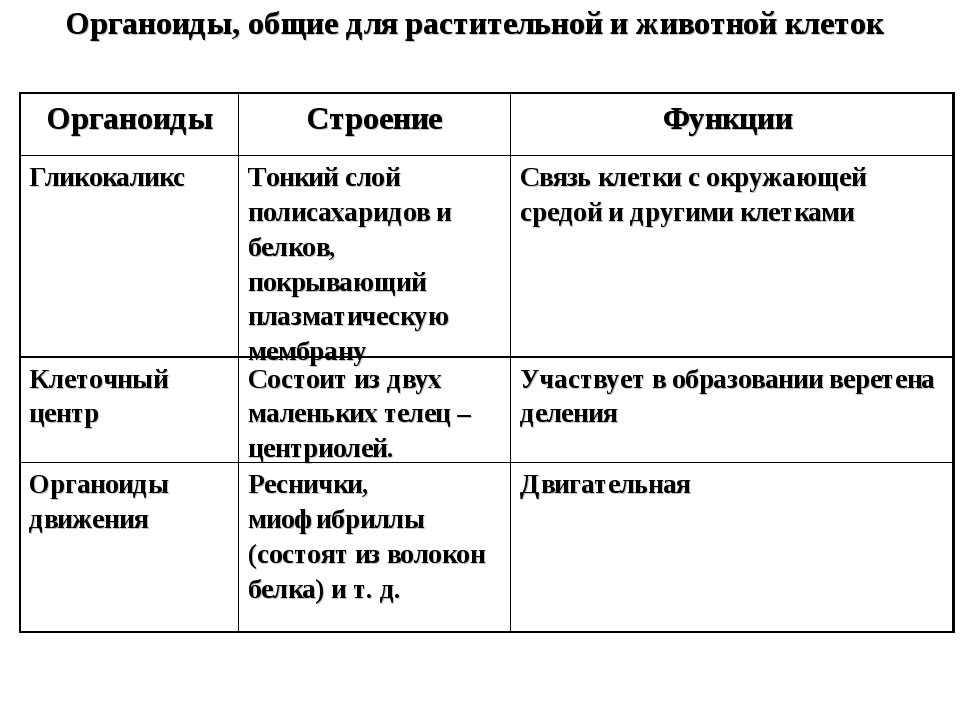 Высокопроизводительный скрининг таких платформ позволит анализировать несколько переменных, чтобы определить, какая комбинация сигналов наиболее подходит для модулирования активности стволовых клеток, и помочь разработать синтетические аналоги ECM для получения желаемого ответа. Клеточные микроматрицы способны выполнять такой высокопроизводительный анализ. Привязывая сигналы микросреды, такие как компоненты ECM, растворимые факторы и белки межклеточного взаимодействия, к дискретным местам, можно создать множество искусственных каркасов (Gjorevski et al., 2014; Гобаа и др., 2011). Другим методом обеспечения соответствующей поддержки ECM и сигнальных сигналов является микроконтактная печать. Этот метод непосредственно наносит белки, ECM или клетки на частично полимеризованный гидрогелевый субстрат. Это делается с помощью штампа, часто состоящего из поли(диметилсилоксана) (PDMS) с использованием техники мягкой литографии (Perl et al., 2009). Однако морфогенез и органогенез по своей сути являются трехмерными процессами, и, таким образом, их внешняя регуляция не может быть полностью понята при двумерном анализе.
Высокопроизводительный скрининг таких платформ позволит анализировать несколько переменных, чтобы определить, какая комбинация сигналов наиболее подходит для модулирования активности стволовых клеток, и помочь разработать синтетические аналоги ECM для получения желаемого ответа. Клеточные микроматрицы способны выполнять такой высокопроизводительный анализ. Привязывая сигналы микросреды, такие как компоненты ECM, растворимые факторы и белки межклеточного взаимодействия, к дискретным местам, можно создать множество искусственных каркасов (Gjorevski et al., 2014; Гобаа и др., 2011). Другим методом обеспечения соответствующей поддержки ECM и сигнальных сигналов является микроконтактная печать. Этот метод непосредственно наносит белки, ECM или клетки на частично полимеризованный гидрогелевый субстрат. Это делается с помощью штампа, часто состоящего из поли(диметилсилоксана) (PDMS) с использованием техники мягкой литографии (Perl et al., 2009). Однако морфогенез и органогенез по своей сути являются трехмерными процессами, и, таким образом, их внешняя регуляция не может быть полностью понята при двумерном анализе.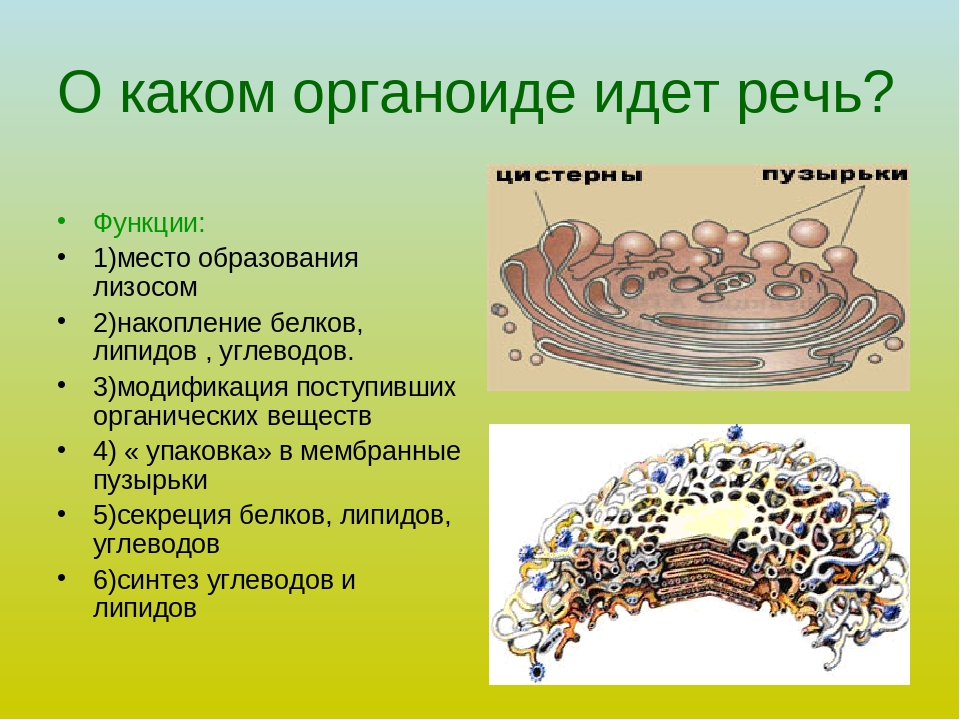 Недавно эта технология была распространена на платформу 3D-микрочипов (Ranga et al., 2014), обеспечивая высокопроизводительный метод выявления влияния сигнальных белков, а также эластичности и способности к деградации матрикса на регуляцию стволовых клеток в пространственно значимом контексте. . Достижение конструкции ECM, которая имеет физиологически значимую топографию, также важно. Стратегии нанолитографии, такие как электроспиннинг, электронно-лучевая литография, наноимпринтная литография и селективное травление, использовались для формирования нановолокнистых подложек, наноямок, наностолбиков или наноканалов на различных материалах.Электронно-лучевая литография использует управляемую компьютером электронную пушку для сканирования поверхности подложек, создавая узоры с наноразмерным разрешением, в то время как электропрядение используется для производства сверхтонких волокон, которые могут образовывать случайно ориентированные волокнистые сетки, подходящие для каркаса тканевой инженерии.
Недавно эта технология была распространена на платформу 3D-микрочипов (Ranga et al., 2014), обеспечивая высокопроизводительный метод выявления влияния сигнальных белков, а также эластичности и способности к деградации матрикса на регуляцию стволовых клеток в пространственно значимом контексте. . Достижение конструкции ECM, которая имеет физиологически значимую топографию, также важно. Стратегии нанолитографии, такие как электроспиннинг, электронно-лучевая литография, наноимпринтная литография и селективное травление, использовались для формирования нановолокнистых подложек, наноямок, наностолбиков или наноканалов на различных материалах.Электронно-лучевая литография использует управляемую компьютером электронную пушку для сканирования поверхности подложек, создавая узоры с наноразмерным разрешением, в то время как электропрядение используется для производства сверхтонких волокон, которые могут образовывать случайно ориентированные волокнистые сетки, подходящие для каркаса тканевой инженерии. Другие методы включают литографию с наноотпечатком (вдавливание жесткой формы в слой нагретого полимера) и селективное травление (с использованием химического травителя для придания шероховатости поверхности). Эти стратегии использовались для создания поверхностных элементов, которые приближаются к естественной форме и размерам волокна базальной мембраны и размерам пор, а также имитируют пористость природного ECM.Было показано, что эти механизмы поддерживают самообновление эмбриональных стволовых клеток человека и контролируют дифференцировку MSC человека, основываясь на различных конфигурациях этих поверхностей (Murphy et al., 2014).
Другие методы включают литографию с наноотпечатком (вдавливание жесткой формы в слой нагретого полимера) и селективное травление (с использованием химического травителя для придания шероховатости поверхности). Эти стратегии использовались для создания поверхностных элементов, которые приближаются к естественной форме и размерам волокна базальной мембраны и размерам пор, а также имитируют пористость природного ECM.Было показано, что эти механизмы поддерживают самообновление эмбриональных стволовых клеток человека и контролируют дифференцировку MSC человека, основываясь на различных конфигурациях этих поверхностей (Murphy et al., 2014).
Механическая передача сигналов окружающими тканями также играет важную роль в модуляции клеточного поведения in vivo. Отсутствие таких сил in vitro может объяснить важные морфологические различия, такие как отсутствие образования ворсинок в кишечных органоидах (Gjorevski et al., 2014; Шайер и др., 2013). Для динамической настройки механических свойств микроокружения можно использовать светоопосредованную технологию формирования паттернов.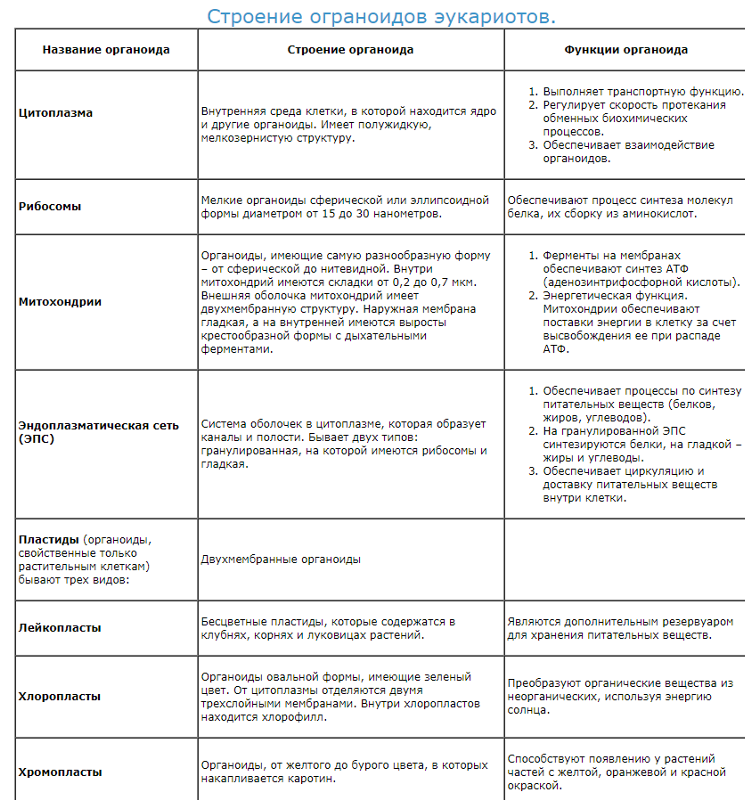 Гидрогель ПЭГ, содержащий фотолабильные поперечные связи, может подвергаться локальной деградации под воздействием света, что приводит к размягчению геля. В качестве альтернативы, при включении в гель фотоинициаторов, попадание света на определенные области вызовет дополнительное сшивание и локальное повышение жесткости (Guvendiren and Burdick, 2012). Эти светозависимые стратегии также могут быть реализованы для создания градиентов жесткости с микромасштабным разрешением.Путем фотомаскирования сшитых УФ-материалов количество света можно использовать для воссоздания естественных изменений жесткости в искусственной матрице (Vincent et al., 2013).
Гидрогель ПЭГ, содержащий фотолабильные поперечные связи, может подвергаться локальной деградации под воздействием света, что приводит к размягчению геля. В качестве альтернативы, при включении в гель фотоинициаторов, попадание света на определенные области вызовет дополнительное сшивание и локальное повышение жесткости (Guvendiren and Burdick, 2012). Эти светозависимые стратегии также могут быть реализованы для создания градиентов жесткости с микромасштабным разрешением.Путем фотомаскирования сшитых УФ-материалов количество света можно использовать для воссоздания естественных изменений жесткости в искусственной матрице (Vincent et al., 2013).
Приспособляемость к клеточным модификациям
Важным шагом на пути к созданию материалов, которые могут взаимодействовать с клетками, является разработка биоактивных интерфейсов, которые обеспечивают как специфичность, так и гибкость. Для этого материалы и поверхности должны быть рационально спроектированы, чтобы придать им определенные биофункциональные свойства.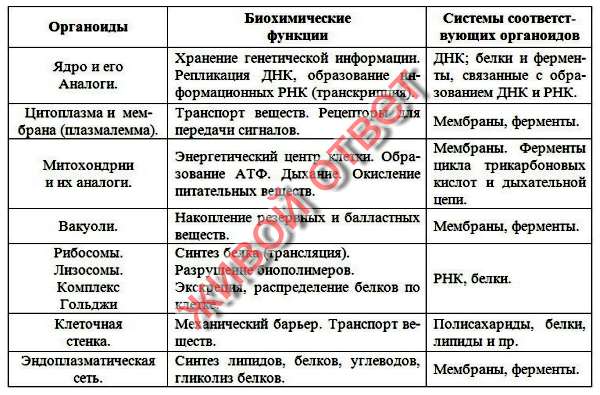 Например, для конструирования стимулирующих рост поверхностей можно использовать общие мотивы клеточной адгезии, такие как RGD (аргинин-глицин-аспарагиновая кислота), или более специфичные для клеток белки, способствующие адгезии, и комплементарные рецепторы для взаимодействия с клеточными интегринами и стимулирования адгезии и распространение. Однако такие материалы также должны быть способны приспосабливаться к изменениям, вызванным клеточной активностью, которую они содержат.
Например, для конструирования стимулирующих рост поверхностей можно использовать общие мотивы клеточной адгезии, такие как RGD (аргинин-глицин-аспарагиновая кислота), или более специфичные для клеток белки, способствующие адгезии, и комплементарные рецепторы для взаимодействия с клеточными интегринами и стимулирования адгезии и распространение. Однако такие материалы также должны быть способны приспосабливаться к изменениям, вызванным клеточной активностью, которую они содержат.
Клетки могут активно модифицировать поверхность, поскольку они проходят быстрые и динамичные процессы клеточной адгезии и роста.В рамках естественного процесса роста клетки после прилипания начинают стягиваться и перестраивать связанные с поверхностью биомолекулы. На искусственной поверхности, где лиганды ковалентно связаны, этот процесс затруднен. Чтобы решить эту проблему, мотивы адгезии, такие как RGD, могут быть связаны с материальными поверхностями с помощью длинных гибких нитей, позволяющих клетке стягивать их в кластеры (Kuhlman et al. , 2007). Искусственные системы, которые включают тщательно организованные белки, также подвержены ферментативному расщеплению, поскольку клетки пытаются реконструировать окружающий их ВКМ для миграции или роста.Можно прививать более короткие полипептиды, менее подверженные протеолизу. Тем не менее, альтернативным подходом может быть разработка преднамеренно разлагаемых материалов, в которых используются секретируемые клетками протеазы. Например, сшивая полимеры, такие как ПЭГ, с синтетическими пептидами, распознаваемыми клеточными протеазами, можно контролировать точку расщепления. Деградация каркаса, опосредованная самой клеткой, может использоваться для стимуляции миграции клеток в заранее заданной ориентации (Raeber et al., 2005).
, 2007). Искусственные системы, которые включают тщательно организованные белки, также подвержены ферментативному расщеплению, поскольку клетки пытаются реконструировать окружающий их ВКМ для миграции или роста.Можно прививать более короткие полипептиды, менее подверженные протеолизу. Тем не менее, альтернативным подходом может быть разработка преднамеренно разлагаемых материалов, в которых используются секретируемые клетками протеазы. Например, сшивая полимеры, такие как ПЭГ, с синтетическими пептидами, распознаваемыми клеточными протеазами, можно контролировать точку расщепления. Деградация каркаса, опосредованная самой клеткой, может использоваться для стимуляции миграции клеток в заранее заданной ориентации (Raeber et al., 2005).
Пространственно-временной контроль
В дополнение к созданию каркаса для трехмерной культуры, который может вместить синтетические аналоги взаимодействий клеток и ВКМ, крайне важно интегрировать другие нишевые компоненты для культивирования стволовых клеток in vitro для стимулирования образования органоидов.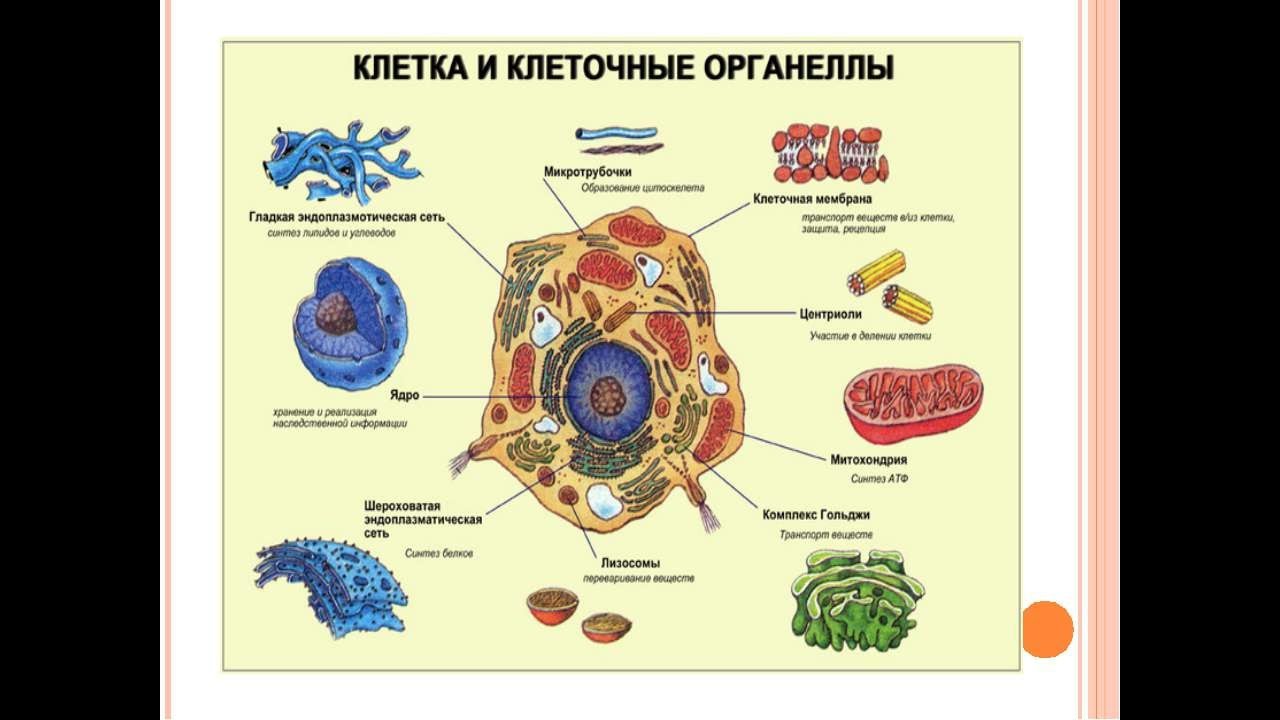 Основная проблема при создании искусственного каркаса in vitro заключается в том, чтобы точно воспроизвести пространственное представление сигналов клеткам. В традиционных трехмерных культурах клетки наполнены биохимическими сигналами без какого-либо пространственно-временного контроля.Это приводит к основным различиям, наблюдаемым между органогенезом in vivo и in vitro. Недавние достижения дали уникальные подходы для преодоления этого ограничения путем манипулирования ECM с использованием светоопосредованного формирования паттернов. Например, путем включения участков связывания биомолекул в гидрогель и маскирования их активных участков фоторазлагаемым фрагментом можно было контролировать миграцию МСК внутри гидрогеля ПЭГ (Gjorevski et al., 2014; Kloxin et al., 2009). . Свет высвобождает активный субстрат трансглютаминазного фактора XIII (FXIIIa), позволяя белкам внеклеточного матрикса и факторам роста быть привязанными к матриксу на основе индуцированного светом паттерна.Этот механизм предлагает мощный инструмент для управления точным шаблоном, местоположением и временем, когда сигнал может быть представлен ячейке.
Основная проблема при создании искусственного каркаса in vitro заключается в том, чтобы точно воспроизвести пространственное представление сигналов клеткам. В традиционных трехмерных культурах клетки наполнены биохимическими сигналами без какого-либо пространственно-временного контроля.Это приводит к основным различиям, наблюдаемым между органогенезом in vivo и in vitro. Недавние достижения дали уникальные подходы для преодоления этого ограничения путем манипулирования ECM с использованием светоопосредованного формирования паттернов. Например, путем включения участков связывания биомолекул в гидрогель и маскирования их активных участков фоторазлагаемым фрагментом можно было контролировать миграцию МСК внутри гидрогеля ПЭГ (Gjorevski et al., 2014; Kloxin et al., 2009). . Свет высвобождает активный субстрат трансглютаминазного фактора XIII (FXIIIa), позволяя белкам внеклеточного матрикса и факторам роста быть привязанными к матриксу на основе индуцированного светом паттерна.Этот механизм предлагает мощный инструмент для управления точным шаблоном, местоположением и временем, когда сигнал может быть представлен ячейке.
Растворимые факторы роста также могут быть доставлены с помощью микрошариков или разлагаемых носителей в культуральном каркасе. Наночастицы, нагруженные факторами роста, также могут быть непосредственно конъюгированы на поверхности клетки, медленно высвобождая молекулы, которые в первую очередь будут повторно захвачены клетками, несущими частицы, в аутокринной сигнальной петле (Stephan and Irvine, 2011).Эти методы позволяют в некоторой степени контролировать кинетику высвобождения сигнальных сигналов в зависимости от конструкции материала. Также можно сконструировать биочувствительные биоматериалы, в которых факторы роста высвобождаются на основе высвобождения матриксных металлопротеиназ из клеток. Гидрогели на основе ПЭГ были изготовлены с пептидными последовательностями, чувствительными к протеолитической деградации, и их успешно использовали для доставки в клетки фибробластов человека биоактивных молекул, помогающих регенерировать кость in vivo (Vazin and Schaffer, 2010).Микрожидкостные устройства также могут доставлять лиганды, формируя градиенты лигандов посредством манипулирования скоростью потока и профилем потока. Хотя этот метод может не позволить макромасштабную архитектуру, он требует небольшого размера выборки, что делает его многообещающим инструментом для высокопроизводительного скрининга и анализа клеточных культур.
Хотя этот метод может не позволить макромасштабную архитектуру, он требует небольшого размера выборки, что делает его многообещающим инструментом для высокопроизводительного скрининга и анализа клеточных культур.
Биопечать и восходящие подходы к конструированию органоидов
Для конструирования органоидов с контролируемыми взаимодействиями между клетками и клетками и матрицей клетки и материалы могут быть непосредственно нанесены на поверхность для получения трехмерных совместных культур двух или более типов клеток с настраиваемой геометрией, которая может быть предварительно определена с помощью данных визуализации с помощью КТ или МРТ желаемых тканей или органов.Биопечать произошла от двухмерной струйной печати; вместо того, чтобы наносить капли черных чернил на подложку, чернила содержат биоматериал с живыми клетками, которые точно позиционируются в аддитивном послойном подходе для создания трехмерных биологических структур, имитирующих структуру и функцию нативных тканей и органов (Atala и Ю, 2015 г. ; Мерфи и Атала, 2014 г.). Современные принтеры можно использовать для создания сложных компонентов ECM из нескольких материалов, содержащих несколько типов клеток (Atala and Yoo, 2015; Murphy and Atala, 2014).Биочернила на основе гидрогеля, содержащие питательные вещества для поддержки выживания и функционирования клеток, например, используются для размещения клеток в 3D-принтерах, в результате чего получаются 3D-тканеподобные массы, которые пытаются походить на нативные ткани (Atala and Yoo, 2015). Например, недавно был создан органоид бьющегося сердца, способный реагировать на электрические и химические сигналы, изменяя характер своего биения. Другими примерами органоидов, созданных с помощью биопечати, являются органоиды печени, мышц и микрососудов крови человека (Atala and Yoo, 2015).Несмотря на большой прогресс, остается несколько проблем, в том числе возможность печати с высоким разрешением, достижение соответствующей и контролируемой плотности клеток, а также достижение долгосрочной функциональности биочернил.
; Мерфи и Атала, 2014 г.). Современные принтеры можно использовать для создания сложных компонентов ECM из нескольких материалов, содержащих несколько типов клеток (Atala and Yoo, 2015; Murphy and Atala, 2014).Биочернила на основе гидрогеля, содержащие питательные вещества для поддержки выживания и функционирования клеток, например, используются для размещения клеток в 3D-принтерах, в результате чего получаются 3D-тканеподобные массы, которые пытаются походить на нативные ткани (Atala and Yoo, 2015). Например, недавно был создан органоид бьющегося сердца, способный реагировать на электрические и химические сигналы, изменяя характер своего биения. Другими примерами органоидов, созданных с помощью биопечати, являются органоиды печени, мышц и микрососудов крови человека (Atala and Yoo, 2015).Несмотря на большой прогресс, остается несколько проблем, в том числе возможность печати с высоким разрешением, достижение соответствующей и контролируемой плотности клеток, а также достижение долгосрочной функциональности биочернил.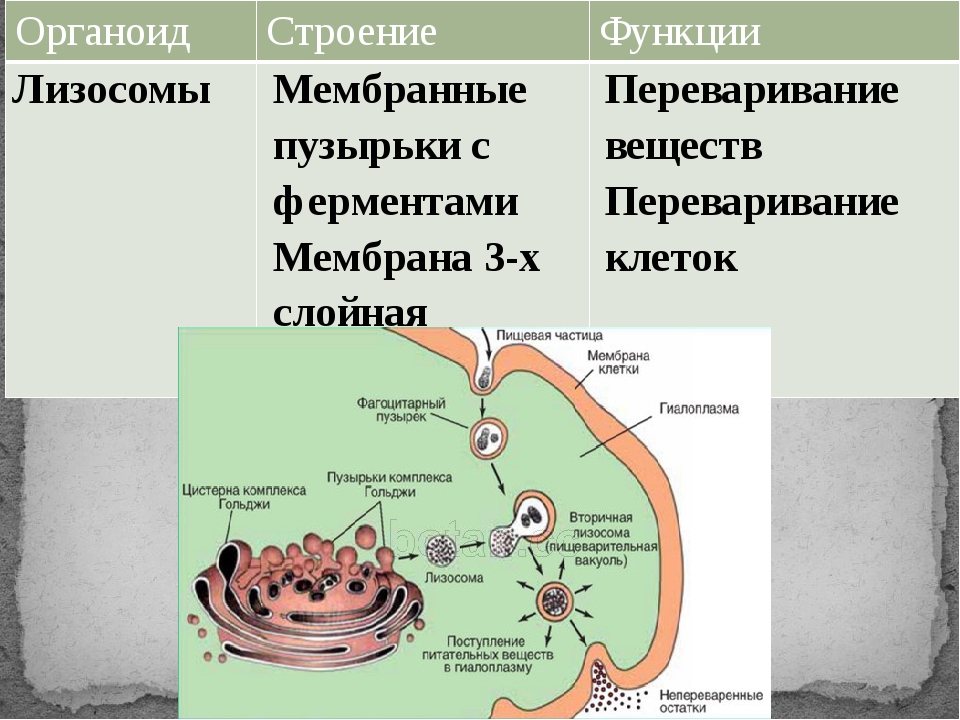 Было продемонстрировано, что в дополнение к биопечати восходящие подходы обеспечивают микромасштабный пространственный контроль межклеточного взаимодействия. Путем сначала индивидуальной сборки микромасштабных клеточных конструкций, а затем вызывая контролируемую многоструктурную организацию, можно собирать пространственно контролируемые клеточные агрегаты (Du et al., 2008). Восходящие подходы представляют интересную возможность для построения контролируемых ниш стволовых клеток или построения мультитканевых органоидных систем.
Было продемонстрировано, что в дополнение к биопечати восходящие подходы обеспечивают микромасштабный пространственный контроль межклеточного взаимодействия. Путем сначала индивидуальной сборки микромасштабных клеточных конструкций, а затем вызывая контролируемую многоструктурную организацию, можно собирать пространственно контролируемые клеточные агрегаты (Du et al., 2008). Восходящие подходы представляют интересную возможность для построения контролируемых ниш стволовых клеток или построения мультитканевых органоидных систем.
Васкуляризация
Обеспечение достаточного снабжения питательными веществами и кислородом является дополнительным важным фактором при разработке функциональных тканевых структур и органоидов in vitro. In vivo органы состоят из иерархически разветвленных сосудистых сетей, и почти все клетки находятся в пределах нескольких сотен микрон от капилляра, чтобы обеспечить достаточное снабжение посредством диффузии.Интеграция сосудистой структуры, которая обеспечивает адекватную доставку кислорода и питательных веществ, является необходимым шагом в полной рекапитуляции более крупных органоидов с ограниченной диффузией. Одна из стратегий для достижения этого состоит в клеточном подходе, при котором эндотелиальные клетки засевают внутри системы для формирования новых кровеносных сосудов в процессе, известном как неоангиогенез. Другая стратегия основана на использовании каркасов, когда синтетические каркасы используются для создания микроинженерных трехмерных структур с настраиваемыми геометрическими, механическими и биологическими свойствами.Многие попытки создать васкуляризацию in vitro объединяли эти подходы. Микрожидкостные устройства, обеспечивающие равномерное распределение потока и массопереноса, могут быть изготовлены с использованием процессов мягкой литографии и микроформования с использованием таких полимеров, как PDMS, полимолочная кислота (согликолевая кислота) (PLGA) и полиглицеринсебацинат (PGS). . Затем можно использовать методы биопечати для заполнения каналов несколькими типами сосудистых клеток (Golden and Tien, 2007; King et al., 2004; Visconti et al., 2010). Дополнительная стратегия включает в себя процесс модульной сборки, при котором клетки высевают в коллагеновые конструкции, достаточно маленькие, чтобы избежать ограничений диффузии, которые затем покрываются эндотелиальными клетками и объединяются для создания более крупных перфузионно-способных структур (McGuigan and Sefton, 2006).
Одна из стратегий для достижения этого состоит в клеточном подходе, при котором эндотелиальные клетки засевают внутри системы для формирования новых кровеносных сосудов в процессе, известном как неоангиогенез. Другая стратегия основана на использовании каркасов, когда синтетические каркасы используются для создания микроинженерных трехмерных структур с настраиваемыми геометрическими, механическими и биологическими свойствами.Многие попытки создать васкуляризацию in vitro объединяли эти подходы. Микрожидкостные устройства, обеспечивающие равномерное распределение потока и массопереноса, могут быть изготовлены с использованием процессов мягкой литографии и микроформования с использованием таких полимеров, как PDMS, полимолочная кислота (согликолевая кислота) (PLGA) и полиглицеринсебацинат (PGS). . Затем можно использовать методы биопечати для заполнения каналов несколькими типами сосудистых клеток (Golden and Tien, 2007; King et al., 2004; Visconti et al., 2010). Дополнительная стратегия включает в себя процесс модульной сборки, при котором клетки высевают в коллагеновые конструкции, достаточно маленькие, чтобы избежать ограничений диффузии, которые затем покрываются эндотелиальными клетками и объединяются для создания более крупных перфузионно-способных структур (McGuigan and Sefton, 2006).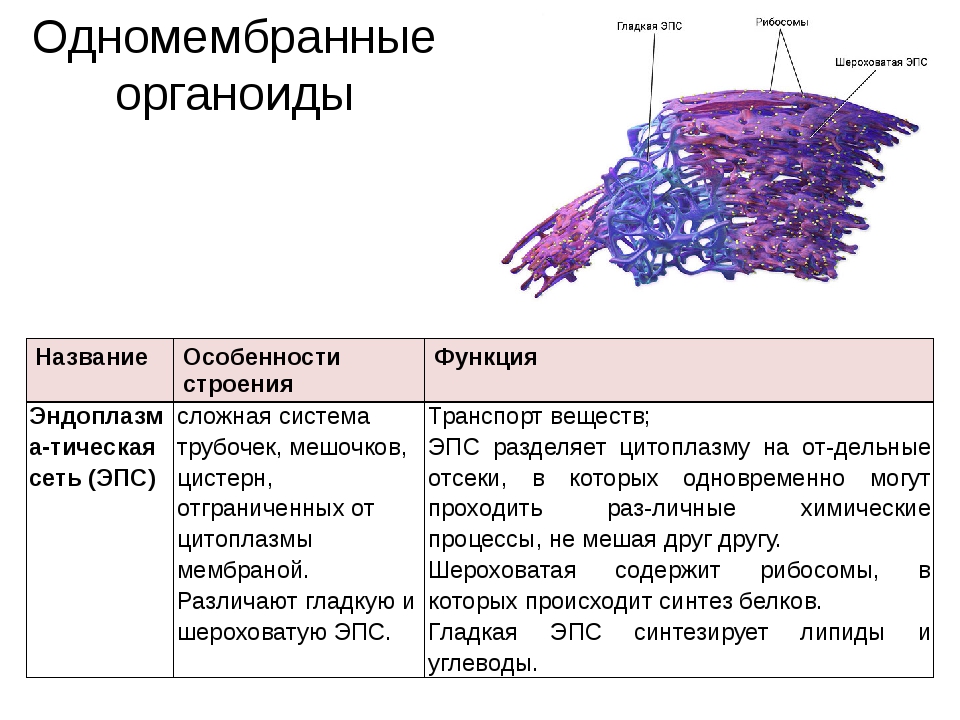 Следует отметить, что для органоидных систем эти стратегии необходимо будет изменить, чтобы они могли интегрироваться в трехмерные макромасштабные структуры ткани и обеспечивать перфузию и специализированные физиологические функции этой ткани.
Следует отметить, что для органоидных систем эти стратегии необходимо будет изменить, чтобы они могли интегрироваться в трехмерные макромасштабные структуры ткани и обеспечивать перфузию и специализированные физиологические функции этой ткани.
Каркасы также можно функционализировать комбинацией проангиогенных биомолекул, таких как факторы роста эндотелия сосудов (VEGF), факторы роста тромбоцитов (PDGGF) и основные факторы роста фибробластов (BFGF) для быстрого формирования зрелых сосудистых сетей (Richardson и другие., 2001; Зиш и др., 2003). Эти ангиогенные факторы роста могут не только запускать неоваскуляризацию, но они также могут направлять миграцию эндотелиальных клеток-предшественников через градиенты и способствовать сборке клеток. Используя зависящее от времени высвобождение из биоразлагаемых пористых каркасов или микрочастиц, эти иммобилизованные белки могут быть доставлены контролируемым в пространстве и времени устойчивым образом (Karal-Yilmaz et al., 2011; Layman et al.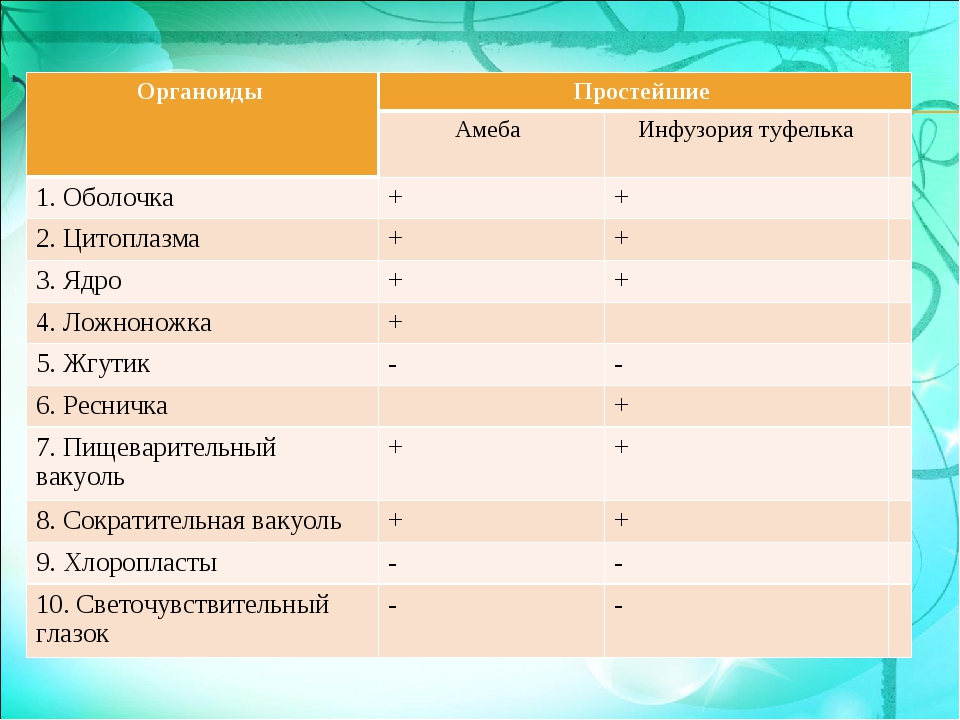 , 2012).
, 2012).
Извлечение клеток
Появилось множество стратегий освобождения клеток от поверхностей с минимальным воздействием на фенотип клеток.Например, термочувствительные полимеры, такие как поли(N-изопропилакриламид) и сополимеры, такие как ди(этиленгликоль)метакрилат и 9-мерный олиго(этиленгликоль)метакрилат, могут переходить из коллапсного состояния в гидратированное, растянутое состояние (Lutz и др., 2006; Wischerhoff и др., 2008). В расправленном состоянии материал становится устойчивым к белкам, образуя слой, который допускает лишь слабое притяжение между клеткой и поверхностью, мягко высвобождая клетки без использования агрессивных химических обработок или протеолитического расщепления.
Действительно, существует острая потребность в новых подходах, позволяющих эффективно извлекать клетки. Например, для получения достаточного количества PSC человека (hPSC) для лечения на основе стволовых клеток, hPSC необходимо быстро и надежно размножить в культуре, а затем собрать.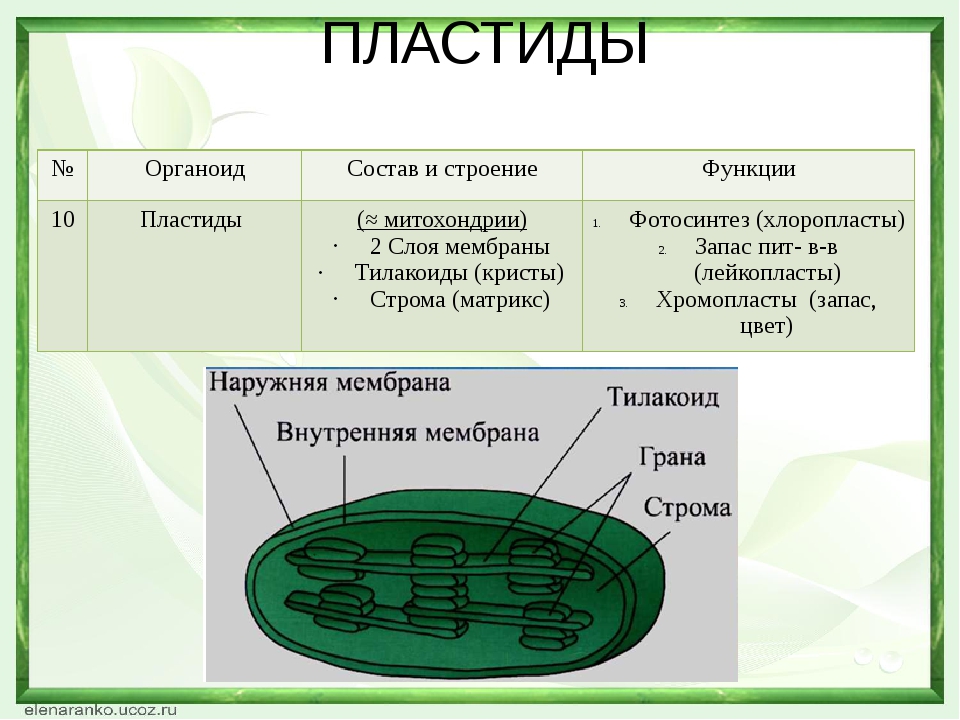 Как и в приведенном выше примере, для достижения этой производственной цели разрабатываются другие синтетические полимерные гидрогелевые системы. Поли(N-изопропилакриламид)-со-поли(этиленгликоль) (PNIPAAm-PEG) представляет собой еще один гидрогель, обладающий термочувствительными свойствами.Этот гидрогель обеспечивает простую инкапсуляцию и извлечение hPSC путем перехода от жидкого к твердому гелю с переключением температуры от 4°C до 37°C. Этот специфический гидрогелевый матрикс также демонстрирует значительно увеличенное размножение клеток из 2D-адгезивных форматов, а также более гомогенную популяцию, которая сохраняет свой плюрипотентный фенотип (McDevitt, 2013), что делает его масштабируемой и совместимой платформой для производственных практик.
Как и в приведенном выше примере, для достижения этой производственной цели разрабатываются другие синтетические полимерные гидрогелевые системы. Поли(N-изопропилакриламид)-со-поли(этиленгликоль) (PNIPAAm-PEG) представляет собой еще один гидрогель, обладающий термочувствительными свойствами.Этот гидрогель обеспечивает простую инкапсуляцию и извлечение hPSC путем перехода от жидкого к твердому гелю с переключением температуры от 4°C до 37°C. Этот специфический гидрогелевый матрикс также демонстрирует значительно увеличенное размножение клеток из 2D-адгезивных форматов, а также более гомогенную популяцию, которая сохраняет свой плюрипотентный фенотип (McDevitt, 2013), что делает его масштабируемой и совместимой платформой для производственных практик.
Мониторинг компонентов ниши in vitro
Некоторые компоненты ниши стволовых клеток, такие как межклеточные взаимодействия, распределение кислорода, локальные уровни pH и транспорт питательных веществ, трудно исследовать in vivo, хотя в последнее время достигнут значительный прогресс.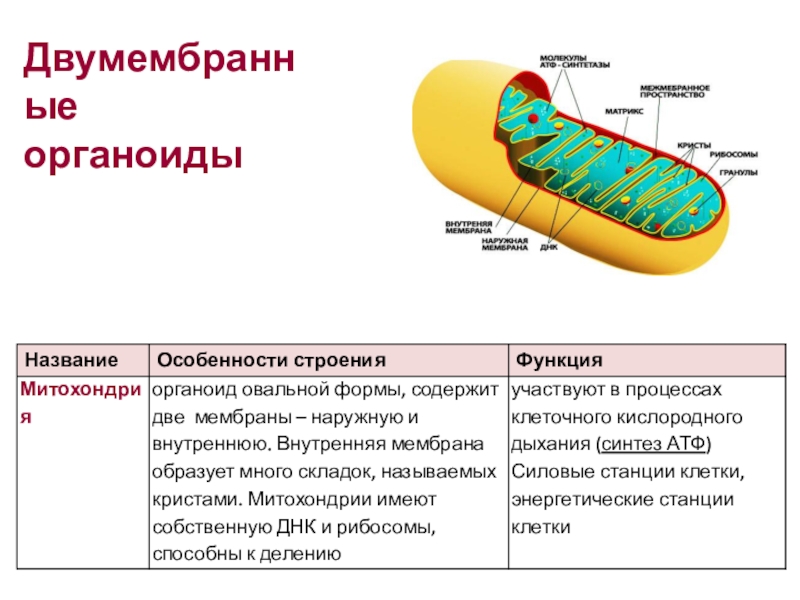 Сенсоры и устройства, которые могут быть включены в нишу in vitro с минимальным вмешательством в естественные процессы, могут обеспечить точный мониторинг условий культивирования и помочь нам лучше понять такие параметры. Некоторые из этих возможностей уже были продемонстрированы in vivo. Например, с помощью двухфотонной фосфоресценции прижизненной микроскопии были измерены локальные уровни кислорода в костном мозге живых мышей с микрометровым пространственным разрешением (Spencer et al., 2014). Влияние передачи сигналов, опосредованной клеточным контактом, в нише стволовых клеток может быть дополнительно проанализировано с использованием микромасштабных устройств.Например, микроструктуры можно использовать для точного контроля пространственного позиционирования клеток и изучения их взаимодействий (Hui and Bhatia, 2007).
Сенсоры и устройства, которые могут быть включены в нишу in vitro с минимальным вмешательством в естественные процессы, могут обеспечить точный мониторинг условий культивирования и помочь нам лучше понять такие параметры. Некоторые из этих возможностей уже были продемонстрированы in vivo. Например, с помощью двухфотонной фосфоресценции прижизненной микроскопии были измерены локальные уровни кислорода в костном мозге живых мышей с микрометровым пространственным разрешением (Spencer et al., 2014). Влияние передачи сигналов, опосредованной клеточным контактом, в нише стволовых клеток может быть дополнительно проанализировано с использованием микромасштабных устройств.Например, микроструктуры можно использовать для точного контроля пространственного позиционирования клеток и изучения их взаимодействий (Hui and Bhatia, 2007).
Кроме того, трехмерные микрофлюидные устройства, которые можно легко контролировать с помощью нескольких методов визуализации, способны точно имитировать ключевые физиологические и структурные особенности небольших функциональных единиц органов и обеспечивают платформу для более подробного изучения таких биологических систем.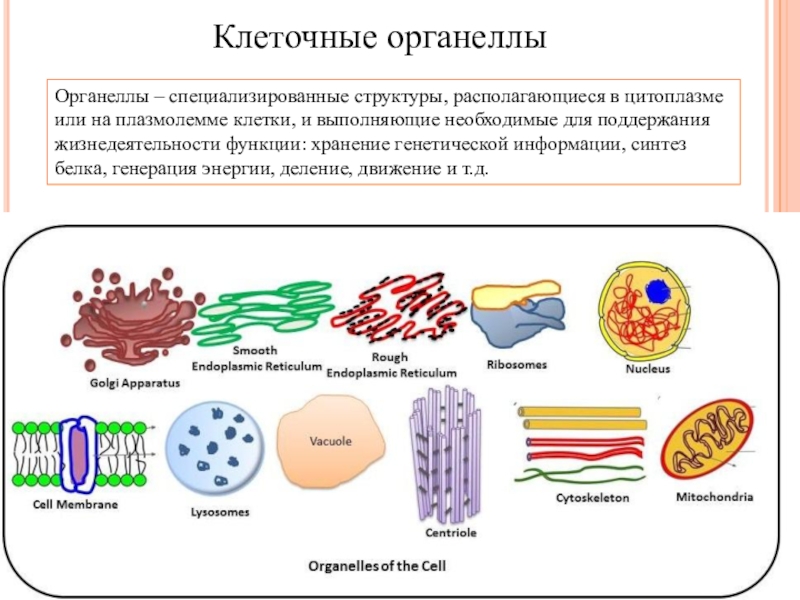 Например, микрожидкостные особенности, такие как микроканалы, могут обеспечить поток жидкости со скоростью, наблюдаемой в естественных условиях.Микрожидкостные устройства, такие как технология «орган на чипе», также могут имитировать перистальтические сокращения и основную функцию кровеносных сосудов по доставке кислорода и питательных веществ при одновременном удалении отходов (Bhatia and Ingber, 2014; Huh et al., 2010). На чипе уже созданы миниатюрные модели функциональных биологических единиц, в том числе модели легких, печени, почек, кишечника, сердца, жира, костного мозга, роговицы, кожи и гематоэнцефалического барьера (см. Bhatia and Ingber, 2014). обзор). Системы «орган-на-чипе» можно использовать для визуализации в реальном времени с высоким разрешением, а также для анализа биохимических, генетических и метаболических процессов в условиях, очень похожих на условия in vivo.
Например, микрожидкостные особенности, такие как микроканалы, могут обеспечить поток жидкости со скоростью, наблюдаемой в естественных условиях.Микрожидкостные устройства, такие как технология «орган на чипе», также могут имитировать перистальтические сокращения и основную функцию кровеносных сосудов по доставке кислорода и питательных веществ при одновременном удалении отходов (Bhatia and Ingber, 2014; Huh et al., 2010). На чипе уже созданы миниатюрные модели функциональных биологических единиц, в том числе модели легких, печени, почек, кишечника, сердца, жира, костного мозга, роговицы, кожи и гематоэнцефалического барьера (см. Bhatia and Ingber, 2014). обзор). Системы «орган-на-чипе» можно использовать для визуализации в реальном времени с высоким разрешением, а также для анализа биохимических, генетических и метаболических процессов в условиях, очень похожих на условия in vivo.
Хотя микрожидкостные системы «орган-на-чипе» могут объединять ключевые компоненты вместе и по-прежнему обеспечивать точный контроль и измерения, некоторые функции традиционных систем 3D-культивирования органоидов все же могут быть более выгодными.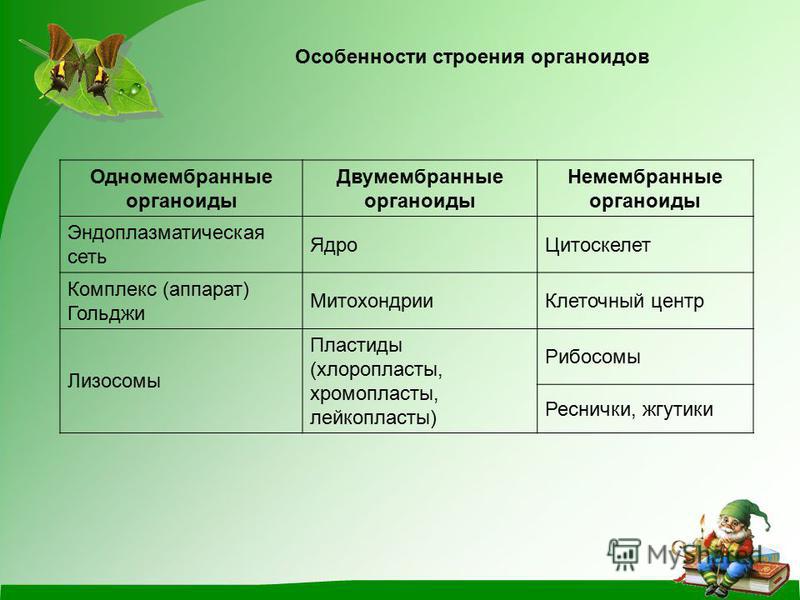 Например, традиционные системы трехмерного культивирования органоидов могут генерировать большую массу ткани, что позволяет ученым проводить аналитические эксперименты, для которых обычно требуются большие образцы. Трехмерные культуры также позволяют выращивать макромасштабную архитектуру и очень сложные и пространственно неоднородные ткани, которые не могут поддерживаться на микроуровне.Кроме того, использование технологии микрофлюидных чипов сопряжено с некоторыми экспериментальными нюансами. Изготовление чипа требует микроинженерных возможностей, и этот процесс подвержен бактериальному загрязнению и образованию пузырьков, которые будут мешать здоровью клеток, функционированию и производству чипа. Тем не менее, несмотря на эти неудачи, микрофлюидные чипы по-прежнему предлагают беспрецедентную гибкость в независимом управлении и мониторинге таких функций, как положение клеток и тканей, поток жидкости и механические сигналы, помогая анализировать их вклад в работу тканей и органов.Что наиболее важно, эта технология устраняет главный недостаток макромасштабного 3D-культивирования.
Например, традиционные системы трехмерного культивирования органоидов могут генерировать большую массу ткани, что позволяет ученым проводить аналитические эксперименты, для которых обычно требуются большие образцы. Трехмерные культуры также позволяют выращивать макромасштабную архитектуру и очень сложные и пространственно неоднородные ткани, которые не могут поддерживаться на микроуровне.Кроме того, использование технологии микрофлюидных чипов сопряжено с некоторыми экспериментальными нюансами. Изготовление чипа требует микроинженерных возможностей, и этот процесс подвержен бактериальному загрязнению и образованию пузырьков, которые будут мешать здоровью клеток, функционированию и производству чипа. Тем не менее, несмотря на эти неудачи, микрофлюидные чипы по-прежнему предлагают беспрецедентную гибкость в независимом управлении и мониторинге таких функций, как положение клеток и тканей, поток жидкости и механические сигналы, помогая анализировать их вклад в работу тканей и органов.Что наиболее важно, эта технология устраняет главный недостаток макромасштабного 3D-культивирования.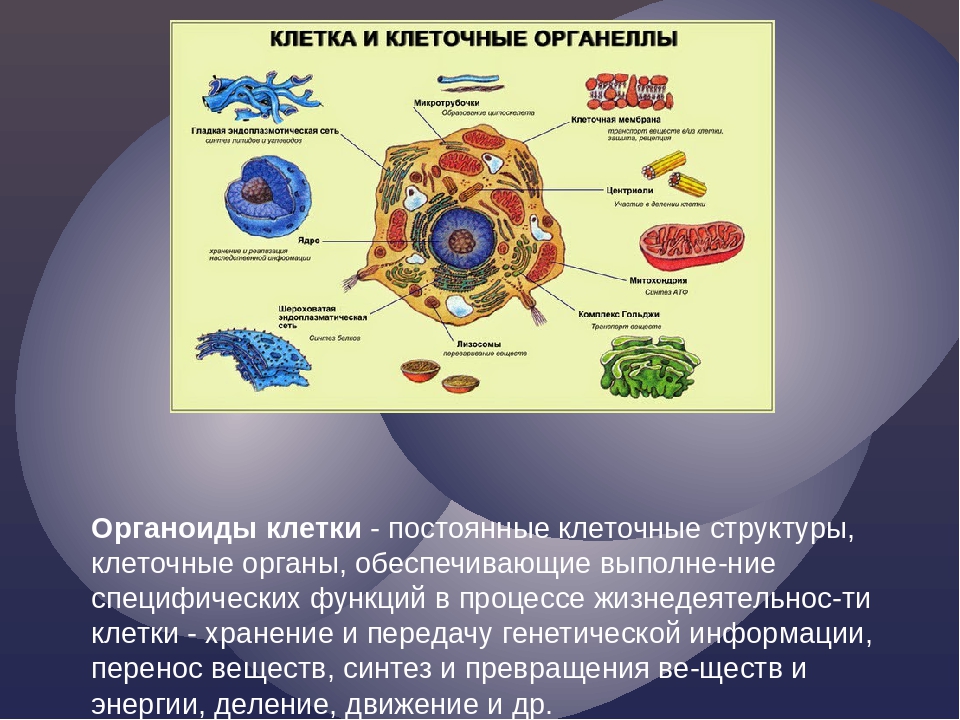 По мере увеличения функциональности и сложности систем 3D-культивирования некоторые ткани становятся более недоступными. Следовательно, становится все труднее выполнять визуализацию с высоким разрешением и отслеживать активность клеток. Орган-на-чипе позволяет легко интегрировать клетки с флуоресцентной конфокальной микроскопией, микрофлуориметрией, измерением трансэпителиального электрического сопротивления, набором нескольких электродов и другими аналитическими системами (Bhatia and Ingber, 2014; Huh et al., 2010).
По мере увеличения функциональности и сложности систем 3D-культивирования некоторые ткани становятся более недоступными. Следовательно, становится все труднее выполнять визуализацию с высоким разрешением и отслеживать активность клеток. Орган-на-чипе позволяет легко интегрировать клетки с флуоресцентной конфокальной микроскопией, микрофлуориметрией, измерением трансэпителиального электрического сопротивления, набором нескольких электродов и другими аналитическими системами (Bhatia and Ingber, 2014; Huh et al., 2010).
Биообработка и масштабирование
Одной из основных проблем при внедрении тканевой инженерии в клинику является существующий пробел в биотехнологии, включая вопросы масштабируемости и стандартизации. Масштабирование органоидной платформы до производственных масштабов сталкивается с аналогичным препятствием, и будущие конструкции нишево-миметической органоидной системы должны приспособиться к некоторой степени масштабирования. Биореакторы с перемешиванием суспензии на основе агрегатов ранее продемонстрировали способность контролировать размножение и дифференцировку стволовых клеток (Fluri et al. , 2012; Кинг и Миллер, 2007 г.; Унгрин и др., 2008). Однако для дальнейшего расширения нашего контроля над поведением стволовых клеток могут быть реализованы биореакторы, которые могут лучше воссоздать нишу стволовых клеток с использованием двухфазной системы (Kirouac and Zandstra, 2008). Он состоит из предоставления как объемных сигналов, таких как физиологические условия рН, напряжения кислорода, уровней глюкозы и температуры, так и сигналов клеточного уровня, таких как сигналы взаимодействия клетка-клетка и клетка-ВКМ. Массовые сигналы могут быть обеспечены с помощью обмена культуральными средами и контролироваться с помощью датчиков и контуров управления процессом, в то время как сигналы микросреды можно контролировать с помощью конструкции каркаса и тех же методов формирования белкового паттерна, которые используются в лабораторных культурах.Для таких трехмерных систем, которые требуют как непрерывного потока, так и взаимодействия с субстратом, пористость и проницаемость каркаса будут важными свойствами, которые следует учитывать.
, 2012; Кинг и Миллер, 2007 г.; Унгрин и др., 2008). Однако для дальнейшего расширения нашего контроля над поведением стволовых клеток могут быть реализованы биореакторы, которые могут лучше воссоздать нишу стволовых клеток с использованием двухфазной системы (Kirouac and Zandstra, 2008). Он состоит из предоставления как объемных сигналов, таких как физиологические условия рН, напряжения кислорода, уровней глюкозы и температуры, так и сигналов клеточного уровня, таких как сигналы взаимодействия клетка-клетка и клетка-ВКМ. Массовые сигналы могут быть обеспечены с помощью обмена культуральными средами и контролироваться с помощью датчиков и контуров управления процессом, в то время как сигналы микросреды можно контролировать с помощью конструкции каркаса и тех же методов формирования белкового паттерна, которые используются в лабораторных культурах.Для таких трехмерных систем, которые требуют как непрерывного потока, так и взаимодействия с субстратом, пористость и проницаемость каркаса будут важными свойствами, которые следует учитывать.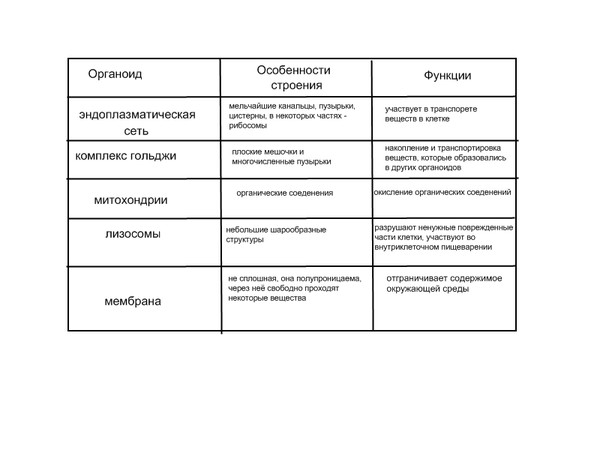 Другие характеристики системы, такие как простота извлечения клеток и строгие методы мониторинга процесса для контроля качества продукции, также должны быть включены. В конечном счете, прежде чем органоиды смогут перейти в клинику и производиться в больших масштабах, необходимо сначала понять их динамическую реакцию на системные параметры. Это включает в себя создание математических моделей, которые могут точно предсказать поведение системы, а также идентификацию регулируемых входных параметров и надежных маркеров ячеек для подтверждения качества выходных данных.
Другие характеристики системы, такие как простота извлечения клеток и строгие методы мониторинга процесса для контроля качества продукции, также должны быть включены. В конечном счете, прежде чем органоиды смогут перейти в клинику и производиться в больших масштабах, необходимо сначала понять их динамическую реакцию на системные параметры. Это включает в себя создание математических моделей, которые могут точно предсказать поведение системы, а также идентификацию регулируемых входных параметров и надежных маркеров ячеек для подтверждения качества выходных данных.
Органоиды: определение, методы культивирования и клинические…
[1] М. А. Ланкастер и Дж. А. Кноблих, «Органогенез в чашке: моделирование развития и заболевания с использованием органоидных технологий», Science (80-.). , том. 345, нет. 6194, 2014, doi: 10.1126/science.1247125.
[2] Ю. Сасаи, М. Эйраку и Х. Суга, «Органогенез in vitro в трех измерениях: самоорганизующиеся стволовые клетки», Dev.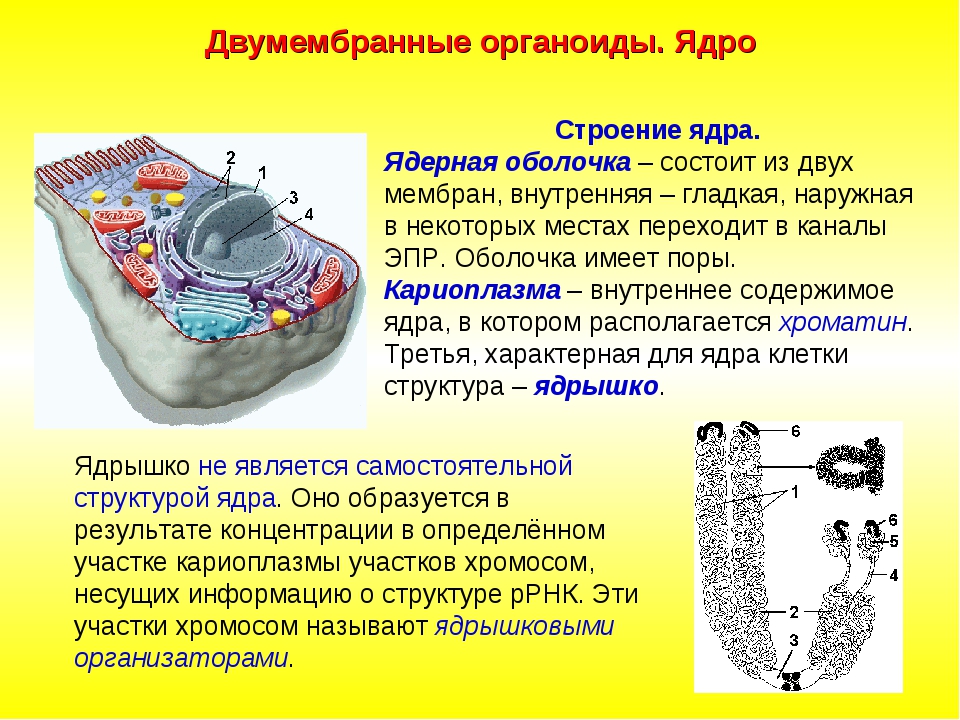 , том. 139, нет. 22, стр. 4111–4121, 2012, doi: 10.1242/dev.079590 .
, том. 139, нет. 22, стр. 4111–4121, 2012, doi: 10.1242/dev.079590 .
[3] X. Qian, H. Song и G. Ming, «Органоиды мозга: достижения, приложения и проблемы», Development , vol. 146, нет. 8, с. dev166074, 2019.
[4] J.M. Rosenbluth et al. , «Органоидные культуры из нормальных и склонных к раку тканей молочной железы человека сохраняют сложные эпителиальные клоны», Nat. коммун. , том. 11, нет. 1, стр. 1–14, 2020.
[5] T. Sato et al. , «Одиночные стволовые клетки Lgr5 строят структуры крипт-ворсинок in vitro без мезенхимальной ниши», Nature , vol.459, нет. 7244, стр. 262–265, 2009, doi: 10.1038/nature07935.
[6] Т. Такебе и др. , «Васкуляризированная и функциональная печень человека из трансплантата зачатка органа, полученного из иПСК», Nature , vol. 499, нет. 7459, стр. 481–484, 2013, doi: 10.1038/nature12271.
[7] М. Хуч и др. , «Размножение одиночных Lgr5 + стволовых клеток печени in vitro, индуцированное Wnt-управляемой регенерацией», Nature , vol. 494, нет. 7436, стр. 247–250, 2013, doi: 10.1038/nature11826.
494, нет. 7436, стр. 247–250, 2013, doi: 10.1038/nature11826.
[8] R. P. Fordham et al. , «Трансплантация разросшихся клеток-предшественников кишечника плода способствует регенерации толстой кишки после повреждения», Cell Stem Cell , vol. 13, нет. 2013. Т. 6. С. 734–744. doi: 10.1016/j.stem.2013.09.015.
[9] Дж. О. Мунера и др. , «Дифференциация плюрипотентных стволовых клеток человека в органоиды толстой кишки посредством временной активации передачи сигналов BMP», Cell Stem Cell , vol. 21, нет. 1, стр. 51-64.e6, 2017, doi: 10.1016/j.stem.2017.05.020.
[10] H. Uchida et al. , «Бесксеногенная система, генерирующая функциональные органоиды кишечника человека из плюрипотентных стволовых клеток», JCI Insight , vol. 2, нет. 1, стр. 1–13, 2017, doi: 10.1172/jci.insight.86492.
[11] Кумар С.В. и др. , «Микроорганоиды почек в суспензионной культуре как масштабируемый источник клеток почек, полученных из плюрипотентных стволовых клеток человека», Dev. , том. 146, нет. 5, 2019 г., doi: 10.1242/dev.172361.
, том. 146, нет. 5, 2019 г., doi: 10.1242/dev.172361.
[12] Z. Li et al. , «3D-культура поддерживает долгосрочную экспансию нефрогенных предшественников мыши и человека», Cell Stem Cell , vol. 19, нет. 2016. Т. 4. С. 516–529. doi: 10.1016/j.stem.2016.07.016.
[13] B. R. Dye и др. , «Получение in vitro органоидов легких, полученных из плюрипотентных стволовых клеток человека», Elife , vol. 2015, нет. 4, стр. 1–25, 2015, doi: 10.7554/eLife.05098.
[14] J. Drost et al. , «Системы органоидных культур эпителия простаты и раковой ткани», Nat.протокол , том. 11, с. 347, январь 2016 г.
[15] L. Huang et al. , «Моделирование протокового рака поджелудочной железы и скрининг лекарств с использованием человеческих плюрипотентных стволовых клеток и опухолевых органоидов, полученных от пациентов», Nat. Мед. , том. 21, нет. 11, стр. 1364–1371, 2015, doi: 10.1038/nm.3973.
[16] Т. Р. Брода, К. В. Маккракен и Дж. М. Уэллс, «Поколение человеческих антральных и фундальных желудочных органоидов из плюрипотентных стволовых клеток», Nat. протокол , том. 14, нет. 1, с.28–50, 2019, doi: 10.1038/s41596-018-0080-z.
Р. Брода, К. В. Маккракен и Дж. М. Уэллс, «Поколение человеческих антральных и фундальных желудочных органоидов из плюрипотентных стволовых клеток», Nat. протокол , том. 14, нет. 1, с.28–50, 2019, doi: 10.1038/s41596-018-0080-z.
[17] М. Боретто и др. , «Органоиды, полученные от пациентов при заболевании эндометрия, фиксируют клиническую гетерогенность и поддаются скринингу на лекарства», Nat. Клеточная биол. , том. 21, нет. 2019. Т. 8. С. 1041–1051. doi: 10.1038/s41556-019-0360-z.
[18] Ю. Сайто и др. , «Разработка функциональной модели щитовидной железы на основе системы культивирования органоидов», Biochem. Биофиз. Рез. коммун. , том. 497, нет.2, стр. 783–789, 2018, doi: 10.1016/j.bbrc.2018.02.154.
[19] H. Sakaguchi et al. , «Генерация функциональных нейронов гиппокампа из самоорганизующейся дорсомедиальной телэнцефалической ткани, происходящей из эмбриональных стволовых клеток», Nat. коммун. , том. 6, 2015 г., doi: 10.1038/ncomms9896.
6, 2015 г., doi: 10.1038/ncomms9896.
[20] M. A. Lancaster et al. , «Церебральные органоиды моделируют развитие человеческого мозга и микроцефалию», Nature , vol. 501, нет. 7467, стр. 373–379, 2013, doi: 10.1038/природа12517.
[21] С. Ким и др. , «Создание, профилирование транскриптома и функциональная проверка богатых колбочками органоидов сетчатки человека», Proc. Натл. акад. науч. США , том. 166, нет. 22, pp. 10824–10833, 2019, doi: 10.1073/pnas.12116.
[22] J. van der Vaart и H. Clevers, «Органоиды дыхательных путей как модели болезней человека», J. Intern. Мед. , 2020.
[23] М. Урбишек, Х. Ранникмае, Т. Фоэтс, К. Равн, М. Хювенен и М.de la Roche, «Органоидная культуральная среда, приготовленная с факторами роста определенной клеточной активности», Sci. Респ. , том. 9, нет. 1, стр. 1–11, 2019.
[24] А. Меренда, Н. Фендерико и М. М. Морис, «Передача сигналов Wnt в 3D: последние достижения в применении кишечных органоидов», Trends Cell Biol. , том. 30, нет. 1, стр. 60–73, 2020.
, том. 30, нет. 1, стр. 60–73, 2020.
[25] Х. Сюй, С. Лю, М. И, В. Чжао, Ю. Сонг и К. Ву, «Органоидные технологии и приложения в исследованиях рака», Дж.Гематол. Онкол. , том. 11, нет. 1, с. 116, 2018.
[26] М. Дж. Краточвил, А. Дж. Сеймур, Т. Л. Ли, С. П. Пашка, К. Дж. Куо и С. К. Хейлсхорн, «Инженерные материалы для органоидных систем», Nat. Преподобный Матер. , том. 4, нет. 2019. Т. 9. С. 606–622. doi: 10.1038/s41578-019-0129-9.
[27] S. Florian, Y. Iwamoto, M. Coughlin, R. Weissleder и T. J. Mitchison, «Система органов человека, которая самоорганизуется для повторения роста и дифференцировки доброкачественной опухоли молочной железы», Proc.Натл. акад. науч. , том. 116, нет. 23, стр. 11444–11453, 2019.
[28] Х. Ву и Б. Д. Хамфрис, «Секвенирование одиночных клеток и почечные органоиды, полученные из плюрипотентных стволовых клеток», Clin. Варенье. соц. Нефрол. , том. 15, нет. 4, стр. 550–556, 2020.
.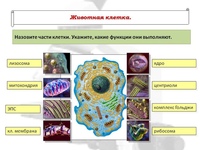 [29] К. Онгена, К. Дас, Дж. Л. Смит, С. Гил и Г. Джонстон, «Определение числа клеток во время культивирования клеток с использованием счетчика клеток со скипетром», Юпитер (Journal Vis. Exp. , № 45, стр. e2204, 2010.
[29] К. Онгена, К. Дас, Дж. Л. Смит, С. Гил и Г. Джонстон, «Определение числа клеток во время культивирования клеток с использованием счетчика клеток со скипетром», Юпитер (Journal Vis. Exp. , № 45, стр. e2204, 2010.
[30] T.Грабингер и др. , «Культура ex vivo органоидов кишечных крипт как модельная система для оценки индукции клеточной гибели эпителиальных клеток кишечника и энтеропатии», Cell Death Dis. , том. 5, нет. 5, pp. e1228—e1228, 2014.
[31] DE Rothschild, T. Srinivasan, LA Aponte-Santiago, X. Shen и IC Allen, «Культура ex vivo и стимуляция рецепторов распознавания образов кишечных органоидов мышей », JoVE (Журнал Vis. Exp. , № 111, стр. e54033, 2016.
[32] HE Francies, A. Barthorpe, A. McLaren-Douglas, WJ Barendt и MJ Garnett, «Анализ чувствительности к лекарственным препаратам культур органоидов рака человека», в Organoids: Stem Cells, Structure, and Function , K , Турксен, изд. Нью-Йорк, штат Нью-Йорк: Springer New York, 2019, стр. 339–351.
339–351.
[33] Ю. Фуджимичи, К. Оцука, М. Томита и Т. Ивасаки, «Эффективная кишечная органоидная система прямой сортировки для оценки конкуренции стволовых клеток in vitro», Sci. Респ. , том. 9, нет.1, стр. 1–9, 2019.
[34] C. P. Santos et al. , «Уротелиальные органоиды, происходящие из стволовых клеток мыши с высоким содержанием Cd49f, демонстрируют Notch-зависимую способность к дифференцировке», Nat. коммун. , том. 10, нет. 1, pp. 1–17, 2019.
[35] K. E. Boonekamp et al. , «Долгосрочное размножение и дифференцировка эпидермальных стволовых клеток взрослых мышей в трехмерных органоидных культурах», Proc. Натл. акад. науч. , том. 116, нет. 29, стр. 14630–14638, 2019.
[36] Т.McCray, Z. Richards, J. Marsili, GS Prins и L. Nonn, «Обработка и оценка культуры первичных органоидов предстательной железы человека», JoVE (Journal Vis. Exp. , № 143, стр. e59051, 2019.
[37] M. Dossena и др. , «Стандартизированное масштабируемое производство органоидов поджелудочной железы человека в соответствии с GMP», Stem Cell Res. Ther., , т. 11, № 1, стр. 1–12, 2020.
Ther., , т. 11, № 1, стр. 1–12, 2020.
[38] J. Mullenders и др. , «Органоиды уротелиального рака мыши и человека: инструмент для исследования рака мочевого пузыря», Proc.Натл. акад. науч. , том. 116, нет. 10, стр. 4567–4574, 2019.
[39] J. T. Neal et al. , «Органоидное моделирование иммунной микросреды опухоли», Cell , vol. 175, нет. 7, стр. 1972-1988.e16, 2018, doi: 10.1016/j.cell.2018.11.021.
[40] К. К. Дейкстра и др. , «Получение опухоле-реактивных Т-клеток путем совместного культивирования лимфоцитов периферической крови и опухолевых органоидов», Cell , vol. 174, нет. 6, pp. 1586-1598.e12, 2018, doi: 10.1016/j.сот.2018.07.009.
[41] Т. Такебе и др. , «Массовое и воспроизводимое производство зачатков печени полностью из плюрипотентных стволовых клеток человека», Cell Rep. , vol. 21, нет. 2017. Т. 10. С. 2661–2670. doi: 10.1016/j.celrep.2017.11.005.
[42] Н. Фан и др. , «Простой высокопроизводительный подход определяет действенную лекарственную чувствительность в опухолевых органоидах, полученных от пациентов», Commun. биол. , том. 2, нет. 1, стр. 1–11, 2019, doi: 10.1038/s42003-019-0305-x.
, «Простой высокопроизводительный подход определяет действенную лекарственную чувствительность в опухолевых органоидах, полученных от пациентов», Commun. биол. , том. 2, нет. 1, стр. 1–11, 2019, doi: 10.1038/s42003-019-0305-x.
[43] Г. Росси, А. Манфрин и М. П. Лутольф, «Прогресс и потенциал в исследованиях органоидов», Nat. Преподобный Жене. , том. 19, нет. 2018. Т. 11. С. 671–687. doi: 10.1038/s41576-018-0051-9.
[44] J. Drost и H. Clevers, «Organoids in Cancer research», Nat. Преподобный Рак , том. 18, нет. 2018. Т. 7. С. 407–418. doi: 10.1038/s41568-018-0007-6.
[45] Т. Сато и Х. Клеверс, «Выращивание самоорганизующихся мини-кишечников из одной стволовой клетки кишечника: механизм и применение», Science (80-.). , том. 340, нет. 6137, стр. 1190–1194, 2013.
[46] H. Gehart et al. , «Идентификация энтероэндокринных регуляторов с помощью картирования дифференцировки одиночных клеток в реальном времени», Cell , vol. 176, нет. 5, стр. 1158-1173.e16, 2019, doi: 10.1016/j.cell.2018.12.029.
176, нет. 5, стр. 1158-1173.e16, 2019, doi: 10.1016/j.cell.2018.12.029.
[47] Дж. Мариани и др. , «Моделирование развития коры головного мозга человека in vitro с использованием индуцированных плюрипотентных стволовых клеток», Proc. Натл. акад. науч. США , том. 109, нет. 31, стр. 12770–12775, 2012, doi: 10.1073/пнас.1202944109.
[48] H. Hu et al. , «Долгосрочное расширение функциональных гепатоцитов мыши и человека как трехмерных органоидов», Cell , vol. 175, нет. 6, стр. 1591-1606.e19, 2018, doi: 10.1016/j.cell.2018.11.013.
[49] Д. Уилкинсон и др. , «Разработка трехмерной биоинженерной технологии для создания легочной ткани для персонализированного моделирования заболеваний», Stem Cells Transl. Мед. , том. 2016. Т. 4. С. 1–11. doi: 10.5966/sctm.2016-0192.
[50] Б. С. Фридман и др. , «Моделирование заболевания почек с помощью CRISPR-мутантных почечных органоидов, полученных из плюрипотентных сфероидов эпибласта человека», Nat.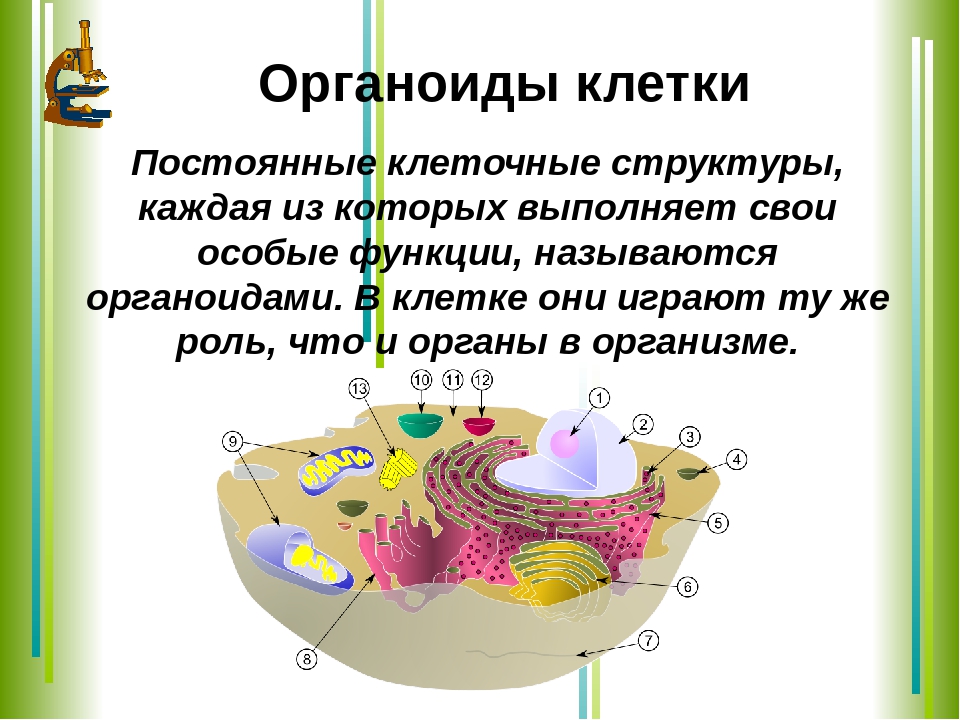 коммун. , том. 6, нет. Май, стр. 1–13, 2015 г., doi: 10.1038/ncomms9715.
коммун. , том. 6, нет. Май, стр. 1–13, 2015 г., doi: 10.1038/ncomms9715.
[51] В. Ефремова и др. , «Модель развития коры на основе органоидов идентифицирует неклеточно-автономные дефекты в передаче сигналов Wnt, способствующие синдрому Миллера-Дикера», Cell Rep. , vol. 19, нет. 2017. Т. 1. С. 50–59. Doi: 10.1016/j.celrep.2017.03.047.
[52] Н. Сакс и др. , «Живой биобанк органоидов рака молочной железы фиксирует гетерогенность заболевания», Cell , vol. 172, нет. 1–2, стр. 373-386.e10, 2018, doi: 10.1016/j.cell.2017.11.010.
[53] М. Такасато и др. , «Органоиды почек из иПС-клеток человека содержат несколько клонов и моделируют нефрогенез человека», Nature , vol. 526, с. 564, октябрь 2015 г.
[54] W. R. Proctor et al. , «Полезность сферических микротканей печени человека для прогнозирования клинического лекарственного поражения печени», Arch.Токсикол. , том. 91, нет. 8, стр. 2849–2863, 2017, doi: 10.1007/s00204-017-2002-1.
2849–2863, 2017, doi: 10.1007/s00204-017-2002-1.
[55] Т. Чжоу и др. , «Скрининг с высоким содержанием в hPSC-нейральных предшественниках идентифицирует кандидатов в лекарственные средства, которые ингибируют вирусную инфекцию Зика в фетальноподобных органоидах и мозге взрослого человека», Cell Stem Cell , vol. 21, нет. 2, стр. 274-283.e5, 2017, doi: 10.1016/j.stem.2017.06.017.
[56] С. Ф. Бой и др. , «Форсколин-индуцированный отек кишечных органоидов: анализ in vitro для оценки реакции на лекарство у пациентов с кистозным фиброзом», J.Вис. Эксп. , том. 2017, нет. 120, стр. 1–12, 2017, doi: 10.3791/55159.
[57] F. Schutgens et al. , «Тубулоиды, полученные из почек и мочи взрослого человека, для персонализированного моделирования заболеваний», Nat. Биотехнолог. , том. 37, нет. 3. С. 303–313, 2019. doi: 10.1038/s41587-019-0048-8.
[58] W. Dieterich, MF Neurath и Y. Zopf, «Кишечная культура органоидов ex vivo выявляет измененные запрограммированные стволовые клетки крипт у пациентов с глютеновой болезнью», Sci.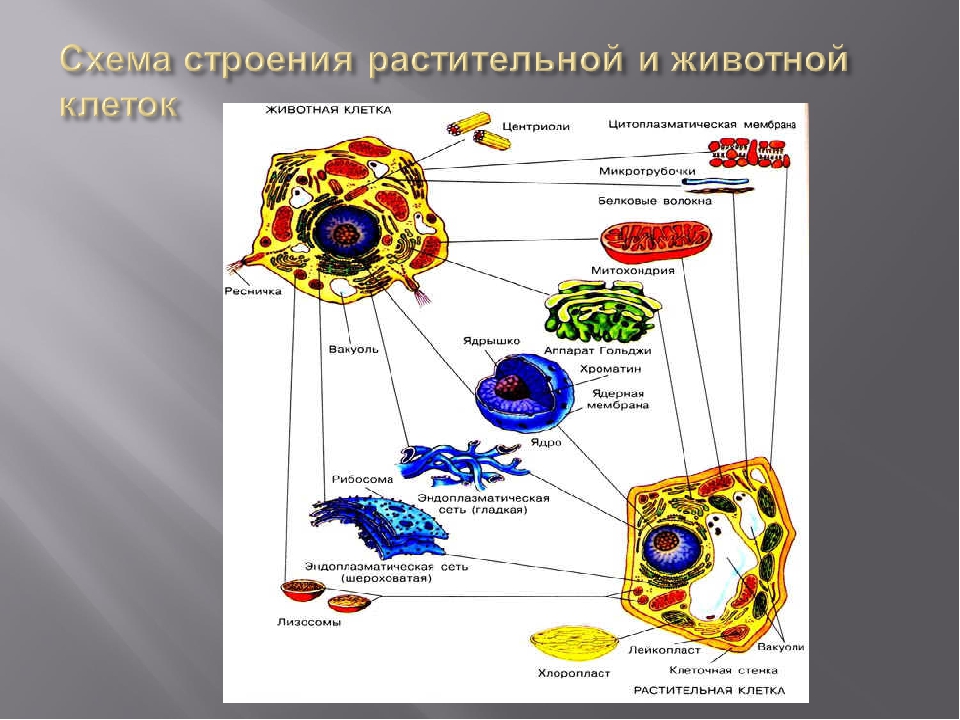 Респ. , том. 10, нет. 1, стр. 1–10, 2020.
Респ. , том. 10, нет. 1, стр. 1–10, 2020.
[59] O. Kopper et al. , «Органоидная платформа для рака яичников фиксирует неоднородность внутри и между пациентами», Nat. Мед. , том. 25, нет. 2019. Т. 5. С. 838–849. doi: 10.1038/s41591-019-0422-6.
[60] С. Ф. Реринк и др. , «Внутриопухолевая диверсификация при колоректальном раке на уровне одной клетки», Nature , vol. 556, нет. 7702, стр. 437–462, 2018, doi: 10.1038/s41586-018-0024-3.
границ | Медицина печени следующего поколения с использованием органоидных моделей
Введение
Распространенность заболеваний печени растет, и на их долю приходится около 2 миллионов смертей в год во всем мире (Asrani et al., 2019). Этиология хронических заболеваний печени многофакторна и варьируется в зависимости от географического положения (Zhou et al., 2014). К основным причинам относятся хронические вирусные инфекции (гепатиты В и С), чрезмерное употребление алкоголя, жировая болезнь печени и стеатогепатит, связанные с ожирением, наследственные заболевания (болезнь Вильсона, нарушения накопления, гепаторенальная тирозинемия и др. ).), аутоиммунные заболевания печени, заболевания печени, связанные с лекарственными препаратами, а также злокачественные новообразования и идиопатические причины (Zhou et al., 2014).
).), аутоиммунные заболевания печени, заболевания печени, связанные с лекарственными препаратами, а также злокачественные новообразования и идиопатические причины (Zhou et al., 2014).
На сегодняшний день для расшифровки молекулярных механизмов развития и патогенеза печени использовались различные клеточные культуры и животные модели. Среди них обычные двумерные (2D) клеточные культуры имеют несколько ограничений, особенно для долгосрочного и стабильного размножения. Кроме того, 2D-культуры первичных гепатоцитов не в состоянии воспроизвести ключевые аспекты ткани печени человека, в частности, сложную архитектуру и клеточную гетерогенность (Duval et al., 2017; Роу и Дейли, 2019). Более того, в этих клетках часто отсутствуют взаимодействия между клетками и клетками и внеклеточным матриксом (ECM), которые необходимы для поддержания 90–114 in situ 90–115 фенотипов и биологических функций, а также тканеспецифических клеточных процессов (Baxter et al., 2015; Duval et al. ., 2017). Кроме того, первичные гепатоциты имеют ограниченную способность к делению при выращивании в 2D-культурах и быстро теряют характерные для печени паттерны экспрессии генов и функции, такие как синтез ингибиторов коагуляции (Boost et al., 2007), поддержание стабильности цитохрома Р450 (Darnell et al., 2012; Kostadinova et al., 2013) и лигирование интегринов (Meli et al., 2012) через несколько недель после посева (Clayton, Darnell, 1983; Bissell et al., 1987; Mitaka and Ooe, 2010).
С тех пор, как была создана технология индуцированных плюрипотентных стволовых клеток (ИПСК), генерация гепатоцитов с помощью протоколов поэтапной дифференцировки, имитирующих органогенез in vivo , стала легко осуществимой в двумерных культурах (Takahashi et al., 2007; Si-Tayeb et al., 2010б; Чен и др., 2012; Ханнан и др., 2013). Эти протоколы обычно используют коктейли факторов роста/цитокинов, чтобы резюмировать эмбриональное развитие печени в условиях in vitro культивирования. Тем не менее, гепатоциты, полученные с помощью этих протоколов дифференцировки, значительно различаются по степени их созревания и в большинстве случаев представляют собой незрелые гепатоциты. Кроме того, они не способны к длительному размножению в монослойной культуре, отчасти из-за отсутствия тканеспецифичной архитектуры, механических и биохимических сигналов и межклеточных коммуникаций в 2D-условиях (Pampaloni et al., 2007; Луо и др., 2018).
Животные модели также могут быть использованы при изучении патологий печени. Подавляющее большинство этих моделей имеют функциональные компоненты сосудистой, стромальной и иммунной систем, что дает многочисленные преимущества по сравнению с 2D-культурами. Однако для разработки моделей животных требуются ресурсоемкие и трудоемкие процессы. Кроме того, физиологические и геномные межвидовые различия в моделях животных накладывают ограничения на представление фенотипов заболеваний и прогнозирование результатов исследований, таких как реакция на лекарство (Mariotti et al., 2018).
Органоиды просто определяются как трехмерные системы клеточных культур, которые имитируют структурные и функциональные характеристики представляемого органа. Это определение относится к сборке органоспецифических типов клеток, которые развиваются из плюрипотентных стволовых клеток/органных стволовых клеток/клеток-предшественников, и их самоорганизации посредством сортировки клеток и пространственно ограниченной детерминации клонов, аналогично процессу развития in vivo (Lancaster and Knoblich, 2014; Clevers, 2016; Fatehullah et al., 2016). Органоидные структуры могут стабильно поддерживаться в долговременных культурах in vitro , продолжая отражать, даже после многих поколений, in vivo характеристики исходной ткани без каких-либо существенных генетических или физиологических изменений (Huch et al., 2015). ; Акбари и др., 2019). В процессе культивирования органоидов, часто тканеспецифическим образом, используется ряд факторов роста и малых молекул для регуляции сигнальных путей, необходимых для самообновления, дифференцировки и пролиферации органоидов.В настоящее время широко используются два основных подхода к успешному формированию органоидов с использованием определенных биохимических факторов в правильной трехмерной матрице. Первый подход основан на дифференцировке плюрипотентных стволовых клеток (ПСК), которые затем самоорганизуются с образованием тканеспецифических органоидов, таких как глазной бокал (Eiraku et al., 2011; Nakano et al., 2012; Kuwahara et al. ., 2015; Eldred et al., 2018), мозг (Lancaster et al., 2013; Pas̨ca et al., 2015), кишечник (Spence et al., 2011), поджелудочная железа (Greggio et al., 2013), печень (Takebe et al., 2013; Sampaziotis et al., 2015; Guan et al., 2017; Lee et al., 2018; Akbari et al., 2019; Koike et al., 2019), легкие (Dye et al., 2015), простаты (Drost et al., 2016), почек (Takasato et al., 2015) и кровеносных сосудов (Wimmer et al., 2019). Второй подход основан на получении функциональных органоидов из тканеспецифичных взрослых/фетальных/детских стволовых клеток или клеток-предшественников, которые сохраняют в нормальных и поврежденных условиях регенеративную способность определенных тканей.Эти типы органоидов также были обнаружены во многих тканях, включая кишечник (Ootani et al., 2009; Sato et al., 2009), желудок (Barker et al., 2010), печень (Huch et al., 2015; Hu et al., 2010). al., 2018), почек (Schutgens et al., 2019), кожи (Boonekamp et al., 2019) и поджелудочной железы (Huch et al., 2013a; Boj et al., 2015).
Печень
Структура и функции
Печень, самый большой орган в организме, выполняет жизненно важные метаболические, экзокринные и эндокринные функции. В дополнение к выработке желчи и регуляции метаболизма гликолиза, мочевины и холестерина, печень способствует детоксикации крови и регулирует гомеостаз крови, в частности, путем секреции факторов свертывания и сывороточных белков, таких как альбумин (Gordillo et al., 2015; Стангер, 2015). Долька печени, состоящая из гетерогенных типов клеток, является наименьшей структурной единицей печени. Метаболически он делится на разные структурные зоны и функциональные организации (Kietzmann, 2017). Гепатоциты являются основным паренхиматозным типом клеток долек печени, на их долю приходится около 70% общей массы взрослого органа. Гепатоциты и холангиоциты (другой тип эпителиальных клеток печени) происходят из эмбриональной энтодермы, в то время как непаренхиматозные клетки печени, такие как стромальные клетки, звездчатые клетки, клетки Купфера и кровеносные сосуды, имеют мезодермальное происхождение (Gordillo). и другие., 2015; Стангер, 2015). Последние передовые технологии, в частности секвенирование одноклеточной РНК, сделали возможным идентифицировать существование эпителиальных предшественников, резидентных в печени взрослого человека, и картировать гетерогенность ствола/предшественника в печени. Эти новые идеи послужили надежным ориентиром для углубления понимания биологии и физиологии печени (Aizarani et al., 2019).
Органогенез печени
Основной принцип технологии органоидов печени заключается в повторении основных фаз органогенеза в чашке.Поэтому понимание последовательных событий и регуляторных факторов в развитии печени имеет решающее значение (Tremblay and Zaret, 2005; Si-Tayeb et al., 2010a; Fiorotto et al., 2018). Во время гаструляции бластула сначала дает начало энтодерме (один из трех первичных зародышевых слоев), которая в дальнейшем разделяется на дискретные домены органов в передней, средней и задней кишке. Затем из энтодермы передней кишки формируется зачаток печени путем индукции сигналов Activin/Nodal, WNT, FGF и BMP (Douarin, 1975; Gualdi et al., 1996; Юнг и др., 1999; Камия и др., 1999; Росси и др., 2001; Зарет, 2002; Д’Амур и др., 2005 г.; Хан и др., 2011). После образования этой структуры гепатобласты подвергаются экспансии и дифференцировке с образованием как гепатоцитов, так и билиарного эпителия, в то время как соседняя мезодермальная мезенхима способствует образованию фибробластов печени и звездчатых клеток. Затем нормальная структура ткани печени завершается дальнейшим созреванием гепатоцитов и холангиоцитов и клеточной интеграцией мезенхимы и эндотелия (Tremblay and Zaret, 2005).
Органоидные модели
Полученные с помощью iPSC 3D-модели органоидов печени
Печеночные органоиды
Создание печеночных органоидов из iPCS впервые было предложено Takebe и его коллегами с использованием элегантной модели совместного культивирования. В этой модели печеночные предшественники были получены путем поэтапной дифференцировки из иПСК в условиях двумерной клеточной культуры, а затем совместно культивированы с мезенхимальными стволовыми клетками человека (МСК) и эндотелиальными клетками пупочной вены человека (HUVEC). Впоследствии макроскопически видимые 3D-агрегаты, называемые зачатками иПСК-печени (LB), спонтанно продуцировались в культуре, залитой матригелем.Кроме того, структуры сосудов человека в iPSC-LB стали функциональными за счет соединения с сосудами хозяина после трансплантации. В частности, клетки печени в привитых зачатках печени начали секретировать альбумин в кровоток мыши-реципиента с 10-го по 45-й день после трансплантации. Что еще более важно, эти структуры зачатков органов продемонстрировали способность регенерировать и восстанавливать летальную печеночную недостаточность, вызванную лекарствами (Takebe et al., 2013). В последующем исследовании секвенирование РНК одиночных клеток выявило паттерны экспрессии генов, уникальные для наследственной идентичности, и облегчило идентификацию гетерогенных и динамических клеточных популяций во время дифференцировки от плюрипотентности до зачатка печени (Camp et al., 2017; Поттер, 2018). После этих усилий по созданию функционального зачатка печени человека многие исследовательские группы разработали различные протоколы для получения различных типов органоидов печени, полученных из плюрипотентных стволовых клеток. Некоторые важные протоколы в этой области представлены на рис. 1.
Рис. 1. Ключевые протоколы для создания трехмерных культур органоидов печени, полученных из иПСК. FCS, эмбриональная телячья сыворотка; 3D, трехмерный; FGF, фактор роста фибробластов; TGF, трансформирующий фактор роста; Р-СПО, Р-Спондин; EGF, эпидермальный фактор роста; HGF, фактор роста гепатоцитов; СМ, состояние среднее; FACS, сортировка клеток, активируемая флуоресценцией; EpCAM, молекула адгезии эпителиальных клеток; иПСК, индуцированные плюрипотентные стволовые клетки; BMP, костный морфогенетический белок; МЭ, мезоэнтодерма; HP, печеночный предшественник; KGF, фактор роста кератиноцитов; HB, гепатобласт; HCM, культуральная среда гепатоцитов; ОСМ, Онкостатин М; H/C, гепатоцит/холангиоцит; Декса, Дексаметазон; ITS, инсулин-трансферрин-селен; DE, окончательная энтодерма; ФГ, передняя кишка; FP, прародитель передней кишки; CP, предшественник холангиоцитов.
Гуан и др. (2017) недавно установили печеночные органоиды, происходящие из иПСК (Hep-org), окруженные протоковыми структурами холангиоцитов, в течение примерно 50–60 дней. К сожалению, когда эти органоиды достигли критического размера, затрудняющего получение достаточного количества питательных веществ и кислорода, их пролиферация и регенеративная способность значительно снизились. Этот недостаток был преодолен путем диссоциации органоидов на отдельные клетки, а затем повторного посева и преобразования их в матригеле (Guan et al., 2017). Недавно был описан новый протокол для получения органоидов, полученных из плюрипотентных стволовых клеток человека (hPSC), с гепатобилиарной структурой. Органоиды демонстрировали сигнатуры экспрессии генов печени и ключевые функциональные характеристики холангиоцитов in vitro и выживали более 8 недель после трансплантации мышам с иммунодефицитом (Wu et al., 2019).
Совсем недавно мы описали быстрый и высокоэффективный протокол для производства органоидов печени человека, полученных из ИПСК.Наше исследование показало, что обогащение клеток эпителиальной клеточной адгезии (EpCAM)-положительными клетками приводит к гомогенной популяции энтодермальных клеток и лицензирует дифференцировку функциональных гепатоцитов. Кроме того, R-Spondin улучшил спецификацию EpCAM-позитивных промежуточных клеток энтодермы в этой культуральной системе (Akbari et al., 2019). Более того, только EpCAM-позитивные эндодермальные клетки, а не EpCAM-негативные клетки, обладают способностью образовывать печеночные органоиды. Наши результаты полностью согласуются с предыдущими исследованиями, показывающими, что EpCAM демонстрирует динамический паттерн экспрессии генов во время развития печени и что EpCAM-позитивные клетки способны образовывать компартменты печени (Schmelzer et al., 2007; Танака и др., 2009 г.; Лу и др., 2013). Кроме того, наше исследование показало, что эти печеночные органоиды, происходящие из энтодермы (получившие название eHEPO), могут продуцироваться за 14 дней и размножаться в течение более 1 года без какой-либо значительной потери эффективности культивирования (Akbari et al., 2019). Аналогично, анализ характеристик in vitro показал, что eHEPO могут приобретать эпителиальную морфологию и псевдостратифицированную структуру. Одним из ключевых аспектов этого метода было сохранение клеточного состава и морфологической структуры eHEPO в молодых и старых органоидах.Кроме того, анализ профилей экспрессии генов выявил переход от плюрипотентности к зрелым гепатоцитам. Наконец, eHEPO проявляли функциональные характеристики зрелых гепатоцитов in vitro , эффективно приживались в печени мыши и экспрессировали ALB человека на 32-й день после интраселезеночной инъекции (Akbari et al., 2019). Совсем недавно был разработан прорывной метод создания целостной многоорганной структуры. Во-первых, сфероиды передней и задней кишки были отдельно дифференцированы из ИПСК.После этого передний сфероид был перенесен на соседний задний сфероид. Со временем эти сферы слились и инвагинировали как взаимосвязанный мультиорган. В целом, этот метод продемонстрировал, что переднезаднее взаимодействие воспроизводит границу передней и средней кишки in vitro , даже в отсутствие внешних факторов (Koike et al., 2019).
Органоиды холангиоцитов
Другой тип органоидов, обладающих характеристиками и функциями холангиоцитов, был разработан и использован несколькими исследовательскими группами для изучения физиологии желчных протоков и холангиопатий.Впервые Дианат и соавт. (2014) успешно создали холангиоцитоподобные клетки (CLC), полученные из иПСК, в 3D-культуре. Эти клетки демонстрировали структурное и функциональное сходство с первичными холангиоцитами, такое как образование ресничек и реакция на гормональную стимуляцию. Точно так же CLC были способны транспортировать Rhodamine 123 в просвет с помощью трансмембраны множественной лекарственной устойчивости 1 (MDR1), еще одного свойства физиологически функциональных холангиоцитов (Dianat et al., 2014). Затем, объединив 2D-монослой и 3D-системы культивирования, Огава и его коллеги создали органоиды холангиоцитов (Chol-org) из hPSCs.В этом методе использовались сигналы развития холангиоцитов для создания самоорганизующейся структуры, подобной желчному протоку. Судьбу холангиоцитов определяли с помощью 3D-совместного культивирования гепатобластов со стромальными клетками OP9 в присутствии гормонов роста. Здесь белок NOTCH, секретируемый клетками OP9, использовали для имитации передачи сигналов JAG1/Notch и стимулирования развития и спецификации холангиоцитов. Холангиоциты проявляли ветвящуюся морфологию и профили экспрессии генов, связанных с холангиоцитами. Кроме того, эти клетки потеряли экспрессию маркеров гепатобластов и гепатоцитов, таких как альфа-фетопротеин (АФП) и альбумин.Анализ транспортной активности и тест набухания кисты, вызванный форсколином, подтвердили функциональность этих холангиоцитов (Ogawa et al., 2015). Другой подход, разработанный Sampaziotis et al. (2015) продемонстрировали, что Chol-org может быть получен из предшественников холангиоцитов, происходящих из гепатобластов, с использованием FGF10, Activin A, ретиноевой кислоты и EGF. Эти Chol-org продемонстрировали функциональные свойства холангиоцитов, такие как активность щелочной фосфатазы и гамма-глутамил-транспептидазы, а также поглощение и экспорт желчных кислот (Sampaziotis et al., 2015, 2017). Кроме того, использование ламинина в качестве матрицы увеличивало количество и диаметр кист, а также экспрессию генов-маркеров холангиоцитов, полученных из иПСК (Takayama et al., 2016).
3D-модели органоидов печени взрослых, полученных из стволовых клеток
Печень обладает замечательной регенеративной способностью (Michalopoulos, 2010; Hindley et al., 2014; Stanger, 2015). Однако типы клеток, участвующих в гомеостазе печени и регенерации после повреждения, точно не определены. Ранее было показано, что Sox9-позитивные клетки (овальные клетки) вблизи желчных протоков участвуют в регенеративной реакции печени после массивного повреждения (Furuyama et al., 2011). Такие результаты хорошо согласуются с другими исследованиями, в которых подчеркивается вклад клеток билиарного эпителия в регенеративный ответ печени (Dorrell et al., 2011; Espanol-Suner et al., 2012). Сходным образом, результаты этих исследований согласуются с другими данными, демонстрирующими, что удаление печеночных предшественников нарушает регенерацию печени (Shin et al., 2015). В совокупности эти находки указывают на то, что стволовые/прогениторные клетки печени сохраняют способность образовывать паренхиму печени in vivo и органоиды in vitro .
Имеющиеся данные свидетельствуют о том, что Lgr5-позитивные клетки-предшественники отсутствуют в здоровой взрослой печени и поджелудочной железе (Huch et al., 2013b), а активируются при химическом повреждении и обнаруживаются вблизи желчных протоков печени. . Было показано, что свежевыделенные фрагменты здоровых желчных протоков и, что более интересно, Lgr5-позитивные одиночные клетки, выделенные из мышиной печени, могут давать 3D органоиды. Эти бипотентные эпителиальные органоиды печени могут быть дифференцированы в зрелые и функциональные гепатоциты in vitro и могут восстанавливать печеночную недостаточность у мутантных мышей по фумарилацетоацетатгидролазе ( Fah -/-), модели тирозинемии I типа заболевания печени, после трансплантации (Huch и другие., 2013б; Брутье и др., 2016). Кроме того, группа Clevers адаптировала протокол органоидов печени мыши для культивирования бипотентных стволовых клеток из печени взрослого человека (Huch et al., 2015). Они продемонстрировали, что EpCAM-позитивные единичные клетки человека из области протоков или даже фрагментов протоков могут развиваться в клональные эпителиальные печеночные органоиды. Эти органоиды могут генерировать функциональные гепатоциты после дифференцировки in vitro и приживления в паренхиме печени реципиента мыши in vivo .Исследование также показало, что органоиды были генетически стабильны в долгосрочных культурах, характеризуясь небольшим количеством изменений одиночных оснований, большинство из которых, вероятно, были включены до или во время образования органоидов, но не во время культивирования (Huch et al., 2015). . Хотя модель Хача элегантно продемонстрировала, что прогениторы протоков обладают способностью генерировать гепатоциты в определенных условиях культивирования, а Рэйвен и его сотрудники совсем недавно показали, что нарушение гепатоцеллюлярной регенерации во время повреждения печени может запускать протоковую реакцию и образование гепатоцитов негепатоцитарного происхождения (Рейвен и другие., 2017), продолжаются споры вокруг исследований, которые показали, что большая часть регенеративного ответа после повреждения печени зависит в первую очередь от гепатоцитов, а не от стволовых клеток (Grompe, 2014). В частности, исследования по отслеживанию клонов мышей предоставили подтверждающие доказательства того, что только гепатоциты участвуют в регенерации печени после повреждения (Schaub et al., 2014; Yanger et al., 2014). Передача сигналов Wnt от эндотелиальных клеток печени может влиять на гомеостатическое самообновление гепатоцитов.Специализированные Axin2-позитивные клетки, локализованные в перицентральной дольке печени, ранее были идентифицированы как источник предшественников для этой гомеостатической реакции (Wang et al., 2015). Экспрессия раннего маркера предшественников печени TBX3 в этих типах клеток подтверждает наличие популяции зрелых клеток и клеток-предшественников во взрослой печени. Сходным образом перипортальные и гибридные гепатоциты с низким уровнем экспрессии SOX9 восполняют массу печени после хронического повреждения (Font-Burgada et al., 2015). Соответственно, группа Clevers недавно создала новую модель органоида, происходящую из одного зрелого Axin2-позитивного гепатоцита.Их исследование показало, что сигнальные пути Wnt/Rspo1 и HGF являются основными регуляторами первичной экспансии гепатоцитов как в мышиных, так и в человеческих моделях органоидов. Этот подход способствовал росту печеночных органоидов из одного гепатоцита сразу после расщепления коллагеназой. Здесь как неповрежденные гепатоциты, так и гепатоциты из физически поврежденной печени (частичная гепатэктомия, PHx) использовали для производства мышиных печеночных органоидов. Эти органоиды отображали ключевые функциональные признаки и профили экспрессии генов гепатоцитов.Кроме того, анализ обогащения набора генов (GSEA) органоидов, полученных из PHx, показал, что профили экспрессии генов печеночных органоидов мыши напоминают профили пост-PHx пролиферирующих гепатоцитов. Соответственно, печеночные органоиды воспроизводили регенеративный ответ взрослой печени после частичной гепатэктомии. Образцы печени плода и взрослого человека также использовались для формирования органоидов в том же исследовании. По сравнению с органоидами печени взрослых доноров органоиды печени эмбрионального происхождения демонстрировали более высокую способность к расширению.Одной из причин нарушения экспансии во взрослых печеночных органоидах может быть изначально ограниченная активность фермента теломеразы (Hu et al., 2018). Более того, низкое количество холангиоцитов внутри печеночных органоидов и трансдифференцировка Hep-org в Chol-org при культивировании в среде холангиоцитов (Huch et al., 2015) является признаком образования de novo желчных протоков после частичного резекция. Печеночные органоиды в этом исследовании отличались от более ранних моделей Chol-org с точки зрения размера клеток, соотношения ядро/цитоплазма, субклеточной структуры и функции, а также профилей экспрессии генов.Это критическое различие можно объяснить клеткой происхождения органоидов. В то время как печеночные органоиды происходят из гепатоцитов, Chol-org развиваются из EpCAM-позитивных клеток-предшественников. Более того, что касается функциональности in vivo , то же исследование показало, что органоиды способны приживаться и репопуляции в печени мышей с иммунодефицитом (Hu et al., 2018).
Сложные перекрестные помехи между гепатоцитами, плазмой и другими резидентными клетками печени играют ключевую роль в поддержании функций печени и регуляции регенеративных реакций.Аутокринные сигналы от гепатоцитов (VEGF, TGF-α), паракринные сигналы от звездчатых клеток (HGF) (Michalopoulos, 2007) и воспалительные цитокины от клеток Купфера (IL-6 и TNF-α) необходимы для запуска успешной регенеративной реакции печени. . Пэн и др. (2018) недавно показали, что TNF-α будет способствовать экспансии мышиных гепатоцитов в условиях 3D-культуры 90–114 in vitro 90–115. Кроме того, эти клетки были способны приживаться и повторно заселяться в печени мыши Fah -/-. Основываясь на этих выводах, можно сделать вывод, что этот подход потенциально может быть интегрирован с протоколом Ху для создания гепатоцитов человека с почти физиологическими характеристиками.Другая модель культуры органоидов печени была разработана Vyas et al. (2017). Здесь децеллюляризованные каркасы печени хорька засевают клетками-предшественниками плода человека, содержащими стромальные и эндотелиальные клетки печени, а затем инкубируют в среде для дифференцировки в течение 3 недель для индукции гепатобилиарных органоидов в условиях культивирования in vitro . Хотя эта модель доказала, что спецификация и созревание печеночных и билиарных клонов в каркасе были лучше, чем для клеток, выращенных в матригеле, способность к самообновлению органоидов и эффективность этого метода в воспроизведении функций печени взрослых были сравнительно низкими (рис. 2).
Рис. 2. Ключевые протоколы для разработки трехмерных культур органоидов печени, полученных из стволовых клеток взрослой печени. 3D, трехмерный, FGF, фактор роста фибробластов; TGF, трансформирующий фактор роста; Р-СПО, Р-Спондин; EGF, эпидермальный фактор роста; HGF, фактор роста гепатоцитов; СМ, состояние среднее; FACS, сортировка клеток, активируемая флуоресценцией; EpCAM, молекула адгезии эпителиальных клеток.
3D-модели органоидов для непаренхиматозных клеток печени
Звездчатые клетки печени (ЗКП) представляют собой специфичные для печени мезенхимальные клетки, которые вносят вклад в физиологию и патофизиологию печени (Scholten et al., 2010; Медераке и др., 2013; Уэллс, 2014). В здоровой печени ГСК исходно находятся в состоянии покоя, и их функция заключается в хранении липидных капель витамина А. После повреждения токсинами или вирусными инфекциями ГСК становятся метаболически активными, что приводит к накоплению ВКМ в печени (Friedman, 2008). ГСК имеют ограниченную способность к пролиферации в 2D-культуре, не могут поддерживать фенотип покоя и спонтанно теряют ключевые функциональные признаки in vitro (Mederacke et al., 2015; Perea et al., 2015). Коуи и др. (2017) показали, что HSC-предшественники, полученные из iPSC, могут размножаться и созревать in vitro и могут приобретать специфичные для линии характеристики. Недавнее исследование Coll et al. (2018) создали эффективную систему культивирования для дифференциации ГСК от ИПСК. В этой системе HSC были созданы с помощью протоколов, которые изначально были разработаны для создания HSC из ESC (Asahina et al., 2009; Onitsuka et al., 2010). Вкратце, иПСК дифференцировались в сторону мезодермальных предшественников с BMP4.Затем эти мезотелиальные клетки индуцировали ретинолом и пальмитиновой кислотой для их последующей дифференцировки в ГСК. Через 12 дней полученные клетки напоминали первичные ГСК с точки зрения морфологии, профиля транскриптома и функциональных признаков. Кроме того, при выращивании в виде сокультур 3D-сфероидов вместе с клетками HepaRG, HSC сохраняли витамин А и, что более важно, они переключались из состояния покоя в состояние активации в ответ на гепатотоксичность. В заключение, этот метод обеспечивает надежную и надежную систему культивирования для исследования биологии и патобиологии печени с использованием печеночных органоидов и активированных ГСК (Coll et al., 2018).
Потенциальное применение органоидов печени
Органоиды имеют много больших преимуществ по сравнению с обычными методами культивирования клеток. Эти миниатюрные органы обеспечивают долгосрочное стабильное расширение почти физиологическим образом и имитируют функцию и структуру трехмерной ткани, а также патологическую патологию. Таким образом, они обладают огромным потенциалом для превращения в отличные платформы для различных фундаментальных и трансляционных исследовательских приложений, включая моделирование заболеваний, скрининг лекарств, генную терапию, выяснение взаимодействий между микробом и хозяином и замену органов (рис. 3).
Рис. 3. Возможное применение органоидов печени.
Модели заболеваний с помощью органоидов печени
За последние несколько лет, с открытием других мощных технологий, в частности редактирования генома CRISPR-Cas9, исследования органоидов открыли новые возможности для понимания молекулярной патофизиологии заболеваний. С этой целью введение специфических для заболевания мутаций в органоиды печени, полученные от здоровых доноров, стало быстрым и беспрепятственным, что позволяет исследователям легко исследовать связанные с мутациями механизмы и клинические фенотипы.В качестве альтернативы, тканевые эксплантаты или биоптаты пациентов также могут быть использованы непосредственно для производства специфических для заболевания органоидов. В таблице 1 приведены модели заболеваний печени, опубликованные в литературе.
Таблица 1. Модели заболеваний печени на основе органоидов.
Редкие и генетические заболевания
Дефицит альфа-1-антитрипсина (A1ATD) — редкое наследственное заболевание, вызывающее заболевания легких и печени, проблемы с кожей и воспаление кровеносных сосудов.A1AT представляет собой ингибитор сериновой протеазы, который синтезируется в основном в печени и с током крови переносится в легкие. Его основная функция в легких заключается в ингибировании фермента, называемого нейтрофильной эластазой, таким образом защищая легочную ткань от протеолитической деградации. Наиболее распространенной генетической миссенс-мутацией в A1ATD является аллель PiZ (Glu 342 Lys) гена SERPINA1, которая приводит к агломерации белков с неправильной укладкой в гепатоцитах (Bals, 2010). Чтобы смоделировать это состояние, Huch et al.(2015) разработали органоиды, используя образцы биопсии печени, полученные от трех пациентов с болезнью A1ATD. Примечательно, что органоиды, полученные от пациентов (PDO), имитировали патологию заболевания со сниженными уровнями белка и агрегацией белка A1AT в эндоплазматическом ретикулуме. Синдром Алажиля (ALGS), еще одно мультисистемное генетическое заболевание, также моделировали с использованием того же подхода (Huch et al., 2015). Следует отметить, что ALGS имеет аутосомно-доминантное наследование и преимущественно вызывается гетерозиготными мутациями в гене JAG1, который кодирует белок Jagged1, трансмембранный лиганд в сигнальном пути Notch.Мутации JAG1 приводят к дефициту в различных тканях, включая печень, сердце и мышцы (Turnpenny and Ellard, 2012). Согласно результатам этого исследования, органоиды пациентов с ALGS были неспособны образовывать интактные структуры желчных протоков 90–114 in vitro 90–115, а клетки в просвете органоида подверглись апоптозу, имитируя 90–114 патологию болезни 90–115 in vivo (Huch et al., 2015). . В дополнение к органоидам, происходящим из ствола печени / предшественников, Гуан и его коллеги использовали ИПСК, специфичные для пациента, для моделирования этого генетического нарушения.В частности, иПСК от двух пациентов с ALGS были дифференцированы в органоиды с помощью протокола, описанного на рисунке 1. В отличие от здоровых органоидов, формирование желчных протоков и билиарная транспортная функция PDO, специфичных для ALGS, были значительно нарушены. Кроме того, используя обратный подход с использованием технологии CRISPR-Cas9, вызывающую ALGS мутацию JAG1 C829X вводили в ИПСК, полученные из фибробластов здорового человека. В результате способность генетически модифицированных органоидов, полученных из ИПСК, образовывать протокоподобные структуры была значительно снижена, повторяя патологию печени ALGS (Guan et al., 2017).
Цитруллинемия типа I (CTLN1) представляет собой наследственное нарушение цикла мочевины в печени, возникающее из-за дефицита фермента аргининосукцинатсинтазы 1 (ASS1) (Kose et al., 2017). У младенцев с тяжелой цитруллинемией I типа наблюдаются опасные для жизни клинические проявления, такие как эпизоды гипераммониемии, которые могут привести к летальному исходу или привести к необратимому неврологическому повреждению. Существующие стратегии (лекарства и диета с низким содержанием белка) для лечения цитруллинемии I типа неэффективны, а в тяжелых случаях долгосрочная выживаемость низкая.Трансплантация клеток с функциональными гепатоцитами становится многообещающим терапевтическим подходом. Недавно ИПСК, полученные от пациентов с цитруллинемией типа I с гомозиготными мутациями G390R в гене ASS1, были использованы для разработки модели, специфичной для заболевания. В частности, специфические для пациента iPSCs были получены путем перепрограммирования дермальных фибробластов с помощью эписомных векторов и дифференцировки в дефинитивную энтодерму при определенных условиях. Затем EpCAM-позитивные энтодермальные клетки, полученные из иПСК, выделяли и использовали для создания культур функциональных печеночных органоидов.Эти органоиды демонстрируют экспрессию гепатоцит-специфического маркерного гена и повторяют ключевые метаболические функции зрелых гепатоцитов, включая поглощение ЛПНП, секрецию альбумина и накопление гликогена. Дальнейший анализ показал, что печеночные органоиды имитировали клинические фенотипы пациентов с цитруллинемией типа I, такие как повышенный уровень аммиака и сниженный уровень мочевины. Более того, эти фенотипы могут быть восстановлены путем эктопической экспрессии гена ASS1 дикого типа в органоидах, полученных от пациентов. В совокупности эта модель предлагает многообещающую основу для изучения стратегий коррекции/замещения генов в клеточной терапии и проведения доклинических исследований по открытию и разработке лекарств при нарушениях цикла мочевины (Akbari et al., 2019).
Органоидыхолангиоцитов, полученные из ИПСК, также использовались для моделирования заболеваний. Например, Огава и его коллеги, как показано на рисунке 1, использовали Chol-org для конкретного пациента для моделирования болезни кистозного фиброза (CF). МВ является опасным для жизни редким аутосомно-рецессивным заболеванием, вызванным мутациями в гене регулятора трансмембранной проводимости муковисцидоза (CFTR). Мутации в гене CFTR нарушают функцию хлорид-ионного канала, вызывая нарушение регуляции потока ионов и транспорта эпителиальной жидкости в легких, поджелудочной железе, толстой кишке и печени.В этом исследовании Chol-org, полученный из иПСК, демонстрировал неправильно свернутые белки CFTR, нарушение образования кист и потерю функции хлоридных каналов, что отражает фенотип заболевания у пациентов. Кроме того, они показали, что воздействие на органоиды препарата VX-770 (Ivacaftor), потенцирующего низкомолекулярный CFTR, вместе с форсколином и IBMX корректировало дефект неправильной укладки и приводило к функциональному восстановлению мутантного белка CFTR (Ogawa et al., 2015). ). Chol-org также использовали в другом исследовании для успешного моделирования ALGS, поликистозной болезни печени и холангиопатии, связанной с муковисцидозом (Sampaziotis et al., 2015). В частности, лечение Chol-org от пациентов препаратами, связанными с CF (верапамил и октреотид), спасло клинический фенотип CF холангиопатии in vitro . В поддержку этих выводов в рамках продолжающегося исследовательского проекта под названием HIT-CF Europe также используются системы культивирования клеток нового поколения с целью оценки эффективности и безопасности лекарств-кандидатов, специфичных для редких мутаций МВ, в органоидах, полученных от пациентов. Проект подчеркивает захватывающее обещание систем культивирования органоидов улучшить жизнь людей с муковисцидозом.В совокупности органоидные технологии следующего поколения обладают огромным потенциалом для точного моделирования заболеваний, связанных с желчевыводящими путями, и прокладывают путь для доклинических исследований на основе органоидов в точной медицине.
Рак и сложные заболевания
Рак печени является пятым наиболее распространенным видом рака в мире и второй основной причиной смерти (Bray et al., 2018). Отсутствие мощных моделей рака печени, которые точно отражают гистопатологию, гетерогенность, профиль генома и транскриптома опухолей, препятствует разработке эффективных методов лечения.В то время как различные модели рака печени, такие как линии раковых клеток и ксенотрансплантаты, полученные от пациентов (PDX), были созданы в прошлом, недостатки каждой модели ограничивают их применение в исследованиях рака печени. Например, при длительном пассировании в 2D-культуре линии раковых клеток накапливают мутации и подвергаются клональной селекции, что приводит к потере исходной генетической и фенотипической гетерогенности (Kim, 2005). Кроме того, низкая скорость приживления трансплантата, высокая стоимость, трудоемкость установки и непригодность для широкомасштабного тестирования на наркотики ограничивают использование моделей PDX (Hidalgo et al., 2014; Гу и др., 2015; Каваллони и др., 2016).
Персонализированная медицина рака — это новый и инновационный подход, направленный на разработку эффективных терапевтических стратегий для каждого пациента на основе специфических особенностей опухоли. В связи с этим опухолевые органоиды, называемые тумороидными моделями, становятся многообещающей платформой. Недавно Брутье и соавт. создали опухолевидную культуральную модель из трех различных подтипов первичного рака печени (PLC), а именно гепатоцеллюлярной карциномы (HCC), холангиокарциномы (CC) и комбинированной гепатоцеллюлярно-холангиокарциномы (CHC), используя образцы рака печени, полученные от пациентов без вирусной инфекции в анамнезе. лечение.Установленные опухолевидные образования сохранили гистологические характеристики, а также профили транскриптома и геномные сигнатуры исходной ткани. Кроме того, исследований in vivo продемонстрировали туморогенный и метастатический потенциал органоидов, полученных из PLC, при трансплантации под капсулу почки. Важно отметить, что интегрированные омические данные органоидов, полученных из PLC, позволили исследователям идентифицировать новые биомаркеры и новые потенциальные терапевтические агенты для PLC, такие как ингибитор ERK (Broutier et al., 2017). В другом исследовании Nuciforo et al. (2018) разработали методологию, с помощью которой они создали опухолевидные образования из образцов пункционной биопсии от разных пациентов с ГЦК с различной стадией опухоли и этиологией. Эти опухолевидные образования успешно воспроизвели гистопатологические свойства наряду с профилями экспрессии генов и мутационными ландшафтами исходных тканей. Более того, они также сохраняли признаки опухоли после трансплантации иммунодефицитным мышам (Nuciforo et al., 2018).
Недавно Li et al.(2019) разработали когорту из 27 опухолевых клеточных линий из нескольких областей образцов опухолей человека от пациентов с CC и HCC. Эпителиальные, желчные протоки, стволовые и муциновые маркеры использовались для характеристики клеточной идентичности опухолевидных образований. Дальнейший анализ показал, что опухоли, полученные от пациентов, отражают гистологические особенности, профили транскриптома и генетический фон исходных первичных опухолей печени. Интересно, что высокопроизводительный скрининг этих опухолевых опухолей показал гетерогенный ответ на лекарство, что свидетельствует о сильной внутриопухолевой и межопухолевой гетерогенности.В результате было обнаружено, что лишь небольшая группа препаратов эффективно блокирует их пролиферацию (Li et al., 2019).
Что касается исследования рака печени, новое исследование показало, что органоидную технологию можно использовать для моделирования возникновения рака (Sun et al., 2019). В частности, Sun и коллеги предположили, что прямое перепрограммирование фибробластов в 3D-гепатоциты может быть осуществлено за счет эктопической экспрессии FOXA3, HNF1A и HNF4A. Интересно, что эти печеночные органоиды имели ограниченную способность к экспансии и пролиферации, которую можно было преодолеть с помощью трансдукции SV40.В этой модели трансдукция c-MYC способствовала инициации HCC и образованию рака печени 90–114 in vivo 90–115, частично за счет индукции чрезмерного сцепления митохондрий и эндоплазматического ретикулума. Кроме того, при ортотопической трансплантации RAS-трансформированные органоиды образовывали внутрипеченочные холангиокарциномы гепатоцитарного происхождения (Sun et al., 2019).
Органоиды, полученные из нормальных тканей, также можно использовать для моделирования рака путем последовательного введения мутаций гена-драйвера рака.Преимущество использования таких моделей заключается в том, что они позволяют исследовать влияние драйверных мутаций на изогенный (идентичный) генетический фон. С этой целью в разных лабораториях были независимо сконструированы мутантные органоиды толстой кишки путем включения мутаций как минимум четырех из наиболее часто изменяемых генов при колоректальной карциноме, а именно KRAS, APC, TP53, SMAD4 и PIK3CA (Drost et al., 2015; Matano et al. др., 2015). Эти мутантные органоиды развили аденокарциномы при трансплантации в капсулу почки мышей-реципиентов, моделируя прогрессирование рака толстой кишки.Точно так же недавнее исследование показало, что потеря функции BAP1 из-за CRISPR-Cas9 в органоидах печени в сочетании с распространенными мутациями холангиокарциномы (TP53, PTEN, SMAD4 и NF1) влияет на организацию эпителиальной ткани и межклеточные соединения. и приводит к приобретению злокачественных признаков (Artegiani et al., 2019).
Потенциал органоидов печени человека как модели для изучения хронических и сложных заболеваний печени также является многообещающим для открытия эффективных методов лечения.В связи с этим Ouchi et al. (2019) разработали метод создания многоклеточной органоидной системы печени для моделирования неалкогольного стеатогепатита. В частности, органоиды печени демонстрировали накопление липидов, фиброз и воспаление при воздействии свободных жирных кислот. Результаты этого исследования позволяют предположить, что эта система может воспроизводить прогрессирующие аспекты стеатогепатита и моделировать болезнь Вольмана и, что более важно, что FGF19 можно использовать для облегчения патологий заболевания (Ouchi et al., 2019).
Взаимодействие хозяина и микробиома
Лаборатория Рэндалла изучала проникновение и локализацию вируса гепатита С (ВГС) в органоидах гепатомы. ВГС колокализуется в базолатеральной мембране, и его вирионы постепенно накапливаются в плотных контактах. Эта модель является многообещающим инструментом для исследования сложных транспортных процессов ВГС (Бакташ и др., 2018). Недавно лаборатория Танигути создала функциональные органоиды печени человека, полученные из ИПСК, и заразила их геномом вируса гепатита В (HBV).Здесь функциональные органоиды печени продемонстрировали более высокую восприимчивость к инфекции HBV, чем 2D-гепатоподобные клетки, полученные из iPSC человека, и могли поддерживать размножение HBV и продуцировать инфекционный вирус в течение более длительного времени. Примечательно, что инфекция HBV приводила к тяжелой печеночной дисфункции органоидов, характеризующейся повышенными маркерами повреждения печени и измененной ультраструктурой печени. Интересно, что это исследование также показало, что органоиды печени, инфицированные HBV, образованные без иммунных клеток, имели нарушенную печеночную функцию, и, таким образом, была предложена гипотеза о том, что HBV действительно может быть цитопатическим вирусом (Nie et al., 2018).
Таким образом, органоиды печени являются многообещающими моделями для изучения взаимодействия вируса гепатита с хозяином и могут легко стать персонализированными моделями инфекции для индивидуальных исследований и лечения гепатита.
Омик Профилирование
Вместо скрининга из установленных библиотек лекарств данные омиксов можно использовать для прогнозирования новых лекарств-кандидатов для болезней. С помощью органоидной технологии можно также амплифицировать достаточное количество здоровых и больных тканей 90–114 in vitro 90–115 и анализировать причинные мутации путем глубокого секвенирования или отслеживать режимы лечения путем фенотипического профилирования органоидов с использованием омических платформ.Недавно команда Хача предсказала новые лекарственные мишени для пациентов с раком печени, изучая омические профили опухолевидных образований, и показала, что ингибиторы ERK могут уменьшать образование опухолей в моделях ксенотрансплантатов, полученных от пациентов (Broutier et al., 2017). Эти результаты показывают, что омическое профилирование может предложить удобную стратегию для понимания молекулярного патогенеза заболеваний и определения новых мишеней для терапевтических препаратов.
Биоинженерные органоидные модели
Для увеличения продолжительности жизни и воспроизводимости клеточных функций in vitro исследовательское сообщество в настоящее время использует множество биоинженерных инструментов, таких как высокопроизводительные микрочипы, технологии «лаборатория на чипе» (Polini et al., 2014; Bhise et al., 2016), белковый микропаттерн, микрофлюидика, специализированные пластины, биомиметические каркасы и биопечать для контроля клеточного микроокружения (Zhang et al., 2017b). Андерхилл и Кетани (2018) недавно рассмотрели достижения в биоинженерных моделях печени, которые можно использовать для скрининга лекарств и детерминант микросреды дифференцировки/функции клеток печени (Massa et al., 2017; Zhang et al., 2017a).
Джин и др. (2018) разработали васкуляризированную трехмерную органоидную модель печени, полученную из индуцированных гепатоцитов (iHep), которые были непосредственно дифференцированы из фибробластов.Они достигли этого путем совместного культивирования iHeps с эндотелиальными клетками в гидрогеле децеллюляризованного трехмерного внеклеточного матрикса печени (LEM) в устройстве для культивирования клеток на основе микрожидкости с непрерывным динамическим потоком среды. Воспользовавшись этой платформой, трехмерные органоиды печени на основе iHep смогли создать мультиорганную систему, состоящую из нескольких органоидов, полученных из различных внутренних органов, и продемонстрировали большую пригодность для функционального и стандартизированного высокопроизводительного скрининга лекарств (HTS) (Jin et al., 2018).
Микротехнологии могут имитировать in vivo -подобную клеточную микросреду, позволяя точно контролировать важнейшие физико-химические факторы, такие как поток жидкости, биохимические сигналы и т. д. (Huh et al., 2010; Schepers et al., 2016; Chung и др., 2017). Недавно Ван и соавт. (2018) предложили простую и надежную стратегию, которая способствовала дифференцировке in situ , длительному 3D-культивированию и созданию функциональных органоидов печени на основе hiPSC в перфузируемой системе микропиллярных чипов.Органоиды печени обнаруживают благоприятный рост и характеристики клеточной гетерогенности, включая дифференцировку гепатоцитов и холангиоцитов, имитируя ткань печени in vivo . В частности, органоиды печени в условиях перфузии продемонстрировали улучшенную жизнеспособность клеток, а также экспрессию генов, специфичных для энтодермы и зрелых гепатоцитов. Более того, по сравнению со статическими культурами они демонстрировали улучшенные метаболические возможности и специфические для печени функции, включая выработку альбумина и мочевины.Наконец, органоиды печени показали гепатотоксический ответ, зависящий от дозы и времени, на ацетаминофен, что снова предлагает идеальную платформу для тестирования наркотиков (Wang et al., 2018).
Гепатотоксичность
Гепатотоксичность относится к токсическому воздействию лекарств и их метаболитов на ткань печени и обычно подразумевает острое повреждение и недостаточность печени, вызванные химическими веществами. Анализ токсичности для всех видов лекарств необходим до их утверждения для выхода на рынок (Kaplowitz, 2005).До сих пор двухмерные первичные гепатоциты использовались в качестве модели для метаболизма лекарств и скрининга токсичности. Однако гепатоциты нестабильны и функционально неэффективны при длительном культивировании из-за нарушения активности цитохрома Р450 (CYP). С этой целью печеночные органоиды могли бы стать отличной платформой для предсказания химической индуцированной гепатотоксичности. Недавно Мун и соавт. (2019) обнаружили, что печеночные органоиды могут экспрессировать ферменты CYP метаболизма лекарств фазы I и ферменты детоксикации фазы II.В частности, CYP1A2 и CYP3A4 индуцировались после лечения омепразолом в культуре органоидов печени. Кроме того, CYP3A4- и CYP1A2/2E1-опосредованные гепатотоксические препараты (троглитазон и АРАР соответственно) анализировали в двумерных культурах гепатоцитов и органоидов. Основываясь на экспериментах по жизнеспособности клеток после воздействия гепатотоксических препаратов в клинически значимых концентрациях, органоиды печени проявляли более высокую чувствительность, чем гепатоциты 2D. В частности, токсическая концентрация тровафлоксацина (антибиотика широкого спектра действия) была примерно в 50 раз выше в гепатоцитах 2D (Mun et al., 2019). В заключение, анализ гепатотоксичности на основе органоидов оказывается полезным для скрининговых исследований лекарств и раннего прогнозирования химического повреждения печени. В качестве альтернативы, наши недавние результаты показывают, что печеночные органоиды, полученные из иПСК, можно легко культивировать в течение многих поколений (по крайней мере, 48 пассажей) и продолжать сохранять функции печени, что делает эту модель подходящей для долгосрочных доклинических скрининговых исследований гепатотоксичности (Akbari et al., 2019).
Биобанкинг
Модели органоидов также будут служить возобновляемым ресурсом благодаря криоконсервации биобанков здоровых и больных человеческих органоидов (van de Wetering et al., 2015). Сегодня эти «живые биобанки» становятся все более привлекательными для исследователей в академических кругах и промышленности для различных целей, особенно связанных с разработкой инновационных терапевтических стратегий, идентификацией новых диагностических маркеров и разработкой индивидуальных планов лечения пациентов. Недавно была создана Инициатива по моделированию рака человека (HCMI) в качестве международного сотрудничества между Национальным институтом рака США (NCI), Cancer Research UK (CRUK), Институтом Wellcome Sanger (WSI) и Hubrecht Organoid Technology (HUB). ).В рамках пилотного этапа, используя передовые технологии, HCMI стремится создать, клинически аннотировать и генетически охарактеризовать около 1000 моделей раковых клеток/органоидов следующего поколения из опухолей пациентов. Общая цель HCMI — продвигать исследования рака, предоставляя исследовательскому сообществу большую коллекцию легкодоступных моделей раковых клеток и все необходимые ресурсы, включая формы согласия и стандартизированные протоколы, используемые для разработки моделей. Затем эти модели рака можно использовать для проведения фундаментальных и трансляционных исследований рака и способствовать обнаружению мишеней для лекарств, идентификации новых биомаркеров, специфичных для заболеваний, и разработке профилактических, а также терапевтических стратегий для персонализированной медицины.
Генная терапия
Целевая генная терапия с большим успехом использовалась для восстановления или инактивации мутаций генетических заболеваний в моделях животных или клеточных культур in vitro. В ближайшем будущем многие усилия, вероятно, будут направлены на объединение современных инструментов редактирования генома с органоидными технологиями in vitro для создания здоровых изогенных органоидов путем исправления генетических дефектов в органоидах, полученных от пациентов. Есть надежда, что эти технологии потенциально могут быть использованы для лечения пациентов с опасными для жизни и другими неизлечимыми заболеваниями, при условии, что трансплантаты будут приняты реципиентной тканью без какого-либо иммунного отторжения.Например, мутация, вызывающая заболевание, недавно была возвращена к дикому типу с помощью CRISPR-Cas9 в органоидах, полученных от пациентов с синдромом Алажиля, и фенотип заболевания был успешно восстановлен in vitro (Guan et al., 2017). ). У нас есть основания полагать, что всякий раз, когда технологии редактирования генома станут полностью применимыми в клинической практике с точки зрения безопасности и эффективности, органоидные технологии также станут пригодными для такой терапии.
Трансплантация
Функциональные органоиды являются многообещающими альтернативами для трансплантации клеток и целых органов, поскольку они могут быть получены из собственных изогенных тканей.Используя технологии iPSC, также возможно генерировать HLA-совместимые тканеспецифические органоиды из легкодоступных биоптатов тканей. Действительно, способность культивируемых in vitro органоидов восстанавливать больную или поврежденную ткань in vivo была продемонстрирована в исследованиях, сообщающих о функциональном приживлении ортотопически трансплантированных органоидов в почках (van den Berg et al., 2018), печени (Takebe et al., 2013; Huch et al., 2015; Hu et al., 2018; Akbari et al., 2019) и головного мозга (Mansour et al., 2018). И последнее замечание: эти трансплантируемые органоиды должны производиться после валидации метода, ключевого элемента доказательства качества и надежности разрабатываемого продукта, в соответствии с требованиями надлежащей производственной лаборатории (GMP).
Ограничения
Несмотря на то, что объем литературы по этой теме невероятно вырос за последние несколько лет (название «Метод года 2017», «2018»), органоидная технология остается несовершенной моделью клеточной культуры, и необходимо решить различные проблемы и ограничения. направлены на улучшение моделей органоидов.В настоящее время время, необходимое для созревания ткани и роста органоидов, является основным ограничением, увеличивающим стоимость генерации органоидов, особенно для определенных органоидов, таких как сетчатка, мозг и печень, где в структуре присутствуют ранние клетки-предшественники/недифференцированные. Другими ограничениями органоидной культуры являются отсутствие васкуляризации, необходимой для обмена питательными веществами, и отсутствие взаимодействия с другими типами клеток нативной микросреды, такими как иммунные и нервные клетки.Более того, современные органоидные культуры не могут воспроизвести сложную сеть между различными системами организма, что является ограничивающим фактором в изучении скоординированных функций и взаимодействий между отдельными органами. Кроме того, органоидные культуры гетерогенны и не имеют надежных средств синхронизации размера, формы и жизнеспособности. Это, к сожалению, приводит к сложностям в систематическом анализе данных и дизайне исследования (Fatehullah et al., 2016). Кроме того, матригель часто является важным компонентом органоидной культуры.Матригель, полученный из мышиной саркомы, является основным практическим барьером на пути создания трансплантируемых человеку органоидов. Более того, культура органоидов не способна имитировать in vivo градиенты факторов роста/сигнальных сигналов в матрице, что потенциально ограничивает рост органоидов из определенных тканей. Чтобы решить эти проблемы и преодолеть эти ограничения, необходимо сконструировать биомиметические каркасы на основе синтетических полимеров или природных макромолекул, а также изменить протоколы, касающиеся рецептов сред.
Обсуждение
Органоиды представляют собой одну из наиболее доступных трехмерных культур клеток и фрагментов органов, в которой самоорганизующиеся свойства стволовых клеток и их дифференцированного потомства используются для создания физиологически релевантных моделей тканей человека in vitro . Эти быстро развивающиеся модели имеют широкий спектр применений, таких как предоставление источника функциональной здоровой и больной ткани человека из ограниченного количества исходного материала для изучения тканеспецифических биологических процессов, анализа динамики поведения стволовых клеток, а также проведения скрининга лекарств и моделирование заболеваний в условиях, близких к физиологическим, тем самым максимально увеличивая их потенциал для преодоления разрыва между фундаментальными исследованиями и трансляционной медициной.Растущий интерес к органоидным технологиям обеспечит доступность этих моделей для широкого круга академических и клинических ученых. В сочетании с более определенным ECM можно предвидеть, что может появиться высокоточная и воспроизводимая модель культуры, которая преодолеет существующие ограничения, препятствующие переходу от лабораторного к прикроватному.
За последнее десятилетие органоиды печени зарекомендовали себя как самая мощная система клеточных культур нового поколения для моделирования заболеваний печени и становятся все более жизнеспособным вариантом для терапевтических стратегий, специфичных для конкретного заболевания или пациента, в персонализированной медицине печени.
Вклад авторов
Все авторы исследовали литературу для рукописи, внесли существенный вклад в обсуждение содержания и написали рукопись. SA, SS и EE рассмотрели и отредактировали рукопись.
Финансирование
Эта работа была поддержана TUBITAK (Совет по научным и технологическим исследованиям Турции) через номер проекта 115S465.
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Благодарности
Мы хотели бы поблагодарить Мустафу Карабичичи за выполнение графического дизайна рисунка 3.
Сноски
Каталожные номера
Айзарани, Н., Савиано, А., Сагар, Майи, Л., Дюран, С., Герман, Дж. С., и соавт. (2019). Атлас клеток печени человека выявляет гетерогенность и эпителиальные предшественники. Природа 572, 199–204. doi: 10.1038/s41586-019-1373-2
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Акбари, С., Севинч Г.Г., Эрсой Н., Басак О., Каплан К., Севинч К. и соавт. (2019). Надежная долговременная культура печеночных органоидов, происходящих из энтодермы, для моделирования заболеваний. Stem Cell Rep. 13, 627–641. doi: 10.1016/j.stemcr.2019.08.007
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Artegiani, B., Van Voorthuijsen, L., Lindeboom, R.G.H., Seinstra, D., Heo, I., Tapia, P., et al. (2019). Исследование опухолевой супрессорной функции BAP1 в органоидах печени человека, сконструированных с помощью CRISPR. Стволовая клетка 24, 927–943.e6. doi: 10.1016/j.stem.2019.04.017
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Асахина, К., Цай, С.Ю., Ли, П., Исии, М., Максон, Р.Е. мл., Суков, Х.М., и соавт. (2009). Мезенхимальное происхождение звездчатых клеток печени, субмезотелиальных клеток и периваскулярных мезенхимальных клеток во время развития печени мыши. Гепатология 49, 998–1011. doi: 10.1002/hep.22721
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Бакташ, Ю., Мадхав А., Коллер К. Э. и Рэндалл Г. (2018). Визуализация отдельных частиц поляризованных органоидов гепатомы при заражении вирусом гепатита С показывает упорядоченный и последовательный процесс проникновения. Микроб-хозяин клетки 23, 382–394.e5. doi: 10.1016/j.chom.2018.02.005
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Barker, N., Huch, M., Kujala, P., Van De Wetering, M., Snippert, H.J., Van Es, J.H., et al. (2010). Стволовые клетки Lgr5(+ve) стимулируют самообновление в желудке и создают долгоживущие желудочные единицы in vitro. Стволовая клетка 6, 25–36. doi: 10.1016/j.stem.2009.11.013
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Бакстер М., Уити С., Харрисон С., Сегериц С.П., Чжан Ф., Аткинсон-Делл Р. и соавт. (2015). Фенотипический и функциональный анализы показывают, что гепатоцитоподобные клетки, полученные из стволовых клеток, лучше имитируют эмбриональные, чем взрослые гепатоциты. J. Гепатол. 62, 581–589. doi: 10.1016/j.jhep.2014.10.016
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Бхизе, Н.С., Манохаран В., Масса С., Тамайол А., Гадери М., Мискуглио М. и др. (2016). Платформа «печень на чипе» с биопечатными печеночными сфероидами. Биофабрикация 8:014101. дои: 10.1088/1758-5090/8/1/014101
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Бисселл, Д.М., Аренсон, Д.М., Махер, Дж.Дж., и Ролл, Ф.Дж. (1987). Поддержка культивируемых гепатоцитов гелем, богатым ламинином. Доказательства функционально значимого субэндотелиального матрикса в нормальной печени крыс. Дж. Клин. Вкладывать деньги. 79, 801–812. дои: 10.1172/JCI112887
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Boj, S.F., Hwang, C.I., Baker, L.A., Chio, I.I., Engle, D.D., Corbo, V., et al. (2015). Органоидные модели протокового рака поджелудочной железы человека и мыши. Сотовый 160, 324–338. doi: 10.1016/j.cell.2014.12.021
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Boonekamp, K.E., Kretzschmar, K., Wiener, D.J., Асра П., Дерахшан С., Пушхоф Дж. и соавт. (2019). Долговременная экспансия и дифференцировка эпидермальных стволовых клеток взрослых мышей в трехмерных органоидных культурах. Проц. Натл. акад. науч. США 116, 14630–14638. doi: 10.1073/pnas.1715272116
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Boost, K.A., Auth, M.K., Woitaschek, D., Kim, H.S., Hilgard, P., Nadalin, S., et al. (2007). Длительная продукция основных факторов и ингибиторов свертывания крови первичными гепатоцитами человека in vitro: перспективы клинического применения. Печень, внутр. 27, 832–844. doi: 10.1111/j.1478-3231.2007.01472.x
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Брей, Ф., Ферлей, Дж., Соэрджоматарам, И., Сигел, Р.Л., Торре, Л.А., и Джемал, А. (2018). Глобальная статистика рака 2018: GLOBOCAN оценивает заболеваемость и смертность во всем мире от 36 видов рака в 185 странах. CA Рак J. Clin. 68, 394–424. doi: 10.3322/caac.21492
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Брутье, Л., Andersson-Rolf, A., Hindley, C.J., Boj, S.F., Clevers, H., Koo, B.K., et al. (2016). Культивирование и создание самообновляющихся 3D-органоидов печени и поджелудочной железы взрослых людей и мышей и их генетические манипуляции. Нац. протокол 11, 1724–1743 гг. doi: 10.1038/nprot.2016.097
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Broutier, L., Mastrogiovanni, G., Verstegen, M.M., Francies, H.E., Gavarro, L.M., Bradshaw, C.R., et al. (2017). Органоидные культуры первичного рака печени человека для моделирования заболеваний и скрининга лекарств. Нац. Мед. 23, 1424–1435. дои: 10.1038/nm.4438
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Camp, J.G., Sekine, K., Gerber, T., Loeffler-Wirth, H., Binder, H., Gac, M., et al. (2017). Многолинейная коммуникация регулирует развитие зачатков печени человека от плюрипотентности. Природа 546, 533–538. doi: 10.1038/nature22796
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Каваллони, Г., Перальдо-Нейя, К., Варамо, К., Casorzo, L., Dell’aglio, C., Bernabei, P., et al. (2016). Создание и характеристика клеточной линии внутрипеченочной холангиокарциномы человека, полученной от итальянского пациента. Тумор Биол. 37, 4041–4052. doi: 10.1007/s13277-015-4215-3
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Chen, Y.F., Tseng, C.Y., Wang, H.W., Kuo, HC, Yang, VW, and Lee, O.K. (2012). Быстрое создание зрелых гепатоцитоподобных клеток из индуцированных человеком плюрипотентных стволовых клеток с помощью эффективного трехэтапного протокола. Гепатология 55, 1193–1203. doi: 10.1002/hep.24790
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Чанг М., Ан Дж., Сон К., Ким С. и Чон Н.Л. (2017). Биомиметическая модель микроокружения опухоли на микрофлюидной платформе. Доп. Здоровьеc. Матер. 6:1700196. doi: 10.1002/adhm.201700196
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Клейтон, Д. Ф., и Дарнелл, Дж. Э. мл. (1983). Изменения транскрипции специфических для печени генов по сравнению с обычными при первичной культуре гепатоцитов мыши. Мол. Клетка. биол. 3, 1552–1561. doi: 10.1128/mcb.3.9.1552
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Coll, M., Perea, L., Boon, R., Leite, S.B., Vallverdu, J., Mannaerts, I., et al. (2018). Генерация звездчатых клеток печени из плюрипотентных стволовых клеток человека позволяет моделировать фиброз печени in vitro. Клетка Стволовая клетка 23, 101–113.e7. doi: 10.1016/j.stem.2018.05.027
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Д’Амур, К.А., Агулник А.Д., Элиазер С., Келли О.Г., Крун Э. и Бетге Э.Э. (2005). Эффективная дифференцировка эмбриональных стволовых клеток человека в дефинитивную энтодерму. Нац. Биотехнолог. 23, 1534–1541. дои: 10.1038/nbt1163
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Дарнелл М., Ульвестад М., Эллис Э., Вайдольф Л. и Андерссон Т.Б. (2012). In vitro оценка основных путей метаболизма лекарств in vivo с использованием первичных гепатоцитов человека и клеток HepaRG в суспензии и динамической трехмерной биореакторной системы. J. Pharmacol. Эксп. тер. 343, 134–144. doi: 10.1124/jpet.112.195834
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Дианат, Н., Дюбуа-Пот-Шнайдер, Х., Штайхен, К., Дестерке, К., Леклерк, П., Равё, А., и соавт. (2014). Создание функциональных холангиоцитоподобных клеток из плюрипотентных стволовых клеток человека и клеток HepaRG. Гепатология 60, 700–714. doi: 10.1002/hep.27165
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Доррелл, К., Erker, L., Schug, J., Kopp, J.L., Canaday, P.S., Fox, A.J., et al. (2011). Перспективное выделение бипотенциальной клоногенной клетки-предшественника печени у взрослых мышей. Гены Дев. 25, 1193–1203. doi: 10.1101/gad.2029411
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Дрост Дж., Картхаус В. Р., Гао Д., Дрихуис Э., Сойерс С. Л., Чен Ю. и др. (2016). Системы органоидных культур эпителия простаты и раковой ткани. Нац. протокол 11, 347–358.doi: 10.1038/nprot.2016.006
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Дрост, Дж., Ван Яарсвельд, Р. Х., Понсиоен, Б., Зимберлин, К., Ван Бокстел, Р., Буйс, А., и др. (2015). Последовательные раковые мутации в культивируемых стволовых клетках кишечника человека. Природа 521, 43–47. doi: 10.1038/nature14415
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Дюваль, К., Гровер, Х., Хан, Л. Х., Моу, Ю., Пегораро, А. Ф., Фредберг, Дж., и другие. (2017). Моделирование физиологических событий в двухмерной и трехмерной культуре клеток. Физиология 32, 266–277. doi: 10.1152/физиол.00036.2016
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Дай, Б.Р., Хилл, Д.Р., Фергюсон, М.А.Х., Цай, Ю.-Х., Наги, М.С., Дьял, Р., и соавт. (2015). Создание in vitro органоидов легких, полученных из плюрипотентных стволовых клеток человека. eLife 4:e05098. doi: 10.7554/eLife.05098
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Эйраку, М., Таката Н., Исибаши Х., Кавада М., Сакакура Э., Окуда С. и др. (2011). Самоорганизующийся морфогенез зрительного бокала в трехмерной культуре. Природа 472, 51–56. doi: 10.1038/nature09941
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Элдред, К.С., Хадыняк, С.Е., Хасси, К.А., Бренерман, Б., Чжан, П.-В., Чамлинг, X., и соавт. (2018). Передача сигналов гормонов щитовидной железы определяет подтипы колбочек в органоидах сетчатки человека. Наука 362:eaau6348.doi: 10.1126/science.aau6348
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Espanol-Suner, R., Carpentier, R., Van Hul, N., Legry, V., Achouri, Y., Cordi, S., et al. (2012). Клетки-предшественники печени дают функциональные гепатоциты в ответ на хроническое повреждение печени у мышей. Гастроэнтерология 143, 1564–1575.e7. doi: 10.1053/j.gastro.2012.08.024
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Фиоротто, Р., Амендуни, М., Мариотти В., Фабрис Л., Спирли К. и Стразабоско М. (2018). Заболевания печени в тарелке: иПСК и органоиды как новый подход к моделированию заболеваний печени. Биохим. Биофиз. Акта Мол. Основа Дис. 1865, 920–928. doi: 10.1016/j.bbadis.2018.08.038
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Фонт-Бургада Дж., Шалапур С., Рамасвами С., Сюэ Б., Росселл Д., Умемура А. и др. (2015). Гибридные перипортальные гепатоциты регенерируют поврежденную печень, не вызывая рака. Сотовый 162, 766–779. doi: 10.1016/j.cell.2015.07.026
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Фуруяма К., Кавагути Ю., Акияма Х., Хоригучи М., Кодама С., Кухара Т. и др. (2011). Непрерывное поступление клеток из зоны предшественников, экспрессирующих Sox9, во взрослую печень, экзокринную поджелудочную железу и кишечник. Нац. Жене. 43, 34–41. doi: 10.1038/ng.722
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Греджио, К., De Franceschi, F., Figueiredo-Larsen, M., Gobaa, S., Ranga, A., Semb, H., et al. (2013). Искусственные трехмерные ниши деконструируют развитие поджелудочной железы in vitro. Разработка 140, 4452–4462. doi: 10.1242/dev.096628
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Gu, Q., Zhang, B., Sun, H., Xu, Q., Tan, Y., Wang, G., et al. (2015). Геномная характеристика большой панели моделей ксенотрансплантата гепатоцеллюлярной карциномы, полученных от пациентов, для доклинической разработки. Онкотарджет 6, 20160–20176. doi: 10.18632/oncotarget.3969
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Gualdi, R., Bossard, P., Zheng, M., Hamada, Y., Coleman, J.R., and Zaret, K.S. (1996). Печеночная спецификация кишечной энтодермы in vitro: клеточная передача сигналов и контроль транскрипции. Гены Дев. 10, 1670–1682. doi: 10.1101/gad.10.13.1670
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Гуань Ю., Xu, D., Garfin, P.M., Ehmer, U., Hurwitz, M., Enns, G., et al. (2017). Органоиды печени человека для анализа генетических заболеваний человека. JCI Insight 2:94954. doi: 10.1172/jci.insight.94954
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Хан, С.Ю., Дзидзич, Н., Гаду, П., Келлер, Г.М., и Гуон-Эванс, В. (2011). Ниша эндотелиальных клеток индуцирует спецификацию печени посредством двойной репрессии передачи сигналов Wnt и notch. Стволовые клетки 29, 217–228.doi: 10.1002/стел.576
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ханнан, Н. Р., Сегериц, К.-П., Тубул, Т., и Валье, Л. (2013). Получение гепатоцитоподобных клеток из плюрипотентных стволовых клеток человека. Нац. протокол 8, 430–437. doi: 10.1038/nprot.2012.153
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Идальго М., Аман Ф., Бьянкин А.В., Будинска Э., Бирн А.Т., Калдас С. и соавт. (2014). Модели ксенотрансплантатов пациентов: новая платформа для трансляционных исследований рака. Рак Дисков. 4, 998–1013. doi: 10.1158/2159-8290.CD-14-0001
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Hu, H., Gehart, H., Artegiani, B., LÖpez-Iglesias, C., Dekkers, F., Basak, O., et al. (2018). Долгосрочное расширение функциональных гепатоцитов мыши и человека как трехмерных органоидов. Ячейка 175, 1591–1606.e19. doi: 10.1016/j.cell.2018.11.013
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Хуч, М., Бонфанти, П., Boj, S.F., Sato, T., Loomans, C.J., Van De Wetering, M., et al. (2013а). Неограниченная экспансия in vitro бипотентных предшественников поджелудочной железы взрослых через ось Lgr5/R-спондин. EMBO J. 32, 2708–2721. doi: 10.1038/emboj.2013.204
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Huch, M., Dorrell, C., Boj, S.F., Van Es, J.H., Li, V.S., Van De Wetering, M., et al. (2013б). Экспансия одиночных стволовых клеток печени Lgr5+ in vitro, индуцированная регенерацией, управляемой Wnt. Природа 494, 247–250. doi: 10.1038/nature11826
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Huch, M., Gehart, H., Van Boxtel, R., Hamer, K., Blockzijl, F., Verstegen, M.M., et al. (2015). Долгосрочная культура стабильных по геному бипотентных стволовых клеток из печени взрослого человека. Сотовый 160, 299–312. doi: 10.1016/j.cell.2014.11.050
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ха Д., Мэтьюз Б. Д., Маммото А., Монтойя-Завала, М., Синь, Х.Ю., и Ингбер, Д.Е. (2010). Воссоздание функций легких на уровне органов на чипе. Наука 328, 1662–1668. doi: 10.1126/science.1188302
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Jin, Y., Kim, J., Lee, J.S., Min, S., Kim, S., Ahn, D.-H., et al. (2018). Васкуляризованные органоиды печени, полученные с использованием индуцированной печеночной ткани и динамической микросреды, специфичной для печени, в качестве платформы для тестирования лекарств. Доп. Функц. Матер. 28:1801954. doi: 10.1002/adfm.201801954
Полнотекстовая перекрестная ссылка | Академия Google
Юнг Дж., Женг М., Гольдфарб М. и Зарет К.С. (1999). Инициация развития печени млекопитающих из энтодермы факторами роста фибробластов. Наука 284, 1998–2003 гг. doi: 10.1126/science.284.5422.1998
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Камия А., Киношита Т., Ито Ю., Мацуи Т., Морикава Ю., Сенба Э. и др. (1999).Развитие печени плода требует паракринного действия онкостатина М через датчик сигнала gp130. EMBO J. 18, 2127–2136. doi: 10.1093/emboj/18.8.2127
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Коике Х., Ивасава К., Оучи Р., Маэдзава М., Гисбрехт К., Сайки Н. и др. (2019). Моделирование органогенеза печени, желчевыводящих путей и поджелудочной железы человека на границе передней и средней кишки. Природа 574, 112–116. doi: 10.1038/s41586-019-1598-0
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Козе, Э., Унал О., Бюльбюль С., Гундуз М., Хаберле Дж. и Арслан Н. (2017). Выявление трех новых мутаций у четырнадцати пациентов с цитруллинемией типа 1. Clin. Биохим. 50, 686–689. doi: 10.1016/j.clinbiochem.2017.01.011
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Костадинова Р., Босс Ф., Эпплгейт Д., Сутер Л., Вайзер Т., Сингер Т. и др. (2013). Долгосрочная трехмерная система совместного культивирования печени для улучшения прогнозирования клинически значимой гепатотоксичности, вызванной лекарствами. Токсикол. заявл. Фармакол. 268, 1–16. doi: 10.1016/j.taap.2013.01.012
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Koui, Y., Kido, T., Ito, T., Oyama, H., Chen, S.W., Katou, Y., et al. (2017). Модель печени человека in vitro с использованием паренхиматозных и непаренхиматозных клеток, полученных из ИПСК. Стволовые клетки Rep. 9, 490-498. doi: 10.1016/j.stemcr.2017.06.010
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Кувахара, А., Озон К., Накано Т., Сайто К., Эйраку М. и Сасаи Ю. (2015). Создание ниши стволовых клеток, похожей на край реснички, из самоорганизующейся ткани сетчатки человека. Нац. коммун. 6:6286. doi: 10.1038/ncomms7286
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ланкастер, Массачусетс, и Кноблих, Дж. А. (2014). Органогенез в блюде: моделирование развития и заболевания с использованием органоидных технологий. Наука 345:1247125. doi: 10.1126/science.1247125
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ланкастер, М.A., Renner, M., Martin, C.A., Wenzel, D., Bicknell, L.S., Hurles, M.E., et al. (2013). Церебральные органоиды моделируют развитие человеческого мозга и микроцефалию. Природа 501, 373–379. doi: 10.1038/nature12517
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ли, Дж., Бске, Р., Тан, П. К., Хартман, Б. Х., Хеллер, С., и Келер, К. Р. (2018). Развитие волосяных фолликулов в органоидах кожи, полученных из плюрипотентных стволовых клеток мышей. Cell Rep. 22, 242–254.doi: 10.1016/j.celrep.2017.12.007
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Li, L., Knutsdottir, H., Hui, K., Weiss, M.J., He, J., Philosophe, B., et al. (2019). Органоиды первичного рака печени человека выявляют неоднородность ответа на лекарство внутри опухоли и между пациентами. JCI Insight [Epub перед печатью].
Реферат PubMed | Академия Google
Лу Х., Ма Дж., Ян Ю., Ши В. и Луо Л. (2013). EpCAM является специфичным для энтодермы дерепрессором Wnt, который лицензирует развитие печени. Дев. Мобильный 24, 543–553. doi: 10.1016/j.devcel.2013.01.021
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Luo, Y., Lou, C., Zhang, S., Zhu, Z.Y., Xing, Q.Z., Wang, P., et al. (2018). Условия культивирования в трехмерном гидрогеле способствуют дифференцировке индуцированных человеком плюрипотентных стволовых клеток в гепатоциты. Цитотерапия 20, 95–107. doi: 10.1016/j.jcyt.2017.08.008
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Мансур, А.A., Goncalves, J.T., Bloyd, C.W., Li, H., Fernandes, S., Quang, D., et al. (2018). Модель in vivo функциональных и васкуляризированных органоидов головного мозга человека. Нац. Биотехнолог. 36, 432–441. doi: 10.1038/nbt.4127
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Мариотти В., Стразабоско М., Фабрис Л. и Кальвизи Д. Ф. (2018). Животные модели повреждения желчевыводящих путей и изменения метаболизма желчных кислот. Биохим. Биофиз. Акта Мол. Основа Дис. 1864, 1254–1261.doi: 10.1016/j.bbadis.2017.06.027
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Масса, С., Сакр, М.А., Сео, Дж., Бандару, П., Арнери, А., Берсини, С., и др. (2017). Биопечатная трехмерная модель васкуляризированной ткани для анализа токсичности лекарств. Биомикрофлюидика 11:044109. дои: 10.1063/1.4994708
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Матано М., Дата С., Симокава М., Такано А., Фуджи М., Охта Ю. и др. (2015).Моделирование колоректального рака с использованием CRISPR-Cas9-опосредованной инженерии кишечных органоидов человека. Нац. Мед. 21, 256–262. дои: 10.1038/nm.3802
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Медераке И., Дапито Д. Х., Аффо С., Учинами Х. и Швабе Р. Ф. (2015). Высокопродуктивное и высокочистое выделение звездчатых клеток печени из нормальной и фиброзной печени мышей. Нац. протокол 10, 305–315. doi: 10.1038/nprot.2015.017
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Медераке, И., Hsu, C.C., Troeger, J.S., Huebener, P., Mu, X., Dapito, D.H., et al. (2013). Отслеживание судьбы показывает, что звездчатые клетки печени являются доминирующими участниками фиброза печени независимо от его этиологии. Нац. коммун. 4:2823. дои: 10.1038/ncomms3823
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Мели, Л., Джордан, Э. Т., Кларк, Д. С., Линхардт, Р. Дж., и Дордик, Дж. С. (2012). Влияние трехмерной микрочиповой среды на культуру клеток человека в системах скрининга наркотиков. Биоматериалы 33, 9087–9096. doi: 10.1016/j.biomaterials.2012.08.065
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Метод года 2017, (2018). Органоиды. Нац. Методы 15:1.
Академия Google
Мун, С.Дж., Рю, Дж.С., Ли, М.О., Сон, Ю.С., О, С.Дж., Чо, Х.С., и другие. (2019). Создание расширяемых человеческих плюрипотентных стволовых клеток, происходящих из гепатоцитоподобных органоидов печени. J. Гепатол. 71, 970–985.doi: 10.1016/j.jhep.2019.06.030
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Накано Т., Андо С., Таката Н., Кавада М., Мугурума К., Секигучи К. и др. (2012). Самостоятельное формирование глазных чашечек и сохраняемой стратифицированной нервной сетчатки из ЭСК человека. Стволовая клетка 10, 771–785. doi: 10.1016/j.stem.2012.05.009
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ни, Ю.З., Чжэн, Ю.В., Миякава, К., Мурата, С., Чжан, Р.Р., Секин К. и соавт. (2018). Повторение взаимодействий вируса гепатита В с хозяином в органоидах печени из плюрипотентных стволовых клеток, индуцированных человеком. EBioMedicine 35, 114–123. doi: 10.1016/j.ebiom.2018.08.014
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Nuciforo, S., Fofana, I., Matter, M.S., Blumer, T., Calabrese, D., Boldanova, T., et al. (2018). Органоидные модели рака печени человека, полученные из игольчатых биопсий опухоли. Cell Rep. 24, 1363–1376.doi: 10.1016/j.celrep.2018.07.001
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Огава, М., Огава, С., Медведь, К.Е., Ахмади, С., Чин, С., Ли, Б., и др. (2015). Направленная дифференцировка холангиоцитов из плюрипотентных стволовых клеток человека. Нац. Биотехнолог. 33, 853–861. doi: 10.1038/nbt.3294
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Оницука И., Танака М. и Миядзима А. (2010). Характеристика и функциональный анализ печеночных мезотелиальных клеток в развитии печени мыши. Гастроэнтерология 138, 1525–1535.e6. doi: 10.1053/j.gastro.2009.12.059
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ootani, A., Li, X., Sangiorgi, E., Ho, Q.T., Ueno, H., Toda, S., et al. (2009). Устойчивая культура кишечного эпителия in vitro в нише Wnt-зависимых стволовых клеток. Нац. Мед. 15, 701–706. doi: 10.1038/nm.1951
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Оучи Р., Того С., Кимура М., Shinozawa, T., Koido, M., Koike, H., et al. (2019). Моделирование стеатогепатита у людей с помощью плюрипотентных органоидов, полученных из стволовых клеток. Cell Metab 30, 374–384.e6. doi: 10.1016/j.cmet.2019.05.007
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Пампалони, Ф., Рейно, Э. Г., и Стельцер, Э. Х. (2007). Третье измерение устраняет разрыв между клеточной культурой и живой тканью. Нац. Преподобный Мол. Клеточная биол. 8, 839–845. doi: 10.1038/nrm2236
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Паска, А.M., Sloan, S.A., Clarke, L.E., Tian, Y., Makinson, C.D., Huber, N., et al. (2015). Функциональные корковые нейроны и астроциты из плюрипотентных стволовых клеток человека в 3D-культуре. Нац. Методы 12, 671–678. doi: 10.1038/nmeth.3415
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Пэн, В. К., Логан, С. Ю., Фиш, М., Анбарчян, Т., Агуисанда, Ф., Альварес-Варела, А., и соавт. (2018). Воспалительный цитокин TNF-альфа способствует длительной экспансии первичных гепатоцитов в 3D-культуре. Ячейка 175, 1607–1619.e15. doi: 10.1016/j.cell.2018.11.012
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Переа, Л., Колл, М., и Санчо-Брю, П. (2015). «Оценка фиброзных поражений печени in vitro», в Protocols in Vitro Hepatocyte Research , eds M. Vinken and V. Rogiers, (Berlin: Springer), 391–401. дои: 10.1007/978-1-4939-2074-7_30
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Полини А., Проданов Л., Бхисе, Н.С., Манохаран, В., Докмечи, М.Р., и Хадемхоссейни, А. (2014). Органы-на-чипе: новый инструмент для открытия лекарств. Экспертное заключение. Препарат Дисков. 9, 335–352. дои: 10.1517/17460441.2014.886562
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Рэйвен А., Лу В.Ю., Ман Т.Ю., Феррейра-Гонсалес С., О’дуибхир Э., Дуайер Б.Дж. и др. (2017). Холангиоциты действуют как факультативные стволовые клетки печени при нарушении регенерации гепатоцитов. Природа 547, 350–354.doi: 10.1038/nature23015
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Росси, Дж. М., Данн, Н. Р., Хоган, Б. Л., и Зарет, К. С. (2001). Различные мезодермальные сигналы, включая BMP от septum transversum мезенхимы, необходимы в комбинации для гепатогенеза из энтодермы. Гены Дев. 15, 1998–2009 гг. doi: 10.1101/gad.1
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Сампазиотис, Ф., Де Брито, М.К., Гети И., Бертеро А., Ханнан Н.Р.Ф. и Валье Л. (2017). Направленная дифференцировка индуцированных человеком плюрипотентных стволовых клеток в функциональные холангиоцитоподобные клетки. Нац. протокол 12, 814–827. doi: 10.1038/nprot.2017.011
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Сампазиотис, Ф., Де Брито, М.С., Мадригал, П., Бертеро, А., Саеб-Парси, К., Соарес, Ф.А.С., и соавт. (2015). Холангиоциты, полученные из индуцированных человеком плюрипотентных стволовых клеток, для моделирования заболеваний и проверки лекарств. Нац. Биотехнолог. 33, 845–852. doi: 10.1038/nbt.3275
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Сато, Т., Врис, Р. Г., Снипперт, Х. Дж., Ван Де Ветеринг, М., Баркер, Н., Штанге, Д. Е., и соавт. (2009). Отдельные стволовые клетки Lgr5 строят структуры крипт-ворсинок in vitro без мезенхимальной ниши. Природа 459, 262–265. doi: 10.1038/nature07935
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Шауб, Дж. Р., Малато, Ю., Гормонд, К., и Вилленбринг, Х. (2014). Доказательства против происхождения новых гепатоцитов из стволовых клеток в обычной мышиной модели хронического повреждения печени. Cell Rep. 8, 933–939. doi: 10.1016/j.celrep.2014.07.003
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Шеперс, А., Ли, К., Чабра, А., Сеней, Б.Т., и Бхатия, С. (2016). Разработка перфузируемой трехмерной платформы печени человека из iPS-клеток. Лабораторный чип 16, 2644–2653. дои: 10.1039/c6lc00598e
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Шмельцер, Э., Zhang, L., Bruce, A., Wauthier, E., Ludlow, J., Yao, H.L., et al. (2007). Стволовые клетки печени человека от эмбриональных и постнатальных доноров. Дж. Эксп. Мед. 204, 1973–1987 гг. doi: 10.1084/jem.20061603
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Scholten, D., Osterreicher, C.H., Scholten, A., Iwaisako, K., Gu, G., Brenner, D.A., et al. (2010). Генетическая маркировка не выявляет эпителиально-мезенхимальный переход холангиоцитов при фиброзе печени у мышей. Гастроэнтерология 139, 987–998. doi: 10.1053/j.gastro.2010.05.005
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Schutgens, F., Rookmaaker, M.B., Margaritis, T., Rios, A., Ammerlaan, C., Jansen, J., et al. (2019). Тубулоиды, полученные из почек и мочи взрослого человека, для персонализированного моделирования заболеваний. Нац. Биотехнолог. 37, 303–313. doi: 10.1038/s41587-019-0048-8
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Шин, С., Upadhyay, N., Greenbaum, L.E., and Kaestner, K.H. (2015). Удаление Foxl1-Cre-меченых клеток-предшественников печени и их потомков ухудшает восстановление мышей после повреждения печени. Гастроэнтерология 148, 192–202.e3. doi: 10.1053/j.gastro.2014.09.039
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Si-Tayeb, K., Noto, F.K., Nagaoka, M., Li, J., Battle, M.A., Duris, C., et al. (2010б). Высокоэффективное получение гепатоцитоподобных клеток человека из индуцированных плюрипотентных стволовых клеток. Гепатология 51, 297–305. doi: 10.1002/hep.23354
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Spence, J.R., Mayhew, C.N., Rankin, S.A., Kuhar, M.F., Vallance, J.E., Tolle, K., et al. (2011). Направленная дифференцировка плюрипотентных стволовых клеток человека в ткани кишечника in vitro. Природа 470, 105–109. doi: 10.1038/nature09691
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Сунь, Л., Ван, Ю., Сен, Дж., Ma, X., Cui, L., Qiu, Z., et al. (2019). Моделирование возникновения рака печени с помощью органоидов, полученных из непосредственно перепрограммированных гепатоцитов человека. Нац. Клеточная биол. 21, 1015–1026. doi: 10.1038/s41556-019-0359-5
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Такахаши К., Танабэ К., Охнуки М., Нарита М., Ичисака Т., Томода К. и др. (2007). Индукция плюрипотентных стволовых клеток из фибробластов взрослого человека определенными факторами. Сотовый 131, 861–872.doi: 10.1016/j.cell.2007.11.019
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Takasato, M., Er, P.X., Chiu, H.S., Maier, B., Baillie, G.J., Ferguson, C., et al. (2015). Органоиды почек из iPS-клеток человека содержат несколько клонов и моделируют нефрогенез человека. Природа 526, 564–568. doi: 10.1038/nature15695
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Такаяма К., Митани С., Нагамото Ю., Сакураи Ф., Тачибана М., Танигути Ю. и др. (2016). Ламинин 411 и 511 способствуют дифференцировке холангиоцитов индуцированных человеком плюрипотентных стволовых клеток. Биохим. Биофиз. Рез. коммун. 474, 91–96. doi: 10.1016/j.bbrc.2016.04.075
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Такебе, Т., Секине, К., Эномура, М., Койке, Х., Кимура, М., Огаэри, Т., и др. (2013). Васкуляризованная и функциональная печень человека из трансплантата зачатка органа, полученного из ИПСК. Природа 499, 481–484.doi: 10.1038/nature12271
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Танака М., Окабе М., Судзуки К., Камия Ю., Цукахара Ю., Сайто С. и др. (2009). Гепатобласты мыши на разных стадиях развития характеризуются экспрессией EpCAM и DLK1: резкое изменение экспрессии EpCAM во время развития печени. Мех. Дев. 126, 665–676. doi: 10.1016/j.mod.2009.06.939
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Трембле, К.Д. и Зарет К.С. (2005). Отдельные популяции клеток энтодермы сливаются, чтобы генерировать эмбриональный зачаток печени и вентральные ткани передней кишки. Дев. биол. 280, 87–99. doi: 10.1016/j.ydbio.2005.01.003
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Андерхилл, Г. Х., и Кетани, С. Р. (2018). Биоинженерные модели печени для тестирования лекарств и изучения дифференцировки клеток. Сотовый. Мол. Гастроэнтерол. Гепатол. 5, 426–439.e1. doi: 10.1016/j.jcmgh.2017.11.012
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
van de Wetering, M., Francies, H.E., Francis, J.M., Bounova, G., Iorio, F., Pronk, A., et al. (2015). Перспективное создание биобанка живых органоидов больных колоректальным раком. Сотовый 161, 933–945. doi: 10.1016/j.cell.2015.03.053
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
ван ден Берг, К.В., Ритсма, Л., Аврамут, М.С., Вирсма, Л.Е., Ван Ден Берг, Б.M., Leuning, D.G., et al. (2018). Почечная подкапсульная трансплантация почечных органоидов, происходящих из ПСХ, индуцирует неоваскулогенез и значительное созревание клубочков и канальцев in vivo. Стволовые клетки Rep. 10, 751-765. doi: 10.1016/j.stemcr.2018.01.041
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Vyas, D., Baptista, P.M., Brovold, M., Moran, E., Gaston, B., Booth, C., et al. (2017). Самособирающиеся органоиды печени резюмируют гепатобилиарный органогенез in vitro. Гепатология 67, 750–761. doi: 10.1002/hep.29483
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ван, Б., Чжао, Л., Фиш, М., Логан, С.Ю., и Нассе, Р. (2015). Самообновляющиеся диплоидные клетки Axin2(+) питают гомеостатическое обновление печени. Природа 524, 180–185. doi: 10.1038/nature14863
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Wang, Y., Wang, H., Deng, P., Chen, W., Guo, Y., Tao, T., et al. (2018).Дифференцировка in situ и создание функциональных органоидов печени из ИПСК человека в системе трехмерных перфузируемых чипов. Лабораторный чип 18, 3606–3616. дои: 10.1039/c8lc00869h
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Виммер Р. А., Леопольди А., Айхингер М., Вик Н., Хантуш Б., Новачкова М. и соавт. (2019). Органоиды кровеносных сосудов человека как модель диабетической васкулопатии. Природа 565, 505–510. doi: 10.1038/s41586-018-0858-8
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ву, Ф., Wu, D., Ren, Y., Huang, Y., Feng, B., Zhao, N., et al. (2019). Генерация гепатобилиарных органоидов из индуцированных человеком плюрипотентных стволовых клеток. J. Гепатол. 70, 1145–1158. doi: 10.1016/j.jhep.2018.12.028
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Янгер К., Книгин Д., Зонг Ю.В., Мэггс Л., Гу Г.К., Акияма Х. и др. (2014). Взрослые гепатоциты генерируются путем самодупликации, а не дифференцировки стволовых клеток. Стволовая клетка 15, 340–349.doi: 10.1016/j.stem.2014.06.003
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Чжан, Ю.С., Алеман, Дж., Шин, С.Р., Килич, Т., Ким, Д., Мусави Шег, С.А., и др. (2017а). Мультисенсорная интегрированная платформа органов на чипах для автоматического и непрерывного мониторинга на месте поведения органоидов. Проц. Натл. акад. науч. США 114, E2293–E2302. doi: 10.1073/pnas.16124
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Чжан Ю.С., Юэ К., Алеман Дж., Могхаддам К.М., Бахт С.М., Ян Дж. и соавт. (2017б). 3D-биопечать для изготовления тканей и органов. Энн. Биомед. англ. 45, 148–163. doi: 10.1007/s10439-016-1612-8
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Органоидные технологии и их применение в исследованиях рака | Journal of Hematology & Oncology
Lai YH, Lin SY, Wu YS, Chen HW, Chen JJW. Йодид AC-
, новый ингибитор Src, подавляет прогрессирование НМРЛ, модулируя множественные сигнальные пути, связанные с Src.J Гематол Онкол. 2017;10:172.ПабМед ПабМед Центральный Статья Google Scholar
Lai Y, Wei X, Lin S, Qin L, Cheng L, Li P. Текущее состояние и перспективы моделей ксенотрансплантатов, полученных от пациентов, в исследованиях рака. J Гематол Онкол. 2017;10:106.
ПабМед ПабМед Центральный Статья Google Scholar
Meng S, Zhou H, Feng Z, Xu Z, Tang Y, Li P, et al.ЦирРНК: функции и свойства нового потенциального биомаркера рака. Мол Рак. 2017;16:94.
ПабМед ПабМед Центральный Статья Google Scholar
Li A, Zhang T, Zheng M, Liu Y, Chen Z. Экзосомальные белки как потенциальные маркеры диагностики опухолей. J Гематол Онкол. 2017;10:175.
ПабМед ПабМед Центральный Статья Google Scholar
Виардо А., Баргу Р. Биспецифические антитела при гематологических злокачественных новообразованиях. Cancer Treat Rev. 2018; 65:87–95.
КАС пабмед Статья ПабМед Центральный Google Scholar
Yu S, Liu Q, Han X, Qin S, Zhao W, Li A, et al. Разработка и клиническое применение моноклональных и биспецифических антител против HER2 для лечения рака. Опыт Гематол Онкол. 2017;6:31.
ПабМед ПабМед Центральный Статья Google Scholar
Ю. С., Ли А., Лю К., Юань Х., Сюй Х., Цзяо Д. и др. Недавние достижения биспецифических антител в солидных опухолях. J Гематол Онкол. 2017;10:155.
ПабМед ПабМед Центральный Статья Google Scholar
Yi M, Jiao D, Xu H, Liu Q, Zhao W, Han X, et al. Биомаркеры для прогнозирования эффективности ингибиторов PD-1/PD-L1. Мол Рак. 2018;17:129.
ПабМед ПабМед Центральный Статья Google Scholar
Wei G, Ding L, Wang J, Hu Y, Huang H. Успехи Т-клеток, модифицированных CD19-направленным химерным антигенным рецептором, при рефрактерном/рецидивирующем остром лимфобластном лейкозе. Опыт Гематол Онкол. 2017;6:10.
ПабМед ПабМед Центральный Статья КАС Google Scholar
Xu H, Yu S, Liu Q, Yuan X, Mani S, Pestell RG, et al. Недавние достижения высокоселективных ингибиторов CDK4/6 при раке молочной железы. J Гематол Онкол. 2017;10:97.
ПабМед ПабМед Центральный Статья Google Scholar
Pang Y, Hou X, Yang C, Liu Y, Jiang G. Достижения в области терапии Т-клеток, модифицированных химерным антигенным рецептором, для онкотерапии. Мол Рак. 2018;17:91.
ПабМед ПабМед Центральный Статья Google Scholar
Liu B, Song Y, Liu D. Последние разработки в области клинического применения антител PD-1 и PD-L1 для иммунотерапии рака.J Гематол Онкол. 2017;10:174.
ПабМед ПабМед Центральный Статья Google Scholar
Zhou J, Su J, Fu X, Zheng L, Yin Z. Микрожидкостное устройство для выделения сфероидов первичной опухоли. Опыт Гематол Онкол. 2017;6:22.
ПабМед ПабМед Центральный Статья КАС Google Scholar
Ben-David U, Ha G, Tseng YY, Greenwald NF, Oh C, Shih J, et al.Ксенотрансплантаты, полученные от пациентов, подвергаются эволюции опухоли, специфичной для мышей. Нат Жене. 2017;49:1567–75.
КАС пабмед ПабМед Центральный Статья Google Scholar
Бирн А.Т., Альферез Д.Г., Амант Ф., Аннибали Д., Аррибас Дж., Бьянкин А.В. и соавт. Изучение открытых вопросов в области медицины рака с использованием ксенотрансплантатов, полученных от пациентов. Нат Рев Рак. 2017;17:632.
ПабМед Статья КАС ПабМед Центральный Google Scholar
Ланкастер М.А., Кноблих Дж.А. Органогенез в блюде: моделирование развития и заболевания с использованием органоидных технологий. Наука. 2014;345:1247125.
ПабМед Статья КАС ПабМед Центральный Google Scholar
Дрост Дж., Клеверс Х. Органоиды в исследованиях рака. Нат Рев Рак. 2018;18:407–18.
КАС пабмед Статья ПабМед Центральный Google Scholar
Yeung TM, Gandhi SC, Wilding JL, Muschel R, Bodmer WF. Раковые стволовые клетки из клеточных линий колоректального рака. Proc Natl Acad Sci U S A. 2010;107:3722–7.
КАС пабмед ПабМед Центральный Статья Google Scholar
Онума К., Очиаи М., Орихаши К., Такахаши М., Имаи Т., Накагама Х. и др. Генетическая реконструкция онкогенеза в первичных клетках кишечника. Proc Natl Acad Sci U S A. 2013;110:11127–32.
КАС пабмед ПабМед Центральный Статья Google Scholar
Scanu T, Spaapen RM, Bakker JM, Pratap CB, Wu LE, Hofland I, et al. Манипулирование сальмонеллой сигнальными путями хозяина провоцирует клеточную трансформацию, связанную с карциномой желчного пузыря. Клеточный микроб-хозяин. 2015;17:763–74.
КАС пабмед Статья ПабМед Центральный Google Scholar
Yin Y, Bijvelds M, Dang W, Xu L, van der Eijk AA, Knipping K, et al. Моделирование ротавирусной инфекции и противовирусной терапии с использованием первичных кишечных органоидов. Антивир Рез. 2015; 123:120–31.
КАС пабмед Статья ПабМед Центральный Google Scholar
Davies H, Glodzik D, Morganella S, Yates LR, Staaf J, Zou X, et al. HRDetect является предиктором дефицита BRCA1 и BRCA2 на основе мутационных сигнатур. Нат Мед.2017;23:517–25.
КАС пабмед ПабМед Центральный Статья Google Scholar
Дрост Дж., Ван Бокстел Р., Блокзейл Ф., Мизутани Т., Сасаки Н., Сасселли В. и др. Использование CRISPR-модифицированных органоидов стволовых клеток человека для изучения происхождения мутационных сигнатур при раке. Наука. 2017; 358: 234–8.
КАС пабмед ПабМед Центральный Статья Google Scholar
Матано М., Дате С., Симокава М., Такано А., Фуджи М., Охта Ю. и др. Моделирование колоректального рака с использованием CRISPR-Cas9-опосредованной инженерии кишечных органоидов человека. Нат Мед. 2015;21:256–62.
КАС пабмед Статья ПабМед Центральный Google Scholar
Li X, Nadauld L, Ootani A, Corney DC, Pai RK, Gevaert O, et al. Онкогенная трансформация различных тканей желудочно-кишечного тракта в первичной органоидной культуре. Нат Мед.2014;20:769–77.
КАС пабмед ПабМед Центральный Статья Google Scholar
Vlachogiannis G, Hedayat S, Vatsiou A, Jamin Y, Fernandez-Mateos J, Khan K, et al. Полученные от пациентов органоиды моделируют реакцию на лечение метастатического рака желудочно-кишечного тракта. Наука. 2018;359:920–6.
КАС пабмед ПабМед Центральный Статья Google Scholar
Сампазиотис Ф., Джастин А.В., Тайсо О.К., Савиак С., Годфри Э.М., Уппони С.С. и др. Реконструкция внепеченочного желчного дерева мыши с использованием первичных внепеченочных холангиоцитарных органоидов человека. Нат Мед. 2017;23:954–63.
КАС пабмед ПабМед Центральный Google Scholar
Ramsden CM, Powner MB, Carr AJ, Smart MJ, da Cruz L, Coffey PJ. Стволовые клетки в регенерации сетчатки: прошлое, настоящее и будущее. Разработка. 2013; 140:2576–85.
КАС пабмед ПабМед Центральный Статья Google Scholar
Pauli C, Hopkins BD, Prandi D, Shaw R, Fedrizzi T, Sboner A, et al. Персонализированные модели рака in vitro и in vivo для точной медицины. Рак Дисков. 2017; 7: 462–77.
ПабМед ПабМед Центральный Статья Google Scholar
Папапетру EP. Полученные от пациентов плюрипотентные стволовые клетки в исследованиях рака и прецизионной онкологии.Нат Мед. 2016; 22:1392–401.
КАС пабмед ПабМед Центральный Статья Google Scholar
Fujii M, Shimokawa M, Date S, Takano A, Matano M, Nanki K, et al. Библиотека органоидов колоректальной опухоли демонстрирует прогрессирующую потерю потребности в факторах ниши во время онкогенеза. Клеточная стволовая клетка. 2016;18:827–38.
КАС пабмед Статья ПабМед Центральный Google Scholar
Schutte M, Risch T, Abdavi-Azar N, Boehnke K, Schumacher D, Keil M, et al. Молекулярная диссекция колоректального рака в доклинических моделях идентифицирует биомаркеры, предсказывающие чувствительность к ингибиторам EGFR. Нац коммун. 2017;8:14262.
ПабМед ПабМед Центральный Статья КАС Google Scholar
Weeber F, van de Wetering M, Hoogstraat M, Dijkstra KK, Krijgsman O, Kuilman T, et al. Сохранившееся генетическое разнообразие в органоидах, культивированных из биопсий метастазов колоректального рака человека.Proc Natl Acad Sci U S A. 2015;112:13308–11.
КАС пабмед ПабМед Центральный Статья Google Scholar
Broutier L, Mastrogiovanni G, Verstegen MM, Francies HE, Gavarro LM, Bradshaw CR, et al. Органоидные культуры первичного рака печени человека для моделирования заболеваний и скрининга лекарств. Нат Мед. 2017;23:1424–35.
КАС пабмед ПабМед Центральный Статья Google Scholar
Хуан Л., Холтцингер А., Джаган И., Бегора М., Лохсе И., Нгай Н. и др. Моделирование протокового рака поджелудочной железы и скрининг лекарств с использованием плюрипотентных стволовых клеток человека и опухолевых органоидов, полученных от пациентов. Нат Мед. 2015;21:1364–71.
КАС пабмед ПабМед Центральный Статья Google Scholar
Сейно Т., Кавасаки С., Симокава М., Тамагава Х., Тосимицу К., Фуджи М. и др. Органоиды опухоли поджелудочной железы человека обнаруживают потерю зависимости от фактора ниши стволовых клеток во время прогрессирования заболевания.Клеточная стволовая клетка. 2018;22:454–67.e6.
КАС пабмед Статья ПабМед Центральный Google Scholar
Гао Д., Вела И., Сбонер А., Яквинта П.Дж., Картхаус В.Р., Гопалан А. и др. Органоидные культуры, полученные от пациентов с распространенным раком простаты. Клетка. 2014; 159:176–87.
КАС пабмед ПабМед Центральный Статья Google Scholar
Sachs N, de Ligt J, Kopper O, Gogola E, Bounova G, Weeber F, et al.Живой биобанк органоидов рака молочной железы фиксирует гетерогенность заболевания. Клетка. 2018;172:373–86.e10.
КАС пабмед Статья ПабМед Центральный Google Scholar
Эванс Г.С., Флинт Н., Сомерс А.С., Эйден Б., Поттен К.С. Разработка метода получения первичных культур эпителиальных клеток кишечника крыс. Дж. Клеточные науки. 1992; 101: 219–31.
ПабМед ПабМед Центральный Google Scholar
Уайтхед Р.Х., Деммлер К., Рокман С.П., Уотсон Н.К. Клоногенный рост эпителиальных клеток нормальной слизистой оболочки толстой кишки как у мышей, так и у людей. Гастроэнтерология. 1999; 117: 858–65.
КАС пабмед Статья ПабМед Центральный Google Scholar
Fukamachi H. Пролиферация и дифференцировка эпителиальных клеток кишечника плода крысы в первичной бессывороточной культуре. Дж. Клеточные науки. 1992; 103: 511–9.
ПабМед ПабМед Центральный Google Scholar
Перро Н., Болье Ж.Ф. Использование диссоциирующего фермента термолизина для создания жизнеспособных культур нормальных эпителиальных клеток кишечника человека. Разрешение ячейки опыта. 1996; 224:354–64.
КАС пабмед Статья ПабМед Центральный Google Scholar
Sato T, Vries RG, Snippert HJ, van de Wetering M, Barker N, Stange DE, et al. Отдельные стволовые клетки Lgr5 строят структуры крипт-ворсинок in vitro без мезенхимальной ниши. Природа.2009; 459: 262–5.
КАС Статья пабмед Google Scholar
Sato T, Stange DE, Ferrante M, Vries RG, Van Es JH, Van den Brink S, et al. Долгосрочное распространение эпителиальных органоидов из толстой кишки человека, аденомы, аденокарциномы и эпителия Барретта. Гастроэнтерология. 2011; 141:1762–72.
КАС Статья пабмед Google Scholar
Станге Д.Е., Коо Б.К., Хуч М., Сиббель Г., Басак О., Любимова А. и др.Дифференцированные troy+ главные клетки действуют как резервные стволовые клетки для образования всех клонов эпителия желудка. Клетка. 2013; 155:357–68.
КАС пабмед ПабМед Центральный Статья Google Scholar
Huch M, Dorrell C, Boj SF, van Es JH, Li VS, van de Wetering M, et al. Экспансия одиночных стволовых клеток печени Lgr5+ in vitro, индуцированная регенерацией, управляемой Wnt. Природа. 2013; 494: 247–50.
КАС пабмед ПабМед Центральный Статья Google Scholar
Месснер С., Агаркова И., Мориц В., Кельм Дж.М. Микроткани печени человека многоклеточного типа для тестирования гепатотоксичности. Арх Токсикол. 2013;87:209–13.
КАС пабмед Статья ПабМед Центральный Google Scholar
Binas B, Spitzer E, Zschiesche W, Erdmann B, Kurtz A, Muller T, et al. Гормональная индукция функциональной дифференцировки и экспрессия ингибитора роста молочной железы в культивируемых эксплантатах молочной железы мыши.In Vitro Cell Dev Biol. 1992; 28а: 625–34.
КАС пабмед Статья ПабМед Центральный Google Scholar
Ван М., Лю Ю.Э., Ни Дж., Айгун Б., Голдберг И.Д., Ши Ю.Е. Индукция дифференцировки молочной железы с помощью гена, связанного с ингибитором роста молочной железы, который взаимодействует с омега-3 жирной кислотой при ингибировании роста клеток рака молочной железы. Рак рез. 2000;60:6482–7.
КАС пабмед ПабМед Центральный Google Scholar
Брок Э.Дж., Джи К., Шах С., Маттингли Р.Р., Слоан Б.Ф. Модели in vitro для изучения инвазивных переходов протоковой карциномы in situ. J Биол. неоплазия молочной железы. 2018. https://doi.org/10.1007/s10911-018-9405-3.
Саксен Л., Лехтонен Э. Эмбриональная почка в органной культуре. Дифференциация. 1987; 36: 2–11.
КАС пабмед Статья ПабМед Центральный Google Scholar
Авнер Э.Д., Пьеско Н.П., Суини В.Е. мл., Эллис Д.Развитие почечного эпителия в органотипической культуре. Педиатр Нефрол. 1988; 2: 92–99.
КАС пабмед Статья ПабМед Центральный Google Scholar
ван ден Берг К.В., Ритсма Л., Аврамут М.С., Вирсма Л.Е., ван ден Берг Б.М., Леунинг Д.Г. и др. Почечная подкапсульная трансплантация почечных органоидов, происходящих из ПСХ, индуцирует неоваскулогенез и значительное созревание клубочков и канальцев in vivo. Отчеты о стволовых клетках. 2018;10:751–65.
ПабМед ПабМед Центральный Статья Google Scholar
Bottenstein JE, Sato GH. Рост клеточной линии нейробластомы крысы в бессывороточной среде с добавками. Proc Natl Acad Sci U S A. 1979;76:514–7.
КАС пабмед ПабМед Центральный Статья Google Scholar
Онеггер П., Ленуар Д., Фаврод П. Рост и дифференцировка агрегирующих клеток головного мозга плода в определенной бессывороточной среде.Природа. 1979; 282: 305–8.
КАС пабмед Статья ПабМед Центральный Google Scholar
Снайдер Э.Ю., Ким С.У. Гормональные потребности для выживания нейронов в культуре. Нейроски Летт. 1979; 13: 225–30.
КАС пабмед Статья ПабМед Центральный Google Scholar
Паска С.П. Построение трехмерных органоидов человеческого мозга. Нат Нейроски.2018. https://doi.org/10.1038/s41593-018-0107-3.
Qian X, Nguyen HN, Song MM, Hadiono C, Ogden SC, Hammack C, et al. Органоиды, специфичные для области мозга, с использованием мини-биореакторов для моделирования воздействия ZIKV. Клетка. 2016; 165:1238–54.
КАС пабмед ПабМед Центральный Статья Google Scholar
Суга Х., Кадошима Т., Минагучи М., Огуши М., Соен М., Накано Т. и др. Самоформирование функционального аденогипофиза в трехмерной культуре.Природа. 2011; 480:57–62.
КАС пабмед Статья ПабМед Центральный Google Scholar
Jo J, Xiao Y, Sun AX, Cukuroglu E, Tran HD, Goke J и др. Подобные среднему мозгу органоиды из плюрипотентных стволовых клеток человека содержат функциональные дофаминергические и нейромеланин-продуцирующие нейроны. Клеточная стволовая клетка. 2016;19:248–57.
КАС пабмед ПабМед Центральный Статья Google Scholar
Мугурума К., Нишияма А., Каваками Х., Хасимото К., Сасаи Ю. Самоорганизация поляризованной ткани мозжечка в 3D-культуре плюрипотентных стволовых клеток человека. Cell Rep. 2015; 10: 537–50.
КАС пабмед Статья ПабМед Центральный Google Scholar
Сакагучи Х., Кадошима Т., Соен М., Нарии Н., Исида Й., Огуши М. и др. Генерация функциональных нейронов гиппокампа из самоорганизующейся дорсомедиальной телэнцефалической ткани, полученной из эмбриональных стволовых клеток человека.Нац коммун. 2015;6:8896.
КАС пабмед ПабМед Центральный Статья Google Scholar
Kuo CJ, Curtis C. Органоиды показывают динамику рака. Природа. 2018; 556: 441–2.
КАС пабмед Статья ПабМед Центральный Google Scholar
Muthuswamy SK. Органоидные модели рака взрываются возможностями. Клеточная стволовая клетка. 2018;22:290–1.
КАС пабмед Статья ПабМед Центральный Google Scholar
Креспо М., Вилар Э., Цай С.Ю., Чанг К., Амин С., Шринивасан Т. и др. Органоиды толстой кишки, полученные из индуцированных человеком плюрипотентных стволовых клеток, для моделирования колоректального рака и тестирования лекарств. Нат Мед. 2017;23:878–84.
КАС пабмед ПабМед Центральный Статья Google Scholar
Boj SF, Hwang CI, Baker LA, Chio II, Engle DD, Corbo V, et al. Органоидные модели протокового рака поджелудочной железы человека и мыши. Клетка. 2015; 160:324–38.
КАС пабмед Статья ПабМед Центральный Google Scholar
Lee SH, Hu W, Matulay JT, Silva MV, Owczarek TB, Kim K, et al. Эволюция опухоли и ответ на лекарство в органоидных моделях рака мочевого пузыря, полученных от пациентов. Клетка. 2018;173:515–28.e17.
КАС пабмед Статья ПабМед Центральный Google Scholar
Пука Л., Бареха Р., Пранди Д., Шоу Р., Бенелли М., Картхаус В.Р. и др. Органоиды, полученные от пациентов, для моделирования редких фенотипов рака предстательной железы. Нац коммун. 2018;9:2404.
ПабМед ПабМед Центральный Статья КАС Google Scholar
Seidlitz T, Merker SR, Rothe A, Zakrzewski F, von Neubeck C, Grutzmann K, et al. Моделирование рака желудка человека с использованием органоидов. Кишка. 2018 г. https://doi.org/10.1136/gutjnl-2017-314549.
Ропер Дж., Таммела Т., Четинбас Н.М., Аккад А., Роганян А., Рикельт С. и др. Редактирование генома in vivo и модели трансплантации органов колоректального рака и метастазов. Нац биотехнолог. 2017; 35: 569–76.
КАС пабмед ПабМед Центральный Статья Google Scholar
Cristobal A, van den Toorn HWP, van de Wetering M, Clevers H, Heck AJR, Mohammed S. Персонализированные протеомные профили органоидов толстой кишки здорового и опухолевого человека раскрывают как индивидуальное разнообразие, так и основные черты колоректального рака.Cell Rep. 2017; 18: 263–74.
КАС пабмед Статья ПабМед Центральный Google Scholar
Nuciforo S, Fofana I, Matter MS, Blumer T, Calabrese D, Boldanova T, et al. Органоидные модели рака печени человека, полученные из игольчатых биопсий опухоли. Cell Rep. 2018; 24:1363–76.
КАС пабмед ПабМед Центральный Статья Google Scholar
Zhang HC, Kuo CJ.Персонализация органоидов рака поджелудочной железы с помощью hPSCs. Нат Мед. 2015;21:1249–51.
КАС пабмед Статья ПабМед Центральный Google Scholar
Walsh AJ, Castellanos JA, Nagathihalli NS, Merchant NB, Skala MC. Оптическая визуализация изменений метаболизма, вызванных лекарствами, в органоидах рака поджелудочной железы у мышей и человека выявляет гетерогенный ответ на лекарство. Поджелудочная железа. 2016; 45:863–9.
КАС пабмед Статья ПабМед Центральный Google Scholar
Ranftl RE, Calvo F. Анализ инвазии клеток рака молочной железы с использованием системы органотипической культуры. Методы Мол Биол. 2017;1612:199–212.
КАС пабмед ПабМед Центральный Статья Google Scholar
Duarte AA, Gogola E, Sachs N, Barazas M, Annunziato S, de Ruiter JR, et al. Органоиды опухоли молочной железы мышей с дефицитом BRCA для изучения лекарственной устойчивости к раку. Нат Методы. 2018;15:134–40.
КАС пабмед Статья ПабМед Центральный Google Scholar
Йошида Т., Сопко Н.А., Кейтс М., Лю Х, Джойс Г., Макконки Д.Дж. и др. Трехмерная культура органоидов показывает участие пути Wnt/бета-катенина в пролиферации клеток рака мочевого пузыря. Онкотаргет. 2018;9:11060–70.
ПабМед ПабМед Центральный Google Scholar
Shenoy TR, Boysen G, Wang MY, Xu QZ, Guo W, Koh FM, et al. Потеря CHD1 повышает чувствительность рака предстательной железы к терапии, повреждающей ДНК, способствуя репарации подверженных ошибкам двухцепочечных разрывов.Энн Онкол. 2017; 28:1495–507.
КАС пабмед ПабМед Центральный Статья Google Scholar
Сун С.Ю., Се К.Л., Лоу А., Чжау Х.Е., Патхак С., Мултани А.С. и др. Коэволюция рака предстательной железы и костной стромы в трехмерной кокультуре: последствия для роста и метастазирования рака. Рак рез. 2008;68:9996–10003.
КАС пабмед ПабМед Центральный Статья Google Scholar
Сайто Ю., Ониши Н., Таками Х., Сейшима Р., Иноуэ Х., Хирата Ю. и др. Разработка функциональной модели щитовидной железы на основе системы культивирования органоидов. Biochem Biophys Res Commun. 2018; 497: 783–9.
КАС пабмед Статья ПабМед Центральный Google Scholar
Jabs J, Zickgraf FM, Park J, Wagner S, Jiang X, Jechow K, et al. Скрининг эффектов лекарств в раковых клетках, полученных от пациентов, связывает органоидные реакции с изменениями генома.Мол Сист Биол. 2017;13:955.
ПабМед ПабМед Центральный Статья КАС Google Scholar
da Silva B, Mathew RK, Polson ES, Williams J, Wurdak H. Спонтанная сфероидная инфильтрация глиобластомы церебральных органоидов на ранней стадии моделирует инвазию опухоли головного мозга. СЛАС Дисков. 2018;23:862–8.
КАС пабмед ПабМед Центральный Google Scholar
Butler CR, Hynds RE, Gowers KH, Lee Ddo H, Brown JM, Crowley C, et al. Быстрое размножение эпителиальных стволовых клеток человека, подходящих для тканевой инженерии дыхательных путей. Am J Respir Crit Care Med. 2016; 194:156–68.
КАС пабмед ПабМед Центральный Статья Google Scholar
Hild M, Jaffe AB. Производство трехмерных органоидов дыхательных путей из первичных базальных клеток дыхательных путей человека и их использование в высокопроизводительном скрининге. Curr Protoc Stem Cell Biol.2016;37:Ie.9.1–ie.9.15.
Артикул Google Scholar
Chu HW, Rios C, Huang C, Wesolowska-Andersen A, Burchard EG, O’Connor BP, et al. Опосредованный CRISPR-Cas9 нокаут гена в первичных эпителиальных клетках дыхательных путей человека указывает на провоспалительную роль MUC18. Джин Тер. 2015;22:822–9.
КАС пабмед ПабМед Центральный Статья Google Scholar
Гао X, Бали А.С., Рэнделл С.Х., Хоган Б.Л. GRHL2 координирует регенерацию поляризованного мукоцилиарного эпителия из базальных стволовых клеток. Джей Селл Биол. 2015; 211:669–82.
КАС пабмед ПабМед Центральный Статья Google Scholar
Реринк С.Ф., Сасаки Н., Ли-Сикс Х., Янг М.Д., Александров Л.Б., Бехджати С. и др. Внутриопухолевая диверсификация при колоректальном раке на уровне одной клетки. Природа. 2018; 556: 457–62.
ПабМед Статья КАС ПабМед Центральный Google Scholar
Fessler E, Drost J, van Hooff SR, Linnekamp JF, Wang X, Jansen M, et al. Передача сигналов TGFbeta направляет зубчатые аденомы к подтипу мезенхимального колоректального рака. EMBO Мол Мед. 2016; 8: 745–60.
КАС пабмед ПабМед Центральный Статья Google Scholar
Сакамото Н., Фэн Ю., Столфи С., Куросу Ю., Грин М., Лин Дж. и др. BRAF(V600E) взаимодействует с инактивацией CDX2, способствуя зазубренному колоректальному онкогенезу.Элиф. 2017;6. https://doi.org/10.7554/eLife.20331.
Дрост Дж., ван Яарсвельд Р.Х., Понсиоен Б., Зимберлин С., ван Бокстел Р., Буйс А. и др. Последовательные раковые мутации в культивируемых стволовых клетках кишечника человека. Природа. 2015; 521:43–7.
КАС пабмед Статья ПабМед Центральный Google Scholar
Yan HHN, Lai JCW, Ho SL, Leung WK, Law WL, Lee JFY, et al. Зародышевая и соматическая мутация RNF43 в пути зазубренной неоплазии и ее связь с мутацией BRAF.Кишка. 2017;66:1645–56.
ПабМед Статья ПабМед Центральный Google Scholar
Камб А. Что не так с нашими моделями рака? Nat Rev Drug Discov. 2005;4:161–5.
КАС пабмед Статья ПабМед Центральный Google Scholar
Caponigro G, Sellers WR. Успехи в доклинических испытаниях терапевтических гипотез рака. Nat Rev Drug Discov.2011;10:179–87.
КАС пабмед Статья ПабМед Центральный Google Scholar
Voskoglou-Nomikos T, Pater JL, Seymour L. Клиническая прогностическая ценность клеточной линии in vitro, ксенотрансплантата человека и аллотрансплантата мыши в доклинических моделях рака. Клин Рак Рез. 2003; 9: 4227–39.
ПабМед ПабМед Центральный Google Scholar
Аббаси Дж. Органоиды, полученные от пациентов, предсказывают реакцию на лечение рака.ДЖАМА. 2018;319:1427.
ПабМед ПабМед Центральный Google Scholar
Эдер А., Фоллерт И., Хансен А., Эшенхаген Т. Человеческая искусственная сердечная ткань как модельная система для тестирования лекарств. Adv Drug Deliv Rev. 2016; 96: 214–24.
КАС пабмед Статья ПабМед Центральный Google Scholar
Duong HQ, Nemazanyy I, Rambow F, Tang SC, Delaunay S, Tharun L, et al.Эндосомальный белок CEMIP связывает передачу сигналов Wnt с активацией MEK1-ERK1/2 в резистентных к Selumetinib кишечных органоидах. Рак рез. 2018;78:4533–48.
ПабМед Статья ПабМед Центральный Google Scholar
van de Wetering M, Francies HE, Francis JM, Bounova G, Iorio F, Pronk A, et al. Перспективное создание биобанка живых органоидов больных колоректальным раком. Клетка. 2015; 161:933–45.
КАС пабмед Статья ПабМед Центральный Google Scholar
Шерр СиДжей, Бич Д, Шапиро Г.И. Ориентация на CDK4 и CDK6: от открытия к терапии. Рак Дисков. 2016;6:353–67.
КАС Статья пабмед Google Scholar
Verissimo CS, Overmeer RM, Ponsioen B, Drost J, Mertens S, Verlaan-Klink I, et al. Ориентация на мутантный RAS в органоидах колоректального рака, полученных от пациентов, путем комбинаторного скрининга лекарств. жизнь. 2016;5. https://doi.org/10.7554/eLife.18489.
Онозато Д., Ямасита М., Наканиши А., Акагава Т., Кида Ю., Огава И. и др. Создание кишечных органоидов, подходящих для фармакокинетических исследований, из индуцированных человеком плюрипотентных стволовых клеток. Препарат Метаб Распоряжение. 2018 г. https://doi.org/10.1124/dmd.118.080374.
Костадинова Р., Босс Ф., Эпплгейт Д., Сутер Л., Вайзер Т., Сингер Т. и другие. Долгосрочная трехмерная система совместного культивирования печени для улучшения прогнозирования клинически значимой гепатотоксичности, вызванной лекарствами. Toxicol Appl Pharmacol.2013; 268:1–16.
КАС пабмед Статья ПабМед Центральный Google Scholar
Meng Q. Трехмерная культура гепатоцитов для прогнозирования лекарственной гепатотоксичности. Мнение эксперта Препарат Метаб Токсикол. 2010;6:733–46.
КАС пабмед Статья ПабМед Центральный Google Scholar
Кацуда Т., Кавамата М., Хагивара К., Такахаши Р.У., Ямамото Ю., Камарго Ф.Д. и др.Преобразование терминально коммитированных гепатоцитов в культивируемые бипотентные клетки-предшественники с регенеративной способностью. Клеточная стволовая клетка. 2017;20:41–55.
КАС пабмед Статья ПабМед Центральный Google Scholar
Huch M, Gehart H, van Boxtel R, Hamer K, Blokzijl F, Verstegen MM, et al. Долгосрочная культура стабильных по геному бипотентных стволовых клеток из печени взрослого человека. Клетка. 2015;160:299–312.
КАС пабмед ПабМед Центральный Статья Google Scholar
Voges HK, Mills RJ, Elliott DA, Parton RG, Porrello ER, Hudson JE. Разработка модели повреждения сердечного органоида человека выявила врожденный регенеративный потенциал. Разработка. 2017; 144:1118–27.
КАС пабмед Статья ПабМед Центральный Google Scholar
Takasato M, Er PX, Chiu HS, Maier B, Baillie GJ, Ferguson C, et al. Органоиды почек из iPS-клеток человека содержат несколько клонов и моделируют нефрогенез человека.Природа. 2015; 526: 564–8.
КАС пабмед Статья ПабМед Центральный Google Scholar
Сато Т., Клеверс Х. Снимок: выращивание органоидов из стволовых клеток. Клетка. 2015;161:1700-.e1.
Артикул КАС Google Scholar
Ризви Н.А., Хеллманн М.Д., Снайдер А., Квистборг П., Макаров В., Гавел Дж.Дж., и соавт. Иммунология рака. Мутационный ландшафт определяет чувствительность к блокаде PD-1 при немелкоклеточном раке легкого.Наука. 2015; 348:124–8.
КАС пабмед ПабМед Центральный Статья Google Scholar
Asaoka Y, Ijichi H, Koike K. Блокада PD-1 в опухолях с дефицитом восстановления несоответствия. N Engl J Med. 2015; 373:1979.
ПабМед Статья ПабМед Центральный Google Scholar
Нозаки К., Мочизуки В., Мацумото Ю., Мацумото Т., Фукуда М., Мизутани Т. и др.Совместное культивирование с кишечными эпителиальными органоидами позволяет проводить эффективный анализ роста и подвижности внутриэпителиальных лимфоцитов. J Гастроэнтерол. 2016;51:206–13.
КАС пабмед ПабМед Центральный Статья Google Scholar
Finnberg NK, Gokare P, Lev A, Grivennikov SI, AWt MF, Campbell KS, et al. Применение трехмерных опухолевидных систем для определения иммунных и цитотоксических терапевтических ответов на основе молекулярных сигнатур опухолевых и тканевых срезов.Онкотаргет. 2017; 8: 66747–57.
ПабМед ПабМед Центральный Статья Google Scholar
Zumwalde NA, Haag JD, Sharma D, Mirrielees JA, Wilke LG, Gould MN, et al. Анализ иммунных клеток эпителиальных органоидов протоков молочной железы человека выявляет Т-клетки Vdelta2+, которые эффективно нацелены на клетки карциномы молочной железы в присутствии бисфосфоната. Рак Prev Res (Фила). 2016;9:305–16.
КАС Статья Google Scholar
Tiriac H, Bucobo JC, Tzimas D, Grewel S, Lacomb JF, Rowehl LM, et al. Успешное создание органоидов рака поджелудочной железы с помощью тонкоигольной биопсии под контролем ЭУЗИ для персонализированного лечения рака. Гастроинтест Эндоск. 2018; 87: 1474–80.
ПабМед Статья ПабМед Центральный Google Scholar
Органоиды могут указывать на лучшую терапию. Рак Дисков. 2018;8:524.
Усуи Т., Сакураи М., Умата К., Эльбадави М., Охама Т., Ямаваки Х. и др.Сигналы ежа опосредуют устойчивость к противораковым препаратам в трехмерной культуре первичных органоидов колоректального рака. Int J Mol Sci. 2018;19(4). https://doi.org/10.3390/ijms198.
Центральный пабмед Статья Google Scholar
Карнейро Б.А., Памарти С., Шах А.Н., Сагар В., Унно К., Хан Х. и др. Мутация киназы анапластической лимфомы (ALK F1174C) при мелкоклеточном раке предстательной железы и молекулярный ответ на алектиниб.Клин Рак Рез. 2018;24:2732–9.
КАС пабмед Статья ПабМед Центральный Google Scholar
Broekgaarden M, Rizvi I, Bulin AL, Petrovic L, Goldschmidt R, Massodi I, et al. Неоадъювантная фотодинамическая терапия увеличивает немедленную и пролонгированную эффективность оксалиплатина в органоидах метастатического рака поджелудочной железы. Онкотаргет. 2018;9:13009–22.
ПабМед ПабМед Центральный Статья Google Scholar
Workman MJ, Mahe MM, Trisno S, Poling HM, Watson CL, Sundaram N, et al.
