Оксиды кислотные — Справочник химика 21
Оксиды кислотные — оксиды, которым соответствуют кислоты. [c.375]Оксиды кислотные, основные и амфотерные 65. [c.187]
Периодичность изменения химических свойств элементов на примере их бинарных соединений с водородо.м и оксидов. Кислотные, основные и амфотерные свойства. [c.302]
Основной оксид Кислотный оксид [c.70]
Оксиды. Группы оксидов кислотные и основные. Номенклатура и химические свойства. [c.91]
Амфотерный оксид + Кислотный оксид = Соль Например [c.251]
Оксиды — соединения элементов с кислородом. Они подразделяются на солеобразующие и несолеобразующие. В свою очередь, солеобразующие оксиды подразделяются на оснбвные, кислотные и амфотерные. Оснбвные оксиды образуют соли при взаимодействии с кислотами или кисл/отными оксидами.

Кислотные оксиды Кислотный, Амфотерный Основной (ангидриды кислот) отчасти амфо- оксид оксид [c.456]
Основный оксид + Кислотный оксид = Соль [c.249]
Известно, что в каждой паре кислотный оксид/кислотный гидроксид степень окисления кислотообразующего элемента одна и та же. Составьте соответствующие пары из следующих наборов оксидов и гидроксидов [c.9]
Основный оксид Амфотерный оксид Кислотный оксид [c.319]
Оксиды азота 1) и (II) — ЫгО и N0 — являются нейтральными, у других оксидов кислотные свойства усиливаются с возрастанием степени окисления [c.471]
Комм. К какому типу оксидов (кислотным, основным или амфотерным) относится оксид ванадия(У) Дайте характеристику его окислительно-восстановительных свойств. При ответе используйте результаты опыта Пз и справочные данные.
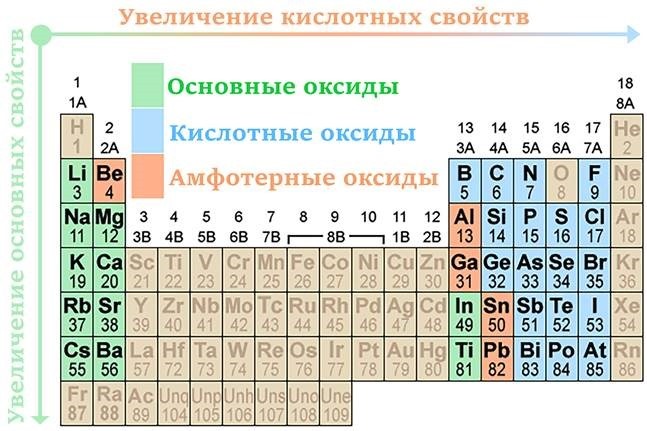
Деление оксидов на оснбвные и кислотные базируется на их собственном отношении к кислотам и щелочам, а также на свойствах соответствующих им гидроксидов. Большая группа оксидов по этим признакам относится к амфотер-ным. Элементы, образующие амфотерные оксиды, характеризуются средними значениями ОЭО в пределах 1,4 — 1,8 и степенями окисления (+2) — (+4). Если при степени окисления +2, +3 электроотрицательность менее 1,4, то оксиды (й отвечающие им гидроксиды) обладают оснбвными свойствами. Так, ОЭО [Са(+2)] составляет 1,0, ОЭО лантаноидов [Ьп (+3)] равна 1,2 — 1,3. Если при степени окисления +4 электроотрицательность элемента больше 1,8, оксид обладает кислотными свойствами. Например, ОЭО С(+4), 81(+4), Се(+4) равны соответственно 2,6, 1,9 и 2,0. Если электроотрицательность элемента находится в пределах 1,4 — 1,8 или даже несколько превышает этот интервал, а степень окисления + 1, оксид принадлежит к оснбвным (у Ag ОЭО 1,9). Когда же степени окисления элементов превышают +4 и значения ОЭО высоки, соответствующие оксиды кислотные.
Среди катализаторов имеются металлы, оксиды, кислотные катализаторы, в том числе цеолиты, больше всего Ре-содержащих систем. Предполагают, что кислород в железооксидных системах имеет особые свойства, облегчающие отщепление атомов водорода и образование радикалов СН3. [c.602]
Свойства стекла зависят от природы и количественного соотношения оксидов. Кислотные оксиды придают стеклу высокую механическую, термическую и химическую стойкость. Оксиды щелочных металлов снижают вязкость расплавленного стекла, механическую и химическую стойкость, твердость наоборот, оксиды щелочноземельных металлов повышают вязкость и химическую стойкость. Наиболее широко применяют стекла, в состав которых входят только оксиды натрия, кальция, магния и кремния. Введение оксида калия вместо оксида натрия, а также оксида свинца вместо оксидов кальция и магния придает стеклу блеск и большую прозрачность, увеличивает коэффициент преломления (хрусталь и оптические стекла).
Оксиды — соединения элементов с кислородом. Они подразделяются на солеобразующие и несолеобразующие. В свою очередь, солеобразующие оксиды подразделяются на основные, кислотные и амфотерные. Основные оксиды образуют соли при взаимодействии с кислотами или кислотными оксидами. Кислотные оксиды образуют соль при взаимодействии с основаниями или основными оксидами. Амфотерные оксиды образуют соли при взаимодействии как с кислотами или кислотными оксидами, так и с основаниями или основными оксидами.
Большинство оксидов являются основными, так как их гидроксиды ведут себя как основания. Однако некоторые оксиды (кислотные) образуют соли только в реакциях со щелочами или [c. 54]
54]
Как видно из табл. 25, низшие оксиды марганца тугоплавки и нелетучи, тогда как его высшие оксиды, наоборот, легкоплавки и летучи. Это указывает на ионный характер низших и ковалентный характер высших оксидов марганца. Наиболее устойчивым из оксидов марганца является диоксид. Низшие оксиды марганца обладают восстановительными, а высшие — окислительными свойствами, В соответствии с этим низшие оксиды марганца имеют основный характер, диоксид—амфотерный, а высшие оксиды — кислотный характер. Что касается оксидов рения, то низшие из них изучены enie недостаточно в связи с их неустойчивостью высшие же оксиды рения легкоплавки и летучи, что свидетельствует об их ковалентной природе, обладают кислотным характером и окислительными свойствами, однако последние выражены у них слабее, чем у соответствуюишх оксидов марганца. [c.292]
При разложении проб растворы гидроксидов, карбонатов щелочных металлов или аммиака применяют значительно реже, чем кислоты. Эти соединения используют для перевода в раствор анионов при этом многае неорганические катионы и органические соединения, входящие в состав образца, остаются в осадке. Гидрокснд натрия (или калия) растворяет некоторые металлы (алюминий) и оксиды кислотного характера (WOз, М0О3,
Эти соединения используют для перевода в раствор анионов при этом многае неорганические катионы и органические соединения, входящие в состав образца, остаются в осадке. Гидрокснд натрия (или калия) растворяет некоторые металлы (алюминий) и оксиды кислотного характера (WOз, М0О3,
В подгруппу входят три элемента V, КЬ и Та. Электронная структура (п — 1) Высшая и наиболее характерная степень окисления +5, но бывают и промежуточные +2, +3, +4. Высшие оксиды кислотного типа, но по мере снижения степени окисления возрастают основные свойства УО — основный оксид, легко растворимый в кислотах, УгОз — амфотерный оксид, мало растворимый в кислотах, УгО, — также амфотерный оксид, а У2О5 — ангидрид типичной кислоты НУО3. [c.181]
Са(0Н)2 + СОг = СаСОз + HjO Основный оксид + Кислотный оксид — Соль (4) [c.179]
В XVUI в. были предприняты неоднократные попытки усовершенствовать химические символы. Но до начала 1780-х годов ученые не пытались найти принцип построения формул соединений, отражающих их качественный и количественный состав. И вот в 1782 г. французский химик Л. Гитон де Морво (1737—1816) создал номенклатуру на основе флогистонной теории. Но это был уже вчерашний день науки, так как в это время А. Лавуазье обосновал кислородную теорию горения. Крупнейшие ученые того времени К. Бертолле, А. де Фуркруа (1755— 1809), а затем и Гитон де Морво в 80-е годы стали соратниками Лавуазье и в 1786—1787 гг. разработали новую систему химической номенклатуры — Опыт химической номенклатуры , опубликованную в 1787 г. В этой работе авторы предлагали соединения кислорода с другими элементами называть оксидами , соли — по их кислотам (так, соли серной кислоты именовались сульфаты , азотной — нитраты ). Оксиды кислотные ( кислоты ,по определению авторов номенклатуры) назывались по радикалу с окончанием ная (по мнению Лавуазье кислоты состоят из кислорода, дающего кислотность, и радикала — серы, азота, фосфора и т. д.) серная, азотная, фосфорная. Если один и тот же радикал образует несколько кислот , то изменялось окончание у менее насыщенной кислородом — истая , у более насыщенной — ная .
И вот в 1782 г. французский химик Л. Гитон де Морво (1737—1816) создал номенклатуру на основе флогистонной теории. Но это был уже вчерашний день науки, так как в это время А. Лавуазье обосновал кислородную теорию горения. Крупнейшие ученые того времени К. Бертолле, А. де Фуркруа (1755— 1809), а затем и Гитон де Морво в 80-е годы стали соратниками Лавуазье и в 1786—1787 гг. разработали новую систему химической номенклатуры — Опыт химической номенклатуры , опубликованную в 1787 г. В этой работе авторы предлагали соединения кислорода с другими элементами называть оксидами , соли — по их кислотам (так, соли серной кислоты именовались сульфаты , азотной — нитраты ). Оксиды кислотные ( кислоты ,по определению авторов номенклатуры) назывались по радикалу с окончанием ная (по мнению Лавуазье кислоты состоят из кислорода, дающего кислотность, и радикала — серы, азота, фосфора и т. д.) серная, азотная, фосфорная. Если один и тот же радикал образует несколько кислот , то изменялось окончание у менее насыщенной кислородом — истая , у более насыщенной — ная .
По химическим свойствам зола и шлак разделяются на кислые, основные и нейтральные в зависимости от соотношения оксидов кисльк — SiO , TiO , Р О основных СаО, MgO, FeO, К О и амфотерных. К кислым относятся зола и шлак, у которых отношение содержания кислых оксидов к суммарному содержанию основных и амфотерных оксидов (кислотность) больше единищ>1. Если отношение содержания основных оксидов к сумме кислых и амфотерных (основность) больше единищ.1, то зола и шлак называются основными, в других случаях — нейтральными. [c.124]
В [259] показано, что введение в ПВХ оксидов металлов [10-50%(масс.)] различной природы (переходных и непереходных, кислотных и основных) значительно изменяет количество и соотношение ароматических продуктов разложения полимера, но их качественный состав остается постоянным. В присутствии оксидов кислотного характера (TIO2, М0О3, Ре20з) возрастает количество выделяющихся при пиролизе алифатических и аро- [c. 150]
150]
Амфотерный оксид, кислотные и основные свойства равновы-раженны. Белый, имеет ионное строение (А1 +)2(0 )з. Тугоплавкий, термически устойчивый. Аморфный гигроскопичен и химически активен, кристаллический химически пассивен. Не реагирует с водой, разбавленными кислотами и щелочами. Переводится в раствор концентрированными кислотами и щелочами, реагирует со щелочами и карбонатом натрия при сплавлении. Применяется как сырье в производстве алюминия, для изготовления огнеупорных, химически стойких и абразивных материалов, особо чистый AI2O3 — для изготовления рубиновых лазеров. [c.138]
Применение в неорганическом анализе. Оксиды кислотного характера, например WO3, МоОо, GeOj, VjOj, растворяют в растворе гидроксида натрия или калия, М0О3 и WO3 — в концентрированном растворе аммиака. Некоторые вольфраматы разлагаются концентрированным раствором гидроксида натрия, что использовано при переработке низкосортных вольфрамовых руд [4.

Изменение кислотно-основных свойств оксидов и гидроксидов элементов 1Б-группы подчиняется общему правилу с ростом степени окисления кислотный характер возрастает, а при движении по группе сверху вниз уменьшается. Так, кислотный характер амфотерных СигО и Ag20 у первого оксида выражен очень слабо, а у второго — практически не проявляется, поэтому их часто относят к основным оксидам. Кислотный характер у СиО и Си (ОН) 2 уже вполне отчетлив, хотя и не превалирует над основным в оксиде золота (III) Аы20з и гидроксиде АиО(ОН) кислотные свойства выражены наиболее отчетливо, последнее соединение носит даже название золотой кислоты за ее способность образовывать комплексные анионы — гидроксоаураты (III) [Аи(0Н)4Г- [c.394]
Оксиды.
Классификация и номенклатура.
Оксидами называют соединения, состоящие из двух элементов, одним из которых является кислород.
Оксиды делят на две группы: солеобразующие и несолеобразующие, а каждую из групп, в свою очередь, подразделяют на несколько подгрупп:
НЕСОЛЕОБРАЗУЮЩИЕ: безразличные, пероксиды, солеобразные;
СОЛЕОБРАЗУЮЩИЕ: основные, амфотерные, кислотные.
Многие элементы проявляют переменную валентность и дают оксиды различного состава, поэтому прежде всего следует рассмотреть номенклатуру оксидов.
Согласно современной международной номенклатуре любой оксид называется оксидом с указанием римскими цифрами степени окисления элемента, например: SО2 — оксид серы (IV), SO3 — оксид серы (VI), CrO — оксид хрома (II), Сr2О3 — оксид хрома (III), СrО3 — оксид хрома (VI).
Получение и свойства.
Основные оксиды. К основным относятся оксиды типичных металлов, им соответствуют гидроксиды, обладающие свойствами оснований.
Получение основных оксидов:
1. Окисление металлов при нагревании в атмосфере кислорода:
Окисление металлов при нагревании в атмосфере кислорода:
2Mg + О2 = 2МgО,
2Сu + О2 = 2СuО.
Этот метод практически неприменим для щелочных металлов, которые при окислении обычно дают пероксиды, поэтому оксиды Na2О, К2О крайне труднодоступны.
2. Обжиг сульфидов:
2CuS + ЗО2 = 2СuО + 2SО2,
4FeS2 + 11О2 = 2Fе2О3 + 8SО2.
Метод неприменим для сульфидов активных металлов, окисляющихся до сульфатов.
3. Разложение гидроксидов:
to
Cu(OH)2 = CuO + H2O
Этим методом нельзя получить оксиды щелочных металлов.
4. Разложение солей кислородсодержащих кислот:
to
BaCO3 = BaO + CO2
to
2Рb(NО3)2 = 2PbО + 4NO2+O2
to
4FеSО4 = 2Fe2O3 + 4SO4 + O2
Этот способ получения оксидов особенно легко осуществляется для нитратов и карбонатов, в том числе и для основных солей:
to
[ZnOH]2 = 2ZnO + CO2 + H2 O
Свойства основных оксидов. Большинство основных оксидов представляет собой твердые кристаллические вещества ионного характера, в узлах кристаллической решетки расположены ионы металлов, достаточно прочно связанные с оксид-ионами О2-, поэтому оксиды типичных металлов обладают высокими температурами плавления и кипения.
Большинство основных оксидов представляет собой твердые кристаллические вещества ионного характера, в узлах кристаллической решетки расположены ионы металлов, достаточно прочно связанные с оксид-ионами О2-, поэтому оксиды типичных металлов обладают высокими температурами плавления и кипения.
Отметим одну характерную для оксидов особенность. Близость ионных радиусов многих ионов металлов приводит к тому, что в кристаллической решетке оксидов часть ионов одного металла может быть заменена на ионы другого металла. Это приводит к тому, что для оксидов часто не выполняется закон постоянства состава и могут существовать смешанные оксиды переменного состава.
Большинство основных оксидов не распадается при нагревании, исключение составляют оксиды ртути и благородных металлов:
t0
2HgO = 2Hg + O2
t0
2Ag2O = 4Ag + O2
Основные оксиды при нагревании могут вступать в реакции c кислотными и амфотерными оксидами, с кислотами:
ВаО + SiO2 = ВаSiO3,
МgО + Аl2О3 = Мg(AlO2)2,
ZnО + Н2SО4 = ZnSО4 + Н2О.
Оксиды щелочных и щелочноземельных металлов непосредственно реагируют с водой:
Как и другие типы оксидов, основные оксиды могут вступать в окислительно-восстановительные реакции:
t0
Fe2O3+2Al = Al2O3 + 2Fe
t0
3CuO+2NH3 = 3Cu + N2+3H2O
t0
4FeO+O2 = 2Fe2 + O3
Кислотные оксиды. Кислотные оксиды представляют ее оксиды неметаллов или переходных металлов в высоких степенях окисления и могут быть получены методами, аналогичными методам получения основных оксидов, например:
t0
4P+5O2 = 2P2 + O5
to
2ZnS+3O2 = 2ZnO + 2SO2
to
K2Cr2O7+H2SO4 = 2CrO3↓+ K2SO4+H2O
Nа2SiO3 + 2НСl = 2NаСl + SiO2↓ + Н2О
Большинство кислотных оксидов непосредственно взаимодействует с водой с образованием кислот:
SO3+ H2O = H2SO4
CO2+ H2O = H2CO3
P2O5+ H2O = 2HPO3
P2O5+ 3H2O = 2H3PO4
P2O5+ 2H2O = H4P2O7
Наиболее типичными для кислотных оксидов являются их реакции с основными и амфотерными оксидами, с щелочами:
to
P2O5+Al2O3 = 2AlPO4
Са(ОН)2 + СО2 = СаСО3↓ + Н2О.
Выше упоминалось, что кислотные оксиды могут вступать в многочисленные окислительно-восстановительные реакции, например:
to
CO2+C = 2CO
to
2SO2+O2 ↔ 2SO3
SО2 + 2Н2S = 3S + 2Н2О,
4CrO3 + С2Н5ОН = 2Сr2О3 + 2СО2 + ЗН2О.
Амфотерные оксиды обладают двойственной природой: они одновременно способны к реакциям, в которые вступают как основные, так и кислотные оксиды, т.е. реагируют и с кислотами, и со щелочами:
Аl2О3 + 6НСl = 2АlСl3 + ЗН2О,
Аl22О3 + 2NаОН + ЗН2О = 2Nа[Аl(ОН)4].
К числу амфотерных оксидов относятся оксид алюминия Аl2О3, оксид хрома (III) Сr2О3, оксид бериллия ВеО, оксид цинка ZnО, оксид железа (III) Fe2О3 и ряд других.
Идеально амфотерным оксидом является вода Н2О, которая диссоциирует с образованием одинаковых количеств ионов водорода (кислотные свойства) и гидроксид-иона (основные свойства). Амфотерные свойства воды ярко проявляются при гидролизе растворенных в ней солей:
Сu2+ + Н2О←→ Сu(ОН)+ + Н+
СО32- + Н2О ↔ НСО3— + ОН—.
Оксиды: классификация и химические свойства
Оксидами называются сложные вещества, в состав молекул которых входят атомы кислорода в степни окисления – 2 и какого-нибудь другого элемента.
Оксиды могут быть получены при непосредственном взаимодействии кислорода с другим элементом, так и косвенным путём (например, при разложении солей, оснований, кислот). В обычных условиях оксиды бывают в твёрдом, жидком и газообразном состоянии, этот тип соединений весьма распространён в природе. Оксиды содержатся в Земной коре. Ржавчина, песок, вода, углекислый газ – это оксиды.
Оксиды содержатся в Земной коре. Ржавчина, песок, вода, углекислый газ – это оксиды.
Они бывают солеобразующими и несолеобразующие.
Солеобразующие оксиды – это такие оксиды, которые в результате химических реакций образуют соли. Это оксиды металлов и неметаллов, которые при взаимодействии с водой образуют соответствующие кислоты, а при взаимодействии с основаниями – соответствующие кислые и нормальные соли. Например, оксид меди (CuO) является оксидом солеобразующим, потому что, например, при взаимодействии её с соляной кислотой (HCl) образуется соль:
CuO + 2HCl → CuCl2 + H2O.
В результате химических реакций можно получать и другие соли:
CuO + SO3 → CuSO4.
Несолеобразующими оксидами называются такие оксиды, которые не образуют солей. Примером могут служить СО, N2O, NO.
Солеобразующие оксиды в свою очередь бывают 3-х типов: основными (от слова «основание»), кислотными и амфотерными.
Основными оксидами называются такие оксиды металлов, которым соответствуют гидроксиды, относящиеся к классу оснований. К основным оксидам относятся, например, Na2O, K2O, MgO, CaO и т.д.
Химические свойства основных оксидов
1. Растворимые в воде основные оксиды вступают в реакцию с водой, образуя основания:
Na2O + H2O → 2NaOH.
2. Взаимодействуют с кислотными оксидами, образуя соответствующие соли
Na2O + SO3 → Na2SO4.
3. Реагируют с кислотами, образуя соль и воду:
CuO + H2SO4 → CuSO4 + H2O.
4. Реагируют с амфотерными оксидами:
Li2O + Al2O3 → 2LiAlO2.
Если в составе оксидов в качестве второго элемента будет неметалл или металл, проявляющий высшую валентность (обычно проявляют от IV до VII), то такие оксиды будут кислотными. Кислотными оксидами (ангидридами кислот) называются такие оксиды, которым соответствуют гидроксиды, относящие к классу кислот. Это, например, CO2, SO3, P2O5, N2O3, Cl2O5, Mn2O7 и т.д. Кислотные оксиды растворяются в воде и щелочах, образуя при этом соль и воду.
Кислотными оксидами (ангидридами кислот) называются такие оксиды, которым соответствуют гидроксиды, относящие к классу кислот. Это, например, CO2, SO3, P2O5, N2O3, Cl2O5, Mn2O7 и т.д. Кислотные оксиды растворяются в воде и щелочах, образуя при этом соль и воду.
Химические свойства кислотных оксидов
1. Взаимодействуют с водой, образуя кислоту:
SO3 + H2O → H2SO4.
Но не все кислотные оксиды непосредственно реагируют с водой (SiO2 и др.).
2. Реагируют с основанными оксидами с образованием соли:
CO2 + CaO → CaCO3
3. Взаимодействуют со щелочами, образуя соль и воду:
CO2 + Ba(OH)2 → BaCO3 + H2O.
В состав амфотерного оксида входит элемент, который обладает амфотерными свойствами. Под амфотерностью понимают способность соединений проявлять в зависимости от условий кислотные и основные свойства. Например, оксид цинка ZnO может быть как основанием, так и кислотой (Zn(OH)2 и H2ZnO2). Амфотерность выражается в том, что в зависимости от условий амфотерные оксиды проявляют либо осно́вные, либо кислотные свойства.
Под амфотерностью понимают способность соединений проявлять в зависимости от условий кислотные и основные свойства. Например, оксид цинка ZnO может быть как основанием, так и кислотой (Zn(OH)2 и H2ZnO2). Амфотерность выражается в том, что в зависимости от условий амфотерные оксиды проявляют либо осно́вные, либо кислотные свойства.
Химические свойства амфотерных оксидов
1. Взаимодействуют с кислотами, образуя соль и воду:
ZnO + 2HCl → ZnCl2 + H2O.
2. Реагируют с твёрдыми щелочами (при сплавлении), образуя в результате реакции соль – цинкат натрия и воду:
ZnO + 2NaOH → Na2 ZnO2 + H2O.
При взаимодействии оксида цинка с раствором щелочи (того же NaOH) протекает другая реакция:
ZnO + 2 NaOH + H2O => Na2[Zn(OH)4].
Координационное число – характеристика, которая определяет число ближайших частиц: атомов или инов в молекуле или кристалле.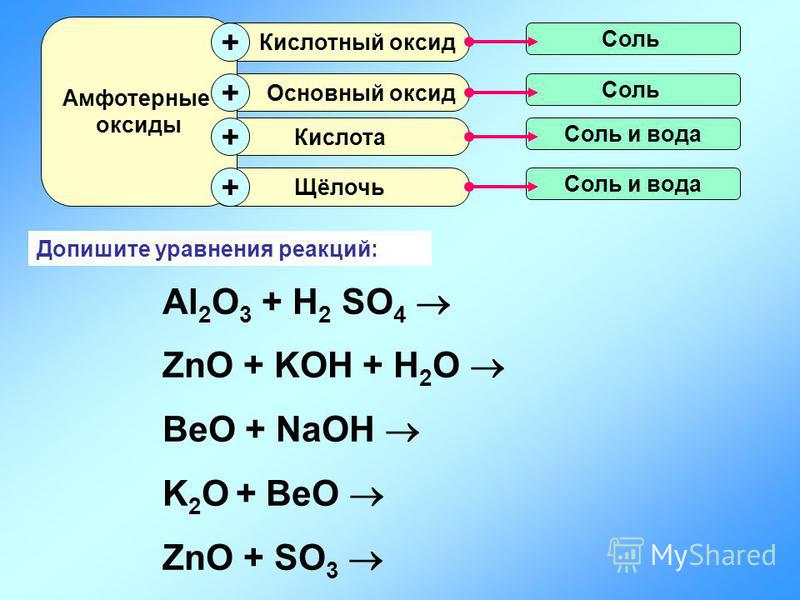 Для каждого амфотерного металла характерно свое координационное число. Для Be и Zn – это 4; Для и Al – это 4 или 6; Для и Cr – это 6 или (очень редко) 4;
Для каждого амфотерного металла характерно свое координационное число. Для Be и Zn – это 4; Для и Al – это 4 или 6; Для и Cr – это 6 или (очень редко) 4;
Амфотерные оксиды обычно не растворяются в воде и не реагируют с ней.
Остались вопросы? Хотите знать больше об оксидах?
Чтобы получить помощь репетитора – зарегистрируйтесь.
Первый урок – бесплатно!
Зарегистрироваться
© blog.tutoronline.ru, при полном или частичном копировании материала ссылка на первоисточник обязательна.
2.4 Характерные химические свойства оксидов: основных, амфотерных, кислотных
Видеоурок 1: Свойства оксидов
Видеоурок 2: Химические свойства основных оксидов
Лекция: Характерные химические свойства оксидов: основных, амфотерных, кислотных
Оксиды — бинарные соединения (сложные вещества), состоящие из кислорода со степенью окисления -2 и другого элемента.
По своим химическим способностям образовывать соли все оксиды подразделены на две группы:
- солеобразующие,
- несолеобразующие.
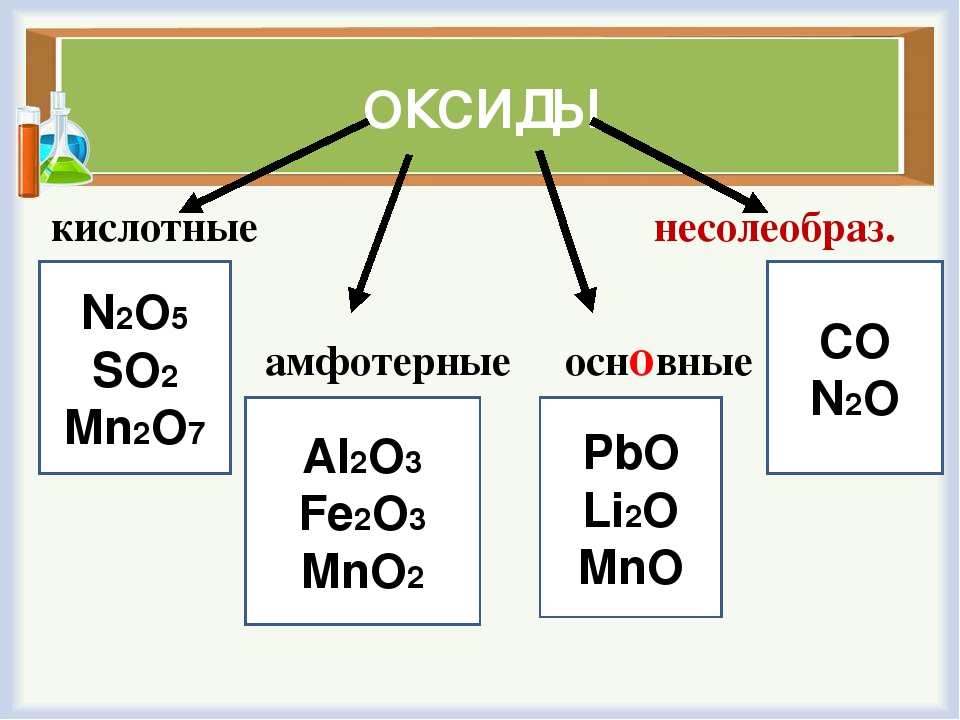
Солеообразующие в свою очередь подразделены на три группы: основные, ксилотные, амфотерные. К несолеобразующим относятся оксид углерода(II) СО, оксид азота(I) N2O, оксид азота(II) NO, оксид кремния(II) SiO.
Основные оксиды — это оксиды, проявляющие основные свойства, образованные щелочными и щелочноземельными металлами в степенях окисления +1,+2, а также переходными металлами в низших степенях окисления.
Данной группе оксидов соответствуют основания: К2О – КОН; ВаО – Ва(ОН)2; La2O3 – La(OH)3.
Кислотные оксиды — это оксиды, проявляющие кислотные свойства, образованные типичными неметаллами, а также некоторыми переходными металлами в степенях окисления от +4 до +7.
Данной группе оксидов соответствуют кислоты: SO3 –H2SO4; CO2 – H2CO3; SO2 – H2SO3 и т. д.
д.
Амфотерные оксиды — это оксиды, проявляющие основные и кислотные свойства, образованные переходными металлами в степенях окисления +3,+4. Искл.: ZnO, BeO, SnO, PbO.
Данной группе оксидов соответствуют амфотерные основания: ZnO – Zn(OH)2; Al2O3 – Al(OH)3.
Рассмотрим химические свойства оксидов:
Реагент | Основные оксиды | Амфотерные оксиды | Кислотные оксиды |
| Вода | Реагируют. Пример: CaO + H2O → Ca(OH)2 | Не реагируют | Реагируют. Пример: SO3 + H2O → H2SO4 |
| Кислота | Реагируют. Пример: Fe2O3 + 6HCl → 2FeCl3 + 3H2O | Реагируют. Пример: ZnO + 2HCl → ZnCl2 + H2O | Не реагируют |
| Основание | Не реагируют | Реагируют. Пример: Пример:ZnO + 2NaOH + H2O → Na2[Zn(OH)4] | Реагируют. Пример: 2NaOH + SiO2 → Na2SiO3 + H2O |
| Основный оксид | Не реагируют | Реагируют. Пример: ZnO + CaO → CaZnO2 | Реагируют. Пример: SiO2 + CaO → CaSiO3 |
| Кислотный оксид | Реагируют. Пример: CaO + CO2 → CaCO3 | Реагируют. Пример: ZnO + SiO2 → ZnSiO3 | Не реагируют |
| Амфотерный оксид | Реагируют. Пример: Li2O + Al2O3 → 2LiAlO | Реагируют | Реагируют. Пример: Al2O3 + 3SO3 → Al2(SO4)3 |
Из приведенной таблицы можно резюмировать следующее:
Основные оксиды наиболее активных металлов взаимодействуют с водой, образуя сильные основания – щелочи.
 Основные оксиды менее активных металлов, при обычных условиях с водой не реагируют. С кислотами реагируют всегда и все оксиды данной группы, образуя соли и воду. А с основаниями не реагируют.
Основные оксиды менее активных металлов, при обычных условиях с водой не реагируют. С кислотами реагируют всегда и все оксиды данной группы, образуя соли и воду. А с основаниями не реагируют. Кислотные оксиды в большинстве своем реагируют с водой. Но не все реагируют в обычных условиях. С основаниями реагирует все оксиды данной группы, образуя соли и воду. С кислотами не реагируют.
Основные и кислотные оксиды способны реагировать между собой, с последующим образованием соли.
Амфотерные оксиды обладают основными и кислотными свойствами. Поэтому они реагируют и с кислотами, и с основаниями, образуя соли и воду. Амфотерные оксиды реагируют с кислотными и основными оксидами. Так же взаимодействуют и между собой. Чаще всего, данные химические реакции протекают при нагревании с образованием солей.
Оксиды
Несолеобразующие (безразличные, индифферентные) оксиды СО, SiO, N20, NO.
Солеобразующие оксиды:
Основные. Оксиды, гидраты которых являются основаниями. Оксиды металлов со степенями окисления +1 и +2 (реже +3). Примеры: Na2O — оксид натрия, СаО — оксид кальция, CuO — оксид меди (II), СоО — оксид кобальта (II), Bi2O3 — оксид висмута (III), Mn2O3 — оксид марганца (III).
Амфотерные. Оксиды, гидраты которых являются амфотерными гидроксидами. Оксиды металлов со степенями окисления +3 и +4 (реже +2). Примеры: Аl2O3 — оксид алюминия, Cr2O3 — оксид хрома (III), SnO2 — оксид олова (IV), МnO2 — оксид марганца (IV), ZnO — оксид цинка, ВеО — оксид бериллия.
Кислотные.
Оксиды, гидраты которых являются кислородсодержащими кислотами. Оксиды неметаллов. Примеры: Р2О3 — оксид фосфора (III), СO2 — оксид углерода (IV), N2O5 — оксид азота (V), SO3 — оксид серы (VI), Cl2O7 — оксид хлора (VII). Оксиды металлов со степенями окисления +5, +6 и +7. Примеры: Sb2O5 — оксид сурьмы (V). СrОз — оксид хрома (VI), МnОз — оксид марганца (VI), Мn2O7 — оксид марганца (VII).
Оксиды металлов со степенями окисления +5, +6 и +7. Примеры: Sb2O5 — оксид сурьмы (V). СrОз — оксид хрома (VI), МnОз — оксид марганца (VI), Мn2O7 — оксид марганца (VII).
Изменение характера оксидов | Cr+2O (осн.) | Cr+32O 3(амф.) | Cr+6O 3(кисл.) |
Mn+2O (осн.) | Mn+4O2 (амф.) | Mn+6O3 (кисл.) | |
Mn+32O3 (осн.) | Mn+72O 7 (кисл.) |
Оксиды бывают твердые, жидкие и газообразные, различного цвета. Например: оксид меди (II) CuO черного цвета, оксид кальция СаО белого цвета — твердые вещества. Оксид серы (VI) SO3 — бесцветная летучая жидкость, а оксид углерода (IV) СО2 — бесцветный газ при обычных условиях.
Оксид серы (VI) SO3 — бесцветная летучая жидкость, а оксид углерода (IV) СО2 — бесцветный газ при обычных условиях.
Твердые:
CaO, СuО, Li2O и др. основные оксиды; ZnO, Аl2O3, Сr2O3 и др. амфотерные оксиды; SiO2, Р2O5, СrO3 и др. кислотные оксиды.
Жидкие:
SO3, Cl2O7, Мn2O7 и др..
Газообразные:
CO2, SO2, N2O, NO, NO2 и др..
Растворимые:
а) основные оксиды щелочных и щелочноземельных металлов;
б) практически все кислотные оксиды (исключение: SiO2).
Нерастворимые:
а) все остальные основные оксиды;
б) все амфотерные оксиды
в) SiO2
1. Кислотно-основные свойства
Общими свойствами основных, кислотных и амфотерных оксидов являются кислотно-основные взаимодействия, которые иллюстрируются следующей схемой:
Пример:
(только для оксидов щелочных и щелочно-земельных металлов) (кроме SiO2).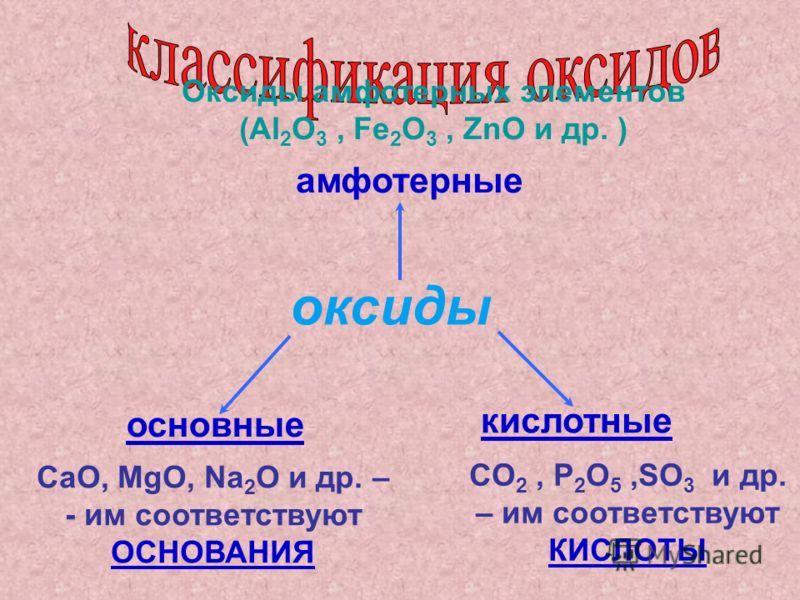
Амфотерные оксиды, обладая свойствами и основных и кислотных оксидов, взаимодействуют с сильными кислотами и щелочами:
2. Окислительно — восстановительные свойства
Если элемент имеет переменную степень окисления (с. о.), то его оксиды с низкими с. о. могут проявлять восстановительные свойства, а оксиды с высокими с. о. — окислительные.
Примеры реакций, в которых оксиды выступают в роли восстановителей:
Окисление оксидов с низкими с. о. до оксидов с высокими с. о. элементов.
2C+2O + O2 = 2C+4O2
2S+4O2 + O2 = 2S+6O3
2N+2O + O2 = 2N+4O2
Оксид углерода (II) восстанавливает металлы из их оксидов и водород из воды.
C+2O + FeO = Fe + 2C+4O2
C+2O + H2O = H2 + 2C+4O2
Примеры реакций, в которых оксиды выступают в роли окислителей:
Восстановление оксидов с высокими с о. элементов до оксидов с низкими с. о. или до простых веществ.
элементов до оксидов с низкими с. о. или до простых веществ.
C+4O2 + C = 2C+2O
2S+6O3 + H2S = 4S+4O2 + H2O
C+4O2 + Mg = C0 + 2MgO
Cr+32O3 + 2Al = 2Cr0 + 2Al2O3
Cu+2O + H2 = Cu0 + H2O
Использование оксидов малоактивных металлов дпя окисления органических веществ.
Некоторые оксиды, в которых элемент имеет промежуточную с. о., способны к диспропорционированию;
например:
2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O
1. Взаимодействие простых веществ — металлов и неметаллов — с кислородом:
4Li + O2 = 2Li2O;
2Cu + O2 = 2CuO;
S + O2 = SO2
4P + 5O2 = 2P2O5
2. Дегидратация нерастворимых оснований, амфотерных гидроксидов и некоторых кислот:
Дегидратация нерастворимых оснований, амфотерных гидроксидов и некоторых кислот:
Cu(OH)2 = CuO + H2O
2Al(OH)3 = Al2O3 + 3H2O
H2SO3 = SO2↑ + H2O
H2SiO3 = SiO2 + H2O
3. Разложение некоторых солей:
2Cu(NO3)2 = 2CuO + 4NO2↑ + O2↑
CaCO3 = CaO + CO2↑
(CuOH)2CO3 = 2CuO + CO2↑ + H2O
4. Окисление сложных веществ кислородом:
CH4 + 2O2 = CO2 + H2O
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
4NH3 + 5O2 = 4NO + 6H2O
5.Восстановление кислот-окислителей металлами и неметаллами:
Cu + H2SO4 (конц) = CuSO4 + SO2↑ + 2H2O
10HNO3 (конц) + 4Ca = 4Ca(NO3)2 + N2O↑ + 5H2O
2HNO3 (разб) + S = H2SO4 + 2NO↑
6. Взаимопревращения оксидов в ходе окислительно-восстановительных реакций (см. окислительно-восстановительные свойства оксидов).
Взаимопревращения оксидов в ходе окислительно-восстановительных реакций (см. окислительно-восстановительные свойства оксидов).
Тема №7249 Характерные химические свойства оксидов: основных, амфотерных, ки
Тема №7249
Характерные химические свойства оксидов: основных, амфотерных, кислотных
Общими свойствами основных, кислотных и амфотерных оксидов являются кислотно-основные взаимодействия.
♦ Основные оксиды — это оксиды, которым в качестве гидроксидов соответствуют основания.
Основные оксиды образуют только металлы и, как правило, в степени окисления +1 и +2 (исключение: BeO, ZnO, SnO, PbO и др.).
Основные оксиды взаимодействуют
1) с кислотами:
Основный оксид + Кислота = Соль + Вода MgO + 2HCl = MgCl2 + H2O
2) с кислотными оксидами:
Основный оксид + Кислотный оксид = Соль 3K2O + P2O5 = 2K3PO4
3) c водой взаимодействуют только оксиды щелочных и щелочноземельных металлов по следующей схеме:
Основный оксид + Вода = Щелочь CaO + H2O = Ca(OH)2
Кислотные оксиды — это оксиды, которым в качестве гидроксидов соответствуют кислоты.
Кислотные оксиды образуют все неметаллы независимо от степени окисления (исключение — несолеобразующие оксиды) и металлы в степени окисления + 5 и выше.
Кислотные оксиды взаимодействуют
1) с основаниями, образуя соль и воду:
Кислотный оксид + Основание = Соль + Вода N2O5 + 2NaOH = 2NaNO3 + H2O
2) с основными оксидами, образуя соль:
Кислотный оксид + Основный оксид = Соль CO2 + MgO = MgCO3
3) с водой кислотные оксиды взаимодействуют с образованием кислот (исключение SiO2):
Кислотный оксид + Вода = Кислота Р2О5 + 3Н2О = 2Н3РО4
Амфотерные оксиды обладают двойственной природой: они одновременно способны к реакциям, в которые вступают как основные, так и кислотные оксиды, т. е. проявляют свойства как оснований, так и кислот. Например, оксиду цинка ZnO соответствуют основание Zn(OH)2 и кислота H2ZnO2.
К числу амфотерных оксидов относятся оксид алюминия Al2O3, оксид хрома (III) Cr2O3, оксид бериллия BeO, оксид цинка ZnO, оксид железа (III) Fe2O3 и ряд других. Амфотерные оксиды образуют только металлы и, как правило, в степени окисления +3 и +4.
Амфотерные оксиды в зависимости от взаимодействующего с ним реагента проявляют свойства как основных, так и кислотных оксидов.
Проявляя свойства основных оксидов, амфотерные оксиды взаимодействуют:
1) с кислотами, образуя соль и воду:
ZnO + 2HNO3 = Zn(NO3)2 + H2O
2) с кислотными оксидами, образуя соль:
СаO + CO2 = СаТО3
Проявляя свойства кислотных оксидов, амфотерные оксиды взаимодействуют:
1) со щелочами, образуя соль и воду:
ZnO + 2NaOH = Na2ZnO2 + H2O (при сплавлении)
(H2ZnO2) цинкат натрия
2) с основными оксидами, образуя соль:
ZnO + CaO = CaZnO2
Амфотерные оксиды не взаимодействуют с водой.
Оксиды, их классификация. Cвойства оксидов в свете ТЭД
Оксиды – это сложные вещества, состоящие из двух элементов, одним из которых является кислород в степени окисления -2. Следовательно, оксиды – это бинарные соединения.
По агрегатному состоянию они бывают жидкими, примером такого оксида является вода, или оксид водорода, примером твердого оксида является уже известный вам оксид кремния (IV), или песок, а также различные разновидности кварца; примером газообразных оксидов являются углекислый газ, или оксид углерода (IV), а также угарный газ, или оксид углерода (II).
По
химическим свойствам оксиды делятся на солеобразующие и несолеобразующие. Несолеобразующие
оксиды не реагируют с кислотами и основаниями, а также не образуют солей. К
несолеобразующим оксидам относятся такие оксиды, как оксид углерода (II)
– CO, оксид азота (I)
– N2O
и оксид азота (II)
– NO. К солеобразующим
оксидам относятся основные, амфотерные и кислотные.
К солеобразующим
оксидам относятся основные, амфотерные и кислотные.
Основные оксиды – это оксиды, которым соответствуют основания. К основным оксидам относятся оксиды металлов I и II A группы, а также оксиды металлов с небольшими степенями окисления (+1, +2). Кроме того, все основные оксиды являются твёрдыми веществами. Например, оксид магния (MgO) – это основный оксид, потому что магний – металл II A группы, ему соответствует основание Mg(OH)2. CrO – тоже основный оксид, т.к. у хрома степень окисления в данном случае +2, этому оксиду соответствует основание – Cr(OH)2. Na2O – основный оксид, т.к. натрий – металл I A группы, ему соответствует основание NaOH.
Основные
оксиды вступают в реакции обмена с кислотами. При
этом образуется соль и вода. Для того чтобы в этом убедиться, проведём
эксперимент: поместим в пробирку немного порошка оксида меди (II),
как видите, он чёрного цвета, в эту пробирку нальём раствора серной кислоты и
слегка нагреем. Постепенно проходит реакция, т.к. порошок начинает
растворяться. Чтобы убедиться в том, что в результате реакции образуется соль,
несколько капель содержимого пробирки поместим на предметное стекло и выпарим,
после чего на стекле появляются кристаллы соли.
При
этом образуется соль и вода. Для того чтобы в этом убедиться, проведём
эксперимент: поместим в пробирку немного порошка оксида меди (II),
как видите, он чёрного цвета, в эту пробирку нальём раствора серной кислоты и
слегка нагреем. Постепенно проходит реакция, т.к. порошок начинает
растворяться. Чтобы убедиться в том, что в результате реакции образуется соль,
несколько капель содержимого пробирки поместим на предметное стекло и выпарим,
после чего на стекле появляются кристаллы соли.
CuO + H2SO4 = CuSO4 + H2O
CuO + 2H+ = Cu2+ + H2O
Основные
оксиды вступают в реакции соединения с кислотными оксидами, при этом образуются
соли. Например, при взаимодействии оксида натрия с оксидом
фосфора (V) образуется соль –
фосфат натрия, в результате взаимодействия оксида магния с оксидом серы (VI)
образуется соль – сульфат магния, а при взаимодействии оксида кальция с оксидом
углерода (IV) образуется соль –
карбонат кальция.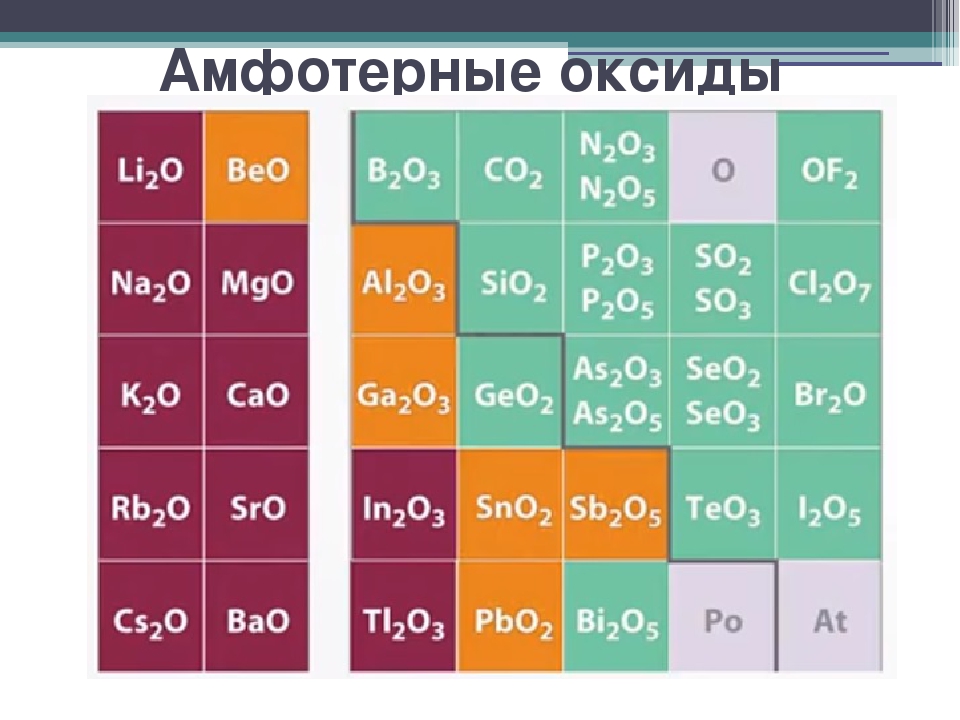
3Na2O + P2O5 = 2Na3PO4
MgO + SO3 = MgSO4
CaO + CO2 = CaCO3
Основные оксиды вступают в реакции соединения с водой с образованием щелочей. Если образуется нерастворимое основание, то такая реакция не идёт. Например, если мы нальём в две пробирки воды и капнем туда несколько капель лакмуса, а затем поместим в первую пробирку оксид кальция, а в другую оксид меди (II), то реакция у нас идёт только в первой пробирке, т.к. образовалась щёлочь и лакмус изменил свою окраску на синюю, во второй пробирке изменений нет, т.к. оксид меди (II) не реагирует с водой, ведь Cu(OH)2 – нерастворимое в воде основание.
CaO + H2O = Ca(OH)2
CaO + H2O = Ca2+ + 2OH—
CuO + H2O ≠
Кислотные
оксиды – это оксиды, которым соответствуют кислоты. К
кислотным оксидам относятся оксиды неметаллов и оксиды металлов с большими
степенями окисления. Например, оксиду азота (V)
соответствует азотная кислота, оксиду фосфора (V)
– фосфорная кислота, оксиду серы (IV)
– сернистая кислота, оксиду серы (VI)
– серная кислота, оксиду кремния (IV)
– кремниевая кислота, оксиду углерода (IV)
– угольная кислота, оксиду хрома (VI)
– хромовая кислота, оксиду марганца (VII)
– марганцевая кислота.
К
кислотным оксидам относятся оксиды неметаллов и оксиды металлов с большими
степенями окисления. Например, оксиду азота (V)
соответствует азотная кислота, оксиду фосфора (V)
– фосфорная кислота, оксиду серы (IV)
– сернистая кислота, оксиду серы (VI)
– серная кислота, оксиду кремния (IV)
– кремниевая кислота, оксиду углерода (IV)
– угольная кислота, оксиду хрома (VI)
– хромовая кислота, оксиду марганца (VII)
– марганцевая кислота.
N2O5 → HNO3
P2O5 → H3PO4
SO2 → H2SO3
SO3 → H2SO4
SiO2 → H2SiO3
CO2 → H2CO3
CrO3 → H2CrO4
Mn2O7 → HMnO4
Кислотные
оксиды вступают в реакции обмена с основаниями,
при этом образуется соль и вода.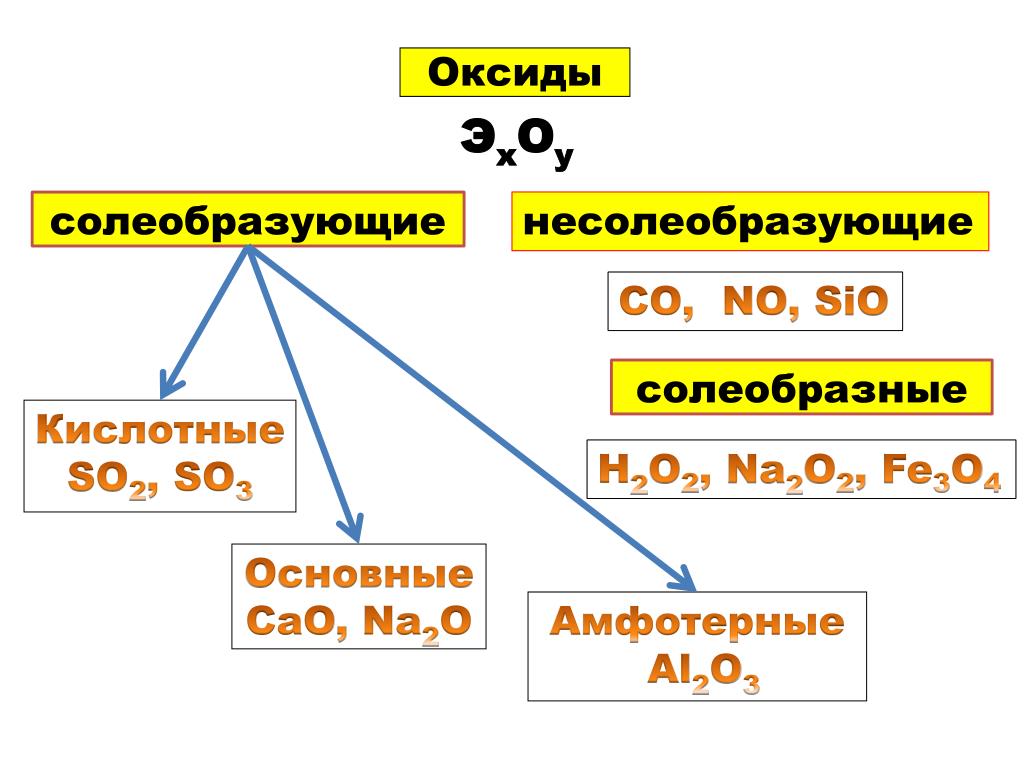 Если через пробирку с известковой водой
пропустить углекислый газ, то известковая вода мутнеет, следствие образования
соли – карбоната кальция.
Если через пробирку с известковой водой
пропустить углекислый газ, то известковая вода мутнеет, следствие образования
соли – карбоната кальция.
CO2 + Ca(OH)2 = CaCO3↓ + H2O
CO2 + Ca2+ + 2OH— = CaCO3↓ + H2O
Кислотные оксиды вступают в реакции соединения с основными оксидами, при этом образуются соли. Например, в результате взаимодействия оксида серы (IV) и оксида калия образуется соль – сульфит калия, в результате взаимодействия оксида кремния (IV) с оксидом натрия при нагревании, образуется соль – силикат натрия, при взаимодействии оксида азота (V) с оксидом бария, образуется соль – нитрат бария.
SO2 + K2O = K2SO3
SiO2 + Na2O = Na2SiO3
N2O5 + BaO = Ba(NO3)2
Кроме
этого, кислотные оксиды вступают в реакции соединения с водой, при этом образуются
кислоты, однако эти реакции возможные, если оксид растворим в воде.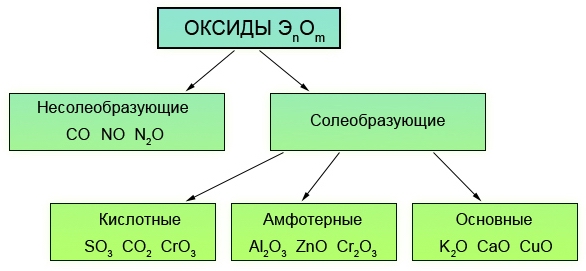 Для этого подтверждения, нальём в одну пробирку дистиллированной воды, а в
другую – раствор углекислого газа (газированной воды). В первую пробирку
добавим оксида кремния (IV).
А затем в каждую из пробирок добавим несколько капель лакмуса. В первой
пробирке изменений нет, а во второй лакмус окрасился в красный цвет, значит, во
второй пробирке кислота. В первой пробирке кислоты не образовалось, потому что
оксид кремния (IV) не растворим в воде.
Для этого подтверждения, нальём в одну пробирку дистиллированной воды, а в
другую – раствор углекислого газа (газированной воды). В первую пробирку
добавим оксида кремния (IV).
А затем в каждую из пробирок добавим несколько капель лакмуса. В первой
пробирке изменений нет, а во второй лакмус окрасился в красный цвет, значит, во
второй пробирке кислота. В первой пробирке кислоты не образовалось, потому что
оксид кремния (IV) не растворим в воде.
SiO2 + H2O ≠
CO2 + H2O ↔ H2CO3
Амфотерные оксиды Факты для детей
Амфотерные оксиды — это те оксиды, которые ведут себя как кислотные, так и основные оксиды. например, оксид алюминия и оксид цинка
Амфотерный оксид может действовать как кислота или основание.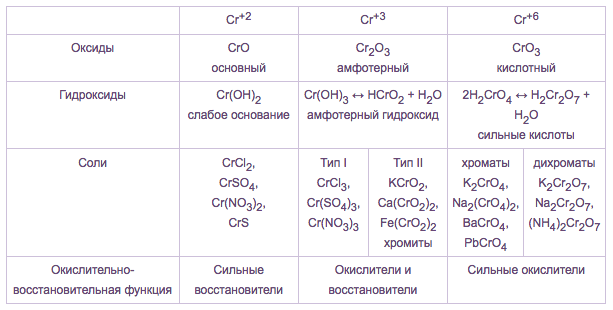 Обычно оксиды неметаллов являются кислотными, а оксиды металлов — основными. Некоторые оксиды неметаллов нейтральны, а некоторые оксиды металлов или полуметаллов являются амфотерными. Есть ряд исключений из этих обобщений.
Обычно оксиды неметаллов являются кислотными, а оксиды металлов — основными. Некоторые оксиды неметаллов нейтральны, а некоторые оксиды металлов или полуметаллов являются амфотерными. Есть ряд исключений из этих обобщений.
Что такое амфотерные оксиды?
“ Амфотерные оксиды – это оксиды, которые ведут себя как кислотные, так и основные оксиды. Амфотерные оксиды обладают свойствами как кислотных, так и основных оксидов, которые нейтрализуют как кислоты, так и основания».
Амфотерные оксиды растворяются в воде с образованием щелочных растворов. Щелочные растворы содержат ионы гидроксида. Таким образом, оксид алюминия (Al2O3) реагирует с соляной кислотой с образованием хлорида алюминия и воды. С раствором гидроксида натрия образует алюминат натрия (NaAlO2) и воду.Другие распространенные примеры амфотерных оксидов включают ZnO, SnO и PbO.
Как идентифицировать амфотерные оксиды?
Оксиды представляют собой соединения металлов или неметаллов с кислородом. Существует четыре типа оксидов. Амфотерные оксиды классифицируются как оксиды металлов, которые реагируют как с кислотами, так и с основаниями с образованием солей и воды. Амфотерные оксиды, среди многих других, включают оксид свинца и оксид цинка. Примеры включают аминокислоты и белки, которые относятся к классам аминов и карбоновых кислот, а также молекулы, которые могут самоионизироваться, такие как вода.
Существует четыре типа оксидов. Амфотерные оксиды классифицируются как оксиды металлов, которые реагируют как с кислотами, так и с основаниями с образованием солей и воды. Амфотерные оксиды, среди многих других, включают оксид свинца и оксид цинка. Примеры включают аминокислоты и белки, которые относятся к классам аминов и карбоновых кислот, а также молекулы, которые могут самоионизироваться, такие как вода.
Амфотерные оксиды представляют собой соединения кислорода, которые проявляют как кислотные, так и основные характеристики. Эти оксиды подвергаются реакции нейтрализации с образованием воды и соли при взаимодействии с кислотой. Это демонстрирует существенные свойства соединений. Точно так же щелочь реагирует на образование соли и воды, проявляя кислотное свойство. Пример: оксид алюминия.
Все оксиды можно получить, нагревая элемент в кислороде. Реакция водных растворов тригалогенидов металлов с гидроксидом дает оксиды в гидратированной форме.Спускаясь вниз по группе, происходит переход от кислых оксидов через амфотерные к основным из-за усиления металлического характера рассматриваемых элементов.
Примеры амфотерных оксидов
Слово «амфотерный» означает и кислоту, и основание. Амфотерные оксиды обладают как кислотными, так и основными свойствами. Оксиды алюминия и цинка являются примерами. Они образуют соли при взаимодействии с кислотами. Они также реагируют со щелочами с образованием комплексных солей.
Примеры:
ZnO(s) + 2HNO3(aq) → Zn(NO3)2(aq) + h3O(l)
ZnO(т) + 2NaOH(водн.) → Na2ZnO2(водн.) + h3O(ж)
Al2O3(т) + 6HCl(водн.) → 2AlCl3(водн.) + 3h3O(ж)
Al2O3(т) + 2NaOH(водн.) → 2NaAlO2(водн.) + h3O(ж)
Цинкаты и алюминаты имеют окончание -ate, чтобы показать, что их ионы являются составными ионами, содержащими кислород, подобно сульфатам, карбонатам и нитратам, указывая на то, что ионы ZnO22-, а ионы алюмината AlO2-.Ионы записываются как Zn(OH)42- и Al(OH)4–. Обратите внимание, что цинкат и алюминат натрия растворимы в воде.
Ссылки
Что такое амфотерные оксиды? | Study.
 com
comКислые и основные растворы солей: объяснение и примеры
Раствор соли можно считать кислым, щелочным или нейтральным в зависимости от pH, который влияет на ионы, с которыми он взаимодействует.Узнайте о растворах солей, поняв соль на молекулярном уровне и влияние pH на растворы солей.
Константа равновесия (K) и коэффициент реакции (Q)
Константа равновесия, K, представляет собой число, которое выражает соотношение продуктов и реагентов в реакции, когда она достигает химического равновесия. Исследуйте состояние равновесия и значение химического равновесия и коэффициента реакции (Q).
Исследуйте состояние равновесия и значение химического равновесия и коэффициента реакции (Q).
Константа скорости и законы скорости
Закон скорости определяется как зависимость между скоростью реакции и концентрацией реагентов.Узнайте о законе скорости, константе скорости и о том, как использовать уравнения закона скорости для определения порядка реакции для одного или двух реагентов.
Амфипротонные вещества: определение и примеры
Амфипротонные вещества — это вещества, которые могут действовать как кислота или основание, поскольку они могут как отдавать, так и принимать протон.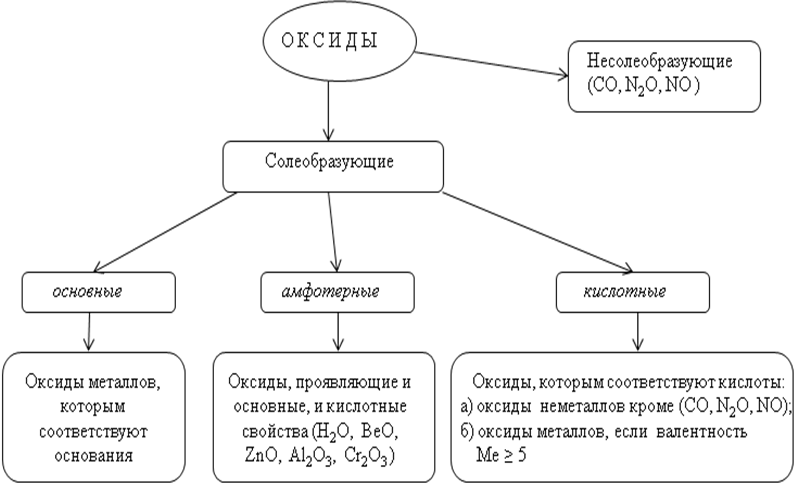 Узнайте об определении амфипротонных веществ и откройте для себя примеры амфипротонных соединений.
Узнайте об определении амфипротонных веществ и откройте для себя примеры амфипротонных соединений.
Химические связи I: ковалентные
Ковалентная связь возникает, когда два атома имеют общие электроны.Узнайте о химической связи, узнайте, как образуются ковалентные связи, откройте для себя валентные электроны и изучите структуру молекулы.
Титрование сильной кислоты или сильного основания
В кислотно-щелочной химии титрование можно использовать для определения концентрации неизвестного раствора.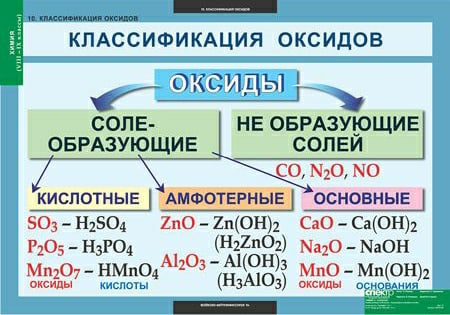 Узнайте о титровании, титранте, реакции нейтрализации и точке эквивалентности, а также о том, как выполнять титрование и интерпретировать кривую титрования.
Узнайте о титровании, титранте, реакции нейтрализации и точке эквивалентности, а также о том, как выполнять титрование и интерпретировать кривую титрования.
Небензодиазепиновые депрессанты: седативные, снотворные и противотревожные препараты
Небензодиазепиновые анксиолитики, седативные и снотворные препараты — это препараты, которые используются для уменьшения беспокойства, успокоения и подавления физических реакций, а также для стимуляции сна соответственно.Просмотрите примеры небензодиазепиновых депрессантов и узнайте о функции препарата и его влиянии на центральную нервную систему.
Лимфатическая жидкость: состав и функция
Лимфатическая жидкость транспортирует и поддерживает иммунные клетки, действуя как интерстициальная жидкость между тканями.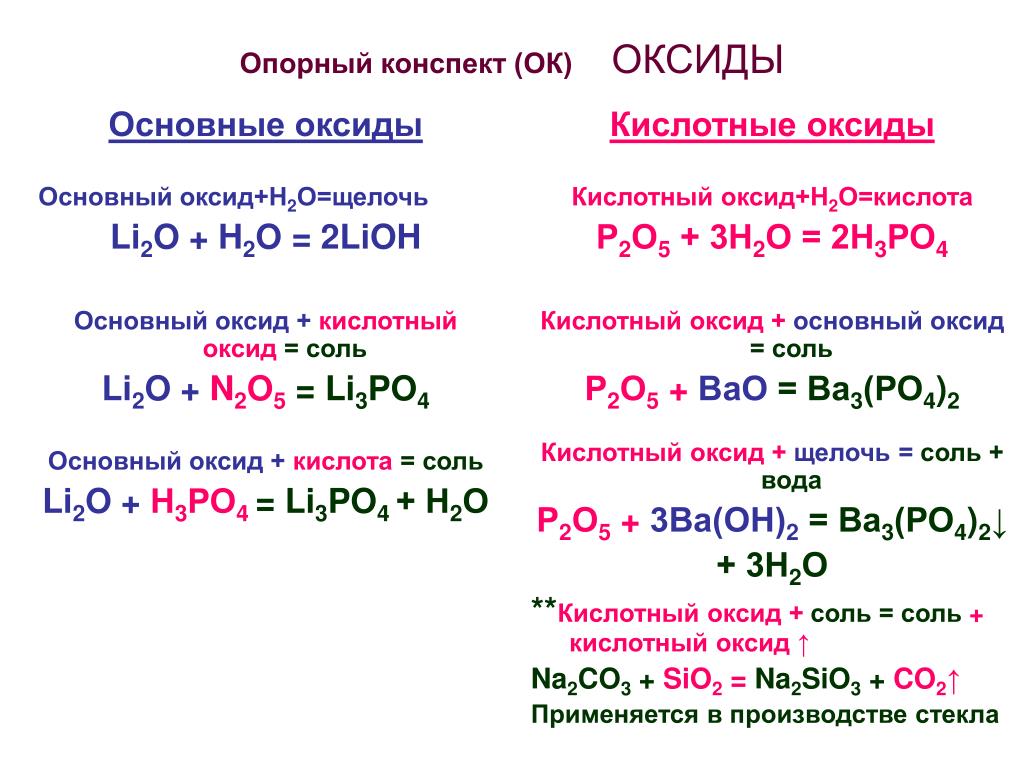 Изучите состав, расположение и функцию лимфатической жидкости в организме.
Изучите состав, расположение и функцию лимфатической жидкости в организме.
Константа диссоциации и автоионизация воды
Константа автоионизации используется для определения концентрации ионов гидроксида или гидроксония в растворе.Исследуйте автоионизацию воды, константу Kw и способы определения концентрации ионов.
Гептан: структура, применение и формула
Гептан представляет собой насыщенный углеводород с прямой цепью, используемый для определения нулевой точки по шкале октанового числа. Изучите структуру и формулу гептана и узнайте о его распространенных источниках, способах применения и мерах безопасности.
Изучите структуру и формулу гептана и узнайте о его распространенных источниках, способах применения и мерах безопасности.
Определение кислот и оснований по Аррениусу
Что такое Аррениусовы кислоты и основания? Изучите определения кислот и оснований по Аррениусу.См. список кислот и оснований Аррениуса и ограничения модели Аррениуса.
Свойства кислот и оснований
Свойства кислот и оснований
Некоторые свойства кислот:
- Вкус кисловатый, лимонный, апельсиновый.
- Их растворимость в воде высокая.

- Их водные растворы проводят электрический ток.
- Соединения, включающие CO 3 -2 и HCO 3 — , производят газ CO 2 ;
Пример:
CaCO 3 + 2HNO 3 → Ca(NO 3 ) 2 + CO 2 (г) + H 2 O
NaHCO 3 + HCl → NaCl + CO 2 (г) + H 2 O
- Они реагируют с активными металлами с образованием соли и газа H 2 .
Пример:
Zn + H 2 SO 4 (раст.) → ZnSO 4 (раст.) + H 2 (г)
Mg + 2HCl → MgCl 2 + H 2
2Al + 3H 2 SO 4 → Al 2 (SO 4 ) 3 +3H 2
Некоторые металлы, такие как Au, Pt, Ag, Cu и Hg, не соответствуют этому свойству. Их называют благородными металлами. Они не образуют газа H 2 в реакциях с кислотами.Однако некоторые благородные металлы реагируют с HNO 3 и H 2 SO 4 и не дают H 2 .
Их называют благородными металлами. Они не образуют газа H 2 в реакциях с кислотами.Однако некоторые благородные металлы реагируют с HNO 3 и H 2 SO 4 и не дают H 2 .
Пример:
Cu + HCl → реакции не происходит
Cu + 2H 2 SO 4 → CuSO 4 + SO 2 + 2H 2 O
3Cu + 8HNO 3 → 3Cu(NO 3 ) 2 + 2NO + 4H 2 O
- Кислоты окрашивают синий лакмус в красный цвет.
- Кислоты реагируют с основаниями и образуют соль и воду.Этот тип реакции называется реакцией нейтрализации .
H 2 SO 4 + 2NaOH → Na 2 SO 4 + 2H 2 O
2HCl + Ba(OH) 2 → BaCl 2 + 2H 2 O
HCl + NaOH → NaCl +H 2 O
Некоторые свойства оснований:
- Вкус горький, как шампунь.
- Их растворы с водой проводят электрический ток.
- Когда мы касаемся основных материй, мы чувствуем их скользкими.
- Их растворимость в воде низкая по сравнению с кислотами.
- Основания превращают красный лакмус в синий.
- Не реагируют с металлами. Однако некоторые металлы, такие как Zn и Al, реагируют с основаниями и образуют газ H 2 и соль. Эти металлы называются амфотерными металлами. Они ведут себя как кислота для основания и основание для кислоты.
Пример:
2Al + 6NaOH → 2Na 3 AlO 3 + 3H 2
Zn + 2NaOH → Na 2 ZnO 2 + H 2
- Реагируют с кислотами и образуют соль и воду.(реакции нейтрализации)
Оксиды
Соединения любого элемента с водой называются оксидами . Мы рассматриваем их под четырьмя названиями; кислотные и основные оксиды, нейтральные оксиды, амфотерные оксиды и пероксиды;
1) Кислотные оксиды: Это оксиды, которые соединяются с основаниями и образуют соли.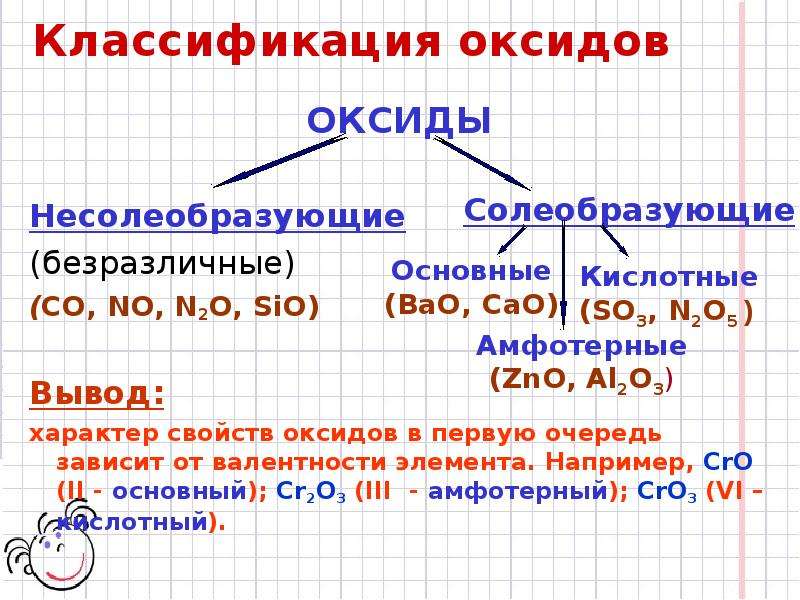 Примерами кислотных оксидов являются SO 2 , SO 3 , CO 2 , N 2 O 5 .
Примерами кислотных оксидов являются SO 2 , SO 3 , CO 2 , N 2 O 5 .
SO 3 + 2 NaOH → Na 2 SO 4 + H 2 O
Кислотно-оксидно-основное Соль Вода
CO 2 + 2 NaOH → Na 2 CO 3 + H 2 O
Оксид кислоты Основание Соль Вода
Кислотные оксиды соединяются с водой и образуют кислоты.
SO 2 + H 2 O → H 2 SO 3
SO 3 + H 2 O → H 2 SO 4
CO 2 + H 2 O → H 2 CO 3
2) Основные оксиды: Они соединяются с кислотами и образуют соли. Оксиды металлов проявляют это свойство подобно; Na 2 O, CaO.
Na 2 O + 2HCl → 2NaCl + H 2 O
Основной оксид Кислота Соль Вода
CaO + 2HCl → CaCl 2 + H 2 O
Основной оксид Кислота Соль Вода
Основные оксиды соединяются с водой и образуют основания.
Na 2 O + H 2 O → 2NaOH
BaO + H 2 O → Ba(OH) 2
3) Нейтральные оксиды: Не реагируют с кислотами и основаниями. Нейтральные оксиды не реагируют с водой и образуют кислоту или основание. NO, N 2 O и CO являются некоторыми примерами нейтральных оксидов.
4) Амфотерные оксиды: Эти оксиды реагируют с кислотами и основаниями и образуют соли. ZnO и Al 2 O 3 являются примерами амфотерных оксидов.Примеры этих реакций приведены ниже;
ZnO + 2HCl → ZnCl 2 + H 2 O
ZnO + 2NaOH → Na 2 ZnO 2 + H 2 O
A l2 O 3 + 6HCl → 2AlCl 3 + 3H 2 O
Al2O3 + 6NaOH → 2Na 3 AlO 3 + 3H 2 O
5) Пероксиды: Соединения, включающие в свою структуру (O 2 ) -2 , называются пероксидами. Примеры пероксидов приведены ниже;
Примеры пероксидов приведены ниже;
H 2 O 2 : Перекись водорода
Na 2 O 2 : Пероксид натрия
Пример: Какие из следующих утверждений верны для водного раствора серной кислоты H 2 SO 4 ?
I. Окрашивает лакмус в красный цвет.
II. Он проводит электрический ток.
III. При взаимодействии с Mg образуется газ H 2 .
IV. Проводит реакцию нейтрализации водным раствором NH 3 .
Решение:
Поскольку это кислота, она превращает синюю лакмусовую бумагу в красную I верно.
Все кислые водные растворы проводят электрический ток, поэтому верно II.
Некоторые металлы реагируют с кислотами и образуется газ H 2 , Mg является одним из этих металлов III также верно.
NH 3 является основанием, а H 2 SO 4 является кислотой, при их сочетании происходит реакция нейтрализации. IV тоже верно.
IV тоже верно.
Кислоты и щелочи Экзамены и решения проблем
| Кислоты и основания< Предыдущая | Далее >Сильные стороны кислот и оснований |
|---|
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера для приема файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно.Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались.
 Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie. - Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.
- Дата на вашем компьютере в прошлом.Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу.Предоставить доступ без файлов cookie
потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только та информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта.Например, сайт не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
Приведите по два примера каждого из следующих оксидов: (а) кислотные оксиды (б) основные оксиды (в) амфотерные оксиды (г) нейтральные оксиды. Укажите, какой из следующих оксидов, т. е. от (a) до (d)
Нажмите, чтобы оценить этот пост!
[Всего: 1 Среднее: 3] (i) Реакция с водой с образованием основания
(ii) Реакция с основанием с образованием соли и воды
(iii) Реакция с кислотами и щелочами с образованием соли и воды.
Кислотный оксид:
Неметаллы реагируют с кислородом с образованием кислотных соединений оксидов, которые удерживаются вместе ковалентными связями. Эти соединения также можно назвать ангидридами кислот. Кислые ангидриды обычно имеют низкую температуру плавления и кипения, за исключением таких соединений, как B 2 O 3 и SiO 2 , которые имеют высокие температуры плавления и образуют гигантские молекулы.
примеры: NO, CO 2
SO 3 + H 2 O -> H 2 o -> H 2 SO 4
B 2 O 3 + H 2 O -> 2H 3 БО 3
Основной оксид:
Металлы реагируют с кислородом с образованием основных соединений кислорода. Эти соединения обычно имеют ионную природу. Группы 1, 2 и лантаноиды образуют основные соединения кислорода при взаимодействии с молекулярным кислородом. При образовании этих соединений выделяется большое количество энергии.Эти соединения легко реагируют с водой, за некоторыми исключениями.
При образовании этих соединений выделяется большое количество энергии.Эти соединения легко реагируют с водой, за некоторыми исключениями.
Примеры: м 2 O 3 , MO 2 , Tho 2 2 Na 2 O + H 2 O -> 2NAOH
Амфотерный оксид:
Амфотерные оксиды представляют собой соединения кислорода, которые проявляют как кислотные, так и основные характеристики. Эти оксиды при взаимодействии с кислотой претерпевают реакцию нейтрализации с образованием воды и соли.В этом проявляется основное свойство соединений. Точно так же реагирует со щелочью с образованием соли и воды, проявляя кислые свойства. Пример: оксид алюминия.
кислотные характеристики:
AL 2 O 3 + 6HCL -> 2AL 3+ + 6CL- + 3H 2 O 2 O
Основные характеристики:
AL 2 O 3 + 2OH – + 3H 2 O -> 2[Al(OH) 4 ] –
Нейтральные оксиды:
Некоторые соединения реагируют с кислородом с образованием оксидов, которые не обладают ни кислотными, ни основными свойствами. Такие соединения называются нейтральными соединениями кислорода.
Такие соединения называются нейтральными соединениями кислорода.
Пример: NO, CO
1. Основные оксиды реагируют с водой с образованием оснований.
2. Кислый оксид реагирует с основанием с образованием соли и воды
3. Амфотерный оксид реагирует с кислотами и основаниями с образованием соли и воды.
оксидов; кислотные, основные, амфотерные Классификация оксидов… Страницы 1-13 — Flip PDF Download
2P32 – Основы неорганической химии Д-р М. Пилкингтон. Лекция 22 – Кислотно-основной характер оксидов и гидроксидов в водном растворе • Оксиды; кислые, основные, амфотерные • Классификация оксидов – кислотность оксидов и основность • Гидролиз оксоанионов • Периодичность кислотно-основного характера оксидов • Реакции кислых и основных оксидов1.Оксиды Кислород образует соединения со всеми элементами, кроме He, Ne, Ar и Kr. Реагирует непосредственно со всеми элементами, кроме галогенов, некоторыми благородными металлами, например. Ag, Au и благородные газы. Как и в случае с гидридами, существуют различные типы связи. Оксиды металлов представляют собой ионные твердые вещества, оксиды неметаллов представляют собой дискретные молекулярные ковалентные газы и жидкости. Оксиды более тяжелых неметаллов и полуметаллов имеют тенденцию быть ковалентными полимерными твердыми веществами. Оксиды переходных металлов иногда нестехиометричны.1
Ag, Au и благородные газы. Как и в случае с гидридами, существуют различные типы связи. Оксиды металлов представляют собой ионные твердые вещества, оксиды неметаллов представляют собой дискретные молекулярные ковалентные газы и жидкости. Оксиды более тяжелых неметаллов и полуметаллов имеют тенденцию быть ковалентными полимерными твердыми веществами. Оксиды переходных металлов иногда нестехиометричны.1
Изменение кислотно-основных свойств оксидов в водном растворе сильно коррелирует с положением линии металл-неметалл. Оксиды в водном растворе (кислые и основные ангидриды) Один из наиболее важных аспектов свойствами оксидов являются их кислотно-основные свойства. Многие оксиды являются основными или кислотными ангидридами; то есть они представляют собой соединения, которые образуются при удалении воды из соответствующего основания или кислоты. Ионные оксиды обычно представляют собой основные ангидриды, тогда как ковалентные оксиды обычно представляют собой кислотные ангидриды.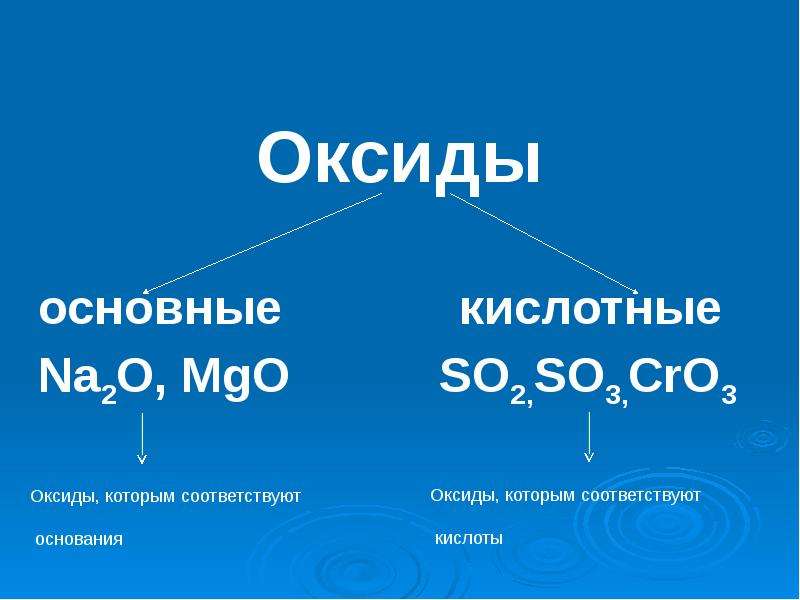 Оксиды полуметаллов представляют собой амфотерные ангидриды, способные действовать как кислота или основание, в зависимости от обстоятельств. Если мы перечислим оксиды данного периода , например В-третьих, мы находим упорядоченную прогрессию их кислотно-основного характера. Сила кислоты увеличивается с кислотностью вовлеченного катиона Na+ Cl+7Na2O, MgO, Al2O3, SiO2, P4O10, SO3, Cl2O7Na(OH) Mg(OH)2 Al(OH)3 Si(OH)4 h4PO4 h3SO4 HClO4(sol) (insol) амфотерная слабая кислота очень сильная кислота.ОСНОВНОЙ ОКСИД КИСЛОТОЙ ОКСИД АМФОТЕРНЫЙ ОКСИД сильное основание Амфотерный вид Сильная кислота 2
Оксиды полуметаллов представляют собой амфотерные ангидриды, способные действовать как кислота или основание, в зависимости от обстоятельств. Если мы перечислим оксиды данного периода , например В-третьих, мы находим упорядоченную прогрессию их кислотно-основного характера. Сила кислоты увеличивается с кислотностью вовлеченного катиона Na+ Cl+7Na2O, MgO, Al2O3, SiO2, P4O10, SO3, Cl2O7Na(OH) Mg(OH)2 Al(OH)3 Si(OH)4 h4PO4 h3SO4 HClO4(sol) (insol) амфотерная слабая кислота очень сильная кислота.ОСНОВНОЙ ОКСИД КИСЛОТОЙ ОКСИД АМФОТЕРНЫЙ ОКСИД сильное основание Амфотерный вид Сильная кислота 2
и молекула воды показана ниже: O2- 2 O H- +HOH Двухзарядный оксид атакует и образует связь с частично положительным атомом водорода молекулы воды.При последующем разрыве связи ОН образуются два иона гидроксида. водн.) 2Na+ + 2OH- (водн.) Процесс представляет собой последовательность от оксида металла к гидроксиду металла, который диссоциирует на водный гидроксид и ионы металла. Таким образом, оксид натрия является основным ангидридом; он производит основной гидроксид натрия в водном растворе. Обратите внимание, чем выше степень ионного характера оксида, тем он более основный. Оксиды неметаллов реагируют с водой с образованием так называемых оксокислот или оксикислот, т.е. кислот, содержащих звено NM-OH, где NM = неметалл. оксид металла обычно характеризуется полярными ковалентными связями, а не ионными связями оксида металла. 3
Обратите внимание, чем выше степень ионного характера оксида, тем он более основный. Оксиды неметаллов реагируют с водой с образованием так называемых оксокислот или оксикислот, т.е. кислот, содержащих звено NM-OH, где NM = неметалл. оксид металла обычно характеризуется полярными ковалентными связями, а не ионными связями оксида металла. 3
Например, OH + H 2h3O NMO22- + 2h4O+ NM OO - H+ NM OH оксокислота Частично отрицательный атом кислорода молекулы воды будет атаковать частично положительный атом неметалла одновременно с кислород оксида притягивается к одному из атомов водорода воды. При разрыве связи ОН в воде образуется оксокислота, которая расщепляется с образованием соответствующего водного аниона и ионов гидроксония. Например, триоксид серы (неметалл) образует серную кислоту в виде оксокислоты, которая, в свою очередь, распадается на сульфат и гидроксоний. ионы. Трехокись серы – это кислотный ангидрид серной кислоты. Амфотерные оксиды – часто оксиды полуметаллов.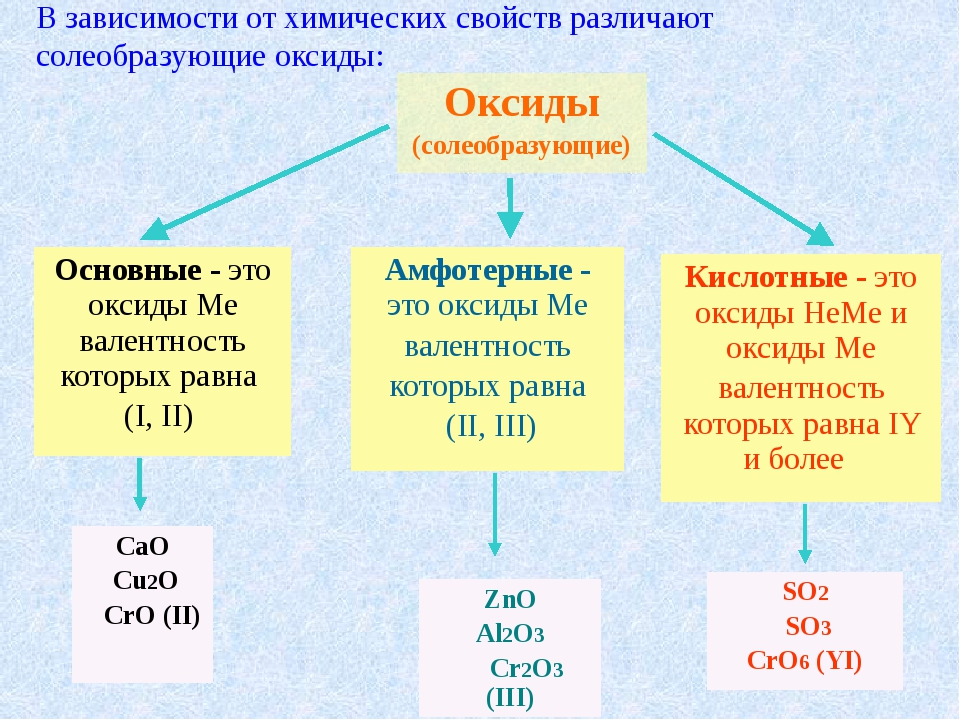 Хотя сами оксиды не слишком растворимы в воде, они могут реагировать как с кислотами, так и с основаниями.ZnO также является амфотерным. + 6H+ 2Al3+(водн.) + 3h3O 2[Al(OH)4]-(водн.) Al2O3(s) + OH- + 3h3O 4
Хотя сами оксиды не слишком растворимы в воде, они могут реагировать как с кислотами, так и с основаниями.ZnO также является амфотерным. + 6H+ 2Al3+(водн.) + 3h3O 2[Al(OH)4]-(водн.) Al2O3(s) + OH- + 3h3O 4
Гидролиз оксоанионов Неметаллы существуют в водном растворе в виде оксокислот, которые ионизируются с образованием оксоанионы в растворе. Оксоанионы (сочетания кислорода и НМ) гидратируются в водном растворе. В этом случае электростатическое притяжение возникает между электронными парами на атомах кислорода оксоаниона и частично положительными Н-атомами молекул воды . Гидратация является экзотермическим процессом. Энергия гидратации увеличивается с увеличением заряда и уменьшением размера. Если взаимодействие между анионом и атомом водорода воды достаточно сильное, Н может быть удален из воды с образованием гидроксид-иона, что приводит к основному раствору. MOxy- + h3O [MO (x-1)OH](y-1) + OH- При определении основности оксоаниона мы должны принимать во внимание заряд, количество оксогрупп и электроотрицательность. Оксоанионы можно разделить на категории, которые описывают степень их гидролиза.Влияние заряда на основность Увеличение заряда аниона увеличивает его склонность к гидролизу и образованию основных растворов. Значения pKb оксоаниона уменьшаются на 4-5 единиц для каждого дополнительного отрицательного заряда аниона.Влияние количества оксогрупп Поскольку большинство неметаллов проявляют более одной степени окисления, они могут образовывать оксоанионы, различающиеся числом оксогрупп (кислород непосредственно связан с металлом). Например, хлор образует четыре различных оксоаниона: ClO-, ClO2-, ClO3-, ClO4-.Добавление дополнительного кислорода снижает основность оксоаниона. Эффект электроотрицательности По мере уменьшения электроотрицательности атома неметалла основность оксоаниона увеличивается. 5
Оксоанионы можно разделить на категории, которые описывают степень их гидролиза.Влияние заряда на основность Увеличение заряда аниона увеличивает его склонность к гидролизу и образованию основных растворов. Значения pKb оксоаниона уменьшаются на 4-5 единиц для каждого дополнительного отрицательного заряда аниона.Влияние количества оксогрупп Поскольку большинство неметаллов проявляют более одной степени окисления, они могут образовывать оксоанионы, различающиеся числом оксогрупп (кислород непосредственно связан с металлом). Например, хлор образует четыре различных оксоаниона: ClO-, ClO2-, ClO3-, ClO4-.Добавление дополнительного кислорода снижает основность оксоаниона. Эффект электроотрицательности По мере уменьшения электроотрицательности атома неметалла основность оксоаниона увеличивается. 5
Классификация оксо-анионов представлена ниже Классификация Результирующая формула Неосновные содержат оксогруппы и не содержат заряда Слабоосновные без заряда и без оксогрупп Умеренно основные без оксогрупп и с зарядом -1/2 или -1 без оксогрупп и с зарядом больше Очень сильно основные отрицательный -1Example1.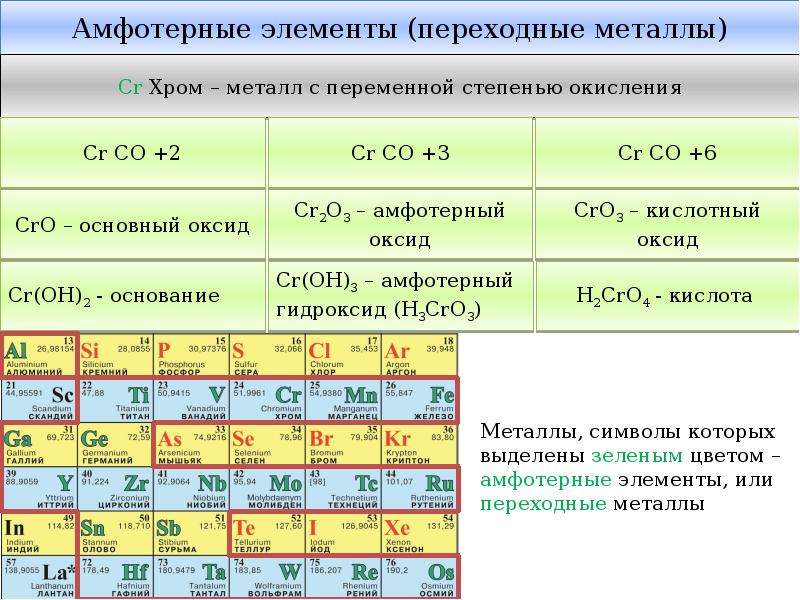 Рассмотрим оксо-анион формулы MO4-. Для этой формулы эффект одной единицы отрицательного заряда компенсирует эффект двух оксогрупп. Если убрать отрицательный заряд и две оксогруппы, получится формула МО2. Этот анион относится к категории неосновных.2. Рассмотрим оксо-анион формулы MO34-. Три оксогруппы нейтрализуют 1,5 единицы отрицательного заряда. Полученная формула становится М-2,5. Этот оксо-анион будет очень сильно основным. В таблице на следующем слайде перечислены рассчитанные pKb для важных простых оксо-анионов элементов.6
Рассмотрим оксо-анион формулы MO4-. Для этой формулы эффект одной единицы отрицательного заряда компенсирует эффект двух оксогрупп. Если убрать отрицательный заряд и две оксогруппы, получится формула МО2. Этот анион относится к категории неосновных.2. Рассмотрим оксо-анион формулы MO34-. Три оксогруппы нейтрализуют 1,5 единицы отрицательного заряда. Полученная формула становится М-2,5. Этот оксо-анион будет очень сильно основным. В таблице на следующем слайде перечислены рассчитанные pKb для важных простых оксо-анионов элементов.6
Краткое изложение динамики количества оксо-групп в оксо-анионах Оксо-анионы с наименьшими центральными атомами относятся к периоду 2p-блока. Они могут иметь максимальную координацию 3 и будут содержать либо 3 оксогруппы, либо две оксогруппы плюс один неподеленный p-электрон. 7
Центральные атомы р-блока периодов 3 и 4, а также атомы 3-го блока 4 и d-блока периодов 4 и 5 имеют больший радиус и могут иметь максимальное координационное число 4. Если валентные орбитали 3p, 4p или 4d, центральный атом может содержать 4 оксогруппы и неподеленные p-электроны. Центральные атомы p-блока и d-блока периода 6 имеют максимальное координационное число 6. Если валентные орбитали центрального атома: 5p, 5d, 5f, 6p или 6d, центральный атом может содержать 4-6 оксогрупп и неподеленные пары p-орбиталей. 8
Если валентные орбитали 3p, 4p или 4d, центральный атом может содержать 4 оксогруппы и неподеленные p-электроны. Центральные атомы p-блока и d-блока периода 6 имеют максимальное координационное число 6. Если валентные орбитали центрального атома: 5p, 5d, 5f, 6p или 6d, центральный атом может содержать 4-6 оксогрупп и неподеленные пары p-орбиталей. 8
2. Обобщить — классификация оксидов Кислотный оксид – образует кислоту при реакции с h3Oe.г. SO3 + h3O h3SO4SO2 + h3O h3SO3CO2 + h3O h3CO3 Основной оксид – образует основание при реакции с h3Oe.g. Na2O + h3O 2NaOH CaO + h3O Ca(OH)2 Амфотерные оксиды – реагируют с h3O с образованием гидроксида, который далее реагирует либо с кислотами, либо с основаниями. Например, ZnO, BeO-, Al2O3-, Ga2O3-, Sn2O2-, PbO2-блок E-OH в водном растворе; (где E = элемент) Мы знаем, что оксиды как металлов, так и монметаллов реагируют с водой с образованием соединений с единицей EOH. Если E представляет собой металл, единица действует как основание, высвобождая ионы гидроксида в растворе.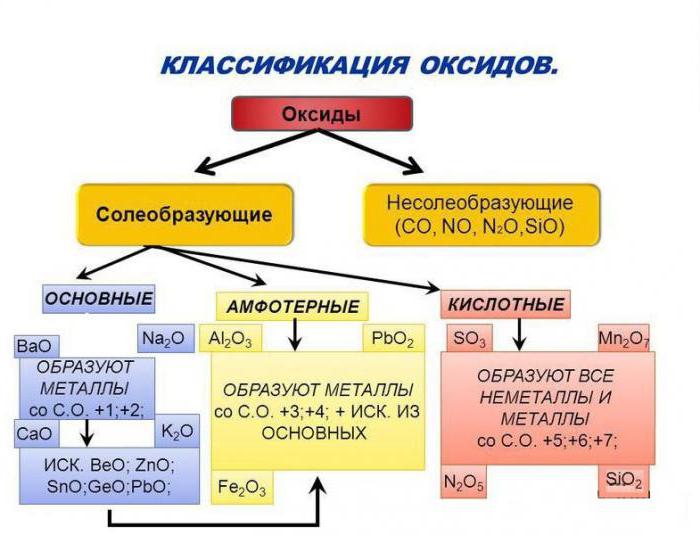 Если Е является неметаллом, высвобождаются ионы гидроксония. В чем разница? Как природа Е определяет, будет ли эта единица кислотой, основанием или амфотерной? Чтобы ответить на этот вопрос, мы внимательно рассмотрим относительную электроотрицательность атомов в этой единице. 9
Если Е является неметаллом, высвобождаются ионы гидроксония. В чем разница? Как природа Е определяет, будет ли эта единица кислотой, основанием или амфотерной? Чтобы ответить на этот вопрос, мы внимательно рассмотрим относительную электроотрицательность атомов в этой единице. 9
гидроксид = OH- = основание X OH гидроксоний = h4O+ = кислота Где разрывается связь?Для металла (ENs 0.7-1.5)X OH X+ + OH- Образуется основание в растворе. Чем больше разница в электроотрицательности между металлом и кислородом, тем больше полярность связи М-О. Более полярная связь МО подвержена атаке полярных молекул воды. Это приводит к разрыву связи МО с образованием водного катиона металла и гидроксид-аниона в растворе. Для неметалла (EN 2.3-3.5) В этом случае Связь ОН более полярна и подвержена атаке молекул воды, в результате чего в растворе появляются оксоанион и ионы гидроксония.X OH XO- + H+ Получение кислого раствора. Для полуметалла Две связи звена E-O-H имеют примерно одинаковую полярность, и любая из них может быть разорвана в зависимости от обстоятельств. В этом случае единица является амфотерной. 10
В этом случае единица является амфотерной. 10
3. Периодичность кислотно-щелочного характера оксида Мы только что видели, что для неметалла звено X-O-H расщепляется между атомами кислорода и водорода под действием полярной воды. При определении относительной силы кислоты также важны два дополнительных фактора: 1. Электроотрицательность центрального атома 2. Количество негидроксильных атомов кислорода, связанных с центральным атомом. По мере увеличения электроотрицательности центрального атома увеличивается и его способность оттягивать электронную плотность от соседних атомов. Окружающие атомы кислорода обладают высокой электроотрицательностью, поэтому центральный атом не может отобрать у них электронную плотность. Электронная плотность обусловлена связями O-H.Атом H имеет низкую электроотрицательность. Электронная плотность связи O-H уменьшается, H становится более частично положительным, и поэтому связь O-H становится более полярной и восприимчивой к атаке молекулами воды.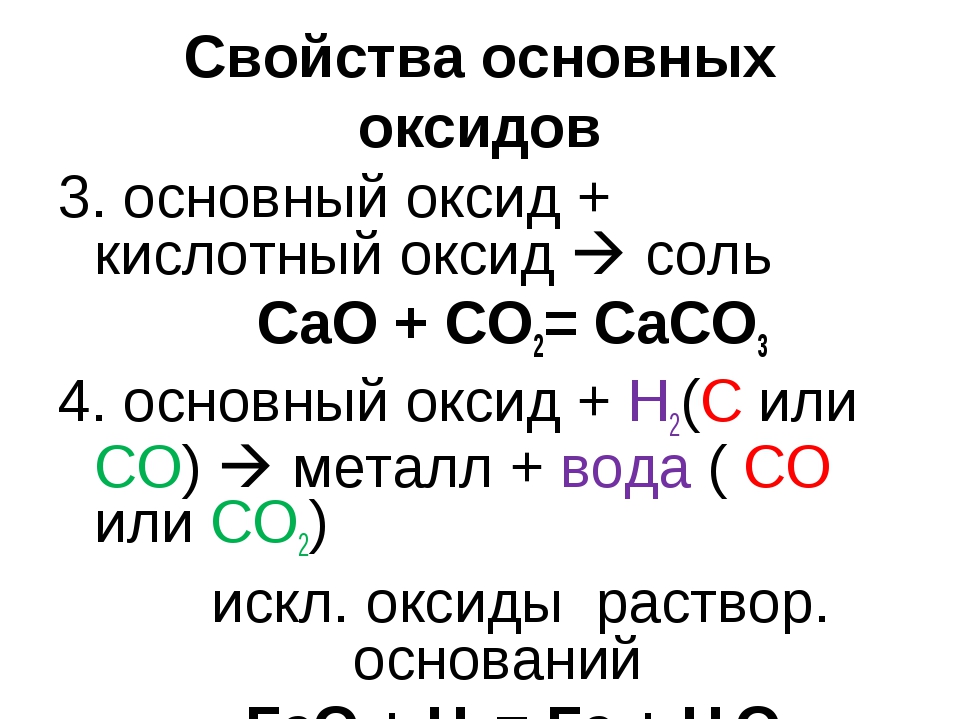 Кислотная сила оксокислоты увеличивается по мере увеличения электроотрицательности центрального атома. Например, серная кислота является более сильной кислотой, чем селеновая кислота, фосфорная кислота сильнее, чем мышьяковая кислота, а хлорная кислота сильнее надбромной кислоты. По мере увеличения количества негидроксильных атомов кислорода они забирают больше электронной плотности у центрального атома, делая его частично положительным. В свою очередь, центральный атом теперь забирает больше электронной плотности из единственного доступного источника, то есть связи O-H. Снова атом H становится частично положительным, а связь OH становится более полярной и, следовательно, более восприимчивой к воздействию воды. В результате по мере увеличения количества негидроксильных атомов кислорода увеличивается и сила оксокислоты. Например, сила кислоты увеличивается от азотистой кислоты к азотной кислоте и от сернистой к серной кислоте. 11
Кислотная сила оксокислоты увеличивается по мере увеличения электроотрицательности центрального атома. Например, серная кислота является более сильной кислотой, чем селеновая кислота, фосфорная кислота сильнее, чем мышьяковая кислота, а хлорная кислота сильнее надбромной кислоты. По мере увеличения количества негидроксильных атомов кислорода они забирают больше электронной плотности у центрального атома, делая его частично положительным. В свою очередь, центральный атом теперь забирает больше электронной плотности из единственного доступного источника, то есть связи O-H. Снова атом H становится частично положительным, а связь OH становится более полярной и, следовательно, более восприимчивой к воздействию воды. В результате по мере увеличения количества негидроксильных атомов кислорода увеличивается и сила оксокислоты. Например, сила кислоты увеличивается от азотистой кислоты к азотной кислоте и от сернистой к серной кислоте. 11
Как насчет переходных металлов? CrIIO является основным и растворяется в кислотах. CrIII2O3 является амфотерным веществом, он растворяется в кислотах (Cr3+) и основаниях [Cr(OH)3]- CrVIO3 представляет собой кислый оксид, который растворяется в воде с образованием h4CrO4 (хромовая кислота). увеличивается (так с увеличением степени окисления центрального атома). Кислотность оксида также увеличивается с уменьшением размера (по мере уменьшения ионного радиуса увеличивается прочность связи X-OH и диссоциирует ион H+). CrO3 аналогичен SO3h3CrO4 h3SO4Хромовая кислота Серная кислота4. Реакции кислотных и основных оксидов1. С h3O для получения кислоты или основанияCaO + h3O Ca(OH)2основной оксидN2O5 + h3O 2HNO3кислый оксид2. Реагируют друг с другом с образованием солей. Na2O(т) + SO3(г) Na2SO4(т)основная кислая соль, оксид 12
CrIII2O3 является амфотерным веществом, он растворяется в кислотах (Cr3+) и основаниях [Cr(OH)3]- CrVIO3 представляет собой кислый оксид, который растворяется в воде с образованием h4CrO4 (хромовая кислота). увеличивается (так с увеличением степени окисления центрального атома). Кислотность оксида также увеличивается с уменьшением размера (по мере уменьшения ионного радиуса увеличивается прочность связи X-OH и диссоциирует ион H+). CrO3 аналогичен SO3h3CrO4 h3SO4Хромовая кислота Серная кислота4. Реакции кислотных и основных оксидов1. С h3O для получения кислоты или основанияCaO + h3O Ca(OH)2основной оксидN2O5 + h3O 2HNO3кислый оксид2. Реагируют друг с другом с образованием солей. Na2O(т) + SO3(г) Na2SO4(т)основная кислая соль, оксид 12
CaO + Cl2O Ca(OCl)2основная кислота, оксид оксида3.Оксид кислоты + основная соль или соль + h3OCO2 + NaOH NaHCO3CO2 + 2NaOH Na2CO3 + h3O(CO2 — ангидрид h3CO3)3. Основной оксид + кислая соль + h3OMgO + 2HCl MgCl2 + h3O 13
р-Блочные элементы образуют кислотные, основные и амфотерные оксиды.
 Объясните каждое свойство, приведя два примера, а также напишите реакции этих оксидов с водой. Элементы p-Block
Объясните каждое свойство, приведя два примера, а также напишите реакции этих оксидов с водой. Элементы p-Blockобразуют кислотные, основные и амфотерные оксиды.Объясните каждое свойство, приведя два примера, а также напишите реакции этих оксидов с водой.
КИСЛОТНЫЕ ОКСИДЫ
Кислотные оксиды — это оксиды, которые реагируют с водой с образованием кислот.
SO 2 , B 2 O 3 являются кислотными оксидами и p-блочными элементами.
Химическое уравнение реакции B 2 O 3 с водой:-
B 2 O 3 +3 H 2 O → 2H 3 BO 3
Химическое уравнение реакции SO 2 с водой:-
SO 2 + H 2 O → H 2 SO 3
ОСНОВНЫЕ ОКСИДЫ
Оксиды, которые реагируют с водой с образованием оснований, известны как основные оксиды.
Cao, BaO, Ti 2 O образуют основные оксиды
Химическое уравнение реакции CaO с водой:
CaO + H 2 O → Ca(OH) 2
Химическое уравнение реакции Ti 2 O с водой:
BaO + H 2 O → Ba(OH) 2
АМФОТЕРНЫЕ ОКСИДЫ
Оксиды, действующие как основные, так и кислотные, известны как амфотерные оксиды.
Оксиды цинка и оксиды алюминия являются двумя амфотерными оксидами.
Химическое уравнение реакции ZnO с водой:
ZnO + 2H 2 O + 2NaOH → Na 3 Zn[OH] 4 + H 2
ZnO +2HCl → ZnCl 2 + H 2 O
Химическое уравнение реакции Al 2 O 3 с водой:
Al 2 O 3 (т) + 6 NaOH(водн.) + 3H 2 O(л) → Na 3 [Al(OH) 6 ] (водн.)
Al 2 O 3 (т) + 6HCl(водн.
