Амедео Авогадро
Граф Лоренцо Романо Амедео Карло Авогадро родился 9 августа 1776 года в Турине (Италия) в семье служащего судебного ведомства Филиппо Авогадро. Амедео был третьим из восьми детей. В юношеские годы посещал школу геометрии и экспериментальной физики. По традиции того времени профессии и должности передавались по наследству, поэтому Амедео занялся юриспруденцией. В 20 лет получил степень доктора церковного законоведения. В 25 лет начал самостоятельно изучать физико-математические науки.
Получил юридическое образование в Туринском университете (1792). В 1800 начал самостоятельно изучать физику и математику. С 1806 Амедео Авогадро работал демонстратором в колледже при Туринской академии. С 1809 — профессор в колледже Верчелли, в 1820-1822 и 1834-1850 заведовал кафедрой математической физики в Туринском университете.
Основные работы Амедео Авогадро посвящены молекулярной физике. В 1811 году он выдвинул молекулярную гипотезу строения вещества, установил один из газовых законов, названный его именем.
Именем Авогадро названа универсальная постоянная — число молекул в одном моле идеального газа (число Авогадро). Амедео установил количественный атомный состав молекул некоторых веществ, для которых он ранее был определен неправильно (вода, водород, кислород, азот, оксиды азота, хлора и др.). Первым обратил внимание на аналогию в свойствах азота, фосфора. мышьяка и сурьмы. Эти химические элементы впоследствии составили главную подгруппу пятой группы периодической системы.
В 20-40-х г.г. 19 века А. Авогадро занимался электрохимией, изучал тепловое расширение тел, теплоемкости. Автор четырехтомного труда «Физика весовых тел, или трактат об общей конституции тел» (1837-41), который стал первым руководством по молекулярной физике.
В историю физики Амедео Авогадро вошел как автор одного из важнейших законов молекулярной физики.
Лоренцо Романо Амедео Карло Авогадро ди Кваренья э ди Черрето родился 9 августа 1776 года в Турине — столице итальянской провинции Пьемонт в семье служащего судебного ведомства Филиппе Авогадро. Амедео был третьим из восьми детей. Предки его с XII века состояли на службе католической церкви адвокатами и по традиции того времени их профессии и должности передавались по наследству. Когда пришла пора выбирать профессию, Амедео также занялся юриспруденцией. В этой науке он быстро преуспел и уже в двадцать лет получил ученую степень доктора церковного права.
Юридическая практика не увлекала Амедео, его интересы были далеки от юриспруденции. В юношеские годы он недолго посещал так называемую школу геометрии и экспериментальной физики. Она-то и пробудила в нем любовь к этим наукам. Но, не получив достаточно систематических знаний, он вынужден был заняться самообразованием. Когда ему уже исполнилось 25 лет, он стал все свободное время посвящать изучению физико-математических наук.
Амедео Авогадро начал свою научную деятельность с изучения электрических явлений. Этот интерес особенно усилился после того, как Вольта в 1800 году изобрел первый источник электрического тока, а также в связи с дискуссией между Гальвани и Вольта о природе электричества. Эти вопросы находились на переднем крае науки того времени, и естественно, что молодой Авогадро решил попробовать свои силы именно здесь.
Работы Авогадро, посвященные разным проблемам электричества, появлялись вплоть до 1846 года. Большое внимание уделял он также исследованиям в области электрохимии, пытаясь найти связь между электрическими и химическими явлениями, что привело его к созданию своеобразной электрохимической теории. В этом отношении его исследования соприкасались с работами известных химиков Дэви и Берцелиуса.
В 1803 и 1804 годах Амедео, совместно со своим братом Феличе, представил в Туринскую Академию наук две работы, посвященные теории электрических и электрохимических явлений, за что и был избран в 1804 году членом-корреспондентом этой академии. В первой работе под названием «Аналитическая заметка об электричестве» он объяснял поведение проводников и диэлектриков в электрическом поле, в частности явление поляризации диэлектриков. Высказанные им идеи получили затем более полное развитие в работах других ученых, в частности Ампера.
В первой работе под названием «Аналитическая заметка об электричестве» он объяснял поведение проводников и диэлектриков в электрическом поле, в частности явление поляризации диэлектриков. Высказанные им идеи получили затем более полное развитие в работах других ученых, в частности Ампера.
В 1806 году Авогадро получает место репетитора в Туринском лицее, а затем, в 1809 году, переводится преподавателем физики и математики в лицей города Верчелли, в котором он проработал около десяти лет В этот период он знакомится с огромным количеством научной литературы, делая многочисленные выписки из прочитанных книг и журнальных статей. Эти выписки, которые он не прекращал вести до конца своих дней, составили 75 томов примерно по 700 страниц в каждом! Содержание этих томов свидетельствует о разносторонности интересов Авогадро, о колоссальной работе, которую он проделал, «переквалифицировавшись» из юриста в физика.
Свою семейную жизнь Амедео Авогадро устроил довольно поздно, когда ему было уже за тридцать. Работая в Верчелли, он познакомился со своей будущей женой Анной Марией Маццье ди Джузеппе, дочерью нотариуса, которая была моложе его на 18 лет. От этого брака он имел восемь детей — двоих сыновей и шесть дочерей. Никто из них не унаследовал его профессии и интересов.
Работая в Верчелли, он познакомился со своей будущей женой Анной Марией Маццье ди Джузеппе, дочерью нотариуса, которая была моложе его на 18 лет. От этого брака он имел восемь детей — двоих сыновей и шесть дочерей. Никто из них не унаследовал его профессии и интересов.
В 1808 году французский ученый Гей-Люсак, изучая реакции между газами, установил, что объемы вступающих в реакцию газов и газообразных продуктов реакции относятся как небольшие целые числ. А в 1811 году появляется статья Авогадро «Очерк метода определения относительных масс элементарных молекул тел и пропорций, согласно которым они входят в соединения». Излагая основные представления молекулярной теории, Авогадро показал, что она не только не противоречит данным, полученным Гей-Люссаком, но, напротив, прекрасно согласуется с ними и открывает возможность точного определения атомных масс, состава молекул и характера происходящих химических реакций Для этого прежде всего, необходимо представить, что молекулы водорода, кислорода, хлора и некоторых других простых веществ состоят не из одного, а из двух атомов.
В этой же работе Амедео Авогадро пришел к следующему важному заключению: «… число… молекул всегда одно и то же в одинаковых объемах любых газов». Разумеется, если объемы измерены при одинаковых давлениях и температурах.
Далее он писал, что теперь «имеется средство очень легкого определения относительных масс молекул тел, которые можно получить в газообразном состоянии, и относительного числа молекул в соединениях». Благодаря новому закону Авогадро впервые получил, в частности, правильную формулу реакции образования воды.
В 1814 году появляется вторая статья Амедео Авогадро «Очерк об относительных массах молекул простых тел, или предполагаемых плотностях их газа, и о конституции некоторых из их соединений». Здесь четко формулируется закон Авогадро: «…равные объемы газообразных веществ при одинаковых давлениях и температурах отвечают равному числу молекул, так что плотности различных газов представляют собою меру масс молекул соответствующих газов».
Так как масса одного моля вещества пропорциональна массе отдельной молекулы, то закон Авогадро можно сформулировать как утверждение, что моль любого вещества в газообразном состоянии при одинаковых температурах и давлениях занимает один и тот же объем. Как показали эксперименты, при нормальных условиях число молекул в моле любого вещества одинаково. Оно получило название числа Авогадро.
Это число — одна из важнейших универсальных постоянных современной физики и химии. Она используется при определении ряда других универсальных постоянных, например, постоянной Больцмана, постоянной Фарадея и т. п.
Число Авогадро можно определить многими независимыми друг от друга методами. Прекрасное совпадение полученных при этом значений явилось убедительным доказательством реальности молекул и справедливости молекулярно-кинетической теории.
В 1821 году в статье «Новые соображения о теории определенных пропорций в соединениях и об определении масс молекул тел» Амедео Авогадро подвел итог своей почти десятилетней работе в области молекулярной теории и распространил свой метод определения состава молекул на целый ряд органических веществ. В той же статье он показал, что другие химики, прежде всего Джон Дальтон, Гемфри Дэви и Берцелиус, незнакомые с его работами, продолжают придерживаться неверных взглядов на природу многих химических соединений и характер происходящих между ними реакций.
В той же статье он показал, что другие химики, прежде всего Джон Дальтон, Гемфри Дэви и Берцелиус, незнакомые с его работами, продолжают придерживаться неверных взглядов на природу многих химических соединений и характер происходящих между ними реакций.
В сентябре 1819 года Авогадро избирается членом Туринской академии наук. К этому времени он уже приобрел известность в кругу своих коллег работами в области молекулярной теории, электричества и химии.
В 1820 году королевским указом Амедео Авогадро назначается первым профессором новой кафедры высшей физики в Туринский университет.
Интересны взгляды Авогадро на преподавание физики, высказанные им при занятии этой должности. Итальянская наука в то время была еще очень слабо развита. Стремясь к тому, чтобы помочь своей родине сравняться по уровню развития естественных наук с другими европейскими странами, Авогадро наметил обширный план действий. Основная его идея заключалась в необходимости сочетания преподавания с научной деятельностью.
Этим прогрессивным идеям не суждено было осуществиться из-за военных и политических событий в Италии начала двадцатых годов. В 1822 году после студенческих волнений Туринский университет был на целый год закрыт властями, а ряд его новых кафедр, в том числе и кафедра высшей физики, ликвидирован. Тем не менее в 1823 году Амедео Авогадро получает почетный титул заслуженного профессора высшей физики и назначается старшим инспектором Палаты по контролю за государственными расходами — должность финансово-юридическая, весьма далекая от науки. Несмотря на новые обязанности, Авогадро продолжал заниматься научными исследованиями.
В 1823 году Туринский университет вновь получил кафедру высшей физики, но ее предложили не Авогадро, а известному французскому математику Огюстену Луи Коши, покинувшему родину в 1830 году. Только спустя два года, после отъезда Коши, Амедео Авогадро смог занять эту кафедру, где и проработал до 1850 года. В том же году он ушел из университета, передав кафедру своему ученику Феличе Кью.
В 1837—1841 годах Авогадро издал четырехтомное сочинение «Физика весомых тел, или трактат об общей конституции тел». Каждый том имел более 900 страниц. К этому времени Авогадро уже исполнилось 65 лет, но ум его по-прежнему был ясным, а любовь к науке и трудолюбие неиссякаемыми. Этот труд оказался первым в истории учебником молекулярной физики.
Современники в своих воспоминаниях рисуют Амедео Авогадро как человека очень скромного, впечатлительного и обаятельного. Они отмечают его доброжелательность, искренность в обращении с другими людьми. «Высокообразованный без педантизма, мудрый без чванливости, презирающий роскошь, не заботящийся о богатстве, не стремящийся к почестям, безразличный к собственным заслугам и собственной известности, скромный, умеренный, доброжелательный» — так характеризует Авогадро один из его современников.
По своему безразличию к почестям Амедео Авогадро представлял редкое исключение среди ученых того времени.
После ухода из университета Авогадро некоторое время занимал должность старшего инспектора Контрольной палаты, а также состоял членом Высшей статистической комиссии. Высшего совета народного образования и председателем Комиссии мер и весов. Несмотря на почтенный возраст, он продолжал публиковать свои исследования в трудах Туринской академии наук. Последняя его работа вышла из печати за три года до смерти, когда Авогадро исполнилось 77 лет.
Высшего совета народного образования и председателем Комиссии мер и весов. Несмотря на почтенный возраст, он продолжал публиковать свои исследования в трудах Туринской академии наук. Последняя его работа вышла из печати за три года до смерти, когда Авогадро исполнилось 77 лет.
Амедео Авогадро умер в Турине 9 июля 1856 года и похоронен в семейном склепе в Верчелли. На следующий год после смерти Авогадро в знак признания его заслуг перед наукой в Туринском университете был установлен его бронзовый бюст.
Огромный вклад Авогадро в развитие молекулярной теории долгое время оставался практически незамеченным современниками. И даже много позже этот закон в литературе часто именовали законом Авогадро—Ампера, хотя Авогадро сформулировал его на три года раньше Ампера.
Вплоть до начала шестидесятых годов XIX века в химии царил произвол, как в оценке молекулярных масс, так и в описании химических реакций; оставалось немало неверных представлений об атомном составе многих сложных веществ. Дело доходило даже до попыток вообще отказаться от молекулярных представлений. Лишь в 1858 году итальянский химик Канниццаро, ознакомившись с письмом Ампера к Бертолле, в котором есть ссылка на работы Авогадро, заново «открыл» эти работы и с удивлением убедился, что они вносят полную ясность в запутанную картину состояния химии того времени.
Дело доходило даже до попыток вообще отказаться от молекулярных представлений. Лишь в 1858 году итальянский химик Канниццаро, ознакомившись с письмом Ампера к Бертолле, в котором есть ссылка на работы Авогадро, заново «открыл» эти работы и с удивлением убедился, что они вносят полную ясность в запутанную картину состояния химии того времени.
В 1860 году Канниццаро подробно рассказал о работах Авогадро на Первом Международном химическом конгрессе в Карлсруэ, и его доклад произвел огромное впечатление на присутствовавших там ученых. Как сказал один из них, он почувствовал, как завеса упала с глаз, сомнения исчезли, и вместо них появилось спокойное чувство уверенности. Великий русский химик Дмитрий Менделеев, также участвовавший в работе этого конгресса, писал позднее: «В 50-х годах одни принимали атомный вес кислорода равным 8, другие — 16. Смута, сбивчивость господствовали. В 1860 году химики всего света собрались в Карлсруэ для того, чтобы достичь соглашения, единообразия. Присутствовав на этом конгрессе, я живо помню, как велико было разногласие и как тогда последователи Шарля Жерара горячо проводили следствия закона Авогадро. Истина, в виде закона Авогадро—Жерара, при посредстве конгресса, получила более широкое распространение и скоро затем покорила все умы. Тогда сами собою укрепились новые атомные веса, и уже с 70-х годов они вошли во всеобщее употребление».
Истина, в виде закона Авогадро—Жерара, при посредстве конгресса, получила более широкое распространение и скоро затем покорила все умы. Тогда сами собою укрепились новые атомные веса, и уже с 70-х годов они вошли во всеобщее употребление».
Заслуги Амедео Авогадро как одного из основоположников молекулярной теории получили с тех пор всеобщее признание.
В вашем браузере отключен Javascript.Чтобы произвести расчеты, необходимо разрешить элементы ActiveX!Больше интересного в телеграм @calcsbox
Авогадро и число его имени
Введение (в сокращении) к книге: Мейлихов Е. З. Число Авогадро. Как увидеть атом. — Долгопрудный: ИД «Интеллект», 2017.
Наука и жизнь // Иллюстрации‹
›
Итальянский учёный Амедео Авогадро — современник А. С. Пушкина — был первым, кто понял, что количество атомов (молекул) в одном грамм-атоме (моле) вещества одинаково для всех веществ. Знание же этого числа открывает путь к оценке размеров атомов (молекул). При жизни Авогадро его гипотеза не получила должного признания.
При жизни Авогадро его гипотеза не получила должного признания.
Истории числа Авогадро посвящена новая книга Евгения Залмановича Мейлихова, профессора МФТИ, главного научного сотрудника НИЦ «Курчатовский институт».
Если бы в результате какой-либо мировой катастрофы все накопленные знания оказались бы уничтоженными и к грядущим поколениям живых существ пришла бы только одна фраза, то какое утверждение, составленное из наименьшего количества слов, принесло бы наибольшую информацию? Я считаю, что это — атомная гипотеза: …все тела состоят из атомов — маленьких телец, находящихся в беспрерывном движении.
Р. Фейнман. Фейнмановские лекции по физике
Число Авогадро (константа Авогадро, постоянная Авогадро) определяется как количество атомов в 12 граммах чистого изотопа углерода-12 (12C). Обозначается оно обычно как NA, реже L. Значение числа Авогадро, рекомендованное CODATA (рабочая группа по фундаментальным постоянным) в 2015 году: NA = 6,02214082(11)·1023 моль-1. Моль — это количество вещества, которое содержит NA структурных элементов (то есть столько же элементов, сколько атомов содержится в 12 г 12C), причем структурными элементами обычно являются атомы, молекулы, ионы и др. По определению атомная единицы массы (а.е.м.) равна 1/12 массы атома 12C. Один моль (грамм-моль) вещества имеет массу (молярную массу), которая, будучи выраженной в граммах, численно равна молекулярной массе этого вещества (выраженной в атомных единицах массы). Например: 1 моль натрия имеет массу 22,9898 г и содержит (примерно) 6,02 · 1023 атомов, 1 моль фторида кальция CaF2 имеет массу (40,08 + 2·18,998) = 78,076 г и содержит (примерно) 6,02·1023 молекул.
Моль — это количество вещества, которое содержит NA структурных элементов (то есть столько же элементов, сколько атомов содержится в 12 г 12C), причем структурными элементами обычно являются атомы, молекулы, ионы и др. По определению атомная единицы массы (а.е.м.) равна 1/12 массы атома 12C. Один моль (грамм-моль) вещества имеет массу (молярную массу), которая, будучи выраженной в граммах, численно равна молекулярной массе этого вещества (выраженной в атомных единицах массы). Например: 1 моль натрия имеет массу 22,9898 г и содержит (примерно) 6,02 · 1023 атомов, 1 моль фторида кальция CaF2 имеет массу (40,08 + 2·18,998) = 78,076 г и содержит (примерно) 6,02·1023 молекул.
В конце 2011 года на XXIV Генеральной конференции по мерам и весам единогласно принято предложение определить моль в будущей версии Международной системы единиц (СИ) таким образом, чтобы избежать его привязки к определению грамма. Предполагается, что в 2018 году моль будет определён непосредственно числом Авогадро, которому будет приписано точное (без погрешности) значение, базирующееся на результатах измерений, рекомендованных CODATA. Пока же число Авогадро является не принимаемой по определению, а измеряемой величиной.
Пока же число Авогадро является не принимаемой по определению, а измеряемой величиной.
Эта константа названа в честь известного итальянского химика Амедео Авогадро (1776—1856), который хотя сам этого числа и не знал, но понимал, что это очень большая величина. На заре развития атомной теории Авогадро выдвинул гипотезу (1811 год), согласно которой при одинаковых температуре и давлении в равных объёмах идеальных газов содержится одинаковое число молекул. Позже было показано, что эта гипотеза есть следствие кинетической теории газов, и сейчас она известна как закон Авогадро. Его можно сформулировать так: один моль любого газа при одинаковых температуре и давлении занимает один и тот же объём, при нормальных условиях равный 22,41383 л (нормальным условиям соответствуют давление P0 = 1 атм и температура T0 = 273,15 К). Эта величина известна как молярный объём газа.
Первую попытку найти число молекул, занимающих данный объём, предпринял в 1865 году Й. Лошмидт. Из его вычислений следовало, что количество молекул в единице объёма воздуха равно 1,8·1018 см-3, что, как оказалось, примерно в 15 раз меньше правильного значения. Через восемь лет Дж. Максвелл привёл гораздо более близкую к истине оценку — 1,9·1019 см-3. Наконец в 1908 году Перрен даёт уже приемлемую оценку: NA = 6,8·1023 моль-1 числа Авогадро, найденную из экспериментов по броуновскому движению.
Лошмидт. Из его вычислений следовало, что количество молекул в единице объёма воздуха равно 1,8·1018 см-3, что, как оказалось, примерно в 15 раз меньше правильного значения. Через восемь лет Дж. Максвелл привёл гораздо более близкую к истине оценку — 1,9·1019 см-3. Наконец в 1908 году Перрен даёт уже приемлемую оценку: NA = 6,8·1023 моль-1 числа Авогадро, найденную из экспериментов по броуновскому движению.
С тех пор было разработано большое число независимых методов определения числа Авогадро, и более точные измерения показали, что в действительности в 1 см3 идеального газа при нормальных условиях содержится (примерно) 2,69·1019 молекул. Эта величина называется числом (или постоянной) Лошмидта. Ей соответствует число Авогадро NA ≈ 6,02·1023.
Число Авогадро — одна из важных физических постоянных, сыгравших большую роль в развитии естественных наук. Но является ли она «универсальной (фундаментальной) физической постоянной»? Сам этот термин не определён и обычно ассоциируется с более или менее подробной таблицей числовых значений физических констант, которые следует использовать при решении задач. В связи с этим фундаментальными физическими постоянными зачастую считаются те величины, которые не являются константами природы и обязаны своим существованием всего лишь выбранной системе единиц (таковы, например, магнитная и электрическая постоянные вакуума) или условным международным соглашениям (такова, например, атомная единица массы). В число фундаментальных констант часто включают многие производные величины (например, газовую постоянную R, классический радиус электрона re = e2/mec2 и т. п.) или, как в случае с молярным объёмом, значение некоторого физического параметра, относящегося к специфическим экспериментальным условиям, которые выбраны лишь из соображений удобства (давление 1 атм и температура 273,15 К).
Но является ли она «универсальной (фундаментальной) физической постоянной»? Сам этот термин не определён и обычно ассоциируется с более или менее подробной таблицей числовых значений физических констант, которые следует использовать при решении задач. В связи с этим фундаментальными физическими постоянными зачастую считаются те величины, которые не являются константами природы и обязаны своим существованием всего лишь выбранной системе единиц (таковы, например, магнитная и электрическая постоянные вакуума) или условным международным соглашениям (такова, например, атомная единица массы). В число фундаментальных констант часто включают многие производные величины (например, газовую постоянную R, классический радиус электрона re = e2/mec2 и т. п.) или, как в случае с молярным объёмом, значение некоторого физического параметра, относящегося к специфическим экспериментальным условиям, которые выбраны лишь из соображений удобства (давление 1 атм и температура 273,15 К). С этой точки зрения число Авогадро есть истинно фундаментальная константа.
С этой точки зрения число Авогадро есть истинно фундаментальная константа.
Истории и развитию методов определения этого числа и посвящена настоящая книга. Эпопея длилась около 200 лет и на разных этапах была связана с многообразными физическими моделями и теориями, многие из которых не потеряли актуальности и по сей день. К этой истории приложили руку самые светлые научные умы — достаточно назвать А. Авогадро, Й. Лошмидта, Дж. Максвелла, Ж. Перрена, А. Эйнштейна, М. Смолуховского. Список можно было бы и продолжить…
Автор должен признаться, что идея книги принадлежит не ему, а Льву Фёдоровичу Соловейчику — его однокашнику по Московскому физико-техническому институту, человеку, который занимался прикладными исследованиями и разработками, но в душе остался физиком-романтиком. Это человек, который (один из немногих) продолжает «и в наш жестокий век» бороться за настоящее «высшее» физическое образование в России, ценит и в меру сил пропагандирует красоту и изящество физических идей. Известно, что из сюжета, который А. С. Пушкин подарил Н. В. Гоголю, возникла гениальная комедия. Конечно, здесь не тот случай, но, может быть, и эта книга покажется кому-то полезной.
Известно, что из сюжета, который А. С. Пушкин подарил Н. В. Гоголю, возникла гениальная комедия. Конечно, здесь не тот случай, но, может быть, и эта книга покажется кому-то полезной.
Эта книга — не «научно-популярный» труд, хотя и может показаться таковым с первого взгляда. В ней на некотором историческом фоне обсуждается серьёзная физика, используется серьёзная математика и обсуждаются довольно сложные научные модели. Фактически книга состоит из двух (не всегда резко разграниченных) частей, рассчитанных на разных читателей — одним она может показаться интересной с историко-химической точки зрения, а другие, возможно, сосредоточатся на физико-математической стороне проблемы. Автор же имел в виду любознательного читателя — студента физического или химического факультета, не чуждого математики и увлечённого историей науки. Есть ли такие студенты? Точного ответа на этот вопрос автор не знает, но, исходя из собственного опыта, надеется, что есть.
Информация о книгах Издательского дома «Интеллект» — на сайте www. id-intellect.ru
id-intellect.ru
Авогадро, Амедео (Доклад) — TopRef.ru
Авогадро, Амедео
Авогадро, Амедео (Avogadro, Amedeo) (1776–1856), итальянский физик и химик. Родился 9 августа 1776 в Турине в семье чиновника судебного ведомства.
Получил юридическое образование и в 1796 стал доктором права. Заинтересовался естественными науками, изучал в свободное время физику, химию и математику, занимался репетиторством. С 1806 – демонстратор в колледже при Туринской академии, с 1809 – преподаватель физики Королевского лицея в Верчелли близ Турина.
В 1820 персонально для него была создана кафедра математической физики в Туринском университете, которую он возглавлял с перерывами около 30 лет. Авогадро известен прежде всего как создатель закона, носящего теперь его имя.
В 1811 он выдвинул гипотезу, что
молекулы простых газов состоят из одного
или нескольких атомов, и на этом основании
сформулировал закон, согласно которому
равные объемы всех газов при одинаковых
температуре и давлении содержат
одинаковое число молекул.
Гипотеза Авогадро была окончательно принята химиками лишь спустя полвека. Большинство его современников не понимали различия между простыми и сложными молекулами (атомами и молекулами). Против идей Авогадро выступили многие ведущие ученые того времени, в том числе Дж.Дальтон, У.Волластон, Й.Берцелиус. Дальтон утверждал: «Никому не дано разделить атом».
Признанию гипотезы Авогадро содействовало выступление на Международном конгрессе химиков в Карлсруэ в 1860 С.Канниццаро, который ярко и убедительно изложил закон Авогадро. В.Нернст назвал закон Авогадро «рогом изобилия, дарованным нам молекулярной теорией».
Именем Авогадро названа физическая константа (число Авогадро) – число молекул в 1 моле любого вещества или число атомов в грамм-моле любого химически простого вещества.
Помимо этого, Авогадро опубликовал
более 40 статей, относящихся к другим
областям естествознания. Он раньше
Берцелиуса дал электрохимическое
толкование химическим процессам,
расположил элементы в непрерывный
электрохимический ряд, высказал новые
идеи в области термохимии. Умер Авогадро
в Турине 9 июля 1856.
Умер Авогадро
в Турине 9 июля 1856.
Список литературы
Для подготовки данной работы были использованы материалы с сайта http://www.krugosvet.ru/
Что такое число Авогадро?
Подскажем: это не 867-5309. Это номер Дженни, а не Авогадро. Вы также не найдете этих цифр нацарапанными маркером на стене общественной ванной. Однако вы обнаружите его на страницах стандартного учебника химии: это 6.0221415 × 10 23 . В письменном виде это 602 214 150 000 000 000 000 000 [источник: Fox ]. Не хватает времени? Назовите это просто кротом.
Точно так же, как дюжина — это 12 вещей, родинка — это просто количество вещей Авогадро. В химии такими «вещами» являются атомы или молекулы. Теоретически у вас может быть крот из бейсбольных мячей или что-то еще, но, учитывая, что крот из бейсбольных мячей покроет Землю на высоту в несколько сотен миль, вам будет трудно найти хорошее практическое применение для чего-либо больше, чем молекула [источник: Хилл и Колб ]. Итак, если родинка используется только для химии, как Амедео Авогадро (полное имя: Лоренцо Романо Амедео Карло Авогадро) и химия пересеклись?
Итак, если родинка используется только для химии, как Амедео Авогадро (полное имя: Лоренцо Романо Амедео Карло Авогадро) и химия пересеклись?
Авогадро родился в Италии в 1776 году и вырос в важный период развития химии. Такие химики, как Джон Далтон и Джозеф Луи Гей-Люссак, начали понимать основные свойства атомов и молекул и горячо обсуждали, как ведут себя эти бесконечно малые частицы. Закон объединения объемов Гей-Люссака особенно интересовал Авогадро. В законе говорилось, что когда два объема газов вступают в реакцию друг с другом с образованием третьего газа, соотношение между объемом реагентов и объемом продукта всегда складывается из простых целых чисел. Вот пример: два объема газообразного водорода объединяются с одним объемом газообразного кислорода, образуя два объема водяного пара (по крайней мере, при достаточно высоких температурах) без каких-либо остатков, или:
2H 2 + O 2 -> 2H 2 O
Размышляя над последствиями этого закона, Авогадро пришел к выводу, что для того, чтобы это было правдой, равные объемы любых двух газов при одинаковой температуре и давлении должны содержать равное количество частиц ( закон Авогадро ). И единственный способ объяснить, что этот закон может быть верным для любого примера, включая тот, который мы только что упомянули, — это если между атомами и молекулами существует разница и что некоторые элементы, такие как кислород, действительно существуют в виде молекул (в случае кислорода O 2а не просто O) Конечно, у Авогадро не было таких слов, как «молекула», чтобы описать его теорию, и его идеи встретили сопротивление со стороны Джона Далтона, среди прочих. Потребовался бы другой химик по имени Станислао Канниццаро, чтобы привлечь внимание к идеям Авогадро, которого они заслуживают. К тому времени, когда эти идеи получили распространение, Авогадро уже скончался.
И единственный способ объяснить, что этот закон может быть верным для любого примера, включая тот, который мы только что упомянули, — это если между атомами и молекулами существует разница и что некоторые элементы, такие как кислород, действительно существуют в виде молекул (в случае кислорода O 2а не просто O) Конечно, у Авогадро не было таких слов, как «молекула», чтобы описать его теорию, и его идеи встретили сопротивление со стороны Джона Далтона, среди прочих. Потребовался бы другой химик по имени Станислао Канниццаро, чтобы привлечь внимание к идеям Авогадро, которого они заслуживают. К тому времени, когда эти идеи получили распространение, Авогадро уже скончался.
Так где же здесь число Авогадро? Поскольку закон Авогадро оказался очень важным для развития химии, химик Жан Батист Перрен назвал это число в его честь. Читайте дальше, чтобы узнать, как химики определили число Авогадро и почему даже сегодня оно является такой важной частью химии.
Авогадро, Амедео
Амедео Авогадро
Авогадро (Avogadro) Амедео (1776-1856),
итальянский физик и химик. В 1811 выдвинул
молекулярную гипотезу строения вещества,
установил один из газовых законов,
названный его именем.
В 1811 выдвинул
молекулярную гипотезу строения вещества,
установил один из газовых законов,
названный его именем.
Авогадро Амедео
Лоренцо Романо Амедео Карло Авогадро ди Кваренья э ди Черрето родился 9 августа 1776 года в Турине — столице итальянской провинции Пьемонт в семье служащего судебного ведомства Филиппе Авогадро. Когда пришла пора выбирать профессию, Амедео также занялся юриспруденцией. В двадцать лет он получил ученую степень доктора церковного права.
Когда ему уже исполнилось 25 лет, он стал все свободное время посвящать изучению физико-математических наук.
Авогадро начал свою научную
деятельность с изучения электрических
явлений. Этот интерес особенно усилился
после того, как Вольта в 1800 году изобрел
первый источник электрического тока, а
также в связи с дискуссией между Гальвани
и Вольта о природе электричества. Работы
Авогадро, посвященные разным проблемам
электричества, появлялись вплоть до 1846
года.
Работы
Авогадро, посвященные разным проблемам
электричества, появлялись вплоть до 1846
года.
В 1803 и 1804 годах Амедео, совместно со своим братом Феличе, представил в Туринскую Академию наук две работы, посвященные теории электрических и электрохимических явлений, за что и был избран в 1804 году членом-корреспондентом этой академии. В первой работе под названием «Аналитическая заметка об электричестве» он объяснял поведение проводников и диэлектриков в электрическом поле, в частности явление поляризации диэлектриков.
В 1806 году Авогадро получает место репетитора в Туринском лицее, а затем, в 1809 году, переводится преподавателем физики и математики в лицей города Верчелли.
В 1811 году появляется статья Авогадро
«Очерк метода определения
относительных масс элементарных молекул
тел и пропорций, согласно которым они
входят в соединения». Излагая основные
представления молекулярной теории,
Авогадро показал, что она открывает
возможность точного определения атомных
масс, состава молекул и характера
происходящих химических реакций. Для
этого необходимо представить, что
молекулы водорода, кислорода, хлора и
некоторых других простых веществ состоят
не из одного, а из двух атомов.
Излагая основные
представления молекулярной теории,
Авогадро показал, что она открывает
возможность точного определения атомных
масс, состава молекул и характера
происходящих химических реакций. Для
этого необходимо представить, что
молекулы водорода, кислорода, хлора и
некоторых других простых веществ состоят
не из одного, а из двух атомов.
В 1814 году появляется вторая статья
Авогадро «Очерк об относительных
массах молекул простых тел, или
предполагаемых плотностях их газа, и о
конституции некоторых из их соединений».
Здесь четко формулируется закон Авогадро:
«…равные объемы газообразных веществ
при одинаковых давлениях и температурах
отвечают равному числу молекул, так что
плотности различных газов представляют
собою меру масс молекул соответствующих
газов». Так как масса одного моля
вещества пропорциональна массе
отдельной молекулы, то закон Авогадро
можно сформулировать как утверждение,
что моль любого вещества в газообразном
состоянии при одинаковых температурах и
давлениях занимает один и тот же объем. Как показали эксперименты, при
нормальных условиях число молекул в моле
любого вещества одинаково. Оно получило
название числа Авогадро.
Как показали эксперименты, при
нормальных условиях число молекул в моле
любого вещества одинаково. Оно получило
название числа Авогадро.
В 1821 году в статье «Новые соображения о теории определенных пропорций в соединениях и об определении масс молекул тел» Авогадро подвел итог своей почти десятилетней работе в области молекулярной теории и распространил свой метод определения состава молекул на целый ряд органических веществ.
В сентябре 1819 года Авогадро избирается членом Туринской академии наук. В 1820 году королевским указом Авогадро назначается первым профессором новой кафедры высшей физики в Туринский университет.
В 1822 году после студенческих волнений
Туринский университет был на год закрыт
властями, а ряд его новых кафедр, в том
числе и кафедра высшей физики,
ликвидирован. Тем не менее в 1823 году
Авогадро получает титул заслуженного
профессора высшей физики и назначается
старшим инспектором Палаты по контролю
за государственными расходами.
Тем не менее в 1823 году
Авогадро получает титул заслуженного
профессора высшей физики и назначается
старшим инспектором Палаты по контролю
за государственными расходами.
В 1823 году Туринский университет вновь получил кафедру высшей физики, но ее предложили не Авогадро, а известному французскому математику Огюстену Луи Коши. Спустя два года, после отъезда Коши, Авогадро смог занять эту кафедру, где и проработал до 1850 года. В 1837-1841 годах Авогадро издал четырехтомное сочинение «Физика весомых тел, или трактат об общей конституции тел». Этот труд оказался первым в истории учебником молекулярной физики.
После ухода из университета Авогадро
некоторое время занимал должность
старшего инспектора Контрольной палаты,
а также состоял членом Высшей
статистической комиссии, Высшего совета
народного образования и председателем
Комиссии мер и весов. Он умер в Турине 9
июля 1856 года и похоронен в семейном
склепе в Верчелли.
Он умер в Турине 9
июля 1856 года и похоронен в семейном
склепе в Верчелли.
Использованы материалы сайта сайта http://100top.ru/encyclopedia/
Граф Лоренцо Романо Амедео
Граф Лоренцо Романо
Амедео Карло Авогадро родился 9 августа
1776 года в Турине (Италия) в семье служащего
судебного ведомства Филиппо Авогадро.
Амедео был третьим из восьми детей. В
юношеские годы посещал школу геометрии
и экспериментальной физики. По традиции
того времени профессии и должности передавались
по наследству, поэтому Амедео занялся
юриспруденцией. В 20 лет получил степень
доктора церковного законоведения. В 25
лет начал самостоятельно изучать физико-математические
науки.
В 1803 и 1804 годах он, совместно со своим братом Феличе, представил в Туринскую академию наук две работы, посвящённые теории электрических и электромагнитных явлений, за что и был избран в 1804 году членом-корреспондентом этой академии. В первой работе под названием «Аналитическая заметка об электричестве» он объяснил поведение проводников и диэлектриков в электрическом поле, в частности явление поляризации диэлектриков. Высказанные им идеи получили затем более полное развитие в работах других ученых. В 1806 году Авогадро получает место репетитора в Туринском лицее. В 1809 переводится преподавателем физики и математики в лицей города Верчелли.
В сентябре 1819 года
Авогадро избирается членом Туринской
академии наук. В 1820 году королевским указом
Авогадро назначается первым профессором
новой кафедры высшей физики в Туринский университет. В 1822 году Туринский
университет был закрыт властями после
студенческих волнений. В 1823 году Авогадро
получает почётный титул заслуженного
профессора высшей физики и назначается
старшим инспектором в палату по контролю
за государственными расходами. Несмотря
на новые обязанности, Авогадро продолжал
заниматься научными исследованиями.
Несмотря
на новые обязанности, Авогадро продолжал
заниматься научными исследованиями.
В 1832 году Туринский университет вновь получил кафедру высшей физики, но её предложили не Авогадро, а известному французскому математику Огюстену Луи Коши, покинувшему родину в 1830 году. Только спустя два года, после отъезда Коши, Авогадро смог занять эту кафедру, где и проработал до 1850 года. В том году он ушёл из университета, передав кафедру своему ученику Феличе Кью.
После ухода из университета
Авогадро некоторое время занимал должность
старшего инспектора Контрольной палаты,
а также состоял членом Высшей статистической
комиссии, Высшего совета народного образования
и председателем Комиссии мер и весов.
Несмотря на почтенный возраст, он продолжал
публиковать свои исследования в трудах
Туринской академии наук. Последняя его
работа вышла из печати за три года до
смерти, когда Авогадро исполнилось 77
лет. Он умер в Турине 9 июля 1856 года и похоронен
в семейном склепе в Верчелли.
Научная деятельность
Свою научную деятельность Авогадро начал с изучения электрических явлений. Работы Авогадро, посвященные этой теме, появлялись вплоть до 1846 года. Большое внимание уделял он также исследованиям в области электрохимии, пытаясь найти связь между электрическими и химическими явлениями, что привело его к созданию своеобразной электрохимической теории. В этом отношении его исследования соприкасались с работами знаменитых химиков Дэви и Берцелиуса. Но в историю физики Авогадро вошел как открыватель одного из важнейших законов молекулярной физики.
В 1811 году появилась
статья Авогадро «Очерк метода определения
относительных масс элементарных молекул
тел и пропорций, согласно которым они
входят в соединения». Излагая основные
представления молекулярной теории, Авогадро
показал, что она не только не противоречит
данным, полученным Гей-Люссаком, но напротив,
прекрасно согласуется с ними и открывает
возможность точного определения атомных
масс, состава молекул и характера происходящих
химических реакций.
Во времена Авогадро
его гипотезу невозможно было доказать
теоретически. Но эта гипотеза давала
простую возможность экспериментально
устанавливать состав молекул газообразных
соединений и определять их относительную
массу. Эксперимент показывает, что объемы
водорода, кислорода и образующихся из
этих газов паров воды относятся как 2:1:2.
Выводы из этого факта можно сделать разные.
Первый: молекулы водорода и кислорода
состоят из двух атомов (Н2 и О2), а молекула
воды — из трех, и тогда верно уравнение
2Н2 + О2 = 2Н2О. Но возможен и такой вывод:
молекулы водорода одноатомны, а молекулы
кислорода и воды двухатомны, и тогда верно
уравнение 2Н + О2 = 2НО с тем же соотношением
объемов 2:1:2. В первом случае из соотношения
масс водорода и кислорода в воде (1:8) следовало,
что относительная атомная масса кислорода
равна 16, а во втором — что она равна 8. Кстати,
даже через 50 лет после работ Гей-Люссака
некоторые ученые продолжали настаивать
на том, что формула воды именно НО, а не
Н2О. Другие же считали, что правильна формула
Н2О2. Соответственно в ряде таблиц атомную
массу кислорода принимали равной 8.
Другие же считали, что правильна формула
Н2О2. Соответственно в ряде таблиц атомную
массу кислорода принимали равной 8.
Однако был простой
способ выбрать из двух предположений
одно верное. Для этого надо было лишь
проанализировать результаты и других
аналогичных экспериментов. Так, из них
следовало, что равные объемы водорода
и хлора дают удвоенный объем хлороводорода.
Этот факт сразу отвергал возможность
одноатомности водорода: реакции типа
H + Cl = HCl, H + Cl2 = HCl2 и им подобные не дают
удвоенного объема HCl. Следовательно, молекулы
водорода (а также хлора) состоят из двух
атомов. Но если молекулы водорода двухатомны,
то двухатомны и молекулы кислорода, а
в молекулах воды три атома, и ее формула —
Н2О. Удивительно, что такие простые доводы
в течение десятилетий не могли убедить
некоторых химиков в справедливости теории
Авогадро, которая в течение нескольких
десятилетий оставалась практически незамеченной.
Отчасти это объясняется отсутствием
в те времена простой и ясной записи формул
и уравнений химических реакций. Но главное —
противником теории Авогадро был знаменитый
шведский химик Йенс Якоб Берцелиус, имевший
непререкаемый авторитет среди химиков
всего мира. Согласно его теории, все атомы
имеют электрические заряды, а молекулы
образованы атомами с противоположными
зарядами, которые притягиваются друг
к другу. Считалось, что атомы кислорода
имеют сильный отрицательный заряд, а
атомы водорода — положительный. С точки
зрения этой теории невозможно было представить
молекулу кислорода, состоящую из двух
одинаково заряженных атомов! Но если
молекулы кислорода одноатомны, то в реакции
кислорода с азотом: N + O = NO соотношение
объемов должно быть 1:1:1. А это противоречило
эксперименту: 1 л азота и 1 л кислорода
давали 2 л NO. На этом основании Берцелиус
и большинство других химиков отвергли
гипотезу Авогадро как не соответствующую
экспериментальным данным!
Но главное —
противником теории Авогадро был знаменитый
шведский химик Йенс Якоб Берцелиус, имевший
непререкаемый авторитет среди химиков
всего мира. Согласно его теории, все атомы
имеют электрические заряды, а молекулы
образованы атомами с противоположными
зарядами, которые притягиваются друг
к другу. Считалось, что атомы кислорода
имеют сильный отрицательный заряд, а
атомы водорода — положительный. С точки
зрения этой теории невозможно было представить
молекулу кислорода, состоящую из двух
одинаково заряженных атомов! Но если
молекулы кислорода одноатомны, то в реакции
кислорода с азотом: N + O = NO соотношение
объемов должно быть 1:1:1. А это противоречило
эксперименту: 1 л азота и 1 л кислорода
давали 2 л NO. На этом основании Берцелиус
и большинство других химиков отвергли
гипотезу Авогадро как не соответствующую
экспериментальным данным!
В 1821 году в статье
«Новые соображения о теории определенных
пропорций в соединениях и об определении
масс молекул тел» Авогадро подвел итог
своей почти десятилетней работы в области
молекулярной теории и распространил
свой метод определения состава молекул
на целый ряд органических веществ. В этой
же статье он показал, что другие химики,
прежде всего Дальтон, Дэви и Берцелиус,
не знакомые с его работами, продолжают
придерживаться неверных взглядов на
природу многих химических соединений
и характер происходящих между ними реакций.
В этой
же статье он показал, что другие химики,
прежде всего Дальтон, Дэви и Берцелиус,
не знакомые с его работами, продолжают
придерживаться неверных взглядов на
природу многих химических соединений
и характер происходящих между ними реакций.
Эта работа интересна
еще в одном отношении: в ней впервые встречается
имя Ампера, по выражению Авогадро, «одного
из самых искусных физиков наших дней»,
в связи с его исследованиями в области
молекулярной теории. Эту сторону деятельности
Ампера обычно не упоминают, поскольку
его заслуги в области электродинамики
затмевают все остальные работы. Тем не
менее, Ампер работал и в области молекулярной
физики и независимо от Авогадро (но несколько
позже) пришел к некоторым из идей, высказанных
Авогадро. В 1814 году Ампер опубликовал
письмо к химику Бертолле, в котором сформулировал
положение, по существу совпадающее с
законом Авогадро. Здесь же он указывал,
что соответствующая работа Авогадро
стала ему известна уже после написания
письма к Бертолле.
Конспект урока по химии «Количество вещества. Моль. Число Авогадро. Молярная масса»
Тема: Количество вещества. Моль. Число Авогадро. Молярная масса.
Цели: — повторить знания учащихся об атомах и молекулах,
об атомно – молекулярном учении, опираясь на знания учащихся,
полученных в курсе физики и химии; закрепить ранее изученный
материал по теме «Количество вещества. Молярная масса»;
— развивать умения решать задачи на определение молярной массы,
количества вещества;
— воспитывать интерес к предмету, активность, внимательность.
Оборудование: учебник, карточки с разноуровневыми заданиями, тесты на повторение, портрет А.Авогадро, оценочный лист.
Ход урока:
Психологический настрой.
Учащиеся встают в круг.
-У кого сегодня хорошее настроение, помашите правой рукой.
-кто считает, что готов к сегодняшнему уроку на все 100, хлопните в ладоши.
— Если уверены в своих силах, топните ногой.
— Давайте прогоним волнение и приступим к уроку.
Историческая справка.
Амедео Авогадро (1776—1856) — итальянский физик и химик, член Туринской АН (1819). Родился 9 августа 1776, в Турине. Скончался 9 июля 1856, там же.
Получил юридическое образование в Туринском университете (1792). В 1800 начал самостоятельно изучать физику и математику. С 1806 Амедео Авогадро работал демонстратором в колледже при Туринской академии. С 1809 — профессор в колледже Верчелли, в 1820-1822 и 1834-1850 заведовал кафедрой математической физики в Туринском университете. Основные работы Амедео Авогадро посвящены молекулярной физике. В 1811 он выдвинул молекулярную гипотезу строения вещества, установил один из газовых законов, названный его именем. Согласно этому закону в одинаковых объемах газов при одинаковых значениях температуры и давления содержится одинаковое количество молекул. Исходя из этого, ученый разработал метод определения молекулярного и атомного весов.
Исходя из этого, ученый разработал метод определения молекулярного и атомного весов.
Именем Авогадро названа универсальная постоянная — число молекул в одном моле идеального газа (число Авогадро). Амедео установил количественный атомный состав молекул некоторых веществ, для которых он ранее был определен неправильно (вода, водород, кислород, азот, оксиды азота, хлора и др.). Первым обратил внимание на аналогию в свойствах азота, фосфора. мышьяка и сурьмы. Эти химические элементы впоследствии составили главную подгруппу пятой группы периодической системы.
В 20-40-х г.г. 19 века А. Авогадро занимался электрохимией, изучал тепловое расширение тел. Полное имя Лоренцо Романо Амедео Карло Авогадро ди Кваренья э ди Черрето. В 1808 году французский ученый Гей-Люсак, изучая реакции между газами, установил, что объемы вступающих в реакцию газов и газообразных продуктов реакции относятся как небольшие целые числ. А в 1811 году появляется статья Авогадро «Очерк метода определения относительных масс элементарных молекул тел и пропорций, согласно которым они входят в соединения».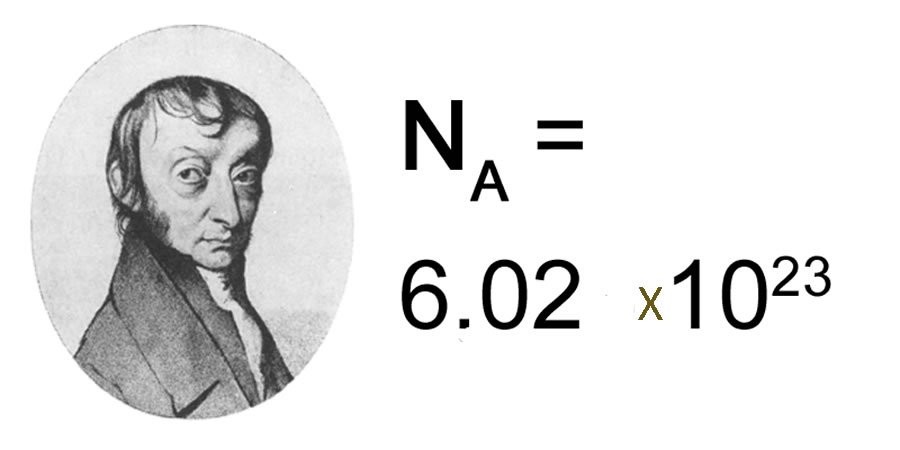 Излагая основные представления молекулярной теории, Авогадро показал, что она не только не противоречит данным, полученным Гей-Люссаком, но, напротив, прекрасно согласуется с ними и открывает возможность точного определения атомных масс, состава молекул и характера происходящих химических реакций Для этого прежде всего, необходимо представить, что молекулы водорода, кислорода, хлора и некоторых других простых веществ состоят не из одного, а из двух атомов.
Излагая основные представления молекулярной теории, Авогадро показал, что она не только не противоречит данным, полученным Гей-Люссаком, но, напротив, прекрасно согласуется с ними и открывает возможность точного определения атомных масс, состава молекул и характера происходящих химических реакций Для этого прежде всего, необходимо представить, что молекулы водорода, кислорода, хлора и некоторых других простых веществ состоят не из одного, а из двух атомов.
В этой же работе Амедео Авогадро пришел к следующему важному заключению: «… число… молекул всегда одно и то же в одинаковых объемах любых газов».
Проверка домашнего задания. Тестовые задания 2-х вариантов.
Вариант №1
1. Может ли капля растительного масла беспредельно растекаться по поверхности воды?
а. Может. Ей ничто не препятствует.
б. Нет. Будет растекаться до тех пор, пока толщина слоя не окажется равной размерам
наименьшей частицы масла.
2. Мельчайшие частицы, из которых состоят различные вещества, называются…
а. Атомами.
б. Молекулами.
3. Составные части мельчайших частиц называются…
а. Атомами.
б. Молекулами.
4. В каких веществах / твёрдых, жидких, газообразных/ происходит диффузия
а. Диффузия происходит только в газах.
б. Диффузия происходит только в жидкостях.
в. Диффузия происходит только в твёрдых телах.
5. Для того, чтобы свежие огурцы быстрее засолились, их заливают горячим рассолом. Почему засолка огурцов в горячем рассоле протекает быстрее?
а. Быстро растворяет соль.
б. Расстояние между молекулами клетчатки огурцов становится больше, и сам процесс увеличивается, и диффузия протекает быстрее.
Вариант №2
1. Все молекулы одного и того же вещества…
а. Не отличаются друг от друга.
б. Отличаются друг от друга.
2. Молекулы различных веществ…
а. Не отличаются друг от друга.
б. Отличаются друг от друга.
3. Что такое диффузия?
а. Явление проникновения молекул одного вещества между молекулами другого.
б. Явление, при котором вещества смешиваются друг с другом.
в. Явление, при котором вещества сами по себе смешиваются друг с другом.
4. Зависит ли диффузия от температуры?
а. Чем выше температура, тем диффузия протекает быстрее.
б. Чем выше температура, тем диффузия протекает медленнее.
в. Диффузия не зависит от температуры.
5. С одинаковой ли скоростью движутся молекулы в горячей и холодной воде?
а. С одинаковой.
б. В горячей воде скорость меньше, чем в холодной.
в. В горячей воде скорость больше, чем в холодной.
Взаимопроверка. (ответы на доске)
Оценки выставляются в оценочный лист
Повторение по теме «Атомно-молекулярного учения». Задания на доске. (вместо пропущенных слов вставить слова «атом» или «молекула».

Разминка. (Разгадывание ребусов на тему «Химический элемент»)
Решение задач.
Найти молярную массу веществ:
Задания на «5»:
1)N2 2) H2S 3) H2O 4) P4 5) Na2O 6) H2SO4
Задания на «4»:
N2 2) H2S 3) H2O 4) P4 5) Na2O
Задания на «3»:
N2 2) H2O 3) P4
Взаимопроверка заданий (ответы на доске). Оценки выставляются в оценочный лист.
Чему равна масса данных веществ в моль?
Задания на «5»:
8 г FeS
12 г NaCl
27 г KNO3
22 г MgCl2
Задания на «4»:
8 г FeS
12 г NaCl
27 г KNO3
Задания на «3»:
8 г FeS
12 г NaCl
Взаимопроверка заданий (ответы на доске). Оценки выставляются в оценочный лист.
Оценки выставляются в оценочный лист.
Какова масса данных веществ в граммах?
Задания на «5»:
0,5 моль Br2
0,6 моль Cl2
1,5 моль BaSO4
1,7 моль CaCl2
1,3 моль MgCO3
Задания на «4»:
0,4 моль BaSO4
0,6 моль CaCl2
1,5 моль Br2
1,7 моль Cl2
Задания на «3»:
0,4 моль Br2
0,6 моль Cl2
Самопроверка (ответы на доске). Оценки выставляются в оценочный лист.
Подведение итога урока.
— Кто такой Амадео Авогадро?
— как называется величина, показывающая число частиц в молекуле вещества?
— в каких единицах измеряется молярная масса?
— единицы измерения количества вещества?
— алгоритм нахождения молярной массы?
Выведение итоговых оценок за урок в оценочном листе.

Оценочный лист
Ф.И. | Проверка дом. задания | Фронтальный опрос | Закрепление | Итог | ||||||
Тест | Повторение | Задание №1 | Задание №2 | Задание №3 | ||||||
Волошенко Анатолий | ||||||||||
Гузовская Катажина | ||||||||||
Кантарбаева Улпан | ||||||||||
Ким Руслан | ||||||||||
Колюжная Виктория | ||||||||||
Колерт Денис | ||||||||||
Палыга Олег | ||||||||||
Петроченко Денис | ||||||||||
Самоанализ
открытого урока по химии в 8 классе
Тема: «Количество вещества. Моль. Число Авогадро. Молярная масса»
Моль. Число Авогадро. Молярная масса»
Цели: — повторить знания учащихся об атомах и молекулах,
об атомно – молекулярном учении, опираясь на знания учащихся,
полученных в курсе физики и химии; закрепить ранее изученный
материал по теме «Количество вещества. Молярная масса»;
— развивать умения решать задачи на определение молярной массы,
количества вещества;
— воспитывать интерес к предмету, активность, внимательность.
Оборудование: учебник, карточки с разноуровневыми заданиями, тесты на повторение, портрет А.Авогадро, оценочный лист.
Тип урока: Закрепление.
Формы работы: Фронтальная, коллективная, индивидуальная.
Методы: Словесный, наглядный, практический.
Этапы урока:
Психологический настрой был представлен в виде «Круга настроения», в котором учащиеся определили свою подготовленность к уроку.
Историческая справка, в которой была дана информация о жизни и деятельности Амадео Авогадро.

Проверка домашнего задания. Тестовая проверка знаний по теме «Атомно-молекулярное учение», со взаимопроверкой. Задания на повторение, в котором учащимся необходимо было вместо пропущенных слов вставить слова «атом» или «молекула» и фронтального опроса по теме «Количество вещества. Моль. Число Авогадро»
Разгадывание ребусов на тему «Химический элемент»
Закрепление.этот этап заключался в решении разноуровневых заданий. Были предложены задания на «3», «4» и «5»
Самопроверка и взаимопроверка. Ответы на все задания были на доске. Оценки заносились в оценочный лист.
Подведение итога урока.
Выведение итоговых оценок по оценочному листу.
Этот месяц в истории физики
Февраль 1811 года: Амадео Авогадро перечислил молекулярный мир
Ричард Уильямс
Фото: wikipedia commons
Амадео Авогадро объяснил экспериментальные данные о химических реакциях, предположив, что равные объемы газа содержат равное количество молекул при одинаковых условиях температуры и давления.
Амадео Авогадро (1776-1856) жил во времена перемен и неопределенности в физике и управлении своим сообществом.В физике сама природа элементов обсуждалась ведущими учеными: был ли кислород атомом или двухатомной молекулой? В управлении Турином и регионом Пьемонт, где он жил, последовательно правили герцоги Савойские, король Сардинии и Наполеон Бонапарт, и им угрожала армия Австро-Венгерской империи.
Наконец Турин был возвращен дому Савойи, и все это еще при жизни Авогадро, пока он жил в том же доме. Он решил молекулярный вопрос в физике и, в ущерб своей карьере, поддержал политическое дело после принятия наполеоновского законодательства.Его открытие фундаментального числового свойства газов лежит в основе нашего понимания молекулярного мира. Его политическая деятельность стоила ему звания профессора в Туринском университете, но вскоре после этого он был восстановлен в должности в следующем политическом цикле.
Его полное имя было Лоренцо Романо Амедео Карло Авогадро, из семьи с большим стажем работы в юридической профессии. Их название происходит от avvocato , что в переводе с итальянского означает «адвокат». Несколько лет он занимался семейной профессией, затем, как самоучка, начал заниматься физикой.Он стал профессором физики в Академии Верчелли, а затем в Туринском университете.
Их название происходит от avvocato , что в переводе с итальянского означает «адвокат». Несколько лет он занимался семейной профессией, затем, как самоучка, начал заниматься физикой.Он стал профессором физики в Академии Верчелли, а затем в Туринском университете.
Большая часть физики в то время была сосредоточена на природе газов. Французский физик Жозеф Луи Гей-Люссак заметил, что в реакциях газов относительные объемы реагентов и продуктов оказываются в отношении небольших целых чисел. Оттуда пошел Авогадро [1].
Он пришел к выводу, что единственный способ объяснить наблюдение Гей-Люссака состоит в том, что при одинаковых условиях температуры и давления для всех идеальных газов любой заданный объем должен содержать одинаковое число молекул.Число Авогадро, N A , представляет собой число молекул в объеме, занимаемом граммом молекулярной массы идеального газа. Величина N A была определена во многих более поздних экспериментах, приближаясь к принятому сейчас значению: N A = 6,023 x 10 23 частиц на моль. Концепция равенства чисел в единице объема теперь известна как закон Авогадро.
Концепция равенства чисел в единице объема теперь известна как закон Авогадро.
Другим важным вопросом того времени был вопрос о том, являются ли элементарные газы, водород и кислород, атомами или двухатомными молекулами.Авогадро аккуратно решил и этот вопрос. Он заметил, что если бы газы были атомами, реакция:
2Н + О → Н 2 О
даст объем газа H 2 O, равный объему кислорода. С другой стороны, если бы водород и кислород были двухатомными молекулами,
2H 2 + O 2 → 2 H 2 O
даст объем H 2 O в два раза больше кислорода. Эксперименты ясно подтвердили правильность последнего уравнения.Это решило вопрос раз и навсегда. Авогадро первым понял, что водород и кислород представляют собой двухатомные молекулы. Чтобы оценить предвидение достижения Авогадро, обратите внимание, что, как ни странно, столетие спустя некоторые влиятельные ученые в физическом сообществе все еще сомневались в самом существовании отдельных молекул. Иллюстрируя это сохраняющееся различие во взглядах, ссылка [2] на Нобелевскую премию Жана Батиста Перрена по физике 1926 года гласила: «за его работу о прерывистой структуре материи, и особенно за его открытие седиментационного равновесия.В то время, ссылаясь на работу Перрина, один ученый заметил: «Это положило конец долгой борьбе относительно физической реальности молекул».
Иллюстрируя это сохраняющееся различие во взглядах, ссылка [2] на Нобелевскую премию Жана Батиста Перрена по физике 1926 года гласила: «за его работу о прерывистой структуре материи, и особенно за его открытие седиментационного равновесия.В то время, ссылаясь на работу Перрина, один ученый заметил: «Это положило конец долгой борьбе относительно физической реальности молекул».
Когда он впервые опубликовал свою работу, научное сообщество мало обратило внимание на открытие Авогадро. Отчасти это произошло потому, что он не пытался посетить ученых во Франции и Германии, чтобы объяснить свои идеи. Кроме того, были очевидные исключения из закона, согласно которому все идеальные газы содержат одинаковое количество молекул в единице объема. Например [3], твердый NH 4 Cl при испарении диссоциирует с образованием молекул NH 3 и HCl:
.NH 4 Cl → NH 3 + HCl
Таким образом, для данного количества NH 4 Cl пар содержит больше молекул, чем если бы NH 4 Cl испарялся без изменений. Эта и некоторые подобные системы, по-видимому, лишали законной силы закон Авогадро. Когда о диссоциации стало известно и понято, это уже не так. В конце концов, в 1860 году итальянский химик Станислао Канниццаро защитил работу Авогадро перед ведущими европейскими учеными на Международном химическом конгрессе в Карлсруэ, и закон Авогадро был наконец признан. К сожалению, Авогадро умер несколькими годами ранее.
Эта и некоторые подобные системы, по-видимому, лишали законной силы закон Авогадро. Когда о диссоциации стало известно и понято, это уже не так. В конце концов, в 1860 году итальянский химик Станислао Канниццаро защитил работу Авогадро перед ведущими европейскими учеными на Международном химическом конгрессе в Карлсруэ, и закон Авогадро был наконец признан. К сожалению, Авогадро умер несколькими годами ранее.
Сегодня, спустя 200 лет после того, как он его предложил, закон Авогадро обретает новую жизнь в физике.В статье « Более фундаментальная международная система единиц » [4] Дэвид Ньюэлл объясняет, как система единиц теперь будет полностью основана на физических константах. Физические объекты, такие как давно используемый стандартный метр с двумя отметками на платиновом слитке и стандартный килограмм, платиновая гиря, хранившиеся в контролируемых условиях в Париже, долгое время были среди эталонов физических единиц. В настоящее время единицы определяются семью физическими константами, одной из которых является число Авогадро. Остальные: скорость света в вакууме, постоянная Планка, постоянная Больцмана, заряд электрона, частота сверхтонкого расщепления цезия-133 и единица силы света. Таким образом, идея Авогадро, едва признанная при его жизни, живет века спустя как один из столпов современной науки.
Остальные: скорость света в вакууме, постоянная Планка, постоянная Больцмана, заряд электрона, частота сверхтонкого расщепления цезия-133 и единица силы света. Таким образом, идея Авогадро, едва признанная при его жизни, живет века спустя как один из столпов современной науки.
Каталожные номера
А. Авогадро, Journal de Physique , 73 , 58-76 [1811]. (Перевод на английский язык можно найти, выполнив поиск по «Alembic Club Reprint No.4″)
Жан Батист Перрен, Нобелевская лекция по физике: 1926 г.
Сванте Аррениус, Нобелевская лекция по химии: 1903.
Д. Б. Ньюэлл, Physics Today , 35–41 июля [2014].
авогадро
авогадро ДР. ДЖЕРАЛЬД А. РОЗЕНТАЛЬНОМЕР АВОГАДРО
Принцип, сформулированный в 1811 году итальянским химиком Амадео Авогадро (1776-1856), что равных объемов газов при
одинаковые температура и давление содержат одинаковое количество молекул независимо от
их химической природы и физических свойств . Это число
(число Авогадро) равно 6,023 X 10 23 . это количество молекул
любого газа, присутствующего в объеме 22,41 л, и то же самое для самого легкого
газ (водород) как тяжелый газ, такой как двуокись углерода или бром.
Это число
(число Авогадро) равно 6,023 X 10 23 . это количество молекул
любого газа, присутствующего в объеме 22,41 л, и то же самое для самого легкого
газ (водород) как тяжелый газ, такой как двуокись углерода или бром.
Номер Авогадро
является одной из фундаментальных констант химии. Он позволяет сравнивать
различные атомы или молекулы данных веществ, где одно и то же число
сравниваются атомы или молекулы.
Это также позволяет
определение того, насколько тяжелее простая молекула одного газа, чем
что другого, в результате относительные молекулярные массы газов могут
можно определить, сравнивая массы равных объемов.
Авогадро — его вклад в химию
Чтобы понять
вклад, который внес Авогадро, мы должны рассмотреть некоторые идеи
разрабатывается
В настоящее время. Химия только начинала становиться точной наукой.
Закон
Определенные пропорции
и Закон множественных пропорций были хорошо приняты к 1808 г.
когда Джон
Дальтон опубликовал свою «Новую систему химической философии».
Далтон предложил, чтобы
атомы каждого элемента имели характерный атомный вес, и что
это было
атомов, которые были
объединяющие звенья в химических реакциях. У Дальтона не было метода измерения
атомных весов однозначно,
поэтому сделал неверное предположение, что в самых распространенных
соединение между
два элемента, по одному атому каждого.
Примерно в это же время
Гей-Люссак изучал химические реакции газов и обнаружил, что
в
соотношения объемов
реагирующих газов представляли собой небольшие целые числа.Это обеспечило более
логический
способ присвоения
атомные веса. Гей-Люссак не довел до конца все последствия
его
работа. Тем не менее, Далтон
понял, что простое интегральное соотношение между объемами реагирующих газов
подразумевал в равной степени
простая связь между реагирующими частицами. Дальтон все еще приравнивал частицы
с участием
атомов, и может
не согласиться с тем, как одна частица кислорода может дать две частицы воды. Это было
Это было
прямая угроза
к относительно новой атомной теории, и поэтому Дальтон пытался дискредитировать
работа
Гей-Люссак.
В 1811 году Авогадро
опубликовал статью в Journal de physique, в которой четко проводилось различие
между молекулой
и атом. Он указал, что Дальтон перепутал понятия атомов
и молекулы. То
«атомы» азота и кислорода на самом деле являются «молекулами», содержащими два
атомы
штук. Таким образом, две молекулы
водорода может соединиться с одной молекулой кислорода с образованием двух
молекул воды.
Авогадро предложил что равные объемы всех газов при одинаковых температуре и давлении содержат то же количество молекул, которое теперь известно как принцип Авогадро.
Работа Авогадро
почти полностью игнорировался, пока не был насильно представлен
Станислао Каннизарро
на конференции в Карлсруэ в 1860 году. Он показал, что принцип Авогадро
можно использовать для
определяют не только молярные массы, но и, косвенно, атомные массы. То
причина
То
причина
для более раннего
пренебрежение работой Авогадро было, вероятно, глубоко укоренившимся убеждением, что
химический
Произошла комбинация
в силу сродства разнородных элементов.После электрики
открытия
Гальвани и Вольта,
это сродство обычно приписывалось притяжению между разноименными зарядами.
Идея, что два
одинаковые атомы водорода могут объединяться в соединение молекулярный водород
было отвратительно
Химическая философия начала XIX века.
Авогадро — его номер
Это было давно
Авогадро, что была введена идея крота.Поскольку молекулярная масса
в
грамм (моль)
любое вещество содержит одинаковое число молекул, то согласно
Принцип Авогадро,
молярные объемы всех газов должны быть одинаковыми. Количество молекул
в одной родинке теперь
позвонил по номеру Авогадро. Необходимо подчеркнуть, что Авогадро, безусловно,
не знал
родинок или числа, которое должно было носить его имя. Таким образом, число было
никогда
Таким образом, число было
никогда
фактически определено
самим Авогадро.
Как мы все знаем сегодня,
Число Авогадро очень велико, принятое в настоящее время значение равно
6.0221367 x 10 23 .
Размер такого числа чрезвычайно трудно понять. Есть
многие
впечатляющих иллюстраций
чтобы помочь визуализировать огромный размер этого числа. Например:
Ан Количество стандартных банок с безалкогольными напитками, предлагаемое Авогадро, покрыло бы поверхность землю на глубину более 200 миль.
Если у вас было столько нелопнутых зерен попкорна, как у Авогадро, и вы разложили их через Соединенные Штаты Америки, страна была бы покрыта попкорном на глубину более 9 миль.
Если
мы могли считать атомы со скоростью 10 миллионов в секунду, это было бы
потребуется около 2 миллиардов лет, чтобы сосчитать количество атомов в одном моле.
Определение номера
Каннизарро, около
1860 г. , использовал идеи Авогадро для получения набора атомных весов, основанного на
, использовал идеи Авогадро для получения набора атомных весов, основанного на
кислород, имеющий
атомный вес 16.В 1865 году Лошмидт использовал комбинацию плотности жидкости,
вязкость газа,
и кинетическая теория газов, чтобы примерно установить размер молекул,
и
отсюда номер
молекул в 1 см3 газа.
Во время последнего
части девятнадцатого века можно было получить разумные оценки
за
Номер Авогадро
из измерений седиментации коллоидных частиц. В двадцатый
век, затем Малликенс
Эксперимент с каплей масла дал гораздо лучшие значения и использовался в течение многих лет.
Более современный метод
заключается в вычислении числа Авогадро по плотности кристалла,
относительный атомный
масса и длина элементарной ячейки, определенные рентгеновскими методами. Быть полезным
для этого
цель, кристалл
должны быть без дефектов. Очень точные значения этих величин для кремния
имеют
было измерено при
Национальный институт стандартов и технологий (NIST).
Чтобы использовать этот подход,
необходимо иметь точные значения атомных весов, часто получаемые
от
измерение массы
атомарных ионов.Например, ионная ловушка, использующая исключительно однородную и
стабильный магнитный
и электрические поля должны позволять проводить такие измерения с большей точностью.
чем 1 часть
в 1010. Родственник
атомная масса кремния особенно важна, так как кристаллы кремния
используются в
рентгенологические методы
упомянутый выше.
В продолжение
этого подхода, один из грантов NIST Precision Measurement Grants 1999 г.
был
вручен Дэвиду
Притчард, профессор физики Массачусетского технологического института.Он будет
проводящий циклотрон
измерения частоты на ионах, которые могут достичь 100-кратного улучшения
в
точность
измерения атомной массы. Массачусетский технологический институт разработал самую точную в мире массу
Спектрометр
, способный
измерения атомной массы атомов с точностью до одной части на 10 миллиардов.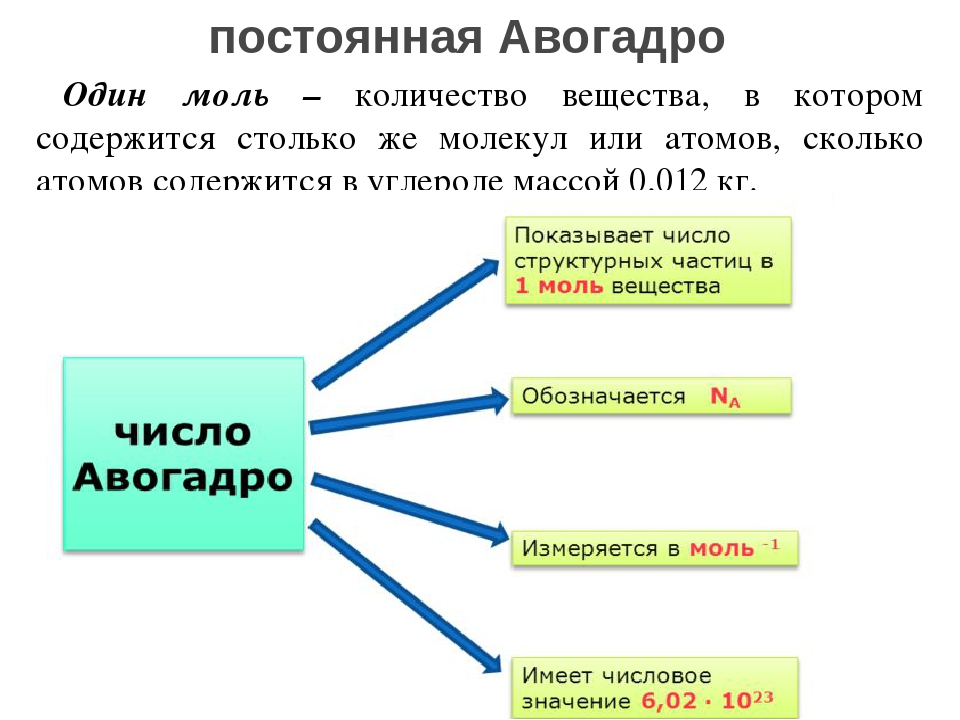 Притчард
Притчард
предлагает одновременно
измерить циклотронные частоты двух разных ионов, чтобы
улучшить значения
нескольких фундаментальных констант, включая число Авогадро.
В настоящее время,
информация о числе Авогадро из множества различных экспериментов объединена
с другими наблюдениями
на другие физические константы. Наиболее вероятный и самосогласованный набор
физических констант
который лучше всего соответствует всем надежным данным, затем находится статистическими методами.
Размер Авогадро
число определяется нашим определением моля. Что оно делает
продемонстрировать, как
маленький атом или молекула сравнивается с количеством материала, которым мы являемся.
знаком с в
повседневной жизни, поскольку определение крота включает в себя количество материала
мы
совершенно знакомый
с участием.
Если вы ученый
о жизни и творчестве Авогадро, и иметь информацию, которая может быть полезной
включены в это
страницу, то почему бы не отправить мне подробности по электронной почте. Вклады будут признаны.
Вклады будут признаны.
Особая благодарность Крис Джонсон за его проницательную презентацию.
| Полное имя Авогадро, родившегося в знатной семье Турина, было Лоренцо Романо Амедео Карло Авогадро ди Куаренья и ди Черрето, и он был графом Куаренья и Черрето. |
| Его ранняя карьера была связана с церковным правом, хотя он много изучал математику и физику. |
| Одной из первых его научных публикаций была статья «Опыт определения относительных масс элементарных молекул тел и пропорций, в которых они входят в эти соединения». |
| Работая профессором физики в Туринском университете, Авогадро поддерживал революцию и поэтому был уволен под предлогом того, что ему было предоставлено больше времени для работы над своими исследованиями. |
Он был восстановлен в должности, и король издал указ об установлении конституции; Авогадро продолжал преподавать физику в университете еще двадцать лет. |
| Авогадро на протяжении всей своей жизни занимал множество интересных должностей, и ему приписывают введение метрической системы в своем регионе. |
| Некоторые из этих важных должностей включали работу в области статистики, мер и весов и метеорологии, хотя его работа по установлению образовательных стандартов для государственных школ, возможно, была наиболее важной для страны в целом. |
| После публикации работы другого физика о массе и объеме газов в сочетании Авогадро впервые предположил, что между атомами и молекулами существует разница. |
| Это первое различение было одним из самых важных понятий во всей физике, и Авогадро был первым, кто предположил, что газы состоят из молекул, а молекулы состоят из атомов. |
Оттуда Авогадро установил закон Авогадро, который гласит, что равные объемы различных газов при объединении будут иметь установленное соотношение в их массах и что это соотношение также будет коррелировать с их молекулярными массами. |
| Однако в то время слова «атом» и «молекула» считались одним и тем же, поэтому именно Авогадро определил, что существуют разные виды молекул. |
| Благодаря его работе ученые быстро поняли, что масса и вес — это тоже не одно и то же. |
| К сожалению, работа Авогадро не получила одобрения в научном сообществе; всего через четыре года после его смерти исследования других ученых начали подтверждать правильность его теорий. |
| Эти более поздние эксперименты также подтвердили то, что продемонстрировал закон Авогадро: он был не только точным для определения молекулярного веса газа, но и его атомного веса. |
Что такое число Авогадро? | HowStuffWorks
Подскажем: это не 867-5309. Это номер Дженни, а не Авогадро. Вы также не найдете эти цифры, нацарапанные маркером на стене общественного туалета. Однако вы обнаружите это на страницах стандартного учебника по химии: It’s 6. 0221415 × 10 23 . Выписано, это 602 214 150 000 000 000 000 000 [источник: Fox]. Короткий срок? Просто назовите это кротом.
0221415 × 10 23 . Выписано, это 602 214 150 000 000 000 000 000 [источник: Fox]. Короткий срок? Просто назовите это кротом.
Точно так же, как дюжина — это 12 вещей, родинка — это просто число вещей Авогадро. В химии такими «вещами» являются атомы или молекулы. Теоретически у вас может быть крот из бейсбольных мячей или что-то еще, но, учитывая, что крот из бейсбольных мячей покроет Землю на высоту в несколько сотен миль, вам будет трудно найти хорошее практическое применение для крота чего-либо. больше, чем молекула [источник: Хилл и Колб].Итак, если родинка используется только для химии, как Амедео Авогадро (полное имя: Лоренцо Романо Амедео Карло Авогадро) и химия пересеклись?
Авогадро родился в Италии в 1776 году и вырос в важный период развития химии. Такие химики, как Джон Дальтон и Жозеф Луи Гей-Люссак, начали понимать основные свойства атомов и молекул и горячо спорили о том, как ведут себя эти бесконечно малые частицы. Особенно интересовал Авогадро закон Гей-Люссака о соединении томов . Закон гласил, что когда два объема газов реагируют друг с другом с образованием третьего газа, отношение между объемом реагентов и объемом продукта всегда состоит из простых целых чисел. Вот пример: два объема газообразного водорода объединяются с одним объемом газообразного кислорода, образуя два объема водяного пара (по крайней мере, при достаточно высоких температурах) без остатка, или:
Закон гласил, что когда два объема газов реагируют друг с другом с образованием третьего газа, отношение между объемом реагентов и объемом продукта всегда состоит из простых целых чисел. Вот пример: два объема газообразного водорода объединяются с одним объемом газообразного кислорода, образуя два объема водяного пара (по крайней мере, при достаточно высоких температурах) без остатка, или:
2H 2 + O 2 —> 2H 2 O
Обдумывая следствия этого закона, Авогадро пришел к выводу, что для того, чтобы это было правдой, равные объемы любых двух газов при одинаковых температуре и давлении должны содержать равное количество частиц ( Закон Авогадро ).И единственный способ объяснить, что этот закон может быть верен для любого примера, включая тот, который мы только что упомянули, — это если бы существовала разница между атомами и молекулами и что некоторые элементы, такие как кислород, действительно существуют в виде молекул (в случае кислорода O 2 , а не просто O) Конечно, у Авогадро не было таких слов, как «молекула», для описания его теории, и его идеи встретили сопротивление, среди прочих, Джона Дальтона. Потребовался еще один химик по имени Станислао Канниццаро, чтобы привлечь к идеям Авогадро то внимание, которого они заслуживали.К тому времени, когда эти идеи получили распространение, Авогадро уже скончался.
Потребовался еще один химик по имени Станислао Канниццаро, чтобы привлечь к идеям Авогадро то внимание, которого они заслуживали.К тому времени, когда эти идеи получили распространение, Авогадро уже скончался.
Так какое место в этом занимает число Авогадро? Поскольку закон Авогадро оказался столь важным для развития химии, химик Жан Батист Перрен назвал это число в его честь. Читайте дальше, чтобы узнать, как химики определили число Авогадро и почему даже сегодня оно является такой важной частью химии.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно. Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie.
 Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie. - Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
- Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie
потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Предоставить доступ без файлов cookie
потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
Avogadro: расширенный семантический химический редактор, платформа визуализации и анализа | Journal of Cheminformatics
Графический пользовательский интерфейс
Первое, что увидит большинство людей, — это главное окно приложения Avogadro, как показано на рисунке 4. Двоичные установщики предоставляются для Apple Mac OS X и Microsoft Windows, а также пакеты для всех основных дистрибутивов Linux. Это означает, что Avogadro можно легко установить в большинстве операционных систем. На основном веб-сайте Avogadro [60, 61] также можно найти простые инструкции по компиляции последнего исходного кода для более предприимчивых или тех, кто использует операционную систему, которая еще не поддерживается.
Двоичные установщики предоставляются для Apple Mac OS X и Microsoft Windows, а также пакеты для всех основных дистрибутивов Linux. Это означает, что Avogadro можно легко установить в большинстве операционных систем. На основном веб-сайте Avogadro [60, 61] также можно найти простые инструкции по компиляции последнего исходного кода для более предприимчивых или тех, кто использует операционную систему, которая еще не поддерживается.
Графический пользовательский интерфейс Avogadro. Снято в Mac OS X, показывает интерфейс редактирования молекулы.
Инструментарий Qt позволяет Avogadro работать с тремя основными поддерживаемыми операционными системами — Linux, Apple Mac OS X и Microsoft Windows. Были реализованы основные функции, ожидаемые от молекулярного конструктора и средства просмотра, а также несколько менее распространенных функций. Новым пользователям очень легко установить Avogado и построить свои первые молекулы за считанные минуты. Благодаря библиотеке Open Babel [51] Avogadro поддерживает большую часть широко используемых форматов химических файлов.Подавляющее большинство этой функциональности было написано с использованием интерфейса, доступного для авторов плагинов, и загружается во время выполнения. Мы обсудим эти интерфейсы плагинов и описания типов плагинов позже.
Благодаря библиотеке Open Babel [51] Avogadro поддерживает большую часть широко используемых форматов химических файлов.Подавляющее большинство этой функциональности было написано с использованием интерфейса, доступного для авторов плагинов, и загружается во время выполнения. Мы обсудим эти интерфейсы плагинов и описания типов плагинов позже.
Семантическая химия
Avogadro с самого начала использовала CML [19, 20] в качестве формата файла по умолчанию; этот формат был выбран среди других форматов файлов из-за расширяемой семантической структуры, обеспечиваемой CML, и поддержки, доступной в Open Babel [51]. Формат CML предлагает ряд преимуществ по сравнению с другими широко используемыми форматами, включая возможность расширения формата.Это позволяет Avogadro и другим программам быть ориентированными на будущее, добавляя новую информацию и функции, необходимые для расширенного семантически осведомленного редактора, в более позднее время, оставаясь при этом читаемым в более старых версиях Avogadro.
Благодаря использованию Open Babel [51] можно интерпретировать большое количество форматов файлов. При расширении Avogadro для считывания больших объемов выходных данных из квантовых кодов необходимо было выделить значительные ресурсы разработки на понимание и добавление семантического значения в выходные данные квантового кода.Эта работа была разработана в виде плагина, который позже был выделен в небольшую независимую библиотеку под названием OpenQube [62, 63]. Совсем недавно в рамках проекта Quixote [64], JUMBO-Converters и семинара Semantic Physical Science была проделана большая работа по расширению квантовых кодов для вывода большего количества этих данных непосредственно из кода. Поскольку CML можно расширить, можно повторно использовать существующие соглашения для данных о молекулярной структуре и добавить новые соглашения для дополнительных квантовых данных.
Построение молекулы: атом за атомом
После открытия Avogadro появляется окно, подобное показанному на рисунке 4. По умолчанию выбран инструмент рисования. Просто щелкнув левой кнопкой мыши по черной части дисплея, пользователь может нарисовать атом углерода. Если пользователь нажимает левую кнопку мыши и перетаскивает, связанный атом углерода рисуется между начальной точкой и конечной позицией, где мышь отпущена.
По умолчанию выбран инструмент рисования. Просто щелкнув левой кнопкой мыши по черной части дисплея, пользователь может нарисовать атом углерода. Если пользователь нажимает левую кнопку мыши и перетаскивает, связанный атом углерода рисуется между начальной точкой и конечной позицией, где мышь отпущена.
Много усилий было потрачено на создание интуитивно понятного инструмента для рисования малых молекул. Общие химические элементы можно выбрать из раскрывающегося списка, или можно отобразить периодическую таблицу для выбора менее распространенных элементов.Щелчок по существующему атому изменяет его на текущий выбранный элемент, перетаскивание изменяет атом обратно на его предыдущий элемент и рисует новый атом, связанный с оригиналом. Если щелкнуть левой кнопкой мыши по облигациям, то порядок связи меняется между одинарным, двойным и тройным. Также доступны сочетания клавиш, например, ввод символа атома (например, «C-o» для кобальта) изменяет выбранный элемент, или ввод чисел «1», «2» и «3» изменяет порядок связи.
Щелчок правой кнопкой мыши по атомам или связям удаляет их.Если флажок «Настроить водороды» установлен, количество водородов, связанных с каждым атомом, автоматически регулируется в соответствии с валентностью. Кроме того, это также можно сделать в конце сеанса редактирования, используя расширение «Добавить водороды» в меню сборки.
В дополнение к инструменту рисования есть два инструмента для настройки положения атомов в существующих молекулах. Инструмент «манипулирование атомами» можно использовать для перемещения атома или группы выбранных атомов. Инструмент «манипулирование связью» можно использовать для выбора связи, а затем различными способами регулировать положение всех атомов относительно выбранной связи (например,г., изменение длины связи, валентных углов или двугранных углов). Эти три инструмента обеспечивают большую гибкость при построении небольших молекул в интерактивном режиме на экране.
После завершения молекулярной структуры можно использовать расширение силового поля для оптимизации геометрии. При нажатии на «Расширения» и «Оптимизировать геометрию» выполняется быстрая оптимизация геометрии молекулы. Силовое поле и параметры расчета можно настроить, но значения по умолчанию подходят для большинства молекул.Этот рабочий процесс типичен при создании небольших молекулярных структур для использования в качестве входных данных для квантовых расчетов или показателей качества публикации.
При нажатии на «Расширения» и «Оптимизировать геометрию» выполняется быстрая оптимизация геометрии молекулы. Силовое поле и параметры расчета можно настроить, но значения по умолчанию подходят для большинства молекул.Этот рабочий процесс типичен при создании небольших молекулярных структур для использования в качестве входных данных для квантовых расчетов или показателей качества публикации.
Альтернативой является объединение инструмента «Автоматическая оптимизация» с инструментом рисования. Это представляет собой уникальный способ лепки молекулы, в то время как геометрия постоянно минимизируется в фоновом режиме. Оптимизация геометрии анимирована, и эффект изменения порядка связей, добавления новых групп или удаления групп можно наблюдать в интерактивном режиме.
Реализовано несколько диалоговых окон для предоставления информации о свойствах молекулы и точного изменения параметров, таких как декартовы координаты атомов в молекуле.
Построение молекулы: из фрагментов
Помимо построения молекул по атомам, пользователи могут вставлять предварительно построенные фрагменты общих молекул, лигандов или аминокислотных последовательностей, как показано на рисунке 5. Во всех случаях после вставки фрагмента выбирается инструмент манипулирования с центрированием атомов, что позволяет легко перемещать или поворачивать фрагмент в нужное положение.
Во всех случаях после вставки фрагмента выбирается инструмент манипулирования с центрированием атомов, что позволяет легко перемещать или поворачивать фрагмент в нужное положение.
Диалоги для вставки готовых фрагментов. Слева показаны молекулы, а справа аминокислотные последовательности.
Пользователи также могут вставить строку SMILES [65, 66] для молекулы. В этом случае грубая трехмерная геометрия создается с использованием Open Babel и быстрой оптимизации силового поля.
Подготовка входных данных для квантовых кодов
Для Avogadro было разработано несколько расширений, которые помогают пользователю в подготовке входных файлов для популярных квантовых кодов, таких как GAMESS-US, [67] NWChem, [68] Gaussian, [69] Q-Chem, [70] Молпро, [71] и MOPAC200x [72].Графические диалоги представляют функции, необходимые для выполнения основных квантовых вычислений; некоторые примеры показаны на рисунке 6.
Рисунок 6 Диалоговое окно для генерации входных данных для квантовых кодов. Диалоги для создания входных данных для Q-Chem, NWCchem, Molpro и MOPAC200x. Обратите внимание, что диалоговые окна похожи по интерфейсу, что позволяет пользователям использовать несколько пакетов вычислительной химии.
Диалоги для создания входных данных для Q-Chem, NWCchem, Molpro и MOPAC200x. Обратите внимание, что диалоговые окна похожи по интерфейсу, что позволяет пользователям использовать несколько пакетов вычислительной химии.
Предварительный просмотр входного файла в нижней части каждого диалогового окна обновляется по мере изменения параметров.Этот подход помогает новым пользователям квантовых кодов изучить синтаксис входных файлов для различных кодов и быстро создавать полезные входные файлы по мере их изучения. Ввод также можно отредактировать вручную в диалоговом окне, прежде чем файл будет сохранен и отправлен в квантовый код. Расширение MOPAC также может напрямую запускать программу MOPAC200x, если она доступна на компьютере пользователя, а затем перезагружать выходной файл в Avogadro после завершения расчета. Эта функция будет распространена на другие квантовые коды в будущих версиях Avogadro.
Плагин GAMESS-US является одним из наиболее совершенных и включает в себя базовый диалог, присутствующий в большинстве других генераторов входных колод, а также расширенный диалог, раскрывающий многие из более необычных и сложных типов вычислений. В дополнение к расширенному диалоговому окну входную колоду можно редактировать в процессе работы, а также имеется подсветка синтаксиса (рис. 7), используемая во многих популярных редакторах, предназначенных для разработчиков программного обеспечения. Это может указывать на простые опечатки в ключевых словах, а также на более трудные для обнаружения ошибки пробелов, которые в противном случае могли бы привести к сбою отредактированной вручную входной колоды при чтении GAMESS-US.
В дополнение к расширенному диалоговому окну входную колоду можно редактировать в процессе работы, а также имеется подсветка синтаксиса (рис. 7), используемая во многих популярных редакторах, предназначенных для разработчиков программного обеспечения. Это может указывать на простые опечатки в ключевых словах, а также на более трудные для обнаружения ошибки пробелов, которые в противном случае могли бы привести к сбою отредактированной вручную входной колоды при чтении GAMESS-US.
Генератор входной деки GAMESS-US. Этот генератор ввода имеет расширенную панель и подсветку синтаксиса.
Выравнивание и измерения
Одним из специализированных инструментов, включенных в стандартный дистрибутив Avogadro, является инструмент выравнивания. Этот инструмент мыши облегчает выравнивание молекулярной структуры относительно начала координат, если выбран один атом, и вдоль заданной оси, если выбраны два атома. Инструмент выравнивания можно комбинировать с инструментами измерения, выбора и управления для создания входных данных для квантовых кодов, где важны положение и ориентация молекулы. Одним из примеров этого являются расчеты, в которых к молекуле прикладывается внешнее электрическое поле. В этих типах вычислений выравнивание молекулы может иметь большое значение. На рис. 8 показан инструмент измерения в действии с диалоговым окном настройки инструмента выравнивания, которое отображается в левом нижнем углу.
Одним из примеров этого являются расчеты, в которых к молекуле прикладывается внешнее электрическое поле. В этих типах вычислений выравнивание молекулы может иметь большое значение. На рис. 8 показан инструмент измерения в действии с диалоговым окном настройки инструмента выравнивания, которое отображается в левом нижнем углу.
Измерительный инструмент. Инструмент измерения, используемый для измерения валентных углов и длин (в Linux с KDE 4).
Можно создавать более сложные инструменты выравнивания для конкретных задач.Инструмент выравнивания был создан всего за несколько часов под конкретный исследовательский проект. Это яркий пример, когда расширяемость была очень важна для проведения исследований с использованием графического инструмента вычислительной химии. Было бы нецелесообразно вкладывать средства в создание нового приложения только для выравнивания молекулярных структур по оси, но создание плагина для расширяемого проекта вполне разумно.
Визуализация
Приложение Avogadro использует OpenGL для интерактивной визуализации молекулярных представлений на экране.OpenGL предлагает высокоуровневый кроссплатформенный API для рендеринга трехмерных изображений с использованием графики с аппаратным ускорением. OpenGL 1.1 и более ранние версии используются в большей части кода рендеринга, поэтому Avogadro можно использовать даже на старых компьютерных системах или без более современной ускоренной графики. Он может использовать некоторые из новых функций, доступных в OpenGL 2.0, как описано ниже, но это было сохранено как необязательная дополнительная функция при работе над новыми визуализациями молекулярной структуры.
Стандартные представления
В химии существует несколько стандартных представлений молекулярной структуры, изначально основанных на возможностях физических моделей. Приложение Avogadro реализует каждое из этих представлений, показанных на рис. 2, в виде подключаемого модуля. Они варьируются от простого каркасного представления, палочки/солодки, мяча и палочки до сфер Ван-дер-Ваальса.
Также возможно комбинировать несколько представлений, таких как шар и палка с визуализацией кольца (рис. 2 (d)) и полупрозрачное представление Ван-дер-Ваальса, заполняющее пространство, с представлением палочки для пояснения молекулярной основы (рис. 2). (е)).
Квантовые расчеты и электронная структура
Квантовые коды изначально были разработаны для линейных принтеров, и, к сожалению, с тех пор в стандартных файлах журналов мало что изменилось. Существует несколько форматов, разработанных для использования в других кодах и специально для визуализации и анализа, но в сообществе вычислительной квантовой химии нет согласия относительно любого стандартного формата файла. В Avogadro был разработан плагин для визуализации вывода различных квантовых кодов и преобразования данных в нужный формат для дальнейшей визуализации и анализа.
Первоначально в Open Babel была добавлена и расширена поддержка файлов куба Гаусса. Этот формат предоставляет атомарные координаты и одну или несколько регулярно расположенных сеток скалярных значений. Это можно прочитать, и такие методы, как алгоритм марширующих кубов, можно использовать для вычисления треугольных сеток изоповерхностей, например, при значениях плотности электронов. После того, как был разработан код для визуализации этих изоповерхностей, стало ясно, что было бы полезно иметь возможность вычислять эти кубы на лету и с различными уровнями детализации в зависимости от предполагаемого использования.
Это можно прочитать, и такие методы, как алгоритм марширующих кубов, можно использовать для вычисления треугольных сеток изоповерхностей, например, при значениях плотности электронов. После того, как был разработан код для визуализации этих изоповерхностей, стало ясно, что было бы полезно иметь возможность вычислять эти кубы на лету и с различными уровнями детализации в зависимости от предполагаемого использования.
Первый формат, который был несколько задокументирован во время его разработки, — это формат контрольной точки в формате Гаусса. Этот формат намного легче анализировать, чем файлы журналов, созданные во время работы программы, и предоставляет все детали, необходимые для расчета скалярных значений молекулярной орбитали или плотности электронов в любой точке пространства. После того, как была разработана структура классов для орбиталей гауссового типа, этот подход был расширен для чтения в нескольких других популярных форматах выходных файлов, включая Q-Chem, GAMESS-US, NWChem и Molpro. Поддержка MOPAC200x была добавлена позже, наряду с поддержкой формата AUX и орбиталей типа Слейтера, используемых в этом коде. Все эти коды выводят свои окончательные конфигурации, используя стандартную линейную комбинацию атомных орбиталей, а это означает, что распараллеливание чрезвычайно просто.
Поддержка MOPAC200x была добавлена позже, наряду с поддержкой формата AUX и орбиталей типа Слейтера, используемых в этом коде. Все эти коды выводят свои окончательные конфигурации, используя стандартную линейную комбинацию атомных орбиталей, а это означает, что распараллеливание чрезвычайно просто.
Плагин был разработан, чтобы воспользоваться преимуществами метода уменьшения карты, предлагаемого QtConcurrent, чтобы использовать все доступные процессорные ядра. Это обеспечивает почти линейное масштабирование, поскольку каждая точка сетки может быть рассчитана независимо от всех других точек, результаты чего можно увидеть на рисунке 9.Альтернативный подход к вычислению молекулярных орбиталей был разработан во втором плагине, который с тех пор был выделен в отдельный проект под названием «OpenQube». Библиотека «OpenQube» также была добавлена в качестве дополнительной серверной части в VTK во время Google Summer of Code 2011, обеспечивая поддержку нескольких форматов выходных файлов и вычисление кубических файлов, которые впоследствии можно будет использовать в более продвинутых конвейерах данных.
Молекулярные орбитали и поверхности. Визуализация изоповерхности молекулярной орбиты (слева) и электростатического поверхностного потенциала, отображенного на плотность электронов (справа).
Для квантового вывода предусмотрена иерархия классов со стандартным API. Добавление поддержки новых кодов включало разработку нового синтаксического анализатора и обеспечение заполнения набора Гаусса или Слейтера правильным порядком и ожидаемой схемой нормализации. Поддерживаются гауссовские орбитали s-, p- и d-типа, а поддержка f и g запланирована для поддержки растущего числа вычислений с использованием этих орбиталей более высокого порядка. Обмен базисными наборами, поддерживаемый EMSL, обеспечивает доступ к широко используемым базисным наборам, хотя в настоящее время эти базисные наборы обычно считываются непосредственно из выходных файлов.Существует несколько связанных проектов для добавления семантического значения к этому типу вывода, в том числе проект JUMBO-Converters и Quixote. Есть надежда, что в будущем больше кодов будут использовать семантический вывод с использованием общего формата, чтобы упростить обмен данными, проверку и анализ в нескольких кодах. Это было предметом недавней встречи с несколькими кодами вычислительной химии, которые начали использовать FoX для вывода CML. Началась разработка кода для чтения в выводе CML либо непосредственно из кодов, либо путем преобразования других форматов с использованием Open Babel или JUMBO-Converters.Если в CML можно добавить достаточно семантической структуры, а преобразователи поддерживают достаточно большой диапазон выходных данных, это может заменить большую часть кода синтаксического анализа, присутствующего в OpenQube. Семантическое значение является одним из самых сложных для извлечения из файлов журналов, и объединение в сообщество поможет таким проектам, как Avogadro, извлечь больше смысла из выходных данных этих кодов.
Есть надежда, что в будущем больше кодов будут использовать семантический вывод с использованием общего формата, чтобы упростить обмен данными, проверку и анализ в нескольких кодах. Это было предметом недавней встречи с несколькими кодами вычислительной химии, которые начали использовать FoX для вывода CML. Началась разработка кода для чтения в выводе CML либо непосредственно из кодов, либо путем преобразования других форматов с использованием Open Babel или JUMBO-Converters.Если в CML можно добавить достаточно семантической структуры, а преобразователи поддерживают достаточно большой диапазон выходных данных, это может заменить большую часть кода синтаксического анализа, присутствующего в OpenQube. Семантическое значение является одним из самых сложных для извлечения из файлов журналов, и объединение в сообщество поможет таким проектам, как Avogadro, извлечь больше смысла из выходных данных этих кодов.
Вторичная биологическая структура
Авогадро использует программу чтения PDB от Open Babel для чтения вторичной биологической структуры. Для обработки и отображения этой информации существуют два плагина. Первый — это плагин, который визуализирует простую трубку между атомами скелета биомолекулы. Второй, более продвинутый плагин, вычисляет сетки для альфа-спиралей и бета-листов. В то время как первый плагин работает намного быстрее, расширенный плагин более точно выдает результаты, ожидаемые в полевых условиях. Это позволяет пользователям гибко отображать вторичные биологические структуры.
Для обработки и отображения этой информации существуют два плагина. Первый — это плагин, который визуализирует простую трубку между атомами скелета биомолекулы. Второй, более продвинутый плагин, вычисляет сетки для альфа-спиралей и бета-листов. В то время как первый плагин работает намного быстрее, расширенный плагин более точно выдает результаты, ожидаемые в полевых условиях. Это позволяет пользователям гибко отображать вторичные биологические структуры.
GLSL, новая визуализация
GLSL, или OpenGL Shader Language, представляет собой C-подобный синтаксис, который можно использовать для разработки кода, который будет работать на графических картах и включен в OpenGL 2.0 спецификация. Он успешно используется в игровой индустрии, а также во многих областях визуализации данных. В нескольких недавних работах подчеркивается потенциал химии, такой как QuteMol [5], в добавлении поддержки таких функций, как окружающее затенение, для добавления глубины изображениям.
Avogadro поддерживает программы вершинных и фрагментных шейдеров, и несколько примеров включены в пакет. Если графическая карта пользователя позволяет, эти программы можно загружать во время выполнения и использовать с большим эффектом для визуализации структуры.Некоторые из них включают в себя методы суммирования, такие как визуализация изоповерхности, при которой видны только края, ортогональные плоскости обзора, что дает гораздо лучшую визуализацию как молекулярной, так и электронной структуры (рис. 10).
Если графическая карта пользователя позволяет, эти программы можно загружать во время выполнения и использовать с большим эффектом для визуализации структуры.Некоторые из них включают в себя методы суммирования, такие как визуализация изоповерхности, при которой видны только края, ортогональные плоскости обзора, что дает гораздо лучшую визуализацию как молекулярной, так и электронной структуры (рис. 10).
Рендеринг молекулярных орбиталей с использованием шейдеров GLSL. Рендеринг изоповерхности молекулярной орбитали с использованием двух шейдеров GLSL для выделения краев поверхностей. Рентгеновский эффект (слева) и красный и синий (справа) показывают положительные и отрицательные формы молекулярных орбиталей.
Трассировка лучей
Avogadro использует абстракцию рисовальщика, которая значительно упрощает разработчикам добавление новых типов отображения. Он также абстрагирует средство визуализации, позволяя добавить поддержку альтернативных серверных частей. В настоящее время поддерживаются только OpenGL и POV-Ray. Благодаря абстракции мы можем использовать неявные поверхности, доступные в трассировщиках лучей, для визуализации молекулярной структуры с очень высоким уровнем четкости и без каких-либо артефактов треугольника, присутствующих в стандартных визуализированных изображениях OpenGL.Гораздо более высокое качество прозрачности и отражения также позволяет использовать изображения в постерных и устных презентациях, а также в исследовательских статьях (рис. 11).
В настоящее время поддерживаются только OpenGL и POV-Ray. Благодаря абстракции мы можем использовать неявные поверхности, доступные в трассировщиках лучей, для визуализации молекулярной структуры с очень высоким уровнем четкости и без каких-либо артефактов треугольника, присутствующих в стандартных визуализированных изображениях OpenGL.Гораздо более высокое качество прозрачности и отражения также позволяет использовать изображения в постерных и устных презентациях, а также в исследовательских статьях (рис. 11).
Изоповерхности ВЗМО с трассировкой лучей различной кубической плотности. Рендеринг изоповерхности молекулярной орбиты с помощью POV-Ray с кубами низкой (слева) и высокой (справа) плотности.
Эта функция реализована в расширении с дополнительным классом рисовальщика, производным от базового класса, и диалоговым окном, позволяющим пользователю редактировать основные элементы управления визуализацией.Входной файл POV-Ray также можно сохранить и отредактировать для создания более сложных изображений или для более точного управления процессом рендеринга, если это необходимо.
Библиотека Avogadro в использовании
Библиотека Avogadro впервые использовалась в приложении Avogadro, за которым последовала программа периодической таблицы Kalzium, которая является частью коллекции программного обеспечения KDE. Эта первоначальная работа была частично профинансирована программой Google Summer of Code в 2007 году, а также привела к добавлению нескольких других функций в библиотеку Avogadro для поддержки Kalzium и общей визуализации и редактирования молекулярной структуры (рис. 12).
Рисунок 12Приложение Kalzium в KDE использует Avogadro для рендеринга молекулярных структур.
Пакет Q-Chem [70] разработал «QUI — пользовательский интерфейс Q-Chem» [73] вокруг Avogadro, первоначально как расширение Avogadro. Это более продвинутая версия генератора входных данных, разработанного в Avogadro, с гораздо более тесной интеграцией. Компания Molpro [71] также опубликовала некоторые результаты своей разработки интерфейса Molpro с использованием библиотеки Avogadro [74].
Packmol
Packmol — сторонний пакет, предназначенный для создания исходных «упакованных» конфигураций молекул для молекулярной динамики или других симуляций [75, 76]. Примеры включают окружение белка растворителем, смесями растворителей, липидными бислоями, сферическими мицеллами, размещением противоионов, добавлением лигандов к наночастицам и т. д. Как правило, пользователи могут иметь уравновешенные «боксы с растворителями», которые были запущены для длительного моделирования, чтобы обеспечить надлежащую плотность, и как короткодействующие, так и дальнодействующие взаимодействия между молекулами растворителя.Использование таких боксов с растворителями позволяет поместить молекулы растворенных веществ, например белков, в примерно правильную исходную структуру, как показано на рис. 13. Растворенное вещество добавляется в бокс, а молекулы растворителя с перекрывающимися атомами удаляются. Хотя этих утилит часто достаточно, создание сложных входных файлов не всегда просто. Для более сложных систем Packmol может создать начальную конфигурацию на основе определенных плотностей, геометрии (например, сфера, коробка и т. д.) и молекул, которые необходимо разместить.Разработчик Avogadro написал внешний плагин для облегчения использования Packmol, в том числе для оценки количества молекул в заданном объеме.
Для более сложных систем Packmol может создать начальную конфигурацию на основе определенных плотностей, геометрии (например, сфера, коробка и т. д.) и молекул, которые необходимо разместить.Разработчик Avogadro написал внешний плагин для облегчения использования Packmol, в том числе для оценки количества молекул в заданном объеме.
Липидный слой PackMol, созданный расширением PackMol.
Плагин в настоящее время не распространяется с Avogadro в качестве стандартной функции, хотя это планируется в какой-то будущей версии. Это служит примером того, как Avogadro может упростить рабочий процесс с помощью текстового пакета (Packmol), включая сохранение файлов в формате PDB, требуемом Packmol, создание входного файла и чтение вывода для визуализации, анализа и дальнейшего моделирования. .
XtalOpt
Программный пакет XtalOpt [77, 78] реализован как стороннее расширение C++ для Avogadro и интенсивно использует API libavogadro. Расширение реализует эволюционный алгоритм, адаптированный для предсказания кристаллической структуры. Команда разработчиков XtalOpt выбрала Avogadro в качестве платформы из-за его лицензии с открытым исходным кодом, хорошо разработанного API, мощных инструментов визуализации и интуитивно понятного пользовательского интерфейса. XtalOpt существует в виде диалогового окна (рис. 14) и использует главное окно Avogadro для визуализации структур-кандидатов по мере их развития.API хорошо подходит для нужд XtalOpt, предоставляя простой механизм, позволяющий пользователю просматривать, редактировать и экспортировать структуры, сгенерированные во время поиска. XtalOpt, использующий кроссплатформенные возможности Avogadro и его зависимостей, доступен для Linux, Windows и Mac.
Расширение реализует эволюционный алгоритм, адаптированный для предсказания кристаллической структуры. Команда разработчиков XtalOpt выбрала Avogadro в качестве платформы из-за его лицензии с открытым исходным кодом, хорошо разработанного API, мощных инструментов визуализации и интуитивно понятного пользовательского интерфейса. XtalOpt существует в виде диалогового окна (рис. 14) и использует главное окно Avogadro для визуализации структур-кандидатов по мере их развития.API хорошо подходит для нужд XtalOpt, предоставляя простой механизм, позволяющий пользователю просматривать, редактировать и экспортировать структуры, сгенерированные во время поиска. XtalOpt, использующий кроссплатформенные возможности Avogadro и его зависимостей, доступен для Linux, Windows и Mac.
Расширение XtalOpt. Расширение XtalOpt, показывающее график зависимости стабильности от хода поиска суперячейки TiO 2 .
Avogadro Constant – обзор
6.
 2 Веса и концентрации
2 Веса и концентрацииМоль и постоянная Авогадро. Универсальным эталоном веса в химии является относительный атомный вес u . Это эквивалентно 112 массам изотопа 612С. Это очень небольшое число, если быть точным, 1,660 538 921 × 10 −27 кг. Чтобы избежать расчета с этим числом, вместо него используется символ u . Поскольку химия обычно имеет дело с физически практичными количествами (в конце концов, работа с отдельными молекулами — непростая задача), мы предполагаем «полезное» количество молекул.В принципе, подойдет любое число, но учитывая, что u уже представляет число с отрицательной экспонентой, почему бы не взять число, которое полностью избавится от экспоненты? Таким образом, мы определяем это число как
(уравнение 6.1)NA=1u≈6,022×10231/моль
Число, которое мы здесь ввели, называется постоянной Авогадро . Итак, если мы возьмем это количество молекул и посчитаем общий вес этой массы, результат будет составлять круглое число. Количество молекул, определяемое константой Авогадро 1 , обозначается как моль : 1 моль.Используя вывод u , теперь мы можем видеть, что 1 моль изотопа 612C имеет общий вес 12 г, что является гораздо более практичным числом для работы. Затем с помощью константы Авогадро вес молекулы выражается как молекулярная масса в г-моль -1 . Иногда, особенно в биологии и биохимии, молекулярные массы выражают в дальтонах (Да). 1 Да эквивалентен 1 г моль -1 , и в принципе эти единицы могут использоваться взаимозаменяемо. Однако, особенно когда необходимо учитывать единицы, г моль -1 использует единицы, конформные СИ, и поэтому предпочтительнее.Постоянную Авогадро часто путают с числом Лошмидта N L , которое описывает (для идеального газа) количество атомов или молекул, содержащихся в заданном объеме (подробности о числе Лошмидта см. также в разделе 6.4.1).
Количество молекул, определяемое константой Авогадро 1 , обозначается как моль : 1 моль.Используя вывод u , теперь мы можем видеть, что 1 моль изотопа 612C имеет общий вес 12 г, что является гораздо более практичным числом для работы. Затем с помощью константы Авогадро вес молекулы выражается как молекулярная масса в г-моль -1 . Иногда, особенно в биологии и биохимии, молекулярные массы выражают в дальтонах (Да). 1 Да эквивалентен 1 г моль -1 , и в принципе эти единицы могут использоваться взаимозаменяемо. Однако, особенно когда необходимо учитывать единицы, г моль -1 использует единицы, конформные СИ, и поэтому предпочтительнее.Постоянную Авогадро часто путают с числом Лошмидта N L , которое описывает (для идеального газа) количество атомов или молекул, содержащихся в заданном объеме (подробности о числе Лошмидта см. также в разделе 6.4.1).
Молекулярные массы. Теперь вычисление молекулярной массы молекулы — это просто вопрос сложения значений, данных для относительных атомных масс отдельных атомов, из которых состоит молекула. Эти значения даны, e.г. , в периодической таблице элементов (см. рис. 6.1) в кг, т.е. , в относительной атомной массе. Теперь, как это поможет нам? Помните, относительная атомная масса дается как 112 массы изотопа 612С в атомных единицах х . Теперь 1 моль углерода весит ровно 12 г; следовательно, молекулярная масса углерода эквивалентна относительной атомной массе. Поэтому молекулярную массу можно просто прочитать из таблицы Менделеева.
Эти значения даны, e.г. , в периодической таблице элементов (см. рис. 6.1) в кг, т.е. , в относительной атомной массе. Теперь, как это поможет нам? Помните, относительная атомная масса дается как 112 массы изотопа 612С в атомных единицах х . Теперь 1 моль углерода весит ровно 12 г; следовательно, молекулярная масса углерода эквивалентна относительной атомной массе. Поэтому молекулярную массу можно просто прочитать из таблицы Менделеева.
Например, молекулярная масса диоксида углерода может быть рассчитана как
MCO2=MC+2MO=12гмоль-1+2⋅16гмоль-1=44гмоль-1 соль хлорида калия
MKCl2=MK+2MCl=39гмоль−1+35⋅45гмоль−1=74.45 гмоль−1
Используя молекулярную массу, можно сформулировать зависимость количества вещества (измеряемого в числе молекул, т.е. , в молях) и массы вещества принимаемой (данной в г) как
(Уравнение 6.2)n=mM
Это позволяет нам перевести заданную массу m вещества в число молекул, содержащихся в этом количестве, используя молекулярную массу M . В общем, химия работает с количествами вещества n , а не с массой m .Это связано с тем, что в химических реакциях участвуют отдельные молекулы, и если для химической реакции требуются две разные молекулы, имеет смысл поставлять такое количество, которое обеспечит достаточное и сбалансированное количество обеих молекул. Например, чтобы создать углекислый газ, нужно две молярные части кислорода и одна молярная часть углерода. Поэтому нам нужно предоставить 12 г углерода и 36 г кислорода, чтобы создать 1 моль углекислого газа. Этот правильный баланс количества вещества называется стехиометрией .
В общем, химия работает с количествами вещества n , а не с массой m .Это связано с тем, что в химических реакциях участвуют отдельные молекулы, и если для химической реакции требуются две разные молекулы, имеет смысл поставлять такое количество, которое обеспечит достаточное и сбалансированное количество обеих молекул. Например, чтобы создать углекислый газ, нужно две молярные части кислорода и одна молярная часть углерода. Поэтому нам нужно предоставить 12 г углерода и 36 г кислорода, чтобы создать 1 моль углекислого газа. Этот правильный баланс количества вещества называется стехиометрией .
Неравномерная масса атома. Как указано в разделе 6.1.2, некоторые элементы имеют в природе более одного изотопа. Это обычное дело, , например. , для благородных газов. Например, для неона данная атомная масса равна 20,18 г моль -1 . Неон имеет несколько изотопов: Ne1020 (91%), Ne1021 (0,2%) и Ne1022 (8,8%). Приведенный атомный вес является усредненным значением. Другими яркими примерами этого являются литий, бор или хлор.
Другими яркими примерами этого являются литий, бор или хлор.
Эдукт, реагент, продукт, реагент. Вся химия основана на согласованной перегруппировке атомов, удалении связей или повторном введении новых связей.Это делается с помощью химических реакций . Химической реакцией называют процесс, который изменяет расположение атомов и связи данной молекулы, поступающей в реакцию, создавая молекулу другого строения и (скорее всего) с другими химическими и физическими свойствами. Материал, подаваемый в химическую реакцию в качестве исходного материала, обычно обозначается как исходный продукт . Термин реагент используется как синоним эдукта. Для химической реакции часто требуется более одного продукта.Перестроенная молекула, полученная в результате реакции, обозначается как продукт . Если речь идет об эдукте или продукте, используется термин , реагент .
Стехиометрия. Как уже говорилось, химические реакции потребляют исходные вещества для образования продуктов. Характер протекающей химической реакции требует наличия определенных количеств исходных продуктов и создания из них определенного количества продукта. Математическая взаимосвязь между количеством продукта и количеством требуемых исходных веществ называется стехиометрией .Мы уже обсуждали пример создания углекислого газа из углерода и кислорода. Другой пример — создание оксида магния из магния и кислорода. Реакция
(Rct 6.1)2Mg+O2→2MgO
Стехиометрия этой реакции подразумевает, что должны быть обеспечены две молярные части магния и одна молярная часть газообразного кислорода. Если дано меньше требуемого количества, что называется недостехиометрией , продукт производится только до тех пор, пока не будет израсходовано все количество исходного продукта с недостаточной стехиометрией.Если одного эдукта «недостаточно», второй эдукт предоставляется в «слишком большом количестве», что называется превышением стехиометрии . Опять же, ограничивающим фактором будет исходный продукт, обеспечиваемый ниже стехиометрии.
Эквивалент. Мы уже видели, что в некоторых случаях молекула содержит более одного атома, который может участвовать в реакции. Вернемся к примеру с оксидом магния, который образуется при сжигании магния (см. рис. 6.1). Мы скорректировали стехиометрию, предоставив 2 молярных эквивалента магния и только 1 молярный эквивалент газообразного кислорода.Мы также могли бы написать
Mg+12O2→MgO
, и в этом случае мы уже объяснили, что 1 моль газообразного кислорода может обеспечить два эквивалента для реакции. f экв. для газообразного кислорода в этой реакции равно feq,o2=12. Таким образом, эквивалентные коэффициенты рассчитываются как обратное число реакций, которые может выполнить одна молекула. Эквиваленты важны, например, . , для реакций нейтрализации с использованием кислот, дающих более одного протона.Примерами являются серная кислота, которая может давать два протона и, таким образом, имеет feq,h3SO4=12, или фосфорная кислота, которая имеет эквивалент feq,h4PO4=13.
Концентрации. Часто вещества растворяют в жидкостях для и во время химических реакций. Свойства этих растворов меняются в зависимости от количества вещества. Хорошим примером являются электролиты, которые обычно получают путем растворения веществ, диссоциирующих на соответствующие им ионы. Существует несколько способов отображения концентрации.Обычно, если речь идет об определенном веществе (и смесь содержит более одного вещества), соответствующему символу будет присвоен индекс, например . , с и , когда речь идет о с вещества и в смеси. Как правило, должен быть указан растворитель, в котором растворено вещество, например, . , «в толуоле». Если это не так, то в качестве растворителя обычно принимают воду.
Молярная концентрация. Молярная концентрация определяется как количество вещества на объем растворителя
c=nVmolL−1
Очень часто молярные концентрации даются с большой буквы М, e. г. , 1 HCl, что эквивалентно 1 моль л -1 .
г. , 1 HCl, что эквивалентно 1 моль л -1 .
Массовая концентрация. Массовая концентрация определяется как масса вещества на объем растворителя
ρ=мВгл-1
Моляльность. Моляльность определяется как количество вещества на массу растворителя
b=нмоль/кг
Например, если концентрация кислоты указана как содержит 0,1 моль хлористого водорода, растворенного в 1 кг воды.Моляльность относится только к используемой массе и поэтому практична, поскольку не зависит от термодинамических условий. Объем растворителя зависит от температуры, масса — нет.
Массовая доля. В смеси массовая доля определяется как масса данного вещества на общую массу смеси как w HCl = 9 %.Это означает, что в 100 г этой кислоты будет содержаться 9 г хлористого водорода и 91 г воды.
Мольная доля. В смеси молярная доля (или молярная доля) определяется как количество данного вещества на общее количество смеси
xi=nintotal=ni∑j=1Nnjmolmol−1
Например, концентрация водная кислота представлена как x HCl = 9 %. Это означает, что 100 моль этой кислоты будут содержать 9 моль хлороводорода и 91 моль воды.
Это означает, что 100 моль этой кислоты будут содержать 9 моль хлороводорода и 91 моль воды.
Эквивалентная молярная концентрация. Эквивалентная концентрация определяется как доля молярной концентрации и коэффициента эквивалентности
ceq=cfeqmolL−1
Для достижения полной нейтрализации кислоты эквивалентные концентрации кислоты и основания должны быть идентичными. Например, если мы хотим нейтрализовать 0,1 моль раствора хлористого водорода разбавленным раствором карбоната натрия. Эквивалентные коэффициенты: f экв. , HCl = 1 и feq,Na2CO3=12.Чтобы полностью нейтрализовать, мы должны использовать один и тот же объем 0,1 моль хлористого водорода и 0,05 моль раствора карбоната натрия.
Эквивалентное количество вещества. В последнем примере мы уже косвенно использовали эквивалентное количество вещества. Он дается как доля количества вещества с коэффициентом эквивалентности
neq=nfeqmol
.
