Электроотрицательность химических элементов теперь можно считать по-новому
Классическая формула и шкала Полинга оказались не так хороши, и химики из Сколтеха нашли способ их улучшить.
Если вы не химик, не биолог и ваша профессия не связана с химией как-нибудь ещё, то, скорее всего, с химической наукой первый и последний раз вы встречались где-то в школьные года. Нет, конечно, с формулой какого-нибудь лекарства или «страшной» химией из состава продуктов большинство из нас так или иначе встречаются и в обычной жизни, но вряд ли вы применяете на практике школьные знания о валентности разных атомов, используете таблицу растворимости солей или получаете ценные следствия из ряд электроотрицательности элементов.
Таблица электроотрицательностей элементов, полученная по новой формуле. Илл.: Christian Tantardini & Artem R. Oganov, Nature Communications (2021)
‹
›
С химией есть ещё одна проблема.
Но химики столетиями прекрасно жили и без всяких сложных теорий, пользуясь правилами, полученными из опытов и экспериментальных наблюдений. Даже в ХХ веке, когда уже стало известно строения атома и более-менее понятна природа химических связей в молекулах, простые формулы и приближённые правила никуда не делись – они до сих пор помогают понимать и чувствовать химию, что называется, на пальцах.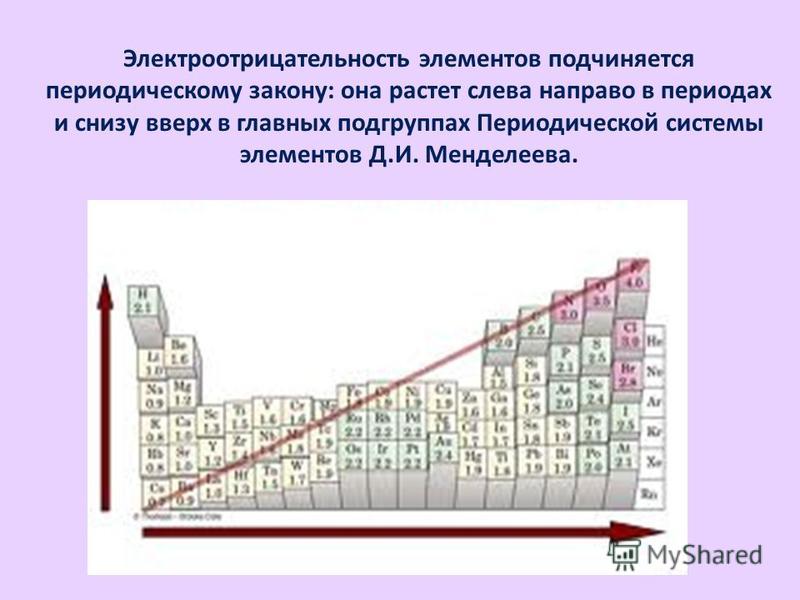
Это длинное слово обозначает способность атома химического элемента притягивать к себе электроны от других атомов, с которыми он образует химические связи. Возьмём, к примеру, две молекулы: водорода H₂ и фтора F₂. Когда атом встречается с другим таким же атомом, то логично, что никто из них не сможет перетянуть на себя чужой электрон – «сила электронного притяжения» каждого из них одинакова. Но что, если атом водорода встретится с атомом фтора? Один из них будет притягивать электроны сильнее, и «электронное одеяло» на нём будет больше. Кто из них окажется в этом перетягивании электронов успешнее (а это будет фтор), у того и больше электроотрицательность. Это не значит, что атом фтора отнимет у водорода его единственный электрон – просто электрон водорода будет больше времени проводить поближе к фтору, чем рядом со своим «хозяином», что, правда, укрепит связь между водородом и фтором. Но чтобы не утонуть в квантово-химическом болоте, не будем дальше углубляться в особенности распределения электронной плотности в молекулах.
Электроотрицательность можно выразить в виде числа, и оно оказалось очень полезным для химиков. Многие характеристики элементов и их соединений вполне определённым образом зависят от этого одного числа, что очень удобно на практике, например, когда нужно предсказать, как изменятся свойство вещества, если заменить в нём один атом на немного другой. Проблема лишь в том, что рассчитать электроотрицательность можно разными способами, и все они дадут немного разные и не всегда логичные результаты. Самая известная шкала электроотрицательностей элементов предложена нобелевским лауреатом Лайнусом Полингом. Кроме того «свои» электроотрицательности предложили в своё время Роберт Малликен, Альберт Оллред и Юджин Рохов, Роберт Сандерсон и Лиланд Аллен.
Совсем недавно пересмотреть классическую формулу расчета электроотрицательности по Поллингу довольно неожиданно получилось у профессора Сколковского института науки и технологий Артёма Оганова и сотрудника Сколтеха Кристиана Тантардини. Копать под школьную программу химии в их планы совсем не входило – научные интересы исследователей лежат больше в области компьютерных расчётов кристаллических структур и химии высоких давлений. В одной из исследований им понадобилось рассчитать электроотрицательности химических элементов под высоким давлением, которое существует, например, в ядрах планет. Взяв за основу определение Полинга (для расчёта он использовал энергии химических связей), учёные сначала рассчитали электроотрицательности элементов для нормальных условий, но здесь их поджидал сюрприз.
Копать под школьную программу химии в их планы совсем не входило – научные интересы исследователей лежат больше в области компьютерных расчётов кристаллических структур и химии высоких давлений. В одной из исследований им понадобилось рассчитать электроотрицательности химических элементов под высоким давлением, которое существует, например, в ядрах планет. Взяв за основу определение Полинга (для расчёта он использовал энергии химических связей), учёные сначала рассчитали электроотрицательности элементов для нормальных условий, но здесь их поджидал сюрприз.
«К огромному удивлению, мы увидели, что эта шкала не согласуется ни с теоретическими, ни с экспериментальными энергиями связей. Более того, это было известно в химической литературе, но удовлетворительного решения предложено не было. Более того, если попытаться извлечь электроотрицательности из энергий ионных связей, получатся электроотрицательности, нарушающие ожидаемые тренды. Я понял, в чём корень проблем – ионная стабилизация молекулы представлялась Полингом как аддитивная добавка, – рассказывает профессор Артём Оганов.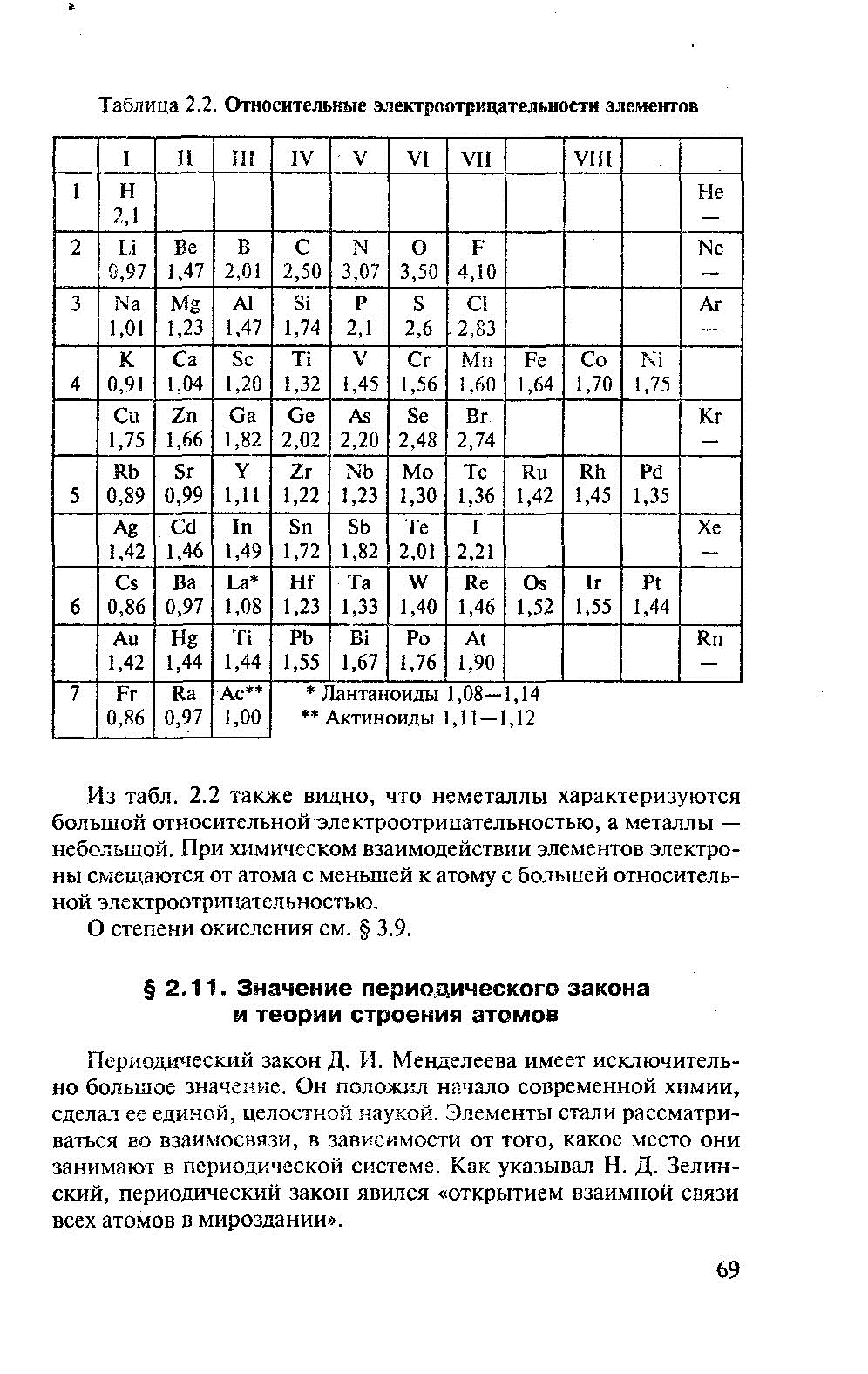 – Я изменил формулу, заменив эту аддитивную добавку на мультипликативную. Полинг прибавлял, а мы умножаем. С помощью новой формулы и экспериментальных энергий химических связей мы определили электроотрицательности всех элементов. У нас получилась очень красивая шкала, которая работает как при маленьких разностях в электроорицательности, так и при больших»
– Я изменил формулу, заменив эту аддитивную добавку на мультипликативную. Полинг прибавлял, а мы умножаем. С помощью новой формулы и экспериментальных энергий химических связей мы определили электроотрицательности всех элементов. У нас получилась очень красивая шкала, которая работает как при маленьких разностях в электроорицательности, так и при больших»
Электроотрицательность – способность атомов притягивать электроны – также определяет возможность образования металлической связи. Элементы с высокой электроотрицательностью не могут быть металлами. Новая шкала электроотрицательности лучше разделяет элементы на металлы и неметаллы, чем шкала Полинга. Например, в шкале Полинга ряд металлов (вольфрам, молибден, платиноиды, золото, свинец) имеют более высокие электроотрицательности, чем такие неметаллы, как бор и водород – что противоречит химической интуиции. В новой шкале эта проблема исправлена.
Результаты расчётов и новая формула опубликованы в Nature Communications (статья в свободном доступе).
учение о химической связи – тема научной статьи по химическим наукам читайте бесплатно текст научно-исследовательской работы в электронной библиотеке КиберЛенинка
ВЕСТНИК САНКТ-ПЕТЕРБУРГСКОГО УНИВЕРСИТЕТА
УДК 373.523 + 54.371.3
А. Б. Никольский, С. В. Телешов
ХИМИЯ В ШКОЛЕ: УЧЕНИЕ О ХИМИЧЕСКОЙ СВЯЗИ
Введение. В связи с введением в действие государственного Образовательного стандарта основного общего образования и Образовательного стандарта среднего (полного) общего образования по химии некоторые вопросы, касающиеся содержания этого учебного предмета, вновь обратили на себя внимание методистов. Одним из таких вопросов является рассмотрение природы химической связи. В соответствии с названными Образовательными стандартами подлежит изучению следующий материал: «Молекулы и химическая связь. Классификация химических связей. Ковалентная связь и её разновидности, механизмы образования. Комплексные соединения. Электроотрицательность. Степень окисления и валентность. Гибридизация орбиталей в молекуле. Геометрия молекул. Полярность молекул. Ионная связь как предельный случай полярной ковалентной связи. Катионы и анионы. Металлическая связь. Внутримолекулярные и межмолекулярные водородные связи. Ван-дер-Ваальсовы взаимодействия. Единая природа химических связей. Вещества молекулярного и немолекулярного строения. Современные представления о строении твёрдых, жидких и газообразных веществ».
В соответствии с названными Образовательными стандартами подлежит изучению следующий материал: «Молекулы и химическая связь. Классификация химических связей. Ковалентная связь и её разновидности, механизмы образования. Комплексные соединения. Электроотрицательность. Степень окисления и валентность. Гибридизация орбиталей в молекуле. Геометрия молекул. Полярность молекул. Ионная связь как предельный случай полярной ковалентной связи. Катионы и анионы. Металлическая связь. Внутримолекулярные и межмолекулярные водородные связи. Ван-дер-Ваальсовы взаимодействия. Единая природа химических связей. Вещества молекулярного и немолекулярного строения. Современные представления о строении твёрдых, жидких и газообразных веществ».
Стандарт требует, чтобы ученик умел:
• определять валентность и (или) степень окисления химических элементов по формулам их соединений,
• определять вид химической связи между атомами элементов в простых веществах и типичных соединениях,
• характеризовать свойства химических соединений, исходя из вида химической связи и типа кристаллической решетки,
• объяснять зависимость свойств веществ от их строения и вида химической связи.
Как мы видим, ученик должен освоить весьма обширный и достаточно сложный материал. Что же и как сообщать школьникам в классе? Что считать критерием (критериями) для определения вида химической связи? Авторы настоящей статьи — преподаватели, университетский и школьный, — обнаружили, что в различных школьных учебниках и пособиях по химии вопрос о природе химической связи излагается настолько по-разному, что свести всё воедино становится весьма затруднительно. Мы хотим обратить внимание читателей на противоречия в материалах, предлагаемых школьнику, и, изложить свою точку зрения на то, что действительно важно знать школьнику о химической связи.
Что говорят школьные учебники и пособия. Между тем история отечественных школьных учебников приближается к своему 180-летнему рубежу — имеются в виду учебники, созданные для средних учебных заведений Н. П. Щегловым (1830 г.) [1], Г. И. Гессом (1834 г. ) [2], Н. Т. Щегловым (1841 г.) [3]. До появления «Основ химии»
) [2], Н. Т. Щегловым (1841 г.) [3]. До появления «Основ химии»
© А. Б. Никольский, С. В. Телешов, 2009
Д. И. Менделеева и открытия периодического закона (1869 г.) первые школьные учебники по химии включали в себя обзор практически полного массива химических знаний, известных учёному сообществу в это время. Шло время, развивалась и усложнялась химическая наука, совершенствовалась и система школьного образования, в том числе методика обучения химии, основой которой стал периодический закон. В 20-30 х годах ХХ века в нашей стране настала пора массовой средней школы и учебников, которые выходили значительными тиражами. К этому же времени относится становление электронной теории химической связи [4, 5] и определение различных типов связи. Вот как это отражено, например, в школьном учебнике В. Н. Верховского 1947 г. [6]: «Возможны несколько типов химической связи между атомами. Первый тип — так называемая ковалентная связь, когда электроны у двух или нескольких атомов делаются общими.
Эти же формулировки сохранились и в пришедшем в 1949 г. на смену стабильному учебнику Верховского новом учебнике В. В. Левченко с соавторами [7]: «Образование молекулы хлористого натрия представляет собой яркий пример, когда соединяются атомы, из которых один (натрий) сравнительно легко отдает свой электрон, а другой (хлор) очень энергично присоединяет электрон. Оба образовавшихся иона совершенно самостоятельны. В молекулу же они объединяются потому, что удерживаются друг около друга силой электростатического притяжения. Так как такая молекула состоит из разноимённо заряженных ионов, она называется ионной».
При всём уважении к В. Н. Верховскому и В. В. Левченко с соавторами мы не можем в очередной раз не отметить, что в этих учебниках настойчиво говорится о молекулах соединений с ионной связью, хотя главным свойством ионных соединений является тот факт, что они не состоят из молекул, а образуют кристаллы. Дело в том, что куло-новские силы электростатического притяжения между ионами ненаправленные, они обладают сферической симметрией, что ведёт к построению трёхмерной кристаллической решетки, в которой каждый катион симметрично окружён определённым количеством анионов, а анионы — определённым количеством катионов. Соотношение общего количества катионов и анионов определяется составом соединения, а характер кристаллической решетки — их относительными размерами. Если реализуются условия для образования катионов и анионов, то образование ионных кристаллов всегда энергетически выгоднее, чем образование молекул с ионной связью.
Вернёмся к требованиям, предъявляемым современным школьникам. Они должны не только давать характеристику различных видов химической связи, но и определять вид связи (ковалентная или ионная) в конкретных соединениях. Обратимся сначала за помощью к учебникам для средней школы, по которым учились нынешние эксперты РАО. Например, в учебнике Ю. В. Ходакова с соавторами [8] мы находим следующее: «Ионная связь обусловливается притяжением друг к другу ионов, как разноимённо заряженных тел. Ионная связь возникает при соединении химических элементов, наиболее отличных по своей химической природе, а именно типичных металлов с типичными неметаллами». «Связь атомов посредством электронных пар называется ковалентной». Затем вводится понятие электроотрицательности (ЭО): «Свойство атомов оттягивать к себе электроны от других атомов для завершения наружного слоя называется электроотрицательностью. Чем сильнее проявляется у элемента это свойство, тем более
он электроотрицателен». -электронов.
-электронов.
В учебнике Г. Е. Рудзитиса и Ф. Г. Фельдмана [9] авторы предварительно вводят понятие электроотрицательности, а затем на этой основе рассматривают главные типы химической связи. «Электроотрицательность — это полусумма энергии ионизации и сродства к электрону». (Подстрочно: «Известны и другие подходы к измерению и определению величины электроотрицательностей элементов»). Приводится таблица электроотрицательности важнейших химических элементов, которая далее используется не для определения количественного критерия типа связи, служит для того, чтобы на качественном уровне различать три случая:
1. ЭО резко отличаются — ионная связь.
2. ЭО одинаковы — ковалентная (атомная) неполярная связь.
3. ЭО отличаются, но не очень сильно — ковалентная полярная связь.
Такой подход представляется вполне доступным школьнику, если не считать того, что шкала ЭО по Р. -С. Малликену возведена в ранг определения понятия электроотрицательности, а также того, что определение того или иного типа связи основано исключительно на электроотрицательности элементов.
-С. Малликену возведена в ранг определения понятия электроотрицательности, а также того, что определение того или иного типа связи основано исключительно на электроотрицательности элементов.
Анализ учебников для школ XXI века показывает, что почти все они рекомендуют учащемуся определять тип химической связи, ориентируясь на электроотрицательность элементов и только на неё. При этом можно выделить две группы учебников и пособий:
Первая группа [10-12] содержит количественный критерий, основанный исключительно на использовании понятия об электроотрицательности, трактуемого авторами учебников по-разному.
Вторая группа [13-17] не содержит количественных критериев, хотя и связывает характер химической связи с электроотрицательностью на качественном уровне.
Вот несколько характерных цитат из учебников первой группы. С. С. Бердоносов [10, С. 98-100]: «Отметим, что если разность значений ЭО (имеется в виду одна из шкал Л. Полинга, введённая без объяснения её физического смысла. — Авт.) двух атомов, образующих химическую связь, около двух или выше, то связь будет иметь ионный характер, если меньше двух — связь будет полярной ковалентной».
С. С. Бердоносов [10, С. 98-100]: «Отметим, что если разность значений ЭО (имеется в виду одна из шкал Л. Полинга, введённая без объяснения её физического смысла. — Авт.) двух атомов, образующих химическую связь, около двух или выше, то связь будет иметь ионный характер, если меньше двух — связь будет полярной ковалентной».
Н. Е. Кузнецова с соавторами [11]: «Химическая связь — это сила (правильно: химическая связь — это причина, удерживающая атомы или ионы в соединениях; её никак нельзя отождествлять с силой, хотя можно характеризовать энергией, направленностью и т. д. — Авт.), соединяющая два или несколько взаимодействующих атомов в молекулы и другие частицы». «Чем больше разность между значениями относительной электроотрицательностью (ОЭО) (имеется в виду шкала Малликена, опять-таки введённая без объяснения её физического смысла — Авт.) атомов, тем выше степень
ионности их соединений. Связи с разностью ОЭО больше 2,1 можно отнести к ионным (более 50 % ионности)».
Связи с разностью ОЭО больше 2,1 можно отнести к ионным (более 50 % ионности)».
И. Н. Новошинский с коллегой пишут [12]: «Ионная связь образуется между атомами типичных металлов и атомами типичных неметаллов, т. е. между элементами, атомы которых резко отличаются по электроотрицательности (здесь явочным порядком используется одна из шкал Л. Полинга. — Авт.) — разность между электроотрицательностями ЭО атомов больше 1,7», затем следует серия упражнений, например: «2. Выпишите из предложенного ряда веществ ионные соединения: Ch5, CaCl2, O2, KF, Nh4, Mg».
Нетрудно видеть, что разные авторы используют разные шкалы ЭО без объяснения их происхождения и физического смысла и при этом дают разные численные критерии типа связи также без особых обоснований.
Для иллюстрации подхода к определению типа химической связи в учебниках второй группы, не содержащих количественных критериев, мы ограничимся одной характерной цитатой.
О. С. Габриелян [13]: «Электроотрицательность (ЭО) — это способность атомов химического элемента оттягивать к себе электронные пары, участвующие в образовании химической связи. Электроотрицательность можно охарактеризовать как меру неме-талличности элементов. Пользуясь рядом ЭО, можно определить, куда смещаются общие электронные пары. Они всегда смещены к атомам элемента с более высокой ЭО.
Например, в молекуле НС1 общая электронная пара смещена к атому хлора, так как его ЭО больше, чем у водорода. Поэтому такую ковалентную связь называют полярной». Здесь же даётся любопытное упражнение 1: «Атомы водорода и фосфора имеют одинаковые значения ЭО. Какой вид химической связи в молекуле фосфина РН3?»
Здесь продемонстрирован доступный школьникам подход, однако он всё-таки неявно основан на количественной оценке ЭО. Более того, добавляется ещё одно ненаблюдаемое свойство — «неметалличность», определение которого отсутствует. Кроме того, следует отметить, что понятие электроотрицательности связано со смещением любых электронов, в том числе неподелённых пар данного атома и неспаренных, а не только именно связывающих пар, как настаивает автор учебника.
Кроме того, следует отметить, что понятие электроотрицательности связано со смещением любых электронов, в том числе неподелённых пар данного атома и неспаренных, а не только именно связывающих пар, как настаивает автор учебника.
Для полноты картины отметим, что существуют отдельные учебники и пособия, в которых авторы упоминают о некоторых характерных наблюдаемых свойствах ионных соединений [14-17]. Например, Р. Г. Иванова [14] пишет: «Вещества с ионной связью образуют ионные кристаллы. Они все твёрдые и тугоплавкие. Такую ионную кристаллическую решётку имеют щёлочи, соли, например КОН, NaCl, KCl, и др.» Перед этим, однако, когда читатели этого ещё не видели, но познакомились с электроотрицательностью, предлагается упражнение: «1. Какая химическая связь (ионная, ковалентная неполярная или ковалентная полярная) в веществах: сероводороде h3S, хлориде калия KC1, воде h3O, кристаллической сере Ss, йоде I2, оксиде магния MgO?»
Таким образом, общей чертой современных учебников является то, что тип химической связи рекомендуется определять по различию в электроотрицательности партнёров по связи. Отличия между учебниками сводятся к использованию-неиспользованию величины ЭО в качестве количественного критерия для оценки характера химической связи.
Отличия между учебниками сводятся к использованию-неиспользованию величины ЭО в качестве количественного критерия для оценки характера химической связи.
Что мы можем предложить. Рассматривая ситуацию в целом, мы видим, что знакомство с химической связью в средней школе в значительной степени сводится к введению условных понятий: ионность-ковалентность, электроотрицательность, степень ионности, металличность-неметалличность, которым ставятся в соответствие
ненаблюдаемые величины. При этом в большинстве случаев данные понятия вводятся некорректно, что вполне понятно, так как корректное их введение требует весьма серьёзного обоснования, явно неуместного в учебнике для средней школы. Зачем же понадобились эти условные понятия? Затем, чтобы с их помощью объяснять и предсказывать наблюдаемые свойства веществ. А откуда же возникли наши условные понятия? Очевидно, что из анализа наблюдаемых свойств веществ, как это, например, блестяще сделал Д.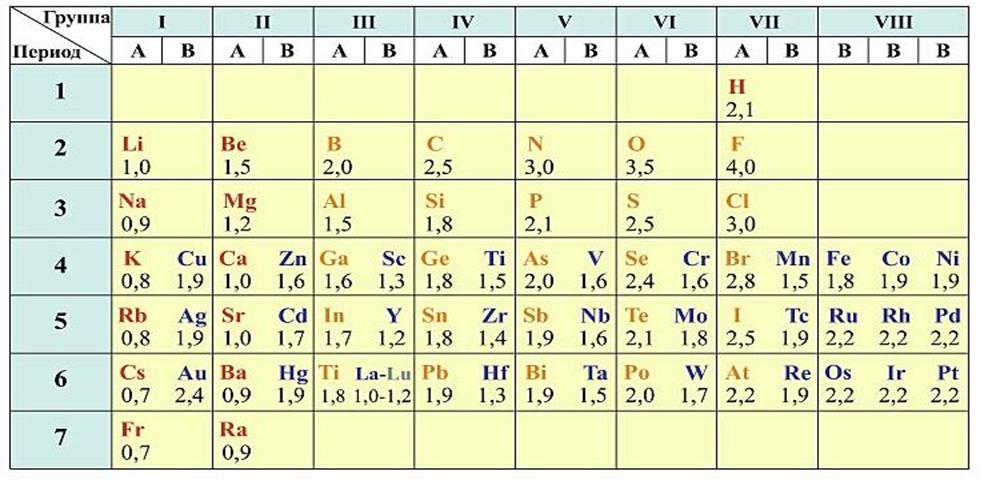 И. Менделеев при обосновании периодического закона. Таким образом, логически и исторически познание химии идёт по пути «наблюдаемые свойства вещества — обобщения — более широкий набор свойств более широкого набора веществ». Если снова обратиться к Д. И. Менделееву и периодическому закону, то начало пути — это такие свойства элементов как атомная масса, физические и химические свойства простых веществ, состав и свойства оксидов и гидридов, физические, кристаллохимические и химические свойства галогенидов и других соединений. Потом последовало знаменитое обобщение — периодический закон и многочисленные уточнения и предсказания.
И. Менделеев при обосновании периодического закона. Таким образом, логически и исторически познание химии идёт по пути «наблюдаемые свойства вещества — обобщения — более широкий набор свойств более широкого набора веществ». Если снова обратиться к Д. И. Менделееву и периодическому закону, то начало пути — это такие свойства элементов как атомная масса, физические и химические свойства простых веществ, состав и свойства оксидов и гидридов, физические, кристаллохимические и химические свойства галогенидов и других соединений. Потом последовало знаменитое обобщение — периодический закон и многочисленные уточнения и предсказания.
Сейчас же школьнику для освоения учения о химической связи предлагается сразу вторая половина логического пути: «обобщения — свойства вещества», причём очевидно, что обобщения можно вводить только простые, доступные для понимания без сложного математического аппарата. В нашем случае это, прежде всего, электроотрицательность — условное ненаблюдаемое свойство атомов в соединениях, обобщённое по всем соединениям данного элемента. Если мы хотим, чтобы школьник умел грамотно пользоваться этим понятием, то надо подробно охарактеризовать его физический смысл, а если нам нужна ещё шкала электроотрицательностей, то надо обоснованно выбрать одну из предложенных на сегодня шкал (а их введено в научный обиход около 20) и пояснить её происхождение. В любом случае это происхождение основано в конечном итоге на наблюдаемых свойствах. Такой сложный путь явно нерационален, а тесты и задачи, опирающиеся на количественную шкалу электроотрицательности применительно к отдельным веществам, — явно некорректны. Отметим также, что разность ЭО, оценённая по любой из имеющихся шкал, в принципе недостаточна для оценки типа связи по ряду причин. Во-первых, как отмечено выше, электроотрицательность усреднена по всем соединениям данного элемента и, следовательно, по разным степеням окисления. Во-вторых, для образования ионной связи между атомами двух элементов важно не только перемещение электронов, но и соотношение размеров ионов и их поляризуемость.
Если мы хотим, чтобы школьник умел грамотно пользоваться этим понятием, то надо подробно охарактеризовать его физический смысл, а если нам нужна ещё шкала электроотрицательностей, то надо обоснованно выбрать одну из предложенных на сегодня шкал (а их введено в научный обиход около 20) и пояснить её происхождение. В любом случае это происхождение основано в конечном итоге на наблюдаемых свойствах. Такой сложный путь явно нерационален, а тесты и задачи, опирающиеся на количественную шкалу электроотрицательности применительно к отдельным веществам, — явно некорректны. Отметим также, что разность ЭО, оценённая по любой из имеющихся шкал, в принципе недостаточна для оценки типа связи по ряду причин. Во-первых, как отмечено выше, электроотрицательность усреднена по всем соединениям данного элемента и, следовательно, по разным степеням окисления. Во-вторых, для образования ионной связи между атомами двух элементов важно не только перемещение электронов, но и соотношение размеров ионов и их поляризуемость.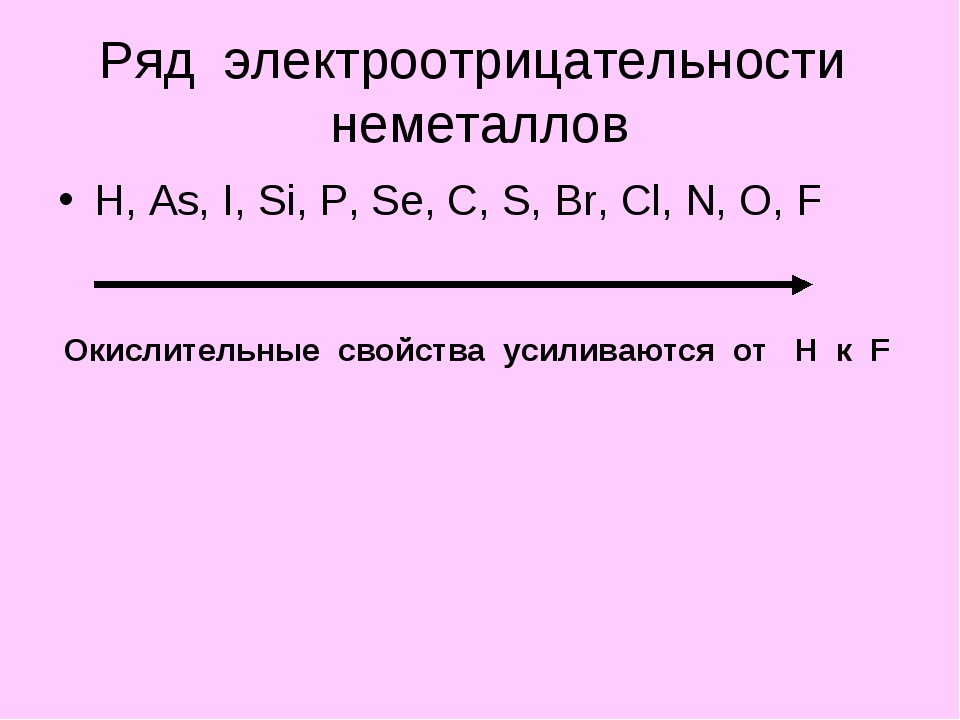 Например, А12 Оз принято рассматривать как ионное соединение, так как разность ЭО кислорода и алюминия велика — 2,0 по термохимической шкале Полинга. Действительно, оксид алюминия в виде корунда представляет собой исключительно твёрдые и тугоплавкие кристаллы (Тпл = 2050 °С), что характерно для соединений с преимущественно ионной связью. В то же время разность ЭО фтора и водорода по той же шкале составляет почти такую же величину, а именно 1,9, и школьные учебники дружно и вполне правильно рассматривают HF как соединение с полярной ковалентной связью. В то же время ионные иодиды натрия и калия характеризуются ещё меньшей разностью ЭО: 1,5 и 1,6, соответственно.
Например, А12 Оз принято рассматривать как ионное соединение, так как разность ЭО кислорода и алюминия велика — 2,0 по термохимической шкале Полинга. Действительно, оксид алюминия в виде корунда представляет собой исключительно твёрдые и тугоплавкие кристаллы (Тпл = 2050 °С), что характерно для соединений с преимущественно ионной связью. В то же время разность ЭО фтора и водорода по той же шкале составляет почти такую же величину, а именно 1,9, и школьные учебники дружно и вполне правильно рассматривают HF как соединение с полярной ковалентной связью. В то же время ионные иодиды натрия и калия характеризуются ещё меньшей разностью ЭО: 1,5 и 1,6, соответственно.
Что можно предложить взамен критикуемого подхода без введения лишних понятий и без потери стройности системы обучения? Ответ прост: уже прозвучавшее «наблюдаемые свойства веществ — обобщения — расширенный набор свойств веществ». Исходим из наблюдаемых свойств известных соединений, сведения о которых легко доступны школьнику, делаем заключения о виде связи и, опираясь на периодический закон, предсказываем вид связи и свойства любых веществ. Проще всего пояснить это на примерах.
Проще всего пояснить это на примерах.
Пусть нас интересует ионная связь, причём мы хорошо знаем, что речь идёт о преимущественно ионной связи. Типичные соединения с ионной связью — это тугоплавкие, труднолетучие хрупкие кристаллы, обладающие высокой твёрдостью и исключительно низкой электрической проводимостью, в то время как их расплавы хорошо проводят электрический ток. Соединения же с ковалентной связью построены из отдельных молекул, относительно слабо связанных друг с другом. Они представляют собой газы, жидкости или легкоплавкие, часто летучие, кристаллы, которые обладают низкой электрической проводимостью так же, как и их расплавы. Отметим, что окончательное и обоснованное заключение о преимущественно ионном или ковалентном характере твёрдых соединений можно сделать только на основании анализа кристалллических решёток веществ, что выходит далеко за рамки школьной химии.
В качестве примера обратимся к данным табл. 1. Нетрудно видеть:
1. Нетрудно видеть:
1. Все фториды — преимущественно ионные соединения.
2. В ряду галогенидов элементов второй группы «степень ионности» у галогенидов бериллия минимальна.
3. «Степень ионности» для каждого элемента II группы уменьшается при переходе от фторидов к иодидам.
Также хорошо видно, что любые количественные оценки «степени ионности» были бы ненадёжными и необоснованными, но в разумно построенных рядах родственных соединений с одинаковой стехиометрией достаточно надёжно прослеживается ход изменений, что и можно положить в основу соответствующих тестов. Примеров, подобных приведённому, можно предложить великое множество, но это уже выходит за рамки данной статьи. На основе наблюдаемых характеристик можно далее сравнивать ход изменений металлических и неметаллических свойств элементов, их относительную электроотрицательность (без введения каких-либо шкал), склонность к гидролизу, кислотно-основные свойства, растворимость, способность к образованию кристаллогидратов и т. д.
д.
Таким образом, мы считаем, что при обсуждении природы химических связей в средней школе необходимо соблюдать следующую логику:
• Рассматривать наблюдаемые свойства веществ, которые может объяснить теория химической связи;
• Изучить основные положения теории химической связи;
• Показать, как она работает, т. е. как объясняет и предсказывает наблюдаемые свойства веществ.
И, конечно же, все некорректные определения понятий, упражнения и тесты должны быть полностью изъяты из обращения, что посильно лишь специалистам с глубоким знанием химии и смежных естественнонаучных дисциплин.
Таблица 1 Температуры плавления и кипения галогенидов элементов второй группы
Соединение Тпл, °С Ткип, С
ВеРо 800 1175
1263 ~ 2270
СаР2 1418 ~ 2530
ЯгРз 1570 ~ 2460
ВаР2 1370 2250
ВеС12 415 550
МёС12 714 1417
СаС12 772 ~ 1960
ЯгСЬ 874 ~ 2040
ВаС12 962 2050
Ве12 490 530
М^з 633 1014
Са12 783 1760
ЯгЬ 538 ~ 1900
Ва12 711 1900
Литература
1. Щеглов Н. П. Начальные основания химии. Указатель открытий по физике, химии, естественной истории и технологии. СПб., 1830. Т. 7. Ч. 2. 734 с.
Щеглов Н. П. Начальные основания химии. Указатель открытий по физике, химии, естественной истории и технологии. СПб., 1830. Т. 7. Ч. 2. 734 с.
2. Гесс Г. И. Основания чистой химии, сокращённые в пользу учебных заведений. СПб., 1834. 590 с.
3. Щеглов Н. Т. Краткая химия. СПб., 1841. 635 с.
4. Сиджвик Н. В. Природа связей в химических соединениях. Л., 1936. 108 с.
5. Полинг Л. Природа химической связи. М.; Л., 1947. 440 с.
6. Верховский В. Н. Неорганическая химия. Учебник для 8-10 классов средней школы. М.; Л., 1947. С. 149-152.
7. Левченко В. В., Иванцова М. А., Соловьев Н. Г., Фельдт В. В. Химия. Учебник для 8-10 классов средней школы. М., 1949. С. 309-310.
309-310.
8. Ходаков Ю. В., Эпштейн Д. А., Глориозов П. А. Неорганическая химия. Учебник для 7-8 классов. М., 1975. С. 164, 169.
9. Рудзитис Г. Е., Фельдман Ф. Г. Химия. 7-11. М., 1981. С. 119.
10. Бердоносов С. С. Химия. 8 класс. М., 2002. С. 41-43, 98-100.
11. Кузнецова Н. Е., Титова И. М., Гара Н. Н., Жегин А. Ю. Химия. 8 класс. М., 2003.
С. 162, 157, 174.
12. Новошинский И. Н., Новошинская Н. С. Химия. 8 класс. М., 2002. С. 52, 53, 61, 63.
13. Габриелян О. С. Химия. 8 класс. М., 2002. С. 37, 43-45.
14. Иванова Р. Г., Каверина А. А., Корощенко А. С. Контроль знаний учащихся по химии.
8-9 классы. М., 2003. 96 с.
15. Савинкина Е. В., Живейнова О. Г., Логинова Г. П. Химия. Учебное пособие для школьников старших классов и абитуриентов. М., 2003. 286 с.
16. Семёнов И. Н., Петрова Г. А. Химия. Учебное пособие для поступающих в вузы. СПб., 1995. 316 с.
17. Семёнов И. Н., Перфилова И. Л. Химия. СПб., 2000. 655 с.
Принято к публикации 26 декабря 2008 г.
Ковалентная полярная неполярная связь
Методическая разработка
Ф.И.О. автор
Шурыгина Валентина Сергеевна
Место работы
МБОУ ООШ № 34
г. Озерск, Челябинской области
Озерск, Челябинской области
Должность
Учитель химии
Урок химии в 8 классе
Полярная и неполярная ковалентные связи.
Цель урока. Сформировать представления о химической связи между
атомами элементов, показать механизм ее образования. Понимать механизм
образования ковалентных соединений с полярной и неполярной связью в
виде схем.
Основные понятия. Ковалентная связь, полярная и неполярная ковалентные связи.
Планируемые результаты обучения. Знать определение ковалентной связи, механизм ее образования. Уметь различать электронные и структурные формулы соединений с ковалентной полярной и неполярной связью, электронные схемы образования ковалентных соединений.
Задачи урока.
Обучающие: на основании знаний о строении атомов разобраться, что и как заставляет атомы соединяться друг с другом в молекулы и другие структурные соединения сложных веществ.

Развивающие: продолжить формирование убежденности в познаваемости мира веществ и взаимосвязи противоположностей.
Воспитывающие: воспитание устойчивого интереса к предмету, воспитание таких нравственных качеств, как аккуратность, дисциплина, умение анализировать, выделять главное в учебном материале, делать выводы.
Оборудование: таблица «Периодическая система химических элементов Д.И. Менделеева». Ряд ЭО, таблица «Образование ковалентной связи» (на доске). Дидактический материал (раздаточный материал) »: таблица «Периодическая система и строение атомов химических элементов», «Виды химической связи», «Образование химических связей», «Ковалентная неполярная химическая связь», «Ковалентная полярная химическая связь».
Тип урока: урок объяснения нового материала.
Ход урока
Организационный момент.

Подготовка учащихся к работе на уроке.
Постановка цели и задачи урока.
На основании знаний о строении атомов разобраться, что и как заставляет атомы соединяться друг с другом.
Научиться различать электронные схемы образования ковалентных соединений, показывать смещение электронной плотности.
III. Подготовка к изучению нового материала, актуализация
знаний и опыта.
А) Что надо вспомнить.
Работа с таблицами « Периодическая система химических элементов Д.И.Менделеева», « Периодическая система и строение атомов химических элементов».
1. В чем особенности строения атомов металлов, неметаллов, инертных газов? Назовите химический элемент, который имеет следующее строение атома:
2 8 1
2 8 1 – это металл натрий.
У металлов на внешнем электронном слое атома находится от 1 до 3 электронов.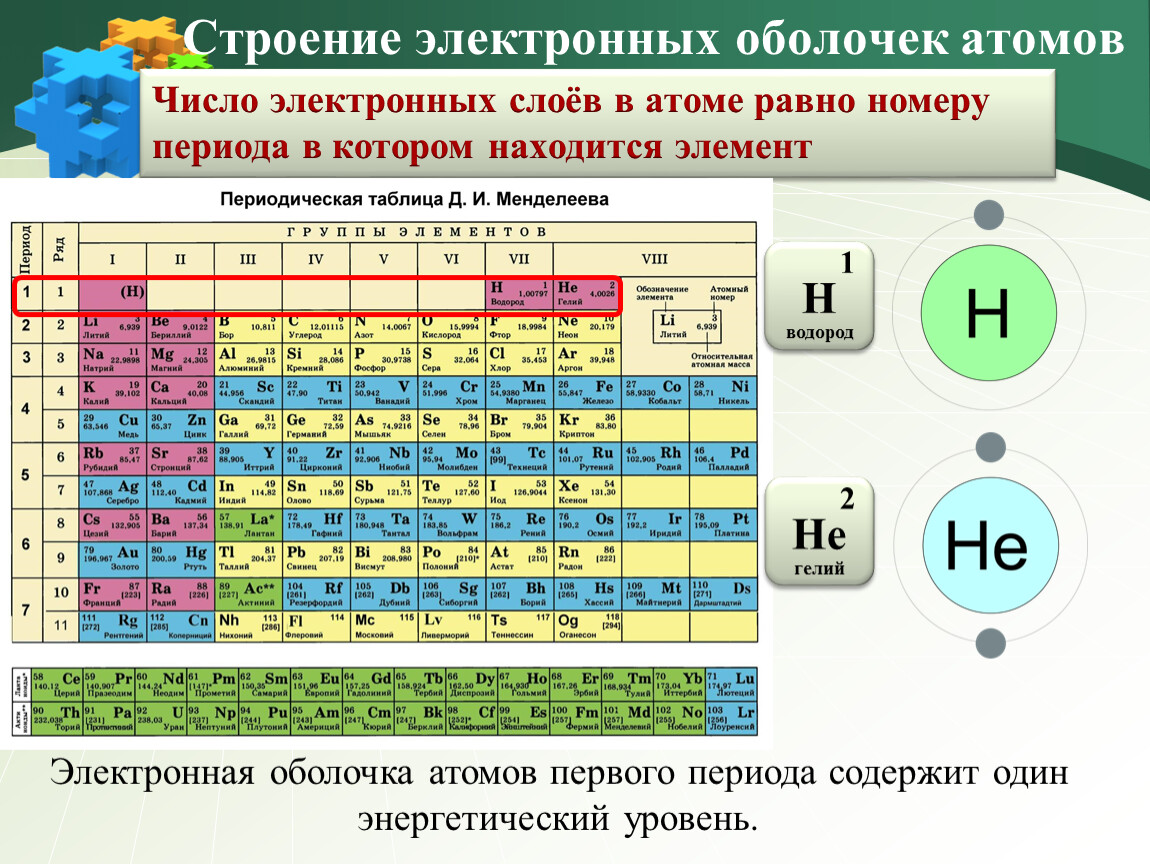 Металлы легко отдают электроны, чтобы внешний электронный слой был его устойчив.
Металлы легко отдают электроны, чтобы внешний электронный слой был его устойчив.
2 8 7
2 8 7 – это неметалл хлор.
У неметаллов на внешнем электронном слое находится от 4 до 7 электронов. Неметаллы легко принимают электроны, чтобы внешний электронный слой был устойчив.
2 8 8
2 8 8 – это инертный газ аргон. Внешний слой атома аргона устойчив.
2. Что собой представляет завершенный и незавершенный электронный слой?
Незавершенный электронный слой атома представлен от 1 до 7 электронов.
Завершенный электронный слой атома состоит из 8 электронов — это оболочка инертных газов, исключение 2 электрона у гелия.
3.Сколько электронов на внешнем слое атома главных А- подгрупп.
Количество электронов на внешнем слое атома равно номеру А- подгруппы.
Химические элементы 1-А подгруппы имеют один электрон, 2 – А подгруппы
два электрона и т.д.
Как по положению элемента в периодической системе определить число парных и непарных электронов на внешнем слое?
Для металлов число непарных электронов равно номеру А – подгрупп.
Примеры. Сколько непарных электронов на внешнем слое атома натрия?, магния?, алюминия?
Для неметаллов число непарных электронов на внешнем слое атома определяется по формуле 8 — № группы.
Примеры. Определите число непарных электронов у атомов хлора, серы, фосфора.
Б) Записи в тетради.
Вывод.
В образовании химической связи участвуют в основном непарные
электроны наружного электронного слоя атома.
Сущность образования химической связи состоит в спаривании непарных электронов.
Мы ответили на один из вопросов, поставленный в задачах нынешнего урока. Какой? ( Что заставляет атомы соединяться в молекулы).
У: Правильно, если в атоме нет непарных электронов и нет возможности для их распаривания, как у инертных газов, они не образуют химической связи, не образуют соединений, поэтому они инертны.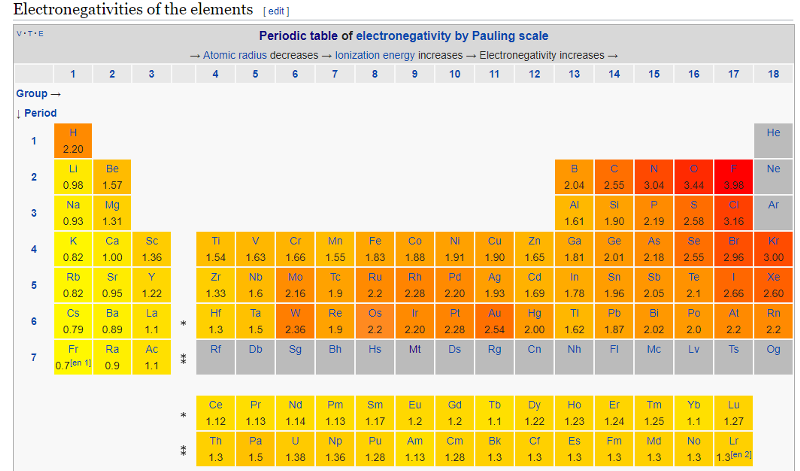
IV. Проблемная задача. А вот как происходит это спаривание, нам предстоит разобраться. Процесс спаривания электронов может идти по ковалентному механизму.
V. Обсуждение в группах. Самостоятельный поиск учащимися информации по таблицам заданиям « Виды химической связи», «Образование химических связей», учебник химии для 8 класса.
1 группа работает над вопросом « Что лежит в основе образования химической связи?» (ответ-запись в тетради, вывод № 2),
«Что такое электроотрицательность?».
2 группа работает над вопросом « Какая связь называется ковалентной неполярной?»
3 группа. «Какая связь называется ковалентной полярной?»
VI. Формирование решение проблемы, обсуждение в группе и фронтальные ответы.
1. Приглашается представитель 1 группы, который обозначает точками электроны наружного слоя атомов следующих элементов: Н, С, N, О, С1, определяет число непарных электронов данных атомов.
2. Следующий учащийся дает определение «Что такое электроотрицательность».
3. Назовите самый электроотрицательтный элемент. Какому элементу по ЭО можно дать золотую медаль? А какому элементу можно присудить серебро, бронзу?
4. Пользуясь рядом электроотрицательности определите, в какую сторону какого химического элемента будут смещены электроны в следующих соединениях: СН4, НС1, Н2S, N2O5, F2O.
5. Что такое ковалентная неполярная связь? Ковалентная полярная связь? При раскрытии данного вопроса могут возникнуть затруднения в решении проблемной ситуации у учащихся.
Учитель объясняет, что такое ковалентная неполярная, полярная связи, электронные схемы образования химических связей в соединениях с ковалентной неполярной и полярной связями (по таблице на доске «Образование ковалентной связи»).
При взаимодействии двух атомов одного и того же элемента-неметалла между ними образуется ковалентная химическая связь с помощью общих электронных пар. Эту ковалентную связь называют неполярной, так как общие электронные пары принадлежат обоим атомам в одинаковой степени и ни на одном из них не будет избытка или недостатка отрицательного заряда, который несут электроны. Электронную пару в соединении можно изобразить графически, такая формула называется структурной формулой.
Эту ковалентную связь называют неполярной, так как общие электронные пары принадлежат обоим атомам в одинаковой степени и ни на одном из них не будет избытка или недостатка отрицательного заряда, который несут электроны. Электронную пару в соединении можно изобразить графически, такая формула называется структурной формулой.
Рассмотрим взаимодействие двух разных атомов неметаллов, например, при образовании молекулы хлороводорода. Пользуясь рядом ЭО, можно определить, куда смещаются общие электронные пары. При образовании молекулы хлороводорода электронная пара смещена к атому хлора, так как его ЭО больше, чем у водорода. В результате на атомах образуются частичные заряды, в молекуле возникают два полюса-положительный у атома водорода и отрицательный у атома хлора. Поэтому такую ковалентную связь называют полярной.
Учащиеся отвечают на поставленные вопросы « Что такое ковалентная неполярная связь? Ковалентная полярная связь?
VII. Закрепление изученного материала.
Закрепление изученного материала.
Работа с дидактическим материалом «Ковалентная неполярная химическая связь».
Задание 2. Игра в «крестики – нолики». Покажите выигрышный путь, состоящий из пар химических элементов, между атомами которых образуется ковалентная неполярная связь.
Задание 3. Определите структурную формулу вещества с одинарной связью.
Задание 4. Определите электронную формулу вещества с двойной связью.
Задание 5. Игра в «крестики – нолики». Покажите выигрышный путь, состоящий из формул веществ с ковалентной неполярной связью.
Работа с дидактическим материалом «Ковалентная полярная связь».
Вывод. Определение. Какая связь называется ковалентной неполярной связью? Ковалентной полярной связью?
VIII. Итоги урока.
Тест. Как я усвоил материал.
А) Получил прочные знания, усвоил весь материал.
Б) Усвоил материал частично. -}.7N2e−,5e−. На внешнем (незавершенном) слое — пять электронов.
-}.7N2e−,5e−. На внешнем (незавершенном) слое — пять электронов.
4) Элемент относится к группе неметаллов. Его простое вещество при обычных условиях находится в газообразном агрегатном состоянии. Формула простого вещества N2\mathrm{N_2}N2.
5) Валентность азота в высшем оксиде равна V, так как это элемент V группы. Валентность в летучем водородном соединении равна III.
6) Формула высшего оксида — N2O5\mathrm{N_2O_5}N2O5. Он принадлежит к кислотным оксидам. Гидроксид, соответствующий ему, предел являет собой кислоту HNO3\mathrm{HNO_3}HNO3.
7) Формула летучего водородного соединения — Nh4\mathrm{NH_3}Nh4.
в) Алюминий
1) Название химического элемента — алюминий, химический знак Al, относительная масса 27.
2) Атомный (порядковый) номер в периодической системе 13, элемент 3-го периода (малого), IIIA-группы (главной).
3) Заряд ядра атома 13+, оно содержит 13 протонов; в ядре нуклида 1327Al  14\mathrm{_{13}^{27}Al\,\, 14}1327Al14 нейтронов.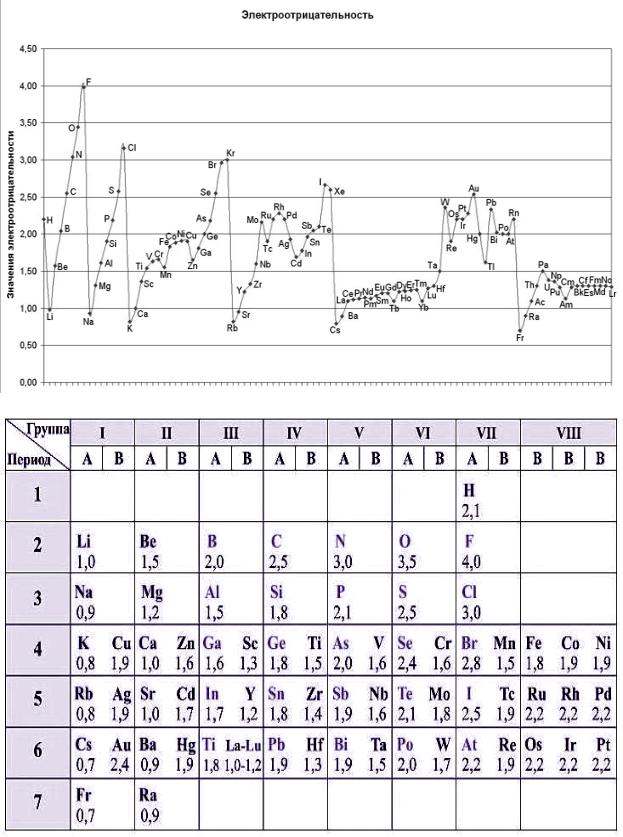 -.}17Cl2e−,8e−,7e−. На внеш нем (незавершенном) слое семь электронов.
-.}17Cl2e−,8e−,7e−. На внеш нем (незавершенном) слое семь электронов.
4) Элемент относится к группе неметаллов. Его простое вещество при обычных условиях находится в газообразном агрегатном состоянии. Формула простого вещества — Cl2\mathrm{Cl_2}Cl2.
5) Валентность хлора в высшем оксиде равна VII, так как это элемент VII-А группы. Валентность в летучем водородном соединении равна I.
6) Формула высшего оксида — Cl2O7\mathrm{Cl_2O_7}Cl2O7. Он принадлежит к кислотным оксидам. Гидроксид, соответствующий ему, представляет собой кислоту — HClO4\mathrm{HClO_4}HClO4.
7) Формула летучего водородного соединения — HCl\mathrm{HCl}HCl.
Понятие электроотрицательности — урок. Химия, 8–9 класс.
Все известные химические элементы можно разделить на металлы и неметаллы.
Металлы — элементы, атомы которых способны отдавать электроны.
Неметаллы — элементы, атомы которых могут принимать электроны.
При взаимодействии металла с неметаллом атом первого теряет электроны, а атом второго их присоединяет.
А что происходит, если взаимодействуют атомы двух неметаллов?
Сравним атомы серы и кислорода:
O8 +8 2e, 6e;
S16 +16 2e, 8e, 6e.
Радиус атома серы больше, валентные электроны слабее связаны с ядром. При образовании связи произойдёт сдвиг электронов от серы к кислороду.
Сравним атомы углерода и кислорода:
O8 +8 2e, 6e;
C6 +6 2е, 4е.
Заряд ядра атома кислорода больше, и притягивать к себе электроны он будет сильнее.
Значит, атомы разных неметаллов притягивают к себе электроны неодинаково.
Способность атомов элементов оттягивать к себе общие электронные пары в химических соединениях называется электроотрицательностью (ЭО).
Так как общие электронные пары образуются валентными электронами, то можно сказать, что электроотрицательность — это способность атома притягивать к себе валентные электроны от других атомов.
Обрати внимание!
Чем больше электроотрицательность, тем сильнее у элемента выражены неметаллические свойства.
Шкала относительной электроотрицательности Полинга
Абсолютные значения ЭО — неудобные для работы числа. Поэтому обычно используют относительную электроотрицательность по шкале Полинга. За единицу в ней принята ЭО лития.
По шкале Полинга наиболее электроотрицательным среди элементов, способных образовывать соединения, является фтор, а наименее электроотрицательным — франций. ЭО франция равна \(0,7\), а ЭО фтора — \(4\). ЭО остальных элементов изменяются в пределах от \(0,7\) до \(4\).
Как правило, неметаллы имеют ЭО больше двух. У металлов значение ЭО меньше двух. Некоторые элементы (B,Si,Ge,As,Te) со значениями электроотрицательности, близкими к \(2\), способны проявлять промежуточные свойства.
Элементы с высокой и низкой электроотрицательностью считаются активными. С высокой — активные неметаллы, с низкой — активные металлы. У первых ЭО близка к \(3\)–\(4\), у вторых — к \(1\).
С высокой — активные неметаллы, с низкой — активные металлы. У первых ЭО близка к \(3\)–\(4\), у вторых — к \(1\).
Изменение электроотрицательности в Периодической системе
С увеличением порядкового номера элементов ЭО изменяется периодически.
В периоде она растёт слева направо при накоплении электронов на внешнем слое.
В группе она убывает сверху вниз при увеличении числа электронных слоёв и увеличении атомных радиусов.
Наибольшей ЭО в каждом периоде обладают самые маленькие атомы с семью внешними электронами — атомы галогенов (инертные газы соединений не образуют).
Наименьшая ЭО в периоде у самого большого атома с одним внешним электроном — атома щелочного металла.
Обрати внимание!
Значения электроотрицательности элементов позволяют определить:
— заряды атомов в соединении;— сдвиг электронов при образовании химической связи.
Установим, как происходит сдвиг электронов при взаимодействии атомов хлора и серы, cеры и кислорода.
Пример:
хлор и сера расположены в третьем периоде. Электроотрицательность по периоду возрастает слева направо. ЭО хлора больше ЭО серы, значит, электроны будут сдвинуты от серы к хлору. Заряд атома серы будет положительным, а хлора — отрицательным:
Sδ+→Clδ−.
Проверим вывод по шкале Полинга. Электроотрицательность хлора равна \(3\), а электроотрицательность серы — \(2,5\). Хлор более электроотрицательный.
Пример:
кислород и сера расположены в шестой А группе. Электроотрицательность по группе сверху вниз уменьшается. ЭО кислорода больше ЭО серы, значит, электроны будут сдвинуты от серы к кислороду. Атом серы имеет положительный заряд, а кислорода — отрицательный:
Sδ+→Oδ−.
По шкале Полинга электроотрицательность кислорода равна \(3,5\), а электроотрицательность серы — \(2,5\). Более электроотрицательный — кислород.
При сравнении ЭО элементов часто используют ряд электроотрицательности, расположив элементы в порядке убывания её значения:
F,O,N,Cl,Br,S,C,P,H,Si,Mg,Li,Na.
Химическая связь. Строение веществ | 8 класс
199. Допишите определение.
Электроотрицательность – это свойство атомов данного элемента оттягивать на себя электроны от атомов других элементов в соединениях.
200. Приведены значения электроотрицательности химических элементов 2-го периода:
2. Подчеркните правильное предположение.
От чего может зависеть изменение значения электроотрицательности элементов в периоде?
а) от атомного радиуса; б) от заряда ядра; в) от числа электронов на внешнем энергетическом уровне.
201. 1. Нарисуйте электронные конфигурации атомов элементов IA-группы (главной подгруппы I группы).
2. Как изменяется значение электроотрицательности у атомов элементов А-групп в направлении сверху вниз?
У атомов элементов А-групп сверху вниз электроотрицательность уменьшается.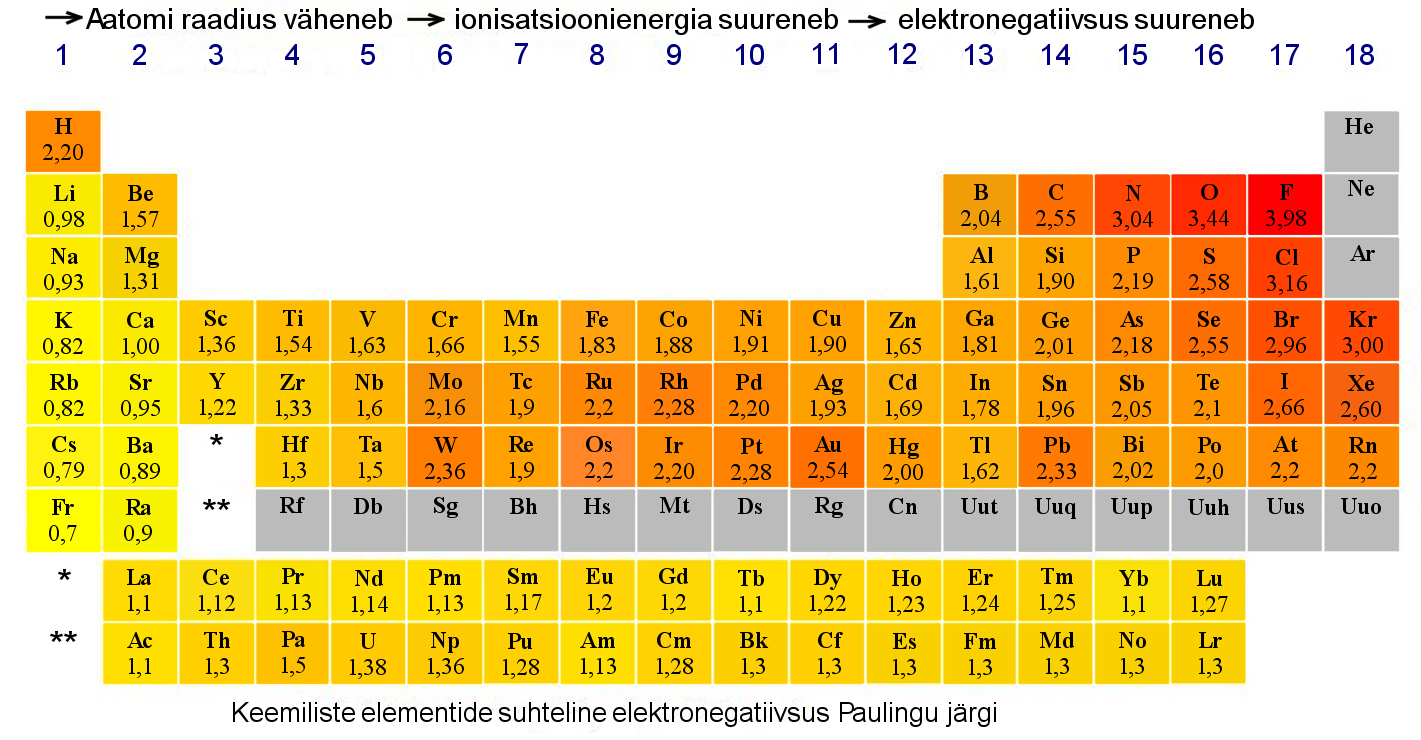
202. Как связано проявление атомами элементов металлических и неметаллических свойств со значением электроотрицательности?
У металлов электроотрицательность, как правило меньше двух, а у неметаллов – больше двух.
203. Обозначьте с помощью знака > или <, какой из двух элементов обладает большим значением электроотрицательности:
а) Mg>Ca; в) Na>K; д) I>At;
б) Ga>In; г) Si>Ge; е) As<Se.
204. Изобразите электронные конфигурации атомов и схемы распределения электронов по орбиталям внешнего энергетического уровня. Какие электроны будут являться валентными?
а) кислород
б) азот
в) фтор
205. Пользуясь таблицей 19 учебника «Относительная электроотрицательность некоторых химических элементов», расположите данные химические элементы в порядке возрастания их электроотрицательности.
Ag, K, Ca, Mg, Al, B, H, P, S, O.
|
Электроотрицательность (ЭО) представляет собой обобщенную характеристику элемента, связанную не с электронами на отдельных орбиталях, а с внешними электронами вообще, определяемую как сумма энергии ионизации и сродства к электрону. Под электроотрицательностью понимают относительную характеристику способности атома, притягивать электронную пару. Если электроотрицательность атомов, образующих молекулу, одинакова или очень близка, то общая электронная пара располагается симметрично по отношению к обоим ядрам.
(Dc)СаСl2 =3.16-1.0=2.16 связь ионная, электронное облако связи смещено в сторону хлора (Dc)РН3= 2,2-2,19=0,01 связь ковалентная неполярная |
Электроотрицательность — Chemistry LibreTexts
Электроотрицательность — это мера тенденции атома притягивать связывающую пару электронов. Чаще всего используется шкала Полинга. Фтору (наиболее электроотрицательному элементу) присваивается значение 4,0, а значения варьируются до цезия и франция, которые являются наименее электроотрицательными при 0,7.
Что, если два атома с одинаковой электроотрицательностью связаны вместе?
Рассмотрим связь между двумя атомами, A и B. Если атомы одинаково электроотрицательны, оба имеют одинаковую тенденцию притягивать связывающую пару электронов, и поэтому она будет находиться в среднем на полпути между двумя атомами:
Чтобы получить такую связь, A и B обычно должны быть одним и тем же атомом.Вы найдете такую связь, например, в молекулах H 2 или Cl 2 . Примечание: Важно понимать, что это средняя картинка. Электроны на самом деле находятся на молекулярной орбитали и все время перемещаются по этой орбитали. Связь такого типа можно рассматривать как «чистую» ковалентную связь, в которой электроны равномерно распределяются между двумя атомами.
Что, если B немного более электроотрицателен, чем A?
B будет притягивать электронную пару больше, чем A.
Это означает, что конец B связи имеет более чем справедливую долю электронной плотности и поэтому становится немного отрицательным. В то же время конец A (довольно короткий от электронов) становится слегка положительным. На диаграмме «\ (\ delta \)» (читается как «дельта») означает «слегка», поэтому \ (\ delta + \) означает «слегка положительный».
Полярная связь — это ковалентная связь, в которой существует разделение зарядов между одним концом и другим, другими словами, в которой один конец является слегка положительным, а другой — слегка отрицательным.Примеры включают большинство ковалентных связей. Связь водород-хлор в HCl или связи водород-кислород в воде являются типичными.
Если B намного более электроотрицателен, чем A, то электронная пара перетаскивается прямо на конец связи B. Фактически, A потерял контроль над своим электроном, а B имеет полный контроль над обоими электронами. Ионы образовались. Тогда связь будет ионной, а не ковалентной.
«Спектр» облигаций
Смысл всего этого состоит в том, что нет четкого разделения между ковалентными и ионными связями.В чистой ковалентной связи электроны удерживаются в среднем ровно на полпути между атомами. В полярной связи электроны слегка притягиваются к одному концу. Как далеко должно пройти это затягивание, прежде чем связь будет считаться ионной? На это нет настоящего ответа. Хлорид натрия обычно считается ионным твердым телом, но даже здесь натрий не полностью потерял контроль над своим электроном. Однако из-за свойств хлорида натрия мы склонны считать его чисто ионным.С другой стороны, йодид лития можно охарактеризовать как «ионный с некоторым ковалентным характером». В этом случае пара электронов не переместилась полностью на йодный конец связи. Например, йодид лития растворяется в органических растворителях, таких как этанол, а ионные вещества не растворяются.
Сводка
- Отсутствие разницы в электроотрицательности между двумя атомами приводит к чистой неполярной ковалентной связи.
- Небольшая разница электроотрицательностей приводит к полярной ковалентной связи.
- Большая разница электроотрицательностей приводит к ионной связи.
Пример 1: Полярные связи против полярных молекул
В простой двухатомной молекуле, такой как HCl, если связь полярна, то вся молекула полярна. А как насчет более сложных молекул?
Рисунок: (слева) CCl 4 (справа) CHCl 3Рассмотрим CCl 4 (левая панель на рисунке выше), который как молекула неполярен — в том смысле, что у него нет конца. (или сторона), которая немного отрицательна, а другая — немного положительна.Вся внешняя часть молекулы несколько отрицательна, но нет общего разделения заряда сверху вниз или слева направо.
Напротив, CHCl 3 — полярная молекула (правая панель на рисунке выше). Водород в верхней части молекулы менее электроотрицателен, чем углерод, и поэтому немного положителен. Это означает, что молекула теперь имеет слегка положительный «верх» и слегка отрицательный «низ», и поэтому в целом молекула является полярной.
Полярная молекула должна быть каким-то образом «односторонней».2} \]
В этом выражении Q представляет собой заряд, k представляет собой константу, а r представляет собой расстояние между зарядами. Когда r = 2, то r 2 = 4. Когда r = 3, то r 2 = 9. Когда r = 4, то r 2 = 16. Из этих чисел легко видно, что, поскольку расстояние между зарядами увеличивается, сила уменьшается очень быстро. Это называется квадратичным изменением.
Результатом этого изменения является то, что электроотрицательность увеличивается снизу вверх в столбце периодической таблицы, даже если в элементах внизу столбца больше протонов.Элементы в верхней части столбца имеют большую электроотрицательность, чем элементы в нижней части данного столбца.
Общая тенденция электроотрицательности в таблице Менделеева диагональна от нижнего левого угла к верхнему правому углу. Поскольку электроотрицательность некоторых важных элементов не может быть определена этими тенденциями (они лежат не на той диагонали), мы должны запомнить следующий порядок электроотрицательности для некоторых из этих общих элементов.
F> O> Cl> N> Br> I> S> C> H> металлы
Самый электроотрицательный элемент — фтор.Если вы помните этот факт, все становится легко, потому что электроотрицательность всегда должна возрастать по отношению к фтору в Периодической таблице.
Примечание: Это упрощение игнорирует благородные газы. Исторически это связано с тем, что считалось, что они не образуют связей — и если они не образуют связей, у них не может быть значения электроотрицательности. Даже сейчас, когда мы знаем, что некоторые из них действительно образуют связи, источники данных по-прежнему не приводят для них значений электроотрицательности.
Тенденции электроотрицательности за период
Положительно заряженные протоны в ядре притягивают отрицательно заряженные электроны. По мере увеличения числа протонов в ядре электроотрицательность или притяжение будет увеличиваться. Следовательно, электроотрицательность увеличивается на с слева направо на подряд в периодической таблице. Этот эффект справедлив только для строки в периодической таблице, потому что притяжение между зарядами быстро спадает с расстоянием.График показывает электроотрицательность от натрия к хлору (без учета аргона, поскольку он не образует связей).
Тенденции снижения электроотрицательности группы
По мере того, как вы спускаетесь по группе, электроотрицательность уменьшается. (Если оно увеличивается до фтора, оно должно уменьшаться по мере снижения.) На диаграмме показаны закономерности электроотрицательности в группах 1 и 7.
Объяснение закономерностей в электроотрицательности
Притяжение, которое связывающая пара электронов испытывает к определенному ядру, зависит от:
- количество протонов в ядре;
- расстояние от ядра;
- степень экранирования внутренними электронами.
Почему электроотрицательность увеличивается с течением времени?
Рассмотрим натрий в начале периода 3 и хлор в конце (без учета благородного газа, аргона). Представьте, что хлорид натрия связан с ковалентной связью.
И натрий, и хлор имеют свои связывающие электроны на 3-м уровне. Электронная пара экранирована от обоих ядер 1s, 2s и 2p-электронами, но в ядре хлора есть еще 6 протонов. Неудивительно, что электронная пара так увлекается к хлору, что образуются ионы.Электроотрицательность увеличивается с течением времени, потому что количество зарядов на ядре увеличивается. Это сильнее притягивает связывающую пару электронов.
Почему электроотрицательность падает по мере того, как вы спускаетесь по группе?
По мере того, как вы спускаетесь на вниз на группу, электроотрицательность уменьшается на , потому что связывающая пара электронов все больше отдаляется от притяжения ядра. Рассмотрим молекулы фтороводорода и хлористого водорода:
Связующая пара защищена от ядра фтора только 1s 2 электронами.В случае хлора он экранирован всеми 1s 2 2s 2 2p 6 электронами. В каждом случае чистое притяжение от центра фтора или хлора +7. Но фтор имеет пару связей на 2-м уровне, а не на 3-м уровне, как в хлоре. Чем ближе к ядру, тем больше притяжение.
Диагональные отношения в Периодической таблице
В начале периодов 2 и 3 Периодической таблицы есть несколько случаев, когда элемент в верхней части одной группы имеет некоторое сходство с элементом в следующей группе.На схеме ниже показаны три примера. Обратите внимание, что сходство проявляется в элементах, которые расположены по диагонали друг к другу, а не бок о бок.
Например, бор — неметалл с некоторыми свойствами, похожими на кремний. В отличие от остальной группы 2, бериллий имеет некоторые свойства, напоминающие алюминий. А литий обладает некоторыми свойствами, которые отличаются от других элементов в группе 1, и в некоторых отношениях напоминает магний. Говорят, что между этими элементами существует диагональная связь.Для этого есть несколько причин, но каждая зависит от того, как атомные свойства, такие как электроотрицательность, изменяются в Периодической таблице. Итак, мы быстро рассмотрим это в отношении электроотрицательности — что, вероятно, проще всего объяснить.
Объяснение диагональной зависимости относительно электроотрицательности
Электроотрицательность увеличивается по Периодической таблице. Так, например, электроотрицательность бериллия и бора составляет:
Электроотрицательность падает по мере того, как вы спускаетесь по Периодической таблице.Так, например, электроотрицательности бора и алюминия:
Итак, сравнивая Be и Al, вы обнаруживаете, что значения (случайно) точно совпадают. Увеличение от группы 2 к группе 3 компенсируется падением по мере перехода от группы 3 к группе бора к алюминию. Нечто подобное происходит с литием (1,0) с магнием (1,2) и с бором (2,0) с кремнием (1,8). В этих случаях электроотрицательности не совсем одинаковы, но очень близки.
Сходная электроотрицательность между членами этих диагональных пар означает, что они могут образовывать схожие типы связей, и это повлияет на их химию.Вы можете встретить примеры этого позже в своем курсе.
Авторы и авторство
Электроотрицательность | Безграничная химия
Электроотрицательность и окислительное число
Электроотрицательность — это тенденция атома / молекулы притягивать электроны; Степень окисления является показателем его связывающей среды.
Цели обучения
Применить правила присвоения степени окисления атомам в соединениях
Основные выводы
Ключевые моменты
- На электроотрицательность атома влияет как атомный номер элемента, так и его размер.
- Чем выше его электроотрицательность, тем больше элемент притягивает электроны.
- Атому с более высокой электроотрицательностью, обычно неметаллическому элементу, присваивается отрицательная степень окисления, а металлическим элементам обычно присваивается положительная степень окисления.
Ключевые термины
- электроотрицательность : химическое свойство, которое описывает тенденцию атома притягивать электроны (или электронную плотность) к себе.
- Степень окисления : гипотетический заряд, который имел бы атом в молекуле / соединении, если бы все связи были чисто ионными.Он указывает на степень окисления атома в химическом соединении.
Электроотрицательность
Электроотрицательность — это свойство, которое описывает тенденцию атома притягивать электроны (или электронную плотность) к себе. На электроотрицательность атома влияет как его атомный номер, так и размер атома. Чем выше его электроотрицательность, тем больше элемент притягивает электроны. Противоположностью электроотрицательности является электроположительность, которая является мерой способности элемента отдавать электроны.
Электроотрицательность не измеряется напрямую, а рассчитывается на основе экспериментальных измерений других атомных или молекулярных свойств. Было предложено несколько методов расчета, и хотя могут быть небольшие различия в численных значениях рассчитанных значений электроотрицательности, все методы показывают одну и ту же периодическую тенденцию среди элементов.
Электроотрицательность, как ее обычно вычисляют, не является строго свойством атома, а скорее свойством атома в молекуле.Свойства свободного атома включают энергию ионизации и сродство к электрону. Ожидается, что электроотрицательность элемента будет меняться в зависимости от его химического окружения, но обычно это свойство считается передаваемым; то есть аналогичные значения будут действительны в различных ситуациях.
На самом базовом уровне электроотрицательность определяется такими факторами, как заряд ядра и количество / расположение других электронов, присутствующих в атомных оболочках. Заряд ядра важен, потому что чем больше протонов в атоме, тем больше он «притягивает» отрицательные электроны.Когда электроны находятся в космосе, это вносит вклад, потому что чем больше электронов у атома, тем дальше от ядра будут находиться валентные электроны, и в результате они будут испытывать меньший положительный заряд; это связано с их увеличенным расстоянием от ядра и тем, что другие электроны на остовных орбиталях с более низкой энергией будут действовать, чтобы экранировать валентные электроны от положительно заряженного ядра.
Наиболее часто используемый метод расчета электроотрицательности был предложен Линусом Полингом.Этот метод дает безразмерную величину, обычно называемую шкалой Полинга, в диапазоне от 0,7 до 4. Если мы посмотрим на таблицу Менделеева без инертных газов, электроотрицательность будет наибольшей в правом верхнем углу и самой низкой в левом нижнем углу.
Электроотрицательность элементов : наибольшая электроотрицательность находится в правом верхнем углу таблицы, а наименьшая — в левом нижнем углу.
Следовательно, фтор (F) является наиболее электроотрицательным из элементов, а франций (Fr) — наименее электроотрицательным.
Число окисления
Обычно считается, что одно значение электроотрицательности является допустимым для большинства ситуаций связывания, в которых может находиться данный атом. Хотя этот подход имеет преимущество простоты, ясно, что электроотрицательность элемента не является неизменным атомным свойством; скорее, его можно представить как зависящее от величины, называемой «степенью окисления» элемента.
Один из способов охарактеризовать атомы в молекуле и отслеживать электроны — это присвоить степени окисления.Степень окисления — это электрический заряд, который имел бы атом, если бы связывающие электроны были отнесены исключительно к более электроотрицательному атому, и она может определить, какой атом окисляется, а какой восстанавливается в химическом процессе. При назначении степеней окисления можно использовать шесть правил:
- Степень окисления элемента в его естественном состоянии (то есть в том виде, в каком он встречается в природе) равна нулю. Например, водород в H 2 , кислород в O 2 , азот в N 2 , углерод в алмазе и т. Д., имеют нулевую степень окисления.
- В ионных соединениях ионный заряд атома равен его степени окисления.
- Сумма степеней окисления всех атомов в ионе или молекуле равна их чистому заряду.
- В соединениях с неметаллами степень окисления водорода +1. Однако, когда водород связан с металлом, его степень окисления снижается до -1, потому что металл является более электроположительным или менее электроотрицательным элементом.
- Кислоду большинству соединений присвоена степень окисления -2.Однако есть и исключения. В пероксидах (O 2 2- ), таких как пероксид водорода (H 2 O 2 ), степень окисления кислорода составляет -1. В дифториде кислорода (OF 2 ) степень окисления кислорода составляет +2, а в дифториде кислорода (O 2 F 2 ) кислороду присваивается степень окисления +1, поскольку фтор является более электроотрицательным элементом. в этих соединениях, поэтому ему присваивается степень окисления -1.
- Атому с более высокой электроотрицательностью, обычно неметаллическому элементу, присваивается отрицательная степень окисления, в то время как другому атому, который часто, но не обязательно, является металлическим элементом, присваивается положительная степень окисления.
Полярность связи
Молекулярная полярность зависит от наличия полярных ковалентных связей и трехмерной структуры молекулы.
Цели обучения
Применение знаний о полярности связей и геометрии молекул для определения дипольного момента молекул
Основные выводы
Ключевые моменты
- Когда неидентичные атомы связаны ковалентно, электронная пара будет сильнее притягиваться к атому, который имеет более высокую электроотрицательность.Это приводит к полярной ковалентной связи.
- Полярность означает разделение электрического заряда, приводящее к тому, что молекула или ее химические группы имеют электрический дипольный момент.
- Полярная молекула действует как электрический диполь, который может взаимодействовать с электрическими полями, созданными искусственно или возникающими из соседних ионов или полярных молекул.
- Дипольный момент [латекс] \ mu [/ латекс], который соответствует отдельной связи, дается произведением количества заряда q и длины связи r: [латекс] \ mu = qr [/ латекс].
Ключевые термины
- Полярность связи : Ковалентная связь полярна, если один атом более электроотрицателен, чем его партнер по связи, что приводит к общему дипольному моменту между двумя атомами.
- Дипольный момент : Мера полярности ковалентной связи или всей молекулы. Это произведение заряда на любом полюсе диполя и расстояния, разделяющего их.
- Молекулярная полярность : Молекула полярна, если у нее есть суммарный дипольный момент, который зависит от наличия полярных ковалентных связей и трехмерной структуры или геометрии молекулы.
Связь и молекулярная полярность
Полярность относится к разделению зарядов, которое создает постоянные положительные и отрицательные «электрические полюса». Эта концепция может применяться в двух контекстах:
- Полярность связи: когда атомы из разных элементов связаны ковалентно, общая пара электронов будет сильнее притягиваться к атому с более высокой электроотрицательностью . В результате электроны не будут разделены поровну. Такие связи называются «полярными» и обладают частично ионным характером.
- Молекулярная полярность: когда целая молекула, которая может состоять из нескольких ковалентных связей, имеет чистую полярность, причем один конец имеет более высокую концентрацию отрицательного заряда, а другой конец имеет избыток положительного заряда. Полярная молекула действует как электрический диполь, который может взаимодействовать с электрическими полями, которые создаются искусственно или возникают в результате взаимодействия с соседними ионами или другими полярными молекулами.
Дипольный момент
Диполи условно изображаются стрелками, указывающими в направлении отрицательного конца.Сила взаимодействия диполя с электрическим полем определяется электрическим дипольным моментом связи или молекулы. Дипольный момент рассчитывается путем оценки произведения величины разделенного заряда q и длины связи r:
.[латекс] \ mu = q r [/ латекс]
В единицах СИ q выражается в кулонах, а r — в метрах, поэтому μ имеет размеры [латекс] C \ cdot м [/ латекс]. Если два заряда величиной +1 и -1 разделены типичной длиной связи 100 пм, то:
[латекс] \ mu = (1.{-29} C \ cdot m = 4,8 D [/ латекс]
Единица Дебая, D, обычно используется для выражения дипольных моментов.
Определение дипольного момента молекулы
В молекулах, содержащих более одной полярной связи, дипольный момент молекулы является просто векторным сложением дипольных моментов отдельных связей. Будучи векторами, они могут усиливать или нейтрализовать друг друга в зависимости от геометрии молекулы. Следовательно, молекулы, содержащие полярные связи, могут быть в целом неполярными, как в примере с диоксидом углерода.
Молекулярный дипольный момент диоксида углерода : Линейная форма молекулы CO 2 приводит к сокращению дипольных моментов двух полярных связей C = O. Таким образом, суммарный дипольный момент молекулы CO 2 равен нулю, и молекула неполярна.
H 2 O, напротив, имеет очень большой молекулярный дипольный момент, который возникает из-за того, что две полярные связи H – O образуют между собой угол 104,5 °. Следовательно, молекула воды полярна.
Дипольный момент молекулы воды : Вода имеет очень большой дипольный момент, который является результатом двух полярных связей H – O, ориентированных под углом 104,5 ° друг к другу. Диполи связи складываются, образуя молекулярный диполь (обозначен зеленой стрелкой).
Частей Периодической таблицы
Разница в электроотрицательности двух связанных элементов определяет, какой тип связи они сформируют.Когда атомы с разницей электроотрицательностей больше чем две единицы соединяются вместе, то образующаяся связь ионная связь , в которой более электроотрицательный элемент имеет отрицательный заряд, а менее электроотрицательный элемент имеет положительный заряд. (По аналогии, вы можете думать об этом как о игра в перетягивание каната, в которой одна команда достаточно сильна, чтобы вытащить веревку подальше от другой команды.) Например, натрий имеет электроотрицательность 0.93 и хлор имеет электроотрицательность 3,16, поэтому, когда натрий и хлор образуют ионный связь, в которой хлор забирает электрон у натрия, с образованием катиона натрия Na + и хлорид-аниона, Класс — . Определенные ионы натрия и хлорида не являются «связаны» вместе, но они очень сильно привлекают друг друга из-за противоположные заряды и образуют прочную кристаллическую решетку.
Когда атомы с разностью электроотрицательностей менее двух единицы соединяются вместе, образуемая связь представляет собой ковалентную связь связь , в которой электроны разделяют оба атома. Когда два одного и того же атома делить электроны ковалентной связью, между ними нет разницы в электроотрицательности, и электронов в ковалентной связи делятся поровну — то есть есть симметричное распределение электронов между связанными атомами.Эти связи неполярные. ковалентные связи . (По аналогии, вы можете думать об этом как о игра в перетягивание каната между двумя одинаково сильными командами, в которой веревка не двигается.) Например, когда два хлора атомы соединены ковалентной связью, электроны проводят так же много времени близко к одному атому хлора, как они делают к другому, и полученная молекула неполярна:
Как рассчитать электроотрицательность молекулы?
Уважаемый Шраваничоудари Чинтала,
В химии электроотрицательность — это мера того, насколько сильно атом притягивает электроны в связи.Атом с высокой электроотрицательностью сильно притягивает электроны, а атом с низкой электроотрицательностью — слабо. Значения электроотрицательности используются для прогнозирования поведения различных атомов, когда они связаны друг с другом, что делает этот навык важным в базовой химии.
Чтобы понять электроотрицательность, сначала важно понять, что такое «связь». Говорят, что любые два атома в молекуле, которые «связаны» друг с другом на молекулярной диаграмме, имеют связь между собой.По сути, это означает, что они разделяют набор из двух электронов — каждый атом вносит в связь один атом.
Точные причины того, почему атомы разделяют электроны и связаны, выходят за рамки этой статьи. Если вы хотите узнать больше, ознакомьтесь с этой статьей об основах связи или собственной статьей WikiHow Как изучить природу химической связи (химия).
Поймите, что химические связи возникают, когда атомы разделяют электроны. Чтобы понять электроотрицательность, важно сначала понять, что такое «связь».Говорят, что любые два атома в молекуле, которые «связаны» друг с другом на молекулярной диаграмме, имеют связь между собой. По сути, это означает, что они разделяют набор из двух электронов — каждый атом вносит в связь один атом.
Точные причины того, почему атомы разделяют электроны и связаны, выходят за рамки этой статьи. Если вы хотите узнать больше, ознакомьтесь с этой статьей об основах связи или собственной статьей WikiHow Как изучить природу химической связи (химия).
Понять, как электроотрицательность влияет на электроны в связи.Когда два атома разделяют набор из двух электронов в связи, они не всегда делят их поровну. Когда один атом имеет более высокую электроотрицательность, чем атом, с которым он связан, он притягивает два электрона в связи ближе к себе. Атом с очень высокой электроотрицательностью может полностью перетянуть электроны на свою сторону связи, почти не разделяя их с другим атомом.
Например, в молекуле NaCl (хлорид натрия) атом хлорида имеет достаточно высокую электроотрицательность, а натрий — довольно низкую.Таким образом, электроны будут притягиваться к хлориду и от натрия.
Для справки используйте таблицу электроотрицательности. Таблица электроотрицательности элементов имеет элементы, расположенные точно так же, как в периодической таблице, за исключением того, что каждый атом помечен своей электроотрицательностью. Их можно найти в различных учебниках по химии и технических статьях, а также в Интернете.
Вот ссылка на отличную таблицу электроотрицательности. Обратите внимание, что здесь используется шкала электроотрицательности Полинга, которая является наиболее распространенной.Однако есть и другие способы измерения электроотрицательности, один из которых будет показан ниже.
Запомните тенденции электроотрицательности для облегчения оценок. Если у вас нет под рукой таблицы электроотрицательности, вы все равно можете оценить электроотрицательность атома на основе того, где он расположен в нормальной периодической таблице. Как правило:
Электроотрицательность атома увеличивается по мере того, как вы перемещаетесь вправо в периодической таблице.
Электроотрицательность атома становится выше по мере продвижения вверх по таблице Менделеева.
Таким образом, атомы в правом верхнем углу имеют самую высокую электроотрицательность, а атомы в левом нижнем углу — самую низкую.
Например, в примере с NaCl выше вы можете сказать, что хлор имеет более высокую электроотрицательность, чем натрий, потому что он почти полностью находится в правом верхнем углу. С другой стороны, натрий находится далеко слева, что делает его одним из атомов более низкого ранга.
Найдите разность электроотрицательностей между двумя атомами. Когда два атома связаны вместе, разница в их электроотрицательности может рассказать вам о качествах их связи.Вычтите меньшую электроотрицательность из большей, чтобы найти разницу.
Например, если мы смотрим на молекулу HF, мы должны вычесть электроотрицательность водорода (2.1) из фтора (4.0). 4,0 — 2,1 = 1,9.
Если разница меньше примерно 0,5, связь неполярная ковалентная. Здесь электроны распределены почти поровну. Эти связи не образуют молекулы с большой разницей заряда на обоих концах. Неполярные связи, как правило, очень трудно разорвать.
Например, молекула O2 имеет такой тип связи. Поскольку два кислорода имеют одинаковую электроотрицательность, разница между ними составляет 0.
Если разница составляет 0,5–1,6, связь полярная ковалентная. Эти связи имеют больше электронов на одном конце, чем на другом. Это делает молекулу немного более отрицательной на конце с электронами и немного более положительной на конце без них. Несбалансированность зарядов в этих связях может позволить молекуле участвовать в определенных особых реакциях.
Хорошим примером этого является молекула h3O (вода). O является более электроотрицательным, чем два H, поэтому он более плотно удерживает электроны и делает всю молекулу частично отрицательной на O-конце и частично положительной на H-концах.
Если разница больше 2,0, связь ионная. В этих связях электроны полностью находятся на одном конце связи. Более электроотрицательный атом получает отрицательный заряд, а менее электроотрицательный атом получает положительный заряд. Такие связи позволяют их атомам хорошо реагировать с другими атомами и даже разъединяться полярными атомами.
Примером этого является NaCl (хлорид натрия). Хлор настолько электроотрицателен, что притягивает оба электрона в связи до самого себя, оставляя натрий с положительным зарядом.
Если разница составляет 1,6–2,0, проверьте наличие металла. Если в связи есть металл, связь ионная. Если присутствуют только неметаллы, связь будет полярной ковалентной
Металлы включают большинство атомов слева и в середине периодической таблицы. На этой странице есть таблица, которая показывает, какие элементы являются металлами.
Наш пример HF сверху попадает в этот диапазон. Поскольку H и F не являются металлами, они имеют полярную ковалентную связь.
Источники и ссылки
↑ http://www.chemguide.co.uk/atoms/bonding/electroneg.html↑ http://www.tutor-homework.com/Chemistry_Help/electronegativity_table/electronegativity.html↑ http : //study.com/academy/lesson/polar-and-nonpolar-covalent-bonds-definitions-and-examples.html↑ http://study.com/academy/lesson/polar-and-nonpolar-covalent-bonds -определения-и-примеры.html ↑ http://www.tutor-homework.com/Chemistry_Help/electronegativity_table/electronegativity.html↑ http://chemwiki.ucdavis.edu/Physical_Chemistry/Physical_Properties_of_Matter/Atomic_and_Molecular_Properties/Atomic_and_Molecular_Properties/ru/ Physical_Chemistry / Physical_Properties_of_Matter / Atomic_and_Molecular_Properties / Electron_Affinity http://dl.clackamas.edu/ch204-07/electron.htmhttp: //www.chemistry.ohio-state.edu/~woodward/ch754/electro электроотрицательность, воспользуйтесь следующей ссылкой: http: // www.wikihow.com/Calculate-ElectronegativityНадеясь, что это будет полезно,
Rafik
ЭЛЕКТРОНЕГАТИВНОСТЬ На этой странице объясняется, что такое электроотрицательность, а также как и почему она изменяется в зависимости от Периодической таблицы. В нем рассматривается, как различия в электроотрицательности влияют на тип связи, и объясняется, что подразумевается под полярными связями и полярными молекулами. Если вас интересует электроотрицательность в контексте органической химии, вы найдете ссылку внизу этой страницы. Что такое электроотрицательность Определение Электроотрицательность — это мера тенденции атома притягивать связывающую пару электронов. Чаще всего используется шкала Полинга. Фтору (наиболее электроотрицательному элементу) присваивается значение 4,0, а значения варьируются до цезия и франция, которые являются наименее электроотрицательными при 0,7. Что произойдет, если два атома с одинаковой электроотрицательностью связаны вместе? Рассмотрим связь между двумя атомами, A и B.Каждый атом может образовывать другие связи, кроме показанной, но они не имеют отношения к аргументу. Если атомы одинаково электроотрицательны, оба имеют одинаковую тенденцию притягивать связывающую пару электронов, и поэтому будет найдено в среднем на полпути между двумя атомами. Чтобы получить такую связь, A и B обычно должны быть одним и тем же атомом. Вы найдете такую связь, например, в молекулах H 2 или Cl 2 . | ||
Примечание: Важно понимать, что это среднее изображение . Электроны на самом деле находятся на молекулярной орбитали и все время перемещаются по этой орбитали. | ||
Связь такого типа можно рассматривать как «чистую» ковалентную связь, в которой электроны равномерно распределяются между двумя атомами. Что произойдет, если B немного более электроотрицателен, чем A? B будет притягивать электронную пару больше, чем A. Это означает, что конец B связи имеет более чем справедливую долю электронной плотности и поэтому становится немного отрицательным. В то же время конец A (довольно короткий от электронов) становится слегка положительным. На диаграмме «» (читается как «дельта») означает «слегка», поэтому + означает «слегка положительный». Определение полярных связей Это описывается как полярная связь . Полярная связь — это ковалентная связь, в которой существует разделение зарядов между одним концом и другим, другими словами, в которой один конец является слегка положительным, а другой — слегка отрицательным.Примеры включают большинство ковалентных связей. Связь водород-хлор в HCl или связи водород-кислород в воде являются типичными. Что произойдет, если B будет намного более электроотрицательным, чем A? В этом случае электронная пара перетаскивается прямо на конец связи B. Фактически, A потерял контроль над своим электроном, а B имеет полный контроль над обоими электронами. Ионы образовались. «Спектр» связей Смысл всего этого состоит в том, что нет четкого разделения между ковалентными и ионными связями.В чистой ковалентной связи электроны удерживаются в среднем ровно на полпути между атомами. В полярной связи электроны слегка притягиваются к одному концу. Как далеко должно пройти это перетаскивание, прежде чем связь будет считаться ионной? На это нет настоящего ответа. Обычно вы думаете о хлориде натрия как о типично ионном твердом веществе, но даже здесь натрий не полностью потерял контроль над своим электроном. Однако из-за свойств хлорида натрия мы склонны считать его чисто ионным. | ||
Примечание: Не беспокойтесь слишком о точной точке отсечения между полярными ковалентными связями и ионными связями. На A’уровне примеры будут стремиться избегать серых областей — они будут явно ковалентными или явно ионными. Однако ожидается, что вы поймете, что эти серые зоны существуют. | ||
Иодид лития, с другой стороны, можно охарактеризовать как «ионный с некоторым ковалентным характером».В этом случае пара электронов не переместилась полностью на йодный конец связи. Например, йодид лития растворяется в органических растворителях, таких как этанол, а ионные вещества не растворяются. Резюме
Полярные связи и полярные молекулы В простой молекуле, такой как HCl, если связь полярна, то же самое происходит и со всей молекулой. А как насчет более сложных молекул? В CCl 4 каждая связь полярна. | ||
Примечание. Обычные линии обозначают связи в плоскости экрана или бумаги. Пунктирные линии представляют собой связи, уходящие от вас в экран или бумагу.Клиновидные линии представляют собой облигации, выходящие из экрана или бумаги к вам. | ||
Молекула в целом, однако, не полярна — в том смысле, что у нее нет конца (или стороны), который был бы слегка отрицательным, а другой — слегка положительным. Вся внешняя часть молекулы несколько отрицательна, но нет общего разделения заряда сверху вниз или слева направо. Напротив, CHCl 3 является полярным. Водород в верхней части молекулы менее электроотрицателен, чем углерод, и поэтому немного положителен. Это означает, что молекула теперь имеет слегка положительный «верх» и слегка отрицательный «низ», и поэтому в целом молекула является полярной. Полярная молекула должна быть каким-то образом «односторонней». Паттерны электроотрицательности в Периодической таблице Самый электроотрицательный элемент — фтор.Если вы помните этот факт, все становится легко, потому что электроотрицательность всегда должна возрастать по отношению к фтору в Периодической таблице. | ||
Примечание: Это упрощение игнорирует благородные газы. Исторически это связано с тем, что считалось, что они не образуют связи — и если они не образуют связи, у них не может быть значения электроотрицательности. Даже сейчас, когда мы знаем, что некоторые из них действительно образуют связи, источники данных по-прежнему не указывают для них значения электроотрицательности. | ||
Тенденции электроотрицательности за период По мере прохождения периода электроотрицательность возрастает. График показывает электроотрицательность от натрия до хлора — аргон не следует учитывать. У него нет электроотрицательности, потому что он не образует связей. Тенденции снижения электроотрицательности группы По мере того, как вы спускаетесь по группе, электроотрицательность уменьшается.(Если оно увеличивается до фтора, оно должно уменьшаться по мере снижения.) На диаграмме показаны закономерности электроотрицательности в группах 1 и 7. Объяснение закономерностей в электроотрицательности Притяжение, которое связывающая пара электронов испытывает к определенному ядру, зависит от:
| ||
Примечание: Если вас не устраивает концепция экранирования или экранирования , вам будет стоить прочитать страницу об энергиях ионизации перед тем, как продолжить. Факторы, влияющие на энергии ионизации, такие же, как и факторы, влияющие на электроотрицательность. Используйте кнопку НАЗАД в браузере, чтобы вернуться на эту страницу. | ||
Почему электроотрицательность увеличивается за период? Рассмотрим натрий в начале периода 3 и хлор в конце (без учета благородного газа, аргона).Представьте, что хлорид натрия связан с ковалентной связью. И натрий, и хлор имеют свои связывающие электроны на 3-м уровне. Электронная пара экранирована от обоих ядер 1s, 2s и 2p-электронами, но в ядре хлора есть еще 6 протонов. Неудивительно, что электронная пара так увлекается к хлору, что образуются ионы. Электроотрицательность увеличивается с течением времени, потому что количество зарядов на ядре увеличивается.Это сильнее притягивает связывающую пару электронов. Почему электроотрицательность падает при уменьшении группы? Подумайте о фтороводороде и хлористом водороде. Связующая пара защищена от ядра фтора только 1s 2 электронами. В случае хлора он экранирован всеми 1s 2 2s 2 2p 6 электронами. В каждом случае чистое притяжение от центра фтора или хлора +7.Но фтор имеет пару связей на 2-м уровне, а не на 3-м уровне, как в хлоре. Чем ближе к ядру, тем больше притяжение. По мере того, как вы спускаетесь по группе, электроотрицательность уменьшается, потому что связывающая пара электронов все больше отдаляется от притяжения ядра. Диагональные отношения в Периодической таблице Что такое диагональное соотношение? В начале периодов 2 и 3 Периодической таблицы есть несколько случаев, когда элемент в верхней части одной группы имеет некоторое сходство с элементом в следующей группе. На схеме ниже показаны три примера. Обратите внимание, что сходство проявляется в элементах, которые расположены по диагонали друг к другу, а не бок о бок. Например, бор — неметалл с некоторыми свойствами, похожими на кремний. В отличие от остальной группы 2, бериллий имеет некоторые свойства, напоминающие алюминий. А литий обладает некоторыми свойствами, которые отличаются от других элементов в группе 1, и в некоторых отношениях напоминает магний. Считается, что между этими элементами существует диагональное соотношение . Для этого есть несколько причин, но каждая зависит от того, как атомные свойства, такие как электроотрицательность, изменяются в Периодической таблице. Итак, мы быстро рассмотрим это в отношении электроотрицательности — что, вероятно, проще всего объяснить. Объяснение диагонального отношения относительно электроотрицательности Электроотрицательность увеличивается по Периодической таблице. Так, например, электроотрицательность бериллия и бора составляет: Электроотрицательность падает по мере того, как вы спускаетесь по Периодической таблице.Так, например, электроотрицательности бора и алюминия: Итак, сравнивая Be и Al, вы обнаруживаете, что значения (случайно) точно совпадают. Увеличение от группы 2 к группе 3 компенсируется падением по мере того, как вы переходите с группы 3 вниз с бора на алюминий. Нечто подобное происходит с литием (1,0) с магнием (1,2) и с бором (2,0) с кремнием (1,8). В этих случаях электроотрицательности не точно и одинаковы, но очень близки. Сходная электроотрицательность между членами этих диагональных пар означает, что они могут образовывать схожие типы связей, и это повлияет на их химию. Вы можете встретить примеры этого позже в своем курсе.
| ||
Внимание! Насколько мне известно, ни одна из британских программ уровня A (или эквивалентных) больше не требует следующего бита. Раньше он входил в программу AQA, но был удален из их новой программы. Однако на момент написания он все еще присутствует по крайней мере в одной зарубежной программе уровня A (Мальта, но могут быть и другие, о которых я не знаю).Если сомневаетесь, проверьте свой учебный план. В противном случае игнорируйте остальную часть этой страницы. Это альтернативный (и, на мой взгляд, более неудобный) способ взглянуть на формирование полярной связи. Чтение этого без надобности может сбить вас с толку. | ||
Поляризующая способность положительных ионов Что мы подразумеваем под «поляризационной способностью»? В ходе обсуждения мы рассмотрели образование полярных связей с точки зрения искажений, которые происходят в ковалентной связи, если один атом более электроотрицателен, чем другой.Но вы также можете посмотреть на образование полярных ковалентных связей, представив, что вы начинаете с ионов. Твердый хлорид алюминия ковалентен. Вместо этого представьте, что он был ионным. Он будет содержать ионы Al 3+ и Cl —. Ион алюминия очень мал и имеет три положительных заряда, поэтому «плотность заряда» очень высока. Это окажет значительное влияние на ближайшие электроны. Мы говорим, что ионы алюминия поляризуют ионы хлорида. В случае хлорида алюминия электронные пары притягиваются к алюминию до такой степени, что связи становятся ковалентными. Но поскольку хлор более электроотрицателен, чем алюминий, электронные пары не будут протягиваться на полпути между двумя атомами, и поэтому образующаяся связь будет полярной. Факторы, влияющие на поляризационную способность Положительные ионы могут иметь эффект поляризации (электрически искажения) соседних отрицательных ионов.Поляризующая способность зависит от плотности заряда положительного иона. Поляризационная способность увеличивается по мере уменьшения размера положительного иона и увеличения количества зарядов. Чем больше размер отрицательного иона, тем легче его поляризовать. Например, в иодид-ионе I — внешние электроны находятся на 5-м уровне — относительно далеко от ядра. Положительный ион будет более эффективным в привлечении пары электронов от иодид-иона, чем соответствующие электроны, скажем, во фторид-ионе, где они намного ближе к ядру. Иодид алюминия ковалентен, потому что электронная пара легко уносится от иона иодида. С другой стороны, фторид алюминия является ионным, потому что ион алюминия не может поляризовать небольшой ион фторида в достаточной степени для образования ковалентной связи.
© Джим Кларк 2000 (последнее изменение в марте 2013 г.) | ||
Электроотрицательность Электроотрицательность является мерой способность атома притягивать к себе общие электроны ковалентной связи. Если связанные вместе атомы имеют одинаковую электроотрицательность, общие электроны будут делиться поровну.Если электроны связи больше притягиваются к одному атомов (потому что он более электроотрицательный), электроны будут неравномерно общий. Если разница в электроотрицательности достаточно велика, электроны вообще не будет делиться; тем более электроотрицательный атом их «заберет», в результате в двух ионах и ионной связи. Представьте себе игру в перетягивание каната. Если две команды равны прочность, веревка остается в центре. Если одна команда сильнее, веревка натянута в направлении этой команды.Если одна команда в подавляющем большинстве сильнее, тем слабее команда больше не может держаться за веревку, и вся веревка оказывается на на стороне более сильной команды. Это аналог химической связи. Если два атома связи имеют одинаковую электроотрицательность, электроны одинаково общий. Если один атом более электроотрицателен, электроны связи больше привлекает этот атом. Если один атом в подавляющем большинстве электроотрицательнее чем другой атом, электроны не будут разделены, и ионная связь будет результат. В таблице Менделеева ниже показана шкала электроотрицательности Полинга. Значение 4,0 присвоено фтору, наиболее электроотрицательному элементу. Как видите, электроотрицательность обычно увеличивается слева направо в течение периода и уменьшается по группе. Шкала электроотрицательности Полинга
дюйм в следующих двух наборах расположите элементы в порядке возрастания электроотрицательности. (1 — наименее электроотрицательный). Помните что электроотрицательность увеличивается при движении слева направо по период и уменьшение, двигаясь вниз по группе. Попробуй еще раз! Хорошо! Если вы помните общую тенденцию изменения значений электроотрицательности, вы обычно может правильно предсказать, какой элемент в связке более электроотрицателен на основе его местоположения в периодической таблице — даже без каких-либо числовых значений значения. Полярная связь — связь между двумя атомы различной электроотрицательности. Более электроотрицательный элемент привлечет электронная плотность к себе, что приводит к неравномерному распределению заряда. Так как отрицательный заряд сместился на одну сторону связи, а положительный заряд остается неподвижным (в каждом ядре), один конец связи будет иметь частичный отрицательный заряд, а другой конец будет иметь частичный положительный заряд (представлены d — и d + ).На двух рисунках ниже сравнивается связь между углеродом и водородом (которые имеют примерно такая же электроотрицательность) и связь между хлором и водородом (хлор гораздо более электроотрицателен, чем водород). | |||||||||||||||||||||||||||||
Электроотрицательность элементов
Корпускуляризм
Корпускуляризм — теория, предложенная Декартом, согласно которой вся материя состоит из крошечных частиц.
Рене Декарт
Рене Декарт был известным математиком и философом 16 века, который выдвинул гипотезу корпускулярной теории об атоме
Блеск
Блеск — это термин, обозначающий отражающую поверхность, которая отражает свет, дающий блестящий вид.
Полупроводники
Полупроводники — это термин для описания металлоидов, которые могут проводить ток, когда электрическая энергия подается из-за движения электронов, но измерения проводимости не такие высокие, как у металлов, из-за меньшего количества электронов, переносящих заряд или менее упорядоченная структура.
Ионное соединение
Ионное соединение — это связь, которая образуется между металлами и неметаллами с образованием большой ионной решетки
Ядерный синтез
Ядерный синтез — это процесс, который происходит в.солнце. Атомы водорода под воздействием большого количества тепла и давления вынуждены вместе образовывать более крупный атом гелия
Принцип неопределенности
Принцип неопределенности Гейзенберга используется для описания взаимосвязи между импульсом и положением электрона. Где, если известно точное положение электрона, импульс будет неопределенным.
Гейзенберг
Вернер Гейзенберг был немецким физиком, пионером в области квантовой механики. Он разработал принцип неопределенности, связанный с импульсом и положением электрона.
Лепестки
Лепестки относятся к форме электронных волн и области наибольшей вероятности того, где этот электрон как частица будет обнаружен.
Принцип исключения Паули
Исключение Паули относится к теории, согласно которой каждый электрон может иметь только уникальный набор из 4 квантовых чисел, и никакие два электрона не могут иметь одинаковые квантовые числа
Квантовые числа
Квантовые числа — это используемый термин описать присвоение чисел электронам как математическую функцию для описания их импульса и энергии.
Модель Бора
Модель Бора рассматривает электроны как частицы, вращающиеся вокруг ядра.
Квантовая механика
Термин квантовая механика относится к уровням энергии и теоретической области физики и химии, где математика используется для объяснения поведения субатомных частиц.
Впадина
Впадина — это самая низкая точка на поперечной волне.
Пик
Пик — это самая высокая точка на поперечной волне.
Режимы вибрации
Режимы вибрации — это термин, используемый для описания постоянного движения в молекуле. Обычно это колебания, вращения и переводы.
Эрвин Шредингер
Эрвин Шредингер был австрийским физиком, который использовал математические модели для улучшения модели Бора электрона и создал уравнение для предсказания вероятности нахождения электрона в заданном положении.
Щелочной металл
Щелочные металлы, входящие в группу 1 периодической таблицы (формально известную как группа IA), настолько реактивны, что обычно встречаются в природе в сочетании с другими элементами.Щелочные металлы — это блестящие, мягкие, высокореактивные металлы при стандартной температуре и давлении.
Щелочноземельные металлы
Щелочноземельные металлы — вторая по активности группа элементов в периодической таблице. Они находятся в группе 2 периодической таблицы (формально известной как группа IIA).
Неизвестные элементы
Неизвестные элементы (или трансактиниды) — самые тяжелые элементы периодической таблицы Менделеева. Это мейтнерий (Mt, атомный номер 109), дармштадций (Ds, атомный номер 110), рентгений (Rg, атомный номер 111), нихоний (Nh, атомный номер 113), московий (Mc, атомный номер 115), ливерморий (Lv. , атомный номер 116) и теннессин (Ts, атомный номер 117).
Постпереходный металл
Постпереходные металлы — это металлы, находящиеся между переходными металлами (слева) и металлоидами (справа). Они включают алюминий (Al), галлий (Ga), индий (In), таллий (Tl), олово (Sn), свинец (Pb) и висмут (Bi).
Оганессон
Оганессон (Ог) — это радиоактивный элемент, имеющий атомный номер 118 в периодической таблице, его внешний вид полностью не известен из-за того, что он производится в незначительных количествах. Он находится в группе 18.Имеет символ Ог.
Теннессин
Теннессин (Ts) — это радиоактивный элемент, имеющий атомный номер 117 в периодической таблице, его внешний вид полностью не известен из-за того, что он производится в незначительных количествах. Он находится в 17-й группе. Имеет символ Ts.
Livermorium
Livermorium (Lv) — это радиоактивный элемент, имеющий атомный номер 116 в периодической таблице, его внешний вид полностью не известен из-за того, что он производится в незначительных количествах. Он находится в группе 16.Имеет символ Ур.
Московий
Московий (Mc) — это радиоактивный металл, имеющий атомный номер 115 в периодической таблице, его внешний вид полностью не известен из-за того, что он производится в незначительных количествах. Он находится в группе 15. Имеет символ Mc.
Флеровий
Флеровий (Fl) — это радиоактивный металл, имеющий атомный номер 114 в периодической таблице, его внешний вид полностью не известен из-за того, что он производится в незначительных количествах. Он находится в группе 14. Обозначается символом Fl.
Nihonium
Nihonium (Nh) — это радиоактивный металл, имеющий атомный номер 112 в периодической таблице, его внешний вид полностью не известен из-за того, что он производится в незначительных количествах. Он находится в группе 13. Обозначается символом Nh.
Copernicium
Copernicium (Cr) — это радиоактивный металл, имеющий атомный номер 112 в периодической таблице, его внешний вид полностью не известен из-за того, что он производится в незначительных количествах. Это переходный металл в группе 11. Он имеет обозначение Rg.
Roentgenium
Roentgenium (Rg) — это радиоактивный металл, имеющий атомный номер 111 в периодической таблице, его внешний вид полностью не известен из-за того, что он производится в незначительных количествах. Это переходный металл в группе 11. Он имеет обозначение Rg.
Дармштадций
Дармштадций (Ds) — это радиоактивный металл, имеющий атомный номер 110 в периодической таблице, его внешний вид полностью не известен из-за того, что он производится в незначительных количествах. Это переходный металл группы 10.Он имеет обозначение Ds
Meitnerium
Meitnerium (Mt) — это радиоактивный металл, имеющий атомный номер 109 в периодической таблице, его внешний вид полностью не известен из-за того, что он производится в незначительных количествах. Это переходный металл в Группе 9. Он имеет символ Mt.
Калий
Калий (Hs) — это радиоактивный металл, имеющий атомный номер 108 в периодической таблице Менделеева, его внешний вид полностью не известен из-за того, что он производится в незначительных количествах. Это переходный металл группы 8.Имеет символ Hs.
Bohrium
Bohrium (Bh) — это радиоактивный металл, имеющий атомный номер 107 в периодической таблице, его внешний вид полностью не известен из-за того, что он производится в незначительных количествах. Это переходный металл в Группе 7. Он имеет символ Bh.
Сиборгий
Сиборгий (Sg) — это радиоактивный металл, имеющий атомный номер 106 в периодической таблице, его внешний вид полностью не известен из-за того, что он производится в незначительных количествах. Это переходный металл группы 6.Имеет символ Sg.
Дубний
Дубний (Db) — радиоактивный металл, имеющий атомный номер 105 в периодической таблице, его внешний вид полностью не известен из-за того, что он производится в незначительных количествах. Это переходный металл в Группе 5. Он имеет обозначение Db.
Резерфордий
Резерфордий (Rf) — это радиоактивный металл, имеющий атомный номер 104 в периодической таблице, его внешний вид полностью не известен из-за того, что он производится в незначительных количествах. Это переходный металл в группе 4.Обозначается символом Rf.
Лоуренсий
Лоуренсий (Lr) — это радиоактивный металл серебристо-белого цвета, имеющий атомный номер 103 в периодической таблице. Это актиноидный металл с символом Lr.
Nobelium
Нобелий (№) — это радиоактивный металл, имеющий атомный номер 102 в периодической таблице, его внешний вид полностью не известен из-за того, что он производится в незначительных количествах. Это актиноидный металл с символом №
Менделевий
Менделевий (Md) — это радиоактивный металл, имеющий атомный номер 101 в периодической таблице, его внешний вид полностью не известен из-за того, что он производится в незначительных количествах.Это актиноидный металл с символом Md.
Фермий
Фермий (Fm) — это радиоактивный металл серебристо-белого цвета, имеющий атомный номер 100 в периодической таблице. Это актиноидный металл с символом Fm.
Эйнштейний
Эйнштейний (Es) — это радиоактивный металл серебристо-белого цвета, имеющий атомный номер 99 в периодической таблице. Это актиноидный металл с символом Es.
Калифорний
Калифорний (Cf) — это радиоактивный металл серебристо-белого цвета, имеющий атомный номер 98 в периодической таблице.Это актиноидный металл с обозначением Cf.
Берклий
Берклий (Bk) — радиоактивный металл серебристого цвета, имеющий атомный номер 97 в периодической таблице. Это актиноидный металл с символом Bk.
Кюрий
Кюрий (Cm) — это радиоактивный металл серебристо-белого цвета, имеющий атомный номер 96 в периодической таблице. Это актиноидный металл с символом Cm.
Америций
Америций (Am) — это радиоактивный металл серебристого цвета, имеющий атомный номер 95 в периодической таблице.Это актиноидный металл с символом Am.
Плутоний
Плутоний (Pu) — это радиоактивный металл серебристого цвета, имеющий атомный номер 94 в периодической таблице. Это актиноидный металл с обозначением Pu.
Нептуний
Нептуний (Np) — радиоактивный металл серебристого цвета, имеющий атомный номер 93 в периодической таблице. Это актиноидный металл с символом Np.
Протактиний
Протактиний (Па) — это блестящий радиоактивный металл серебристого цвета, имеющий атомный номер 91 в периодической таблице.Это актиноидный металл с символом Pa.
Торий
Торий (Th) — это радиоактивный металл серебристо-белого цвета, имеющий атомный номер 90 в периодической таблице. Это актиноидный металл с символом Th.
Актиний
Актиний (Ac) — это радиоактивный металл серебристого цвета, имеющий атомный номер 89 в периодической таблице. Это актиноидный металл с символом Ас.
Радий
Радий (Ra) — это металл серебристо-белого цвета, имеющий атомный номер 88 в периодической таблице.Это щелочноземельный металл с символом Ra, расположенный во 2-й группе периодической таблицы.
Франций
Франций (Fr) считается металлом серого цвета с атомным номером 87 в периодической таблице. Это щелочной металл с символом Fr, расположенный в группе 1 периодической таблицы.
Радон
Радон (Rn) — неметалл без цвета и запаха, радиоактивный газ, имеющий атомный номер 86 в периодической таблице в Группе 18. Он имеет символ Rn.
Астатин
Астатин (At) — это радиоактивный неметалл, имеющий атомный номер 85 в периодической таблице в Группе 17. Он имеет символ At.
Полоний
Полоний (Po) — это серебристо-серый металл, имеющий атомный номер 84 в периодической таблице в группе 16. Он имеет символ Po.
Висмут
Висмут (Bi) — это твердый металл серо-стального цвета, имеющий атомный номер 83 в периодической таблице в Группе 15. Он имеет символ Bi.
Свинец
Свинец (Pb) — это мягкий серый металл, имеющий атомный номер 82 в периодической таблице Группы 14.Обозначается символом Pb.
Таллий
Таллий (Tl) — это мягкий серый металл, имеющий атомный номер 81 в периодической таблице в группе 13. Он имеет символ Tl.
Меркурий
Ртуть (Hg) — жидкий металл серебристого цвета, имеющий атомный номер 80 в периодической таблице. Это переходный металл в группе 12. Он имеет символ Hg.
Золото
Золото (Au) — это металл мягкого золотого цвета, имеющий атомный номер 79 в периодической таблице. Это переходный металл группы 11.Имеет символ Au.
Платина
Платина (Pt) — тяжелый белый металл, имеющий атомный номер 78 в периодической таблице. Это переходный металл группы 10. Он имеет обозначение Pt.
Иридий
Иридий (Ir) — тяжелый белый металл, имеющий атомный номер 77 в периодической таблице. Это переходный металл в группе 9. Он имеет обозначение Ir.
Осмий
Осмий (Os) — твердый мелкий черный порошок или сине-белый металл, имеющий атомный номер 76 в периодической таблице.Это переходный металл группы 8. Он обозначен символом Os.
Рений
Рений (Re) — металл серебристо-белого цвета, имеющий атомный номер 75 в периодической таблице. Это переходный металл группы 7. Он имеет символ Re.
Вольфрам
Вольфрам (W) — металл серого стального цвета, имеющий атомный номер 74 в периодической таблице. Это переходный металл в группе 6. Он имеет обозначение W.
Тантал
Тантал (Ta) — металл серого цвета, имеющий атомный номер 73 в периодической таблице.Это переходный металл в группе 5. Он имеет символ Ta.
Гафний
Гафний (Hf) — металл серебристого цвета, имеющий атомный номер 72 в периодической таблице. Это переходный металл в группе 4. Он имеет обозначение Hf.
Лютеций
Лютеций (Lu) — металл серебристо-белого цвета, имеющий атомный номер 71 в периодической таблице. Это металл лантаноид. Он имеет символ Лу.
Иттербий
Иттербий (Yb) — металл серебристого цвета, имеющий атомный номер 70 в периодической таблице.Это металл лантаноид. Имеет символ Yb.
Тулий
Тулий (Tm) — металл серебристого цвета, имеющий атомный номер 69 в периодической таблице. Это металл лантаноид. Обозначается символом Tm.
Эрбий
Эрбий (Er) — металл серебристого цвета, имеющий атомный номер 68 в периодической таблице. Это металл лантаноид. Имеет символ Er.
Гольмий
Гольмий (Ho) — металл серебристого цвета, имеющий атомный номер 67 в периодической таблице.Это металл лантаноид. Имеет символ Хо.
Диспрозий
Диспрозий (Dy) — металл серебристого цвета, имеющий атомный номер 66 в периодической таблице. Это металл лантаноид. Имеет символ Dy.
Тербий
Тербий (Tb) — металл серебристо-серого цвета, имеющий атомный номер 65 в периодической таблице. Это металл лантаноид. Обозначается символом Tb.
Гадолиний
Гадолиний (Gd) — металл серебристо-белого цвета, имеющий атомный номер 64 в периодической таблице.Это металл лантаноид. Он имеет символ Б-г.
Европий
Европий (Eu) — металл серебристо-белого цвета, имеющий атомный номер 63 в периодической таблице. Это металл лантаноид. Имеет символ Eu.
Самарий
Самарий (Sm) — металл серебристого цвета, имеющий атомный номер 62 в периодической таблице. Это металл лантаноид. Имеет символ Sm.
Прометий
Прометий (Pm) — редкий металл, имеющий атомный номер 61 в периодической таблице.Это металл лантаноид. Имеет символ Pm.
Неодим
Неодим (Nd) — металл серебристо-белого цвета, имеющий атомный номер 60 в периодической таблице. Это металл лантаноид. Обозначается символом Nd.
Празеодим
Празеодим (Pr) — металл серебристо-белого цвета, имеющий атомный номер 59 в периодической таблице. Это металл лантаноид. Имеет обозначение Pr.
Церий
Церий (Ce) — металл серого цвета, имеющий атомный номер 58 в периодической таблице.Это металл лантаноид. Имеет символ Ce.
Лантан
Лантан (La) — мягкий серебристо-белый металл, имеющий атомный номер 57 в периодической таблице. Это металл лантаноид. Он имеет символ La.
Барий
Барий (Ва) — это мягкий серебристо-белый металл, имеющий атомный номер 56 в периодической таблице. Это щелочноземельный металл, который находится во 2-й группе периодической таблицы. у него есть символ Ва.
Цезий
Цезий (Cs) — это металл мягкого серого цвета, имеющий атомный номер 55 в периодической таблице.Это щелочной металл, который находится в группе 1 периодической таблицы. он имеет символ Cs.
Ксенон
Ксенон (Хе) существует в виде бесцветного газа без запаха и химически инертен. Он имеет атомный номер 54 в периодической таблице Менделеева и относится к 18-й группе «Благородные газы». Это неметалл с символом Xe.
Йод
Йод (I) — неметаллическое твердое вещество пурпурно-серого цвета. Он имеет атомный номер 53 в периодической таблице. Он расположен в Группе 17, Галогены. Имеет символ I.
Теллур
Теллур (Те) — это серебристо-белый полуметалл, имеющий атомный номер 52 в периодической таблице. Он находится в 16-й группе таблицы Менделеева. Имеет символ Те.
Сурьма
Сурьма (Sb) — твердый хрупкий серебристо-белый полуметалл, имеющий атомный номер 51 в периодической таблице. Он находится в 15-й группе таблицы Менделеева. Имеет символ Sb.
Олово
Олово (Sn) — это серебристо-белый металл, имеющий атомный номер 50 в периодической таблице.Он находится в 14-й группе периодической таблицы. Имеет символ Sn.
Индий
Индий (In) — это серебристо-белый металл, имеющий атомный номер 49 в периодической таблице. Он находится в 13-й группе периодической таблицы. Имеет символ In.
Кадмий
Кадмий (Cd) — это бело-голубой металл, имеющий атомный номер 48 в периодической таблице. Это переходный металл, который находится в группе 12 периодической таблицы. Обозначается символом Cd.
Серебро
Серебро (Ag) — это металлическое серебро, имеющее атомный номер 47 в периодической таблице.Это переходный металл, расположенный в группе 11 периодической таблицы. Имеет символ Ag.
Палладий
Палладий (Pd) — это серебристо-белый металл, имеющий атомный номер 46 в периодической таблице. Это переходный металл, расположенный в 10-й группе периодической таблицы. Обозначается символом Pd.
Родий
Родий (Rh) — хрупкий серебристо-белый металл, имеющий атомный номер 45 в периодической таблице. Это переходный металл, расположенный в 9-й группе периодической таблицы.Имеет символ Rh.
Рутений
Рутений (Ru) — хрупкий серебристо-серый металл, имеющий атомный номер 44 в периодической таблице. Это переходный металл, расположенный в 8-й группе периодической таблицы. Имеет символ Ru.
Технеций
Технеций (Tc) — это серебристо-серый металл, имеющий атомный номер 43 в периодической таблице. Это переходный металл, расположенный в 7-й группе периодической таблицы. Обозначается символом Tc.
Молибден
Молибден (Мо) — это серебристо-белый металл, имеющий атомный номер 42 в периодической таблице.
