Реакции ионного обмена. Карточки-задания и алгоритм составления ионных уравнений
Карточки-задания на составление ионных уравнений реакций
Вариант 1.Закончите уравнения реакций. Составьте полное и сокращенное ионное уравнения этих реакций.
К2C O3 + Н2SО4 = … + … + СО2
AgNO3 + Н3РO4 = … + …
Ва(ОН)2 + НCl = … + …
При выполнении задания можно воспользоваться страничкой приложения 1.
Вариант 2.Закончите уравнения реакций. Составьте полное и сокращенное ионное уравнения этих реакций.
Nа2C O3 + НCl = … + … + СО2
Ва(NO3)2 + Н2SО4 = … + …
Са(ОН)2 + НNO3 = … + …
При выполнении задания можно воспользоваться страничкой
 Вариант 3.
Вариант 3.Закончите уравнения реакций. Составьте полное и сокращенное ионное уравнения этих реакций.
К2C O3 + НNO3= … + … + СО2
ВаСl2 + Н3РО4 = … + …
КОН + Н2SО4 = … + …
При выполнении задания можно воспользоваться страничкой приложения 1.
Приложение 1Реакции ионного обмена. Условия протекания.
Реакции ионного обмена – это реакции между ионами, образовавшимися в результате диссоциации электролитов.
Реакции ионного обмена протекают до конца в следующих случаях:
Если образуется осадок (нерастворимое в воде вещество):
р р н р
NaCl + AgNO3 = AgCl + NaNO3
Na+ + Cl— + Ag+ + NO3— = AgCl + Na+ + NO3—
Ag+ + NO3— = AgCl
Если образуется газообразное вещество :
Na2C O3 + 2НCl =2NaCl + Н2O + СО2
2Na+ + C O3 2-+ 2Н++ 2С l — = 2Na+ + 2Cl — + Н2O + СО2
C O3 2-+ 2Н+= Н2O + СО2
Если образуется малодиссоциирующее вещество — Н2O:
КОН + НNO3 = КNO3 + Н2O
К+ + ОН —
ОН — + Н + = Н2O
Если в растворах нет таких ионов, которые могут связываться между собой с образованием осадка, газа, или воды Н2O, то реакция является обратимой.
Составление ионных уравнений.
Правила:
Простые вещества, оксиды, нерастворимые кислоты, основания и соли не диссоциируют.
Для реакции берут растворы веществ, поэтому даже малорастворимые вещества находятся в растворах в виде ионов.
Если малорастворимое вещество образуется в результате реакции, то при записи ионного уравнения его считают нерастворимым.
Алгоритм составления ионного уравнения реакции.
Записать молекулярное уравнение реакции. Расставить коэффициенты.С помощью таблицы растворимости определить растворимость каждого вещества
Составить полное ионное уравнение, записывая растворимые в воде вещества в виде ионов, а нерастворимые вещества, газообразные вещества и воду в виде молекул.
Составить сокращённое ионное уравнение, найдя одинаковые ионы в уравнении слева и справа и сократив их.
3NaОН + FeCl3 = Fe(ОН)3 + 3NaCl
р р н р
3NaОН + FeCl3 = Fe(ОН)3 + 3NaCl
3Na++3ОН— + Fe3++3Cl — = Fe(ОН)3 + 3Na+ +3Cl—
3Na++3ОН— + Fe3++3Cl — = Fe(ОН)3 + 3Na+ +3Cl—
3ОН— + Fe3+ = Fe(ОН)3
Самостоятельная работа «Реакции ионного обмена»
Вариант 1
Расставьте коэффициенты в схемах химических реакций и составьте
уравнения реакций в полном и сокращенном ионно-молекулярном виде:
Вариант 2
Расставьте коэффициенты в схемах химических реакций и составьте
уравнения реакций в полном и сокращенном ионно-молекулярном виде:
Вариант 3
Расставьте коэффициенты в схемах химических реакций и составьте
уравнения реакций в полном и сокращенном ионно-молекулярном виде:
Вариант 4
Расставьте коэффициенты в схемах химических реакций и составьте
уравнения реакций в полном и сокращенном ионно-молекулярном виде:
Вариант 5
Расставьте
уравнения реакций в полном и сокращенном ионно-молекулярном виде:
Вариант 6
Расставьте коэффициенты в схемах химических реакций и составьте
уравнения реакций в полном и сокращенном ионно-молекулярном виде:
Вариант 7
Расставьте коэффициенты в
схемах химических реакций и составьтеуравнения реакций в полном и сокращенном ионно-молекулярном виде:
Вариант 8
Расставьте коэффициенты в схемах химических реакций и составьте
уравнения реакций в полном и сокращенном ионно-молекулярном виде:
Вариант 9
Расставьте коэффициенты в схемах
уравнения реакций в полном и сокращенном ионно-молекулярном виде:
Вариант 10
Расставьте коэффициенты в схемах химических реакций и составьте
уравнения реакций в полном и сокращенном ионно-молекулярном виде:
Вариант 11
Расставьте коэффициенты в схемах химических реакций и составьте
уравнения реакций в полном и сокращенном ионно-молекулярном виде:
Вариант 12
Расставьте коэффициенты в схемах химических реакций и составьте
уравнения реакций в полном и сокращенном ионно-молекулярном виде:
Na 3PO 4+ CaCL 2 →
Вариант 13
Расставьте коэффициенты в схемах химических
уравнения реакций в полном и сокращенном ионно-молекулярном виде:
Al 2(SO) 3 + KOH →
Вариант 14
Расставьте коэффициенты в схемах химических реакций и составьте
уравнения реакций в полном и сокращенном ионно-молекулярном виде:
HBr + Ba(OH)2 →
Вариант 15
Расставьте коэффициенты в схемах химических реакций и составьте
уравнения реакций в полном и сокращенном ионно-молекулярном виде:
K 2SO3 + HNO 3 →
Вариант 16
Расставьте коэффициенты в схемах химических реакций и составьте
уравнения реакций в полном и сокращенном ионно-молекулярном виде:
Fe 2(SO 4) 3 + BaCl 2→
Вариант 17
Расставьте коэффициенты в схемах химических реакций и составьте
уравнения реакций в полном и сокращенном ионно-молекулярном виде:
Na 2S + H 3PO4→
| 1. |
Условия протекания ионных реакций
Сложность: лёгкое |
1 |
| 2. |
Виды ионных уравнений
Сложность: лёгкое |
1 |
3.
|
Составление ионных уравнений
Сложность: среднее |
3 |
| 4. |
Суть сокращённого ионного уравнения
Сложность: среднее |
4 |
5.
|
Реакция нейтрализации
Сложность: среднее |
4 |
| 6. |
Сокращённое ионное уравнение с образованием осадка сульфата бария
Сложность: среднее |
4 |
7.
|
Основные понятия темы
Сложность: среднее |
3 |
| 8. |
Сокращённое ионное уравнение с образованием осадка хлорида серебра
Сложность: среднее |
4 |
9.
|
Признаки ионных реакций
Сложность: среднее |
4 |
| 10. |
Признаки ионных реакций
Сложность: среднее |
4 |
Реакции ионного обмена с образованием осадка — урок.
 Химия, 8–9 класс.
Химия, 8–9 класс.Рассмотрим первый случай, когда реакции ионного обмена протекают до конца:
ионы связываются и образуют нерастворимое вещество, которое выпадает в осадок.
Смешаем растворы сульфата натрия и хлорида бария (см. рисунок).
Рис. \(1\). Образование осадка сульфата бария
В результате химической реакции выпадет белый осадок сульфата бария.
- Молекулярное уравнение реакции выглядит так:
Na2SO4+BaCl2=BaSO4↓+2NaCl.
Перепишем это уравнение, изобразив сильные электролиты в виде ионов, а нерастворимое вещество, уходящее из сферы реакции — в молекулярном виде.
- Получившееся уравнение — полное ионное уравнение реакции:
2Na++SO42−+Ba2++2Cl−=BaSO4↓+2Na++2Cl−.
- Если исключить из обеих частей равенства одинаковые ионы, которые не участвуют в реакции, то получится сокращённое ионное уравнение реакции:
Ba2++SO42−=BaSO4↓.
Сокращённое ионное уравнение показывает, что сущность реакции сводится к взаимодействию ионов бария Ba2+ и сульфат-ионов SO42−, в результате которого образуется осадок сульфата бария BaSO4.
Сокращённое ионное уравнение характеризует сущность реакции, показывает, какие ионы реагируют между собой, и какое вещество они образуют в результате ионной реакции.
При этом неважно, в состав каких веществ-электролитов входили эти ионы до реакции. Это могли быть растворы серной кислоты и нитрата бария, или сульфата аммония и хлорида бария и т. д. Сокращённое ионное уравнение реакций этих пар веществ будет иметь вид:
Ba2++SO42−=BaSO4↓.
Таким образом, если в любых водных растворах электролитов содержатся ионы бария и сульфат-ионы, то они всегда взаимодействуют между собой, образуя белый осадок сульфата бария.
Такие реакции для обнаружения ионов (веществ) и называются качественными реакциями.
Источники:
Рис. 1. Образование осадка сульфата бария © ЯКласс
ЗАДАНИЯ ПО ТЕМЕ «РЕАКЦИИ ИОННОГО ОБМЕНА»
ЗАДАНИЯ ПО ТЕМЕ «РЕАКЦИИ ИОННОГО ОБМЕНА»
Задание №1.
Определите, может ли осуществляться взаимодействие между растворами следующих веществ, записать реакциив молекулярном,полном, кратком ионном виде:
гидроксид калия и хлорид аммония.
Решение
— Составляем химические формулы веществ по их названиям, используя валентности и записываем РИО в молекулярном виде (проверяем растворимость веществ по ТР):
KOH + NH4Cl = KCl + NH4OH
так как NH4OH неустойчивое вещество и разлагается на воду и газ NH3 уравнение РИО примет окончательный вид
KOH (p) + NH4Cl (p) = KCl (p) + NH3 ↑+ H2O
-Cоставляем полное ионное уравнение РИО, используя ТР (не забывайте в правом верхнем углу записывать заряд иона):
K+ + OH— + NH4+ + Cl— = K+ + Cl— + NH3 ↑+ H2O
— Cоставляем краткое ионное уравнение РИО, вычёркивая одинаковые ионы до и после реакции:
OH— + NH4+ = NH3 ↑+ H2O
— Делаем вывод:
Взаимодействие между растворами следующих веществ может осуществляться, так как продуктами данной РИО являются газ (NH3 ↑) и малодиссоциирующее вещество вода (H2O).
Задание №2
Дана схема:
2H+ + CO32- = H2O + CO2↑
Подберите вещества, взаимодействие между которыми в водных растворах выражается следующими сокращёнными уравнениями. Составьте соответствующие молекулярное и полное ионное уравнения.
Решение
— Используя ТР подбираем реагенты — растворимые в воде вещества, содержащие ионы 2H+и CO32-.
Например, кислота — H3PO4 (p) и соль -K2CO3 (p).
— Составляем молекулярное уравнение РИО:
2H3PO4 (p) +3 K2CO3 (p) -> 2K3PO4 (p) + 3H2CO3 (p)
так как угольная кислота – неустойчивое вещества, она разлагается на углекислый газ CO2 ↑ и воду H2O, уравнение примет окончательный вид:
2H3PO4 (p) +3 K2CO3 (p) -> 2K3PO4 (p) + 3CO2 ↑ + 3H2O
— Составляем полное ионное уравнение РИО:
6H+ +2PO43- + 6K+ + 3CO32- -> 6K++ 2PO43-+ 3CO2 ↑ + 3H2O
-Составляем краткое ионное уравнение РИО:
6H+ +3CO32- = 3CO2 ↑ + 3H2O
Сокращаем коэффициенты на три и получаем:
2H+ +CO32- = CO2 ↑ + H2O
— Делаем вывод:
В конечном итоге мы получили искомое сокращённое ионное уравнение, следовательно, задание выполнено верно.
Задание №3
Запишите реакцию обмена между оксидом натрия и фосфорной кислотой в молекулярном, полном и кратком ионном виде.
1. Составляем молекулярное уравнение, при составлении формул учитываем валентности (см. ТР)
3Na2O (нэ) + 2H3PO4 (р) -> 2Na3PO4 (р) + 3H2O (мд)
, где нэ — неэлектролит, на ионы не диссоциирует,
мд — малодиссоциирующее вещество, на ионы не раскладываем, вода — признак необратимости реакции
2. Составляем полное ионное уравнение:
3Na2O + 6H+ + 2PO43- -> 6Na+ + 2PO43- + 3H2O
3. Сокращаем одинаковые ионы и получаем краткое ионное уравнение:
3Na2O + 6H+ -> 6Na+ + 3H2O
Сокращаем коэффициенты на три и получаем:
Данная реакция необратима, т.
 е. идёт до конца, так как в продуктах образуется малодиссоциирующее вещество вода.ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫЗадание №1
е. идёт до конца, так как в продуктах образуется малодиссоциирующее вещество вода.ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫЗадание №1Посмотрите следующий эксперимент
Взаимодействие карбоната натрия и серной кислоты
Составьте уравнение реакции ионного обмена карбоната натрия с серной кислотой в молекулярном, полном и кратком ионном виде.
Задание №2
Закончите уравнения реакций в молекулярном, полном и кратком ионном виде:
ZnF2 + Ca(OH)2 ->
K2S + H3PO4 ->
При выполнении задания используйте таблицу растворимости веществ в воде. Помните об исключениях!
Задание №3
Посмотрите следующий эксперимент
Осаждение сульфата бария
Составьте уравнение реакции ионного обмена хлорида бария с сульфатом магния в молекулярном, полном и кратком ионном виде.
Задание №4
Закончите уравнения реакций в молекулярном, полном и кратком ионном виде:
Hg(NO3)2 + Na2S ->
K2SO3 + HCl ->
При выполнении задания используйте таблицу растворимости веществ в воде. Помните об исключениях!
Помните об исключениях!
Ионные уравнения. Задача 31 на ЕГЭ по химии. Полные и краткие ионные уравнения
Переходим от полного ионного уравнения к краткому
← Начало статьи
Пора двигаться дальше. Как мы уже знаем, полное ионное уравнение нуждается в «чистке». Необходимо удалить те частицы, которые присутствуют и в правой, и в левой частях уравнения. Эти частицы иногда называют «ионами-наблюдателями»; они не принимают участия в реакции.
В принципе, ничего сложного в этой части нет. Нужно лишь быть внимательным и осознавать, что в некоторых случаях полное и краткое уравнения могут совпадать (подробнее — см. пример 9).
Пример 5. Составьте полное и краткое ионные уравнения, описывающие взаимодействие кремниевой кислоты и гидроксида калия в водном растворе.
Решение. Начнем, естественно, с молекулярного уравнения:
H2SiO3 + 2KOH = K2SiO3 + 2H2O.
Кремниевая кислота — один из редких примеров нерастворимых кислот; записываем в молекулярной форме. KOH и K2SiO3 пишем в ионной форме. H2O, естественно, записываем в молекулярной форме:
H2SiO3 + 2K+ + 2OH— = 2K+ + SiO32- + 2H2O.
Видим, что ионы калия не изменяются в ходе реакции. Данные частицы не принимают участия в процессе, мы должны убрать их из уравнения. Получаем искомое краткое ионное уравнение:
H2SiO3 + 2OH— = SiO32- + 2H2O.
Как видите, процесс сводится к взаимодействию кремниевой кислоты с ионами OH—. Ионы калия в данном случае не играют никакой роли: мы могли заменить КОН гидроксидом натрия или гидроксидом цезия, при этом в реакционной колбе протекал бы тот же самый процесс.
Пример 6. Оксид меди (II) растворили в серной кислоте. Напишите полное и краткое ионные уравнения данной реакции.
Напишите полное и краткое ионные уравнения данной реакции.
Решение. Основные оксиды реагируют с кислотами с образованием соли и воды:
H2SO4 + CuO = CuSO4 + H2O.
Соответствующие ионные уравнения приведены ниже. Думаю, комментировать что-либо в данном случае излишне.
2H+ + SO42- + CuO = Cu2+ + SO42- + H2O
2H+ + CuO = Cu2+ + H2O
Пример 7. C помощью ионных уравнений опишите взаимодействие цинка с соляной кислотой.
Решение. Металлы, стоящие в ряду напряжений левее водорода, реагируют с кислотами с выделением водорода (специфические свойства кислот-окислителей мы сейчас не обсуждаем):
Zn + 2HCl = ZnCl2 + H2↑.
Полное ионное уравнение записывается без труда:
Zn + 2H+ + 2Cl— = Zn2+ + 2Cl— + H2↑.
К сожалению, при переходе к краткому уравнению в заданиях такого типа школьники часто делают ошибки. Например, убирают цинк из двух частей уравнения. Это грубая ошибка! В левой части присутствует простое вещество, незаряженные атомы цинка. В правой части мы видим ионы цинка. Это совершенно разные объекты! Попадаются и еще более фантастические варианты. Например, в левой части зачеркиваются ионы H+, а в правой — молекулы H2. Мотивируют это тем, что и то, и другое является водородом. Но тогда, следуя этой логике, можно, например, считать, что H2, HCOH и CH4 — это «одно и тоже», т. к. во всех этих веществах содержится водород. Видите, до какого абсурда можно дойти!
Естественно, в данном примере мы можем (и должны!) стереть только ионы хлора. Получаем окончательный ответ:
Zn + 2H+ = Zn2+ + H2↑.
В отличие от всех разобранных выше примеров, данная реакция является окислительно-восстановительной (в ходе данного процесса происходит изменение степеней окисления). Для нас, однако, это совершенно непринципиально: общий алгоритм написания ионных уравнений продолжает работать и здесь.
Для нас, однако, это совершенно непринципиально: общий алгоритм написания ионных уравнений продолжает работать и здесь.
Пример 8. Медь поместили в водный раствор нитрата серебра. Опишите происходящие в растворе процессы.
Решение. Более активные металлы (стоящие левее в ряду напряжений) вытесняют менее активные из растворов их солей. Медь находится в ряду напряжений левее серебра, следовательно, вытесняет Ag из раствора соли:
Сu + 2AgNO3 = Cu(NO3)2 + 2Ag↓.
Полное и краткое ионные уравнения приведены ниже:
Cu0 + 2Ag+ + 2NO3— = Cu2+ + 2NO3— + 2Ag↓0,
Cu0 + 2Ag+ = Cu2+ + 2Ag↓0.
Дабы уберечь вас от соблазна считать, что Сu2+ и Cu (или Ag+ и Ag) — это «одно и то же», я снабдил нейтральные атомы нулевыми зарядами. Естественно, ионами-наблюдателями являются ионы NO3— (и только они!).
Пример 9. Напишите ионные уравнения, описывающие взаимодействие водных растворов гидроксида бария и серной кислоты.
Решение. Речь идет о хорошо знакомой всем реакции нейтрализации, молекулярное уравнение записывается без труда:
Ba(OH)2 + H2SO4 = BaSO4↓ + 2H2O.
Полное ионное уравнение:
Ba2+ + 2OH— + 2H+ + SO42- = BaSO4↓ + 2H2O.
Пришло время составлять краткое уравнение, и тут выясняется интересная деталь: сокращать, собственно, нечего. Мы не наблюдаем одинаковых частиц в правой и левой частях уравнения. Что делать? Искать ошибку? Да нет, никакой ошибки здесь нет. Встретившаяся нам ситуация нетипична, но вполне допустима. Здесь нет ионов-наблюдателей; все частицы участвуют в реакции: при соединении ионов бария и сульфат-аниона образуется осадок сульфата бария, а при взаимодействии ионов H+ и OH— — слабый электролит (вода).
«Но, позвольте!» — воскликните вы. — «Как же нам составлять краткое ионное уравнение?»
Никак! Вы можете сказать, что краткое уравнение совпадает с полным, вы можете еще раз переписать предыдущее уравнение, но смысл реакции от этого не изменится. Будем надеяться, что составители вариантов ЕГЭ избавят вас от подобных «скользких» вопросов, но, в принципе, вы должны быть готовы к любому варианту развития событий.
Пора начинать работать самостоятельно. Предлагаю вам выполнить следующие задания:
Упражнение 6. Составьте молекулярные и ионные уравнения (полное и краткое) следующих реакций:
- Ba(OH)2 + HNO3 =
- Fe + HBr =
- Zn + CuSO4 =
- SO2 + KOH =
Как решать задание 31 на ЕГЭ по химии
В принципе, алгоритм решения данной задачи мы уже разобрали. Единственная проблема заключается в том, что на ЕГЭ задание формулируется несколько. .. непривычно. Вам будет предложен список из нескольких веществ. Вы должны будете выбрать два соединения, между которыми возможна реакция, составить молекулярное и ионные уравнения. Например, задание может формулироваться следующим образом:
.. непривычно. Вам будет предложен список из нескольких веществ. Вы должны будете выбрать два соединения, между которыми возможна реакция, составить молекулярное и ионные уравнения. Например, задание может формулироваться следующим образом:
Пример 10. В вашем распоряжении имеются водные растворы гидроксида натрия, гидроксида бария, сульфата калия, хлорида натрия и нитрата калия. Выберите два вещества, которые могут реагировать друг с другом; напишите молекулярное уравнение реакции, а также полное и краткое ионные уравнения.
Решение. Вспоминая свойства основных классов неорганических соединений, приходим к выводу, что единственная возможная реакция — это взаимодействие водных растворов гидроксида бария и сульфата калия:
Ba(OH)2 + K2SO4 = BaSO4↓ + 2KOH.
Полное ионное уравнение:
Ba2+ + 2OH— + 2K+ + SO42- = BaSO4↓ + 2K+ + 2OH—.
Краткое ионное уравнение:
Ba2+ + SO42- = BaSO4↓.
Кстати, обратите внимание на интересный момент: краткие ионные уравнения получились идентичными в данном примере и в примере 1 из первой части данной статьи. На первый взгляд, это кажется странным: реагируют совершенно разные вещества, а результат одинаковый. В действительности, ничего странного здесь нет: ионные уравнения помогают увидеть суть реакции, которая может скрываться под разными оболочками.
И еще один момент. Давайте попробуем взять другие вещества из предложенного списка и составить ионные уравнения. Ну, например, рассмотрим взаимодействие нитрата калия и хлорида натрия. Запишем молекулярное уравнение:
KNO3 + NaCl = NaNO3 + KCl.
Пока все выглядит достаточно правдоподобно, и мы переходим к полному ионному уравнению:
K+ + NO3— + Na+ + Cl— = Na+ + NO3— + K+ + Cl—.
Начинаем убирать лишнее и обнаруживаем неприятную деталь: ВСЕ в этом уравнении является «лишним». Все частица, присутствующие в левой части, мы находим и в правой. Что это означает? Возможно ли такое? Да, возможно, просто никакой реакции в данном случае не происходит; частицы, изначально присутствовавшие в растворе, так и останутся в нем. Реакции нет!
Видите, в молекулярном уравнении мы спокойно написали чепуху, но «обмануть» краткое ионное уравнение не удалось. Это тот самый случай, когда формулы оказываются умнее нас! Запомните: если при написании краткого ионного уравнения, вы приходите к необходимости убрать все вещества, это означает, что либо вы ошиблись и пытаетесь «сократить» что-то лишнее, либо данная реакция вообще невозможна.
Пример 11. Карбонат натрия, сульфат калия, бромид цезия, соляная кислота, нитрат натрия. Из предложенного перечня выберите два вещества, которые способны прореагировать друг с другом, напишите молекулярное уравнение реакции, а также полное и краткое ионные уравнения.
Решение. В приведенном списке присутствуют 4 соли и одна кислота. Соли способны реагировать друг с другом только в том случае, если в ходе реакции образуется осадок, но ни одна из перечисленных солей не способна образовать осадок в реакции с другой солью из этого списка (проверьте этот факт, пользуясь таблицей растворимости!) Кислота способна прореагировать с солью лишь в том случае, когда соль образована более слабой кислотой. Серная, азотная и бромоводородная кислоты не могут быть вытеснены действием HCl. Единственный разумный вариант — взаимодействие соляной кислоты с карбонатом натрия.
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
Обратите внимание: вместо формулы H2CO3, которая, по идее, должна была образоваться в ходе реакции, мы пишем H2O и CO2. Это правильно, т. к. угольная кислота крайне неустойчива даже при комнатной температуре и легко разлагается на воду и углекислый газ.
При записи полного ионного уравнения учитываем, что диоксид углерода не является электролитом:
2Na+ + CO32- + 2H+ + 2Cl— = 2Na+ + 2Cl— + H2O + CO2↑.
Убираем лишнее, получаем краткое ионное уравнение:
CO32- + 2H+ = H2O + CO2↑.
А теперь поэкспериментируйте немного! Попробуйте, как мы это сделали в предыдущей задаче, составить ионные уравнения неосуществимых реакций. Возьмите, например, карбонат натрия и сульфат калия или бромид цезия и нитрат натрия. Убедитесь, что краткое ионное уравнение вновь окажется «пустым».
Пора двигаться дальше. В третьей части статьи мы:
- рассмотрим еще 6 примеров решения заданий ЕГЭ-31,
- обсудим, как составлять ионные уравнения в случае сложных окислительно-восстановительных реакций,
- приведем примеры ионных уравнений с участием органических соединений,
- затронем реакции ионного обмена, протекающие в неводной среде.

Продолжение статьи →
Погода в Ногинске Живой календарь Праздники | 1. Записывают формулы веществ, вступивших в реакцию, ставят знак «равно» и записывают формулы образовавшихся веществ. Расставляют коэффициенты. 2. Пользуясь таблицей растворимости, записывают в ионном виде формулы веществ (солей, кислот, оснований), обозначенных в таблице растворимости буквой «Р» (хорошо растворимые в воде), исключение – гидроксид кальция, который, хотя и обозначен буквой «М», все же в водном растворе хорошо диссоциирует на ионы. 3. Нужно помнить, что на ионы не разлагаются металлы, оксиды металлов и неметаллов, вода, газообразные вещества, нерастворимые в воде соединения, обозначенные в таблице растворимости буквой «Н». Формулы этих веществ записывают в молекулярном виде. Получают полное ионное уравнение. 4. Сокращают одинаковые ионы до знака «равно» и после него в уравнении. 5. Помните! Р — растворимое вещество; М — малорастворимое вещество; ТР — таблица растворимости. в молекулярном, полном и кратком ионном виде Примеры составления реакций ионного обмена 1. Если в результате реакции выделяется малодиссоциирующее (мд) вещество – вода. В данном случае полное ионное уравнение совпадает с сокращенным ионным уравнением.2. Если в результате реакции выделяется нерастворимое в воде вещество. В данном случае полное ионное уравнение реакции совпадает с сокращенным. Эта реакция протекает до конца, о чем свидетельствуют сразу два факта: образование вещества, нерастворимого в воде, и выделение воды.3. Если в результате реакции выделяется газообразное вещество.
Задание №1. — Составляем химические формулы веществ по их названиям, используя валентности и записываем РИО в молекулярном виде (проверяем растворимость веществ по ТР): KOH + Nh5Cl = KCl + Nh5OH так как Nh5OH неустойчивое вещество и разлагается на воду и газ Nh4 уравнение РИО примет окончательный вид KOH (p) + Nh5Cl (p) = KCl (p) + Nh4 ↑+ h3O -Cоставляем полное ионное уравнение РИО, используя ТР (не забывайте в правом верхнем углу записывать заряд иона): K+ + OH- + Nh5+ + Cl- = K+ + Cl- + Nh4 ↑+ h3O — Cоставляем краткое ионное уравнение РИО, вычёркивая одинаковые ионы до и после реакции: OH — + Nh5+ = Nh4 ↑+ h3O— Делаем вывод: Задание №2 Дана схема: 2H + + CO32- = h3O + CO2↑Подберите вещества, взаимодействие между которыми в водных растворах выражается следующими сокращёнными уравнениями. Решение — Используя ТР подбираем реагенты — растворимые в воде вещества, содержащие ионы 2H +и CO32-.Например, кислота — H 3PO4 (p) и соль -K2CO3 (p).— Составляем молекулярное уравнение РИО: 2H 3PO4 (p) +3 K2CO3 (p) -> 2K3PO4 (p) + 3h3CO3 (p)так как угольная кислота – неустойчивое вещества, она разлагается на углекислый газ CO 2 ↑ и воду h3O, уравнение примет окончательный вид:2H 3PO4 (p) +3 K2CO3 (p) -> 2K3PO4 (p) + 3CO2 ↑ + 3h3O— Составляем полное ионное уравнение РИО: 6H + +2PO43- + 6K+ + 3CO32- -> 6K++ 2PO43-+ 3CO2 ↑ + 3h3O-Составляем краткое ионное уравнение РИО: 6H + +3CO32- = 3CO2 ↑ + 3h3OСокращаем коэффициенты на три и получаем: 2H + +CO32- = CO2 ↑ + h3O— Делаем вывод: В конечном итоге мы получили искомое сокращённое ионное уравнение, следовательно, задание выполнено верно. Задание №3Запишите реакцию обмена между оксидом натрия и фосфорной кислотой в молекулярном, полном и кратком ионном виде. 1. Составляем молекулярное уравнение, при составлении формул учитываем валентности (см. ТР) 3Na 2O (нэ) + 2h4PO4 (р) -> 2Na3PO4 (р) + 3h3O (мд)где нэ — неэлектролит, на ионы не диссоциирует, 2. Составляем полное ионное уравнение: 3Na 2O + 6H+ + 2PO43- -> 6Na+ + 2PO43- + 3h3O3. Сокращаем одинаковые ионы и получаем краткое ионное уравнение: 3Na 2O + 6H+ -> 6Na+ + 3h3OСокращаем коэффициенты на три и получаем: Na2O + 2H+ -> 2Na+ + h3O Данная реакция необратима, т.е. идёт до конца, так как в продуктах образуется малодиссоциирующее вещество вода. ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ Задание №1 Посмотрите следующий эксперимент Взаимодействие карбоната натрия и серной кислоты Составьте уравнение реакции ионного обмена карбоната натрия с серной кислотой в молекулярном, полном и кратком ионном виде. Задание №2 ZnF 2 + Ca(OH)2 ->K2S + h4PO4 -> При выполнении задания используйте таблицу растворимости веществ в воде. Задание №3 Посмотрите следующий эксперимент Осаждение сульфата бария Составьте уравнение реакции ионного обмена хлорида бария с сульфатом магния в молекулярном, полном и кратком ионном виде. Задание №4 Закончите уравнения реакций в молекулярном, полном и кратком ионном виде: Hg(NO 3)2 + Na2S ->K2SO3 + HCl -> При выполнении задания используйте таблицу растворимости веществ в воде. Помните об исключениях! ТРЕНАЖЁР «РЕАКЦИИ ИОННОГО ОБМЕНА» ТРЕНАЖЁР «РЕАКЦИИ В РАСТВОРАХ ЭЛЕКТРОЛИТОВ» ПАМЯТКА «НЕОБРАТИМЫЕ РЕАКЦИИ» | Новости сайта Поздравляем победителей и лауреатов Всероссийских дистанционных олимпиад по химии и биологии Полезные ссылки Архив записей |
Реакция ионного обмена – обзор
3.
 2.1.7 Метод ионного обмена и эффекта Киркендалла
2.1.7 Метод ионного обмена и эффекта КиркендаллаРеакции ионного обмена представляют собой метод превращения одного материала в другой в жидкой среде. Реакция ионного обмена основана на большой разнице в произведении растворимости (Ksp) между исходными нанокристаллами и конечным продуктом. Вопрос о том, может ли иметь место реакция ионного обмена, очень сложен. Из-за фазового перехода реальная концентрация ионов в растворе, эффект растворителя и энергия активации поверхностной энергии зависят от многих факторов.Однако, хотя более четким критерием является разница в растворимости реагентов и продукта, о нем можно судить грубо, глядя на растворимость продукта.
Реакция катионного обмена используется для замены существующей ионной нанокристаллической структуры ионом другого металла. Он особенно эффективен при трансформации нанокристаллов халькогенидов металлов. В методе катионного обмена морфология продукта контролируется свойствами исходных нанокристаллов реагента и кристаллической структурой продукта. Если размер нанокристаллов ниже критического значения, морфология получаемого конечного продукта определяется формируемой структурой. Если размер нанокристаллов намного больше этого критического значения, продукт сохранит исходную морфологию реагентов.
Если размер нанокристаллов ниже критического значения, морфология получаемого конечного продукта определяется формируемой структурой. Если размер нанокристаллов намного больше этого критического значения, продукт сохранит исходную морфологию реагентов.
Реакция анионного обмена основана на различии растворимости реагентов и продуктов, таких как катионный обмен. Многие материалы MC могут быть эффективно получены реакцией анионного обмена.В MC, поскольку анионы обычно намного больше катионов, они являются сложными по сравнению с катионным обменом, и обычно анионы образуют каркас кристаллической структуры. Поэтому обменный процесс, обычно основанный на диффузии ионов, протекает медленнее, чем процесс катионного обмена, и требует большей энергии. Поскольку реакцию анионного обмена обычно проводят в более сложных условиях, морфология продукта отличается от морфологии реагентов [53, 54].
Реакция ионного обмена осуществляется в выгравированных наночастицах, нанотрубках, наноклетках и подобных материалах. Это также может привести к образованию резных структур. Это связано с эффектом Киркендалла, классическим явлением в металлургии. Поскольку реакция ионного обмена осуществляется за счет диффузии ионов, за счет эффекта Киркендалла будут образовываться полые структуры. Реакция ионного обмена, сплавление из наноструктурированного халькогена (такого как нанопроволоки Te) или источника металла (такого как наночастицы Co), также может вызывать эффект Киркендалла.Однако, если в качестве реагентов используются наноструктурированные халькогены, полая структура не может быть сформирована, так как чистая диффузия атомов будет происходить внутрь из-за больших анионов. Тот факт, что Se и Te реагируют с различными металлами даже при комнатной температуре, делает их идеальными формами для синтеза халькогенидов различных металлов. Например, нанопроволоки Ag 2 Te получают из нанопроволок Te [55].
Это также может привести к образованию резных структур. Это связано с эффектом Киркендалла, классическим явлением в металлургии. Поскольку реакция ионного обмена осуществляется за счет диффузии ионов, за счет эффекта Киркендалла будут образовываться полые структуры. Реакция ионного обмена, сплавление из наноструктурированного халькогена (такого как нанопроволоки Te) или источника металла (такого как наночастицы Co), также может вызывать эффект Киркендалла.Однако, если в качестве реагентов используются наноструктурированные халькогены, полая структура не может быть сформирована, так как чистая диффузия атомов будет происходить внутрь из-за больших анионов. Тот факт, что Se и Te реагируют с различными металлами даже при комнатной температуре, делает их идеальными формами для синтеза халькогенидов различных металлов. Например, нанопроволоки Ag 2 Te получают из нанопроволок Te [55].
Катионообменным методом успешно синтезирован широкий спектр тройных и четвертичных халькогенидных нанолистов на основе меди с включениями CuInS 2 , CuInxGa1 − xS 2 и Cu 2 ZnSnS 4 [5].
Справочник по воде – Ионный обмен и деминерализация воды
Все природные воды содержат в различных концентрациях растворенные соли, которые диссоциируют в воде с образованием заряженных ионов. Положительно заряженные ионы называются катионами; отрицательно заряженные ионы называются анионами. Ионные примеси могут серьезно повлиять на надежность и эффективность работы котла или технологической системы. Перегрев, вызванный накоплением накипи или отложений, образованных этими примесями, может привести к катастрофическим отказам труб, дорогостоящим производственным потерям и незапланированным простоям.Ионы жесткости, такие как кальций и магний, должны быть удалены из воды, прежде чем ее можно будет использовать в качестве питательной воды для котлов. Для систем питательной воды котлов высокого давления и многих технологических систем требуется почти полное удаление всех ионов, включая двуокись углерода и диоксид кремния. Ионообменные системы используются для эффективного удаления растворенных ионов из воды.
Ионообменники заменяют один ион на другой, временно удерживают его, а затем выпускают в регенерирующий раствор. В системе ионного обмена нежелательные ионы в воде заменяются более приемлемыми ионами.Например, в умягчителе на основе цеолита натрия образующие накипь ионы кальция и магния заменены ионами натрия.
ИСТОРИЯ
В 1905 году немецкий химик Ганс использовал синтетические алюмосиликатные материалы, известные как цеолиты, в первых ионообменных умягчителях воды. Хотя алюмосиликатные материалы в настоящее время редко используются, термин «цеолитный умягчитель» обычно используется для описания любого процесса катионного обмена.
Синтетический цеолитовый обменный материал вскоре был заменен природным материалом под названием Greensand.Greensand имеет более низкую обменную способность, чем синтетический материал, но его более высокая физическая стабильность делает его более подходящим для промышленного применения. Емкость определяется как количество способных к обмену ионов, которое единица количества смолы удаляет из раствора. Он обычно выражается в килограммах на кубический фут в пересчете на карбонат кальция.
Он обычно выражается в килограммах на кубический фут в пересчете на карбонат кальция.
Рис. 8-1. Микроскопический вид шариков ячеистой смолы (20-50 меш) сильнокислотного катионообменника сульфированного стирола-дивинилбензола. (Предоставлено компанией Rohm and Haas.)
Разработка катионообменной среды на основе сульфированного угля, называемой углеродистым цеолитом, расширила применение ионного обмена до операции водородного цикла, позволив снизить щелочность, а также жесткость. Вскоре была разработана анионообменная смола (продукт конденсации полиаминов и формальдегида). Новая анионная смола использовалась с катионитом с водородным циклом в попытке деминерализовать (удалить из воды все растворенные соли). Однако ранние анионообменники были нестабильны и не могли удалять такие слабоионизированные кислоты, как кремниевая и угольная.
В середине 1940-х годов были разработаны ионообменные смолы на основе сополимеризации стирола, сшитого с дивинилбензолом. Эти смолы были очень стабильны и обладали гораздо большей обменной способностью, чем их предшественники. Анионообменник на основе полистирола-дивинилбензола может удалять все анионы, включая кремниевую и угольную кислоты. Это новшество сделало возможной полную деминерализацию воды.
Анионообменник на основе полистирола-дивинилбензола может удалять все анионы, включая кремниевую и угольную кислоты. Это новшество сделало возможной полную деминерализацию воды.
Полистирол-дивинилбензольные смолы до сих пор используются в большинстве приложений ионного обмена.Хотя основные компоненты смолы одинаковы, смолы были модифицированы во многих отношениях, чтобы соответствовать требованиям конкретных приложений и обеспечить более длительный срок службы смолы. Одним из наиболее значительных изменений стало развитие макросетчатой или макропористой структуры смолы.
Стандартные гелеобразные смолы, подобные показанным на рис. 8-1, имеют структуру проницаемой мембраны. Эта структура отвечает химическим и физическим требованиям большинства применений. Однако в некоторых применениях физическая прочность и химическая стойкость, требуемые от структуры смолы, выходят за рамки возможностей типичной гелевой структуры.Макросетчатые смолы имеют дискретные поры в высокосшитой полистирол-дивинилбензольной матрице. Эти смолы обладают более высокой физической прочностью, чем гели, а также большей устойчивостью к термическому разложению и действию окислителей. Макросетчатые анионные смолы (рис. 8-2) также более устойчивы к органическому загрязнению из-за их более пористой структуры. В дополнение к полистирол-дивинилбензольным смолам (рис. 8-3) существуют более новые смолы с акриловой структурой, что повышает их устойчивость к органическому загрязнению.
Эти смолы обладают более высокой физической прочностью, чем гели, а также большей устойчивостью к термическому разложению и действию окислителей. Макросетчатые анионные смолы (рис. 8-2) также более устойчивы к органическому загрязнению из-за их более пористой структуры. В дополнение к полистирол-дивинилбензольным смолам (рис. 8-3) существуют более новые смолы с акриловой структурой, что повышает их устойчивость к органическому загрязнению.
В дополнение к пластиковой матрице ионообменная смола содержит ионизируемые функциональные группы. Эти функциональные группы состоят как из положительно заряженных катионных элементов, так и из отрицательно заряженных анионных элементов. Однако только один из ионных видов подвижен. Другая ионная группа присоединена к структуре шарика. Рисунок 8-4 представляет собой схематическое изображение шарика сильнокислотного катионита, который имеет ионные центры, состоящие из неподвижных анионных (SO 3 ¯) радикалов и подвижных катионов натрия (Na + ). Ионный обмен происходит, когда ионы сырой воды диффундируют в структуру гранул и обмениваются на подвижную часть функциональной группы. Ионы, вытесненные из шарика, диффундируют обратно в водный раствор.
Ионный обмен происходит, когда ионы сырой воды диффундируют в структуру гранул и обмениваются на подвижную часть функциональной группы. Ионы, вытесненные из шарика, диффундируют обратно в водный раствор.
КЛАССИФИКАЦИЯ ИОНООБМЕННЫХ СМОЛ
Ионизируемые группы, присоединенные к шарику смолы, определяют функциональные возможности смолы. Смолы для промышленной обработки воды подразделяются на четыре основные категории:
- Катион сильной кислоты (SAC)
- Катион слабой кислоты (WAC)
- Сильноосновный анион (SBA)
- Слабоосновный анион (WBA)
Смолы SAC могут нейтрализовать сильные основания и превращать нейтральные соли в соответствующие им кислоты.Смолы SBA могут нейтрализовать сильные кислоты и превращать нейтральные соли в соответствующие основания. Эти смолы используются в большинстве приложений для умягчения и полного обессоливания. Смолы WAC и WBA способны нейтрализовать сильные основания и кислоты соответственно. Эти смолы используются для декальцинации, частичной деминерализации или (в сочетании с сильными смолами) полной деминерализации.
Эти смолы используются для декальцинации, частичной деминерализации или (в сочетании с сильными смолами) полной деминерализации.
SAC получают свою функциональность от сульфокислотных групп (HSO 3 ¯). При деминерализации смолы SAC удаляют почти все катионы сырой воды, заменяя их ионами водорода, как показано ниже:
Реакция обмена обратима.Когда ее емкость исчерпана, смолу можно регенерировать избытком минеральной кислоты.
Сильнокислотные катиониты хорошо работают во всех диапазонах pH. Эти смолы нашли широкое применение. Например, они используются в натриевом цикле (натрий как подвижный ион) для умягчения и в водородном цикле для декатионирования.
Слабокислотные катионообменные смолы получают свою обменную активность от карбоксильной группы (-COOH). При работе в водородной форме смолы WAC удаляют катионы, связанные с щелочностью, с образованием угольной кислоты, как показано:
Эти реакции также являются обратимыми и позволяют вернуть израсходованную смолу WAC в регенерированную форму. Смолы WAC не способны удалить все катионы из большинства источников воды. Их основным преимуществом является высокая эффективность регенерации по сравнению со смолами SAC. Эта высокая эффективность снижает количество кислоты, необходимой для регенерации смолы, тем самым уменьшая количество отработанной кислоты и сводя к минимуму проблемы с утилизацией.
Смолы WAC не способны удалить все катионы из большинства источников воды. Их основным преимуществом является высокая эффективность регенерации по сравнению со смолами SAC. Эта высокая эффективность снижает количество кислоты, необходимой для регенерации смолы, тем самым уменьшая количество отработанной кислоты и сводя к минимуму проблемы с утилизацией.
Слабокислотные катиониты используются в основном для умягчения и удаления щелочи из высокожестких и высокощелочных вод, часто в сочетании с системами полировки натриевого цикла SAC.В системах полной деминерализации использование смол WAC и SAC в комбинации обеспечивает экономию более эффективной смолы WAC наряду с полными обменными возможностями смолы SAC.
СмолыSBA получают свою функциональность от функциональных групп четвертичного аммония. Используются два типа групп четвертичного аммония, называемые Типом I и Типом II. Сайты типа I имеют три метильные группы:
В смоле типа II одна из метильных групп заменена этанольной группой. Смола типа I обладает большей стабильностью, чем смола типа II, и способна удалять большее количество слабоионизированных кислот. Смолы типа II обеспечивают более высокую эффективность регенерации и большую производительность при том же количестве используемого регенерирующего химиката.
Смола типа I обладает большей стабильностью, чем смола типа II, и способна удалять большее количество слабоионизированных кислот. Смолы типа II обеспечивают более высокую эффективность регенерации и большую производительность при том же количестве используемого регенерирующего химиката.
В форме гидроксида смолы SBA удаляют все обычно встречающиеся анионы, как показано ниже:
Как и в случае с катионными смолами, эти реакции обратимы, что позволяет регенерировать смолу сильной щелочью, такой как каустическая сода, чтобы вернуть смолу в гидроксидную форму.
Слабоосновная функциональность смолы возникает из первичных (R-NH 2 ), вторичных (R-NHR’) или третичных (R-NR’ 2 ) аминогрупп. Смолы WBA легко удаляют серную, азотную и соляную кислоты, что представлено следующей реакцией:
ЦЕОЛИТ НАТРИЯ СМЯГЧАЮЩИЙ
Смягчение цеолитом натрия является наиболее широко применяемым методом ионного обмена. При умягчении цеолитом вода, содержащая образующие накипь ионы, такие как кальций и магний, проходит через слой смолы, содержащий смолу SAC в натриевой форме.В смоле происходит обмен ионов жесткости с натрием, и натрий диффундирует в объемный водный раствор. Вода без жесткости, называемая мягкой водой, затем может использоваться для питательной воды котлов низкого и среднего давления, подпитки системы обратного осмоса, некоторых химических процессов и коммерческих применений, таких как прачечные.
При умягчении цеолитом вода, содержащая образующие накипь ионы, такие как кальций и магний, проходит через слой смолы, содержащий смолу SAC в натриевой форме.В смоле происходит обмен ионов жесткости с натрием, и натрий диффундирует в объемный водный раствор. Вода без жесткости, называемая мягкой водой, затем может использоваться для питательной воды котлов низкого и среднего давления, подпитки системы обратного осмоса, некоторых химических процессов и коммерческих применений, таких как прачечные.
Принципы умягчения цеолита
Удаление жесткости воды с помощью процесса умягчения цеолитом описывается следующей реакцией:
Вода из правильно работающего цеолитного умягчителя почти не имеет определяемой жесткости.Однако в очищенной воде присутствует небольшое количество жесткости, известное как утечка. Уровень утечки жесткости зависит от жесткости и уровня натрия в поступающей воде, а также от количества соли, используемой для регенерации.
На рис. 8-5 представлен типичный профиль жесткости стоков цеолитного умягчителя во время рабочего цикла. После окончательного ополаскивания умягчитель обеспечивает низкий, почти постоянный уровень жесткости до тех пор, пока ионообменная смола не истощится. При истощении жесткость стоков резко возрастает, требуется регенерация.
Как показывают реакции размягчения, смола SAC легко принимает ионы кальция и магния в обмен на ионы натрия. Когда отработанная смола регенерируется, на смолу наносится высокая концентрация ионов натрия, чтобы заменить кальций и магний. Смолу обрабатывают 10% раствором хлорида натрия, и регенерация протекает по следующему уравнению:
При регенерации используется большой избыток регенеранта (примерно в 3 раза больше кальция и магния в смоле).Вымываемая жесткость удаляется из блока умягчения в отработанном солевом растворе и путем промывки.
После регенерации в смоле остаются небольшие остаточные количества твердости. Если оставить смолу в стоячем сосуде с водой, некоторая жесткость будет диффундировать в объем воды. Следовательно, в начале потока вода, выходящая из цеолитного умягчителя, может иметь жесткость, даже если она недавно регенерировалась. Через несколько минут потока жесткость вымывается из умягчителя, а очищенная вода становится мягкой.
Если оставить смолу в стоячем сосуде с водой, некоторая жесткость будет диффундировать в объем воды. Следовательно, в начале потока вода, выходящая из цеолитного умягчителя, может иметь жесткость, даже если она недавно регенерировалась. Через несколько минут потока жесткость вымывается из умягчителя, а очищенная вода становится мягкой.
Продолжительность сервисного цикла зависит от расхода умягчителя, уровня жесткости воды и количества соли, используемой для регенерации. В Таблице 8-1 показано влияние уровня регенеранта на смягчающую способность гелеобразной сильной катионитовой смолы. Обратите внимание, что емкость смолы увеличивается по мере увеличения дозы регенеранта, но это увеличение непропорционально. Регенерация менее эффективна при более высоких уровнях регенерации. Таким образом, эксплуатационные расходы умягчителя увеличиваются по мере увеличения уровня регенерации.Как показывают данные в Таблице 8-1, увеличение количества регенерирующей соли на 150 % обеспечивает увеличение рабочей мощности только на 67 %.
Таблица 8-1. Влияние уровня регенерирующей соли на способность умягчения сильнокислотных катионитов.
| Таблица 8-1. Влияние уровня регенерирующей соли на смягчающую способность сильнокислотной катионитовой смолы . | |
| Соль (фунт/фут 3 ) | Вместимость (г/фут 3 ) |
| 6 | 18 000 |
| 8 | 20 000 |
| 10 | 24 000 |
| 15 | 30 000 |
Оборудование
Оборудование, используемое для умягчения цеолита натрия, состоит из емкости для замены умягчителя, регулирующих клапанов и трубопроводов, а также системы для рассола или регенерации смолы. Обычно бак умягчителя представляет собой вертикальный стальной сосуд высокого давления с выпуклыми днищами, как показано на рис. 8-6. Основные характеристики резервуара умягчения включают входную распределительную систему, надводное пространство, систему распределения регенерата, ионообменную смолу и удерживающую смолу систему сбора подземных стоков.
Обычно бак умягчителя представляет собой вертикальный стальной сосуд высокого давления с выпуклыми днищами, как показано на рис. 8-6. Основные характеристики резервуара умягчения включают входную распределительную систему, надводное пространство, систему распределения регенерата, ионообменную смолу и удерживающую смолу систему сбора подземных стоков.
Впускная распределительная система обычно расположена в верхней части бака. Впускная система обеспечивает равномерное распределение поступающей воды. Это предотвратит выдавливание водой проточных каналов в слое смолы, что уменьшит пропускную способность системы и качество сточных вод.Впускная система также действует как коллектор для воды обратной промывки.
Впускной распределитель состоит из центрального коллектора/ступицы с распределительными боковыми/радиальными или простыми перегородками, которые равномерно направляют поток воды по слою смолы. Если не предотвратить попадание воды прямо на дно или стенки резервуара, это приведет к образованию каналов.
Объем между впускным распределителем и верхней частью слоя смолы называется свободным пространством. Свободный борт обеспечивает расширение смолы во время обратной промывки регенерации без потери смолы.Он должен составлять не менее 50% от объема смолы (предпочтительно 80%).
Распределитель регенерата обычно представляет собой систему коллектор-боковик, которая равномерно распределяет регенерирующий рассол во время регенерации. Расположение распределителя на высоте 6 дюймов над верхней частью слоя смолы предотвращает разбавление регенеранта водой в свободном пространстве. Это также снижает потребность в воде и времени для вытеснения и быстрой промывки. Распределитель регенерата должен быть закреплен на конструкции бака, чтобы предотвратить поломку и последующее попадание реагента в канал.
Вода смягчается слоем сильнокислотного катионита в натриевой форме. Требуемое количество смолы зависит от расхода воды, общей жесткости и желаемого времени между циклами регенерации. Для всех систем рекомендуется минимальная глубина слоя 24 дюйма.
Для всех систем рекомендуется минимальная глубина слоя 24 дюйма.
Система нижнего дренажа, расположенная на дне резервуара, удерживает ионообменную смолу в резервуаре, равномерно собирает рабочий поток и равномерно распределяет поток обратной промывки. Неравномерный сбор воды при эксплуатации или неравномерное распределение воды обратной промывки может привести к образованию каналов, загрязнению или потере смолы.
Несмотря на то, что используется несколько конструкций поддона, существует два основных типа: засыпка и удерживающая смолу. Система подзасыпки состоит из нескольких слоев поддерживающей среды (например, фракционированного гравия или антрацита), которые поддерживают смолу, и системы сбора, включающей просверленные трубы или сетчатые фильтры подзасыпки. Пока опорные слои остаются неповрежденными, смола остается на месте. Если поддерживающая среда нарушается, обычно из-за неправильной обратной промывки, смола может пройти через разрушенные слои и выйти из сосуда. Коллектор, удерживающий смолу, такой как сетчатый боковой или профильный сетчатый фильтр, дороже, чем система с засыпкой, но защищает от потери смолы.
Коллектор, удерживающий смолу, такой как сетчатый боковой или профильный сетчатый фильтр, дороже, чем система с засыпкой, но защищает от потери смолы.
Главный клапан и система трубопроводов направляет поток воды и реагента в нужные места. Клапанная система состоит из клапанного гнезда или одного многопортового клапана. Гнездо клапана включает в себя шесть основных клапанов: сервисный вход и выход, вход и выход обратной промывки, вход регенеранта и слив регенерата/промывки. Клапаны могут управляться вручную или автоматически с помощью воздуха, электрического импульса или давления воды.В некоторых системах вместо гнезда клапана используется один многоходовой клапан. По мере того, как клапан вращается через ряд фиксированных положений, отверстия в клапане направляют поток таким же образом, как гнездо клапана. Многопортовые клапаны могут устранить ошибки в работе, вызванные открытием не того клапана, но их необходимо надлежащим образом обслуживать, чтобы избежать утечек через уплотнения портов.
Система рассола состоит из оборудования для растворения соли/рассола и оборудования для контроля разбавления, обеспечивающего желаемую силу регенерации.Растворяющее/измерительное оборудование предназначено для подачи правильного количества концентрированного солевого раствора (примерно 26% NaCl) для каждой регенерации, не допуская попадания нерастворенных солей в смолу. В большинстве систем используется поплавковый клапан для управления заполнением и сливом расходного бака, тем самым контролируя количество соли, используемой при регенерации. Обычно концентрированный рассол удаляется из резервуара с помощью эжекторной системы, которая также разбавляет рассол до оптимальной регенерирующей концентрации (8-10% NaCl).Рассол также можно перекачивать из резервуара с концентрированной солью и смешивать с водой для разбавления, чтобы обеспечить желаемую силу регенерации.
Работа умягчителя
Умягчитель на основе цеолита натрия работает в двух основных циклах: рабочий цикл, при котором производится мягкая вода для использования, и цикл регенерации, который восстанавливает емкость смолы при истощении.
В рабочем цикле вода поступает в умягчитель через впускную распределительную систему и проходит через слой.Ионы жесткости диффундируют в смолу и обмениваются с ионами натрия, которые возвращаются в воду. Мягкая вода собирается в дренажной системе и сбрасывается. Поток технической воды к умягчителю должен быть как можно более постоянным, чтобы предотвратить внезапные скачки напряжения и частое включение-выключение.
Из-за требований к смоле и конструкции резервуара операция умягчения наиболее эффективна, когда поддерживается скорость рабочего потока от 6 до 12 галлонов в минуту на квадратный фут площади поверхности смолы. Большая часть оборудования предназначена для работы в этом диапазоне, но в некоторых специальных конструкциях используется глубокий слой смолы, позволяющий работать при расходе 15-20 галлонов в минуту/фут².Непрерывная эксплуатация выше пределов, рекомендованных производителем, может привести к уплотнению слоя, образованию каналов, преждевременному скачку твердости и утечке жесткости. Эксплуатация значительно ниже рекомендуемой производителем скорости потока также может отрицательно сказаться на работе умягчителя. При низких расходах вода распределяется недостаточно, и оптимальный контакт смолы с водой невозможен.
Эксплуатация значительно ниже рекомендуемой производителем скорости потока также может отрицательно сказаться на работе умягчителя. При низких расходах вода распределяется недостаточно, и оптимальный контакт смолы с водой невозможен.
Когда смягчитель израсходован, смола должна быть регенерирована. Мониторинг жесткости сточных вод показывает истощение смолы.Когда твердость увеличивается, агрегат истощается. Автоматические мониторы обеспечивают более постоянную индикацию состояния умягчителя, чем периодический отбор проб и тестирование оператором, но требуют частого обслуживания для обеспечения точности. Многие предприятия регенерируют умягчители перед их истощением, исходя из заданного периода времени или количества переработанных галлонов.
Большинство систем умягчения состоят из более чем одного умягчителя. Они часто работают так, что один умягчитель находится в режиме регенерации или в режиме ожидания, в то время как другие блоки работают.Это обеспечивает бесперебойную подачу мягкой воды. Перед вводом резервного умягчителя в эксплуатацию его необходимо промыть, чтобы удалить любую жесткость, которая попала в воду во время простоя.
Перед вводом резервного умягчителя в эксплуатацию его необходимо промыть, чтобы удалить любую жесткость, которая попала в воду во время простоя.
Регенерация смягчителя
Цикл регенерации умягчителя на основе цеолита натрия состоит из четырех этапов: обратная промывка, регенерация (рассол), вытеснение (медленная промывка) и быстрая промывка.
Обратная промывка. Во время рабочего цикла нисходящий поток воды вызывает накопление взвешенных веществ на слое смолы.Смола является отличным фильтром и может улавливать твердые частицы, прошедшие через вышестоящее фильтрующее оборудование. Этап обратной промывки удаляет накопленный материал и реклассифицирует слой смолы. На этапе обратной промывки вода течет из поддонного распределителя вверх через слой смолы и выходит из сервисного распределителя в отходы. Восходящий поток поднимает и расширяет смолу, позволяя удалять твердые частицы и мелкие частицы смолы, а также классифицировать смолу. Классификация смолы приводит к тому, что более мелкие гранулы оказываются наверху устройства, а более крупные оседают на дне. Это улучшает распределение регенерирующей химической и технической воды.
Это улучшает распределение регенерирующей химической и технической воды.
Обратная промывка должна продолжаться не менее 10 минут или до тех пор, пока сточные воды из выпускного отверстия обратной промывки не станут прозрачными. Поток обратной промывки должен быть достаточным для увеличения объема слоя смолы на 50% или более, в зависимости от доступного надводного слоя. Недостаточная обратная промывка может привести к загрязнению слоя и образованию каналов. Чрезмерная скорость потока обратной промывки приводит к потере смолы. Скорость потока обратной промывки обычно варьируется от 4-8 (температура окружающей среды) до 12-15 (горячее обслуживание) галлонов в минуту на квадратный фут площади кровати, но следует следовать рекомендациям каждого производителя.Способность воды расширять смолу сильно зависит от температуры. Для расширения слоя с холодной водой требуется меньший поток, чем с теплой водой. Расширение слоя смолы следует регулярно проверять, а скорость потока регулировать по мере необходимости для поддержания надлежащего расширения слоя.
Обычно вода для обратной промывки представляет собой отфильтрованную сырую воду. Вода, выходящая из выпускного отверстия обратной промывки, не изменяется по химическому составу, но может содержать взвешенные вещества. В целях экономии воды сточные воды обратной промывки можно возвращать в осветлитель или фильтровать сточные воды для очистки.
Регенерация (Рассол). После обратной промывки применяется регенерирующий раствор. Поток солевого раствора поступает в установку через распределитель регенерата и стекает вниз через слой смолы с небольшой скоростью (обычно от 0,5 до 1 гал/мин на квадратный фут смолы). Поток рассола собирается через дренаж и направляется в отходы. Низкая скорость потока увеличивает контакт между соляным раствором и смолой. Для достижения оптимальной эффективности рассола крепость раствора должна составлять 10% при вводе рассола.
Смещение (медленная промывка). После введения регенерирующего солевого раствора медленный поток воды продолжается через систему распределения регенерирующего агента. Этот поток воды вытесняет регенерант через слой с желаемой скоростью потока. Стадия вытеснения завершает регенерацию смолы, обеспечивая надлежащий контакт регенеранта с нижней частью слоя смолы. Расход вытесняющей воды обычно равен расходу, используемому для разбавления концентрированного рассола.Продолжительность этапа вытеснения должна быть достаточной для того, чтобы через устройство прошел примерно один объем воды из слоя смолы. Это обеспечивает «пробку» вытесняющей воды, которая постепенно полностью перемещает рассол через слой.
Этот поток воды вытесняет регенерант через слой с желаемой скоростью потока. Стадия вытеснения завершает регенерацию смолы, обеспечивая надлежащий контакт регенеранта с нижней частью слоя смолы. Расход вытесняющей воды обычно равен расходу, используемому для разбавления концентрированного рассола.Продолжительность этапа вытеснения должна быть достаточной для того, чтобы через устройство прошел примерно один объем воды из слоя смолы. Это обеспечивает «пробку» вытесняющей воды, которая постепенно полностью перемещает рассол через слой.
Быстрое полоскание. После завершения вытесняющей промывки вода подается через впускной распределитель с высокой скоростью потока. Эта промывочная вода удаляет остатки рассола, а также любую остаточную жесткость из слоя смолы. Скорость быстрого ополаскивания обычно составляет от 1.5 и 2 галлона в минуту на квадратный фут смолы. Иногда это определяется скоростью обслуживания умягчителя.
Первоначально промывочные воды содержат большое количество жесткости и хлорида натрия. Обычно жесткость вымывается из умягчителя перед избытком хлорида натрия. Во многих операциях умягчитель можно вернуть в эксплуатацию, как только жесткость достигнет заданного уровня, но в некоторых случаях требуется промывка до тех пор, пока содержание хлоридов в сточных водах или проводимость не будут близки к уровням входящих. Эффективная быстрая промывка важна для обеспечения высокого качества сточных вод во время сервисного обслуживания.Если умягчитель находился в режиме ожидания после регенерации, можно использовать второе быстрое полоскание, известное как сервисное полоскание, для удаления любой жесткости, которая попала в воду во время ожидания.
Обычно жесткость вымывается из умягчителя перед избытком хлорида натрия. Во многих операциях умягчитель можно вернуть в эксплуатацию, как только жесткость достигнет заданного уровня, но в некоторых случаях требуется промывка до тех пор, пока содержание хлоридов в сточных водах или проводимость не будут близки к уровням входящих. Эффективная быстрая промывка важна для обеспечения высокого качества сточных вод во время сервисного обслуживания.Если умягчитель находился в режиме ожидания после регенерации, можно использовать второе быстрое полоскание, известное как сервисное полоскание, для удаления любой жесткости, которая попала в воду во время ожидания.
ГОРЯЧИЙ ЦЕОЛИТ РАЗМЯГЧЕНИЕ
Умягчители на основе цеолита можно использовать для удаления остаточной жесткости сточных вод горячей технологической извести или известково-натриевого умягчителя. Горячие технологические стоки проходят через фильтры, а затем через слой сильнокислотного катионита в натриевой форме (рис. 8-7).Оборудование и работа умягчителя на горячем цеолите аналогичны умягчителю с температурой окружающей среды, за исключением того, что клапаны, трубопроводы, контроллеры и контрольно-измерительные приборы должны быть рассчитаны на высокую температуру (220-250°F). Стандартную смолу с сильным катионитом можно использовать при температуре до 270°F, но для более длительного срока службы рекомендуется гель премиум-класса или макросетчатая смола. При эксплуатации цеолитной системы после умягчителя горячего процесса важно спроектировать систему таким образом, чтобы исключить скачки потока в установке для производства горячей извести.Общие конструкции включают использование резервуаров для хранения воды обратной промывки в установке для производства горячей извести и расширенные медленные промывки для цеолита вместо стандартной быстрой промывки.
8-7).Оборудование и работа умягчителя на горячем цеолите аналогичны умягчителю с температурой окружающей среды, за исключением того, что клапаны, трубопроводы, контроллеры и контрольно-измерительные приборы должны быть рассчитаны на высокую температуру (220-250°F). Стандартную смолу с сильным катионитом можно использовать при температуре до 270°F, но для более длительного срока службы рекомендуется гель премиум-класса или макросетчатая смола. При эксплуатации цеолитной системы после умягчителя горячего процесса важно спроектировать систему таким образом, чтобы исключить скачки потока в установке для производства горячей извести.Общие конструкции включают использование резервуаров для хранения воды обратной промывки в установке для производства горячей извести и расширенные медленные промывки для цеолита вместо стандартной быстрой промывки.
Применение и преимущества
Накипь и отложения в котлах, а также образование нерастворимого мыльного творога в процессе промывки вызвали большой спрос на умягченную воду. Поскольку умягчители на основе цеолита натрия способны экономически удовлетворить этот спрос, они широко используются при подготовке воды для котлов низкого и среднего давления, прачечных и химических процессов.Умягчение цеолитом натрия также имеет следующие преимущества по сравнению с другими методами умягчения:
Поскольку умягчители на основе цеолита натрия способны экономически удовлетворить этот спрос, они широко используются при подготовке воды для котлов низкого и среднего давления, прачечных и химических процессов.Умягчение цеолитом натрия также имеет следующие преимущества по сравнению с другими методами умягчения:
- обработанная вода имеет очень низкую склонность к образованию накипи, поскольку умягчение цеолитом снижает уровень жесткости большинства источников воды до менее 2 частей на миллион
- операция проста и надежна; автоматические и полуавтоматические средства управления регенерацией доступны по разумной цене Соль
- недорогая и простая в обращении
- не образуется отработанный шлам; обычно утилизация отходов не представляет проблемы
- в определенных пределах изменения расхода воды мало влияют на качество очищенной воды
- , так как эффективная работа может быть обеспечена в установках практически любого размера, умягчители на основе цеолита натрия подходят как для больших, так и для малых установок
Ограничения
Хотя умягчители на основе цеолита натрия эффективно снижают жесткость воды, растворенную в воде, общее содержание твердых веществ, щелочность и кремнезем в воде остаются неизменными. Умягчитель на основе цеолита натрия не является прямой заменой умягчителю с горячей известью и содой. Заводы, которые заменили свои умягчители горячего процесса только умягчителями на основе цеолита, столкнулись с проблемами с уровнем кремнезема и щелочностью в своих котлах.
Умягчитель на основе цеолита натрия не является прямой заменой умягчителю с горячей известью и содой. Заводы, которые заменили свои умягчители горячего процесса только умягчителями на основе цеолита, столкнулись с проблемами с уровнем кремнезема и щелочностью в своих котлах.
Поскольку смола является таким эффективным фильтром, умягчители на основе цеолита натрия не действуют эффективно на мутной воде. Продолжительная работа с мутностью входящего потока, превышающей 1,0 JTU, вызывает загрязнение слоя, короткие периоды обслуживания и низкое качество сточных вод.Подходит большинство городских и колодезных вод, но многие поверхностные источники должны быть очищены и отфильтрованы перед использованием.
Смола может быть загрязнена примесями тяжелых металлов, таких как железо и алюминий, которые не удаляются в ходе обычной регенерации. Если в водопроводе присутствует избыток железа или марганца, смолу необходимо периодически очищать. Всякий раз, когда алюминиевые коагулянты используются перед цеолитными умягчителями, надлежащая работа оборудования и тщательный контроль рН осветлителя необходимы для хорошей работы умягчителя.
Сильные окислители в сырой воде разрушают смолу. Хлор, присутствующий в большинстве коммунальных материалов, является сильным окислителем и должен быть удален до умягчения цеолита фильтрацией с активированным углем или реакцией с сульфитом натрия.
ДЕМИНЕРАЛИЗАЦИЯ
Одного умягчения недостаточно для большинства питательной воды котлов высокого давления и для многих технологических потоков, особенно тех, которые используются в производстве электронного оборудования. В дополнение к удалению жесткости эти процессы требуют удаления всех растворенных твердых веществ, таких как натрий, кремнезем, щелочность и минеральные анионы (Cl¯, SO 4 ¯, NO 3 ¯).
Деминерализация воды – это удаление практически всех неорганических солей путем ионного обмена. В этом процессе сильнокислотный катионит в водородной форме превращает растворенные соли в соответствующие им кислоты, а сильноосновной анионит в форме гидроксида удаляет эти кислоты. Деминерализация дает воду, по качеству аналогичную дистилляции, но с меньшими затратами для большинства пресных вод.
Деминерализация дает воду, по качеству аналогичную дистилляции, но с меньшими затратами для большинства пресных вод.
Принципы обессоливания
Система деминерализации состоит из одной или нескольких колонок с ионообменной смолой, которые включают в себя блок сильнокислотного катиона и блок сильноосновного аниона.Катионит обменивает водород на катионы сырой воды, как показывают следующие реакции:
Мерой общей концентрации сильных кислот в катионных стоках является свободная минеральная кислотность (FMA). Как показано на рис. 8-8, при типичном запуске службы содержимое FMA остается стабильным большую часть времени. Если бы катионный обмен был эффективен на 100%, FMA от теплообменника был бы равен теоретической минеральной кислотности (TMA) воды. FMA обычно немного ниже, чем TMA, потому что небольшое количество натрия просачивается через катионообменник.Величина утечки натрия зависит от уровня регенерации, расхода и доли натрия по отношению к другим катионам в сырой воде. Как правило, утечка натрия увеличивается по мере увеличения отношения натрия к общему количеству катионов.
Как правило, утечка натрия увеличивается по мере увеличения отношения натрия к общему количеству катионов.
По мере того, как установка катионного обмена приближается к истощению, FMA в сточных водах резко падает, что указывает на необходимость вывода теплообменника из эксплуатации. В это время смолу следует регенерировать раствором кислоты, который возвращает обменные центры в водородную форму.Серная кислота обычно используется из-за ее доступной стоимости и доступности. Однако неправильное использование серной кислоты может вызвать необратимое загрязнение смолы сульфатом кальция.
Чтобы предотвратить это, серная кислота обычно применяется с высокой скоростью потока (1 галлон в минуту на квадратный фут смолы) и начальной концентрацией 2% или менее. Концентрацию кислоты постепенно увеличивают до 6-8% до полной регенерации.
В некоторых установках для регенерации используется соляная кислота.Это требует использования специальных конструкционных материалов в регенерирующей системе. Как и в случае установки с цеолитом натрия, требуется избыток регенеранта (серной или соляной кислоты), в три раза превышающий теоретическую дозу.
Как и в случае установки с цеолитом натрия, требуется избыток регенеранта (серной или соляной кислоты), в три раза превышающий теоретическую дозу.
Для завершения процесса обессоливания воду из катионитной установки пропускают через сильноосновную анионообменную смолу в гидроксидной форме. Смола обменивает ионы водорода как на сильно ионизированные минеральные ионы, так и на более слабо ионизированные угольную и кремниевую кислоты, как показано ниже:
Приведенные выше реакции показывают, что деминерализация полностью удаляет катионы и анионы из воды.В действительности, поскольку реакции ионного обмена являются равновесными реакциями, происходит некоторая утечка. Большая часть утечек из катионитов приходится на натрий. Эта утечка натрия преобразуется в гидроксид натрия в анионном блоке. Таким образом, рН выходящего потока двухслойной катионно-анионной системы деминерализации является слабощелочным. Щелочь, образующаяся в анионах, вызывает небольшую утечку кремнезема. Степень утечки анионов зависит от химического состава обрабатываемой воды и используемой дозы регенерирующего средства.
Степень утечки анионов зависит от химического состава обрабатываемой воды и используемой дозы регенерирующего средства.
Деминерализация с использованием сильных анионных смол удаляет диоксид кремния, а также другие растворенные твердые вещества. Выходящий кремнезем и электропроводность являются важными параметрами, которые необходимо контролировать во время обслуживания деминерализатора. Как показано на рис. 8-9, в конце быстрой промывки как диоксид кремния, так и электропроводность низкие.
Когда в конце рабочего цикла происходит прорыв кремнезема, уровень кремнезема в очищенной воде резко возрастает. Часто проводимость воды на мгновение уменьшается, а затем быстро возрастает.Это временное падение проводимости легко объяснимо. Во время нормального обслуживания большая часть проводимости сточных вод связана с небольшим уровнем гидроксида натрия, образующегося в анионообменнике. Когда происходит прорыв диоксида кремния, гидроксид становится недоступным, а натрий из катионита превращается в силикат натрия, проводящий гораздо меньше, чем гидроксид натрия. По мере истощения анионита более проводящие минеральные ионы прорываются, вызывая последующее увеличение проводимости.
По мере истощения анионита более проводящие минеральные ионы прорываются, вызывая последующее увеличение проводимости.
При обнаружении окончания работы деминерализатора устройство должно быть немедленно выведено из эксплуатации. Если деминерализатор остается в эксплуатации после точки останова, уровень кремнезема в очищенной воде может подняться выше уровня поступающей воды из-за концентрации кремнезема, которая происходит в анионите во время работы.
Сильноосновные анионообменники регенерируются 4% раствором едкого натра. Как и в случае регенерации катионов, относительно высокая концентрация гидроксида запускает реакцию регенерации.Чтобы улучшить удаление кремнезема из слоя смолы, регенерирующую щелочь обычно нагревают до 120°F или до температуры, указанной производителем смолы. Удаление кремнезема также улучшается за счет предварительного нагрева слоя смолы перед введением теплой щелочи.
Оборудование и операции
Оборудование, используемое для катионно-анионной деминерализации, аналогично оборудованию, используемому для умягчения цеолитом. Основное отличие состоит в том, что сосуды, клапаны и трубопроводы должны быть изготовлены из коррозионно-стойких материалов (или облицованы ими).Резина и поливинилхлорид (ПВХ) обычно используются для футеровки ионообменных сосудов. Системы управления и регенерации для деминерализаторов более сложны, что позволяет использовать такие усовершенствования, как ступенчатая регенерация кислотой и теплой щелочью.
Основное отличие состоит в том, что сосуды, клапаны и трубопроводы должны быть изготовлены из коррозионно-стойких материалов (или облицованы ими).Резина и поливинилхлорид (ПВХ) обычно используются для футеровки ионообменных сосудов. Системы управления и регенерации для деминерализаторов более сложны, что позволяет использовать такие усовершенствования, как ступенчатая регенерация кислотой и теплой щелочью.
по действию аналогичны цеолитным умягчителям. Рекомендации по скорости потока для деминерализатора составляют от 6 до 10 галлонов в минуту на квадратный фут смолы. Скорость потока более 10 галлонов в минуту на квадратный фут смолы вызывает повышенную утечку натрия и кремнезема с некоторыми видами воды.Анионит намного легче катионита. Следовательно, скорость потока обратной промывки для анионообменных смол намного ниже, чем для катионообменных смол, и на расширение анионита больше влияет температура воды, чем на расширение катионита. Вода, используемая для каждой стадии регенерации анионита, не должна быть жесткой, чтобы предотвратить осаждение солей жесткости в слое щелочного анионита.
Приборы непрерывной проводимости и анализаторы диоксида кремния обычно используются для контроля качества сточных вод с анионами и определения необходимости регенерации.В некоторых случаях датчики электропроводности помещают в слой смолы над дренажными коллекторами для обнаружения истощения смолы до того, как произойдет прорыв кремнезема в очищенную воду.
Преимущества и ограничения
Деминерализаторымогут производить воду высокой чистоты практически для любого использования. Деминерализованная вода широко используется в качестве питательной воды для котлов высокого давления и для многих технологических вод. Качество произведенной воды сравнимо с дистиллированной водой, обычно за небольшую часть стоимости.Деминерализаторы бывают самых разных размеров. Системы варьируются от лабораторных колонн, производящих всего несколько галлонов в час, до систем, производящих тысячи галлонов в минуту.
Как и другие системы ионного обмена, для эффективной работы деминерализаторов требуется фильтрованная вода. Перед деминерализацией следует избегать смолистых загрязнений и разлагающих агентов, таких как железо и хлор. Аниониты очень восприимчивы к загрязнению и воздействию органических материалов, присутствующих во многих источниках поверхностной воды.Некоторые формы кремнезема, известные как коллоидные или нереакционноспособные, не удаляются деминерализатором. Горячая щелочная котельная вода растворяет коллоидный материал, образуя простые силикаты, подобные тем, которые поступают в котел в растворимом виде. Как таковые, они могут образовывать отложения на поверхности труб и улетучиваться в пар.
Перед деминерализацией следует избегать смолистых загрязнений и разлагающих агентов, таких как железо и хлор. Аниониты очень восприимчивы к загрязнению и воздействию органических материалов, присутствующих во многих источниках поверхностной воды.Некоторые формы кремнезема, известные как коллоидные или нереакционноспособные, не удаляются деминерализатором. Горячая щелочная котельная вода растворяет коллоидный материал, образуя простые силикаты, подобные тем, которые поступают в котел в растворимом виде. Как таковые, они могут образовывать отложения на поверхности труб и улетучиваться в пар.
ДЕАЛКАЛИЗАЦИЯ
Часто рабочие условия котла или процесса требуют удаления жесткости и снижения щелочности, но не удаления других твердых веществ.Умягчение цеолитом не снижает щелочность, а деминерализация слишком затратна. Для таких ситуаций используется процесс дезактивации. Наиболее часто используемыми процессами являются декальцинация цеолитом натрия/водородным цеолитом (разделенный поток), дещелочная декальцинация хлорид-анионом и слабокислотным катионитом.
Цеолит натрия/водородный цеолит (разделенный поток) Декальцинация
В декальцинаторах с разделенным потоком часть сырой воды проходит через умягчитель на основе цеолита натрия.Остаток проходит через катионит сильной кислоты в форме водорода (водородный цеолит). Выходящий поток из цеолита натрия объединяют с выходящим потоком водородного цеолита. Сточные воды установки цеолита водорода содержат угольную кислоту, полученную за счет щелочности сырой воды, и свободные минеральные кислоты. Когда два потока объединяются, свободная минеральная кислота в выходящем потоке цеолита водорода преобразует щелочность карбоната натрия и бикарбоната в выходящем потоке цеолита натрия в угольную кислоту, как показано ниже:
Угольная кислота нестабильна в воде.Он образует углекислый газ и воду. Смешанные стоки направляются в декарбонизатор или дегазатор, где двуокись углерода удаляется из воды противотоком воздуха. На рис. 8-10 показана типичная система дещелализации с разделенным потоком.
Желаемый уровень щелочности смешанной воды можно поддерживать, контролируя процентное содержание цеолита натрия и цеолита водорода в смеси. Более высокий процент воды с цеолитом натрия приводит к более высокой щелочности, а повышенный процент воды с цеолитом водорода снижает щелочность.
В дополнение к снижению щелочности декальцинатор с разделенным потоком уменьшает общее количество растворенных твердых веществ в воде. Это важно для воды с высокой щелочностью, потому что проводимость этих вод влияет на процесс и может ограничивать циклы концентрирования котлов.
Цеолит натрия/хлоридный анион, декальцинация
Сильноосновная анионная смола в форме хлорида может использоваться для снижения щелочности воды. Вода проходит через цеолитовый умягчитель, а затем через анионную установку, которая заменяет ионы карбоната, бикарбоната, сульфата и нитрата ионами хлорида, как показано в следующих реакциях:
Декальцинатор аниона хлорида снижает щелочность примерно на 90%, но не уменьшает общее содержание твердых веществ.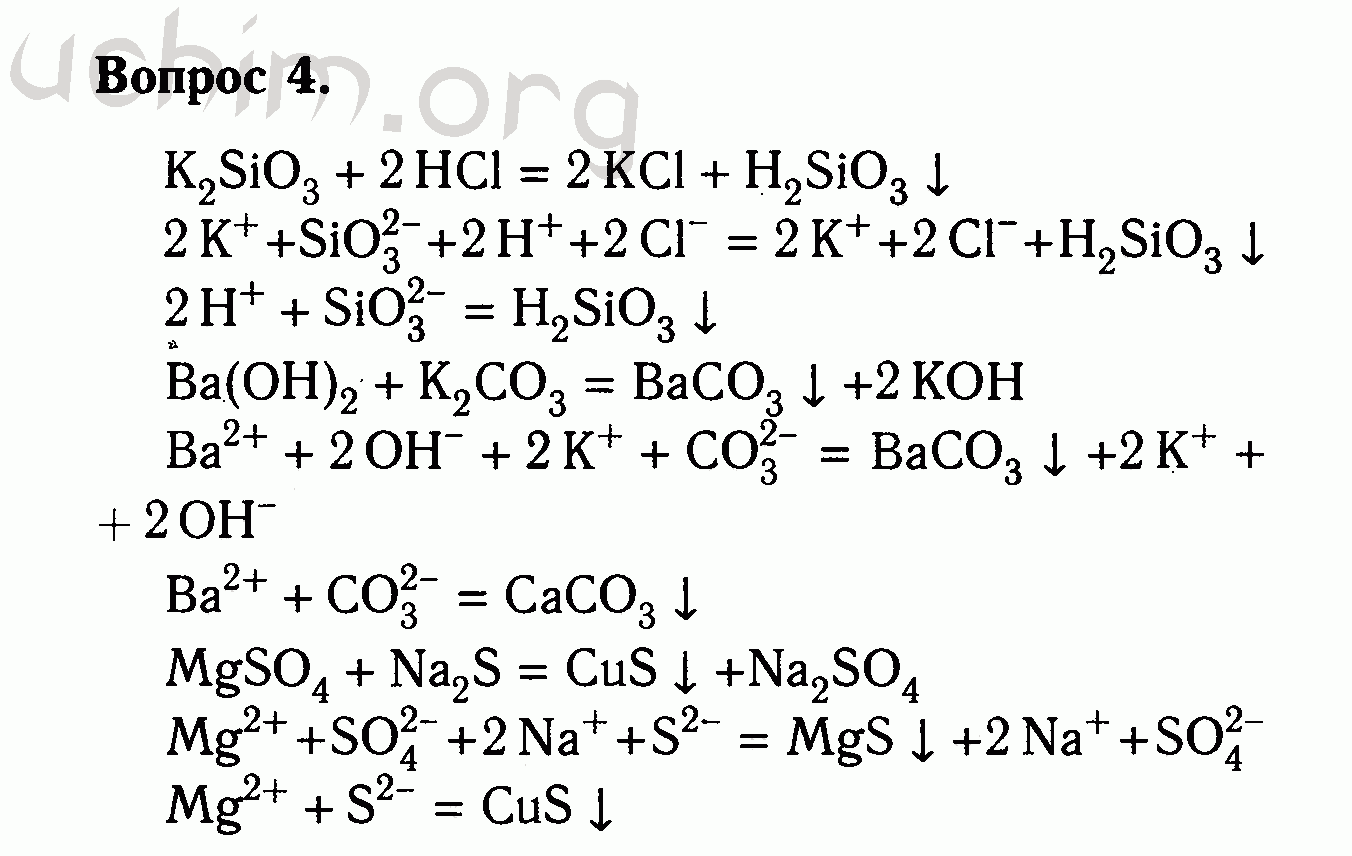 Когда смола приближается к истощению, щелочность очищенной воды быстро увеличивается, сигнализируя о необходимости регенерации.
Когда смола приближается к истощению, щелочность очищенной воды быстро увеличивается, сигнализируя о необходимости регенерации.
Цеолитовый умягчитель регенерируется, как описано выше. Кроме того, анионная смола также регенерируется соляным раствором хлорида натрия, который возвращает смолу в хлоридную форму. Часто в регенерирующий солевой раствор добавляют небольшое количество каустической соды для улучшения удаления щелочности.
Слабокислотный катион декальцинации
В другом методе удаления щелочи используются слабокислотные катиониты.Слабокислотные смолы по действию аналогичны сильнокислотным катионитам, но обмениваются только на катионы, связанные с щелочностью, как показывают следующие реакции:
, где Z представляет собой смолу. Образовавшуюся угольную кислоту (H 2 CO 3 ) удаляют декарбонизатором или дегазатором, как в системе с разделенным потоком.
Идеальный входной поток для слабокислотной катионной системы имеет уровень жесткости, равный щелочности (оба значения выражены в ppm как CaCO 3 ). В водах с более высокой щелочностью, чем жесткость, щелочность не снижается до самого низкого уровня. В водах, содержащих большую жесткость, чем щелочность, некоторая жесткость остается после обработки. Обычно эти воды необходимо полировать смягчителем на основе цеолита натрия для удаления жесткости. Во время начального периода работы слабокислотных катионов (первые 40-60%) некоторые катионы, связанные с минеральными анионами, обмениваются, образуя небольшое количество минеральных кислот в сточных водах. По мере прохождения рабочего цикла в стоках появляется щелочность.Когда щелочность сточных вод превышает 10 % щелочности поступающих, установка выводится из эксплуатации и регенерируется 0,5 % раствором серной кислоты. Концентрация регенерирующей кислоты должна поддерживаться ниже 0,5-0,7%, чтобы предотвратить осаждение сульфата кальция в смоле. Слабокислотный обмен катионита очень эффективен. Таким образом, необходимое количество кислоты практически равно (химически) количеству катионов, удаленных во время рабочего цикла.
В водах с более высокой щелочностью, чем жесткость, щелочность не снижается до самого низкого уровня. В водах, содержащих большую жесткость, чем щелочность, некоторая жесткость остается после обработки. Обычно эти воды необходимо полировать смягчителем на основе цеолита натрия для удаления жесткости. Во время начального периода работы слабокислотных катионов (первые 40-60%) некоторые катионы, связанные с минеральными анионами, обмениваются, образуя небольшое количество минеральных кислот в сточных водах. По мере прохождения рабочего цикла в стоках появляется щелочность.Когда щелочность сточных вод превышает 10 % щелочности поступающих, установка выводится из эксплуатации и регенерируется 0,5 % раствором серной кислоты. Концентрация регенерирующей кислоты должна поддерживаться ниже 0,5-0,7%, чтобы предотвратить осаждение сульфата кальция в смоле. Слабокислотный обмен катионита очень эффективен. Таким образом, необходимое количество кислоты практически равно (химически) количеству катионов, удаленных во время рабочего цикла.
Если материалы конструкции последующего оборудования или процесса в целом не выдерживают минеральной кислотности, присутствующей во время начальных частей рабочего цикла, перед окончательной промывкой через регенерированную слабокислотную смолу пропускают соляной раствор.Этот раствор удаляет минеральную кислотность без существенного влияния на качество или продолжительность последующего цикла.
Оборудование, используемое для слабокислотного декальцинатора, аналогично оборудованию, используемому для сильнокислотного катионита, за исключением смолы. В одном варианте стандартной конструкции используется слой слабокислотной смолы поверх сильнокислотной катионитной смолы. Поскольку он легче, слабокислотная смола остается сверху. Слоистая система смолы регенерируется серной кислотой, а затем рассолом хлорида натрия.Солевой раствор переводит сильнокислотную смолу в натриевую форму. Затем эта смола действует как полирующий смягчитель.
Прямой впрыск кислоты
В процессе прямого впрыска кислоты и декарбонизации кислота используется для преобразования щелочности в угольную кислоту. Угольная кислота диссоциирует с образованием двуокиси углерода и воды, и двуокись углерода удаляется в декарбонизаторе. К использованию системы впрыска кислоты следует подходить с осторожностью, потому что избыточная подача кислоты или неисправность в системе контроля pH могут привести к образованию кислой питательной воды, которая разъедает железные поверхности систем питательной воды и котлов.Требуется надлежащий мониторинг pH и контролируемая подача щелочи после декарбонизации.
Угольная кислота диссоциирует с образованием двуокиси углерода и воды, и двуокись углерода удаляется в декарбонизаторе. К использованию системы впрыска кислоты следует подходить с осторожностью, потому что избыточная подача кислоты или неисправность в системе контроля pH могут привести к образованию кислой питательной воды, которая разъедает железные поверхности систем питательной воды и котлов.Требуется надлежащий мониторинг pH и контролируемая подача щелочи после декарбонизации.
Преимущества и ограничения систем дезактивации
Системы ионообменной декальцинации производят воду без жесткости, с низкой щелочностью по разумной цене и с высокой степенью надежности. Они хорошо подходят для обработки питательной воды для котлов среднего давления и технологической воды для производства напитков. Системы с разделенным потоком и слабокислые катиониты также снижают общее количество растворенных твердых веществ.В дополнение к этим преимуществам необходимо учитывать следующие недостатки:
- декальцинаторы не полностью удаляют щелочность и не влияют на содержание кремнезема в воде Декальцинаторы
- требуют такой же чистоты входящего потока, как и другие процессы ионного обмена; необходимо использовать фильтрованную воду с низким содержанием потенциальных загрязнителей
- вода, полученная в системе декальцинации с использованием декарбонизатора с принудительной тягой, насыщается кислородом, поэтому она потенциально вызывает коррозию
ПРОТИВОТОЧНАЯ И СМЕШАННАЯ ДЕИОНИЗАЦИЯ
Из-за увеличения рабочего давления в котлах и производства продуктов, требующих воды, не содержащей примесей, растет потребность в воде более высокого качества, чем могут производить катионно-анионные деминерализаторы. Поэтому возникла необходимость модификации стандартного процесса обессоливания для повышения чистоты очищаемой воды. Наиболее значительные улучшения чистоты деминерализованной воды были достигнуты при использовании противоточных катионитов и теплообменников смешанного действия.
Поэтому возникла необходимость модификации стандартного процесса обессоливания для повышения чистоты очищаемой воды. Наиболее значительные улучшения чистоты деминерализованной воды были достигнуты при использовании противоточных катионитов и теплообменников смешанного действия.
Противоточные катиониты
В традиционной системе деминерализации регенерирующий поток течет в том же направлении, что и рабочий поток, вниз через слой смолы. Эта схема известна как прямоточная работа и является основой для большинства конструкций систем ионного обмена.Во время регенерации прямоточной установки загрязняющие вещества вытесняются через слой смолы во время регенерации. В конце регенерации некоторые ионы, преимущественно ионы натрия, остаются на дне слоя смолы. Поскольку верхняя часть слоя была подвергнута воздействию свежего регенеранта, она сильно регенерирована. По мере того, как вода проходит через смолу во время работы, обмен катионов сначала происходит в верхней части слоя, а затем перемещается вниз через смолу по мере истощения слоя. Ионы натрия, оставшиеся в слое во время регенерации, диффундируют в декатионированную воду до того, как она покинет сосуд. Эта утечка натрия поступает в анионную установку, где при анионном обмене образуется щелочь, повышающая pH и проводимость деминерализованной воды.
Ионы натрия, оставшиеся в слое во время регенерации, диффундируют в декатионированную воду до того, как она покинет сосуд. Эта утечка натрия поступает в анионную установку, где при анионном обмене образуется щелочь, повышающая pH и проводимость деминерализованной воды.
В регенерируемом катионите с противотоком регенерант течет в направлении, противоположном рабочему потоку. Например, если рабочий поток идет вниз через слой, поток регенерирующей кислоты идет вверх через слой.В результате наиболее регенерируемая смола находится там, где техническая вода выходит из сосуда. Смола с высокой степенью регенерации удаляет небольшое количество загрязняющих веществ, которые не удалось удалить в верхней части слоя. Это приводит к более высокой чистоте воды, чем могут обеспечить прямоточные конструкции. Чтобы максимизировать контакт между кислотой и смолой и предотвратить смешивание наиболее регенерированной смолы с остальной частью слоя, слой смолы должен оставаться сжатым во время введения регенеранта. Это сжатие обычно достигается одним из двух способов:
Это сжатие обычно достигается одним из двух способов:
Теплообменники смешанного действия
В теплообменнике смешанного действия катионит и анионит смешаны в одном сосуде.Когда вода течет через слой смолы, процесс ионного обмена повторяется много раз, «полируя» воду до очень высокой чистоты. Во время регенерации смола разделяется на отдельные катионные и анионные фракции, как показано на рис. 8-12. Смола отделяется обратной промывкой, при этом более легкая анионная смола оседает поверх катионной смолы. Регенерирующая кислота вводится через нижний распределитель, а щелочь – через распределители над слоем смолы. Потоки регенерата встречаются на границе между катионитом и анионитом и выводятся через коллектор, расположенный на границе раздела смолы.После введения реагента и вытесняющей промывки воздух и вода используются для смешивания смол. Затем смолы промываются, и установка готова к эксплуатации.
Противоточные системы и системы со смешанным слоем производят более чистую воду, чем обычные катионно-анионные деминерализаторы, но требуют более сложного оборудования и имеют более высокую начальную стоимость.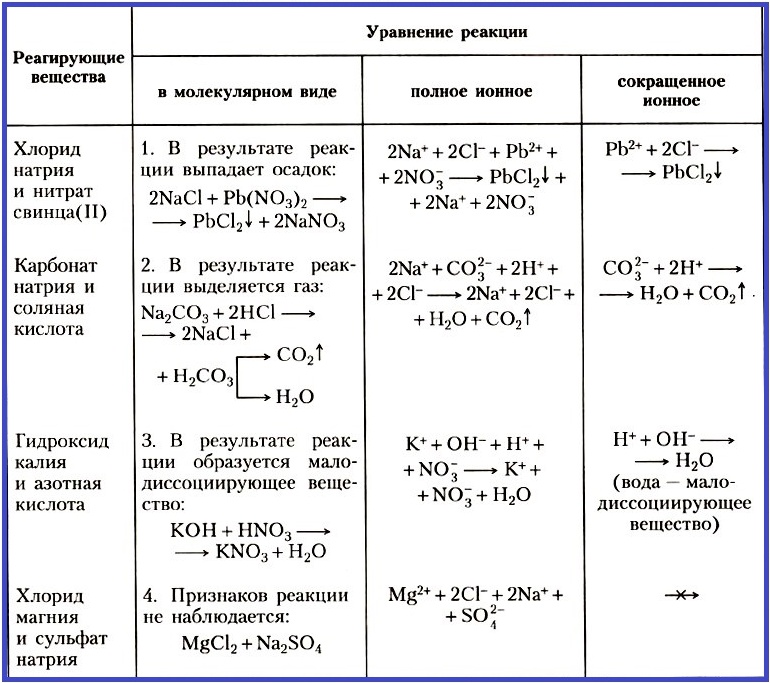 Более сложные последовательности регенерации требуют более пристального внимания оператора, чем стандартные системы. Особенно это касается смешанной кровати.
Более сложные последовательности регенерации требуют более пристального внимания оператора, чем стандартные системы. Особенно это касается смешанной кровати.
ПРОЧИЕ ПРОЦЕССЫ ДЕМИНЕРАЛИЗАЦИИ
Стандартный катионно-анионный процесс был изменен во многих системах для сокращения использования дорогостоящих регенерантов и образования отходов. Модификации включают использование декарбонизаторов и дегазаторов, слабокислотных и слабоосновных смол, отходов сильноосновного анионного каустика (для регенерации слабоосновных анионообменников) и утилизации части отработанного каустика для последующих циклов регенерации. Несколько различных подходов к деминерализации с использованием этих процессов показаны на рис. 8-13.
Декарбонизаторы и дегазаторы
Декарбонизаторы и дегазаторы экономически выгодны для многих систем обессоливания, поскольку они уменьшают количество щелочи, необходимой для регенерации. Вода из катионита разбивается на мелкие капли с помощью распылителей и лотков или набивается в декарбонизатор.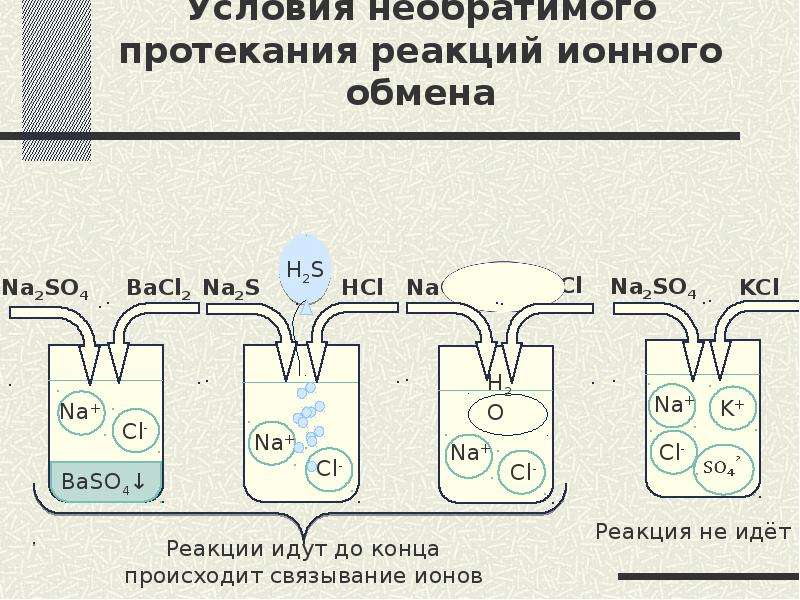 Затем вода течет через поток воздуха, идущего в противоположном направлении. Углекислота, присутствующая в выбросах катионов, диссоциирует на углекислый газ и воду.Углекислый газ удаляется из воды воздухом, что снижает нагрузку на анионообменники. Типичные декарбонизаторы с принудительной тягой способны удалять углекислый газ до 10-15 частей на миллион. Однако вода, выходящая из декарбонатора, насыщена кислородом.
Затем вода течет через поток воздуха, идущего в противоположном направлении. Углекислота, присутствующая в выбросах катионов, диссоциирует на углекислый газ и воду.Углекислый газ удаляется из воды воздухом, что снижает нагрузку на анионообменники. Типичные декарбонизаторы с принудительной тягой способны удалять углекислый газ до 10-15 частей на миллион. Однако вода, выходящая из декарбонатора, насыщена кислородом.
В вакуумном дегазаторе капли воды вводятся в насадочную колонку, работающую под вакуумом. Углекислый газ удаляется из воды благодаря пониженному парциальному давлению в вакууме. Вакуумный дегазатор обычно снижает содержание углекислого газа до уровня менее 2 частей на миллион, а также удаляет большую часть кислорода из воды.Однако приобрести и эксплуатировать вакуумные дегазаторы дороже, чем декарбонизаторы с принудительной тягой.
Слабокислотные и слабоосновные смолы
Смолы со слабыми функциональными свойствами имеют гораздо более высокую эффективность регенерации, чем их аналоги с сильными функциональными свойствами. Слабокислотные катиониты, как описано в разделе о снижении щелочности, обмениваются с катионами, связанными с щелочностью. Слабоосновные смолы обмениваются на анионы неорганических кислот (SO 4 ¯, Cl¯, NO 3 ¯) в растворе сильной кислоты.Эффективность регенерации слабых смол практически стехиометрична, для удаления 1 кг ионов (как CaCO 3 ) требуется лишь немногим более 1 кг регенерирующего иона (как CaCO 3 ). Прочные смолы требуют в три-четыре раза больше регенеранта для того же удаления загрязняющих веществ.
Слабокислотные катиониты, как описано в разделе о снижении щелочности, обмениваются с катионами, связанными с щелочностью. Слабоосновные смолы обмениваются на анионы неорганических кислот (SO 4 ¯, Cl¯, NO 3 ¯) в растворе сильной кислоты.Эффективность регенерации слабых смол практически стехиометрична, для удаления 1 кг ионов (как CaCO 3 ) требуется лишь немногим более 1 кг регенерирующего иона (как CaCO 3 ). Прочные смолы требуют в три-четыре раза больше регенеранта для того же удаления загрязняющих веществ.
Слабоосновные смолы настолько эффективны, что общепринятой практикой является регенерация слабоосновного обменника с помощью части «отработанного» каустика после регенерации сильноосновной анионита.Первую фракцию каустика из сильноосновной единицы отправляют в отходы, чтобы предотвратить загрязнение кремнеземом слабоосновной смолы. Оставшаяся щелочь используется для регенерации слабоосновной смолы. Дополнительным свойством слабоосновных смол является их способность удерживать природные органические материалы, загрязняющие сильноосновные смолы, и высвобождать их во время цикла регенерации. Благодаря этой способности слабоосновные смолы обычно используются для защиты сильноосновных смол от вредного органического загрязнения.
Благодаря этой способности слабоосновные смолы обычно используются для защиты сильноосновных смол от вредного органического загрязнения.
Повторное использование регенерата
Из-за высокой стоимости каустической соды и растущих проблем с утилизацией отходов многие системы деминерализации в настоящее время оснащены функцией регенерации каустической соды.Система регенерации использует часть отработанного каустика от предыдущей регенерации в начале следующего цикла регенерации. После повторного использования каустика следует свежий каустик для завершения регенерации. Затем новый каустик используется для следующей регенерации. Как правило, серная кислота не регенерируется, поскольку она дешевле, а осаждение сульфата кальция представляет собой потенциальную проблему.
ПОЛИРОВКА КОНДЕНСАТОМ
Применение ионного обмена не ограничивается подпиткой технологической воды и котловой воды.Ионный обмен можно использовать для очистки или полировки возвращаемого конденсата, удаления продуктов коррозии, которые могут вызывать вредные отложения в котлах.
Обычно загрязняющие вещества в системе конденсата представляют собой твердые частицы железа и меди. Низкие уровни других загрязняющих веществ могут попасть в систему из-за утечек конденсатора и уплотнения насоса или переноса котловой воды с паром. Полировщики конденсата отфильтровывают твердые частицы и удаляют растворимые загрязнения путем ионного обмена.
Большинство машин для полировки конденсата на бумажных фабриках работают при температурах, приближающихся к 200°F, что исключает использование анионита.Катионит, который стабилен до температуры выше 270°F, используется для глубокой полировки конденсата в этих применениях. Смола регенерируется раствором хлорида натрия, как и в цеолитовом умягчителе. В ситуациях, когда утечка натрия из полировщика неблагоприятно влияет на внутреннюю химическую программу котловой воды или пар снижает чистоту воды, смолу можно регенерировать с помощью раствора ионизированного амина, чтобы предотвратить эти проблемы.
Рабочий расход для глубокой полировки (20-50 галлонов в минуту на квадратный фут площади поверхности смолы) очень высок по сравнению с обычным умягчителем. Допустимы высокие скорости потока, поскольку уровень растворимых ионов в конденсате обычно может быть очень низким. Железо в виде частиц и медь удаляются фильтрацией, а количество растворенных загрязняющих веществ снижается за счет обмена на натрий или амин в смоле.
Допустимы высокие скорости потока, поскольку уровень растворимых ионов в конденсате обычно может быть очень низким. Железо в виде частиц и медь удаляются фильтрацией, а количество растворенных загрязняющих веществ снижается за счет обмена на натрий или амин в смоле.
Регенерация конденсата катионитовой смолы с глубоким слоем регенерируется с помощью 15 фунтов хлорида натрия на кубический фут смолы способом, аналогичным тому, который используется для обычной регенерации цеолита натрия. Солюбилизирующий или восстанавливающий агент часто используется для облегчения удаления железа.Иногда дополнительный коллектор обратной промывки располагается непосредственно под поверхностью слоя смолы. Этот подповерхностный распределитель, используемый перед обратной промывкой, вводит воду для разрушения корки, которая образуется на поверхности смолы между регенерациями.
Важным моментом является выбор смолы для полировки конденсата. Поскольку высокие перепады давления создаются высокими скоростями рабочего потока и загрузками твердых частиц, а также поскольку многие системы работают при высоких температурах, структура смолы подвергается значительным нагрузкам. Гелеобразную или макропористую смолу высшего качества следует использовать для полировки конденсата в глубоком слое.
Гелеобразную или макропористую смолу высшего качества следует использовать для полировки конденсата в глубоком слое.
В системах, требующих полного удаления растворенных твердых частиц и твердых частиц, можно использовать полировщик конденсата со смешанным слоем. Температура конденсата должна быть ниже 140°F, что является максимальной продолжительной рабочей температурой для анионита. Кроме того, расход через устройство обычно снижается примерно до 20 галлонов в минуту/фут².
Ионообменные смолы также используются как часть системы предварительной фильтрации, как показано на рис. 8-14, для очистки конденсата.Смола измельчается и смешивается в суспензию, которая используется для покрытия отдельных септ в емкости фильтра. Порошкообразная смола представляет собой очень тонкую фильтрующую среду, которая улавливает твердые частицы и удаляет некоторые растворимые загрязнения путем ионного обмена. Когда фильтрующий материал засоряется, материал предварительного покрытия утилизируется, а перегородки покрывают свежей суспензией порошкообразной смолы.
ПРОБЛЕМЫ ОБЩЕЙ СИСТЕМЫ ИОНООБМЕНА
Как и в любой динамической операционной системе, включающей электрическое и механическое оборудование и химические операции, в системах ионного обмена все же возникают проблемы.Проблемы обычно приводят к плохому качеству сточных вод, уменьшению продолжительности обслуживания или увеличению потребления регенеранта. Чтобы система ионного обмена работала эффективно и надежно, при каждом обнаружении проблем следует учитывать изменения качества воды, длины цикла или расхода регенеранта.
Диаграммы причинно-следственных связей для коротких циклов (Рисунок 8-15) и некачественных стоков (Рисунок 8-16) показывают, что существует множество возможных причин снижения производительности системы обессоливания.Некоторые из наиболее распространенных проблем обсуждаются ниже.
Эксплуатационные проблемы
Изменения качества сырой воды оказывают значительное влияние как на продолжительность цикла, так и на качество сточных вод, производимых ионообменной установкой.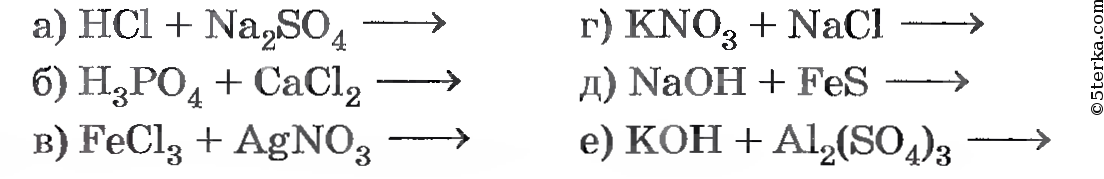 Хотя большинство колодезных вод имеют постоянное качество, состав большинства поверхностных вод сильно меняется с течением времени. Увеличение жесткости воды на 10 % для умягчителя на основе цеолита натрия приводит к сокращению срока службы на 10 %. Увеличение отношения натрия к общему количеству катионов вызывает повышенную утечку натрия из системы деминерализации.Для выявления таких отклонений необходимо регулярно проводить химический анализ воды, поступающей в ионообменники.
Хотя большинство колодезных вод имеют постоянное качество, состав большинства поверхностных вод сильно меняется с течением времени. Увеличение жесткости воды на 10 % для умягчителя на основе цеолита натрия приводит к сокращению срока службы на 10 %. Увеличение отношения натрия к общему количеству катионов вызывает повышенную утечку натрия из системы деминерализации.Для выявления таких отклонений необходимо регулярно проводить химический анализ воды, поступающей в ионообменники.
Другие причины проблем в работе ионного обмена включают:
- Неправильная регенерация, вызванная неправильными расходами, временем или концентрацией регенерирующего средства. При регенерации ионообменных смол необходимо соблюдать рекомендации производителя.
- Каналообразование в результате высокой или низкой скорости потока, повышенного содержания взвешенных твердых частиц или плохой обратной промывки.Это вызывает преждевременное истощение, даже когда большая часть кровати находится в регенерированном состоянии.

- Загрязнение или деградация смолы из-за некачественного регенеранта.
- Неудачное удаление диоксида кремния из смолы, что может быть результатом низкой температуры регенерирующей щелочи. Это может привести к увеличению утечки кремнезема и сокращению сроков службы.
- Избыточное количество загрязняющих веществ в смоле из-за предыдущей эксплуатации после истощения. Поскольку в смоле содержится больше загрязняющих веществ, чем может удалить обычная регенерация, после продолжительного обслуживания требуется двойная регенерация.
Механические проблемы
Типичные механические проблемы, связанные с системами ионного обмена, включают:
- Негерметичные клапаны, что приводит к некачественному стоку и длительной промывке.
- Сломанный или засоренный распределитель, что приводит к засорению.
- Потери смолы из-за чрезмерной обратной промывки или неисправности дренажного экрана или опорной среды.
- Катионная смола в анионном блоке, что приводит к увеличению времени промывки и утечке натрия в деминерализованную воду.

- Проблемы с приборами, такие как неисправные сумматоры или измерители проводимости, которые могут указывать на проблему, когда ее нет, или могут привести к использованию воды низкого качества. Инструментарий в зоне деминерализации следует регулярно проверять.
ЗАГРЯЗНЕНИЕ И РАЗЛОЖЕНИЕ СМОЛЫ
Смола может быть загрязнена загрязняющими веществами, которые препятствуют процессу обмена. На рис. 8-17 показана смола, загрязненная железом. Смола также может подвергаться воздействию химических веществ, вызывающих необратимое разрушение.Некоторые материалы, такие как природные органические вещества (рис. 8-18), сначала загрязняют смолы, а затем с течением времени разлагают смолы. Это наиболее распространенная причина загрязнения и деградации ионообменных систем, и она обсуждается в разделе «Органическое загрязнение» далее в этой главе.
Причины загрязнения смолой
Железо и марганец . Железо может находиться в воде в виде неорганической соли двухвалентного или двухвалентного железа или в виде секвестрированного органического комплекса. Двухвалентное железо переходит в смолу, а трехвалентное нерастворимо и не растворяется.Трехвалентное железо покрывает катионит, предотвращая обмен. Для удаления этого железа необходимо использовать кислоту или сильный восстановитель. Органически связанное железо проходит через катионит и загрязняет анионит. Его необходимо удалить вместе с органическим материалом. Марганец, присутствующий в воде некоторых колодцев, загрязняет смолу так же, как и железо.
Двухвалентное железо переходит в смолу, а трехвалентное нерастворимо и не растворяется.Трехвалентное железо покрывает катионит, предотвращая обмен. Для удаления этого железа необходимо использовать кислоту или сильный восстановитель. Органически связанное железо проходит через катионит и загрязняет анионит. Его необходимо удалить вместе с органическим материалом. Марганец, присутствующий в воде некоторых колодцев, загрязняет смолу так же, как и железо.
Алюминий . Алюминий обычно присутствует в виде гидроксида алюминия в результате использования квасцов или алюмината натрия для осветления или смягчения осадков.Алюминиевый флок, если он проходит через фильтры, покрывает смолу в умягчителе на основе цеолита натрия. Его удаляют очисткой либо кислотой, либо щелочью. Обычно алюминий не загрязняет систему деминерализации, поскольку он удаляется из смолы во время обычной регенерации.
Осадки жесткости . Осадки жесткости выносят через фильтр из умягчителя осадков или образуются после фильтрации путем доосаждения. Эти осадки загрязняют смолы, используемые для умягчения цеолита натрия.Их удаляют кислотой.
Эти осадки загрязняют смолы, используемые для умягчения цеолита натрия.Их удаляют кислотой.
Сульфатные осадки. Осаждение сульфата кальция может происходить в сильнокислотной катионной установке, работающей в водородном цикле. В конце рабочего цикла верхняя часть слоя смолы богата кальцием. Если в качестве регенеранта используется серная кислота и ее вводят в слишком высокой концентрации или при слишком низкой скорости потока, происходит осаждение сульфата кальция, загрязняющего смолу. После образования сульфата кальция его очень трудно растворить; поэтому смола, загрязненная сульфатом кальция, обычно выбрасывается.Легкие случаи загрязнения сульфатом кальция можно устранить длительным вымачиванием в соляной кислоте.
Сульфат бария еще менее растворим, чем сульфат кальция. Если источник воды содержит измеримые количества бария, следует рассмотреть возможность регенерации соляной кислотой.
Масляное загрязнение . Масло покрывает смолу, блокируя прохождение ионов к местам обмена и от них. Для удаления масла можно использовать поверхностно-активное вещество. Следует проявлять осторожность при выборе поверхностно-активного вещества, которое не загрязняет смолу.Загрязненные маслом анионные смолы следует очищать только неионогенными поверхностно-активными веществами.
Для удаления масла можно использовать поверхностно-активное вещество. Следует проявлять осторожность при выборе поверхностно-активного вещества, которое не загрязняет смолу.Загрязненные маслом анионные смолы следует очищать только неионогенными поверхностно-активными веществами.
Микробиологическое загрязнение. Микробиологическое загрязнение может происходить в слоях смолы, особенно в слоях, которые могут оставаться без потока. Микробиологическое загрязнение может привести к серьезной закупорке слоя смолы и даже к механическому повреждению из-за чрезмерного перепада давления на загрязненной смоле. Если микробиологическое загрязнение в резервных блоках представляет собой проблему, следует использовать постоянный поток рециркуляционной воды, чтобы свести к минимуму проблему.Тяжелые условия могут потребовать применения подходящих стерилизующих агентов и поверхностно-активных веществ.
Кремнеземное обрастание . Загрязнение диоксидом кремния может происходить в сильноосновных анионных смолах, если температура регенерации слишком низкая, или в слабоосновных смолах, если выходящий каустик из установки SBA, используемый для регенерации слабоосновного элемента, содержит слишком много кремнезема. При низких уровнях pH в слабоосновной смоле может происходить полимеризация кремнезема. Это также может быть проблемой в исчерпавшей себя сильноосновной анионообменной смоле.Загрязнение кремнеземом удаляется длительным вымачиванием в теплой (120 ° F) каустической соды.
При низких уровнях pH в слабоосновной смоле может происходить полимеризация кремнезема. Это также может быть проблемой в исчерпавшей себя сильноосновной анионообменной смоле.Загрязнение кремнеземом удаляется длительным вымачиванием в теплой (120 ° F) каустической соды.
Причины необратимой деградации смолы
Окисление . Окислители, такие как хлор, разрушают как катионные, так и анионные смолы. Окислители разрушают поперечные связи дивинилбензола в катионной смоле, снижая общую прочность шарика смолы. По мере продолжения атаки катионит начинает терять свою сферическую форму и жесткость, что приводит к его уплотнению во время эксплуатации.Это уплотнение увеличивает перепад давления на слое смолы и приводит к образованию каналов, что снижает эффективную производительность установки.
В случае хлорирования сырой воды анионит не подвергается прямому воздействию, поскольку хлор поглощается катионитом. Однако последующие сильноосновные анионные смолы загрязняются некоторыми продуктами разложения из окисленных катионитов.
Если в сырой воде присутствует хлор, его следует удалить перед ионным обменом с помощью фильтрации с активированным углем или сульфита натрия.Приблизительно 1,8 промилле сульфита натрия требуется для потребления 1 промилле хлора.
Насыщенная кислородом вода, такая как вода, обнаруженная после декарбонизации с принудительной тягой, ускоряет разрушение мест сильного обмена оснований, которое происходит естественным образом с течением времени. Это также ускоряет деградацию из-за органического загрязнения.
Термическое разложение . Термическая деградация происходит, если анионит перегревается во время цикла обслуживания или регенерации. Это особенно верно для акриловых смол, которые имеют температурные ограничения до 100°F, и сильноосновных анионных смол типа II, которые имеют температурный предел 105°F в форме гидроксида.
Органические загрязнения
Органическое загрязнение является наиболее распространенной и дорогостоящей формой загрязнения и деградации смолы. Обычно в колодезной воде обнаруживаются только низкие уровни органических материалов. Однако поверхностные воды могут содержать сотни частей на миллион природных и искусственных органических веществ. Природные органические вещества получают из разлагающейся растительности. Они ароматические и кислые по своей природе и могут образовывать комплексы с тяжелыми металлами, такими как железо. Эти загрязняющие вещества включают дубильные вещества, дубильные кислоты, гуминовые кислоты и фульвокислоты.
Обычно в колодезной воде обнаруживаются только низкие уровни органических материалов. Однако поверхностные воды могут содержать сотни частей на миллион природных и искусственных органических веществ. Природные органические вещества получают из разлагающейся растительности. Они ароматические и кислые по своей природе и могут образовывать комплексы с тяжелыми металлами, такими как железо. Эти загрязняющие вещества включают дубильные вещества, дубильные кислоты, гуминовые кислоты и фульвокислоты.
Изначально органические вещества блокируют участки сильного основания на смоле. Эта блокировка приводит к длительному заключительному полосканию и снижает способность к расщеплению соли. По мере того, как загрязнитель продолжает оставаться на смоле, он начинает разрушать участки сильного основания, снижая способность смолы расщеплять соли. Функциональность сайта меняется с сильной базы на слабую базу и, наконец, на неактивный сайт. Таким образом, смола на ранних стадиях разложения обладает высокой общей емкостью, но пониженной способностью к расщеплению солей. На этом этапе очистка смолы еще может вернуть часть, но не всю утраченную работоспособность. Потеря способности расщеплять соли снижает способность смолы удалять диоксид кремния и угольную кислоту.
На этом этапе очистка смолы еще может вернуть часть, но не всю утраченную работоспособность. Потеря способности расщеплять соли снижает способность смолы удалять диоксид кремния и угольную кислоту.
Об органическом загрязнении анионита свидетельствует цвет стока из анионита при регенерации, который варьируется от цвета чая до темно-коричневого. Во время работы очищенная вода имеет более высокую электропроводность и более низкий рН.
Профилактика . Следующие методы используются по отдельности или в комбинации для уменьшения органического загрязнения:
- Предварительное хлорирование и осветление.Вода предварительно хлорируется в источнике, а затем очищается с помощью добавки для удаления органических веществ.
- Фильтрация через активированный уголь. Следует отметить, что угольный фильтр имеет ограниченную способность по удалению органических материалов и что эффективность удаления угля следует часто контролировать.
- Макропористая и слабоосновная смола опережает сильноосновную.
 Слабое основание или макропористая смола поглощают органический материал и вымываются во время регенерации.
Слабое основание или макропористая смола поглощают органический материал и вымываются во время регенерации. - Специальные смолы.Были разработаны акриловые и другие специальные смолы, которые менее подвержены органическому загрязнению.
Осмотр и очистка . В дополнение к этим профилактическим процедурам программа регулярного осмотра и очистки ионообменной системы помогает сохранить срок службы анионита. В большинстве процедур очистки используется одно из следующих средств:
- Теплый (120°F) рассол и щелочь. Для улучшения очистки можно добавить мягкие окислители или солюбилизирующие агенты.
- Кислота соляная.Когда смолы также загрязнены значительным количеством железа, используются соляные кислоты.
- Растворы 0,25-0,5% гипохлорита натрия. Эта процедура разрушает органический материал, но также значительно ухудшает качество смолы. Чистка гипохлоритом считается крайней мерой.
Важно очистить смолу, загрязненную органическими веществами, до того, как произойдет чрезмерная необратимая деградация участков сильного основания. Очистка после необратимой деградации удаляет значительное количество органического материала, но не улучшает производительность установки.Необходимо внимательно следить за состоянием смолы, чтобы определить оптимальный график очистки.
Очистка после необратимой деградации удаляет значительное количество органического материала, но не улучшает производительность установки.Необходимо внимательно следить за состоянием смолы, чтобы определить оптимальный график очистки.
ИСПЫТАНИЯ И АНАЛИЗ СМОЛЫ
Чтобы отслеживать состояние ионообменной смолы и определять наилучшее время для ее очистки, необходимо периодически брать пробы смолы и анализировать ее на физическую стабильность, уровень загрязнения и способность выполнять требуемый ионный обмен.
Образцы должны быть репрезентативными для всего слоя смолы. Таким образом, образцы должны быть собраны на разных уровнях в пределах слоя, или для получения «кернового» образца следует использовать поглотитель зерна или полую трубу.Во время отбора проб следует осмотреть впускной патрубок и распределитель регенерата, а также отметить состояние верхней части слоя смолы. Чрезмерные холмы или впадины в слое смолы указывают на проблемы с распределением потока.
Образец смолы следует исследовать под микроскопом на наличие признаков загрязнения, трещин или сломанных шариков. Его также следует проверить на физические свойства, такие как плотность и содержание влаги (Рисунок 8-19). Следует определить уровень органических и неорганических загрязнений в смоле и сравнить с известными стандартами и предыдущим состоянием смолы.Наконец, следует измерить расщепление соли и общую емкость образцов анионита, чтобы оценить скорость разложения или органического загрязнения.
Рисунок 8-1. Микроскопический вид шариков ячеистой смолы (20-50 меш) сильнокислотного катионообменника сульфированного стирола-дивинилбензола. (Предоставлено компанией Rohm and Haas.)
ИксРисунок 8-2. Микроскопический вид макропористой сильноосновной анионита. (С разрешения Dow Chemical Company.)
ИксРис. 8-3.Химическая структурная формула сульфосильнокислотного катионита (Амберлит IR-120), (XL): поперечная связь; (ПК): полимерная цепь; (ES): сайт обмена; (EI): обменный ион.
 Икс
ИксРис. 8-4. Схема гидратированного сильнокислотного катионита. (Предоставлено компанией Rohm and Haas.)
ИксРис. 8-5. Типичный профиль сточных вод умягчителя на основе цеолита натрия.
ИксРис. 8-6. Смягчитель на основе цеолита натрия. (Любезно предоставлено Graver Water Division, Ecodyne Corporation.)
ИксРис. 8-7. Комбинированная система умягчения горячей известью/горячим цеолитом. (Предоставлено Отделом водоподготовки Envirex, Inc.)
ИксРис. 8-8. Типичный профиль сточных вод для сильнокислотного катионита.
ИксРис. 8-9. Профиль проводимости/кремнезема для сильноосновного анионообменника.
ИксРис. 8-10. Разделительный умягчитель потока на основе цеолита натрия/цеолита водорода.
ИксРис. 8-11.Катионный профиль противотока, показывающий метод блокировки двойного потока кислоты.
ИксРис.
 8-12. Важные шаги в последовательности регенерации теплообменника смешанного действия. Икс
8-12. Важные шаги в последовательности регенерации теплообменника смешанного действия. ИксРис. 8-13. Системы деминерализации.
ИксРис. 8-14. Средство для полировки конденсата в виде порошка смолы. (Предоставлено Graver Water Div., Ecodyne Corporation).
ИксРис. 8-15. Причинно-следственная диаграмма для коротких циклов в системе деминерализации с двумя слоями.
ИксРис. 8-16. Диаграмма причин и следствий плохого качества сточных вод в системе деминерализации с двумя слоями.
ИксРис. 8-17. Загрязненная железом смола.
ИксРис. 8-18. Анионит загрязнен органическим материалом.
ИксРис. 8-19. Периодический отбор проб и оценка смолы необходимы для поддержания производительности и эффективности на оптимальном уровне.
Икс
История, введение и кинетика ионообменных материалов
За последние несколько десятилетий ионообменные материалы превратились из лабораторных инструментов в промышленные продукты, имеющие значительное техническое и коммерческое значение.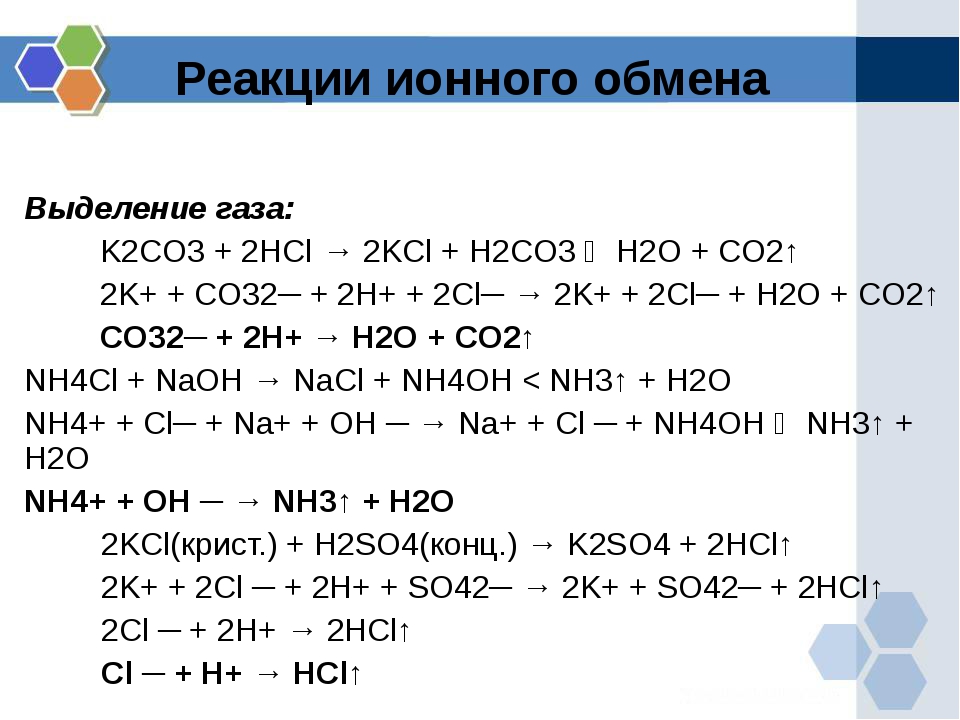 В настоящей статье кратко изложена история развития ионообменных материалов. В статье даны определения ионообменных материалов и их видов. В статье обозначена кинетика процесса ионного обмена с описанием факторов, влияющих на скорость ионного обмена. Механизм ионного обмена также показан на схематической диаграмме, показывающей, что существует два типа диффузии: пленочная диффузия и диффузия, контролируемая частицами. Также включен краткий математический подход к кинетике ионного обмена.
В настоящей статье кратко изложена история развития ионообменных материалов. В статье даны определения ионообменных материалов и их видов. В статье обозначена кинетика процесса ионного обмена с описанием факторов, влияющих на скорость ионного обмена. Механизм ионного обмена также показан на схематической диаграмме, показывающей, что существует два типа диффузии: пленочная диффузия и диффузия, контролируемая частицами. Также включен краткий математический подход к кинетике ионного обмена.
1. Введение
1.1. Историческая справка
Всякий раз, когда ион удаляется из водного раствора и заменяется другим ионным веществом, это обычно называют «ионным обменом». Это древняя техника, находящаяся в культурном наследии. Керамика эпохи Возрождения Средиземноморья, состоящая из тонких стеклянных пленок, имела неоднородное распределение наночастиц серебра и меди разного размера, нанесенных на керамическую подложку [1–3]. Отложение меди/серебра было получено путем нанесения смеси солей и оксидов меди и серебра вместе с уксусом, охрой и глиной на поверхность предварительно глазурованной керамики. Затем всю систему нагревали примерно до 600°С в восстановительной атмосфере, создаваемой введением дымящихся веществ в печь. В этих условиях индуцировался процесс ионного обмена между ионами металла и ионами щелочи в стекле. Позже ионы металлов с последующим восстановлением агрегировали, оставаясь в ловушке внутри первого слоя.
Затем всю систему нагревали примерно до 600°С в восстановительной атмосфере, создаваемой введением дымящихся веществ в печь. В этих условиях индуцировался процесс ионного обмена между ионами металла и ионами щелочи в стекле. Позже ионы металлов с последующим восстановлением агрегировали, оставаясь в ловушке внутри первого слоя.
Еще до заката человеческой цивилизации метод ионного обмена восходит к Священному Писанию, где упоминается приготовление питьевой воды «Моисеем» из солоноватой воды.
Хотя обмен катионов как явление впервые был открыт немногим более ста лет назад, два английских агрохимика Томпсон и Уэй отметили, что одни почвы обладают большей способностью, чем другие, поглощать аммиак из удобрений [4, 5] . Они обнаружили, что сложные силикаты в почве выполняют функцию ионного обмена. Они смогли приготовить материалы этого типа в лаборатории из растворов алюмината натрия и силиката натрия. В 1906 г. Робер Ганс использовал материалы этого типа для умягчения воды и обработки сахарных растворов [6]. Первые органические ионообменники были синтезированы в 1935 г.; Адамс и Холмс обнаружили, что измельченные грампластинки обладают ионообменными свойствами [7]. В середине 40-х гг. были разработаны ионообменные смолы на основе сополимеризации стирола, сшитого с дивинилбензолом. Эти смолы были очень стабильны и обладали гораздо большей обменной способностью, чем их предшественники. Анионообменник на основе полистирола-дивинилбензола может удалять все анионы, включая кремниевую и угольную кислоты. Это новшество сделало возможной полную деминерализацию воды.
Первые органические ионообменники были синтезированы в 1935 г.; Адамс и Холмс обнаружили, что измельченные грампластинки обладают ионообменными свойствами [7]. В середине 40-х гг. были разработаны ионообменные смолы на основе сополимеризации стирола, сшитого с дивинилбензолом. Эти смолы были очень стабильны и обладали гораздо большей обменной способностью, чем их предшественники. Анионообменник на основе полистирола-дивинилбензола может удалять все анионы, включая кремниевую и угольную кислоты. Это новшество сделало возможной полную деминерализацию воды.
Открытие ионообменников было предопределено общим прогрессом фундаментальной науки в середине (Майкл Фарадей, концепция ионов) и конце (Сванте Аррениус, теория растворов электролитов) восемнадцатого века. Эти идеи имели решающее значение для научного открытия ионообменников, потому что такие материалы, как органические, так и неорганические, по существу являются полиэлектролитами . Это означает, что их можно рассматривать как состоящие из двух ионов с противоположным зарядом. В отличие от обычных электролитов ионы одного заряда фиксируются в полимерной (органические ионообменники) или кристаллической (неорганические ионообменники) структуре.Как и любое ионное соединение, ионообменный материал может диссоциировать и участвовать в реакциях ионного обмена. Однако диссоциация не приводит к растворению материала. Это обуславливает множество специфических явлений и множество возможностей для создания гетерогенных систем с ионными свойствами (табл. 1).
В отличие от обычных электролитов ионы одного заряда фиксируются в полимерной (органические ионообменники) или кристаллической (неорганические ионообменники) структуре.Как и любое ионное соединение, ионообменный материал может диссоциировать и участвовать в реакциях ионного обмена. Однако диссоциация не приводит к растворению материала. Это обуславливает множество специфических явлений и множество возможностей для создания гетерогенных систем с ионными свойствами (табл. 1).
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ионообменные материалы
Ионный обмен представляет собой химическую реакцию, в которой свободные подвижные ионы твердого вещества, ионообменника, заменяются на различные ионы с аналогичным зарядом в растворе. Теплообменник должен иметь открытую сетчатую структуру, органическую или неорганическую, которая несет ионы и позволяет ионам проходить через нее.
Теплообменник должен иметь открытую сетчатую структуру, органическую или неорганическую, которая несет ионы и позволяет ионам проходить через нее.
Ионообменник представляет собой нерастворимое в воде вещество, способное обменивать часть своих ионов на ионы с таким же зарядом, содержащиеся в среде, с которой оно находится в контакте; это определение является всеобъемлющим. Ссылка на «вещество», а не на соединение, включает в себя множество обменников — некоторые из них являются натуральными продуктами, не имеющими четко определенного состава. Термин «среда» означает, что ионный обмен может происходить как в водном, так и в неводном растворе, в расплавленных солях или даже при контакте с парами.Определение не ограничивается твердыми веществами, поскольку некоторые органические растворители, не смешивающиеся с водой, могут извлекать ионы из водного раствора по механизму ионного обмена [10].
Определение также указывает на процесс ионного обмена. В основном он состоит в контакте между обменником и средой, в которой происходит обмен. Обычно это твердый ионообменник и водный раствор. Тот факт, что ионы обмениваются, означает, что обменник должен быть ионизирован, но только один из ионов в обменнике является растворимым.Этот ион может обмениваться, а другой, будучи нерастворимым, этого делать не может.
Обычно это твердый ионообменник и водный раствор. Тот факт, что ионы обмениваются, означает, что обменник должен быть ионизирован, но только один из ионов в обменнике является растворимым.Этот ион может обмениваться, а другой, будучи нерастворимым, этого делать не может.
Если мы представим ионообменник как М + X — , чтобы показать, что он ионизирован (М + является растворимым ионом), и представим его помещенным в раствор соли NY, которая ионизируется с образованием ионов N + и Y — реакция обмена может быть записана следующим образом: Это напоминает простую реакцию замещения между двумя солями MX и NY. Поскольку ион Y − не принимает участия в реакции, его можно опустить в обеих частях уравнения, что тогда упрощается до В этом примере происходит обмен катионов, аналогичное уравнение можно написать для ионного обмена, когда нерастворимым ионом в обменнике является катион.
Не существует строгой разницы между ионообменной смолой и хелатирующей смолой, поскольку некоторые полимеры могут действовать как хелатирующие или нехелатирующие вещества в зависимости от химической среды. Ионный обмен напоминает сорбцию, потому что оба являются поверхностными явлениями, и в обоих случаях твердое вещество поглощает растворенные частицы. Характерное отличие этих двух явлений заключается в стехиометрическом характере ионного обмена. Каждый ион, удаленный из раствора, заменяется эквивалентным количеством того же заряда (рис. 1).С другой стороны, при сорбции растворенное вещество обычно поглощается нестехиометрически без замены.
Ионный обмен напоминает сорбцию, потому что оба являются поверхностными явлениями, и в обоих случаях твердое вещество поглощает растворенные частицы. Характерное отличие этих двух явлений заключается в стехиометрическом характере ионного обмена. Каждый ион, удаленный из раствора, заменяется эквивалентным количеством того же заряда (рис. 1).С другой стороны, при сорбции растворенное вещество обычно поглощается нестехиометрически без замены.
Обычно ионообменные материалы подразделяются на две категории: катионообменники и анионообменники, в зависимости от типа ионных групп, присоединенных к материалу.
Катионообменные материалы, содержащие отрицательно заряженные группы, такие как сульфатные, карбоксилатные, фосфатные, бензоатные и т. д., закрепляются на материале основной цепи и пропускают катионы, но не пропускают анионы, в то время как анионообменные материалы, содержащие положительно заряженные группы, такие как аминогруппа, алкил замещенный фосфин (), алкилзамещенные сульфиды () и т. д. фиксируются на материалах основной цепи и пропускают анионы, но не пропускают катионы.Существуют также амфотерные обменники, способные одновременно обменивать и катионы, и анионы. Однако одновременный обмен катионов и анионов можно более эффективно проводить в смешанных слоях , содержащих смесь анионообменных и катионообменных смол, или пропуская обработанный раствор через несколько различных ионообменных материалов. Существует еще один класс ионообменников, известный как хелатирующий ионообменник. Многие ионы принимают неподеленную пару электронов от лигандов, образуя ковалентные связи, называемые координационными связями.В зависимости от количества координационных связей лиганд называют монодентатным, бидентатным или полидентатным. Координационные взаимодействия весьма специфичны. Примером координационного соединения является координация иона металла с этилендиаминтетрауксусной кислотой (ЭДТА) (рис. 2).
д. фиксируются на материалах основной цепи и пропускают анионы, но не пропускают катионы.Существуют также амфотерные обменники, способные одновременно обменивать и катионы, и анионы. Однако одновременный обмен катионов и анионов можно более эффективно проводить в смешанных слоях , содержащих смесь анионообменных и катионообменных смол, или пропуская обработанный раствор через несколько различных ионообменных материалов. Существует еще один класс ионообменников, известный как хелатирующий ионообменник. Многие ионы принимают неподеленную пару электронов от лигандов, образуя ковалентные связи, называемые координационными связями.В зависимости от количества координационных связей лиганд называют монодентатным, бидентатным или полидентатным. Координационные взаимодействия весьма специфичны. Примером координационного соединения является координация иона металла с этилендиаминтетрауксусной кислотой (ЭДТА) (рис. 2).
Органическая структура функциональных групп часто содержит атомы азота, кислорода и серы, которые являются элементами-донорами электронов (рис. 3).
3).
1.3. Типы ионообменных материалов
По происхождению ионообменные материалы можно разделить на натуральные и синтетические (рис. 4).
1.4. Натуральные органические продукты
Некоторые природные органические материалы обладают ионообменными свойствами или могут быть приданы им простой химической обработкой. Клетки растений и животных действуют как ионообменники благодаря наличию карбоксильных групп амфотерных белков. Эти карбоксильные группы (-CO 2 H) и фенольные группы (-OH) являются слабокислотными и будут обменивать свои ионы водорода на другие катионы в нейтральных или щелочных условиях. Гумины и гуминовые кислоты, обнаруженные в естественном почвенном «гумусе», являются примерами этого класса обменников; частично разложившиеся и окисленные растительные продукты содержат кислотные группировки.На рынке продается несколько органических продуктов, основанных на обработанной целлюлозе, либо в форме волокна для использования в ионообменных колонках, либо в виде фильтровальной бумаги для ионообменного разделения на бумаге. Многие ионообменники были приготовлены из других природных материалов, таких как древесина, волокна, торф и уголь, путем окисления азотной кислотой или, что еще лучше, концентрированной серной кислотой, когда сильнокислотная сульфокислотная группа (–SO 3 H) вводится в материал. Последний процесс был особенно успешным с сульфированными углями.Они могут обмениваться в кислом растворе, потому что сама обменивающаяся группа в этих условиях ионизирована, тогда как более слабые карбоксильные и фенольные группы — нет. Все эти материалы имеют определенные недостатки; однако они имеют тенденцию окрашивать обрабатываемые растворы, и их свойства трудно воспроизвести из-за сложности контроля обработки, которую им проводят.
Многие ионообменники были приготовлены из других природных материалов, таких как древесина, волокна, торф и уголь, путем окисления азотной кислотой или, что еще лучше, концентрированной серной кислотой, когда сильнокислотная сульфокислотная группа (–SO 3 H) вводится в материал. Последний процесс был особенно успешным с сульфированными углями.Они могут обмениваться в кислом растворе, потому что сама обменивающаяся группа в этих условиях ионизирована, тогда как более слабые карбоксильные и фенольные группы — нет. Все эти материалы имеют определенные недостатки; однако они имеют тенденцию окрашивать обрабатываемые растворы, и их свойства трудно воспроизвести из-за сложности контроля обработки, которую им проводят.
1.5. Натуральные неорганические продукты
Многие природные минеральные соединения, такие как глины (например,например, бентонит, каолинит и иллит), вермикулит и цеолиты (например, анальцит, шабазит, содалит и клиноптилолит) проявляют ионообменные свойства. Природные цеолиты были первыми материалами, которые стали использовать в процессах ионного обмена. Глинистые материалы часто используются в качестве засыпки или буферных материалов для мест захоронения радиоактивных отходов из-за их ионообменных свойств, низкой проницаемости и простоты обработки. Глины также можно использовать в процессах периодического ионного обмена, но они обычно не подходят для работы в колонне, поскольку их физические свойства ограничивают поток через слой.
Природные цеолиты были первыми материалами, которые стали использовать в процессах ионного обмена. Глинистые материалы часто используются в качестве засыпки или буферных материалов для мест захоронения радиоактивных отходов из-за их ионообменных свойств, низкой проницаемости и простоты обработки. Глины также можно использовать в процессах периодического ионного обмена, но они обычно не подходят для работы в колонне, поскольку их физические свойства ограничивают поток через слой.
1.6. Модифицированные природные ионообменники
Для улучшения обменной способности и селективности некоторые природные органические ионообменники модифицированы; например, катиониты на основе целлюлозы могут быть модифицированы введением фосфатных, угольных или других кислотных функциональных групп.
Сорбционные параметры природных материалов могут быть изменены путем химической и/или термической обработки; например, путем обработки клиноптилолита разбавленным раствором кислот или некоторых солей можно разработать более селективную форму сорбента для того или иного радионуклида [11].
В Японии для сорбции цезия и стронция из раствора предложены природные минералы, обработанные растворами щелочей в гидротермальных условиях. Эти обработки позволили получить материалы с коэффициентами распределения от 1000 до 10000. Сообщалось о хороших результатах удаления цезия и стронция неолиновыми глинами, модифицированными фосфорной кислотой [12].
1.7. Синтетические органические ионообменники
В 1935 году два химика из Национальной химической лаборатории в Теддингтоне, Адамс и Холмс [7], продемонстрировали, что органические ионообменные смолы могут быть синтезированы способом, подобным хорошо известной смоле «бакелит», которая была подготовленный Бэкеландом в 1909 году.«Бакелит» представляет собой твердый, нерастворимый полимер конденсационной смолы, и его можно легко получить путем нагревания вместе фенолов и формальдегида в присутствии кислоты или щелочи с удалением воды. В основном реакция протекает в две стадии (рис. 5).
Повторение предыдущих реакций приведет к образованию трехмерной структуры, содержащей слабокислотные фенольные группы –OH или OR (рис. 6).
6).
Адамс и Холмс показали, что они обменивают свои ионы водорода в щелочном растворе; они также подготовили катионит, работающий в кислом растворе, путем введения в структуру сильнокислотных сульфокислотных групп –SO 3 H.Делали это либо сульфированием конечного продукта, либо используя в качестве исходного материала не фенол, а фенолсульфокислоту, в которой уже присутствовала сульфокислотная группа.
Путем соответствующей модификации их синтеза они также смогли ввести основные группы, полученные из аминов, и, таким образом, получить синтетические анионообменники. Впервые стало возможным получать в контролируемых условиях как катионообменные, так и анионообменные смолы, поведение и стабильность которых значительно превосходят другие материалы.
До разработки современных методов высокой химии полимеров успешно использовались конденсационные смолы. В 1944 году д’Алелио в Соединенных Штатах производил превосходные материалы. Смолы Д’Алелио, как и большинство их потомков, были основаны на регулярной трехмерной сетке, образованной путем полимеризации производного бензола стирола (см. рис. 7).
рис. 7).
Двойная связь в боковой цепи может быть разомкнута, и стирольные звенья могут быть соединены друг с другом, образуя полимерную цепь (рис. 8).
Здесь повторяющаяся единица на основе молекулы стирола встречается миллионы раз. Стирол также можно рассматривать как производное этилена, в котором один атом водорода заменен фенильной группой, –C 6 H 6 . Точно так же, как этилен может полимеризоваться в полиэтилен (политен), стирол легко полимеризуется в полистирол. Цепи могут быть связаны вместе в двух- и трехмерные структуры, если стирол смешать с небольшой долей дивинилбензола (рис. 9), который по своим свойствам напоминает стирол, но имеет две ненасыщенные боковые цепи, через которые он может полимеризоваться.
Полимер, образованный из смеси стирола и дивинилбензола, состоит из цепей, подобных упомянутым ранее, связанных с другой цепью, где единицей является молекула дивинилбензола вместо стирола (рис. 10).
10).
В областях, обведенных пунктирными линиями, цепи соединены вместе, и если мы представим это происходящим в трех измерениях, то легко увидеть, что полученный полимер образует довольно правильную сеть (рис. 10). Связи между цепями называются «поперечными связями», и смола обычно характеризуется процентным содержанием дивинилбензола (ДВБ), используемого при ее получении; таким образом, 2-процентная сшитая смола содержит 2 процента ДВБ и 98 процентов стирола.
D’Alelio приготовила такие смолы путем эмульсионной полимеризации с использованием подходящих эмульгаторов, из которых смола осаждается в виде сферических шариков. Сам полимер не работает как ионообменник, но его можно сульфировать так же, как и конденсационные смолы, вводя в бензольные кольца полимера сильнокислотную группу типа –SO 3 H. Ионы водорода этой группы будут обмениваться в растворе с другими катионами.
Учитывая, что одно бензольное кольцо многократно повторяется в полимере, основные этапы введения обменных групп (или «функциональных» групп, как их обычно называют) показаны на рисунке катионный обмен (а) и анионный обмен (б) (Рисунок 11).
Вторая из этих реакций дает соль четвертичного аммония, которая сильно ионизирована и легко превращается в соответствующее основание. Анион легко обменивается с другими анионами при всех значениях рН. Катион образует часть нерастворимой полимерной цепи или сетки, так что обменник в целом нерастворим в воде.
Синтетические ионообменники, такие как смолы на основе полистирола, составляющие основу большинства коммерчески доступных сегодня смол, обладают многочисленными преимуществами по сравнению с более ранними природными органическими ионообменниками: (1) более контролируемый метод синтеза и более однородный конечный продукт по размеру частиц, степени сшивки и содержанию функциональных групп; (2) путем подходящего изменения этих факторов можно получить широкий спектр различных продуктов; (3) продукт имеет сферическую форму, в отличие от частиц неправильной формы, образующихся при измельчении и просеивании твердой массы конденсационной смолы.Это минимизирует отходы; кроме того, сферические частицы более равномерно упаковываются в слои, чем частицы неправильной формы. Это влияет на характер течения растворов через слои и облегчает контроль за их поведением; (4) физическая и химическая стабильность этих смол выше, чем у конденсационных смол.
Это влияет на характер течения растворов через слои и облегчает контроль за их поведением; (4) физическая и химическая стабильность этих смол выше, чем у конденсационных смол.
1.8. Синтетические неорганические ионообменники
1.8.1. Синтетические цеолиты
Цеолиты представляют собой кристаллические гидратированные алюмосиликаты щелочных и щелочноземельных металлов, имеющие бесконечные трехмерные атомные структуры [13].Кроме того, они характеризуются способностью обратимо терять и набирать воду и обменивать определенные составляющие атомы, также без существенного изменения атомной структуры. Наряду с минералами кварца и полевого шпата цеолиты представляют собой трехмерные каркасы силикатных (SiO 4 ) тетраэдров, в которых все четыре угловых атома кислорода каждого тетраэдра являются общими с соседними тетраэдрами. Если каждый тетраэдр в каркасе содержит кремний в качестве центрального атома, общая структура электрически нейтральна, как и кварц (SiO 2 ). В цеолитных структурах часть четырехзарядного кремния заменена трехзарядным алюминием, что приводит к дефициту положительного заряда. Заряд уравновешивается наличием одно- и двухзарядных атомов, таких как натрий (Na + ), калий (K + ), аммоний (Nh5 + ), кальций (Ca 2+ ) и магний (Mg 2+ ) в других частях структуры. Эмпирическая формула цеолита имеет вид где М представляет собой любой атом щелочного или щелочноземельного металла, представляет собой заряд этого атома, соотношение кремнезема и оксида алюминия варьируется от 2 до 10 и представляет собой число от 2 до 7.Химическая формула клиноптилолита, распространенного природного цеолита:
В цеолитных структурах часть четырехзарядного кремния заменена трехзарядным алюминием, что приводит к дефициту положительного заряда. Заряд уравновешивается наличием одно- и двухзарядных атомов, таких как натрий (Na + ), калий (K + ), аммоний (Nh5 + ), кальций (Ca 2+ ) и магний (Mg 2+ ) в других частях структуры. Эмпирическая формула цеолита имеет вид где М представляет собой любой атом щелочного или щелочноземельного металла, представляет собой заряд этого атома, соотношение кремнезема и оксида алюминия варьируется от 2 до 10 и представляет собой число от 2 до 7.Химическая формула клиноптилолита, распространенного природного цеолита:
Атомы или катионы (т. е. заряженные атомы металлов) во втором наборе скобок известны как структурные атомы, потому что вместе с кислородом они составляют жесткий каркас структуры. Ионы в первом наборе скобок известны как обменные ионы, потому что они могут быть более или менее легко заменены (обменены) другими катионами в водном растворе, не затрагивая алюмосиликатный каркас. Это явление известно как ионный обмен или, чаще, катионный обмен. Процесс обмена включает замену одного однозарядного обменного атома в цеолите одним однозарядным атомом из раствора или замену двух однозарядных обменных атомов в цеолите одним двухзарядным атомом из раствора. Величина такого катионного обмена в данном цеолите известна как его катионообменная емкость (CEC) и обычно измеряется в молях обменного катиона на грамм (или 100 грамм) цеолита или в эквивалентах обменных катионов на грамм. (или 100 грамм) цеолита.
Это явление известно как ионный обмен или, чаще, катионный обмен. Процесс обмена включает замену одного однозарядного обменного атома в цеолите одним однозарядным атомом из раствора или замену двух однозарядных обменных атомов в цеолите одним двухзарядным атомом из раствора. Величина такого катионного обмена в данном цеолите известна как его катионообменная емкость (CEC) и обычно измеряется в молях обменного катиона на грамм (или 100 грамм) цеолита или в эквивалентах обменных катионов на грамм. (или 100 грамм) цеолита.
1.8.2. Соли многоосновных кислот
Это кислые соли многовалентных, преимущественно четырехвалентных металлов, образованные смешением кислых оксидов металлов, принадлежащих к IV, V и VI группам периодической таблицы. Они имеют нестехиометрический состав в зависимости от условий осаждения. Особые соли четырехвалентных металлов с кислотами (tma) [14, 15] приобретают все большее значение из-за их превосходной термической стабильности и химической стойкости. Это катиониты, имеющие общую формулу M(IV)(HXO 4 )2 × H 2 O, где M(IV) = Zr, Ti, Sn, Ce, Th и т.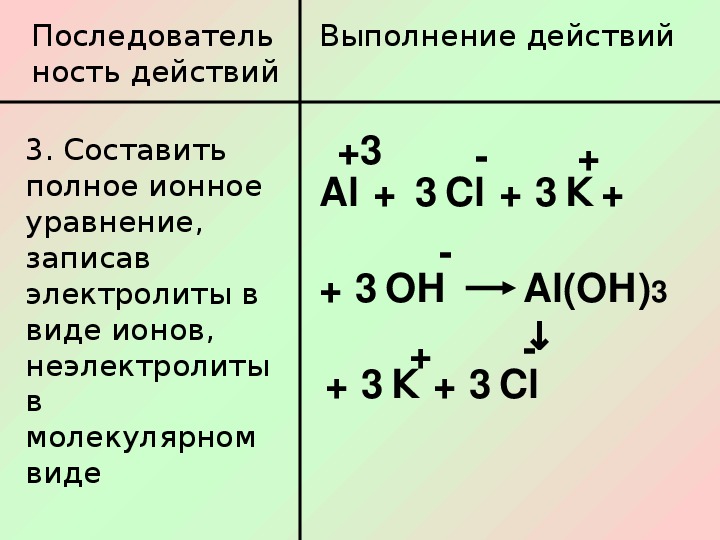 д., а X = P , W, As, Mo, Sb и так далее.Эти материалы имеют структурные гидроксильные группы, причем H в -OH является заменяемым центром. Они обладают значительной ионообменной емкостью, а также высокой селективностью в отношении ионов некоторых металлов. Соли ТМА могут быть получены как в аморфной, так и в кристаллической формах. Хотя структуры кристаллических материалов хорошо известны, оказалось, что они не подходят для колонных операций, поскольку их получают в виде порошка. С другой стороны, аморфные материалы могут быть получены в гранулированной форме, что очень удобно для работы в колонне [16].Соли ТМА синтезируются золь-гель способами, материалы с различным содержанием воды, составом, ионообменной емкостью и кристалличностью могут быть получены путем варьирования таких параметров, как стехиометрия и концентрация используемых реагентов, температура их смешивания, скорость добавления , способ смешивания и рН. Ионообменные материалы с более высокой селективностью постоянно исследуются [17].
д., а X = P , W, As, Mo, Sb и так далее.Эти материалы имеют структурные гидроксильные группы, причем H в -OH является заменяемым центром. Они обладают значительной ионообменной емкостью, а также высокой селективностью в отношении ионов некоторых металлов. Соли ТМА могут быть получены как в аморфной, так и в кристаллической формах. Хотя структуры кристаллических материалов хорошо известны, оказалось, что они не подходят для колонных операций, поскольку их получают в виде порошка. С другой стороны, аморфные материалы могут быть получены в гранулированной форме, что очень удобно для работы в колонне [16].Соли ТМА синтезируются золь-гель способами, материалы с различным содержанием воды, составом, ионообменной емкостью и кристалличностью могут быть получены путем варьирования таких параметров, как стехиометрия и концентрация используемых реагентов, температура их смешивания, скорость добавления , способ смешивания и рН. Ионообменные материалы с более высокой селективностью постоянно исследуются [17].
1.8.3. Водные оксиды
Водные оксиды некоторых ионов металлов также используются в качестве ионообменных материалов, как и свежеосажденные оксиды трехвалентных металлов.
1.8.4. Металлические ферроцианиды
Нерастворимые ферроцианиды металлов также используются в качестве неорганических ионообменных материалов, широко известных как поглотители щелочных металлов. Их легко приготовить, и они широко используются при переработке радиоактивных отходов.
1.8.5. Нерастворимые ионообменные материалы
Они представляют большой интерес в качестве ионообменников и в основном изготавливаются путем осаждения из раствора соли металла сульфидом натрия и сероводородом.
1.8.6. Гетерополикислоты
ГПК представляют собой сложные протонные кислоты, в состав которых входят полиоксометаллатные анионы (гетерополианионы), имеющие в качестве основных структурных единиц металлокислородные октаэдры [10]. Гетерополисоединения являются достаточно сильными окислителями. Гетерополикислоты используются в качестве ионообменников, полученных из 12 ГПК с общей формулой H n XY 12 O 40 · H 2 O. Первым охарактеризованным и наиболее известным из них является гетерополианион Кеггина, обычно представленный по формуле XM 12 O 40 x −8 , где X — центральный атом (Si 4+ , P 5+ и т. д.), — его степень окисления, а М — ион металла (Mo 6+ или W 6+ ).
Гетерополикислоты используются в качестве ионообменников, полученных из 12 ГПК с общей формулой H n XY 12 O 40 · H 2 O. Первым охарактеризованным и наиболее известным из них является гетерополианион Кеггина, обычно представленный по формуле XM 12 O 40 x −8 , где X — центральный атом (Si 4+ , P 5+ и т. д.), — его степень окисления, а М — ион металла (Mo 6+ или W 6+ ).
2. Механизм процесса ионного обмена
Наиболее распространенная система ионного обмена включает набухший в воде ионообменный материал и окружающий водный раствор. Ионный обмен, как и всякий гетерогенный процесс, осуществляется за счет переноса ионов к межфазной границе и от нее; то есть сама химическая реакция, диффузия внутри материала и диффузия в окружающем растворе должны рассматриваться как ионный обмен.Помимо двух основных фаз, следует отдельно рассматривать тонкую пленку раствора на поверхности теплообменника. Свойства пленки отличаются от свойств окружающего объемного раствора. Образование тонкой пленки неизбежно. Даже сильное перемешивание только уменьшает толщину межфазной пленки.
Свойства пленки отличаются от свойств окружающего объемного раствора. Образование тонкой пленки неизбежно. Даже сильное перемешивание только уменьшает толщину межфазной пленки.
На рис. 12 представлена простейшая иллюстрация массообмена при ионном обмене. Ионы В диффундируют из раствора через пленку в шарики, а ионы А диффундируют из шариков, пересекая пленку, в раствор.Эта межфазная диффузия противоионов называется ионным обменом. Противоионы представляют собой обменные ионы, переносимые ионообменниками. Противоионы могут свободно перемещаться внутри каркаса, но их движение должно компенсироваться соответствующими встречными движениями других ионов такого же изменения, выполняющих принцип электронейтральности. Термин противоион имеет два толкования. (а) Его можно использовать исключительно для ионов внутри ионообменника. (б) Его можно использовать в широком смысле как в ионообменнике, так и во внешнем растворе; все ионные частицы со знаком заряда, противоположным знаку заряда функциональных групп, можно назвать противоионами.
Коион – это термин, используемый для обозначения ионных частиц с тем же знаком заряда, что и у функциональной группы. Ионная форма — это термин, определяющий, какой противоион присутствует в ионном обмене.
Любой противоион, покидающий ионообменник, замещается эквивалентным количеством других противоионов. Это является следствием требования электронейтральности. Когда противоион пересекает межфазную границу, между двумя фазами создается электрический потенциал. Этот потенциал должен быть компенсирован движением другого противоиона в противоположном направлении (ионный обмен) или движением коиона в том же направлении.Во многих системах, особенно в разбавленных растворах, исключение Доннана (исключение Доннана: снижение концентрации подвижных ионов внутри ионообменной мембраны из-за присутствия неподвижных ионов того же знака, что и подвижные ионы) ограничивает поступление коионов в обменник во время весь процесс. В этом случае коионы не участвуют в реакции и мало влияют на скорость. Однако косвенное влияние может иметь место.
Однако косвенное влияние может иметь место.
Из рис. 13 видно, что вначале происходит диссоциация растворенной соли, содержащей первый ион, а затем происходит диффузия первого иона из раствора в сторону межфазной ступени пленки.Затем ион диффундирует из ступени пленки в сторону ступени материальной фазы. Ион связывается со стадией функциональной группы, а затем на стадии происходит диссоциация второго иона и функциональной группы. Второй ион диффундирует внутри фазы материала по направлению к поверхностной ступеньке. Второй ион диффундирует внутри ступени межфазной пленки с последующей диффузией и случайным распределением на ступени растворения. Таким образом, завершается этап образования второй ионной пары.
2.1. Селективность ионообменных материалов
Селективность — это параметр, определяемый в конкретных условиях раствора.Другое равновесие, связанное с интересующим ионом, может повлиять на селективность иона. Для объяснения селективности обмена использовались три основных класса моделей.
Немеханистические модели были получены с использованием принципов действия масс и термодинамики, механистических моделей, основанных на теории диффузного двойного слоя, и механистических моделей, основанных на энергетике гидратации и электростатических взаимодействиях.
Расчет коэффициентов селективности действия масс на основании измеренных данных ионного обмена, возможно, является наиболее распространенным подходом к определению селективности катионного обмена.В идеале такие коэффициенты оценивают константы термодинамического равновесия (~). Эта трактовка ионного обмена не делает различий между твердой и жидкой фазами и поэтому требует определения активности адсорбированных ионов. Vanselow (1932) предположил, что активность адсорбированных ионов близко соответствует мольной доле ионов, адсорбированных на твердом теле [18]. Однако измеренные коэффициенты Ванзелоу () часто меняются в зависимости от ионного состава ионообменника и общей ионной силы уравновешивающего раствора [19]. Гейнс и Томас (1953) предложили интегрировать измеренные коэффициенты селективности по всему диапазону состава в качестве средства оценки констант термодинамического равновесия [20]. В соответствии с подходом Гейнса-Томаса изменения измеренных коэффициентов селективности в зависимости от ионного состава обменника произвольно приписываются изменениям активности адсорбированных ионов. Подход Гейнса-Томаса явно включает изменения химического потенциала воды, которые могут происходить во время реакции ионного обмена.
Гейнс и Томас (1953) предложили интегрировать измеренные коэффициенты селективности по всему диапазону состава в качестве средства оценки констант термодинамического равновесия [20]. В соответствии с подходом Гейнса-Томаса изменения измеренных коэффициентов селективности в зависимости от ионного состава обменника произвольно приписываются изменениям активности адсорбированных ионов. Подход Гейнса-Томаса явно включает изменения химического потенциала воды, которые могут происходить во время реакции ионного обмена.
Термодинамическая трактовка селективности катионного обмена имеет 2 фундаментальные проблемы: иногда наблюдается гистерезис в реакциях ионного обмена с участием 2 : 1 филлосиликатов [21], а при наличии гистерезиса термодинамическая трактовка ионного обмена недействительна, поскольку требуется обратимость равновесия. Стандартный термодинамический подход по своей сути немеханистичен: можно предсказать исход реакции ионного обмена, но никогда не узнать причину селективности ионного обмена.
Эрикссон предложил механистическую модель селективности катионного обмена, основанную на теории диффузного двойного слоя (DDL) [22]. Показано, что с различными модификациями модель Эрикссона позволяет оценивать коэффициенты селективности реакций гетеровалентного обмена, находящиеся в пределах порядка величины измеренных коэффициентов [19, 23]. Модель Эрикссона рассматривает только электростатические взаимодействия и рассматривает все катионы как точечные заряды; следовательно, он не различает селективности обменных реакций с участием катионов с одинаковым зарядом.Несколько авторов предложили модификации модели Эрикссона, чтобы решить эту проблему. Нил и Купер, например, предположили, что ион не может приблизиться к заряженной поверхности ближе, чем его гидратированный радиус [24], а Нир использовал специфические коэффициенты связывания для учета различий в селективности для катионов с одинаковым зарядом [25]. Для данной глины модель Эрикссона можно скорректировать, чтобы она соответствовала измеренным данным. Однако никакая корректировка не изменит фундаментального предсказания модели Эрикссона о том, что катионы с более высоким зарядом будут все более предпочтительными по мере увеличения заряда слоя глины.Хотя эта зависимость была качественно продемонстрирована для обмена Na-Ca [23], для обмена K-Ca наблюдается обратная зависимость [26, 27]. Неспособность модели Эрикссона объяснить взаимосвязь между зарядом слоя и селективностью в реакциях обмена K-Ca свидетельствует о серьезном недостатке модели Эрикссона.
Однако никакая корректировка не изменит фундаментального предсказания модели Эрикссона о том, что катионы с более высоким зарядом будут все более предпочтительными по мере увеличения заряда слоя глины.Хотя эта зависимость была качественно продемонстрирована для обмена Na-Ca [23], для обмена K-Ca наблюдается обратная зависимость [26, 27]. Неспособность модели Эрикссона объяснить взаимосвязь между зарядом слоя и селективностью в реакциях обмена K-Ca свидетельствует о серьезном недостатке модели Эрикссона.
На более фундаментальном уровне достоверность модели Эрикссона для описания селективности ионного обмена, проявляемой смектитами, может быть поставлена под сомнение, поскольку модель Эрикссона основана на теории DDL.В водных системах смектиты существуют в виде квазикристаллов. Каждый квазикристалл состоит из от 1 до нескольких сотен ламелей, уложенных друг на друга с параллельными, но случайно ориентированными осями. В объемном растворе могут образовываться диффузные двойные слои, примыкающие к внешним поверхностям квазикристаллов; однако ДДЛ не образуются между ламелями внутри квазикристалла. В квазикристалле ламели разделены 4 или менее дискретными слоями молекул воды, а анионы исключены из межслоевых пространств [28].Если предположить, что средний квазикристалл состоит из 10 скоординированных ламелей с равномерно распределенным по всем поверхностям зарядом слоев, то 90 % обменных катионов удерживается на внутренних поверхностях и только 10 % — на внешних поверхностях. Теория диффузного двойного слоя и модель Эрикссона применимы для описания селективности, проявляемой 10% катионов, сорбированных на внешних поверхностях, но не имеют отношения к селективности в отношении 90% катионов, удерживаемых на внутренних поверхностях.
В квазикристалле ламели разделены 4 или менее дискретными слоями молекул воды, а анионы исключены из межслоевых пространств [28].Если предположить, что средний квазикристалл состоит из 10 скоординированных ламелей с равномерно распределенным по всем поверхностям зарядом слоев, то 90 % обменных катионов удерживается на внутренних поверхностях и только 10 % — на внешних поверхностях. Теория диффузного двойного слоя и модель Эрикссона применимы для описания селективности, проявляемой 10% катионов, сорбированных на внешних поверхностях, но не имеют отношения к селективности в отношении 90% катионов, удерживаемых на внутренних поверхностях.
Другой подход к пониманию селективности катионного обмена основан на теории Эйзенмана, которая была разработана для объяснения поведения ионоселективных электродов [29].Эйзенман утверждал, что молярная свободная энергия обмена (AGex) определяется чистым изменением кулоновской энергии и энергии гидратации обменивающихся катионов. Эберл применил теорию Эйзенмана к филлосиликатам 2 : 1 для обменных реакций между Cs и другими щелочными катионами [30]. Для этого он предположил, что Cs негидратирован как в растворе, так и при адсорбции на глине. Однако он не смог использовать подход Эйзенмана для частично гидратированных глин 2 : 1, поскольку состояния гидратации частично гидратированных межслоевых катионов были неизвестны.Вместо этого он предположил, что межслойная вода в глине 2 : 1 аналогична воде в концентрированном растворе галоида щелочного металла. С этим предположением он смог оценить ~ как функцию межслойной молярности и заряда слоя. В соответствии с экспериментальными данными анализ показал, что предпочтение менее гидратированного катиона увеличивается по мере уменьшения количества межслоевой воды и увеличения плотности заряда слоя.
Для этого он предположил, что Cs негидратирован как в растворе, так и при адсорбции на глине. Однако он не смог использовать подход Эйзенмана для частично гидратированных глин 2 : 1, поскольку состояния гидратации частично гидратированных межслоевых катионов были неизвестны.Вместо этого он предположил, что межслойная вода в глине 2 : 1 аналогична воде в концентрированном растворе галоида щелочного металла. С этим предположением он смог оценить ~ как функцию межслойной молярности и заряда слоя. В соответствии с экспериментальными данными анализ показал, что предпочтение менее гидратированного катиона увеличивается по мере уменьшения количества межслоевой воды и увеличения плотности заряда слоя.
3. Кинетика ионообменных материалов
Кинетика зависит от этих соображений.(i) Массоперенос (диффузия) в растворе или в другой внешней среде является неизбежным этапом любого ионообменного взаимодействия. Процесс хорошо известен. Этому легко могут способствовать гидродинамические турбулентности, и поэтому его нельзя рассматривать как ограничивающую стадию ионного обмена. (ii) Пленка представляет собой зону раствора определенной толщины без конвекции. Массоперенос в пленке определяется исключительно коэффициентами диффузии. Толщина пленки может быть уменьшена перемешиванием. (iii) Массоперенос в обменной фазе зависит от физико-химических свойств системы и не может быть улучшен без изменения самой химической системы.(iv) Реакция между противоионами и фиксированными группами является единственным химическим взаимодействием, которое может повлиять на общую скорость ионного обмена. (v) Диссоциация комплексов и образование ионных пар в растворе не рассматривается как часть ионного обмена.
(ii) Пленка представляет собой зону раствора определенной толщины без конвекции. Массоперенос в пленке определяется исключительно коэффициентами диффузии. Толщина пленки может быть уменьшена перемешиванием. (iii) Массоперенос в обменной фазе зависит от физико-химических свойств системы и не может быть улучшен без изменения самой химической системы.(iv) Реакция между противоионами и фиксированными группами является единственным химическим взаимодействием, которое может повлиять на общую скорость ионного обмена. (v) Диссоциация комплексов и образование ионных пар в растворе не рассматривается как часть ионного обмена.
Как следует из этих соображений, большинство ионообменных процессов представляют собой чисто диффузионное явление; то есть они контролируются диффузией противоионов, а не реальной химической реакцией.
В большинстве случаев рассматриваются две основные стадии, определяющие скорость: диффузия ионов внутри материала или диффузия ионов через пленку жидкости.В обоих случаях миграция ионов определяется исключительно свойствами системы. Скорость этих шагов не может быть увеличена или замедлена внешним воздействием без изменения самой системы.
Скорость этих шагов не может быть увеличена или замедлена внешним воздействием без изменения самой системы.
Диффузия внутри материала называется диффузией частиц, а диффузия через пленку называется диффузией через пленку. В простых случаях скорость ионного обмена определяется более медленным из этих двух процессов. Доминирование одного из этих механизмов можно предсказать с помощью приближенных [31–33]. О контроле диффузии частиц см. [32–34]. А для управления пленочной диффузией см. [34], где – концентрация фиксированной группы, а – концентрация раствора.– коэффициент взаимной диффузии в ионообменнике, – коэффициент взаимной диффузии в пленке, – радиус шарика, – толщина пленки, – отдельный коэффициент.
В соответствии с критерием все факторы, которые увеличивают скорость взаимной диффузии в шариках и уменьшают скорость в пленке, благоприятствуют контролю диффузии в пленке и наоборот. Таким образом, пленочный диффузионный контроль может преобладать в системе, характеризующейся следующими свойствами [31]: (i) высокая концентрация обменных центров, (ii) низкая степень сшивки, (iii) малый размер частиц, (iv) разбавленный раствор ,(v) неэффективное перемешивание.
Самый простой способ отличить контроль диффузии частиц от контроля диффузии пленки – это испытание на прерывание. Ионообменное взаимодействие осуществляется в периодическом режиме. Степень конверсии отслеживается. Шарики удаляются из раствора задолго до завершения процесса. Через некоторое время материал снова погружают в тот же раствор. Если внутри шариков создается градиент концентрации, то эти градиенты выравниваются при прекращении поступления свежих ионов из раствора.Если процесс контролируется диффузией частиц, скорость сразу после повторного погружения выше до прерывания. В случае пленочной диффузии количество ионов, неравномерно распределенных в пленке в момент разрыва, практически не обнаруживается, а градиента концентрации в шарике не существует. Таким образом, прерывание не влияет на этот процесс и скорость до и после прерывания одинакова.
4. Математический подход к кинетике ионного обмена
Общий подход к кинетике ионного обмена металлов заключается в применении обычных уравнений диффузии. Из-за учета взаимодействия для ионного обмена моделирование сильно усложняется. Эти взаимодействия представляют собой диффузионно-индуцированные электрические силы, селективность, специфические взаимодействия, изменения при набухании. В основе описания диффузионных процессов лежит первый закон Фика [35]: (см. [35]). Для фазы ионного обмена (см. [35]), где – поток иона в молях/время и единице поперечного сечения, – коэффициент диффузии, – концентрация в молях на единицу объема.
Из-за учета взаимодействия для ионного обмена моделирование сильно усложняется. Эти взаимодействия представляют собой диффузионно-индуцированные электрические силы, селективность, специфические взаимодействия, изменения при набухании. В основе описания диффузионных процессов лежит первый закон Фика [35]: (см. [35]). Для фазы ионного обмена (см. [35]), где – поток иона в молях/время и единице поперечного сечения, – коэффициент диффузии, – концентрация в молях на единицу объема.
В простейшем случае коэффициент диффузии принимается постоянным, поэтому поток пропорционален градиенту концентрации. постоянство означает, что на вид не действуют никакие силы, кроме концентрационной неоднородности. Это не обычный случай, когда рассматривается ионный обмен из-за электросвязи ионных потоков. Влиянием связи можно пренебречь только при равенстве потоков. Исключения могут быть в ионном обмене. Примером такого исключения является изотоп, контролируемый диффузией, в системах, где концентрация других выравнивается. Соответствующий коэффициент диффузии (одинаковый для обоих изотопов) называется коэффициентом самодиффузии. Его величина постоянна в любой отдельной фазе системы, но, конечно, зависит от природы и состава конкретной фазы и от температуры.
Соответствующий коэффициент диффузии (одинаковый для обоих изотопов) называется коэффициентом самодиффузии. Его величина постоянна в любой отдельной фазе системы, но, конечно, зависит от природы и состава конкретной фазы и от температуры.
В большинстве других случаев коэффициент диффузии непостоянен. Это означает, что необходимо учитывать изменение коэффициента диффузии. Влияние электрического поля можно учесть, используя уравнение Нернста-Планка вместо уравнения Фика: (см. [35]), где – электрический потенциал.
Если в фазе присутствуют два обменных иона с разной концентрацией, их диффузия подвергается электромуфтовому взаимодействию неодинаково. Как показано в (7), поток диффузионных частиц зависит только от градиента концентрации и не зависит от самой концентрации (первое слагаемое в (7)), поскольку диффузия является чисто статистическим явлением, в котором отсутствует физическая сила на молекулярном уровне. .
Напротив, электрическое поле вызывает реальную физическую силу, действующую на каждый ион и создающую поток, пропорциональный концентрации соответствующего иона (второй член в (8)). В результате электрическое поле в основном воздействует на ионы, присутствующие в большинстве. Для тех, кто в меньшинстве, второй член мал и, таким образом, (8) приближается к (6). В результате ионы, присутствующие в малых концентрациях, мигрируют в основном со скоростью их обычной диффузии. При взаимной диффузии двух противоионов в отсутствие значительного коионного переноса два потока строго связаны. Диффузия большинства ионов не сильно зависит от действия электрического поля и, таким образом, контролирует скорость.
В результате электрическое поле в основном воздействует на ионы, присутствующие в большинстве. Для тех, кто в меньшинстве, второй член мал и, таким образом, (8) приближается к (6). В результате ионы, присутствующие в малых концентрациях, мигрируют в основном со скоростью их обычной диффузии. При взаимной диффузии двух противоионов в отсутствие значительного коионного переноса два потока строго связаны. Диффузия большинства ионов не сильно зависит от действия электрического поля и, таким образом, контролирует скорость.
Уравнение (6) является не только возможным способом описания процесса диффузии. Теория необратимой термодинамики утверждает, что движущей силой диффузии является не градиент концентрации, а градиент химического потенциала.
В этом случае (см. [35]), где – химический потенциал и связан с уравнением: (см. [35]), а зависит от концентрации и поэтому может различаться в разных точках неоднородной среды.можно считать постоянным значением. Если в системе содержится более двух соединений (9), их следует заменить на (см. [35]), где – количество соединений. Однако из-за электросвязи ионных потоков только один диффузионный поток можно считать независимым, и, таким образом, (9) можно было использовать для большей части ионного обмена [10].
[35]), где – количество соединений. Однако из-за электросвязи ионных потоков только один диффузионный поток можно считать независимым, и, таким образом, (9) можно было использовать для большей части ионного обмена [10].
В заключение, концентрация внешнего раствора может иметь решающее значение для этапа определения скорости; то есть простое увеличение концентрации раствора может изменить механизм с пленочной диффузии на контроль диффузии частиц.
5. Заключение
Ионный обмен — древний метод, описанный более ста лет назад. С тех пор они использовались для умягчения воды в несравненно более широком диапазоне применений и стали неотъемлемой частью новых технических и промышленных процессов. Существует большое разнообразие ионообменных материалов. Они имеют много видов: природные и синтетические, органические и неорганические, катионные, анионные и амфотерные и так далее. Наиболее распространенная ионообменная система включает набухшие в воде ионообменные материалы и окружающие системы.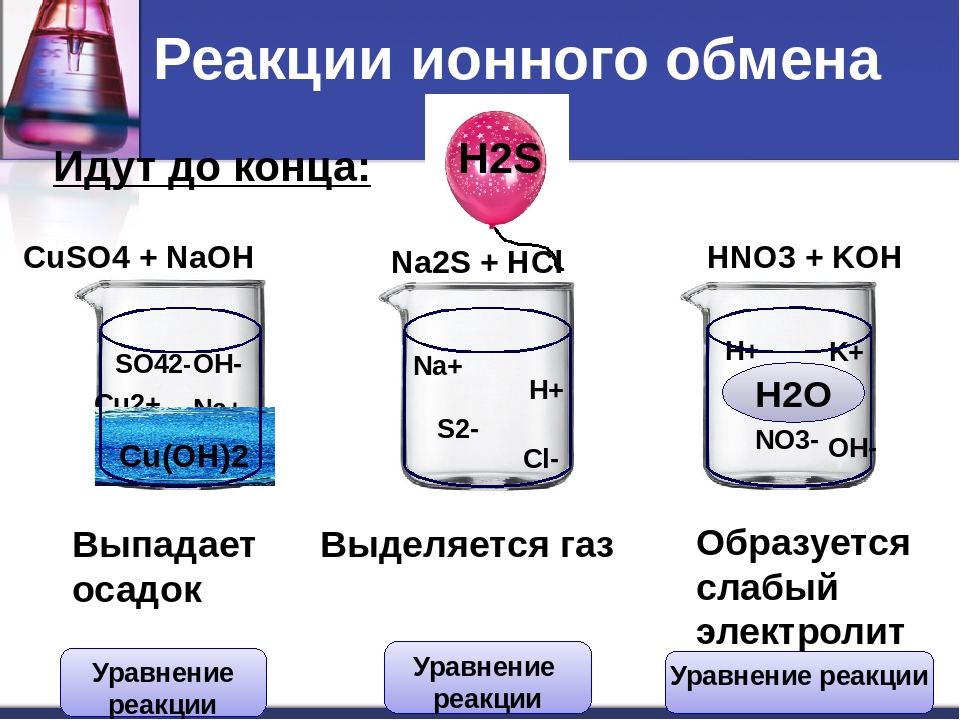 Во всех случаях механизм включает образование тонкой пленки. При межфазной диффузии сохраняется электронейтральность. Кинетика ионного обмена включает массоперенос, который определяется исключительно коэффициентами диффузии. Это зависит от физико-химических свойств системы. Считается, что на скорость влияют два основных этапа: диффузия ионов внутри материала или диффузия ионов через пленку жидкости. Самый простой способ их различения — это тест прерывания.
Во всех случаях механизм включает образование тонкой пленки. При межфазной диффузии сохраняется электронейтральность. Кинетика ионного обмена включает массоперенос, который определяется исключительно коэффициентами диффузии. Это зависит от физико-химических свойств системы. Считается, что на скорость влияют два основных этапа: диффузия ионов внутри материала или диффузия ионов через пленку жидкости. Самый простой способ их различения — это тест прерывания.
В статье предлагаются шаги, направленные на повышение скорости процесса ионного обмена. Самый простой способ добиться более быстрой диффузии внутри ионообменных шариков — выбрать материалы с низкой плотностью геля. В целом, скорость процесса может быть повышена даже без замены материалов. Уменьшение размера гранул может сократить время достижения равновесия для процесса, контролируемого частицами. Повышенная температура повышает скорость независимо от стадии контроля скорости.
превосходные сорбенты для улавливания токсичных и связанных с ядерными отходами ионов металлов
Сульфиды металлов со слоистой анионной структурой и лабильными межслоевыми катионами составляют наиболее хорошо изученный класс MSIE . Эти материалы демонстрируют отличные и селективные ионообменные свойства благодаря (а) легкой диффузии введенных ионов и их легкому доступу к внутренней поверхности слоев сульфидов металлов и (б) образованию прочных связей между внедренными ионами металла и S . 2– лиганда.Ниже мы представляем основные многослойные MSIE , выделяя их синтез, структурные особенности и химию ионного обмена.
Эти материалы демонстрируют отличные и селективные ионообменные свойства благодаря (а) легкой диффузии введенных ионов и их легкому доступу к внутренней поверхности слоев сульфидов металлов и (б) образованию прочных связей между внедренными ионами металла и S . 2– лиганда.Ниже мы представляем основные многослойные MSIE , выделяя их синтез, структурные особенности и химию ионного обмена.
2.1. Интеркалированные щелочными ионами дисульфиды металлов
Обычный способ получения слоистых MSIE включает частичное восстановление ионов металла дисульфида металла, такого как SnS 2 или MoS 2 , путем обработки его ионом щелочного металла. (A + ), содержащий восстановитель (, например, n -бутиллитий, дитионит щелочных ионов).16 Таким образом, образуется анионный слой, отрицательный заряд которого компенсируется катионами щелочных металлов, обеспечиваемыми восстановителем. Катионы, введенные в межслоевое пространство материалов, могут быть быстро и топотактически заменены различными неорганическими и органическими катионами. 16 Синтез таких слоистых материалов представлен следующим уравнением:
16 Синтез таких слоистых материалов представлен следующим уравнением:
MS 2 + x + + x E — → 9005 x Р.Schöllhorn и др. , были щелочно-ионные интеркалированные металлические дисульфиды, специально гидратированные наслоистые фазы Sn сульфид A x x x y [SNS 2 ] x — (A + = K + , Rb + , Cs + ).17 Эти материалы проявляют хорошие ионообменные свойства для ряда неорганических катионов, таких как Li + , Na + , Mg 2 + , Ca 2+ и Ni 2+ .Внедрение различных ионов в межслоевое пространство материалов исследовали с помощью порошковой рентгеновской дифракции (PXRD). Было замечено, что чем выше энергия гидратации внедренного катиона, тем больше межслоевые расстояния, что указывает на внедрение ионов в виде гидратированных комплексов в пространстве между слоями. Однако эти материалы подвержены окислению, что приводит к SnS 2 .
Однако эти материалы подвержены окислению, что приводит к SnS 2 .
Примерно через двадцать лет после Шёльхорна ионообменные свойства Li x MoS 2 (0.25 ≤ x ≤ 1,9) были исследованы A. E. Gash et al. 18 Этот материал особенно эффективно связывает Hg 2+ в кислых условиях. Авторы предложили механизм поглощения Hg 2+ , который показан и представлен следующими уравнениями: H 2 (г) + 1,3Li + (водн.) + (H 3 O) 0,78 MoS 2 (т) + 0.52H 2 O (L)
2
(H 3 o) 0.78 MOS 2 (S) + 0.20HG 2+ (AQ) → (H 3 O) 0.38 HG 0.20 MOS 2 (ы) + 0.40H 3 O + (AQ)
1 + (AQ) + (AQ)3
Предлагаемый механизм Hg 2+ поглощение / десорбция для LI x Материал MoS 2 . Мо, фиолетовый; С, желтый.
Мо, фиолетовый; С, желтый.
Таким образом, первая стадия ионообменной реакции включала превращение материала, интеркалированного Li + , в материал, содержащий гидроксоний, который, в свою очередь, реагирует с Hg 2+ с образованием конечного продукта.Движущей силой второй реакции было более высокое сродство мягких основных слоев MoS 2 x – к мягкой кислоте Hg 2+ по сравнению с жесткими ионами гидроксония. Аналитические данные индуктивно-связанной плазменно-атомной эмиссии (ICP-AES) показали, что ∼200 ppm Hg 2+ (pH ∼ 1) можно уменьшить до 6,5 ppb после обработки раствора Hg 2+ Li x MoS 2 (мольное отношение Li x MoS 2 к Hg равно 5).Установлено, что содержание Hg в различных продуктах обмена составляет от 0,24 до 0,32 моля на формульную единицу обменного материала в зависимости от исходного молярного соотношения Li x MoS 2 /Hg.
Интересно, что ртуть может быть извлечена путем нагревания продукта обмена ртути при 425 °C, что приводит к испарению ртути и образованию MoS 2 () в соответствии со следующим уравнением:
Hg x MoS 2 (с) → x Hg(г) + MoS 2 (с)
4
Затем пары ртути собираются в охлаждаемой ловушке при 77 К.MoS 2 может быть повторно преобразован в Li x MoS 2 посредством интеркаляции восстановление-Li с n -BuLi. Как и в случае материалов с дисульфидом олова, интеркалированных щелочью, сорбенты Li x MoS 2 также чувствительны к воздуху и влаге, поэтому их следует хранить в анаэробных условиях, чтобы сохранить их сорбционную способность по Hg 2+ .
Li x MoS 2 также тестировали на сорбцию Zn 2+ , Pb 2+ и Cd 2+ . 18 Результаты показали лишь умеренную способность удаления Pb 2+ (удаление 40–75 % исходного содержания Pb), относительно низкую способность Cd 2+ (4–40 % способности удаления) и незначительную сорбцию Zn 2+ ( способность удаления 1–4 %). Напротив, возможности удаления Hg 2+ составляли 74–100%. Селективность Li x MoS 2 соответствует порядку Hg 2+ > Pb 2+ > Cd 2+ > Zn 2+ , что указывает на более мягкий материал. ионы металлов из-за их более сильного взаимодействия с мягким слоем MoS 2 x – .
18 Результаты показали лишь умеренную способность удаления Pb 2+ (удаление 40–75 % исходного содержания Pb), относительно низкую способность Cd 2+ (4–40 % способности удаления) и незначительную сорбцию Zn 2+ ( способность удаления 1–4 %). Напротив, возможности удаления Hg 2+ составляли 74–100%. Селективность Li x MoS 2 соответствует порядку Hg 2+ > Pb 2+ > Cd 2+ > Zn 2+ , что указывает на более мягкий материал. ионы металлов из-за их более сильного взаимодействия с мягким слоем MoS 2 x – .
2.2. KMS Материалы
Эти материалы имеют общую формулу k 2 x M x x x 73 x 70011 6 (mn 2+ , км — 1; m = Mg 2+ , KMS-2, x = от 0,5 до 1).13c–h Их можно получить в многограммовом масштабе с высокой степенью чистоты с использованием твердофазных и гидротермальных методов синтеза. Они исключительно стабильны на воздухе и в сильнокислых и щелочных водных растворах. Рентгеновские измерения монокристаллов, выполненные на гексагональных кристаллах КМС-1 и 2 (), показали, что их структура основана на объединении ребер октаэдров «Sn/M»S 6 (структурный тип CdI 2 ) с Sn 4+ и M 2+ , занимающие ту же кристаллографическую позицию и трехкоординированные лиганды S 2– ().Межслоевое пространство заполнено ионами К + (), которые компенсируют отрицательный заряд сульфидных слоев металлов. В межслоевом пространстве гораздо больше места, чем требуется для всех катионов K + . В результате эти ионы сильно разупорядочены и подвижны и, таким образом, легко заменяются множеством других катионных частиц (см. Ниже). Соединения КМС фактически являются производными SnS 2 с частичным замещением Sn 4+ ионами M 2+ (Mn 2+ или Mg 2+ ).КМС-1 и 2 имеют практически одинаковые конструктивные характеристики; единственные их различия связаны с укладкой слоев.
Они исключительно стабильны на воздухе и в сильнокислых и щелочных водных растворах. Рентгеновские измерения монокристаллов, выполненные на гексагональных кристаллах КМС-1 и 2 (), показали, что их структура основана на объединении ребер октаэдров «Sn/M»S 6 (структурный тип CdI 2 ) с Sn 4+ и M 2+ , занимающие ту же кристаллографическую позицию и трехкоординированные лиганды S 2– ().Межслоевое пространство заполнено ионами К + (), которые компенсируют отрицательный заряд сульфидных слоев металлов. В межслоевом пространстве гораздо больше места, чем требуется для всех катионов K + . В результате эти ионы сильно разупорядочены и подвижны и, таким образом, легко заменяются множеством других катионных частиц (см. Ниже). Соединения КМС фактически являются производными SnS 2 с частичным замещением Sn 4+ ионами M 2+ (Mn 2+ или Mg 2+ ).КМС-1 и 2 имеют практически одинаковые конструктивные характеристики; единственные их различия связаны с укладкой слоев.
(A) Сканирующая электронная микроскопия (СЭМ) изображение типичного кристалла КМС-1. (B) Представление части слоистой структуры KMS-1 (S, желтый, Sn/Mn, зеленый).
Представления кристаллических структур КМС-1 и его Rb + и Cs + — замененных аналогов и межслоевого расстояния.
Материалы КМС-1 и 2 были подробно исследованы на предмет их ионообменных свойств с катионами, связанными с ядерными отходами, такими как Cs + , Sr 2+ , Ni 2+ и UO 2 2+ и ионы тяжелых металлов (такие как Hg 2+ , Pb 2+ , Cd 2+ ), которые являются обычными загрязнителями промышленных сточных вод.Ниже мы опишем наиболее важные результаты ионного обмена для материалов KMS.
2.2.1. Ионообменные свойства Cs
+ и Rb + . продукты ядерных отходов.4 Поэтому особенно важно найти селективные сорбенты Cs + и расширить спектр материалов, которые можно использовать для улавливания этого иона. По этой причине были подробно исследованы ионообменные свойства Cs + КМС-1 и 2. Для сравнения также было изучено поглощение Rb + .
По этой причине были подробно исследованы ионообменные свойства Cs + КМС-1 и 2. Для сравнения также было изучено поглощение Rb + . К + ионы можно полностью и топотаксически заменить на Cs + или Rb + обработкой КМС-1 водным раствором соответствующей щелочно-ионной хлоридной соли. Интересно, что сорбция Cs + и Rb + может быть достигнута не только с поликристаллическими образцами КМС-1, но и по схеме монокристалл-монокристалл ( SCSC ) с использованием крупных образцов.13 D Когда монокристаллы K 2 x 60011 3 x x x x x x 6 = 0,95, км — 1) погружены в раствор CSCL или RbCl, монокристаллы Cs + или Rb + — обменного материала могут быть выделены и, таким образом, их структура может быть точно определена с помощью рентгеновской кристаллографии (). Рентгенологическое уточнение показало формулы Rb 1,57 Mn 0,95 Sn 2,05 S 6 и CsMn 0.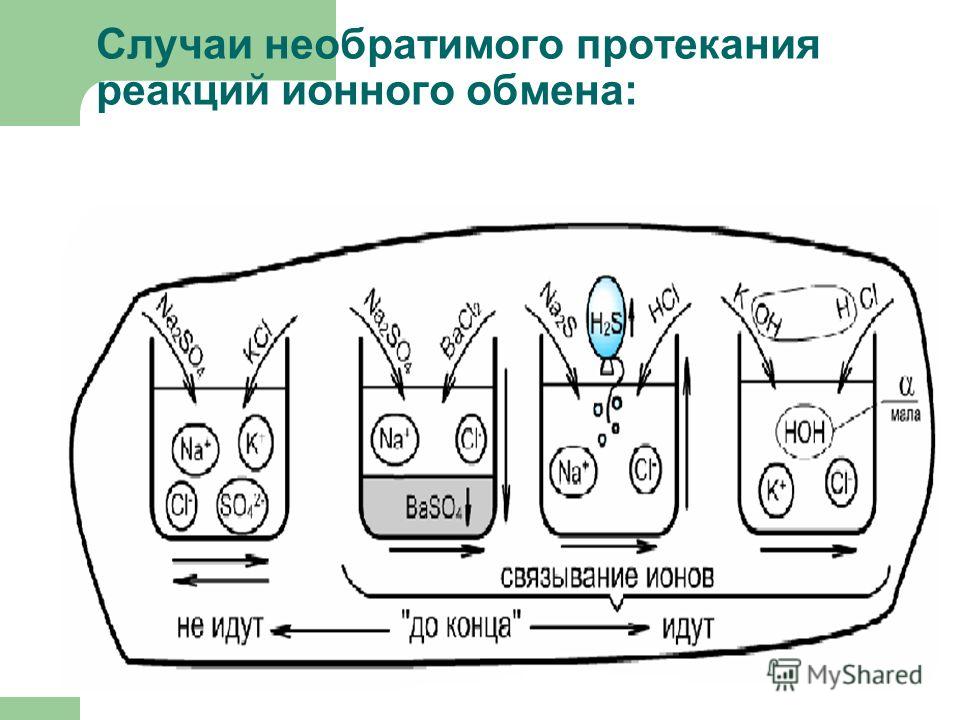 95 Sn 2,05 S 6 для Rb + и Cs + — обменные материалы соответственно. На основании этих формул и требований баланса заряда Mn должен находиться в степенях окисления 2,3+ и 3+ в соединениях, содержащих Rb + и Cs + , соответственно. Степени окисления Mn в этих обменных материалах также были подтверждены с использованием данных рентгеновской фотоэлектронной спектроскопии (XPS). Стабильность степени окисления Mn 3+ в Cs + -обменном аналоге объяснена на основе повышенного ионного характера взаимодействий Cs + ···S 2–.Так, в присутствии Cs + слой [Mn x Sn 3– x S 6 ] 2 x – становится более электронно-обогащенным. , становится более склонным к потере электрона.13 d
95 Sn 2,05 S 6 для Rb + и Cs + — обменные материалы соответственно. На основании этих формул и требований баланса заряда Mn должен находиться в степенях окисления 2,3+ и 3+ в соединениях, содержащих Rb + и Cs + , соответственно. Степени окисления Mn в этих обменных материалах также были подтверждены с использованием данных рентгеновской фотоэлектронной спектроскопии (XPS). Стабильность степени окисления Mn 3+ в Cs + -обменном аналоге объяснена на основе повышенного ионного характера взаимодействий Cs + ···S 2–.Так, в присутствии Cs + слой [Mn x Sn 3– x S 6 ] 2 x – становится более электронно-обогащенным. , становится более склонным к потере электрона.13 d
Подробные исследования ионного обмена серии Cs + были выполнены для KMS-1, и данные могут быть хорошо описаны с помощью модели Ленгмюра:
5
, где q (мг г –1 ) – количество катиона, поглощенного при равновесной концентрации C e (млн), q m – максимальная сорбционная (обменная) емкость сорбента, b (L мг –1 ) – постоянная Ленгмюра, связанная со свободной энергией сорбции. 13 d
13 d
Подгонка данных показала максимальную сорбционную емкость ~1,7 ммоль г –1 (226 ± 2 мг г –1 ), близкую к максимальной теоретической емкости (1,6 ммоль г –1 ), рассчитанный для обмена двух ионов K + на один Cs + (). Материал можно регенерировать путем обработки соединения, содержащего Cs + , большим избытком водного раствора KCl. Регенерированное соединение показало почти такую же обменную емкость Cs + , что и исходный материал КМС-1.
(А) Данные изотермы сорбции Cs + для КМС-1 (при рН ∼ 7). Сплошная линия представляет подгонку данных с помощью модели Ленгмюра. (Б) Кинетические данные для сорбции Cs + (исходная концентрация ~ 1 ppm) КМС-1. (C) Максимальная сорбционная емкость Cs + КМС-1, найденная для различных значений pH. Пунктирная линия представляет собой максимальную теоретическую обменную емкость для КМС-1. (D) Диаграммы PXRD для продуктов обмена Cs + , выделенных из сильнокислых и щелочных растворов.
Кинетические исследования со следовыми концентрациями Cs + (∼1 ppm) выявили очень быстрый процесс сорбции при комнатной температуре. В частности, менее чем за 5 мин контакта с раствором КМС-1 ионный обмен Cs + достиг своего равновесия с удалением ~90% исходного содержания Cs + (). Материал также был способен к эффективному ионному обмену Cs + в сильно кислых (pH ~ 1) и щелочных условиях (pH ~ 12), как показано на рис. Исследования PXRD показывают, что продукты обмена Cs + , выделенные из кислых или щелочных растворов, были кристаллическими и сохраняли слоистую структуру исходного соединения KMS-1 ().
Наконец, были проведены ионообменные исследования с растворами, имитирующими щелочные подземные воды, загрязненные радиоактивными элементами. Эти растворы с pH ~ 11 содержали низкие уровни Cs + (~ 1 ppm) и относительно высокие концентрации (от 7 до 125 ppm) Na + , Mg 2+ и Ca 2+ . Несмотря на наличие различных конкурирующих ионов, КМС-1 показал высокую способность удаления (74–99%) Cs + из этих комплексных растворов.
Несмотря на наличие различных конкурирующих ионов, КМС-1 показал высокую способность удаления (74–99%) Cs + из этих комплексных растворов.
КМС-2 также проявляет ионообменные свойства Cs + .13 ч Максимальная сорбционная емкость КМС-2 531 ± 28 мг г –1 . Это в 2,35 ± 0,12 раза больше, чем у KMS-1, и является одним из самых высоких показателей, когда-либо зарегистрированных для ионообменников Cs + . в последнем сорбционная емкость снижается при окислении Mn 2+ до Mn 3+ (см. выше). Это окисление не может происходить в КМС-2, содержащем Mg 2+ ; таким образом, два эквивалента Cs + могут быть поглощены одним молем КМС-2.Кроме того, КМС-2 проявляет высокую сорбционную способность по Cs + не только в условиях нейтрального pH, но и в кислой (pH = 3) и щелочной (pH = 10) средах.
2.2.2. Sr
2+ ионообменные свойства Sr 2+ ионный обмен и улавливание также являются важными процессами, поскольку радиоактивный 90 Sr + представляет собой один из основных источников тепла и биологической опасности в ядерных отходах. 4 Таким образом, , подробные исследования ионообменных свойств Sr 2+ были проведены на КМС-1 и 2.13c,h Данные изотерм сорбции для этих материалов могут быть аппроксимированы моделью Ленгмюра и показали максимальную сорбционную емкость Sr 2+ 77 ± 2 и 87 ± 2 мг г –1 для КМС-1 и 2 соответственно. Как KMS-1, так и KMS-2 работают очень эффективно в очень широком диапазоне pH. Сродство сорбентов к Sr 2+ выражали через коэффициент распределения К d , который рассчитывают по уравнению:
4 Таким образом, , подробные исследования ионообменных свойств Sr 2+ были проведены на КМС-1 и 2.13c,h Данные изотерм сорбции для этих материалов могут быть аппроксимированы моделью Ленгмюра и показали максимальную сорбционную емкость Sr 2+ 77 ± 2 и 87 ± 2 мг г –1 для КМС-1 и 2 соответственно. Как KMS-1, так и KMS-2 работают очень эффективно в очень широком диапазоне pH. Сродство сорбентов к Sr 2+ выражали через коэффициент распределения К d , который рассчитывают по уравнению:
6
где e — начальная и равновесная концентрации Sr 2+ (ppm) соответственно, V — объем (мл) тестируемого раствора и m — количество ионита (г), использованного в эксперимент.13 Значения K d , равные или превышающие 10 4 мл г –1 , считаются отличными. КМС-1 показал очень высокие значения K d в диапазоне от 10 4 до 10 5 мл г –1 при рН от 3 до 14. + сорбция. Его удаляющая способность составляет ∼92% ( K d ∼1,2 × 10 4 мл г –1 ) при очень высоких концентрациях солей (∼5 M Na + ) и pH ∼ 14, которые являются условия, обычно встречающиеся в щелочных ядерных отходах.КМС-1 превосходит оксидные сорбенты по ионообмену Sr 2+ в кислых условиях. Материал КМС-1 содержит мягкие основные лиганды S 2– с очень малым сродством к протонам. Это не относится к обычным оксидным обменникам, где жесткие ионы H + проявляют большое сродство к лигандам O 2–, что препятствует процессу.19–21
+ сорбция. Его удаляющая способность составляет ∼92% ( K d ∼1,2 × 10 4 мл г –1 ) при очень высоких концентрациях солей (∼5 M Na + ) и pH ∼ 14, которые являются условия, обычно встречающиеся в щелочных ядерных отходах.КМС-1 превосходит оксидные сорбенты по ионообмену Sr 2+ в кислых условиях. Материал КМС-1 содержит мягкие основные лиганды S 2– с очень малым сродством к протонам. Это не относится к обычным оксидным обменникам, где жесткие ионы H + проявляют большое сродство к лигандам O 2–, что препятствует процессу.19–21
Сравнение КМС-1 с различными сорбентами Sr 2+ по их значениям K d vs. рН раствора, приведенный в .
Сравнительная диаграмма, показывающая зависимость K d от pH для Sr 2+ ионного обмена различных материалов. NaTi: титанат натрия,19 CST: силикотитанат натрия,19b,d CRY-1: оксид марганца криптомеланового типа,20 SOMS: октаэдрические молекулярные сита Sandia21 и SbSi: силикат Sb. 19 b
19 b КМС-2 также эффективен в удаление Sr 2+ как в щелочных, так и в кислых условиях.Так, для Sr 2+ обмена КМС-2 при рН ∼ 1,0,3 соответственно.
2.2.3. Ni
2+ ионообменные свойстваВ процессе ядерного деления радиоактивные побочные продукты образуются из-за коррозии контейнеров под действием тепла и кислоты. Среди этих побочных продуктов 63 Ni считается низкоэнергетическим бета-загрязнителем.4 Таким образом, удаление Ni 2+ из водных растворов актуально для обеззараживания ядерных отходов от продуктов коррозии процесса деления. По этой причине были исследованы ионообменные свойства Ni 2+ КМС-1 и 2 (13). представляют подгонку данных с помощью модели Ленгмюра.
Данные изотермы сорбции Ni 2+ для КМС-1 и 2 соответствуют модели Ленгмюра и показывают максимальную сорбционную емкость ~29 и 151 мг г –1 соответственно.Относительно низкая сорбционная способность КМС-1 по Ni 2+ , вероятно, связана с окислением Mn 2+ до Mn 3+ .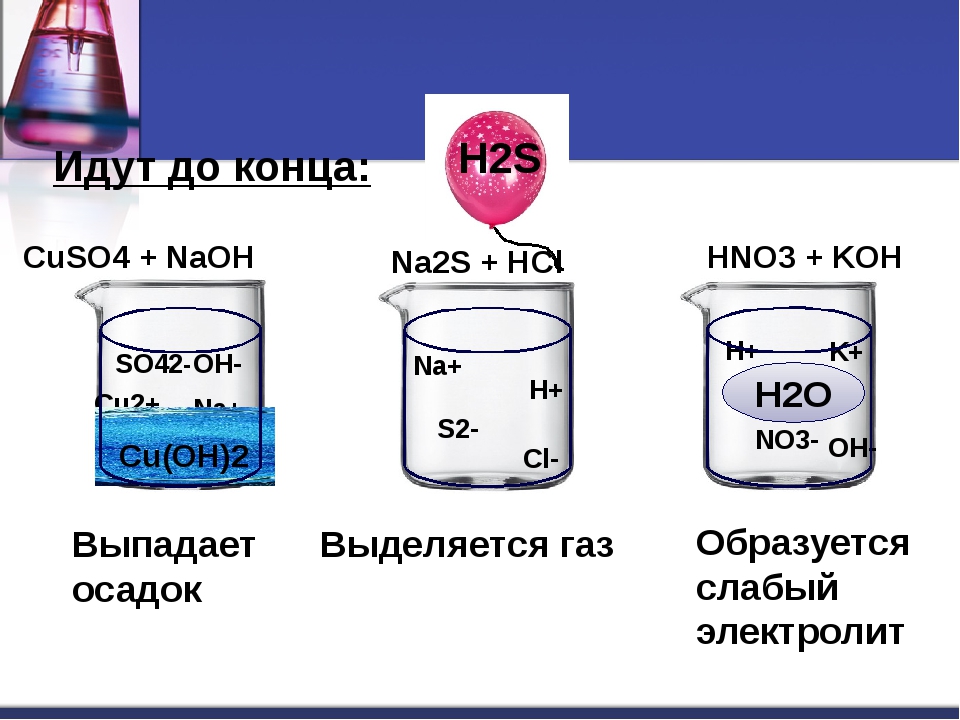 В случае КМС-2 наблюдаемая сорбционная емкость Ni 2+ примерно в 1,4 раза больше теоретически ожидаемой. Это связано с обменом не только межслоевых ионов К + , но и внутрислоевых ионов Mg 2+ . Материалы KMS обладают высокой селективностью к Ni 2+ в присутствии огромного избытка ионов Na + .Так, для Ni 2+ при обмене КМС-2 (исходная концентрация Ni 2+ ~6 ppm ) в присутствии 5 М Na + . Жесткие ионы Na + очень слабо взаимодействуют со слоем сульфидов мягких металлов, в отличие от относительно мягких Ni 2+ , которые могут сильно взаимодействовать с мягкими лигандами S 2–. В результате высокие концентрации Na + оказывают незначительное влияние на обмен Ni 2+ в материалах КМС.Это впечатляющее связывание с ионами Ni 2+ также указывает на то, что материалы KMS могут быть эффективными средствами для извлечения никеля из промышленных сточных вод, возникающих в результате массовых операций по никелированию во всем мире.
В случае КМС-2 наблюдаемая сорбционная емкость Ni 2+ примерно в 1,4 раза больше теоретически ожидаемой. Это связано с обменом не только межслоевых ионов К + , но и внутрислоевых ионов Mg 2+ . Материалы KMS обладают высокой селективностью к Ni 2+ в присутствии огромного избытка ионов Na + .Так, для Ni 2+ при обмене КМС-2 (исходная концентрация Ni 2+ ~6 ppm ) в присутствии 5 М Na + . Жесткие ионы Na + очень слабо взаимодействуют со слоем сульфидов мягких металлов, в отличие от относительно мягких Ni 2+ , которые могут сильно взаимодействовать с мягкими лигандами S 2–. В результате высокие концентрации Na + оказывают незначительное влияние на обмен Ni 2+ в материалах КМС.Это впечатляющее связывание с ионами Ni 2+ также указывает на то, что материалы KMS могут быть эффективными средствами для извлечения никеля из промышленных сточных вод, возникающих в результате массовых операций по никелированию во всем мире. 22
22
2.2.4. Hg
2+ , Pb 2+ и Cd 2+ ионообмен и улавливаниеПоскольку ионы Hg 2+ , Pb 2+ и Cd 2+ 900 представляют большую опасность для здоровья при питье 9005 и промышленных сточных вод,1 важно разработать высокоселективные сорбенты для этих ионов с очень высокой емкостью загрузки.11 Слоистая структура сорбента КМС-1 и наличие мягких основных центров (лиганды S 2–) обеспечивают очень быструю кинетику обмена межслоевых ионов К + мягкими кислотами Льюиса, такими как Hg 2+ , Pb 2+ и Cd 2+ ().13 e
Захват Hg 2+ КМС-1 за счет обмена его межслоевых катионов калия.
Исследования методом РФА показали, что значительное сокращение межслоевого пространства происходит при обмене ионов К + на Hg 2+ (), что связано с меньшим размером иона Hg 2+ по сравнению с К + и образование сильных ковалентных взаимодействий Hg 2+ –S 2– .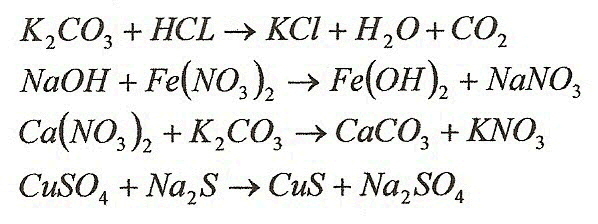
Рентгенограмма продукта обмена Pb 2+ показала наличие двух межслоевых промежутков из-за разной гидратации ионов Pb 2+ ([Pb(H 2 O) x ] 2+ ). Особенно интересен ионообменный процесс Cd 2+ . Аналитические данные для продукта обмена Cd 2+ показали отсутствие не только ионов K + , но и Mn 2+ . В частности, средняя формула соединения, содержащего Cd 2+ , была определена как Cd 1 .8 SN 2.1 S 6 и ионообменный процесс описывается следующим уравнением:
K 1.9 MN 0,95 SN 2.05 S 6 + 1.9CD 2+ → [CD (H 2 O) 1.5 ] 0,95 [CD 0,95 SN 2.05 S 6 ] + 0,95 млн. 2+ + 1.9K +
7
CD 2+ -замещенный КМС-1 имеет слоистую структуру, на что указывают данные РФА, причем Cd 2+ внедряется в виде гидратированного иона в межслоевое пространство и также замещает все внутрислоевые Mn 2+ ионы. Из-за полного обмена Mn 2+ на Cd 2+ наблюдалось резкое изменение цвета материала от темно-коричневого до оранжево-коричневого при замене Cd 2+ ().
Из-за полного обмена Mn 2+ на Cd 2+ наблюдалось резкое изменение цвета материала от темно-коричневого до оранжево-коричневого при замене Cd 2+ ().
Изменение цвета КМС-1 в процессе замены Cd 2+ .
Данные периодической сорбции Isotherm показали максимальную сорбционную емкость от 320 до 377 мг г –1 для процессов обмена Hg 2+ , Pb 2+ и Cd 2+ . На захват этих ионов КМС-1 не влияет кислотность или основность водных растворов.Таким образом, могут быть достигнуты очень высокие значения K d (>10 4 мл г –1 ) для этих ионов в широком диапазоне рН (от 2,5 до 10). Кроме того, на обмен Hg 2+ и Pb 2+ и лишь немного мешает процессу обмена Cd 2+ .
Когда в растворе одновременно присутствуют Hg 2+ , Pb 2+ и Cd 2+ , KMS-1 может захватывать все три иона без явной селективности. Концентрации всех трех ионов снижаются значительно ниже безопасных пределов всего за 2 мин контакта KMS-1 с раствором (1). KMS-2 также проявляет исключительные обменные свойства Hg 2+ , Pb 2+ и Cd 2+ . и обладают сорбционной способностью от низкой до умеренной для Pb 2+ и Cd 2+ .11
Кинетика дезактивации проб питьевой воды, преднамеренно загрязненных ртутью (116 частей на миллиард), свинцом (61 часть на миллиард) и кадмием (98 частей на миллиард) с помощью КМС-1.
Регенерация KMS-1/2 из материалов, содержащих Hg 2+ , Pb 2+ или Cd 2+ , была невозможна из-за очень сильного связывания этих ионов. Из-за чрезвычайно высокой сорбционной емкости по ионам металлов (до 50% по весу) и относительно низкой стоимости материалов КМС может не потребоваться их регенерация; таким образом, материалы с ионным наполнением можно рассматривать как постоянные отходы, подходящие для безопасного удаления.Первоначальные исследования указывают на незначительное выщелачивание Hg 2+ , Pb 2+ или Cd 2+ из соответствующих продуктов обмена после их гидротермальной обработки при 70 °С в течение 24 часов.
Наконец, метиламмоний аналог KMS-1, с формулой [CH 3 NH 3 ] 2 x Sn 3- x S 6 · 0,5H 2 O ( x = 1,0–1,1) (CMS)23 был недавно описан, и были изучены его ионообменные свойства Cd 2+ и Pb 2+ .Результаты этих исследований выявили быструю кинетику сорбции, высокую сорбционную емкость и исключительную селективность ХМС в отношении Cd 2+ и Pb 2+ (см. также раздел ниже для сравнения обменников МС и ).
Таблица 1
Важные ионообменные характеристики репрезентативных MSIE
| Материал | к м а (мг г –1 ) | К d (мл г –1 ) индивидуальный (pH ∼ 7) | К d (мл г –1 ) конкурентный (Na + ) | К d (мл г –1 ) конкурентный (Ca 2+ ) | Активный диапазон рН | Кинетические исследования – время установления равновесия (мин) при комнатной температуре Cs + + | |
| KMS-1 | 226 ± 2 | ≥10 4 | ≥10 3 E | ≥10 2 f | 0.8–12 | 5 | 13 д |
| КМС-2 | 531 ± 28 | ≥10 3 | ≥10 г | нет данных b | 3–10 | Нет данных | 13 ч |
| КТС-1 | 205 ± 6 | ≥10 5 | н.д. | н.п. 33 | |||
| КТС-3 | 280 ± 11 | ≥10 4 | ≥10 3 7 3 ч | Нет данных | 2–12 | 5 | 13 и |
| FJSM-SnS | 409 ± 29 (65 °C) | ≥10 3 | н/д | н/д | 5 (65 °C), 30 (кт) | 34 | GESBS-2 | 2 | 231 ± 15 (65 ° C) | ≥10 3 | Na | Na | 2.8-11 | 2 (65 ° C) | 39 |
| К 6 МС | 66 ± 4 | ≥10 4 | ≥10 2 73 910 910 | ≥10 3 j | 2,5–12 | Нет данных | 42 |
| Старший 2+ 2+ | |||||||
| KMS-1 | 77 ± 2 | ≥10 5 | ≥10 5 K | Нет данных | 1–14 | Нет данных | 13 в |
| КМС-2 | 87 ± 2 | ≥10 4 | ≥10 л | Нет данных | 3–10 | Нет данных | 13 ч |
| КТС-3 | 102 ± 5 | ≥10 5 | ≥10 2 4 м | Нет данных | 2–12 | 5 | 13 и |
| FJSM-SnS | 65 ± 5 | ≥10 4 | н.д.7–11 | 5 (65 °C), 60 (КТ) | 34 | ||
| рт.ст. 2+ | |||||||
| КМС-1 | 377 ± 15 в | ≥10 5 | ≥10 5 n | ≥9 × 10 4 n | 2,5–9,5 | 5 | 13 и |
| LHMS-1 | 87 ± 6 в | ≥10 6 | ≥10 5 n | ≥10 5 n | 0–9 | 10 | 13 ф |
| К 6 MS | NA | ≥10 6 | ≥10 63 12n 4 | ≥10 6 n | 3–8 | 60 | 43 |
| Пб 2+ | |||||||
| КМС-1 | 319 ± 4 в | ≥10 6 | ≥8 × 10 4 n | ≥10 4 n | 2.5–9,5 | 5 | 13 и |
| КМС | 1053 д | ≥10 6 | ≥10 6 n | ≥10 6 n | 1–7 | 30 | 23 |
| CD 2+ | |||||||
| КМС-1 | 329 д | ≥10 7 | ≥6 × 10 3 n | ≥7 × 10 3 n | 0–9 | 5 | 13 и |
| КМС | 515 д | ≥10 5 | ≥10 5 n | ≥10 5 n | 1–7 | 90 | 23 |
| УО 2 2 2+ 2 | |||||||
| KMS-1 | 380 ± 20 | ≥10 5 | ≥10 5 o | ≥10 4 р | 2.5–10 | 120 q | 13 г |
| КТС-3 | 287 ± 15 | ≥10 4 | ≥5 × 10 3 | Нет данных | 2–12 | 50 r | 13 и |
| Никель 2+ 2+ | |||||||
| KMS-1 | 29 ± 1 | ≥10 5 | ≥10 5 S | Нет данных | 3–10 | Нет данных | 13ч |
| КМС-2 | 151 ± 8 | ≥10 5 | ≥10 5 4 | Нет данных | 3–10 | Нет данных | 13ч |
| Медь 2+ 2+ | |||||||
| KMS-1 | 155 | ≥10 5 | ≥10 4 T | ≥10 4 т | 2–6 | 20 | 29 |
| Тл + | |||||||
| К 6 МС | 508 ± 31 в | ≥10 5 | НП | НП | НП | НП | 43 |
2.2.5. Извлечение ионов Ag
+ и Hg 2+ из их цианидных комплексовЦианид-ионы широко используются для растворения драгоценных металлов, таких как золото и серебро, из их минералов. В дополнение к ионам драгоценных металлов минералы также содержат несколько ионов тяжелых металлов, которые необходимо удалить и отделить от драгоценных металлов.24 Одним из примеров является минерал Ag 2 Hg 2 S 2 . Цианирование этого минерала приводит к образованию комплексов [Hg(CN) 4 ] 2– и [Ag(CN) 2 ] – .25 Примечательно, что материалы KMS могут извлекать Hg 2+ и Ag + из их цианидных комплексов. Для этих ионообменных процессов был изучен КМС-2.26 После обработки КМС-2 водными растворами [Hg(CN) 4 ] 2– или [Ag(CN) 2 ] – . КМС-2 также был способен одновременно и количественно улавливать Hg 2+ и Ag + из водных растворов, содержащих как [Hg(CN) 4 ] 2–, так и [Ag(CN) 2 ] – комплекса (мощности удаления >97%).
Кинетика сорбции Hg 2+ и Ag + из смешанного раствора [Hg(CN) 4 ] 2– –[Ag(CN) 2 ] (рН – 10) показывают, что в течение 3 часов обмен Hg 2+ и Ag + достиг равновесия с наблюдаемой способностью удаления ≥99,9% (). Быстрое извлечение Hg 2+ и Ag + из их цианидных комплексов объясняется высокой подвижностью ионов К + КМС-2 и высоким сродством мягких кислот Льюиса Hg 2+ и Ag + для мягкого основного сульфидного каркаса КМС-2.Предполагается, что КМС-2 поглощает Hg 2+ и Ag + после выхода ионов в раствор и достижения равновесия в соответствии с принципом Ле Шателье (реакции 7–9):
[Ag(CN) 2 ] — ↔ Ag + + 2CN —
8
8
[HG (CN) 4 ] 2- ↔ HG 2+ + 4Cn —
9
K 2 MGSN 2 S 6 + x HG 2+ + Y AG + → K 2-2 x — Y HG x Y Y MGSN 2 S 6 + (2 x + y ) k +
10
Кинетические данные для сорбции Hg 2+ и Ag + смесь комплексов Hg(CN) 4 ] 2– –[Ag(CN) 2 ] – в растворе (pH ∼ 10).Воспроизведено с разрешения исх. 26. © 2015, Американское химическое общество.Элементарные Hg и Ag могут быть извлечены из Hg 2+ /Ag + -KMS-2 с помощью двухстадийного процесса. Сначала продукт обмена нагревают до 425 °С; HgS возгоняется и собирается в конце трубы, которая находится вне печи. Затем соединение, не содержащее Hg, растворяют в азотной кислоте и выделяют элементарное Ag путем восстановления растворенного Ag + гидразином.
В целом, результаты этих исследований показывают, что MSIE очень эффективны для извлечения ионов драгоценных металлов и обеззараживания шахтных сточных вод.
2.2.6. UO
2 2+ обменные свойстваУран, существующий главным образом в виде катиона UO 2 2+ , представляет собой основной источник ядерной энергии и ее отходов; он может попадать в окружающую среду в результате различных промышленных и горнодобывающих процессов.4 Кроме того, в результате закрытия различных ядерных объектов по всему миру остались загрязненные ураном участки.4 Таким образом, селективные ионообменники UO 2 2+ для эффективного улавливания этого вида особенно привлекательны. Сорбенты UO 2 2+ могут использоваться не только для восстановления окружающей среды, но и для извлечения урана из морской воды, которая содержит в 1000 раз больше урана, чем наземные руды.
Традиционно подходящими сорбентами для UO 2 2+ являются материалы с жесткими основными функциональными группами,27 a e.г. карбоксильных, фосфонатных или амидоксимных групп, принимая во внимание, что U со степенью окисления 6+, как ожидается, будет вести себя как типичная жесткая кислота Льюиса. Однако это может быть упрощенным предположением, поскольку были сообщения о соединениях уранила, образующих достаточно прочные ковалентные связи с S 2– .27 b KMS-1 проявляет селективные обменные свойства UO 2 2+ . Полный обмен ионов K + КМС-1 на UO 2 2+ может быть осуществлен очень быстро13 g по следующему уравнению:
K 1.9 MN 0,95 SN 2.05 S SN 6 + 0,95UO 2 9005UO 2 2+ → [UO 2 (H 2 o) 1.5 ] 0,95 [MN 0,95 SN 2.05 S 6 ] + 1.9K +
+11
PXRD Исследования показывают, что основной UO 2 2+ -Exchanged Phase содержит линейную группу [OUO] 2+ , заказанный параллель к плоскости слоя ().
Схема механизма УО 2 2+ захват КМС-1.
Данные твердотельного отражения в ближней ИК/УФ-видимой области указывают на значительно меньшую ширину запрещенной зоны для обменного соединения UO 2 2+ (∼0,95 эВ) по сравнению с таковым (1,3 эВ) исходного KMS-1. Это свидетельствует об относительно сильных взаимодействиях UO 2 2+ ···S 2– .
Данные периодической сорбции Isotherm, приспособленные к модели Ленгмюра, показывают максимальную емкость 380 ± 20 мг г –1 . Материал можно регенерировать путем обработки продукта, содержащего UO 2 2+ , Na 2 CO 3 , и его можно повторно использовать несколько раз для ионного обмена UO 2 2+ .КМС-1 хорошо сорбирует UO 2 2+ в широком диапазоне рН (от 2 до 10). Интересно, что очень высокая способность удаления UO 2 2+ (94–98%) для КМС-1 наблюдалась даже в присутствии огромных избытков (до 10 4 раз выше концентрации) конкурирующих ионов, таких как Na + и Са 2+ .
Кроме того, KMS-1 был испытан на обмен UO 2 2+ в реальных условиях. Было обнаружено, что он особенно эффективен для обеззараживания проб питьевой и озерной воды, преднамеренно загрязненных следами урана (от 400 до 1000 частей на миллиард).Таким образом, обработка образцов КМС-1 в течение всего лишь 2 мин приводит к конечной концентрации урана около 1 мкг/л, что значительно ниже допустимого предела (30 мкг/л по определению USA-EPA).
KMS-1 был испытан на извлечение U из проб морской воды, которые содержат U в концентрациях от 3 до 4 частей на миллиард и очень высокие количества Na + , Ca 2+ , Mg 2+ и K + (от 200 до 10 000 частей на миллион). КМС-1 эффективно поглощает (удаляющая способность до 84%) даже такое чрезвычайно низкое содержание урана в присутствии достаточно высоких концентраций конкурирующих ионов.В целом результаты сорбции UO 2 2+ KMS-1 показали, что этот ион намного мягче, чем считалось ранее, и MSIE могут обеспечить новые стратегии для селективных сорбентов UO 2 2+ . Требуется дополнительная работа для дальнейшей оценки потенциала этого материала для добычи урана в море; в частности, тестирование следует проводить в более реалистичных условиях, соответствующих масштабируемому практическому процессу.
2.2.7. Cu
2+ ионообменные свойстваВысокие концентрации Cu 2+ в питьевой воде могут привести к ряду проблем со здоровьем, таких как поражение печени или почек или желудочно-кишечные расстройства.1,28 KMS-1 был недавно протестирован. в качестве обменника Cu 2+ .29 Результаты показали, что Cu 2+ внедряется в виде гидратированного катиона в межслоевое пространство, заменяя все K + ; в то же время он частично замещает ионы Mn 2+ из слоя.Ионообменный процесс описывается следующим образом:
K 1.88 MN 0,94 SN 2.06 S 6 + 1.34CU 2+ → [CU (H 2 O) 5.6 ] 0,94 [CU 0,4 MN 0.54 SN 2.06 S 6 ] + 0,4 млн. 2+ + 1.88K +
12
Подробное кинетическое исследование было выполнено для CU 2+ Обмен по КМС-1. Данные показали, что поглощение Cu 2+ происходит очень быстро, при этом ионообменное равновесие достигается за 40, 20 и 10 мин при 10, 25 и 40 °C соответственно ().Кроме того, подгонка кинетических данных может быть легко достигнута с помощью модели псевдовторого порядка, которая указывает на то, что стадия, ограничивающая скорость, представляет собой процесс химической адсорбции. Дальнейший анализ кинетических данных показал, что стадиями, контролирующими скорость, были процессы внешней пленочной и внутричастичной диффузии.
Кинетические данные сорбции Cu 2+ КМС-1, полученные при трех различных температурах. Воспроизведено с разрешения исх. 29; © 2014, Эльзевир.2.2.8. Сорбция радионуклидов
КМС-1 также был испытан на сорбцию ряда радионуклидов, включая 233 U, 239 Pu и 241 Am.30 Результаты показали, что материал особенно эффективен для быстрого поглощения этих радионуклидов в широком диапазоне рН (от 2 до 9) с возможностью удаления ≥99%, наблюдаемой даже в присутствии высоких концентраций Na + . Это исследование впервые показало, что МСИЭ могут быть высокоэффективными для дезактивации радиоактивных отходов.
2.4. Слоистые материалы на основе Sn
3 S 7 2– netЕще одно семейство интересных МСИЭ основано на Sn 3 S 7 –
5 5 слоистых каркасов. О первом члене этого ряда, (ТМА) 2 (Sn 3 S 7 )·H 2 O (ТМА + = ион тетраметиламмония), сообщил проф. JB Parise и его коллеги.32 Соединение было выделено реакцией SnS 2 , ТМАОН и S в гидротермальных условиях.Он имеет микропористый слоистый каркас, состоящий из полукубов [Sn 3 S 4 ] с общими краями (). Шесть единиц [Sn 3 S 4 ] соединены мостами S 2–, образуя кольцо, окруженное двенадцатью тригональными бипирамидами SnS 5 . Слои разделены катионами ТМА + и молекулами гостевой воды (). Предварительные эксперименты по ионному обмену показали, что ионы ТМА + легко заменяются ионами щелочных и щелочноземельных металлов и ионами некоторых переходных металлов; однако ионный обмен с ионами мягких металлов, такими как ионы Ag + , приводил к разрушению структуры слоистого каркаса.
(A) Слоистая структура (ТМА) 2 (Sn 3 S 7 )·H 2 O (Sn, красный; S, желтый). (B) Расположение двух соседних слоев (с полиэдрическим изображением) и катионов ТМА + (C, серый; N, синий), расположенных в межслоевом пространстве (молекулы гостевой воды для ясности опущены).
Дополнительные примеры материалов со слоистой структурой Sn 3 S 7 2– содержат различные межслоевые органические катионы, такие как DABCOH + (протонированный 1,8-диазабициклооктан), QUIN (хинуклид) , TBA + ( трет- -бутиламмоний) и Et 4 N + (тетраэтиламмоний).33
Совсем недавно был описан новый член семейства Sn 3 S 7 2– , созданный с помощью смешанных MeNH 2 + и Me 3 NH + катион. Формула этого материала, обозначенного как FJSM-SnS, была следующей: (Me 2 NH 2 ) 4/3 (Me 3 NH) 2/3 Sn 3 S 1 7 H 2 O.34 Обменные свойства Cs + и Sr 2+ этого материала при 65 °C показали, что максимальная сорбция достигается всего за 5 мин, тогда как при комнатной температуре достигается ионообменное равновесие в течение 30-60 мин.Максимальная сорбционная емкость Cs + и Sr 2+ составила 409 ± 29 и 65 ± 5 мг/г –1 соответственно. Эти значения являются одними из самых высоких, зарегистрированных для MSIE . Кроме того, эксперименты в зависимости от рН показали хорошую способность удаления Cs + и Sr 2+ в широком диапазоне рН (от 0,7 до 10). Интересно, что FJSM-SnS можно использовать в качестве неподвижной фазы в ионообменной колонке, которая оказалась особенно эффективной при абсорбции Cs + и Sr 2+ из водных растворов, содержащих оба иона (исходные концентрации: Cs + = от 12 до 15 м.д., Sr 2+ = 6 м.д.).Таким образом, способность удаления 96–100% Cs + и Sr 2+ наблюдалась после пропускания 900 объемов слоя (общий пропущенный объем = 2,42 л, объем одного слоя = 2,79 мл) через ионообменную колонку (). Это один из первых отчетов об использовании MSIE в столбцах. Однако для практического применения ионообменных колонок могут потребоваться специально разработанные формы сорбентов (см. ниже).
% удаление Sr 2+ и Cs + vs. объем слоя для колонки материала FJSM-SnS.
2.5. Материалы КТС
Дополнительным примером слоистого материала сульфида олова с перспективными ионообменными свойствами является К 2 Sn 4 S 9 (КТС-1). Это соединение может быть выделено посредством твердофазного синтеза . Кристаллическая структура КТС-1 родственна структурам Rb 2 Sn 4 S 9 и Cs 2 Sn 4 S 9 .35 Базовой единицей структуры этих материалов является дустер Sn 4 S 9 2–, состоящий из двух тетраэдрически координированных ионов Sn 4+ и двух ионов Sn 4+ , принимающих тригонально-бипирамидальную геометрию. Кластеры соединены мостиками S 2–, образуя слоистую структуру, перфорированную относительно большими отверстиями (). Слои гофрированы, а межслоевое пространство заполнено сильно разупорядоченными катионами ().
(А) Часть слоя Sn 4 S 9 2– (Sn, красный; S, желтый).(B) Расположение двух соседних слоев с катионами (Cs + , розовый), заполняющими межслоевое пространство.
Предварительные исследования обменных свойств Cs + КТС-1 выявили максимальную сорбционную емкость 205 ± 6 мг г –1 и очень высокие значения K d в диапазоне 10 2 3 до 10 5 мл г –1 . Кроме того, ионы K + KTS-1 могут быть полностью заменены ионами мягких металлов, таких как Hg 2+ , Pb 2+ и Cd 2+ .36 Таким образом, КТС-1 представляется перспективным ионообменником, хотя и требует дальнейших исследований.
КТС-2, еще один ионообменник на основе сульфида олова, представляет собой трехмерный материал и обсуждается ниже (см. раздел 2.3)36. x S 8– x ( x = от 0,65 до 1, KTS-3). добавление Mn или Mg к реакционной смеси.Кристаллическая структура КТС-3 показана на рис. Октаэдры SnS 6 образуют ленты, идущие вдоль оси с и соединены между собой звеньями SnS 4 в виде мостиков Sn 2 S 6 . Межслоевое пространство заполнено неупорядоченными ионами К + .
Структурный сегмент пласта КТС-1, вид вдоль оси b . Сн, красный; С, желтый.
КТС-3 является отличным ионообменником для Cs + , Sr 2+ и UO 2 2+ .Установлено, что емкость этого сорбента по Sr 2+ составляет 102 ± 5 мг/г –1 (подгонка данных по модели Ленгмюра), что является самым высоким показателем среди MSIE . Он также показывает высокую обменную емкость Cs + и UO 2 2+ (подгонка Ленгмюра: 280 ± 11 мг Cs/г, 287 ± 15 мг U/г). Интересно, что он проявляет очень хорошую селективность в отношении Cs + (значение K d 4,4 × 10 3 мл г –1 ) в присутствии Na + в молярной концентрации (0.1 М) в 2000 раз выше исходного содержания Cs + (). Даже при 10 000-кратном избытке Na + значение K d для Cs + было >10 3 мл г –1 . Эффект Na + , по-видимому, более важен в случае ионного обмена Sr 2+ ; значения K d резко снижались при повышении концентрации Na + (). Кроме того, конкурентные эксперименты по ионному обмену Cs + /Sr 2+ показали, как правило, более высокие значения K d для обмена Cs + , чем для обмена Sr 2+ ().Наконец, Na + даже в огромном избытке (концентрация до 5 М) оказывает незначительное влияние на обмен UO 2 2+ , поскольку значения K d показывают лишь незначительные изменения, когда Na + концентрация повышена (). Этот результат также указывает на то, что UO 2 2+ ведет себя скорее как типичный мягкий ион (погранично мягкий), сильно взаимодействующий со слоем мягкого основного сульфида металла, чем как жесткий ион, поскольку UO 2 2+ вообще классифицируется.КТС-3 также является эффективным сорбентом тяжелых металлов, таких как Hg 2+ , Pb 2+ , Cd 2+ , Ag + и Tl + .
(A) K d индивидуальных и конкурентных Cs + и Sr 2+ ионообмен против молярной концентрации Na + (исходные концентрации были + ) + и Sr 2+ соответственно, соотношение V m –1 составляло 1000 мл г –1 , рН ~ 7).(Б) К d для UO 2 2+ ионообмен vs. Соотношение –1 составляло 1000 мл г –1 , рН ~ 7).
2.6. Слоистые сульфиды с ионами трехвалентных металлов в их каркасе
Большинство слоистых MSIE основаны на четырехвалентных или комбинированных четырехвалентных/двухвалентных ионах металлов. Как правило, эти ионы металлов в основном принимают тетраэдрическую или октаэдрическую координацию; лишь в нескольких случаях наблюдается также тригонально-бипирамидальная координация.Альтернативный подход к созданию сульфидных материалов включает комбинацию трехвалентных ионов, таких как In 3+ или Ga 3+ , которые предпочитают тетраэдрическую координацию, и Sb 3+ , который имеет тенденцию принимать тригонально-пирамидальную координационную геометрию.
2.6.1. [(CH
3 CH 2 CH 2 ) 2 NH 2 ] 5 в 5 SB 6 S 19 · 1.45H 2 o (insbs)Слоистый материал, выделенный этой синтетической стратегией [(CH 3 CH 2 CH 2 ) 2 NH 2 ] 5 в 5 SB 6 S 19 · 1.45H 2 O (InSbS), получен гидротермальной реакцией In 2 S 3 , Sb 2 S 3 , S и дипропиламина37. Слой 19 ] 5– состоит из тетраэдров InS 4 с общим углом, соединенных тригональными пирамидальными единицами SbS 3 , и димеров Sb 2 S 6 (). Слой содержит большие отверстия с размерами 13,3 × 3,8 Å 2 , достаточные для размещения части органических противоионов, а остальные органические катионы располагаются в межслоевом пространстве ().
(A) Часть слоя [In 5 Sb 6 S 19 ] 5–, если смотреть вниз по оси b . (B) Упаковка слоев с атомами N катионов дипропиламмония в виде больших шаров (атомы C и H не показаны для ясности). В, голубой; сбн, коричневый; Н, синий; С, желтый.
Благодаря неупорядоченному состоянию органических ионов-гостей и относительно большим окнам слоя это соединение проявляет легкие ионообменные свойства с различными катионными частицами.Интересно, что Cs + может полностью заменять органические катионы, тогда как Rb + заменяет только 37% катионов. Кроме того, 12 % ионов заменены на Li + , а незначительное количество органических гостей может быть заменено на K + и Na + .
Конкурентные эксперименты со смесью эквимолярных количеств Na + , K + , Rb + и Cs + показали, что поглощение Cs + InSbS в 10 раз выше, чем у других ионов .Такая значительная селективность соединения по Cs + , вероятно, является результатом совпадения размера этого катиона с апертурой окон в слое [In 5 Sb 6 S 19 ] 5–. Таким образом, перфорированные слои соединения, по-видимому, способствуют его легким ионообменным свойствам. В пользу этой гипотезы говорит и отсутствие какой-либо ионообменной способности у пластинчатого материала [CH 2 NH 2 ] 2 In 2 Sb 2 S 7 , слои которого относительно плотные и не имеют отверстий.
2.6.2. [CH
2 NH 2 ] 2 Ga 2 Sb 2 S 7 ·H 2 O (GaSbS-1)2 9 [CH 2 NH 2 ] 2 Ga 2 Sb 2 S 7 ·H 2 O (GaSbS-1)38. общие тетраэдры GaS 4 и две тригональные пирамидальные единицы SbS 3 , дополнительно соединяющие фрагменты GaS 4 ().В слоях есть относительно открытые окна, которые определяются 16-членными кольцами, состоящими из четырех строительных единиц. Катионы диметиламмония находятся в межслоевом пространстве и взаимодействуют со слоями через водородную связь N–H···S.(А) Часть слоя GaSbS-1. Пунктирные линии представляют взаимодействия водородных связей между ионами диметиламмония и слоем. (Б) Часть слоя GaSbS-2 и часть межслоевых ионов Cs + . Га, фиолетовый; сбн, коричневый; С, желтый; С, розовый.
GaSbS-1 обладает легкими ионообменными свойствами для ионов щелочных и щелочноземельных металлов благодаря своей слоистой структуре и относительно большим окнам в слоях, которые обеспечивают диффузию частиц в реакциях ионного обмена. Особый интерес представляет сорбция Cs + соединением GaSbS-1. Этот материал особенно селективен в отношении Cs + в присутствии очень большого (100-кратного) избытка Na + . Интересно, что обмен Cs + может быть достигнут даже посредством процесса трансформации SCSC.Таким образом, можно определить кристаллическую структуру продукта обмена Cs + (GaSbS-2).
Связность атомов в GaSbS-2 () такая же, как и в GaSbS-1. Однако существует значительное сокращение многоуровневой структуры. Так, размер окон изменился с 11,36 × 4,28 Å 2 в GaSbS-1 до 11,85 × 3,69 Å 2 (включая атомные радиусы) в GaSbS-2 (). Таким образом, представляется, что при попадании в структуру ионов Cs + имеет место реакция каркаса, приводящая к уменьшению размеров окон в слоях.Два из трех кристаллографически независимых ионов Cs + расположены близко к слою, а третий находится между двумя слоями. Эти ионы прочно связаны в соединении, так как никакие Cs + не могут быть вымыты при обработке материала большим избытком ионов Na + . Открытие/закрытие окон, наблюдаемое в слоистой структуре соединения GaSbS-1 при обмене Cs + , напоминает механизм захвата насекомых венериной мухоловкой.
(A) 16-членное кольцо в GaSbS-1 с указанием его размера. (B) 16-членное кольцо в GaSbS-2 с указанием его размера. Га, фиолетовый; сбн, коричневый; S, желтый..
2.6.3. [CH
3 NH 3 ] 20 GE 10 SB 28 S 72 · 7H 2 o (GESBS-1)Это соединение было приготовлено сольветально путем взаимодействия GEO 2 , Sb, S и метиламмониевая соль.39 Он имеет необычную двухслойную структуру, состоящую из двух связанных по симметрии толстых слоев, соединенных ионами Ge 4+ ().Каждый отдельный слой состоит из двух частей, L1 и L2. L1 представляет собой одномерную цепь взаимосвязанных [GeSb 3 S 8 ] 3– звеньев, тогда как фрагмент L2 представляет собой слой, основанный на [GeSb 4 S 11 ] 6 звеньев. В структуре наблюдаются два типа каналов с размерами 10,17 × 9,90 Å 2 и 5,94 × 5,94 Å 2 . Катионы метиламмония и молекулы гостевой воды находятся внутри этих каналов, а также в межслоевом пространстве.
(а) Двухслойная сеть GeSbS-1. (б) Блок L1. (c) Блок L2. (d и e) Два типа каналов в сети. (f и g) 18- и 14-членные кольца, образующие каналы в структуре. Воспроизведено с разрешения исх. 39 © 2015, Американское химическое общество.GeSbS-1 демонстрирует впечатляющие обменные свойства Cs + . В частности, он демонстрирует емкость обмена Cs + , равную 231 ± 15 мг/г –1 . Кинетика сорбции Cs + также очень быстрая, ионный обмен достигает равновесия в течение 2 мин.Кроме того, селективность материала по Cs + значительна, о чем свидетельствуют относительно высокие значения K d (от 2 до 4 × 10 3 мл г –1 ) для Cs + . обмен в присутствии большого избытка (20-кратного) Na + или Ca 2+ .
2.7. Полисульфид и MoS
4 2– -интеркалированные двойные слоистые гидроксидыНедавно был разработан новый тип металлического сульфидоподобного сорбента с селективными сорбционными свойствами в отношении ионов тяжелых металлов.40 Эти материалы состоят из слоистых двойных гидроксидов (СДГ), интеркалированных полисульфидными группами [S x ] 2– (, слева).
Слева: Расположение групп [S 4 ] 2– в межслоевом пространстве материала СДГ. Справа: предполагаемое связывание ионов металлов с полисульфидным звеном. Металл, зеленый; О, красный.
Механизм захвата ионов металлов сорбентами LDH(S x ) зависит от мольного соотношения ионов металлов : LDH(S x ).
В случае низкой концентрации ионов металлов и большого избытка сорбента протекает следующая реакция:
СДГ(S x ) + M(NO 3 ) 2 → LDH(NO 3 — ) м ([M 2+ (S x 2- ) 2 ] 2- ) N
13
Таким образом , группы [S x ] 2– действуют как второй хозяин для поступающих ионов (справа).
Однако, когда концентрация иона металла относительно велика, реакции сорбции являются стехиометрическими; таким образом, образуются два продукта, LDH(NO 3 ) и MS x : 3 ) + МС x
14
Сорбционные эксперименты с водными растворами, содержащими ряд ионов металлов, таких как Ni 2+ , Co 2+ , Cu 90 9051 2+ + , Hg 2+ , Pb 2+ , Zn 2+ и Ag + указывают на более высокую селективность LDH (S x ) для более мягких ионов.Чрезвычайно высокие значения K d (до 10 7 мл г –1 ) обнаружены для сорбции Ag + и Hg 2+ , что свидетельствует о высоком потенциале СДГ(S 3 х ) сорбенты для улавливания ионов тяжелых металлов.40 а
материалы LDH(S х ) испытаны также на UO 2 2+ серия 2.474 UO 2 2+ Сорбционные эксперименты выявили исключительную селективность сорбентов СДГ(S x ) в отношении UO 2 2+ в присутствии очень больших избытков Na и Ca + 9 2+ .Кроме того, материалы LDH (S x ) могут эффективно поглощать U из проб морской воды. Эти результаты еще раз подтверждают потенциал сульфидных сорбентов для селективного улавливания U.
Совсем недавно сообщалось о интеркалированных СДГ MoS 4 2– .40 c Они демонстрируют чрезвычайно высокую сорбционную способность в отношении Hg 2+ (∼500 мг г –1 502 + ) и Ag . (~450 мг г –1 ). Они также эффективны для захвата дополнительных ионов металлов, таких как Cu 2+ , Pb 2+ и Co 2+ .Предполагается, что при низких и средних концентрациях ионов металлов (М 2+ ) сорбция протекает через образование частиц [M(MoS 4 ) 2 ] 2–, захваченных в межслоевом пространстве материалы ЛДГ. При высоких начальных концентрациях ионов металлов образуются нейтральные аморфные соли [M(MoS 4 )].
Ионообменная смола | Качественная продукция, консультация специалиста
Ионный обмен — это обратимая химическая реакция, при которой растворенные ионы удаляются и заменяются другими ионами с таким же или подобным электрическим зарядом.Этот механизм используется ионообменными смолами, которые представляют собой среду, облегчающую обмен ионами между шариками смолы и водой, когда она движется внутри сосуда.
Этот процесс позволяет получать сверхчистую воду для использования в производстве полупроводников, солнечных фотоэлектрических элементов, фармацевтических препаратов и плоских дисплеев для ополаскивания/очистки и различных других важных процессов.
Производители пищевых продуктов могут использовать ионообменные смолы множеством способов: от очистки воды до использования в качестве ингредиента для обесцвечивания, деминерализации и устранения вкуса и запаха.
Ионообменные смолы используются в производстве полупроводников.
На электростанциях ионообменные смолы используются для деминерализации питательной воды и обработки конденсата из парового цикла. Они даже используются для восстановления различных металлов, таких как золото, уран и медь.
Возможно, самое широкое применение – в качестве этапа предварительной обработки в различных установках водоподготовки, где они могут повышать эффективность установок обратного осмоса за счет снижения нагрузки на мембраны фильтров.
Две наиболее часто используемые ионообменные смолы:
- Катиониты, которые обменивают положительно заряженные ионы, например натрия, на кальций,
- Аниониты, которые обменивают отрицательно заряженные ионы, такие как хлорид, на мышьяк.
Они используются для удаления ядовитых и опасных ионов металлов из раствора, заменяя их более безопасными ионами, такими как натрий и калий.
Как работают ионообменные смолы
Умягчение воды — это удаление из жесткой воды катионов кальция, магния и некоторых других металлов.Полученная в результате мягкая вода требует меньшего количества мыла для того же усилия по очистке, поскольку мыло не тратится впустую, связываясь с ионами кальция.
Мягкая вода также продлевает срок службы сантехники, уменьшая или устраняя образование накипи в трубах и фитингах.
Рис. Процесс ионного обмена или деионизации или деминерализации.
Жесткая вода образуется, когда вода просачивается через отложения известняка, мела или гипса, которые в основном состоят из карбонатов, бикарбонатов и сульфатов кальция и магния.Оксиды или карбонаты железа могут придавать красновато-коричневый цвет отложениям жесткой воды.
И хотя Всемирная организация здравоохранения заявляет, что «по-видимому, нет убедительных доказательств того, что жесткость воды вызывает неблагоприятные последствия для здоровья человека», существуют исследования, которые связывают использование жесткой воды в домашних условиях с увеличением заболеваемости экземой у детей.
Они могут помочь улучшить как доступ, так и качество, помогая обеспечить более высокий уровень фильтрации питьевой воды в развивающихся странах по всему миру.
Redox может поставлять его в мешках по 25 л и 1000 л.
Свяжитесь с нами сегодня по телефону и поговорите с одним из наших отраслевых специалистов, чтобы узнать больше.
Кинетика эпоксидирования высоколиноленового триглицерида, катализируемого твердой кислотно-ионообменной смолой
На рисунке 1b показан химический состав масла периллы 27,28 . В то время как средняя молекулярная масса триглицерида (масло периллы) оценивалась примерно в 871 г/моль, его функциональность двойной связи (т.д., среднее число двойных связей на моль триглицерида) рассчитывали как ~7. Экспериментально определено йодное число масла периллы 196,6 г/100 г масла (т. е. 0,775 моль/100 г масла) 3 .
Влияние положения двойной связи на ее реакционную способность
Определенные экспериментально (показаны точками) и предсказанные моделью (показаны линиями для всех сценариев) IV и EV вместе с их соответствующим процентом ошибки (с использованием уравнений (11) и (12) )) показаны для 40 °C (рис. 2а,б) и 60 °C (рис.2в,г) соответственно. Кроме того, на рис. 3a,b показаны IV и EV, предсказанные при 50 °C во время проверки предложенной нами модели, а на рис. 3c приведены значения оптимизированной функции стоимости при всех температурах реакции, полученные во время оценки параметров и проверки модели (при 50°C). °C) для всех четырех сценариев.
Рисунок 2Экспериментально полученные и предсказанные моделью (для всех четырех сценариев) во время оценки параметров: ( a ) значения йода и ( b ) значения эпоксидной смолы при температуре реакции 40 °C; ( c ) Йодные числа и ( d ) Эпоксидные числа при температуре реакции 60 °C.
Рисунок 3Экспериментально полученные и предсказанные моделью (для всех четырех сценариев): ( a ) йодные числа и ( b ) эпоксидные значения во время проверки модели при температуре реакции 50 °C; и ( c ) Оптимизированная функция стоимости (среднеквадратичное значение) разработанной модели для всех четырех сценариев при трех температурах реакции во время оценки параметров и для 50 °C во время проверки модели.
Как видно (рис. 2a–d и 3c), как процент ошибки, так и оптимизированная функция стоимости, полученные во время оценки параметров, оказались выше для сценариев S3 и S4 при всех трех температурах.Напротив, сценарии S1 и S2 показали наименьшие значения ошибки и функции стоимости, при этом S1 более точно предсказал экспериментальные наблюдения по сравнению со S2 во время оценки параметров. Однако после проверки нашей модели (рис. 3a, b) сценарий S2 точно предсказал экспериментальные наблюдения с наименьшей ошибкой (<10%) и функцией стоимости (0,06). И наоборот, сценарий S4 продемонстрировал очень высокую ошибку (> 50%) и функцию стоимости (0,776), таким образом, полностью не подтверждая себя как вероятный сценарий, в то время как сценарии S1 и S3 имели более высокую ошибку (≥ 15%) по сравнению с S2, хотя их предсказанные значения были близки к наблюдаемым экспериментально по сравнению с S4.
Основываясь на этих наблюдениях (из рис. 2a–d и 3a–c), наша модель показывает, что предположения, сделанные в сценарии S2, с наибольшей вероятностью объясняют экспериментально наблюдаемое поведение эпоксидирования. Другими словами, реакционная способность двойных связей в положениях 9 и 12 одинакова, а двойных связей в положении 15 различна. Это согласуется с аналогичными выводами, о которых ранее сообщали Scala и Wool 5 . Они объясняли это сильным влиянием стерических и электронных эффектов глицеринового центра на более близкие к ним двойные связи (т.е., 9 й и 12 й позиции), без влияния таких эффектов на двойные связи, которые находятся дальше от глицеринового центра (т.е. 15 й позиция).
Традиционно кинетика эпоксидирования различных триглицеридов моделировалась с использованием сценария S4 в существующей литературе 6,9,11,14,15,17 , что указывает на то, что модели, основанные на этом сценарии, очень надежны и точно предсказывают эпоксидирование различных триглицеридов. Однако наша модель показывает, что сценарий S4 с наименьшей вероятностью объясняет экспериментально наблюдаемое поведение эпоксидирования периллового масла с высоким содержанием линоленовой кислоты.Этот резкий контраст обусловлен отсутствием линоленовой кислоты (C18:3), которая имеет двойную связь в положении 15 th , в триглицеридах, использованных в вышеупомянутых исследованиях, в то время как масло периллы (использовавшееся в этом исследовании) имеет высокое содержание линоленовой кислоты ( >50%). Это означает, что сценарии S2 (наиболее точные) и S4 (наименее точные) в нашем исследовании одинаковы для высокоолеиновых триглицеридов, которые изучались до настоящего времени.
Вместе эти объяснения подчеркивают насущную необходимость разработки модели, которая надежно фиксирует изменение реакционной способности двойных связей для синтеза EVO с более высоким содержанием оксирана — аспект, достигнутый нашей моделью.В дополнение к захвату этой вариации наша модель также дает результаты, которые дают дополнительное представление об их поведении при эпоксидировании. Далее приводится объяснение некоторых таких выводов для двух сценариев (S1 и S2).
Реакционная способность двойной связи и эпоксидных групп в различных положениях связи — сценарий S1
На рис. 4a–f показано изменение концентрации двойной связи и эпоксидной смолы — в зависимости от их положения связи — как предсказано нашей предложенной моделью для сценария S1 для всех трех температуры реакции.На рисунке 4a показана вялая реакционная способность двойной связи, присутствующей в положении 9 . Тем не менее, предполагается, что почти все двойные связи в этом положении будут участвовать в реакции эпоксидирования как при 50, так и при 60 °С. С другой стороны, предполагается, что значительное количество остаточного содержания двойных связей будет существовать при 40 °C, что указывает на то, что реакция эпоксидирования не завершена даже через 8 часов. Напротив, рис. 4c, e указывает на высокую реакционную способность двойных связей, присутствующих в положениях 12 th и 15 th , при температурах реакции 50 и 60 °C, показывая, что они расходуются в течение первых 50 минут реакции.Однако предполагается, что при 40 °C двойная связь в положении 12 будет реагировать медленнее по сравнению с двойной связью в положении 15 .
Рисунок 4( a – f ) Изменение реакционной способности двойной связи и эпоксидных групп в зависимости от их положения при различных температурах реакции и продолжительности реакции для сценария S1.
Напротив, реакционная способность эпоксидной группы, которая указывает на ее стабильность или вероятность расщепления эпоксидной группы, показана на рис.4b,d,f (соответствует позициям 9 th , 12 th и 15 th соответственно). Как можно видеть, при всех температурах реакции эпоксидные группы, образованные в положении 15 th (рис. 4f), согласно предложенной нами модели, подверглись расщеплению. Однако предполагается, что эпоксидные группы, образованные в положениях 9 и 12 (рис. 4b, d), не участвуют в реакции раскрытия кольца.
Тем не менее, как упоминалось ранее, сценарий S1 показывает более высокую ошибку по сравнению с S2 во время проверки модели (при 50 °C).Кроме того, как видно из таблиц 1 и 2, доверительный интервал оценок кинетических констант скорости и констант равновесия значительно выше для S1, чем для S2. Эти два аспекта указывают на то, что сценарий S1 не является наиболее точным сценарием для объяснения экспериментально наблюдаемого поведения эпоксидирования. Следовательно, изменение реакционной способности двойных связей и эпоксидных групп в различных положениях, предсказанное в сценарии S2, представлено в следующем разделе.
Таблица 1. Кинетические константы скорости реакций эпоксидирования и раскрытия цикла, определенные путем подгонки экспериментально полученных значений при 40, 50 и 60 °C к предложенной нами модели для сценария S1. Таблица 2. Кинетические константы скорости реакций эпоксидирования и раскрытия цикла, определенные путем подгонки экспериментально полученных значений при 40, 50 и 60 °C к предложенной нами модели для сценария S2 и энергии активации различных реакций.Реакционная способность двойной связи и эпоксидных групп в различных положениях связи – Сценарий S2
На рис. 5a–d показано изменение концентрации двойной связи и эпоксидной смолы с увеличением продолжительности реакции при всех трех температурах реакции, как это предсказывает сценарий S2.Кроме того, в Таблице 2 представлены различные кинетические константы скорости (k) и константы равновесия (K), предсказанные нашей моделью, и показано, что доверительный интервал для различных констант скорости (k) наблюдался в пределах 90% для 40°C и 95°C. % для 60 °C, что указывает на устойчивость сценария S2 в предлагаемой нами модели.
Рисунок 5( a – d ) Изменение реакционной способности двойной связи и эпоксидных групп в зависимости от их положения при различных температурах реакции и продолжительности реакции для сценария S2.
Как видно (рис. 5а), двойные связи в положениях 9 th и 12 th проявляют вялую реакционную способность при 40 °C, что приводит к значительному количеству непрореагировавших двойных связей. Однако скорость реакционной способности двойных связей в этих положениях возрастала с повышением температуры до 50 и 60 °С. В то же время рис. 5б свидетельствует о том, что эпоксидные группы, образованные в положениях 9 и 12 , расщеплению не подвергались. Эти наблюдения сравнимы с прогнозами, сделанными для изменения эпоксидной прочности (EV) в сценарии S1 (рис.4б,г).
С другой стороны, на рис. 5c показано, что двойная связь в положении 15 th полностью реагирует в течение первых 50 минут реакции эпоксидирования, в то время как эпоксидная группа, образованная в этом положении, склонна к расщеплению (рис. 5d) . Следовательно, как для двойной связи, так и для эпоксидной группы в положении 15 th скорость реакционной способности сопоставима для обоих сценариев S1 (рис. 4e,f) и S2 (рис. 5c,d). Это отличается от результатов, наблюдаемых в большинстве исследований кинетики реакций EVO до настоящего времени, которые показывают значительное расщепление эпоксидной смолы (в положениях 9 и/или 12 ) в растительных маслах с высоким содержанием олеиновой кислоты 17,29, 30,31,32,33 .Следовательно, поведение (предсказываемое нашей моделью) эпоксидных групп, находящихся в положениях 9 th и 12 th , не подвергающихся расщеплению оксирана под действием муравьиной кислоты, может быть обусловлено комбинацией трех факторов.
Первым фактором является возможное стерическое влияние гидроксилированной группы, находящейся в положении 15 th (образующейся в результате расщепления оксирана) на поступающую муравьиную кислоту. Предполагается, что этот эффект предотвращает любое взаимодействие между муравьиной кислотой и эпоксидными группами, присутствующими в положениях 9 th и 12 th , тем самым предотвращая их расщепление.
Вторым содействующим фактором является сочетание стерических и электронных эффектов, о чем сообщили Scala and Wool 34 в их исследовании кинетики реакции ацилирования (т.е. расщепление эпоксидных групп и образование акриловой группы) EVO. Они заметили, что растительные масла, богатые олеиновой кислотой, демонстрируют более высокие скорости реакции ацилирования по сравнению с маслами, содержащими большее количество групп линолевой (C18:2) и линоленовой кислоты (C18:3), что они связывают со стерическими и электронными эффектами.Стерический эффект был вызван присутствием нескольких эпоксидных групп в одной и той же цепи жирной кислоты, что препятствовало атаке этих групп другими химическими веществами. В то же время считается, что электронный эффект, возникающий из-за глицеринового центра, предотвращает расщепление эпоксидной группы, присутствующей в положении 9 th в жирных кислотах.
Третий интересный фактор, который объясняет низкие уровни расщепления оксирана, наблюдаемые по снижению кинетической константы скорости расщепления оксирана (в положениях 9 и 12 ) при повышении температуры реакции (таблицы 1 и 2). , представляет собой разложение муравьиной кислоты при более высоких температурах из-за более высокой реакционной способности перекиси водорода 35,36 .Такая деградация, вероятно, уменьшит возможность расщепления оксирана посредством атаки муравьиной кислотой на эпоксидные группы, особенно для эпоксидных групп в относительно менее доступных положениях (т.
Энергия активации различных реакций
Энергии активации реакций образования и расщепления эпоксидной смолы в различных положениях двойной связи (9 th , 12 th и 15 th ) представлены в таблице 2. Эти энергии активации были рассчитаны для сценарий S2, поскольку этот сценарий считается наиболее точным предсказателем кинетики эпоксидирования в этом исследовании (как объяснялось ранее).Как видно, за исключением энергии активации расщепления оксирана в положениях 9 th и 12 th (k 3d ), все остальные значения энергии активации являются положительными и соответствуют соответствующим значениям для эпоксидирования других растительных масла 3 . Напротив, расщепление эпоксидной смолы в положениях 9 th и 12 th демонстрирует отрицательную энергию активации (-688,40 кДж / моль) — математический результат уменьшения константы скорости (k 3d ) с повышением температуры.Хотя такая отрицательная энергия активации встречается редко, это объясняется двумя факторами, которые вместе ингибируют расщепление оксирана в положениях 9 th и 12 th : усиливает стерический эффект гидроксилированной группы в положении 15 th на поступающую муравьиную кислоту; и b) разложение муравьиной кислоты при более высоких температурах. Следовательно, реакция становится более сложной и менее вероятной при более высоких температурах, что приводит к получению незначительной константы скорости при более высоких температурах.
Ионообменная смола – пилотные испытания и испытания смолы
Первоначально представлено на Extraction 2018, 26–29 августа 2018 г. Пожалуйста, посетите Springer для получения дополнительной информации о конференции или о том, как приобрести документ или материалы.
Дональд Д. Дауни
Purolite Corporation, Париж, Онтарио, Канада
Резюме
Пилотные испытания Ионообменная смола (IEX) может пройти путь от очень простого тестирования в стакане до сложного тестирования на колонке. Объемные скорости, количество регенерантов, нагрузочная способность, утечка ионов — все это параметры, которые суммируются вместе, чтобы доказать или опровергнуть способность смолы (или смол) загружать один ион (или конкретный набор ионов).Несоблюдение всех рабочих параметров смолы приведет к дисквалификации (или, по крайней мере, искажению) результатов.
Лабораторные испытания на вместимость, влажность, размер гранул, загрязнение металлами и т. д. – что все это значит? По последним подсчетам конечным пользователям было доступно более двадцати пяти отдельных тестов (анализов) ионообменных смол. Стандартные процедуры тестирования определяют свойства смолы, но для выявления проблем с работой оборудования можно использовать более конкретные процедуры. Затем необходимо учитывать затраты; простое тестирование катионитовой смолы (содержание влаги, общая вместимость и целостность шариков) стоит в диапазоне 200 долларов за образец.Однако, если добавить к этому испытания Chatillon, Russian Ball Mill Test, размер частиц HIAC, процедуры испытаний металлов и % регенерации, то стоимость лабораторных работ может возрасти до более чем 1000 долларов за образец.
В этой статье автор объяснит «обязательные» пилотные и испытательные процедуры и почему они важны и являются ключом к пониманию того, как смола выполняет ионный обмен.
Ключевые слова: ионообменная смола, пилотное исследование, лабораторный анализ
Введение в химию полимеров (сульфокислота и четвертичный аммоний).Большинство полимерных основ, используемых для IEX, представляют собой сополимеры стирола и дивинилбензола (ДВБ) и обычно состоят из сферических частиц диаметром от 300 до 1200 мкм. Сшитый сополимер синтезируют смешиванием стирола (одна винильная группа) с ДВБ (две виниловые группы) и проведением суспензионной полимеризации в воде.
Затем производится ионообменная смола путем введения функциональных групп в эту сополимерную матрицу посредством химических реакций. Введенные ионообменные группы химически связаны с полимером, и, поскольку они не могут свободно двигаться, они известны как фиксированные ионы.Мобильные ионы с зарядом, противоположным ионообменным группам (ионы H+ в случае R-SO3H), известны как противоионы. Если при полимеризации увеличить количество бифункционального мономера ДВБ, то получится плотная пористая структура со значительным разветвлением цепи. Если, с другой стороны, количество ДВБ уменьшить, получается рыхлая пористая структура без сильного разветвления. Поскольку DVB определяет плотность пористости, он известен как сшивающий агент. Доля ДВБ в % называется перекрестной связью.
Так как IEX содержат поры, поры заполнены жидкостью (в этой статье мы будем предполагать воду). Ионы диффундируют через эти поры и вызывают ионный обмен. Чем более сшита смола, тем больше будет затруднена диффузия ионов. И наоборот, низкая степень сшивки будет способствовать большей диффузии ионов. Однако, если поперечная связь слишком низкая, содержание влаги становится чрезмерным, поэтому смола становится более мягкой и трудной в использовании, а ее прочность также снижается.Поэтому обычно используют смолы с поперечными связями около 8%.
Реакции ионного обмена осуществляются с диффузией противоионов в частицы смолы. Пористая структура полимерной матрицы оказывает значительное влияние на эти реакции, поэтому сшивка является важным фактором при анализе свойств смолы.
Сополимер стирола и ДВБ не поглощает воду до тех пор, пока не будут добавлены функциональные группы. Поглощение воды происходит за счет гидратации фиксированных и противоионов.Цепи полимерной матрицы удлиняются и набухают до тех пор, пока не будет достигнут баланс между водопоглощающей способностью смолы и силами упругости полимера. Это удерживает смолу в набухшем состоянии со стабильным содержанием влаги. Чем выше поперечная связь, тем меньше полимерная матрица может удлиниться, что приводит к получению смолы с более низким содержанием влаги. Низкая поперечная связь приводит к получению шарика с высоким содержанием влаги по мере увеличения набухания. По мере набухания смолы на этапе функционализации в шариках образуются микропоры.
Смола ионообменная, полученная простой полимеризацией стирола с ДВБ, прозрачна и имеет гелеобразную структуру; следовательно, он известен как ионообменная смола гелевого типа.

 Реакция нейтрализации. Химия, 8–9 класс: уроки, тесты, задания.
Реакция нейтрализации. Химия, 8–9 класс: уроки, тесты, задания. Получают сокращенное ионное уравнение.
Получают сокращенное ионное уравнение.
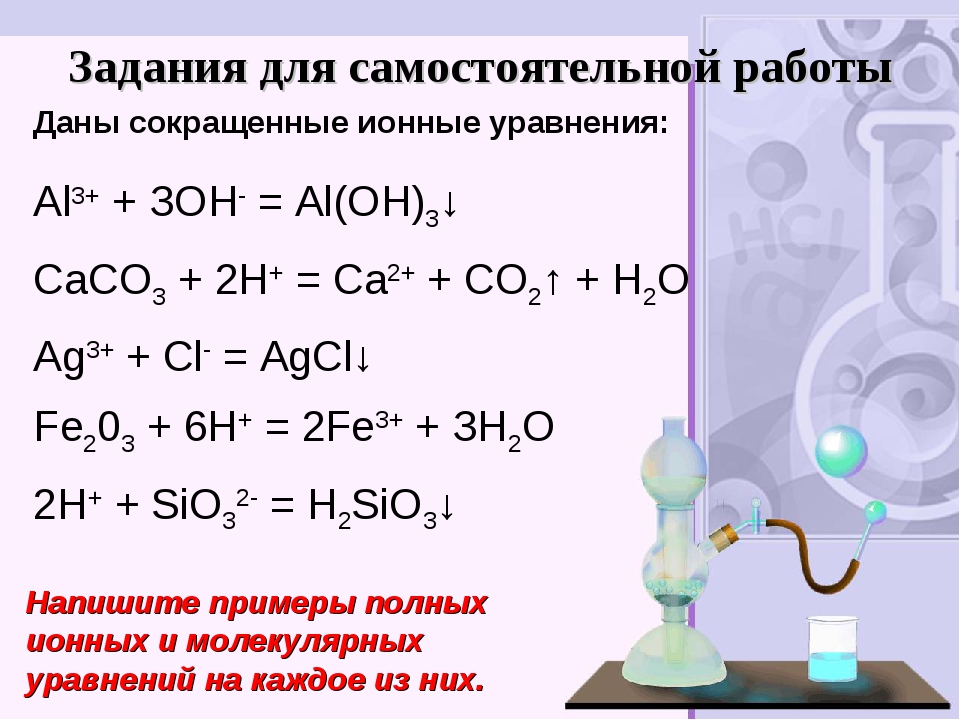 Составьте соответствующие молекулярное и полное ионное уравнения.
Составьте соответствующие молекулярное и полное ионное уравнения.
 Помните об исключениях!
Помните об исключениях!
 Харм, А.Rumper, S. Mayert, and K. Halse
Харм, А.Rumper, S. Mayert, and K. Halse
 H. Mcburney
H. Mcburney В. Пеппер и Л. Р. Моррис
В. Пеппер и Л. Р. Моррис