Тема 6. Строение электронных оболочек атомов.
Часть I
1. Совокупность электронов в атоме называется электронной оболочкой.
2. Электроны на электронной оболочке атома располагаются по электронным слоям, или энергетическим уровням.
3. Номер периода соответствует числу электронных слоёв в атоме химического элемента.
4. Номер группы соответствует числу электронов на внешнем энергетическом уровне.
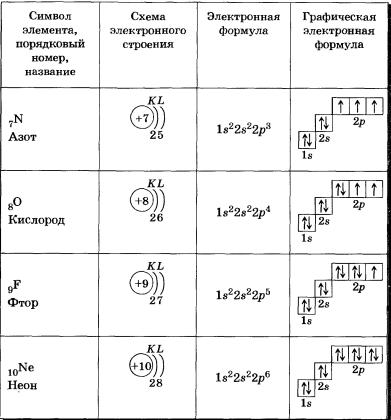
5. Запишите схемы строения электронных оболочек атомов химических элементов с порядковыми номерами с 1-го по 10-й в таблице Д. И. Менделеева, а также калия и кальция.
Часть II
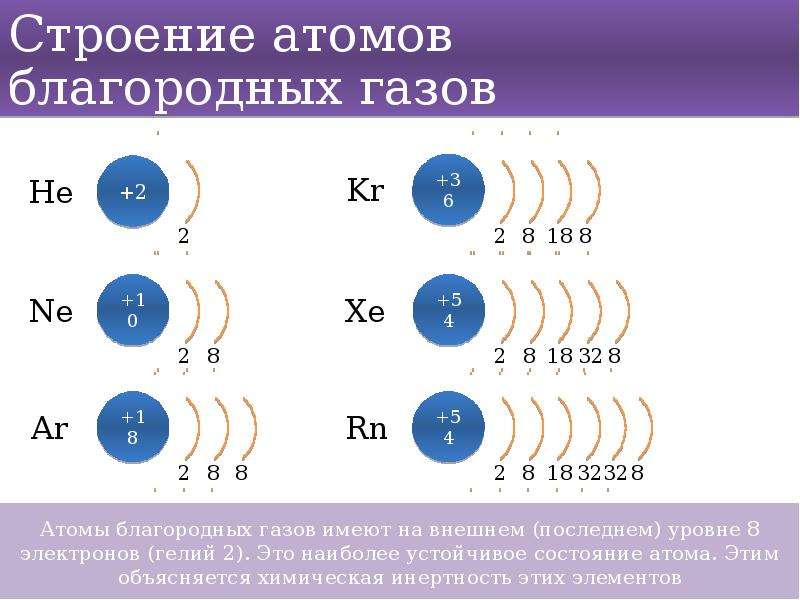
1. В приведённом перечне: мышьяк, теллур, германий, йод, селен, полоний, астат, — число элементов, в атомах которых по шесть электронов на внешнем энергетическом уровне, равно:
3) трём.
2. Атомы химических элементов 4-го периода имеют одинаковое число:
3) энергетических уровней.
3. Установите соответствие между символом химического элемента (в заданном порядке) и числом электронов на внешнем энергетическом уровне его атома. Из букв, соответствующих правильным ответам, вы составите название установки, которая позволит человечеству ещё глубже познать строение атома: коллайдер.
4. Установите соответствие между символом химического элемента (в заданном порядке) и числом энергетических уровней в электронной оболочке атома. Из букв, соответствующих правильным ответам, вы составите название частиц, из которых, в свою очередь, состоят протоны и нейтроны: кварки.
5. Верны ли следующие суждения?
А. Число электронов в электронной оболочке атома Cl равно 7.
Б. Число электронов на внешнем энергетическом уровне атома Br равно 35.

4) Оба суждения неверны.
6. Вычеркните «лишний» химический элемент из ряда
P, Be, S, N, Ne, Ca, H
По признаку завершённости внешнего электронного слоя атома.
7. Предложите алгоритм составления электронной схемы атома химического элемента.
1. Определить общее число электронов на оболочке по порядковому номеру;
2. Определить число энергетических уровней по номеру периода;
3. Определить число внешних электронов по номеру группы;
4. Рассчитать число электронов на предпоследнем уровне, предварительно указав число электронов на всех уровнях.
8. Сравните строение электронных оболочек атомов Ca и Mg.
1) сходство: на внешнем уровне есть одинаковое число электронов, равное 2
кальций 2е8е8е2е, магний 2е8е2е.
Тема 7 Электронное строение сложных атомов
%PDF-1.5
%
1 0 obj
>
/Metadata 2 0 R
/Outlines 3 0 R
/PageLayout /OneColumn
/Pages 4 0 R
/StructTreeRoot 5 0 R
/Type /Catalog
>>
endobj
6 0 obj /Comments ()
/Company ()
/CreationDate (D:20151006103331+03’00’)
/Creator
/Keywords ()
/ModDate (D:20151006103338+03’00’)
/Producer (Adobe PDF Library 10. 0)
/SourceModified (D:20151006073324)
/Subject ()
/Title
>>
endobj
2 0 obj
>
stream
2015-10-06T10:33:38+03:002015-10-06T10:33:31+03:002015-10-06T10:33:38+03:00Acrobat PDFMaker 10.1 для Worduuid:4350221a-2d21-4d56-afcf-2257e9808a0auuid:e5e6745a-0d7f-431e-88eb-05d7f6b1170b
0)
/SourceModified (D:20151006073324)
/Subject ()
/Title
>>
endobj
2 0 obj
>
stream
2015-10-06T10:33:38+03:002015-10-06T10:33:31+03:002015-10-06T10:33:38+03:00Acrobat PDFMaker 10.1 для Worduuid:4350221a-2d21-4d56-afcf-2257e9808a0auuid:e5e6745a-0d7f-431e-88eb-05d7f6b1170b
`vfǘܲKdwmcSǚ!k08lۺk@3,lΨn7?،tOX2?㖘 gɈB_A{wyIBFsWn;1[
Строение атома реферат по химии
МОСКОВСКИЙ ГОСУДАРСТВЕННЫЙ ИНСТИТУТ МЕЖДУНАРОДНЫХ ОТНОШЕНИЙ (УНИВЕРСИТЕТ) МИД РФ РЕФЕРАТ на тему “СТРОЕНИЕ АТОМА И АТОМНОГО ЯДРА” студента 12-ой ак. группы 2-ого курса фак-та МИ Козловского А.А. Научный руководитель: проф. Иванов-Шиц А.К. Москва — 1997 СОДЕРЖАНИЕ: 1. Зарождение теории строения вещества 2 2. Атомистическая теория Дальтона 4 3. Катодные лучи и электроны 6 4. Ядерная модель строения атомов 9 5. Состав атомных ядер 11 6. Изотопы 14 7. Электронные оболочки атомов. Теория Бора 17 8. Квантовая (волновая) механика. Характеристика поведения электронов в атомах 22 Список использованной литературы 25 сведения о том, как химические вещества реагируют друг с другом, и разрабатывались более количественные методы изучения химических реакций. Это подготовило почву для новых, более содержательных формулировок в рамках атомистической теории. 2. Атомистическая теория Дальтона Джон Дальтон (1766 — 1844) большую часть своей жизни преподавал в школе и колледже в Манчестере. Возможно потому, что сам Дальтон не был химиком, он подошел к ее проблемам с иных позиций, чем химики его времени. Его атомистическая теория, опубликованная в период 1803-1807 гг.
группы 2-ого курса фак-та МИ Козловского А.А. Научный руководитель: проф. Иванов-Шиц А.К. Москва — 1997 СОДЕРЖАНИЕ: 1. Зарождение теории строения вещества 2 2. Атомистическая теория Дальтона 4 3. Катодные лучи и электроны 6 4. Ядерная модель строения атомов 9 5. Состав атомных ядер 11 6. Изотопы 14 7. Электронные оболочки атомов. Теория Бора 17 8. Квантовая (волновая) механика. Характеристика поведения электронов в атомах 22 Список использованной литературы 25 сведения о том, как химические вещества реагируют друг с другом, и разрабатывались более количественные методы изучения химических реакций. Это подготовило почву для новых, более содержательных формулировок в рамках атомистической теории. 2. Атомистическая теория Дальтона Джон Дальтон (1766 — 1844) большую часть своей жизни преподавал в школе и колледже в Манчестере. Возможно потому, что сам Дальтон не был химиком, он подошел к ее проблемам с иных позиций, чем химики его времени. Его атомистическая теория, опубликованная в период 1803-1807 гг.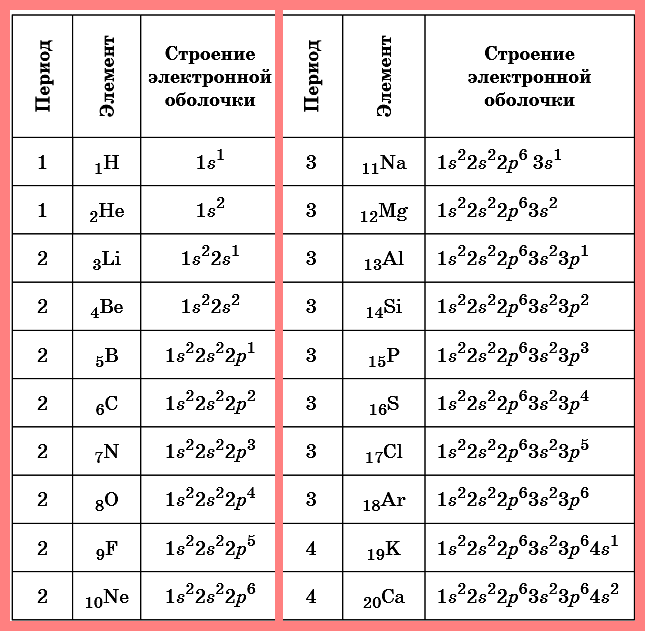 , прочно основывалась на экспериментальных наблюдениях. Она оказалась столь успешной, что с этого времени заняла господствующее положение в науке и почти не потребовала дальнейшего пересмотра. Основные постулаты теории Дальтона заключались в следующем: Каждый элемент состоит из чрезвычайно мелких частиц, называемых атомами. 2. Все атомы одного элемента одинаковы. 3. Атомы различных элементов обладают разными свойствами, в том числе имеют разные массы. 4. Атомы одного элемента не превращаются в атомы других элементов в результате химических реакций; атомы не создаются и не разрушаются в химических реакциях. 5. Соединения образуются в результате комбинации атомов двух или нескольких элементов. 6. В данном соединении относительные количества атомов разных сортов и сорта этих атомов всегда постоянны. Теория Дальтона позволяет мысленно нарисовать картину строения материи. Мы представляем себе элемент состоящим из мельчайших частиц, называемых атомами. Атомы являются основными структурными единицами материи, это мельчайшие частицы элемента, которые могут соединяться с другими элементами.
, прочно основывалась на экспериментальных наблюдениях. Она оказалась столь успешной, что с этого времени заняла господствующее положение в науке и почти не потребовала дальнейшего пересмотра. Основные постулаты теории Дальтона заключались в следующем: Каждый элемент состоит из чрезвычайно мелких частиц, называемых атомами. 2. Все атомы одного элемента одинаковы. 3. Атомы различных элементов обладают разными свойствами, в том числе имеют разные массы. 4. Атомы одного элемента не превращаются в атомы других элементов в результате химических реакций; атомы не создаются и не разрушаются в химических реакциях. 5. Соединения образуются в результате комбинации атомов двух или нескольких элементов. 6. В данном соединении относительные количества атомов разных сортов и сорта этих атомов всегда постоянны. Теория Дальтона позволяет мысленно нарисовать картину строения материи. Мы представляем себе элемент состоящим из мельчайших частиц, называемых атомами. Атомы являются основными структурными единицами материи, это мельчайшие частицы элемента, которые могут соединяться с другими элементами.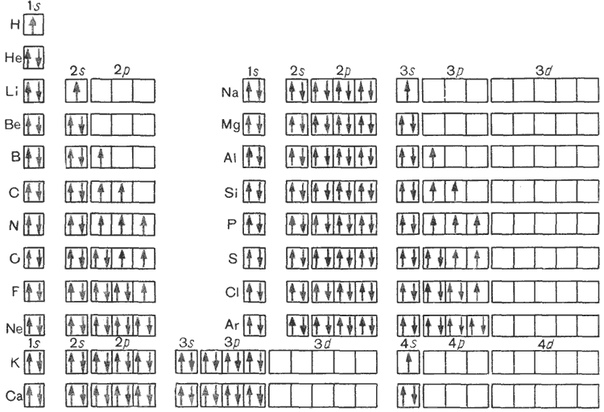 Соединения состоят из атомов двух или нескольких элементов, образующих определенные сочетания друг с другом. 3. Катодные лучи и электроны До конца XIX века в химии господствовало метафизическое убеждение, что атом есть наименьшая частица простого вещества, последний предел делимости материи. Дальтон и его современники рассматривали атом как неделимый объект. Считалось, что при всех химических превращениях разрушаются и вновь создаются только молекулы, атомы же остаются неизменными и не могут дробиться на более мелкие части. Но все эти предположения в то время еще не могли быть подтверждены какими-либо экспериментальными данными. Лишь в конце XIX века были сделаны открытия, показавшие сложность строения атома и возможность превращения при известных условиях одних атомов в другие. На основе этих открытий начало быстро развиваться учение о строении атома. Первые указания на сложную структуру атомов были получены при изучении катодных (исходящих от отрицательно заряженного электрода, или катода) лучей, возникающих при электрическом разряде в сильно разреженных газах.
Соединения состоят из атомов двух или нескольких элементов, образующих определенные сочетания друг с другом. 3. Катодные лучи и электроны До конца XIX века в химии господствовало метафизическое убеждение, что атом есть наименьшая частица простого вещества, последний предел делимости материи. Дальтон и его современники рассматривали атом как неделимый объект. Считалось, что при всех химических превращениях разрушаются и вновь создаются только молекулы, атомы же остаются неизменными и не могут дробиться на более мелкие части. Но все эти предположения в то время еще не могли быть подтверждены какими-либо экспериментальными данными. Лишь в конце XIX века были сделаны открытия, показавшие сложность строения атома и возможность превращения при известных условиях одних атомов в другие. На основе этих открытий начало быстро развиваться учение о строении атома. Первые указания на сложную структуру атомов были получены при изучении катодных (исходящих от отрицательно заряженного электрода, или катода) лучей, возникающих при электрическом разряде в сильно разреженных газах. Для наблюдения этих лучей из стеклянной трубки, в которую впаяны два металлических электрода, выкачивается по возможности весь воздух и затем пропускается сквозь нее ток высокого напряжения (порядка 1000 вольт). При таких условиях от катода трубки перпендикулярно к его поверхности распространяются «невидимые» катодные лучи, вызывающие яркое зеленое свечение в том месте, электронов и были определены величина заряда и масса электрона. Факт выделения электронов самыми разнообразными веществами приводил к выводу, что электроны входят в состав всех атомов. Но атом в целом электрически нейтрален, следовательно, он должен содержать в себе еще другую составную часть, заряженную положительно, причем ее заряд должен уравновешивать сумму отрицательных зарядов электронов. Эта положительно заряженная часть атома была открыта в 1911 г. Эрнестом Резерфордом (1871-1937). Резерфорд предложил следующую схему строения атома. В центре атома находится положительно заряженное ядро, вокруг которого по разным орбитам вращаются электроны.
Для наблюдения этих лучей из стеклянной трубки, в которую впаяны два металлических электрода, выкачивается по возможности весь воздух и затем пропускается сквозь нее ток высокого напряжения (порядка 1000 вольт). При таких условиях от катода трубки перпендикулярно к его поверхности распространяются «невидимые» катодные лучи, вызывающие яркое зеленое свечение в том месте, электронов и были определены величина заряда и масса электрона. Факт выделения электронов самыми разнообразными веществами приводил к выводу, что электроны входят в состав всех атомов. Но атом в целом электрически нейтрален, следовательно, он должен содержать в себе еще другую составную часть, заряженную положительно, причем ее заряд должен уравновешивать сумму отрицательных зарядов электронов. Эта положительно заряженная часть атома была открыта в 1911 г. Эрнестом Резерфордом (1871-1937). Резерфорд предложил следующую схему строения атома. В центре атома находится положительно заряженное ядро, вокруг которого по разным орбитам вращаются электроны. Возникающая при их вращении центробежная сила уравновешивается притяжением между ядром и электронами, вследствие чего они остаются на определенных расстояниях от ядра. Суммарный отрицательный заряд электронов численно равен положительному заряду ядра, так что атом в целом электронейтрален. Так как масса электронов ничтожно мала, то почти вся масса атома сосредоточена в его ядре. Наоборот, размер ядер чрезвычайно мал даже по сравнению с размером самих атомов: диаметр атома — величина порядка 10 см, а диаметр ядра — порядка 10 — 10 см. Отсюда ясно, что на долю ядра и электронов, число которых, как увидим дальше, сравнительно невелико, приходится лишь ничтожная часть всего пространства, занятого атомной системой. 5. Состав атомных ядер Таким образом, открытия Резерфорда положили начало ядерной теории атома. Со времен Резерфорда физики узнали еще очень многие подробности о строении атомного ядра. Самым легким атомом является атом водорода (Н). Поскольку почти вся масса атома сосредоточена в ядре, естественно было бы предположить, что ядро атома водорода представляет собой элементарную частицу положительного электричества, которая была названа протоном от греческого слова “протос”, что означает “первый”.
Возникающая при их вращении центробежная сила уравновешивается притяжением между ядром и электронами, вследствие чего они остаются на определенных расстояниях от ядра. Суммарный отрицательный заряд электронов численно равен положительному заряду ядра, так что атом в целом электронейтрален. Так как масса электронов ничтожно мала, то почти вся масса атома сосредоточена в его ядре. Наоборот, размер ядер чрезвычайно мал даже по сравнению с размером самих атомов: диаметр атома — величина порядка 10 см, а диаметр ядра — порядка 10 — 10 см. Отсюда ясно, что на долю ядра и электронов, число которых, как увидим дальше, сравнительно невелико, приходится лишь ничтожная часть всего пространства, занятого атомной системой. 5. Состав атомных ядер Таким образом, открытия Резерфорда положили начало ядерной теории атома. Со времен Резерфорда физики узнали еще очень многие подробности о строении атомного ядра. Самым легким атомом является атом водорода (Н). Поскольку почти вся масса атома сосредоточена в ядре, естественно было бы предположить, что ядро атома водорода представляет собой элементарную частицу положительного электричества, которая была названа протоном от греческого слова “протос”, что означает “первый”. Таким образом, протон обладает массой, практически равной массе атома водорода (точно 1,00728 углеродных единиц) и электрическим зарядом, равным +1 (если за единицу отрицательного электричества принять заряд электрона, равный -1,602*10 Кл). Атомы других, более тяжелых элементов содержат ядра, обладающие большим зарядом и, очевидно, большей массой. Измерения заряда ядер атомов показали, что заряд ядра атома в указанных условных единицах численно равен атомному, или порядковому, номеру элемента. Однако невозможно было допустить, так как последние, будучи одноименно заряженными, неизбежно отталкивались бы друг от друга и, следовательно, такие ядра оказались бы неустойчивыми. К тому же масса атомных ядер оказалась больше суммарной массы протонов, обуславливающих заряд ядер атомов соответствующих элементов, в два раза и более. Тогда было сделано предположение, что ядра атомов содержат протоны в числе, превышающем атомный номер элемента, а создающийся таким образом четверти существующих в природе атомов хлора имеют массу 35, а одна четверть — 37.
Таким образом, протон обладает массой, практически равной массе атома водорода (точно 1,00728 углеродных единиц) и электрическим зарядом, равным +1 (если за единицу отрицательного электричества принять заряд электрона, равный -1,602*10 Кл). Атомы других, более тяжелых элементов содержат ядра, обладающие большим зарядом и, очевидно, большей массой. Измерения заряда ядер атомов показали, что заряд ядра атома в указанных условных единицах численно равен атомному, или порядковому, номеру элемента. Однако невозможно было допустить, так как последние, будучи одноименно заряженными, неизбежно отталкивались бы друг от друга и, следовательно, такие ядра оказались бы неустойчивыми. К тому же масса атомных ядер оказалась больше суммарной массы протонов, обуславливающих заряд ядер атомов соответствующих элементов, в два раза и более. Тогда было сделано предположение, что ядра атомов содержат протоны в числе, превышающем атомный номер элемента, а создающийся таким образом четверти существующих в природе атомов хлора имеют массу 35, а одна четверть — 37. Таким образом, существующие в природе элементы состоят из смеси атомов, имеющих разные массы, но, очевидно, одинаковые химические свойства, т. е. существуют разновидности атомов одного элемента с разными и притом целочисленными массами. Ф. Астону удалось разделить такие смеси на составные части, которые были названы изотопами (от греческих слов “изос” и “топос”, что означает “одинаковый” и “место” (здесь имеется в виду, что разные изотопы одного элемента занимают одно место в периодической системе)). С точки зрения протонно-нейтронной теории, изотопами называются разновидности элементов, ядра атомов которых содержат различное число нейтронов, но одинаковое число протонов. Химическая природа элемента обусловлена числом протонов в атомном ядре, которому равно и число электронов в оболочке атома. Изменение же числа нейтронов (при неизменном числе протонов) не сказывается на химических свойствах атома. Все это дает возможность сформулировать понятие химического элемента как вида атомов, характеризующихся определенным зарядом ядра.
Таким образом, существующие в природе элементы состоят из смеси атомов, имеющих разные массы, но, очевидно, одинаковые химические свойства, т. е. существуют разновидности атомов одного элемента с разными и притом целочисленными массами. Ф. Астону удалось разделить такие смеси на составные части, которые были названы изотопами (от греческих слов “изос” и “топос”, что означает “одинаковый” и “место” (здесь имеется в виду, что разные изотопы одного элемента занимают одно место в периодической системе)). С точки зрения протонно-нейтронной теории, изотопами называются разновидности элементов, ядра атомов которых содержат различное число нейтронов, но одинаковое число протонов. Химическая природа элемента обусловлена числом протонов в атомном ядре, которому равно и число электронов в оболочке атома. Изменение же числа нейтронов (при неизменном числе протонов) не сказывается на химических свойствах атома. Все это дает возможность сформулировать понятие химического элемента как вида атомов, характеризующихся определенным зарядом ядра. Среди изотопов различных элементов были найдены такие, которые содержат в ядре при разном числе протонов одинаковое общее число нуклонов, то есть атомы которых обладают одинаковой массой. Такие изотопы были названы изобарами (от греческого слова “барос”, что означает “вес”). Различная химическая природа изобаров убедительно подтверждает то, что природа элемента обуславливается не массой его атома. Для различных изотопов применяются названия и символы самих элементов с указанием массового числа, которое следует за названием элемента или обозначается в виде индекса вверху слева от символа, например : хлор — 35 или Cl. Различные изотопы отличаются друг от друга устойчивостью. 26 элементов имеют лишь по одному устойчивому изотопу — такие элементы называются моноизотопными (они характеризуются преимущественно нечетными атомными номерами), и атомные массы их приблизительно равны целым числам. У 55 элементов имеется по несколько устойчивых изотопов — они называются полиизотопными (большое число изотопов характерно преимущественно для элементов с четными номерами).
Среди изотопов различных элементов были найдены такие, которые содержат в ядре при разном числе протонов одинаковое общее число нуклонов, то есть атомы которых обладают одинаковой массой. Такие изотопы были названы изобарами (от греческого слова “барос”, что означает “вес”). Различная химическая природа изобаров убедительно подтверждает то, что природа элемента обуславливается не массой его атома. Для различных изотопов применяются названия и символы самих элементов с указанием массового числа, которое следует за названием элемента или обозначается в виде индекса вверху слева от символа, например : хлор — 35 или Cl. Различные изотопы отличаются друг от друга устойчивостью. 26 элементов имеют лишь по одному устойчивому изотопу — такие элементы называются моноизотопными (они характеризуются преимущественно нечетными атомными номерами), и атомные массы их приблизительно равны целым числам. У 55 элементов имеется по несколько устойчивых изотопов — они называются полиизотопными (большое число изотопов характерно преимущественно для элементов с четными номерами). У остальных элементов известны только неустойчивые, радиоактивные изотопы. Это все тяжелые элементы, начиная с элемента №84 (полоний), а из относительно легких — №43 (технеций) и №61 (прометий). Однако радиоактивные изотопы некоторых элементов относительно устойчивы (характеризуются большим периодом полураспада), и поэтому эти элементы, например торий, уран, встречаются в природе. В большинстве же радиоактивные изотопы получают искусственно, в том числе и многочисленные радиоактивные изотопы устойчивых элементов. 7. Электронные оболочки атомов. Теория Бора. По теории Резерфорда, каждый электрон вращается вокруг ядра, причем сила притяжения ядра уравновешивается центробежной силой, возникающей при вращении электрона. Вращение электрона совершенно аналогично его быстрым колебаниям и должно вызвать испускание электромагнитных волн. Поэтому можно предположить, что вращающийся электрон излучает свет определенной длины волны, зависящий от частоты обращения электрона по орбите. Но, излучая свет, электрон теряет часть своей энергии, вследствие чего нарушается равновесие между ним и ядром.
У остальных элементов известны только неустойчивые, радиоактивные изотопы. Это все тяжелые элементы, начиная с элемента №84 (полоний), а из относительно легких — №43 (технеций) и №61 (прометий). Однако радиоактивные изотопы некоторых элементов относительно устойчивы (характеризуются большим периодом полураспада), и поэтому эти элементы, например торий, уран, встречаются в природе. В большинстве же радиоактивные изотопы получают искусственно, в том числе и многочисленные радиоактивные изотопы устойчивых элементов. 7. Электронные оболочки атомов. Теория Бора. По теории Резерфорда, каждый электрон вращается вокруг ядра, причем сила притяжения ядра уравновешивается центробежной силой, возникающей при вращении электрона. Вращение электрона совершенно аналогично его быстрым колебаниям и должно вызвать испускание электромагнитных волн. Поэтому можно предположить, что вращающийся электрон излучает свет определенной длины волны, зависящий от частоты обращения электрона по орбите. Но, излучая свет, электрон теряет часть своей энергии, вследствие чего нарушается равновесие между ним и ядром. Для восстановления равновесия электрон должен постепенно передвигаться ближе к ядру, причем так же постепенно будет изменяться частота обращения электрона и характер испускаемого им света. В конце концов, исчерпав всю энергию, электрон должен квантов. Эти орбиты получили название устойчивых, стационарных или квантовых орбит. Когда электрон движется по одной из возможных для него устойчивых орбит, то он не излучает электромагнитной энергии. Переход электрона с удаленной орбиты на более близкую сопровождается потерей энергии. Потерянная атомом при каждом переходе энергия превращается в один квант лучистой энергии. Частота излучаемого при этом света определяется радиусами тех двух орбит, между которыми совершается переход электрона. Обозначив запас энергии атома при положении электрона на более удаленной от ядра орбите через Е F 0E D, а на более близкой через Е F 0E A и разделив потерянную атомом энергию Е F 0E D — Е F 0E A на постоянную Планка, получим искомую частоту: = (Е F 0E D — Е F 0E A ) / h Чем больше расстояние от орбиты, на которой находится электрон, до той, на которую он переходит, тем больше частота излучения.
Для восстановления равновесия электрон должен постепенно передвигаться ближе к ядру, причем так же постепенно будет изменяться частота обращения электрона и характер испускаемого им света. В конце концов, исчерпав всю энергию, электрон должен квантов. Эти орбиты получили название устойчивых, стационарных или квантовых орбит. Когда электрон движется по одной из возможных для него устойчивых орбит, то он не излучает электромагнитной энергии. Переход электрона с удаленной орбиты на более близкую сопровождается потерей энергии. Потерянная атомом при каждом переходе энергия превращается в один квант лучистой энергии. Частота излучаемого при этом света определяется радиусами тех двух орбит, между которыми совершается переход электрона. Обозначив запас энергии атома при положении электрона на более удаленной от ядра орбите через Е F 0E D, а на более близкой через Е F 0E A и разделив потерянную атомом энергию Е F 0E D — Е F 0E A на постоянную Планка, получим искомую частоту: = (Е F 0E D — Е F 0E A ) / h Чем больше расстояние от орбиты, на которой находится электрон, до той, на которую он переходит, тем больше частота излучения. Простейшим из атомов является атом водорода, вокруг ядра которого вращается только один электрон. Исходя из приведенных постулатов, Бор рассчитал радиусы возможных орбит для этого электрона и нашел, что они относятся, как квадраты натуральных чисел: 1 : 2 : 3 : …: n . Величина n получила название главного квантового числа. В дальнейшем теория Бора была распространена и на атомную структуру других элементов, хотя это было связано с некоторыми трудностями из-за ее новизны. Она позволила разрешить очень важный вопрос о расположении электронов в атомах различных элементов и установить зависимость свойств элементов от строения электронных оболочек их атомов. В настоящее время разработаны схемы строения атомов всех химических элементов. Однако надо иметь в виду, что все эти схемы — это лишь более или менее достоверная гипотеза, позволяющая объяснить многие физические и химические свойства элементов. Как было уже сказано раньше, число электронов, вращающихся вокруг ядра атома, соответствует порядковому номеру элемента в периодической системе.
Простейшим из атомов является атом водорода, вокруг ядра которого вращается только один электрон. Исходя из приведенных постулатов, Бор рассчитал радиусы возможных орбит для этого электрона и нашел, что они относятся, как квадраты натуральных чисел: 1 : 2 : 3 : …: n . Величина n получила название главного квантового числа. В дальнейшем теория Бора была распространена и на атомную структуру других элементов, хотя это было связано с некоторыми трудностями из-за ее новизны. Она позволила разрешить очень важный вопрос о расположении электронов в атомах различных элементов и установить зависимость свойств элементов от строения электронных оболочек их атомов. В настоящее время разработаны схемы строения атомов всех химических элементов. Однако надо иметь в виду, что все эти схемы — это лишь более или менее достоверная гипотеза, позволяющая объяснить многие физические и химические свойства элементов. Как было уже сказано раньше, число электронов, вращающихся вокруг ядра атома, соответствует порядковому номеру элемента в периодической системе. Электроны расположены по слоям, т.е. каждому слою принадлежит определенное заполняющее или как бы насыщающее его число электронов. Электроны одного и того же слоя характеризуются почти одинаковым запасом энергии, т.е. находятся примерно на одинаковом энергетическом уровне. Вся оболочка атома распадается на несколько энергетических уровней. Электроны каждого следующего слоя находятся на более высоком энергетическом уровне, чем электроны предыдущего слоя. Наибольшее число электронов N, имеющих возможность находиться на данном энергетическом уровне, равно удвоенному квадрату номера слоя: N=2n где n — номер слоя. Таким образом на 1-2, на 2-8, на 3-18 и т.д. Кроме того, установлено, что число электронов в наружном слое для всех элементов, кроме палладия, не превышает восьми, а в предпоследнем — восемнадцати. Электроны наружного слоя, как наиболее удаленные от ядра и, следовательно, наименее прочно связанные с ядром, могут отрываться от атома и присоединяться к другим атомам, входя в состав наружного слоя последних.
Электроны расположены по слоям, т.е. каждому слою принадлежит определенное заполняющее или как бы насыщающее его число электронов. Электроны одного и того же слоя характеризуются почти одинаковым запасом энергии, т.е. находятся примерно на одинаковом энергетическом уровне. Вся оболочка атома распадается на несколько энергетических уровней. Электроны каждого следующего слоя находятся на более высоком энергетическом уровне, чем электроны предыдущего слоя. Наибольшее число электронов N, имеющих возможность находиться на данном энергетическом уровне, равно удвоенному квадрату номера слоя: N=2n где n — номер слоя. Таким образом на 1-2, на 2-8, на 3-18 и т.д. Кроме того, установлено, что число электронов в наружном слое для всех элементов, кроме палладия, не превышает восьми, а в предпоследнем — восемнадцати. Электроны наружного слоя, как наиболее удаленные от ядра и, следовательно, наименее прочно связанные с ядром, могут отрываться от атома и присоединяться к другим атомам, входя в состав наружного слоя последних. Атомы, лишившиеся одного или нескольких электронов, становятся положительно заряженными, так как заряд ядра атома превышает сумму зарядов оставшихся электронов. Наоборот, атомы, присоединившие электроны становятся отрицательно заряженными. Образующиеся таким путем заряженные частицы, качественно отличные от соответствующих атомов, называются ионами. Многие ионы в свою очередь могут терять или присоединять электроны, превращаясь при орбиталей. Энергетические подуровни обозначаются следующим образом: 0 1 2 3 s p d f 3) Магнитное квантовое число m определяет положение плоскости орбиты электрона в пространстве или, в соответствии с представлениями волновой механики, то направление, в котором вытянуто электронное облако. Может принимать целые значения от -l до l (включая 0), всего (2*l+1) значений. Число значений m определяет число орбиталей данного (s-, p-, d-, f- типа). 4) Спиновое квантовое число s определяет направление вращения электрона, может принимать только два значения: 1/2 и -1/2.
Атомы, лишившиеся одного или нескольких электронов, становятся положительно заряженными, так как заряд ядра атома превышает сумму зарядов оставшихся электронов. Наоборот, атомы, присоединившие электроны становятся отрицательно заряженными. Образующиеся таким путем заряженные частицы, качественно отличные от соответствующих атомов, называются ионами. Многие ионы в свою очередь могут терять или присоединять электроны, превращаясь при орбиталей. Энергетические подуровни обозначаются следующим образом: 0 1 2 3 s p d f 3) Магнитное квантовое число m определяет положение плоскости орбиты электрона в пространстве или, в соответствии с представлениями волновой механики, то направление, в котором вытянуто электронное облако. Может принимать целые значения от -l до l (включая 0), всего (2*l+1) значений. Число значений m определяет число орбиталей данного (s-, p-, d-, f- типа). 4) Спиновое квантовое число s определяет направление вращения электрона, может принимать только два значения: 1/2 и -1/2. Изучению распределения электронов в атомах уделяется большое внимание, так как поведение атомов в химических реакциях в значительной мере зависит от того, насколько прочно их электроны удерживаются на своих орбиталях. СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ: 1. Бердоносов С.С. “Химия” М., 1994. 2. Браун Т., Лемей Г.Ю. “Химия — в центре наук”, часть 1, М., 1983. 3. “Введение в общую химию”. Под редакцией проф. Г. П. Лучинского. M., 1980. 4. Глинка Н.Л. Общая химия Л., 1985. 5. Г. П. Лучинский “Курс химии”. М., 1985.
Изучению распределения электронов в атомах уделяется большое внимание, так как поведение атомов в химических реакциях в значительной мере зависит от того, насколько прочно их электроны удерживаются на своих орбиталях. СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ: 1. Бердоносов С.С. “Химия” М., 1994. 2. Браун Т., Лемей Г.Ю. “Химия — в центре наук”, часть 1, М., 1983. 3. “Введение в общую химию”. Под редакцией проф. Г. П. Лучинского. M., 1980. 4. Глинка Н.Л. Общая химия Л., 1985. 5. Г. П. Лучинский “Курс химии”. М., 1985.
Строение атома. Состав атомных ядер. Изотопы. Химический элемент
С помощью данного урока вы узнаете, из чего состоит атом, а также познакомитесь с историей появления и развития представлений о сложном строении атома. На уроке рассматриваются результаты некоторых физических опытов, которые позволили установить состав и строение атома.
I. Атом: термин и эволюция понятия
Идея о том, что все вещества состоят из мелких, невидимых частиц возникла у людей еще до нашей эры в Древней Индии и Древней Греции. Известный греческий философ Демокрит, будучи одним из первых материалистов, впервые ввел термин «атом» (от греч.atomos- неделимый). Последователь идей Демокрита, Эпикур (341-270 г. до н.э.) впервые высказал предположение об атомном весе.
Известный греческий философ Демокрит, будучи одним из первых материалистов, впервые ввел термин «атом» (от греч.atomos- неделимый). Последователь идей Демокрита, Эпикур (341-270 г. до н.э.) впервые высказал предположение об атомном весе.
Согласно его теории атом — неделимая частица, которая существует вечно. По теории Демокрита:
- все тела состоят из бесчисленного количества сверхмалых, невидимых глазом, неделимых частиц-атомов;
- атомы непрерывно двигаются в пустоте;
- атомы никто не создавал, они были всегда;
- никто не может уничтожить атомы;
- атомы материальны: имеют вес, размеры, форму;
- одни атомы имеют крючочки, другие петельки с помощью которых соединяются друг с другом.
Дальнейшее развитие атомизм, как теория, получил в философии и науке Средних веков и Нового времени. В середине XVII в. французский философ и физик Пьер Гассенди (1592—1655) заново пересказал учение Демокрита и Эпикура, дополнив его новым понятием «молекула» для обозначения различного сочетания атомов друг с другом.
Р. Бойль (1627-1691 г.г.) написал знаменитую книгу «Химик-скептик», в которой доказал нереальность «начал» Аристотеля и ввел представление о химических элементах как о веществах, не поддающихся дальнейшему разложению. Определив задачей химии изучение элементов и их соединений. Р. Бойль поставил ее на научную основу.
Далее атомистическая теория получила свое логическое развитие в работах Ломоносова, Лавуазье, Дальтона и оформилась в атомно-молекулярное учение.
II. Модель Дж. Томсона («сливовый пудинг» или «булочка с изюмом»). Открытие электрона
До 1897 г атом считался мельчайшей неделимой частицей (элементарной). Именно этот год считается датой открытия электрона, первой субатомной частицы. Во второй половине 19 в. многие физики занимались исследованием так называемых «катодных лучей» — лучей, исходящих с поверхности катода при пропускании электрического разряда между катодом и анодом в стеклянной трубке с сильно разреженным газом.
В своих опытах по отклонению катодных лучей в электрических и магнитных полях, Томсон убедительно показал, что эти лучи представляют собой поток заряженных частиц, а самое главное, ему удалось измерить удельный заряд (e/m) этих частиц. (Он оказался примерно в 2000 раз меньше удельного заряда иона водорода, известного из опытов по электролизу.) Томсон сразу же предположил, что электроны входят в состав атомов – откуда еще им было взяться? Дальнейшие работы ученых-физиков подтвердили это предположение. Таким образом, к концу 19 века электрон считался элементарной заряженной частицей, масса которой в 2000 раз меньше массы атома водорода.
После открытия электрона Томпсон предложил модель строения атома, которую обычно называют «сливовый пудинг» (или «пудинг с изюмом») или на русский манер «булочка с изюмом». Согласно Томпсону атом представляет собой положительно заряженную сферу, в которую вкраплены (как изюм в булочке) отрицательно заряженные электроны. Однако, эта модель была опровергнута опытом Резерфорда.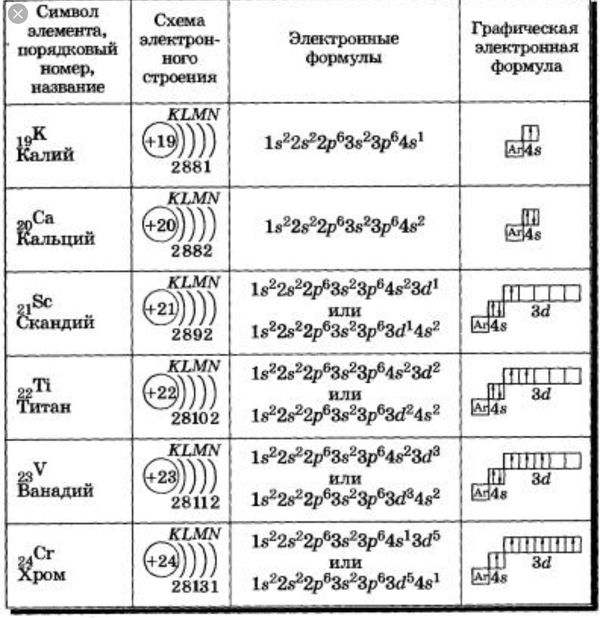
Так появилась одна из первых моделей строения атома, которую предложил английский физик Джозеф Томсон (Рис. 1). В соответствии с этой моделью, атом представляет собой шар, состоящий из положительно заряженного вещества с вкраплениями отрицательно заряженных электронов (наподобие изюма в бисквите).
Рис. 1. Модель строения атома, предложенная Дж. Томсоном
Особенность модели Томсона заключалась в предположении того, что положительный заряд «размыт» внутри атома и не «вылетает» из него, т. к. обладает значительно большей массой по сравнению с электронами.
III. Модель Э. Резерфорда
Следующим удивительным экспериментальным фактом было открытие Беккерелем в 1896 г. явления радиоактивности. Было обнаружено, что атомы некоторых элементов самопроизвольно распадаются с образованием новых атомов, электронов и α-частиц. Также установили, что α-частицы имеют положительный заряд и относительно большую массу.
Также установили, что α-частицы имеют положительный заряд и относительно большую массу.
В 1911 г англ. учёный Э. Резерфорд доказал нa опыте, что в центре атома имеется положительно заряженное ядро.
Например, модель атома азота
С помощью α-частиц Эрнест Резерфорд и его ученики провели эксперимент, результаты которого опровергли модель строения атома Дж. Томсона. Англичанин Эрнест Резерфорд и его ученики поставили следующий эксперимент: направляли быстрый поток α-частиц на тонкую золотую фольгу. Оказалось, что большинство α-частиц проходит через фольгу беспрепятственно, небольшая часть отклоняется на различные углы, а примерно 1 на 10 000 частиц отскакивает в обратном направлении (Рис. 2).
Рис. 2. Схема опыта Э. Резерфорда
Результаты опыта противоречили модели Томсона. Частица с большой массой и положительным зарядом может отскочить назад, если только встретит в качестве препятствия большой положительный заряд, сконцентрированный в одном месте.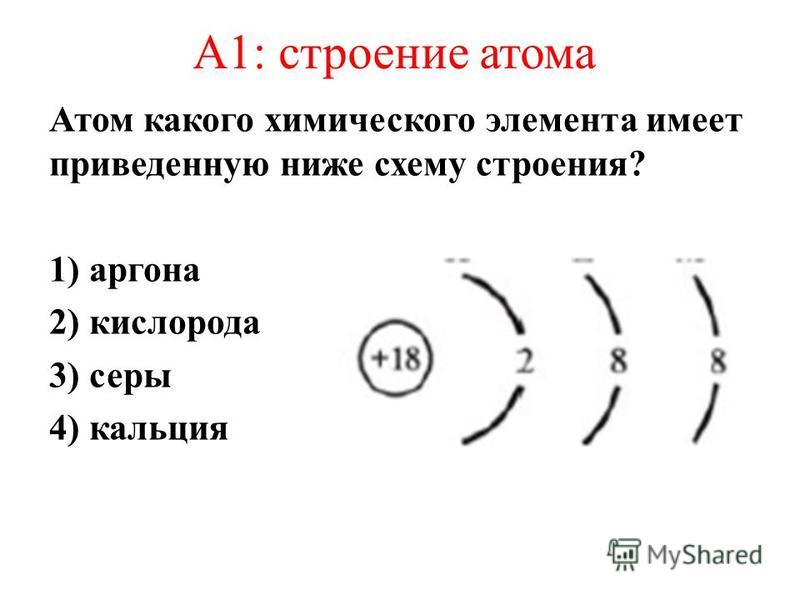
Положительный заряд, сконцентрированный в центре атома, Резерфорд назвал ядром и предложил свою модель строения атома: в центре атома находится положительно заряженное ядро, вокруг которого вращаются отрицательно заряженные электроны (Рис.3). При этом основная масса атома сосредоточена в ядре, масса электронов очень мала.
Суммарный заряд ядра и электронов должен быть равен нулю, т. к. атом в целом электронейтрален.
Модель Резерфорда напоминает Солнечную систему, поэтому ее назвали «планетарной».
Рис. 3. Планетарная модель атома, предложенная Резерфордом
III. Модель Бора (планетарная модель)
В 1913 Нильсом Бором была предложена модель строения атома, известная как «планетарная модель». По Бору электроны вращаются по орбитам расположены на строго определенном удалении от атомного ядра, точно также как планеты Солнечной системы вращаются вокруг солнца (отсюда и название модели).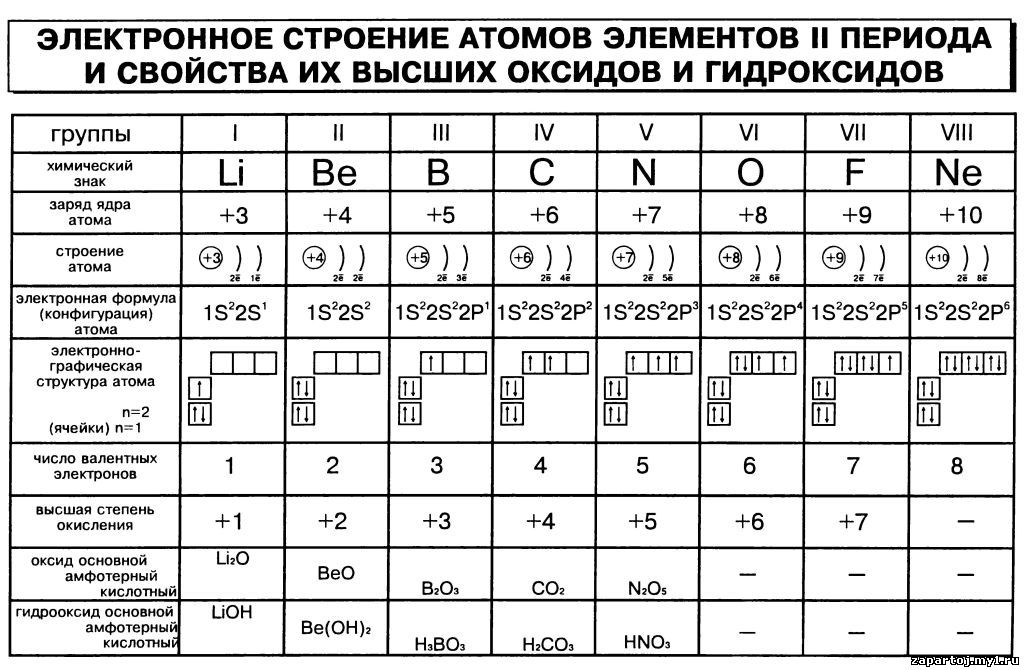 Эти орбиты (сейчас всем известны как энергетические уровни)- стационарные и вне их электрон существовать не может. К сожалению, объяснить это утверждение Бору на тот момент не удалось. Кроме того, предложенная модель Бора противоречила законам физики:
Эти орбиты (сейчас всем известны как энергетические уровни)- стационарные и вне их электрон существовать не может. К сожалению, объяснить это утверждение Бору на тот момент не удалось. Кроме того, предложенная модель Бора противоречила законам физики:
В начале прошлого века на смену планетарной модели строения атома пришла волновая модель, которая разрешила возникшие противоречия и на сегодняшний момент считается общепринятой.
Современное представление о строении атома было бы невозможно без открытия явления радиоактивности, элементарных частиц (электрона, протона и нейтрона). Решающий вклад в установлении строения атома внесли Дальтон, Дж.Дж. Томпсон (или Томсон), Э. Резерфорд, Н. Бор, Э. Шредингер, М. Планк, Люис, Паули.
История развития представлений о строении атома условно изображена на схеме ниже:
IV. Современное строение атома
Атом — электронейтрален, то есть количество положительно заряженных частиц в нем равно количеству отрицательно заряженных частиц.
Долгое время считалось, что протоны и нейтроны являются элементарными (то есть неделимыми) частицами. Но на сегодняшний момент признано, что они имеют сложное строение и состоят из кварков. Электрон же до сих пор считается элементарной частицей. Положительно и нейтрально заряженные частицы (протоны и нейтроны, соответственно) сосредоточены в ядре, чья масса составляет около 99,97% от массы атома. Радиус атома, как правило, составляет несколько ангстрем (10−10 м), радиус ядра в 10 000 раз меньше радиуса атома.
Ядро — самая тяжелая и самая маленькая часть атома.
Заряд ядра равен порядковому номеру химического элемента
Из курса физики вам известно, что вокруг положительного ядра находятся отрицательно заряженные частицы электроны — е— . В электронейтральном атоме число электронов должно быть равно заряду ядра и, следовательно, порядковому номеру элемента.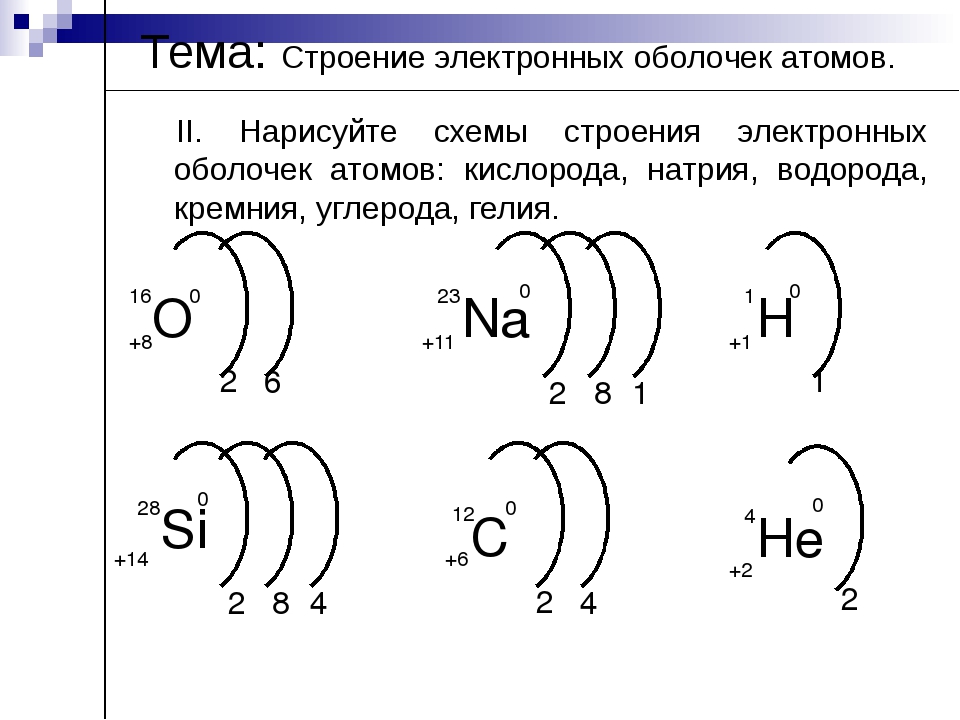 Масса электрона очень мала и принимается равной нулю, таким образом, масса атома сосредоточена в ядре, в котором расположены протоны – p+ и нейтроны – n0.
Масса электрона очень мала и принимается равной нулю, таким образом, масса атома сосредоточена в ядре, в котором расположены протоны – p+ и нейтроны – n0.
|
Заряд ядра атома = Порядковому номеру = Числу протонов = Число электронов Число нейтронов = Атомная масса (Ar) – Порядковый номер |
Например, определите состав атома бора?
Бор
N (порядковый номер) – 5
Ar(B) = 11
e—=5
p+=5
n0= 11 – 5 = 6
Например:
- Изотопы хлора
- Изотопы природного водорода: Протий 11 H, Дейтерий 12Н, Тритий 13Н
- Модели изотопов водорода
Изотопы одного и того же химического элемента имеют разную массу, так как в ядрах содержится разное количество нейтронов.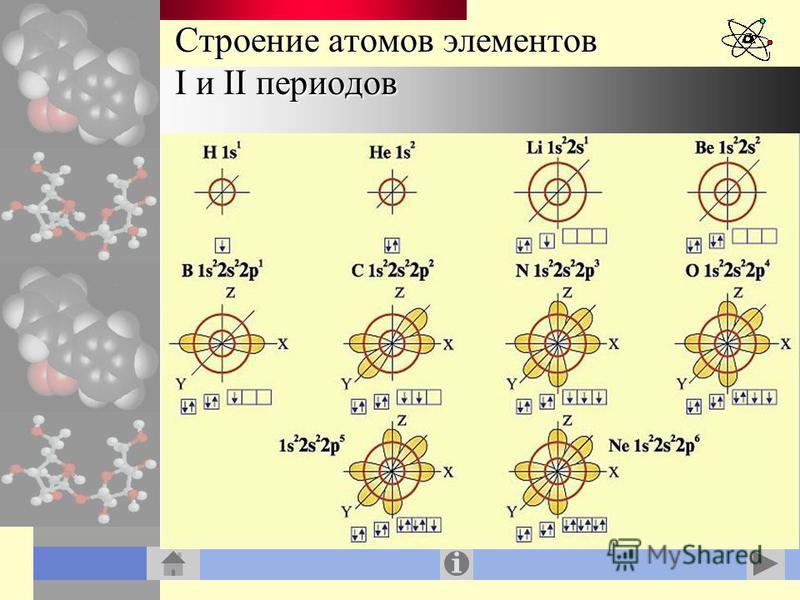 +)=6
+)=6
N(n0) = A — Z = 13 — 6 = 7
Углерод-13 содержит 6 электронов, 6 протонов и 7 нейтронов
V. Химический элемент
Химический элемент – это вид атомов с одинаковым зарядом ядра.
В природе химические элементы существуют в виде смесей изотопов. Изотопный состав одного и того же химического элемента выражают в атомных долях (ωат.), которые указывают какую часть составляет число атомов данного изотопа от общего числа атомов всех изотопов данного элемента, принятого за единицу или 100%.
Например:
ωат (35Сl) = 0,754 или 75,4%
ωат (37Сl) = 0,246 или 24,6%
В таблице Менделеева приведены средние значения относительных атомных масс химических элементов с учётом их изотопного состава. Поэтому Ar , указанные в таблице являются дробными.
Ar средняя= ωат.(1) ∙ Ar(1) + … + ωат.(n) ∙ Ar(n)
Например:
Arсредняя (Cl) = 0,754 ∙ 35 + 0,246 ∙ 37 = 35,453
VI. Задания для закрепления
Задание №1. Определите атомный состав изотопов хлора 35Cl и 37Сl. Почему изотопы хлора имеют разное массовое число?
Задание №2. Определите относительную атомную массу элемента кремния, если известно, что он состоит из трёх изотопов: 28Si (атомная доля 92,3%), 29Si (4,7%), 30Si (3%).
ЦОРы
Видео: “Строение атома”
атомов, молекул и соединений | manoa.hawaii.edu/ExploringOurFluidEarth
Химические структуры
Свойства элементов и соединений определяются их структурой. Простейшей структурной единицей элемента является атом. Атомы очень маленькие. Сто миллионов (100000000) атомов водорода, поставленных рядом, имеют длину всего один сантиметр!
Некоторые элементы имеют одноатомных атомов , что означает, что они состоят из одного ( mon- ) атома ( -атомного ) в их молекулярной форме.Гелий (He, см. Рис. 2.8) является примером одноатомного элемента. Другие элементы содержат два или более атомов в своей молекулярной форме (рис. 2.8). Молекулы водорода (H 2 ), кислорода (O 2 ) и хлора (Cl 2 ), например, содержат по два атома каждая. Другая форма кислорода, озон (O 3 ), состоит из трех атомов, а сера (S 8 ) состоит из восьми атомов. Все элементарные молекулы состоят из атомов одного элемента.
Все элементарные молекулы состоят из атомов одного элемента.
Молекулы соединений содержат атомы двух или более различных элементов.Например, вода (H 2 O) имеет три атома, два атома водорода (H) и один атом кислорода (O). Метан (CH 4 ), обычный парниковый газ, состоит из пяти атомов: одного углерода (C) и четырех атомов водорода (H, см. Рис. 2.9).
Электростатические силы
Электростатические силы удерживают атомы в молекулах. Электростатические силы, удерживающие атомы вместе в молекулах, представляют собой силы того же типа, которые вызывают статическое электричество.Распространенные примеры статического электричества — это когда кто-то получает электрический ток, когда тянется к дверной ручке, или когда у ребенка вздымаются волосы, когда он спускается с пластиковой горки (рис. 2.10).
Деятельность
Определите, как взаимодействует заряженная материя.
Части атомов
Частицы, составляющие атом, называются субатомными частицами ( sub — означает «меньший размер»). Эти частицы —
- протон (p + ), который заряжен положительно (+);
- электрон (е —), который отрицательно (-) заряжен; и
- нейтрон (n 0 ), у которого нет заряда, он нейтрален (0).
Протоны и нейтроны занимают ядро , или центр атома. Электроны существуют в областях, называемых оболочками , вне ядра атома (рис. 2.11).
Электростатические силы удерживают атомы вместе в молекулах — как два атома водорода, удерживаемые вместе в газе h3. Электростатические силы также удерживают электроны и протоны вместе в атоме. Притяжение между отрицательно заряженными электронами и положительно заряженными протонами в атоме придает атому его структуру. Сильная сила удерживает нейтроны и протоны вместе в ядре. Эта сила получила свое название, потому что она достаточно сильна, чтобы преодолеть силу отталкивания положительно заряженных протонов. Количество электронов и протонов в атоме определяет его химические свойства. Химические свойства включают особые способы реакции атомов и молекул, а также энергию, которую они выделяют или используют в этих реакциях.
Сильная сила удерживает нейтроны и протоны вместе в ядре. Эта сила получила свое название, потому что она достаточно сильна, чтобы преодолеть силу отталкивания положительно заряженных протонов. Количество электронов и протонов в атоме определяет его химические свойства. Химические свойства включают особые способы реакции атомов и молекул, а также энергию, которую они выделяют или используют в этих реакциях.
Размер субатомных частиц
Сто миллионов (100 000 000) атомов водорода, поставленных рядом, равняются примерно сантиметру.Протоны и нейтроны имеют примерно одну тысячную (1/1000) диаметра атома водорода. Это означает, что потребуется около ста миллиардов (100000000000) протонов или нейтронов, поставленных рядом, чтобы равняться сантиметру. Электроны составляют примерно одну тысячную (1/1000) диаметра протона или нейтрона. Это означает, что потребуется сто триллионов (10000000000000000) электронов, поставленных бок о бок, чтобы равняться сантиметру!
Нейтральные атомы
Субатомные частицы в атоме определяют свойства атома.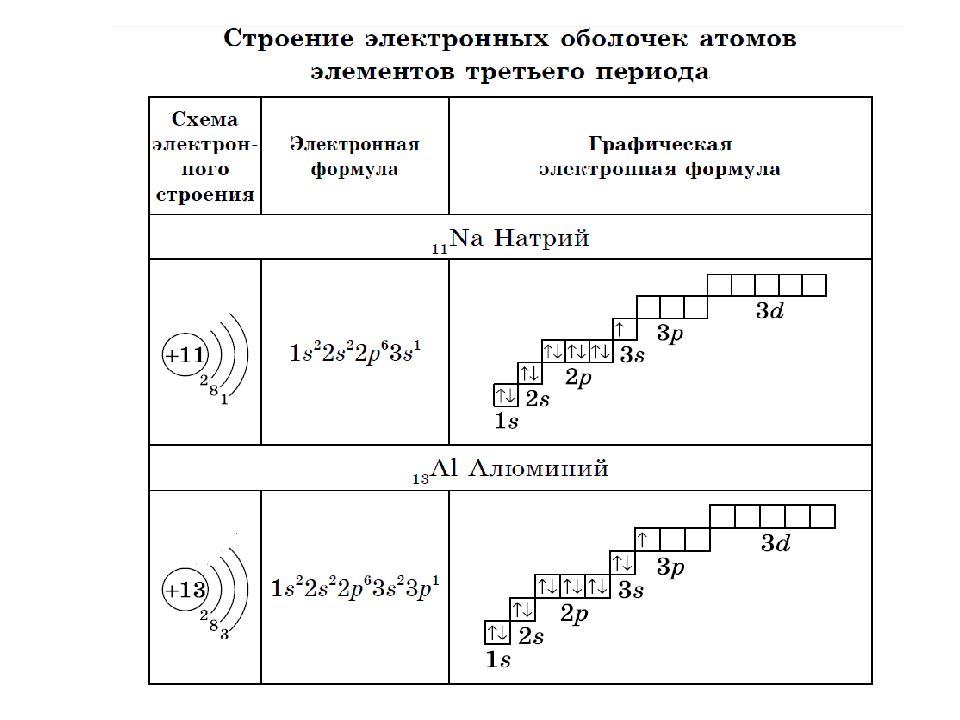 Некоторые атомы в природе существуют как нейтральные или незаряженные атомы. Один незаряженный атом имеет равное количество протонов (+) и электронов (-). Незаряженный атом электрически нейтрален, потому что электроны и протоны имеют противоположные заряды равных размеров. Когда количество протонов и электронов в атоме одинаково, заряды компенсируются или противодействуют друг другу.
Некоторые атомы в природе существуют как нейтральные или незаряженные атомы. Один незаряженный атом имеет равное количество протонов (+) и электронов (-). Незаряженный атом электрически нейтрален, потому что электроны и протоны имеют противоположные заряды равных размеров. Когда количество протонов и электронов в атоме одинаково, заряды компенсируются или противодействуют друг другу.
Протоны и нейтроны
Каждый атом определенного элемента имеет одинаковое количество протонов. Атомный номер равен количеству протонов в элементе.В периодической таблице атомный номер обычно указывается как целое число над символом элемента (см. Рис. 2.13). Например, водород (H) имеет атомный номер один (1). Это означает, что у атома водорода есть один протон. Если атом водорода нейтрален, он также должен иметь один электрон. Атом кислорода (O) имеет атомный номер восемь (8). Это означает, что у нейтрального атома кислорода восемь протонов и восемь электронов. Элемент Actium (Ac) имеет атомный номер 89, то есть у него 89 протонов и 89 электронов в нейтральном атоме.Таблица 2.2 показывает атомный номер, атомный символ, атомную структуру и количество протонов, нейтронов и электронов для первых трех элементов.
Элемент Actium (Ac) имеет атомный номер 89, то есть у него 89 протонов и 89 электронов в нейтральном атоме.Таблица 2.2 показывает атомный номер, атомный символ, атомную структуру и количество протонов, нейтронов и электронов для первых трех элементов.
| Водород | Гелий | Литий | |
| Атомный номер | 1 | 2 | 3 |
| Атомарный символ | H | He | Li |
| Число протонов | 1 | 2 | 3 |
| Число электронов | 1 | 2 | 3 |
| Число нейтронов | 0 | 2 | 4 |
| Атомная структура |
Нейтроны влияют на массу атома и играют роль в стабильности атомов. В отличие от протонов, количество нейтронов в элементах разное. Например, у большинства атомов водорода нет нейтронов, но у некоторых есть один нейтрон, а у некоторых редких атомов водорода есть два нейтрона. У большинства атомов гелия есть два нейтрона, но у некоторых есть три нейтрона.
В отличие от протонов, количество нейтронов в элементах разное. Например, у большинства атомов водорода нет нейтронов, но у некоторых есть один нейтрон, а у некоторых редких атомов водорода есть два нейтрона. У большинства атомов гелия есть два нейтрона, но у некоторых есть три нейтрона.
Периоды, группы и периодическая таблица
Периодическая таблица (рис. 2.12) — широко используемый метод организации элементов, который предоставляет полезную информацию об элементах и их поведении.На рис. 2.12 элементы, выделенные синим цветом, являются металлами, а элементы желтым цветом — неметаллами. На рис. 2.13 запись для водорода показывает расположение атомного номера, символа элемента, имени элемента и атомного веса.
Периодическая таблица Менделеева имеет три характерные особенности. Во-первых, таблица Менделеева выстроена в горизонтальные ряды, которые называются периодами , . Есть семь периодов. В периоде 1 есть два элемента: водород (H) и гелий (He).Второй и третий периоды содержат восемь элементов, четвертый и пятый периоды содержат 18 элементов, а шестой и седьмой периоды содержат 32 элемента.
В периоде 1 есть два элемента: водород (H) и гелий (He).Второй и третий периоды содержат восемь элементов, четвертый и пятый периоды содержат 18 элементов, а шестой и седьмой периоды содержат 32 элемента.
Во-вторых, все элементы перечислены последовательно в соответствии с их атомными номерами. Атомный номер соответствует количеству протонов и находится над символом элемента. Например, на рис. 2.13 атомный номер водорода равен 1, что соответствует H
. В-третьих, периодическая таблица состоит из столбцов элементов, которые реагируют одинаково.Эти столбцы называются группами . Номер группы находится вверху столбца. Группы 1–12 содержат только металлы, группы 13–16 содержат как металлы, так и неметаллы, а группы 17 и 18 содержат только неметаллы. Единственное исключение — водород. Хотя технически это неметалл, водород обладает свойствами как металлов, так и неметаллов, и его часто помещают в группу 1. Две длинные строки в нижней части периодической таблицы являются исключением.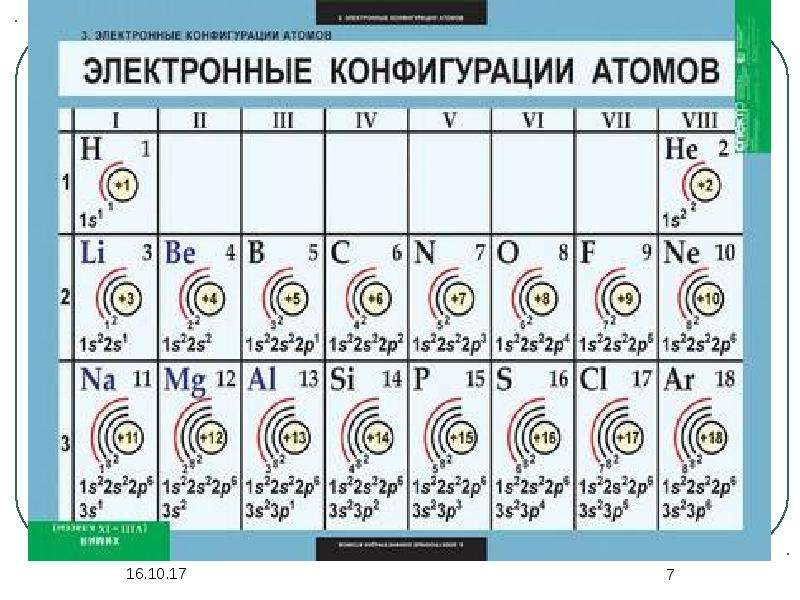 Элементы в каждой из этих строк ведут себя одинаково, поэтому считаются группами.Эти две группы расположены в строках, а не столбцах.
Элементы в каждой из этих строк ведут себя одинаково, поэтому считаются группами.Эти две группы расположены в строках, а не столбцах.
Металлы и неметаллы
Металлы — это элементы, проводящие тепло и электричество. Металлы обычно ковкие, их можно гнуть или формовать без разрушения, а — блестящие, или блестящие. Большинство металлов имеют серебристый цвет (рис. 2.14 A – C), хотя некоторые из них не такие, как медь (Cu, рис. 2.14 D). Большинство металлов твердые при комнатной температуре. Единственным исключением является ртуть (Hg), которая при комнатной температуре является жидкостью (рис.2.14 А). Элементы группы 1, включая литий (Li), натрий (Na, рис. 2.14 B), калий (K, рис. 2.14 C) и рубидий (Rb), являются металлами. Эти металлические элементы Группы 1 имеют аналогичные реакционные свойства. На рис. 2.12 металлы показаны синим цветом.
Неметаллы плохо проводят тепло и электричество; они не блестящие и существуют в природе в виде твердых тел, жидкостей или газов. В твердом состоянии неметаллы имеют тенденцию быть хрупкими, например сера, которая расслаивается, а не изгибается, как металл (рис.2,15 А). Элементы в группе 17, включая фтор (F 2 ), хлор (Cl 2 , рис. 2.15 B), бром (Br 2 , рис. 2.15 C) и йод (I 2 , рис. 2.15 D), все неметаллы. Неметаллы в Группе 17 все двухатомные (два атома) в своей элементной форме и имеют аналогичные реакционные свойства. На рис. 2.12 неметаллы показаны желтым цветом.
В твердом состоянии неметаллы имеют тенденцию быть хрупкими, например сера, которая расслаивается, а не изгибается, как металл (рис.2,15 А). Элементы в группе 17, включая фтор (F 2 ), хлор (Cl 2 , рис. 2.15 B), бром (Br 2 , рис. 2.15 C) и йод (I 2 , рис. 2.15 D), все неметаллы. Неметаллы в Группе 17 все двухатомные (два атома) в своей элементной форме и имеют аналогичные реакционные свойства. На рис. 2.12 неметаллы показаны желтым цветом.
См. Таблицу 2.3, где представлена сводная информация о свойствах металлов и неметаллов.
| Металлы | Неметаллы | |
| Физические свойства | Хороший проводник тепла и электричества | Плохой проводник тепла и электричества |
| Ковкий — можно бить или деформировать без трещин; податливый | Хрупкий | |
| Пластичный — можно перековать в проволоку | Непластичный | |
| Блестящий | Бесцветный, может быть непрозрачным или прозрачным | |
| Твердое вещество при комнатной температуре (кроме Hg и некоторых других металлов, находящихся в жидком состоянии при комнатной температуре или близкой к ней) | Твердое, жидкое или газообразное при комнатной температуре | |
| Химические свойства | Обычно имеют 1-3 валентных электрона | Обычно имеют 4-8 валентных электронов |
| Имеют тенденцию терять валентные электроны | Накапливают электроны |
Другие организационные особенности Периодической таблицы
Есть и другие организационные особенности таблицы Менделеева. Большинство периодов имеют первый элемент периода в группе 1 и последний элемент в группе 18. Исключением является первый период. На рис. 2.12 водород (H) находится в группе 1. Иногда водород (H) помещается в группу 17, выше фтора (F), потому что он имеет свойства, аналогичные неметаллам в этой группе; например, в элементарном состоянии водород существует в виде двухатомного газа h3. Иногда водород помещают в группы 1 и 17.
Большинство периодов имеют первый элемент периода в группе 1 и последний элемент в группе 18. Исключением является первый период. На рис. 2.12 водород (H) находится в группе 1. Иногда водород (H) помещается в группу 17, выше фтора (F), потому что он имеет свойства, аналогичные неметаллам в этой группе; например, в элементарном состоянии водород существует в виде двухатомного газа h3. Иногда водород помещают в группы 1 и 17.
Группы элементов имеют похожие свойства.Свойства некоторых групп настолько уникальны или важны, что группы называются специальными именами. Последняя группа, группа 18, включает гелий (He), неон (Ne), аргон (Ar), криптон (Kr), ксенон (Xe) и радон (Rn). Элементы этой группы называются благородными газами. Благородные газы редко вступают в реакцию с другими элементами. Благородные газы имеют множество применений, например, они используются в неоновых вывесках (рис. 2.16).
Группа 1 часто называется щелочными металлами, группа 2 — щелочноземельными металлами, а группа 17 — галогенами. Две группы, расположенные в нижней части таблицы Менделеева в строках, называются серией редкоземельных элементов лантаноидов (верхняя строка) и серией актинидов (нижняя строка).
Две группы, расположенные в нижней части таблицы Менделеева в строках, называются серией редкоземельных элементов лантаноидов (верхняя строка) и серией актинидов (нижняя строка).
2: Элементы, атомы и периодическая таблица
- Последнее обновление
- Сохранить как PDF
Подобно тому, как в языке есть алфавит, из которого состоят слова, в химии есть алфавит, из которого описывается материя.Однако химический алфавит больше того, который мы используем для написания. Возможно, вы уже догадались, что химический алфавит состоит из химических элементов. Их роль играет центральную роль в химии, поскольку они объединяются, чтобы образовать миллионы и миллионы известных соединений.
- 2.1: Прелюдия к элементам, атомам и периодической таблице
- Самым твердым материалом в человеческом теле является зубная эмаль. Он должен быть твердым, чтобы наши зубы могли служить нам всю жизнь при кусании и жевании; однако, несмотря на свою прочность, зубная эмаль подвержена химическому воздействию.Кислоты, содержащиеся в некоторых продуктах питания или производимые бактериями, которые питаются остатками пищи на наших зубах, способны растворять эмаль. Незащищенный эмалью зуб начнет разрушаться, что приведет к развитию кариеса и других стоматологических проблем.
- 2.2: Элементы
- Вся материя состоит из элементов. Химические элементы обозначаются одно- или двухбуквенным символом.
- 2.3: Атомная теория
- Атомы — это основные строительные блоки всей материи.Современная атомная теория устанавливает представления об атомах и о том, как они составляют материю.
- 2.4: Структура атомов
- Атомы состоят из трех основных субатомных частиц: протонов, нейтронов и электронов. Протоны и нейтроны группируются в ядре атома, а электроны вращаются вокруг ядра.
- 2.5: Ядра атомов
- Элементы можно идентифицировать по их атомному номеру и массовому числу.Изотопы — это атомы одного и того же элемента, имеющие разные массы.
- 2.6: Атомные массы
- Масса атомов в значительной степени зависит от количества протонов и нейтронов в их ядрах.
- 2.7: Расположение электронов
- Электроны организованы в оболочки и подоболочки вокруг ядра атома.
- 2.8: Периодическая таблица
- Химические элементы расположены в диаграмме, называемой периодической таблицей.Некоторые характеристики элементов связаны с их положением в таблице Менделеева.

- 2.E: Элементы, атомы и периодическая таблица (упражнения)
- Это домашние упражнения, сопровождающие главу 2 Ball et al. Текстовая карта «Основы химии ГОБ».
- 2.S: Элементы, атомы и периодическая таблица (сводка)
- Чтобы убедиться, что вы понимаете материал этой главы, вам следует просмотреть значения следующих жирным шрифтом терминов и спросить себя, как они связаны к темам в главе.
Эскиз: энергии ионизации, наложенные на периодическую таблицу. (CC BY-NC-SA; анонимно по запросу).
Атомная теория — Введение в химию — 1-е канадское издание
- Изложите современную атомную теорию.
- Узнайте, как устроены атомы.
Наименьший кусок элемента, который поддерживает идентичность этого элемента, называется атомом. Отдельные атомы чрезвычайно малы.Чтобы образовать линию длиной 1 см, потребуется около пятидесяти миллионов атомов подряд. Точка в конце печатного предложения состоит из нескольких миллионов атомов. Атомы настолько малы, что трудно поверить, что вся материя состоит из атомов, но это так.
Точка в конце печатного предложения состоит из нескольких миллионов атомов. Атомы настолько малы, что трудно поверить, что вся материя состоит из атомов, но это так.
Представление о том, что атомы играют фундаментальную роль в химии, формализовано современной атомной теорией, впервые изложенной английским ученым Джоном Далтоном в 1808 году. Она состоит из трех частей:
- Вся материя состоит из атомов.
- Атомы одного и того же элемента одинаковы; атомы разных элементов разные.
- Атомы объединяются в целочисленных отношениях с образованием соединений.
Эти концепции составляют основу химии.
Хотя слово атом происходит от греческого слова, означающего «неделимый», теперь мы понимаем, что сами атомы состоят из более мелких частей, называемых субатомными частицами . Первым был обнаружен электрон, крошечная субатомная частица с отрицательным зарядом.Его часто обозначают как e — , с правым надстрочным индексом, показывающим отрицательный заряд. Позже были обнаружены две более крупные частицы. Протон — более массивная (но все же крошечная) субатомная частица с положительным зарядом, представленная как p + . Нейтрон — это субатомная частица с массой примерно такой же, как у протона, но без заряда. Он представлен как n или n 0 . Теперь мы знаем, что все атомы всех элементов состоят из электронов, протонов и (за одним исключением) нейтронов.Таблица 3.7 «Свойства трех субатомных частиц» суммирует свойства этих трех субатомных частиц.
Позже были обнаружены две более крупные частицы. Протон — более массивная (но все же крошечная) субатомная частица с положительным зарядом, представленная как p + . Нейтрон — это субатомная частица с массой примерно такой же, как у протона, но без заряда. Он представлен как n или n 0 . Теперь мы знаем, что все атомы всех элементов состоят из электронов, протонов и (за одним исключением) нейтронов.Таблица 3.7 «Свойства трех субатомных частиц» суммирует свойства этих трех субатомных частиц.
| Имя | Символ | Масса (прибл. В кг) | Заряд |
|---|---|---|---|
| Протон | п. + | 1,6 × 10 −27 | 1+ |
| Нейтрон | п, н 0 | 1.6 × 10 −27 | нет |
| Электрон | e — | 9,1 × 10 −31 | 1− |
Как эти частицы расположены в атомах? Они не расположены случайным образом. Эксперименты Эрнеста Резерфорда в Англии в 1910-х годах указали на ядерную модель атома. Относительно массивные протоны и нейтроны собираются в центре атома, в области, называемой ядром атома (множество ядер , ).Электроны находятся вне ядра и проводят время, вращаясь в космосе вокруг ядра. (См. Рисунок 3.4 «Структура атома».)
Эксперименты Эрнеста Резерфорда в Англии в 1910-х годах указали на ядерную модель атома. Относительно массивные протоны и нейтроны собираются в центре атома, в области, называемой ядром атома (множество ядер , ).Электроны находятся вне ядра и проводят время, вращаясь в космосе вокруг ядра. (См. Рисунок 3.4 «Структура атома».)
Современная атомная теория утверждает, что атомы одного элемента одинаковы, а атомы разных элементов различны. Что отличает атомы разных элементов? Фундаментальной характеристикой, которой обладают все атомы одного и того же элемента, является число протонов , число .Все атомы водорода имеют в ядре один и только один протон; все атомы железа имеют в ядре 26 протонов. Это количество протонов настолько важно для идентичности атома, что его называют атомным номером элемента. Таким образом, атомный номер водорода равен 1, а атомный номер железа — 26. Каждый элемент имеет свой собственный характерный атомный номер.
Каждый элемент имеет свой собственный характерный атомный номер.
Однако атомы одного и того же элемента могут иметь разное количество нейтронов. Атомы одного и того же элемента (т. Е. Атомы с одинаковым числом протонов) с разным числом нейтронов называются изотопами.Большинство природных элементов существуют в виде изотопов. Например, большинство атомов водорода имеют в своем ядре единственный протон. Однако небольшое количество (примерно один из миллиона) атомов водорода имеет в своих ядрах протон и нейтрон. Этот конкретный изотоп водорода называется дейтерий. Очень редкая форма водорода имеет в ядре один протон и два нейтрона; этот изотоп водорода называется тритием. Сумма количества протонов и нейтронов в ядре называется массовым числом изотопа.
У нейтральных атомов такое же количество электронов, как и у протонов, поэтому их общий заряд равен нулю. Однако, как мы увидим позже, так будет не всегда.
- Наиболее распространенные атомы углерода имеют шесть протонов и шесть нейтронов в своих ядрах.
 Каковы атомный номер и массовое число этих атомов углерода?
Каковы атомный номер и массовое число этих атомов углерода? - Изотоп урана имеет атомный номер 92 и массовое число 235. Каково количество протонов и нейтронов в ядре этого атома?
Решения
- Если в ядре атома углерода шесть протонов, его атомный номер равен 6.Если у него также есть шесть нейтронов в ядре, то массовое число равно 6 + 6, или 12.
- Если атомный номер урана 92, то это количество протонов в ядре. Поскольку массовое число равно 235, то количество нейтронов в ядре равно 235 — 92, или 143.
Число протонов в ядре атома олова — 50, а число нейтронов в ядре — 68. Каковы атомный номер и массовое число этого изотопа?
Ответ
Атомный номер = 50, массовое число = 118
Обращаясь к атому, мы просто используем название элемента: термин натрий относится к элементу, а также к атому натрия.Но постоянно использовать имя элемента может быть неудобно. Вместо этого химия определяет символ для каждого элемента. Атомарный символ — это одно- или двухбуквенное сокращение имени элемента. По соглашению первая буква символа элемента всегда заглавная, а вторая буква (если есть) — строчная. Таким образом, символ водорода — H, символ натрия — Na, а символ никеля — Ni. Большинство символов происходит от английского названия элемента, хотя некоторые символы происходят от латинского названия элемента.(Символ натрия Na происходит от его латинского названия natrium .) В таблице 3.8 «Названия и символы общих элементов» перечислены некоторые общие элементы и их символы. Вам следует запомнить символы в Таблице 3.8 «Названия и символы общих элементов», так как именно так мы будем представлять элементы в химии.
Атомарный символ — это одно- или двухбуквенное сокращение имени элемента. По соглашению первая буква символа элемента всегда заглавная, а вторая буква (если есть) — строчная. Таким образом, символ водорода — H, символ натрия — Na, а символ никеля — Ni. Большинство символов происходит от английского названия элемента, хотя некоторые символы происходят от латинского названия элемента.(Символ натрия Na происходит от его латинского названия natrium .) В таблице 3.8 «Названия и символы общих элементов» перечислены некоторые общие элементы и их символы. Вам следует запомнить символы в Таблице 3.8 «Названия и символы общих элементов», так как именно так мы будем представлять элементы в химии.
| Имя элемента | Символ |
|---|---|
| Алюминий | Al |
| Аргон | Ar |
| Мышьяк | как |
| Барий | Ba |
| Бериллий | Be |
| Висмут | Bi |
| Бор | B |
| Бром | Br |
| Кальций | Ca |
| Углерод | С |
| Хлор | Класс |
| Хром | Cr |
| Кобальт | Co |
| Медь | Cu |
| Фтор | F |
| Галлий | Ga |
| Германий | Ge |
| Золото | Au |
| Гелий | He |
| Водород | H |
| Йод | I |
| Иридий | Ir |
| Утюг | Fe |
| Криптон | Кр |
| Свинец | Пб |
| Литий | Li |
| Магний | мг |
| Марганец | Mn |
| Меркурий | Hg |
| молибден | Пн |
| Неон | Ne |
| Никель | Ni |
| Азот | N |
| Кислород | O |
| Палладий | Pd |
| фосфор | -П |
| Платина | Pt |
| Калий | К |
| Радий | Ra |
| Радон | Rn |
| Рубидий | руб. |
| Скандий | SC |
| Селен | SE |
| Кремний | Si |
| Серебро | Ag |
| Натрий | Na |
| Стронций | Sr |
| Сера | S |
| Тантал | Ta |
| Олово | Sn |
| Титан | Ti |
| Вольфрам | Вт |
| Уран | U |
| Ксенон | Xe |
| цинк | Zn |
| Цирконий | Zr |
Элементы сгруппированы вместе в специальной таблице, называемой периодической таблицей.Простая периодическая таблица показана на рисунке 3.5 «Простая периодическая таблица», а более обширная представлена в «Приложении A: Периодическая таблица элементов». Элементы в периодической таблице перечислены в порядке возрастания атомного номера. Периодическая таблица имеет особую форму, которая станет для нас важной, когда мы рассмотрим организацию электронов в атомах (см. Главу 8 «Электронная структура»). Одно немедленное использование таблицы Менделеева помогает нам идентифицировать металлы и неметаллы. Неметаллы находятся в верхнем правом углу таблицы Менделеева, по одну сторону от жирной линии, разделяющей правую часть таблицы.Все остальные элементы — металлы.
Периодическая таблица имеет особую форму, которая станет для нас важной, когда мы рассмотрим организацию электронов в атомах (см. Главу 8 «Электронная структура»). Одно немедленное использование таблицы Менделеева помогает нам идентифицировать металлы и неметаллы. Неметаллы находятся в верхнем правом углу таблицы Менделеева, по одну сторону от жирной линии, разделяющей правую часть таблицы.Все остальные элементы — металлы.
Есть простой способ представить изотопы с помощью атомных символов. Используем конструкцию:
, где X — это символ элемента, A — массовое число, а Z — атомный номер. Таким образом, для изотопа углерода, содержащего 6 протонов и 6 нейтронов, символ будет:
., где C — символ элемента, 6 — атомный номер, а 12 — массовое число.
- Какой символ у изотопа урана с атомным номером 92 и массовым числом 235?
- Сколько протонов и нейтронов внутри?
Решения
- Обозначение этого изотопа.
- В этом атоме железа 26 протонов и 56 — 26 = 30 нейтронов.
Сколько протонов внутри?
Ответ
11 протонов
Также принято указывать массовое число после названия элемента, чтобы указать на конкретный изотоп. Углерод-12 представляет собой изотоп углерода с 6 протонами и 6 нейтронами, а уран-238 представляет собой изотоп урана с 146 нейтронами.
- Химия основана на современной атомной теории, которая утверждает, что вся материя состоит из атомов.
- Сами атомы состоят из протонов, нейтронов и электронов.
- Каждый элемент имеет свой атомный номер, равный количеству протонов в его ядре.
- Изотопы элемента содержат разное количество нейтронов.
- Элементы представлены атомным символом.
- Таблица Менделеева — это таблица, в которой упорядочены все элементы.
Атрибуция СМИ
Упражнения
Атомная структура
Курс геолого-геофизических исследований мистера Панико — Чартерная школа Odyssey — сентябрь 2012 г.
Модель атома и материя
Студенты: вся вселенная состоит из чрезвычайно маленьких частиц материи, называемых атомами .
Слово атом означает неделимый. Если атом разделен, он больше не может быть распознан как материя
. Внутри атома находятся три типа субатомных частиц: протонов, нейтронов и электронов.
| Часть 1 — Структура атома — Протоны, нейтроны и электроны |
Протоны, нейтроны и электроны
Протон — это частица, которая несет положительный электрический заряд и расположена в центре атома.Центр атома называется ядром . Второй тип частиц в ядре называется нейтроном. Нейтроны также расположены в ядре, и эти частицы не имеют электрического заряда и, следовательно, являются нейтральными .
Третий тип субатомных частиц называется электроном и намного меньше протона или нейтрона. Электроны вращаются вокруг атома в большой области пространства, окружающей ядро.Электрон имеет отрицательный электрический заряд . Мы знакомы с электронами в том смысле, что электроны текут по проводам как электричество .
Модель атома
Электроны вращаются вокруг ядра на разном расстоянии от ядра, при этом более энергичные электроны вращаются дальше по орбите. Если бы мы могли создать точную в масштабе модель атома, мы бы увидели, что ядро очень маленькое, скажем, размером с бейсбольный мяч, а электроны подобны размеру изюма, вращающегося вокруг бейсбольного мяча с очень большого расстояния. примерно 5 футбольных полей, или 1500 футов.
Атомы состоят в основном из пустого пространства
Вы можете видеть, что эта истинная масштабная модель показывает, что существует огромное количество пространства, содержащего атомы, и поэтому атомов в основном состоят из пространства .
Число протонов определяет тип атома
Первичной субатомной частицей является протон, потому что число протонов внутри атома определяет тип этого атома . Например, все атомы, в ядре которых есть 8 протонов, являются атомами кислорода.Все атомы, у которых есть 6 протонов, являются атомами углерода. Лучше сказать, чтобы атом был атомом золота, он должен иметь 79 протонов, не больше и не меньше. Если бы атом мог изменить количество протонов, он стал бы атомом другого типа. (Изменение числа протонов в атоме происходит в природе, и это называется ядерным распадом).
94 известных типа атомов
Во вселенной есть 94 естественных атома, о которых известно науке.Эти атомы представлены в Периодической таблице. Подробнее об этом позже…
Периодическая таблица
Элементы
Атомы также называют элементами. Элемент — это чистое вещество, состоящее только из одного типа атомов. Поскольку существует 94 типа атомов, существует 94 типа элементов. Железо — это один из видов элементов. Углерод — другое. Так же свинец и золото.
Поскольку существует 94 типа атомов, существует 94 типа элементов. Железо — это один из видов элементов. Углерод — другое. Так же свинец и золото.
Буквы представляют элементы
Буквы, которые вы видите в периодической таблице, представляют элементы.Ртуть — Hg . Золото — Au . Нержавеющая сталь состоит из нескольких элементов, поэтому она не представлена в периодической таблице. В Периодической таблице присутствуют только чистые элементы, а не смеси нескольких элементов.
Атомный номер = число протонов
Число протонов , которое имеет атом, называется его атомным номером . Атомный номер углерода равен 6, потому что атомы углерода имеют 6 протонов. Атомный номер кислорода равен 8, потому что атомы кислорода имеют в своем ядре 8 протонов.Атомный номер золота 79, потому что атомы золота имеют 79 протонов.
Здесь вы видите медь с атомным номером 29, потому что атомы меди содержат 29 протонов в своем ядре.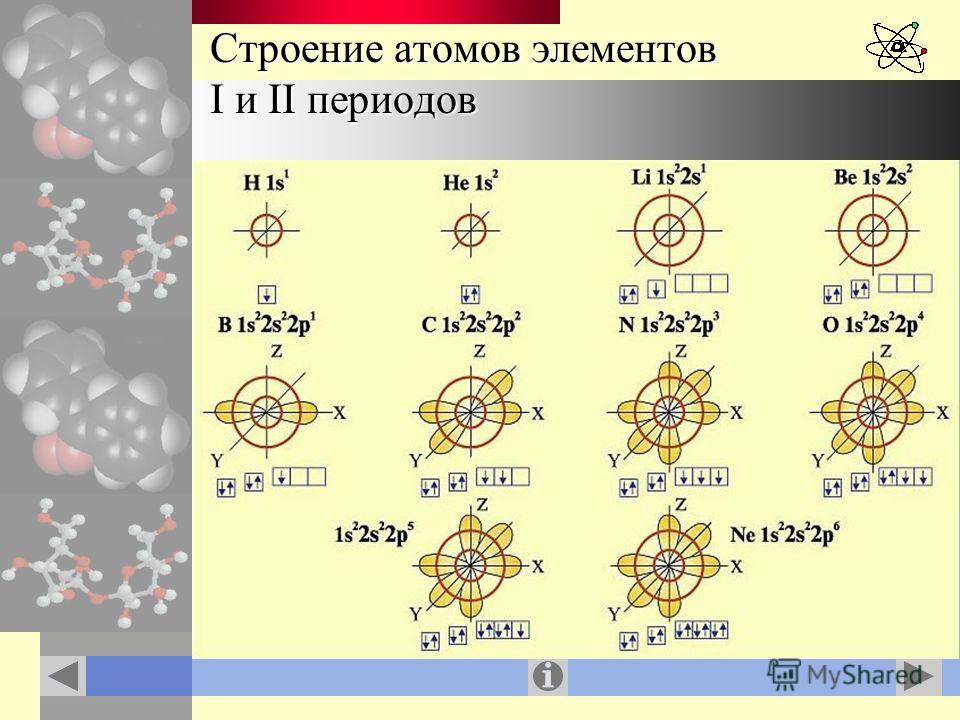
Атомы — это чистые химические элементы
Во Вселенной 94 естественных атома, это означает, что существует 94 естественных элемента . Элементы — это вещества, формы материи и газы, которые состоят из только одного типа атома .
По состоянию на май 2011 года было идентифицировано 118 элементов, последним из которых был унунокций в 2002 году. Считается, что из 118 известных элементов только первые 94 встречаются на Земле в естественных условиях. Из этих встречающихся в природе элементов 80 являются стабильными или практически стабильными, в то время как другие радиоактивны, распадаясь на другие, более легкие элементы в различных временных масштабах от часов до миллиардов лет. |
Когда только один тип атома составляет часть материи, эта материя называется элементом. Если вы держали в руке кусок чистой меди, это означает, что в этом кусочке меди содержатся только атомы меди. Итак, это чистый кусок меди без каких-либо других типов атомов.Удерживать большой образец чистого элемента бывает редко. Большинство веществ, достаточно больших, чтобы их вместить, будут содержать смешанные с ними другие типы атомов.
Нержавеющая сталь, например, содержит несколько типов атомов, поэтому это не элемент, а смесь элементов.
3 протона и 3 электрона
| Часть 2 — Изотопы и атомная масса |
Число протонов = Число электронов = Нейтральный заряд Атом
Теперь в большинстве атомов число положительных протонов, которые он имеет, такое же, как число отрицательных электронов, которые он имеет. Итак, у атома углерода с 6 протонами должно быть также 6 электронов, чтобы он был нейтральным атомом . Атом алюминия имеет 13 протонов, поэтому у него также должно быть 13 электронов.
Итак, у атома углерода с 6 протонами должно быть также 6 электронов, чтобы он был нейтральным атомом . Атом алюминия имеет 13 протонов, поэтому у него также должно быть 13 электронов.
Помните, что количество протонов равно количеству электронов в нейтрально заряженных стабильных атомах . (Есть исключение, когда атом является ионом, как это объясняется ниже).
В некоторых атомах количество нейтронов будет отличаться от количества протонов. Этот факт называют изотопами.
В общем, меньшие атомы имеют такое же количество нейтронов, что и протоны, но это не относится ко всем атомам. Например, среди атомов углерода, каждый из которых имеет 6 протонов, большинство атомов углерода будут иметь 6 нейтронов, НО не все будут. У некоторых атомов углерода может быть 8 нейтронов, хотя у большинства — 6 нейтронов.
На этом изображении углерод-13 имеет 7 нейтронов, а углерод-14 — 8
Изотопы относятся к вариациям в количестве нейтронов внутри одного типа атома.
Ссылаясь на тот факт, что атомы любого типа будут иметь некоторые вариации относительно количества содержащихся в них нейтронов, мы будем называть изотопами .У всех атомов углерода должно быть 6 протонов, чтобы быть атомом углерода. У большинства атомов углерода также будет 6 нейтронов, но у некоторых будет 8 нейтронов. Эти вариации числа нейтронов составляют изотопов углерода . Атом углерода с 6 нейтронами — это изотоп под названием углерод-12 . Атом углерода с 8 нейтронами — это изотоп под названием cabaron-14 . Изотоп Углерод-12 имеет 6 протонов и 6 нейтронов, следовательно, Углерод-12. Изотоп Углерод-14 имеет 6 протонов и 8 нейтронов, отсюда и его название Углерод-14.
19 протонов + 20 нейтронов = атомная масса 39
Атомная масса (атомный вес) — это количество протонов + нейтронов
Еще одно важное понятие для ученых — это атомная масса (также называемая атомной массой ). Атомная масса относится к весу или на самом деле массе атома. Каждая частица в ядре равна одной единице массы. Итак, 12 частиц в ядре атома равны массе 12. Если в ядре атома 6 протонов и 6 нейтронов, то общая масса этого атома = 12.У атома углерода 6 протонов и 6 нейтронов, поэтому его атомная масса = 12 ..
Атомная масса относится к весу или на самом деле массе атома. Каждая частица в ядре равна одной единице массы. Итак, 12 частиц в ядре атома равны массе 12. Если в ядре атома 6 протонов и 6 нейтронов, то общая масса этого атома = 12.У атома углерода 6 протонов и 6 нейтронов, поэтому его атомная масса = 12 ..
Если в ядре атома 8 протонов и 8 нейтронов, то этот атом имеет атомную массу 16.
Атомная масса атомов просто складывает протоны и нейтроны в его ядре .
Но количество нейтронов различается (изотопы)
Однако в любом типе атома будет некоторое изменение количества нейтронов, так как мы можем объявить точную атомную массу? Ученые просто используют среднее количество нейтронов для любого типа атома при определении атомной массы.Например, в углероде всего 6 протонов, но на самом деле в среднем 6,0107 нейтронов. Таким образом, атомная масса углерода равна 12,0107. НО ДЛЯ НАШИХ ЦЕЛЕЙ МЫ МОЖЕМ ОКРУГНУТЬ АТОМНУЮ МАССУ ДО 12.
Кислород состоит из 8 протонов и 8 электронов. Хотя большинство атомов кислорода имеют 8 нейтронов, у некоторых может быть меньше, поэтому общее число нейтронов для кислорода составляет в среднем 7,9994. Но для наших целей мы можем просто сказать 8 нейтронов.
Хотя большинство атомов кислорода имеют 8 нейтронов, у некоторых может быть меньше, поэтому общее число нейтронов для кислорода составляет в среднем 7,9994. Но для наших целей мы можем просто сказать 8 нейтронов.
Короткое видео по атомам и изотопам:
Пожалуйста, послушайте — Отличное видео по изотопам — 5 минут
Символы периодической таблицы
Периодическая таблица — это организованное визуальное представление всей информации о 94 типах атомов (то есть элементов), аккуратно помещенное в таблицу данных.Каждый атом или элемент представлен символом, который дает информацию об атоме.
Здесь вы видите атомный символ в Периодической таблице углерода.
~ Атомный номер 6 (состоит из 6 протонов)
~ Символ — C (для углерода, да).
~ Имя Карбон.
~ Средняя атомная масса 12.0107. Атомная масса — это протоны + нейтроны. У большинства атомов углерода 6 нейтронов, но у некоторых их больше. Таким образом, среднее количество нейтронов составляет 6,0 · 107. Итак, атомная масса 12,0107.Но для наших целей мы можем просто округлить до 12.
У большинства атомов углерода 6 нейтронов, но у некоторых их больше. Таким образом, среднее количество нейтронов составляет 6,0 · 107. Итак, атомная масса 12,0107.Но для наших целей мы можем просто округлить до 12.
Вот несколько периодических таблиц, которые вы можете увидеть в Интернете. Просмотрите эти диаграммы и ознакомьтесь с их информацией.
Простой цвет: http://go.hrw.com/resources/go_sc/periodic/SSHK1PER.PDF
Цвет: http://www.ktf-split.hr/periodni/download/en-color100.pdf
Черный и белый: http://www.ktf-split.hr/periodni/download/en-black.pdf
Подробнее о Периодической таблице (более тяжелые, большие атомы)
Периодическая таблица — это диаграмма, которая показывает возрастающее количество протонов с водородом (H) в верхнем левом углу в качестве первого элемента, поскольку он имеет только 1 протон.Затем справа находится гелий (He), поскольку у него 2 протона. Затем вернитесь влево с литием (Li) с 3 протонами и так далее по таблице.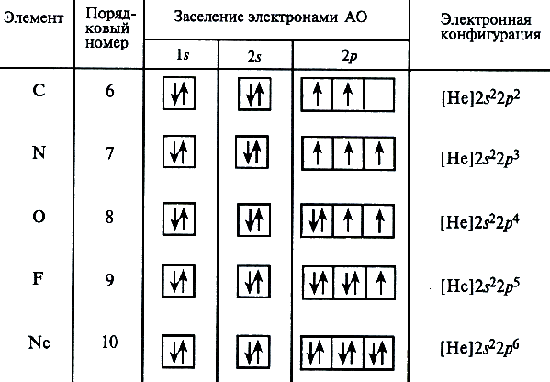
Обратите внимание на более крупные атомы, то есть атомы с большим количеством протонов и нейтронов расположены в нижней части таблицы. Эти «более тяжелые» элементы имеют большую массу на , то есть на частиц больше и буквально весят больше . У них также намного больше нейтронов, чем протонов. Правило состоит в том, что в целом у атома будет такое же количество нейтронов, как и у протонов, в основном применяется к меньшим атомам в первых 3 строках Периодической таблицы .
Тяжелый элемент борий (Bh) имеет 107 протонов, но его атомная масса равна 264. Итак, 264 — 107 = 157 нейтронов в среднем для атомов бория. Это много нейтронов и делает атом более массивным. Бориум и другие более тяжелые атомы определенно содержат больше нейтронов в ядре, чем протонов.
| Часть 3 — Материя, ионная и ковалентная связь (молекула и решетка) |
Дело
Когда одни и те же типы атомов объединяются, чтобы образовать вещество, материя называется элементом, потому что состоит только из одного типа атомов.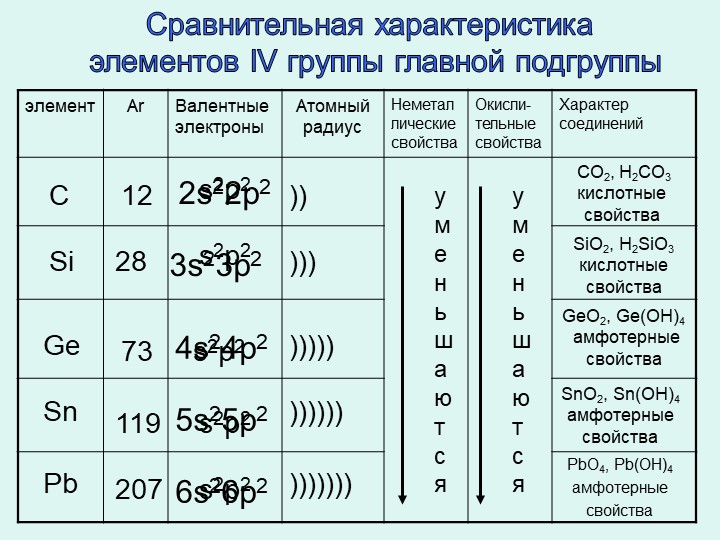 Но разные элементы могут объединяться вместе, образуя соединения.
Но разные элементы могут объединяться вместе, образуя соединения.
Соединения
Соединения — это вещества, которые образованы двумя или более типами элементов (атомов), которые объединяются для создания совершенно нового вещества, чем элементы, которые его составляют. Например, элемент хлор (Cl) может объединиться с элементом натрия (Na), и тогда будет создано новое вещество, поваренная соль (NaCl). Элемент кислород (газ) может соединиться с элементом водород (также газ), и тогда будет создано новое вещество — вода (h3O, жидкость).
Два типа связи атомов: ионная и ковалентная
Когда различные типы атомов объединяются (то есть связываются друг с другом), чтобы создать новое вещество, существует два типа связи атомов. Один называется ионной связью , а другой называется ковалентной связью .
Ковалентное связывание для воды; Внешние оболочки разделяют электроны
Ионная связь
Ионная связь — это положительные и отрицательные электрические заряды, притягивающие друг друга (аналогично тому, как северный и южный концы магнита притягивают друг друга).
Ковалентная связь
Ковалентная связь — это самая внешняя оболочка электронов, разделяемая между другими атомами, внешняя оболочка электронов. Молекулы воды являются примером ковалентной связи.
| Помните, ~ Ионная связь — это положительные и отрицательные ионы, притягивающие друг друга (как магниты). ~ Ковалентная связь — это две или более молекулы, разделяющие одни и те же электроны. |
Ионы — это атомы, которые приобрели или потеряли электроны
Ион — это атом, который потерял или приобрел электроны, так что он больше не является нейтрально заряженным атомом.Например, атом кислорода может получить электрон и стать отрицательно заряженным атомом кислорода, потому что теперь у него на один отрицательный электрон больше, чем положительных протонов.
Или, если атом кислорода теряет электрон, он становится положительно заряженным ионом, потому что у него больше положительных протонов, чем отрицательных электронов.
Примеры молекул, образованных разными атомами
Молекулы
Молекулы — это группы атомов, связанных вместе, чтобы создать новый тип материи (то есть соединение).Молекулы образованы ковалентной связью (разделяя большинство внешних электронов) . Многие, но не все вещества созданы атомами, соединяющимися в молекулы.
Ионные атомы могут объединяться, образуя соединения (Ионные связи).
Когда атомы приобретают или теряют электрон и, следовательно, становятся положительно или отрицательно заряженными, эти атомы могут притягиваться или связываться друг с другом. Отрицательно заряженные атомы притягиваются к положительно заряженным и наоборот. Таким образом, ионы могут связываться посредством притяжения.Например, отрицательно заряженные ионы хлора, притянутые к положительно заряженным ионам натрия, объединятся в поваренную соль.
Ионная связь создает решетку (а не молекулы). Минералы имеют решетчатую структуру .
Ионная связь образует не молекулы, а скорее минеральное вещество.
Ковалентная связь образует молекулы. Ионная связь образует минералы. Минералы представляют собой комбинацию
различных типов элементов, которые связываются посредством положительно-отрицательного притяжения, а не путем образования молекул.
Структура решетки (также называемая матрицей), но не молекулы
Структура ионной связи называется решеткой или матрицей . Это повторяющаяся структура атомов, из которых состоят вещества. Ковалентное связывание формирует повторяющиеся молекулы, но ионное связывание формирует повторяющиеся решетчатые матрицы. В обоих случаях у вас есть много разных типов веществ, которые создаются связанными вместе атомами.
Смеси
Смесь веществ, без химической связи
Смеси (физические твердые частицы)
Когда различные соединения смешиваются вместе, получается смесь.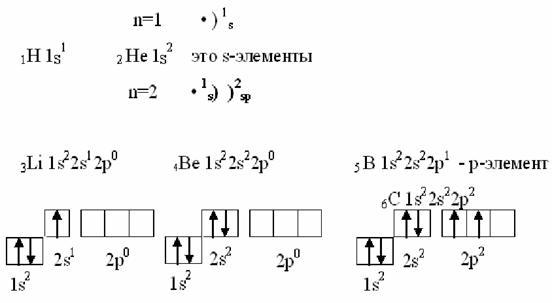 Например, если вы взяли пакет соли и смешали его с пакетом перца, у вас получилась бы смесь соли и перца. Важным моментом здесь является то, что соль остается солью, а перец остается перцем, и никаких химических связей не происходит. Два типа веществ, соль и перец, просто смешиваются вместе, вот и все. Их можно было разделить.
Например, если вы взяли пакет соли и смешали его с пакетом перца, у вас получилась бы смесь соли и перца. Важным моментом здесь является то, что соль остается солью, а перец остается перцем, и никаких химических связей не происходит. Два типа веществ, соль и перец, просто смешиваются вместе, вот и все. Их можно было разделить.
Растворы — это частицы в жидкостях
В воде частицы могут быть очень маленькими; раствор
Растворы (частицы в жидкости)
Раствор — это раствор, примешанный к воде определенного типа вещества.Поскольку вода хорошо растворяет вещество, вещество в конечном итоге распадается на крошечные кусочки, которые не видны глазом. Эти крошечные кусочки подвешены в воде и могут быть невидимы или могут придавать воде цвет.
Например, если вы взяли сахар, налили его в банку с водой и перемешали воду, в конечном итоге, казалось бы, частицы сахара исчезнут, но, конечно, этого не произошло. Вместо этого сахар просто растворился в таких маленьких кусочках, что вы больше не можете их видеть.Пейте воду, она будет сладкой с сахаром. Это называется решением .
Вместо этого сахар просто растворился в таких маленьких кусочках, что вы больше не можете их видеть.Пейте воду, она будет сладкой с сахаром. Это называется решением .
Четыре состояния материи
Вся материя обычно существует в 3 состояниях, хотя технически существует 4-е состояние материи:
твердое, жидкое, газообразное и плазменное . Вода — прекрасный пример трех состояний материи.
Вода, например, может быть лед, , твердое тело, вода, , жидкость или пар в воздухе, , который находится в газообразном состоянии.
В твердых телах есть молекулы, расположенные близко друг к другу, что делает материю жесткой.У жидкостей есть молекулы, которые расположены дальше друг от друга и обладают большей энергией и, следовательно, более гибкими или текучими по свойствам. У газа есть молекулы, которые находятся далеко друг от друга и обладают еще большей энергией, поэтому он не имеет определенной формы и может расширяться в атмосферу.
Плазма — это настолько горячий газ, что атомы теряют часть своих электронов, которые перемещаются свободно и отделяются от атомов. Этот тип материи существует в звездах в космосе и на Земле в молниях и в лабораториях.
Ковалентная связь — обзор
1.1 Определения
Координационные соединения — это соединения, содержащие одну или несколько координационных ковалентных связей.
Координатные ковалентные связи — это ковалентные связи, в которых оба связывающих электрона вносятся одним из партнеров по связи. На рисунке 2 ковалентные связи отличаются от координационных ковалентных связей в NH 3 BF 3 . В то время как три ковалентные связи BF образуются из-за совместного использования электронных пар в результате вкладов как атомов бора, так и атомов фтора, связь NB образуется из-за передачи неподеленной пары электронов из азота на пустые орбитали бора. Координатная ковалентная связь показана стрелкой с головкой, указывающей в направлении передачи пары электронов, как показано на рисунке 2.
Координатная ковалентная связь показана стрелкой с головкой, указывающей в направлении передачи пары электронов, как показано на рисунке 2.
Рисунок 2. Связывание в NH 3 BF 3 .
Комплекс представляет собой молекулу / ион, содержащую центральный атом / ион металла, окруженный определенным числом лигандов, удерживаемых вторичными валентностями или координированными ковалентными связями.
Первичная валентность относится к заряду над ионом металла e.г. Co (III) имеет заряд +3, который можно уравновесить -3 зарядообразующими соединениями, такими как CoCl 3 . Первичная валентность является ионной и выполняется во второй координационной сфере, как показано на рисунке 3.
Рисунок 3. Первая и вторая координационные сферы в [Co (NH 3 ) 6 ] Cl 3 .
Вторичная валентность — это количество пустых валентных орбиталей, как показано на рисунке для [Co (NH 3 ) 6 ] Cl 3 . Ион Co (III) имеет шесть пустых валентных орбиталей. Следовательно, его вторичная валентность равна шести. Вторичная валентность — это координатная ковалентная валентность, и она выполняется в первой координационной сфере иона металла, как показано на рисунке 4.
Ион Co (III) имеет шесть пустых валентных орбиталей. Следовательно, его вторичная валентность равна шести. Вторичная валентность — это координатная ковалентная валентность, и она выполняется в первой координационной сфере иона металла, как показано на рисунке 4.
Рисунок 4. Вторичная валентность Co (III) в [Co (NH 3 ) 6 ] Cl 3 .
Координационное число — это свойство иона металла, представляющее общее количество донорных атомов, непосредственно связанных с центральным атомом.В приведенном выше случае координационное число Co (III) равно шести, поскольку шесть донорных атомов азота напрямую связаны с центральным ионом металла (кобальтом (III)).
Лиганд представляет собой любой атом, ион или нейтральную молекулу, способную отдавать электронную пару и связанную с центральным ионом или атомом металла посредством вторичной валентности.
Зубчатый знак — это свойство лиганда, представляющего ряд координирующих атомов.
В случае [Co (NH 3 ) 6 ] Cl 3 , аммиак, NH 3 лиганд содержит один донорный атом (N).Следовательно, его зубчатый характер является единым и классифицируется как монодентатный лиганд. Точно так же хлор (Cl —) представляет собой анионный, одноатомный и монодентатный лиганд, а гидроксо (OH —) представляет собой двухатомный, монодентатный и анионный лиганд. Aquo (OH 2 ) представляет собой нейтральный трехатомный монодентатный лиганд. Несколько популярных лигандов и их характеристики показаны на рисунке 5.
Рисунок 5. Структуры и характеристики нескольких важных лигандов.
Из-за большей зубчатости лигандов иногда также образуются различные комплексы, известные как хелаты. Хелат представляет собой соединение, образующееся, когда полидентатный лиганд использует более одного из своих координирующих атомов для образования замкнутой кольцевой структуры, которая включает центральный ион металла.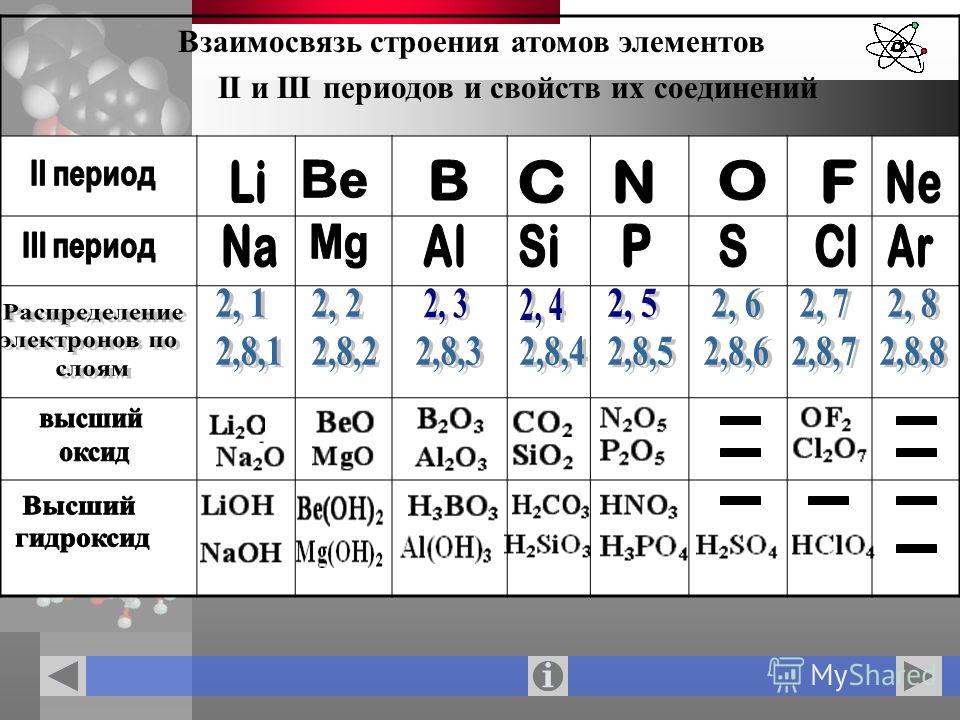 Известно, что пяти- и шестичленные кольца придают хелатам дополнительную стабильность. Процесс образования хелатов известен как хелатирование. Полидентатный лиганд, участвующий в образовании хелата, также известен как хелатирующий лиганд. Хелаты обычно обладают более высокой стабильностью, чем аналогичные комплексы.
Известно, что пяти- и шестичленные кольца придают хелатам дополнительную стабильность. Процесс образования хелатов известен как хелатирование. Полидентатный лиганд, участвующий в образовании хелата, также известен как хелатирующий лиганд. Хелаты обычно обладают более высокой стабильностью, чем аналогичные комплексы.
Полидентатный лиганд может быть присоединен к центральному иону металла через функциональные группы более чем одного типа.Таким образом, количество и вид связей, с помощью которых ион металла присоединяется к лигандам, может стать критерием для классификации хелатов. Ковалентные связи образуются за счет замены одного или нескольких H-атомов, в то время как координационные ковалентные связи образуются за счет передачи электронной пары от лигандов. Некоторые хелаты, включающие множество полидентатных лигандов и связей, показаны на фиг. 6. Координатные ковалентные связи показаны тонкими нитевидными связями.
Рисунок 6.Структуры и характеристики некоторых хелатов.
Полиядерный комплекс представляет собой комплекс с более чем одним атомом / ионом металла. Эти ионы металлов иногда соединяются мостиковыми связями через соответствующие лиганды, что приводит к образованию мостиковых полиядерных комплексов.
Расшифровка: Химия в ее стихии: неон(Promo) Вы слушаете Химию в ее стихии, представленную вам Chemistry World , журналом Королевского химического общества. (конец акции) Крис Смит Здравствуйте! На этой неделе мы познакомимся с элементом, который сделал квартал красных фонарей тем, чем он является сегодня, ну вроде как; то, что вы обязательно увидите, — это пламя неоновых вывесок, а с историей о том, как они появились, — это Виктория Гилл. Victoria Gill Это может быть самый увлекательный элемент таблицы Менделеева. Это газ, который может дать вам ваше имя или любое слово, которое вам нравится, на самом деле, в свете.Неоновый газ заполнил первые световые науки, которые были созданы почти столетие назад и с тех пор проникли в язык и культуру. Это слово вызывает в воображении образы красочных, а иногда и довольно захудалых, пылающих наук, многие из которых теперь не содержат самого газа. Только красное свечение является чистым неоном, почти все остальные цвета теперь производятся с использованием аргона, ртути и фосфора в различных пропорциях, что дает более 150 возможных цветов. Тем не менее, именно неон стал общим названием для всех светящихся трубок, которые позволяют рекламодателям и даже многим художникам рисовать и писать светом, и именно это свечение впервые выдало свое присутствие. До того, как он был изолирован, оставшееся место в периодической таблице было источником многих лет разочарования. Это потребовало немного воображения от французского инженера, химика и изобретателя Жоржа Клода, который в начале 20 -х годов века впервые применил электрический разряд к запечатанной трубке с неоновым газом. Создаваемое им красное свечение натолкнуло Клода на идею создания источника света совершенно новым способом.Он сделал стеклянные трубки из неона, которые можно было использовать как лампочки. Клод представил публике первую неоновую лампу 11 декабря года года 1910 года на выставке в Париже. Его поразительный дисплей вскружил голову, но, к сожалению, неоновые лампы не продавались. Люди просто не хотели освещать свои дома красным светом; но Клода это не остановило. Он запатентовал свое изобретение в 1915 году и, пытаясь найти ему применение, обнаружил, что, сгибая трубки, он может создавать светящиеся буквы. Итак, Неон мог потерять часть своего уникального блеска здесь, на Земле, но еще дальше он помог раскрыть некоторые секреты самого важного светящегося объекта для нашей планеты — Солнца. Так что, может быть, вам стоит остановиться и остановиться на следующей неоновой вывеске, которую вы увидите, и просто оценить поистине уникальное свечение. Крис Смит Итак, элемент, который как дома в космосе, рекламирует торговую марку здесь, на Земле. Это была Виктория Гилл с историей неона. В следующий раз к химическому веществу, которое сглаживает морщины при производстве стали. Рон Каспи Когда сэр Генри Бессемер изобрел процесс производства стали в 1856 году, его сталь распалась при горячей прокатке или ковке; проблема была решена позже в том же году, когда Роберт Фостер Мушет, другой англичанин, обнаружил, что добавление небольшого количества марганца в расплавленное железо решает проблему. Крис Смит Но как это работает? Рон Каспи будет здесь на следующей неделе и расскажет о марганце, элементе, который делает возможным фотосинтез и дал нам альтернативу зеленому стеклу. Это на следующей неделе Chemistry in its element; Надеюсь, вы сможете к нам присоединиться. Я Крис Смит, спасибо за внимание и до свидания! (Промо) (Окончание промо) |
Атомная структура
Атомная структураАтомная структура
Вся материя состоит из основных строительных блоков, называемых атомами .
Атомы состоят из еще более мелких частиц, называемых протонами , электронов и нейтронов . Протоны и нейтроны
живут в ядре атома и практически идентичны по массе. Тем не мение,
протоны имеют положительный заряд, тогда как нейтроны не имеют заряда. Электроны
имеют отрицательный заряд и вращаются вокруг ядра в оболочках или электронов
орбитали и намного менее массивны, чем другие частицы.С
электроны в 1836 раз менее массивны, чем протоны или нейтроны, большая часть
масса атома находится в ядре, которое составляет всего 1/100 000 размера атома.
весь атом (!).
Протоны и нейтроны
живут в ядре атома и практически идентичны по массе. Тем не мение,
протоны имеют положительный заряд, тогда как нейтроны не имеют заряда. Электроны
имеют отрицательный заряд и вращаются вокруг ядра в оболочках или электронов
орбитали и намного менее массивны, чем другие частицы.С
электроны в 1836 раз менее массивны, чем протоны или нейтроны, большая часть
масса атома находится в ядре, которое составляет всего 1/100 000 размера атома.
весь атом (!).
Организация атома водорода показана ниже:
Атом водорода
Красная точка — это протон в ядре. Имеет положительный заряд +1 ед. Синяя точка — электрон. Имеет отрицательный заряд -1 ед. Для любого нормального атома количество электронов и протоны равны, что означает, что электрический заряд уравновешен.Там это только одна орбиталь для водорода. Давайте посмотрим на атом углерода большего размера.
Атом углерода
В ядре появилась новая частица — нейтрон.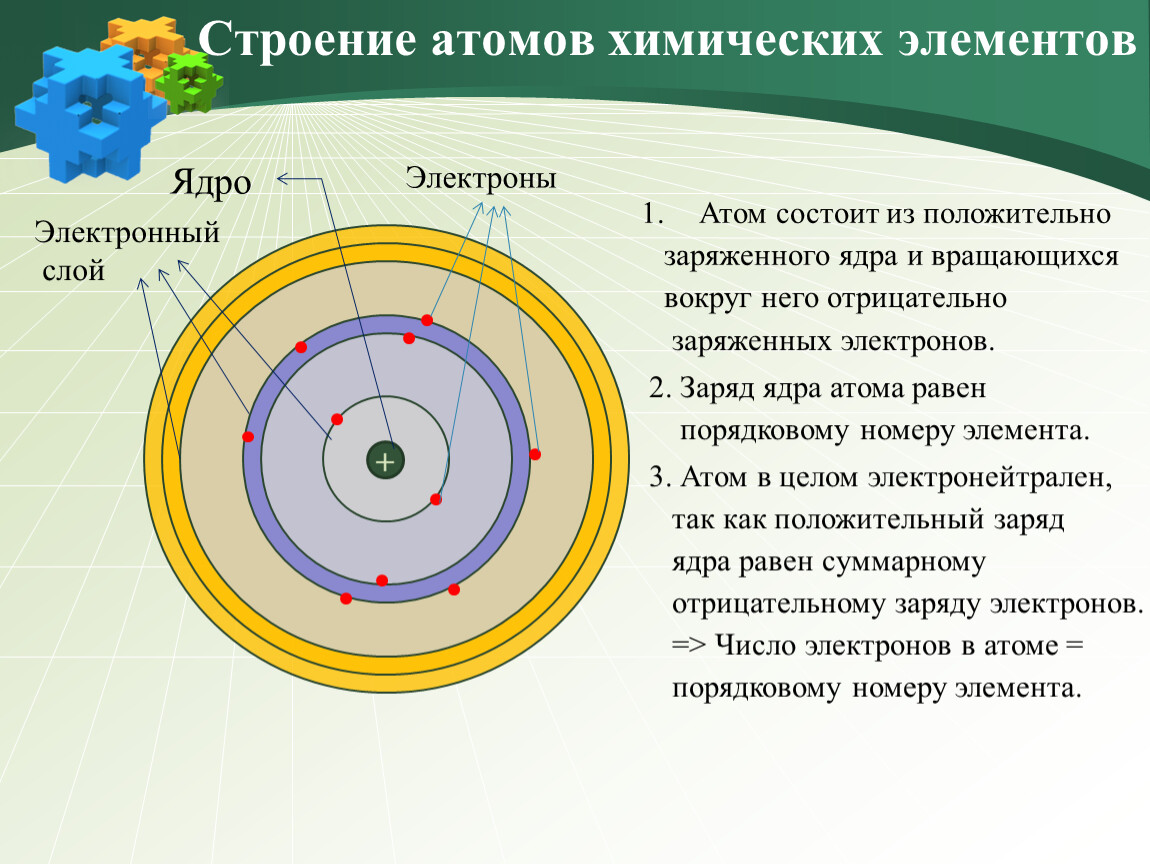 (представлен белыми точками). В ядре также 6 протонов,
всего 12 частиц. Кроме того, теперь есть 6 электронов.
вращается вокруг ядра по двум орбиталям. Причина, по которой атом углерода нуждается в
вторая орбиталь сложна и выходит за рамки этого геологического класса.
Но правила, управляющие атомами, гласят, что первая орбиталь может иметь только две
электронов, на второй орбитали разрешено восемь электронов, на третьей — только
восемь электронов и т. д. (См. стр. 27 вашего текста с номерами
электронов на каждой орбитали для первых 20 элементов.)
(представлен белыми точками). В ядре также 6 протонов,
всего 12 частиц. Кроме того, теперь есть 6 электронов.
вращается вокруг ядра по двум орбиталям. Причина, по которой атом углерода нуждается в
вторая орбиталь сложна и выходит за рамки этого геологического класса.
Но правила, управляющие атомами, гласят, что первая орбиталь может иметь только две
электронов, на второй орбитали разрешено восемь электронов, на третьей — только
восемь электронов и т. д. (См. стр. 27 вашего текста с номерами
электронов на каждой орбитали для первых 20 элементов.)
Есть 91 природный элемент. Атомы — это самые маленькие из возможных элементов, и на самом деле слово «атом» происходит от греческого слова «томос», что означает «не резать» — то есть вы не можете вырезать меньше, чем это.Мы обычно представляют элементы их атомным символом. Водород представлен буквой «H»; углерод буквой «C».
Для атомов изменение числа протонов меняет вид
элемент . Итак, если бы я бросил дополнительный протон в
ядра атома углерода, проиллюстрированного выше, у меня больше не будет углерода — я
будет азот. Точно так же, если бы я убрал протон из углерода
атом, у меня был бы другой элемент, бор. Число протонов в
ядро атома совпадает с атомным номером этого
атом.Если сложить количество протонов и нейтронов, получится атомных
массовое число этого конкретного атома.
Точно так же, если бы я убрал протон из углерода
атом, у меня был бы другой элемент, бор. Число протонов в
ядро атома совпадает с атомным номером этого
атом.Если сложить количество протонов и нейтронов, получится атомных
массовое число этого конкретного атома.
Быстрая проверка : Какой атомный номер показан атом водорода выше? Что это за атомное массовое число? Что такое атомный номер и массовое атомное число указанного выше атома углерода?
Ответы : атомный номер водорода 1 (посчитайте протоны). Атомно-массовое число водорода тоже , одно (есть нет нейтронов!).Для углерода атомный номер 6 , а атомный номер массовое число 12 (6 протонов плюс 6 нейтронов).
Посмотрите еще раз на изображение атома углерода. Что, если бы мы добавили
нейтрон вместо протона? Будет ли у нас такой же элемент?
да. Но атом был бы другим. A dding или
вычитание нейтронов из ядра атома создает изотопы этого атома . Например, давайте добавим два нейтрона к атому углерода, обозначенному зеленым
точки ниже:
Например, давайте добавим два нейтрона к атому углерода, обозначенному зеленым
точки ниже:
Изотоп углерода
Сложение двух нейтронов меняет наш атом.Однако, поскольку количество протонов то же самое, это все еще углерод, но теперь это изотоп углерода. Мы представляем изотопы с помощью химического символа («C» для углерода) и число. Первый атом углерода только с 6 нейтроны будут называться 12 C или углерод-12. Новый с 8 нейтроны будут 14 C или углерод-14. Обратите внимание, что число «14» также является атомным массовым числом для этого изотопа.
Химики работали над организацией элементов особым образом, называемым Периодическая таблица.Он упорядочен так, что элементы в каждом столбце имеют некоторые общие химические и физические свойства. Ниже приведено изображение Периодическая таблица:
* Изображение с http://www.chemtutor.com/perich.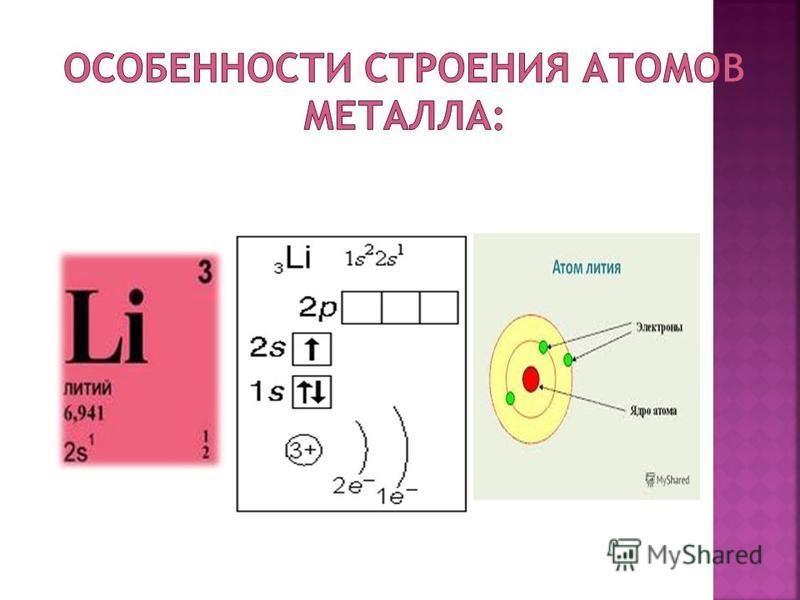 htm
htm
Каждый элемент имеет атомарный символ и атомарный символ. номер.
Quick Quiz: Напомним, что атомный номер — это количество протонов в ядре. Сколько протонов в Атом натрия (Na)? Атом кислорода (O)? Атом урана (U)?
Ответы: Натрий имеет протонов 11 , Кислород 8 протонов и урана 92 протонов.
Продолжить и узнать об ионах.
Вернуться в главное меню.
Вернуться на страницу вводного курса наук о Земле.
(Для получения дополнительной информации по основам химии и атомной структуре, посетите http://www.chemtutor.com/.)
.

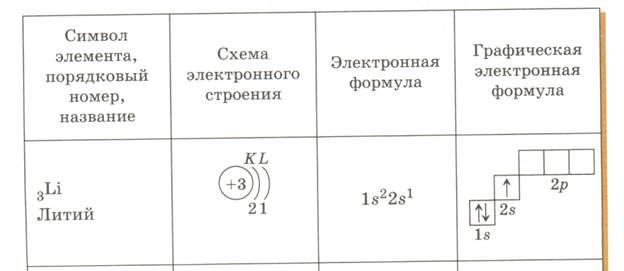 Дополнительные элементы с более высокими атомными номерами, чем те, которые встречаются в природе, были получены технологически в последние десятилетия как продукты ядерных реакций.
Дополнительные элементы с более высокими атомными номерами, чем те, которые встречаются в природе, были получены технологически в последние десятилетия как продукты ядерных реакций. 
 Открыв аргон в 1894 году и выделив гелий в 1895 году, британский химик Уильям Рамзи обнаружил первого и третьего членов группы инертных газов. Чтобы восполнить пробел, ему нужно было найти вторую. Наконец, в 1898 году в Университетском колледже в Лондоне Рамзи и его коллега Моррис Траверс изменили эксперимент, который они опробовали ранее, они позволили твердому аргону, окруженному жидким воздухом, медленно испаряться при пониженном давлении, и собрали газ, который выходил первым.Когда они поместили образец недавно открытого газа в атомный спектрометр, нагревая его, они были поражены его сияющим блеском. Трэверс писал об этом открытии : «Вспышка малинового света из трубки рассказывала свою собственную историю и была зрелищем, на котором стоит остановиться и никогда не забыть». Название неон происходит от греческого слова neos , что означает новый. На самом деле это был тринадцатилетний сын Рэмси, который предложил название для газа, сказав, что он хотел бы назвать его novum от латинского слова «новый».
Открыв аргон в 1894 году и выделив гелий в 1895 году, британский химик Уильям Рамзи обнаружил первого и третьего членов группы инертных газов. Чтобы восполнить пробел, ему нужно было найти вторую. Наконец, в 1898 году в Университетском колледже в Лондоне Рамзи и его коллега Моррис Траверс изменили эксперимент, который они опробовали ранее, они позволили твердому аргону, окруженному жидким воздухом, медленно испаряться при пониженном давлении, и собрали газ, который выходил первым.Когда они поместили образец недавно открытого газа в атомный спектрометр, нагревая его, они были поражены его сияющим блеском. Трэверс писал об этом открытии : «Вспышка малинового света из трубки рассказывала свою собственную историю и была зрелищем, на котором стоит остановиться и никогда не забыть». Название неон происходит от греческого слова neos , что означает новый. На самом деле это был тринадцатилетний сын Рэмси, который предложил название для газа, сказав, что он хотел бы назвать его novum от латинского слова «новый». Его отцу идея понравилась, но он предпочел использовать греческий язык. Так новый элемент в названии и природе, наконец, занял свое место в таблице Менделеева. И изначально отсутствие реактивности означало, что у Neon не было очевидного применения.
Его отцу идея понравилась, но он предпочел использовать греческий язык. Так новый элемент в названии и природе, наконец, занял свое место в таблице Менделеева. И изначально отсутствие реактивности означало, что у Neon не было очевидного применения.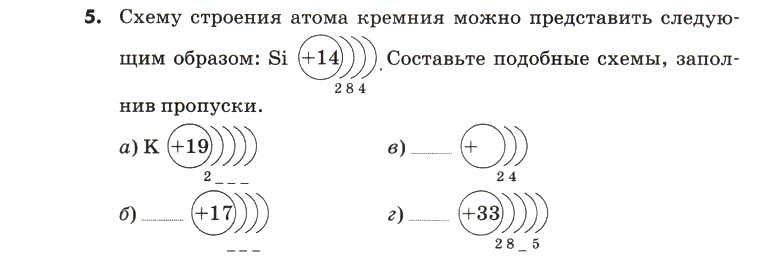 Использование неоновых трубок для рекламных вывесок началось в 1923 году, когда его компания Claude Neon представила в США трубчатые вывески с газовым наполнением. Два он продал автосалону Packard в Лос-Анджелесе. Первые неоновые вывески были названы «жидким огнем», и люди останавливались на улице, чтобы смотреть на них, даже при дневном свете они заметно светятся. В наши дни неон извлекается из жидкого воздуха путем фракционной перегонки, и всего несколько тонн в год имеющегося в изобилии газа достаточно для удовлетворения любых коммерческих потребностей.И, конечно же, сейчас есть много источников световых вывесок, экранов и дисплеев, которые дают нам гораздо более впечатляющие прокручиваемые буквы и движущиеся картинки, которые мы ассоциируем с яркими красочными огнями, скажем, Таймс-сквер в Нью-Йорке.
Использование неоновых трубок для рекламных вывесок началось в 1923 году, когда его компания Claude Neon представила в США трубчатые вывески с газовым наполнением. Два он продал автосалону Packard в Лос-Анджелесе. Первые неоновые вывески были названы «жидким огнем», и люди останавливались на улице, чтобы смотреть на них, даже при дневном свете они заметно светятся. В наши дни неон извлекается из жидкого воздуха путем фракционной перегонки, и всего несколько тонн в год имеющегося в изобилии газа достаточно для удовлетворения любых коммерческих потребностей.И, конечно же, сейчас есть много источников световых вывесок, экранов и дисплеев, которые дают нам гораздо более впечатляющие прокручиваемые буквы и движущиеся картинки, которые мы ассоциируем с яркими красочными огнями, скажем, Таймс-сквер в Нью-Йорке. Солнечные частицы или солнечный ветер также содержат неон в соотношении двух изотопов неона в образцах лунных горных пород, горные породы, которые взрываются солнечным ветром в течение миллиардов лет, до недавнего времени ставили ученых в тупик.Это потому, что соотношение двух изотопов варьировалось в зависимости от глубины породы; с большим количеством неона-22, чем неона-20 на меньших глубинах. Значит ли это, что когда-то Солнце было значительно более активным, чем сегодня, выбрасывая частицы с более высокой энергией, которые могли проникать глубже в скалы? Наконец, на этот вопрос был дан ответ, когда ученые изучили кусок металлического стекла, который подвергался воздействию солнечного ветра всего два года на космическом корабле Genesis, который упал на Землю в 2004 году.Когда ученые измерили распределение неона в образцах стекла, подвергшихся воздействию солнечного ветра, они обнаружили, что верхний слой также содержал больше неона-20, чем нижележащий слой. Нижележащий слой был похож на лунную скалу.
Солнечные частицы или солнечный ветер также содержат неон в соотношении двух изотопов неона в образцах лунных горных пород, горные породы, которые взрываются солнечным ветром в течение миллиардов лет, до недавнего времени ставили ученых в тупик.Это потому, что соотношение двух изотопов варьировалось в зависимости от глубины породы; с большим количеством неона-22, чем неона-20 на меньших глубинах. Значит ли это, что когда-то Солнце было значительно более активным, чем сегодня, выбрасывая частицы с более высокой энергией, которые могли проникать глубже в скалы? Наконец, на этот вопрос был дан ответ, когда ученые изучили кусок металлического стекла, который подвергался воздействию солнечного ветра всего два года на космическом корабле Genesis, который упал на Землю в 2004 году.Когда ученые измерили распределение неона в образцах стекла, подвергшихся воздействию солнечного ветра, они обнаружили, что верхний слой также содержал больше неона-20, чем нижележащий слой. Нижележащий слой был похож на лунную скалу. Поскольку активность Солнца вряд ли изменилась в течение двухлетней миссии, похоже, что несоответствие вызывало что-то вроде космической эрозии, микрометеороиды или частицы просто удалили часть исходного неона с верхней поверхности Луны. камень.
Поскольку активность Солнца вряд ли изменилась в течение двухлетней миссии, похоже, что несоответствие вызывало что-то вроде космической эрозии, микрометеороиды или частицы просто удалили часть исходного неона с верхней поверхности Луны. камень.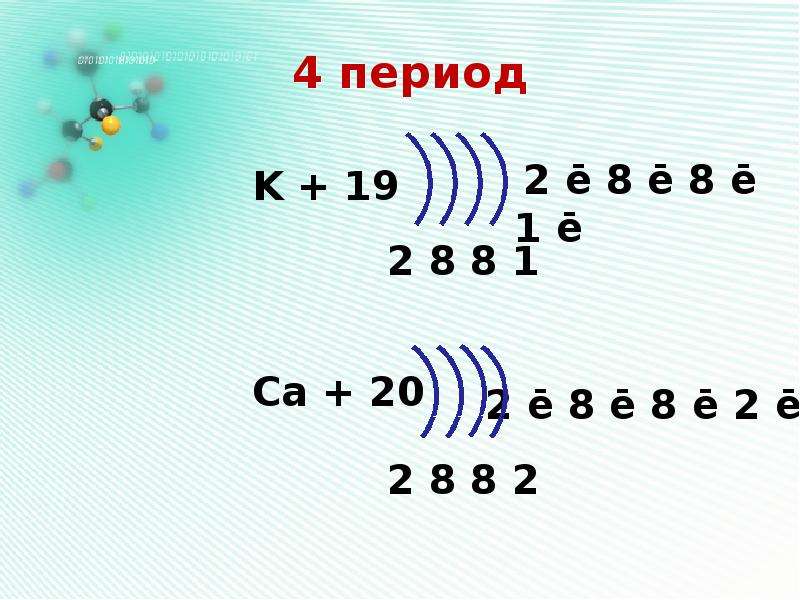 Поскольку марганец имеет большее сродство к сере, чем железо, он превращает легкоплавкий сульфид железа в стали в тугоплавкий сульфид марганца.
Поскольку марганец имеет большее сродство к сере, чем железо, он превращает легкоплавкий сульфид железа в стали в тугоплавкий сульфид марганца.