Щелочные металлы и их свойства
Автор Марина Андреева На чтение 2 мин Просмотров 54 Опубликовано
Химия изучает свойства металлов и неметаллов. А вы знали, что металлы бывают щелочные и не щелочные? А мы не только знаем, а и список вам дадим для успешной подготовки по предмету химии. Итак, щелочные металлы список уже приведен в периодической таблице Менделеева. Там все металлы главной подгруппы в первой группе являются щелочными.
Это литий, калий, натрий, цезий, рубидий и франций. Только эти металлы называются щелочными. А называются они так потому, что если они будут взаимодействовать с водой, то в результате образуются щелочи.
Есть еще один вид металлов — это щелочно-земельные. Если вам нужен список только щелочных металлов, то в нем всего 6 металлов. Если всех металлов, гидроксиды которых обладают щелочными свойствами, то тут войдут еще четыре элемента — кальций, стронций, барий и радий.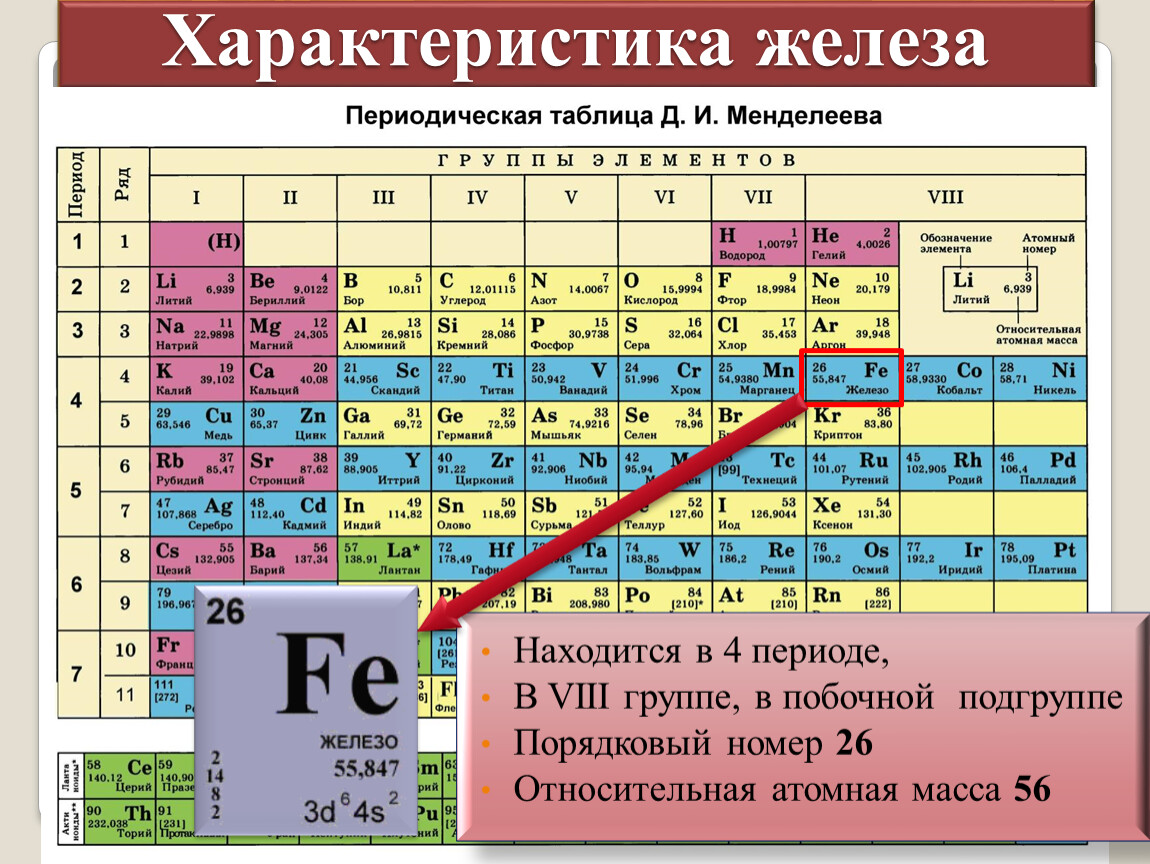
Все щелочные металлы в чистом виде в природе встретить сложно — ведь они легко вступают в соединения. В частности, в виде этих соединений эти металлы и находят.
Щелочные металлы отличные проводники тепла, а также они хорошо проводят электрический ток.
Щелочные металлы имеют низкую температуру плавления
Плотность металлов с увеличением номера увеличивается, а вот плавить их становится все проще, если металлы находятся внизу группы.
Обычно щелочные металлы получают с помощью электролиза, однако два металла щелочно-земельных — стронций и барий, получают, используя алюмотермический метод.
Химические свойства
Как мы уже сказали, эти металлы являются очень активными, они также отличные восстановители. Встречаются в виде соединений, в которых главной будет ионная связь.
Как правило, всегда они образуют устойчивые соединения. Основные реакции и дополнительные свойства щелочных металлов приведены в таблице:
Итак, вы теперь, пользуясь списком и таблицей, а также периодической системой Менделеева, сможете многое рассказать про щелочные металлы.
Посмотреть как выглядят щелочные металлы можно здесь. Там также есть список и приведены реакции связи с водой, серой, с кислотами, солями и галогенами.
1.2.2. Общая характеристика металлов IА–IIIА групп.
Элементы IA группы
В IA группу (главная подгруппа первой группы) таблицы Менделеева входят металлы — литий Li, натрий Na, калий К, рубидий Rb, цезий Cs и франций Fr. Традиционно, данные элементы называют щелочными металлами (ЩМ), так как их простые вещества образуют при взаимодействии с водой едкие щелочи. Последний из известных представителей группы щелочных металлов (Fr) является радиоактивным элементом, в связи с чем его химические свойства изучены недостаточно: период полураспада его наиболее долгоживущего изотопа 223Fr составляет всего лишь около 22 мин.
Электронные формулы, а также некоторые свойства щелочных металлов представлены в таблице ниже:
| Свойство | Li | Na | К | Rb | Cs | Fr |
| Заряд ядра Z | 3 | 11 | 19 | 37 | 55 | 87 |
| Электронная конфигурация в основном состоянии | [He]2s1 | [Ne]3s1 | [Аr]4s1 | [Kr]5s1 | [Хе]6s1 | [Rn]7s1 |
| Металлический радиус rмет, нм | 0,152 | 0,186 | 0,227 | 0,248 | 0,265 | 0,270 |
| Ионный радиус rион*, нм | 0,074 | 0,102 | 0,138 | 0,149 | 0,170 | 0,180 |
| Радиус гидратированного иона,rион , нм | 0,340 | 0,276 | 0,232 | 0,228 | 0,228 | — |
| Энергия ионизации, кДж/моль: I1 I2 | 520,2 7298 | 495,8 4562 | 418,8 3052 | 403,0 2633 | 375,7 2234 | (380) (2100) |
| Электроотрицательность | 0,98 | 0,93 | 0,82 | 0,82 | 0,79 | 0,70 |
При движении вниз по IA группе возрастает радиус атомов металлов (rмет), что, собственно, характерно для любых элементов всех главных подгрупп. Относительно малое увеличение радиуса при переходе от K к Rb и далее к Cs обусловлено заполнением 3d- и 4d-подуровней соответственно.
Ионные радиусы ЩМ существенно меньше металлических, что связано с потерей единственного валентного электрона. Они также закономерно возрастают от Li+ к Cs+. Размеры же гидратированных катионов изменяются в противоположном направлении, что объясняется в рамках простейшей электростатической модели. Наименьший по размеру ион Li+ лучше катионов остальных щелочных металлов притягивает к себе полярные молекулы воды, образуя наиболее толстую гидратную оболочку. Исследования показали, что в водном растворе катион лития Li+ окружен 26 молекулами воды, из которых только 4 находятся в непосредственном контакте с ионом лития (первой координационной сфере). По этой причине многие соли лития, например, хлорид, перхлорат и сульфат, а также гидроксид выделяются из водных растворов в виде кристаллогидратов. Хлорид LiCl·Н2O теряет воду при температуре 95 °С, LiOH·Н2O — при 110°С, а LiClO4·Н2O — только при температуре выше 150°С. С увеличением ионного радиуса катиона щелочного металла сила его электростатического взаимодействия с молекулами воды ослабевает, что приводит к снижению толщины гидратной оболочки и, как следствие, радиуса гидратированного иона [М(Н2O)n] (где n = 17, 11, 10, 10 для М+ = Na+, К+, Rb+, Cs+ соответственно).
Внешний энергетический уровень атома ЩМ содержит один единственный электрон, который слабо связан с ядром, о чем говорят низкие значения энергии ионизации I1. Атомы щелочных металлов легко ионизируются с образованием катионов М+, входящих в состав практически всех химических соединений этих элементов. Значения I2 для всех щелочных металлов настолько высоки, что в реально осуществимых условиях ион М2+ не образуется. Электроотрицательность щелочных элементов мала, их соединения с наиболее электроотрицательными элементами (хлор, кислород, азот)имеют ионное строение, как минимум в кристаллическом состоянии.
Маленький радиус иона Li+ и высокая плотность заряда, являются причиной того, что соединения лития оказываются схожими по свойствам аналогичным соединениям магния (диагональное сходство) и в то же время отличаются от соединений остальных ЩМ.
Элементы IIA группы
В IIA группу Периодической системы элементов входят бериллий Ве, магний Мg и четыре щелочноземельных металла (ЩЗМ): кальций Са, стронций Sr, барий Ва и радий Ra, оксиды которых, раньше называемые «землями», при взаимодействии с водой образуют щелочи. Радий — радиоактивный элемент (α-распад, период полураспада примерно 1600 лет).
Электронная конфигурация и некоторые свойства элементов второй группы приведены в таблице ниже.
По электронному строению атомов элементы второй группы близки щелочным металлам. Они имеют конфигурацию благородного газа, дополненную
| Свойство | Be | Mg | Ca | Sr | Ba | Ra |
| Заряд ядра Z | 4 | 12 | 20 | 38 | 56 | 88 |
| Электронная конфигурация в основном состоянии | [He]2s2 | [Ne]3s2 | [Ar]4s2 | [Kr]5s2 | [Xe]6s2 | [Rn]7s2 |
| Металлический радиус rмет, нм | 0,112 | 0,160 | 0,197 | 0,215 | 0,217 | 0,223 |
| Ионный радиус rион*, нм | 0,027 | 0,72 | 0,100 | 0,126 | 0,142 | 0,148 |
| Энергия ионизации, кДж/моль: I1 I2 I3 | 899,5 1757 14850 | 737,7 1451 7733 | 589,8 1145 4912 | 549,5 1064 4138 | 502,8 965 3619 | 509,3 979 3300 |
| Электроотрицательность | 1,57 | 1,31 | 1,00 | 0,95 | 0,89 | 0,90 |
двумя s-электронами на внешнем уровне. В то же время от элементов первой группы они отличаются более высокими значениями энергии ионизации, убывающими в ряду Ве—Мg—Са—Sr— Ва. Эта тенденция нарушается при переходе от бария к радию: повышениe П и І, для Rа по сравнению с Ва объясняется эффектом инертной 6s2-пары.
В то же время от элементов первой группы они отличаются более высокими значениями энергии ионизации, убывающими в ряду Ве—Мg—Са—Sr— Ва. Эта тенденция нарушается при переходе от бария к радию: повышениe П и І, для Rа по сравнению с Ва объясняется эффектом инертной 6s2-пары.
Следует отметить, что в то время как для щелочных металлов характерна значительная разница между I1 и I2 для элементов второй группы подобный скачок наблюдается между I2 и I3. Именно поэтому щелочные металлы в сложных веществах проявляют только степень окисления +1, а элементы второй группы +2. Наличие единственной положительной степени окисления и невозможность восстановления ионов M2+ в водной среде придает большое сходство всем металлам s-блока.
Изменение свойств по группе следует общим закономерностям, рассмотренным на примере щелочных металлов. Элемент второго периода бериллий, подобно элементу первой группы литию, значительно отличается по своим свойствам от других элементов второй группы. Так, ион Be2+ благодаря чрезвычайно малому ионному радиусу (0,027 нм), высокой плотности заряда, большим значениям энергий атомизации и ионизации оказывается устойчивым лишь в газовой фазе при высоких температурах. Поэтому химическая связь в бинарных соединениях бериллия даже с наиболее электроотрицательными элементами (кислород, фтором) обладает высокой долей ковалентности. Химия водных растворов бериллия также имеет свою специфику: в первой координационной сфере бериллия могут находиться лишь четыре лиганда ([Be(H2O)4]2+, (Bе(OH)4]—), что связано с малым ионным радиусом металла и отсутствием d-орбиталей.
Так, ион Be2+ благодаря чрезвычайно малому ионному радиусу (0,027 нм), высокой плотности заряда, большим значениям энергий атомизации и ионизации оказывается устойчивым лишь в газовой фазе при высоких температурах. Поэтому химическая связь в бинарных соединениях бериллия даже с наиболее электроотрицательными элементами (кислород, фтором) обладает высокой долей ковалентности. Химия водных растворов бериллия также имеет свою специфику: в первой координационной сфере бериллия могут находиться лишь четыре лиганда ([Be(H2O)4]2+, (Bе(OH)4]—), что связано с малым ионным радиусом металла и отсутствием d-орбиталей.
Щелочноземельные металлы (Са, Sr, Ва, Ra) образуют единое семейство элементов, в пределах которого некоторые свойства (энергия гидратации, растворимость и термическая устойчивость солей) меняются монотонно с увеличением ионного радиуса, а многие их соединения являются изоморфными.
Элементы IIIA группы
Элементы IIIA группы: бор В, алюминий Al, галлий Ga, индий In и таллий Tl — имеют мало стабильных изотопов, что характерно для атомов с нечетными порядковыми номерами. Электронная конфигурация внешнего энергетического уровня в основном состоянии ns2nр1 характеризуется наличием одного неспаренного электрона. В возбужденном состоянии элементы IIIA группы содержат три неспаренных электрона, которые, находясь в sp2-гибридизации, принимают участие в образовании трех ковалентных связей. При этом у атомов остается одна незанятая орбиталь. Поэтому многие ковалентные соединения элементов IIIA группы являются акцепторами электронной пары (кислоты Льюиса), т.е. могут образовывать четвертую ковалентную связь по донорно-акцепторному механизму, создавая которую, они изменяют геометрию своего окружения — она из плоской становится тетраэдрической (состояние sp3-гибридизации). Бор сильно отличается по свойствам от других элементов IIIA группы. Он является единственным неметаллом, химически инертен и образует ковалентные связи со фтором, азотом, углеродом и т.д. Химия бора более близка химии кремния, в этом проявляется Диагональное сходство.
Электронная конфигурация внешнего энергетического уровня в основном состоянии ns2nр1 характеризуется наличием одного неспаренного электрона. В возбужденном состоянии элементы IIIA группы содержат три неспаренных электрона, которые, находясь в sp2-гибридизации, принимают участие в образовании трех ковалентных связей. При этом у атомов остается одна незанятая орбиталь. Поэтому многие ковалентные соединения элементов IIIA группы являются акцепторами электронной пары (кислоты Льюиса), т.е. могут образовывать четвертую ковалентную связь по донорно-акцепторному механизму, создавая которую, они изменяют геометрию своего окружения — она из плоской становится тетраэдрической (состояние sp3-гибридизации). Бор сильно отличается по свойствам от других элементов IIIA группы. Он является единственным неметаллом, химически инертен и образует ковалентные связи со фтором, азотом, углеродом и т.д. Химия бора более близка химии кремния, в этом проявляется Диагональное сходство. У атомов алюминия и его тяжелых аналогов появляются вакантные d-орбитали, возрастает радиус атома. Галлий, индий и таллий расположены в Периодической системе сразу за металлами d-блока, поэтому их часто называют постпереходными элементами. Заполнение d-оболочки сопровождается последовательным сжатием атомов, в 3d-pяду оно оказывается настолько сильным, что нивелирует возрастание радиуса при появлении четвертого энергетического уровня. В результате d-сжатия ионные радиусы алюминия и галлия близки, а атомный радиус галлия даже меньше, чем алюминия.
У атомов алюминия и его тяжелых аналогов появляются вакантные d-орбитали, возрастает радиус атома. Галлий, индий и таллий расположены в Периодической системе сразу за металлами d-блока, поэтому их часто называют постпереходными элементами. Заполнение d-оболочки сопровождается последовательным сжатием атомов, в 3d-pяду оно оказывается настолько сильным, что нивелирует возрастание радиуса при появлении четвертого энергетического уровня. В результате d-сжатия ионные радиусы алюминия и галлия близки, а атомный радиус галлия даже меньше, чем алюминия.
Для таллия, свинца, висмута и полония наиболее устойчивы соединения со степенью окисления +1, +2, +3, +4 соответственно.
| Свойство | B | Al | Ga | In | Tl |
| Заряд ядра Z | 5 | 13 | 31 | 49 | 81 |
| Электронная конфигурация в основном состоянии | [He]2s22p1 | [Ne]3s23p1 | [Ar]3d104s24p1 | [Kr]4d105s25p1 | [Xe]4f145d106s26p1 |
| Атомный радиус, нм | 0,083 | 0,143 | 0,122 | 0,163 | 0,170 |
| Энергия ионизации, кДж/моль: I1 I2 I3 | 801 2427 3660 | 577 1817 2745 | 579 1979 2963 | 558 1821 2704 | 589 1971 2878 |
| Электроотрицательность | 2,04 | 1,61 | 1,81 | 1,78 | 2,04 |
Для соединений элементов IIIA группы наиболее характерна степень окисления +3. В ряду бор-алюминий-галлий-индий-таллий устойчивость таких соединений уменьшается, а устойчивость соединений со степенью окисления +1, напротив, увеличивается. Энергия связи М—Hal в галогенидах последних при переходе от легких к более тяжелым элементам М уменьшаются, амфотерные свойства оксидов и гидроксидов смещаются в сторону большей основности, склонность катионов к гидролизу (взаимодействию с водой) ослабевает.
В ряду бор-алюминий-галлий-индий-таллий устойчивость таких соединений уменьшается, а устойчивость соединений со степенью окисления +1, напротив, увеличивается. Энергия связи М—Hal в галогенидах последних при переходе от легких к более тяжелым элементам М уменьшаются, амфотерные свойства оксидов и гидроксидов смещаются в сторону большей основности, склонность катионов к гидролизу (взаимодействию с водой) ослабевает.
Химия индия и особенно галлия вообще очень близка химии алюминия. Соединения этих металлов в низших степенях окисления (Ga2O, Ga2S, InCl и др.) в водных растворах диспропорционируют. Для таллия состояние +1, напротив, является наиболее устойчивым из-за инертности электронной пары 6s2.
общая характеристика, строение; свойства и получение простых веществ — урок. Химия, 8–9 класс.
Щелочными металлами называются химические элементы-металлы \(IA\) группы Периодической системы Д. И. Менделеева: литий \(Li\), натрий \(Na\), калий \(K\), рубидий \(Rb\), цезий \(Cs\) и франций \(Fr\).
Электронное строение атомов. На внешнем энергетическом уровне атомы щелочных металлов имеют один электрон ns1. Поэтому для всех металлов группы \(IA\) характерна степень окисления \(+1\).
Этим объясняется сходство свойств всех щелочных металлов.
Для них (сверху вниз по группе) характерно:
- увеличение радиуса атомов;
- уменьшение электроотрицательности;
- усиление восстановительных, металлических свойств.
Нахождение в природе. Из щелочных металлов наиболее широко распространены в природе натрий и калий. Но из-за высокой химической активности они встречаются только в виде соединений.
Основными источниками натрия и калия являются:
- каменная соль (хлорид натрия \(NaCl\)),
- глауберова соль, или мирабилит — декагидрат сульфата натрия Na2SO4 \(·\) 10h3O,
- сильвин — хлорид калия \(KCl\),
- сильвинит — двойной хлорид калия-натрия \(KCl\) \(·\)\(NaCl\) и др.

Соединения лития, рубидия и цезия в природе встречаются значительно реже, поэтому их относят к числу редких и рассеянных.
Физические свойства простых веществ. В твёрдом агрегатном состоянии атомы связаны металлической связью. Наличие металлической связи обусловливает общие физические свойства простых веществ-металлов: металлический блеск, ковкость, пластичность, высокую тепло- и электропроводность.
В свободном виде простые вещества, образованные элементами \(IA\) группы — это легкоплавкие металлы серебристо-белого (литий, натрий, калий, рубидий) или золотисто-жёлтого (цезий) цвета, обладающие высокой мягкостью и пластичностью.
Рис. \(1\). Литий
Рис. \(2\). Натрий
Наиболее твёрдым является литий, остальные щелочные металлы легко режутся ножом и могут быть раскатаны в фольгу.
Только у натрия плотность немного больше единицы ρ=1,01 г/см3, у всех остальных металлов плотность меньше единицы.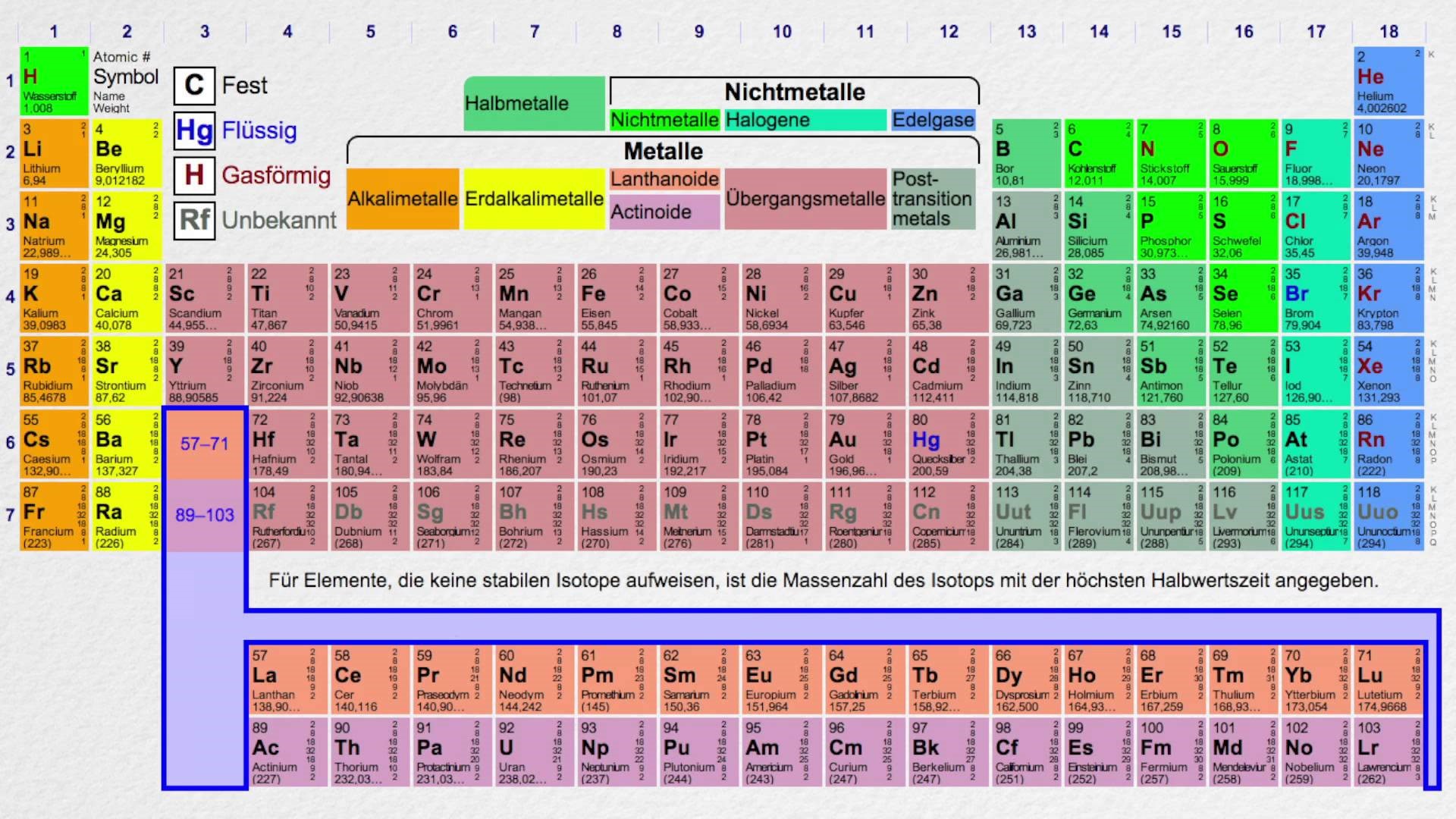
Химические свойства. Щелочные металлы обладают высокой химической активностью, реагируя с кислородом и другими неметаллами.
Поэтому хранят щелочные металлы под слоем керосина или в запаянных ампулах. Они являются сильными восстановителями.
Все щелочные металлы активно реагируют с водой, выделяя из неё водород.
Пример:
2Na+2h3O=2NaOH+h3↑.
Взаимодействие натрия с водой протекает с выделением большого количества теплоты (т. е. реакция является экзотермической). Кусочек натрия, попав в воду, начинает быстро двигаться по её поверхности. Под действием выделяющейся теплоты он расплавляется, превращаясь в каплю, которая, взаимодействуя с водой, быстро уменьшается в размерах. Если задержать её, прижав стеклянной палочкой к стенке сосуда, капля воспламенится и сгорит ярко-жёлтым пламенем.
Получение. Металлический натрий в промышленности получают главным образом электролизом расплава хлорида натрия с инертными (графитовыми) электродами.
В расплаве хлорида натрия присутствуют ионы:
NaCl⇄Na++Cl−.
При электролизе
на катоде восстанавливаются катионы Na+, а на аноде окисляются анионы Cl−:
катод (\(–\)): 2Na++2e=2Na,
анод (\(+\)): 2Cl−−2e=Cl2↑.
Суммарное уравнение реакции при электролизе расплава хлорида натрия:
2NaCl→2Na+Cl2↑.
Источники:
Рис. 1. Литий © ЯКласс
Рис. 2. Натрий © ЯКласс
Элементы: Самый неустойчивый – франций
Химический элемент — франций (символ Fr, атомный номер 87), выделяется среди своих собратьев по Таблице Менделеева двумя особенностями. Это самый тяжёлый и самый активный щелочной металл. Это самый неустойчивый элемент из обнаруженных в природе – период полураспада самого долгоживущего изотопа 223Fr составляет 22 минуты.
Элемент № 87 – франций, атомная масса – 223, 02 а.е.м.
Несмотря на то, что Франций был предсказан Менделеевым в 1871 году как эка-цезий, открыт он был лишь в 1939 году Маргаритой Перей в Институте радия в Париже.
Маргарита Перей (1909-1975), первооткрыватель франция.
Франций — один из редчайших элементов с общим содержанием в земной коре около 300 граммов. Среди элементов, найденных в земной коре, только астат (№ 85), возможно, имеет меньшее содержание. Весь природный франций — радиогенный и образуется как промежуточный продукт распада урана-235 и тория-232.
Так как франций не может быть получен в значимых количествах, его физико-химические свойства рассчитываются с учетом свойств других членов группы щелочных металлов. Согласно таким расчетам его плотность при нормальных условиях составляет 1,87 г/см³, температура плавления +27 °C, температура кипения +677 °C.
В связи с малым периодом полураспада и высокой радиоактивностью ожидать широкого использования элемента №87, конечно, не приходится. Поэтому в настоящее время франций интересен науке лишь с теоретической точки зрения.
Стоимость одного грамма 87-го элемента столь высока, что даже не объявляется.
Самый активный металл на Земле
Наиболее активными металлами являются элементы I и II групп, находящиеся с левой стороны периодической таблицы Менделеева. Металл считается активным, когда он сильно и быстро реагирует с другими элементами.Реакционная способность металла возрастает по мере того, как мы переходим от верхней к нижней части периодической таблицы.
Исключением является водород, который не считается металлом и размещен в верхнем левом углу периодической системы химических элементов Менделеева.
Самые активные металлы в мире
По реакционной способности металлических элементов, перечисленных в периодической таблице химических элементов, они подразделяются на три группы:
- Активные металлы.
- Средней активности металлы.
- Малоактивные металлы.
Наиболее активные металлы на Земле — литий, цезий и франций.
Цезий — самым активный из нерадиоактивных элементов. Это редкий серебристо-желтый блестящий металл с атомным числом (число протонов в ядре) 55. Это очень мягкий элемент, который будет таять в ваших руках — если не взорвется раньше, так как он сильно реагирует на влагу.
Caesium (Cs), номер – 55, атомная масса – 132,905Существует также очень радиоактивный элемент, франций, который может быть более активным, чем цезий. Или не может, мы, вероятно, никогда этого не узнаем, потому что франций не только крайне радиоактивный, но и крайне редкий металл.
Или не может, мы, вероятно, никогда этого не узнаем, потому что франций не только крайне радиоактивный, но и крайне редкий металл.
Последний из тройки наиболее активных металлов — литий — обладает интересным свойством. Он придает малиновый цвет языкам пламени.
Вот видео-демонстрация активности лития, натрия, калия, рубидия и цезия.
Что такое цезий
Цезий относится к щелочным металлам. Они очень реакционноспособны, и не встречаются свободно в природе. Эти металлы также очень пластичные, они хорошие тепловые и электрические проводники.
Цезий был первым элементом, который можно было обнаружить со спектроскопом. В 1860 году его открыли немецкие химики Роберт Бунзен и Густав Кирхгоф, когда анализировали спектр минеральной воды из Бад-Дюркхаймского источника.
Цезий встречается естественным образом в минералах поллуцита и лепидолита. Также он содержится во многих алюмосиликатах, таких как берилл, петалит и карналлит. Самое богатое из известных месторождений цезия находится в Канаде, на берегу озера Берник-Лейк. Там сосредоточено около 70% всех земных запасов. Любопытно, что это озеро является местом проведения ежегодного фестиваля цезия (24 февраля), когда в снегу сжигаются тонны этого вещества, и преобладает другое цезиевое безумие.
Самое богатое из известных месторождений цезия находится в Канаде, на берегу озера Берник-Лейк. Там сосредоточено около 70% всех земных запасов. Любопытно, что это озеро является местом проведения ежегодного фестиваля цезия (24 февраля), когда в снегу сжигаются тонны этого вещества, и преобладает другое цезиевое безумие.
А еще цезий является побочным продуктом ядерного деления в реакторах.
Свойства цезия
Пусть цезий и не самый тяжелый металл в мире, зато он самый активный и обладает рядом уникальных свойств:
- Он спонтанно горит на воздухе и моментально взрывается при контакте с водой или влагой в любой форме, даже со льдом до -116 С.
- Он горит блестящим голубым пламенем. Непосвященным пламя кажется пурпурным, а не синим, однако после достаточной медитации, изучения трудов по химии и блаженных часов, проведенных в благоговении перед тем, как горит цезий, раскрывается истинная синяя природа его пламени
- Название «цезий» происходит от двух ярко-синих линий в его эмиссионном спектре.
 В переводе с латинского «caesius» означает «небесно-синий».
В переводе с латинского «caesius» означает «небесно-синий». - Его гидроксид (жидкое расплавленное состояние) способен проесть плоть, стекло и многие другие вещества. Лишь металл родий и ряд его сплавов способны противостоять расплаву гидроксида цезия.
- Иодид и бромид цезия используются в качестве центральных компонентов при производстве высокоточной оптики, в том числе прицелов, очков и биноклей ночного видения. Цезий также экспериментально использовался в ионных силовых установках для космических аппаратов, из-за его низкого потенциала ионизации.
- Цезий используется при создании самых точных атомных часов. Даже лучшие наручные часы в мире могут отставать на несколько секунд или даже минуту. А вот атомные часы на основе цезия теряют всего одну секунду в пять миллиардов лет.
- Природный цезий состоит из одного стабильного изотопа, Cs 133. Известно 30 других радиоактивных изотопов, заполняющих диапазон от Cs 114 до Cs 145. Цезий-137 (он же радиоцезий) является одним из наиболее биологически опасных компонентов радиоактивных отходов и ядерных осадков.
Он накапливается в живых организмах и даже в грибах, а самое высокое его содержание обнаружено в у северных оленей и водоплавающих птиц в Северной Америке.
Люди и животные постоянно подвергаются воздействию минимального количеств цезия при еде, дыхании и питье. Хотя маловероятно, что мы будем болеть только из-за цезия, его длительное воздействие может привести к неблагоприятным последствиям для здоровья, включая тошноту, рвоту, кровотечение и повреждение клеток.
Цезий и лечение рака
Еще Парацельс утверждал, что все есть яд, и все есть лекарство. Дело лишь в дозировке. И когда речь заходит о цезии, то слова Парацельса абсолютно верны.
В настоящее время исследуется эффективность цезия для лечения нескольких форм рака, включая опухоли головного мозга. Цезий-131, радиоактивный изотоп цезия, вместе с другим радиоактивным изотопом (йодом-125) помещают в брахитерапевтическую капсулу («семя»).
По данным Американского общества брахитерапии, брахитерапевтическая капсула является радиоактивным «стручком», который помещается непосредственно в раковую ткань. Такие семена эффективны при нескольких формах рака, включая рак простаты, шейки матки и эндометрия.
Такие семена эффективны при нескольких формах рака, включая рак простаты, шейки матки и эндометрия.
В одном из исследований группе из 24 пациентов с опухолями головного мозга были имплантированы в опухоль брахиотерапевтические семена с цезием-131. Были отмечены минимальные побочные эффекты, но в целом пациенты хорошо перенесли эту форму лечения.
Идея использования семян брахитерапии с цезием-131 в качестве лечения рака возникла еще в 1960-х годах и была описана в исследовании, опубликованном в журнале « Радиология». В исследовании, опубликованном в журнале Medical Physics, в 2009 году обсуждалось использование семян цезия-131 для лечения рака предстательной железы с положительными результатами.
Необходимо больше исследований, прежде чем лечение цезием прочно займет свое место в медицине. Однако пока что исследования доказывают, что использование цезия-131 для лечения раковых опухолей при помощи брахиотерапии является обнадеживающим.
Сравнение цезия и франция
II группа главная подгруппа Периодической таблицы Менделеева (щелочноземельные металлы)
К щелочноземельным металлам относят химические элементы: двувалентные металлы, составляющие IIА группу:
Бериллий Be
магний Mg
кальций Ca,
стронций Sr,
барий Ba и
радий Ra.
Хотя бериллий Be по свойствам больше похож на алюминий, а магний Mg проявляет некоторые свойства щелочноземельных металлов, но в целом отличается от них.
Все щелочноземельные металлы — вещества серого цвета и гораздо более твердые, чем щелочные металлы.
Бериллий Be устойчив на воздухе. Магний и кальций (Mg и Ca) устойчивы в сухом воздухе. Стронций Sr и барий Ba хранят под слоем керосина.
Общая характеристка щелочноземельных металлов
От Be к Ra (сверху вниз в периодической таблице) происходит увеличение:
- атомного радиуса,
- металлических, основных, восстановительных свойств,
- реакционной способности.
Уменьшается
- электроотрицательность,
- энергия ионизация,
- сродство к электрону.
Электронные конфигурации у данных элементов схожи, все они содержат 2 электрона на внешнем уровне ns2:
Be — 2s2
Mg —3s2
Ca — 4s2
Sr — 5s2
Ba — 6s2
Ra — 7s2
Нахождение в природе щелочноземельных металлов
Как правило, щелочноземельные металлы в природе присутствуют в виде минеральных солей: хлоридов, бромидов, йодидов, карбонатов, нитратов и др.
Основные минералы, в которых присутствуют щелочноземельные металлы:
Способы получения щелочноземельных металлов
Магний
- Магний получают электролизом солей, чаще всего хлоридов: расплавленного карналлита (KCl·MgCl26H2O) или хлорида магния с добавками хлорида натрия при 720–750°С:
MgCl2 → Mg + Cl2
- восстановлением прокаленного доломита в электропечах при 1200–1300°С:
2(CaO · MgO) + Si → 2Mg + Ca2SiO4
Кальций
Кальций получают электролизом расплавленного хлорида кальция с добавками фторида кальция:
CaCl2 → Ca + Cl2
Барий
Барий получают алюмотермическим способом — восстановление оксида бария алюминием в вакууме при 1200 °C:
4BaO+ 2Al → 3Ba + Ba(AlO2)2
Химические свойства щелочноземельных металлов
Качественные реакции
- Окрашивание пламени солями щелочных металлов
Цвет пламени:
Ca — кирпично-красный
Sr — карминово-красный (алый)
Ba — яблочно-зеленый
- Взаимодействие с веществами:
Взаимодействие с простыми веществами — неметаллами
С кислородом
С кислородом взаимодействуют при нагревании с образованием оксидов
2Сa + O2 → 2CaO
Видео Горение кальция
С галогенами
(F, Cl, Br, I)
Щелочноземельные металлы реагируют с галогенами при нагревании с образованием галогенидов .
Сa + Cl2→ 2СaCl2
С водородом
Щелочноземельные металлы реагируют с водородом при нагревании с образованием гидридов:
Сa + H2 СaH2
Бериллий с водородом не взаимодействует.
Магний реагирует только при повышенном давлении:
Mg + H2 → MgH2
С серой
Щелочноземельные металлы при нагревании взаимодействуют с серой с образованием сульфидов сульфидов:
Сa + S СaS
Ca + 2C → CaC2 (карбиды)
С азотом
При комнатной температуре с азотом взаимодействует только магний с образованием нитрида:
6Mg + 2N2 → 2Mg3N2
Остальные щелочноземельные металлы реагируют с азотом при нагревании.
С углеродом
Щелочноземельные металлы реагируют с углеродом с образованием карбидов, преимущественно ацетиленидов:
Ca + 2C → CaC2
Бериллий при нагревании с углеродом с образует карбид — метанид:
2Be + C → Be2C
С фосфором
Щелочноземельные металлы при нагревании взаимодействуют с фосфором с образованием фосфидов:
3Сa + 2P Сa3 P2
Взаимодействие со сложными веществами
С водой
Кальций, стронций и барий взаимодействуют с водой при комнатной температуре с образованием щелочи и водорода:
Sr + 2H2O → Sr(OH)2 + H2↑,
Магний реагирует с водой при кипячении, а бериллий с водой не реагирует.
С кислотами
- С растворами HCl, H2SO4, H3PO4 щелочноземельные металлы взаимодействуют с образованием соли и выделением водорода:
Са + H2SO4(разб)= СаSO4 + H2
- С кислотами-окислителями (HNO3 и конц. H2SO4):
с концентрированной серной:
4Ca + 10H2SO4(конц) → 4CaSO4 + H2S↑ + 5H2O;
с разбавленной и концентрированной азотной:
4Sr + 5HNO3(конц) → 4Sr(NO3)2 + N2O +4H2O
С водными растворами щелочей
В водных растворах щелочей растворяется только бериллий:
Be + 2NaOH + 2H2O → Na2[Be(OH)4] + H2
С солями
В расплаве щелочноземельные металлы могут взаимодействовать с некоторыми солями:
Ca + CuCl2 → CaCl2 + Cu
Запомните! В растворе щелочноземельные металлы взаимодействуют с водой, а не с солями других металлов.
С оксидами
Щелочноземельные металлы могут восстанавливать из оксидов такие неметаллы как кремний, бор, углерод:
2Ca + SiO2 → 2CaO + Si
Магний сгорает в атмосфере углекислого газа с образованием оксида магния и сажи (С):
2Mg + CO2 → 2MgO + C
Амфотерные металлы, что это в химии
Амфотерные тела – это такие вещества, которые напоминают своим строением, характеристиками металлические элементы. К тому же им свойственна и химическая двойственность.
Амфотерные тела – это не металлы, а их формы: оксиды, соли и т. д. Ряд оксидов может сочетать в себе 2 свойства и при определенных условиях проявлять параметры как кислот, так и щелочей.
Известными не понаслышке амфотерными материалами является алюминий, хром, цинк и т. д.
Впервые сам термин «амфотерность» появился в начале 19 столетия. На тот период химические компоненты классифицировали на основании их похожих свойств, которые можно наблюдать во время протекания реакций.
На тот период химические компоненты классифицировали на основании их похожих свойств, которые можно наблюдать во время протекания реакций.
Амфотерные металлы: особенности, виды
Перечень амфотерных металлов немалый, причем далеко не все из них являются чистыми амфотерными, а лишь условными.
Вещества все обозначены в таблице Менделеева под определенными порядковыми номерами. Так, железо, бериллий, хром и стронций считаются основными аморфными элементами. Также типичным и распространенным в природе представителем является алюминий.
Металл алюминий повсеместно применяется в быту и промышленности в самых различных областях. Его используют для изготовления фюзеляжей самолетов, кухонной посуды, автомобильных кузовов, электрических приборов, электронной техники, приборов для тепловых сетей. Алюминий отличается от других металлов тем, что всегда остается химически активным. На поверхности стабильно располагается оксидная пленка, которая защищает материал от окисления. Благодаря этому при нормальных условиях и возникновении реакций металл с восстановительным веществом. Алюминий вступает в реакцию с кислородом, если предварительно был разделен на более мелкие фракции. Также для такой манипуляции потребуются повышенные температуры. Примечательно, что сама реакция продуцирует уйму тепловой энергии. Если повысить температуру до 200 ºC, то прореагировать алюминий может и с серой. При смешивании с различными металлами алюминий может давать различные функциональные сплавы с получением дополнительных свойств.
Благодаря этому при нормальных условиях и возникновении реакций металл с восстановительным веществом. Алюминий вступает в реакцию с кислородом, если предварительно был разделен на более мелкие фракции. Также для такой манипуляции потребуются повышенные температуры. Примечательно, что сама реакция продуцирует уйму тепловой энергии. Если повысить температуру до 200 ºC, то прореагировать алюминий может и с серой. При смешивании с различными металлами алюминий может давать различные функциональные сплавы с получением дополнительных свойств.
Не при всех условиях вещество вступает с реакцию с водородом.
Еще один типичный представитель амфотерных металлов – железо, который располагается под номером 26 в Таблице и находится между марганцем и кобальтом.
Железо считается одним из самых доступных элементов, залежи которого расположены в земной коре. Он одновременно является компонентом бело-серебристого цвета с хорошей ковкостью при высоких температурах. В то же время вещество может быть коррозировать при сильном нагревании.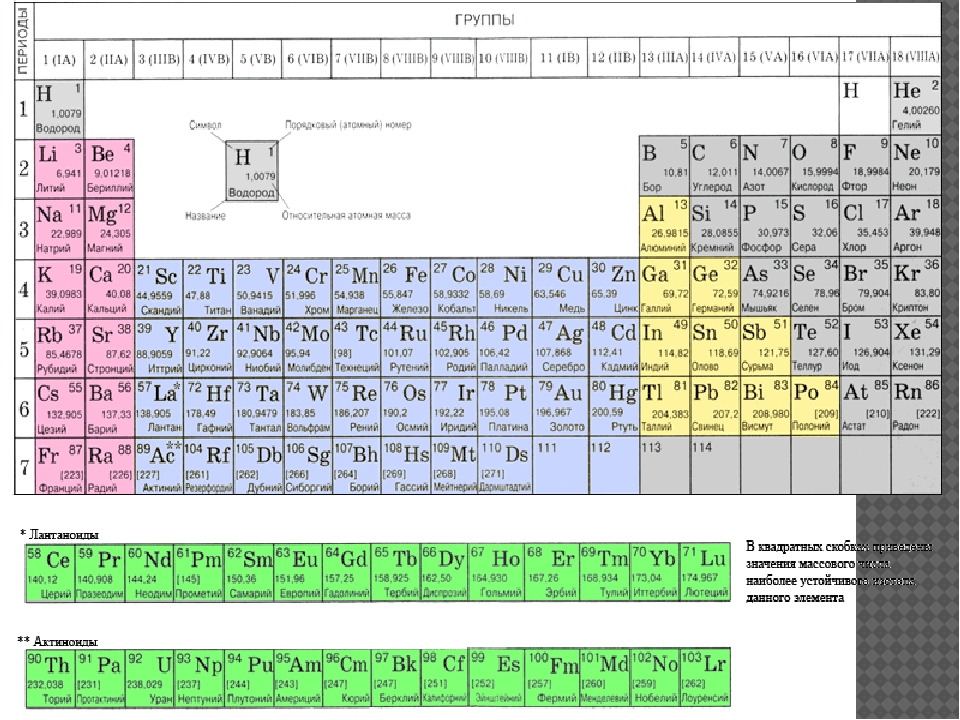 А в случае помещения его в среду чистого кислорода можно ожидать воспламенения и даже перегорания железа. Также, находясь на открытом воздухе, железо под воздействием высокой влажности начинает стремительно окисляться и даже ржаветь. А в процессе горения в массе с кислородом железо дает определенную окалину – это и есть его оксид.
А в случае помещения его в среду чистого кислорода можно ожидать воспламенения и даже перегорания железа. Также, находясь на открытом воздухе, железо под воздействием высокой влажности начинает стремительно окисляться и даже ржаветь. А в процессе горения в массе с кислородом железо дает определенную окалину – это и есть его оксид.
Свойства амфотерных веществ
Главные характеристики этих веществ заключены в самом понятии амфотерности. Так, в своем обычном состоянии при подходящих условиях внешней среды большинство металлов являются твердыми веществами. При этом ни один металл не растворим в обычной воде. А щелочные же основания могут выделяться только после начала некоторых химических реакций. И тогда в процессе соли в составе метала начинают реагировать. Необходимо обратить внимание, что правила безопасности требуют повышенной осторожности во время наблюдения за такими реакциями.
В процессе соединения амфотерных материалов с кислотными реагентами или оксидами они показывают химическую реакцию, характерную для оснований.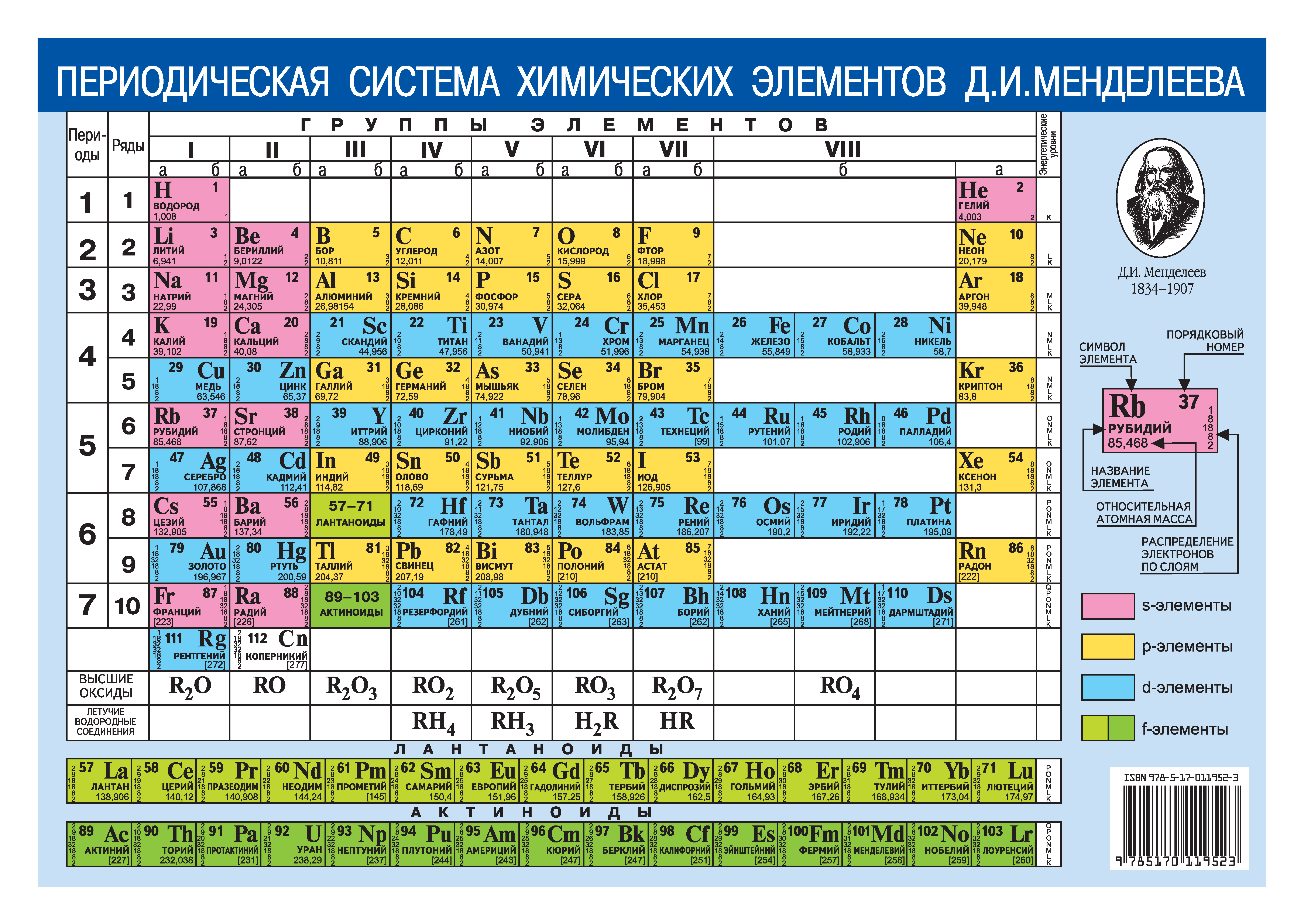 В случае, когда металлы реагируют с основаниями, регистрируются, наоборот кислотные характеристики.
В случае, когда металлы реагируют с основаниями, регистрируются, наоборот кислотные характеристики.
Если амфотерные гидроксиды подвергнуть нагреванию, то в результате они распадутся на оксид и воду.
Отметим, что амфотерные материалы обладают самыми различными свойствами, которые изучаются научными светилами до сих пор. Свойства также можно разобрать, сравнивая их с характеристиками обычных материалов. Так, многие металлы демонстрируют малый потенциал ионизации, что наделяет их свойствами восстановителя во время реакции.
Амфотерные тела демонстрируют сразу 2 свойства: окислительное и восстановительное. При этом некоторые соединения имеют отрицательный уровень окисления.
Все металлы, представленные в таблице Менделеева, образуют основные оксиды и гидроксиды.
Интересный момент – металлы могут окисляться далеко не со всеми кислотами в реакциях. Само окисление может не давать взаимодействие с азотной кислотой.
Простые амфотерные материалы имеют различную структуру и характеристики.
Некоторые вещества имеют такие характеристики, что их принадлежность к определенному классу можно выявить даже визуально. Так, мы сразу понимаем, что медь и алюминий – это металл.
Неметалл и металл: в чем же разница
Известно, что металлы выделяют электроны со своего внешнего электронного поля (облака). В свою очередь неметаллы притягивают такие электроны.
Также металлы хорошо проводят электроток и тепло, в отличие от неметаллов, полностью лишенных таких свойств.
Основания амфотерных маметиралов
При располагающих условиях основания нерастворимы в воде, можно сказать, являются довольно слабыми электролитами. Образуются они в результате химической реакции солей металла и щелочной жидкости. Такая химическая реакция опасна для лаборанта, поэтому для получения гидроксидов необходимо вводить едкие вещества осторожно, капля за каплей.
Амфотерные материалы реагируют с кислотами в роли оснований. В случае когда гидроксид цинка реагирует с соляной кислотой, то на выходе получится хлорид цинка. При реакции с основаниями материалы, напротив, выступают кислотами.
При реакции с основаниями материалы, напротив, выступают кислотами.
Щелочные металлы: факты об элементах в первой колонке Периодической таблицы
Щелочные металлы сейчас окружают вас повсюду. Натрий содержится в поваренной соли, литий — в батарее телефона, а калий — в бананах. Щелочные металлы состоят из шести различных элементов, содержащихся в первом столбце периодической таблицы. Это:
- литий (Li),
- натрия (Na),
- калий (K),
- рубидий (Rb),
- цезий (Cs)
- франций (Fr)
Они часть S-блока элементов периодической таблицы, которая, наряду с водородом, гелием, кальцием и другими, имеет внешний электрон на S-орбитали.Щелочные металлы — это мягкие металлы, которые обладают высокой реакционной способностью с водой и кислородом. Они такие мягкие, что их можно разрезать пластиковым ножом. Они также имеют серебристый блеск и являются отличными проводниками тепла и света.
Щелочные металлы называются так, потому что, реагируя с водой, они создают сильно щелочные вещества. Щелочность относится к pH вещества или способности нейтрализовать кислоту. Сильно щелочные вещества могут образовывать сильные основания, способные нейтрализовать кислоты и поддерживать стабильный уровень pH.
Щелочность относится к pH вещества или способности нейтрализовать кислоту. Сильно щелочные вещества могут образовывать сильные основания, способные нейтрализовать кислоты и поддерживать стабильный уровень pH.
У каждого элемента есть ядро, состоящее из протонов и нейтронов, и щелочные металлы не исключение. Ядра атомов окружают электроны — частицы с отрицательным зарядом. Эти электроны существуют в энергетических оболочках вокруг ядер атомов, каждый из которых может содержать различное количество электронов. Первая оболочка может содержать до двух электронов, вторая — до восьми, третья — 18, а четвертая — 32. Именно эти оболочки электронов и структура щелочных металлов делают их такими реактивными.
Естественно, что все атомы хотят иметь полностью полную внешнюю оболочку из электронов. Однако все элементы в этом первом столбце периодической таблицы имеют по одному электрону на внешней оболочке. Эта самая внешняя оболочка также называется валентной оболочкой, а находящиеся в ней электроны называются валентными электронами.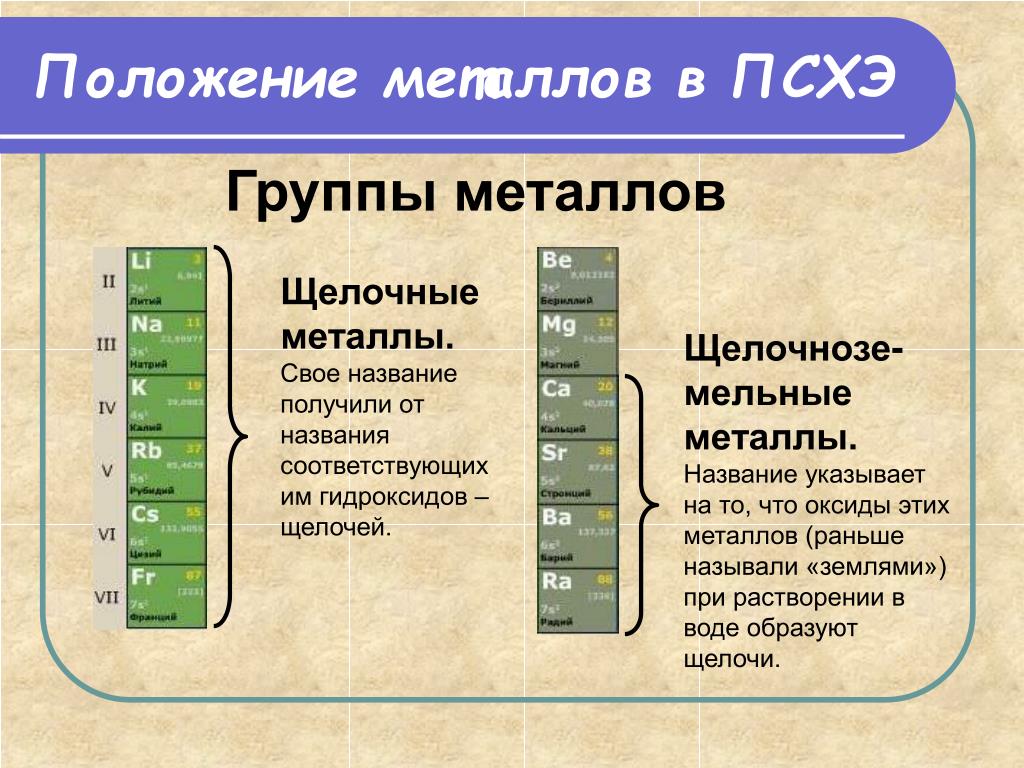
Наличие только одного электрона во внешней оболочке позволяет атомам щелочных металлов легко достигать точек стабильности — им просто нужно потерять один электрон! Эта готовность и легкость потери электрона для достижения состояния равновесия известна как высокая реактивность.Фактически, реакционная способность в химии определяется количеством электронов во внешней оболочке. Благородные газы (такие элементы, как неон и гелий) очень инертны, потому что их внешние электронные оболочки заполнены.
«Поскольку щелочные металлы имеют только один валентный электрон, они обычно достигают этого состояния, отдавая этот электрон. В этом процессе щелочной металл окисляется, и все, что отнимает электрон у щелочного металла, восстанавливается. Все щелочных металлов любят отдавать свой единственный валентный электрон », — говорит д-р.Чип Натаро, профессор химии в колледже Лафайет в Истоне, штат Пенсильвания. «Поскольку электроны имеют заряд -1, потеря электрона приводит к тому, что атом имеет заряд +1. Когда это происходит, атом называют ионом, а поскольку он будет иметь положительный заряд, его называют катионом. . Итак, все щелочные металлы любят образовывать катионы с зарядом +1 ».
Когда это происходит, атом называют ионом, а поскольку он будет иметь положительный заряд, его называют катионом. . Итак, все щелочные металлы любят образовывать катионы с зарядом +1 ».
Поскольку щелочные металлы обладают такой реакционной способностью, они обычно встречаются в природе вместе с другими металлами.
Если элемент имеет высокую реактивность, его сложнее найти естественным путем.
«Все эти элементы были впервые обнаружены в соединениях, [и] некоторые открытия трудно приписать из-за обилия и использования соединений», — говорит Натаро. «По мере того, как вы спускаетесь по таблице Менделеева, щелочные металлы становятся более склонными терять свой валентный электрон» и, таким образом, «количество элемента, обнаруженного в природе, также уменьшается, что приводит к более поздним датам открытия».
Когда были обнаружены щелочные металлы?
Литий был впервые обнаружен в 1817 году, когда шведский химик Йохан Август Арфведсон занимался анализом минеральной руды.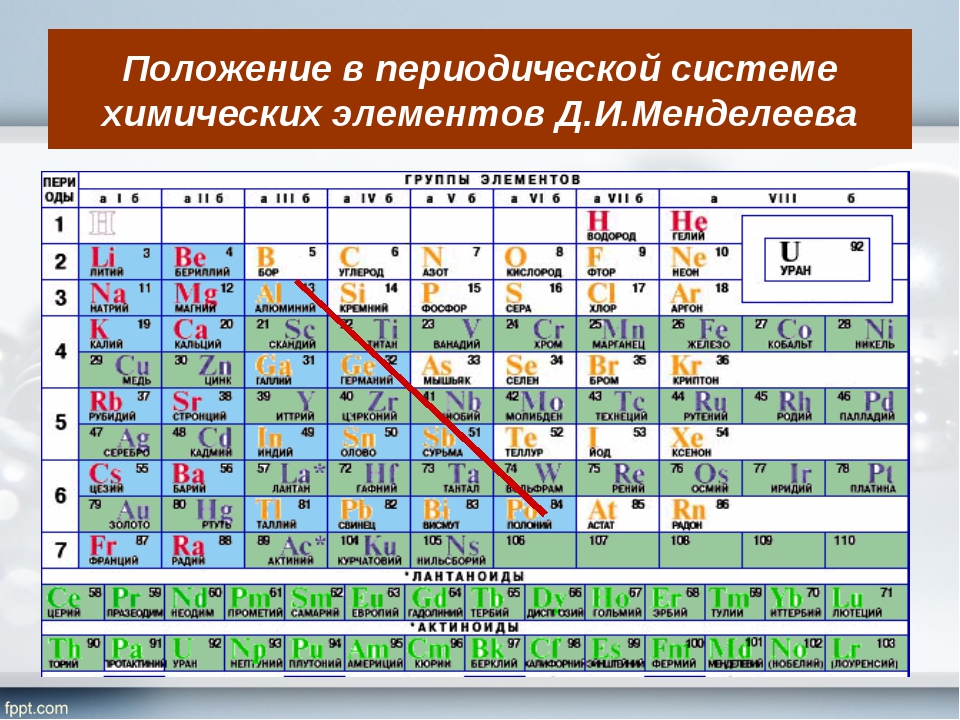 Цезий и рубидий были открыты в 1860 и 1861 годах, соответственно, немецкими химиками Робертом Бунзеном (назвавшим горелку Бунзена своим именем) и Густавом Кирхгофом (разработавшим законы Кирхгофа для электрического тока). Франций, наиболее реактивный из известных нам в настоящее время щелочных металлов, был открыт в 1939 году французским ученым Маргерит Перей в Институте Кюри в Париже.
Цезий и рубидий были открыты в 1860 и 1861 годах, соответственно, немецкими химиками Робертом Бунзеном (назвавшим горелку Бунзена своим именем) и Густавом Кирхгофом (разработавшим законы Кирхгофа для электрического тока). Франций, наиболее реактивный из известных нам в настоящее время щелочных металлов, был открыт в 1939 году французским ученым Маргерит Перей в Институте Кюри в Париже.
Натрий и калий, два очень распространенных щелочных металла, имеют неизвестные даты открытия, они так долго использовались.Но они не были выделены в чистом виде до 1807 года (известным химиком Хамфри Дэви). Рубидий не выделяли до 1928 года, также Бунзеном и Кирхгофом.
Одной из наиболее распространенных черт щелочных металлов является их реакционная способность к воде и воздуху. Эти элементы будут танцевать, шипя из-за образования газообразного водорода, и часто взрываются. Чем ниже по таблице Менделеева, тем больше они становятся реактивными, причем цезий и франций настолько реактивны, что могут загореться, просто оказавшись на воздухе.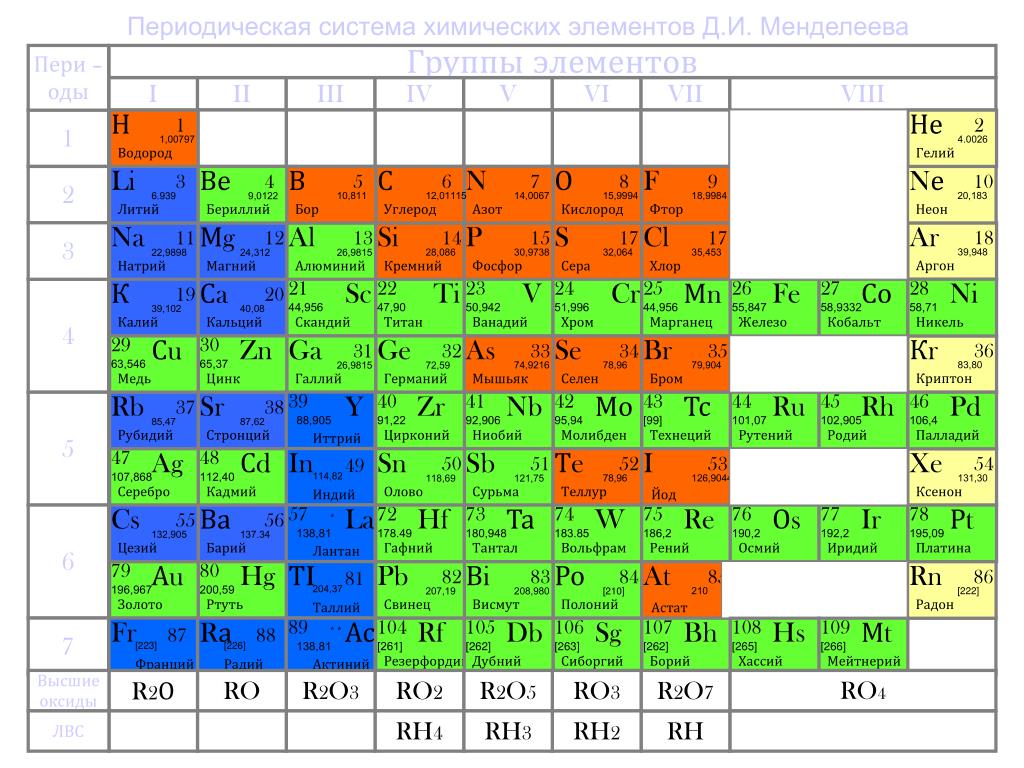 Элементы также увеличиваются в атомном радиусе, уменьшаются электроотрицательность и уменьшаются точки плавления и кипения по мере того, как вы перемещаетесь по таблице Менделеева.
Элементы также увеличиваются в атомном радиусе, уменьшаются электроотрицательность и уменьшаются точки плавления и кипения по мере того, как вы перемещаетесь по таблице Менделеева.
Вы можете задаться вопросом, как в природе вообще были открыты щелочные металлы, если они так бурно реагируют на воздух и воду. Оказывается, большинство щелочных металлов встречаются в природе в виде ионов из-за их сильного желания вступить в реакцию и потерять один валентный электрон. В ионной форме металлы гораздо менее химически активны.
Щелочные металлы в повседневной жизни
Щелочные металлы обладают интересной химической двойственностью, потому что они очень распространены в повседневной жизни, но также очень редко встречаются в необработанных элементарных формах.
Например, натрий не встречается в природе и должен быть получен из соединений. Натрий и калий являются важными элементами повседневной жизни, при этом натрий помогает регулировать кровяное давление и перемещать электролиты по клеткам. Натрий также соединяется с другими соединениями, чтобы сделать поваренную соль и пищевую соду. Калий помогает регулировать кровяное давление и уровень глюкозы, он содержится в удобрениях. Литий, как упоминалось ранее, используется в производстве батарей, а также является лекарством, стабилизирующим настроение.
Натрий также соединяется с другими соединениями, чтобы сделать поваренную соль и пищевую соду. Калий помогает регулировать кровяное давление и уровень глюкозы, он содержится в удобрениях. Литий, как упоминалось ранее, используется в производстве батарей, а также является лекарством, стабилизирующим настроение.
Более химически активные элементы, цезий, рубидий и франций, имеют меньшее естественное применение.Цезий используется в атомных часах, сверлении и создании оптического стекла среди других узкоспециализированных приложений. Рубидий используется в медицинской визуализации и электронных лампах. Франций, который встречается очень редко, не имеет большого коммерческого применения, но используется в исследованиях и для диагностики некоторых форм рака.
Наконец, все щелочные металлы также являются невероятно полезными учебными пособиями в области химии. Учителя любят демонстрировать принцип реактивности, роняя щелочной металл в воду только для того, чтобы класс с трепетом наблюдал, как он изрыгает огонь и взрывается.
Металлы | Безграничная химия
Щелочные металлы
Щелочные металлы — это химические элементы из s-блока периодической таблицы. Они обладают гомологичными физическими и химическими свойствами.
Цели обучения
Вспомните периодические тенденции, наблюдаемые в щелочных металлах.
Основные выводы
Ключевые моменты
- Щелочные металлы — это группа химических элементов из s-блока периодической таблицы со схожими свойствами: они кажутся серебристыми и их можно разрезать пластиковым ножом.
- Щелочные металлы обладают высокой реакционной способностью при стандартной температуре и давлении и легко теряют свой внешний электрон с образованием катионов с зарядом +1.
- Все обнаруженные щелочные металлы встречаются в природе.
- У большинства щелочных металлов есть много различных применений, таких как атомные часы рубидия и цезия, натриевые лампы и поваренная соль.
Ключевые термины
- щелок : Сильный едкий щелочной раствор солей калия или натрия, полученный выщелачиванием древесной золы.
 Он широко используется в производстве мыла, а также в биодизеле.
Он широко используется в производстве мыла, а также в биодизеле. - щелочной металл : Любой из мягких, легких, химически активных металлов группы 1 периодической таблицы Менделеева; литий, натрий, калий, рубидий, цезий и франций.
- атомные часы цезия : основной стандарт частоты, в котором электронные переходы между двумя сверхтонкими основными состояниями атомов цезия-133 используются для управления выходной частотой.
Щелочные металлы — это группа химических элементов в периодической таблице со следующими физическими и химическими свойствами:
- блестящий
- мягкий
- серебристый
- высокореактивный при стандартной температуре и давлении
- легко теряют свой крайний электрон, образуя катионы с зарядом +1
Все они легко режутся пластиковым ножом благодаря своей мягкости, а их блестящая поверхность быстро тускнеет на воздухе из-за окисления.Из-за их высокой реакционной способности щелочные металлы должны храниться под маслом, чтобы предотвратить реакцию с воздухом. В современной номенклатуре ИЮПАК щелочные металлы включают элементы группы 1, за исключением водорода. Все щелочные металлы реагируют с водой, причем более тяжелые щелочные металлы реагируют более энергично, чем более легкие.
В современной номенклатуре ИЮПАК щелочные металлы включают элементы группы 1, за исключением водорода. Все щелочные металлы реагируют с водой, причем более тяжелые щелочные металлы реагируют более энергично, чем более легкие.
Щелочные металлы : Литий хранится в масле из-за его высокой реакционной способности.
Периодические изменения щелочных металлов
Щелочные металлы: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).Эта группа находится в s-блоке периодической таблицы, поскольку у всех щелочных металлов крайний электрон находится на s-орбитали. Щелочные металлы представляют собой лучший пример групповых тенденций в свойствах в периодической таблице с элементами, демонстрирующими аналогичные свойства. Например, при движении вниз по таблице все известные щелочные металлы показывают:
- увеличение атомного радиуса,
- уменьшение электроотрицательности
- повышение реактивности
- понижение температуры плавления и кипения
Как правило, их плотность увеличивается при движении вниз по столу, за исключением калия, который менее плотен, чем натрий.
Реакции щелочных металлов
Щелочные металлы бурно реагируют с водой, галогенами и кислотами. В результате реакции выделяется удивительное количество тепла и света. В химическом уравнении щелочные металлы представлены буквой M. Вот несколько примеров уравнений реакции:
- Щелочные металлы реагируют с кислородом с образованием оксидов, которые имеют более тусклый вид и более низкую реакционную способность. Оксиды гораздо менее химически активны, чем чистые металлы.
[латекс] 4 {\ text {M}} _ {(\ text {s})} + {\ text {O}} _ {2 (\ text {g})} \ rightarrow 2 {\ text {M }} _ {2} \ text {O} [/ latex]
- Оксиды активно реагируют с водой с образованием гидроксида.Образующиеся гидроксиды этих элементов полностью диссоциируют в воде с образованием некоторых из самых сильных из известных оснований. Гидроксид натрия (NaOH), также называемый щелочью, представляет собой промышленную основу.
[латекс] {\ text {M}} _ {2} \ text {O} _ {(\ text {s})} + \ text {H} _ {2} {\ text {O}} \ rightarrow 2 \ text {MOH} _ {(\ text {aq})} [/ latex]
- Чистый щелочной металл также может напрямую реагировать с водой. В этом случае металл представляет собой основной ангидрид. Выделяется газообразный водород, который легко воспламеняется.
[латекс] 2 {\ text {M}} _ {(\ text {s})} +2 {\ text {H}} _ {2} \ text {O} \ rightarrow 2 \ text {MOH} _ {(\ text {aq})} + {\ text {H}} _ {2 (\ text {g})} [/ latex]
- Воздействие галогена на щелочной металл вызывает чрезвычайно экзотермическую реакцию, в результате которой образуется ионная соль. Почти каждая соль щелочного металла хорошо растворяется в воде. Они образуют проводящие растворы, что доказывает их ионную природу.
[латекс] 2 {\ text {M}} _ {(\ text {s})} + {\ text {Cl}} _ {2 (\ text {g})} \ rightarrow 2 \ text {MCl} _ {(\ text {s})} [/ latex]
Встречаемость в природе
Все обнаруженные щелочные металлы встречаются в природе.Были проведены эксперименты, чтобы попытаться синтезировать унунениум (Uue), который, вероятно, станет следующим членом группы, если попытка окажется успешной. Предполагается, что следующим щелочным металлом после унунения будет негэкспентиум (Uhp), элемент, который еще не получил даже попыток синтеза из-за его чрезвычайно высокого атомного номера.
Применение щелочных металлов
Большинство щелочных металлов находят множество различных применений. Двумя наиболее известными применениями чистых элементов являются атомные часы рубидия и цезия, из которых атомные часы цезия являются наиболее точным представлением времени, известным по состоянию на 2012 год.Обычно соединения натрия используются в натриевых лампах, излучающих очень эффективный свет. С другой стороны, поваренная соль или хлорид натрия использовались с древних времен.
Щелочноземельные металлы
Щелочноземельные металлы — это химические элементы в s-блоке периодической таблицы с очень похожими физическими и химическими свойствами.
Цели обучения
Предскажите степень окисления щелочноземельного металла.
Основные выводы
Ключевые моменты
- Щелочноземельные металлы — это блестящие, серебристо-белые металлы, обладающие некоторой реакционной способностью при стандартной температуре и давлении.
- Все щелочноземельные металлы легко теряют два своих внешних электрона с образованием катионов с зарядом 2+.
- Все щелочноземельные металлы, кроме магния и стронция, содержат по крайней мере один радиоизотоп природного происхождения.
- Магний и кальций присутствуют повсеместно и необходимы всем известным живым организмам.
Ключевые термины
- Щелочноземельные металлы : Группа химических элементов в периодической таблице со схожими свойствами: блестящие, серебристо-белые, несколько реактивные при стандартной температуре и давлении.Они легко теряют два своих крайних электрона с образованием катионов с зарядом +2.
Свойства щелочноземельных металлов
Щелочноземельные металлы (бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra)) представляют собой группу химических элементов в s-блоке таблица Менделеева с очень похожими свойствами:
- блестящий
- серебристо-белый
- несколько реактивных металлов при стандартных температуре и давлении
- легко теряют два своих крайних электрона с образованием катионов с зарядом 2+
- низкой плотности
- низкая температура плавления
- низкая температура кипения
Щелочноземельные металлы включают элементы 2 группы.Все обнаруженные щелочноземельные металлы встречаются в природе.
Реакции щелочноземельных металлов
Все щелочноземельные металлы имеют два электрона в валентной оболочке, поэтому они теряют два электрона, образуя катионы с зарядом 2+. Большая часть химии наблюдалась только у первых пяти членов группы; химический состав радия не изучен из-за его радиоактивности.
С химической точки зрения все щелочные металлы реагируют с галогенами с образованием ионных галогенидов щелочноземельных металлов.Все щелочноземельные металлы, за исключением бериллия, также реагируют с водой с образованием сильнощелочных гидроксидов, с которыми следует обращаться с большой осторожностью. Более тяжелые щелочноземельные металлы реагируют более энергично, чем более легкие.
Щелочные металлы имеют вторые по величине первые энергии ионизации в соответствующие периоды периодической таблицы Менделеева. Это происходит из-за их низких эффективных ядерных зарядов и способности достичь полной конфигурации внешней оболочки, потеряв всего два электрона. Вторая энергия ионизации всех щелочных металлов также несколько мала.
Бериллий — исключение. Он не реагирует с водой или паром, а его галогениды ковалентны. Все соединения, в состав которых входит бериллий, имеют ковалентную связь. Даже фторид бериллия, который является наиболее ионным соединением бериллия, имеет низкую температуру плавления и низкую электропроводность при плавлении.
Вот список некоторых обычных реакций щелочноземельных металлов, где E = элементы, которые действуют как восстановители:
- Металлы восстанавливают галогены с образованием ионных галогенидов: [латекс] \ text {E} _ {(\ text {s})} + \ text {X} _ {2} \ rightarrow \ text {EX} _ {2 ( \ text {s})} [/ latex] где X = F, Cl, Br или I
- Металлы восстанавливают O2 с образованием оксидов:
[латекс] 2 \ text {E} _ {(\ text {s})} + \ text {O} _ {2} \ rightarrow 2 \ text {EO} _ {(\ text {s})} [ / латекс]
- Более крупные металлы реагируют с водой с образованием газообразного водорода: [латекс] \ text {E} _ {(\ text {s})} +2 \ text {H} _ {2} \ text {O} _ {( \ text {l})} \ rightarrow \ text {E} _ {(\ text {aq})} ^ {2+} +2 \ text {OH} _ {(\ text {aq})} ^ {-} + \ text {H} _ {2 (\ text {g})} [/ latex], где E = Ca, Sr или Ba
- Металлы подвергаются реакциям трансметаллирования с обменом лигандов: [латекс] \ text {Ae} + \ text {Hg} {\ {\ text {N} (\ text {SiMe} _ {3}) _ {2} \} _ {2}} \ rightarrow [\ text {Ae} \ {{\ text {N} (\ text {SiMe} _ {3}) _ {2} \} _ {2}} (\ text {THF}) _ {2}] [/ latex], где Ae = Ca, Sr или Ba.
Соединения щелочноземельных металлов
- Галогениды алкилмагния (RMgX, где R = углеводородная группа и X = галоген) используются для синтеза органических соединений. Вот пример: [латекс] 3 \ text {RMgCl} + \ text {SnCl} _ {4} \ rightarrow 3 \ text {MgCl} _ {2} + \ text {R} _ {3} \ text {SnCl} [/ латекс]
- Оксид магния (MgO) используется в качестве материала для преломления печного кирпича и изоляции проводов (температура плавления 2852 ° C).
- Карбонат кальция (CaCO 3 ) в основном используется в строительной промышленности и для производства известняка, мрамора, мела и кораллов.
Радиоактивность
Все щелочноземельные металлы, за исключением магния и стронция, содержат по крайней мере один радиоизотоп природного происхождения: бериллий-7, бериллий-10 и кальций-41 являются радиоизотопами в следовых количествах. Кальций-48 и барий-130 имеют очень длительный период полураспада и поэтому встречаются в природе. Все изотопы радия радиоактивны.
Встречаемость в природе
Изумруд — это встречающееся в природе соединение бериллия. В земной коре содержится большое количество кальция и магния, которые составляют несколько важных породообразующих минералов, таких как доломит (долостон) и кальцит (известняк).Остальные нерадиоактивные члены группы присутствуют только в меньших количествах. Месторождения каждого из этих минералов разрабатываются для извлечения элементов для дальнейшего использования. Радий с максимальным периодом полураспада 1601 год присутствует в природе только тогда, когда он пополняется цепочкой распада в результате радиоактивного распада более тяжелых элементов.
Изумруд : Изумруд — это разновидность берилла, минерала, содержащего щелочноземельный металл бериллий. Бериллий встречается в природе только в сочетании с другими элементами в минералах.
Биологическая роль и токсичность щелочноземельных металлов
Магний и кальций необходимы всем известным живым организмам. Они задействованы более чем в одной роли. Например, насосы ионов магния или кальция играют роль в некоторых клеточных процессах. Магний действует как активный центр некоторых ферментов, а соли кальция играют структурную роль в костях.
Стронций играет важную роль в морской водной жизни, особенно в твердых кораллах, которые используют стронций для создания своих экзоскелетов.Стронций и барий находят применение в медицине. Например, «бариевая мука» используется в радиографической визуализации, а соединения стронция используются в некоторых зубных пастах.
Однако бериллий и радий токсичны. Низкая растворимость бериллия в воде означает, что он редко доступен для биологических систем. Его роль в живых организмах неизвестна, и, когда они встречаются, он обычно очень токсичен. Радий имеет низкую доступность и очень радиоактивен, что делает его токсичным для жизни.
Алюминий
Алюминий — мягкий серебристый металл из группы бора периодической таблицы.
Цели обучения
Опишите свойства алюминия.
Основные выводы
Ключевые моменты
- Алюминий — мягкий, легкий и ковкий серебристый металл, не растворяющийся в воде.
- В подавляющем большинстве соединений алюминий имеет степень окисления 3+, но известны соединения со степенью окисления +1 и +2.
- Алюминий содержит много известных изотопов, массовые числа которых находятся в диапазоне от 21 до 42.
- Алюминий является наиболее широко используемым цветным металлом и в основном легирован, что улучшает его механические свойства.
Ключевые термины
- алюминий : металлический химический элемент (обозначение Al) с атомным номером 13.
- пассивация : Относится к материалу, который становится «пассивным», то есть меньше подвержен влиянию факторов окружающей среды, таких как воздух или вода.
Физические свойства алюминия
Алюминий это:
- относительно мягкий
- прочный
- легкий
- пластичный
- податливый
- внешний вид от серебристого до тускло-серого
- не растворяется в воде при нормальных условиях
- немагнитный
- плохо воспламеняется
- способный быть сверхпроводником
Химические свойства
Алюминий устойчив к коррозии из-за явления пассивации.Когда металл подвергается воздействию воздуха, образуется тонкий поверхностный слой оксида алюминия. Этот оксидный слой защищает находящийся под поверхностью алюминий от дальнейшего окисления. Как и многие другие металлы, алюминий также может окисляться водой с образованием водорода и тепла:
[латекс] 2 \ text {Al} \ quad + \ quad 3 {\ text {H}} _ {2} \ text {O} \ quad \ longrightarrow \ quad {\ text {Al}} _ {2} { \ text {O}} _ {3} +3 {\ text {H}} _ {2} [/ latex]
Хотя алюминий чрезвычайно легко окисляется, можно удалить оксидный слой с образца без его немедленного риформинга.Самый простой и безопасный способ — подключить батарею к образцу и провести электролиз либо в инертной атмосфере (например, газообразный аргон), либо в условиях вакуума.
Подавляющее большинство соединений алюминия имеют металл в степени окисления 3+. Координационное число алюминия может варьироваться, но обычно Al 3+ является тетра- или гексакоординированным. Это означает, что у него будет 4 или 6 лигандов.
Галогениды алюминия: использование в качестве кислот Льюиса
Алюминий — очень реактивный металл, который легко вступает в реакцию с трехвалентными соединениями продукта.Его галогениды (AlF 3 , AlCl 3 , AlBr 3 и AlI 3 ) являются общими примерами. Трехвалентный алюминий является электронодефицитным и поэтому исключительно полезен в качестве кислоты Льюиса, особенно в органическом синтезе.
Гидриды алюминия и алюминийорганические соединения
Существует множество соединений эмпирической формулы AlR 3 и AlR 1,5 Cl 1,5 . Эти разновидности обычно имеют тетраэдрические центры Al. С большими органическими группами триорганоалюминий существует в виде трехкоординированных мономеров, таких как триизобутилалюминий.
Важным гидридом алюминия является алюмогидрид лития (LiAlH 4 ), который используется в качестве восстановителя в органической химии. Его можно производить из гидрида лития и трихлорида алюминия:
[латекс] 4 \ text {LiH} \ quad + \ quad \ text {Al} {\ text {Cl}} _ {3} \ quad \ longrightarrow \ quad \ text {LiAl} {\ text {H}} _ {4} \ quad + \ quad 3 \ text {LiCl} [/ латекс]
Алюминий общего назначения
Алюминий — наиболее широко используемый цветной металл. Алюминий почти всегда легирован, что заметно улучшает его механические свойства, особенно при отпуске.Например, обычная алюминиевая фольга и банки для напитков представляют собой сплавы с содержанием алюминия от 92% до 99%. Некоторые из многих применений металлического алюминия находятся в:
- Транспортировка листов, труб, отливок и т. Д.
- Упаковка (банки, фольга и др.)
- Строительство (окна, двери, сайдинг, строительная проволока и т. Д.)
- Широкий ассортимент предметов домашнего обихода, от кухонной утвари до бейсбольных бит и часов
- Столбы уличного освещения, мачты парусных судов, прогулочные шесты и т. Д.
- Наружные корпуса бытовой электроники, а также корпуса для оборудования (например, фотоаппаратуры)
- Линии электропередачи для распределения электроэнергии
- Алюминий особой чистоты, используемый в электронике и компакт-дисках
- Радиаторы для электронных устройств, таких как транзисторы и процессоры
- Материал подложки из ламината с металлической сердцевиной, плакированного медью, используемого в светодиодном освещении высокой яркости
- Алюминий порошковый, используемый в красках и пиротехнике
- Множество стран, включая Францию, Италию, Польшу, Финляндию, Румынию, Израиль и бывшую Югославию, выпустили монеты, отчеканенные из алюминия или алюминиево-медных сплавов
Использование алюминия в транспорте : Austin «A40 Sports» в алюминиевом корпусе (ок.1951).
Щелочные металлы | Введение в химию
Цель обучения
- Вспомните периодические тенденции, наблюдаемые в щелочных металлах.
Ключевые моменты
- Щелочные металлы представляют собой группу химических элементов из s-блока периодической таблицы со схожими свойствами: они кажутся серебристыми и их можно разрезать пластиковым ножом.
- Щелочные металлы обладают высокой реакционной способностью при стандартной температуре и давлении и легко теряют свой внешний электрон с образованием катионов с зарядом +1.
- Все обнаруженные щелочные металлы встречаются в природе.
- У большинства щелочных металлов есть много различных применений, таких как атомные часы рубидия и цезия, натриевые лампы и поваренная соль.
Условия
- атомные часы цезия Основной стандарт частоты, в котором электронные переходы между двумя сверхтонкими основными состояниями атомов цезия-133 используются для управления выходной частотой.
- щелочной металл — любой из мягких, легких, химически активных металлов группы 1 периодической таблицы; литий, натрий, калий, рубидий, цезий и франций.
- щелок Сильный едкий щелочной раствор солей калия или натрия, полученный выщелачиванием древесной золы. Он широко используется в производстве мыла, а также в биодизеле.
Щелочные металлы представляют собой группу химических элементов в периодической таблице со следующими физическими и химическими свойствами:
- блестящий
- мягкий
- серебристый
- высокореактивный при стандартной температуре и давлении
- легко теряют свой крайний электрон, образуя катионы с зарядом +1
Все они легко режутся пластиковым ножом благодаря своей мягкости, а их блестящая поверхность быстро тускнеет на воздухе из-за окисления.Из-за их высокой реакционной способности щелочные металлы должны храниться под маслом, чтобы предотвратить реакцию с воздухом. В современной номенклатуре ИЮПАК щелочные металлы включают элементы группы 1, за исключением водорода. Все щелочные металлы реагируют с водой, причем более тяжелые щелочные металлы реагируют более энергично, чем более легкие.
Щелочные металлы Литий хранится в масле из-за его высокой реакционной способности.Периодические изменения щелочных металлов
Щелочные металлы: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).Эта группа находится в s-блоке периодической таблицы, поскольку у всех щелочных металлов крайний электрон находится на s-орбитали. Щелочные металлы представляют собой лучший пример групповых тенденций в свойствах в периодической таблице с элементами, демонстрирующими аналогичные свойства. Например, при движении вниз по таблице все известные щелочные металлы показывают:
- увеличение атомного радиуса,
- уменьшение электроотрицательности
- повышение реактивности
- понижение температуры плавления и кипения
Как правило, их плотность увеличивается при движении вниз по столу, за исключением калия, который менее плотен, чем натрий.
Реакции щелочных металлов
Щелочные металлы бурно реагируют с водой, галогенами и кислотами. В результате реакции выделяется удивительное количество тепла и света. В химическом уравнении щелочные металлы представлены буквой M. Вот несколько примеров уравнений реакции:
- Щелочные металлы реагируют с кислородом с образованием оксидов, которые имеют более тусклый вид и более низкую реакционную способность. Оксиды гораздо менее химически активны, чем чистые металлы.
[латекс] 4 {M} _ {(s)} + {O} _ {2 (g)} \ rightarrow 2 {M} _ {2} O [/ латекс]
- Оксиды активно реагируют с водой с образованием гидроксида.Образующиеся гидроксиды этих элементов полностью диссоциируют в воде с образованием некоторых из самых сильных из известных оснований. Гидроксид натрия (NaOH), также называемый щелочью, представляет собой промышленную основу.
[латекс] {M} _ {2} O_ {(s)} + H_ {2} {O} \ rightarrow 2MOH_ {(aq)} [/ латекс]
- Чистый щелочной металл также может напрямую реагировать с водой. В этом случае металл представляет собой основной ангидрид. Выделяется газообразный водород, который легко воспламеняется.
[латекс] 2 {M} _ {(s)} +2 {H} _ {2} O \ rightarrow 2MOH_ {(aq)} + {H} _ {2 (g)} [/ латекс]
- Воздействие галогена на щелочной металл вызывает чрезвычайно экзотермическую реакцию, в результате которой образуется ионная соль.Почти каждая соль щелочного металла хорошо растворяется в воде. Они образуют проводящие растворы, что доказывает их ионную природу.
[латекс] 2 {M} _ {(s)} + {Cl} _ {2 (g)} \ rightarrow 2MCl_ {(s)} [/ латекс]
Встречаемость в природе
Все обнаруженные щелочные металлы встречаются в природе. Были проведены эксперименты, чтобы попытаться синтезировать унунениум (Uue), который, вероятно, станет следующим членом группы, если попытка окажется успешной. Предполагается, что следующим щелочным металлом после унунения будет негэкспентиум (Uhp), элемент, который еще не получил даже попыток синтеза из-за его чрезвычайно высокого атомного номера.
Применение щелочных металлов
Большинство щелочных металлов находят множество различных применений. Двумя наиболее известными применениями чистых элементов являются атомные часы рубидия и цезия, из которых атомные часы цезия являются наиболее точным представлением времени, известным по состоянию на 2012 год. Обычно соединения натрия используются в натриевых лампах. , который излучает очень эффективный свет. С другой стороны, поваренная соль или хлорид натрия использовались с древних времен.
Показать источникиBoundless проверяет и курирует высококачественный контент с открытой лицензией из Интернета.Этот конкретный ресурс использовал следующие источники:
Группа 1: Щелочные металлы
Корпускуляризм
Корпускуляризм — это теория, предложенная Декартом, согласно которой вся материя состоит из крошечных частиц.
Рене Декарт
Рене Декарт был известным математиком и философом 16 века, который выдвинул гипотезу корпускулярной теории об атоме
Блеск
Блеск — это термин, обозначающий отражающую поверхность, которая отражает свет, дающий блестящий вид.
Полупроводники
Полупроводники — это термин для описания металлоидов, которые могут проводить ток, когда электрическая энергия подается из-за движения электронов, но измерения проводимости не такие высокие, как у металлов, из-за меньшего количества электронов, переносящих заряд или менее упорядоченная структура.
Ионное соединение
Ионное соединение — это связь, которая образуется между металлами и неметаллами с образованием большой ионной решетки
Ядерный синтез
Ядерный синтез — это процесс, который происходит в.солнце. Атомы водорода под воздействием большого количества тепла и давления вынуждены вместе образовывать более крупный атом гелия
Принцип неопределенности
Принцип неопределенности Гейзенберга используется для описания взаимосвязи между импульсом и положением электрона. Где, если известно точное положение электрона, импульс будет неопределенным.
Гейзенберг
Вернер Гейзенберг был немецким физиком, пионером в области квантовой механики. Он разработал принцип неопределенности, связанный с импульсом и положением электрона.
Лепестки
Лепестки относятся к форме электронных волн и области наибольшей вероятности того, где этот электрон как частица будет обнаружен.
Принцип исключения Паули
Исключение Паули относится к теории, согласно которой каждый электрон может иметь только уникальный набор из 4 квантовых чисел, и никакие два электрона не могут иметь одинаковые квантовые числа
Квантовые числа
Квантовые числа — это используемый термин описать присвоение чисел электронам как математическую функцию для описания их импульса и энергии.
Модель Бора
Модель Бора рассматривает электроны как частицы, вращающиеся вокруг ядра.
Квантовая механика
Термин квантовая механика относится к уровням энергии и теоретической области физики и химии, где математика используется для объяснения поведения субатомных частиц.
Впадина
Впадина — это самая низкая точка на поперечной волне.
Пик
Пик — это самая высокая точка на поперечной волне.
Режимы вибрации
Режимы вибрации — это термин, используемый для описания постоянного движения в молекуле. Обычно это колебания, вращения и переводы.
Эрвин Шредингер
Эрвин Шредингер был австрийским физиком, который использовал математические модели для улучшения модели Бора электрона и создал уравнение для предсказания вероятности нахождения электрона в заданном положении.
Щелочной металл
Щелочные металлы, входящие в группу 1 периодической таблицы (формально известную как группа IA), настолько реактивны, что обычно встречаются в природе в сочетании с другими элементами.Щелочные металлы — это блестящие, мягкие, высокореактивные металлы при стандартной температуре и давлении.
Щелочноземельные металлы
Щелочноземельные металлы — вторая по активности группа элементов в периодической таблице. Они находятся в группе 2 периодической таблицы (формально известной как группа IIA).
Неизвестные элементы
Неизвестные элементы (или трансактиниды) — самые тяжелые элементы периодической таблицы Менделеева. Это мейтнерий (Mt, атомный номер 109), дармштадций (Ds, атомный номер 110), рентгений (Rg, атомный номер 111), нихоний (Nh, атомный номер 113), московий (Mc, атомный номер 115), ливерморий (Lv. , атомный номер 116) и теннессин (Ts, атомный номер 117).
Постпереходный металл
Постпереходные металлы — это металлы, находящиеся между переходными металлами (слева) и металлоидами (справа). Они включают алюминий (Al), галлий (Ga), индий (In), таллий (Tl), олово (Sn), свинец (Pb) и висмут (Bi).
Оганессон
Оганессон (Ог) — это радиоактивный элемент, имеющий атомный номер 118 в периодической таблице, его внешний вид полностью не известен из-за того, что он производится в незначительных количествах. Он находится в группе 18.Имеет символ Ог.
Теннессин
Теннессин (Ts) — это радиоактивный элемент, имеющий атомный номер 117 в периодической таблице, его внешний вид полностью не известен из-за того, что он производится в незначительных количествах. Он находится в 17-й группе. Имеет символ Ts.
Livermorium
Livermorium (Lv) — это радиоактивный элемент, имеющий атомный номер 116 в периодической таблице, его внешний вид полностью не известен из-за того, что он производится в незначительных количествах. Он находится в группе 16.Имеет символ Ур.
Московий
Московий (Mc) — это радиоактивный металл, имеющий атомный номер 115 в периодической таблице, его внешний вид полностью не известен из-за того, что он производится в незначительных количествах. Он находится в группе 15. Имеет символ Mc.
Флеровий
Флеровий (Fl) — это радиоактивный металл, имеющий атомный номер 114 в периодической таблице, его внешний вид полностью не известен из-за того, что он производится в незначительных количествах. Он находится в группе 14. Обозначается символом Fl.
Nihonium
Nihonium (Nh) — это радиоактивный металл, имеющий атомный номер 112 в периодической таблице, его внешний вид полностью не известен из-за того, что он производится в незначительных количествах. Он находится в группе 13. Обозначается символом Nh.
Copernicium
Copernicium (Cr) — это радиоактивный металл, имеющий атомный номер 112 в периодической таблице, его внешний вид полностью не известен из-за того, что он производится в незначительных количествах. Это переходный металл в группе 11. Он имеет обозначение Rg.
Roentgenium
Roentgenium (Rg) — это радиоактивный металл, имеющий атомный номер 111 в периодической таблице, его внешний вид полностью не известен из-за того, что он производится в незначительных количествах. Это переходный металл в группе 11. Он имеет обозначение Rg.
Дармштадций
Дармштадций (Ds) — это радиоактивный металл, имеющий атомный номер 110 в периодической таблице, его внешний вид полностью не известен из-за того, что он производится в незначительных количествах. Это переходный металл группы 10.Он имеет обозначение Ds
Meitnerium
Meitnerium (Mt) — это радиоактивный металл, имеющий атомный номер 109 в периодической таблице, его внешний вид полностью не известен из-за того, что он производится в незначительных количествах. Это переходный металл в Группе 9. Он имеет символ Mt.
Калий
Калий (Hs) — это радиоактивный металл, имеющий атомный номер 108 в периодической таблице Менделеева, его внешний вид полностью не известен из-за того, что он производится в незначительных количествах. Это переходный металл группы 8.Имеет символ Hs.
Bohrium
Bohrium (Bh) — это радиоактивный металл, имеющий атомный номер 107 в периодической таблице, его внешний вид полностью не известен из-за того, что он производится в незначительных количествах. Это переходный металл в Группе 7. Он имеет символ Bh.
Сиборгий
Сиборгий (Sg) — это радиоактивный металл, имеющий атомный номер 106 в периодической таблице, его внешний вид полностью не известен из-за того, что он производится в незначительных количествах. Это переходный металл группы 6.Имеет символ Sg.
Дубний
Дубний (Db) — радиоактивный металл, имеющий атомный номер 105 в периодической таблице, его внешний вид полностью не известен из-за того, что он производится в незначительных количествах. Это переходный металл в Группе 5. Он имеет обозначение Db.
Резерфордий
Резерфордий (Rf) — это радиоактивный металл, имеющий атомный номер 104 в периодической таблице, его внешний вид полностью не известен из-за того, что он производится в незначительных количествах. Это переходный металл в группе 4.Обозначается символом Rf.
Лоуренсий
Лоуренсий (Lr) — это радиоактивный металл серебристо-белого цвета, имеющий атомный номер 103 в периодической таблице. Это актиноидный металл с символом Lr.
Nobelium
Нобелий (№) — это радиоактивный металл, имеющий атомный номер 102 в периодической таблице, его внешний вид полностью не известен из-за того, что он производится в незначительных количествах. Это актиноидный металл с символом №
Менделевий
Менделевий (Md) — это радиоактивный металл, имеющий атомный номер 101 в периодической таблице, его внешний вид полностью не известен из-за того, что он производится в незначительных количествах.Это актиноидный металл с символом Md.
Фермий
Фермий (Fm) — это радиоактивный металл серебристо-белого цвета, имеющий атомный номер 100 в периодической таблице. Это актиноидный металл с символом Fm.
Эйнштейний
Эйнштейний (Es) — это радиоактивный металл серебристо-белого цвета, имеющий атомный номер 99 в периодической таблице. Это актиноидный металл с символом Es.
Калифорний
Калифорний (Cf) — это радиоактивный металл серебристо-белого цвета, имеющий атомный номер 98 в периодической таблице.Это актиноидный металл с обозначением Cf.
Берклий
Берклий (Bk) — радиоактивный металл серебристого цвета, имеющий атомный номер 97 в периодической таблице. Это актиноидный металл с символом Bk.
Кюрий
Кюрий (Cm) — это радиоактивный металл серебристо-белого цвета, имеющий атомный номер 96 в периодической таблице. Это актиноидный металл с символом Cm.
Америций
Америций (Am) — это радиоактивный металл серебристого цвета, имеющий атомный номер 95 в периодической таблице.Это актиноидный металл с символом Am.
Плутоний
Плутоний (Pu) — это радиоактивный металл серебристого цвета, имеющий атомный номер 94 в периодической таблице. Это актиноидный металл с обозначением Pu.
Нептуний
Нептуний (Np) — радиоактивный металл серебристого цвета, имеющий атомный номер 93 в периодической таблице. Это актиноидный металл с символом Np.
Протактиний
Протактиний (Па) — это блестящий радиоактивный металл серебристого цвета, имеющий атомный номер 91 в периодической таблице.Это актиноидный металл с символом Pa.
Торий
Торий (Th) — это радиоактивный металл серебристо-белого цвета, имеющий атомный номер 90 в периодической таблице. Это актиноидный металл с символом Th.
Актиний
Актиний (Ac) — это радиоактивный металл серебристого цвета, имеющий атомный номер 89 в периодической таблице. Это актиноидный металл с символом Ас.
Радий
Радий (Ra) — это металл серебристо-белого цвета, имеющий атомный номер 88 в периодической таблице.Это щелочноземельный металл с символом Ra, расположенный во 2-й группе периодической таблицы.
Франций
Франций (Fr) считается металлом серого цвета с атомным номером 87 в периодической таблице. Это щелочной металл с символом Fr, расположенный в группе 1 периодической таблицы.
Радон
Радон (Rn) — неметалл без цвета и запаха, радиоактивный газ, имеющий атомный номер 86 в периодической таблице в Группе 18. Он имеет символ Rn.
Астатин
Астатин (At) — это радиоактивный неметалл, имеющий атомный номер 85 в периодической таблице в Группе 17. Он имеет символ At.
Полоний
Полоний (Po) — это серебристо-серый металл, имеющий атомный номер 84 в периодической таблице в группе 16. Он имеет символ Po.
Висмут
Висмут (Bi) — это твердый металл серо-стального цвета, имеющий атомный номер 83 в периодической таблице в Группе 15. Он имеет символ Bi.
Свинец
Свинец (Pb) — это мягкий серый металл, имеющий атомный номер 82 в периодической таблице Группы 14.Обозначается символом Pb.
Таллий
Таллий (Tl) — это мягкий серый металл, имеющий атомный номер 81 в периодической таблице в группе 13. Он имеет символ Tl.
Меркурий
Ртуть (Hg) — жидкий металл серебристого цвета, имеющий атомный номер 80 в периодической таблице. Это переходный металл в группе 12. Он имеет символ Hg.
Золото
Золото (Au) — это металл мягкого золотого цвета, имеющий атомный номер 79 в периодической таблице. Это переходный металл группы 11.Имеет символ Au.
Платина
Платина (Pt) — тяжелый белый металл, имеющий атомный номер 78 в периодической таблице. Это переходный металл группы 10. Он имеет обозначение Pt.
Иридий
Иридий (Ir) — тяжелый белый металл, имеющий атомный номер 77 в периодической таблице. Это переходный металл в группе 9. Он имеет обозначение Ir.
Осмий
Осмий (Os) — твердый мелкий черный порошок или сине-белый металл, имеющий атомный номер 76 в периодической таблице.Это переходный металл группы 8. Он обозначен символом Os.
Рений
Рений (Re) — металл серебристо-белого цвета, имеющий атомный номер 75 в периодической таблице. Это переходный металл группы 7. Он имеет символ Re.
Вольфрам
Вольфрам (W) — металл серого стального цвета, имеющий атомный номер 74 в периодической таблице. Это переходный металл в группе 6. Он имеет обозначение W.
Тантал
Тантал (Ta) — металл серого цвета, имеющий атомный номер 73 в периодической таблице.Это переходный металл в группе 5. Он имеет символ Ta.
Гафний
Гафний (Hf) — металл серебристого цвета, имеющий атомный номер 72 в периодической таблице. Это переходный металл в группе 4. Он имеет обозначение Hf.
Лютеций
Лютеций (Lu) — металл серебристо-белого цвета, имеющий атомный номер 71 в периодической таблице. Это металл лантаноид. Он имеет символ Лу.
Иттербий
Иттербий (Yb) — металл серебристого цвета, имеющий атомный номер 70 в периодической таблице.Это металл лантаноид. Имеет символ Yb.
Тулий
Тулий (Tm) — металл серебристого цвета, имеющий атомный номер 69 в периодической таблице. Это металл лантаноид. Обозначается символом Tm.
Эрбий
Эрбий (Er) — металл серебристого цвета, имеющий атомный номер 68 в периодической таблице. Это металл лантаноид. Имеет символ Er.
Гольмий
Гольмий (Ho) — металл серебристого цвета, имеющий атомный номер 67 в периодической таблице.Это металл лантаноид. Имеет символ Хо.
Диспрозий
Диспрозий (Dy) — металл серебристого цвета, имеющий атомный номер 66 в периодической таблице. Это металл лантаноид. Имеет символ Dy.
Тербий
Тербий (Tb) — металл серебристо-серого цвета, имеющий атомный номер 65 в периодической таблице. Это металл лантаноид. Обозначается символом Tb.
Гадолиний
Гадолиний (Gd) — металл серебристо-белого цвета, имеющий атомный номер 64 в периодической таблице.Это металл лантаноид. Он имеет символ Б-г.
Европий
Европий (Eu) — металл серебристо-белого цвета, имеющий атомный номер 63 в периодической таблице. Это металл лантаноид. Имеет символ Eu.
Самарий
Самарий (Sm) — металл серебристого цвета, имеющий атомный номер 62 в периодической таблице. Это металл лантаноид. Имеет символ Sm.
Прометий
Прометий (Pm) — редкий металл, имеющий атомный номер 61 в периодической таблице.Это металл лантаноид. Имеет символ Pm.
Неодим
Неодим (Nd) — металл серебристо-белого цвета, имеющий атомный номер 60 в периодической таблице. Это металл лантаноид. Обозначается символом Nd.
Празеодим
Празеодим (Pr) — металл серебристо-белого цвета, имеющий атомный номер 59 в периодической таблице. Это металл лантаноид. Имеет обозначение Pr.
Церий
Церий (Ce) — металл серого цвета, имеющий атомный номер 58 в периодической таблице.Это металл лантаноид. Имеет символ Ce.
Лантан
Лантан (La) — мягкий серебристо-белый металл, имеющий атомный номер 57 в периодической таблице. Это металл лантаноид. Он имеет символ La.
Барий
Барий (Ва) — это мягкий серебристо-белый металл, имеющий атомный номер 56 в периодической таблице. Это щелочноземельный металл, который находится во 2-й группе периодической таблицы. у него есть символ Ва.
Цезий
Цезий (Cs) — это металл мягкого серого цвета, имеющий атомный номер 55 в периодической таблице.Это щелочной металл, который находится в группе 1 периодической таблицы. он имеет символ Cs.
Ксенон
Ксенон (Хе) существует в виде бесцветного газа без запаха и химически инертен. Он имеет атомный номер 54 в периодической таблице Менделеева и относится к 18-й группе «Благородные газы». Это неметалл с символом Xe.
Йод
Йод (I) — неметаллическое твердое вещество пурпурно-серого цвета. Он имеет атомный номер 53 в периодической таблице. Он расположен в Группе 17, Галогены. Имеет символ I.
Теллур
Теллур (Те) — это серебристо-белый полуметалл, имеющий атомный номер 52 в периодической таблице. Он находится в 16-й группе таблицы Менделеева. Имеет символ Те.
Сурьма
Сурьма (Sb) — твердый хрупкий серебристо-белый полуметалл, имеющий атомный номер 51 в периодической таблице. Он находится в 15-й группе таблицы Менделеева. Имеет символ Sb.
Олово
Олово (Sn) — это серебристо-белый металл, имеющий атомный номер 50 в периодической таблице.Он находится в 14-й группе периодической таблицы. Имеет символ Sn.
Индий
Индий (In) — это серебристо-белый металл, имеющий атомный номер 49 в периодической таблице. Он находится в 13-й группе периодической таблицы. Имеет символ In.
Кадмий
Кадмий (Cd) — это бело-голубой металл, имеющий атомный номер 48 в периодической таблице. Это переходный металл, который находится в группе 12 периодической таблицы. Обозначается символом Cd.
Серебро
Серебро (Ag) — это металлическое серебро, имеющее атомный номер 47 в периодической таблице.Это переходный металл, расположенный в группе 11 периодической таблицы. Имеет символ Ag.
Палладий
Палладий (Pd) — это серебристо-белый металл, имеющий атомный номер 46 в периодической таблице. Это переходный металл, расположенный в 10-й группе периодической таблицы. Обозначается символом Pd.
Родий
Родий (Rh) — хрупкий серебристо-белый металл, имеющий атомный номер 45 в периодической таблице. Это переходный металл, расположенный в 9-й группе периодической таблицы.Имеет символ Rh.
Рутений
Рутений (Ru) — хрупкий серебристо-серый металл, имеющий атомный номер 44 в периодической таблице. Это переходный металл, расположенный в 8-й группе периодической таблицы. Имеет символ Ru.
Технеций
Технеций (Tc) — это серебристо-серый металл, имеющий атомный номер 43 в периодической таблице. Это переходный металл, расположенный в 7-й группе периодической таблицы. Обозначается символом Tc.
Молибден
Молибден (Мо) — это серебристо-белый металл, имеющий атомный номер 42 в периодической таблице.Это переходный металл, расположенный в 6-й группе периодической таблицы. Обозначается символом Mb.
Ниобий
Ниобий (Nb) — это блестящий белый металл, имеющий атомный номер 41 в периодической таблице. Это переходный металл, расположенный в 5-й группе периодической таблицы. Обозначается символом Nb.
Цирконий
Цирконий (Zr) — это серый белый металл, имеющий атомный номер 40 в периодической таблице. Это переходный металл, который находится в группе 4 периодической таблицы Менделеева.Он имеет обозначение Zr.
Иттрий
Иттрий (Y) — это серебристый металл, имеющий атомный номер 39 в периодической таблице. Это переходный металл, который находится в группе 3 периодической таблицы. Он имеет обозначение Y.
Группа 1: Водород и щелочные металлы
- Последнее обновление
- Сохранить как PDF
Щелочные металлы — это химические элементы, входящие в группу 1 периодической таблицы Менделеева.К щелочным металлам относятся: литий, натрий, калий, рубидий, цезий и франций. Хотя водород часто входит в группу 1 из-за его электронной конфигурации, технически он не является щелочным металлом, поскольку он редко демонстрирует подобное поведение. Слово «щелочь» получило свое название от арабского слова «al qali», что означает «из золы», поскольку эти элементы реагируют с водой с образованием гидроксид-ионов, создавая щелочных раствора (pH> 7).
- Группа 1: Свойства щелочных металлов
- На этой странице обсуждаются тенденции изменения некоторых атомных и физических свойств элементов группы 1 — лития, натрия, калия, рубидия и цезия.В разделах ниже рассматриваются тенденции изменения атомного радиуса, энергии первой ионизации, электроотрицательности, точек плавления и кипения и плотности.
- Группа 1: Реакционная способность щелочных металлов
- Щелочные металлы относятся к числу наиболее реактивных металлов. Частично это связано с их большим атомным радиусом и низкой энергией ионизации. Они склонны отдавать свои электроны в реакциях и имеют степень окисления +1. Эти металлы отличаются мягкой текстурой и серебристым цветом.Они также имеют низкие температуры кипения и плавления и менее плотны, чем большинство элементов. Все эти характеристики можно объяснить большими атомными радиусами этих элементов и слабой металлической связью.
- Химия водорода (Z = 1)
- Водород — один из важнейших элементов в мире. Это все вокруг нас. Он входит в состав воды (h3O), жиров, нефти, столового сахара (C6h22O6), аммиака (Nh4) и перекиси водорода (h3O2) — вещей, необходимых для жизни, как мы ее знаем.Этот модуль исследует несколько аспектов элемента и то, как они применимы к миру.
- Химия лития (Z = 3)
- Хлор — это галоген в Литии — редкий элемент, обнаруживаемый в основном в расплавленных породах и соленой воде в очень небольших количествах. Считается, что он не является жизненно важным для биологических процессов человека, хотя он используется во многих лекарствах из-за его положительного воздействия на человеческий мозг. Из-за его реактивных свойств люди использовали литий в батареях, реакциях ядерного синтеза и термоядерном оружии.
- Химия натрия (Z = 11)
- Натрий — металлический элемент, входящий в первую группу периодической таблицы Менделеева. Как шестой по численности элемент земной коры, соединения натрия обычно растворяются в океанах, минералах и даже в наших телах.
- Химический состав калия (Z = 19)
- В чистом виде калий имеет бело-серебристый цвет, но он быстро окисляется на воздухе и тускнеет за считанные минуты, если не хранить в масле или смазке .Калий необходим для нескольких аспектов жизни растений, животных и человека, поэтому его добывают, производят и потребляют в огромных количествах по всему миру.
- Химия рубидия (Z = 37)
- Рубидий (лат. Rubidius = красный) похож по физическим и химическим характеристикам на калий, но гораздо более активен. Это семнадцатый по распространенности элемент, который был обнаружен Бунзеном и Кирхгофом в 1861 году по его красному спектральному излучению. Его температура плавления настолько низкая, что вы можете растопить его в руке, если у вас будет температура (39 ° C).Но это было бы не очень хорошей идеей, потому что это будет сильно реагировать с влагой в вашей коже.
- Химия цезия (Z = 55)
- Цезий настолько реактивен, что даже взорвется при контакте со льдом! Он использовался в качестве «геттера» при производстве вакуумных трубок (т. Е. Помогает удалять следовые количества оставшихся газов). В атомных часах используется изотоп цезия.
- Химия франция (Z = 87)
- Франций является последним из известных щелочных металлов и в значительной степени не встречается в природе.Все известные изотопы радиоактивны и имеют короткий период полураспада (22 минуты — самый длинный).
Щелочные и щелочноземельные металлы
Элементы первой группы периодической таблицы Менделеева (за исключением водорода — см. Ниже) известны как щелочные металлы , потому что они образуют щелочные растворы, когда вступают в реакцию с водой. В эту группу входят элементы литий , натрий , калий , рубидий , цезий и франций .Каждый из этих элементов имеет только один валентный электрон, что означает, что они образуют только слабые металлические связи. В результате они относительно мягкие и имеют низкие температуры плавления.
Электрон с одной валентностью легко теряется, что делает эти металлы очень реактивными. Они бурно реагируют как с воздухом, так и с водой — например, когда натрий вступает в контакт с водой, он бурно реагирует с образованием гидроксида натрия и водорода. Тепло реакции фактически воспламеняет водород! Щелочные металлы также легко соединяются с элементами семнадцатой группы ( хлор , фтор , бром и т. Д.) с образованием стабильных ионных соединений , таких как хлорид натрия.
Щелочные металлы (выделены) занимают первую группу в периодической таблице.
Вторая группа периодической таблицы включает элементы бериллий , магний , кальций , стронций , барий и радий .Элементы в этой группе, которые все блестящие и серебристо-белые на вид, известны как щелочноземельные металлы , . Как и щелочные металлы, они образуют щелочные растворы при взаимодействии с водой. Термин «земля» историчен; это было общее название, используемое алхимиками для оксидов этих элементов (которые когда-то считались элементами сами по себе).
Все элементы второй группы имеют двух электронов на своей внешней оболочке.Таким образом, металлические связи в щелочноземельных металлах прочнее, чем в щелочных металлах, что приводит к более высоким температурам плавления, но они все еще довольно реактивны, потому что два внешних электрона легко теряются. В результате они не встречаются в природе в своем элементарном состоянии.
Все щелочноземельные металлы, кроме одного, реагируют с галогенами ( хлор , фтор и т. Д.) С образованием ионных соединений (за исключением хлорида бериллия, поскольку связь ковалентная).Все щелочноземельные металлы, за исключением бериллия и магния, также реагируют с водой с образованием газообразного водорода и их соответствующих гидроксидов (однако магний будет реагировать с паром). По сути, чем тяжелее щелочноземельный металл, тем интенсивнее он вступает в реакцию с водой.
Щелочноземельные металлы (выделены) занимают вторую группу в периодической таблице.
Магний является пятым по распространенности элементом на Земле, за ним следует кальций на восьмом месте, что тоже хорошо, поскольку и магний, и кальций жизненно важны для всех живых существ, включая людей! Магний участвует в огромном количестве биохимических реакций; помимо прочего, он необходим для здоровья костей и зубов.Кальций составляет примерно два процента от общей массы нашего тела, большая часть которого находится в наших зубах и костях.
Как элементы сгруппированы в Периодической таблице?
В конце 19 века русский химик Дмитрий Менделеев опубликовал свою первую попытку сгруппировать химические элементы по их атомному весу. В то время было известно только около 60 элементов, но Менделеев понял, что, когда элементы были организованы по весу, определенные типы элементов возникали через равные промежутки времени или периоды.
Сегодня, 150 лет спустя, химики официально признают 118 элементов (после добавления четырех новичков в 2016 году) и до сих пор используют периодическую таблицу элементов Менделеева для их организации. Таблица начинается с простейшего атома, водорода, а затем упорядочиваются остальные элементы по атомному номеру, который представляет собой количество протонов, содержащихся в каждом. За некоторыми исключениями порядок элементов соответствует увеличению массы каждого атома.
В таблице семь строк и 18 столбцов.Каждая строка представляет один период; номер периода элемента показывает, сколько из его энергетических уровней содержат электроны. Например, натрий находится в третьем периоде, что означает, что атом натрия обычно имеет электроны на первых трех энергетических уровнях. Двигаясь вниз по таблице, периоды становятся длиннее, потому что для заполнения более крупных и сложных внешних уровней требуется больше электронов.
Столбцы таблицы представляют группы или семейства элементов. Элементы в группе часто выглядят и ведут себя одинаково, потому что у них одинаковое количество электронов во внешней оболочке — лице, которое они показывают миру.Элементы группы 18, например, в крайней правой части таблицы, имеют полностью сплошные внешние оболочки и редко участвуют в химических реакциях.
Элементы обычно классифицируются как металлические или неметаллические, но разделительная линия между ними нечеткая. Металлические элементы обычно являются хорошими проводниками электричества и тепла. Подгруппы металлов основаны на схожих характеристиках и химических свойствах этих коллекций. Согласно данным Лос-Аламосской национальной лаборатории, в нашем описании периодической таблицы используются общепринятые группы элементов.
Щелочные металлы: Щелочные металлы составляют большую часть Группы 1, первого столбца таблицы. Эти блестящие и достаточно мягкие, чтобы разрезать ножом, эти металлы начинаются с лития (Li) и заканчиваются францием (Fr). Они также чрезвычайно реактивны и воспламеняются или даже взрываются при контакте с водой, поэтому химики хранят их в маслах или инертных газах. Водород с одним электроном также находится в группе 1, но газ считается неметаллом.
Щелочно-земельные металлы: Щелочноземельные металлы составляют группу 2 периодической таблицы, от бериллия (Be) до радия (Ra).Каждый из этих элементов имеет два электрона на внешнем энергетическом уровне, что делает щелочноземельные земли достаточно реактивными, поэтому их редко можно встретить в природе в одиночку. Но они не так реактивны, как щелочные металлы. Их химические реакции обычно протекают медленнее и выделяют меньше тепла по сравнению с щелочными металлами.
Лантаноиды: Третья группа слишком длинна, чтобы поместиться в третий столбец, поэтому она вырывается и переворачивается боком, чтобы стать верхней строкой острова, плавающего в нижней части таблицы.Это лантаноиды, элементы с 57 по 71 — от лантана (La) до лютеция (Lu). Элементы этой группы имеют серебристо-белый цвет и тускнеют при контакте с воздухом.
Актиниды: Актиниды выстилают нижний ряд острова и включают элементы от 89, актиний (Ac) до 103, лоуренсий (Lr). Из этих элементов только торий (Th) и уран (U) встречаются на Земле в значительных количествах. Все радиоактивны. Актиниды и лантаноиды вместе образуют группу, называемую внутренними переходными металлами.
Переходные металлы: Возвращаясь к основной части таблицы, остатки групп с 3 по 12 представляют остальные переходные металлы. Твердые, но податливые, блестящие и обладающие хорошей проводимостью, эти элементы — это то, о чем вы обычно думаете, когда слышите слово «металл». Здесь живут многие из лучших хитов металлического мира, включая золото, серебро, железо и платину.
Металлы после перехода: Перед прыжком в мир неметаллов общие характеристики не разделены аккуратно по вертикальным групповым линиям.Постпереходными металлами являются алюминий (Al), галлий (Ga), индий (In), таллий (Tl), олово (Sn), свинец (Pb) и висмут (Bi), и они охватывают группы с 13 по 17. Эти элементы обладают некоторыми из классических характеристик переходных металлов, но они, как правило, более мягкие и проводят хуже, чем другие переходные металлы. Во многих периодических таблицах жирным шрифтом будет выделена линия «лестницы» под диагональю, соединяющей бор с астатом. Постпереходные металлы кластеры в нижнем левом углу этой линии.
Металлоиды: Металлоиды: бор (B), кремний (Si), германий (Ge), мышьяк (As), сурьма (Sb), теллур (Te) и полоний (Po). Они образуют лестницу, символизирующую постепенный переход от металлов к неметаллам. Эти элементы иногда ведут себя как полупроводники (B, Si, Ge), а не как проводники. Металлоиды также называют «полуметаллами» или «бедными металлами».
Неметаллы: Все остальное в правом верхнем углу лестницы, а также водород (H), скрученный на мель в Группе 1, является неметаллом.К ним относятся углерод (C), азот (N), фосфор (P), кислород (O), сера (S) и селен (Se).
Галогены: Четыре верхних элемента Группы 17, от фтора (F) до астата (At), представляют собой одно из двух подмножеств неметаллов. Галогены довольно химически реактивны и имеют тенденцию образовывать пары со щелочными металлами с образованием различных типов солей.
