Электролитическая диссоциация — материалы для подготовки к ЕГЭ по Химии
Автор статьи — профессиональный репетитор И. Давыдова (Юдина).
Электрический ток – направленное движение заряженных частиц – электронов или ионов.
Электролиты – это вещества, растворы или расплавы (в ЕГЭ чаще речь о растворах) которых проводят электрический ток, то есть содержат заряженные частицы. Свободных электронов в растворе не бывает, носителями заряда являются ионы. Электрический ток проводят расплавы веществ с ионной кристаллической решеткой.
К электролитам относятся:
- Соли
- Кислоты
- Основания
Чем больше в растворе заряженных частиц, тем лучше он проводит электрический ток, т.е. чем больше молекул вещества диссоциирует, тем более сильным электролитом оно является.
Список сильных и слабых электролитов нужно знать наизусть!
Сильные электролиты (в растворах): 11
- Растворимые соли
FeCl3, CuSO4, K2CO3 и т. д.
д.
8 растворимых гидроксидов: LiOH, NaOH, KOH, RbOH, CsOH, Ba(OH)2, Sr(OH)2, Ca(OH)2.
- Сильные кислоты
HI, HBr, HCl, H2SO4(разб), HNO3, HClO4, HClO3, HMnO4, H2CrO4
Слабые электролиты:
- Слабые основания
нерастворимые гидроксиды, NH3∙H2O, растворы аминов
- Слабые кислоты и кислоты средней силы
H3PO4, HF, H2SO3, H2CO3, H2S, H2SiO3, органические кислоты.
H2O – очень слабый электролит, диссоциирует ничтожно мало. Чистая дистиллированная вода не проводит ток.
Неэлектролиты: большинство органических соединений, оксиды, вещества, в молекулах которых имеются только ковалентные неполярные или малополярные связи и т. д.
д.
Сила электролита определяется степенью диссоциации. Рассмотрим соль А2В и кислоту Н3Х:
Диссоциация — всегда обратимый процесс.
Соли диссоциируют (обратимо распадаются на ионы) почти на 100%:
А2В ⇄ 2А+ + В2-. Так как все молекулы распались на ионы, из 1 моль АВ получилось 1 моль В2- и 2 моль А+, то есть три моль ионов.
Многоосновные кислоты и основания диссоциируют ступенчато:
Н3Х ⇄ H+ + H2X—
H2X— ⇄ HX2- + H+
HX2-⇄X3- + H
При этом каждая следующая ступень диссоциации протекает хуже предыдущей, т.к. присутсвует конкурирующий процесс — обратная реакция. Порядок примерно такой: Из 1 моль молекул слабой кислоты по первой ступени диссоциировало 0,05 моль, по второй — 0,0002 моль и по третьей – 0,00000001 моль. Итого образовалось чуть больше 0,1 моль ионов.
Очевидно, этот раствор этой кислоты проводит ток хуже, чем раствор соли.
Пара вопросов для тренировки:
1) Какие частицы образутся при диссоциации нитрата натрия
а) Na+, N+5, O-2; б) Na+, NO3— в) Na, NO2, O2 г) NaNO2, O2
Решение: нитрат натрия образован остатком азотной кислоты и катионом натрия. Уравнение его диссоциации: NaNO3 ⇄ Na+ + NO3—. Ответ б).
2) В четырех пробирках находятся одномолярные растворы следующих веществ:
а) H3PO4 б) Na2SO4 в) NaCl г) HBr
В какой пробирке больше всего ионов?
Решение: a) ортофосфорная кислота – средней силы, диссоциирует слабо, большая часть молекул останутся в растворе молекулами.
б) сульфат натрия – соль, диссоциирует полностью, из одного моль соли олучается три моль ионов: Na2SO4 ⇄ 2Na+ + SO42-.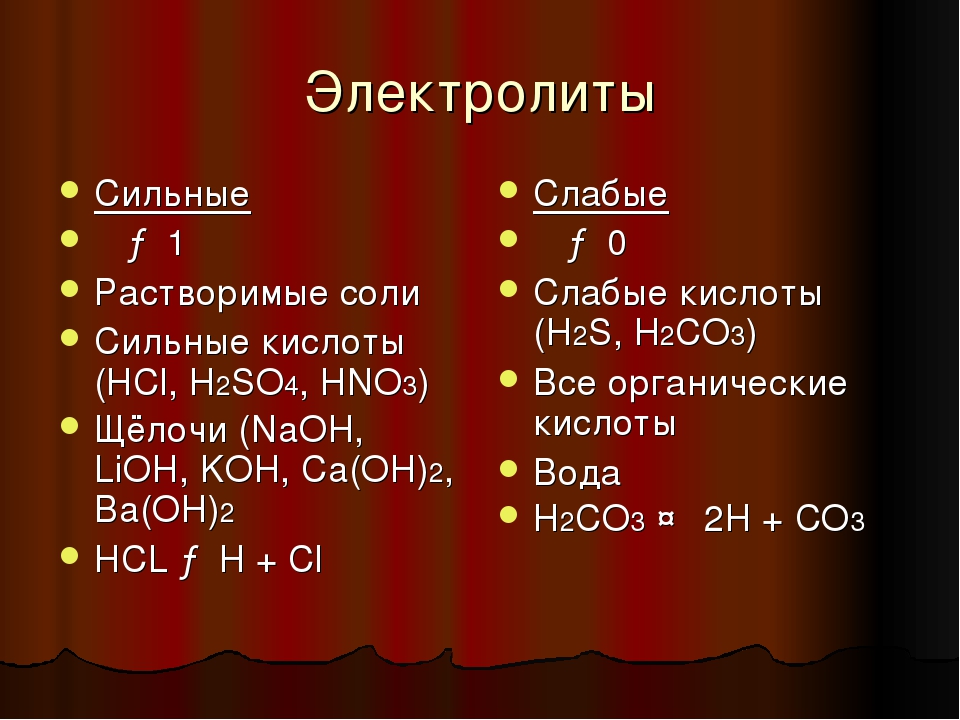
в) хлорид натрия – соль, диссоциирует полностью, из одного моль соли образуется два моль ионов: NaCl ⇄ Na+ + Cl—.
г) бромоводородная кислота – сильная, но диссоциирует не полностью (в отличие от солей). В реакции HBr ⇄ H+ + Br- из одного моль HBr образуется меньше двух моль ионов.
Ответ б).
Ты нашел то, что искал? Поделись с друзьями!Применение электролитов » Primelab | Производство лабораторного и аналитического оборудования
Основные свойства
Обычная вода и многие другие вещества не способны проводить ток. Растворы становятся токопроводимыми, только если вещества могут распадаться на ионы. В отличие от металлов электролиты называют проводниками второго порядка. Ими могут выступать некоторые кристаллы и расплавы, например иодид серебра, диоксид циркония.
Основным свойством электролитов является возможность электролитической диссоциации, представляющей собой процесс распада молекул при взаимодействии с водой, другими растворителями. В результате распада появляются заряженные ионы.
В результате распада появляются заряженные ионы.
В зависимости от типа образующихся ионов различают такие электролиты:
- щелочные,
- кислотные,
- солевые.
В щелочных электропроводимость обеспечивается ионами ОН и металлов. В кислотных – ионами Н+, а также остатками оснований кислот. Процесс диссоциации зависит от таких факторов:
- концентрации веществ,
- выбора растворителя,
- температуры.
- растворимые соли,
- сильные кислоты,
- щелочи.
Если говорить об аккумуляторах, то для них важна плотность токопроводящих сред. Она определяет емкость батарей и срок их службы.
Возможности для применения
В основном применение электролитов распространено в промышленности. С их помощью изготавливают источники тока разного назначения. Это могут быть автомобильные аккумуляторы и различные виды батарей.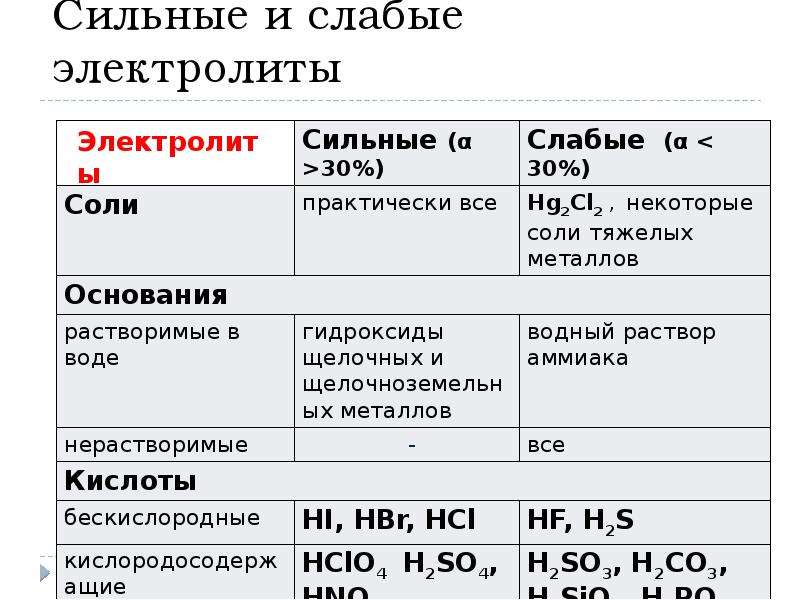 Для них используются щелочные вещества, проводящие ток.
Для них используются щелочные вещества, проводящие ток.
Аналитическая практика предполагает использование ионометров и рН-метров, которые заполнены солевыми веществами, проводящими ток. Приборы применяют для измерения кислотности среды, концентрации определенных веществ.
Если говорить об электрохимической индустрии, то многие растворы для гальванирования металлов создаются на основе веществ, способных к диссоциации. Также они применяются в биологии и медицине. Многие диагностические методы построены на анализе кислотно-щелочного и водно-солевого балансов. Применение электролитов довольно разнообразно, как и их составы.
К достоинствам аккумуляторов, построенных на щелочных веществах, способных к диссоциации, относят:
- длительный срок службы;
- надежность;
- меньшее количество токсичных веществ, выделяемых в процессе работы;
- возможность использования в широком температурном диапазоне;
- неприхотливость;
- меньшая масса в сравнении с кислотными.

Если говорить об автомобильной индустрии, в ней являются востребованными кислотные аккумуляторы. К их непосредственным преимуществам относятся:
- простое и отработанное обслуживание;
- низкий саморазряд;
- приемлемая стоимость;
- способность давать высокий ток при старте.
Основные меры предосторожности
Все популярные вещества, способные проводить ток, созданы на основе щелочи или серной кислоты. Они могут стать причиной ожога, поэтому при обращении с ними важно предпринимать меры предосторожности. Среди правил обращения с такими опасными веществами главными являются следующие:
- наличие в помещении нейтрализующих веществ, воды, аптечки;
- для нейтрализации кислотного ожога необходим раствор соды, используется одна чайная ложка на стакан воды;
- для нейтрализации щелочных ожогов применяется раствор борной кислоты, берется чайная ложка на стакан воды;
- если агрессивное вещество попало в глаза, для его нейтрализации применяются растворы в два раза слабее;
- если произошел ожог, сначала используется нейтрализующее вещество, а потом вода.

Важно при работе соблюдать все правила техники безопасности, чтобы избежать ожогов. Основные из них:
- кислоту необходимо наливать в воду и ни в коем случае не наоборот;
- при работе с твердой щелочью ее необходимо опускать в воду при помощи щипцов;
- хранение в одном помещении или работа одновременно с кислотными и щелочными веществами запрещена.
Если при выполнении работ предполагается кипение вещества, оно будет сопровождаться выделением взрывоопасного и горючего газа – водорода. Соответственно, в помещении необходимо предусмотреть его отвод, взрывобезопасную проводку, защитить все электроприборы.
Хранение опасных веществ организовывают в пластиковых емкостях. Для работы с ними подходит фарфоровая, керамическая и стеклянная посуда.
Гидролиз солей — электролит
HCl => H+ + Cl—
H2SO4=> 2H+ +
Выбери правильный ответ.
Трудно? Ладно, здесь подсказка.
Положи перед собой таблицу растворимости — заряд аниона указан в левом столбце!
Как узнать сильная кислота или слабая?
В таблице растворимости три сильных кислоты H2SO4, HCl, HNO3, соли всех остальных кислот подвергаются гидролизу по I ступени.
Cлабые основания обычно не растворимы. NН4ОН исключение — слабое, но растворимое.
Сильные основания диссоциируют на ионы полностью:
КОН => К+ + ОН—
NаОН=> Nа+ + ОН—
Определите какое основание слабое (пользуйтесь таблицей растворимости)
Совет — Если вы ошибаетесь — внимательно рассмотрите таблицу растворимости:
на пересечении ионов, из которых состоят основания стоит буква Н — основание
нерастворимое, значит слабое. NН4ОН — исключение —
растворимое, но слабое.
NН4ОН — исключение —
растворимое, но слабое.
Еще раз.
Соль АICI3 образована слабым основанием АI(ОН)3 сильной кислотой НСI.
Теперь определите сами какой кислотой и каким основанием образованы соли. (Если ответ верен, то загорается зеленый цвет, если не верен — красный.)
AI(NO3)3
слабое основание
слабая кислота
сильное основание
сильная кислота
CuCI2
слабое основание
слабая кислота
сильное основание
сильная кислота
FeCI3
слабое основание
слабая кислота
сильное основание
сильная кислота
NH4CIO
слабое основание
слабая кислота
сильное основание
сильная кислота
ВаСIО
слабое основание
слабая кислота
сильное основание
сильная кислота
Гидролиз солей.
 Задача 23 на ЕГЭ по химии. Кислоты и основания. Основные факты о гидролизе
Задача 23 на ЕГЭ по химии. Кислоты и основания. Основные факты о гидролизе В первой части мы дали определение гидролиза, вспомнили некоторые факты о солях. Сейчас мы обсудим сильные и слабые кислоты и выясним, что «сценарий» гидролиза зависит именно от того, какой кислотой и каким основанием образована данная соль.
← Гидролиз солей. Часть I
Сильные и слабые электролиты Напомню, что все кислоты и основания можно условно разделить на сильные и слабые. Сильные кислоты (и, вообще, сильные электролиты) в водном растворе диссоциируют практически полностью. Слабые электролиты распадаются на ионы в незначительной степени.К сильным кислотам относятся:
- H2SO4 (серная кислота),
- HClO4 (хлорная кислота),
- HClO3 (хлорноватая кислота),
- HNO3 (азотная кислота),
- HCl (соляная кислота),
- HBr (бромоводородная кислота),
- HI (иодоводородная кислота).

Ниже приведен список слабых кислот:
- H2SO3 (сернистая кислота),
- H2CO3 (угольная кислота),
- H
- H3PO3 (фосфористая кислота),
- H3PO4 (ортофосфорная кислота),
- HClO2 (хлористая кислота),
- HClO (хлорноватистая кислота),
- HNO2 (азотистая кислота),
- HF (фтороводородная кислота),
- H2S (сероводородная кислота),
- большинство органических кислот, напр., уксусная (CH3COOH).
Естественно, невозможно перечислить все существующие в природе кислоты. Приведены лишь наиболее «популярные». Следует также понимать, что разделение кислот на сильные и слабые является достаточно условным.
Существенно проще обстоят дела с сильными и слабыми основаниями. Можно воспользоваться таблицей растворимости. К сильным основаниям относятся все растворимые в воде основания, кроме NH4OH. Эти вещества называют щелочами (NaOH, KOH, Ca(OH)2 и т. д.)
Можно воспользоваться таблицей растворимости. К сильным основаниям относятся все растворимые в воде основания, кроме NH4OH. Эти вещества называют щелочами (NaOH, KOH, Ca(OH)2 и т. д.)
Слабые основания — это:
- все нерастворимые в воде гидроксиды (напр., Fe(OH)3, Cu(OH)2 и т. д.),
- NH4OH (гидроксид аммония).
Гидролиз солей. Главные факты
Читающим эту статью может показаться, что мы уже забыли об основной теме разговора, и ушли куда-то в сторону. Это не так! Наша беседа о кислотах и основаниях, о сильных и слабых электролитах имеет прямое отношение к гидролизу солей. Сейчас вы в этом убедитесь.
Итак, позвольте изложить вам основные факты:
- Не все соли подвергаются гидролизу. Существуют гидролитически устойчивые соединения, например, хлорид натрия.
- Гидролиз солей может быть полным (необратимым) и частичным (обратимым).

- В ходе реакции гидролиза происходит образование кислоты или основания, изменяется кислотность среды.
- Принципиальная возможность гидролиза, направление соответствующей реакции, ее обратимость или необратимость определяются силой кислоты и силой основания, которыми образована данная соль.
- В зависимости от силы соответствующей кислоты и соотв. основания, все соли можно условно разделить на 4 группы. Для каждой из этих групп характерен свой «сценарий» гидролиза.
| Сильная кислота, слабое основание | Слабая кислота, сильное основание | Слабая кислота, слабое основание | Сильная кислота, сильное основание | |
| Направление гидролиза | По катиону | По аниону | По катиону и по аниону | Гидролиз не идет |
| Характер среды | Кислая | Щелочная | Близкая к нейтральной | Нейтральная |
| Продукты реакции | Кислота и основная соль | Основание и кислая соль | Довольно разнообразны | — |
Пример 4. Соль NaNO3 образована сильной кислотой (HNO3) и сильным основанием (NaOH). Гидролиз не идет, новых соединений не образуется, кислотность среды не изменяется.
Соль NaNO3 образована сильной кислотой (HNO3) и сильным основанием (NaOH). Гидролиз не идет, новых соединений не образуется, кислотность среды не изменяется.
Пример 5. Соль NiSO4 образована сильной кислотой (H2SO4) и слабым основанием (Ni(OH)2). Идет гидролиз по катиону, в ходе реакции образуются кислота и основная соль.
Пример 6. Карбонат калия образован слабой кислотой (H2CO3) и сильным основанием (KOH). Гидролиз по аниону, образование щелочи и кислой соли. Щелочная среда раствора.
Пример 7. Сульфид алюминия образован слабой кислотой (H2S) и слабым основанием (Al(OH)3). Идет гидролиз как по катиону, так и по аниону. Необратимая реакция. В ходе процесса образуются H2S и гидроксид алюминия. Кислотность среды меняется в незначительной степени.
Попробуйте самостоятельно:
Упражнение 2. К какому типу относятся следующие соли: FeCl3, Na3PO3, KBr, NH4NO2? Подвергаются ли эти соли гидролизу? По катиону или по аниону? Что образуется в ходе реакции? Как меняется кислотность среды? Уравнения реакций можно пока не записывать.
Нам осталось последовательно обсудить 4 группы солей и для каждой из них привести специфический «сценарий» гидролиза. В следующей части мы начнем с солей, образованных слабым основанием и сильной кислотой.
Гидролиз солей. Часть III →
Возможно, вам будут интересны следующие материалы:Сильные и слабые электролиты — степень диссоциации
Электролиты — вещества, расплавы или растворы которых могут проводить электрический ток.
Неэлектролиты — вещества, расплавы или растворы которых не могут проводить электрический ток.
Диссоциация и степень диссоциации
Диссоциация — это распад соединений на ионы.
Степень диссоциации (α) — это отношения числа продиссоциировавших, то есть распавшихся на ионы молекул к их общему числу растворенных молекул.
Формула:
Стрелкой → обозначают распад соединений на ионы.
Стрелкой ← обозначают обратный процесс.
Сильные электролиты
Сильные электролиты — это вещества, которые при растворении в воде почти полностью диссоциируют на ионы.
Поэтому в уравнениях диссоциации ставят знак равенства (=) для сильных электролитов.
К сильным электролитам относятся:
- Многие неорганические кислоты, такие как: h3SO4, HNO3, HClO3, HMnO4, HClO4, HBr, HCl, HI.
- Основания щелочноземельных (Ca(OH)2, Ba(OH)2, Sr(OH)2) и щелочных (KOH, NaOH, LiOH) металлов.
- Растворимые соли.
Слабые электролиты
Слабые электролиты — это такие вещества, которые только частично диссоциируют на ионы.
Поэтому в уравнениях диссоциации ставят знак обратимости (⇄) для слабых электролитов.
К слабым электролитам относятся:
- Вода и практически все органические кислоты.
- Некоторые неорганические кислоты: h4PO4, h3SiO3, h3S, h4PO4, HNO2, h3CO3.
- Нерастворимые гидроксиды металлов: Zn(OH)2, Mg(OH)2, Fe(OH)2.
Сильные и слабые электролиты
Как различить сильные и слабые электролиты? Сильные электролиты в растворах почти полностью диссоциированы. К данной группе в большой степени относятся соли, сильные кислоты и щелочи. Слабые электролиты включают слабые основания и кислоты, а также некоторые соли, цианид ртути (II), хлорид ртути (II), иодид кадмия и роданид железа (II).
Степень диссоциации, сильные и слабые электролиты — видео
Это интересно:
Электролиты: понятие и свойства
Электролиты — растворы, содержащие большую концентрацию ионов, обеспечивающих прохождение электрического тока. Как правило, это водные растворы солей, кислот и щелочей.
Это интересно
В организме человека и животных электролиты играют важную роль: к примеру, электролиты крови с ионами железа транспортируют кислород в ткани; электролиты с ионами калия и натрия регулируют водно-солевой баланс организма, работу кишечника и сердца.
Свойства
Чистая вода, безводные соли, кислоты, щелочи ток не проводят. В растворах же вещества распадаются на ионы и проводят ток. Именно поэтому электролиты называют проводниками второго порядка (в отличие от металлов). Электролитами могут быть также расплавы и некоторые кристаллы, в частности диоксид циркония и иодид серебра.
Главное свойство электролитов — способность к электролитической диссоциации, то есть к распаду молекул при взаимодействии с молекулами воды (или других растворителей) на заряженные ионы.
По типу ионов, образующихся в растворе, различают электролит щелочной (электропроводимость обусловлена ионами металлов и ОН-), солевой и кислотный (с ионами Н+ и остатками основания кислоты).
Для количественной характеристики способности электролита к диссоциации введен параметр «степень диссоциации». Эта величина отражает процент молекул, подвергшихся распаду. Она зависит от:
• самого вещества;
• растворителя;
• концентрации вещества;
• температуры.
Электролиты делят на сильные и слабые. Чем лучше реагент растворяется (распадается на ионы), тем сильнее электролит, тем лучше он проводит ток. К сильным электролитам относятся щелочи, сильные кислоты и растворимые соли.
Для электролитов, использующихся в аккумуляторах, очень важен такой параметр, как плотность. От нее зависят условия эксплуатации аккумулятора, его емкость и срок службы. Определяют плотность с помощью ареометров.
Меры предосторожности при работе с электролитами
Самые популярные электролиты, это раствор концентрированной серной кислоты и щелочи — чаще всего гидроксиды калия, натрия, лития. Все они вызывают химические ожоги кожи и слизистых, очень опасные ожоги глаз. Именно поэтому все работы с такими электролитами нужно производить в отдельном, хорошо вентилируемом помещении, используя средства защиты: одежду, маски, очки, резиновые перчатки.
• Рядом с помещением, где проводятся работы с электролитами, должна храниться аптечка с набором нейтрализующих средств и кран с водой.
• Кислотные ожоги нейтрализуются раствором соды (1 ч.л. на 1 ст. воды).
• Ожоги щелочью нейтрализуют раствором борной кислоты (1 ч.л. на 1 ст. воды).
• Для промывания глаз нейтрализующие растворы должны быть в два раза слабее.
• Поврежденные участки кожи сначала промывают нейтрализатором, а потом мылом и водой.
• Если электролит пролили, его собирают опилками, потом промывают нейтрализатором и вытирают насухо.
При работе с электролитом следует выполнять все требования техники безопасности. Например, кислоту наливают в воду (а не наоборот!) не вручную, а с помощью приспособлений. Куски твердой щелочи в воду опускают не руками, а щипцами или ложками. Нельзя работать в одном помещении с аккумуляторами на разнотипных электролитах, и хранить их вместе тоже запрещается.
Некоторые работы требуют «кипения» электролита. При этом выделяется водород — горючий и взрывоопасный газ. В таких помещениях должна использоваться взрывобезопасная электропроводка и электроприборы, запрещается курение и любые работы с открытым огнем.
Хранят электролиты в пластиковых емкостях. Для работы подходит стеклянная, керамическая, фарфоровая посуда и инструменты.
В следующей статье расскажем подробнее о видах и применении электролита.
Электролиты и неэлектролиты
1. Электролиты — это вещества, растворы или расплавы которых проводят электрический ток.
2. К электролитам относятся щелочи, растворимые соли и кислоты.
3. В водных растворах электролиты распадаются на ионы.
4. Неэлектролиты — вещества, растворы которых не проводят электрический ток.
5. К неэлектролитам относят простые вещества (металлы и неметаллы), оксиды, большинство органических веществ: углеводороды, спирты, альдегиды, углеводы, простые и сложные эфиры и др.
6. Слабые кислоты: H2S, H2CO3, HF, H2SO3, H2SiO3, органические кислоты
Давайте порассуждаем вместе
1. К электролитам относится
1) метанол
2) железо
3) хлорид железа (II)
4) оксид железа (III)
Ответ: электролитом является хлорид железа (II) — растворимая соль
2. К электролитам относится
1) фосфор
2) сера
3) глюкоза
4) уксусная кислота
Ответ: электролитом является уксксная кислота — т.к. это растворимая кислота.
3. К слабым электролитам не относится
1) соляная кислота
2) сероводород
3) угольная кислота
4) уксусная кислота
Ответ: соляная кислота не относится к слабым электролитам, это сильный электролит
4. К сильным электролитам не относится
1) бромоводород
2) хлороводород
3) сероводород
4) серная кислота
Ответ: сероводород — это слабый электролит, не относится к сильным электролитам
5. Сильным электролитом является
1) угольная кислота
2) серная кислота
3) сахароза
4) метан
Ответ: серная кислота — сильный электролит
6. Не является электролитом
1) поваренная соль
2) щелочь
3) азотная кислота
4) спирт
Ответ: спирт не является электролитом
7. К электролитам относится
1) C2H5OH
2) C2H4
3) Ca(OH)2
4) CO
Ответ: Ca(OH)2 — малорастворимое основание, значит относится к электролитам
| Электролиты — это вещества, которые при растворении в воде распадаются на
катионы (положительно заряженные ионы) и анионы (отрицательно заряженные ионы). Мы говорим, что они ионизируют . Сильные электролиты полностью ионизируются (100%), а слабые электролиты ионизируется лишь частично (обычно порядка 1–10%). То есть основных видов в растворе для сильных электролитов — ионы, в то время как в растворе
для слабых электролитов — это само неионизированное соединение. Сильные электролиты делятся на три категории: сильные кислоты, , сильных оснований и солей . (Соли иногда также называют ионными соединениями , но действительно сильные основания также являются ионными соединениями.) Слабые электролиты включают слабых кислот и слабых оснований . Примеры сильных и слабых электролитов приведены ниже:
Возможность классифицировать электролиты критичнаКак химики, мы должны иметь возможность взглянуть на такую формулу, как HCl или NaOH, и быстро узнать к какой из этих классификаций он относится, потому что нам нужно уметь знать, с чем мы работаем (ионами или соединениями), когда мы работаем с химикаты.Например, нам нужно знать, что бутылка с надписью «NaCN» (соль) действительно содержит нет NaCN, скорее Na + и CN — , или что бутылка с надписью «HCN» (слабая кислота) в основном HCN с небольшим количеством также присутствуют H + и CN — . Разница между простым открытием бутылки с надписью «HCN» и бутылки с надписью «NaCN» может быть вашей жизнью, поскольку HCN, или цианистый водород , является токсичным газом, в то время как CN —, или цианид-ион , являющийся ионом, не является газом и передается только в твердой или растворной форме.Тем не менее, именно цианид-ион CN — является убийцей. (Он фиксируется на Fe 3+ в гемоглобине, из-за чего в мозг поступает меньше кислорода.) Цианид присутствует в обоих флаконах, и если он попадет в ваш кровоток в виде CN – или HCN, он вас убьет. Шесть шагов для классификации электролитовТак как же нам классифицировать соединения на основе их формулы? Один из практических методов описан ниже:
Обратите внимание, что здесь есть двусмысленность, начиная с шага 4.Просто так оно и есть. Чтобы определить, является ли вещество слабой кислотой или слабым основанием, у вас есть знать больше, чем молекулярная формула, особенно для соединений, содержащих углерод. (Часто необходима структурная формула , которая показывает подробные связи атомов.) СводкаТаким образом, вы должны знать наиболее распространенные имена и символы элементов, запомнить семь сильных кислот, уметь заметить металл (знать хотя бы, где они на таблица Менделеева), запомните хотя бы несколько наиболее распространенных слабых кислот и слабых оснований, и будешь в хорошей форме. ВЫ МОЖЕТЕ ЭТО СДЕЛАТЬ! |
Электролитная прочность — Chemistry LibreTexts
Навыки для развития
- Определите 3 типа электролитов
- Опишите взаимосвязь между растворимостью и прочностью электролита
Электролит означает растворенное вещество, которое позволяет водному раствору проводить электричество. Электролиты производят ионы, когда растворяются в растворе. Соли обычно являются электролитами, а молекулярные вещества — нет, если только они не являются кислотами или основаниями.
Сильные и слабые электролиты
Однако ситуация несколько усложняется из-за различия между сильными электролитами и слабыми электролитами. Сильный электролит, такой как NaCl, полностью распадается на ионы натрия и хлора в растворе. Точно так же сильная кислота, такая как HCl, полностью распадается на ионы водорода и хлора в растворе. Соли часто являются сильными электролитами, а сильные кислоты всегда являются сильными электролитами. Слабые кислоты — это слабые электролиты, а большинство других молекулярных соединений не являются электролитами.{-} (водн.) \; (для \; a \; 0,5 \; M \; раствора) \]
Как видите, эти соли являются электролитами (они действительно производят ионы), но если вы сделаете расчеты, предполагая, что они полностью разделяются на ионы сульфата, калия, кадмия (II) и йодида, вы можете получить очень неправильные ответы! Это не сильные электролиты. В общем, чем ниже концентрация и чем меньше заряд на ионах, тем «сильнее» будут электролиты. Щелочные металлы, отличные от лития, обычно являются сильными электролитами, особенно когда анион также имеет небольшой заряд, и в разбавленных растворах (<0.1M). Соединения щелочноземельных металлов являются более слабыми электролитами, а другие металлы еще слабее. О том, почему это так, мы поговорим позже.
Растворимость и прочность электролита
Растворимость здесь может вызвать некоторую путаницу. Например, возможно, что соединение является сильным электролитом, но не очень растворимым. По этой причине невозможно получить раствор с большим количеством ионов, потому что он не растворим, а не потому, что ионы все еще прикреплены друг к другу в растворе.В общем, имеет смысл предположить, что если ионы в соединении очень сильно притягиваются друг к другу, соединение будет менее растворимым, а также может быть более слабым электролитом, потому что даже в растворе ионы будут связаны друг с другом. . Однако электролиты также выглядят сильнее при более низких концентрациях, потому что, если ионы расщепляются, они с меньшей вероятностью снова найдут друг друга.
Авторы и авторство
Сильные и слабые электролиты | Химия для неосновных специалистов
Цели обучения
- Определите сильный электролит.
- Определите слабый электролит.
- Объясните, как писать уравнения для слабого электролита в растворе.
Могут ли автомобильные аккумуляторы быть опасными?
Автомобильные аккумуляторы, подобные показанному выше, используются во всем мире для запуска двигателей автомобилей. Одним из важнейших компонентов автомобильных аккумуляторов является серная кислота с сильным электролитом. В батарее этот материал ионизируется на ионы водорода и ионы сульфата. По мере использования батареи концентрация этих ионов уменьшается.У старых батарей в верхней части были отверстия, куда можно было добавить новую серную кислоту для пополнения запаса. Сегодня батареи герметичны, чтобы предотвратить утечку опасной серной кислоты.
Сильные и слабые электролиты
Некоторые полярные молекулярные соединения не являются электролитами, когда они находятся в чистом состоянии, но становятся электролитами, когда они растворяются в воде. Хлористый водород (HCl) представляет собой газ в чистом молекулярном состоянии и не является электролитом. Однако, когда HCl растворяется в воде, она хорошо проводит ток, потому что молекула HCl ионизируется с образованием ионов водорода и хлорида.
HCl ( г ) → H + ( водн. ) + Cl — ( водн. )
Когда HCl растворяется в воде, она называется соляной кислотой. Ионные соединения и некоторые полярные соединения полностью распадаются на ионы и поэтому очень хорошо проводят ток. Электролит strong — это раствор, в котором большая часть растворенных растворенных веществ существует в виде ионов.
Некоторые другие полярные молекулярные соединения становятся электролитами при растворении в воде, но не ионизируются в очень значительной степени.Газообразная азотистая кислота в растворе ионизируется на ионы водорода и ионы нитрита, но делает это очень слабо. Водная азотистая кислота состоит только из 5% ионов и 95% интактных молекул азотистой кислоты. Слабый электролит — это раствор, в котором только небольшая часть растворенного вещества существует в виде ионов. В уравнении, показывающем ионизацию слабого электролита, используется двойная стрелка, указывающая на равновесие между реагентами и продуктами.
Сводка
- Сильный электролит существует в основном в виде ионов в растворе.
- Раствор слабого электролита имеет лишь небольшую ионизацию.
Практика
Воспользуйтесь ссылкой ниже, чтобы ответить на следующие вопросы:
http://www.stolaf.edu/depts/chemistry/courses/toolkits/121/js/naming/elec.htm
- Какая основная разновидность сильного электролита?
- Какая основная разновидность слабого электролита?
- КОН — это сильный электролит или слабый электролит?
- Как бы вы классифицировали CaCl 2 ?
Обзор
- Газообразный HCl — это электролит или неэлектролит?
- Что происходит с газообразным HCl, когда он растворяется в воде?
- Что такое сильный электролит?
- Что такое слабый электролит?
- Является ли HNO 3 сильным электролитом или слабым электролитом?
Глоссарий
- сильный электролит: Раствор, в котором большая часть растворенного вещества существует в виде ионов.
- слабый электролит: Раствор, в котором лишь небольшая часть растворенного вещества существует в виде ионов.
Учебное пособие по химии сильных и слабых электролитов
Рабочие примеры: определение сильного или слабого электролита
Вопрос 1: Соляная кислота полностью диссоциирует в воде с образованием ионов водорода и ионов хлора.
Соляная кислота — сильный электролит или слабый электролит?
Решение:
(На основе подхода StoPGoPS к решению проблем.)
- Что вас просят сделать?
Определить, является ли соляная кислота сильным электролитом или слабым электролитом.
- Какие данные (информацию) вы указали в вопросе?
соляная кислота полностью диссоциирует в воде
- Какая связь между тем, что вы знаете, и тем, что вам нужно выяснить?
HCl (водн.) полностью диссоциирует в воде с образованием ионов водорода H + (водн.) и ионов хлора, Cl — (водн.)
HCl (водн.) → H + (водн.) + Cl — (водн.)
Следовательно, в растворе много ионов. - Определите концентрацию соляной кислоты как электролита:
Соляная кислота, HCl (водн.) , полностью диссоциирует, поэтому в растворе много ионов, проводящих электричество, поэтому соляная кислота является сильным электролитом.
- Правдоподобен ли ваш ответ?
Используйте Рекомендации, чтобы проверить свой ответ:
Рекомендация (1): большинство кислот являются слабыми электролитами.
ЗА ИСКЛЮЧЕНИЕМ HCl (водн.) и некоторых других кислот, таких как HNO 3 (водн.) и H 2 SO 4 (водн.) , которые являются сильными кислотами и, следовательно, сильными электролитами
Следовательно, соляная кислота является сильным электролитом в соответствии с инструкциями.Поскольку ответ, который мы получаем из руководящих принципов, совпадает с ответом, который мы получаем с использованием информации о диссоциации HCl (водн.) из вопроса, мы уверены, что наш ответ правильный.
- Укажите свое решение проблемы «сильным или слабым электролитом является соляная кислота»:
Соляная кислота — сильный электролит.
Вопрос 2: Является ли водный раствор гидроксида натрия сильным электролитом или слабым электролитом?
Решение:
(На основе подхода StoPGoPS к решению проблем.)
- Что вас просят сделать?
Определить, является ли водный раствор гидроксида натрия сильным электролитом или слабым электролитом.
- Какие данные (информацию) вы указали в вопросе?
водный раствор гидроксида натрия: NaOH (водн.)
- Какая связь между тем, что вы знаете, и тем, что вам нужно выяснить? Норматив
(2): гидроксиды металлов группы 1 (щелочные) и металлов группы 2 (щелочно-земельные) являются сильными электролитами.
(Ba (OH) 2 — исключение)
Натрий — металл группы 1 (щелочной). - Определите концентрацию гидроксида натрия как электролита:
Гидроксид натрия — сильный электролит, потому что это гидроксид металла группы 1.
- Правдоподобен ли ваш ответ?
Гидроксид натрия, NaOH (s) , используется в очистителях канализации.
Это твердое ионное вещество, состоящее из ионов натрия Na + и гидроксид-ионов OH — .
При добавлении воды для образования водного раствора мы видим, что он растворяется, то есть решетка ионов разрушается, так что каждый ион полностью окружен водой, то есть гидроксид натрия полностью диссоциирует в воде:NaOH (водн.) → Na + (водн.) + OH — (водн.)
Следовательно, в растворе будет много ионов, проводящих электричество.
Следовательно, водный раствор гидроксида натрия является сильным электролитом.Поскольку ответ, который мы получаем, размышляя о диссоциации гидроксида натрия в воде, совпадает с ответом, который мы получаем с помощью Руководства, мы уверены, что наш ответ правильный.
- Укажите свое решение проблемы «гидроксид натрия — сильный или слабый электролит»:
Водный раствор гидроксида натрия — сильный электролит.
Вопрос 3: Хлорид натрия полностью диссоциирует в воде с образованием ионов натрия и ионов хлора.
Хлорид натрия — сильный электролит или слабый электролит?
Решение:
(На основе подхода StoPGoPS к решению проблем.)
- Что вас просят сделать?
Определить, является ли хлорид натрия сильным электролитом или слабым электролитом.
- Какие данные (информацию) вы указали в вопросе?
Натрия хлорид полностью диссоциирует в воде
- Какая связь между тем, что вы знаете, и тем, что вам нужно выяснить?
Хлорид натрия, NaCl (s) , представляет собой соль (получается нейтрализацией соляной кислоты гидроксидом натрия)
Если соль полностью диссоциирует, 100% диссоциация, в растворе много ионов.NaCl (водн.) → Na + (водн.) + Cl — (водн.)
Чем больше ионов, тем лучше раствор проводит электричество.
- Определите концентрацию хлорида натрия как электролита:
Хлорид натрия — сильный электролит, потому что это соль, полностью диссоциирующая в воде.
- Правдоподобен ли ваш ответ?
Используйте рекомендации, чтобы проверить свой ответ:
Рекомендация (3): большинство солей являются сильными электролитами.
Исключения: HgCl 2 и CdSO 4 — слабые электролиты.Хлорид натрия — сильный электролит, потому что это соль, не указанная в списке слабых солей.
Поскольку ответ, который мы получили при рассмотрении процентной диссоциации хлорида натрия, такой же, как и при рассмотрении руководящих принципов, мы уверены, что наш ответ правильный.
- Укажите свое решение проблемы «является ли хлорид натрия сильным или слабым электролитом»:
Хлорид натрия — сильный электролит.
Вопрос 4: Уксусная кислота (этановая кислота), CH 3 COOH, имеет небольшую константу диссоциации кислоты (K a = 1,8 × 10 -5 ).
Является ли уксусная кислота (этановая кислота) сильным электролитом или слабым электролитом?
Решение:
(На основе подхода StoPGoPS к решению проблем.)
- Что вас просят сделать?
Определить, является ли уксусная кислота сильным электролитом или слабым электролитом.
- Какие данные (информацию) вы указали в вопросе? Уксусная кислота
имеет небольшую константу диссоциации (K a маленькая)
- Какая связь между тем, что вы знаете, и тем, что вам нужно выяснить?
Если константа диссоциации кислоты, K a , мала, то очень мало молекул кислоты диссоциирует (ионизируется), то есть в растворе будет мало ионов.
Малая константа диссоциации означает, что в растворе мало ионов, проводящих электричество.
Положение равновесия для реакции диссоциации:CH 3 COOH (водн.) ⇋ CH 3 COO — (водн.) + H + (водн.)
лежит левее, то есть предпочтение отдается недиссоциированным молекулам. - Определите концентрацию уксусной кислоты как электролита:
Уксусная кислота — слабый электролит, потому что ее константа диссоциации мала, что означает, что в растворе будет мало ионов, проводящих электричество.
- Правдоподобен ли ваш ответ?
Используйте Рекомендации, чтобы проверить свой ответ:
Рекомендация (1): большинство кислот являются слабыми электролитами.
Исключения (сильные электролиты): HCl (водн.) , HNO 3 (водн.) , H 2 SO 4 (водн.) , HClO 3 (водн.) , HClO 4 (водн. ) , HBr (водн.) и HI (водн.)
Уксусная кислота (этановая кислота, CH 3 COOH) не указана в качестве исключения, поэтому уксусная кислота является слабым электролитом.Поскольку мы пришли к одному и тому же ответу, используя как малую константу диссоциации кислоты, так и Рекомендации, мы уверены, что наш ответ правильный.
- Укажите свое решение проблемы «является ли уксусная кислота сильным или слабым электролитом»:
Уксусная кислота — слабый электролит.
1. Серная кислота — сильная полипротонная кислота.
Первая константа диссоциации очень велика, поэтому мы предполагаем, что эта реакция идет до завершения:
H 2 SO 4 (водн.) → HSO 4 — (водн.) + H + (водн.)
Вторая константа диссоциации намного меньше первой, поэтому реакция в которой HSO 4 — теряет протон, H + , не доходит до завершения, ионы находятся в равновесии с недиссоциированными молекулами кислоты:
HSO 4 — (водн.) ⇋ SO 4 2- (водн.) + H + (водн.)
2.Молекулы воды в очень небольшой степени подвергаются самодиссоциации.
K w = 10 -14 при 25 ° C
То есть K w очень маленький.
Что такое электролиты в химии? Сильные, слабые и неэлектролиты
Разница между сильными, слабыми и неэлектролитами заключается в том, насколько они диссоциируют на ионы в воде.Электролиты — это химические вещества, которые распадаются на ионы (ионизируются) при растворении в воде.Положительно заряженные ионы называются катионами, а отрицательно заряженные ионы — анионами. Вещества классифицируются как сильные электролиты, слабые электролиты или неэлектролиты.
Сильные электролиты
Сильные электролиты полностью ионизируются в воде. Это означает, что 100% растворенного химического вещества распадается на катионы и анионы. Однако это не означает, что химическое вещество полностью растворяется в воде! Например, некоторые виды мало растворимы в воде, но являются сильными электролитами.Это означает, что растворяется не очень много, но все, что растворяется, распадается на ионы. Примером является гидроксид стронция с сильным основанием, Sr (OH) 2 . Он имеет низкую растворимость в воде, но полностью диссоциирует на ионы Sr 2+ и OH — . В то время как колба с гидроксидом натрия (NaOH) в воде будет содержать ионы Na + и OH — в воде, но не фактический NaOH, колба с водным гидроксидом стронция будет содержать ионы Sr 2+ и OH —. , Sr (OH) 2 и вода.
Примеры : Сильные кислоты, сильные основания и соли являются сильными электролитами.
Слабые электролиты
Слабые электролиты частично ионизируются в воде. Практически любая диссоциация на ионы между 0% и 100% делает химическое вещество слабым электролитом, но на практике от 1% до 10% слабого электролита распадается на ионы.
Примеры : Слабые кислоты и слабые основания являются слабыми электролитами. Большинство азотсодержащих молекул — слабые электролиты.Некоторые источники считают воду слабым электролитом, потому что она частично диссоциирует на ионы H + и OH — , но неэлектролитом по другим источникам, потому что только очень небольшое количество воды диссоциирует на ионы.
Неэлектролиты
Если вещество вообще не ионизируется в воде, это неэлектролит.
Примеры : Большинство соединений углерода неэлектролиты. Жиры, сахара и спирты в значительной степени неэлектролиты.
Почему вас это должно волновать?
Самая важная причина узнать, является ли химическое вещество электролитом и насколько сильно оно диссоциирует в воде, заключается в том, что эта информация нужна вам для определения химических реакций, которые могут происходить в воде.Кроме того, если у вас есть контейнер с химическим веществом в воде, неплохо знать, растворяется ли это вещество в воде (его растворимость) и диссоциирует ли оно на ионы.
Классическим примером того, почему это важно, является раствор цианида натрия (NaCN). Вы, вероятно, знаете, что цианид является реактивным и чрезвычайно токсичным, поэтому не могли бы вы открыть бутылку цианида натрия в воде? Если вы узнаете, что цианид натрия является солью, вы будете в безопасности (при условии, что не пьете раствор), потому что в воде нет цианида натрия, только ионы Na + и CN — в воде. .Ионы цианида не летучие и не вызывают болезней. Сравните это с бутылкой цианистого водорода (HCN) в воде. Вы бы открыли эту бутылку? Если вы узнаете, что цианистый водород является слабой кислотой, вы будете знать, что в бутылке содержится газообразный цианистый водород, ионы водорода, ионы цианида и вода. Открытие этой бутылки может стоить вам жизни!
Как узнать, какие химические вещества являются электролитами?
Теперь, когда вы заинтересованы в том, чтобы узнать, что такое электролит, вы, вероятно, задаетесь вопросом, как определить, к какому типу электролита относится химическое вещество, по его названию или структуре.Вы делаете это путем исключения. Вот несколько шагов, которые необходимо выполнить, чтобы определить сильные, слабые и неэлектролиты.
- Это сильная кислота? Их всего 7 штук, и вы будете часто сталкиваться с ними по химии, так что это хороший план, чтобы их запомнить. Сильные кислоты — сильный электролит.
- Это сильная база? Это немного большая группа, чем сильные кислоты, но вы можете идентифицировать сильные основания, потому что они являются гидроксидами металлов. Любой элемент из первых двух столбцов периодической таблицы в сочетании с гидроксидом является сильным основанием.Сильные основания — сильные электролиты.
- Это соль? Соли — сильные электролиты.
- Содержит ли химическая формула азот или «N»? Это может быть слабое основание, что сделало бы его слабым электролитом.
- Химическая формула начинается с водорода или «H»? Это может быть слабая кислота, которая делает ее слабым электролитом.
- Это соединение углерода? Большинство органических соединений не являются электролитами.
- Ничего из вышеперечисленного? Есть большая вероятность, что это неэлектролит, хотя это может быть слабый электролит.
Таблица сильных электролитов, слабых электролитов и неэлектролитов
В этой таблице обобщены группы сильных, слабых и неэлектролитов с примерами каждой категории.
| Сильные электролиты | ||
| сильные кислоты | HCl (соляная кислота) | |
| HBr (бромистоводородная кислота) | ||
| HI (иодоводородная кислота) | ||
| HNO 3 (азотная кислота) | ||
| HClO 3 | ||
| HClO 4 | ||
| H 2 SO 4 (серная кислота) | ||
| сильных оснований | NaOH (гидроксид натрия) | |
| KOH (гидроксид калия) | ||
| LiOH | ||
| Ba (OH) 2 | ||
| Ca ( OH) 2 | ||
| соли | NaCl | |
| KBr 9003 3 | ||
| MgCl 2 | ||
| Слабые электролиты | ||
| слабые кислоты | HF (плавиковая кислота) | |
| HC 2 O 3 (уксусная кислота) | ||
| H 2 CO 3 (угольная кислота) | ||
| H 3 PO 4 (фосфорная кислота) | ||
| слабые основания | NH 3 (аммиак) | |
| (соединения «N») | C 5 H 5 N (пиридин) | |
| Неэлектролиты | ||
| сахара и углеводы | C 6 H 12 O 6 (глюкоза) | |
| жиры и липиды | холестерин | |
| спирты | C 2 H 5 OH (этиловый спирт) | |
| другие углеродные соединения | C 5 H 12 (пентан) |
Как определить, является ли соединение сильным электролитом
Вывод Если соединение является сильным электролитом, это может помочь вам еще больше различать различные типы химических связей, из которых состоят соединения и молекулы.Сильный электролит — это соединение, которое полностью диссоциирует в растворе на положительные катионы и отрицательные анионы. Он хорошо проводит электричество в растворе. Соединение может быть либо сильным электролитом, либо слабым электролитом. Важно уметь различать их, поскольку каждый из них имеет разные свойства.
Определите, является ли соединение ионным или ковалентным. Ионные соединения обычно состоят из металлов и неметаллов. Металлы, за исключением водорода, расположены слева от таблицы Менделеева, а неметаллы — с правой стороны.Примером ионного соединения является KCl или хлорид калия. Ковалентные соединения обычно состоят из неметаллов. Примером является C2H6 или этан. Если соединение ковалентное, то это, вероятно, не сильный электролит. Ионные соединения, скорее всего, будут сильными электролитами.
Определите, является ли соединение сильной кислотой. Сильные кислоты также являются сильными электролитами. Соединения, которые образованы из элементов Группы 17, таких как HCl, HBr и HI, являются сильными кислотами. Другие сильные кислоты включают h3SO4, HNO3, HClO3 и HClO4.
Проверьте, является ли состав сильным основанием. Сильные основания также являются сильными электролитами. Соединения, которые образуются с гидроксид-ионом ОН-, обычно являются сильными основаниями. Примеры включают LiOH, NaOH, КОН, Ca (OH) 2 и Ba (OH) 2.
Определите, образовано ли соединение из элемента Группы 1 или 2 с элементом Группы 17. Такие соединения обычно представляют собой ионные соли, которые также являются сильными электролитами. Примеры включают NaCl и KCl.
Запомните сильные электролиты, которые образуются с цинком и медью.Два соединения, которые являются сильными электролитами, — это ионные соединения ZnSO4 и CuSO4. Если соединение относится к одному из них, то это определенно сильный электролит.
Exam II Review
Exam II ReviewОтзыв к экзамену II
Далее следует пошаговый обзор концепций и проблем для глав 4 и 5. Обязательно ПОПРОБУЙТЕ проблемы самостоятельно, прежде чем смотреть ответы, иначе вы зря тратите время.
Concept 1: Сбалансированная химическая реакция
Чтобы уравновесить реакции, по обе стороны стрелки реакции должно быть одинаковое количество каждого элемента.
Уравновесить следующие реакции:
1) ____ N 2 + ____ H 2 à ____ NH 3
2) ____ KClO 3 à ____ KCl + ____ O 2
3) ____ NaCl + ____ F 2 à ____ NaF + ____ Cl 2
4) ____ H 2 + ____ O 2 à ____ H 2 O
5) ____ Pb (OH) 2 + ____ HCl à ____ H 2 O + ____ PbCl 2
6) ____ AlBr 3 + ____ K 2 SO 4 à ____ KBr + ____ Al 2 (SO 4 ) 3
7) ____ CH 4 + ____ O 2 à ____ CO 2 + ____ H 2 O
8) ____ C 3 H 8 + ____ O 2 à ____ CO 2 + ____ H 2 O
9) ____ C 8 H 18 + ____ O 2 à ____ CO 2 + ____ H 2 O
10) ____ FeCl 3 + ____ NaOH à ____ Fe (OH) 3 + ____NaCl
11) ____ P + ____O 2 à ____P 2 O 5
12) ____ Na + ____ H 2 O ____ NaOH + ____H 2
13) ____ Ag 2 O ____ Ag + ____O 2
14) ____ S 8 + ____O 2 à ____ SO 3
15) ____ CO 2 + ____ H 2 O ____ C 6 H 12 O 6 + ____O 2
16) ____ K + ____ MgBr à ____ KBr + ____ Mg
17) ____ HCl + ____ CaCO 3 à ____ CaCl 2 + ____H 2 O + ____ CO 2
18) ____ HNO 3 + ____ NaHCO 3 à ____ NaNO 3 + ____ H 2 O + ____ CO 2
19) ____ H 2 O + ____ O 2 à ____ H 2 O 2
20) ____ NaBr + ____ CaF 2 à ____ NaF + ____ CaBr 2
21) ____ H 2 SO 4 + ____ NaNO 2 à ____ HNO 2 + ____ Na 2 SO 4
Нажмите здесь, чтобы проверить свои ответы
Концепция 2: Стехиометрия
Как только вы освоите балансировку уравнений, вы должны знать, как их использовать.Когда вы читаете реакцию, она дает вам информацию о том, как реагенты и продукты связаны друг с другом.
Например: H 2 SO 4 (водн.) + 2KOH àK 2 SO 4 (водн.) + 2H 2 O (л)
Вы бы прочитали это так, как один моль серной кислоты реагирует с двумя молями гидроксида калия, давая один моль сульфата калия и два моля воды.
Отношения реагента к реагенту и реагента к продукту по существу являются коэффициентами пересчета.Поэтому, если вам даны моли продукта или реагента, вы можете использовать эти отношения для прогнозов.
Например: Сколько молей гидроксида калия необходимо для реакции с 12 молями серной кислоты?
12 моль H 2 SO 4 x [2 моль KOH / 1 моль H 2 SO 4 ] = 24 моль KOH
или
Сколько молей сульфуровой кислоты и гидроксида калия необходимо для получения 5 молей воды?
5 моль H 2 O x [2 моль KOH / 2 моль H 2 O] = 5 моль KOH
5 моль H 2 O x [1 моль H 2 SO 4 /2 моль H 2 O] = 2.5 моль H 2 SO 4
Обратите внимание, что во всех отношениях используются родинки. Чтобы использовать «коэффициенты пересчета», указанные в химической реакции, вы должны сначала указать количество продукта или реагента в молях.
Вот некоторые практические задачи по вычислению молекулярных масс и преобразованию из граммов в моль и из молей в граммы и использования этих значений для прогнозирования количества продукта и реагентов: ПРАКТИКА
Ограничение и избыток реагентов — это просто продолжение использования сбалансированной реакции для прогнозирования.В этом типе вопросов можно задать всего 5 вопросов:
1) Учитывая количество реагента, сколько продукта можно получить. (Это количество часто называют «теоретическим выходом») Реагент, который дает наименьшее количество продукта или наименьший теоретический выход, является ограничивающим реагентом. Другой реагент останется после завершения реакции, так что это избыток реагента.
2) Учитывая количество реагента, какое количество другого реагента необходимо. Вы можете использовать количество ограничивающего реагента, чтобы рассчитать, сколько излишка реагента израсходовано. Разница между тем, что используется излишка реагента, и тем, что вам дают, — это оставшееся количество.
3) Учитывая количество продукта, сколько реагента было использовано или необходимо для его производства.
4) Каков процент выхода продукта при заданном количестве продукта. Этот тип проблемы требует завершения задачи типа 1).
5) Проблема реакции нейтрализации.Этот тип проблемы требует завершения задачи типа 2).
Вот практическое руководство по ограничению и избытку реагентов: ПРАКТИКА
Подробнее ПРАКТИКА
Молярность
Молярность (М) — это наиболее распространенная единица концентрации для растворов. Это количество молей растворенного вещества на литр раствора. M = моль / л.
Растворенное вещество — это химическая молекула, растворенная в растворе.Растворителем является жидкость, в которой растворяется растворенное вещество. Чаще всего растворителем является вода. Раствор, в котором в качестве растворителя используется вода, называется водным раствором.
Вот некоторые практические задачи с использованием решений, а не граммов: ПРАКТИКА
Электролиты
Электролит — это любое вещество, содержащее свободные ионы, которое ведет себя как электропроводящая среда. Поскольку они обычно состоят из ионов в растворе, электролиты также известны как ионные растворы, но также возможны расплавленные электролиты и твердые электролиты.
Электролиты — это вещества, которые при растворении в воде распадаются на катионы (положительно заряженные ионы) и анионы (отрицательно заряженные ионы). Мы говорим, что они ионизируются. Сильные электролиты ионизируются полностью (100%), тогда как слабые электролиты ионизируются только частично (обычно порядка 1–10%). Таким образом, основными компонентами раствора для сильных электролитов являются ионы, а в растворе для слабых электролитов основным веществом является само неионизированное соединение.
Сильные электролиты делятся на три категории: сильные кислоты, сильные основания и соли.(Соли иногда также называют ионными соединениями, но действительно сильные основания также являются ионными соединениями.) Слабые электролиты включают слабые кислоты и слабые основания.
Классифицирующие электролиты
Примеры сильных и слабых электролитов приведены ниже:
| Сильные электролиты | сильные кислоты | HCl, HBr, HI, HNO 3 , HClO 3 , HClO 4 и H 2 SO 4 |
| прочные основания | NaOH, KOH, LiOH, Ba (OH) 2 и Ca (OH) 2 | |
| соли | NaCl, KBr, MgCl 2 и многие, многие другие | |
| Слабые электролиты | ||
| слабые кислоты | HF, HC 2 H 3 O 2 (уксусная кислота), H 2 CO 3 (угольная кислота), H 3 PO 4 (фосфорная кислота) и многие другие | |
| слабые базы | NH 3 (аммиак), C 5 H 5 N (пиридин) и несколько других, все содержащие «N» |
Неэлектролиты
Неэлектролиты — это соединения, которые не ионизируются при растворении в воде.Неэлектролиты ограничиваются ковалентными соединениями. Многие соединения углерода, такие как матан CH 4 , бензол C 6 H 6 , этанол C 2 H 5 OH, эфир (C 2 H 5 ) 2 O и формальдегид CH 2 O, неэлектролиты. Некоторые неорганические соединения, такие как закись азота N 2 O, фосфин PH 3 и хлорид азота (III) NCl 3 , не являются электролитами.Осадки
Осадок образуется, когда реакция между двумя или более реагентами приводит к образованию нерастворимой соли.Осадки показаны как твердые частицы в сбалансированных химических реакциях. В самом растворе они падают на дно емкости, поскольку плотность нерастворимой соли обычно больше, чем плотность растворителя вокруг нее.
Образование осадка — одна из причин, по которой реакция будет идти в прямом направлении (как написано) до завершения. Чтобы знать, образуется осадок или нет, вы должны знать, какие соли растворимы, а какие нет.
Правила растворимости
Следующий набор правил очень полезен для предсказания, какие соли растворимы в воде, а какие нет.- Соли, содержащие катионы щелочных металлов или аммоний, растворимы.
- Соли, содержащие анионы нитрата, ацетата хлората или перхлората, растворимы.
- Соли, содержащие хлорид, бромид или йодид, растворимы. (За исключением Cu + , Ag + , Hg 2 +2 и Pb +2 )
- Соли, содержащие сульфат или сульфит, растворимы. (За исключением Ca +2 , Ba +2 , Sr +2 и Pb +2 )
- Соли оксидов и гидроксидов не растворимы.(За исключением катионов группы IA и аммония.)
- Сульфидные и сероводородные соли нерастворимы. (За исключением катионов группы IA и аммония.)
- Карбонатные и хроматные соли нерастворимы. (За исключением группы IA и катионов аммония и аммония.)
| Пример | Причина | ||
| Na 2 CO 3 | растворимый | Катион натрия обеспечивает растворимость. | Правила №1, 7 |
| CoCO 3 | нерастворимый | Карбонат-анион не растворяется. | Правило № 7 |
| Pb (НЕТ 3 ) 2 | растворимый | Нитрат-анион обеспечивает растворимость. | Правило № 2 |
| К 2 S | растворимый | Катион калия обеспечивает растворимость, несмотря на присутствие сульфида. | Правила №1, 6 |
| BaSO 4 | нерастворимый | Сульфат-анион обеспечивает растворимость, за исключением того, что соль содержит барий. | Правило № 4 |
| PbCl 2 | нерастворимый | Хлориды растворимы, за исключением свинца (II). | Правило № 3 |
| (NH 4 ) 2 S | растворимый | Сульфиды нерастворимы, за исключением аммония. | Правила №1, 6 |
| CaCO 3 | нерастворимый | Карбонат-анион делает это соединение нерастворимым. | Правило № 7 |
| Li 2 O | растворимый | Оксиды нерастворимы, за исключением катионов группы IA. | Правила № 1, 5 |
| CuSO 4 | растворимый | Сульфаты растворимы. | Правило № 4 |
| FeS | нерастворимый | Сульфиды нерастворимы. | Правило № 6 |
| Pb (C 2 H 3 O 2 ) 2 | растворимый | Ацетаты растворимы. (Даже со свинцом (II)!) | Правило № 2 |
| AgI | нерастворимый | Иодиды растворимы, за исключением серебра (I). | Правило № 3 |
| Ni (НЕТ 3 ) 2 | растворимый | Нитрат обеспечивает растворимость. | Правило № 2 |
| NaI | растворимый | Натрий делает эту соль растворимой, как и йодид. | Правила № 1, 3 |
Кислоты и основания
Сильные кислоты — это кислоты, которые полностью или почти на 100% ионизированы в своих растворах.Вот некоторые распространенные сильные кислоты:
Ионизация ГК сильной кислоты может быть представлена как:
HA = H + + A —x x , где x — концентрация H + , [H + ]. Для сильной кислоты [H + ] = [A — ] = концентрация кислоты (= x ), если x намного больше, чем 1×10 -7 (представлено как e-7).Для очень разбавленного раствора сильной кислоты с концентрацией менее 1E-7, pH определяется автоионизацией воды , H 2 O = H + + OH — , K w = 1e- 14 при 298 К.
Шкалы pH и pOH
pH и pOH | ||
|---|---|---|
| pH | [H + ] | pOH |
| 1 | 0.1 | 13 |
| 2 | 0,01 | 12 |
| 3 | 0,001 | 11 |
| 4 | 1e-4 | 10 |
| 5 | 1e-5 | 9 |
| 6 | 1e-6 | 8 |
Решение
Раствор сильной кислоты полностью ионизирован. Таким образом, [H + ] = 1,234e-4.
Обсуждение
Каков pH раствора, содержащего 1,234 M [HCl]? pH = 0,0913
Решение
Плотность такого раствора необходима, прежде чем мы сможем рассчитать pH.Поскольку плотность не указана на этикетке, нам нужно найти ее в паспорте безопасности материала, в котором указан удельный вес 1,150. Таким образом, количество кислоты в 1,0 л составляет 1150 г.
Количество HCl = 1000 * 1,150 * 0,32
= 368 г (1 моль / 36,5 г <- молярная масса HCl)
= 10,08 M
= [H + ]
Обсуждение
Да, pH имеет отрицательные значения, если [H + ]> 1.0
Прочные основания
Сильные основания полностью ионизируются в растворе. Например, KOH растворяется в воде в реакции KOH = K + + OH — .| Прочные основания | ||
|---|---|---|
| Имя | Формула | |
| Натрий гидроксид | NaOH | |
| Калий гидроксид | КОН | |
| Цезий гидроксид | CsOH | |
| Кальций гидроксид | Са (ОН) 2 | |
Решение
По ионизации,
pOH = -log (2,468E-4)
= 3.61
Обсуждение
Молярная растворимость гидроксида кальция составляет 0,013 М Ca (OH) 2 . Рассчитайте pOH. рОН = 1,58
Автоионизация воды
Равновесный продукт K w = [H + ] [OH — ] является константой при определенной температуре из-за автоионизации воды, H 2 O = H + + OH — .При 298 K, K w = 10 -14 и следующая связь в любом водном растворе очевидна: pOH + pH = 14 при 298 K.Определение кислот и щелочей: ПРАКТИКА
Тесты по кислотам, основам и pH: ПРАКТИКА
Чистые ионные реакции
Наличие (или отсутствие) движущей силы для реакций, протекающих в воде, можно оценить с помощью чистого ионного уравнения.Полное и чистое ионные уравнения показывают реальное физическое состояние каждого компонента реакции. Соединение является сильным электролитом (растворимым ионным соединением или сильной кислотой), затем соединение разделяется на соответствующие водные ионы. В противном случае он остается в недиссоциированном (ионные соединения) состоянии или неионизированном состоянии (слабые кислоты, основания и вода).
Пример 1: CaCO 3 (s) + HCl ®?Молекулярное уравнение: CaCO 3 (s) + 2HCl (водн.) ® CaCl 2 (водн.) + H 2 O (l) + CO 2 (g)
Полное ионное уравнение: CaCO 3 (s) + 2H + (вод.) + 2Cl — (водн.) ® Ca 2+ (водн.) + 2Cl — (водн.) + H 2 O (л) + CO 2 (г)
Чистое ионное уравнение: CaCO 3 (с) + 2H + (водн.) ® Ca 2+ (водн.) + H 2 O (л) + CO 2 (г)
Движущей силой было образование воды и газа!
Пример 2: Fe (s) + AgNO 3 (водн.) ®?
Молекулярное уравнение: Fe (s) + 2AgNO 3 (водн.) ® 2Ag (s) + Fe (NO 3 ) 2 (водн.)
Полное ионное уравнение: Fe (s) + 2Ag + (вод.) + 2NO 3 — (вод.) ® 2Ag (s) + Fe 2+ (вод.) + 2NO 3 — (водн.)
Чистое ионное уравнение : Fe (s) + 2Ag + (водн.) ® 2Ag (s) + Fe 2+ (водн.)Движущей силой был перенос электронов от железа (восстановитель) к иону серебра (окислитель). Помните: восстановитель — это реагент, который отдает электроны реагенту, который восстанавливается. Когда восстановитель теряет электроны, он окисляется. Окислитель в реагенте, который принимает электроны от окисляемого реагента. При этом окислитель восстанавливается.
Пример 3: K 3 PO 4 (водн.) + 3HNO 3 (водн.) ®?
Молекулярное уравнение: K 3 PO 4 (водн.) + 3HNO 3 (водн.) ® H 3 PO 4 (водн.) + 3KNO 3 (водн.)
Полное ионное уравнение:
3K + (водн.) + PO 4 3- (водн.) + 3H + (водн.) + 3NO 3 — (водн.) ® H 3 PO 4 (водн. ) + 3K + (водн.) + 3НО 3 — (водн.)
Чистое ионное уравнение: PO 4 3- (водн.) + 3H + (водн.) ® H 3 PO 4 (водн.)
Движущей силой было образование слабоионизированной кислоты.
Пример 4: KNO 3 (водн.) + HCl (водн.) ®?
Молекулярное уравнение: KNO 3 (водн.) + HCl (водн.) ® KCl (водн.) + HNO 3 (водн.)
Полное ионное уравнение:
K + (водн.) + NO 3 — (водн.) + H + (водн.) + Cl — (водн.) ® K + (водн.) + Cl — (водн. ) + H + (водн.) + NO 3 — (водн.)
Чистое ионное уравнение: Нет никакой сети, потому что все частицы оставались в виде водных ионов до и после моей гипотетической реакции двойного замещения.Отсутствие движущей силы приводит меня к выводу, что правильная гипотеза — Нет реакции.
Итак, есть четыре причины, по которым реакция «запускается»:
1) Образование осадка
2) Создание слабого электролита
3) Создание газа
4) изменение окисления одного или нескольких реагентов.
Запись чистых ионных реакций: ПРАКТИКА
Число окисления
Степень окисления (или степень окисления) химических соединений можно определить, следуя нескольким простым правилам.Правила представлены в порядке, в котором предыдущее правило заменяет следующее.
1. Степень окисления атома равна нулю в нейтральном веществе, содержащем атомы только одного элемента. Таким образом, атомы в O 2 , O 3 , P 4 , S 8 и металлическом алюминии имеют степень окисления 0.
2. Степень окисления простых ионов равна заряду иона. Степень окисления натрия в ионе Na + равна, например, +1, а степень окисления хлора в ионе Cl — равна -1.
3. Степень окисления водорода равна +1, когда он сочетается с неметаллом , как в CH 4 , NH 3 , H 2 O и HCl.
4. Степень окисления водорода равна -1, когда он соединен с металлом , например, LiH, NaH, CaH 2 и LiAlH 4 .
5. Металлы в группе IA образуют соединения (такие как Li 3 N и Na 2 S), в которых атом металла имеет степень окисления +1.
6. Элементы Группы IIA образуют соединения (такие как Mg 3 N 2 и CaCO 3 ), в которых атом металла имеет степень окисления +2.
7. Кислород обычно имеет степень окисления -2. Исключения включают молекулы и многоатомные ионы, которые содержат связи O-O, такие как O 2 , O 3 , H 2 O 2 и ион O 2 2-.
8. Элементы группы VIIA часто образуют соединения (такие как AlF 3 , HCl и ZnBr 2 ), в которых неметалл имеет степень окисления -1.
9. Сумма степеней окисления нейтрального соединения равна нулю.
H 2 O: 2 (+1) + (-2) = 0
10. Сумма степеней окисления многоатомного иона равна заряду иона. Степень окисления атома серы в ионе SO 4 2- должна быть, например, +6, потому что сумма степеней окисления атомов в этом ионе должна равняться -2.
СО 4 2- : (+6) + 4 (-2) = -2
11.Элементы в нижнем левом углу таблицы Менделеева с большей вероятностью будут иметь положительную степень окисления, чем элементы в правом верхнем углу таблицы. Сера имеет положительную степень окисления в SO 2 , например, потому что она ниже кислорода в периодической таблице.
Определения: Окисленный атом — это атом, степень окисления которого увеличивается. Восстановленный атом — это атом, степень окисления которого уменьшается. Половина реакций показывает усиление или потерю электронов одним атомом (окисленным или восстановленным).Окислитель — это реагент, содержащий восстановленный атом. Восстановитель — это реагент, содержащий окисленный атом. Уравновешивание окислительно-восстановительной реакции: Найдите количество электронов, полученных и потерянных агентами. Выберите коэффициенты перед ними, чтобы количество полученных и потерянных электронов было одинаковым.
Присвоение номеров окисления: ПРАКТИКА
РЕДОКС
Уравновешивание окислительно-восстановительных реакций может быть выполнено двумя способами: 1) методом числа окисления или 2) методом полуреакции.
1) Уравновешивание реакции с использованием метода числа окисления:
i) Присвойте каждому элементу степень окисления:
ii) Определите, какой элемент окисляется, а какой восстанавливается:
iii) Уравновесить левую часть реакции умножением на коэффициенты:
iv) Сбалансируйте оставшуюся часть уравнения:
2) Уравновешивание реакции методом полуреакций как в кислой, так и в основной среде:
i) Присвойте каждому элементу степень окисления:
ii) Разделите реакцию на половину реакции: окисление и восстановление.
iii) Уравновесить некислородные и водородные элементы:
iv) Уравновесить атомы кислорода, добавив H 2 O:
v) Уравновесить атомы водорода, добавив H + :
vi) Уравновесить заряд с обеих сторон, добавив e — к стороне с большим положительным зарядом:
vii) Умножьте две половинные реакции на коэффициенты, чтобы отменить e — :
viii) Сложите две реакции вместе и отмените ионы и т.
