липиды — урок. Биология, Общие биологические закономерности (9–11 класс).
Липиды — обширная группа жироподобных веществ (сложных эфиров жирных кислот и трёхатомного спирта глицерина), нерастворимых в воде. К липидам относят жиры, воски, фосфолипиды и стероиды (липиды, не содержащие жирных кислот).
Липиды состоят из атомов водорода, кислорода и углерода.
Липиды присутствуют во всех без исключения клетках, но их содержание в разных клетках сильно варьирует (от \(2\)–\(3\) до \(50\)–\(90\) %).
Липиды могут образовывать сложные соединения с веществами других классов, например с белками (липопротеины) и с углеводами (гликолипиды).
Функции липидов:
- запасающая — жиры являются основной формой запасания липидов в клетке.
- Энергетическая — половина энергии, потребляемой клетками позвоночных животных в состоянии покоя, образуется в результате окисления жиров (при окислении они дают более чем в два раза больше энергии по сравнению с углеводами).

- Жиры используются и как источник воды (при окислении \(1\) г жира образуется более \(1\) г воды).
- Защитная — подкожный жировой слой защищает организм от механических повреждений.
- Структурная — фосфолипиды входят в состав клеточных мембран.
- Теплоизоляционная — подкожный жир помогает сохранить тепло.
- Электроизоляционная — миелин, выделяемый клетками Шванна (образуют оболочки нервных волокон), изолирует некоторые нейроны, что во много раз ускоряет передачу нервных импульсов.
- Гормональная (регуляторная) — гормон надпочечников (кортизон) и половые гормоны (прогестерон и тестостерон) являются стероидами.
- Смазывающая — воски покрывают кожу, шерсть, перья и предохраняют их от воды. Восковым налётом покрыты листья многих растений, воск используется при строительстве пчелиных сот.
Источники:
Каменский А. А., Криксунов Е. А., Пасечник В. В. Биология. 9 класс // ДРОФА.
А., Криксунов Е. А., Пасечник В. В. Биология. 9 класс // ДРОФА.
Каменский А. А., Криксунов Е. А., Пасечник В. В. Биология. Общая биология (базовый уровень) 10–11 класс // ДРОФА.
Лернер Г. И. Биология: Полный справочник для подготовки к ЕГЭ: АСТ, Астрель.
СОСТАВ ЛИПИДОВ И ФУНКЦИОНАЛЬНОЕ СОСТОЯНИЕ МЕМБРАННЫХ СИСТЕМ STELLARIA HUMIFUSA | Марковская
Алаудинова Е. В., Миронов П. В. Липиды меристем лесообразующих хвойных пород центральной Сибири в условиях низкотемпературной адаптации. 2. Особенности метаболизма жирных кислот фосфолипидов меристем Larix sibirica Ledeb., Picea obovata L. и Pinus sylvestris L // Химия растительного сырья. 2009. № 2. С. 71–76.
Галибина Н. А., Мошкина Е. В., Никерова К. М., Мощенская Ю. Л., Знаменский С. Р. Активность пероксидазы как индикатор степени узорчатости древесины карельской березы // Лесоведение. 2016. № 4. С. 294–304.
Герасименко Т. В., Швецова В. М. Основные итоги эколого-физиологических исследований фотосинтеза в Арктике // Эколого-физиологические исследования фотосинтеза и дыхания растений. Л.: Наука, 1989. С. 65–114.
Л.: Наука, 1989. С. 65–114.
Жиров В. К., Мерзляк М. Н. Воздействие низких температур на вменение степени повреждения мембран и интенсивность пероксидации пшидов у гороха, подвергшегося холодовому закаливанию // Биологические науки. 1983. № 2. С 77–82.
Лось Д. А. Десатуразы жирных кислот. М.: Научный мир, 2014. 372 с.
Лось Д. А. Структура, регуляция экспрессии и функционирования десатураз жирных кислот // Успехи биологической химии. 2001. Т. 41. С. 163–169.
Марковская Е. Ф., Сысоева М. И., Шерудило Е. Г. Кратковременная гипотермия и растение / Отв. редактор Н. П. Чернобровкина. Петрозаводск: Карельский научный центр РАН, 2013. 194. с.
Мирошниченко О. С. Биогенез, физиологическая роль и свойства каталазы // Biopolymers and Cell. 1992. Т. 8, №6. С. 3–25. doi: 10.7124/bc.00033C.
Никерова К. М., Галибина Н. А. Влияние нитратного азота на пероксидазную активность в тканях Betula pendula Roth var. pendula и B. pendula var. carelica (Mercklin) // Сибирский лесной журнал. 2017. № 1. С. 15–24.
pendula var. carelica (Mercklin) // Сибирский лесной журнал. 2017. № 1. С. 15–24.
Никерова К. М., Галибина Н. А., Мощенская Ю. Л., Новицкая Л. Л., Подгорная М. Н., Софронова И. Н. Каталазная активность в листовом аппарате у сеянцев березы повислой разных форм (Betula pendula Roth): var. pendula и var. carelica (Mercklin) // Труды КарНЦ РАН. 2016. № 11. С. 68–77. doi: 10.17076/eb460.
Павлова В. А., Нефедьева Е. Э., Лысак В. И., Шайхиев И. Г. Влияние импульсного давления на некоторые биохимические процессы семян гречихи при прорастании // Вестник Казанского технологического университета. 2014. Т. 17, № 21. С. 199–203.
Прадедова Е. В., Ишеева О. Д., Саляев Р. К. Ферменты антиоксидантной защиты вакуолей корнеплодов столовой свеклы // Физиология растений. 2011. Т. 58, № 1. С. 40–48.
Родионов В. С. Влияние низких температур на липидный обмен и фазовые переходы в мембранах // Эколого-физиологические механизмы устойчивости растений к действию экстремальных температур. Петрозаводск: КФ АН СССР, 1978. С. 37–57.
Петрозаводск: КФ АН СССР, 1978. С. 37–57.
Синькевич М. С., Дерябин А. Н., Трунова Т. И. Особенности окислительного стресса у растений картофеля с измененным углеводным метаболизмом // Физиология растений 2009. Т. 56, № 2. С. 161–162.
Шмакова Н. Ю., Марковская Е. Ф. Фотосинтетические пигменты растений и лишайников арктических тундр Западного Шпицбергена // Физиология растений. 2010. Т. 57, № 6. С. 819–825.
Шуляковская Т. А., Ильинова М. К., Карелина Т. В. Липидный состав тканей ствола Betula pendula и B. pendula var. carelica (Betulaceae) // Растительные ресурсы. 2014. Т. 50, № 1. С. 94–104.El-Beltagi H. S., Mohamed A. A., Mekki B. B. Differences in some constituents, enzymes activity and electrophoretic characterization of different rapeseed (Brassica napus L.) cultivars // Ann Univ Oradea – Fascicle Biol Tom. 2011. Vol. 18, no. 1. P. 39–46.
Gechev T., Willekens H., Van Montagu M., Inze D., Van Camp W., Toneva V., Minkov I. Different responses of tobacco antioxidant enzymes to light and chilling stress // J Plant Physiol. 2003. Vol. 160, no. 5. P. 509–515. doi: 10.1078/0176-1617-00753.
Different responses of tobacco antioxidant enzymes to light and chilling stress // J Plant Physiol. 2003. Vol. 160, no. 5. P. 509–515. doi: 10.1078/0176-1617-00753.
Hugly S., Somerville C. A role for membrane lipid polyunsaturation in chloroplast biogenesis at low temperature // Plant Physiology. 1992. Vol. 99, no. 1. P. 197–202.
Korner С. Alpine plant life: Functional plant ecology of high mountain ecosystems. Berlin, Germany: Springer Verlag, 1999. P. 101–114.
Laskay G., Lehoczki E. Correlation between linolenic-acid deficiency in chloroplast membrane lipids and decreasing photosynthetic activity in barley // Biochimic. Biophys. Acta. 1986. Vol. 849, no. 1. P. 77–84. doi: 10.1016/0005-2728(86)90098-8.
Levitt J. Responses of plants to environmental stress. Vol.1. Chilling, freezing and high temperatures stresses. New York: Acad. Press, 1980. P. 163–166.
Li W., Wang R., Li M., Li L., Wang C., Welti R., Wang X. Differential degradation of extraplastidic and plastidic lipids during freezing and post-freezing recovery in Arabidopsis thaliana // Journal of Biological Chemistry. 2008. Vol. 283, no. 1. P. 461–468. doi: 10.1074/jbc.M706692200.
2008. Vol. 283, no. 1. P. 461–468. doi: 10.1074/jbc.M706692200.
Lütz C., Bergweiler P., Di Piazza L., Holzinger A. Cell organelle structure and function in alpine and polar plants are influenced by growth conditions and climate. Plants in alpine regions / Eds. C. Lütz, Wien: Springer, 2012. Р. 43–60.
Matsuda O., Iba K. Trienoic fatty acids and stress responsis in higher plants // Plant Biothechnology. 2005. Vol. 22, no. 5. P. 423–430. doi: 10.5511/plantbiotechnology.22.423
Namdjoyan S. H., Khavari-Nejad R. A., Bernard F., Nejadsattari T., Shaker H. Antioxidant Defense Mechanisms in Response to Cadmium Treatments in Two Safflower Cultivars // Russ J Plant Physiol. 2011. Vol. 58, no. 3. P. 467–477. doi: 10.1134/S1021443711030149.
Nazari M. R., Habibpour Mehraban F., Maali Amiri R., Zeinali Khaneghah H. Change in antioxidant responses against oxidative damage in black chickpea following cold acclimation // Russ J Plant Physiol. 2012.
Nimaeva O. D., Pradedova, E. V., Salyaev, R. K. Activity and isoenzyme composition of vacuolar peroxidase in the roots of red beet at different stages of development and upon changes in storage conditions // Russ J Plant Physiol. 2014. Vol. 61, no. 3. P. 324–331 doi: 10.1134/S1021443714030108.
Rivero R. M., Ruiz J. M., Garcia P. C., López-Lefebre L. R., Sánchez, E., Romero L. Resistance to cold and heat stress: accumulation of phenolic compounds in tomato and watermelon plants // Plant Sci. 2001. Vol. 160, no. 2. P. 315–321. doi: 10.1016/S0168-9452(00)00395-2.
Ronning O. I. The flora of Svalbard. Norsk Polarinst. Polarhеndbok, Oslo, 1996. 184 р.
Routaboul J. H., Fischer S. F., Browse J. Trienoic fatty acids are required to maintain chrloroplast function at low temperatures // Plant Physiol. 2000. Vol. 124, no. 4. P. 1697–1705. doi: 10.1104/pp.124.4.1697.
Sakai A. ; Larcher W. Frost Survival of Plants: Response and Adaptation to Freezing Stress. Berlin, Heidelberg: Springer Verlag, 1987. doi: 10.1007/978-3-642-71745-1.
; Larcher W. Frost Survival of Plants: Response and Adaptation to Freezing Stress. Berlin, Heidelberg: Springer Verlag, 1987. doi: 10.1007/978-3-642-71745-1.Schmid K. M., Ohlrogge J. B. Lipid metabolism in plants / Eds. D. E., Vance J. E. Biochemistry of lipids, lipoproteins and membranes. Amsterdam, the Netherlands: Elsevier. 2002. P. 93–126.
Upchurch R. G. Fatty acid unsaturation, mobilization, and regulation in the response of plant to stress // Biotechnology Letters. 2008. Vol. 30, no. 6. P. 967–977. doi: 10.1007/s10529-008-9639-z.
Wallis J. G., Browse J. Mutants of Arabidopsis reveal many roles for membrane lipids // Progress in Lipid Research. 2002. Vol. 41, no. 3. P. 354–278. doi: 10.1016/S0163-7827(01)00027-3.
Zheng G., Tian B., Zhang F., Tao F., Li W. Plant adaptation to frequent alterations between high and low temperatures: remodeling of membrane lipids and maintenance of unsaturation levels // Plant Cell Environ. 2011.
References in English
Alaudinova E. V., Mironov P. V. Lipidy meristem lesoobrazuyushchikh khvoinykh porod central’noj Sibiri v usloviyakh nizkotemperaturnoj adaptacii. 2. Osobennosti metabolizma zhirnykh kislot fosfolipidov meristem Larix sibirica Ledeb., Picea obovata L. i Pinus sylvestris L. [Lipids of forest-forming coniferous species meristems of the Central Siberia under low-temperature adaptation. 2. Features of fatty acids metabolism of Larix sibirica Ledeb., Picea obovata L. and Pinus sylvestris L. meristems phospholipids]. Himiya rastitel’nogo syr’ya [Chem. of Crude Plants]. 2009. No. 2. P. 71–76.
Galibina N. A., Moshkina E. V., Nikerova K. M., Moshchenskaya
Yu. L., Znamenskii S. R. Aktivnost’ peroksidazy kak indikator stepeni uzorchatosti drevesiny karelskoy berezy [Peroxidase activity indicates veining of the curly birch]. Lesovedenie [Russ. Journal of Forest Sci. ]. 2016. No. 4. P. 294–304.
]. 2016. No. 4. P. 294–304.
Gerasimenko T. V., Shvetsova V. M. Osnovnye itogi ekologo-fiziologicheskikh issledovanii fotosinteza v Arktike [Main results of ecological and physiological research on photosynthesis in the Arctic]. Ekologo-fiziologicheskie issledovaniya fotosinteza i dykhaniya rastenii [Ecological and Physiological Research on Photosynthesis and Respiration of Plants]. Leningrad: Nauka,
P. 65–114.
Los’ D. A. Desaturazy zhirnykh kislot [Fatty acid desaturases].
Moscow: Nauchnyj mir, 2014. 372 p.
Los’ D. A. Struktura, regulyatsiya ehkspressii i funktsionirovaniya
desaturaz zhirnyh kislot [Structure, regulation of expression and functioning of fatty acid desaturases] Uspekhi biologicheskoj khimii [Biological Chemistry Rev.]. 2001. Vol. 41. P. 163–169.
Markovskaya E. F., Sysoeva M. I., Sherudilo E. G. Kratkovremennaya gipotermiya i rastenie [Short-term hypothermia and plants]. Ed. N. P. Chernobrovkina. Petrozavodsk: KarRC of RAS, 2013. 194 p.
P. Chernobrovkina. Petrozavodsk: KarRC of RAS, 2013. 194 p.
Miroshnichenko O. S. Biogenez, fiziologicheskaya rol’ i svojstva katalazy [The biogenesis, physiological role, and properties of catalase]. Biopolymers and Cell. 1992. Vol. 8, no. 6. P. 3–25. doi: 10.7124/bc. 00033C
Nikerova K. M., Galibina N. A. Vliyanie nitratnogo azota na peroksidaznuyu aktivnost’ v tkanyakh Betula pendula Roth var. pendula i B. pendula var. carelica (Mercklin) [The influence of nitrate on peroxidase activity in tissues of the Betula pendula Roth var. pendula and B. pendula var. carelica (Mercklin)]. Sibirskiy lesnoy zhurnal [Siberian Journal of Forest Sci.]. 2017. No. 1. P. 15–24.
Nikerova K. M., Galibina N. A., Moshchenskaya Yu. L., Novitskaya L. L., Podgornaya M. N., Sofronova I. N. Katalaznaya aktivnost’ v listovom apparateu seyantsev berezy povisloj raznykh form (Betula pendula Roth): var. pendula i var. carelica (Mercklin) [Catalase activity in leaves of the silver birch seedlings of different forms (Betula pendula Roth): var. pendula and var. carelica (Mercklin)]. Trudy KarNTC RAN [Trans. of
pendula and var. carelica (Mercklin)]. Trudy KarNTC RAN [Trans. of
KarRC of RAS]. 2016. No. 11. P. 68–77. doi: 10.17076/eb460
Pavlova V. A., Nefed’eva E. Eh., Lysak V. I., Shajhiev I. G. Vliyanie impul’snogo davleniya na nekotorye biokhimicheskie protsessy semyan grechikhi pri prorastanii [Impact of impulse pressure on some biochemical processes in germinating seeds of the buckwheat]. Vestnik Kazanskogo tekhnologicheskogo universiteta [Herald of Kazan Tech. Un.]. 2014. Vol. 17, no. 21.
P. 199–203.
Pradedova E. V., Isheeva O. D., Salyaev R. K. Fermenty
antioksidantnoi zashchity vakuolei korneplodov stolovoi svekly [Antioxidant defense enzymes in cell vacuoles of red beet roots]. Fiziologiya rastenii [Russ. Journal of Plant Physiol.]. 2011. Vol. 58, no. 1. P. 36–44. doi: 10.1134/S1021443711010110
Rodionov V. S. Vliyanie nizkikh temperatur na lipidnyj obmen i fazovye perekhody v membranakh. Ekologo-
fiziologicheskie mekhanizmy ustojchivosti rastenij k dejstviyu ekstremal’nykh temperatur [Influence flow temperatures on lipid exchange and phase transitions in membranes. Ecological and physiological mechanisms of plants resistance to extreme temperatures impact]. Petrozavodsk: Karel. fil. AN SSSR, 1978. P. 37–57.
Ecological and physiological mechanisms of plants resistance to extreme temperatures impact]. Petrozavodsk: Karel. fil. AN SSSR, 1978. P. 37–57.
Shmakova N. Yu., Markovskaya E. F. Fotosinteticheskie pigmenty rastenii i lishainikov arkticheskikh tundr Zapadnogo Shpitsbergena [Photosynthetic pigments of plants and lichens inhabiting Arctic tundra of West Spitsbergen]. Fiziologiya rastenii [Russian Journal of Plant Physiology]. 2010. Vol. 57, no. 6. P. 819–825.
Shulyakovskaya T. A., Il’inova M. K., Karelina T. V. Lipidnyj sostav tkanej stvola Betula pendula i B. pendula var. carelica (Betulaceae) [Lipid composition in trunk tissues of the Betula pendula and B. pendula var. carelica (Betulaceae)]. Rastitel’nye resursy [Plant Resources]. 2014. Vol. 50, no. 1. P. 94–104.
Sin’kevich M. S., Deryabin A. N., Trunova T. I. Osobennosti
okislitel’nogo stressa u rastenii kartofelya s izmenennym uglevodnym metabolizmom [Characteristics of oxidative stress in potato plants with modified carbohydrate metabolism].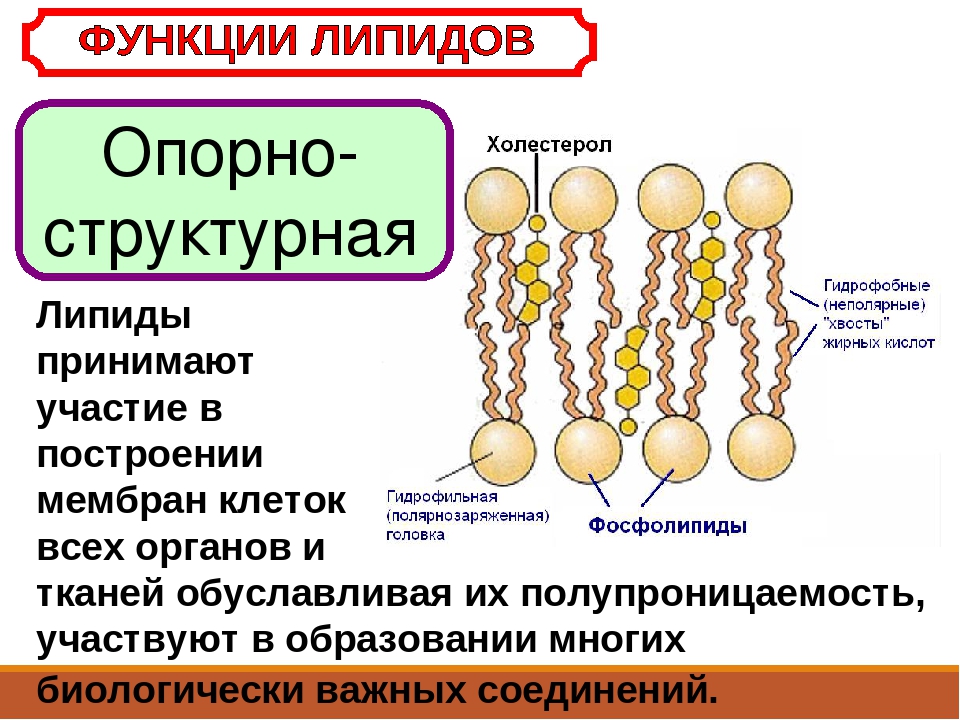 Fiziologiya rastenii [Russ. Journal of Plant Physiol.]. 2009. Vol. 56, no. 2. P. 168–174. doi: 10.1134/S1021443709020046
Fiziologiya rastenii [Russ. Journal of Plant Physiol.]. 2009. Vol. 56, no. 2. P. 168–174. doi: 10.1134/S1021443709020046
Zhirov V. K., Merzlyak M. N. Vozdejstvie nizkikh temperatur na izmenenie stepeni povrezhdeniya membran i intensivnost’ peroksidatsii lipidov u gorokha, podvergshegosya holodovomu zakalivaniyu [Impact of low temperatures on membranes damage degree and intensity of lipids peroxidation in peas under cold hardening]. Biologicheskie nauki [Biological Sciences]. 1983. No. 2. P. 77–82.
El-Beltagi H. S., Mohamed A. A., Mekki B. B. Differences in some constituents, enzymes activity and electrophoretic
characterization of different rapeseed (Brassica napus L.) cultivars. Ann Univ Oradea – Fascicle Biol Tom. 2011. Vol. 18, no. 1. P. 39–46.
Gechev T., Willekens H., Van Montagu M., Inze D., Van Camp W., Toneva V., Minkov I. Different responses of tobacco antioxidant enzymes to light and chilling stress. J. Plant Physiol. 2003.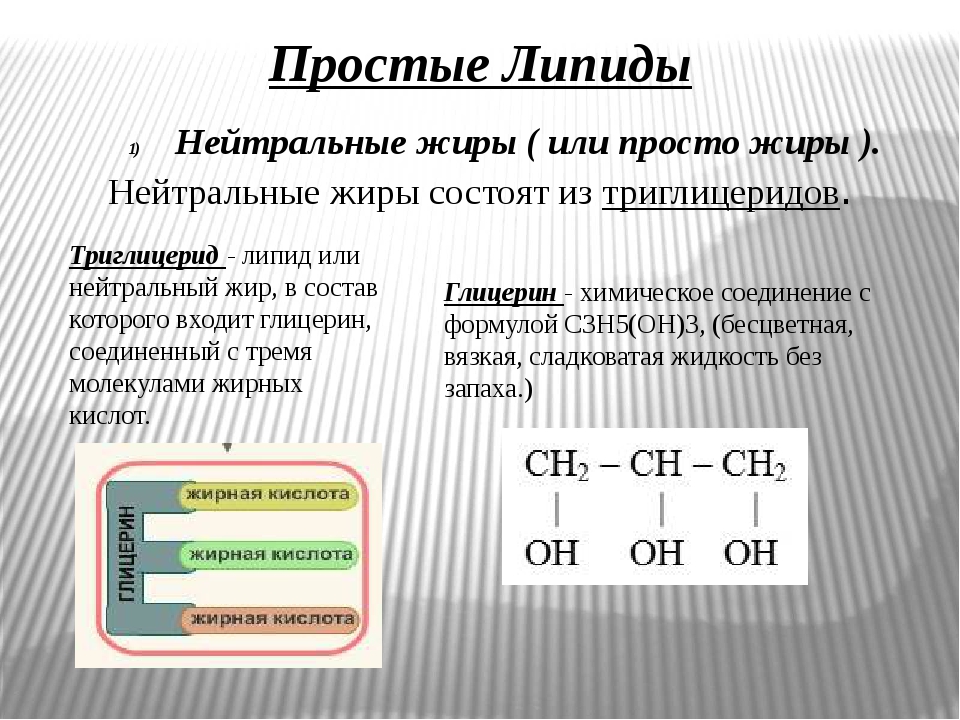 Vol. 160, no. 5. P. 509–515. doi: 10.1078/0176‑1617‑00753
Vol. 160, no. 5. P. 509–515. doi: 10.1078/0176‑1617‑00753
Hugly S., Somerville C. A role for membrane lipid polyunsaturation in chloroplast biogenesis at low temperature. Plant Physiology. 1992. Vol. 99, no. 1. P. 197–202.
Korner С. Alpine plant life: Functional plant ecology of high mountain ecosystems. Berlin, Germany: Springer Verlag, 1999. P. 101–114.
Laskay G., Lehoczki E. Correlation between linolenic acid deficiency in chloroplast membrane lipids and decreasing photosynthetic activity in barley. Biochimic. Biophys. Acta. 1986. Vol. 849, no. 1. P. 77–84. doi: 10.1016/0005-2728(86)90098-8
Levitt J. Responses of plants to environmental stress. Chilling, freezing and high temperatures stresses. New York: Acad. Press, 1980. Vol. 1. P. 163–166.
Li W., Wang R., Li M., Li L., Wang C., Welti R., Wang X. Differential degradation of extraplastidic and plastidic lipids during freezing and post-freezing recovery in Arabidopsis thaliana.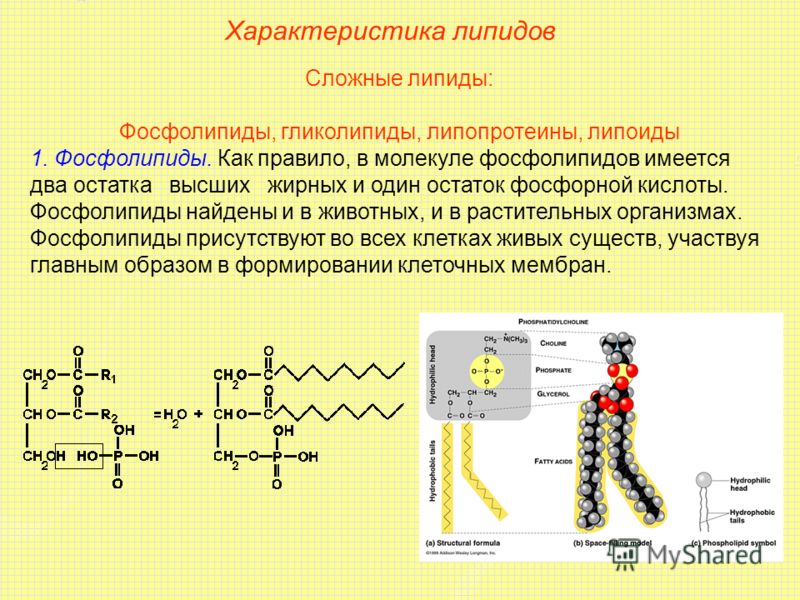 Journal of Biological Chemistry. 2008. Vol. 283, no. 1. P. 461–468. doi: 10.1074/jbc.M706692200
Journal of Biological Chemistry. 2008. Vol. 283, no. 1. P. 461–468. doi: 10.1074/jbc.M706692200
Lütz C., Bergweiler P., Di Piazza L., Holzinger A. Cell organelle structure and function in alpine and polar plants are influenced by growth conditions and climate. Plants in alpine regions. Ed. C. Lütz, Wien: Springer, 2012. Р. 43–60.
Matsuda O., Iba K. Trienoic fatty acids and stress responsis in higher plants. Plant Biothechnology. 2005. Vol. 22, no. 5. P. 423–430. doi: 10.5511/plantbiotechnology.22.423
Namdjoyan S. H., Khavari-Nejad R. A., Bernard F., Nejadsattari T., Shaker H. Antioxidant Defense Mechanisms in Response to Cadmium Treatments in TwoSafflower Cultivars. Russ. J. Plant Physiol. 2011. Vol. 58, no. 3. P. 467–477. doi: 10.1134/S1021443711030149
Nazari M. R., Habibpour Mehraban F., Maali Amiri R., Zeinali Khaneghah H. Change in antioxidant responses against oxidative damage in black chickpea following cold acclimation. Russ. J. Plant Physiol. 2012. Vol. 59, no. 2. P. 183–189. doi: 10.1134/S102144371201013X
J. Plant Physiol. 2012. Vol. 59, no. 2. P. 183–189. doi: 10.1134/S102144371201013X
Nimaeva O. D., Pradedova E. V., Salyaev R. K. Activity and isoenzyme composition of vacuolar peroxidase in the roots of red beet at different stages of development and upon changes in storage conditions. Russ. J. Plant Physiol. 2014. Vol. 61, no. 3. P. 324–331. doi: 10.1134/S1021443714030108
Rivero R. M., Ruiz J. M., Garcia P. C., López-Lefebre L. R., Sánchez E., Romero L. Resistance to cold and heat stress: accumulation of phenolic compounds in tomato and watermelon plants. Plant Sci. 2001. Vol. 160, no. 2. P. 315–321. doi: 10.1016/S0168-9452(00)00395-2
Ronning O. I. The flora of Svalbard. Norsk Polarinst. Polarhеndbok, Oslo, 1996. 184 р.
Routaboul J. H., Fischer S. F., Browse J. Trienoic fatty acids are required to maintain chrloroplast function at low temperatures. Plant Physiol. 2000. Vol. 124, no. 4. P. 1697–1705. doi: 10.1104/pp.124.4.1697
Sakai A. , Larcher W. Frost Survival of Plants: Response and Adaptation to Freezing Stress. Berlin, Heidelberg: Springer Verlag, 1987. doi: 10.1007/978‑3‑642‑71745‑1
, Larcher W. Frost Survival of Plants: Response and Adaptation to Freezing Stress. Berlin, Heidelberg: Springer Verlag, 1987. doi: 10.1007/978‑3‑642‑71745‑1
Schmid K. M., Ohlrogge J. B. Lipid metabolism in plants. Eds. D. E. Vance, J. E. Vance. Biochemistry of lipids, lipoproteins and membranes. Amsterdam, the Netherlands: Elsevier, 2002. P. 93–126.
Upchurch R. G. Fatty acid unsaturation, mobilization, and regulation in the response of plant to stress. Biotechnology Letters. 2008. Vol. 30, no. 6. P. 967–977. doi: 10.1007/s10529‑008‑9639‑z
Wallis J. G., Browse J. Mutants of Arabidopsis reveal many roles for membrane lipids. Progress in Lipid Research. 2002. Vol. 41, no. 3. P. 354–278. doi: 10.1016/S0163-7827(01)00027-3
Zheng G., Tian B., Zhang F., Tao F., Li W. Plant adaptation to frequent alterations between high and low temperatures: remodeling of membrane lipids and maintenance of unsaturation levels. Plant Cell Environ. 2011. Vol. 34, no. 9. P. 1431–1442. doi: 10.1111/j.1365-3040.2011.02341.x
34, no. 9. P. 1431–1442. doi: 10.1111/j.1365-3040.2011.02341.x
СОСТАВ ЛИПИДОВ И ЖИРНЫХ КИСЛОТ В МЫШЕЧНОЙ ТКАНИ ЯПОНСКОЙ СКУМБРИИ SCOMBER JAPONICUS | Шульгина
1. Акулин В.Н., Блинов Ю.Г., Швидкая З.П., Попков А.А. Состав липидов натуральных консервов из некоторых видов рыб и беспозвоночных // Изв. ТИНРО. — 1995. — Т. 118. — С. 48–53.
2. Акулин В.Н., Первунинская Т.А. Жирнокислотный состав липидов некоторых видов тихоокеанских рыб // Исследования по технологии рыбных продуктов. — Владивосток : ТИНРО, 1974. — Вып. 5. — С. 39–42.
3. Гайковая Л.Б. Омега-3 полиненасыщенные жирные кислоты: лабораторные методы в оценке их многофакторного действия // Обзоры по клин. фармакол. и лек. терапии. — 2010. — Т. 8, № 4. — С. 3–14.
4. Гроза Н.В., Голованов А.Б., Наливайко Е.А., Мягкова Г.И. Терапевтическая роль полиненасыщенных жирных кислот и их производных в патофизиологических процессах // Вестн. МИТХТ. — 2012. — Т. 7, № 5. — С. 3–16.
Гроза Н.В., Голованов А.Б., Наливайко Е.А., Мягкова Г.И. Терапевтическая роль полиненасыщенных жирных кислот и их производных в патофизиологических процессах // Вестн. МИТХТ. — 2012. — Т. 7, № 5. — С. 3–16.
5. Дворянинова О.П., Соколов А.В., Алехина А.В. Новые сырьевые источники рыбьего жира: физико-химические показатели качества, пищевая и биологическая ценность // Рыб. хозво. — 2016. — № 5. — С. 112–117.
6. Запорожская Л.И., Гаммель И.В. Характеристика и биологическая роль эссенциальных полиненасыщенных жирных кислот // Медицинский совет. — 2012. — № 12. — С. 134–136.
7. Леванидов И.П. Классификация рыб по содержанию в их мясе жира и белков // Рыб. хоз-во. — 1968. — № 9. — С. 50–51; № 10. — С. 64–66.
8. Левачев М.М. Жиры, полиненасыщенные жирные кислоты, фосфолипиды: биологическая роль и применение в профилактической и клинической медицине. Введение в частную микронутриентологию : моногр. — Новосибирск : Академиздат, 1999. — 284 с.
Левачев М.М. Жиры, полиненасыщенные жирные кислоты, фосфолипиды: биологическая роль и применение в профилактической и клинической медицине. Введение в частную микронутриентологию : моногр. — Новосибирск : Академиздат, 1999. — 284 с.
9. Нетребенко О.К., Щеплягина Л.А. Иммунонутриенты в питании детей // Педиатрия. — 2006. — Т. 85, № 6. — С. 61–66.
10. Синчихин С.П., Мамиев О.Б. Перспективы использования омега-3 полиненасыщенных жирных кислот в акушерстве и гинекологии // Астраханский медицинский журнал. — 2010. — Т. 5, № 3. — С. 19–24.
11. Ушкалова Е.А. Место эссенциальных фосфолипидов в современной медицине // Фарматека. — 2003. — № 10(73). — С. 10–15.
12. Швидкая З.П. Консервы «Сельдь иваси натуральная» — источник ЭПК в питании человека // Экологические проблемы питания населения Украины : тез. докл. Междунар. конф. — Киев, 1992. — С. 109.
докл. Междунар. конф. — Киев, 1992. — С. 109.
13. Шульгина Л.В., Давлетшина Т.А., Павловский А.М. и др. Консервы из сайры тихоокеанской — источник полиненасыщенных жирных кислот семейства омега-3 // Изв. ТИНРО. — 2017а. — Т. 191. — С. 235–242. DOI: 10.26428/1606-9919-2017-191-235-242.
14. Шульгина Л.В., Якуш Е.В., Давлетшина Т.А. и др. Полиненасыщенные жирные кислоты семейства омега-3 в продукции из дальневосточных рыб // Здоровье. Медицинская экология. Наука. — 2017б. — № 5. — С. 42–45. DOI: 10.5281/zenodo.1115456.
15. Aherne F.X., Bowland J.P., Christian R.G., Hardin R.T. Performance of myocardial and blood seral changes in pigs fed diets containing high or low erucic acid rapeseed oils // Can. J. Anim. Sci. — 1976. — Vol. 56. — P. 275–284. DOI: 10.4141/cjas76-032.
16. Bell M.V., Tocher D.R. Biosynthesis of polyunsaturated fatty acids in aquatic ecosystems: General pathways and new directions // Lipids in Aquatic Ecosystems / eds M.T. Arts, M. Brett, M. Kainz. — N.Y. : Springer, 2009. — P. 211–236. DOI: 10.1007/978-0-387-89366-2_9.
17. Bernal-Santos G., O’Donnell A.M., Vicini J.L. et al. Hot topic: Enhancing omega-3 fatty acids in milk fat of dairy cows by using stearidonic acid-enriched soybean oil from genetically modified soybeans // J. Dairy Sci. — 2010. — Vol. 93, Iss. 1. — P. 32–37. DOI: 10.3168/jds.2009-2711.
18. Carreau J.P., Dubacq J.P. Adaptation of a macro-scale method to the micro-scale for fatty acid methyl transesterification of biological lipid extracts // J. Chromatogr. — 1978. — Vol. 151, Iss. 3. — P. 384–390. DOI: 10.1016/S0021-9673(00)88356-9.
19. Christie W.W. Equivalent chain-lengths of methyl ester derivatives of fatty acids on gaschromatography A reappraisal // J. Chromatogr. — 1988. — Vol. 447, Iss. 2. — P. 305–314. DOI: 10.1016/0021-9673(88)90040-4.
20. Corner A.H. Cardiopathology associated with the feeding of vegetable and marine oils // High and Low Erucic Acid Rapeseed Oils. Production, Usage, Chemistry, and Toxicological Examination / eds J.K.G. Kramer, F.D. Sauer, W.J. Pigden. — Toronto : Academic Press, 1983. — P. 293–313.
21. Cunningham-Rundles S. Is the fatty acid composition of immune cells the key to normal variatiosn in human immune response? // Am. J. Clin. Nutr. — 2003. — Vol. 77, Iss 5. — P. 1096–1097. DOI: 10.1093/ajcn/77.5.1096.
22. Harris W.S., Mozaffarian D., Lefevre M. et al. Towards establishing dietary reference intakes for eicosapentaenoic and docosahexaenoic acids // J. Nutr. — 2009. — Vol. 139, Iss. 4. — P. 804S–819S. DOI: 10.3945/jn.108.101329.
23. Hibbeln J.R., Nieminen L.R.G., Blasbalg T.L. et al. Healthy intakes of n-3 and n-6 fatty acids: estimations considering worldwide diversity // Am. J. Clin. Nutr. — 2006. — Vol. 83, Iss. 6. — P. 1483S–1493S. DOI: 10.1093/ajcn/83.6.1483S.
24. Laggai S., Simon Y., Ranssweiler T. et al. Rapid chromatographic method to decipher distinct alterations in lipid classes in NAFLD/NASH // World J. Hepatol. — 2013. — Vol. 5, Iss. 10. — P. 558–567. DOI: 10.4254/wjh.v5.i10.558.
25. Lands W.E.M. Human life: caught in the food web // Lipids in aquatic ecosystems / eds M.T. Arts, M.T. Brett, M.J. Kainz. — N.Y. : Springer, 2009. — P. 327–354.
26. Lewis E.J. Omega-3 fatty acid supplementation and cardiovascular disease events // JAMA. — 2013. — Vol. 309, № 1. — P. 27.
27. McNamara R.K., Carlson S.E. Role of omega-3 fatty acids in brain development and function: Potential implications for the pathogenesis and prevention of psychopathology // Prostaglandins, Leukotrienes and Essential Fatty Acids. — 2006. — Vol. 75, Iss. 4–5. — P. 329–349. DOI: 10.1016/j.plefa.2006.07.010.
28. Plourde M., Cunnane S.C. Extremely limited synthesis of long chain polyunsaturates in adults: implications for their dietary essentiality and use as supplements // Appl. Physiol. Nutr. Metab. — 2007. — Vol. 32, № 4. — P. 619–634. DOI: 10.1139/H07-034.
29. Robert S.S. Production of eicosapentaenoic and docosahexaenoic acid-containing oils in transgenic land plants for human and aquaculture nutrition // Mar. Biotechnol. — 2006. — Vol. 8, Iss. 2. — P. 103–109. DOI: 10.1007/s10126-005-5142-x.
30. Saldanha L.G., Salem N.Jr., Brenna J.T. Workshop on DHA as a required nutrient: Overview // Prostaglandins, Leukotrienes and Essential Fatty Acids. — 2009. — Vol. 81, Iss. 2–3. — P. 233–236. DOI: 10.1016/j.plefa.2009.07.001.
31. Sanz París A., Marí Sanchis A., García Malpartida K., García Gómez M.C. Proposed profile of omega 3 fatty acids in enteral nutrition // Nutr. Hosp. — 2012. — Vol. 27, № 6. — P. 1782–1802. DOI: 10.3305/nh.2012.27.6.6023.
32. Sauer F.D., Kramer J.K.G. The problems associated with the feeding of high erucic acid rapeseed oils and some fish oils to experimental animals // High and Low Erucic Acid Rapeseed Oils. Production, Usage, Chemistry, and Toxicological Examination / eds J.K.G. Kramer, F.D. Sauer, W.J. Pigden. — Toronto : Academic Press, 1983. — P. 253–292.
33. Schneider C.A., Rasband W.S., Eliceiri K.W. NIH Image to ImageJ: 25 years of image analysis // Nat. Methods. — 2012. — Vol. 9, № 7. — P. 671–675.
34. Wall R., Ross R.P., Fitzgerald G.F., Stanton C. Fatty acids from fish: the anti-inflammatory potential of long-chain omega-3 fatty acids // Nutr. Rev. — 2010. — Vol. 68, Iss. 5. — P. 280–289. DOI: 10.1111/j.1753-4887.2010.00287.x.
Липидный профиль, базовый. Узнать стоимость в лаборатории KDL.
Липидный профиль – комплекс тестов, который включает в себя анализ на общий холестерин, ЛПВП (липопротеины высокой плотности), ЛПНП (липопротеины низкой плотности), ЛПОНП (липопротеины очень низкой плотности) и триглицериды. Знать свой липидный профиль необходимо каждому, кто заботится о здоровье своей сердечно-сосудистой системы и хочет снизить риск развития атеросклероза и заболеваний сердца, а также тем, кто проходит лечение. Контроль липидного профиля важен и при смене образа жизни, питания, физической нагрузки, при приеме лекарственных средств.
Показатели липидного профиля:
Общий холестерин – общий уровень холестерина в крови. Это вещество входит в состав мембран клеток и необходимо для функционирования всех систем организма, однако его избыток связывают с развитием атеросклероза и сердечно-сосудистых патологий.
ЛПВП – липопротеины высокой плотности. Их еще называют «хорошим холестерином». Высокий уровень ЛПВП снижает риск развития атеросклероза и сердечно-сосудистых заболеваний. ЛПВП помогают выводить часть холестерина из крови, возвращая его в печень. Следует стремиться к тому, чтобы уровень ЛПВП был как можно выше. Особенно это важно для пациентов, страдающих сердечно-сосудистыми заболеваниями.
ЛПНП и ЛПОНП – липопротеины низкой и очень низкой плотности. Именно этот тип холестерина считается «вредным» из-за доказанной связи между высоким содержанием ЛПНП и развитием сердечно-сосудистых заболеваний. Главная цель при лечении в случае нарушений липидного обмена состоит именно в снижении уровня ЛПНП и ЛПОНП.
Триглицериды — частицы жира, уровень содержания которых в крови повышается при таких состояниях, как неконтролируемый диабет и ожирение. Злоупотребление алкоголем и прием некоторых лекарственных препаратов также способны повысить уровень триглицеридов. Высокие уровни триглицеридов означают более высокий риск развития сердечно-сосудистых заболеваний.
В каких случаях обычно назначают исследование?
- При профилактическом обследовании здоровых людей
- При повышении уровня общего холестерина.
- При наличии у ближайших родственников следующих состояний: сахарный диабет, инсульт, инфаркт миокарда, артериальная гипертензия.
- При наличии других факторов риска развития атеросклероза и сердечно-сосудистых заболеваний (возраст более 45 лет для мужчин и 55 лет для женщин, курение, избыточный вес, нарушения углеводного обмена, повышенное артериальное давление).
- При контроле эффективности гиполипидемической диеты и/или медикаментозного лечения статинами.
Что именно определяется в процессе анализа?
Проводится измерение концентрации различных показателей липидного профиля (общий холестерин, ЛПНП, ЛПОНП, ЛПВП, триглицериды) колориметрическим фотометрическим методом.
Что означают результаты теста?
При выдаче результата анализа на бланке будет указано полученное значение, а также границы, к которым надо стремиться. Врачи при ведении пациентов с рисками сердечно- сосудистых осложнений в первую очередь руководствуются не референсными значениями, а порогом принятия решений — целевыми значениями показателей липидного профиля, которые рассчитаны в соответствии с популяционными и клиническими критериями, подкреплены многочисленными статистическими данными и утверждены ВОЗ.
Для общего холестерина оптимальное значение должно быть ниже 5,2 ммоль/л. Это усредненная верхняя граница, к которой надо стремиться. Значения в диапазоне 5,2–6,1 ммоль/л считаются пограничными. При значениях выше 6,1 ммоль/л можно говорить о серьезных рисках развития атеросклероза.
Для ЛПНП оптимальное значение составляет не более 2,6 ммоль/л. Пограничными считаются значения от 2,6 до 3,3 ммоль/л. Выше 3,3 ммоль/л — риск развития атеросклероза.
Значение уровня ЛПВП в норме должно быть не менее 1,03 ммоль/л для пациентов с низким риском развития атеросклероза. Для пациентов группы риска, а также для пациентов, уже страдающих атеросклерозом, целевой показатель выше — более 1,55 ммоль/л.
Для триглицеридов нормой считается значение до 1,7 ммоль/л. От 1,7 до 2,2 ммоль/л — пограничное значение, выше 2,2 ммоль/л — опасно повышенное, связанное с риском развития атеросклероза. Однако следует помнить, что само по себе повышение триглицеридов может и не быть признаком атеросклероза или нарушения липидного обмена. Так, это может быть связано с тем, что пациент неправильно подготовился к сдаче анализа (не выдержал 10–12-часового голодного перерыва) или иными патологическими процессами.
Сроки выполнения теста.
Результат можно получить через 1-2 дня после сдачи анализа.
Как подготовиться к анализу?
Для того, чтобы сдать анализ на липидный профиль, рекомендуется воздерживаться от еды в течение 10–12 часов непосредственно перед взятием крови. Также перед сдачей анализа врачи рекомендуют:
- в течение трех недель соблюдать свой обычный режим и рацион питания
- за 3 дня до сдачи анализа воздержаться от употребления алкоголя
- непосредственно перед сдачей анализа воздержаться от курения
- осуществлять физические нагрузки в обычном режиме
- сообщить врачу о приеме лекарственных препаратов, т. к. некоторые препараты могут иметь влияние на липидный профиль.
Влияние мексидола на состав и перекисное окисление липидов миокарда в постреанимационном периоде | Андреева
1. Биленко М. В. Ишемические и реперфузионные повреждения органов. М.: Медицина; 1989.
2. Гринберг А. Роль липидов в метаболизме сердечной мышцы. Медикография. 1999; 2: 29—38.
3. Оковитый С. В., Смирнов А. В. Антигипоксанты Эксперим. и клинич. фармакология. 2001; 64 (3): 76—80.
4. Долгих В. Т., Русаков В. В., Корпачева О. В. и др. Ведущие патогенетические факторы постреанимационной кардиодепрессии Теоретические и клинические проблемы современной реаниматологии: Материалы Международного симпозиума, посвящен. 90-летию со дня рождения академика РАМН В. А. Неговского, 23—24 марта 1999г. М.; 1999: 56.
5. Лебедев А. С. Перекисное окисление липидов в миокарде крыс после оживления В кн.: Терминальные состояния.: Сб. науч. тр. Новосибирск; 1983: 3—5.
6. Неговский В. А., Мороз В. В. Теоретические и клинические проблемы реаниматологии Анестезиология и реаниматология. 2000; 6: 4—6.
7. Корпачев В. Г., Лысенков С. П., Тель Л. З. Моделирование клинической смерти и постреанимационной болезни у крыс Патол. Физиология. 1982; 3: 78—80.
8. Folch J., Less M., Stanley G. A simple method for the isolation and purification of total lipid from animal tissue. Biol. Chem. 1957; 226 (2): 497—509.
9. Шаршунова М., Шварц В., Михалец Ч. Разделение липидов по классам Тонкослойная хроматография в фармации и клинической биохимии. М.: Мир; 1980: 536—541.
10. Ланкин В. З., Герасимова Е. Н., Касаткин Л. Б. Перекиси липидов и атеросклероз. Ферментативная детоксикация перекисей липидов в крови больных ишемической болезнью сердца, обусловленной атеросклерозом коронарных артерий. Кардиология. 1979; 6: 71—75.
11. Smith J. B., Jngerman C. M., Silver M. J. Malondialdehyde formation as an indication of prostaglandin production by human platelets. J. lab. Clin. Med. 1976; 88 (1): 167—172.
12. Aebi H. Methoden der erymatiechen analyses. Biochemistry. 1970; 2: 636—647.
13. Nischikimi M., Rao A., Xagi K. The occurrence of superoxide anion in reaction of reduсed phenaxinemetasulfate and molecular oxygen. Biochem. Biohys. Res. Commun. 1972; 146 (2): 849—854.
14. Андреева Н. Н., Мухина И. В., Лапшин Р. Д. Модификации фосфолипидного компонента мембран кардиомиоцитов и гепатоцитов в постишемическом периоде. Нижегородский мед. журн. 2003; 2: 20—25.
15. Бурлакова Е. Б., Кайране Ч. Б., Молочкина Е. М. и др. Модификация липидов наружной мембраны митохондрий печени мышей и кинетических параметров мембраносвязанной моноаминоксидазы in vivo и in vitro. Вопр. мед. химии 1984; 1: 66—72.
16. Левитина Е. В. Влияние мексидола на клинико-биохимические проявления перинатальной гипоксии у новорожденных детей. Эксперим. и клинич. фармакология. 2001; 64 (5): 34—36.
17. Клебанов Г. И., Любицкий О. Б., Васильева О. В. и др. Антиоксидантные свойства производных 3 оксипиридина: мексидола, эмоксипина и проксипина. Вопр. мед. химии. 2001; 47: 288—300.
18. Лукьянова Л. Д. Новые подходы к созданию антигипоксантов метаболического действия. Вестник РАМН. 1999; 3: 18—25.
19. Ivanics T., Miklos Z., Dezsi L. et all. Concomitant accumulation of intracellular free calcium and arachidonic acid in the ischemic reperfused rat heart Mol. Cell. Biochem. 2001; 226 (1—2): 119—128.
20. Гацура В. В., Пичугин В. В., Сернов Л. Н. и др. Противоишемический кардиопротекторный эффект мексидола. Кардиология.1996; 36 (11): 59—62.
21. Опи Л. Х. Обмен веществ и энергии в миокарде. Физиология и патофизиология сердца/ Под ред. Н. Сперелакиса. Т. 2. М.: Медицина; 1990: 7—63.
ВЛИЯНИЕ ЧЕТЫРЕХХЛОРИСТОГО УГЛЕРОДА НА ЛИПИДНЫЙ СОСТАВ КРОВИ КРЫС И ВОЗМОЖНОСТЬ ЕГО КОРРЕКЦИИ ПРИРОДНЫМИ РАСТИТЕЛЬНЫМИ ПОЛИФЕНОЛАМИ | Другова
1. Занавескин Л.Н., Першикова Е.В., Конорев О.А. Переработка четыреххлористого углерода и содержащих его отходов в хлористый метил. Технология органических веществ. 2006; 12: 10-21.
2. Кравченко Л.В., Трусов Н.В., Усакова М.А., Аксенов И.В., Авреньева Л.И., Гусева Г.В., и др. Характеристика токсического действия четыреххлористого углерода как модели окислительного стресса. Токсикологический вестник. 2009; 1: 12-17.
3. Момот Т.В., Кушнерова Н.Ф., Фоменко С.Е. Профилактика нарушений липидного обмена печени при интоксикации сероуглеродом. Тихоокеанский медицинский журнал. 2013; 2 (52): 57-59.
4. Спрыгин В.Г., Кушнерова Н.Ф., Фоменко С.Е. Влияние профилактического применения олигомерных проантоцианидинов на липидный обмен и антирадикальную активность печени крыс при поражении четыреххлористым углеродом. Сибирский медицинский журнал. 2013; 1: 60-63.
5. Спрыгин В.Г., Кушнерова Н.Ф. Калина — новый нетрадиционный источник олигомерных проантоцианидинов. Химико — фармацевтический журнал. 2004; 38 (2): 41-45.
6. Венгеровский А.И., Маркова И.В., Саратиков А.С. Доклиническое изучение гепатозащитных средств. Вед. фарм. ком. 1999; 2: 9-12.
7. Folch J., Less M., Sloane-Stanley G.H. A simple method for the isolation and purification of total lipids from animal tissue. 1957; 226: 497-509.
8. Svetachev V.I., Vaskovsky V.E. A simplified technique for thin layer microchromatography of lipids. J. Chromatography. 1972; 67 (2): 376-378.
9. Vaskovsky V.E., Kostetsky E.Y, Vasenden I.M. A universal reagent for phospholipid analyses. J. Chromatography. 1975; 114: 129-141.
10. Rouser G., Kritchevsky G., Yamamoto A. Column chromatographic and associated procedures for separation and determination of phosphatides and glicolipids. Lipid chromatography. Anal. N.Y.: Dekker. 1967; 1: 99-162.
11. Amenta J.S. A rapid chemical method for quantification of lipids separated by thin-layer chromatography. J. Lipid Res. 1964; 5 (2): 270-272.
12. Колб В.Г., Камышников В.С. Справочник по клинической химии. 2-е изд. Минск: Беларусь; 1982.
13. Boll M., Weber L.W., Becker E., Stampfl A. Mechanism of carbon tetrachlorideinduced hepatotoxicity. Hepatocellular damage by reactive carbon tetrachloride metabolites. Z. Naturforsch C. 2001; 56 (7-8): 649-59.
14. Момот Т.В., Кушнерова Н. Ф., Рахманин Ю. А. Профилактика нарушения биохимических показателей в крови крыс при экспериментальном стрессе. Гигиена и санитария. 2016; 95 (7): 678-681.
15. Satoh T., Cohen H.T., Katz A.I. Intracellular signaling in the regulation of renal Na-K-ATP-ase. II. Role of eicosanoids. J. Clin. Invest. 1993; 91: 409-415.
16. Berson A., Fau D., Fornacciari R., Degove-Goddard P., Sutton A., Descatoire V., et al. Mechanisms for experimental buprenorphine hepatotoxicity: major role of mitochondrial dysfunction versus metabolic activation. Hepatology. 2001; 34 (2): 261-9.
17. Фоменко С.Е., Кушнерова Н.Ф. Экспериментальная оценка токсического влияния ацетона на метаболические реакции печени в условиях повышенной влажности воздуха. Токсикологический вестник. 2013; 2 (11): 9-14.
18. Gresele P., Cerletti C., Guglielmini G., Pignatelli P., de Gaetano G., Violi F. Effects of resveratrol and other wine polyphenols on vascular function: an update. J. Nutr. Biochem. 2011; 22 (3): 201-211.
19. Kim M., Yang S.G., Kim J.M., Lee J.W., Kim Y.S., Lee J.I. Silymarin suppresses hepatic stellate cell activation in a dietary rat model of non-alcoholic steatohepatitis: analysis of isolated hepatic stellate cells. Int. J. Mol. Med. 2012; 30 (3): 473-479.
жиры у человека видоизменились сильнее, чем у других млекопитающих
June 27, 2018 9:49am
Эксперты исследовали жировой состав шести различных тканей у 32 видов млекопитающих
Липиды, к которым относятся жиры и ряд жироподобных веществ, у млекопитающих изменялись в ходе эволюции качественно и количественно, но наибольшие изменения при этом произошли у человека, выяснили ученые из Сколковского института науки и технологий (Сколтеха) совместно с коллегами из Германии. Об этом в понедельник сообщает пресс-служба российского вуза.
Екатерина Храмеева. Фото: Skoltech
Липиды играют большую структурную и функциональную роль в клетках живых организмов. Из жиров построены клеточные мембраны, жиры запасают энергию. Более того, липиды передают сигналы между клетками, в первую очередь в мозге. Ученые считают, что именно липидный состав может многое рассказать о процессе развития мозга в ходе эволюции.
«Ученые из Сколтеха совместно с коллегами из Германии провели масштабное исследование, направленное на изучение жирового состава шести различных тканей у 32 видов млекопитающих. Полученные данные продемонстрировали, что в процессе эволюции представленность и концентрация различных жиров сильно меняется. Больше всего специфических эволюционных изменений было обнаружено у человека», — говорится в сообщении. Исследовались образцы тканей из коры больших полушарий головного мозга, почек, сердца, мышц, печени и мозжечка. Выяснилось, что у человека липидные изменения локализованы преимущественно в мозге.
«Найденные нами человеко-специфичные липиды преимущественно вовлечены в метаболические пути, связанные с когнитивными заболеваниями, такими как болезнь Альцгеймера, Паркинсона, и другими нарушениями работы нервной системы. Получается, эти липиды важны для когнитивной деятельности человека, а это именно то, что отличает наш вид от других», — заявила первый автор исследования, научный сотрудник Сколтеха Екатерина Храмеева, слова которой приводятся в сообщении.
Источник: tass.ru
липидов | Определение, структура, примеры, функции, типы и факты
Липид , любое из разнообразных групп органических соединений, включая жиры, масла, гормоны и определенные компоненты мембран, которые сгруппированы вместе, потому что они не взаимодействуют в значительной степени с водой. Один тип липидов, триглицериды, в виде жира депонируется в жировых клетках, которые служат хранилищем энергии для организмов, а также обеспечивают теплоизоляцию. Некоторые липиды, такие как стероидные гормоны, служат химическими посредниками между клетками, тканями и органами, а другие передают сигналы между биохимическими системами внутри одной клетки.Мембраны клеток и органеллы (структуры внутри клеток) представляют собой микроскопически тонкие структуры, образованные из двух слоев молекул фосфолипидов. Мембраны служат для отделения отдельных клеток от окружающей их среды и для разделения внутренней части клетки на структуры, выполняющие особые функции. Эта функция компартментализации настолько важна, что мембраны и липиды, которые их образуют, должны были иметь важное значение для происхождения самой жизни.
липидная структураСтруктура и свойства двух репрезентативных липидов.И стеариновая кислота (жирная кислота), и фосфатидилхолин (фосфолипид) состоят из химических групп, которые образуют полярные «головы» и неполярные «хвосты». Полярные головки гидрофильны или растворимы в воде, тогда как неполярные хвосты гидрофобны или нерастворимы в воде. Молекулы липидов этого состава спонтанно образуют агрегатные структуры, такие как мицеллы и липидные бислои, с их гидрофильными концами, ориентированными в сторону водной среды, а их гидрофобные концы защищены от воды.
Британская энциклопедия, Inc.Популярные вопросы
Что такое липид?
Липид — это любое из различных органических соединений, нерастворимых в воде. Они включают жиры, воски, масла, гормоны и определенные компоненты мембран и действуют как молекулы-аккумуляторы энергии и химические посланники. Вместе с белками и углеводами липиды являются одним из основных структурных компонентов живых клеток.
Почему липиды важны?
Липиды представляют собой разнообразную группу соединений и выполняют множество различных функций.На клеточном уровне фосфолипиды и холестерин являются одними из основных компонентов мембран, отделяющих клетку от окружающей среды. Гормоны липидного происхождения, известные как стероидные гормоны, являются важными химическими посредниками и включают тестостерон и эстрогены. На уровне организма триглицериды, хранящиеся в жировых клетках, служат хранилищами энергии, а также обеспечивают теплоизоляцию.
Что такое липидные рафты?
Липидные рафты — это возможные области клеточной мембраны, которые содержат высокие концентрации холестерина и гликосфинголипидов.Существование липидных рафтов окончательно не установлено, хотя многие исследователи подозревают, что такие рафты действительно существуют и могут играть роль в текучести мембран, межклеточной коммуникации и заражении вирусами.
Вода — это биологическая среда, вещество, делающее жизнь возможной, и почти все молекулярные компоненты живых клеток, будь то животные, растения или микроорганизмы, растворимы в воде. Такие молекулы, как белки, нуклеиновые кислоты и углеводы, обладают сродством к воде и называются гидрофильными («водолюбивыми»).Липиды, однако, гидрофобны («боятся воды»). Некоторые липиды являются амфипатическими: часть их структуры гидрофильная, а другая часть, обычно большая часть, гидрофобная. Амфипатические липиды проявляют уникальное поведение в воде: они спонтанно образуют упорядоченные молекулярные агрегаты, гидрофильные концы которых находятся снаружи, в контакте с водой, а их гидрофобные части внутри, защищенные от воды. Это свойство является ключом к их роли в качестве основных компонентов мембран клеток и органелл.
липид; oogoniumМикрофотография оогониума (яйцеклетки некоторых водорослей и грибов), полученная с помощью просвечивающего электронного микроскопа в ложных цветах, демонстрирующая обилие липидных капель (желтый), ядра (зеленый), атипичного ядрышка (темно-синий) и митохондрий ( красный).
© Jlcalvo / Dreamstime.comХотя биологические липиды не являются крупными макромолекулярными полимерами (например, белками, нуклеиновыми кислотами и полисахаридами), многие из них образуются в результате химического связывания нескольких небольших составляющих молекул.Многие из этих молекулярных строительных блоков похожи или гомологичны по структуре. Гомология позволяет разделить липиды на несколько основных групп: жирные кислоты, производные жирных кислот, холестерин и его производные, а также липопротеины. В этой статье рассматриваются основные группы и объясняется, как эти молекулы функционируют как молекулы-аккумуляторы, химические посредники и структурные компоненты клеток.
Жирные кислоты редко встречаются в природе в виде свободных молекул, но обычно находятся в составе многих сложных липидных молекул, таких как жиры (соединения, аккумулирующие энергию) и фосфолипиды (основные липидные компоненты клеточных мембран).В этом разделе описывается структура и физико-химические свойства жирных кислот. Это также объясняет, как живые организмы получают жирные кислоты как из своего рациона, так и в результате метаболического расщепления накопленных жиров.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчасКонструкция
Биологические жирные кислоты, члены класса соединений, известных как карбоновые кислоты, состоят из углеводородной цепи с одной концевой карбоксильной группой (COOH).Фрагмент карбоновой кислоты, не включающий гидроксильную (ОН) группу, называется ацильной группой. В физиологических условиях воды эта кислотная группа обычно теряет ион водорода (H + ) с образованием отрицательно заряженной карбоксилатной группы (COO — ). Большинство биологических жирных кислот содержат четное число атомов углерода, потому что путь биосинтеза, общий для всех организмов, включает химическое соединение двухуглеродных единиц вместе (хотя в некоторых организмах действительно встречаются относительно небольшие количества нечетных жирных кислот).Хотя молекула в целом нерастворима в воде благодаря своей гидрофобной углеводородной цепи, отрицательно заряженный карбоксилат является гидрофильным. Эта обычная форма биологических липидов, которая содержит хорошо разделенные гидрофобные и гидрофильные части, называется амфипатической.
Структурная формула стеариновой кислоты.
Британская энциклопедия, Inc.Помимо углеводородов с прямой цепью, жирные кислоты могут также содержать пары атомов углерода, связанных одной или несколькими двойными связями, метильными разветвлениями или трехуглеродным циклопропановым кольцом рядом с центром углеродной цепи.
Липидный состав — обзор
3.2.5 Стадия роста
Жирнокислотный состав бактериальных липидов явно зависит от возраста культуры, как и у растений (см. Раздел 3.1.3). В случае грамотрицательной бактерии [264] состав резко менялся в зависимости от стадии роста. Более молодые клетки содержали больше моноеновых кислот C-16 и C-18, тогда как клетки поздних логарифмических стадий содержали циклопропановые кислоты C-17 и C-19 до 10 и 50% соответственно.
Относительная доля Glc 2 DAG в общем липиде Bacillus cereus увеличивалась в зависимости от возраста культуры, тогда как доля Ptd-этаноламина снижалась, вероятно, из-за фосфатного голодания [306]. В средне-логарифмической фазе роста и в начале стационарной фазы Lactobacillus casei могли быть обнаружены ацилированные Hex 2 DAG и Hex 3 DAG, но преобладали Hex 2 DAG и Hex 4 DAG присутствовал в меньших количествах.Увеличение Hex 3 DAG и Hex 4 DAG было характерным паттерном для GGroL в стационарной фазе [85]. За счет ингибирования синтеза белка в Streptococcus faecium после воздействия хлорамфеникола или лишения валина электрофоретическая подвижность LTA снизилась (т.е. увеличился отрицательный заряд), а замещение глюкозы в C2 глицеринов также увеличилось.
В A. laylawii общая концентрация гликолипидов оставалась примерно постоянной на протяжении всего периода культивирования, хотя соотношение GlcDAG / Glc 2 DAG увеличивалось примерно с 0.7 в возрасте 10 часов культивирования до 2,6 в возрасте 32 часов [97]. Присутствие высокой концентрации GlcDAG в A. laylawii является необычным. GroP-Glc 2 DAG (хотя предложенная авторами структура sn -3-GroP теперь должна быть sn -1-GroP [30]) встречается у A. laylawii во все культурные эпохи и составляет почти половина фосфолипидов в экспоненциально растущих клетках. Ptd-Glc 2 DAG встречается только в старых культурах [274].
В S.Lactis GroP-Glc 2 DAG вместе с его 6- O -ацильным производным, а также Galα1-2Gro-1-P-6Glc (acyl-6) Glcα1-3 (1) DAG (число Фишера XV, Таблица 2.2.4 (8)) и Galα1-3Gro-1-P-6Glc (acyl-6) GlcDAG (XVI) не появлялись до конца логарифмической фазы роста, тогда как Galα1-3, Galα1-2 -sn — Gro-1-P-6Glc (ацил-6) GlcDAG (XVII) и Galα1-6Galα1-3 -sn- Gro-1-P-6Glc (acyl-6) GlcDAG (XVIII) были обнаружены повсюду в относительно постоянные пропорции. Напротив, Gro-1-P-6Glcβ1-6Glcβ1-3 (1) DAG [243] был обнаружен в B.licheniformis на всех стадиях роста в относительно высокой концентрации.
Структура GGroL стрептококков группы B уникальна. Даже в стационарной фазе GlcDAG присутствует в больших количествах и на молярной основе составляет примерно 20% полярных липидов. В группе D и других грамположительных организмах количество GlcDAG было меньше во время логарифмического роста и резко уменьшилось в начале стационарной фазы. Это предполагает, что GlcDAG функционирует в этих организмах в основном как промежуточное звено в биосинтезе более распространенного Glc 2 DAG, тогда как у стрептококков группы B он должен рассматриваться как составляющая мембраны [4].
Понимание разнообразия липидного состава мембран
Куйвенховен, Дж. А. и Хегеле, Р. А. Анализ генома на наличие липидных генов. Biochim. Биофиз. Acta 1842 , 1993–2009 (2014).
CAS PubMed Google Scholar
Ламари, Ф., Мохель, Ф., Седель, Ф. и Саудубрей, Дж. М. Нарушения биосинтеза фосфолипидов, сфинголипидов и жирных кислот: к новой категории наследственных заболеваний обмена веществ. J. Inherit. Метаб. Дис. 36 , 411–425 (2013).
CAS PubMed Google Scholar
van Meer, G., Voelker, D. R. & Feigenson, G. W. Мембранные липиды: где они находятся и как ведут себя. Nat. Rev. Mol. Клетка. Биол. 9 , 112–124 (2008).
CAS PubMed PubMed Central Google Scholar
Накамура, М.Т., Юдель, Б. Э. и Лоор, Дж. Дж. Регуляция энергетического обмена с помощью длинноцепочечных жирных кислот. Prog. Lipid Res. 53 , 124–144 (2014).
CAS PubMed Google Scholar
Симидзу Т. Липидные медиаторы в здоровье и болезнях: ферменты и рецепторы как терапевтические мишени для регуляции иммунитета и воспаления. Annu. Rev. Pharmacol. Toxicol. 49 , 123–150 (2009).
CAS PubMed Google Scholar
Салиба, А.Е., Вонкова, И., Гэвин, А. С. Систематический анализ белок-липидных взаимодействий достиг совершеннолетия. Nat. Rev. Mol. Клетка. Биол. 16 , 753–761 (2015).
CAS PubMed Google Scholar
Реш, М. Д. Жировое ацилирование белков: длинное и короткое. Prog. Lipid Res. 63 , 120–131 (2016).
CAS PubMed PubMed Central Google Scholar
Hannich, J.T., Umebayashi, K. & Riezman, H. Распределение и функции стеринов и сфинголипидов. Cold Spring Harb. Перспектива. Биол. 3 , а004762 (2011).
PubMed PubMed Central Google Scholar
Yamashita, A. et al. Ацилтрансферазы и трансацилазы, которые определяют состав жирных кислот глицеролипидов и метаболизм биоактивных липидных медиаторов в клетках млекопитающих и модельных организмах. Prog. Lipid Res. 53 , 18–81 (2014).
CAS PubMed Google Scholar
Hannich, J. T., Mellal, D., Feng, S., Zumbuehl, A. & Riezman, H. Структура и консервативная функция изоразветвленных сфингоидных оснований нематоды Caenorhabditis elegans . Chem. Sci. 8 , 3676–3686 (2017).
CAS PubMed PubMed Central Google Scholar
Grosch, S., Schiffmann, S. & Geisslinger, G. Зависящие от длины цепи свойства керамидов. Prog. Lipid Res. 51 , 50–62 (2012).
PubMed Google Scholar
Harayama, T. et al. Лизофосфолипид-ацилтрансферазы опосредуют диверсификацию фосфатидилхолина для достижения требуемых физических свойств in vivo . Cell Metab. 20 , 295–305 (2014). Это исследование предоставляет подробную информацию о регуляции состава ацильной цепи PtdCho и использует эти знания для анализа функции насыщенных видов PtdCho in vivo , показывая важность базового понимания метаболизма липидов.
CAS PubMed Google Scholar
Антонни, Б., Ванни, С., Шиндо, Х. и Феррейра, Т. От нуля до шести двойных связей: ненасыщенность фосфолипидов и функция органелл. Trends Cell Biol. 25 , 427–436 (2015).
CAS PubMed Google Scholar
Сезгин Э., Левенталь И., Майор С. и Эггелинг К. Тайна мембранной организации: состав, регуляция и роли липидных рафтов. Nat. Rev. Mol. Клетка. Биол. 18 , 361–374 (2017).
CAS PubMed PubMed Central Google Scholar
Хишикава, Д., Хашидате, Т., Симидзу, Т., Шиндо, Х. Разнообразие и функция мембранных глицерофосфолипидов, генерируемых путем ремоделирования в клетках млекопитающих. J. Lipid Res. 55 , 799–807 (2014).
CAS PubMed PubMed Central Google Scholar
da Silveira dos Santos, A.X. et al. Систематический липидомный анализ дрожжевых мутантов протеинкиназы и фосфатазы позволяет по-новому взглянуть на регуляцию липидного гомеостаза. Мол. Биол. Ячейка 25 , 3234–3246 (2014). Авторы выполнили комплексный липидомный анализ мутантов киназы и фосфатазы дрожжей, который не только дает новое понимание того, как поддерживается гомеостаз липидов, но также предоставляет исчерпывающий набор данных, потенциально содержащий информацию о все еще неизвестных регуляторных путях.
PubMed PubMed Central Google Scholar
Contreras, F. X. et al. Молекулярное распознавание одного вида сфинголипидов трансмембранным доменом белка. Природа 481 , 525–529 (2012). Эта основополагающая статья описывает специфическое взаимодействие между C18-сфингомиелином и трансмембранным белком p24, которое влияет на димеризацию белка и перенос пузырьков.
CAS PubMed PubMed Central Google Scholar
Хашидатэ-Ёсида, Т.и другие. Ремоделирование жирных кислот с помощью LPCAT3 обогащает арахидонат фосфолипидными мембранами и регулирует транспорт триглицеридов. eLife http://dx.doi.org/10.7554/eLife.06328 (2015). Это исследование объединяет генетические, липидомические и биофизические подходы для раскрытия роли арахидоновой кислоты в мембранных GPL, которые необходимы для локальной кластеризации триглицеридов, транспорта и включения в липопротеины кишечника или печени.
Park, J.-W. и другие.Удаление сфинголипидов с очень длинными ацильными цепями вызывает у мышей резистентность к инсулину печени из-за изменения мембран, устойчивых к детергентам. Гепатология 57 , 525–532 (2013).
CAS PubMed Google Scholar
Pinot, M. et al. Биология липидных клеток. Полиненасыщенные фосфолипиды способствуют деформации мембран и делению эндоцитарными белками. Наука 345 , 693–697 (2014). Это исследование показывает важность полиненасыщенных фосфолипидов в деформации мембран во время эндоцитоза путем сочетания моделирования клеточной биологии, биофизики и молекулярной динамики, что является ярким примером междисциплинарных подходов, необходимых для детального понимания функций липидов.
CAS PubMed PubMed Central Google Scholar
Caires, R. et al. Жирные кислоты омега-3 модулируют функцию TRPV4 посредством ремоделирования плазматической мембраны. Cell Rep. 21 , 246–258 (2017). Используя генетически модифицированный C. elegans в качестве хозяина для экспрессии канала TRPV4 человека, авторы элегантно демонстрируют важность мембранного состава для функции этого канала, что также проливает свет на важность кислородного модифицированные жирные кислоты в мембране.
CAS PubMed Google Scholar
Васкес, В., Krieg, M., Lockhead, D. & Goodman, M. B. Фосфолипиды, содержащие полиненасыщенные жирные кислоты, улучшают механику нервных клеток и чувствительность к прикосновению. Cell Rep. 6 , 70–80 (2014).
CAS PubMed PubMed Central Google Scholar
Atilla-Gokcumen, G.E. et al. Делящиеся клетки регулируют свой липидный состав и локализацию. Cell 156 , 428–439 (2014).
CAS PubMed PubMed Central Google Scholar
Köberlin, Marielle, S.и другие. Консервированная кольцевая сеть корегулируемых липидов модулирует врожденные иммунные ответы. Cell 162 , 170–183 (2015).
PubMed PubMed Central Google Scholar
Berchtold, D. et al. Стресс плазматической мембраны вызывает перемещение белков Slm и активацию TORC2, что способствует синтезу сфинголипидов. Nat. Cell Biol. 14 , 542–547 (2012). Эта статья дает представление о том, как TORC2 определяет уровни сфинголипидов через их влияние на свойства мембран, а затем использует эту информацию для регулирования метаболизма сфинголипидов через каскад протеинкиназ.
CAS PubMed Google Scholar
Roelants, F. M., Breslow, D. K., Muir, A., Weissman, J. S. & Thorner, J. Протеинкиназа Ypk1 фосфорилирует регуляторные белки Orm1 и Orm2 для контроля гомеостаза сфинголипидов в Saccharomyces cerevisiae . Proc. Natl Acad. Sci. США 108 , 19222–19227 (2011).
CAS PubMed Google Scholar
Чиаппарино, А., Маеда, К., Турей, Д., Саез-Родригес, Дж. И Гэвин, А. С. Оркестр белков-переносчиков липидов на перекрестке между метаболизмом и передачей сигналов. Prog. Lipid Res. 61 , 30–39 (2016).
CAS PubMed Google Scholar
Чжан Х. и Ху Дж. Формирование эндоплазматического ретикулума в социальной сети. Trends Cell Biol. 26 , 934–943 (2016).
CAS PubMed Google Scholar
Hannun, Y.А. и Обейд, Л. М. Принципы передачи сигналов биоактивными липидами: уроки сфинголипидов. Nat. Rev. Mol. Клетка. Биол. 9 , 139–150 (2008).
CAS PubMed Google Scholar
Барнеда Д. и Кристиан М. Рост липидных капель: регулирование динамической органеллы. Curr. Opin. Cell Biol. 47 , 9–15 (2017).
CAS PubMed Google Scholar
Тиам, А.Р., Фарезе, Р. В. Младший, и Вальтер, Т. С. Биофизика и клеточная биология липидных капель. Nat. Rev. Mol. Клетка. Биол. 14 , 775–786 (2013).
CAS PubMed PubMed Central Google Scholar
Хикс, А.М., ДеЛонг, К.Дж., Томас, М.Дж., Самуэль, М. и Куи, З. Уникальные молекулярные сигнатуры видов глицерофосфолипидов в различных тканях крыс проанализированы с помощью тандемной масс-спектрометрии. Biochim.Биофиз. Acta 1761 , 1022–1029 (2006).
CAS PubMed Google Scholar
Де Краен, Ж.-О., Бертацци, Д., Бэр, С. и Фриант, С. Фосфоинозитиды, основные участники мембранного переноса и липидных сигнальных путей. Внутр. J. Mol. Sci. 18 , 634 (2017).
PubMed Central Google Scholar
Руссо, Д., Парашураман, С. и Д’Анджело, Г. Взаимодействие гликосфинголипид-белок при передаче сигнала. Внутр. J. Mol. Sci. 17 , E1732 (2016).
PubMed Google Scholar
Griffiths, W. J. et al. Холестероломика: новости. Анал. Biochem. 524 , 56–67 (2017).
CAS PubMed PubMed Central Google Scholar
Парк, Дж.W., Park, W. J. & Futerman, A.H. Церамидсинтазы как потенциальные мишени для терапевтического вмешательства при заболеваниях человека. Biochim. Биофиз. Acta 1841 , 671–681 (2014).
CAS PubMed Google Scholar
Сасса Т. и Кихара А. Метаболизм жирных кислот с очень длинной цепью: гены и патофизиология. Biomol. Ther. (Сеул) 22 , 83–92 (2014).
CAS Google Scholar
Кихара, А.Пути синтеза и разложения, функции и патология церамидов и эпидермальных ацилцерамидов. Prog. Lipid Res. 63 , 50–69 (2016).
CAS PubMed Google Scholar
Гаспар, Дж. Дж. И Макмастер, К. Р. Метаболизм кардиолипина и его причинная роль в этиологии наследственной кардиомиопатии синдрома Барта. Chem. Phys. Липиды 193 , 1–10 (2015).
CAS PubMed Google Scholar
Шевалье, Дж.и другие. Лизобисфосфатидная кислота контролирует уровень холестерина в эндосомах. J. Biol. Chem. 283 , 27871–27880 (2008).
CAS PubMed Google Scholar
Биссиг, К. и Грюнберг, Дж. Сортировка липидов и мультивезикулярный биогенез эндосом. Cold Spring Harb. Перспектива. Биол. 5 , а016816 (2013).
PubMed PubMed Central Google Scholar
Гассама-Диань, А.и другие. Фосфатидилинозитол-3,4,5-трифосфат регулирует образование базолатеральной плазматической мембраны в эпителиальных клетках. Nat. Cell Biol. 8 , 963–970 (2006).
CAS PubMed Google Scholar
Raghupathy, R. et al. Межслойные липидные взаимодействия опосредуют нанокластеризацию липид-заякоренных белков. Cell 161 , 581–594 (2015). Авторы описывают новый механизм образования нанодоменов за счет кластеризации PtdSer и межслойных пересечений, который не только важен для понимания латеральных неоднородностей в плазматической мембране, но также интересен с точки зрения биологии липидов из-за небольшого различия в ацил- Длина цепи сильно влияет на результат образования нанодоменов.
CAS PubMed PubMed Central Google Scholar
Сузуки, Дж., Умеда, М., Симс, П. Дж. И Нагата, С. Кальций-зависимое скремблирование фосфолипидов с помощью TMEM16F. Природа 468 , 834–838 (2010).
CAS PubMed PubMed Central Google Scholar
Судзуки, Дж., Деннинг, Д. П., Иманиши, Э., Хорвиц, Х. Р. и Нагата, С.Связанный с Xk белок 8 и CED-8 способствуют экспозиции фосфатидилсерина в апоптотических клетках. Наука 341 , 403–406 (2013).
CAS PubMed PubMed Central Google Scholar
Carbon, S. et al. AmiGO: онлайн-доступ к онтологическим и аннотационным данным. Биоинформатика 25 , 288–289 (2009).
CAS Google Scholar
Тидхар Р.& Футерман, А. Х. Сложность биосинтеза сфинголипидов в эндоплазматическом ретикулуме. Biochim. Биофиз. Acta 1833 , 2511–2518 (2013).
CAS PubMed Google Scholar
Wegner, M. S., Schiffmann, S., Parnham, M. J., Geisslinger, G. & Grosch, S. Загадка регуляции церамидсинтазы в клетках млекопитающих. Prog. Lipid Res. 63 , 93–119 (2016).
CAS PubMed PubMed Central Google Scholar
Консорциум проектов кодирования.Интегрированная энциклопедия элементов ДНК в геноме человека. Nature 489 , 57–74 (2012).
Ichi, I. et al. Идентификация генов и путей, участвующих в синтезе медовой кислоты (20: 3n-9), индикатора дефицита незаменимых жирных кислот. Biochim. Биофиз. Acta 1841 , 204–213 (2014).
CAS PubMed Google Scholar
Imae, R. et al.LYCAT, гомолог C. elegans, acl-8, acl-9 и acl-10, определяет жирнокислотный состав фосфатидилинозитола у мышей. J. Lipid Res. 53 , 335–347 (2012).
CAS PubMed PubMed Central Google Scholar
Lee, H.C. et al. LPIAT1 регулирует содержание арахидоновой кислоты в фосфатидилинозитоле и необходим для кортикального ламинирования у мышей. Мол. Биол. Ячейка 23 , 4689–4700 (2012).
CAS PubMed PubMed Central Google Scholar
Вэнс, Дж. Э. МАМ (митохондриально-ассоциированные мембраны) в клетках млекопитающих: липиды и не только. Biochim. Биофиз. Acta 1841 , 595–609 (2014).
CAS Google Scholar
Kim, Y.J., Guzman-Hernandez, Maria, L. & Balla, T.A. Высокодинамичная ER-производная синтезирующая фосфатидилинозит органелла поставляет фосфоинозиты на клеточные мембраны. Dev. Ячейка 21 , 813–824 (2011). Авт. Идентифицируют новый субдомен (описанный как органеллы в этой статье) ER для локального синтеза PtdIns, который необходим для их доставки к др. Мембранам, показывая важность компартментализации в метаболизме липидов.
CAS PubMed PubMed Central Google Scholar
Bone, L. N. et al. Ацилтрансфераза LYCAT контролирует специфические фосфоинозитиды и связанный с ними мембранный трафик. Мол. Биол. Ячейка 28 , 161–172 (2017).
CAS PubMed PubMed Central Google Scholar
Nishimura, T. et al. Формирование аутофагосом инициируется в субдоменах ER, обогащенных фосфатидилинозитолсинтазой. EMBO J. 36 , 1719–1735 (2017).
CAS PubMed PubMed Central Google Scholar
Английский, А.R. & Voeltz, G.K. Rab10 GTPase регулирует динамику и морфологию ER. Nat. Cell Biol. 15 , 169–178 (2012).
PubMed PubMed Central Google Scholar
Эпанд Р. М. Особенности цикла фосфатидилинозитола и его роль в передаче сигнала. J. Membr. Биол. 250 , 353–366 (2016).
PubMed Google Scholar
Шульга Ю.В., Топхам М. К. и Эпанд Р. М. Изучение арахидоноильной специфичности двух ферментов цикла PI. J. Mol. Биол. 409 , 101–112 (2011).
CAS PubMed PubMed Central Google Scholar
Nadler, A. et al. Состав жирных кислот диацилглицеринов определяет паттерны локальной передачи сигналов. Angew. Chem. Int. Эд. Англ. 52 , 6330–6334 (2013).
CAS PubMed Google Scholar
Уоткинс, С.M., Zhu, X. & Zeisel, S.H. Активность фосфатидилэтаноламин- N -метилтрансферазы и диетический холин регулируют поток липидов в плазме печени и метаболизм незаменимых жирных кислот у мышей. J. Nutr. 133 , 3386–3391 (2003).
CAS PubMed Google Scholar
da Costa, K. A. et al. Добавка с пищей докозагексаеновой кислоты модулирует развитие гиппокампа у мышей Pemt — / — . J. Biol. Chem. 285 , 1008–1015 (2009).
PubMed PubMed Central Google Scholar
Hishikawa, D., Valentine, W. J., Iizuka-Hishikawa, Y., Shindou, H., Shimizu, T. Метаболизм и функции содержащих докозагексаеновую кислоту мембранных глицерофосфолипидов. FEBS Lett. 591 , 2730–2744 (2017).
CAS PubMed PubMed Central Google Scholar
Нгуен, Л.N. et al. Mfsd2a является переносчиком докозагексаеновой кислоты, незаменимой жирной кислоты омега-3. Nature 509 , 503–506 (2014).
CAS Google Scholar
Mullen, T. D. et al. Селективный нокдаун церамидсинтаз выявляет сложную взаимную регуляцию метаболизма сфинголипидов. J. Lipid Res. 52 , 68–77 (2010).
PubMed Google Scholar
Накахара, К.и другие. Ген синдрома Шегрена-Ларссона кодирует гексадеценальную дегидрогеназу пути деградации сфингозин-1-фосфата. Мол. Ячейка 46 , 461–471 (2012).
CAS PubMed Google Scholar
Braverman, N.E. et al. Нарушения биогенеза пероксисом в спектре Зеллвегера: обзор современного диагноза, клинических проявлений и рекомендаций по лечению. Мол. Genet. Метаб. 117 , 313–321 (2016).
CAS PubMed Google Scholar
Malheiro, A. R., da Silva, T. F. & Brites, P. Плазмалогены и жирные спирты при точечной ризомелической хондродисплазии и синдроме Шегрена-Ларссона. J. Inherit. Метаб. Дис. 38 , 111–121 (2015).
CAS PubMed Google Scholar
Гейбл К. и др. Болезненная мутация в активном центре серинпальмитоилтрансферазы вызывает каталитическую распущенность. J. Biol. Chem. 285 , 22846–22852 (2010).
CAS PubMed PubMed Central Google Scholar
Duan, J. & Merrill, A.H. 1-дезоксисфинголипиды, обнаруженные экзогенно и madede novo: опасные загадки внутри загадки. J. Biol. Chem. 290 , 15380–15389 (2015).
CAS PubMed PubMed Central Google Scholar
Гури, Ю.и другие. mTORC2 способствует онкогенезу за счет синтеза липидов. Cancer Cell 32 , 807–823.12 (2017). Это продольное транскриптомное, протеомное, фосфопротеомное и липидомное исследование на мышиной модели показывает, что управляемый mTORC2 туморогенез при гепатоцеллюлярной карциноме требует повышенного de novo синтеза липидов, в частности образцов кардиолипина и глюкозилцерамида, а также поддержки биопсии человека. актуальность этой модели для рака печени человека.
CAS PubMed Google Scholar
Wigger, L. et al. Дигидроцерамиды плазмы являются кандидатами в биомаркеры предрасположенности к диабету у мышей и людей. Cell Rep. 18 , 2269–2279 (2017).
CAS PubMed Google Scholar
Schaefer, E.J. et al. Содержание фосфатидилхолина докозагексаеновой кислоты в плазме и риск деменции и болезни Альцгеймера. Arch. Neurol. 63 , 1545 (2006).
PubMed Google Scholar
Perrotti, F. et al. Достижения в липидомике для открытия биомаркеров рака. Внутр. J. Mol. Sci. 17 , 1992 (2016).
PubMed Central Google Scholar
Bridges, J. P. et al. LPCAT1 регулирует синтез поверхностно-активных фосфолипидов и необходим для перехода мышей к дыханию воздухом. J. Clin. Вкладывать деньги. 120 , 1736–1748 (2010).
CAS PubMed PubMed Central Google Scholar
Hirabayashi, T. et al. PNPLA1 играет решающую роль в функции кожного барьера, направляя биосинтез ацилцерамида. Nat. Commun. 8 , 14609 (2017).
PubMed PubMed Central Google Scholar
Оно, Ю., Kamiyama, N., Nakamichi, S. & Kihara, A. PNPLA1 представляет собой трансацилазу, необходимую для образования липидного ω-O-ацилцерамида кожного барьера. Nat. Commun. 8 , 14610 (2017).
PubMed PubMed Central Google Scholar
Grond, S. et al. Дефицит PNPLA1 у мышей и людей приводит к нарушению синтеза омега- O -ацилцерамидов. J. Invest. Дерматол. 137 , 394–402 (2017).
CAS PubMed PubMed Central Google Scholar
Grall, A. et al. Мутации PNPLA1 вызывают аутосомно-рецессивный врожденный ихтиоз у золотистых ретриверов и людей. Nat. Genet. 44 , 140–147 (2012).
CAS PubMed Google Scholar
Johansen, A. et al. Мутации в MBOAT7, кодирующем лизофосфатидилинозитол-ацилтрансферазу I, приводят к умственной отсталости, сопровождающейся эпилепсией и особенностями аутизма. Am. J. Hum. Genet. 99 , 912–916 (2016).
CAS PubMed PubMed Central Google Scholar
Эрнст, Р., Эйсинг, С. С. и Антонни, Б. Гомеовязкая адаптация и регуляция мембранных липидов. J. Mol. Биол. 428 , 4776–4791 (2016).
CAS PubMed Google Scholar
Зик, М., Stroupe, C., Orr, A., Douville, D. & Wickner, W. T. Мембраны, связанные trans -SNARE комплексами, требуют липидов, склонных к недислойной структуре для прогрессирования к слиянию. eLife 3 , e01879 (2014).
PubMed PubMed Central Google Scholar
Ири, А., Ямамото, К., Мики, Ю. и Мураками, М. Динамика фосфатидилэтаноламина необходима для слияния остеокластов. Sci. Rep. 7 , 46715 (2017).
PubMed PubMed Central Google Scholar
Pagliuso, A. et al. Деление мембраны Гольджи требует индуцированной CtBP1-S / BARS активации ацилтрансферазы лизофосфатидовой кислоты δ. Nat. Commun. 7 , 12148 (2016).
CAS PubMed PubMed Central Google Scholar
Розетти, К.М., Манджиаротти, А. и Вилке, Н. Размеры липидных доменов: что мы знаем об искусственных липидных мембранах? Каковы возможные общие черты мембранных рафтов в клетках? Biochim. Биофиз. Acta 1859 , 789–802 (2017).
CAS Google Scholar
Stone, M. B., Shelby, S. A., Núñez, M. F., Wisser, K. & Veatch, S. L. Сортировка белков липидными фазоподобными доменами поддерживает возникающую сигнальную функцию в плазматических мембранах B-лимфоцитов. eLife 6 , e19891 (2017).
PubMed PubMed Central Google Scholar
Guan, X. L. et al. Функциональные взаимодействия сфинголипидов и стеринов в биологических мембранах, регулирующие физиологию клеток. Мол. Биол. Ячейка 20 , 2083–2095 (2009). Систематический липидомный анализ мутантов показывает, что дрожжи адаптируют свой сфинголипидом при накоплении стеролов с аберрантной структурой, а генетические данные демонстрируют важность функциональных взаимодействий между сфинголипидом и стеринами, показывая важность беспристрастных систематических подходов для ответа на самые основные вопросы биологии липидов.
CAS PubMed PubMed Central Google Scholar
Maekawa, M. & Fairn, G.D. Дополнительные пробы показывают, что фосфатидилсерин необходим для правильного межслойного распределения холестерина. J. Cell Sci. 128 , 1422–1433 (2015).
CAS PubMed Google Scholar
Барелли, Х. и Антонни, Б.Ненасыщенность липидов и динамика органелл. Curr. Opin. Cell Biol. 41 , 25–32 (2016).
CAS PubMed Google Scholar
Rawicz, W., Olbrich, K. C., McIntosh, T., Needham, D. & Evans, E. Влияние длины цепи и ненасыщенности на эластичность липидных бислоев. Biophys. J. 79 , 328–339 (2000).
CAS PubMed PubMed Central Google Scholar
Иидзука-Хисикава, Ю.и другие. Ацилтрансфераза 3 лизофосфатидной кислоты регулирует статус мембран половых клеток путем включения докозагексаеновой кислоты во время сперматогенеза. J. Biol. Chem. 292 , 12065–12076 (2017).
CAS PubMed PubMed Central Google Scholar
Shindou, H. et al. Докозагексаеновая кислота сохраняет зрительную функцию, поддерживая правильную морфологию диска в фоторецепторных клетках сетчатки. Дж.Биол. Chem. 292 , 12054–12064 (2017).
CAS PubMed PubMed Central Google Scholar
Rong, X. et al. Lpcat3-зависимая продукция арахидоноилфосфолипидов является ключевым фактором секреции триглицеридов. eLife 4 , e06557 (2015).
PubMed Central Google Scholar
Stockwell, B.R.и другие. Ферроптоз: регулируемое звено клеточной смерти, связывающее метаболизм, окислительно-восстановительную биологию и болезнь. Cell 171 , 273–285 (2017).
CAS PubMed PubMed Central Google Scholar
Dixon, S.J. et al. Генетика гаплоидных клеток человека выявляет роль генов липидного метаболизма в неапоптотической гибели клеток. ACS Chem. Биол. 10 , 1604–1609 (2015).
CAS PubMed PubMed Central Google Scholar
О’Доннелл, В.Б. и Мерфи Р. С. Направление этерификации эйкозаноидов в фосфолипиды. J. Lipid Res. 58 , 837–839 (2017).
CAS PubMed PubMed Central Google Scholar
Исааксон, Ю., Шербурн, К. Д., Гросс, Р. В. и Стенсон, В. Ф. Синтез и молекулярная динамика фосфолипидов, содержащих гидроксилированные жирные кислоты в положении sn-2. Chem. Phys. Липиды 52 , 217–226 (1990).
CAS PubMed Google Scholar
Lemmon, M. A. Распознавание мембраны фосфолипид-связывающими доменами. Nat. Rev. Mol. Клетка. Биол. 9 , 99–111 (2008).
CAS PubMed Google Scholar
Lee, S. et al. Нарушение ретроградного мембранного движения через эндосомы в мутантных клетках СНО, дефектных по синтезу фосфатидилсерина. Гены Клетки 17 , 728–736 (2012).
CAS PubMed Google Scholar
Вонькова И. и др. Кооперативность липидов как общий принцип привлечения мембраны для доменов PH. Cell Rep. 12 , 1519–1530 (2015).
CAS PubMed Google Scholar
Краудер, М. К., Сикрист, К. Д. и Блинд, Р.D. Фосфолипидная регуляция надсемейства ядерных рецепторов. Adv. Биол. Regul. 63 , 6–14 (2017).
CAS PubMed Google Scholar
Чакраварти, М. В. и др. Идентификация физиологически релевантного эндогенного лиганда PPARalpha в печени. Cell 138 , 476–488 (2009).
CAS PubMed PubMed Central Google Scholar
Ли, Дж.M. et al. Фосфатидилхолиновый путь, зависимый от ядерных рецепторов, с антидиабетическим действием. Nature 474 , 506–510 (2011).
CAS PubMed PubMed Central Google Scholar
Мозер фон Фильзек, Дж. И Дрин, Дж. Взлет на холм: как создать клеточные липидные градиенты за счет встречных потоков липидов. Biochimie 130 , 115–121 (2016).
CAS PubMed Google Scholar
Moser von Filseck, J.и другие. Транспорт фосфатидилсерина белками ORP / Osh управляется фосфатидилинозитол-4-фосфатом. Наука 349 , 432–436 (2015).
CAS PubMed Google Scholar
Антонни Б. Механизмы определения кривизны мембраны. Annu. Rev. Biochem. 80 , 101–123 (2011).
CAS PubMed Google Scholar
Даумке, О., Roux, A. & Haucke, V. Каркасы BAR-домена в опосредованном динамином делении мембраны. Cell 156 , 882–892 (2014).
CAS PubMed PubMed Central Google Scholar
Hirama, T. et al. Искривление мембраны, вызванное близостью анионных фосфолипидов, может инициировать эндоцитоз. Nat. Commun. 8 , 1393 (2017).
PubMed PubMed Central Google Scholar
Магделейн, М.и другие. Фильтр на входе в аппарат Гольджи, который отбирает везикулы по размеру и липидному составу. eLife 5 , e16988 (2016). Это исследование показывает, что отбор пузырьков, которые входят в Гольджи, осуществляется путем определения липидного состава через дефекты упаковки, показывая важность разнообразия липидного состава в различных органеллах.
PubMed PubMed Central Google Scholar
Ли, А.G. Биологические мембраны: важность молекулярных деталей. Trends Biochem. Sci. 36 , 493–500 (2011).
CAS PubMed Google Scholar
Hedger, G. & Sansom, M. S. P. Сайты взаимодействия липидов на каналах, переносчиках и рецепторах: последние выводы из моделирования молекулярной динамики. Biochim. Биофиз. Acta 1858 , 2390–2400 (2016).
CAS PubMed PubMed Central Google Scholar
Контрерас, Ф.X., Эрнст, А. М., Виланд, Ф. и Брюггер, Б. Специфичность внутримембранных белок-липидных взаимодействий. Cold Spring Harb. Перспектива. Биол. 3 , а004705 (2011).
PubMed PubMed Central Google Scholar
Андерсон Р. Г. У. А. Роль липидных оболочек в нацеливании белков на кавеолы, рафты и другие липидные домены. Наука 296 , 1821–1825 (2002).
CAS PubMed Google Scholar
Ким Т.& Im, W. Пересмотр гидрофобного несоответствия с исследованиями моделирования свободной энергии наклона и вращения трансмембранной спирали. Biophys. J. 99 , 175–183 (2010).
CAS PubMed PubMed Central Google Scholar
Милованович Д. и др. Гидрофобное несоответствие разделяет белки SNARE на отдельные мембранные домены. Nat. Commun. 6 , 5984 (2015).
CAS PubMed PubMed Central Google Scholar
Шарп, Х.Дж., Стивенс, Т. Дж. И Манро, С. А. Всестороннее сравнение трансмембранных доменов выявляет специфические для органелл свойства. Cell 142 , 158–169 (2010).
CAS PubMed PubMed Central Google Scholar
Norimatsu, Y., Hasegawa, K., Shimizu, N. & Toyoshima, C. Выявлено взаимодействие белков и фосфолипидов с кристаллами кальциевого насоса. Природа 545 , 193–198 (2017).
CAS PubMed Google Scholar
Gupta, K. et al. Роль межфазных липидов в стабилизации олигомеров мембранных белков. Nature 541 , 421–424 (2017).
CAS PubMed PubMed Central Google Scholar
Laganowsky, A. et al. Мембранные белки избирательно связывают липиды, чтобы модулировать их структуру и функцию. Природа 510 , 172–175 (2014). Авторы анализируют поведение очищенных мембранных белков в газовой фазе масс-спектрометра ионной подвижности (нативная масс-спектрометрия), показывая важность специфических липид-белковых взаимодействий для регулирования структуры белка.
CAS PubMed PubMed Central Google Scholar
Haberkant, P. et al. In vivo профилирование и визуализация клеточных белково-липидных взаимодействий с использованием бифункциональных жирных кислот. Angew. Chem. 52 , 4033–4038 (2013).
CAS Google Scholar
Niphakis, Micah, J. et al. Глобальная карта липидсвязывающих белков и их лиганда в клетках. Ячейка 161 , 1668–1680 (2015). Эта статья демонстрирует возможности химической биологии для идентификации новых липид-связывающих белков в протеомном масштабе, что приводит к идентификации новых липидных функций.
CAS PubMed PubMed Central Google Scholar
Hulce, J. J., Cognetta, A. B., Niphakis, M. J., Tully, S. E. и Cravatt, B.F. Картирование белков, взаимодействующих с холестерином, в клетках млекопитающих по всему белку. Nat. Методы 10 , 259–264 (2013).
PubMed PubMed Central Google Scholar
Габеркант, П.и другие. Бифункциональный сфингозин для клеточного анализа белок-сфинголипидных взаимодействий. ACS Chem. Биол. 11 , 222–230 (2016).
CAS PubMed Google Scholar
Авирам Р. и др. Липидомический анализ выявляет временную и пространственную организацию липидов и раскрывает суточные колебания внутриклеточных органелл. Мол. Ячейка 62 , 636–648 (2016).
CAS PubMed Google Scholar
Loizides-Mangold, U.и другие. Липидомика выявляет суточные колебания липидов в скелетных мышцах человека, сохраняющиеся в клеточных мышечных трубках, культивируемых in vitro . Proc. Natl Acad. Sci. США 114 , E8565 – E8574 (2017).
CAS PubMed Google Scholar
Horton, J. D., Goldstein, J. L. & Brown, M. S. SREBPs: активаторы полной программы синтеза холестерина и жирных кислот в печени. J. Clin.Вкладывать деньги. 109 , 1125–1131 (2002).
CAS PubMed PubMed Central Google Scholar
Янг, Х. и др. Структурный механизм регуляции эргостерина с помощью фактора транскрипции стеролов грибов Upc2. Nat. Commun. 6 , 6129 (2015).
CAS PubMed Google Scholar
Sousa, S. B. et al. Мутации с усилением функции в гене фосфатидилсерин-синтазы 1 (PTDSS1) вызывают синдром Ленца-Маевского. Nat. Genet. 46 , 70–76 (2013).
PubMed Google Scholar
Генри С. А., Кольвейн С. Д. и Карман Г. М. Метаболизм и регуляция глицеролипидов в дрожжах Saccharomyces cerevisiae . Генетика 190 , 317–349 (2012).
CAS PubMed PubMed Central Google Scholar
Корнелл, Р.Б. и Нортвуд, И. С. Регулирование CTP: фосфохолинцитидилилтрансфераза путем амфитропизма и релокализации. Trends Biochem. Sci. 25 , 441–447 (2000).
CAS PubMed Google Scholar
Covino, R. et al. Эукариотический датчик липидного насыщения мембраны. Мол. Ячейка 63 , 49–59 (2016). Функция дрожжевого Mga2 в качестве датчика насыщения мембранными липидами объяснена в молекулярных деталях, что является наглядным примером того, как состав мембраны может влиять на функцию трансмембранного белка.
CAS PubMed Google Scholar
Holzer, R.G. et al. Насыщенные жирные кислоты индуцируют кластеризацию c-Src в субдоменах мембраны, что приводит к активации JNK. Cell 147 , 173–184 (2011).
CAS PubMed PubMed Central Google Scholar
Ariyama, H., Kono, N., Matsuda, S., Inoue, T. & Arai, H. Снижение ненасыщенности мембранных фосфолипидов вызывает ответ развернутого белка. J. Biol. Chem. 285 , 22027–22035 (2010).
CAS PubMed PubMed Central Google Scholar
Volmer, R., van der Ploeg, K. & Ron, D. Насыщение мембранными липидами активирует преобразователи ответа белка развернутого эндоплазматического ретикулума через их трансмембранные домены. Proc. Natl Acad. Sci. США 110 , 4628–4633 (2013).
CAS Google Scholar
Коно, Н., Amin-Wetzel, N., Ron, D. & Gilmore, R. Общие свойства, связанные с охватом мембран, придают IRE1α чувствительность к мембранным аберрантам. Мол. Биол. Ячейка 28 , 2318–2332 (2017).
CAS PubMed PubMed Central Google Scholar
Akagi, S. et al. Лизофосфатидилхолинацилтрансфераза 1 защищает от цитотоксичности, вызванной полиненасыщенными жирными кислотами. FASEB J. 30 , 2027–2039 (2016).
CAS PubMed Google Scholar
Breslow, D. K. et al. Белки семейства Орм опосредуют гомеостаз сфинголипидов. Nature 463 , 1048–1053 (2010).
CAS PubMed PubMed Central Google Scholar
Siow, D. L. & Wattenberg, B. W. Белки ORMDL млекопитающих опосредуют ответную реакцию при биосинтезе церамидов. J. Biol. Chem. 287 , 40198–40204 (2012).
CAS PubMed PubMed Central Google Scholar
Kiefer, K. et al. Скоординированная регуляция экспрессии семейства оросомукоидоподобных генов контролирует синтез церамидов de novo в клетках млекопитающих. J. Biol. Chem. 290 , 2822–2830 (2015).
CAS PubMed Google Scholar
Siow, D., Сункара, М., Данн, Т. М., Моррис, А. Дж. И Ваттенберг, Б. Стехиометрия ORMDL / серинпальмитоилтрансфераза определяет влияние экспрессии ORMDL3 на биосинтез сфинголипидов. J. Lipid Res. 56 , 898–908 (2015).
CAS PubMed PubMed Central Google Scholar
Жакупова А. и др. Уровни экспрессии ORMDL3 не влияют на активность серинпальмитоилтрансферазы. FASEB J. 30 , 4289–4300 (2016).
CAS PubMed Google Scholar
Capasso, S. et al. Метаболический поток сфинголипидов контролирует оборот фосфоинозитидов в сети транс-Гольджи. EMBO J. 36 , 1736–1754 (2017).
CAS PubMed PubMed Central Google Scholar
Senkal, C.E. et al. Церамид метаболизируется до ацилцерамида и хранится в липидных каплях. Cell Metab. 25 , 686–697 (2017).
CAS PubMed PubMed Central Google Scholar
Hofbauer, Harald, F. et al. Регулирование экспрессии генов с помощью репрессора транскрипции, который определяет длину ацильной цепи в мембранных фосфолипидах. Dev. Ячейка 29 , 729–739 (2014).
CAS PubMed PubMed Central Google Scholar
Янг, Б.P. et al. Фосфатидная кислота — это биосенсор pH, который связывает биогенез мембраны с метаболизмом. Наука 329 , 1085–1088 (2010). Это исследование предлагает новую концепцию PtdA в качестве датчика pH, показывающую, как клетки используют эту информацию для определения метаболического статуса (изменения клеточного pH в зависимости от метаболического статуса) клетки, а затем регулируют транскрипцию генов синтеза фосфолипидов.
CAS PubMed Google Scholar
Чжан, К.и другие. Сигналы глицеролипидов изменяют комплекс mTOR 2 (mTORC2), уменьшая передачу сигналов инсулина. Proc. Natl Acad. Sci. США 109 , 1667–1672 (2012).
CAS PubMed Google Scholar
Menon, D. et al. Зондирование липидов комплексами mTOR посредством новосинтеза фосфатидной кислоты. J. Biol. Chem. 292 , 6303–6311 (2017).
CAS PubMed PubMed Central Google Scholar
Юн, М.-S. и другие. Быстрая митогенная регуляция ингибитора mTORC1, DEPTOR, фосфатидной кислотой. Мол. Ячейка 58 , 549–556 (2015).
CAS PubMed PubMed Central Google Scholar
Ohba, Y. et al. GPAT митохондриального типа необходим для слияния митохондрий. EMBO J. 32 , 1265–1279 (2013).
CAS PubMed PubMed Central Google Scholar
Höglinger, D.и другие. Внутриклеточный сфингозин высвобождает кальций из лизосом. eLife 4 , e10616 (2015).
PubMed PubMed Central Google Scholar
Savoglidis, G. et al. Метод анализа и дизайна метаболизма с использованием данных метаболомики и кинетических моделей: применение в липидомике с использованием новой кинетической модели метаболизма сфинголипидов. Metab. Англ. 37 , 46–62 (2016).
CAS PubMed Google Scholar
Франк, Дж.A. et al. Фотопереключаемые диацилглицерины обеспечивают оптический контроль протеинкиназы C. Nat. Chem. Биол. 12 , 755–762 (2016).
CAS PubMed PubMed Central Google Scholar
Doll, S. et al. ACSL4 определяет чувствительность к ферроптозу, формируя липидный состав клеток. Nat. Chem. Биол. 13 , 91–98 (2016).
PubMed PubMed Central Google Scholar
Гульбинс, Э.и другие. Кислая сфингомиелиназа-церамидная система опосредует действие антидепрессантов. Nat. Med. 19 , 934–938 (2013). Авторы идентифицируют кислую сфингомиелиназу как мишень для антидепрессантов и используют различные подходы для модуляции уровней церамидов, чтобы показать их важность при большой депрессии, что является хорошим примером продукции липидов в качестве терапевтической мишени.
CAS PubMed Google Scholar
Дин Дж.и другие. Пероксисомальный фермент L-PBE необходим для предотвращения диетической токсичности жирных кислот со средней длиной цепи. Cell Rep. 5 , 248–258 (2013).
CAS PubMed Google Scholar
Андреоне, Б. Дж. И др. Проницаемость гематоэнцефалического барьера регулируется зависимым от транспорта липидов подавлением трансцитоза, опосредованного кавеолами. Нейрон 94 , 581–594 (2017).
CAS PubMed PubMed Central Google Scholar
Гийу, Х., Задравец, Д., Мартин, П. Г. и Якобссон, А. Ключевые роли элонгаз и десатураз в метаболизме жирных кислот у млекопитающих: данные трансгенных мышей. Prog. Lipid Res. 49 , 186–199 (2010).
CAS PubMed Google Scholar
7.3: Липиды — Биология LibreTexts
Цели обучения
- Охарактеризуйте химический состав липидов
- Опишите уникальные характеристики и разнообразные структуры липидов
- Сравните и сопоставьте триацилглицериды (триглицериды) и фосфолипиды.
- Опишите, как фосфолипиды используются для создания биологических мембран.
Хотя они состоят в основном из углерода и водорода, молекулы липидов могут также содержать кислород, азот, серу и фосфор. Липиды служат многочисленным и разнообразным целям в структуре и функциях организмов. Они могут быть источником питательных веществ, формой хранения углерода, молекул-накопителей энергии или структурными компонентами мембран и гормонов. Липиды включают широкий класс многих химически различных соединений, наиболее распространенные из которых обсуждаются в этом разделе.
Жирные кислоты и триацилглицериды
Жирные кислоты представляют собой липиды, которые содержат длинноцепочечные углеводороды, оканчивающиеся функциональной группой карбоновой кислоты. Из-за длинной углеводородной цепи жирные кислоты являются гидрофобными («водобоязненными») или неполярными. Жирные кислоты с углеводородными цепями, содержащими только одинарные связи, называются насыщенными жирными кислотами, потому что они имеют наибольшее возможное количество атомов водорода и, следовательно, «насыщены» водородом. Жирные кислоты с углеводородными цепями, содержащими по крайней мере одну двойную связь, называются ненасыщенными жирными кислотами, потому что они имеют меньше атомов водорода.Насыщенные жирные кислоты имеют прямой гибкий углеродный скелет, тогда как ненасыщенные жирные кислоты имеют «изгибы» в углеродном скелете, потому что каждая двойная связь вызывает жесткий изгиб углеродного скелета. Эти различия в структуре насыщенных и ненасыщенных жирных кислот приводят к различным свойствам соответствующих липидов, в которые включены жирные кислоты. Например, липиды, содержащие насыщенные жирные кислоты, являются твердыми веществами при комнатной температуре, тогда как липиды, содержащие ненасыщенные жирные кислоты, являются жидкостями.
Триацилглицерин или триглицерид образуется, когда три жирные кислоты химически связаны с молекулой глицерина (рисунок \ (\ PageIndex {1} \)). Триглицериды являются основными компонентами жировой ткани (телесного жира) и являются основными составляющими кожного сала (кожные масла). Они играют важную метаболическую роль, выступая в качестве эффективных молекул хранения энергии, которые могут обеспечить более чем вдвое калорийность углеводов и белков.
Рисунок \ (\ PageIndex {1} \): Триглицериды состоят из молекулы глицерина, присоединенной к трем жирным кислотам в результате реакции синтеза дегидратации.Упражнение \ (\ PageIndex {1} \)
Объясните, почему жирные кислоты с углеводородными цепями, содержащими только одинарные связи, называются насыщенными жирными кислотами.
Фосфолипиды и биологические мембраны
Триглицериды классифицируются как простые липиды, потому что они образованы всего из двух типов соединений: глицерина и жирных кислот. Напротив, сложные липиды содержат по меньшей мере один дополнительный компонент, например, фосфатную группу (фосфолипид s ) или углеводный фрагмент (гликолипид s ).На рисунке \ (\ PageIndex {2} \) изображен типичный фосфолипид, состоящий из двух жирных кислот, связанных с глицерином (диглицеридом). Две углеродные цепи жирных кислот могут быть как насыщенными, так и ненасыщенными, или по одной из каждой. Вместо другой молекулы жирной кислоты (как для триглицеридов) третье положение связывания на молекуле глицерина занято модифицированной фосфатной группой.
Рисунок \ (\ PageIndex {2} \): На этой иллюстрации показан фосфолипид с двумя разными жирными кислотами, одной насыщенной и одной ненасыщенной, связанными с молекулой глицерина.Ненасыщенная жирная кислота имеет небольшой изгиб в своей структуре из-за двойной связи.Молекулярная структура липидов приводит к уникальному поведению в водной среде. На рисунке \ (\ PageIndex {1} \) изображена структура триглицерида. Поскольку все три заместителя в основной цепи глицерина представляют собой длинные углеводородные цепи, эти соединения неполярны и не сильно притягиваются к полярным молекулам воды — они гидрофобны. И наоборот, фосфолипиды, такие как показанный на рисунке \ (\ PageIndex {2} \), имеют отрицательно заряженную фосфатную группу.Поскольку фосфат заряжен, он способен сильно притягиваться к молекулам воды и, следовательно, является гидрофильным или «водолюбивым». Гидрофильная часть фосфолипида часто упоминается как полярная «голова», а длинные углеводородные цепи — как неполярные «хвосты». Молекула, представляющая гидрофобную часть и гидрофильную часть, называется амфипатической. Обратите внимание на обозначение «R» внутри гидрофильной головки, изображенное на рисунке \ (\ PageIndex {2} \), что указывает на то, что полярная головная группа может быть более сложной, чем простой фосфатный фрагмент.Гликолипиды являются примерами, в которых углеводы связаны с головными группами липидов.
Амфипатическая природа фосфолипидов позволяет им образовывать уникальные функциональные структуры в водных средах. Как уже упоминалось, полярные головы этих молекул сильно притягиваются к молекулам воды, а неполярные хвосты — нет. Фактически, из-за своей значительной длины эти хвосты сильно притягиваются друг к другу. В результате образуются энергетически стабильные крупномасштабные сборки молекул фосфолипидов, в которых гидрофобные хвосты собираются в закрытых областях, защищенных от контакта с водой полярными головками (Рисунок \ (\ PageIndex {3} \)).Простейшими из этих структур являются мицеллы s , сферические сборки, содержащие гидрофобную внутреннюю часть фосфолипидных хвостов и внешнюю поверхность полярных головных групп. Более крупные и сложные структуры создаются из липидно-двухслойных листов или единичных мембран, которые представляют собой большие двумерные сборки фосфолипидов, собранных от хвоста к хвосту. Клеточные мембраны почти всех организмов состоят из двухслойных липидных слоев, как и мембраны многих внутриклеточных компонентов. Эти листы могут также образовывать липидно-бислойные сферы, которые являются структурной основой везикул и липосом, субклеточных компонентов, которые играют роль во многих физиологических функциях.
Рисунок \ (\ PageIndex {3} \): Фосфолипиды имеют тенденцию располагаться в водном растворе, образуя липосомы, мицеллы или липидные двухслойные слои. (Источник: модификация работы Марианы Руис Вильярреал)Упражнение \ (\ PageIndex {2} \)
Насколько важна амфипатическая природа фосфолипидов?
Изопреноиды и стерины
Изопреноиды представляют собой разветвленные липиды, также называемые терпеноидами, которые образуются в результате химических модификаций молекулы изопрена (Рисунок \ (\ PageIndex {4} \)).Эти липиды играют широкий спектр физиологических ролей у растений и животных, с множеством технологических применений, таких как фармацевтические препараты (капсаицин), пигменты (например, бета-каротин апельсина, ксантофиллы) и ароматизаторы (например, ментол, камфора, лимонен [аромат лимона], и пинен [аромат сосны]). Изопреноиды с длинной цепью также содержатся в гидрофобных маслах и восках. Воски, как правило, водостойкие и твердые при комнатной температуре, но они размягчаются при нагревании и разжижаются при соответствующем нагревании. У людей основное производство воска происходит в сальных железах волосяных фолликулов на коже, в результате чего выделяется материал, называемый кожным салом, который состоит в основном из триацилглицерина, сложных эфиров воска и углеводородного сквалена.В микробиоте кожи есть много бактерий, которые питаются этими липидами. Одной из самых известных бактерий, питающихся липидами, является Propionibacterium acnes , которая использует липиды кожи для образования короткоцепочечных жирных кислот и участвует в образовании прыщей.
Рисунок \ (\ PageIndex {4} \): молекулы пятиуглеродного изопрена химически модифицируются различными способами с образованием изопреноидов.Другой тип липидов — стероиды s , сложные кольцевые структуры, которые обнаруживаются в клеточных мембранах; некоторые действуют как гормоны.Наиболее распространенными типами стероидов являются стеролы и , которые представляют собой стероиды, содержащие группу ОН. В основном это гидрофобные молекулы, но также они имеют гидрофильные гидроксильные группы. Самый распространенный стерол, обнаруживаемый в тканях животных, — это холестерин. Его структура состоит из четырех колец с двойной связью в одном из колец и гидроксильной группы в определяющем стерол положении. Функция холестерина заключается в укреплении клеточных мембран у эукариот и бактерий без клеточных стенок, таких как Mycoplasma .Прокариоты обычно не производят холестерин, хотя бактерии производят аналогичные соединения, называемые гопаноидами, которые также представляют собой многокольцевые структуры, укрепляющие бактериальные мембраны (рисунок \ (\ PageIndex {5} \)). Грибы и некоторые простейшие производят аналогичное соединение, называемое эргостерином, которое укрепляет клеточные мембраны этих организмов.
Рисунок \ (\ PageIndex {5} \): Холестерин и гопен (соединение гопаноидов) — это молекулы, которые укрепляют структуру клеточных мембран у эукариот и прокариот соответственно.Липосомы
Это видео предоставляет дополнительную информацию о фосфолипидах и липосомах.
Упражнение \ (\ PageIndex {3} \)
Как изопреноиды используются в технике?
Клиническая направленность: часть 2
Увлажняющий крем, прописанный врачом Пенни, представлял собой крем с кортикостероидами для местного применения, содержащий гидрокортизон. Гидрокортизон — это синтетическая форма кортизола, кортикостероидного гормона, вырабатываемого надпочечниками из холестерина. При нанесении непосредственно на кожу он может уменьшить воспаление и временно облегчить незначительные кожные раздражения, зуд и сыпь за счет уменьшения секреции гистамина, соединения, вырабатываемого клетками иммунной системы в ответ на присутствие патогенов или других чужеродных веществ.Поскольку гистамин вызывает воспалительную реакцию организма, способность гидрокортизона снижать местное производство гистамина в коже эффективно подавляет иммунную систему и помогает ограничить воспаление и сопутствующие симптомы, такие как зуд (зуд) и сыпь.
Упражнение \ (\ PageIndex {4} \)
Кортикостероидный крем лечит причину сыпи Пенни или только симптомы?
Основные понятия и краткое содержание
- Липиды состоят в основном из углерода и водорода, но они также могут содержать кислород, азот, серу и фосфор.Они обеспечивают организм питательными веществами, накапливают углерод и энергию, играют структурную роль в мембранах и действуют как гормоны, фармацевтические препараты, ароматизаторы и пигменты.
- Жирные кислоты — это длинноцепочечные углеводороды с функциональной группой карбоновой кислоты. Их относительно длинные неполярные углеводородные цепи делают их гидрофобными . Жирные кислоты без двойных связей: насыщенных, ; с двойными связями ненасыщенных .
- Жирные кислоты химически связываются с глицерином с образованием структурно незаменимых липидов, таких как триглицеридов, и фосфолипидов. Триглицериды содержат три жирные кислоты, связанные с глицерином, с образованием гидрофобной молекулы. Фосфолипиды содержат как гидрофобные углеводородные цепи, так и полярные головные группы, что делает их амфипатическими и способными образовывать уникально функциональные крупномасштабные структуры.
- Биологические мембраны — это крупномасштабные структуры на основе фосфолипидных бислоев, которые обеспечивают гидрофильные внешние и внутренние поверхности, подходящие для водной среды, разделенные промежуточным гидрофобным слоем.Эти бислои являются структурной основой клеточных мембран у большинства организмов, а также субклеточных компонентов, таких как везикулы.
- Изопреноиды — это липиды, полученные из молекул изопрена, которые выполняют множество физиологических функций и имеют множество коммерческих применений.
- Воск представляет собой изопреноид с длинной цепью, который обычно водостойкий; Примером воскосодержащего вещества является кожный жир, вырабатываемый сальными железами кожи. Стероиды — это липиды со сложной кольцевой структурой, которые функционируют как структурные компоненты клеточных мембран и как гормоны. Стерины представляют собой подкласс стероидов, содержащих гидроксильную группу в определенном месте на одном из колец молекулы; один пример — холестерин.
- Бактерии продуцируют гопаноиды, структурно похожие на холестерин, для укрепления бактериальных мембран. Грибы и простейшие производят укрепляющий агент под названием эргостерин.
Множественный выбор
Что из перечисленного описывает липиды?
A. Источник питательных веществ для организмов
B.молекулы-накопители энергии
C. молекулы, играющие структурную роль в мембранах
D. молекулы, которые являются частью гормонов и пигментов
E. все вышеперечисленное
E
К каким из следующих молекул относятся как полярные, так и неполярные группы?
A. гидрофильный
B. амфипатический
C. гидрофобный
D. полифункциональный
В
Верно / Неверно
Липиды — это встречающаяся в природе группа веществ, которые не растворяются в воде, но свободно растворяются в органических растворителях.
Ложь
Жирные кислоты, не содержащие двойных связей, называются «ненасыщенными».
Ложь
Триглицерид образуется путем присоединения трех молекул глицерина к основной цепи жирной кислоты в реакции дегидратации.
Ложь
Заполните пропуск
Воски содержат сложные эфиры, образованные из длинноцепочечных __________ и насыщенных __________, а также могут содержать замещенные углеводороды.
спиртов; жирные кислоты
Холестерин — самый распространенный член группы __________, обнаруженный в тканях животных; он имеет тетрациклическую углеродную кольцевую систему со связью __________ в одном из колец и одной свободной __________ группой.
стероид; двойной; гидроксил
Критическое мышление
Микроорганизмы могут процветать во многих различных условиях, включая высокотемпературную среду, такую как горячие источники. Для правильного функционирования клеточные мембраны должны находиться в жидком состоянии. Как вы ожидаете, что содержание жирных кислот (насыщенных и ненасыщенных) в бактериях, живущих в высокотемпературной среде, может сравниваться с содержанием жирных кислот, живущих при более умеренных температурах?
Короткий ответ
Опишите структуру типичного фосфолипида.Эти молекулы полярны или неполярны?
Авторы и авторство
Нина Паркер (Университет Шенандоа), Марк Шнегурт (Университет штата Уичито), Ань-Хуэ Тхи Ту (Университет Юго-Западного штата Джорджия), Филип Листер (Общественный колледж Центрального Нью-Мексико) и Брайан М. Форстер (Университет Святого Иосифа) ) со многими авторами. Исходный контент через Openstax (CC BY 4.0; бесплатный доступ по адресу https://openstax.org/books/microbiology/pages/1-introduction)
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Состав липидов в мембранах растений
Skupień, J., Wójtowicz, J., Kowalewska,., Mazur, R., Garstka, M., Gieczewska, K., & Mostowska, A. (2017). Охлаждение в темноте вызывает существенные структурные изменения и модифицирует состав галактолипидов и каротиноидов во время биогенеза хлоропластов в семядолях огурца (Cucumis sativus L.). Физиология и биохимия растений , 111 , 107–118.
PubMed Google Scholar
Гарстка М., Венема Я. Х., Румак И., Gieczewska, K., Rosiak, M., Koziol-Lipinska, J., & Mostowska, A. (2007). Контрастное влияние охлаждения в темноте на структуру хлоропластов и расположение комплексов хлорофилл-белок в горохе и томате: растения с различной восприимчивостью к незамерзающим температурам. Planta , 226 (5), 1165–1181.
CAS PubMed Google Scholar
Велти, Р., Ли, В., Ли, М., Санг, Ю., Биесиада, Х., Чжоу, Х.Э. и Ван Х. (2002). Профилирование мембранных липидов в ответах растений на стресс: роль фосфолипазы Dα в изменениях липидов, вызванных замораживанием, у Arabidopsis. Журнал биологической химии , 277 (35), 31994–32002.
CAS PubMed Google Scholar
Ли, К., Ченг, X., Цзя, К., Сун, Х., Лю, X., Ван, К., и Чжан, М. (2017). Изучение видов растений с идентифицированными жирными кислотами масел семян в китайской литературе и анализ пяти неисследованных китайских эндемичных видов. Frontiers in Plant Science , 8 , 224.
PubMed PubMed Central Google Scholar
Ларсен Э., Харазми А., Кристенсен Л. П. и Кристенсен С. Б. (2003). Противовоспалительный галактолипид из шиповника (Rosa canina), ингибирующий хемотаксис нейтрофилов периферической крови человека in vitro. Journal of Natural Products , 66 (7), 994–995.
CAS PubMed Google Scholar
Ларсен, Э., и Кристенсен, Л. П. (2007). Обычные овощи и фрукты как источник 1,2-ди-о-a-линоленоил-3-о-b-d-галактопиранозил-sn-глицерина, потенциального противовоспалительного и противоопухолевого агента. Журнал пищевых липидов , 14 , 272–279.
CAS Google Scholar
Катени, Ф., Фальсоне, Дж., Зилич, Дж., Бонивенто, П., Закчинья, М., Жигон, Д. и Алтиниер, Г. (2004). Глицерогликолипиды Euphorbia nicaeensis All.с противовоспалительным действием. Винченцо Торторелла ARKIVOC , v , 54–65.
Курияма И., Мусуми К., Йонезава Ю., Такемура М., Маэда Н., Иидзима Х. и Мизушина Ю. (2005). Ингибирующее действие фракции гликолипидов из шпината на активность ДНК-полимеразы млекопитающих и пролиферацию раковых клеток человека. Журнал пищевой биохимии , 16 , 594–601.
CAS PubMed Google Scholar
Маэда, Н., Кокай, Ю., Отани, С., Сахара, Х., Кумамото-Ёнедзава, Ю., Курияма, И., и Мизушина, Ю. (2008). Противоопухолевый эффект перорально вводимой гликолипидной фракции шпината на имплантированные раковые клетки толстой кишки-26 у мышей. Липиды , 43 (8), 741–748.
CAS PubMed Google Scholar
Катени, Ф., Бонивенто, П., Прочида, Г., Заккинья, М., Фавретто, Л. Г., Шалино, Г., и Банфи, Э.(2008). Хемоэнзиматический синтез и оценка антимикробной активности моногалактозил диглицеридов. Европейский журнал медицинской химии , 43 (1), 210–221.
CAS PubMed Google Scholar
Мишра П. К., Сингх Н., Ахмад Г., Дубе А. и Маурья Р. (2005). Гликолипиды и другие компоненты Desmodium gangeticum с антилейшманиозным и иммуномодулирующим действием. Письма по биоорганической и медицинской химии , 15 (20), 4543–4546.
CAS PubMed Google Scholar
Уильямс, К. М., и Бердж, Г. (2006). Длинноцепочечные ПНЖК n-3: растительные против морских источников. Труды Общества питания , 65 (1), 42–50.
CAS PubMed Google Scholar
Конда, А. Р., Назаренус, Т. Дж., Нгуен, Х., Янг, Дж., Джелли, М., Свенсон, С., и Кахун, Э. Б.(2020). Метаболическая инженерия семян сои для повышения содержания токохроманола витамина Е и влияния на антиоксидантные свойства масла в зародышевой плазме, богатой полиненасыщенными жирными кислотами. Метаболическая инженерия , 57 , 63–73.
CAS PubMed Google Scholar
Leutou, A. S., Mccall, J. R., York, B., Govindapur, R. R., & Bourdelais, A. J. (2020). Гликолипиды и метиловый эфир полиненасыщенных жирных кислот, выделенные из морских Dinoflagellate Karenia mikimotoi. Морские препараты , 18 , 138.
CAS PubMed Central Google Scholar
Ohlrogge, J., & Browse, J. (1995). Биосинтез липидов. Растительная клетка , 7 , 957–970.
CAS PubMed PubMed Central Google Scholar
Ли-Бейссон Ю., Нойнциг Дж., Ли Ю. и Филиппар К. (2017). Растительный мембранный белок опосредован внутриклеточным движением жирных кислот и ациллипидов. Текущее мнение по биологии растений , 40 , 138–146.
CAS PubMed Google Scholar
Рейнольдс, К. Б., Тейлор, М. К., Каллерн, Д. П., Бланшар, К. Л., Вуд, К. К., Синг, С. П., и Петри, Дж. Р. (2017). Перенастроенный путь Кеннеди, который способствует эффективному накоплению жирных кислот со средней длиной цепи в масле листьев. Журнал биотехнологии растений , 15 , 1397–1408.
CAS PubMed PubMed Central Google Scholar
Верниг Ф., Болес Э. и Ореб М. (2020). Биосинтез de novo 8-гидроксиоктановой кислоты через среднецепочечную специфическую синтазу жирных кислот и цитохром P450 в Saccharomyces cerevisiae . Метаболические инженерные коммуникации , 10 , 1–8.
Google Scholar
Искандаров, У., Сильва, Дж. Э., Ким, Х. Дж., Андерссон, М., Кахун, Р. Э., Мокайтис, К., и Кахун, Э. Б. (2017).Специализированная диацилглицерин ацилтрансфераза способствует чрезвычайно высокому содержанию жирных кислот со средней длиной цепи в масле семян Cuphea. Физиология растений , 174 (1), 97–109.
CAS PubMed PubMed Central Google Scholar
Камп Ф. и Гамильтон Дж. А. (2006). Как жирные кислоты с разной длиной цепи входят в клетки и покидают их путем свободной диффузии. Простагландины, лейкотриены и незаменимые жирные кислоты , 75 , 149–159.
CAS Google Scholar
Гуо, З. Х., Йе, З. В., Хаслам, Р. П., Майклсон, Л. В., Напье, Дж. А., и Чье, М. Л. (2019). Цитозольные ацил-КоА-связывающие белки Arabidopsis играют роль в определении состава масла семян. Plant Direct , 3 (12), 1–9.
Google Scholar
Ван, Д. К. Х., Портинкаса, П., и Нойшвандер-Тетри, Б.А. (2013). Стеатоз печени. Комплексная физиология , 3 (4), 1493–1532.
PubMed Google Scholar
Кастро, Л. Ф. К., Точер, Д. Р., и Монройг, О. (2016). Биосинтез длинноцепочечных полиненасыщенных жирных кислот в хордовых: взгляд на эволюцию репертуара генов Fads и Elovl. Прогресс в исследованиях липидов , 62 , 25–40.
CAS PubMed Google Scholar
Бир-Роджерс, Дж., Диффенбахер, А., и Холм, Дж. В. (2001). Международный союз чистой и прикладной химии, объединенный комитет Международного союза наук о питании и комиссия ИЮПАК по пищевым продуктам * Лексикон липидного питания (Технический отчет ИЮПАК). Pure Appl. Chem , 73 (4), 685–744.
CAS Google Scholar
Руст, А. К., & Древон, К. А. (2005). Жирные кислоты: состав и свойства. Энциклопедия наук о жизни , John Wiley & Sons, 1–7.
Thelen, J. J., & Ohlrogge, J. J. (2002). Метаболическая инженерия биосинтеза жирных кислот у растений. Метаболическая инженерия , 4 (1), 12–21.
CAS PubMed Google Scholar
Ван Т. Ю., Лю М., Портинкаса П. и Ван Д. К. Х. (2013). Новое понимание молекулярного механизма всасывания жирных кислот в кишечнике. Европейский журнал клинических исследований , 43 (11), 1203–1223.
CAS PubMed PubMed Central Google Scholar
Колдер П. К. и Гримбл Р. Ф. (2002). Полиненасыщенные жирные кислоты, воспаление и иммунитет. Европейский журнал клинического питания , 56 (3), 14–19.
Google Scholar
Мелендес-Мартинес, А. Дж., Мапелли-Брам, П., Хорнеро-Мендес, Д., и Викарио, И. М. (2019). Глава 1: Структура, номенклатура и общая химия каротиноидов и их сложных эфиров. В Пищевая химия, функции и анализ (стр. 3–50).
Пэн, З., Жуань, Дж., Тиан, Х., Шань, Л., Мэн, Дж., Го, Ф., и Ли, X. (2020). Семейство генов десатуразы жирных кислот арахиса и функциональный анализ четырех членов ω-3 AhFAD3. Репортер молекулярной биологии растений , 38 , 209–221.
CAS Google Scholar
Кескин, К., и Качар, С. (2013). Жирнокислотный состав образцов корней и побегов некоторых таксонов Astragalus L. (Fabaceae), произрастающих на востоке и юго-востоке Турции. Турецкий биологический журнал , 37 , 122–128.
CAS Google Scholar
Семенова Г.А. (1994). Регулярность частиц на поверхностях изломов тилакоидов зависит от условий хранения 1. Канадский журнал ботов , 73 , 1676–1682.
Google Scholar
Джавидния К., Мири Р., Камалинеджад М., Саркарзаде Х. и Джамалиан А. (2004). Химический состав эфирных масел Anthemis altissima L., выращенных в Иране. Журнал ароматов и ароматов , 19 , 213–216.
CAS Google Scholar
Бретаньоль, Ф., Матейчек, А., Грегуар, С., Ребуд, X., и Габа, С. (2015). Определение содержания жирных кислот, общей антиоксидантной активности и энергетической ценности семян сорняков с сельскохозяйственных полей во Франции. Weed Research , 56 , 78–95.
Google Scholar
Мотавализадехкахки А., Шафагат А., Мехрзад Дж., Шафагатлонбар М., Азими Ф., Эбрахими З. и Сакери А. (2016). Химический состав гексанового экстракта различных частей Anthemis talyschensis и его потенциал для использования в солнцезащитных продуктах. Журнал химических рисков для здоровья , 6 (3), 195–202.
CAS Google Scholar
Гимарайнш, Р., Баррос, Л., Дуэньяс, М., Кальельха, Р. К., Карвалью, А. М., Сантос-Буэлга, К., и Феррейра, И. К. Ф. Р. (2013). Питательные вещества, фитохимические вещества и биологическая активность дикой римской ромашки: сравнение травы и ее препаратов. Пищевая химия , 136 , 718–725.
PubMed Google Scholar
Халил, М., Раила, Дж., Али, М., Ислам, К. М. С., Шенк, Р., Краузе, Дж. П., и Роуэл, Х. (2012). Стабильность и биодоступность добавок эфира лютеина из цветов бархатцев, приготовленных в условиях пищевой промышленности. Журнал функционального питания , 4 (3), 602–610.
CAS Google Scholar
Чжан, К., Хуа, Ю., Ли, X., Конг, X., и Чен, Ю. (2020). Основные летучие соединения с неприятным запахом в горохе (Pisum sativum L.) и их связи с эндогенными предшественниками и ферментами с использованием сои (Glycine max) в качестве эталона. Пищевая химия , 333 , 1–10.
Google Scholar
Павлович М., Ковачевич Н., Цаку О. и Куладис М. (2007). Компоненты циклогексанового экстракта Anthemis triumfetti. Химия природных соединений , 43 (5), 420–421.
Google Scholar
Озек, Г., Озбек, М. У., и Арслан, М. (2018). Липидные и эфирные масла, составляющие cota hamzaoglui Özbek & vural (Asteraceae). Журнал Турецкого химического общества, раздел A: Химия , 5 (3), 1361–1370.
Google Scholar
Липин, В., Шен, В., Казачков, М., Чен, Г., Чен, К., Карлссон, А.С., и Цзоу, Дж. (2012). Метаболические взаимодействия между земельным циклом и путем Кеннеди синтеза глицеролипидов в развивающихся семенах арабидопсисаw. Растительная клетка , 24 (11), 4652–4669.
Google Scholar
Вуйисич, Л., Вучкович, И., Тешевич, В., Докович, Д., Ристич, М. С., Яначкнович, П., и Милосавлевич, С. (2006). Сравнительный анализ эфирных масел Anthemis ruthenica и A. arvensis дикорастущих в Серебии. Журнал ароматов и ароматов , 21 , 458–461.
Google Scholar
Паулин, О., Лассина, О., Робишо, П.-П., Сюретт, М. Э., Уоба, П., Уаттара, Л., и Дуарон, Дж. А. (2018). Экстракция растительного масла из Cissus populnea Guill and Perr. семена и определение содержания в них жирных кислот ENRECA (Расширение и наращивание потенциала в Западной Африке) рассматривает проект по сохранению сельскохозяйственных культур и безопасности пищевых продуктов с использованием натуральных растительных продуктов в малых количествах. Международный журнал пищевой науки и питания , 3 (4), 80–83.
Google Scholar
Синкович, Л., Кокаль, Д., Видрих, Р., и Меглич, В. (2020). Жирнокислотный состав помольных фракций гречихи обыкновенной (Fagopyrum esculentum Moench) и винной (Fagopyrum tataricum (L.) Gaertn). Журнал исследований хранимых продуктов , 85 , 1–5.
Google Scholar
Kunst, L., Browse, J., & Somerville, C. (1989). Мутант арабидопсиса, лишенный насыщения пальмитиновой кислоты липидами листьев. Физиология растений , 90 (3), 943–947.
CAS PubMed PubMed Central Google Scholar
Макдональд Г. Э., Лада Р. Р., Колдуэлл К. Д., Уденигве К. и Макдональд М. Т. (2019). Возможная роль жирных кислот и липидов в физиологии опадания хвои после сбора урожая. Американский журнал наук о растениях , 10 (06), 1069–1089.
CAS Google Scholar
Накамура Ю. (2017). Разнообразие фосфолипидов растений: новые функции в метаболизме и белок-липидных взаимодействиях. Тенденции в растениеводстве , 22 (12), 1027–1040.
CAS PubMed Google Scholar
Mackender, R.O., & Leech, R.M. (1974). Галактолипид, фосфолипид и состав жирных кислот мембран оболочки хлоропластов Vicia faba. Л. Физиология растений , 53 (3), 496–502.
CAS PubMed PubMed Central Google Scholar
Микогуллари, Ю., Басу, С. С., Анг, Дж., Вайсхаар, Н., Шмитт, Н. Д., Абдельмула, В. М., и Ханна, Дж. (2019). Нарушение регуляции метаболизма очень длинноцепочечных жирных кислот вызывает насыщение мембран и индукцию развернутого белкового ответа. Текущее название: ЖКОДЦ и контроль качества белка. Молекулярная биология клетки , 31 (1), 1–17.
Google Scholar
Бен Хамед, К., Бен Юсеф, Н., Раньери, А., Заррук, М., и Абделли, К. (2005). Изменение содержания и профиля жирных кислот общих липидов и сульфолипидов у галофита Crithmum maritimum при солевом стрессе. Журнал физиологии растений , 162 , 599–602.
CAS PubMed Google Scholar
Härtel, H., Дёрманн, П., и Беннинг, К. (2000). DGD1-независимый биосинтез экстрапластидных галактолипидов после фосфатной депривации у Arabidopsis. Proc. Natl. Акад. Sci. , 97 (19), 10649–10654.
PubMed Google Scholar
Авай, К., Маре Чал, Э., Блок, М.А., Брун, Д., Масуда, Т., Шимада, Х., и Джоярд, Дж. (2001). Два типа генов MGDG-синтазы, широко встречающиеся в растениях 16: 3 и 18: 3, по-разному опосредуют синтез галактолипидов в фотосинтетических и нефотосинтетических тканях Arabidopsis thaliana. Proc. Natl. Акад. Sci. , 98 (19), 10960–10965.
CAS PubMed Google Scholar
Кобаяси К., Кондо М., Фукуда Х., Нисимура М. и Охта Х. (2007). Синтез галактолипидов во внутренней оболочке хлоропластов важен для правильного биогенеза тилакоидов, фотосинтеза и эмбриогенеза. Proc. Natl. Акад. Sci. , 104 (43), 17216–17221.
CAS PubMed Google Scholar
Пью К. Э., Рой А. Б., Хокест Т. и Харвуд Дж. Л. (1995). Новый путь синтеза растительного сульфолипида, сульфохиновозилдиацилглицерина. Biochem. J , 309 , 513–519.
CAS PubMed PubMed Central Google Scholar
Кирхгоф, Х., Хаазе, В., Вегнер, С., Даниэльссон, Р., Акерманн, Р., и Альбертссон, П. А. (2007). Формирование массивов полукристаллической фотосистемы II в хлоропластах высших растений при слабом освещении. Биохимия , 46 (39), 11169–11176.
CAS PubMed Google Scholar
Кирхгоф, Х. (2008). Молекулярная скученность и порядок в фотосинтетических мембранах. Тенденции в растениеводстве , 13 (5), 201–207.
CAS PubMed Google Scholar
Сюй, Ю. Н., Ван, З. Н., Цзян, Г. З., Ли, Л. Б., и Куанг, Т.Ю. (2003). Влияние различных температур на биосинтез фосфатидилглицерина в тилакоидных мембранах. Physiologia Plantarum , 118 (1), 57–63.
CAS PubMed Google Scholar
Кобаяши К., Эндо К. и Вада Х. (2017). Специфическое распределение фосфатидилглицерина в комплексах фотосистемы в тилакоидной мембране. Frontiers in Plant Science , 8 , 1–7.
Google Scholar
Блок, М. А., Дорн, А.-Дж., Джоярд, Дж., И Дус, Р. (1983). Получение и характеристика мембранных фракций, обогащенных внешней и внутренней оболочкой мембран из хлоропластов шпината 11. Биохимическая характеристика. Журнал биологической химии , 258 (21), 13281–13286.
CAS PubMed Google Scholar
Мамод Кассим, А., Гуге, П., Гронье, Ж., Лоран, Н., Жермен, В., Гризон, М., и Монгранд, С. (2019). Липиды растений: ключевые участники организации и функции плазматической мембраны. Прогресс в исследованиях липидов , 73 , 1-27.
CAS PubMed Google Scholar
Сато, М., Нагано, М., Дж. Ин, С., Мияги, А., Ямагути, М., Кавай-Ямада, М., и Исикава, Т. (2020). Уникальная для растений цис / транс-изомерия ненасыщенности длинноцепочечных оснований избирательно требуется для толерантности к алюминию, возникающей в результате зависимой от глюкозилцерамида текучести плазматической мембраны. Растения , 9 (19), 1–14.
Google Scholar
Майклсон, Л. В., Напье, Дж. А., Молино, Д., и Фор, Дж. Д. (2016). Сфинголипиды растений: их значение в клеточной организации и адаптации. Biochimica et Biophysica Acta — Молекулярная и клеточная биология липидов , 1861 , 1329–1335.
CAS Google Scholar
Карлссон, К. А. (1970). Основания с длинной цепью сфинголипидов. Липиды , 5 (11), 878–891.
CAS PubMed Google Scholar
Линч Д. В. и Данн Т. М. (2004). Введение в сфинголипиды растений и обзор последних достижений в понимании их метаболизма и функций. Новый фитолог , 161 , 677–702.
CAS Google Scholar
Маркхэм, Дж. Э., Ли, Дж., Кахун, Э. Б., и Яворски, Дж. Г. (2006). Отделение и идентификация основных классов сфинголипидов растений от листьев. Журнал биологической химии , 281 (32), 22684–22694.
CAS PubMed Google Scholar
Моро П., Бессул Дж. Дж., Монгранд С., Тестет Э., Винсент П. и Кассань К. (1998). Перенос липидов в растительных клетках. Progre , 37 (6), 371–391.
CAS Google Scholar
Warnecke, D., & Heinz, E. (2003). Недавно обнаружены функции глюкозилцерамидов в растениях и грибах. Клеточные и молекулярные науки о жизни , 60 , 919–941.
CAS PubMed Google Scholar
Айкиса Т., К. В. Т. Т. (1991). Физиология и биохимия стеринов . В G.У. Паттерсон и У. Д. Нес (ред.). Шампейн, Иллинойс: Американское нефтехимическое общество.
Пелилло М., Яфеличе Г., Маркони Э. и Кабони М. Ф. (2003). Идентификация растительных стеролов в гексаплоидной и тетраплоидной пшенице с использованием газовой хроматографии с масс-спектрометрией. Быстрая связь в масс-спектрометрии , 17, (20), 2245–2252.
CAS PubMed Google Scholar
Гараб, Г., Лонер, К., Лаггнер, П., и Фаркас, Т. (2000). Саморегуляция липидного состава мембран недвойными липидами: гипотеза. Тенденции в растениеводстве , 5 (11), 489–494.
CAS PubMed Google Scholar
Длоухи, О., Курасова, И., Карлики, В., Яворник, У., Шкет, П., Петрова, Н. З., и Гараб, Г. (2020). Модуляция недислойных липидных фаз, а также структура и функции тилакоидных мембран: влияние на водорастворимый фермент виолаксантин де-эпоксидаза. Научные отчеты , 10 , 11959.
PubMed PubMed Central Google Scholar
Chen, J., Burke, J. J., Xin, Z., Xu, C., & Velten, J. (2006). Характеристика термочувствительного мутанта atts02 Arabidopsis показывает важную роль галактолипидов в термотолерантности. Растения, клетки и окружающая среда , 29 (7), 1437–1448.
CAS PubMed Google Scholar
Монгранд, С., Станислас, Т., Байер, Э. М. Ф., Лерминье, Дж., И Саймон-Плас, Ф. (2010). Мембранные рафты в растительных клетках. Тенденции в растениеводстве , 15 (12), 656–663.
CAS PubMed Google Scholar
Ноак, Л. К., и Жайле, Ю. (2020). Ежегодный обзор функций анионных липидов растений в биологии растений. 71 , 71–102.
Ким, Х. У. (2020).Липидный обмен в растениях. Растения , 9 (871), 1–4.
Google Scholar
Эпанд Р. М. (1998). Полиморфизм липидов и белок-липидные взаимодействия. Biochimica et Biophysica Acta , 1376 , 353–368.
CAS PubMed Google Scholar
Хэнсон, М. Р., & Хайнс, К. М. (2018). Стромулы: образование и функция зонда. Физиология растений , 176 , 128–137.
CAS PubMed Google Scholar
Мортимер, К. Л., Мисава, Н., Перес-Фонс, Л., Робертсон, Ф. П., Харада, Х., Брамли, П. М., и Фрейзер, П. Д. (2017). Образование и секвестрация неэндогенных кетокаротиноидов у трансгенной Nicotiana glauca. Физиология растений , 173 , 1617–1635.
CAS PubMed PubMed Central Google Scholar
Маатта, С., Шеу, Б., Рот, М. Р., Тамура, П., Ли, М., Уильямс, Т. Д., и Велти, Р. (2012). Уровни фосфатидных кислот, фосфатидилсеринов и большинства триеноатсодержащих полярных липидных молекулярных форм листьев Arabidopsis thaliana повышаются в темный период суточного цикла. Frontiers in Plant Science , 3 (49), 1–12.
Google Scholar
Накамура Ю., Андрес Ф., Канехара К., Лю Ю.К., Дёрманн П. и Коупленд Г. (2014). Arabidopsis florigen FT связывается с дневно колеблющимися фосфолипидами, которые ускоряют цветение. Nature Communications , 5 , 1–7.
Google Scholar
Miquel, M., & Browse, J. (1992). Мутанты арабидопсиса, дефицитные по синтезу полиненасыщенных жирных кислот. Журнал биологической химии , 267 (3), 1502–1509.
CAS Google Scholar
Mou, Z., He, Y., Dai, Y., Liu, X., & Li, J. (2000). Дефицит синтазы жирных кислот приводит к преждевременной гибели клеток и резким изменениям морфологии растений. Растительная клетка , 12 , 405–417.
CAS PubMed PubMed Central Google Scholar
Тьельстрём, Х., Янг, З., Аллен, Д. К., и Ольрогге, Дж. Б. (2012). Быстрое кинетическое мечение суспензионных культур клеток Arabidopsis: значение для моделей экспорта липидов из пластид. Физиология растений , 158 , 601–611.
PubMed Google Scholar
Попов В. Н., Антипина О. В., Пчелкин В. П., Цыдендамбаев В. Д. (2017). Изменение жирнокислотного состава липидов хлоропластных мембран растений табака при закаливании. Российский журнал физиологии растений , 64 (2), 156–161.
CAS Google Scholar
Гу, Ю., Хэ, Л., Чжао, К., Ван, Ф., Янь, Б., Гао, Ю., и Сюй, Дж. (2017). Биохимическая и транскрипционная регуляция мембранного липидного обмена в листьях кукурузы при низкой температуре. Frontiers in Plant Science , 8 (2053), 1–13.
Google Scholar
Яник, Э., Беднарска, Дж., Зубик, М., Пузио, М., Лучовски, Р., Грудзинский, В., & Грушецкий, В. И. (2013). Молекулярная архитектура тилакоидов растений в условиях физиологического и светового стресса: исследование модельных мембран липид-светособирающего комплекса II. Растительная клетка , 25 (6), 2155–2170.
Sprague, S. G., & Staehelin, L.A. (1984). Влияние метода восстановления на структурную организацию изолированных липидов мембран хлоропластов. BBA — Биомембраны , 777 , 306–322.
CAS Google Scholar
Зайверт, Д., Витт, Х., Ритц, С., Яншофф, А., и Паульсен, Х. (2018). Недислойный липид MGDG и главный светособирающий комплекс (LHCII) способствуют укладке мембран в поддерживаемые липидные бислои. Биохимия , 57 , 2278–2288.
CAS PubMed Google Scholar
Duchêne, S., & Siegenthaler, P.-A. (2000). Проявляют ли глицеролипиды латеральную неоднородность тилакоидной мембраны? Липиды , 35 (7), 739–744.
PubMed Google Scholar
Латовски, Д., Крук, Дж., Бурда, К., Скшинецка-Яскир, М., Костецка-Гугала, А., и Стржалка, К. (2002). Кинетика деэпоксидирования виолаксантина под действием виолаксантин деэпоксидазы, фермента ксантофиллового цикла, регулируется текучестью мембран в модельных липидных бислоях. Европейский журнал биохимии , 269 (18), 4656–4665.
CAS PubMed Google Scholar
Szilágyi, A., Selstam, E., & Akerlund, H.E. (2008). Флуоресцентная спектроскопия лаурдана в тилакоидном бислое: влияние конверсии виолаксантина в зеаксантин на липидную среду с преобладанием галактолипидов. Biochimica et Biophysica Acta — Биомембраны , 1778 , 348–355.
Google Scholar
Barclay, K. D., & Mckersie, B. D. (1994). Реакции перекисного окисления в мембранах растений: действие свободных жирных кислот. Липиды , 29 (12), 877–882.
Госс, Р., & Латовски, Д. (2020). Липидная зависимость круговорота ксантофилла у высших растений и водорослей. Frontiers in Plant Science , 11 (455), 1-22.
Google Scholar
Кирхгоф, Х. (2018). Отношения структура-функция в фотосинтетических мембранах: проблемы и новые области. Наука о растениях , 266 , 76–82.
CAS PubMed Google Scholar
Кобаяши К. (2016). Роль мембранных глицеролипидов в фотосинтезе, биогенезе тилакоидов и развитии хлоропластов. Журнал исследований растений , 129 (4), 565–580.
CAS PubMed PubMed Central Google Scholar
Су К., Бремер Д. Дж., Жаннотт Р., Велти Р. и Янг К. (2009). Состав мембранных липидов и термостойкость дерновых трав в прохладное время года, включая гибридный мятлик. Журнал Американского общества садоводческих наук , 134 (5), 511–520.
Google Scholar
Семенова Г.А. (1995). Регулярность частиц на поверхностях изломов тилакоидов зависит от условий хранения. Канадский журнал ботаники , 73 (10), 1676–1682.
Google Scholar
Цветкова Н. М., Апостолова Е. Л., Брейн А. П. Р., Патрик Уильямс В. и Куинн П. Дж. (1995). Факторы, влияющие на формирование массива частиц ФС II в хлоропластах Arabidopsis thaliana и взаимосвязь таких массивов с термостабильностью ФС II. ББА . Биоэнергетика , 1228 , 201–210.
Google Scholar
Ю Б., Сюй К. и Беннинг К. (2002). Arabidopsis, у которого нарушен SQD2, кодирующий сульфолипидсинтазу, нарушается при ограниченном фосфатом росте. Proc. Natl. Акад. Sci. , 99 (8), 5732–5737.
CAS PubMed Google Scholar
Анишкин, А., Лукин, С. Х., Тенг, Дж., И Кунг, К. (2014). Ощущать скрытые механические силы в липидном бислое — это оригинальное чувство. Proc. Natl. Акад. Sci. , 111 (22), 7898–7905.
CAS PubMed Google Scholar
Се, Ю., Цзян, С., Ли, М., Го, Ю., Ченг, Ю., Цянь, Х., и Яо, В. (2019). Оценка образования свободных радикалов липидов в процессе окисления арахисового масла. LWT , 104 , 24–29.
CAS Google Scholar
Gruszecki, W. I., & Krupa, Z. (1993). LHCII, основной светособирающий пигмент-белковый комплекс, представляет собой зеаксантинэпоксидазу. BBA — Биоэнергетика , 1144 , 97–101.
CAS Google Scholar
Куни, Л. Дж., Логан, Б. А., Уолш, М. Дж. Л., Ннатубейго, Н. Б., Реблин, Дж. С., и Гулд, К. С.(2018). Фотозащита от антоцианов и рассеивание тепловой энергии в стареющих красных и зеленых цветоносах Sambucus canadensis. Экологическая и экспериментальная ботаника , 148 , 27–34.
CAS Google Scholar
Се, Х., Гу, В., Гао, С., Лу, С., Ли, Дж., Пан, Г., и Шен, С. (2013). Альтернативные переносчики электронов участвуют в поддержании активности виолаксантиндеэпоксидазы Ulva sp.при низкой освещенности. PLoS ONE , 8 (11), 78211.
Google Scholar
Ли, Х.-П., Бджо, О., Ркман, Э., Ши, К., Гроссман, А.Р., Розенквист, М., и Нийоги, К.К. (2000). Связывающий пигмент белок, необходимый для регуляции фотосинтетического сбора света. Nature , 403 , 391–395.
CAS PubMed Google Scholar
Ольчава-Паджор, М., Бойко, М., Стшалка, В., Стшалка, К., и Латовски, Д. (2019). Конверсия виолаксантина рекомбинантными деэпоксидазами диатомовых и растений, выраженная в Escherichia coli — сравнительный анализ. Acta Biochimica Polonica , 66 (3), 249–255.
CAS PubMed Google Scholar
Госс, Р., Латовски, Д., Гжиб, Дж., Вилер, А., Лор, М., Вильгельм, К., & Стржалка, К. (2007).Липидная зависимость солюбилизации и деэпоксидирования диадиноксантина в искусственных мембранных системах, напоминающих липидный состав естественной тилакоидной мембраны. Biochimica et Biophysica Acta — Биомембраны , 1768 (1), 67–75.
CAS Google Scholar
Ли-Бейссон Ю., Шоррош Б., Бейссон Ф., Андерссон М. Х., Арондел В., Бейтс П. Д. и Олрогге Дж. (2013). Ацил-липидный метаболизм. Книга Arabidopsis , 11 , 1–70.
Google Scholar
Ли, К., Чжэн, К., Шен, В., Крам, Д., Брайан Фаулер, Д., Вэй, Ю., и Цзоу, Дж. (2015). Понимание биохимических основ изменения липидного пути у растений, вызванного температурой. Растительная клетка , 27 , 8–103.
CAS Google Scholar
Negi, J., Мунемаса, С., Сонг, Б., Тадакума, Р., Фудзита, М., Азулай-Шемер, Т., и Иба, К. (2018). Путь метаболизма липидов эукариот важен для функциональных хлоропластов, CO 2 и световых ответов в замыкающих клетках Arabidopsis. Proc. Natl. Акад. Sci. , 115 (36), 9038–9043.
CAS PubMed Google Scholar
Карки Н., Джонсон Б. С. и Бейтс П. Д. (2019). Метаболически различные пулы фосфатидилхолина участвуют в транспортировке жирных кислот из и в хлоропласт для производства мембран. Растительная клетка , 31 , 2768–2788.
CAS PubMed PubMed Central Google Scholar
Ван, Л., Казачков, М., Шен, В., Бай, М., Ву, Х., и Цзоу, Дж. (2014). Расшифровка роли LPCAT и PAH Arabidopsis в гомеостазе фосфатидилхолина и координации путей синтеза липидов хлоропластов. Заводской журнал , 80 (6), 965–976.
CAS PubMed Google Scholar
Miquel, M. & Browse, J. (1992). Мутанты Arabidopsis, дефицитные в синтезе полиненасыщенных жирных кислот: биохимическая и генетическая характеристика растительной олеоил-фосфатидилхолин-десатуразы. Журнал биологической химии , 267 (3), 1502–1509.
CAS PubMed Google Scholar
Hölzl, G., & Dörmann, P. (2019). Липиды хлоропластов и их биосинтез. Ежегодный обзор биологии растений , 70 , 51–81.
PubMed Google Scholar
Джарвис П., Дерманн П., Пето К. А., Лютес Дж., Беннинг К. и Чори Дж. (2000). Дефицит галактолипидов и аномальное развитие хлоропластов у мутанта MGD-синтазы 1 Arabidopsis. Proc. Natl. Акад. Sci. , 97 (14), 8175–8179.
CAS PubMed Google Scholar
Troncoso-Ponce, M.А., Цао, X., Ян, З., и Олрогге, Дж. Б. (2013). Обмен липидов во время старения. Plant Science , 205–206 , 13–19.
PubMed Google Scholar
Чепмен, К. Д., и Олрогге, Дж. Б. (2012). Компартментация накопления триацилглицерина в растениях. Журнал биологической химии , 287 , 2288–2294.
CAS PubMed Google Scholar
Фан, Дж., Чжай, З., Янь, К., и Сюй, К. (2015). Arabidopsis trigalactosyldiacylglycerol5 взаимодействует с TGD1, TGD2 и TGD4, облегчая перенос липидов из эндоплазматического ретикулума в пластиды. Растительная клетка , 27 , 2941–2955.
CAS PubMed PubMed Central Google Scholar
Накамура, Ю., Коидзуми, Р., Шуй, Г., Симодзима, М., Венк, М. Р., Ито, Т., & Охтад, Х. (2009). Липины арабидопсиса опосредуют эукариотический путь липидного обмена и критически справляются с фосфатным голоданием. Proc. Natl. Акад. Sci. , 106 (49), 20978–20983.
CAS PubMed Google Scholar
Келли, А., Калиш, Б., Хёльцль, Г., Шульце, С., Тиле, Дж., Мельцер, М., & Дёрманн, П. (2016). Синтез и перенос галактолипидов в мембранах оболочки хлоропластов Arabidopsis thaliana. Proc. Natl. Акад. Sci. , 113 (38), 10714–10719.
CAS PubMed Google Scholar
Госс, Р., Вильгельм, К., и Дьёзё, Г. (2000). Организация молекул пигмента в хлорофилле a / b / c, содержащей водоросль Mantoniella squamata (Prasinophyceae), изучена методами абсорбционной, круговой и линейной спектроскопии дихроизма. Biochimica et Biophysica Acta , 1457 , 190–199.
CAS PubMed Google Scholar
Уильямс, Дж. П., Империал, В., Хан, М. У., и Ходсон, Дж. Н.(2000). Роль фосфатидилхолина в обмене жирных кислот и десатурации в листьях Brassica napus L. Биохимический журнал , 349 (1), 127–133.
CAS PubMed PubMed Central Google Scholar
Джессен Д., Рот К., Вирмер М. и Фульда М. (2015). Две активности длинноцепочечной ацил-кофермент синтетазы участвуют в перемещении липидов между эндоплазматическим ретикулумом и пластидой у арабидопсиса. Физиология растений , 167 , 351–366.
CAS PubMed Google Scholar
Шнурр, Дж. А., Шокей, Дж. М., Де Боер, Г. Дж., И Брауз, Дж. А. (2002). Экспорт жирных кислот из хлоропласта. Молекулярная характеристика основной пластидальной ацил-кофермента А синтетазы из Arabidopsis. Физиология растений , 129 , 1700–1709.
CAS PubMed PubMed Central Google Scholar
Симодзима, М., Охта, Х., Ивамацу, А., Масуда, Т., Сиои, Ю., и Такамия, К. И. (1997). Клонирование гена моногалактозилдиацилглицеринсинтазы и его эволюционное происхождение. Proc. Natl. Акад. Sci. , 94 , 333–337.
CAS PubMed Google Scholar
Mazur, R., Mostowska, A., Szach, J., Gieczewska, K., Wójtowicz, J., Bednarska, K., & Kowalewska,. (2019). Дефицит галактолипидов нарушает пространственное расположение тилакоидной сети у растений Arabidopsis thaliana. Журнал экспериментальной ботаники , 70 (18), 4689–4703.
CAS PubMed Google Scholar
Kunst, L., Browse, J., & Somerville, C. (1989). Повышенная термостойкость у мутанта Arabidopsis, лишенного ненасыщенности пальмитиновой кислоты. Plant Physiol , 91 , 401–408.
CAS PubMed PubMed Central Google Scholar
Ким Х. У. и Хуанг А. Х. С. (2004). Пластидная лизофосфатидилацилтрансфераза необходима для развития эмбриона Arabidopsis. Физиология растений , 134 , 1206–1216.
CAS PubMed PubMed Central Google Scholar
Ю. Б., Вакао С., Фан Дж. И Беннинг К. (2004). Потеря пластидной ацилтрансферазы лизофосфатидовой кислоты вызывает гибель эмбрионов у Arabidopsis. Физиология растений и клетки , 45 (5), 503–510.
CAS PubMed Google Scholar
Bacher, A., Eberhardt, S., Fischer, M., Kis, K., & Richter, G. (2000). Биосинтез витамина В2 (рибофлавин). Annual Review of Nutrition , 20 , 153–167.
CAS PubMed Google Scholar
Окадзаки, Ю., Симодзима, М., Савада, Ю., Тоёка, К., Нарисава, Т., Мочида, К., & Сайто, К. (2009). Хлоропластная UDP-глюкозопирофосфорилаза из Arabidopsis является коммитированным ферментом для первой стадии биосинтеза сульфолипидов. Растительная клетка , 21 , 892–909.
CAS PubMed PubMed Central Google Scholar
Эссигманн Б., Гюлер С., Наранг Р. А., Линке Д. и Беннинг К. (1998). Доступность фосфатов влияет на липидный состав тилакоидов и экспрессию SQD1, гена, необходимого для биосинтеза сульфолипидов у Arabidopsis thaliana. Биология растений , 95 , 1950–1955.
CAS Google Scholar
Ноблет А., Леймари Дж. И Байи К. (2017). Низкая температура ремоделирует фосфолипидом семян Zea mays во время набухания. Scientific Reports , 7 (1), 1–12.
CAS Google Scholar
Кодама, Х., Хоригути, К., Нисиучи, Т., Нисимура, М., и Иба, К. (1995). Десатурация жирных кислот во время акклиматизации к холоду — один из факторов, влияющих на устойчивость молодых листьев табака к низким температурам. Plant Physiol , 107 , 1177–1185.
CAS PubMed PubMed Central Google Scholar
Okuley, J., Lightner, J., Feldmann, K., Yadav, N., Lark, E., & Browse, J. (1994). Ген арабидопсиса FAD2 кодирует фермент, необходимый для синтеза полиненасыщенных липидов. Растительная клетка , 6 (1), 147–158.
CAS PubMed PubMed Central Google Scholar
Мюллер, С. П., Унгер, М., Гюндер, Л., Фекете, А., и Мюллер, М. Дж. (2017). Фосфолипид: опосредованный диацилглицерин ацилтрансферазой синтез триацилглиерола увеличивает базальную термотолерантность. Физиология растений , 175 (1), 486–497.
CAS PubMed PubMed Central Google Scholar
Дуарте, Б., Матос, А. Р., Маркес, Дж. К., и Касадор, И. (2018). Ремоделирование жирных кислот в листьях солеотводящей галофитной травы Spartina patens по градиенту солености. Физиология и биохимия растений , 124 , 112–116.
CAS PubMed Google Scholar
Хатциг, С. В., Нуппенау, Дж. Н., Сноудон, Р. Дж., И Шиссл, С. В. (2018). Стресс засухи оказывает трансгенеративное воздействие на семена и рассаду озимого рапса ( Brassica napus L.). BMC Plant Biology , 18 , 297
CAS PubMed PubMed Central Google Scholar
Фальконе, Д. Л., Огас, Дж. П., и Сомервилль, К. Р. (2004). Регулирование состава мембранных жирных кислот по температуре у мутантов Arabidopsis с изменениями липидного состава мембран. BMC Plant Biology , 4 , 1–45.
Google Scholar
Макдональд, Г. Э., Лада, Р. Р., Колдуэлл, К. Д., Уденигве, К., и Макдональд, М. (2020). Изменения липидов и жирных кислот, связанные с опадением хвои после сбора урожая у пихтового бальзама, Abies balsamea. Деревья — структура и функции , 34 , 297–305.
CAS Google Scholar
Кобаяси, К., Осава, Ю., Йошихара, А., Симодзима, М., и Аваи, К. (2020). Взаимосвязь между глицеролипидами и фотосинтетическими компонентами при восстановлении тилакоидных мембран от ослабления, вызванного азотным голоданием, у Synechocystis sp.PCC 6803. Frontiers in Plant Science , 11 (432), 1–13.
Google Scholar
Пата, М. О., Ханнун, Ю. А., и Нг, К. К. Ю. (2009). Сфинголипиды растений: расшифровка загадки Сфинкса. Новый фитолог , 185 , 611–630.
PubMed Google Scholar
Бакоглу А., Коктен К. и Килич О. (2017).Состав жирных кислот семян некоторых таксонов Fabaceae из Турции, хемотаксономический подход. Прогресс в питании , 19 (1), 86–91.
Google Scholar
Ayaz Faik, A., Huseyin, I., Sema, H.-A., & Nursen, A.-K. (2016). Состав ахеновых жирных кислот в племени Anthemideae (Asteraceae). Румынские биотехнологические письма , 21 , 11576–11584.
Google Scholar
Марсиньяк, М. С., Куэнка, А. П. (2019). Влияние жирных кислот облепихового масла на здоровье человека. Липиды в здоровье и болезнях , 18 (1), 1–11.
Google Scholar
Бансал, С., Ким, Х. Дж., На, Г. Н., Гамильтон, М. Э., Кахун, Э. Б., Лу, К., и Дарретт, Т. П. (2018). На пути к синтетическому дизайну масла камелины, обогащенного специально подобранными ацетил-триацилглицеринами со среднецепочечными жирными кислотами. Журнал экспериментальной ботаники , 69 (18), 4395–4402.
CAS PubMed PubMed Central Google Scholar
Хинча, Д. К. (2008). Влияние альфа-токоферола (витамина Е) на стабильность и динамику липидов модельных мембран, имитирующих липидный состав мембран хлоропластов растений. FEBS Letters , 582 (25–26), 3687–3692.
CAS PubMed Google Scholar
Гауд, Н., Брехелин, К., Тишендорф, Г., Кесслер, Ф., и Дёрманн, П. (2007). Дефицит азота у Arabidopsis влияет на состав галактолипидов и экспрессию генов и приводит к накоплению фитиловых эфиров жирных кислот. Заводской журнал , 49 (4), 729–739.
CAS PubMed Google Scholar
Джуэ, Дж., Марешал, Э., Балдан, Б., Блиньи, Р., Джояр, Дж., И Блок, М. А. (2004). Депривация фосфата вызывает перенос галактолипида DGDG из хлоропласта в митохондрии. Журнал клеточной биологии , 167 (5), 863–874.
CAS PubMed Google Scholar
Мишо, М., Гро, В., Тардиф, М., Брюгьер, С., Ферро, М., Принц, В. А., и Жуэ, Дж. (2016). AtMic60 участвует в транспортировке липидов митохондрий растений и является частью большого комплекса. Current Biology , 26 (5), 627–639.
CAS PubMed Google Scholar
Degenkolbe, T., Giavalisco, P., Zuther, E., Seiwert, B., Hincha, D. K., & Willmitzer, L. (2012). Дифференциальное ремоделирование липидома при акклиматизации к холоду у природных образцов Arabidopsis thaliana. Заводской журнал , 72 , 972–982.
CAS PubMed Google Scholar
Неджадсадеги, Л., Маали-Амири, Р., Зейнали, Х., Рамезанпур, С., & Садегзаде, Б. (2015). Составы мембранных жирных кислот и холодовые реакции у тетраплоидной и гексаплоидной пшеницы. Отчеты о молекулярной биологии , 42 (2), 363–372.
CAS PubMed Google Scholar
Дуарте, Б., Кабрита, М. Т., Гамейро, К., Матос, А. Р., Годиньо, Р., Маркес, Дж. К., и Касадор, И. (2017). Распутывание толерантности к фотохимической солености у Aster tripolium L: соединение биофизических характеристик с изменениями в составе жирных кислот. Биология растений , 19 , 239–248.
CAS PubMed Google Scholar
Чжан, Дж., Кенуорти, К., Унру, Дж. Б., Эриксон, Дж., И Макдональд, Г. (2017). Изменение жирнокислотного состава листовой мембраны и степени насыщенности дерновой травы теплого сезона при стрессе засухи. Crop Science , 57 (5), 2843–2851.
CAS Google Scholar
Глава 4. Липиды и жирные кислоты
Глава 4. Липиды и жирные кислоты1.ВВЕДЕНИЕ
2. СОСТАВ ЖИРНЫХ КИСЛОТ РЫБЫ
3. ЛИПИДНЫЙ СОСТАВ ТЕЛА И ТРЕБОВАНИЯ К ПИЩЕВЫМ ЛИПИДАМ
4. ПОЛИНЕНАСЫЩЕННЫЕ ТРЕБОВАНИЯ РЫБЫ В ЖИРНЫХ КИСЛОТАХ
5. ВАЖНЕЙШИЕ ПОТРЕБНОСТИ РЫБЫ В ЖИРНЫХ КИСЛОТАХ
6. МЕТАБОЛИЗМ ЖИРНЫХ КИСЛОТ В РЫБЕ
7. ОТРИЦАТЕЛЬНЫЙ АСПЕКТЫ ЛИПИДОВ В ПИТАНИИ РЫБ
8. ССЫЛКИ
Дж. Э. Халвер
Вашингтонский университет
Сиэтл, Вашингтон
Липиды — это общие названия, присвоенные группе жирорастворимых соединений, обнаруживаемых в тканях растений и животных: и широко классифицируются как: а) жиры, б) фосфолипиды, в) сфингомиелины, г) воски и д) стерины. .
Жиры представляют собой сложные эфиры жирных кислот глицерина и являются основными запасами энергии животных. Они используются для долгосрочной потребности в энергии в периоды интенсивных физических упражнений или в периоды недостаточного питания и потребления энергии. Рыбы обладают уникальной способностью легко метаболизировать эти соединения и, как следствие, могут существовать в течение длительных периодов времени в условиях отсутствия пищи. Типичный пример — это многонедельная миграция лососей, возвращающихся вверх по течению на нерест; накопленные липидные отложения сжигаются в качестве топлива, позволяя процессам организма продолжаться во время напряженного путешествия.
Фосфолипиды представляют собой сложные эфиры жирных кислот и фосфатидной кислоты. Это основные липиды, составляющие клеточные мембраны, позволяющие поверхностям мембран быть гидрофобными или гидрофильными в зависимости от ориентации липидных соединений во внутри- или внеклеточном пространстве.
Сфингомиелины представляют собой сложные эфиры жирных кислот сфингозина и присутствуют в соединениях головного мозга и нервной ткани.
Воски представляют собой сложные эфиры жирных кислот и длинноцепочечных спиртов.Эти соединения могут метаболизироваться для получения энергии и придания физических и химических характеристик за счет накопленных липидов некоторых растений и некоторых соединений животного происхождения.
Стерины представляют собой полициклические длинноцепочечные спирты и действуют как компоненты нескольких гормональных систем, особенно при половом созревании и физиологических функциях, связанных с полом.
Жирные кислоты могут существовать в виде компонентов с прямой или разветвленной цепью; многие рыбные жиры содержат многочисленные ненасыщенные двойные связи в структурах жирных кислот.Краткое обозначение облигации. жирные кислоты будут использоваться повсюду, где число w определяет положение первой двойной связи, считая от метильного конца. Линоленовая кислота будет написана 18: 3w 3. Первое число определяет количество атомов углерода; второе число — количество двойных связей; и последнее число, положение двойных связей.
Было опубликовано много обзоров по кормлению рыб, в которых содержится информация о потребностях в липидах. Большая часть исследований по потребностям рыб в липидах была проведена с лососевыми.Радужная форель имеет потребность в незаменимых жирных кислотах (EFA) для линоленовой кислоты серии w 3 1 , а не для линоленовой кислоты или w 6, как того требует большинство млекопитающих. Основной упор на потребности в липидах был сделан на EFA и энергетической ценности липидов.
2.1 Влияние окружающей среды
2.2 Влияние диеты
2.3 Сезонные колебания
2.1 Влияние окружающей среды
2.1.1 Соленость
На различие жирнокислотного состава морских и пресноводных рыб отмечали несколько авторов.Некоторые примеры структуры жирных кислот приведены в таблице 1. Хотя эти рыбные липиды содержат больше жирных кислот w 3, ясно, что пресноводная рыба имеет более высокие уровни жирных кислот w 6, чем морские виды. Среднее соотношение w 6 / w 3 составляет 0,37 и 0,16 для пресноводных и морских рыб соответственно. Рыба в целом содержит больше w 3, чем w 6 полиненасыщенных жирных кислот (ПНЖК) и должна иметь более высокие диетические потребности в w 3 ПНЖК; таким образом, диетическая потребность морской рыбы в w 3 ПНЖК в ОЖК может быть выше, чем у пресноводных рыб.
Таблица 1 — Сравнение содержания жирных кислот общего липида из цельной рыбы или мяса пресноводных и морских видов 1/
Такое же различие в соотношении w 6 / w 3 между пресной и морской водой наблюдается, когда некоторые виды рыб мигрируют из океанов в ручьи или наоборот. Соотношение ПНЖК сладкой корюшки ( Plecoglosus altivelis ) резко меняется всего за один месяц по мере их миграции из моря в пресноводные реки.Аналогичное, но обратное изменение происходит у лосося масу ( Oncorhynchus masu ), когда они мигрируют из пресной воды в морскую. Даже в пределах одного и того же вида рыб соленость воды, кажется, вызывает резкое изменение в структуре жирных кислот.
Разница между морской и пресноводной рыбой может быть связана просто с различиями в содержании жирных кислот в рационе или может быть связана с особыми потребностями рыб, связанными с физиологической адаптацией к окружающей среде.Фосфолипиды обычно считаются структурными или функциональными липидами, которые в значительной степени включены в мембранную структуру клеточных и субклеточных частиц. Триглицериды чаще представляют собой запасные липиды и в большей степени отражают жирнокислотный состав рациона, чем фосфолипиды. В таблице 2 представлены составы жирных кислот триглицеридной и фосфолипидной фракций липидов рыб. Можно видеть, что влияние изменения окружающей среды на состав жирных кислот фосфолипида так же велико в случае лосося и значительно больше в случае сладкой корюшки, чем на состав триглицеридов.Радужная форель на рационах, содержащих кукурузное масло с высоким содержанием w 6 и низким содержанием w 6 ПНЖК, показала более высокую смертность и снижение роста в морской воде, чем в пресной воде, в течение двенадцатинедельного периода кормления.
2.1.2 Температура
Есть несколько других факторов, помимо солености воды, которые влияют на состав жирных кислот и особенно ПНЖК рыбы. В таблицах 1 и 2 можно видеть, что лососевые, даже в пресной воде, имеют тенденцию иметь более высокое общее содержание ПНЖК с длиной углеродной цепи 20 и 22 и более низкое отношение w 6 / w 3, чем у других рыб.Лососевые в основном относятся к холодноводным рыбам. Жирные кислоты ряда морских животных из умеренных и арктических вод демонстрируют некоторые существенные различия в общей структуре; к сожалению, анализ включал жирные кислоты более 20: 1. Есть ряд других экспериментов, демонстрирующих влияние температуры окружающей среды на жирнокислотный состав водных животных. Общая тенденция к увеличению содержания длинноцепочечных ПНЖК при более низких температурах очевидна. Отношение w 6 / w 3 уменьшается с понижением температуры (таблица 3).Если тенденции в составе жирных кислот можно рассматривать как ключ к пониманию потребностей рыбы в ОДВ, то требование w 3 будет больше для рыбы, выращиваемой при более низких температурах. Рыбы, выращенные в более теплых водах, такие как карп, канальный сом и тилапия, могут лучше справиться со смесью жирных кислот w 6 и w 3.
2.2 Влияние диеты
На некоторые из композиций жирных кислот, перечисленных в таблице 3, могут серьезно повлиять пищевые липиды. Комаров и гуппи кормили гранулами форели, которые имели соотношение вес 6 / вес 3, равное 2.75. Сома кормили рационом с добавлением либо говяжьего жира, либо масла менхадена с соотношением w 6 / w 3 18,13 и 0,15 соответственно. Эти рыбы были способны изменять диетическое соотношение w 6 / w 3 в пользу включения жирных кислот w 3 в липиды мяса даже при самой высокой температуре. Коммерчески доступные гранулы форели часто содержат мало w 3 ПНЖК и много w 6 жирных кислот. Важно не игнорировать влияние липидного состава рациона на состав жирных кислот рыб, получающих искусственные корма.Из данных в таблице 3 ясно, что соотношение вес 6 / вес 3 липидов рыбы в значительной степени зависит от соотношения вес 6 / вес 3 пищевых липидов. Когда в рационе очень высокое содержание жирных кислот w 6, содержащихся в животном сале или растительных маслах, рыба имеет тенденцию изменять соотношение включенных ПНЖК в пользу жирных кислот w 3. Когда диетическое масло представляет собой рыбий жир с высоким содержанием жирных кислот до 3, соотношение липидов, содержащихся в рыбе, мало изменяется. Это еще одно свидетельство потребности рыбы в w 3 ПНЖК в ОЖК.
Таблица 2 Изменения жирнокислотного состава липидов рыб по мере их миграции из морской воды в свежую и наоборот 1/
Таблица 3 Влияние температуры окружающей среды на жир Кислотный состав липидов рыб 1/
2.3 Сезонные колебания
Часто сообщается о сезонных колебаниях в составе жирных кислот у видов рыб.Наблюдаются сезонные изменения общего липидного и йодного числа масел сельди. Йодное число или степень ненасыщенности масла была минимальной в апреле и максимальной в июне. Сильное увеличение ненасыщенности соответствовало началу кормления весной. Отсутствие газожидкостного хроматографа (ГЖХ) в то время не позволяло идентифицировать изменения в отдельных жирных кислотах.
Содержание липидов в плоти и внутренних органах сардины Sardinops melanosticta варьируется от 3.С 9 до 10,77 процента и с 10,9 до 38,3 процента соответственно. Жирные кислоты, представляющие основной интерес с точки зрения метаболизма EFA, — это 20: 4w 6, 20: 5w 3 и 22: 6w 3. Наблюдались значительные различия во всех этих жирных кислотах как в нейтральных, так и в полярных липидах обеих тканей. В мясе соотношение 20: 4 w 6 было постоянно выше в нейтральном липиде, чем в полярном липиде. Общее соотношение 20: 5w 3 плюс 22: 6w 3 было постоянно выше в полярном липиде, чем в нейтральном липиде. Таким образом, несмотря на значительные колебания содержания жирных кислот, вызванные изменениями в диете и температуре в течение сезона, наблюдалось последовательное предпочтительное включение ПНЖК серии w 3 в полярную или фосфолипидную фракцию липидов.
Один из лучших ключей к пониманию потребностей вида в ОДВ может быть получен из состава жирных кислот липидов, включенных в потомство или яйцо. Акт воспроизводства или нереста также оказывает значительное влияние на сезонные колебания липидов у рыб. Состав жирных кислот липидов икры рыб, вероятно, различен для каждого вида и содержит повышенные уровни 16: 0, 20: 4 w 6, 20: 5 w 3 и 22: 6 w 3 по сравнению с липидами печени той же самки рыб (Ackman , 1967).
Повышенные уровни 16: 0, 20: 5w 3 и 22: 6 w 3 и пониженные 18: 1 в яичнике наблюдались по сравнению с мезентериальным жиром тихоокеанской сардины, получавшей естественную диету копепод. Жирные кислоты в крови сардин, получавших естественный рацион, были аналогичны жирным кислотам яичников. Когда сардины скармливали форелевым кормом, и кровь, и мезентериальный жир реагировали на диету повышением 18: 2w 6 и уменьшением 20: 5w 3 и 22: 6w 3. Влияние диеты на содержание жирных кислот в яичниках было значительно меньше. поскольку были сохранены относительно высокие уровни 20: 5w 3 и 22: 6w 3.
Липиды яичников сладкой корюшки показывают увеличение 16: 0 и снижение ПНЖК, особенно фосфолипидов, по сравнению с липидами из мяса рыбы, пойманной в то же время года. Соотношение w 6 / w 3 яичника было ниже, чем у липидов плоти, 0,21 и 0,17 для яичника по сравнению с 0,31 и 0,20 для триглицеридов и фосфолипидов мяса, соответственно.
Выводимость яиц карпа, получавшего несколько различных составов кормов, значительно снижается, если соотношение липидов яиц 22: 6w 3 составляет менее 10 процентов.Кроме того, состав жирных кислот в мышцах, плазме и эритроцитах более подвержен влиянию пищевых липидов, чем составы яиц.
Потребности в ОДВ для ряда видов рыб были изучены в исследованиях питания. Сами рыбы дали убедительные доказательства предпочтения EFA по типам жирных кислот, которые они включают в свои липиды. Рыба, как правило, имеет тенденцию использовать w 3 по сравнению с w 6. Это особенно наблюдается, когда пищевые липиды с высоким содержанием w 6, поскольку рыба имеет тенденцию изменять соотношение w 6 / w 3 в сторону жирных кислот w 3 в ткани. липиды.Липиды яйца должны удовлетворять потребность эмбриона в EFA до тех пор, пока он не сможет питаться. Данные по составу жирных кислот показывают, что потребность в w 3 выше в морской воде, чем в пресной, и выше в холодной воде, чем в теплой.
Подробная информация о потребностях в липидах с пищей для многих видов рыб все еще отсутствует, но имеется большое количество информации о составе жирных кислот рыбьего жира. Информация о липидном составе рыбы может быть использована, чтобы сделать некоторые предположения о диетических потребностях в липидах.Линоленовая кислота (18: 3w 3) приводила к некоторому щадящему действию и стимулированию роста у крыс, а жирные кислоты w 6 EFA предотвращали все симптомы дефицита EFA. Исследования на домашних животных, обитающих на суше, показали, что жирные кислоты серии w 6 являются «незаменимыми жирными кислотами», в то время как серия w 3 считается несущественной или оказывает лишь частичное сдерживающее действие на дефицит EFA. Было показано, что серия жирных кислот w6 является незаменимой для достаточного количества видов животных, поэтому стало принято считать, что это незаменимые жирные кислоты для всех животных.
Многие считали, что рыбе также требуется 6 жирных кислот. Многие исследователи начали с добавления в рацион рыб растительных масел, таких как кукурузное, арахисовое или подсолнечное масло, которые были богаты линолевой кислотой. Основным симптомом, наблюдаемым во время развития дефицита EFA у обезжиренных рационов чавычи, была выраженная депигментация, которую можно предотвратить добавлением 1% трилинолеина, но не 0,1% линоленовой кислоты.
Хотя жирные кислоты w 6 считаются незаменимыми, одной из общих характеристик рыбьего жира является низкий уровень жирных кислот серии w 6 и более высокий уровень жирных кислот типа w 3.Имеются данные о том, что полиненасыщенные жирные кислоты (PUPA) серии w 3, которые присутствуют в относительно больших концентрациях в рыбьем жире, играют роль незаменимых жирных кислот для рыбы.
Когда тестируемая диета, содержащая 13% кукурузного масла и 2% рыбьего жира, давалась радужной форели, последующее исключение рыбьего жира из рациона приводило к угнетению роста и некоторой дегенерации почек, что могло быть связано с отсутствием достаточного количества рыбьего жира. w 3 ПНЖК, присутствующие в значительных количествах в рыбьем жире (McLaren et al ., 1947). Пищевой рыбий жир превосходит кукурузное масло в стимулировании роста радужной форели (Salmo gairdneri) и желтохвостой ( Seriola guingueradiata ). Диетическая линоленовая кислота или этиллиноленат (18: 3 w 3) дает положительную реакцию роста радужной форели, что может быть связано с диетической потребностью в жирных кислотах w 3.
5.1 Радужная форель
5.2 Канальный сом
5.3 Карп
5.4 Угорь
5.5 Камбала
5.6 Тюльпан
5.7 Красноморский лещ
5.8 Другие виды
Одна из наиболее широко распространенных теорий, объясняющих присутствие таких высоких уровней жирных кислот 20: 5w 3 и 22: 6w 3 в рыбьем жире, связана с влиянием ненасыщенности на температуру плавления липидов. Большая степень ненасыщенности жирных кислот в фосфолипидах рыб обеспечивает гибкость клеточной мембраны при более низких температурах. Структура w 3 допускает большую степень ненасыщенности, чем w 6 или w 9.Эта теория согласуется с тем фактом, что холодноводная рыба имеет более высокую потребность в питательных веществах в жирных кислотах w 3, в то время как потребность в EFA некоторых теплокровных рыб может быть удовлетворена за счет смеси w 6 плюс w 3.
5.1 Радужная форель
Радужная форель, холодноводная рыба, требует в рационе w 3 жирных кислот в качестве НЖК. Требование ОДВ в рационе может составлять 1 процент 18: 3w 3. Включение 18: 2w 6 в рацион может привести к некоторому улучшению роста и конверсии корма по сравнению с рационами с дефицитом EFA; однако жирные кислоты w 6 не предотвращают некоторые симптомы дефицита EFA, такие как «синдром шока».Хотя очевидно, что радужная форель требует w 3 жирных кислот, еще предстоит окончательно доказать, является ли необходимый уровень содержания w 6 жирной кислоты в рационе.
Во всех вышеупомянутых исследованиях с радужной форелью диетические 18: 2w 6 или 18: 3w 3 были легко преобразованы в ПНЖК C-20 и C-22 той же серии, а 18: 3w 3 или 22: 6w 3 имели аналогичные Значение EFA для радужной форели. Либо 20: 5w 3, либо 22: 6 w 3 превосходит 18: 3w 3 по значению EFA для радужной форели, а первые две жирные кислоты в комбинации превосходят любую по отдельности.Это согласуется с данными для млекопитающих, где 20: 4w 6 имеет более высокое значение EFA, чем 18: 2w 6. Превосходная питательная ценность C-20 и C-22 углерода w 3-PUFA дополнительно подтверждается превосходным стимулирующим рост эффектом диетический рыбий жир, такой как масло печени минтая и масло лосося для радужной форели.
5.2 Канальный сом
Одной из самых важных теплопроводных рыб в Северной Америке является канальный сом (Ictalurus punctatus) . Количественная потребность сома в ОДВ еще не определена.Однако есть убедительные доказательства того, что потребность в w 3 не так высока, как у радужной форели. Анализ жирных кислот липидов сома, приобретенного на пяти перерабатывающих предприятиях, показал очень низкие уровни 20: 4w 6, 20: 5w 3 и 22: 6w 3; 0,8 — 5,5, 0,2 — 1,3 и 0,6 — 6,1 процента от общего количества жирных кислот соответственно. Было показано, что кукурузное масло, добавленное к полуочищенному рациону на основе казеина, первоначально приводило к положительной реакции роста и экономии белка, но позже наблюдалось ингибирование роста.Очевидные репрессивные эффекты кукурузного масла могут быть связаны с его содержанием 18: 2 w 6, поскольку 20: 5 w 3 и 22: 6 w 3, присутствующие в масле менхадена, не оказывали видимого вредного воздействия. Эффект подавления роста 18: 2w 6 был также отмечен, когда 3 процента кукурузного масла было добавлено к 3 процентам говяжьего жира и 3 процентам масла менхадена. Подавление роста, вызванное ненасыщенными жирными кислотами, не ограничивается жирными кислотами. Льняное масло (с высоким содержанием 18: 3w 3) в рационе сома привело к подавлению роста, аналогичному тому, которое вызывается кукурузным маслом, по сравнению с диетическим говяжьим жиром, оливковым маслом и маслом менхадена.
5.3 Обыкновенный карп
Картина для другой теплопроводной рыбы, обыкновенного карпа (Cyprinus carpio) , намного яснее, чем для канального сома. У этой рыбы есть потребность в EFA как в жирных кислотах w 3, так и в w 6. Наилучшая прибавка в весе и конверсия корма были получены у рыб, получавших рацион, содержащий как 1 процент 18: 2 w 6, так и 1 процент 18: 3 w 3. У карпа 20: 5 w 3 и 22: 6 w 3 составляли 0,5 процента рациона. превосходят 1 процент 18: 3u3.Карп, получавший обезжиренную диету или диету с дефицитом EFA, содержал высокие уровни липидов 20: 3w 9, особенно фосфолипидов.
5.4 Угорь
Угорь ( Anguilla japonica ), еще одна теплопроводная рыба, нуждается в жирных кислотах w 3 и w 6. Кукурузное масло (с высоким содержанием w 6) и жир печени трески (с высоким содержанием w 3) в смеси 2: 1 наиболее благоприятны для роста угрей. Угрю требуется w 6 и w 3 в той же пропорции, что и карпу, но в меньшем количестве в рационе; а именно 0.5 процентов каждого, а не 1,0 процента каждой ПНЖК.
5.5 Камбала
В камбалах истощаются как w 3, так и w 6 ПНЖК при обезжиренной диете. Добавление к рациону 12: 0 и 14: 0 приводит к синтезу насыщенных и моноеновых жирных кислот с длиной цепи до С18; однако о повышенных уровнях 20: 3w 9, отмеченных у форели и млекопитающих, у камбалы не сообщалось. Камбала, получавшая пищу 18: 2w 6 и 18: 3w 3, не будет производить значительных количеств 20: 4w 6, 20: 5w 3 или 22: 6w 3.
5.6 Турбот
Рост камбалы (Scophthalmus matimus) намного лучше с w 3 ПНЖК, чем с w 6 или насыщенным жиром (гидрогенизированное кокосовое масло) в рационе. Палтус также, по-видимому, не может преобразовать диетическое 18: 2w 6 в 20: 4w 6 при кормлении кукурузным маслом или преобразовать эндогенное 18: 1w 9 в 20: 3w 9 при кормлении рационом с дефицитом EFA. Хотя он, по-видимому, требует EFA для жирных кислот w 3, таких как присутствующие в масле печени трески, 18: 3w 3 этому требованию не удовлетворяет.Удлинение цепи и обесцвечивание 18: lw 9, 18: 2 w 6 или 18: 3w 3 оказалось очень ограниченным (3-15 процентов) у камбалы по сравнению с радужной форелью, у которой 70 процентов от 18: 3w. 3 был преобразован в 22: 6w 3. Требуемый уровень длинноцепочечных жирных кислот w 3 для палтуса составляет не менее 0,8 процента от рациона.
5.7 Красноморский лещ
Красный морской лещ (Chrysophyrys major) растет лучше, когда пищевые липиды имеют морское происхождение (остаточное масло минтая), а не растительное масло (например, кукурузное масло).Требование EFA красного морского леща не удовлетворяется ни линолевой кислотой кукурузного масла, ни добавками линолената. Смесь 20: 5w 3 и 22: 6w 3, добавленная к диете с кукурузным маслом, оказалась эффективной для улучшения роста и состояния этих рыб. Таким образом, даже в теплой воде морской рыбе, по-видимому, требуется не только w 3 жирных кислоты, но и 0) 3 жирные кислоты с длиной углеродной цепи от 20 до 22. Постулируется прямая корреляция между эффективностью корма и уровнем липидов красного морского леща 18: 1.
5,8 Прочие виды
Среди теплокровных морских рыб кефаль и глазное дно обладают способностью образовывать цепочки, удлиняться и обесцвечивать 18: 2w 6 или 18: 3w 3 ПНЖК. Однако этот процесс тормозится в глазном дне за счет высоких уровней (около 5 процентов) этих ПНЖК 18: 2 w 6 или 18: 3 w 3 в рационе.
Похоже, что высокие уровни 18-углеродных жирных кислот w 6 или w 3 ингибируют синтез и метаболизм 18: lw 9. Интересно отметить, что канальный сом, который также демонстрирует отрицательную реакцию роста на диетическое 18: 2w 6 или 18: 3w 3, содержит очень высокие уровни липидов тела 18: 1.Включение в рацион 18: 2w 6 или 18: 3w 3 снижает уровень 18: 1 жирных кислот в липидах организма. Подобное снижение также наблюдалось в фосфолипидах печени морского леща при добавлении в рацион любой из ПНЖК.
Конкурентное ингибирование удлинения цепи и десатурации членов одной серии жирных кислот для членов другой серии хорошо установлено, причем w 3> w 6> w 9 является обычным порядком эффективности для ингибирования.
Пути метаболизма жирных кислот были рассмотрены Мидом и Каямой (1967).Рыба способна синтезировать de novo из ацетата насыщенные жирные кислоты с четной цепью, как показано на рисунке 1. Исследования с использованием радиоизотопных индикаторов показали, что рыба может преобразовывать 16: 0 в моноен w 7 и 18: 0 к моноену w 9. Моноены w 5, w 11 и w 3 предложены на основе идентификации этих изомеров в моноенах сельдевого масла.
Рыба не может синтезировать какие-либо жирные кислоты серий w 6 и u 3, если в рационе не присутствует предшественник с такой структурой w.Рыба способна обесцвечивать и удлинять жирные кислоты серий w 9, w 6 или w 3, как показано на рисунке 1. Существует конкурентное ингибирование десатурации жирных кислот одной серии за счет удлинения членами другой серии. Жирные кислоты w 3 являются наиболее сильными ингибиторами, а w 9 — наименее. Как отмечалось ранее, способность к удлинению и обесцвечиванию жирных кислот не одинакова у всех видов рыб. Палтус был способен обесцвечивать и удлинять только 3-15 процентов 18: 1w 9, 18: 2w 6 или 18: 3 w 3, когда вводили жирную кислоту, меченную C 14 ; у радужной форели 70 процентов метки из 18: 3w 3 (C 14 ) было найдено в 22: 6 w 3.
Незаменимые жирные кислоты не уникальны по своей способности поставлять энергию. Β-окисление жирных кислот у рыб в основном такое же, как у млекопитающих. Все EFA, насыщенные и моноеновые жирные кислоты в равной степени используются рыбой для производства энергии.
Рис. 1 Блок-схема механизмов синтеза жирных кислот в рыбе — Насыщенные и моноеновые жирные кислоты (адаптировано из Castell, 1979)
Рис. 1 Блок-схема механизмов синтеза жирных кислот в рыбе — Полиненасыщенные жирные кислоты (Адаптировано из Castell, 1979)
Повышенная скорость набухания митохондрий печени наблюдается в рационах питания радужной форели с дефицитом жирных кислот w 3.Возможно, что EFA играет важную роль в проницаемости, а также в пластичности мембран. Роль жирных кислот w 3 в проницаемости мембран может быть одним из факторов, определяющих различия в содержании этого семейства жирных кислот у пресноводных и морских рыб.
Митохондрии рыб с высоким уровнем w 3 ПНЖК и очень низким уровнем w 6 жирных кислот очень похожи на митохондрии млекопитающих в отношении содержания цитохрома, b-окисления жирных кислот, функционирования цикла трикарбоновых кислот, транспорта электронов и т. Д. и окислительное фосфорилирование.W 3 ПНЖК может играть ту же роль в рыбе, что и жирные кислоты w 6 у крыс. EFA играют еще одну роль в митохондриях. Помимо их важности в структуре мембраны, EFA важны в некоторых ферментных системах.
Ненасыщенные жирные кислоты играют важную роль в транспортировке других липидов. Неоднократно было показано, что кормление ПНЖК снижает уровень холестерина у животных с уровнем липидов и холестерина в крови выше нормы. Рыбий жир более эффективен в снижении уровня холестерина, чем большинство пищевых липидов.Основная часть жирных кислот, всасываемых через слизистую оболочку кишечника, транспортируется в виде белково-липидных комплексов, стабилизированных фосфолипидами. Низкая температура тела у рыб, вероятно, имеет большее значение для ненасыщенности в транспорте липидов, чем у гомеотермных животных.
Потребность рыбы в ПНЖК серии w 3 создает проблемы с хранением кормов. Эти типы жирных кислот очень неустойчивы к окислению. Продукты окисления липидов могут вступать в реакцию с другими питательными веществами, такими как белки, витамины и т. Д., а также снижение доступных диетических уровней или продуктов окисления может быть токсичным. Было продемонстрировано влияние окисленных липидов на пищевые белки, ферменты и аминокислоты.
Использование окисленного масла менхадена в рационах свиней и крыс вызывало снижение аппетита, замедление роста, желтовато-коричневую пигментацию жировых отложений и снижение уровней гемоглобина и гематокрита. Негативные эффекты окисленного рыбьего жира были устранены добавлением в рацион альфа-токоферола ацетата или этоксиохина.
Использование растительных масел в рационах рыб в 1950-х и 1960-х годах частично могло быть связано с их большей стабильностью в готовых рационах. Было продемонстрировано, что прогорклая сельдь и мука хека в кормах для рыб вызывают темную окраску, анемию, вялость, коричнево-желтую пигментированную печень, аномалии почек и мелкую жаберную булаву у чавычи. Симптомы можно облегчить, добавив альфа-токоферол к рациону, содержащему прогорклую рыбную муку. Добавление витамина Е предотвратит токсические или отрицательные эффекты добавления 5% сильно окисленного лососевого масла в рацион радужной форели.Такой же щадящий эффект альфа-токоферола можно применить и к корму для прогорклого карпа.
Положительная питательная ценность жирных кислот w 3 в липидах рыб для кормов для рыб может стать отрицательным фактором, если при приготовлении и хранении кормов не будут приняты соответствующие меры. В корма следует использовать только свежие масла с низким содержанием пероксидов. Ингредиенты рыбных кормов, такие как рыбная мука, должны быть защищены от окисления. Уровень витамина Е, добавляемого в рацион, следует увеличивать по мере увеличения уровня ПНЖК.Готовый корм, по возможности, следует хранить в герметичных контейнерах при пониженных температурах с минимальным воздействием УФ-излучения и других факторов, ускоряющих скорость окисления липидов. Нельзя игнорировать проблемы прогорклости или антиокисления липидов в кормах для рыб.
Акман Р.Г., 1967 Характеристики жирнокислотного состава и биохимии некоторых жиров и липидов пресноводных рыб в сравнении с жирами и липидами морских животных. Comp.Biochem.Physiol., 22: 907-22
Кастелл, Дж.Д., 1979 г. Обзор потребностей рыб в липидах. В Технология кормления и кормления рыб для рыб, под редакцией Дж. Э. Халвера и К. Труса. Труды Всемирного симпозиума, спонсируемого и поддержанного EIFAC / FAO / ICES / IUNS, Гамбург, 20-23 июня 1978 г. Schr.Bundesforschungsanst.Fisch., Hamb., (14/15) vol.1: 59-84
Коуи, С.Б. и Дж.Р. Сарджент, 1972 Кормление рыб. Adv.Mar.Biol ., 10: 383-492,
Коуи, С.Б. и Дж.Р. Сарджент, 1977 Липидное питание рыб. Comp.Biochem.Physiol. (B Comp.Biochem .) 57: 269-73
Макларен, Б.А. 1947 г., и др. , и др. . Кормление радужной форели. 1. Исследования витаминной потребности. Арх-Биохим . 19: 169-78
Мид, Дж. Ф. и М. Каяма, 1967 Липидный обмен у рыб. В Рыбий жир, под редакцией М.Э. Стэнсби. Вестпорт, Коннектикут, Avi Publ. Co., стр. 289-99.
Национальный исследовательский совет, Подкомитет 1973 года по питанию рыб, потребности в питательных веществах форели, лосося и сома.Вашингтон, округ Колумбия, Национальная академия наук, (Потребности домашних животных в питательных веществах), 11:57 стр.
Национальный исследовательский совет, Подкомитет по тепловодным рыбам 1977 года, Потребности теплопроводных рыб в питательных веществах. Вашингтон, округ Колумбия, Национальная академия наук, (Потребности домашних животных в питательных веществах), 78 стр.
