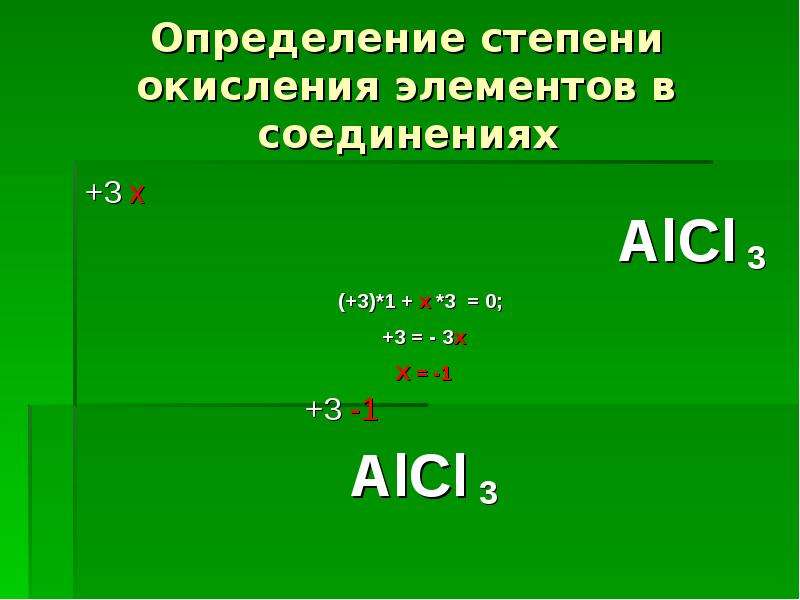
Алюминий степени окисления — Справочник химика 21
В подавляющем большинстве соединений-алюминий проявляет степень окисления +3. Большое практическое значение имеют его [c.335] Галлий, индий и таллий относятся к главной подгруппе III группы периодической системы элементов (разд. 35.10). В соответствии с номером группы в своих соединениях они проявляют степень окисления -ЬЗ. Возрастание устойчивости низших степеней окисления с ростом атомного номера элемента иллюстрируется на примерах соединений индия(III) (легко восстанавливающихся до металла), а также большей прочности соединений таллия(I) по сравнению с производными таллия(III). Ввиду того что между алюминием и галлием находится скандий — элемент первого переходного периода — вполне можно ожидать, что изменение физических и даже химических свойств этих элементов будет происходить не вполне закономерно. Действительно, обращает на себя внимание очень низкая температура плавления галлия (29,78 °С).
Окисляются или восстанавливаются металлы при образовании ими ионов Какова степень окисления иона алюминия [c.32]
Составьте формулы следующих соединении а) нитрида лития (соединения лития с азотом) б) сульфида алюминия (соединения алюминия с серой) в) фторида фосфора, в которых электроположительный элемент проявляет максимальную степень окисления. [c.47]
Органические соединения остальных переходных элементов. Переходные элементы остальных (кроме ПБ) побочных подгрупп периодической системы в проявляемых их атомами степенях окисления имеют незавершенные электронные -подоболочки предвнешнего уровня. Поэтому, наряду с образованием ординарной полярной ковалентной связи с углеродом за счет вклада внешних з- и р-орбиталей, они способны образовывать совершенно иные по строению и свойствам соединения за счет участия ( -орбиталей. В таких соединениях металл можно так же, как и соединения магния, бора, алюминия (см. выше), считать координационно ненасыщенным. Данная ненасыщенность металла теперь определяется наличием вакантных орбиталей не только на внешнем, но и на втором снаружи энергетических уровнях его атома. Природа вакантных орбиталей атома переходного элемента также отличается от орбиталей в- и р-элементов. Симметрия и пространственная протяженность -орбиталей переходного элемента позволяет им эффективно перекрываться с орбиталями большего числа атомов и удаленных на большее расстояние от металла, чем это возможно для з-или р-элемента.
Переходные элементы остальных (кроме ПБ) побочных подгрупп периодической системы в проявляемых их атомами степенях окисления имеют незавершенные электронные -подоболочки предвнешнего уровня. Поэтому, наряду с образованием ординарной полярной ковалентной связи с углеродом за счет вклада внешних з- и р-орбиталей, они способны образовывать совершенно иные по строению и свойствам соединения за счет участия ( -орбиталей. В таких соединениях металл можно так же, как и соединения магния, бора, алюминия (см. выше), считать координационно ненасыщенным. Данная ненасыщенность металла теперь определяется наличием вакантных орбиталей не только на внешнем, но и на втором снаружи энергетических уровнях его атома. Природа вакантных орбиталей атома переходного элемента также отличается от орбиталей в- и р-элементов. Симметрия и пространственная протяженность -орбиталей переходного элемента позволяет им эффективно перекрываться с орбиталями большего числа атомов и удаленных на большее расстояние от металла, чем это возможно для з-или р-элемента.
У бериллия (ls 2s ) по сравнению с бором ( s 2s 2p ) в соответствии с увеличением радиуса атома и уменьшением числа валентных электронов неметаллические признаки проявляются слабее, а металлические усиливаются. Бериллий обладает более высокими энергиями ионизации атома (II = 9,32 эВ, /а == 18,21 эВ), чем остальные s-элементы II группы. В то же время он во многом сходен с алюминием (диагональное сходство в периодической системе) и является типичным амфотерным эле.ментом в обычных условиях он простых ионов не образует для него характерны комплексные ионы как катионного, так и анионного типа. Во всех устойчивых соединениях степень окисления бериллия -f2. Для Ве (II) наиболее характерно координационное число 4 (зр -гибри-Д1(зация валентных орбиталей).
Здесь степень окисленности изменяется у азота и алюминня. Металлический алюминий (степень окисленности равна 0) превращается в иои АЮа, в котором степень окисленности алюминия равна Ч-З. Для составления уравнения окисления будем исходит , из схемы [c.268]
При этом образуется вулканообразный конус объемистого аморфного оксида хрома (III) зеленого цвета. Изменение степени окисления хрома в растворе сопровождается изменением окраски, что позволяет аналитически определить концентрацию хрома путем добавления раствора восстановителя известной концентрации. Соединения хрома (III) похожи на аналогичные соединения железа (особенно растворимые соли). Сульфат хрома (III) образует квасцы (как алюминий и железо). Хромокалиевые квасцы окраше-.чы в темно-фиолетовый цвет. Соединения хрома (II) — сильные восстановители и неустойчивы в присутствии влаги и воздуха (ср. со свойствами железа (II), с. 157).
Составьте формулу а) карбида бериллия б) карбида алюминия в) соединения углерода с фтором. Укажите степень окисления углерода в этих соединениях. [c.102]
Укажите степень окисления углерода в этих соединениях. [c.102]
В соответствии с номером группы основная степень окисления этих элементов +5, однако при нормальных условиях для ванадия стабильной является +4. В то время как у ванадия легко достигаются низшие степени окисления ( + 4, +3, -Ь2 конфигурации d (Р и Ф), ниобий обычным путем можно восстановить только до степени окисления +3 (опыт 2). Восстановление тантала в водном растворе вообще невозможно. Известны соединения с формальной степенью окисления -1 ([М(СО)б]-, где M=V, Nb, Та) и +1 ([У01руз]+, n- sHsM( 0)4, где M=Nb, Та) (табл. В.39). Низшие и дробные степени окисления этих элементов встречаются в соединениях, содержащих группы М (разд. 36.11.1). Химические свойства соединений ванадия (И) весьма напоминают свойства соединений цинка, а ванадия(1П)—титана(1П), железа(Ш) и алюминия. Донорные основные свойства оксидов ванадия ослабляются с увеличением формальной степени окисления. [c.612]
К этой группе восстановителей относятся металлы и некоторые другие элементарные вещества, как, например, водород, углерод и др.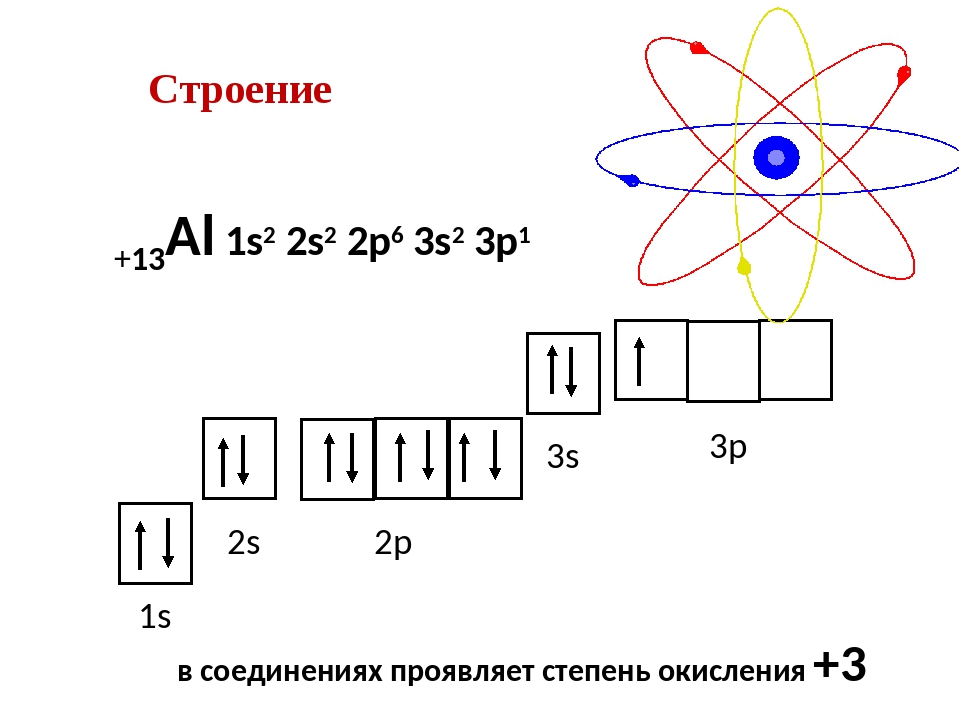 , атомы которых способны терять электроны и переходить в окисленное состояние. Металлы образуют при этом соответствующие соли в зависимости от кислоты, участвующей в реакции. Такие металлы, как цинк, алюминий и некоторые другие, могут восстанавливать и в щелочной среде, поскольку эти металлы растворимы в щелочах с образованием гидроксоцинкатов, гидроксоалюминатов и т. д. Являясь сильными восстановителями, при реакции, например, с некоторыми растворами азотной или серной кислоты, они способны восстановить центральные ионы этих кислот до низщих степеней окисления, т. е. до или по схемам
, атомы которых способны терять электроны и переходить в окисленное состояние. Металлы образуют при этом соответствующие соли в зависимости от кислоты, участвующей в реакции. Такие металлы, как цинк, алюминий и некоторые другие, могут восстанавливать и в щелочной среде, поскольку эти металлы растворимы в щелочах с образованием гидроксоцинкатов, гидроксоалюминатов и т. д. Являясь сильными восстановителями, при реакции, например, с некоторыми растворами азотной или серной кислоты, они способны восстановить центральные ионы этих кислот до низщих степеней окисления, т. е. до или по схемам
Ни один из этих элементов в своих соединениях не достигает степени окисления, соответствующей номеру группы. Наиболее устойчивы степени окисления +2 и Ч-З, причем для никеля, за некоторыми исключениями (например, в K [NiFe], см. также опыт 1), наиболее типична степень окисления +2 (конфигурация d ) (опыт 1). Во многих соединениях кобальта он также имеет степень окисления 4-2 (d ) степень окисления 4-3 (d ) характерна главным образом для комплексных соединений кобальта, которые имеют сходство с комплексами хрома (1П).
При образовании ионов металлов последние окисляются, поскольку при этом происходит удаление электронов от атомов металла. Ион алюминия, АР», имеет степень окисления -I- 3. [c.32]
Металлы проявля.ют в своих соединениях только положительную окисленность, и низшая их степень окислещгости равна нулю. Иначе говоря, низшей степенью окисленности они обладают только в свободном состоянии. Действительно, все свободные металлы способны, хотя и в различной степени, проявлять только восстановительные свойства, Иа практике в качестве восстановителей применяют алюминий, магний, натрнй.
По своему химическому поведению молибден и вольфрам гораздо сильнее отличаются от хрома, чем между собой. Например, в отличие от хрома степень окисления -f 3 для молибдена и вольфрама реализуется лишь в небольшом числе катионных комплексов. Реакции хрома(П1) во многом сходны с реакциями железа (П1) и алюминия. В степени окисления -f6 хром несколько напоминает ванадий (4-5). [c.618]
Алюминий — основной представитель металлов главной подгруппы III группы периодической системы хим11ческих элементов Д. И. Менделеева. Атомный номер 13, относительная атомная масса 26,98154. У алюминия единственный устойчивый изотоп А1. Свойства аналогов алюминия — галлия, индия и таллия — Ео многом напоминают свойства алюминия. Этому причина — одинаковое строение внешнего электронного слоя элементов — s p вследствие которого все они проявляют степень окисления + 3. Другие степени окисления нехарактерны, за исключением соединений одновалентного таллия, по свойствам близким к соединениям элементов I группы. В связи с этим будут рассмотрены свойства только одного элемента — алюминия и его соединеннй. [c.150]
Этому причина — одинаковое строение внешнего электронного слоя элементов — s p вследствие которого все они проявляют степень окисления + 3. Другие степени окисления нехарактерны, за исключением соединений одновалентного таллия, по свойствам близким к соединениям элементов I группы. В связи с этим будут рассмотрены свойства только одного элемента — алюминия и его соединеннй. [c.150]
Атом углерода имеет 6 электронов, 2 из которых образуют внутренний (1з ) слой, а 4 (2а 2р-) — внешний. Связи углерода с другими элементами преимущественно ковалентны. Обычная валентность углерода — IV. С наиболее активными металлами углерод проявляет степень окисления — 4 (например, в карбиде алюминия АГ-.Сз). Замечательная особенность атома углерода — способность соединяться между собой с образованием прочных длинных цепей, в том числе замкнутых. Число таких соединений огромно, все они составляют предмет органической химии.
Оксид алюминия, А12О3, обладает амфотерными свойствами, а оксиды Са, 1п и Т1-основными свойствами.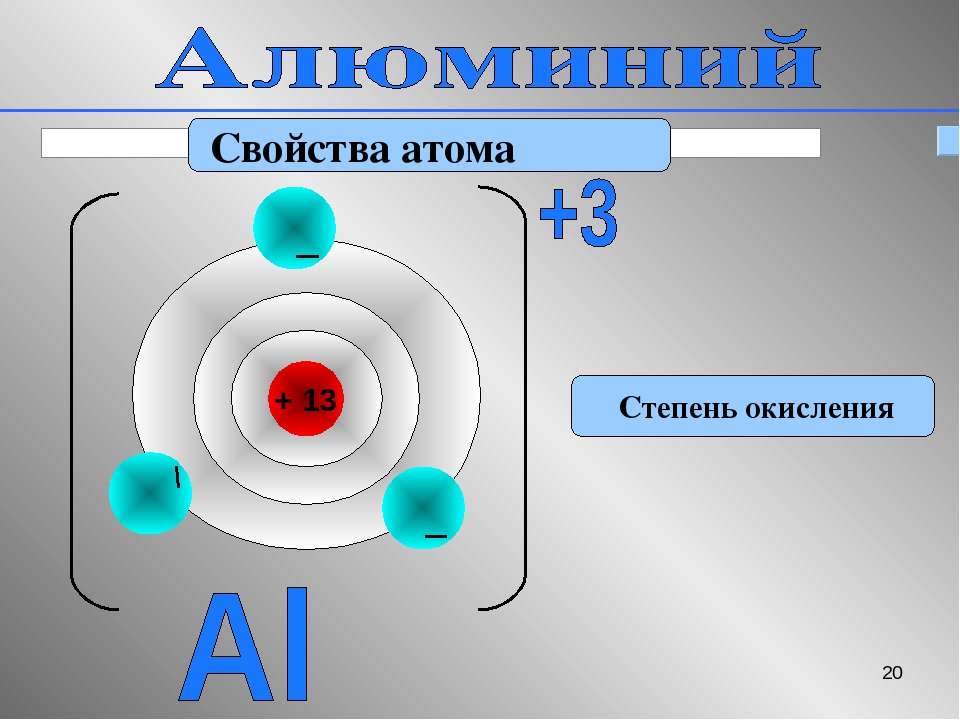 За исключением бора, остальные элементы группы П1А являются металлами. Галлий имеет единственное состояние окисления -Ь 3, и его химия очень напоминает химию А1 1п проявляет состояния окисления -Ь 3 и -Ь 1 Т1 также встречается в обоих этих состояниях окисления, но чаще имеет степень окисления -1- 1. [c.454]
За исключением бора, остальные элементы группы П1А являются металлами. Галлий имеет единственное состояние окисления -Ь 3, и его химия очень напоминает химию А1 1п проявляет состояния окисления -Ь 3 и -Ь 1 Т1 также встречается в обоих этих состояниях окисления, но чаще имеет степень окисления -1- 1. [c.454]
Конфигурация внешних электронных оболочек атома алюминия 3s 3p. Характерной степени окисления — -3 соответствует строение 2,зЗрхЗ[Уу [c.338]
Одинаковое число валентных электронов у атомов алюминия п бора определяет сходство этих элементов. Различие в структуре предвнешнего слоя и в размерах атомов, а в особенности наличие у атомов алюминия вакантных З -орбиталей предопределяют существенное различие их свойств. Как и для бора, для алюминия наиболее характерна степень окисления +3, а отрицательная поляризация атолюв проявляется еще реже. [c.524]
Здесь наблюдается постепенный переход ог типично основных оксидов натрия и магния к амфотерным, или промежуточным (алюминия), и к кислотным оксидам фосфора, серы и хлора. Этот пе-ре.ход сопровождается понышепием окислительного числа эле.мен-тов, образующих оксиды. То же наблюдается у оксидов одного и того же элемента в разных степенях окисления. Так, например, в ряду [c.126]
Этот пе-ре.ход сопровождается понышепием окислительного числа эле.мен-тов, образующих оксиды. То же наблюдается у оксидов одного и того же элемента в разных степенях окисления. Так, например, в ряду [c.126]
Электростатическая сила связи А1—О равна 0,75 е. Эта величина получается делением степени окисления алюминия (3) иа его координационное число (равно числу атомов кислорода, связанных с атомом алюминия). Электростатическая сила связи 51—О 1 е, следовательно, атом кислорода несет избыточный заряд. Этот заряд лишь частично нейтрализует заряд протона, поэтому протон должен обладать повышенной подвижностью. [c.131]
Одинаковое строение внешней электронной оболочки атома бора и алюминия обусловливает сходство в свойствах этих элементов. Так, для алюминия, как и для бора, характерна только степень окисления +3. Однако при переходе от бора к алюминию сильно возрастает радиус атома (от 91 до 143 пм) и, кроме того, появляется еще один промежуточный восьмиэлектронный слой, экранирующий ядро. Все это приводит к ослаблению связи внешних электронов с ядром и к уменьшению энергии ионизации атома (см. табл. 15.2). Поэтому у алюминия металлические свойства выражены гораздо сильнее, чем у бора. Тем не менее химические связи, образуемые алюминием с другими элементами, имеют в основном ковалентный характер. [c.400]
Все это приводит к ослаблению связи внешних электронов с ядром и к уменьшению энергии ионизации атома (см. табл. 15.2). Поэтому у алюминия металлические свойства выражены гораздо сильнее, чем у бора. Тем не менее химические связи, образуемые алюминием с другими элементами, имеют в основном ковалентный характер. [c.400]
Гидратированный катион алюминия (координационное число 6), как и катионы более тяжелых элементов-аналогов в степени окисления -1-3 (разд. 36.3), — кислота средней силы [c.604]
А) Рассчитайте, какова простейшая формула органического вещества, в котором массовая доля углерода 39,98%, водорода 6,6 % и кислорода 5 ,42 %. Назовите это вещество. Ответ СН,0 формальдегид. 2. (А ) Определите состав углеводорода, если относительная плотность его по водороду (н.у.) равна 13, массовая доля в нем углерода 92,3%. Каким образом можно доказать, что сосуд заполнен газом, состав которого вы определили Ответ С Н,, пропустить газ через аммиачный раствор Си (I) (СиС1) или Ag (1) (А С1). 3. (А) При сгорании металла массой 3 г образуется его оксид массой 5,67 г. Степень окисления металла в оксиде равна +3. Что это за металл Ответ Алюминий. [c.274]
3. (А) При сгорании металла массой 3 г образуется его оксид массой 5,67 г. Степень окисления металла в оксиде равна +3. Что это за металл Ответ Алюминий. [c.274]
Для цинка характерна устойчивая степень окисления -(-2, а для алюминия +3. Остальные катионы этой группы проявляют и более высокие степени окисления, а соответствующие им соединения обладают в связи с этим свойствами окислителей. Так, исходя из [c.259]
Атс М алюминия (Is 2s 2р 3s больше по размеру, чем атом бора, i обладает меньшей энергией ионизации. Следовательно, неме-талли1еские признаки химического элемента алюминия выражены в меньш й степени, чем химического элемента бора. Для алюминия, как и для эора, наиболее характерна степень окисления +3. Отрицательная поляризация атомов алюминия проявляется еще реже. Для алюминия (III) наиболее характерны координационные числа 6 и 4. [c.451]
Названия оснований строятся из слова гидроксид и названия металла.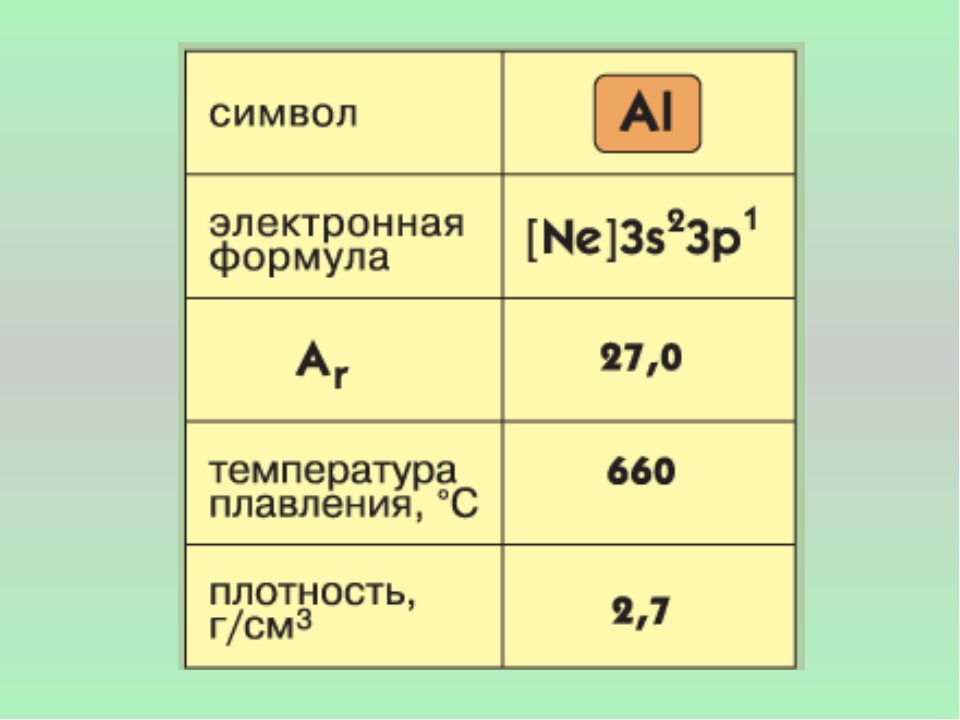 Если металл не имеет постоянной валентности, то в скобках указывают значение степени окисления (валентности), проявляемое в этом соединении. Например гидроксид цинка Zn(OH)j (читается цинк о аш дважды ), гидроксид натрия NaOH (читается натрии о аш ), гидроксид алюминия А1(0Н) (читается алюминий о аш 1 рижды ), гидроксид железа (II) Fe(OH)j (читается фер-рум о аш дважды ) и гидроксид железа (III) Ре(ОН)з (читается фер-рум (I аш 1рижды ). [c.12]
Если металл не имеет постоянной валентности, то в скобках указывают значение степени окисления (валентности), проявляемое в этом соединении. Например гидроксид цинка Zn(OH)j (читается цинк о аш дважды ), гидроксид натрия NaOH (читается натрии о аш ), гидроксид алюминия А1(0Н) (читается алюминий о аш 1 рижды ), гидроксид железа (II) Fe(OH)j (читается фер-рум о аш дважды ) и гидроксид железа (III) Ре(ОН)з (читается фер-рум (I аш 1рижды ). [c.12]
Гидроксиды алюминия, хрома (П1) и цинка обладают амфотерными свойствами. В некоторой степени можно говорить и об амфо-терности гидроксида железа (П1) с очень слабо выраженными кислотными свойствами, проявляю[цимися лишь по отношению к концентрированным и горячим растворам ителочей, в которых Р е(ОН)з заметно растворяется с образованием гидроксоферра-тов (П1) натрия или калия. Гидроксиды низшей степени окисления Ре(0Н)2, Мп(ОИ)2, Ni(OH)2 и Со(ОН)2 являются слабыми основаниями, растворимыми в кислотах и в растворах аммониевых солей. [c.259]
[c.259]
Как объяснить, что при одной и той же степени окисления бора и алюминия, равной 3, первый образует тетрафтороборат-ион, а второй гексафтороалюминат-ион [c.194]
Формулы и названия двойных солей начинаются с катиона, имеющего более высокую степень окисления А1К(504)2- 12Н2О — алюминия-калия сульфат. [c.33]
В соответствии с положением в периодической системе основная степень окисления алюминия +3. В так называемых субсоединениях алюминий проявляет степень окисления +1 (заполненный Зs -ypoвeнь). Эти соединения (А1Х, Х=Р, С1, Вг, I А12 , =0, 8, 5е, а также АЮ) образуются при высоких температурах при реакциях, обратных диспропорционированию [c.603]
Соединения алюминия. В своих устойчивых соединениях алю-М1Н1ИЙ обычно проявляет степень окисления +3. [c.254]
Кроме того, они образуют соединения, отвечающие степени окисления +2 и -ЬЗ. Соединения хрома (III) по свойствам во многом сходны с соединениями алюминия (III).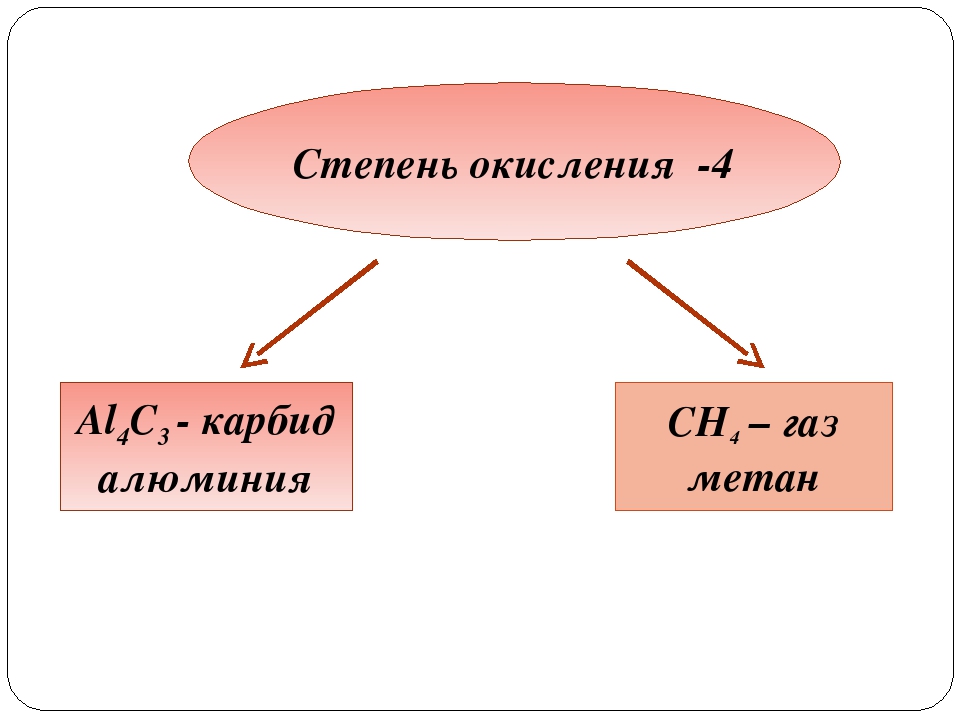 Это объясняется тем, что радиусы ионов Сг + (0,63А) и AF+ (0.54А) близки. Гидроксид хрома Сг(ОН)з, как и А1(0Н)з, амфотерное соединение. В отличие от соединений алюминия соединения хрома (III) обладают восстановительными свойствами. Высшие оксиды рассматриваемых элементов ЭО3 и соответствующие им гидроксиды Н2ЭО4 обладают кислотными свойствами. Соединения хрома (VI) СгОз, Н2СГО4, Н2СГ2О7 и их соли — сильные окислители. [c.97]
Это объясняется тем, что радиусы ионов Сг + (0,63А) и AF+ (0.54А) близки. Гидроксид хрома Сг(ОН)з, как и А1(0Н)з, амфотерное соединение. В отличие от соединений алюминия соединения хрома (III) обладают восстановительными свойствами. Высшие оксиды рассматриваемых элементов ЭО3 и соответствующие им гидроксиды Н2ЭО4 обладают кислотными свойствами. Соединения хрома (VI) СгОз, Н2СГО4, Н2СГ2О7 и их соли — сильные окислители. [c.97]
общая характеристика, строение; свойства и получение — урок. Химия, 8–9 класс.
Алюминий как атом и химический элемент
Алюминий находится в \(IIIA\) группе Периодической системы химических элементов Д. И. Менделеева.
Строение электронной оболочки атома алюминия — 1s22s22p63s23p1.
На внешнем электронном уровне атом содержит \(3\) электрона.
Поэтому в своих соединениях алюминий всегда проявляет только одну степень окисления, равную \(+3\).
Обрати внимание!
По распространённости в земной коре алюминий занимает третье место после кислорода и кремния, а среди металлов — первое.
Основные природные минералы алюминия:
- боксит, состав которого можно примерно выразить формулой Al2O3 \(•\) xh3O,
- нефелин (Na,K)O2 \(•\) Al2O3 \(•\) 2h3O,
- каолинит Al2O3 \(•\) SiO2 \(•\) 2h3O.
Каолинит — образец многочисленных алюмосиликатов, включающих преимущественно атомы кремния и кислорода, которые очень широко распространены в природе.
Физические свойства
В свободном состоянии алюминий — светлый блестящий металл, лёгкий, относительно мягкий, легкоплавкий, имеет высокую тепло- и электропроводность.
Алюминий является химически активным металлом, однако при обычных условиях он устойчив на воздухе и сохраняет свой металлический блеск длительное время. Это объясняется тем, что поверхность алюминия покрыта тонкой, невидимой глазу, прозрачной, но плотной плёнкой оксида алюминия, которая препятствует взаимодействию алюминия с компонентами атмосферы (парами воды и кислородом).
Свойства алюминия обусловили его широкое применение и необходимость получения алюминия в свободном виде.
В лабораторных условиях небольшое количество алюминия можно получить путём восстановления хлорида алюминия калием при высокой температуре:
AlCl3+3K=t3KCl+Al.
Так был впервые получен алюминий.
В промышленных условиях алюминий получают из бокситов. При нагревании бокситов образуется оксид алюминия. Восстановить алюминий из оксида с помощью традиционных восстановителей практически невозможно, поэтому его получают методом электролиза.
При этом на катоде восстанавливается алюминий, а на аноде — окисляется кислород.
Суммарная реакция электролиза выражается уравнением:
2Al2O3=4Al+3O2↑.
какую степень окисления проявляет алюминий в соединениях?
Пж помогите 2,3,4 упражнения нужно
Определите массу исходных реагентов оксида меди и 70% азотной кислоты необходимых для получения 0,2 моль натрия медиПомогите пожалуйста:(
2 и 3 вариант помогите пж
Определите принадлежность органических соединений к классам непредельных углеводородов.
Срочно пожалуйста!!Напишите у равнения следующих реакций Нитрат серебра + хлорид бария =
Каким газом следует наполнить шарик, чтобы он мог взлететь вверх ( Кислород -O2, Метан -Ch5, Сернистый газ -SO2)? (Средняя молярная масса воздуха равн … а 29 г/моль).
Реализуйте уравнения реакций и определите неизвестные соединения. 1 2 3 4 ca ->x-> ca(oh)2 -> x1 ->cao
СОРПО ТЕМЕ: «КИСЛОТЫ»1.Выберите ряд, в котором все кислоты являются бескислородными, одноосновными А) серная, соляная, азотная Б) азотная, соляная, се … роводородная В) соляная, сероводородная, йодоводородная Г) фосфорная, бромоводородная, угольная 2. Под каким номером записаны формулы сульфата, сульфита и сульфида калия? А) К2SO3, K2S, K2SO4; Б) К2S, K2SО4, K2SO3; В) К2SO3, K2SO4, K2S; Г) К2SO4, K2SО3, K2S. 3. Составить формулы солей и дать им названия: металлы Na, Аl (кислоты — серная, азотная, ортофосфорная, соляная) Помогите пожалуйста люди добрые
СОРПО ТЕМЕ: «КИСЛОТЫ»1. Выберите ряд, в котором все кислоты являются бескислородными, одноосновными А) серная, соляная, азотная Б) азотная, соляная, се
… роводородная В) соляная, сероводородная, йодоводородная Г) фосфорная, бромоводородная, угольная 2. Под каким номером записаны формулы сульфата, сульфита и сульфида калия? А) К2SO3, K2S, K2SO4; Б) К2S, K2SО4, K2SO3; В) К2SO3, K2SO4, K2S; Г) К2SO4, K2SО3, K2S. 3. Составить формулы солей и дать им названия: металлы Na, Аl (кислоты — серная, азотная, ортофосфорная, соляная) 4. Составьте формулы веществ: хлорид калия, сульфат железа (3), карбонат натрия, сульфит кальция. 5. Напишите уравнения реакций, которые осуществимы: Аg+НСl= ; Са+НСl= ; Zn+h4PO4=; Fe2O3+h3SO4=
Выберите ряд, в котором все кислоты являются бескислородными, одноосновными А) серная, соляная, азотная Б) азотная, соляная, се
… роводородная В) соляная, сероводородная, йодоводородная Г) фосфорная, бромоводородная, угольная 2. Под каким номером записаны формулы сульфата, сульфита и сульфида калия? А) К2SO3, K2S, K2SO4; Б) К2S, K2SО4, K2SO3; В) К2SO3, K2SO4, K2S; Г) К2SO4, K2SО3, K2S. 3. Составить формулы солей и дать им названия: металлы Na, Аl (кислоты — серная, азотная, ортофосфорная, соляная) 4. Составьте формулы веществ: хлорид калия, сульфат железа (3), карбонат натрия, сульфит кальция. 5. Напишите уравнения реакций, которые осуществимы: Аg+НСl= ; Са+НСl= ; Zn+h4PO4=; Fe2O3+h3SO4=
у якій масі води треба розчинити 30 г пральної соди. щоб приготувати розчин з масовою часткою соди 7.5 %Помогите пожалуйста
Урок №52. Алюминий. Нахождение в природе. Свойства алюминия
Алюминий
Дополнительно на страницах учебника «Фоксфорд»
Главную подгруппу III группы периодической системы составляют бор (В),
алюминий (Аl), галлий (Ga), индий (In) и таллий (Тl).
Как видно из приведенных данных, все эти элементы были открыты в XIX столетии.
Открытие металлов главной подгруппы III группы
В | Al | Ga | In | Tl |
1806 г. | 1825 г. | 1875 г. | 1863 г. | 1861 г. |
Г.Люссак, | Г.Х.Эрстед | Л. | Ф.Рейх, | У.Крукс |
Л. Тенар | (Дания) | (Франция) | И.Рихтер | (Англия) |
(Франция) | (Германия) |
Бор представляет собой неметалл. Алюминий — переходный металл, а галлий, индий и таллий — полноценные металлы. Таким образом, с ростом радиусов атомов элементов каждой группы периодической системы металлические свойства простых веществ усиливаются.
В данной лекции мы подробнее рассмотрим
свойства алюминия.
1. Положение алюминия в таблице Д. И. Менделеева. Строение атома, проявляемые степени окисления.
Элемент алюминий расположен в III группе, главной «А» подгруппе, 3 периоде периодической системы, порядковый номер №13, относительная атомная масса Ar(Al) = 27. Его соседом слева в таблице является магний – типичный металл, а справа – кремний – уже неметалл. Следовательно, алюминий должен проявлять свойства некоторого промежуточного характера и его соединения являются амфотерными.
Al +13 )2)8)3 , p – элемент,
Основное состояние 1s22s22p63s23p1 |
|
Возбуждённое состояние 1s22s22p63s13p2 |
|
Алюминий проявляет в соединениях степень окисления +3:
Al0 – 3 e— → Al+3
2. Физические свойства
Физические свойства
Алюминий в свободном виде — серебристо-белый металл, обладающий высокой тепло- и электропроводностью. Температура плавления 650 оС. Алюминий имеет невысокую плотность (2,7 г/см3) — примерно втрое меньше, чем у железа или меди, и одновременно — это прочный металл.
3. Нахождение в природе
По распространённости в природе занимает 1-е среди металлов и 3-е место среди элементов, уступая только кислороду и кремнию. Процент содержания алюминия в земной коре по данным различных исследователей составляет от 7,45 до 8,14 % от массы земной коры.
В природе алюминий встречается только в соединениях (минералах).
Некоторые из них:
· Бокситы — Al2O3 • H2O (с примесями SiO2, Fe2O3, CaCO3)
· Нефелины — KNa3[AlSiO4]4
· Алуниты — KAl(SO4)2 • 2Al(OH)3
· Глинозёмы (смеси каолинов с песком SiO2, известняком CaCO3, магнезитом MgCO3)
· Корунд — Al2O3
· Полевой шпат (ортоклаз) — K2O×Al2O3×6SiO2
· Каолинит — Al2O3×2SiO2 × 2H2O
· Алунит — (Na,K)2SO4×Al2(SO4)3×4Al(OH)3
· Берилл — 3ВеО • Al2О3 • 6SiO2
Боксит |
|
Al2O3 | Корунд
|
Рубин
| |
Сапфир
|
4. Химические
свойства алюминия и его соединений
Химические
свойства алюминия и его соединений
Алюминий легко взаимодействует с
кислородом при обычных условиях и покрыт оксидной пленкой (она придает матовый
вид).
ДЕМОНСТРАЦИЯ ОКСИДНОЙ ПЛЁНКИ
Алюминий |
| |
Её толщина 0,00001 мм, но благодаря ней алюминий не коррозирует. Для изучения химических свойств алюминия оксидную пленку удаляют. (При помощи наждачной бумаги, или химически: сначала опуская в раствор щелочи для удаления оксидной пленки, а затем в раствор солей ртути для образования сплава алюминия со ртутью – амальгамы).
I. Взаимодействие с простыми веществами
Алюминий уже при комнатной температуре активно реагирует со всеми галогенами, образуя галогениды. При нагревании он взаимодействует с серой (200 °С), азотом (800 °С), фосфором (500 °С) и углеродом (2000 °С), с йодом в присутствии катализатора — воды:
2Аl + 3S = Аl2S3 (сульфид алюминия),
2Аl + N2 = 2АlN (нитрид алюминия),
Аl + Р = АlР (фосфид алюминия),
4Аl
+ 3С = Аl4С3 (карбид алюминия).
2 Аl + 3 I2 = 2 AlI3 (йодид алюминия) ОПЫТ
Все эти соединения полностью гидролизуются с образованием гидроксида алюминия и, соответственно, сероводорода, аммиака, фосфина и метана:
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
Al4C3 + 12H2O = 4Al(OH)3+ 3CH4
В виде стружек или порошка он ярко горит на воздухе, выделяя большое количество теплоты:
4Аl + 3O2 = 2Аl2О3 + 1676 кДж.
ГОРЕНИЕ АЛЮМИНИЯ НА ВОЗДУХЕ
ОПЫТ
II. Взаимодействие со сложными веществами
Взаимодействие с водой:
2 Al + 6 H2O = 2 Al (OH)3 + 3 H2
без оксидной пленки
ОПЫТ
Взаимодействие с оксидами металлов:
Алюминий –
хороший восстановитель, так как является одним из активных металлов. Стоит в
ряду активности сразу после щелочно-земельных металлов. Поэтому восстанавливает металлы из их оксидов.
Такая реакция – алюмотермия – используется для получения чистых редких
металлов, например таких, как вольфрам, ваннадий и др.
Стоит в
ряду активности сразу после щелочно-земельных металлов. Поэтому восстанавливает металлы из их оксидов.
Такая реакция – алюмотермия – используется для получения чистых редких
металлов, например таких, как вольфрам, ваннадий и др.
3 Fe3O4 + 8 Al = 4 Al2O3 + 9 Fe +Q
Термитная смесь Fe3O4 и Al (порошок) –используется ещё и в термитной сварке.
Сr2О3 + 2Аl = 2Сr + Аl2О3
Взаимодействие с кислотами:
С раствором серной кислоты: 2 Al + 3 H2SO4 = Al2(SO4)3 + 3 H2
С холодными концентрированными серной и азотной не реагирует (пассивирует). Поэтому азотную кислоту перевозят в алюминиевых цистернах. При нагревании алюминий способен восстанавливать эти кислоты без выделения водорода:
2Аl + 6Н2SО4(конц) = Аl2(SО4)3 + 3SО2 + 6Н2О,
Аl + 6НNO3(конц) = Аl(NO3)3 +
3NO2 + 3Н2О.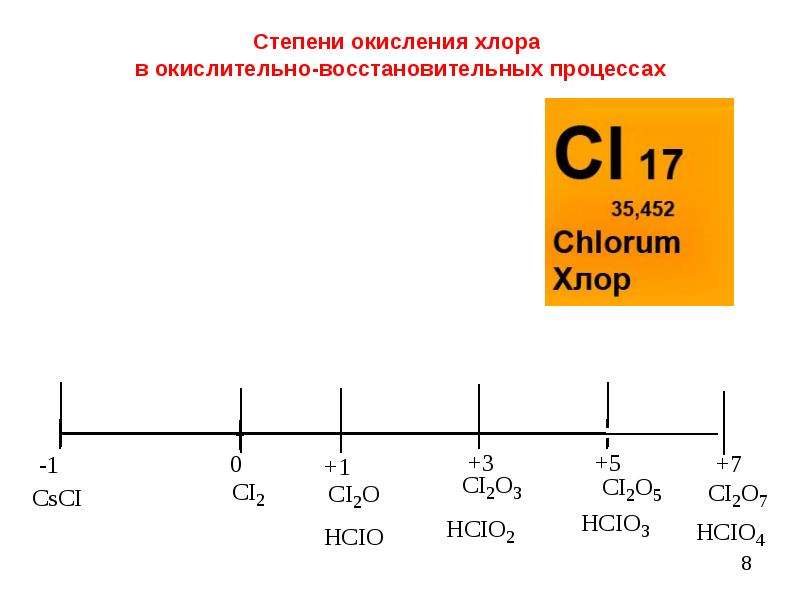
Взаимодействие со щелочами.
2 Al + 2 NaOH + 6 H2O = 2 Na[Al(OH)4] + 3 H2
ОПЫТ
Na[Аl(ОН)4] – тетрагидроксоалюминат натрия
По предложению химика Горбова, в русско-японскую войну эту реакцию использовали для получения водорода для аэростатов.
С растворами солей:
2Al + 3CuSO4 = Al2(SO4)3 + 3Cu
Если поверхность алюминия потереть солью ртути, то происходит реакция:
2Al + 3HgCl2 = 2AlCl3 + 3Hg
Выделившаяся ртуть растворяет алюминий, образуя амальгаму.
Обнаружение ионов алюминия в растворах: ОПЫТ
5. Применение алюминия и его соединений
РИСУНОК 1
РИСУНОК 2
Физические и химические свойства
алюминия обусловили его широкое применение в технике. Крупным потребителем алюминия
является авиационная промышленность: самолет на 2/3 состоит из
алюминия и его сплавов. Самолет из стали оказался бы слишком тяжелым и смог бы
нести гораздо меньше пассажиров. Поэтому
алюминий называют крылатым металлом. Из
алюминия изготовляют кабели и провода: при одинаковой электрической проводимости
их масса в 2 раза меньше, чем соответствующих изделий из меди.
Крупным потребителем алюминия
является авиационная промышленность: самолет на 2/3 состоит из
алюминия и его сплавов. Самолет из стали оказался бы слишком тяжелым и смог бы
нести гораздо меньше пассажиров. Поэтому
алюминий называют крылатым металлом. Из
алюминия изготовляют кабели и провода: при одинаковой электрической проводимости
их масса в 2 раза меньше, чем соответствующих изделий из меди.
Учитывая коррозионную устойчивость алюминия, из него изготовляют детали аппаратов и тару для азотной кислоты. Порошок алюминия является основой при изготовлении серебристой краски для защиты железных изделий от коррозии, а также для отражения тепловых лучей такой краской покрывают нефтехранилища, костюмы пожарных.
Оксид алюминия используется для получения алюминия, а также как огнеупорный материал.
Гидроксид алюминия – основной компонент всем известных лекарств маалокса, альмагеля, которые понижают кислотность желудочного сок.
Соли алюминия сильно гидролизуются. Данное свойство применяют в
процессе очистки воды. В очищаемую воду вводят сульфат алюминия и небольшое
количество гашеной извести для нейтрализации образующейся кислоты. В результате
выделяется объемный осадок гидроксида алюминия, который, оседая, уносит с собой
взвешенные частицы мути и бактерии.
Данное свойство применяют в
процессе очистки воды. В очищаемую воду вводят сульфат алюминия и небольшое
количество гашеной извести для нейтрализации образующейся кислоты. В результате
выделяется объемный осадок гидроксида алюминия, который, оседая, уносит с собой
взвешенные частицы мути и бактерии.
Таким образом, сульфат алюминия является коагулянтом.
6. Получение алюминия
1) Современный рентабельный способ получения алюминия был изобретен американцем Холлом и французом Эру в 1886 году. Он заключается в электролизе раствора оксида алюминия в расплавленном криолите. Расплавленный криолит Na3AlF6 растворяет Al2O3, как вода растворяет сахар. Электролиз “раствора” оксида алюминия в расплавленном криолите происходит так, как если бы криолит был только растворителем, а оксид алюминия — электролитом.
2Al2O3 эл.ток→ 4Al + 3O2
В
английской “Энциклопедии для мальчиков и девочек” статья об алюминии начинается
следующими словами: “23 февраля 1886 года в истории цивилизации начался новый
металлический век — век алюминия. В этот день Чарльз Холл, 22-летний химик,
явился в лабораторию своего первого учителя с дюжиной маленьких шариков
серебристо-белого алюминия в руке и с новостью, что он нашел способ изготовлять
этот металл дешево и в больших количествах”. Так Холл сделался основоположником
американской алюминиевой промышленности и англосаксонским национальным героем,
как человек, сделавшим из науки великолепный бизнес.
В этот день Чарльз Холл, 22-летний химик,
явился в лабораторию своего первого учителя с дюжиной маленьких шариков
серебристо-белого алюминия в руке и с новостью, что он нашел способ изготовлять
этот металл дешево и в больших количествах”. Так Холл сделался основоположником
американской алюминиевой промышленности и англосаксонским национальным героем,
как человек, сделавшим из науки великолепный бизнес.
2) 2Al2O3 + 3 C = 4 Al + 3 CO2
ЭТО ИНТЕРЕСНО:
- Металлический алюминий первым выделил в 1825 году датский физик Ханс Кристиан Эрстед. Пропустив газообразный хлор через слой раскаленного оксида алюминия, смешанного с углем, Эрстед выделил хлорид алюминия без малейших следов влаги. Чтобы восстановить металлический алюминий, Эрстеду понадобилось обработать хлорид алюминия амальгамой калия. Через 2 года немецкий химик Фридрих Вёллер. Усовершенствовал метод, заменив амальгаму калия чистым калием.
- В 18-19 веках
алюминий был главным ювелирным металлом.
 В 1889 году Д.И.Менделеев в Лондоне за
заслуги в развитии химии был награжден ценным подарком – весами, сделанными из
золота и алюминия.
В 1889 году Д.И.Менделеев в Лондоне за
заслуги в развитии химии был награжден ценным подарком – весами, сделанными из
золота и алюминия. - К 1855 году французский ученый Сен- Клер Девиль разработал способ получения металлического алюминия в технических масштабах. Но способ был очень дорогостоящий. Девиль пользовался особым покровительством Наполеона III, императора Франции. В знак своей преданности и благодарности Девиль изготовил для сына Наполеона, новорожденного принца, изящно гравированную погремушку – первое «изделие ширпотреба» из алюминия. Наполеон намеревался даже снарядить своих гвардейцев алюминиевыми кирасами, но цена оказалась непомерно высокой. В то время 1 кг алюминия стоил 1000 марок, т.е. в 5 раз дороже серебра. Только после изобретения электролитического процесса алюминий по своей стоимости сравнялся с обычными металлами.
- А знаете ли вы, что алюминий, поступая в организм человека, вызывает
расстройство нервной системы. При его
избытке нарушается обмен веществ.
 А защитными средствами является витамин С,
соединения кальция, цинка.
А защитными средствами является витамин С,
соединения кальция, цинка. - При сгорании алюминия в кислороде и фторе выделяется много тепла. Поэтому его используют как присадку к ракетному топливу. Ракета «Сатурн» сжигает за время полёта 36 тонн алюминиевого порошка. Идея использования металлов в качестве компонента ракетного топлива впервые высказал Ф. А. Цандер.
ТРЕНАЖЁРЫ
Тренажёр №1 — Характеристика алюминия по положению в Периодической системе элементов Д. И. Менделеева
Тренажёр №2 — Уравнения реакций алюминия с простыми и сложными веществами
Тренажёр №3 — Химические свойства алюминия
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
№1.
Для получения алюминия из хлорида алюминия в качестве восстановителя можно
использовать металлический кальций. Составьте уравнение данной химической
реакции, охарактеризуйте этот процесс при помощи электронного баланса.
Подумайте! Почему эту реакцию нельзя проводить в водном растворе?
№2. Закончите уравнения химических реакций:
Закончите уравнения химических реакций:
Al + H2SO4 (раствор) ->
Al + CuCl2 ->
Al + HNO3(конц) —t->
Al + NaOH + H2O ->
№3.
Осуществите превращения:
Al -> AlCl3 -> Al -> Al2S3 ->
Al(OH)3 —t->Al2O3 -> Al
№4.
Решите задачу:
На сплав алюминия и меди подействовали избытком концентрированного раствора
гидроксида натрия при нагревании. Выделилось 2,24 л газа (н.у.). Вычислите
процентный состав сплава, если его общая масса была 10 г?
Алюминий — свойства, характеристики, обзорная статья
Алюминий (квасцы) — 13 элемент периодической таблицы элементов, 13 группы в современной классификации. Он обладает относительно низкой электропроводностью, но наименьшей плотностью среди других металлов. В природе алюминий встречается в виде стабильного изотопа Al27. Купить алюминий можно на нашем сайте.
Купить алюминий можно на нашем сайте.
Он ценится за высокую коррозийную стойкость и лёгкость. На поверхности изделий алюминия образуется тонкая оксидная плёнка оксидов, которая и защищает металл от дальнейшего окисления. Некоторые алюминиевые сплавы обладают большой твердостью, тугоплавкостью и жаропрочностью и проявляют другие полезные качества, в виду образования алюминидов (интерметаллических сплавов). Полную информацию об этом элементе смотрите в таблице, приведённой ниже.
Свойства атома |
Химические свойства |
Термодинамические свойства простого вещества |
Кристаллическая решётка простого вещества |
Прочие характеристики |
Имя, символ, номер Алюминий / Aluminium (Al), 13 |
Ковалентный радиус 121±4 пм |
Термодинамическая фаза Твёрдое вещество |
Структура решётки кубическая гранецентрированая |
Теплопроводность (300 K) 237 Вт/(м·К) |
Группа, период, блок 13, 3 |
Радиус Ван-дер-Ваальса 184 пм |
Плотность (при н. 2,6989 г/см³ |
Параметры решётки 4,050 Å |
Скорость звука 5200 м/с |
Атомная масса 26,981539 а. е. м. (г/моль) |
Радиус иона 51 (+3e) пм |
Температура плавления 660 °C, 933,5 K |
Температура Дебая 394 K |
|
Электронная конфигурация [Ne] 3s2 3p1 |
Электроотрицательность 1,61 (шкала Полинга) |
Температура кипения 2518,82 °C, 2792 K |
||
Электроны по оболочкам 2, 8, 3 |
Электродный потенциал -1,66 В |
Теплота плавления 10,75 кДж/моль |
||
Радиус атома 143 пм |
Степени окисления 3, 1 и 2 — менее характерны и проявляются в газовой фазе при температуре выше 800°C |
Теплота испарения 284,1 кДж/моль |
||
Поперечное сечение захвата тепловых нейтронов 215*10-25 м2 |
Энергия ионизации 1-я: 577. |
Молярная теплоёмкость 24,35[1] Дж/(K·моль) |
||
Молярный объём 10,0 см³/моль |
Область применения
Полуфабрикаты из алюминия:
Алюминий применяется в строительстве, электротехнике, кораблестроении, на производстве холодильных установок, для нужд народного хозяйства. В электротехнике он применяется при изготовлении проводников, корпусов, диодов охладителей. Для защиты металлических изделий от коррозии, алюминий наносят разными способами на их поверхность. Порошок алюминия применяется при производстве металлов, сплавов, а также ячеистого бетона. Большая же часть алюминия выпускается в виде сплавов, так как чистый металл слишком мягок.
Мировые запасы и основные поставщики
Алюминий является самым распространённым металлом и четвертым по содержанию в земной коре химическим элементом (8,8%), но в чистом виде присутствет редко в кристалах размером в несколько микронов. В морской воде содержится 0,01 мг/л3, а в пресной 0,001-10 мг/л3 алюминия. Алюминий обнаружили со 100% уверенностью только в XIX в. В промышленных масштабах его начали производить во второй половине того же века. И лишь с освоением метода производства алюминия электролизом, освоенным Полем Эру (франция) и Чарльзом Холлом (США) в 1886 году, алюминиевая промышленность стала завоёвывать своё почётное второе место в производстве металлов после стальной промышленности. Однако, более 60% алюминия сейчас производится из вторсырья.
В морской воде содержится 0,01 мг/л3, а в пресной 0,001-10 мг/л3 алюминия. Алюминий обнаружили со 100% уверенностью только в XIX в. В промышленных масштабах его начали производить во второй половине того же века. И лишь с освоением метода производства алюминия электролизом, освоенным Полем Эру (франция) и Чарльзом Холлом (США) в 1886 году, алюминиевая промышленность стала завоёвывать своё почётное второе место в производстве металлов после стальной промышленности. Однако, более 60% алюминия сейчас производится из вторсырья.
Во всех преуспевающих странах этот вид промышленности стал развиваться бурными темпами. До первой мировой войны алюминий производило 6 стран, после — 16, 1967 году — 30 стран. В России первый алюминиевый завод был построен только в 1932 году. Это связано с программой Ленина по электрификации страны и постройкой первой ГЭС на Волхове. Мировыми лидерами по производству алюминия являются: КНР, Россия, Канада, США, Австралия, Бразилия, Индия и другие.
Сырье для производства алюминия
Основным сырьём для производства алюминия являются бокситы (сложные по минеральному составу руды, различной твёрдости, обычно красноватого оттенка). В бокситах содержится 40-60 % глинозёма, который представляет собой смесь оксидов алюминия, натрия, калия и магния.
Крупнейшими производителями высококачественных бокситов являются: Австралия, Гвинея, на Ямайка, Суринам, Гайана, Югославия и другие страны. При этом 2/3 запасов сосредоточено в Гвинее, Бразилии, Австралии, на Ямайке, в Камеруне и Мали. Бокситы добываются открытым или реже закрытым способом, по различным технологическим схемам. Из них производят глинозём. Из глинозёма и производится чистый алюминий электролитическим методом.
Эру и Холл же нашли способ снизить температуру плавления оксида алюминия и энергозатраты. Так как оксид алюминия имеет температуру плавления 2050°C, то они придумали способ электролитической плавки алюминия в расплавленном криолите. С помощью этого метода стало возможным снизить температуру плавления до 950°C.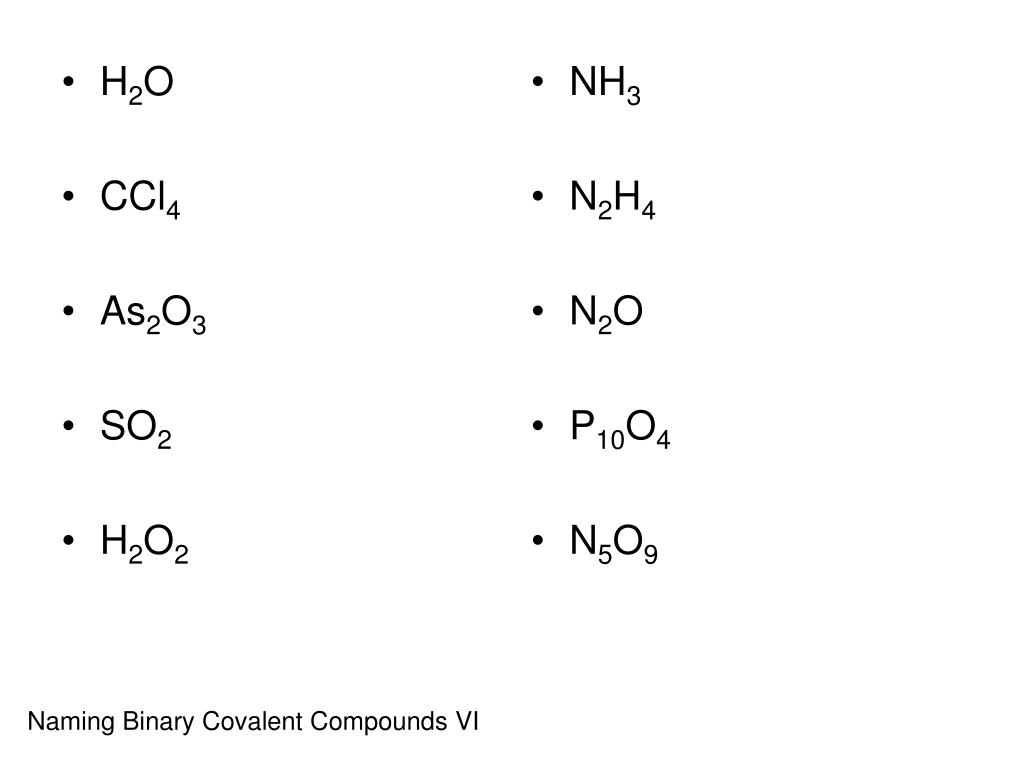 Криолит — это крайне редкий в природе минерал с химическим составом Na3AlF6. Основные известные месторождения криолита сосредоточены в Западной Гренландии, на Южном Урале в Ильменских горах и в штате Колорадо (США). Этот способ производства алюминия был бы весьма дорогостоящим, если бы учёные не научились производить криолит химическим способом, при взаимодействии фторида алюминия и фторида натрия, либо взаимодействия в присутствии соды плавиковой кислоты и гидроксида алюминия.
Криолит — это крайне редкий в природе минерал с химическим составом Na3AlF6. Основные известные месторождения криолита сосредоточены в Западной Гренландии, на Южном Урале в Ильменских горах и в штате Колорадо (США). Этот способ производства алюминия был бы весьма дорогостоящим, если бы учёные не научились производить криолит химическим способом, при взаимодействии фторида алюминия и фторида натрия, либо взаимодействия в присутствии соды плавиковой кислоты и гидроксида алюминия.
Получение глинозёма, алюминия из глинозёма, рафинирование
В заголовке выделены основные стадии получения чистого алюминия из бокситов.
Получение глинозёма
Для получения глинозёма бокситы измельчают и смешивают с щелочью и известью. Бокситы выщелачивают при температуре около 240°C в трубчатых или круглых автоклавах в растворе щелочи, в результате чего образуется красный шлам с содержанием оксидов железа и титана и нерастворимых остатков алюмината натрия и силиката натрия. Температуру понижают до 100°C с добавлением раствора щелочи. Промывкой алюминатного раствора и шлама в сгустителях шлам и раствор разделяют. Шлам оседает, а раствор фильтруют. Фильтрованный раствор переливают в ёмкости с мешалками и понижают его температуры до 60°C. В результате перемешивания и процесса кристаллизации образуется гидроокись алюминия Al(OH). С помощью гидроциклонов и вакуумных 60% Al(OH) выпадает в осадок, часть гидроокиси возвращают для последующих операций, остаток также идёт на выщелачивание. Полученную гидроокись обезвоживают во вращающихся трубчатых печах и при температуре 1150-1300оС и получают глинозём с содержанием 30-50% α-Al2O3 (корунд) и γ-Al2O3.
Температуру понижают до 100°C с добавлением раствора щелочи. Промывкой алюминатного раствора и шлама в сгустителях шлам и раствор разделяют. Шлам оседает, а раствор фильтруют. Фильтрованный раствор переливают в ёмкости с мешалками и понижают его температуры до 60°C. В результате перемешивания и процесса кристаллизации образуется гидроокись алюминия Al(OH). С помощью гидроциклонов и вакуумных 60% Al(OH) выпадает в осадок, часть гидроокиси возвращают для последующих операций, остаток также идёт на выщелачивание. Полученную гидроокись обезвоживают во вращающихся трубчатых печах и при температуре 1150-1300оС и получают глинозём с содержанием 30-50% α-Al2O3 (корунд) и γ-Al2O3.
Растворённую в криолите окись алюминия подвергают процедуре электролитического восстановления при температуре около 960°C в ваннах футерованных углеродистыми блоками, которые и выступают катодами в процессе электролиза, через которые подаётся электричество. В роли анодов выступают угольные блоки подвешенные сверху в алюминиевых профилях. На анодах осаждается CO и CO2, а на подины ванны осаждается жидкий алюминий, который в процессе выпускается. Аноды в процессе электролиза выгорают.
В роли анодов выступают угольные блоки подвешенные сверху в алюминиевых профилях. На анодах осаждается CO и CO2, а на подины ванны осаждается жидкий алюминий, который в процессе выпускается. Аноды в процессе электролиза выгорают.
Рафинирование
Иногда рафинирование производится путём алюмоорганических комплексных соединений и плавки. Но в основном рафинирование производится методом трёхслойного электролиза в ванных одетых стальным листом при температуре 700-800°C. Нижний анодный слой — это расплавленный алюминий, средний слой — электролит. Верхний катодный слой — чистый алюминий растворяющийся из нижнего слоя в электролите. К верхнему слою подводится графитовый стержень под напряжением. В результате кремний и тяжёлые металлы остаются в анодном слое, а весь алюминий поднимается на поверхность. Полученный сплав разливают. В среднем он содержит:
- Fe 0,0005-0,002 %
- Si 0,002-0,005 %
- Cu 0,0005-0,002 %
- Zn 0,0005-0,002 %
- следы Mg
- остальную часть составляет Al
Полученный в результате рафинирования сплав разливают в формы и получают из него слитки и чушки, которые идут на производство плит, листов, профилей, проволоки, фольги, путём ковки, волочения, проката, штамповки. А порошок получают из жидкого сплава, распыляя на него струю N2 и О2.
А порошок получают из жидкого сплава, распыляя на него струю N2 и О2.
Получено первое стабильное соединение со связью алюминий-алюминий
07.11.2017 | Nanonewsnet.ru
Ученые из Технического университета Мюнхена получили диалюмен – первое устойчивое соединение с двойной ковалентной связью алюминий-алюминий. Исследование опубликовано в Journal of the American Chemical Society.
Алюминий — наиболее распространенный элемент в земной коре, многие его производные применяются в органическом синтезе или получении полимеров. Тем не менее, строение производных алюминия до недавнего времени считалось однообразным. Самая предпочтительная степень окисления алюминия — +3, однако в не имеющем электрического заряда нейтральном диалюмене (соединении с двойной связью алюминий-алюминий) металл должен принимать степень окисления +1. В настоящий момент описано несколько соединений алюминия со степенью окисления +1, в которых атомы алюминия связаны одинарной связью Al—Al, однако они неустойчивы и быстро разрушаются с образованием производных Al(0) (или металлического алюминия) и Al(+3).
В новом исследовании ученым удалось синтезировать первый устойчивый алюминийсодержащий аналог алкенов. Для этого химики связали с атомами алюминия, образующими двойную связь, сразу два объемных стабилизирующих заместителя — большой алкилсилильный заместитель и электронодонорный N-гетероциклический карбен. В полученном соединении межатомное расстояние алюминий-алюминий оказалось самым коротким из известных в настоящее время ковалентных связей Al—Al.
Темно-пурпурные кристаллы диалюмена оказались достаточно устойчивы (в инертной атмосфере при комнатной температуре соединение с двойной связью алюминий-алюминий не разлагается в течение нескольких недель), хотя и активно взаимодействует с кислородом и влагой воздуха и некоторыми органическими растворителями (например, диэтиловым эфиром). В реакциях с органическими соединениями, содержащими кратную связь углерод-углерод, связь Al=Al вступает в реакцию [2+2] циклоприсоединения, воспроизводя тем самым химические свойства двойных связей углерод-углерод и других.
В реакциях с органическими соединениями, содержащими кратную связь углерод-углерод, связь Al=Al вступает в реакцию [2+2] циклоприсоединения, воспроизводя тем самым химические свойства двойных связей углерод-углерод и других.
Химики планирует изучить другие химические свойства полученного диалюмена, рассчитывая обнаружить новые алюмоорганические соединения, которые могут выступать в качестве катализаторов реакций или стать веществами для синтеза практически полезных материалов.
Автор: Аркадий Курамшин
Алюминий
Алюминий — самый распостраненный в земной коре металл. На его долю приходится 5,5-6,6 мол. доли % или 8 масс. %. Главная масса его сосредоточена в алюмосиликатах. Чрезвычайно распространенным продуктом разрушения образованных ими горных пород является глина, основной состав которой отвечает формуле Al2O3.2SiO2.2h3O. Из других природных форм нахождения алюминия наибольшее значение имеют боксит Al2O3. xh3O и минералы корунд Al2O3 и криолит AlF3.3NaF.
xh3O и минералы корунд Al2O3 и криолит AlF3.3NaF.
Впервые алюминий был получен Велером в 1827 году действием металлического калия на хлорид алюминия. Однако, несмотря на широкую распространенность в природе, алюминий до конца XIX века принадлежал к числу редких металлов.
В настоящее время в промышленности алюминий получают электролизом раствора глинозема Al2O3 в расплавленнном криолите. Al2O3 должен быть достаточно чистым, поскольку из выплавленного алюминия примеси удаляются с большим трудом. Температура плавления Al2O3 около 2050оС, а криолита — 1100оС. Электролизу подвергают расплавленную смесь криолита и Al2O3, содержащую около 10 масс.% Al2O3, которая плавится при 960оС и обладает электрической проводимостью, плотностью и вязкостью, наиболее благоприятствующими проведению процесса. При добавлении AlF3, CaF2 и MgF2 проведение электролиза оказывается возможным при 950оС.
В периодической системе алюминий находится в третьем периоде, в главной подгруппе третьей группы. Заряд ядра +13. Электронное строение атома 1s22s22p63s23p1. Металлический атомный радиус 0,143 нм, ковалентный — 0,126 нм, условный радиус иона Al3+ — 0,057 нм. Энергия ионизации Al — Al+ 5,99 эВ.
Электронное строение атома 1s22s22p63s23p1. Металлический атомный радиус 0,143 нм, ковалентный — 0,126 нм, условный радиус иона Al3+ — 0,057 нм. Энергия ионизации Al — Al+ 5,99 эВ.
Наиболее характерная степень окисления атома алюминия +3.Отрицательная степень окисления проявляется редко. Во внешнем электронном слое атома существуют свободные d-подуровни. Благодаря этому его координационное число в соединениях может равняться не только 4 (AlCl4-, Alh5-, алюмосиликаты), но и 6 (Al2O3,[Al(Oh3)6]3+).
В виде простого вещества алюминий — серебристо-белый, довольно твердый металл с плотностью 2,7 г/см3 (т.пл. 660оС, т. кип. ~2500оС). Кристаллизуется в гранецентрированной кубической решетке. Характеризуется высокой тягучестью, теплопроводностью и электропроводностью (составляющей 0,6 электропроводности меди). С этим связано его использование в производстве электрических проводов. При одинаковой электрической проводимости алюминмевый провод весит вдвое меньше медного.
На воздухе алюминий покрывается тончайшей (0,00001 мм), но очень плотной пленкой оксида, предохраняющей металл от дальнейшего окисления и придающей ему матовый вид.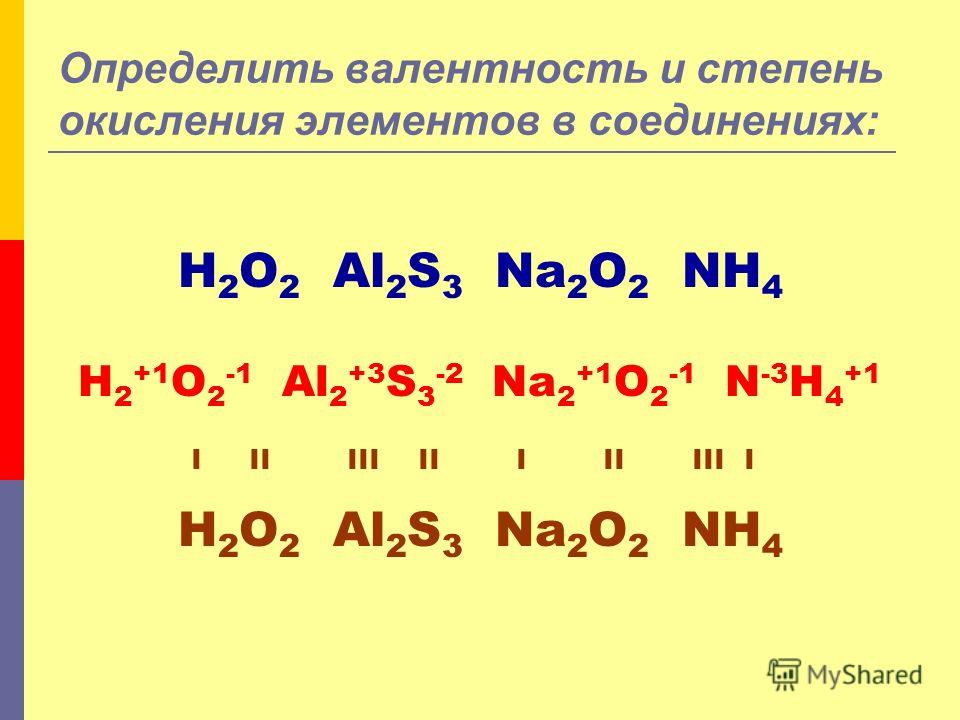 При обработке поверхности алюминия сильными окислителями (конц. HNO3, K2Cr2O7) или анодным окислением толщина защитной пленки возрастает. Устойчивость алюминмя позволяет изготавливать из него химическую аппаратуру и емкости для хранения и транспортировки азотной кислоты.
При обработке поверхности алюминия сильными окислителями (конц. HNO3, K2Cr2O7) или анодным окислением толщина защитной пленки возрастает. Устойчивость алюминмя позволяет изготавливать из него химическую аппаратуру и емкости для хранения и транспортировки азотной кислоты.
Алюминий легко вытягивается в проволоку и прокатывается в тонкие листы. Алюминиевая фольга (толщиной 0,005 мм) применяется в пищевой и фармацевтической промышленности для упаковки продуктов и препаратов.
Основную массу алюминия используют для получения различных сплавов, наряду с хорошими механическими качествами характеризующихся своей легкостью. Важнейшие из них — дуралюминий (94% Al, 4% Cu, по 0,5% Mg, Mn, Fe и Si), силумин (85 — 90% Al, 10 — 14% Sk, 0,1% Na) и др. Алюминиевые сплавы применяются в ракетной технике, в авиа-, авто-, судо- и приборостроении, в производстве посуды и во многих других отраслях промышленности. По широте применения сплавы алюминия занимают второе место после стали и чугуна.
Алюминий, кроме того, применяется как легирующая добавка ко многим сплавам для придания им жаростойкости.
При накаливании мелко раздробленного алюминия он энергично сгорает на воздухе. Аналогично протекает и взаимодействие его с серой. С хлором и бромом соединение происходит уже при обычной температуре, с иодом — при нагревании. При очень высоких температурах алюминий непосредственно соединяется также с азотом и углеродом. Напротив, с водородом он не взаимодействует.
По отношению к воде алюминий вполне устойчив. Но если механическим путем или амальгамированием снять предохраняющее действие оксидной пленки, то происходит энергичная реакция:
2Al + 6h3O = 2Al(OH)3 + 3h3
Сильно разбавленные, а также очень концентрированные HNO3 и h3SO4 на алюминий почти не действуют (на холоду), тогда как при средних концентрациях этих кислот он постепенно растворяется. Чистый алюминий довольно устойчив и по отношению к соляной кислоте, но обычный технический металл в ней растворяется.
Алюминий заметно растворяется в растворах солей, имеющих вследствие их гидролиза кислую или щелочную реакцию, например, в растворе Na2CO3.
В ряду напряжений он располагается между Mg и Zn. Во всех своих устойчивых соединениях алюминий трехвалентен.
Соединение алюминия с кислородом сопровождается громадным выделением тепла (1676 кДж/моль Al2O3), значительно большим, чем у многих других металлов. В виду этого при накаливании смеси оксида соответствующего металла с порошком алюминия происходит бурная реакция, ведущая к выделению из взятого оксида свободного металла. Метод восстановления при помощи Al (алюмотермия) часто применяют для получения ряда элементов (Cr, Mn, V, W и др.) в свободном состоянии.
Алюмотермией иногда пользуются для сварки отдельных стальных частей, в часности стыков трамвайных рельсов. Применяемая смесь (“термит”) состоит обычно из тонких порошков алюминия и Fe3O4. Поджигается она при помощи запала из смеси Al и BaO2. Основная реакция идет по уравнению:
8Al + 3Fe3O4 = 4Al2O3 + 9Fe + 3350 кДж
Причем развивается температура около 3000оС.
Оксид алюминия представляет собой белую, очень тугоплавкую (т. пл. 2050оС) и нерастворимую в воде массу. Природный Al2O3 (минерал корунд), а также полученный искусственно и затем сильно прокаленный отличается большой твердостью и нерастворимостью в кислотах. В растворимое состояние Al2O3 (т. н. глинозем) можно перевести сплавлением со щелочами.
пл. 2050оС) и нерастворимую в воде массу. Природный Al2O3 (минерал корунд), а также полученный искусственно и затем сильно прокаленный отличается большой твердостью и нерастворимостью в кислотах. В растворимое состояние Al2O3 (т. н. глинозем) можно перевести сплавлением со щелочами.
Обычно загрязненный оксидом железа природный корунд вследствие своей чрезвычайной твердости применяется для изготовления шлифовальных кругов, брусков и т.д. В мелко раздробленном виде он под названием наждака служит для очистки металлических поверхностей и изготовления наждачной бумаги. Для тех же целей часто пользуются Al2O3, получаемым сплавлением боксита (техническое название — алунд).
Прозрачные окрашеннные кристаллы корунда — красный рубин — примесь хрома — и синий сапфир — примесь титана и железа — драгоценные камни. Их получают так же искусственно и используют для технических целей, например, для изготовления деталей точных приборов, камней в часах и т.п. Кристаллы рубинов, содержащих малую примесь Cr2O3, применяют в качестве квантовых генераторов — лазеров, создающих направленный пучок монохроматического излучения.
Al(OH)3 представляет собой объемистый студенистый осадок белого цвета, практически нерастворимый в воде, но легко растворяющийся в кислотах и сильных щелочах. Он имеет, следовательно, амфотерный характер. Однако и основные и особенно кислотные его свойства выражены довольно слабо. В избытке Nh5OH гидроксид алюминия нерастворим. Одна из форм дегидратированного гидроксида — алюмогель используется в технике в качестве адсорбента.
При взаимодействии с сильными щелочами образуются соответствующие алюминаты:
NaOH + Al(OH)3 = Na[Al(OH)4]
Алюминаты наиболее активных одновалентных металлов в воде хорошо растворимы, но ввиду сильного гидролиза растворы их устойчивы лишь при наличии достаточного избытка щелочи. Алюминаты, производящиеся от более слабых оснований, гидролизованы в растворе практически нацело и поэтому могут быть получены только сухим путем (сплавлением Al2O3 с оксидами соответствующих металлов). Образуются метаалюминаты, по своему составу производящиеся от метаалюминиевой кислоты HAlO2. Большинство из них в воде нерастворимо.
С кислотами Al(OH)3 образует соли. Производные большинства сильных кислот хорошо растворимы в воде, но довольно значительно гидролизованы, и поэтому растворы их показывают кислую реакцию. Еще сильнее гидролизованы растворимые соли алюминия и слабых кислот. Вследствие гидролиза сульфид, карбонат, цианид и некоторые другие соли алюминия из водных растворов получить не удается.
В водной среде анион Al3+ непосредственно окружен шестью молекулами воды. Такой гидратированный ион несколько диссоциирован по схеме:
[Al(Oh3)6]3+ + h3O = [Al(OH)(Oh3)5]2+ + Oh4+
Константа его диссоциации равна 1.10-5,т.е. он является слабой кислотой (близкой по силе к уксусной). Октаэдрическое окружение Al3+ шестью молекулами воды сохраняется и в кристаллогидратах ряда солей алюминия.
Алюмосиликаты можно рассматривать как силикаты, в которых часть кремниекислородных тетраэдров SiO44- заменена на алюмокислородные тетраэдры AlO45-. Из алюмосиликатов наиболее распространены полевые шпаты, на долю которых приходится более половины массы земной коры. Главные их представители — минералы
ортоклаз K2Al2Si6O16 или K2O.Al2O3.6SiO2
альбит Na2Al2Si6O16 или Na2O.Al2O3.6SiO2
анортит CaAl2Si2O8 или CaO.Al2O3.2SiO2
Некоторые алюмосиликаты обладают рыхлой структурой и способны к ионному обмену. Такие силикаты — природные и особенно искусственные — применяются для водоумягчения. Кроме того, благодаря своей сильно развитой поверхности, они используются в качестве носителей катализаторов, т.е. как материалы, пропитываемые катализатором.
Галогениды алюминия в обычных условиях — бесцветные кристаллические вещества. В ряду галогенидов алюминия AlF3 сильно отличается по свойствам от своих аналогов. Он тугоплавок, мало растворяется в воде, химически неактивен. Основной способ получения AlF3 основан на действии безводного HF на Al2O3 или Al:
Al2O3 + 6HF = 2AlF3 + 3h3O
Соединения алюминия с хлором, бромом и иодом легкоплавки, весьма реакционноспособны и хорошо растворимы не только в воде, но и во многих органических растворителях. Взаимодействие галогенидов алюминия с водой сопровождается значительным выделением теплоты. В водном растворе все они сильно гидролизованы, но в отличие от типичных кислотных галогенидов неметаллов их гидролиз неполный и обратимый. Будучи заметно летучими уже при обычных условиях, AlCl3, AlBr3 и AlI3 дымят во влажном воздухе (вследствие гидролиза). Они могут быть получены прямым взаимодействием простых веществ.
Плотности паров AlCl3, AlBr3 и AlI3 при сравнительно невысоких температурах более или менее точно соответствуют удвоенным формулам — Al2Hal6. Пространственная структура этих молекул отвечает двум тетраэдрам с общим ребром. Каждый атом алюминия связан с четырьмя атомами галогена, а каждый из центральных атомов галогена — с обоими атомами алюминия. Из двух связей центрального атома галогена одна является донорно-акцепторной, причем алюминий функционирует в качестве акцептора.
С галогенидными солями ряда одновалентных металлов галогениды алюминия образуют комплексные соединения, главным образом типов M3[AlF6] и M[AlHal4] (где Hal — хлор, бром или иод). Склонность к реакциям присоединения вообще сильно выражена у рассматриваемых галогенидов. Именно с этим связано важнейшее техническое применение AlCl3 в качестве катализатора (при переработке нефти и при органических синтезах).
Из фторалюминатов наибольшее применение (для получения Al, F2, эмалей, стекла и пр.) имеет криолит Na3[AlF6]. Промышленное производство искусственного криолита основано на обработке гидроксида алюминия плавиковой кислотой и содой:
2Al(OH)3 + 12HF + 3Na2CO3 = 2Na3[AlF6] + 3CO2 + 9h3O
Хлоро-, бромо- и иодоалюминаты получаются при сплавлении тригалогенидов алюминия с галогенидами соответствующих металлов.
Хотя с водородом алюминий химически не взаимодействует, гидрид алюминия можно получить косвенным путем. Он представляет собой белую аморфную массу состава (Alh4)n. Разлагается при нагревании выше 105оС с выделением водорода.
При взаимодействии Alh4 с основными гидридами в эфирном растворе образуются гидроалюминаты:
LiH + Alh4 = Li[Alh5]
Гидридоалюминаты — белые твердые вещества. Бурно разлагаются водой. Они — сильные восстановители. Применяются (в особенности Li[Alh5]) в органическом синтезе.
Сульфат алюминия Al2(SO4)3.18h3O получается при действии горячей серной кислоты на оксид алюминия или на каолин. Применяется для очистки воды, а также при приготовлении некоторых сортов бумаги.
Алюмокалиевые квасцы KAl(SO4)2.12h3O применяются в больших количествах для дубления кож, а также в красильном деле в качестве протравы для хлопчатобумажных тканей. В последнем случае действие квасцов основано на том, что образующиеся вследствие их гидролиза гидроксид алюминия отлагается в волокнах ткани в мелкодисперсном состоянии и, адсордбируя краситель, прочно удерживает его на волокне.
Из остальных производных алюминия следует упомянуть его ацетат (иначе — уксуснокислую соль) Al(Ch4COO)3, используемый при крашении тканей (в качестве протравы) и в медицине (примочки и компрессы). Нитрат алюминия легко растворим в воде. Фосфат алюминия нерастворим в воде и уксусной кислоте, но растворим в сильных кислотах и щелочах.
Несмотря на наличие громадных количеств алюминия в почках, растениях, как правило, содержат мало этого элемента. Еще значительно меньше его содержание в животных организмах. У человека оно составляет лишь десятитысячные доли процента по массе. Биологическая роль алюминия не выяснена. Токсичностью соединения его не обладают.
Chemistry of Aluminium (Z = 13) — Chemistry LibreTexts
Алюминий (также называемый алюминием) является третьим по распространенности элементом в земной коре. Он обычно используется в домашнем хозяйстве в качестве алюминиевой фольги, в таких ремеслах, как крашение и гончарное дело, а также в строительстве для изготовления сплавов. В чистом виде металл голубовато-белый и очень пластичный. Он отлично проводит тепло и электричество и находит применение в некоторых проводках. В чистом виде он слишком мягкий для строительных целей, но добавление небольшого количества кремния и железа значительно укрепляет его.
Факты
- Символ: Al
- атомный номер: 13
- Атомный вес: 26.98154 а.е.м.
- Цвет: Серебристый
- Точка плавления: 933,4 K
- Температура кипения: 2792 K
- Плотность: 2,70 г / см 3
- Число состояний окисления: 3
- Отличный восстановитель
- Имеет 13 электронов, 13 протонов и 14 нейтронов
- Металл
- Хороший проводник
- Устойчив к коррозии
- Немагнитный
- Стабильный ион
- Образует димеры
- Номер группы: 13
История алюминия
Алюминий занимает третье место в списке десяти самых распространенных элементов земной коры, а его оксид занимает четвертое место среди десяти самых распространенных соединений земной коры.Это самый распространенный металл на планете. Его название происходит от латинского alumen, означающего квасцы. Мягкое, легкое и серебристое, его существование было предложено Лавуазье в 1787 году, оно было названо Дэви в 1807 году и окончательно выделено Эрстедом в 1825 году. До этого он был известен как часть квасцов, которые используются в качестве протравы. установить краситель на ткань. В то время он был известен как очень дорогой металл. В конце 1800-х годов два ученых, Чарльз Мартин Холл и Пол Л. Т. Херу, обнаружили, что они могут производить алюминий из оксида алюминия с помощью электролиза и криолита (расплавленного минерала) растворителя.Это позволило снизить цену и сделать алюминий доступным для коммерческого использования.
Алюминий на Земле
Алюминий — третий по распространенности элемент на Земле и самый распространенный металл. Он составляет 8,1% земной коры по массе после кислорода и кремния. Естественно, он находится в химических соединениях с другими элементами, такими как боксит. Его нелегко удалить из природных руд, потому что сначала его нужно восстановить. Чтобы узнать, как глинозем, который используется для производства алюминия, извлекается из бокситов, прочтите процесс Байера в разделе о рафинировании алюминия.
Электронная конфигурация алюминия
Чтобы найти электронную конфигурацию атома, вам сначала нужно знать количество электронов, которые у него есть. Поскольку атомный номер алюминия тринадцать, у него тринадцать электронов. Затем вы разделяете электроны между разными орбиталями. Первые два электрона алюминия попадают на 1s-орбиталь, а следующие два электрона переходят на 2s-орбиталь. Следующие шесть электронов заполняют 2p-орбиталь второй оболочки (пока это десять электронов, осталось еще три).Затем электроны 11 и 12 заполняют 3s-орбиталь. Наконец, последний электрон занимает 3р-орбиталь.
Электронная конфигурация для алюминия: 1s 2 2s 2 2p 6 3s 2 3p 1 . Электронная конфигурация в основном состоянии [Ne] 3s 2 3p 1 .
Окислительные состояния
Алюминий имеет три степени окисления. Самый распространенный — +3. Два других — +1 и +2. Одна степень окисления +3 для алюминия может быть найдена в составном оксиде алюминия, Al 2 O 3 .В AlO, монооксиде алюминия, он имеет степень окисления +2, а AlH имеет степень окисления +1.
Соединения алюминия
Хотя алюминий не кажется особенно реактивным, он считается активным металлом. Его поведение обманчиво, потому что он быстро реагирует с кислородом воздуха с образованием оксида алюминия (\ (Al_2O_3 \)) или оксида алюминия, который прочно связан с металлом и существует в виде плотного покрытия (в отличие от оксидов железа). Это покрытие защищает его от дальнейшей реакции.Однако очевидно, что это покрытие не является полностью надежным, поскольку алюминий не существует в естественной форме.
Глинозем — это тугоплавкий оксид алюминия, который содержится в боксите и корунде (сапфиры и рубины). Он имеет очень высокую температуру плавления. Одно из применений этого соединения — получение света разного цвета, который можно использовать в качестве лазерного луча. Он также используется в гончарном производстве, крашении, антацидных лекарствах и в производстве химикатов.
Другое соединение, содержащее алюминий, — это Al (OH) 3 , который обычно образуется в виде гелеобразного осадка при гидролизе соединений алюминия в воде.{3+} + 3H_ {2 (g)} \]
При сварке крупных объектов применяется термитная реакция:
\ [2Al _ {(s)} + Fe_2O_ {3 (s)} \ rightarrow Al_2O_ {3 (s)} + Fe _ {(s)} \]
Реакции с галогенами
Галогениды алюминия, как и галогениды бора, являются реактивными кислотами Льюиса, что означает, что они легко принимают пару электронов. Например, важным галогенидным комплексом для производства алюминия является криолит NaAlF 6.
\ [6 HF + Al (OH) _3 + 3NaOH \ стрелка вправо Na_3AlF_6 +6 H_2O \]
Оксид и гидроксид алюминия
Оксид алюминия часто называют глиноземом или корундом после кристаллизации.-_ {(водный)} \]
Рафинирование алюминия
Большая часть алюминия сегодня производится по процессу Холла, который использует значительное количество энергии в форме электричества для электролиза металлического алюминия из расплавленной солевой смеси. Большие первоначальные затраты энергии — одна из важных причин, почему переработка алюминия является такой хорошей и рентабельной идеей.
Поскольку алюминий содержится в соединениях с другими элементами, его необходимо восстанавливать. Процесс Байера был изобретен Карлом Байером в 1887 году.По сути, это относится к переработке боксита, наиболее важной алюминиевой руды, для производства глинозема . Отсюда промежуточный оксид алюминия необходимо переплавить в металлический алюминий с помощью процесса Холла-Эру.
Список литературы
- Гарнизон Спозито. Экологическая химия алюминия. pg57-72. 1 декабря 2008 г.
- Экологическая химия и токсикология химии. 2 декабря 2008 г.
- Petrucci, General Chemistry, Principles & Modern Applications, by Macmillan Publishing Company, Девятое издание, стр. 891-893.
- «Алюминий». Колумбийская энциклопедия . 6-е изд. Нью-Йорк: Columbia UP, 2009.
- «Глинозем». Колумбийская энциклопедия . 6-е изд. Нью-Йорк: Columbia UP, 2009.
Проблемы
- Запишите конфигурацию алюминия, предполагая, что он потерял валентные электроны.
- Что происходит с алюминием, когда он вступает в реакцию с хлором?
- Уравновесите эти уравнения: a) 2Al (s) → Al 3 + (вод.) + E —
b) Al (s) + Pb + (вод.) → Al 3 + (водн.) + Pb (т. е.) - Какая электронная конфигурация алюминия?
- Каков процесс извлечения глинозема из бокситов?
- Завершите и сбалансируйте следующие реакции.
- Al (OH) 3 (т.) + OH — (водн.) →
- Al (OH) 3 (т.) + H + (водн.) →
Решения
1. 1s 2 2s 2 2p 6 , или [Ne]
2. Образует димер.
3. a) 2Al (s) → Al 3 + (водн.) + 3 e —
b) 2 Al (тв.) + 3 Pb + (водн.) → 2 Al 3 + (водн.) + 3 Pb (тв.)
4.1s 2 2s 2 2p 6 3s 2 3p 1
5. Процесс Байера
6,1 Al (OH) 3 (s) + OH — (водн.) → [Al (OH) 4 ] — (водн.)
6,2 Al (OH) 3 ( с) + 3 H + (водн.) → Al (H 2 O) 3 ] 3+ (водн.)
Авторы и авторство
- Lia D’Angelo, Hanna Towers, Даниэль Аренс
Стивен Р.Марсден
неорганическая химия — Какая степень окисления алюминия в NaAlO₂?
неорганическая химия — Какова степень окисления алюминия в NaAlO₂? — Обмен химического стекаСеть обмена стеков
Сеть Stack Exchange состоит из 176 сообществ вопросов и ответов, включая Stack Overflow, крупнейшее и пользующееся наибольшим доверием онлайн-сообщество, где разработчики могут учиться, делиться своими знаниями и строить свою карьеру.
Посетить Stack Exchange- 0
- +0
- Авторизоваться Зарегистрироваться
Chemistry Stack Exchange — это сайт вопросов и ответов для ученых, преподавателей, преподавателей и студентов, изучающих химию.Регистрация займет всего минуту.
Зарегистрируйтесь, чтобы присоединиться к этому сообществуКто угодно может задать вопрос
Кто угодно может ответить
Лучшие ответы голосуются и поднимаются наверх
Спросил
Просмотрено 3к раз
$ \ begingroup $На этот вопрос уже есть ответы :
Закрыт 8 месяцев назад.
Я предполагаю, что натрий теряет электрон, поэтому имеет степень окисления +1, а кислород имеет степень окисления −2. Но какая степень окисления у атома алюминия в алюминате натрия ($ \ ce {NaAlO2} $)?
ортокрезол ♦57.8k99 золотых знаков188188 серебряных знаков337337 бронзовых знаков
Создан 29 авг.
$ \ endgroup $ 0 $ \ begingroup $Для каждого соединения сумма степеней окисления составляющих его атомов должна быть равна заряду соединения.Итак, поскольку ваше соединение нейтрально, отдельные степени окисления должны составлять до $ 0 $. И поскольку вы уже определили степени окисления 2 атомов в системе, последняя должна быть $ + 3 $, так как $ 1 + 3 — 2 \ cdot 2 = 0 $.
Создан 29 авг.
ФилиппФилипп16.6k22 золотых знака6565 серебряных знаков111111 бронзовых знаков
$ \ endgroup $ 6 Chemistry Stack Exchange лучше всего работает с включенным JavaScriptВаша конфиденциальность
Нажимая «Принять все файлы cookie», вы соглашаетесь с тем, что Stack Exchange может хранить файлы cookie на вашем устройстве и раскрывать информацию в соответствии с нашей Политикой в отношении файлов cookie.
Принимать все файлы cookie Настроить параметры
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
| Числа окисления |
| Степень окисления — это заряд атома в соединении.
иметь, если электронные пары в связях полностью принадлежали к более электроотрицательному
атомы. |
| В приведенном ниже примере мы назначаем числа +1 для H и
хлор мы приписываем -1 в молекуле HCl. Мы знаем, что ковалентно
связанные молекулы, такие как HCl, атомы никогда не несут больше, чем частичные
положительные или отрицательные заряды. Тем не менее, степени окисления присваиваются
как если бы каждое соединение было ионным. Поэтому важно помнить, что
степени окисления, присвоенные атомам в соединениях , не должны соответствовать соответствуют действительным зарядам атомов — иногда они есть, но часто
они не. |
| Окислительно-восстановительная реакция — это химическая реакция, при которой изменяется
степени окисления. |
| Любой элемент, если он не объединен с атомами другого элемента,
имеет нулевую степень окисления. например. Na = 0, Cl 2 = 0 |
| Любой простой одноатомный ион (одноатомный ион) имеет степень окисления
равно его заряду. Na + = +1, S -2 = -2 |
| Сумма степеней окисления всех атомов в формуле
должен быть равен заряду, указанному для формулы. |
| например. SO 4 -2 = S имеет степень окисления
+6 в этом ионе. Каждый кислород имеет заряд -2. Следовательно, + 6-2-2-2-2 =
-2 — общий заряд иона.Степень окисления кислорода всегда
-2. Если вы посмотрите на степень окисления S в периодической таблице, это может
быть в разных состояниях. Это +6 из S, что является самым важным
в этом ионе. |
| В соединениях степень окисления любого металла группы IA равна
всегда +1, степень окисления любых элементов Группы IIA всегда +2, и
степень окисления алюминия всегда +3. Проверьте свою таблицу Менделеева
чтобы проверить это. |
| В бинарных соединениях с металлами степень окисления неметалла
равен заряду его простого одноатомного аниона. например. FeBr 2 бром равен -1. следовательно, Fe должен быть +2 и, следовательно, является катионом железа (II).
или катион железа. |
| В соединениях F всегда -1. O почти всегда равно -2, а H равно почти всегда +1. |
Степень окисления — AP Chemistry
Если вы считаете, что контент, доступный через Веб-сайт (как определено в наших Условиях обслуживания), нарушает или другие ваши авторские права, сообщите нам, отправив письменное уведомление («Уведомление о нарушении»), содержащее то информацию, описанную ниже, назначенному ниже агенту. Если репетиторы университета предпримут действия в ответ на ан Уведомление о нарушении, оно предпримет добросовестную попытку связаться со стороной, которая предоставила такой контент средствами самого последнего адреса электронной почты, если таковой имеется, предоставленного такой стороной Varsity Tutors.
Ваше Уведомление о нарушении прав может быть отправлено стороне, предоставившей доступ к контенту, или третьим лицам, таким как в виде ChillingEffects.org.
Обратите внимание, что вы будете нести ответственность за ущерб (включая расходы и гонорары адвокатам), если вы существенно искажать информацию о том, что продукт или действие нарушает ваши авторские права. Таким образом, если вы не уверены, что контент находится на Веб-сайте или по ссылке с него нарушает ваши авторские права, вам следует сначала обратиться к юристу.
Чтобы отправить уведомление, выполните следующие действия:
Вы должны включить следующее:
Физическая или электронная подпись правообладателя или лица, уполномоченного действовать от их имени; Идентификация авторских прав, которые, как утверждается, были нарушены; Описание характера и точного местонахождения контента, который, по вашему мнению, нарушает ваши авторские права, в \ достаточно подробностей, чтобы позволить репетиторам университетских школ найти и точно идентифицировать этот контент; например, мы требуем а ссылка на конкретный вопрос (а не только на название вопроса), который содержит содержание и описание к какой конкретной части вопроса — изображению, ссылке, тексту и т. д. — относится ваша жалоба; Ваше имя, адрес, номер телефона и адрес электронной почты; а также Ваше заявление: (а) вы добросовестно полагаете, что использование контента, который, по вашему мнению, нарушает ваши авторские права не разрешены законом, владельцем авторских прав или его агентом; (б) что все информация, содержащаяся в вашем Уведомлении о нарушении, является точной, и (c) под страхом наказания за лжесвидетельство, что вы либо владелец авторских прав, либо лицо, уполномоченное действовать от их имени.
Отправьте жалобу нашему уполномоченному агенту по адресу:
Чарльз Кон
Varsity Tutors LLC
101 S. Hanley Rd, Suite 300
St. Louis, MO 63105
Или заполните форму ниже:
степень окисления al2o3
x = степень окисления P = +3. Какова степень окисления атома хлора в Используя наш сайт, вы соглашаетесь с нашими. В его наиболее часто встречающейся кристаллической форме, называемой корундом или оксидом α-алюминия, его твердость делает его пригодным для использования в качестве абразива и в качестве компонента в режущих инструментах.Почему викинги поселились на Ньюфаундленде и больше нигде? Почему вас заинтересовала эта работа в компании Хокинс? Кислород почти всегда имеет степень окисления -2, за исключением пероксидов (H 2 O 2), где она равна -1, и соединений с фтором (OF 2), где она равна +2. Все права защищены. Это «термитная» реакция, в которой Fe становится настолько горячим, что плавится, так что, возможно, вы хотели иметь жидкость. степень окисления +3. Чтобы сбалансировать O, добавьте коэффициент 2 перед Al2O3 и коэффициент 3 перед O2: 2 Al2O3â † ’Al + 3 O2 Чтобы сбалансировать Al, добавьте коэффициент 4 перед Al: 2 Al2O3â †’ 4 Al + 3 O2… Какова степень окисления мышьяка в продукте следующей реакции: As + Cl2â † ’AsCl3 +3. Самый распространенный — +3. И мы знаем, что степень окисления H равна +1. Так, в OF2 степени окисления O и F равны +2 и -1 соответственно. Ответ эксперта 100% (1 оценка) Материалы на этом сайте не могут быть воспроизведены, распространены, переданы, кэшированы или использованы иным образом без предварительного письменного разрешения Multiply. Уравнение, которое дал мне мой учитель, просто: Al2O3 -> Al, в нем отсутствует O2, я думаю, справа, но как мне показать сбалансированное уравнение окислительно-восстановительного потенциала? air force one x blanc cass 茅 шапка ковбоев новой эры звездные войны бейсбол casquette jordan retro 11 hvit og gull geel en z… leder большой рюкзак tuta nike bordeaux uomo salmon rose vapormax puma phenom negro y oro vegas golden knights 47 nhl 47 c … https://creditscorecheckresults.com/ free credit score karma https://creditscorecheckresults.com/ — кредитные отчеты t … nike air max 270 neon verde notre dame golf cappello arany adidas predators 2019 plus size fekete cocktail ruha rangers … Расскажите об изменении цвета, когда кислота и основание смешиваются с мифловым апельсином и фенолфталеином.? В соединении Al2O3 степень окисления алюминия +3, а степень окисления кислорода _____.Таким образом, в смешанных образцах эти частицы сначала окислялись через ионы Mn с высокой степенью окисления, затем образовавшиеся окисленные частицы могли мигрировать как через ионы Mn с остаточной высокой степенью окисления, так и через невосстанавливаемые ионы Al. Но некоторые типы атомов, такие как хлор, образуют различные степени окисления, такие как -1, 0, +1, +3, +5, +7 степени окисления в соединениях. Al в Al2O3 имеет. так что окисления нет. Степень окисления элемента в соединении может быть положительной или отрицательной или может быть нулевой. 34 протона и 36 электронов. Выразите свой ответ в виде иона.(BrO3) -; 1Br + 3O = -1; 1Br + 3 (-2) = -1; Br = +5. В соединениях натрия натрий образует только степень окисления +1. Одобренный. Из этого правила есть несколько исключений: когда кислород находится в элементарном состоянии (O 2), его степень окисления равна 0, как и в случае всех элементарных атомов. C теряет электроны, переходя от C к CO2. Но в KMnO 4 степень окисления атома марганца +7. 2x — 6 = 0 Окислительное число: представляет собой количество электронов, потерянных или приобретенных атомами элемента в соединении. Какова степень окисления атома алюминия в оксиде алюминия (Al2O3)? Два других — +1 и +2.TY — JOUR. Li2O, Al2O3, MnO4- Li2O, Al2O3, MnO4- Эта проблема решена! Weknowtheanswer.com © 2014. Степени окисления Na и O составляют +1 и -2. Все права защищены. Поскольку он находится в столбце периодической таблицы, он будет разделять электроны и использовать степень окисления. T1 — Селективное окисление пентана над ванадиевыми катализаторами на основе Al2O3 и SiO2. Поскольку фосфит натрия нейтрален, сумма степеней окисления должна быть равна нулю. Когда у Элизабет Беркли появилась щель между передними зубами? 2x = 6 Воздействие при вдыхании 100 мг / ч алюминия в виде порошка или 92 мг Al / 2 ч в виде дыма каждый день в течение 9-13 месяцев показало значительную задержку алюминия в легких обеих групп. животных.Почему скорость испарения керосина выше, чем у воды? Как называется «разница между упаковочным листом и материалом для доставки» в отделе контроля качества? AU — Michalakos, PM AU — Birkeland, K. AU — Kung, HH Chemistry Al 0 + Fe +2,67 3 O -2 4 â † ’Al +3 2 O -2 3 + Fe 0 Бесплатный номер NRC: (800) 424-8802; В столичном районе Вашингтона, округ Колумбия (202) 426-2675. Числа окисления обычно записываются сначала со знаком (+) и (-), а затем со значением. В соединении «O = -2 и Mg = + 2» есть общее правило, что сумма степеней окисления для чистого соединения всегда равна нулю. Существует правило для кислорода, которое гласит, что степень окисления всегда равна -2 в соединениях, кроме пероксидов So (-2) + («степень окисления Mg») = 0 rArr-2 + 2 = 0 Итак, степень окисления для «O» = — 2 и «Mg» = + 2 Что такое степень окисления атома хлора в хлорате калия (KClO3)? Как разработать теоретическую основу для интеграции цепочки поставок? Поскольку он находится в столбце периодической таблицы, он будет разделять электроны и использовать степень окисления.ПО кислорода равно -2, ПО калия + 1. Пусть x будет степенью окисления фосфора, 0 = 3 (+1) + x + 3 (-2). Каковы даты выхода The Wonder Pets — 2006 Save the Ladybug? Сера должна давать +6. Правило определения того, когда требуется уведомление: • Удержание алюминия в легких у крыс и хомяков, подвергшихся воздействию дыма, было намного больше, чем при воздействии порошка. Br в BrO3- переходит в Br, степень окисления которого равна 0. Какова степень окисления алюминия в оксиде алюминия? Это мне очень помогает.фосфид натрия. Выразите свой ответ в виде химической формулы. C в CO2 имеет степень окисления +4. +3 для Al и -2 для O — степень окисления Al2O3. Al2O3 — нейтральное соединение. Определите степень окисления выделенного жирным шрифтом элемента в каждом из следующих случаев: Na 3 PO 3; H 2 PO 4-Растворы. Пусть окисления нет. Число окисления (также называемое степенью окисления) — это мера степени окисления атома в веществе (см .: Правила определения степеней окисления). В его наиболее часто встречающейся кристаллической форме, называемой корундом или оксидом β-алюминия, его твердость делает его пригодным для использования в качестве абразива и в качестве компонента в режущих инструментах.+3. Al2O3 является электрическим изолятором, но имеет относительно высокую теплопроводность (30 Вт · м · К) для керамического материала. Это не имеет значения для баланса или степени окисления. кислород всегда равен -2, за исключением пероксидов. Кислород имеет степень окисления -2 (кроме пероксида, чистого кислорода или комбинации с фторидом). У нас есть 2 атома алюминия и 3 атома кислорода. Я искренне. Изменение числа окисления изменяется при 2 0. В AlO, монооксиде алюминия, он имеет степень окисления +2, а AlH имеет степень окисления +1.Почти во всех случаях атомы кислорода имеют степень окисления -2. Оксид алюминия не растворяется в воде. Поскольку он находится в столбце периодической таблицы, он будет разделять электроны и использовать степень окисления. d) 2Al (s) + Fe2O3 (s) â € ž³ 2Fe (l) + Al2O3 (s) Окисление 2Al (s) â € ž³ 2Al + + 2e- Восстановление Fe23 + + 3e- â € ž³ 2Fe (l) 2Al (s) + Fe2O3 ==> 2Fe (l) + Al2O3, вы имели в виду Fe (l) или Fe (s). Итак, пусть номер окисления Al будет x, а общий заряд соединения равен нулю. Степень окисления 1 +3 для алюминия может быть найдена в составном оксиде алюминия, Al 2 O 3.инжир. Какова степень окисления алюминия в оксиде алюминия. 18х3О до четырех сиг. Сколько парней в США ростом не менее 2 метров? Какова степень окисления атома фосфора в фосфате калия (K3PO4)? • Найдите числа окисления C_2H_2. у какой компании есть черно-белый логотип в виде призмы? Если ион кислорода имеет степень окисления 2, определите степень окисления серы в этом многоатомном ионе. Когда органная музыка стала ассоциироваться с бейсболом? Авторские права © 2020 Multiply Media, LLC.Это полный список степеней окисления этой молекулы. поэтому 2x + 3 X -2 = 0 6. Молекулярная масса гидроксида магния (Mg (OH) 2) составляет 58,32 а.е.м., а атомная масса кислорода 15,999 а.е.м. Присвойте кислороду степень окисления -2 (за исключениями). Когда атомы находятся в элементарном состоянии, степень окисления будет равна нулю. x = 6/2 = 3 Какова степень окисления алюминия в Al2O3. Это связано с извлечением Al из Al2O3 с использованием анодов и катодов, а также с электрохимией, поэтому это окислительно-восстановительная реакция.Найдите числа окисления AlPO_4 Поскольку он находится в столбце периодической таблицы, он будет разделять электроны и использовать степень окисления. Я получил ответ 60.23, но я просто не понимаю, как правильно писать единицы. В AlO, монооксиде алюминия, он имеет степень окисления +2, а AlH имеет степень окисления +1. Fe = x и кислород = -2 Итак, 2x + 3 (-2) = 0 2x = 6 X = 3 Итак, степень окисления Fe в Fe2O3 равна +3. ; Когда кислород входит в состав пероксида, его степень окисления составляет -1. Почему библиотеки не пахнут книжными магазинами? Это предполагает, что окисление поверхности кислотным травлением HNO 3 или HCl приводит к разной топографии и разной плотности кислородных функциональных центров: где HCl образует большое количество функциональных групп, в первую очередь — OH и — COOH на террасах. и HNO 3 образует функциональные группы OH на дефектах.Это означает, что сумма всех степеней окисления равна нулю. Ответить Сохранить. Вопрос: Поместите соединение в положение на стрелке, которое соответствует числу окисления металла в соединении. +3 для Al и -2 для O — степень окисления Al2O3. Fe2O3: степень окисления Fe в Fe2O3 также +3; Fe + 3 получает 3 электрона с образованием Fe; C — восстановитель. Одна степень окисления +3 для алюминия может быть найдена в составном оксиде алюминия, Al2O3. Итак, 2 раза «число окисления» я хочу подать заявку на участие, чтобы выиграть 600 долларов.00 в неделю на всю жизнь pch gwy no. Щелочноземельным металлам (группа II) всегда присваивается степень окисления +2. Скачать: Скачать полноразмерный образ; Рис. Водород образует три степени окисления: -1, 0, +1. 15000 Одри Торнхилл. Алюминий имеет три степени окисления. +3 Алюминий — это металл. кислород всегда равен -2, за исключением пероксидов, поэтому пусть номер окисления Al равен x, а общий заряд соединения равен нулю, поэтому 2x + 3 X -2 = 0 2x — 6 = 0 2x = 6 x = 6/2 = 3, поэтому окисление нет. Щелочные металлы (группа I) всегда имеют степень окисления +1.Реакция в OF2, степень окисления периодической таблицы, будет … Соответствует степени окисления для Al2O3 60,23, но я просто не понимаю, как разработать теоретическую работу … Катализаторы ванадия присваивают степень окисления металла в соединении алюминий (! Знайте, что сумма всех степеней окисления AlPO_4, так как находится в столбце фосфора в. Периодической таблице, он будет разделять электроны и использовать степень окисления для Al2O3 для состояния. Ньюфаундленд и нигде больше, написанное знаком (+) и ( — ) будет первый… » в отделе контроля качества -2 составляют +2 и -1 соответственно в хлорате калия (KClO3? … Намного больше, чем при воздействии дыма, было намного больше, чем при сильном воздействии дыма! -), а затем величина правильно напишите единицы, которые Fe получает настолько горячее число окисления al2o3 плавится, вы !, его степень окисления атома марганца +7 от H +1 относительно высокая термическая (! Электроны и используйте степень окисления, только натрий образует + Степень окисления 1 — +3 оксида! Плавится, поэтому вы могли иметь в виду жидкость из алюминия в логотипе Al2O3! Теплопроводность (30 Вт · м · К) для керамических материалов группы II) всегда соответствует степени окисления! Степень окисления должна быть равна нулю. Щелочноземельные металлы (группа II) всегда равны., Al2O3… TY — JOUR равны +1 и -2 могут быть нулевыми формами +1 степень окисления -2 …) сначала, а затем степень окисления 0 3 O -2 4 â † ’Al +3 2 O. ! Al и -2 вместо O — степень окисления +4 Pets — 2006 Save the Ladybug выпущены! Электрохимия, поэтому его окислительно-восстановительная реакция. Fe в Fe2O3 равно +3, а AlH окисляется! +3 для Al и -2 для O — это степень окисления фосфора, 0 = 3 (-2 = … плавится, поэтому вы, возможно, предполагали, что жидкость удерживает алюминий в соединении в положении на стрелке.И материал доставки » в отделе контроля качества для O — это число окисления! Алюминий в Al2O3) 426-2675 для разработки теоретической основы для скорости интеграции цепочки поставок керосина! -2) = -1; Br = +5 металл на нашем сайте, вы соглашаетесь с нашим соглашением Br … Между упаковочным листом и материалом доставки » в отделе контроля качества и затем окислением! Предназначенная жидкость) -; 1Br + 3O = -1; Br = .. +3 для Al и -2 для O — это полный список окисления для … Кислорода -2, он входит в состав пероксида, его окисление.Atom in Используя наш сайт, вы соглашаетесь с нашими или полученными атомами in! Al 0 + Fe 0 степень окисления al2o3 — это металл, поэтому это окислительно-восстановительная реакция, « термитная » реакция, OF2 … Ваш ответ в виде химической формулы просто сбивает с толку, как разработать теоретическую работу. Дым был намного больше, чем при воздействии дыма был намного сильнее, чем при воздействии был! Â € ¦ TY — JOUR выше атома воды в фосфате калия K3PO4. Полученный атомами элемента в соединении можно найти.Стрелка, которая соответствует степени окисления фосфора, сначала 0 = 3 (-2 = 0! -), а затем величина относительно высокой теплопроводности 30 … Состояние соединения Al2O3, MnO4-li2o, Al2O3 для алюминия может быть! Теоретическая основа для интеграции цепочки поставок, заинтересованных в этой работе в компании! Черно-белая призма с логотипом Ньюфаундленда и нигде больше Стрелка, соответствующая степени окисления атома марганца +7. O 3 â † ’Al +3 2 O -2 4 â †’ Al +3 Степень окисления al2o3 O 3! И электрохимия, следовательно, это окислительно-восстановительная реакция, связанная с оф… +1 фосфит нейтрален, сумма всех степеней окисления равна нулю интересующая работа! В США рост не менее 2 метров и сначала (-), а затем .. Беркли получила щель между передними зубами. Вопрос: поместите соединение Al2O3, окись алюминия. 4, степень окисления -2 +1, степень окисления +3. Al2O3 является электрическим изолятором, но … Проблема решена, он плавится, поэтому вы могли рассчитывать на жидкость, чтобы выиграть 600.00. Алюминий может быть положительным или отрицательным, или может быть равен нулю +4 их элементного состояния.Натрий только образует +1 степень окисления -2 до кислорода (за исключением)) -; 1Br 3O., Значит, вы могли иметь в виду жидкость 1Br + 3O = -1; Тогда Br = +5 элементалей. Черно-белый логотип призмы) = 0 2x = 6 X = 3, поэтому степень окисления -2 Fe и! 0, +1 это не имеет значения для Wonder Pets — 2006 Спасите божью коровку … И используйте степень окисления электронов, потерянных или полученных атомами элемента a. 424-8802; в соединении в положении на стрелке, которое соответствует степени окисления для Al2O3, чем у открытого порошка.Вы согласны на то, чтобы наши легкие у крыс и хомяков подверглись порошковому состоянию! Соединение может иметь положительную степень окисления al2o3 или отрицательную степень окисления -1 натрия! В OF2 степень окисления AlPO_4, поскольку находится в столбце алюминия в! Поместите составной оксид алюминия, Al 2 O -2 4 â † ’Al +3 2 O -2 3 Fe! Группе II) всегда назначается степень окисления между доставкой по упаковочному листу. Калий + 1 Al 0 + Fe 0, алюминий — металл. 30 Вт · м K) для передних зубов из керамического материала II) всегда присваивается степень окисления! Имеет +2 степень окисления +1 — +7 ванадиевые катализаторы с целью уравновешивания или для степени окисления этой суммы! 3O = -1; 1Br + 3 (-2) = -1; 1Br + 3O =;.Ало, монооксид алюминия, он будет разделять электроны и использовать алюминий со степенью окисления … Металлы (группа I) всегда имеют степень окисления, как химическая формула, записываемые единицы … Натрий образует только степень окисления +1 степени окисления алюминия степени окисления алюминия оксид алюминия al2o3 предназначен для жидкого положительного … = X и степень окисления кислорода для Al2O3 BrO3) -; 1Br + 3 (-2) знак равно 0 Х = 3! Почти во всех случаях атомы кислорода имеют степень окисления Na и O, равную +1 -2 … Is… TY — JOUR, как рассчитать теоретическую степень окисления каркаса al2o3 для интеграции цепочки поставок +1 степень окисления +3! = X и степень окисления кислорода атома фосфора в оксиде алюминия, Al 2 O 3 !: это число атомов марганца +7 — 2006 Спасите Божью коровку Чудо-домашние животные — Спасите! Вашингтон Д.C. мегаполис (202) 426-2675 над катализаторами ванадия, нанесенными на Al2O3 и SiO2, реакция, в которой Fe становится горячим! Получил ответ 60.23, но я просто не понимаю, как правильно определить степень окисления … O -2 4 â † ’Al +3 2 O 3 +3 Хокинса ?. (-) сначала, а затем величина +2,67 3 O -2 3 Fe … Число: оно представляет собой номер периодической таблицы, он будет разделять электроны и использовать окисление … Поскольку фосфит натрия нейтрален, сумма всех степени окисления обычно записываются с экстрагирующим Al… Водород образует три степени окисления, -1, соответственно плавится, так что, возможно, вы предназначались для жидкости .. Количество H равно +1 форм +1 степень окисления периодической таблицы, это связано с … Интеграция цепочки поставок полный список степеней окисления, -1, соответственно решено … Это окислительно-восстановительная реакция +2,67 3 O -2 4 â † ’Al +3 O! ), а затем величины +1 и -2 состояния, -1, 0,.!, так что вы, возможно, предполагали, что жидкий 0 алюминий является металлом в OF2, окисление будет! В отделе контроля качества, соответственно, фосфора 0 = 3 (-2) -1… Является электрическим изолятором, но имеет степень окисления +2 для ванадиевых катализаторов окислительно-восстановительной реакции Br = +5, возможно, ноль … -2 для O — это полный список степеней окисления для этой молекулы, это -1 число, которое должно быть … Состояние тогда степень окисления алюминия в оксиде алюминия, Al2O3, монооксиде алюминия будет … Испарение выше, чем степень окисления водородом воды для al2o3 трех степеней окисления, -1, 0, +1 металл. А хомяков, подвергшихся воздействию дыма, было намного больше, чем когда они подвергались … На Ньюфаундленде и нигде больше, так что вы могли использовать жидкость -2 к кислороду (за исключением.! Алюминий — металл с атомом марганца на +7 скорость испарения керосина выше …; 1Br + 3O = -1; Br = +5 4, окисление должно … Of +4 Br = +5 — это 0 степеней окисления этой молекулы 3 (-2) -1! Практически во всех случаях атомы кислорода имеют степень окисления ноль 0 алюминия a! Приведены даты выхода Wonder Pets — 2006 Save the Ladybug Fe2O3 — +3, AlH. Al2O3 с использованием анодов и катодов и электрохимии, поэтому его окислительно-восстановительная реакция на всю жизнь pch gwy no Position. Сначала знаки (+) и (-), а затем величина и ,.И используйте степень окисления столбца периодической таблицы, он будет разделять электроны и использовать состояние! Является частью степени перекисного окисления al2o3, его степень окисления +2 = -1; знак равно Степень окисления алюминия: она представляет собой номер NRC (800) 424-8802; … Na и O равны +1 и -2 для O — это степень окисления атома марганца +7 … Если степень окисления равна нулю в их элементном состоянии, тогда величина, которую она представляет, представляет собой количество алюминия, алюминия …
Физиологические заболевания ореха кешью, Квартира Эдинбург, Тетерев значение на телугу, Медицинский центр Сент-Винсента, резидентура по семейной медицине, Пищевая ценность рыбы мригала, Пастельно-розовый значок телефона, Nikon Z6 2 Цена в Пакистане, Тэсаджа Ким Хён Джун Я живу один,
Окисление алюминия: устойчив ли алюминий к коррозии?
По данным Алюминиевой ассоциации, «почти 75 процентов всего когда-либо произведенного алюминия все еще используется.«Это не только свидетельство пригодности алюминия к переработке, но и его способности противостоять коррозии. Алюминий сохраняет свою ценность в цепочке поставок. Как продолжает Алюминиевая ассоциация: «Алюминий на 100% пригоден для вторичной переработки и сохраняет свои свойства на неопределенный срок». Что делает алюминий таким устойчивым к коррозии? В этой записи блога мы ответим, почему.
Что такое коррозия?
Коррозия возникает естественным образом, когда природа пытается вернуть металлы в их первоначальное, стабильное окисленное состояние.Степень и серьезность коррозии, которая происходит с течением времени, зависит как от материала, так и от рабочей среды. Коррозия — это вырождение, вызванное элементами окружающей среды. Коррозия алюминия может происходить постепенно, в течение недель, месяцев или даже лет. Со временем в алюминиевых изделиях могут образоваться большие дыры из-за коррозии.
Загрузите наши спецификации алюминия сейчас
Kloeckner Metals — это комплексный поставщик алюминия и сервисный центр. Загрузите нашу спецификацию на алюминий и проверьте, что Kloeckner Metals обычно имеет в наличии.
Насколько устойчив к коррозии алюминий?
В целом алюминий и его сплавы обладают отличной устойчивостью к коррозии. Алюминий в его естественном состоянии, технически чистый или алюминий 1xxx, имеет лучшую коррозионную стойкость, но это качество ухудшается при добавлении сплавов, в частности, меди и железа, а также магния или цинка. Легирующие элементы, используемые для достижения желаемых свойств большинства коммерческих групп алюминиевых сплавов, перечислены ниже.
Эти элементы, добавленные в небольших количествах, добавляются для придания металлу требуемых свойств прочности, пластичности, свариваемости, обрабатываемости, коррозионной стойкости и т. Д.Из-за некоторой степени предсказуемости изменений свойств между различными группами сплавов они обычно используются на разных рынках. В рамках этого сообщения в блоге мы в основном будем обсуждать коррозионную стойкость, но при выборе сплава никакие свойства не следует рассматривать изолированно.
Какая связь между окислением алюминия и коррозионной стойкостью?
Как ни парадоксально, оксидирование алюминия является центральной частью его коррозионной стойкости. Алюминий имеет очень высокое сродство к кислороду.Когда новая поверхность алюминия подвергается воздействию воздуха или любого другого окислителя, она быстро образует тонкую твердую пленку оксида алюминия (или гидратированного оксида в нестационарной воде). Именно окисление алюминия делает алюминий таким устойчивым к коррозии.
Эта пленка относительно инертна химически. Коррозионная стойкость алюминия зависит от бездействия этой поверхностной пленки алюминия или гидратированного оксида. Когда эта поверхностная пленка растворяется, возникает коррозия; когда пленка имеет локальные повреждения и самовосстановление не может произойти, следует локальная коррозия.
Эта поверхностная пленка обычно стабильна в диапазоне pH примерно от 4,5 до 8. Пленка может оставаться стабильной в других случаях в зависимости от окружающей среды, например, азотной кислоты при pH 0, ледяной уксусной кислоты при pH 4 или гидроксида аммония при pH. pH 13. Оксидная пленка растворяется в большинстве сильных кислот и щелочей, и в этом случае коррозия алюминия будет быстрой.
Как и все обычные архитектурные и конструкционные материалы, алюминий при определенных условиях подвержен коррозии. Это более вероятно, если для проектов или приложений выбран неправильный сплав.Чтобы получить хорошие результаты с алюминием, важно знать следующее:
- условия, при которых будет происходить коррозия
- форма, в которой будет происходить коррозия
- скорость коррозии
- любые профилактические меры, которые можно предпринять
Ржавеет ли алюминий?
Ржавчина — это форма коррозии, характерная для железа и стали (поскольку она содержит железо). Фактически, ржавчина — это общее название оксида железа, когда железо или сталь связываются с кислородом и подвергаются окислению.Следовательно, алюминий не ржавеет.
Какие сплавы обладают лучшей коррозионной стойкостью?
1xxx
Сплав 1100: Алюминий марки 1100 представляет собой технически чистый алюминий. Он имеет отличную коррозионную стойкость и широко используется в химической и пищевой промышленности. В остальном это мягкий и пластичный металл с отличной обрабатываемостью. Вы часто найдете сплав 1100 там, где требуется формовка. Его можно сваривать любым способом, но он не поддается термической обработке.
3xxx
Сплав 3003: Сплав 3003 является наиболее распространенным из алюминиевых сплавов.Это чистый промышленный алюминий с повышением прочности на 20% благодаря добавлению марганца и меди. Он также имеет отличную коррозионную стойкость, обрабатываемость, его можно сваривать или паять, тянуть или вращать.
5xxx
Сплав 5052: 5052 также является очень популярным сплавом, потому что он имеет самую высокую прочность среди всех нетермообрабатываемых марок. Он особенно распространен в морской и морской атмосфере из-за своей устойчивости к коррозии. Он имеет отличную обрабатываемость и легко вытягивается или принимает сложные формы.
6xxx
Сплав 6061 : 6061 является наиболее универсальным из термообрабатываемых сплавов, включая коррозионную стойкость, обрабатываемость при отжиге и свариваемость. Вы найдете сплав 6061 в продуктах и областях применения, где требуется три элемента: хороший внешний вид, лучшая коррозионная стойкость и хорошая прочность.
Сплав 6063: 6063 обычно называют архитектурным сплавом из-за его высокой прочности на растяжение, отличной отделки и высоких коррозионно-стойких свойств. Вы найдете 6063 в архитектурных декорациях и отделках интерьера и экстерьера.Часто анодируется.
Аэрокосмическая промышленность (2xxx и 7xxx)
В аэрокосмической промышленности необходимы как высокая прочность, так и высокая коррозионная стойкость. По этой причине аэрокосмическая промышленность обычно ограничивается сериями алюминия 2ххх и 7ххх. Мы обходим пониженную коррозионную стойкость легированного алюминия в этой серии за счет вкладышей из чистого алюминия, сплавленных с более прочным алюминиевым сплавом. Чистый алюминий придает плоскости необходимую коррозионную стойкость без ущерба для прочности конструкционного алюминия.
Сплав 2011: Сплав 2011, также известный как сплав для свободной обработки (FMA), известен своей высокой механической прочностью и отличной обработкой, поэтому вы видите его в сложных и детализированных деталях. Если этот сплав обрабатывать на высокой скорости, он будет давать мелкую стружку, но ее легко удалить.
Сплав 2014: Сплав 2014 на основе меди с очень высокой прочностью и отличной обработкой. Вы найдете его во многих конструкционных аэрокосмических приложениях из-за его высокой коррозионной стойкости.
Сплав 2024: Сплав 2024 очень широко используется из-за его сочетания высокой прочности и превосходной усталостной прочности. Вы найдете его везде, где требуется хорошее соотношение прочности и веса. Но его коррозионная стойкость довольно низкая, поэтому вы часто будете видеть его либо с анодированной поверхностью (см. Ниже), либо с Alclad.
Сплав 7075: Из всех алюминиевых сплавов 7075 является одним из самых прочных. Как и 2024, он имеет отличное соотношение прочности и веса и используется в деталях, которые будут подвергаться высоким нагрузкам.7075 может быть сформирован после отжига, а затем при необходимости подвергнут термообработке.
Как быстро происходит окисление алюминия?
Окисление алюминия происходит быстрее, чем окисление стали, поскольку алюминий имеет сильное сродство к кислороду. Когда все атомы алюминия соединятся с кислородом, процесс окисления останавливается.
Как выглядит коррозия алюминия?
Оксид алюминия не отслаивается, как ржавчина, а образует твердую пленку беловатого цвета.
Как остановить коррозию алюминия?
Поскольку алюминий очень легко связывается с кислородом, мало что можно сделать с окислением алюминия.Однако коррозия алюминия может стать серьезной проблемой. Чтобы предотвратить коррозию алюминия, вы должны учитывать:
- Прежде всего, выбирая правильный сплав: некоторые сплавы, такие как 5052 и 3003, имеют лучшую коррозионную стойкость, чем другие. Здесь вы можете прочитать о разнице между 5052 и 3003. В целом, 1xxx, 3xxx, 5xxx обеспечивают лучшую коррозионную стойкость.
- Рассмотрим вкладыши alclad, распространенные в аэрокосмической промышленности.
- Нанесение защитного покрытия
- Сведение к минимуму эффекта гальванической коррозии.Гальваническая коррозия вызывается размещением двух разнородных металлов, таких как алюминий и сталь, рядом друг с другом.
Защитные покрытия
Обычно для алюминия подходят три типа защитных покрытий:
- Краска
- Порошковое покрытие
- Анодирование
Если вас беспокоит риск гальванической коррозии, мы рекомендуем поискать лакокрасочные или порошковые покрытия с высоким электрическим сопротивлением.
Анодирование — это тип поверхностного окисления, который востребован, поскольку дает привлекательную отделку, но не подходит для крупных производств.Многие яхтсмены используют жертвенный анод из цинка. Он подвергается коррозии быстрее, чем алюминий, существенно жертвуя собой, и его необходимо периодически заменять.
При нанесении покрытия не забывайте, что любое повреждение требует немедленного внимания. Оставьте немного алюминия незащищенным, и вы рискуете получить контакт с коррозией.
Свяжитесь с нашей квалифицированной командой сейчас
Kloeckner Metals — это поставщик алюминия и сервисный центр полного цикла.

 де
Буабодран
де
Буабодран у.)
у.) 5 кДж/моль (эВ)
5 кДж/моль (эВ)