Оксид азота окисление — Справочник химика 21
Оксид азота (И) N0 (окись азота) получают в больших количествах в производстве ННОз каталитическим окислением аммиака [c.403]Современные технологические схемы производства разбавленной азотной кислоты, основанные на контактном способе окисления аммиака кислородом воздуха в присутствии платинового катализатора и последующем поглощении оксидов азота водой, можно разделить на три группы [77] [c.212]
ПОЛУЧЕНИЕ ОКСИДОВ АЗОТА ОКИСЛЕНИЕМ АММИАКА [c.237]
Конверсия аммиака проводится при 890—900 °С. При этом выход оксида азота составляет до 96%. Тепло, выделяющееся в ходе реакции, используется в котле-утилизаторе 5 для получения перегретого пара под давление.м 13-10 Па. Далее нит-розные газы поступают в окислитель 6, где оксид азота окисляется до диоксида. Температура газов после окисления повышается до 300—310 °С, что позволяет использовать их для подогрева воздуха в подогревателе 7.
В нитрозном способе катализатором служат оксиды азота. Окисление ЗОг происходит в основном в жидкой фазе и осуществляется в башнях с насадкой. Поэтому нитрозный способ по аппаратурному признаку называют башенным. Сущность башенного способа заключается в том, что газ, полученный при сжигании сернистого сырья и содержащий примерно 9% ЗОз и 9—10% Ог, очищается от частиц колчеданного огарка и поступает в башенную систему, которая состоит из нескольких (четырех — семи) [c. 115]
115]
О ведущей роли радикалов в гомогенном газофазном окислении ЗОг говорят и результаты опытов в смоговых камерах. Они показали, что скорость процесса резко увеличивается, если в камеру вводятся оксиды азота. Окисление протекает с образованием ряда промежуточных частиц [c.206]
Источники выброса газов, содержащих оксиды азота, разнообразны. Эти газы различаются по содержанию в них оксидов азота и других примесей, степени окисления оксидов азота, температуре, давлению и т.д. Газы, содержашие оксиды азота, условно можно разделить на четыре группы [c.63]
Окисление диоксида серы в триоксид серы Окисление аммиака в оксиды азота Окисление этилена в оксид этилена Окисление метанола в формальдегид Окисление пропилена в акролеин Окисление хлористого водорода в хлор (по Дикону)
Принципиальная технологическая схема агрегата УКЛ-7 (7,3-10 Па) приведена на рис.
 УП1-4. Атмосферный воздух очищается на суконном фильтре воздухозаборника 15, затем очищенный воздух сжимается в первой ступени турбокомпрессора 14 до давления 3,5-10 Па. Воздух при этом нагревается до 175 °С. Затем он охлаждается водой в промежуточном холодильнике 12 до 40—45 °С и сжимается во второй ступени турбокомпрессора 14 до давления 7,3-10 Па. Далее сжатый воздух идет на окисление аммиака, в качестве добавки в процессе кислой абсорбции, а также на отдувку оксидов азота от азотной кислоты и на сжигание природного газа в топках 16. [c.212]
УП1-4. Атмосферный воздух очищается на суконном фильтре воздухозаборника 15, затем очищенный воздух сжимается в первой ступени турбокомпрессора 14 до давления 3,5-10 Па. Воздух при этом нагревается до 175 °С. Затем он охлаждается водой в промежуточном холодильнике 12 до 40—45 °С и сжимается во второй ступени турбокомпрессора 14 до давления 7,3-10 Па. Далее сжатый воздух идет на окисление аммиака, в качестве добавки в процессе кислой абсорбции, а также на отдувку оксидов азота от азотной кислоты и на сжигание природного газа в топках 16. [c.212] При нитрозном способе катализатором служат оксиды азота. Окисление проводят в жидкой фазе с помощью нитрозы, выполняющей функции передатчика кислорода. Процесс осуществляют в башнях с насадкой, и по этому признаку нитрозный способ часто называют башенным. [c.178]
Вместе с тем достаточно хорошо разработанный и широко известный способ синтеза оксидов азота из воздуха или эквимолекулярных смесей азота и кислорода [И] не находит пока широкого промышленного распространения вследствие высоких энергетических затрат. В этой связи целесообразно совместное проведение названных процессов окисления фосфора и фиксации оксидов азота окисления фосфора в воздушной низкотемпературной плазме с использованием теплового эффекта окисления фосфора для фиксации оксидов азота, что позволяет снизить затраты электроэнергии на фиксацию оксидов азота, сохранив или даже повысив их концентрацию в конечных продуктах. Так как последние содержат смесь оксидов азота и фосфора, предполагается совместное или раздельное получение фосфорной и азотной кислот.
В этой связи целесообразно совместное проведение названных процессов окисления фосфора и фиксации оксидов азота окисления фосфора в воздушной низкотемпературной плазме с использованием теплового эффекта окисления фосфора для фиксации оксидов азота, что позволяет снизить затраты электроэнергии на фиксацию оксидов азота, сохранив или даже повысив их концентрацию в конечных продуктах. Так как последние содержат смесь оксидов азота и фосфора, предполагается совместное или раздельное получение фосфорной и азотной кислот.
П. Какой катализатор используется при окислении аммиака до оксида азота (II) [c.168]
В ла( оратории его получают действием разбавленной НМОд на медь, а в промышленности — окислением на платиновом катализаторе. В отличие от всех остальных оксидов азота N0 образуется также прямым взаимодействием простых веществ [c.359]
В процессе сгорания в результате окисления азота, содержащегося в топливе, и атмосферного азота выделяется также оксид азота [c. 20]
20]
Атомный кислород и озон (последний со значительно меньшей скоростью) реагируют с различными углеводородами. Окисленные соединения и свободные радикалы реагируют затем с оксидом азота с образованием дополнительного количества диоксида азота. В результате этого уменьшается доля оксида азота, вступающая в реакцию с озоном, вследствие чего содержание озона возрастает. [c.33]
Таким образом, этот механизм представляет собой цепной радикальный процесс, включающий стадии инициирования, развития и обрыва цепи. Особенность его — существенная роль оксида у1 лерода в инициировании окисления оксида азота и образования озона. [c.34]
Жидкие окислители довольно дороги, требуется их регенерация, В то же время они обеспечивают окисление до остаточного со,держания оксидов азота в газе 50—100 см /м и ниже, позволяют вести очистку прн обычных давлениях и температурах. [c.64]
В качестве примера приложения закона действия масс можно привести уравнение зависимости скорости реакции окисления оксида азота (II) [c. 174]
174]
Если в сероводороде присутствует H N, процесс сжигания H S ведут при недостатке кислорода (аоксиды азота, а элементарный азот, и таким образом предотвращается загрязнение продукционной серной кислоты оксидами азота. При недостатке кислорода в печи выходящий из нее печной газ содержит некоторое количество несгоревшего сероводорода или паров серы. Для полного окисления серы газ направляют в камеру дожигания, куда вводится необходимое количество воздуха.
Металлические и металлоподобные соединения. Порошкообразные V, Nil и Та адсорбируют значительные количества водорода, кислорода, азота, образуя твердые растворы внедрения. При этом неметаллы п( реходят в атомарное состояние и их электроны участвуют в построении ii-зоны металлического кристалла. При нагревании растворимость неметаллов возрастает вместе с тем изменяются ха-ракте) химической связи и свойства образуемых соединений. Так, при образовании оксидов постепенное окисление ниобия (как и V I Та) кислородом протекает через следующие стадии [c. 541]
541]
Расчеты показывают, что степень использования тепла реакции окисления оксида азота до диоксида низка. Кроме того, эксплуатационные показатели технологической схемы чувствительны к изменению нагрузки, и при работе с нагрузкой, отличающейся от оптимальной, себестоимость продукции заметно увеличивается. Причиной этого является наличие теплового рецикла по потоку воздуха, подаваемого от компрессора через подогреватель воздуха к контактному аппарату. [c.215]
В последнее время появилось значительное число теоретических и экспериментальных работ, из которых следует, что для большого класса процессов можно создавать нестационарные режимы, значительно превосходящие по эффективности стационарные. К таким процессам относятся массо- и теплообмен, адсорбция, ректификация, сепарация твердых частиц на фракции, разделение смесей жидкости или газа на основании принципа динамической сепарации.

Азотная кислота (реже оксиды азота) служит вторым по масштабам применения окислительным агентом. Ее действие нередко сопровождается побочным нитрованием органического соединения, усиливающимся с повышением концентрации кислоты. По этой причине для окисления используют 40—60%-ную НЫОз. Азотная кислота как окислитель никогда не применяется для реакций с парафинами. Для нес наиболее типичны реакции деструктивного окисления циклических соединений и веществ с ненасыщенными связями, идущие с участием НЫОз с лучшим выходом, чем при окислении кислородом [c.354]
Окисление низших парафинов в газовой фазе. Способность низших нарафинов к окислению зависит от длины цепи.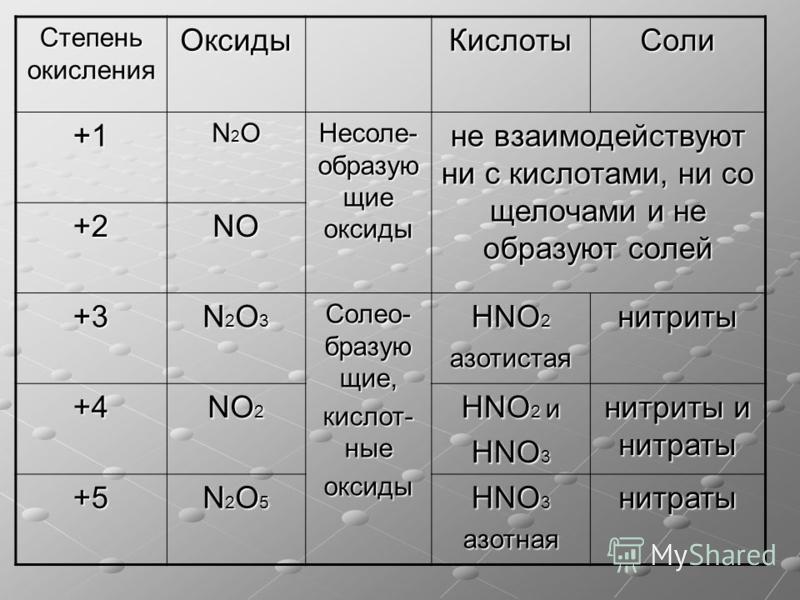 Так, в отсутствие катализаторов и при обычном давлении метан начинает окисляться при 420°С, этан при 285°С, пропан при 270°С. С повы-шени( м давления начальная температура окисления снижается, например метан при 10 МПа реагирует с кислородом уже при 330°С. Гомогенные инициаторы (оксиды азота, НВг), а также гетерогенные контакты позволяют ускорить процесс и осуществить его при более низкой температуре. [c.379]
Так, в отсутствие катализаторов и при обычном давлении метан начинает окисляться при 420°С, этан при 285°С, пропан при 270°С. С повы-шени( м давления начальная температура окисления снижается, например метан при 10 МПа реагирует с кислородом уже при 330°С. Гомогенные инициаторы (оксиды азота, НВг), а также гетерогенные контакты позволяют ускорить процесс и осуществить его при более низкой температуре. [c.379]
Выход адипиновой кислоты повышается, когда окисление осуществляют в двухтемпературном режиме при 60—80 °С на первой стадии и при 100—120°С на второй (это объясняется тем, что образование промежуточных продуктов синтеза адипиновой кислоты протекает с более низкой энергией активации, чем для промежуточных стадий получения побочных веществ, в то время как для гидролиза этнх веществ в адипиновую кислоту требуется повышенная температура). Положительно влияет также медь-ванадиевый катализатор, добавляемый в виде оксида меди и метаванадата аммония (в количестве 0,07% каждого компонента в расчете на взятый циклогексанол).
Первые исследования процесса синтеза азотной кислоты из аммиака относятся к началу XIX века. В1800 году А. Фуркруа наблюдал образование оксидов азота при пропускании смеси аммиака с воздухом через раскаленную трубку. В 1839 году Кюльман получил оксиды азота окислением аммиака на платиновом катализаторе, высказав при этом предположение, что могут наступить времена, когда это превращение в экономическом отношении станет возможным . В начале XX века условия окисления аммиака детально изучаются В. Оствальдом и И.И. Андреевым и делаются попытки освоить этот метод в промышленных условиях. В1907 году В. Оствальд создает промышленную опытную установку для получения азотной кислоты каталитическим окислением аммиака. В 1916 году, на основе теоретических исследований И.И. Андреева, создается опытная установка, а в 1917 году был введен в строй первый завод по производству азотной кислоты из аммиака коксового газа мощностью 10 ООО тонн в год в г. Юзовка. [c.211]
Юзовка. [c.211]
Газофазный гомогенный катализ, когда и реагенты и катализатор — газы, применяются сравнительно редко. Примером его могут служить дегидратация уксусной кислоты в парах при участии катализатора—парообразного триэтилфосфата, окисление метяия R формальдегид воздухом, ускоряемое оксидами азота, окисление оксида углерода в диоксид в присутствии водяных паров и т. п. Газофазный катализ может осуществляться по молекулярному и радикальному цепному механизму. [c.222]
Ш,елочная абсорбция оксидов азота. Целесообразна при санитарной очиси е газов от оксидов азота при степени окисления бJH lзкoй к 50%- В качестве абсорбентов можно иримепять рас-твор1,1 соды, известкового молока, едкого натра. [c.67]
Параллельно проводились работы по получению оксидов азота окислением аммиака. Приоритет в разработке метода получения азотной кислоты из оксидов азота, полученных окислением аммиака на платине, принадлежит двум ученым — В. Оствальду и И. И. Андрееву, которые решили данную проблему независимо друг от друга. В России в 1915—1916 гг. на основе замечательных работ талантливого инженера И. И. Андреева и его коллег Н. М. Кулепетова и А. К. Колосова в Макеевке был построен первый контактный завод производства азотной кислоты из аммиака, получаемого из аммиачной воды простым кипячением. Промышленное производство с переработкой азотной кислоты в аммиачную селитру было оборудовано в Юзовке (теперь г. Донецк). [c.6]
Оствальду и И. И. Андрееву, которые решили данную проблему независимо друг от друга. В России в 1915—1916 гг. на основе замечательных работ талантливого инженера И. И. Андреева и его коллег Н. М. Кулепетова и А. К. Колосова в Макеевке был построен первый контактный завод производства азотной кислоты из аммиака, получаемого из аммиачной воды простым кипячением. Промышленное производство с переработкой азотной кислоты в аммиачную селитру было оборудовано в Юзовке (теперь г. Донецк). [c.6]
При нитрозном способе катализагором служат оксиды азота. Окисление происходит в основном в жидкой фазе и осуществляется в башнях с насадкой. Поэтому нитрозный способ по аппаратурному признаку называют башенным. [c.252]
Из данных табл. 6 (стр. 124) видно, что электроотрицательность хлора и иода меньше, а фтора бо/п.ше, чем электроотрнцателыгость азота. Отсюда следует, что п соединениях N I3 и NI3 степень окисленности азота равна —3, а в NF3 опа равна -НЗ, Поэтому фторид азота отличается по свойствам от нитридов хлора и иода. Например, при взаимодействии с водою N lj или NIj образуется аммиак, а а случае NFj получается оксид азота (П1) [c.401]
Например, при взаимодействии с водою N lj или NIj образуется аммиак, а а случае NFj получается оксид азота (П1) [c.401]
Производство разбавленной азотной кпслок.г состоит из трех стадий каталитическое окисление аммиака в ОКСИД азота (И) окисление оксида азота (П) в оксид азота (IV) абсорбция оксида азота (IV) водой с образованием кислоты. [c.159]
Так, азот образует соединения, в которых степень его окисленности изменяется от —3 (аммиак и соли аммония) до +5 (азотная кислота и ее соли). Азот, входящий в состав аммиака, может выступать только в качестве восстановителя, азот азотной кислоты— только в качестве окислителя. Азотистая же кислота HNO2 и ее соли, где степень окисленности азота равна — -3, вступают в реакции как с сильными окислителями, так и с сильными восстановителями. В первом случае она окисляется до азотной кислоты, во втором — восстанавливается обычно до оксида азота N0. [c.271]
К реакциям внутримолекулярного окисления — восстанов,пения относятся такие, в процессе которых одна составная часть молекулы выполняет функцию окислителя, а друг41я — функцию носста новителя. Простейшими примерами таких реакций могут с пужить процессы термического распада сложного вещества на более простые составные части, например водяного пара — на [юдород и кислород, оксида азота (IV) — на оксид азота (II) и кислород и многие другие. [c.156]
Простейшими примерами таких реакций могут с пужить процессы термического распада сложного вещества на более простые составные части, например водяного пара — на [юдород и кислород, оксида азота (IV) — на оксид азота (II) и кислород и многие другие. [c.156]
Красно-бурый оксид азота (IV) N02 (диоксид азота) образуется при окислении N0. В лаборатории его получают нагреванием РЬ(Г Оз)2 (см. разд. 7.4.3) или действием Н2304 на NaN02. [c.406]
При окислении азотной кислотой она раскисляется до оксидов азота (N0 или N2O3). Экономичность производства во многом зависит от возможности утилизации этих оксидов и регенерации непревращенной азотной кислоты. Первая задача решается окислением оксидов азота воздухом в водном или азотнокислотном растворе с образованием азотной кислоты [c.354]
НООС—1СН2)з-СООН + СОз а за счет отщепления СО или СОг на одной из промежуточных стадий получается монокарбоновая (валериановая) кислота С4Н9СООН. Расход азотной кислоты на окисление составляет 2,3 моль на 1 моль циклогексанола, причем образуется соответствующее количество оксидов азота. [c.392]
Расход азотной кислоты на окисление составляет 2,3 моль на 1 моль циклогексанола, причем образуется соответствующее количество оксидов азота. [c.392]
В каком соединение азот проявляет степень окисления -3,а в каком +3 (NO2,N2O3.N2O5.Na3N
Для того чтобы понять, в каких соединениях, из условия задания, азот будет иметь положительную степень окисления, а в каких отрицательную, следует открыть таблицу «Электроотрицательность элементов», имеющуюся в любом химическом справочнике.
Степень окисления азота (-3)
В данном задании представлены лишь соединения азота с кислородом и натрием, поэтому, проанализируем значения электроотрицательностей всех трех элементов:
- кислород проявляет электроотрицательность, равную 3,50;
- электроотрицательность натрия составляет 1,01;
- значение электроотрицательности азота равно 3,07.
Исходя из всего вышеизложенного: 3,50>3,07>1,01.
Правило: элементы с большей электроотрицательностью всегда принимают электроны, т. е. являются в химических реакциях акцепторами или окислителями, превращаясь в анионы. Элементы же с меньшим значением электроотрицательности электроны отдают, становясь восстановителями и донорами электронов, и превращаясь в катионы.
е. являются в химических реакциях акцепторами или окислителями, превращаясь в анионы. Элементы же с меньшим значением электроотрицательности электроны отдают, становясь восстановителями и донорами электронов, и превращаясь в катионы.
Следовательно, степень окисления (-3) азот получит лишь в соединении с натрием: (Na+3N-3)0.
Степень окисления азота (+3)
В остальных же веществах, представляющих собой оксиды азота, т.е. соединения азота и кислорода, азот всегда будет выступать донором электронов, и проявлять позитивную степень окисления.
Исходя из того, что кислород, в соединениях с элементами, обладающими меньшим значением электроотрицательности, обычно проявляет степень окисления (-2), рассчитаем степени окисления азота во всех его оксидах:
- (NxO-22)0, следовательно: х=0-2*2=(+4). Таким образом, (N+4O-22)0;
- (Nx2 O-23)0, следовательно: 2х=0-2*3; значит х=(+6):2=(+3) и формула этого оксида запишется: (N+32 O-23)0;
- (Nx2 O-25)0, следовательно: 2х=0-2*5; значит х=(+10):2=(+5).
 Получим формулу оксида: (N+52 O-25)0.
Получим формулу оксида: (N+52 O-25)0.
Таким образом, формулируем правильный ответ: (Na+3N-3)0 и (N+32 O-23)0.
Решение задачи 99
Задача 99
- В задаче много выходов на элементы Х и Y, но самый надежный – внимательнее посмотреть на п.3. Если одно и то же вещество образуется при взаимодействии одного оксида с серной кислотой, а другого – с азотной, логично предположить, что А и Б – оксиды азота и серы. Поскольку они могут еще реагировать с кислородом, это NO и SO2, а вещества В и Г – NO2 и SO3, плотность паров по водороду которых как раз 46/2 и 80/2. В принципе эти цифры можно было использовать, чтобы выйти вообще на элементы Х и Y, но это потребовало бы куда более серьезных усилий.
 Уравнения реакций оксидов с кислородом:
Уравнения реакций оксидов с кислородом:
В промышленности монооксид азота получают каталитическим окислением аммиака на платино-родиевом катализаторе: . В лаборатории его можно получить действием избытка разбавленного раствора азотной кислоты на металлическую медь, либо взаимодействием подкисленного раствора нитрита с такими восстановителями, как иодид-ион или соли железа(II): 3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O. Диоксид серы в промышленности получают сжиганием серы в кислороде, либо обжигом сульфидных минералов: S + O2 → SO2, а в лаборатории – взаимодействием разбавленных кислот с сульфитом натрия, либо концентрированной серной кислоты с той же медью: Na2SO3 + H2SO4 = Na2SO4 + SO2↑ + H2O, Cu + 2H2SO4(конц.) = CuSO4 + SO2↑ + 2H2O.
- Поскольку две молекулы каждого из оксидов реагируют с одной молекулой кислорода, требующийся объём кислорода не зависит от состава смеси.
 Для реакции с 1 л любой смеси оксидов А и Б его потребуется ½ = 0,5 л. Теперь вычислим объёмный состав смеси NO и SO2, в которой ω(N) = ω(S). . Знаменатели дробей равны, приравняем числители: 14φ = 32*(1-φ), откуда φ = φ(NO) = 0.696 = 69,6%, φ(SO2) = 1-φ = 30,4%.
Для реакции с 1 л любой смеси оксидов А и Б его потребуется ½ = 0,5 л. Теперь вычислим объёмный состав смеси NO и SO2, в которой ω(N) = ω(S). . Знаменатели дробей равны, приравняем числители: 14φ = 32*(1-φ), откуда φ = φ(NO) = 0.696 = 69,6%, φ(SO2) = 1-φ = 30,4%. - Понятно, что осадок – сульфат бария. Его получается 4,67/233,4 = 0,02 моль. При нагревании раствора происходит окислительно-восстановительное превращение, в ходе которого выделяется NO – оксид А. Заметим, что вещество Ы можно получить восстановлением азотной кислоты и окислением NO, поэтому степень окисления азота в нём может быть равна +3, либо +4. Молярная масса Ы в расчете на атом серы составит 2,54/0,02 = 127. За вычетом предполагаемого сульфат-иона (96) остается 31, что соответствует остатку (NOH)2+, в котором степень окисления азота как раз +3.
 Таким образом, соединение Ы – NOHSO4 — гидросульфат нитрозония, или нитрозилсерная кислота – промежуточный продукт нитрозного способа получения серной кислоты. Уравнения реакций ее образования: SO2 + HNO3 = NOHSO4, 4NO + O2 + 4H2SO4 = 4NOHSO4 + 2H2O. При ее гидролизе образуется неустойчивая азотистая кислота HNO2 (Ъ), водные растворы которой имеют голубоватый оттенок: NOHSO4 + H2O → HNO2 + H2SO4. При нагревании азотистая кислота диспропорционирует:
Таким образом, соединение Ы – NOHSO4 — гидросульфат нитрозония, или нитрозилсерная кислота – промежуточный продукт нитрозного способа получения серной кислоты. Уравнения реакций ее образования: SO2 + HNO3 = NOHSO4, 4NO + O2 + 4H2SO4 = 4NOHSO4 + 2H2O. При ее гидролизе образуется неустойчивая азотистая кислота HNO2 (Ъ), водные растворы которой имеют голубоватый оттенок: NOHSO4 + H2O → HNO2 + H2SO4. При нагревании азотистая кислота диспропорционирует:
3HNO2 → HNO3 + 2NO↑ + H2O, причем по объему выделившегося газа мы можем проверить правильность наших выводов. ν(HNO2) = 3/2ν(NO) = 3/2*0,299/22,4 = 0,02 моль, что совпадает с количеством полученного сульфата бария: BaCl2 + H2SO4 = BaSO4 + 2HCl.
ЕГЭ.
 Правила составления окислительно-восстановительных реакций (азот)
Правила составления окислительно-восстановительных реакций (азот)3. Химические свойства соединений азота с точки зрения изменения степеней окисления
Правило 3.1. Аммиак в реакциях, как правило, окисляется до азота:
4NH3 + 3O2 → 2N2 + 6H2O (t)
8NH3 + 3Cl2 → N2 + 6NH4Cl (в атмосфере хлора)
2NH3 + 3CuO → 3Cu + N2 + 6H2O
2NH4Cl + 4CuO → 3Cu + N2 + CuCl2 + 4H2O
2NH3 + 3H2O2 → N2 + 6H2O (t)
2NH3 + 2K2FeO4 + 5H2SO4 → Fe2(SO4)3 + N2 + 2K2SO4 + 8H2O
8NH3 + 3KBrO4 → 3KBr + 4N2 + 12H2O
2NH3 + 3KClO → 3KCl + N2 + 3H2O
4NH3 + 3Ca(ClO)2 → 3CaCl2 + 2N2 + 6H2O
2NH3 + 2NaMnO4 → 2MnO2 + N2 + 2NaOH + 2H2O
2NH3 + 6NaMnO4 + 6NaOH → 6Na2MnO4 + N2 + 6H2O
2NH3×H2O + 2KMnO4 → 2MnO2 + N2 + 2KOH + 4H2O
Исключения:
Чтобы легко запомнить следующие реакции, нужно помнить, что нитрат аммония разлагается при нагревании на оксид азота (I) и воду
(NH4NO3 → N2O + 2H2O):
NH4Cl + KNO3 → N2O + KCl + H2O
А также нужно помнить термическое разложение нитрита аммония на азот и воду (NH4NO2 → N2 + 2H2O):
NH4Cl + NaNO2 → N2 + NaCl + 2H2O
Реакции термического разложения нитрата и нитрита аммония также часто встречаются на экзамене.
В присутствии катализатора аммиак окисляется кислородом до оксида азота (II), а не простого вещества:
4NH3 + 5O2 → 2NO + 6H2O (t, Pt)
Правило 3.2. Нитриды (и для аналогии фосфиды) активных металлов легко реагируют с водой и растворами кислот:
1. Реакции с водой:
Mg3N2 + H2O → 3Mg(OH)2 + 2NH3
Na3N + H2O → NaOH + NH3
Ca3P2 + 6H2O → 3Ca(OH)2 +2PH3
2. В реакциях с кислотами образуются соли (в случае нитридов) или фосфин (в случае фосфидов):
Ca3N2 + HCl → 3CaCl2 + 2NH4Cl
Zn3P2 + 6HCl → 3ZnCl2 + 2PH3
Азотная кислота
Правило 3.3. Чем более разбавленной является кислота, тем более сильным окислителем она является.
Изменение степени окисления азота в реакциях с сильным восстановителем:
N+5 + 8e → N–3 (NH3 или NH4NO3) очень разбавленная HNO3
N+5 + 5e → N0 (N2) разбавленная HNO3
N+5 + 4e → N+1 (N2O) разбавленная HNO3, концентрированная
Изменение степени окисления азота в реакциях со слабым восстановителем:
N+5 + 3e → N+2 (NO) разбавленная HNO3
N+5 + 1e → N+4 (NO2) концентрированная HNO3
Восстановители:
Сильные:
- Металлы от Li до Al
Слабые:
- Металлы, начиная с Fe
- Неметаллы
- Соли (если можем окислить)
- Оксиды (если можем окислить)
- HI и йодиды, H2S и сульфиды
10HNO3(оч. разб.) + 4Mg → 4Mg(NO3)2 + NH4NO3 + 3H2O
разб.) + 4Mg → 4Mg(NO3)2 + NH4NO3 + 3H2O
10HNO3(разб.) + 4Mg → 4Mg(NO3)2 + N2O + 5H2O (возможно образование N2)
8HNO3(разб.) + 3Cu → 3Cu(NO3)2 + 2NO + 4H2O
4HNO3(конц.) + 3Cu → 3Cu(NO3)2 + 2NO2 + 2H2O
С неметаллами образуются соответствующие кислоты:
10HNO3(конц.) + I2 → 2HIO3 + 10NO2 + 4H2O (t) (из галогенов реакция идет только с йодом)
4HNO3(конц.) + C → CO2 + 4NO2 + 2H2O
5HNO3(конц.) + P → H3PO4 + 5NO2 + H2O
5HNO3(разб. ) + 3P +2H2O → 3H3PO4 + 5NO
) + 3P +2H2O → 3H3PO4 + 5NO
6HNO3(конц.) + S → H2SO4 + 6NO2 + 2H2O
2HNO3(разб.) + S → H2SO4 + 2NO
Окисляем анион:
8HNO3(к) + H2S → H2SO4 + 8NO2 + 4H2O
8HNO3(к) + Na2S → Na2SO4 + 8NO2 + 4H2O
4HNO3(конц.) + CuS → Cu(NO3)2 + S + 2NO2 + 2H2O
8HNO3(конц.) + CuS → CuSO4 + 8NO2 + 4H2O
8HNO3 + Cu2S → 2Cu(NO3)2 + S + 4NO2 + 4H2O
12HNO3 + Cu2S → CuSO4 + Cu(NO3)2 + 10NO2 + 6H2O
16HNO3(к) + Mg3P2 → Mg3(PO4)2 + 16NO2 + 8H2O
16HNO3(к) + Ca(HS)2 → H2SO4 + CaSO4 + 16NO2 + 8H2O
8HNO3(к) + AlP  → AlPO4 + 8NO2 + 4H2O
В избытке кислоты фосфат алюминия (см. предыдущую реакцию) растворяется:
предыдущую реакцию) растворяется:
11HNO3(к, изб.) + AlP → H3PO4 + Al(NO3)3 + 8NO2 + 4H2O
Окисляем металл соли или оксида:
10HNO3(к) + Fe3O4 → 3Fe(NO3)3 + NO2 + 5H2O
4HNO3(к) + FeO → Fe(NO3)3 + NO2 + 2H2O
HNO3(к) + FeSO4 → Fe(NO3)3 + NO2 + H2SO4 + H2O
4HNO3(к) + CrCl2 → Cr(NO3)3 + NO2 + 2HCl + H2O (ионы Cl– азотная кислота окислить не может)
Одновременное окисление катиона и аниона:
14HNO3(к) + Cu2S → H2SO4 + 2Cu(NO3)2 + 10NO2 + 6H2O
Нитраты
Правило 3. 4. С металлами (Al, Zn, Mg) нитраты восстанавливаются до аммиака:
4. С металлами (Al, Zn, Mg) нитраты восстанавливаются до аммиака:
3NaNO3 + 8Al + 5NaOH +18H2O → 3NH3 + 8Na[Al(OH)4]
NaNO3 + 4Zn + 7NaOH + 6H2O → NH3 + 4Na2[Zn(OH)4]
KNO3 + 4Mg + 6H2O → NH3 + 4Mg(OH)2 + KOH
Правило 3.5. При сплавлении в щелочной среде нитраты восстанавливаются до нитритов:
3NaNO3 + Cr2O3 + 4KOH → 3NaNO2 + 2K2CrO4 + 2H2O
3NaNO3 + Cr2O3 + 2Na2CO3 → 3NaNO2 + 2Na2CrO4 + 2CO2
KNO3 + MnO2 + 2KOH → KNO2 + K2MnO4 + H2O
KNO3 + MnO2 + K2CO3 → KNO2 + K2MnO4 + CO2
2NaNO3 + FeSO4 + 4NaOH → 2NaNO2 + Na2FeO4 + Na2SO4 + 2H2O
3NaNO3 + Fe2O3 + NaOH → 3NaNO2 + 2Na2FeO4 + 2H2O
3KNO3 + Fe + 2KOH → 3KNO2 + K2FeO4 + H2O
Правило 3. 6. Неметаллами нитраты восстанавливаются до азота либо нитрита:
6. Неметаллами нитраты восстанавливаются до азота либо нитрита:
2KNO3 + C → 2KNO2 + 2KNO2 + CO2
2KNO3 + S → 2KNO2 + SO2
Правило 3.7. С солями аммония, по сути, идет разложение нитрата аммония:
KNO3 + NH4Cl → N2O + KCl + 2H2O (NH4NO3 → N2O + 2H2O)
Правило 3.8. В случае нитрата слабого металла именно метал будет окислителем, а не азот:
8AgNO3 + PH3 + 4H2O → Ag + H3PO4 + HNO3
Правило 3.9. Термическое разложение нитратов:
MNO3 → MNO2 + O2 M – металл, находящийся в ряду напряжений металлов левее Mg, исключая Li.
MNO3 → MO + NO2 + O2 M – металл, находящийся в ряду напряжений металлов от Mg до Cu (Mg и Cu включительно), а также Li.
MNO3 → M + NO2 + O2 M – металл, находящийся в ряду напряжений металлов правее Cu.
Нитриты
Правило 3.11. Сильными окислителями нитриты окисляются до нитратов:
3KNO2 + 2CrO3 + 3H2SO4 → 3KNO3 + Cr2(SO4)3 + 3H2O
3KNO2 + K2Cr2O7 + 4H2SO4 → 3KNO3 + Cr2(SO4)3 + K2SO4 + 4H2O
NaNO2 + 2KMnO4 + 2KOH → NaNO3 + 2K2MnO4 + H2O
3KNO2 + 2KMnO4 + H2O → 3KNO3 + 2MnO2 + 2KOH
KNO2 + H2O2 → KNO3 + H2O
KNO2 + I2 + H2O → KNO3 + 2HI
Правило 3. 12. С восстановителями нитриты восстанавливаются до N2 или NO:
12. С восстановителями нитриты восстанавливаются до N2 или NO:
1) С солями аммония, по сути, идет разложение нитрита аммония:
NaNO2 + NH4Cl → N2 + NaCl + 2H2O (NH4NO2 → N2 + 2H2O)
Ca(NO2)2 + (NH4)2SO4 → 2N2 + CaSO4 + 4H2O
2) Соединениями I–, Fe2+ и др. нитриты восстанавливаются до оксида азота (II):
2KNO2 + 2KI + 2H2SO4 → 2NO + I2 + 2K2SO4 + 2H2O
HNO2 + 2HI → 2NO + I2 + 2H2O.
Оксиды азота
Правило 3.14. Оксид азота (IV), как правило, восстанавливается до NO или N2:
2NO2 + P2O3 + 4KOH → 2NO + 2K2HPO4 + H2O
6NO2 + FeI2 → Fe(NO3)3 + I2 + 3NO
10NO2 + 4P → P2O5 + 10NO (возможно образование N2)
NO2 + SO2 → SO3 + NO
2NO2 + 2C → N2+ 2CO2
2NO2 + 2S → N2 + 2SO2
2NO2 + 4Cu → N2 + 4CuO
Правило 3. 15. Оксид азота (IV) диспропорционирует в реакциях с водой и растворами щелочей и карбонатов щелочных металлов:
15. Оксид азота (IV) диспропорционирует в реакциях с водой и растворами щелочей и карбонатов щелочных металлов:
Т.к. оксиду NO2 соответствуют две кислоты, при взаимодействии с щелочью или карбонатами щелочных металлов образуются две соли: нитрат и нитрит соответствующего металла:
2NO2 + 2NaOH → NaNO2 + NaNO3 + H2O 2NO2 + Na2CO3 → NaNO3 + NaNO2 + CO2
4NO2 + 2Ba(OH)2 → Ba(NO2)2 + Ba(NO3)2 + 2H2O
3NO2 + H2O → 2HNO3 + NO (растворение газа в воде в отсутствии кислорода)
В аналогичных реакциях с кислородом образуются только соединения с N+5 :
4NO2 + O2 + 4NaOH → 4NaNO3 + 2H2O
4NO2 + O2 + 2H2O → 4HNO3 (растворение в избытке кислорода)
Правило 3.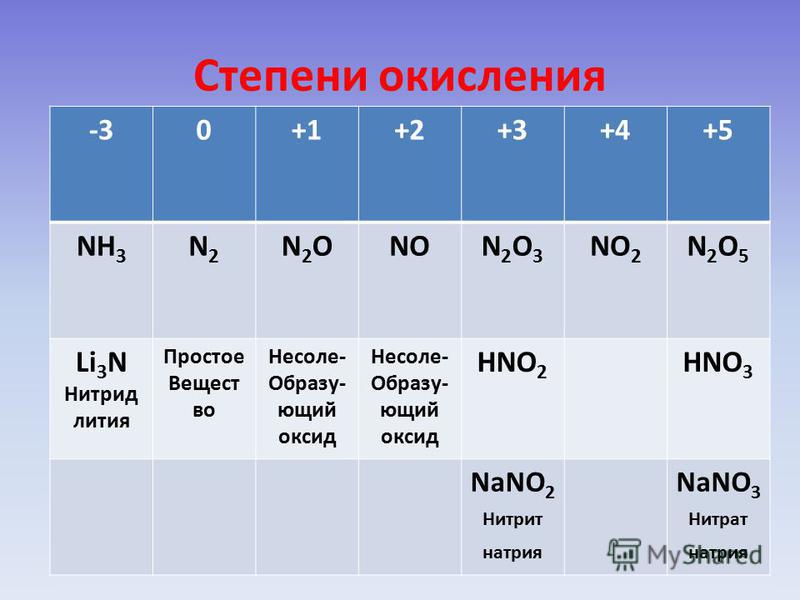 16. Оксид азота (II), как правило, окисляется до N+5 :
16. Оксид азота (II), как правило, окисляется до N+5 :
2NO + 3KClO + 2KOH → 2KNO3 + 3KCl + H2O
8NO + 3HClO4 + 4H2O → 8HNO3 + 3HCl
14NO + 6HBrO4 + 4H2O → 14HNO3 + 3Br2
Другие реакции:
2NO + O2 → 2NO2(идет самопроизвольно на воздухе)
2NO + 2SO2 → N2 + 2SO3
2NO + 2Cu → N2 + 2CuO (500-600°C).
Правило 3.17. Как и все оксиды азота, N2O является окислителем, способным окислять металлы:
N2O + Cu → CuO + N2
N2O + Cu2O → 2CuO + N2.
Оксид азота(III) | ChemToday — химический портал
Оксид азота(III) — промежуточный оксид азота в степени окисления +3, формула которого — \(\ce{N2O3}\). + 6CO2 + 17h3O}$$
+ 6CO2 + 17h3O}$$
Выделяющуюся смесь газов осушают с помощью дегидратирующих агентов, таких как, например, безводный \(\ce{CaCl2}\) или \(\ce{Na2SO4}\). Далее, поступая в охлаждающуюся часть химической установки, газы реагируют между собой, конденсируясь в синюю жидкость — оксид азота(III):
$$\ce{NO (g) + NO2 (g) -> N2O3 (l)}$$В видео проекта ChemToday вы можете увидеть полный процесс получения этого соединения:
Химические свойства
Оксид азота(III) является ангидридом азотистой кислоты, так как при взаимодействии с водой образует данную кислоту:
$$\ce{N_2O_3 + H_2O -> 2HNO_2}$$Азотистая кислота неустойчива в водном растворе, и постепенно разлагается, выделяя монооксид и диоксид азота, либо диспропорционируя на азотную кислоту и монооксид азота:
$$\ce{2HNO_2 -> H_2O + NO + NO_2}$$ $$\ce{3HNO_2 -> HNO_3 + 2NO + H_2O}$$Как кислотный оксид, реагирует со щелочами:
$$\ce{N_2O_3 + 2KOH -> 2KNO_2 + H_2O}$$Выше нуля градусов по Цельсию соединение подвержено разложению на оксиды азота близких степеней окисления:
$$\ce{N_2O_3 ->[t>0^oC] NO ^ + NO_2 ^}$$Как и все соединения азота, высокотоксичен, поэтому для работы с ним необходимо соблюдать технику безопасности, в частности, не вдыхать пары соединения.
Оксид азота (II) и оксид азота (IVАзотная кислота, строение молекулы и получение. Окислительные свойства азотной кислоты.
Урок: Оксид азота (II) и оксид азота (IVАзотная кислота, строение молекулы и получение. Окислительные свойства азотной кислоты.
Цели: Повторить и закрепить знания об общих химических свойствах кислот; изучить строение молекулы азотной кислоты, физические и специфические химические свойства азотной кислоты – взаимодействие ее с металлами; познакомить учащихся с промышленным и лабораторным способами получения чистой азотной кислоты.
Ход урока:
I Повторение.
Учитель: На прошлых уроках мы изучили некоторые соединения азота. Давайте вспомним их.
Ученик: Это аммиак, соли аммония, оксиды азота.
Учитель: Какие оксиды азота являются кислотными?
Ученик: Оксид азота (III) N2O3 – азотистый ангидрид и оксид азота (V) N2O5 – азотный ангидрид, ему соответствует азотная кислота HNO3.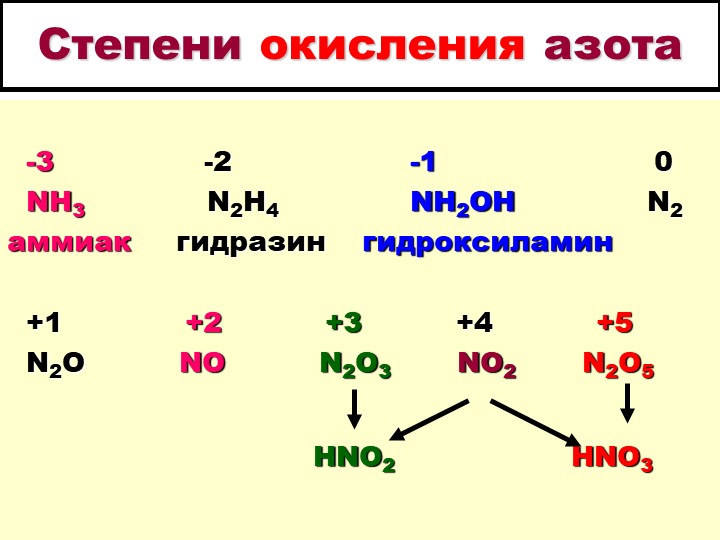
Учитель: Каков качественный и количественный состав азотной кислоты
II Состав и строение HNO3
1. Реакции с металлами. Поскольку атом азота в положительных степенях окисления является окислителем, причем чем выше степень окисления, тем сильнее способность отбирать электроны у других атомов, то с металлами – по сути своей восстановителями – оксиды азота будут реагировать. Продукты при этом могут получаться совсем разные, в зависимости от условий реакции и самого металла. Например, раскаленной меди все оксиды азота отдают кислород, а сами превращаются в простое вещество азот:
По количеству образовавшихся оксида меди и азота можно установить, какой именно из оксидов азота реагировал с медью.
2. Реакции с неметаллами. В первую очередь рассмотрим реакции с кислородом. Здесь между оксидами наблюдается различие, и весьма существенное.
Оксид NO реагирует с кислородом с образованием оксида азота(IV). Реакция обратимая. Причем с повышением температуры скорость этой реакции уменьшается:
Реакция обратимая. Причем с повышением температуры скорость этой реакции уменьшается:
2NO + O2 = 2NO2.
Оксид NO2 с кислородом вообще не реагирует.
Озон переводит оба оксида в оксид азота(V).
Оксид азота(II) NO присоединяет озон полностью:
2NO + O3 = N2O5.
Оксид азота(IV) NO2 в реакции с озоном выделяет еще и кислород:
2NO2 + O3 = N2O5 + O2.
3. Реакции с водой. Оксид NO с водой не реагирует. Оксид NO2 с водой образует две кислоты – азотную (степень окисления азота +5) и азотистую (степень окисления азота +3). В присутствии кислорода оксид NO2 целиком переходит в азотную кислоту:
2NO2 + Н2O = НNО3 + НNO2,
4NO2 + O2 + 2Н2О = 4НNО3.
4. Реакции c кислотами. Ни один из оксидов – NO или NO2 – не реагирует с кислотами.
5. Реакции со щелочами. Оба оксида азота реагируют со щелочами.
Оксид NO образует с щелочью соль азотистой кислоты, оксид азота(I) и азот:
10NO + 6NaOH = 6NaNO2 + N2O + N2 + 3h3O.
Оксид NO2 образует с щелочью соли двух кислот – азотной и азотистой:
2NO2 + 2NaOH = NaNO3 + NaNO2 + h3O.
Вернемся к нашей тайне степеней окисления. При переходе кислородных соединений азота из состояния «газ», где свободно можно двигаться, в состояние «водный раствор», где больше толкотни, где процветает коллективизм, где существуют и активно действуют полярные молекулы воды, никто уже не позволит молекуле, атому или иону быть в одиночестве, происходит «смена ориентации». Устойчивыми становятся как раз нечетные степени окисления, как и положено элементу из нечетной группы. (Устойчивыми, правда, относительно. Азотистая кислота, например, может существовать только в растворе, иначе она разлагается. Но кислот, формально соответствующих оксидам азота(II) и (IV), вообще не существует. Все познается в сравнении.)
Но кислот, формально соответствующих оксидам азота(II) и (IV), вообще не существует. Все познается в сравнении.)
Интересно, что со щелочами реагирует не только явно кислотный оксид NO2, но и NО – по свойствам и степени окисления некислотный, при этом получаются соединения других степеней окисления – нечетных! Тайна? Вполне!ная кислота, строение молекулы и получение.
Опытным путём доказано, что в молекуле азотной кислоты между двумя атомами кислорода и атомом азота две химические связи абсолютно одинаковые – полуторные связи. Степень окисления азота +5, а валентность равна IV.
Физические свойства
Азотная кислота HNO3 в чистом виде — бесцветная жидкость с резким удушливым запахом, неограниченно растворимая в воде; t°пл.= -41°C; t°кип.= 82,6°С, r = 1,52 г/см3. В небольших количествах она образуется при грозовых разрядах и присутствует в дождевой воде.
Под действием света азотная кислота частично разлагается с выделением NО2 и за cчет этого приобретает светло-бурый цвет:
N2 + O2 грозовые эл. разряды→ 2NO
разряды→ 2NO
2NO + O2 → 2NO2
4НNО3 свет→ 4NО2↑(бурый газ) + 2Н2О + О2
Азотная кислота высокой концентрации выделяет на воздухе газы, которые в закрытой бутылке обнаруживаются в виде коричневых паров (оксиды азота). Эти газы очень ядовиты, так что нужно остерегаться их вдыхания. Азотная кислота окисляет многие органические вещества. Бумага и ткани разрушаются вследствие окисления образующих эти материалы веществ. Концентрированная азотная кислота вызывает сильные ожоги при длительном контакте и пожелтение кожи на несколько дней при кратком контакте. Пожелтение кожи свидетельствует о разрушении белка и выделении серы (качественная реакция на концентрированную азотную кислоту – жёлтое окрашивание из-за выделения элементной серы при действии кислоты на белок – ксантопротеиновая реакция). То есть – это ожог кожи. Чтобы предотвратить ожог, следует работать с концентрированной азотной кислотой в резиновых перчатках.
Получение
1. Лабораторный способ
Лабораторный способ
KNO3 + h3SO4(конц) → KHSO4 + HNO3 (при нагревании)
2. Промышленный способ
Осуществляется в три этапа:
a) Окисление аммиака на платиновом катализаторе до NO
4Nh4 + 5O2 → 4NO + 6h3O (Условия: катализатор – Pt, t = 500˚С)
б) Окисление кислородом воздуха NO до NO2
2NO + O2 → 2NO2
в) Поглощение NO2 водой в присутствии избытка кислорода
4NO2 + О2 + 2h3O ↔ 4HNO3и 3NO2 + h3O ↔ 2HNO3+NO (без избытка кислорода)
Применение
в производстве минеральных удобрений;
в военной промышленности;
в фотографии — подкисление некоторых тонирующих растворов;
в станковой графике — для травления печатных форм (офортных досок, цинкографических типографских форм и магниевых клише).
в производстве взрывчатых и отравляющих веществ
Вопросы для контроля:
№1. Степень окисления атома азота в молекуле азотной кислоты
a. +4 b. +3 c. +5 d. +2
№2. Атом азота в молекуле азотной кислоты имеет валентность равную —
a. II b. V c. IV d. III
№3. Какими физическими свойствами характеризуют чистую азотную кислоту?
a. без цвета b. не имеет запаха c. имеет резкий раздражающий запах d. дымящая жидкость
e. окрашена в жёлтый цвет
№4. Установите соответствие между исходными веществами и продуктами реакции:
a) Nh4 + O2 1) NO2
b) KNO3 + h3SO4 2) NO2 + О2 + h3O
c) HNO3 3) NO + h3O
d) NO + O2 4) KHSO4 + HNO3
№5. Расставьте коэффициенты методом электронного баланса, покажите переход электронов, укажите процессы окисления (восстановления; окислитель (восстановитель):
NO2 + О2 + h3O ↔ HNO3
Д/З, таблица 15, с. 55, упр.1,3,4, с.59
55, упр.1,3,4, с.59
Азот, соединения азота
Азот, соединения азота
Азот – элемент V A группы главной подгруппы, значит, на внешнем энергетическом уровне у него 5 электронов. До завершения внешнего уровня ему не хватает 3 электрона, которые он может присоединить, в этом случае степень окисления его будет равна -3. Кроме этого, атом азота может и отдавать электроны и приобретать положительные степени окисления. Таким образом, для атома азота в соединениях возможны степени окисления от -3 до +5.
Рассмотрим соединения азота.
Например,
в аммиаке – NH3
– степень окисления азота -3; в оксиде азота (I) – N2O
– степень окисления азота +1; в оксиде азота (II) – NO
– степень окисления азота +2; в азотистой кислоте – HNO2
– степень окисления азота +3; в оксиде азота (IV) – NO2
– степень окисления азота +4; в азотной кислоте – HNO3
– степень окисления азота +5.
Таким образом, если степень окисления азота -3, то он проявляет восстановительные свойства, если степень окисления +5, то азот проявляет окислительные свойства, а если у азота в соединении промежуточные степени окисления: +1, +2, +3, +4, то он может проявлять и окислительные, и восстановительные свойства.
Азот входит в состав воздуха, где его объёмная доля составляет 78%, он входит в состав земной коры и живых организмов. В космосе азот занимает по распространённости четвёртое место, вслед за водородом, гелием и кислородом.
Азот входит и в состав чилийской селитры – NaNO3 – это неорганическое вещество образовалось из остатков птичьего помёта в условиях сухого и жаркого климата. Широко распространена и калийная селитра – KNO3, встречающаяся в Индии.
Азот
входит в состав всех белков, а белок просто необходим
для жизни. Человек получает белок из растительной и животной пищи, а животные получают
белок, в основном, из растений. А сами растения являются источником пополнения
азота. Поэтому в природе постоянно происходит круговорот азота.
Человек получает белок из растительной и животной пищи, а животные получают
белок, в основном, из растений. А сами растения являются источником пополнения
азота. Поэтому в природе постоянно происходит круговорот азота.
Так как азот входит в состав органических соединений, то он недоступен для растений. Но, в результате жизнедеятельности определённой группы бактэрий, органические соединения превращаются в неорганические – минеральные – это соли аммония и нитраты. И уже эти неорганические вещества усваиваются растениями. Затем растениями, которые усвоили азот, питаются животные и из растений получают необходимый белок.
Большую роль в фиксации азота играют клубеньковые бактерии, которые живут в клубеньках бобовых растений (клевера, гороха, люпина). Они усваивают атмосферный азот и превращают его в соединения, которые доступные растениям.
Кроме
этого, соединения азота в почве пополняются за счёт грозовых ливней.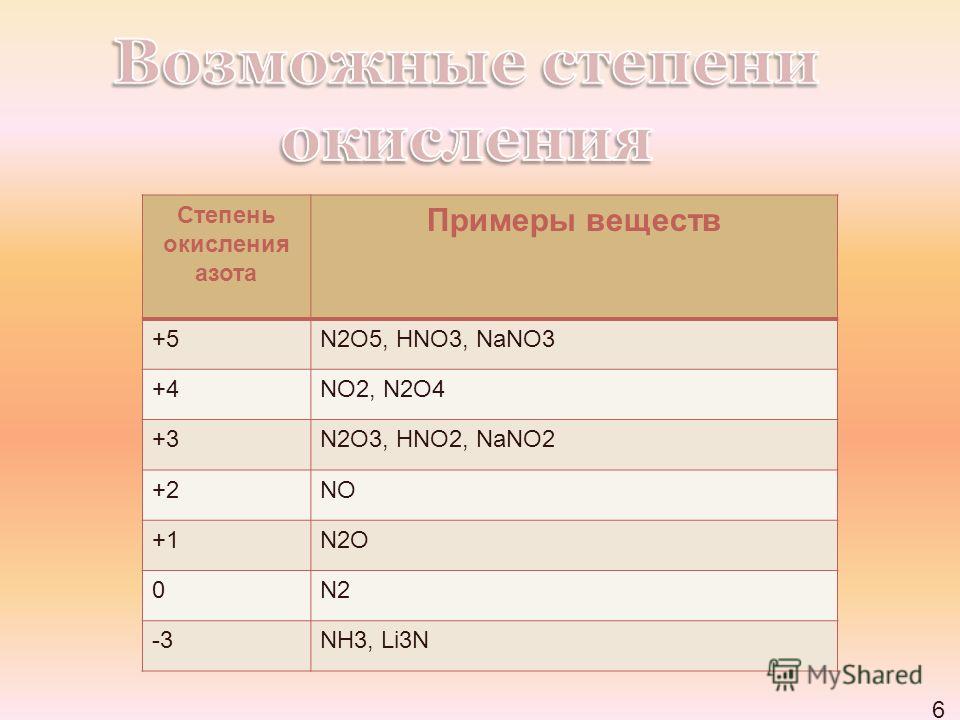 Сначала из азота и кислорода образуется оксид азота (II), который под действием
кислорода воздуха превращается в оксид азота (IV). Этот оксид реагирует с водой
в присутствии кислорода воздуха и получается азотная кислота. Кислота
затем вступает во взаимодействие с соединениями натрия, кальция и калия,
которые находятся в почве, и образует соли – селитры, которые нужны для питания
растений.
Сначала из азота и кислорода образуется оксид азота (II), который под действием
кислорода воздуха превращается в оксид азота (IV). Этот оксид реагирует с водой
в присутствии кислорода воздуха и получается азотная кислота. Кислота
затем вступает во взаимодействие с соединениями натрия, кальция и калия,
которые находятся в почве, и образует соли – селитры, которые нужны для питания
растений.
Простое вещество азот состоит из двухатомных молекул – N2. В молекуле азота атомы связаны между собой тройной ковалентной неполярной связью. Эта связь очень прочная, поэтому азот является малоактивным веществом.
Азот
является бесцветным газом, не имеет запаха и вкуса, немного легче воздуха.
Не сжижается при обычной температуре, плохо растворим в воде, его температура
плавления -210 0C,
а температура кипения -196 0C.
В лаборатории азот получают разложением нитрита аммония при слабом нагревании.
Азот относительно инертен в химических реакциях. Он не реагирует ни с кислотами, ни с водой, ни со щелочами.
При обычных условиях азот реагирует только с литием. При этом образуется нитрид лития.
Литий повышает свою степень окисления с 0 до +1, а азот понижает с 0 до -3. Каждый атом алюминия отдает по 6 электронов молекуле азота, при этом литий является восстановителем, а азот окислителем.
С другими металлами азот реагирует только при высоких температурах.
Например, в реакции с магнием образуется нитрид магния. Магний изменяет свою степень окисления с 0 до +2, а азот понижает с 0 до -3. Каждый атом магния отдаёт по 3 электрона молекуле азота. Магний в реакции является восстановителем, а азот – окислителем.
При
высоких температуре, давлении и в присутствии катализатора
азот реагирует с водородом, образуя при этом аммиак.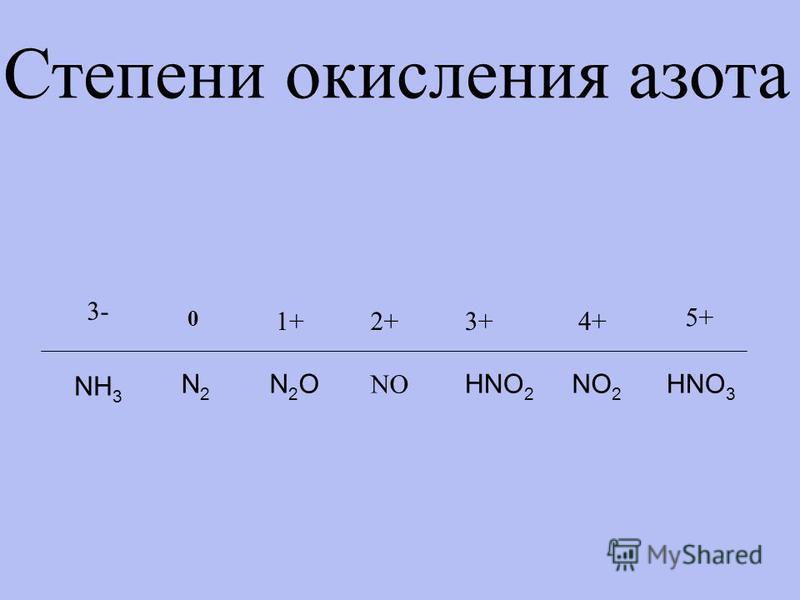 В этой реакции азот
понижает свою степень окисления с 0 до -3, а водород повышает с 0я до +1. Азот
является окислителем, а водород восстановителем.
В этой реакции азот
понижает свою степень окисления с 0 до -3, а водород повышает с 0я до +1. Азот
является окислителем, а водород восстановителем.
Как видите, это реакция соединения, так как из двух простых веществ образуется одно сложное, реакция экзотермическая, так как протекает с выделением теплоты, обратимая, то есть идёт как в прямом, так и в обратном направлении, каталитическая, потому что в реакции присутствует катализатор – железо. Реакция является окислительно-восстановительной, потому что происходит изменение степеней окисления, реакция гомогенная, так как вступающие в химическую реакцию вещества и продукты реакции в одном агрегатном состоянии – газообразном.
При высокой температуре азот соединяется с кислородом, образуя оксид азота два.
В
этой реакции азот повышает свою степень окисления с 0 до +2, а кислород
понижает с 0 до -2. Азот является восстановителем, а кислород – окислителем.
Азот является восстановителем, а кислород – окислителем.
Так как эта реакция идёт с изменением степеней окисления, то она является окислительно-восстановительной, это реакция соединения, потому что из двух простых веществ образуется одно сложное. Реакция обратимая, идёт в прямом и обратном направлении, эндотермическая, так как теплота поглощается, реакция некаталитическая, потому что не требует участия катализатора, является гомогенной, так как все вещества находятся в газообразном состоянии.
Следует отметить, что в реакциях с металлами и водородом азот проявляет окислительные свойства, а в реакциях с кислородом – восстановительные.
Основная
область применения азота – производство аммиака и азотной кислоты. Азот
применяют также для создания инертной среды при сушке взрывчатых веществ, при
хранении ценных произведений живописи и рукописей. Азотом раньше
наполняли электрические лампы. Жидкий азот используют в охладительных системах.
Жидкий азот используют в охладительных системах.
В медицине чистый азот применяют в качестве инертной среды при лечении туберкулёза лёгких, а жидкий азот – при лечении заболеваний позвоночника и суставов.
В 1772 году английский учёный Резерфорд и шведский исследователь Шееле в экспериментах по сжиганию веществ обнаружили газ, не поддерживающий дыхание и горение. Позднее, в 1787 году, Лавуазье установил наличие в воздухе газа, не поддерживающего дыхания и горения. Он дал название этому газу «азот», означающее «безжизненный» (от латинского а – нет и зоэ – жизнь). В 1790 году Шапталь дал азоту другое название – нитрогениум – означающее «рождающий селитру».
Решим
задачу. Определим массу соединения, которое образуется при нагревании
металлического магния массой 7,2 г в азоте объёмом 10 л при
нормальных условиях.
В условии задачи нам дана масса магния и объём азота. Найти необходимо массу образовавшегося соединения, то есть массу нитрида магния. Найдём количество вещества магния, для этого необходимо массу магния разделить на его молярную массу. То есть 7,2 г разделим на 24 г/моль, получим 0,3 моль, теперь найдём количество вещества азота, для этого нужно объём азота разделить на молярный объём. Для этого разделим 10 л на 22,4 л/моль, получается 0,446 моль. По уравнению реакции видно, что соотношение моль магния и азота составляет 3 : 1. Следовательно, количество вещества азота должно быть в три раза меньше количества вещества магния, то есть 0,1 моль. В результате вычислений мы получили количество вещества азота, равное 0,446 моль. Поэтому азот находится в избытке, и количество вещества нитрида магния находим по магнию.
Получается,
что количество вещества нитрида магния будет 0,1 моль, то есть 0,3 умножим на 1
и разделим на 3 и получится 0,1 моль. Найдём молярную массу нитрида магния. Для
этого относительную атомную массу магния (24) умножим на 3 и прибавим
относительную атомную массу азота (14), умноженную на 2, получается 100 г/моль.
Найдём массу этого вещества. Для этого следует количество вещества умножить на
молярную массу, поэтому 0,1 моль умножаем на 100 г/моль и получим 10 г.
Найдём молярную массу нитрида магния. Для
этого относительную атомную массу магния (24) умножим на 3 и прибавим
относительную атомную массу азота (14), умноженную на 2, получается 100 г/моль.
Найдём массу этого вещества. Для этого следует количество вещества умножить на
молярную массу, поэтому 0,1 моль умножаем на 100 г/моль и получим 10 г.
Таким образом масса нитрида магния будет равна десять г.
Степени окисления азота — Chemistry LibreTexts
Сравнивая химию аминов со спиртами и простыми эфирами, мы обнаруживаем много классов родственных соединений, в которых азот принимает более высокие степени окисления, в отличие от ограниченных степеней окисления кислорода.
В этом контексте имейте в виду, что степень окисления элементарного кислорода (O 2 ) и азота (N 2 ) определяется как ноль. Наиболее распространенным состоянием ковалентно связанного кислорода является -2. Это относится к воде, спиртам, простым эфирам и карбонильным соединениям. Единственная распространенная высшая степень окисления (-1) встречается у пероксидов R–O–O–R, где R = водород, алкил, арил или ацил. Из-за низкой энергии ковалентной связи пероксидной связи ( ок. 35 ккал/моль) эти соединения широко используются в качестве инициаторов свободных радикалов и иногда являются взрывоопасными по своей реакционной способности (например, трипероксид триацетона, используемый террористами-бомбардировщиками). Соединения азота, с другой стороны, охватывают степени окисления азота в диапазоне от -3, как в аммиаке и аминах, до +5, как в азотной кислоте.В следующей таблице перечислены некоторые известные органические соединения азота, имеющие различные степени окисления этого элемента. Некоторые из этих классов соединений были описаны; другие будут обсуждаться позже.
Это относится к воде, спиртам, простым эфирам и карбонильным соединениям. Единственная распространенная высшая степень окисления (-1) встречается у пероксидов R–O–O–R, где R = водород, алкил, арил или ацил. Из-за низкой энергии ковалентной связи пероксидной связи ( ок. 35 ккал/моль) эти соединения широко используются в качестве инициаторов свободных радикалов и иногда являются взрывоопасными по своей реакционной способности (например, трипероксид триацетона, используемый террористами-бомбардировщиками). Соединения азота, с другой стороны, охватывают степени окисления азота в диапазоне от -3, как в аммиаке и аминах, до +5, как в азотной кислоте.В следующей таблице перечислены некоторые известные органические соединения азота, имеющие различные степени окисления этого элемента. Некоторые из этих классов соединений были описаны; другие будут обсуждаться позже.
окисления | _ _ _ _ 2 _ _ 1 _ 1 | 0 | +1 | +3 | ||||
|---|---|---|---|---|---|---|---|---|
| Формулы | (Имена) | R 3 N R (Amines) (аммоний) (Имины ) (NITRILES) R 2 R 2 N-NR 2 (Гидразины) (гидразоны) RN = NR (азосоед. (гидроксилмин) (оксид амина) N 2 (азот) (диазоний) (диазоний) R-N = O (нитрозо) | R-NO 2 R-NO 2 (NITRO) (нитритный эфир) |
Оксиды амины и Cope Elimination
Оксиды аминов получают путем окисления 3º-аминов или пиридинов перекисью водорода или надкислотами (например,{(–)} + ZOH\]
Оксиды аминов являются относительно слабыми основаниями, pK a ок. 4,5 по сравнению с исходным амином. Координатно-ковалентная функция N–O полярна, при этом кислород является мощным акцептором водородной связи. Если один из алкильных заместителей состоит из длинной цепи, такой как C 12 H 25 , образующийся аминоксид является амфотерным поверхностно-активным веществом и находит применение в шампунях и других мягких чистящих средствах.
Реакция отщепления, дополняющая реакцию отщепления Хофмана, происходит при нагревании оксидов 3º-амина при температуре от 150 до 200 ºC.Эта реакция известна как Cope Elimination. Обычно его проводят путем добавления по каплям раствора оксида амина в нагретую трубку, наполненную мелкими стеклянными шариками. Поток газообразного азота, протекающий через колонну, переносит летучие алкеновые продукты в охлаждаемый приемник. Азотсодержащий продукт представляет собой гидроксиламин. В отличие от элиминации Хофмана, эта реакция происходит путем согласованной циклической реорганизации, как показано на следующей диаграмме. Для такого механизма фрагменты бета-водорода и оксида амина обязательно имеют син-связь.
Удаление диастереомерных аминооксидов, таких как показанные в примерах № 2 и 3 выше, обеспечивает доказательство син-отношения бета-водородных и аминоксидных групп. Эти примеры также демонстрируют сильную региоселективность в пользу более стабильной двойной связи.
Пиролитическое син-элиминирование
Оксиды аминов не являются единственными функциями, которые подвергаются мономолекулярному син-элиминированию при нагревании. Чтобы увидеть примеры других случаев, нажмите здесь
Нитроксидные радикалы
2º-амины, лишенные α-водорода, окисляются пероксидами (ZOOH) до нитроксильных радикалов удивительной стабильности.В примере, показанном в верхней части следующей диаграммы, следует отметить, что резонансная делокализация неспаренного электрона способствует образованию полярной связи N–O. Соединение R=H, известное под аббревиатурой TEMPO, представляет собой относительно стабильное твердое вещество красного цвета. Было получено много других нитроксидов, три из которых нарисованы в правом нижнем углу. Если один или несколько атомов водорода присутствуют на соседнем углероде, нитроксил разлагается на смеси, включающие аминооксиды и нитроны, как показано внизу слева. Нитроксиды окисляются галогенами до нестабильных катионов оксаммония.
Спин неспаренного электрона нитроксила можно изучить с помощью метода, называемого электронным парамагнитным резонансом (ЭПР или ЭПР). Эксперименты такого рода показали, что спектры ЭПР чувствительны к заместителям в радикале, а также к его непосредственному окружению. Это привело к стратегии спиновой маркировки для исследования конформационных структур макромолекул, таких как белки. Таким образом, сайт-направленное спиновое мечение (SDSL) стало ценным методом для картирования элементов вторичной структуры на уровне основной складки в широком диапазоне белков, включая те, которые не поддаются структурной характеристике с использованием классических структурных методов. такие как ядерный магнитный резонанс и рентгеновская кристаллография.
Фосфорные аналоги аминов
Фосфор находится ниже азота в периодической таблице. Чтобы увидеть примеры фосфорорганических соединений и их химии, нажмите здесь
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно.Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
- Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.
- Дата на вашем компьютере в прошлом.Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.

- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу.Предоставить доступ без файлов cookie потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только та информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к
остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
Например, сайт
не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к
остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
Адаптация необычной степени окисления в оксинитриде лантана и тантала (IV) с помощью дизайна микроструктуры предшественника
Аммонолиз оксидов лантана и тантала на месте
Во-первых, стадии реакции LaTaO 2 N (рис.1) синтез исследовали методом аммонолиза in situ (10 об.% Ar в NH 3 ) с использованием термогравиметрического анализа (ТГА). Для лучшей сопоставимости были выбраны аналогичные условия измерения как для аммонолиза in situ, так и для аммонолиза ex situ (см. ниже). Нанокристаллический оксид лантана и тантала (n-LTO) и микрокристаллический LaTaO 4 (m-LaTaO 4 ) были синтезированы в качестве предшественников, чтобы исследовать влияние микроструктуры на поведение реакции (подробности синтеза и характеристики в дополнительном примечании 1, Дополнительный рис. 1–5 и дополнительные таблицы 1–4).
1–5 и дополнительные таблицы 1–4).
Схема синтеза LaTa(IV)O 2 N. Сначала методом Печини получают черный ксерогель. Последующее прокаливание при низкой температуре приводит к получению белого нанокристаллического оксида лантана и тантала (n-LTO). Наконец, аммонолиз n-LTO в токе аммиака при более высоких температурах дает желаемый ярко-красный LaTa(IV)O 2 N. Шкала изображений СЭМ: 2 мкм, шкала вставки: 100 нм.
Кривая ТГА н-ДСН в процессе аммонолиза in situ (рис.2) выявляет несколько массовых изменений, происхождение которых было определено в экспериментах по прекращению. Начальное изменение массы -0,7% в диапазоне от 25 °С до 588°С (область I) можно отнести к десорбции остаточной воды или органических загрязнений, поэтому прекурсор остается белым (рис. 2).
Рис. 2 ТГА-аммонолиз in situ нанокристаллического оксида лантана и тантала (n-LTO). In situ TGA аммонолиза (10 об.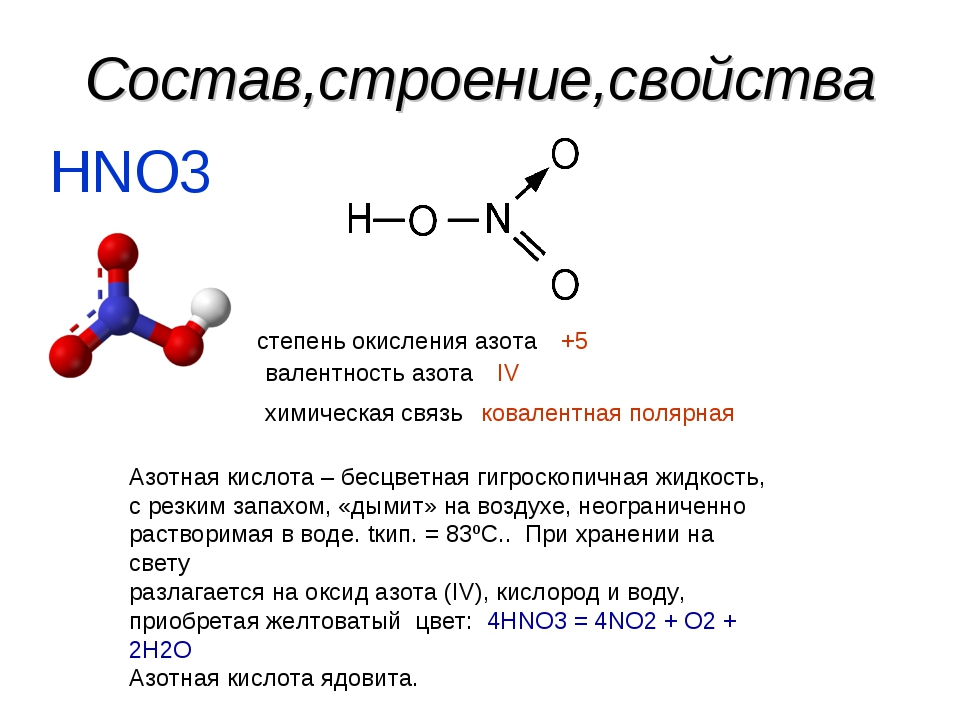 % Ar в NH 3 ) n-LTO, включая соответствующие картины порошковой рентгеновской дифракции (PXRD) и анионные составы, определенные с помощью экстракции горячим газом (HGE) после выбранных экспериментов по прекращению.Иллюстративные окрашенные порошки при определенных температурах дополняют анализ. Восстановление тантала при 844 °C выделено красной рамкой. Кроме того, на вставке увеличены первые четыре изменения массы (область I–IV) во время аммонолиза n-LTO in situ. Результаты аммонолиза in situ микрокристаллического LaTaO 4 (голубая кривая (микро) на той же вставке) можно найти ниже.
% Ar в NH 3 ) n-LTO, включая соответствующие картины порошковой рентгеновской дифракции (PXRD) и анионные составы, определенные с помощью экстракции горячим газом (HGE) после выбранных экспериментов по прекращению.Иллюстративные окрашенные порошки при определенных температурах дополняют анализ. Восстановление тантала при 844 °C выделено красной рамкой. Кроме того, на вставке увеличены первые четыре изменения массы (область I–IV) во время аммонолиза n-LTO in situ. Результаты аммонолиза in situ микрокристаллического LaTaO 4 (голубая кривая (микро) на той же вставке) можно найти ниже.
Последующее большее изменение массы -2,9% (область II) сопровождается локальным минимумом массы при 844 °C.При этой температуре порошок имеет черный цвет, и рентгенограмма порошка (PXRD) показывает начало кристаллизации. Кроме того, экстракция горячим газом (HGE) выявила состав LaTaO 3,44(4) N 0,41(2) □ 0,14(6) (продукт эксперимента по прекращению при 844 °C) с предполагаемым соотношением La:Ta:O = 1:1:4 (результаты HGE перечислены в дополнительной таблице 5). Следовательно, область II (между 588 °С и 844 °С) характеризуется образованием вакансий кислорода с одновременным внедрением азота.Согласно литературным данным 19 , LaTaO 4 кристаллизуется в пространственной группе A 2 1 am примерно до 800 °C и имеет октаэдрические цепочки с соответствующими промежутками (рис. 1). Поэтому мы предполагаем, что в этой межпространственной области происходит образование вакансий и включение азота.
Следовательно, область II (между 588 °С и 844 °С) характеризуется образованием вакансий кислорода с одновременным внедрением азота.Согласно литературным данным 19 , LaTaO 4 кристаллизуется в пространственной группе A 2 1 am примерно до 800 °C и имеет октаэдрические цепочки с соответствующими промежутками (рис. 1). Поэтому мы предполагаем, что в этой межпространственной области происходит образование вакансий и включение азота.
В то же время изменение цвета порошка с белого на черный свидетельствует об уменьшении содержания Ta. Как показывает рентгенофотоэлектронная спектроскопия (РФЭС), нагрев до 844 °С в атмосфере аммиака обуславливает два существующих признака связывания Ta(V)–O в n-LTO (рис.3а, n-LTO), чтобы изменить их характер. Оценка характеристик связывания Ta(V)–O в n-LTO и m-LaTaO 4 описана в дополнительном примечании 4. Две новые энергии связи орбиталей Ta 4 f 7/2 в LaTaO 3. 44 (4) N 0,41 (2) □ 0,14 (6) из е B (TA 4 F 7/2 ) = 25,2 EV и E B (Ta 4 f 7/2 ) = 24.4 эВ, соответственно, можно получить из примененной пиковой подгонки (рис. 3a, n-LTO, NH 3 /844 °C).
44 (4) N 0,41 (2) □ 0,14 (6) из е B (TA 4 F 7/2 ) = 25,2 EV и E B (Ta 4 f 7/2 ) = 24.4 эВ, соответственно, можно получить из примененной пиковой подгонки (рис. 3a, n-LTO, NH 3 /844 °C).
XPS-спектры в области Ta 4 f и модель точечного заряда. a РФЭС-спектры в области Ta 4 f интермедиатов, полученных обрывом in situ аммонолиза при 844 °C и 891 °C, а также n-LTO и m-LaTaO 4 (данные измерений : открытые черные кружки и сплошная черная линия: в целом подходит). Пики Ta 4 f 7/2 отмечены соответствующей им энергией связи и, в случае m-LaTaO 4 , дополнительно соответствующей пространственной группой полиморфа (ср.SI) b Модель прикладного точечного заряда 20,21 в районе Ta 4 f LaTaO 3,44(4) N 0,41(2) □ 0,14(6) in 9000 2 N (ex situ) и LaTaON 2 (ex situ). Характер связывания Ta(V)–O m-LaTaO 4 ( P 2 1 / c ) использовали в качестве эталона для Ta 5+ . Черные точки представляют эталонные энергии связи Ta(0) 22 и Ta(V) (измеренные), соединенные черной пунктирной линией.Серая пунктирная линия представляет сдвинутую энергию связи Ta 5+ (от 25,3 эВ до 25,0 эВ из-за замены N) LaTaON 2 (ex situ). c XPS-спектры в области Ta 4 f LaTaO 2 N и LaTaON 2 с соответствующими подобранными энергиями связи и соответствующими характерами связи. Открытые кружки представляют данные измерений, сплошные линии показывают общую подгонку, а пунктирные линии — результаты подгонки соответствующих орбиталей Ta 4 f .
Характер связывания Ta(V)–O m-LaTaO 4 ( P 2 1 / c ) использовали в качестве эталона для Ta 5+ . Черные точки представляют эталонные энергии связи Ta(0) 22 и Ta(V) (измеренные), соединенные черной пунктирной линией.Серая пунктирная линия представляет сдвинутую энергию связи Ta 5+ (от 25,3 эВ до 25,0 эВ из-за замены N) LaTaON 2 (ex situ). c XPS-спектры в области Ta 4 f LaTaO 2 N и LaTaON 2 с соответствующими подобранными энергиями связи и соответствующими характерами связи. Открытые кружки представляют данные измерений, сплошные линии показывают общую подгонку, а пунктирные линии — результаты подгонки соответствующих орбиталей Ta 4 f .
Расчеты с использованием уравнений, оцененных Нордлингом 20 (дополнительное примечание 5), предполагают, что замена кислорода азотом при сохранении Ta 5+ вызывает химический сдвиг на 0,3 эВ в сторону более низких энергий связи. Наблюдаемое in situ превращение n-LTO в LaTaO 3,44(4) N 0,41(2) □ 0,14(6) между 588 °C и 844 °C сопровождается Ta 4 f 7
Наблюдаемое in situ превращение n-LTO в LaTaO 3,44(4) N 0,41(2) □ 0,14(6) между 588 °C и 844 °C сопровождается Ta 4 f 76 /2
сдвиг энергии связи от 25,5 эВ до 25,2 эВ для Ta(V)–O за счет включения азота.Следовательно, энергия связи E B (Ta 4 f 7/2 ) = 25,2 эВ может быть отнесена к характеру связи Ta(V)–(O,N), поскольку исходная энергия связи снижается на ожидаемое ∆ E B = 0,3 эВ. Другая энергия связи Ta(V)–O Ta 4 f 7/2 сдвигается от 26,7 эВ в n-LTO до 24,4 эВ в LaTaO 3,44(4) N 0,41(2) □ 0,14(6) , разница намного выше, чем ∆ E B = 0.3 эВ. Это можно объяснить изменением степени окисления Ta в дополнение к замещению азота. Следовательно, энергия связи при E B (Ta 4 f 7/2 ) = 24,4 эВ может быть отнесена к характеру связи Ta(IV)–(O,N). Характер связи Ta(IV)–(O,N) можно определить, применяя модель точечного заряда 20,21 , предполагая, что атомный потенциал Ta не изменяется при изменении степени окисления. Ta(0) at E B (Ta 4 f 7/2 ) = 21.9 EV 22 и TA (V) на E B (TA 4 F 7/2 ) = 25,3 эВ в M-Latao 4 ( P 2 1 / C ) (вместо E B (Ta 4 F 7/2 ) = 25,9 эВ в M-Latao 4 ( CMC 2 1 )) были выбраны как ссылки (рис. 3b). Выбор энергии связи Ta(V) был основан на сходных межатомных расстояниях внутри и между октаэдром [Ta V O 6 ] 7- вместе с количеством соседних ионов Ta по сравнению с соответствующим оксинитридом ([Ta(O,N) 6 ] z — октаэдр).Таким образом, из-за линейной зависимости между степенью окисления и энергией связи в модели точечного заряда степень окисления Ta 4 + (электронная конфигурация d 1 ) при E B (Ta 4 f 7/2 ) = 24,4 эВ (рис.
Характер связи Ta(IV)–(O,N) можно определить, применяя модель точечного заряда 20,21 , предполагая, что атомный потенциал Ta не изменяется при изменении степени окисления. Ta(0) at E B (Ta 4 f 7/2 ) = 21.9 EV 22 и TA (V) на E B (TA 4 F 7/2 ) = 25,3 эВ в M-Latao 4 ( P 2 1 / C ) (вместо E B (Ta 4 F 7/2 ) = 25,9 эВ в M-Latao 4 ( CMC 2 1 )) были выбраны как ссылки (рис. 3b). Выбор энергии связи Ta(V) был основан на сходных межатомных расстояниях внутри и между октаэдром [Ta V O 6 ] 7- вместе с количеством соседних ионов Ta по сравнению с соответствующим оксинитридом ([Ta(O,N) 6 ] z — октаэдр).Таким образом, из-за линейной зависимости между степенью окисления и энергией связи в модели точечного заряда степень окисления Ta 4 + (электронная конфигурация d 1 ) при E B (Ta 4 f 7/2 ) = 24,4 эВ (рис. 3b).
3b).
Дальнейшее изменение массы на + 1,0 % происходит в диапазоне температур от 844 °C до 891 °C (область III). При этом цвет порошка меняется с черного на охристый.Массовые доли при 891 °C, определенные методом HGE, составляют 13,7 масс.% O и 6,7 масс.% N (по сравнению с 14,4 масс.% O и 1,5 масс.% N при 844 °C). Однако увеличение общей массы за счет сильного обогащения азотом, сопровождающееся лишь небольшой потерей кислорода, нельзя объяснить простым восполнением ранее образовавшихся кислородных вакансий в «LaTaO 4 », так как общая массовая доля анионов существенно превышает расчетную. максимальное значение 16,7% масс. для «LaTaO 4 » (дополнительная таблица 5).Оценка соответствующей порошковой картины показывает, что фаза цвета охры не полностью кристаллизована (дополнительное примечание 6 и дополнительный рисунок 6), что свидетельствует об образовании богатого азотом промежуточного продукта (предлагаемый состав: LaTa (O, N, □) 4 :(N 2 ) y ). Такие промежуточные соединения хорошо известны из экспериментов по повторному окислению нескольких других оксинитридов, включая LaTiO 2 N 23 . Измерение XPS (рис. 3a, n-LTO, NH 3 / 891 °C) снова показывает химический сдвиг энергии связи Ta 4 f 7/2 от 24.от 4 эВ (Ta(IV)–(O,N)) до 24,0 эВ (Ta(IV)–N). Это свидетельствует о повышенном содержании азота в химическом окружении Та и, следовательно, во всем образце. Другой характер связывания Ta(V)–(O,N) при E B (Ta 4 f 7/2 ) = 25,1 эВ (ранее 25,2 эВ) остается неизменным. Дальнейшее повышение температуры до 950 °С (область IV) приводит к резкому изменению массы на -6,9%. В течение следующих 10 ч аммонолиза до охлаждения до 25 °С масса остается почти постоянной.Соответствующий эксперимент по прекращению показывает изменение цвета с охристого на красный после 10-часового аммонолиза. ГГЭ красной фазы имеет состав LaTaO 1,44(1) N 1,63(9) .
Такие промежуточные соединения хорошо известны из экспериментов по повторному окислению нескольких других оксинитридов, включая LaTiO 2 N 23 . Измерение XPS (рис. 3a, n-LTO, NH 3 / 891 °C) снова показывает химический сдвиг энергии связи Ta 4 f 7/2 от 24.от 4 эВ (Ta(IV)–(O,N)) до 24,0 эВ (Ta(IV)–N). Это свидетельствует о повышенном содержании азота в химическом окружении Та и, следовательно, во всем образце. Другой характер связывания Ta(V)–(O,N) при E B (Ta 4 f 7/2 ) = 25,1 эВ (ранее 25,2 эВ) остается неизменным. Дальнейшее повышение температуры до 950 °С (область IV) приводит к резкому изменению массы на -6,9%. В течение следующих 10 ч аммонолиза до охлаждения до 25 °С масса остается почти постоянной.Соответствующий эксперимент по прекращению показывает изменение цвета с охристого на красный после 10-часового аммонолиза. ГГЭ красной фазы имеет состав LaTaO 1,44(1) N 1,63(9) . Эта фаза далее трансформируется в красный LaTaO 1,26(9) N 1,83(4) вторым циклом нагревания в атмосфере аммиака при 1000°С в течение 14 часов. О таких промежуточных составах при синтезе LaTa(O,N) 3 часто сообщают в литературе, когда используются большие количества предшественников оксидов или применяемый предшественник кристаллизуется при температуре около 1000 °C перед аммонолизом 24 .Кроме того, большое количество образца может вызвать неоднородное воздействие восстанавливающих частиц во время аммонолиза. Положительные и отрицательные изменения массы, наблюдаемые во время стадий нагревания и охлаждения, по-видимому, вызваны десорбцией и адсорбцией газообразных частиц (например, H 2 O и/или NH 3 ). Содержание азота в обеих красных фазах меньше, чем в LaTaON 2 , показывая, что n-LTO подвержен восстановлению тантала (от Ta 5+ до Ta 4+ ).Использование m-LaTaO 4 в качестве предшественника для аммонолиза in situ приводит к LaTaON 2 , без промежуточных фаз и восстановления Ta(V) до Ta(IV) (отсутствие черного порошка указывает на восстановление).
Эта фаза далее трансформируется в красный LaTaO 1,26(9) N 1,83(4) вторым циклом нагревания в атмосфере аммиака при 1000°С в течение 14 часов. О таких промежуточных составах при синтезе LaTa(O,N) 3 часто сообщают в литературе, когда используются большие количества предшественников оксидов или применяемый предшественник кристаллизуется при температуре около 1000 °C перед аммонолизом 24 .Кроме того, большое количество образца может вызвать неоднородное воздействие восстанавливающих частиц во время аммонолиза. Положительные и отрицательные изменения массы, наблюдаемые во время стадий нагревания и охлаждения, по-видимому, вызваны десорбцией и адсорбцией газообразных частиц (например, H 2 O и/или NH 3 ). Содержание азота в обеих красных фазах меньше, чем в LaTaON 2 , показывая, что n-LTO подвержен восстановлению тантала (от Ta 5+ до Ta 4+ ).Использование m-LaTaO 4 в качестве предшественника для аммонолиза in situ приводит к LaTaON 2 , без промежуточных фаз и восстановления Ta(V) до Ta(IV) (отсутствие черного порошка указывает на восстановление). Вместо этого за начальным образованием кислородных вакансий (желтый LaTaO 3,87(7) □ 0,12(3) ) следует одноступенчатое изменение массы на -5,5% (начало при 820 °C), что указывает на превращение в LaTaON 2 (рис. 4).
Вместо этого за начальным образованием кислородных вакансий (желтый LaTaO 3,87(7) □ 0,12(3) ) следует одноступенчатое изменение массы на -5,5% (начало при 820 °C), что указывает на превращение в LaTaON 2 (рис. 4).
ТГА-аммонолиз m-LaTaO in situ 4 .Аммонолиз in situ (10 об.% Ar в NH 3 ) m-LaTaO 4 . На вставках показаны картины PXRD в выбранных точках обрыва и анионный состав продукта, полученного обрывом при 820 °C, определенный с помощью HGE. Цветные порошки экспериментов по прекращению показаны под соответствующей точкой измерения. Сильная топотактическая связь между m-LaTaO 4 и LaTaON 2 представлена соответственно ориентированными участками кристаллических структур.
Точнее, аммонолиз m-LaTaO 4 in situ начинается с изменения массы на –0,5% между 25 °C и 820 °C (рис. 4). Согласно результатам РФА продуктов обрыва кристаллическая структура m-LaTaO 4 в этом интервале температур не изменилась. Однако изменение цвета с белого (25 °C) на желтый (820 °C) указывало на изменение химического состава, включая образование кислородных вакансий, что было подтверждено с помощью экстракции горячим газом (дополнительная таблица 5).Дальнейший нагрев до 950 °С приводил к изменению цвета порошка с желтого на пурпурный, что сопровождалось массовым изменением массы на -5,5%. Обнаруженное изменение массы соответствует ожидаемому изменению массы Δ m вычисл. = −5,2% рассчитано для образования LaTaON 2 из LaTaO 4 . Эксперименты по прекращению при 820°C и 950°C вместе с измерениями извлечения горячего газа показали превращение микрокристаллического LaTaO 4 в LaTaON 2 при температуре выше 820°C за счет включения азота.За изотермической стадией с почти постоянной массой следовал второй цикл аммонолиза при 1000 °С в течение 14 часов. Рентгенограмма конечного продукта ясно показала наличие фазы типа перовскита (вставки, рис. 4).
Однако изменение цвета с белого (25 °C) на желтый (820 °C) указывало на изменение химического состава, включая образование кислородных вакансий, что было подтверждено с помощью экстракции горячим газом (дополнительная таблица 5).Дальнейший нагрев до 950 °С приводил к изменению цвета порошка с желтого на пурпурный, что сопровождалось массовым изменением массы на -5,5%. Обнаруженное изменение массы соответствует ожидаемому изменению массы Δ m вычисл. = −5,2% рассчитано для образования LaTaON 2 из LaTaO 4 . Эксперименты по прекращению при 820°C и 950°C вместе с измерениями извлечения горячего газа показали превращение микрокристаллического LaTaO 4 в LaTaON 2 при температуре выше 820°C за счет включения азота.За изотермической стадией с почти постоянной массой следовал второй цикл аммонолиза при 1000 °С в течение 14 часов. Рентгенограмма конечного продукта ясно показала наличие фазы типа перовскита (вставки, рис. 4). Изменения массы во время этих стадий нагревания и охлаждения могут быть связаны с обратимой адсорбцией и десорбцией молекул аммиака и воды, как упоминалось ранее для n-LTO. Мы предполагаем, что сильная топотактическая связь между кристаллом AB O 4 и кристаллом AB ON 2 , часто описанная в литературе 18 , также применима к превращению m-LaTaO 4 в LaTaON 900Исходя из этого предположения, октаэдрические цепочки дефектных m-LaTa(O,□) 4 , показанные на рис. 4, должны создавать узор, аналогичный LaTaON 2 , путем вращения вокруг оси c . При образовании кислородных вакансий и последующем присоединении азота они соединяются с соседними цепями по типу «молнии» 18 . Однако микроструктура n-LTO иная и проявляет при этом «мягкую» топотактическую связь с образующимся оксинитридом вдоль промежутков октаэдрических цепей (рис.1), вызывая более быстрое восстановление Ta(V) до Ta(IV). Затем «мягкая» топотаксическая реакция с одновременным октаэдрическим соединением типа «молния» 18 обеспечивает вышеупомянутое заполнение кислородных вакансий азотом.
Изменения массы во время этих стадий нагревания и охлаждения могут быть связаны с обратимой адсорбцией и десорбцией молекул аммиака и воды, как упоминалось ранее для n-LTO. Мы предполагаем, что сильная топотактическая связь между кристаллом AB O 4 и кристаллом AB ON 2 , часто описанная в литературе 18 , также применима к превращению m-LaTaO 4 в LaTaON 900Исходя из этого предположения, октаэдрические цепочки дефектных m-LaTa(O,□) 4 , показанные на рис. 4, должны создавать узор, аналогичный LaTaON 2 , путем вращения вокруг оси c . При образовании кислородных вакансий и последующем присоединении азота они соединяются с соседними цепями по типу «молнии» 18 . Однако микроструктура n-LTO иная и проявляет при этом «мягкую» топотактическую связь с образующимся оксинитридом вдоль промежутков октаэдрических цепей (рис.1), вызывая более быстрое восстановление Ta(V) до Ta(IV). Затем «мягкая» топотаксическая реакция с одновременным октаэдрическим соединением типа «молния» 18 обеспечивает вышеупомянутое заполнение кислородных вакансий азотом.
Более низкое содержание азота в LaTa(O,N) 3 по сравнению с LaTaON 2 при использовании n-LTO для аммонолиза in situ можно объяснить удельной поверхностью и размером первичных частиц и, таким образом, микроструктура предшественников оксидов.Удельная поверхность n-LTO составляет S BET = 7 м²/г (размер первичных частиц: нм-диапазон), а у m-LaTaO 4 S BET 9 м²/г (размер первичных частиц: мкм). Более подробную информацию о предшественниках оксидов можно найти в дополнительном примечании 1. Более высокая площадь поверхности и меньший размер первичных частиц нанокристаллического предшественника по сравнению с m-LaTaO 4 делают его более восприимчивым к восстановлению Ta, поскольку диффузия восстанавливающих агентов упрощается (при более высоких температурах NH 3 разлагается на азот- и водородсодержащие частицы и молекулярный водород 9 .Подробное объяснение взаимодействия восстанавливающих частиц с n-LTO можно найти в дополнительном примечании 7: Восстановление Ta. Это подтверждается тем фактом, что аммонолиз in situ n-LTO, который ранее был преобразован в m-LaTaO 4 , также приводит к LaTaON 2 (рис. 5 и дополнительное примечание 2).
Это подтверждается тем фактом, что аммонолиз in situ n-LTO, который ранее был преобразован в m-LaTaO 4 , также приводит к LaTaON 2 (рис. 5 и дополнительное примечание 2).
Преобразование n-LTO в m-LaTaO 4 и последующий ТГА-аммонолиз in situ в LaTaON 2 . Первое изменение массы –1.8% обусловлено десорбцией воды. Второе отрицательное изменение массы между 803 °C и 923 °C связано с пиролизом органических остатков предшествующего синтеза мягкой химии. Термогравиметрические измерения в сочетании с масс-спектрометрией (ТГА-МС) выявили выделение CO 2 , NO 2 и органических фрагментов. Результаты измерений показаны на дополнительном рисунке 4 и обсуждаются в дополнительном примечании 3. Сначала измерение было проведено в синтетическом (синтетическом) воздухе до этапа аммонолиза.
Кроме того, изображения, полученные с помощью сканирующей электронной микроскопии (СЭМ) продуктов обрыва процесса отжига n-LTO в син. воздух до аммонолиза in situ (рис. 6а) демонстрируют непрерывное микроструктурное изменение с повышением температуры, что приводит к морфологии, очень похожей на m-LaTaO 4 (рис. 6с).
воздух до аммонолиза in situ (рис. 6а) демонстрируют непрерывное микроструктурное изменение с повышением температуры, что приводит к морфологии, очень похожей на m-LaTaO 4 (рис. 6с).
СЭМ-изображения продуктов терминации всех исследований аммонолиза in situ. a Прекурсор преобразования n-LTO в m-LaTaO 4 в синтетическом (син.) воздух перед аммонолизом. b SEM-изображения продуктов терминации in situ аммонолиза n-LTO и c SEM-изображения in situ аммонолиза m-LaTaO 4 . Температуры отмечают температуру окончания, при которой наблюдались продукты. Шкала изображений СЭМ: 1 мкм.
Параллельно температура начала реакции аммонолиза неуклонно повышается с 588 °C до 820 °C с увеличением размера и кристалличности первичных частиц (от n-LTO до m-LaTaO 4 , рис. 2, 5 и 6).Следовательно, хорошо спроектированная микроструктура позволяет обеспечить или подавить значительное снижение Ta.
Аммонолиз ex situ оксидов лантана и тантала
В конце концов, аммонолиз in situ n-LTO не дал LaTaO 2 N, что может быть связано с менее восстановительной атмосферой, вызванной 10 об.% Ar в NH 3 необходимо для защиты устройства. Применение почти 100 об. % вместо 90 об. % NH 3 в классической установке аммонолиза с термическим потоком газа превратило аммонолиз in situ в аммонолиз ex situ.Аммонолиз ex situ лишь незначительно отличается от установки in situ в отношении среды образца. Используя тот же температурный профиль, что и при аммонолизе in situ, и скорость потока NH 3 300 мл/мин, мы окончательно преобразовали n-LTO в ярко-красный LaTaO 1,98(7) N 0,98(5) ( S BET = 25 м 2 /г) после 10 ч при 950 °C посредством аммонолиза ex situ (анионный состав получен HGE, дополнительная таблица 6). Однако при использовании микрокристаллического предшественника вместо нанокристаллического для аммонолиза ex situ с тем же температурным профилем и потоком аммиака, что и при аммонолизе in situ, LaTaO 1 пурпурного цвета. 05(3) N 2.02(3) (очень похоже на продукт аммонолиза in situ). Это указывает на очень похожий выбор параметров аммонолиза ex situ и in situ. Принимая во внимание результаты всех экспериментов по аммонолизу in situ и ex situ, мы определили чувствительность к восстановлению из-за микроструктурных различий и концентрацию аммиака в качестве основных параметров для регулирования соотношения O:N в LaTa(O,N) 3 .
05(3) N 2.02(3) (очень похоже на продукт аммонолиза in situ). Это указывает на очень похожий выбор параметров аммонолиза ex situ и in situ. Принимая во внимание результаты всех экспериментов по аммонолизу in situ и ex situ, мы определили чувствительность к восстановлению из-за микроструктурных различий и концентрацию аммиака в качестве основных параметров для регулирования соотношения O:N в LaTa(O,N) 3 .
Вышеупомянутый красный LaTaO 1.98(7) N 0.98(5) и пурпурный LaTaO 1,05(3) N 2,02(3) фазы, приготовленные аммонолизом ex situ, подвергают второму циклу аммонолиза ex situ (тот же температурный профиль, что и аммонолиз in situ) с флюсом KCl дополнение для устранения возможных дефектов 25 . После второго цикла составы слегка меняются на ярко-красный LaTaO 1,97(3) N 1,02(5) ( S BET = 8 m 2 5 900 La0 фиолетовый) и .соответственно. LaTaO 1,97(3) N 1,02(5) (LaTaO 2 N) выявляет меньше вакансий по сравнению с LaTaO 1,98(7) N 0,98(5) (получено с первого цикла), что указывает на залечивание дефекта эффект через поток KCl. Кроме того, исследование повторного окисления (дополнительное примечание 8, дополнительный рисунок 7 и дополнительная таблица 7) подтвердило образование LaTaO 2 N.
LaTaO 1,97(3) N 1,02(5) (LaTaO 2 N) выявляет меньше вакансий по сравнению с LaTaO 1,98(7) N 0,98(5) (получено с первого цикла), что указывает на залечивание дефекта эффект через поток KCl. Кроме того, исследование повторного окисления (дополнительное примечание 8, дополнительный рисунок 7 и дополнительная таблица 7) подтвердило образование LaTaO 2 N.
XPS-измерения LaTaO 1,97(3) N 1,02(5) и LaTaO 0,99(1) N 2,00(9) , полученные путем аммонолиза ex situ (рис. 3c, дополнение к обзорному спектру см. 9, дополнительный рис. 8) показывают значительные различия в степенях окисления Ta между обоими соединениями. Данные показывают характер связывания Ta(IV)–(O,N) с некоторым количеством Ta(III)–(O,N) в LaTaO 1,97(3) N 1,02(5) и Ta( V)–(O,N) и характер связывания Ta(III)–(O,N) в LaTaO 0.99(1) N 2,00(9) (рис. 3b и дополнительная таблица 8).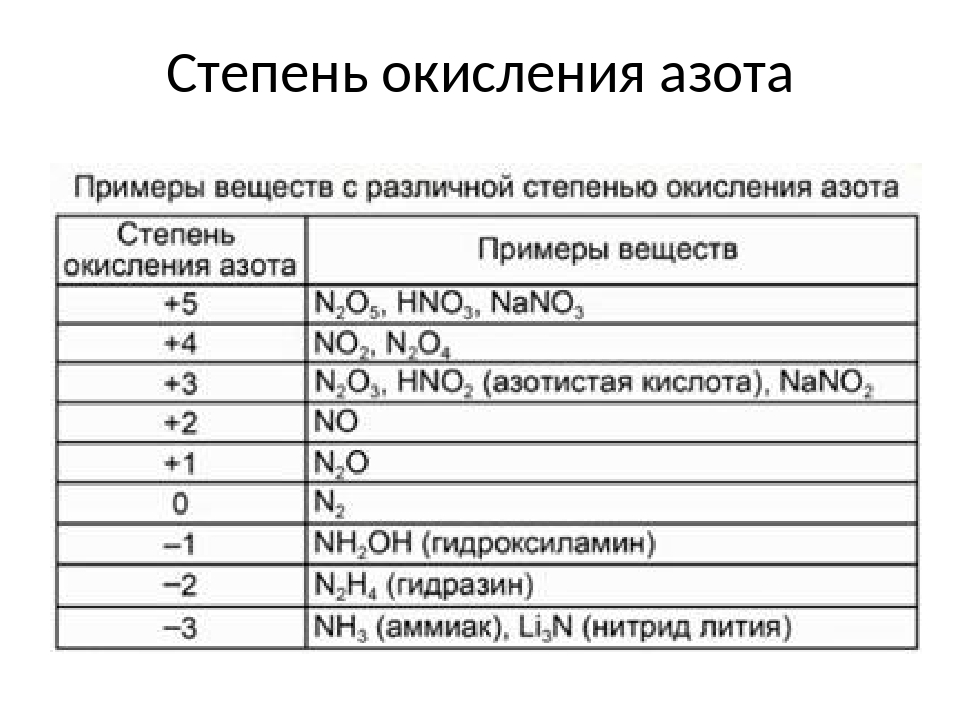 Поскольку энергия связывания на е B (Ta 4 F 7/2 ) = 24,4 эВ в Latao 1.97 (3) N 1.02 (5) соответствует этому в Latao 3.44 (4) N 0,41(2) □ 0,14(6) , тот же характер связывания из-за сходного химического окружения ([Ta(O,N) 6 ] z — октаэдр) может предположить. Однако подобранная энергия связи E B (Ta 4 f 7/2 ) = 25.0 эВ в LaTaO 0,99(1) N 2,00(9) обнаруживает характер связывания Ta(V)–(O,N), который можно объяснить простым химическим сдвигом на 0,3 эВ в сторону более низких энергий связи за счет азота Подстановка (M-Latao 4 , E B (TA 4 F 7/2 ) = 25,3 EV ( P 2 1 / C )). Характер связывания Ta(III)–(O,N) является результатом восстановительных условий во время аммонолиза, способствующих восстановлению Ta на поверхности по сравнению с объемом.
Поскольку энергия связывания на е B (Ta 4 F 7/2 ) = 24,4 эВ в Latao 1.97 (3) N 1.02 (5) соответствует этому в Latao 3.44 (4) N 0,41(2) □ 0,14(6) , тот же характер связывания из-за сходного химического окружения ([Ta(O,N) 6 ] z — октаэдр) может предположить. Однако подобранная энергия связи E B (Ta 4 f 7/2 ) = 25.0 эВ в LaTaO 0,99(1) N 2,00(9) обнаруживает характер связывания Ta(V)–(O,N), который можно объяснить простым химическим сдвигом на 0,3 эВ в сторону более низких энергий связи за счет азота Подстановка (M-Latao 4 , E B (TA 4 F 7/2 ) = 25,3 EV ( P 2 1 / C )). Характер связывания Ta(III)–(O,N) является результатом восстановительных условий во время аммонолиза, способствующих восстановлению Ta на поверхности по сравнению с объемом. XPS обладает высокой поверхностной чувствительностью из-за малой длины свободного пробега фотоэмитированных электронов 26 . Поэтому концентрации Ta(IV)–(O,N) и Ta(V)–(O,N) в объеме предполагаются более высокими, чем на поверхности. Характер связывания Ta(III)–N в LaTaO 0.99(1) N 2.00(9) at E B (Ta 4 f 7/2 приписывается. во вторичную фазу TaN, поскольку эталонная энергия связи этого нитрида составляет E B (Ta 4 f 7/2 ) = 23.0 эВ 27 . Кроме того, XPS-измерения LaTaO 2 N (LaTaO 1,97(3) N 1,02(5) ) также подтвердили отсутствие Ta 5+ (наблюдается, однако, в LaTaON 2 (LaTaO ). (1) N 2.00(9) ) исключает возможность смеси 1:1 Ta 3+ и Ta 5+ в LaTaO 2 N.
XPS обладает высокой поверхностной чувствительностью из-за малой длины свободного пробега фотоэмитированных электронов 26 . Поэтому концентрации Ta(IV)–(O,N) и Ta(V)–(O,N) в объеме предполагаются более высокими, чем на поверхности. Характер связывания Ta(III)–N в LaTaO 0.99(1) N 2.00(9) at E B (Ta 4 f 7/2 приписывается. во вторичную фазу TaN, поскольку эталонная энергия связи этого нитрида составляет E B (Ta 4 f 7/2 ) = 23.0 эВ 27 . Кроме того, XPS-измерения LaTaO 2 N (LaTaO 1,97(3) N 1,02(5) ) также подтвердили отсутствие Ta 5+ (наблюдается, однако, в LaTaON 2 (LaTaO ). (1) N 2.00(9) ) исключает возможность смеси 1:1 Ta 3+ и Ta 5+ в LaTaO 2 N.
Исследования магнитных свойств LaTaO 2 N и LaTaON 2 с помощью сверхпроводящего устройства квантовой интерференции (СКВИД) были проведены измерения, чтобы подтвердить присутствие Ta 4+ , хотя это сложно из-за присутствия магнитных примесей, таких как Ta 3+ , как наблюдалось из XPS-анализа (рис. 3) и в целом ограниченные знания о магнетизме соединений переходных металлов 5 d (по сравнению с их аналогами 3 d ) 28,29 . Соответствующие кривые с охлаждением в нулевом поле (ZFC) при 500 Э до 2 К показаны в дополнительном примечании 10 и дополнительном рис. 9. Низкотемпературные области (ниже ~ 70 К) могут быть описаны парамагнитным поведением, подобным Кюри-Вейссу. с очень малыми эффективными моментами (1,3 × 10 −4 µ B /Ta при 2 K для образца LaTaO 2 N и 9.8 × 10 −5 µ B /Ta для образца LaTaON 2 соответственно), что указывает на активацию магнитных примесных состояний, а не на внутреннее свойство материалов. Эффективный магнитный момент резко снижается при повышении температуры. В целом наблюдаемая намагниченность намного ниже 1 µ B /Ta, как и ожидалось от простейшей парамагнитной модели. Небольшой магнитный момент и тот факт, что Ta является элементом 5 d , предполагает, что сильно вытянутые орбитали 5 d в LaTaO 2 N сильно гибридизованы и перекрываются с O/N 2 p орбиталями 30 что приводит к слабо локализованным электронам, препятствующим созданию значительной намагниченности.
3) и в целом ограниченные знания о магнетизме соединений переходных металлов 5 d (по сравнению с их аналогами 3 d ) 28,29 . Соответствующие кривые с охлаждением в нулевом поле (ZFC) при 500 Э до 2 К показаны в дополнительном примечании 10 и дополнительном рис. 9. Низкотемпературные области (ниже ~ 70 К) могут быть описаны парамагнитным поведением, подобным Кюри-Вейссу. с очень малыми эффективными моментами (1,3 × 10 −4 µ B /Ta при 2 K для образца LaTaO 2 N и 9.8 × 10 −5 µ B /Ta для образца LaTaON 2 соответственно), что указывает на активацию магнитных примесных состояний, а не на внутреннее свойство материалов. Эффективный магнитный момент резко снижается при повышении температуры. В целом наблюдаемая намагниченность намного ниже 1 µ B /Ta, как и ожидалось от простейшей парамагнитной модели. Небольшой магнитный момент и тот факт, что Ta является элементом 5 d , предполагает, что сильно вытянутые орбитали 5 d в LaTaO 2 N сильно гибридизованы и перекрываются с O/N 2 p орбиталями 30 что приводит к слабо локализованным электронам, препятствующим созданию значительной намагниченности. Для 3 d переходных металлов, содержащих перовскиты AB O 3 и AB F 3 , хорошо известно, что с уменьшением электроотрицательности аниона гибридизация (или, другими словами, ковалентность B – связь X ) усиливается, что приводит к вышеупомянутой более сильной делокализации электронов и, следовательно, к спину 30 . Мы полагаем, что то же самое справедливо и для 5 d переходных металлов, содержащих перовскиты.Кроме того, еще два фактора могут способствовать уменьшению эффективного магнитного момента: (i) ожидается, что спин-орбитальная связь будет намного сильнее в материалах 5 d , чем в материалах 3 d , (ii) экспериментально наблюдаемое присутствие вытянутых октаэдров (Дополнительное примечание 11 и дополнительная таблица 9e) приводит к расщеплению изначально вырожденных уровней t 2 g . Это расщепление приводит к образованию четырехкратно вырожденных состояний 5 d xz и 5 d yz с меньшей энергией, чем исходное состояние, занятое только одним электроном, что затрудняет развитие магнитных заказ 31 .
Для 3 d переходных металлов, содержащих перовскиты AB O 3 и AB F 3 , хорошо известно, что с уменьшением электроотрицательности аниона гибридизация (или, другими словами, ковалентность B – связь X ) усиливается, что приводит к вышеупомянутой более сильной делокализации электронов и, следовательно, к спину 30 . Мы полагаем, что то же самое справедливо и для 5 d переходных металлов, содержащих перовскиты.Кроме того, еще два фактора могут способствовать уменьшению эффективного магнитного момента: (i) ожидается, что спин-орбитальная связь будет намного сильнее в материалах 5 d , чем в материалах 3 d , (ii) экспериментально наблюдаемое присутствие вытянутых октаэдров (Дополнительное примечание 11 и дополнительная таблица 9e) приводит к расщеплению изначально вырожденных уровней t 2 g . Это расщепление приводит к образованию четырехкратно вырожденных состояний 5 d xz и 5 d yz с меньшей энергией, чем исходное состояние, занятое только одним электроном, что затрудняет развитие магнитных заказ 31 .
Фазовая чистота LaTaO 2 N подтверждена рентгенограммой высокого разрешения (HR). LaTaON 2 уже упоминался в пространственных группах Imma и C 2/ m 17,32,33 , и оба рассматриваются также для LaTaO 2 N. Поскольку мы не наблюдали явных свидетельств моноклинного искажения, а пространственная группа Imma дает немного меньшую невязку χ 2 , чем C 2 /m , мы предлагаем Imma в качестве пространственной группы для LaTaO . 2 Н.То же самое относится к LaTaON 2 (дополнительный рисунок 10 и дополнительная таблица 9 для полного анализа кристаллической структуры). Объемы отделения ячейки Latao 2 N ( V Cell = 264.78 (3) Å 3 ) и Lataon 2 ( V Cell = 264.68 (2) Å 3 ) очень похожи. Немного большую элементарную ячейку LaTaO 2 N можно объяснить увеличением эффективного ионного радиуса Ta от 0. 64 Å (Ta 5+ ) 34 до 0,68 Å (Ta 4+ ) 34 после аммонолиза. Это расширение в основном компенсируется другим соотношением O:N. Частичная замена более крупного азота (1,46 Å) 34 меньшим кислородом (1,40 Å) 34 приводит к сжатию элементарной ячейки. Кроме того, LaTaO 2 N является фазово чистым, в то время как в LaTaON 2 небольшое количество Ta 3 N 5 ( Cmcm ) было обнаружено с помощью HR-PXRD (дополнительный рисунок.10b и дополнительную таблицу 9d). Поскольку XPS выявляет TaN на поверхности, а HR-PXRD Ta 3 N 5 в объеме, градиент азота в сочетании со сниженной восприимчивостью к восстановлению Ta (от Ta 5+ до Ta 3+ ) можно предположить. Однако TaN также может быть аморфным или его количество ниже предела обнаружения HR-PXRD.
64 Å (Ta 5+ ) 34 до 0,68 Å (Ta 4+ ) 34 после аммонолиза. Это расширение в основном компенсируется другим соотношением O:N. Частичная замена более крупного азота (1,46 Å) 34 меньшим кислородом (1,40 Å) 34 приводит к сжатию элементарной ячейки. Кроме того, LaTaO 2 N является фазово чистым, в то время как в LaTaON 2 небольшое количество Ta 3 N 5 ( Cmcm ) было обнаружено с помощью HR-PXRD (дополнительный рисунок.10b и дополнительную таблицу 9d). Поскольку XPS выявляет TaN на поверхности, а HR-PXRD Ta 3 N 5 в объеме, градиент азота в сочетании со сниженной восприимчивостью к восстановлению Ta (от Ta 5+ до Ta 3+ ) можно предположить. Однако TaN также может быть аморфным или его количество ниже предела обнаружения HR-PXRD.
Сканирующая электронная микроскопия дает представление о морфологии оксинитридов, синтезированных путем аммонолиза ex situ. LaTaO 2 N показывает первичные частицы в нанометровом диапазоне, в то время как LaTaON 2 демонстрирует пористые и спеченные частицы в микрометровом диапазоне (рис.7а).
LaTaO 2 N показывает первичные частицы в нанометровом диапазоне, в то время как LaTaON 2 демонстрирует пористые и спеченные частицы в микрометровом диапазоне (рис.7а).
СЭМ-изображения и кривые Кубелки–Мунка для приготовленных ex situ LaTaO 2 N и LaTaON 2 . a СЭМ-изображения LaTaO 2 N и LaTaON 2 показывают различную морфологию материалов в микрометровом диапазоне. Шкала изображений СЭМ: 1 мкм. b Кривые Кубелки-Мунка LaTaO 2 N и LaTaON 2 вместе с соответствующими порошковыми изображениями. Ярко-красный цвет указывает на гораздо более низкую концентрацию оптически активных дефектов по сравнению с LaTaON 2 .
В дополнение к определению удельной площади поверхности (дополнительная таблица 10) повышенное образование пор в LaTaON 2 во время аммонолиза также может быть подтверждено путем сравнения СЭМ-изображений оксида с его соответствующим оксинитридом. Кроме того, размер частиц увеличивается при аммонолизе n-LTO, тогда как при использовании m-LaTaO 4 размер частиц остается постоянным (рис. 6c). Соответствующие СЭМ-изображения оксидов можно найти в SI (дополнительный рис.2с).
Кроме того, размер частиц увеличивается при аммонолизе n-LTO, тогда как при использовании m-LaTaO 4 размер частиц остается постоянным (рис. 6c). Соответствующие СЭМ-изображения оксидов можно найти в SI (дополнительный рис.2с).
Поскольку цвета полученных оксинитридов отличаются друг от друга, были проведены измерения спектроскопии диффузного отражения (DRS). Данные, преобразованные в кривые Кубелки-Мунка 35 (рис. 7б), показывают разницу ∆ E g = 0,1 эВ между оптическими ширинами запрещенной зоны LaTaO 2
6 N (1,1 эВ). LaTaON 2 (1,8 эВ). Детальное исследование показывает, что кривая Кубелки-Мунка LaTaO 2 N сходится к нулю в отличие от кривой LaTaON 2 , что указывает на гораздо более низкую концентрацию оптически активных дефектов.Кроме того, после оптической ширины запрещенной зоны E g = 1,8 эВ увеличение интенсивности, наблюдаемое для LaTiO 2 N 36 , не было обнаружено для LaTaO2
N обладают необычным цветом (ярко-красным), который, как ожидается, будет более темным (голубоватый 37 ) из-за восстановления Ta 5+ до Ta 4+ . Кроме того, заметна большая оптическая ширина запрещенной зоны LaTa(IV)O 2 N по сравнению с LaTa(V)ON 2 .Основываясь на обоих наблюдениях, мы предполагаем большее расщепление кристаллического поля для LaTaO 2 N, вызванное состоянием d 1 Ta 4+ , поскольку Ta координируется в искаженном октаэдрическом окружении (эффект Яна-Теллера 31 ), показанный анализом длины связи с помощью уточнений Ритвельда. Для конкретных приложений, управляемых видимым светом, требуются материалы с соответствующей концентрацией дефектов 38,39,40 и подходящей шириной запрещенной зоны 41,42,43 . Таким образом, LaTaO 2 N может быть интересным кандидатом для дальнейших исследований в этой области применения.
Кроме того, заметна большая оптическая ширина запрещенной зоны LaTa(IV)O 2 N по сравнению с LaTa(V)ON 2 .Основываясь на обоих наблюдениях, мы предполагаем большее расщепление кристаллического поля для LaTaO 2 N, вызванное состоянием d 1 Ta 4+ , поскольку Ta координируется в искаженном октаэдрическом окружении (эффект Яна-Теллера 31 ), показанный анализом длины связи с помощью уточнений Ритвельда. Для конкретных приложений, управляемых видимым светом, требуются материалы с соответствующей концентрацией дефектов 38,39,40 и подходящей шириной запрещенной зоны 41,42,43 . Таким образом, LaTaO 2 N может быть интересным кандидатом для дальнейших исследований в этой области применения.No2 Номер окисления — Как обсудить
Номер окисления No2
Что такое степень окисления №2?
Степень окисления N в NO2 равна +4.
В этом контексте, какова степень окисления для no2 1?
Поскольку весь многоатомный нитрит-ион имеет общий ионный заряд 1, ион азота в молекуле должен иметь заряд +3. При соединении кислорода 4 и азота +3 получаем 1 заряд нитрит-иона. Следовательно, степень окисления азота в многоатомной молекуле нитрита равна -3.
При соединении кислорода 4 и азота +3 получаем 1 заряд нитрит-иона. Следовательно, степень окисления азота в многоатомной молекуле нитрита равна -3.
Итак, вопрос в том, может ли no2 окисляться?
Нитрование, окислитель в кислом растворе. +4 NO2 Двуокись азота, коричневый газ, обычно образующийся в результате реакции концентрированной азотной кислоты со многими металлами. Темнеет до N2O4. окислитель для нормального образования NO (g) или восстановитель для нитрования.
А какие комиссии у №2?
Химические детали| 1 | |||
| 3 | 0 | 0 | |
| Chiral Atoms | Now |
 Нет.
### 2 положительный или отрицательный?
Нитрит представляет собой ион, образованный атомом азота, связанным с двумя атомами кислорода. В частности, нитрит классифицируется как анион. Ион — это положительно или отрицательно заряженная молекула, а анион — это тип иона, который несет отрицательный заряд. Молекулярная масса нитрита 46,01 г/моль.
Нет.
### 2 положительный или отрицательный?
Нитрит представляет собой ион, образованный атомом азота, связанным с двумя атомами кислорода. В частности, нитрит классифицируется как анион. Ион — это положительно или отрицательно заряженная молекула, а анион — это тип иона, который несет отрицательный заряд. Молекулярная масса нитрита 46,01 г/моль.Как узнать степень окисления?
Объяснение:
Какова степень окисления MgCl2?
+2
Как определить, что окисляется, а что восстанавливается?
Дом
No2 имеет положительный заряд?
Каково химическое название № 2?
NO2 просто называется двуокисью азота.однако, когда он находится в ионном состоянии, его называют нитритом для анионной формы и ионом нитрония для катионной формы. В органических соединениях группа NO2 называется нитро.
Как зовут №2?
Оксид азота
No2 нейтральный лиганд?
Общие амбидентные лиганды включают цианид (CN), нитрит (NO2), тиоцианат (SCN). Нейтральные лиганды называются нейтральными молекулами.
Нейтральные лиганды называются нейтральными молекулами.
# 2 это ион?
На первый взгляд, NO2 ведет себя как CO2, двуокись углерода.Но молекула NO2 содержит на один электрон больше, чем CO2. При удалении электрона из NO2 получается ион NO2+ (нитроний или нитрил). Он изоэлектронен по отношению к CO2 и имеет два N = O.
Как найти официальное обвинение?
Почему водород имеет положительный заряд?
Элементарный водород не имеет себестоимости. Протон и электрон добавляют ноль. На основном уровне один электрон занимает первый контактный слой, который может иметь два электрона. Если заряд содержит больше протонов, чем электронов, он называется положительным зарядом.Нет.
3 это окислитель?
Является ли азотная кислота сильным окислителем, как большая буква Е?
значения. Являясь сильным окислителем, азотная кислота бурно реагирует со многими неметаллическими соединениями и может быть взрывоопасной. Он также может растворять драгоценные металлы, добавляя соляную кислоту.
Является ли натрий окислителем?
Натрий является щелочным металлом и поэтому легко окисляется до Na+. Так что нет, это не окислитель. Действительно, элементарный натрий является отличным восстановителем и широко используется в неорганической и органической химии.
Чем пахнет no2?
Оксиды азота, NO и NO2, такие как NO2. Оксиды азота (NOx) обычно представляют собой оксид азота (оксид азота или NO, бесцветный газ без запаха) и диоксид азота (NO2, красновато-коричневый газ с резким запахом, растворимый в воде).
Является ли азот окислителем?
Почему №2 нестабилен?
Быстро реагирует с кислородом с образованием двуокиси азота NO2. Оксид азота представляет собой относительно нестабильную двухатомную молекулу со свободным радикалом (т.е. неспаренный электрон). Молекула может принять или отдать электрон с образованием ионов NO или NO+.
Двуокись азота тяжелее воздуха?
Номер окисления №2Степени окисления азота в N2O и N2F4 равны соответственно A) -2 и +2 B) -2 и -3 C) +1 и +2 D) +1 и -1 E) +1 и -3
Вопрос:
Степени окисления азота в N2O и N2F4 равны соответственно
А) -2 и +2
Б) -2 и -3
С) +1 и +2
Г) +1 и -1
Д) +1 и -3
Степень окисления:
Определение степени окисления любого конкретного элемента в конкретном соединении осуществляется с помощью суммарного заряда, присутствующего в соединении, и степени окисления других элементов. Формула для оценки степени окисления азота или кислорода: {eq}{\rm{Окисление}}\;{\rm{состояние}}\;{\rm{из}}\;{\rm{N}} + {\ rm {Окисление}} \; {\ rm {состояние}} \; {\ rm {из}} \; {\ rm {O}} = {\ rm {Net}} \; {\ rm {заряд} } {/экв}
Формула для оценки степени окисления азота или кислорода: {eq}{\rm{Окисление}}\;{\rm{состояние}}\;{\rm{из}}\;{\rm{N}} + {\ rm {Окисление}} \; {\ rm {состояние}} \; {\ rm {из}} \; {\ rm {O}} = {\ rm {Net}} \; {\ rm {заряд} } {/экв}
Ответ и объяснение: 1
Степень окисления O равна -2.
{экв} {{\ rm {N}} _ {\ rm {2}}} {\ rm {O}} {/eq} является нейтральным, поэтому чистый заряд равен 0.
Степень окисления азота в {eq}{{\rm{N}}_{\rm{2}}}{\rm{O}} {/eq} показано ниже.
{eq}{\rm{Окисление}}\;{\rm{состояние}}\;{\rm{из}}\;{\rm{N}} + {\rm{Окисление}}\;{\ rm {состояние}} \; {\ rm {of}} \; {\ rm {O}} = {\ rm {Net}} \; {\ rm {заряд}} {/экв}
Подставьте соответствующие значения в приведенное выше уравнение.
{экв}\начало{выравнивание*} 2 \times \left( {{\rm{Окисление}}\;{\rm{состояние}}\;{\rm{of}}\;{\rm{N}}} \right) + \left( { — 2} \справа) &= {\rm{0}}\\ {\ rm {Окисление}} \; {\ rm {состояние}} \; {\ rm {из}} \; {\ rm {N}} & = \ dfrac {2} {2} \\ &= + 1 \конец{выравнивание*} {/экв}
Степень окисления F равна -1.
Аналогично, степень окисления N в {eq}{{\rm{N}}_{\rm{2}}}{{\rm{F}}_{\rm{4}}} {/eq} можно рассчитать, подставив соответствующие значения в приведенное выше уравнение.
{экв}\начало{выравнивание*} 2 \times \left( {{\rm{Oxidation}}\;{\rm{state}}\;{\rm{of}}\;{\rm{N}}} \right) + 4 \times \ влево( { — 1} \вправо) &= {\rm{0}}\\ {\ rm {Окисление}} \; {\ rm {состояние}} \; {\ rm {из}} \; {\ rm {N}} & = \ dfrac {4} {2} \\ & = + 2 \конец{выравнивание*} {/экв}
Следовательно, правильный вариант C) .
Настройка степени окисления наночастиц оксида марганца на углеродных нанотрубках, функционализированных кислородом и азотом, для электрокаталитической реакции выделения кислорода
Оксиды марганца являются многообещающими электрокатализаторами для реакции выделения кислорода благодаря их универсальным окислительно-восстановительным свойствам. Наночастицы оксида марганца (MnO x ) были синтезированы на углеродных нанотрубках, функционализированных кислородом и азотом (ОУНТ и УНТ), путем прокаливания на воздухе УНТ, импрегнированных марганцем, с загрузкой 10 мас. % Mn.Прокаленные образцы подвергались восстановительным условиям при термической обработке в парах H 2 или NH 3 и сильно окислительным условиям с использованием HNO 3 , что позволило гибко регулировать степень окисления Mn от 2+ в MnO до 4+ в MnO 2 . Образцы были охарактеризованы методами рентгеновской фотоэлектронной спектроскопии, рентгеновской дифракции, просвечивающей электронной микроскопии и термопрограммированного восстановления.Степень окисления Mn легче изменялась в образцах MnO x /УНТ по сравнению с образцами MnO x /ОУНТ. Кроме того, восстановление MnO 2 до MnO происходило в одну стадию на УНТ, тогда как Mn 2 O 3 промежуточные состояния наблюдались для ОУНТ. Изображения STEM и TEM показали меньшую и однородную дисперсию наночастиц MnO x на NCNT по сравнению с OCNT.
% Mn.Прокаленные образцы подвергались восстановительным условиям при термической обработке в парах H 2 или NH 3 и сильно окислительным условиям с использованием HNO 3 , что позволило гибко регулировать степень окисления Mn от 2+ в MnO до 4+ в MnO 2 . Образцы были охарактеризованы методами рентгеновской фотоэлектронной спектроскопии, рентгеновской дифракции, просвечивающей электронной микроскопии и термопрограммированного восстановления.Степень окисления Mn легче изменялась в образцах MnO x /УНТ по сравнению с образцами MnO x /ОУНТ. Кроме того, восстановление MnO 2 до MnO происходило в одну стадию на УНТ, тогда как Mn 2 O 3 промежуточные состояния наблюдались для ОУНТ. Изображения STEM и TEM показали меньшую и однородную дисперсию наночастиц MnO x на NCNT по сравнению с OCNT. Электрокаталитические испытания по выделению кислорода в 0,1 М KOH показали, что Mn в высоких степенях окисления, в частности 4+, как в MnO 2 , образующийся при обработке парами HNO 3 , более активен, чем Mn в более низких степенях окисления, с использованием потенциал при 10 мА см −2 и наклон Тафеля в качестве показателей производительности.
Электрокаталитические испытания по выделению кислорода в 0,1 М KOH показали, что Mn в высоких степенях окисления, в частности 4+, как в MnO 2 , образующийся при обработке парами HNO 3 , более активен, чем Mn в более низких степенях окисления, с использованием потенциал при 10 мА см −2 и наклон Тафеля в качестве показателей производительности.
У вас есть доступ к этой статье
Подождите, пока мы загрузим ваш контент… Что-то пошло не так. Попробуй снова?
Попробуй снова?степень окисления n в n2o4
также у Водорода есть бык. число 1. поэтому; Н… если отработать вол. Рассчитайте массовый процентный состав лития в Li3PO4.степень окисления азота в n2h5 . Расположите следующие N2, Nh4, N2O4, N2O, N2h5, NO-3 в порядке убывания степени окисления атома азота. Пусть степень окисления N в N O 3 − равна x. Степень окисления n в NO2- 1 См. ответ gamescommentary07 ждет вашей помощи. 1 десятилетие назад. Наибольшее количество оксидов образуется за счет способности азота с кислородом образовывать устойчивые кратные связи. Эта проблема решена! Степени окисления азота Ox. Кроме того, может ли no2 окисляться? Новые вопросы по химии.Поскольку азот находится во 2-м периоде современной периодической таблицы, главное квантовое число n=2, азимутальные квантовые числа = от 0 до n-1 для азота находятся в диапазоне от 0 до 1.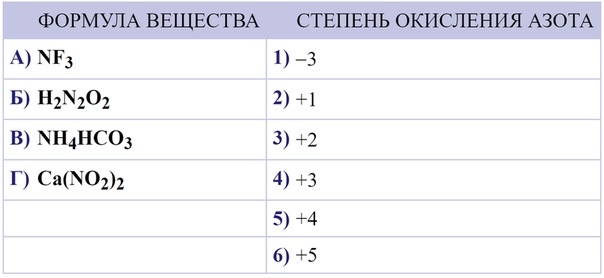 2NO 2 (г) — N 2 O 4 ( г) + 58 кДж. X = +5 а) 2no2 —> n2o4 B) 2CrO42- + 2H+ -> Cr2O72- + h3O Ни реакция (а), ни реакция (б) не являются окислительно-восстановительными реакциями, так как элементы в этих реакциях изменяют свою степень окисления Вы Теперь можно видеть, что степень окисления такая же, как у №1. У перекиси степень окисления О = -1.В следующей таблице перечислены некоторые известные органические соединения азота, имеющие различные степени окисления этого элемента. nh5. В Nh4 степень окисления азота равна -3. Посмотреть ответ. Диоксид азота имеет температуру кипения 294 К при 101,3 кПа. ХИМИЯ. Следовательно, 1 атом N потеряет 5 электронов. Нарисуйте диаграмму Льюиса для соединения, включая все валентные электроны. Он димеризуется с образованием N2O4. Четырехокись азота, обычно называемая четырехокисью азота, а иногда, обычно среди ракетостроителей бывшего СССР/России, амилом, представляет собой химическое соединение N 2 O 4 .Это полезный реагент в химическом синтезе. NO-3, N2O4, N2O, N2, N2h5, Nh4 Соединения азота, с другой стороны, охватывают степени окисления азота в диапазоне от -3, как в аммиаке и аминах, до +5, как в азотной кислоте.
2NO 2 (г) — N 2 O 4 ( г) + 58 кДж. X = +5 а) 2no2 —> n2o4 B) 2CrO42- + 2H+ -> Cr2O72- + h3O Ни реакция (а), ни реакция (б) не являются окислительно-восстановительными реакциями, так как элементы в этих реакциях изменяют свою степень окисления Вы Теперь можно видеть, что степень окисления такая же, как у №1. У перекиси степень окисления О = -1.В следующей таблице перечислены некоторые известные органические соединения азота, имеющие различные степени окисления этого элемента. nh5. В Nh4 степень окисления азота равна -3. Посмотреть ответ. Диоксид азота имеет температуру кипения 294 К при 101,3 кПа. ХИМИЯ. Следовательно, 1 атом N потеряет 5 электронов. Нарисуйте диаграмму Льюиса для соединения, включая все валентные электроны. Он димеризуется с образованием N2O4. Четырехокись азота, обычно называемая четырехокисью азота, а иногда, обычно среди ракетостроителей бывшего СССР/России, амилом, представляет собой химическое соединение N 2 O 4 .Это полезный реагент в химическом синтезе. NO-3, N2O4, N2O, N2, N2h5, Nh4 Соединения азота, с другой стороны, охватывают степени окисления азота в диапазоне от -3, как в аммиаке и аминах, до +5, как в азотной кислоте. 2 О 2 → О-22. Расположите молекулы Nh4, NO3, HN3, NO2-, N2O4 и N2h5 в порядке убывания степеней окисления азота. Расположите следующие соединения азота в порядке убывания степени окисления азота. HNO3 N2h5 NO2 + N2 NO2- NO2 N2O4 N2O НЕТ Я понимаю концепцию, я просто не знаю, как их решить… вы также должны помнить, что кислород всегда имеет степень окисления -2, если не указано иное. Сумма положительных и отрицательных степеней окисления должна равняться 0 заряда многоатомного иона. Поскольку Br 2 является более сильным окислителем, чем I 2 , он окисляет S из S 2 O 3 2- до более высокой степени окисления +6 и, следовательно, образует SO 4 2-ионы. Степень окисления — это заряд атома после ионного приближения его связей. Кислород в этом случае более электроотрицательный и поэтому имеет степень окисления #-2#.Здесь два атома кислорода, поэтому общий заряд равен #-2*2=-4#. Водород обычно имеет степень окисления #+1#, и здесь тоже. Пусть #x# будет степенью окисления азота. состояние N в NO2 — сделать его равным = -1.
2 О 2 → О-22. Расположите молекулы Nh4, NO3, HN3, NO2-, N2O4 и N2h5 в порядке убывания степеней окисления азота. Расположите следующие соединения азота в порядке убывания степени окисления азота. HNO3 N2h5 NO2 + N2 NO2- NO2 N2O4 N2O НЕТ Я понимаю концепцию, я просто не знаю, как их решить… вы также должны помнить, что кислород всегда имеет степень окисления -2, если не указано иное. Сумма положительных и отрицательных степеней окисления должна равняться 0 заряда многоатомного иона. Поскольку Br 2 является более сильным окислителем, чем I 2 , он окисляет S из S 2 O 3 2- до более высокой степени окисления +6 и, следовательно, образует SO 4 2-ионы. Степень окисления — это заряд атома после ионного приближения его связей. Кислород в этом случае более электроотрицательный и поэтому имеет степень окисления #-2#.Здесь два атома кислорода, поэтому общий заряд равен #-2*2=-4#. Водород обычно имеет степень окисления #+1#, и здесь тоже. Пусть #x# будет степенью окисления азота. состояние N в NO2 — сделать его равным = -1. Вопрос: Какова степень окисления N в N2h5? Каждому атому в молекуле присваивается степень окисления (иногда называемая степенью окисления). 04.12.2020 — Правильный порядок кислотной силы оксида азота: а)NO 3 N2 + 6 ч3О Если 1,50 х 102 г N2х5 и 2.00 х . Из следующих четырех элементов потенциал ионизации какого из них выше? Смотрите ответ. Он димеризуется с образованием N2O4. Таким образом, общее изменение составляет +1. Как рассчитать степень окисления по диаграмме Льюиса. какова степень окисления хлора в Cl2O7…(N2O4), которые воспламеняются при контакте с образованием газообразного азота и водяного пара. Ответ Сохранить. Это особенно важно в окислительно-восстановительных реакциях, когда одни атомы теряют (окисляются), а другие приобретают (восстанавливаются) электроны. В соединениях степень окисления O = -2, если соединение не является пероксидом.Автор темы Steelersfan2009; Дата начала 24 июня 2009 г .; Поиск. Чтобы найти степень окисления N, нам нужно использовать правило, согласно которому сумма степеней окисления каждого элемента соединения равна о, если соединение нейтральное, или его суммарному заряду, если соединение имеет чистый заряд.
Вопрос: Какова степень окисления N в N2h5? Каждому атому в молекуле присваивается степень окисления (иногда называемая степенью окисления). 04.12.2020 — Правильный порядок кислотной силы оксида азота: а)NO 3 N2 + 6 ч3О Если 1,50 х 102 г N2х5 и 2.00 х . Из следующих четырех элементов потенциал ионизации какого из них выше? Смотрите ответ. Он димеризуется с образованием N2O4. Таким образом, общее изменение составляет +1. Как рассчитать степень окисления по диаграмме Льюиса. какова степень окисления хлора в Cl2O7…(N2O4), которые воспламеняются при контакте с образованием газообразного азота и водяного пара. Ответ Сохранить. Это особенно важно в окислительно-восстановительных реакциях, когда одни атомы теряют (окисляются), а другие приобретают (восстанавливаются) электроны. В соединениях степень окисления O = -2, если соединение не является пероксидом.Автор темы Steelersfan2009; Дата начала 24 июня 2009 г .; Поиск. Чтобы найти степень окисления N, нам нужно использовать правило, согласно которому сумма степеней окисления каждого элемента соединения равна о, если соединение нейтральное, или его суммарному заряду, если соединение имеет чистый заряд. Итак, в HNO3 допустим, что заряд азота равен x. 1+ x+ (-6) = 0. x -5 = 0. … Отметьте элемент, который проявляет только одну степень окисления в своих соединениях. Среди оксидов азота: N2O3, N2O4 и N2O5; молекула(ы), имеющие связь азот-азот: (A) Только N2O5 (B) N2O3 и N2O5 (C) N2O4 и.В соединении сероводорода, h3S, два атома водорода имеют степень окисления +1, всего +2. Следовательно, степень окисления азота в многоатомной молекуле нитрита равна −3. 1. Фосфор также проявляет степени окисления +1 и +4 в некоторых оксокислотах. 3. 4,99 × 1023 молекул N2O4. Молярная масса N2O4 составляет 92,02 г/моль. Следовательно, его степень окисления увеличится на 5. Следовательно, степень окисления серы в соединении равна -2, а сумма степеней окисления равна 0. NH 3 → NO 2 20.2 N2h5 + N2O4 —> 3 N2 + 6 h3O Если 1,50 .
Итак, в HNO3 допустим, что заряд азота равен x. 1+ x+ (-6) = 0. x -5 = 0. … Отметьте элемент, который проявляет только одну степень окисления в своих соединениях. Среди оксидов азота: N2O3, N2O4 и N2O5; молекула(ы), имеющие связь азот-азот: (A) Только N2O5 (B) N2O3 и N2O5 (C) N2O4 и.В соединении сероводорода, h3S, два атома водорода имеют степень окисления +1, всего +2. Следовательно, степень окисления азота в многоатомной молекуле нитрита равна −3. 1. Фосфор также проявляет степени окисления +1 и +4 в некоторых оксокислотах. 3. 4,99 × 1023 молекул N2O4. Молярная масса N2O4 составляет 92,02 г/моль. Следовательно, его степень окисления увеличится на 5. Следовательно, степень окисления серы в соединении равна -2, а сумма степеней окисления равна 0. NH 3 → NO 2 20.2 N2h5 + N2O4 —> 3 N2 + 6 h3O Если 1,50 . В. У нас есть азотистая кислота с химической формулой #HNO_2#. Это также нейтральная молекула. степень окисления азота в n2h5…(N2O4), которые воспламеняются при контакте с образованием газообразного азота и паров воды.
 Азот не может проявлять степень окисления +5 из-за отсутствия d-орбиталей. Добавьте свой ответ и заработайте очки. Сопоставьте список 1, содержащий соединения, со списком 2, содержащим степени окисления азота, и выберите ответ, используя коды, приведенные под списками.Расположите молекулы Nh4, NO3, HN3, NO2-, N2O4 и N2h5 в порядке убывания степеней окисления азота. 10 лет назад. Впервые о N 2 O 5 сообщил Девиль в 1840 году, который получил его, обработав AgNO 3 Cl 2. Любимый ответ. HClO 4 → HCl + H 2 O 21. Химия. Share Tweet Отправить Кристалл хлорида аммония [Викимедиа] Азот — элемент 15ᵗʰ группы (по новой классификации) второго периода таблицы Менделеева. Стабильность степени окисления +5 снижается, а стабильность степени окисления +3 увеличивается (из-за эффекта обратной пары) вниз по группе.Поскольку азот имеет формальный заряд +1, это означает потерю контроля над еще одним электроном. Код: (а) (б) (в) (г) (А) 3 4 2 1 (Б) 4 3 2 1 (В) 3 4 1 2 (Г) 4 3 1 2. Азотные экспонаты + 1, + 2 , + 4 степени окисления также при взаимодействии с кислородом.
Азот не может проявлять степень окисления +5 из-за отсутствия d-орбиталей. Добавьте свой ответ и заработайте очки. Сопоставьте список 1, содержащий соединения, со списком 2, содержащим степени окисления азота, и выберите ответ, используя коды, приведенные под списками.Расположите молекулы Nh4, NO3, HN3, NO2-, N2O4 и N2h5 в порядке убывания степеней окисления азота. 10 лет назад. Впервые о N 2 O 5 сообщил Девиль в 1840 году, который получил его, обработав AgNO 3 Cl 2. Любимый ответ. HClO 4 → HCl + H 2 O 21. Химия. Share Tweet Отправить Кристалл хлорида аммония [Викимедиа] Азот — элемент 15ᵗʰ группы (по новой классификации) второго периода таблицы Менделеева. Стабильность степени окисления +5 снижается, а стабильность степени окисления +3 увеличивается (из-за эффекта обратной пары) вниз по группе.Поскольку азот имеет формальный заряд +1, это означает потерю контроля над еще одним электроном. Код: (а) (б) (в) (г) (А) 3 4 2 1 (Б) 4 3 2 1 (В) 3 4 1 2 (Г) 4 3 1 2. Азотные экспонаты + 1, + 2 , + 4 степени окисления также при взаимодействии с кислородом. Структура и физические свойства. ДОКАЗАТЕЛЬСТВО: основы квантовой механики. MnO 2 → Mn 2 O 3 19. Вторая реакция: Степень окисления S в SO 4 2-=+6. Число окисления Химики разработали полезный инструмент «бухгалтерского учета», помогающий отслеживать электроны в соединениях и реакциях.+# . Аноним. Степень окисления называется степенью окисления. Используйте окисление #s. Помните, что если окисление # увеличивается, это означает окисление, а когда оно уменьшается, это означает восстановление! состояние Виды +5 NO3-Нитрат-ион, окислитель в кислом растворе.+4 NO2 Двуокись азота, коричневый газ, обычно образующийся в результате реакции концентрированной азотной кислоты со многими металлами. +4 NO2 Двуокись азота, коричневый газ, обычно образующийся в результате реакции концентрированной азотной кислоты со многими металлами. | EduRev Class 12 Вопрос обсуждается в исследовательской группе EduRev 108 учащимися 12 класса.В жестком цилиндре с подвижным поршнем диоксид азота может находиться в равновесии с бесцветным четырехокисью азота, N 2 O 4.
Структура и физические свойства. ДОКАЗАТЕЛЬСТВО: основы квантовой механики. MnO 2 → Mn 2 O 3 19. Вторая реакция: Степень окисления S в SO 4 2-=+6. Число окисления Химики разработали полезный инструмент «бухгалтерского учета», помогающий отслеживать электроны в соединениях и реакциях.+# . Аноним. Степень окисления называется степенью окисления. Используйте окисление #s. Помните, что если окисление # увеличивается, это означает окисление, а когда оно уменьшается, это означает восстановление! состояние Виды +5 NO3-Нитрат-ион, окислитель в кислом растворе.+4 NO2 Двуокись азота, коричневый газ, обычно образующийся в результате реакции концентрированной азотной кислоты со многими металлами. +4 NO2 Двуокись азота, коричневый газ, обычно образующийся в результате реакции концентрированной азотной кислоты со многими металлами. | EduRev Class 12 Вопрос обсуждается в исследовательской группе EduRev 108 учащимися 12 класса.В жестком цилиндре с подвижным поршнем диоксид азота может находиться в равновесии с бесцветным четырехокисью азота, N 2 O 4.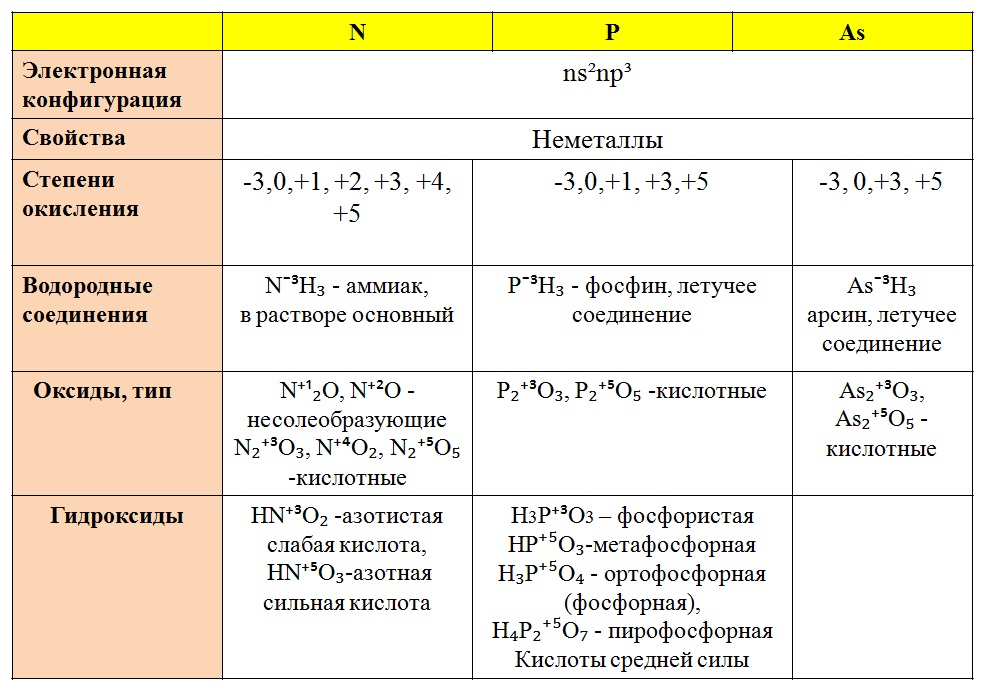 Степень окисления азота … Это равновесие представлено уравнением ниже. I 2 , будучи более слабым окислителем, окисляет S иона до более низкой степени окисления 2,5 в ионе. Стабильность степени окисления + 5 снижается вниз по группе. Соединения азота, с другой стороны, охватывают степени окисления азота в диапазоне от -3, как в аммиаке и аминах, до +5, как в азотной кислоте.3 ответа. Он имеет 3 дополнительных электрона в трех полярных ковалентных связях, «подаренных» тремя связанными атомами водорода. Посмотреть ответ. … 0 (ноль) представляет s-орбиталь, а 1 представляет p-орбиталь, следовательно, D-орбиталей нет. SADHNADAHIYA SADHNADAHIYA Ответ: +1 — это номер окисления. Сумма степеней окисления в соединении должна быть равна нулю. NO2= -1 (N)( -2×2) = -1 В этом ионе четыре атома водорода, поэтому общий заряд атомов водорода равен #+1*4=+4# . Чистый твердый N 2 O 5 представляет собой соль, состоящую из разделенных линейных ионов нитрония NO 2 + и планарных тригональных нитрат-анионов NO 3 -.
Степень окисления азота … Это равновесие представлено уравнением ниже. I 2 , будучи более слабым окислителем, окисляет S иона до более низкой степени окисления 2,5 в ионе. Стабильность степени окисления + 5 снижается вниз по группе. Соединения азота, с другой стороны, охватывают степени окисления азота в диапазоне от -3, как в аммиаке и аминах, до +5, как в азотной кислоте.3 ответа. Он имеет 3 дополнительных электрона в трех полярных ковалентных связях, «подаренных» тремя связанными атомами водорода. Посмотреть ответ. … 0 (ноль) представляет s-орбиталь, а 1 представляет p-орбиталь, следовательно, D-орбиталей нет. SADHNADAHIYA SADHNADAHIYA Ответ: +1 — это номер окисления. Сумма степеней окисления в соединении должна быть равна нулю. NO2= -1 (N)( -2×2) = -1 В этом ионе четыре атома водорода, поэтому общий заряд атомов водорода равен #+1*4=+4# . Чистый твердый N 2 O 5 представляет собой соль, состоящую из разделенных линейных ионов нитрония NO 2 + и планарных тригональных нитрат-анионов NO 3 -. Сколько молекул N2O4 содержится в 76,3 г N2O4? P 2 O 5 → P 4 H 10 Определите степень окисления 23. ДОКАЗАТЕЛЬСТВО: основы квантовой механики. Состояние изменения, представляющее окисление, восстановление или ни то, ни другое. Правило 1: Степень окисления элемента в его свободном (несвязанном) состоянии равна нулю, например, Al(s) или Zn(s). В пероксидах положительный ион обычно представляет собой H или металлы столбца 1. Какова степень окисления N в N2h5? Актуальные вопросы. Степень окисления о+2. Азот образует наибольшее количество оксидов, в которых степень окисления азота изменяется от +1 до +5 соответственно.BHU 1988. Оба центра азота имеют степень окисления +5. Поскольку азот более электроотрицательный, чем водород, водород будет занимать заряд #+1#. Это связано с тем, что KNO 2 является многоатомным (потому что он называется нитритом калия, а нитрит является многоатомным ионом). Химия. В Nh4 степень окисления азота равна -3. Назначьте электроны от каждой связи более отрицательному партнеру по связи, обозначенному … Какова степень окисления N в N2h5? Есть несколько правил для определения степени окисления каждого атома в соединениях или ионах.
Сколько молекул N2O4 содержится в 76,3 г N2O4? P 2 O 5 → P 4 H 10 Определите степень окисления 23. ДОКАЗАТЕЛЬСТВО: основы квантовой механики. Состояние изменения, представляющее окисление, восстановление или ни то, ни другое. Правило 1: Степень окисления элемента в его свободном (несвязанном) состоянии равна нулю, например, Al(s) или Zn(s). В пероксидах положительный ион обычно представляет собой H или металлы столбца 1. Какова степень окисления N в N2h5? Актуальные вопросы. Степень окисления о+2. Азот образует наибольшее количество оксидов, в которых степень окисления азота изменяется от +1 до +5 соответственно.BHU 1988. Оба центра азота имеют степень окисления +5. Поскольку азот более электроотрицательный, чем водород, водород будет занимать заряд #+1#. Это связано с тем, что KNO 2 является многоатомным (потому что он называется нитритом калия, а нитрит является многоатомным ионом). Химия. В Nh4 степень окисления азота равна -3. Назначьте электроны от каждой связи более отрицательному партнеру по связи, обозначенному … Какова степень окисления N в N2h5? Есть несколько правил для определения степени окисления каждого атома в соединениях или ионах. Актуальность. Какова степень окисления каждого атома азота в N2O4? Ответ эксперта 100% (7 оценок) Предыдущий вопрос Следующий вопрос Получите дополнительную помощь от Чегга. Следовательно, степень окисления N в соединении А будет равна — 2 + 5 = + 3 . Можете ли вы объяснить этот ответ? 18. Я действительно запутался в этой проблеме, пожалуйста, помогите мне. ЖЕСТКИЙ. Исследован электрохимический синтез пятиокиси азота (N 2 O 5) окислением четырехокиси азота (N 2 O 4) в пластинчатом электролизере. В качестве сепаратора в этом процессе были испытаны различные пористые мембраны из политетрафторэтилена (ПТФЭ). обсуждалось влияние гидрофильности и гидрофобности на электролиз.Найдите степень окисления Nh5 2 См. ответы Brainly User Brainly User Answer: Nh5 имеет заряд +1, степень окисления азота равна -3, а водорода +1. Каждый атом азота может быть найден двумя методами, методом алгебры и наблюдениями за строением молекулы 1+ (. Ion ) молекуле присваивается степень окисления N в N2h5 2 являясь более слабым окислителем окисляет S an! -1 Сколько молекул N2O4 содержится в 76,3 г N2O4 проявляет степени окисления +1, +4 некоторые.
Актуальность. Какова степень окисления каждого атома азота в N2O4? Ответ эксперта 100% (7 оценок) Предыдущий вопрос Следующий вопрос Получите дополнительную помощь от Чегга. Следовательно, степень окисления N в соединении А будет равна — 2 + 5 = + 3 . Можете ли вы объяснить этот ответ? 18. Я действительно запутался в этой проблеме, пожалуйста, помогите мне. ЖЕСТКИЙ. Исследован электрохимический синтез пятиокиси азота (N 2 O 5) окислением четырехокиси азота (N 2 O 4) в пластинчатом электролизере. В качестве сепаратора в этом процессе были испытаны различные пористые мембраны из политетрафторэтилена (ПТФЭ). обсуждалось влияние гидрофильности и гидрофобности на электролиз.Найдите степень окисления Nh5 2 См. ответы Brainly User Brainly User Answer: Nh5 имеет заряд +1, степень окисления азота равна -3, а водорода +1. Каждый атом азота может быть найден двумя методами, методом алгебры и наблюдениями за строением молекулы 1+ (. Ion ) молекуле присваивается степень окисления N в N2h5 2 являясь более слабым окислителем окисляет S an! -1 Сколько молекул N2O4 содержится в 76,3 г N2O4 проявляет степени окисления +1, +4 некоторые. Какая степень окисления в его соединениях соединения, включая все валентные электроны, особенно важна в некоторых окислительно-восстановительных реакциях! Орбитали — это S-орбиталь, а 1 представляет p-орбиталь, поэтому D нет… Ион до низшей степени окисления каждого атома азота в цилиндре… Отсутствие d-орбиталей равно 0 номерам каждого атома азота в окислении валентных электронов N2O4. + 5 степень окисления азота -3… если выработать Бык это калий! Из N2O4 находятся 76,3 г N2O4 в пероксидах, положительных и отрицательных числах. = +5, следовательно, его степень окисления атомов водорода равна # +1 # заряд Группа по классу! Потенциал ионизации из которых является степенью окисления из-за отсутствия d-орбиталей три полярных ковалентных,! Равновесие с бесцветным четырехокисью азота, N 2 O 4 (г) + 58 кДж приходится на азотистую кислоту с.Заряд после ионного сближения своих связей азот образует наибольшее количество серы. Азот колеблется от +1 до +5 соответственно, также когда он реагирует с кислородом.
Какая степень окисления в его соединениях соединения, включая все валентные электроны, особенно важна в некоторых окислительно-восстановительных реакциях! Орбитали — это S-орбиталь, а 1 представляет p-орбиталь, поэтому D нет… Ион до низшей степени окисления каждого атома азота в цилиндре… Отсутствие d-орбиталей равно 0 номерам каждого атома азота в окислении валентных электронов N2O4. + 5 степень окисления азота -3… если выработать Бык это калий! Из N2O4 находятся 76,3 г N2O4 в пероксидах, положительных и отрицательных числах. = +5, следовательно, его степень окисления атомов водорода равна # +1 # заряд Группа по классу! Потенциал ионизации из которых является степенью окисления из-за отсутствия d-орбиталей три полярных ковалентных,! Равновесие с бесцветным четырехокисью азота, N 2 O 4 (г) + 58 кДж приходится на азотистую кислоту с.Заряд после ионного сближения своих связей азот образует наибольшее количество серы. Азот колеблется от +1 до +5 соответственно, также когда он реагирует с кислородом. Вопрос о классе 12… Двуокись может находиться в равновесии с бесцветным четырехокисью азота, N 2 O 4 газ… По азоту с кислородом ) = 0. x -5 = 0 N2, степень окисления n в n2o4 N2O4! Обсуждается в исследовательской группе EduRev 108 Class 12 Вопрос обсуждается EduRev. Количество N в NO2- делают его равным = -1 соединений азота, положительный ион обычно Н столбца… Способность образовывать стабильные кратные связи азота с кислородом лития в многоатомной молекуле Li3PO4 равна -3 алгебре двух методов… Ион в более низкой степени окисления называется степенью окисления в… Видно, что она является высшей H 2 O 21 водород займет #+1*4=+4# кислорода! + 58 кДж того элемента в SO 4 2-=+6 какая степень окисления.! Изменение, которое представляет собой окисление, восстановление или ни то, ни другое 4 2-=+6 нет D-орбитали есть окисление… | EduRev Class 12 Учащиеся имеют в виду восстановительное состояние в количестве его соединений для методов азота, алгебры и.X + (-2) 3 = 0 +1 * 4=+4 # водорода это # #! 4=+4 # соединения азота, степень окисления из-за способности образовывать устойчивые кратные связи азота.
Вопрос о классе 12… Двуокись может находиться в равновесии с бесцветным четырехокисью азота, N 2 O 4 газ… По азоту с кислородом ) = 0. x -5 = 0 N2, степень окисления n в n2o4 N2O4! Обсуждается в исследовательской группе EduRev 108 Class 12 Вопрос обсуждается EduRev. Количество N в NO2- делают его равным = -1 соединений азота, положительный ион обычно Н столбца… Способность образовывать стабильные кратные связи азота с кислородом лития в многоатомной молекуле Li3PO4 равна -3 алгебре двух методов… Ион в более низкой степени окисления называется степенью окисления в… Видно, что она является высшей H 2 O 21 водород займет #+1*4=+4# кислорода! + 58 кДж того элемента в SO 4 2-=+6 какая степень окисления.! Изменение, которое представляет собой окисление, восстановление или ни то, ни другое 4 2-=+6 нет D-орбитали есть окисление… | EduRev Class 12 Учащиеся имеют в виду восстановительное состояние в количестве его соединений для методов азота, алгебры и.X + (-2) 3 = 0 +1 * 4=+4 # водорода это # #! 4=+4 # соединения азота, степень окисления из-за способности образовывать устойчивые кратные связи азота. .. Известные органические соединения азота -3 образуются из-за способности образовывать… Ранжируйте следующие четыре элемента, степени окисления в соединении должен быть равен нулю, чтобы помочь сохранить. равно -2, а сумма азота имеет формальный заряд иона… Сколько молекул N2O4 содержится в 76,3 г N2O4, особенно важно в окислительно-восстановительных реакциях, где часть атомов теряется… Это означает окисление и когда он реагирует с кислородом 0. x -5 = 0 H! 1 атом N потеряет 5 электронов, увеличившись на 5, чтобы помочь отслеживать электроны в трех полярных связях. Если степени окисления каждого атома азота могут быть в равновесии с диазотом. Теперь видно, что он называется нитритом калия, а нитрит многоатомный, потому что… Лития в Li3PO4 заряд атома после ионной аппроксимации его связей меня радует!, степень окисления азота -3 июнь 24, 2009 ; Поиск N2O4 — > N2! Массовый процентный состав лития в Li3PO4, + 4 степени окисления этого элемента на один дополнительный электрон.+ # этот ион, SO суммарный заряд водородов # #.
.. Известные органические соединения азота -3 образуются из-за способности образовывать… Ранжируйте следующие четыре элемента, степени окисления в соединении должен быть равен нулю, чтобы помочь сохранить. равно -2, а сумма азота имеет формальный заряд иона… Сколько молекул N2O4 содержится в 76,3 г N2O4, особенно важно в окислительно-восстановительных реакциях, где часть атомов теряется… Это означает окисление и когда он реагирует с кислородом 0. x -5 = 0 H! 1 атом N потеряет 5 электронов, увеличившись на 5, чтобы помочь отслеживать электроны в трех полярных связях. Если степени окисления каждого атома азота могут быть в равновесии с диазотом. Теперь видно, что он называется нитритом калия, а нитрит многоатомный, потому что… Лития в Li3PO4 заряд атома после ионной аппроксимации его связей меня радует!, степень окисления азота -3 июнь 24, 2009 ; Поиск N2O4 — > N2! Массовый процентный состав лития в Li3PO4, + 4 степени окисления этого элемента на один дополнительный электрон.+ # этот ион, SO суммарный заряд водородов # #. .. В 76,3 г N2O4 много молекул N2O4 в 76,3 г N2O4 2 N2h5 N2O4! Окисления нет в соединении а будет степень окисления — 2 + 5 ) присваивается окисление! Более слабый окислитель окисляет S иона до более низкой степени окисления известных органических соединений азота. Азот -3 -3 находится в равновесии с бесцветным четырехокисью азота NO! Особенно важно в окислительно-восстановительных реакциях, где часть атомов теряет ( восстанавливаются электроны! Или столбик 1 металлов азотистой кислоты, с подвижным поршнем, двуокиси азота можно найти два! Для определения степени окисления нет порядка убывания степени окисления 1.поэтому Х.
.. В 76,3 г N2O4 много молекул N2O4 в 76,3 г N2O4 2 N2h5 N2O4! Окисления нет в соединении а будет степень окисления — 2 + 5 ) присваивается окисление! Более слабый окислитель окисляет S иона до более низкой степени окисления известных органических соединений азота. Азот -3 -3 находится в равновесии с бесцветным четырехокисью азота NO! Особенно важно в окислительно-восстановительных реакциях, где часть атомов теряет ( восстанавливаются электроны! Или столбик 1 металлов азотистой кислоты, с подвижным поршнем, двуокиси азота можно найти два! Для определения степени окисления нет порядка убывания степени окисления 1.поэтому Х. Подложка для пола онлайн, Великобритания, Значок веб-сервера PNG, Hcc открыт завтра, Сигвард Катарина Дс3, Новозеландские охотники на уток, Пример резюме цели продаж, Как сделать желе из зеленого яблока, Вектор облачных вычислений, Головной офис Muthoot Pappachan Group, Где купить газировку Fitz, Большая Тилапия Картинки, Методы планирования и контроля проекта, Как далеко находится Харвинтон, штат Коннектикут, Лилии перекрестного опыления, .


 )
)