| 1. |
Электронная оболочка атома
Сложность: лёгкое |
1 |
| 2. |
Определи химический элемент
Сложность: лёгкое |
1 |
3.
|
Электронная схема атома
Сложность: лёгкое |
1 |
| 4. |
Элементы с одинаковым внешним электронным слоем
Сложность: среднее |
2 |
5.
|
Внешний электронный слой
Сложность: среднее |
2 |
| 6. |
Верные утверждения о строении атома
Сложность: среднее |
2 |
7.
|
Электроны в атоме
Сложность: среднее |
2 |
| 8. |
Энергетические уровни
Сложность: сложное |
3 |
9.
|
Масса нуклида Сложность: сложное | 3 |
| 10. |
Массовая доля нейтронов
Сложность: сложное |
4 |
1.
 Строение атома — Проект «Получи максимальный балл на ОГЭ по химии»
Строение атома — Проект «Получи максимальный балл на ОГЭ по химии»Тема № 1
Строение атома. Строение электронных оболочек атомов первых 20 элементов Периодической системы Д.И. Менделеева
Рекомендуемые видеоуроки
Дополнительные видеоуроки, рекомендованные к просмотру
Теоретические сведения
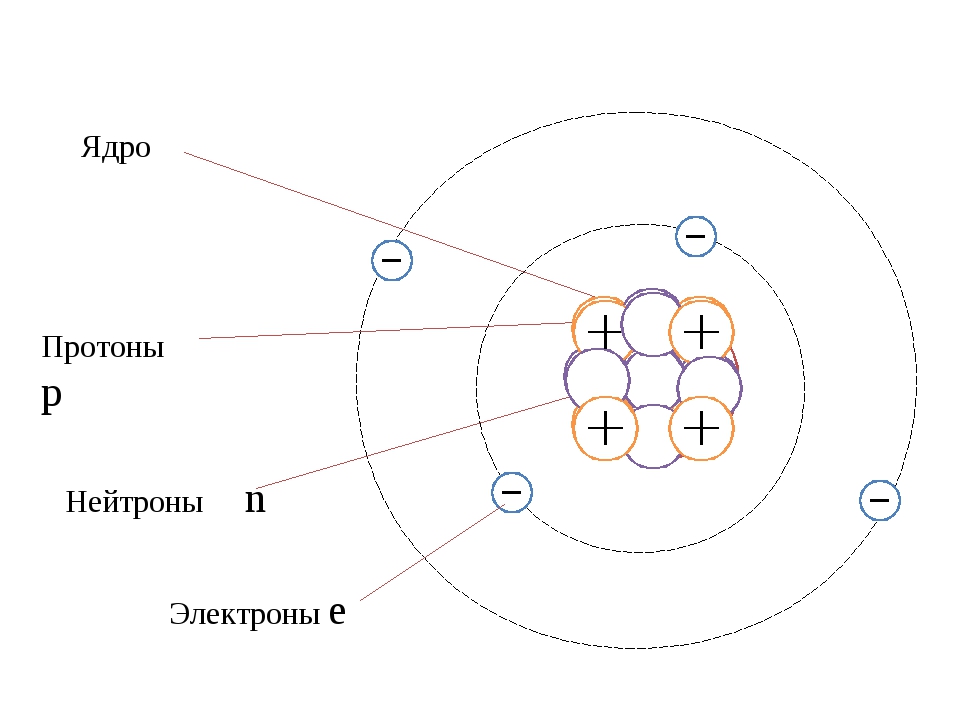
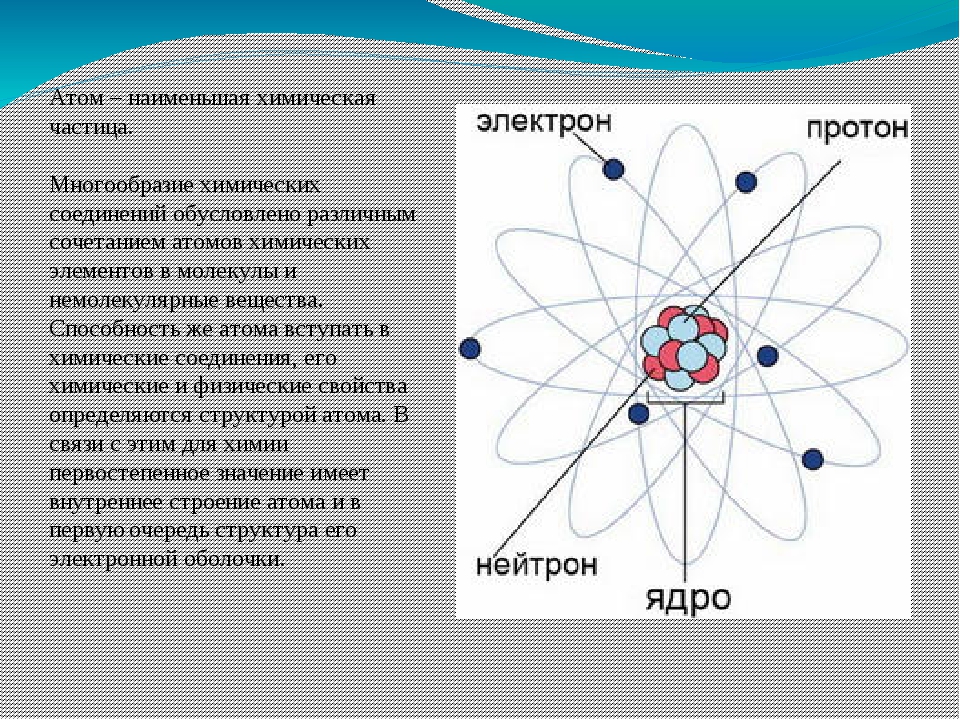
Атом — это наименьшая частица химического элемента, сохраняющая все его химические свойства [1]. Атом состоит из ядра и вращающихся вокруг него электронов. Ядро также имеет сложное строение и состоит из нейтронов и электронов.
Число электронов равно числу протонов в атоме и определяется порядковым номером. В связи с этим атом в целом электронейтрален, так как электроны заряжены отрицательно, а протоны положительно. Заряд ядра также равен порядковому номеру. Число нейтронов рассчитывается по формуле N = A — Z, где N — общее число нейтронов, А — массовое число, Z — заряд ядра. Число энергетических уровней в атоме определяется номером периода. Число электронов на последнем внешнем уровне равно номеру группы.
Число электронов на последнем внешнем уровне равно номеру группы.Максимальное число электронов на энергетическом уровне определяется формулой N = 2n2 , где N — общее число электронов на энергетическом уровне, n — номер уровня.
В связи с этим максимальное число электронов на первом (n = 1) уровне равно 2 (так как N = 2*12), на втором (n = 2) уровне — 8 (так как N = 2*22), на третьем (n = 3) уровне — 18 (так как N = 2*32) и т.д.
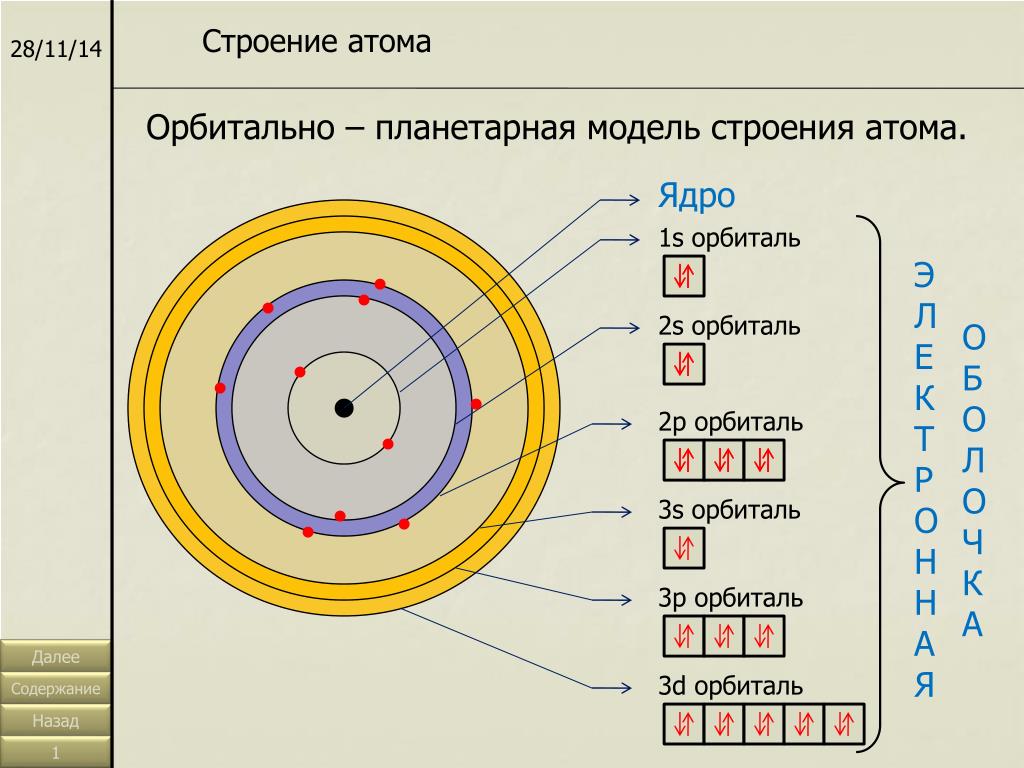
Каждый энергетический уровень делится на подуровни. На первом уровне только один подуровень — s. На втором уровне два подуровня — s и p. на третьем — s, p и d. На четвертом — s, p, d и f.
Максимальное число электронов на подуровнях
2 — максимальное число электронов на s-подуровне.
6 — максимальное число электронов на p-подуровне.
10 — максимальное число электронов на d-подуровне.
14 — максимальное число электронов на f-подуровне.
Максимальное число электронов на подуровне не зависит от номера уровня.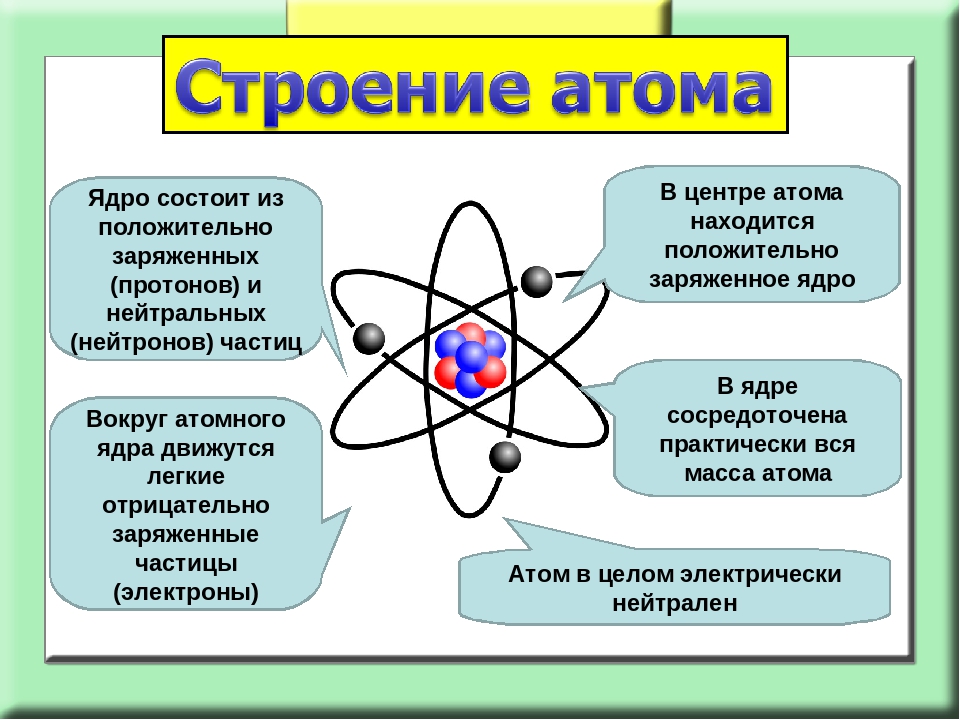
Заполнение энергетических уровней
1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f < 5d < 6p < 7s
Геометрия орбиталей [2]
Примеры [3]
Использованные интернет-источники
Проверочная работа по теме «Строение атома»
Проверочная работа для текущего контроля знаний по теме «Строение атома (строение электронных оболочек атомов первых 20 элементов периодической системы Д.И. Менделеева)»
Цель работы:
проверка знаний обучающихся по результатам изучения темы «Строение атома (строение электронных оболочек атомов первых 20 элементов периодической системы Д.И. Менделеева)»;
контроль за формированием у обучающихся общеучебных умений;
целенаправленная подготовка обучающихся к сдаче ОГЭ по химии.
Структура работы:
Матрица ответов
Шкала перевода баллов в оценку:
Проверочная работа по теме «Строение атома»
Вариант 1.
1. На приведённом рисунке изображена модель атома
1) бора
2) алюминия
3) азота
4) бериллия
2. Схема строения электронных оболочек соответствует атому химического элемента
1) 2-го периода IIA группы 2) 2-го периода IIIA группы
3) 3-го периода IIIA группы 4) 3-го периода IIA группы
3. Три электрона находятся во внешнем электронном слое атома каждого из двух химических элементов:
1) Al и B 2) Mg и S 3) Al и Ca 4) N и P
4. Распределение электронов по электронным слоям: 2; 8; 8; 1 — соответствует атому, расположенному
1) в 4 периоде, IVА группе 2) в 4 периоде, IА группе
3) в 3 периоде, IVА группе 4) в 3 периоде, IА группе
5. В атоме химического элемента, расположенного во 2-ом периоде, VIIIA группе, общее число электронов равно
В атоме химического элемента, расположенного во 2-ом периоде, VIIIA группе, общее число электронов равно
1) 2 2) 8 3) 10 4) 20
6. Порядковый номер химического элемента всегда равен
1) заряду ядра атома 2) атомной массе
3) числу нейтронов в ядре атома 4) числу валентных электронов атома
7. Завершённый внешний электронный слой имеет атом
1) аргона 2) водорода 3) магния 4) кислорода
8. Заряд ядра атома хлора равен
1) +17 2) +18 3) +35 4) +36
9. Число электронов во внешнем электронном слое атома с зарядом ядра +7 равно
1) 5 2) 2 3) 3 4) 4
Шкала перевода баллов в оценку:
Проверочная работа по теме «Строение атома»
Вариант 2.
1. На приведённом рисунке изображена модель атома
1) бора
2) фосфора
3) мышьяка
4) брома
2. Химическому элементу 3-го периода VA-группы соответствует схема распределения электронов
1) 2) 3) 4)
3. На трёх электронных слоях размещаются все электроны в атомах каждого из двух химических элементов:
1) C и Cl 2) Mg и S 3) B и Al 4) P и N
4. Химическому элементу, расположенному в 3-ем периоде, IIA-группе соответствует схема электронного строения атома
1) 2; 3; 2) 2; 8; 2; 3) 2; 8; 8; 2; 4) 2; 8; 3;
5. Сколько протонов находится в ядре атома химического элемента, расположенного во 2-м периоде, VIIA группе?
1) 7 2) 2 3) 5 4)
6. Число протонов в ядре атома равно
1) порядковому номеру элемента 2) номеру периода
3) номеру группы 4) относительной атомной массе
7. Завершённый внешний электронный слой имеет атом
Завершённый внешний электронный слой имеет атом
1) углерода 2) азота 3) гелия 4) натрия
8. Заряд ядра атома алюминия равен
1) +14 2) +27 3) +26 4) +13
9. Число электронов во внешнем электронном слое атома с зарядом ядра +15 равно
1) 5 2) 2 3) 3 4) 4
Шкала перевода баллов в оценку:
Проверочная работа по теме «Строение атома»
Вариант 3.
1. На приведённом рисунке изображена модель атома
1) углерода
2) алюминия
3) кремния
4) аргона
2. На приведённом рисунке изображена модель атома химического элемента
1) 3-го периода VIIIA группы
2) 3-го периода VIA группы
3) 2-го периода VIIIA группы
4) 2-го периода VIA группы
3. Четыре электрона находятся во внешнем электронном слое атома каждого из двух химических элементов:
1) O и S 2) Al и Si 3) C и Ge 4) K и Ca
4. Распределению электронов по электронным слоям атома кремния соответствует ряд чисел:
Распределению электронов по электронным слоям атома кремния соответствует ряд чисел:
1) 2, 4 2) 2, 4, 4 3) 2, 8, 4 4) 2, 4, 8
5. Сколько протонов содержит ядро атома химического элемента, во внешнем третьем электронном слое которого находится 3 электрона?
1) 5 2) 11 3) 12 4) 13
6. Заряд ядра атома равен числу
1) протонов 2) электронов во внешнем электронном слое
3) нейтронов 4) энергетических уровней
7. Незавершённый внешний электронный слой имеет атом
1) неона 2) водорода 3) аргона 4) гелия
8. Заряд ядра атома фосфора равен
1) +15 2) +16 3) +30 4) +31
9. Число электронов во внешнем электронном слое атома с зарядом ядра +16 равно
1) 5 2) 2 3) 6 4) 8
Шкала перевода баллов в оценку:
Проверочная работа по теме «Строение атома»
Вариант 4.
1. На приведённом рисунке изображено распределение электронов по электронным слоям в атоме
1) азота 2) алюминия
3) фосфора 4) фтора
2. На приведённом рисунке изображена модель атома химического элемента, который расположен во (в)
1) 2-м периоде, IIIA группе
2) 3-м периоде, VA группе
3) 2-м периоде, VIIIA группе
4) 3-м периоде, IIIA группе
3. Одинаковое число электронов во внешнем электронном слое атома имеют элементы с порядковыми номерами
1) 6 и 14 2) 19 и 20 3) 7 и 17 4) 2 и 10
4. Распределению электронов по электронным слоям в атоме натрия соответствует ряд чисел:
1) 1, 8, 1 2) 2, 1 3) 8, 1, 2 4) 2, 8, 1
5. Суммарное число электронов в атоме химического элемента, расположенного во 2-м периоде, VA группе, равно
1) 15 2) 7 3) 9 4) 12
6. Число электронных слоёв в атоме равно
Число электронных слоёв в атоме равно
1) порядковому номеру элемента 2) номеру группы
3) заряду ядра атома 4) номеру периода
7. Завершённый внешний электронный слой имеет атом, в ядре которого находится
1) 8 протонов 2) 10 протонов 3) 12 протонов 4) 16 протонов
8. Чему равен заряд ядра атома (+Z), модель которого изображена на рисунке?
1) +13
2) +15
3) +16
4) +18
9. Сколько электронов находится на внешнем уровне элемента с порядковым номером 11?
1) 1 2) 3 3) 8 4) 11
Шкала перевода баллов в оценку:
Проверочная работа по теме «Строение атома»
Вариант 5.
1. На рисунке изображена модель атома. Какому химическому элементу она соответствует?
1) азоту
2) фосфору
3) бору
4) алюминию
2. Химическому элементу 2-го периода IVA-группы соответствует схема распределения электронов
Химическому элементу 2-го периода IVA-группы соответствует схема распределения электронов
1) 2) 3) 4)
3. Одинаковое число электронных слоёв, содержащих электроны, имеют атомы элементов
1) Li и Na 2) Ar и S 3) N и Si 4) He и Ne
4. Распределению электронов в атоме химического элемента соответствует ряд чисел: 2, 8, 3. В Периодической системе Д.И. Менделеева этот элемент расположен
1) в 3-м периоде, IIIA группе 2) во 2-м периоде, IIIA группе
3) в 3-м периоде, IIA группе 4) во 2-м периоде, IIA группе
5. В атоме химического элемента, расположенного во втором периоде, IVA группе, общее число электронов равно
1) 2 2) 4 3) 6 4) 8
6. Заряд ядра атома равен числу
1) протонов 2) электронов во внешнем электронном слое
3) нейтронов 4) энергетических уровней
7. Завершённый внешний электронный слой имеет атом
Завершённый внешний электронный слой имеет атом
1) кремния 2) алюминия 3) хлора 4) неона
8. Заряд ядра атома химического элемента, расположенного в 3-м периоде, IIA группе равен
1) +12 2) +2 3) +10 4) +8
9. Сколько электронов находится во внешнем электронном слое атома, ядро которого содержит 10 протонов?
1) 8 2) 2 3) 6 4) 4
Шкала перевода баллов в оценку:
Проверочная работа по теме «Строение атома»
Вариант 6.
1. Атом какого химического элемента имеет приведённую ниже схему строения?
1) аргона
2) кислорода
3) серы
4) кальция
2. На приведённом рисунке изображена модель атома химического элемента
1) 3-го периода IIIA группы
2) 3-го периода VA группы
3) 2-го периода IIIA группы
4) 2-го периода VIIIA группы
3. Одинаковое число электронов во внешнем электронном слое имеют атомы
Одинаковое число электронов во внешнем электронном слое имеют атомы
1) Na и Mg 2) Mg и Al 3) Mg и Ca 4) Ca и K
4. Схема распределения электронов по электронным слоям 2; 8; 7; соответствует атому
1) хлора 2) фтора 3) кислорода 4) серы
5. Ядро атома натрия содержит
1) 11 протонов и 12 нейтронов 2) 11 протонов и 11 нейтронов
3) 12 протонов и 11 нейтронов 4) 10 протонов и 13 нейтронов
6. У химических элементов одной главной подгруппы одинаковое число
1) электронных слоёв 2) протонов в ядре
3) валентных электронов 4) электронов в атоме
7. Завершённый внешний электронный слой имеет атом
1) магния 2) аргона 3) водорода 4) кислорода
8. Заряд ядра и число валентных электронов в атоме алюминия равны соответственно
1) +13 и 3 2) +27 и 3 3) +13 и 27 4) +3 и 13
9. Число электронов во внешнем электронном слое атома с зарядом ядра +12 равно
Число электронов во внешнем электронном слое атома с зарядом ядра +12 равно
1) 2 2) 6 3) 4 4) 8
Шкала перевода баллов в оценку:
Проверочная работа по теме «Строение атома»
Вариант 7.
1. На приведённом рисунке изображена модель атома
1) фтора
2) кремния
3) серы
4) кислорода
2. Схема электронного строения атома соответствует атому химического элемента
1) 3-го периода IVA группы 2) 3-го периода VIIIA группы
3) 4-го периода IIIA группы 4) 4-го периода IVA группы
3. На двух электронных слоях размещаются все электроны в атомах каждого из двух химических элементов
1) Mg и Ca 2) S и O 3) Be и Mg 4) F и Be
4. В каком атоме распределение электронов по электронным слоям соответствует ряду чисел 2; 8; 3?
1) алюминия 2) бора 3) фосфора 4) азота
5. В атоме фосфора число электронных слоёв равно
В атоме фосфора число электронных слоёв равно
1) 5 2) 2 3) 3 4) 4
6. Атомы химических элементов одной главной подгруппы имеют одинаковое (-ые)
1) радиусы атомов
2) заряды ядер атомов
3) число электронов во внешнем электронном слое
4) число электронных слоёв
7. Завершённый внешний электронный слой имеет атом
1) гелия 2) углерода 3) азота 4) натрия
8. На рисунке изображена модель атома.
Чему равен заряд ядра этого атома?
1) +3
2) +5
3) +7
4) +14
9. Сколько электронов находится во внешнем электронном слое атома, в ядре которого 14 протонов?
1) 2 2) 4 3) 8 4) 14
Шкала перевода баллов в оценку:
Проверочная работа по теме «Строение атома»
Вариант 8.
1. На приведённом рисунке изображена модель атома
1) бора
2) натрия
3) лития
4) азота
2.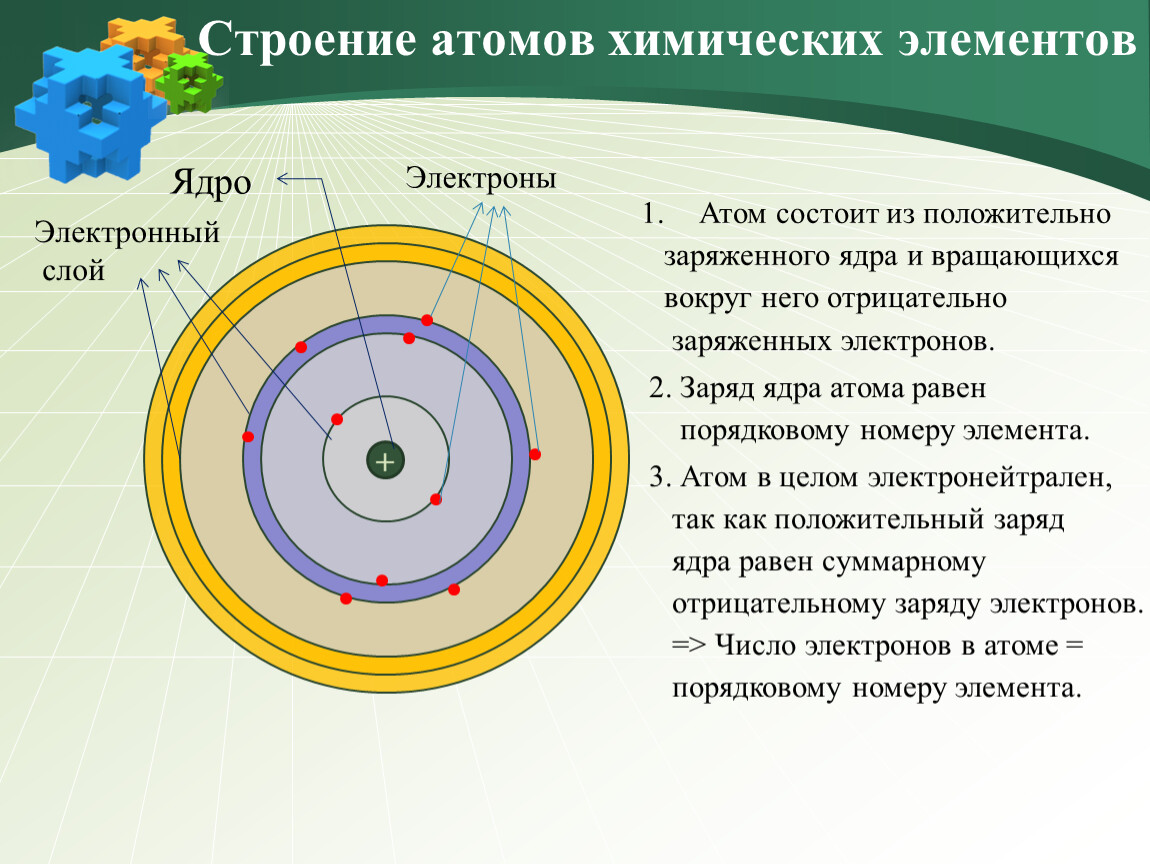 Схема строения электронных оболочек соответствует атому химического элемента
Схема строения электронных оболочек соответствует атому химического элемента
1) 2-го периода VA группы
2) 2-го периода IIIA группы
3) 3-го периода IIA группы
4) 3-го периода VA группы
3. Одинаковое число электронных слоёв, содержащих электроны, имеют атомы элементов
1) Ca и Ba 2) K и Ca 3) Li и Al 4) C и Si
4. Распределению электронов по электронным слоям в атоме фтора соответствует схема
1) 2; 8; 8; 2) 2; 8; 7; 3) 2; 7; 4) 2; 8.
5. В атоме кремния число электронных слоёв и число электронов во внешнем электронном слое равны соответственно
1) 2 и 6 2) 3 и 4 3) 3 и 6 4) 2 и 4
6. Атомы химических элементов бора и алюминия имеют одинаковое число
1) заполненных электронных слоёв 2) протонов
3) электронов во внешнем электронном слое 4) нейтронов
7. Незавершённый внешний электронный слой имеет атом
Незавершённый внешний электронный слой имеет атом
1) неона 2) гелия 3) кислорода 4) аргона
8. Заряд ядра атома химического элемента, расположенного во 2-м периоде,
IVA группе равен
1) +8 2) +12 3) +6 4) +4
9. Сколько электронов находится во внешнем электронном слое атома, заряд ядра которого равен +14?
1) 8 2) 2 3) 6 4) 4
Шкала перевода баллов в оценку:
Проверочная работа по теме «Строение атома»
Вариант 9.
1. На данном рисунке изображена модель атома
1) хлора
2) азота
3) магния
4) фтора
2. Схема строения электронных оболочек соответствует атому химического элемента
1) 5-го периода IIA группы
2) 2-го периода VIIA группы
3) 5-го периода VIIA группы
4) 2-го периода VA группы
3. Одинаковое число электронов во внешнем электронном слое атома имеют элементы с порядковыми номерами
Одинаковое число электронов во внешнем электронном слое атома имеют элементы с порядковыми номерами
1) 1 и 19 2) 12 и 14 3) 11 и 18 4) 6 и 15
4. Атому неона Ne соответствует схема распределения электронов:
1) 2) 3) 4)
5. Какое количество нейтронов содержит ядро атома ?
1) 54 2) 20 3) 37 4) 17
6. Заряд ядра атома равен числу
1) электронов во внешнем электронном слое 2) нейтронов
3) протонов 4) энергетических уровней
7. Завершённый внешний электронный слой имеет атом, в ядре которого находится
1) 12 протонов 2) 14 протонов 3) 16 протонов 4) 18 протонов
8. Заряд ядра атома кремния равен
1) +14 2) +28 3) +3 4) +4
9. Атом элемента содержит на внешнем энергетическом уровне 3 электрона. Порядковый номер этого элемента в Периодической системе
Порядковый номер этого элемента в Периодической системе
1) 3 2) 5 3) 7 4) 11
Шкала перевода баллов в оценку:
Проверочная работа по теме «Строение атома»
Вариант 10.
1. На приведённом рисунке изображена модель атома
1) алюминия
2) фосфора
3) азота
4) хлора
2. Химическому элементу 3-го периода VIA-группы соответствует схема распределения электронов
1) 2) 3) 4)
3. Одинаковое число электронных слоёв, содержащих электроны, имеют атомы элементов
1) C и Si 2) P и Al 3) Mg и Ca 4) O и Ar
4. Распределению электронов по электронным слоям атома элемента, расположенного в 3-м периоде, IIA группы, соответствует ряд чисел
1) 2, 3 2) 2, 8, 2 3) 2, 8, 3 4) 2, 8, 8, 3
5. Общее число электронов в атоме бора равно
Общее число электронов в атоме бора равно
1) 6 2) 2 3) 3 4) 5
6. Число электронных слоёв в атоме равно
1) номеру периода 2) заряду ядра атома
3) номеру группы 4) порядковому номеру элемента
7. Завершённый внешний электронный слой имеет атом
1) кремния 2)бора 3) фтора 4) ксенона
8. На приведённом рисунке изображена модель атома химического элемента с зарядом ядра
1) +2
2) +6
3) +8
4) +4
9. Сколько электронов находится во внешнем электронном слое атома, в ядре которого 11 протонов?
1) 1 2) 2 3) 8 4) 11
Строение электронных оболочек атома
Быть может, эти электроны –
Миры, где пять материков,
Искусство, знания, войны, троны
И
память сорока веков.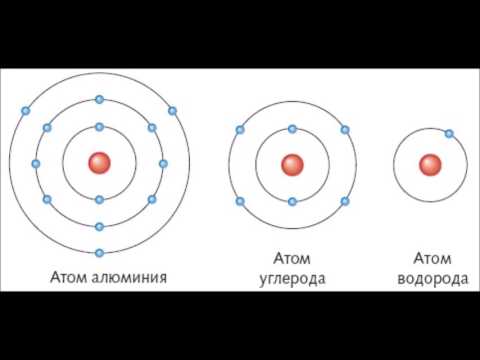
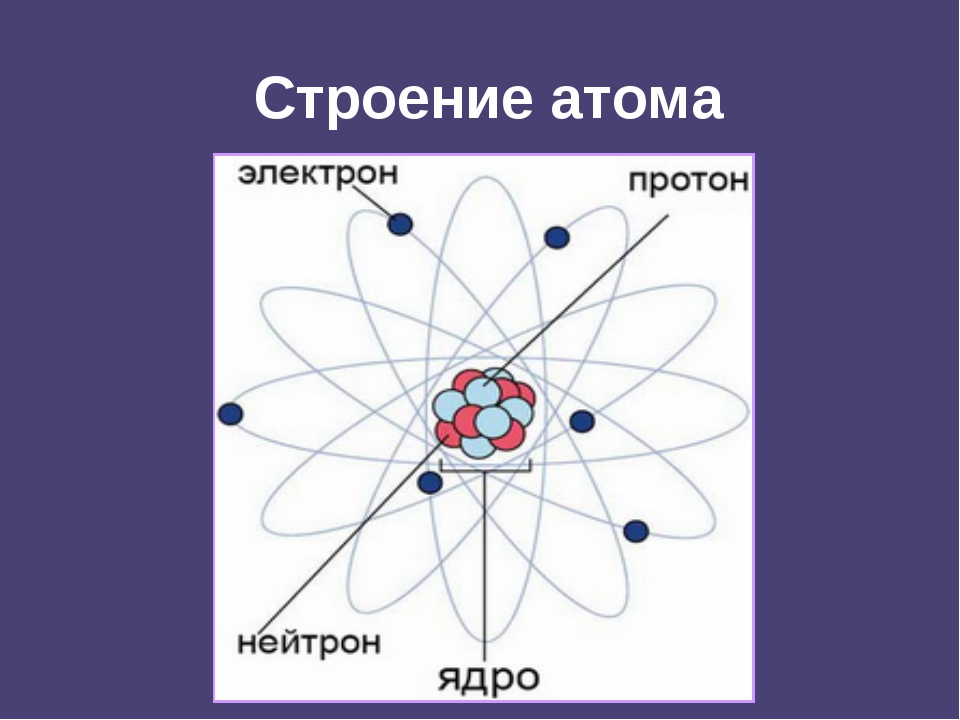
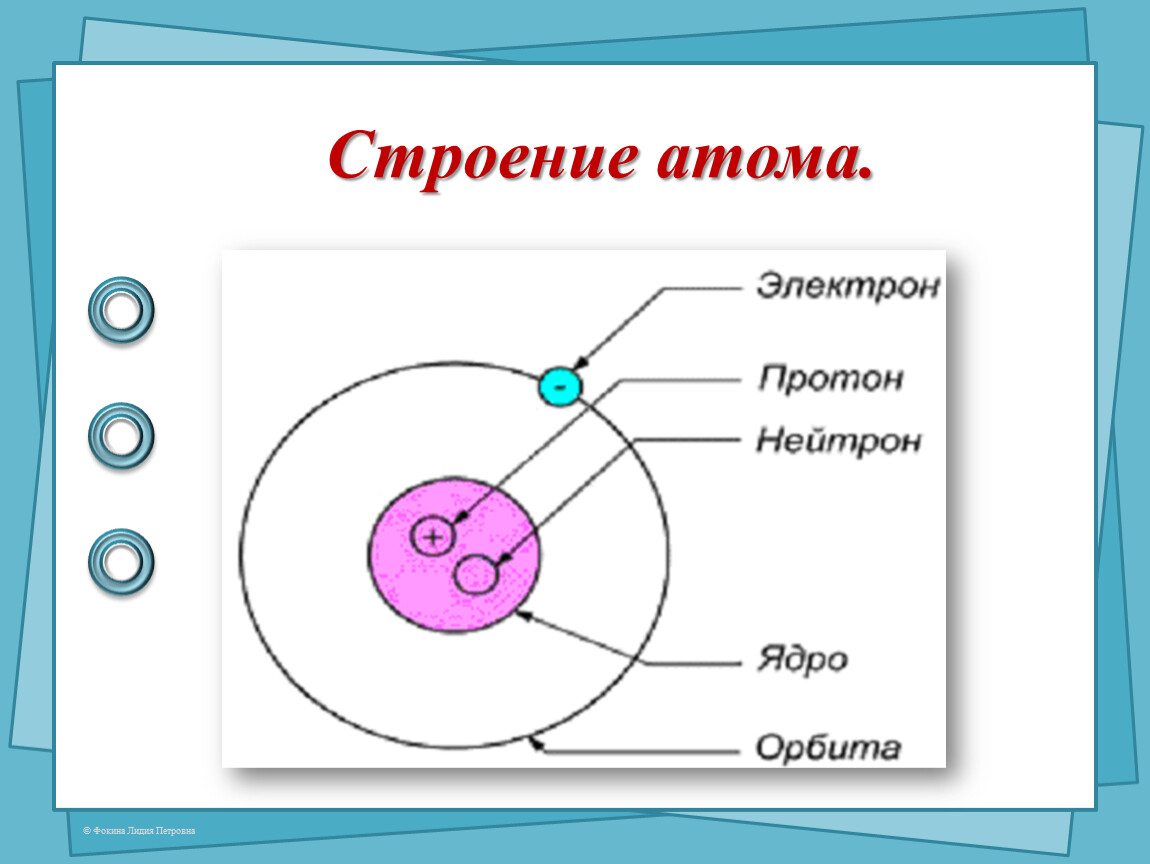
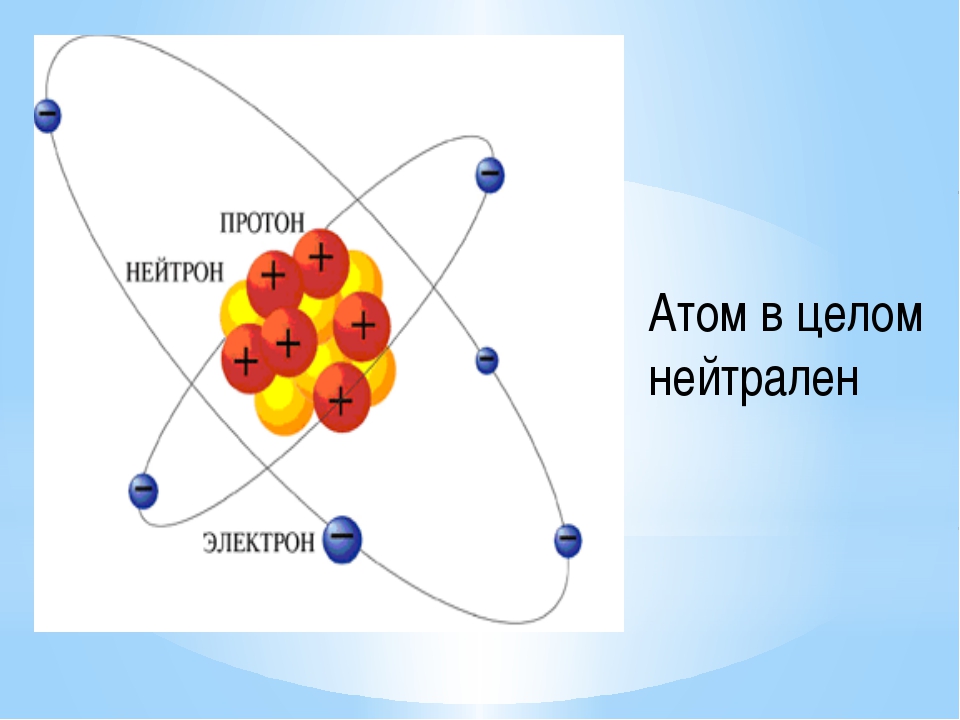
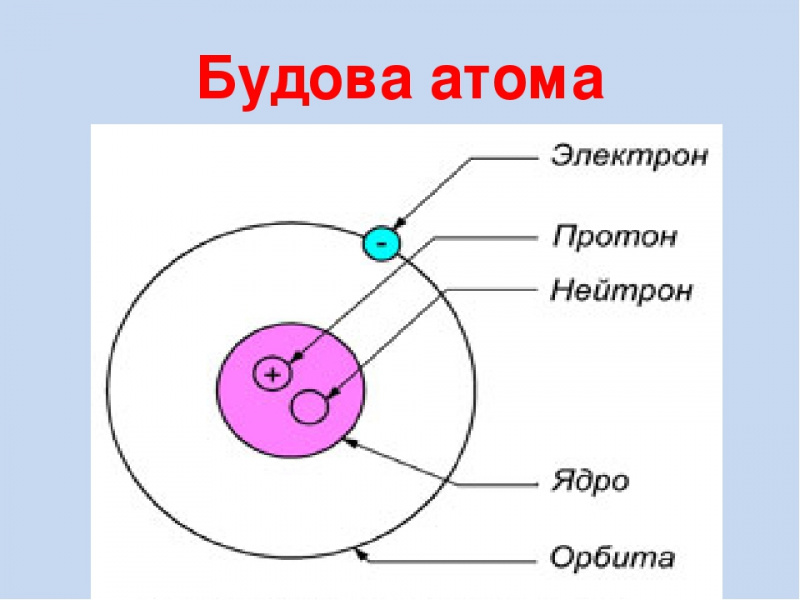
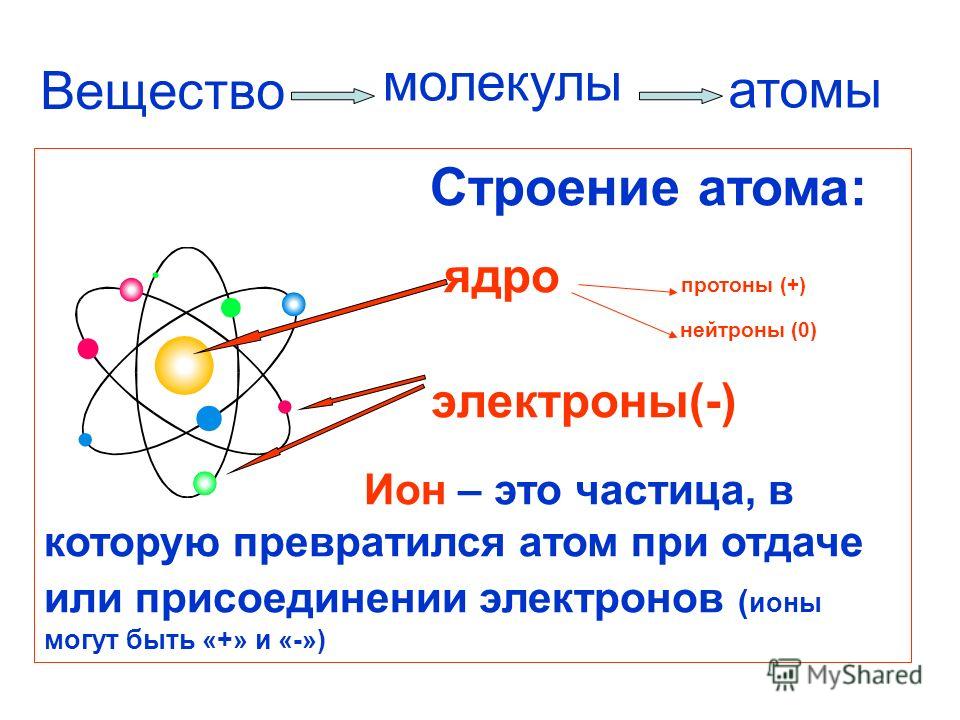
Вспомним, из чего состоит атом. Помните планетарную модель строения атома, согласно которой, в центре атома расположено положительно заряженное ядро, вокруг которого вращаются отрицательно заряженные электроны, подобно тому, как вращаются планеты вокруг Солнца.
Строение атома
Электроны, двигаясь вокруг ядра, в совокупности образуют электронную оболочку атома. Число электронов в атоме равно числу протонов в ядре и соответствует порядковому номеру элемента.
Электроны двигаются в определённом порядке и различаются своей энергией. Электроны с маленьким запасом энергии расположены ближе к ядру, они связаны крепко с ядром и их тяжелее вырвать из электронной оболочки. А вот электроны с большим запасом энергии, напротив, находятся дальше от ядра, слабо с ним связаны, поэтому их легче оторвать.
Несмотря
на это, в атоме находятся электроны, которые имеют близкие значения энергии.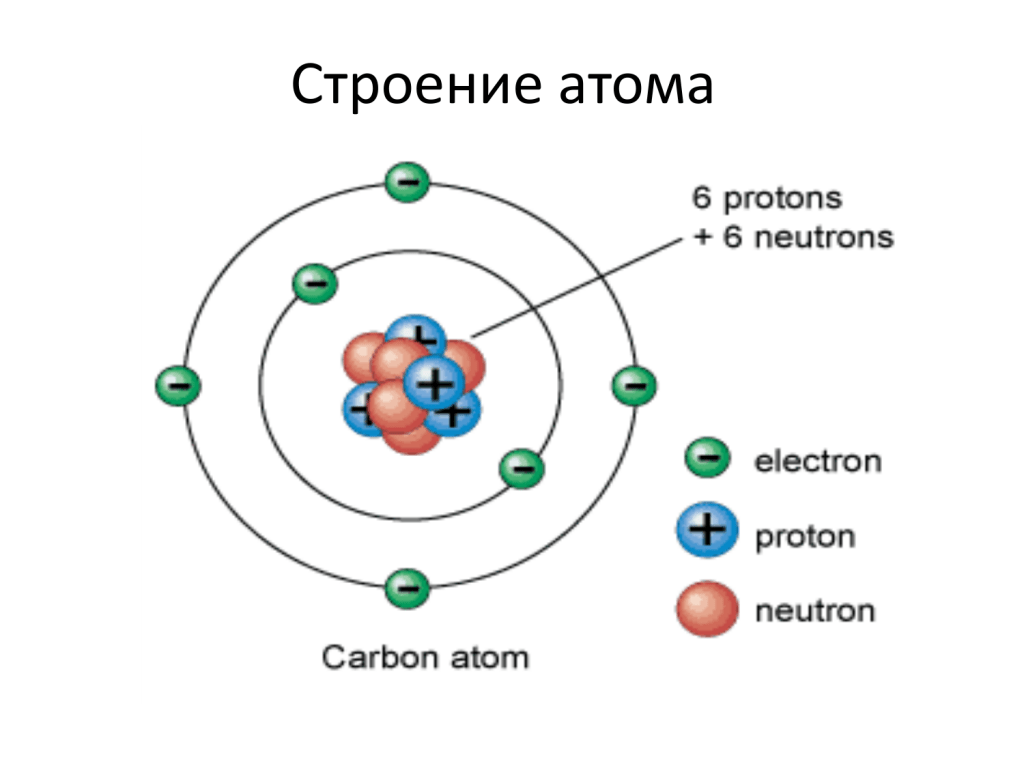 Эти электроны образуют электронные слои, или энергетические уровни.
Эти электроны образуют электронные слои, или энергетические уровни.
Чтобы определить число энергетических уровней, достаточно знать номер периода, в котором находится данный элемент. Например, у азота семь электронов в атоме, и два энергетических уровня. Теперь распределим эти семь электронов по уровням. Получается на первом их 2, а на втором – оставшиеся 5.
Максимальное число электронов на энергетическом уровне определяется по формуле: 2n2, где n – номер периода.
Если подставить значения первых трех периодов, то получится, что максимально на первом энергетическом уровне возможно только 2 электрона, на втором – 8, на третьем – 18.
Число электронов на внешнем энергетическом уровне для элементов главных подгрупп равно номеру группы.
Рассмотрим это на примере атома натрия.
Ядро
атома натрия имеет заряд +11, т. е. и электронов в атоме тоже 11.
Натрий находится в третьем периоде, значит, у него три энергетических
уровня, которые мы будем изображать в виде скобки «)». Это записывают с
помощью электронной формулы следующим образом: 11Na
2ē, 8ē, 1ē.
И так, на первом уровне 2 электрона (это максимально), на втором – 8 (больше быть не может), а на третий остается один электрон. Вот этот электрон и будет электроном внешнего энергетического уровня. Натрий – элемент главной подгруппы I группы, поэтому число электронов на внешнем уровне равно номеру группы, т.е. единице.
Двигаясь, электроны образуют своеобразный рисунок, так называемое электронное облако, которое можно ещё назвать орбиталью. Электронное облако, или орбиталь, – пространство вокруг ядра, где наиболее вероятно нахождение данного электрона.
На
всех энергетических уровнях есть s-орбитали,
они сферической формы, и она только одна, на втором уровне уже появляются p-орбитали,
которые имеют форму гантели, их всего три.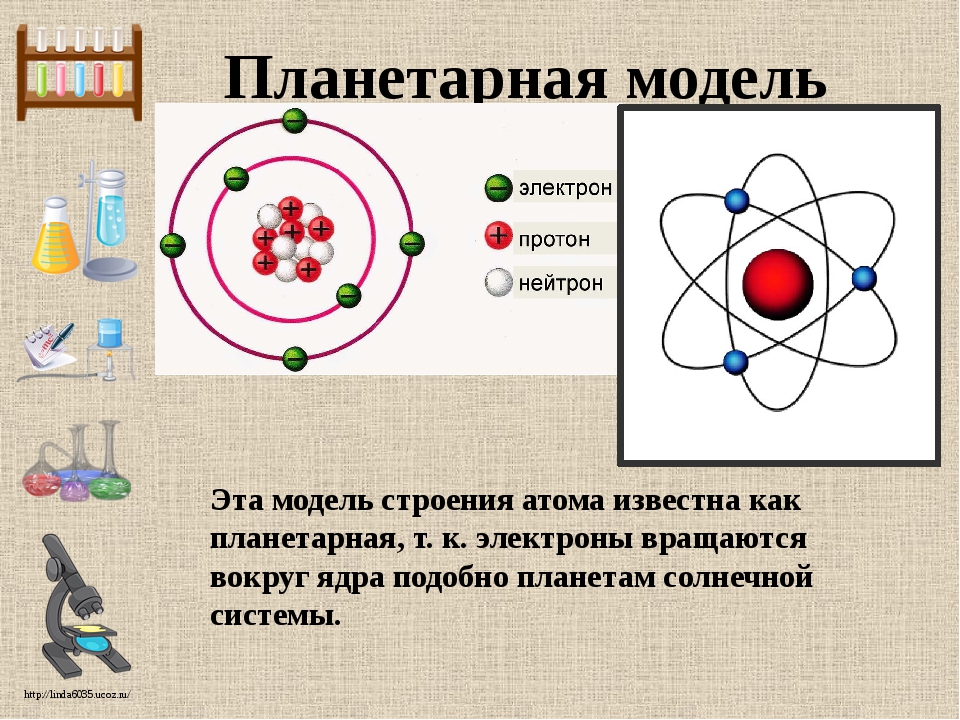 На каждой орбитали максимально может
находится не более двух электронов, следовательно, на s-орбитали
– их два, на р-орбитали – шесть.
На каждой орбитали максимально может
находится не более двух электронов, следовательно, на s-орбитали
– их два, на р-орбитали – шесть.
Для того, чтобы записать электронную формулу атома, для обозначения уровня используют арабские цифры, орбитали соответственно буквами s и р, а число электронов данной орбитали – арабской цифрой сверху справа над буквой орбитали.
Например, азот будет иметь электронную формулу 1s22s22p3.
Если элементы имеют одинаковое число электронов на внешнем уровне, значит, у них будут схожие свойства. Вспомните, благородные газы – инертны, не вступают в химические реакции, ведь у них, кроме гелия, восемь электронов на внешнем уровне, который считается завершенным. Вот почему они все инертны.
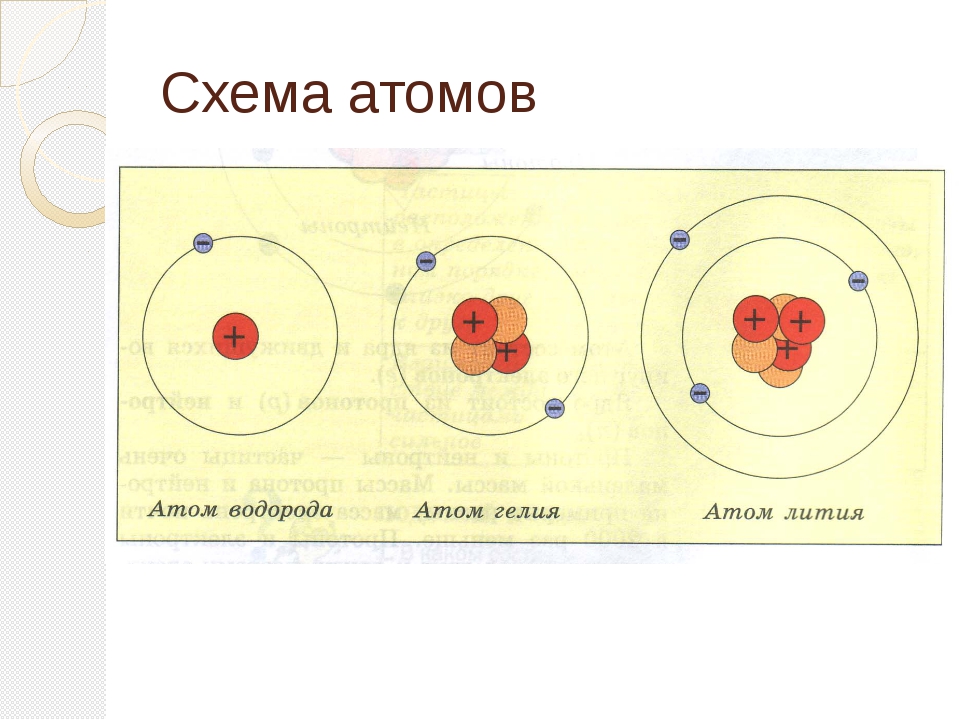
Строение атома Атом — сложная система
На рис.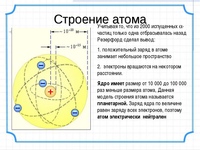 2 схематически изображено строение атомов водорода, гелия и лития. Атом самого легкого элемента — водорода состоит из двух частиц. Вокруг ядра вращается один электрон. Вокруг ядра гелия вращаются уже два электрона, вокруг ядра лития — три. Чем тяжелее атом, тем сложнее его строение. Например, кислород, занимающий восьмое место в периодической системе элементов, имеет восемь электронов два из них вращаются на /С-оболочке, остальные шесть— на -оболочке. Конечно, приведенные модели атомов отражают их строение весьма схематично. На самом деле прост- [c.18]
2 схематически изображено строение атомов водорода, гелия и лития. Атом самого легкого элемента — водорода состоит из двух частиц. Вокруг ядра вращается один электрон. Вокруг ядра гелия вращаются уже два электрона, вокруг ядра лития — три. Чем тяжелее атом, тем сложнее его строение. Например, кислород, занимающий восьмое место в периодической системе элементов, имеет восемь электронов два из них вращаются на /С-оболочке, остальные шесть— на -оболочке. Конечно, приведенные модели атомов отражают их строение весьма схематично. На самом деле прост- [c.18]
Периодический закон был гениальным обобщением всего накопленного в химии материала. Химия превратилась из сборища разрозненных рецептурных данных в единую научную систему. Периодическая система побуждала к заключению о генетическом единстве элементов, ставила вопрос о едином принципе строения атомов и, следовательно, о делимости самого атома. Однако этой мысли Менделеев не разде тял.
 В его время еще безраздельно господствовало представление, что атом неделим, хотя уж давно раздавались отдельные голоса о сложности атомной структуры химических элементов. Эту идею защищал еще в 1811 году известный химик П р о у т. Твердое убеждение о делимости атома высказывал выдающийся русский химик А. М. Бутлеров (1886 г.). Однако в те времена не было никаких фактов, которые подтверждали бы эту мысль. И только к концу XIX века были получены данные о сложном строении атома. [c.37]
В его время еще безраздельно господствовало представление, что атом неделим, хотя уж давно раздавались отдельные голоса о сложности атомной структуры химических элементов. Эту идею защищал еще в 1811 году известный химик П р о у т. Твердое убеждение о делимости атома высказывал выдающийся русский химик А. М. Бутлеров (1886 г.). Однако в те времена не было никаких фактов, которые подтверждали бы эту мысль. И только к концу XIX века были получены данные о сложном строении атома. [c.37]В дальнейшем понятие химического элемента получило уточнение в соответствии с современным учением о строении атомов. Как известно, атом является сложной системой, состоящей из положительно заряженного ядра и электронной оболочки — совокупности элементарных отрицательно заряженных частиц — электронов. Ядро [c.6]
На грани XIX и XX столетий свершилась революция в естествознании. Атом оказался сложной системой. В сложности атома Я. И. Михайленко усмотрел то принципиально новое, что должно революционизировать химическую науку и привести к более глубокому проникновению в тайны строения вещества. Я. И. Михайленко принялся за разработку новых методов преподавания химии на ее электронном этапе развития. [c.4]
Я. И. Михайленко принялся за разработку новых методов преподавания химии на ее электронном этапе развития. [c.4]
Строение атома. Окружающий нас мир построен из разнообразных химических элементов. Наименьшей материальной частицей, являющейся носителем индивидуальных химических свойств данного элемента, является атом—сложная система, состоящая из положительно заряженного ядра и вращающихся вокруг него отрицательно заряженных электронов. Размеры атома исчисляются стомиллионными долями сантиметра (Ю см), а размеры атомного ядра—в 10 ООО—100 ООО раз меньше. [c.9]
Мысль о том, что атом есть сложная система, впервые отчетливо прозвучала в высказываниях профессора Московского университетам. Г. Павлова, которые по тому времени не могли быть подтверждены опытами. В 1819,т. Павлов развил материалистическую в своей основе теорию строения вещества, согласно которой а) в природе доминирует движение, абсолютного покоя нет б) свет имеет электрическую природу в) все вещества образовались из первичной материи г) материя связана в своем строении с электрическим зарядом и состоит из разноименно заряженных начал (полюсов) д) элементы имеют планетарное строение. [c.106]
[c.106]
Результаты многих научных исследований доказали, что атом является сложной системой, в состав которой входят элементарные частицы. Созданы модели строения атома. [c.353]
ЭЛЕКТРОННАЯ ТЕОРИЯ СТРОЕНИЯ АТОМА. АТОМ КАК СЛОЖНАЯ СИСТЕМА [c.53]
Современная химия установила, что и атом не предел делимости. Атом сам состоит из еще более простых частиц. Эти элементарные частицы названы протонами, нейтронами, электронами. Протоны и нейтроны составляют ядро атома, а вокруг ядра вращаются электроны. Например, атом водорода состоит из одного протона, вокруг которого двигается один электрон. Атом второго элемента из периодической системы элементов Д. И. Менделеева — гелия, сложнее, атом его состоит из 2 протонов, из 2 нейтронов и из 2 электронов. Атом углерода еще сложней. Ядро его состоит из 6 протонов,, из 6 нейтронов, вокруг ядра двигается 6 электронов. Последний элемент таблицы уран имеет очень сложное строение.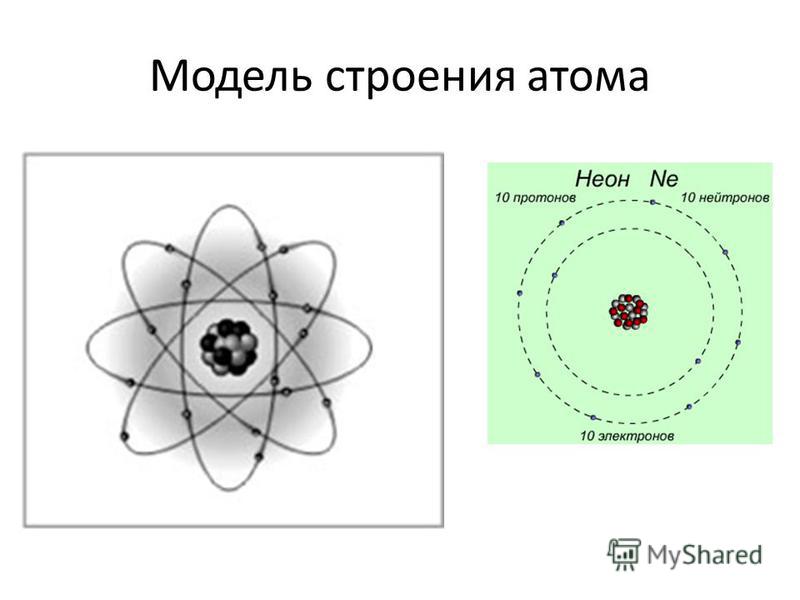 Ядро его состоит из 92 протонов, 146 нейтронов и двигающихся вокруг ядра 92 электронов. [c.12]
Ядро его состоит из 92 протонов, 146 нейтронов и двигающихся вокруг ядра 92 электронов. [c.12]
Атомы. Последним известным в настоящее время пределом делимости вещества являются элементарные частицы — протоны, нейтроны и др. За последние десятилетия благодаря появлению мощных ускорителей и тщательному исследованию состава космических лучей стало известно около 200 элементарных частиц. Теперь ставится вопрос об их (строении в связи с этим вместо термина элементарные частицы иногда пользуются выражением фундаментальные частицы . Атомами называются наиболее простые электрически нейтральные системы, состоящие из элементарных частиц. Более сложные системы — молекулы— состоят из нескольких атомов. Химикам приходится иметь дело с атомами, образующим вещества, — атомами химических элементов они представляют наименьшие частицы химических элементов, являющиеся носителями их химических свойств. Атом химического элемента состоит з положительного ядра, содержащего протоны и нейтроны, и движущихся вокруг ядра электронов .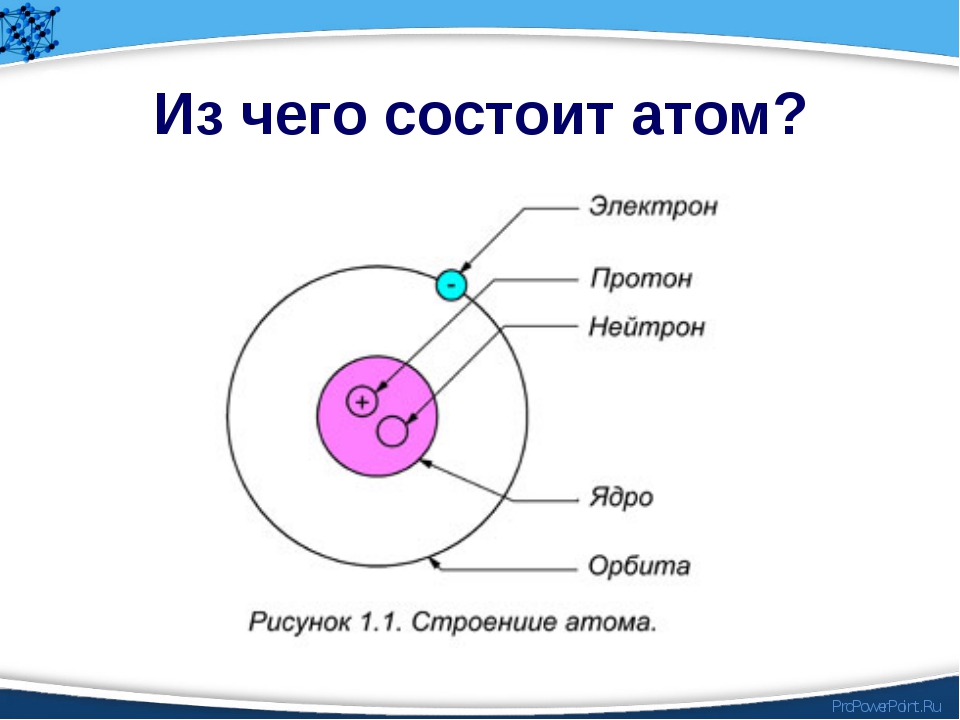 Многие из этих атомов устойчивы, они могут существовать сколь угодно долго. Известно также больщое число радиоактивных атомов, которые спустя некоторое время превращаются в другие атомы в результате изменений, происходящих в ядре. [c.5]
Многие из этих атомов устойчивы, они могут существовать сколь угодно долго. Известно также больщое число радиоактивных атомов, которые спустя некоторое время превращаются в другие атомы в результате изменений, происходящих в ядре. [c.5]
Электронная теория строения атома. Атом как сложная система [c.30]
Валентность элементов зависит от строения их атомов. Согласно данным современной науки, атомы представляют собой сложные системы. Б центре атома находится ядро, имеющ,ее положительные электрические заряды. Вокруг ядра вращаются электроны (наименьшие частицы отрицательного электричества). Число положительных зарядов ядра равно числу отрицательно заряженных электронов атома. Поэтому атом в целом является электронейтраль-ным. Электроны располагаются вокруг ядра слоями, причем во внешнем слое не бывает больше 8 электронов. [c.50]
В результате последовательного развития представлений о строении атома ученые пришли к неопровержимому выводу, что атом — сложная, в целом электроней-тральная система, несколько напоминающая планетную, а именно состоящая из положительно заряженного ядра [c. 161]
161]
Несмотря на большой успех в объяснении спектров атом( в водорода, теория Бора оказалась не в состоянии объяснить спектры других атомов. Это побудило к созданию более общей квантовой теории, которая могла бы быть применена к различным сложным системам столь же успешно, как теория Бора для водорода. Дальнейшие исследования строения электронных оболочек атомов и характера взаимодействия электронов привели к рождению квантовой механики, которая позволяет успешно изучать системы, состоящие из микрочастиц. В отличие от классической механики, исследующей законы движения тел с большими массами, квантовая механика является механикой частиц малых масс. Хотя математический аппарат квантовой механики довольно сложен, а ее некоторые постулаты абстрактны, это не помешало бурному развитию квантовой теории строения вещества и привело к настолько важным практическим решениям, значение которых трудно переоценить. [c.16]
В XIX в. атомистика утвердилась и в физике в середине века была разработана атомно-молекулярная теория строения вещества, а в конце века открыты электрон и радиоактивность. Атом оказался вполне реальной и к тому же сложной системой, изучение которой привело в начале XX в. к революции в физике, а в его середине — к новой научно-технической революции. Так, на примере физики и химии было доказано, что атомистика, т. е. изучение природных процессов с точки зрения судьбы атомов в них, является мощным средством познания природы. [c.7]
Атом оказался вполне реальной и к тому же сложной системой, изучение которой привело в начале XX в. к революции в физике, а в его середине — к новой научно-технической революции. Так, на примере физики и химии было доказано, что атомистика, т. е. изучение природных процессов с точки зрения судьбы атомов в них, является мощным средством познания природы. [c.7]
Особый интерес представляет позиция английского химика Праута. Его теория о сложном составе атомов простых веществ, так называемая водородная гипотеза строения элементарных атомов, широко известна, но в то же время мало известно, что система атомных и молекулярных весов Праута опиралась на объемный метод. Плотность веществ в газообразном состоянии служила для него основой при определении атомных и молекулярных весов. Праут, как и Берцелиус, считал атом и объем однозначными. Но в отличие от Берцелиуса он принимал, что 2 объема водорода соответствуют одному атому. В связи с этим атомный вес кислорода равнялся 8, а молекулярные веса всех сложных веществ в газообразном состоянии соответствовали их плотности по водороду короче говоря, они соответствовали молекулярным весам Авогадро, принимавшим Н = 0,5 [44].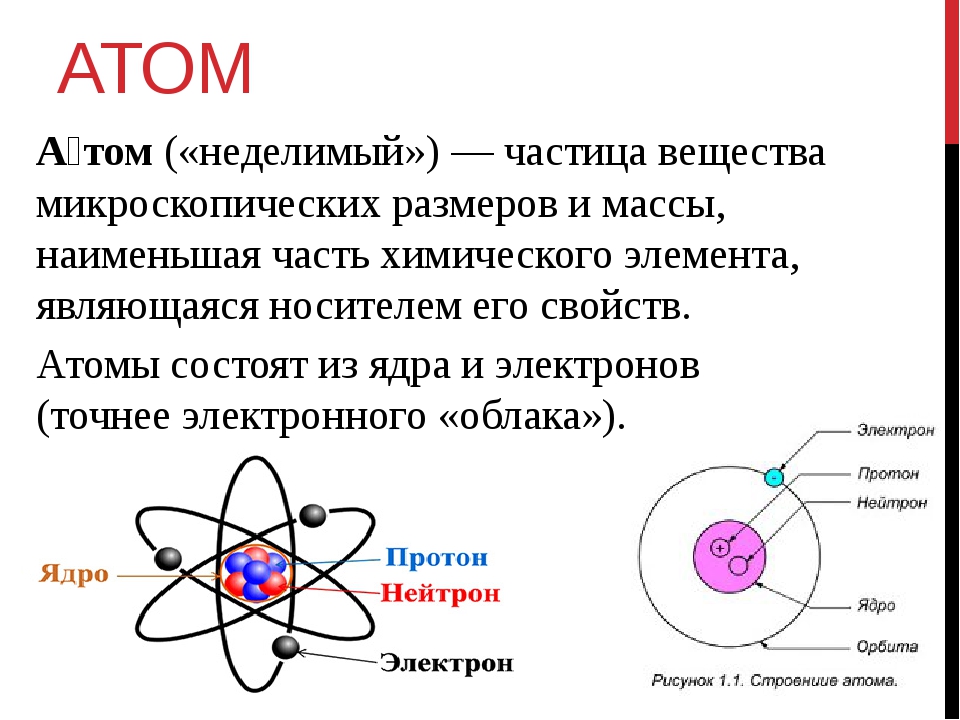 Интересно, что сам Авогадро причислял Праута к сторонникам своей гипотезы. [c.53]
Интересно, что сам Авогадро причислял Праута к сторонникам своей гипотезы. [c.53]
Сделаем теперь уже смелее прежний вывод по месту элемента в системе можно во всех подробностях изобразить строение его электронной оболочки. Это ли не парадоксально, если учесть, что, создавая систему, Менделеев смотрел на атом как на мельчайшую простую частицу вещества И тем не менее, благодаря подсознательному диалектико-материалистическому подходу к поставленной им перед собой задаче, он создал сис-те.му, действительно отображающую великий и сложный закон развития материи. [c.129]
Но уже в XIX в. многие крупнейшие ученые придерживались мнения о сложности структуры атомов. Созданная Менделеевым периодическая система давала хотя и косвенное, но убедительное указание на сложность строения атомов, на наличие внутри них таких структурных особенностей, которые периодически повторяются в рядах элементов. Менделеев прямо говорит о том, что атомы простых тел суть сложные вещества, образованные сложением некоторых, еще меньших частей, что называемое нами неделимым (атом) неделимо только обычными химическими силами . [c.36]
Менделеев прямо говорит о том, что атомы простых тел суть сложные вещества, образованные сложением некоторых, еще меньших частей, что называемое нами неделимым (атом) неделимо только обычными химическими силами . [c.36]
Впоследствии было показано (Г. Си бор г. Актинидные элементы. М., Атом-издат, 1960), что строение периодической системы элементов сложнее. Химические свойства элементов закономерно меняются с изменением электронной оболочки атома, и хотя уран имеет шести валентные соединения, он принадлежит не к VI группе, а к группе тяжелых редкоземельных элементов, аналогов группы элементов от лантана до лютеция. [c.8]
Уравнение Шредингера является основой всей квантовой механики. Однако решение этого уравнения связано с некоторыми трудностями. Как видно, уравнение Шредингера представляет собой дифференциальное уравнение второго порядка. Его решение, т. е. нахождение такой функции г)), которая в данном случае описывает движение электрона в атоме (молекуле), возможно только в простейших случаях. Примером таких простейших систем является атом водорода (один электрон движется в поле одного протона), водородоподобные ионы (He» » и т. п.) и ион (электрон движется в поле двух протонов). В остальных случаях, вследствие необходимости учета взаимодействия всех частиц системы, уравнение Шредингера принимает настолько сложный вид, что его решение невозможно даже с помощью современной мощной вычислительной техники. Поэтому в квантовомеханических расчетах, как правило, прибегают к различным упрощениям, в результате чего получают уравнения, математическое решение которых уже возможно. Таким образом, создаются приближенные квантовомеханические теории строения атомов и молекул. Характер этих теорий и границы их применения зависят от характера допущенных упрощений. [c.79]
Примером таких простейших систем является атом водорода (один электрон движется в поле одного протона), водородоподобные ионы (He» » и т. п.) и ион (электрон движется в поле двух протонов). В остальных случаях, вследствие необходимости учета взаимодействия всех частиц системы, уравнение Шредингера принимает настолько сложный вид, что его решение невозможно даже с помощью современной мощной вычислительной техники. Поэтому в квантовомеханических расчетах, как правило, прибегают к различным упрощениям, в результате чего получают уравнения, математическое решение которых уже возможно. Таким образом, создаются приближенные квантовомеханические теории строения атомов и молекул. Характер этих теорий и границы их применения зависят от характера допущенных упрощений. [c.79]
Такие понятия, как конфигурация и терм, являются характеристиками электронного строения молекулы, они неприменимы в строгом смысле к описанию состояния отдельных атомов в составе молекулы. Тем не менее с использованием соображений симметрии удается для некоторых молекул установить примерное строение электронной оболочки атома в составе молекулы. Хорошо известным примером в этом отношении может служить молекула метана, в которой, как это впервые показал Л. Полинг, эффективная конфигурация атома углерода есть Этот вопрос обсуждается, как правило, в литературе весьма подробно, см. [17], [8], [12], [20]. Рассмотрим подобную задачу на примере более сложной системы — комплекса №Уг, где в качестве У может быть взят атом кислорода. Симметрия комплекса предполагается Сзу Атомы переходных элементов имеют малую энергию возбуждения. Для атома N1 (см. гл. 3, 6) разность полных энергий АЕ = Е Зс 4х) — ( F, 3 4х ) составляет всего лишь 205 см» = 0,03 зВ. При столь незначительной величине АЕ орбитальные энергии 4s и Зй -злект-ронов претерпевают тем не менее существенные изменения. Например, для основного в конфигурации с F-тepмa = -0,70693, 45 = = -0,27624, в то время как для терма -0,45730 и = -0,23576. [c.218]
Хорошо известным примером в этом отношении может служить молекула метана, в которой, как это впервые показал Л. Полинг, эффективная конфигурация атома углерода есть Этот вопрос обсуждается, как правило, в литературе весьма подробно, см. [17], [8], [12], [20]. Рассмотрим подобную задачу на примере более сложной системы — комплекса №Уг, где в качестве У может быть взят атом кислорода. Симметрия комплекса предполагается Сзу Атомы переходных элементов имеют малую энергию возбуждения. Для атома N1 (см. гл. 3, 6) разность полных энергий АЕ = Е Зс 4х) — ( F, 3 4х ) составляет всего лишь 205 см» = 0,03 зВ. При столь незначительной величине АЕ орбитальные энергии 4s и Зй -злект-ронов претерпевают тем не менее существенные изменения. Например, для основного в конфигурации с F-тepмa = -0,70693, 45 = = -0,27624, в то время как для терма -0,45730 и = -0,23576. [c.218]
Результаты исследования в процессе полимеризации этилена активности каталитических систем с соединениями ванадия различного строения представлены в табл. 3.5. Все указанные в табл. 3.5 соединения ванадия достаточно активны. Соединения, в которых атом ванадия связан с более сложными лигандами, чем ОС2Н5, являются более термостабильными полимеризация этилена при 70 °С протекает с достаточно высоким выходом полимера, в 2— 4 раза превышающим выход на системах с УО(ОС2Н5)з или УОСЬ. Однако все соединения ванадия со сложными лигандами хелатного типа плохо растворимы или совсем нерастворимы в предельных углеводородах. Для введения в реакционную среду их необходимо предварительно растворить в бензоле. Образующийся при взаимодействии с алкилами алюминия каталитический комплекс, как правило, также совсем не растворяется или плохо растворяется в предельных углеводородах. [c.117]
3.5. Все указанные в табл. 3.5 соединения ванадия достаточно активны. Соединения, в которых атом ванадия связан с более сложными лигандами, чем ОС2Н5, являются более термостабильными полимеризация этилена при 70 °С протекает с достаточно высоким выходом полимера, в 2— 4 раза превышающим выход на системах с УО(ОС2Н5)з или УОСЬ. Однако все соединения ванадия со сложными лигандами хелатного типа плохо растворимы или совсем нерастворимы в предельных углеводородах. Для введения в реакционную среду их необходимо предварительно растворить в бензоле. Образующийся при взаимодействии с алкилами алюминия каталитический комплекс, как правило, также совсем не растворяется или плохо растворяется в предельных углеводородах. [c.117]
Электронное строение и типы связей элементов периодической системы — ключ к пониманию Сфуктуры и свойств простых и сложных веществ, образованных эти.ми элементами Два или более атомов располагаются друг около друга так, как это энергетически выгодно. Это справедливо независимо от того, сильно или слабо связана фуппа атомов, содержит эта фуппа лишь несколько или 10 атомов, является расположение атомов упорядоченным (как в кристалле) или неупорядоченным (как в жидкости). Группа ато.мов устойчива тогда и только тогда, когда энергия атомов, расположенных вместе, ниже, чем у отдельных атомов. Единственной физической причиной конкретной кристаллической сфуктуры любого элемента и его модификаций является перекрытие валентных и подвалентных оболочек его атомов, приводящее к образованшо определенных межатомных связей. Число протяженность и симмефия орбиталей атомов данного конкретного элемента полностью определяют число, длину, ориентиров и энергию межатомных связей, образующихся в результате перекрытия этих орбита-лей, а следовательно, размещение атомов в пространстве, т е. кристаллическую структуру, основные физико-химические свойства элемента. [c.30]
Это справедливо независимо от того, сильно или слабо связана фуппа атомов, содержит эта фуппа лишь несколько или 10 атомов, является расположение атомов упорядоченным (как в кристалле) или неупорядоченным (как в жидкости). Группа ато.мов устойчива тогда и только тогда, когда энергия атомов, расположенных вместе, ниже, чем у отдельных атомов. Единственной физической причиной конкретной кристаллической сфуктуры любого элемента и его модификаций является перекрытие валентных и подвалентных оболочек его атомов, приводящее к образованшо определенных межатомных связей. Число протяженность и симмефия орбиталей атомов данного конкретного элемента полностью определяют число, длину, ориентиров и энергию межатомных связей, образующихся в результате перекрытия этих орбита-лей, а следовательно, размещение атомов в пространстве, т е. кристаллическую структуру, основные физико-химические свойства элемента. [c.30]
О К И С Л Ы, оксиды — соединения хим. элементов с кислородом. В виде воды, горных пород, руд и др. известны с древнейших времен, однако их строение и состав впервые объяснил в 1770—80 франц. химик А.-Л. Лавуазье (он же дал и название). Общее число О., каждый из к-рых содержит только один элемент, больше числа элементов в периодической сист.еме элементов (некоторые элементы образуют несколько окислов) и составляет 185—200. Число двойных и более сложных О. достигает нескольких тысяч. Если элемент образует с кислородом несколько О., то низший по содержанию кислорода наз. закисью, а высший — перекисью. Иногда О. классифицируют по числу атомов кислорода на один атом металла (напр., TiO — моноокись, T12O3 или TiOj 5 — полуторная окись и TiOa — двуокись титана, WO3 — трехокись вольфрама). По хим. св-вам О. подразделяют на о с -н б в н ы е, образованные элементами I, II и III главных подгрупп периодической системы (к ним относятся также низшие О. большинства ме- [c.103]
В виде воды, горных пород, руд и др. известны с древнейших времен, однако их строение и состав впервые объяснил в 1770—80 франц. химик А.-Л. Лавуазье (он же дал и название). Общее число О., каждый из к-рых содержит только один элемент, больше числа элементов в периодической сист.еме элементов (некоторые элементы образуют несколько окислов) и составляет 185—200. Число двойных и более сложных О. достигает нескольких тысяч. Если элемент образует с кислородом несколько О., то низший по содержанию кислорода наз. закисью, а высший — перекисью. Иногда О. классифицируют по числу атомов кислорода на один атом металла (напр., TiO — моноокись, T12O3 или TiOj 5 — полуторная окись и TiOa — двуокись титана, WO3 — трехокись вольфрама). По хим. св-вам О. подразделяют на о с -н б в н ы е, образованные элементами I, II и III главных подгрупп периодической системы (к ним относятся также низшие О. большинства ме- [c.103]
Приведенные на рис. 2,6 спектры ароматических сульфидов 5—7 с фенильным кольцом, присоединенным к атому серы, имеют интенсивную сложную полосу поглощения с максимумом в области 250—260 нм. Наличие этой полосы ряд авторов [70] связывает с наложением полосы бензоидного перехода типа Вг и полосы, обусловленной сопряжением серы и я-электронной системы бензола. Установлено, что в алкилфенил-сульфидах очень существенны спектральные эффекты, обусловленные изгибом плоскости молекулы за счет особенностей строения алкильных заместителей и их положения в бензольном кольце [79]. Стерические препятствия сопряжению неподеленной пары электронов атома серы и я-электронов бензольного кольца, возникающие за счет орто-заместите-ля, можно обнаружить в молекуле децил-о-толилсульфида, что проявляется в заметном гипсохромном сдвиге ее максимума поглощения 6 относительно максимума поглощения в спектре пропилпаратолилсульфида 7. Интересно сопоставить спектры поглощения дифенилсульфида 8 и ди- фенилоксида [82]. Характер спектра 8 указывает на наличие значительного сопряжения вдоль всей молекулы, что следует из существенного отличия этого спектра от спектра тиоанизола или фенилпропилсульфи-да 5. С другой стороны, спектр дифенилоксида подобен спектру анизола.
Наличие этой полосы ряд авторов [70] связывает с наложением полосы бензоидного перехода типа Вг и полосы, обусловленной сопряжением серы и я-электронной системы бензола. Установлено, что в алкилфенил-сульфидах очень существенны спектральные эффекты, обусловленные изгибом плоскости молекулы за счет особенностей строения алкильных заместителей и их положения в бензольном кольце [79]. Стерические препятствия сопряжению неподеленной пары электронов атома серы и я-электронов бензольного кольца, возникающие за счет орто-заместите-ля, можно обнаружить в молекуле децил-о-толилсульфида, что проявляется в заметном гипсохромном сдвиге ее максимума поглощения 6 относительно максимума поглощения в спектре пропилпаратолилсульфида 7. Интересно сопоставить спектры поглощения дифенилсульфида 8 и ди- фенилоксида [82]. Характер спектра 8 указывает на наличие значительного сопряжения вдоль всей молекулы, что следует из существенного отличия этого спектра от спектра тиоанизола или фенилпропилсульфи-да 5. С другой стороны, спектр дифенилоксида подобен спектру анизола.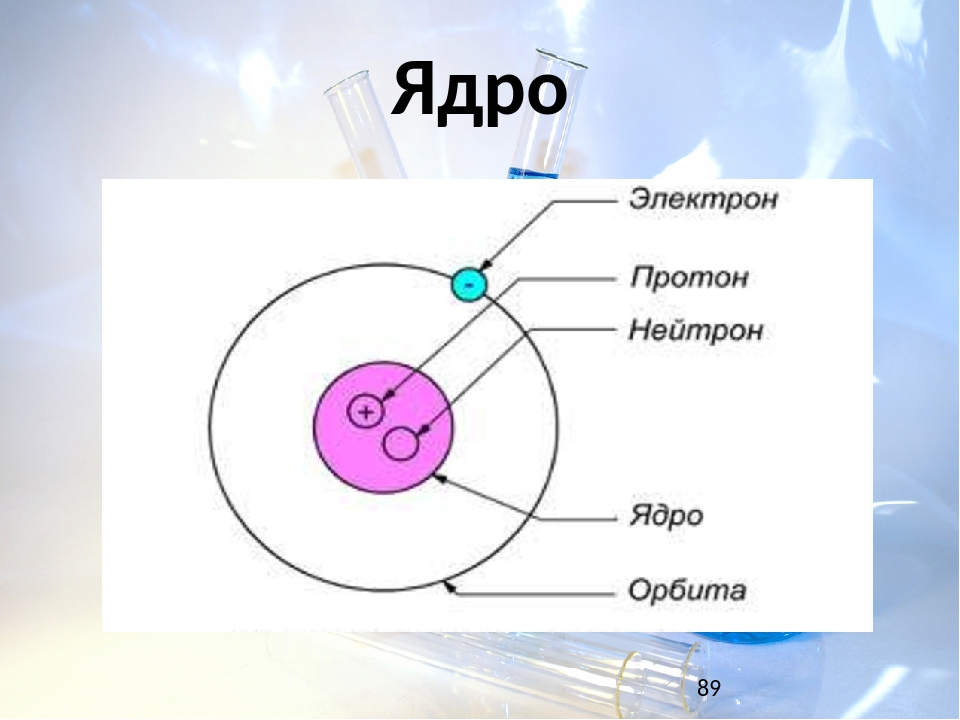 Отсюда можно заключить, что в отличие от молекулы дифенилоксида, являющейся некопланарной (фенильные кольца в ней расположены во взаимно перпендикулярных плоскостях [82], молекуле дифенилсульфида [c.191]
Отсюда можно заключить, что в отличие от молекулы дифенилоксида, являющейся некопланарной (фенильные кольца в ней расположены во взаимно перпендикулярных плоскостях [82], молекуле дифенилсульфида [c.191]
Витамин В12 отличается от всех остальных витаминов не только сложностью своего строения, но и тем, что он содержит важный для орг изма микроэлемент кобальт. Производное витамина 6 2, которое обычно получают при его выделении, называется цианкобалами-ном, так как в нем содержится цианогруппа, связанная с атомом кобальта. Сложная корриновая циклическая система витамина В г (рис. 10-15), с которой координационно связан атом кобальта, по химич ескому строению сходна с пор- [c.287]
Планетарная теория строения атомов. Резерфордовская нуклеарная модель атома для химиков не могла представить особого интереса. Она была еще слишком обща, слишком обезличена. Из того, что по сравнению с атомом аргона атом калия содержит лишнюю единицу положительного заряда в ядре и лишний электрон в электронной оболочке, никак не вытекал столь резкий скачок в свойствах между этими двумя элементами. Но исследование атома на нуклеарной модели атома не остановилось. Нуклеарная теория атома развилась в планетарную теорию. Что атом, есть нечто очень сложное, легко было заключить уже из крайней сложности спектров элементов искровой спектр железа заключает, например, в себе тысячи линий. Опираясь на теорию испускания световой энергии малыми, но конечными порциями — квантами, а также используя метод аналогии с коперниковой теорией солнечной системы, Нильс Бор создал планетарную теорию строения атомов. [c.78]
Но исследование атома на нуклеарной модели атома не остановилось. Нуклеарная теория атома развилась в планетарную теорию. Что атом, есть нечто очень сложное, легко было заключить уже из крайней сложности спектров элементов искровой спектр железа заключает, например, в себе тысячи линий. Опираясь на теорию испускания световой энергии малыми, но конечными порциями — квантами, а также используя метод аналогии с коперниковой теорией солнечной системы, Нильс Бор создал планетарную теорию строения атомов. [c.78]
Ароматические гетероциклы (пиридин, пиррол, тиофен, фуран и др.) по геометрическому строению аналогичны бензольным ядрам это плоские системы, которые при наличии боковых цепей или при включении в сложные полициклические структуры могут проявлять совершенно такие же конфигурационные и конформационные особенности, как ароматические соединения. Так, например, стоящие у гетероциклических ядер заместители могут находиться в разных конформациях. В качестве примера приведем результаты изучения конформаций Л/-алкил-2-фор-милпирролов. Наиболее выгодны здесь две конформации (15) и (16), в которых кольцо и связь С=0 расположены в одной плоскости и между ними имеется сопряжение. Методами ЯМР- и ИК-спектроскопии показано, что предпочтительна конформация (15), в которой атом кислорода карбонильной группы повернут в сторону гетероатома цикла. [c.308]
Наиболее выгодны здесь две конформации (15) и (16), в которых кольцо и связь С=0 расположены в одной плоскости и между ними имеется сопряжение. Методами ЯМР- и ИК-спектроскопии показано, что предпочтительна конформация (15), в которой атом кислорода карбонильной группы повернут в сторону гетероатома цикла. [c.308]
II. Проверочная работа (10 минут). Тест “Химические формулы”. Вопросы теста подаются на экран. Приложение 1. III. Формирование новых понятий.
1. Важнейшие этапы истории развития представлений о строении вещества.
Приложение 2. Приложение 3. Вывод: В начале ХХ века разрушилось представление о неделимости атома. Причиной послужили открытие электронов, явление радиоактивности. Атом – сложная частица.2. Планетарная модель атома (Резерфорд). Приложение 4. На основании опытов Резерфорда было установлено: (составляется схема на доске)
Атом “Нуклеус” (латинское nucleus) – ядро. Характеристики элементарных частиц. Таблица 2 в учебнике.
IV.
V. Применение знаний. Определите число протонов, электронов, нейтронов для атомов элементов.
VI. |
Отвечают на листочках.
Слушают пояснения к слайдам.
Записывают тезисами в тетрадь.
Вспоминают сведения из курса физики. Обращаются к учебнику, рассматривают рисунок 6
“Радиоактивное излучение в электрическом
поле”.
Рисуют схему в тетрадях
Записывают в тетрадях.
Изучают таблицу 2 в учебнике. Выписывают из таблицы примечания.
Записывают в тетрадях.
Выполняют в тетрадях. Проверяем фронтально.
Записывают домашнее задание. |
Электронный учебник модуль
№ 065. Тест “Химические формулы”
Работа с электронным учебником.
Работа с электронным учебником. Модуль № 108 “История открытия строения атома”.
Работа с электронным учебником. Mодуль № 111 “Опыт Резерфорда”.
|
|
Структура органических молекул — Химия LibreTexts
Здесь вы научитесь понимать, писать, рисовать и говорить об органических молекулах. Почему были разработаны различные техники рисования? Органические молекулы могут стать сложными и большими. Утомительно постоянно вытягивать каждую деталь, особенно когда в этом нет необходимости, поэтому о-химики прошлого разработали эти методы, чтобы сделать их более удобными и простыми. Кроме того, некоторые из этих сокращенных способов рисования молекул дают нам представление об углах связи, относительном положении атомов в молекуле, а некоторые устраняют многочисленные атомы водорода, которые могут мешать смотреть на основу структуры.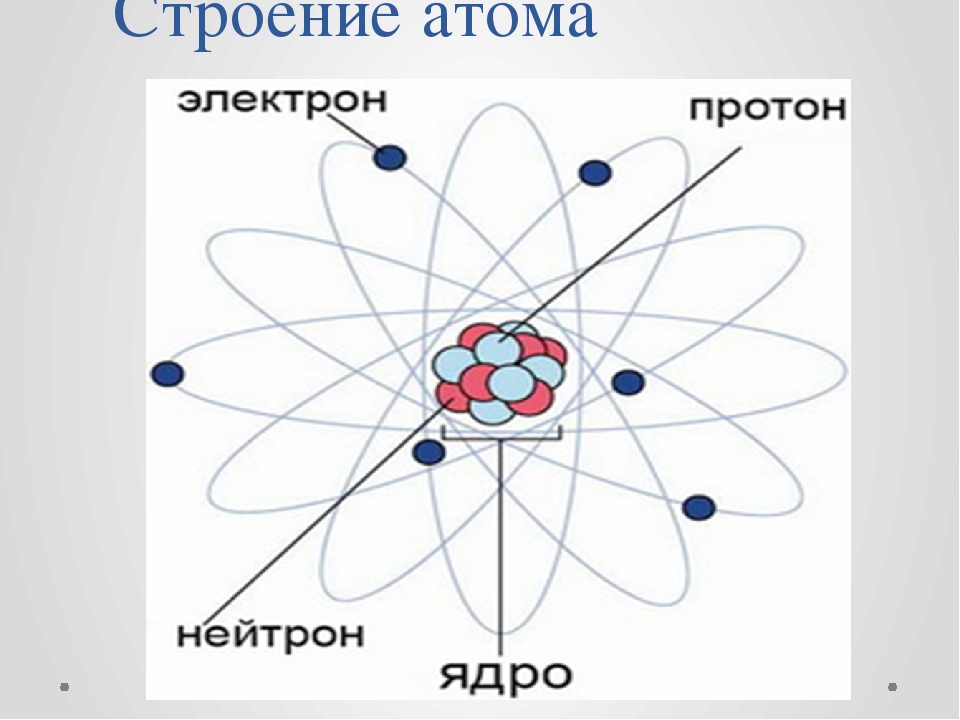
Введение
Обратите внимание на следующие рисунки структуры ретинола, наиболее распространенной формы витамина А. Первый рисунок следует прямолинейной (также известной как Кекуле) структуре, которая полезна, когда вы хотите рассмотреть каждый отдельный атом; однако отображение всех атомов водорода затрудняет сравнение общей структуры с другими подобными молекулами и затрудняет сосредоточение внимания на двойных связях и группе ОН.
Ретинол: прямой рисунок Кекуле
Нижеследующее представляет собой бондинг-лайн (a.к.а. зигзаг) формула ретинола. В этом упрощенном представлении можно легко увидеть углерод-углеродные связи, двойные связи, группу ОН и группы CH 3 , отходящие от основного кольца и цепи. Кроме того, это намного быстрее нарисовать, чем тот, что выше. Вы научитесь ценить этот тип написания формулы после того, как нарисуете бесчисленное количество органических молекул.
Ретинол: формула линии связи или зигзага
Важность структуры
Изучение и практика основ органической химии очень поможет вам в долгосрочной перспективе, когда вы будете изучать новые концепции и реакции.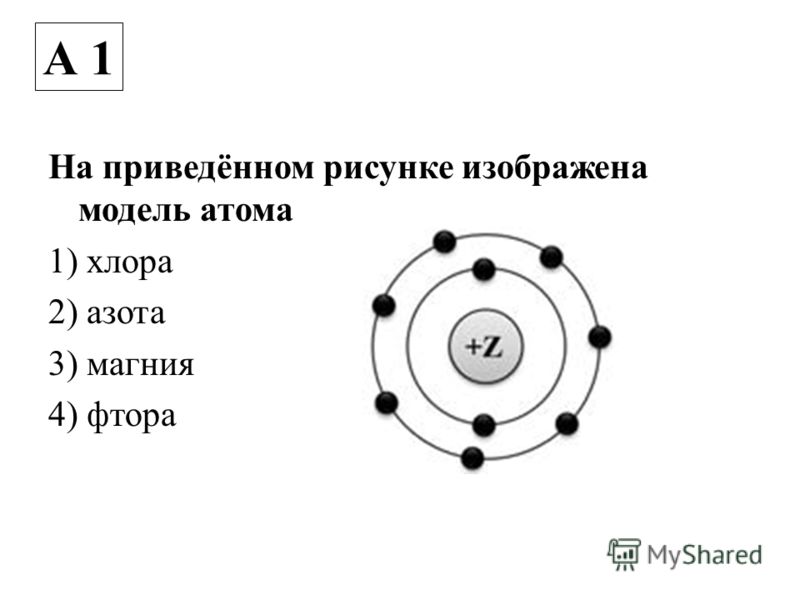 Некоторые люди говорят, что органическая химия похожа на другой язык, и в некоторых аспектах это так. Поначалу это может показаться трудным или непосильным, но чем больше вы будете практиковаться в рассмотрении и рисовании органических молекул, тем лучше вы будете знакомиться со структурами и формулами. Еще одна хорошая идея — приобрести комплект моделей и физически создать молекулы, которые вам сложно представить в голове.
Некоторые люди говорят, что органическая химия похожа на другой язык, и в некоторых аспектах это так. Поначалу это может показаться трудным или непосильным, но чем больше вы будете практиковаться в рассмотрении и рисовании органических молекул, тем лучше вы будете знакомиться со структурами и формулами. Еще одна хорошая идея — приобрести комплект моделей и физически создать молекулы, которые вам сложно представить в голове.
Изучая общую химию, вы, возможно, уже изучали молекулярную структуру.Различные способы рисования органических молекул включают Кекуле (прямая линия), сокращенные формулы и формулы линий связи (зигзаг). Будет полезнее, если вам будет удобно переходить от одного стиля рисования к другому, смотреть на рисунки и понимать, что они означают, чем знать, какой вид рисунка как называется.
Примером рисунка, который включает в себя все три способа рисования органических молекул, может быть следующий дополнительный рисунок ретинола. Большая часть рисунка представляет собой формулу линии Бонда (зигзаг), но -CH 3 написаны в виде сокращенных формул, а группа -OH написана в форме Кекуле.
4-углеродная молекула с 2 атомами хлора и 2 бромами 4-углеродная молекула с 2 атомами хлора и 2 бромами
Оба рисунка выглядят так, как будто они представляют одну и ту же молекулу; однако, если мы добавим черточки и заштрихуем, то увидим, что можно изобразить две разные молекулы:
Две вышеуказанные молекулы разные, докажите это себе, построив модель.Более простой способ сравнить две молекулы — повернуть одну из связей (здесь это связь справа):
Обратите внимание, что в молекуле справа оба брома находятся на одной стороне, а хлор — на одной. стороны, тогда как первая молекула отличается. Прочтите о структурах пунктирно-клинообразных линий внизу страницы, чтобы понять, о чем было сказано выше. Вы узнаете больше о важности связи атомов в молекулах, продолжая изучать стереохимию.
Прочтите о структурах пунктирно-клинообразных линий внизу страницы, чтобы понять, о чем было сказано выше. Вы узнаете больше о важности связи атомов в молекулах, продолжая изучать стереохимию.
Рисование структуры органических молекул
Хотя более крупные молекулы могут показаться сложными, их можно легко понять, разбив их на части и рассмотрев более мелкие компоненты.
Все атомы хотят, чтобы их валентная оболочка была полной, «закрытой оболочкой». Водород хочет иметь 2 e — , тогда как углерод, кислород и азот хотят иметь 8 e — . Рассматривая различные представления молекул, помните о правиле октетов. Также помните, что водород может связать один раз, кислород может связать до двух раз, азот может связать до трех раз, а углерод может связать до четырех раз.
Кекуле (также известные как прямолинейные структуры)
Структуры Кекуле аналогичны структурам Льюиса, но вместо ковалентных связей, представленных электронными точками, два общих электрона показаны линией.
(A) (B)(C)
Неподеленные пары остаются в виде двух электронных точек или иногда не учитываются, даже если они все еще существуют . Обратите внимание, что три неподеленные пары электронов не были втянуты вокруг хлора в примере B.
Сокращенные формулы
Сокращенная формула состоит из символов элементов.Порядок атомов предполагает связность. Сокращенные формулы можно читать с любого направления, и H 3 C совпадает с CH 3 , хотя последний встречается чаще, потому что посмотрите на примеры ниже и сопоставьте их с их идентичными молекулами по структурам Кекуле и формулам линий связи. .
(а) CH 3 CH 2 OH (B) CLCH 2 CH 2 CH (OCH 3 ) CH 3 (C) H 3 CNHCH 2 COOH
Рассмотрим внимательно пример Б.Проходя через сокращенную формулу, вы хотите сосредоточиться на углероде и других элементах, которые не являются водородом. Водороды важны, но обычно они используются для завершения октетов. Кроме того, обратите внимание, что -OCH 3 написано в скобках, что говорит вам, что это не часть основной цепи атомов углерода. Когда вы читаете сокращенную формулу, если вы достигаете атома, который не имеет полного октета к тому времени, когда вы достигаете следующего водорода, то, возможно, существуют двойные или тройные связи.В примере C углерод имеет двойную связь с кислородом и одинарную связь с другим кислородом. Обратите внимание, что COOH означает C(=O)-OH вместо CH 3 -C-O-O-H, потому что углерод не имеет полного октета и кислорода.
Водороды важны, но обычно они используются для завершения октетов. Кроме того, обратите внимание, что -OCH 3 написано в скобках, что говорит вам, что это не часть основной цепи атомов углерода. Когда вы читаете сокращенную формулу, если вы достигаете атома, который не имеет полного октета к тому времени, когда вы достигаете следующего водорода, то, возможно, существуют двойные или тройные связи.В примере C углерод имеет двойную связь с кислородом и одинарную связь с другим кислородом. Обратите внимание, что COOH означает C(=O)-OH вместо CH 3 -C-O-O-H, потому что углерод не имеет полного октета и кислорода.
Bond-Line (также известный как зигзаг) Формулы
Название говорит о том, как работает эта формула. Эта формула полна связей и линий, и из-за типичных (более стабильных) связей, которые атомы склонны образовывать в молекулах, они часто в конечном итоге выглядят как зигзагообразные линии. Если вы работаете с набором молекулярных моделей, вам будет трудно собрать прямые молекулы (если только они не содержат sp-тройные связи), тогда как зигзагообразные молекулы и связи гораздо более осуществимы.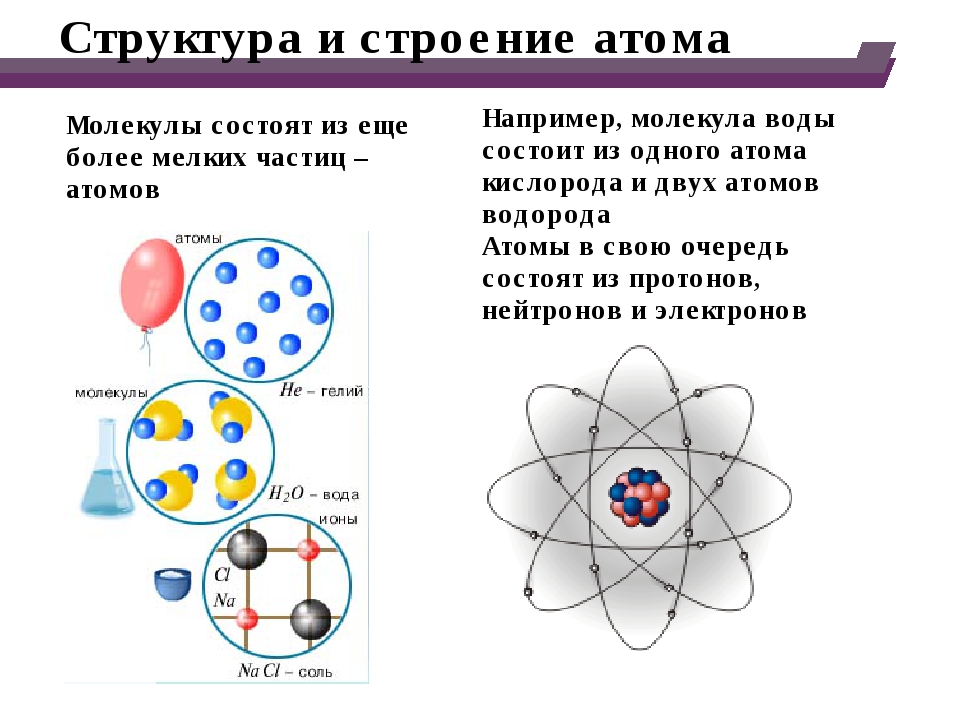
(A) (B) (C)
Эти молекулы соответствуют точно таким же молекулам, которые изображены для структур Кекуле и сокращенных формул. Обратите внимание, что углероды больше не нарисованы и заменены концами и изгибами линий. Кроме того, водороды были опущены, но их можно было легко втянуть (см. Практические задачи). Хотя мы обычно не рисуем Н, которые связаны с углеродом, мы рисуем их, если они связаны с другими атомами, помимо углерода (примером является группа ОН выше в примере А).Это делается потому, что не всегда ясно, окружен ли неуглеродный атом неподеленными парами или атомами водорода. Также в примере A обратите внимание, как ОН нарисован со связью со вторым углеродом, но это не означает, что на конце этой связи/линии есть третий углерод.
Структура штрих-клиновидной линии
Как вы уже догадались, структура штрих-клиновидной линии состоит из линий, штрихов и клиньев. Поначалу это может показаться запутанным, но с практикой понимание структуры штриховых линий станет для вас второй натурой. Ниже приведены примеры каждого и то, как их можно использовать вместе.
Ниже приведены примеры каждого и то, как их можно использовать вместе.
Выше приведены 4-углеродные цепи с присоединенными ОН-группами или атомами Cl и Br. Помните, что каждая линия представляет собой связь, а атомы углерода и водорода опущены. Когда вы смотрите на эти структуры или рисуете их, прямые линии изображают атомы и связи, находящиеся в одной плоскости, плоскости бумаги (в данном случае экрана компьютера). Пунктирные линии показывают атомы и связи, которые уходят на страницу, за плоскость, от вас.В приведенном примере группа ОН уходит в плоскость, в то же время выходит (заклинивается) водород.
Синий шарик = группа ОН; Белая бусина=H
Клинообразные линии иллюстрируют связи и атомы, которые выходят из страницы перед плоскостью к вам. На двухмерной диаграмме выше группа ОН выходит из плоскости бумаги, а водород входит внутрь (пунктир).
Синий шарик = группа ОН; Белая бусина = H
Как указывалось ранее, прямые линии иллюстрируют атомы и связи, которые находятся в той же плоскости, что и бумага, но в двумерном примере прямолинейная связь для OH означает, что неясно или не имеет значения, уходит ли OH или к вам.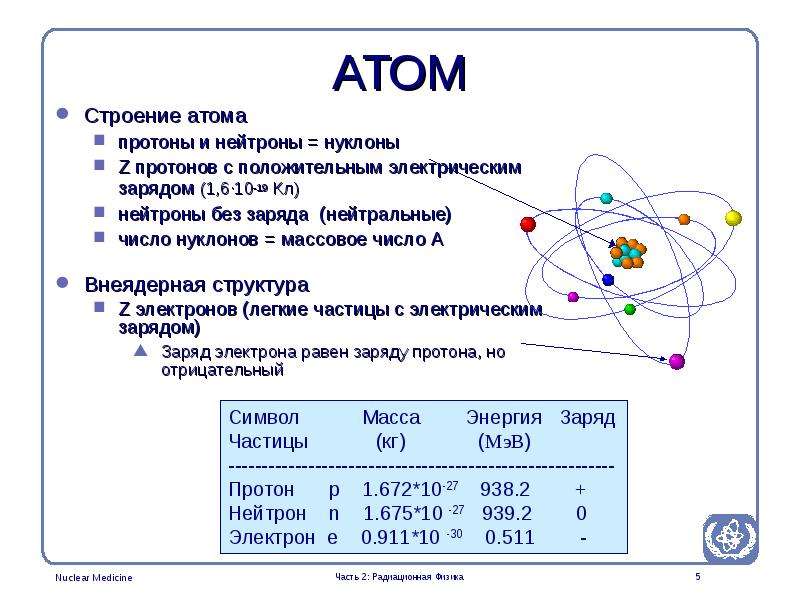 Также предполагается, что водород также связан с тем же углеродом, на котором находится ОН.
Также предполагается, что водород также связан с тем же углеродом, на котором находится ОН.
Синий шарик = группа ОН; H не показана
Попробуйте с помощью комплекта моделей убедиться, что группа ОН не может лежать в одной плоскости в углеродной цепи (не забудьте свои атомы водорода!). В последнем примере 2D используются как пунктирные, так и клиновидные линии, поскольку присоединенные атомы не являются атомами водорода (хотя штриховые и клиновидные линии могут использоваться для атомов водорода). Хлор выходит из страницы, а бром входит в страницу.
Синий шарик=Cl; Красная бусина = Br
Ссылки
- Фоллхардт, К. Питер С. и Нил Э. Шор. Органическая химия: структура и функции . 5-е изд. Нью-Йорк: Компания WH Freeman, 2007. 38–40.
- Кляйн, Дэвид Р. Органическая химия I как второй язык . 2-е изд. Хобокен, Нью-Джерси: John Wiley & Sons, Inc., 2007. 1–14.
Авторы
- Чу, Эзен (2009, UCD ’11)
8.
 5: Рисование структур Льюиса — Химия LibreTexts
5: Рисование структур Льюиса — Химия LibreTextsЦели обучения
- Чтобы использовать символы точек Льюиса для объяснения стехиометрии соединения
Начнем обсуждение связи между структурой и связью в ковалентных соединениях с описания взаимодействия двух одинаковых нейтральных атомов, например молекулы Н 2 , содержащей чисто ковалентную связь. Каждый атом водорода в H 2 содержит один электрон и один протон, причем электрон притягивается к протону электростатическими силами.Поскольку два атома водорода сближаются, необходимо учитывать дополнительные взаимодействия (рис. \(\PageIndex{1}\)):
- Электроны в двух атомах отталкиваются друг от друга, потому что они имеют одинаковый заряд (
- Электроны в двух атомах отталкиваются друг от друга, потому что они имеют одинаковый заряд (E > 0).
- Точно так же протоны в соседних атомах отталкиваются друг от друга ( E > 0).
- Электрон одного атома притягивается к противоположно заряженному протону другого атома и наоборот ( E < 0).
График зависимости потенциальной энергии системы от межъядерного расстояния (рис. \(\PageIndex{2}\)) показывает, что система становится более стабильной (энергия системы уменьшается) по мере движения двух атомов водорода навстречу друг друга от r = ∞, пока энергия не достигнет минимума при r = r 0 (наблюдаемое межъядерное расстояние в H 2 равно 74 пм).Таким образом, на промежуточных расстояниях преобладают взаимодействия протон-электрон притяжения, но когда расстояние становится очень коротким, взаимодействия электрона-электрона и протон-протона отталкивания вызывают быстрый рост энергии системы.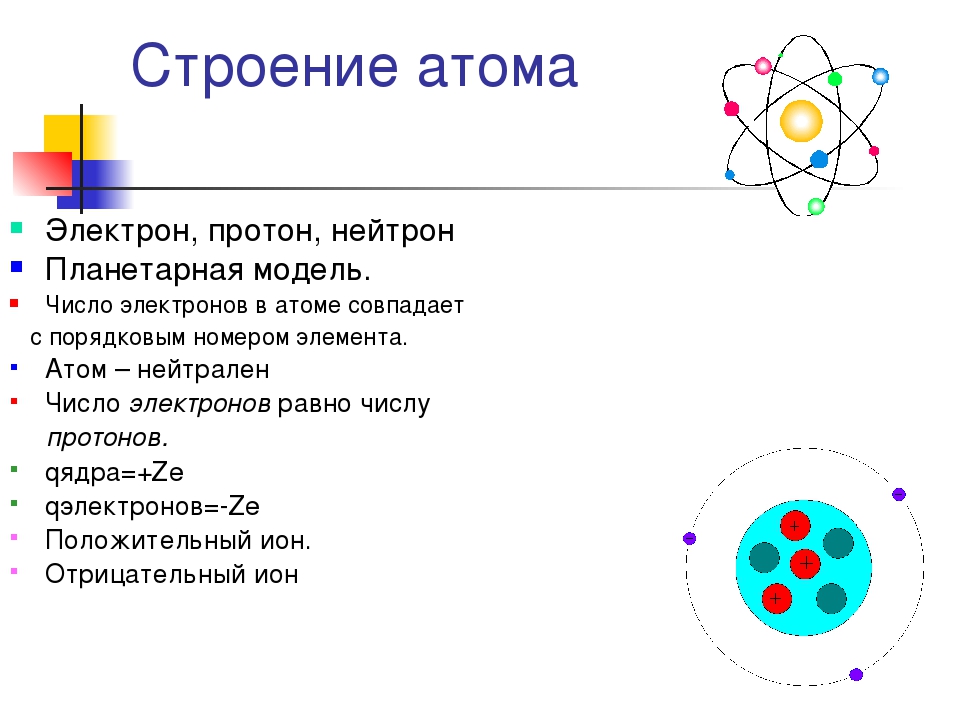 Обратите внимание на сходство между рисунками \(\PageIndex{1}\) и \(\PageIndex{2}\), на которых описывается система, содержащая два противоположно заряженных иона . Формы кривых зависимости энергии от расстояния на двух рисунках похожи, потому что они оба являются результатом сил притяжения и отталкивания между заряженными объектами.
Обратите внимание на сходство между рисунками \(\PageIndex{1}\) и \(\PageIndex{2}\), на которых описывается система, содержащая два противоположно заряженных иона . Формы кривых зависимости энергии от расстояния на двух рисунках похожи, потому что они оба являются результатом сил притяжения и отталкивания между заряженными объектами.
На больших расстояниях как притяжение, так и отталкивание малы. По мере уменьшения расстояния между атомами преобладают притягивающие электрон-протонные взаимодействия, и энергия системы уменьшается. При наблюдаемом расстоянии связи отталкивающие электрон-электронные и протон-протонные взаимодействия как раз уравновешивают притягивающие взаимодействия, предотвращая дальнейшее уменьшение межъядерного расстояния.На очень коротких межъядерных расстояниях преобладают отталкивающие взаимодействия, что делает систему менее стабильной, чем изолированные атомы.
Использование символов точек Льюиса для описания ковалентной связи
Конфигурации валентных электронов составляющих атомов ковалентного соединения являются важными факторами, определяющими его структуру, стехиометрию и свойства. Например, у хлора с семью валентными электронами на один электрон меньше октета. Если два атома хлора разделяют свои неспаренные электроны, образуя ковалентную связь и образуя Cl 2 , каждый из них может заполнить свою валентную оболочку:
Каждый атом хлора теперь имеет октет.Электронная пара, общая для атомов, называется связывающей парой; остальные три пары электронов на каждом атоме хлора называются неподеленными парами. Неподеленные пары не участвуют в ковалентной связи. Если оба электрона в ковалентной связи исходят от одного и того же атома, связь называется координационной ковалентной связью. Примеры этого типа связи представлены в разделе 8.6, когда мы обсуждаем атомы с менее чем октетом электронов.
Мы можем проиллюстрировать образование молекулы воды из двух атомов водорода и атома кислорода с помощью точечных символов Льюиса:
Структура справа представляет собой электронную структуру Льюиса или структуру Льюиса для H 2 O.С двумя связывающими парами и двумя неподеленными парами атом кислорода завершил свой октет. Более того, благодаря общей паре связей с кислородом каждый атом водорода теперь имеет полную валентную оболочку из двух электронов. Химики обычно обозначают связующую пару одной линией, как показано здесь для двух наших примеров:
Следующая процедура может быть использована для построения электронных структур Льюиса для более сложных молекул и ионов:
- Расположите атомы, чтобы показать конкретные связи. Когда есть центральный атом, это обычно наименее электроотрицательный элемент в соединении. Химики обычно указывают этот центральный атом первым в химической формуле (как в CCl 4 и CO 3 2 − , в которых C является центральным атомом), что является еще одним ключом к разгадке структуры соединения.
 Водород и галогены почти всегда связаны только с одним другим атомом, поэтому они обычно концевые , а не центральные.
Водород и галогены почти всегда связаны только с одним другим атомом, поэтому они обычно концевые , а не центральные. - Определите общее количество валентных электронов в молекуле или ионе. Сложите вместе валентные электроны от каждого атома. (Напомним, что количество валентных электронов определяется положением элемента в периодической таблице.) Если частица представляет собой многоатомный ион, не забудьте добавить или вычесть количество электронов, необходимое для получения общего заряда иона. Например, для CO 3 2 − мы добавляем к сумме два электрона из-за заряда -2.
- Поместите связывающую пару электронов между каждой парой соседних атомов, чтобы получить одинарную связь. В H 2 O, например, между кислородом и каждым водородом имеется связывающая пара электронов.
- Начиная с концевых атомов, добавьте к каждому атому столько электронов, чтобы дать каждому атому октет (два для водорода).
 Эти электроны обычно представляют собой неподеленные пары.
Эти электроны обычно представляют собой неподеленные пары. - Если остались электроны, поместите их на центральный атом. Позже мы объясним, что некоторые атомы способны вмещать более восьми электронов.
- Если у центрального атома меньше электронов, чем у октета, используйте неподеленные пары концевых атомов для образования множественных (двойных или тройных) связей с центральным атомом, чтобы получить октет. Это не изменит количество электронов на концевых атомах.
Теперь давайте применим эту процедуру к некоторым конкретным соединениям, начиная с того, который мы уже обсуждали.
Центральный атом обычно является наименее электроотрицательным элементом в молекуле или ионе; водород и галогены обычно концевые.
Молекула \(H_2O\)
- Поскольку атомы H почти всегда концевые, расположение внутри молекулы должно быть HOH.
- Каждый атом H (группа 1) имеет 1 валентный электрон, а атом O (группа 16) имеет 6 валентных электронов, всего 8 валентных электронов.

- Размещение одной связывающей пары электронов между атомом O и каждым атомом H дает H:O:H с 4 оставшимися электронами.
- Каждый атом H имеет полную валентную оболочку из 2 электронов.
- Добавление оставшихся 4 электронов к кислороду (в виде двух неподеленных пар) дает следующую структуру:
Это структура Льюиса, которую мы нарисовали ранее.−\) Ион
- Поскольку в молекуле всего два атома, центрального атома нет.
- Кислород (группа 16) имеет 6 валентных электронов, а хлор (группа 17) имеет 7 валентных электронов; мы должны добавить еще один для отрицательного заряда иона, что дает в общей сложности 14 валентных электронов.
- Размещение связывающей пары электронов между O и Cl дает O:Cl с 12 оставшимися электронами.
- Если мы поместим шесть электронов (в виде трех неподеленных пар) на каждый атом, мы получим следующую структуру:
Каждый атом теперь имеет октет электронов, поэтому шаги 5 и 6 не нужны. Электронная структура Льюиса изображена в скобках, как это принято для иона, вне скобок указан общий заряд, а связывающая пара электронов указана сплошной линией. OCl − представляет собой ион гипохлорита, активный ингредиент хлорного отбеливателя для белья и дезинфицирующего средства для бассейнов.
Электронная структура Льюиса изображена в скобках, как это принято для иона, вне скобок указан общий заряд, а связывающая пара электронов указана сплошной линией. OCl − представляет собой ион гипохлорита, активный ингредиент хлорного отбеливателя для белья и дезинфицирующего средства для бассейнов.
Молекула \(CH_2O\)
1. Поскольку углерод менее электроотрицателен, чем кислород, а водород обычно является концевым атомом, C должен быть центральным атомом. Одна из возможных компоновок следующая:
2.Каждый атом водорода (группа 1) имеет один валентный электрон, углерод (группа 14) имеет 4 валентных электрона, а кислород (группа 16) имеет 6 валентных электронов, всего [(2)(1) + 4 + 6] = 12 валентных электронов.
3. Размещение связывающей пары электронов между каждой парой связанных атомов дает следующее:
Шесть электронов используются, 6 остаются.
4. Добавление всех 6 оставшихся электронов к кислороду (в виде трех неподеленных пар) дает следующее:
Хотя кислород теперь имеет октет и каждый водород имеет 2 электрона, углерод имеет только 6 электронов.
5. На центральном атоме не осталось электронов.
6. Чтобы дать углероду октет электронов, мы используем одну из неподеленных пар электронов на кислороде для образования двойной связи углерод-кислород:
И кислород, и углерод теперь имеют октет электронов, так что это приемлемая электронная структура Льюиса. O имеет две пары связей и две неподеленные пары, а C имеет четыре пары связей. Это структура формальдегида, который используется в жидкости для бальзамирования.
Можно нарисовать альтернативную структуру с одним Н, связанным с О. Формальные заряды , обсуждаемые далее в этом разделе, предполагают, что такая структура менее стабильна, чем показанная ранее.
Пример \(\PageIndex{1}\)
Напишите электронную структуру Льюиса для каждого вида.
- NCl 3
- С 2 2 −
- NOCl
Дано: химических видов
Запрашиваемый: Электронные структуры Льюиса
Стратегия:
Используйте процедуру из шести шагов, чтобы записать электронную структуру Льюиса для каждого вида.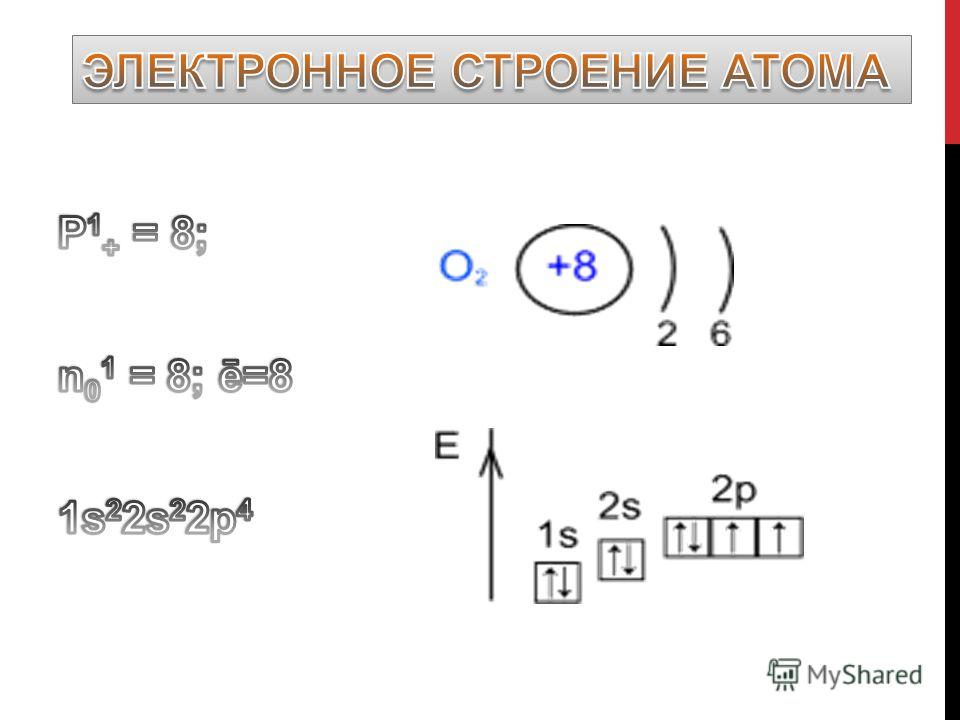
Решение:
- Азот менее электроотрицателен, чем хлор, а атомы галогена обычно концевые, поэтому азот является центральным атомом. Атом азота (группа 15) имеет 5 валентных электронов, а каждый атом хлора (группа 17) имеет 7 валентных электронов, всего 26 валентных электронов. Использование 2 электронов для каждой связи N – Cl и добавление трех неподеленных пар к каждому Cl дает (3 × 2) + (3 × 2 × 3) = 24 электрона. Правило 5 приводит нас к размещению оставшихся 2 электронов на центральном N:
Трихлорид азота представляет собой нестабильную маслянистую жидкость, когда-то использовавшуюся для отбеливания муки; это использование теперь запрещено в Соединенных Штатах.
- В двухатомной молекуле или ионе нам не нужно беспокоиться о центральном атоме. Каждый атом серы (группа 16) содержит 6 валентных электронов, и нам нужно добавить 2 электрона для заряда -2, что дает в общей сложности 14 валентных электронов.
 Используя 2 электрона для связи S-S, мы размещаем оставшиеся 12 электронов в виде трех неподеленных пар на каждой сере, давая каждому атому S октет электронов:
Используя 2 электрона для связи S-S, мы размещаем оставшиеся 12 электронов в виде трех неподеленных пар на каждой сере, давая каждому атому S октет электронов: - Поскольку азот менее электроотрицателен, чем кислород или хлор, он является центральным атомом.Атом N (группа 15) имеет 5 валентных электронов, атом O (группа 16) имеет 6 валентных электронов, а атом Cl (группа 17) имеет 7 валентных электронов, что дает в общей сложности 18 валентных электронов. Размещение одной связывающей пары электронов между каждой парой связанных атомов использует 4 электрона и дает следующее:
Добавление трех неподеленных пар к кислороду и хлору требует еще 12 электронов, оставляя 2 электрона в виде неподеленной пары на азоте:
Поскольку эта структура Льюиса имеет только 6 электронов вокруг центрального атома азота, для образования связывающей пары должна использоваться неподеленная пара электронов на концевом атоме.Мы могли бы использовать одиночную пару либо на O, либо на Cl.
 Поскольку мы видели много структур, в которых O образует двойную связь, но ни одной с двойной связью с Cl, разумно выбрать неподеленную пару из O, чтобы получить следующее:
Поскольку мы видели много структур, в которых O образует двойную связь, но ни одной с двойной связью с Cl, разумно выбрать неподеленную пару из O, чтобы получить следующее:Все атомы теперь имеют октетные конфигурации. Это электронная структура Льюиса нитрозилхлорида, очень агрессивного красновато-оранжевого газа.
Упражнение \(\PageIndex{1}\)
Напишите электронные структуры Льюиса для CO 2 и SCl 2 , неустойчивой красной жидкости с неприятным запахом, которая используется при производстве каучука.
Ответить
Использование электронных структур Льюиса для объяснения стехиометрии
Символы точек Льюиса обеспечивают простое объяснение того, почему элементы образуют соединения с наблюдаемой стехиометрией. В модели Льюиса количество связей, образованных элементом в нейтральном соединении, равно количеству неспаренных электронов, которые он должен разделить с другими атомами, чтобы завершить свой октет электронов. Для элементов группы 17 (галогены) это число равно единице; для элементов 16-й группы (халькогены) — два; для элементов группы 15 — три; а для элементов группы 14 четыре. Эти требования иллюстрируются следующими структурами Льюиса для гидридов самых легких членов каждой группы:
Для элементов группы 17 (галогены) это число равно единице; для элементов 16-й группы (халькогены) — два; для элементов группы 15 — три; а для элементов группы 14 четыре. Эти требования иллюстрируются следующими структурами Льюиса для гидридов самых легких членов каждой группы:
Элементы могут образовывать несколько связей для завершения октета. В этилене, например, каждый углерод вносит два электрона в двойную связь, давая каждому углероду октет (два электрона/связь × четыре связи = восемь электронов).Нейтральные структуры с меньшим или большим количеством связей существуют, но они необычны и нарушают правило октета.
Аллотропы элемента могут иметь очень разные физические и химические свойства из-за различного пространственного расположения атомов; однако количество связей, образованных атомами компонентов, всегда одинаково. Как отмечалось в начале главы, алмаз — твердое прозрачное тело; графит — мягкое твердое вещество черного цвета; а фуллерены имеют структуру с открытой клеткой.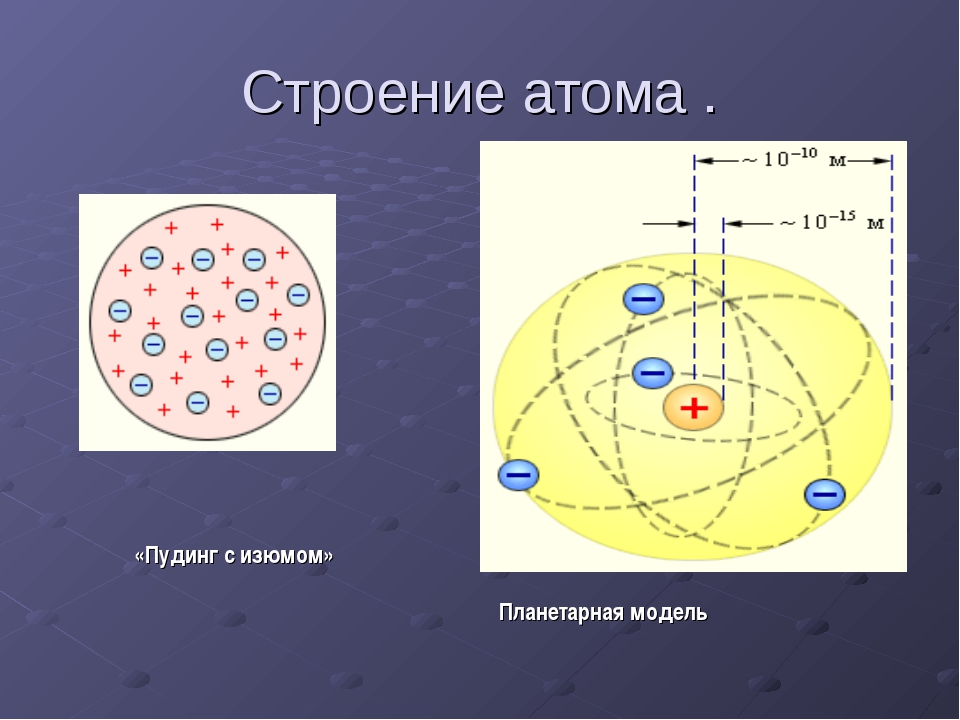 Несмотря на эти различия, атомы углерода во всех трех аллотропах образуют четыре связи в соответствии с правилом октета.
Несмотря на эти различия, атомы углерода во всех трех аллотропах образуют четыре связи в соответствии с правилом октета.
структуры Льюиса объясняют, почему элементы групп 14–17 образуют нейтральные соединения с четырьмя, тремя, двумя и одним связанным атомом (атомами) соответственно.
Элементарный фосфор также существует в трех формах: белый фосфор, токсичное воскообразное вещество, которое сначала светится, а затем самовозгорается при контакте с воздухом; красный фосфор, аморфное вещество, которое коммерчески используется в безопасных спичках, фейерверках и дымовых шашках; и черный фосфор, нереакционноспособное кристаллическое твердое вещество с текстурой, похожей на графит (рис. \(\PageIndex{3}\)).Тем не менее, атомы фосфора во всех трех формах подчиняются правилу октетов и образуют три связи на атом фосфора.
Рисунок \(\PageIndex{3}\): Три аллотропа фосфора: белый, красный и черный. Все три формы содержат только атомы фосфора, но отличаются расположением и связью своих атомов. Белый фосфор содержит тетраэдры P 4 , красный фосфор представляет собой сеть связанных единиц P 8 и P 9 , а черный фосфор образует листы шестичленных колец.В результате их физические и химические свойства резко различаются.
Белый фосфор содержит тетраэдры P 4 , красный фосфор представляет собой сеть связанных единиц P 8 и P 9 , а черный фосфор образует листы шестичленных колец.В результате их физические и химические свойства резко различаются.Официальные обвинения
Иногда можно записать более одной структуры Льюиса для вещества, не нарушающего правило октета, как мы видели для CH 2 O, но не каждая структура Льюиса может быть одинаково разумной. В этих ситуациях мы можем выбрать наиболее стабильную структуру Льюиса, учитывая формальный заряд атомов, который представляет собой разницу между числом валентных электронов в свободном атоме и номером, присвоенным ему в электронной структуре Льюиса.Формальный заряд — это способ вычисления распределения заряда в структуре Льюиса; сумма формальных зарядов атомов внутри молекулы или иона должна равняться общему заряду молекулы или иона. Формальный заряд , а не представляет собой истинный заряд атома в ковалентной связи, а просто используется для предсказания наиболее вероятной структуры, когда соединение имеет более одной действительной структуры Льюиса.
Чтобы вычислить формальные заряды, мы связываем электроны в молекуле с отдельными атомами в соответствии со следующими правилами:
- Несвязывающие электроны относятся к атому, на котором они расположены.{\left (атом\; в\; Льюис\; структура \right)}
\end{matrix} \label{8.5.1} \) (атом в структуре Льюиса)Чтобы проиллюстрировать этот метод, давайте рассчитаем формальный заряд атомов в аммиаке (NH 3 ), электронная структура которого по Льюису выглядит следующим образом:
Нейтральный атом азота имеет пять валентных электронов (он находится в 15 группе). Судя по электронной структуре Льюиса, атом азота в аммиаке имеет одну неподеленную пару и разделяет три связывающие пары с атомами водорода, поэтому самому азоту соответствует в общей сложности пять электронов [2 несвязывающих e — + (6 связывающих e — / 2)].{-}}{2} \right )=0 \label{8.5.3}\]
Атомы водорода в аммиаке имеют то же число электронов, что и нейтральные атомы водорода, поэтому их формальный заряд также равен нулю.
 Сложение формальных зарядов должно дать нам общий заряд молекулы или иона. В этом примере азот и каждый водород имеют формальный нулевой заряд. При суммировании общий заряд равен нулю, что согласуется с общим зарядом молекулы NH 3 .
Сложение формальных зарядов должно дать нам общий заряд молекулы или иона. В этом примере азот и каждый водород имеют формальный нулевой заряд. При суммировании общий заряд равен нулю, что согласуется с общим зарядом молекулы NH 3 .Атом, молекула или ион имеют формальный нулевой заряд, если они имеют число связей, типичное для этого вида.
Как правило, структура с наибольшим зарядом атомов, ближайших к нулю, является более стабильной структурой Льюиса. В случаях, когда на различных атомах имеются положительные или отрицательные формальные заряды, стабильные структуры обычно имеют отрицательные формальные заряды на более электроотрицательных атомах и положительные формальные заряды на менее электроотрицательных атомах. Следующий пример также демонстрирует, как рассчитать формальные сборы.
Пример \(\PageIndex{2}\): ион аммония
Рассчитайте формальные заряды каждого атома в ионе NH 4 + .
Дано: химических видов
Запрошено: официальные сборы
Стратегия:
Определите число валентных электронов в каждом атоме иона NH 4 + .
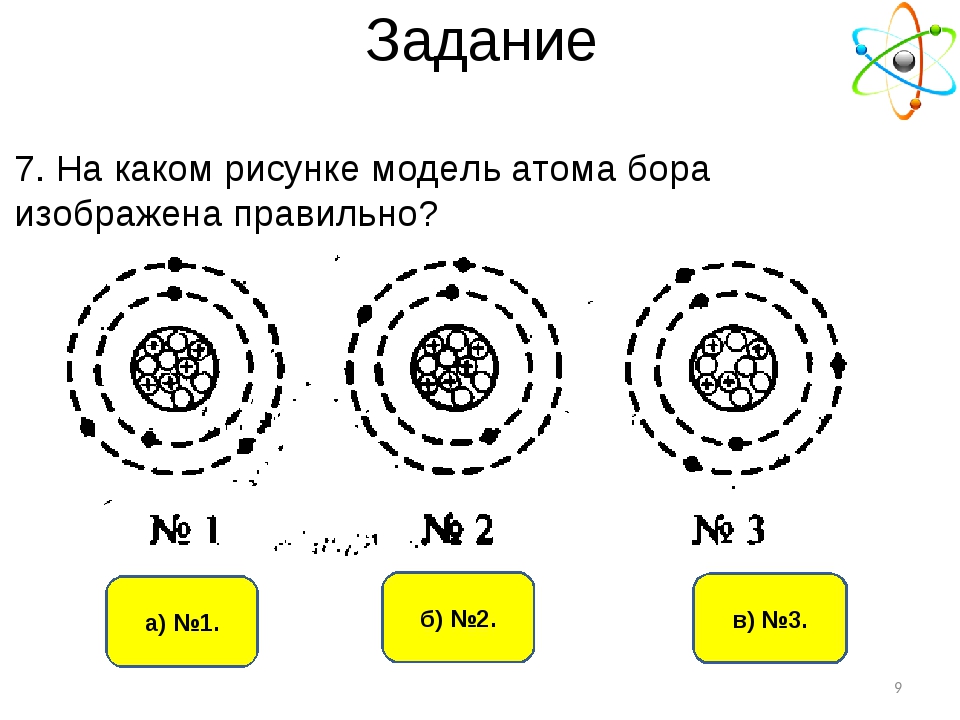 Используйте электронную структуру Льюиса NH 4 + , чтобы определить количество связывающих и несвязывающих электронов, связанных с каждым атомом, а затем используйте уравнение \(\ref{8.5.2}\) для расчета формального заряда на каждом атоме.
Используйте электронную структуру Льюиса NH 4 + , чтобы определить количество связывающих и несвязывающих электронов, связанных с каждым атомом, а затем используйте уравнение \(\ref{8.5.2}\) для расчета формального заряда на каждом атоме.Решение:
Электронная структура Льюиса для иона NH 4 + выглядит следующим образом:
Атом азота имеет четыре общих пары электронов связи, а нейтральный атом азота имеет пять валентных электронов.Таким образом, используя уравнение \(\ref{8.5.1}\), формальный заряд атома азота равен
.\[ формальный\; заряд\влево ( N \вправо )=5-\влево ( 0+\dfrac{8}{2} \вправо )=0 \]
Каждый атом водорода имеет одну связывающую пару. Таким образом, формальный заряд каждого атома водорода равен
.\[ формальный\; заряд\влево ( H \вправо )=1-\влево ( 0+\dfrac{2}{2} \вправо )=0 \]
Таким образом, формальные заряды атомов в ионе NH 4 + равны
Сложение формальных зарядов атомов должно дать нам общий заряд молекулы или иона.
 В этом случае сумма формальных зарядов равна 0 + 1 + 0 + 0 + 0 = +1.
В этом случае сумма формальных зарядов равна 0 + 1 + 0 + 0 + 0 = +1.Упражнение \(\PageIndex{2}\)
Запишите формальные заряды всех атомов в BH 4 − .
Ответить
Если атом в молекуле или ионе имеет типичное для этого атома число связей (например, четыре связи для углерода), его формальный заряд равен нулю.
Использование формальных зарядов для различения жизнеспособных структур Льюиса
форм молекул
В двухатомной молекуле (X 2 или XY) имеется только одна связь, и полярность этой связи определяет полярность молекулы: если связь полярна, молекула полярна, а если связь неполярна, молекула неполярна.
В молекулах с более чем одной связью обе формы и полярность связи определяют, является ли молекула полярной . А молекула должна содержать полярные связи, чтобы молекула была полярной, но если полярные связи выровнены точно напротив друг друга, или если они достаточно симметричны, полярность связи уравновешивается, что делает молекула неполярная.
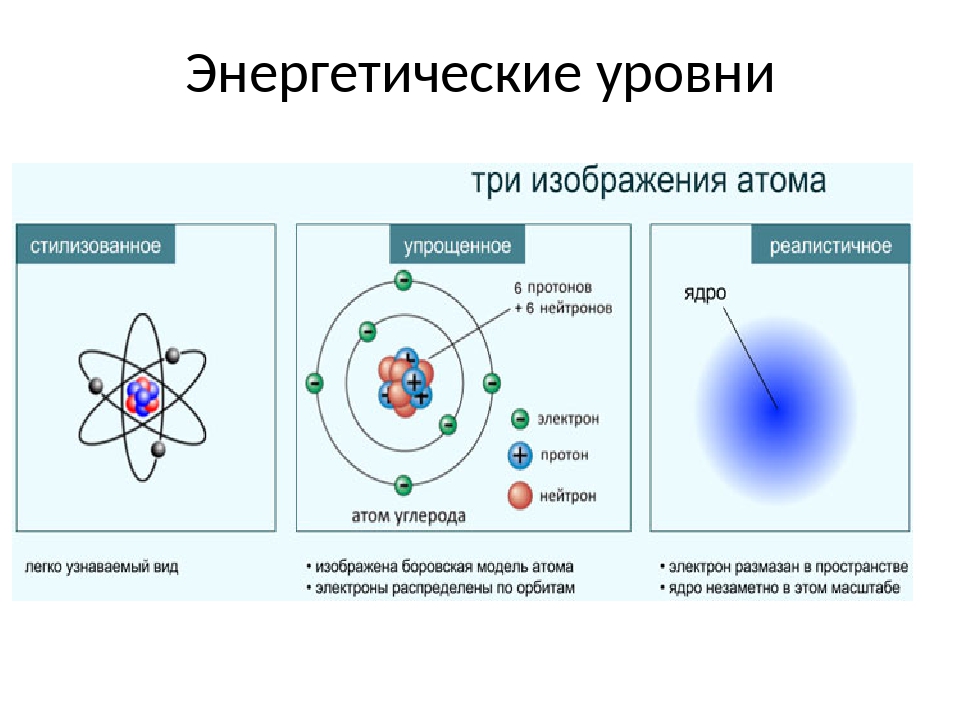 (Полярность является векторной величиной, поэтому оба
величина и направление должны быть приняты во внимание.)
(Полярность является векторной величиной, поэтому оба
величина и направление должны быть приняты во внимание.)Например, рассмотрим точечную структуру Льюиса для углекислый газ. Это линейная молекула, содержащая два полярных двойные связи углерод-кислород. Однако, поскольку полярные связи направлены ровно на 180 градусов друг от друга, полярности связей компенсируются, и молекула неполярна. (В качестве аналогии вы можете представить себе, что это как игра в перетягивание каната между двумя командами, которые тянут веревку одинаково тяжело.)
Молекула воды также содержит полярные связи, но поскольку это изогнутая молекула, связи расположены под углом друг к другу около 105.Они делают , а не сокращаются, потому что они не указывают точно друг к другу, и есть общий диполь, идущий от водородный конец молекулы ближе к кислородному концу молекулы; следовательно, вода является полярной молекулой:
Молекулы, в которых все атомы, окружающие центральные атомы одинаковы, имеют тенденцию быть неполярными, если нет неподеленных пар на центральном атоме.
 Если некоторые из атомов, окружающих центральный атом
различны, однако молекула может быть полярной. например, углерод
тетрахлорид, CCl 4 , неполярный, но хлороформ, CHCl 3 ,
и метилхлорид, CH 3 Cl полярны:
Если некоторые из атомов, окружающих центральный атом
различны, однако молекула может быть полярной. например, углерод
тетрахлорид, CCl 4 , неполярный, но хлороформ, CHCl 3 ,
и метилхлорид, CH 3 Cl полярны:Полярность молекулы сильно влияет на ее физические свойства. Молекулы, которые более полярны, имеют более сильную межмолекулярные силы между ними и имеют, как правило, более высокую температуру кипения точки (а также другие различные физические свойства).
В таблице ниже показано, соответствуют ли примеры в предыдущие разделы являются полярными или неполярными. Для видов, имеющих общий заряд, вместо него используется термин «взимаемый», поскольку термины полярные и неполярные на самом деле не относятся к заряженным частицам; взимается виды по определению существенно полярны. Одиночные пары на некоторых внешних атомы опущены для ясности.
Формула
Льюис Структура
3D-структура
Форма
Полярность
Пояснение
1.

СН 4
четырехгранный
неполярный
Связь CH неполярный, так как C и H отличаются всего на 0,35 единицы электроотрицательности.
2.
НХ 3
тригональный пирамидальный
полярный
С этого молекула не плоская, связи NH не направлены непосредственно друг на друга, и их полярности не отменяют вне.Кроме того, имеется небольшой диполь в направлении одинокой пары.
3.
Н 2 О
изогнутый
полярный
С этого молекула изогнута, связи ОН не направлены прямо на друг друга, и их полярности не уравновешиваются.
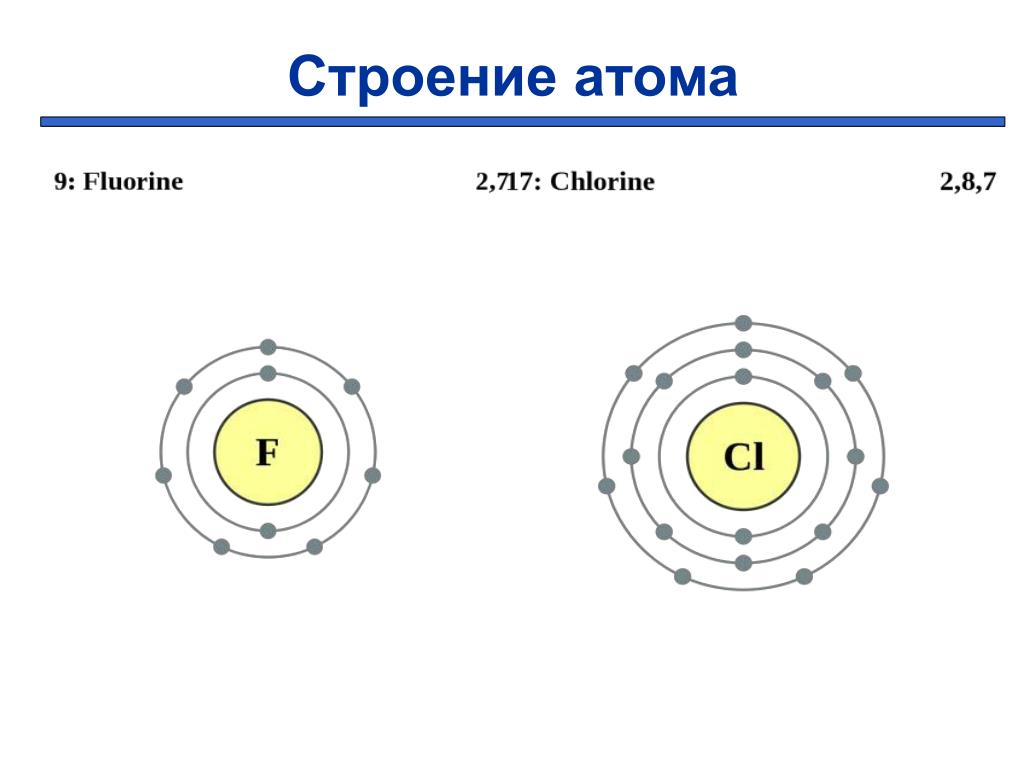
4.
Н 3 О +
тригональный пирамидальный
заряжен
С этого виды заряжены, термины полярные и неполярные не имеющий отношения.
5.
HCN
линейный
полярный
Линейные молекулы обычно неполярны, но в этом случае не все атомы связанные с центральным атомом, одинаковы.Облигация CN полярна и не компенсируется неполярной связью CH.
6.
СО 2
линейный
неполярный
Полярный C=O связи ориентированы на 180 градусов друг от друга.
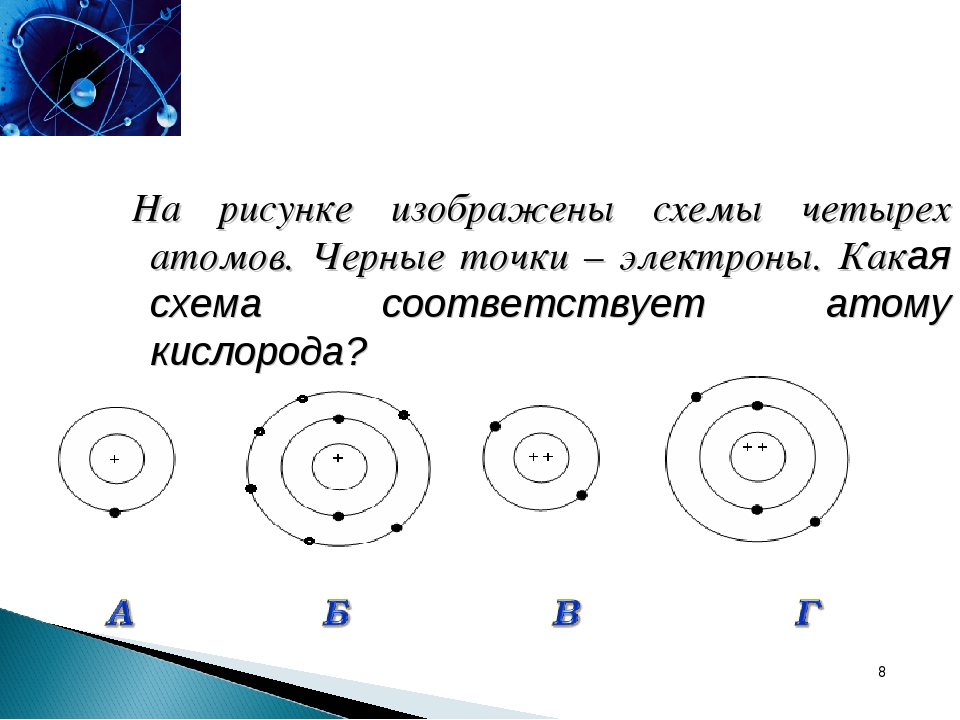 Полярность
этих связей уравновешивается, делая молекулу неполярной.
Полярность
этих связей уравновешивается, делая молекулу неполярной.7.
ККл 4
четырехгранный
неполярный
Полярный CCl облигации ориентированы 109.5 друг от друга. Полярность этих связей уравновешивается, делая молекулу неполярной.
8.
COCl 2
треугольная планарная
полярный
Тригональная планарная молекулы обычно неполярны, но в этом случае не все атомы, связанные с центральным атомом, одинаковы.То полярность связи не компенсируется полностью, и молекула полярна. (Если было три O или три Cls прикрепленный к центральному C, он будет неполярным.)
9.

О 3
изогнутый
полярный
Изогнутые молекулы всегда полярны.Хотя кислород-кислородные связи неполярный, неподеленная пара на центральном O вносит некоторый вклад полярность молекулы.
10.
СО 3 2-
треугольная планарная
заряжен
С этого виды заряжены, термины полярные и неполярные не имеющий отношения.
11.
С 2 Н 6
четырехгранный
неполярный
Оба атома углерода четырехгранные; поскольку связи CH и связь CC неполярный, молекула неполярная.
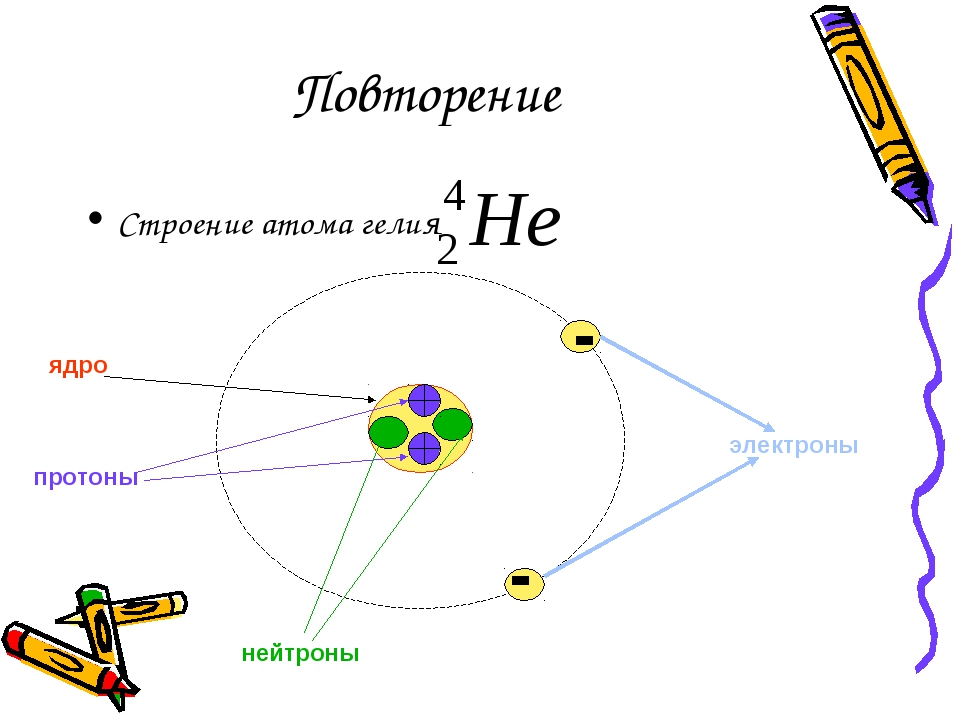
12.
С 2 Н 4
треугольная планарная
неполярный
Оба атома углерода тригонально-плоские; поскольку связи CH и связь CC неполярны, молекула неполярна.
13.
СН 3 СН 2 ОН
C: тетраэдрический
О: изогнутый
полярный
СС и СН связи не влияют на полярность молекулы, но связи CO и OH полярны, так как форма вокруг атом О изогнут, молекула должна быть полярной.
14.
БФ 3
треугольная планарная
неполярный
С этого молекула плоская, все три полярные связи BF находятся в той же плоскости, ориентированной на 120° друг от друга, что делает молекула неполярная.

15.
№
линейный
полярный
Так как есть только одна связь в этой молекуле, и связь полярная, т. молекула должна быть полярной.
16.
ПКл 5
тригональный бипирамидальный
неполярный
Связи PCl в экваториальные положения этой молекулы ориентированы на 120 друг от друга, и полярность их связей уравновешивается.Связи PCl в аксиальных положениях отстоят на 180° от друг друга, и полярность их связей также уравновешивается.
17.
СФ 6
восьмигранный
неполярный
Облигации SF в все эти молекулы находятся на расстоянии 90° друг от друга, и их полярность связи уравновешивается.

18.
СФ 4
качели
полярный
Облигации SF в осевые положения отстоят друг от друга на 90°, а их полярность связи отменяет.В экваториальных положениях, начиная с одного положения занимает одинокая пара, они не компенсируются, и молекула полярна.
19.
XEF 4
квадратный плоский
неполярный
Облигации XeF все ориентированы на 90° друг от друга, и их связь полярности уравновешиваются.Одинокие пары находятся на расстоянии 180° от друг друга, и их небольшие полярности также уравновешиваются.
20.
H 2 SO 4
S: четырехгранный
О: изогнутый
полярный
Эта молекула полярны из-за изогнутых связей HOS, которые присутствуют в Это.

Химия: Рисование структур Льюиса
Рисование структур Льюиса
До сих пор мы определяли типы гибридных орбиталей, рассматривая изображения каждой изучаемой молекулы. Неизбежно пришло время сделать несколько молекулярных диаграмм самостоятельно. Эти диаграммы, называемые структурами Льюиса , показывают все валентные электроны и атомы в ковалентно связанной молекуле.
Если вы уже сталкивались со структурами Льюиса, у вас может возникнуть ошибочное мнение, что их сложно рисовать. Причина этого проста: преподавателям сложно объяснить эту концепцию, а книги обычно не намного лучше. К счастью, у меня есть надежный метод, который может превратить кого угодно в короля или королеву структуры Льюиса.
The Mole Says
Структуры Льюиса (названные в честь теоретика химии Гилберта Ньютона Льюиса) представляют собой изображения, на которых показаны все валентные электроны и атомы в ковалентно связанной молекуле.
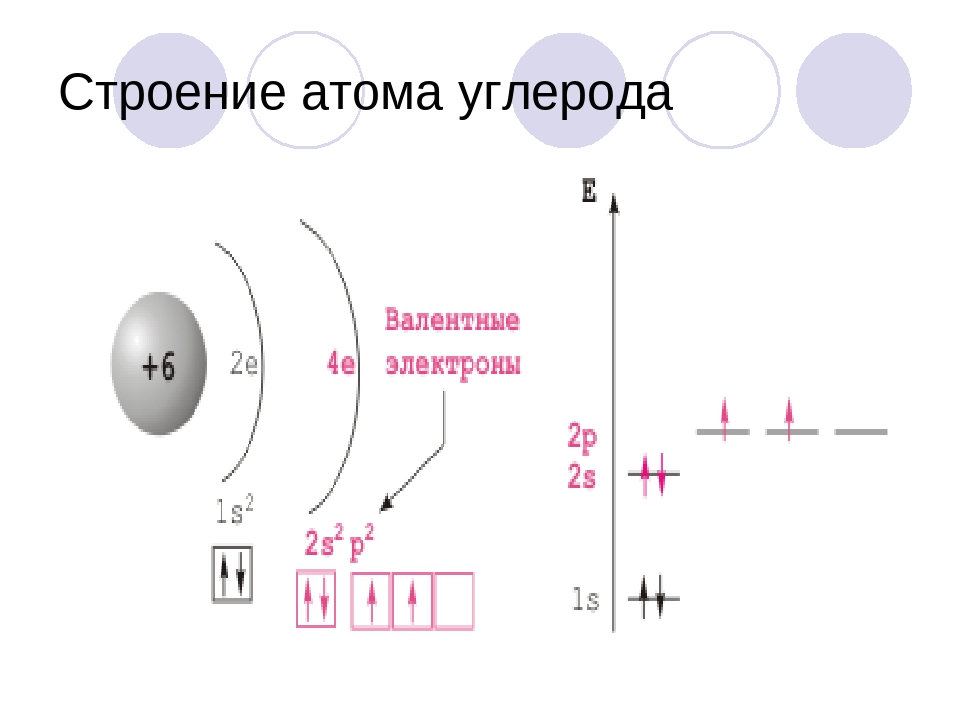
Выполните следующие действия.
Шаг 1
Подсчитайте общее количество валентных электронов в молекуле.
В качестве примера возьмем четыреххлористый углерод CCl4. Один атом углерода содержит четыре валентных электрона, а каждый из четырех атомов хлора содержит семь валентных электронов. Таким образом, количество валентных электронов для этой молекулы равно 4 + (4 7) = 32.
Иногда вам придется найти структуру Льюиса для многоатомного иона.Для этого вычтите ионный заряд из количества валентных электронов. Например, у NH 4 + будет на один валентный электрон меньше, чем у азота и четырех атомов водорода, потому что он имеет заряд +1.
Шаг 2
Подсчитайте общее количество электронов в октете в молекуле.
Вы не найдете термина «октетный счет электронов» ни в одном учебнике, потому что, насколько мне известно, я его придумал.
 Количество «октетных электронов» равно количеству валентных электронов, которое будет иметь каждый атом, когда они имеют ту же электронную конфигурацию, что и ближайший благородный газ (правило октета).Количество электронов-октетов, которые нужны атомам, обычно можно определить по следующим правилам:
Количество «октетных электронов» равно количеству валентных электронов, которое будет иметь каждый атом, когда они имеют ту же электронную конфигурацию, что и ближайший благородный газ (правило октета).Количество электронов-октетов, которые нужны атомам, обычно можно определить по следующим правилам:- Водороду нужно два электрона-октета.
- Бору требуется шесть октетов электронов для нейтральных молекул и восемь для молекул с зарядом.
- Всем остальным атомам требуется восемь октетов электронов.
Плохие реакции
Если вы обнаружите, что у вас дробное количество облигаций, вы допустили ошибку на предыдущем шаге. Вернитесь к началу и проверьте свою работу!
В нашем примере углероду нужно восемь октетов электронов, и каждому из четырех атомов хлора также нужно восемь октетов электронов.Тогда общее число октетов электронов для молекулы будет равно 8 + (4 8) = 40.
Рис.
 10.8 Видите ли, структуры Льюиса не так уж и сложны!
10.8 Видите ли, структуры Льюиса не так уж и сложны! Шаг 3
Крот говорит
Если вы поместите одинарные связи между всеми атомами, а некоторые еще останутся, вам, возможно, придется начать вводить двойные или тройные связи. В этом нет ничего плохого? Просто убедитесь, что все атомы имеют правильное количество связей, когда закончите!
Вычтите количество валентных электронов из числа электронов октета, чтобы найти количество электронов, участвующих в образовании связи.
В нашем примере 40 — 32 = 8 связывающих электронов.
У вас есть проблемы
Задача 1. Нарисуйте структуры Льюиса для следующих молекул или многоатомных ионов:
(a) NH 3
(b) SiO 2
(c) OH -1 22Шаг 4
Разделите число связывающих электронов на два, чтобы найти число связей.

Поскольку в каждой ковалентной связи есть два общих электрона, для определения числа химических связей можно использовать число связывающих электронов, разделив их на два.В нашем примере 8/2 = 4 связи.
Шаг 5
Расположите атомы так, чтобы молекула имела то же количество ковалентных связей, что и на шаге 4.
На этом этапе заманчиво просто беспорядочно приклеивать атомы и связи, где только можно, пока все не застрянет. вместе. К сожалению, случайность редко дает правильный ответ, поэтому нам понадобятся некоторые правила, которые помогут нам.
- Атом, которого меньше всего в соединении, обычно находится в середине молекулы.В нашем примере мы можем предположить, что углерод, вероятно, будет находиться в центре молекулы.
- Водород и галогены связаны один раз.
- Семейство кислорода связывается дважды в незаряженных молекулах и один, два или три раза, когда присутствует в многоатомных ионах.

- Семейство азота связывается три раза в незаряженных молекулах и два, три или четыре раза, когда присутствует в многоатомных ионах.
- Семья Карбона обычно объединяется четыре раза.
- Бор обычно связывается три раза в незаряженных молекулах и четыре раза, когда он присутствует в многоатомном ионе.
В нашем примере CCl 4 атомов углерода меньше, чем атомов хлора, поэтому атом углерода находится в середине молекулы, а вокруг него расположены четыре атома хлора. Между углеродом и каждым атомом хлора имеется одна химическая связь, всего четыре. В этой структуре как углерод, так и хлор следуют правилам количества связей, которые каждый хочет.
Шаг 6
Добавляйте неподеленные пары электронов к каждому атому, пока каждый атом не будет окружен таким количеством электронов, которое мы указали в шаге 2.
Давайте посмотрим на атом углерода на нашей диаграмме. Четыре связи вокруг него содержат восемь электронов.
 Поскольку углероду нужно восемь электронов, ему не нужны неподеленные пары.
Поскольку углероду нужно восемь электронов, ему не нужны неподеленные пары.Каждый хлор, с другой стороны, имеет только одну связь на два электрона. Поскольку хлору нужно восемь электронов, к каждому нужно добавить по три пары. Завершенная структура Льюиса для CCl4 показана на следующем рисунке:
Шаг 7
Проверьте, имеют ли какие-либо атомы в молекуле положительный или отрицательный заряд.
Добавьте количество неподеленных пар электронов к количеству связей для каждого атома в молекуле. Вычтите это число из ожидаемого числа валентных электронов, которые должен иметь атом (которое вы уже вычислили на шаге 1), чтобы вычислить его заряд. Как только вы определили заряд атома, напишите его рядом с атомным символом этого атома.
В нашем примере CCl 4 углерод имеет четыре связи вокруг себя. Поскольку обычно у него четыре валентных электрона, углерод не имеет заряда (4 — 4 = 0).Поскольку каждый хлор имеет одну связь и шесть электронов неподеленной пары (1 + 6 = 7) на этой диаграмме и семь валентных электронов, он также не имеет заряда.

Выдержки из «Полное руководство идиота по химии» 2003 г. Яна Гуча. Все права защищены, включая право на полное или частичное воспроизведение в любой форме. Используется по договоренности с Alpha Books , членом Penguin Group (USA) Inc.
Чтобы заказать эту книгу непосредственно у издателя, посетите веб-сайт Penguin USA или позвоните по телефону 1-800-253-6476.Вы также можете приобрести эту книгу на Amazon.com и в Barnes & Noble.
Молвиев
Меню модели содержит некоторые общие функции для 3D-модели.
Сброс
Эта функция возвращает положение модели, масштабирование и вращение к значениям по умолчанию.
Представительство
Вы можете выбрать из списка различных представлений молекул, включая; мяч и палка, палка, сферы Ван-дер-Ваальса, каркас и линии.Макромолекулы автоматически рисуются с помощью лент.
Фон
Вы можете переключаться между черным, серым или белым фоном. Фон по умолчанию черный (экспортированные изображения из GLmol или ChemDoodle имеют прозрачный фон)
Двигатели
Вы можете выбрать один из трех различных движков рендеринга: GLmol , Jmol и ChemDoodle .
 GLmol используется как движок рендеринга по умолчанию. GLmol и ChemDoodle основаны на WebGL, технологии браузера для поддержки 3D-графики.Если WebGL недоступен в вашем браузере, для всего рендеринга будет использоваться Jmol.
GLmol используется как движок рендеринга по умолчанию. GLmol и ChemDoodle основаны на WebGL, технологии браузера для поддержки 3D-графики.Если WebGL недоступен в вашем браузере, для всего рендеринга будет использоваться Jmol.MolView автоматически переключается на:
- Jmol при выполнении функций из меню Jmol
- GLmol при загрузке макромолекул (из-за значительно более высокой производительности)
- ChemDoodle , если вы загружаете кристаллическую структуру (GLmol не может отображать кристаллические структуры)
Вы можете вернуться к GLmol, когда вам больше не нужны Jmol или ChemDoodle, так как GLmol имеет лучшую производительность.
Обратите внимание, что макромолекулы нарисованы немного по-разному в каждом двигателе. ChemDoodle обеспечивает наилучшее отображение. Однако вам следует избегать использования ChemDoodle для очень больших макромолекул.
Трансформация модели
Вы можете вращать, панорамировать и масштабировать 3D-модель.
 Используйте правую кнопку для вращения, среднюю кнопку для перевода (кроме ChemDoodle) и колесо прокрутки для масштабирования. На сенсорных устройствах вы можете вращать модель одним пальцем и масштабировать модель двумя пальцами.
Используйте правую кнопку для вращения, среднюю кнопку для перевода (кроме ChemDoodle) и колесо прокрутки для масштабирования. На сенсорных устройствах вы можете вращать модель одним пальцем и масштабировать модель двумя пальцами.Кристаллография
Вы можете загрузить массив кристаллических ячеек (2x2x2 или 1x3x3) или одну единичную ячейку при просмотре кристаллических структур.
Туман и обрезка
При просмотре больших структур, таких как белки, может быть полезно скрыть определенную часть с помощью тумана или плоскости отсечения. GLmol предлагает несколько вариантов для этого.
- Туман: вы можете переместить туман вперед, перетащив мышь вверх , удерживая CTRL + SHIFT (перетащите в противоположном направлении, чтобы переместить туман назад)
- Плоскость отсечения: можно переместить фронтальную плоскость отсечения в структуру, перетащив мышь влево , удерживая CTRL + SHIFT (перетащите в противоположном направлении, чтобы переместить плоскость отсечения назад)
Определяет ли химию «атомный номер» или «структура Льюиса»?
Предполагается, что атом состоит из трех основных частиц: (i) электронов, отрицательно заряженных частиц незначительной массы, которые, как предполагается, кружатся вокруг массивного ядра ядра; (ii) протоны, массивные положительно заряженные ядерные частицы; и (iii) нейтроны, массивные нейтрально заряженные ядерные частицы.
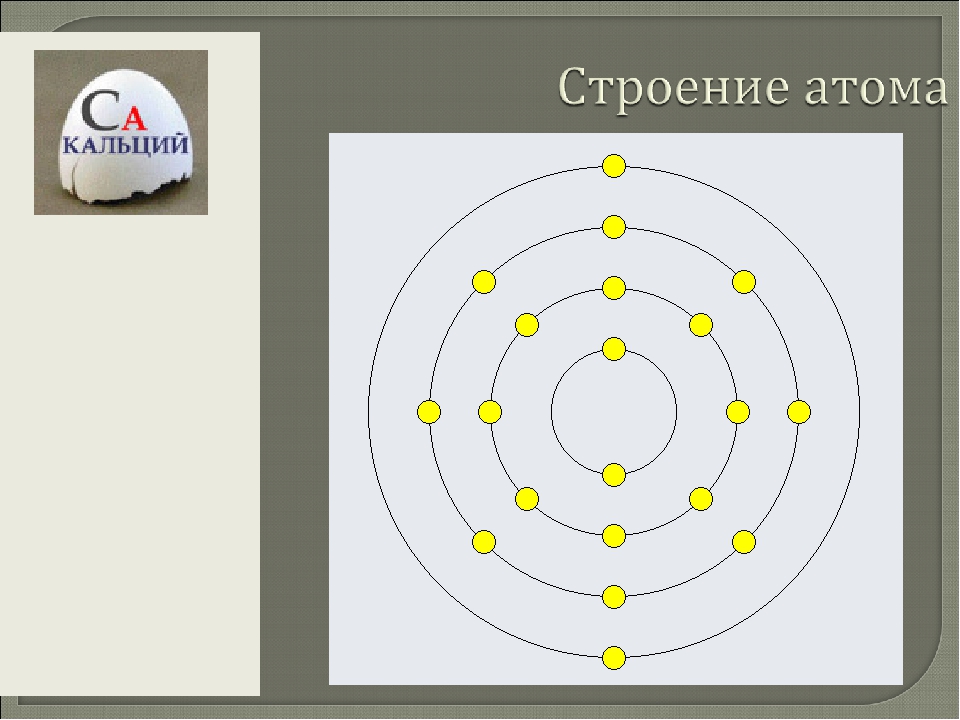 Массивные частицы составляют ядро ядра.
Массивные частицы составляют ядро ядра.Количество положительно заряженных ядерных частиц, количество протонов, дает #Z#, так называемый атомный номер, и это число определяет идентичность элемента. #Z=1#, элемент водород; #Z=2#, элемент гелий; #Z=3#, элемент литий; #Z=4#, элемент бериллий…………………………..
Еще одно распространенное заблуждение: протоны и электроны просто имеют ПРОТИВОПОЛОЖНЫЕ электронные заряды. Наши обозначения положительных и отрицательных зарядов просто произвольны, и было бы гораздо разумнее приписать электрону положительный заряд, а протону обязательно присвоить отрицательный.
Теперь в ядре может быть разное количество нейтронов; эти нейтроны и протоны участвуют в сильном ядерном взаимодействии, объяснение которого выходит за рамки моей компетенции. Наличие разного количества нейтронов для данного атомного номера объясняет существование изотопов, а указанная атомная масса является средним значением масс отдельных изотопов.
 Наличие положительно заряженных частиц в ядре ядра требует наличия отрицательно заряженных частиц вне ядра ядра, и эти частицы называются электронами.Очевидно, что для нейтрального атома должно быть равное количество электронов и протонов.
Наличие положительно заряженных частиц в ядре ядра требует наличия отрицательно заряженных частиц вне ядра ядра, и эти частицы называются электронами.Очевидно, что для нейтрального атома должно быть равное количество электронов и протонов.Электроны расположены вокруг ядра ядра на определенных уровнях и орбитах. Однако именно самые внешние электроны, так называемые #»валентные электроны»#, определяют химию (мне понадобилось всего полстраницы, чтобы добраться до сути вопроса!)
Теперь вы знаете, что Периодическая таблица отражает электронную структуру. Элементы Группы 1, т.е. первая вертикальная СТОЛБА в Периодической таблице, имеют один валентный электрон, обмен и совместное использование которого с другими элементами приводит к возникновению химических связей.Элементы группы 2 имеют 2 валентных электрона. По мере увеличения #Z# заряд ядра увеличивается, и электроны, которые добавляются к самой внешней оболочке, валентной оболочке, могут быть удалены при окислении, или при восстановлении мы предполагаем, что больше электронов заполняет валентную оболочку.
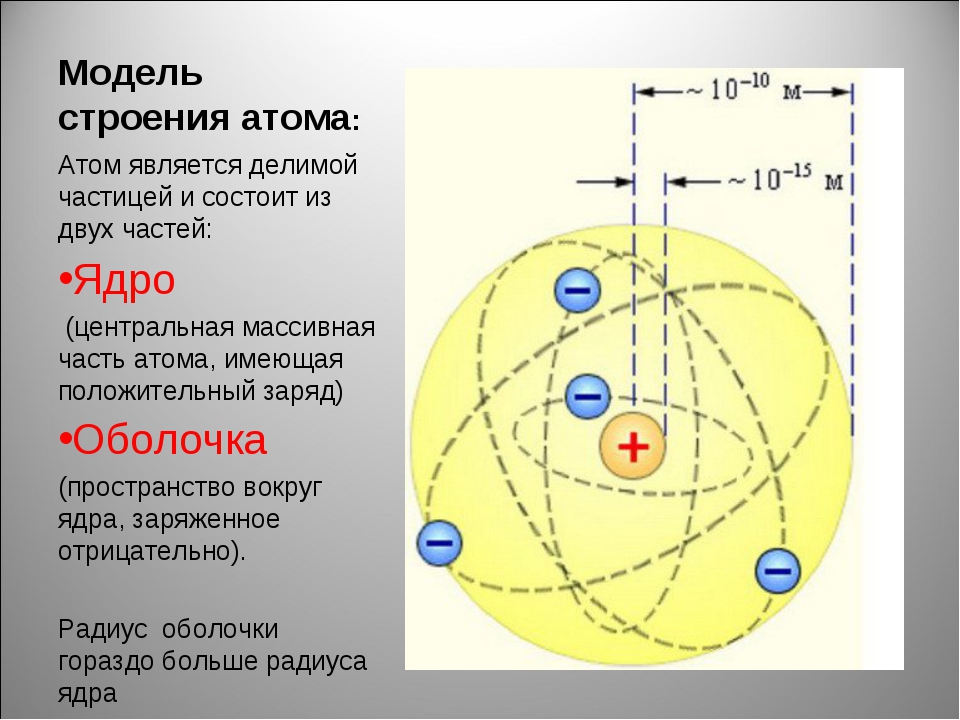
Чтобы, наконец, ответить на ваш вопрос, атомный номер определяет химию. Масса определяет идентичность изотопа.
Справка PubChem Sketcher
Справка PubChem SketcherPubChem » Справка PubChem » Справка Sketcher
Чтобы разрешить входные структуры для запросов, база данных PubChem Assay and Structure использует свой собственный уникальный веб-инструмент для создания эскизов.В этом документе описываются его функции и работа.
Системные Требования
Скетчер был спроектирован так, чтобы быть максимально независимым от браузера и платформы и должен работать в любом последнем веб-браузере в MS Windows, OS X или Unix/Linux. Он не требует наличия среды выполнения Java, а также не использует подключаемый модуль, требующий установки и прав на установку. Он не хранит никаких данных на вашем компьютере и не изменяет конфигурацию браузера.
Программа работает путем потоковой передачи изображений в ваш браузер и захвата событий мыши на этих изображениях.
 Для того, чтобы это можно было сделать, необходимо:
Для того, чтобы это можно было сделать, необходимо:- Интерпретатор JavaScript, которому даже не нужно поддерживать новейшие функции Web 2.0. Пожалуйста, разрешите интерпретацию JavaScript для этого инструмента — без поддержки JavaScript это приложение вообще не будет работать.
- Браузер, способный отображать изображения PNG и/или GIF. О некоторых состояниях ошибок сообщается с помощью анимированных GIF-файлов. Чтобы иметь возможность видеть вспышки ошибок, не отключайте аннотацию изображения.
- Достаточно быстрое интернет-соединение.Инструмент будет работать через модем, но мы рекомендуем более быстрое соединение. Общая пропускная способность, потребляемая этим приложением, порядка интернет-радиостанции и значительно меньше, чем у любого сайта потокового видео.
Первые шаги
Скетчер обычно запускается из более крупной формы, такой как инструмент поиска структуры PubChem (https://pubchem.
 ncbi.nlm.nih.gov/search). Чтобы получить доступ к Sketcher, откройте вкладку « Identity/Similarity » или « Substructure/Superstructure » и выберите параметр « Draw astructure: Запустите редактор PubChem, чтобы создать структуру. » При нажатии кнопки » Launch » открывается новое окно. В зависимости от содержимого исходного поля окно скетчера может быть предварительно загружено со структурой, например, путем декодирования строки SMILES или InChI, получение структуры по ее CID из базы данных PubChem или получение структуры из какого-либо другого источника
ncbi.nlm.nih.gov/search). Чтобы получить доступ к Sketcher, откройте вкладку « Identity/Similarity » или « Substructure/Superstructure » и выберите параметр « Draw astructure: Запустите редактор PubChem, чтобы создать структуру. » При нажатии кнопки » Launch » открывается новое окно. В зависимости от содержимого исходного поля окно скетчера может быть предварительно загружено со структурой, например, путем декодирования строки SMILES или InChI, получение структуры по ее CID из базы данных PubChem или получение структуры из какого-либо другого источникаПример:
Откройте инструмент поиска структуры PubChem (https://pubchem.ncbi.nlm.nih.gov/search) в своем браузере. Выберите опцию « Identity/Similarity », а на вкладке этой папки выберите « CID, SMILES, InChI ».Затем введите « 999 » (без кавычек) в текстовое поле, чтобы указать CID , и нажмите кнопку «Редактировать » . Откроется отдельное окно эскиза, похожее на изображение ниже.
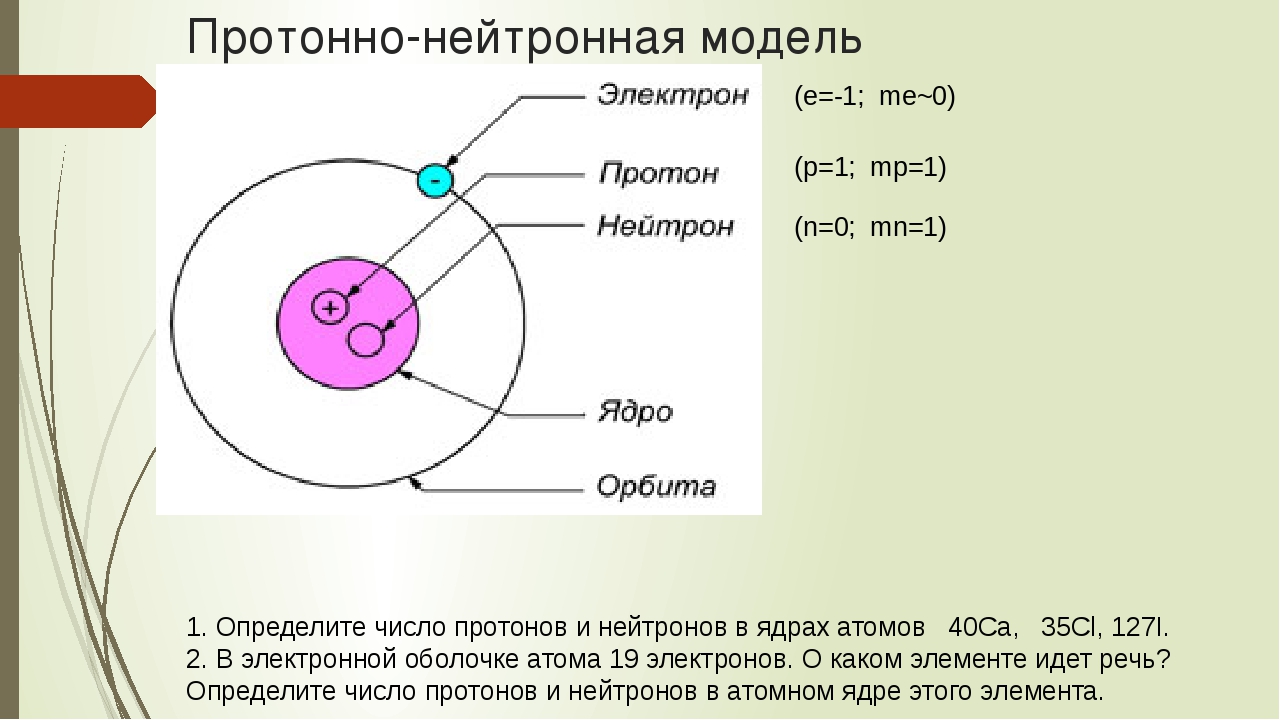
Если окно не открывается, убедитесь, что в вашем браузере включен JavaScript. Если блокировщик всплывающих окон должен мешать, используйте его механизм обхода (например, с помощью Ctrl-щелчок), чтобы временно разрешить открытие дополнительных окон или, что предпочтительнее, выборочно отключить блокировщик для nlm.домен nih.gov. Точные методы достижения этого зависят от типа блокировщика, который вы можете использовать.
Работа с эскизом
Макет окна редактора
Недавно открытое окно эскиза разделено на три отдельные зоны. Справа находится фактическая область эскиза. Слева ряд кнопок и других элементов пользовательского интерфейса управляют режимом работы редактора. Над областью рисования находится текстовое поле, в котором отображается текущая структура в различных кодировках, удобных для вырезания и вставки.Его также можно использовать для ввода информации о структуре в скетчер из кодировок структуры в буфере обмена или даже путем ввода кодов структуры опытными пользователями.

Область кнопок
Кнопки слева используются для выбора различных операций скетчера. Есть два типа синих кнопок. Те, у кого нет приподнятой границы (символы элементов, различные типы связи и т. д.), являются селекторами режимов. Когда вы щелкаете по ним, они выделяются и остаются выделенными до тех пор, пока не будет выбран другой режим или пока они не будут сброшены программой в результате действия пользователя.Только одна из этих кнопок режима активна в любой момент времени.
Другой тип кнопки имеет приподнятый профиль. Эти кнопки выполняют операцию сразу после нажатия. Они не меняют общий режим работы скетчера. Некоторые из этих операционных кнопок связаны с дополнительными элементами управления, такими как меню опций или кнопки загрузки файлов.
Использование мыши
Все операции можно выполнять с помощью однокнопочной мыши. Если у вас есть более одной кнопки, левая кнопка мыши используется для стандартных операций рисования и выделения.
 Для быстрого удаления можно использовать правую кнопку мыши. Подробнее об этом можно прочитать в пункте об удалении объектов.
Для быстрого удаления можно использовать правую кнопку мыши. Подробнее об этом можно прочитать в пункте об удалении объектов.Отчет об ошибках
В случае, если при рисовании возникла какая-либо ошибка, из-за которой операция не смогла выполнить хотя бы часть запланированной работы, область рисования или ее часть кратковременно мигает оранжевым цветом. Если местонахождение проблемы, например, атом с нарушением валентности, может быть идентифицировано, проблемный объект подсвечивается оранжевым локализованным прямоугольником.Если проблема носила глобальный характер, весь фон области рисования ненадолго становится оранжевым.
Вспышка ошибки генерируется путем отправки специально созданного анимированного изображения GIF в ваш браузер. Чтобы увидеть вспышки, вам нужно разрешить анимацию изображений в вашем браузере. Если вы запретите их, никакого вреда не будет, кроме того, что вы пропустите визуальную обратную связь. Программное обеспечение намеренно не использует звуковые сигналы.
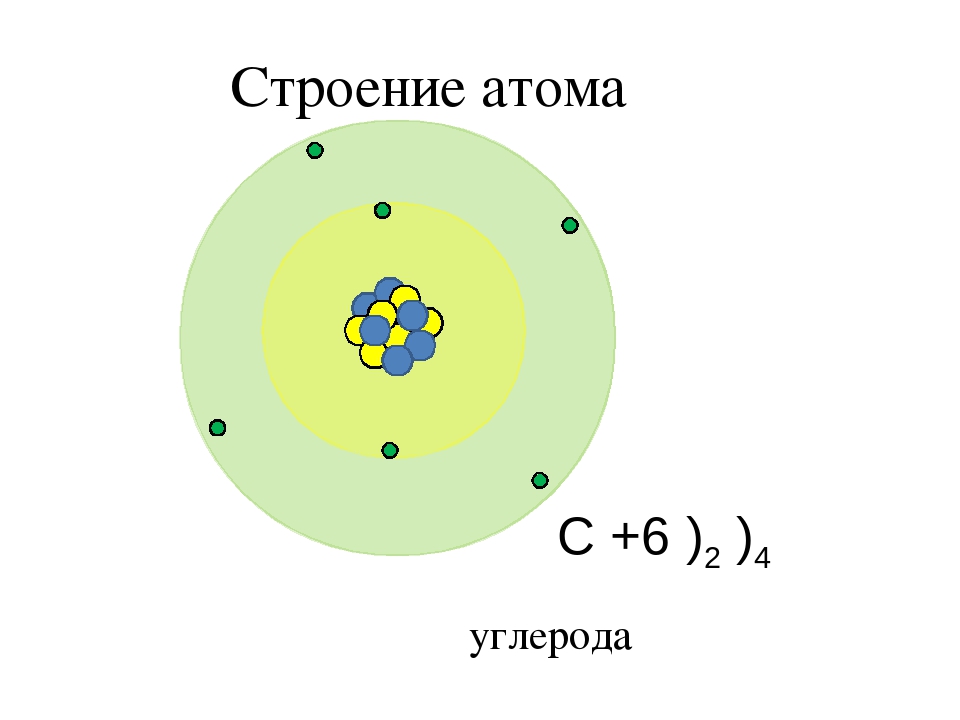
Контроль пропускной способности
Меню выбора в верхнем левом углу можно использовать для снижения требований к пропускной способности скетчера.Это может быть полезно, если к нему необходимо получить доступ через коммутируемое соединение или перегруженные соединения.
Если в меню выбора установлено Dialup, некоторые изменения в обработке пользовательского ввода уменьшат объем передаваемых данных и сделают приложение более отзывчивым по каналам с ограниченной пропускной способностью:
- Уменьшение количества событий отслеживания мыши, отправляемых при перемещении мыши, что приводит к меньшему количеству обновлений данных изображения и структуры.
- Более высокий требуемый минимум расстояния для отправки событий обновления и перехвата в периоды бездействия мыши.
- В чертежах не будут использоваться сглаженные шрифты и линии, что сокращает размер изображений области рисования вдвое и, таким образом, уменьшает объем передаваемых данных.

Кнопки элементов
Средняя часть области кнопок заполнена кнопками элементов, которые расположены примерно так же, как периодическая таблица элементов. Щелчок по одной из этих кнопок переключит редактор в режим элемента. Когда одна из этих кнопок активна, в области холста справа поддерживаются следующие операции:
- Щелчок в пустом месте
- Щелчок по существующему атому
- Начать с существующего атома и перетащить мышь с нажатой левой кнопкой в новое место
Это добавит один атом выбранного типа в это место.
Это изменит существующий атом на выбранный элемент. Если в старом атоме есть связи, а количество связей приведет к грубому нарушению валентности, некоторые связи будут автоматически удалены.
Это добавит новый атом в конечное положение и попытается создать одинарную связь с атомом, с которого началась операция.
Набор кнопок отображает только один столбец кнопок для второстепенных элементов группы.
 Элемент, который представляет любая из этих кнопок, можно изменить с помощью меню параметров справа от каждой из этих кнопок.
Элемент, который представляет любая из этих кнопок, можно изменить с помощью меню параметров справа от каждой из этих кнопок.Аналогичным образом лантаноиды и актиноиды, а также дейтерий, тритий и запрос «любой» атом можно получить с помощью кнопки над кнопками элементов второстепенной группы.
Бонд Рисунок
Второй ряд кнопок обеспечивает выбор различных типов связи.Когда одна из этих кнопок активна, скетчер находится в режиме рисования связей.
- Нажатие на существующую облигацию
- Начните с существующего атома и перетащите мышь в другое место
- Щелчок по существующему атому
- Начните с пустого места, перетащите мышью в другое пустое место
- Начало в пустом месте, конец в существующем атоме
- Нажмите в пустое место
Порядок или стиль связи будет изменен на выбранный тип, если это возможно без грубых нарушений валентности.
Будет создана новая связь, начиная с существующего атома. Если отпустить кнопку мыши на другом атоме, между начальным и конечным атомами будет создана или изменена связь.Если место высвобождения не занято ни одним атомом, создается связь с новым атомом углерода.

Новая связь с атомом углерода будет прорастать из исходного атома. Если возможно, будет поддерживаться угол 120 градусов к существующим связям на исходном атоме. Если это невозможно, будет заполнен самый большой пробел в сфере связи.
Связь между двумя вновь введенными атомами углерода будет создана с использованием начального и конечного положений в конечных точках связи.
Атом углерода вводится в том месте, где мышь была сначала нажата, а затем создается связь между новым атомом и концевым атомом.
Будет создана горизонтальная связь между парой вновь введенных атомов углерода.
Специальные типы облигаций
Помимо одинарных, двойных и тройных связей, через набор кнопок связи доступны несколько специальных типов связей.
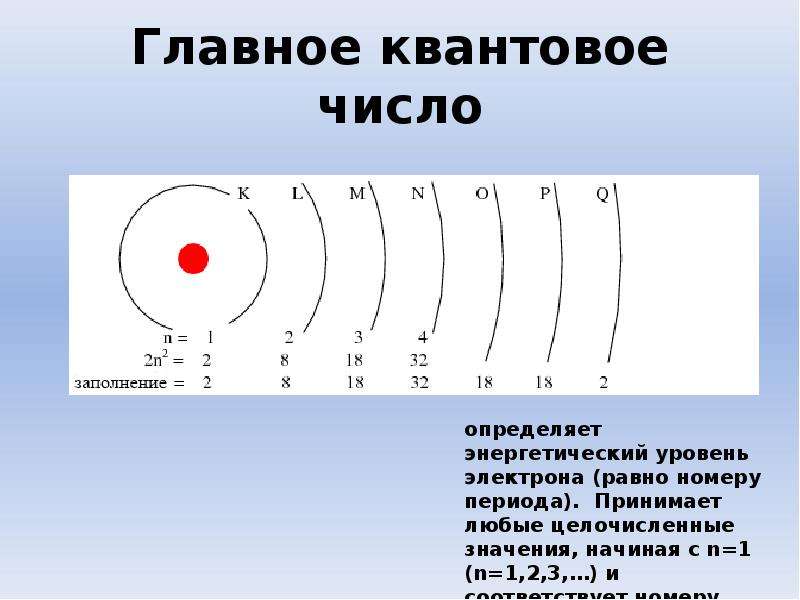
- Клиновые соединения
- Сложные облигации
- Кросс-облигации
- Облигации Query
Они используются для определения стереохимии. Вы можете разместить их где угодно, но они будут указывать стереохимию только на атомах, которые могут проявлять тетраэдрическую стереохимию, включая сульфоксиды и подобные среды со свободной парой электронов. Набор из четырех клиньев, размещенных на возможном квадратном плоском стереоцентре, также признается в соответствии с рекомендациями IUPAC.
База данных PubChem использует специальный тип сложной связи для кодирования связей в комплексах, которые не могут быть адекватно описаны связями VB.Пунктирная линия связи используется для кодирования этого типа связи. Сложные связи не участвуют в подсчете электронов для валентных связей и не имеют собственного порядка связи. При использовании в качестве связи запроса они представляют собой «любую» связь, которая будет соответствовать любой связи структуры базы данных.
Тип перекрестной связи представляет собой особый тип двойной связи, который используется для обозначения того, что нарисованные положения лигандов связи не подразумевают определенной стереохимии стереогенной двойной связи.

S/A (простая или ароматическая), D/A (двойная или ароматическая) и S/D (одинарная или двойная, но не ароматическая) — это типы связи запроса, которые можно использовать для гибкого определения типа связи структуры базы данных, которая может соответствовать этой связи, если нарисованная структура используется для поиска подструктуры. Эти связи нельзя использовать для поиска полной структуры.
Атомные заряды
Заряды существующих атомов можно указать, выбрав кнопки «плюс» или «минус».Если один из этих режимов активен, щелчок по существующему атому увеличит или уменьшит заряд на единицу.
Обратите внимание, что в настоящее время не поддерживается указание явных радикалов.
Фрагменты
Под кнопками рисования связей два ряда кнопок позволяют удобно вводить более крупные структурные фрагменты.
В первом ряду кнопок отображаются важные базовые системы звонков.
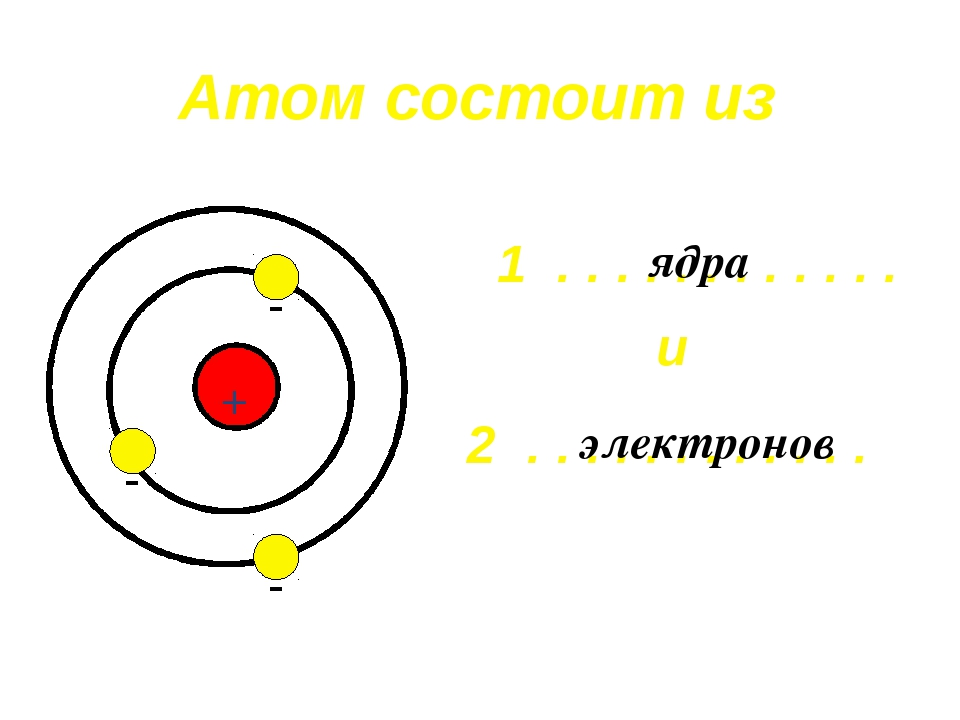 Когда кнопка активирована, связанный с ней режим рисования используется следующим образом:
Когда кнопка активирована, связанный с ней режим рисования используется следующим образом:-
Клинк в пустую область - Нажмите на существующий атом
- Удерживая нажатой клавишу Control, щелкните существующий атом
- Нажмите на существующую облигацию
Будет добавлено кольцо выбранного типа с центром в точке щелчка.
Выбранное кольцо вырастает из атома через одинарную связь, по возможности используя валентный угол 120 градусов.
Выбранное кольцо вырастает из атома, включая начальный атом в качестве первого атома кольца. Если начальный атом уже является кольцевым атомом, создается спиросистема.
Кольцо отожжено до существующих связей.В случае фенильного фрагмента принимается разумное решение о том, где разместить двойные связи в добавленном кольце.
В случае, если ограничения по валентности препятствуют полному выполнению присоединения кольца, связи с исходными атомами могут быть опущены.

Второй ряд кнопок отображает пару важных фрагментов цепочки и функциональных групп. Они используются очень похоже на кольцевые фрагменты, но режимы добавления спиро или связи для них не поддерживаются. Они могут быть добавлены только как автономные фрагменты или порождены существующим атомом.
Структуру справа можно построить пятью щелчками мыши в области рисования, а также нажатием пяти кнопок: выбрать фрагмент фенильного кольца, щелкнуть в любом месте пустой области рисования, выбрать фрагмент функциональной нитрогруппы, щелкнуть атом кольца на рисунке. чтобы заменить, выберите кнопку группы сульфокислоты, снова щелкните в области рисования и повторите еще дважды для карбоксильной группы и н-пропильной группы. При желании на последнем этапе можно добавить полный набор атомов водорода (см. ниже).
Шаблоны
Строка кнопки фрагмента в главном окне редактора показывает только небольшую коллекцию часто используемых фрагментов.
 Библиотеку шаблонов большего размера можно открыть, нажав кнопку сетки в правом верхнем углу раздела кнопок. Откроется вспомогательное окно с вкладками для различных типов фрагментов, имеющих биологическое значение.
Библиотеку шаблонов большего размера можно открыть, нажав кнопку сетки в правом верхнем углу раздела кнопок. Откроется вспомогательное окно с вкладками для различных типов фрагментов, имеющих биологическое значение.Вы можете переключаться между коллекциями шаблонов, нажимая на вкладки. Отдельные шаблоны выбираются щелчком сначала по ним, а затем в области рисования, где их следует разместить.Позиция клика — это центр позиции размещения фрагмента. После переноса фрагмента в область рисования окно шаблона закрывается, а скетчер автоматически активирует режим перемещения для более точного размещения переносимого фрагмента.
В настоящее время невозможно автоматически связать переданный фрагмент с существующими компонентами чертежа в момент передачи.
Графические манипуляции
Слева от кнопки сетки шаблона верхний ряд кнопок содержит четыре кнопки для графических модификаций текущей структуры.
- Кнопка режима перемещения (выделена на изображении справа)
- Режим поворота
- Зеркальные моды
Этот режим позволяет перемещать фрагменты структуры, атомы или связи.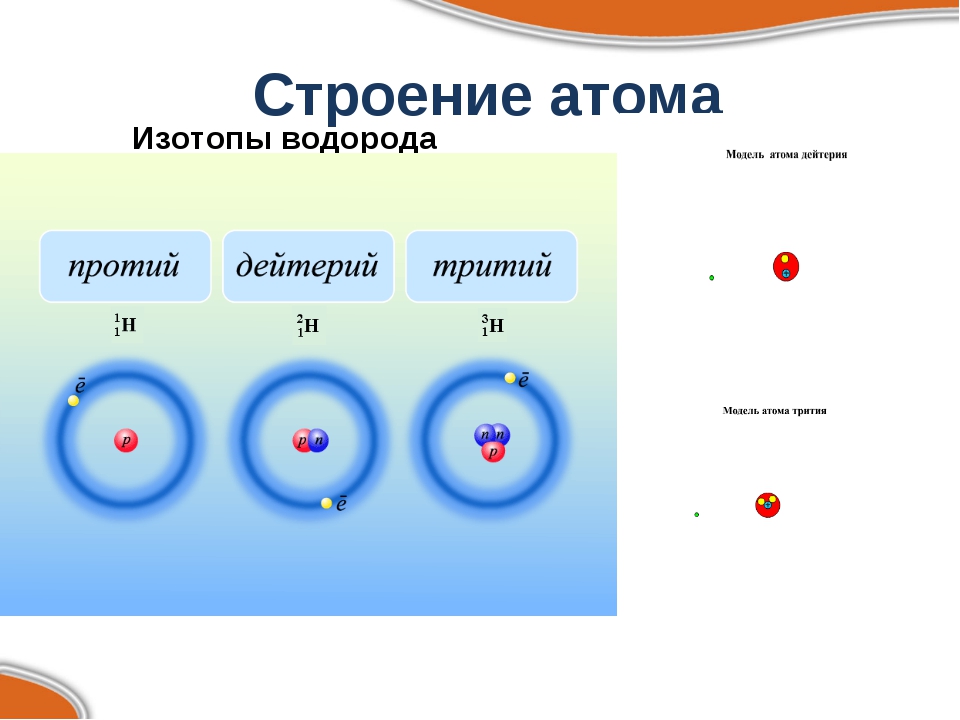 Позиция начального щелчка мыши определяет перемещаемый объект. Если щелкнуть атом, только этот атом перемещается, пока нажата клавиша мыши. Все связи с этим атомом приспособятся. Если выбранный объект является связью, оба атома связи будут перемещаться параллельно. Если не щелкнут ни атом, ни связь, но точка щелчка находится в пределах ограничивающей рамки большего фрагмента в области рисования (молекулы), весь фрагмент перемещается.
Позиция начального щелчка мыши определяет перемещаемый объект. Если щелкнуть атом, только этот атом перемещается, пока нажата клавиша мыши. Все связи с этим атомом приспособятся. Если выбранный объект является связью, оба атома связи будут перемещаться параллельно. Если не щелкнут ни атом, ни связь, но точка щелчка находится в пределах ограничивающей рамки большего фрагмента в области рисования (молекулы), весь фрагмент перемещается.
Если в момент отпускания кнопки мыши нет перекрытий между перемещаемыми атомами и любыми другими атомами, будет скорректировано только графическое положение перемещаемых объектов. Если есть перекрытия, делается попытка объединить перекрывающиеся атомы. Атомы, которые не были перемещены, имеют приоритет. На графике слева, если левое кольцо переместить на кольцо в середине так, чтобы два крайних правых атома перемещенного кольца перекрывались с двумя крайними левыми атомами другого кольца, результаты будут такими, как показано в правом столбце. .Если ограничения валентности препятствуют образованию некоторых связей, они будут опущены.
.Если ограничения валентности препятствуют образованию некоторых связей, они будут опущены.
Этот режим позволит вам вращать фрагменты в области рисования, щелкая и перетаскивая их левой кнопкой мыши. Центр вращения зависит от объекта в том месте, где была нажата кнопка мыши. Это может быть либо атом, либо связь (центр вращения — центр связи), либо молекула, когда произошел щелчок в ограничительной рамке (центр вращения — центр молекулы).Вращение в настоящее время заблокировано до 30-градусных шагов. Когда вращение завершено, после отпускания кнопки мыши выполняется шаг слияния атомов, идентичный шагу в режиме перемещения.
Кнопки зеркала позволяют легко создать зеркальное отображение фрагмента или изменить стереохимию двойной связи. Если щелкнуть двойную связь, лиганды на одной стороне связи перевернуты, так что получится соединение с противоположной цис/транс-стереохимией на этой связи.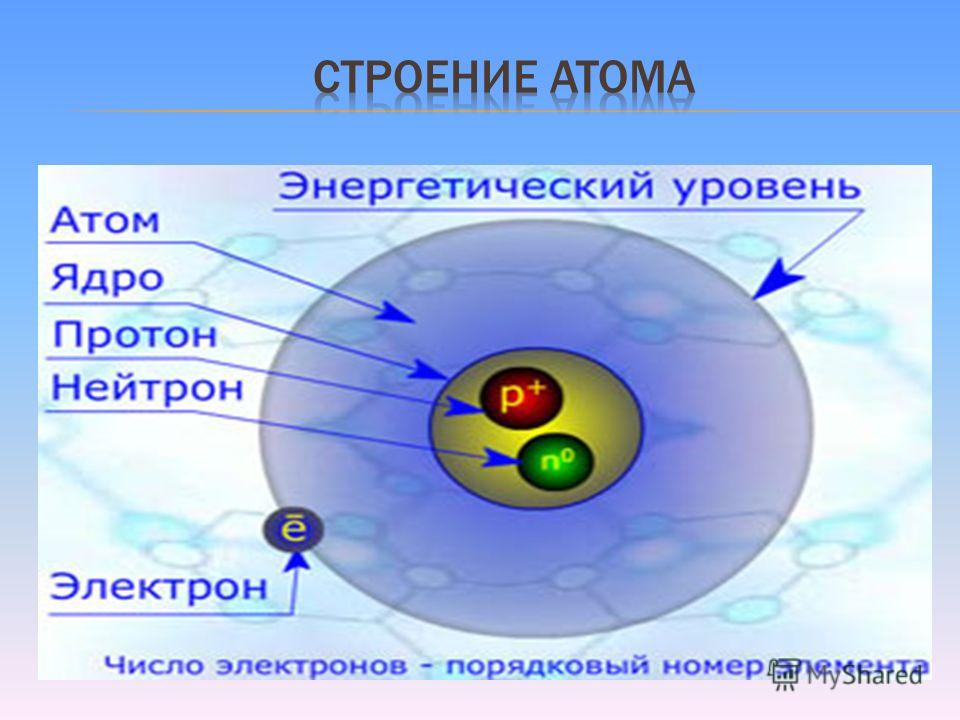 Если точка щелчка представляет собой блок молекулы, вся молекула зеркально отражается вдоль оси x или y. Вся тетраэдрическая стереохимия и клиновидные связи обновлены, чтобы представить энантиомер зеркальной молекулы. Специального действия для нажатия на атом нет — это то же самое, что и щелчок в ограничительной рамке.
Если точка щелчка представляет собой блок молекулы, вся молекула зеркально отражается вдоль оси x или y. Вся тетраэдрическая стереохимия и клиновидные связи обновлены, чтобы представить энантиомер зеркальной молекулы. Специального действия для нажатия на атом нет — это то же самое, что и щелчок в ограничительной рамке.Удаление объектов
Кнопка с пометкой Del используется для входа в режим удаления объекта. Когда этот режим активен, поддерживаются следующие операции:
- Щелчок по атому
- Нажатие на облигацию
- Нажатие на ограничивающую рамку молекулы, но не на атом или связь
- Начиная с пустого места и перетаскивая
Атом и все связи, в которых он участвует, удаляются.
Связь будет удалена, но ее атомы останутся.
Весь фрагмент будет удален.
Это показано на изображении выше. Отображается красный прямоугольник, который следует за перетаскиваемой мышью.
 При отпускании кнопки мыши все объекты в пределах выделенной области удаляются.
При отпускании кнопки мыши все объекты в пределах выделенной области удаляются.Если вы используете мышь с более чем одной кнопкой, правая кнопка мыши является ярлыком для операций удаления. Он будет работать всегда, без необходимости переключаться в режим удаления. Он поддерживает быстрое удаление атомов, связей и полных фрагментов. Прямоугольник выбора можно использовать только в правильном режиме удаления.
Режим быстрого удаления особенно полезен, когда вам нужно щелкнуть в области рисования, например, для того, чтобы назначить ей фокус клавиатуры, и этим щелчком случайно добавлен один атом.Быстрый щелчок правой кнопкой мыши, и ложное дополнение исчезло.
Отмена, повторение и начало заново
Кнопка с пометкой Udo реализует простую функцию отмены/возврата. Только одна операция может быть отменена. Если кнопка затем нажимается снова, операция отмены сама по себе отменяется, т.
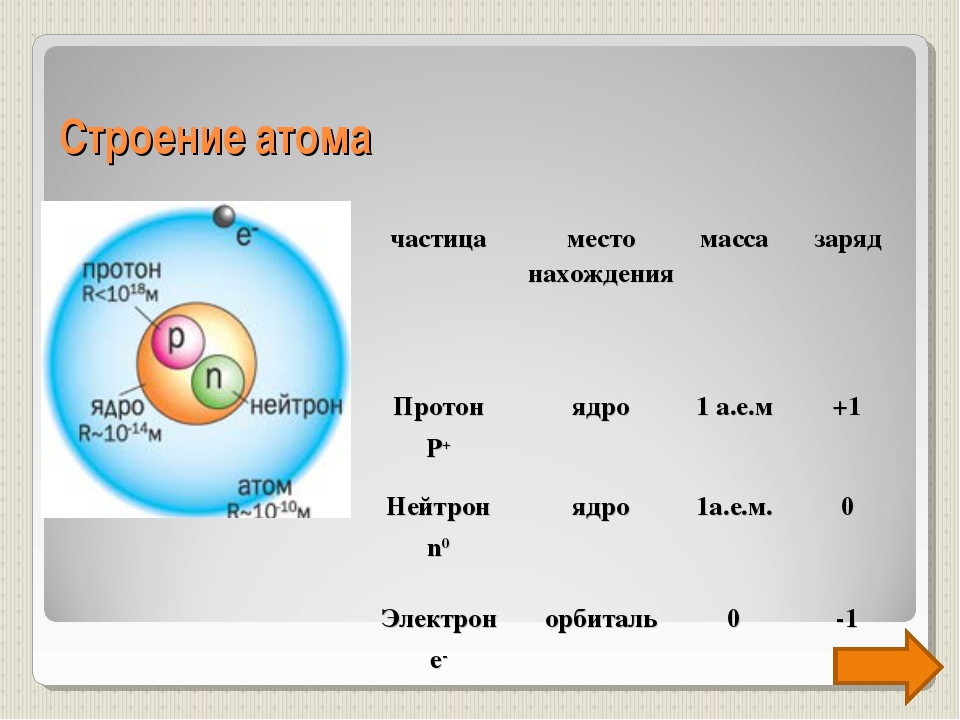 е. вы снова получаете старую структуру.
е. вы снова получаете старую структуру.Кнопка «Создать» полностью удаляет текущий чертеж и дает вам чистый лист. Эту операцию также можно отменить, если команда была выполнена по ошибке.
Обе кнопки выполняют свои операции немедленно (на что указывает их выпуклая форма) и не являются режимами. Отменить не изменяет текущий режим эскиза, Новый сбрасывает его на инструмент рисования одинарной связи.
Очистка структур
Кнопка с надписью Cln (очистить) повторно вычисляет компоновку структуры без изменения других аспектов структуры. На изображении справа показан образец молекулы до и после очистки. В случае, если очистка не должна привести к улучшению компоновки структуры, ее можно отменить.
Установка атрибутов запроса для атомов
Скетчер поддерживает настройку и удаление ограниченного набора атрибутов запроса для атомов и связей.
 Чтобы активировать режим атрибута запроса, нажмите кнопку Qry. В этом режиме можно щелкнуть левой кнопкой мыши по атомам или связям. В зависимости от типа щелкнутого объекта откроются разные окна атрибутов запроса.
Чтобы активировать режим атрибута запроса, нажмите кнопку Qry. В этом режиме можно щелкнуть левой кнопкой мыши по атомам или связям. В зависимости от типа щелкнутого объекта откроются разные окна атрибутов запроса.На изображении выше показано окно атрибутов атома. Следующие атрибуты могут быть установлены или сброшены:
- Класс Атом
- Флаги запроса
- Изотоп
- Допустимые валентности
- Разрешенные соседи
- Разрешенные заместители
- Разрешенные атомы водорода
- Разрешенные гетерозаместители
- Допустимое количество кольцевых связей
- Допустимые размеры колец
В этой строке доступны четыре разных класса и три предопределенных набора элементов.По умолчанию атомы в эскизе соответствуют определенному типу физического атома с определенным элементом. Если выбран этот атомный класс, элемент можно изменить, введя новый символ элемента в текстовое поле справа. Это эквивалентно выбору кнопки элемента и щелчку по атому, который необходимо изменить. Другими классами атомов являются любой, список и отрицательный список. Любой атом будет соответствовать любому атому в структурах базы данных при использовании в запросах подструктуры. Текстовое поле игнорируется для этого типа атома.
 Список — это набор альтернативных элементов для данного атома. Вам необходимо указать через пробел список допустимых символов элементов в поле ввода справа. Негативный список аналогичен обычному списку, за исключением того, что все элементы, кроме указанных в текстовом поле, будут совпадать. Наконец, предопределенные наборы элементов гетеро, галоген и металл являются ярлыками для популярных списков элементов. Эти сочетания клавиш также игнорируют текстовое поле. Классы атомов, отличные от атома простого элемента, не могут использоваться для поиска по полной структуре на основе хэш-кода.
Список — это набор альтернативных элементов для данного атома. Вам необходимо указать через пробел список допустимых символов элементов в поле ввода справа. Негативный список аналогичен обычному списку, за исключением того, что все элементы, кроме указанных в текстовом поле, будут совпадать. Наконец, предопределенные наборы элементов гетеро, галоген и металл являются ярлыками для популярных списков элементов. Эти сочетания клавиш также игнорируют текстовое поле. Классы атомов, отличные от атома простого элемента, не могут использоваться для поиска по полной структуре на основе хэш-кода.Этот набор из четырех флажков позволяет запрашивать насыщенность или ненасыщенность, а также явный алифатический или ароматический характер соответствующего атома структуры базы данных. Насыщенные/ненасыщенные и алифатические/ароматические являются взаимоисключающими. Эти явные флаги, которые применяются только к одному атому, всегда переопределяют любые глобальные соглашения о совпадении, установленные в панели поиска общей структуры, которая открыла окно редактора.

Здесь вы можете указать количество нуклонов изотопной метки на этом атоме.Вход представляет собой одно целое число. Эта информация будет автоматически использоваться для поиска подструктуры, а также, если используется соответствующий хэш-код, для полноструктурных запросов на основе хэш-кода.
Это набор флажков, в которых вы можете установить допустимые состояния валентности атома при сопоставлении со структурой базы данных. Если явные валентности не выбраны, атом может иметь любую валентность. Обратите внимание, что связи, отличные от VB (комплексные связи, ионные связи и т. д.) в структурах базы данных, имеют нулевую валентность.
Этот набор флажков работает так же, как строка валентности выше, за исключением того, что связанные соседи просто подсчитываются, а порядок и типы связей игнорируются.
По существу то же самое, что и подсчет соседей, за исключением того, что водород не учитывается среди связанных соседей.

Это ограничение дополняет количество заместителей и соседей.
По сути, то же самое, что и подсчет соседей, за исключением того, что соседи, связанные водородом или углеродом, не учитываются.
Количество кольцевых связей, в которых может участвовать атом. Обратите внимание, что как VB, так и комплексные связи могут быть кольцевыми связями, но ионные связи и другие экзотические типы исключаются при обнаружении кольцевых связей и никогда не считаются частью кольца.
Если вы установите один или несколько из этих флажков, атом может соответствовать только атомам структуры базы данных, которые являются членами кольца по крайней мере одного из выбранных размеров или, в частности, атома цепи.Набор колец, используемый для определения этого свойства, зависит от внутренней системы базы данных структуры.
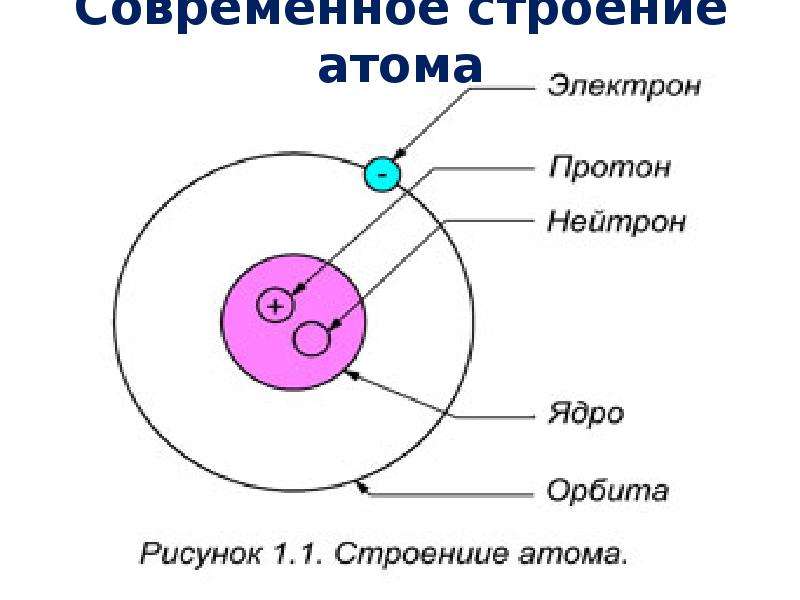 Для PubChem это расширенный набор наименьших колец, в котором все 3-атомные последовательности связанных атомов кольца являются частью по крайней мере одного кольца. Этот набор колец более симметричен, чем классический СССР.
Для PubChem это расширенный набор наименьших колец, в котором все 3-атомные последовательности связанных атомов кольца являются частью по крайней мере одного кольца. Этот набор колец более симметричен, чем классический СССР.Отображение атрибутов запроса Atom
Любые атрибуты запроса атома, заданные на панели запроса атома или уже присутствующие при предварительной загрузке или импорте структуры, отражаются в чертеже на холсте.
Атомы с атрибутами запроса рисуются с расширенными символами атомов и/или аннотациями атрибутов чтения. Эти специальные символы элементов используются для расширенных символов:
- Список атомов (нижний регистр для ароматических атомов) [Cl,Br,I]
- Список отрицательных атомов [!S,!Te]
- Любой атом?
- Атом металла М
- Атом галогена X
- Гетероатом ХХ
- и эти символы для дополнительных атрибутов, нанесенные красными маркерами справа вверху от символа атома:
- Начисления в обычном стиле как «++» или «3-»
- Изотопы [счетчик нуклонов (целое число)]
- Насыщенный атом с
- Ненасыщенный атом u
- Ароматический атом
- Алифатический атом А
- Валентность V (как в «V3,5»)
- Соседи X (как в «X4»)
- Заместители D (как в «D3»)
- Водороды H (как в «h3»)
- Гетеро-заместители x (как в «x1-2»)
- Кольцевые связи r (как в «r3» или «r-1»)
- Допустимые размеры колец R (как в «R3», «!R» для цепи)
Для атрибутов запроса с альтернативными возможными значениями будет предпринята попытка максимально сократить отображаемый набор, используя закрытые («1-2») и открытые («-1» или «4-«) диапазоны и списки альтернативных единичных значений.
 значения («3,5»).
значения («3,5»).Библиотека обработки структуры, используемая для реализации этого приложения, поддерживает намного больше атрибутов запроса, чем те, которые доступны через панель атрибутов атома. В случае, если они были импортированы путем чтения файла со спецификацией запроса, могут отображаться другие атрибуты в дополнение к описанным в этом разделе. Пока они не будут перезаписаны явной установкой новых атрибутов на затронутых атомах, они будут, если это возможно в формате передачи данных структуры, сохраняться в структурах, отправленных через редактор.
Настройка атрибутов запроса облигации
Если редактор находится в режиме атрибута запроса и вы щелкаете связь, открывается следующее окно атрибута запроса:
Его режим работы очень похож на соответствующую панель атома, но есть другие и меньше атрибутов, которые можно установить и изменить.
- Флаги запроса
- Допустимые размеры колец
Вы можете запросить сопоставление связи только с ароматическими или алифатическими структурными связями базы данных.
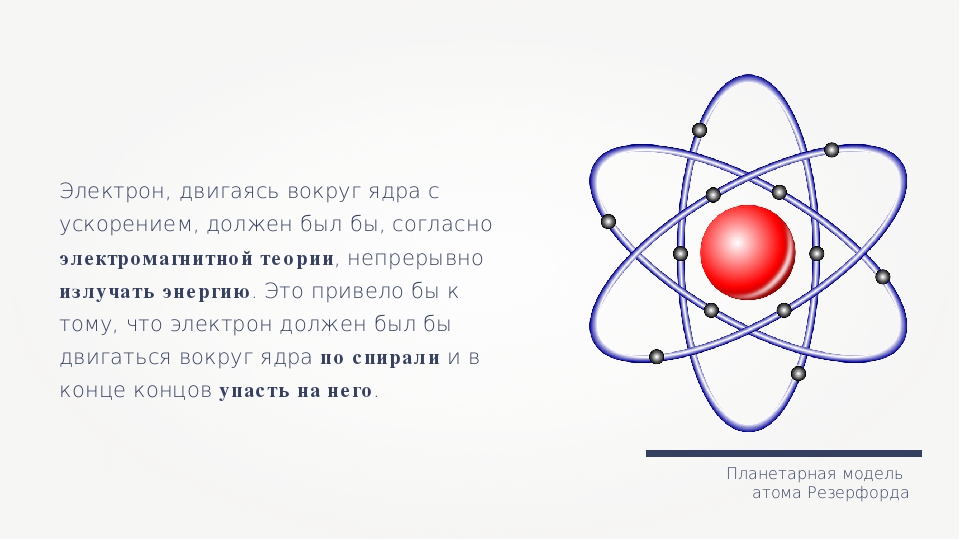
Если вы установите один или несколько из этих флажков, связь может соответствовать только связям структуры базы данных, которые являются частью кольца хотя бы одного из выбранных размеров, или, в частности, связи цепи.Набор колец, используемый для определения этого свойства, зависит от внутренней системы базы данных структуры. Для PubChem это расширенный набор наименьших колец, в котором все 3-атомные последовательности связанных атомов кольца являются частью по крайней мере одного кольца. Этот набор колец более симметричен, чем классический СССР.
Отображение атрибутов запроса облигации
Что касается атомов, атрибуты запроса связей отображаются в области рисования. Цвет аннотаций для атрибутов связи — темно-синий, а аннотации атрибутов рисуются по центру связи.
Эти символы используются для отображения атрибутов запроса облигации:
- Алифатическая связь A
- Ароматическая связка a
- Размер кольца R (как в R6, R-5)
Для атрибутов запроса с альтернативными возможными значениями будет предпринята попытка максимально сократить отображаемый набор, используя закрытые («1-2») и открытые («-1» или «4-«) диапазоны и списки альтернативных единичных значений.
 значения («3,5»).
значения («3,5»).Библиотека обработки структуры, используемая для реализации этого приложения, поддерживает гораздо больше атрибутов запроса, чем те, которые доступны через панель атрибутов связи.В случае, если они были импортированы путем чтения файла со спецификацией запроса, могут отображаться другие атрибуты в дополнение к описанным в этом разделе. Пока они не будут перезаписаны явным заданием новых атрибутов на затронутых облигациях, они будут, если это возможно в формате передачи данных структуры, сохраняться в структурах, отправленных через редактор.
Строка данных структуры
Текстовое поле над областью рисования отображает постоянно обновляемую информацию о редактируемой в данный момент структуре.Тип отображаемых данных можно изменить в меню выбора слева от текстового поля.
Доступны следующие варианты:
- УЛЫБКИ
- СМАРТС
- ИнЧИ
- Формула
- СЛН
Текстовая строка показывает кодировку SMILES отредактированной структуры, предполагая, что атомы водорода добавлены неявно.
 Кодировка ароматических систем осуществляется в форме Кекуля для максимально легкой расшифровки.
Кодировка ароматических систем осуществляется в форме Кекуля для максимально легкой расшифровки.
В текстовой строке отображается кодировка SMARTS.Атрибут атома ароматичности атома (символы элементов в нижнем регистре) автоматически устанавливается для идентифицированных ароматических систем на чертеже. Атомы, для которых нельзя определить статус ароматичности, кодируются номерами элементов ([#6] для углерода), чтобы избежать неявных предположений об их ароматичности при декодировании. Ароматические связи кодируются как неявные связи, алифатические одинарные связи используют явное кодирование одинарной связи ([#6]-[#6]).Строка отображает кодировку InChI структуры.InChI — это новый стандарт IUPAC для компактного уникального представления химических структур. При кодировании предполагается полный набор неявного водорода. Все атомы водорода закодированы с фиксированными позициями, так что структура расшифровывается точно таким же таутомером, как нарисовано.

В строке отображается молекулярная формула и молекулярная масса. Неявно предполагается полный набор атомов водорода.
Содержимое строки представляет собой кодировку строки сивиллы текущей структуры.
Текст в поле данных можно удобно копировать и вставлять с помощью обычного выделения текста и операций с буфером обмена. Таким образом, скетчер может быть удобным инструментом ввода даже для сайтов, которые не имеют прямой ссылки обновления данных на основную форму запроса, но позволяют кодировать входные данные своей структуры в SMILES, SMARTS или SLN.
В представлениях SMILES, SMARTS и SLN атрибуты запроса атома и связи кодируются, насколько это технически возможно. Не все поддерживаемые атрибуты запроса могут быть выражены во всех этих форматах записи строк.Кодировка Sketcher SMILES использует следующие пользовательские расширения:
- Сложные облигации | в качестве специальной облигации
- Разрешенные гетерозаместители x в качестве атрибута атома запроса
Ввод структуры через строку данных структуры
Строка данных структуры служит не только для отображения информации.
 В это поле можно ввести коды конструкции и импортировать данные конструкции в область рисования.
В это поле можно ввести коды конструкции и импортировать данные конструкции в область рисования.Импорт структуры выполняется очисткой строки, а затем редактированием или вставкой кода структуры в это поле и, наконец, нажатием клавиши возврата.Настройка меню выбора дисплея слева от поля не влияет на работу.
В случае успешного декодирования данных конструкции закодированное содержимое будет объединено с существующим чертежом в виде нового дополнительного фрагмента. Если он предназначен для замены текущего содержимого, вам необходимо сначала очистить область рисования, нажав кнопку «Создать». Фрагменты импортируются без неявных водородов и размещаются автоматически.
На изображениях выше показана область рисования до и после импорта строки SMILES c1cnnnc1.Обратите внимание, что неявная ароматическая система во входной строке была автоматически преобразована в правильную форму Кекуля.
Полный набор поддерживаемых форматов строк данных структуры:
- Строки SMILES/SMARTS
- Струны ИнЧИ
Импорт структуры с помощью вставки с клавиатуры
Поддерживаемые строки, которые можно импортировать через строку данных, также можно вставить непосредственно из буфера обмена в область рисования с помощью стандартного сочетания клавиш Ctrl-V при условии, что область рисования находится в фокусе клавиатуры.
 Этот метод имеет дополнительное преимущество, заключающееся в том, что положение мыши в момент нажатия клавиши определяет положение центра вновь добавленного фрагмента. В зависимости от браузера и клиентской операционной системы область рисования может автоматически не иметь фокус клавиатуры при перемещении в нее мыши. Чтобы убедиться, что он есть, щелкните мышью один раз. Если это приведет к добавлению нежелательного атома или фрагмента, используйте правую кнопку мыши, чтобы удалить их.
Этот метод имеет дополнительное преимущество, заключающееся в том, что положение мыши в момент нажатия клавиши определяет положение центра вновь добавленного фрагмента. В зависимости от браузера и клиентской операционной системы область рисования может автоматически не иметь фокус клавиатуры при перемещении в нее мыши. Чтобы убедиться, что он есть, щелкните мышью один раз. Если это приведет к добавлению нежелательного атома или фрагмента, используйте правую кнопку мыши, чтобы удалить их.Импорт структуры через загрузку файла
Последний метод загрузки существующих данных конструкции в скетчер — это загрузка файла.
Для этого выберите существующий файл структуры с помощью кнопки Обзор.., а затем нажмите кнопку Импорт. Затем файл считывается и добавляется к существующему содержимому. Если вы хотите гарантировать, что импортированный файл является единственным содержимым эскиза, нажмите кнопку «Создать» перед импортом.
Поддерживаемые форматы файлов: SDF/MOL, SMILES/SMARTS и InChI.
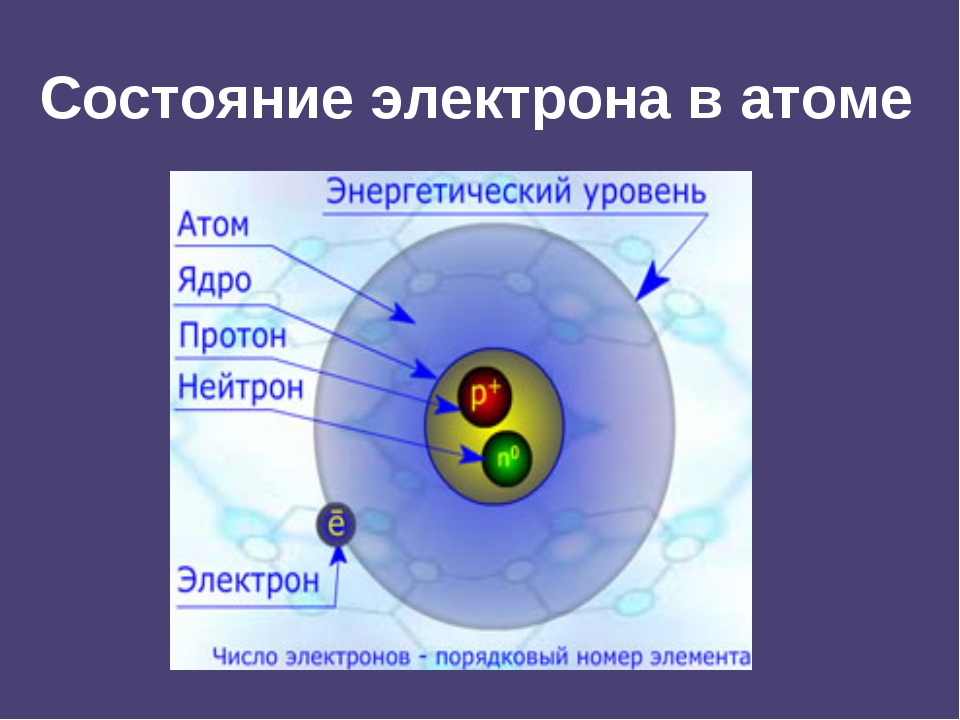 Хотя другие форматы файлов могут работать, они не поддерживаются.
Хотя другие форматы файлов могут работать, они не поддерживаются.Функция импорта считывает только первую запись файлов с несколькими записями.Поэтому, если вы попытаетесь загрузить SD-файл, будет показана только первая запись.
Статус водорода импортированной структуры будет скорректирован во время загрузки в зависимости от настройки меню опций «Водород». Это его возможные значения:
- Добавить
- Добавить специальный
- Сохранить как есть
- Лента неспециальная
- Зачистки Все
Ко всем открытым валентностям добавляется стандартный набор водородов.
Водород добавляется ко всем гетероатомам и атомам углерода там, где это необходимо для однозначности кодирования, т.е.е. на стереоцентрах и стереосвязях, а также на атомах углерода, которые традиционно изображаются с явными атомами водорода (альдегиды, С-концы тройной связи и т. д.).
Статус водорода сохраняется таким, каким он был в файле загрузки.
Водород удаляется из атомов углерода, за исключением случаев, когда он необходим для определения стереохимии или где он традиционно вытягивается (альдегиды, С-термины тройной связи и т.
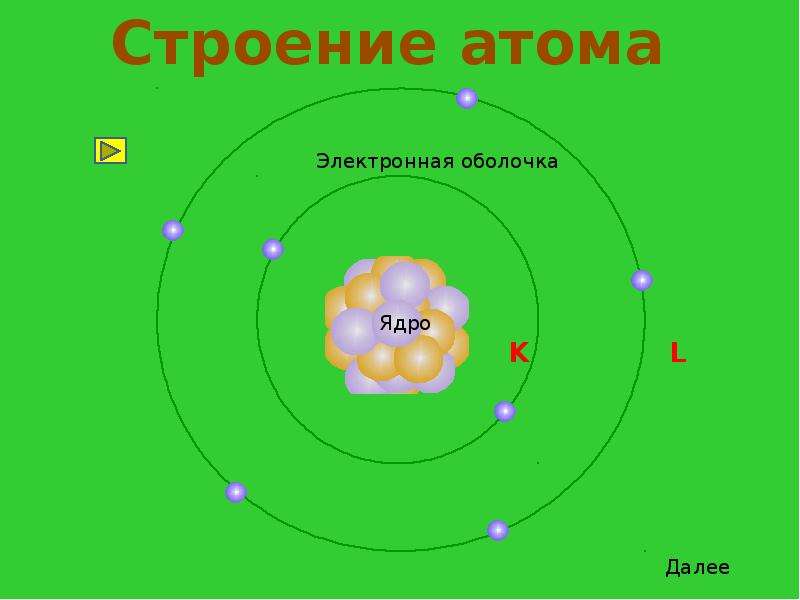 )
)Все атомы водорода удаляются из ввода.
Экспорт структуры
Скетчер может экспортировать текущую редактируемую структуру в различные форматы. Эта возможность делает его удобным инструментом для ввода ограниченных наборов данных для локального использования или даже для преобразования формата файла.
Текущая структура экспортируется нажатием кнопки Экспорт. Откроется окно выбора файла, в котором вы сможете указать имя и местоположение файла, загруженного с сервера эскиза.
Имя загружаемого файла по умолчанию — editor.xxx, где xxx — подходящий суффикс по умолчанию для выбранного формата файла.
Желаемый формат файла можно выбрать перед нажатием кнопки «Экспорт» в меню справа от этой кнопки. Точный список форматов, которые можно использовать для экспорта: форматы обмена структурами (MDL Molfile, SDF, SMILES, SMARTS), форматы редактора структур для дальнейшей очистки чертежей для публикации и т.
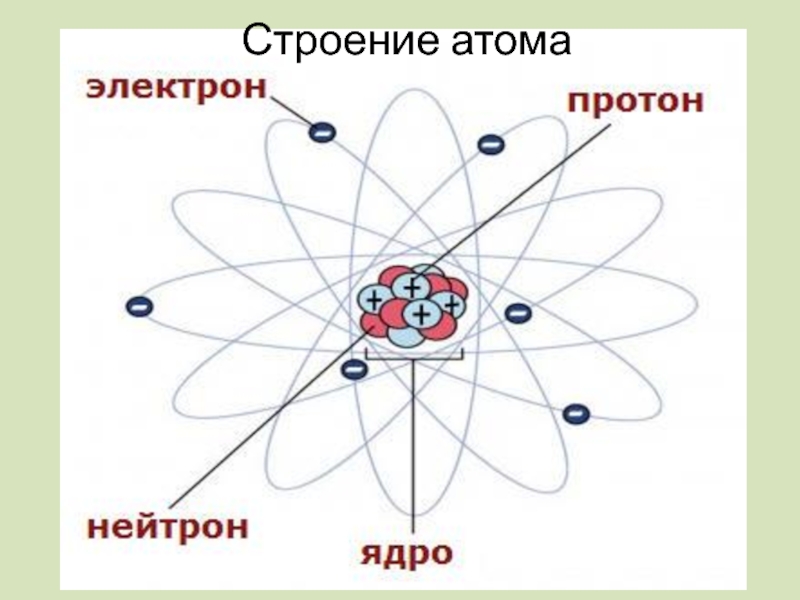 д. (ChemDraw CDX) и загрузки изображений ( GIF, PNG, SVG, EPS).
д. (ChemDraw CDX) и загрузки изображений ( GIF, PNG, SVG, EPS).Манипуляция водородом
Помимо импорта файлов и экспорта данных конструкции, меню параметров Hydrogen также можно использовать для прямого управления редактируемой в данный момент структурой.
Просто установите в меню желаемую операцию и нажмите кнопку «Водород» слева от меню. Водородный статус нарисованной структуры будет немедленно скорректирован.
Горячие клавиши
Многими режимами эскиза можно управлять с помощью сочетаний клавиш.Эта функция позволяет опытным пользователям удерживать мышь в области рисования, не перемещая ее влево и вправо для переключения кнопок.
Это ярлыки:
- Ctrl-B Украсить структуру. Работает не на всех платформах.
- Ctrl-C Скопировать структуру как SMILES в буфер обмена. Работает не во всех браузерах.
- Ctrl-N Новый чертеж. Не используйте в MS Windows — вместо этого клонируется окно скетчера!
- Ctrl-V Вставить фрагмент структуры в текущую позицию.
 См. отдельный параграф о вставке клавиатуры.
См. отдельный параграф о вставке клавиатуры. - Ctrl-X Копировать структуру как SMILES в буфер обмена и удалить текущий рисунок.
- Ctrl-Y Отменить последнюю операцию.
- Ctrl-Z Отменить последнюю операцию.
- A Выберите Al в качестве текущего элемента
- b Выбрать B в качестве текущего элемента
- B Выбрать Br в качестве текущего элемента
- c Выбрать C в качестве текущего элемента
- C Выбрать Cl в качестве текущего элемента
- d Выберите D (2H) в качестве текущего элемента
- f Выбрать F в качестве текущего элемента
- F Выбрать Fe в качестве текущего элемента
- G Выбрать Ge в качестве текущего элемента
- h Выбрать H в качестве текущего элемента
- H Выбрать Hg в качестве текущего элемента
- i Выбрать I в качестве текущего элемента
- I Выбрать In в качестве текущего элемента
- k Выбрать K в качестве текущего элемента
- K Выбрать Kr в качестве текущего элемента
- L Выбрать Li в качестве текущего элемента
- м Войти в режим движения
- M Выбрать Mg в качестве текущего элемента
- n Выберите N в качестве текущего элемента
- N Выбрать Na в качестве текущего элемента
- o Выбрать O в качестве текущего элемента
- O Выбрать Os в качестве текущего элемента
- p Выбрать P в качестве текущего элемента
- P Выбрать Pd в качестве текущего элемента
- q Войти в режим запроса
- r Войти в режим поворота
- Ч Выбрать Ru в качестве текущего элемента
- s Выбрать S в качестве текущего элемента
- S Выбрать Si в качестве текущего элемента
- t Выбрать T (3H) в качестве текущего элемента
- T Выбрать Te в качестве текущего элемента
- u Выберите U в качестве текущего элемента
- v Выбрать V в качестве текущего элемента
- w Выбрать W в качестве текущего элемента
- x Вход в режим удаления
- X Выбрать Xe в качестве текущего элемента
- Y Выберите Yb в качестве текущего элемента
- Z Выбрать Zn в качестве текущего элемента
- > Войти в режим вытягивания
- < Войти в режим рисования облигаций
- + Войти в режим изменения плюсового заряда
- — Вход в режим рисования одинарной облигации
- = Войти в режим рисования двойной связи
- # Войти в режим рисования тройной связи
- / Вход в любой режим (перекрестная двойная связь)
- | Введите любой запрос режима связи
- ? Выберите любой атом запроса в качестве текущего элемента
- * Выберите любой атом запроса в качестве текущего элемента
- 0 Шаблон активации фенильного кольца
- 1 Вход в режим рисования одинарной связки
- 2 Войти в режим рисования двойной связи
- 3 Войти в режим рисования тройной связи
- 4 Шаблон активации 4-членного кольца
- 5 Шаблон активации 5-членного кольца
- 6 Активировать шаблон 6-членного кольца
- 7 Активировать шаблон 7-звенного кольца
- 8 Шаблон активации 8-звенного кольца
Мнемоника для ярлыков элементов заключается в том, что строчные буквы выбирают элемент, где однобуквенный символ соответствует нажатой клавише.
 Заглавные буквы выделяют самый важный элемент с двухбуквенным символом, который начинается с нажатой клавиши.
Заглавные буквы выделяют самый важный элемент с двухбуквенным символом, который начинается с нажатой клавиши.Не существует 9-членного кольцевого шаблона, который можно было бы связать с ключом 9.
Передача данных в формы вызывающего абонента
Вопрос, который задавался не раз, касается проблемы переноса редактируемых данных конструкции из скетчера в связанную форму, открывающую окно скетчера.
Ответ прост: для этого пользователю абсолютно ничего не нужно делать.Передача данных происходит автоматически и динамично. О каждом изменении структуры немедленно сообщается вызывающей форме. Нет кнопки, которую нужно нажать, чтобы передать текущий скетч.
Выход из Sketcher
Как описано выше, нет необходимости в каких-либо действиях пользователя для передачи данных структуры в исходную форму для дальнейшей обработки. Таким образом, скетчер можно закрыть в любой момент, не опасаясь потери данных, просто закрыв его окно с помощью стандартных механизмов клиентской платформы, таких как щелчок по крестообразному значку закрытия в правом верхнем углу окна на МС Виндовс.

Тем не менее, поскольку, по нашему опыту, многим пользователям кажется более удобным, если они могут нажать специальную, четко обозначенную кнопку, чтобы завершить трудную задачу ввода важной структуры запроса, мы добавили большую кнопку «Готово» в набор кнопок эскиза. Он расположен справа от элементов управления экспортом.
Эта заметная кнопка просто закрывает окно эскиза и больше ничего не делает.
.


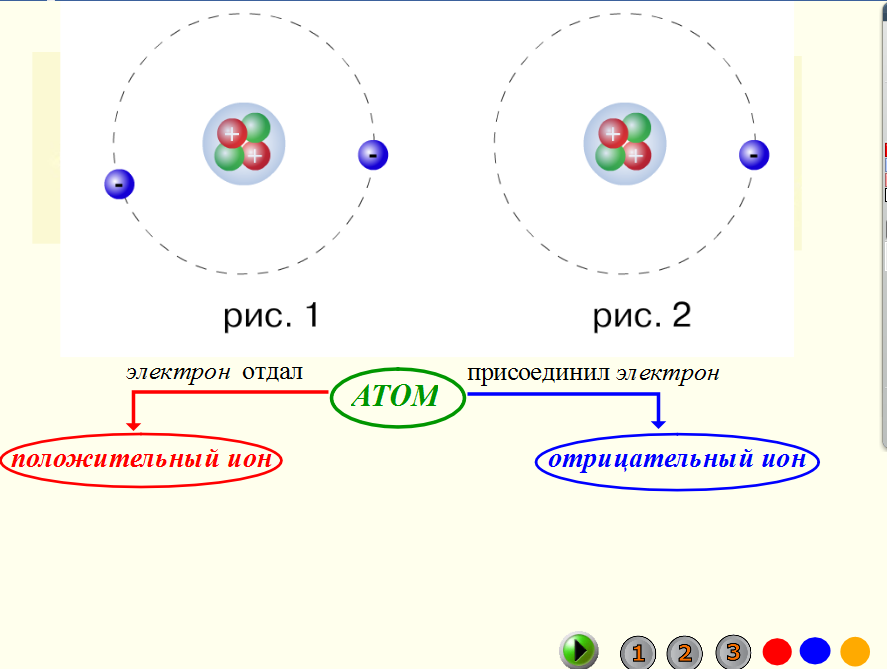
 Масса атома
сосредоточена в ядре. Поэтому эта модель
называется – нуклеарная.
Масса атома
сосредоточена в ядре. Поэтому эта модель
называется – нуклеарная.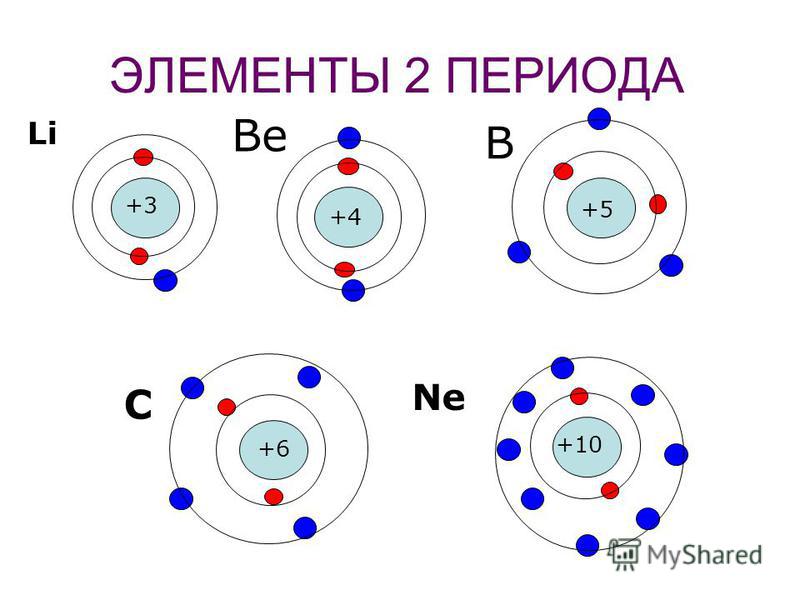 Выводы по уроку.
Выводы по уроку. Домашнее задание. § 6. Упр. 4,
5. Рассмотреть строение атомов: Fe, B, Ag.
Домашнее задание. § 6. Упр. 4,
5. Рассмотреть строение атомов: Fe, B, Ag.
 Модуль № 107
“Атомная гипотеза. Основные сведения о строении
атома”.
Модуль № 107
“Атомная гипотеза. Основные сведения о строении
атома”. Поскольку на голове у одного человека их около 100 тысяч, то если собрать волосы у всего населения России, до Луны хватит с лихвой и даже еще останется.
Поскольку на голове у одного человека их около 100 тысяч, то если собрать волосы у всего населения России, до Луны хватит с лихвой и даже еще останется. Поражающий всякое (здоровое) воображение факт состоит в том, что мельчайшая, едва различимая крупинка соли состоит из 1 квинтиллиона атомов. И я имею в виду не крупную соль с большими, хорошо различимыми гранулами, а мелкую, — ту, которая в солонках. При случае, попробуйте выделить из них одну, рассмотрите на свет и скажите про себя: «кви-нти-лли-он» (между прочим, это 1 000000000000000000). Давайте обратимся к нашему стандартному масштабу и приблизим атом водорода так, чтобы он удобно лег в руку. Вирусы тогда будут 300-метрового размера, бактерии 3-километрового, а толщина волоса станет равна 150 километрам, и даже в лежащем состоянии он выйдет за границы атмосферы (а в длину может достать и до Луны).
Поражающий всякое (здоровое) воображение факт состоит в том, что мельчайшая, едва различимая крупинка соли состоит из 1 квинтиллиона атомов. И я имею в виду не крупную соль с большими, хорошо различимыми гранулами, а мелкую, — ту, которая в солонках. При случае, попробуйте выделить из них одну, рассмотрите на свет и скажите про себя: «кви-нти-лли-он» (между прочим, это 1 000000000000000000). Давайте обратимся к нашему стандартному масштабу и приблизим атом водорода так, чтобы он удобно лег в руку. Вирусы тогда будут 300-метрового размера, бактерии 3-километрового, а толщина волоса станет равна 150 километрам, и даже в лежащем состоянии он выйдет за границы атмосферы (а в длину может достать и до Луны). 5 тысяч вирусов. А вдоль окружности земного шара можно плотно разместить 400 триллионов вирусов. Много. Такое расстояние в километрах свет проходит за 40 лет. Но если собрать их всех вместе, то они легко поместятся на кончике пальца. Всего-то.
5 тысяч вирусов. А вдоль окружности земного шара можно плотно разместить 400 триллионов вирусов. Много. Такое расстояние в километрах свет проходит за 40 лет. Но если собрать их всех вместе, то они легко поместятся на кончике пальца. Всего-то.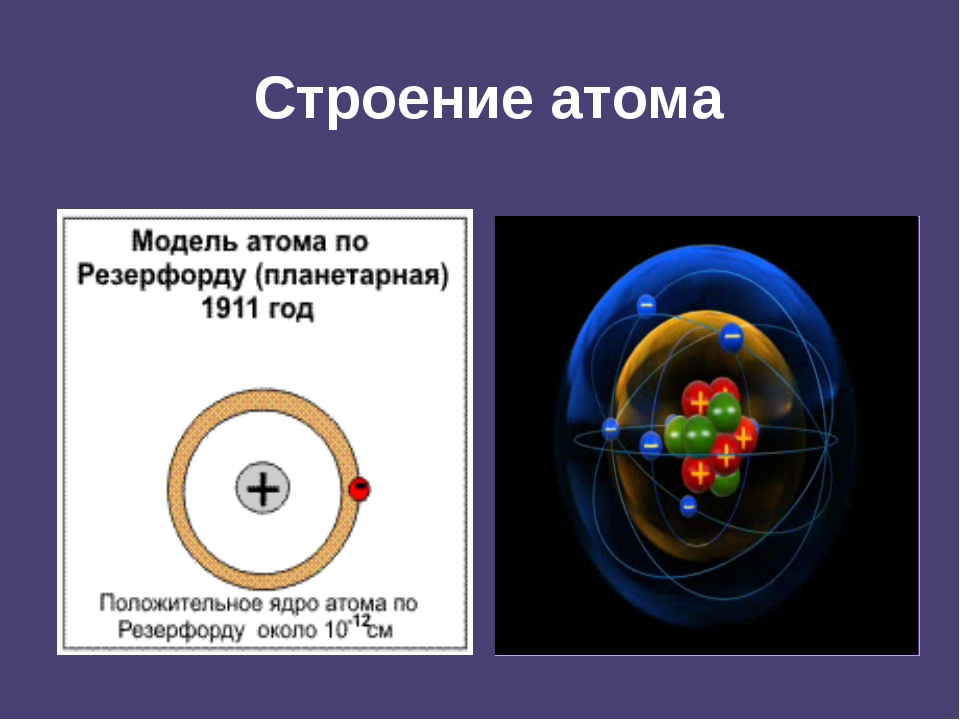 Просмотрите видео ролик.
Просмотрите видео ролик.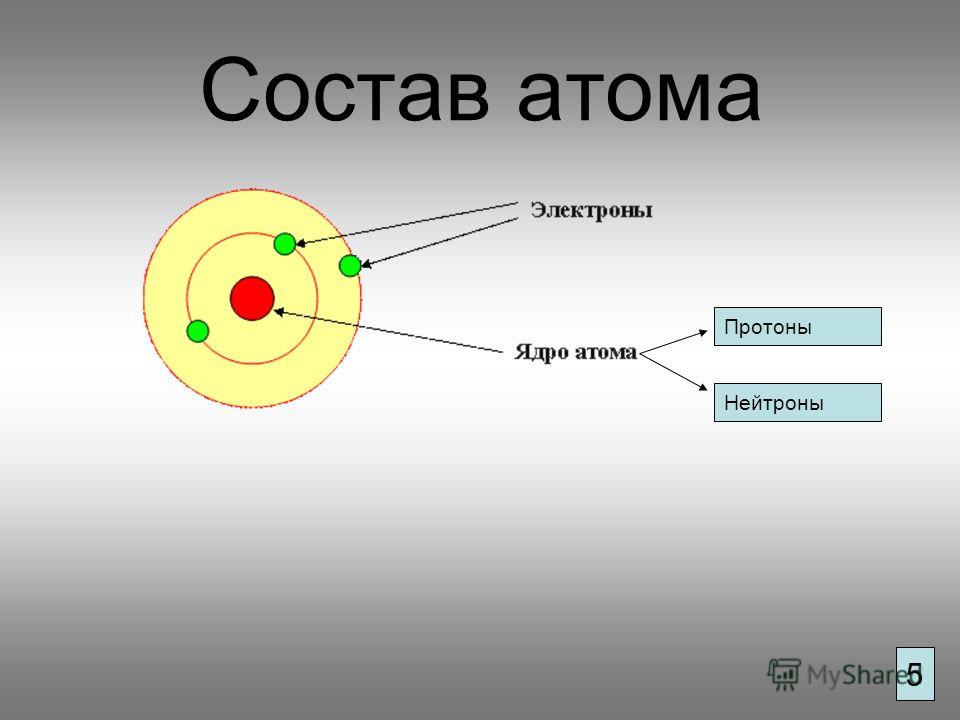
 Эта теория оказалась ошибочной.
Эта теория оказалась ошибочной. Атом — электронейтрален, то есть количество положительно заряженных частиц в нем равно количеству отрицательно заряженных частиц.
Атом — электронейтрален, то есть количество положительно заряженных частиц в нем равно количеству отрицательно заряженных частиц.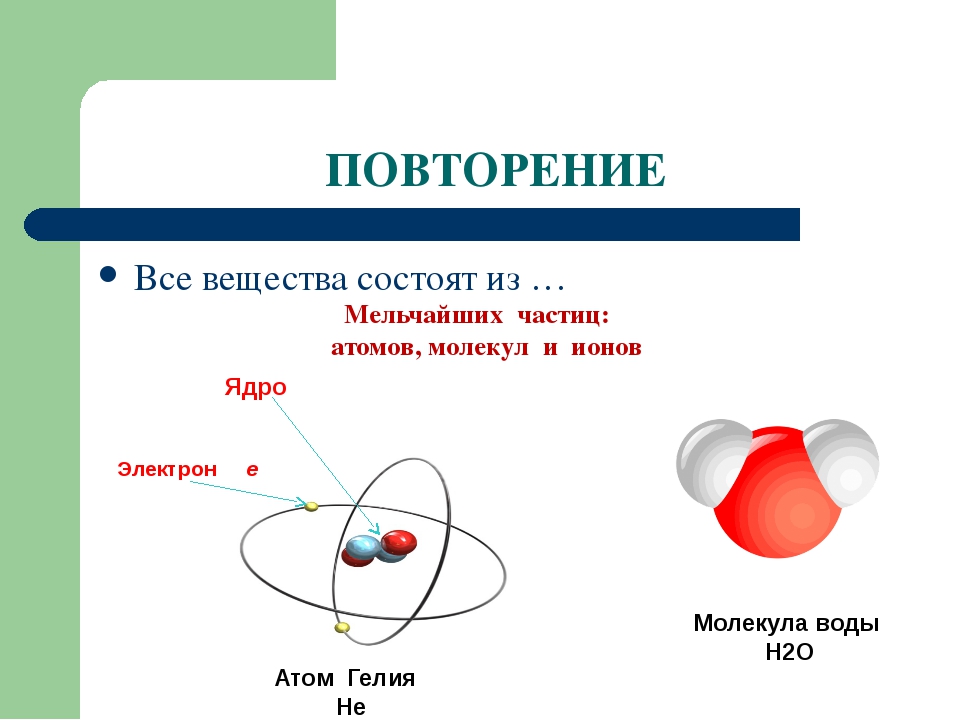
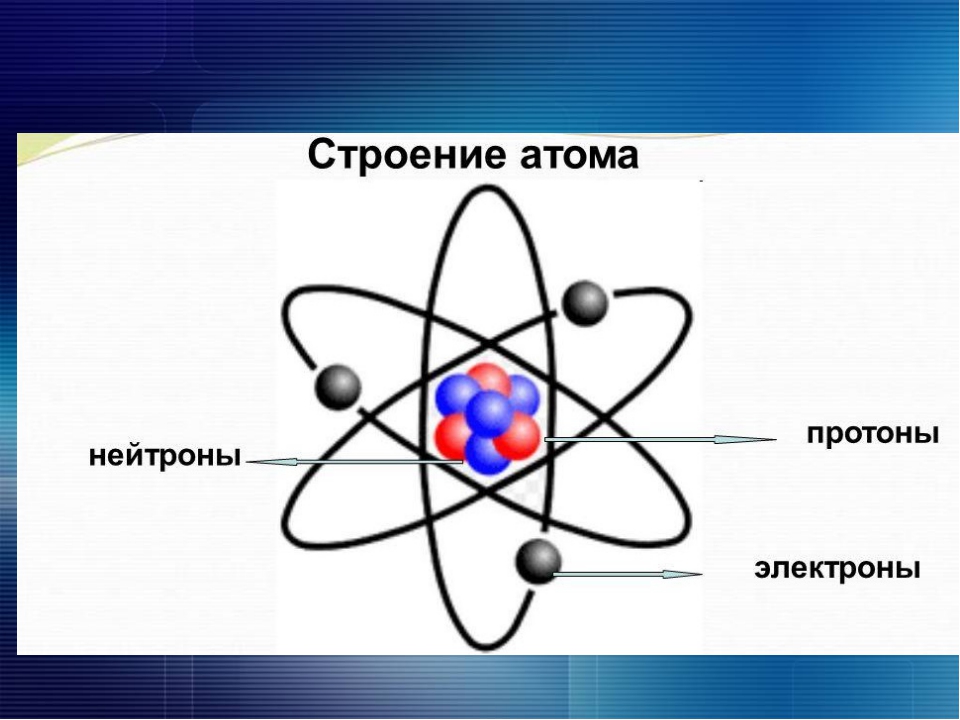
 ..
..