100 ballov.kz образовательный портал для подготовки к ЕНТ и КТА
В 2021 году казахстанские школьники будут сдавать по-новому Единое национальное тестирование. Помимо того, что главный школьный экзамен будет проходить электронно, выпускникам предоставят возможность испытать свою удачу дважды. Корреспондент zakon.kz побеседовал с вице-министром образования и науки Мирасом Дауленовым и узнал, к чему готовиться будущим абитуриентам.
— О переводе ЕНТ на электронный формат говорилось не раз. И вот, с 2021 года тестирование начнут проводить по-новому. Мирас Мухтарович, расскажите, как это будет?
— По содержанию все остается по-прежнему, но меняется формат. Если раньше школьник садился за парту и ему выдавали бумажный вариант книжки и лист ответа, то теперь тест будут сдавать за компьютером в электронном формате. У каждого выпускника будет свое место, огороженное оргстеклом.
Зарегистрироваться можно будет электронно на сайте Национального центра тестирования.
Кроме того, в этом году ЕНТ для претендующих на грант будет длиться три месяца, и в течение 100 дней сдать его можно будет два раза.
— Расскажите поподробнее?
— В марте пройдет тестирование для желающих поступить на платной основе, а для претендующих на грант мы ввели новые правила. Школьник, чтобы поступить на грант, по желанию может сдать ЕНТ два раза в апреле, мае или в июне, а наилучший результат отправить на конкурс. Но есть ограничение — два раза в один день сдавать тест нельзя. К примеру, если ты сдал ЕНТ в апреле, то потом повторно можно пересдать его через несколько дней или в мае, июне. Мы рекомендуем все-таки брать небольшой перерыв, чтобы еще лучше подготовиться. Но в любом случае это выбор школьника.
— Система оценивания останется прежней?
— Количество предметов остается прежним — три обязательных предмета и два на выбор.
Самое главное — результаты теста можно будет получить сразу же после нажатия кнопки «завершить тестирование». Раньше уходило очень много времени на проверку ответов, дети и родители переживали, ждали вечера, чтобы узнать результат. Сейчас мы все автоматизировали и набранное количество баллов будет выведено на экран сразу же после завершения тестирования.
Максимальное количество баллов остается прежним — 140.
— А апелляция?
— Если сдающий не будет согласен с какими-то вопросами, посчитает их некорректными, то он сразу же на месте сможет подать заявку на апелляцию. Не нужно будет ждать следующего дня, идти в центр тестирования, вуз или школу, все это будет электронно.
— С учетом того, что школьникам не придется вручную закрашивать листы ответов, будет ли изменено время сдачи тестирования?
— Мы решили оставить прежнее время — 240 минут.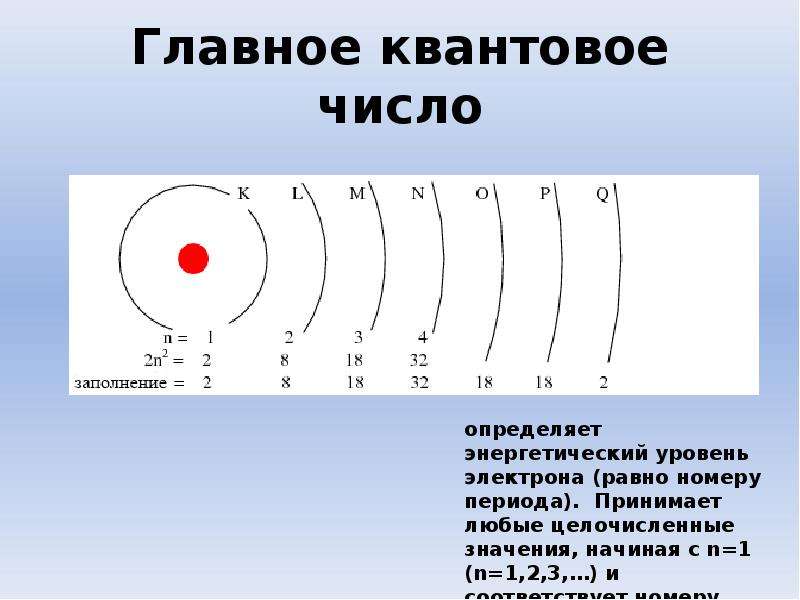 Но теперь, как вы отметили, школьникам не нужно будет тратить час на то, чтобы правильно закрасить лист ответов, они спокойно смогут использовать это время на решение задач.
Но теперь, как вы отметили, школьникам не нужно будет тратить час на то, чтобы правильно закрасить лист ответов, они спокойно смогут использовать это время на решение задач.
— Не секрет, что в некоторых селах и отдаленных населенных пунктах не хватает компьютеров. Как сельские школьники будут сдавать ЕНТ по новому формату?
— Задача в том, чтобы правильно выбрать время и дату тестирования. Центры тестирования есть во всех регионах, в Нур-Султане, Алматы и Шымкенте их несколько. Школьники, проживающие в отдаленных населенных пунктах, как и раньше смогут приехать в город, где есть эти центры, и сдать тестирование.
— На сколько процентов будет обновлена база вопросов?
— База вопросов ежегодно обновляется как минимум на 30%. В этом году мы добавили контекстные задания, то что школьники всегда просили. Мы уделили большое внимание истории Казахстана и всемирной истории — исключили практически все даты. Для нас главное не зазубривание дат, а понимание значения исторических событий. Но по каждому предмету будут контекстные вопросы.
Но по каждому предмету будут контекстные вопросы.
— По вашему мнению система справится с возможными хакерскими атаками, взломами?
— Информационная безопасность — это первостепенный и приоритетный вопрос. Центральный аппарат всей системы находится в Нур-Султане. Связь с региональными центрами сдачи ЕНТ проводится по закрытому VPN-каналу. Коды правильных ответов только в Национальном центре тестирования.
Кроме того, дополнительно через ГТС КНБ (Государственная техническая служба) все тесты проходят проверку на предмет возможного вмешательства. Здесь все не просто, это специальные защищенные каналы связи.
— А что с санитарными требованиями? Нужно ли будет школьникам сдавать ПЦР-тест перед ЕНТ?
— ПЦР-тест сдавать не нужно будет. Требование по маскам будет. При необходимости Центр национального тестирования будет выдавать маски школьникам во время сдачи ЕНТ. И, конечно же, будем измерять температуру. Социальная дистанция будет соблюдаться в каждой аудитории.
— Сколько человек будет сидеть в одной аудитории?
— Участники ЕНТ не за семь дней будут сдавать тестирование, как это было раньше, а в течение трех месяцев. Поэтому по заполняемости аудитории вопросов не будет.
— Будут ли ужесточены требования по дисциплине, запрещенным предметам?
— Мы уделяем большое внимание академической честности. На входе в центры тестирования, как и в предыдущие годы, будут стоять металлоискатели. Перечень запрещенных предметов остается прежним — телефоны, шпаргалки и прочее. Но, помимо фронтальной камеры, которая будет транслировать происходящее в аудитории, над каждым столом будет установлена еще одна камера. Она же будет использоваться в качестве идентификации школьника — как Face ID. Сел, зарегистрировался и приступил к заданиям. Мы применеям систему прокторинга.
Понятно, что каждое движение абитуриента нам будет видно. Если во время сдачи ЕНТ обнаружим, что сдающий использовал телефон или шпаргалку, то тестирование автоматически будет прекращено, система отключится.
— А наблюдатели будут присутствовать во время сдачи тестирования?
— Когда в бумажном формате проводили ЕНТ, мы привлекали очень много дежурных. В одной аудитории было по 3-4 человека. При электронной сдаче такого не будет, максимум один наблюдатель, потому что все будет видно по камерам.
— По вашим наблюдениям школьники стали меньше использовать запрещенные предметы, к примеру, пользоваться телефонами?
— Практика показывает, что школьники стали ответственнее относиться к ЕНТ. Если в 2019 году на 120 тыс. школьников мы изъяли 120 тыс. запрещенных предметов, по сути у каждого сдающего был телефон. То в прошлом году мы на 120 тыс. школьников обнаружили всего 2,5 тыс. телефонов, и у всех были аннулированы результаты.
Напомню, что в 2020 году мы также начали использовать систему искусственного интеллекта. Это анализ видеозаписей, который проводится после тестирования. Так, в прошлом году 100 абитуриентов лишились грантов за то, что во время сдачи ЕНТ использовали запрещенные предметы.
— Сколько средств выделено на проведение ЕНТ в этом году?
Если раньше на ЕНТ требовалось 1,5 млрд тенге из-за распечатки книжек и листов ответов, то сейчас расходы значительно сокращены за счет перехода на электронный формат. Они будут, но несущественные.
— Все-таки почему именно в 2021 году было принято решение проводить ЕНТ в электронном формате. Это как-то связано с пандемией?
— Это не связано с пандемией. Просто нужно переходить на качественно новый уровень. Мы апробировали данный формат на педагогах школ, вы знаете, что они сдают квалификационный тест, на магистрантах, так почему бы не использовать этот же формат при сдаче ЕНТ. Тем более, что это удобно, и для школьников теперь будет много плюсов.
Строение атомов химических элементов. Состав атомного ядра. Строение электронных оболочек атомов
Билет № 3
1. Строение атомов химических элементов. Состав атомного ядра. Строение электронных оболочек атомов первых 20 химических элементов периодической системы Д.

Атом — наименьшая частица вещества, неделимая химическим путем. В XX веке было выяснено сложное строение атома. Атомы состоят из положительно заряженного ядра и оболочки, образованной отрицательно заряженными электронами. Общий заряд свободного атома* равен нулю, так как заряды ядра и электронной оболочки уравновешивают друг друга. При этом величина заряда ядра равна номеру элемента в периодической таблице (атомному номеру) и равна общему числу электронов (заряд электрона равен −1).
Атомное ядро состоит из положительно заряженных протонов и нейтральных частиц — нейтронов, не имеющих заряда. Обобщенные характеристики элементарных частиц в составе атома можно представить в виде таблицы:
| Название частицы | Обозначение | Заряд | Масса |
| протон | p | +1 | 1 |
| нейтрон | n | 0 | 1 |
| электрон | e− | −1 | принимается равной 0 |
Число протонов равно заряду ядра, следовательно, равно атомному номеру. Чтобы найти число нейтронов в атоме, нужно от атомной
массы (складывающейся из масс протонов и нейтронов) отнять заряд ядра (число протонов).
Чтобы найти число нейтронов в атоме, нужно от атомной
массы (складывающейся из масс протонов и нейтронов) отнять заряд ядра (число протонов).
Например, в атоме натрия 23Na число протонов p = 11, а число нейтронов n = 23 − 11 = 12
Число нейтронов в атомах одного и того же элемента может быть различным. Такие атомы называют изотопами.
Электронная оболочка атома также имеет сложное строение. Электроны располагаются на энергетических уровнях (электронных слоях).
Номер уровня характеризует энергию электрона. Связано это с тем, что элементарные частицы могут передавать и принимать энергию не сколь угодно малыми величинами, а определенными порциями — ква́нтами. Чем выше уровень, тем большей энергией обладает электрон. Поскольку чем ниже энергия системы, тем она устойчивее (сравните низкую устойчивость камня на вершине горы, обладающего большой потенциальной энергией, и устойчивое положение того же камня внизу на равнине, когда его энергия значительно ниже), вначале заполняются уровни с низкой энергией электрона и только затем — высокие.
Максимальное число электронов, которое может вместить уровень, можно рассчитать по формуле:
N = 2n2, где N — максимальное число электронов на уровне,
n — номер уровня.
Тогда для первого уровня N = 2 · 12 = 2,
для второго N = 2 · 22 = 8 и т. д.
Число электронов на внешнем уровне для элементов главных (А) подгрупп равно номеру группы.
В большинстве современных периодических таблиц расположение электронов по уровням указано в клеточке с элементом. Очень
важно понимать, что уровни читаются снизу вверх, что соответствует их энергии. Поэтому столбик цифр в клеточке с натрием:
1
8
2
следует читать так:
на 1-м уровне — 2 электрона,
на 2-м уровне — 8 электронов,
на 3-м уровне — 1 электрон
Будьте внимательны, очень распространенная ошибка!
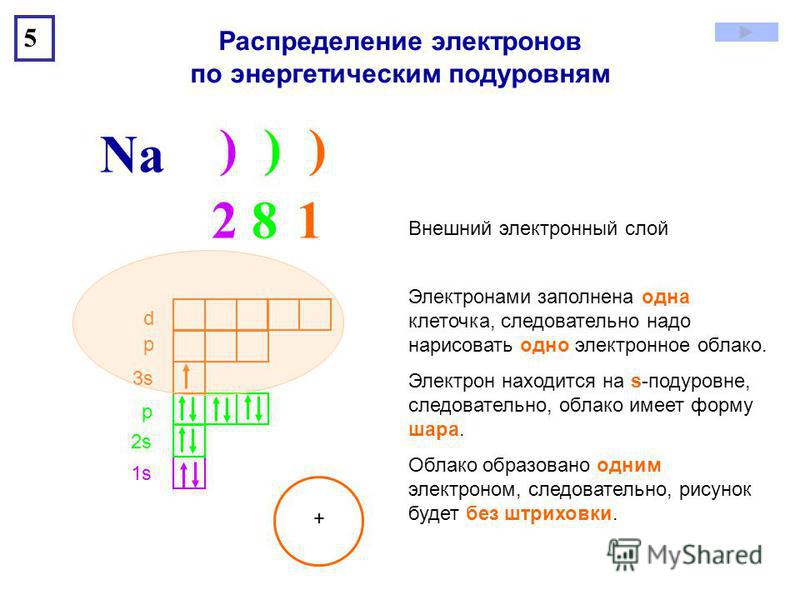
Распределение электронов по уровням можно представить в виде схемы:
11Na ) ) )
2 8 1
Если в периодической таблице не указано распределение электронов по уровням, можно руководствоваться:
- максимальным количеством электронов: на 1-м уровне не больше 2 e−,
на 2-м — 8 e−,
на внешнем уровне — 8 e−; - числом электронов на внешнем уровне (для первых 20 элементов совпадает с номером группы)
Тогда для натрия ход рассуждений будет следующий:
- Общее число электронов равно 11, следовательно, первый уровень заполнен и содержит 2 e−;
- Третий, наружный уровень содержит 1 e− (I группа)
- Второй уровень содержит остальные электроны: 11 − (2 + 1) = 8 (заполнен полностью)
* Ряд авторов для более четкого разграничения свободного атома и атома в составе соединения предлагают использовать термин «атом» только для обозначения свободного (нейтрального) атома, а для обозначения всех атомов, в том числе и в составе соединений, предлагают термин «атомные частицы». Время покажет, как сложится судьба этих терминов. С нашей точки зрения, атом по определению является частицей, следовательно, выражение «атомные частицы» можно рассматривать как тавтологию («масло масляное»).
Время покажет, как сложится судьба этих терминов. С нашей точки зрения, атом по определению является частицей, следовательно, выражение «атомные частицы» можно рассматривать как тавтологию («масло масляное»).
2. Задача. Вычисление количества вещества одного из продуктов реакции, если известна масса исходного вещества.
Пример:
Какое количество вещества водорода выделится при взаимодействии цинка с соляной кислотой массой 146 г?
Решение:
- Записываем уравнение реакции: Zn + 2HCl = ZnCl2 + H2↑
- Находим молярную массу соляной кислоты: M (HCl) = 1 + 35,5 = 36,5 (г/моль)
(молярную массу каждого элемента, численно равную относительной атомной массе, смотрим в периодической таблице под знаком элемента и округляем до целых, кроме хлора, который берется 35,5) - Находим количество вещества соляной кислоты: n (HCl) = m / M = 146 г / 36,5 г/моль = 4 моль
- Записываем над уравнением реакции имеющиеся данные, а под уравнением — число моль согласно уравнению (равно коэффициенту перед веществом):
4 моль x моль
Zn + 2HCl = ZnCl2 + H2↑
2 моль 1 моль - Составляем пропорцию:
4 моль — x моль
2 моль — 1 моль
(или с пояснением:
из 4 моль соляной кислоты получится x моль водорода,
а из 2 моль — 1 моль) - Находим x:
x = 4 моль • 1 моль / 2 моль = 2 моль
Ответ: 2 моль.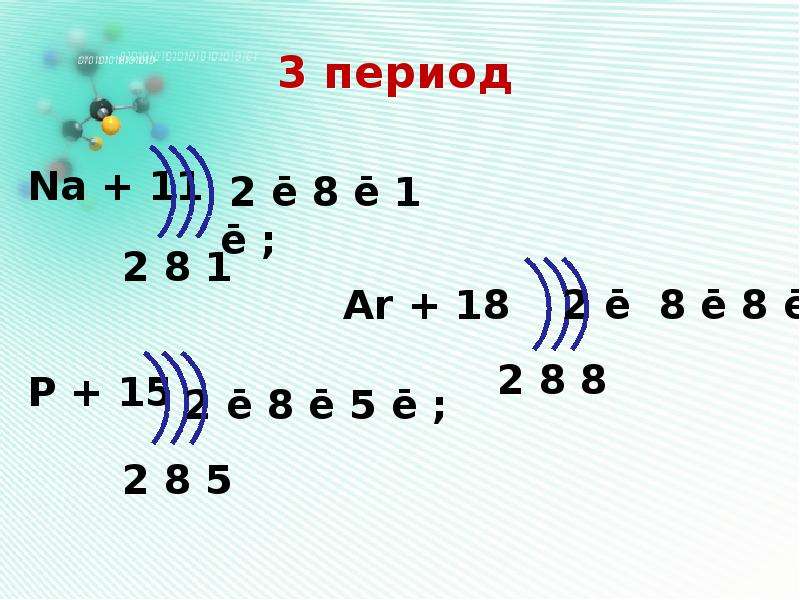
автор: Владимир Соколов
Натрий. Строение атома натрия
Разнообразен и интересен мир металлов. Их свойства издавна изучались человеком, и нашу жизнь просто невозможно представить без таких элементов, как железо, алюминий, хром. В нашей статье речь пойдет о натрии.
Строение атома натрия, расположение электронов по энергетическим уровням определяют его главные характеристики. К ним, например, относятся такие показатели, как высокая химическая активность, пластичность, способность проводить тепло и электрический ток.
Но особое внимание стоит уделить рассмотрению строения элементарной частицы химического элемента натрия – его атома.
Самые активные и агрессивные
Щелочные металлы, к которым относится натрий, в химии по праву считаются самыми реакционно-способными. Именно поэтому ни один из них, в том числе и натрий, не встречается в природе как самородок, а находится в ионном виде в составе горных пород и минералов.
К ним относится поваренная соль, сильвинит и карналлит. Чем же можно это объяснить?
Чем же можно это объяснить?
Ответ лежит в особенностях строения атома натрия. Элемент, как и его собратья по подгруппе щелочных металлов, имеет большой радиус атома. Кроме того, его единственный электрон, расположенный на последнем энергетическом уровне, слабо связан с положительно заряженным ядром. Поэтому он легко отрывается от самого атома и захватывается частицами других химических элементов. Эта способность – легко отдавать собственные электроны — и определяет все главные свойства металлических элементов.
Электронное строение атома натрия
Полная формула, показывающая распределение электронов по энергетическим уровням в атоме, имеет следующий вид: 1s22s22p63s1.
Последний неспаренный электрон, при вращении образующий облако в виде сферы, находится на значительном удалении от собственного ядра. Он участвует в возникновении такого типа связи, как ионное взаимодействие, и называется валентным.
Радиус самого атома составляет около 0,189 нм, а энергия его ионизации равна 5,14 эВ. Благодаря такому строению атома элемента натрия, его простое вещество проявляет хорошо выраженные восстановительные свойства, то есть в реакциях с атомами других элементов всегда отдает свой единственный электрон, расположенный на последнем энергетическом уровне (третий).
Благодаря такому строению атома элемента натрия, его простое вещество проявляет хорошо выраженные восстановительные свойства, то есть в реакциях с атомами других элементов всегда отдает свой единственный электрон, расположенный на последнем энергетическом уровне (третий).
При этом электронейтральная частица натрия превращается в положительно заряженный ион – катион. Ярко выраженные восстановительные свойства металла и его химическая активность предъявляют особые требования к условиям его хранения. Чтобы металл не окислялся кислородом воздуха, его сберегают под слоем технического масла или керосина. Электронная схема атома натрия имеет следующий вид (см. фото ниже).
Физические свойства
Какова же зависимость между электронной формулой и физическими свойствами натрия? Строение атома натрия раскрывает эту взаимосвязь.
Природный Na состоит только из одного изотопа. Он представляет собой очень мягкий серебристо-белый металл, который можно резать ножом. Его плотность составляет всего 0,97 г/см.
Как и другие металлы, натрий хорошо проводит электрический ток и тепло. Поскольку в подгруппе щелочных металлов радиусы атомов и их свойства как восстановителей с увеличением заряда ядра увеличиваются, то температуры кипения и плавления будут уменьшаться.
Как строение атома влияет на химические свойства элемента?
Продолжим изучение строения атома натрия. Натрий содержит на третьем энергетическом уровне один электрон, электронное облако которого имеет форму сферы. Поэтому металл относят к s-элементам, а они, как известно, легко вступают в химическое взаимодействие с неметаллами, например с кислородом, водородом, серой, азотом и т. д. Реагируя с водой, натрий быстро растворяется в ней, образуя раствор щелочи.
Высокая активность щелочного металла натрия выражается в особенностях его взаимодействия с кислотами, которая сопровождается взрывом. Поэтому такую реакцию в лабораторных условиях проводить запрещено. Еще одна особенность металлического натрия заключается в том, что он не реагирует с растворами солей и щелочей, так как сам начинает активно взаимодействовать с растворителем – водой.
Так что, как можно видеть, строение атома натрия, а также его взаимосвязь с физическими и химическими свойствами элемента, действительно представляют собой научный интерес.
Натрий атом, строение — Справочник химика 21
В молекуле этилового спирта один атом водорода связан с углеродом через кислород (полярная ковалентная связь), а поэтому этот атом водорода более подвижен, чем атомы водорода, связанные с углеродом. В молекуле диметилового эфира все атомы водорода одинаково связаны с атомами углерода (ковалентная связь). Разным строением молекулы объясняется различное отношение этих веш,еств к металлическому натрию. Этиловый спирт взаимодействует с натрием по уравнению [c.273]Естественно, что фундаментальный закон химии, открытый Д. И. Менделеевым, — периодический закон—должен найти себе объяснение в закономерности строения атоМов, вскрываемой квантовой механикой. Периодичность в изменении химических свойств элементов при возрастании заряда ядра определяется периодическим повторением у определенных атомов строения внешних электронных оболочек.
 Легко заметить, что число электронов в последовательности от 5 до ближайшей конфигурации (первый период) или (остальные периоды) равно 2, 8, 8, 18, 32 (табл. 3), т. е. совпадает с числом элементов в периодах системы Д. И. Менделеева и объясняет, почему именно столько элементов содержится в данном периоде. Период начинается элементом, у которого впервые в системе возникает новый квантовый слой, содержащий один л-электрон (щелочной металл), и оканчивается элементом, у которого впервые в этом квантовом слое достраивается шестью электронами -подоболочка (благородные газы). Очевидно, что номер периода )авен главному квантовому числу электронов внешнего слоя. Например, атом натрия, открывающий третий период, и атом аргона, заканчивающий его, имеют конфигурации К 13л и К соответст- [c.60]
Легко заметить, что число электронов в последовательности от 5 до ближайшей конфигурации (первый период) или (остальные периоды) равно 2, 8, 8, 18, 32 (табл. 3), т. е. совпадает с числом элементов в периодах системы Д. И. Менделеева и объясняет, почему именно столько элементов содержится в данном периоде. Период начинается элементом, у которого впервые в системе возникает новый квантовый слой, содержащий один л-электрон (щелочной металл), и оканчивается элементом, у которого впервые в этом квантовом слое достраивается шестью электронами -подоболочка (благородные газы). Очевидно, что номер периода )авен главному квантовому числу электронов внешнего слоя. Например, атом натрия, открывающий третий период, и атом аргона, заканчивающий его, имеют конфигурации К 13л и К соответст- [c.60] Справа выписано число неспаренных внешних электронов и формулы соответствующих водородных соединений. Валентность, согласно изложенному, должна равняться этому числу неспаренных электронов. Мы видим, что в полном соответствии с опытными данными водород, литий, фтор и натрий — одновалентны, кислород — двухвалентен, азот — трехвалентен. Атомы инертных газов гелия и неона не образуют молекул, так как все их электроны спарены, поэтому их валентность равна нулю. Противоречие мы наблюдаем лишь для атомов Ве, В, С, для которых возможны и другие валентности (указанные в скобках). Но это противоречие только кажущееся и объясняется тем, что мы привыкли считать, что свободные атомы, образуя химическую связь, обязательно сохраняют строение своих электронных оболочек. Но не существует никаких причин, по которым это должно быть только так атом, образуя связь, уже не является свободным, и его электронная конфигурация может и должна — в большей или меньшей степени) измениться. Поэтому необходимо принимать во снимание те изменения энергии, которые могут возникнуть при образовании химической связи. [c.71]
Мы видим, что в полном соответствии с опытными данными водород, литий, фтор и натрий — одновалентны, кислород — двухвалентен, азот — трехвалентен. Атомы инертных газов гелия и неона не образуют молекул, так как все их электроны спарены, поэтому их валентность равна нулю. Противоречие мы наблюдаем лишь для атомов Ве, В, С, для которых возможны и другие валентности (указанные в скобках). Но это противоречие только кажущееся и объясняется тем, что мы привыкли считать, что свободные атомы, образуя химическую связь, обязательно сохраняют строение своих электронных оболочек. Но не существует никаких причин, по которым это должно быть только так атом, образуя связь, уже не является свободным, и его электронная конфигурация может и должна — в большей или меньшей степени) измениться. Поэтому необходимо принимать во снимание те изменения энергии, которые могут возникнуть при образовании химической связи. [c.71]
Понятие о полосах (или зонах) разрешенных значений энергии, разделенных запрещенными зонами, — наиболее новая и наиболее важная черта этого метода.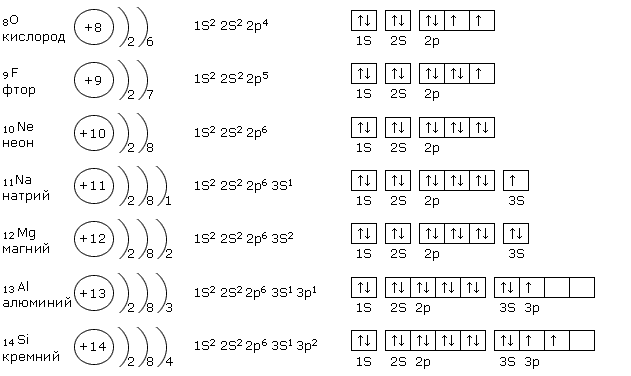 Ее нельзя считать совсем неожиданной, как можно судить на основании следующих рас-суждений. Рассмотрим кусок металлического натрия. Ионизационный потенциал атома натрия равен лишь 5,1 эв, и мы получим довольно правильную картину строения металла, если представим, что его электроны в совокупности (по одному на каждый атом) движутся свободно и движение ограничено только объемом металла. Иногда такую модель называют ящичной [c.346]
Ее нельзя считать совсем неожиданной, как можно судить на основании следующих рас-суждений. Рассмотрим кусок металлического натрия. Ионизационный потенциал атома натрия равен лишь 5,1 эв, и мы получим довольно правильную картину строения металла, если представим, что его электроны в совокупности (по одному на каждый атом) движутся свободно и движение ограничено только объемом металла. Иногда такую модель называют ящичной [c.346]
Периодический закон. Основной закон химии-Периодический закон был открыт Д. И. Менделеевым в то время, когда атом считался неделимым и о ехо внутреннем строении ничего не было известно. В основу Периодического закона Д. И. Менделеев положил атомные массы (ранее — атомные веса) и химические свойства элементов. Расположив 63 известных в то время элемента в порядке возрастания их атомных масс, Д. И. Менделеев получил естественный ряд химических элементов, в котором он обнаружил периодическую повторяемость химических свойств. Например, свойства типичного металла литий 1л повторялись у элементов натрий Ка и калий К, свойства типичного неметалла фтор Р-у элементов хлор С1, бром Вг, иод I и т. д. [c.33]
д. [c.33]
Гипотеза Григоровича. По мнению В. К. Григоровича, расположение атомов в твердых и жидких простых веществах определяется, в основном, их электронным строением [8]. В металлической решетке, где внешние электроны положительных ионов сильно возбуждены вследствие возмущающего действия соседних атомов, сравнительно небольшой прирост температуры может быть достаточным для наступления перекрытия и обменного взаимодействия внешних р оболочек ионов, не перекрывающихся при низких температурах ([8], стр. 202). Так, например, объемноцентрированная кубическая структура натрия, область существования которой простирается от 30 К до температуры плавления, по Григоровичу, может быть объяснена с помощью следующих соображений. Из экспериментальных данных (об оптических свойствах, эффекте Холла и т. д.) известно, что натрий в твердом и жидком состоянии имеет один электрон проводимости на атом. Это означает, что его валентный электрон с Зз уровня переходит в электронный газ.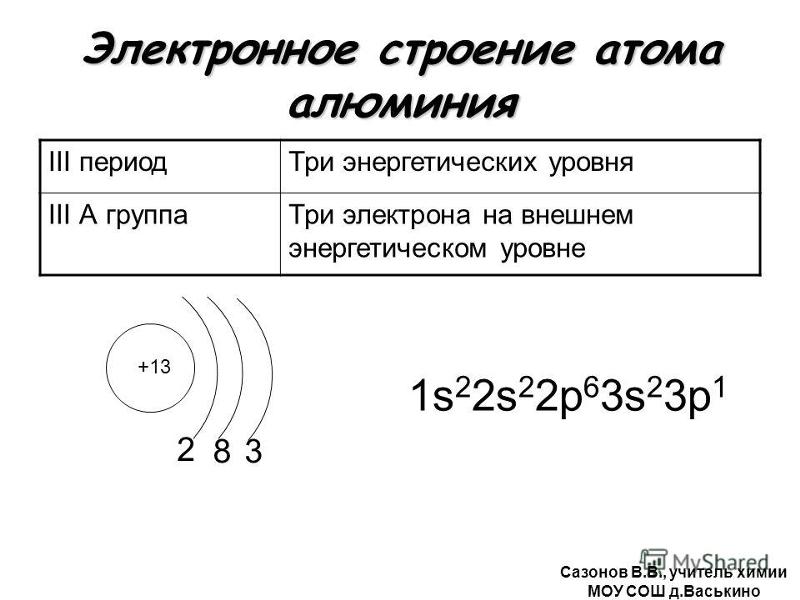 Атомы натрия в конденсированном состоянии имеют внешнюю 25 2р оболочку. Взаимодействие ионов с электронным газом приводит к сближению и перекрыванию р-орбиталей внешних р оболочек ионов, в результате чего возникают обменные / вухэлектронные о-связи, направленные по трем осям прямоугольных координат. Образование шести связей каждым атомом со своими соседями приводит к простой кубической ячейке со свободным объемом в центре, который может быть заполнен таким же ионом. Так, из двух простых кубических под-решеток, энергетически невыгодных, а потому редко реализующихся в металлах, образуется ОЦК структура, одна из трех типичных металлических структур. Гипотеза Григоровича иллюстрируется рис. 43. Точно так же обосновывается возникновение ОЦК структур и у других щелочных металлов. Для лития, ионы которого имеют 15 оболочку, возникновение ОЦК структуры связывается с предположением о переходе 8 электронов на р уровни. [c.175]
Атомы натрия в конденсированном состоянии имеют внешнюю 25 2р оболочку. Взаимодействие ионов с электронным газом приводит к сближению и перекрыванию р-орбиталей внешних р оболочек ионов, в результате чего возникают обменные / вухэлектронные о-связи, направленные по трем осям прямоугольных координат. Образование шести связей каждым атомом со своими соседями приводит к простой кубической ячейке со свободным объемом в центре, который может быть заполнен таким же ионом. Так, из двух простых кубических под-решеток, энергетически невыгодных, а потому редко реализующихся в металлах, образуется ОЦК структура, одна из трех типичных металлических структур. Гипотеза Григоровича иллюстрируется рис. 43. Точно так же обосновывается возникновение ОЦК структур и у других щелочных металлов. Для лития, ионы которого имеют 15 оболочку, возникновение ОЦК структуры связывается с предположением о переходе 8 электронов на р уровни. [c.175]
Химики давно уже связывали различие в свойствах типичных неорганических и органических соединений с существованием разных видов химической связи в этих соединениях.
 Как известно, соединения, подобные хлориду натрия, диссоциируют на ноны не только в водном растворе уже в твердой соли в узлах кристаллической решетки находятся не атомы, а катион натрия и анион хлора, притягивающиеся друг к другу электростатическими силами. Ионы образуются из атомов путем передачи внешних (валентных) электронов, Так, атом натрия способен легко отдавать свой единственный внешний электрон и превращаться в катион. Атом хлора, наоборот, принимает один электрон, превращаясь в анион. В результате этого процесса внешние электронные слои обоих атомов приобретают строение электронной оболочки инертных газов, создаются устойчивые восьмиэлектронные группировки, так называемые октеты электронов. Такой тип связи называется гетерополярным или ионным [c.77]
Как известно, соединения, подобные хлориду натрия, диссоциируют на ноны не только в водном растворе уже в твердой соли в узлах кристаллической решетки находятся не атомы, а катион натрия и анион хлора, притягивающиеся друг к другу электростатическими силами. Ионы образуются из атомов путем передачи внешних (валентных) электронов, Так, атом натрия способен легко отдавать свой единственный внешний электрон и превращаться в катион. Атом хлора, наоборот, принимает один электрон, превращаясь в анион. В результате этого процесса внешние электронные слои обоих атомов приобретают строение электронной оболочки инертных газов, создаются устойчивые восьмиэлектронные группировки, так называемые октеты электронов. Такой тип связи называется гетерополярным или ионным [c.77] Рассмотрим строение атома какого-нибудь элемента, например натрия, с позиций протонно-нейтронной теории. Порядковый номер натрия в периодической системе 11, массовое число 23. В соответствии с порядковым номером заряд ядра натрия равен 11+. Следовательно, в атоме натрия имеется И электронов, сумма зарядов которых равна положительному заряду ядра. Если атом натрия потеряет один электрон, то положительный заряд ядра будет на единицу больше суммы отрицательных зарядов электронов (10), и атом натрия станет ионом с зарядом 1+. Заряд ядра атома равен сумме зарядов 11 протонов, находящихся в ядре, масса [c.41]
Следовательно, в атоме натрия имеется И электронов, сумма зарядов которых равна положительному заряду ядра. Если атом натрия потеряет один электрон, то положительный заряд ядра будет на единицу больше суммы отрицательных зарядов электронов (10), и атом натрия станет ионом с зарядом 1+. Заряд ядра атома равен сумме зарядов 11 протонов, находящихся в ядре, масса [c.41]
По аналогии с поведением 2-метилциклогексанона можно ожидать, что при метилировании а-декалона I атаке предпочтительно будет подвергаться атом водорода в положении 9, но прямое алкилирование приводит к образованию в качестве главного продукта 2-метильного производного. Различные косвенные методы алкилирования у Сд включают блокирование 2-метиленовой группы. По одному из методов (Джонсон, 1947) конденсируют кетон I с этилформиатом и оксиметиленовое производное II превращают в О-изопропильное производное III путем алкилирования иодистым изопропилом. Оксиметиленовое производное II, подобно енолу 1,3-дикетона, образует гибридный енолят, в котором отрицательный заряд распределен между кислородом и углеродом и направление алкилирования такой системы зависит от ее строения, характера алкил ирующего агента и условий реакции при алкилировании в ацетоне в присутствии карбоната натрия главным образом получается 0-алкильное производное (метод Клайзена). В приведенном случае соединение II образует С-алкильное производное при действии иодистого метила и 0-алкильное производное — при действии иодистого изопропила. Из эфира III может образоваться только желаемый продукт ангулярного метилирования IV. Блокирующую группу затем удаляют путем кислого гидролиза эфира енола и щелочного расщепления V [c.524]
В приведенном случае соединение II образует С-алкильное производное при действии иодистого метила и 0-алкильное производное — при действии иодистого изопропила. Из эфира III может образоваться только желаемый продукт ангулярного метилирования IV. Блокирующую группу затем удаляют путем кислого гидролиза эфира енола и щелочного расщепления V [c.524]
Но и это предположение представляется несостоятельным, так как в настоящее время установлено, что связь с металлом в диазотате натрия ионная, а анион имеет строение, показанное в формуле (78), причем ион натрия координируется по месту с наибольшей электронной плотностью — по атому кислорода. Однако, подобно другим солям с амбидентными анионами, диазотаты металлов как нуклеофилы способны по-разному взаимодействовать с алкилгалогенидами как субстратами (см. разд. 2.1.1). [c.450]
Строение ионных кристаллов. При реакции металлического натрия с газообразным хлором каждый атом натрия передает электрон атому хлора [c. 161]
161]
В настоящее время обычное мыло все более заменяют различные синтетические моющие средства. Как правило, основой их являются углеводороды с общим числом атомов С от 12 до 20 и различным строением, в которых часть атомов водорода замещена на атомы или радикалы, сообщающие молекулам достаточную растворимость в воде. Различают анионоактивные (как и обычное мыло), катионоактивные, амфотерные и неионогенные моющие вещества. Первые обычно характеризуются наличием в их составе группы —ЗОзЫа (с ионогенным натрием), вторые-группы —ЫНзС1 (с ионогенным хлором), третьи — одновременно групп и того и другого типа, а характерной для четвертых (неионогенных) является общая формула К—Н1—СНгСНгО- -СНгСНзО- -СИгСНгОН, где Р — углеводородный радикал, а Н1 — двухвалентный атом (О, 8) или радикал (—СНз—ЫН—, —СО—ЫН— и др.). Почти все синтетические моющие средства имеют перед обычным мылом то важное преимущество, что безотказно действуют и в жесткой воде. [c.566]
Химическим строением Бутлеров назвал последовательность связи атомов в молекуле. Он указал, каким путем на основании изучения химических реакций данного вещества можно установить его структуру и написать структурную формулу, которая для каждого химического индивидуума является единственной адэкватной. В соответствии с этой формулой можно и синтезировать данное соединение. Свойства определенного атома в соединении прежде всего зависят от того, с каким атомом он связан. Так, свойства водорода, связанного с кислородом, иные, чем водорода, связанного с углеродом, и, зная эти свойства, можно установить, с каким атомом связан интересующий нас атом. Например, атом водорода, связанный с кислородом, как в спиртах, способен замещаться на натрий при действии металла (так же как водород в воде — неорганическом прототипе с тем же характером связи), а водород, связанный с углеродом, обычно инертен по отношению к натрию. На свойства данного атома влияют и другие его соседи, непосредственно с ним не связанные. Хотя это влияние более слабое, но оно такн е должно быть учтено при установлении химического строения.
Он указал, каким путем на основании изучения химических реакций данного вещества можно установить его структуру и написать структурную формулу, которая для каждого химического индивидуума является единственной адэкватной. В соответствии с этой формулой можно и синтезировать данное соединение. Свойства определенного атома в соединении прежде всего зависят от того, с каким атомом он связан. Так, свойства водорода, связанного с кислородом, иные, чем водорода, связанного с углеродом, и, зная эти свойства, можно установить, с каким атомом связан интересующий нас атом. Например, атом водорода, связанный с кислородом, как в спиртах, способен замещаться на натрий при действии металла (так же как водород в воде — неорганическом прототипе с тем же характером связи), а водород, связанный с углеродом, обычно инертен по отношению к натрию. На свойства данного атома влияют и другие его соседи, непосредственно с ним не связанные. Хотя это влияние более слабое, но оно такн е должно быть учтено при установлении химического строения. [c.17]
[c.17]
Строение атомов натрия и хлора можно представить соот ветственно (+11), 2, 8, 1 и (+17), 2, 8, 7. Как видно, это атомы с незавершенными энергетическими уровнями. Очевидно, для завершения их атому натрия легче отдать 1 электрон, чем присоединить 7, а атому хлора легче присоединить 1 электрон, чем отдать 7. [c.73]
При ведении записи отнюдь не следует переписывать текст учебного пособия. Нужно стараться по возможности оперировать языком формул строения, дополняя их различными условными пометками, стрелками, примечаниями и т. д. Надо помнить, что формулы являются своеобразной химической стенографией умелое пользование формулами значительно сокращает время записи. Например, длинную фразу Если взять какое-либо органическое вещество, содержащее азот, и сплавить его с металлическим натрием, то натрий отщепляет от вещества атом азота вместе с атомом углерода и образует цианистый натрий можно заменить одной строчкой [c.11]
Строение дигидрострептомицина изучено на основании сопоставления его со стрептомицином. В отличие от стрептомицина он не реагирует с реагентами на карбонильную группу. В результате гидролиза дигидрострептомицина образуются стрептидин и дигидрострептобиозамин, дающий при дальнейшем расщеплении Ы-метил-/-глюкозамин. Дигидрострептомицин может быть получен восстановлением стрептомицина боргидридом натрия или лучше водородом при 6 ат в присутствии скелетного никеля в герметическом реакторе, либо электрохимическим восстановлением. Эти и другие данные подтверждают строение дигидрострептомицина как гидрированного в стрептозной части стрептомицина. Чистоту препарата определяют по прозрачности 28%-ного раствора, водородному показателю его в пределах 5,0—7,5 потере в весе при высушивании в течение 3 ч в вакууме при 60° и 5 лш рт. ст. не свыше 2,5%. [c.724]
В отличие от стрептомицина он не реагирует с реагентами на карбонильную группу. В результате гидролиза дигидрострептомицина образуются стрептидин и дигидрострептобиозамин, дающий при дальнейшем расщеплении Ы-метил-/-глюкозамин. Дигидрострептомицин может быть получен восстановлением стрептомицина боргидридом натрия или лучше водородом при 6 ат в присутствии скелетного никеля в герметическом реакторе, либо электрохимическим восстановлением. Эти и другие данные подтверждают строение дигидрострептомицина как гидрированного в стрептозной части стрептомицина. Чистоту препарата определяют по прозрачности 28%-ного раствора, водородному показателю его в пределах 5,0—7,5 потере в весе при высушивании в течение 3 ч в вакууме при 60° и 5 лш рт. ст. не свыше 2,5%. [c.724]
Реакцию проводят следующим образом. Готовят раствор 2 экв анилина в 3 экв соляной кислоты, к которому затем добавляют 1 экв нитрита натрия и 2 экв ацетата натрия. Атом водорода в системе —N = N—NH— активирован и, по-видимому, достаточно подвижен, поскольку одно и то же соединение образуется при конденсации как хлористого фенилдиазония с л-толуидином, так и хлористого л-толилдиазо-ния с анилином.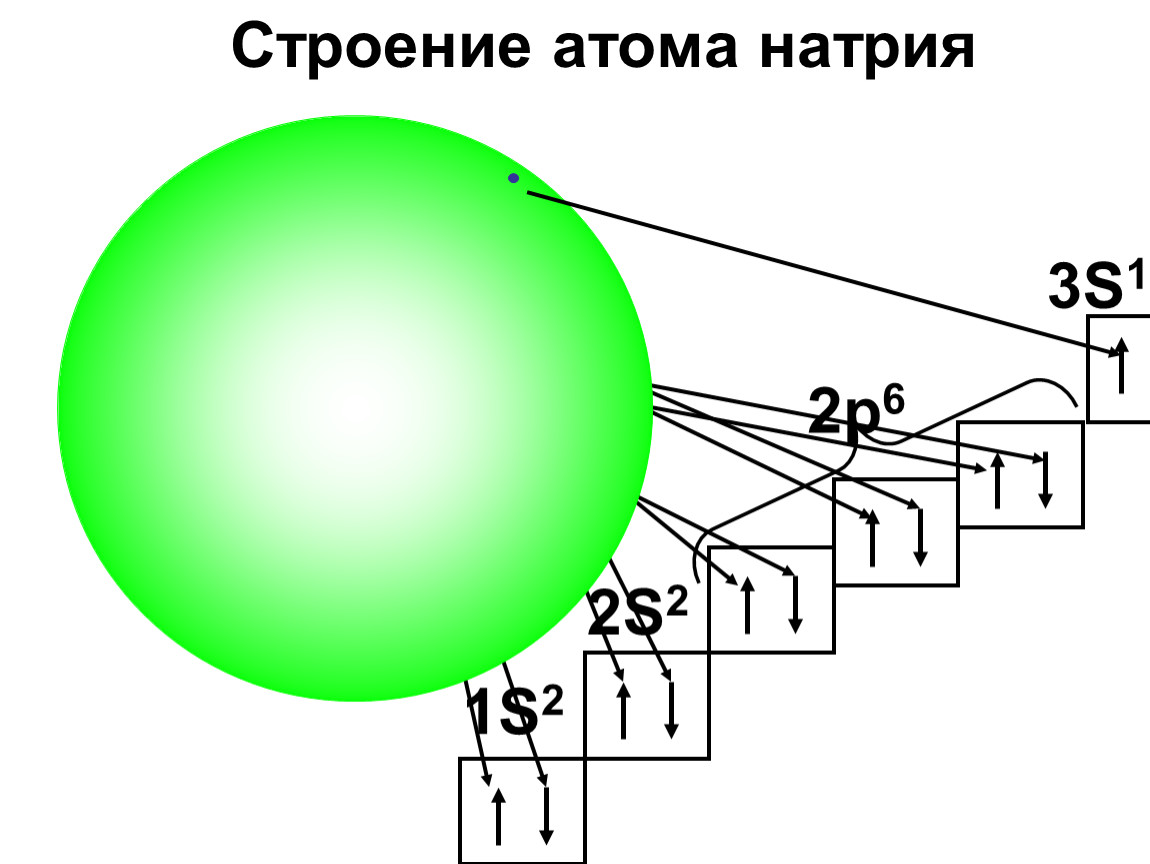 Продукт реакции, по-видимому, имеет строение, отвечающее приведенной ниже формуле [c.263]
Продукт реакции, по-видимому, имеет строение, отвечающее приведенной ниже формуле [c.263]
Если ионы натрия и хлора находятся на близком расстоянии, то между ними возникает сильное электростатическое притяжение. В то же время между ионами одного ж того же знака имеет место отталкивание. Б результате действия электростатических сил притяжения, а также сил отталкивания, возникающих при перекрывании электронных орбит, ионы правильно распределяются при атом вокруг каждого иона натрия оказывается шесть ближайших к нему ионов хлора, а все остальные ионы натрия удерживаются на некотором удалении. Строение кристалла хлористого натрия показано на рис. 53. [c.161]
Прочность связи галоида в галоидированных ароматических углеводородах сильно зависит от их строения. Атом галоида, связанный с атомом углерода бензольного ядра, не отщепляется ни щелочью (водной или спиртовой), ни спиртовым раствором азотнокислого серебра. Столь малая реакционная способность галоида сближает галоидопроизводные этого типа (например, хлорбензол) с соединениями жирного ряда, содержащими галоид у атома углерода, связанного с другим атомом углерода двойной связью, например с хлористым винилом СНз=СНС1. Наоборот, у ароматических галоидопроизводных с галоидом в боковой цепи галоид отщепляется (например, при гидролизе) еще легче, чем у большинства насыщенных галоидопроизводных жирного ряда. В некоторых других реакциях (например, с магнием в эфирной среде, с металлическим натрием) атом галоида, находящийся при атоме углерода ядра, оказывается достаточно подвижным. [c.220]
Наоборот, у ароматических галоидопроизводных с галоидом в боковой цепи галоид отщепляется (например, при гидролизе) еще легче, чем у большинства насыщенных галоидопроизводных жирного ряда. В некоторых других реакциях (например, с магнием в эфирной среде, с металлическим натрием) атом галоида, находящийся при атоме углерода ядра, оказывается достаточно подвижным. [c.220]
Осагкденные твердые катализаторы. Осажденные катализаторы можно приготовлять взаимодействием двух жидких материалов или жидкости с твердым веществом. Одними из первых катализаторов этого типа были катализаторы алфин [61], состоящие из хлористого натрия, изопропоксида натрия и аллил—натрия. В присутствии катализатора алфин бутадиен нолимеризуется, образуя твердый чрезвычайно высокомолекулярный полимер с преобладанием 7 г/)(1нс-1,4-строен я, в то время как при П0лимеризац и металлическим натрием преобладает 1,2-конфигурация. Полимеризация ст1 рола на катализаторе алфин ведет к образованию стереорегулярного полимера [98]. Согласно патентному описанию [12] катализаторы алфин полимеризуют этилен в жидкой фазе при температуре от —80 до -)-9° I давлении около 10 ат с образованием высокомолекулярных полиэтиленов. [c.287]
Согласно патентному описанию [12] катализаторы алфин полимеризуют этилен в жидкой фазе при температуре от —80 до -)-9° I давлении около 10 ат с образованием высокомолекулярных полиэтиленов. [c.287]
Количество спектральных линий, относящихся к одному атому, достаточно велико. В настоящее время наши представления о строении любой химической частицы (будь то атом, ион или молекула) настолько детальны, что сведения о практически всех ее спектральных линиях имеются в справочных изданиях. Для атомов и их ионов наибольшей популярностью пользуются диаграммы уровней энергий с указанием на них длин волн спектральных линий и сил осцилляторов соответствующих переходов. Такие диаграммы носят название Гротриановских (по имени ученого Гротриана, впервые широко использовавшего их). На рис. 1.2 приведен пример Гротриановской диаграммы для атома натрия. На основании приведенных значений сил осцилляторов можно сразу судить о наиболее интенсивных линиях в спектре этого атома. [c. 16]
16]
Кристалл хлорида натрия имеет кубическое кристаллическое строение с а = 562,8 пм, В каждой структурной единице (элементарной ячейке) имеется четыре атома натрия с координатами О О 0 О /а /г /г О /г Чй Ч2 О, а также четыре атома хлора с координатами Ч2 Ч2 /2 Ч2 О 0 О Ч2 0 О О /г. Начертите схе1му структурной единицы (элементарной кубической ячейки) с указанием положения отдельных атомов. Сколько ближайших соседних атомов имеет каждый атом Каковы расстояния между соседними атомами Какой маогогравник они образуют (Такой тип расположения атомов, называемый типом хлорида натрия, обычно присущ солям.) [c.47]
Помимо важнейших кислот НаЗОд и Н2304 и их солей известны соли и других серусодержащих кислот. Важнейшей из них является тиосульфат натрия КааЗгОз 5НаО. Его строение можно представить как результат замены одного из атомов кислорода на атом серы в сульфатном тетраэдре ЗО» . Тиосульфат применяется, в частности, для количественного определения йода, с которым он взаимодействует по реакции [c. 164]
164]
Диспропорционирование силанов в присутствии металлов известно уже давно. Этот тип реакции наблюдался только в тех случаях, когда у атома кремния имелся по крайней мере один атом водорода (см. стр. 319). Тщательные исследования показали, что от атома кремния отщепляется арильная, но не алкильная группа [5]. Показано, что продолжительность реакции и используемый металл оказывают заметное влияние на строение продуктов. При обработке дифенилсилана литием в тетрагидрофуране в течение 84 час с выходом 77% образуется трифенилсилан [98]. При действии на дифенилсилан сплава натрия с калием в эфире в течение 8 час получается 80% тетрафенилсилана и 8% трифенилсилана [4]. Взаимодействие трифенилсилана с литием в тетрагидрофуране в течение 4 и 7,5 час и последующая обработка триметилхлорсиланом приводят к получению 58 и 0% 1, 1, 1-триметил-2,2,2-трифенилдисилана соответственно. Наблюдалось, что дифенилсилан при обработке сплавом натрия с калием давал тетрафенилсилаи. Трифенилсилан реагирует со сплавом натрия с калием, давая трифенилсилилкалий, который при обработке триметилхлорсиланом дает 1,1,1-триметил-2,2,2-трифенилдисилан. С другой стороны. [c.327]
С другой стороны. [c.327]
В период, предшествующий ионной теории, натрийацетоуксусному эфиру приписывалось строение, в котором атом натрия был связан с кислородом ( енолят натрия , см. формулу I, приведенную ниже). Эта формула основывалась на том, что вероятность связывания положительного металла с отрицательным кислородом больше, чем вероятность его связывания с нейтральным углеродом, подобно тому как в алкоголятах HgONa и фенолятах eHgONa принимали, что металл связан с кислородом, а не с каким-либо из атомов углерода молекулы [c.68]
электронами электронное строение — Справочник химика 21
Напишите электронные формулы строения атомов кислорода, серы, селена и теллура. В чем сходство и в чем различие в их электронных оболочках Как это отражается на свойствах элементов [c.63] Составить электронные схемы строения атомов калия и цезия. Какой из этих элементов является более сильным восстановителем Почему [c. 263]
263]
Изобразите электронные схемы строения атомов натрия, хлора, хрома, кальция и железа. [c.44]
Ванадий, ниобий и тантал между собой и с металлами, близко расположенными к ним Q периодической системе (подгрупп железа, титан,1 и хрома), образуют металлические твердые растворы. По мере /величения различий в электронно.м строении взаимодействую- [c.541]
Изобразите электронную схему строения отрицательного иона водорода (гидрид-иона). Атому какого инертного газа он подобен [c.47]
Изобразите электронные схемы строения атомов элементов с порядковыми номерами 15, 20, 36, 40, 47. Укажите расположение этих элементов в периодической системе Д. И. Менделеева и их высшую валентность. [c.44]
Атомы натрия ( = 11) и магния (2 = 12) подобно первым элементам второго периода — литию и бериллию — содержат во внешнем слое соответственно один и два 5-электрона. Их строению отвечают электронные формулы 1з 28 2р 38 (натрий) и 18 2з 2р 38 (магний) и следующие схемы [c.66]
Их строению отвечают электронные формулы 1з 28 2р 38 (натрий) и 18 2з 2р 38 (магний) и следующие схемы [c.66]
Атомы натрия (2= И) и магния (2= 12), подобно нерв >1М элементам второго периода — литию и бериллию — содержат зо внешнем слое соответственно одии или два -электрона. Их строению отвечают электронные формулы 15 25 2р 35 (натрий) [c.91]
Хром Ст значительно отличается от титана и ванадия по электронному строению и свойствам. Это объясняется тем, что предыдущие переходные элементы содержат заполненную внешнюю 3-оболочку, в то время как у атома хрома в основном состоянии всего один 48-электрон. Электронное строение хрома (конфигурация Зd 4s ) обусловлено устойчивостью наполовину заполненной [c.154]
Как влияет делокализация электронов на строение карбоксильного иона Где находится отрицательный заряд после ионизации карбоновой кислоты [c.341]
Составить электронные схемы строения атомов щелочных металлов. Какой из них является наиболее сильным восстановителем Почему [c.231]
Какой из них является наиболее сильным восстановителем Почему [c.231]
Больщинство известных химических элементов, находясь в виде простых веществ, представляют собой металлы. Некоторые элементы (германий, мышьяк, сурьма, алюминий) в одних условиях ведут себя как металлы, в других условиях — как неметаллы. Все металлы имеют на внешнем энергетическом уровне небольшое число валентных электронов — электронные конфигурации металлов представлены в табл. I. Повторение химических свойств металлов обусловлено периодическим повторением строения электронных конфигураций внешних электронных уровней. [c.317]
ЭЛЕКТРОННАЯ ТЕОРИЯ СТРОЕНИЯ АТОМА. [c.41]
Составьте электронные схемы строения молекул водорода, хлора, азота, воды и аммиака. [c.45]
Зеркальный электронный микроскоп. Изображение в микроскопе создается зеркалом , состоящим из анода, иммерсионной линзы и объекта (под потенциалом катода).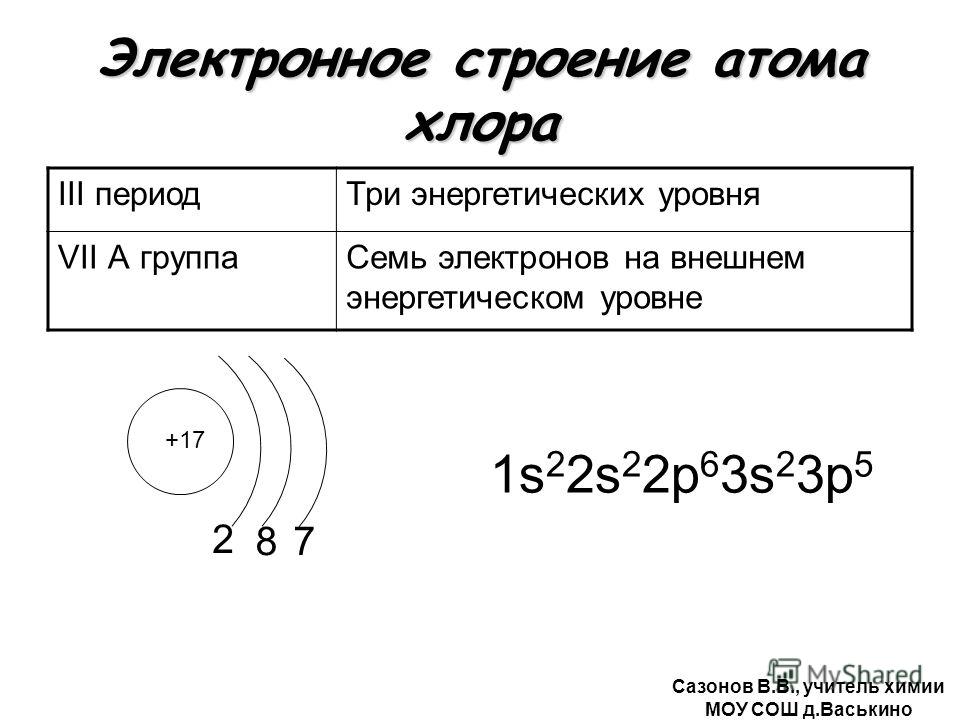 Пучок электронов, идущий от анода, рассеивается поверхностью зеркала в зависимости от отражательной способности разных ее участков. Рассеивание электронов происходит вблизи поверхности образца, несущей контактную разность потенциалов. Контактные разности потенциалов обусловлены неоднородностью состава и рельефа образца,, поэтому видимое изображение на экране картины рассеянных электронов отображает строение поверхности. Разрешение зеркального микроскопа является функцией напряжения поля у поверхности образца и составляет около 100 нм. Так, зеркальный микроскоп JEM-M1 (Япония) имеет разрешение 100 нм при увеличении 1000. Микро- [c.155]
Пучок электронов, идущий от анода, рассеивается поверхностью зеркала в зависимости от отражательной способности разных ее участков. Рассеивание электронов происходит вблизи поверхности образца, несущей контактную разность потенциалов. Контактные разности потенциалов обусловлены неоднородностью состава и рельефа образца,, поэтому видимое изображение на экране картины рассеянных электронов отображает строение поверхности. Разрешение зеркального микроскопа является функцией напряжения поля у поверхности образца и составляет около 100 нм. Так, зеркальный микроскоп JEM-M1 (Япония) имеет разрешение 100 нм при увеличении 1000. Микро- [c.155]
В дальнейшем, в связи с возникновением и развитием электронной теории строения атома и химической связи, валентность стали связывать с числом электронов, переходящих от одного атома к другому, или с числом химических связей, возникающих между атомами в процессе образования химического соединения (см. III.7). [c.15]
Следовательно, при образовании любой молекулы атомы в ней связываются друг с другом. Причина образования молекул состоит в том, что между атомами действуют определенные силы — образуется химическая связь. Химические связи характеризуются прежде всего способностью разрываться и возникать при определенных реакциях. Доказано, что в образовании химической связи между атомами главную роль играют электроны, расположенные на внешней оболочке и, следовательно, связанные с ядром наименее прочно, так называемые валентные электроны. Поэтому строение валентной электронной оболочки атомов является определяющим фактором при рассмотрении условий образования химической связи. [c.69]
Причина образования молекул состоит в том, что между атомами действуют определенные силы — образуется химическая связь. Химические связи характеризуются прежде всего способностью разрываться и возникать при определенных реакциях. Доказано, что в образовании химической связи между атомами главную роль играют электроны, расположенные на внешней оболочке и, следовательно, связанные с ядром наименее прочно, так называемые валентные электроны. Поэтому строение валентной электронной оболочки атомов является определяющим фактором при рассмотрении условий образования химической связи. [c.69]
Ее можно рассматривать как результат присоединения атома кислорода к молекуле О2. Электронные схемы строения молекулы озона следует представить согласно с методом ВС так 0+0+0 о [c.189]
Из экспериментов с рассеянием ал ьфа-частиц вырисовывалась такая картина строения атома в центре его находится чрезвычайно плотное, положительно заряженное ядро, которое окружено отрицательными зарядами-электронами. Электроны занимают область атома, радиус которой в 100000 раз превышает радиус ядра. Большинство альфа-частиц, пронизывающих металлическую фольгу, не отклонялись от первоначального направления, потому что они не сталкивались ни с одним ядром. Однако частицы, проходящие вблизи такой большой концентрации заряда, должны были испытывать отклонения, а немногочисленные частицы, которым пришлось столкнуться с крохотной мишенью, отражались в направлении, противоположном тому, из которого они летели. [c.332]
Электроны занимают область атома, радиус которой в 100000 раз превышает радиус ядра. Большинство альфа-частиц, пронизывающих металлическую фольгу, не отклонялись от первоначального направления, потому что они не сталкивались ни с одним ядром. Однако частицы, проходящие вблизи такой большой концентрации заряда, должны были испытывать отклонения, а немногочисленные частицы, которым пришлось столкнуться с крохотной мишенью, отражались в направлении, противоположном тому, из которого они летели. [c.332]
Металлы. Строение металлов характеризуется наличием положительно заряженного атомного остова, связанного за счет взаимодействия с делокализованными электронами. Такое строение обусловливает осуществление связей металлического типа. [c.346]
Электронная структура аморфных веществ, как и отдельных молекул, представляет собой набор дискретных уровней, разделенных высокими потенциальными барьерами.
 Близкие энергетические состояния валентных электронов разобщены, так как геометрия волноводов — неодинаковые длины и углы межатомных связей, обусловленные непериодичноотью структуры — препятствует распространению электронных волн за границы каждой данной межатомной связи. Но поскольку аморфные вещества, как и кристаллы, обладают множеством близких энергетических состояний валентных электронов, электронные энергетические спектры твердых тел непериодического строения похожи в некоторых отношениях на энергетические спектры кристаллов. [c.99]
Близкие энергетические состояния валентных электронов разобщены, так как геометрия волноводов — неодинаковые длины и углы межатомных связей, обусловленные непериодичноотью структуры — препятствует распространению электронных волн за границы каждой данной межатомной связи. Но поскольку аморфные вещества, как и кристаллы, обладают множеством близких энергетических состояний валентных электронов, электронные энергетические спектры твердых тел непериодического строения похожи в некоторых отношениях на энергетические спектры кристаллов. [c.99] Работы Г. Мозли (1887—1915) показали, что действительной основой периодического закона являются не атомные массы, а положительные заряды ядер атомов, численно равные порядковому номеру элемента в периодической системе. На основании периодического закона и работ Г. Мозли был решен важный вопрос о числе еще неоткрытых элементов. Было установлено, например, что между водородом н гелием или между натрием и магнием новых элементов быть не может. Открытие и дальнейшее развитие периодического закона не только избавило исследователей во многих случаях от бесполезной и трудоемкой работы по поиску новых элементов, но и позволило установить число неоткрытых элементов и их порядковые номера в периодической системе. Однако знание только порядкового номера не давало еще оснований помещать элемент в определенную группу периодической системы. Этот вопрос решался с помощью электронной теории строения атома. Применение этой теории показало, например, что неоткрытый элемент № 72 должен быть аналогом циркония, а не лантаноидов. Элемент № 72 (гафний) действительно был найден в циркониевом минерале в 1923 г., а не в лантаноидах, где его много лет безуспешно искэли, ошибочно считая аналогом лантаноидов. Даже спустя 70 лет после открытия периодического закона в таблице элементов до урана пустовали четыре клетки с номерами 43, 61, 85 и 87. Эти элементы — технеций, прометий, астат и франций — были [c.14]
Однако знание только порядкового номера не давало еще оснований помещать элемент в определенную группу периодической системы. Этот вопрос решался с помощью электронной теории строения атома. Применение этой теории показало, например, что неоткрытый элемент № 72 должен быть аналогом циркония, а не лантаноидов. Элемент № 72 (гафний) действительно был найден в циркониевом минерале в 1923 г., а не в лантаноидах, где его много лет безуспешно искэли, ошибочно считая аналогом лантаноидов. Даже спустя 70 лет после открытия периодического закона в таблице элементов до урана пустовали четыре клетки с номерами 43, 61, 85 и 87. Эти элементы — технеций, прометий, астат и франций — были [c.14]
Нафталин — ароматическое соединение, в котором я-электрон-ную систему образуют, согласно формуле Хюккеля Ап + 2), 10 электронов. Доказательством строения нафталина является способность присоединять — на катализаторе (N1) два, четыре и далее — десять атомов водорода с образованием соответственно 1,4-дигидронафталина а), тетралина (б) и декалина (в) [c.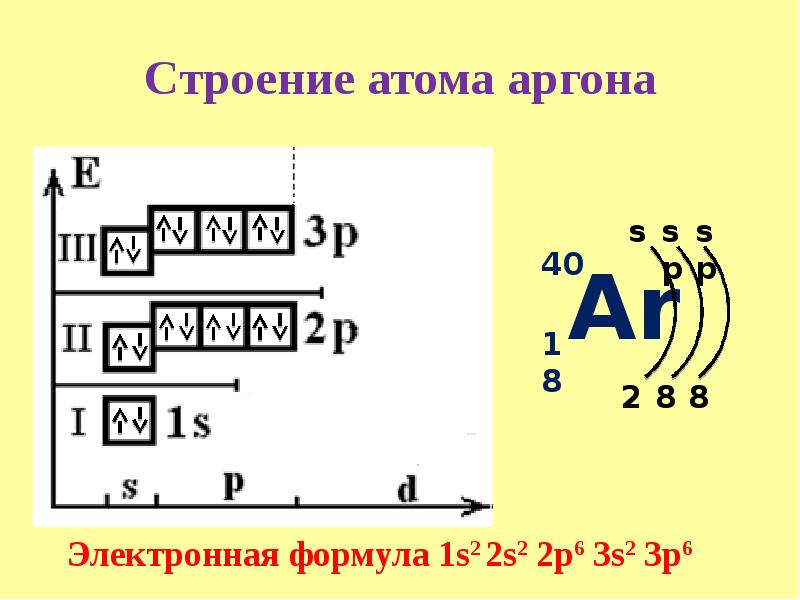 274]
274]
Изобразите электронную схему строения нона гидроксида (так, как ранее изображались электронные схемы строения молекулы воды и пр.). Как можно обнаружить ионы гидроксида в водном растворе [c.80]
Возбуждение молекулы или атома происходит при столкновении с электроном и зависит от энергии электрона и строения молекулы. Кинетическая энергия электрона должна превышать энергию возбуждения. Зависимость от энергии электрона вероятности передачи энергии от электрона к молекуле называется функцией возбуждения-, она может иметь один (Не) или два (Hg) максимума (табл. 48). [c.215]
Следовательно, в жидких металлах, как и в кристаллических телах, возможен полиморфизм. Ближний порядок может существенно изменяться как при плавлении, так и при дальнейшем нагревании расплава, что определяется концентрацией свободных электронов и строением электронных оболочек атомов (ионов). [c.181]
В молекуле Вг на ее орбиталях размещается шесть электронов, ее строение выражается так [c. 112]
112]
В электронных схемах строения атомов следующих элементов подчеркнуть атомные остовы и указать число валентных электронов в атоме каждого элемента [c.36]
Подсчитать общее число электронов в каждом случае, указать положительный заряд ядра представ ить электронные схемы строения атомов подобно тому, как это сделано в задаче 17, Назвать элементы, схемы строения электронных оболочек которых даны выше. [c.37]
Путем действия озона на КОН с последующей перекристаллизацией продукта реакции из жидкого аммиака получают красный кристаллический озонид калия. Магнитные измерения показали, что в КО3, N303 и СзОз присутствует ион О3 с неспаренным электроном (угловое строение). Соединений, содержащих ионы Оз -, получено не было. [c.483]
Эти факты получили объяснение в электронной теории строения вещества. [c.66]
В химической теории особенно важным является выработка широких обобщений и создание достаточно простых качественных приемов определения электронного, пространственного строения и реакционной способности молекул. Это объясняется тем, что число известных химических соединений составляет уже несколько миллионов и растет со скоростью около 100 тыс. в год. Следовательно, получить данные точных количественных расчетов для каждого соединения просто не представляется возможным. Кроме того, вместо строгих расчетов важнее получить ответы на вопросы а) какова относительная устойчивость или реакционная способность в данном ряду соединений б) какой структурный признак определяет устойчивость (или неустойчивость) данной однотипной группы молекул в) каким образом отразится то или иное структурное искажение на положении энергетических уровней и форме орбиталей той или иной молекулы г) реакции какого типа должны быть характерны для данного соединения и при каких условиях их легче реализовать [c.331]
Это объясняется тем, что число известных химических соединений составляет уже несколько миллионов и растет со скоростью около 100 тыс. в год. Следовательно, получить данные точных количественных расчетов для каждого соединения просто не представляется возможным. Кроме того, вместо строгих расчетов важнее получить ответы на вопросы а) какова относительная устойчивость или реакционная способность в данном ряду соединений б) какой структурный признак определяет устойчивость (или неустойчивость) данной однотипной группы молекул в) каким образом отразится то или иное структурное искажение на положении энергетических уровней и форме орбиталей той или иной молекулы г) реакции какого типа должны быть характерны для данного соединения и при каких условиях их легче реализовать [c.331]
Образование химической связи между атомами осуществляется главным образом за счет электронов внешнего (или наружного) квантового слоя, иаименее прочно связанных с ядрами, так называемых валентных электронов. Поэтому строение электронной оболочки атомов является решающим фактором при определении условий образования химической связи. [c.20]
Поэтому строение электронной оболочки атомов является решающим фактором при определении условий образования химической связи. [c.20]
Она (электронная теория. — В. П.) ничего не предсказывает того, чего нельзя предположить и без этой гипотезы, и, во всяком случае, на основе предсказаний электронных гипотез не было сделано ни одного сколько-нибудь выдающегося открытия, а делаемые открытия лишь позднее объясняются электронными теориями. Пока эта гипотеза все же еще пересказ фактов органической химии на язык электронных представлений. Стремление к этому психологически весьма понятно ввиду общей уверенности в огромном значении электронной теории строения атомов для будущего химии [c.39]
Окпслсние первоначально рассматривалось как реакция присоединения кислорода к какому-либо веществу. Противоположный процесс — отнятие кислорода от вен1,ества (или присоединение водорода к нему)—называли реакцией восстановления. Развитие электронной теории строения атомоа и химической связи да. — ю возможность широко обобщить представления об окислительно-вос-стаио- штельных реакциях. [c.54]
— ю возможность широко обобщить представления об окислительно-вос-стаио- штельных реакциях. [c.54]
У всех -элементов независимо от группы на внешней электронной оболочке содержатся только два электрона (электронная конфигурация где п — номер периода), так как у них заселяются -орбитали предвнешнего слоя. Следовательно, характер изменения свойств в периоде у этих элементов будет определяться изменением строения предвнеш-ней электронной оболочки. Поэтому у -элементов в периоде свойства изменяются не так резко, как у я- или р-элементов. Если у элементов главных подгрупп свойства в периоде изменяются от типичного металла к типичному неметаллу, то все -элементы являются металлами. [c.62]
Предполагается, что при образовании ионной связи атомы стремятся отдать или приобрести столько электронов, чтобы строение их внешней электронной оболочки оказа.пось аналогичным строению устойчивой внешней оболочки ближайшего по расположению в периодической системе благородного газа. [c.143]
[c.143]
Нанишите электронные схемы строения метиламина, анилина, аллиламина. [c.105]
Кобальт, родий и иридий составляют подгруппу электронных аналогов d-элементоБ. Атомы рассматриваемых химических элементов имеют на внешнем квантовом слое по одному или два s-электрона. Электронный слой, соседний с внешним квантовым слоем, у них еще не заполнен, он имеет (8 + 7) или (8 + 8) электронов. Электронная конфигурация атомов кобальта и иридия — а родия (для последнего характерен провал одного внешнего s-электрона на соседний -подуровень). Строение и физические константы атомов данной подгруппы приведены в табл. 111. [c.367]
С атомом какого благородного газа и с ионом какого галогена сходна по электрон юму строению часгица, образующаяся при отрыве от аюма алюминия его валентных электронов [c.283]
Урок №4-5. Строение электронных оболочек атомов химических элементов. Короткий и длинный вариант таблицы химических элементов
Повторите следующие темы 8 класса:
№43. Периодический закон Д. И. Менделеева
Периодический закон Д. И. Менделеева
№44. Периодическая таблица химических элементов. Группы и периоды
№45. Строение атома. Состав атомных ядер. Изотопы. Химический элемент
№46. Строение электронных оболочек атомов первых 20 элементов периодической системы Д. И. Менделеева. Современная формулировка периодического закона
№47. Состояние электронов в атомах. Периодическое изменение свойств химических элементов в периодах и главных подгруппах
№48. Значение периодического закона. Жизнь и деятельность Д. И. Менделеева
№49. Повторение и обобщение по теме « Периодический закон и Периодическая система химических элементов Д. И. Менделеева. Строение атома»
Это интересно:
Таблица Менделеева
Изучите:
Состояние электрона в атоме. Квантовые числа
Ответьте на вопросы тестов
1. Чему равен заряд ядра атома натрия?
1) 0; 2) +11; 3) +1; 4) +23.
2. Сколько электронов в атоме азота?
1) 0; 2) 1; 3) 7; 4) 14.
3. Сколько нейтронов в атоме углерода 12 6C?
1) 0; 2) 12; 3) 6; 4) 7.
4. Что общего в атомах 14 7N и 14 6C?
1) массовое число; 2) число протонов; 3) число нейтронов; 4) заряд ядра.
5. Укажите атом, в котором больше всего электронов:
1) 1H; 2) 40Ar; 3) 41Ar; 4) 39K.
6. Сколько электронов содержится в молекуле CO2?
1) 6; 2) 12; 3) 8; 4) 22.
7. Сколько протонов и электронов содержит ион CO32-?
1) 30p,30e; 2)30p,28e; 3)28p,30e; 4)30p,32e.
8. Природный кремний состоит из трёх изотопов: 28Si (молярная доля 92,3%), 29Si (4,7%), какой ещё изотоп входит в состав кремния, если атомная масса кремния 28,1.
1) 27; 2) 31; 3) 32; 4) 30.
9. На внешнем энергоуровне элементов главных подгрупп число
электронов :
1) равно 2; 2) равно номеру периода; 3) равно номеру группы; 4) равно 1.
10. Элементу 2-го периода до завершения внешнего уровня не хватает 3 электронов. Это элемент-…
1) бор; 2) углерод; 3) азот; 4) фосфор.
11. Элемент проявляет в соединениях максимальную степень окисления +7. Какую конфигурацию валентных электронов может иметь этот элемент в основном состоянии?
1) 2s22p5;
2) 3s23p5;
3) 3s24d5.
12. Формула высшего оксида некоторого элемента – ЭО3. Какую конфигурацию валентных электронов может иметь этот элемент в основном состоянии?
1) 2s22p4;
2) 3s23p4;
3) 3s13d5.
13. Строение внешнего и второго снаружи электронных слоёв атома меди
1) 3s23p63d94s2;
2) 3s23p63d104s0;
3) 3s23p64s13d10;
4) 3s23p63d11.
14. Изотопы
одного элемента различаются
1) числом протонов 2) числом нейтронов 3)
числом электронов 4) зарядом ядра
15. Относительная атомная масса элемента в периодической системе соответствует
1) заряду ядра атома этого элемента
2) числу электронов на валентной оболочке атома этого элемента
3) числу электронных уровней атома этого элемента
4) среднему значению массовых чисел изотопов этого элемента
16. В
периоде слева направо уменьшается
1) число уровней 2) число валентных электронов
3) радиус атома 4) активность неметаллов
17. Металлические свойства простых веществ
1) уменьшаются в периодах и увеличиваются в группах
2) уменьшаются в периодах и уменьшаются в группах
3) увеличиваются в периодах и увеличиваются в группах
4) увеличиваются в периодах и уменьшаются в группах
18. Формула
оксида, соответствующая элементу седьмой группы в его высшей степени окисления
1) ЭО3 2) Э2О7 3) Э2О5 4) ЭО2
19. Все
атомы одного элемента имеют
1)одинаковое число электронов 2) одинаковое массовое число
3) разный заряд ядра 4) одинаковое число нейтронов
20. Номер
периода элемента в периодической системе соответствует
1) заряду ядра атома этого элемента
2) числу электронов на валентной оболочке атома этого элемента
3) числу электронных уровней атома этого элемента
4) среднему значению массовых чисел изотопов этого элемента
21. В группе
сверху вниз уменьшается
1) высшая степень окисления 2) число валентных электронов
3) радиус атома 4) активность неметаллов
22. Основные
свойства высших гидроксидов
1) уменьшаются в периодах и уменьшаются
в группах
2) уменьшаются в периодах и
увеличиваются в группах
3) увеличиваются в периодах и
уменьшаются в группах
4) увеличиваются в периодах и
увеличиваются в группах
23. Формула
основания, соответствующая элементу четвертой группы в его высшей степени
окисления
1) ЭОН
2) Э(ОН)2
3) Э(ОН)3
4) Э(ОН)4
24. Электронная формула валентного уровня 3d84s2 у
атома
1) скандия 2) никеля 3) марганца 4) титана
25. Электронная формула атома натрия
1) ls22s22p63s23p1
2) 1s22s22p63s23p3
3) 1s22s22p63s1
4) ls22s1
26. Число
неспаренных электронов в основном состоянии атома бериллия равно
1) 0 2) 1 3) 2 4) 4
27. Элемент,
атомы которого имеют в основном состоянии 4 неспаренных электронов
1) марганец 2) железо 3) ванадий 4) хром
28. Является
f-элементом
1) Sr 2) Se 3) Sc 4) Sm
29. Никель
является
1) s-элементом 2) р-элементом
3) d-элементом 4) f-элементом
30. Какой
подуровень из перечисленных заполняется электронами первым?
1) 3d 2) 4d 3) 4p 4) 4s
Ответы:
| 1)-2 | 10)-3 | 19)-1 |
| 2)-3 | 11)-2 | 20)-3 |
| 3)-3 | 12)-2 | 21)-4 |
| 4)-1 | 13)-3 | 22)-2 |
| 5)-4 | 14)-2 | 23)-4 |
| 6)-4 | 15)-4 | 24)-2 |
| 7)-4 | 16)-3 | 25)-3 |
| 8)-4 | 17)-1 | 26)-1 |
| 9)-3 | 18)-2 | 27)-2 28)-4 29)-3 30)-4 |
2. Заполнение электронных слоёв атомов элементов малых периодов
Общее число электронов в атоме равно порядковому номеру химического элемента в Периодической таблице.
Каждый электрон находится на своей орбитали. Чем больше энергия электрона, тем больше по размеру его орбиталь, и тем дальше он находится от ядра.
Электроны с близкими значениями энергии образуют энергетический уровень (электронный слой).
Энергетический уровень (электронный слой) — совокупность электронов с близкими значениями энергии.
Энергетические уровни нумеруют, начиная с самого близкого к ядру.
Установлено, что максимальное число электронов на энергетическом уровне равно \(2n²\), где \(n \)— его номер. Значит, на первом уровне может находиться не более \(2\) электронов, на втором — не более \(8\), на третьем — не более \(18\) и т. д.
В атоме водорода — один электрон, и он располагается на первом энергетическом уровне:
h2)1.
В атоме гелия — два электрона. Первый энергетический уровень у гелия завершён, так как он не может содержать более двух электронов:
He2)2.
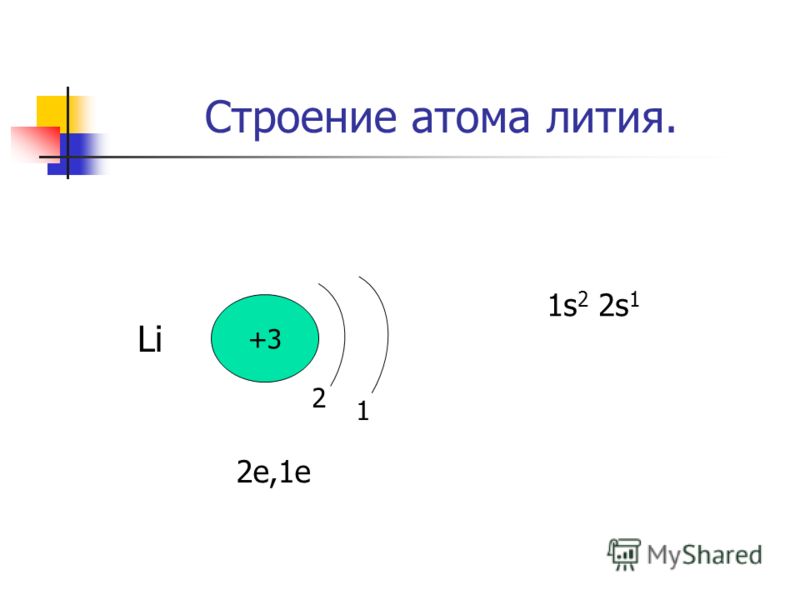
В атоме лития — три электрона. Два из них находятся на первом уровне. Третий электрон имеет большую энергию и движется дальше от ядра. В атоме лития появляется второй энергетический уровень:
Li3)2)1.
У следующих элементов второго периода электроны добавляются на второй уровень:
Be4)2)2; B5)2)3; C6)2)4; N7)2)5; O8)2)6; F9)2)7; Ne10)2)8.
У неона второй электронный слой завершён, так как содержит \(8\) электронов — максимально возможное число.
Заполнение третьего энергетического уровня начинается у атома натрия и завершается у атома аргона:
Na11)2)8)1; Mg12)2)8)2; Al13)2)8)3; Si14)2)8)4; P15)2)8)5; S16)2)8)6; Cl17)2)8)7; Ar18)2)8)8.
Максимальное количество электронов на третьем слое равно \(18\), но у элементов третьего периода его заполнение не происходит, потому что внешний электронный слой не может содержать более \(8\) электронов.
Обрати внимание!
На внешнем электронном слое не может быть более \(8\) электронов.
У элементов четвёртого периода начинается заполнение четвёртого энергетического уровня:
K19)2)8)8)1; Ca20)2)8)8)2.
Полностью четвёртый электронный слой заполняется, как и в малых периодах, у инертного газа криптона.
Электронная структура — Периодическая таблица — AQA — GCSE Chemistry (Single Science) Revision — AQA
Электронная структура — это способ расположения электронов в атоме.
Электроны в оболочках
Электроны в атомах занимают энергетические уровни, также называемые электронными оболочками, вне ядра. Различные оболочки могут содержать разное максимальное количество электронов. Электроны в атоме первыми занимают самый низкий доступный уровень энергии. Это ближайшая к ядру оболочка.Когда эта оболочка заполнена, электроны начинают занимать следующий энергетический уровень.
Ниже приведена таблица, показывающая максимальное количество электронов, которое элемент может иметь для каждой из его оболочек энергетического уровня. Представленная информация относится к элементам с атомными номерами от 1 до 20:
| Оболочка | Максимум |
|---|---|
| Первый | 2 |
| Второй | 8 |
| Третий | 8 |
Предсказание электронной структуры
Электронную структуру атома можно предсказать по его атомному номеру.Например, атомный номер натрия равен 11. Атомы натрия имеют 11 протонов и, следовательно, 11 электронов:
- два электрона занимают первую оболочку
- восемь электронов занимают вторую оболочку
- один электрон занимает третью оболочку
Это электронная структура может быть записана как 2,8,1 (каждая запятая или точка отделяет одну оболочку от другой). Эту электронную структуру также можно изобразить в виде диаграммы. На этих диаграммах:
- каждая оболочка показана в виде круга
- каждый электрон показан в виде точки или креста
Электронные структуры и периодическая таблица
Электронная структура элемент связан с его положением в периодической таблице.
| Элемент электронной структуры | Ссылка на периодическую таблицу |
|---|---|
| Число оболочек | Номер периода |
| Число электронов во внешней оболочке | Номер группы |
| Сложенные числа | Атомный номер |
Электронная структура натрия (2,8,1) показывает, что натрий, Na:
- находится в периоде 3
- находится в группе 1
- имеет атомный номер (2 + 8 + 1) = 11
Как сделать 3D-модель натрия
Элемент натрий относится к группе щелочных металлов периодической таблицы.Он составляет примерно 2,8 процента земной коры. По внешнему виду натрий — мягкий серебристо-белый металл. Его атомная формула — Na. Создание трехмерной модели атома натрия дает интерактивный практический опыт, который является одновременно проницательным и информативным.
Общие сведения
Трехмерные модели — это визуализированные копии того, как может выглядеть атомная структура элемента. Они основаны на модели атома Бора. Датский физик Нильс Бор (1885-1962) был первым, кто концептуализировал планетарную модель атома.Модель Бора по существу делит атом на электронное облако и ядро. Ядро содержит протоны и нейтроны. Электронное облако — это то место, где можно найти электроны. Электроны вращаются вокруг ядра атома по стабильным орбитам или оболочкам. Хотя модель Бора претерпела множество изменений за прошедшие годы, ее основные принципы все еще используются при обучении основам атомной структуры. По этой причине модель Бора используется для иллюстрации того, как создать трехмерную модель атома натрия.
Соберите необходимые материалы. К ним относятся ватные шарики разных оттенков для декоративно-прикладного искусства, изображающие электроны, протоны и нейтроны. Протоны и нейтроны равны по размеру, а электроны меньше, чем протоны и нейтроны. Следовательно, выбирайте ватные шарики подходящего размера, чтобы имитировать эти различия в размерах. Что касается «скорлупы» электронного облака, то их можно вырезать ножницами из картона или толстого картона. Точно так же убедитесь, что под рукой есть веревка.Используйте веревку, чтобы связать электронные оболочки концентрическими кругами, чтобы имитировать орбиты вокруг ядра. Клей прикрепляет ватные шарики к соответствующим областям.
Найдите натрий в периодической таблице, чтобы определить его атомный номер. Атомный номер элемента будет указывать на количество протонов и количество электронов, которые у него есть. Помните, что у стабильного нейтрального атома количество электронов равно количеству протонов. Следовательно, атомный номер натрия 11 указывает на то, что он имеет одинаковое количество протонов и электронов 11.
Найдите количество нейтронов, которое есть у натрия, сначала посмотрев на его атомный вес в периодической таблице. У натрия атомный вес около 23. Это означает, что в его ядре 12 нейтронов, поскольку 23 минус 11 протонов равняются 12 нейтронам. Теперь, когда вы определили количество протонов и нейтронов, выберите создание ядра из 11 протонов желтого цвета и 12 нейтронов зеленого цвета, как показано на фотографии.
Создайте электронные оболочки, окружающие ядро атома натрия.В химии и атомной физике электронные оболочки соответствуют основным энергетическим уровням, на которых электроны вращаются вокруг ядра атома. Причем каждая из этих оболочек занята фиксированным числом электронов. Общее практическое правило состоит в том, что n-я оболочка может содержать до 2 (n-квадрат) электронов. Таким образом, первая оболочка, которая является самой внутренней оболочкой, содержит максимум два электрона. Затем вторая оболочка содержит максимум восемь электронов. За ним следует третья оболочка, которая содержит максимум 18 электронов.Поскольку у натрия 11 электронов, его первая оболочка будет полностью занята двумя электронами. За этим следует его вторая оболочка, полностью занятая восемью электронами, в результате чего в третьей оболочке остается только один электрон, как показано на приведенной иллюстрации.
Электронная конфигурация | физика | Britannica
Электронная конфигурация , также называемая электронной структурой , расположение электронов на энергетических уровнях вокруг атомного ядра.Согласно более старой модели оболочечного атома, электроны занимают несколько уровней от первой оболочки, ближайшей к ядру, K, до седьмой оболочки, Q, наиболее удаленной от ядра. С точки зрения более совершенной, квантово-механической модели, оболочки K — Q подразделяются на набор орбиталей ( см. Орбиталь ), каждая из которых может быть занята не более чем парой электронов. В таблице ниже указано количество орбиталей, доступных в каждой из первых четырех оболочек.
Британская викторина
Викторина «Все о физике»
Кто был первым ученым, проведшим эксперимент по управляемой цепной ядерной реакции? Какая единица измерения для циклов в секунду? Проверьте свою физическую хватку с помощью этой викторины.
Электронная конфигурация атома в оболочечной атомной модели может быть выражена указанием числа электронов в каждой оболочке, начиная с первого.Например, у натрия (атомный номер 11) 11 электронов распределены в первых трех оболочках следующим образом: оболочки K и L полностью заполнены 2 и 8 электронами соответственно, а оболочка M — только частично заполнен одним электроном.
Электронная конфигурация атома в квантово-механической модели указывается путем перечисления занятых орбиталей в порядке заполнения, причем количество электронов на каждой орбитали указывается надстрочным индексом.В этих обозначениях электронная конфигурация натрия будет 1 с 2 2 с 2 2 p 6 3 с 1 , распределенных по орбиталям как 2-8-1 . Часто используется сокращенный метод, который перечисляет только те электроны, которые превышают конфигурацию благородного газа, непосредственно предшествующую атому в периодической таблице. Например, у натрия на 3 s электронов больше, чем у благородного газа неона (химический символ Ne, атомный номер 10), поэтому его сокращенное обозначение — [Ne] 3 s 1 .
Элементы одной группы в периодической таблице имеют схожую электронную конфигурацию. Например, элементы лития, натрия, калия, рубидия, цезия и франция (щелочные металлы Группы I) имеют электронные конфигурации, показывающие, что один электрон находится на самой внешней (наиболее слабосвязанной) орбитали s . Этот так называемый валентный электрон отвечает за аналогичные химические свойства, присущие вышеупомянутым щелочным элементам в Группе I: яркий металлический блеск, высокая реакционная способность и хорошая теплопроводность.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчасионных соединений | manoa.hawaii.edu/ExploringOurFluidEarth
Электронные оболочки
Электроны находятся в постоянном движении вне ядра атома. Электронная оболочка — это область, в которой движутся электроны (см. Рис. 2.21). Электронные оболочки обозначены номерами от 1 до 7. Каждая оболочка содержит все большее количество электронов, начиная с электронной оболочки 1, которая содержит максимум два электрона (см. Таблицу 2.6).
| Электронная оболочка | Число электронов в оболочке |
|---|---|
| 1 | 2 |
| 2 | 8 |
| 3 | 18 |
| 4 | 32 |
| 5 | 50 |
| 6 | 50 |
| 7 | 50 |
Теоретически электронные оболочки 6 и 7 могут содержать больше электронов, но в известных элементах 50 — это максимальное количество электронов в этих оболочках.
Когда одна оболочка заполняется до предела, электроны добавляются к следующей оболочке. В нейтральном атоме количество отрицательно заряженных электронов равно количеству положительно заряженных протонов.
- Водород (H) с атомным номером один имеет один электрон в оболочке 1 (рис. 2.21 A).
- Кислород (O) с атомным номером восемь имеет в общей сложности восемь электронов, два в оболочке 1 и шесть в оболочке 2 (рис. 2.21 B).
- Натрий (Na) с атомным номером одиннадцать имеет два электрона в оболочке 1, восемь электронов в оболочке 2 и один электрон в оболочке 3.(Рис. 2.21 C).
Когда электронные оболочки меняются от 1 до 7, они увеличиваются в размере и средней энергии. Другими словами, чем дальше оболочка от ядра, тем она больше и тем выше ее средняя энергия. Валентная оболочка — это самая внешняя электронная оболочка атома. В общем, электроны в валентных оболочках определяют, как атом ведет себя в химических реакциях. Например, атомы с полной валентной оболочкой, благородные газы, наименее химически активны.С другой стороны, электроны, у которых есть только один электрон в валентных оболочках (элементы группы 1), или элементы, которым не хватает всего на один электрон, чтобы иметь полную оболочку (группа 17), являются наиболее реактивными.
Ионы
Хотя атомный номер, количество протонов в ядре, никогда не меняется, некоторые электроны легко теряются или приобретаются атомом. Когда атом получает или теряет электрон, атом больше не имеет сбалансированного заряда. Следовательно, атом больше не нейтрален.Ион — заряженный атом. Атом, получивший отрицательно заряженные электроны, становится отрицательным. Отрицательный ион или анион — это атом, который приобрел электроны. Атом, потерявший отрицательно заряженные электроны, становится положительным. Положительный ион или катион — это атом, потерявший электроны.
Неметаллы имеют тенденцию приобретать электроны и становиться анионами. Например, на рис. 2.22 A нейтральный атом кислорода (O) с восемью протонами и восемью электронами получает два электрона.Это дает ему на два отрицательных заряда больше, чем положительных, а общий заряд равен 2–. Металлические элементы имеют тенденцию терять электроны и превращаться в катионы. Например, на рис. 2.22 B нейтральный атом натрия (Na) с 11 протонами и 11 электронами теряет один электрон. Это дает ему на один отрицательный заряд меньше, чем положительных, а общий заряд равен 1+.
Элементы группы 18, благородные газы, очень стабильны (инертны). Это потому, что они имеют полностью полную валентную электронную оболочку.Правило октета гласит, что независимо от того, сколько электронов потенциально может удерживать оболочка, валентная оболочка может содержать только восемь электронов. Благородные газы имеют восемь электронов в валентных оболочках. Другие элементы будут получать или терять электроны для достижения полностью полных валентных оболочек, восемь электронов в валентной оболочке, так что они также будут стабильными. На рис. 2.22 A атом кислорода получил два электрона, так что у него было восемь электронов в оболочке 2, его валентной оболочке. На рис. 2.22 B натрий потерял один электрон, так что у него было восемь электронов в оболочке 2, которая стала его валентной оболочкой.
Периодическая таблица Менделеева может помочь в прогнозировании типа иона, который образует элемент, в зависимости от того, сколько электронов необходимо получить или потерять, чтобы он стал стабильным. Элементы будут получать или терять электроны, чтобы иметь ту же конфигурацию, что и благородный газ, другими словами, чтобы иметь полный октет. Атомы имеют тенденцию набирать или терять наименьшее количество электронов для достижения полного октета. Другими словами, если атом может потерять один электрон или получить семь, чтобы получить полный октет, он потеряет один.
Модели образования ионов
Обычно атомы образуют ионы по следующей схеме:
- Металлы группы 1 имеют только один электрон на валентной оболочке. Они могут отказаться от этого одного электрона и стать 1+. Элементы группы 2 отдают два электрона, чтобы стать 2+, а группа 3 отдают три электрона, чтобы стать 3+.
- Неметаллам Группы 17 нужен всего один электрон, чтобы завершить свою валентную оболочку. Они могут получить один электрон и стать 1–.Элементы группы 16 получают два электрона, чтобы стать 2–, а элементы группы 15 получают три электрона, чтобы стать 3–.
- Все остальные металлические элементы производят по крайней мере один ион с зарядом 2+.
Некоторые элементы могут образовывать ионы с двумя или более разными зарядами. Железо (Fe), например, может образовывать как ион железа с 2+ (Fe 2+ ), так и ион железа с 3+ (Fe 3+ ).
Ионы именования
Нейтральный атом натрия (Na) теряет один электрон с образованием иона натрия (Na + ) с зарядом 1+ (см. Таблицу 2.8). Положительный ион или катион имеет то же имя, что и элемент. Таким образом, существуют ионы натрия (Na + ), а также ионы калия (K + ), ионы кальция (Ca 2+ ) и ионы алюминия (Al 3+ ). Обратите внимание, что если заряд иона равен 1+, символ представляет собой верхний индекс плюс ( + ) без числа 1 (например, Na + ).
| Элемент | Имя элемента | Протоны в нейтральном атоме | Электроны в нейтральном атоме | Количество электронов, полученных или потерянных для достижения октета | Ион образован | Имя иона |
|---|---|---|---|---|---|---|
| Na | Натрий | 11 | 11 | 1 потеряно | Na + (катион) | Ион натрия |
| Класс | Хлор | 17 | 17 | 1 получено | Cl- (анион) | Хлор ide ион |
Нейтральный атом хлора (Cl), который приобретает один электрон, превращается в хлорид-ион (Cl — ) с зарядом 1– (см. Таблицу 2.8). Чтобы назвать отрицательный ион или анион, последняя часть имени атома опускается и заменяется на -ide. Таким образом, существуют ионы хлора (Cl — ), ионы фтора (F — ), ионы сульфида (S 2-) и ионы нитрида (N 3-). Обратите внимание, что если заряд иона равен 1–, символ представляет собой верхний индекс минус (–) без числа 1 (например, Cl –).
Ионные соединения
Ионное соединение — это соединение, образованное ионной связью.Ионная связь происходит посредством процесса, называемого переносом электронов , когда один атом отдает электроны другому. Представьте себе двух щенков. У одного из щенков есть кость (рис. 2.23 А). Щенки представляют собой атомы. Кость представляет собой электрон. Оба щенка нейтральные. Один щенок — вор и крадет кость у другого щенка. Теперь у щенка-вора есть кость (рис. 2.23 B). Щенок, у которого нет кости, потерял свой электрон и теперь заряжен положительно, будет следовать за щенком-вором, у которого есть отрицательный заряд, вокруг, образуя пару щенков.Пара щенков — это ионное соединение (рис. 2.23 C).
При переносе электрона атом одного элемента теряет один или несколько электронов, а атом другого элемента получает эти электроны. Оба атома, участвующие в переносе электрона, становятся ионами. Атом, который получает электроны, становится отрицательно измененным анионом, атом, теряющий электроны, становится положительно заряженным катионом. Противоположные заряды на ионах заставляют ионы связываться или удерживаться вместе за счет электростатических сил.Ионная связь — это связь между ионами, где противоположно заряженные атомы притягиваются друг к другу и нейтрализуют свои заряды с образованием нейтральных соединений.
Информация об электронных оболочках и образовании ионов может быть использована для предсказания того, как элементы будут взаимодействовать с образованием ионных соединений. Например, каждый элемент в группе 1 отдает один электрон, чтобы стать катионом 1+. Каждый элемент в Группе 17 может получить один электрон, чтобы стать анионом 1–. Элементы из групп 1 и 17 могут объединяться с образованием ионных соединений в соотношении один к одному.Следовательно, один катион лития (Li) связывается с одним анионом фтора (F) как фторид лития (LiF). Другими примерами ионных соединений, которые объединяются в соотношении один катион к одному аниону, являются хлорид натрия (NaCl) и иодид калия (KI). Для сравнения, катионы группы 1 (1+) соединяются с анионами группы 16 (2–) в соотношении два к одному. Итак, на каждый анион кислорода приходится два катиона лития, когда они связываются с образованием оксида лития (Li 2 O). Связи между другими элементами в группах 1 и 16 также образуют соотношение два к одному.Их примеры включают оксид калия (K 2 O), сульфид лития (Li 2 S) и сульфид натрия (Na 2 S).
Пример ионной связи с соотношением один к одному показан на рис. 2.24. Атом натрия переносит электрон на атом хлора (рис. 2.24 A). Во время этого процесса натрий потерял электрон, чтобы стать положительным катионом Na + , а хлор приобрел электрон, чтобы стать анионом Cl — (рис. 2.24 B). Затем ион Na + связывается с ионом Cl — за счет электростатических сил.Заряд 1+ натрия уравновешивается зарядом 1– хлора. Полученное соединение хлорида натрия (NaCl) заряжено нейтрально (рис. 2.24 C).
Пример ионной связи с соотношением два к одному показан на рис. 2.25 для магния и хлора. Поскольку каждый атом магния может потерять два электрона, а каждый атом хлора может получить только один электрон, магний должен передать свои два электрона двум атомам хлора. Катион магния (Mg 2+ ) затем связывается с двумя хлорид-анионами (Cl — ).
Соли ионные соединения
Когда большинство людей используют слово «соль», они имеют в виду особый вид соли, хлорид натрия (NaCl). Хлорид натрия — это обычная поваренная соль, которую мы добавляем в пищу. Однако термин «соль» имеет более общее значение в химии; Соли представляют собой ионные соединения, образованные из катионов и анионов, удерживаемых вместе ионной связью.
В кристалле поваренной соли ионы натрия и хлора расположены очень близко друг к другу.Один крошечный кристалл поваренной соли может состоять из миллиарда триллионов ионов. Ионы натрия и хлора в поваренной соли расположены очень близко друг к другу, их расположение образует кристалл в форме куба. В других солях ионы могут располагаться по-разному с образованием кристаллов разной формы (рис. 2.26).
Химические облигации
Химические связи
Внимательное изучение периодической таблицы покажет, что атомы всех элементов в последнем столбце таблицы (т.е. гелий, неон, аргон и т. д.) имеют 8 электронов на своих внешних оболочках (за исключением гелия), следовательно, их внешние электронные оболочки заполнены. Все эти элементы являются газами, и все они стабильны, что означает, что они не вступают в реакцию с другими элементами. Химики часто ссылаются на «правило восьми», которое гласит, что если во внешней электронной оболочке 8 электронов, элемент стабилен. Атомы всех других элементов имеют вакансии во внешних электронных оболочках и будут реагировать с другими атомами, заполняя свои внешние оболочки.В следующих разделах описаны некоторые важные процессы, благодаря которым атомы становятся стабильными. Процессы, приводящие к заполнению внешних электронных оболочек, приводят к образованию химических связей. В некоторых случаях это связано с образованием молекул. Молекулы представляют собой два или более атома, удерживаемых вместе за счет обмена электронами (описано ниже). Молекулы, состоящие более чем из одного типа элементов, также можно назвать соединениями . Следовательно, H 2 (один и тот же элемент) — это молекула, а H 2 O (разные элементы) — это и молекула, и соединение.
Ионные связи
Чтобы объяснить, как образуются ионные связи, мы будем использовать обычную поваренную соль NaCl в качестве примера. У натрия атомный номер 11, следовательно, у натрия есть один электрон во внешней электронной оболочке. С другой стороны, хлор имеет атомный номер 17 и 7 электронов на внешней оболочке. Когда эти два элемента вступают в реакцию, натрий отдает один электрон в своей внешней оболочке хлору. На внешней оболочке натрия теперь 8 электронов, и он стабилен. Однако в результате потери одного электрона у натрия остается на один протон больше, чем на электрон, и, следовательно, теперь это ион с электрическим зарядом +1.Ион — это атом, который имеет общий заряд + или -. Ионы, которые имеют чистый положительный заряд, называются катионами , . Хлор захватил один электрон, и теперь его внешняя электронная оболочка также заполнена и в процессе превратился в ион с зарядом -1 (на один электрон больше, чем протонов). Ионы, которые имеют общий отрицательный заряд, называются анионами (подумайте о термине анион как об акрониме, обозначающем a n egative ion ). Противоположные заряды на этих ионах создают притяжение, которое удерживает их вместе.Мы называем это притяжение ионной связью . На рис. 3 показано образование ионов натрия и хлорида. Изменив электронную конфигурацию этих двух элементов, их химические свойства резко изменились. Нам необходим NaCl (Na + и Cl — ) для правильного функционирования нашего организма, но и натрий, и хлор с разными электронными конфигурациями могут быть смертельными. Газообразный хлор, Cl 2 , является смертельным ядом, а элементарный натрий (без заряда) — это металл, который воспламеняется при помещении в воду.Это подчеркивает важность утверждения выше, что химические свойства элемента определяются его электронной конфигурацией.
Также важно отметить, что ионные связи не образуют четкого взаимно однозначного притяжения между ионами, поэтому технически ионные связи не образуют молекулы. Вместо этого они образуют кристаллические структуры, в которых каждый анион притягивается ко всем находящимся рядом катионам, а каждый катион притягивается ко всем находящимся рядом анионам. Даже в этом случае вы можете прочитать или услышать, что NaCl упоминается как молекула / соединение.
изображение создано студенткой BYU-I Ханной Краудер Осень 2013 г.
На изображении выше в верхнем левом углу показано образование ионной связи. Натрий отдает один электрон и становится положительно заряженным ионом натрия. При этом его внешняя электронная оболочка теперь имеет 8 электронов. Хлор получает один электрон и становится отрицательно заряженным хлорид-ионом с 8 электронами на внешней оболочке. Вверху справа — отрицательно заряженные ионы хлорида притягиваются к положительно заряженным ионам натрия, образуя ионную связь.Внизу — кристалл хлорида натрия. Каждый ион натрия (фиолетовый) притягивается всеми ионами хлора (зеленый), которые его окружают, а каждый ион хлора притягивается всеми ионами натрия, которые его окружают.
Ковалентные облигации
Другой способ, которым атомы могут заполнить свои внешние электронные оболочки, — это делиться электронами. Например, водород имеет атомный номер 1 и, следовательно, имеет 1 электрон на внешней электронной оболочке. Чтобы заполнить эту оболочку, водороду нужен еще один электрон (напомним, что первая электронная оболочка будет содержать максимум 2 электрона).Один из способов заполнения этой оболочки — объединение двух атомов водорода в молекулу путем обмена электронами друг с другом. Этот тип связи, образованный обменом электронов, называется ковалентной связью . Химическое сокращение для ковалентной связи — это просто прочерк, поэтому молекула, представленная на рисунке 6, может быть выражена как H-H, где штрих представляет собой общие электроны. Обратите внимание, что равное распределение электронов не приводит к тому, что ни один из атомов имеет неравное количество электронов и протонов, следовательно, нет чистого — или + заряда.Кроме того, в отличие от ионных связей, которые образуют кристаллы, ковалентные связи создают тесные отношения между двумя атомами, то есть эти два атома напрямую связаны друг с другом. Вы можете думать об ионных связях как о групповом свидании или тусовке, а о ковалентных связях как о браке. Изображение ниже представляет ковалентную связь между двумя атомами водорода.
изображение создано MG Fall 2013
Ковалентные связи также могут быть образованы путем совместного использования более чем одной пары электронов.Например, кислород имеет атомный номер 8 с 6 электронами на внешней электронной оболочке. Два атома кислорода объединятся в газообразный кислород, O 2 , разделяя две пары электронов, таким образом завершая внешнюю оболочку обоих атомов кислорода. Мы называем это двойной ковалентной связью и обозначаем его двумя штрихами, O = O, причем каждый штрих снова представляет пару общих электронов. Следует отметить, что тройные ковалентные связи также возможны при разделении трех пар электронов, однако в соединениях, которые мы будем изучать, ни одно из них не имеет тройных ковалентных связей .
В зависимости от атомов, участвующих в ковалентных связях, электроны могут либо распределяться поровну, либо электроны могут проводить больше времени с одним партнером, чем с другим, что приводит к неравному распределению электронов. Две молекулы показаны на рисунке ниже. Метан — это изображение слева, это газ, состоящий из одного углерода и 4 атомов водорода. В этой молекуле электроны поровну распределяются между углеродом и каждым водородом, образуя неполярных ковалентных связей .Другое изображение справа — это вода. В этой молекуле отрицательно заряженные электроны сильнее притягиваются к кислороду и, следовательно, проводят больше времени с кислородом, чем с водородом. Это создает молекулу, которая имеет небольшой отрицательный заряд на одном конце (конец кислорода) и небольшой положительный заряд на другом конце (конец водорода). Поскольку молекула имеет противоположно заряженные концы, мы называем этот тип связи полярной ковалентной связью . Обратите внимание, что общий заряд молекулы равен 0, но концы заряжены.Полярные ковалентные связи и ионные связи похожи в том, что электроны отталкиваются от одного атома и толкаются к другому. Разница в том, что с ионными связями электроны полностью удаляются от одного атома, образующего катион, и захватываются другим атомом, образующим анион.
изображение создано студенткой BYU-I Ханной Краудер Осень 2013 г.
Водородные связи
изображение создано студенткой BYU-I Ханной Краудер Осень 2013 г.
Еще одно важное взаимодействие в биологических системах называется водородной связью .На самом деле это не связь, которая образует молекулы или ионные кристаллы; скорее это взаимодействие между молекулами, содержащими полярные ковалентные связи. Из-за этого она упоминается как межмолекулярная сила , или притяжение между двумя молекулами. Водородные связи могут возникать только между молекулами, содержащими полярные ковалентные связи, и являются результатом притяжения между противоположно заряженными концами этих молекул. Обратите внимание, что водородные и ионные связи подобны. Разница в том, что ионные связи создаются притяжением между противоположно заряженными ионами, а водородные связи — притяжениями между противоположно заряженными концами полярных ковалентных молекул.Хотя водородные связи очень слабы по сравнению с другими связями, которые мы обсуждали, они играют важную роль во многих соединениях, которые мы будем изучать в этом классе. Например, большинство важных характеристик воды обусловлено ее способностью образовывать водородные связи между собой и другими полярными молекулами. Точно так же сложные структуры белков и нуклеиновых кислот в значительной степени зависят от водородных связей.
** Вы можете использовать кнопки ниже, чтобы перейти к следующему или предыдущему чтению в этом модуле **
Распечатать эту страницуWebElements Periodic Table »Натрий» Свойства свободных атомов
Атомы натрия имеют 11 электронов, а структура оболочки : — 2.8.1.
Электронная конфигурация основного состояния газообразного нейтрального натрия в основном состоянии равна [ Ne ]. 3s 1 и символ термина равен 2 S 1/2 .
Схематическая электронная конфигурация натрия. Оболочечная структура Косселя натрия.Атомный спектр
Представление атомного спектра натрия.
Энергии ионизации и сродство к электрону
Сродство натрия к электрону равно 52.8 кДж моль ‑1 . Энергии ионизации натрия приведены ниже.
| Число энергии ионизации | Энтальпия / кДж моль ‑1 |
|---|---|
| 1-й | 495,85 |
| 2-й | 4562,44 |
| 3-й | 6910,28 |
| 4-й | 9545,87 |
| 13357 | |
| 5-й | 0|
| 6-й | 16617,7 |
| 7-й | 20117,6 |
| 8-й | 25490,6 |
| 9-й | 28931.7 |
| 9022 | |
| 9022 |
Эффективные ядерные заряды
Ниже приведены эффективные ядерные заряды «Клементи-Раймонди», Z eff .Для получения более подробной информации и графиков в различных форматах перейдите по гиперссылкам.
| 1 с | 10,6259 | ||||||
|---|---|---|---|---|---|---|---|
| 2 с | 6,57 | 2 пол | 6,80 | ||||
| 3с | 2,51 | 3п | (нет данных) | 3d | (нет данных) | ||
| 4s | (нет данных) | 4p | (нет данных) | 4д | (нет данных) | 4f | (нет данных) |
| 5s | (нет данных) | 5p | (нет данных) | 5д | (нет данных) | ||
| 6с | (нет данных) | 6p | (нет данных) | ||||
| 7с | |||||||
Список литературы
Эти эффективные ядерные заряды, Z eff , взяты из следующих ссылок:
- E.Clementi and D.L.Raimondi, J. Chem. Phys. 1963, 38 , 2686.
- Э. Клементи, Д.Л. Раймонди, В.П. Reinhardt, J. Chem. Phys. 1967, 47 , 1300.
Энергии связи электрона
| Этикетка | Орбитальная | эВ [ссылка на литературу] |
|---|---|---|
| K | 1s | 1070,8 [3] |
| L I | 2s | 63,5 [3] |
| L II | 2p 1/2 30,4 [3] | |
| L III | 2p 3/2 | 30,5 [2] |
Примечания
Я благодарен Гвину Уильямсу (Лаборатория Джефферсона, Вирджиния, США), которая предоставила данные об энергии связи электронов.Данные взяты из ссылок 1-3. Они сведены в таблицы в другом месте в Интернете (ссылка 4) и в бумажной форме (ссылка 5).
Список литературы
- Дж. А. Бирден и А. Ф. Берр, «Переоценка рентгеновских уровней атомной энергии», Rev. Mod. Phys. , 1967, 39 , 125.
- М. Кардона и Л. Лей, ред., Фотоэмиссия в твердых телах I: Общие принципы (Springer-Verlag, Берлин) с дополнительными исправлениями, 1978 г.
- Gwyn Williams WWW таблица значений
- Д.Р. Лиде (ред.) В справочнике по химии и физике Chemical Rubber Company , CRC Press, Бока-Ратон, Флорида, США, 81-е издание, 2000 г.
- J. C. Fuggle и N. Mårtensson, «Энергии связи на уровне ядра в металлах», J. Electron Spectrosc. Relat. Феном. , 1980, 21 , 275.
Скрипт
Образование химической связи
ВВЕДЕНИЕ
Если мы придерживаемся чисто механистического взгляда на жизнь, мы можем рассматривать каждую живую клетку как сложную сеть химических реакций.Атомы соединяются с другими атомами, образуя молекулы, а затем снова рекомбинируют во время других химических реакций, образуя другие молекулы. Эти химические реакции лежат в основе структуры и метаболизма клетки.
В сопровождающей анимации мы исследуем химические связи, которые представляют собой силы притяжения между атомами. Мы сосредоточимся, в частности, на роли электронов в химических связях. Поведение электронов объясняет большинство аспектов взаимодействия атомов друг с другом в живом и неживом мире.
СЦЕНАРИЙ АНИМАЦИИ
Электронные оболочки и химическая реакционная способность
Химическая реакционная способность атома основана на количестве электронов, которые атом содержит в своей внешней электронной оболочке. Электронные оболочки изображены здесь в виде кругов вокруг ядер атомов. Каждая оболочка содержит электроны с определенными уровнями энергии.
Рассмотрим электронные оболочки элемента аргон.Первая электронная оболочка содержит всего два электрона. Это электроны на самом низком энергетическом уровне, оболочка, которую электроны атома заполняют первыми. Каждая из следующих двух оболочек может содержать по восемь электронов. Третья и самая внешняя оболочка аргона уже заполнена до отказа, что делает этот элемент крайне инертным или инертным.
У хлора также есть электроны в трех электронных оболочках, но его третья оболочка содержит только семь электронов. В химических реакциях хлор имеет тенденцию приобретать электрон, заполняя эту оболочку восемью электронами.Эта тенденция к заполнению внешней электронной оболочки восемью электронами известна как правило октетов.
У натрия есть электроны в трех электронных оболочках, но его внешняя оболочка содержит только один электрон. Натрий не может получить семь дополнительных электронов для завершения этой оболочки — это потребует огромного количества энергии. Вместо этого натрий имеет тенденцию терять свой внешний электрон, оставляя этот атом с двумя заполненными внутренними оболочками.
В общем, элементы с заполненными внешними оболочками инертны, но атомы всех других элементов химически активны и могут образовывать химические связи с другими атомами.Химическая связь — это сила притяжения между атомами. Формирование связи зависит от способности атомов делиться, отдавать или получать электроны от других атомов.
Давайте исследуем природу химической связи на примере атомов водорода. Два атома изображены со своими электронными оболочками. Два других изображены более реалистично, показывая область пространства вокруг ядра, где электрон с большой вероятностью будет обнаружен. Эта область — орбиталь электрона.
Если два атома водорода приближаются друг к другу, положительно заряженное ядро одного притягивается к отрицательно заряженному электрону другого. Орбитали сливаются, и электроны в равной степени притягиваются к обоим ядрам и разделяются ими. Богатая электронами область между ядрами связывает атомы вместе.
Ковалентные облигации
Ковалентная связь возникает, когда два атома разделяют электроны. В случае двух атомов водорода каждый из них разделяет свой единственный электрон с другим.Это совместное использование позволяет каждому заполнить свою электронную оболочку двумя электронами. Пара общих электронов образует ковалентную одинарную связь.
Давайте теперь рассмотрим кислород, атом с восемью электронами. Два электрона заполняют самую внутреннюю оболочку, а остальные шесть электронов находятся в следующей оболочке. Этой внешней оболочке нужны еще два электрона для завершения (правило октетов). Два атома кислорода образуют ковалентную двойную связь, разделяя две пары электронов из своих внешних оболочек.
Углерод, пожалуй, самый универсальный элемент на Земле, во многом потому, что он содержит только четыре электрона в оболочке, которая может вместить восемь.Чтобы заполнить свою внешнюю оболочку, углерод образует четыре ковалентные связи с четырьмя другими атомами.
В молекуле метана углерод делит электроны с атомами водорода, образуя четыре ковалентные одинарные связи. Хотя эта молекула относительно проста, углерод часто составляет основу больших сложных молекул. Поскольку каждый атом углерода может связываться с четырьмя другими атомами, молекулы на основе углерода невероятно разнообразны.
Тройные связи встречаются редко, но молекулы газообразного азота (самая распространенная молекула в воздухе, которым мы дышим) образуют тройные связи.Два атома азота разделяют три пары электронов, что позволяет каждому иметь по восемь электронов на внешней электронной оболочке.
Полярность и водородная связь
В ковалентной связи два атома могут иметь одинаковые или неодинаковые электроны. В случаях, когда оба атома принадлежат одному и тому же элементу, например, в молекулярном водороде или молекулярном кислороде, электроны делятся поровну между каждым атомом. Распределение между атомами разных элементов может быть неравным, например, атомами углерода и водорода этана или атомами водорода и кислорода этанола.
Для этих молекул нам нужно рассмотреть концепцию, называемую электроотрицательностью, то есть способность атома притягивать электроны. Кислород имеет высокую электроотрицательность, что означает, что он сильно притягивает электроны. Водород имеет гораздо более низкую электроотрицательность. Общие электроны притягиваются ближе к атому кислорода этанола.
Поскольку кислород притягивает отрицательно заряженные электроны ближе к себе, он становится слегка отрицательным по заряду, обозначенный δ-.Водород, который не так плотно удерживает электроны, становится слегка положительным по заряду, обозначенный знаком δ +. Ковалентная связь, в которой электроны не разделены поровну, является полярной ковалентной связью.
Теперь рассмотрим ковалентные связи в этане. Все связи образуются между углеродом и водородом, которые имеют одинаковую низкую электроотрицательность и почти одинаково притягивают общие электроны. Ни один атом в этане не получает значительного частичного заряда. Связи между атомами представляют собой неполярные ковалентные связи.
Полярная природа связи между кислородом и водородом в этаноле приводит к образованию полярной молекулы, которая может взаимодействовать с другими полярными молекулами. Водород с частичным положительным зарядом притягивается к атому с частичным отрицательным зарядом другой полярной молекулы, например воды. Такого рода притяжение — водородная связь.
Структура многих молекул, а также их способность растворяться в воде основаны на способности образовывать водородные связи.Например, молекула ДНК состоит из двух цепей атомов. Связи внутри каждой нити ковалентны, но две нити связаны друг с другом посредством водородных связей.
Ионные связи
Способность атома притягивать электроны — его электроотрицательность — может быть настолько сильной, что атом не разделяет электроны с другими атомами, а вместо этого отрывает электроны от других атомов. Хлор имеет высокую электроотрицательность, тогда как натрий имеет очень низкую электроотрицательность.
Поскольку натрий имеет низкую электроотрицательность, он очень слабо удерживает свой внешний электрон и легко теряет его из-за хлора. Когда это происходит, хлор заполняет свою внешнюю оболочку восемью электронами, становясь отрицательно заряженными. Натрий теряет свой электрон и становится положительно заряженным.
Атомы, которые потеряли или приобрели электроны, называются ионами. Положительные ионы (катионы) и отрицательные ионы (анионы) образуют ионные связи за счет электрического притяжения.В твердой форме ионные связи между ионами натрия и хлорида очень сильны, потому что ионы расположены так близко друг к другу. Эти ионы составляют поваренную соль.
Ионные связи могут разрушаться в воде. Частичные заряды на молекулах воды притягиваются к полным ионным зарядам на ионах. Когда твердое вещество растворяется, оно распадается на отдельные ионы, каждый из которых окружен сферой из молекул воды.
ЗАКЛЮЧЕНИЕ
Два основных свойства влияют на то, как образуются связи между атомами.Во-первых, состояние внешней электронной оболочки атома определяет, является ли атом реактивным. Гелий и неон имеют внешние оболочки, полностью заполненные электронами, и по этой причине эти атомы инертны. Однако если атом имеет частично заполненную внешнюю оболочку, он имеет тенденцию образовывать связи с другими атомами. Второе главное свойство — это электроотрицательность атома, которая влияет на типы связей, которые формирует атом. Если два атома имеют одинаковую электроотрицательность, они имеют тенденцию делить электроны поровну в неполярных ковалентных связях.Однако, если электроотрицательности различаются, то атомы имеют тенденцию образовывать полярные ковалентные связи или ионные связи.
Связи между атомами в молекулах также влияют на то, как эти молекулы взаимодействуют с другими молекулами. Например, если молекула содержит полярные ковалентные связи, то сама молекула, вероятно, полярна. Полярная молекула может образовывать водородные связи с молекулами воды и, следовательно, растворяться в водянистой среде клетки. После растворения он может легче находить и взаимодействовать с другими молекулами и, таким образом, участвовать в метаболизме клетки.Водородные связи также важны, потому что они удерживают вместе области больших молекул, таких как ДНК или белки, поддерживая форму и функции этих важных биомолекул.
