«Человеческая электростанция»: как работают молекулярные станки в клетках
Каждая наша клетка представляет собой цех, наполненный станками. Станки вмонтированы в мембраны митохондрий — микроскопических энергетических центров. Они служат для производства АТФ (аденозинтрифосфат) — это «человеческий бензин», на котором работает весь наш организм. Сотни триллионов митохондрий ежесекундно «гудят» от «рева» проворачивающихся робототехнических устройств на протонной тяге. В маленькую дырочку попадает фосфат, который проваливается в контейнер, за счет электрического тока протонов приобретает там новые химические свойства, а потом вываливается в шланг, по которому поступает внутрь митохондрии для присоединения к другим фосфатам для образования молекулы АТФ.
Неужели эта промышленная картина может быть частью нашего организма? И откуда в наших клетках эти «станки»? И как там оказываются протоны? И неужели устройства, напоминающие круговые двери в супермаркетах, могут в количестве миллионов штук «населять» нас изнутри?
Все эти вопросы, а также ответы на них родились у микробиологов и биофизиков, которые хотели понять, как разнообразная еда, поглощаемая человеком, превращается в вещество, снабжающее энергией каждую нашу мышцу.
Потом глюкоза попадает в клетку. Там она распадается пополам на две составляющие — и в таком виде (это называется пируват) попадает в митохондрию.
Митохондрии — это обязательная часть клеток большинства живых организмов — животных, растений, грибов. По одной из версий, митохондрии когда-то были самостоятельными организмами и жили отдельно от нас, поэтому до сих пор сохранили свой геном (митохондриальный). То есть в каждой клеточке любого человека сидит существо со своим геномом! Но в какой-то момент, еще в древности, они слились с нашими клетками, обеспечивая им переработку пищи в энергию.
Итак, попадая в митохондрию, пируваты — части глюкозы (в цикле Кребса) последовательно окисляются.
Неподалеку в митохондрии плавает никотинамидадениндинуклеотид (NAD), у которого энергия окисления при переходе на эту молекулу вызывает отщепление протона.
Вот! Наконец-то в сложной схеме превращений возник тот самый протон, который необходим для синтеза молекулы АТФ. На нашей главной иллюстрации эти протоны носятся в быстром темпе над мембраной митохондрии, прежде чем попасть в «станок». На самом деле, до последнего времени не было понятно, как именно они туда попадают. Ведь эти протоны могут уплывать куда им вздумается! Однако почему-то они держатся около мембраны, «кучкуясь» прямо у входа в круговые ворота «станка». Российские ученые НИТУ «МИСиС» в кооперации с австрийскими коллегами из Института биофизики Университета имени Иоганна Кеплера (Линц), проведя филигранные эксперименты, теперь знают, почему же так получается.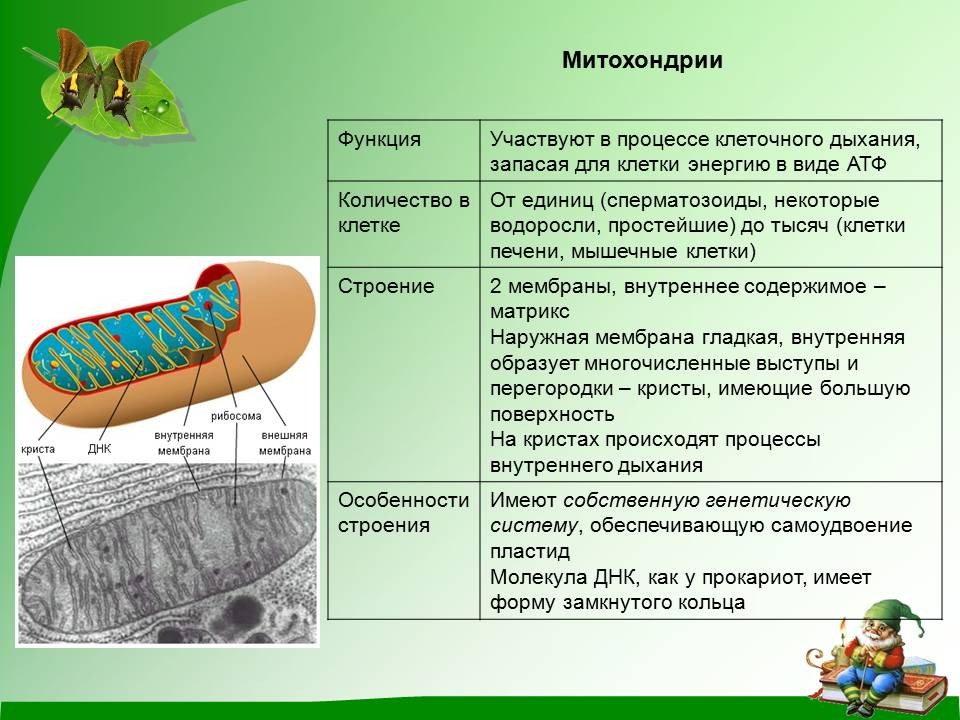
Поясняет сотрудник кафедры теоретической физики и квантовых технологий НИТУ «МИСиС» Сергей Акимов: «Протоны, двигаясь внутри митохондрии, пребывают в воде. Известно, что молекула воды (h3O) состоит из двух атомов водорода (h2) и одного атома кислорода (O16). Помимо химической связи внутри одной молекулы воды, эти атомы могут образовывать слабые связи с соседними молекулами воды, называемые водородными связями. Вблизи поверхности мембраны эти связи в молекуле воды образуются особым образом, поскольку с одной стороны находится вода, с другой — „стенка“. Водородные связи вблизи мембраны другие, у них другое число, другая структура. Именно их протон и использует в качестве „рельсов“ для продвижения вперед вдоль мембраны. Наше исследование показало, что ему „нравится“ эта структура, он не уплывает вглубь митохондрии, а аномально быстро носится вдоль мембраны».
Так происходит «захват» протонов для образования самой главной энергетической молекулы нашего тела — АТФ. Они используются для любого нашего движения, поддержания температуры тела и так далее. АТФ представляет собой универсальный «аккумулятор», поставляющий энергию для большинства реакций, происходящих в клетке. Таким образом обеспечивается синтез белков, углеводов, жиров, движение жгутиков и ресничек, транспорт веществ, избавление клетки от отходов. При расщеплении АТФ — разрядке «аккумулятора» — выделяется нужная нам энергия.
Они используются для любого нашего движения, поддержания температуры тела и так далее. АТФ представляет собой универсальный «аккумулятор», поставляющий энергию для большинства реакций, происходящих в клетке. Таким образом обеспечивается синтез белков, углеводов, жиров, движение жгутиков и ресничек, транспорт веществ, избавление клетки от отходов. При расщеплении АТФ — разрядке «аккумулятора» — выделяется нужная нам энергия.
Полученные результаты фундаментального исследования приближают ученых к пониманию глобальных механизмов генерации энергии в клетках, а также открывают перспективы перед фармакологией. Результаты работы могут быть использованы для разработки препаратов, нейтрализующих действие разобщительных ядов, а также для профилактики заболеваний, связанных с гиперфункцией щитовидной железы. При этих патологиях в митохондриях накапливаются так называемые вещества-разобщители — слабые жирорастворимые кислоты, которые эффективно связывают протоны, что приводит к общему снижению синтеза АТФ. Новые знания, полученные российскими учеными, позволяют понимать, что нужно сделать для того, чтобы восстановить энергию человека на уровне каждой клетки.
Митохондрии | Cell Biology.ru
Митохондрии (от греч. mitos– нить, chondrion- зернышко) — органеллы эукариотических клеток, обладающие собственной ДНК и выполняющие функцию синтеза АTP.Размеры и форма митохондрий сильно варьирует у разных видов. Обычно ширина ~0,5 мкм, длина 7-60 мкм.
Митохондрии подвижные, пластичные, постоянно изменяют форму, могут ветвиться, сливаться друг с другом, и расходится. Перемещение митохондрий связано с микротрубочками.
В культуре клеток эндотелия сердца головастика ксенопуса наблюдали до 40 случаев слияния и деления митохондрий за 1 час.
Митохондрии расположены около мест высокого потребления АТФ (между миофибриллами в сердечной мышце, вокруг жгутика сперматозоида).
Число митохондрий зависит от потребности клетки в энергии, чем больше потребность, тем больше митохондрий в клетке и тем более они развиты.

Сложная форма митохондрий затрудняет их микроскопическое исследование. На срезе одна извитая митохондрия может быть представлена
В некоторых клетках имеется одна сильно разветвленная митохондрия (одноклеточные зеленые водоросли Polytomella, Engiena, Chlorella). Длинные ветвящиеся митохондрии были описаны в клетках культуры ткани млекопитающих, в клетках многих растений как в нормальных, так и в анаэробных условиях.
В последнее время стал широко применяться для изучения свойств митохондрий флуорохром родамин. Этот краситель обладает способностью люминисцировать в фиолетовом свете, если он связывается с мембранами активных митохондрий. При этом в люминисцентном микроскопе видна единая митохондриальнвя система – митохондриальный ретикулум.

Печеночную клетку приходится около 200 митохондрий. Это составляет более 20% от общего объема цитоплазмы и около 30-35% от общего
количества белка в клетке. Площадь поверхности всех митохондрий печеночной клетки в 4-5 раз больше поверхности ее плазматической мембраны. Больше всего митохондрий в ооцитах (около 300000) и у гигантской амебы Chaos chaos (до 500000).
В клетках зеленых растений число митохондрий меньше, чем в клетках животных, так как часть их функций могут выполнять хлоропласты. В спермиях часто присутствуют гигантские митохондрии, спирально закрученные вокруг осевой части жгутика.
Отсутствуют митохондрии у кишечных энтамеб, живущих в условиях анаэробиоза, и у некоторых других паразитических простейших.
Обычно митохондрии скапливаются вблизи тех участков цитоплазмы, где возникает потребность в АТФ, образующейся в митохондриях. Так, в скелетных мышцах митохондрии находятся вблизи миофибрилл. В сперматозоидах митохондрии образуют спиральный футляр вокруг оси жгутика; вероятно, это связано с необходимостью использования АТФ для движения хвоста сперматозоида.

у простейших и в других клетках, снабженных ресничками, митохондрии локализуются непосредственно под клеточной мембраной у основания ресничек, для работы которых необходим АТФ. В аксонах нервных клеток митохондрии располагаются около синапсов, где происходит процесс передачи нервного импульса.
Строение митохондрий.
Внешняя мембрана
Внутренняя мембрана
Матрикс м-на, матрикс, кристы. она имеет ровные контуры, не образует впячиваний или складок. На нее приходится около 7% от площади всех клеточных мембран. Ее толщина около 7 нм, она не бывает связана ни с какими другими мембранами цитоплазмы и замкнута сама на себя, так что представляет собой мембранный мешок. Наружнюю мембрану от внутренней отделяет межмембранное пространство шириной около 10-20 нм. Внутренняя мембрана (толщиной около 7 нм) ограничивает собственно внутреннее содержимое митохондрии,
ее матрикс или митоплазму.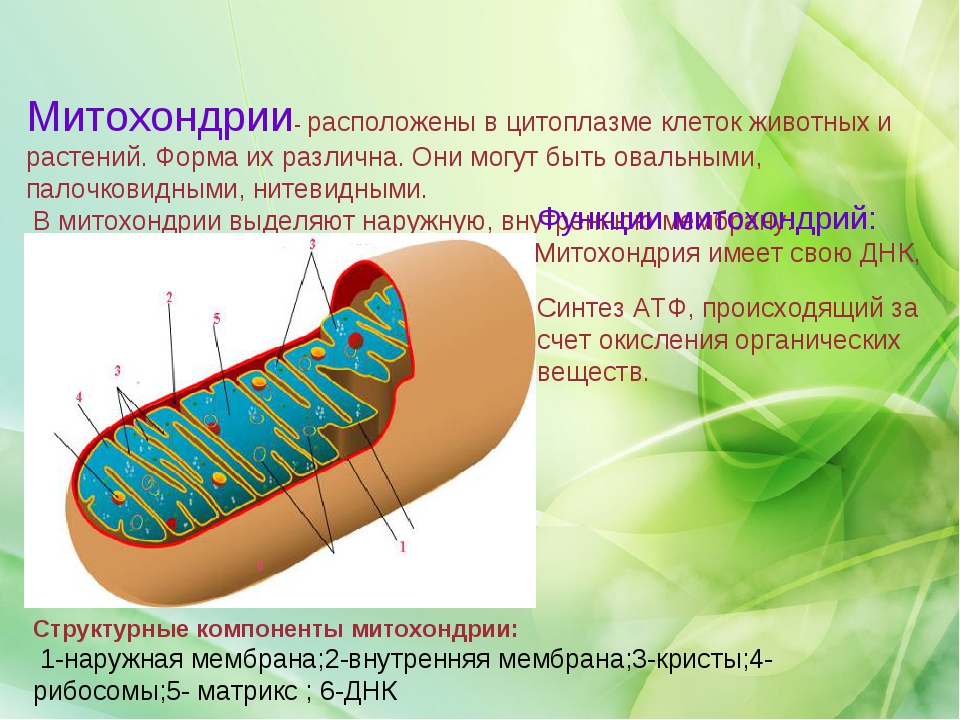 Характерной чертой внутренней мембраны митохондрий является их способность образовывать многочисленные впячивания внутрь митохондрий. Такие впячивания чаще всего имеют вид плоских гребней, или крист. Расстояние между мембранами в кристе составляет около 10-20 нм. Часто кристы могут ветвиться или образовывать пальцевидные отростки, изгибаться и не иметь выраженной ориентации. У простейших, одноклеточных водорослей, в некоторых клетках высших растений и животных выросты внутренней мембраны имеют вид трубок (трубчатые кристы).
Характерной чертой внутренней мембраны митохондрий является их способность образовывать многочисленные впячивания внутрь митохондрий. Такие впячивания чаще всего имеют вид плоских гребней, или крист. Расстояние между мембранами в кристе составляет около 10-20 нм. Часто кристы могут ветвиться или образовывать пальцевидные отростки, изгибаться и не иметь выраженной ориентации. У простейших, одноклеточных водорослей, в некоторых клетках высших растений и животных выросты внутренней мембраны имеют вид трубок (трубчатые кристы).
Матрикс митохондрий имеет тонкозернистое гомогенное строение, в нем иногда выявляются тонкие собранные в клубок нити (около 2-3 нм) и гранулы около 15-20нм. Теперь стало известно, что нити матрикса митохондрий представляют собой молекулы ДНК в составе митохондриального нуклеоида, а мелкие гранулы – митохондриальные рибосомы.
Функции митохондрий
1. В митохондриях происходит синтез ATP (см. Окислительное фосфорилирование)
pH межмембранного пространства ~4, pH матрикса ~8 | содержание белков в м: 67% — матрикс, 21% -наруж м-на, 6% — внутр м-на и 6% — в межм-ном пр-ве
Хандриома – единая система митохондрий
наружная м-на: порины-поры позволяют проходить до 5 kD | внутренняя м-на: кардиолипин-делает непроницаемой м-ну для ионов |
межм-ное пр-во: группы ферментов фосфорилируют нуклеотиды и сахара нуклеотидов
внутренняя м-на:
матрикс: метаболические ферменты – окисление липидов, окисление углеводов, цикла трикарбоновых к-т, цикла Кребса
Происхождение от бактерий: амеба Pelomyxa palustris единств из эукариот не содержит м.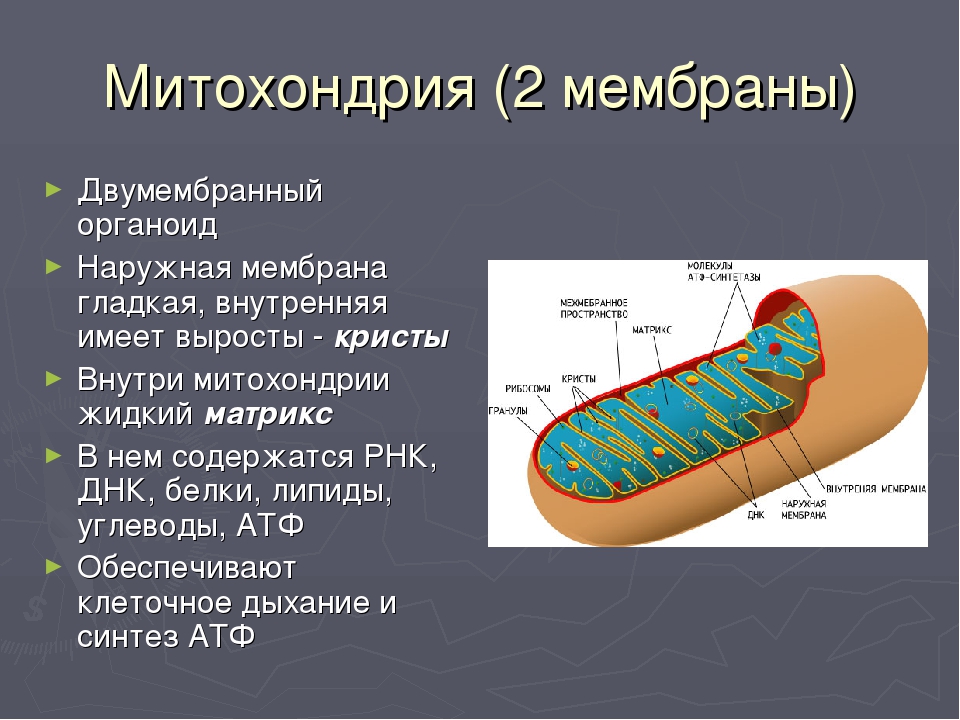 , живет в симбиозе с аэробными бактериями | собственная ДНК | схожие с бактериями оx процессы
, живет в симбиозе с аэробными бактериями | собственная ДНК | схожие с бактериями оx процессы
Митохондриальная ДНК
Деление миохондрий
реплицируется
в интерфазе | репликация не связана с S-фазой | во время кл цикла митох один раз делятся надвое, образуя перетяжку, перетяжка сначала на внутр м-не | ~16,5 kb | кольцевая, кодирует 2 рРНК 22 тРНК и 13 белков |
транспорт белков: сигнальный пептид | амфифильный завиток | митохондриальный распознающий рецептор |
Окислительное фосфорилирование
Цепь переноса электронов
АТР-синтаза
в кл печени, м живут ~20 дней деление митохондрий путем образования перетяжки
16569пн=13белков,22тРНК,2pРНК | гладкая внешняя м-на (порины – проницаемость белков до 10 кДа) складчатая внутренняя (кристы) м-на (75% -белков: транспортные белки-переносчики, ф-ты, компаненты дыхат. цепи и АТФ-синтаза, кардиолипин) матрикс (обогащен ф-тами цитратного цикла) межм-ное пр-во
Чужие внутри нас (возможно, папины).
 Оказывается, митохондрии все-таки могут наследоваться от отца. А чего еще мы не знаем о митохондриях?
Оказывается, митохондрии все-таки могут наследоваться от отца. А чего еще мы не знаем о митохондриях?Откуда ты взялась?
Митохондрия когда-то была бактерией, но примерно 2 500 миллионов лет назад ее проглотил предок эукариотической (то есть содержащей ядро) клетки, и с тех пор они живут с нами. Точнее — в нас. Так гласит теория симбиогенеза, которой в прошлом году исполнилось 50 лет. Ее подтверждают многие особенности строения митохондрий — например, у них две мембраны разного состава (снаружи — клеточная, а под ней еще одна — бактериальная). А если забраться под них, то внутри можно найти характерные для бактерий рибосомы (они меньше, чем эукариотические) и свернутую в кольцо ДНК. Впрочем, никто не знает точно, как именно и зачем бактерия — будущая митохондрия — оказалась внутри клетки. Возможно, такое сожительство было чем-то выгодно для обеих.
Недавно ученые взяли дрожжи (эукариот) и кишечную палочку (прокариот) и заставили первых проглотить вторую. Правда, для этого пришлось сделать так, чтобы они не могли выжить друг без друга. Бактерий лишили гена, отвечающего за производство витаминов, а дрожжам удалили митохондрии, чтобы они не могли получать энергию. Гибридные клетки, образовавшиеся после поглощения бактерий, были вполне жизнеспособны. Однако это лишь модель, и мы все еще не знаем, каким путем двигалась эволюция на самом деле.
Правда, для этого пришлось сделать так, чтобы они не могли выжить друг без друга. Бактерий лишили гена, отвечающего за производство витаминов, а дрожжам удалили митохондрии, чтобы они не могли получать энергию. Гибридные клетки, образовавшиеся после поглощения бактерий, были вполне жизнеспособны. Однако это лишь модель, и мы все еще не знаем, каким путем двигалась эволюция на самом деле.
Куда ты подевала гены?
За то время, что эукариотическая клетка и митохондрия живут вместе, они окончательно лишились своей автономности. И если без энергии, поставляемой митохондриями, клетка существовать может (хотя полностью безмитохондриальных эукариот все равно мало), то бывшая бактерия превратилась в полностью зависимое от хозяина существо. В геноме наших, человеческих, митохондрий, осталось всего 37 генов, остальные же либо потерялись за ненадобностью, либо перекочевали в ядро. Как именно гены перемещались по клетке, точно никто не знает — мы можем только догадываться.
Не ты ли меня старишь?
Теорий старения люди успели придумать несколько сотен, из них множество так или иначе связаны с митохондриями. Одни полагают, что митохондрии изнашиваются с годами, поэтому клетки получают все меньше и меньше энергии. Другие, напротив, утверждают, что митохондрии в течение жизни работают слишком активно. При этом они потребляют слишком много кислорода, а он уже, в свою очередь, вызывает образование свободных радикалов и повреждения внутриклеточных молекул. Третьи же винят во всем апоптоз — программу клеточной гибели: мол, ее запускают белки из внутренней мембраны митохондрий. Этот способ умереть в нашу жизнь тоже привнесла предковая симбиотическая бактерия. У них есть собственные программы апоптоза и белки, похожие на наши. Со временем гены апоптоза переселились в наше ядро, а программа стала работать на уровне целой клетки. Правда, подробности этого перехода все еще неизвестны.
Зачем тебе теломераза?
Теломераза — еще один белок, популярный среди исследователей старения.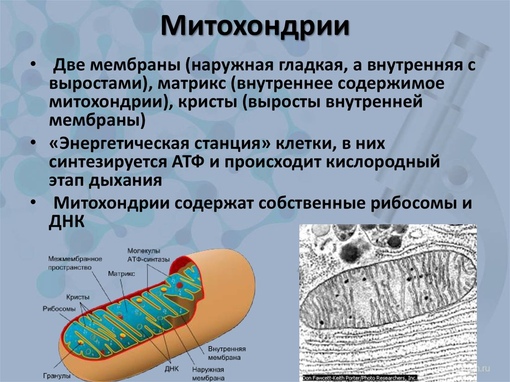 Ее основная функция — достраивать концы ДНК, которые укорачиваются при каждом делении клетки. У человека теломераза активна только в стволовых клетках, поэтому многие винят именно ее в том, что с возрастом ткани обновляются хуже. Однако не так давно теломеразу обнаружили и в митохондриях, причем не отдельные молекулы, а 20% всей теломеразы клетки. Что она там делает — большая загадка, ведь митохондриальная ДНК свернута в кольцо, концов не имеет и потому теломеразе там заняться, казалось бы, нечем. Тем не менее под действием теломеразы митохондрии расходуют кислород экономнее и меньше повреждаются. А мыши, у которых теломеразы в митохондриях много, лучше восстанавливаются после инфаркта.
Ее основная функция — достраивать концы ДНК, которые укорачиваются при каждом делении клетки. У человека теломераза активна только в стволовых клетках, поэтому многие винят именно ее в том, что с возрастом ткани обновляются хуже. Однако не так давно теломеразу обнаружили и в митохондриях, причем не отдельные молекулы, а 20% всей теломеразы клетки. Что она там делает — большая загадка, ведь митохондриальная ДНК свернута в кольцо, концов не имеет и потому теломеразе там заняться, казалось бы, нечем. Тем не менее под действием теломеразы митохондрии расходуют кислород экономнее и меньше повреждаются. А мыши, у которых теломеразы в митохондриях много, лучше восстанавливаются после инфаркта.
Кому ты достанешься?
До этого дня официально считалось, что митохондрии наследуются только по материнской линии. Это связано с тем, что при оплодотворении яйцеклетка превращается в зародыш целиком, вместе со всеми органеллами, а сперматозоид привносит только генетический материал и одну из центриолей (часть клеточного скелета, образующую полюс делящейся клетки). Вместе с митохондриями зародыш наследует и мутации в их ДНК — отсюда ряд генетических заболеваний, передающихся только от матери, например синдром Лея (проявляющийся в основном в нервной системе) или диабет и глухота. Но в свежей статье, появившейся в журнале PNAS, описаны несколько случаев наследования митохондрий от отца.
Вместе с митохондриями зародыш наследует и мутации в их ДНК — отсюда ряд генетических заболеваний, передающихся только от матери, например синдром Лея (проявляющийся в основном в нервной системе) или диабет и глухота. Но в свежей статье, появившейся в журнале PNAS, описаны несколько случаев наследования митохондрий от отца.
Все началось с ребенка, который попал в генетическую клинику с подозрением на митохондриальное заболевание. Он страдал хронической усталостью, слабостью и мышечными болями. Эти симптомы нередко указывают на то, что митохондрии в мышцах не производят достаточно энергии. Однако его мать ничего подобным не болела. В процессе секвенирования митохондриальной ДНК выяснилось, что в клетках ребенка одновременно живут два типа митохондрий, материнские и отцовские. Это явление называют гетероплазмией, и его удалось обнаружить еще в нескольких семьях.
Вас много — как вы уживаетесь вместе?
В каждой клетке человека митохондрий очень много. Их могут быть сотни и тысячи. Если они все генетически идентичны, то никакой конкуренции между ними нет. Но при оплодотворении какая-то часть из этих тысяч митохондрий сперматозоида все же оказывается внутри яйцеклетки. И здесь начинается настоящая битва. К сожалению, мы до сих пор не знаем, как именно материнским митохондриям человека удается одержать верх над отцовскими. У большинства живых организмов это тоже так, но победы куются разными способами. В одних клетках отцовские митохондрии поглощаются пищеварительными вакуолями, в других — разрушаются путем аутофагии.
Тем не менее можно предположить, что ядерные гены, ответственные за этот процесс, могут мутировать, и тогда в зародыше отцовские митохондрии будут выживать. Правда, одной мутацией здесь, скорее всего, не обойтись. Отцовских митохондрий, даже если они избегают уничтожения, в оплодотворенной яйцеклетке все равно очень мало (около 0,1% от всего количества). Но раз их повреждения проявляются у ребенка и оказывают серьезное влияние на здоровье, значит, они должны были как-то размножиться.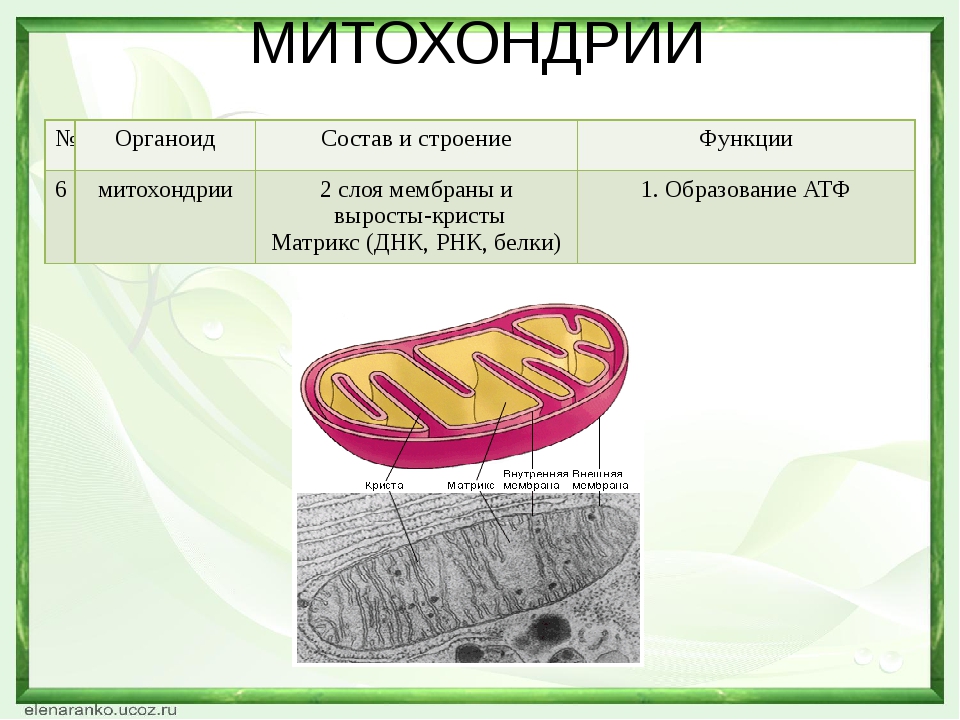 То есть в самой митохондриальной ДНК отца должны быть еще какие-то мутации, которые позволяют этим органеллам избирательно размножаться и захватывать все больше клеточного пространства.
То есть в самой митохондриальной ДНК отца должны быть еще какие-то мутации, которые позволяют этим органеллам избирательно размножаться и захватывать все больше клеточного пространства.
Можно ли от тебя избавиться?
Митохондриальные генетические проблемы доставляют не меньше проблем, чем ядерные. Тем не менее их мы уже почти научились чинить — с помощью технологии «ребенка от трех родителей». Идея состоит в том, чтобы пересадить родительские ядра в донорскую цитоплазму со здоровыми митохондриями. Есть несколько вариантов того, как это можно осуществить. Например, можно оплодотворить яйцеклетку матери сперматозоидом отца, а затем гибридное ядро пересадить в яйцеклетку донора. Или же — более этичный вариант, не требующий разрушения зародыша, — пересадить ядро яйцеклетки матери в цитоплазму донора, а потом оплодотворить гибридную яйцеклетку сперматозоидом отца. Подобные операции не всегда проходят успешно: в некоторых случаях митохондрии матери все же попадают в цитоплазму донора и есть риск, что они там останутся. А теперь, судя по всему, придется проверять и отца, потому что ребенок может оказаться тройным митохондриальным гибридом, а исход такой битвы не всегда просто предсказать.
А теперь, судя по всему, придется проверять и отца, потому что ребенок может оказаться тройным митохондриальным гибридом, а исход такой битвы не всегда просто предсказать.
Полина Лосева
Строение и функции митохондрий, пластид, клеточного центра, органоидов движения
Все эукариотические клетки содержат – митохондрии, это энергетические станции клеток. Митохондрия покрыта двумя мембранами: наружной и внутренней.
Наружная мембрана гладкая. Она состоит из липидов с вкраплениями белков. Основная её функция — отграничение митохондрии от цитоплазмы.
А внутренняя мембрана имеет многочисленные складки и выступы — кристы, существенно увеличивающие площадь её поверхности.
Внутриклеточное пространство митохондрий заполнено розовым веществом – матриксом.
В матриксе митохондрии,
находятся ферменты, необходимые для многих биохимических реакций.
Крупные молекулы могут пересекать наружную мембрану только через транспортные белки митохондриальных мембран.
Внутренняя мембрана митохондрии в отличие от внешней не имеет специальных отверстий для транспорта мелких молекул и ионов. На стороне мембраны, обращённой к матриксу, располагаются особые молекулы АТФ-синтазы (это группа ферментов).
Благодаря АТФ-синтезам происходит синтез АТФ (аденозин трифосфорной кислоты).
Перед нами химическая структура АТФ. В ней имеется азотистое основание аденин. Углевод – рибоза. И три…именно три остатка фосфорной кислоты, фосфатные связи которых богаты энергией. При их разрыве эта энергия высвобождается.
Рассмотрим подробнее синтез АТФ.
В АТФ-синтазу
с внешней стороны мембраны митохондрии проходят протоны (ионы водорода). При
прохождении 3х ионов в матрикс высвобождается достаточно энергии. Полученная
энергия пойдёт на синтез 1 молекулы АТФ.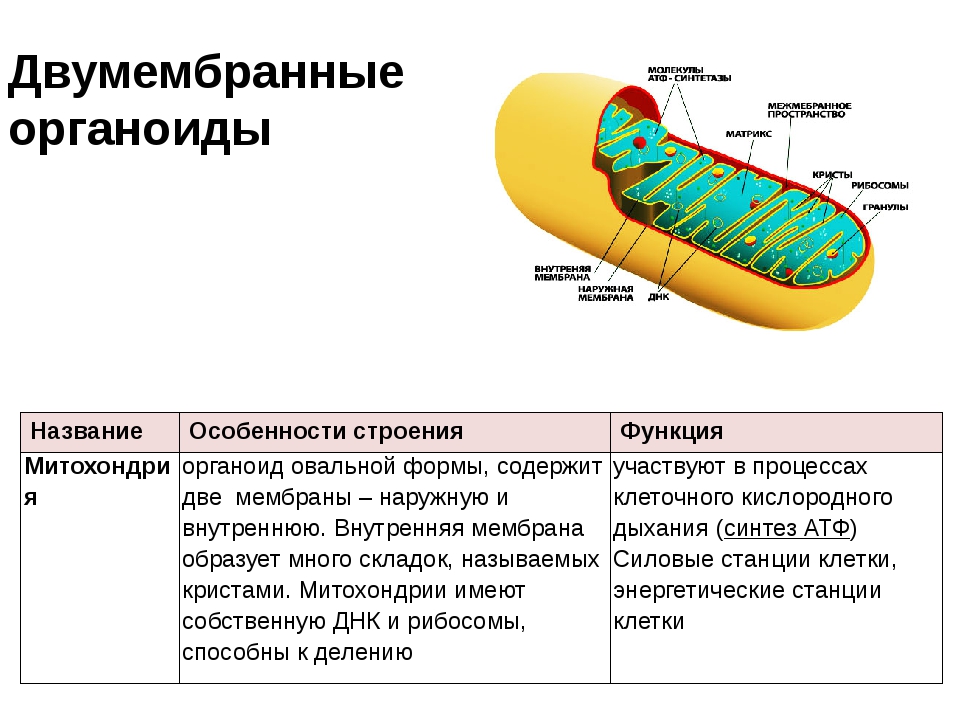
То есть к АДФ (аденозин дифосфорной кислоте) присоединится фосфат и получится молекула АТФ. (аденозин трифосфорная кислота).
Когда концентрация протонов по обе стороны мембраны становится одинаковая процесс синтеза АТФ прекращается. Синтезированные молекулы АТФ переносятся в разные части клетки, при помощи белков переносчиков.
Благодаря синтезу АТФ, митохондрии называют энергетическими органоидами клетки.
В матриксе митохондрии находится собственный белоксинтезирующий аппарат митохондрии, РНК и митохондриальная ДНК. Собственная ДНК митохондрий представляет собой замкнутую кольцевую двуспиральную молекулу.
Также митохондрии могут самостоятельно размножаться. Например, перед делением клетки, число митохондрий возрастает настолько, чтобы их хватило на две клетки. Таким образом, митохондрии всегда образуются от митохондрий. Формы митохондрий могут быть различными: овальными, круглыми, палочковидными.
Количество их в клетке
также неодинаково. Очень много митохондрий в клетках, где велики энергетические
затраты. Например, в активно работающих тканях — клетках крыльев птиц и клетках
печени.
Очень много митохондрий в клетках, где велики энергетические
затраты. Например, в активно работающих тканях — клетках крыльев птиц и клетках
печени.
Митохондрии содержатся во всех эукариотических клетках. А вот в прокариотических их нет. Этот факт, а также наличие в митохондриях ДНК позволили учёным полагать, что ранее митохондрии были свободноживущими существами.
Ещё в 1921 г. русский ботаник Борис Михайлович Козо-Полянский высказал мнение, о том, что клетка — это симбиотрофная система, в которой сожительствует несколько организмов.
В настоящее время эндосимбиотическая теория происхождения митохондрий и хлоропластов является общепринятой. Согласно этой теории, митохондрии — это в прошлом самостоятельные организмы. Которые затем за многие миллионы лет превратились в важнейшие энергетические станции клеток.
Таким образом, главной
функцией митохондрий является захват богатых энергией субстратов (жирные
кислоты, углеродный скелет аминокислот) из цитоплазмы и их окислительное
расщепление с образованием углекислого газа и воды, связанное с синтезом АТФ.
Растительные клетки помимо митохондрий содержат пластиды – это полуавтономные органеллы. То есть органеллы, которые отчасти не зависят от ядра.
Пластиды подразделяют на лейкопласты, хлоропласты и хромопласты.
Лейкопла́сты − это бесцветные сферические пластиды в клетках растений.
Они образуются в запасающих тканях (клубнях, корневищах), клетках эпидермы и других частях растений.
Лейкопласты содержат ферменты, с помощью которых из глюкозы, образованной в процессе фотосинтеза, синтезируется крахмал.
Лейкопласты подразделяются на амилопласты – это пластиды, которые накапливают крахмал.
Олеопласты, которые накапливают жиры.
Протеинопласты накапливают белки.
А также этиопласты – это лейкопласты, на которые не попал солнечный свет.
Все типы пластид могут
превращаться друг в друга.
Например, на свету в лейкопластах образуется зелёный пигмент хлорофилл, и они тем самым превращаются в хлоропласты. Вот почему на свету клубни картофеля зеленеют.
Хлоропласты, пожалуй, самые главные органоиды растений. Так как основная функция зелёных пластид — это фотосинтез.
Фотосинтез — это синтез органических веществ из углекислого газа и воды с обязательным использованием энергии света. В результате, которого образуются органические вещества и кислород.
У высших растений органом фотосинтеза является лист, а органоидами фотосинтеза — хлоропласты. Хлоропласты, как и митохондрии, имеют двумембранное строение. Между складками мембран находятся стопки связанных с ней пузырьков.
Каждая отдельная стопка таких пузырьков называется граной. В одном хлоропласте может быть до 50 гран, которые расположены таким образом, чтобы на каждую попадал свет.
Граны состоят из тилакоидов. Мембрана тилакоида
собственно и является тем местом, где протекают светозависимые
реакции фотосинтеза. Эти реакции идут при участии фотосинтетических
пигментов хлорофиллов, расположенных непосредственно на мембране тилакода. Так как именно хлорофилл обладает способностью
поглощать лучи света.
Эти реакции идут при участии фотосинтетических
пигментов хлорофиллов, расположенных непосредственно на мембране тилакода. Так как именно хлорофилл обладает способностью
поглощать лучи света.
Хлорофилл окрашивает хлоропласты растений в зелёный цвет. Он необходим для превращения энергии света в химическую энергию АТФ. Энергия, которая заключена в молекуле АТФ, необходима для синтеза углеводов.
Синтез органических веществ осуществляется во внутреннем пространстве хлоропластов между гранами.
Например, для того чтобы
в клубнях картофеля образовался крахмал. В растение через корневую систему
поступает вода. По стеблю она приходит в клетки листьев, а затем и в
хлоропласты. Одновременно через устьица в клетку поступает углекислый газ. Из
воды и углекислого газа под действием солнечного света образуется органическое
вещество глюкоза. Полученную в процессе фотосинтеза глюкозу хранить достаточно
сложно, она легко выходит из клетки. Поэтому растения хранят её в виде крахмала. Из хлоропластов крахмал перемещается по сосудам растения, а затем поступает в
клубни картофеля и используется клетками, которые не содержат хлорофилл.
Из хлоропластов крахмал перемещается по сосудам растения, а затем поступает в
клубни картофеля и используется клетками, которые не содержат хлорофилл.
Хлоропласты созданы для того, чтобы ловить энергию солнечного света… И если посмотреть под микроскоп на срез листа, то можно увидеть, как в его клетках зелёные хлоропласты движутся в ту сторону где свет наиболее ярок.
Хлоропласты имеют зелёную
окраску, так как хлорофиллы поглощают красный и сине-фиолетовый свет, а
отражают зелёный.
Благодаря хлоропластам и фотосинтезу из атмосферы ежегодно поглощаются миллиарды тонн углекислого газа и выделяются миллиарды тонн кислорода; фотосинтез является основным источником образования органических веществ.
Активный фотосинтез ведёт
к довольно быстрому старению листьев и в конце концов к их отмиранию. Видимый
признак старения листа — покраснение или пожелтение, оно связанно с деградацией
хлоропластов, разрушением хлорофилла и накоплением пигментов каротиноидов.
Каротиноиды – это комбинация пигментов, которые содержатся в хромопластах.
Хромопласты − (от греч. «хромо» – цвет, краска) – пластиды с желтой, оранжевой и красной окраской.
Пигменты, так же, как и хлорофилл, участвуют в фотосинтезе, однако они улавливают ту часть солнечного спектра, которая осталась вне поля зрения хлорофилла.
Кроме того, пигменты, расположенные в хромопластах, выполняют роль светофильтров, защищающих чувствительные к свету ферменты от разрушения.
Хромопласты наиболее характерны для клеток околоцветников и плодов многих растений. Яркая окраска цветков привлекает насекомых-опылителей. А яркая окраска плодов привлекает животных и птиц, благодаря которым распространяются семена.
Зелёные хлоропласты могут терять хлорофилл и превращаться в хромопласты. Этот процесс мы наблюдает при созревании плодов.
Также в цитоплазме всех
клеток вблизи ядра располагается клеточный центр.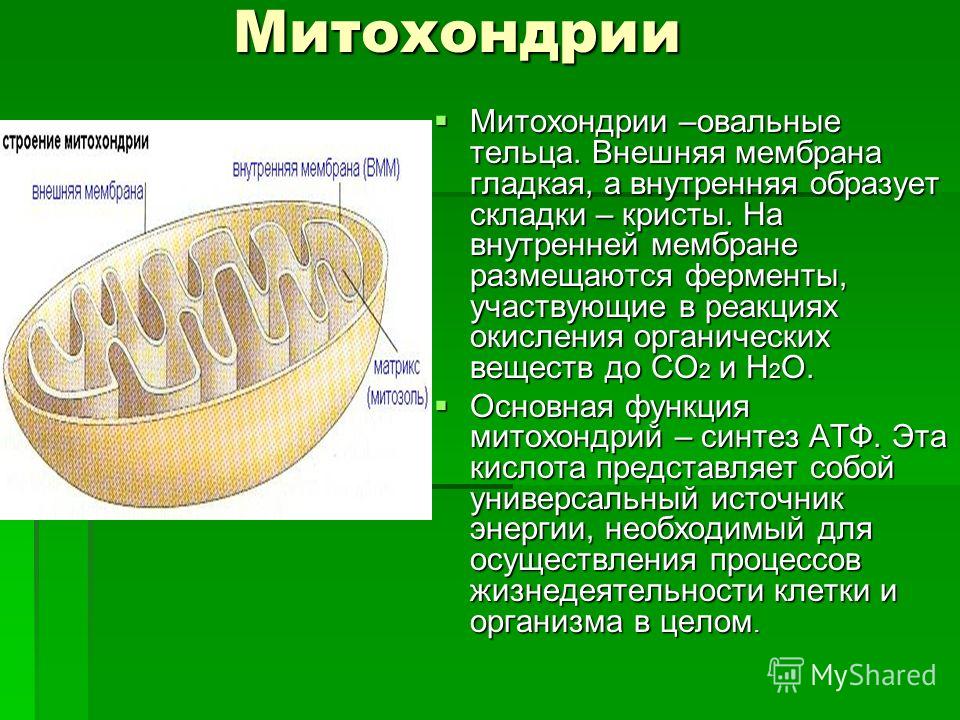
Клеточный центр — это немембранный органоид, главный центр организации микротрубочек и регулятор хода клеточного цикла в клетках эукариот.
У многих животных и низших растений клеточный центр содержит пару центриолей.
Центриоли – это цилиндрические структуры, расположенные под прямым углом друг к другу.
Каждая центриоль состоит из девяти триплетов – состоящих из трёх частей микротрубочек, которые расположены по кругу.
Микротрубочки играют ключевую роль во внутриклеточном транспорте (служат «рельсами», по которым перемещаются молекулярные моторы- белки-кинезины.
Кинезин перемещает вдоль микротрубочек мембранные пузырьки (везикулы) и другие органоиды.
Клеточный центр играет важную роль в формировании цитоскелета, поддерживающего форму клеток.
Очень велика роль
клеточного центра при делении клеток, когда центриоли расходятся к полюсам
делящейся клетки и образуют веретено деления. Это
веретенообразная система микротрубочек. Микротрубочки веретена, присоединяются
к белковым структурам хроматид в области центромер и
обеспечивают движение хромосом по направлению к полюсам.
Это
веретенообразная система микротрубочек. Микротрубочки веретена, присоединяются
к белковым структурам хроматид в области центромер и
обеспечивают движение хромосом по направлению к полюсам.
Органоиды движения
Некоторые клетки способны к движению. Например, одноклеточные организмы инфузория туфелька и эвглена зелёная перемещаются при помощи особых органоидов движения – ресничек и жгутиков.
Несмотря на то, что реснички отличаются по размерам от жгутиков, они имеют общее строение.
Органоиды движения образованы такими же микротрубочками, как и центриоли клеточного центра.
Жгутики и реснички крепятся к цитоплазме клеток благодаря базальным тельцам. Рядом с базальным тельцем располагается особая органелла, которая обеспечивает выработку энергии для жгутика.
Органоиды движения
встречаются и у многоклеточных организмов. Например, эпителий бронхов человека
покрыт множеством ресничек. Реснички двигаются одновременно, образуя
своеобразные волны. Так они очищают бронхи от инородных частиц и пыли.
Так они очищают бронхи от инородных частиц и пыли.
При рассмотрении клетки под микроскопом в её цитоплазме можно обнаружить различные включения, гранулы, содержащие питательные вещества для клетки. Клеточные включения — это образования, которые могут появляться и исчезать.
Ими могут быть капли жира, гранулы крахмала, кристаллы солей и другие.
Урок по биологии «Митохондрии. Пластиды. Клеточный центр»
Тема урока: «Митохондрии. Пластиды. Клеточный центр» (Биология. 9 класс)
По учебнику «Биология. Введение в общую биологию. В.В. Пасечник, А. А. Каменский, Е. А. Криксунов, Г. Г. Швецов)
Задачи урока: Создать педагогические условия, при которых ученик сможет проявить
универсальные учебные действия:
личностные: справедливо оценивать свою работу и работу окружающих, применять полученные знания в практической деятельности;
регулятивные: самоконтроль и самооценку; коррекцию
познавательные: осуществлять поиск необходимой информации для выполнения учебных заданий;
коммуникативные: умение участвовать в коллективном обсуждении проблемы; рассуждать.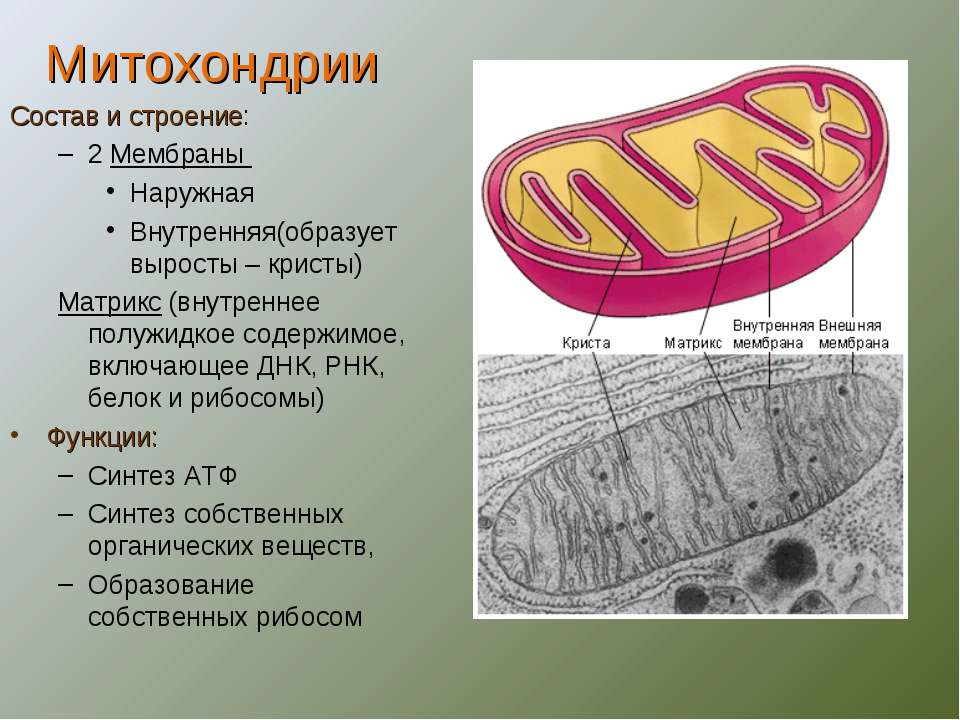
Оборудование: компьютер, экран, проектор, дидактический материал для проверки знаний, результаты опыта (позеленевший клубень картофеля), гербарий осенних листьев растений, электронное издание «Биология 6 – 11 класс. Лабораторный практикум»
Тип урока: комбинированный.
Методы: самостоятельная работа учащихся, работа в группах, объяснение, беседа, игровые.
Междисциплинарные связи: биохимия.
Внутридисциплинарные связи: цитология, генетика
Ход урока:
Организационный момент.
Приветствие
Подготовка аудитории к работе
Наличие учащихся, класс разбивается на 2 группы
Определение цели урока.
Завершили ли мы с вами изучение строения клетки? Давайте, попытаемся сформулировать цель своего присутствия на уроке.
Ученики: узнать, что такое митохондрии и пластиды, познакомиться с их разнообразием, строением, выполняемой функцией.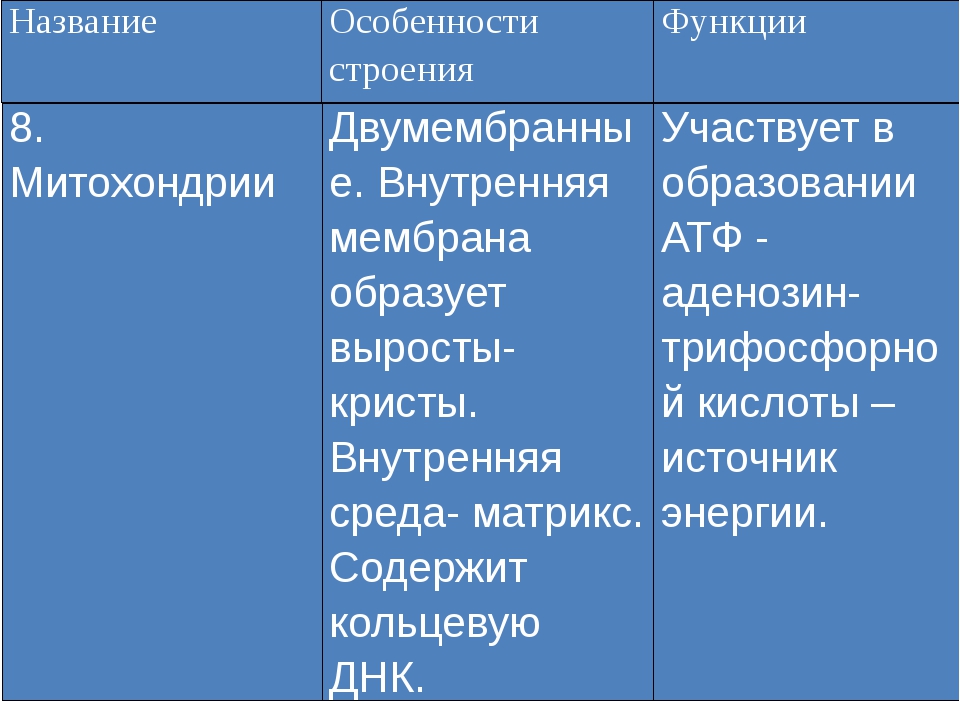
Учитель:
— углубить знания о строении эукариотической клетки;
— познакомиться со строением и функциями митохондрий и пластид;
— определить роль каждого органоида в жизни клетки;
— научиться распознавать органоиды по внешнему виду.
Проверка знаний учащихся о строении клетки и изученных органоидов.
Ученикам раздаются карточки «Карточка учета знаний»
Чтобы получить хорошую оценку за урок, вы должны набрать как можно больше баллов на каждом из этапов урока. Баллы будете проставлять на «Карточках учета знаний».
Разминка «Органоиды клетки» (выполняется устно и на скорость). За каждый правильный ответ 1 балл.
Закончите фразы:
Раздел биологии, изучающий строение клетки, ее органеллы и их функции, называется…(цитология)
Основной метод цитологии…(микроскопический)
Все живые существа состоят из…(клеток)
Органоид, координирующий жизнедеятельность клетки…(ядро)
Внутреннее содержимое клетки отделено от внешней среды… (клеточной мембраной)
Органоиды, функция которых синтез белков… (рибосомы)
Она бывает гладкой и шероховатой… (ЭПС)
Регуляция поступления веществ в клетку осуществляется с помощью…
Одномембранные структуры с продуктами обмена, характерные для растительных клеток, — …(вакуоли с клеточным соком)
Пористая структура из целлюлозы, придающая клетке растений прочность и постоянную форму, называется…(клеточная стенка)
Одномембранные структуры с ферментами, осуществляющими автолиз, — …(лизосомы)
Основное вещество клетки, в котором находятся все органоиды клетки, — …(цитоплазма)
Кто сколько набрал баллов, отметьте в карточке учета знаний
А теперь работаем с терминами. Игра «Горячий стул»
Игра «Горячий стул»
Ученик сидит спиной к доске, учитель показывает термины вразброс по одному, учащиеся дают им определения, не называя их, по этим определениям сидящему ученику необходимо узнать, о каких терминах идет речь.
Пиноцитоз – поглощение капель жидкости
Фагоцитоз – поглощение твердых частиц
Кариоплазма – ядерный сок
Эукариоты – клетки с ядром
Прокариоты – клетки без ядра
Органоиды – постоянные структуры клетки
Соматическая клетка – неполовая клетка
Гамета – половая клетка
Диплоидный набор – двойной набор хромосом Гиалоплазма, основное вещество, часть цитоплазмы животных и растительных клеток, не содержащая структур, различимых в световом микроскопе
Гомологичные хромосомы – парные хромосомы
Гаплоидный набор — одинарный набор хромосом
Хроматин – нити ДНК в ядре
Кариотип — набор хромосом клетки
Завершился еще один этап. Проставьте себе баллы в карточках учета знаний.
Проставьте себе баллы в карточках учета знаний.
Следующий этап урока «Кто есть кто?». Работаем в тетрадях. Перед вами таблица. Распределите характеристики соответственно органоидам клетки. Цифрам подберите соответствующие буквы. Работаем 3 минуты.
1 команда – плазматическая мембрана и ядро: 1-…. ; 2 — …..
2 команда – рибосомы и эпс: 5 — ….; 6 — ….
Баллы проставляю я после проверки вашей работы.
Плазматическая мембранаЯдро
Митохондрии
Пластиды
Рибосомы
ЭПС
Клеточный центр
Комплекс Гольджи
Лизосомы
Цитоскелет
Жгутики и реснички
Транспорт веществ по клетке, пространственное разделение реакций в клетке.
Б. Синтез белка
Фотосинтез
Г. Движение органоидов по клетке
Д. Хранение наследственной информации
Е. Немембранные
Ж. Синтез жиров и углеводов
З. Содержит ДНК
И. Одномембранные
К. Обеспечение клетки энергией
Обеспечение клетки энергией
Л. Самопереваривание клетки и внутриклеточное пищеварение
М. Движение клетки
Н. Двухмембранные
О. Связь клетки с внешней средой
П. Управление цитоскелетом и делением ядра
Р. Есть только у растений
С. Есть только у животных
Ответы: 1 команда
1 – И,О; плазматическая мембрана
2 – Д, З, Н; ядро
2 команда
5 – Б, Е; рибосомы
6 – А, И; эпс
Спасибо. Приступаем к изучению нового материала
3. Изучение нового материала.
Изучите самостоятельно по учебнику строение и функции митохондрий (стр. 68 -69). Найдите информацию!
Форма митохондрий (овальные, округлые, палочковидные)
Размеры (диаметр 1 микрон, длина 7 – 10 микрон)
В каких клетках содержаться митохондрии? (эукариотических)
Количество митохондрий варьирует от 1 до 1000. Особенно их много в тех клеток, которые нуждаются в больших количествах энергии.
Рассказ о внутреннем строении митохондрий.
Микроскопические органеллы, имеющие двухмембранное строение. Внешняя мембрана гладкая, внутренняя образует различной формы выросты – кристы. В матриксе митохондрий (полужидком веществе) находятся ферменты, рибосомы, ДНК и РНК.
Постановка и решение проблемного вопроса:
Почему митохондрии называют силовыми, энергетическими станциями клетки?
В митохондриях осуществляется кислородный этап клеточного дыхания и происходит запасание энергии в виде АТФ (т. е. в той форме, в которой энергия доступна для использования на все процессы жизнедеятельности).
Изучение строения и функций пластид.
— фронтальная беседа с опорой на знания учащихся об органоидах, характерных только для растительных клеток (за исключением некоторых жгутиковых) – пластидах.
— систематизация знаний и оформление в форме таблицы.
Основные типы пластид
ФотосинтезСинтез АТФ
— сообщение учащегося о взаимных переходах пластид друг в друга с демонстрацией результатов опыта, выполненного во внеурочное время и объяснение данного явления:
Лейкопласты ——хлоропласты——— хромопласты.
На свету в клетках покровной ткани картофеля образуется хлорофилл, и формируются граны. Лейкопласты превращаются в хлоропласты. В осеннее время в связи с изменением климатических условий наблюдается разрушение хлорофилла и образование из хлоропластов хромопластов, которые принимают форму кристаллов, каротиноидов, типичную для данного вида растения. Поэтому листья теряют зелёную окраску, их окраска становится красной, оранжевой, жёлтой (демонстрация гербария осенних листьев)
Рассказ о строении хлоропласта. Хлоропласты — это зеленые пластиды. Цвет хлоропластов обеспечивается магнийорганическим веществом хлорофиллом. Хлорофилл поглощает лучи в красной и синей области спектра, а отражает в зеленой. Вот почему хлорофилл, хлоропласт и лист растения воспринимаются нашим глазом как зеленые.
Хлоропласт состоит из наружной и внутренней мембран. Наружная мембрана гладкая. Внутренняя мембрана складчатая, образует выросты внутрь хлоропласта- ламеллы. Ламеллы могут образовывать локальные расширения, имеющие вид уплощенных мешочков-тилакоидов. Тилакоиды располагаются стопками, один над другим, напоминая стопки монет. Эти стопки называются гранами. Пигмент хлорофилл располагается внутри мембран тилакоида. У лейкопластов стромы почти нет, а у хромопластов строма развита несколько хуже, чем у хлоропластов. В строме содержатся ДНК, рибосомы, ферменты. Клетке достаточно одного хлоропласта после деления, чтобы он воспроизвел себе подобный. Хлоропласты могут переходить в хромопласты, а лейкопласты-в хлоропласты.
Ламеллы могут образовывать локальные расширения, имеющие вид уплощенных мешочков-тилакоидов. Тилакоиды располагаются стопками, один над другим, напоминая стопки монет. Эти стопки называются гранами. Пигмент хлорофилл располагается внутри мембран тилакоида. У лейкопластов стромы почти нет, а у хромопластов строма развита несколько хуже, чем у хлоропластов. В строме содержатся ДНК, рибосомы, ферменты. Клетке достаточно одного хлоропласта после деления, чтобы он воспроизвел себе подобный. Хлоропласты могут переходить в хромопласты, а лейкопласты-в хлоропласты.
Функции хлоропласта — осуществление фотосинтеза.
Самостоятельная работа 5-7 мин
.
Сравните, пожалуйста митохондрии и хлоропласты.
1. состоят из 2-х мембран2. наружная мембрана гладкая
3. внутренняя мембрана складчатая и образует:
кристы граны
4. внутренняя полужидкая среда
матрикс строма
5. имеют ДНК, РНК, рибосомы
6. синтез АТФ
синтез АТФ
7. Окисление орган. в-в Синтез орг. в-в
Различия:
— в митохондриях синтезируются молекулы АТФ, а в хлоропластах не только синтез АТФ, но и происходит использование АТФ в процессе фотосинтеза.
—число митохондрий в клетке больше, чем число хлоропластов.
-различный набор ферментов.
Постановка проблемного вопроса:
Благодаря каким особенностям пластиды и митохондрии являются полуавтономными органеллами клетки?
Решение поставленной проблемы с опорой на знания учащихся:
— имеют собственные ДНК
— двумембранные
— синтезируют АТФ
Вывод: имея такие особенности, 2-х мембранные органоиды могут самостоятельно делиться, независимо от деления самой клетки.
Прочитайте в учебнике о клеточном центре.
Имеет ли он мембранное строение?
Какие функции он выполняет в клетке
Функции: 1. Микротрубочки поддерживают форму клетки; 2.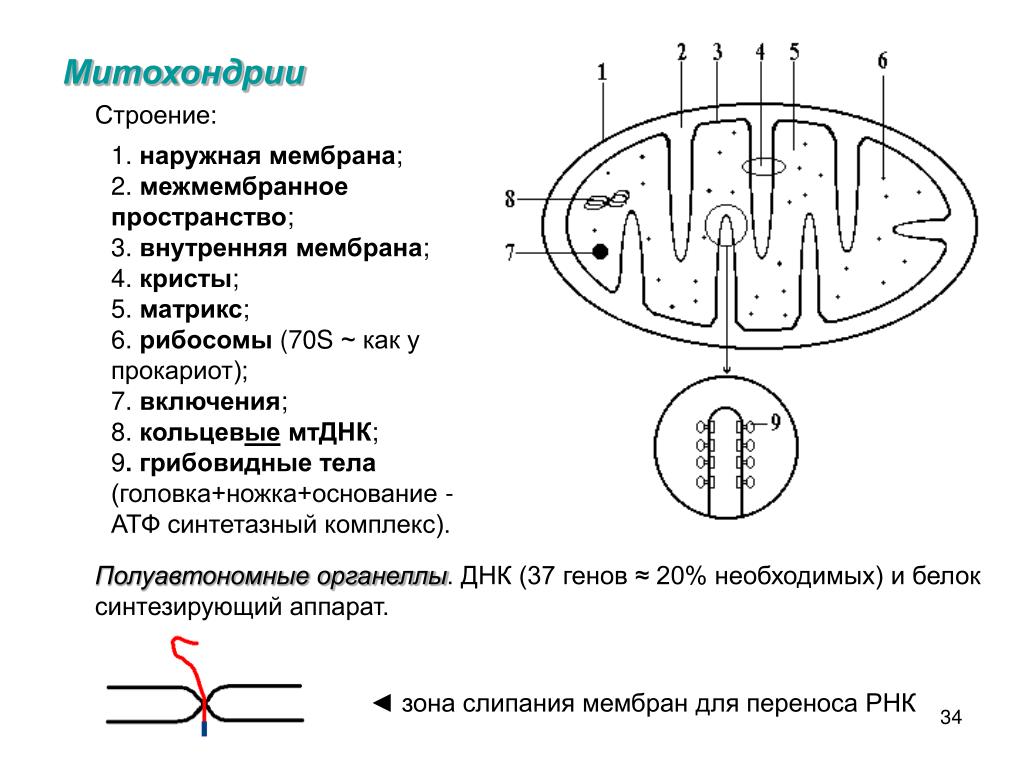 Участвуют в образовании веретена деления и равномерном распределении хромосом при делении клети.
Участвуют в образовании веретена деления и равномерном распределении хромосом при делении клети.
Итоговый контроль «Задание 2» (Лабораторный практикум. Биология»
Домашнее задание §17 (до органоидов движения). Биологический диктант. Приготовить презентацию по теме «Органоиды клетки»
Рефлексия.
Приложение
Биологический диктант «Путешествие по растительной клетке»
Запишите названия органоидов
Перед вами растительная клетка. Чтобы попасть внутрь клетки, нужно преодолеть оболочку. Как будете проникать: с помощью фагоцитоза или мембранных белков?
Вы попали с помощью мембранных белков в цитоплазму растительной клетки. какие органоиды растительной клетки встретятся вам здесь?
Вы находитесь в центральной вакуоли растительной клетки.
Заблудившийся ион магния просит у вас помощи. Он забыл название пластида и вещества, в которое ему надо попасть. Это…
Он забыл название пластида и вещества, в которое ему надо попасть. Это…
Итак, вы в хлоропласте и ваше растение съедено травоядным животным и уже переваривается. Вы оказались в пищеварительном пузырьке клетки. К вашему пузырьку приближается одномембранный органоид, наполненный пищеварительными ферментами. Как он называется?
Ура! Вы попали в ЭПС и плывете по ее канальцам. Вы проплываете через ее участок, покрытый рибосомами. Как он называется?
ЭПС постепенно превратилась в систему плоских пузырьков. Где вы оказались?
Этот органоид упаковал каждого из вас в маленький пузырек, чтобы вы смогли безопасно плыть дальше по гиалоплазме. Теперь подплываете к двухмембранному органоиду, внутренняя мембрана которого собрана в большие округлые складки. Он помог вам пополнить запасы энергии. Что это за органоид?
По микротрубочкам цитоскелета вы попали в не изученную нами главную часть клетки…
Карточка учета знаний
Лаборат.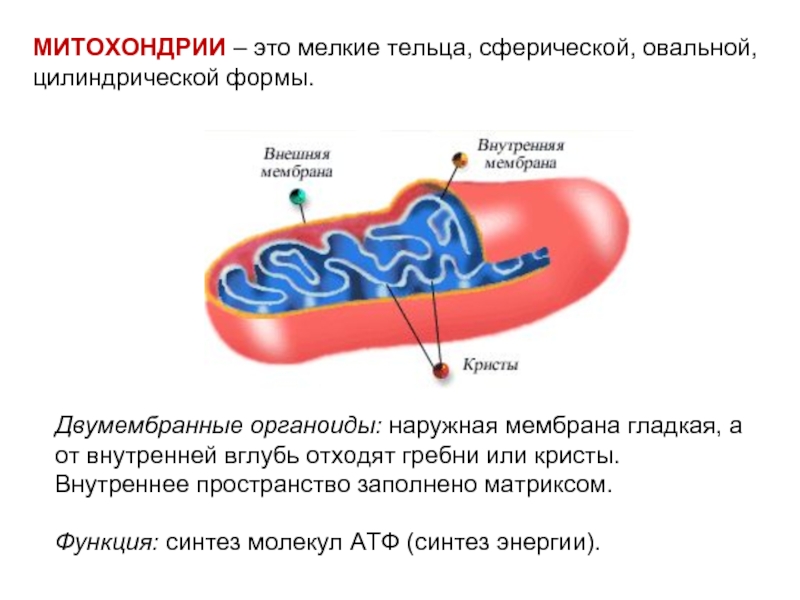
практикум
Кто есть кто?
Плазматическая мембранаЯдро
Митохондрии
Пластиды
Рибосомы
ЭПС
Клеточный центр
Комплекс Гольджи
Лизосомы
Цитоскелет
Жгутики и реснички
Транспорт веществ по клетке, пространственное разделение реакций в клетке.
Б. Синтез белка
Фотосинтез
Г. Движение органоидов по клетке
Д. Хранение наследственной информации
Е. Немембранные
Ж. Синтез жиров и углеводов
З. Содержит ДНК
И. Одномембранные
К. Обеспечение клетки энергией
Л. Самопереваривание клетки и внутриклеточное пищеварение
М. Движение клетки
Н. Двухмембранные
О. Связь клетки с внешней средой
П. Управление цитоскелетом и делением ядра
Р. Есть только у растений
С. Есть только у животных
. Игра «Горячий стул»
Ученик сидит спиной к доске, учитель показывает термины вразброс по одному, учащиеся дают им определения, не называя их, по этим определениям сидящему ученику необходимо узнать, о каких терминах идет речь.
Пиноцитоз – поглощение капель жидкости
Фагоцитоз – поглощение твердых частиц
Кариоплазма – ядерный сок
Эукариоты – клетки с ядром
Прокариоты – клетки без ядра
Органоиды – постоянные структуры клетки
Соматическая клетка – неполовая клетка
Гамета – половая клетка
Диплоидный набор – двойной набор хромосом Гиалоплазма, основное вещество, часть цитоплазмы животных и растительных клеток, не содержащая структур, различимых в световом микроскопе
Гомологичные хромосомы – парные хромосомы
Гаплоидный набор — одинарный набор хромосом
Хроматин – нити ДНК в ядре
Кариотип — набор хромосом клетки
Основные типы пластид
хромопласты
Хлоропласты
Биологи обнаружили микробов, которые не должны существовать
В Избранное Учёные обнаружили сложные микроорганизмы с ядром и другими признаками строения эукариотов, у которых при этом отсутствует одна из главных составляющих – митохондрии. Это первые эукариоты с таким строением, обнаруженные биологами.
Это первые эукариоты с таким строением, обнаруженные биологами.
Эукариотическими организмами называют те организмы, клетки которых содержат ядро (в котором находится генетический аппарат), и особые органеллы, размножающиеся делением и окружённые мембраной — митохондрии и пластиды.
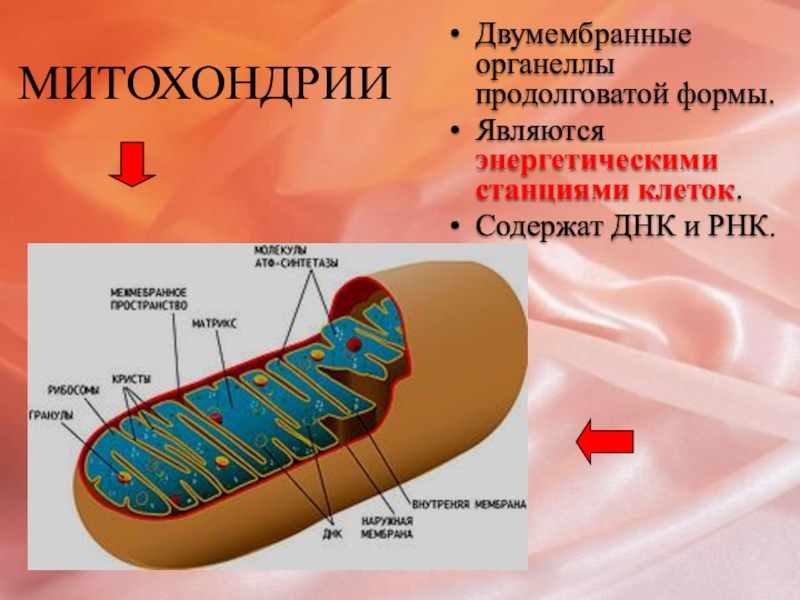
По своему строению (у них даже есть своя ДНК) и жизнедеятельности эти органеллы так похожи на бактерий, что учёные решили – они и являются потомками бактерий, вступившими в симбиотические отношения с эукариотами. Митохондрии работают энергетическими станциями клетки; их основная функция — окисление органических соединений и использование освобождающейся при их распаде энергии для генерации электрического потенциала, синтеза аденозинтрифосфата и выработки тепла.
Кроме эукариот, существуют прокариоты – одноклеточные живые организмы, у которых нет ядра и большинства органелл, включая митохондрий. В результате, все клеточные организмы поделены на эукариоты (с ядром и митохондриями) и прокариоты (без них).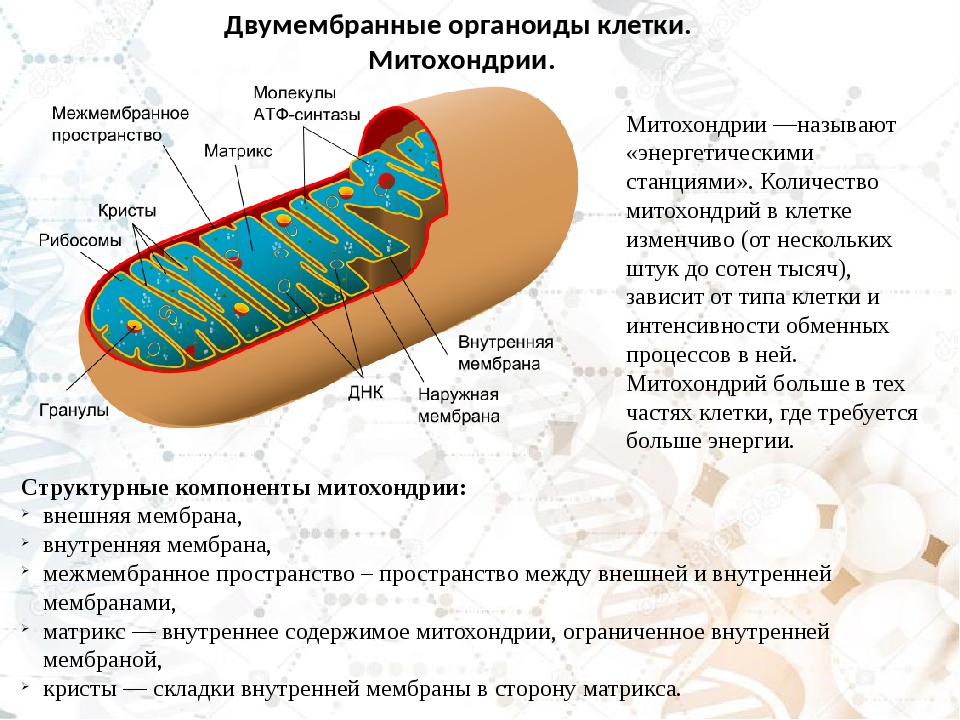 Но теперь, похоже, учёным придётся переписывать учебники биологии.
Но теперь, похоже, учёным придётся переписывать учебники биологии.
«Митохондрии рассматривались как необходимые составляющие эукариотических клеток и самим признаком таких клеток»,- делится наблюдениями Анна Карнковская, исследователь эволюционной биологии в Университете Британской Колумбии.
Учёные давно пытались найти сложные клеточные организмы, лишённые митохондрий, и один раз им даже показалось, что они нашли такой организм – это были лямблии, кишечные паразиты, живущие в кишечнике у человека и птиц. Однако вскоре выяснилось, что хотя они лишены митохондрий и аппарата Гольджи, у них есть рудиментарные митохондрии — митосомы, имеющие двойную мембрану и снабжаемые белками тем же способом, что и митохондрии, но лишённые генетического материала.
Одна из основных функций митохондрий – сборка железосерных кластеров для определённых белков. Так что, даже если микроб получает энергию каким-то экзотическим способом, и у него есть некие органеллы, которые не похожи на митохондрии людей – это всё равно будут митохондрии.
Так что исследователи искали именно такие, рудиментарные органеллы, выполняющие функции митохондрий, в новом микробе, выделенном из кишечной микрофлоры шиншиллы. Но после расшифровки ДНК оказалось, что микроорганизм не производит вообще никаких митохондриальных белков. «Это было для нас огромным сюрпризом,- поясняет Анна. – В теории такая ситуация должна была просто убить эту клетку – она не должна существовать».
Судя по всему, микроорганизмы используют другой механизм для сборки железосерных кластеров, который они переняли у бактерий. При этом учёные уверены, что эти микроорганизмы не являются переходным звеном между прокариотами и эукариотами, а просто демонстрируют нам, насколько гибкой может быть жизнь.
«Они живут в среде при отсутствии кислорода, и поэтому им не нужна та сложная химия, которая нужна нам с вами для выживания наших клеток,- поясняет Марк ван дер Гизен, исследователь в области эволюционной биохимии Эксетерского университета. – Этот организм сумел приспособиться к среде, утеряв органеллу, которая в любом учебнике представлена неотъемлемым свойством эукариот. Это удивительно. Это показывает, насколько творчески подходит жизнь к тому, чтобы продлить своё существование».
Это удивительно. Это показывает, насколько творчески подходит жизнь к тому, чтобы продлить своё существование».
Исследование опубликовано в журнале Current Biology
Mitochondria — The Cell — NCBI Bookshelf
Митохондрии играют решающую роль в выработке метаболической энергии в эукариотических клетках. Как уже говорилось в главе 2, они ответственны за большую часть полезной энергии, получаемой при расщеплении углеводов и жирных кислот, которая в процессе окислительного фосфорилирования превращается в АТФ. Большинство митохондриальных белков транслируются на свободных цитозольных рибосомах и импортируются в органеллы с помощью специфических сигналов-мишеней. Кроме того, митохондрии уникальны среди уже рассмотренных цитоплазматических органелл тем, что содержат собственную ДНК, которая кодирует тРНК, рРНК и некоторые митохондриальные белки.Таким образом, в сборке митохондрий участвуют белки, кодируемые их собственными геномами и транслируемые внутри органеллы, а также белки, кодируемые ядерным геномом и импортируемые из цитозоля.
Организация и функция митохондрий
Митохондрии окружены двойной мембранной системой, состоящей из внутренней и внешней митохондриальных мембран, разделенных межмембранным пространством (). Внутренняя мембрана образует многочисленные складки ( cristae ), которые простираются внутрь (или в матрикс) органеллы.Каждый из этих компонентов играет различные функциональные роли, при этом матрикс и внутренняя мембрана представляют собой основные рабочие отсеки митохондрий.
Рисунок 10.1
Строение митохондрии. Митохондрии ограничены двойной мембранной системой, состоящей из внутренней и внешней мембран. Складки внутренней мембраны (кристы) вдаются в матрикс. (Микрофотография K. R. Porter/Photo Researchers, Inc.)
Матрица содержит митохондриальную генетическую систему, а также ферменты, ответственные за центральные реакции окислительного метаболизма ().Как обсуждалось в главе 2, окислительный распад глюкозы и жирных кислот является основным источником метаболической энергии в клетках животных.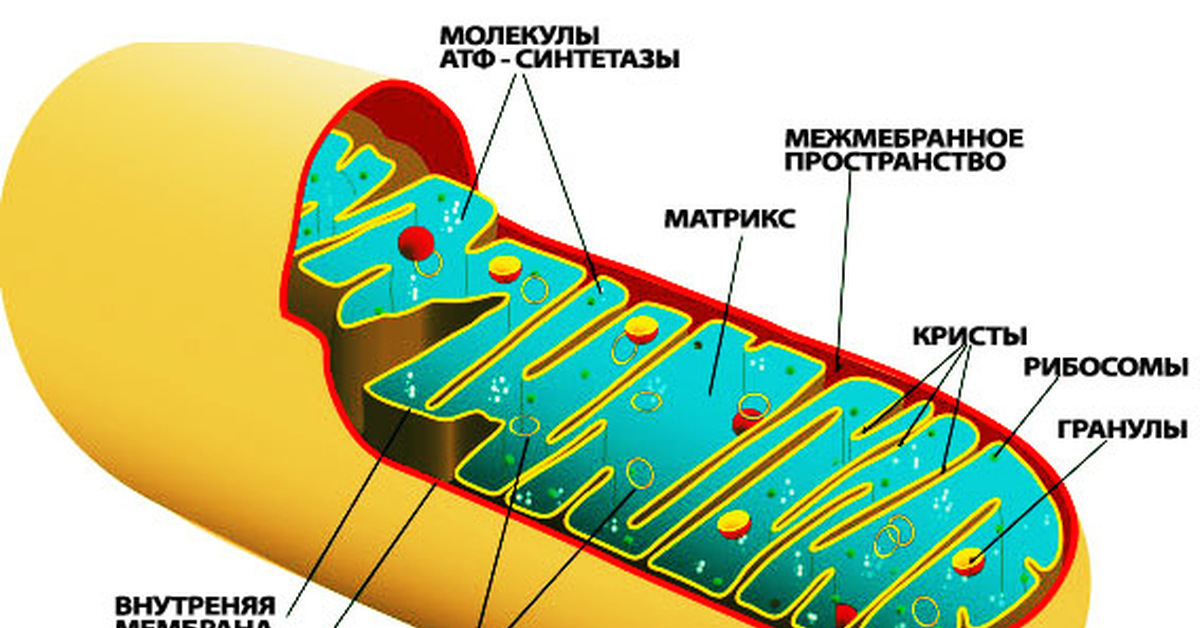 Начальные стадии метаболизма глюкозы (гликолиз) происходят в цитозоле, где глюкоза превращается в пируват (см.). Затем пируват транспортируется в митохондрии, где его полное окисление до CO 2 дает большую часть полезной энергии (АТФ), полученной в результате метаболизма глюкозы. Это включает первоначальное окисление пирувата до ацетил-КоА, который затем расщепляется до CO 2 посредством цикла лимонной кислоты (см. и ).Окисление жирных кислот также дает ацетил-КоА (см. ), который аналогичным образом метаболизируется в цикле лимонной кислоты в митохондриях. Таким образом, ферменты цикла лимонной кислоты (расположенные в матриксе митохондрий) играют центральную роль в окислительном расщеплении как углеводов, так и жирных кислот.
Начальные стадии метаболизма глюкозы (гликолиз) происходят в цитозоле, где глюкоза превращается в пируват (см.). Затем пируват транспортируется в митохондрии, где его полное окисление до CO 2 дает большую часть полезной энергии (АТФ), полученной в результате метаболизма глюкозы. Это включает первоначальное окисление пирувата до ацетил-КоА, который затем расщепляется до CO 2 посредством цикла лимонной кислоты (см. и ).Окисление жирных кислот также дает ацетил-КоА (см. ), который аналогичным образом метаболизируется в цикле лимонной кислоты в митохондриях. Таким образом, ферменты цикла лимонной кислоты (расположенные в матриксе митохондрий) играют центральную роль в окислительном расщеплении как углеводов, так и жирных кислот.
Рисунок 10.2
Метаболизм в матриксе митохондрий. Пируват и жирные кислоты импортируются из цитозоля и превращаются в ацетил-КоА в митохондриальном матриксе. Затем ацетил-КоА окисляется до CO 2 через цикл лимонной кислоты, центральный путь окислительного метаболизма.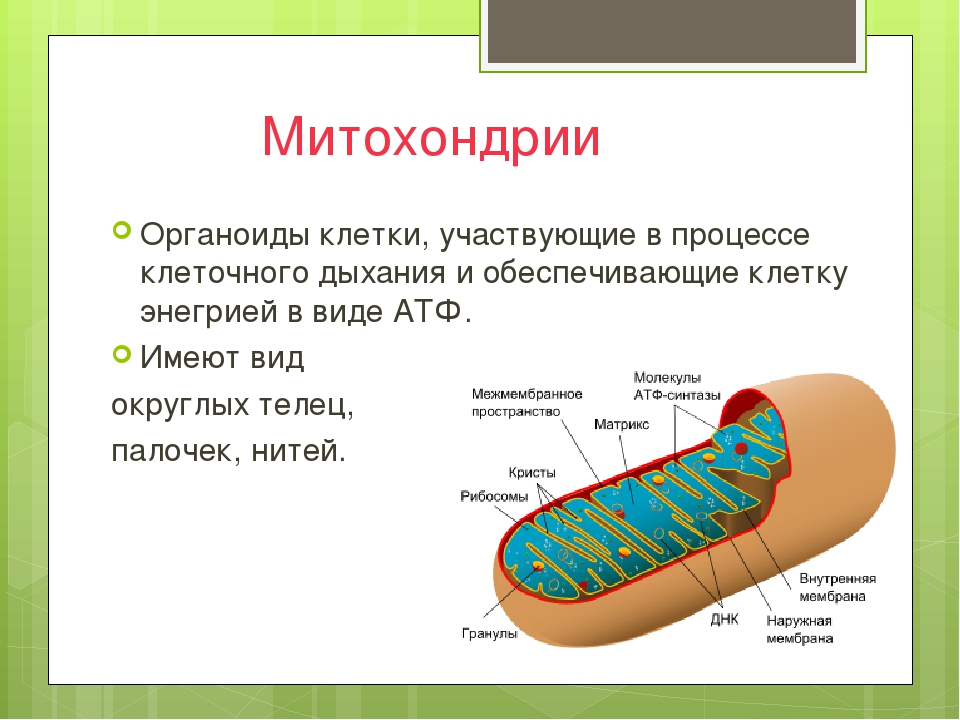 (подробнее…)
(подробнее…)
Окисление ацетил-КоА до СО 2 сопряжено с восстановлением НАД + и ФАД до НАДН и ФАДН 2 соответственно. Большая часть энергии, полученной в результате окислительного метаболизма, затем производится в процессе окислительного фосфорилирования (подробно обсуждается в следующем разделе), которое происходит во внутренней митохондриальной мембране. Высокоэнергетические электроны от NADH и FADH 2 переносятся через ряд переносчиков в мембране к молекулярному кислороду.Энергия, полученная в результате этих реакций переноса электронов, преобразуется в потенциальную энергию, хранящуюся в градиенте протонов через мембрану, которая затем используется для запуска синтеза АТФ. Таким образом, внутренняя митохондриальная мембрана представляет собой основное место образования АТФ, и эта важная роль отражена в ее структуре. Во-первых, площадь его поверхности существенно увеличивается за счет складывания в кристы. Кроме того, внутренняя митохондриальная мембрана содержит необычно высокий процент (более 70%) белков, которые участвуют в окислительном фосфорилировании, а также в транспорте метаболитов (напр. г., пируват и жирные кислоты) между цитозолем и митохондриями. В противном случае внутренняя мембрана непроницаема для большинства ионов и малых молекул — свойство, имеющее решающее значение для поддержания протонного градиента, который запускает окислительное фосфорилирование.
г., пируват и жирные кислоты) между цитозолем и митохондриями. В противном случае внутренняя мембрана непроницаема для большинства ионов и малых молекул — свойство, имеющее решающее значение для поддержания протонного градиента, который запускает окислительное фосфорилирование.
В отличие от внутренней мембраны, внешняя митохондриальная мембрана свободно проницаема для малых молекул. Это связано с тем, что он содержит белки, называемые поринами , которые образуют каналы, обеспечивающие свободную диффузию молекул размером менее 6000 дальтон.Таким образом, состав межмембранного пространства подобен цитозолю в отношении ионов и малых молекул. Следовательно, внутренняя митохондриальная мембрана является функциональным барьером для прохождения малых молекул между цитозолем и матриксом и поддерживает протонный градиент, который запускает окислительное фосфорилирование.
Генетическая система митохондрий
Митохондрии содержат собственную генетическую систему, которая отделена от ядерного генома клетки. Как было рассмотрено в главе 1, считается, что митохондрии произошли от бактерий, которые развили симбиотические отношения, в которых они жили внутри более крупных клеток (эндосимбиоз). Эта гипотеза недавно была подтверждена результатами анализа последовательности ДНК, которые выявили поразительное сходство между геномами митохондрий и бактерии Rickettsia prowazekii . Rickettsia — это внутриклеточные паразиты, которые, подобно митохондриям, способны воспроизводиться только в эукариотических клетках.В соответствии с их схожим симбиотическим образом жизни, последовательности геномной ДНК Rickettsia и митохондрий предполагают, что они имеют общего предка, от которого развилась генетическая система современных митохондрий.
Как было рассмотрено в главе 1, считается, что митохондрии произошли от бактерий, которые развили симбиотические отношения, в которых они жили внутри более крупных клеток (эндосимбиоз). Эта гипотеза недавно была подтверждена результатами анализа последовательности ДНК, которые выявили поразительное сходство между геномами митохондрий и бактерии Rickettsia prowazekii . Rickettsia — это внутриклеточные паразиты, которые, подобно митохондриям, способны воспроизводиться только в эукариотических клетках.В соответствии с их схожим симбиотическим образом жизни, последовательности геномной ДНК Rickettsia и митохондрий предполагают, что они имеют общего предка, от которого развилась генетическая система современных митохондрий.
Митохондриальные геномы обычно представляют собой кольцевые молекулы ДНК, как и у бактерий, которые присутствуют во множестве копий на органеллу. Они значительно различаются по размеру у разных видов. Геномы митохондрий человека и большинства других животных имеют размер всего около 16 т.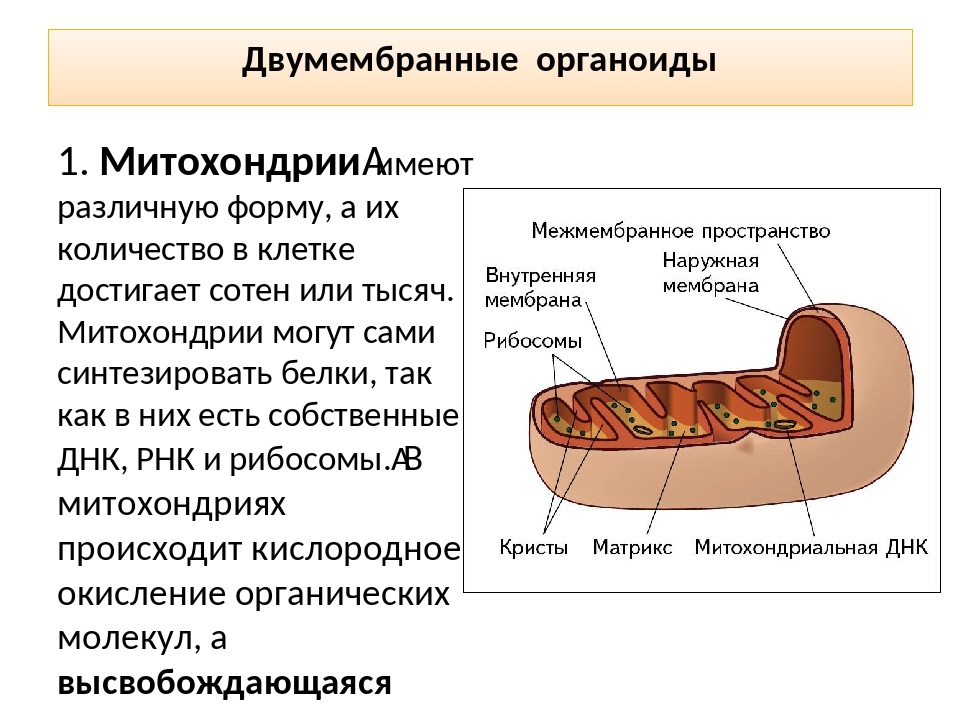 п.н., но значительно большие митохондриальные геномы обнаружены у дрожжей (примерно 80 т.п.н.) и растений (более 200 т.п.н.).Однако эти более крупные митохондриальные геномы состоят преимущественно из некодирующих последовательностей и, по-видимому, не содержат значительно большего количества генетической информации. Например, самый большой секвенированный митохондриальный геном принадлежит растению Arabidopsis thaliana . Хотя митохондриальная ДНК Arabidopsis составляет приблизительно 367 т.п.н., она кодирует только 32 белка: чуть более чем в два раза больше, чем митохондриальная ДНК человека. Наибольшее количество митохондриальных генов обнаружено в митохондриальной ДНК простейшего Reclinomonas americana , которая составляет 69 т.п.н. и содержит 97 генов.Митохондриальный геном Reclinomonas , по-видимому, больше напоминает бактериальный геном, из которого произошли митохондрии, чем большинство современных митохондриальных геномов, которые кодируют лишь небольшое количество белков, являющихся важными компонентами системы окислительного фосфорилирования.
п.н., но значительно большие митохондриальные геномы обнаружены у дрожжей (примерно 80 т.п.н.) и растений (более 200 т.п.н.).Однако эти более крупные митохондриальные геномы состоят преимущественно из некодирующих последовательностей и, по-видимому, не содержат значительно большего количества генетической информации. Например, самый большой секвенированный митохондриальный геном принадлежит растению Arabidopsis thaliana . Хотя митохондриальная ДНК Arabidopsis составляет приблизительно 367 т.п.н., она кодирует только 32 белка: чуть более чем в два раза больше, чем митохондриальная ДНК человека. Наибольшее количество митохондриальных генов обнаружено в митохондриальной ДНК простейшего Reclinomonas americana , которая составляет 69 т.п.н. и содержит 97 генов.Митохондриальный геном Reclinomonas , по-видимому, больше напоминает бактериальный геном, из которого произошли митохондрии, чем большинство современных митохондриальных геномов, которые кодируют лишь небольшое количество белков, являющихся важными компонентами системы окислительного фосфорилирования. Кроме того, митохондриальные геномы кодируют все рибосомные РНК и большинство транспортных РНК, необходимых для трансляции этих кодирующих белок последовательностей в митохондриях. Другие митохондриальные белки кодируются ядерными генами, которые, как полагают, были перенесены в ядро из предкового митохондриального генома.
Кроме того, митохондриальные геномы кодируют все рибосомные РНК и большинство транспортных РНК, необходимых для трансляции этих кодирующих белок последовательностей в митохондриях. Другие митохондриальные белки кодируются ядерными генами, которые, как полагают, были перенесены в ядро из предкового митохондриального генома.
Митохондриальный геном человека кодирует 13 белков, участвующих в транспорте электронов и окислительном фосфорилировании (). Кроме того, митохондриальная ДНК человека кодирует 16S и 12S рРНК и 22 тРНК, которые необходимы для трансляции белков, кодируемых геномом органеллы. Две рРНК являются единственными РНК-компонентами митохондриальных рибосом животных и дрожжей, в отличие от трех рРНК бактериальных рибосом (23S, 16S и 5S). Однако митохондриальные ДНК растений также кодируют третью рРНК 5S.Митохондрии растений и простейших также различаются по импорту и использованию тРНК, кодируемых как ядерным, так и митохондриальным геномом, тогда как в митохондриях животных все тРНК кодируются органеллой.
Рисунок 10.3
Митохондриальный геном человека. Геном содержит 13 белоккодирующих последовательностей, которые обозначены как компоненты дыхательных комплексов I, III, IV или V. Кроме того, геном содержит гены 12S и 16S рРНК и 22 тРНК, которые обозначены (подробнее…)
Небольшое количество тРНК, кодируемых митохондриальным геномом, подчеркивает важную особенность митохондриальной генетической системы — использование несколько иного генетического кода, отличного от «универсального» генетического кода, которым пользуются как прокариотические, так и эукариотические клетки (). Как обсуждалось в главе 3, существует 64 возможных триплетных кодона, 61 из которых кодирует 20 различных аминокислот, входящих в состав белков (см. табл. 3.1). Многие тРНК как в прокариотических, так и в эукариотических клетках способны распознавать более одного кодона в мРНК из-за «колебания», которое допускает некоторое неправильное спаривание между антикодоном тРНК и третьим положением некоторых комплементарных кодонов (см. Однако для трансляции универсального кода в соответствии с правилами колебания требуется не менее 30 различных тРНК. Тем не менее, митохондриальная ДНК человека кодирует только 22 вида тРНК, и это единственные тРНК, используемые для трансляции митохондриальных мРНК. Это достигается крайней формой колебания, при которой U в антикодоне тРНК может спариваться с любым из четырех оснований в третьем положении кодона мРНК, позволяя одной тРНК распознавать четыре кодона. Кроме того, некоторые кодоны определяют в митохондриях другие аминокислоты, чем в универсальном коде.
Однако для трансляции универсального кода в соответствии с правилами колебания требуется не менее 30 различных тРНК. Тем не менее, митохондриальная ДНК человека кодирует только 22 вида тРНК, и это единственные тРНК, используемые для трансляции митохондриальных мРНК. Это достигается крайней формой колебания, при которой U в антикодоне тРНК может спариваться с любым из четырех оснований в третьем положении кодона мРНК, позволяя одной тРНК распознавать четыре кодона. Кроме того, некоторые кодоны определяют в митохондриях другие аминокислоты, чем в универсальном коде.
Таблица 10.1
Различия между универсальным и митохондриальным генетическими кодами.
Как и ДНК ядерных геномов, митохондриальная ДНК может быть изменена мутациями, которые часто вредны для органеллы. Поскольку почти все митохондрии оплодотворенных яйцеклеток формируются ооцитом, а не спермой, мутации зародышевой линии в митохондриальной ДНК передаются следующему поколению от матери. Такие мутации связаны с рядом заболеваний. Например, наследственная оптическая невропатия Лебера, заболевание, приводящее к слепоте, может быть вызвано мутациями в митохондриальных генах, кодирующих компоненты цепи переноса электронов. Кроме того, было высказано предположение, что прогрессирующее накопление мутаций в митохондриальной ДНК в течение жизни людей способствует процессу старения.
Например, наследственная оптическая невропатия Лебера, заболевание, приводящее к слепоте, может быть вызвано мутациями в митохондриальных генах, кодирующих компоненты цепи переноса электронов. Кроме того, было высказано предположение, что прогрессирующее накопление мутаций в митохондриальной ДНК в течение жизни людей способствует процессу старения.
Импорт белков и митохондриальная сборка
В отличие от РНК-компонентов митохондриального аппарата трансляции (рРНК и тРНК), большинство митохондриальных геномов не кодируют белки, необходимые для репликации, транскрипции или трансляции ДНК.Вместо этого гены, кодирующие белки, необходимые для репликации и экспрессии митохондриальной ДНК, содержатся в ядре. Кроме того, ядро содержит гены, кодирующие большинство митохондриальных белков, необходимых для окислительного фосфорилирования, и все ферменты, участвующие в митохондриальном метаболизме (например, ферменты цикла лимонной кислоты). Белки, кодируемые этими генами (более 95% митохондриальных белков), синтезируются на свободных цитозольных рибосомах и импортируются в митохондрии в виде законченных полипептидных цепей. Из-за двухмембранной структуры митохондрий импорт белков значительно сложнее, чем перенос полипептида через одиночный фосфолипидный бислой. Белки, нацеленные на матрикс, должны пересекать как внутреннюю, так и внешнюю митохондриальные мембраны, в то время как другие белки должны быть отсортированы по отдельным компартментам внутри органеллы (например, межмембранное пространство).
Из-за двухмембранной структуры митохондрий импорт белков значительно сложнее, чем перенос полипептида через одиночный фосфолипидный бислой. Белки, нацеленные на матрикс, должны пересекать как внутреннюю, так и внешнюю митохондриальные мембраны, в то время как другие белки должны быть отсортированы по отдельным компартментам внутри органеллы (например, межмембранное пространство).
Импорт белков в матрикс является наиболее изученным аспектом сортировки митохондриальных белков ().Большинство белков нацелены на митохондрии с помощью амино-концевых последовательностей из 20-35 аминокислот (называемых препоследовательностями ), которые удаляются протеолитическим расщеплением после их импорта в органеллу. Препоследовательности митохондриальных белков, впервые описанные Готфридом Шацем, содержат множество положительно заряженных аминокислотных остатков, обычно в амфипатической α-спирали. Первым шагом в импорте белков является связывание этих препоследовательностей с рецепторами на поверхности митохондрий. Затем полипептидные цепи встраиваются в белковый комплекс, который направляет транслокацию через внешнюю мембрану (транслоказа внешней мембраны или комплекс Тома). Затем белки переносятся во второй белковый комплекс внутренней мембраны (транслоказу внутренней мембраны или комплекс Тима). Для непрерывной транслокации белка требуется электрохимический потенциал, устанавливаемый на внутренней митохондриальной мембране во время переноса электронов. Как обсуждается в следующем разделе этой главы, перенос высокоэнергетических электронов от NADH и FADH 2 к молекулярному кислороду связан с переносом протонов из митохондриального матрикса в межмембранное пространство.Поскольку протоны являются заряженными частицами, этот перенос создает электрический потенциал на внутренней мембране, а матрица является отрицательной. Во время импорта белка этот электрический потенциал управляет перемещением положительно заряженной препоследовательности.
Затем полипептидные цепи встраиваются в белковый комплекс, который направляет транслокацию через внешнюю мембрану (транслоказа внешней мембраны или комплекс Тома). Затем белки переносятся во второй белковый комплекс внутренней мембраны (транслоказу внутренней мембраны или комплекс Тима). Для непрерывной транслокации белка требуется электрохимический потенциал, устанавливаемый на внутренней митохондриальной мембране во время переноса электронов. Как обсуждается в следующем разделе этой главы, перенос высокоэнергетических электронов от NADH и FADH 2 к молекулярному кислороду связан с переносом протонов из митохондриального матрикса в межмембранное пространство.Поскольку протоны являются заряженными частицами, этот перенос создает электрический потенциал на внутренней мембране, а матрица является отрицательной. Во время импорта белка этот электрический потенциал управляет перемещением положительно заряженной препоследовательности.
Рисунок 10.4
Импорт белков в митохондрии. Белки направляются в митохондрии с помощью амино-концевой последовательности, содержащей положительно заряженные аминокислоты. Белки поддерживаются в частично развернутом состоянии за счет ассоциации с цитозольным Hsp70 и (больше…)
Белки направляются в митохондрии с помощью амино-концевой последовательности, содержащей положительно заряженные аминокислоты. Белки поддерживаются в частично развернутом состоянии за счет ассоциации с цитозольным Hsp70 и (больше…)
Для перемещения через митохондриальную мембрану белки должны быть хотя бы частично развернуты. Следовательно, импорт белка в митохондрии требует молекулярных шаперонов в дополнение к мембранным белкам, участвующим в транслокации (see). На цитозольной стороне члены семейства шаперонов Hsp70 поддерживают белки в частично развернутом состоянии, так что они могут быть встроены в митохондриальную мембрану. Когда они пересекают внутреннюю мембрану, развернутые полипептидные цепи связываются с другим членом семейства Hsp70, который связан с комплексом Tim и действует как двигатель, который управляет импортом белка.Затем полипептид переносится на шаперон семейства Hsp60 (шаперонин), внутри которого происходит сворачивание белка. Поскольку эти взаимодействия полипептидных цепей с молекулярными шаперонами зависят от АТФ, для импорта белка требуется АТФ как снаружи, так и внутри митохондрий, в дополнение к электрическому потенциалу на внутренней мембране.
Как отмечалось выше, некоторые митохондриальные белки нацелены на внешнюю мембрану, внутреннюю мембрану или межмембранное пространство, а не на матрикс, поэтому необходимы дополнительные механизмы для направления этих белков в правильный субмитохондриальный компартмент.Эти белки направляются к месту назначения с помощью второго сортировочного сигнала, следующего за положительно заряженной предварительной последовательностью, которая направляет митохондриальный импорт. Нацеливание белков на митохондриальные мембраны, по-видимому, опосредовано гидрофобными последовательностями остановки-переноса, которые останавливают транслокацию полипептидных цепей через комплексы Тима или Тома, что приводит к их встраиванию во внутреннюю или внешнюю митохондриальные мембраны соответственно. Белки могут направляться в межмембранное пространство с помощью нескольких разных механизмов (14).Некоторые белки переносятся через внешнюю мембрану через комплекс Тома, но затем высвобождаются в межмембранном пространстве вместо переноса в комплекс Тима. Другие белки переносятся в комплекс Tim, но затем высвобождаются в межмембранное пространство в результате расщепления гидрофобных стоп-трансферных последовательностей. Другие белки могут быть полностью импортированы в митохондриальный матрикс, а затем экспортированы обратно через внутреннюю мембрану в межмембранное пространство.
Другие белки переносятся в комплекс Tim, но затем высвобождаются в межмембранное пространство в результате расщепления гидрофобных стоп-трансферных последовательностей. Другие белки могут быть полностью импортированы в митохондриальный матрикс, а затем экспортированы обратно через внутреннюю мембрану в межмембранное пространство.
Рисунок 10.5
Вставка белков митохондриальной мембраны. Белки, нацеленные на митохондриальные мембраны, содержат гидрофобные последовательности остановки-переноса, которые останавливают их транслокацию через комплексы Тома или Тима и приводят к их включению во внешнее или (подробнее…)
Рисунок 10.6
Сортировка белков в межмембранное пространство. Белки могут направляться в межмембранное пространство с помощью нескольких механизмов. Некоторые белки (I) транслоцируются через комплекс Тома и высвобождаются в межмембранное пространство.Другие белки (II) переносятся (подробнее…)
Из цитозоля импортируются не только белки, но и фосфолипиды митохондриальных мембран. В клетках животных фосфатидилхолин и фосфатидилэтаноламин синтезируются в ER и переносятся в митохондрии белками-переносчиками фосфолипидов, которые извлекают отдельные молекулы фосфолипидов из мембран ER. Затем липид может транспортироваться через водную среду цитозоля, скрываться в месте гидрофобного связывания белка и высвобождаться, когда комплекс достигает новой мембраны, такой как мембрана митохондрий.Затем митохондрии синтезируют фосфатидилсерин из фосфатидилэтаноламина, в дополнение к катализу синтеза необычного фосфолипида кардиолипина, который содержит четыре цепи жирных кислот (4).
В клетках животных фосфатидилхолин и фосфатидилэтаноламин синтезируются в ER и переносятся в митохондрии белками-переносчиками фосфолипидов, которые извлекают отдельные молекулы фосфолипидов из мембран ER. Затем липид может транспортироваться через водную среду цитозоля, скрываться в месте гидрофобного связывания белка и высвобождаться, когда комплекс достигает новой мембраны, такой как мембрана митохондрий.Затем митохондрии синтезируют фосфатидилсерин из фосфатидилэтаноламина, в дополнение к катализу синтеза необычного фосфолипида кардиолипина, который содержит четыре цепи жирных кислот (4).
Рисунок 10.7
Структура кардиолипина. Кардиолипин представляет собой необычный «двойной» фосфолипид, содержащий четыре цепи жирных кислот, который в основном обнаруживается во внутренней митохондриальной мембране.
Коробка
Молекулярная медицина: Болезни митохондрий: Наследственная нейропатия зрительного нерва Лебера.
Митохондриальная форма и функция
Природа. Авторская рукопись; Доступно в PMC 2014 30 июня.
Авторская рукопись; Доступно в PMC 2014 30 июня.
Опубликовано в окончательной редактированной форме AS:
PMCID: PMC4075653
NIHMSID: NIHMS5
Джонатан Р. Фридман
1 Департамент молекулярной и сотовой биологии, колледж биологических наук , Калифорнийский университет, Дэвис, Калифорния 95616, США
Джоди Нуннари
1 Кафедра молекулярной и клеточной биологии, Колледж биологических наук, Калифорнийский университет, Дэвис, Калифорния 95616, США
1 Факультет молекулярной и клеточной биологии, Колледж биологических наук, Калифорнийский университет, Дэвис, Калифорния 95616, США
Окончательная отредактированная версия этой статьи доступна на сайте Nature.Abstract
Митохондрии являются одной из основных древних эндомембранных систем эукариотических клеток. Благодаря своей способности производить АТФ посредством дыхания они стали движущей силой эволюции. Важным шагом в процессе эукариотической эволюции стало резкое уменьшение размера митохондриальной хромосомы и радикальное изменение поведения митохондрий внутри эукариотических клеток. Недавние достижения показали, как эволюционировало поведение органеллы, чтобы обеспечить точную передачу своего генома и реагировать на потребности клетки и ее собственную дисфункцию.
Недавние достижения показали, как эволюционировало поведение органеллы, чтобы обеспечить точную передачу своего генома и реагировать на потребности клетки и ее собственную дисфункцию.
Митохондрии возникли около двух миллиардов лет назад в результате поглощения α-протеобактерии предшественником современной эукариотической клетки 1 . Хотя митохондрии сохранили двухмембранный характер своих предков и ядро производства АТФ, их общая форма и состав резко изменились, и они приобрели множество дополнительных функций внутри клетки. Как часть процесса приобретения новых функций в ходе эволюции, большая часть геномного материала предшественника α-протеобактерий была быстро утрачена или перенесена в ядерный геном 2 .То, что остается в клетках человека, представляет собой небольшой кольцевой геном размером примерно 16 тысяч оснований, который присутствует в клетках в значительном избытке копий по сравнению с ядерными хромосомами.
Митохондриальный геном человека содержит информацию о генетическом кодировании 13 белков, которые являются основными составляющими митохондриальных дыхательных комплексов I–IV, встроенных во внутреннюю мембрану. Функционируя вместе с циклом Кребса в матриксе, дыхательная цепь создает электрохимический градиент за счет сопряженного переноса электронов на кислород и транспорта протонов из матрикса через внутреннюю мембрану в межмембранное пространство.Электрохимический градиент приводит в действие терминальный комплекс V цепи, АТФ-синтазу, которая представляет собой древнюю вращающуюся турбинную машину, катализирующую синтез большей части клеточного АТФ. Электрохимический потенциал используется для дополнительных важных митохондриальных функций, таких как буферизация сигнального иона Ca 2+ посредством поглощения uniporter во внутренней мембране 3,4 . Снижение электрохимического потенциала митохондрий в клетках развилось как показатель функционального статуса митохондрий, который, как обсуждается позже, создает сигналы для активации путей, которые восстанавливают и/или устраняют дефектные митохондрии.
Функционируя вместе с циклом Кребса в матриксе, дыхательная цепь создает электрохимический градиент за счет сопряженного переноса электронов на кислород и транспорта протонов из матрикса через внутреннюю мембрану в межмембранное пространство.Электрохимический градиент приводит в действие терминальный комплекс V цепи, АТФ-синтазу, которая представляет собой древнюю вращающуюся турбинную машину, катализирующую синтез большей части клеточного АТФ. Электрохимический потенциал используется для дополнительных важных митохондриальных функций, таких как буферизация сигнального иона Ca 2+ посредством поглощения uniporter во внутренней мембране 3,4 . Снижение электрохимического потенциала митохондрий в клетках развилось как показатель функционального статуса митохондрий, который, как обсуждается позже, создает сигналы для активации путей, которые восстанавливают и/или устраняют дефектные митохондрии.
Благодаря сочетанию протеомики, геномики и биоинформатики мы знаем, что современные митохондрии состоят из более чем 1000 белков; состав является пластичным по своей природе, меняющимся в зависимости от вида и между видами в ответ на клеточные и тканеспецифические потребности организма 5–7 . Происхождение митохондриального протеома представляет собой смесь «старых» бактериальных и «новых» эукариотических белков 2 . Например, машины репликации и транскрипции митохондриальной ДНК (мтДНК) имеют отчетливое эволюционное происхождение от бактериофага 8–10 , тогда как митохондриальная машина трансляции имеет явное эволюционное родство с бактериями 11 .Помимо белковых компонентов, митохондриальный геном кодирует 22 транспортные РНК и 2 митохондриальные РНК, кодирующие рибосомы, которые являются важными компонентами его собственного аппарата трансляции. Сборка митохондриальных рибосом в митохондриальном матриксе является относительно сложным и строго регулируемым процессом, который включает процессинг и созревание митохондриальной рибосомной кодирующей РНК и сборку митохондриальных рибосомных белков в малые и большие субъединицы 12 . Однако только часть митохондриальных рибосомных белков имеет идентифицируемые гомологи у бактерий 13 .
Происхождение митохондриального протеома представляет собой смесь «старых» бактериальных и «новых» эукариотических белков 2 . Например, машины репликации и транскрипции митохондриальной ДНК (мтДНК) имеют отчетливое эволюционное происхождение от бактериофага 8–10 , тогда как митохондриальная машина трансляции имеет явное эволюционное родство с бактериями 11 .Помимо белковых компонентов, митохондриальный геном кодирует 22 транспортные РНК и 2 митохондриальные РНК, кодирующие рибосомы, которые являются важными компонентами его собственного аппарата трансляции. Сборка митохондриальных рибосом в митохондриальном матриксе является относительно сложным и строго регулируемым процессом, который включает процессинг и созревание митохондриальной рибосомной кодирующей РНК и сборку митохондриальных рибосомных белков в малые и большие субъединицы 12 . Однако только часть митохондриальных рибосомных белков имеет идентифицируемые гомологи у бактерий 13 . Роль митохондриальных специфических рибосомных белков не выяснена, но считается, что эти белки эволюционировали, чтобы регулировать координацию митохондриальной трансляции с внемитохондриальными путями в эукариотических клетках. Таким образом, как и многие митохондриальные машины, рибосома представляет собой смесь старых и новых инноваций.
Роль митохондриальных специфических рибосомных белков не выяснена, но считается, что эти белки эволюционировали, чтобы регулировать координацию митохондриальной трансляции с внемитохондриальными путями в эукариотических клетках. Таким образом, как и многие митохондриальные машины, рибосома представляет собой смесь старых и новых инноваций.
Кодируемые ядром белки, составляющие большую часть митохондриального протеома, транслируются на цитозольных рибосомах и активно импортируются и сортируются в митохондриальные субкомпартменты с помощью транслоказных машин внешней и внутренней мембраны способом, который зависит от электрохимического потенциала 14, 15 .Для кодируемых ядром митохондриальных белков существуют транскрипционные, посттранскрипционные и посттрансляционные способы регуляции. У людей транскрипционная регуляция митохондриального биогенеза происходит за счет действия коактиваторов семейства PGC-1, которые реагируют на изменения в нутритивном статусе, такие как НАД + /НАДН и соотношения АМФ/АТФ (определяемые через SIRT1 и AMPK).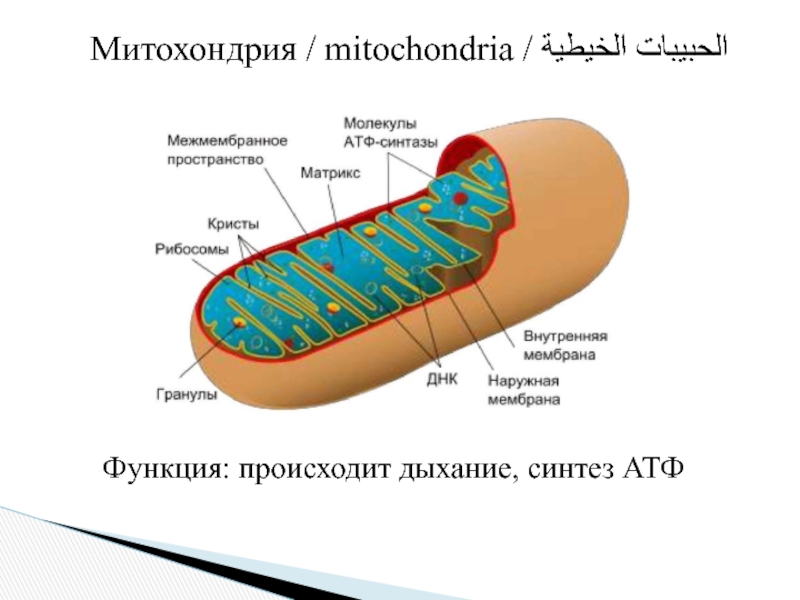 , соответственно), а также сигналы окружающей среды 16,17 . Комбинаторные взаимодействия между коактиваторами PGC-1 и специфическими факторами транскрипции (NRF1, NRF2 и ERR) уравновешивают и определяют основные функциональные пути внутри митохондрий.Посредством индукции ядерных генов, которые напрямую влияют на поддержание мтДНК, эти взаимодействия координируют ядерный и митохондриальный геномы 18 . Доказательства в дрожжах подтверждают, что транскрибируемые в ядре матричные РНК, кодирующие митохондриальные белки, посттранскрипционно локализуются на внешней мембране митохондрий строго регулируемым пространственным и временным образом и координированно транслируются 19,20 . Хотя лежащие в основе молекулярные механизмы нацеливания мРНК на митохондрии плохо изучены, такие пути, вероятно, будут важны в поляризованных клетках, таких как нейроны.Посттрансляционные модификации, такие как фосфорилирование компонентов митохондриального механизма импорта с помощью цитозольных киназ, в конечном итоге точно настраивают протеом в ответ на метаболические сигналы -21-.
, соответственно), а также сигналы окружающей среды 16,17 . Комбинаторные взаимодействия между коактиваторами PGC-1 и специфическими факторами транскрипции (NRF1, NRF2 и ERR) уравновешивают и определяют основные функциональные пути внутри митохондрий.Посредством индукции ядерных генов, которые напрямую влияют на поддержание мтДНК, эти взаимодействия координируют ядерный и митохондриальный геномы 18 . Доказательства в дрожжах подтверждают, что транскрибируемые в ядре матричные РНК, кодирующие митохондриальные белки, посттранскрипционно локализуются на внешней мембране митохондрий строго регулируемым пространственным и временным образом и координированно транслируются 19,20 . Хотя лежащие в основе молекулярные механизмы нацеливания мРНК на митохондрии плохо изучены, такие пути, вероятно, будут важны в поляризованных клетках, таких как нейроны.Посттрансляционные модификации, такие как фосфорилирование компонентов митохондриального механизма импорта с помощью цитозольных киназ, в конечном итоге точно настраивают протеом в ответ на метаболические сигналы -21-.
Мутации либо в генах мтДНК, либо в ядерных генах, которые кодируют митохондриальные белки, необходимые для аэробной выработки АТФ, вызывают разнообразные и часто разрушительные митохондриальные заболевания человека, которые могут поражать любой орган в организме в любой момент жизни человека 22 .Кроме того, существует высокая степень клинической гетерогенности митохондриальных заболеваний. Некоторую его гетерогенность можно объяснить тем фактом, что клетки человека могут содержать переменное соотношение мутантной и дикого типа мтДНК, состояние, называемое гетероплазмией. По-видимому, это относится к мутациям мтДНК в кодирующих белок участках митохондриального генома, в которых увеличение мутантной нагрузки приводит к более тяжелым фенотипам заболевания. Однако гетерогенность заболевания, которую нельзя объяснить гетероплазмией, также существует, когда мутации присутствуют в некодирующих митохондриальных тРНК.Кроме того, мутации в генах с общей функцией, таких как гены, кодирующие субъединицы комплекса I дыхательной цепи, приводят к совершенно различным проявлениям заболевания, таким как атрофия зрительного нерва у взрослых или энцефалопатия у младенцев 23,24 . Недавние исследования также указывают на причинно-следственную связь между мутациями в мтДНК и старением, вероятно, в результате связанных с мтДНК дефектов в соматических стволовых клетках 25,26 .
Недавние исследования также указывают на причинно-следственную связь между мутациями в мтДНК и старением, вероятно, в результате связанных с мтДНК дефектов в соматических стволовых клетках 25,26 .
Роль митохондрий в заболевании была расширена за пределы дыхательной цепи, поскольку дефекты дополнительных митохондриальных функций и поведения были связаны с раком, нарушениями обмена веществ и нейродегенеративными заболеваниями, такими как болезнь Альцгеймера, Паркинсона и Гентингтона 22 .В целом, однако, наше нынешнее понимание лежащих в основе отношений между митохондриальным фенотипом и заболеванием является недостаточным и требует лучшего понимания митохондриальной организации, а также связей митохондрий с ядерным геномом и внемитохондриальными путями в различных типах клеток и в организменном уровне. Чтобы восполнить этот дефицит, возник ренессанс в митохондриальных исследованиях, ускоренный недавними достижениями в генетике, системными подходами и нашей способностью визуализировать митохондрии с высоким временным и пространственным разрешением. В этом обзоре мы обсуждаем, как это возрождение переопределяет и расширяет наши знания о митохондриальном поведении и коммуникации.
Митохондриальная хромосома
Учитывая важность генов, кодируемых мтДНК, для функции митохондрий, неудивительно, что существуют специальные механизмы, которые активно контролируют структуру и распределение митохондрий и мтДНК, но у высших эукариот эти механизмы отличаются от их предков 22 .В отличие от бактерий, в большинстве типов клеток не существует отдельных митохондрий; вместо этого они представляют собой связанную сеть, содержащую несколько копий митохондриальной хромосомы, образующую «синцитий» (4). Подобно бактериальным и ядерным хромосомам, мтДНК сильно компактирована в митохондриальном матриксе, и, следовательно, комплексы мтДНК-белок можно визуализировать в виде точечных структур, называемых нуклеоидами, внутри сетей. Механизм, лежащий в основе конденсации мтДНК, был раскрыт исследователями, которые раскрыли кристаллическую структуру наиболее распространенного белка, ассоциированного с мтДНК, в клетках млекопитающих, митохондриального транскрипционного фактора А (TFAM). Структура указывает на то, что TFAM связывает и изгибает короткие участки мтДНК, образуя петли, которые позволяют упаковывать мтДНК 27,28 . TFAM также играет решающую роль в транскрипции мтДНК, и его экспрессия контролирует число копий мтДНК в клетках, что делает его центральным игроком в поддержании и передаче мтДНК 29,30 .
Структура указывает на то, что TFAM связывает и изгибает короткие участки мтДНК, образуя петли, которые позволяют упаковывать мтДНК 27,28 . TFAM также играет решающую роль в транскрипции мтДНК, и его экспрессия контролирует число копий мтДНК в клетках, что делает его центральным игроком в поддержании и передаче мтДНК 29,30 .
Митохондриальная организация является консервативным признаком. a , мтДНК в фибробластах человека упакована в нуклеоиды (зеленые), распределенные в трубчатых митохондриях (красные) вокруг ядра (синие).Масштабная линейка, 20 микрон. Адаптировано с разрешения исх. 40. b , Аналогичное распределение наблюдается в дрожжевой клетке с нуклеоидами (зеленый) в митохондриях (красный). Масштабная линейка, 2 микрона. c , Количество митохондриальных копий контролируется совместными действиями митохондриального деления и слияния. Митохондриальное деление контролируется сборкой динамин-родственного белка (DRP) на внешней стороне органеллы в спиральную структуру, которая обеспечивает расщепление посредством взаимодействия через спиральные ступени (отмечены оранжевыми кружками).Слияние митохондрий контролируется взаимодействием DRP слияния внешней и внутренней мембран (синий и красный кружки соответственно) через митохондриальные мембраны.
Митохондриальное деление контролируется сборкой динамин-родственного белка (DRP) на внешней стороне органеллы в спиральную структуру, которая обеспечивает расщепление посредством взаимодействия через спиральные ступени (отмечены оранжевыми кружками).Слияние митохондрий контролируется взаимодействием DRP слияния внешней и внутренней мембран (синий и красный кружки соответственно) через митохондриальные мембраны.
Дополнительные белки, имеющие решающее значение для поддержания мтДНК, локализованы в нуклеоидах. Эти белки включают механизмы репликации и репарации, которые у людей включают ДНК-полимеразу γ и ее вспомогательные белки, такие как репликационная геликаза twinkle 31 . Мутации в генах, кодирующих эти и дополнительные факторы, необходимые для поддержания мтДНК, вызывают ряд митохондриальных заболеваний человека, но на молекулярном уровне до сих пор неясно, как эти и многие другие идентифицированные белки, ассоциированные с мтДНК, собираются вместе и организуются для построения нуклеоидов. 32 .И это несмотря на тот факт, что протеомный перечень белков, ассоциированных с мтДНК, был определен для многих видов 33–35 . Кроме того, как организация нуклеоидов более высокого порядка, так и способ репликации мтДНК различаются между биологическими царствами, что приводит к дополнительной сложности. Эти различия являются следствием состава генома и нуклеоида. Напр., дрожжи обладают активным рекомбинационным аппаратом, сходным с рекомбинационными белками Rad52, и репликация, вероятно, в первую очередь управляется рекомбинацией 36 .В результате, по сравнению с митохондриальным геномом человека, более крупный геном дрожжей размером 80 тысяч оснований упакован в несколько копий в нуклеоид. Напротив, механизм репликации мтДНК человека не зависит от рекомбинации в большинстве тканей и происходит за счет смещения нитей 37,38 . Визуализация со сверхвысоким разрешением постоянно указывает на то, что нуклеоиды человека содержат относительно небольшое количество молекул мтДНК и, таким образом, являются более одиночными по своей природе 39,40 .
32 .И это несмотря на тот факт, что протеомный перечень белков, ассоциированных с мтДНК, был определен для многих видов 33–35 . Кроме того, как организация нуклеоидов более высокого порядка, так и способ репликации мтДНК различаются между биологическими царствами, что приводит к дополнительной сложности. Эти различия являются следствием состава генома и нуклеоида. Напр., дрожжи обладают активным рекомбинационным аппаратом, сходным с рекомбинационными белками Rad52, и репликация, вероятно, в первую очередь управляется рекомбинацией 36 .В результате, по сравнению с митохондриальным геномом человека, более крупный геном дрожжей размером 80 тысяч оснований упакован в несколько копий в нуклеоид. Напротив, механизм репликации мтДНК человека не зависит от рекомбинации в большинстве тканей и происходит за счет смещения нитей 37,38 . Визуализация со сверхвысоким разрешением постоянно указывает на то, что нуклеоиды человека содержат относительно небольшое количество молекул мтДНК и, таким образом, являются более одиночными по своей природе 39,40 . Эти различия в организации и способах передачи митохондриальной хромосомы сильно влияют на поведение сегрегации мтДНК.
Эти различия в организации и способах передачи митохондриальной хромосомы сильно влияют на поведение сегрегации мтДНК.
Способы сегрегации мтДНК
Многокопийная природа мтДНК означает, что способ передачи мтДНК рассматривается как стохастический или «расслабленный» в большинстве типов клеток и, таким образом, радикально отличается от такового для ядерных генов 41 . На организменном уровне, например, у людей, мтДНК наследуется однородительским образом по материнской линии, а отцовская мтДНК активно разрушается после оплодотворения 42,43 . Митохондрии в яйцеклетке и сперме также имеют разные функциональные состояния, формы и клеточное распределение, и эти различия, вероятно, важны для придания приспособленности.Кроме того, от поколения к поколению генотипы мтДНК быстро сегрегируют, указывая на то, что существует «узкое место» для потенциальной элиминации сильно дефектных митохондрий и/или мтДНК. В ооцитах узкое место частично обусловлено способом репликации мтДНК, а также следствием митохондриальной организации.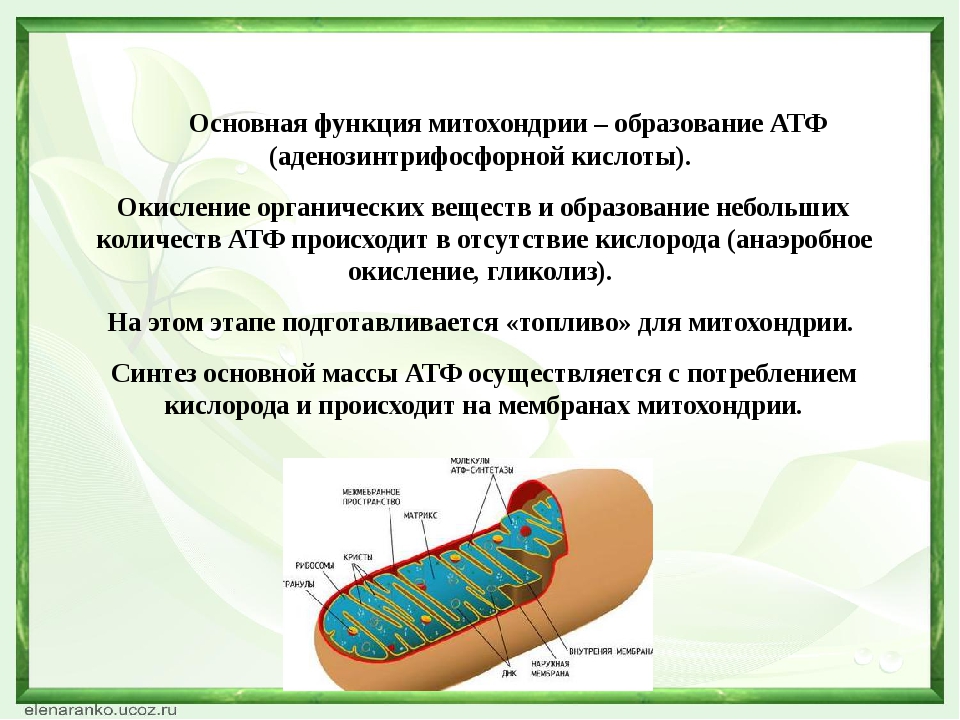 Митохондрии ооцитов организованы в временную структуру, называемую тельцем Бальбиани, состоящую из других органелл, таких как эндоплазматический ретикулум (ER) и аппарат Гольджи, но биогенез этой структуры плохо изучен 44 .Во время репрограммирования фибробластов в индуцированные плюрипотентные стволовые (иПС) клетки гетероплазматические генотипы мтДНК также сегрегируют через узкое место, а митохондрии организуются в структуру, подобную Бальбиани 45 , что позволяет предположить, что иПС клетки могут быть полезным инструментом для изучения клеточные и молекулярные механизмы сегрегации генотипов мтДНК в процессе развития.
Митохондрии ооцитов организованы в временную структуру, называемую тельцем Бальбиани, состоящую из других органелл, таких как эндоплазматический ретикулум (ER) и аппарат Гольджи, но биогенез этой структуры плохо изучен 44 .Во время репрограммирования фибробластов в индуцированные плюрипотентные стволовые (иПС) клетки гетероплазматические генотипы мтДНК также сегрегируют через узкое место, а митохондрии организуются в структуру, подобную Бальбиани 45 , что позволяет предположить, что иПС клетки могут быть полезным инструментом для изучения клеточные и молекулярные механизмы сегрегации генотипов мтДНК в процессе развития.
Ядерные гены реплицируются в течение конечной фазы клеточного цикла и разделяются совместным действием механизма веретена на основе микротрубочек и машины цитокинеза на основе актина, которые работают вместе, чтобы физически разделить хромосомы на дочерние клетки.Бактериальные клетки также обладают механизмами клеточного цикла для координации клеточного деления с сегрегацией хромосом за счет размещения тубулиноподобной машины для деления клеток FtsZ.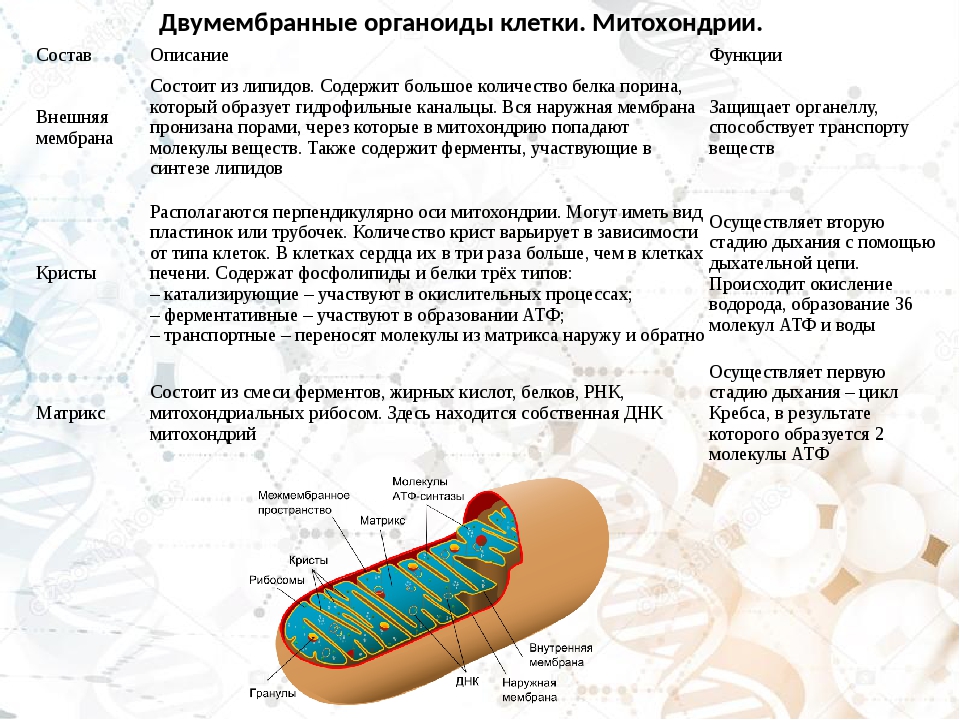 Напротив, репликация и сегрегация митохондриальных хромосом у большинства эукариот строго не связана с клеточным циклом, и в любой момент времени репликация мтДНК происходит только для подмножества нуклеоидов в данной клетке 46 . Бактериальный цитоскелетный аппарат был утрачен во время митохондриальной эволюции, что ставит вопрос: какие механизмы используются для размещения сайтов деления и сегрегации мтДНК? Такие механизмы, вероятно, будут важны для понимания клеточно- и тканеспецифических механизмов, лежащих в основе заболеваний, связанных с мутациями мтДНК.
Напротив, репликация и сегрегация митохондриальных хромосом у большинства эукариот строго не связана с клеточным циклом, и в любой момент времени репликация мтДНК происходит только для подмножества нуклеоидов в данной клетке 46 . Бактериальный цитоскелетный аппарат был утрачен во время митохондриальной эволюции, что ставит вопрос: какие механизмы используются для размещения сайтов деления и сегрегации мтДНК? Такие механизмы, вероятно, будут важны для понимания клеточно- и тканеспецифических механизмов, лежащих в основе заболеваний, связанных с мутациями мтДНК.
Опосредованная динамином митохондриальная динамика
У высших эукариот сегрегация мтДНК на клеточном уровне частично зависит от непрерывных событий деления и слияния (), скорость которых зависит от потребностей определенного типа клеток 47 . Одна фундаментальная роль митохондриального слияния состоит в обеспечении связи между органеллами, возможно, для облегчения доступа к продуктам экспрессии мтДНК 48-50 . Митохондриальное слияние также служит механизмом для буферизации временных дефектов, возникающих в митохондриях -51-.Митохондриальное деление препятствует сборке сети, управляемой слиянием, для облегчения распределения и транспорта митохондрий с помощью моторных белков в сетях цитоскелета в отдаленные места потребности и из них 52 . Баланс между делением и слиянием важен для распределения и поддержания мтДНК. Потеря митохондриального слияния вызывает фрагментацию нормально связанной сети на множественные маленькие митохондрии вследствие беспрепятственного деления, и мтДНК либо полностью, либо частично теряется из клеток с ассоциированными тяжелыми дефектами окислительного фосфорилирования 50,53 .Затухание митохондриального деления заставляет митохондрии удлиняться и формировать высоко взаимосвязанные сетчатые структуры, а также вызывать дефекты окислительного фосфорилирования и потерю мтДНК во время клеточного деления 54–57 . Связь между митохондриальной динамикой и передачей мтДНК согласуется с первичной ролью динамики в контроле числа копий митохондрий.
Митохондриальное слияние также служит механизмом для буферизации временных дефектов, возникающих в митохондриях -51-.Митохондриальное деление препятствует сборке сети, управляемой слиянием, для облегчения распределения и транспорта митохондрий с помощью моторных белков в сетях цитоскелета в отдаленные места потребности и из них 52 . Баланс между делением и слиянием важен для распределения и поддержания мтДНК. Потеря митохондриального слияния вызывает фрагментацию нормально связанной сети на множественные маленькие митохондрии вследствие беспрепятственного деления, и мтДНК либо полностью, либо частично теряется из клеток с ассоциированными тяжелыми дефектами окислительного фосфорилирования 50,53 .Затухание митохондриального деления заставляет митохондрии удлиняться и формировать высоко взаимосвязанные сетчатые структуры, а также вызывать дефекты окислительного фосфорилирования и потерю мтДНК во время клеточного деления 54–57 . Связь между митохондриальной динамикой и передачей мтДНК согласуется с первичной ролью динамики в контроле числа копий митохондрий. Таким образом, более дистрибутивная природа митохондриального деления в сочетании с противоположным слиянием эволюционировала, чтобы заменить наследственные бактериальные цитоскелетные машины.
Таким образом, более дистрибутивная природа митохондриального деления в сочетании с противоположным слиянием эволюционировала, чтобы заменить наследственные бактериальные цитоскелетные машины.
События митохондриального деления и слияния опосредуются действием высококонсервативных родственных динамину белков (DRPs), которые благодаря своей способности к самосборке и гидролизу GTP облегчают ремоделирование мембран различных внутриклеточных мембран 58 . Деление митохондрий катализируется одним DRP, DRP1 у млекопитающих (Dnm1 у дрожжей). DRP1 и Dnm1 собираются через стеблевые домены в спиральные структуры, которые обертывают внешнюю поверхность митохондрий в местах перетяжек, диаметры которых совпадают с диаметрами спирали деления 59,60 .Взаимодействия между доменами GTPase деления DRPs через спиральные звенья катализируют гидролиз GTP — событие, которое, как считается, производит конформационные изменения, которые трансдуцируются через спираль DRP, чтобы сделать возможным координированное расщепление внешней и внутренней мембран 61-63 . Слияние наружной и внутренней мембран митохондрий требует действия двух эволюционно различных интегральных мембранных DRP, MFN1/MFN2 у млекопитающих (Fzo1 у дрожжей) и OPA1 у млекопитающих (Mgm1 у дрожжей), соответственно 64 .Гораздо меньше известно о том, как слитые DRP работают на механистическом уровне, хотя вполне вероятно, что взаимодействия между доменами GTPase на противоположных мембранах используются для связывания мембраны и что самосборка через предполагаемые стеблевидные области внутри мембраны используется для слияние.
Слияние наружной и внутренней мембран митохондрий требует действия двух эволюционно различных интегральных мембранных DRP, MFN1/MFN2 у млекопитающих (Fzo1 у дрожжей) и OPA1 у млекопитающих (Mgm1 у дрожжей), соответственно 64 .Гораздо меньше известно о том, как слитые DRP работают на механистическом уровне, хотя вполне вероятно, что взаимодействия между доменами GTPase на противоположных мембранах используются для связывания мембраны и что самосборка через предполагаемые стеблевидные области внутри мембраны используется для слияние.
Семейство DRP происходит от бактерий, для которых данные свидетельствуют о том, что члены также функционируют в процессах, связанных с мембраной 65 . Тем не менее, приобретенные DRP роли в качестве первичных машин, контролирующих число копий митохондрий, являются радикальным отличием от бактериальной FtsZ-зависимой машины деления, которая работает с цитозольной стороны плазматической мембраны, опосредуя сужение и деление (16). Понимание этого перехода к DRP-управляемому делению исходит из машин деления примитивных эукариотических органелл таких организмов, как красные водоросли Cyanidioschyzon merolae , а также из эндосимбиотических пластид и хлоропластов большинства фотосинтезирующих эукариот. Эти эндосимбиотические органеллы обладают гибридными машинами деления, содержащими как внутренние FtsZ, так и внешние сборки DRP 66,67 . Машина FtsZ функционирует при сжатии и разрыве внутренней и внешней мембран и позиционировании места деления, в то время как машина DRP задействована на внешней поверхности органеллы — в месте сужения — и функционирует относительно поздно в процессе завершения процесса деления. разрыв наружной мембраны.Как и в случае с бактериями, FtsZ-зависимое расположение сайтов деления в этих митохондриях и пластидах имеет решающее значение для передачи органелларных геномов.
Понимание этого перехода к DRP-управляемому делению исходит из машин деления примитивных эукариотических органелл таких организмов, как красные водоросли Cyanidioschyzon merolae , а также из эндосимбиотических пластид и хлоропластов большинства фотосинтезирующих эукариот. Эти эндосимбиотические органеллы обладают гибридными машинами деления, содержащими как внутренние FtsZ, так и внешние сборки DRP 66,67 . Машина FtsZ функционирует при сжатии и разрыве внутренней и внешней мембран и позиционировании места деления, в то время как машина DRP задействована на внешней поверхности органеллы — в месте сужения — и функционирует относительно поздно в процессе завершения процесса деления. разрыв наружной мембраны.Как и в случае с бактериями, FtsZ-зависимое расположение сайтов деления в этих митохондриях и пластидах имеет решающее значение для передачи органелларных геномов.
a , Роль FtsZ и родственных динамину белков (DRP) в делении бактериальных и эндосимбиотических органелл и размещении мест деления.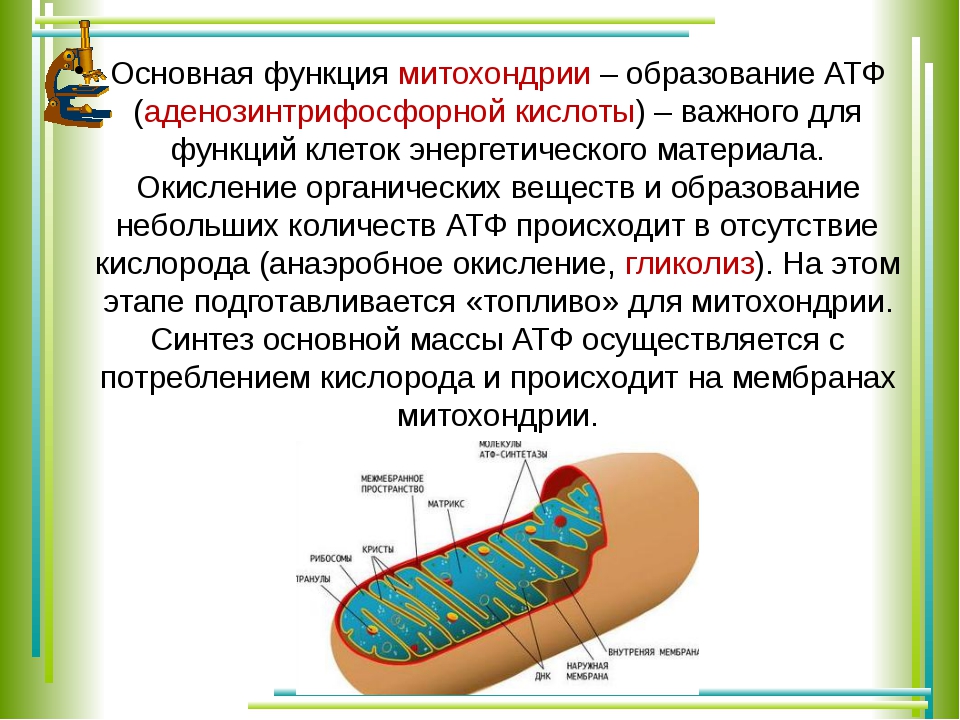 У α-протеобактериального предка митохондрий кольцо FtsZ помещается в середину клетки с помощью активных механизмов. Комбинированные действия FtsZ-содержащего кольца и синтеза клеточной стенки необходимы для клеточного деления.В хлоропластах и митохондриях водорослей FtsZ-зависимое размещение (указано стрелками) и механизмы деления внутри органеллы сохранились в ходе эволюции. Однако в этих органеллах DRPs также функционируют на цитозольной поверхности при делении органелл, возможно, заменяя потребность в синтезе клеточной стенки при делении. У дрожжей или животных DRP функционируют на цитозольной поверхности при делении органелл. Перед рекрутированием DRP, однако, эндоплазматический ретикулум (ER) связан с размещением сайта деления и сужением снаружи органеллы, потенциально заменяя FtsZ-зависимое размещение и сужение. b , Молекулярная модель размещения сайта деления в сочетании с сегрегацией нуклеоидов в митохондриях дрожжей. У дрожжей комплекс связывания ER-митохондрий, ER-митохондриальная структура столкновения (ERMES) и консервативная Miro GTPase Gem1 пространственно и функционально связаны с ER-ассоциированным митохондриальным делением (ERMD).
У α-протеобактериального предка митохондрий кольцо FtsZ помещается в середину клетки с помощью активных механизмов. Комбинированные действия FtsZ-содержащего кольца и синтеза клеточной стенки необходимы для клеточного деления.В хлоропластах и митохондриях водорослей FtsZ-зависимое размещение (указано стрелками) и механизмы деления внутри органеллы сохранились в ходе эволюции. Однако в этих органеллах DRPs также функционируют на цитозольной поверхности при делении органелл, возможно, заменяя потребность в синтезе клеточной стенки при делении. У дрожжей или животных DRP функционируют на цитозольной поверхности при делении органелл. Перед рекрутированием DRP, однако, эндоплазматический ретикулум (ER) связан с размещением сайта деления и сужением снаружи органеллы, потенциально заменяя FtsZ-зависимое размещение и сужение. b , Молекулярная модель размещения сайта деления в сочетании с сегрегацией нуклеоидов в митохондриях дрожжей. У дрожжей комплекс связывания ER-митохондрий, ER-митохондриальная структура столкновения (ERMES) и консервативная Miro GTPase Gem1 пространственно и функционально связаны с ER-ассоциированным митохондриальным делением (ERMD). Сайты ERMD, отмеченные этими компонентами, также пространственно локализованы в подмножестве нуклеоидов, которые активно реплицируются, и они сегрегируют перед ERMD. Gem1 действует как негативный регулятор ERMES-зависимых контактов ER-митохондрий и необходим для пространственного разрешения вновь генерируемых митохондрий с помощью ERMD, возможно, посредством локального рекрутирования актинового цитоскелета.Компоненты цитоскелета могут также участвовать в ER-ассоциированном сокращении митохондрий до рекрутирования DRP. Размещение нуклеоидов в сайтах ERMD может быть опосредовано меткой внутри органеллы, образованной каркасным комплексом MitOS. Mdm33 является возможным кандидатом на роль машины для разрезания внутренней мембраны у дрожжей.
Сайты ERMD, отмеченные этими компонентами, также пространственно локализованы в подмножестве нуклеоидов, которые активно реплицируются, и они сегрегируют перед ERMD. Gem1 действует как негативный регулятор ERMES-зависимых контактов ER-митохондрий и необходим для пространственного разрешения вновь генерируемых митохондрий с помощью ERMD, возможно, посредством локального рекрутирования актинового цитоскелета.Компоненты цитоскелета могут также участвовать в ER-ассоциированном сокращении митохондрий до рекрутирования DRP. Размещение нуклеоидов в сайтах ERMD может быть опосредовано меткой внутри органеллы, образованной каркасным комплексом MitOS. Mdm33 является возможным кандидатом на роль машины для разрезания внутренней мембраны у дрожжей.
Митохондриальное деление, связанное с ER
Утрата FtsZ-подобной машины у высших эукариот поднимает вопросы о том, как и где в митохондриях располагаются сайты деления и важно ли размещение сайтов деления для передачи мтДНК.Ответы частично получены благодаря открытию того, что размещение сайта митохондриального деления зависит от ключевого межорганеллярного взаимодействия с ER 68 . Перед рекрутированием DRP1 на наружную мембрану митохондрий ER-трубочки оборачиваются вокруг митохондрий и отмечают участки митохондриального деления — феномен, названный ER-associated mitochondrial Division (ERMD), который сохранился от дрожжей до человека. В этих местах митохондрии сужаются, и таким образом также создаются геометрические горячие точки для сборки спирали деления DRP.Кроме того, интегральный наружный мембранный рецептор DRP1 и эффектор MFF 69 рекрутируются в места контакта, что обеспечивает пространственную метку для связи рекрутирования DRP1 с его активацией и сборкой в машине деления. Ни механизм, лежащий в основе генерации такого ER-митохондриального микродомена, ни связанного с ER митохондриального сужения не понятен. Вполне возможно, что ER способен непосредственно изменять состав и/или морфологию митохондриальной мембраны, чтобы облегчить рекрутирование факторов, локализованных снаружи и/или внутри митохондрий, которые способствуют митохондриальному сужению и делению.
Перед рекрутированием DRP1 на наружную мембрану митохондрий ER-трубочки оборачиваются вокруг митохондрий и отмечают участки митохондриального деления — феномен, названный ER-associated mitochondrial Division (ERMD), который сохранился от дрожжей до человека. В этих местах митохондрии сужаются, и таким образом также создаются геометрические горячие точки для сборки спирали деления DRP.Кроме того, интегральный наружный мембранный рецептор DRP1 и эффектор MFF 69 рекрутируются в места контакта, что обеспечивает пространственную метку для связи рекрутирования DRP1 с его активацией и сборкой в машине деления. Ни механизм, лежащий в основе генерации такого ER-митохондриального микродомена, ни связанного с ER митохондриального сужения не понятен. Вполне возможно, что ER способен непосредственно изменять состав и/или морфологию митохондриальной мембраны, чтобы облегчить рекрутирование факторов, локализованных снаружи и/или внутри митохондрий, которые способствуют митохондриальному сужению и делению. В клетках млекопитающих актиновый цитоскелет вовлечен в ERMD, потенциально через ER-локализованную изоформу formin INF2, повышая вероятность того, что митохондриальные сужения во время деления опосредованы актином 70 .
В клетках млекопитающих актиновый цитоскелет вовлечен в ERMD, потенциально через ER-локализованную изоформу formin INF2, повышая вероятность того, что митохондриальные сужения во время деления опосредованы актином 70 .
ERMD также должен включать связь или связь между двумя органеллами. Молекулярная основа этой связи была недавно выяснена у дрожжей и опосредована мультибелковым комплексом, названным ER-митохондриальной структурой столкновения (ERMES). Эта структура образует дискретное и конечное число интерфейсов между ЭР и митохондриями в клетках 71,72 .Помимо маркировки участков деления, структуры ERMES тесно связаны с подмножеством нуклеоидов, участвующих в репликации мтДНК 46,73 , потенциально как компоненты более крупной структуры, которая охватывает несколько мембран. На участках комплекса ERMES нуклеоиды сегрегируют по неизвестному механизму и в большинстве случаев распределяются по обеим верхушкам разделенных митохондрий 72 .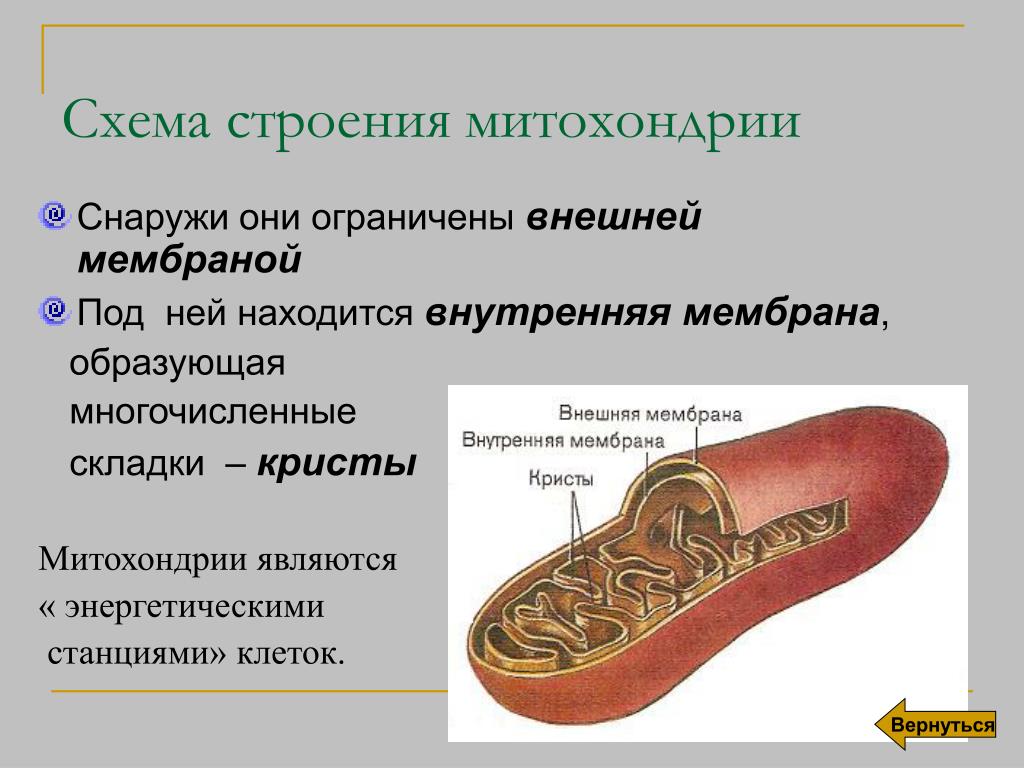 В этом контексте комплекс ERMES также участвует в качестве моста между митохондриями и актиновой сетью, предполагая, что он может связывать и координировать сегрегацию нуклеоидов, митохондриальные перетяжки во время деления и распределение митохондрий после деления 74.Т.о., процесс ERMD и сегрегации нуклеоидов у дрожжей может фундаментально быть связан с ролью актина в ERMD в клетках млекопитающих.
В этом контексте комплекс ERMES также участвует в качестве моста между митохондриями и актиновой сетью, предполагая, что он может связывать и координировать сегрегацию нуклеоидов, митохондриальные перетяжки во время деления и распределение митохондрий после деления 74.Т.о., процесс ERMD и сегрегации нуклеоидов у дрожжей может фундаментально быть связан с ролью актина в ERMD в клетках млекопитающих.
Для распределения дочерних митохондрий после ERMD у дрожжей требуется высококонсервативная Miro GTPase Gem1 (ref. 72). Gem1 может функционировать с ERMES, чтобы способствовать разрешению дочерних митохондрий путем рекрутирования факторов подвижности на кончики митохондрий после деления. Ортологи Gem1 многоклеточных животных, MIRO1 и MIRO2 (здесь и далее обозначаемые как Miro), также функционируют в митохондриальном распределении.В этом случае было предложено, что белки Miro соединяют митохондрии с членом семейства белков Milton/TRAK адаптеров kinesin-1, чтобы обеспечить транспорт митохондрий на основе микротрубочек 75,76 .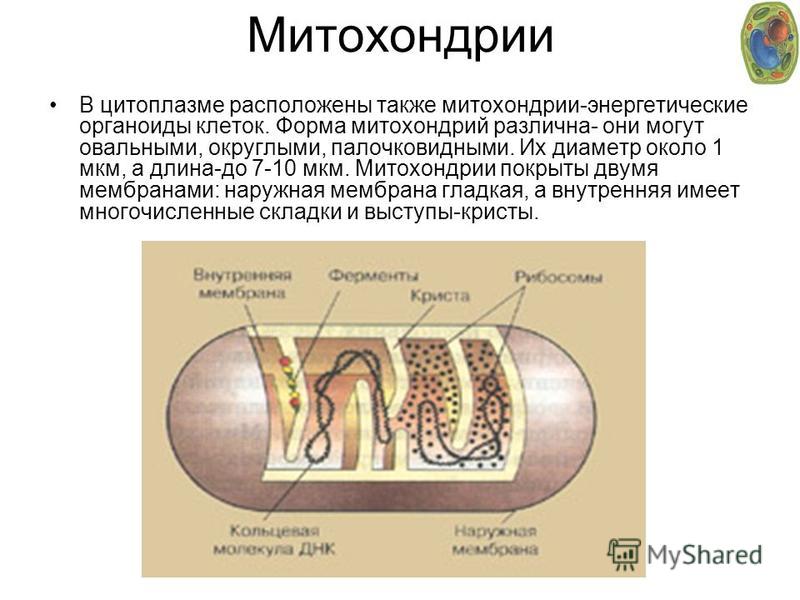 Однако, хотя семейство Miro GTPase удивительно консервативно, механизмы митохондриального транспорта различаются у эукариот, а у дрожжей митохондриальная подвижность зависит от актина. Т.о., возможно, что роль Gem1 и Miro GTPases в митохондриальном распределении вместо этого может заключаться в обеспечении подвижности путем непосредственной регуляции молекулярных связей для отделения митохондрий от ER в местах деления.В любом случае Gem1-зависимое распределение дочерних митохондрий после митохондриального деления служит клеточным механизмом для координированного распределения митохондрий и мтДНК.
Однако, хотя семейство Miro GTPase удивительно консервативно, механизмы митохондриального транспорта различаются у эукариот, а у дрожжей митохондриальная подвижность зависит от актина. Т.о., возможно, что роль Gem1 и Miro GTPases в митохондриальном распределении вместо этого может заключаться в обеспечении подвижности путем непосредственной регуляции молекулярных связей для отделения митохондрий от ER в местах деления.В любом случае Gem1-зависимое распределение дочерних митохондрий после митохондриального деления служит клеточным механизмом для координированного распределения митохондрий и мтДНК.
Внутренние детерминанты митохондриального деления
Обсуждаемые наблюдения рисуют убедительную картину, в которой ERMD размещает плоскость деления рядом с митохондриальными нуклеоидами, чтобы сместить их распределение во вновь образованные дочерние митохондрии (). В клетках млекопитающих нуклеоиды сходным образом локализованы в местах деления митохондрий и на кончиках митохондрий 77,78 , а в отсутствие деления DRP DRP1 нуклеоиды агрегируют в кластеры внутри гиперфузированных митохондрий 79 . Это указывает на то, что роль ERMD в распределении нуклеоидов законсервирована, хотя молекулярная идентичность ER-митохондриальной связи или связей в местах деления в клетках млекопитающих неизвестна. Что еще более важно, вопрос о том, что определяет размещение участков деления, все еще требует ответа. В частности, неизвестно, какие детерминанты необходимы для конечного числа и пространственной локализации сайтов контактов ER-митохондрий, связанных с сегрегацией нуклеоидов. Эти вопросы связаны с тем, существует ли внутри митохондрий механизм, аналогичный бактериальному FtsZ, который способствует митохондриальному делению.У дрожжей прекрасным кандидатом на роль машины для расщепления внутренней мембраны является белок внутренней мембраны Mdm33, который обладает локализованными в матриксе спирально-скрученными областями, которые могут действовать in trans через внутренние мембраны, опосредуя сужение 80 .
Это указывает на то, что роль ERMD в распределении нуклеоидов законсервирована, хотя молекулярная идентичность ER-митохондриальной связи или связей в местах деления в клетках млекопитающих неизвестна. Что еще более важно, вопрос о том, что определяет размещение участков деления, все еще требует ответа. В частности, неизвестно, какие детерминанты необходимы для конечного числа и пространственной локализации сайтов контактов ER-митохондрий, связанных с сегрегацией нуклеоидов. Эти вопросы связаны с тем, существует ли внутри митохондрий механизм, аналогичный бактериальному FtsZ, который способствует митохондриальному делению.У дрожжей прекрасным кандидатом на роль машины для расщепления внутренней мембраны является белок внутренней мембраны Mdm33, который обладает локализованными в матриксе спирально-скрученными областями, которые могут действовать in trans через внутренние мембраны, опосредуя сужение 80 .
Учитывая эндосимбиотическое происхождение митохондрий, заманчиво предположить, что пространственная метка внутри органелл используется в качестве детерминанты размещения плоскости деления.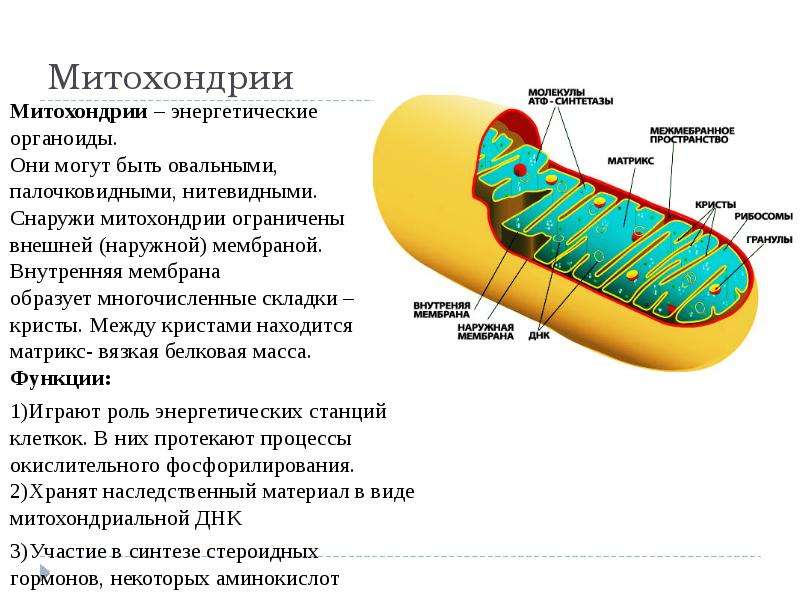 Имеются данные об автономной структуре в митохондриях, сходной с ДНК-реплицирующей реплисомой, которая может функционировать как такая метка.В частности, нуклеоидные белки, необходимые для поддержания мтДНК, остаются локализованными в дискретных точечных структурах в митохондриальных канальцах в отсутствие мтДНК в клетках дрожжей и млекопитающих, что позволяет предположить, что они обладают внутренней способностью организовываться в структуру независимым от мтДНК образом 46,81 . У дрожжей реплисомы сегрегируют внутри митохондрий и поддерживают свою ассоциацию с ERMES-маркированными сайтами контактов ER-митохондрий, даже в отсутствие митохондриальных геномов 46 .
Имеются данные об автономной структуре в митохондриях, сходной с ДНК-реплицирующей реплисомой, которая может функционировать как такая метка.В частности, нуклеоидные белки, необходимые для поддержания мтДНК, остаются локализованными в дискретных точечных структурах в митохондриальных канальцах в отсутствие мтДНК в клетках дрожжей и млекопитающих, что позволяет предположить, что они обладают внутренней способностью организовываться в структуру независимым от мтДНК образом 46,81 . У дрожжей реплисомы сегрегируют внутри митохондрий и поддерживают свою ассоциацию с ERMES-маркированными сайтами контактов ER-митохондрий, даже в отсутствие митохондриальных геномов 46 .
Митохондриальные скелетные структуры также могут служить внутренними пространственными метками. Хотя бактериоподобные элементы цитоскелета, по-видимому, утрачены, внутри митохондрий существует множество подобных каркасу структур, способствующих формированию их сложной внешней и внутренней структуры.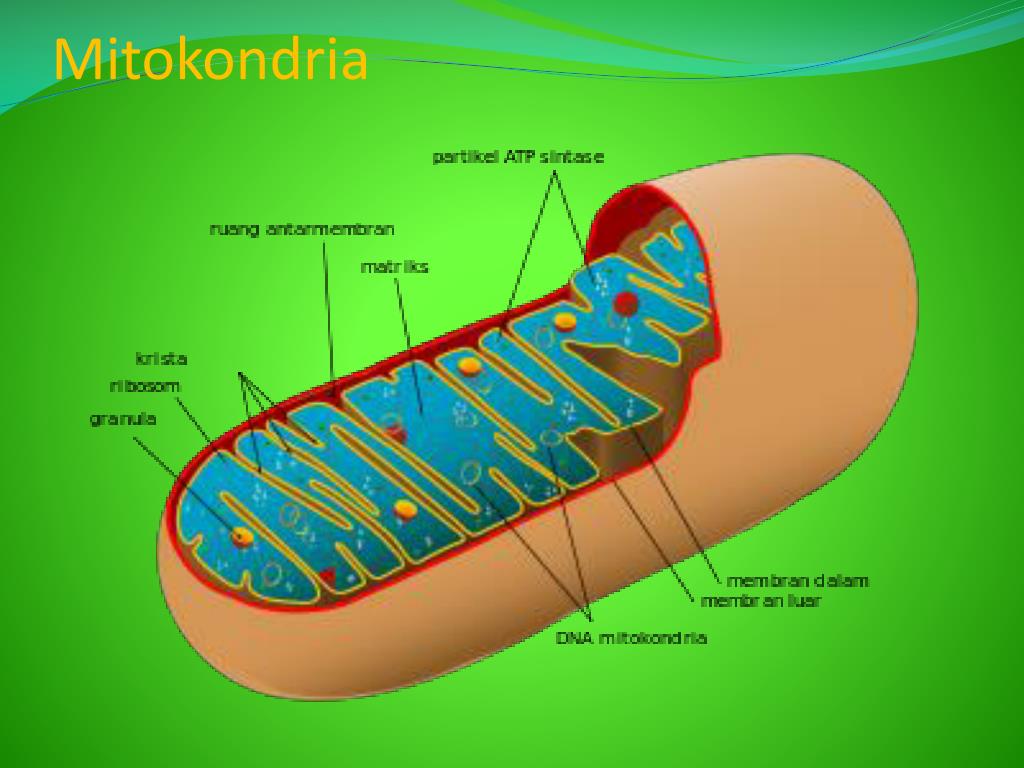 Митохондриальные каркасы работают вместе, создавая организацию органелл более высокого уровня, которая может кодировать пространственные метки для размещения нуклеоида и/или сайта деления. Эти каркасы включают консервативный комплекс запретина, который образует кольцеобразные структуры во внутренней мембране, которые функционируют вместе с митохондриальными липидами, такими как кардиолипин и фосфатидилэтаноламин, для организации доменов внутренней мембраны -82-.Другим первичным «скелетным» элементом в митохондриях является консервативный мультисубъединичный комплекс, ассоциированный с внутренней мембраной MitOS (также называемый MICOS и MINOS) 83–85 . Имеющиеся данные указывают на то, что MitOS образует расширенную гетероморфную структуру, которая организует и потенциально формирует внутреннюю мембрану митохондрий, которая дифференцируется на области, отличающиеся структурно, композиционно и функционально. Область, расположенная близко к наружной мембране, называемая пограничной областью, облегчает перенос липидов, импорт митохондриальных белков и сборку дыхательных комплексов.
Митохондриальные каркасы работают вместе, создавая организацию органелл более высокого уровня, которая может кодировать пространственные метки для размещения нуклеоида и/или сайта деления. Эти каркасы включают консервативный комплекс запретина, который образует кольцеобразные структуры во внутренней мембране, которые функционируют вместе с митохондриальными липидами, такими как кардиолипин и фосфатидилэтаноламин, для организации доменов внутренней мембраны -82-.Другим первичным «скелетным» элементом в митохондриях является консервативный мультисубъединичный комплекс, ассоциированный с внутренней мембраной MitOS (также называемый MICOS и MINOS) 83–85 . Имеющиеся данные указывают на то, что MitOS образует расширенную гетероморфную структуру, которая организует и потенциально формирует внутреннюю мембрану митохондрий, которая дифференцируется на области, отличающиеся структурно, композиционно и функционально. Область, расположенная близко к наружной мембране, называемая пограничной областью, облегчает перенос липидов, импорт митохондриальных белков и сборку дыхательных комплексов.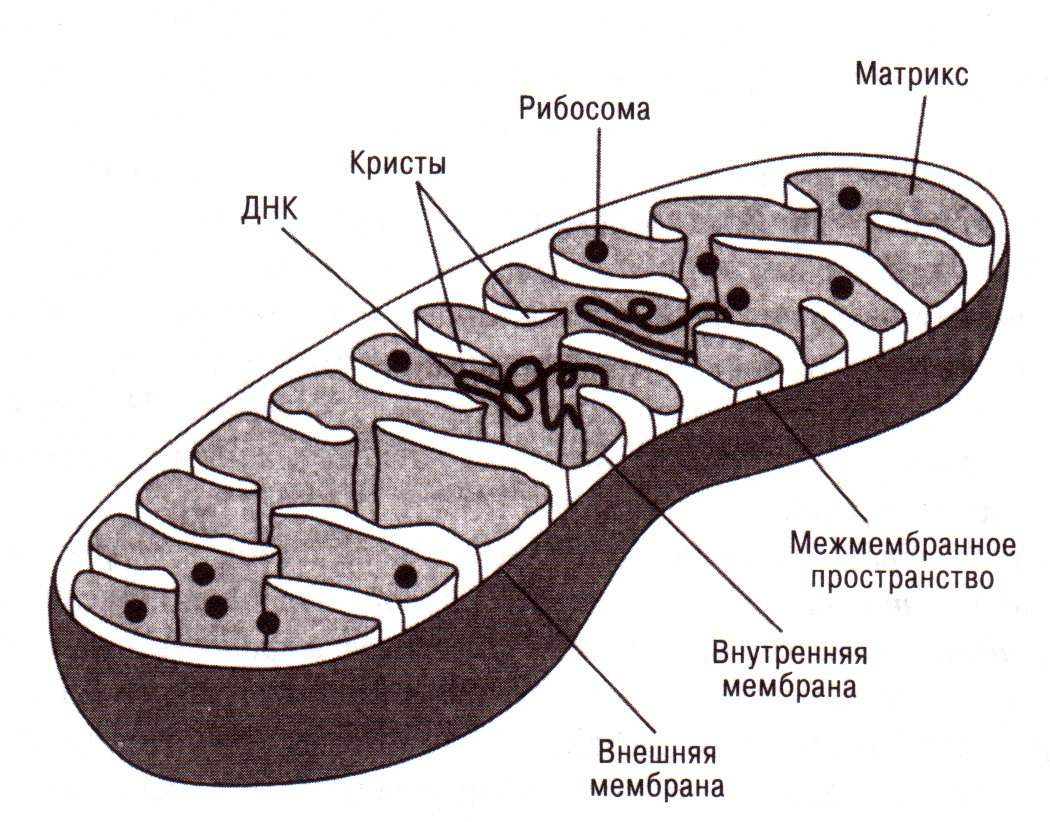 Цистернальные инвагинации внутренней мембраны, называемые кристами, содержат собранные дыхательные комплексы и имеют сильно изогнутые края, которые стабилизируются за счет димеризации или мультимеризации комплексов АТФ-синтазы 86 . Относительно узкие канальцы, называемые соединениями крист, соединяют кристы с пограничной мембраной и отделяют растворимые компоненты межмембранного пространства от пограничных областей. Эти соединения реструктурируются при апоптозе, чтобы способствовать высвобождению локализованных в межмембранном пространстве медиаторов гибели клеток в цитозоль во время митохондриальной проницаемости внешней мембраны (MOMP) 87 .Визуализация сверхвысокого разрешения показала, что нуклеоиды млекопитающих тесно связаны с кристами внутренней мембраны 39 . Т.о., комплекс MitOS может также играть непосредственную роль в позиционировании нуклеоидов и/или может быть частью пространственной метки, которая связывает внутреннюю часть митохондрий с внешней.
Цистернальные инвагинации внутренней мембраны, называемые кристами, содержат собранные дыхательные комплексы и имеют сильно изогнутые края, которые стабилизируются за счет димеризации или мультимеризации комплексов АТФ-синтазы 86 . Относительно узкие канальцы, называемые соединениями крист, соединяют кристы с пограничной мембраной и отделяют растворимые компоненты межмембранного пространства от пограничных областей. Эти соединения реструктурируются при апоптозе, чтобы способствовать высвобождению локализованных в межмембранном пространстве медиаторов гибели клеток в цитозоль во время митохондриальной проницаемости внешней мембраны (MOMP) 87 .Визуализация сверхвысокого разрешения показала, что нуклеоиды млекопитающих тесно связаны с кристами внутренней мембраны 39 . Т.о., комплекс MitOS может также играть непосредственную роль в позиционировании нуклеоидов и/или может быть частью пространственной метки, которая связывает внутреннюю часть митохондрий с внешней.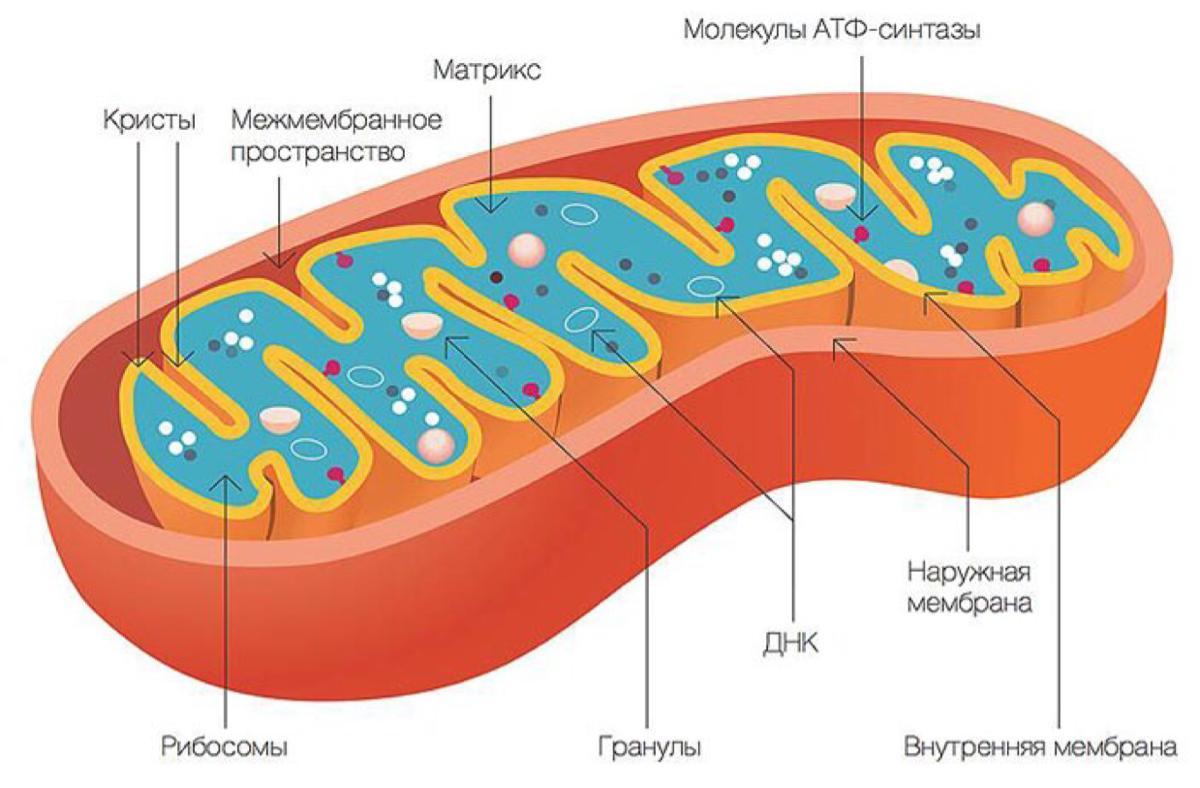 В соответствии с этой возможностью, у дрожжей элементы комплекса MitOS кажутся смежными с нуклеоидами, и потеря интактного комплекса MitOS приводит к агрегации нуклеоидов 88 . Этот комплекс также способствует митохондриальному биогенезу, взаимодействуя с компонентами механизмов импорта и сортировки во внешней митохондриальной мембране 85 .Таким образом, MitOS может иметь более глобальную функцию в качестве «чертежа» митохондриальной организации и в этом качестве может действовать как интегратор «форма-функция».
В соответствии с этой возможностью, у дрожжей элементы комплекса MitOS кажутся смежными с нуклеоидами, и потеря интактного комплекса MitOS приводит к агрегации нуклеоидов 88 . Этот комплекс также способствует митохондриальному биогенезу, взаимодействуя с компонентами механизмов импорта и сортировки во внешней митохондриальной мембране 85 .Таким образом, MitOS может иметь более глобальную функцию в качестве «чертежа» митохондриальной организации и в этом качестве может действовать как интегратор «форма-функция».
Микродомен ERMD как системный интегратор
Хотя фундаментальная роль связанного с ER деления может заключаться в контроле распределения мтДНК, данные свидетельствуют о том, что домены ERMD используются для дополнительных и разнообразных функций в клетках и, таким образом, могут также функционировать как интеграторы . В дополнение к ERMD комплекс ERMES функционально связан с биогенезом белков внешней мембраны и с транспортом липидов между ER и митохондриями, что имеет решающее значение для синтеза основных митохондриальных липидов, таких как фосфатидилэтаноламин и кардиолипин 71,89 .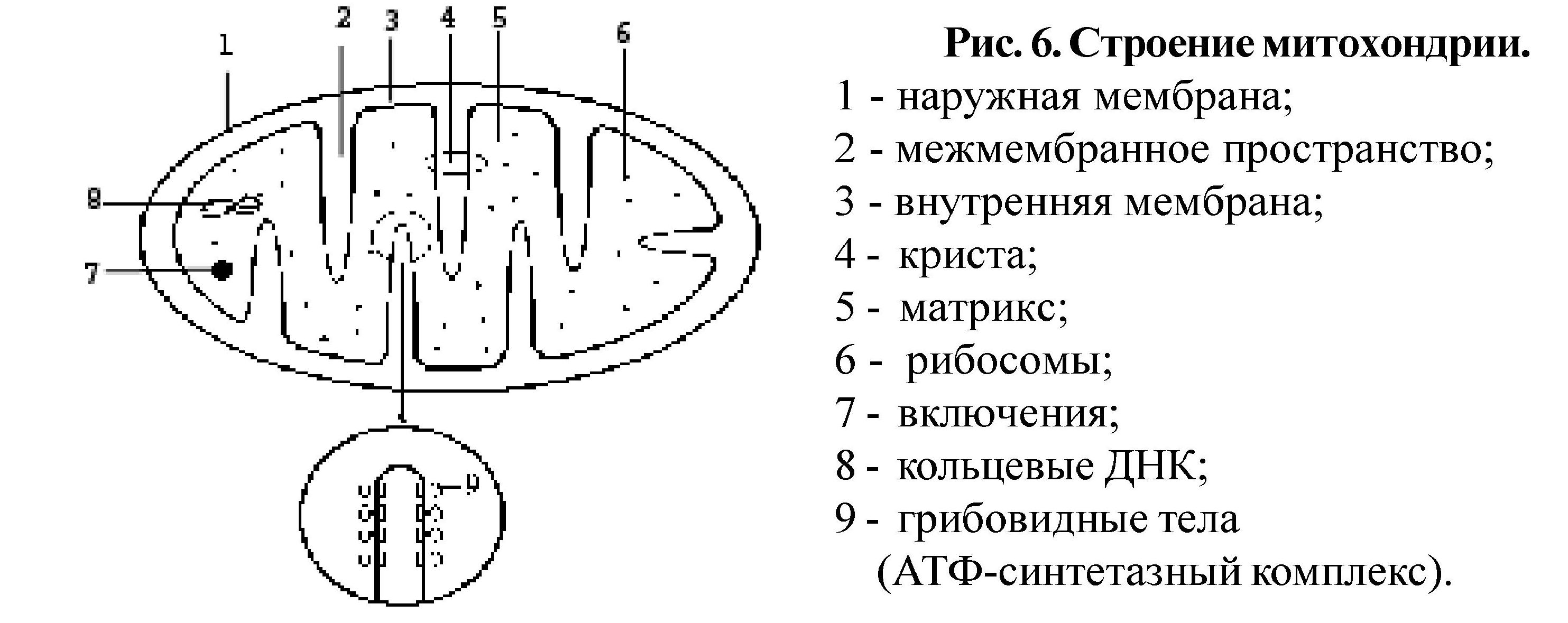 Таким образом, домены ERMD могут также контролировать клеточный статус, облегчая связь между митохондриальным поведением и клеточными сигнальными путями, например, между митохондриальным делением, слиянием и гибелью клеток. С этой возможностью согласуется тот факт, что DRP1 облегчает рекрутирование и активацию проапоптотического белка Bcl-2 BAX на внешней мембране митохондрий, чтобы опосредовать MOMP 90 . Кроме того, сфинголипиды, синтезированные ER, способствуют митохондриальной сборке BAX и активации MOMP in vitro 91 .Наоборот, митохондриальное слияние играет негативную регуляторную роль в MOMP, т.к. цитозольный BAX способствует митохондриальному слиянию in vitro посредством DRP MFN2 (ссылка 92), повышая вероятность того, что слитые DRPs также регулируют апоптоз посредством доменов ERMD. Возможно, что домены ERMD простираются как во внутренние митохондриальные компартменты, так и в просвет ER, чтобы интегрировать функциональный статус обеих органелл, как предполагает регуляция MOMP при стрессе ER.
Таким образом, домены ERMD могут также контролировать клеточный статус, облегчая связь между митохондриальным поведением и клеточными сигнальными путями, например, между митохондриальным делением, слиянием и гибелью клеток. С этой возможностью согласуется тот факт, что DRP1 облегчает рекрутирование и активацию проапоптотического белка Bcl-2 BAX на внешней мембране митохондрий, чтобы опосредовать MOMP 90 . Кроме того, сфинголипиды, синтезированные ER, способствуют митохондриальной сборке BAX и активации MOMP in vitro 91 .Наоборот, митохондриальное слияние играет негативную регуляторную роль в MOMP, т.к. цитозольный BAX способствует митохондриальному слиянию in vitro посредством DRP MFN2 (ссылка 92), повышая вероятность того, что слитые DRPs также регулируют апоптоз посредством доменов ERMD. Возможно, что домены ERMD простираются как во внутренние митохондриальные компартменты, так и в просвет ER, чтобы интегрировать функциональный статус обеих органелл, как предполагает регуляция MOMP при стрессе ER. В соответствии с этим, когда возникает стресс ER, регулятор апоптоза CDIP1 взаимодействует с белком ER BAP31, что впоследствии приводит к сборке BAX на митохондриях -93-.Таким образом, будет интересно определить, совпадают ли сайты взаимодействия BAP31 и CDIP1 с сайтами ERMD. Связь между ЭР и митохондриями подтверждается их ролью в общем наборе заболеваний, связанных с измененной митохондриальной динамикой. Например, белки, локализованные в ER-митохондриальных контактах, вовлечены в болезнь Гентингтона, атрофию зрительного нерва и спиноцеребеллярные атаксии 94 ; и изменение ER-митохондриального контакта было описано при болезни Альцгеймера 95,96 .Таким образом, дисфункция домена ERMD может быть фактором, способствующим развитию многих заболеваний.
В соответствии с этим, когда возникает стресс ER, регулятор апоптоза CDIP1 взаимодействует с белком ER BAP31, что впоследствии приводит к сборке BAX на митохондриях -93-.Таким образом, будет интересно определить, совпадают ли сайты взаимодействия BAP31 и CDIP1 с сайтами ERMD. Связь между ЭР и митохондриями подтверждается их ролью в общем наборе заболеваний, связанных с измененной митохондриальной динамикой. Например, белки, локализованные в ER-митохондриальных контактах, вовлечены в болезнь Гентингтона, атрофию зрительного нерва и спиноцеребеллярные атаксии 94 ; и изменение ER-митохондриального контакта было описано при болезни Альцгеймера 95,96 .Таким образом, дисфункция домена ERMD может быть фактором, способствующим развитию многих заболеваний.
Домены ERMD представляют собой только один тип контакта ER-митохондрий. У дрожжей, напр., ER является компонентом двух различных связей Num1 и Mmr1, которые избирательно позиционируют митохондрии в коре материнских и дочерних клеток, соответственно, способом, независимым от ERMES и ERMD 97,98.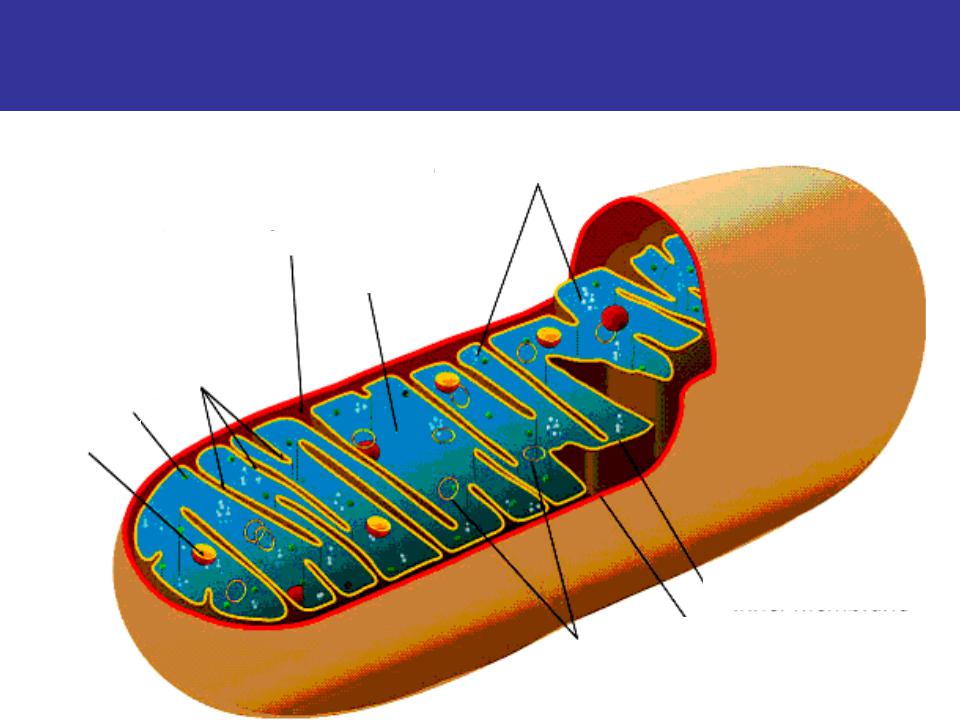 Кроме того, слияние DRP MFN2, которое не является существенным для образования контактов ERMD, как предполагается, действует в клетках млекопитающих как ER-митохондриальная связь 68,99 .Необходима дополнительная работа, особенно в клетках млекопитающих, чтобы понять молекулярную основу контактов ER-митохондрий и существуют ли специализированные контакты и связи для различных общих функций ER-митохондрий, таких как гомеостаз Ca 2+ , биосинтез липидов, ERMD и для ER-митохондриальные контакты, участвующие в аутофагии 100,101 . Это захватывающая область митохондриальной биологии, которая обещает быть весьма актуальной для нашего понимания этиологии, лежащей в основе болезней, связанных с митохондриальной дисфункцией.
Кроме того, слияние DRP MFN2, которое не является существенным для образования контактов ERMD, как предполагается, действует в клетках млекопитающих как ER-митохондриальная связь 68,99 .Необходима дополнительная работа, особенно в клетках млекопитающих, чтобы понять молекулярную основу контактов ER-митохондрий и существуют ли специализированные контакты и связи для различных общих функций ER-митохондрий, таких как гомеостаз Ca 2+ , биосинтез липидов, ERMD и для ER-митохондриальные контакты, участвующие в аутофагии 100,101 . Это захватывающая область митохондриальной биологии, которая обещает быть весьма актуальной для нашего понимания этиологии, лежащей в основе болезней, связанных с митохондриальной дисфункцией.
Координация разнообразного поведения митохондрий
Хотя митохондриальное деление и слияние являются основными детерминантами распределения митохондрий, поведение митохондриальной сети в клетках контролируется дополнительными действиями, такими как связывание и подвижность.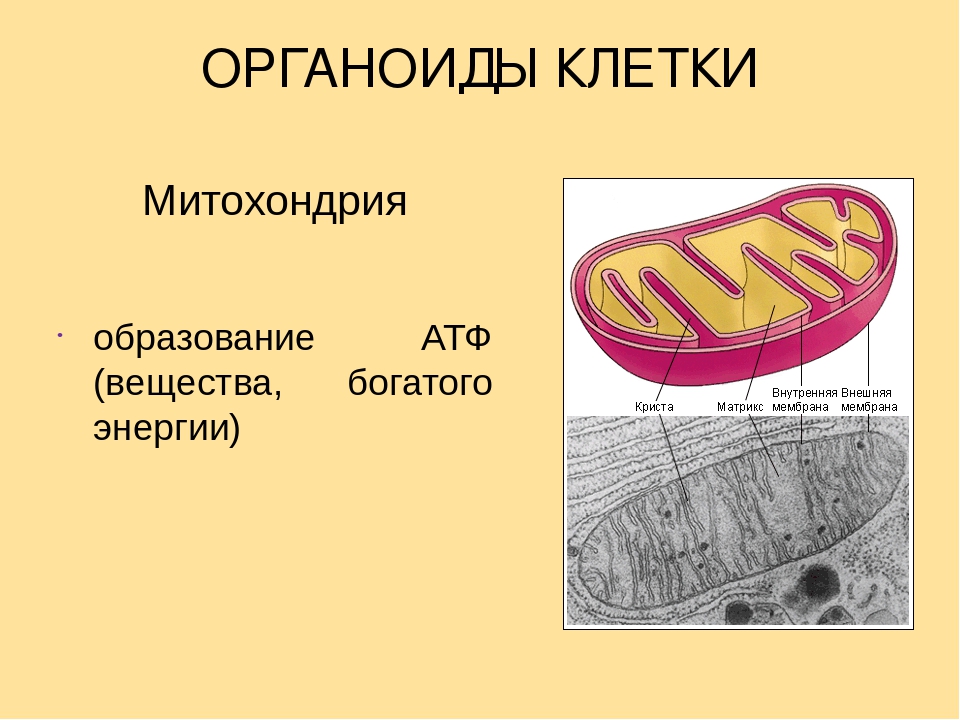 Нейронные клетки являются ярким примером того, как эти поведенческие сети должны работать вместе, чтобы поддерживать клеточную функцию. Нейроны представляют собой длинные, возбудимые клетки, которые сильно разделены, и для правильного функционирования митохондрии должны быть соответствующим образом распределены, чтобы обслуживать различные пространственные и временные потребности клеток.Потребность в митохондриальной продукции АТФ и буферизации Ca 2+ особенно высока на окончаниях аксонов, которые представляют собой динамические структуры, требующие локализованного присутствия митохондрий для синаптической передачи. Учитывая, что большая часть митохондриального биогенеза происходит в соме нейрона, необходимы активные механизмы как для транспорта, так и для иммобилизации митохондрий на дистальных синаптических окончаниях.
Нейронные клетки являются ярким примером того, как эти поведенческие сети должны работать вместе, чтобы поддерживать клеточную функцию. Нейроны представляют собой длинные, возбудимые клетки, которые сильно разделены, и для правильного функционирования митохондрии должны быть соответствующим образом распределены, чтобы обслуживать различные пространственные и временные потребности клеток.Потребность в митохондриальной продукции АТФ и буферизации Ca 2+ особенно высока на окончаниях аксонов, которые представляют собой динамические структуры, требующие локализованного присутствия митохондрий для синаптической передачи. Учитывая, что большая часть митохондриального биогенеза происходит в соме нейрона, необходимы активные механизмы как для транспорта, так и для иммобилизации митохондрий на дистальных синаптических окончаниях.
Понимание того, как эти два процесса координируются и функционируют вместе для избирательного нацеливания митохондрий на активные синаптические окончания, стало возможным благодаря недавним исследованиям нейрон-специфического белка синтафилина, который специфически связывается с наружной мембраной митохондрий и накапливается на иммобилизованных аксональных митохондриях, локализованных в активные терминалы 102 .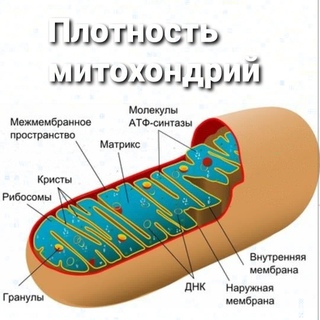 Митохондрии, предназначенные для аксонов, образуются в результате митохондриального деления в соме и транспортируются в синапс по микротрубочкам. Пространственная связь между делением и нуклеоидами, а также нуклеоидами и элементами цитоскелета может в клетках этого типа гарантировать, что митохондрии, предназначенные для транспорта, содержат мтДНК. Синтафилин действует как тормоз, используя как минимум два отдельных механизма. Он напрямую связывается с основанным на микротрубочках кинезиновым мотором KIF5 in vitro и ингибирует его моторную активность, указывая на то, что он превращает KIF5 в компонент статической зависимой от микротрубочек митохондриальной связи.Играет ли роль ER в биогенезе связи syntaphilin-KIF5, остается открытым вопросом. Синтафилин также конкурирует за связывание KIF5 с адаптером Milton/TRAK, чтобы облегчить привязку. Т.о., существует обширное взаимодействие между подвижными и связывающими машинами для управления распределением митохондрий зависящим от активности и пространственно специфичным образом.
Митохондрии, предназначенные для аксонов, образуются в результате митохондриального деления в соме и транспортируются в синапс по микротрубочкам. Пространственная связь между делением и нуклеоидами, а также нуклеоидами и элементами цитоскелета может в клетках этого типа гарантировать, что митохондрии, предназначенные для транспорта, содержат мтДНК. Синтафилин действует как тормоз, используя как минимум два отдельных механизма. Он напрямую связывается с основанным на микротрубочках кинезиновым мотором KIF5 in vitro и ингибирует его моторную активность, указывая на то, что он превращает KIF5 в компонент статической зависимой от микротрубочек митохондриальной связи.Играет ли роль ER в биогенезе связи syntaphilin-KIF5, остается открытым вопросом. Синтафилин также конкурирует за связывание KIF5 с адаптером Milton/TRAK, чтобы облегчить привязку. Т.о., существует обширное взаимодействие между подвижными и связывающими машинами для управления распределением митохондрий зависящим от активности и пространственно специфичным образом.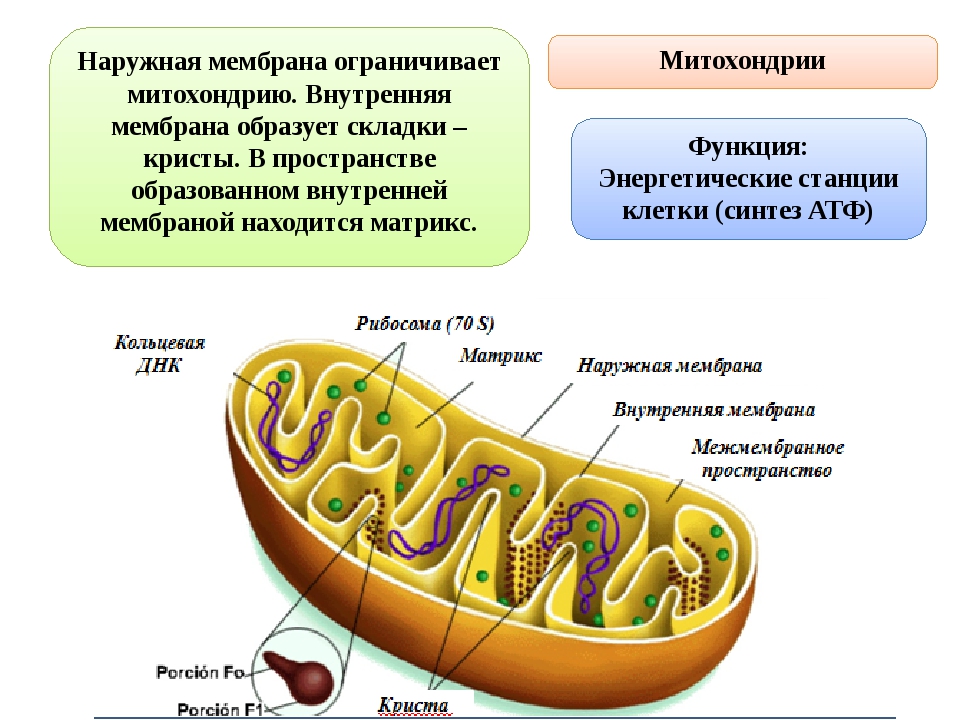
Митохондриальная динамика, вероятно, также координируется на молекулярном уровне с транспортными и связывающими механизмами в различных типах клеток.В клетках млекопитающих митохондрии, в которых отсутствует слитый DRP MFN2, обнаруживают серьезные дефекты подвижности 103 , сходные с дефектами подвижности, наблюдаемыми в клетках, в которых отсутствует Miro, и, как сообщается, MFN2 физически взаимодействует с Miro и Milton/TRAK 104 . Эта связь между слиянием митохондрий и подвижностью может иметь отношение к пониманию того, почему у людей мутации в MFN2 и OPA1 вызывают тканеспецифические нейродегенеративные заболевания, Charcot Marie Tooth Type 2A (CMT2A) и доминантную атрофию зрительного нерва (DOA), соответственно 22 .Действительно, высокая частота мутаций в мтДНК и ядерных генах, которые вызывают митохондриальную дисфункцию, избирательно влияют на нейроны и вызывают разнообразный набор нейродегенеративных заболеваний 32 .
Митохондриальные пути контроля качества
Митохондриальное поведение не только интегрировано друг с другом, но и интегрировано с аккумулятором стресса или путей контроля качества в клетках, которые чувствуют и реагируют на митохондриальную и клеточную дисфункцию (). Внутри митохондрий молекулярные шапероны и протеазы контроля качества действуют вместе, способствуя сборке белковых комплексов, состоящих из белков, кодируемых мтДНК и ядром, а также для мониторинга и деградации развернутых белков 105 .Дисбаланс между ядерным и митохондриальным протеомами и/или накопление развернутых митохондриальных белков запускает программу транскрипционного ответа у многоклеточных животных, называемую путем реакции на стресс митохондриальных развернутых белков (UPRmt) 106–108 . Ответ инициируется сигналами, продуцируемыми на митохондриальном уровне, которые активируют транскрипцию кодируемых ядром генов митохондриальных шаперонов, а также дополнительных генов для восстановления гомеостаза органелл. Этот путь был охарактеризован на молекулярном уровне у Caenorhabditis elegans , для которых и митохондриальный переносчик пептидов внутренней мембраны HAF1, и транскрипционный фактор bZip ATFS1 необходимы для передачи сигналов UPRmt 109 .
Внутри митохондрий молекулярные шапероны и протеазы контроля качества действуют вместе, способствуя сборке белковых комплексов, состоящих из белков, кодируемых мтДНК и ядром, а также для мониторинга и деградации развернутых белков 105 .Дисбаланс между ядерным и митохондриальным протеомами и/или накопление развернутых митохондриальных белков запускает программу транскрипционного ответа у многоклеточных животных, называемую путем реакции на стресс митохондриальных развернутых белков (UPRmt) 106–108 . Ответ инициируется сигналами, продуцируемыми на митохондриальном уровне, которые активируют транскрипцию кодируемых ядром генов митохондриальных шаперонов, а также дополнительных генов для восстановления гомеостаза органелл. Этот путь был охарактеризован на молекулярном уровне у Caenorhabditis elegans , для которых и митохондриальный переносчик пептидов внутренней мембраны HAF1, и транскрипционный фактор bZip ATFS1 необходимы для передачи сигналов UPRmt 109 . Недавние данные указывают на то, что в здоровых клетках ATFS1 активно импортируется в митохондриальный матрикс, где он конститутивно деградирует в здоровых митохондриях 110 . В условиях, когда цепь переноса электронов нарушена, мембранный потенциал ослабляется, и, следовательно, эффективность импорта ATFS1 снижается таким образом, который каким-то образом зависит от HAF1. Внемитохондриальный ATFS1 стабилизируется и направляется в ядро, где он инициирует транскрипционный ответ, который увеличивает экспрессию митохондриальных шаперонов и импортирует механизмы, а также ремоделирует метаболизм, чтобы меньше полагаться на дыхание.Активация UPRmt у C. elegans связана с увеличением продолжительности жизни, а недавние данные свидетельствуют о том, что у млекопитающих активация этого пути также способствует долголетию, далее вовлекая митохондрии как решающий фактор старения 106 . Остается определить, законсервированы ли молекулярные механизмы, лежащие в основе UPRmt, в системах млекопитающих.
Недавние данные указывают на то, что в здоровых клетках ATFS1 активно импортируется в митохондриальный матрикс, где он конститутивно деградирует в здоровых митохондриях 110 . В условиях, когда цепь переноса электронов нарушена, мембранный потенциал ослабляется, и, следовательно, эффективность импорта ATFS1 снижается таким образом, который каким-то образом зависит от HAF1. Внемитохондриальный ATFS1 стабилизируется и направляется в ядро, где он инициирует транскрипционный ответ, который увеличивает экспрессию митохондриальных шаперонов и импортирует механизмы, а также ремоделирует метаболизм, чтобы меньше полагаться на дыхание.Активация UPRmt у C. elegans связана с увеличением продолжительности жизни, а недавние данные свидетельствуют о том, что у млекопитающих активация этого пути также способствует долголетию, далее вовлекая митохондрии как решающий фактор старения 106 . Остается определить, законсервированы ли молекулярные механизмы, лежащие в основе UPRmt, в системах млекопитающих.
Несколько различных митохондриальных путей реагируют на стресс или повреждение и координируются с митохондриальной динамикой.Митохондрии в здоровых клетках генерируют электрохимический потенциал, который служит для окислительного фосфорилирования и запускает импорт белков в органеллы. Повреждение, которое приводит к потере (синий цвет) потенциала митохондриальной мембраны, может привести к потере эффективности импорта белка. В пути ответа на стресс развернутого белка (UPRmt) потеря импорта приводит к накоплению фактора транскрипции ATFS1 в ядре, активируя репарацию транскрипции митохондрий и метаболический адаптационный ответ.Потеря мембранного потенциала также запускает ОМА1-зависимый протеолиз длинных изоформ слияния внутренней мембраны DRP OPA1, который ослабляет слияние митохондрий и потенциально увеличивает ER-опосредованное митохондриальное деление (ERMD), что приводит к фрагментации митохондрий. Эти фрагментированные митохондрии, утратившие способность дышать и импортировать, могут также накапливать киназу PINK1, запускающую митофагию. Кроме того, в этих условиях домен ERMD может быть изменен, чтобы непосредственно способствовать олигомеризации BAX на внешней мембране митохондрий, пермеабилизации внешней мембраны и высвобождению цитохрома c , что приводит к гибели клеток.Митохондриальная дисфункция и стрессы, такие как голодание, могут вызвать митохондриальную гиперфузию, которая зависит от поддержания потенциала митохондриальной мембраны (красный цвет) и присутствия как длинных, так и коротких изоформ OPA1. Гиперфузии митохондрий могут временно буферировать эффекты дисфункции дыхательной цепи и не вступать в путь митофагии. Связь между UPRmt и формой митохондрий не исследовалась.
Эти фрагментированные митохондрии, утратившие способность дышать и импортировать, могут также накапливать киназу PINK1, запускающую митофагию. Кроме того, в этих условиях домен ERMD может быть изменен, чтобы непосредственно способствовать олигомеризации BAX на внешней мембране митохондрий, пермеабилизации внешней мембраны и высвобождению цитохрома c , что приводит к гибели клеток.Митохондриальная дисфункция и стрессы, такие как голодание, могут вызвать митохондриальную гиперфузию, которая зависит от поддержания потенциала митохондриальной мембраны (красный цвет) и присутствия как длинных, так и коротких изоформ OPA1. Гиперфузии митохондрий могут временно буферировать эффекты дисфункции дыхательной цепи и не вступать в путь митофагии. Связь между UPRmt и формой митохондрий не исследовалась.
Дополнительные пути, индуцированные митохондриальным стрессом, запускаются нарушениями функции электрон-транспортной цепи и/или снижением мембранного потенциала.Слияние митохондриальной внутренней мембраны DRP OPA1 действует как переключатель между двумя путями. В здоровых клетках процессинг OPA1 происходит конститутивно с помощью i-AAA протеазы YME1L с образованием длинных трансмембранных закрепленных и коротких растворимых изоформ, которые необходимы для слияния мембран 111 . Снижение потенциала митохондриальной мембраны вызывает преобразование длинных изоформ OPA1 в короткие формы с помощью металлопротеазы OMA1, что приводит к ингибированию слияния митохондрий и последующей фрагментации митохондрий 112,113 .Это изменение служит для усиления митофагии и/или гибели клеток. И наоборот, длинные изоформы OPA1 необходимы для другого стресс-индуцированного ответа, называемого митохондриальной гиперфузией. Гиперфузия митохондрий опосредует формирование высокосвязанной митохондриальной сети и, таким образом, считается, что она амортизирует потенциально вредные эффекты стрессов, в том числе вызванных ультрафиолетовым облучением и недостатком питательных веществ. В случае голодания гиперфузия была предложена для защиты митохондрий от аутофагической деградации или митофагии посредством стерических затруднений 114,115 .
В здоровых клетках процессинг OPA1 происходит конститутивно с помощью i-AAA протеазы YME1L с образованием длинных трансмембранных закрепленных и коротких растворимых изоформ, которые необходимы для слияния мембран 111 . Снижение потенциала митохондриальной мембраны вызывает преобразование длинных изоформ OPA1 в короткие формы с помощью металлопротеазы OMA1, что приводит к ингибированию слияния митохондрий и последующей фрагментации митохондрий 112,113 .Это изменение служит для усиления митофагии и/или гибели клеток. И наоборот, длинные изоформы OPA1 необходимы для другого стресс-индуцированного ответа, называемого митохондриальной гиперфузией. Гиперфузия митохондрий опосредует формирование высокосвязанной митохондриальной сети и, таким образом, считается, что она амортизирует потенциально вредные эффекты стрессов, в том числе вызванных ультрафиолетовым облучением и недостатком питательных веществ. В случае голодания гиперфузия была предложена для защиты митохондрий от аутофагической деградации или митофагии посредством стерических затруднений 114,115 .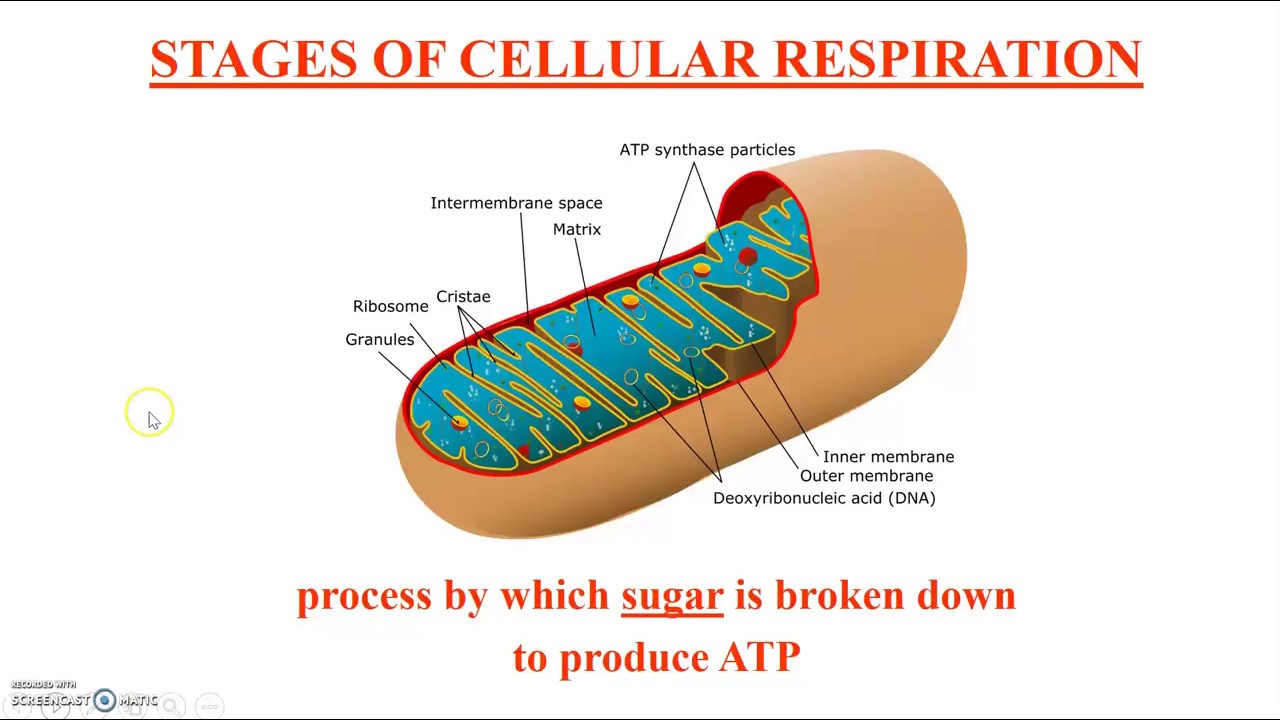 В более поздних работах показано, что митохондриальная гиперфузия также служит гомеостатическим ответом для поддержания продукции АТФ в случаях, когда комплекс IV цепи переноса электронов нарушен 51 . Реакция гиперфузии, однако, является временной и, таким образом, не может компенсировать долговременные дефекты в активности цепи переноса электронов. Более терминальной реакцией на митохондриальную дисфункцию является митофагия, которая также запускается снижением импорта белка, управляемого мембранным потенциалом. На этом пути киназа PINK1 импортируется в здоровые митохондрии и подвергается конститутивной деградации.Уменьшение импорта, вызванное митохондриальной дисфункцией, заставляет PINK1 накапливаться на внешней мембране, где он рекрутирует E3 ligase Parkin 116,117 . Среди мишеней для убиквитинирования Parkin — транспортный фактор Miro и митохондриальный слитый белок MFN2 (ref. 118 — 120). Протеасомная деградация убиквитинированных белков внешней мембраны митохондрий зависит от AAA-ATPase p97 способом, аналогичным ER-ассоциированной деградации 120,121 .
В более поздних работах показано, что митохондриальная гиперфузия также служит гомеостатическим ответом для поддержания продукции АТФ в случаях, когда комплекс IV цепи переноса электронов нарушен 51 . Реакция гиперфузии, однако, является временной и, таким образом, не может компенсировать долговременные дефекты в активности цепи переноса электронов. Более терминальной реакцией на митохондриальную дисфункцию является митофагия, которая также запускается снижением импорта белка, управляемого мембранным потенциалом. На этом пути киназа PINK1 импортируется в здоровые митохондрии и подвергается конститутивной деградации.Уменьшение импорта, вызванное митохондриальной дисфункцией, заставляет PINK1 накапливаться на внешней мембране, где он рекрутирует E3 ligase Parkin 116,117 . Среди мишеней для убиквитинирования Parkin — транспортный фактор Miro и митохондриальный слитый белок MFN2 (ref. 118 — 120). Протеасомная деградация убиквитинированных белков внешней мембраны митохондрий зависит от AAA-ATPase p97 способом, аналогичным ER-ассоциированной деградации 120,121 . Зависимая от паркина деградация факторов, участвующих в подвижности и слиянии митохондрий, повышает селективность удаления дефектных митохондрий путем аутофагии. В дополнение к определению дефектных митохондрий для деградации, исследование in vivo на Drosophila показало, что путь PINK1-Parkin может быть также способен избирательно нацеливаться на дыхательные комплексы для деградации 122 . В поддержку этой идеи селективное нацеливание комплекса I на деградацию также было описано в моделях клеточных культур 45 , но механизмы, лежащие в основе этого явления, в настоящее время неизвестны.
Зависимая от паркина деградация факторов, участвующих в подвижности и слиянии митохондрий, повышает селективность удаления дефектных митохондрий путем аутофагии. В дополнение к определению дефектных митохондрий для деградации, исследование in vivo на Drosophila показало, что путь PINK1-Parkin может быть также способен избирательно нацеливаться на дыхательные комплексы для деградации 122 . В поддержку этой идеи селективное нацеливание комплекса I на деградацию также было описано в моделях клеточных культур 45 , но механизмы, лежащие в основе этого явления, в настоящее время неизвестны.
Пути митохондриального стресса, вероятно, играют важную роль в проявлениях митохондриальной дисфункции и, как таковые, могут указывать на многообещающие терапевтические мишени. В случае пути митофагии PINK1-Parkin мутации в каждом гене связаны с генетически наследуемой болезнью Паркинсона 123,124 , что подразумевает релевантность пути. Однако большинство стрессовых путей, описанных выше, особенно вызванных потерей мембранного потенциала, были охарактеризованы в условиях острого экстремального стресса, что ставит вопрос об их физиологической значимости 125 .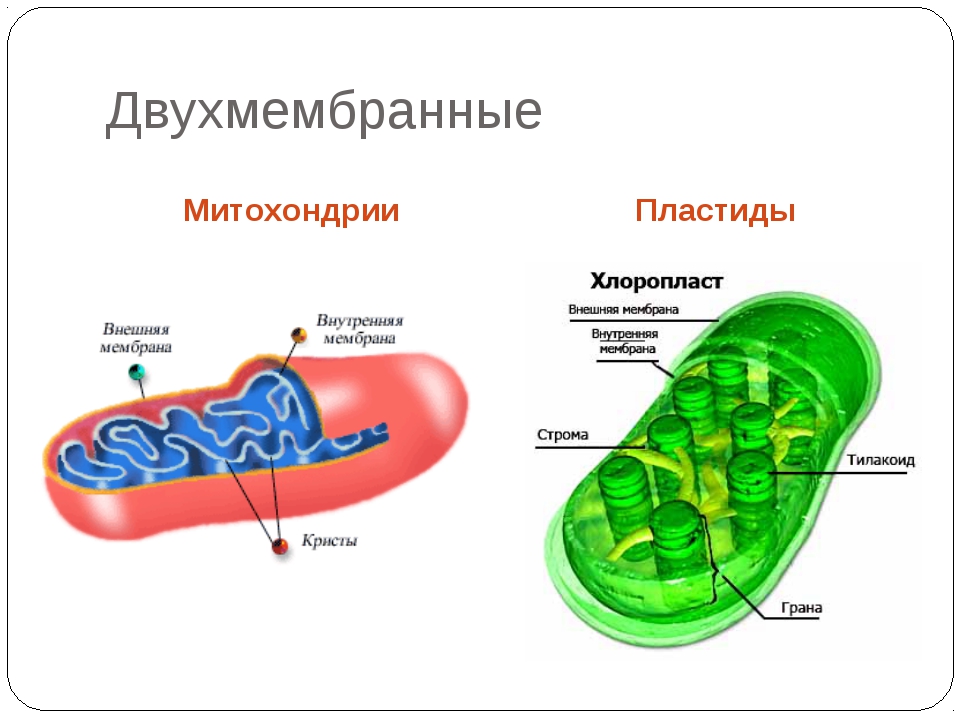 Кроме того, несмотря на эти многочисленные стрессовые пути, мутации мтДНК способны накапливаться, особенно в дифференцированных постмитотических клетках, за счет функциональной мтДНК дикого типа, что приводит к болезненным состояниям. Таким образом, будущая работа должна быть сосредоточена на разработке моделей животных, которые имитируют заболевания, связанные с митохондриальной дисфункцией, для оценки физиологического вклада этих путей. Кроме того, необходимы постоянные базовые биологические подходы для оценки того, как клетка адекватно воспринимает, а также по-разному активирует и координирует эти пути друг с другом и с другими сигнальными путями, такими как те, которые участвуют в гибели клеток (4).Например, неясно, как клетки соответствующим образом интегрируют пути UPRmt и митофагии, которые оба регулируются на базовом уровне импорта. Также неизвестно, может ли OPA1 функционировать как молекулярный интегратор стрессов или просто как модулятор митохондриальной формы, или как OPA1-зависимые пути стресса координируются с UPRmt и митофагией.
Кроме того, несмотря на эти многочисленные стрессовые пути, мутации мтДНК способны накапливаться, особенно в дифференцированных постмитотических клетках, за счет функциональной мтДНК дикого типа, что приводит к болезненным состояниям. Таким образом, будущая работа должна быть сосредоточена на разработке моделей животных, которые имитируют заболевания, связанные с митохондриальной дисфункцией, для оценки физиологического вклада этих путей. Кроме того, необходимы постоянные базовые биологические подходы для оценки того, как клетка адекватно воспринимает, а также по-разному активирует и координирует эти пути друг с другом и с другими сигнальными путями, такими как те, которые участвуют в гибели клеток (4).Например, неясно, как клетки соответствующим образом интегрируют пути UPRmt и митофагии, которые оба регулируются на базовом уровне импорта. Также неизвестно, может ли OPA1 функционировать как молекулярный интегратор стрессов или просто как модулятор митохондриальной формы, или как OPA1-зависимые пути стресса координируются с UPRmt и митофагией.
Возникающая картина митохондрий — это картина «сверхорганизованных» структурных доменов для построения органеллы, поведение которых запрограммировано, чтобы реагировать на клеточные потребности, а также на собственную дисфункцию.Комбинированное использование системных подходов, микроскопии сверхвысокого разрешения и новых генетических инструментов позволит нам детально понять молекулярную основу митохондриальной структуры. То, как именно устроена митохондриальная суперорганизация, ответит на фундаментальный вопрос о том, происходят ли первичные детерминанты организации изнутри органеллы и тесно связаны с самой древней особенностью — геномом.
Благодарности
Мы благодарим сотрудников лаборатории Нуннари за полезные обсуждения и комментарии.Мы также благодарим K. Osteryoung и S. Lewis за полезные обсуждения. Дж.Н. поддерживается грантами NIH R01GM062942, R01GM097432 и R01GM106019. JF поддерживается стипендией Мемориального фонда медицинских исследований Джейн Коффин Чайлдс.
Сноски
Авторы заявляют об отсутствии конкурирующих финансовых интересов.
Ссылки
1. Лейн Н., Мартин В. Энергетика сложности генома. Природа. 2010; 467:929–934. [PubMed] [Google Scholar]2. Габальдон Т., Хюйнен М.А. Формирование митохондриального протеома.Биохим. Биофиз. Акта. 2004; 1659: 212–220. [PubMed] [Google Scholar]3. Боуман Дж. М. и соавт. Интегративная геномика идентифицирует MCU как важный компонент митохондриального унипортера кальция. Природа. 2011; 476:341–345. [Бесплатная статья PMC] [PubMed] [Google Scholar]4. De Stefani D, Raffaello A, Teardo E, Szabo I, Rizzuto R. Сороккилодальтонный белок внутренней мембраны является митохондриальным унипортером кальция. Природа. 2011; 476:336–340. [Бесплатная статья PMC] [PubMed] [Google Scholar]7. Форнер Ф., Фостер Л.Дж., Кампанаро С., Валле Г., Манн М.Количественное протеомное сравнение митохондрий крыс из мышц, сердца и печени. Мол. Клетка. Протеомика. 2006; 5: 608–619. [PubMed] [Google Scholar]8. Лекренье Н. , Ван Дер Брюгген П., Фури Ф. Митохондриальные ДНК-полимеразы от дрожжей до человека: новое семейство полимераз. Ген. 1997; 185:147–152. [PubMed] [Google Scholar]9. Stumpf JD, Copeland WC. Репликация митохондриальной ДНК и заболевания: выводы из γ-мутаций ДНК-полимеразы. Клеточные и молекулярные науки о жизни. Клетка. Мол. Жизнь наук. 2011;68:219–233.[Бесплатная статья PMC] [PubMed] [Google Scholar]10. Тиранти В. и др. Идентификация гена, кодирующего митохондриальную РНК-полимеразу человека (h-mtRPOL), путем киберскрининга базы данных меток экспрессируемых последовательностей. Гум. Мол. Жене. 1997; 6: 615–625. [PubMed] [Google Scholar] 11. Кристиан Б.Э., Спремулли Л.Л. Механизм биосинтеза белка в митохондриях млекопитающих. Биохим. Биофиз. Акта. 2012; 1819: 1035–1054. [Бесплатная статья PMC] [PubMed] [Google Scholar]12. Фунг С., Нисимура Т., Сасарман Ф., Шубридж Э.А.Консервативное взаимодействие C7orf30 с MRPL14 способствует биогенезу митохондриальной большой рибосомной субъединицы и митохондриальной трансляции.
, Ван Дер Брюгген П., Фури Ф. Митохондриальные ДНК-полимеразы от дрожжей до человека: новое семейство полимераз. Ген. 1997; 185:147–152. [PubMed] [Google Scholar]9. Stumpf JD, Copeland WC. Репликация митохондриальной ДНК и заболевания: выводы из γ-мутаций ДНК-полимеразы. Клеточные и молекулярные науки о жизни. Клетка. Мол. Жизнь наук. 2011;68:219–233.[Бесплатная статья PMC] [PubMed] [Google Scholar]10. Тиранти В. и др. Идентификация гена, кодирующего митохондриальную РНК-полимеразу человека (h-mtRPOL), путем киберскрининга базы данных меток экспрессируемых последовательностей. Гум. Мол. Жене. 1997; 6: 615–625. [PubMed] [Google Scholar] 11. Кристиан Б.Э., Спремулли Л.Л. Механизм биосинтеза белка в митохондриях млекопитающих. Биохим. Биофиз. Акта. 2012; 1819: 1035–1054. [Бесплатная статья PMC] [PubMed] [Google Scholar]12. Фунг С., Нисимура Т., Сасарман Ф., Шубридж Э.А.Консервативное взаимодействие C7orf30 с MRPL14 способствует биогенезу митохондриальной большой рибосомной субъединицы и митохондриальной трансляции.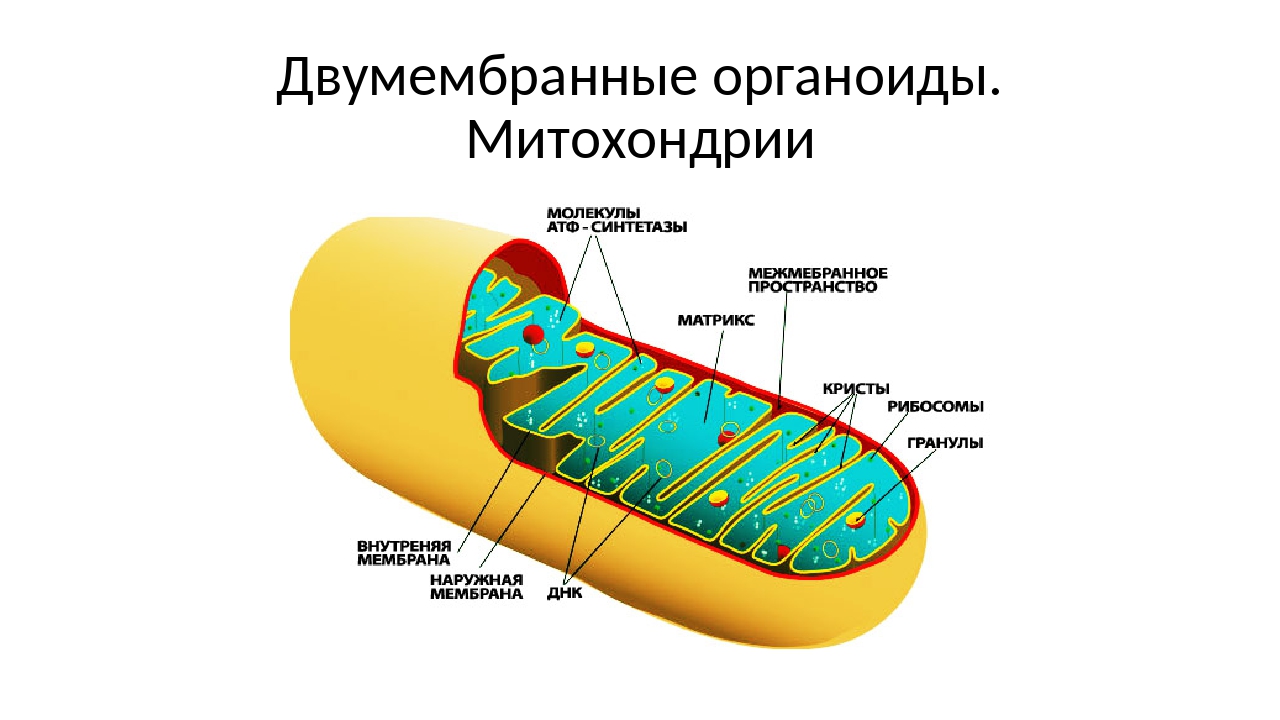 Мол. биол. Клетка. 2013; 24:184–193. [Бесплатная статья PMC] [PubMed] [Google Scholar]13. Шарма М.Р. и соавт. Структура митохондриальной рибосомы млекопитающих обнаруживает расширенную функциональную роль составляющих ее белков. Клетка. 2003; 115: 97–108. [PubMed] [Google Scholar] 14. Нойперт В., Херрманн Дж. М. Транслокация белков в митохондрии. Анну. Преподобный Биохим.2007; 76: 723–749. [PubMed] [Google Scholar] 15. Шмидт О., Пфаннер Н., Мейзингер С. Импорт митохондриального белка: от протеомики к функциональным механизмам. Природа Преподобный Мол. Клеточная биол. 2010; 11: 655–667. [PubMed] [Google Scholar] 16. Ягер С., Хандшин С., Сен-Пьер Дж., Шпигельман Б.М. Действие AMP-активируемой протеинкиназы (AMPK) в скелетных мышцах посредством прямого фосфорилирования PGC-1α Proc. Натл акад. науч. США. 2007;104:12017–12022. [Бесплатная статья PMC] [PubMed] [Google Scholar]17. Дженинга Э.Х., Шунджанс К., Ауверкс Дж.Обратимое ацетилирование PGC-1: подключение сенсоров энергии и эффекторов для гарантии метаболической гибкости.
Мол. биол. Клетка. 2013; 24:184–193. [Бесплатная статья PMC] [PubMed] [Google Scholar]13. Шарма М.Р. и соавт. Структура митохондриальной рибосомы млекопитающих обнаруживает расширенную функциональную роль составляющих ее белков. Клетка. 2003; 115: 97–108. [PubMed] [Google Scholar] 14. Нойперт В., Херрманн Дж. М. Транслокация белков в митохондрии. Анну. Преподобный Биохим.2007; 76: 723–749. [PubMed] [Google Scholar] 15. Шмидт О., Пфаннер Н., Мейзингер С. Импорт митохондриального белка: от протеомики к функциональным механизмам. Природа Преподобный Мол. Клеточная биол. 2010; 11: 655–667. [PubMed] [Google Scholar] 16. Ягер С., Хандшин С., Сен-Пьер Дж., Шпигельман Б.М. Действие AMP-активируемой протеинкиназы (AMPK) в скелетных мышцах посредством прямого фосфорилирования PGC-1α Proc. Натл акад. науч. США. 2007;104:12017–12022. [Бесплатная статья PMC] [PubMed] [Google Scholar]17. Дженинга Э.Х., Шунджанс К., Ауверкс Дж.Обратимое ацетилирование PGC-1: подключение сенсоров энергии и эффекторов для гарантии метаболической гибкости. Онкоген. 2010;29:4617–4624. [Бесплатная статья PMC] [PubMed] [Google Scholar]18. Scarpulla RC, Vega RB, Kelly DP. Транскрипционная интеграция митохондриального биогенеза. Тенденции Эндокринол. Метаб. 2012; 23: 459–466. [Бесплатная статья PMC] [PubMed] [Google Scholar]19. Гадир Н., Хаим-Вильмовский Л., Краут-Коэн Дж., Герст Дж. Э. Локализация мРНК, кодирующих митохондриальные белки, у дрожжей Saccharomyces cerevisiae .РНК. 2011;17:1551–1565. [Бесплатная статья PMC] [PubMed] [Google Scholar]20. Гарсия М. и соавт. Митохондриально-ассоциированные мРНК дрожжей и биогенез молекулярных комплексов. Мол. биол. Клетка. 2007; 18: 362–368. [Бесплатная статья PMC] [PubMed] [Google Scholar]21. Шмидт О. и др. Регуляция импорта митохондриальных белков цитозольными киназами. Клетка. 2011; 144: 227–239. [PubMed] [Google Scholar] 23. Уоллес, округ Колумбия, и др. Мутация митохондриальной ДНК, связанная с наследственной оптической нейропатией Лебера. Наука. 1988; 242:1427–1430.[PubMed] [Google Scholar] 24.
Онкоген. 2010;29:4617–4624. [Бесплатная статья PMC] [PubMed] [Google Scholar]18. Scarpulla RC, Vega RB, Kelly DP. Транскрипционная интеграция митохондриального биогенеза. Тенденции Эндокринол. Метаб. 2012; 23: 459–466. [Бесплатная статья PMC] [PubMed] [Google Scholar]19. Гадир Н., Хаим-Вильмовский Л., Краут-Коэн Дж., Герст Дж. Э. Локализация мРНК, кодирующих митохондриальные белки, у дрожжей Saccharomyces cerevisiae .РНК. 2011;17:1551–1565. [Бесплатная статья PMC] [PubMed] [Google Scholar]20. Гарсия М. и соавт. Митохондриально-ассоциированные мРНК дрожжей и биогенез молекулярных комплексов. Мол. биол. Клетка. 2007; 18: 362–368. [Бесплатная статья PMC] [PubMed] [Google Scholar]21. Шмидт О. и др. Регуляция импорта митохондриальных белков цитозольными киназами. Клетка. 2011; 144: 227–239. [PubMed] [Google Scholar] 23. Уоллес, округ Колумбия, и др. Мутация митохондриальной ДНК, связанная с наследственной оптической нейропатией Лебера. Наука. 1988; 242:1427–1430.[PubMed] [Google Scholar] 24. Моррис А.А. и соавт. Дефицит комплекса дыхательной цепи I является частой причиной болезни Ли. Анна. Нейрол. 1996; 40:25–30. [PubMed] [Google Scholar] 25. Росс Дж.М. и др. Мутации митохондриальной ДНК зародышевой линии усугубляют старение и могут нарушать развитие мозга. Природа. 2013; 501:412–415. [Бесплатная статья PMC] [PubMed] [Google Scholar]26. Алквист К.Дж. и соавт. Уязвимость соматических клеток-предшественников к мутагенезу митохондриальной ДНК лежит в основе прогероидных фенотипов у мышей-мутаторов Polg.Клеточный метаб. 2012;15:100–109. [PubMed] [Google Scholar] 27. Нго Х.Б., Кайзер Дж.Т., Чан Д.К. Митохондриальный фактор транскрипции и упаковки Tfam вызывает разворот митохондриальной ДНК. Структура природы. Мол. биол. 2011;18:1290–1296. [Бесплатная статья PMC] [PubMed] [Google Scholar]28. Рубио-Козиалс А и др. Митохондриальный фактор транскрипции человека А индуцирует U-образную структуру в промоторе легкой цепи. Структура природы. Мол. биол. 2011;18:1281–1289. [PubMed] [Google Scholar] 29.
Моррис А.А. и соавт. Дефицит комплекса дыхательной цепи I является частой причиной болезни Ли. Анна. Нейрол. 1996; 40:25–30. [PubMed] [Google Scholar] 25. Росс Дж.М. и др. Мутации митохондриальной ДНК зародышевой линии усугубляют старение и могут нарушать развитие мозга. Природа. 2013; 501:412–415. [Бесплатная статья PMC] [PubMed] [Google Scholar]26. Алквист К.Дж. и соавт. Уязвимость соматических клеток-предшественников к мутагенезу митохондриальной ДНК лежит в основе прогероидных фенотипов у мышей-мутаторов Polg.Клеточный метаб. 2012;15:100–109. [PubMed] [Google Scholar] 27. Нго Х.Б., Кайзер Дж.Т., Чан Д.К. Митохондриальный фактор транскрипции и упаковки Tfam вызывает разворот митохондриальной ДНК. Структура природы. Мол. биол. 2011;18:1290–1296. [Бесплатная статья PMC] [PubMed] [Google Scholar]28. Рубио-Козиалс А и др. Митохондриальный фактор транскрипции человека А индуцирует U-образную структуру в промоторе легкой цепи. Структура природы. Мол. биол. 2011;18:1281–1289. [PubMed] [Google Scholar] 29.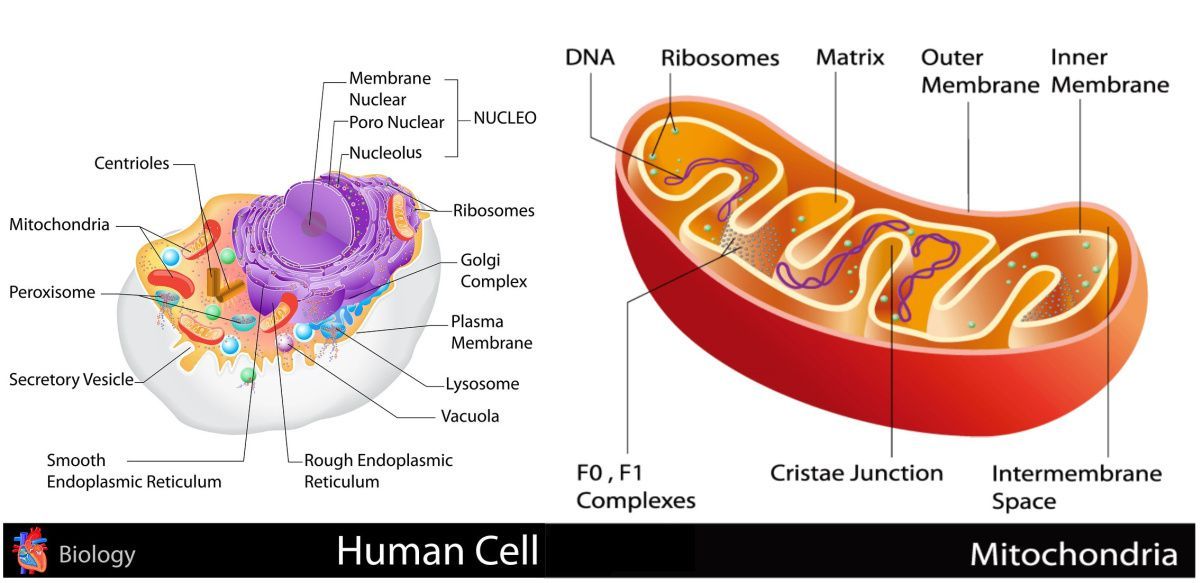 Экстранд М.И. и соавт. Митохондриальный транскрипционный фактор А регулирует количество копий мтДНК у млекопитающих.Гум. Мол. Жене. 2004; 13: 935–944. [PubMed] [Google Scholar] 30. Ши Ю и др. Транскрипционный фактор А млекопитающих является основным компонентом митохондриального аппарата транскрипции. проц. Натл акад. науч. США. 2012;109:16510–16515. [Бесплатная статья PMC] [PubMed] [Google Scholar]31. Богенхаген ДФ. Нуклеоидная структура митохондриальной ДНК. Биохим. Биофиз. Акта. 2012; 1819: 914–920. [PubMed] [Google Scholar] 33. Богенхаген Д.Ф., Ван Ю., Шен Э.Л., Кобаяши Р. Белковые компоненты нуклеоидов митохондриальной ДНК высших эукариот.Мол. Клетка. Протеомика. 2003; 2: 1205–1216. [PubMed] [Google Scholar] 34. Кауфман Б.А. и соавт. В органелло формальдегидное сшивание белков с мтДНК: идентификация бифункциональных белков. проц. Натл акад. науч. США. 2000;97:7772–7777. [Бесплатная статья PMC] [PubMed] [Google Scholar]35. Он Дж. и соавт. Белки, взаимодействующие с митохондриальными нуклеоидами, поддерживают синтез митохондриальных белков.
Экстранд М.И. и соавт. Митохондриальный транскрипционный фактор А регулирует количество копий мтДНК у млекопитающих.Гум. Мол. Жене. 2004; 13: 935–944. [PubMed] [Google Scholar] 30. Ши Ю и др. Транскрипционный фактор А млекопитающих является основным компонентом митохондриального аппарата транскрипции. проц. Натл акад. науч. США. 2012;109:16510–16515. [Бесплатная статья PMC] [PubMed] [Google Scholar]31. Богенхаген ДФ. Нуклеоидная структура митохондриальной ДНК. Биохим. Биофиз. Акта. 2012; 1819: 914–920. [PubMed] [Google Scholar] 33. Богенхаген Д.Ф., Ван Ю., Шен Э.Л., Кобаяши Р. Белковые компоненты нуклеоидов митохондриальной ДНК высших эукариот.Мол. Клетка. Протеомика. 2003; 2: 1205–1216. [PubMed] [Google Scholar] 34. Кауфман Б.А. и соавт. В органелло формальдегидное сшивание белков с мтДНК: идентификация бифункциональных белков. проц. Натл акад. науч. США. 2000;97:7772–7777. [Бесплатная статья PMC] [PubMed] [Google Scholar]35. Он Дж. и соавт. Белки, взаимодействующие с митохондриальными нуклеоидами, поддерживают синтез митохондриальных белков.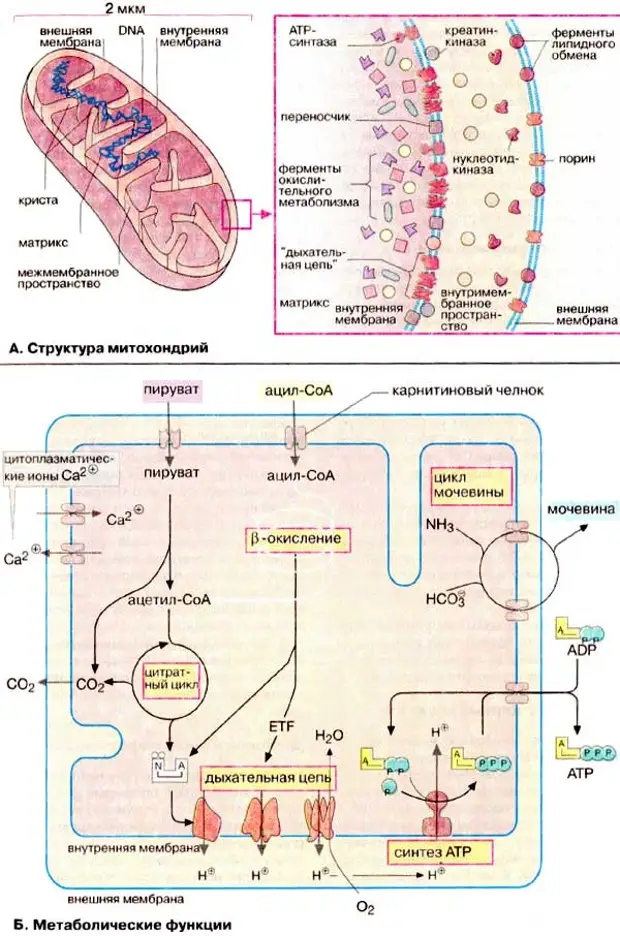 Нуклеиновые Кислоты Res. 2012;40:6109–6121. [Бесплатная статья PMC] [PubMed] [Google Scholar]36. Мбантенху М. и соавт.Mgm101 представляет собой родственный Rad52 белок, необходимый для рекомбинации митохондриальной ДНК. Дж. Биол. хим. 2011; 286:42360–42370. [Бесплатная статья PMC] [PubMed] [Google Scholar]38. Браун Т.А., Ткачук А.Н., Клейтон Д.А. Нативные R-петли сохраняются во всем геноме митохондриальной ДНК мыши. Дж. Биол. хим. 2008; 283:36743–36751. [Бесплатная статья PMC] [PubMed] [Google Scholar]39. Браун Т.А. и соавт. Флуоресцентное изображение сверхвысокого разрешения митохондриальных нуклеоидов выявляет их пространственный диапазон, пределы и взаимодействие с мембраной. Мол.Клетка. биол. 2011;31:4994–5010. [Бесплатная статья PMC] [PubMed] [Google Scholar]40. Кукат С и др. Микроскопия сверхвысокого разрешения показывает, что митохондриальные нуклеоиды млекопитающих имеют одинаковый размер и часто содержат одну копию мтДНК. проц. Натл акад. науч. США. 2011;108:13534–13539. [Бесплатная статья PMC] [PubMed] [Google Scholar]41.
Нуклеиновые Кислоты Res. 2012;40:6109–6121. [Бесплатная статья PMC] [PubMed] [Google Scholar]36. Мбантенху М. и соавт.Mgm101 представляет собой родственный Rad52 белок, необходимый для рекомбинации митохондриальной ДНК. Дж. Биол. хим. 2011; 286:42360–42370. [Бесплатная статья PMC] [PubMed] [Google Scholar]38. Браун Т.А., Ткачук А.Н., Клейтон Д.А. Нативные R-петли сохраняются во всем геноме митохондриальной ДНК мыши. Дж. Биол. хим. 2008; 283:36743–36751. [Бесплатная статья PMC] [PubMed] [Google Scholar]39. Браун Т.А. и соавт. Флуоресцентное изображение сверхвысокого разрешения митохондриальных нуклеоидов выявляет их пространственный диапазон, пределы и взаимодействие с мембраной. Мол.Клетка. биол. 2011;31:4994–5010. [Бесплатная статья PMC] [PubMed] [Google Scholar]40. Кукат С и др. Микроскопия сверхвысокого разрешения показывает, что митохондриальные нуклеоиды млекопитающих имеют одинаковый размер и часто содержат одну копию мтДНК. проц. Натл акад. науч. США. 2011;108:13534–13539. [Бесплатная статья PMC] [PubMed] [Google Scholar]41.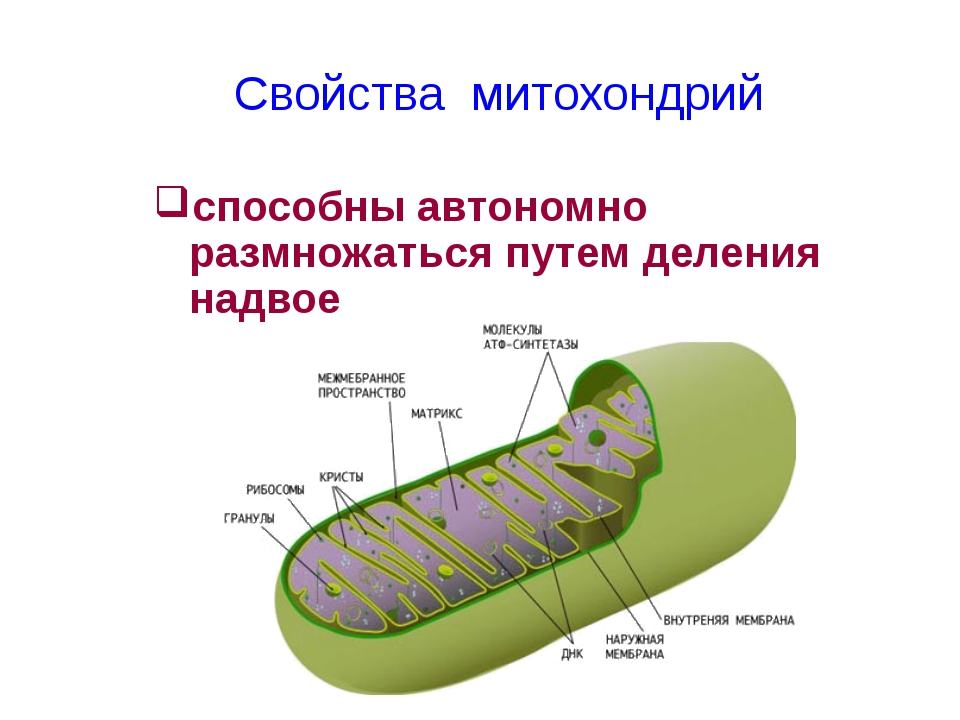 Бирки К.В., мл. Наследование генов в митохондриях и хлоропластах: законы, механизмы и модели. Анну. Преподобный Жене. 2001; 35: 125–148. [PubMed] [Google Scholar]42.Аль Рави С. и др. Аутофагия органоидов сперматозоидов после оплодотворения предотвращает передачу отцовской митохондриальной ДНК. Наука. 2011; 334:1144–1147. [PubMed] [Google Scholar]43. Сато М., Сато К. Деградация отцовских митохондрий в результате оплодотворения вызвала аутофагию у эмбрионов C. elegans . Наука. 2011; 334:1141–1144. [PubMed] [Google Scholar]44. Пеплинг М.Е., Вильгельм Дж.Э., О’Хара А.Л., Гепхардт Г.В., Спрадлинг А.С. Ооциты мышей внутри кист зародышевых клеток и примордиальных фолликулов содержат тельца Бальбиани.проц. Натл акад. науч. США. 2007; 104: 187–192. [Бесплатная статья PMC] [PubMed] [Google Scholar]45.
Hämäläinen RH, et al. Ткане- и клеточно-специфические проявления гетероплазматической мутации мтДНК 3243A>G в модели заболевания, вызванного плюрипотентными стволовыми клетками человека. проц.
Бирки К.В., мл. Наследование генов в митохондриях и хлоропластах: законы, механизмы и модели. Анну. Преподобный Жене. 2001; 35: 125–148. [PubMed] [Google Scholar]42.Аль Рави С. и др. Аутофагия органоидов сперматозоидов после оплодотворения предотвращает передачу отцовской митохондриальной ДНК. Наука. 2011; 334:1144–1147. [PubMed] [Google Scholar]43. Сато М., Сато К. Деградация отцовских митохондрий в результате оплодотворения вызвала аутофагию у эмбрионов C. elegans . Наука. 2011; 334:1141–1144. [PubMed] [Google Scholar]44. Пеплинг М.Е., Вильгельм Дж.Э., О’Хара А.Л., Гепхардт Г.В., Спрадлинг А.С. Ооциты мышей внутри кист зародышевых клеток и примордиальных фолликулов содержат тельца Бальбиани.проц. Натл акад. науч. США. 2007; 104: 187–192. [Бесплатная статья PMC] [PubMed] [Google Scholar]45.
Hämäläinen RH, et al. Ткане- и клеточно-специфические проявления гетероплазматической мутации мтДНК 3243A>G в модели заболевания, вызванного плюрипотентными стволовыми клетками человека. проц.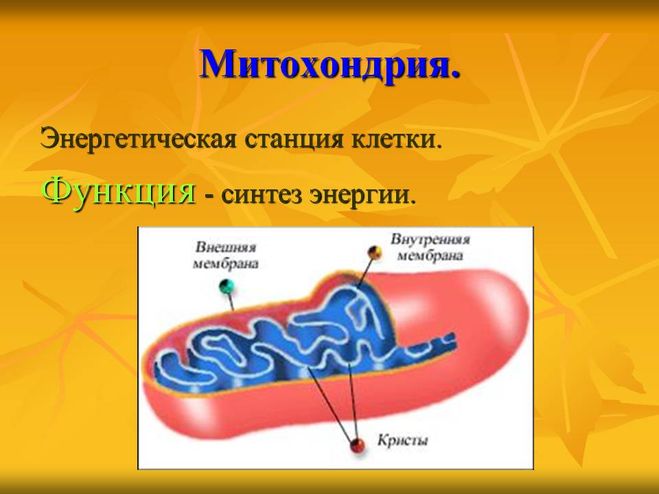 Натл акад. науч. США. 2013; 110:E3622–E3630. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Эта статья показала, что во время перепрограммирования гетероплазматических фибробластов, полученных от пациентов с митохондриальными заболеваниями, мутантные и дикие митохондриальные геномы сегрегируют через узкое место в сторону гомоплазматического состояния.46. Meeusen S, Nunnari J. Доказательства двухмембранной автономной митохондриальной ДНК-реплисомы. Дж. Клеточная биология. 2003; 163: 503–510. [Бесплатная статья PMC] [PubMed] [Google Scholar]47. Хоппинс С., Лакнер Л., Нуннари Дж. Машины, которые делят и сливают митохондрии. Анну. Преподобный Биохим. 2007; 76: 751–780. [PubMed] [Google Scholar]48. Чен Х., Маккаффери Дж. М., Чан Д. С. Митохондриальное слияние защищает от нейродегенерации в мозжечке. Клетка. 2007; 130: 548–562. [PubMed] [Google Scholar]49. Чен Х и др.Слияние митохондрий необходимо для стабильности мтДНК в скелетных мышцах и толерантности к мутациям мтДНК. Клетка. 2010; 141: 280–289.
Натл акад. науч. США. 2013; 110:E3622–E3630. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Эта статья показала, что во время перепрограммирования гетероплазматических фибробластов, полученных от пациентов с митохондриальными заболеваниями, мутантные и дикие митохондриальные геномы сегрегируют через узкое место в сторону гомоплазматического состояния.46. Meeusen S, Nunnari J. Доказательства двухмембранной автономной митохондриальной ДНК-реплисомы. Дж. Клеточная биология. 2003; 163: 503–510. [Бесплатная статья PMC] [PubMed] [Google Scholar]47. Хоппинс С., Лакнер Л., Нуннари Дж. Машины, которые делят и сливают митохондрии. Анну. Преподобный Биохим. 2007; 76: 751–780. [PubMed] [Google Scholar]48. Чен Х., Маккаффери Дж. М., Чан Д. С. Митохондриальное слияние защищает от нейродегенерации в мозжечке. Клетка. 2007; 130: 548–562. [PubMed] [Google Scholar]49. Чен Х и др.Слияние митохондрий необходимо для стабильности мтДНК в скелетных мышцах и толерантности к мутациям мтДНК. Клетка. 2010; 141: 280–289. [Бесплатная статья PMC] [PubMed] [Google Scholar]51.
Ролланд С.Г. и соавт. Нарушенная активность комплекса IV в ответ на потерю функции LRPPRC может быть компенсирована митохондриальной гиперфузией. проц. Натл акад. науч. США. 2013; 110:E2967–E2976. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Эта статья демонстрирует, что митохондрии могут подвергаться гиперфузии и временно поддерживать продукцию АТФ, чтобы компенсировать снижение активности комплекса IV из-за потери РНК-связывающего белка LRPPRC.52. Верстрекен П. и соавт. Синаптические митохондрии имеют решающее значение для мобилизации везикул резервного пула в нервно-мышечных соединениях. Нейрон. 2005; 47: 365–378. [PubMed] [Google Scholar]53. Чен Х., Чомин А., Чан Д.С. Нарушение слияния приводит к митохондриальной гетерогенности и дисфункции. Дж. Биол. хим. 2005; 280:26185–26192. [PubMed] [Google Scholar]54. Исихара Н. и др. Митохондриальный фактор деления Drp1 необходим для эмбрионального развития и формирования синапсов у мышей.
[Бесплатная статья PMC] [PubMed] [Google Scholar]51.
Ролланд С.Г. и соавт. Нарушенная активность комплекса IV в ответ на потерю функции LRPPRC может быть компенсирована митохондриальной гиперфузией. проц. Натл акад. науч. США. 2013; 110:E2967–E2976. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Эта статья демонстрирует, что митохондрии могут подвергаться гиперфузии и временно поддерживать продукцию АТФ, чтобы компенсировать снижение активности комплекса IV из-за потери РНК-связывающего белка LRPPRC.52. Верстрекен П. и соавт. Синаптические митохондрии имеют решающее значение для мобилизации везикул резервного пула в нервно-мышечных соединениях. Нейрон. 2005; 47: 365–378. [PubMed] [Google Scholar]53. Чен Х., Чомин А., Чан Д.С. Нарушение слияния приводит к митохондриальной гетерогенности и дисфункции. Дж. Биол. хим. 2005; 280:26185–26192. [PubMed] [Google Scholar]54. Исихара Н. и др. Митохондриальный фактор деления Drp1 необходим для эмбрионального развития и формирования синапсов у мышей.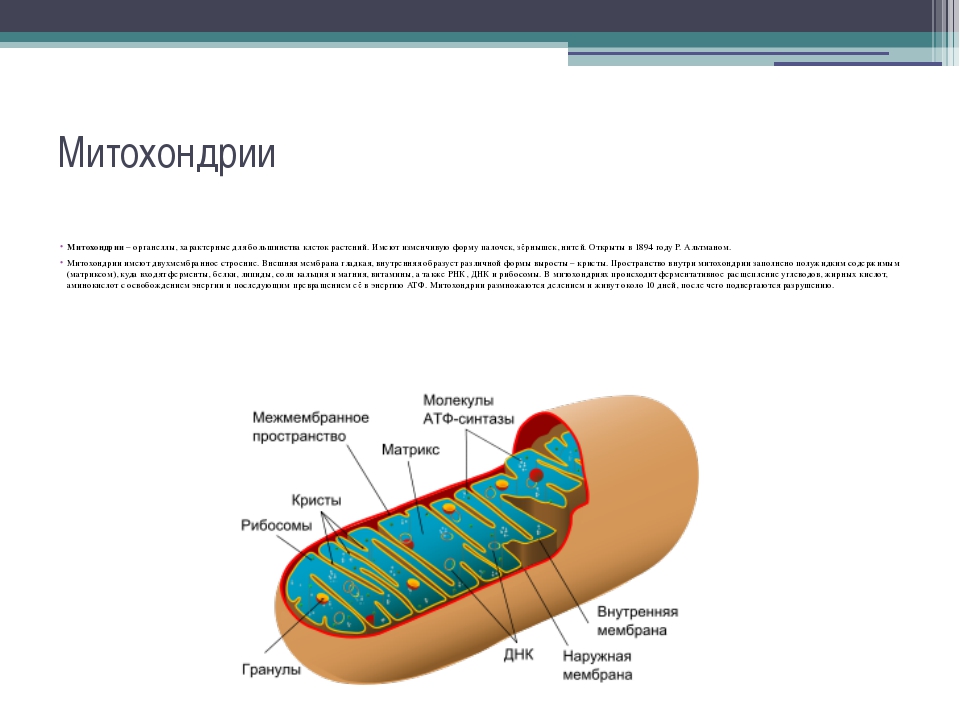 Природа Клетка Биол. 2009; 11: 958–966. [PubMed] [Google Scholar]55. Пароне П.А. и соавт. Предотвращение митохондриального деления ухудшает митохондриальную функцию и приводит к потере митохондриальной ДНК. ПЛОС ОДИН. 2008;3:e3257. [Бесплатная статья PMC] [PubMed] [Google Scholar]56. Вакабаяши Дж. и др. Связанная с динамином ГТФаза Drp1 необходима для эмбрионального развития и развития мозга у мышей. Дж. Клеточная биология. 2009; 186: 805–816. [Бесплатная статья PMC] [PubMed] [Google Scholar]57. Ханекамп Т. и др. Поддержание митохондриальной морфологии связано с поддержанием митохондриального генома у Saccharomyces cerevisiae .Генетика. 2002; 162:1147–1156. [Бесплатная статья PMC] [PubMed] [Google Scholar]58. Фельбер К. и др. Олигомеризация белков суперсемейства динаминов в норме и при патологии. прог. Мол. биол. Перевод науч. 2013; 117:411–443. [PubMed] [Google Scholar] 60. Лабрусс А.М., Заппатерра М.Д., Рубе Д.А., ван дер Блик А.М. C. elegans Родственный динамину белок DRP-1 контролирует разрыв наружной мембраны митохондрий.
Природа Клетка Биол. 2009; 11: 958–966. [PubMed] [Google Scholar]55. Пароне П.А. и соавт. Предотвращение митохондриального деления ухудшает митохондриальную функцию и приводит к потере митохондриальной ДНК. ПЛОС ОДИН. 2008;3:e3257. [Бесплатная статья PMC] [PubMed] [Google Scholar]56. Вакабаяши Дж. и др. Связанная с динамином ГТФаза Drp1 необходима для эмбрионального развития и развития мозга у мышей. Дж. Клеточная биология. 2009; 186: 805–816. [Бесплатная статья PMC] [PubMed] [Google Scholar]57. Ханекамп Т. и др. Поддержание митохондриальной морфологии связано с поддержанием митохондриального генома у Saccharomyces cerevisiae .Генетика. 2002; 162:1147–1156. [Бесплатная статья PMC] [PubMed] [Google Scholar]58. Фельбер К. и др. Олигомеризация белков суперсемейства динаминов в норме и при патологии. прог. Мол. биол. Перевод науч. 2013; 117:411–443. [PubMed] [Google Scholar] 60. Лабрусс А.М., Заппатерра М.Д., Рубе Д.А., ван дер Блик А.М. C. elegans Родственный динамину белок DRP-1 контролирует разрыв наружной мембраны митохондрий. Мол. Клетка. 1999; 4: 815–826. [PubMed] [Google Scholar]62. Фрёлих С. и соавт. Структурное понимание олигомеризации и митохондриального ремоделирования динамин-1-подобного белка.EMBO J. 2013; 32:1280–1292. [Бесплатная статья PMC] [PubMed] [Google Scholar]63. Фельбер К. и др. Кристаллическая структура безнуклеотидного динамина. Природа. 2011; 477: 556–560. [PubMed] [Google Scholar]64. Meeusen S, McCaffery JM, Nunnari J. Промежуточные продукты слияния митохондрий выявили in vitro . Наука. 2004; 305:1747–1752. [PubMed] [Google Scholar]65. Low HH, Sachse C, Amos LA, Lowe J. Структура липидной трубки бактериального динаминоподобного белка обеспечивает механизм сборки и изгиба мембраны.Клетка. 2009; 139:1342–1352. [Бесплатная статья PMC] [PubMed] [Google Scholar]66. Osteryoung KW, Nunnari J. Разделение эндосимбиотических органелл. Наука. 2003; 302:1698–1704. [PubMed] [Google Scholar]67. Нисида К. и др. Динамическое рекрутирование динамина для окончательного разрыва митохондрий у примитивной красной водоросли.
Мол. Клетка. 1999; 4: 815–826. [PubMed] [Google Scholar]62. Фрёлих С. и соавт. Структурное понимание олигомеризации и митохондриального ремоделирования динамин-1-подобного белка.EMBO J. 2013; 32:1280–1292. [Бесплатная статья PMC] [PubMed] [Google Scholar]63. Фельбер К. и др. Кристаллическая структура безнуклеотидного динамина. Природа. 2011; 477: 556–560. [PubMed] [Google Scholar]64. Meeusen S, McCaffery JM, Nunnari J. Промежуточные продукты слияния митохондрий выявили in vitro . Наука. 2004; 305:1747–1752. [PubMed] [Google Scholar]65. Low HH, Sachse C, Amos LA, Lowe J. Структура липидной трубки бактериального динаминоподобного белка обеспечивает механизм сборки и изгиба мембраны.Клетка. 2009; 139:1342–1352. [Бесплатная статья PMC] [PubMed] [Google Scholar]66. Osteryoung KW, Nunnari J. Разделение эндосимбиотических органелл. Наука. 2003; 302:1698–1704. [PubMed] [Google Scholar]67. Нисида К. и др. Динамическое рекрутирование динамина для окончательного разрыва митохондрий у примитивной красной водоросли.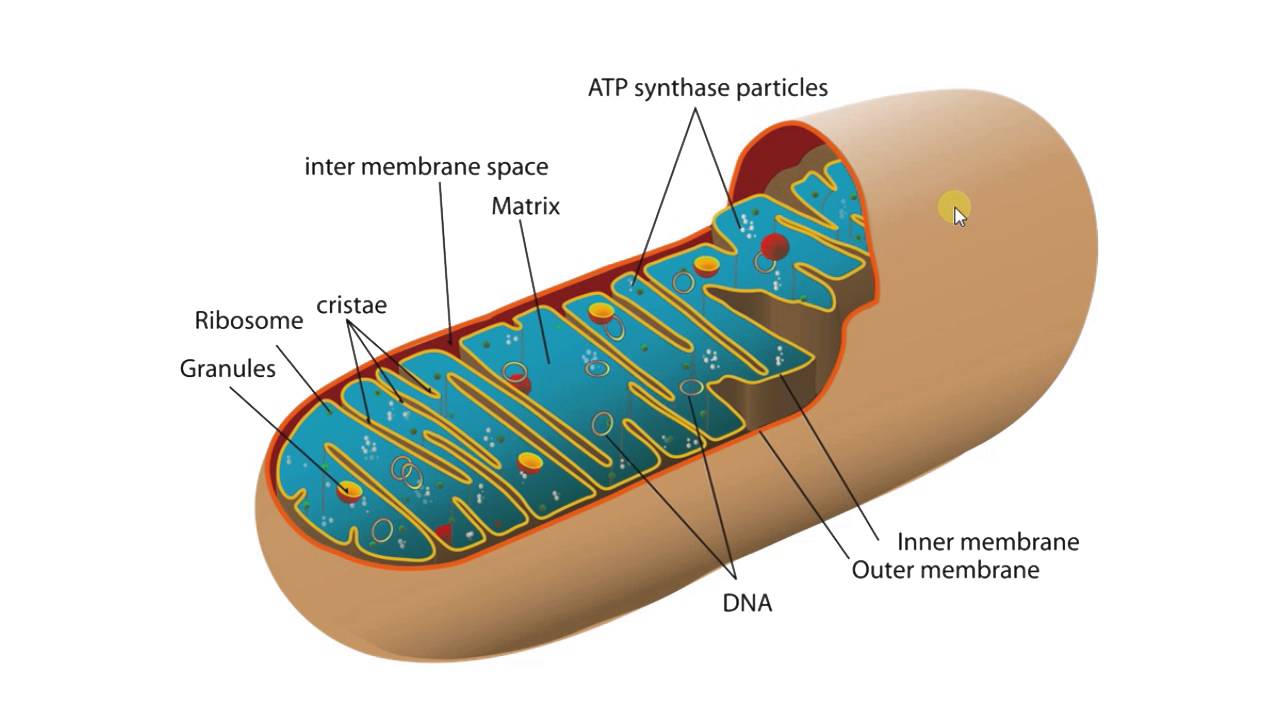 проц. Натл акад. науч. США. 2003; 100:2146–2151. [Бесплатная статья PMC] [PubMed] [Google Scholar]69. Отера Х. и др. Mff является существенным фактором для митохондриального рекрутирования Drp1 во время деления митохондрий в клетках млекопитающих.Дж. Клеточная биология. 2010;191:1141–1158. [Бесплатная статья PMC] [PubMed] [Google Scholar]70. Коробова Ф, Рамабхадран В, Хиггс ХН. Актинзависимый этап деления митохондрий, опосредуемый ER-ассоциированным формином INF2. Наука. 2013; 339: 464–467. [Бесплатная статья PMC] [PubMed] [Google Scholar]72.
Мерли А. и др. Митохондриальное деление, связанное с ER, связывает распределение митохондрий и митохондриальной ДНК у дрожжей. электронная жизнь. 2013;2:e00422. [Бесплатная статья PMC] [PubMed] [Google Scholar]
У дрожжей ERMD служит для разделения митохондриальных геномов на кончики недавно разделенных митохондрий, а консервативная Miro GTPase Gem1 может пространственно разрешать ER-митохондриальные контакты после деления.73. Хоббс А.Е., Сринивасан М.
проц. Натл акад. науч. США. 2003; 100:2146–2151. [Бесплатная статья PMC] [PubMed] [Google Scholar]69. Отера Х. и др. Mff является существенным фактором для митохондриального рекрутирования Drp1 во время деления митохондрий в клетках млекопитающих.Дж. Клеточная биология. 2010;191:1141–1158. [Бесплатная статья PMC] [PubMed] [Google Scholar]70. Коробова Ф, Рамабхадран В, Хиггс ХН. Актинзависимый этап деления митохондрий, опосредуемый ER-ассоциированным формином INF2. Наука. 2013; 339: 464–467. [Бесплатная статья PMC] [PubMed] [Google Scholar]72.
Мерли А. и др. Митохондриальное деление, связанное с ER, связывает распределение митохондрий и митохондриальной ДНК у дрожжей. электронная жизнь. 2013;2:e00422. [Бесплатная статья PMC] [PubMed] [Google Scholar]
У дрожжей ERMD служит для разделения митохондриальных геномов на кончики недавно разделенных митохондрий, а консервативная Miro GTPase Gem1 может пространственно разрешать ER-митохондриальные контакты после деления.73. Хоббс А.Е., Сринивасан М. , МакКаффери Дж.М., Дженсен Р.Е. Mmm1p, белок внешней мембраны митохондрий, связан с нуклеоидами митохондриальной ДНК (мтДНК) и необходим для стабильности мтДНК. Дж. Клеточная биология. 2001; 152:401–410. [Бесплатная статья PMC] [PubMed] [Google Scholar]74. Болдог И.Р. и соавт. Белковый комплекс, содержащий Mdm10p, Mdm12p и Mmm1p, связывает митохондриальные мембраны и ДНК с механизмом сегрегации на основе цитоскелета. Мол. биол. Клетка. 2003; 14:4618–4627. [Бесплатная статья PMC] [PubMed] [Google Scholar]75.Glater EE, Megeath LJ, Stowers RS, Schwarz TL. Аксональный транспорт митохондрий требует milton для рекрутирования тяжелой цепи кинезина и не зависит от легкой цепи. Дж. Клеточная биология. 2006; 173: 545–557. [Бесплатная статья PMC] [PubMed] [Google Scholar]76. Франссон С., Руусала А., Аспенстром П. Атипичные Rho GTPases Miro-1 и Miro-2 играют важную роль в митохондриальной торговле. Биохим. Биофиз. Рез. коммун. 2006; 344: 500–510. [PubMed] [Google Scholar]79. Бан-Исихара Р., Исихара Т.
, МакКаффери Дж.М., Дженсен Р.Е. Mmm1p, белок внешней мембраны митохондрий, связан с нуклеоидами митохондриальной ДНК (мтДНК) и необходим для стабильности мтДНК. Дж. Клеточная биология. 2001; 152:401–410. [Бесплатная статья PMC] [PubMed] [Google Scholar]74. Болдог И.Р. и соавт. Белковый комплекс, содержащий Mdm10p, Mdm12p и Mmm1p, связывает митохондриальные мембраны и ДНК с механизмом сегрегации на основе цитоскелета. Мол. биол. Клетка. 2003; 14:4618–4627. [Бесплатная статья PMC] [PubMed] [Google Scholar]75.Glater EE, Megeath LJ, Stowers RS, Schwarz TL. Аксональный транспорт митохондрий требует milton для рекрутирования тяжелой цепи кинезина и не зависит от легкой цепи. Дж. Клеточная биология. 2006; 173: 545–557. [Бесплатная статья PMC] [PubMed] [Google Scholar]76. Франссон С., Руусала А., Аспенстром П. Атипичные Rho GTPases Miro-1 и Miro-2 играют важную роль в митохондриальной торговле. Биохим. Биофиз. Рез. коммун. 2006; 344: 500–510. [PubMed] [Google Scholar]79. Бан-Исихара Р., Исихара Т. , Сасаки Н., Михара К., Исихара Н.Динамика нуклеоидной структуры, регулируемая делением митохондрий, способствует формированию крист и высвобождению цитохрома c . проц. Натл акад. науч. США. 2013; 110:11863–11868. [Бесплатная статья PMC] [PubMed] [Google Scholar]80. Мессершмитт М. и др. Белок внутренней мембраны Mdm33 контролирует морфологию митохондрий у дрожжей. Дж. Клеточная биология. 2003; 160: 553–564. [Бесплатная статья PMC] [PubMed] [Google Scholar]81. Спелбринк Дж. Н. и соавт. Делеции митохондриальной ДНК человека, связанные с мутациями в гене, кодирующем Twinkle, 4-подобный белок фага T7, локализованный в митохондриях.Природа Жене. 2001; 28: 223–231. [PubMed] [Google Scholar]83. Хоппинс С. и соавт. Карта генетического взаимодействия, сфокусированная на митохондриях, выявляет подобный каркасу комплекс, необходимый для организации внутренней мембраны в митохондриях. Дж. Клеточная биология. 2011;195:323–340. [Бесплатная статья PMC] [PubMed] [Google Scholar]85. фон дер Мальсбург К.
, Сасаки Н., Михара К., Исихара Н.Динамика нуклеоидной структуры, регулируемая делением митохондрий, способствует формированию крист и высвобождению цитохрома c . проц. Натл акад. науч. США. 2013; 110:11863–11868. [Бесплатная статья PMC] [PubMed] [Google Scholar]80. Мессершмитт М. и др. Белок внутренней мембраны Mdm33 контролирует морфологию митохондрий у дрожжей. Дж. Клеточная биология. 2003; 160: 553–564. [Бесплатная статья PMC] [PubMed] [Google Scholar]81. Спелбринк Дж. Н. и соавт. Делеции митохондриальной ДНК человека, связанные с мутациями в гене, кодирующем Twinkle, 4-подобный белок фага T7, локализованный в митохондриях.Природа Жене. 2001; 28: 223–231. [PubMed] [Google Scholar]83. Хоппинс С. и соавт. Карта генетического взаимодействия, сфокусированная на митохондриях, выявляет подобный каркасу комплекс, необходимый для организации внутренней мембраны в митохондриях. Дж. Клеточная биология. 2011;195:323–340. [Бесплатная статья PMC] [PubMed] [Google Scholar]85. фон дер Мальсбург К. и др. Двойная роль митофилина в организации митохондриальной мембраны и биогенезе белка. Дев. Клетка. 2011; 21: 694–707. [PubMed] [Google Scholar]86. Дэвис К.М., Ансельми С., Виттиг И., Фаральдо-Гомес Д.Д., Кульбрандт В.Структура дрожжевого димера F1Fo-АТФ-синтазы и его роль в формировании митохондриальных крист. проц. Натл акад. науч. США. 2012;109:13602–13607. [Бесплатная статья PMC] [PubMed] [Google Scholar]87. Фреза С. и др. OPA1 контролирует ремоделирование апоптотических крист независимо от слияния митохондрий. Клетка. 2006; 126: 177–189. [PubMed] [Google Scholar]88. Itoh K, Tamura Y, Iijima M, Sesaki H. Влияние Fcj1-Mos1 и деления митохондрий на агрегацию нуклеоидов митохондриальной ДНК и морфологию органелл.Мол. биол. Клетка. 2013; 24:1842–1851. [Бесплатная статья PMC] [PubMed] [Google Scholar]89. Восс С., Лахири С., Янг Б.П., Лоуэн С.Дж., Принц В.А. ER-образующие белки облегчают обмен липидов между ER и митохондриями в S. cerevisiae . Дж. Клеточные науки. 2012; 125:4791–4799.
и др. Двойная роль митофилина в организации митохондриальной мембраны и биогенезе белка. Дев. Клетка. 2011; 21: 694–707. [PubMed] [Google Scholar]86. Дэвис К.М., Ансельми С., Виттиг И., Фаральдо-Гомес Д.Д., Кульбрандт В.Структура дрожжевого димера F1Fo-АТФ-синтазы и его роль в формировании митохондриальных крист. проц. Натл акад. науч. США. 2012;109:13602–13607. [Бесплатная статья PMC] [PubMed] [Google Scholar]87. Фреза С. и др. OPA1 контролирует ремоделирование апоптотических крист независимо от слияния митохондрий. Клетка. 2006; 126: 177–189. [PubMed] [Google Scholar]88. Itoh K, Tamura Y, Iijima M, Sesaki H. Влияние Fcj1-Mos1 и деления митохондрий на агрегацию нуклеоидов митохондриальной ДНК и морфологию органелл.Мол. биол. Клетка. 2013; 24:1842–1851. [Бесплатная статья PMC] [PubMed] [Google Scholar]89. Восс С., Лахири С., Янг Б.П., Лоуэн С.Дж., Принц В.А. ER-образующие белки облегчают обмен липидов между ER и митохондриями в S. cerevisiae . Дж. Клеточные науки. 2012; 125:4791–4799. [Бесплатная статья PMC] [PubMed] [Google Scholar]90. Монтессуит С. и др. Ремоделирование мембраны, индуцированное родственным dynamin белком Drp1, стимулирует олигомеризацию Bax. Клетка. 2010; 142:889–901. [Бесплатная статья PMC] [PubMed] [Google Scholar]91.Чипук Дж. Э. и соавт. Метаболизм сфинголипидов взаимодействует с BAK и BAX, чтобы способствовать митохондриальному пути апоптоза. Клетка. 2012; 148:988–1000. [Бесплатная статья PMC] [PubMed] [Google Scholar]92. Хоппинс С. и соавт. Растворимая форма Bax регулирует слияние митохондрий через гомотипические комплексы MFN2. Мол. Клетка. 2011;41:150–160. [Бесплатная статья PMC] [PubMed] [Google Scholar]93. Намба Т. и др. Комплекс CDIP1-BAP31 передает апоптотические сигналы от эндоплазматического ретикулума к митохондриям при стрессе эндоплазматического ретикулума.Cell Rep. 2013; 5: 331–339. [Бесплатная статья PMC] [PubMed] [Google Scholar]95. Area-Gomez E, et al. Повышенная регуляция функции митохондриально-ассоциированных мембран ER при болезни Альцгеймера.
[Бесплатная статья PMC] [PubMed] [Google Scholar]90. Монтессуит С. и др. Ремоделирование мембраны, индуцированное родственным dynamin белком Drp1, стимулирует олигомеризацию Bax. Клетка. 2010; 142:889–901. [Бесплатная статья PMC] [PubMed] [Google Scholar]91.Чипук Дж. Э. и соавт. Метаболизм сфинголипидов взаимодействует с BAK и BAX, чтобы способствовать митохондриальному пути апоптоза. Клетка. 2012; 148:988–1000. [Бесплатная статья PMC] [PubMed] [Google Scholar]92. Хоппинс С. и соавт. Растворимая форма Bax регулирует слияние митохондрий через гомотипические комплексы MFN2. Мол. Клетка. 2011;41:150–160. [Бесплатная статья PMC] [PubMed] [Google Scholar]93. Намба Т. и др. Комплекс CDIP1-BAP31 передает апоптотические сигналы от эндоплазматического ретикулума к митохондриям при стрессе эндоплазматического ретикулума.Cell Rep. 2013; 5: 331–339. [Бесплатная статья PMC] [PubMed] [Google Scholar]95. Area-Gomez E, et al. Повышенная регуляция функции митохондриально-ассоциированных мембран ER при болезни Альцгеймера. EMBO J. 2012; 31:4106–4123. [Бесплатная статья PMC] [PubMed] [Google Scholar]96. Хедског Л. и соавт. Модуляция интерфейса эндоплазматический ретикулум-митохондрия при болезни Альцгеймера и родственных моделях. проц. Натл акад. науч. США. 2013;110:7916–7921. [Бесплатная статья PMC] [PubMed] [Google Scholar]97. Лакнер Л.Л., Пинг Х., Граф М., Мерли А., Нуннари Дж.Эндоплазматический ретикулум-ассоциированная связь митохондрий-коры функционирует в распределении и наследовании митохондрий. проц. Натл акад. науч. США. 2013;110:E458–E467. [Бесплатная статья PMC] [PubMed] [Google Scholar]98. Суэйн Т.С. и др. Роль cER и Mmr1p в закреплении митохондрий в местах роста поляризованной поверхности у почкующихся дрожжей. Курс. биол. 2011;21:1994–1999. [Бесплатная статья PMC] [PubMed] [Google Scholar]99. де Брито О.М., Скоррано Л. Митофузин 2 привязывает эндоплазматический ретикулум к митохондриям.Природа. 2008; 456: 605–610. [PubMed] [Google Scholar] 100. Роуленд А.А., Вольц Г.К. Контакты эндоплазматического ретикулума и митохондрий: функция соединения.
EMBO J. 2012; 31:4106–4123. [Бесплатная статья PMC] [PubMed] [Google Scholar]96. Хедског Л. и соавт. Модуляция интерфейса эндоплазматический ретикулум-митохондрия при болезни Альцгеймера и родственных моделях. проц. Натл акад. науч. США. 2013;110:7916–7921. [Бесплатная статья PMC] [PubMed] [Google Scholar]97. Лакнер Л.Л., Пинг Х., Граф М., Мерли А., Нуннари Дж.Эндоплазматический ретикулум-ассоциированная связь митохондрий-коры функционирует в распределении и наследовании митохондрий. проц. Натл акад. науч. США. 2013;110:E458–E467. [Бесплатная статья PMC] [PubMed] [Google Scholar]98. Суэйн Т.С. и др. Роль cER и Mmr1p в закреплении митохондрий в местах роста поляризованной поверхности у почкующихся дрожжей. Курс. биол. 2011;21:1994–1999. [Бесплатная статья PMC] [PubMed] [Google Scholar]99. де Брито О.М., Скоррано Л. Митофузин 2 привязывает эндоплазматический ретикулум к митохондриям.Природа. 2008; 456: 605–610. [PubMed] [Google Scholar] 100. Роуленд А.А., Вольц Г.К. Контакты эндоплазматического ретикулума и митохондрий: функция соединения. Природа Преподобный Мол. Клеточная биол. 2012;13:607–625. [Бесплатная статья PMC] [PubMed] [Google Scholar]101. Хамасаки М. и др. Аутофагосомы образуются в местах контакта ER-митохондрий. Природа. 2013; 495:389–393. [PubMed] [Google Scholar] 102.
Чен Ю, Шэн Ж. Связывание кинезина-1-синтафилина опосредует зависимую от активности регуляцию аксонального митохондриального транспорта. Дж.Клеточная биол. 2013; 202: 351–364. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Авторы показывают, что белок синтафилин может регулировать положение митохондрий в нейронах, действуя как молекулярный тормоз посредством его связывания с мотором микротрубочек Kif5103. Baloh RH, Schmidt RE, Pestronk A, Milbrandt J. Измененный аксональный митохондриальный транспорт в патогенезе болезни Шарко-Мари-Тута из-за мутаций митофузина 2. Дж. Нейроски. 2007; 27: 422–430. [Бесплатная статья PMC] [PubMed] [Google Scholar]104. Миско А., Цзян С., Вегожевска И., Милбрандт Дж., Бало Р.Х.Митофузин 2 необходим для транспорта аксональных митохондрий и взаимодействует с комплексом Миро/Милтона.
Природа Преподобный Мол. Клеточная биол. 2012;13:607–625. [Бесплатная статья PMC] [PubMed] [Google Scholar]101. Хамасаки М. и др. Аутофагосомы образуются в местах контакта ER-митохондрий. Природа. 2013; 495:389–393. [PubMed] [Google Scholar] 102.
Чен Ю, Шэн Ж. Связывание кинезина-1-синтафилина опосредует зависимую от активности регуляцию аксонального митохондриального транспорта. Дж.Клеточная биол. 2013; 202: 351–364. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Авторы показывают, что белок синтафилин может регулировать положение митохондрий в нейронах, действуя как молекулярный тормоз посредством его связывания с мотором микротрубочек Kif5103. Baloh RH, Schmidt RE, Pestronk A, Milbrandt J. Измененный аксональный митохондриальный транспорт в патогенезе болезни Шарко-Мари-Тута из-за мутаций митофузина 2. Дж. Нейроски. 2007; 27: 422–430. [Бесплатная статья PMC] [PubMed] [Google Scholar]104. Миско А., Цзян С., Вегожевска И., Милбрандт Дж., Бало Р.Х.Митофузин 2 необходим для транспорта аксональных митохондрий и взаимодействует с комплексом Миро/Милтона.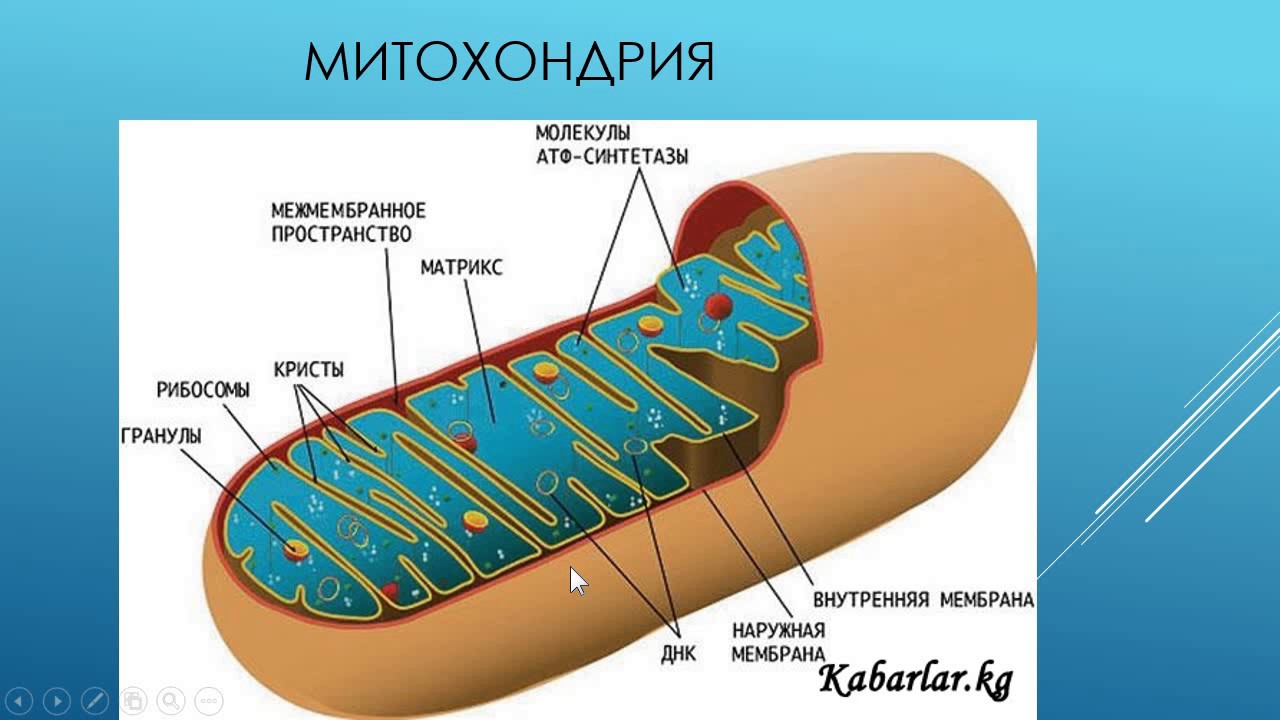 Дж. Нейроски. 2010;30:4232–4240. [Бесплатная статья PMC] [PubMed] [Google Scholar]108. Мартинус Р.Д. и соавт. Селективная индукция митохондриальных шаперонов в ответ на потерю митохондриального генома. Евро. Дж. Биохим. 1996; 240:98–103. [PubMed] [Google Scholar] 109. Haynes CM, Yang Y, Blais SP, Neubert TA, Ron D. Экспортер матричного пептида HAF-1 сигнализирует митохондриальный UPR, активируя фактор транскрипции ZC376.7 в C. elegans . Мол. Клетка. 2010; 37: 529–540. [Бесплатная статья PMC] [PubMed] [Google Scholar]110.
Наргунд А.М., Пеллегрино М.В., Фиорез К.Дж., Бейкер Б.М., Хейнс К.М. Эффективность митохондриального импорта ATFS-1 регулирует активацию митохондриального UPR. Наука. 2012; 337: 587–590. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Эта работа продемонстрировала, что у C. elegans фактор транскрипции ATFS-1 ощущает и модулирует ответ на митохондриальный стресс посредством его нацеливания либо на митохондриальный матрикс, либо на ядро.111. Грипарик Л.
Дж. Нейроски. 2010;30:4232–4240. [Бесплатная статья PMC] [PubMed] [Google Scholar]108. Мартинус Р.Д. и соавт. Селективная индукция митохондриальных шаперонов в ответ на потерю митохондриального генома. Евро. Дж. Биохим. 1996; 240:98–103. [PubMed] [Google Scholar] 109. Haynes CM, Yang Y, Blais SP, Neubert TA, Ron D. Экспортер матричного пептида HAF-1 сигнализирует митохондриальный UPR, активируя фактор транскрипции ZC376.7 в C. elegans . Мол. Клетка. 2010; 37: 529–540. [Бесплатная статья PMC] [PubMed] [Google Scholar]110.
Наргунд А.М., Пеллегрино М.В., Фиорез К.Дж., Бейкер Б.М., Хейнс К.М. Эффективность митохондриального импорта ATFS-1 регулирует активацию митохондриального UPR. Наука. 2012; 337: 587–590. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Эта работа продемонстрировала, что у C. elegans фактор транскрипции ATFS-1 ощущает и модулирует ответ на митохондриальный стресс посредством его нацеливания либо на митохондриальный матрикс, либо на ядро.111. Грипарик Л. , Канадзава Т., ван дер Блик А.М. Регуляция митохондриального динаминоподобного белка Opa1 путем протеолитического расщепления. Дж. Клеточная биология. 2007; 178: 757–764. [Бесплатная статья PMC] [PubMed] [Google Scholar]112. Хед Б., Грипарик Л., Амири М., Гандре-Баббе С., ван дер Блик А.М. Индуцируемая протеолитическая инактивация OPA1, опосредованная протеазой OMA1 в клетках млекопитающих. Дж. Клеточная биология. 2009; 187: 959–966. [Бесплатная статья PMC] [PubMed] [Google Scholar]113. Эхсес С. и соавт. Регуляция процессинга OPA1 и слияния митохондрий с помощью изоферментов протеазы m-AAA и OMA1.Дж. Клеточная биология. 2009; 187:1023–1036. [Бесплатная статья PMC] [PubMed] [Google Scholar]114. Рамбольд А.С., Костелецкий Б., Элиа Н., Липпинкотт-Шварц Дж. Формирование трубчатой сети защищает митохондрии от аутофагосомной деградации во время голодания по питательным веществам. проц. Натл акад. науч. США. 2011;108:10190–10195. [Бесплатная статья PMC] [PubMed] [Google Scholar]115. Gomes LC, Di Benedetto G, Scorrano L.
, Канадзава Т., ван дер Блик А.М. Регуляция митохондриального динаминоподобного белка Opa1 путем протеолитического расщепления. Дж. Клеточная биология. 2007; 178: 757–764. [Бесплатная статья PMC] [PubMed] [Google Scholar]112. Хед Б., Грипарик Л., Амири М., Гандре-Баббе С., ван дер Блик А.М. Индуцируемая протеолитическая инактивация OPA1, опосредованная протеазой OMA1 в клетках млекопитающих. Дж. Клеточная биология. 2009; 187: 959–966. [Бесплатная статья PMC] [PubMed] [Google Scholar]113. Эхсес С. и соавт. Регуляция процессинга OPA1 и слияния митохондрий с помощью изоферментов протеазы m-AAA и OMA1.Дж. Клеточная биология. 2009; 187:1023–1036. [Бесплатная статья PMC] [PubMed] [Google Scholar]114. Рамбольд А.С., Костелецкий Б., Элиа Н., Липпинкотт-Шварц Дж. Формирование трубчатой сети защищает митохондрии от аутофагосомной деградации во время голодания по питательным веществам. проц. Натл акад. науч. США. 2011;108:10190–10195. [Бесплатная статья PMC] [PubMed] [Google Scholar]115. Gomes LC, Di Benedetto G, Scorrano L.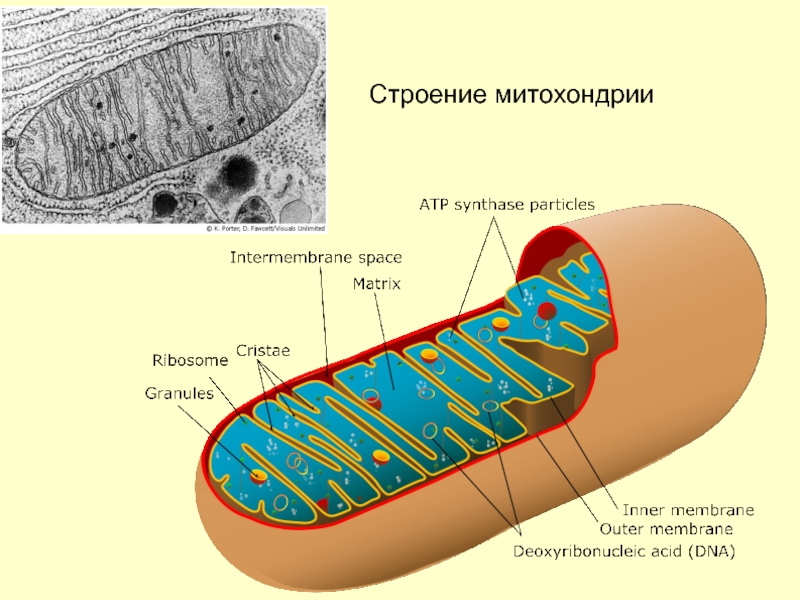 Во время аутофагии митохондрии удлиняются, избавляются от деградации и поддерживают жизнеспособность клеток. Природа Клетка Биол. 2011; 13: 589–598.[Бесплатная статья PMC] [PubMed] [Google Scholar]116. Мацуда Н. и др. PINK1, стабилизированный деполяризацией митохондрий, рекрутирует паркин в поврежденные митохондрии и активирует латентный паркин для митофагии. Дж. Клеточная биология. 2010;189:211–221. [Бесплатная статья PMC] [PubMed] [Google Scholar]118. Ван Х и др. PINK1 и Parkin нацелены на Miro для фосфорилирования и деградации, чтобы остановить подвижность митохондрий. Клетка. 2011; 147: 893–906. [Бесплатная статья PMC] [PubMed] [Google Scholar]119. Чан Н.К. и др. Широкая активация убиквитин-протеасомной системы паркином имеет решающее значение для митофагии.Гум. Мол. Жене. 2011;20:1726–1737. [Бесплатная статья PMC] [PubMed] [Google Scholar]120. Танака А. и др. Протеасома и р97 опосредуют митофагию и деградацию митофузинов, индуцированную паркином. Дж. Клеточная биология. 2010;191:1367–1380.
Во время аутофагии митохондрии удлиняются, избавляются от деградации и поддерживают жизнеспособность клеток. Природа Клетка Биол. 2011; 13: 589–598.[Бесплатная статья PMC] [PubMed] [Google Scholar]116. Мацуда Н. и др. PINK1, стабилизированный деполяризацией митохондрий, рекрутирует паркин в поврежденные митохондрии и активирует латентный паркин для митофагии. Дж. Клеточная биология. 2010;189:211–221. [Бесплатная статья PMC] [PubMed] [Google Scholar]118. Ван Х и др. PINK1 и Parkin нацелены на Miro для фосфорилирования и деградации, чтобы остановить подвижность митохондрий. Клетка. 2011; 147: 893–906. [Бесплатная статья PMC] [PubMed] [Google Scholar]119. Чан Н.К. и др. Широкая активация убиквитин-протеасомной системы паркином имеет решающее значение для митофагии.Гум. Мол. Жене. 2011;20:1726–1737. [Бесплатная статья PMC] [PubMed] [Google Scholar]120. Танака А. и др. Протеасома и р97 опосредуют митофагию и деградацию митофузинов, индуцированную паркином. Дж. Клеточная биология. 2010;191:1367–1380. [Бесплатная статья PMC] [PubMed] [Google Scholar]121. Xu S, Peng G, Wang Y, Fang S, Karbowski M. AAA-ATPase p97 необходима для оборота белков внешней митохондриальной мембраны. Мол. биол. Клетка. 2011; 22: 291–300. [Бесплатная статья PMC] [PubMed] [Google Scholar]122.
Винкоу Э.С. и соавт. Путь PINK1-Parkin способствует как митофагии, так и избирательному обновлению дыхательной цепи in vivo .проц. Натл акад. науч. США. 2013;110:6400–6405. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Авторы использовали протеомику Drosophila, мутантов Pink1 и Parkin, чтобы показать, что компоненты респираторного комплекса избирательно переключаются по сравнению с другими митохондриальными белками во время митофагии.123. Китада Т. и др. Мутации в гене паркин вызывают аутосомно-рецессивный ювенильный паркинсонизм. Природа. 1998; 392: 605–608. [PubMed] [Google Scholar] 124. Валенте Э.М. и соавт. Наследственная болезнь Паркинсона с ранним началом, вызванная мутациями в гене PINK1 .
[Бесплатная статья PMC] [PubMed] [Google Scholar]121. Xu S, Peng G, Wang Y, Fang S, Karbowski M. AAA-ATPase p97 необходима для оборота белков внешней митохондриальной мембраны. Мол. биол. Клетка. 2011; 22: 291–300. [Бесплатная статья PMC] [PubMed] [Google Scholar]122.
Винкоу Э.С. и соавт. Путь PINK1-Parkin способствует как митофагии, так и избирательному обновлению дыхательной цепи in vivo .проц. Натл акад. науч. США. 2013;110:6400–6405. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Авторы использовали протеомику Drosophila, мутантов Pink1 и Parkin, чтобы показать, что компоненты респираторного комплекса избирательно переключаются по сравнению с другими митохондриальными белками во время митофагии.123. Китада Т. и др. Мутации в гене паркин вызывают аутосомно-рецессивный ювенильный паркинсонизм. Природа. 1998; 392: 605–608. [PubMed] [Google Scholar] 124. Валенте Э.М. и соавт. Наследственная болезнь Паркинсона с ранним началом, вызванная мутациями в гене PINK1 . Наука. 2004; 304:1158–1160. [PubMed] [Google Scholar] 125. Стерки Ф.Х., Ли С., Вибом Р., Олсон Л., Ларссон Н.Г. Нарушение митохондриального транспорта и независимая от паркина дегенерация дофаминовых нейронов с дефицитом дыхательной цепи in vivo . проц. Натл акад. науч. США. 2011;108:12937–12942. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Наука. 2004; 304:1158–1160. [PubMed] [Google Scholar] 125. Стерки Ф.Х., Ли С., Вибом Р., Олсон Л., Ларссон Н.Г. Нарушение митохондриального транспорта и независимая от паркина дегенерация дофаминовых нейронов с дефицитом дыхательной цепи in vivo . проц. Натл акад. науч. США. 2011;108:12937–12942. [Бесплатная статья PMC] [PubMed] [Google Scholar]Митохондрии растительных клеток: структура и роль — видео и стенограмма урока
Роль митохондрий
Так что же это означает? Сырьем для растительных митохондрий является глюкоза, образующаяся в результате фотосинтеза.Митохондрии берут это и проходят через процесс, называемый окислительным фосфорилированием , в котором глюкоза трансформируется с помощью ряда белков и ферментов. Преобразованная глюкоза представляет собой молекулу, известную как пируват .
Затем пируват соединяется с кислородом во внутренней части митохондрий, образуя АТФ (аденозинтрифосфат). АТФ — это молекула, которая может быть легко использована растениями в качестве источника химической энергии. Митохондрии являются основными источниками энергии для каждой клетки, а значит и для растения в целом.Процесс преобразования сырых питательных веществ в полезную энергию известен как клеточное дыхание .
Митохондрии являются основными источниками энергии для каждой клетки, а значит и для растения в целом.Процесс преобразования сырых питательных веществ в полезную энергию известен как клеточное дыхание .
Хотя производство энергии является основной функцией митохондрий, они также выполняют другие функции для клетки. Например, митохондрии играют важную роль в запрограммированной гибели клеток, когда клетки, которые ведут себя ненормально, погибают. Это не позволяет аномальным клеткам нанести вред растению или помешать его росту и размножению.
Структура митохондрий
Митохондрии состоят из трех основных частей: внешней мембраны, внутренней мембраны и матрикса, расположенного внутри внутренней мембраны.
Митохондрии представляют собой органеллы, связанные двойной мембраной, что означает, что они имеют два набора мембран. Внешняя мембрана гладкая и проницаемая , что означает, что небольшие молекулы могут свободно проходить через нее в любом направлении. Благодаря этой проницаемости молекулы глюкозы попадают в митохондрии и как молекулы АТФ перемещаются из митохондрий в остальную часть клетки.
Благодаря этой проницаемости молекулы глюкозы попадают в митохондрии и как молекулы АТФ перемещаются из митохондрий в остальную часть клетки.
Внутренняя мембрана менее гладкая. Он сложен много раз (подумайте о гармошке), чтобы увеличить площадь поверхности и обеспечить более высокую скорость производства АТФ.Белки вдоль мембраны помогают в этом процессе. Внутренняя мембрана менее проницаема, чем наружная. Пропускают только молекулы кислорода и АТФ. Пространство, образованное складками внутренней мембраны, известно как крист , и именно в кристах происходят реакции образования АТФ.
Внутри внутренней мембраны находится матрица . Матрица содержит большое количество белков, ферментов и других молекул, необходимых для производства АТФ.Кроме того, именно здесь находится митохондриальная ДНК (мДНК). Наличие отдельной ДНК позволяет митохондриям воспроизводиться отдельно от клетки в целом. Это также означает, что митохондрии могут производить свои собственные белки, необходимые для производства АТФ.
Итоги урока
Итак, давайте кратко повторим, что мы узнали о митохондриях растительных клеток. Как мы узнали, в целом митохондрий являются жизненно важной частью жизни растения. Они являются электростанцией клетки, а это означает, что они берут сырой питательный материал и превращают его в удобную для использования форму энергии.В растениях это сырье принимает форму глюкозы, образующейся в результате фотосинтеза. Глюкоза превращается в пируват и затем соединяется с кислородом в процессе, известном как окислительное фосфорилирование . При этом образуется АТФ (аденозинтрифосфат), который растение может легко использовать в качестве источника химической энергии. Весь процесс производства АТФ также называют клеточным дыханием .
Митохондрии представляют собой связанные двойной мембраной органеллы , которые представляют собой крошечные органоподобные структуры, поэтому они состоят из внешней мембраны, внутренней мембраны и матрикса , который находится внутри внутренней мембраны и содержит большое количество белков, ферментов и других молекул, необходимых для производства АТФ. Внешняя мембрана обладает высокой проницаемостью , что означает, что небольшие молекулы могут свободно проходить через нее в любом направлении, но внутренняя мембрана гораздо менее проницаема, пропуская только молекулы кислорода и АТФ. Внутренняя мембрана складывается много раз, образуя пространства, называемые cristae , где происходит большая часть производства АТФ.
Внешняя мембрана обладает высокой проницаемостью , что означает, что небольшие молекулы могут свободно проходить через нее в любом направлении, но внутренняя мембрана гораздо менее проницаема, пропуская только молекулы кислорода и АТФ. Внутренняя мембрана складывается много раз, образуя пространства, называемые cristae , где происходит большая часть производства АТФ.
Это определенно много, но вы должны иметь достаточное представление о том, как работают митохондрии растительных клеток, чтобы никогда больше не смотреть на зеленый лист как раньше!
Общая нить между органами, болезнями и старением
Митохондрии занимают центральное место во всех основных и продвинутых клеточных и организменных функциях.В дополнение к подавляющему большинству клеточной энергии, генерируемой этими уникальными органеллами, они также являются важными сигнальными узлами и связываются с остальной частью клетки с помощью различных средств, включая активные формы кислорода. Их дисфункция связана почти со всеми распространенными заболеваниями, от нервно-мышечных до диабета и рака. В этом специальном выпуске «Митохондриальная структура, функция и динамика: общая нить между органами, болезнями и старением» мы хотели предоставить читателям Oxidative Medicine and Cellular Longevity множество примеров того, как митохондрии функционируют и как различные неблагоприятные условия приводят к их дисфункции.Статьи в этом специальном выпуске можно разделить на статьи, посвященные изучению митохондрий, связанных с такими темами, как болезнь Альцгеймера, раковая кахексия, диабет, заживление ран и сепсис.
В этом выпуске несколько статей посвящены роли митохондрий в мозге. Например, П. Мартин-Маэстро и его коллеги сообщают о подавлении генов, участвующих в митохондриальной динамике, у пациентов с диагнозом болезни Альцгеймера, тогда как Д. Дж. Тиррелл и соавт. исследовали биоэнергетические профили крови в качестве потенциальных биомаркеров изменений метаболизма головного мозга. Д. Ф. Бебенси и его коллеги использовали модель трансгенных мышей (Mecp2 null) для изучения окислительного стресса в области гиппокампа, и потенциальное клиническое применение их результатов связано с пониманием расстройства развития нервной системы, называемого синдромом Ретта. Кроме того, в статье К. К. Гриффитса и Р. Дж. Леви представлен прекрасный обзор роли митохондриальной дисфункции при аутизме. В совокупности эти исследования дают ценную информацию о роли функции митохондрий в мозге.
Д. Ф. Бебенси и его коллеги использовали модель трансгенных мышей (Mecp2 null) для изучения окислительного стресса в области гиппокампа, и потенциальное клиническое применение их результатов связано с пониманием расстройства развития нервной системы, называемого синдромом Ретта. Кроме того, в статье К. К. Гриффитса и Р. Дж. Леви представлен прекрасный обзор роли митохондриальной дисфункции при аутизме. В совокупности эти исследования дают ценную информацию о роли функции митохондрий в мозге.
Другой тканью, в которой митохондрии играют решающую роль в биоэнергетике, являются скелетные мышцы, составляющие 50% общей массы тела человека. Скелетные мышцы динамичны и поэтому реагируют как на положительные стимулы, такие как физические упражнения, так и на негативные, такие как старение. В этом специальном выпуске представлены три статьи, которые дают более глубокое представление о роли митохондрий в скелетных мышцах. Р. Г. Файхтингер и его коллеги представляют случай ребенка, который вскоре после рождения страдал респираторным дистресс-синдромом и нуждался в искусственной вентиляции легких. Кроме того, этому пациенту потребовалась заместительная терапия сурфактантом. В этом отчете обсуждается мутация UQCC2 при неонатальной энцефаломиопатии с особым акцентом на комплекс III. В дополнение к этому клиническому случаю представлены две обзорные статьи из лабораторий Худ и Карсон: «Влияние старения и упражнений на контроль качества митохондрий в скелетных мышцах» и «Нарушенная динамика, митофагия и биогенез скелетных мышц при раковой кахексии»: Роль воспаления», соответственно.В этих статьях представлены два разных сценария (старение/упражнения и раковая кахексия), а также то, как скелетные мышцы реагируют на эти стимулы, и потенциальное влияние на структуру и функцию митохондрий.
Кроме того, этому пациенту потребовалась заместительная терапия сурфактантом. В этом отчете обсуждается мутация UQCC2 при неонатальной энцефаломиопатии с особым акцентом на комплекс III. В дополнение к этому клиническому случаю представлены две обзорные статьи из лабораторий Худ и Карсон: «Влияние старения и упражнений на контроль качества митохондрий в скелетных мышцах» и «Нарушенная динамика, митофагия и биогенез скелетных мышц при раковой кахексии»: Роль воспаления», соответственно.В этих статьях представлены два разных сценария (старение/упражнения и раковая кахексия), а также то, как скелетные мышцы реагируют на эти стимулы, и потенциальное влияние на структуру и функцию митохондрий.
Другая область исследований, которая представлена, — это влияние рака на различные ткани и его роль в митохондриальной функции. В отчете А. Койта и его коллег показано, что существуют различия между митохондриальным дыханием, а также проницаемостью мембран у больных раком молочной железы по сравнению с пациентами с диагнозом колоректальный рак.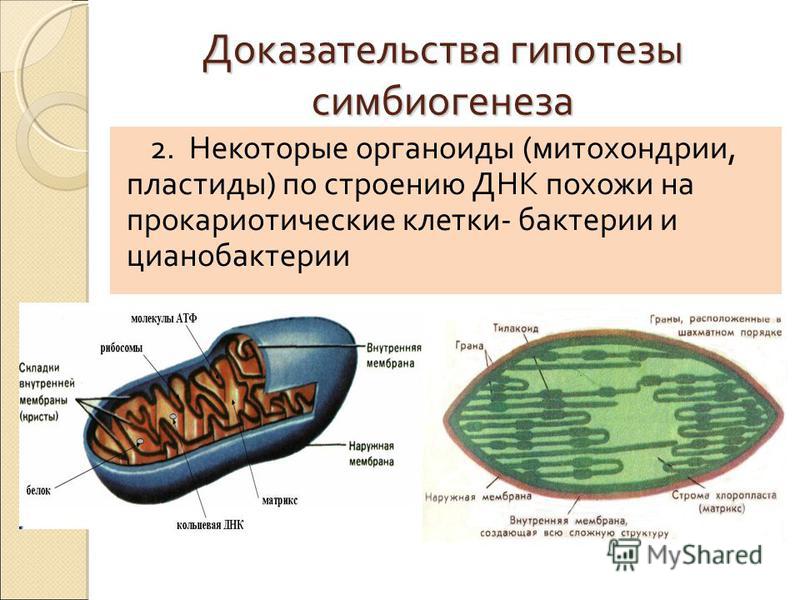 Исследователи используют комбинацию образцов тканей человека, а также моделей клеточных культур, чтобы различать различия в митохондриальных реакциях. В другой статье Р. Г. Файхтингера и его коллег исследователи изучают комплексы OXPHOS при двух основных типах рака желудка.
Исследователи используют комбинацию образцов тканей человека, а также моделей клеточных культур, чтобы различать различия в митохондриальных реакциях. В другой статье Р. Г. Файхтингера и его коллег исследователи изучают комплексы OXPHOS при двух основных типах рака желудка.
Направленные на митохондрии поглотители АФК вызвали большой интерес в научном сообществе по мере их продвижения, то есть локализации в основе проблемы митохондрий. Соединения, такие как MitoQ, MitoTEMPO и SKQ1, объединяют поглотитель АФК с положительно заряженной частью трифенилфосфония, которая нацеливает соединения на отрицательно заряженные внутренние части митохондрий, что приводит к обогащению на несколько порядков.Таким образом, P. Rademann и его коллеги использовали модель сепсиса на грызунах, чтобы определить влияние SkQ1 и MitoTEMPO на ослабление воспалительных реакций, что не улучшило выживаемость животных и даже снизило выживаемость для SKQ1. Однако Илья и его коллеги использовали SkQ1 в мышиной модели диабета, чтобы определить, улучшит ли он заживление кожных ран.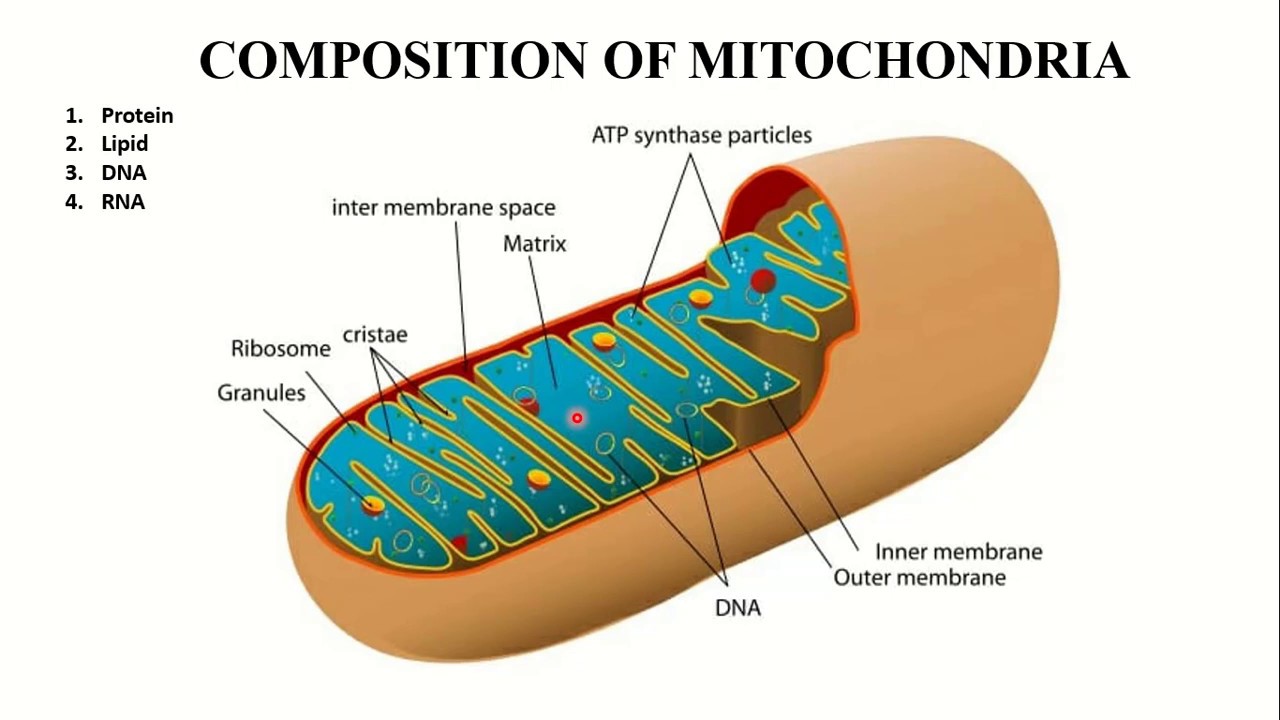 Авторы сообщили о нескольких положительных эффектах, включая снижение перекисного окисления липидов, увеличение α актин-позитивных клеток гладких мышц и закрытие ран.В заключение, хотя терапевтическая польза митохондриально-направленных поглотителей АФК была убедительно продемонстрирована для ряда острых и хронических заболеваний, связанных с митохондриальными АФК, они не могут считаться универсальным методом лечения за некоторыми исключениями, такими как острая воспалительная сигнализация, наблюдаемая при сепсисе. .
Авторы сообщили о нескольких положительных эффектах, включая снижение перекисного окисления липидов, увеличение α актин-позитивных клеток гладких мышц и закрытие ран.В заключение, хотя терапевтическая польза митохондриально-направленных поглотителей АФК была убедительно продемонстрирована для ряда острых и хронических заболеваний, связанных с митохондриальными АФК, они не могут считаться универсальным методом лечения за некоторыми исключениями, такими как острая воспалительная сигнализация, наблюдаемая при сепсисе. .
Чтобы лучше понять роль митохондриальной функции, мы представляем обширный обзор субъединиц оксидазы цитохрома c от функции до заболевания человека.С. Тан и Э. Вонг также представляют обзор роли и эффективности полифенолов в контроле качества митохондрий. Кроме того, J.D.A. Losano et al. исследовали метаболические пути в эпидидимальной бычьей сперме, тогда как В. Ян и его коллеги исследовали взаимодействие между тестостероном и окислительным повреждением у орхиэктомированных крыс.
В заключение, все статьи, представленные в этом специальном выпуске, подчеркивают важность правильного функционирования митохондрий для здоровой работы органов и организма, тогда как митохондриальная дисфункция, вызванная различными причинами, от конкретных мутаций до старения как, возможно, окончательного митохондриального заболевания, занимает центральное место во все возрастающем числе патологий, включая все распространенные заболевания.
Мох Х. Малек
Майк Хюттеманн
Иксу Ли
Авторское право
Авторское право © 2018 Мох Х. Малек и др. Это статья с открытым доступом, распространяемая в соответствии с лицензией Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии надлежащего цитирования оригинальной работы.
СТРУКТУРА И ФУНКЦИЯ МИТОХОНДРИЙ
ОПРЕДЕЛЕНИЕ МИТОХОНДРИЙ:
Митохондрии являются центром клеточного дыхания. Он преобразует химическую энергию в кинетическую энергию.
Он преобразует химическую энергию в кинетическую энергию.
Информация о митохондриях
- В 1857 г. Колликер наблюдал митохондрии и назвал их саркосомами.
- Флемминг называл их Фила.
- Альтманн в 1890 году назвал их биопластами.
- Бенда дал название митохондрии.
- Porter & Palade описали их электронно-микроскопическую структуру.
- Митохондрии присутствуют во всех эукариотических клетках.
Размер: Длина варьируется от 1,5 до 10 мкм. Самая маленькая митохондрия наблюдается у дрожжей. Его длина составляет 1 миллион микрон. Ширина составляет от 0,5 до 0,7 микрон (ооциты амфибий имеют митохондрии длиной от 20 до 40 микрон).
Номер: В Micro monas присутствует только одна митохондрия. В клетке печени имеется от 1000 до 1600 митохондрий.Наибольшее количество митохондрий наблюдается в клетке летательных мышц. Однако клетки зеленых растений содержат меньше митохондрий. В красных кровяных тельцах млекопитающих и других высших животных митохондрии отсутствуют.
В красных кровяных тельцах млекопитающих и других высших животных митохондрии отсутствуют.
Структура митохондрий: Митохондрии покрыты 2 слоями. Он показывает наружную мембрану и внутреннюю мембрану. В каждой митохондрии имеется 2 камеры.
- Наружная камера
- Внутренняя камера.
Наружная мембрана: Это непрерывная мембрана, покрывающая и защищающая митохондрию. !t отделяет митохондрию от цитозоля. Он проницаем.
Внутренняя мембрана: Проецируется внутрь в виде крист. Мембрана показывает две стороны. Внешняя грань «C» (цитозольная грань) и внутренняя грань называется «M» гранью (матричная грань). На этой М-грани присутствует ряд структур, похожих на ручки.
Наружная камера: Это пространство между внешней и внутренней мембранами.Это от 60 до 80А°. Он заполнен жидкостью.
Внутренняя камера: Называется митохондриальной матрицей.
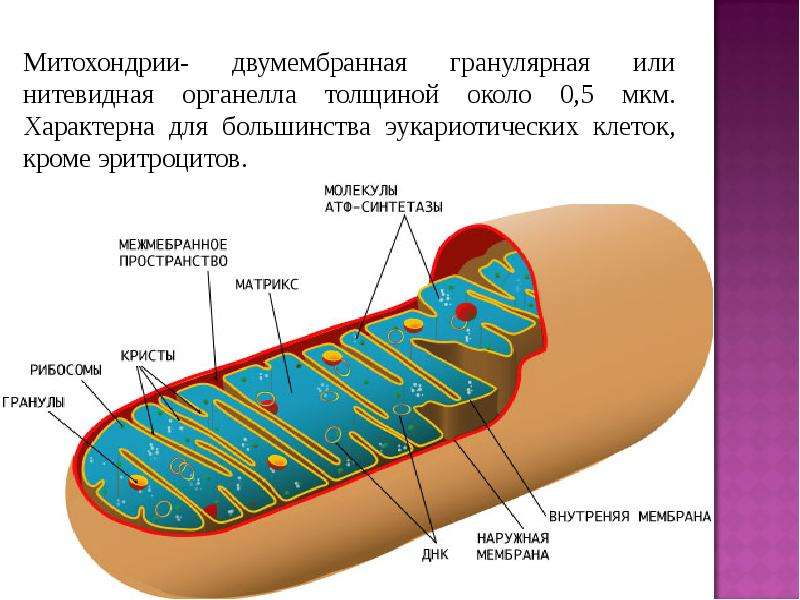 Он наполнен желеобразным веществом. Он содержит множество ферментных систем. В 1963 г. «Насс» наблюдал присутствие молекулы ДНК в митохондриях.
Он наполнен желеобразным веществом. Он содержит множество ферментных систем. В 1963 г. «Насс» наблюдал присутствие молекулы ДНК в митохондриях.
Вариации крист: Обычно кристы перпендикулярны, но можно заметить различное их расположение.
Параллельные кристы: В нервных клетках и клетках поперечнополосатых мышц митохондрии имеют параллельные кристы.
Концентрические кристы: В сперматогониях человека митохондрии имеют концентрические кристы.
Беспорядочное расположение: В хоа-хоа митохондрии демонстрируют неправильное расположение крист
Сферические кристы: В сперматоцитах кристы имеют сферическую форму.
Митохондрии без крист: Очень редко внутренняя мембрана гладкая. Он не будет показывать кристы.
Редуцированные гребни: В клетках семенников опоссума гребни редуцированы в митохондриях.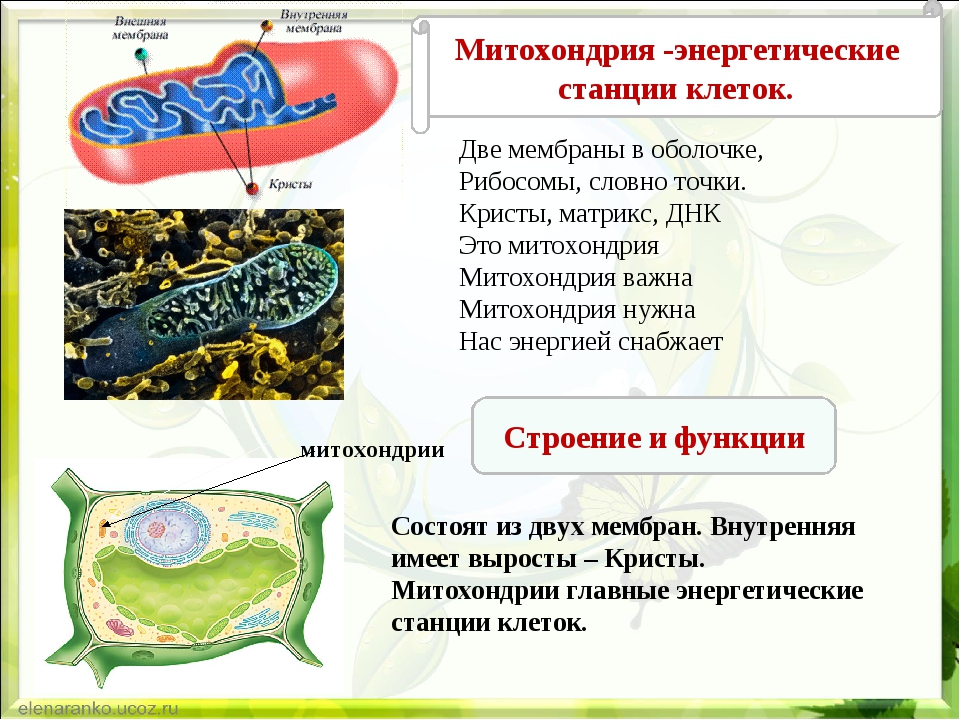
Химический состав: Митохондрии содержат 73 % белков, от 25 до 30 % липидов, 5 % РНК и небольшое количество ДНК. Ферментные комплексы больше. Липиды содержат 90% фосфолипидов, холестерин, каротиноиды и т. д.
Ферменты: В 1969 г. Ленингер дал учет ферментов в митохондриях.
1) Ферменты наружной мембраны митохондрий
а) Фермент мономиноксидаза.
б) Ферменты, активирующие жирные кислоты.
2) Ферменты наружной камеры митохондрий
1) Аденилаткиназа.
2) Дифосфокиназа нейкоцитов.
3) Ферменты внутренней мембраны
Во внутренней мембране присутствуют ферменты переноса электронов. Это цитохромы, ароматические белки, дегидрогиназы и т. д.
а) АТФ-синтетаза-оксидаза.
b) карнитин-ацилтрансфераза жирных кислот и т. д., ферменты присутствуют. Ферменты матрикса: Эти системы ферментов связаны с циклом Кребса и циклом жирных кислот.
а) Фумараза.
б) Аконитаза.
c) Цитратсинтаза и др.
Элементарные частицы: На внутренней мембране митохондрий присутствуют стебельчатые частицы. Их называют F, или элементарные частицы. Они расположены на равном расстоянии. Каждая частица имеет стебель и головную часть. Длина стебля 50А°. Головка 100° в диаметре.Расстояние между двумя частицами равно 100°. Головка содержит ферменты АТФ-азной системы и осуществляет окислительное фосфорелирование. Поэтому их называют оксисомами.
Дыхательные цепи: Дыхательная цепь содержит ряд сложных белков и переносчиков электронов. Эти переносчики электронов представлены 4 комплексами.
Комплекс I: Содержит флавопротеин НАДН-дегидрогиназы. Он содержит негемирон, который сочетается с белком.Он получает водород из НАДН.
Комплекс II: Содержит флавопротеин янтарной дегидрогеназы. Он получает водород от янтарной дегидрогиназы.
Он получает водород от янтарной дегидрогиназы.
Комплекс III: Он содержит цитохром b1, цитохром cr
Комплекс IV:
Эти комплексы связаны убинохиноном. Будет присутствовать цитохром С.Убинохинон соединяет комплексы 1,2 и 3. Цитохром С будет соединять комплекс 384.
- Удача заявила, что свободные существующие митохондрии будут удлиняться и делиться, и образуются новые митохондрии.
- Моррисон заявил, что митохондрии возникают либо из плазматической мембраны, либо из эндоплазматического ретикулума.
- В цитоплазме могут присутствовать мелкие частицы, они называются промитохондриями, они могут давать начало митохондриям.
Митохондриальная ДНК: Митохондрии содержат одну или две молекулы ДНК. Митохондриальная ДНК круглая. Это сильно скрученная двухцепочечная молекула. «Рабино-с» заявил, что митохондриальная ДНК. содержит больше G и C, чем неясная ДНК. Молекулярная масса митохондриальной ДНК составляет от 9 до 11 миллионов. Эта ДНК обладает способностью умножения. ДНК присутствует фермент полимераза. Эта ДНК будет производить R.N.A. Считается, что он может взять на себя производство некоторых белков.
Происхождение Mitochondria
Митохондрий полуавтоматический или прокариотическое происхождение:
В 1890 «Акманн» предложил, что митохондрия и хлоропласты могут быть внутриклеточными паразитами клеток, которые вошли в цитоплазму эукариотического клетка. И они живут как симботоны. Поэтому Акманн назвал их биоплатами.
- В бактериях и митохондриях система транспорта электронов присутствует в плазматической мембране и во внутренней мембране соответственно.
- Бактериальная плазматическая мембрана имеет мезосомы, с ними можно сравнить митохондриальные кристаллы.
- И бактерии, и митохондрии будут иметь кольцевую ДНК.
- Сообщается о рибосомах как у бактерий, так и у митохондрий.
- И бактерии, и митохондрии будут производить АТ.Ф. и Р.Н.А. Следовательно, мы считаем, что митохондрии могли произойти из бактериальной клетки. В клетке митохондрии будут функционировать как полуавтономные органы.
Функции митохондрий:
- А.Т.П. Синтез: Это электростанция клетки. Он вызывает окисление пищи. Отсюда реакции цикла Кребса, ферменты электронтранспортной системы находятся в митохондриях. При окислении пищи энергия высвобождается в виде АТФ. (Происходит окислительная фосфореляция.)
- Образование желтка: Митохондрии ответственны за образование желтка в развивающейся яйцеклетке Гранулы образуются в матриксе Они образуют большие массы Митохондрии превращаются в запасающие желток тела.
- Митохондриальное образование сперматозоидов: Когда сперматиды становятся? Митохондрии
- Происхождение новой системы: Считается, что некоторые клеточные органеллы могут происходить из митохондрий.
- Производство тепла: При окислении пищевых продуктов выделяется АТФ. Только 45% всей энергии удерживается в форме АТФ. Остальные 35% АТФ будут выделяться в виде тепла.(У птиц и млекопитающих это тепло полезно для поддержания температуры тела).
- АТФ, высвобождаемая при дыхании (из-за митохондрий), принимает участие во многих биосинтетических путях клетки.
Клеточная биология
Митохондрии
Энергия, хранящаяся в пище, имеет большие номиналы. Липиды, углеводы и даже белки, потребляемые или поглощаемые клетками, обеспечивают их энергией, необходимой для роста и метаболической активности.Однако, прежде чем клетки смогут получить доступ к этой энергии, она должна быть разбита на кусочки «размера в один укус». Это роль митохондрий.
В эукариотических клетках митохондрии участвуют в заключительных стадиях высвобождения энергии из пищевых молекул, таких как сахара. После распада на двухуглеродные фрагменты в цитоплазме конечные продукты катаболических процессов, таких как гликолиз, перемещаются внутрь органелл митохондрий. В следующей серии химических реакций распада образуется углекислый газ, а энергия захватывается электронами высокой энергии.Наконец, энергия этих электронов высвобождается в ходе ступенчатой цепной реакции, которая передает управляемые порции энергии молекулам АТФ и образует конечный продукт жизнедеятельности — воду.
Такая сложная деятельность возможна из-за структурной организации митохондрий. Каждая органелла имеет двойную мембрану; наружная мембрана гладкая и определяет форму органеллы, а внутренняя мембрана сильно сложена в пальцеобразные кристы, образующие большую площадь поверхности.
В центральном отделе внутренней митохондриальной мембраны находятся ферменты цикла Кребса, которые в циклической серии химических реакций расщепляют двухуглеродные фрагменты до углекислого газа. В ходе этих реакций распада образуются высокоэнергетические электроны. Переносимые модифицированными молекулами нуклеотидов, эти электроны переносятся на высокоорганизованный ряд белков, ферментов и переносчиков электронов, встроенных во внутреннюю митохондриальную мембрану.Ступенчатым, каскадным образом электроны последовательно передаются вниз по энергетической цепи, теряя часть своей энергии на каждом шаге. Эта высвобождаемая энергия не теряется, а используется для перекачивания ионов водорода с одной стороны мембраны на другую.
Когда электроны находятся на самом низком уровне, они соединяются с ионами кислорода и водорода, образуя воду. Но в митохондриальных мембранах несбалансированный градиент ионов водорода по обе стороны митохондриальной мембраны создает энергетический потенциал через барьер.Когда электроны возвращаются во внутренний компартмент, они проходят через ферментно-белковый комплекс, встроенный во внутреннюю мембрану митохондрий. Энергия снова перемещается, на этот раз в химическую реакцию, в результате которой образуется АТФ. Эта молекула АТФ является краткосрочной энергетической валютой клеток и организмов.
Все эукариотические клетки имеют митохондрии. Клетки сердца или другие подобные клетки с высокой метаболической активностью имеют много митохондрий, чтобы обеспечить клетку АТФ, необходимой для ее специализированной роли.Другие клетки, такие как запасающие липиды клетки, все еще имеют митохондрии, но из-за гораздо более низкого уровня метаболической активности они имеют меньше таких органелл и производят меньше АТФ.
В отличие от других органелл внутри клетки, митохондрии имеют свои собственные молекулы ДНК, и этот генетический материал отвечает за кодирование некоторых белков и компонентов, используемых в метаболических процессах. Митохондрии также имеют свои собственные различные типы рибосом и подвергаются тому, что выглядит как процесс деления.В момент полового размножения у животных оплодотворенная зигота получает все свои митохондрии от матери. Это «материнское» наследование митохондрий и ДНК, которую они несут, позволяет проследить генезис нашего вида в обратном направлении до «первоначальной» женщины, от чьих митохондрий мы все еще зависим.
инструментов для изучения морфологии и функций митохондрий | Thermo Fisher Scientific
Мультиплексируйте ваши митохондриальные данные
(см. список продуктов, представленных в этой статье.)
Митохондрии могут составлять до 10% объема клеток эукариотических клеток. Изменения в митохондриальной морфологии и функции являются хорошими индикаторами здоровья клеток, и мультиплексирование реагентов митохондриальной морфологии с зондами, которые оценивают функцию, может предоставить более подробную информацию о митохондриальном здоровье. Мы разработали широкий спектр реагентов Molecular Probes™ для исследования митохондрий как при визуализации живых, так и фиксированных клеток. В этой статье мы выделяем некоторые из наших наиболее часто упоминаемых митохондриальных зондов.
Зонды морфологии митохондрий
Митохондрии могут иметь фрагментированную морфологию с множеством митохондрий сфероидальной формы или сетчатую морфологию, при которой митохондрия представляет собой единую многоветвящуюся структуру [1,2]. Количество митохондрий зависит от нескольких переменных, включая тип клеток, клеточный цикл или стадию дифференцировки, уровень клеточной энергии и общее состояние клеток. Простое окрашивание митохондрий и наблюдение за их морфологией под микроскопом может предоставить значительный объем информации об их общей биологии и функциональном состоянии (Таблица 1) . На рис. 1 показаны митохондрии с нормальной сетчатой морфологией, а также митохондрии сфероидной формы, очищенные путем аутофагии.
Таблица 1. Различные инструменты Molecular Probes для изучения митохондриальной морфологии.
| Зонд | Механизм действия |
|---|---|
| Зонды MitoTracker™ Green, Red и Deep Red | MitoTracker Green (кат. Deep Red FM (кат. №M22426) красители секвестрируются функционирующими митохондриями. Однако клетки, окрашенные этими красителями, сохраняют флуоресцентное окрашивание, даже если функция митохондрий нарушена или если клетки подвергаются фиксации и пермеабилизации. Это свойство делает их полезными морфологическими маркерами, которые после связывания не зависят от митохондриальной функции [3]. |
| Зонды CellLight™ | CellLight Mitochondria-GFP (C10600) и CellLight Mitochondria-RFP (Cat. No.C10601) окрашивают митохондрии независимо от их функционального состояния. Эти зонды используют одноэтапный протокол, основанный на технологии доставки и экспрессии генов BacMam, для маркировки всех митохондрий в клетках GFP или RFP. После применения митохондрии могут быть визуализированы в живых клетках, или клетки могут быть зафиксированы и пермеабилизированы для дальнейшего изучения. |
| Антитела | Антитела являются мощным инструментом для окрашивания митохондрий в фиксированных клетках. Антитела, такие как моноклональные антитела против комплекса V (кат.№ 459000) может окрашивать все митохондрии в клетках для морфологических исследований. |
| клеток HeLa, помеченных красителем Hoechst™ 33342 (синий) и экспрессирующих CellLight™ Mitochondria-GFP (зеленый) и Premo™ Autophagy Sensor LC3B-RFP (красный), обрабатывали CCCP для деполяризации митохондрий. Потеря потенциала митохондриальной мембраны запускает целенаправленный клиренс поврежденных митохондрий посредством митофагии, что отражается в колокализации аутофагосомного маркера LC3B-RFP с митохондриальными сфероидами. |
Митохондриальные функциональные инструменты
Митохондриальная дисфункция связана с различными заболеваниями [4] и является признаком клеточной токсичности. Мы предлагаем различные реагенты Molecular Probes для изучения функции митохондрий с разных точек зрения, включая зонды для определения потенциала митохондриальной мембраны, потока кальция, окислительного фосфорилирования, аутофагии/митофагии и цитозольного pH (таблица 2) .
Таблица 2. Различные инструменты Molecular Probes для изучения функции митохондрий.
| Функция | Рекомендации зонда |
|---|---|
| Потенциал митохондриальной мембраны | TMRM (кат. потенциал проникает в цитоплазму. |
| Митохондриальный поток кальция | Индикатор кальция rhod-2 AM (кат. № R1244) уже давно используется для измерения митохондриального потока кальция из-за его преимущественного накопления в митохондриях (рисунок 3) . |
| Окислительное фосфорилирование | Митохондрии генерируют различные активные формы кислорода (АФК), особенно супероксиды [5]. Краситель MitoSOX™ Red (кат. № M36008) представляет собой датчик супероксида, нацеленный на митохондрии. Реагенты CellROX™ Orange (кат. № C10443) и CellROX™ Deep Red (кат. № C10422) являются общими индикаторами окислительного стресса, но их сигналы могут быть локализованы в митохондриях при использовании вместе с митохондриальными морфологическими зондами (рис. 4) . |
| Аутофагия/митофагия | Клетки регулярно рециркулируют дисфункциональные митохондрии посредством особого процесса аутофагии, называемого митофагией.Этот механизм можно обнаружить путем мультиплексирования CellLight Mitochondria-GFP или CellLight Mitochondria-RFP с одним из датчиков аутофагии Premo™ (рис. 1) . |
| Цитозольный рН | Нарушение функции митохондрий может изменить цитозольный рН [6]. pHrodo™ Green AM (кат. № P35373) или pHrodo™ Red AM (кат. № P35372) можно использовать для обнаружения изменений цитозольного pH. |
Сила мультиплексирования
Изучение митохондрий может быть улучшено за счет мультиплексирования функциональных зондов с морфологическими зондами.Например, CellLight Mitochondria-GFP или CellLight Mitochondria-RFP можно комбинировать с чувствительными к потенциалу красителями, такими как TMRM, для мониторинга структурной целостности митохондрий, а также для оценки потенциала митохондриальной мембраны (рис. 2) . Рисунок 3 демонстрирует эффективность мультиплексирования индикатора митохондриального потока кальция rhod-2 AM с потенциально независимыми митохондриальными маркерами, такими как CellLight Mitochondria-GFP, что позволяет визуализировать митохондриальное деление, слияние и подвижность до, во время и после кальция. поглощение.С помощью мультиплексирования функцию митохондрий можно определить даже с помощью инструментов, не предназначенных специально для митохондрий, когда они используются совместно с митохондриально-направленными зондами. При мультиплексировании с CellLight Mitochondria-GFP CellROX Orange, зонд общего окислительного стресса, может указывать на состояние окислительного стресса митохондрий (рис. 4) .
| клеток HeLa трансдуцировали с помощью CellLight™ Mitochondria-GFP и загружали 50 нМ TMRM в течение 10 минут при 37°C. (A–E) Изображения были получены с 5-секундными интервалами в течение 90 секунд после обработки разобщителем CCCP; увеличенные срезы (B – D) выявляют гетерогенность в регуляции потенциала митохондриальной мембраны. Временная деполяризация наблюдалась в одной, но не во всех митохондриях (C, стрелка) , на что указывает потеря оранжевого сигнала TMRM; Флуоресценция GFP сохранялась во время деполяризации, что указывает на интактную митохондрию.Потеря потенциала митохондриальной мембраны была очевидна через 90 секунд после обработки CCCP (E) ; однако митохондрии все еще были неповрежденными, информация, которая была бы потеряна при использовании только TMRM. Рис. (A) Клетки HeLa метили с помощью CellLight™ Mitochondria-GFP и 5 мкМ rhod-2 AM в течение 15 минут при 37°C перед визуализацией в реальном времени в течение 100 секунд. (B–D) Область, обведенная (A) , увеличена, чтобы показать отдельные митохондрии в одной клетке с течением времени. (C, D) Кальций высвобождается из внутренних запасов после применения 10 мкМ гистамина. Митохондрии, находящиеся в непосредственной близости от выброса кальция, выявляются по усилению оранжево-красной флуоресценции rhod-2. Стрелка в (C) обозначает митохондрию, которая может иметь нарушенное поглощение кальция, деталь, которая была бы упущена при использовании только rhod-2 AM.Звездочкой отмечена митохондрия, для которой характерно временное повышение уровня кальция. Рис. 4. Мультиплексное изображение структуры и функции митохондрий. Клетки остеосаркомы человека (U2OS), экспрессирующие CellLight™ Mitochondria-GFP (зеленые), обрабатывали 200 мкМ трет-бутилгидропероксида (TBHP, индуктор окислительного стресса) в течение 2 часов. Раствор красителя, содержащий 5 мкМ CellROX™ Orange (оранжевый) и 2 капли красителя NucBlue™ Live Cell Stain (синий) на мл образца клеток, наносили на 30 мин при 37°C.Клетки промывали и визуализировали раствором для визуализации живых клеток с использованием конфокального микроскопа. В то время как зеленые флуоресцентные митохондрии с нормальной морфологией указывают на здоровые митохондрии, оранжевые флуоресцентные сфероиды предполагают, что часть митохондрий демонстрирует признаки окислительного стресса после лечения TBHP. |
Ссылки
- Koopman WJ, Visch HJ, Smeitink JA et al. (2006) Цитометрия A 69:1–12.
- Duvezin-Caubet S, Jagasia R, Wagener J et al.
