| 1. |
Число протонов и заряд ядра
Сложность: лёгкое |
1 |
| 2. |
Число электронов
Сложность: лёгкое |
1 |
3.
|
Число нейтронов в атоме
Сложность: лёгкое |
1 |
| 4. |
Основные понятия
Сложность: лёгкое |
1 |
5.
|
Сложность: среднее |
2 |
| 6. |
Число нейтронов и электронов в нуклиде
Сложность: среднее |
2 |
7.
|
Состав атома
Сложность: среднее |
2 |
| 8. |
Количество нейтронов
Сложность: сложное |
3 |
9.
|
Определи элемент
Сложность: сложное |
3 |
| 10. |
Молекулярные массы хлоридов
Сложность: сложное |
4 |
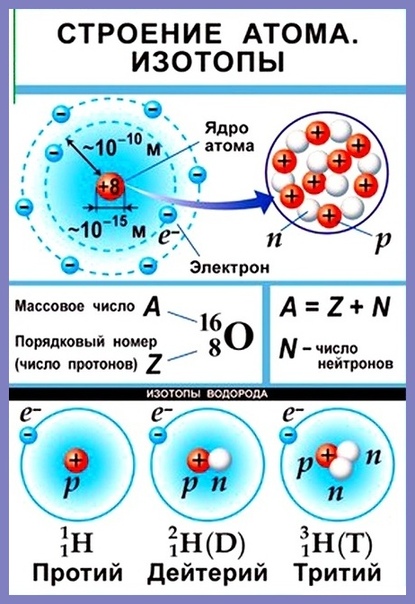
Состав атомного ядра.
 Число протонов — урок. Химия, 8–9 класс.
Число протонов — урок. Химия, 8–9 класс.Предложенная Э. Резерфордом в \(1911\) году ядерная (планетарная) модель строения атома сводится к следующим положениям:
- атом состоит из положительно заряженного ядра и движущихся вокруг него электронов;
- более \(99,96\) % массы атома сосредоточено в его ядре;
- диаметр ядра примерно в сто тысяч раз меньше диаметра самого атома.
Согласно этой модели можно дать следующее определение атома:
Атом — электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов.
Ядро атома состоит из элементарных частиц: протонов и нейтронов. Протоны и нейтроны имеют общее название нуклоны (ядерные частицы).
Протон (\(p\)) — частица, имеющая заряд \(+1\) и относительную массу, равную \(1\).
Нейтрон (\(n\)) — частица без заряда с относительной массой \(1\).
К элементарным частицам относятся также электроны (\(e\)), которые образуют электронную оболочку атома.
Рис. \(1\). Строение атома
Протоны и нейтроны имеют одинаковую массу. Масса электрона составляет 11840 массы протона и нейтрона. Поэтому основная масса атома сосредоточена в его ядре.
Протон имеет положительный заряд \(+1\). Заряд электрона — отрицательный и по величине равен заряду протона: \(–\)\(1\).
Частицы | Обозначения | Относительная масса | Относительный заряд |
| Протон | \(p\) | \(1\) | \(+1\) |
| Нейтрон | \(n\) | \(1\) | \(0\) |
| Электрон | \(e\) | \(1/1840\) | \(–1\) |
Установлено, что число протонов в ядре равно порядковому номеру элемента в Периодической таблице.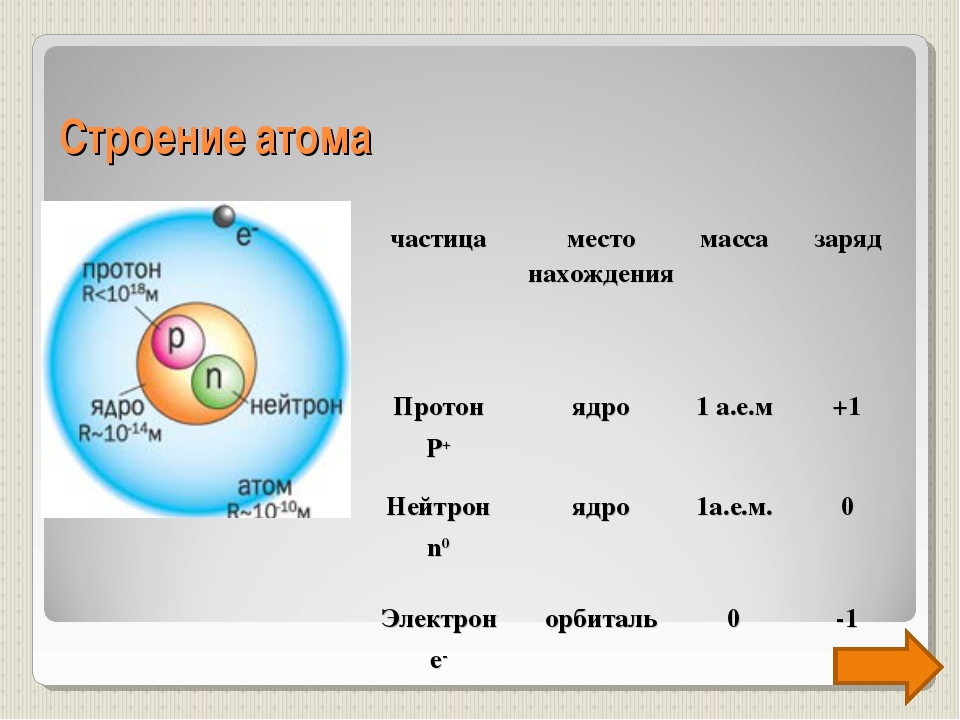
Заряд ядра определяется числом протонов в нём. Значит, заряд ядра тоже равен порядковому номеру элемента.
Атом — электронейтральная частица, поэтому число электронов в нём равно числу протонов.
Обрати внимание!
Порядковый номер элемента \(=\) заряд ядра атома \(=\) число протонов в ядре \(=\) число электронов в атоме.
Водород — элемент № \(1\). Заряд ядра его атома равен \(+1\). В ядре находится один протон, а в электронной оболочке — один электрон.
Углерод — элемент № \(6\). Заряд ядра его атома равен \(+6\), в нём — \(6\) протонов. В атоме содержится \(6\) электронов с общим зарядом \(–\)\(6\).
Обрати внимание!
Заряд ядра — главная характеристика атома.
Изучение строения атомных ядер привело к уточнению формулировки периодического закона. Современная формулировка звучит следующим образом:
Современная формулировка звучит следующим образом:
cвойства химических элементов и образуемых ими простых и сложных веществ находятся в периодической зависимости от величин зарядов ядер их атомов.
Источники:
Рис. 1. Строение атома © ЯКласс
Основные сведения о строении атома. состав атомных ядер
«Химия – это область чудес, в ней скрыто счастье человечества, величайшие завоевания разума будут сделаны именно в этой области».
А.М. Горький
Наиболее точную и полную модель строения атома предложил Эрнест Резерфорд, хотя понятие «атом» было известно еще в античном мире. Свою модель строения атома ученый назвал планетарной, потому что атом как крошечная Солнечная система, в центре которого ядро, а вокруг ядра вращаются электроны.
Крошечное
ядро состоит из элементарных частиц – протонов и нейтронов. Рассмотрим
таблицу, в которой указан символ этой частицы, её масса и заряд.
Рассмотрим
таблицу, в которой указан символ этой частицы, её масса и заряд.
Состав ядра
Из таблицы видно, что протон имеет заряд +1, масса протона равна 1, как и у водорода, поэтому он имеет символ р (пэ). Нейтроны тоже имеют массу равную 1, не имеют заряда, он равен 0 и обозначаются буквой n (эн). Электроны обозначаются буквой е, заряд их равен —1, т.к. масса их ничтожна мала, то ей можно пренебречь.
Сумма чисел протонов и нейтронов называется массовым числом и обозначается буквой А, которая численно равна относительной атомной массе, округленной до целого значения.
Для
того чтобы определить число протонов и электронов, достаточно знать
порядковый номер элемента. Например, у атома фосфора порядковый
номер 15, значит у него 15 протонов в ядре, 15 электронов в
атоме.
Для нахождения числа нейтронов можно использовать следующую формулу:
N = A – Z
т.к. A = Z + N, где N – число нейтронов, а Z – число протонов.
Несмотря на то, что атом очень малы, швейцарские учёные Биннинг и Рорер с помощью сканирующего микроскопа смогли увидеть реальные молекулы и атомы, в последствие им дали Нобелевскую премию за это достижение. Сканирующие микроскопы могут увеличивать объект в 100 млн. раз, т.е. позволяет увидеть частицы размером всего 10-9 м. Такие частицы называются наночастицами.
Разработка урока по теме «Строение атома. Состав атомных ядер. Изотопы» 8 класс
Разработка урока для 8 класса
Строение атома.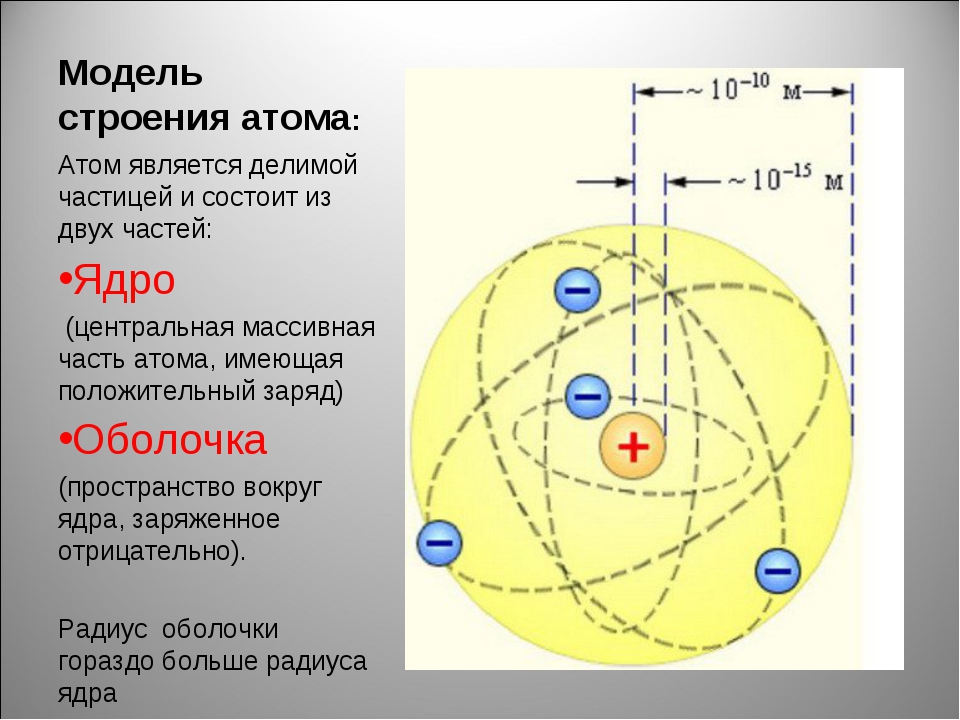 Состав атомных ядер. Изотопы.
Состав атомных ядер. Изотопы.
Цели:
— Сформировать представление об атоме и атомном ядре;
— Научить пользоваться Периодической системой химических элементов Менделеева для определения состава атома
Задачи:
Образовательные: показать, что этимологическое начало понятия атом («неделимый») не соответствует действительности — атом делим. Дать понятие о составе атома и атомного ядра, изотопов.
Развивающие: Расширить кругозор учащихся, создать условия для дальнейшего развития общеучебных умений (анализировать, сравнивать, делать выводы). Способствовать развитию монологической речи учащихся.
Воспитательные: Вызвать устойчивый интерес к изучаемой теме, мотивировать учебную деятельность учащихся; воспитание культуры умственного труда;
Тип урока: комбинированный.
Метод обучения: словесно-логические (объяснение, эвристическая беседа), наглядные (презентация), практические (работа по карточкам – заданиям, по таблице).
Оборудование: таблица «Периодическая система химических элементов Д.И. Менделеева», карточки-задания для проверки знаний учащихся, компьютер.
Эпиграф к уроку: «Как рыба об лед, испокон веков билась мысль мудрецов в своём стремлении к единству во всем, то есть в искании начала всех начал».
Д. И. Менделеев.
Ход урока
1. Организационный момент. Настроить учащихся на урок. Здравствуйте ребята, садитесь. Надеюсь на сотрудничество и плодотворную работу на сегодняшнем уроке химии.
Озвучить эпиграф. Пояснить связь с темой урока.
2. Проверка усвоения изученного материала.
Давайте проверим домашнее задание. Что мы изучали на прощлом уроке? (строение пер. таблицы)
Устный опрос
1. Рассказать о строении периодической таблицы хим. элементов.
2. Дайте определение периода. Какие бывают периоды? Сколько всего периодов?
3. Дайте определение группы. Как делятся группы? Сколько всего групп? Подгрупп?
Дайте определение группы. Как делятся группы? Сколько всего групп? Подгрупп?
4. Что же такое периодическая система хим. элементов?
Химический диктант. (письменно в тетрадях)
Я буду называть адрес элемента, а вы определяете по периодической таблице что это за элемент.
1) 2 период, 5 группа главная подгруппа
2) 3 период, 2 группа главная подгруппа
3) 2 период, 6 группа главная подгруппа
4) 5 период, 2 группа побочная подгруппа
5) 4 период, 6 группа побочная подгруппа
Правильные ответы: 1) азот; 2) магний; 3) кислород; 4) кадмий;
5) хром.
Обменяйтесь тетрадями и проверьте правильность ответов. Правильно – знак «+», неправильно «-». Ответы на слайде.
3. Самоопределение к деятельности (целеполагание)
Ребята! Прежде, чем перейти к изучению новой темы, давайте вернемся к первым урокам, когда мы начали изучать химию. Вы можете дать определения следующим понятиям?
Химия – это … (это наука о веществах, их свойствах и превращениях)
Физическое тело – это… (это все то, что нас окружает)
Вещество – это…(это то, из чего состоит физическое тело)
Из чего состоит большая часть веществ? (из молекул)
А молекулы – это наименьшие частицы вещкств?
А чем образованы молекулы? (атомами)
А что входит в состав атома?
А сколько частиц содержится в атоме и какими характеристиками они обладают?
Решению этого вопроса мы и посвятим наш урок. Попробуйте сформулировать тему урока.
Попробуйте сформулировать тему урока.
И так тема урока: «Строение атомов. Состав атомных ядер. Изотопы»
(открываем тетради, записываем тему урока).
Вопрос классу: Как выдумаете, исходя из темы урока, каковы цели урока?
4. Учебно-познавательная деятельность (изучение нового содержания)
Любой химический элемент может существовать в трех формах:
Cвободные атомы
Простое вещество
Сложное вещество
Рассмотрим форму существования в виде свободных атомов и их строение.
Давайте вначале немного познакомимся с историей открытия атома. Об этом нам расскажет Семенюта Кирилл.
Рассказ ученика:
История открытия атома
Впервые понятие «атом» ввел Демокрит, но он не вкладывал в него глубокий смысл.
В основе философии Демокрита лежит учение об атомах и пустоте как двух принципах, порождающих многообразие космоса. Атом есть мельчайшее «неделимое» тело, не подверженное никаким изменениям. Демокрит считал, что атомы, как семена растений. Одни круглые, другие – пирамидальные, плоские, треугольные. Поэтому и состоящий из них мир неисчерпаемо богат в своих свойствах и качествах. Демокрит считал, что, цепляясь друг за друга « крючочками», атомы образуют твердые вещества.
Атом есть мельчайшее «неделимое» тело, не подверженное никаким изменениям. Демокрит считал, что атомы, как семена растений. Одни круглые, другие – пирамидальные, плоские, треугольные. Поэтому и состоящий из них мир неисчерпаемо богат в своих свойствах и качествах. Демокрит считал, что, цепляясь друг за друга « крючочками», атомы образуют твердые вещества.
В настоящее время ученые выяснили, что атом состоит из еще более меньших частиц. В 1896 году французский ученый Антуан Анри Беккерель открывает явление самопроизвольного деления атома, которое было названо радиоактивностью. Это явилось доказательством делимости атома.
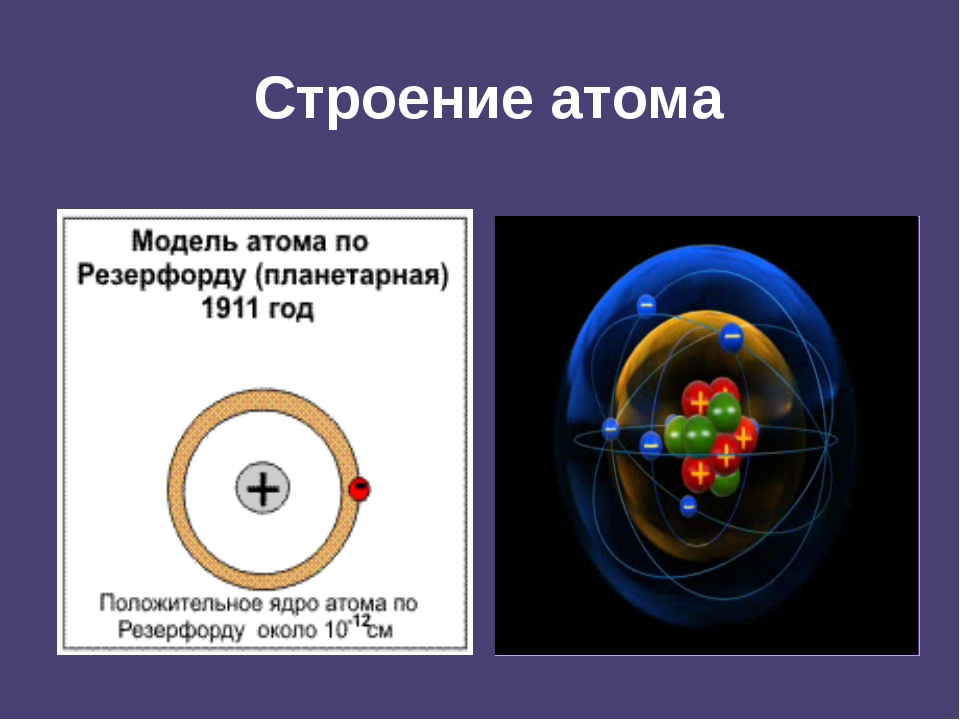
В 1901 году физик Жан Батист Перрен предлагает первую модель строения атома, в соответствии с которой в центре атома находится массивное положительно заряженное ядро, вокруг которого движутся отрицательно заряженные электроны.
В 1911 году английский ученый Эрнест Резефорд предложил уточненную «планетарную» модель строения атома, в которой атом любого химического элемента представляет собой крохотную солнечную систему с ядром-солнцем по центру и электронами-планетами, вращающимися по орбитам вокруг ядра.
В 1913 году английский ученый Генри Мозли доказал, что порядковый (атомный) номер химического элемента численно равен заряду ядра его атома. То есть химический элемент – это вид атомов с одинаковым зарядом ядра.
Учитель: Модель Резерфорда считается наиболее точной, отражающей строение атома. А почему ее назвали планетарной?
Далее учащиеся самостоятельно разбирают строение атома.
Учебник стр. 182.
Задание классу: Ребята, в учебнике на стр.182 прочитайте описание строения атома до п. «Изотопы». Попробуйте составить кластер «Строение атома». Поработайте парами.
Кластер
Атом
Ядро + Электроны
e—
Протоны Нейтроны
P+ n0
Далее провести проверку и анализ усвоения материала учащимися. (один ученик записывает полученную схему на доске, остальные проверяют и записывают в тетради).
(один ученик записывает полученную схему на доске, остальные проверяют и записывают в тетради).
Атом состоит из ядра, в котором сосредоточена вся его основная масса, и электронов вне ядра.
Ядро атома состоит из частиц, называемых нуклонами. К нуклонам относятся положительно заряженные протоны и электрически нейтральные нейтроны.
Давайте рассмотрим каждую из частиц, входящих в состав атома, более подробно.
Протоны.
Заряд положительный. Обозначается p+ (пэ-плюс). Число протонов в атоме соответствует порядковому номеру элемента в Периодической системе Дмитрия Ивановича Менделеева.
Нейтроны.
Не несут заряда. Обозначаются n0 (эн-ноль). Число нейтронов в атоме определяется по формуле:
N = A – Z, где A – это сумма чисел протонов и нейтронов в атоме, которая называется массовым числом, N– число нейтронов в ядре, Z – число протонов в ядре, которое, как мы уже знаем, равно порядковому номеру элемента.
Массовое число элемента определяется экспериментально, и численно примерно равно относительной атомной массе элемента, или сумме протонов и нейтронов.
Например, найдем число нейтронов в ядре калия:
N = A – Z, где A равно 39, Z из периодической таблицы равно 19. Отсюда число нейтронов в ядре атома калия равно 39 – 19, то есть 20.
Например, найдем число нейтронов в ядре аргона:
N = A – Z, где A равно 40, Z из периодической таблицы равно 18. Отсюда число нейтронов в ядре атома калия равно 40 – 18, то есть 22.
Электроны.
Заряд отрицательный. Обозначается е— (э-минус). Число электронов равно числу протонов и соответствует порядковому номеру элемента в Периодической системе Дмитрия Ивановича Менделеева.
Например, найдем из периодической системы число электронов и протонов брома: число электронов равно 35 и число протонов также 35;
число электронов и протонов серы: число электронов равно 16 и число протонов также 16.
Подвести итог: Что можно определить по порядковому номеру химического элемента. (составить небольшой кластер)
Рассмотрим физические характеристики элементарных частиц.
Вопрос классу: Если количество протонов и электронов в атоме равное, а по знаку они противоположны, то какой заряд в атоме в целом?
( нейтральный).
Таким образом, мы можем определить строение атома любого химического элемента по положению в периодической системе Дмитрия Ивановича Менделеева.
Закрепление материала.
Учащиеся выполняют задания для самоконтроля и самопроверки (Приложение).
Проверить заполнение таблицы: сравнить друг у друга, что получилось.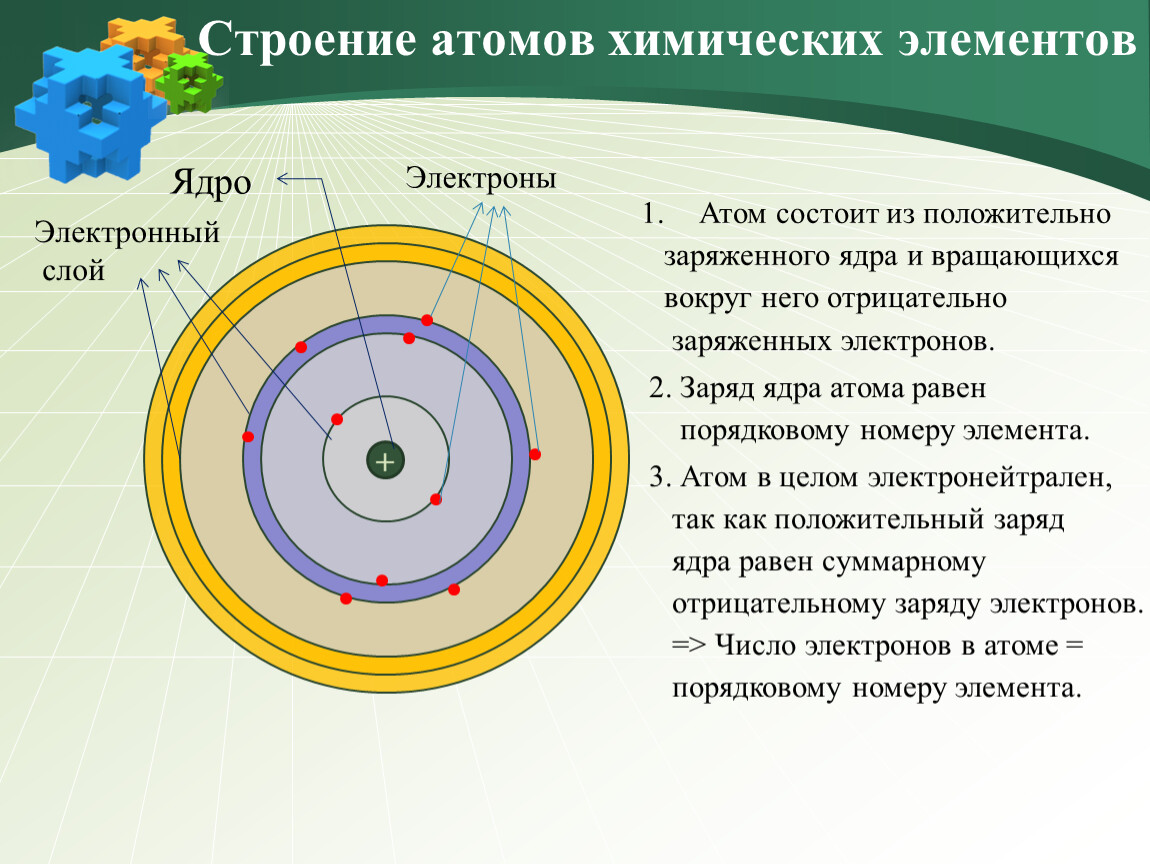
Вопрос классу: Скажите, ребята, вам ничего не показалось странным при заполнении таблицы? ( атом азота различается по массам).
Еще в 20 веке было установлено, что разные атомы одного и того же химического элемента различаются по массам. Например, известны три разновидности атомов водорода с массовыми числами 1, 2 и 3. Но атомы всех этих разновидностей имеют одинаковый заряд ядра, равный +1, а соответственно один электрон и один протон.
Разновидности атомов одного и того же химического элемента, имеющие одинаковый заряд ядра, но разное массовое число, называются изотопами.
На самом деле химический элемент представляет собой смесь изотопов.
Например, химический элемент хлор состоит из двух изотопов с массовыми числами 35 и 37; кислород из трех изотопов с массовыми числами 16, 17 и 18, калий также из трех изотопов с массовыми числами 39, 40, 41.
Приводимые в таблице Дмитрия Ивановича Менделеева относительные атомные массы химических элементов, являются средним значением атомных масс всех изотопов данного химического элемента с учетом их относительного содержания в природе.
Радиоактивные изотопы широко применяются в научных исследованиях, медицине, биологии и химии. Например, аппарат МРТ. Магниторезонансная томография (МРТ) —
способ получения томографических медицинских изображений для исследования внутренних органов и тканей человека.
В настоящее время изобретены сканирующие микроскопы, позволяющие увеличить объекты материального мира в 100 миллионов раз и увидеть атомы, а так же производить различные манипуляции с ними. Этот вид человеческой деятельности называется нанотехнологии, и в настоящее время активно развивается по всему миру.
5. Выводы по уроку:
Мы сегодня узнали важную информацию об атоме и его строении. Давайте подведем итог:
Давайте подведем итог:
1. Атом – это
2. Ядро состоит …
3. Протоны — это
4. Электроны — это
5. Нейтроны – это
6. По порядковому номеру можно определить –
7. Химический элемент – это
Скажите, ребята, атомы разных химических элементов имеют одинаковое строение или разное? Как вы думаете, это на что – то влияет? (на свойства)
Это основная проблема нашего урока, которую мы решили. Строение атома влияет на свойства химических элементов.
В настоящее время определение понятия «атом» звучит так:
Атом – наименьшая частица химического элемента, являющаяся носителем его свойств.
А вот как и на какие свойства влияет строение атома мы будем изучать в дальнейшем курсе химии.
6. Итог урока.
Завершить урок я хочу строками стихотворения Сергея Щипачева:
Нам каждый день природа дарит
Прикосновенье к алтарю.
За жизнь – космический подарок –
Тебя, Земля, благодарю.
Круговращение планеты,
Прикосновение стихий.
Все – север, юг, зима и лето,
Дорога, труд, любовь, стихи,
Сплетение души и мысли,
Провалы, взлеты вверх и вниз…
Какой же смысл – в исканье смысла?
Процесс познанья – в этом смысл.
7. Домашнее задание: § 52, подготовить сообщения по темам: «Изотопы водорода», «Что такое тяжелая вода?»
Приложение
Задания для самоконтроля и самопроверки.
Задание №1. ( оценка «3»)
Пользуясь периодической таблицей, запиши символ химического элемента, в атоме которого содержится:
А) 33 протона_____ б) 100 протонов_____ в) 10 протонов_____
Г) 2 электрона_____ д) 18 электронов______ е) 50 электронов______
Задание №2. (оценка «4», если выполнено задание №1 и №2)
Запиши обозначения элементарных частиц, имеющих:
А) одинаковую массу______________
Б) одинаковый по значению, но противоположный по знаку заряд_________________
Задание №3 (оценка «5»)
Заполни таблицу:
Вариант 1
2
7
15
3
9
Вариант 2
2
7
15
3
9
Химия.
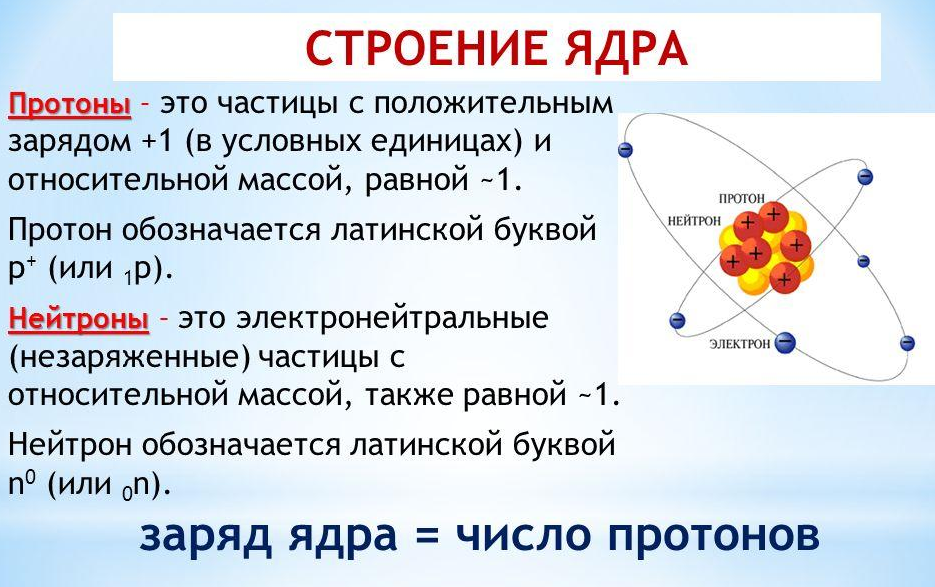 8 класс. Строение атомов – МКОУ средняя общеобразовательная школа д.Васькино
8 класс. Строение атомов – МКОУ средняя общеобразовательная школа д.ВаськиноРазработка урока химии в 8 классе по теме «Строение атомов» по программе О.С. Габриеляна.
Содержание: Атомы как форма существования химических элементов. Основные сведения о строении атомов. Доказательства сложности строения атомов. Опыты Резерфорда. Планетарная модель строения атома. Состав атомных ядер: протоны, нейтроны. Относительная атомная масса. Взаимосвязь понятий «протон», «нейтрон», «относительная атомная масса».
Задачи урока: организовать деятельность учащихся по изучению и первичному закреплению состава и строения атомов химических элементов;
обеспечить понимание сложности вопроса строения атома;
создать условия для развития у школьников представлений об исторической эволюции понятий.
Оборудование: персональный компьютер, мультимедийный проектор, экран.
Лабораторная работа “Анализ содержимого “черного ящика”.
План урока:
1. Постановка цели и задач урока, составление плана работы.
2. Актуализация знаний учащихся:
а) что изучает химия?
б) что называют химической реакцией?
в) перечислите формы существования химического элемента.
г) дайте определение понятия «атом».
3. Изучение нового материала.
Выдающийся физик современности, лауреат Нобелевской премии Роберт Фейнман говорил: «Если бы в результате какой-то мировой катастрофы все накопленные знания вдруг оказались уничтоженными, и к грядущим поколениям живых существ перешла только одна фраза, то какое утверждение, составленное из наименьшего количества слов, принесло бы наибольшую информацию? Я считаю, что это атомная гипотеза: все тела состоят из атомов – маленьких телец, которые находятся в беспрерывном движении, притягиваются на небольшом расстоянии, но отталкиваются, если одно из них плотнее прижать к другому».
Почему утверждение об атомном строении веществ так высоко оценено? Попробуем ответить на этот вопрос.
Вспомним, что понятие «атом» впервые появилось в работах древнегреческих философов Демокрита и Левкипта. Под атомом они понимали мельчайшую частицу вещества (atomos – неделемый). К атомной гипотезе они пришли только на основании размышлений, т.к. в то время люди не владели современными физическими методами исследования.
Если считать атом неделимой частицей, тогда невозможно объяснить образование химических связей в веществах. В ходе химических реакций атомы элементов не изменяются. Сущность химической реакции заключается в разрыве связей в исходных веществах и образовании связей в продуктах реакции. Как атомы соединяются в молекулы? Ответить на этот вопрос можно только в том случае, если изучим строение атомов.
Лабораторная работа “Анализ содержимого “черного ящика”.
Группам учащихся выдаются закрытые “черные ящики”, содержащие некоторую геометрическое тело.
Задание: определить какое тело находится в ящике, его размеры, цвет.
Данная работа показывает сложность познания строения атома.
Предположение о сложном строении атома было высказано на основании результатов нескольких экспериментов. В первую очередь это открытие электрона – частицы, которая переносит электрический ток. Масса электрона оказалась в 1840 раз меньше массы самого легкого атома – атома водорода. Исследования показали, что электрон несет на себе электрический заряд (–1,6∙10–19 Кл), который принят за единицу (–1), т.к. является наименьшим отрицательным зарядом. Условное обозначение электрона .
Следующим шагом в познании атома стало открытие явления радиоактивности. Анри Беккерель обнаружил, что соли урана излучают невидимые лучи, которые вызывают засвечивание фотопластинки. Позднее были установлены три вида радиоактивных лучей. a–лучи представляют собой частицы, масса которых в 4 раза больше массы атома водорода и несущие положительный заряд (+2). b–лучи представляют собой поток электронов, а g–лучи –коротковолновое электромагнитное излучение.
В 1911 году английский физик Эрнест Резерфорд проводил опыты с a–лучами. Он направил поток a–частиц на очень тонкую золотую фольгу, за которой поместил экран. Было установлено, что большая часть a–частиц проходила через фольгу, не изменяя своего направления движения, т.е. не встречая на своем пути препятствий. Но небольшая доля a–частиц отклонялась от прямолинейного пути на различные углы. Самым интересным оказалось то, что приблизительно одна из 10000 a–частиц отскакивала от металлической фольги обратно почти под углом 180°.
Он направил поток a–частиц на очень тонкую золотую фольгу, за которой поместил экран. Было установлено, что большая часть a–частиц проходила через фольгу, не изменяя своего направления движения, т.е. не встречая на своем пути препятствий. Но небольшая доля a–частиц отклонялась от прямолинейного пути на различные углы. Самым интересным оказалось то, что приблизительно одна из 10000 a–частиц отскакивала от металлической фольги обратно почти под углом 180°.
Какие выводы сделал Резерфорд? Он предположил, что в атомах большая часть «пустая», а отлетающие обратно a–частицы встречают на своем пути «сгусток» положительно зараженной массы. Этот сгусток был назван ядром атома.
Проанализировав результаты проведенных экспериментов, Резерфорд сделал ряд выводов, которые составили основу планетарной модели строения атома. В центре атома находится положительно заряженное ядро, которое имеет достаточно малые размеры, но в нем заключена почти вся масса, приходящаяся на атом. Вокруг ядра по круговым орбитам двигаются отрицательно заряженные электроны, подобно планетам вокруг Солнца.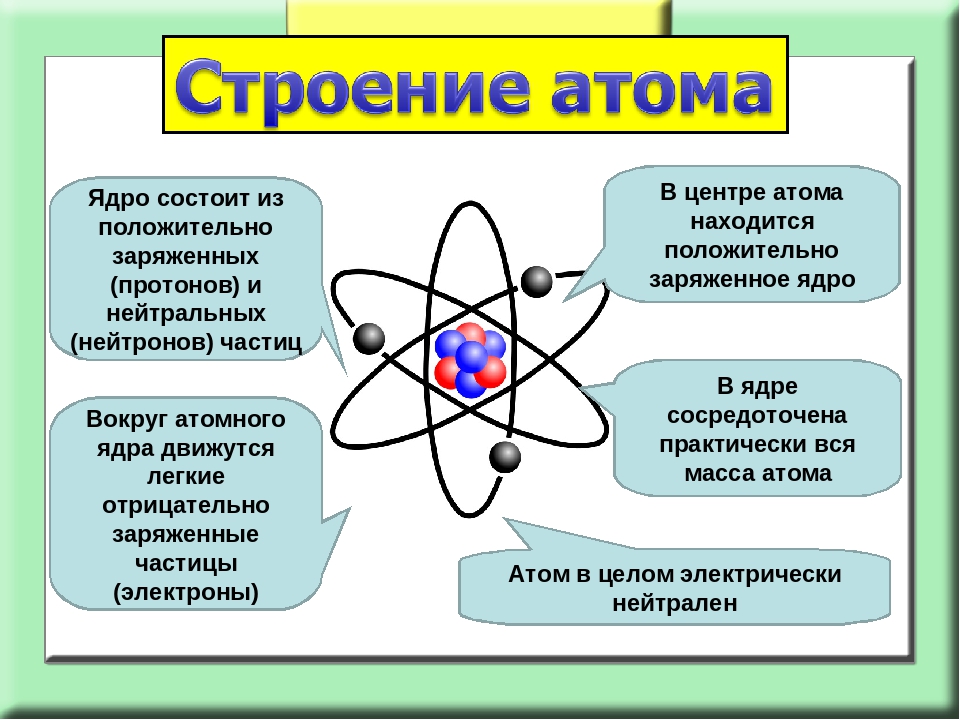
Ядро – внутренняя часть атома, имеет положительный заряд и весьма малый объем, но невероятно высокую плотность вещества: 1014–1015 г/см3 (в 1 см3 ~ 100 млн т). Электроны образуют электронную оболочку, которая определяет размеры атома, имеет отрицательный заряд.
Позднее было установлено, что ядро атома состоит из частиц двух видов – протонов ( или р+) и нейтронов ( или n°). Массы этих частиц почти одинаковы, но протон несет на себе единичный положительный заряд, а нейтрон не имеет заряда.
Протоны, нейтроны и электроны определяют важнейшие свойства атома: массу, заряд ядра и заряд электронной оболочки. Масса атома имеет очень маленькое значение. Например, масса атома водорода равна 1,674∙10–24 г, атома кислорода – 2,667∙10–23 г. Принято использовать не абсолютные, а относительные атомные массы, показывающие сколько единиц массы содержит данный атом. В качестве атомной единицы массы (а.е.м.) была выбрана 1/12 массы атома углерода, в ядре которого содержится 6 протонов и 6 нейтронов.
В качестве атомной единицы массы (а.е.м.) была выбрана 1/12 массы атома углерода, в ядре которого содержится 6 протонов и 6 нейтронов.
1 а.е.м. = 1,661∙10–24 г
Наряду с относительной атомной массой используют так называемое массовое число (А) – сумму протонов и нейтронов, входящих в состав ядра атома.
Заряд ядра (зарядовое число) обозначается Z. Величина заряда ядра равна числу протонов в атоме. Заряд электронной оболочки равен числу электронов.
Массовое и зарядовое числа используют при обозначении атома: . Например, обозначение говорит о том, что масса атома водорода равна 1, а ядро имеет заряд +1.
Как определить состав атома? Оказалось, что число протонов в ядре атома равно порядковому (атомному) номеру химического элемента в Периодической системе. Так как атом электронейтрален (не имеет заряда), то число протонов равно числу электронов. Число нейтронов равно разности между массой атома и порядковым номером химического элемента в Периодической системе. Например, определим состав и характеристики атома кислорода : 6р+, 6n0, 6е–; Z(ядра) = + 6, Z(эл.об.) = – 6.
Например, определим состав и характеристики атома кислорода : 6р+, 6n0, 6е–; Z(ядра) = + 6, Z(эл.об.) = – 6.
Обобщим полученные сведения о частицах, входящих в состав атома:
Название частиц | |||
протоны | нейтроны | электроны | |
| обозначение | р+ | n0 | е– |
| масса | 1 | 1 | 0 |
| заряд | +1 | 0 | –1 |
число протонов равно порядковому номеру элемента. | число нейтронов находят по формуле: N=A–Z | число электронов равно порядковому номеру элемента | |
4. Закрепление изученного на уроке. Коррекция знаний учащихся.
5. Итоги урока.
.pdf (1 130 КБ)
Строение ядра атома, схема и примеры
Общие сведения о строении ядра атома
По величине заряда ядра атома определяют химический элемент, к которому этот атом относится.
Существование атомного ядра было доказано в 1911 году Э. Резерфордом и описано в труде под названием «Рассеяние α и β-лучей и строение атома». После этого разными учеными выдвигались многочисленные теории строения атомного ядра (капельная (Н. Бор), оболочечная, кластерная, оптическая и т.д.).
Электронное строение ядра атома
Согласно современным представлениям атомное ядро состоит из положительно заряженных протонов и нейтральных нейтронов, которые вместе называют нуклонами. Они удерживаются в ядре за счет сильного взаимодействия.
Они удерживаются в ядре за счет сильного взаимодействия.
Число протонов в ядре называют зарядовым числом (Z). Его можно определить при помощи Периодической таблицы Д. И. Менделеева – оно равно порядковому номеру химического элемента, к которому относится атом.
Число нейтронов в ядре называют изотопическим числом (N). Суммарное количество нуклонов в ядре называют массовым числом (M) и оно равно относительной атомной массе атома химического элемента, указанной в Периодической таблице Д. И. Менделеева.
Ядра с одинаковым числом нейтронов, но разным числом протонов называют изотонами. Если же в ядре одинаковое число протонов, но различное нейтронов – изотопами. В случае, когда равны массовые числа, но различный состав нуклонов – изобарами.
Ядро атома может находиться в стабильном (основном) состоянии и в возбужденном.
Рассмотрим строение ядра атома на примере химического элемента кислорода. Кислород имеет порядковый номер 8 в Периодической таблице Д. И. Менделеева и относительную атомную массу 16 а. е.м. Это означает, что ядро атома кислорода имеет заряд равный (+8). В ядре содержится 8 протонов и 8 нейтронов (Z=8, N=8, M=16), а по 2-м орбитам вокруг ядра движутся 8 электронов (рис. 1).
е.м. Это означает, что ядро атома кислорода имеет заряд равный (+8). В ядре содержится 8 протонов и 8 нейтронов (Z=8, N=8, M=16), а по 2-м орбитам вокруг ядра движутся 8 электронов (рис. 1).
Рис. 1. Схематичное изображение строения атома кислорода.
Примеры решения задач
Урок «Строение атома. Опыт Резерфорда», (физика, 8 класс)
Урок физики 8 класс
Строение атома. Опыт Резерфорда
Подготовила и провела
учитель физики МОУ «Луховский лицей»
Смирнова С.Г.
Цели урока: обеспечить усвоение учащимися знаний о строении атома и атомного ядра; дать представление о научных экспериментах, которые привели к построению планетарной модели атома; учить применять полученные знания на практике: научить пользоваться периодической системой химических элементов Менделеева для определения состава атома; реализовать межпредметные связи физика- химия; расширить кругозор учащихся.
Организационный момент
Фронтальный опрос по пройденной теме, актуализация знаний для изучения нового материала
— Какой физической величиной характеризуют действие одного тела на другое?
— Почему мы считаем, что электрический заряд- физическая величина?
— Как называется единица физического заряда?
— Опишите опыт, иллюстрирующий, что заряд тела можно многократно делить на порции
— Как называется наименьшая порция заряда?
— Может ли существовать заряд без частицы?
— Частица без заряда?
— Чему равен заряд электрона?
— Можно ли «снять» заряд с электрона?
— Перечислите известные вам микрочастицы, имеющие заряд, и не имеющие его
Изучение нового материала
Учитель. После того как был открыт электрон, встал вопрос: где искать электроны. Где было бы естественным их искать?
Ученики: может быть, в атомах?
Учитель. Это верное предположение. И эпиграфом к нашему уроку я взяла слова:
И эпиграфом к нашему уроку я взяла слова:
Еще, быть может, каждый атом-
Вселенная, где сто планет,
Там все, что есть, в объеме сжатом,
Но также то, чего здесь нет
Разные ученые предложили разные модели строения атома. Рассмотрим модель Томсона (слайд с диска «Физика -9», урок «Строение атома»)
Модель Томсона. Отрицательный заряд равно распределен внутри положительного атома. Электроны- изюмины в кексе
Проверить правильность этой модели взялся Э. Резерфорд. Он догадался, что атом каким-то образом нужно «разбить», чтобы заглянуть внутрь. Как вы думаете, возможно ли это? (выслушиваются предложения учащихся)
Учитель. Если через атомы пролетают очень маленькие, сравнимые по размерам с самими атомами, заряженные частицы, то по их движению можно судить о строении атома. Встал вопрос: чем обстрелять атом? (выслушиваются предложения учащихся)
Учитель. Оказалось, что есть вещества (уран, радий и др.), из которых непрерывно вылетают положительные частицы, масса которых очень мала, а скорость велика, 15000 км/с. Расстояние от Земли до Луны они пролетели бы за 25 сек. Но как заметить альфа-частицу? Воспользовались экраном, покрытым особым составом, который светился, когда на него попадали частицы. Каждая частица, попавшая на экран, создавала на нем маленькую вспышку (частицы можно было обнаружить и сосчитать)
Расстояние от Земли до Луны они пролетели бы за 25 сек. Но как заметить альфа-частицу? Воспользовались экраном, покрытым особым составом, который светился, когда на него попадали частицы. Каждая частица, попавшая на экран, создавала на нем маленькую вспышку (частицы можно было обнаружить и сосчитать)
Затем перед экраном была поставлена тончайшая золотая фольга толщиной 0,001 мкм (3300 слоев атомов золота)
Результаты опыта Резерфорда
Учитель. 1-й результат: почти все альфа-частицы пролетели через все 3300 слоев атомов золота так, как будто на их пути ничего не было. Как бы вы объяснили этот результат?
Учащиеся в ходе рассуждений находят ответ: в атоме есть пустоты, не заполненные частицами вещества
Учитель. Как велики эти пустоты?
Учащиеся доходят до верного ответа, что пустоты составляют значительную часть атома, иначе альфа-частицы не пролетели бы прямо сквозь пластину, а разбрасывались бы в разные стороны.
Учитель. 2-й результат: небольшая часть частиц отклонилась от своего пути, когда частицы прошли сквозь пластину. Как бы вы объяснили этот результат?
Учащиеся. Те частицы, которые отклонились, очевидно прошли около каких-то заряженных тел, но далеко от них, т.к. притяжение или отталкивание было не очень сильным
Учитель. Верно,молодцы.3-й результат: несколько альфа-частиц отклонились на большой угол, а некоторые из них (33 из 150000) были отброшены назад. Как бы вы объяснили этот результат?
Учащиеся. Эти частицы налетели на другую частицу, которая ее оттолкнула
Учитель: Как была заряжена та частица?
Ученик. Если оттолкнула, значит была заряжена так же как и альфа- частица, т.е. положительно
Учитель. При взаимодействии двух тел какое из них больше изменит скорость?
Ученик. То, у которого масса меньше, следовательно, масса альфа-частицы меньше массы той, которой она была отброшена.
Учитель. Молодцы. Вы сделали правильные выводы из результатов опыта Резерфорда.
Молодцы. Вы сделали правильные выводы из результатов опыта Резерфорда.
Итак, опыт Резерфорда показал, что внутри атома имеются положительно заряженная частица- ядро. Именно от ядра и оттолкнулись те немногие частицы, которые пролетали вблизи от него. На большом расстоянии от ядра в атоме находятся отрицательно заряженные частицы- электроны. Они притягиваются, но не приближаются вплотную к ядру, потому что вращаются вокруг него
Закрепление и углубление изученного материала. Составляется таблица строения атома, учащиеся зарисовывают в тетрадь
Строение атома (планетарная модель по Резерфорду) | ||
ядро(99,98% массы атома) | оболочка атома ( R=0, 00000001см) | |
протоны | нейтроны | электроны (0,02% от массы атома) |
Работа с таблицей Д.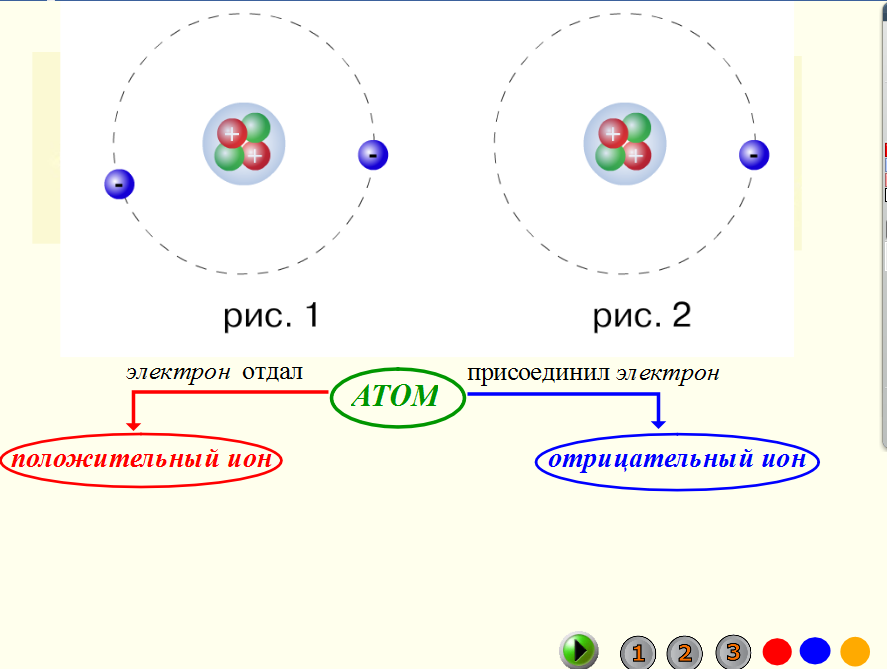 И. Менделеева
И. Менделеева
Учитель. Пользуясь таблицей Д.И. Менделеева, научимся определять строение атома любого химического элемента
Число протонов в ядре равно порядковому номеру элемента, для бора 5
Массовое число, округленное до целых, определяет число всех частиц в ядре (протонов и нейтронов), 10, 811= 11
11-5=6-число нейтронов в ядре
В нейтральном атоме электронов вращается вокруг ядра столько, сколько в ядре протонов, для атома бора 5
Тестовые задания
- Заряд ядра атома азота равен:
а) 7 б) 13 в) 4 г) 29 д) 11 - Число протонов в ядре атома криптона:
а) 36 б) 17 в) 4 г) 31 д) 6 - Число нейтронов в ядре атома цинка:
а) 8 б) 35 в)11 г)30 д)4 - Число электронов в атоме железа:
а) 11 б)8 в)56 г)26 д)30
Поменяйтесь заданиями с соседом по парте, проверим ответы:
- Заряд ядра атома азота равен:
а) 7 б) 13 в) 4 г) 29 д) 11 - Число протонов в ядре атома криптона:
а) 36 б) 17 в) 4 г) 31 д) 6 - Число нейтронов в ядре атома цинка:
а) 8 б) 35 в)11 г)30 д)4 - Число электронов в атоме железа:
а) 11 б)8 в)56 г)26 д)30
Это интересно!
1)m (атома) =m (ядра)- вся масса атома сосредоточена в ядре!
2) (атома) \ r (ядра) = 100000- сплошная пустота!
3) Если все частицы, из которых вы состоите, сложить вплотную, то вы уменьшитесь в 100000 раз, и под микроскопом вас не будет видно. А масса- те же 50 кг!. Вот это кроха!. Но самое потрясающее то, что объекты с такой чудовищной плотностью нашлись в природе. Не на Земле, не в солнечной системе. Это нейтронные звезды, расположенные в разных местах Вселенной. Они состоят из одних ядер, уложенных вплотную.
А масса- те же 50 кг!. Вот это кроха!. Но самое потрясающее то, что объекты с такой чудовищной плотностью нашлись в природе. Не на Земле, не в солнечной системе. Это нейтронные звезды, расположенные в разных местах Вселенной. Они состоят из одних ядер, уложенных вплотную.
4)Чайная ложка вещества нейтронной звезды весит 100 млрд тонн!
5)Если бы плотность Земли уменьшилась до плотности нейтронной звезды, то в поперечнике осталось бы не более 100 метров
6)Поперек ногтя мизинца могло бы уместиться 100000000 атомов
4.Подведение итогов урока
5. Задание на дом: п. 29, нарисовать схему строения атомов лития, бериллия
21.1 Ядерная структура и стабильность – химия
Цели обучения
К концу этого раздела вы сможете:
- Описать структуру ядра с точки зрения протонов, нейтронов и электронов
- Расчет дефекта массы и энергии связи для ядер
- Объяснить тенденции относительной стабильности ядер
Ядерная химия — это изучение реакций, включающих изменения в ядерной структуре. {14}\text{C}[/latex] называется «углерод-14».
{14}\text{C}[/latex] называется «углерод-14».
Протоны и нейтроны, вместе называемые нуклонами , плотно упакованы в ядре. Имея радиус около 10 −15 метра, ядро довольно мало по сравнению с радиусом всего атома, который составляет около 10 −10 метра. Ядра чрезвычайно плотные по сравнению с объемным веществом, в среднем 1,8 × 10 14 грамма на кубический сантиметр. Например, вода имеет плотность 1 грамм на кубический сантиметр, а иридий, один из самых плотных известных элементов, имеет плотность 22.6 г/см 3 . Если бы плотность Земли была равна средней плотности ядер, радиус Земли был бы всего около 200 метров (фактический радиус Земли составляет примерно 6,4 × 10 6 метра, в 30 000 раз больше). Пример 1 демонстрирует, насколько велика может быть плотность ядер в естественном мире.
Пример 1
Плотность нейтронной звезды
Нейтронные звезды образуются, когда ядро очень массивной звезды подвергается гравитационному коллапсу, в результате чего внешние слои звезды взрываются сверхновой. Почти полностью состоящие из нейтронов, они являются самыми плотными из известных звезд во Вселенной, их плотность сравнима со средней плотностью атомного ядра. Нейтронная звезда в далекой галактике имеет массу, равную 2,4 массы Солнца (1 масса Солнца = [латекс]\text{M}_\odot[/латекс] = масса Солнца = 1,99 × 10 30 кг) и диаметр 26 км.
Почти полностью состоящие из нейтронов, они являются самыми плотными из известных звезд во Вселенной, их плотность сравнима со средней плотностью атомного ядра. Нейтронная звезда в далекой галактике имеет массу, равную 2,4 массы Солнца (1 масса Солнца = [латекс]\text{M}_\odot[/латекс] = масса Солнца = 1,99 × 10 30 кг) и диаметр 26 км.
(а) Какова плотность этой нейтронной звезды?
(b) Как плотность этой нейтронной звезды соотносится с плотностью ядра урана, имеющего диаметр около 15 фм (1 фм = 10 –15 м)?
Решение
Мы можем рассматривать как нейтронную звезду, так и ядро U-235 как сферы.3[/латекс]
Эти значения довольно близки (одинаковый порядок величины), но ядро более чем в два раза плотнее нейтронной звезды.
Проверьте свои знания
Найдите плотность нейтронной звезды с массой 1,97 солнечной массы и диаметром 13 км и сравните ее с плотностью ядра водорода, имеющего диаметр 1,75 фм (1 фм = 1 × 10 –15 м).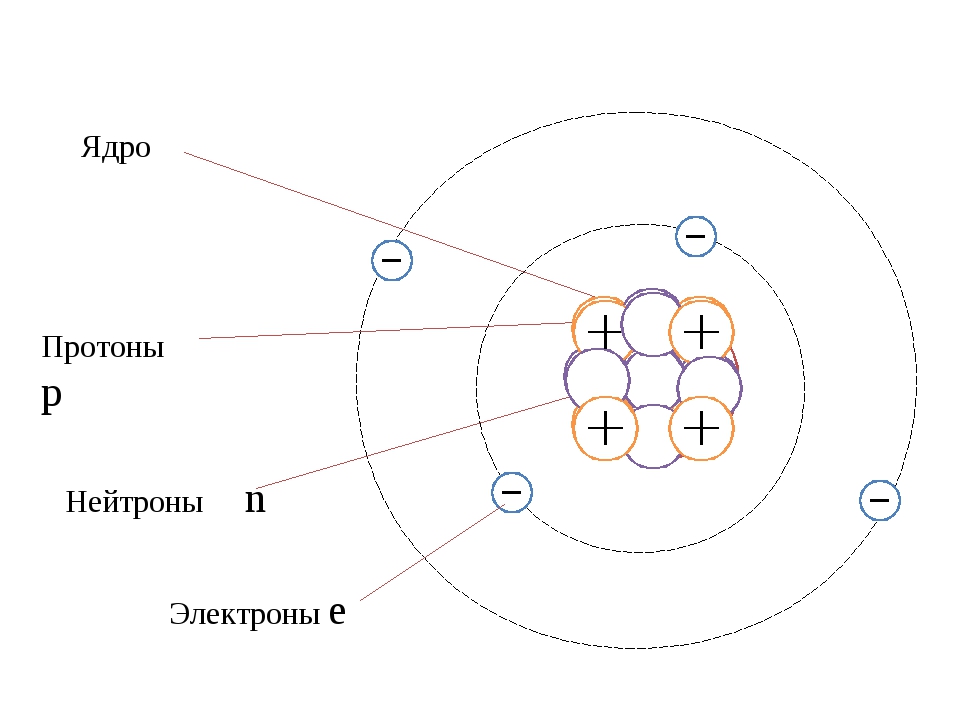
Ответ:
Плотность нейтронной звезды составляет 3,4 × 10 18 кг/м 3 .Плотность ядра водорода 6,0 × 10 17 кг/м 3 . Нейтронная звезда в 5,7 раза плотнее ядра водорода.
Чтобы удерживать положительно заряженные протоны вместе в очень маленьком объеме ядра, требуются очень сильные силы притяжения, потому что положительно заряженные протоны сильно отталкиваются друг от друга на таких коротких расстояниях. Сила притяжения, удерживающая ядро вместе, представляет собой сильное ядерное взаимодействие . (Сильное взаимодействие — это одно из четырех известных фундаментальных взаимодействий.Другими являются электромагнитная сила, гравитационная сила и слабое ядерное взаимодействие.) Эта сила действует между протонами, между нейтронами и между протонами и нейтронами. Это сильно отличается от электростатической силы, которая удерживает отрицательно заряженные электроны вокруг положительно заряженного ядра (притяжение между противоположными зарядами). На расстояниях менее 10 −15 метров и внутри ядра сильное ядерное взаимодействие намного сильнее электростатического отталкивания между протонами; на больших расстояниях и вне ядра он практически не существует.
На расстояниях менее 10 −15 метров и внутри ядра сильное ядерное взаимодействие намного сильнее электростатического отталкивания между протонами; на больших расстояниях и вне ядра он практически не существует.
Посетите этот веб-сайт для получения дополнительной информации о четырех фундаментальных силах.
В качестве простого примера энергии, связанной с сильным ядерным взаимодействием, рассмотрим атом гелия, состоящий из двух протонов, двух нейтронов и двух электронов. Общая масса этих шести субатомных частиц может быть рассчитана как:
[латекс]\begin{массив}{ccccccc}(2\;\times\;1.0073\;\text{аму}) & + & (2\;\times\;1.0087\;\text{аму}) & + & (2\;\times\;0.00055\;\text{аму}) & = & 4.Атом 4\text{He}[/latex] составляет 4,0026 а.е.м., что меньше, чем совокупные массы шести составляющих его субатомных частиц. Эта разница между рассчитанной и экспериментально измеренной массой известна как дефект массы атома. В случае гелия дефект массы указывает на «потерю» массы на 4,0331 а. 2[/латекс]
2[/латекс]
, где E — энергия, m — масса преобразуемого вещества, c — скорость света в вакууме.Это уравнение можно использовать для определения количества энергии, которое получается при преобразовании материи в энергию. Используя это уравнение эквивалентности массы и энергии, энергия связи ядра ядра может быть рассчитана по дефекту его массы, как показано в примере 2. Для энергии связи ядра обычно используются различные единицы, включая электрон-вольт (эВ) , где 1 эВ равен количеству энергии, необходимой для перемещения заряда электрона через разность электрических потенциалов в 1 вольт, что делает 1 эВ = 1.Ядро 4\text{He}[/latex] составляет 0,0305 а.е.м., как показано ранее. Определите энергию связи в джоулях на нуклид, используя уравнение эквивалентности массы и энергии. Для размещения требуемых единиц энергии дефект массы должен быть выражен в килограммах (напомним, что 1 Дж = 1 кг·м··2·/с··2·).
(a) Сначала выразите дефект массы в г/моль. Это легко сделать, учитывая числовую эквивалентность атомной массы (а.е.м.) и молярной массы (г/моль), которая следует из определений единиц а.е.м. и молей (см. предыдущее обсуждение в главе об атомах, молекулах и ионы при необходимости).{19}\text{F}[/latex] (атомная масса: 18,9984 а.е.м.) в МэВ на ядро?
Это легко сделать, учитывая числовую эквивалентность атомной массы (а.е.м.) и молярной массы (г/моль), которая следует из определений единиц а.е.м. и молей (см. предыдущее обсуждение в главе об атомах, молекулах и ионы при необходимости).{19}\text{F}[/latex] (атомная масса: 18,9984 а.е.м.) в МэВ на ядро?
Поскольку изменения энергии при разрыве и образовании связей настолько малы по сравнению с изменениями энергии при разрыве или образовании ядер, изменения массы во время всех обычных химических реакций практически незаметны. Как описано в главе о термохимии, наиболее энергичные химические реакции имеют энтальпии порядка 90 103 тысяч 90 104 кДж/моль, что эквивалентно разности масс в нанограммовом диапазоне (10 –9 г).С другой стороны, энергии связи ядер обычно составляют порядка 90 103 миллиардов 90 104 кДж/моль, что соответствует разности масс в миллиграммовом диапазоне (10 –3 г).
Ядро стабильно, если оно не может быть преобразовано в другую конфигурацию без добавления энергии извне. Из тысяч существующих нуклидов около 250 являются стабильными. График зависимости числа нейтронов от числа протонов для стабильных ядер показывает, что стабильные изотопы попадают в узкую полосу.Эта область известна как полоса стабильности (также называемая поясом, зоной или долиной стабильности). Прямая линия на рисунке 1 представляет ядра, в которых соотношение протонов и нейтронов составляет 1:1 (соотношение n:p). Обратите внимание, что более легкие стабильные ядра, как правило, имеют одинаковое количество протонов и нейтронов. Например, азот-14 имеет семь протонов и семь нейтронов. Однако в более тяжелых стабильных ядрах нейтронов становится все больше, чем протонов. Например: железо-56 имеет 30 нейтронов и 26 протонов, отношение n:p равно 1.15, тогда как стабильный нуклид свинец-207 имеет 125 нейтронов и 82 протона, отношение n:p равно 1,52. Это связано с тем, что более крупные ядра имеют большее протон-протонное отталкивание и требуют большего количества нейтронов, чтобы обеспечить компенсирующие сильные силы для преодоления этих электростатических отталкиваний и удержания ядра вместе.
Из тысяч существующих нуклидов около 250 являются стабильными. График зависимости числа нейтронов от числа протонов для стабильных ядер показывает, что стабильные изотопы попадают в узкую полосу.Эта область известна как полоса стабильности (также называемая поясом, зоной или долиной стабильности). Прямая линия на рисунке 1 представляет ядра, в которых соотношение протонов и нейтронов составляет 1:1 (соотношение n:p). Обратите внимание, что более легкие стабильные ядра, как правило, имеют одинаковое количество протонов и нейтронов. Например, азот-14 имеет семь протонов и семь нейтронов. Однако в более тяжелых стабильных ядрах нейтронов становится все больше, чем протонов. Например: железо-56 имеет 30 нейтронов и 26 протонов, отношение n:p равно 1.15, тогда как стабильный нуклид свинец-207 имеет 125 нейтронов и 82 протона, отношение n:p равно 1,52. Это связано с тем, что более крупные ядра имеют большее протон-протонное отталкивание и требуют большего количества нейтронов, чтобы обеспечить компенсирующие сильные силы для преодоления этих электростатических отталкиваний и удержания ядра вместе.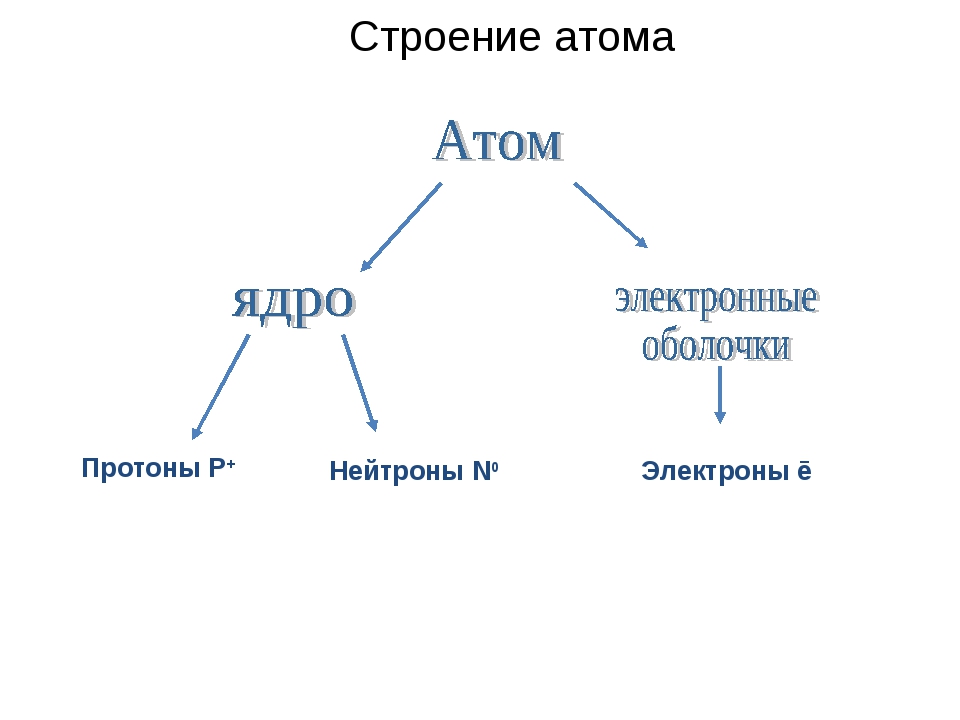
Ядра, находящиеся слева или справа от полосы стабильности, нестабильны и проявляют радиоактивность . Они спонтанно превращаются (распадаются) в другие ядра, находящиеся либо в полосе стабильности, либо ближе к ней. Эти реакции ядерного распада превращают один нестабильный изотоп (или радиоизотоп ) в другой, более стабильный изотоп. Мы обсудим природу и продукты этого радиоактивного распада в последующих разделах этой главы.
Можно сделать несколько замечаний относительно взаимосвязи между стабильностью ядра и его структурой. Ядра с четным числом протонов, нейтронов или того и другого более стабильны (см. Таблицу 1). Ядра с определенным числом нуклонов, известные как магических чисел , устойчивы к ядерному распаду. Это количество протонов или нейтронов (2, 8, 20, 28, 50, 82 и 126) образует полные оболочки в ядре. По своей концепции они аналогичны стабильным электронным оболочкам, наблюдаемым для благородных газов.{208}\text{Pb}[/latex], называются «двойной магией» и отличаются особой стабильностью. Эти тенденции в ядерной стабильности можно рационализировать, рассматривая квантово-механическую модель состояний ядерной энергии, аналогичную той, которая использовалась для описания электронных состояний ранее в этом учебнике. Детали этой модели выходят за рамки этой главы.
Это количество протонов или нейтронов (2, 8, 20, 28, 50, 82 и 126) образует полные оболочки в ядре. По своей концепции они аналогичны стабильным электронным оболочкам, наблюдаемым для благородных газов.{208}\text{Pb}[/latex], называются «двойной магией» и отличаются особой стабильностью. Эти тенденции в ядерной стабильности можно рационализировать, рассматривая квантово-механическую модель состояний ядерной энергии, аналогичную той, которая использовалась для описания электронных состояний ранее в этом учебнике. Детали этой модели выходят за рамки этой главы.
| Количество стабильных изотопов | Номер протона | Нейтрон Номер | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 157 | даже | даже | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 53 | даже | нечетный | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 50 | нечетный | даже | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5 | нечетный | нечетный | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Таблица 1. 2 = 0.{19}\text{F}[/latex] (атомная масса, 18,9984 а.е.м.)? 2 = 0.{19}\text{F}[/latex] (атомная масса, 18,9984 а.е.м.)?Ответ:7,810 МэВ/нуклон Атомное ядро состоит из протонов и нейтронов, вместе называемых нуклонами. Несмотря на то, что протоны отталкиваются друг от друга, ядра плотно удерживаются вместе короткодействующей, но очень сильной силой, называемой сильным ядерным взаимодействием. Масса ядра меньше, чем общая масса составляющих его нуклонов. Эта «недостающая» масса представляет собой дефект массы, который был преобразован в энергию связи, которая удерживает ядро вместе в соответствии с уравнением эквивалентности массы и энергии Эйнштейна: E = mc 2 .Из многих существующих нуклидов лишь небольшое число стабильны. Нуклиды с четным числом протонов или нейтронов или нуклиды с магическим числом нуклонов, скорее всего, будут стабильными. Эти стабильные нуклиды занимают узкую полосу стабильности на графике зависимости числа протонов от числа нейтронов. Энергия связи на нуклон максимальна для элементов с массовыми числами около 56; это самые стабильные ядра. (а) Рассчитайте энергию связи на атом в миллионах электрон-вольт. (б) Рассчитайте его энергию связи на нуклон. (а) хлор-37 (б) кальций-40 (в) 204 Би (г) 56 Fe (д) 206 Pb (ж) 211 Pb (г) 222 Рн (ч) углерод-14 (а) аргон-40 (б) кислород-16 (в) 122 Ва (г) 58 Никель (д) 205 Тл (ж) 210 Тл (г) 226 Ра (ч) магний-24
Глоссарий
РешенияОтветы на упражнения по химии в конце главы 1. 7. Ядерные реакции обычно превращают один тип ядер в другой; химические изменения перестраивают атомы. Ядерные реакции требуют гораздо больших энергий, чем химические реакции, и имеют измеримые изменения массы. 9. (а), (б), (в), (г) и (д) 1.1: Атомная структура — ядро Ядерный атомТочная физическая природа атомов, наконец, была установлена в результате серии элегантных экспериментов, проведенных между 1895 и 1915 годами.Самым заметным из этих достижений был знаменитый эксперимент Эрнеста Резерфорда по рассеянию альфа-излучения в 1911 году, который установил, что:
Само ядро состоит из двух видов частиц. Протоны являются носителями положительного электрического заряда в ядре; заряд протона точно такой же, как заряд электрона, но противоположного знака. Это означает, что в любом [электрически нейтральном] атоме количество протонов в ядре (часто называемое 90 103 ядерным зарядом 90 104 ) уравновешивается таким же числом электронов вне ядра.
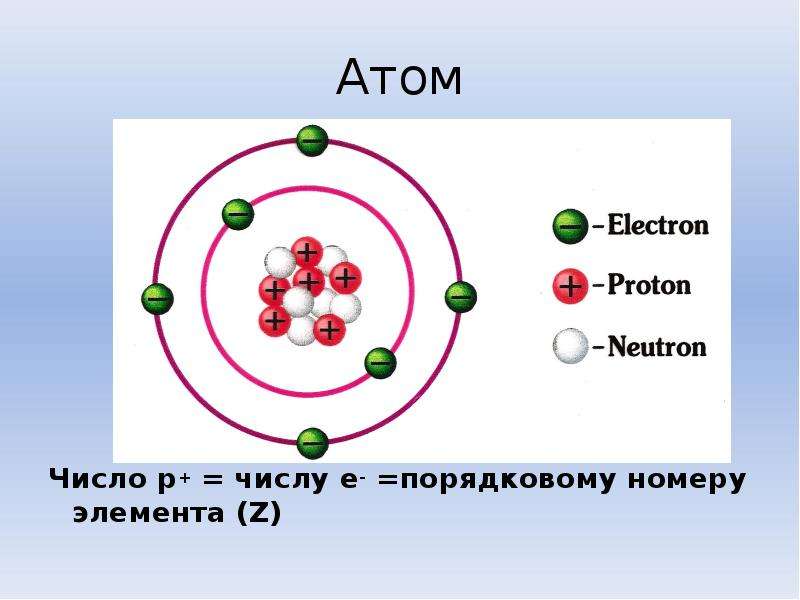
Атомный номер (Z) Какой единственный параметр однозначно характеризует атом данного элемента? Это не относительная масса атома, как мы увидим в разделе об изотопах ниже. Это, скорее, число протонов в ядре, которое мы называем атомным номером и обозначаем символом Z . Каждый протон несет электрический заряд +1, поэтому атомный номер также определяет электрический заряд ядра. Атомные числа были впервые рассчитаны в 1913 году Генри Мозли, молодым членом исследовательской группы Резерфорда в Манчестере. Мозли искал измеримое свойство каждого элемента, линейно возрастающее с атомным номером. Он обнаружил это в классе рентгеновских лучей, испускаемых элементом при его бомбардировке электронами.Частоты этих рентгеновских лучей уникальны для каждого элемента, и они равномерно увеличиваются в последовательных элементах. Мозли обнаружил, что квадратные корни этих частот дают прямую линию при построении графика относительно Z; это позволило ему отсортировать элементы в порядке возрастания атомного номера. Вы можете представить себе атомный номер как своего рода порядковый номер элемента, начинающийся с 1 для водорода и увеличивающийся на единицу для каждого последующего элемента. Химическое название элемента и его символ однозначно связаны с атомным номером; таким образом, символ «Sr» означает стронций, все атомы которого имеют Z = 38. Массовый номер (А)Массовое число равно сумме числа протонов и числа нейтронов в ядре. Иногда его обозначают символом \(A\), поэтому \[А = Z + N\]А=Z+N , где \(Z\) — атомный номер, а \(N\) — номер нейтрона . ЭлементыНа сегодняшний день открыто около 115 различных элементов; по определению каждый из них химически уникален. Чтобы понять, почему они уникальны, нужно понять строение атома (фундаментальной, отдельной частицы элемента) и характеристики его компонентов.Атомы состоят из электронов, протонов и нейтронов. Хотя это чрезмерное упрощение, игнорирующее другие открытые субатомные частицы, этого достаточно для обсуждения химических принципов. Некоторые свойства этих субатомных частиц суммированы в таблице \(\PageIndex{1}\), которая иллюстрирует три важных момента:
Открытие электрона и протона имело решающее значение для развития современной модели атома и представляет собой прекрасный пример применения научного метода.Фактически, выяснение структуры атома — одна из величайших детективных историй в истории науки.
В большинстве случаев символы элементов происходят непосредственно от названия каждого элемента, например, C для углерода, U для урана, Ca для кальция и Po для полония. Элементы также были названы в честь их свойств [например, радий (Ra) из-за его радиоактивности], в честь страны ученого (ученых), открывшего их [полоний (Po) для Польши], в честь выдающихся ученых [курий (Cm) для Кюри], для богов и богинь [selenium (Se) для греческой богини луны Селены] и по другим поэтическим или историческим причинам.Некоторые из символов, используемых для элементов, которые были известны с древних времен, произошли от исторических названий, которые больше не используются; остаются только символы, указывающие на их происхождение. Примеры: Fe для железа, от латинского ferrum ; Na для натрия, от латинского natrium ; и W для вольфрама, от немецкого wolfram .
Напомним, что ядра большинства атомов содержат нейтроны, а также протоны. Изотопы углерода Элемент углерод (C) имеет атомный номер 6, что означает, что все нейтральные атомы углерода содержат 6 протонов и 6 электронов.{14} С\) ( 14 С), с 8 нейтронами и 6 протонами. Однако ядро 14 C не является стабильным, а подвергается медленному радиоактивному распаду, что является основой метода датирования по углероду-14, используемого в археологии. Многие элементы, кроме углерода, имеют более одного стабильного изотопа; олово, например, имеет 10 изотопов.
Источники изотопных данных: G. Audi et al., Nuclear Physics A 729 (2003): 337–676; Дж. К. Коц и К. Ф. Перселл, Химия и химическая реактивность, 2-е изд., 1991. Пример \(\PageIndex{1}\)Элемент с тремя стабильными изотопами имеет 82 протона. Отдельные изотопы содержат 124, 125 и 126 нейтронов. Определите элемент и напишите символы для изотопов. Дано : количество протонов и нейтронов Запрашиваемый : символ элемента и атома Стратегия :
 Селина Глава 4 Атомная структура Решения ICSE Класс 8 ХимияУпражнение Ответ Ответ (a) dalton сказал , что атомы не могут быть разделены(b) ион, который имеет положительный заряд, называется катион . (c) Внешняя оболочка атома известна как валентная оболочка . (d) Ядро атома очень твердое и плотное.  (e) Нейтроны – это нейтральные частицы, имеющие массу, равную массе протонов. (f) Изотопы – это атомы элемента , имеющие одинаковый атомный номер, но разные массовые числа. 2. Напишите «верно» или «неверно» для следующих утверждений: 3. Дайте следующее подходящее слово/фразу. 4. Вопросы с несколькими вариантами ответов Ответ 2. валентные электроны (b) Количество валентных электронов, присутствующих в магнии, равно Ответ 1. два (c) Субатомная частица с отрицательным зарядом Ответ 3. электрон Ответить 3.18 (e) Количество электронов в атоме равно числу Ответ 39 39 Ответ 1. массовое число 5. Назовите три основные частицы атома. Дайте символ с зарядом на каждой частице. 6. Дайте определение следующим терминам: (a) Атомный номер (b) Массовое число (c) Нуклоны (d) Валентная оболочка Ответ (a) Атомный номер: Атомный номер относится к числу протонов, присутствующих в атоме.Обозначается буквой Z. Пример: Атом кислорода содержит 8 протонов. Следовательно, его атомный номер равен 8. (b) Массовое число: Массовое число относится к сумме количества протонов и нейтронов, присутствующих в ядре атома. атома и обозначается массовым числом = количество протонов + количество нейтронов. (c) Нуклоны: Протоны и нейтроны вместе известны как нуклоны. (d) Валентная оболочка: Самая внешняя оболочка атома известна как его валентная оболочка. 7. Кратко назовите основные черты атомной теории Дальтона (пять баллов).
8. (a) Каковы две основные особенности модели атома Резерфорда? (b) Назовите один его недостаток. Ответ (a) Согласно модели Резерфорда атом состоит из:
(b) Модель атома Резерфорда не могла объяснить стабильность атома, так как он подобен солнечной системе, солнце находится в центре, а планеты вращаются вокруг него, в атоме электроны вращаются вокруг центрально расположенного ядра, содержащего протоны . 9. Каковы наблюдения эксперимента, проведенного Резерфордом для определения строения атома?
10. Укажите массовое число, атомный номер, число нейтронов и электронную конфигурацию следующих атомов.  Также нарисуйте для них атомные диаграммы. Ответить11. Что такое переменная валентность? Назовите два элемента с переменной валентностью и укажите их валентность. Ответить Переменная валентность: некоторые элементы обладают более чем одной валентностью. Говорят, что они имеют переменную валентность, т.е. Железо, медь, олово, свинец. 12. Атомный номер и массовое число натрия равны 11 и 23 соответственно. Какую информацию несет это высказывание. 13. Начертите схемы атомной структуры следующих веществ: 14. Объясните на примере правило, согласно которому электроны заполняются на различных энергетических уровнях, Ответить Максимальное количество электронов, которое может присутствовать на любой оболочке или орбите атома, определяется формулой 2n 2 , где n — порядковый номер оболочки. 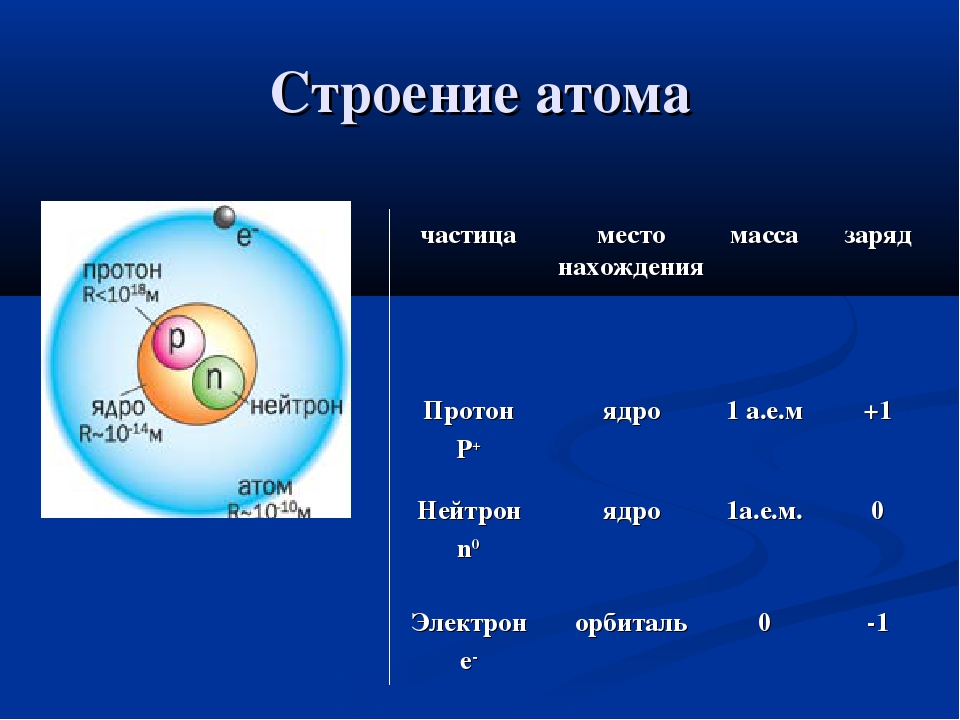 Следовательно: K оболочка, n = 1, нет. электронов = 2×1 2 = 2 L оболочка, n = 2, шт. электронов = 2×2 2 = 8 Оболочка М, n = 3, вып. электронов = 2×3 2 = 18 N оболочка, n = 4, нет. электронов = 2×4 2 = 32 Электроны не размещаются в данной оболочке, если внутренние оболочки не заполнены. То есть оболочки заполняются ступенчато. Пример: 15.Атом элемента состоит из 4 протонов, 5 нейтронов и 4 электронов. Каков его атомный номер и массовое число? Ответить Протоны = 4, нейтроны = 5, электроны = 4 Атомный номер = 4, Массовое число = 4 + 5 = 9 16. а) Из каких двух основных частей состоит атом? 17. Что такое изотопы? Как существование изотопов противоречит атомной теории Дальтона? Дополнительные практические вопросыЗаполните пропуски ядерная структура атома? Ответ Ответ 2. JJ Thomson Ответ 1 1,6×10 -19 C Ответ 3. 1840 Ответ 2. Marie Curie Ответ 2. электроны Ответ Сопоставьте столбцыВерно/Неверно 1.  Элементы образуют соединения в определенных пропорциях. Элементы образуют соединения в определенных пропорциях. Верно. 2. Элементы, имеющие тенденцию принимать электроны, называются металлами. 5. Катодные лучи представляют собой поток быстро движущихся частиц, движущихся в случайных направлениях. Верно. 7. После испускания бета-частицы порядковый номер атома увеличивается на единицу. Верно. Пишите краткие ответы 1.  Что такое атом? Что такое атом? Ответ Атом определяется как мельчайшая частица молекулы, которая далее подразделяется на электроны, протоны и нейтроны. 2. Опишите разрядную трубку. Ответ Газоразрядная трубка представляет собой цилиндрическую стеклянную трубку, которую можно заполнить газом и которая снабжена металлическими пластинами, называемыми электродами, на каждом конце. 3. Как называется центральная часть атома? Ответ Ядро, состоящее из нейтронов и протонов. 4. Что вы понимаете под электронным переходом? Ответ Перескок электрона с одного энергетического уровня на другой называется электронным переходом. 5. Дайте определение ионному соединению. Ответ Ионное соединение определяется как соединение, образованное противоположно заряженными ионами, которые притягиваются друг к другу, образуя химическую связь, например. Хлорид натрия. 6. Определите атомное массовое число атома. Ответ Атомное массовое число относится к общему количеству протонов и нейтронов в ядре. 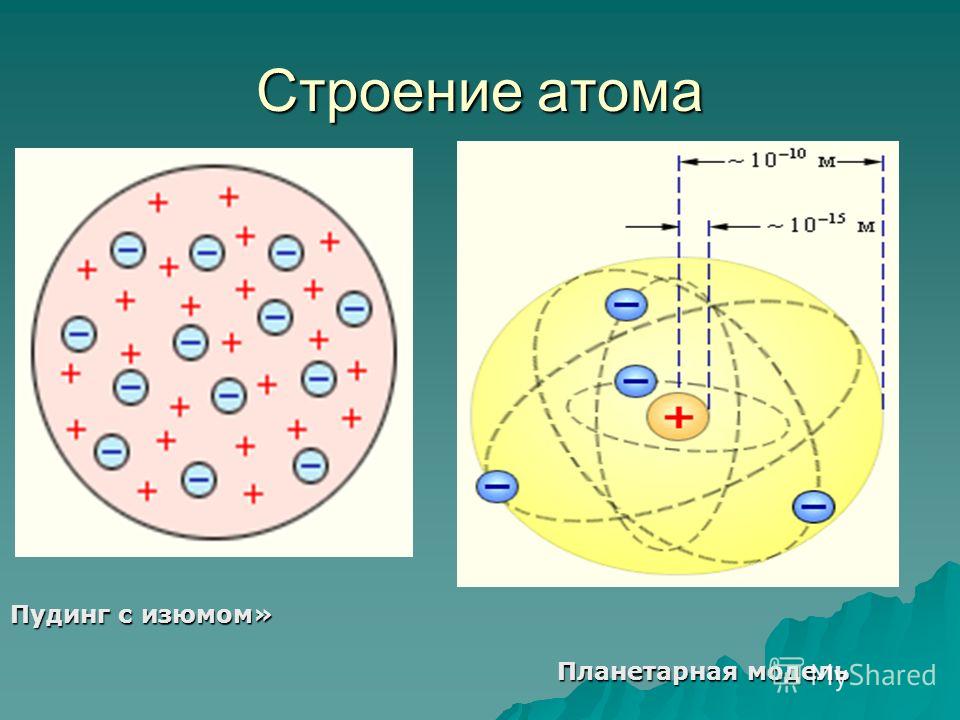 7. Назовите изотопы водорода. 7. Назовите изотопы водорода. Ответ Есть 3 (три) изотопы водорода
8. Что такое радиоактивность? Ответ Радиоактивность – это явления, при которых некоторые вещества спонтанно излучают излучение. 9. Назовите три инертных газа. Ответ Инертный газ: аргон, гелий, неон. 10. Каков заряд нейтрона? Ответить Бесплатно. 11. Какое число нейтронов присутствует в атоме калия? Ответить 20 Подробно ответить1. Сформулировать постулаты теории атома Дальтона. Ответ Постулаты атомной теории Дальтона:
Ответ Тремя субатомными частицами являются:
3. Перечислите черты боровской модели атома. Как он исправил модель Резерфорда? Ответ Постулаты Бора:
Ответ Максимально возможное количество электронов, которое может разместиться на оболочке, можно определить по формуле 2nr. (Здесь n — номер оболочки) В случае L-оболочки n = 2 ∴ 2n 2 = 2(2) 2 = 8 Таким образом, L-оболочка может вместить максимум 8 электронов. 5. Нарисуйте электронную конфигурацию следующих элементов, четко указав количество нейтронов и протонов в их ядре. б.Кремний  Алюминий Алюминий эл. Азот Ответ 6. Чем изобары отличаются от изотопов?
Ответ Самая внешняя оболочка атома называется его валентной оболочкой. Количество электронов, которые атом должен принять, отдать или разделить, чтобы сформировать полный внешний октет (восемь электронов), называется валентностью этого элемента. Итак, валентность элемента можно определить как его способность сочетаться с другими элементами.  Валентность элемента всегда является целым числом. 8. Что такое деление ядер? Чем он отличается от ядерного синтеза? Валентность элемента всегда является целым числом. 8. Что такое деление ядер? Чем он отличается от ядерного синтеза? Ответ
Ответ Атомная электростанция имеет перечисленные компоненты.
10. Как радиоактивное излучение используется в медицине?
Атомная структура Class-8 Dalal Simplified ICSE Chemistry Атомная структура Class-8 Dalal ICSE Новый Упрощенный Химия Dr Viraf J Dalal Middle School Allied Publishers Solutions. Глава 4 . Мы предоставляем пошаговые решения упражнения / урока -4 Атомная структура с вопросами объективного типа, заполните пробелы и объясните причину, сопоставьте следующее из издательства Dr Viraf J Dalal Middle School Chemistry Allied Publishers. УПРАЖНЕНИЕ-4 Вопрос 1. Основные постулаты теории атома Дальтона:
Современная атомная теория противоречит атомной теории Дальтона:
Вопрос 2. Что касается открытия структуры атома, объясните вкратце – эксперимент Уильяма Крукса по открытию катодных лучей, а затем – Дж.Дж. Эксперимент Томсона, относящийся к составляющим катодных лучей.Укажите, какая субатомная частица была открыта в результате его эксперимента. Три субатомные частицы, составляющие атом:
Открытие катодных лучей привело к открытию электронов : Эксперимент Уильяма Крукса по открытию катодных лучей: Эксперимент. На рисунке показана вакуумная трубка, в которой находится газ при очень низком давлении.Через трубку пропускают электрический разряд. Видно испускание синих лучей от катода. Заключение. Синие лучи, испускаемые катодом, являются катодными лучами. Дж.Дж. Эксперимент Томсона по составляющим катодных лучей: Эксперимент. Чтобы проверить свойства частиц, Томсон поместил две противоположно заряженные электрические пластины вокруг катодного луча. Томсон также поместил два магнита по обе стороны от трубки и заметил, что это магнитное поле также отклоняет катодный луч. Эти субатомные частицы можно найти внутри атомов всех элементов. Вывод. Катодные лучи состоят из отрицательно заряженных частиц, известных как электроны. Вопрос 3. Эксперимент Гольдштейна, приведший к открытию протонов: Эксперимент – На рисунке показана модифицированная электронно-лучевая трубка с перфорированным катодом. Когда через эту трубку пропускают электрический разряд, от анода, проходящего через отверстия положительного катода, образуются лучи нового типа, это лучи анода. Заключение. Анодные лучи состоят из положительно заряженных частиц, потому что на них воздействовали магнитные поля в направлении, противоположном направлению катодных лучей.Эти положительно заряженные частицы — протоны. Эксперимент лорда Резерфорда по открытию атомного ядра: Эксперимент— направить энергичные альфа-частицы на тонкую металлическую фольгу и измерить, как луч альфа-частиц рассеивается при ударе о тонкую металлическую фольгу. Узкий коллимированный пучок альфа-частиц был направлен на золотую фольгу толщиной около 1 мкм (толщиной около 10 000 атомов). Альфа-частицы представляют собой энергетические ядра гелия (обычно около 6 МэВ).Альфа-частицы, которые примерно в 7300 раз массивнее электронов, имеют положительный заряд +2e. Из-за своей относительно большей массы альфа-частицы незначительно отклоняются от своего пути электронами в атомах металла. Если альфа-частица столкнется с атомом, она пролетит насквозь, а ее траектория отклонится не более чем на долю градуса. Заключение. Было обнаружено, что каждый атом содержит ядро (диаметр которого порядка 10-14 м), где весь его положительный заряд и большая часть его массы сосредоточены в небольшой области, называемой атомным ядром. Вопрос-4 «Электроны вращаются вокруг ядра по фиксированным орбитам или оболочкам, называемым энергетическими уровнями». Укажите, как представлены эти энергетические уровни. Ответ 4: Электроны вращаются вокруг ядра по фиксированным орбитам или оболочкам, называемым энергетическими уровнями.Электроны вращаются вокруг ядра на одном или нескольких энергетических уровнях. Они представлены как 1, 2, 3, то есть целое число «n» или как K, L, M, N. Вопрос 5. Вопрос 6. Атомный номер — это количество протонов в атоме. Атом электрически нейтрален, то есть не имеет заряда. Атомный номер = Количество электронов = Количество протонов В атоме «А» атомный номер = 11, то есть число протонов и электронов равно 11. Атомный номер = z = p = e Вопрос 7. Массовое число атома равно сумме числа протонов и нейтронов в ядре атома. Читать далее 👇 Нажмите на номер страницы, указанный ниже 👇 История открытия ядра | Разделы | Американский институт физикиРезерфорд в Манчестере, 1907–1919 гг. Эрнест Резерфорд открыл ядро атома в 1911 году.Мы читаем об этом в учебниках и в популярных сочинениях. Но что означает это утверждение? Географическое открытие обычно означает, что человек видит место впервые. Но может ли открытие быть таким же для царства, скрытого от глаз? В этом смысле нельзя увидеть атом. Так что это намекает на то, что, возможно, история открытия ядра была более сложной. История, разворачивавшаяся в лаборатории Резерфорда в Манчестерском университете, вращалась вокруг реальных людей. Это было связано с разочарованиями и триумфами.Это включало в себя тяжелую работу, недоумение и вдохновение. Резерфорд прибыл в Манчестер летом 1907 года, за несколько месяцев до начала семестра в университете. Он был назначен профессором физики Лэнгуорти, преемником Артура Шустера (1851–1934), который вышел на пенсию в возрасте 56 лет, чтобы завербовать Резерфорда. Шустер построил современный корпус физического факультета, нанял Ганса Гейгера, доктора философии. (1882–1945) из-за его экспериментальных навыков и предоставил новую должность в математической физике, чтобы завершить полную программу физики. Прослушать голосовой клип Для прослушивания этого аудиоклипа у вас должен быть установлен Flash Player. Дом Резерфорда показался мне очень занятым, трудолюбивым. Но очень грязное место. А именно, в Манчестере очень туманно, туманно и дымно. И конечно везде дым там, везде дым. Теперь техника, используемая в лаборатории Резерфорда, заключалась в установке электроскопа.Вы должны построить его самостоятельно из коробок какао, сусального золота и изоляции серы. А электроскоп вы заряжаете сургучом, которым натерли штаны. Так что это была очень примитивная техника. Но, конечно, также микроскоп, чтобы читать электроскоп. Теперь микроскоп был зафиксирован, и тогда к нему нельзя было прикасаться. И, конечно же, вы не должны были его чистить. Так прошли годы без чистки аппарата. Но если не считать недостатков, это была очень хорошая лаборатория, хорошие помещения, и там работало много людей — способных людей. Резерфорд прибыл с множеством исследовательских вопросов. Он не закончил с загадками семейств распада тория, радия и т. д., но передал большую часть этой работы Болтвуду, Хану и Содди. Болтвуд и Хан оба работали с Резерфордом в Манчестере, Болтвудом в 1909–1910 годах и Ханом в 1907–1908 годах. В первую команду Резерфорда в Манчестере входили Гейгер и Уильям Кей (1879–1961), младший лаборант с 1894 года. Резерфорд повысил Кея до начальника лаборатории в 1908 году, чтобы управлять лабораторным оборудованием и помогать ему в его исследованиях. В 1957 году Кей вспомнил свою юность с Резерфордом в интервью. Язык причудливый, но описание максимально близко к подходу Резерфорда. Ганс Гейгер был главным партнером Резерфорда в исследованиях альфа-излучения с 1907 по 1913 год. Вместе они разработали несколько способов обнаружения альфа-лучей. Они доказали, что альфа-лучи представляют собой дважды ионизированные ядра гелия.ок. 1908 г. Предоставлено: AIP Emilio Segre Visual Archives, Physics Today Collection. Резерфорд и Ганс Гейгер тесно сотрудничали в 1907 и 1908 годах над обнаружением и измерением α частиц. Если бы они использовали α частиц для исследования атома, они должны были сначала узнать больше об этих частицах и их поведении. Резерфорд пытался еще в Макгилле сосчитать α частиц, но потерпел неудачу. Год спустя в Манчестере он и Гейгер преуспели в двух методах наблюдения α частиц. Резерфорд написал Генри Бамстеду (1870–1920), американскому физику, 11 июля 1908 года: Гейгер — хороший человек и работал как раб. Хотя Резерфорд еще в 1906 г. подозревал, что частицы α представляют собой атомы гелия, лишенные своих электронов, он требовал высоких стандартов доказательств.Одного эксперимента было недостаточно. Одного детектора было недостаточно. Он хотел больше доказательств. Для этого Резерфорду нужны были «большие напряжения» и большие электромагниты, чтобы отклонять α частиц, но этот метод еще не созрел. Стюард лаборатории Уильям Кей вспоминал в процитированном устном историческом интервью, что Резерфорд в 1908 году настаивал на том, что сильные электрические и магнитные поля необходимы для более непосредственного измерения заряда и массы частиц α и β : И таким он был все время. Кей сказал, что Резерфорду нужен был большой магнит с водяным охлаждением, но он «выбросил его как горячий пирог», когда узнал его стоимость. Поэтому ему нужна была новая линия атаки. Новая линия была очень простой, химическая процедура смешана с физикой. Для этой работы Резерфорд нанял Томаса Ройдса (1884–1955), получившего степень с отличием по физике в 1906 году.Они собрали α частиц в запаянную стеклянную трубку, сжали их и пропускали электрическую искру. Они изучили испускаемый свет в спектроскопе и обнаружили, что он идентичен спектру гелия. Через несколько месяцев Резерфорд был удостоен Нобелевской премии по химии «за исследования распада элементов и химии радиоактивных веществ». (Нобелевская цитата) Резерфорд и Ройдс установили идентичность и основные свойства частиц α . Осенью 1908 года началась важная серия исследований. Гейгер пропускал лучи частиц α через золотую и другую металлическую фольгу, используя новые методы обнаружения, чтобы измерить, насколько эти лучи были рассеяны атомами в фольге. Гейгер подумал, что Эрнест Марсден (1889–1970), 19-летний студент факультета физики с отличием, готов помочь в этих экспериментах, и предложил это Резерфорду.Поскольку Резерфорд часто подталкивал к исследованиям студентов третьего курса, говоря, что это лучший способ узнать физику, он с готовностью согласился. На этом рисунке из статьи Гейгера и Марсдена 1909 года показана коническая стеклянная трубка, наполненная «излучением радия» (радона), закрытая в точке B тонкой пластиной из слюды. Это был их источник альфа ( α ) частиц. S представлял собой экран из сульфида цинка, который мерцал при попадании частицы α . P представлял собой свинцовый экран, который блокировал попадание любых частиц α непосредственно на экран из сульфида цинка. РР представлял собой фольгу (или фольги) из различных металлов (включая золото), которые «диффузно отражали» α падающих частиц. Гейгер и Марсден наблюдали возникающие мерцания через наблюдательный микроскоп, М. Кредит: Х. Гейгер и Э. Марсден, «О диффузном отражении α -частиц», Proceedings of the Royal Society , 1909, 82: 495–500. РР представлял собой фольгу (или фольги) из различных металлов (включая золото), которые «диффузно отражали» α падающих частиц. Гейгер и Марсден наблюдали возникающие мерцания через наблюдательный микроскоп, М. Кредит: Х. Гейгер и Э. Марсден, «О диффузном отражении α -частиц», Proceedings of the Royal Society , 1909, 82: 495–500.Гейгер и Марсден начали с малоугловой дисперсии и попробовали различные толщины фольги, ища математические отношения между дисперсией и толщиной фольги или числом пройденных атомов.Позже Марсден вспоминал, что Резерфорд сказал ему во время этих экспериментов: «Посмотрите, сможете ли вы получить какой-нибудь эффект альфа-частиц, прямо отраженных от металлической поверхности». (Сообщено Марсденом в Birks, 1962, стр. 8). Марсден сомневался, что Резерфорд ожидал обратного рассеяния α частиц, но, как писал Марсден, … это было одно из тех «предчувствий», что, возможно, можно было бы наблюдать какой-то эффект, и что в любом случае соседняя территория земли этого Тома Тиддлера может быть исследована разведкой. Это был игровой подход Резерфорда в действии. Его ученики и другие люди опробовали его идеи, многие из которых оказались тупиковыми. Однако эта идея поиска обратного рассеяния α частиц окупилась. Резерфорд писал: Эксперимент, направляемый дисциплинированным воображением либо отдельного человека, либо, что еще лучше, группы людей с различным мировоззрением, способен достичь результатов, далеко превосходящих воображение одного лишь величайшего философа.(Цитируется по Eve, 1939, Frontmatter) Некоторое время спустя, в 1908 или 1909 году, сказал Марсден, он сообщил о своих результатах Резерфорду. Резерфорд вспоминал об этом несколько иначе: Помню… позже Гейгер подошел ко мне в большом волнении и сказал: «Мы смогли получить некоторые из α -частиц, летящих назад. Человеческая память подвержена ошибкам. Рассказывали ли Марсден или Гейгер Резерфорду, эффект был одинаковым. Резерфорд сказал, что они должны подготовить публикацию по этому исследованию, которое они представили в мае 1909 года. Более того, это заставило Резерфорда задуматься о том, что в конечном итоге, почти два года спустя, он опубликовал как теорию атома. Чем занимался Резерфорд до конца 1909 г. и весь 1910 г.? Во-первых, его близкий друг Болтвуд был в Манчестере в течение учебного года, работая с Резерфордом над продуктами радиоактивного распада радия.Он также рассматривал и говорил о более ранних идеях об атомной структуре. Самое главное, он систематически рассматривал явление рассеяния α частиц и проверял каждую частицу. Осенью 1910 года он привез Марсдена обратно в Манчестер, чтобы вместе с Гейгером завершить тщательную экспериментальную проверку своих идей. Они повторно установили скорость выброса и диапазоны α частиц радиоактивными источниками и пересмотрели свой статистический анализ.Резерфорд пытался согласовать результаты рассеяния с различными атомными моделями, особенно с моделью Дж.Дж. Томсона, в котором положительное электричество рассматривалось как рассеянное равномерно по всей сфере атома. Страница ранних недатированных (1910 или 1911) черновых заметок Резерфорда. Первые несколько строк гласят: «Теория строения атома. Предположим, атом состоит из + заряда ne в центре и из – заряда в виде электрона, распределенного по сфере радиусом r». Затем он набросал идеи о расчете силы отклонения заряженной частицы, проходящей вблизи этого заряженного центра. Авторы и права: Дж. Б. Биркс, изд., , Резерфорд в Манчестере, (Лондон: Heywood & Co., 1962), с. 70. Авторы и права: Дж. Б. Биркс, изд., , Резерфорд в Манчестере, (Лондон: Heywood & Co., 1962), с. 70.В какой-то момент зимой 1910–1911 годов Резерфорд разработал основную идею атома с «заряженным центром». Как указали Гейгер и Марсден в своей статье 1909 года: Если принять во внимание высокую скорость и массу α -частиц, то кажется удивительным, что некоторые из α -частиц, как показывает опыт, могут поворачиваться в пределах слоя 6 x 10 -5 см.золота под углом 90° и даже больше. Чтобы произвести подобный эффект магнитным полем, потребовалось бы огромное поле в 109 абсолютных единиц. (Биркс, стр. 179) Резерфорд пришел к выводу в своей статье, опубликованной в мае 1911 г., что такое значительное отклонение на пути массивной заряженной частицы может быть достигнуто только в том случае, если большая часть массы, скажем, атома золота и большая часть его заряда будут сосредоточены в очень маленьком центральном тело. Примечание: в этот момент в 1911 году Резерфорд не называл это «ядром». Послушайте выступление Чедвика о первом публичном заявлении Резерфорда Для прослушивания этого аудиоклипа у вас должен быть установлен Flash Player. Первое публичное заявление Резерфорда о ядерной теории было сделано на собрании Манчестерского литературно-философского общества, и он пригласил нас, мальчишек, пойти на собрание. Он сказал, что у него есть что сказать, и он подумал, что мы хотели бы их услышать.В то время мы не знали, о чем идет речь. Пожилые люди в лаборатории знали, конечно, Гейгер и Марсден знали, потому что они уже проводили эксперименты. На самом деле, если только они не сделали чего-то достаточного, чтобы иметь решающее значение, Резерфорд никогда не упоминал об этом публично. И, конечно же, Дарвин знал об этом гораздо раньше. Но это должно было быть в начале 1911 года, и мы пошли на собрание, и он рассказал нам. И тут же он упомянул, что есть некоторые экспериментальные доказательства, полученные Гейгером и Марсденом. На самом деле, Резерфорд был чрезвычайно осторожен в выводах об этом центральном заряде: «Простые расчеты показывают, что атом должен быть очагом сильного электрического поля, чтобы произвести такое большое отклонение за одно столкновение. Послушайте рассказ Чедвика об интересе Резерфорда к исследованиям Для прослушивания этого аудиоклипа у вас должен быть установлен Flash Player. Интерес Резерфорда был тогда почти полностью связан с исследованиями. Он очень мало преподавал в Макгилле. Он был профессором-исследователем. Я предполагаю, что он читал несколько лекций, но их было очень мало. И его интерес вполне естественно был на исследовательской стороне. Мне часто говорили, что Резерфорд был плохим лектором. Такого бреда я еще не слышал. Правда, иногда он был немного скучен, немного путался, но это было только в очень редких случаях.Были и другие случаи, когда он действительно возбуждал. От него исходил огромный энтузиазм. Резерфорд рассматривал возможность того, что заряженный центр отрицателен. Сегодня это звучит странно, так что же сделало это разумным? Во-первых, она не сильно отличалась от модели Томсона. Во-вторых, поскольку Резерфорд знал, что частицы α несут двойной + заряд, он подумал, что это может действовать так же, как Солнце действует на проносящуюся мимо комету.  Резерфорд видел возможные проверки природы центрального заряда. Он сказал, что поглощение частиц β должно быть разным с отрицательным центром по сравнению с положительным.Положительный центр объяснил бы большую скорость, которую α частиц достигают при испускании из радиоактивных элементов. Но это были только намеки. На этой схеме представлены усовершенствованные эксперименты 1912–1913 годов, проведенные Гейгером и Марсденом. R — источник альфа-частиц, E — золотая фольга, M — микроскоп, вращающийся вокруг вертикальной оси с центром на золотой фольге. Альфа-частицы от источника проходили через диафрагму D, рассеивались фольгой и наблюдались в виде сцинтилляций на экране S.Гейгер и Марсден наблюдали за углами рассеяния частиц, вращая узел микроскопа и экрана. Авторы и права: Х. Гейгер и Э. Марсден, «Законы отклонения частиц α под большими углами», Philosophical Magazine , 1913, 25:604–623. Гейгер и Марсден действительно систематически работали над проверяемыми следствиями гипотезы Резерфорда о центральном заряде. 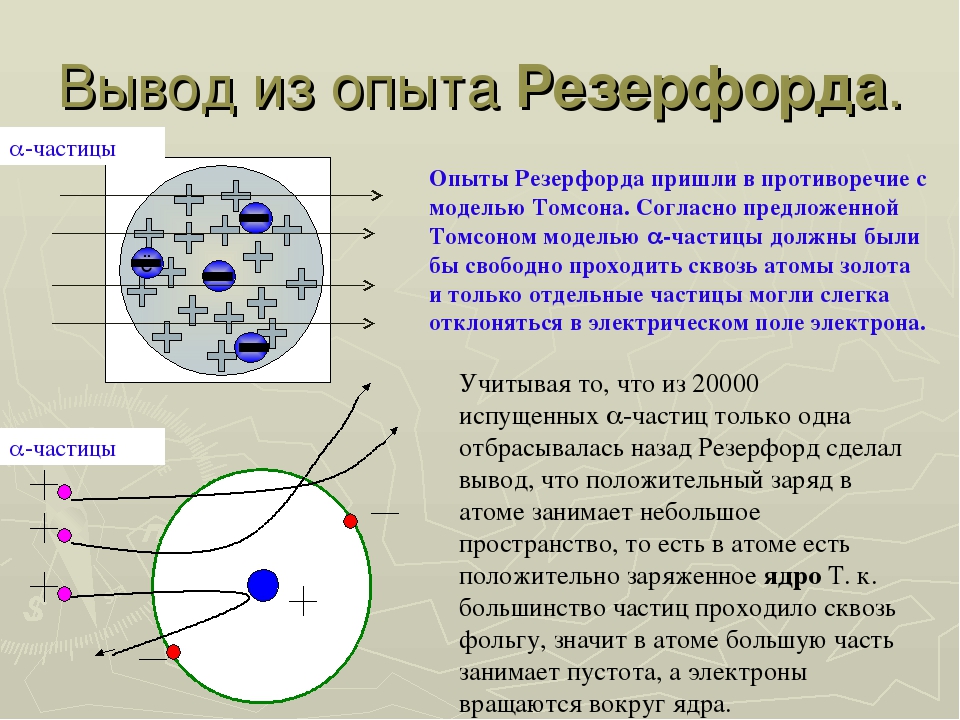 «Великая война» полностью нарушила работу манчестерского отдела Резерфорда. Бор вернулся в Данию. Марсден принял должность профессора в Новой Зеландии.Мозли погиб в битве при Галлиполи. Джеймс Чедвик (1891–1974), который работал с Гейгером в Берлинском техническом университете, когда началась война, провел несколько лет в лагере для военнопленных Рулебен. Другие студенты тоже ушли на войну, и Резерфорд посвятил много сил мобилизации науки для военных действий и, в частности, противолодочной техники. Нильс Бор впервые работал с Резерфордом по адресуManchester в 1912 году. На этой фотографии изображены молодые Нильс и Маргрета Бор, ок.1914 г., когда Бор сменил Чарльза Гальтона Дарвина на посту читателя Шустера по математической физике в Манчестере. Предоставлено: AIP Emilio Segre Visual Archives, коллекция Маргрет Бор. На этом отвлекающем фоне Резерфорд и его лаборант Уильям Кей в 1917 году начали исследовать прохождение частиц α через водород, азот и другие газы. Во время этих экспериментов Резерфорд имел в виду несколько тонких вопросов, главным образом связанных с природой ядра.Он попросил своего коллегу Дарвина проанализировать эти столкновения на основе «простой теории» упругих столкновений между точечными ядрами, отталкивающимися по закону обратных квадратов, α частиц, несущих заряд в 2 раза больше заряда электрона (и противоположного знака). ) и ядер водорода в 1 раз. Дарвин обнаружил, что все α частиц, сближающихся в пределах 2,4×10 -13 см, образуют «быстрый атом водорода». Однако эта простая теория предсказывала гораздо меньшее количество ускоренных атомов водорода, чем наблюдалось в экспериментах. Резерфорд отверг объяснения этой дисперсии, основанные на различных зарядах частиц или других законах, кроме законов обратных квадратов. Скорее, он пришел к выводу, что для расстояний порядка диаметра электрона «структура ядра гелия больше не может рассматриваться как точка…». Он утверждал, что ядро гелия (частица α ) имеет сложную структуру из четырех ядер водорода и двух отрицательно заряженных электронов. Принимая во внимание интенсивные силы, возникающие при таких столкновениях, неудивительно, если ядро гелия распадется. Никаких свидетельств такого распада… не наблюдалось, что указывает на то, что ядро гелия должно быть очень стабильной структурой. Мы должны помнить, что Резерфорд не мог непосредственно наблюдать структуру ядра, поэтому его выводы были предварительными.Тем не менее он открыто рассматривал возможности сложного ядра, способного к деформации и даже к возможному распаду. Эти мысли сформировали этот напряженный период экспериментальных исследований. Упражнение «Структура атома»Расширенный поискСодержание: Язык: AfarAbkhazAvestanAfrikaansAkanAmharicAragoneseArabicAssameseAsturianuAthabascanAvaricAymaraAzerbaijaniBashkirBelarusianBulgarianBihariBislamaBambaraBengali, BanglaTibetan стандарт, тибетский, CentralBretonBosnianCatalanChechenChamorroCorsicanCreeCzechOld церковнославянский, церковнославянский, Старый BulgarianChuvashWelshDanishGermanDivehi, Мальдивский, MaldivianDzongkhaEweGreek (современный) EnglishEsperantoSpanishEstonianBasquePersian (фарси) Фуле, фулах, пулар, PularFinnishFijianFaroeseFrenchWestern FrisianIrishScottish гэльский, GaelicGalicianGuaraníGujaratiManxHausaHebrew (современный) HindiHiri MotuCroatianHaitian, гаитянский CreoleHungarianArmenianHereroInterlinguaIndonesianInterlingueIgboNuosuInupiaqIdoIcelandicItalianInuktitutJapaneseJavaneseGeorgianKarakalpakKongoKikuyu, GikuyuKwanyama, KuanyamaKazakhKalaallisut , гренландский кхмерский каннада корейский канури кашмирский курдский коми корнуоллский кыргызский латинский люксембургский , летзебургский ганда лимбургский , лимбургский , лимбургский лингала лаосский литовский люба-катанга латышский малагасийский маршалльский мао riMacedonianMalayalamMongolianMarathi (маратхи) MalayMalteseBurmeseNauruanNorwegian BokmålNorthern NdebeleNepaliNdongaDutchNorwegian NynorskNorwegianSouthern NdebeleNavajo, NavahoChichewa, Chewa, NyanjaOccitanOjibwe, OjibwaOromoOriyaOssetian, OsseticEastern пенджаби, Восточная PanjabiPāliPolishPashto, PushtoPortugueseQuechuaRomanshKirundiRomanianRussianKinyarwandaSanskrit (санскрит) SardinianSindhiNorthern SamiSangoSinhalese, SinhalaSlovakSloveneSamoanShonaSomaliAlbanianSerbianSwatiSouthern SothoSundaneseSwedishSwahiliTamilTeluguTajikThaiTigrinyaTurkmenTagalogTswanaTonga (Остров Тонга) TurkishTsongaTatarTwiTahitianUyghurUkrainianUrduUzbekValencianVendaVietnameseVolapükWalloonWolofXhosaYiddishYorubaZhuang, ChuangChineseZulu Предмет: Класс/уровень: Возраст: 345678 | 12131415161718+|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

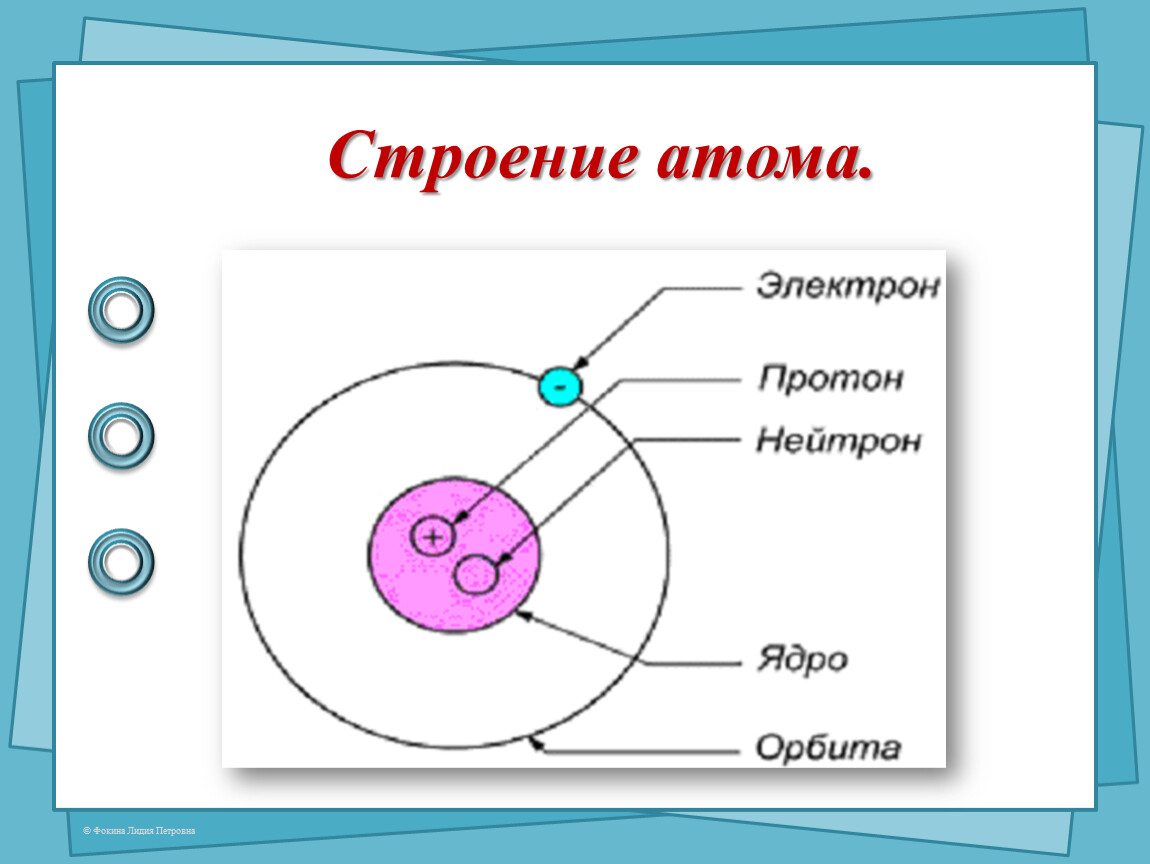
 {24}\text{Mg}[/латекс] в г/мл, предполагая, что оно имеет типичный диаметр ядра 1 × 10 –13 см и имеет сферическую форму.{23}\text{Na}[/latex] составляет 22,9898 а.е.м.
{24}\text{Mg}[/латекс] в г/мл, предполагая, что оно имеет типичный диаметр ядра 1 × 10 –13 см и имеет сферическую форму.{23}\text{Na}[/latex] составляет 22,9898 а.е.м. {243}\text{Bk}[/латекс]
{243}\text{Bk}[/латекс] Чрезвычайно малая масса электрона (1/1840 массы ядра водорода) заставляет его вести себя как квантовая частица, а это означает, что его местоположение в любой момент времени не может быть определено; лучшее, что мы можем сделать, — это описать его поведение в терминах вероятности его проявления в любой точке пространства. Общепринято (но несколько ошибочно) описывать объем пространства, в котором электроны атома имеют значительную вероятность быть обнаруженными, как электронное облако .Последний не имеет определенной внешней границы, как и атом. Радиус атома должен быть определен произвольно, например граница, в которой электрон может быть найден с вероятностью 95%. Атомные радиусы обычно составляют 30-300 пм.
Чрезвычайно малая масса электрона (1/1840 массы ядра водорода) заставляет его вести себя как квантовая частица, а это означает, что его местоположение в любой момент времени не может быть определено; лучшее, что мы можем сделать, — это описать его поведение в терминах вероятности его проявления в любой точке пространства. Общепринято (но несколько ошибочно) описывать объем пространства, в котором электроны атома имеют значительную вероятность быть обнаруженными, как электронное облако .Последний не имеет определенной внешней границы, как и атом. Радиус атома должен быть определен произвольно, например граница, в которой электрон может быть найден с вероятностью 95%. Атомные радиусы обычно составляют 30-300 пм. Другой ядерной частицей является нейтрон . Как следует из названия, эта частица не несет электрического заряда. Его масса почти такая же, как у протона. Большинство ядер содержат примерно равное количество нейтронов и протонов, поэтому мы можем сказать, что эти две частицы вместе составляют почти всю массу атома.
Другой ядерной частицей является нейтрон . Как следует из названия, эта частица не несет электрического заряда. Его масса почти такая же, как у протона. Большинство ядер содержат примерно равное количество нейтронов и протонов, поэтому мы можем сказать, что эти две частицы вместе составляют почти всю массу атома. В нейтральном атоме Z протонов внутри ядра уравновешиваются Z электронов вне его.
В нейтральном атоме Z протонов внутри ядра уравновешиваются Z электронов вне его.

 {-24}\)
{-24}\) Примеры приведены в таблице \(\PageIndex{2}\).
Примеры приведены в таблице \(\PageIndex{2}\). ст.
ст. В отличие от протонов, число нейтронов не является абсолютно фиксированным для большинства элементов. Атомы, имеющие одинаковое количество протонов и, следовательно, одинаковый атомный номер, но разное количество нейтронов, называются изотопами. Все изотопы элемента имеют одинаковое количество протонов и электронов, что означает, что они обладают одинаковым химическим составом. Изотопы элемента отличаются только своей атомной массой, которая определяется массовым числом (А), суммой числа протонов и нейтронов.
В отличие от протонов, число нейтронов не является абсолютно фиксированным для большинства элементов. Атомы, имеющие одинаковое количество протонов и, следовательно, одинаковый атомный номер, но разное количество нейтронов, называются изотопами. Все изотопы элемента имеют одинаковое количество протонов и электронов, что означает, что они обладают одинаковым химическим составом. Изотопы элемента отличаются только своей атомной массой, которая определяется массовым числом (А), суммой числа протонов и нейтронов. Свойства некоторых распространенных изотопов приведены в таблице \(\PageIndex{3}\).
Свойства некоторых распространенных изотопов приведены в таблице \(\PageIndex{3}\). 014102
014102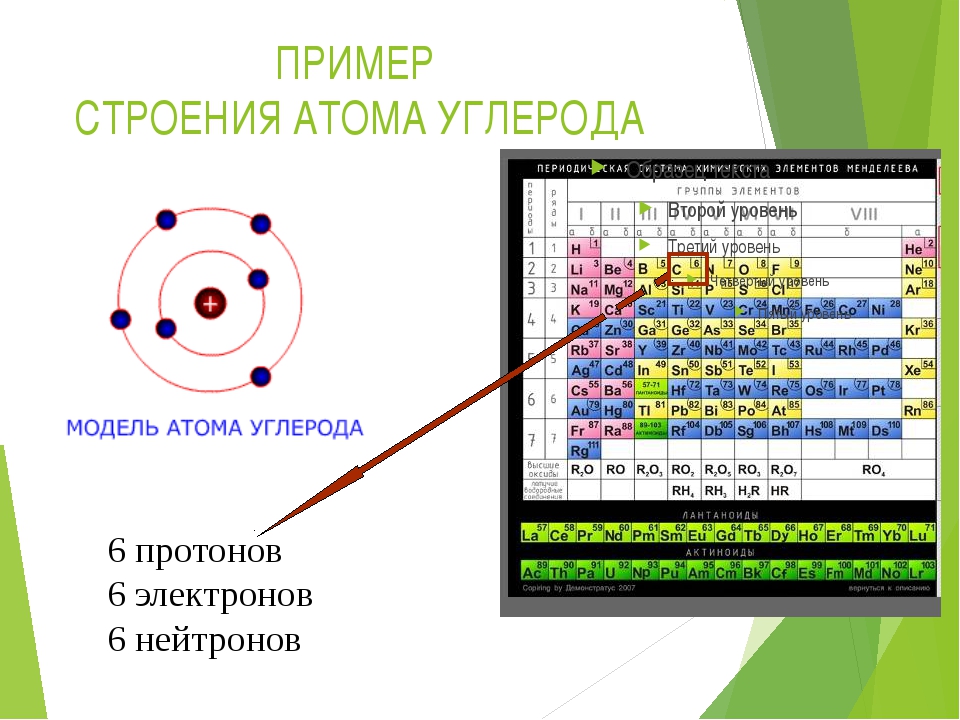 003355
003355 939611
939611 043930
043930

 нейтрон
нейтрон 


 Внешние круговые орбиты.
Внешние круговые орбиты.  Итак, изотопы имеют атомы, которые не похожи во всех аспектах.
Итак, изотопы имеют атомы, которые не похожи во всех аспектах. Гамма-лучи — это излучений, подобных свету.
Гамма-лучи — это излучений, подобных свету. 
 1.4 × 10 -19 C
1.4 × 10 -19 C 


 ] [ Границы оценки: Оценка ограничивается элементами основной группы. Оценка не включает количественное понимание энергии ионизации за пределами относительных тенденций. ]
] [ Границы оценки: Оценка ограничивается элементами основной группы. Оценка не включает количественное понимание энергии ионизации за пределами относительных тенденций. ] Оценка ограничивается альфа-, бета- и гамма-радиоактивным распадом. ]
Оценка ограничивается альфа-, бета- и гамма-радиоактивным распадом. ] Посетите официальный веб-сайт CISCE для получения подробной информации о ICSE Board Class-8.
Посетите официальный веб-сайт CISCE для получения подробной информации о ICSE Board Class-8.
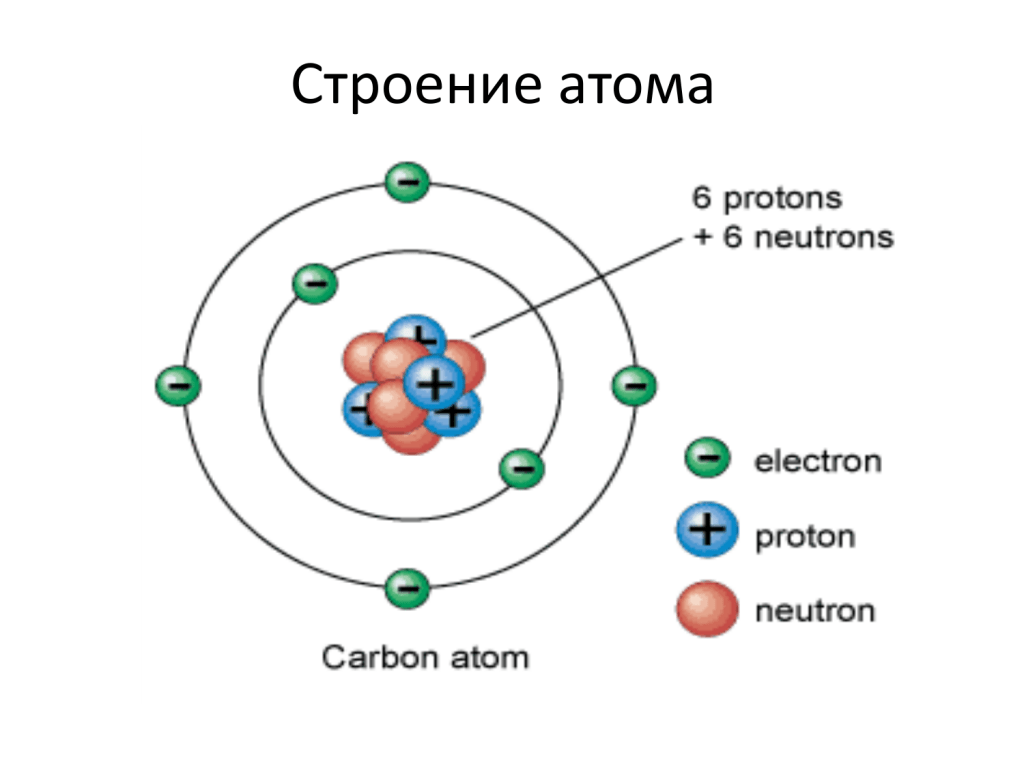
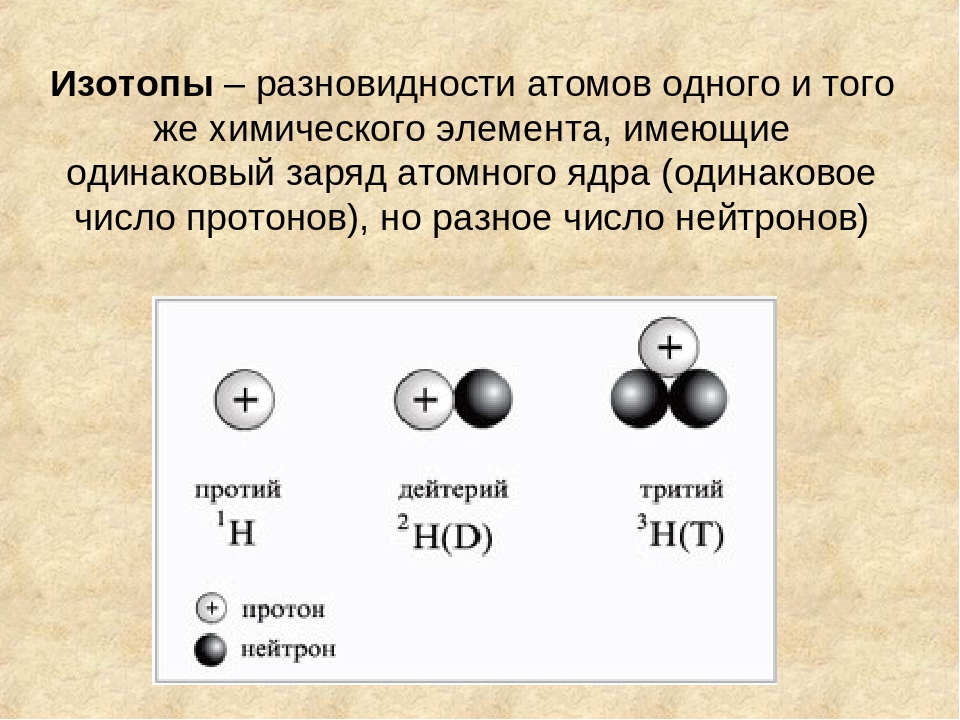 Катодный луч отклонялся от отрицательно заряженной пластины к положительно заряженной пластине.Это указывало на то, что катодный луч состоит из отрицательно заряженных частиц.
Катодный луч отклонялся от отрицательно заряженной пластины к положительно заряженной пластине.Это указывало на то, что катодный луч состоит из отрицательно заряженных частиц.
 Чтобы отклонить альфа-частицу назад, должна быть очень большая сила. Эта сила могла быть обеспечена только в результате столкновения с массивной целью или от взаимодействия с электрическим или магнитным полем большой напряженности.
Чтобы отклонить альфа-частицу назад, должна быть очень большая сила. Эта сила могла быть обеспечена только в результате столкновения с массивной целью или от взаимодействия с электрическим или магнитным полем большой напряженности.


 Резерфорд вошел в центр физического мира. Исследователи приходили к нему десятками.
Резерфорд вошел в центр физического мира. Исследователи приходили к нему десятками. … Я очень хорошо помню Мозли, с которым был в очень дружеских отношениях. Я расскажу вам позже о его работе. И Чарльз Дарвин был там. Он читал лекции по теоретической физике. И Рассел, который позже поступил в Оксфорд. Итальянец Росси занимался спектроскопией. Он показал, что ионий и натрий имеют одинаковый спектр. И тут появился Гейгер. Он был помощником. А также помощник по имени Маковер, который с тех пор умер. Гейгер и Маковер вместе опубликовали книгу. А еще парень Робинзон, работавший над бета-лучами.Грей, житель Новой Зеландии. Марсден, приехавший из Австралии. Фаяны, приехавшие из Германии. И Болтвуд был там какое-то время. Он приехал из Йеля. Резерфорд пригласил его в надежде, что Болтвуд, великий химик, очистит ионий, но он потерпел неудачу, как и многие другие.
… Я очень хорошо помню Мозли, с которым был в очень дружеских отношениях. Я расскажу вам позже о его работе. И Чарльз Дарвин был там. Он читал лекции по теоретической физике. И Рассел, который позже поступил в Оксфорд. Итальянец Росси занимался спектроскопией. Он показал, что ионий и натрий имеют одинаковый спектр. И тут появился Гейгер. Он был помощником. А также помощник по имени Маковер, который с тех пор умер. Гейгер и Маковер вместе опубликовали книгу. А еще парень Робинзон, работавший над бета-лучами.Грей, житель Новой Зеландии. Марсден, приехавший из Австралии. Фаяны, приехавшие из Германии. И Болтвуд был там какое-то время. Он приехал из Йеля. Резерфорд пригласил его в надежде, что Болтвуд, великий химик, очистит ионий, но он потерпел неудачу, как и многие другие. Резерфорд постепенно все больше обращал свое внимание на сами лучи α (альфа), β (бета) и γ (гамма) и на то, что они могут рассказать об атоме. То есть он оставлял радиохимию другим и обращался к физике.
Резерфорд постепенно все больше обращал свое внимание на сами лучи α (альфа), β (бета) и γ (гамма) и на то, что они могут рассказать об атоме. То есть он оставлял радиохимию другим и обращался к физике.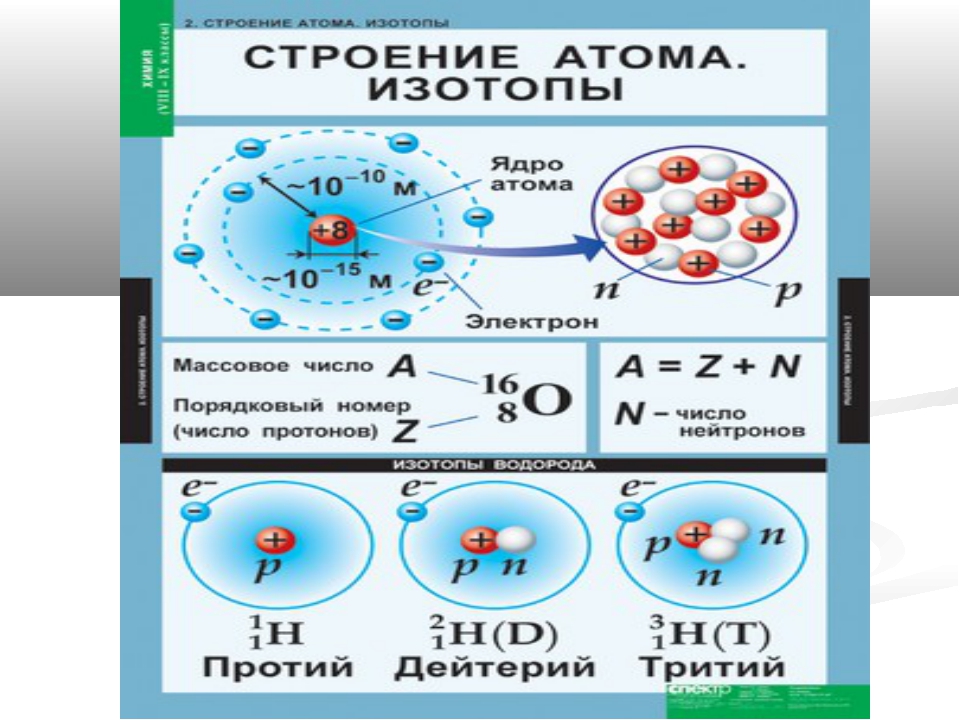 Задавшим вопрос был Сэмюэл Девонс (1914–2006), который был одним из последних учеников Резерфорда в 1930-х годах.
Задавшим вопрос был Сэмюэл Девонс (1914–2006), который был одним из последних учеников Резерфорда в 1930-х годах. ……. напал на эти мелочи, понимаете».
……. напал на эти мелочи, понимаете». В первом методе использовались сцинтилляции, возбуждаемые частицами α на тонком слое сульфида цинка. Они наблюдали их в микроскоп и подсчитывали мерцания под разными углами рассеивания. Они также разработали «электрометр», который мог продемонстрировать большой аудитории прохождение отдельной частицы α . Прибор, который превратился в «счетчик Гейгера», имел частично вакуумированный металлический цилиндр с проволокой по центру. Они приложили напряжение между цилиндром и проводом, достаточно высокое, чтобы почти искрить.Они пропускали α частиц через тонкое слюдяное окно, где эти частицы сталкивались с газами, образуя ионы газа. Затем они столкнулись с другими молекулами и произвели больше ионов и так далее. Каждая частица α производила каскад ионов, которые частично разряжали цилиндр и указывали на прохождение частицы α . Гейгер и Резерфорд опубликовали в 1908 и 1909 годах несколько статей об этих методах и их использовании.
В первом методе использовались сцинтилляции, возбуждаемые частицами α на тонком слое сульфида цинка. Они наблюдали их в микроскоп и подсчитывали мерцания под разными углами рассеивания. Они также разработали «электрометр», который мог продемонстрировать большой аудитории прохождение отдельной частицы α . Прибор, который превратился в «счетчик Гейгера», имел частично вакуумированный металлический цилиндр с проволокой по центру. Они приложили напряжение между цилиндром и проводом, достаточно высокое, чтобы почти искрить.Они пропускали α частиц через тонкое слюдяное окно, где эти частицы сталкивались с газами, образуя ионы газа. Затем они столкнулись с другими молекулами и произвели больше ионов и так далее. Каждая частица α производила каскад ионов, которые частично разряжали цилиндр и указывали на прохождение частицы α . Гейгер и Резерфорд опубликовали в 1908 и 1909 годах несколько статей об этих методах и их использовании. У меня никогда не было бы времени на рутинную работу, пока мы не наладили бы дела в хорошем стиле. В итоге все прошло хорошо, но россыпь это черт. Наша трубка работала как часы, и мы могли легко получить дальность 50 мм. для каждой частицы. … Гейгер — демон в работе по подсчету мерцаний, и он мог считать с интервалами всю ночь, не нарушая своего невозмутимости. Я энергично ругался и удалился через две минуты. (Цитируется по Еве, стр. 180.)
У меня никогда не было бы времени на рутинную работу, пока мы не наладили бы дела в хорошем стиле. В итоге все прошло хорошо, но россыпь это черт. Наша трубка работала как часы, и мы могли легко получить дальность 50 мм. для каждой частицы. … Гейгер — демон в работе по подсчету мерцаний, и он мог считать с интервалами всю ночь, не нарушая своего невозмутимости. Я энергично ругался и удалился через две минуты. (Цитируется по Еве, стр. 180.) Это то, что он получил в Кембридже [после 1919 года], чего мы никогда не получали здесь, понимаете, потому что у нас не было денег. (Хьюз, «Уильям Кей», 2008 г., стр. 109–110.)
Это то, что он получил в Кембридже [после 1919 года], чего мы никогда не получали здесь, понимаете, потому что у нас не было денег. (Хьюз, «Уильям Кей», 2008 г., стр. 109–110.)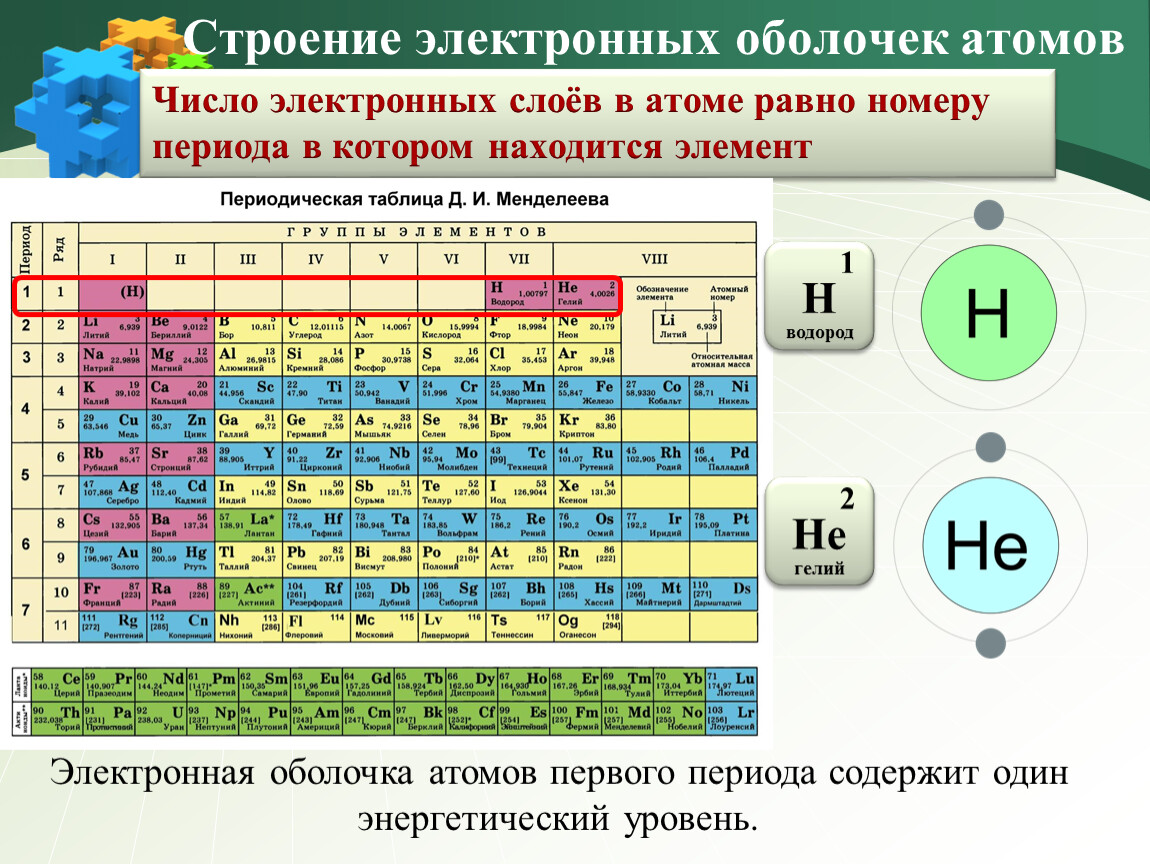 Затем Резерфорд обратил свое внимание на использование их для исследования атома.
Затем Резерфорд обратил свое внимание на использование их для исследования атома.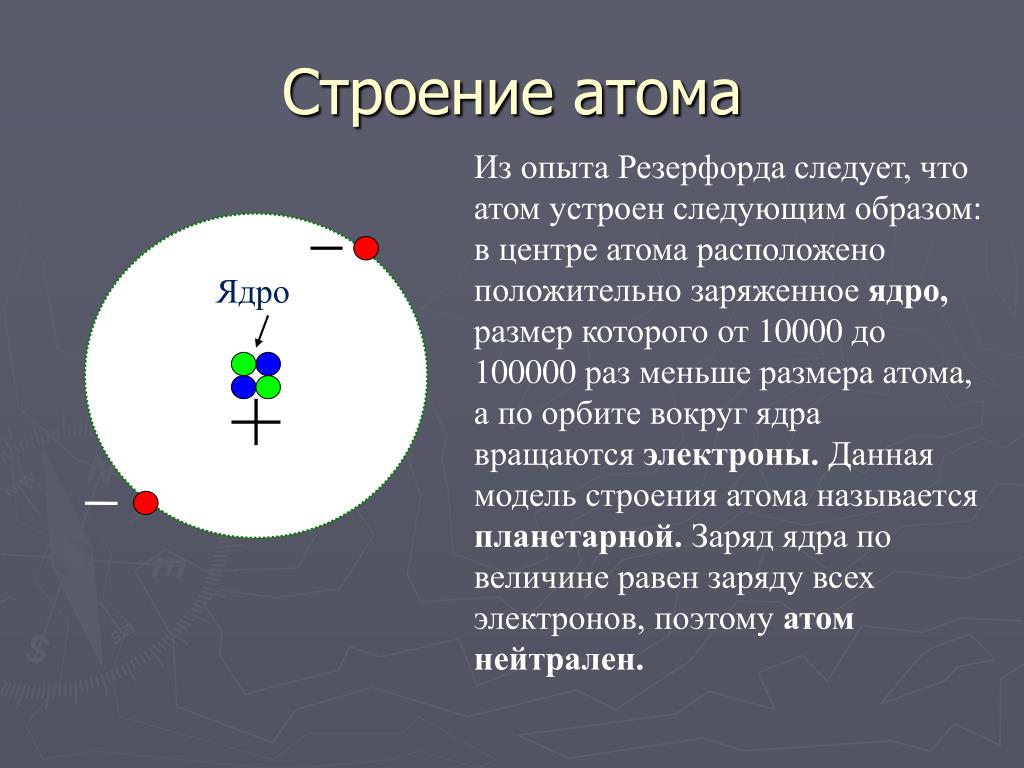 Резерфорд всегда был готов встретить неожиданное и использовать его там, где это было выгодно, но он также знал, когда нужно остановиться в таких прогулках. (Биркс, 1962, стр. 8)
Резерфорд всегда был готов встретить неожиданное и использовать его там, где это было выгодно, но он также знал, когда нужно остановиться в таких прогулках. (Биркс, 1962, стр. 8) ..» Это было самое невероятное событие, которое когда-либо случалось с меня в моей жизни. Это было почти невероятно, как если бы вы выстрелили 15-дюймовым снарядом в кусок папиросной бумаги, а он вернулся бы и попал в вас.( Резерфорд , 1938, стр. 68)
..» Это было самое невероятное событие, которое когда-либо случалось с меня в моей жизни. Это было почти невероятно, как если бы вы выстрелили 15-дюймовым снарядом в кусок папиросной бумаги, а он вернулся бы и попал в вас.( Резерфорд , 1938, стр. 68) У Резерфорда не сразу появилась смелая идея — ядерный атом, а он пришел к ней постепенно, рассматривая проблему со многих сторон.
У Резерфорда не сразу появилась смелая идея — ядерный атом, а он пришел к ней постепенно, рассматривая проблему со многих сторон. »
»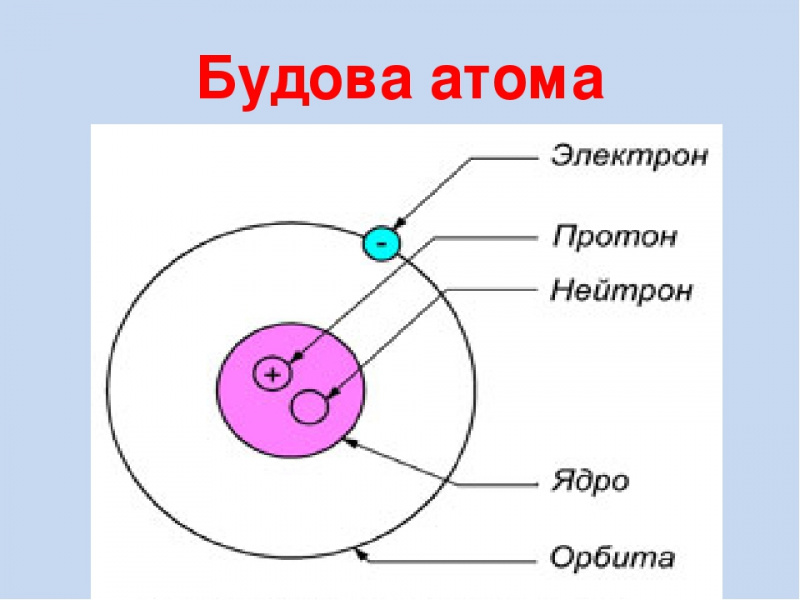 Он, насколько я помню, ничего не сказал о результатах, кроме того, что они были весьма решающими. И, как я уже говорил, он никогда бы не сделал такого публичного заявления, если бы у него не было веских доказательств. И это одна из характеристик, пронизывающих всю работу Резерфорда, особенно всю его работу вплоть до конца манчестерского периода. Если вы посмотрите на некоторые из его ранних работ — я называю Макгилла ранними днями, — он был совершенно убежден, что альфа-частицы — это атомы гелия, но он никогда не говорил этого в тех словах.Он всегда говорил, что это либо атомы гелия, либо молекулы водорода, а может быть, он говорил что-то еще об этом весе. Для него было весьма характерным то, что он никогда не говорил, что что-то так, если у него не было экспериментальных доказательств этого, которые действительно его удовлетворяли.
Он, насколько я помню, ничего не сказал о результатах, кроме того, что они были весьма решающими. И, как я уже говорил, он никогда бы не сделал такого публичного заявления, если бы у него не было веских доказательств. И это одна из характеристик, пронизывающих всю работу Резерфорда, особенно всю его работу вплоть до конца манчестерского периода. Если вы посмотрите на некоторые из его ранних работ — я называю Макгилла ранними днями, — он был совершенно убежден, что альфа-частицы — это атомы гелия, но он никогда не говорил этого в тех словах.Он всегда говорил, что это либо атомы гелия, либо молекулы водорода, а может быть, он говорил что-то еще об этом весе. Для него было весьма характерным то, что он никогда не говорил, что что-то так, если у него не было экспериментальных доказательств этого, которые действительно его удовлетворяли. (Биркс, стр. 183). Он быстро и грубо определил, что если эта основная теория верна, то несколько количественных соотношений должны быть верными. Во-первых, число α частиц, рассеянных на заданный угол, должно быть пропорционально толщине фольги. Во-вторых, это число должно быть пропорционально квадрату заряда ядра. Наконец, она должна быть обратно пропорциональна четвертой степени скорости частицы α . Эти три идеи определили экспериментальную программу Гейгера и Марсдена на следующий год.
(Биркс, стр. 183). Он быстро и грубо определил, что если эта основная теория верна, то несколько количественных соотношений должны быть верными. Во-первых, число α частиц, рассеянных на заданный угол, должно быть пропорционально толщине фольги. Во-вторых, это число должно быть пропорционально квадрату заряда ядра. Наконец, она должна быть обратно пропорциональна четвертой степени скорости частицы α . Эти три идеи определили экспериментальную программу Гейгера и Марсдена на следующий год. Он читал несколько лекций, но элементарных лекций, таких, которые человек должен знать до поступления в университет.Это были лекции для инженеров. Они были шумной компанией, и Резерфорд мог держать их под контролем. Возможно, в отделе был только один человек, который мог бы это сделать, и ему (Резерфорду?) они понравились, потому что он смог показать им очень интересные эксперименты, которые можно проводить на начальных курсах.
Он читал несколько лекций, но элементарных лекций, таких, которые человек должен знать до поступления в университет.Это были лекции для инженеров. Они были шумной компанией, и Резерфорд мог держать их под контролем. Возможно, в отделе был только один человек, который мог бы это сделать, и ему (Резерфорду?) они понравились, потому что он смог показать им очень интересные эксперименты, которые можно проводить на начальных курсах. Он будет метать частицу α по кругу и обратно к своему источнику. Он также рассмотрел почти забытую модель, предложенную японским физиком Хантаро Нагаока (1865–1950), — модель Сатурна. Нагаока и Резерфорд контактировали в 1910 и 1911 годах, и Резерфорд упомянул модель Нагаоки о «центральной притягивающей массе, окруженной кольцами вращающихся электронов» (Биркс, стр. 203). Конечным результатом этой критической статьи Резерфорда, однако, было заявление Резерфорда о том, что то, является ли атом диском или сферой, и действительно, положительный или отрицательный заряд в центре, не повлияет на расчеты.Резерфорд всегда старался не претендовать на большее, чем могли подтвердить его результаты.
Он будет метать частицу α по кругу и обратно к своему источнику. Он также рассмотрел почти забытую модель, предложенную японским физиком Хантаро Нагаока (1865–1950), — модель Сатурна. Нагаока и Резерфорд контактировали в 1910 и 1911 годах, и Резерфорд упомянул модель Нагаоки о «центральной притягивающей массе, окруженной кольцами вращающихся электронов» (Биркс, стр. 203). Конечным результатом этой критической статьи Резерфорда, однако, было заявление Резерфорда о том, что то, является ли атом диском или сферой, и действительно, положительный или отрицательный заряд в центре, не повлияет на расчеты.Резерфорд всегда старался не претендовать на большее, чем могли подтвердить его результаты.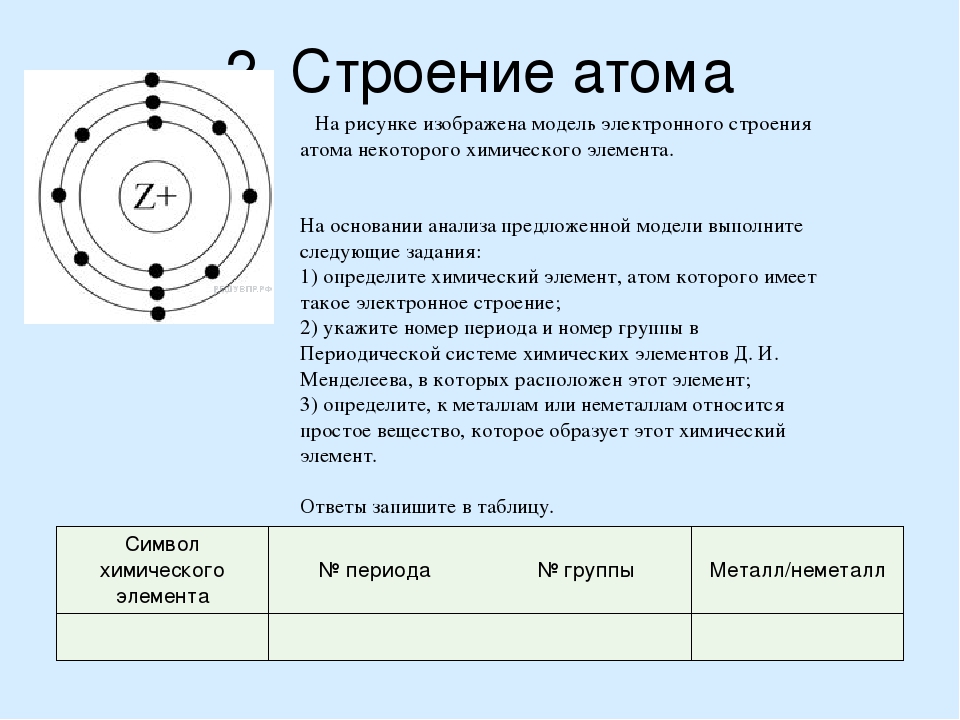 Первая крупная публикация их результатов была на немецком языке в Proceedings Венской академии наук ( Sitzungberichte der Wiener Akademie der Wissenschaften) в 1912 году.За этой 30-страничной версией последовала версия на английском языке в 1913 году в Философском журнале : «Законы отклонения α частиц под большими углами». Английская версия более известна. Небольшие различия между ними привели одного историка к предположению, что к августу 1912 года Резерфорд принял решение в пользу положительно заряженного центра (Trenn, 1974). Другие члены команды Резерфорда, особенно Чарльз Гальтон Дарвин (1887–1962), Х.Г.Дж. Мозли (1887–1915) и Нильс Бор (1885–1962) сыграли важную роль в окончательном создании Резерфордом ядерного атома.
Первая крупная публикация их результатов была на немецком языке в Proceedings Венской академии наук ( Sitzungberichte der Wiener Akademie der Wissenschaften) в 1912 году.За этой 30-страничной версией последовала версия на английском языке в 1913 году в Философском журнале : «Законы отклонения α частиц под большими углами». Английская версия более известна. Небольшие различия между ними привели одного историка к предположению, что к августу 1912 года Резерфорд принял решение в пользу положительно заряженного центра (Trenn, 1974). Другие члены команды Резерфорда, особенно Чарльз Гальтон Дарвин (1887–1962), Х.Г.Дж. Мозли (1887–1915) и Нильс Бор (1885–1962) сыграли важную роль в окончательном создании Резерфордом ядерного атома. Когда закончилась Великая война, Эрнест Марсден ненадолго помог с утомительными наблюдениями сцинтилляций, которые дали ключ к пониманию природы ядра.Резерфорд сообщил о предварительных результатах этих обширных экспериментов в 1919 году. Резерфорд поместил источник радия C (висмут-214) в герметичный латунный контейнер, приспособленный таким образом, чтобы положение источника можно было менять и чтобы можно было вводить или вводить различные газы. вакуум создается по желанию. Частицы α пересекали внутреннюю часть контейнера, проходили через щель, закрытую серебряной пластиной или другим материалом, и попадали на экран из сульфида цинка, где в затемненной комнате наблюдали мерцание.Когда в контейнер ввели газообразный водород и постарались поглотить частицы α до того, как они попадут на экран, сцинтилляции все еще наблюдались. Резерфорд предположил, что когда частицы α пересекают газообразный водород, они время от времени сталкиваются с ядрами водорода. Как писал Резерфорд, это произвело «стремительные атомы водорода», которые в основном выбрасывались вперед в направлении первоначального движения α частиц.
Когда закончилась Великая война, Эрнест Марсден ненадолго помог с утомительными наблюдениями сцинтилляций, которые дали ключ к пониманию природы ядра.Резерфорд сообщил о предварительных результатах этих обширных экспериментов в 1919 году. Резерфорд поместил источник радия C (висмут-214) в герметичный латунный контейнер, приспособленный таким образом, чтобы положение источника можно было менять и чтобы можно было вводить или вводить различные газы. вакуум создается по желанию. Частицы α пересекали внутреннюю часть контейнера, проходили через щель, закрытую серебряной пластиной или другим материалом, и попадали на экран из сульфида цинка, где в затемненной комнате наблюдали мерцание.Когда в контейнер ввели газообразный водород и постарались поглотить частицы α до того, как они попадут на экран, сцинтилляции все еще наблюдались. Резерфорд предположил, что когда частицы α пересекают газообразный водород, они время от времени сталкиваются с ядрами водорода. Как писал Резерфорд, это произвело «стремительные атомы водорода», которые в основном выбрасывались вперед в направлении первоначального движения α частиц. (Мы бы сказали, что он состоит из двух протонов.) Резерфорд пришел к выводу, что более вероятным объяснением является деформация сложных ядер во время столкновений, поскольку изменение сил между ядрами сложным образом меняется при близком сближении.
(Мы бы сказали, что он состоит из двух протонов.) Резерфорд пришел к выводу, что более вероятным объяснением является деформация сложных ядер во время столкновений, поскольку изменение сил между ядрами сложным образом меняется при близком сближении.