Химические свойства оснований, кислот, солей.
Химические свойства ОСНОВАНИЙ:1. Действие на индикаторы: лакмус — синий, метилоранж — жёлтый, фенолфталеин — малиновый,
2. Основание + кислота = Соли + вода Примечание: реакция не идёт, если и кислота, и щёлочь слабые. NaOH + HCl = NaCl + h3O
3. Щёлочь + кислотный или амфотерный оксид = соли + вода
2NaOH + SiO2 = Na2SiO3 + h3O
4. Щёлочь + соли = (новое) основание + (новая) соль прим-е: исходные вещества должны быть в растворе, а хотя бы 1 из продуктов реакции выпасть в осадок или мало растворяться. Ba(OH)2 + Na2SO4 = BaSO4+ 2NaOH
5.Слабые основания при нагреве разлагаются: Cu(OH)2+Q=CuO + h3O
6.При нормальных условиях невозможно получить гидроксиды серебра и ртути, вместо них в реакции появляются вода и соответствующий оксид: AgNO3 + 2NaOH(p) = NaNO3+Ag2O+h3O
Химические свойства КИСЛОТ:
Взаимодействие с оксидами металлов с образованием соли и воды:
CaO + 2HCl(разб. ) = CaCl2 + h3O
Взаимодействие с амфотерными оксидами с образованием соли и воды:
ZnO+2HNO3=ZnNO32+h3O
Взаимодействие со щелочами с образованием соли и воды (реакция нейтрализации) :
NaOH + HCl(разб. ) = NaCl + h3O
Взаимодействие с нерастворимыми основаниями с образованием соли и воды, если полученная соль растворима:
CuOh3+h3SO4=CuSO4+2h3O
Взаимодействие с солями, если выпадает осадок или выделяется газ:
BaCl2(тверд. ) + h3SO4(конц. ) = BaSO4↓ + 2HCl↑
Сильные кислоты вытесняют более слабые из их солей:
K3PO4+3HCl=3KCl+h4PO4
Na2CO3 + 2HCl(разб. ) = 2NaCl + CO2↑ + h3O
Металлы, стоящие в ряду активности до водорода, вытесняют его из раствора кислоты (кроме азотной кислоты HNO3 любой концентрации и концентрированной серной кислоты h3SO4), если образующаяся соль растворима:
Mg + 2HCl(разб. ) = MgCl2 + h3↑
С азотной кислотой и концентрированной серной кислотами реакция идёт иначе:
Mg + 2h3SO4 = MgSO4 + 2h3O + SO4↑
Для органических кислот характерна реакция этерификации (взаимодействие со спиртами с образованием сложного эфира и воды) :
Ch4COOH + C2H5OH = Ch4COOC2H5 + h3O
Химические свойства СОЛЕЙ
Определяются свойствами катионов и анионов, входящих в их состав.
Соли взаимодействуют с кислотами и основаниями, если в результате реакции получается продукт, который выходит из сферы реакции (осадок, газ, мало диссоциирующие вещества, например, вода) :
BaCl2(тверд. ) + h3SO4(конц. ) = BaSO4↓ + 2HCl↑
NaHCO3 + HCl(разб. ) = NaCl + CO2↑ + h3O
Na2SiO3 + 2HCl(разб. ) = SiO2↓ + 2NaCl + h3O
Соли взаимодействуют с металлами, если свободный металл находится левее металла в составе соли в электрохимическом ряде активности металлов:
Cu+HgCl2=CuCl2+Hg
Соли взаимодействуют между собой, если продукт реакции выходит из сферы реакции; в том числе эти реакции могут проходить с изменением степеней окисления атомов реагентов:
CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl
NaCl(разб. ) + AgNO3 = NaNO3 +AgCl↓
3Na2SO3 + 4h3SO4(разб. ) + K2Cr2O7 = 3Na2SO4 + Cr2(SO4)3 + 4h3O + K2SO4
Некоторые соли разлагаются при нагревании:
CuCO3=CuO+CO2↑
Nh5NO3 = N2O↑ + 2h3O
Nh5NO2 = N2↑ + 2h3O
УФФФФФФФФФФФФФФФФФ….
otvet.mail.ru
Кислоти, основания, соли основные свойства
|
Кислоты
H2SO4 — серная (сульфаты) HCl — соляная (хлориды) HNO3 — азотная (нитраты) H3PO4 — фосфорная (Фосфаты) H2SO3 -сернистая (сульфиты) H2S — сероводород (сульфиды) H2CO3 — угольная (карбонаты) H2SiO3 — кремниевая (силикаты) |
Основания NaOH — гидроксид натрия KOH — гидроксид калия Ca(OH)2 — гидроксид кальция Ba(OH)2 — гидроксид бария Mg(OH)2 — гидроксид магния Cu(OH)2 — гидроксид меди (II) Fe(OH)2 — гидроксид железа (II) Al(OH)3 — гидроксид алюминия |
Соли CuSO4 — сульфат меди (II) NaCl — хлориднатрия Fe(NO3)3 — нитрат железа (III) Ba3(PO4)3 -фосфат бария MgSO3 — сульфит магния FeS -сульфид железа (II) CaCO3 -карбонат кальция K2SiO3 -силикат калия Al2(SO4)3 -сульфат алюминия |
1. Кислоты реагируют
- с металлами, стоящими в ряду активностм левее водорода с выделением водорода (кроме азотной и концентрированной серной)
- с основными оксидами с образованием соли и воды
- с основаниями с образованием соли и воды
- с солями, образованными более слабыми кислотами с выпадением осадка или выделением газа
2. Азотная кислота реагирует со всеми металлами, кроме Au, Pt, Al, Fe, при этом водород не выделяется, а образуются различные соединения азота (NH4NO3, N2, N2O, NO, NO2) в зависимости от концентрации кислоты и активности металла.
3. Концентрированная серная кислота реагирует со всеми металлами, кроме Au, Pt, Al, Fe, при этом водород не выделяется, а выделяются различные соединения серы (H2S, S, SO2) в зависимости от активности металла.
4. Вытеснительный ряд кислот (по убыванию):
H2SO4 —> HCl и HNO3 —> H3PO4 —> H2SO3 —> H2S —> H2CO3 —> H2SiO3
5. Кислоты (кроме нерастворимой в воде кремниевой кислоты) изменяют окраску
6. Щелочи реагируют с кремнием, галогенами, кислотами, кислотными и амфотерными оксидами, амфотерными металлами и растворимыми солями, если выпадает осадок или выделяется газ аммиак.
7. Щелочи при нагревании не разлагаются, изменяют окраску индикаторов: фиолетовый лакмус в щелочах синеет, оранжевый метилоранж становится желтым, бесцветный фенолфталеин становится малиновым.
8. Нерастворимые основания реагируют с кислотами и разлагаются при нагревании на оксид металла и воду.
9. Амфотерные основания реагируют с кислотами, щелочами и разлагаются при нагревании.
10. Соли реагируют
-
со щелочами (если выпадает осадок или выделяется газ аммиак)
-
с кислотами, более сильными, чем та, которой образована соль
-
с другими растворимыми солями (если выпадает осадок)
-
с металлами (более активные вытесняют менее активные)
-
с галогенами (более активные галогены вытесняют менее активные и серу)
11. Нитраты разлагаются с выделением кислорода:
-
если металл стоит до Mg, образуется нитрит + кислород
-
если металл от Mg до Cu, образуется оксид металла + NO2 + O2
-
если металл стоит после Cu, образуется металл + NO2 + O2
-
нитрат аммония разлагается на N2O и H2O
12. Карбонаты щелочных металлов не разлагаются при нагревании
13. Карбонаты
Давайте порассуждаем вместе
1. Установите соответствие между исходными веществами и продуктами реакции.
Исходные вещества
Продукты реакции
А) Na2CO3 + HCl 1) NaCl + CO2 + H2O Б) Na2CO3 + CO2 + H2O 2) NaHCO3 + HCl В) Na2CO3 + CaCl2 3) NaOH + NaHCO3 4) NaHCO3 5) NaCl + CaCO3 Ответ:
т.к. Na2CO3 + 2HCl = 2NaCl + CO2 + H2O
Na2CO3 + CO2 + H2O = NaHCO3
Na2CO3 + CaCl2 = 2NaCl + CaCO3
2. Установите соответствие между исходными веществами и продуктами реакции.
Исходные вещества
Продукты реакции
А) H2SO4 + MgO 1) MgSO4 + H2O Б) H2SO4 + Mg(OH)2 2) MgSO4 + H2 В) Mg + H2S 3) MgS + H 2O 4) MgH2 + S 5) MgS + H2
Ответ:
т.к. H2SO4 + MgO = MgSO4 + H2O
H2SO4 + Mg(OH)2 = MgSO4 + 2H2O
Mg + H2S = MgS + H2
3. Установите соответствие между исходными веществами и продуктами реакции.
Исходные вещества
Продукты реакции
А) Al2O3 + NaOH 1) NaAlO2 + H2O Б) Al2 O3 + HCl 2) NaH2AlO3 В) Na2SO3 + CaCl2 3) AlCl3 + H2O 4) AlCl3 + H2 5) NaCl + CaSO3
Ответ:
т.к. Al2O3 + 2NaOH = 2NaAlO2 + H2O
Al2O3 + 6HCl = 2AlCl3 + 3H2O
Na2SO3 + CaCl2 = 2NaCl + CaSO3
dx-dy.ru
Свойства оснований и кислот | Дистанционные уроки
24-Май-2013 | Нет комментариев | Лолита Окольнова
Задание А10 ЕГЭ по химии —
Характерные химические свойства оснований и амфотерных гидроксидов. Характерные химические свойства кислот

Темы, которые нужно знать:
И опять определять основные химические свойства оснований и кислот мы будем по таблице:
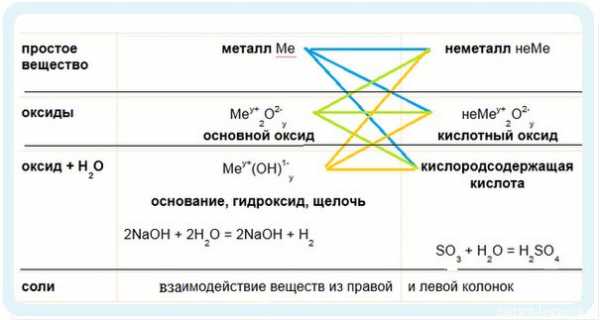
Химические свойства оснований:
1. Взаимодействие с неметаллами (идем по желтым стрелочкам):
при нормальных условиях гидроксиды не взаимодействуют с большинством неметаллов, исключение — взаимодействие щелочей с хлором:
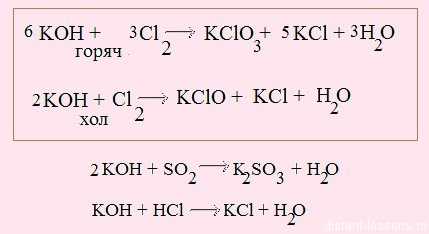
2. Взаимодействие с кислотными оксидами с образованием солей:
2NaOH + SO2 = Na2SO3 + H2O
3. Взаимодействие с кислотами — реакция нейтрализации:
- с образованием средних солей: 3NaOH + H3PO4 = Na3PO4 + 3H2O
условие образования средней соли — избыток щелочи; - с образованием кислых солей: NaOH + H3PO4 = NaH2PO4 + H2O
условие образования кислой соли — избыток кислоты; - с образованием основных солей: Cu(OH)2 + HCl = Cu(OH)Cl + H2O
условие образования основной соли — избыток основания.
4. С солями основания реагируют при выпадении осадка в результате реакции, выделения газа или образования малодиссоциирующего вещества:
2NaOH + CuCl2 = Cu(OH)2 ↓+ 2NaCl
NaOH + NH4Cl = NaCl + NH4OH — малодисс.
Амфотерные гидроксиды:
Ко всем свойствам оснований добавляются взаимодействие с основаниями:
Al(OH)3 + NaOH = Na[Al(OH)4]
Zn(OH)2 + NaOH = Na2[Zn(OH)4]
Основные свойства кислот
1. Кислоты взаимодействуют с металлами с выделением водорода, если металл стоит в ряду напряжений до водорода H:
2Na + 2HCl =2 NaCl + H2
с металлами после водорода Н взаимодействуют только кислоты — окислители и уже без выделения водорода:
Cu +2 H2SO4 = CuSO4 + SO2 +2 H2O
Кислоты — окислители могут взаимодействовать и с неметаллами:
S +2H2SO4 = 3SO2 +2 H2O
Какие кислоты являются окислителями? Те, в которых элемент кислотного остатка проявляет высшую (или близкую к высшей) степень окисления (соответствует номеру группы элемента):
| Кислота — окислитель | Степень окисления элемента |
| H2SO4 | степень окисления серы S= +6 |
| HNO3 | степень окисления азота N= +5 |
| HClO4 | степень окисления хлора Cl= +7 |
| HMnO4 | степень окисления марганца Mn= +7 |
| h3Cr2O7 | степень окисления хрома Cr= +6 |
2. С основными и амфотерными оксидами и основаниями кислоты дают соли:
Na2O + 2HCl = 2NaCl + H2O
2Al(OH)3 +3 H2SO4 = Al2(SO4)3 + H2O
3. C солями кислоты реагируют, если образуется осадок, газ или малодиссоциирующее вещество:
AgNO3 + HCl = AgCl ↓ + HNO3
Na2CO3 + H2SO4= Na2SO4 + CO2 ↑+ H2O
Свойства оснований и кислот определяются самыми простыми реакциями обмена и замещения, дополнительно — различные окислительно-восстановительные с участием кислот — окислителей.
Кстати, в нашем вопросе с гидроксидом калия:
1) Осадок. газ или малодиссоциирующее вещество не образуется — не подходит;
2) С гидроксидом алюминия реакция пойдет, а вот с нитратом серебра — нет;
3) С гидроксидом цинка реакция пойдет, с оксидом — нет, т.к. он основной;
4) 2KOH + ZnCl2 = Zn(OH)2 ↓+ 2KCl — выпадает осадок
6KOH + P2O5 (кислотный оксид) = 2K3PO4 + 3H2O
Ответ: 4)
Еще на эту тему:
Обсуждение: «Свойства оснований и кислот»
(Правила комментирования)distant-lessons.ru
Химические свойства оснований
1.
Основание + кислота 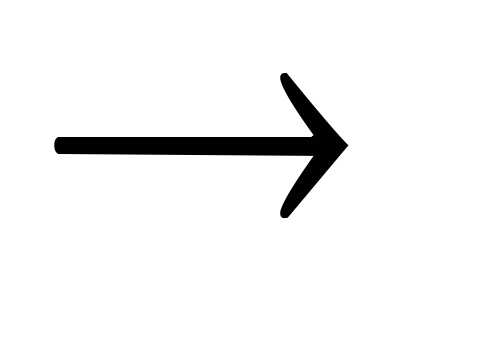 соль + вода
соль + вода
КОН
+ HCl 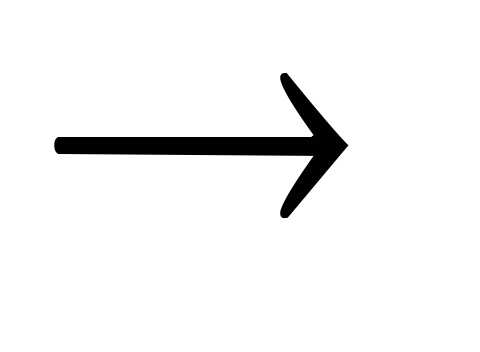 KCl + H2O.
KCl + H2O.
2.
Основание + кислотный оксид  соль + вода
соль + вода
2KOH
+ SO2 K2SO3 + H2O.
K2SO3 + H2O.
3.
Щелочь + амфотерный оксид/гидроксид  соль
+ вода
соль
+ вода
2NaOH(тв) + Al2O3 2NaAlO2 + H2O;
2NaAlO2 + H2O;
NaOH(тв) + Al(OH)3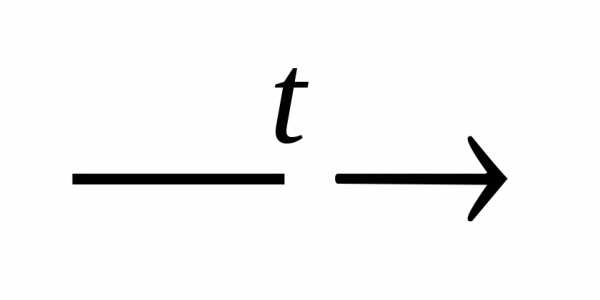 NaAlO2 + 2H2O.
NaAlO2 + 2H2O.
Основание + соль
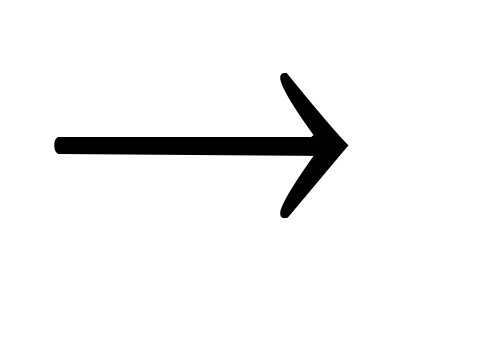 соль + основание.
соль + основание.
Реакция обмена между основанием и солью протекает только в растворе (и основание, и соль должны быть растворимы) и только в том случае, если хотя бы один из продуктов – осадок или слабый электролит (NH4OH, H2O)
Ba(OH)2 + Na2SO4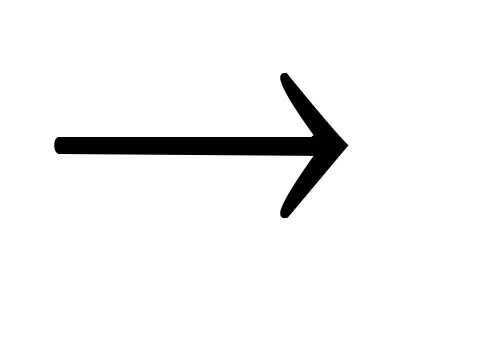 BaSO4
BaSO4 +
2NaOH;
+
2NaOH;
Ba(OH)2 + NH4Cl 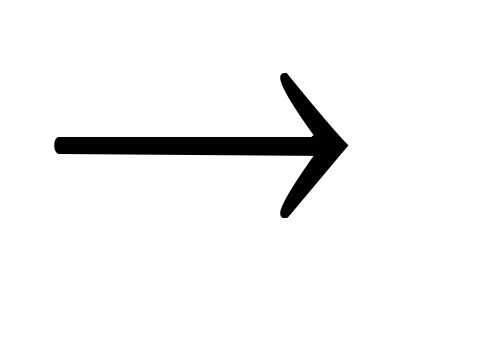 BaCl2 + NH4OH.
BaCl2 + NH4OH.
Основание
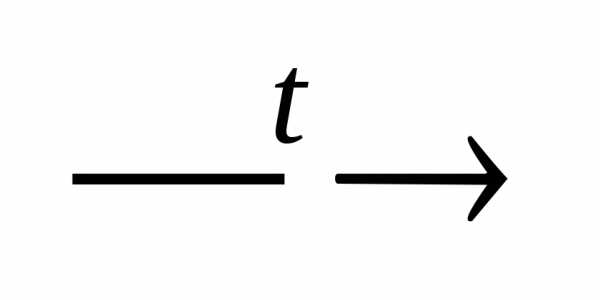 основной
оксид + вода.
основной
оксид + вода.
Термостойки только основания щелочных металлов за исключением LiOH
Ca(OH)2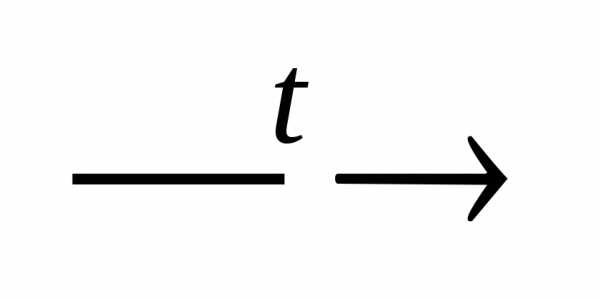 CaO
+ H2O;
CaO
+ H2O;
NaOH  ;
;
NH4OH 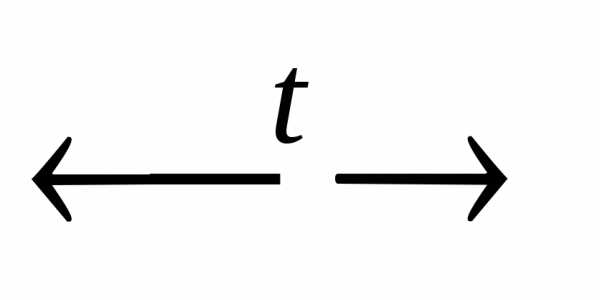 NH3 + H2O.
NH3 + H2O.
Щелочь + металл (образующий амфотерный оксид)
 соль + Н2
соль + Н2
2NaOH(тв) + Zn  Na2ZnO2 + H2.
Na2ZnO2 + H2.
КИСЛОТЫ
Кислотами с позиции ТЭД называются сложные вещества, диссоциирующие в растворах с образованием иона водорода Н+.
Классификация кислот
1. По числу атомов водорода, способных к отщеплению в водном растворе, кислоты делят на одноосновные (HF, HNO2), двухосновные (H2CO3, H2SO4), трехосновные (H3PO4).
2. По составу кислоты делят на бескислородные (HCl, H2S) и кислородсодержащие (HClO4, HNO3).
3. По способности кислот диссоциировать в водных растворах их делят на слабые и сильные. Молекулы сильных кислот в водных растворах распадаются на ионы полностью и их диссоциация необратима.
Например,
HCl  H+ + Cl—;
H+ + Cl—;
H2SO4 H+ + HSO
H+ + HSO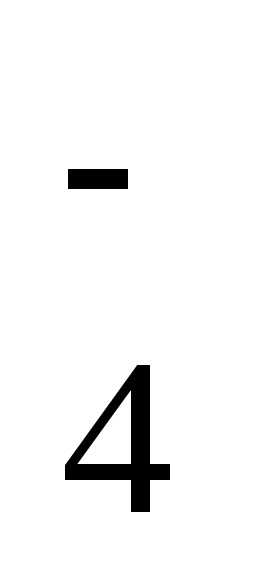 .
.
Слабые кислоты диссоциируют обратимо, т.е. их молекулы в водных растворах распадаются на ионы частично, а многоосновные — ступенчато.
СН3СООН 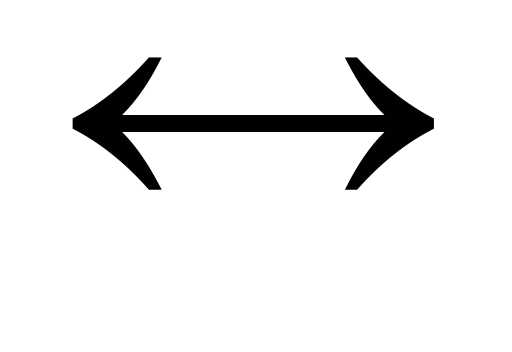 СН3СОО— + Н+;
СН3СОО— + Н+;
1)
H2S 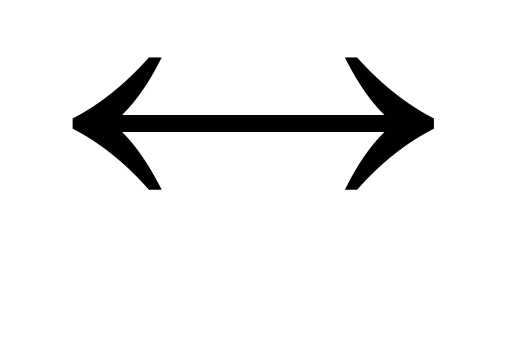 HS— +
H+,
2)
HS—
HS— +
H+,
2)
HS— 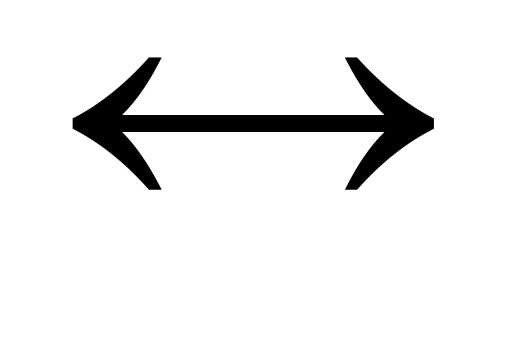 H+ + S2-.
H+ + S2-.
Часть
молекулы кислоты без одного или нескольких
ионов водорода Н+ называется кислотным
остатком.
Заряд кислотного остатка всегда
отрицательный и определяется числом
ионов Н+,
отнятых от молекулы кислоты. Например,
ортофосфорная кислота H3PO4 может
образовать три кислотных остатка: H2PO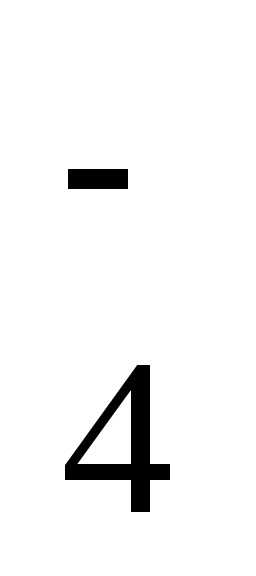 —
дигидрофосфат-ион, HPO
—
дигидрофосфат-ион, HPO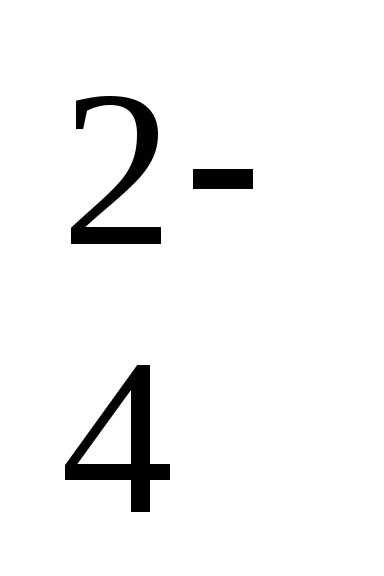 —
гидрофосфат-ион, PO
—
гидрофосфат-ион, PO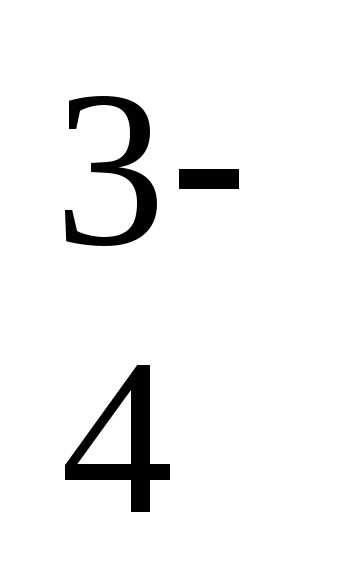 —
фосфат-ион.
—
фосфат-ион.
Названия бескислородных кислот составляют, добавляя к корню русского названия кислотообразующего элемента (или к названию группы атомов, например, CN— — циан) окончание — водородная: HCl – хлороводородная кислота (соляная кислота), H2S – сероводородная кислота, HCN – циановодородная кислота (синильная кислота).
Названия кислородсодержащих кислот также образуются от русского названия кислотообразующего элемента с добавлением слова «кислота». При этом название кислоты, в которой элемент находится в высшей степени окисления, оканчивается на «…ная» или «…овая», например, H2SO4 – серная кислота, H3AsO4 – мышьяковая кислота. С понижением степени окисления кислотообразующего элемента окончания изменяются в следующей последовательности: «…ная» (HClO4 – хлорная кислота), «…оватая» (HClO3 – хлорноватая кислота), «…истая» (HClO2 – хлористая кислота), «…оватистая» (HClO- хлорноватистая кислота). Если элемент образует кислоты, находясь только в двух степенях окисления, то название кислоты, отвечающей низшей степени окисления элемента, получает окончание «…истая» (HNO3 – азотная кислота, HNO2 – азотистая кислота).
Одному и тому же кислотному оксиду (например, Р2О5) могут соответствовать несколько кислот, содержащих по одному атому данного элемента в молекуле (например, HPO3 и H3PO4). В подобных случаях к названию кислоты, содержащей наименьшее число атомов кислорода в молекуле, добавляется приставка «мета…», а к названию кислоты, содержащей в молекуле наибольшее число атомов кислорода – приставка «орто…» (HPO3 – метафосфорная кислота, H3PO4 – ортофосфорная кислота).
Если же молекула кислоты содержит несколько атомов кислотообразующего элемента, то к ее названию добавляется числительная приставка, например, Н4Р2О7 – двуфосфорная кислота, Н2В4О7 – четырехборная кислота.
Кислоты, содержащие в своем составе группировки атомов –О-О-, можно рассматривать как производные перекиси водорода. В случае необходимости после приставки «пероксо…» в название кислоты помещают числительную добавку, указывающую на число атомов кислотообразующего элемента, входящего в состав молекулы, например,
Н2SO5 H2S2O8
H — O O O O
S H – O – S –O – O – S – O — H
H
— O — O  O
O
O
O
O
O
Пероксосерная кислота Пероксодвусерная кислота
Химические свойства кислот
Кислота + основание
 соль + вода
соль + вода
HF
+ KOH  KF + H2O.
KF + H2O.
Кислота + основной оксид
 соль + вода
соль + вода
H2SO4 + CuO  CuSO4 + H2O.
CuSO4 + H2O.
Кислота + амфотерный оксид/гидроксид
 соль + вода
соль + вода
2HCl
+ BeO  BeCl2 + H2O.
BeCl2 + H2O.
Кислота + соль
 соль + кислота.
соль + кислота.
Кислоты взаимодействуют с растворами солей, если при этом образуется нерастворимая в кислотах соль или более слабая (летучая) по сравнению с исходной кислота
H2SO4 + BaCl2 BaSO4
BaSO4  +2HCl;
+2HCl;
2HNO3 + Na2CO3 2NaNO3 + H2O +
CO2
2NaNO3 + H2O +
CO2 .
.
Кислота
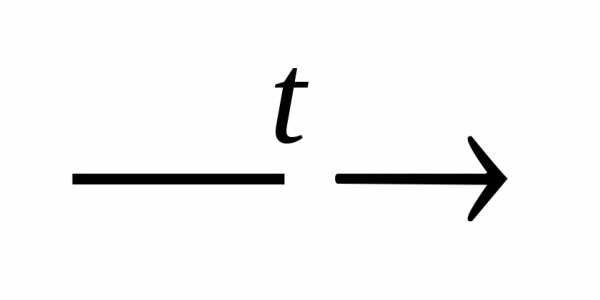 кислотный
оксид + вода
кислотный
оксид + вода
Н2СО3 Н2О
+ СО2.
Н2О
+ СО2.
Кислота + металл (в ряду напряжений до Н2)
 соль + Н2
соль + Н2
H2SO4(разб) + Fe  FeSO4 + H2;
FeSO4 + H2;
HCl
+ Cu 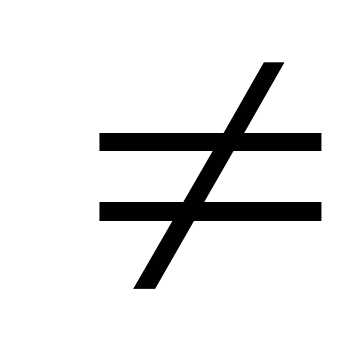 .
.
На рисунке 2 показано взаимодействие кислот с металлами.
КИСЛОТА — ОКИСЛИТЕЛЬ
Металл в ряду напряжения после Н2
+ реакция не идет
реакция не идетМеталл в ряду напряжения до Н2
+  соль металла
+ Н2
соль металла
+ Н2
в min степени
H2SO4 концентриро-
ванная
Au, Pt, Ir, Rh, Ta
окисления (с.о.) +  реакция
не идет
реакция
не идет
Металл щелочной/ щелочноземельный/Mq/Zn
H2S/SO2/S
от условий
Сульфат металла в max с.о.
Н2О
+  + +
+ +
+
Металл (остальные)
SO2
+  +
+
+
+
HNO3 концентриро-
ванная
Au, Pt, Ir, Rh, Ta
+  реакция не идет
реакция не идет
Металл щелочной/ щелочноземельный
N2O
Нитрат металла в max с.о.
Н2О
Металл (остальные; Al,Cr, Fe, Co, Ni при нагревании)
NO2
ТN +
+
 +
+
+
HNO3 разбавленная
Au, Pt, Ir, Rh, Ta
+  реакция
не идет
реакция
не идет
Металл щелочной/ щелочноземельный
NH3 (NH4NO3)
Нитратметал
ла в max с.о.
Н2О
+  +
+
Металл (остальные в ярду напряжений до Н2)
NO/N2O/N2/NH3(NH4NO3)
от условий
+ 
Металл (остальные в ряду напряжений после Н2)
NO
+ +
Рис.2. ВЗАИМОДЕЙСТВИЕ КИСЛОТ С МЕТАЛЛАМИ
СОЛИ
Соли – это сложные вещества, диссоциирующие в растворах с образованием положителльно заряженных ионов (катионов – основных остатков), за исключением ионов водорода, и отрицательно заряженных ионов (анионов – кислотных остатков), отличных от гидрокисид – ионов.
studfiles.net
Свойства кислот, оснований и солей — Знаешь как
Рис. 78. Прибор для сравнения силы различных кислот по скорости выделения водорода
В предыдущих параграфах мы познакомились с теорией электролитической диссоциации. Рассмотрим теперь в свете этой теории свойства тех веществ — кислот, оснований и солей, которые являются электролитами в водных растворах.
1. Кислоты. Как известно, для кислот характерны следующие свойства:
а) кислый вкус;
б) способность изменять цвета многих индикаторов, в частности окрашивать лакмус в красный цвет;
в) способность растворять некоторые металлы с выделением водорода;
г) способность взаимодействовать с основаниями, с образованием солей.
Все эти свойства кислоты проявляют только в растворах, и притом почти исключительно в водных растворах. Так, например, сухой хлористый водород или раствор его в бензоле совсем не обладает кислотными свойствами, даже не окрашивает лакмусовую бумажку в красный цвет, а раствор его в воде — соляная кислота — одна из наиболее типичных кислот; точно так же безводная серная кислота совершенно не действует на цинк при обыкновенной температуре, тогда как ее водный раствор энергично реагирует с цинком, выделяя водород.
Но в водных растворах, как мы теперь знаем, присутствуют не молекулы кислот, а главным образом свободные ионы. Понятно, что и свойства таких растворов должны зависеть от свойств отдельных ионов, а не целых молекул.
Так как при диссоциации любой кислоты обязательно образуются водородные ионы, то все свойства, которые являются общими для водных растворов кислот, мы должны приписать водородным ионам, или, точнее, ионам гидроксония. Это они окрашивают лакмус в красный цвет, они вступают в реакцию с металлами, сообщают кислотам кислый вкус и т. д. С устранением водородных ионов, например при нейтрализации, исчезают и кислотные свойства. Поэтому теория электролитической диссоциации определяет кислоты как электролиты, диссоциирующие в водных растворах с образованием ионов водорода и не дающие никаких других положительно заряженных ионов. Последнее добавление необходимо потому, что некоторые кислые соли, как, например, КН2РО4, NaHSО4, также отщепляют в водных растворах ионы водорода, но наряду с ними образуют и положительно заряженные ионы металлов .
Кислоты, у которых ярко проявляются перечисленные выше свойства, называются сильные и кислотами. Так как носителями кислотных свойств являются ионы водорода, то, конечно, кислота будет тем сильнее, чем больше концентрация ионов водорода в ее растворе при данном разбавлении, т. е. чем лучше кислота диссоциирует. Сильными являются, например, соляная и азотная кислоты, которые, вероятно, диссоциированы целиком, но вследствие электрического взаимодействия между ионами их кажущаяся степень диссоциации в 0,1 н. растворе равна примерно 92%. Наоборот, такие кислоты, степень диссоциации которых не велика, как, например, уксусная, угольная и др., считаются слабыми.
Таким образом, мерой силы кислот служит степень их диссоциации.
О силе кислот можно судить по различным реакциям. В качестве примера укажем на скорость выделения водорода из различных кислот при взаимодействии их с металлами.
Произведем следующий опыт. Нальем в три маленькие колбочки нормальные растворы соляной, фосфорной и уксусной кислот. Бросив в колбочки по одинаковому кусочку цинка или магния, быстро закупорим их пробками с газоотводными трубками, концы которых подведены под отверстия бюреток, опрокинутых в ванну с водой (рис. 78).
Быстрее всего водород выделяется из соляной кислоты, значительно медленнее из фосфорной и очень медленно из уксусной. Таким образом, если судить о силе кислот по скорости выделения водорода, то наиболее сильной из взятых кислот оказывается соляная, а наименее сильной — уксусная, что вполне согласуется со степенью их диссоциации.
Различие в силе кислот по мере разбавления их растворов водой постепенно сглаживается, так как с увеличением разбавления степень диссоциации всех электролитов растет, приближаясь степень диссоциации и концентрация водородных ионов в растворах HCl к 100%. При очень большом разбавлении все кислоты и основания диссоциированы почти нацело, т. е. одинаково сильны. Отсюда не следует, однако, делать вывода, что чем более разбавлена кислота, тем энергичнее она действует. Дело в том, что действие кислоты определяется концентрацией находящихся в ее растворе ионов водорода, которая, в свою очередь, зависит как от степени диссоциации, так и от общей концентрации кислоты. Хотя с разбавлением раствора степень диссоциации увеличивается, но общая концентрация кислоты уменьшается, и притом обыкновенно быстрее, чем растет первая. Поэтому в разбавленных растворах концентрация водородных ионов всегда меньше, чем в концентрированных. В сказанном легко убедиться хотя бы на примере соляной кислоты (табл. 13).
2. Основания. Водные растворы оснований обладают следующими общими свойствами:
а) своеобразным «мыльным» вкусом;
б) способностью изменять цвета индикаторов иначе, чем их изменяют кислоты, например окрашивать лакмус в синий цвет;
в) способностью взаимодействовать с кислотами с образованием солей.
Так как общим для всех растворов оснований является присутствие в них гидроксильных ионов, то ясно, что носителем щелочных свойств является ион гидроксила. Поэтому с точки зрения ионной теории основания — это электролиты, диссоциирующие в водных растворах с отщеплением гидроксильных ионов .
Сила оснований, как и сила кислот, зависит от степени их диссоциации. Наиболее сильные основания — едкий натр и едкое кали, которые в водных растворах, вероятно, диссоциируют полностью, хотя кажущаяся степень их диссоциации в0,1 н. растворах составляет около 90%. Большинство оснований являются слабыми электролитами.
3. Соли. Соли можно определить как электролиты, которые при растворении в воде диссоциируют, отщепляя положительные ионы, отличные от ионов водорода, и отрицательные ионы, отличные от ионов гидроксила. Таких ионов, которые были бы общими для водных растворов всех солей, нет; поэтому соли и не
| Концентрация НCl | Степень диссоциации в % | Концентрация водородных ионов в г-ион/л |
| 10 н. 1 н. 0,1 н. | 12 78 92 | 1,2 0,78 0,092 |
обладают общими свойствами. Как правило, соли хорошо диссоциированы, и тем лучше, чем меньше валентность образующих соль ионов.
91 93 94
Вы читаете, статья на тему Свойства кислот, оснований и солей
znaesh-kak.com
Химические свойства оснований — урок. Химия, 8–9 класс.
Химические свойства гидроксида металла во многом зависят от того, к какой группе он принадлежит — к щелочам или к нерастворимым основаниям.
Общие химические свойства щелочей
1. Кристаллы щелочей при растворении в воде полностью диссоциируют, то есть распадаются на положительно заряженные ионы металла и отрицательно заряженные гидроксид-ионы.
A) Например, при диссоциации гидроксида натрия образуются положительно заряженные ионы натрия и отрицательно заряженные гидроксид-ионы:
NaOH→Na++OH−.
Б) Процесс диссоциации гидроксида кальция отображается следующим уравнением:
Ca(OH)2→Ca2++2OH−.
2. Растворы щелочей изменяют окраску индикаторов.
Фактически с индикатором взаимодействуют гидроксид-ионы, содержащиеся в растворе любой щёлочи. При этом протекает химическая реакция с образованием нового продукта, признаком протекания которой является изменение окраски вещества.
Изменение окраски индикаторов в растворах щелочей
Индикатор | Изменение окраски индикатора |
| Лакмус | Фиолетовый лакмус становится синим |
| Фенолфталеин | Беcцветный фенолфталеин становится малиновым |
Универсальный индикатор | Универсальный индикатор становится синим |
Видеофрагмент:
Действие щелочей на индикаторы |
3. Щёлочи взаимодействуют с кислотами, образуя соль и воду.
Реакции обмена между щелочами и кислотами называют реакциями нейтрализации.
А) Например, при взаимодействии гидроксида натрия с соляной кислотой образуются хлорид натрия и вода: NaOH+HCl→NaCl+h3O.
Видеофрагмент:
Взаимодействие гидроксида натрия с соляной кислотой |
Б) Если нейтрализовать гидроксид кальция азотной кислотой, образуются нитрат кальция и вода:
Ca(OH)2+2HNO3→Ca(NO3)2+2h3O.
4. Щёлочи взаимодействуют с кислотными оксидами, образуя соль и воду.
А) Например, при взаимодействии гидроксида кальция с оксидом углерода(\(IV\)) т. е. углекислым газом, образуются карбонат кальция и вода:
Ca(OH)2+CO2→CaCO3↓+h3O.
Обрати внимание!
При помощи этой химической реакции можно доказать присутствие оксида углерода(\(IV\)): при пропускании углекислого газа через известковую воду (насыщенный раствор гидроксида кальция) раствор мутнеет, поскольку выпадает осадок белого цвета — образуется нерастворимый карбонат кальция.
Б) При взаимодействии гидроксида натрия с оксидом фосфора(\(V\)) образуются фосфат натрия и вода:
6NaOH+P2O5→2Na3PO4+3h3O.
5. Щёлочи могут взаимодействовать с растворимыми в воде солями.
Обрати внимание!
Реакция обмена между основанием и солью возможна в том случае, если оба исходных вещества растворимы, а в результате образуется хотя бы одно нерастворимое вещество (выпадает осадок).
А) Например, при взаимодействии гидроксида натрия с сульфатом меди(\(II\)) образуются сульфат натрия и гидроксид меди(\(II\)):
2NaOH+CuSO4→Na2SO4+Cu(OH)2↓.
Б) При взаимодействии гидроксида кальция с карбонатом натрия образуются карбонат кальция и гидроксид натрия:
Ca(OH)2+Na2CO3→CaCO3↓+2NaOH.
6. Малорастворимые щёлочи при нагревании разлагаются на оксид металла и воду.
Например, если нагреть гидроксид кальция, образуются оксид кальция и водяной пар:
Ca(OH)2⟶t°CaO+h3O↑.
Общие химические свойства нерастворимых оснований
1. Нерастворимые основания взаимодействуют с кислотами, образуя соль и воду.
А) Например, при взаимодействии гидроксида меди(\(II\)) с серной кислотой образуются сульфат меди(\(II\)) и вода:
Cu(OH)2+h3SO4→CuSO4+2h3O.
Б) При взаимодействии гидроксида железа(\(III\)) с соляной (хлороводородной) кислотой образуются хлорид железа(\(III\)) и вода:
Fe(OH)3+3HCl→FeCl3+3h3O.
Видеофрагмент:
Взаимодействие гидроксида железа(\(III\)) с соляной кислотой |
2. Некоторые нерастворимые основания могут взаимодействовать с некоторыми кислотными оксидами, образуя соль и воду.
Например, при взаимодействии гидроксида меди(\(II\)) с оксидом серы(\(VI\)) образуются сульфат меди(\(II\)) и вода:
Cu(OH)2+SO3⟶t°CuSO4+h3O.
3. Нерастворимые основания при нагревании разлагаются на оксид металла и воду.
А) Например, при нагревании гидроксида меди(\(II\)) образуются оксид меди(\(II\)) и вода:
Cu(OH)2⟶t°CuO+h3O.
Видеофрагмент:
Разложение гидроксида меди(\(II\)) |
Б) Гидроксид железа(\(III\)) при нагревании разлагается на оксид железа(\(III\)) и воду:
2Fe(OH)3⟶t°Fe2O3+3h3O.
www.yaklass.ru
Свойства оснований, кислот, солей и оксидов
Кислоты в свете ТЭД
Химические свойства кислот.
Кислота Р., Н. + Ме(ОН)х Р., Н. = соль + вода (р. Обмена, р. Нейтрализации, если Ме(ОН)х— щелочь)
Кислота Р.+ МехОу (степень окисления Ме от +1до +4) = сольР. + вода (р. Обмена,)
Кислота Р.+ соль Р. иногда Н.= новая кислота + новая соль (р. Обмена, ↓, ↑-СО2, SO2, Н2S, кислота сильнее новой кислоты)
Кислота + Ме = соль + Н2↑ (р. Замещения, происходит если: а) Ме стоит в ЭХРН до Н2, б) Соль — р., в) Кислота – р., г) Кислота не HNO3 и не конц. Н2SO4)
Способы получения
Кислотный оксид + вода = кислота (кислородсодержащие кислоты)
НеМе + Н2= НхнеМе (бескислородные кислоты)
Соль + кислота = новая кислота + новая соль↓
Основания в свете ТЭД
Химические свойства оснований.
Кислота Р., Н. + Ме(ОН)х Р., Н. = соль + вода (р. Обмена, р. Нейтрализации, если Ме(ОН)х— щелочь)
Основание Р.+ МехОу (степень окисления Ме от +5 до +7) = соль + вода (р. Обмена)
Основание Р.+ неМехОу = соль + вода (р. Обмена)
Основание Р.+ соль Р.= новое основание + новая соль (р. Обмена, ↓, ↑-NH3)
Нерастворимое основание t= неМехОу + Н2О↑ (р. Разложения)
Способы получения
Оксид Ме + вода = щелочь (Li2O, Na2O, K2O, Rb2O, Cs2O, CaO, BaO, SrO)
Щелочной 2Ме + 2Н2О= 2МеОН Р + Н2↑ (щелочь) ( Li, Na, K, Rb, Cs)
Щелочноземельный Ме + 2Н2О= Ме(ОН) Р (щелочь) + Н2↑ (Ca, Ba, Sr)
Соль р + основание р = новое основание↓+ новая соль
Соли, их классификация, свойства в свете ТЭД
Соли
Свойства солей
1. Соль + кислота = другая соль + другая кислота (↓ или ↑ CO2, SO2, H2S)
2. Соль (р) + щелочь = другая соль + другое основание (↓ или ↑ NH3)
3. Соль1 (р) + соль2 (р) = соль3 + соль4 (↓ )
4. Соль (р) + металл (более активный, но не IA, IIA-подгрупп) = другая соль (р) + другой металл (менее активный)
5. Некоторые соли могут разлагаться при прокаливании.
СаСО3 = СаО + СО2
(CuOH)2 СО3 CuO + CO2 + H2O
2NaHCO3Na2CO3 + CO2 + H2O
MeNO3 —
Оксиды, их классификация, свойства в свете ТЭД
Оксиды
Несолеобразующие Солеобразующие
CO, N2O, NO, SiO,
Основные Амфотерные Кислотные
Ме+1,+2xOy Ме+3,+4xOy Ме>+4xOy
НЕМеxOy
Химические свойства основных оксидов
1. О.О + кислота = соль + вода
2. O.O+ вода = щелочь!!!
3. О.О + К.О = соль
4. О.О + А.О = соль
Химические свойства кислотных оксидов
1. К.О + основание = соль + вода
2. К.O+ вода = кислота (искл. SiO2)
3. О.О + К.О = соль
4. K.О + А.О = соль
5. K.O + соль летучих К.О= новая соль + летучий К.О↑
Химические свойства амфотерных оксидов
1. А.О + щелочь = соль + вода
А.О + кислота = соль + вода
2. А.O+ вода = реакция не идет
3. А.О + К.О = соль
4. А.О + О.О = соль
5. А.O + соль летучих К.О= новая соль + летучий К.О↑
infourok.ru
