Органические и неорганические вещества клетки их функции: таблица
Химическая организация клеток: неорганические и органические вещества и их роль в жизнедеятельности клетки
Неорганические вещества клетки и их роль. Химические элементы и их роль в клетке
Из известных ныне около 110 химических элементов в состав клетки входит около 60. В соответствии с их количественным содержанием они делятся на три группы.
Таблица 7 Группы химических элементов клетки
| Макроэлементы | Микроэлементы | Ультрамикроэлементы |
| Количество определяется десятками процентов | Количество определяется десятыми и сотыми долями процента | Количество определяется тысячными долями процента и менее |
| Углерод, азот, водород, кислород | Натрий, калий, кальций, магний, железо, сера, фосфор, хлор | Кадмий, медь, цинк, фтор, кобальт и др. |
| Входят в состав основных органических веществ (белки, липиды, углеводы, нуклеиновые кислоты), а также в состав многих неорганических соединений | Входят в состав органических и неорганических соединений (сложные белки, пигменты, фосфолипиды, нуклеиновые кислоты, неорганические соли и др.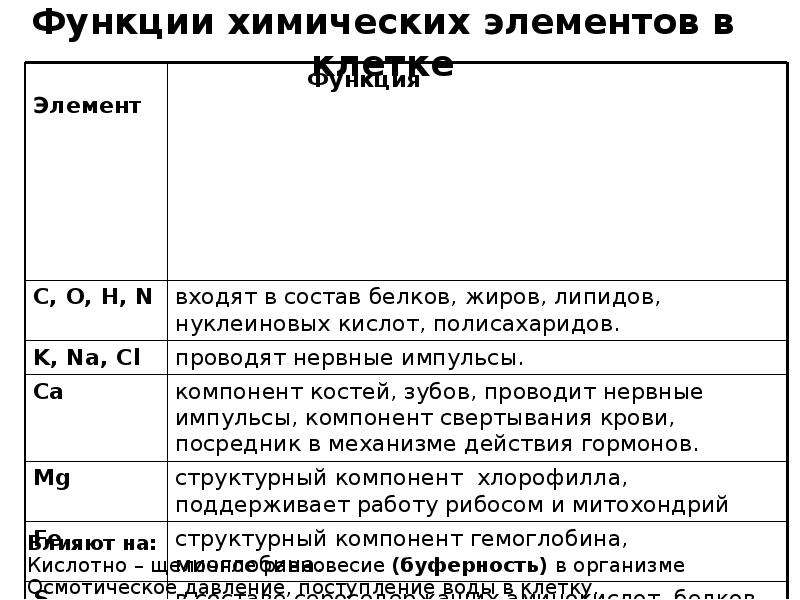 ) ) | Входят в состав ферментов, гормонов, витаминов и др. |
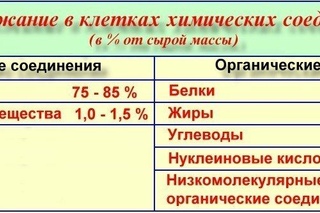
Вода и ее роль в клетке
Содержание воды в клетках различных тканей колеблется от 20% (в костной ткани) до 85% (в нервной ткани).
Молекула воды полярная (является диполем), что делает ее хорошим растворителем. Полярность и нелинейность молекулы воды определяется тем, что атомы водорода и кислорода, входящие в ее состав, различны по размерам и электроотрицательности.
Вода – хороший растворитель. Электростатическое притяжение между полярными молекулами воды и ионами сильнее, чем притяжение между катионом и анионом. В водном растворе ионы гидратируются.
Вещества, молекулы которых полярны и легко взаимодействуют с молекулами воды, называются гидрофильными. Вещества, молекулы которых неполярны и не могут растворяться в воде, называют гидрофобными.В воде такие вещества взаимодействуют друг с другом, образуя комплексы таким образом, чтобы с водой соприкасалась как можно меньшая поверхность.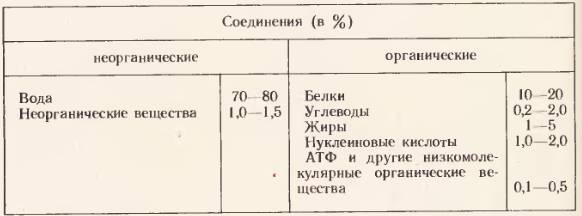
Молекулы воды способны образовывать водородные связи. Одна молекула может образовать водородные связи с 4 другими молекулами воды.
Способность молекул воды образовывать водородные связи обеспечивает ряд ее свойств:
- высокая удельная теплоемкость;
- вязкость и поверхностное натяжение;
- несжимаемость.
Удельная теплоемкость – количество тепла, необходимое для повышения температуры 1 кг воды на 1°С, очень велика. Большое количество энергии тратится на разрыв водородных связей.
Водородные связи являются причиной вязкости воды, а также обеспечивают силы поверхностного натяжения: на поверхности воды из-за сильного притяжения ее молекул возникают силы сцепления, направленные внутрь воды.
Таблица 8 Свойства воды
| Свойства воды | Роль воды, определяемая этим свойством |
| Молекулы воды являются диполями, вода – полярное вещество | Вода – хороший растворитель |
| Вода несжимаема | Вода обеспечивает тургор клеток |
| Вода обладает высокой теплоемкостью и теплопроводностью | Вода участвует в теплорегуляции клетки |
| Вода обладает текучестью | Вода переносит растворенные в ней вещества |
Другие функции воды в клетке:
- Среда для протекания химических реакций
- Участник и продукт химических реакций
- Источник водорода и кислорода в фотосинтезе цианобактерий и эукариот
- Снижает силу трения в некоторых структурах
Неорганические соли и их роль в клетке
В большинстве клеток и тканей соли присутствуют в растворенном состоянии, т. е. в виде катионов и анионов. Некоторые ткани содержат нерастворимые соли в составе своего межклеточного вещества (например, костная ткань животных).
е. в виде катионов и анионов. Некоторые ткани содержат нерастворимые соли в составе своего межклеточного вещества (например, костная ткань животных).
Основными катионами клеток являются К+, Na+, Ca2+, Mg2+, основными анионами – Cl-, HPO24-, h3PO4-, HCO-3.
Катионы и анионы распределены неравномерно между клеткой и внеклеточной средой, что является необходимым условием существования клетки. Так, содержание ионов калия существенно выше внутри клетки, а ионов натрия – во внеклеточной среде.
Таблица 9 Значение некоторых ионов в клетке
| Ионы натрия, калия и хлора | Участвуют в формировании нервных импульсов |
| Ионы калия, кальция, магния | Активируют ряд ферментов |
| Ионы кальция |
|
| Ионы магния | Входят в состав хлорофилла |
| Ионы железа Fe2+ | Входят в состав гемоглобина |
| Ионы цинка | Входят в состав гормона поджелудочной железы инсулина |
| Ионы иода | Входят в состав гормона щитовидной железы тироксина |
| Анионы HPO24-, h3PO4-, HCO-3 | Входят в состав буферных систем клетки, которые поддерживают рН на постоянном уровне |
| Анионы РО43- | Входят в состав ряда органических веществ: нуклеотидов, фосфолипидов и др. |
Углеводы и их роль в клетке
Эти соединения имеют общую формулу Cn(h3O)n, где n>3
Таблица 10 Классификация углеводов и их свойства
| Характеристика | Моносахариды | Полисахариды первого порядка | Полисахариды второго порядка |
| Строение | Состоят из одной молекулы, которая может включать 3 (триозы), 4 (тетрозы), 5 (пентозы) или 6 (гексозы) атомов углерода | Состоят из 2–4 остатков моносахаридов | Состоят из большого числа остатков моносахаридов |
| Свойства | Имеют кристаллическую форму, хорошо растворимы в воде, имеют сладкий вкус | Имеют кристаллическую форму, хорошо растворимы в воде, имеют сладкий вкус | Не имеют кристаллической формы, нерастворимы в воде |
| Примеры | Пентозы – рибоза, дезоксирибоза. Гексозы – глюкоза, фруктоза, галактоза | Дисахариды – сахароза, мальтоза, лактоза | Крахмал, целлюлоза, гликоген, хитин |
Функции углеводов
- Структурная (целлюлоза входит в состав клеточной стенки клеток растений, хитин входит в состав панциря членистоногих, клеточной стенки клеток грибов).

- Энергетическая (при окислении углеводов выделяется энергия).
- Запасающая (откладываются в запас – крахмал у растений, гликоген у животных).
Липиды и их роль в клетке
Липиды или жиры – это сложные эфиры трехатомного спирта глицерина и высокомолекулярных карбоновых кислот (жирных кислот).
Молекула липида состоит из гидрофильной головки, в состав которой входит глицерин, остаток фосфорной кислоты (фосфолипид) или углевод (гликолипид), и двух гидрофобных хвостов, состоящих из остатков жирных кислот (рис. 12).
Рисунок 12 – Схема молекулы фосфолипида: 1 – жирнокислотные хвосты; 2 – полярная головка
Функции липидов
- Структурная (входят в состав мембран).
- Энергетическая (при окислении липидов выделяется энергия).
- Запасающая (откладываются в запас).
- Защитная (липиды образуют прослойки между внутренними органами – сальники).
- Терморегулирующая (липиды обладают низкой теплопроводностью и, образуя теплоизоляционный слой, способствуют сохранению тепла).
- Являются источником эндогенной воды.
Белки и их роль в клетке
Белки представляют собой полимеры, мономерами которых являются аминокислоты. В природе существует около 300 аминокислот, но в белках обнаружено только 20 из них. Особенностью аминокислот является наличие аминогруппы (Nh3) и карбоксильной группы (СООН). Участки молекул, лежащие вне амино- и карбоксильной групп и определяющие специфику аминокислоты, называются
Аминокислоты, которые не могут синтезироваться в организме человека, называются незаменимыми. К незаменимым относятся гистидин, лейцин, изолейцин, лизин, метионин, фенилаланин, треонин, триптофан, валин.
Аминокислоты, входящие в состав белков, можно разбить на две группы, в зависимости от того, каким является их радикал – полярным или неполярным. К неполярным аминокислотам относятся аланин, валин, изолейцин, лейцин, метионин, пролин, триптофан, фенилаланин. Полярными аминокислотами являются все остальные, например, аргинин, аспарагин, аспарагиновая кислота, гистидин, лизин, тирозин, треонин и др.
Соединение аминокислот в цепь происходит за счет амино- и карбоксильной групп, при этом образуется пептидная связь.
Пептидная связь – прочная ковалентная связь. Разнообразие белков определяется аминокислотами, которые входят в состав белка.
Таблица 11 Уровни организации белковой молекулы
| Уровень организации | Описание | Основные взаимодействия |
| Первичная | линейная последовательность аминокислот | пептидные связи |
| Вторичная | спирально закрученная молекула | водородные связи |
| Третичная | глобула (шарообразная молекула) | гидрофобные взаимодействия, электростатические взаимодействия, дисульфидные связи |
| Четвертичная | объединение нескольких глобул в единый комплекс | гидрофобные взаимодействия |
Первичная структура белка образуется в результате биосинтеза на рибосомах, однако в таком состоянии белки в клетке не существуют. Они приобретают более высокие уровни организации – вторичную, третичную или четвертичную структуры.
Они приобретают более высокие уровни организации – вторичную, третичную или четвертичную структуры.
Вторичная структура представляет собой спирально закрученную молекулу. Между витками спирали образуются водородные связи (между кислородом карбоксильной группы и водородом аминогруппы). Водородные связи гораздо слабее ковалентных, но их образуется большое количество, поэтому они обеспечивают образование довольно прочной структуры.
Третичная структура белка представляет собой глобулу – шарообразную структуру. Связи, поддерживающие третичную структуру, довольно слабые. Они возникают, в частности, в результате гидрофобного взаимодействия. Это взаимодействие связано с силами притяжения между неполярными участками белка в водной среде. Гидрофобные остатки некоторых аминокислот в водном растворе сближаются, «слипаются» и тем самым стабилизируют структуру белка.
Внутри белковой глобулы оказываются гидрофобные остатки аминокислот, а на поверхности глобулы – гидрофильные. Кроме гидрофобного взаимодействия в поддержании третичной структуры участвуют электростатические силы между заряженными участками аминокислот.
Кроме гидрофобного взаимодействия в поддержании третичной структуры участвуют электростатические силы между заряженными участками аминокислот.
Между атомами серы, которую содержат некоторые аминокислоты, образуются ковалентные дисульфидные мостики. Третичная структура не является конечной. К макромолекуле белка могут присоединяться макромолекулы такого же белка или молекулы других белков. Такая структура называется четвертичной (рис. 13).
Рисунок 13 – Уровни организации молекул белка
Начиная со вторичной структуры пространственные конформации белка поддерживаются слабыми взаимодействиями. Под воздействием внешних факторов (изменение температуры, солевого состава среды, рН, под действием радиации и иных факторов) слабые связи, стабилизирующие макромолекулу, рвутся, что приводит к изменению структуры белка. Этот процесс называется денатурацией. Денатурация может быть обратимой и необратимой
Функции белка
Белки выполняют наиболее разнообразные функции по сравнению с другими веществами клетки.
- Структурная – белки входят в состав биомембран и ряда органоидов, например, рибосом. Белки соединительных тканей обеспечивают их прочность и эластичность: кератин шерсти и волос, коллаген сухожилий, хрящей и др.
- Ферментативная – белки являются биокатализаторами, которые ускоряют протекание биохимических реакций в клетке (далее – подробно).
- Транспортная – многие белки являются транспортерами ряда веществ, например, гемоглобин переносит кислород; многие белки клеточных мембран образуют транспортные системы клетки: каналы, обменники, насосы.
- Регуляторная – белки-регуляторы контролируют процессы, происходящие в клетке. Например, гормоны пептидной или белковой природы (гормон роста, инсулин и др.), влияя на продукцию или активность белков-ферментов, управляют обменными процессами в клетке.
- Двигательная – белки осуществляют движения клеток или их частей, например белки мышечной ткани актин и миозин обеспечивают движение мышц.
- Защитная функция белков реализуется антителами, интерфероном и фибриногеном.

- Антитела, вырабатываемые лимфоцитами, противостоят возбудителям болезней.
- Интерферон – белок, приостанавливающий размножение вирусов.
- Фибриноген – растворимый белок плазмы крови, на последнем этапе свертывания крови переходящий в нерастворимый белок фибрин, который участвует в образовании тромба.
- Рецепторную или сигнальную функцию выполняют специфические белки, встроенные в биомембраны, которые реагируют с химическими веществами (например, гормонами или нейромедиаторами), вызывая изменение функционирования клетки.
- Энергетическая – белки после их расщепления на аминокислоты и дезаминирования (реакция отщепления аминогруппы) служат субстратами для реакций энергетического обмена. Дезаминирование аминокислот – отщепление аминогруппы, которая преобразуется в аммиак, а затем в мочевину.
Белки-ферменты
Фермент – биологический катализатор белковой природы, ускоряющий биохимические процессы в клетке.
Субстрат – вещество, с которым взаимодействует фермент.
Ферментативная реакция проходит по следующей схеме:
В ходе ферментативной реакции образуется фермент-субстратный комплекс, который распадается на свободный фермент и продукт реакции. Таким образом, фермент не расходуется в ходе реакции.
Фермент имеет центр для связывания субстрата, который называют активным центром. Субстрат и фермент подходят друг к другу, как ключ к замку.
Для активизации фермента необходимы специальные вещества, в роли которых могут выступать витамины (никотиновая кислота, витамины группы В), ионы металлов и др.
Кроме активаторов, известны вещества, которые, напротив, снижают скорость ферментативной реакции или вообще прекращают ее. Эти вещества называются ингибиторами.
Скорость ферментативной реакции зависит от ряда факторов внешней среды, в частности от температуры, и рН среды, а также от наличия ингибиторов. Максимальная скорость ферментативной реакции отмечается при оптимальных значениях температуры и рН, а также в отсутствие ингибиторов.
Фермент активен при определенной температуре среды. Увеличение или уменьшение температуры приводит к снижению скорости ферментативной реакции. Оптимальная температура для ферментов человеческого организма 37–380С. Кроме того, для каждого фермента существует оптимальное значение рН, при котором трехмерная структура фермента в области активного центра принимает необходимую форму.
Нуклеиновые кислоты и их роль в клетке
Нуклеиновые кислоты были открыты в конце XIX века Мишером. Их структура была изучена уже в ХХ веке. Расшифровка структуры ДНК связана с именами Уотсона и Крика (1953).
Различают дезоксирибонуклеиновую (ДНК) и рибонуклеиновую (РНК) кислоты. Мономерами нуклеиновых кислот (НК) являются нуклеотиды. В состав каждого нуклеотида входят азотистое основание, пентоза, остаток фосфорной кислоты.
Азотистые основания разделяются на две группы – производные пурина и производные пиримидина. К пуриновым азотистым основаниям относятся аденин и гуанин, к пиримидиновым принадлежат тимин, цитозин и урацил.
Пентозы (пятиуглеродные моносахариды) представлены рибозой и дезоксирибозой.
Соединение нуклеотидов в цепь происходит благодаря эфирным связям, которые образуются между остатками пентоз и фосфорной кислоты. Таким образом, формируется сахарно-фосфорный скелет молекулы (рис. 14).
Таблица 12 Сравнительная характеристика ДНК и РНК
| Признак | ДНК | РНК |
| Локализация в клетке | Ядро, митохондрии, хлоропласты | Ядро, митохондрии, хлоропласты, цитоплазма, рибосомы |
| Локализация в ядре | Хромосомы | Ядрышко |
| Вид молекулы | Двойная правозакрученная спираль (две полинуклеотидные цепи, соединенные водородными связями) | Одна полинуклеотидная цепь |
| Мономеры | Дезоксирибонуклеотиды | Рибонуклеотиды |
| Строение мономера | ||
| Пуриновые азотистые основания | Аденин, гуанин | Аденин, гуанин |
| Пиримидиновые азотистые основания | Тимин, цитозин | Урацил, цитозин |
| Пентоза | Дезоксирибоза | Рибоза |
| Остаток фосфорной кислоты | имеется | имеется |
| Свойства | Стабильность, способность к самоудвоению | Лабильность |
| Функции |
| Различны для разных видов РНК
|
Двойная спираль ДНК образуется благодаря наличию водородных связей между комплементарными азотистыми основаниями разных цепей (рис. 14).
14).
Комплементарными являются такие азотистые основания, пространственная конфигурация которых позволяет образовывать им между собой водородные связи.
Комплементарную пару образуют одно пуриновое и одно пиримидиновое основания.
Комплементарные пары- аденин – тимин
- тимин – аденин
- гуанин – цитозин
- цитозин – гуанин
- аденин – урацил (при образовании и-РНК)
Между тимином и аденином образуется две, а между гуанином и цитозином – три водородные связи.
Рисунок 14 – Структура РНК и ДНК
Содержание химических элементов в клетке
Вода и другие неорганические вещества, их роль в жизнедеятельности клетки. Органические вещества, их роль в клетке. Самоудвоение ДНК
К неорганическим соединениям клетки относятся вода и различные соли.
В среднем в клетке содержится около 80% воды: в клетках эмбриона воды до 95%, в клетках старых организмов — 60%, то есть количество воды зависит от интенсивности обмена веществ.
Количество воды зависит также от вида ткани: в нейронах ее 85%, в костях — не более 20%. При потере организмом 20% воды наступает смерть. Вода определяет тургор (упругость) тканей, создает среду для химических реакций, участвует в реакциях гидролиза, в световой фазе фотосинтеза, в терморегуляции, является хорошим растворителем.
По отношению к воде различают вещества гидрофильные (полярные вещества) — хорошо растворимые в воде и гидрофобные (неполярные вещества) — плохо растворимые в воде.
Роль солей в организме заключается в обеспечении трансмембранной разности потенциалов (вследствие разницы во внутри- и внеклеточной концентрации ионов калия и натрия), создании буферных свойств (за счет наличия в цитоплазме анионов фосфорной и угольной кислоты), в создании осмотического давления клетки и т.д.
В состав неорганических веществ клетки входят микроэлементы (их доля составляет менее 0,1%). К ним относятся цинк, марганец и кобальт, которые входят в состав активных центров ферментов; железо в составе гемоглобина; магний в составе хлорофилла; йод в составе гормонов щитовидной железы и др.
К органическим веществам клетки относятся белки, углеводы, жиры, нуклеиновые кислоты.
Белки— это гетерополимеры, состоящие из 20 различных мономеров — природных альфа-аминокислот.
Белки — нерегулярные полимеры.
Общее строение аминокислоты может быть представлено следующим образом: R—CCNh3)—СООН. Аминокислоты в белке связаны пептидной связью —N(H)—С(=0). Аминокислоты разделяют на заменимые, синтезирующиеся в самом организме, и незаменимые, которые животный организм получает с пищей.
Среди белков различают протеины — состоят только из аминокислот и протеиды — содержат небелковую часть (например, гемоглобин, который состоит из белка глобина и порфирина — гема).
В строении молекулы белка различают первичную структуру — последовательность аминокислотных остатков; вторичную — как правило, это спиральная структура (альфа-спираль), которая удерживается множеством водородных связей, возникающих между находящимися близко друг от друга С=0 и NH-группами.
Другой тип вторичной структуры — бета-слой, или складчатый слой, — это две параллельные полипептидные цепи, связанные водородными связями, перпендикулярными цепям. Третичная структура белковой молекулы — это пространственная конфигурация, напоминающая компактную глобулу. Она поддерживается ионными, водородными и дисульфидными (S=S) связями, а также гидрофобными взаимодействиями. Четвертичная структура образуется при взаимодействии нескольких глобул (например, молекула гемоглобина состоит из четырех таких субъединиц).
Третичная структура белковой молекулы — это пространственная конфигурация, напоминающая компактную глобулу. Она поддерживается ионными, водородными и дисульфидными (S=S) связями, а также гидрофобными взаимодействиями. Четвертичная структура образуется при взаимодействии нескольких глобул (например, молекула гемоглобина состоит из четырех таких субъединиц).
Утрата белковой молекулой своей структуры называется денатурацией; она может быть вызвана температурой, обезвоживанием, облучением и т.д. Если при денатурации первичная структура не нарушается, то при восстановлении нормальных условий полностью воссоздается структура белка.
Функции белков в клетке очень разнообразны.
Они играют роль катализаторов, то есть ускоряют химические реакции в организме (ферменты ускоряют реакции в десятки и сотни тысяч раз). Белки выполняют также строительную функцию (входят в состав мембран и органоидов клетки, а также в состав внеклеточных структур, например, волокна коллагена в соединительной ткани).
Движение организмов обеспечивается специальными белками (актином и миозином). Белки выполняют также транспортную функцию (например, гемоглобин транспортирует 02). Белки входят в состав иммунной системы организма (антитела и антигены), обеспечивают свертывание крови (например, белок фибриноген плазмы крови), то есть выполняют защитную функцию.
Они служат одним из источников энергии (при распаде 1 г белка выделяется 17,6 кДж энергии). Различают также регуляторную функцию белков, так как многие гормоны являются белками (например, гормоны гипофиза, поджелудочной железы и т.д.).
Кроме того, в организме имеются еще и резервные белки, являющиеся источником питания для развития плода.
Углеводы — это органические соединения, в состав которых входят водород, углерод и кислород.
Образуются из воды и углекислого газа в процессе фотосинтеза в хлоропластах зеленых растений (у бактерий в процессе бактериального фотосинтеза или хемосинтеза).
Различают моносахариды (глюкоза, фруктоза, галактоза, рибоза, дезоксирибоза), дисахариды (сахароза, мальтоза), полисахариды (крахмал, клетчатка, гликоген, хитин).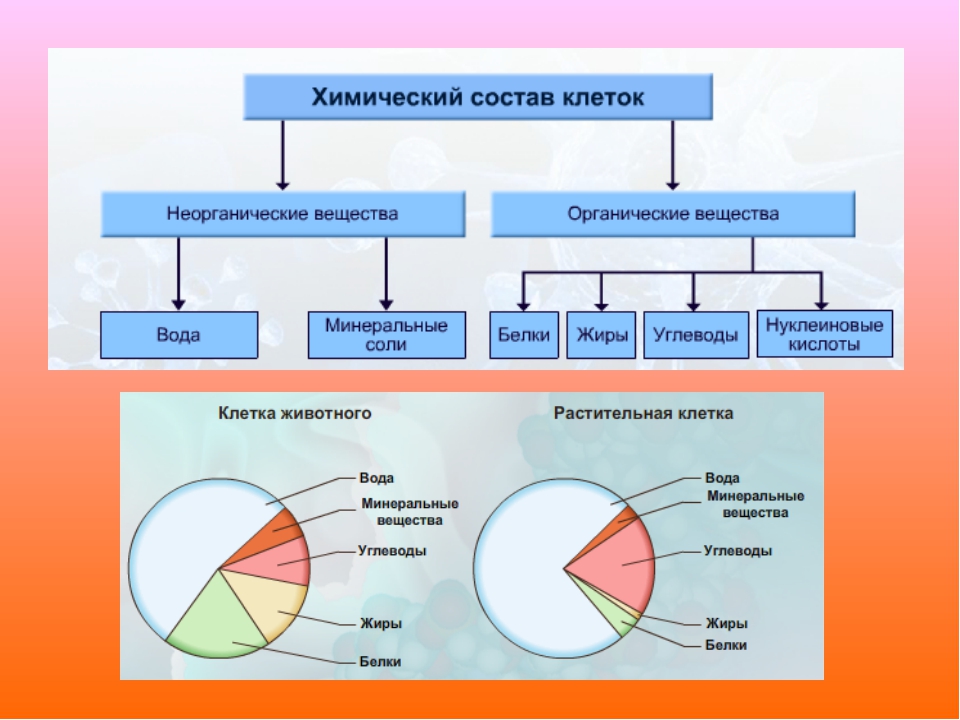
Углеводы выполняют следующие функции: являются источником энергии (при распаде 1 г глюкозы освобождается 17,6 кДж энергии), выполняют строительную функцию (целлюлозная оболочка в растительных клетках, хитин в скелете насекомых и в клеточной стенке грибов), входят в состав ДНК, РНК и АТФ в виде дезоксирибозы и рибозы.
Обычно в клетке животных организмов содержится около 1% углеводов (в клетках печени до 5%), а в растительных клетках до 90%.
Жиры и липиды относятся к группе неполярных органических соединений, то есть являются гидрофобными веществами. Жиры — это триглицериды высших жирных кислот, липиды — большой класс органических веществ с гидрофобными свойствами (например, холестерин). К липидам относят фосфолипиды (в их молекуле один или два остатка жирных кислот замещены группами, содержащими фосфор, а иногда также азот) и стероиды (в основе их структуры лежат 4 углеродных кольца).
Эти соединения выполняют энергетическую функцию (при распаде 1 г жира выделяется 38,9 кДж), структурную (являются основой биологических мембран), защитную (защита от ударов, теплорегуляция, гидроизоляция).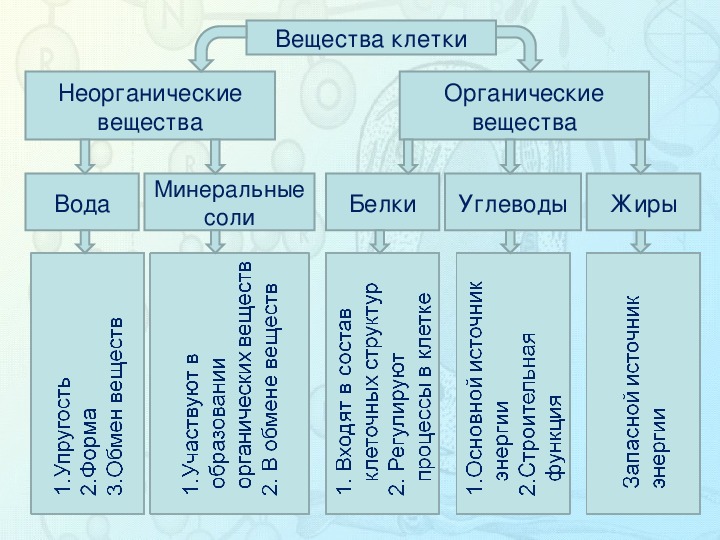
АТФ — это аденозинтрифосфат, нуклеотид, относящийся к группе нуклеиновых кислот.
Концентрация АТФ в клетке мала (в среднем 0,04%; в скелетных мышцах 0,5%). Молекула АТФ состоит из адени- на, рибозы и трех остатков фосфорной кислоты.
При гидролизе остатка фосфорной кислоты выделяется энергия:
Связь между остатками фосфорной кислоты является макроэргической, при ее расщеплении выделяется примерно в 4 раза больше энергии, чем при расщеплении других связей.
Энергию АТФ клетка использует в процессах биосинтеза, при движении, при производстве тепла, при проведении нервных импульсов, в процессе фотосинтеза и т.д.
АТФ является универсальным аккумулятором энергии в живых организмах.
ДНК (дезоксирибонуклеиновая кислота) — это молекула, состоящая из двух спирально закрученных полинуклеотидных цепей. ДНК образует правую спираль шириной примерно 20 ангстрем, длиной несколько сотен микрон и молекулярной массой
дальтон. Структура ДНК была расшифрована Д. Уотсоном и Ф. Криком в 1953 г. Мономером ДНК является дезоксирибонуклеотид, состоящий из азотистого основания (аденина (А), цитозина (Ц), тимина (Т) или гуанина (Г)), пентозы (дезоксирибозы) и фосфата.
Уотсоном и Ф. Криком в 1953 г. Мономером ДНК является дезоксирибонуклеотид, состоящий из азотистого основания (аденина (А), цитозина (Ц), тимина (Т) или гуанина (Г)), пентозы (дезоксирибозы) и фосфата.Нуклеотиды соединяются в цепь за счет остатков фосфорной кислоты, расположенных между пентозами; в полинуклеотиде может быть до 30 тыс. нуклеотидов. Последовательность нуклеотидов одной цепи комплементарна, то есть соответствует последовательности в другой цепи. Цепи удерживаются за счет водородных связей между комплементарными азотистыми основаниями: по две водородные связи между А и Т и по три между Г и Ц. В интерфазе перед делением клетки происходит репликация (редупликация) ДНК: ДНК раскручивается с одного конца, и на каждой цепи синтезируется новая комплементарная цепь; это ферментативный процесс, идущий с использованием энергии АТФ.
ДНК содержится в основном в ядре; к внеядерным формам ДНК относятся митохондриальная и пластидная.
РНК (рибонуклеиновая кислота) — это молекула, состоящая из одной цепи нуклеотидов. Рибонуклеотид состоит из одного из четырех азотистых оснований, но вместо тимина (Т) в РНК урацил (У), а вместо дезоксирибозы — рибоза.
В клетке имеются разные виды РНК: тРНК (транспортная — транспортирует аминокислоты к рибосомам), и РНК (информационная — переносит информацию о последовательности аминокислот с ДНК на белок), рРНК (рибосомальная — входит в состав рибосом), митохондриальная РНК и др.
Перед делением клетки происходит удвоение ДНК для того, чтобы обеспечить нормальный набор генов в обеих образующихся клетках.
Удвоение ДНК получило название редупликации.
При редупликации водородные связи между комплементарными азотистыми основаниями аденином-тимином и гуанином-цитозином разрываются специальным ферментом. Нити, составляющие двойную спираль ДНК, расходятся, и к каждому нуклеотиду обеих нитей последовательно подстраиваются комплементарные нуклеотиды.
Подстраивающиеся нуклеотиды соединяются в две нити ДНК, каждая из которых представляет копию разошедшихся нитей ДНК. Таким образом, в результате редупликации возникают две одинаковые двойные спирали ДНК, состоящие из нити «материнской» молекулы и вновь синтезированной нити.
В процессе удвоения ДНК участвует много ферментов. Как на любой синтез в клетке, на редупликацию затрачивается энергия АТФ.
Органические и неорганические вещества
Организм человека и животных состоит из органических и неорганических веществ, что определяется тем в каком виде потребляются и усваиваются ими жидкости и продукты питания.
Органические и неорганические вещества имеют общие и различные свойства.
Неорганические вещества растворяются в воде и впитываются растениями . В растениях неорганические вещества меняют свое состояние и переходят в органическое вещество.
Это тот же самый химический элемент, но его связи меняются после того, как из жидкости он попадает в клетку растения, т.е.
в структуру растительного вещества. Органические вещества, попадающие с растительной пищей в организм человека и животных, идентичны химическим элементам живой материи. Усваиваясь организмом из растительной пищи, химические элементы сохраняют природные свойства живой материи, т.е. органическое состояние.
Живой организм может усваивать вещества из воздуха, жидкостей, растительной и животной пищи. С воздухом и водой живой организм получает в основном неорганические вещества, которые могут входить в состав клеток живого организма, если своевременно не были удалены из него.
Неорганические вещества отсутствуют в чистой дождевой воде, в дистиллированной воде и в свежеприготовленных соках ягод, фруктов и овощей. При хранении соков ягод, фруктов и овощей химические элементы утрачивают органическое состояние и переходят в неорганические вещества. Только растение имеет свойство длительное время, а именно до полного созревания, сохранять химические элементы в органическом состоянии.
Неорганические соединения.1.Вода, её свойства и значение для биологических процессов.
Вода — универсальный растворитель.
Она имеет высокую теплоёмкость и одновременно высокую для жидкостей теплопроводность. Эти свойства делают воду идеальной жидкостью для подержания теплового равновесия организма.
Благодаря полярности своих молекул вода выступает в роли стабилизатора структуры.
Вода — источник кислорода и водорода , она является основной средой где протекают биохимические и химические реакции, важнейшим реагентом и продуктом биохимических реакций.
Для воды характерна полная прозрачность в видимом участке спектра, что имеет значение для процесса фотосинтеза, транспирации.
Вода практически не сжимается, что очень важно для придания формы органам, создания тургора и обеспечения определённого положения органов и частей организма в пространстве.
Благодаря воде возможно осуществление осмотических реакций в живых клетках.
Вода — основное средство передвижения веществ в организме ( кровообращение, восходящий и нисходящий токи растворов по телу растения и т.д.).
Минеральные вещества.В составе живых организмов современными методами химического анализа обнаружено 80 элементов периодической системы.
По количественному составу их разделяют на три основные группы.
Макроэлементы составляют основную массу органических и неорганических соединений, концентрация их колеблется от 60% до 0.001% массы тела (кислород, водород, углерод, азот, сера, магний, калий, натрий, железо и др.).
Микроэлементы — преимущественно ионы тяжёлых металлов.
Урок 5. химический состав клетки — Биология — 5 класс
Биология, 5 класс
Урок 5. Химический состав клетки
Перечень вопросов, рассматриваемых на уроке:
- Урок посвящён изучению химического состава клетки.
Ключевые слова:
Клетка, химический состав, неорганические и органические вещества, вода, минеральные соли, белки, жиры, углеводы, нуклеиновые кислоты
Тезаурус:
Химический элемент – это атомы одного и того же вида.
Органические вещества – это вещества, которые входят в состав живых организмов и образуются только при их участии.
Неорганические вещества – это вещества, которые входят в состав неживой природы и могут образовываться без участия живых организмов.
Обязательная и дополнительная литература по теме
- Биология. 5–6 классы. Пасечник В. В., Суматохин С. В., Калинова Г. С. и др. / Под ред. Пасечника В. В. М.: Просвещение, 2019
- Биология. 6 класс. Теремов А. В., Славина Н. В. М.: Бином, 2019.
- Биология. 5 класс. Мансурова С. Е., Рохлов В. С., Мишняева Е. Ю. М.: Бином, 2019.
- Биология. 5 класс. Суматохин С. В., Радионов В. Н. М.: Бином, 2014.
- Биология. 6 класс. Беркинблит М. Б., Глаголев С. М., Малеева Ю. В., Чуб В. В. М.: Бином, 2014.
- Биология. 6 класс. Трайтак Д. И., Трайтак Н. Д. М.: Мнемозина, 2012.
- Биология. 6 класс. Ловягин С. Н., Вахрушев А. А., Раутиан А. С. М.: Баласс, 2013.
Теоретический материал для самостоятельного изучения
Сейчас на Земле известно более ста химических элементов. Из их атомов состоят все вещества, встречающиеся на Земле. 80 химических элементов обнаружены в составе живых организмов. При этом четыре из них – углерод, водород, азот и кислород составляют около 98 % массы любого организма. Остальные химические элементы встречаются в живых организмах в малых количествах.
Клетки всех живых организмов состоят из одних и тех же химических элементов. Эти же элементы входят и в состав объектов неживой природы. Сходство состава указывает на общность живой и неживой природы.
На этом уроке вы узнаете, из каких химических элементов состоят клетки живых организмов, и какие изменения претерпевают эти химические соединения по мере роста и развития клеток.
В клетках живых организмов больше всего содержится таких химических элементов, как углерод, водород, кислород и азот. Вместе они составляют до 98 % массы клетки. Около 2 % массы клетки приходится на восемь элементов: калий, натрий, кальций, хлор, магний, железо, фосфор и серу. Остальные химические элементы содержатся в клетках в очень малых количествах.
Химические элементы, соединяясь между собой, образуют неорганические (вода и минеральные соли) и органические (белки, жиры, углеводы, нуклеиновые кислоты и др.) вещества.
Значение каждого из веществ, содержащегося в клетке уникально. Вода придаёт клетке упругость, определяет её форму, участвует в обмене веществ. Неорганические вещества используются для синтеза органических молекул. При недостатке минеральных веществ важнейшие процессы жизнедеятельности клеток нарушаются. Углеводы придают прочность клеточным оболочкам, а также служат запасающими веществами. Белки входят в состав разнообразных клеточных структур, регулируют процессы жизнедеятельности и тоже могут запасаться в клетках. Жиры откладываются в клетках. При расщеплении жиров освобождается необходимая живым организмам энергия. Нуклеиновые кислоты играют ведающую роль в сохранении наследственной информации.
Клетка – это миниатюрная природная лаборатория, в которой синтезируются и претерпевают изменения различные химические соединения. Сходство химического состава клеток разных организмов доказывает единство живой природы.
Разбор типового тренировочного задания:
Тип задания: Сортировка элементов по категориям
Текст вопроса: Расставьте названия веществ в таблицу:
Органические вещества | Неорганические вещества |
Варианты ответов:
Белки
Вода
Углеводы
Жиры
Кислород
Правильный вариант ответа:
Органические вещества | Неорганические вещества |
белки углеводы жиры | вода кислород |
Разбор типового контрольного задания
Тип задания: Выделение цветом
Текст вопроса: Выделите цветом вещества, входящие в состав живых организмов:
Варианты ответов:
- Вода
- Пластик
- Белки
- Жиры
- Нефть
- Углеводы
- ДНК и РНК
Правильный вариант ответа:
1) Вода
3) Белки
4) Жиры
6) Углеводы
7) ДНК и РНК
Неорганические вещества и их роль в клетке
Вода. Из неорганических веществ, входящих в состав клетки, важнейшим является вода. Количество ее составляет от 60 до 95% общей массы клетки. Вода играет важнейшую роль в жизни клеток и живых организмов в целом. Помимо того что она входит в их состав, для многих организмов это еще и среда обитания.
Роль воды в клетке определяется ее уникальными химическими и физическими свойствами, связанными главным образом с малыми размерами молекул, с полярностью ее молекул и с их способностью образовывать друг с другом водородные связи.
Вода как компонент биологических систем выполняет следующие важнейшие функции:
- Вода—универсальный растворитель для полярных веществ, например солей, Сахаров, спиртов, кислот и др. Вещества, хорошо растворимые в воде, называются гидрофильными. Когда вещество переходит в раствор, его молекулы или ионы получают возможность двигаться более свободно; соответственно возрастает реакционная способность вещества. Именно по этой причине большая часть химических реакций в клетке протекает в водных растворах. Ее молекулы участвуют во многих химических реакциях, например при образовании или гидролизе полимеров. В процессе фотосинтеза вода является донором электронов, источником ионов водорода и свободного кислорода.
- Неполярные вещества вода не растворяет и не смешивается с ними, поскольку не может образовывать с ними водородные связи. Нерастворимые в воде вещества называются гидрофобными. Гидрофобные молекулы или их части отталкиваются водой, а в ее присутствии притягиваются друг к другу. Такие взаимодействия играют важную роль в обеспечении стабильности мембран, а также многих белковых молекул, нуклеинов вых кислот и ряда субклеточных структур.
- Вода обладает высокой удельной теплоемкостью. Для разрыва водородных связей, удерживающих молекулы воды, требуется поглотить большое количество энергии. Это свойство обеспечивает поддержание теплового баланса организма при значительных перепадах температуры в окружающей среде. Кроме того, вода отличается высокой теплопроводностью, что позволяет организму поддерживать одинаковую температуру во всем его объеме.
- Вода характеризуется высокой теплотой парообразования, т. е. способностью молекул уносить с собой значительное количество тепла при одновременном охлаждении организма. Благодаря этому свойству воды, проявляющемуся при потоотделении у млекопитающих, тепловой одышке у крокодилов и других животных, транспирации у растений, предотвращается их перегрев.
- Для воды характерно исключительно высокое поверхностное натяжение. Это свойство имеет очень важное значение для адсорбционных процессов, для передвижения растворов по тканям (кровообращение, восходящий и нисходящий токи в растениях). Многим мелким организмам поверхностное натяжение позволяет удерживаться на воде или скользить по ее поверхности.
- Вода обеспечивает передвижение веществ в клетке и организме, поглощение веществ и выведение продуктов метаболизма.
- У растений вода определяет тургор клеток, а у некоторых животных выполняет опорные функции, являясь гидростатическим скелетом (круглые и кольчатые черви, иглокожие).
- Вода — составная часть смазывающих жидкостей (синовиальной — в суставах позвоночных, плевральной — в плевральной полости, перикардиальной — в околосердечной сумке) и слизей (облегчают передвижение веществ по кишечнику, создают влажную среду на слизистых оболочках дыхательных путей). Она входит в состав слюны, желчи, слез, спермы и др.
Минеральные соли. Неорганические вещества в клетке, кроме воды, прецспавлевы минеральными солями. Молекулы солей в водном растворе распадаются на катионы и анионы. Наибольшее значение имеют катионы (К+, Na+, Са2+, Mg:+, NH4+) и анионы (С1 , Н2Р04-, НР042- , НС03-, NO32—, SO42- ) Существенным является не только содержание, но и соотношение ионов в клетке.
Разность между количеством катионов и анионов на поверхности и внутри клетки обеспечивает возникновение потенциала действия, что лежит в основе возникновения нервного и мышечного возбуждения. Разностью концентрации ионов по разные стороны мембраны обусловлен активный перенос веществ через мембрану, а также преобразование энергии.
Анионы фосфорной кислоты создают фосфатную буферную систему, поддерживающую рН внутриклеточной среды организма на уровне 6,9.
Угольная кислота и ее анионы формируют бикарбонатную буферную систему, поддерживающую рН внеклеточной среды (плазма крови) на уровне 7,4.
Некоторые ионы участвуют в активации ферментов, создании осмотического давления в клетке, в процессах мышечного сокращения, свертывании крови и др.
Ряд катионов и анионов необходим дпясинтеза важных органических веществ (например, фосфолипидов, АТФ, нуклеоти-дов, гемоглобина, гемоцианина, хлорофилла и др.), а также аминокислот, являясь источниками атомов азота и серы.
Источник : Н.А. Лемеза Л.В.Камлюк Н.Д. Лисов «Пособие по биологии для поступающих в ВУЗы»
Тема 2.2. Химический состав клетки.
1. Дайте определения понятий.
Клетка – элементарная единица живого, обладающая всеми признаками организма: способностью к размножению, росту, обмену веществ и энергией с окружающей средой, раздражимостью, постоянством химического сотсава.
Макроэлементы – элементы, количество которых в клетке составляет до 0.001% от массы тела. Примеры – кислород, углерод, азот, фосфор, водород, сера, железо, натрий, кальций и др.
Микроэлементы – элементы, количество которых в клетке составляет от 0.001% до 0.000001% от массы тела. Примеры – бор, медь, кобальт, цинк, йод и др.
Ультрамикроэлементы – элементы, содержание которых в клетке не превышает 0.000001% от массы тела. Примеры – золото, ртуть, цезий, селен и др.
2. Составьте схему «Вещества клетки».
3. О чем говорит научный факт сходства элементарного химического состава живой и неживой природы?
Это указывает на общность живой и неживой природы.
Неорганические вещества. Роль воды и минеральных веществ в жизнедеятельности клетки.
1. Дайте определения понятий.
Неорганические вещества – это вода, минеральные соли, кислоты, анионы и катионы, присутствующие как в живых, так и в неживых организмах.
Вода – одно из самых распространенных неорганических веществ в природе, молекула которого состоит из двух атомов водорода и одного атом кислорода.
2. Нарисуйте схему «Строение воды».
3. Какие особенности строения молекул воды придают ей уникальные свойства, без которых невозможна жизнь?
Структура молекулы воды образована двумя атомами водорода и одним атомом кислорода, которые образуют диполь, то есть вода имеет две полярности «+»и»-«.Это способствует ее проницаемости через стенки мембраны, способностью растворять химические вещества. Кроме того, диполи воды связываются водородными связями друг с другом, что обеспечивает ее способность быть в различных агрегатных состояниях, а также — растворять или не растворять различные вещества.
4. Заполните таблицу «Роль воды и минеральных веществ в клетке».
5. Каково значение относительного постоянства внутренней среды клетки в обеспечении процессов ее жизнедеятельности?
Постоянство внутренней среды клетки называется гомеостазом. Нарушение гомеостаза влечёт к повреждению клетки или к её смерти, в клетке постоянно происходит пластический обмен и энергетический обмен, это две составляющие метаболизма, и нарушение этого процесса ведёт к повреждению или к гибели всего организма.
6. В чем состоит назначение буферных систем живых организмов и каков принцип их функционирования?
Буферные системы поддерживают определенное значение рН (показатель кислотности) среды в биологических жидкостях. Принцип функционирования заключается в том, что рН среды зависит от концентрации протонов в этой среде (Н+). Буферная система способна поглощать или отдавать протоны в зависимости от их поступления в среду извне или, напротив, удаления из среды, при этом рН не будет изменяться. Наличие буферных систем необходимо в живом организме, так как из-за изменения условий окружающей среды рН может сильно меняться, а большинство ферментов работает только при определенном значении рН.
Примеры буферных систем:
карбонатно-гидрокарбонатная (смесь Na2СО3 и NaHCO3)
фосфатная (смесь K2HPO4 и Kh3PO4).
Органические вещества. Роль углеводов, липидов и белков в жизнедеятельности клетки.
1. Дайте определения понятий.
Органические вещества – это вещества, в состав которых обязательно входит углерод; они входят в состав живых организмов и образуются только при их участии.
Белки – высокомолекулярные органические вещества, состоящие из альфа-аминокислот, соединённых в цепочку пептидной связью.
Липиды – обширная группа природных органических соединений, включающая жиры и жироподобные вещества. Молекулы простых липидов состоят из спирта и жирных кислот, сложных — из спирта, высокомолекулярных жирных кислот и других компонентов.
Углеводы – это органические вещества, в своем составе имеющие карбонильную и несколько гидроксильных групп и иначе называемые сахарами.
2. Впишите в таблицу недостающую информацию «Строение и функции органических веществ клетки».
3. Что понимают под денатурацией белка?
Денатурация белка – это утрата белком своей природной структуры.
Нуклеиновые кислоты, АТФ и другие органические соединения клетки.
1. Дайте определения понятий.
Нуклеиновые кислоты – это биополимеры, состоящие из мономеров – нуклеотидов.
АТФ – это соединение, состоящее из азотистого основания аденина, углевода рибозы и трех остатков фосфорной кислоты.
Нуклеотид – это мономер нуклеиновой кислоты, который состоит из фосфатной группы, пятиуглеродного сахара (пентозы) и азотистого основания.
Макроэргическая связь – это связь между остатками фосфорной кислоты в АТФ.
Комплементарность – это пространственное взаимное соответствие нуклеотидов.
2. Докажите, что нуклеиновые кислоты являются биополимерами.
Нуклеиновые кислоты состоят из большого количества повторяющихся нуклеотидов и имеют массу 10.000 до нескольких миллионов углеродных единиц.
3. Охарактеризуйте особенности строения молекулы нуклеотида.
Нуклеотид представляет собой соединение из трех компонентов: остатка фосфорной кислоты, пятиуглеродного сахара (рибозы), и одного из азотистых соединений (аденин, гуанин, цитозин, тимин или урацил).
4. Какое строение имеет молекула ДНК?
ДНК – двойная спираль, состоящая из множества нуклеотидов, которые последовательно соединяются между собой за счет ковалентных связей между дезоксирибозой одного и остатком фосфорной кислоты другого нуклеотида. Азотистые основания, которые располагаются по одну сторону от остова одной цепи, связаны Н-связями с азотистыми основаниями второй цепи по принципу комплементарности.
5. Применив принцип комплементарности, постройте вторую цепочку ДНК.
Т-А-Т-Ц-А-Г-А-Ц-Ц-Т-А-Ц
А-Т-А-Г-Т-Ц-Т-Г-Г-А-Т-Г.
6. Каковы основные функции ДНК в клетке?
При помощи четырех типов нуклеотидов в ДНК записана вся важная информация в клетке об организме, которая передается последующим поколениям.
7. Чем молекула РНК отличается от молекулы ДНК?
РНК представляет собой одинарную цепь меньшего, чем ДНК, размера. В нуклеотидах находится сахар рибоза, а не дезоксирибоза, как в ДНК. Азотистым основанием, вместо тимина, является урацил.
8. Что общего в строении молекул ДНК и РНК?
И РНК, и ДНК являются биополимерами, состоящими из нуклеотидов. В нуклеотидах общим в строении является наличие остатка фосфорной кислоты и оснований аденина, гуанина, цитозина.
9. Заполните таблицу «Типы РНК и их функции в клетке».
10. Что такое АТФ? Какова его роль в клетке?
АТФ – аденозинтрифосфат, макроэргическое соединение. Его функции – универсальный хранитель и переносчик энергии в клетке.
11. Каково строение молекулы АТФ?
АТФ состоит из трех остатков фосфорной кислоты, рибозы и аденина.
12. Что представляют собой витамины? На какие две большие группы их разделяют?
Витамины – биологически активные органические соединения, играющие важную роль в процессах обмена веществ. Их разделяют на водорастворимые (С, В1, В2 и др.) и жирорастворимые (А, Е и др.).
13. Заполните таблицу «Витамины и их роль в организме человека».
Химический состав клетки: неорганические вещества
Чем различается химический состав тел живой и неживой природы? Организмы состоят из клеток. Клетки разных организмов обладают сходным химическим составом. В таблице представлены основные химические элементы, обнаруженные в клетках живых организмов.
| Содержание химических элементов в клетке | ||||
| Кислород | 65-75 | Кальций | 0,04-2,00 | |
| Углевод | 15-18 | Магний | 0,02-0,03 | |
| Водород | 8-10 | Натрий | 0,02-0,03 | |
| Азот | 1,5-3,0 | Железо | 0,01-0,015 | |
| Фосфор | 0,2-1,0 | Цинк | 0,0003 | |
| Азот | 1,5-3,0 | Железо | 0,01-0,015 | |
| Калий | 0,15-0,4 | Медь | 0,0002 | |
| Сера | 0,15-0,2 | Иод | 0,0001 | |
| Хлор | 0,05-0,10 | Фтор | 0,0001 | |
По содержанию в клетке можно выделить три группы элементов. В первую группу входят кислород, углерод, водород и азот. На их долю приходится почти 98% всего состава клетки. Во вторую группу входят калий, натрий, кальций, сера, фосфор, магний, железо, хлор. Их содержание в клетке составляет десятые и сотые доли процента. Элементы этих двух групп относят к макроэлементам (от греч. macros — большой).
Остальные элементы, представленные в клетке сотыми и тысячными долями процента, входят в третью группу. Это микроэлементы (от греч. micros — малый).
Каких-либо элементов, присущих только живой природе, в клетке не обнаружено. Все перечи 1000 сленные химические элементы входят и в состав неживой природы. Это указывает на единство живой и неживой природы.
Недостаток какого-либо элемента может привести к заболеванию и даже гибели организма, так как каждый элемент играет определенную роль. Макроэлементы первой группы составляют основу биополимеров — белков, углеводов, нуклеиновых кислот, а также липидов, без которых жизнь невозможна. Сера входит в состав некоторых белков, фосфор — в состав нуклеиновых кислот, железо — в состав гемоглобина, а магний — в состав хлорофилла. Кальций играет важную роль в обмене веществ.
Часть химических элементов, содержащихся в клетке, входит в состав неорганических веществ — минеральных солей и воды.
Минеральные соли находятся в клетке, как правило, в виде катионов (K+, Na+, Ca2+, Mg2+) и анионов (HPO42-, H2PO4—, Сl—, HCO3), соотношение которых определяет важную для жизнедеятельности клеток кислотность среды. (У многих клеток среда слабощелочная и ее pH почти не изменяется, так как в ней постоянно поддерживается определенное соотношение катионов и анионов.)
Из неорганических веществ в живой природе огромную роль играет вода.
Без воды жизнь невозможна. Она составляет значительную массу большинства клеток. Много воды содержится в клетках мозга и эмбрионов человека: воды более 80%; в клетках жировой ткани — всего 40%. К старости содержание воды в клетках снижается. Человек, потерявший 20% воды, погибает.
Уникальные свойства воды определяют ее роль в организме. Она участвует в теплорегуляции, которая обусловлена высокой теплоемкостью воды — потреблением большого количества энергии при нагревании.
Чем определяется высокая теплоемкость воды?
B молекуле воды атом кислорода ковалентно связан с двумя атомами водорода. Молекула воды полярна, так как атом кислорода имеет частично отрицательный заряд, а каждый из двух атомов водорода имеет частично положительный заряд. Между атомом кислорода одной молекулы воды и атомом водорода другой молекулы образуется водородная связь. Водородные связи обеспечивают соединение большого числа молекул воды. При нагревании воды значительная часть энергии расходуется на разрыв водородных связей, что и определяет ее высокую теплоемкость.
Вода — хороший растворитель. Благодаря полярности ее молекулы взаимодействуют с положительно и отрицательно заряженными ионами, способствуя тем самым растворению вещества. По отношению к воде все вещества клетки делятся на гидрофильные и гидрофобные.
Гидрофильными (от греч. hidor — вода и fileo — люблю) называют вещества, которые растворяются в воде. К ним относят ионные соединения (например, соли) и некоторые неионные соединения (например, сахара).
Гидрофобными (от греч. hidor — вода и fobos — страх) называют вещества, нерастворимые в воде. К ним относят, например, липиды.
Вода играет большую роль в химических реакциях, протекающих в клетке в водных растворах. Она растворяет ненужные организму продукты обмена веществ и тем самым способствует выводу их из организма. Большое содержание воды в клетке придает ей упругость. Вода способствует перемещению различных веществ внутри клетки или из клетки в клетку.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
6. Неорганические вещества клетки. Биология. Общая биология. 10 класс. Базовый уровень
6. Неорганические вещества клетки
Вспомните!
Что такое неорганические вещества?
Какими физическими и химическими свойствами обладает вода?
Что называют ионами, анионами и катионами?
Значительная часть соединений, входящих в состав клетки, встречается в больших количествах только в живой природе. Это органические вещества. Однако есть соединение, которое одинаково характерно как для живой, так и для неживой природы. Это вода (рис. 9).
Вода. Считается, что миллиарды лет тому назад в первичном океане на нашей планете зародилась жизнь и вся дальнейшая эволюция природы была неразрывно связана с водой. Уникальные свойства этой относительно небольшой молекулы позволили нашей планете стать такой, какая она есть сейчас. Все жители Земли, растения и животные, грибы и бактерии, обязаны воде жизнью. В чём же заключается особенность этого вещества?
Молекула воды – это диполь, т. е. на одной стороне молекулы сосредоточен частичный положительный заряд, а на другом конце – частичный отрицательный (рис. 10). Именно эта особенность строения молекулы воды определяет её свойство универсального растворителя. Любые вещества, имеющие заряженные группы, растворяются в воде (рис. 11). Такие соединения называют гидрофильными (от греч. hydros – вода и phileo – люблю). Большинство веществ, присутствующих в клетке, относится к этой группе, например соли, аминокислоты, сахара, белки, простые спирты. Когда вещество переходит в раст вор, его реакционная способность увеличивается. Однако есть соединения, которые в воде растворяются очень плохо или вовсе не растворяются. Такие вещества называют гидрофобными (от греч. hydros – вода и phobos – страх), к ним относятся, в частности, жиры (липиды), жироподобные вещества (липоиды), полисахариды и некоторые белки.
Рис. 9. Вещества, входящие в состав живых организмов
Рис. 10. Диполь. Схематичное изображение молекулы воды
Рис. 11. Растворение в воде хлорида натрия
Большинство процессов, которые протекают внутри клетки, могут осуществляться только в водной среде. Но вода не только обеспечивает условия химических реакций, она сама участвует во многих метаболических процессах. В реакциях гидролиза[1] белки расщепляются до аминокислот, а крахмал – до глюкозы. Высвобождение энергии в организме происходит при взаимодействии с водой главной энергетической молекулы – АТФ. Вода участвует в реакциях фотосинтеза и в синтезе АТФ в митохондриях.
Отрицательные и положительные полюсы разных молекул воды притягиваются друг к другу, что приводит к образованию водородных связей. Наличие этих связей придаёт воде структурированность, что объясняет многие её необычные свойства: высокую температуру кипения, плавления, высокую теплоёмкость.
Сочетание высокой теплоёмкости и теплопроводности делает воду идеальной жидкостью для поддержания теплового равновесия. Тепло быстро и равномерно распределяется между всеми частями организма.
Рис. 12. Уменьшение количества воды в клетках приводит к увяданию растений
Высокая интенсивность испарения приводит к быстрой потере тепла и предохраняет от перегрева: испарение у растений и потоотделение у животных являются защитными реакциями и позволяют при минимальной потере воды существенно снизить температуру тела.
Практически полная несжимаемость воды обеспечивает поддержание формы клетки (рис. 12), а вязкость придаёт воде свойства смазки.
Высокая сила поверхностного натяжения воды обеспечивает восходящий и нисходящий транспорт веществ в растениях и движение крови в капиллярах. Многие мелкие организмы легко удерживаются и передвигаются по поверхности воды благодаря наличию плёнки поверхностного натяжения.
Полость тела круглых червей заполнена жидкостью, находящейся под давлением и образующей гидроскелет, что придаёт этим организмам постоянную форму. Свойство несжимаемости воды используется медузами, чьё тело на 95 % состоит из этого вещества.
Жидкость в подчерепном пространстве предохраняет от сотрясения головной мозг, а околоплодные воды в матке защищают и поддерживают плод у млекопитающих.
Жидкость в околосердечной сумке – перикарде – облегчает движения сердца при его сокращениях, а в плевральной полости снижает трение при дыхании.
Благодаря высокому тургорному давлению растительные ткани обладают упругостью, а стебли травянистых растений поддерживают вертикальное положение.
Соли. Важную роль в жизнедеятельности клетки играют минеральные соли, представленные в основном катионами калия (K+), натрия (Na+), кальция (Ca2+), магния (Mg2+) и анионами соляной (Сl–), угольной (HCO3–), фосфорной (HPO42–, H2PO4–) и некоторых других кислот. Многие ионы неравномерно распределены между клеткой и окружающей средой, так, например, в цитоплазме концентрация ионов калия в 20–30 раз выше, чем снаружи, а концентрация ионов натрия внутри клетки, наоборот, в 10 раз ниже. Именно благодаря существованию подобных градиентов концентраций осуществляются многие важные процессы жизнедеятельности, такие как возбуждение нервных клеток, сокращение мышечных волокон. После гибели клетки концентрация катионов снаружи и внутри быстро выравнивается.
Анионы слабых кислот (HCO3–, HPO42–) участвуют в поддержании кислотно-щелочного баланса (рН) клетки. Анионы фосфорной кислоты необходимы для синтеза нуклеотидов и нуклеиновых кислот.
Минеральные соли в живых организмах находятся не только в виде ионов, но и в твёрдом состоянии. Кости нашего скелета в основном состоят из фосфатов кальция и магния. Раковины моллюсков формируются из карбоната кальция.
Вопросы для повторения и задания
1. Каковы особенности пространственной организации молекул воды, обусловливающие её биологическое значение?
2. В чём заключается биологическая роль воды?
3. Какие вещества называют гидрофильными; гидрофобными? Приведите примеры.
4. Какие вещества поддерживают pH клетки на постоянном уровне? Объясните, почему жизнедеятельность клетки возможна только при определённом значении pH.
5. Расскажите о роли минеральных солей в жизнедеятельности клетки.
Подумайте! Выполните!
1. Почему при работе в горячих цехах для утоления жажды рекомендуют пить минеральную или подсоленную воду?
2. Известно, что ионный состав внутреннего содержимого клетки имеет большое сходство с ионным составом морской воды. Какой вывод можно из этого сделать?
3. Как изменяется количество воды в теле человека с возрастом?
4. Вспомните из курса биологии растений, какие структуры покровной ткани растений обеспечивают испарение воды. Каков принцип их работы?
5. Выполните исследовательскую работу «Изучение процесса осмоса в растительных клетках». Исследуйте влияние гипо– и гипертонических растворов на мембрану типичной вакуолизированной растительной клетки.
Работа с компьютером
Обратитесь к электронному приложению. Изучите материал и выполните задания.
Повторите и вспомните!
Растения
Поглощение корнями воды и минеральных веществ. Большая часть воды с растворёнными в ней минеральными веществами поглощается корнем с помощью корневых волосков в зоне всасывания. Всасывание воды происходит пассивно, посредством осмоса, так как концентрация осмотически активных веществ (минеральных солей и органических веществ) в клетках корня больше, чем в почвенном растворе. Интенсивность поглощения воды корневыми волосками называют сосущей силой (S). Она равна разнице между осмотическим (P) и тургорным (T) давлением: S = P – T. Когда осмотическое давление равно тургорному (P = T), то S = 0 и вода перестаёт поступать в корневой волосок. Если же концентрация веществ в почвенном растворе будет выше, чем внутри клеток корня, то вода будет выходить из клеток и растение завянет (см. рис. 12). Такое явление наблюдается при засухе или при неумеренном внесении удобрения в почву.
Животные
Первично– и вторичноводные животные. Кроме систематического деления на классы, подтип Позвоночные обычно условно подразделяют ещё на две группы, не имеющие таксономического значения: первичноводные (анамнии) и первичноназемные (амниоты). Жизнь и размножение животных, относящихся к анамниям, неразрывно связаны с водой. В качестве органов дыхания у них в течение всей жизни или на личиночной стадии функционируют жабры. При развитии оплодотворённой яйцеклетки не образуются защитные зародышевые оболочки. К этой группе относят классы Круглоротые, Хрящевые рыбы, Костные рыбы, Земноводные.
Размножение первичноназемных животных не связано с водой. Жаберного дыхания нет ни на одной из жизненных стадий. При развитии зародыша формируются зародышевые оболочки. К группе амниот относят классы Пресмыкающиеся, Птицы, Млекопитающие.
Вторичноводными называют амниот, которые вернулись к обитанию в воде. Такими животными, например, являются китообразные, которые полностью перешли к водному образу жизни. Их передние конечности превратились в ласты, задние – редуцированы.
Человек
Водный и минеральный обмены. Ткани взрослого человека содержат в среднем до 60 % воды. В сутки организм человека теряет около 2,0–2,5 л воды. В составе мочи выводится 1,2–1,5 л, с потом – около 0,5–0,7 л, с парами воздуха через лёгкие – 0,3–0,5 л, через кишечник с калом – около 0,1 л. Столько же воды в сумме организм получает с питьём (1,0 л) и пищей (1,0 л), а часть воды образуется при обмене белков, жиров, углеводов (0,3–0,4 л). Для нормальной жизнедеятельности важно, чтобы поступление воды полностью покрывало её расход. Отношение количества потреблённой воды к количеству выделенной называют водным балансом. Обезвоживание организма приводит к быстрой гибели, без воды человек может прожить не более 5–6 дней. Однако обильное избыточное питьё тоже вредно, оно повышает нагрузку на организм и нарушает работу сердца и почек.
Минеральные соли поступают в организм человека с пищей и водой. И хотя они составляют не более 4 % от массы тела, набор их очень разнообразен. В сутки в организм человека должно поступать не менее 4,4 г натрия, 5 г хлора, 2 г калия, 1 г кальция, 1 г фосфора, 0,2 г железа. Из различных минеральных солей специально в пищу мы добавляем только поваренную соль (NaCl), около 10 г в сутки. Все остальные минеральные соли содержатся в натуральных продуктах. Вода и растворённые в ней минеральные соли всасываются по всему желудочно-кишечному тракту, но больше всего в тонком кишечнике.
Данный текст является ознакомительным фрагментом.
Продолжение на ЛитРесХимический состав клетки. Неорганические вещества. Липиды. Углеводы. 9-й класс
Цели и задачи:
Задачи урока: познакомить учащихся с химическим составом клеток; охарактеризовать неорганические и органические вещества, входящие в состав клетки; показать значение неорганических и органических веществ, входящих в состав клетки; сформировать понятие о гомеостазе.
1. Учащиеся должны усвоить понятия “водородная связь, диполь, буферные системы, углеводы, липиды, фосфолипиды, дисахариды, моносахариды, полисахариды, полимер, мономер, регулярныеи нерегулярные полимеры”; знать биологическую роль веществ клетки.
2. Учащиеся должны уметь самостоятельно прорабатывать учебный материал, устанавливать взаимосвязь между строением и биологической ролью веществ в клетке, делать обобщения, аргументировать свои выводы.
3. Способствовать развитию научного мировоззрения, коммуникативной культуры.
Форма учебной деятельности: комбинированный урок-рассказ с элементами самостоятельной работы, 2 урока.
Оборудование: ИД (мультмедиапроектор, ПК, Smartboard), SmartNotebook11 “Химический состав клетки”, печатные тетради.
Средства обучения: таблицы “Строение клетки” и “Содержание химических элементов в клетке”.
Ход занятия
Проблема жизни — это проблема
первичной
организации материи в живых объектах.
В.А. Энгельгардт
I. Проверка знаний
Фронтальный опрос о клетке как основе структурной организации организмов, об основных этапах развития цитологии, о современных положениях клеточной теории и определении клетки как элементарной биосистемы.
II. Изучение нового материала
1. Вступление. Введение в тему. (Предлагаемый образец презентации.)
Слайд 1 (Иллюстрации)
Благодаря созданию клеточной теории стало понятно, что клетка — это важнейшая составляющая часть всех живых организмов. Все клетки, за исключением бактериальных, построены по общему плану. В чем разница между этими двумя группами?
Слайд 2
Точный молекулярный состав организмов до настоящего времени полностью не известен. Это объясняется невероятным числом и сложностью разных молекул даже в одноклеточном организме, не говоря уже о сложных многоклеточных системах. Но! Все клетки живых организмов сходны по химическому составу!
Вопрос: о чем это свидетельствует?
Отличия живой клетки от неживого в следующем:
- высокое содержание воды;
- большое количество сложных органических веществ.
Слайд 3
Такое многообразие обусловлено свойствами атомов углерода и их способностью к структурным изменениям. Подавляющая часть молекул клетки, исключая воду, относится к углеродным соединениям, называемым органическими. Сегодня мы познакомимся с веществами, входящими в состав клетки. (Работа в ПТ №1, стр. 12).
(Интеративная схема — при нажатии на заголовки, открываются следующие вкладки. Так выглядит схема в развернутом виде)
Вопрос: Каково значение многообразия химических веществ, находящихся в клетке?
2. Изучение нового материала.
Слайд 4
Во время моего рассказа вам предстоит выбрать самый главный материал, характеризующий многообразие химического состава в клетках живых организмов и внести эти данные в таблицу.
(Учащиеся готовят в рабочей тетради таблицу)
Слайд 51. Элементарный состав клетки.
В состав живых клеток входит ряд относительно простых соединений, которые встречаются и в неживой природе – в минералах, природных водах. Это неорганические соединения. Нажать на стрелочку слева на панели и перейти на слайд №6.
После возвращения на слайд 5 после слайда №10:
- Невероятное число и сложность разных молекул даже в одноклеточном организме, не говоря уже о сложных многоклеточных система обусловлено свойствами атомов углерода и их способностью к структурным изменениям. Подавляющая часть молекул клетки, исключая воду, относится к углеродным соединениям, называемым органическими.
- Ссылка на слайд №11. (“Основой…)
- Ссылка на слайд №12. (“Углеводы)
Слайд 6
Вода – одно из самых распространённых веществ на Земле. Она покрывает большую часть земной поверхности. Почти все живые существа состоят в основном из воды.
- Рассказ о строении молекулы воды.
- Ссылка 1 — ссылка на слайд № 7 — flash-анимация о водородных связях (нажать назад для возвращения на данный слайд)
- Вода в клетке находится в двух формах…
- Ссылка 2 — ссылка на слайд № 8, а от него на №9 - свойства, функции и значение воды (нажать назад для возвращения на данный слайд)
- Рассказ о минеральных солях. Ссылка на слайд № 10 — flash-анимация о минеральных солях и буферности.
Слайд 7
Слайд № 7 — flash-анимация о водородных связях (нажать назад для возвращения на слайд 6).
Если flash-анимация не воспроизводится, нажать на флажок — flash-воспроизведение.
Слайд 8
Слайд № 8, а от него нажать на стрелочку слева на панели и перейти на слайд №9 — свойства, функции и значение воды.
Слайд 9
Слайд №9 — свойства, функции и значение воды (нажать назад для возвращения на данный слайд 6)
Слайд 10
Слайд № 10 — flash-анимация о минеральных солях и буферности (нажать назад для возвращения на данный слайд 5).
Буферность – способность клетки поддерживать слабощелочную реакцию своего содержимого на постоянном уровне.
Функции солей.
1) Регуляторная.
2) Структурная (АТФ, ДНК, костная ткань, раковины).
3) Обеспечивает буферные свойства.
4) Обеспечивает возникновение нервного импульса (ПД, ПП).
5) Обеспечивает гомеостаз внутренней среды.
Слайд 11
Рассказ о свойствах атомов углерода и их способности к структурным изменениям (нажать назад для возвращения на данный слайд 5).
Слайд 12
Сегодня мы познакомимся с органическими веществами, входящими в состав клетки.
Биополимеры,мономеры.
- Ссылка на слайд № 13 — flash-анимация о биополимерах (нажать назад для возвращения на данный слайд).
- Полимеры регулярного и нерегулярного строения.
- Нажать далее — для перехода к слайду №14
Слайд 13
flash-анимация о биополимерах (нажать назад для возвращения на данный слайд 12).
Слайд 14
Рассказ об углеводы и их многообразие, биологической роли для живых организмов (нажать на стрелочку слева на панели и перейти на слайд №15).
Слайд 15
Рассказ о функциях углеводов (нажать на стрелочку слева на панели и перейти на слайд №16).
Слайд 16
Рассказ о липидах и их многообразие, биологической роли для живых организмов.
- Ссылка на слайд № 17 — flash-анимация о сложных эфирах. (нажать назад для возвращения на данный слайд).
- Нажать далее — для перехода к слайду №18.
Слайд 17
flash-анимация о сложных эфирах. (нажать назад для возвращения на слайд 16).
Слайд 18
Рассказ о функциях липидов (нажать на стрелочку слева на панели и перейти на слайд №19).
III. Обобщение. Закрепление
Мы познакомились лишь с частью химических соединений, входящих в состав клетки, убедились, что минеральные соли, углеводы, липиды очень разнообразны.
— Каково значение многообразия химических веществ, находящихся в клетке?
Самостоятельная работа в парах с конспектом, учебником и ПТ (печатной тетрадью) № 2, 6, 7, 8, на стр. 13-14 — письменно, № 4, 5 — устно.
Работа в группах. Ообсудить ответ на вопросы заданий.
Задание 1. Перечислите физико-химические свойства воды, которые наиболее важны для живых организмов. Чем определяются эти свойства?
Проверка выполнения. (В воде растворяются в первую очередь неорганические вещества).
Задание 2. Чем объяснить, что плазма наземных позвоночных по солевому составу близка к морской воде? К чему приводит изменение солевого состава плазмы крови?
Проверка выполнения. (Минеральные соли составляют незначительную часть сухого вещества клетки. Львиная доля приходится на органические вешества).
Задание 3. Известно, что содержание углеводов в листьях и клубнях растений составляет до 90% сухого веса, в клетках мышц и печени животных – до 5%, а в прочих клетках животных – до 1%. Чем можно объяснить такую разницу?
Проверка выполнения.
IV. Закрепление знаний о химическом составе клетки, о неорганических веществах и их значении в клетке, об органических веществах и их роли в жизни клетки, о гомеостазе.
Итак, в микроскопической клетке содержится несколько тысяч веществ, которые участвуют в разнообразных химических реакциях. Химические процессы, протекающие в клетке, — одно из основных условий её жизни, развития, функционирования.
Вопросы для беседы.
1. Какие элементы и в каком количестве присутствуют в клетках растений и животных?
2. Какова биологическая роль микроэлементов?
3. Что представляют собой липиды и какова их роль в живой природе?
4. Почему в составе растительных клеток больше углеводов, чем в животных клетках?
Слайд 19
Самоконтроль по теме “Неорганические вещества клетки”.
V. Домашнее задание: изучить § 5 учебника, выполнить задания в конце параграфа и задание №3 в печатной тетради.
Творческое задание. Подготовить сообщение об открытии и изучении структуры нуклеиновых кислот Д. Уотсоном и Ф. Криком.
Приложение 1
Приложение 2
2.4 Неорганические соединения, необходимые для функционирования человека — анатомия и физиология
Цели обучения
К концу этого раздела вы сможете:
- Сравнить и сопоставить неорганические и органические соединения
- Определить свойства воды, которые делают ее жизненно важной
- Объясните роль солей в функционировании организма
- Различайте кислоты и основания и объясняйте их роль в pH
- Обсудить роль буферов в поддержании гомеостаза pH в организме
Концепции, которые вы изучили до сих пор в этой главе, управляют всеми формами материи и будут работать как основа как для геологии, так и для биологии.Этот раздел главы сужает фокус до химии человеческой жизни; то есть соединения, важные для структуры и функций организма. Как правило, эти соединения бывают либо неорганическими, либо органическими.
- Неорганическое соединение — это вещество, не содержащее ни углерода, ни водорода. Многие неорганические соединения действительно содержат атомы водорода, такие как вода (H 2 O) и соляная кислота (HCl), вырабатываемая вашим желудком. Напротив, только несколько неорганических соединений содержат атомы углерода.Двуокись углерода (CO 2 ) — один из немногих примеров.
- Органическое соединение — это вещество, содержащее как углерод, так и водород. Органические соединения синтезируются ковалентными связями в живых организмах, в том числе в организме человека. Вспомните, что углерод и водород являются вторым и третьим по распространенности элементами в вашем теле. Вскоре вы обнаружите, как эти два элемента сочетаются в пищевых продуктах, которые вы едите, в соединениях, составляющих структуру вашего тела, и в химических веществах, которые подпитывают ваше функционирование.
В следующем разделе рассматриваются четыре группы неорганических соединений, необходимых для жизни: вода, соли, кислоты и основания. Органические соединения рассматриваются далее в этой главе.
Вода
До 70 процентов веса взрослого человека составляет вода. Эта вода содержится как внутри клеток, так и между клетками, из которых состоят ткани и органы. Несколько функций делают воду незаменимой для жизнедеятельности человека.
Вода как смазка и амортизатор
Вода является основным компонентом многих смазочных жидкостей организма.Подобно тому, как масло смазывает петли двери, вода в синовиальной жидкости смазывает суставы тела, а вода в плевральной жидкости помогает легким расширяться и отскакивать при дыхании. Водянистая жидкость помогает пище течь по пищеварительному тракту и обеспечивает отсутствие трения при движении соседних органов брюшной полости.
Вода также защищает клетки и органы от физических травм, смягчая, например, мозг внутри черепа и защищая нежную нервную ткань глаз.Вода также смягчает развивающийся плод в утробе матери.
Вода как теплоотвод
Радиатор — это вещество или объект, которые поглощают и рассеивают тепло, но не испытывают соответствующего повышения температуры. В организме вода поглощает тепло, выделяемое в результате химических реакций, без значительного повышения температуры. Более того, когда температура окружающей среды стремительно растет, вода, хранящаяся в организме, помогает ему сохранять прохладу. Этот охлаждающий эффект возникает, когда теплая кровь из ядра тела течет к кровеносным сосудам под кожей и переносится в окружающую среду.В то же время потовые железы выделяют теплую воду вместе с потом. Когда вода испаряется в воздух, она уносит тепло, а затем более холодная кровь с периферии циркулирует обратно к сердцевине тела.
Вода как компонент жидких смесей
Смесь — это комбинация двух или более веществ, каждое из которых сохраняет свою химическую идентичность. Другими словами, составляющие вещества не связаны химически в новое, более крупное химическое соединение. Эту концепцию легко представить, если вы подумаете о порошкообразных веществах, таких как мука и сахар; когда вы перемешиваете их в миске, очевидно, что они не связываются с образованием нового соединения.Воздух в помещении, которым вы дышите, представляет собой газовую смесь, содержащую три отдельных элемента — азот, кислород и аргон — и одно соединение — диоксид углерода. Есть три типа жидких смесей, все из которых содержат воду в качестве ключевого компонента; это растворы, коллоиды и суспензии.
Чтобы клетки тела выжили, они должны оставаться влажными в жидкости на водной основе, называемой раствором. В химии жидкий раствор состоит из растворителя, который растворяет вещество, называемое растворенным веществом.Важной характеристикой растворов является их однородность; то есть молекулы растворенного вещества равномерно распределяются по всему раствору. Если бы вы размешали чайную ложку сахара в стакане воды, сахар растворился бы в молекулах сахара, разделенных молекулами воды. Соотношение сахара и воды в левой части стакана будет таким же, как соотношение сахара и воды в правой части стакана. Если бы вы добавили больше сахара, соотношение сахара к воде изменилось бы, но распределение — при условии, что вы хорошо перемешали — все равно было бы равномерным.
Вода считается «универсальным растворителем», и поэтому считается, что жизнь не может существовать без воды. Вода, безусловно, является самым распространенным растворителем в организме; практически все химические реакции организма происходят между соединениями, растворенными в воде. Поскольку молекулы воды полярны, с областями положительного и отрицательного электрического заряда, вода легко растворяет ионные соединения и полярные ковалентные соединения. Такие соединения называют гидрофильными или «водолюбивыми».Как было сказано выше, сахар хорошо растворяется в воде. Это связано с тем, что молекулы сахара содержат области полярных водородно-кислородных связей, что делает его гидрофильным. Неполярные молекулы, которые с трудом растворяются в воде, называются гидрофобными или «водобоязненными».
Концентрации растворенных веществ
В химии описаны различные смеси растворенных веществ и воды. Концентрация данного растворенного вещества — это количество частиц этого растворенного вещества в данном пространстве (кислород составляет около 21 процента атмосферного воздуха).В кровотоке человека концентрация глюкозы обычно измеряется в миллиграммах (мг) на децилитр (дл), а у здорового взрослого человека в среднем составляет около 100 мг / дл. Другой метод измерения концентрации растворенного вещества — его молярность, которая составляет моль (M) молекул на литр (L). Моль элемента — это его атомный вес, а моль соединения — это сумма атомных весов его компонентов, называемая молекулярной массой. Часто используемый пример — вычисление моля глюкозы по химической формуле C6h22O6.Согласно периодической таблице, атомный вес углерода (C) составляет 12,011 грамма (г), а в глюкозе шесть атомов углерода, что дает общий атомный вес 72,066 г. Проведя те же вычисления для водорода (H) и кислорода (O), молекулярная масса равна 180,156 г («грамм молекулярной массы» глюкозы). Когда вода добавляется для получения одного литра раствора, у вас есть один моль (1М) глюкозы. Это особенно полезно в химии из-за отношения родинок к «числу Авогадро». В моль любого раствора столько же частиц: 6.02 × 10 23 . Многие вещества в кровотоке и других тканях тела измеряются в тысячных долях моля или миллимолях (мМ).
Коллоид представляет собой смесь, которая чем-то похожа на тяжелый раствор. Частицы растворенного вещества состоят из крошечных сгустков молекул, достаточно больших, чтобы сделать жидкую смесь непрозрачной (поскольку частицы достаточно большие, чтобы рассеивать свет). Знакомые примеры коллоидов — молоко и сливки. В щитовидной железе гормон щитовидной железы хранится в виде густой белковой смеси, также называемой коллоидом.
Суспензия представляет собой жидкую смесь, в которой более тяжелое вещество временно суспендировано в жидкости, но со временем оседает. Такое отделение частиц от суспензии называется седиментацией. Пример седиментации происходит в анализе крови, который устанавливает скорость седиментации или скорость седиментации. Тест измеряет, как быстро красные кровяные тельца в пробирке выделяются из водянистой части крови (известной как плазма) в течение определенного периода времени. Быстрое осаждение клеток крови обычно не происходит в здоровом организме, но некоторые заболевания могут вызывать слипание клеток крови, и эти тяжелые скопления клеток крови оседают на дно пробирки быстрее, чем нормальные клетки крови.
Роль воды в химических реакциях
Два типа химических реакций включают образование или потребление воды: дегидратационный синтез и гидролиз.
- При дегидратационном синтезе один реагент отдает атом водорода, а другой реагент отдает гидроксильную группу (ОН) при синтезе нового продукта. При образовании их ковалентной связи в качестве побочного продукта выделяется молекула воды (рис. 2.4.1). Это также иногда называют реакцией конденсации.
- При гидролизе молекула воды разрушает соединение, разрывая его связи. Сама вода расщепляется на H и OH. Одна часть разорванного соединения затем связывается с атомом водорода, а другая часть связывается с гидроксильной группой.
Эти реакции обратимы и играют важную роль в химии органических соединений (о чем мы поговорим ниже).
Рисунок 2.4.1 — Дегидратационный синтез и гидролиз: Мономеры, основные единицы для построения более крупных молекул, образуют полимеры (два или более химически связанных мономера).(а) При дегидратационном синтезе два мономера ковалентно связаны в реакции, в которой один отдает гидроксильную группу, а другой — атом водорода. Молекула воды выделяется как побочный продукт во время реакций дегидратации. (b) При гидролизе ковалентная связь между двумя мономерами расщепляется путем присоединения атома водорода к одному и гидроксильной группы к другому, что требует участия одной молекулы воды.Соли
Напомним, что соли образуются, когда ионы образуют ионные связи.В этих реакциях один атом отдает один или несколько электронов и, таким образом, становится положительно заряженным, тогда как другой атом принимает один или несколько электронов и становится отрицательно заряженным. Теперь вы можете определить соль как вещество, которое при растворении в воде диссоциирует на ионы, отличные от H + или OH —. Этот факт важен для отличия солей от кислот и оснований, обсуждаемых далее.
Типичная соль NaCl полностью диссоциирует в воде (рисунок 2.4.2). Положительные и отрицательные области на молекуле воды (концы водорода и кислорода соответственно) притягивают отрицательные ионы хлорида и положительные ионы натрия, отталкивая их друг от друга.Опять же, в то время как неполярные и полярные ковалентно связанные соединения распадаются на молекулы в растворе, соли диссоциируют на ионы. Эти ионы являются электролитами; они способны проводить электрический ток в растворе. Это свойство имеет решающее значение для функции ионов при передаче нервных импульсов и стимулировании сокращения мышц.
Рисунок 2.4.2 — Диссоциация хлорида натрия в воде: Обратите внимание, что кристаллы хлорида натрия диссоциируют не на молекулы NaCl, а на катионы Na + и анионы Cl — , каждый из которых полностью окружен молекулами воды.Многие другие соли важны для организма. Например, соли желчных кислот, вырабатываемые печенью, помогают расщеплять пищевые жиры, а соли фосфата кальция образуют минеральную часть зубов и костей.
Кислоты и основания
Кислоты и основания, как и соли, диссоциируют в воде с образованием электролитов. Кислоты и основания могут сильно изменить свойства растворов, в которых они растворены.
Кислоты
Кислота — это вещество, выделяющее ионы водорода (H + ) в растворе (Рисунок 2.4.3 a ). Поскольку у атома водорода есть только один протон и один электрон, положительно заряженный ион водорода — это просто протон. Этот одиночный протон с большой вероятностью участвует в химических реакциях. Сильные кислоты — это соединения, которые выделяют весь свой H + в растворе; то есть они полностью ионизируются. Соляная кислота (HCl), которая выделяется из клеток слизистой оболочки желудка, является сильной кислотой, поскольку она выделяет весь свой H + в водянистую среду желудка.Эта сильная кислота помогает пищеварению и убивает микробы, попавшие в организм. Слабые кислоты не ионизируются полностью; то есть некоторые из их ионов водорода остаются связанными внутри соединения в растворе. Пример слабой кислоты — уксус или уксусная кислота; он называется ацетатом после того, как отдает протон.
Рисунок 2.4.3. — Кислоты и основания: (a) В водном растворе кислота диссоциирует на ионы водорода (H + ) и анионы. Почти каждая молекула сильной кислоты диссоциирует, образуя высокую концентрацию H + .(b) В водном растворе основание диссоциирует на гидроксильные ионы (OH — ) и катионы. Почти каждая молекула сильного основания диссоциирует, образуя высокую концентрацию OH — .Основания
A base — это вещество, которое выделяет гидроксильные ионы (OH — ) в растворе, или вещество, которое принимает H +, уже присутствующий в растворе (см. Рисунок 2.4.3 b ). Ионы гидроксила (также известные как ионы гидроксида) или другие основные вещества объединяются с присутствующим H + с образованием молекулы воды, тем самым удаляя H + и снижая кислотность раствора.Сильные основания высвобождают большую часть или все свои гидроксильные ионы; слабые основания выделяют только некоторые гидроксильные ионы или поглощают только несколько H + . Пища, смешанная с соляной кислотой из желудка, сожгла бы тонкий кишечник (следующий участок пищеварительного тракта после желудка), если бы не высвобождение бикарбоната (HCO 3 — ), слабого основания, которое привлекает Н + . Бикарбонат принимает часть протонов H +, тем самым снижая кислотность раствора.
Концепция pH
Относительную кислотность или щелочность раствора можно определить по его pH. pH раствора представляет собой отрицательный десятичный логарифм концентрации иона водорода (H + ) в растворе. Например, раствор с pH 4 имеет концентрацию H + , которая в десять раз больше, чем у раствора с pH 5. То есть раствор с pH 4 в десять раз более кислый, чем раствор с pH 5. Понятие pH станет более понятным, когда вы изучите шкалу pH, как показано на рисунке 2.4.4. Шкала состоит из серии приращений от 0 до 14.Раствор с pH 7 считается нейтральным — ни кислым, ни основным. Чистая вода имеет pH 7. Чем ниже число ниже 7, тем кислее раствор или тем выше концентрация H + . Концентрация ионов водорода при каждом значении pH в 10 раз отличается от следующего значения pH. Например, значение pH 4 соответствует концентрации протонов 10 –4 M или 0,0001M, а значение pH 5 соответствует концентрации протонов 10 –5 M или 0.00001M. Чем выше число выше 7, тем более щелочной (щелочной) раствор или тем ниже концентрация H + . Например, человеческая моча в десять раз более кислотная, чем чистая вода, а HCl в 10 000 000 раз кислотнее воды.
Рисунок 2.4.4 Шкала pHБуферы
pH крови человека обычно находится в диапазоне от 7,35 до 7,45, хотя обычно его определяют как pH 7,4. При таком слегка щелочном pH кровь может снизить кислотность, возникающую из-за того, что углекислый газ (CO 2 ) постоянно попадает в кровоток триллионами клеток тела.Гомеостатические механизмы (наряду с выдыханием CO 2 во время дыхания) обычно поддерживают pH крови в этом узком диапазоне. Это очень важно, потому что колебания — либо слишком кислые, либо слишком щелочные — могут привести к опасным для жизни расстройствам.
Все клетки организма зависят от гомеостатической регуляции кислотно-щелочного баланса при pH примерно 7,4. Таким образом, в организме есть несколько механизмов для этой регуляции, включая дыхание, выделение химических веществ с мочой и внутреннее высвобождение химических веществ, которые в совокупности называются буферами, в жидкости организма.Буфер представляет собой раствор слабой кислоты и ее конъюгированного основания. Буфер может нейтрализовать небольшое количество кислот или оснований в жидкостях организма. Например, если есть даже небольшое снижение pH жидкости организма ниже 7,35, буфер в жидкости — в данном случае действующий как слабое основание — будет связывать избыточные ионы водорода. Напротив, если pH поднимается выше 7,45, буфер будет действовать как слабая кислота и вносить ионы водорода.
Гомеостатический дисбаланс
Чрезмерная кислотность кислот и оснований, крови и других жидкостей организма известна как ацидоз.Распространенными причинами ацидоза являются ситуации и нарушения, которые снижают эффективность дыхания, особенно способность человека полностью выдохнуть, что вызывает накопление CO 2 (и H + ) в кровотоке. Ацидоз также может быть вызван метаболическими проблемами, которые снижают уровень или функцию буферов, которые действуют как основания или способствуют выработке кислот. Например, при тяжелой диарее из организма может выводиться слишком много бикарбоната, в результате чего кислоты накапливаются в жидкостях организма.У людей с плохо управляемым диабетом (неэффективное регулирование уровня сахара в крови) кислоты, называемые кетонами, вырабатываются в качестве топлива для организма. Они могут накапливаться в крови, вызывая серьезное заболевание, называемое диабетическим кетоацидозом. Почечная недостаточность, печеночная недостаточность, сердечная недостаточность, рак и другие заболевания также могут вызывать метаболический ацидоз.
Напротив, алкалоз — это состояние, при котором кровь и другие жидкости организма слишком щелочные (щелочные). Как и в случае ацидоза, основной причиной являются респираторные расстройства; однако при респираторном алкалозе уровни углекислого газа падают слишком низко.Заболевания легких, передозировка аспирином, шок и обычное беспокойство могут вызвать респираторный алкалоз, который снижает нормальную концентрацию H + .
Метаболический алкалоз часто возникает в результате продолжительной сильной рвоты, которая вызывает потерю ионов водорода и хлорида (как компонентов HCl). Лекарства также могут вызвать алкалоз. К ним относятся диуретики, которые заставляют организм терять ионы калия, а также антациды при приеме в чрезмерных количествах, например, при стойкой изжоге или язве.
Обзор главыНеорганические соединения, необходимые для функционирования человека, включают воду, соли, кислоты и основания. Эти соединения неорганические; то есть они не содержат ни водорода, ни углерода. Вода — это смазка и подушка, теплоотвод, компонент жидких смесей, побочный продукт реакций синтеза дегидратации и реагент в реакциях гидролиза. Соли — это соединения, которые при растворении в воде диссоциируют на ионы, отличные от H + или OH —.Напротив, кислоты выделяют в растворе H + , делая его более кислым. Основания принимают H + , тем самым делая раствор более щелочным (едким).
pH любого раствора — это его относительная концентрация H + . Раствор с pH 7 нейтрален. Растворы с pH ниже 7 являются кислотами, а растворы с pH выше 7 — основаниями. Изменение одной цифры на шкале pH (например, от 7 до 8) представляет десятикратное увеличение или уменьшение концентрации H + .У здорового взрослого человека pH крови колеблется от 7,35 до 7,45. Механизмы гомеостатического контроля, которые важны для поддержания крови в здоровом диапазоне pH, включают химические вещества, называемые буферами, слабые кислоты и слабые основания, высвобождаемые, когда pH крови или других жидкостей организма колеблется в любом направлении за пределами этого нормального диапазона.
Контрольные вопросы Вопросы критического мышленияpH лимонного сока равен 2, а pH апельсинового сока равен 4.Какой из них более кислый и насколько? Что это значит?
Лимонный сок в сто раз более кислый, чем апельсиновый сок. Это означает, что в лимонном соке концентрация ионов водорода в сто раз выше.
Во время вечеринки Эли проигрывает пари и вынужден выпить бутылку лимонного сока. Вскоре после этого он начинает жаловаться на затрудненное дыхание, и его друзья отвозят его в местное отделение неотложной помощи. Там ему внутривенно вводят раствор бикарбоната.Почему?
Лимонный сок, как и любая кислота, выделяет ионы водорода в растворе. Поскольку избыток H + попадает в пищеварительный тракт и всасывается в кровь, pH крови Эли падает ниже 7,35. Напомним, что бикарбонат — это буфер, слабое основание, которое принимает ионы водорода. Вводя бикарбонат внутривенно, врач отделения неотложной помощи помогает поднять pH крови Эли до нейтрального.
Молекулярный состав клеток — Клетка
Клетки состоят из воды, неорганических ионов и углеродсодержащих (органических) молекул.Вода — самая распространенная молекула в клетках, составляющая 70% или более общей клеточной массы. Следовательно, взаимодействие между водой и другими составляющими клетки имеет центральное значение в биологической химии. Важнейшим свойством воды в этом отношении является то, что это полярная молекула, в которой атомы водорода имеют небольшой положительный заряд, а кислород — небольшой отрицательный заряд (). Из-за своей полярной природы молекулы воды могут образовывать водородные связи друг с другом или с другими полярными молекулами, а также взаимодействовать с положительно или отрицательно заряженными ионами.В результате этих взаимодействий ионы и полярные молекулы легко растворяются в воде (гидрофильные). Напротив, неполярные молекулы, которые не могут взаимодействовать с водой, плохо растворимы в водной среде (гидрофобны). Следовательно, неполярные молекулы стремятся минимизировать свой контакт с водой, вместо этого тесно связываясь друг с другом. Как обсуждается далее в этой главе, такие взаимодействия полярных и неполярных молекул с водой и друг с другом играют решающую роль в формировании биологических структур, таких как клеточные мембраны.
Рисунок 2.1
Характеристики воды. (A) Вода — полярная молекула с небольшим отрицательным зарядом (δ — ) на атоме кислорода и небольшим положительным зарядом (δ + ) на атомах водорода. Из-за этой полярности молекулы воды могут образовывать водородные связи (пунктирная (подробнее …)
Неорганические ионы клетки, включая натрий (Na + ), калий (K + ), магний (Mg 2). + ), кальций (Ca 2+ ), фосфат (HPO 4 2- ), хлорид (Cl — ) и бикарбонат (HCO 3 — ) составляют 1% или менее клеточной массы.Эти ионы участвуют во многих аспектах клеточного метаболизма и, таким образом, играют решающую роль в функционировании клетки.
Однако органические молекулы являются уникальными составляющими клеток. Большинство этих органических соединений относятся к одному из четырех классов молекул: углеводов, липидов, белков и нуклеиновых кислот. Белки, нуклеиновые кислоты и большинство углеводов (полисахариды) представляют собой макромолекулы, образованные путем объединения (полимеризации) сотен или тысяч низкомолекулярных предшественников: аминокислот, нуклеотидов и простых сахаров соответственно.Такие макромолекулы составляют от 80 до 90% сухой массы большинства клеток. Липиды — еще одна важная составляющая клеток. Остальная часть клеточной массы состоит из множества небольших органических молекул, включая макромолекулярные предшественники. Таким образом, основную химию клеток можно понять с точки зрения структур и функций четырех основных классов органических молекул.
Углеводы
Углеводы включают простые сахара, а также полисахариды. Эти простые сахара, такие как глюкоза, являются основными питательными веществами клеток.Как обсуждается далее в этой главе, их распад обеспечивает как источник клеточной энергии, так и исходный материал для синтеза других компонентов клетки. Полисахариды являются формами хранения сахаров и образуют структурные компоненты клетки. Кроме того, полисахариды и более короткие полимеры сахаров действуют как маркеры для множества процессов распознавания клеток, включая адгезию клеток к своим соседям и транспорт белков в соответствующие внутриклеточные пункты назначения.
Структуры типичных простых сахаров (моносахаридов) проиллюстрированы на.Основная формула этих молекул: (CH 2 O) n , от которой происходит название углевод (C = «углевод» и H 2 O = «гидрат»). Шестиуглеродная ( n = 6) сахарная глюкоза (C 6 H 12 O 6 ) особенно важна для клеток, поскольку она обеспечивает основной источник клеточной энергии. Другие простые сахара содержат от трех до семи атомов углерода, из которых наиболее распространены трех- и пятиуглеродные сахара. Сахара, содержащие пять или более атомов углерода, могут циклизоваться с образованием кольцевых структур, которые являются преобладающими формами этих молекул в клетках.Как показано на рисунке, циклизованные сахара существуют в двух альтернативных формах (называемых α или β), в зависимости от конфигурации углерода 1.
Рисунок 2.2
Структура простых сахаров. Проиллюстрированы типичные сахара, содержащие три, пять и шесть атомов углерода (триоза, пентоза и гексоза, соответственно). Сахара с пятью или более атомами углерода могут циклизоваться с образованием колец, которые существуют в двух альтернативных формах (подробнее …)
Моносахариды могут быть соединены вместе реакциями дегидратации, в которых удаляется H 2 O, а сахара связываются посредством гликозидная связь между двумя их атомами углерода ().Если соединить вместе только несколько сахаров, полученный полимер называется олигосахаридом. Если задействовано большое количество (сотни или тысячи) сахаров, полученные полимеры представляют собой макромолекулы, называемые полисахаридами.
Рисунок 2.3
Образование гликозидной связи. Два простых сахара соединяются в результате реакции дегидратации (реакции, при которой удаляется вода). В показанном примере две молекулы глюкозы в α-конфигурации соединены связью между атомами углерода 1 и 4, которые (более…)
Два обычных полисахарида — гликоген и крахмал — являются формами хранения углеводов в клетках животных и растений, соответственно. И гликоген, и крахмал полностью состоят из молекул глюкозы в α-конфигурации (). Основная связь — между углеродом 1 одной глюкозы и углеродом 4 второй. Кроме того, как гликоген, так и одна из форм крахмала (амилопектин) содержат случайные α (1 → 6) связи, в которых углерод 1 одной глюкозы соединен с углеродом 6 второй. Как показано в, эти связи приводят к образованию разветвлений в результате соединения двух отдельных α (1 → 4) связанных цепей.Такие ответвления присутствуют в гликогене и амилопектине, хотя другая форма крахмала (амилоза) представляет собой неразветвленную молекулу.
Рисунок 2.4
Структура полисахаридов. Полисахариды — это макромолекулы, состоящие из сотен или тысяч простых сахаров. Гликоген, крахмал и целлюлоза полностью состоят из остатков глюкозы, которые соединены α (1 → 4) гликозидом (подробнее …)
Таким образом, структуры гликогена и крахмала в основном похожи, как и их функция: хранить глюкозу.Целлюлоза, напротив, выполняет совершенно определенную функцию в качестве основного структурного компонента стенки растительной клетки. Возможно, удивительно, что целлюлоза также полностью состоит из молекул глюкозы. Однако остатки глюкозы в целлюлозе имеют β, а не α конфигурацию, а целлюлоза является неразветвленным полисахаридом (см.). Связывание остатков глюкозы связями β (1 → 4), а не α (1 → 4) заставляет целлюлозу образовывать длинные вытянутые цепи, которые упаковываются бок о бок, образуя волокна с большой механической прочностью.
Помимо своей роли в хранении энергии и структуре клетки, олигосахариды и полисахариды играют важную роль в различных процессах передачи сигналов в клетке. Например, олигосахариды часто связаны с белками, где они служат маркерами белков-мишеней для транспорта на поверхность клетки или включения в различные субклеточные органеллы. Олигосахариды и полисахариды также служат маркерами на поверхности клеток, играя важную роль в распознавании клеток и взаимодействии между клетками в тканях многоклеточных организмов.
Липиды
Липиды играют в клетках три основных роли. Во-первых, они обеспечивают важную форму хранения энергии. Во-вторых, что очень важно для клеточной биологии, липиды являются основными компонентами клеточных мембран. В-третьих, липиды играют важную роль в передаче сигналов в клетке как стероидные гормоны (например, эстроген и тестостерон), так и как молекулы-посредники, передающие сигналы от рецепторов клеточной поверхности к мишеням внутри клетки.
Самыми простыми липидами являются жирные кислоты, которые состоят из длинных углеводородных цепей, чаще всего содержащих 16 или 18 атомов углерода, с карбоксильной группой (COO — ) на одном конце ().Ненасыщенные жирные кислоты содержат одну или несколько двойных связей между атомами углерода; в насыщенных жирных кислотах все атомы углерода связаны с максимальным числом атомов водорода. Длинные углеводородные цепи жирных кислот содержат только неполярные связи C — H, которые не могут взаимодействовать с водой. Гидрофобная природа этих цепей жирных кислот во многом определяет поведение сложных липидов, особенно при формировании биологических мембран.
Рисунок 2.5
Структура жирных кислот.Жирные кислоты состоят из длинных углеводородных цепей, оканчивающихся карбоксильной группой (COO — ). Пальмитат и стеарат представляют собой насыщенные жирные кислоты, состоящие из 16 и 18 атомов углерода соответственно. Олеат — ненасыщенная 18-углеродная жирная кислота (подробнее …)
Жирные кислоты хранятся в форме триацилглицеринов или жиров, которые состоят из трех жирных кислот, связанных с молекулой глицерина (). Триацилглицерины нерастворимы в воде и поэтому накапливаются в цитоплазме в виде капелек жира. При необходимости их можно разделить для использования в реакциях выделения энергии, которые обсуждаются далее в этой главе.Примечательно, что жиры являются более эффективной формой хранения энергии, чем углеводы, давая более чем в два раза больше энергии на вес расщепленного материала. Таким образом, жиры позволяют накапливать энергию, составляющую менее половины массы тела, которая потребовалась бы для хранения такого же количества энергии в углеводах — что особенно важно для животных из-за их подвижности.
Рисунок 2.6
Структура триацилглицеринов. Триацилглицерины (жиры) содержат три жирные кислоты, присоединенные к глицерину.В этом примере все три жирные кислоты представляют собой пальмитат, но триацилглицерины часто содержат смесь различных жирных кислот.
Фосфолипиды, основные компоненты клеточных мембран, состоят из двух жирных кислот, связанных с полярной головной группой (). В фосфолипидах глицерина две жирные кислоты связаны с атомами углерода в глицерине, как и в триацилглицеринах. Однако третий углерод глицерина связан с фосфатной группой, которая, в свою очередь, часто присоединяется к другой небольшой полярной молекуле, такой как холин, серин, инозитол или этаноламин.Сфингомиелин, единственный неглицериновый фосфолипид в клеточных мембранах, содержит две углеводородные цепи, связанные с полярной головной группой, образованной из серина, а не из глицерина. Все фосфолипиды имеют гидрофобные хвосты, состоящие из двух углеводородных цепей, и гидрофильные головные группы, состоящие из фосфатной группы и ее полярных присоединений. Следовательно, фосфолипиды представляют собой амфипатические молекулы, частично растворимые в воде и частично нерастворимые в воде. Это свойство фосфолипидов является основой для образования биологических мембран, как обсуждается далее в этой главе.
Рисунок 2.7
Структура фосфолипидов. Фосфолипиды глицерина содержат две жирные кислоты, присоединенные к глицерину. Жирные кислоты могут отличаться друг от друга и обозначаются R1 и R2. Третий углерод глицерина присоединен к фосфатной группе (образуя фосфатидную (подробнее …)
Помимо фосфолипидов, многие клеточные мембраны содержат гликолипиды и холестерин. Гликолипиды состоят из двух углеводородных цепей, связанных с полярными головными группами, которые содержат углеводы ( ).Таким образом, они похожи на фосфолипиды в своей общей организации как амфипатические молекулы. Холестерин, напротив, состоит из четырех углеводородных колец, а не из линейных углеводородных цепей (). Углеводородные кольца сильно гидрофобны, но гидроксильная (ОН) группа, присоединенная к одному концу холестерина, слабо гидрофильна, поэтому холестерин также является амфипатическим.
Рисунок 2.8
Структура гликолипидов. Две углеводородные цепи присоединены к полярной головной группе, образованной из серина и содержащей углеводы (например,г., глюкоза).
Рисунок 2.9
Холестерин и стероидные гормоны. Холестерин, важный компонент клеточных мембран, является амфипатической молекулой из-за его полярной гидроксильной группы. Холестерин также является предшественником стероидных гормонов, таких как тестостерон и эстрадиол (форма (подробнее …)
Помимо своей роли в качестве компонентов клеточных мембран, липиды действуют как сигнальные молекулы как внутри, так и между клетками. стероидные гормоны (например, эстрогены и тестостерон) являются производными холестерина (см.).Эти гормоны представляют собой разнообразную группу химических посредников, каждая из которых содержит четыре углеводородных кольца, к которым присоединены различные функциональные группы. Производные фосфолипидов также служат в качестве молекул-посредников внутри клеток, передавая сигналы от рецепторов клеточной поверхности к внутриклеточным мишеням (см. Главу 13).
Нуклеиновые кислоты
Нуклеиновые кислоты — ДНК и РНК — являются основными информационными молекулами клетки. Дезоксирибонуклеиновая кислота (ДНК) играет уникальную роль в качестве генетического материала, который в эукариотических клетках располагается в ядре.Различные типы рибонуклеиновой кислоты (РНК) участвуют в ряде клеточных активностей. Информационная РНК (мРНК) передает информацию от ДНК к рибосомам, где она служит матрицей для синтеза белка. Два других типа РНК (рибосомная РНК и транспортная РНК) участвуют в синтезе белка. Еще другие виды РНК участвуют в процессинге и транспорте как РНК, так и белков. Помимо того, что РНК действует как информационная молекула, она также способна катализировать ряд химических реакций.В современных клетках они включают реакции, участвующие как в синтезе белка, так и в процессинге РНК.
ДНК и РНК представляют собой полимеры нуклеотидов, которые состоят из пуриновых и пиримидиновых оснований, связанных с фосфорилированными сахарами (). ДНК содержит два пурина (аденин и гуанин) и два пиримидина (цитозин и тимин). Аденин, гуанин и цитозин также присутствуют в РНК, но РНК содержит урацил вместо тимина. Основания связаны с сахарами ( 2 ‘-дезоксирибоза в ДНК или рибоза в РНК) с образованием нуклеозидов.Нуклеотиды дополнительно содержат одну или несколько фосфатных групп, связанных с 5′-атомом углерода нуклеозидных сахаров.
Рисунок 2.10
Компоненты нуклеиновых кислот. Нуклеиновые кислоты содержат пуриновые и пиримидиновые основания, связанные с фосфорилированными сахарами. Основание нуклеиновой кислоты, связанное только с сахаром, является нуклеозидом. Нуклеотиды дополнительно содержат одну или несколько фосфатных групп.
Полимеризация нуклеотидов с образованием нуклеиновых кислот включает образование фосфодиэфирных связей между 5′-фосфатом одного нуклеотида и 3′-гидроксилом другого ().Олигонуклеотиды — это небольшие полимеры, содержащие всего несколько нуклеотидов; большие полинуклеотиды, из которых состоят клеточные РНК и ДНК, могут содержать тысячи или миллионы нуклеотидов соответственно. Важно отметить, что полинуклеотидная цепь имеет определенное направление, причем один конец цепи оканчивается 5′-фосфатной группой, а другой — 3′-гидроксильной группой. Полинуклеотиды всегда синтезируются в направлении от 5 ‘к 3’, причем свободный нуклеотид добавляется к 3 ‘ОН-группе растущей цепи.По соглашению, последовательность оснований в ДНК или РНК также записывается в направлении от 5 ‘к 3’.
Рисунок 2.11
Полимеризация нуклеотидов. Фосфодиэфирная связь образуется между 3′-гидроксильной группой одного нуклеотида и 5′-фосфатной группой другого. У полинуклеотидной цепи есть чувство направления, один конец заканчивается 5 ‘(подробнее …)
Информация в ДНК и РНК передается в порядке оснований в полинуклеотидной цепи. ДНК — это двухцепочечная молекула, состоящая из двух полинуклеотидных цепей, идущих в противоположных направлениях (см. Главу 3).Основания находятся внутри молекулы, и две цепи соединены водородными связями между комплементарными парами оснований — соединение аденина с тимином и гуанина с цитозином (). Важным следствием такого комплементарного спаривания оснований является то, что одна цепь ДНК (или РНК) может действовать как матрица для управления синтезом комплементарной цепи. Таким образом, нуклеиновые кислоты обладают уникальной способностью управлять собственной саморепликацией, что позволяет им функционировать в качестве основных информационных молекул клетки.Информация, переносимая ДНК и РНК, направляет синтез определенных белков, которые контролируют большую часть клеточной активности.
Рисунок 2.12
Комплементарное спаривание между основаниями нуклеиновых кислот. Образование водородных связей между основаниями на противоположных цепях ДНК приводит к специфическому спариванию гуанина (G) с цитозином (C) и аденина (A) с тимином (T).
Нуклеотиды важны не только как строительные блоки нуклеиновых кислот; они также играют важную роль в других клеточных процессах.Возможно, наиболее ярким примером является аденозин-5′-трифосфат (АТФ), который является основной формой химической энергии в клетках. Другие нуклеотиды аналогичным образом действуют как переносчики энергии или реактивных химических групп в широком спектре метаболических реакций. Кроме того, некоторые нуклеотиды (например, циклический АМФ) являются важными сигнальными молекулами внутри клеток (см. Главу 13).
Белки
Хотя нуклеиновые кислоты несут генетическую информацию клетки, основная ответственность белков заключается в выполнении задач, управляемых этой информацией.Белки являются наиболее разнообразными из всех макромолекул, и каждая клетка содержит несколько тысяч различных белков, которые выполняют самые разные функции. Роли белков включают в себя выполнение функций структурных компонентов клеток и тканей, действие в транспорте и хранении малых молекул (например, перенос кислорода гемоглобином), передачу информации между клетками (например, белковых гормонов) и обеспечение защиты от инфекция (например, антитела). Однако наиболее фундаментальным свойством белков является их способность действовать как ферменты, которые, как обсуждается в следующем разделе, катализируют почти все химические реакции в биологических системах.Таким образом, белки направляют практически всю деятельность клетки. На центральное значение белков в биологической химии указывает их название, которое происходит от греческого слова proteios , что означает «первого ранга».
Белки представляют собой полимеры 20 различных аминокислот. Каждая аминокислота состоит из атома углерода (называемого α-углеродом), связанного с карбоксильной группой (COO — ), аминогруппы (NH 3 + ), атома водорода и характерной боковой цепи () .Конкретные химические свойства различных боковых цепей аминокислот определяют роль каждой аминокислоты в структуре и функции белка.
Рисунок 2.13
Структура аминокислот. Каждая аминокислота состоит из центрального атома углерода (α-углерода), связанного с атомом водорода, карбоксильной группы, аминогруппы и определенной боковой цепи (обозначенной R). При физиологическом pH как карбоксил, так и амино (подробнее …)
Аминокислоты можно разделить на четыре широкие категории в соответствии со свойствами их боковых цепей ().Десять аминокислот имеют неполярные боковые цепи, которые не взаимодействуют с водой. Глицин — простейшая аминокислота, боковая цепь которой состоит только из атома водорода. Аланин, валин, лейцин и изолейцин имеют боковые углеводородные цепи, содержащие до четырех атомов углерода. Боковые цепи этих аминокислот гидрофобны и поэтому имеют тенденцию располагаться внутри белков, где они не контактируют с водой. У пролина также есть углеводородная боковая цепь, но он уникален тем, что его боковая цепь связана с азотом аминогруппы, а также с α-углеродом, образуя циклическую структуру.Боковые цепи двух аминокислот, цистеина и метионина, содержат атомы серы. Метионин довольно гидрофобен, но цистеин менее гидрофобен из-за его сульфгидрильной (SH) группы. Как обсуждается ниже, сульфгидрильная группа цистеина играет важную роль в структуре белка, поскольку дисульфидные связи могут образовываться между боковыми цепями различных остатков цистеина. Наконец, две неполярные аминокислоты, фенилаланин и триптофан, имеют боковые цепи, содержащие очень гидрофобные ароматические кольца.
Рисунок 2.14
Аминокислоты. Для каждой аминокислоты указаны трехбуквенные и однобуквенные сокращения. Аминокислоты сгруппированы в четыре категории в соответствии со свойствами их боковых цепей: неполярные, полярные, основные и кислотные.
Пять аминокислот имеют незаряженные, но полярные боковые цепи. К ним относятся серин, треонин и тирозин, которые имеют гидроксильные группы на их боковых цепях, а также аспарагин и глутамин, которые имеют полярные амидные (O = C-NH 2 ) группы.Поскольку полярные боковые цепи этих аминокислот могут образовывать водородные связи с водой, эти аминокислоты являются гидрофильными и имеют тенденцию располагаться снаружи белков.
Аминокислоты лизин, аргинин и гистидин имеют боковые цепи с заряженными основными группами. Лизин и аргинин являются очень основными аминокислотами, и их боковые цепи имеют положительный заряд в клетке. Следовательно, они очень гидрофильны и находятся в контакте с водой на поверхности белков. Гистидин может быть незаряженным или положительно заряженным при физиологическом pH, поэтому он часто играет активную роль в ферментативных реакциях, включающих обмен ионами водорода, как показано на примере ферментативного катализа, обсуждаемом в следующем разделе.
Наконец, две аминокислоты, аспарагиновая кислота и глутаминовая кислота, имеют кислотные боковые цепи, оканчивающиеся карбоксильными группами. Эти аминокислоты имеют отрицательный заряд внутри клетки и поэтому часто называются аспартатом и глутаматом. Как и основные аминокислоты, эти кислые аминокислоты очень гидрофильны и обычно расположены на поверхности белков.
Аминокислоты соединены пептидными связями между α-аминогруппой одной аминокислоты и α-карбоксильной группой второй ().Полипептиды представляют собой линейные цепи аминокислот, обычно длиной в сотни или тысячи аминокислот. Каждая полипептидная цепь имеет два различных конца, один из которых заканчивается α-аминогруппой (амино- или N-конец), а другой — α-карбоксильной группой (карбокси или C-конец). Полипептиды синтезируются от амино до карбокси-конца, и последовательность аминокислот в полипептиде записывается (по соглашению) в том же порядке.
Рисунок 2.15
Образование пептидной связи.Карбоксильная группа одной аминокислоты связана с аминогруппой второй.
Определяющей характеристикой белков является то, что они представляют собой полипептиды с определенными аминокислотными последовательностями. В 1953 году Фредерик Сэнджер первым определил полную аминокислотную последовательность белка, гормона инсулина. Было обнаружено, что инсулин состоит из двух полипептидных цепей, соединенных дисульфидными связями между остатками цистеина (). Самое главное, эксперимент Сэнгера показал, что каждый белок состоит из определенной аминокислотной последовательности.В настоящее время белки секвенированы с использованием автоматизированных методов, и теперь известны полные аминокислотные последовательности более 100 000 белков. Каждый состоит из уникальной последовательности аминокислот, определяемой порядком нуклеотидов в гене (см. Главу 3).
Рисунок 2.16
Аминокислотная последовательность инсулина. Инсулин состоит из двух полипептидных цепей, одна из 21, а другая из 30 аминокислот (обозначенных здесь их однобуквенными кодами). Боковые цепи трех пар остатков цистеина соединены дисульфидными связями, две из которых (больше…)
Аминокислотная последовательность белка — это только первый элемент его структуры. Вместо того, чтобы быть протяженными цепочками аминокислот, белки принимают различные трехмерные конформации, которые имеют решающее значение для их функции. Эти трехмерные конформации белков являются результатом взаимодействий между составляющими их аминокислотами, поэтому формы белков определяются их аминокислотными последовательностями. Впервые это было продемонстрировано в экспериментах Кристиана Анфинсена, в которых он разрушил трехмерные структуры белков с помощью таких обработок, как нагрев, которые разрывают нековалентные связи — процесс, называемый денатурацией ().После инкубации в более мягких условиях такие денатурированные белки часто самопроизвольно возвращались к своим природным конформациям, что указывает на то, что эти конформации непосредственно определялись аминокислотной последовательностью.
Рисунок 2.17
Денатурация и рефолдинг белка. Рибонуклеаза (РНКаза) представляет собой белок из 124 аминокислот (обозначенных цифрами). Белок обычно свернут в свою нативную конформацию, которая содержит четыре дисульфидные связи (обозначены парными кружками, представляющими (больше…)
Трехмерная структура белков наиболее часто анализируется с помощью рентгеновской кристаллографии, метода высокого разрешения, который может определять расположение отдельных атомов в молекуле. Луч рентгеновских лучей направляется на кристаллы белка, подлежащего анализу, и картина рентгеновских лучей, которые проходят через кристалл белка, регистрируется на рентгеновской пленке. Когда рентгеновские лучи попадают на кристалл, они рассеиваются по характерным узорам, определяемым расположением атомов в молекуле.Таким образом, структура молекулы может быть выведена из картины рассеянных рентгеновских лучей (картины дифракции).
В 1958 году Джон Кендрю первым определил трехмерную структуру белка миоглобина — относительно простого белка из 153 аминокислот (). С тех пор были проанализированы трехмерные структуры нескольких тысяч белков. Большинство из них, как и миоглобин, представляют собой глобулярные белки с полипептидными цепями, сложенными в компактные структуры, хотя некоторые (например, структурные белки соединительной ткани) представляют собой длинные волокнистые молекулы.Анализ трехмерных структур этих белков выявил несколько основных принципов, которые управляют сворачиванием белка, хотя структура белка настолько сложна, что предсказать трехмерную структуру белка непосредственно по его аминокислотной последовательности невозможно.
Рисунок 2.18
Трехмерная структура миоглобина. Миоглобин — это белок из 153 аминокислот, который участвует в транспорте кислорода. Полипептидная цепь свернута вокруг гемовой группы, которая служит сайтом связывания кислорода.
Белковая структура обычно описывается как имеющая четыре уровня. Первичная структура белка — это последовательность аминокислот в его полипептидной цепи. Вторичная структура — это регулярное расположение аминокислот в локализованных областях полипептида. Особенно распространены два типа вторичной структуры, которые впервые были предложены Линусом Полингом и Робертом Кори в 1951 году: α-спираль и β-лист. Обе эти вторичные структуры удерживаются вместе водородными связями между группами CO и NH пептидных связей.Спираль α образуется, когда область полипептидной цепи наматывается вокруг себя, при этом группа CO одной пептидной связи образует водородную связь с группой NH пептидной связи, расположенной на четыре остатка ниже по ходу линейной полипептидной цепи (). Напротив, β-лист образуется, когда две части полипептидной цепи лежат бок о бок с водородными связями между ними. Такие β-слои могут быть образованы между несколькими полипептидными цепями, которые могут быть ориентированы либо параллельно, либо антипараллельно друг другу.
Рисунок 2.19
Вторичная структура белков. Наиболее распространенными типами вторичной структуры являются α-спираль и β-лист. В α-спирали водородные связи образуются между группами CO и NH пептидных связей, разделенными четырьмя аминокислотными остатками. (подробнее …)
Третичная структура — это сворачивание полипептидной цепи в результате взаимодействий между боковыми цепями аминокислот, лежащих в разных областях первичной последовательности (). В большинстве белков комбинации α-спиралей и β-листов, соединенных петлевыми участками полипептидной цепи, складываются в компактные глобулярные структуры, называемые доменами, которые являются основными единицами третичной структуры.Небольшие белки, такие как рибонуклеаза или миоглобин, содержат только один домен; более крупные белки могут содержать несколько разных доменов, которые часто связаны с разными функциями.
Рисунок 2.20
Третичная структура рибонуклеазы. Участки вторичных структур α-спирали и β-листка, соединенные участками петель, складываются в нативную конформацию белка. В этом схематическом представлении полипептидной цепи как (подробнее …)
Критическим детерминантом третичной структуры является локализация гидрофобных аминокислот внутри белка и гидрофильных аминокислот на поверхности, где они взаимодействуют с вода.Таким образом, внутренняя часть свернутых белков состоит в основном из гидрофобных аминокислот, расположенных в α-спиралях и β-листах; эти вторичные структуры обнаруживаются в гидрофобных сердцевинах белков, поскольку водородные связи нейтрализуют полярный характер групп CO и NH основной цепи полипептида. Участки петель, соединяющие элементы вторичной структуры, находятся на поверхности свернутых белков, где полярные компоненты пептидных связей образуют водородные связи с водой или с полярными боковыми цепями гидрофильных аминокислот.Взаимодействия между полярными боковыми цепями аминокислот (водородными связями и ионными связями) на поверхности белка также являются важными детерминантами третичной структуры. Кроме того, ковалентные дисульфидные связи между сульфгидрильными группами остатков цистеина стабилизируют складчатые структуры многих белков клеточной поверхности или секретируемых белков.
Четвертый уровень структуры белка, четвертичная структура, состоит из взаимодействий между различными полипептидными цепями в белках, состоящих из более чем одного полипептида.Гемоглобин, например, состоит из четырех полипептидных цепей, удерживаемых вместе одними и теми же типами взаимодействий, которые поддерживают третичную структуру ().
Рисунок 2.21
Четвертичная структура гемоглобина. Гемоглобин состоит из четырех полипептидных цепей, каждая из которых связана с гемовой группой. Две α-цепи и две β-цепи идентичны.
Таким образом, различные химические характеристики 20 различных аминокислот приводят к значительным вариациям в трехмерных конформациях свернутых белков.Следовательно, белки представляют собой чрезвычайно сложную и разнообразную группу макромолекул, подходящих для широкого круга задач, которые они выполняют в клеточной биологии.
Box
Ключевой эксперимент: сворачивание полипептидных цепей.
Неорганические соединения, необходимые для функционирования человека — анатомия и физиология
OpenStaxCollege
Цели обучения
К концу этого раздела вы сможете:
- Сравнить и сопоставить неорганические и органические соединения
- Определить свойства воды, которые делают ее жизненно важной
- Объясните роль солей в функционировании организма
- Различайте кислоты и основания и объясняйте их роль в pH
- Обсудить роль буферов в поддержании гомеостаза pH в организме
Концепции, которые вы изучили до сих пор в этой главе, управляют всеми формами материи и будут работать как основа как для геологии, так и для биологии.Этот раздел главы сужает фокус до химии человеческой жизни; то есть соединения, важные для структуры и функций организма. Как правило, эти соединения бывают либо неорганическими, либо органическими.
- Неорганическое соединение — это вещество, не содержащее ни углерода, ни водорода. Многие неорганические соединения действительно содержат атомы водорода, такие как вода (H 2 O) и соляная кислота (HCl), вырабатываемая вашим желудком. Напротив, только несколько неорганических соединений содержат атомы углерода.Двуокись углерода (CO 2 ) — один из немногих примеров.
- Таким образом, органическое соединение — это вещество, содержащее как углерод, так и водород. Органические соединения синтезируются ковалентными связями в живых организмах, в том числе в организме человека. Вспомните, что углерод и водород являются вторым и третьим по распространенности элементами в вашем теле. Вскоре вы обнаружите, как эти два элемента сочетаются в пищевых продуктах, которые вы едите, в соединениях, составляющих структуру вашего тела, и в химических веществах, которые подпитывают ваше функционирование.
В следующем разделе рассматриваются три группы неорганических соединений, необходимых для жизни: вода, соли, кислоты и основания. Органические соединения рассматриваются далее в этой главе.
До 70 процентов веса взрослого человека составляет вода. Эта вода содержится как внутри клеток, так и между клетками, из которых состоят ткани и органы. Несколько функций делают воду незаменимой для жизнедеятельности человека.
Вода как смазка и подушка
Вода является основным компонентом многих смазочных жидкостей организма.Подобно тому, как масло смазывает петли двери, вода в синовиальной жидкости смазывает суставы тела, а вода в плевральной жидкости помогает легким расширяться и отскакивать при дыхании. Водянистая жидкость помогает пище течь по пищеварительному тракту и обеспечивает отсутствие трения при движении соседних органов брюшной полости.
Вода также защищает клетки и органы от физических травм, смягчая, например, мозг внутри черепа и защищая нежную нервную ткань глаз.Вода также смягчает развивающийся плод в утробе матери.
Вода как теплоотвод
Радиатор — это вещество или объект, которые поглощают и рассеивают тепло, но не испытывают соответствующего повышения температуры. В организме вода поглощает тепло, выделяемое в результате химических реакций, без значительного повышения температуры. Более того, когда температура окружающей среды стремительно растет, вода, хранящаяся в организме, помогает ему сохранять прохладу. Этот охлаждающий эффект возникает, когда теплая кровь из ядра тела течет к кровеносным сосудам под кожей и переносится в окружающую среду.В то же время потовые железы выделяют теплую воду вместе с потом. Когда вода испаряется в воздух, она уносит тепло, а затем более холодная кровь с периферии циркулирует обратно к сердцевине тела.
Вода как компонент жидких смесей
Смесь — это комбинация двух или более веществ, каждое из которых сохраняет свою химическую идентичность. Другими словами, составляющие вещества не связаны химически в новое, более крупное химическое соединение. Эту концепцию легко представить, если вы подумаете о порошкообразных веществах, таких как мука и сахар; когда вы перемешиваете их в миске, очевидно, что они не связываются с образованием нового соединения.Воздух в помещении, которым вы дышите, представляет собой газовую смесь, содержащую три отдельных элемента — азот, кислород и аргон — и одно соединение — диоксид углерода. Есть три типа жидких смесей, все из которых содержат воду в качестве ключевого компонента. Это растворы, коллоиды и суспензии.
Чтобы клетки тела выжили, они должны оставаться влажными в жидкости на водной основе, называемой раствором. В химии жидкий раствор состоит из растворителя, который растворяет вещество, называемое растворенным веществом. Важной характеристикой растворов является их однородность; то есть молекулы растворенного вещества равномерно распределяются по всему раствору.Если бы вы размешали чайную ложку сахара в стакане воды, сахар растворился бы в молекулах сахара, разделенных молекулами воды. Соотношение сахара и воды в левой части стакана будет таким же, как соотношение сахара и воды в правой части стакана. Если бы вы добавили больше сахара, соотношение сахара к воде изменилось бы, но распределение — при условии, что вы хорошо перемешали — все равно было бы равномерным.
Вода считается «универсальным растворителем», и поэтому считается, что жизнь не может существовать без воды.Вода, безусловно, является самым распространенным растворителем в организме; практически все химические реакции организма происходят между соединениями, растворенными в воде. Поскольку молекулы воды полярны, с областями положительного и отрицательного электрического заряда, вода легко растворяет ионные соединения и полярные ковалентные соединения. Такие соединения называют гидрофильными или «водолюбивыми». Как уже говорилось выше, сахар хорошо растворяется в воде. Это связано с тем, что молекулы сахара содержат области полярных водородно-кислородных связей, что делает его гидрофильным.Неполярные молекулы, которые с трудом растворяются в воде, называются гидрофобными или «водобоязненными».
Концентрации растворенных веществ
В химии описаны различные смеси растворенных веществ и воды. Концентрация данного растворенного вещества — это количество частиц этого растворенного вещества в данном пространстве (кислород составляет около 21 процента атмосферного воздуха). В кровотоке человека концентрация глюкозы обычно измеряется в миллиграммах (мг) на децилитр (дл), а у здорового взрослого человека в среднем составляет около 100 мг / дл.Другой метод измерения концентрации растворенного вещества — его молярность, которая составляет моль (M) молекул на литр (L). Моль элемента — это его атомный вес, а моль соединения — это сумма атомных весов его компонентов, называемая молекулярной массой. Часто используемый пример — вычисление моля глюкозы по химической формуле C 6 H 12 O 6 . Согласно периодической таблице, атомный вес углерода (C) составляет 12,011 грамма (г), а в глюкозе шесть атомов углерода, что дает общий атомный вес 72.066 г. Проведя те же вычисления для водорода (H) и кислорода (O), молекулярная масса равна 180,156 г («грамм молекулярной массы» глюкозы). Когда вода добавляется для получения одного литра раствора, у вас есть один моль (1М) глюкозы. Это особенно полезно в химии из-за отношения родинок к «числу Авогадро». В моль любого раствора такое же количество частиц: 6,02 × 10 23 . Многие вещества в кровотоке и других тканях тела измеряются в тысячных долях моля или миллимолях (мМ).
Коллоид — это смесь, которая чем-то похожа на тяжелый раствор. Частицы растворенного вещества состоят из крошечных сгустков молекул, достаточно больших, чтобы сделать жидкую смесь непрозрачной (поскольку частицы достаточно большие, чтобы рассеивать свет). Знакомые примеры коллоидов — молоко и сливки. В щитовидной железе гормон щитовидной железы хранится в виде густой белковой смеси, также называемой коллоидом.
Суспензия — это жидкая смесь, в которой более тяжелое вещество временно суспендировано в жидкости, но со временем оседает.Такое отделение частиц от суспензии называется седиментацией. Пример седиментации происходит в анализе крови, который устанавливает скорость седиментации или скорость седиментации. Тест измеряет, как быстро красные кровяные тельца в пробирке выделяются из водянистой части крови (известной как плазма) в течение определенного периода времени. Быстрое осаждение клеток крови обычно не происходит в здоровом организме, но некоторые заболевания могут вызывать слипание клеток крови, и эти тяжелые скопления клеток крови оседают на дно пробирки быстрее, чем нормальные клетки крови.
Роль воды в химических реакциях
Два типа химических реакций включают образование или потребление воды: дегидратационный синтез и гидролиз.
- При дегидратационном синтезе один реагент отдает атом водорода, а другой реагент отдает гидроксильную группу (ОН) при синтезе нового продукта. При образовании их ковалентной связи в качестве побочного продукта выделяется молекула воды ([ссылка]). Это также иногда называют реакцией конденсации.
- При гидролизе молекула воды разрушает соединение, разрывая его связи. Сама вода расщепляется на H и OH. Одна часть разорванного соединения затем связывается с атомом водорода, а другая часть связывается с гидроксильной группой.
Эти реакции обратимы и играют важную роль в химии органических соединений (о чем мы поговорим ниже).
Дегидратация, синтез и гидролиз
Мономеры, основные единицы для построения более крупных молекул, образуют полимеры (два или более химически связанных мономера).(а) При дегидратационном синтезе два мономера ковалентно связаны в реакции, в которой один отдает гидроксильную группу, а другой — атом водорода. Молекула воды выделяется как побочный продукт во время реакций дегидратации. (b) При гидролизе ковалентная связь между двумя мономерами расщепляется путем присоединения атома водорода к одному и гидроксильной группы к другому, что требует участия одной молекулы воды.
Напомним, что соли образуются, когда ионы образуют ионные связи.В этих реакциях один атом отдает один или несколько электронов и, таким образом, становится положительно заряженным, тогда как другой атом принимает один или несколько электронов и становится отрицательно заряженным. Теперь вы можете определить соль как вещество, которое при растворении в воде диссоциирует на ионы, отличные от H + или OH —. Этот факт важен для отличия солей от кислот и оснований, обсуждаемых далее.
Типичная соль NaCl полностью диссоциирует в воде ([ссылка]). Положительные и отрицательные области на молекуле воды (концы водорода и кислорода соответственно) притягивают отрицательные ионы хлорида и положительные ионы натрия, отталкивая их друг от друга.Опять же, в то время как неполярные и полярные ковалентно связанные соединения распадаются на молекулы в растворе, соли диссоциируют на ионы. Эти ионы являются электролитами; они способны проводить электрический ток в растворе. Это свойство имеет решающее значение для функции ионов при передаче нервных импульсов и стимулировании сокращения мышц.
Диссоциация хлорида натрия в воде
Обратите внимание, что кристаллы хлорида натрия диссоциируют не на молекулы NaCl, а на катионы Na + и анионы Cl — , каждый из которых полностью окружен молекулами воды.
Многие другие соли важны для организма. Например, соли желчных кислот, вырабатываемые печенью, помогают расщеплять пищевые жиры, а соли фосфата кальция образуют минеральную часть зубов и костей.
Кислоты и основания, как и соли, диссоциируют в воде с образованием электролитов. Кислоты и основания могут сильно изменить свойства растворов, в которых они растворены.
Кислоты
Кислота — это вещество, которое выделяет ионы водорода (H + ) в растворе ([ссылка] a ).Поскольку у атома водорода есть только один протон и один электрон, положительно заряженный ион водорода — это просто протон. Этот одиночный протон с большой вероятностью участвует в химических реакциях. Сильные кислоты — это соединения, которые выделяют весь свой H + в растворе; то есть они полностью ионизируются. Соляная кислота (HCl), которая выделяется из клеток слизистой оболочки желудка, является сильной кислотой, поскольку она выделяет весь свой H + в водянистую среду желудка. Эта сильная кислота помогает пищеварению и убивает микробы, попавшие в организм.Слабые кислоты не ионизируются полностью; то есть некоторые из их ионов водорода остаются связанными внутри соединения в растворе. Пример слабой кислоты — уксус или уксусная кислота; он называется ацетатом после того, как отдает протон.
Кислоты и основания
(a) В водном растворе кислота диссоциирует на ионы водорода (H + ) и анионы. Почти каждая молекула сильной кислоты диссоциирует, образуя высокую концентрацию H + . (b) В водном растворе основание диссоциирует на гидроксильные ионы (OH — ) и катионы.Почти каждая молекула сильного основания диссоциирует, образуя высокую концентрацию OH — .
Базы
Основание — это вещество, которое выделяет гидроксильные ионы (OH — ) в растворе, или вещество, которое принимает H + , уже присутствующий в растворе (см. [Ссылка] b ). Ионы гидроксила (также известные как ионы гидроксида) или другие основные вещества объединяются с присутствующим H + с образованием молекулы воды, тем самым удаляя H + и снижая кислотность раствора.Сильные основания высвобождают большую часть или все свои гидроксильные ионы; слабые основания выделяют только некоторые гидроксильные ионы или поглощают только несколько H + . Пища, смешанная с соляной кислотой из желудка, сожгла бы тонкий кишечник, следующую часть пищеварительного тракта после желудка, если бы не высвобождение бикарбоната (HCO 3 — ), слабого основания, которое привлекает H + . Бикарбонат принимает часть протонов H + , тем самым снижая кислотность раствора.
Концепция pH
Относительную кислотность или щелочность раствора можно определить по его pH. PH раствора — это отрицательный десятичный логарифм концентрации ионов водорода (H + ) в растворе. Например, раствор с pH 4 имеет концентрацию H + , которая в десять раз больше, чем у раствора с pH 5. То есть раствор с pH 4 в десять раз более кислый, чем раствор с pH 5. Понятие pH станет более понятным, когда вы изучите шкалу pH, как показано в [ссылка].Шкала состоит из серии приращений от 0 до 14. Раствор с pH 7 считается нейтральным — ни кислым, ни основным. Чистая вода имеет pH 7. Чем ниже число ниже 7, тем кислее раствор или тем выше концентрация H + . Концентрация ионов водорода при каждом значении pH в 10 раз отличается от следующего значения pH. Например, значение pH 4 соответствует концентрации протонов 10 –4 M или 0,0001M, а значение pH 5 соответствует концентрации протонов 10 –5 M или 0.00001M. Чем выше число выше 7, тем более щелочной (щелочной) раствор или тем ниже концентрация H + . Например, человеческая моча в десять раз более кислотная, чем чистая вода, а HCl в 10 000 000 раз кислотнее воды.
Шкала pH
Буферы
pH крови человека обычно находится в диапазоне от 7,35 до 7,45, хотя обычно его определяют как pH 7,4. При таком слегка щелочном pH кровь может снизить кислотность, возникающую из-за того, что углекислый газ (CO 2 ) постоянно попадает в кровоток триллионами клеток тела.Гомеостатические механизмы (наряду с выдыханием CO 2 во время дыхания) обычно поддерживают pH крови в этом узком диапазоне. Это очень важно, потому что колебания — либо слишком кислые, либо слишком щелочные — могут привести к опасным для жизни расстройствам.
Все клетки организма зависят от гомеостатической регуляции кислотно-щелочного баланса при pH примерно 7,4. Таким образом, в организме есть несколько механизмов для этой регуляции, включая дыхание, выделение химических веществ с мочой и внутреннее высвобождение химических веществ, которые в совокупности называются буферами, в жидкости организма.Буфер представляет собой раствор слабой кислоты и сопряженного с ней основания. Буфер может нейтрализовать небольшое количество кислот или оснований в жидкостях организма. Например, если есть даже небольшое снижение pH жидкости организма ниже 7,35, буфер в жидкости — в данном случае действующий как слабое основание — будет связывать избыточные ионы водорода. Напротив, если pH поднимается выше 7,45, буфер будет действовать как слабая кислота и вносить ионы водорода.
Гомеостатический дисбаланс
Кислоты и основания
Чрезмерная кислотность крови и других жидкостей организма известна как ацидоз.Распространенными причинами ацидоза являются ситуации и нарушения, которые снижают эффективность дыхания, особенно способность человека полностью выдохнуть, что вызывает накопление CO 2 (и H + ) в кровотоке. Ацидоз также может быть вызван метаболическими проблемами, которые снижают уровень или функцию буферов, которые действуют как основания или способствуют выработке кислот. Например, при тяжелой диарее из организма может выводиться слишком много бикарбоната, в результате чего кислоты накапливаются в жидкостях организма.У людей с плохо управляемым диабетом (неэффективное регулирование уровня сахара в крови) кислоты, называемые кетонами, вырабатываются в качестве топлива для организма. Они могут накапливаться в крови, вызывая серьезное заболевание, называемое диабетическим кетоацидозом. Почечная недостаточность, печеночная недостаточность, сердечная недостаточность, рак и другие заболевания также могут вызывать метаболический ацидоз.
Напротив, алкалоз — это состояние, при котором кровь и другие жидкости организма слишком щелочные (щелочные). Как и в случае ацидоза, основной причиной являются респираторные расстройства; однако при респираторном алкалозе уровни углекислого газа падают слишком низко.Заболевания легких, передозировка аспирином, шок и обычное беспокойство могут вызвать респираторный алкалоз, который снижает нормальную концентрацию H + .
Метаболический алкалоз часто возникает в результате продолжительной сильной рвоты, которая вызывает потерю ионов водорода и хлорида (как компонентов HCl). Лекарства также могут вызвать алкалоз. К ним относятся диуретики, которые заставляют организм терять ионы калия, а также антациды при приеме в чрезмерных количествах, например, при стойкой изжоге или язве.
Неорганические соединения, необходимые для функционирования человека, включают воду, соли, кислоты и основания. Эти соединения неорганические; то есть они не содержат ни водорода, ни углерода. Вода — это смазка и подушка, теплоотвод, компонент жидких смесей, побочный продукт реакций синтеза дегидратации и реагент в реакциях гидролиза. Соли — это соединения, которые при растворении в воде диссоциируют на ионы, отличные от H + или OH —. Напротив, кислоты выделяют в растворе H + , делая его более кислым.Основания принимают H + , тем самым делая раствор более щелочным (едким).
pH любого раствора — это его относительная концентрация H + . Раствор с pH 7 нейтрален. Растворы с pH ниже 7 являются кислотами, а растворы с pH выше 7 — основаниями. Изменение одной цифры на шкале pH (например, от 7 до 8) представляет десятикратное увеличение или уменьшение концентрации H + . У здорового взрослого человека pH крови колеблется от 7,35 до 7,45. Механизмы гомеостатического контроля, важные для поддержания крови в здоровом диапазоне pH, включают химические вещества, называемые буферами, слабые кислоты и слабые основания, высвобождаемые, когда pH крови или других жидкостей организма колеблется в любом направлении за пределами этого нормального диапазона.
CH 4 — метан. Это соединение ________.
- неорганическое
- органический
- реактивная
- кристалл
Что из следующего, вероятнее всего, будет равномерно распределено в воде в гомогенном растворе?
- ионы натрия и ионы хлорида
- молекул NaCl
- кристаллов соли
- эритроцитов
Дженни смешивает тесто для блинов, затем добавляет шоколадную стружку.Ожидая, когда приготовятся первые несколько блинов, она замечает, как шоколадная стружка опускается на дно прозрачной стеклянной миски. Тесто с шоколадной крошкой является примером ________.
- растворитель
- растворенное вещество
- раствор
- подвеска
Вещество распадается на K + и Cl — в растворе. Вещество a (n) ________.
- кислота
- база
- соль
- буфер
Тай три года, и в результате «желудочного недуга» его рвало около 24 часов.Его pH крови 7,48. Что это значит?
- Кровь Тая слегка кислая.
- Кровь Тая слабощелочная.
- Кровь Тая очень кислая.
- Кровь Тая в пределах нормы
pH лимонного сока составляет 2, а pH апельсинового сока — 4. Какой из них более кислый и насколько? Что это значит?
Лимонный сок в сто раз более кислый, чем апельсиновый сок. Это означает, что в лимонном соке концентрация ионов водорода в сто раз выше.
Во время вечеринки Эли проигрывает пари и вынужден выпить бутылку лимонного сока. Вскоре после этого он начинает жаловаться на затрудненное дыхание, и его друзья отвозят его в местное отделение неотложной помощи. Там ему внутривенно вводят раствор бикарбоната. Почему?
Лимонный сок, как и любая кислота, выделяет ионы водорода в растворе. Когда избыток H + попадает в пищеварительный тракт и всасывается в кровь, pH крови Эли падает ниже 7,35. Напомним, что бикарбонат — это буфер, слабое основание, которое принимает ионы водорода.Вводя бикарбонат внутривенно, врач отделения неотложной помощи помогает поднять pH крови Эли до нейтрального.
Глоссарий
- кислота
- соединение, выделяющее ионы водорода (H + ) в растворе
- основание
- соединение, которое принимает ионы водорода (H + ) в растворе
- буфер
- Раствор, содержащий слабую кислоту или слабое основание, противодействующий широким колебаниям pH жидкостей организма
- коллоид
- жидкая смесь, в которой частицы растворенного вещества состоят из сгустков молекул, достаточно больших, чтобы рассеивать свет
- неорганическое соединение
- вещество, не содержащее ни углерода, ни водорода
- органическое соединение
- Вещество, содержащее как углерод, так и водород
- pH
- отрицательный логарифм концентрации иона водорода (H + ) в растворе
- раствор
- гомогенная жидкая смесь, в которой растворенное вещество растворено в молекулах в растворителе
- подвеска
- жидкая смесь, в которой распределенные в жидкости частицы оседают с течением времени
Неорганический материал — обзор
25.2.1 Неорганические материалы
Неорганические материалы были использованы в первом транзисторе в 1947 году в Bell Labs. Лучший способ получить представление о различных классах неорганических полупроводниковых материалов — это изучить периодическую таблицу элементов. Таблица 25.1 показывает часть таблицы Менделеева, которая связана со многими элементарными и составными полупроводниками.
Таблица 25.1. Часть периодической таблицы, которая связана со многими элементарными и сложными полупроводниками
| II | III | IV | V | VI |
|---|---|---|---|---|
| B | N | N | N | |
| Ma | Al | Si | P | S |
| Zn | Ga | Ge | As | Se | 4
| Hg | Tl | Pb | Bi |
Большинство неорганических полупроводников относятся к группе IV, углерод (C) в форме алмаза, кремний (Si), германий (Ge) , и олово (Sn).Кристаллическая структура всех этих полупроводников показана в виде алмаза. Разница между ними заключается в проводящих свойствах металлов и изоляторов. Алмаз гораздо больше похож на изолятор; Между тем олово очень похоже на металл. Между ними кремний и германий действуют как два типичных полупроводника. В настоящее время они являются доминирующими материалами в микроэлектронике и наиболее важными материалами во всех современных коммуникационных технологиях. Помимо чистых элементарных полупроводников Si и Ge, сплавы обоих материалов также обладают полупроводниковыми свойствами, такими как SiGe или Si 1- x Ge x , где x представляет собой мольную долю компонентов сплава.
Общей чертой элементов основной группы IV периодической таблицы является то, что на внешней оболочке их электронных облаков, так называемой валентной оболочке, находится четыре электрона. Они могут быть легированы примесями разных типов и концентраций для изменения их проводимости. Это изменение проводимости можно рассматривать как одно из важнейших свойств полупроводника.
На рис. 25.1 показаны три основных представления связей в полупроводнике. На рис. 25.1 (а) показан собственный кремний, который очень чистый и содержит пренебрежимо малое количество примесей.Каждый атом кремния разделяет свои четыре внешних электрона со своими четырьмя соседними атомами, образуя четыре ковалентные связи. На рис. 25.1 (b) показан кремний n-типа, где замещающий атом фосфора с пятью крайними электронами заменил атом кремния. В результате отрицательно заряженный электрон передается решетке в зоне проводимости. Рис. 25.1 (c) показывает, что когда атом бора с тремя крайними электронами заменяет атом кремния, в валентной зоне создается положительно заряженная дырка, и дополнительный электрон будет принят для образования четырех ковалентных связей вокруг бора.Это кремний p-типа.
Рисунок 25.1. Три основных изображения связи полупроводника. (а) Собственный Si без примесей; (б) Si n-типа с донором (фосфором). (в) Si p-типа с акцептором (бором).
Помимо группы IV, соединения атомов в группах III-V также являются полупроводниками, такими как BN, BP, Bas, AlN, AlP, AlAs, AlSb, GaN, GaP, GaAs, GaSb, InN, InP, InAs, и InSb. За исключением нитридов, все эти соединения кристаллизуются в структуру цинковой обманки. Нитриды стабильны в структуре вюрцита.Между тем, кристаллы смеси, состоящие из бинарных соединений III-V, также обладают полупроводниковыми свойствами, такими как (Ga, Al) As, Ga (As, P), (In, Ga) As и (In, Ga) (As, P ).
Соединения атомов в группах II-VI, такие как ZnS, ZnSe, ZnTe, CdTe, HgSe, HgTe, CdS, CdSe и MgTe, также обладают полупроводниковыми свойствами. Как и в случае соединений III-V, большое количество полупроводниковых сплавов также может быть получено из соединений II-IV, таких как (Hg, Cd) Te, Zn (S, Se), Cd (S, Se) и т. Д.
Хотя неорганические материалы обеспечивают изготовленное устройство с лучшими характеристиками в области применения полупроводников, их кристаллическая структура не позволяет использовать их в тканевых изделиях, пригодных для носки.Эти материалы не могут быть нанесены на гибкую основу, такую как лист, пленку или пряжу, с удовлетворительными адгезионными свойствами, поскольку они хрупкие и хрупкие и чувствительны к примесям в производственных условиях. Требование высокой температуры для их нанесения также является препятствием для их нанесения на текстильные основы. Наиболее распространенные текстильные материалы не могут выдерживать температуры выше 300 ° C, что препятствует традиционным технологиям нанесения покрытия, применяемым на текстильных подложках, таким как нанесение напыления (Carlston et al., 1965). Однако это неудобство преодолевается за счет использования аморфного кремния (a-Si) (Madan, 2006).
Работа над a-Si с использованием плазменного химического осаждения из паровой фазы (PECVD) в газообразном силане (SiH 4 ) была впервые проведена Стерлингом и его коллегами из Standard Telecommunication Laboratories, начиная с 1965 года (Sterling and Swann, 1965). В настоящее время он стал основой многомиллиардного рынка разнообразных приложений, таких как полевые устройства (Le Comber et al., 1979), жидкокристаллические дисплеи с активной матрицей (Rose, 2012), электрофотография (Schein, 1988). , датчики изображения, солнечные элементы (Rech, Wagner, 1999) и т. д.Его неупорядоченная атомная структура — главная особенность, которая отличает аморфные материалы от кристаллических. Хотя для a-Si существует слово аморфный , он не является полностью аморфным, поскольку a-Si сохраняет ковалентные связи между атомами кремния таким же образом в кристаллическом кремнии, с тем же числом соседей и той же средней связью. длины и валентные углы. Беспорядок представлен функцией распределения пар атомов. Аморфный кремний имеет тот же ближний порядок, что и кристалл, но не имеет дальнего порядка.Однако все еще остаются некоторые дефекты, так называемые оборванные связи, из-за неупорядоченной природы материала.
В отличие от традиционного транзистора на основе кремния, для которого обычно требуется высокотемпературный процесс выше 800 ° C, большое преимущество аморфного кремния заключается в том, что он может быть нанесен в виде тонкой пленки при низкой температуре на различные подложки. Это дает огромное количество возможностей для использования в текстильных приложениях. Однако подвижность носителей аморфного кремния ограничена величиной порядка 1 см 2 V −1 с −1 , что на два или три порядка меньше, чем у монокристаллического Si (∼200 см 2 В −1 с −1 для концентрации носителей ∼10 19 см 3 ) (Nomura et al., 2004). Фактически, из-за шероховатости поверхности текстиля и загрязнений фактическая линейная подвижность будет ниже идеального значения.
5 Химические аспекты жизни
Все, на что мы можем натолкнуться, потрогать или сжать, включая живые существа, состоит из атомов. Химические элементы — это чистые вещества одного типа атомов. Атомы объединяются, образуя молекулы. Молекулы, состоящие из более чем одного элемента, называются соединениями.
Обычно люди различают органические и неорганические соединения.Однако не существует четкого или общепризнанного различия между органическими и неорганическими соединениями. Химики-органики традиционно и обычно относятся к любой молекуле, содержащей углерод, как к органическому соединению, и по умолчанию это означает, что неорганическая химия имеет дело с молекулами, не имеющими углерода. Поскольку многие минералы имеют биологическое происхождение, биологи могут отличать органические от неорганических соединений другим способом, который не зависит от наличия атома углерода. Например, пулы органических веществ, которые были метаболически включены в живые ткани, сохраняются в разлагающихся тканях, но когда молекулы окисляются в открытой среде, такой как атмосферный CO 2 , это создает отдельный пул неорганических соединений.Международный союз теоретической и прикладной химии (IUPAC), агентство, широко известное за определение химических терминов, не предлагает определений неорганических или органических соединений. Следовательно, определение неорганического и органического соединения в мультидисциплинарном контексте охватывает разделение на органическую жизнь, живую (или одушевленную), и неорганическую неживую (или неодушевленную) материю. В более широком смысле этот термин обычно относится к соединениям, синтезируемым чисто геологическими системами, в отличие от тех, которые имеют биологический компонент в своем происхождении.
Клетки состоят в основном из воды (70% -90%). Основная масса их сухого веса состоит из соединений, содержащих элементы углерода (C), водород (H), кислород (O), азот (N) и фосфор (P). Четыре основных типа органических биомолекул — это углеводы, липиды, белки и нуклеиновые кислоты. Более сложные члены этих категорий (биомакромолекулы) состоят из цепочек более мелких молекул (мономеров), связанных друг с другом, более или менее подобно бусинам в ожерелье. Эти сложные молекулы называются полимерами.В живых организмах полимеры образуются путем дегидратационного синтеза, потери молекулы воды между каждой парой мономеров. И наоборот, полимеры можно переваривать (разбивать на мономеры) путем добавления молекулы воды между каждой парой мономеров. Этот процесс известен как гидролиз.
Углеводы — это биомолекулы, состоящие из атомов углерода (C), водорода (H) и кислорода (O), обычно с соотношением атомов водорода и кислорода 2: 1 (как в воде) с формулой C n (H 2 О) н. .
Липиды — это вещества биологического происхождения, не растворимые в воде. Липиды включают группу встречающихся в природе молекул, которые включают жиры, воски, стерины, жирорастворимые витамины (такие как витамины A, D, E и K), моноглицериды, диглицериды, триглицериды и фосфолипиды. Основные биологические функции липидов включают хранение энергии, передачу сигналов и действие в качестве структурных компонентов клеточных мембран.
Белки — это большие биомолекулы, состоящие из одной или нескольких длинных цепочек аминокислот, связанных пептидными связями.Белки выполняют широкий спектр функций внутри организмов, в том числе катализируют метаболические реакции, репликацию ДНК, реагируют на стимулы и транспортируют молекулы из одного места в другое. Белки отличаются друг от друга в первую очередь своей аминокислотной последовательностью, которая определяется нуклеотидной последовательностью их генов и обычно приводит к сворачиванию белка в определенную трехмерную структуру, определяющую его активность.
Тест на восстановление сахара
Восстанавливающий сахар — это сахар, который восстанавливает другое соединение и сам окисляется; то есть карбонильный углерод сахара окисляется до карбоксильной группы.Восстановительный сахар имеет свободную альдегидную группу или свободную кетонную группу. Все моносахариды представляют собой восстанавливающие сахара, а также некоторые дисахариды, олигосахариды и полисахариды. Моносахариды, содержащие альдегидную группу, известны как альдозы, а те, которые имеют кетоновую группу, известны как кетозы. Альдегид может быть окислен посредством окислительно-восстановительной реакции, в которой восстанавливается другое соединение. Таким образом, редуцирующий сахар — это сахар, уменьшающий количество определенных химикатов. Сахара с кетонными группами в форме их открытой цепи способны изомеризоваться посредством серии таутомерных сдвигов с образованием альдегидной группы в растворе.Следовательно, кетоносодержащие сахара, такие как фруктоза, считаются восстанавливающими сахарами, но восстанавливающими являются изомер, содержащий альдегидную группу, поскольку кетоны не могут быть окислены без разложения сахара. Этот тип изомеризации катализируется основанием, присутствующим в растворах, которые проверяют наличие альдегидов. Альдозы или альдегидсодержащие сахара восстанавливаются также потому, что во время окисления альдоз восстанавливаются определенные окислители. Обычные диетические моносахариды галактоза, глюкоза и фруктоза являются редуцирующими сахарами.Многие дисахариды, такие как лактоза и мальтоза, также имеют восстанавливающую форму, поскольку одно из двух звеньев может иметь форму с открытой цепью с альдегидной группой. Однако сахароза является невосстанавливающим дисахаридом, поскольку ни одно из колец не способно раскрыться. Реагент Бенедикта (Cu 2+ в водном растворе цитрата натрия) используется в качестве качественного теста для обнаружения присутствия редуцирующих сахаров. Восстановительный сахар восстанавливает ионы меди (II) до меди (I), которая затем образует осадок оксида меди (I) кирпично-красного цвета.
Методика эксперимента
- Включите нагревательный блок 65 ° C (Рисунок 5.1), переведя маленький черный переключатель в нижнем правом углу в положение «высоко». Поверните белую кнопку «Регулировка высокой температуры» на цифру от 2 до 3.
Рисунок 5.1: Нагревательный блок («сухая ванна»).
- Включите нагревательный блок на 37 ° C, переместив маленький черный переключатель в правом нижнем углу на «низкий». Поверните белую кнопку «Регулировка низкой температуры» в положение с 3 по 4.
- Возьмите бутылку с деионизированной водой (рис. 5.2).
Рисунок 5.2: Бутылка с деионизированной водой для использования в экспериментах.
- Возьмите 7 пластиковых пробирок (рис. 5.3) и штатив для пробирок (рис. 5.4).
Рисунок 5.3: Дополнительные экспериментальные материалы для этой лаборатории.
Рисунок 5.4: Экспериментальные материалы для этой лаборатории, предоставленные на вашем лабораторном столе.
- С помощью воскового карандаша пометьте каждую пробирку номером (от 1 до 7).
- Поместите пробирки слева (пробирка №1) направо (пробирка №7) в первый ряд стойки для пробирок.
- Добавьте исследуемый материал в каждую пробирку, как указано в таблице 5.1.
- Добавьте 2 мл реагента Бенедикта в каждую пробирку с помощью пластиковой пипетки для переноса.
Рисунок 5.5: Пластиковая пипетка для переноса (емкость 2 мл).
- Хорошо перемешайте.
- Убедитесь, что температура теплового блока составляет ~ 65 ° C, а затем поместите трубки в тепловой блок. Установите таймер и инкубируйте пробирки в течение 15 минут.Начните установку эксперимента 2 (ниже), пока пробирки инкубируются.
- Через 15 минут извлеките пробирки с помощью держателя для пробирок (будьте осторожны, они горячие!), Поместите их в штатив для пробирок и запишите цвет (своими словами) в Таблицу 5.1.
| 1 | 2 мл H 2 O | 2 мл | ||
| 2 | 2 мл глюкозы | 2 мл | ||
| 3 | 2 мл молока | 2 мл | ||
| 4 | 2 мл яблочного сока | 2 мл | ||
| 5 | 2 мл крахмала | 2 мл | ||
| 6 | 2 мл мелассы | 2 мл | ||
| 7 | 2 мл сахарозы | 2 мл |
Рисунок 5.6: Результаты эксперимента 1. Сравните со своими результатами!
Тест на крахмал
Крахмал — это полимерный углевод, состоящий из большого количества единиц глюкозы, соединенных гликозидными связями. Этот полисахарид вырабатывается большинством зеленых растений в качестве накопителя энергии. Это наиболее распространенный углевод в рационе человека и в больших количествах содержится в основных продуктах питания, таких как картофель, пшеница, кукуруза (кукуруза), рис и маниока. Чистый крахмал — это белый порошок без вкуса и запаха, не растворимый в холодной воде или спирте.Он состоит из двух типов молекул: линейной и спиральной амилозы и разветвленного амилопектина.
Амилаза — это фермент, катализирующий гидролиз крахмала до мальтозы и глюкозы. Амилаза присутствует в слюне человека, где начинается химический процесс пищеварения. Он также вырабатывается поджелудочной железой.
Методика эксперимента
- Возьмите 9 пластиковых пробирок и штатив для пробирок.
- С помощью воскового карандаша промаркируйте каждую пробирку номером (от 1 до 9).
- Поместите пробирки слева (пробирка №1) направо (пробирка №9) в первый ряд стойки для пробирок.
- Добавьте тестируемый материал в пробирки с 1 по 8, как указано в таблице ниже. Оставьте пробирку 9 пустой.
- Убедитесь, что температура теплового блока составляет ~ 37 ° C, а затем поместите трубку № 8 в тепловой блок. Установите таймер и инкубируйте пробирки в течение 15 минут.
- Добавьте 5 капель раствора йода в пробирки №1 — №7. Хорошо смешать.
- Запишите цвет (своими словами) в Таблицу 5.2.
- Через 15 минут извлеките пробирку 8 из нагревательного блока и перенесите 2 мл (половина содержимого пробирки 8) в пробирку 9.
- Добавьте 5 капель йода в пробирку 8 и запишите свое наблюдение в Таблицу 5.2.
- Добавьте 2 мл раствора Бенедикта в пробирку №9.
- Поместите трубку 9 в термоблок ~ 65 ° C. Установите таймер и инкубируйте пробирку в течение 15 минут.
- Через 15 минут извлеките пробирку 9 с помощью держателя для пробирок (осторожно, она горячая!), Поместите ее в штатив для пробирок и запишите цвет (своими словами) в таблицу.
| 1 | 2 мл крахмала | 5 капель | ||
| 2 | 2 мл глюкозы | 5 капель | ||
| 3 | 2 мл H 2 O | 5 капель | ||
| 4 | 2 мл сахарозы | 5 капель | ||
| 5 | хлопок (целлюлоза) | 5 капель | ||
| 6 | кусок хлеба | 5 капель | ||
| 7 | кусочек картофеля | 5 капель | ||
| 8 | 2 мл крахмала плюс 2 мл амилазы, затем поместите пробирку в термоблок 37 ° C | |||
| 9 | Оставьте пустым и выполните шаг 8 выше |
Рисунок 5.7: Результаты эксперимента 2. Сравните со своими результатами!
Тест на белки
Белки — это большие биомолекулы или макромолекулы, состоящие из одной или нескольких длинных цепочек аминокислотных остатков. Белки выполняют широкий спектр функций внутри организмов, в том числе катализируют метаболические реакции, репликацию ДНК, реагируют на стимулы и транспортируют молекулы из одного места в другое. Белки отличаются друг от друга в первую очередь своей аминокислотной последовательностью, которая определяется нуклеотидной последовательностью их генов и обычно приводит к сворачиванию белка в определенную трехмерную структуру, определяющую его активность.Линейная цепочка аминокислотных остатков называется полипептидом. Белок содержит по крайней мере один длинный полипептид. Короткие полипептиды, содержащие менее 20-30 остатков, редко считаются белками и обычно называются пептидами или иногда олигопептидами. Отдельные аминокислотные остатки связаны пептидными связями и соседними аминокислотными остатками. Последовательность аминокислотных остатков в белке определяется последовательностью гена, который закодирован в генетическом коде. В общем, генетический код определяет 20 стандартных аминокислот; однако у некоторых организмов генетический код может включать селеноцистеин и, в некоторых архей, пирролизин.
Биуретовый тест — это химический тест, используемый для определения наличия пептидных связей. В присутствии пептидов ион меди (II) образует в щелочном растворе координационные комплексы фиолетового цвета. Биуретовую реакцию можно использовать для оценки концентрации белков, поскольку пептидные связи возникают с одинаковой частотой на аминокислоту в пептиде. Интенсивность цвета прямо пропорциональна концентрации белка. Несмотря на свое название, реагент фактически не содержит биурета ((H 2 N-CO-) 2 NH).Тест назван так потому, что он также дает положительную реакцию на пептидоподобные связи в молекуле биурета. В этом анализе медь (II) связывается с азотом, присутствующим в пептидах белков. Во вторичной реакции медь (II) восстанавливается до меди (I). Из-за своей нечувствительности и небольшого влияния свободных аминокислот этот анализ наиболее полезен для образцов цельной ткани и других источников с высокой концентрацией белка.
Методика эксперимента
- Возьмите 7 пластиковых пробирок и штатив для пробирок.
- С помощью воскового карандаша промаркируйте каждую пробирку номером (от 1 до 7).
- Поместите пробирки слева (пробирка №1) направо (пробирка №7) в первый ряд стойки для пробирок.
- Добавьте материалы в эти пробирки, как указано в таблице 5.3, и хорошо перемешайте. Для реакции нагревания не требуется.
- Подождите 2 минуты и затем запишите свои наблюдения в таблицу ниже. Делайте вывод только на основании наличия или отсутствия фиолетового цвета.
| 1 | 2 мл H 2 O | 2 мл | ||
| 2 | 2 мл сахарозы | 2 мл | ||
| 3 | 2 мл альбумина | 2 мл | ||
| 4 | 2 мл молока | 2 мл | ||
| 5 | кусок хлеба | 2 мл | ||
| 6 | 2 мл сои | 2 мл | ||
| 7 | 2 мл растительного масла | 2 мл |
Рисунок 5.8: Результаты эксперимента 3. Сравните со своими результатами!
Уборка
- Вылейте содержимое всех пластиковых пробирок в помеченный контейнер для отходов (коричневая бутылка) в вытяжном шкафу для химикатов (рис. 5.9).
- Выбросьте пустые пробирки в обычную корзину для отходов.
Рисунок 5.9: Контейнеры для отходов, острых предметов, жидкостей и битого стекла в вытяжном шкафу.
Тест на липиды
В биологии липид — это вещество биологического происхождения, растворимое в неполярных растворителях.Он включает группу встречающихся в природе молекул, которые включают жиры, воски, стерины, жирорастворимые витамины (такие как витамины A, D, E и K), моноглицериды, диглицериды, триглицериды и фосфолипиды. Основные биологические функции липидов включают хранение энергии, передачу сигналов и действие в качестве структурных компонентов клеточных мембран. Липиды находят применение в косметической и пищевой промышленности, а также в нанотехнологиях. Ученые иногда широко определяют липиды как гидрофобные или амфифильные небольшие молекулы; амфифильная природа некоторых липидов позволяет им образовывать структуры, такие как везикулы, липосомы или мембраны в водной среде.Хотя термин «липид» иногда используется как синоним жиров, жиры представляют собой подгруппу липидов, называемых триглицеридами. Липиды также включают молекулы, такие как жирные кислоты и их производные (включая три-, ди-, моноглицериды и фосфолипиды), а также другие стеринсодержащие метаболиты, такие как холестерин. Хотя люди и другие млекопитающие используют различные биосинтетические пути как для расщепления, так и для синтеза липидов, некоторые важные липиды не могут быть получены таким образом и должны быть получены с пищей.
Методика эксперимента
- Возьмите небольшую стеклянную трубку.
- Добавьте 2 мл воды в стеклянную пробирку.
- Добавьте сверху 6 капель растительного масла.
- Тщательно встряхните и только временно наблюдайте за диспергированием масла. Это эмульсия, представляющая собой смесь двух жидкостей, каждая из которых не растворяется в другой.
- Теперь добавьте 3 капли липид-специфического красного красителя Судана и снова перемешайте.
- Добавьте в пробирку 2 мл жидкого моющего средства и снова встряхните.
- Дайте трубке постоять и обратите внимание на то, что две фазы (масло и вода) больше не разделены четко. Моющее средство часто называют эмульгатором. Его молекулы водорастворимы с одной стороны и жирорастворимы с другой. Они окружают мелкие капельки масла водорастворимыми концом наружу и позволяют каплям оставаться взвешенными в воде.
Уборка
Вылейте содержимое стеклянной трубки в помеченный контейнер для отходов (коричневая бутылка) в вытяжном шкафу.Выбросьте стеклянную трубку в пластиковый контейнер с надписью «битое стекло» в вытяжном шкафу (рис. 5.9).
Тест на органические и неорганические соединения (демонстрационный)
Методика эксперимента
- Инструктор будет использовать горелку Бунзена для нагрева ряда веществ. Органические вещества сгорят, неорганические останутся неизменными.
- Запишите свое наблюдение в Таблицу 5.4.
| сахар | ||
| соль поваренная | ||
| пищевая сода | ||
| неизвестно |
Уборка
- Вылейте содержимое пластиковой трубки в помеченный контейнер для отходов (коричневая бутылка) в вытяжном шкафу.
- Выбросьте пустые пробирки и другие отходы в обычную корзину для отходов.
- Промойте стеклянный стержень и стеклянную посуду водой с моющим средством.
- Верните стеклянный стержень и стеклянную посуду на подносы на вашей скамейке, где вы их изначально нашли.
Обзорные вопросы
- Что такое органические соединения?
- Какие пять элементов встречаются в живых организмах чаще всего?
- Каковы четыре основные группы биомакромолекул?
- Какие строительные блоки (мономеры) ДНК?
- Что такое липиды?
- Что такое белки?
- Что такое пептидная связь?
- Что такое химическое восстановление?
- Что такое химическое окисление?
- Что такое моющие средства?
- Почему мы используем детергент в эксперименте по выделению ДНК?
Химический состав человеческого тела
Многие элементы, встречающиеся в природе, также находятся в теле.Это химический состав среднего взрослого человека с точки зрения элементов и соединений.
Основные классы соединений в организме человека
Большинство элементов содержится в соединениях. Вода и минералы — это неорганические соединения. Органические соединения включают жир, белок, углеводы и нуклеиновые кислоты.
- Вода: Вода является самым распространенным химическим соединением в живых клетках человека, составляя от 65 до 90 процентов каждой клетки.Он также присутствует между ячейками. Например, кровь и спинномозговая жидкость в основном состоят из воды.
- Жир: Процент жира варьируется от человека к человеку, но даже у тучного человека воды больше, чем жира.
- Белок: У худощавого мужчины процентное содержание белка и воды сопоставимо. Это около 16 процентов по массе. Мышцы, в том числе сердце, содержат много мышц. Волосы и ногти — это белок. Кожа также содержит большое количество белка.
- Минералы: Минералы составляют около 6 процентов тела. В их состав входят соли и металлы. Общие минералы включают натрий, хлор, кальций, калий и железо.
- Углеводы: Хотя люди используют сахар глюкозу в качестве источника энергии, ее не так уж много в кровотоке в любой момент времени. Сахар и другие углеводы составляют всего около 1% массы тела.
Элементы человеческого тела
Шесть элементов составляют 99% массы человеческого тела.Аббревиатура CHNOPS может использоваться, чтобы помочь запомнить шесть ключевых химических элементов, которые используются в биологических молекулах. C — углерод, H — водород, N — азот, O — кислород, P — фосфор и S — сера. Хотя аббревиатура — хороший способ запомнить идентичность элементов, она не отражает их изобилие.
- Кислород — самый распространенный элемент в организме человека, на долю которого приходится примерно 65% массы человека. Каждая молекула воды состоит из двух атомов водорода, связанных с одним атомом кислорода, но масса каждого атома кислорода намного превышает общую массу водорода.Кислород не только входит в состав воды, но и необходим для клеточного дыхания.
- Углерод содержится во всех органических соединениях, поэтому углерод является вторым по распространенности элементом в организме, составляя около 18% от массы тела. Углерод содержится в белках, углеводах, липидах и нуклеиновых кислотах. Он также содержится в двуокиси углерода.
- Водород атома — самый многочисленный тип атомов в организме человека, но из-за того, что они такие легкие, они составляют всего около 10% от массы.Водород находится в воде, плюс это важный переносчик электронов.
- Азот составляет около 3,3% массы тела. Он содержится в белках и нуклеиновых кислотах.
- Кальций составляет 1,5% массы тела. Он используется для наращивания костей и зубов, а также важен для сокращения мышц.
- Фосфор составляет около 1% массы тела. Этот элемент содержится в нуклеиновых кислотах. Разрыв связей, соединяющих молекулы фосфата, является основным компонентом передачи энергии.
- Калий составляет около 0,2-0,4% от массы человека. Он используется в нервной проводимости. Калий — это ключевой катион или положительно заряженный ион в организме.
- Сера содержится в некоторых аминокислотах и белках. Это примерно 0,2-0,3% массы тела.
- Натрий , как и калий, является положительно заряженным ионом. Это примерно 0,1-0,2% массы тела. Натрий помогает регулировать баланс электролитов в организме и поддерживать гомеостаз по отношению к объему воды в крови и клетках.
- Хотя алюминий и кремний широко распространены в земной коре, они обнаруживаются в следовых количествах в организме человека.
- Другие микроэлементы включают металлы, которые часто являются кофакторами ферментов (например, кобальт для витамина B 12 ). Микроэлементы включают железо, кобальт, цинк, йод, селен и фтор.
| Элемент | Массовый процент |
| Кислород | 65 |
| Углерод | 18 |
| Водород | 10 |
| Азот | 3 |
| Кальций | 1.5 |
| фосфор | 1,2 |
| Калий | 0,2 |
| сера | 0,2 |
| Хлор | 0,2 |
| Натрий | 0,1 |
| Магний | 0,05 |
| Железо, кобальт, медь, цинк, йод | след |
Селен, фтор | минут составляет |
Содержит ли тело все элементы?
В среднем человеческое тело содержит крошечные количества элементов, которые не выполняют никаких известных биологических функций.К ним относятся германий, сурьма, серебро, ниобий, лантан, теллур, висмут, таллий, золото и даже радиоактивные элементы, такие как торий, уран и радий. Однако не все элементы периодической таблицы находятся в организме. В первую очередь это синтетические элементы, которые производятся в лабораториях. Даже если бы они действительно возникли в теле, большинство сверхтяжелых ядер имеют такой короткий период полураспада, что они почти мгновенно распадутся на один из наиболее распространенных элементов.
Источники
- Анке М.(1986). «Мышьяк». В: Mertz W. ed., Микроэлементы в питании человека и животных, , 5-е изд. Орландо, Флорида: Academic Press. С. 347-372.
- Чанг, Раймонд (2007). Химия , Девятое издание. Макгроу-Хилл. С. 52.
- Эмсли, Джон (2011). Строительные блоки природы: руководство по элементам от А до Я . ОУП Оксфорд. п. 83. ISBN 978-0-19-960563-7.
- Подкомитет по десятому изданию Рекомендованных диетических пособий, Совета по продовольствию и питанию; Комиссия по наукам о жизни, Национальный исследовательский совет (февраль 1989 г.). Рекомендуемые нормы диеты : 10-е издание. Национальная академия прессы. ISBN 978-0-309-04633-6.
- Зумдал, Стивен С. и Сьюзан А. (2000). Химия , пятое издание. Компания Houghton Mifflin. п. 894. ISBN 0-395-98581-1.
Смотри: 10 удивительных загадок о человеческом теле
Органические соединения
Химические соединения живых существ известны как органических соединений из-за их связи с организмами и потому, что они являются углеродсодержащими соединениями.Органические соединения, которые представляют собой соединения, связанные с жизненными процессами, являются предметом органической химии. Среди многочисленных типов органических соединений во всем живом есть четыре основные категории: углеводы, липиды, белки и нуклеиновые кислоты.Углеводы
Почти все организмы используют углеводов в качестве источников энергии. Кроме того, некоторые углеводы служат конструкционными материалами. Углеводы — это молекулы, состоящие из углерода, водорода и кислорода; отношение атомов водорода к атомам кислорода и углерода составляет 2: 1.
Простые углеводы, обычно называемые сахарами , могут быть моносахаридами, , если они состоят из одиночных молекул, или дисахаридами, , если они состоят из двух молекул. Самый важный моносахарид — это глюкоза, углевод с молекулярной формулой C 6 H 12 O 6 . Глюкоза — это основная форма топлива для живых существ. В многоклеточных организмах он растворим и транспортируется жидкостями организма ко всем клеткам, где метаболизируется, чтобы высвободить свою энергию.Глюкоза является исходным материалом для клеточного дыхания и основным продуктом фотосинтеза (см. Главы 5 и 6).
Три важных дисахарида также содержатся в живых организмах: мальтоза, сахароза и лактоза. Мальтоза представляет собой комбинацию двух ковалентно связанных единиц глюкозы. Сахароза столового сахара образуется путем связывания глюкозы с другим моносахаридом, называемым фруктозой. (Рисунок 2-2 показывает, что при синтезе сахарозы образуется молекула воды. Поэтому процесс называется реакцией дегидратации . Обратный процесс — это гидролиз , процесс, в котором молекула расщепляется и добавляется вода.) Лактоза состоит из единиц глюкозы и галактозы.
Рисунок 2-2 Молекулы глюкозы и фруктозы объединяются, образуя дисахарид сахарозу.
Сложные углеводы известны как полисахариды . Полисахариды образуются путем связывания бесчисленных моносахаридов. Среди наиболее важных полисахаридов — крахмал, который состоит из сотен или тысяч единиц глюкозы, связанных друг с другом.Крахмал служит формой хранения углеводов. Большая часть населения мира удовлетворяет свои потребности в энергии с помощью крахмала в виде риса, пшеницы, кукурузы и картофеля.
Два других важных полисахарида — это гликоген и целлюлоза. Гликоген также состоит из тысяч единиц глюкозы, но эти единицы связаны другим образом, чем в крахмале. Гликоген — это форма, в которой глюкоза хранится в печени человека. Целлюлоза используется в основном как структурный углевод.Он также состоит из единиц глюкозы, но единицы не могут высвобождаться одна из другой, за исключением нескольких видов организмов. Древесина состоит в основном из целлюлозы, как и стенки растительных клеток. Хлопчатобумажная ткань и бумага — это товарные целлюлозные продукты.
Липиды
Липиды представляют собой органические молекулы, состоящие из атомов углерода, водорода и кислорода. Отношение атомов водорода к атомам кислорода в липидах намного выше, чем в углеводах. Липиды включают стероиды (материал, из которого состоят многие гормоны), воски и жиры.
Молекулы жира состоят из молекулы глицерина и одной, двух или трех молекул жирных кислот (см. Рис. 2-3). Молекула глицерина содержит три гидроксильные (–ОН) группы. Жирная кислота представляет собой длинную цепочку из атомов углерода (от 4 до 24) с карбоксильной (–COOH) группой на одном конце. Все жирные кислоты в жире могут быть одинаковыми или разными. Они связаны с молекулой глицерина в процессе удаления воды.
Некоторые жирные кислоты имеют в своих молекулах одну или несколько двойных связей.Жиры, в состав которых входят эти молекулы, представляют собой ненасыщенных жиров. Другие жирные кислоты не имеют двойных связей. Жиры, в состав которых входят эти жирные кислоты, представляют собой насыщенных жира. В большинстве случаев, связанных со здоровьем человека, потребление ненасыщенных жиров предпочтительнее насыщенных жиров.
Жиры, хранящиеся в клетках, обычно образуют прозрачные масляные капли, называемые глобулами , потому что жиры не растворяются в воде. Растения часто хранят жиры в своих семенах, а животные — в больших прозрачных шариках в клетках жировой ткани.Жиры в жировой ткани содержат много концентрированной энергии. Следовательно, они служат резервным источником энергии для организма. Фермент липаза расщепляет жиры на жирные кислоты и глицерин в пищеварительной системе человека.
Рис. 2-3 Молекула жира создается путем объединения молекулы глицерина с тремя молекулами жирных кислот. (Две насыщенные жирные кислоты и одна ненасыщенная жирная кислота показаны для сравнения.) Сконструированная молекула находится внизу.
Белки
Белки, среди самых сложных из всех органических соединений, состоят из аминокислот (см. Рис. 2-4), которые содержат атомы углерода, водорода, кислорода и азота.Некоторые аминокислоты также содержат атомы серы, фосфора или других микроэлементов, таких как железо или медь.
Рисунок 2-4 Структура и химический состав аминокислот. Когда две аминокислоты соединяются в дипептид, –OH одной аминокислоты удаляется, а –H второй удаляется. Итак, вода удалена. Дипептидная связь (справа) образует соединение аминокислот вместе.
Многие белки огромны и чрезвычайно сложны. Однако все белки состоят из длинных цепочек относительно простых аминокислот.Есть 20 видов аминокислот. Каждая аминокислота (см. Левую иллюстрацию на рисунке 2-4) имеет амино (–NH 2 ) группу, карбоксильную (–COOH) группу и группу атомов, называемую группой –R (где R обозначает радикал ). Аминокислоты различаются в зависимости от природы группы –R, как показано на средней иллюстрации рисунка 2-4. Примерами аминокислот являются аланин, валин, глутаминовая кислота, триптофан, тирозин и гистидин.
Удаление молекул воды связывает аминокислоты с образованием белка.Процесс называется дегидратационным синтезом , и побочным продуктом синтеза является вода. Связи между аминокислотами составляют пептидных связей, и небольшие белки часто называют пептидами .
Все живое зависит от белков. Белки — это основные молекулы, из которых построены живые существа. Некоторые белки растворены или взвешены в водянистом веществе клеток, а другие включены в различные структуры клеток.Белки также являются поддерживающими и укрепляющими материалами в тканях вне клеток. Кости, хрящи, сухожилия и связки состоят из белков.
Одна из важнейших функций белков — это фермент. Ферменты катализируют химические реакции, происходящие в клетках. Они не расходуются в реакции; скорее, они остаются доступными для катализа последующих реакций.
Каждый вид производит белки, уникальные для этого вида. Информация для синтеза уникальных белков находится в ядре клетки.Так называемый генетический код определяет аминокислотную последовательность в белках. Следовательно, генетический код регулирует химию, происходящую внутри клетки. Белки также могут служить резервным источником энергии для клетки. Когда аминогруппа удаляется из аминокислоты, полученное соединение богато энергией.
Нуклеиновые кислоты
Подобно белкам, нуклеиновые кислоты представляют собой очень большие молекулы. Нуклеиновые кислоты состоят из более мелких единиц, называемых нуклеотидами. Каждый нуклеотид содержит молекулу углевода (сахар), фосфатную группу и азотсодержащую молекулу, которая в силу своих свойств является азотистым основанием .
У живых организмов есть две важные нуклеиновые кислоты. Один тип — это дезоксирибонуклеиновая кислота , ДНК или . Другой — это рибонуклеиновая кислота, или РНК. ДНК находится в основном в ядре клетки, в то время как РНК обнаруживается как в ядре, так и в цитоплазме , — полужидкое вещество, составляющее объем клетки (см. Главу 3).
ДНК и РНКотличаются друг от друга по своим компонентам.
