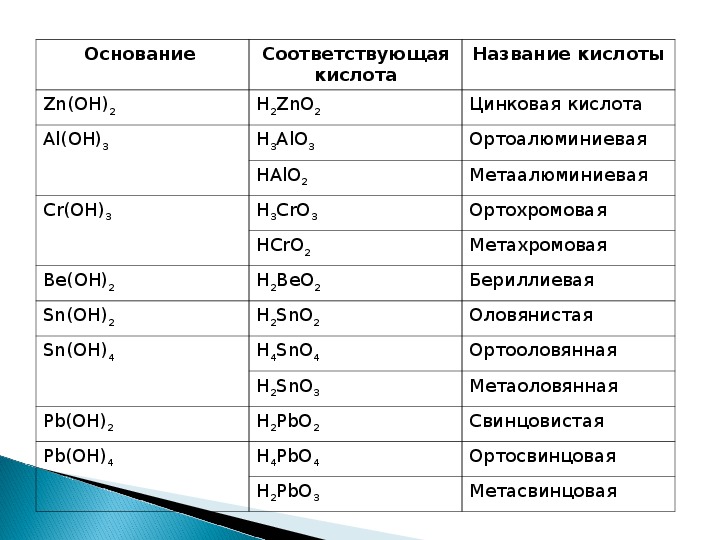
| | Навигация по справочнику TehTab.ru: главная страница / / Техническая информация / / Химический справочник / / «Химический алфавит (словарь)» — названия, сокращения, приставки, обозначения веществ и соединений. / / Таблица названий (наименований) кислот и их солей.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Нашли ошибку? Есть дополнения? Напишите нам об этом, указав ссылку на страницу.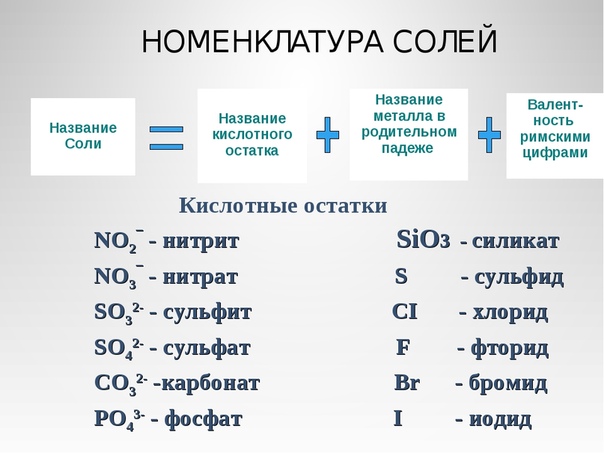 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| TehTab.ru Реклама, сотрудничество: [email protected] | Обращаем ваше внимание на то, что данный интернет-сайт носит исключительно информационный характер. Информация, представленная на сайте, не является официальной и предоставлена только в целях ознакомления. Все риски за использование информаци с сайта посетители берут на себя. Проект TehTab.ru является некоммерческим, не поддерживается никакими политическими партиями и иностранными организациями. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Стенд по химии «Таблица растворимости кислот, солей и оснований в воде» р-р 100*61 см, в золотом цвете
Стенд по химии «Таблица растворимости кислот, солей и оснований в воде» без борта . Стоимость за 1 шт.
Стенд выполнен на твердом пластике толщиной 3 мм, с креплением для стены (скрытые металлические завесы).
Доставка в любой город, район, агрогородок Республики Беларусь.
Доставка в Москву.
Стенды для оформления кабинета химии. Стенд по химии «Таблица растворимости кислот, солей и оснований в воде», Стенды по химии 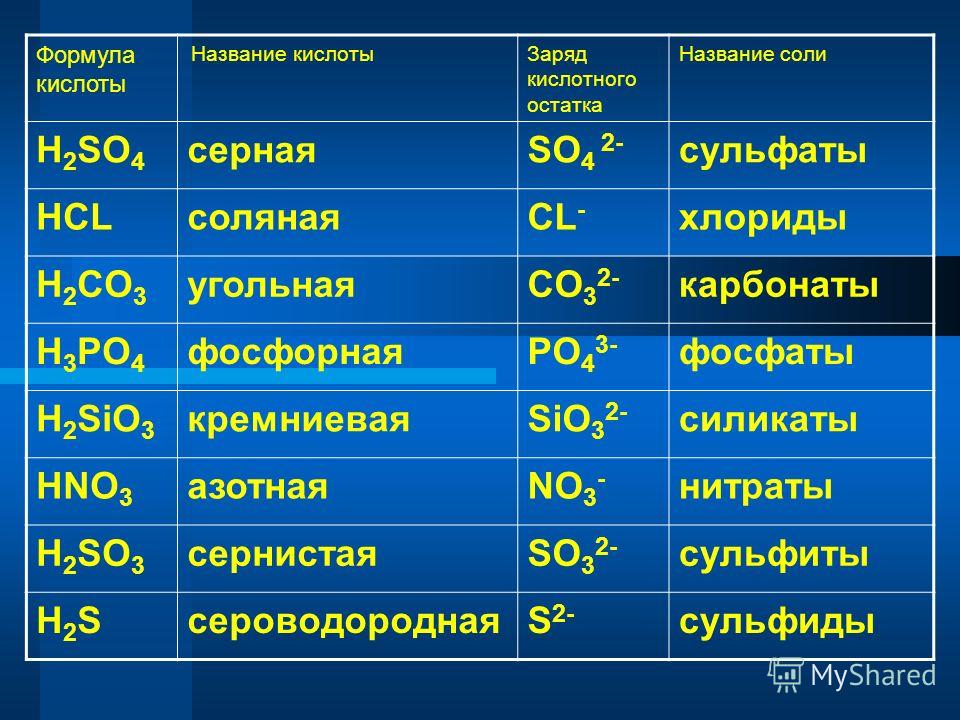
Стенды для оформления кабинета химии. Стенды по химии Классификация неорганических веществ, Физические понятия, применяемые при решении задач, Генетические связи между гомологическими рядами и классами органических веществ. Окраска индикаторов, Ряд активных металлов. Ряд электроотрицательности неметаллов. . Стенды для школ.Стенды в учебные кабинеты . Оформить учебные кабинеты стендами. Плакаты учебные наглядные для кабинетов. Стенды в кабинет химии, стенды по химии, портреты химиков, заказать стенды для школы, у нас можно заказать портреты великих химиков, так же изготавливаем тематические стенды по химии, изготавливаем стенды любых размеров и цветов, изготавливаем стенды с карманами любых размеров, собственное производство стендов для школ, у нам самые дешевые стенды, в нашей организации осуществляется доставка в любой город и район нашей республики, наши стенды разработаны с участием и под руководством преподавателей школ и гимназий, у нас производятся качественный и красочные стенды для школ, гимназий и других учебных заведений, в нашей организации стенды разработаны нашими дизайнерами с участием преподавателей учебных заведений, мы и сегодня разрабатываем стенды для школ и других учебных организаций.
Стенды для оформления кабинета химии. Стенды по химии Классификация неорганических веществ, Физические понятия, применяемые при решении задач, Генетические связи между гомологическими рядами и классами органических веществ. Окраска индикаторов, Ряд активных металлов. Ряд электроотрицательности неметаллов. . Стенды для школ.Стенды в учебные кабинеты . Оформить учебные кабинеты стендами. Плакаты учебные наглядные для кабинетов. Стенды в кабинет химии, стенды по химии, портреты химиков, заказать стенды для школы, у нас можно заказать портреты великих химиков, так же изготавливаем тематические стенды по химии, изготавливаем стенды любых размеров и цветов, изготавливаем стенды с карманами любых размеров, собственное производство стендов для школ, у нам самые дешевые стенды, в нашей организации осуществляется доставка в любой город и район нашей республики, наши стенды разработаны с участием и под руководством преподавателей школ и гимназий, у нас производятся качественный и красочные стенды для школ, гимназий и других учебных заведений, в нашей организации стенды разработаны нашими дизайнерами с участием преподавателей учебных заведений, мы и сегодня разрабатываем стенды для школ и других учебных организаций.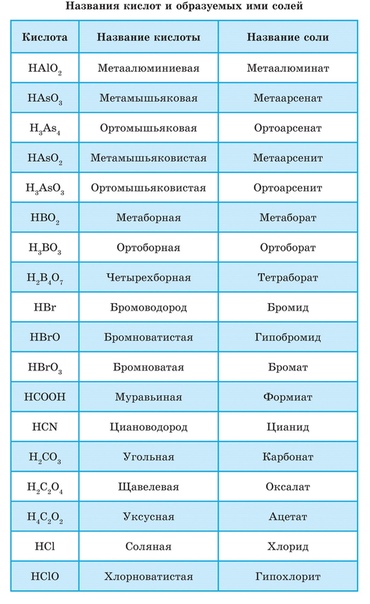
стенды в кабинет химии, таблица растворимости, стенды для школы, таблица менделеева
стенды в кабинет химии, таблица растворимости, стенды для школы, таблица менделеева
стенды в кабинет химии, таблица растворимости, стенды для школы, таблица менделеева
стенды в кабинет химии, таблица растворимости, стенды для школы, таблица менделеева
стенды в кабинет химии, таблица растворимости, стенды для школы, таблица менделеева
стенды в кабинет химии, таблица растворимости, стенды для школы, таблица менделеева
стенды в кабинет химии, таблица растворимости, стенды для школы, таблица менделеева
стенды в кабинет химии, таблица растворимости, стенды для школы, таблица менделеева
стенды в кабинет химии, таблица растворимости, стенды для школы, таблица менделеева
стенды в кабинет химии, таблица растворимости, стенды для школы, таблица менделеева
| Оксиды. Соли. Кислоты. Классификация, свойства, получение. Ряд напряжений металлов. Гидролиз. | Основания. Классификация, свойства, получение. Электролитическая диссоциация. Таблица растворимости кислот, оснований и солей. | Строение атома, периодическая система Менделлева, таблица Менделеева. | Химическая связь. Ионная, ковалентная, металлическая, водородная химические связи. Классификация химических реакций. Реакции — ионного обмена, окислительно-восстановительные, термохимические, обратимые и необратимые. |
| Органическая химия. Гибридизация. Химические связи в органических веществах, их характеристики. Типы химических реакций — замещение, присоединение, отщепление (элиминирование), перегруппировка (изомеризация), окисления и восстановления. | Теория Бутлерова. Виды изомерии. Пространственная изомерия, Структурная изомерия, основные классы органических веществ — углеводороды, кислородосодержащие, серосодержащие, азотосодержащие. Виды изомерии. Пространственная изомерия, Структурная изомерия, основные классы органических веществ — углеводороды, кислородосодержащие, серосодержащие, азотосодержащие. |
||
| Растворимость оснований, кислот и солей в воде. Относительные молекулярные массы неорганических солей, оснований, кислот, оксидов. Относительные молекулярные массы органических веществ. Ряд электроотрицательностей. Ряд анионов | Классификация химических реакций по типам и видам | Периодический закон в современной формулировке. Периодическая система. Физический смысл периодического закона. Структура. | |
| Строение вещества. Ядерная модель строения атома. Состояние электрона в атоме. Заполнение электронами орбиталей, принцип наименьшей энергии, правило Клечковского, принцип Паули, правило Хунда | Важнейшие классы неорганических веществ. Оксиды. Гидроксиды. Соли. Кислоты, основания, амфотерные вещества. Важнейшие кислоты и их соли. Генетическая связь важнейших классов неорганических веществ. Оксиды. Гидроксиды. Соли. Кислоты, основания, амфотерные вещества. Важнейшие кислоты и их соли. Генетическая связь важнейших классов неорганических веществ. |
||
| Химия металлов. Щелочные металлы. Элементы IIА группы. Алюминий. Железо | Химия неметаллов. Галогены. Сера. Азот. Углерод. Инертные газы | Закономерности течения химических реакций | — — — — — — — — — |
| — — — — — — — — — | |||
| Химическая связь. Понятия.Правило октета. Металлы и неметаллы. Гибридизация электронных орбиталей. Валентные электроны, понятие валентности, понятие электроотрицательности. | Виды химической связи. Ковалентная связь (механизмы образования, характеристики, полярная, неполярная. Ионная связь. Степень окисления. Металлическая связь. Водородная связь | ||
|
Растворы. |
Реакции в растворах электролитов + Окислительно-восстановительные реакции. (Реакции ионного обмена. Образование малорастворимого вещества. Образование газообразного вещества. Образование малодиссоциирующего вещества. Гидролиз водных растворов солей. Окислитель. Восстановитель.) | ||
|
Важнейшие производные углеводородов: спирты, фенолы, карбонильные соединения, карбоновые кислоты, амины, аминокислоты |
— — — — — — — — — | ||
| — — — — — — — — — | |||
Свойства солей
Соли — это сложные вещества,
состоящие из одного (нескольких) атомов металла (или более сложных
катионных групп, например, аммонийных
групп NН4+,
гидроксилированных групп Ме(ОН)nm+) и одного
(нескольких) кислотных
остатков. Общая формула солей МеnАm,
где А — кислотный остаток. Соли (с точки зрения электролитической диссоциации)
представляют собой электролиты, диссоциирующие в водных растворах на
катионы металла (или аммония NН4+) и анионы кислотного остатка.
Общая формула солей МеnАm,
где А — кислотный остаток. Соли (с точки зрения электролитической диссоциации)
представляют собой электролиты, диссоциирующие в водных растворах на
катионы металла (или аммония NН4+) и анионы кислотного остатка.
Классификация. По составу соли подразделяют на средние (нормальные), кислые (гидросоли), основные (гидроксосоли), двойные, смешанные и комплексные (см. таблицу).
Таблица — Классификация солей по составу
| СОЛИ | |||||
|
Средние (нормальные) — продукт полного замещения атомов водорода в кислоте на металл AlCl3 |
Кислые(гидросоли) - продукт неполного замещения атомов водорода в кислоте на металл КHSO4 |
Основные (гидроксосоли) —продукт неполного замещения ОН-групп основания на кислотный остаток FeOHCl |
Двойные — содержат два разных металла и один кислотный остаток КNaSO4 |
Смешанные — содержат один металл и несколько кислотных остатков CaClBr |
Комплексные [Cu(NH3)4]SO4 |
Физические свойства. Соли — это
кристаллические вещества разных цветов и разной растворимости в
воде.
Соли — это
кристаллические вещества разных цветов и разной растворимости в
воде.
Химические свойства
1) Диссоциация. Средние, двойные и смешанные соли диссоциируют одноступенчато. У кислых и основных солей диссоциация происходит ступенчато.
NaCl Na+ + Cl–.
КNaSO4 К+ + Na+ + SO42– .
CaClBr Ca2+ + Cl –+ Br–.
КHSO4 К+ + НSO4– HSO4– H+ + SO42–.
FeOHClFeOH+
+ Cl–
FeOH+Fe2+
+ OH–.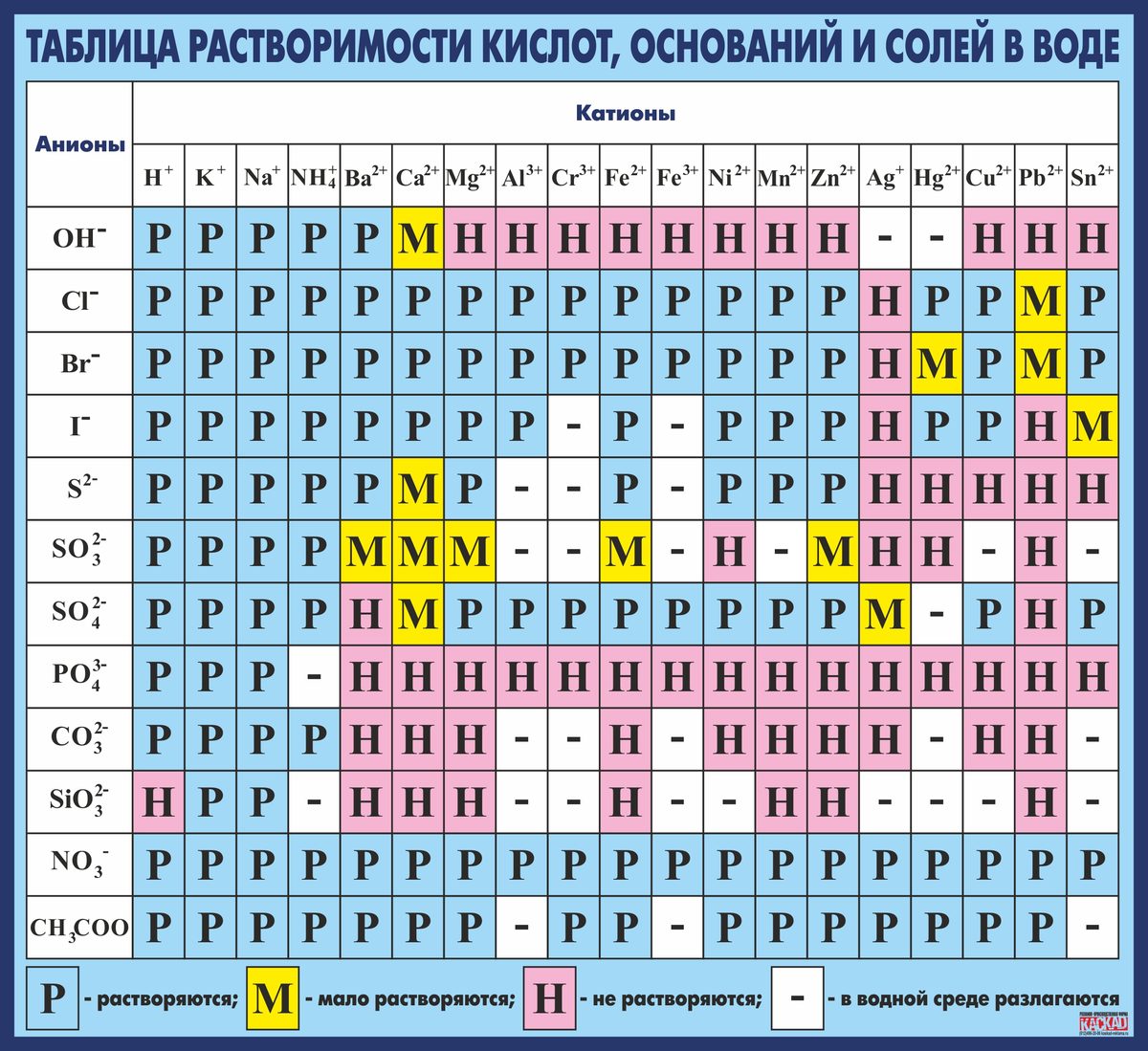
[Cu(NH3)4]SO4 [Cu(NH3)4]2+ + SO42– [Cu(NH3)4]2+ Cu2+ + 4NH3.
2) Взаимодействие с индикаторами. В результате гидролиза в растворах солей накапливаются ионы Н+ (кислая среда) или ионы ОН– (щелочная среда). Гидролизу подвергаются растворимые соли, образованные хотя бы одним слабым электролитом. Растворы таких солей взаимодействуют с индикаторами:
индикатор + Н+ (ОН–) окрашенное соединение.
AlCl3 + H2O AlOHCl2 + HCl Al3+ + H2O AlOH2+ + H+
3) Разложение при нагревании. При
нагревании некоторых солей они разлагаются на оксид металла и
кислотный оксид:
При
нагревании некоторых солей они разлагаются на оксид металла и
кислотный оксид:
СаСO3 СаO + СО2.
соли бескислородных кислот при нагревании могут распадаться на простые вещества:
2AgCl Ag + Cl2.
Соли, образованные кислотами-окислителями, разлагаются сложнее:
2КNO3 2КNO2 + O2.
4) Взаимодействие с кислотами: Реакция происходит, если соль образована более слабой или летучей кислотой, или если образуется осадок.
2HCl + Na2CO3 ®
2NaCl + CO2
+ H2O
2H+ + CO32–®
CO2
+ H2O.
СaCl2 + H2SO4 ® CaSO4¯ + 2HCl Сa2+ + SO42- ® CaSO4¯.
Основные соли при действии кислот переходят в средние:
FeOHCl + HCl ® FeCl2 + H2O.
Средние соли, образованные многоосновными кислотами, при взаимодействии с ними образуют кислые соли:
Na2SO4 + H2SO4 ® 2NaHSO4.
5) Взаимодействие со щелочами. Со щелочами реагируют соли, катионам которых соответствуют нерастворимые основания.
CuSO4 +
2NaOH
®
Cu(OH)2¯
+ Na2SO4 Cu2+
+ 2OH–
®
Cu(OH)2¯.
6) Взаимодействие друг с другом. Реакция происходит, если взаимодействуют растворимые соли и при этом образуется осадок.
AgNO3 + NaCl ® AgCl¯ + NaNO3 Ag+ + Cl– ® AgCl¯.
7) Взаимодействие с металлами. Каждый предыдущий металл в ряду напряжений вытесняет последующий за ним из раствора его соли:
Fe + CuSO4 ® Cu¯ + FeSO4 Fe + Cu2+ ® Cu¯ + Fe2+.
Li, Rb, K, Ba, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb, H, Sb, Bi, Cu, Hg, Ag, Pd, Pt, Au
8) Электролиз (разложение под действием постоянного
электрического тока). Соли подвергаются электролизу в растворах
и расплавах:
Соли подвергаются электролизу в растворах
и расплавах:
2NaCl + 2H2O H2 + 2NaOH + Cl2.
2NaClрасплав 2Na + Cl2.
9) Взаимодействие с кислотными оксидами.
СО2 + Na2SiO3 ® Na2CO3 + SiO2
Na2CO3 + SiO2 СО2 + Na2SiO3
Получение. 1) Взаимодействием металлов с неметаллами:
2Na + Cl2
®
2NaCl.
2) Взаимодействием основных и амфотерных оксидов с кислотными оксидами:
CaO + SiO2 CaSiO3 ZnO + SO3 ZnSO4.
3) Взаимодействием основных оксидов с амфотерными оксидами:
Na2O + ZnO Na2ZnO2.
4) Взаимодействием металлов с кислотами:
2HCl + Fe ® FeCl2 + H2.
5) Взаимодействием основных и амфотерных оксидов с кислотами:
Na2O
+ 2HNO3
® 2NaNO3
+ H2O
ZnO +
H2SO4 ®
ZnSO4
+ H2O.
6) Взаимодействием амфотерных оксидов и гидроксидов со щелочами:
В растворе: 2NaOH + ZnO + H2O ® Na2[Zn(OH)4] 2OH–+ ZnO + H2О ® [Zn(OH)4]2–.
При сплавлении с амфотерным оксидом: 2NaOH + ZnO Na2ZnO2 + H2O.
В растворе: 2NaOH + Zn(OH)2 ® Na2[Zn(OH)4] 2OH– + Zn(OH)2 ® [Zn(OH)4]2–
При сплавлении: 2NaOH + Zn(OH)2 Na2ZnO2 + 2H2O.
7) Взаимодействием гидроксидов металлов с кислотами:
Ca(OH)2+ H2SO4
®
CaSO4¯
+ 2H2O Zn(OH)2+ H2SO4
®
ZnSO4 + 2H2O.
8) Взаимодействием кислот с солями:
2HCl + Na2S ® 2NaCl + Н2S.
9) Взаимодействием солей со щелочами:
ZnSО4 + 2NaOH ® Na2SO4 + Zn(OH)2¯.
10) Взаимодействием солей друг с другом:
AgNO3 + KCl ® AgCl¯ + KNO3.
Л.А. Яковишин
Химический состав столовой соли
Поваренная соль — одна из самых распространенных бытовых химикатов. Поваренная соль содержит от 97% до 99% хлорида натрия, NaCl. Чистый хлорид натрия представляет собой твердое ионное кристаллическое вещество.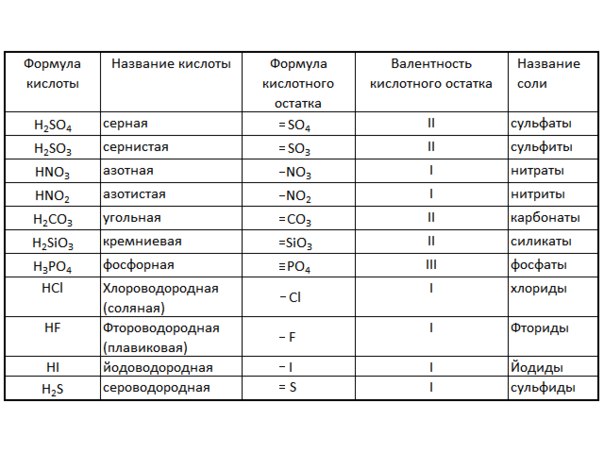 Однако в поваренной соли присутствуют и другие соединения, в зависимости от ее источника или добавок, которые могут быть включены перед упаковкой. В чистом виде хлорид натрия имеет белый цвет. Поваренная соль может быть белой или иметь слабый фиолетовый или синий оттенок из-за примесей. Морская соль может быть тускло-коричневой или серой. Неочищенная каменная соль может иметь любой цвет в зависимости от ее химического состава.
Однако в поваренной соли присутствуют и другие соединения, в зависимости от ее источника или добавок, которые могут быть включены перед упаковкой. В чистом виде хлорид натрия имеет белый цвет. Поваренная соль может быть белой или иметь слабый фиолетовый или синий оттенок из-за примесей. Морская соль может быть тускло-коричневой или серой. Неочищенная каменная соль может иметь любой цвет в зависимости от ее химического состава.
Откуда берется соль?
Одним из основных источников поваренной соли является минерал галит или каменная соль. Добывается галит. Минералы в добытой соли придают ей химический состав и аромат, уникальные для ее происхождения. Каменную соль обычно очищают из добытого галита, поскольку галит встречается с другими минералами, в том числе с некоторыми, которые считаются токсичными. Самородная каменная соль продается для употребления в пищу людьми , но ее химический состав непостоянен, и некоторые примеси могут представлять опасность для здоровья, которая может составлять до 15% от массы продукта.
Другой распространенный источник поваренной соли — это испаренная морская вода или морская соль. Морская соль состоит в основном из хлорида натрия с небольшими количествами хлоридов и сульфатов магния и кальция, водорослей, отложений и бактерий. Эти вещества придают морской соли сложный аромат. В зависимости от источника морская соль может содержать загрязняющие вещества, связанные с источником воды. Кроме того, в морскую соль можно смешивать добавки, в основном для того, чтобы она текла более свободно.
Независимо от того, является ли источником соли галит или море, продукты содержат сопоставимые количества натрия по весу.Другими словами, использование того же количества морской соли, а не галита (или наоборот) не влияет на количество пищевого натрия, которое вы получаете из него.
Добавки к соли
Натуральная соль уже содержит множество химикатов. Когда его перерабатывают в поваренную соль, он также может содержать добавки.
Одной из наиболее распространенных добавок является йод в виде йодида калия, йодида натрия или йодата натрия. Йодированная соль может также содержать декстрозу (сахар) для стабилизации йода.Дефицит йода считается самой большой предотвратимой причиной умственной отсталости, когда-то известной как умственная отсталость. Соль йодирована, чтобы предотвратить кретинизм у детей, а также гипотиреоз и зоб у взрослых. В некоторых странах йод обычно добавляют в соль (йодированную соль), а продукты, не содержащие эту добавку, могут быть помечены как «неойодированная соль». Неодизированная соль не подвергалась удалению каких-либо химикатов; скорее, это означает, что дополнительный йод не был добавлен.
Йодированная соль может также содержать декстрозу (сахар) для стабилизации йода.Дефицит йода считается самой большой предотвратимой причиной умственной отсталости, когда-то известной как умственная отсталость. Соль йодирована, чтобы предотвратить кретинизм у детей, а также гипотиреоз и зоб у взрослых. В некоторых странах йод обычно добавляют в соль (йодированную соль), а продукты, не содержащие эту добавку, могут быть помечены как «неойодированная соль». Неодизированная соль не подвергалась удалению каких-либо химикатов; скорее, это означает, что дополнительный йод не был добавлен.
Еще одна распространенная добавка к поваренной соли — фторид натрия.Фтор добавлен для предотвращения разрушения зубов. Эта добавка чаще встречается в странах, где вода не фторируется.
«Дважды обогащенная» соль содержит соли железа и йодид. Фумарат железа — обычный источник железа, который добавляют для предотвращения железодефицитной анемии.
Другой добавкой может быть фолиевая кислота (витамин B 9 ). Фолиевая кислота или фолицин добавляются для предотвращения дефектов нервной трубки и анемии у развивающихся младенцев. Этот тип соли может использоваться беременными женщинами для предотвращения распространенных врожденных дефектов.Соль, обогащенная фолицином, имеет желтоватый цвет из-за витамина.
Фолиевая кислота или фолицин добавляются для предотвращения дефектов нервной трубки и анемии у развивающихся младенцев. Этот тип соли может использоваться беременными женщинами для предотвращения распространенных врожденных дефектов.Соль, обогащенная фолицином, имеет желтоватый цвет из-за витамина.
В соль могут быть добавлены вещества, предотвращающие слеживание, чтобы зерна не слипались. Распространены любые из следующих химических веществ:
- Алюмосиликат кальция
- Карбонат кальция
- Силикат кальция
- Соли жирных кислот (кислые соли)
- Карбонат магния
- Оксид магния
- Диоксид кремния
- Алюмосиликат натрия
- Натрия ферроцианид или желтый пруссат соды
- Трикальций фосфат
соль | Химия, история, возникновение, производство и факты
Соль (NaCl) , хлорид натрия , минеральное вещество, имеющее большое значение для здоровья человека и животных, а также для промышленности. Минеральную форму галита или каменной соли иногда называют поваренной солью, чтобы отличить ее от класса химических соединений, называемых солями.
Минеральную форму галита или каменной соли иногда называют поваренной солью, чтобы отличить ее от класса химических соединений, называемых солями.
Кристалл соли увеличен.
Геологическая служба СШАУзнайте о влиянии соли на здоровье человека
Узнайте о соли, в том числе о ее влиянии на здоровье.
Contunico © ZDF Enterprises GmbH, Майнц См. Все видео к этой статье Свойства поваренной соли показаны в таблице. Соль необходима для здоровья как людей, так и животных.Поваренная соль, повсеместно используемая в качестве приправы, мелкозернистая и очень чистая. Чтобы гарантировать, что это гигроскопичное (т. Е. Притягивающее воду) вещество останется сыпучим при контакте с атмосферой, добавляются небольшие количества алюмосиликата натрия, трикальцийфосфата или силиката магния. Йодированная соль, то есть соль, в которую были добавлены небольшие количества йодида калия, широко используется в регионах, где йод отсутствует в рационе, и этот дефицит может вызвать отек щитовидной железы, обычно называемый зобом.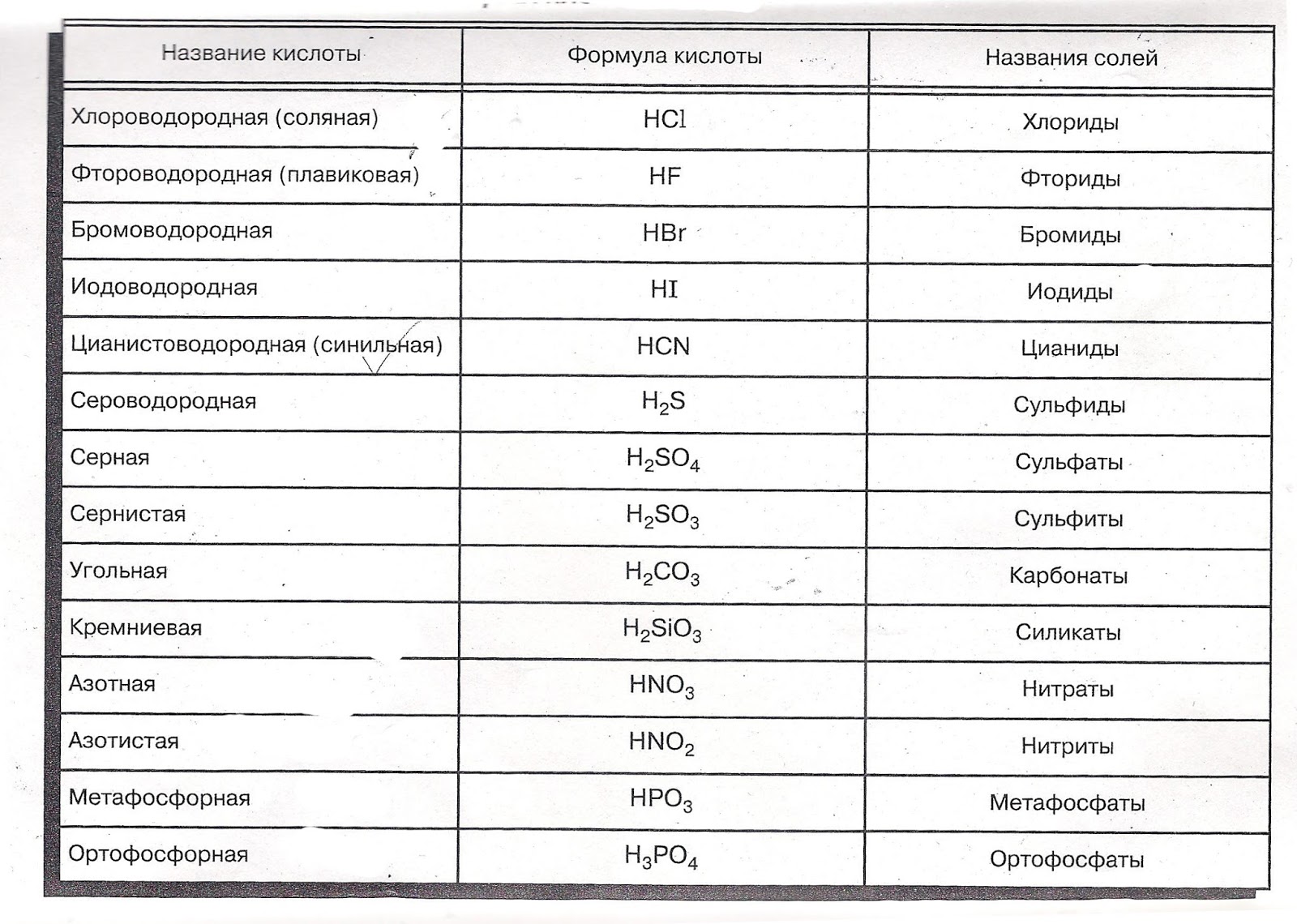 Животноводству также нужна соль; он часто выпускается в виде сплошных блоков.
Животноводству также нужна соль; он часто выпускается в виде сплошных блоков.
В мясоперерабатывающей, колбасной, рыбной и пищевой промышленности соль используется в качестве консерванта или приправы, либо и того, и другого. Он используется для обработки и консервирования шкур, а также в качестве рассола для охлаждения.
В химической промышленности соль требуется при производстве бикарбоната натрия (пищевой соды), гидроксида натрия (каустической соды), соляной кислоты, хлора и многих других химикатов. Соль также используется в производстве мыла, глазури и фарфоровой эмали и входит в металлургические процессы в качестве флюса (вещества, способствующего плавлению металлов).
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчасПри нанесении на снег или лед соль снижает температуру плавления смеси. Таким образом, большие количества используются в северном климате, чтобы помочь очистить проезжие части от скопившегося снега и льда. Соль используется в оборудовании для умягчения воды, которое удаляет из воды соединения кальция и магния.
История использования
В некоторых частях Западного полушария и в Индии использование соли было введено европейцами, но в некоторых частях Центральной Африки она по-прежнему остается роскошью, доступной только богатым.Там, где люди питаются в основном молоком и сырым или жареным мясом (чтобы не терялись его природные соли), добавки хлорида натрия не нужны; кочевники со своими отарами овец или стадами крупного рогатого скота, например, никогда не едят соль с пищей. С другой стороны, люди, которые живут в основном на злаковых, овощных или отварных мясных диетах, нуждаются в добавках соли.
Привычное употребление соли тесно связано с переходом от кочевой жизни к земледелию, этапом цивилизации, оказавшим глубокое влияние на ритуалы и культы почти всех древних народов.Богам поклонялись как дарителям добрых плодов земли, и соль обычно включалась в жертвенные приношения, полностью или частично состоящие из зерновых элементов. Такие подношения были распространены среди греков и римлян, а также среди ряда семитских народов.
Заветы обычно заключались во время жертвенной трапезы, в которой соль была обязательным элементом. Консервирующие свойства соли сделали ее особенно подходящим символом прочного компакта, скрепившим ее обязательством верности.Таким образом, слово , соль приобрело коннотации высокого уважения и почета в древних и современных языках. Примеры включают арабское признание «между нами соль», еврейское выражение «съесть соль дворца» и современную персидскую фразу namak arām , «неверно соли» (т. Е. Неверный или неблагодарный). В английском языке термин «соль земли» описывает человека, которого очень уважают.
Соль вносит большой вклад в наши знания о древних торговых путях.Одна из старейших дорог в Италии — Соляная дорога (Соляной путь), по которой римская соль из Остии доставлялась в другие части Италии. Геродот рассказывает о караванном пути, объединившем соляные оазисы Ливийской пустыни. Древняя торговля между Эгейским и Черноморским побережьями юга России в значительной степени зависела от соляных ванн (прудов для испарения морской воды для получения соли) в устье Днепра и от соленой рыбы, привозимой из этого района.
Соляные лепешки использовались в качестве денег в Эфиопии, других странах Африки и Тибете.В римской армии офицерам и солдатам разрешалось употреблять соль; в имперские времена этот salarium (от которого происходит английское слово salary ) был преобразован в денежное пособие на соль.
Китай, США, Индия, Германия, Канада и Австралия являются крупнейшими производителями соли в мире в начале 21 века.
Фрэнк Осборн Вуд5.1: Сахар и соль — Chemistry LibreTexts
Хлорид натрия, также известный как поваренная соль, представляет собой ионное соединение с химической формулой \ (\ ce {NaCl} \), представляющее соотношение 1: 1 натрия и ионы хлорида.Он обычно используется в качестве приправы и пищевого консерванта. Соль можно создать, сложив вместе два очень реактивных элемента: металлический натрий (\ (\ ce {Na (s)} \) и газообразный хлор (\ (\ ce {Cl2 (g)} \).
)\ [\ ce {2Na (s) + Cl2 (g) \ rightarrow 2NaCl (s)} \ label {eq1} \]
Элемент натрий (рисунок \ (\ PageIndex {1a} \)) является очень химически активным металлом; при возможности он вступит в реакцию с потом на ваших руках и образует гидроксид натрия, который является очень едким веществом. Элемент хлор (рис. \ (\ PageIndex {1b} \)) — это бледно-желтый едкий газ, который нельзя вдыхать из-за его ядовитости.Однако объедините эти два опасных вещества вместе, и они вступят в реакцию с образованием ионного соединения хлорида натрия (рис. \ (\ PageIndex {1c} \)), известного просто как соль.
Рисунок \ (\ PageIndex {1} \): Натрий + Хлор = Хлорид натрия (a) Натрий — очень реактивный металл. (b) Хлор — это бледно-желтый ядовитый газ. (c) Вместе натрий и хлор образуют хлорид натрия — соль, которая необходима для нашего выживания. Источник: фото слева предоставлено reenhorn1, а фото в центре любезно предоставлено Benjah-bmm27.{-}} \) ионы необходимы для нормальной работы нервов и дыхания. Оба эти иона поставляются солью. Вкус соли — один из основных вкусов; соль, вероятно, самый древний из известных ароматизаторов и один из немногих камней, которые мы едим. Очевидно, что когда элементарный натрий и хлор объединяются (уравнение \ ref {eq1}), образующийся солевой продукт имеет радикально разные свойства (как физические, так и химические). Наблюдать за этой реакцией очень интересно (Видео \ (\ PageIndex {1} \)).Видео \ (\ PageIndex {1} \): Приготовление столовой соли с использованием металлического натрия и газообразного хлора
Еще одно соединение — сахар, общее название сладких растворимых углеводов, многие из которых используются в пище.Сахар имеет химическую формулу \ (\ ce {C12h32O11} \) и состоит из элементов, отличных от соли: углерода, водорода и кислорода. Хотя сахар качественно напоминает поваренную соль (которую часто путают на кухне), они имеют совершенно разные физические и химические свойства. Существуют разные типы сахара, полученные из разных источников. Хотя сахар состоит из углерода, водорода и кислорода, его значительно сложнее синтезировать из составляющих его элементов, чем поваренную соль (уравнение \ ref {eq1}).Однако термическое разложение значительно проще и может быть представлено как дегидратация сахарозы до чистого углерода и водяного пара в уравнении \ ref {eq2} и продемонстрировано в видео \ (\ PageIndex {2} \).
\ [\ ce {C12h32O11 (s) + тепло → 12C (s) + 11h3O (g)} \ label {eq2} \]
Видео \ (\ PageIndex {2} \): Научный эксперимент на кухне показывает, что происходит с молекулами сахара при их нагревании. Эксперимент не разочаровал!
Как и соль, сахар имеет радикально другие свойства (как физические, так и химические), чем составляющие его элементы.Это различие в свойствах составляющих элементов и соединений является главной особенностью химических реакций.
Добавления и авторства
Эта страница была создана на основе содержимого следующими участниками и отредактирована (тематически или широко) командой разработчиков LibreTexts в соответствии со стилем, представлением и качеством платформы:
Именные соли (ионные соединения)
Соли — это ионные соединения, которые при растворении в воде полностью распадаются. в ионы.Они возникают в результате реакции кислот с основаниями и всегда содержат катион металла или катион аммония (NH 4 + ).
Примеры солей включают NaCl, NH 4 F, MgCO 3 и Fe 2 (HPO 4 ) 3 .
Соли получают названия, перечисляя имена составляющих их ионов, сначала катион, затем анион. Это включает три отдельных шага.
Шаг 1. Разделите формулу пополам
Начните с вертикального среза формулы сразу после металла или аммония:
| NaCl | Na | Cl |
| NH 4 F | NH 4 | F |
| MgCO 3 | Mg | CO 3 |
| Fe 2 (HPO 4 ) 3 | Fe 2 | (HPO 4 ) 3 904 |
Шаг 2: Определите заряды ионов
Определите ионы и их заряды на каждой половине.Это определенно сложная часть. Здесь пригодятся семь правил:
Правило 1: Все металлы группы 1 (Li — Fr) относятся к категории 1+
Правило 2: Металлы группы 2 (Be — Ra) — все 2+
Правило 3: Алюминий 3+; Аммоний 1+
Правило 4: Для всех остальных металлов требуется римская цифра.
Правило 5: Неметаллы группы 7 (F — I): все 1–
Правило 6: Неметаллы группы 6 (O — Te) КАК АНИОНЫ обычно 2–
Правило 7: Общий сбор должен составлять 0
Например:
| NaCl | Na | Cl | Na + | Класс — | |||
| NH 4 F | NH 4 | F | NH 4 + | F — | |||
| MgCO 3 | Mg | CO 3 | Mg 2+ | CO 3 2– | Fe 2 (HPO 4 ) 3 | Fe 2 | (HPO 4 ) 3 | Fe 3+ | HPO 4 2– |
Шаг 3. Назовите Ионы
Затем назовите эти ионы:
| NaCl | Na + | Cl — | хлорид натрия |
| NH 4 F | NH 4 + | F — | фторид аммония |
| MgCO 3 | Mg 2+ | CO 3 2– | карбонат магния |
| Fe 2 (HPO 4 ) 3 | Fe 3+ | HPO 4 2– | гидрофосфат железа (III) |
Эти ионы, кстати, называются основными частицами в растворе . для соли.Выявление основных видов в растворе именно в этом способ становится ДЕЙСТВИТЕЛЬНО важным, когда вы изучаете равновесие. Вам тоже нужно знать эти обвинения, так что вы можете выучить их сейчас и покончить с этим.
Советы для успеха
Еще несколько советов могут быть полезны:
Невозможно обойтись без запоминания имен элементов. Просто сделай это.
Правило 7 гораздо ценнее, чем думает большинство новичков.
Застрял, потому что у вас есть переходный металл, такой как Fe или Mn, и вы не можете вспомнить заряд аниона? Посмотрите вокруг, чтобы увидеть другие примеры используемого аниона. Например, скажем, вы необходимо назвать FeSO 4 , и вы не можете вспомнить заряд по СО 4 . Если вы найдете «Na 2 SO 4 » где-нибудь еще на экзамене, викторине или в книге ты дома свободен. Обладая этой информацией, вы узнаете, что SO 4 должно быть 2–, следовательно, заряд Fe должен быть 2+.
Если вы знаете свои сильные кислоты, тогда вы знаете «H 2 SO 4 .» H здесь H + , а общий заряд равен 0. Итак, SO 4 должно быть 2–. По аналогии,
- HNO 3 дает NO 3 —,
HClO 3 дает ClO 3 —, и
HClO 4 дает ClO 4 —.
Это работает и со слабыми кислотами, если вы их помните, например как H 2 CO 3 и H 3 PO 4 .
Выучите много названий кислот, потому что они здесь помогают.
Кислоты X-ic образуют анионы X-ата (серная / сульфатная, азотная / нитратная)
X-кислоты образуют анионы X-ite (азотистые / нитритные)
Сводка
Ключ, который следует помнить, это то, что система разработана так, чтобы быть однозначно .Мы должны иметь возможность получить одну и только одну формулу из имени, и это имя должно быть стандартным, а не каким-то милым названием вроде nutrasweet .
Таким образом, запомните наиболее распространенные названия и символы элементов, запомнить семь правил, иметь под рукой таблицу Менделеева, выучите множество кислотных названий и формул, и практикуйтесь, практикуйтесь, практикуйтесь!
ВЫ МОЖЕТЕ ЭТО СДЕЛАТЬ!
Примеры солей в химии | Education
В химии соли — это ионные продукты, когда кислота реагирует с основанием и нейтрализует.В твердой форме соли имеют нейтральный заряд. При растворении в воде они становятся ионами. Некоторые соли можно отличить по цвету. Химики часто используют испытания пламенем, чтобы наблюдать цвета, возникающие при возбуждении электронов пламенем. Многие соли обычно встречаются и используются в домашних условиях.
Хлорид натрия
Поваренная соль или хлорид натрия — это ионный продукт комбинации щелока или гидроксида натрия и соляной кислоты. От прозрачного до молочно-белого, хлорид натрия ценится как приправа к пище уже более 2000 лет.Это было так высоко, что римляне платили своим солдатам соляными пайками. Вкус мяса и пищевых продуктов усиливается за счет добавления поваренной соли.
Дихлорат аммония
Используемый в литографии, очистке масел и некоторых формах проявки фотографий, дихромат аммония представляет собой оранжевый кристалл. Это сильный агент окисления и может вызвать серьезные ожоги кожи, если обращаться с ним без защиты. Одно из забавных применений дихромата аммония на уроках естественных наук — это поджечь небольшую кучу химического вещества и позволить ученикам наблюдать.Небольшая кучка дихромата аммония окислится и сформирует образец вулкана. Студентам нравится наблюдать, как летят искры, когда пепел образует типичный вулканический конус.
Сульфат магния
Сульфат магния — это белый кристалл природного происхождения, также известный как английская соль. Это продукт химической реакции между гидроксидом магния и серной кислотой. В натуральной медицине английскую соль можно использовать как слабительное. Раствор солей используется во многих домах в качестве замачивания при болях в ногах, ушибах и растяжениях.Некоторым людям нравится добавлять это химическое вещество в воду в ванне.
Бикарбонат натрия
Бикарбонат натрия — это белый натуральный продукт, широко известный как пищевая сода. Хотя он встречается в природе, он может быть образован в результате химической реакции гидроксида натрия и диоксида углерода. Он также производится реакцией гидроксида натрия и угольной кислоты. Бикарбонат натрия обычно используется в выпечке. В научных проектах ученики начальной школы часто используют реакцию бикарбоната натрия и уксусной кислоты для имитации извержения вулкана.
Ссылки
Ресурсы
Биография писателя
Рассел Грей — профессор педагогических наук в различных университетах. Он специализируется на обучении лучшим практикам преподавания, образовательным технологиям и поликультурному образованию. Грей имеет докторскую степень. и преподает более 30 лет.
Свойства соли — The Salt Association
Соль — химическое соединение с рядом интересных свойств:
- Кристаллы или белый кристаллический порошок.
- Прозрачный и бесцветный в кристаллической форме, похожий на лед.
- Кристаллизуется в изометрической системе, обычно в форме кубов.
- Растворим в воде (35,6 г / 100 г при 0 ° C и 39,2 г / 100 г при 100 °).
- Слабо растворим в спирте, но не растворим в концентрированной соляной кислоте.
- Плавится при 801 ° C и начинает испаряться при температурах чуть выше этой точки кипения 1413 ° C.
- Твердость 2,5 по шкале твердости MOH.
- Удельный вес 2,165.
- Негорючие — низкая токсичность.
- Гигроскопичен — впитывает влагу из влажной атмосферы с относительной влажностью выше 75% — ниже этого значения она высыхает.
В натуральном виде соль часто содержит следы хлорида магния, сульфата магния, бромида магния и других. Эти примеси могут окрашивать прозрачные кристаллы в желтый, красный, синий или фиолетовый цвет.
Химикаты из соли
При пропускании электрического тока через крепкий раствор соли в воде происходит электролиз и образуются три продукта:
- Хлор (Cl 2 )
- Гидроксид натрия (NaOH)
- Водород (H 2 ).
Поскольку газообразные водород и хлор образуют взрывоопасную смесь, важно держать их разделенными. Все три продукта полезны по отдельности, и их также можно комбинировать для создания других продуктов. Гидроксид натрия и хлор объединяются с образованием раствора гипохлорита натрия, который широко используется в домашних условиях в качестве отбеливателя. Более крепкий раствор гипохлорита натрия используется в качестве молочного и промышленного дезинфицирующего средства.
В разных условиях реакции гидроксид натрия и хлор будут реагировать с образованием хлората натрия.Он образуется в виде белых кристаллов, которые могут быть взрывоопасными или легковоспламеняющимися при смешивании с органическими веществами. Растворы хлората натрия широко используются в качестве гербицидов.
Когда газообразный хлор сжигается в водороде, два газа реагируют с образованием хлористого водорода. Хлороводород растворяется в воде с образованием соляной кислоты. Полученная таким образом соляная кислота очень чиста и может безопасно использоваться в пищевой и фармацевтической промышленности.
Соль — натрий, вода, ионы и реакция
Соль, наиболее известной из которых является хлорид натрия или поваренная соль, представляет собой соединение, образованное химической реакцией кислоты с основанием.Во время этой реакции кислота и основание нейтрализуются с образованием соли, воды и тепла . Натрий хлорид, распространен в природе в виде отложений на суше, образованных испарениями древних морей, а также растворен в океанах. Соль является важным соединением, имеющим множество применений, включая для консервирования продуктов , для производства мыла , а также для защиты от обледенения дорог и пешеходных дорожек. Он также является основным источником хлора, и натрия для промышленных химикатов.
С точки зрения химии, соль может быть любым соединением, образованным реакцией кислоты с основанием. Энергия в виде тепла выделяется во время этой реакции нейтрализации , поэтому она считается экзотермической. Наиболее распространенная соль, хлорид натрия (NaCl), является продуктом реакции между соляной кислотой (HCl) и основанием гидроксидом натрия (NaOH). В этой реакции положительно заряженные ионов водорода (H +) кислоты притягиваются к отрицательно заряженным гидроксильным ионам (OH-) основания.Эти ионы объединяются и образуют воду. После образования воды ионы натрия и хлора остаются растворенными, а кислота и основание нейтрализуются. Твердая соль образуется, когда вода испаряется и отрицательно заряженные ионы хлора соединяются с положительно заряженными ионами натрия.
Твердый хлорид натрия существует в форме крошечных частиц кубической формы, называемых кристаллами. Эти кристаллы бесцветны, имеют плотность 2,165 г / см 3 и плавятся при 1472 ° F (800.8 ° С). Они также растворяются в воде, разделяя на компоненты ионы натрия и хлора. Этот процесс, известный как ионизация, важен для многих промышленных химических реакций .
Поваренная соль (хлорид натрия) встречается повсюду в природе. Он растворен в океанах со средней концентрацией 2,68%. На суше широко распространены толстые солевые отложения, образовавшиеся в результате испарения доисторических океанов. Эти отложения представляют собой настоящих осадочных пород и называются каменной солью или галитом.
Люди получают соль из окружающей среды разными способами. Месторождения твердых солей добываются непосредственно в виде каменной соли и очищаются. Соль из морской воды выделяется путем солнечного испарения. Подземные солевые месторождения разрабатываются растворным способом. Этот тип добычи включает закачку воды под землю для растворения соли месторождения , извлечение воды с растворенной в ней солью и испарение воды для выделения соли.
Помимо того, что соль необходима для выживания большинства растений и животных, она также широко используется во многих отраслях промышленности.В пищевой промышленности он используется для консервирования мяса и рыбы , потому что он может замедлить рост вредных для здоровья микроорганизмов . Он также используется для улучшения вкуса многих продуктов. В косметической промышленности из него делают мыло и шампуни. В других отраслях химической промышленности он является основным источником натрия и хлора, которые являются сырьем, используемым для различных химических реакций.

 ru / Технический справочник ДПВА / Таблицы для инженеров (ex DPVA-info)
ru / Технический справочник ДПВА / Таблицы для инженеров (ex DPVA-info)