ГДЗ по химии 8 класс Минченков Е.Е Задание: 6 Знаки химических элементов Периодической таблицы Д И Менделеева
Изображения обложек учебников приведены на страницах данного сайта исключительно в качестве иллюстративного материала (ст. 1274 п. 1 части четвертой Гражданского кодекса Российской Федерации)
Авторы: Минченков Е.Е.
На данной странице представлено детальное решение задания 6 Знаки химических элементов Периодической таблицы Д. И. Менделеева по химии для учеников 8 классa автор(ы) Минченков Е.Е.
6 Знаки химических элементов Периодической таблицы Д. И. Менделеева
Информация, которую несет химический знак (символ):
Обозначает конкретный химический элемент;
Обозначает один атом химического элемента;
Относительную атомную массу.
По горизонтали таблица Д. И. Менделеева делится на периоды. В короткопериодном варианте таблицы выделяют 1-3 периоды – малые периоды, 4-7 периоды – большие периоды.

По вертикали таблица Д. И. Менделеева делится на группы. В короткопериодном варианте таблицы 8 групп, каждая состоит из двух подгрупп: главные или А-группы и побочные или Б-группы.
C – углерод (цэ) – происхождение названия от слова «уголь»
Cr – хром — элемент получил от греч. слова — цвет, краска — из-за разнообразия окраски своих соединений.
Cu – медь (купрум) — латинское название меди произошло от названия острова Кипр, где было богатое месторождение.
Сo – кобальт — Название «кобальт» происходит от нем. Kobold — домовой, гном.
Cd – кадмий — Штромейер назвал кадмий по греческому названию руды, из которой в Германии добывали цинк, — καδμεία. В свою очередь, руда получила своё название в честь Кадма, героя древнегреческой мифологии.
Химические элементы делятся на металлы и неметаллы, так как обладают похожими свойствами:
металлы имеют металлический блеск, хорошо проводят тепло и электрический ток, имеют высокую температуру кипения, твердое агрегатное состояние.

Неметаллы имеют разное агрегатное состояние, большинство плохо проводит электрический ток, обладают летучестью.
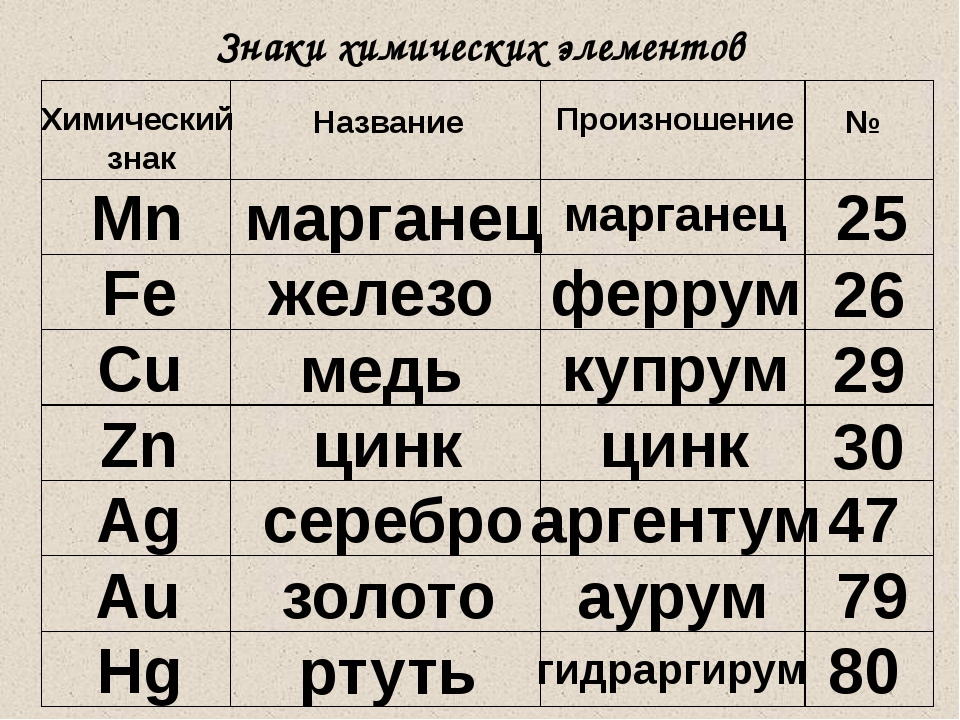
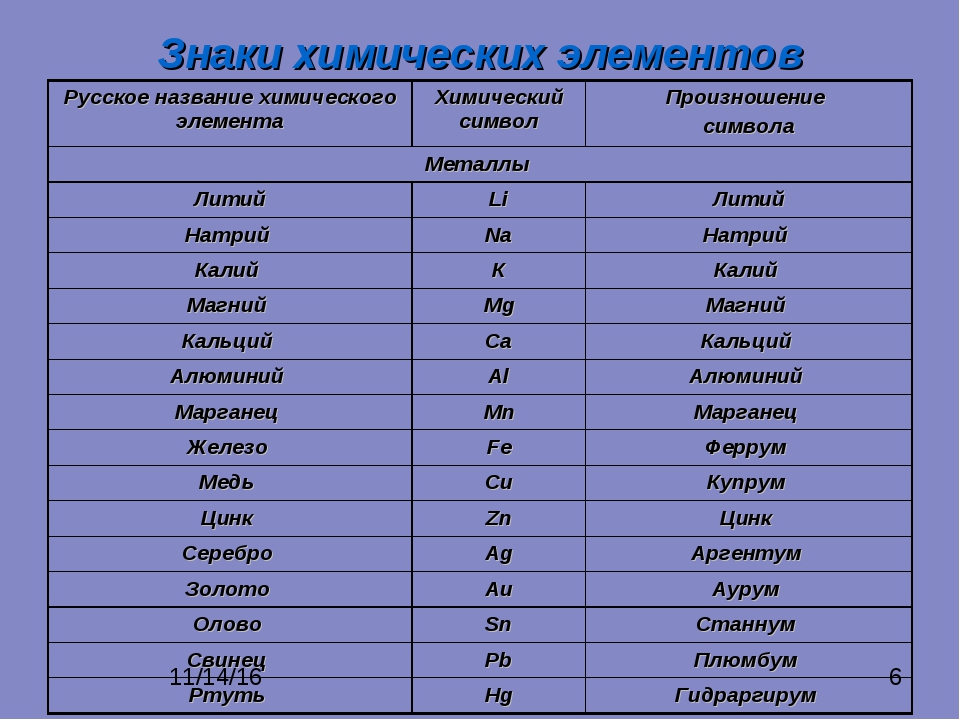
Металлы
| Железо | Fe | Феррум |
| Калий | K | Калий |
| Кальций | Ca | Кальций |
| Литий | Li | Литий |
| Медь | Cu | Купрум |
| Серебро | Ag | Аргентум |
Неметаллы
| Азот | N | Эн |
| Водород | H | Аш |
| Кислород | O | О |
| Cера | S | Эс |
| Углерод | C | Цэ |
Ru – рутений – в честь России
Sm – самарий – в честь русского горного инженера, полковника В. Е. Самарского-Быховца
Е. Самарского-Быховца
Md – менделевий – в честь Дмитрия Ивановича Менделеева
Db – дубний – в честь российского центра по исследованиям в области ядерной физики, наукограда Дубны
Fl – флеровий – в честь Лаборатории ядерных реакций им. Г. Н. Флёрова
Mc – московий – в честь Московской области
Og – оганесон – в честь академика Юрия Цолаковича Оганесяна
Коротко- и длиннопериодные таблицы имеют по 7 периодов, где 1-3 периоды являются малыми, а 4-7 периоды – большими периодами.
В короткопериодном имеется 8 групп, которые делятся на главные (А) и побочные (Б) группы — пронумерованы римскими цифрами от I до VIII.
В длиннопериодном варианте имеется 18 групп, которые обозначают или арабскими цифрами.
Атомная единица массы: 1 а. е. м. = 1,66·10−27 кг = 1,66·10−23 г
m(Fe) = Ar(Fe) · 1 а. е. м. = 56 · = 1,66·10−23 г = 92. 96·1,66·10−23 г
96·1,66·10−23 г
Для сообщения о других формах периодической таблицы Д. И. Менделеева используйте следующую информацию:
Наиболее распространёнными являются 3 формы таблицы Менделеева: «короткая», «длинная», «сверхдлинная».
Нильсом Бором разработана лестничная (пирамидальная) форма периодической системы.
Существует несколько сотен вариантов, редко или вовсе не используемых, но весьма оригинальных, способов графического или табличного отображения Периодического закона, при этом учёные предлагают всё новые варианты.
Источник информации: https://www.sstu.ru/nauka/iypt/formy-periodicheskoy-tablitsy/
Рис. 1. ГДЗ по химии 8 класс Минченков Е.Е Задание: 6 Знаки химических элементов Периодической таблицы Д И Менделеева
Add
Новыe решебники
Периодическая система химических элементов Д.И. Менделеева. Знаки химических элементов.

Паспорт урока химии в 8 классе
Периодическая система химических элементов Д.И. Менделеева. Знаки химических элементов.Учитель
Костюкова О.А
Образовательная цель
Развитие теоретического мышления восьмиклассников на основе осмысления Периодической системы химических элементов
Д.И. Менделеева
Планируемые образовательные результаты
По окончании изучения темы ученик:
МР — самостоятельно формулирует тему урока;
МР — устанавливает причинно-следственные связи;
МР — планирует познавательную деятельность;
МР — сопоставляет ответы с эталоном ответов;
ЛР — высказывает свое собственное мнение;
ЛР – оценивает результат своей деятельности;
ПР — применяют полученные знания на практике;
Программные требования к образовательным результатам раздела «Периодическая система химических элементов Д. И. Менделеева. Знаки химических элементов».
И. Менделеева. Знаки химических элементов».
Ученик научиться:
называть: принцип построения таблицы; расположение химического элемента в периодах и группах;
определять: малые и большие периоды, главную и побочную подгруппы;
объяснять: закономерности изменения свойств элементов в пределах малых периодов и главных подгрупп.
Ученик получит возможность научиться:
использовать приобретенные знания и умения в практической деятельности: располагать элементы в порядке возрастания или уменьшения металлических или неметаллических свойств;
сравнивать химические элементы на основе положения элемента в периодической системе.
Программное содержание
Основная классификация химических элементов Д.И. Менделеева. Периодическая система как естественно — научная классификация химических элементов. Табличная форма представления классификации химических элементов. Структура таблицы «Периодическая система химических элементов Д.И. Менделеева» (короткая форма): А- и Б –группы, периоды.
Табличная форма представления классификации химических элементов. Структура таблицы «Периодическая система химических элементов Д.И. Менделеева» (короткая форма): А- и Б –группы, периоды.
Гениальное и простое – результат долгого и упорного труда.
Ценностно-смысловые ориентиры
Чувство гордости за российскую химическую науку.
План изучения учебного материала
1.Подтверждения периодического закона.
2.Периодическая таблица.
3.Самостоятельная работа.
Основные понятия
периодический закон, период, группа, подгруппа, периодическая система
Тип урока
урок изучения нового материала
Форма урока
обсуждение с доказательствами
Образовательная технология
развивающего обучения
Оснащение урока
учебник:О.
видиофильм: tps://www.youtube.com/watch?v=1M7iKKVnPJE Гениальность таблицы Менделеева [TED-ED], презентация,
мультипроектор, мультимедийная доска, листы с заданием
Технологическая карта хода урока
Вводная беседа:-Чей портрет изображен на слайде?
-Чем знаменит этот человек?
Задание: прочитайте эпиграф к уроку
“Будущее не грозит периодическому закону разрушением, а только надстройки и развитие обещает”. (Д.И. Менделеев)
— Какова тема нашего урока?
— Какова главная задача урока?
фронтально
отвечают на вопросы
— запись темы в тетрадь
— письменно в тетрадях
устанавливают причинно — следственные связи(МР)
высказывают собственное суждение (ЛР)
самостоятельно формулируют тему урока, определяют главную задачу (МР)
III. Актуализации новых знаний (15мин.)
Интересные факты о Д.И. Менделееве
Видеофильм о гениальности таблицы Д.И. Мендилеева
Обсуждение
Вывод: На основе периодического закона можно предсказать свойства элементов и открывать новые.
Периодическая таблица. Беседа:
— Как сформулировал закон Д.И. Менделеев?
— Как выглядит закон в графическом изображении?
— Каков принцип построения системы элементов?
3.1.Знакомство со строением таблицы.
— формы таблицы Д.И. Менделеева
— строение таблицы: периоды и изменения;
группы и изменения.
устная фронтальная работа
фронтальная
работа и индивидуальная.
индивидуальный лист
устная фронтальная работа
по периодической системе
высказывают собственное мнение о личности ученого.
обсуждение сюжета, высказывают собственное мнение, дают оценку периодическому закону, самостоятельно делают вывод(МР, ЛР)
высказывание суждений (ЛР),
сопоставляют свои ответы с эталоном (МР)
применяют знания на практике: находят по таблице элементы, расположенные в разных периодах и группах (ПР)
IV. ПРИМЕНЕНИЕ НОВЫХ ЗНАНИЙ (5-7 мин.)
3.Самостоятельная работа по вариантам.
индивидуальная работа по таблице с использованием схемы
планируют свою познавательную деятельность (МР)
V. ПОДВЕДЕНИЕ ИТОГОВ УРОКА (3 мин.)
Ситуация рефлексии.
-Удалось ли нам выполнить задачу урока?
— Что у нас хорошо получилось?
— Над чем еще предстоит поработать?
Ситуация самооценки – содержательная самооценка.
-Чему научились на уроке?
— Оцените результат своей работы на уроке?
коллективная дискуссия
индивидуальная
высказывают собственное мнение, обосновывают свою позицию (ЛР)
Периодическая система химических элементов (таблица Менделеева)
https://ria.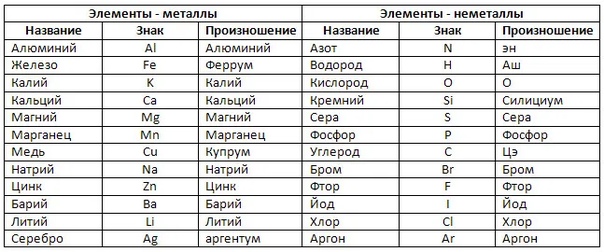 ru/20190129/1550014194.html
ru/20190129/1550014194.html
Периодическая система химических элементов (таблица Менделеева)
Периодическая система химических элементов (таблица Менделеева) — РИА Новости, 29.01.2019
Периодическая система химических элементов (таблица Менделеева)
Периодическая система химических элементов – упорядоченное множество химических элементов и их естественная классификация. РИА Новости, 29.01.2019
2019-01-29T04:51
2019-01-29T04:51
2019-01-29T04:51
справки
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdnn21.img.ria.ru/images/99408/72/994087230_0:105:2000:1230_1920x0_80_0_0_b528d261d40438ab5524fc6ad7f580a3.jpg
Периодическая система химических элементов – упорядоченное множество химических элементов и их естественная классификация. Является табличным представлением периодического закона, открытого Дмитрием Менделеевым. Современная формулировка этого закона звучит так: свойства элементов находятся в периодической зависимости от заряда их атомных ядер.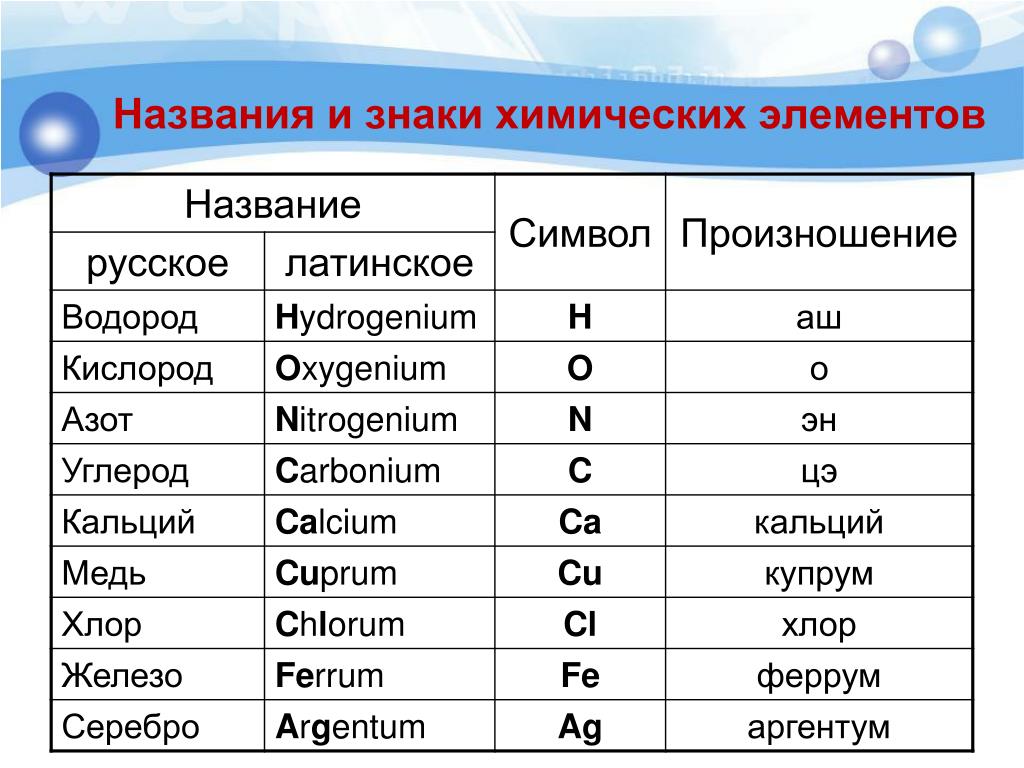 Прообразом Периодической системы химических элементов служит таблица «Опыт системы элементов, основанной на их атомном весе и химическом сходств», составленная Менделеевым в 1869 году. По мере совершенствования этой таблицы он развил представления о периодах и группах элементов и о месте каждого элемента в системе. В 1871 году в книге «Основы химии» Менделеевым была включена «Естественная система элементов Д. Менделеева» – первая классическая короткая форма Периодической системы химических элементов. Современная Периодическая система химических элементов включает 118 элементов. За последние 50 лет таблица Менделеева пополнилась семнадцатью новыми элементами (102-118). Девять из них были впервые получены в российском Объединенном институте ядерных исследований в Дубне. Последнее добавление в таблицу Менделеева было сделано в 2016 году, она пополнилась четырьмя элементами с 113, 115, 117 и 118 атомными номерами, которые соответственно были названы нихоний (Nh), московий (Mc), теннессин (Ts) и оганесон (Og).
Прообразом Периодической системы химических элементов служит таблица «Опыт системы элементов, основанной на их атомном весе и химическом сходств», составленная Менделеевым в 1869 году. По мере совершенствования этой таблицы он развил представления о периодах и группах элементов и о месте каждого элемента в системе. В 1871 году в книге «Основы химии» Менделеевым была включена «Естественная система элементов Д. Менделеева» – первая классическая короткая форма Периодической системы химических элементов. Современная Периодическая система химических элементов включает 118 элементов. За последние 50 лет таблица Менделеева пополнилась семнадцатью новыми элементами (102-118). Девять из них были впервые получены в российском Объединенном институте ядерных исследований в Дубне. Последнее добавление в таблицу Менделеева было сделано в 2016 году, она пополнилась четырьмя элементами с 113, 115, 117 и 118 атомными номерами, которые соответственно были названы нихоний (Nh), московий (Mc), теннессин (Ts) и оганесон (Og). Сейчас в крупнейших ядерно-физических центрах мира фактически начаты работы по синтезу 119-го, 120-го и 121-го элементов, которые назвали «большой гонкой».Опубликовано свыше 500 вариантов Периодической системы химических элементов, что связано с попытками поиска решения некоторых частных проблем ее структуры. Наиболее распространены две табличные формы: короткая и длинная (разрабатывалась Дмитрием Менделеевым, усовершенствована в 1905 году Альфредом Вернером). Современная форма Периодической системы химических элементов (в 1989 году Международным союзом теоретической и прикладной химии рекомендована длинная форма таблицы) состоит из семи периодов (горизонтальных последовательностей элементов, расположенных по возрастанию порядкового номера) и 18 групп (вертикальных последовательностей элементов в соответствии с количеством валентных электронов), а короткая форма таблицы – из восьми групп.Номер группы элементов короткого варианта таблицы Менделеева соответствует числу валентных электронов во внешней электронной оболочке атомов.
Сейчас в крупнейших ядерно-физических центрах мира фактически начаты работы по синтезу 119-го, 120-го и 121-го элементов, которые назвали «большой гонкой».Опубликовано свыше 500 вариантов Периодической системы химических элементов, что связано с попытками поиска решения некоторых частных проблем ее структуры. Наиболее распространены две табличные формы: короткая и длинная (разрабатывалась Дмитрием Менделеевым, усовершенствована в 1905 году Альфредом Вернером). Современная форма Периодической системы химических элементов (в 1989 году Международным союзом теоретической и прикладной химии рекомендована длинная форма таблицы) состоит из семи периодов (горизонтальных последовательностей элементов, расположенных по возрастанию порядкового номера) и 18 групп (вертикальных последовательностей элементов в соответствии с количеством валентных электронов), а короткая форма таблицы – из восьми групп.Номер группы элементов короткого варианта таблицы Менделеева соответствует числу валентных электронов во внешней электронной оболочке атомов.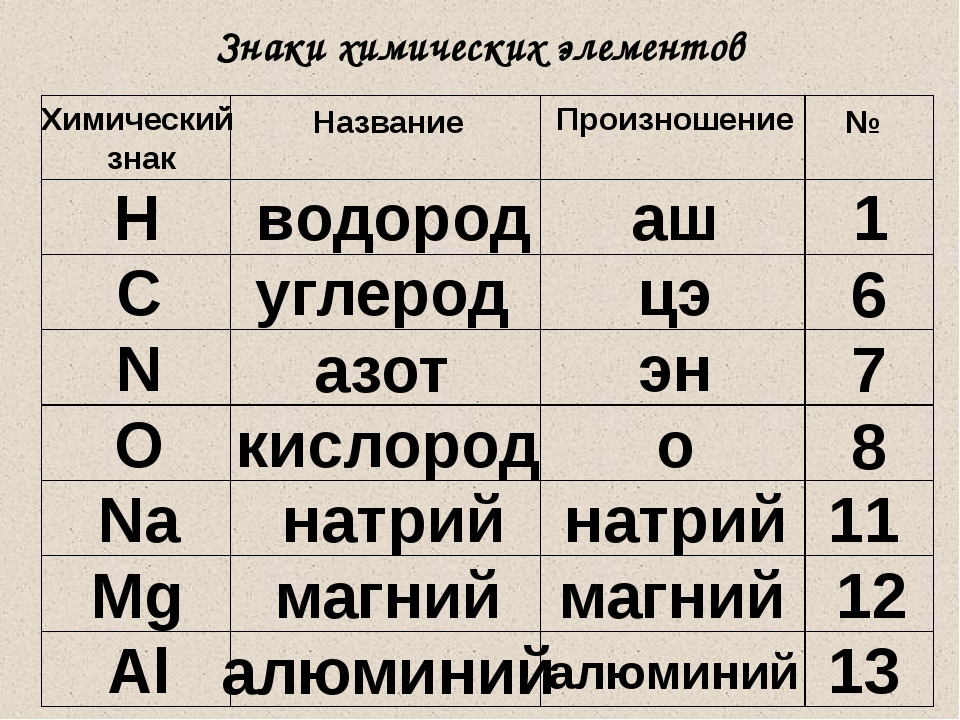 В длинном варианте таблицы номер группы в большей мере формален. Группы короткого варианта включают главную (а) и побочную (б) подгруппы, в каждой из которых содержатся элементы, сходные по химическим свойствам. Элементы некоторых групп имеют собственные тривиальные названия: щелочные металлы (группа 1 длинной формы таблицы), щелочноземельные металлы (группа 2), халькогены (группа 16), галогены (группа 17), благородные газы (группа 18). В Периодической системе химических элементов для каждого элемента указывается его символ, название, порядковый номер и значение относительной атомной массы.Первый период содержит два элемента – водород и гелий. Второй и третий периоды (литий – неон; натрий – аргон) содержат по восемь элементов. Четвертый (калий – криптон) и пятый (рубидий – ксенон) периоды содержат по 18 элементов. Шестой период (цезий – радон) содержит 32 элемента и включает особую группу элементов – лантаноиды.Седьмой период (франций – оганесон), подобно шестому, содержит 32 элемента и включает особую группу элементов – актиноиды.
В длинном варианте таблицы номер группы в большей мере формален. Группы короткого варианта включают главную (а) и побочную (б) подгруппы, в каждой из которых содержатся элементы, сходные по химическим свойствам. Элементы некоторых групп имеют собственные тривиальные названия: щелочные металлы (группа 1 длинной формы таблицы), щелочноземельные металлы (группа 2), халькогены (группа 16), галогены (группа 17), благородные газы (группа 18). В Периодической системе химических элементов для каждого элемента указывается его символ, название, порядковый номер и значение относительной атомной массы.Первый период содержит два элемента – водород и гелий. Второй и третий периоды (литий – неон; натрий – аргон) содержат по восемь элементов. Четвертый (калий – криптон) и пятый (рубидий – ксенон) периоды содержат по 18 элементов. Шестой период (цезий – радон) содержит 32 элемента и включает особую группу элементов – лантаноиды.Седьмой период (франций – оганесон), подобно шестому, содержит 32 элемента и включает особую группу элементов – актиноиды. Лантаноиды и актиноиды помещены отдельно внизу таблицы.Периодическая система химических элементов сыграла и продолжает играть огромную роль в развитии многих естественнонаучных дисциплин. Она стала важным звеном в эволюции атомно-молекулярного учения, способствовала формулировке современного понятия «химический элемент» и уточнению представлений о простых веществах и соединениях, оказала значительное влияние на разработку теории строения атомов и возникновение понятия изотопии. С периодической системой связана строго научная постановка проблемы прогнозирования в химии, что проявилось как в предсказании существования неизвестных элементов и их свойств, так и новых особенностей химического поведения уже открытых элементов. Периодическая система – важнейшая основа неорганической химии; она служит, например, задачам синтеза веществ с заранее заданными свойствами, созданию новых материалов, подбору специфических катализаторов для различных химических процессов. Периодическая система – научная база преподавания общей и неорганической химии, а также некоторых разделов атомной физики.
Лантаноиды и актиноиды помещены отдельно внизу таблицы.Периодическая система химических элементов сыграла и продолжает играть огромную роль в развитии многих естественнонаучных дисциплин. Она стала важным звеном в эволюции атомно-молекулярного учения, способствовала формулировке современного понятия «химический элемент» и уточнению представлений о простых веществах и соединениях, оказала значительное влияние на разработку теории строения атомов и возникновение понятия изотопии. С периодической системой связана строго научная постановка проблемы прогнозирования в химии, что проявилось как в предсказании существования неизвестных элементов и их свойств, так и новых особенностей химического поведения уже открытых элементов. Периодическая система – важнейшая основа неорганической химии; она служит, например, задачам синтеза веществ с заранее заданными свойствами, созданию новых материалов, подбору специфических катализаторов для различных химических процессов. Периодическая система – научная база преподавания общей и неорганической химии, а также некоторых разделов атомной физики. По решению ООН 2019 год провозглашен Международным годом Периодической таблицы химических элементов.Материал подготовлен на основе информации РИА Новости и открытых источников
По решению ООН 2019 год провозглашен Международным годом Периодической таблицы химических элементов.Материал подготовлен на основе информации РИА Новости и открытых источников
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
2019
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://ria.ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
https://cdnn21.img.ria.ru/images/99408/72/994087230_112:0:1889:1333_1920x0_80_0_0_597a34ca28aa89475eedcbd63e1a68a3.jpgРИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.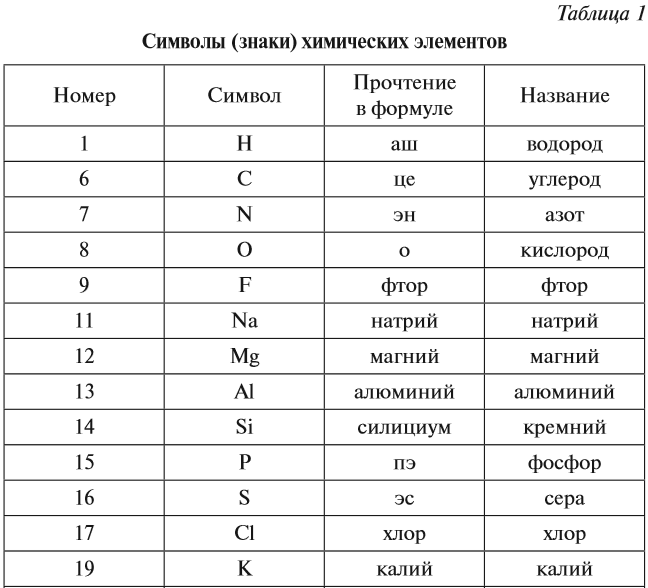 xn--p1ai/awards/
xn--p1ai/awards/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
справки
Периодическая система химических элементов – упорядоченное множество химических элементов и их естественная классификация.
Является табличным представлением периодического закона, открытого Дмитрием Менделеевым. Современная формулировка этого закона звучит так: свойства элементов находятся в периодической зависимости от заряда их атомных ядер.Прообразом Периодической системы химических элементов служит таблица «Опыт системы элементов, основанной на их атомном весе и химическом сходств», составленная Менделеевым в 1869 году. По мере совершенствования этой таблицы он развил представления о периодах и группах элементов и о месте каждого элемента в системе. В 1871 году в книге «Основы химии» Менделеевым была включена «Естественная система элементов Д. Менделеева» – первая классическая короткая форма Периодической системы химических элементов.
Современная Периодическая система химических элементов включает 118 элементов. За последние 50 лет таблица Менделеева пополнилась семнадцатью новыми элементами (102-118). Девять из них были впервые получены в российском Объединенном институте ядерных исследований в Дубне. Последнее добавление в таблицу Менделеева было сделано в 2016 году, она пополнилась четырьмя элементами с 113, 115, 117 и 118 атомными номерами, которые соответственно были названы нихоний (Nh), московий (Mc), теннессин (Ts) и оганесон (Og). Сейчас в крупнейших ядерно-физических центрах мира фактически начаты работы по синтезу 119-го, 120-го и 121-го элементов, которые назвали «большой гонкой».Опубликовано свыше 500 вариантов Периодической системы химических элементов, что связано с попытками поиска решения некоторых частных проблем ее структуры. Наиболее распространены две табличные формы: короткая и длинная (разрабатывалась Дмитрием Менделеевым, усовершенствована в 1905 году Альфредом Вернером).
Современная форма Периодической системы химических элементов (в 1989 году Международным союзом теоретической и прикладной химии рекомендована длинная форма таблицы) состоит из семи периодов (горизонтальных последовательностей элементов, расположенных по возрастанию порядкового номера) и 18 групп (вертикальных последовательностей элементов в соответствии с количеством валентных электронов), а короткая форма таблицы – из восьми групп.
Номер группы элементов короткого варианта таблицы Менделеева соответствует числу валентных электронов во внешней электронной оболочке атомов. В длинном варианте таблицы номер группы в большей мере формален. Группы короткого варианта включают главную (а) и побочную (б) подгруппы, в каждой из которых содержатся элементы, сходные по химическим свойствам. Элементы некоторых групп имеют собственные тривиальные названия: щелочные металлы (группа 1 длинной формы таблицы), щелочноземельные металлы (группа 2), халькогены (группа 16), галогены (группа 17), благородные газы (группа 18).
В Периодической системе химических элементов для каждого элемента указывается его символ, название, порядковый номер и значение относительной атомной массы.
Первый период содержит два элемента – водород и гелий.
Второй и третий периоды (литий – неон; натрий – аргон) содержат по восемь элементов.
Четвертый (калий – криптон) и пятый (рубидий – ксенон) периоды содержат по 18 элементов.
Шестой период (цезий – радон) содержит 32 элемента и включает особую группу элементов – лантаноиды.
Седьмой период (франций – оганесон), подобно шестому, содержит 32 элемента и включает особую группу элементов – актиноиды.
Лантаноиды и актиноиды помещены отдельно внизу таблицы.
Периодическая система химических элементов сыграла и продолжает играть огромную роль в развитии многих естественнонаучных дисциплин. Она стала важным звеном в эволюции атомно-молекулярного учения, способствовала формулировке современного понятия «химический элемент» и уточнению представлений о простых веществах и соединениях, оказала значительное влияние на разработку теории строения атомов и возникновение понятия изотопии. С периодической системой связана строго научная постановка проблемы прогнозирования в химии, что проявилось как в предсказании существования неизвестных элементов и их свойств, так и новых особенностей химического поведения уже открытых элементов. Периодическая система – важнейшая основа неорганической химии; она служит, например, задачам синтеза веществ с заранее заданными свойствами, созданию новых материалов, подбору специфических катализаторов для различных химических процессов.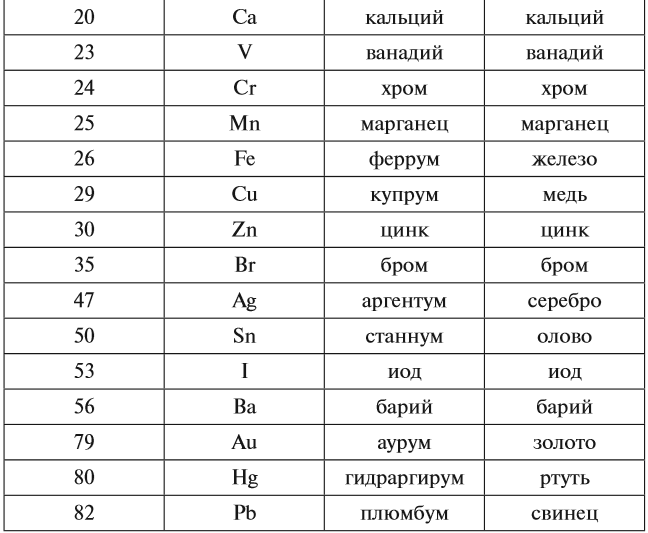 Периодическая система – научная база преподавания общей и неорганической химии, а также некоторых разделов атомной физики.По решению ООН 2019 год провозглашен Международным годом Периодической таблицы химических элементов.
Периодическая система – научная база преподавания общей и неорганической химии, а также некоторых разделов атомной физики.По решению ООН 2019 год провозглашен Международным годом Периодической таблицы химических элементов.Материал подготовлен на основе информации РИА Новости и открытых источников
«Знаки химических элементов. Периодическая система химических элементов Д.И. Менделеева». Вариант 2
САМОСТОЯТЕЛЬНАЯ РАБОТА ПО ХИМИИ
8 КЛАСС
ТЕМА: «ЗНАКИ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ.
ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ Д.И. МЕНДЕЛЕЕВА»
ВАРИАНТ 2
Самостоятельные работы предназначены для текущей проверки знаний учащихся по всем программным темам 8 класса. Самостоятельные работы включают в себя 2 — 3 задания, на выполнение которых отводится от 10 до 20 минут. По усмотрению учителя задания самостоятельных работ могут быть использованы для индивидуального опроса учащихся или в качестве практических заданий во время зачетов или переводных экзаменов.
1. Заполните таблицу:
| Название химического элемента | Химический символ |
Произношение химического символа |
| Кислород | ||
| Кремний | ||
| Алюминий | ||
| Сера | ||
| Цинк |
2. Установите соответствие. Ответом к заданию является набор из цифры и двух букв:
| Химический элемент |
Положение в Периодической системе |
Химический символ |
1. Фтор Фтор |
А) IV период, 6 группа, побочная подгруппа |
а) F |
| 2. Хром |
Б) II период, 7 группа, главная подгруппа |
б) Na |
| 3. Бор |
В) III период, 1 группа, главная подгруппа |
в) Cr |
| 4. Натрий |
Г) II период, 3 группа, главная подгруппа |
г) B |
3. Выпишите в два столбика символы элементов, расположенных:
а) в главных подгруппах
б) в побочных подгруппах
N, Ni, Ga, As, Mn, Ag
Химия / 8 класс / Самостоятельные работы / Знаки химических элементов. Периодическая система химических элементов Д. И. Менделеева
И. Менделеева
Преподавателю: Данная самостоятельная работа по химии проводится с учащимися 8 класса общеобразовательной школы. По структуре и сложности задания самостоятельной работы соответствуют обязательному минимуму содержания по химии в полной средней школе, а также соответствуют тематическому поурочному планированию к учебнику О.С. Габриеляна для 2-х часовой программы. Данная самостоятельная работа может быть использована для контроля знаний учащихся по химии учителями, работающими по любым другим учебникам.
Целью данной самостоятельной работы является контроль усвоения учащимися темы «Знаки химических элементов. Периодическая система химических элементов Д.И. Менделеева».
| < Предыдущая | Следующая > |
|---|
Урок 25. классификация химических элементов.понятие о группах сходных элементов.
 периодический закон и периодическая таблица д. и. менделеева — Химия — 8 класс
периодический закон и периодическая таблица д. и. менделеева — Химия — 8 классКлассификация химических элементов. Понятие о группах сходных элементов. Периодический закон и периодическая таблица Д. И. Менделеева
Для ориентировки в мире окружающих нас веществ необходима их классификация. Попытки ее создать предпринимались с давних пор. Металлы уже с давних времён выделяли в отдельную группу. Михаил Васильевич Ломоносов говорил про металлы так: «Металлы – суть светлые тела, которые ковать можно». В этих словах заключено общее свойство металлов – ковкость. Если посмотреть на внешний вид металла, то мы заметим ещё одно сходство – все металлы обладают металлическим блеском. И ещё все металлы хорошо проводят тепло и электрический ток. Существуют физические свойства – общие для всех металлов, которые позволили их объединить под этим названием. А у неметаллов общих физических свойств нет. Общим в простых веществах-неметаллах является только то, что для них не характерны свойства металлов.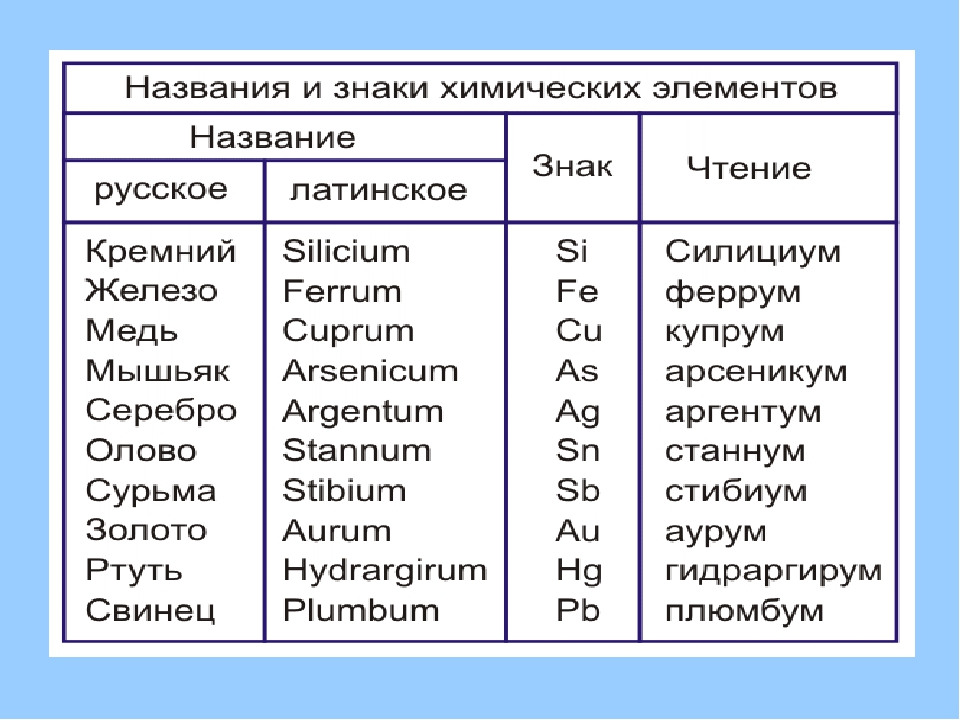 На металлы и неметаллы стали разделять и химические элементы. Такая классификация была слишком условной, учёные не оставляли попыток боле точно классифицировать химические элементы.
На металлы и неметаллы стали разделять и химические элементы. Такая классификация была слишком условной, учёные не оставляли попыток боле точно классифицировать химические элементы.
Дёберейнер Иоганн Вольфганг выявил сходство между химическими элементами, так называемое «Правило Триад»: элементы в триадах образуют сходные по составу со-единения и обладают сходными свойствами (например, общей формулой оксидов)
Li Na K;
Ca Sr Ba;
P As Sb;
S Se Te;
Cl Br I
В дальнейшем число элементов в триадах увеличилось до 4–5. Такие группы полу-чили своё название – естественные семейства химических элементов. К началу 60-х годов XIX века практически все известные химические элементы были объединены в естественные семейства.
Были предприняты и другие попытки создать единую систему химических элемен-тов. Александр Эмиль Бегье де Шанкуртуа Расположил химические элементы по спирали, пытаясь связать свойства с их атомной массой, Джон Александер Ньюлендс расположил элементы в таблицу по возрастанию их атомных масс и сформулировал закон Октав, Лотар-Юлиус Мейер рассмотрел общую систему химических элементов, расположив их по возрастанию атомных масс.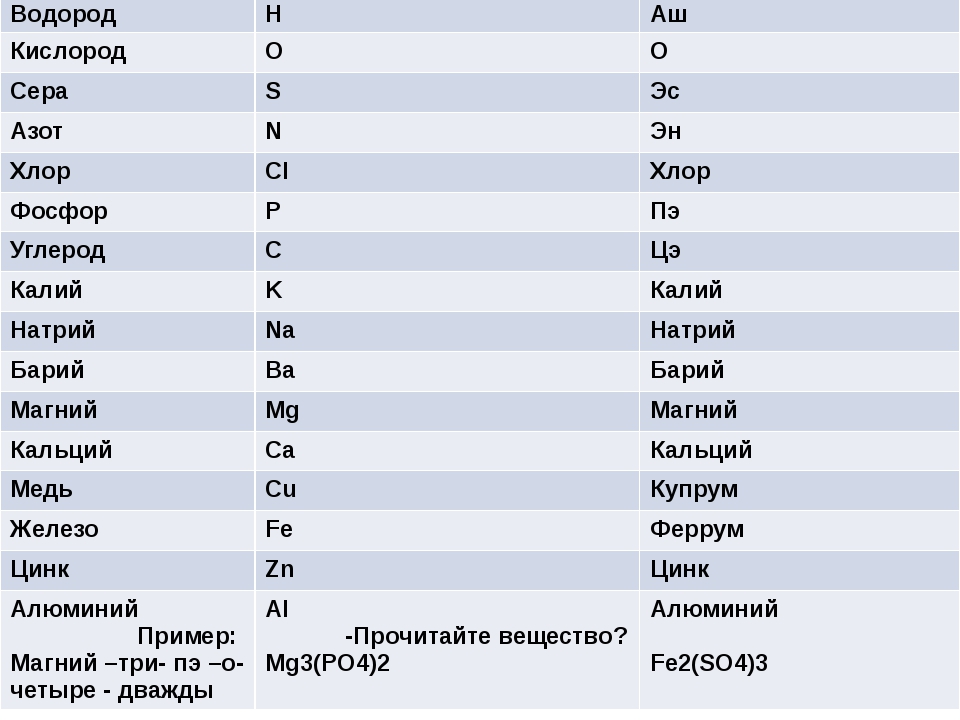
Все предложенные системы имели слишком много исключений из правил, в отли-чие от системы, созданной Дмитрием Ивановичем Менделеевым.
В основу системы были положены следующие подходы:
— расположение химических элементов в порядке возрастания их атомных масс;
учёт валентности и свойств образуемых ими соединений.
В таблице Менделеева были предусмотрены пробелы для ещё неоткрытых химиче-ских элементов. Открытие предсказанных химических элементов только подтвердило теорию Дмитрия Ивановича. С течением времени были изменены атомные массы некото-рых элементов, изменён порядок расположения элементов по сравнению с принципом возрастания атомной массы.
1869 год считается годом открытия периодического закона: «Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов».
Периодическую систему химических элементов можно представить в виде перио-дической таблицы. Каждый элемент занимает определённое место (клетку) и имеет свой порядковый (атомный) номер. Расположив химические элементы по возрастанию их атомных масс, Менделеев разделил эту последовательность на ряды (периоды), которые начинались щелочным металлом, а заканчивались инертным газом.
Расположив химические элементы по возрастанию их атомных масс, Менделеев разделил эту последовательность на ряды (периоды), которые начинались щелочным металлом, а заканчивались инертным газом.
Например, элементы третьего периода – 11Na 12Mg 13Al 14N 15P 16S 17Cl
В периодах постепенно увеличивается высшая валентность химических элементов, свойства металлов сменяются неметаллическими свойствами.
Вертикальные ряды химических элементов тоже получили своё название – группы.
Малые периоды состоят только из элементов главных подгрупп, символы химических элементов побочных подгрупп находятся сбоку от символов главных. Элементы одной подгруппы обладают сходными свойствами:
1. Одинаковое значение высшей валентности
2. Одинаковые общие формулы высших оксидов, летучих водородных соеди-нений, гидроксидов.
3. Сходство в свойствах простых веществ и соединениях химических элемен-тов.
Урок №8. Знаки химических элементов. Относительная атомная масса
Химический язык и его части
Человечество использует много разных языков. Кроме естественных
языков (японского, английского, русского – всего более 2,5 тысяч),
существуют еще и искусственные языки, например, эсперанто. Среди
искусственных языков выделяются языки различных наук. Так, в
химии используется свой, химический язык.
Кроме естественных
языков (японского, английского, русского – всего более 2,5 тысяч),
существуют еще и искусственные языки, например, эсперанто. Среди
искусственных языков выделяются языки различных наук. Так, в
химии используется свой, химический язык.
Химический язык – система условных обозначений и понятий, предназначенная для краткой, ёмкой и наглядной записи и передачи химической информации. Сообщение, написанное на большинстве естественных языков, делится на предложения, предложения – на слова, а слова – на буквы. Если предложения, слова и буквы мы назовем частями языка, то тогда мы сможем выделить аналогичные части и в химическом языке (таблица 1).
Таблица 1.Части химического языка
Информация об атомах и химических элементах | Информация о химических веществах | Информация о химических реакциях («предложения» химического языка) |
СИМВОЛЫ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ | ХИМИЧЕСКИЕ ФОРМУЛЫ | СХЕМЫ И УРАВНЕНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ |
Любым языком овладеть сразу невозможно, это относится
и к химическому языку. Поэтому пока вы познакомитесь только с основами этого
языка: выучите некоторые » буквы» , научитесь понимать смысл »
слов» и» предложений» . Вы познакомитесь с названиями химических
веществ – неотъемлемой частью химического языка. По мере изучения химии ваше
знание химического языка будет расширяться и углубляться.
Поэтому пока вы познакомитесь только с основами этого
языка: выучите некоторые » буквы» , научитесь понимать смысл »
слов» и» предложений» . Вы познакомитесь с названиями химических
веществ – неотъемлемой частью химического языка. По мере изучения химии ваше
знание химического языка будет расширяться и углубляться.
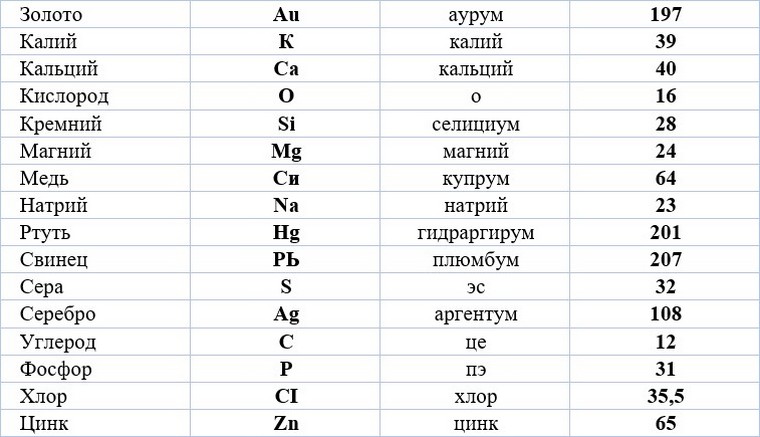
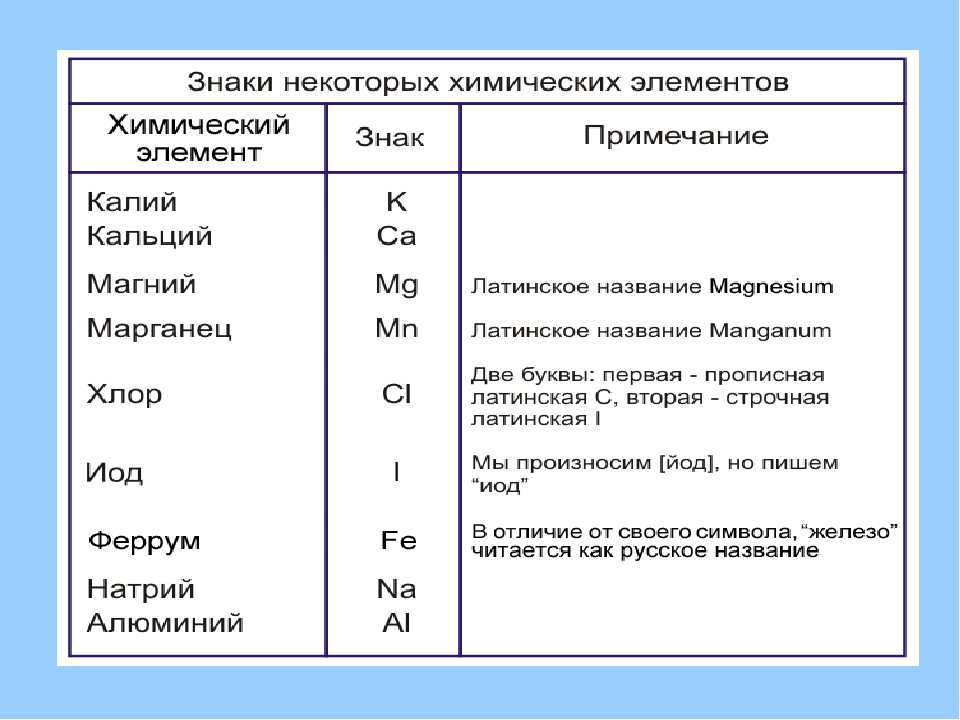
Химические знаки (символы химические) — буквенные обозначения химических элементов. Состоят из первой или из первой и одной из следующих букв латинского названия элемента, напр., углерод — С (Carboeum), кальций — Ca (Calcium), кадмий — Cd…
Символ химического элемента – условное обозначение химического элемента.
Историческая справка
Этимология названий химических элементов: астрономические названия
Этимология названий химических элементов: географические названия
Этимология названий химических элементов: имена ученых
Этимология названий химических элементов: названия, заимствованные из мифологии
Ниже приведена таблица химических знаков
некоторых элементов, их названия , относительные массы и произношение.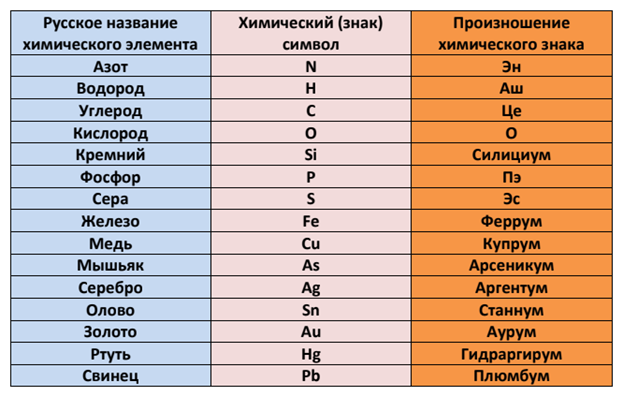
ОТНОСИТЕЛЬНАЯ АТОМНАЯ МАССА
Историческая справка
Атомы настолько малы, что их массу трудно выражать в привычных единицах — граммах или килограммах. Даже самые тяжелые атомы весят ничтожно мало — около 0,000 000 000 000 000 000 000 1 г.
Гораздо удобнее сравнивать массу данного атома с какой-то другой малой массой, принятой за единицу. В качестве такой единицы измерения ученые договорились использовать 1/12 часть массы атома углерода. Эту единицу называют атомной единицей массы (а.е.м.) Массы атома, выраженная через эту величину, получила название относительной атомной массы.
Например, масса атома урана – самого тяжелого из
существующих на Земле элементов – составляет всего 3,952·10–22 г.
Поэтому массу атомов выражают в относительных единицах, показывающих, во
сколько раз масса атомов данного элемента больше массы атомов другого элемента,
принятого в качестве стандарта. Фактически это и есть «соотношение весов» по
Дальтону, т. е. относительная атомная масса.
е. относительная атомная масса.
· Массы атомов очень малы.
Абсолютные массы некоторых атомов:
m(C) =1,99268 ∙ 10-23 г
m(H) =1,67375 ∙ 10-24 г
m(O) =2,656812 ∙ 10-23 г
В настоящее время в физике и химии принята единая система измерения.
Введена атомная единица массы (а.е.м.)
m(а.е.м.) = 1/12 m(12C) = 1,66057 ∙ 10—24 г
Ar(H) = m(атома) / m (а.е.м.) = 1,67375 ∙ 10-24 г/1,66057 ∙ 10-24 г = 1,0079 а.е.м.
Ar – показывает, во сколько раз данный атом тяжелее 1/12 части атома 12С, это безразмерная величина.
Относительная
атомная масса — это 1/12 массы атома углерода, масса которого равна 12 а. е.м.
е.м.
Относительная атомная масса безразмерная величина
Например,
относительная атомная масса атома кислорода равна 15,994 (используем значение
из периодической системы химических
элементов Д. И. Менделеева).
Записать это следует так, Ar(O) = 16. Всегда используем округлённое
значение, исключение представляет относительная атомная масса атома хлора:
Ar(Cl) = 35,5.
Связь между абсолютной и относительной массами атома представлена формулой:
m(атома) = Ar ∙ 1,66 ∙ 10 -27 кг |
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ ТЕМЫ
№1.
Учим названия и произношение:
Знаки и произношение химических элементов
№2.
Используя ПСХЭ составьте пары из знаков химических элементов и соответствующих русских названий:
- N, F, P, Ag, S, Ba, Cr
- Cеребро, сера, азот, хром, фосфор, фтор, барий
№4.
Дайте характеристику химическому элементу – Si по его положению в ПСХЭ согласно плану:
Символы химических элементов и принципы их обозначения. Язык химии. Знаки химических элементов Названия химические символы и относительные атомные массы
Часть I
1. По горизонтали таблица Д. И. Менделеева делится на периоды, которые подразделяются на:
а) малые, это периоды – 1, 2, 3;
б) большие, это периоды – 4, 5, 6, 7.
2. По вертикали таблица Д. И. Менделеева делится на группы, каждая из которых подразделяется на:
а) главную, или А группу;
б) побочную, или В группу.
IА группа – это группа щелочных металлов.
IIА группа – это группа щелочноземельных металлов.
VIIА группа – это группа галогенов.
VIIIА группа – это группа благородных, или инертных газов.
4. Аналогии языка химии с русским языком.
5. Дополните таблицу «Названия и знаки химических элементов».
6. Примеры названий химических элементов (в скобках укажите химический знак) в соответствии с этимологическими источниками.
1) Свойства простых веществ
Водород (Н), кислород (О), фтор (F)
2) Астрономия
Селен (Se), теллур (Te), уран (U)
3) География
Германий (Ge), галлий (Ga), полоний (Po)
4) Древнегреческие мифы
Тантал (Та), прометий (Pm), лютеций (Lu)
5) Великие учёные
Менделевий (Md), резерфордий (Rt), эйнштейний (Es)
Часть II
1. Установите соответствие между положением химического элемента в Периодической системе Д. И. Менделеева и химическим знаком.
А — 5; Б — 1; В – 2; Г – 4
2. Выберите символы или названия химических элементов одного большого периода. Из букв, соответствующих правильным ответам, вы составите название металла, который используется для изготовления бенгальских огней: магний.
1) калий М
2) Br А
5) марганец Г
6) Cu Н
8) Ca И
9)Zn Й
3. Впишите в соответствующие столбцы названия следующих химических элементов:
Впишите в соответствующие столбцы названия следующих химических элементов:
Cl, He, Br, Ne, Li, I, K, Ba, Ca, Na, Xe, Sr.
4. Заполните пропуски в логической схеме.
Химический элемент (Н, О) → химическая реакция (Н₂О) → химическое получение (2 Н₂О = 2 Н₂ + О₂).
5. Сделайте обобщение:
химические элементы – углерод, кремний, олово, свинец – относятся к IVА группе.
6. В левую колонку таблицы запишите, по какому признаку химические элементы разделены на две группы.
7. Установите соответствие между произношением и химическим знаком (символом).
А – 3; Б – 6; В – 2; Г – 7; Д – 5; Е – 1.
8. Вычеркните «лишнее»:
Кюрий, менделевий, бром , эйнштейний.
9. Общий этимологический источник названий химических элементов:
U, Te, Se – это планетарий.
10. В честь различных государств или частей света названы элементы:
Германий, галлий, франций, дубний.
Муниципальное казенное общеобразовательное учреждение
«Попово-Лежачанская средняя общеобразовательная школа»
Районный семинар учителей химии
Глушковского района Курской области
Открытый урок по химии в 8 классе на тему: «Знаки химических элементов»
Подготовила:
Кондратенко Ольга Васильевна,
учитель химии и биологии
МКОУ «Попово-Лежачанская» СОШ
Глушковского района Курской области
с.Попово-Лежачи
Химия, 8 класс
Дата: 29.09.2015
Урок №12
Тема: Знаки химических элементов
Цель: закрепить знания и умения у обучающихся по темам «Методы познания в химии», «Чистые вещества и смеси», «Химические элементы», «Относительная атомная масса химических элементов».
Задачи урока:
Образовательн ые :
- проверить знания и умения у обучающихся по темам «Методы познания в химии», «Чистые вещества и смеси», «Химические элементы», «Относительная атомная масса химических элементов» пользуясь интерактивными средствами обучения;
- обобщить знания учащихся по изученным темам;
- выявить пробелы в усвоении учебного материала.
Развивающие:
- развивать химический язык, логическое мышление, внимание, память, интерес к современной химической науке, любознательность учащихся, умение делать выводы и обобщения;
- формировать навык работы с различными источниками информации с целью поиска и отбора необходимого материала.
Воспитательные:
- формировать положительную мотивацию учебной деятельности, научное мировозрение;
- развивать культуру умственного труда; навыки делового сотрудничества в процессе решения проблемы, работы в группах;
- воспитывать умение работать в коллективе, вежливость, дисциплинированность, аккуратность, трудолюбие;
- развивать умения формулировать и аргументировать собственное мнение, самостоятельность.
Планируемые результаты:
личностные: готовность и способность учащихся к саморазвитию, самоопределению; ответственное отношение к учению; способность ставить цели и строить жизненные планы; формирование коммуникативной культуры, ценности здорового и безопасного образа жизни;
метапредметные: уметь ставить цель и планировать пути её достижения, выбирая более рациональные способы решения данной проблемы; учиться корректировать свои действия в связи с изменением создавшейся ситуации; уметь создавать, применять и преобразовывать знаки и символы, модели и схемы для решения учебных и познавательных задач; уметь осознанно использовать речевые средства в соответствии с задачей коммуникации для выражения своих мыслей и потребностей; уметь организовывать совместную работу со сверстниками в группе; уметь находить информацию в различных источниках; владеть навыками самоконтроля, самооценки;
предметные:
знать : основные химические понятия «химический элемент», «простое вещество», «сложное вещество», знаки основных химических элементов; состав простых и сложных веществ; роль химии в жизни человека и в решении экологических проблем;
уметь: по формуле отличать простое вещество от сложного; химический элемент отличать от простого вещества; анализировать и объективно оценивать навыки безопасного обращения с веществами; устанавливать связи между реально наблюдаемыми химическими явлениями и процессами, происходящими в микромире; использовать различные методы изучения веществ.
Тип урока: контроль знаний.
Формы работы : групповая, работа в парах, игровая.
Методы обучения: проблемное изложение, частично-поисковый.
Приемы обучения : постановка проблемных вопросов.
Средства обучения: компьютер, проектор, презентация Power Point
Оборудование для учителя и учащихся: компьютер, проектор, таблица «Периодическая таблица химических элементов», лабораторный штатив, кольцо, фарфоровая чашка, спиртовка, фильтровальная бумага, ножницы, химические стаканы, стеклянная палочка, загрязненная смесь соли, вода.
Литература:
Для учителя:
- Горковенко М. Ю. Поурочные разработки по химии 8 класс к учебникам О. С. Габриеляна, Л. С. Гузея, Г. Е. Рудзитиса. — М: «ВАКО», 2004;
- Радецкий А. М., Горшкова В. П. Дидактический материал: химия 8-9 классы — М: Просвещение, 1997.
Для ученика:
Химия: неорганическая химия: учебник для 8 класса общеобразовательных учреждений/ Г. Е. Рудзитис, Ф. Г. Фельдман. — М: «Просвещение», 2014 г.
Е. Рудзитис, Ф. Г. Фельдман. — М: «Просвещение», 2014 г.
Ход урока:
I. Организационный момент (1 мин)
Учитель: Добрый день! Прошу всех садиться. Я поздравляю вас еще с одним чудесным днем. И мы с вами продолжаем творить волшебство на уроках химии.
II. Мотивация учебной деятельности (1 мин)
Учитель: Сегодня у нас необычный урок. Он будет проходить в форме игры. Оценка вашей работы в конце урока будет тем выше, чем больше баллов вы наберете. Количество заданий и их тип подобраны таким образом, что за выполнение работы вы сможете заработать более 40 баллов. Оценку вы получите согласно схемам пересчета, находящимся у вас на партах.
БЛАНК ОТВЕТОВ | |
ЗАДАНИЯ | Количество набранных баллов |
1. «Внимание, вопрос!» (7 баллов) | |
2. | |
3. «Крестики-нолики». (3 балла) | |
4. «Юные химики и химички». (15 баллов) | |
5. «Раздели меня». (4 балла) | |
6. «Ассоциации». (9 баллов) | |
7. «Я на выдумки мастак». (7 баллов) | |
8. «Парад химических элементов». (3 балла) | |
9. «Логические круги». (6 баллов) | |
10. «Пирамида». (3 балла) | |
11. Конкурс «Термины». (12 мин) | |
12. Конкурс «Последний шанс» (10 мин) | |
III. Контроль и коррекция знаний
1. Внимание, вопрос! (10 мин)
Учитель: Расскажите об этимологии названий химических элементов.
Ученик: Названия элементов имеют различную этимологию. Они происходят из:
названий стран и континентов — например, название рутений произошло от латинского названия России, а названия европий и америций — от названий континентов: Европа и Америка;
фамилий выдающихся химиков — например: менделевий, нобелий, резерфордий;
названий планет — например: уран, нептуний, плутоний;
названий рек — например, рений.
Все известные элементы имеют символы. Символьное обозначение элементов было предложено в 1814 году Й. Я. Берцелиусом. Раньше тоже использовались различные сокращенные обозначения элементов и соединений. Одним из таких видов обозначений были графические символы.
Учитель: Что мы знаем из истории развития языка химии?
Ученик: Еще в Средневековье, во времена алхимии использовались различные знаки для обозначения веществ, в основном металлов. Ведь основной целью алхимиков было получение из различных металлов золота. Поэтому каждый из них использовал свою систему обозначений.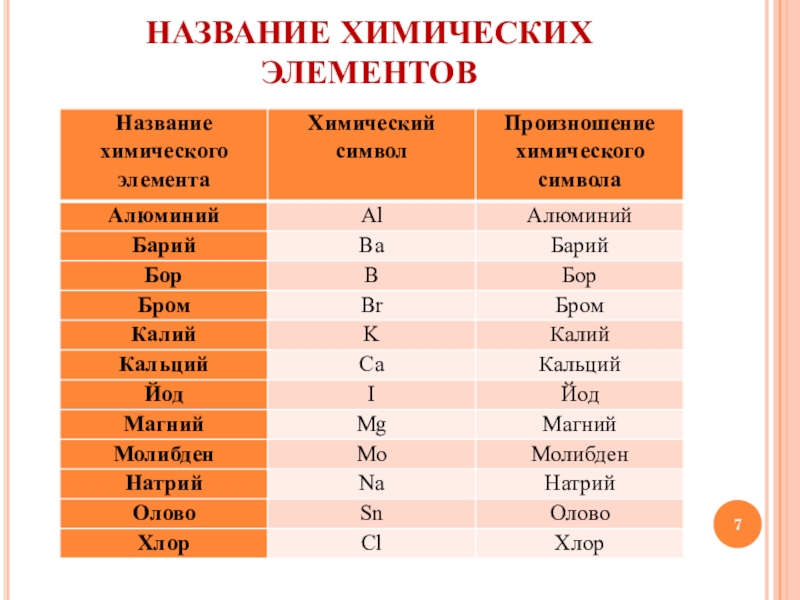 В 19 в. появилась необходимость использования понятной для всех ученых символики. И одним из первых такую символику предложил Джон Дальтон. Но его обозначениями было неудобно пользоваться.
В 19 в. появилась необходимость использования понятной для всех ученых символики. И одним из первых такую символику предложил Джон Дальтон. Но его обозначениями было неудобно пользоваться.
Учитель: Расскажите об системе обозначения химических элементов Й.Я. Берцелиуса
Ученик: Современную систему химических знаков предложил в начале XIX в. шведский химик Йёнс Якоб Берцелиус. Ученый предложил обозначать химические элементы первой буквой их латинского названия. В те времена все научные статьи печатала на латинском языке, он был общепринятым и понятным для всех ученых. Например, химический элемент кислород (по-латински Oxygenium) получил обозначение О. А химический элемент водород (Hydrogenium) — Н. Если названия нескольких элементов начинались на одну и ту же букву, то в символе элемента указывали вторую или одну из последующих букв названия. Например, ртуть (Hydrargyrum) обозначается Hg. Обратите внимание, что первая буква знака химического элемента всегда заглавная, если есть вторая буква — то она строчная. Необходимо запоминать не только названия элементов и их символы, но и произношение, т.е. как эти символы читаются. Определенных правил произношения знаков химических элементов нет. Их надо учить наизусть. Знаки некоторых химических элементов произносятся так же, как и соответствующая буква: кислород — «о», сера — «эс», фосфор — «пэ», азот — «эн», углерод — «цэ». Знаки других элементов произносятся так же, как и называются сами элементы: «натрий», «калий», «хлор», «фтор». Произношение некоторых знаков соответствует их латинскому названию: кремний — «силициум», ртуть — «гидраргирум», медь — «купрум», железо — «феррум».
Необходимо запоминать не только названия элементов и их символы, но и произношение, т.е. как эти символы читаются. Определенных правил произношения знаков химических элементов нет. Их надо учить наизусть. Знаки некоторых химических элементов произносятся так же, как и соответствующая буква: кислород — «о», сера — «эс», фосфор — «пэ», азот — «эн», углерод — «цэ». Знаки других элементов произносятся так же, как и называются сами элементы: «натрий», «калий», «хлор», «фтор». Произношение некоторых знаков соответствует их латинскому названию: кремний — «силициум», ртуть — «гидраргирум», медь — «купрум», железо — «феррум».
Учитель: Какое значение знаков химических элементов?
Ученик: Знак химического элемента имеет несколько значений. Во-первых, им обозначают все атомы данного элемента. Во-вторых, знаком химического элемента можно обозначить один или несколько атомов данного элемента. Например, запись O может означать: «химический элемент кислород» или «один атом кислорода».
Чтобы обозначить несколько атомов данного химического элемента, нужно перед его знаком поставить число, соответствующее количеству атомов. Например, запись 3N означает «три атома азота». Цифра, стоящая перед знаком химического элемента, называется коэффициентом.
Ученик: Попытки упорядочить старинные химические знаки продолжались до конца XVIII века. В начале XIX века английский химик Дж. Дальтон предложил обозначать атомы химических элементов кружками, внутри которых помещались точки, чёрточки, начальные буквы английских названий металлов и др. Химические знаки Дальтона получили некоторое распространение в Великобритании и в Западной Европе, но вскоре были вытеснены чисто буквенными знаками, которые шведский химик Й. Я. Берцелиус предложил в 1814. Высказанные им принципы составления химических знаков сохранили свою силу до настоящего времени. В России первое печатное сообщение о химических знаках Берцелиуса сделал в 1824 московский врач И. Я. Зацепин.
Учитель: Каковы принципы обозначения?
Ученик: Современные символы химических элементов состоят из первой буквы или из первой и одной из следующих букв латинского названия элементов. При этом только первая буква — заглавная. Например, H — водород (лат. Hydrogenium), N — азот (лат. Nitrogenium), Ca — кальций (лат. Calcium), Pt — платина (лат. Platinum) и т. п. Для новооткрытых трансурановых элементов, которые пока не получили утверждённого ИЮПАК названия, используют трехбуквенные обозначения, означающие числительное — порядковый номер. Например, Uut — унунтрий (лат. Ununtrium, 113), Uuh — унунгексий (лат. Ununhexium, 116). Изотопы водорода имеют особые символы и названия: H — протий 1H, D — дейтерий 2H, T — тритий 3H. Для обозначения изобаров и изотопов перед символом химического элемента вверху ставится массовое число (напр., 14N), а слева внизу — порядковый номер элемента (атомный номер) (напр., 64Gd). В том случае, когда в химических формулах и химических уравнениях не указаны массовое число и порядковый номер, каждый химический знак выражает среднюю относительную атомную массу его изотопов в земной коре. Для обозначения заряженного атома вверху справа указывается заряд иона (напр.
При этом только первая буква — заглавная. Например, H — водород (лат. Hydrogenium), N — азот (лат. Nitrogenium), Ca — кальций (лат. Calcium), Pt — платина (лат. Platinum) и т. п. Для новооткрытых трансурановых элементов, которые пока не получили утверждённого ИЮПАК названия, используют трехбуквенные обозначения, означающие числительное — порядковый номер. Например, Uut — унунтрий (лат. Ununtrium, 113), Uuh — унунгексий (лат. Ununhexium, 116). Изотопы водорода имеют особые символы и названия: H — протий 1H, D — дейтерий 2H, T — тритий 3H. Для обозначения изобаров и изотопов перед символом химического элемента вверху ставится массовое число (напр., 14N), а слева внизу — порядковый номер элемента (атомный номер) (напр., 64Gd). В том случае, когда в химических формулах и химических уравнениях не указаны массовое число и порядковый номер, каждый химический знак выражает среднюю относительную атомную массу его изотопов в земной коре. Для обозначения заряженного атома вверху справа указывается заряд иона (напр. , Ca2+). Внизу справа указывают число атомов данного элемента в реальной или условной молекуле (напр., N2 или Fe2O3). Свободные радикалы обозначаются точкой справа (напр., Cl·).
, Ca2+). Внизу справа указывают число атомов данного элемента в реальной или условной молекуле (напр., N2 или Fe2O3). Свободные радикалы обозначаются точкой справа (напр., Cl·).
Ученик: Химики древнего мира и средних веков применяли для обозначения веществ, химических операций и приборов символические изображения, буквенные сокращения, а также сочетания тех и других. Семь металлов древности изображали астрономическими знаками семи небесных светил: Солнца (, золото), Луны (☽ , серебро), Юпитера (♃ , олово),Венеры (♀, медь), Сатурна (♄ , свинец), Меркурия (☿ , ртуть),Марса (♁ , железо). Металлы, открытые в XV—XVIII веках, — висмут, цинк, кобальт — обозначали первыми буквами их названий. Знак винного спирта (лат. spiritus vini) составлен из букв S и V. Знаки крепкой водки (лат. aqua fortis, азотная кислота) и золотой водки (лат. aqua regis, царская водка, смесь соляной и азотной кислот) составлены из знака воды Ñ и прописных букв F и R соответственно. Знак стекла (лат. vitrum) образован из двух букв V —прямой и перевёрнутой.
Учитель: Расскажите про международные и национальные символы.
Ученик: Приведённые в Периодической таблице элементов символы являются международными, но наряду с ними в некоторых странах употребительны обозначения, произведённые от национальных названий элементов. Например, во Франции вместо символов азота N, бериллия Be и вольфрама W могут использоваться Az (Azote), Gl (Glucinium) и Tu (Tungstène). В США вместо знака ниобия Nb нередко применяют Cb (Columbium). В Китае используется свой вариант химических знаков, основанный на китайских символах. Большинство символов были изобретены в XIX — XX веках. Символы для металлов (кроме ртути) используют радикал или («золото», металл вообще), для твёрдых при нормальных условиях неметаллов — радикал («камень»), для жидкостей — («вода»), для газов — («пар»). Например, символ молибдена состоит из радикала и фонетика, задающего произношение mu4.
Физкультминутка (1 мин)
2. Игра «Цветик-семицветик» (7 баллов) (2 мин.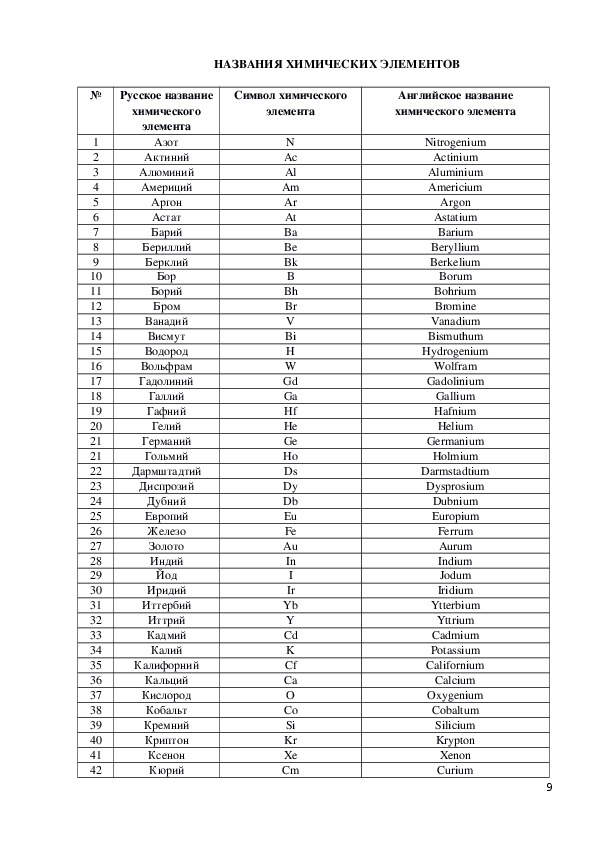 )
)
Вписать в каждый лепесток цветика-семицветика физические тела или вещества (по вариантам), которые нужно выбрать из определенного перечня.
Гвоздь, цинк, ваза, молоток, железо, поваренная соль, ложка, магний, золото, вода, льдина, яблоко, карандаш, стекло.
Физические тела Вещества
Ответы:
Тела: гвоздь, ваза, молоток, ложка, льдина, яблоко, карандаш.
Вещества: цинк, железо, поваренная соль, магний, золото, вода, стекло.
3. Игра «Крестики-нолики» (3 балла) (1 мин)
Найдите выигрышный путь в таблицах:
I вариант — однородные смеси;
II вариант — неоднородные смеси.
Ответ:
Верхняя строчка — однородные смеси;
Нижняя строчка — неоднородные смеси.
4. Конкурс «Юные химики» (15 баллов, по 1 баллу за каждое правильный ответ) (2мин)
Какая из команд больше назовет правил техники безопасности в кабинете химии.
5. Конкурс «Раздели меня» (4 балла), по 1 баллу за правильный ответ) (3 мин)
Установите соответствие между смесью и методом, которым ее можно разделить на чистые вещества.
Ответ:
I вариант
II вариант
6. Конкурс «Ассоциации». (9 баллов) (2 мин)
Участникам необходимо назвать лабораторное оборудование, которое по функции, внешнему виду или названию ассоциируется с изображенным на рисунке объектом;
7. Конкурс «Я на выдумки мастак» (7 баллов, по 1 баллу за элемент). (1 мин)
Назовите как можно больше химических элементов, используя буквы термина «Вольфрам».
Ответ: ванадий, осмий, литий, франций, родий, алюминий, магний.
8. Конкурс «Парад химических элементов» (3 балла). (1 мин)
Заполни таблицу.
Ответ:
10 . Конкурс «Пирамида» (3 балла) (2 мин)
Составьте пирамиду химических элементов по их атомным массам.
Ответ:
11. Конкурс «Термины». (12 баллов, по 1 баллу за правильный ответ) (2 мин)
Учитель диктует названия химических элементов, учащиеся записывают их символами на доске.
Ответ:
N, Na, Ba, Ca, H, O, C, Al, Mg, K, Cl, F.
12. Конкурс «Последний шанс» (10 баллов, по 1 баллу правильный ответ) (2 мин)
Команды по очереди, не повторяясь, отвечают на вопросы. Выигрывает та из них, которая последней даст ответ. Переведите с химического языка на общепринятый следующие выражения:
Не все то аурум, что блестит. (Не все то золото, что блестит).
Белый, как карбонат кальция. (Белый как мел).
Феррумный характер. (Железный характер).
Слово — аргентум, а молчание — аурум. (Слово — серебро, а молчание — золото) .
Много аш два о утекло. (Много воды утекло) .
Какой элемент всегда рад. (Радон).
Какой газ утверждает, что он не он? (Неон).
Какой элемент «вращается» вокруг Солнца? (Уран).
Какой элемент является настоящим «гигантом» (Титан).
Какой элемент назван в честь России? (Рутений).
IV. П одведение итогов. (1 мин.)
П одведение итогов. (1 мин.)
Учитель: Мы с вами все это время на протяжении двенадцати уроков старались открыть символическую дверь и войти в интересную страну, которая называется химией. Мы смогли ее немножечко приоткрыть и поглядеть, что за ней. Там интересно, там много неизвестного, которое влечет нас. Сейчас мы решим, готовы ли вы к серьезным испытаниям, которые ждут нас. Выясним, достаточно ли у вас для этого знаний, хорошо ли вы усвоили данные темы. Да не просто усвоили, а кто из вас сделал лучше.
(Объявление оценок по баллам)
V. Домашнее задание (1 мин)
§12, №1-4 с.44. Творческое задание: составить химический кроссворд.
VI. Рефлексия (1 мин)
Сегодня я узнал…
было трудно…
я понял, что…
я научился…
было интересно узнать, что…
меня удивило…
Занятие 4. Химические элементы. Знаки химических элементов. Относительная атомная масса.
Химический элемент
— совокупность атомов одного вида.
Почему одинаковые атомы были названы именно так? Слово «элемент» (лат. elementum) использовалось еще в античности (Цицероном, Овидием, Горацием) как часть чего-то (элемент речи, элемент образования и т. п.). В древности было распространено изречение «Как слова состоят из букв, так и тела — из элементов». Отсюда вероятное происхождение этого слова: по названию ряда согласных букв в латинском алфавите: l, m, n, t («el» — «em» — «en» — «tum»).
ХИМИЧЕСКИЙ ЯЗЫК
Человечество использует много разных языков.
Кроме естественных языков (японского, английского, русского – всего более 2,5
тысяч), существуют еще и искусственные языки, например, эсперанто. Среди
искусственных языков выделяются языки различных наук. Так, в химии используется
свой, химический язык. Химический язык – система условных обозначений и
понятий, предназначенная для краткой, ёмкой и наглядной записи и передачи
химической информации. Сообщение, написанное на большинстве естественных
языков, делится на предложения, предложения – на слова, а слова – на
буквы.
Мы с вами будем говорить особым, химическим языком. В нем, как и в нашем родном, русском, мы выучим вначале буквы — химические символы, затем научимся писать на их основе слова — формулы и далее, с помощью последних, — предложения — уравнения химических реакций:
Болгарские просветители Кирилл и Мефодий являются авторами славянской письменности-алфавита. А вот отцом химической письменности является шведский ученый Й. Я. Берцелиус, который предложил в качестве букв — символов химических элементов использовать начальные буквы их латинских названий, или, если с этой буквы начинаются названия нескольких элементов, то — добавлять к начальной букве еще одну из последующих букв названия.
Химические знаки (символы химические) — буквенные обозначения химических элементов. Состоят из первой или из первой и одной из следующих букв латинского названия элемента,напр., углерод — С (Carboeum), кальций — Ca (Calcium), кадмий — Cd…
Символ химического элемента
– это условное
обозначение химического элемента.
Историческая справка: Химики древнего мира и средних веков применяли для обозначения веществ, химических операций и приборов символические изображения, буквенные сокращения, а также сочетания тех и других. Семь металлов древности изображали астрономическими знаками семи небесных светил: Солнца ( ☉ , золото), Луны (☽ , серебро), Юпитера (♃ , олово),Венеры (♀, медь), Сатурна (♄ , свинец), Меркурия (☿ , ртуть),Марса (♁ , железо).
Металлы, открытые в XV—XVIII веках, — висмут, цинк,кобальт — обозначали первыми буквами их названий. Знак винного спирта (лат. spiritus vini) составлен из букв S и V. Знаки крепкой водки (лат. aqua fortis, азотная кислота) и золотой водки (лат. aqua regis, царская водка, смесь соляной и азотной кислот) составлены из знака водыÑ и прописных букв F и R соответственно. Знак стекла (лат. vitrum) образован из двух букв V —прямой и перевёрнутой.
Попытки упорядочить старинные химические знаки продолжались до конца
XVIIIвека. В начале XIX века английский химик Дж. Дальтон предложил обозначать
атомы химических элементов кружками, внутри которых помещались точки, чёрточки,
начальные буквы английских названий металлов и др.
В начале XIX века английский химик Дж. Дальтон предложил обозначать
атомы химических элементов кружками, внутри которых помещались точки, чёрточки,
начальные буквы английских названий металлов и др.
Химические знаки
Дальтона получили некоторое распространение в Великобритании и в Западной
Европе, но вскоре были вытеснены чисто буквенными знаками, которые шведский
химик Й. Я. Берцелиус предложил в 1814. Высказанные им принципы составления
химических знаков сохранили свою силу до настоящего времени. В России первое
печатное сообщение о химических знаках Берцелиуса сделал в 1824московский врач
И. Я. Зацепин.
ОТНОСИТЕЛЬНАЯ АТОМНАЯ МАССА
Историческая справка: Английский ученый Джон Дальтон (1766–1844) на своих лекциях демонстрировал студентам выточенные из дерева модели атомов, показывая, как они могут соединяться, образуя различные вещества. Когда одного из студентов спросили, что такое атомы, он ответил: «Атомы – это раскрашенные в разные цвета деревянные кубики, которые изобрел мистер Дальтон».
Конечно, Дальтон прославился не своими «кубиками» и даже не тем, что в двенадцатилетнем возрасте стал школьным учителем. С именем Дальтона связано возникновение современной атомистической теории. Впервые в истории науки он задумался о возможности измерения масс атомов и предложил для этого конкретные способы. Понятно, что непосредственно взвесить атомы невозможно. Дальтон рассуждал только о «соотношении весов мельчайших частиц газообразных и других тел», то есть об относительных их массах. И поныне, хотя масса любого атома в точности известна, ее никогда не выражают в граммах, так как это исключительно неудобно. Например, масса атома урана – самого тяжелого из существующих на Земле элементов – составляет всего 3,952·10
–22 г. Поэтому массу атомов выражают в относительных единицах, показывающих, во сколько раз масса атомов данного элемента больше массы атомов другого элемента, принятого в качестве стандарта. Фактически это и есть «соотношение весов» по Дальтону, т.е. относительная атомная масса. Массы атомов очень малы.
Массы атомов очень малы.
Абсолютные массы некоторых атомов:
m(C) =1,99268 ∙ 10 -23 г
m(H) =1,67375 ∙ 10 -24 г
m(O) =2,656812 ∙ 10 -23 г
В настоящее время в физике и химии принята единая система измерения. Введена атомная единица массы (а.е.м.)
m(а.е.м.) = 1/12 m(12C) = 1,66057 ∙ 10 -24 г.
Ar(H) = m(атома)/ m (а.е.м.) = 1,67375 ∙ 10 -24 г/1,66057 ∙ 10 -24 г = 1,0079 а.е.м.
Ar – показывает, во сколько раз данный атом тяжелее 1/12 части атома 12С, это безразмерная величина.
Относительная атомная масса — это 1/12 массы атома углерода, масса которого равна 12 а.е.м.
Относительная атомная масса безразмерная величина!!!
Например , относительная атомная масса атома кислорода равна 15,994. Считать самим значения относительной атомной массы не всегда обязательно. Можно воспользоваться значениями, приведенными в периодической системы химических элементов Д.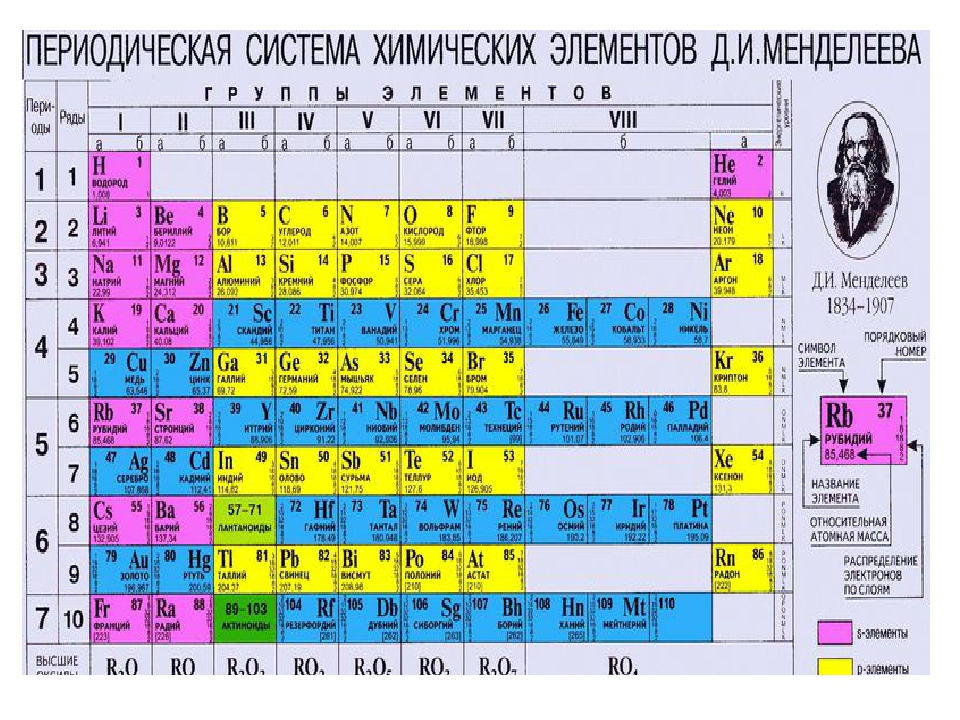 И. Менделеева. Записать это следует так:
И. Менделеева. Записать это следует так:
Ar(O) = 16 .
Всегда используем округлённое значение.
Исключение представляет относительная атомная масса атома хлора: Ar(Cl) = 35,5.
Связь между абсолютной и относительной массами атома представлена формулой:
Распространённость элементов в природе. Основную массу космического вещества составляют Н и Не (99,9%).
Из 107 химических элементов только 89 обнаружены в природе, остальные, а именно технеций (атомный номер 43), прометий (атомный номер 61), астат (атомный номер 85), франций (атомный номер 87) и трансурановые элементы, получены искусственно посредством ядерных реакций (ничтожные количества Te, Pm, Np, Fr образуются при спонтанном делении урана и присутствуют в урановых рудах). В доступной части Земли наиболее распространены 10 элементов с атомными номерами в интервале от 8 до 26. В земной коре они содержатся в следующих относительных количествах:
Перечисленные 10 элементов составляют 99,92% массы земной коры.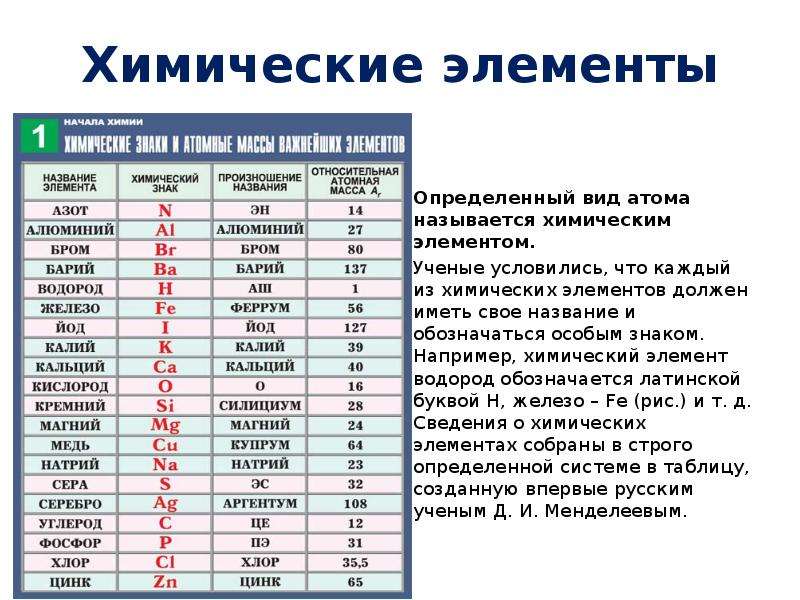
Ртути соответствовала планета Меркурий, которая быстрее всех передвигается по небосводу. Да на “защите экологии” кормится большое количество народу! Ртуть — химический элемент, переходный метал. Вы, разумеется, догадались, что речь идет о ртути. Сколько ртути в люминесцентных лампах? Что делать? Опасность ртути чрезвычайно преувеличена!
«Химический элемент алюминий» — Какими физическими свойствами обладает алюминий. Незнакомец. Алюминий. На каких свойствах алюминия основано его применение. Цепочки превращений. Применение. Алюминиевая посуда. Состав. Химические свойства. Темные пятна. Физические свойства. Посуда из алюминия.
«Знаки элементов» — Мифы древних греков. Астрономические начала. Знаки химических элементов. Понятие о знаках химических элементов. Период. Имена великих ученых. Металлы. Свойства элементов. Географические начала. Координаты. Фтор. Литий. Малые периоды. Водород. Йёнс Якоб Берцелиус. Химический элемент. Подгруппы. Cера.
«Никель» — Блестящий серебристо-белый металл. Элемент земных глубин. Сплавы никеля. Шведский минералог А. Кронштедт. Немецкий химик Иеремия Рихтер. Применяется во многих отраслях народного хозяйства. Горит никель только в виде порошка. Является основным компонентом метеоритов. Похожий на серебро метал. Нержавеющие стали.
Элемент земных глубин. Сплавы никеля. Шведский минералог А. Кронштедт. Немецкий химик Иеремия Рихтер. Применяется во многих отраслях народного хозяйства. Горит никель только в виде порошка. Является основным компонентом метеоритов. Похожий на серебро метал. Нержавеющие стали.
«Медь, серебро, золото» — Комплексные соединения. Особенности химии меди. Простые вещества. Получение меди. Серебро. Получение и разрушение. Почернение серебряных предметов. Кислородные соединения. Простые вещества. Элементы IБ-группы. Выплавка меди. Окислительно-восстановительные свойства. Минералы. Степени окисления. Химия элементов.
«Химический элемент водород» — Слово хранителям знаний. Дилетанты. Лучший спортсмен. Обыватели. Фронтальная беседа. Свойства водорода. Ведущий. Скоростная дорожка. Водород. Номера практически возможных реакций. Материалы проекта или урока. Главное применение водорода. Проведем проверку знаний. Уравнения реакций. Действующие лица.
Всего в теме 46 презентаций
Язык химии.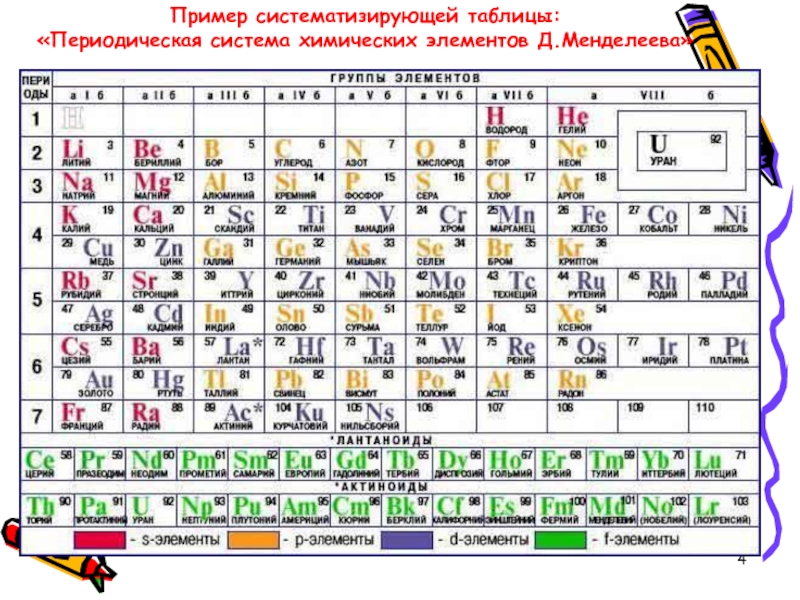 Знаки химических элементов.
Знаки химических элементов.
Химический язык и его части
Человечество использует много разных языков. Кроме естественных языков (японского, английского, русского – всего более 2,5 тысяч), существуют еще и искусственные языки, например, эсперанто. Среди искусственных языков выделяются языки различных наук. Так, в химии используется свой, химический язык. Химический язык – система условных обозначений и понятий, предназначенная для краткой, ёмкой и наглядной записи и передачи химической информации. Сообщение, написанное на большинстве естественных языков, делится на предложения, предложения – на слова, а слова – на буквы. Если предложения, слова и буквы мы назовем частями языка, то тогда мы сможем выделить аналогичные части и в химическом языке (таблица 1).
Таблица 1.Части химического языка
Информация об атомах и химических элементах (» буквы» химического языка) | Информация о химических веществах («слова» химического языка) | Информация о химических реакциях («предложения» химического языка) |
СИМВОЛЫ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ | ХИМИЧЕСКИЕ ФОРМУЛЫ | СХЕМЫ И УРАВНЕНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ |
Любым языком овладеть сразу невозможно, это относится и к химическому языку. Поэтому пока вы познакомитесь только с основами этого языка: выучите некоторые » буквы» , научитесь понимать смысл » слов» и»
предложений» . Вы познакомитесь с названиями химических веществ – неотъемлемой частью химического языка. По мере изучения химии ваше знание химического языка будет расширяться и углубляться.
Поэтому пока вы познакомитесь только с основами этого языка: выучите некоторые » буквы» , научитесь понимать смысл » слов» и»
предложений» . Вы познакомитесь с названиями химических веществ – неотъемлемой частью химического языка. По мере изучения химии ваше знание химического языка будет расширяться и углубляться.
Химические знаки (символы химические) — буквенные обозначения химических элементов. Состоят из первой или из первой и одной из следующих букв латинского названия элемента,напр., углерод — С (Carboeum), кальций — Ca (Calcium), кадмий — Cd…
Символ химического элемента – условное обозначение химического элемента.
Историческая справка: Химики древнего мира и средних веков применяли для обозначения веществ, химических операций и приборов символические изображения, буквенные сокращения, а также сочетания тех и других. Семь металлов древности изображали астрономическими знаками семи небесных светил: Солнца (☉ , золото), Луны (☽ , серебро), Юпитера (♃ , олово),Венеры (♀, медь), Сатурна (♄ , свинец), Меркурия (☿ , ртуть),Марса (♁ , железо). Металлы, открытые в XV-XVIII веках, — висмут, цинк,кобальт — обозначали первыми буквами их названий. Знак винного спирта (лат. spiritus vini) составлен из букв S и V. Знаки крепкой водки (лат. aqua fortis, азотная кислота) и золотой водки (лат. aqua regis, царская водка, смесь соляной и азотной кислот) составлены из знака водыÑ и прописных букв F и R соответственно. Знак стекла (лат. vitrum) образован из двух букв V -прямой и перевёрнутой.
Металлы, открытые в XV-XVIII веках, — висмут, цинк,кобальт — обозначали первыми буквами их названий. Знак винного спирта (лат. spiritus vini) составлен из букв S и V. Знаки крепкой водки (лат. aqua fortis, азотная кислота) и золотой водки (лат. aqua regis, царская водка, смесь соляной и азотной кислот) составлены из знака водыÑ и прописных букв F и R соответственно. Знак стекла (лат. vitrum) образован из двух букв V -прямой и перевёрнутой.
Попытки упорядочить старинные химические знаки продолжались до конца XVIIIвека. В начале XIX века английский химик Дж. Дальтон предложил обозначать атомы химических элементов кружками, внутри которых помещались точки, чёрточки, начальные буквы английских названий металлов и др. Химические знаки Дальтона получили некоторое распространение в Великобритании и в Западной Европе, но вскоре были вытеснены чисто буквенными знаками, которые шведский химик Й. Я. Берцелиус предложил в 1814. Высказанные им принципы составления химических знаков сохранили свою силу до настоящего времени. В России первое печатное сообщение о химических знаках Берцелиуса сделал в 1824московский врач И. Я. Зацепин.
В России первое печатное сообщение о химических знаках Берцелиуса сделал в 1824московский врач И. Я. Зацепин.
Ниже приведена таблица химических знаков некоторых элементов, их названия, относительные массы и произношение.
ОТНОСИТЕЛЬНАЯ АТОМНАЯ МАССА
Историческая справка: Английский ученый Джон Дальтон (1766–1844) на своих лекциях демонстрировал студентам выточенные из дерева модели атомов, показывая, как они могут соединяться, образуя различные вещества. Когда одного из студентов спросили, что такое атомы, он ответил: «Атомы – это раскрашенные в разные цвета деревянные кубики, которые изобрел мистер Дальтон».
Конечно, Дальтон прославился не своими «кубиками» и даже не тем, что в двенадцатилетнем возрасте стал школьным учителем. С именем Дальтона связано возникновение современной атомистической теории. Впервые в истории науки он задумался о возможности измерения масс атомов и предложил для этого конкретные способы. Понятно, что непосредственно взвесить атомы невозможно.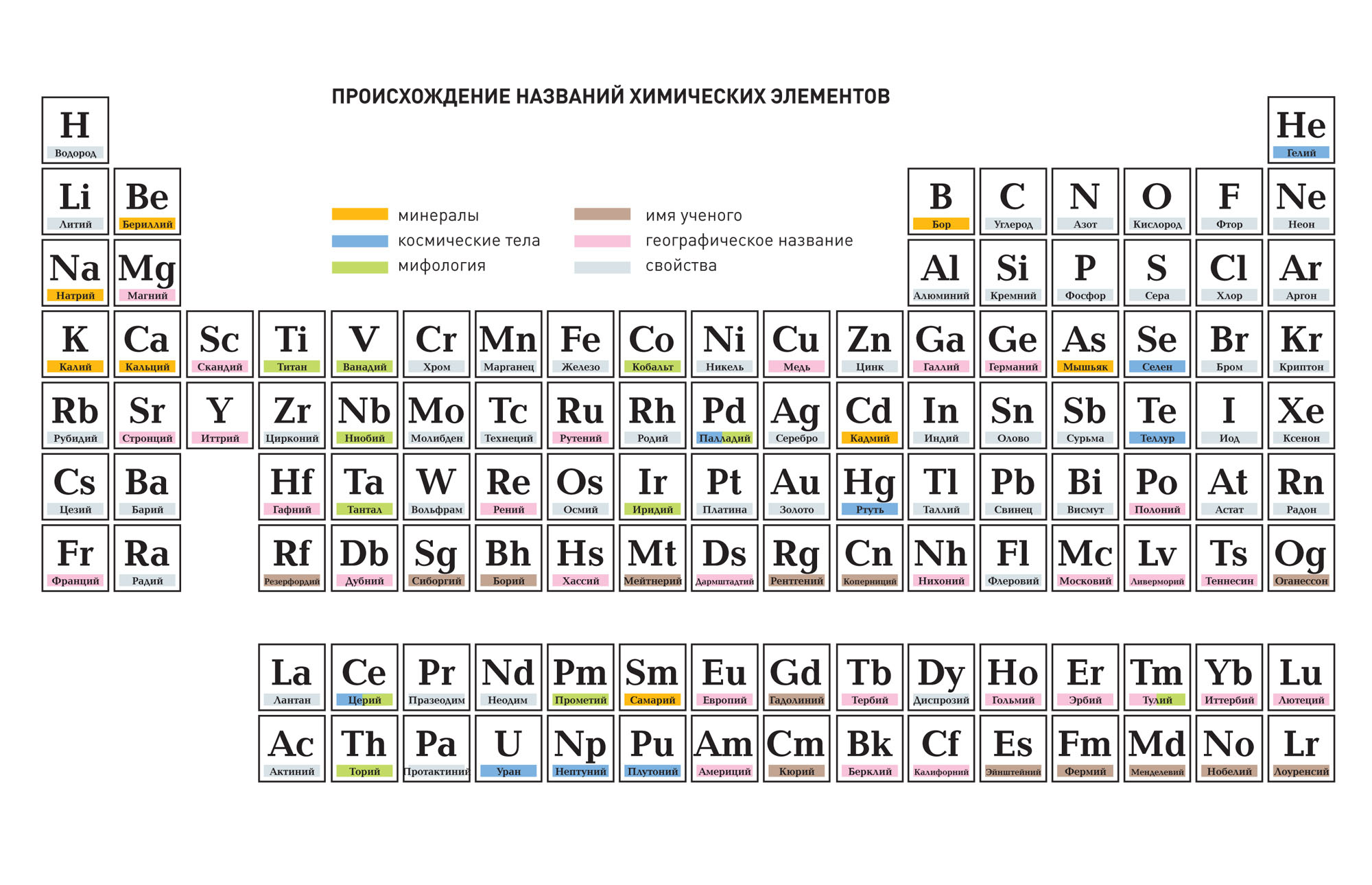 Дальтон рассуждал только о «соотношении весов мельчайших частиц газообразных и других тел», то есть об относительных их массах. И поныне, хотя масса любого атома в точности известна, ее никогда не выражают в граммах, так как это исключительно неудобно. Например, масса атома урана – самого тяжелого из существующих на Земле элементов – составляет всего 3,952·10–22 г. Поэтому массу атомов выражают в относительных единицах, показывающих, во сколько раз масса атомов данного элемента больше массы атомов другого элемента, принятого в качестве стандарта. Фактически это и есть «соотношение весов» по Дальтону, т.е. относительная атомная масса.
Дальтон рассуждал только о «соотношении весов мельчайших частиц газообразных и других тел», то есть об относительных их массах. И поныне, хотя масса любого атома в точности известна, ее никогда не выражают в граммах, так как это исключительно неудобно. Например, масса атома урана – самого тяжелого из существующих на Земле элементов – составляет всего 3,952·10–22 г. Поэтому массу атомов выражают в относительных единицах, показывающих, во сколько раз масса атомов данного элемента больше массы атомов другого элемента, принятого в качестве стандарта. Фактически это и есть «соотношение весов» по Дальтону, т.е. относительная атомная масса.
· Массы атомов очень малы.
Абсолютные массы некоторых атомов:
M(C) =1,99268 ∙ 10-23 г
M(H) =1,67375 ∙ 10-24 г
M(O) =2,656812 ∙ 10-23 г
· В настоящее время в физике и химии принята единая система измерения.
Введена атомная единица массы (а.е.м.)
m(а.е.м.) = 1/12 m(12C) = 1,66057 ∙ 10-24 г.
· Ar(H) = m(атома) / m (а. е.м.) =
е.м.) =
1,67375 ∙ 10-24 г/1,66057 ∙ 10-24 г = 1,0079 а.е.м.
· Ar – показывает, во сколько раз данный атом тяжелее 1/12 части атома 12С, это безразмерная величина.
Относительная атомная масса — это 1/12 массы атома углерода, масса которого равна 12 а.е.м.
Относительная атомная масса безразмерная величина
Например, относительная атомная масса атома кислорода равна 15,994 (используем значение из периодической системы химических элементов Д. И. Менделеева).
Записать это следует так, Ar(O) = 16. Всегда используем округлённое значение, исключение представляет относительная атомная масса атома хлора:
·Связь между абсолютной и относительной массами атома представлена формулой:
m(атома) = Ar ∙ 1,66 ∙ 10 -27 кг
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ ТЕМЫ
Используя ПСХЭ составьте пары из знаков химических элементов и соответствующих русских названий:
N, Ar, P, Al, S, Mg, Cr
Алюминий, сера, азот, хром, фосфор, аргон, магний
№2.
Используя ПСХЭ определите относительные атомные массы химических элементов с порядковыми номерами: 80, 23, 9, 2
Дайте характеристикухимическому элементу – О по его положению в ПСХЭ согласно плану:
Название русское
Порядковый номер
Произношение
Значение относительной атомной массы
№4.
Например, Cr , убираем из названия «хром» одну начальную букву и получаем «ром»
Разгадайте новое слово,которое можно получить, если от начала или конца названия химического элемента убрать число букв, соответствующее числу точек.
А) : . Pd:
Б) . Sn.
№6.
«Химический диктант»
Ваша задача при ответе на данный вопрос записать химические знаки (символы) элементов, русские названия которых будут приведены ниже (при написании ответа, записывайте символы через запятую и пробел, например, Ti, Co, Al):
Сера
Азот
Водород
Медь
Углерод
Калий
Кальций
Фосфор
Поработайте с тренажёром «Относительные атомные массы «
открытых учебников | Сиявула
Математика
Наука
- Читать онлайн
Учебники
Английский
Класс 7А
Класс 7Б
Класс 7 (объединенные А и В)
Африкаанс
Граад 7А
Граад 7Б
Graad 7 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Класс 8А
Класс 8Б
Класс 8 (объединенные А и В)
Африкаанс
Граад 8А
Граад 8Б
Graad 8 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Класс 9А
Класс 9Б
Класс 9 (объединенные А и В)
Африкаанс
Граад 9А
Граад 9Б
Graad 9 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Класс 4А
Класс 4Б
Класс 4 (объединенные A и B)
Африкаанс
Граад 4А
Граад 4Б
Graad 4 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Класс 5А
Класс 5Б
Класс 5 (объединенные A и B)
Африкаанс
Граад 5А
Граад 5Б
Graad 5 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Класс 6А
Класс 6Б
Класс 6 (объединенные A и B)
Африкаанс
Граад 6А
Граад 6Б
Graad 6 (A en B saam)
Пособия для учителя
Лицензирование нашей книги
Эти книги не только бесплатны, но и имеют открытую лицензию! Один и тот же контент, но разные версии (фирменные или нет) имеют разные лицензии, как объяснено:
CC-BY-ND (фирменные версии)
Вам разрешается и поощряется свободное копирование этих версий. Вы можете копировать, распечатывать и распространять их столько раз, сколько захотите. Вы можете загрузить их на свой мобильный телефон, iPad, ПК или флешку. Вы можете записать их на компакт-диск, отправить по электронной почте или загрузить на свой веб-сайт. Единственное ограничение заключается в том, что вы не можете каким-либо образом адаптировать или изменять эти версии учебников, их содержание или обложки, поскольку они содержат соответствующие бренды Siyavula, логотипы спонсоров и одобрены Департаментом базового образования. Для получения дополнительной информации посетите Creative Commons Attribution-NoDerivs 3.0 Непортированный.
Вы можете копировать, распечатывать и распространять их столько раз, сколько захотите. Вы можете загрузить их на свой мобильный телефон, iPad, ПК или флешку. Вы можете записать их на компакт-диск, отправить по электронной почте или загрузить на свой веб-сайт. Единственное ограничение заключается в том, что вы не можете каким-либо образом адаптировать или изменять эти версии учебников, их содержание или обложки, поскольку они содержат соответствующие бренды Siyavula, логотипы спонсоров и одобрены Департаментом базового образования. Для получения дополнительной информации посетите Creative Commons Attribution-NoDerivs 3.0 Непортированный.
Узнайте здесь больше о спонсорстве и партнерстве с другими, которые сделали возможным выпуск каждого из открытых учебников.
CC-BY (версии без торговой марки)
Эти небрендированные версии одного и того же контента доступны для совместного использования, адаптации, преобразования, изменения или дальнейшего развития любым способом, при единственном требовании — отдать должное Сиявуле. Для получения дополнительной информации посетите Creative Commons Attribution 3.0 Unported.
Для получения дополнительной информации посетите Creative Commons Attribution 3.0 Unported.
21 увлекательное занятие по периодической таблице для студентов-химиков всех возрастов
Периодическая таблица элементов является ключом к пониманию и усвоению химических концепций.Эти упражнения с периодической таблицей веселые и увлекательные, и вы можете использовать многие из них как с младшими, так и со старшими учениками. Выберите несколько, чтобы попробовать в своем собственном классе!
Напоминаем, что WeAreTeachers может собирать долю продаж по ссылкам на этой странице. Спасибо за Вашу поддержку!
1. Начните с якорной диаграммы
Периодическая таблица — гениальная конструкция, но она требует небольшого пояснения. Эти якорные диаграммы объясняют расположение и детали и являются отличным справочным материалом для использования во всех ваших действиях с периодической таблицей.
Узнать больше: Школьный
2.
 Изучите иллюстрированную таблицу Менделеева
Изучите иллюстрированную таблицу МенделееваУчителя любят эту таблицу, и не зря. Это оживляет таблицу, помогая студентам-химикам понять, какую роль каждый элемент играет в окружающем нас мире. Вы можете бесплатно распечатать его копии или купить плакаты и наборы открыток. Есть даже интерактивная версия!
Узнайте больше: elements.wlonk.com
3. Раскрась и узнай об элементах
Вы можете использовать эту умную книжку-раскраску для всех видов занятий с периодической таблицей.Попробуйте несколько бесплатных печатных страниц с сайта автора Терезы Бондора здесь. Если они вам нравятся, купите книжку-раскраску «Периодическая таблица элементов» на Amazon.
4. Спойте песенку из таблицы Менделеева
Хотя детям не обязательно запоминать периодическую таблицу, такие песни могут помочь, если они захотят попробовать! Нам нравится этот новый современный подход, но и старая классика Тома Лерера 1959 года тоже доставляет массу удовольствия.
5. Соберите модель из коробок для яиц
Любите хорошие поделки из вторсырья? Это деятельность, которую вы ищете! Накопите картонные коробки для яиц и используйте их для создания модели таблицы Менделеева.
Узнайте больше: Странные несоциализированные домашние школьники
6. Создайте колоду карт элементов
Эти бесплатные распечатанные карточки отлично подходят для повторения элементов, особенно если вы работаете над запоминанием некоторых или всех из них.
Подробнее: Домашнее школьное творчество
7. Изготовьте элементы для чистки труб модели
.Получите более глубокое представление о конструкции каждого элемента, создавая модели с помпонами, бусинами и ершиками для труб.
Узнайте больше: Обучайте рядом со мной
8. Найдите элементы, чтобы выиграть игру
Узнайте, где расположен каждый элемент на столе, а также их аббревиатуры в этой простой (и бесплатной) компьютерной игре «укажи и щелкни».
Узнайте больше: Мистер Нуссбаум Обучение + развлечение
9. Отправляйтесь на поиски элементов
Отправьте учащихся на поиск реальных примеров различных элементов.Они будут удивлены тем, как легко их найти.
Узнать больше: Pinay Homeschooler
10. Составьте периодическую таблицу гигантских плиток
Этот классический исследовательский проект объединяется в гигантской периодической таблице. Вы можете использовать доску для плакатов или добавить трехмерный элемент, вместо этого создав плитки на коробках для пиццы.
Подробнее: миссмиклиус
11. Играть в периодическую таблицу Морской бой
Вот еще одна забавная игра, которая поможет детям познакомиться с тем, где на столе находятся различные элементы.Узнайте, как играть по ссылке.
Узнайте больше: Обучайте рядом со мной
12. Превратите элементы в супергероев (или злодеев)
Это такой забавный поворот в обычном проекте по исследованию элементов. Учащиеся узнают больше о характеристиках своей стихии, а затем решают, супергерой это или злодей!
Учащиеся узнают больше о характеристиках своей стихии, а затем решают, супергерой это или злодей!
Узнайте больше: Morpho Наука/Учителя платят учителям
13. Загрузите приложение Atomidoodle
Это классное маленькое приложение, доступное как в Apple AppStore, так и в Google Play, предлагает учащимся рисовать пути в лабиринтах.Они используют слияние (сложение) и деление (деление) для создания новых атомов, изучая при этом сотни фактов об элементах.
Подробнее: Атомидудл
14. Сортировать «периодических людей» в таблицу
Это умное задание дает учащимся возможность увидеть, как Менделеев сортировал элементы, чтобы создать свою блестящую периодическую таблицу. Получите бесплатно по ссылке.
Подробнее: Sunrise Science
15. Повесьте таблицу Менделеева на потолок
Источник: Sentinel округа Джексон
Используйте все свободное пространство в классе, превратив потолочные плитки в огромную таблицу Менделеева! Клейкий винил хорошо подходит для этого амбициозного проекта.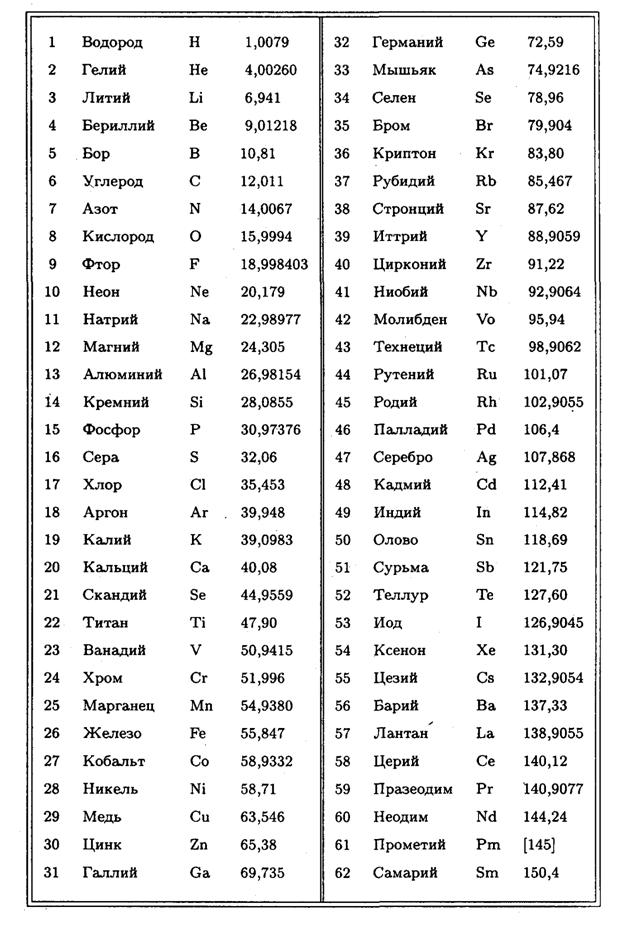
16. Разгадать
Тайну периодической таблицыЧитателям средней школы понравится этот рассказ о разработке периодической таблицы, и они узнают о различных ученых, участвовавших в процессе. Купите The Mystery of the Periodic Table на Amazon здесь.
17. Знакомство с персонажами Элемента
Каждый элемент имеет свой собственный набор характеристик, которые почти можно назвать его личностью. В этом и заключается идея этих невероятно забавных карт, которые представляют элементы как живых персонажей.Вы можете использовать набор из них для всех видов периодической таблицы.
Подробнее: Элементы — эксперименты в дизайне персонажей
18. Победить в квесте с таблицей Менделеева
Эскейп-комнаты в моде, и в классе тоже очень весело. Создайте свой собственный набор задач, основанных на химии, или купите эту готовую квест-комнату с таблицей Менделеева на сайте Teachers Pay Teachers.
Узнать больше: Наука Кеслера
19.Сделать пиксельную графику периодической таблицы
В этой бесплатной интерактивной программе учащиеся отвечают на вопросы об элементах, чтобы разблокировать квадраты периодической таблицы, создав пиксельную картинку. Бонус: пусть дети создают свои собственные пиксельные картинки, используя таблицу!
Подробнее: Преподавание вне теста
20. Соберите разноцветные плитки
Эти красочные элементы соединяются друг с другом, образуя интерактивную головоломку, которую можно использовать для множества различных действий с периодической таблицей.Купите набор на Amazon.
21. Соревнуйтесь в таблице Менделеева Бинго
Бинго всегда весело, но эта версия также поможет вам выучить различные сокращения элементов. Сделайте свои карты или купите готовый набор по ссылке.
Подробнее: Семейство с питанием от STEAM
Хотите больше практической науки? Попробуйте лучшие научные наборы для детей, выбранные учителями.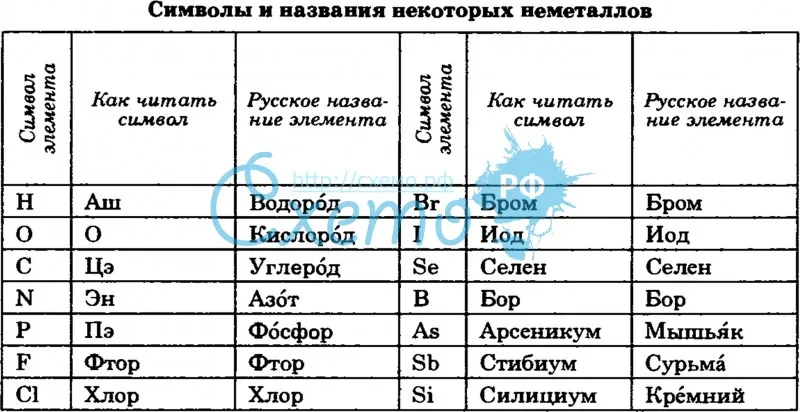
Плюс, 20 лучших научных досок объявлений и идей декора классной комнаты.
Периодическая таблица kahoot | Научно-обучающая игра
Верно, периодическая таблица мания . Учебник JenKrug с метким названием «Атомная структура и периодическая таблица Менделеева» превращает изучение химии в увлекательное занятие — вот как…
1. Критична формулировка вопроса!
В этой удивительной книге Периодической таблицы есть вопросы, которые звучат почти почти одинаково, но это не так. Насколько внимательно слушали ваши студенты-химики? Могут ли они вспомнить, какая Периодическая таблица была основана на атомных n um , а какая основана на атомных m ass ?
ГЛАВНЫЙ СОВЕТ: Вопросы, подобные этим, являются аккуратной небольшой подсказкой, чтобы остановиться и освежить знания ваших учащихся об атомной массе и атомном номере, а также о значении самой схемы Периодической таблицы.
2. Разумное использование специальных символов и форматирование
Итак, мы должны признать, что мы не создавали наш «выборщик символов» с учетом расположения электронов… так что видеть, как этот учитель химии использует стрелки в ответах, было приятным сюрпризом!
ГЛАВНЫЙ СОВЕТ: Если вы любите математику и естественные науки, вам понравится средство выбора символов и инструменты форматирования! Щелкните в любой текстовой области, и вы сможете добавить надстрочные и нижние индексы, специальные символы и иностранные символы.
3. Примеры бытовой химии
Из-за сложных обозначений и всех этих разговоров о субатомных частицах некоторым учащимся может быть очень трудно понять химию — это просто не кажется реальным. Один из лучших приемов — по возможности возвращаться к примерам из реальной жизни.
Например, вы можете сделать термодинамику более доступной, просто поговорив с классом (на простом английском языке!) о том, что на самом деле происходит на субатомном уровне, когда ваша чашка кофе остывает. Этот Kahoot!’er использовал простой вопрос о повседневных химических смесях, чтобы сделать основы химии немного более осязаемыми.
Этот Kahoot!’er использовал простой вопрос о повседневных химических смесях, чтобы сделать основы химии немного более осязаемыми.
Лучший совет по адаптации этого кахута: разбейте его!
Нам очень нравится этот кахут, и наш местный химик утверждает, что она узнала о Периодической таблице больше за одну игру, чем за весь первый год в университете. Но… очень длинный, который (в зависимости от того, как его использовать) может скорее вызвать давление или отчуждение, чем радость и активное обучение.Нам бы очень хотелось, чтобы такие кахуты были разбиты на три или четыре игры размером с укус.
Создавая кахуты, думайте о каждом вопросе как о возможности чему-то научиться. Каждый вопрос дает возможность учащимся освежить свое понимание, учителю выявить пробелы в знаниях, классу обсудить, почему они ответили тем или иным образом, и даже еще раз пройтись по основам определенного предмета. .
Когда kahoots длиннее 10-15 вопросов, и вы действительно используете каждый вопрос как возможность для обучения, все начинают чувствовать небольшое давление, чтобы спешить.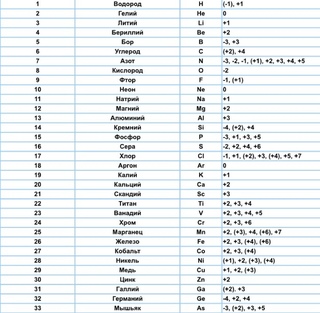 Вместо этого создавайте короткие и целенаправленные кахуты с некоторой передышкой, и кахуты будут веселее и эффективнее.
Вместо этого создавайте короткие и целенаправленные кахуты с некоторой передышкой, и кахуты будут веселее и эффективнее.
Ваш вызов!
Во-первых, вернитесь к созданным вами кахутам и найдите тот, который, по вашему мнению, слишком длинный. Или, если у вас нет своего собственного для работы, вы можете найти действительно длинный, но в остальном красиво оформленный кахут по вашей любимой теме — вы можете использовать наши списки трендов в качестве ярлыка или использовать причудливые ключевые слова в поиске. найти что-то крутое.
Теперь создайте идеальный маленький кахут серии на основе этого длинного кахута. Используя периодическую таблицу kahoot в качестве примера, вот как вы можете разбить kahoot из 32 вопросов на 4 kahoot размером с укус:
1. Дублируйте один и тот же кахут 4 раза.
2. Измените название каждого дубликата, чтобы вы и другие пользователи Kahoot! узнали их позже как часть серии, например. Периодическая таблица, часть 1.
3. Отредактируйте первый кахут, удалив все вопросы, кроме первых 8, и сохраните.
4. Отредактируйте второй кахут, удалив первые 8 вопросов и последние 16 вопросов, и сохраните.
5. И повторяйте, пока не получите 4 кахута без перекрывающихся вопросов. Теперь у вас есть серия периодической таблицы.
Было ли это полезно?
Напишите нам в Твиттере @GetKahoot или загляните в Kahoot! Сообщество Facebook, чтобы сообщить нам, какие еще кахуты вы хотели бы, чтобы мы изучили или представили!
Химический символ: определение и примеры — видео и расшифровка урока
Происхождение химических символов
Итак, каково происхождение этих химических символов? Когда ранние химики (известные в то время как алхимики) открывали увлекательный мир химии, они часто обозначали свои вновь открытые элементы странными значками, такими как показанная здесь.
Сравните эти странные символы с теми, которые используются для этих элементов сегодня:
1..jpeg) Олово-Sn (от латинского слова, stannum )
Олово-Sn (от латинского слова, stannum )
2. Свинец-Pb (от латинского слова, plumbus )
3. Золото-Au (от латинского слова, aurum )
4. Сера-S (от латинского слова, сульфуриум )
5. Ртуть-Hg (от латинского слова, Hydrargyrum означает «жидкое серебро»)
6.Серебро-Ag (от латинского слова argentum )
7. Железо-Fe (от латинского слова ferrum )
Все эти 118 элементов периодической таблицы имеют химические символы, представленные первой или двумя буквами из имя элемента. Если химический символ состоит из двух букв, первая буква всегда пишется заглавной, а вторая буква пишется строчными буквами. Для химических символов, состоящих из одной буквы, эта буква всегда пишется заглавной. Например, C представляет собой углерод, Ca — кальций, O — кислород.
Некоторые химические символы кажутся бессмысленными, потому что они не соответствуют английскому слову, обозначающему элемент. Например, элемент золота — это не «G» или «Go». Химический символ золота — Au. Вам, наверное, интересно, почему.
Химический символ золота — Au. Вам, наверное, интересно, почему.
Многие химические символы произошли от латинских названий элементов, потому что латынь когда-то использовалась в качестве международного языка науки. Латинское слово для обозначения золота — aurum , и именно отсюда был получен химический символ золота.
После элемента номер 56 вы можете увидеть, что многие названия элементов происходят от имени ученого или места, где они были изучены. Некоторые элементы даже названы в честь планет. Например, элемент номер 93 имеет химический символ Np, от названия элемента, нептуния, и он был назван в честь планеты Нептун.
Элемент номер 99 имеет химический символ Es и назван в честь Альберта Эйнштейна. Элемент номер 102 имеет химический символ No и назван в честь Альфреда Нобеля.Поскольку элемент номер 97 был открыт учеными, работающими в Калифорнийском университете в Беркли, штат Калифорния, он имеет химический символ Bk.
Только в начале 1800-х годов были предприняты попытки стандартизировать способ представления элементов.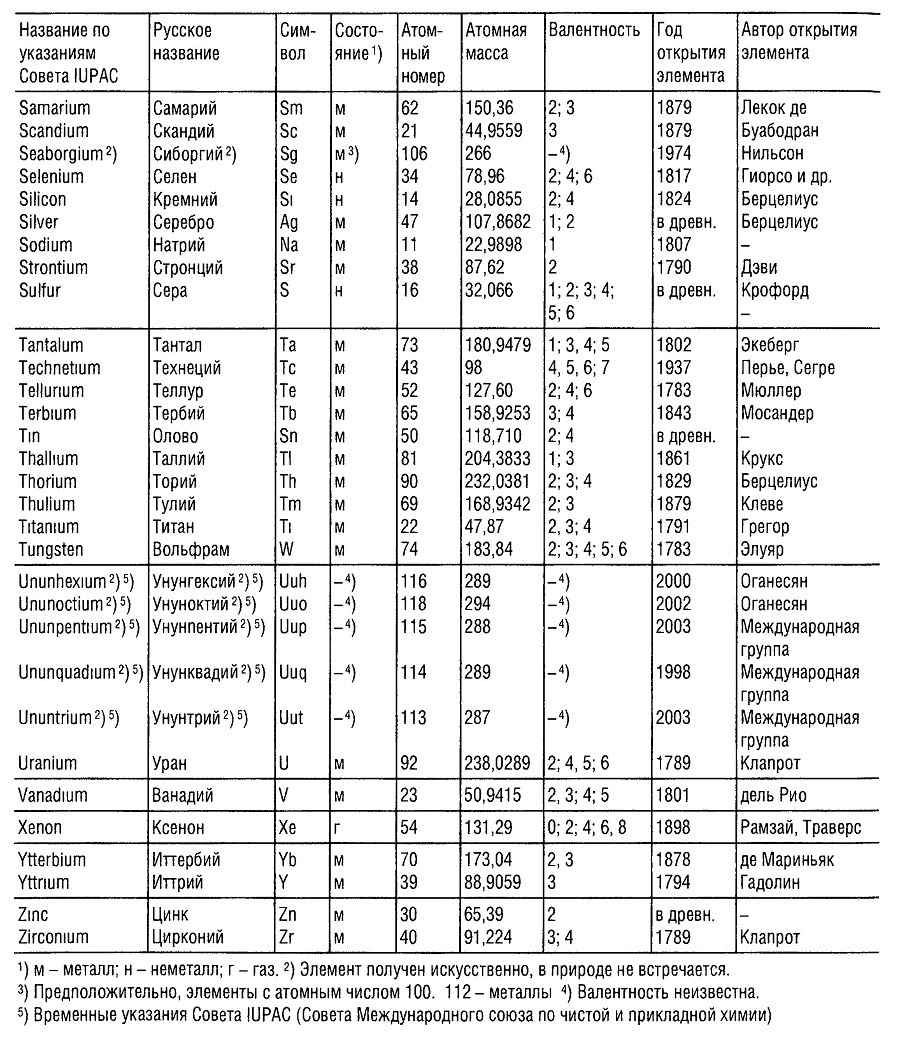 Шведскому ученому Йонсу Якобу Берцелиусу приписывают создание стандартного способа представления элементов, хотя он не был первым ученым, который их использовал. Он думал, что будет намного проще использовать буквы вместо странных картинок для обозначения элементов.
Шведскому ученому Йонсу Якобу Берцелиусу приписывают создание стандартного способа представления элементов, хотя он не был первым ученым, который их использовал. Он думал, что будет намного проще использовать буквы вместо странных картинок для обозначения элементов.
Использование химических символов
Как вы узнали, ученые стандартизировали сокращенное представление элементов по их химическому символу. Одна из основных причин, по которой это было разработано, заключалась в том, что использование букв было самым простым способом представления элементов.
Еще одна причина, по которой мы используем химические символы, заключается в том, что они позволяют нам легко записывать химические формулы. Химическая формула — это представление соединения или молекулы, которая содержит более одного атома. Например, химическая формула монооксида углерода — CO.Вы пишете химический символ углерода, а затем O. Вы можете узнать больше о написании химических формул на других уроках, если вам интересно.
Примеры химических символов
Чтобы начать знакомство с некоторыми распространенными элементами и их химическими символами, просмотрите рисунки ниже. Они показывают химический символ и местонахождение элемента в периодической таблице. При изучении химии вам не нужно запоминать все химические символы в таблице Менделеева, поскольку каждый хороший химик (и студент-химик) всегда имеет свою копию таблицы Менделеева.
Резюме урока
В этом уроке вы узнали, что химический символ является сокращенным способом представления элемента и что каждый элемент в периодической таблице имеет уникальный химический символ. Химические символы используются для стандартизации «языка химии» и легкого определения элементов и атомов в химической формуле. Химические символы состоят из одной или двух букв, чаще всего производных от названия элемента.Наши стандартные химические символы, используемые сегодня, используются уже более двухсот лет.
Мои ученики изучают все элементы… 6 стратегий, которые я использую
Я должен признаться: я плохой учитель. Я заставляю своих младших школьников-химиков учить названия и символы элементов — все сто восемнадцать.
Вы можете сказать, что это невозможно, пустая трата времени или совершенно не нужно в наш век информации, которая всегда под рукой. Когда я был новым учителем, я мог бы согласиться.Я начал свой первый год преподавания в ноябре после того, как долгое время работал заместителем, который занимался атомной структурой и связью — вы знаете, основами. Я решил, что мы можем сразу перейти к химической номенклатуре, а затем написать и сбалансировать химические уравнения. Вы, наверное, догадываетесь, как это получилось, раз уж я пишу это.
Вскоре я понял, что просить моих студентов писать и интерпретировать химические формулы, не зная символов элементов, было сродни тому, чтобы просить кого-то составить слова по буквам и написать предложения, не зная алфавита. За последние несколько лет я испробовал множество тактик, от создания карточек до проведения викторин по постепенно увеличивающимся фрагментам элементов. Вначале я рассматривал возможность выбора только определенных элементов, которые необходимо было запомнить, но вскоре решил, что любой список, который я выберу, будет в лучшем случае произвольным и не позволит моим ученикам ознакомиться с обширными разделами периодической таблицы. Я определенно не хотел, чтобы МОИ ученики ошибочно принимали дилитий, вибраниум или унобтаниум за настоящие элементы!
За последние несколько лет я испробовал множество тактик, от создания карточек до проведения викторин по постепенно увеличивающимся фрагментам элементов. Вначале я рассматривал возможность выбора только определенных элементов, которые необходимо было запомнить, но вскоре решил, что любой список, который я выберу, будет в лучшем случае произвольным и не позволит моим ученикам ознакомиться с обширными разделами периодической таблицы. Я определенно не хотел, чтобы МОИ ученики ошибочно принимали дилитий, вибраниум или унобтаниум за настоящие элементы!
В первые несколько лет я столкнулся со значительным сопротивлением со стороны учеников, желающих выучить все элементы.Однако, как только я доказал, что это можно сделать (я проявил свою гиковскую браваду и процитировал все элементы по памяти), они восприняли эту идею как вызов, который стоит принять. Моим ученикам до сих пор трудно дается химическая номенклатура, а также составление и составление химических уравнений, но, по крайней мере, они сначала знают свой алфавит. Вот несколько методов (в произвольном порядке), которые я нашел полезными.
Вот несколько методов (в произвольном порядке), которые я нашел полезными.
Флэш-карты
Это может показаться простым, но одно из заданий, которое я даю на первой неделе в школе, состоит в том, чтобы сделать набор карточек вручную.Несмотря на то, что для этого есть «приложение», как каждый год напоминает мне по крайней мере один студент, физический акт изготовления карточек имеет огромную ценность. Я прошу студентов регулярно приносить эти карточки с собой в класс, а в качестве дополнительного занятия попрошу их вытащить свои карточки и опросить своего партнера по лаборатории.
Рисунок 1 — Флэш-карты Element
Накопительные викторины
Как съесть слона? Один укус за раз. Вдохновленный этой старой шуткой и моим соседом-учителем богословия, который заставлял учеников учить стихи для запоминания Священных Писаний, я разбил периодическую таблицу на куски по 10 элементов.Каждые две недели студенты проходят опрос по следующим десяти элементам плюс несколько элементов из более раннего года, выбранных случайным образом. Следуя этому графику, учащиеся знают подавляющее большинство элементов к первой части второго семестра и успевают написать химические названия и формулы. Вы можете найти несколько примеров тестов в вспомогательной информации ниже. (Примечание: я не обновлял эти викторины, чтобы включить последние четыре элемента, так как сейчас я использую Sporcle для создания своих викторин.)
Следуя этому графику, учащиеся знают подавляющее большинство элементов к первой части второго семестра и успевают написать химические названия и формулы. Вы можете найти несколько примеров тестов в вспомогательной информации ниже. (Примечание: я не обновлял эти викторины, чтобы включить последние четыре элемента, так как сейчас я использую Sporcle для создания своих викторин.)
Рисунок 2 — Образец опроса по элементам
Броненосец Периодической таблицы
Веселье — один из лучших способов учиться, и моим ученикам нравится играть в эту игру.Вы можете найти объяснение игры здесь от Huffington Post. Вы можете использовать любую версию периодической таблицы, которая вам нравится, для создания игры — я предпочитаю вариант с одними символами. Это отличное занятие, если у вас есть неловкие 15-20 минут, скажем, перед собранием или досрочным увольнением. Я включил периодическую таблицу для вашего использования в дополнительную информацию ниже.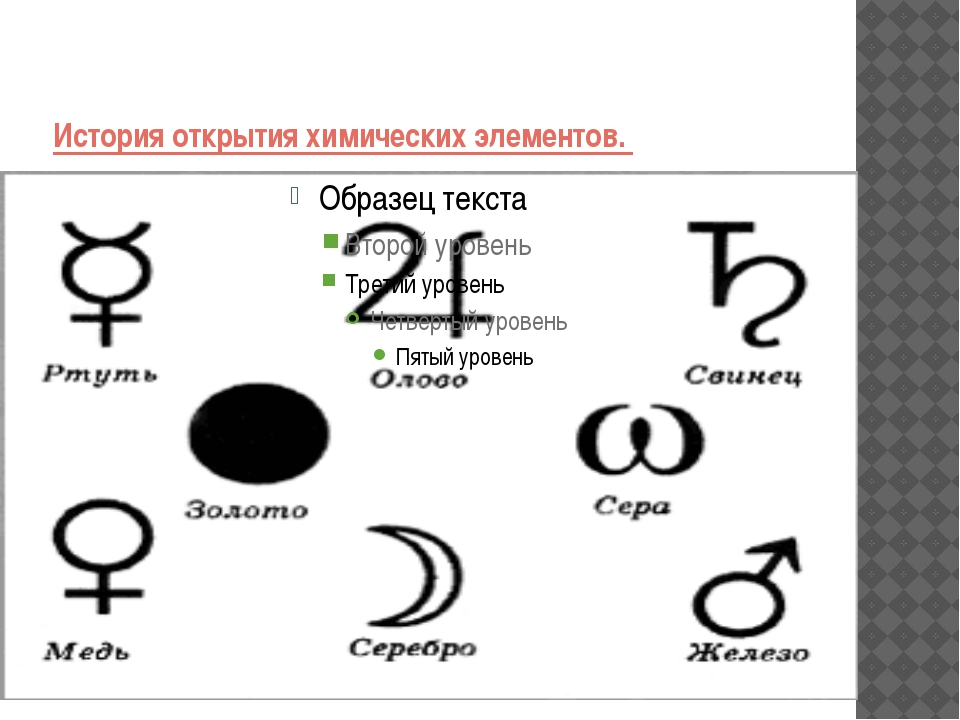
Элемент пчелы
Орфографические пчелы являются одним из основных предметов в начальной школе, но реже в старшей школе.Я часто делаю «элемент пчелы» со своими классами, и хотя я обычно не делаю написание имен в этой игре, конечно, вы можете играть в нее таким образом. Все встают и, используя свой собственный набор карточек с элементами, я даю первому ученику название или символ элемента. Если я даю символ, они должны дать имя, и наоборот. Опять же, это хорошее дополнительное занятие, примерно 5 минут в конце урока.
Вишневый пирог «Элемент»
Работая в школе PS-12 (под одной крышей), у меня есть необычная возможность черпать идеи у своих коллег из разных предметных областей и классов.Я подхватил эту идею у своего коллеги, который учит пятый класс. Чтобы играть в эту игру (в стиле химии), учащиеся встают в круг. Первому ученику дается название элемента. Они должны назвать первую букву, и по мере того, как ученики идут по кругу, каждый дает следующую букву.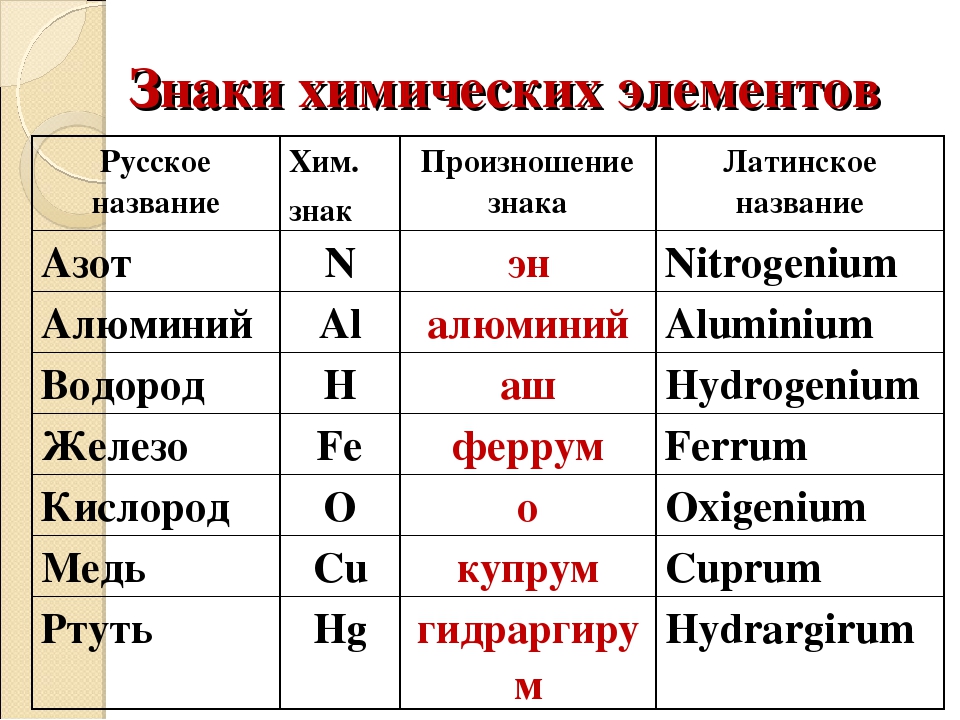 Если они ошибаются в букве, они выбывают из игры и должны сесть. Игра продолжается по кругу до тех пор, пока не будет завершено название элемента. Следующий за последней буквой человек говорит название элемента, символ и «вишневый пирог».Затем этот ученик выходит и садится. Следующий ученик в кругу начинает следующий элемент. Я даже не задумывался, почему он называется «Вишневый пирог»… я думаю, что пироги… круглые?
Если они ошибаются в букве, они выбывают из игры и должны сесть. Игра продолжается по кругу до тех пор, пока не будет завершено название элемента. Следующий за последней буквой человек говорит название элемента, символ и «вишневый пирог».Затем этот ученик выходит и садится. Следующий ученик в кругу начинает следующий элемент. Я даже не задумывался, почему он называется «Вишневый пирог»… я думаю, что пироги… круглые?
Споркле
Опять же, вдохновленный коллегой (на этот раз нашим школьным учителем обществознания), я решил поэкспериментировать с использованием Sporcle в качестве альтернативы накопительным викторинам в этом году, поскольку моя школа перешла на индивидуальную программу Chromebook. В этом году вместо кумулятивных викторин я выбрал три разных викторины sporcle: соответствие элемента символу, элемент за символом и аббревиатуры элементов и запланировал их чередование раз в месяц.Каждый месяц повышается планка количества элементов, необходимых для полного зачета.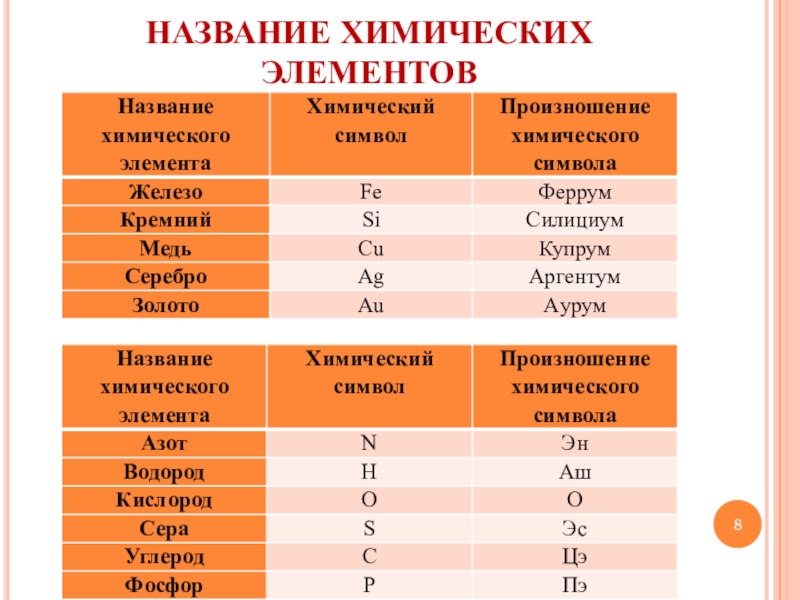 В этом году это было очень успешно!
В этом году это было очень успешно!
ЦИТАТЫ
Споркл, Инк. (2007, 30 января). В Споркле . Получено с https://www.sporcle.com/
Touch Press Inc. (2018). В Флэш-карты Элементы . Получено с https://itunes.apple.com/us/app/the-elements-flashcards/id835885718?mt=8
Ваншел, Э. (2016, октябрь). В Мама создала игру «Морской бой» с периодической таблицей, чтобы научить своих детей химии .Получено с https://www.huffingtonpost.com/entry/mom-creates-periodic-table-battleship-game-to-teach-her-kids-chemistry_us_5697f3d4e4b0b4eb759da83b
.БЛАГОДАРНОСТИ
Г-н Бенджамин О’Хирн, доктор юридических наук, бывший преподаватель богословия
Миссис Кэй Сэндборн, учитель социальных наук
Миссис Гейл Телен, учительница 5-го класса
Периодические тренды — Химия LibreTexts
Периодические тренды — это определенные закономерности, которые присутствуют в периодической таблице и иллюстрируют различные аспекты определенного элемента, включая его размер и его электронные свойства. Основные периодические тенденции включают: электроотрицательность, энергию ионизации, сродство к электрону, атомный радиус, температуру плавления и металлический характер. Периодические тренды, возникающие в результате расположения периодической таблицы, предоставляют химикам бесценный инструмент для быстрого предсказания свойств элемента. Эти тенденции существуют из-за схожей атомной структуры элементов в пределах их соответствующих групповых семейств или периодов, а также из-за периодического характера элементов.
Основные периодические тенденции включают: электроотрицательность, энергию ионизации, сродство к электрону, атомный радиус, температуру плавления и металлический характер. Периодические тренды, возникающие в результате расположения периодической таблицы, предоставляют химикам бесценный инструмент для быстрого предсказания свойств элемента. Эти тенденции существуют из-за схожей атомной структуры элементов в пределах их соответствующих групповых семейств или периодов, а также из-за периодического характера элементов.
Тенденции электроотрицательности
Электроотрицательность можно понимать как химическое свойство, описывающее способность атома притягивать и связывать электроны.Поскольку электроотрицательность является качественным свойством, стандартного метода расчета электроотрицательности не существует. Однако наиболее распространенной шкалой для количественной оценки электроотрицательности является шкала Полинга (таблица A2), названная в честь химика Линуса Полинга. Числа, присвоенные шкалой Полинга, безразмерны из-за качественного характера электроотрицательности. Значения электроотрицательности для каждого элемента можно найти в определенных периодических таблицах. Пример приведен ниже.
Числа, присвоенные шкалой Полинга, безразмерны из-за качественного характера электроотрицательности. Значения электроотрицательности для каждого элемента можно найти в определенных периодических таблицах. Пример приведен ниже.
Электроотрицательность измеряет тенденцию атома притягивать и образовывать связи с электронами.Это свойство существует благодаря электронной конфигурации атомов. Большинство атомов следуют правилу октета (имея валентную или внешнюю оболочку, состоящую из 8 электронов). Поскольку элементы в левой части периодической таблицы имеют менее чем наполовину заполненную валентную оболочку, энергия, необходимая для приобретения электронов, значительно выше по сравнению с энергией, необходимой для потери электронов. В результате элементы в левой части периодической таблицы обычно теряют электроны при образовании связей. И наоборот, элементы в правой части периодической таблицы более энергоэффективны в получении электронов для создания полной валентной оболочки из 8 электронов.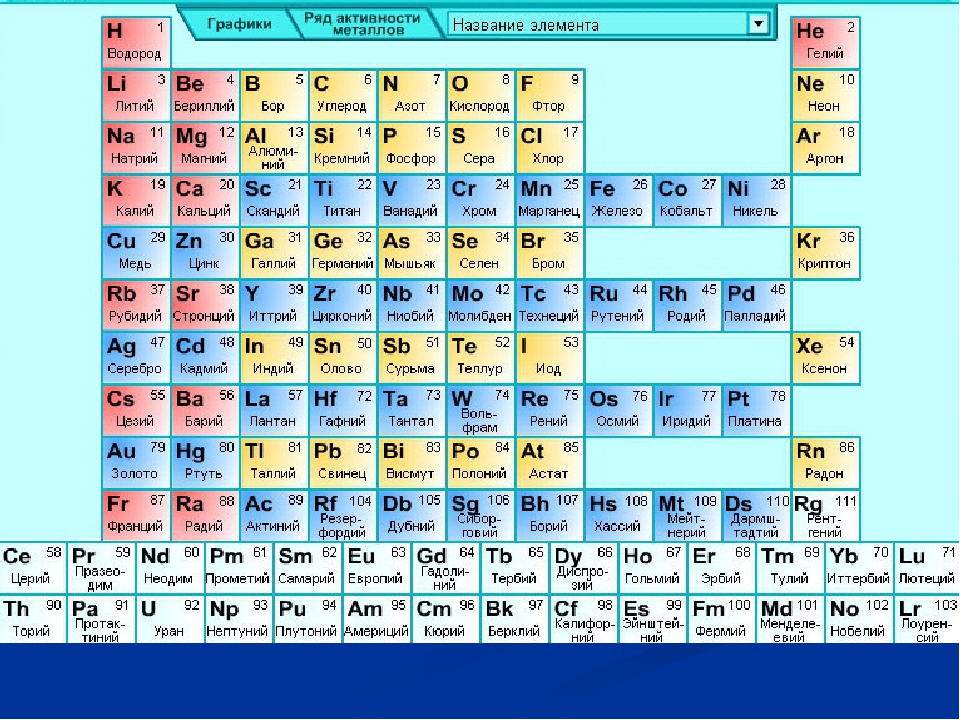 Природа электроотрицательности эффективно описывается следующим образом: чем больше атом склонен приобретать электроны, тем больше вероятность того, что атом будет притягивать электроны к себе.
Природа электроотрицательности эффективно описывается следующим образом: чем больше атом склонен приобретать электроны, тем больше вероятность того, что атом будет притягивать электроны к себе.
- Слева направо по периоду элементов электроотрицательность увеличивается. Если валентная оболочка атома заполнена менее чем наполовину, для потери электрона требуется меньше энергии, чем для его приобретения. И наоборот, если валентная оболочка заполнена более чем наполовину, легче втянуть электрон в валентную оболочку, чем отдать его.
- Сверху вниз по группе электроотрицательность уменьшается. Это связано с тем, что атомный номер увеличивается вниз по группе, и, таким образом, увеличивается расстояние между валентными электронами и ядром, или увеличивается атомный радиус.
- Важные исключения из вышеуказанных правил включают инертные газы, лантаноиды и актиноиды. Благородные газы обладают полной валентной оболочкой и обычно не притягивают электроны.
 Лантаниды и актиноиды обладают более сложным химическим составом, который обычно не следует каким-либо тенденциям.Следовательно, благородные газы, лантаноиды и актиноиды не имеют значений электроотрицательности.
Лантаниды и актиноиды обладают более сложным химическим составом, который обычно не следует каким-либо тенденциям.Следовательно, благородные газы, лантаноиды и актиноиды не имеют значений электроотрицательности. - Что касается переходных металлов, хотя они имеют значения электроотрицательности, между ними мало различий по периоду и вверх и вниз по группе. Это потому, что их металлические свойства влияют на их способность притягивать электроны так же легко, как и другие элементы.
В соответствии с этими двумя общими тенденциями наиболее электроотрицательным элементом является фтор с 3.98 единиц Полинга.
Рисунок \(\PageIndex{2}\): Периодическая таблица, показывающая тренды электроотрицательностиТенденции энергии ионизации
Энергия ионизации — это энергия, необходимая для отрыва электрона от нейтрального атома в его газовой фазе. Концептуально энергия ионизации противоположна электроотрицательности.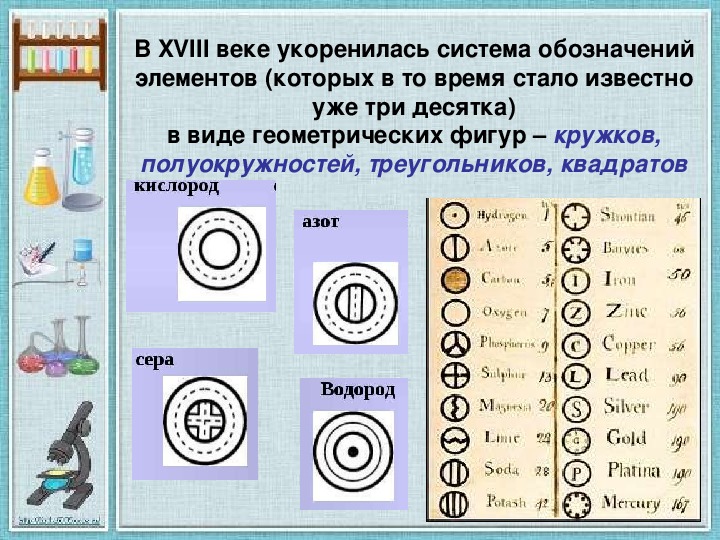 Чем ниже эта энергия, тем легче атом становится катионом. Следовательно, чем выше эта энергия, тем менее вероятно, что атом станет катионом. Как правило, элементы в правой части периодической таблицы имеют более высокую энергию ионизации, потому что их валентная оболочка почти заполнена.Элементы в левой части периодической таблицы имеют низкую энергию ионизации из-за их готовности терять электроны и становиться катионами. Таким образом, энергия ионизации увеличивается слева направо в таблице Менделеева.
Чем ниже эта энергия, тем легче атом становится катионом. Следовательно, чем выше эта энергия, тем менее вероятно, что атом станет катионом. Как правило, элементы в правой части периодической таблицы имеют более высокую энергию ионизации, потому что их валентная оболочка почти заполнена.Элементы в левой части периодической таблицы имеют низкую энергию ионизации из-за их готовности терять электроны и становиться катионами. Таким образом, энергия ионизации увеличивается слева направо в таблице Менделеева.
Другим фактором, влияющим на энергию ионизации, является экранирование электронов . Электронное экранирование описывает способность внутренних электронов атома экранировать его положительно заряженное ядро от его валентных электронов.При движении вправо от точки увеличивается число электронов и увеличивается сила экранирования. В результате электронам валентной оболочки легче ионизироваться, и, таким образом, энергия ионизации уменьшается вниз по группе. Электронное экранирование также известно как экранирование .
Электронное экранирование также известно как экранирование .
Тренды
- Энергия ионизации элементов внутри периода обычно увеличивается слева направо. Это связано со стабильностью валентной оболочки.
- Энергия ионизации элементов внутри группы обычно уменьшается сверху вниз.Это происходит из-за электронного экранирования.
- Благородные газы обладают очень высокой энергией ионизации из-за их полных валентных оболочек, как показано на графике. Обратите внимание, что у гелия самая высокая энергия ионизации среди всех элементов.
Некоторые элементы имеют несколько энергий ионизации; эти различные энергии называются первой энергией ионизации, второй энергией ионизации, третьей энергией ионизации и т. д. Первая энергия ионизации — это энергия, необходимая для удаления электрона с самой внешней или наивысшей энергией, вторая энергия ионизации — это энергия, необходимая для удалить любой последующий высокоэнергетический электрон из газообразного катиона и т. 2} \]
2} \]
- Через период \(Z_{eff}\) увеличивается на и n (главное квантовое число) остается тем же самым , поэтому энергия ионизации увеличивается .
- Вниз по группе \(n\) увеличивает и \(Z_{eff}\) немного увеличивает ; энергия ионизации уменьшается .
Тренды электронного сродства
Как следует из названия, сродство к электрону — это способность атома принимать электрон. В отличие от электроотрицательности, сродство к электрону является количественным измерением изменения энергии, которое происходит, когда электрон присоединяется к нейтральному атому газа. Чем отрицательнее значение сродства к электрону, тем выше сродство атома к электронам.
Рисунок \(\PageIndex{5}\): Периодическая таблица, показывающая тренд сродства к электрону Сродство к электрону обычно уменьшается вниз по группе элементов, потому что каждый атом больше, чем атом над ним (это тренд атомного радиуса, обсуждаемый ниже). Это означает, что добавленный электрон находится дальше от ядра атома по сравнению с его положением в меньшем атоме. При большем расстоянии между отрицательно заряженным электроном и положительно заряженным ядром сила притяжения относительно слабее.Следовательно, сродство к электрону уменьшается. Двигаясь слева направо по периоду, атомы становятся меньше по мере того, как силы притяжения становятся сильнее. Это заставляет электрон двигаться ближе к ядру, тем самым увеличивая сродство к электрону слева направо по периоду.
Это означает, что добавленный электрон находится дальше от ядра атома по сравнению с его положением в меньшем атоме. При большем расстоянии между отрицательно заряженным электроном и положительно заряженным ядром сила притяжения относительно слабее.Следовательно, сродство к электрону уменьшается. Двигаясь слева направо по периоду, атомы становятся меньше по мере того, как силы притяжения становятся сильнее. Это заставляет электрон двигаться ближе к ядру, тем самым увеличивая сродство к электрону слева направо по периоду.
- Сродство к электрону увеличивается слева направо в пределах периода. Это связано с уменьшением атомного радиуса.
- Внутри группы сродство к электрону уменьшается сверху вниз. Это связано с увеличением атомного радиуса.
Тенденции атомного радиуса
Радиус атома равен половине расстояния между ядрами двух атомов (точно так же, как радиус равен половине диаметра окружности). Однако эта идея усложняется тем фактом, что не все атомы обычно связаны друг с другом одинаковым образом. Одни связаны ковалентными связями в молекулах, другие притягиваются друг к другу в ионных кристаллах, третьи удерживаются в металлических кристаллах. Тем не менее подавляющее большинство элементов могут образовывать ковалентные молекулы, в которых два одинаковых атома удерживаются вместе одинарной ковалентной связью.Ковалентные радиусы этих молекул часто называют атомными радиусами. Это расстояние измеряется в пикометрах. Модели атомного радиуса наблюдаются во всей периодической таблице.
Одни связаны ковалентными связями в молекулах, другие притягиваются друг к другу в ионных кристаллах, третьи удерживаются в металлических кристаллах. Тем не менее подавляющее большинство элементов могут образовывать ковалентные молекулы, в которых два одинаковых атома удерживаются вместе одинарной ковалентной связью.Ковалентные радиусы этих молекул часто называют атомными радиусами. Это расстояние измеряется в пикометрах. Модели атомного радиуса наблюдаются во всей периодической таблице.
Размер атома постепенно уменьшается слева направо по периоду элементов. Это связано с тем, что в пределах периода или семейства элементов все электроны добавляются к одной и той же оболочке. Однако в то же время к ядру добавляются протоны, что делает его более положительно заряженным. Эффект увеличения числа протонов больше, чем эффект увеличения числа электронов; следовательно, существует большее ядерное притяжение.Это означает, что ядро сильнее притягивает электроны, притягивая оболочку атома ближе к ядру. Валентные электроны удерживаются ближе к ядру атома. В результате атомный радиус уменьшается.
Валентные электроны удерживаются ближе к ядру атома. В результате атомный радиус уменьшается.
D принадлежит группе , атомный радиус увеличивается. Валентные электроны занимают более высокие уровни из-за увеличения квантового числа (n). В результате валентные электроны удаляются от ядра по мере увеличения «n».Экранирование электронов предотвращает притяжение этих внешних электронов к ядру; таким образом, они удерживаются слабо, и результирующий атомный радиус велик.
- Атомный радиус уменьшается слева направо в течение периода. Это вызвано увеличением числа протонов и электронов за период. Один протон имеет больший эффект, чем один электрон; таким образом, электроны притягиваются к ядру, что приводит к меньшему радиусу.
- Атомный радиус увеличивается сверху вниз внутри группы.Это происходит из-за электронного экранирования.
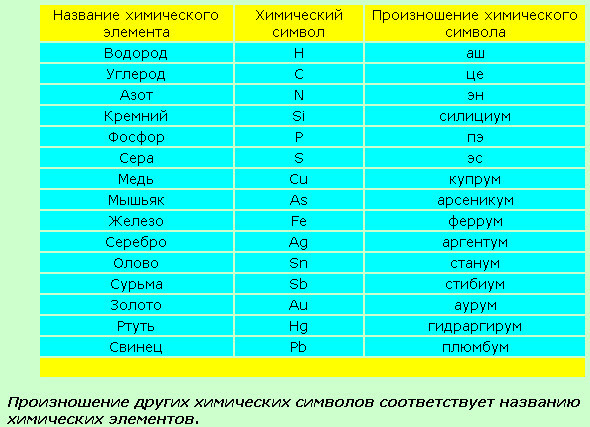
Тенденции точки плавления
Температура плавления — это количество энергии, необходимое для разрыва связи (связей) для превращения твердой фазы вещества в жидкость. Как правило, чем прочнее связь между атомами элемента, тем больше энергии требуется для разрыва этой связи. Поскольку температура прямо пропорциональна энергии, высокая энергия диссоциации связи коррелирует с высокой температурой. Точки плавления различны и обычно не образуют различимой тенденции в периодической таблице.Однако из рисунка \(\PageIndex{7}\) можно сделать определенные выводы.
- Металлы обычно имеют высокую температуру плавления .
- Большинство неметаллов имеют низкую температуру плавления .
- Неметалл углерод обладает самой высокой температурой плавления среди всех элементов . Полуметаллический бор также обладает высокой температурой плавления.
Тенденции металлического характера
Металлический характер элемента можно определить как легкость, с которой атом может потерять электрон. Справа налево по периоду металлический характер усиливается, потому что притяжение между валентным электроном и ядром слабее, что облегчает потерю электронов. Металлический характер усиливается по мере продвижения вниз по группе, потому что увеличивается размер атома. Когда размер атома увеличивается, внешние оболочки удаляются. Главное квантовое число увеличивается, а средняя электронная плотность перемещается дальше от ядра. Электроны валентной оболочки имеют меньшее притяжение к ядру и, как следствие, могут легче терять электроны.Это вызывает усиление металлического характера.
Справа налево по периоду металлический характер усиливается, потому что притяжение между валентным электроном и ядром слабее, что облегчает потерю электронов. Металлический характер усиливается по мере продвижения вниз по группе, потому что увеличивается размер атома. Когда размер атома увеличивается, внешние оболочки удаляются. Главное квантовое число увеличивается, а средняя электронная плотность перемещается дальше от ядра. Электроны валентной оболочки имеют меньшее притяжение к ядру и, как следствие, могут легче терять электроны.Это вызывает усиление металлического характера.
- Металлические характеристики уменьшаются слева направо по периоду. Это вызвано уменьшением радиуса (вызванного Z eff , как указано выше) атома, что позволяет внешним электронам легче ионизироваться.
- Металлические характеристики увеличиваются вниз по группе. Электронное экранирование вызывает увеличение атомного радиуса, поэтому внешние электроны ионизируются легче, чем электроны в более мелких атомах.
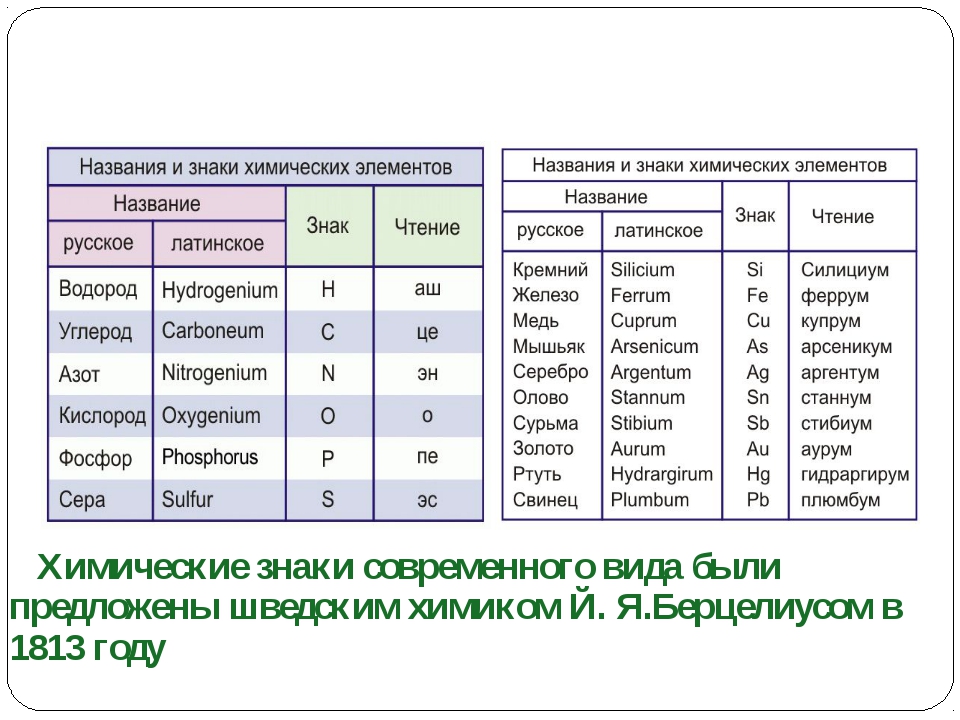
- Металлический характер относится к способности терять электроны, а неметаллический характер относится к способности приобретать электроны.
Другой более простой способ запомнить тенденцию металлического характера состоит в том, что при движении влево и вниз к нижнему левому углу периодической таблицы металлический характер увеличивается в направлении групп 1 и 2, или групп щелочных и щелочноземельных металлов . Точно так же, двигаясь вверх и вправо к верхнему правому углу таблицы Менделеева, металлический характер уменьшается, потому что вы проходите по правой стороне лестницы, которая указывает на неметаллов .К ним относятся Группа 8, благородные газы и другие распространенные газы, такие как кислород и азот.
- Другими словами:
- Переместиться влево по периоду и вниз по группе: увеличить металлический характер (в сторону щелочных и щелочных металлов)
- Перемещение вправо по периоду и вверх по группе: уменьшение металлического характера (в сторону неметаллов, таких как благородные газы)
Проблемы
Следующая серия задач проверяет общее понимание вышеупомянутого материала.
1. Основываясь на периодических трендах энергии ионизации, какой элемент имеет наибольшую энергию ионизации?
- Фтор (F)
- Азот (N)
- Гелий (Не)
2.) Азот имеет больший атомный радиус, чем кислород.
- А.) Правда
- Б.) Ложь
3.) Что имеет более металлический характер, свинец (Pb) или олово (Sn)?
4.) Какой элемент имеет более высокую температуру плавления: хлор (Cl) или бром (Br)?
5.) Какой элемент более электроотрицательный, сера (S) или селен (Se)?
6) Почему значение электроотрицательности большинства благородных газов равно нулю?
7) Расположите эти атомы в порядке убывания эффективного заряда ядра на валентные электроны: Si, Al, Mg, S
8) Перепишите следующий список в порядке убывания сродства к электрону: фтор (F), фосфор (P), сера (S), бор (B).
9) Атом с атомным радиусом меньшим, чем у серы (S), является __________.
- А.) Кислород (О)
- Б.) Хлор (Cl)
- С.) Кальций (Ca)
- D.) Литий (Li)
- E.) Ничего из вышеперечисленного
10) Неметалл имеет меньший ионный радиус по сравнению с металлом того же периода.
- А.) Верно Б.) Неверно
Решения
1. Ответ: C.) Гелий (He)
Пояснение: Гелий (He) имеет наибольшую энергию ионизации, потому что, как и у других благородных газов, валентная оболочка гелия заполнена.Следовательно, гелий стабилен и с трудом теряет или приобретает электроны.
2. Ответ: A.) Верно
Объяснение: Радиус атома увеличивается справа налево в периодической таблице. Следовательно, азот больше кислорода.
3. Ответ: Свинец (Pb)
Объяснение: Свинец и олово находятся в одном столбце. Металлический характер увеличивается вниз по столбцу. Свинец находится под оловом, поэтому свинец имеет более металлический характер.
4. Ответ: Бром (Br)
Пояснение: В неметаллах температура плавления увеличивается вниз по столбцу. Поскольку хлор и бром находятся в одной колонке, бром имеет более высокую температуру плавления.
Поскольку хлор и бром находятся в одной колонке, бром имеет более высокую температуру плавления.
5. Ответ: Сера (S)
Пояснение: Обратите внимание, что сера и селен находятся в одной колонке. Электроотрицательность увеличивается вверх по столбцу. Это указывает на то, что сера более электроотрицательна, чем селен.
6. Ответ: Большинство благородных газов имеют полные валентные оболочки.
Объяснение: Из-за своей полной валентной электронной оболочки благородные газы чрезвычайно стабильны и с трудом теряют или приобретают электроны.
7. Ответ: S > Si > Al > Mg.
Пояснение: Электроны над закрытой оболочкой защищены закрытой оболочкой. S имеет 6 электронов над закрытой оболочкой, поэтому каждый чувствует притяжение 6 протонов в ядре.
8. Ответ: Фтор (F)>Сера (S)>Фосфор (P)>Бор (B)
Пояснение: Сродство к электрону обычно увеличивается слева направо и снизу вверх.
9. Ответ: C.) Кислород (O)
Объяснение: Периодические тренды показывают, что атомный радиус увеличивается вверх по группе и слева направо по периоду.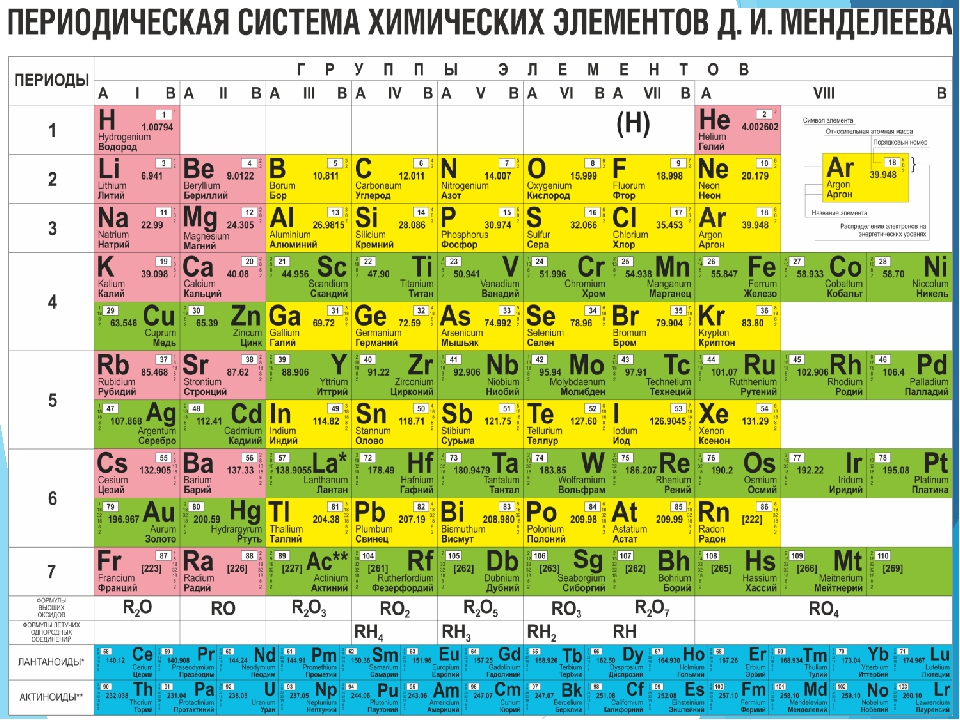 Поэтому кислород имеет меньший атомный радиус серы.
Поэтому кислород имеет меньший атомный радиус серы.
10. Ответ: B.) Неверно
Объяснение: Причина этого заключается в том, что металл обычно теряет электрон, превращаясь в ион, а неметалл приобретает электрон. Это приводит к меньшему ионному радиусу для иона металла и большему ионному радиусу для иона неметалла.
Ссылки
- Пинто, Габриэль. «Использование мячей различных видов спорта для моделирования изменения размеров атомов». Дж.хим. Образовательный 1998 75 725.{cke_protected}{C}
- Куреши, Пушкин М.; Камунпури, С. Икбал М. «Сольватация ионов: проблема ионных радиусов». J. Chem. Образовательный 1991 , 68 , 109.
- Смит, Дерек В. «Энтальпии атомизации металлических элементарных веществ с использованием полуколичественной теории ионных твердых тел: простая модель для рационализации периодических тенденций». J. Chem. Образовательный 1993 , 70 , 368.

- Руссо, Стив и Майк Сильвер. Введение в химию. Сан-Франциско: Пирсон, 2007. .
- Петруччи, Ральф Х. и др. Общая химия: принципы и современные приложения. 9-е изд. Нью-Джерси: Пирсон, 2007. .
- Аткинс, Питер и др. al, Physical Chemistry , 7 th Edition, 2002, W.H Freeman and Company, New York, pg. 390.
- Альберти, Роберт А. и др. al, Physical Chemistry , 3 rd Edition, 2001, John Wiley & Sons, Inc, pg.380.
- Котс, Джон К. и др. al, Chemistry & Chemical Reactivity , 5 th Edition, 2003, Thomson Learning Inc, pg. 305-309.
Авторы и авторство
- Света Рамиредди (UCD), Бинъяо Чжэн (UCD), Эмили Нгуен (UCD)
Это элементарно — Периодическая таблица элементов
Периодическая таблица элементов
| Перечислено по химическому названию | Перечислены по атомному номеру | Перечислены по химическому символу | Водород1H Гелий-2He Литий3Li Бериллий4Be Бор5Б Углерод6C Азот7N Кислород8O Фтор9F Неон10Ne Натрий11Na Магний12Mg Алюминий13Al Кремний14Si Фосфор15P Сера16S Хлор17Cl Аргон18Ar Калий19K Кальций20Ca Скандий21Sc Титан22Ti Ванадий23В Хром24Cr Марганец25Mn Железо26Fe Кобальт27Co Никель28Ni Медь29Cu Цинк30Zn Галлий-31Ga Германий32Ge Мышьяк33As Селен34Se Бром35Br Криптон36Кр Рубидий37Rb Стронций38Sr Иттрий39Y Цирконий40Zr ниобий41Nb Молибден42Mo Технеций43Tc Рутений44Ru Родий45Rh Палладий46Pd Silver47Ag Кадмий48Cd Индий49В Олово50Sn Сурьма51Sb Теллур52Те Йод53I Ксенон54Хе Цезий55Cs Барий56Ba Лантан57La Церий58Ce Празеодим59Pr Неодим60Nd Прометий61Pm Самарий62см Европий63Eu Гадолиний-64Gd Тербий65Tb Диспрозий66Dy Холмиум67Хо Эрбий68Er Тулий69Tm Иттербий70Yb Лютеций71Lu Гафний72Hf Тантал73Ta Вольфрам74Вт Рений75Re Осмий76Os Иридий77Ir Платина78Pt Золото79Au Меркурий80Hg Таллий81Tl Lead82Pb Висмут83Би Полоний84Po Астатин85Ат Радон86Рн Франций87Fr Радий88Ra Актиний89Ac Торий90Th Протактиний91Па Уран-92U Нептуний93Np Плутоний-94Pu Америций95Am Куриум96см Берклиум97Бк Калифорния98Cf Эйнштейний99Es Фермиум100FM Менделевиум101Md Нобелий102Нет Лоуренсиум103Lr Резерфордий104Rf Дубний105Дб Сиборгиум106Sg Бориум107Bh Хассиум108Hs Мейтнериум109Mt Дармштадтиум110Ds Рентгений111Rg Копернициум112Cn Нихоний113Nh Флеровиум114Fl Московиум115Mc Ливермориум116Lv Теннессин117Ц Оганесон118OgСкачать версию для печати Периодической таблицы элементов в формате PDF:
— Цвет: базовый/расширенный
— Черно-белый: базовый/расширенный
Доступны следующие онлайн-игры на основе Периодической таблицы элементов:
— Флэш-карты Element
— Элемент Палач
— Соответствие элементов
— Математика элементов
— Элемент кроссвордов
— Концентрация элемента
— Балансировка элементов
— Скремблирование слова элемента
Доступны следующие бумажные действия:
— Элемент БИНГО
— Элемент поиска слов
В дополнение к информации, содержащейся в Периодической таблице элементов, следующие статьи могут быть полезны, если вы пишете отчет об элементе или создаете модель атома:
— Как рассчитать количество протонов, нейтронов и электронов в атоме элемента
— Как сделать модель атома
— Как нарисовать атом (видео)
— Как читать схему электронной конфигурации
— Список тех, кто открыл каждый элемент
Информация на этом сайте собрана из нескольких источников.

 «Цветик-семицветик». (7 баллов)
«Цветик-семицветик». (7 баллов)