Тест по химии на тему «строение электронных оболочек атомов» (8 класс)
Строение электронных оболочек атомов
Вопрос №1
Какая модель строения атома была принята в хх веке
A) радиусная
B) кругосветная
C) радиальная
D) планетарная
Вопрос №2
Чему равно число электронов в оболочке атома
A) числу нейтронов
B) числу протонов
C) массовому числу
D) числу календаря
Вопрос №3
Чему равно число заполняемых электронами энергетических уровней в атоме
A) номеру группы
B) номеру периода
C) порядковому номеру
D) номеру квартиры
Вопрос №4
Чему равно число электронов на внешнем энергетическом уровне элементов главных подгрупп
A) номеру группы
B) номеру периода
C) номеру подгруппы
D) номеру банковской ячейки
Вопрос №5
Какое количество электронов на S-орбитали
A) 8
B) 6
C) 4
D) 2
Правильные ответы, решения к тесту:
Вопрос №1
Правильный ответ — D
Решение: В начале хх века былапринята планетарная модель строения атома, согласно которой вокруг очень малого по размерам положительного ядра движутся электроны, подобно тому как вращаются планеты вокруг Солнца.
Вопрос №2
Правильный ответ — B
Решение: Число электронов в оболочке атома равно числу протонов в ядре атома, ему соответствует порядковый номер элемента в ПСХЭ Д.И. Меделеева
Вопрос №3
Правильный ответ — B
Решение: Число заполняемых электронами энергетических уровней в атоме равно номеру периода в ПСХЭ Д.И.Менделеева.
Вопрос №4
Правильный ответ — A
Решение: Число электронов на внешнем энергетическом уровне для элементов главных подгрупп равно номеру группы
Вопрос №5
Правильный ответ — D
Решение: На S-орбитали может быть только два электрона. Исключение составляет водород, у него один электрон
Интерактивный тест «Строение электронных оболочек атомов»
Всероссийский дистанционный конкурс для педагогов на лучшую методическую разработку интерактивного теста по предметам естественнонаучного цикла педагогического сообщества «УРОК.РФ»Методическая разработка
Учебно-дидактический материал
Интерактивный тест «Строение электронных оболочек атомов»
Пояснительная записка
Автор: Маланина Е. А. учитель химии
А. учитель химии
Образовательное учреждение: МБОУ Одинцовская гимназия № 13,
Московская область
Предмет: химия
Возрастная категория: 8-9 класс
Тема: Строение электронных оболочек атомов
Техническое оснащение (в зависимости от формы организации работы):
Фронтальная работа: мультимедийный проектор, экран или интерактивная доска, компьютер. Индивидуальная работа: персональные компьютеры для учащихся.
Цель создания интерактивного теста: Систематизация знаний по теме «Строение электронных оболочек атомов»
Ссылка на интерактивный тест-видео: https://www.learnis.ru/163466/
Описание мультимедийного ресурса.
Цифровой образовательный ресурс выполнен на образовательной платформе Learnis https://www.learnis.ru/. Основатель и разработчик образовательной платформы Learnis — Новиков Максим Юрьевич, Лауреат конкурса «Учитель года России — 2018» https://www. learnis.ru/about-us.html
learnis.ru/about-us.html
Цифровой образовательный ресурс «Строение электронных оболочек атомов» представляет видеоматериал длительностью 05:40 минут сайта http://videouroki.net расположенный на сервисе YouTube по ссылке https://www.youtube.com/watch?v=vCXaOtQx-h0
Доступ к интерактивному тест-видео учащиеся получают по ссылке. Для прохождения теста необходимо зарегистрироваться, указав фамилию, имя и класс. В тот же момент открывается интерактивный тест-видео. В видео включены 8 тестовых вопросов составленные по содержанию темы видео. На определенном временном отрезке видео останавливается и учащемуся предлагается тестовый вопрос.
После ответа на вопрос воспроизведение видео продолжится. Варианты тестовых вопросов: одиночный выбор, множественный выбор, свободный ответ. Длительность выполнения работы не ограничена, количество попыток не ограничено. После выполнения теста учащемуся предоставляются итоги
В личном кабинете учителя будет отражен результат учащегося.
ЦОР можно использовать при фронтальном опросе в классе при повторении изученного материала.
Достоинства
Использование имеющихся видео на сервисе YouTube . Возможность использования собственного видео, размещенного на сервисе YouTube. Интерактивное тест-видео предполагает активную деятельность учащегося в процессе просмотра видеоматериала. Активная деятельность включает получение дополнительной информации по теме, ответы на вопросы в просмотре учебного материала. Учащийся может пройти тест-видео повторно, исправив ошибки. Интерактивное тест-видео можно использовать: как источник информации, для организации практической работы, при подготовке к «перевернутому» уроку, для получения новых знаний, в качестве домашнего задания, в качестве контроля знаний.
Недостатки
Учащийся может использовать неверные личные данные. Прохождение интерактивного тест-видео не ограничено по времени.
Данный интерактивный тест-видео был использован в период дистанционного обучения в качестве домашнего задания для учащихся 8-х классов при изучении темы «Периодический закон и периодическая система химических элементов Д. И. Менделеева».
Задания и ответы интерактивного тест-видео «Строение электронных оболочек атомов» https://www.learnis.ru/163466/
Временной отрезок видео | Содержание вопроса, верные ответы |
00:16 | Вопрос 1. (множественный выбор) Атом состоит из: положительно заряженных электронов; отрицательно заряженного ядра; положительно заряженных нейтронов, вращающихся вокруг ядра; положительно заряженного ядра в центре; отрицательно заряженных электронов, вращающихся вокруг ядра; положительно заряженных протонов, вращающихся вокруг ядра. |
00:46 | Вопрос 2. (одиночный выбор) Чему равно число электронов в атоме? числу нейтронов номеру периода номеру группы числу протонов в ядре |
01:37 | Вопрос 3. (одиночный выбор) Как определить число энергетических уровней в атоме? по числу нейтронов в атоме по номеру периода по числу протонов в атоме по номеру группы по числу электронов в атоме |
01:54 | Вопрос 4. (одиночный выбор) Укажите число энергетических уровней в атоме селена 4 5 6 3 |
02:34 | Вопрос 5. Укажите правильное распределение электронов в атомах химических элементов +12Mg )2 )8 )2 +6 C ) 2) 4 +18 Ar )8 )8 )2 +16O )2 )8 )6 +4 Be )2 )2 +15P )3 )7 )5 |
03:47 | Вопрос 6. (множественный выбор) Укажите атомы химических элементов, содержащие 4 электрона на внешнем энергетическом уровне C K Zn Si Sn Mn V |
04:41 | Вопрос 7. (множественный выбор) Какие орбитали существуют? s a b p d y r |
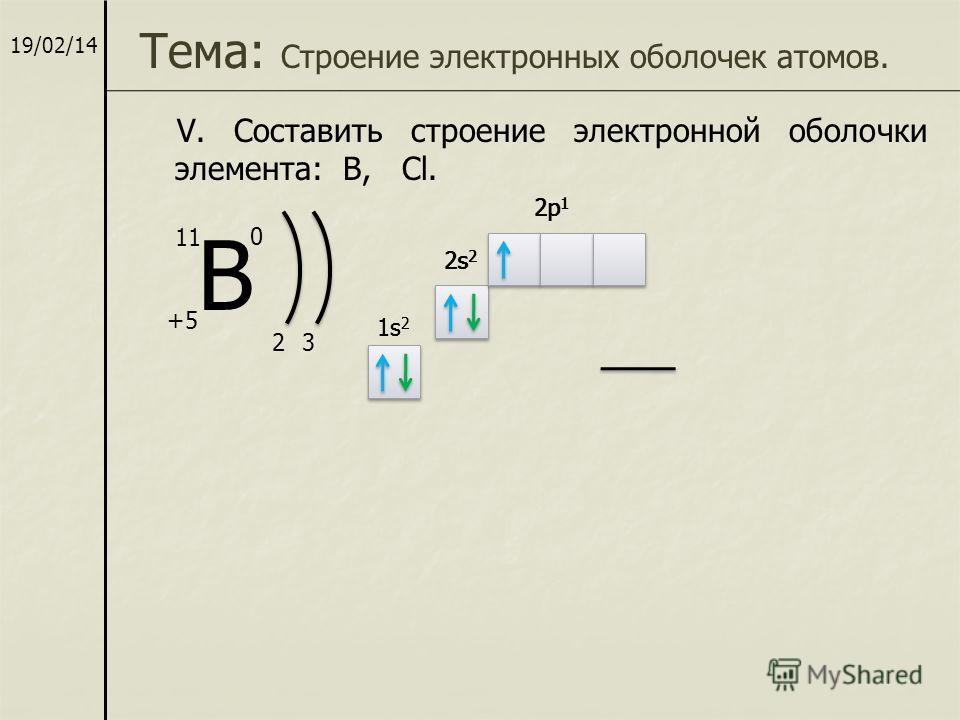
05:11 | Вопрос 8. Укажите правильное распределение электронов в атоме бора по образцу для азота +7N 1s(2) 2s(2) 2p(3), где цифры в скобках — это число электронов на орбитали +5B 1s(2) 2s(2) 2p(1) +5B 1s(2) 2s(2) 2p(3) +5B 1s(3) 2s(1) 2p(1) |
Подготовка к ЕГЭ по химии.Тематический тест №1
Электронная конфигурация атома. Строение электронных оболочек. s-, p-, d-, f-элементы
Данный онлайн-тест — первый из серии тематических тестов по химии для подготовки к ЕГЭ. Вам предстоит ответить на несколько вопросов, которые могут встретиться на реальном ЕГЭ по химии.
Тематика данного теста соответствует тематике задания №1, предлагаемого в вариантах «настоящего» ЕГЭ. Обсуждаются следующие темы: «Строение атома», «Строение электронных оболочек атомов», «s-, p-, d- f- элементы», «Основное и возбужденное состояния атомов», «Распределение электронов по уровням».
Чтобы сделать этот тест интересным для абитуриентов с разным уровнем подготовки, я разделил его на три части. Первые пять вопросов — самые легкие. Они предназначены для тех, кто готовится к ЕГЭ по химии «с нуля». Вопросы 6 — 10 чуть сложнее — для выпускников «обычных» школ, добросовестно изучавших курс химии в течение 3 — 4 лет.
Задания 11-15 — наиболее сложные. Их уровень существенно выше уровня ЕГЭ. На вопросы 11 — 15 интересно будет отвечать тем ребятам, которые готовятся к олимпиадам по химии, мечтают сдать ЕГЭ на 90 — 100 баллов.
Не пытайтесь решать все задания, выбирайте те, которые будут интересны именно вам. Если вы только начинаете изучение химии, ограничьтесь первыми пятью задачами. Если вы учитесь в специализированном химическом классе, попробуйте пройти III часть теста.
Как интерпретировать результаты тестов?
Если вы набираете 4-5 баллов в первой части теста и 4-5 баллов во второй, можете считать, что тема «Строение электронных оболочек атомов» усвоена вами отлично. Если во второй части вы сможете решить правильно менее 4 заданий, советую еще немного поработать над данной темой.
Если во второй части вы сможете решить правильно менее 4 заданий, советую еще немного поработать над данной темой.
Если вы не только легко справились с задачами 1-10, но и набрали хотя бы 3 балла в III части теста, положительная оценка на ЕГЭ за задание №1 гарантирована!
Другие материалы для подготовки к ЕГЭ по химии
Если вас интересуют полные тесты ЕГЭ или ОГЭ (ГИА) по химии или другие тематические тесты, рекомендую обратить внимание на следующие ссылки:
Тематический тест № 3 (подготовка к ЕГЭ по химии)Тематический тест № 5 (подготовка к ЕГЭ по химии)
Тематический тест № 8 (подготовка к ЕГЭ по химии)
Тематический тест № 14 (подготовка к ЕГЭ по химии)
Тест для подготовки к ОГЭ по химии (№ 1)
Тест для подготовки к ОГЭ по химии (№ 2)
Тест для подготовки к ЕГЭ по химии (№ 1)
Тест для подготовки к ЕГЭ по химии (№ 2)
Тест для выпускников, готовящихся к ЕГЭ (I часть)
Тест для выпускников, готовящихся к ЕГЭ (II часть)
Тест для выпускников, готовящихся к ЕГЭ (III часть)
Желаю всем успехов на экзаменах по химии!
Тест II уровня
Тест III уровня
Тест по химии на тему «Строение атома» » 4ЕГЭ
9 класс.
stroenie-atoma.pdf
Вопрос №1
В периодической системе, химический элемент со строением электронной оболочки 2e, 8e, 8e, 1e находится
A) в 4-м периоде,IIA группе
B) в 3-м периоде, IIБ группе
C) во 2-м периоде, IV Б группе
D) в 4-м периоде, I А группе
Вопрос №2
Как будет распределение электронов по электронным слоям атома кремния?
A) 2e, 4e
B) 2e, 2e, 2e
C) 2e, 4e
D) 2e, 4e, 2e
Вопрос №3
Число электронных слоев и число электронов во внешнем слое в атоме хлора равны соответственно:
A) 6 и 4
B) 2 и 5
C) 3 и 7
D) 4 и 5
Вопрос №4
Химическому элементу, в атоме которого распределение электронов по слоям 2e, 8e, 5e соответствуют симол элемента, формула высшего оксида и водородного соединения:
A) Cl, Cl2O, HCl
B) N, N2O5, Nh4
C) P, P2O5, Ph4
D) C, CO2, Ch5
Вопрос №5
Химический элемент имеет распределение электронов в атоме: 2e, 8e, 4e Каково будет его водородное соединение?
A) Ch5
B) Nh4
C) Sih5
D) h3S
Вопрос №6
Химический элемент, в котором содержится 7 электронов:
A) неон
B) сера
C) азот
D) кремний
Вопрос №7
В атоме серы общее число электронов и число электронных слоев соответственно равны:
A) 14 и 3
B) 16 и 3
C) 16 и 2
D) 32 и 3
Вопрос №8
Химический элемент, в ядре которого содержится 13 протонов:
A) алюминий
B) натрий
C) азот
D) бор
Вопрос №9
Химический элемент, на внешнем электронном слое которого находится пять электронов, образует водородное соединение, формула которого
A) НЭ
B) Н2Э
C) Н3Э
D) Н4Э
Вопрос №10
Химический элемент, атом которого имеет распределение по электронным слоям 2е, 8е, 8е, 2е, в периодической системе Д. И.Менделеева находится в периоде, номер которого
И.Менделеева находится в периоде, номер которого
A) 1
B) 2
C) 3
D) 4
Ответы
Вопрос №1 — D
Вопрос №2 — C
Вопрос №3 — C
Вопрос №4 — A
Вопрос №5 — C
Вопрос №6 — C
Вопрос №7 — B
Вопрос №8 — A
Вопрос №9 — C
Вопрос №10 — D
Презентация «Тест по теме» Строение атома»»
библиотека
материалов
Номер слайда 1
Тесты по химии, 8 класс Тема. Строение атома
Номер слайда 2
Тест 1.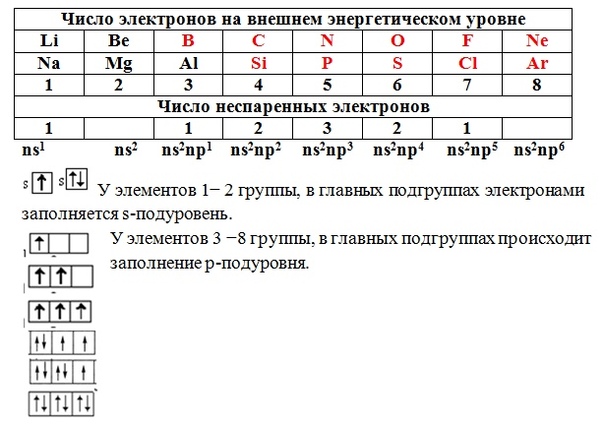 Выберите правильные суждения. Номера верных суждений отметьте знаком +, а неверных знаком —
Выберите правильные суждения. Номера верных суждений отметьте знаком +, а неверных знаком —Номер слайда 3
1.В переводе с греческого атом означает «неделимый»
2. Заряд ядра определяется по порядковому номеру элемента
Заряд ядра определяется по порядковому номеру элемента
Номер слайда 5
3.В ядре атома кислорода 8 протонов
Номер слайда 64. В атоме магния 2 энергетических уровня
В атоме магния 2 энергетических уровня
Номер слайда 7
Номер слайда 8
6. На втором энергетическом уровне максимально может находиться 18 электронов
На втором энергетическом уровне максимально может находиться 18 электронов
7.При изменении числа нейтронов в атоме образуется изотоп
Номер слайда 10
8. Количество электронов в атоме определяется по номеру группы
Количество электронов в атоме определяется по номеру группы
9.На внешнем уровне атома фосфора(№15) находится 5 электронов
Номер слайда 12
10. В атоме кремния 14 электронов
В атоме кремния 14 электронов
Номер слайда 13
Тест № 2 Допишите пропущенные слова
Номер слайда 14
1. Число протонов в ядре атома определяется по……
Число протонов в ядре атома определяется по……
Номер слайда 15
2.Число энергетических уровней в атоме определяется по ……..
Номер слайда 16
3. Совокупность атомов с одинаковым зарядом ядра —
Совокупность атомов с одинаковым зарядом ядра —
Номер слайда 17
4.Распределение электронов по уровням 2,8,3 имеет атом…..
Номер слайда 18
5. В ядре атома натрия (№11) содержится ….. нейтронов
В ядре атома натрия (№11) содержится ….. нейтронов
Номер слайда 19
6.Сумму чисел протонов и нейтронов называют……
Номер слайда 20
Ответы Тест 1 1+, 2+, 3+, 4- , 5-, 6-, 7+, 8-, 9+, 10+ Тест 2. 1.порядковому номеру элемента 2.номеру периода 3.изотоп 4.алюминия 5. 12 6.массовое число
1.порядковому номеру элемента 2.номеру периода 3.изотоп 4.алюминия 5. 12 6.массовое число
| 1. |
Металлические свойства
Сложность: лёгкое |
1 |
2.
|
Элементы одного периода
Сложность: лёгкое |
1 |
| 3. |
Свойства металлов и неметаллов
Сложность: среднее |
1 |
4.
|
Изменение свойств в периоде
Сложность: среднее |
1 |
| 5. |
Относительные атомные массы
Сложность: среднее |
2 |
6.
|
Сущность и значение Периодического закона
Сложность: среднее |
2 |
| 7. |
Высшие валентности элементов
Сложность: сложное |
3 |
8.
|
Установи последовательность элементов
Сложность: сложное |
3 |
| 9. |
Общие формулы высших оксидов и водородных соединений
Сложность: сложное |
3 |
Обзор химии / Учебное пособие
Учебное пособие
|
1. Элемент
2. Символ
3. Символ
4. Ядро
5. Электронная оболочка
6. Облако
7. Субатом Частицы
8. Протон
9. Neuton
10. Электрон
11. Атомный номер
12. Атомный вес
13. Масса №
Краткий ответ
14.Какие две субатомные частицы имеют одинаковый размер?
15. Какие две субатомные частицы имеют одинаковое расположение?
16. Какие две субатомные частицы встречаются в равном количестве?
17.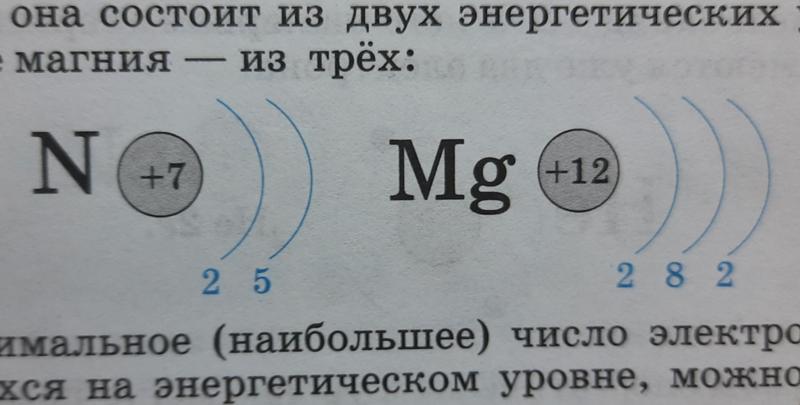 Почему ядро имеет положительный заряд?
Почему ядро имеет положительный заряд?
18. Почему атом нейтрален?
19. Сколько электронных оболочек может существовать в атоме?
20. Сколько электронов может содержать каждая из оболочек?
21. Какая оболочка имеет наименьшую энергию?
22. Какая оболочка имеет наибольшую энергию?
23.Какая оболочка ближе всего к ядру?
24. О чем говорит атомный номер?
25. О чем говорит атомный вес?
26. Включает ли атомный вес массу электронов? Объяснять.
27. Как рассчитать массовое число?
28. Как определить количество каждого из следующих элементов в атоме?
(A) протоны
(B) электроны
(C) нейтроны
29. Насколько протон больше электрона?
30.Сравните объем ядра с объемом атома.
31. Сравните массу ядра с массой атома.
32. Атом состоит в основном из
33. Как быстро движутся электроны?
34. Опишите два движения электрона:
35. Движутся ли электроны вокруг ядра, как планеты вокруг Солнца? Объяснять.
36. Как электроны могут переходить с одной оболочки на другую?
37. Какую форму могут иметь электронные оболочки?
38.Как представлены электронные оболочки?
39. Укажите расположение каждого из следующих веществ:
(A) ядро
(B) протон
(C) нейтрон
(D) электрон
40. Укажите размер каждого из следующих:
(A) ядро
(B) протон
(C) нейтрон
(D) электрон
(С) нейтрон
(Г) электрон
42.Что такое электростатическая сила? Какое значение это имеет для строения атома?
43. Объясните, почему атомы не коллапсируют.
электронная конфигурация | физика | Британика
электронная конфигурация , также называемая электронная структура , расположение электронов на энергетических уровнях вокруг атомного ядра. Согласно старой оболочечной модели атома, электроны занимают несколько уровней от первой оболочки, ближайшей к ядру, К, , до седьмой оболочки, Q, , самой дальней от ядра. С точки зрения более тонкой, квантово-механической модели, оболочки K – Q подразделяются на набор орбиталей ( см. орбиталь), каждая из которых может быть занята не более чем парой электронов. В таблице ниже указано количество орбиталей, доступных в каждой из первых четырех оболочек.
С точки зрения более тонкой, квантово-механической модели, оболочки K – Q подразделяются на набор орбиталей ( см. орбиталь), каждая из которых может быть занята не более чем парой электронов. В таблице ниже указано количество орбиталей, доступных в каждой из первых четырех оболочек.
Электронная конфигурация атома в оболочечной модели атома может быть выражена указанием числа электронов в каждой оболочке, начиная с первой. Например, у натрия (атомный номер 11) 11 электронов распределены в первых трех оболочках следующим образом: оболочки K и L полностью заполнены, с 2 и 8 электронами соответственно, а оболочка M только частично заполнен одним электроном.
Британская викторина
Физика и естественное право
Какая сила замедляет движение? Каждому действию есть равное и противоположное что? В этом викторине по физике нет ничего, что E = mc было бы квадратным.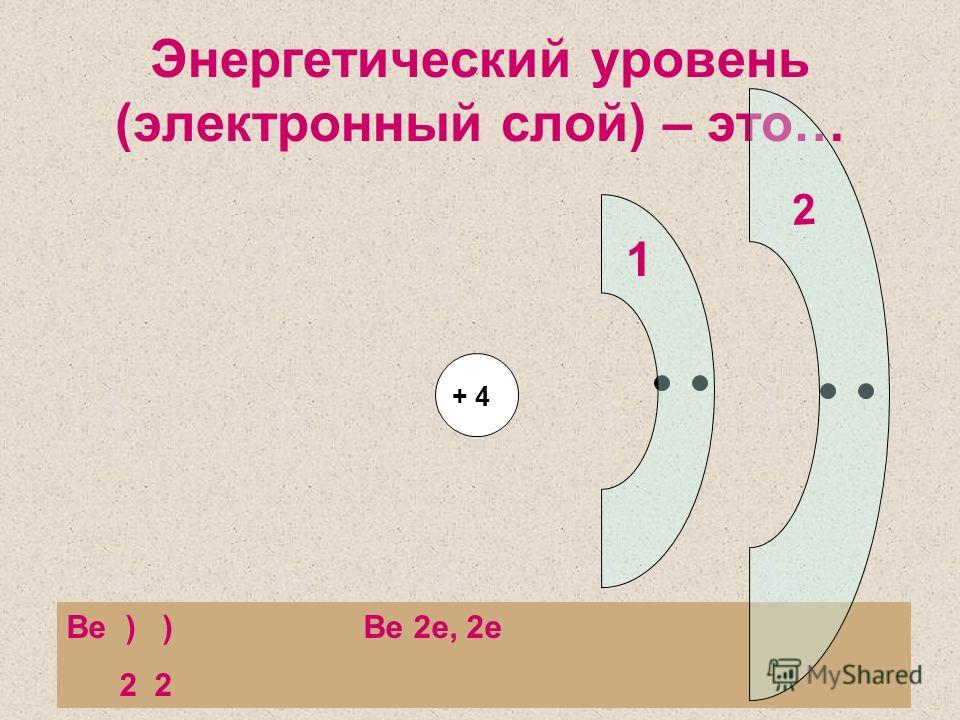
Электронная конфигурация атома в квантово-механической модели указывается путем перечисления занятых орбиталей в порядке заполнения, при этом количество электронов на каждой орбитали указывается верхним индексом.В этих обозначениях электронная конфигурация натрия будет выглядеть следующим образом: . Часто используется сокращенный метод, в котором перечислены только те электроны, которые превышают конфигурацию благородного газа, непосредственно предшествующую атому в периодической таблице. Например, у натрия на один 3 s электрон больше, чем у благородного газа неона (химический символ Ne, атомный номер 10), поэтому его сокращенное обозначение — [Ne]3 s 1 .
Элементы одной группы в периодической таблице имеют сходные электронные конфигурации. Например, элементы литий, натрий, калий, рубидий, цезий и франций (щелочные металлы группы I) имеют электронные конфигурации, в которых один электрон находится на самой внешней (наиболее слабо связанной) орбитали s .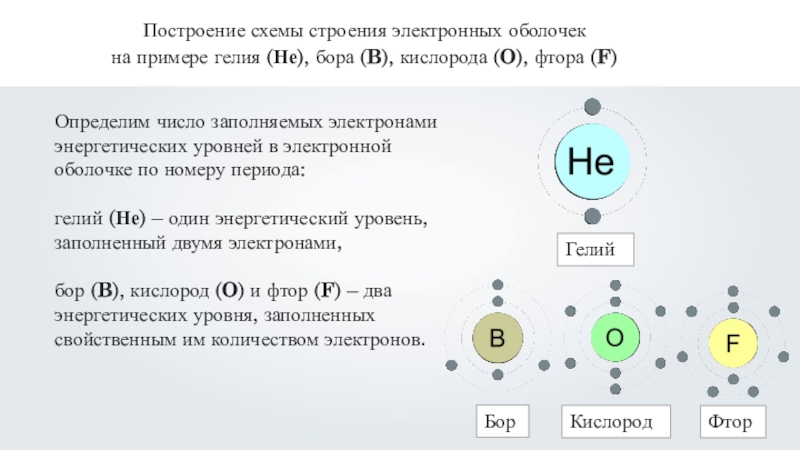 Этот так называемый валентный электрон отвечает за сходные химические свойства, присущие вышеупомянутым щелочным элементам группы I: яркий металлический блеск, высокую реакционную способность и хорошую теплопроводность.
Этот так называемый валентный электрон отвечает за сходные химические свойства, присущие вышеупомянутым щелочным элементам группы I: яркий металлический блеск, высокую реакционную способность и хорошую теплопроводность.
Структура материи
Существует большое перекрытие мира статического электричества и повседневного мира, который вы испытываете. Одежда кувыркается в сушилке и слипается. Вы идете по ковру, чтобы выйти из комнаты, и получаете удар дверной ручкой. В конце дня вы стягиваете шерстяной свитер и видите искры электричества. В засушливую зиму вы выходите из машины и получаете удар в дверь автомобиля, когда пытаетесь закрыть дверь. Видны искры электричества, когда вы стягиваете шерстяное одеяло с простыней своей кровати.Вы гладите кошачью шерсть и наблюдаете, как шерсть встает дыбом. Молнии несутся по вечернему небу во время весенней грозы. И самое трагичное, у тебя неудачный день с прической. Все это явления статического электричества — события, которые можно объяснить только пониманием физики электростатики.
Мало того, что электростатические явления пронизывают события повседневной жизни, без сил, связанных со статическим электричеством, жизнь, какой мы ее знаем, была бы невозможна.Электростатические силы — как притягивающие, так и отталкивающие по своей природе — удерживают мир атомов и молекул в идеальном равновесии. Без этой электрической силы материальные вещи не существовали бы. Атомы как строительные блоки материи зависят от этих сил. А материальные объекты, в том числе и мы, земляне, состоят из атомов, а акты стояния и ходьбы, осязания и осязания, обоняния и вкуса и даже мышления являются результатом электрического явления. Электростатические силы лежат в основе нашего существования.
Один из основных вопросов, которые необходимо задать в этом разделе «Класс физики»: как объект может быть заряжен и какое влияние этот заряд оказывает на другие объекты, находящиеся поблизости? Ответ на этот вопрос начинается с понимания строения материи. Понимание заряда как фундаментальной величины требует от нас понимания структуры атома. Итак, мы начинаем этот раздел с того, что многим студентам может показаться кратким обзором раздела из курса химии.
Итак, мы начинаем этот раздел с того, что многим студентам может показаться кратким обзором раздела из курса химии.
Поиски атома начались как философский вопрос. Именно естествоиспытатели Древней Греции начали поиски атома, задавая такие вопросы, как: из чего состоит веществ ? Какова структура материальных объектов? Существует ли базовая единица, из которой состоят все объекты? Еще в 400 году до нашей эры некоторые греческие философы предположили, что материя состоит из неделимых строительных блоков, известных как атомов .( Atomos в переводе с греческого означает неделимый.) Для этих древних греков материя не могла непрерывно разрушаться и делиться до бесконечности. Скорее, существовала базовая единица или строительный блок, неделимый и лежащий в основе его структуры. Этот неделимый строительный блок, из которого состоит вся материя, стал известен как атом.
Древние греки были просто философами. Они не проводили экспериментов для проверки своих теорий. На самом деле наука как экспериментальная дисциплина не стала заслуживающей доверия и популярной практикой лишь где-то в 1600-х годах.Таким образом, поиск атома оставался философским исследованием в течение нескольких тысячелетий. С 1600-х годов до настоящего века поиск атома стал экспериментальным занятием. Известны несколько ученых; среди них Роберт Бойл, Джон Далтон, Дж.Дж. Томсон, Эрнест Резерфорд и Нильс Бор.
Они не проводили экспериментов для проверки своих теорий. На самом деле наука как экспериментальная дисциплина не стала заслуживающей доверия и популярной практикой лишь где-то в 1600-х годах.Таким образом, поиск атома оставался философским исследованием в течение нескольких тысячелетий. С 1600-х годов до настоящего века поиск атома стал экспериментальным занятием. Известны несколько ученых; среди них Роберт Бойл, Джон Далтон, Дж.Дж. Томсон, Эрнест Резерфорд и Нильс Бор.
Исследования газообразных веществ, проведенные Бойлем (середина-конец 1600-х гг.), способствовали выдвижению идеи о существовании различных типов атомов, известных как элементы. Дальтон (начало 1800-х годов) провел множество экспериментов, чтобы показать, что различные элементы могут соединяться в фиксированных соотношениях масс с образованием соединений.Впоследствии Дальтон предложил одну из первых теорий поведения атомов, которая была подтверждена фактическими экспериментальными данными.
Английский ученый Дж. Дж. Опыты Томсона с катодными лучами (конец 19 в.) привели к открытию отрицательно заряженного электрона и первым представлениям о строении этих неделимых атомов. Томсон предложил модель сливового пудинга , предполагая, что структура атома напоминает любимый английский десерт — сливовый пудинг.Изюм, рассеянный среди сливового пудинга, аналогичен отрицательно заряженным электронам, погруженным в море положительного заряда.
Дж. Опыты Томсона с катодными лучами (конец 19 в.) привели к открытию отрицательно заряженного электрона и первым представлениям о строении этих неделимых атомов. Томсон предложил модель сливового пудинга , предполагая, что структура атома напоминает любимый английский десерт — сливовый пудинг.Изюм, рассеянный среди сливового пудинга, аналогичен отрицательно заряженным электронам, погруженным в море положительного заряда.
Почти через десять лет после Томсона знаменитые эксперименты Эрнеста Резерфорда с золотой фольгой привели к ядерной модели строения атома. Модель Резерфорда предполагала, что атом состоит из плотно упакованного ядра положительного заряда, известного как ядро , окруженного отрицательно заряженными электронами. Хотя ядро было уникальным для атома Резерфорда, еще более удивительным было предположение, что атом состоит в основном из пустого пространства.Большая часть массы была упакована в ядро, которое было аномально маленьким по сравнению с реальным размером атома.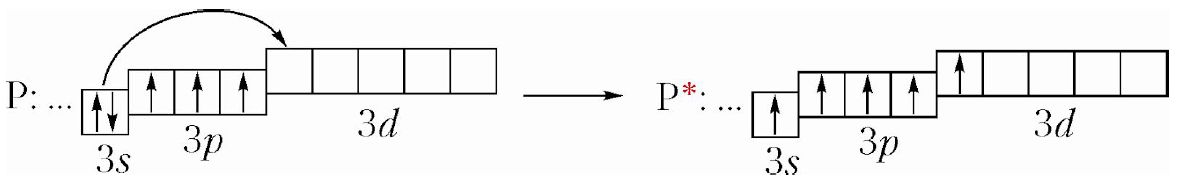
Нильс Бор усовершенствовал ядерную модель Резерфорда (1913 г.), объяснив, что электроны присутствуют на орбитах вне ядра. Электроны были ограничены определенными орбитами фиксированного радиуса, каждая из которых характеризовалась своими дискретными уровнями энергии. Хотя электроны могут быть перемещены с одной орбиты на другую, они никогда не смогут занимать пространство между орбитами.
Взгляд Бора на квантовые уровни энергии был предшественником современных квантово-механических взглядов на атомы. Математическая природа квантовой механики не позволяет обсуждать ее детали и ограничивает нас кратким концептуальным описанием ее особенностей. Квантовая механика предполагает, что атом состоит из множества субатомных частиц. Тремя основными субатомными частицами являются протон, электрон и нейтрон. Протон и нейтрон — самые массивные из трех субатомных частиц; они расположены в ядре атома, образуя плотное ядро атома.Протон заряжен положительно. Нейтрон не имеет заряда и называется нейтральным. Протоны и нейтроны тесно связаны друг с другом внутри ядра атома. За пределами ядра находятся концентрические сферические области пространства, известные как электронных оболочек . Оболочки являются домом для отрицательно заряженных электронов. Каждая оболочка характеризуется определенным энергетическим уровнем. Внешние оболочки имеют более высокие энергетические уровни и характеризуются меньшей устойчивостью. Электроны в более высоких энергетических оболочках могут перемещаться с вниз по к более низким энергетическим оболочкам; это движение сопровождается выделением энергии.Точно так же электроны в оболочках с более низкой энергией можно заставить двигаться к внешним оболочкам с более высокой энергией путем добавления энергии к атому. Если обеспечить достаточную энергию, электрон может быть удален из атома и освободиться от притяжения к ядру.
Протоны и нейтроны тесно связаны друг с другом внутри ядра атома. За пределами ядра находятся концентрические сферические области пространства, известные как электронных оболочек . Оболочки являются домом для отрицательно заряженных электронов. Каждая оболочка характеризуется определенным энергетическим уровнем. Внешние оболочки имеют более высокие энергетические уровни и характеризуются меньшей устойчивостью. Электроны в более высоких энергетических оболочках могут перемещаться с вниз по к более низким энергетическим оболочкам; это движение сопровождается выделением энергии.Точно так же электроны в оболочках с более низкой энергией можно заставить двигаться к внешним оболочкам с более высокой энергией путем добавления энергии к атому. Если обеспечить достаточную энергию, электрон может быть удален из атома и освободиться от притяжения к ядру.
Применение атомной структуры к статическому электричеству
Этот краткий экскурс в историю теории атома приводит к некоторым важным выводам о структуре материи, которые будут иметь огромное значение для нашего изучения статического электричества. Эти выводы кратко изложены здесь:
Эти выводы кратко изложены здесь:
- Все материальные объекты состоят из атомов. Существуют различные виды атомов, известных как элементы; эти элементы могут объединяться, образуя соединения. Различные соединения обладают совершенно разными свойствами. Материальные объекты состоят из атомов и молекул этих элементов и соединений, что обеспечивает различные материалы с различными электрическими свойствами.
- Атом состоит из ядра и обширной области пространства вне ядра.Электроны находятся в области пространства вне ядра. Они отрицательно заряжены и слабо связаны с атомом. Электроны часто удаляются из атома и присоединяются к нему в результате обычных повседневных процессов. Эти события находятся в центре внимания этого блока статического электричества в классе физики.
- Ядро атома содержит положительно заряженные протоны и нейтральные нейтроны. Эти протоны и нейтроны не могут быть удалены или возмущены обычными повседневными методами. Потребовалась бы какая-то форма высокоэнергетического ядерного явления, чтобы потревожить ядро и впоследствии вытеснить его положительно заряженные протоны.
 Эти высокоэнергетические явления, к счастью, не являются повседневным явлением, и они, конечно же, не являются предметом этого раздела «Класс физики». Одна несомненная истина этой единицы состоит в том, что протоны и нейтроны останутся внутри ядра атома. Электростатическое явление никогда нельзя объяснить движением протонов.
Эти высокоэнергетические явления, к счастью, не являются повседневным явлением, и они, конечно же, не являются предметом этого раздела «Класс физики». Одна несомненная истина этой единицы состоит в том, что протоны и нейтроны останутся внутри ядра атома. Электростатическое явление никогда нельзя объяснить движением протонов.
| Краткое описание субатомных частиц | ||
Протон | Нейтрон | Электрон |
В ядре Плотно связанные Положительный заряд Массивный | В ядре Плотно связанные Бесплатно Массивный | Вне ядра Слабосвязанный Отрицательный заряд Не очень массивный |
Различные явления будут обдуманы, исследованы и объяснены в ходе этого курса Статического Электричества.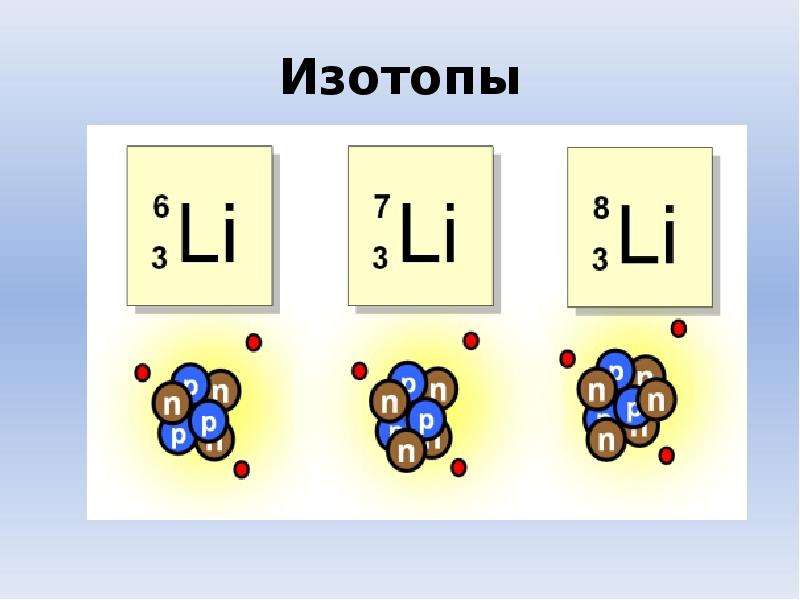 Каждое явление будет объяснено с использованием модели материи, описанной тремя приведенными выше утверждениями. Явления будут варьироваться от резинового воздушного шара, прилипшего к деревянной двери, до слипшейся одежды, которая упала в сушилку, до молнии, увиденной в вечернем небе. Каждое из этих явлений будет объяснено с точки зрения движения электронов — как внутри атомов и молекул материала, так и от атомов и молекул одного материала к атомам и молекулам другого. В следующем разделе урока 1 мы рассмотрим, как можно использовать движение электронов, чтобы объяснить, как и почему объекты приобретают электростатический заряд.
Каждое явление будет объяснено с использованием модели материи, описанной тремя приведенными выше утверждениями. Явления будут варьироваться от резинового воздушного шара, прилипшего к деревянной двери, до слипшейся одежды, которая упала в сушилку, до молнии, увиденной в вечернем небе. Каждое из этих явлений будет объяснено с точки зрения движения электронов — как внутри атомов и молекул материала, так и от атомов и молекул одного материала к атомам и молекулам другого. В следующем разделе урока 1 мы рассмотрим, как можно использовать движение электронов, чтобы объяснить, как и почему объекты приобретают электростатический заряд.
Проверьте свое понимание
Используйте свое понимание заряда, чтобы ответить на следующие вопросы. Когда закончите, нажмите кнопку, чтобы просмотреть ответы.
1. ____ — заряженные части атома.
а. Только электроны
б. Только протоны
в.
Только нейтронов
д.Электроны и нейтроны
эл. Электроны и протоны
ф. Протоны и нейтроны
Наука об электричестве – Управление энергетической информации США (EIA)
Все состоит из атомов
Чтобы понять электричество, полезно знать некоторые основные сведения об атомах.Атомы являются строительными блоками Вселенной. Все во Вселенной состоит из атомов — каждая звезда, каждое дерево и каждое животное. Человеческое тело состоит из атомов. Воздух и вода тоже состоят из атомов. Атомы настолько малы, что миллионы из них поместились бы на булавочной головке.
Атомы состоят из еще более мелких частиц
Центр атома называется ядром . Ядро состоит из частиц, называемых протонов и нейтронов . Электронов вращаются вокруг ядра в оболочках . Если бы ядро было размером с теннисный мяч, атом был бы размером со сферу диаметром около 1450 футов, или размером с один из крупнейших спортивных стадионов в мире. Атомы в основном пустое пространство.
Атомы в основном пустое пространство.
Если бы невооруженным глазом можно было увидеть атом, он немного напоминал бы крошечное скопление шаров, окруженных гигантскими невидимыми пузырями (или оболочек ). Электроны будут находиться на поверхности пузырьков, постоянно вращаясь и двигаясь, чтобы оставаться как можно дальше друг от друга.Электроны удерживаются в своих оболочках электрическими силами.
Протоны и электроны атома притягиваются друг к другу. Они оба несут электрический заряд . Протоны имеют положительный заряд (+), а электроны имеют отрицательный заряд (-). Положительный заряд протонов равен отрицательному заряду электронов. Противоположные заряды притягиваются друг к другу. Атом находится в равновесии, когда он имеет равное количество протонов и электронов.Нейтроны не несут заряда, и их количество может варьироваться.
Число протонов в атоме определяет вид атома, или элемента , которым он является. Элемент – это вещество, состоящее из атомов одного типа. Периодическая таблица элементов показывает элементы с их атомными номерами — количеством протонов, которые они имеют. Например, каждый атом водорода (Н) имеет один протон, а каждый атом углерода (С) имеет шесть протонов.
Периодическая таблица элементов показывает элементы с их атомными номерами — количеством протонов, которые они имеют. Например, каждый атом водорода (Н) имеет один протон, а каждый атом углерода (С) имеет шесть протонов.
Электричество — это движение электронов между атомами
Электроны обычно остаются на постоянном расстоянии от ядра атома в точных оболочках.Ближайшая к ядру оболочка может содержать два электрона. Следующий снаряд может вместить до восьми. Внешние оболочки могут вместить еще больше. Некоторые атомы с большим количеством протонов могут иметь до семи оболочек с электронами.
Электроны в ближайших к ядру оболочках обладают сильной силой притяжения к протонам. Иногда электроны в самых внешних оболочках атома не имеют сильной силы притяжения к протонам. Эти электроны могут быть вытолкнуты со своих орбит.Приложение силы может заставить их смещаться от одного атома к другому. Эти движущиеся электроны и есть электричество.
Статическое электричество существует в природе
Молния — это форма электричества.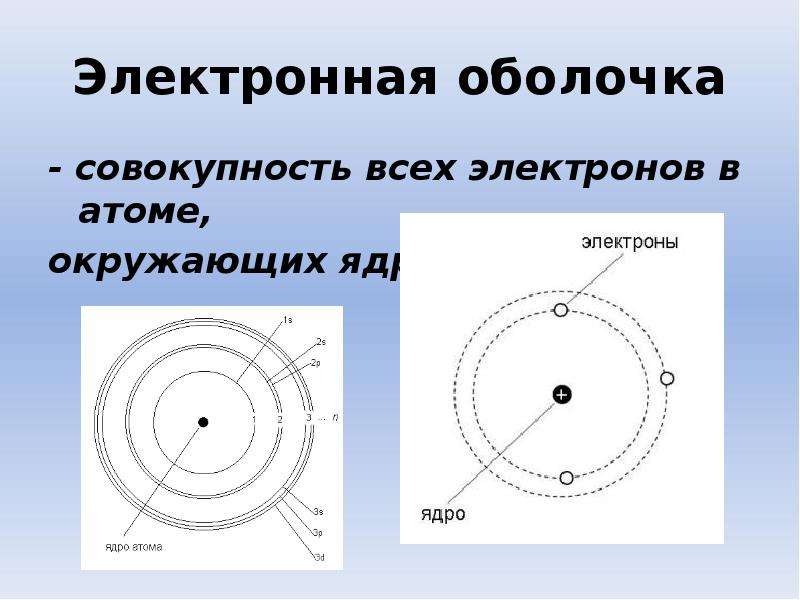 Молния — это электроны, перемещающиеся из одного облака в другое, или электроны, прыгающие из облака на землю. Испытывали ли вы когда-нибудь шок, когда касались предмета после прогулки по ковру? От этого объекта к вам прыгнул поток электронов. Это называется статическое электричество .
Молния — это электроны, перемещающиеся из одного облака в другое, или электроны, прыгающие из облака на землю. Испытывали ли вы когда-нибудь шок, когда касались предмета после прогулки по ковру? От этого объекта к вам прыгнул поток электронов. Это называется статическое электричество .
Вы когда-нибудь заставляли волосы стоять прямо, потирая их воздушным шариком? Если да, то вы стерли часть электронов с воздушного шара. Электроны переместились в ваши волосы из воздушного шара. Электроны пытались уйти подальше друг от друга, двигаясь к кончикам ваших волос. Они толкались или отталкивались друг от друга и заставляли ваши волосы двигаться. Как противоположные заряды притягиваются друг к другу, так и заряды отталкиваются.
Последнее рассмотрение: 17 декабря 2021 г.
Как рисовать диаграммы электронной конфигурации | Feature
Диаграмма конфигурации электронов — это модель, которая изображает положение электронов, когда они вращаются вокруг ядра атома. Электроны представлены точками или крестами и расположены на энергетических уровнях или «оболочках» вокруг центрального ядра. Иногда ее называют моделью Бора или моделью «солнечной системы».
Электроны представлены точками или крестами и расположены на энергетических уровнях или «оболочках» вокруг центрального ядра. Иногда ее называют моделью Бора или моделью «солнечной системы».
Скачать это
Эта инфографика предназначена для демонстрации в классе в виде плаката, хотя ее также можно отображать на проекторе или распечатывать в качестве раздаточного материала.
Используйте прилагаемый информационный бюллетень и рабочий лист, чтобы ваши учащиеся рисовали диаграммы конфигурации электронов.
Скачать все
В модели Бора есть несколько правил, которые помогут вам рисовать точные диаграммы.
- Электроны должны занимать самую нижнюю доступную оболочку , ближайшую к ядру .
- Максимальное количество электронов, которое может заполнить каждую оболочку , равно:
- два в первой оболочке,
- восемь во второй оболочке,
- восемь в третьем корпусе.

- Кальций , 20 -й элемент, имеет еще два электрона, которые находятся в четвертой оболочке .
В сокращенном обозначении для электронной конфигурации число электронов в каждой оболочке может быть написано, а не нарисовано. Каждая оболочка отделяется точкой или запятой. Для азота это будет 2,5 или 2,5, а для кальция это будет 2,8,8,2 или 2,8,8,2.
Знаете ли вы…?Расположение электронов элемента говорит вам, где он находится в периодической таблице . количество оболочек показывает, в каком периоде или строке он находится, а количество электронов во внешней оболочке показывает, в какой группе он находится.
Как нарисовать схему электронной конфигурации
Теперь нарисуйте первые 20 элементов
Все иллюстрации © Dan Bright
Полярные и неполярные молекулы
Полярные и неполярные молекулыПолярные и неполярные молекулы
Масло и вода не смешиваются, верно? Вот почему вы взбалтываете заправку для салата; чтобы временно заставить их вместе. Почему добавление небольшого количества средства для мытья посуды (мыла) помогает удалить жир с грязной посуды лучше, чем одна вода? Почему химчистка удаляет пятна, а мыло и вода не удаляют? Ответ связан с химическими свойствами растворителей, которые мы используем, и химическими свойствами веществ, которые мы пытаемся растворить (растворенных веществ). Мы вернемся к этим примерам позже.
Почему добавление небольшого количества средства для мытья посуды (мыла) помогает удалить жир с грязной посуды лучше, чем одна вода? Почему химчистка удаляет пятна, а мыло и вода не удаляют? Ответ связан с химическими свойствами растворителей, которые мы используем, и химическими свойствами веществ, которые мы пытаемся растворить (растворенных веществ). Мы вернемся к этим примерам позже.
масло и вода не смешиваются
Химические связи : Атомы ищут более стабильные состояния.Структура атома подобна Солнечной системе. Большие протоны (с положительным зарядом) и нейтроны (без заряда) находятся в ядре или центре. Крошечные электроны (с отрицательными зарядами) быстро вращаются по орбитам вокруг ядра, образуя электронные оболочки на разных расстояниях, подобно планетам и другим объектам, вращающимся вокруг Солнца. Атомы каждого элемента имеют разное количество электронов на своих внешних оболочках. Атомы становятся более стабильными, когда их внешние электронные оболочки опустошаются или заполняются. Один из способов достижения этой цели состоит в том, что два атома делят между собой один или несколько электронов, так что каждый из них может заполнить или опустошить эту самую внешнюю оболочку. Но они могут делиться электронами только в том случае, если они остаются близко друг к другу, и это называется ковалентной связью. В других ситуациях один атом может стать более стабильным, потеряв электроны, а другой может стать более стабильным, приобретя их. Атом, получивший электрон (помните, что электроны имеют отрицательный заряд), становится отрицательно заряженным (-1), а атом, потерявший электрон, становится положительно заряженным (+1).Вот небольшая шутка, которая поможет вам вспомнить…
Один из способов достижения этой цели состоит в том, что два атома делят между собой один или несколько электронов, так что каждый из них может заполнить или опустошить эту самую внешнюю оболочку. Но они могут делиться электронами только в том случае, если они остаются близко друг к другу, и это называется ковалентной связью. В других ситуациях один атом может стать более стабильным, потеряв электроны, а другой может стать более стабильным, приобретя их. Атом, получивший электрон (помните, что электроны имеют отрицательный заряд), становится отрицательно заряженным (-1), а атом, потерявший электрон, становится положительно заряженным (+1).Вот небольшая шутка, которая поможет вам вспомнить…
Когда атом теряет электрон, его суммарный заряд изменяется от 0 (нейтральный) до +1 (положительный)
Образование ионной связи является окислительно-восстановительной реакцией. Один атом теряет электроны (окисление), а другой приобретает электроны (восстановление) . Атомы, несущие положительный или отрицательный заряд, называются ионами, и, поскольку противоположности притягиваются, они могут образовывать ионную связь. Ионные и ковалентные связи являются наиболее важными во всей химии.Вот небольшая шутка, которая поможет вам вспомнить…
Атомы, несущие положительный или отрицательный заряд, называются ионами, и, поскольку противоположности притягиваются, они могут образовывать ионную связь. Ионные и ковалентные связи являются наиболее важными во всей химии.Вот небольшая шутка, которая поможет вам вспомнить…
При ионных связях атомы отдают или принимают электроны. При ковалентных связях они должны их делить.
противоположные полюса магнита притягиваются
Теперь подумайте о магните. Магниты имеют как положительный (+) полюс, так и отрицательный (-) полюс. Так же и аккумуляторы. Так же и Земля. Когда вещи разные на каждом конце, мы называем их полярными . Некоторые молекулы также имеют положительные и отрицательные концы, и когда они есть, мы называем их полярными.Если они этого не делают, мы называем их неполярными. Полярные предметы могут притягиваться и отталкиваться друг от друга (разноименные заряды притягиваются, одинаковые отталкиваются). Два магнита на изображении выше будут притягиваться, потому что их противоположные полюса находятся рядом. Поверните один из них, и они будут отталкивать друг друга.
Два магнита на изображении выше будут притягиваться, потому что их противоположные полюса находятся рядом. Поверните один из них, и они будут отталкивать друг друга.
молекулы воды полярны
Вода — полярная молекула. В то время как общий заряд молекулы нейтрален, ориентация двух положительно заряженных атомов водорода (+1 каждый) на одном конце и отрицательно заряженного кислорода (-2) на другом конце дает ей два полюса.Это свойство заставляет молекулы воды слабо притягиваться к другим молекулам воды (положительные к отрицательным, отрицательные к положительным) и приводит к сцеплению воды с самой собой. Капли воды на плоском стекле, например, образуют капли и собираются вверх.
фосфолипидный бислой клеточной мембраны
Мембраны ваших клеток состоят из двух слоев фосфолипидов. Полярные головки (круглые 90 502 фосфорных 90 503 частей) обращены наружу, а неполярные хвосты (липиды — помните, что липиды — это жиры) обращены к середине мембраны.
 Вода, будучи полярной, поэтому прилипает сама к себе и прилипает к фосфатам на внешней и внутренней поверхностях мембраны, но отталкивается (точно так же, как масло и вода отталкиваются друг от друга) от центра мембраны. . Головы гидрофильны (любят воду), а хвосты гидрофобны (боятся воды). Этот умный дизайн делает клеточные мембраны влажными на поверхности, но водонепроницаемыми в середине. Небольшие неполярные молекулы, такие как кислород и углекислый газ, могут дрейфовать прямо через мембрану, но все полярные или большие молекулы застревают, и их нужно будет активно транспортировать через одни из клеточных ворот.
Вода, будучи полярной, поэтому прилипает сама к себе и прилипает к фосфатам на внешней и внутренней поверхностях мембраны, но отталкивается (точно так же, как масло и вода отталкиваются друг от друга) от центра мембраны. . Головы гидрофильны (любят воду), а хвосты гидрофобны (боятся воды). Этот умный дизайн делает клеточные мембраны влажными на поверхности, но водонепроницаемыми в середине. Небольшие неполярные молекулы, такие как кислород и углекислый газ, могут дрейфовать прямо через мембрану, но все полярные или большие молекулы застревают, и их нужно будет активно транспортировать через одни из клеточных ворот.поперечное сечение через мыльную «мицеллу»
Так почему же мыло и моющие средства очищают нашу посуду и нашу одежду? Мыла химически похожи на клеточные мембраны. Когда мыло добавляется в воду, оно образует структуры, называемые «мицеллами». Головки мыльных мицелл полярны, а хвосты, обращенные внутрь, чтобы отступить от полярной воды, неполярны. Когда мыльная мицелла сталкивается с маслом или жиром, эти неполярные материалы вытесняются внутрь мицеллы, чтобы уйти от полярной воды и полярных головок мицеллы, где они задерживаются.Когда мыльную воду смывают, захваченный жир и масло смываются вместе с ней.
Когда мыльная мицелла сталкивается с маслом или жиром, эти неполярные материалы вытесняются внутрь мицеллы, чтобы уйти от полярной воды и полярных головок мицеллы, где они задерживаются.Когда мыльную воду смывают, захваченный жир и масло смываются вместе с ней.
Мини-эксперимент 1 : Налейте немного воды в неглубокую миску. Теперь возьмите отрезок нити или длинный волос и положите его поверх воды в замкнутую петлю. Капните несколько капель растительного масла внутрь петли нити и осторожно перемешайте масло. Теперь добавьте немного средства для мытья посуды вне петли веревки и осторожно размешайте его в воде. Удалите нить и посмотрите, что произойдет.
Мини-эксперимент 2 : Вот драматический эксперимент, который вы можете провести с пищевым красителем, средством для мытья посуды и молоком.Посмотрите видео, чтобы увидеть, как это будет выглядеть. Почему это работает? Подсказка: молоко содержит жиры, а мыло отталкивает жиры. Пищевой краситель переносится молоком по мере того, как он отделяется от жиров.

 (множественный выбор)
(множественный выбор) (множественный выбор)
(множественный выбор) Это просто руководство вопросов для подготовки к тесту. Мы не обещаем, что здесь будут рассмотрены все вопросы теста. Кроме того, обратите внимание, что вопросы в тесте могут быть разного типа (соответствие, множественный выбор и т. д.)
Это просто руководство вопросов для подготовки к тесту. Мы не обещаем, что здесь будут рассмотрены все вопросы теста. Кроме того, обратите внимание, что вопросы в тесте могут быть разного типа (соответствие, множественный выбор и т. д.)