«Строение и функции белков» (10 класс)
Тест «Строение и функции белков»
1. Какие вещества синтезируются в клетках человека из аминокислот?
А) фосфолипиды Б) углеводы В) витамины Г) белки
2. Мономерами молекул каких органических веществ являются аминокислоты? А) белков Б) углеводов В) ДНК Г) липидов
3. В основе образования пептидных связей между аминокислотами в молекуле белка лежит: А) принцип комплементарности Б) нерастворимость аминокислот в воде В) растворимость аминокислот в воде Г) наличие в них карбоксильной и аминной групп
4. Водородные связи между СО- и NН-группами в молекуле белка придают ей форму спирали, характерную для структуры: А) первичной
Б) вторичной В) третичной Г) четвертичной
5. Какие связи определяют первичную структуру молекул белка? А) гидрофобные между радикалами аминокислот Б) водородные между полипептидными нитями В) пептидные между аминокислотами Г) водородные между –NH- и –СО- группами
6. Последовательность и число аминокислот в полипептидной цепи – это: А) первичная структура ДНК Б) первичная структура белка В) вторичная структура ДНК Г) вторичная структура белка
Последовательность и число аминокислот в полипептидной цепи – это: А) первичная структура ДНК Б) первичная структура белка В) вторичная структура ДНК Г) вторичная структура белка
7. Третичная структура молекулы белка имеет форму: А) спирали Б) глобулы В) клубка Г) нити
8. Четвертичная структура молекулы белка – это: А) спираль Б) нить
В) глобула Г) несколько объединенных глобул.
9. Нарушение структуры молекулы белка – это А) денатурация Б) репликация В) транскрипция Г) ренатурация
10. Защитную функцию в организме выполняют белки, которые: А) осуществляют иммунные реакции Б) способны к сокращению В) осуществляют транспорт кислорода Г) ускоряют реакции обмена веществ
11. Процесс восстановления природной структуры белка после ее нарушения – это: А) денатурация Б) репликация В) транскрипция Г) ренатурация
Тест «Строение и функции белков»
1. Какие вещества синтезируются в клетках человека из аминокислот?
Какие вещества синтезируются в клетках человека из аминокислот?
А) фосфолипиды Б) углеводы В) витамины Г) белки
2. Мономерами молекул каких органических веществ являются аминокислоты? А) белков Б) углеводов В) ДНК Г) липидов
3. В основе образования пептидных связей между аминокислотами в молекуле белка лежит: А) принцип комплементарности Б) нерастворимость аминокислот в воде В) растворимость аминокислот в воде Г) наличие в них карбоксильной и аминной групп
4. Водородные связи между СО- и NН-группами в молекуле белка придают ей форму спирали, характерную для структуры: А) первичной
Б) вторичной В) третичной Г) четвертичной
5. Какие связи определяют первичную структуру молекул белка? А) гидрофобные между радикалами аминокислот Б) водородные между полипептидными нитями В) пептидные между аминокислотами Г) водородные между –NH- и –СО- группами
6. Последовательность и число аминокислот в полипептидной цепи – это: А) первичная структура ДНК Б) первичная структура белка В) вторичная структура ДНК Г) вторичная структура белка
Последовательность и число аминокислот в полипептидной цепи – это: А) первичная структура ДНК Б) первичная структура белка В) вторичная структура ДНК Г) вторичная структура белка
7. Третичная структура молекулы белка имеет форму: А) спирали Б) глобулы В) клубка Г) нити
8. Четвертичная структура молекулы белка – это: А) спираль Б) нить
В) глобула Г) несколько объединенных глобул.
9. Нарушение структуры молекулы белка – это А) денатурация Б) репликация В) транскрипция Г) ренатурация
10. Защитную функцию в организме выполняют белки, которые: А) осуществляют иммунные реакции Б) способны к сокращению В) осуществляют транспорт кислорода Г) ускоряют реакции обмена веществ
11. Процесс восстановления природной структуры белка после ее нарушения – это: А) денатурация Б) репликация В) транскрипция Г) ренатурация
Тест «Неорганические соединения клетки»
1. Сколько химических элементов можно обнаружить в клетке? а) 16; б)24; в) около 90; г) более 100.
Сколько химических элементов можно обнаружить в клетке? а) 16; б)24; в) около 90; г) более 100.
2. «Элементы жизни» — это: а) натрий, калий, сульфур, хлор; б) оксиген, гидроген, нитроген, карбон; в) манган, купрум, цинк, кобальт; г) фосфор, феррум, карбон, кальций.
3. Производители зубной пасты добавляют в ее состав соединения фтора с целью а) воздействия на болезнетворные бактерии; б) придания зубам большей прочности; в) снижения кровоточивости десен; г) нормализации деятельности слюнных желез.
4. Снижение содержания ионов кальция в крови приводит к нарушению а) работы скелетных мышц; б) восприятия изображения глазом; в) всасывания питательных веществ в тонкой кишке; г) выделения мочи мочевым пузырем.
5. Больше всего воды содержится в клетках: а) младенца; б) молодого человека; в) взрослого человека; в) старика.
6. Гидрофобным веществам относится: а) соль; б) свиной жир; в) сахар; г) аминокислоты.
7. К гидрофильным веществам относится: а) подсолнечное масло; б) сахар; в) оливковое масло; г) бараний жир.
Тест «Неорганические соединения клетки»
1. Сколько химических элементов можно обнаружить в клетке? а) 16; б)24; в) около 90; г) более 100.
2. «Элементы жизни» — это: а) натрий, калий, сульфур, хлор; б) оксиген, гидроген, нитроген, карбон; в) манган, купрум, цинк, кобальт; г) фосфор, феррум, карбон, кальций.
3. Производители зубной пасты добавляют в ее состав соединения фтора с целью а) воздействия на болезнетворные бактерии; б) придания зубам большей прочности; в) снижения кровоточивости десен; г) нормализации деятельности слюнных желез.
4. Снижение содержания ионов кальция в крови приводит к нарушению а) работы скелетных мышц; б) восприятия изображения глазом; в) всасывания питательных веществ в тонкой кишке; г) выделения мочи мочевым пузырем.
5. Больше всего воды содержится в клетках: а) младенца; б) молодого человека; в) взрослого человека; в) старика.
6. Гидрофобным веществам относится: а) соль; б) свиной жир; в) сахар; г) аминокислоты.
7. К гидрофильным веществам относится: а) подсолнечное масло; б) сахар; в) оливковое масло; г) бараний жир.
Тест «Неорганические соединения клетки»
1. Сколько химических элементов можно обнаружить в клетке? а) 16; б)24; в) около 90; г) более 100.
2. «Элементы жизни» — это: а) натрий, калий, сульфур, хлор; б) оксиген, гидроген, нитроген, карбон; в) манган, купрум, цинк, кобальт; г) фосфор, феррум, карбон, кальций.
3. Производители зубной пасты добавляют в ее состав соединения фтора с целью а) воздействия на болезнетворные бактерии; б) придания зубам большей прочности; в) снижения кровоточивости десен; г) нормализации деятельности слюнных желез.
4. Снижение содержания ионов кальция в крови приводит к нарушению а) работы скелетных мышц; б) восприятия изображения глазом; в) всасывания питательных веществ в тонкой кишке; г) выделения мочи мочевым пузырем.
5. Больше всего воды содержится в клетках: а) младенца; б) молодого человека; в) взрослого человека; в) старика.
6. Гидрофобным веществам относится: а) соль; б) свиной жир; в) сахар; г) аминокислоты.
7. К гидрофильным веществам относится: а) подсолнечное масло; б) сахар; в) оливковое масло; г) бараний жир.
Тест по теме » Строение и функции белков», 10 класс
Тест по теме » Строение и функции белков», 10 класс
1. Выберите один, наиболее правильный вариант. Вторичная структура молекулы белка имеет форму
1) спирали
2) двойной спирали
3) клубка
4) нити.
2. Выберите один, наиболее правильный вариант. Водородные связи между СО- и NН-группами в молекуле белка придают ей форму спирали, характерную для структуры
Водородные связи между СО- и NН-группами в молекуле белка придают ей форму спирали, характерную для структуры
1) первичной
2) вторичной
3) третичной
4) четвертичной
3. Выберите один, наиболее правильный вариант. Четвертичная структура молекулы белка образуется в результате взаимодействия
1) участков одной белковой молекулы по типу связей S-S
2) нескольких полипептидных нитей, образующих клубок
3) участков одной белковой молекулы за счет водородных связей
4) белковой глобулы с мембраной клетки
4. Установите соответствие между характеристикой и функцией белка, которую он выполняет: 1) регуляторная, 2) структурная
А) входит в состав центриолей
Б) образует рибосомы
В) представляет собой гормон
Г) формирует мембраны клеток
Д) изменяет активность генов
5. Выберите три варианта. Белки в организме человека и животных
1) служат основным строительным материалом
2) расщепляются в кишечнике до глицерина и жирных кислот
4) в печени превращаются в гликоген
5) откладываются в запас
6) в качестве ферментов ускоряют химические реакции.

6. Перечисленные ниже признаки, кроме двух, используются для описания строения, функций изображенного органического вещества. Определите два признаки, «выпадающие» из общего списка, и запишите цифры, под которыми они указаны.
1) имеет структурные уровни организации молекулы
2) входит в состав клеточных стенок
3) является биополимером
4) служит матрицей при трансляции
5) состоит из аминокислот
7. Все приведенные ниже признаки, кроме двух, можно использовать для описания ферментов. Определите два признака, «выпадающих» из общего списка, и запишите цифры, под которыми они указаны.
1) входят в состав клеточных мембран и органоидов клетки
2) играют роль биологических катализаторов
4) оказывают влияние на обмен веществ, регулируя различные процессы
5) специфические белки
8. Выберите один, наиболее правильный вариант. Первичная структура белка образована связью
1) водородной
2) макроэргической
3) пептидной
4) ионной
Тест по биологии «Строение и функции белков» (9 класс).
 Тест по биологии «Строение и функции белков» (9 класс) Тесты по теме функциональные свойства белков
Тест по биологии «Строение и функции белков» (9 класс) Тесты по теме функциональные свойства белковБиология 10 класс. Тема: Белки.
1..Живое отличается от неживого:
А) составом неорганических веществ
Б) наличием катализаторов
В) обменом веществ
Г) взаимодействием молекул друг с другом
2 Белки — это:
А) мономеры; Б) биополимеры; В) моносахариды; Г) полисахариды.
3. Мономерами белка являются:
А) нуклеотиды; Б)аминокислоты; В) азотистые основания.
4. Аминокислоты различаются:
А)аминогруппой, Б) карбоксильной группой; В)радикалом.
5. В состав молекул белков входят:
А) только аминокислоты
Б) аминокислоты и иногда ионы металлов
В) аминокислоты и иногда молекулы липидов
Г) аминокислоты и иногда молекулы углеводов
6. Структура молекулы белка, которую определяет последовательность аминокислотных остатков: А) первичная; Б) вторичная; В) третичная; Г) четвертичная.
7.Вторичная структура белка поддерживается связями:
А) только пептидными;
Б) только водородными;
В) дисульфидные и водородными;
Г) водородными и пептидными;
8. Третичная структура белка образована связями
А – водородными, пептидными, гидрофобными
Б – пептидными, гидрофобными, ионными
В – водородными, гидрофобными, ионными.
9. Наименее прочными структурами белка является:
А) первичная и вторичная
Б) вторичная и троичная
В) третичная и четвертичная
Г) четвертичная и вторичная
10. Ферменты выполняют следующие функции:
А) являются основным источником энергии;
Б) ускоряют биохимические реакции;
В) транспортируют кислород;
Г) участвуют в химической реакции, превращаясь в другие вещества.
11. Биологическую активность белка определяет структура:
А) только первичная;
Б) только вторичная;
В) всегда четвертичная;
Г) четвертичная, иногда третичная.
Почему из 200 аминокислот в состав белка входит только 20?
Процесс денатурации — это…?
Тест №1 «Строение и функции белков» — 1 вариант.
Зад. № 1 один правильные ответы
I. Какие соединения являются мономерами молекул белка?
а) глюкоза б) глицерин в) жирные кислоты
д) аминокислоты
2. Сколько из известных аминокислот участвуют в синтезе белка?
а) 20 б) 23 в) 100
З. Какая часть молекул аминокислот отличает их друг от друга?
а) радикал б) аминогруппа в) карбоксильная группа
4.Посредством какой химической связи соединены между собой аминокислоты в молекуле белка первичной структуры?
a ) пептидная связь
NH , расположенных в соседних завитках спирали
5.О каком уровне структурной организации белка идёт речь:«Это трёхмерная, пространственная «упаковка» полипептидной цепи, в результате которой возникает — глобула»?
6.Простые белки состоят из:
а) только из аминокислот в)аминокислот и липидов
7. О какой функции белка идёт речь: «Специальные белки способны ускорять биохимические реакции, идущие в клетке»?
О какой функции белка идёт речь: «Специальные белки способны ускорять биохимические реакции, идущие в клетке»?
8.О какой функции белка идет речь: «Специальные белки поддерживают постоянную концентрацию веществ в крови и клетках, участвуют в росте, размножении и других жизненно важных процессах»?
а) пластическая г) защитная ж) рецепторная
б) каталитическая д) сократительная з) энергетическая
в) транспортна е) регуляторная
Зад. № 2 Ответьте на предложенные вопросы, выберите два правильных ответа
9. Что является общим для всех аминокислот?
а) радикал б) аминогруппа в) карбоксильная группа
Зад. № 3 Ответьте на предложенные вопросы, выберите три правильных ответа
10.Какне структуры белка способны нарушаться, а затем восстанавливаться?
а) первичная структура в)третичная структура
б) вторичная структура г) четвертичная структура
Тест №1 «Строение и функции белков» — 2 вариант.
Зад. № 1 Ответьте на предложенные вопросы, выберите один правильные ответы
1.Какие соединения являются мономерами молекул белков?
а) жирные кислоты б) глицерин в) аминокислоты
г) глюкоза
2.Сколько из известных аминокислот участвуют в синтезе белка?
а) 150 6)5 в) 20
З.Какая часть молекул аминокислот отличает их друг
от друга?
4.Посредством какой химической связи возникает третичная структура белка?
а) пептидная
б) водородная связь между группами -СО и — NH , расположенными в соседних завитках спирали
в) связи между радикалами аминокислот
5.О каком уровне структурной организации белка идёт речь: «Она возникает в результате соединения нескольких макромолекул с третичной структурой в сложный комплекс?
а) первичная структура в) третичная структура
б) вторичная структура г) четвертичная структура
6.О какой функции белков идёт речь: «Специфические белки предохраняют организмы от вторжения чужеродных белков и организмов и от повреждения»?
а) пластическая г) защитная ж) рецепторная
б) каталитическая д) сократительная з) энергетическая
в) транспортна е) регуляторная
7. О какой функции белков идёт речь: «Специальные белки способны присоединять и переносить различные вещества».
О какой функции белков идёт речь: «Специальные белки способны присоединять и переносить различные вещества».
а) пластическая г) защитная ж) рецепторная
б) каталитическая д) сократительная з) энергетическая
в) транспортна е) регуляторная
Зад. № 2 Ответьте на предложенные вопросы, выберите два правильных ответа
8.Что является общим для всех аминокислот?
а) карбоксильная группа б) радикал в) аминогруппа
Зад. № 3 Ответьте на предложенные вопросы, выберите три правильных ответа
9.Какие структуры молекул белка способны нарушаться при денатурации, а затем вновь восстанавливаться?
а) четвертичная структура в) вторичная структура
б) третичная структура г) первичная структура
10.Сложные белки состоят из:
а) только аминокислот в) аминокислот и липидов
б) аминокислот и углеводов г) аминокислот и нуклеиновых кислот
Тесты составила: учитель химии КГУ «Средняя школа № 5» Калиничева Е.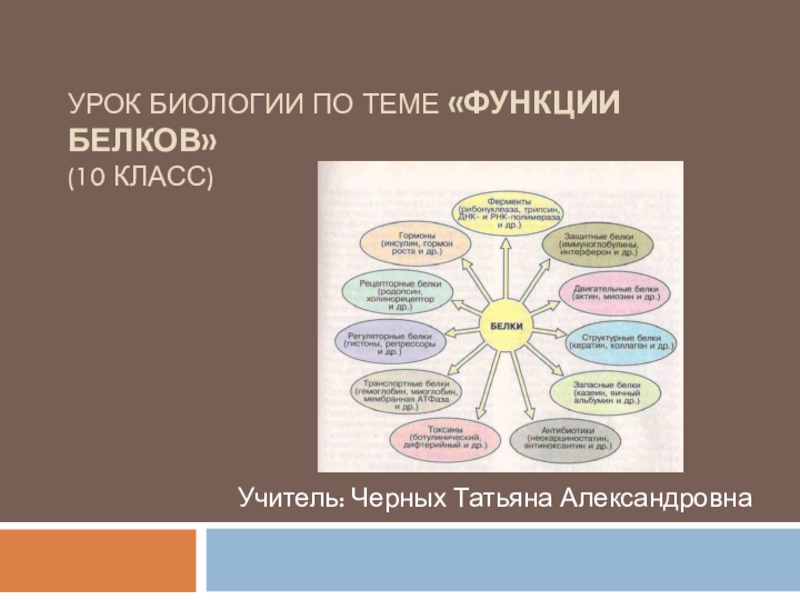 А.
А.
г. Петропавловск, Республика Казахстан
11 класс. Контрольный тест. Амины. Аминокислоты. Белки . 1 вариант
1. Не входит в состав белков:
А) Водород В) Ртуть С) Кислород Д) Азот Е) Сера
2. Относительная молекулярная масса глицина:
А) 75 В) 65 С) 88 Д) 95 Е) 59
3. Глицин образует пептидную связь в реакции с:
А) Гидроксидом натрия В) Серной кислотой С) Аланином
Д) Хлороводородом Е) Гидроксидом меди (II )
4. Вторичная структура белка имеет прочную форму благодаря:
А) Водородным связям
В) Сложноэфирным связям
С) Пептидным связям
Д) Сульфидным мостикам
Е) Солевым мостикам
5. Ксантопротеиновой реакцией называют взаимодействие белков с концентрированной:
А) НСl B) H 2 SO 4 C) H 2 S Д) HI E) HNO 3
NH 2
А) Альдегидам. В) Карбоновым кислотам. С) Аминокислотам.
Д) Эфирам. Е) Аминам.
7. Три аминокислоты, последовательно соединяясь, образуют число пептидных связей, равное:
А) 2 В) 1 С) 4 Д) 3 Е) 0
8. Аминокислота образует сложный эфир в реакции с:
Аминокислота образует сложный эфир в реакции с:
А) кислотой В) ангидридом С) альдегидом Д) спиртом Е) основанием
9. Аминокислоту можно получить при гидролизе:
А) Фенилацетата В) Этилформиата С) Этилбензоата
Д) Хлорида натрия Е) Глицилглицина
10. Сумма всех коэффициентов в уравнении реакции, схема которого Н 2 N – C Н 2 – СООН + NaOH →
А) 1 В) 2 С) 3 Д) 4 Е) 5
А) (СН 3 ) 2 NO 2 B) CH 3 – CO – NH 2 C) CH 3 – COONH 4
Д) С 3 Н 7 NH 2 E ) C 6 H 5 NO 2
12. Осуществима реакция:
А) NH 3 + NaCl → B ) C 2 H 5 – NH 2 + HCl → C ) C 2 H 5 – NH 2 + СН 3 СОН →
Д) C 2 H 5 – NH 2 + NaOH → Е) CH 3 – NH 2 + Н 2 →
13. Промышленный способ получения анилина:
А) Синтез Вюрца В) Синтез Зелинского С) Реакция Зинина
Д) Реакция Кучерова Е) Синтез Лебедева
14. Дана схема
А) 24,6 г В) 22,7 г С) 25,2 г Д) 29,5 г Е) 20,5 г
А) Лекарств В) Красителей С) Полиэтилена
11 класс. Контрольный тест. Амины. Аминокислоты. Белки . 2 вариант
Контрольный тест. Амины. Аминокислоты. Белки . 2 вариант
1. К классу аминокислот относится вещество:
А) NH 2 – CH 2 – CH 2 – NH 2
B ) CH 2 NH 2 – COOH
C ) C 6 H 5 NO 2
Д) (CH 3) 2 – NH
Е) CH 3 – (СН 2) 2 – СООН
2. Массовая доля углерода в молекуле глицина:
А) 24 % В) 32 % С) 40 % Д) 56 % Е) 65 %
3. Аминокислоты не взаимодействуют с:
А) Спиртами В) Щелочами С) Циклоалканами
Д) Аминокислотами Е) Кислотами
4. Биполярный ион аминокислоты образуется при:
А) взаимодействии со щелочами
В) взаимодействии со спиртами
С) взаимодействии с кислотами
Д) внутренней нейтрализации
Е) взаимодействии с галогеноводородами
5. Аминокислоты – амфотерные соединения, так как:
В) Реагируют с водой.
С) Образуют сложные эфиры.
6. В состав белков обязательно входит элемент:
А) кремний В) хлор С) бром Д) углерод Е) йод
7. Первый белок, строение которого было полностью расшифровано:
А) лизин В) казеин С) альбумин Д) инсулин Е) гемоглобин
8. Ближайший гомолог глицина называется:
Ближайший гомолог глицина называется:
А) Тирозин В) Треонин С) Цистоин Д) Аланин Е) Гуанин
9. Первичная структура белка формируется за счет связей:
А) Ионных В) Пептидных С) Сложноэфирных Д) Гликозидных Е) Водородных
10. Эффект биуретовой реакции на белки – окрашивание:
А) красное В) синее С) фиолетовое Д) желтое Е) малиновое
11. К классу аминов относится вещество:
А) СН 3 – СО – NH 2 В) СН 3 – СООNH 4 С) С 3 Н 7 NH 2
Д) (СН 3)2 N О 2 Е) С 6 Н 5 N О 2
12.Бесцветная маслянистая жидкость с характерным запахом, плохо растворимая в воде, хорошо растворимая в органических растворителях – это:
А) (СН 3)3 N В) СН 3 NH 2 С) С 2 Н 5 NH 2
Д ) (С 2 Н 5) 2 NH Е) С 6 Н 5 N Н 2
13. Открыл реакцию С 6 Н 5 NO 2 + 6Н →
А) Н.Н.Зинин В) А.М.Бутлеров С) М.В.Ломоносов
Д) М.Бертло Е) Н.Н.Семенов
14. Сумма всех коэффициентов в уравнении реакции, схеме которого С 6 Н 5 NH 2 + Br 2 →
А) 3 В) 5 С) 6 Д) 4 Е) 8
15. Дана схема
Дана схема
С 2 Н 2 → С 6 Н 6 → С 6 Н 5 NO 2 → С 6 Н 5 N Н 2 → Cl
Для получения 18,6 г анилина потребуется нитробензол массой:
А) 20,5 г В) 25,2 г С) 24,6 г Д) 22,7 г Е) 29,5 г
11 класс. Контрольный тест. Амины. Аминокислоты. Белки . 3 вариант
1. Функциональная группа первичных аминов:
А) > NH B ) > N C ) — NO 3 Д) — N Н 2 Е) — NO 2
2. Относительная молекулярная масса этиламина С 2 Н 5 N Н 2:
А) 31 В) 45 С) 46 Д) 48 Е) 54
3. Реакция Зинина:
А) С 2 Н 2 + НОН → СН 3 – СОН
В) С 6 Н 5 NO 2 + 6H → С 6 Н 5 NH 2 + 2H 2 O
C ) СН 2 = СН 2 + Н 2 → СН 3 – СН 3
Д) n СН 2 = СН 2 → (- СН 2 – СН 2 -) n
Е) Cl – CH 2 – COOH + NH 3 → NH 2 – CH 2 – COOH + HCl
4. Бромная вода служит реактивом для определения:
5. Дана схема
С 2 Н 2 → С 6 Н 6 → С 6 Н 5 NO 2 → C 6 H 5 NH 2 → Cl
Для получения 18,6 г анилина потребуется нитробензол массой:
А) 20,5 г В) 22,7 г С) 25,2 г Д) 29,5 г Е) 24,6 г
6. В состав аминокислот обязательно входит элемент:
В состав аминокислот обязательно входит элемент:
А) Cl В) Fe C ) Na Д) Р Е) С
7. Используя только глицин и цистеин можно получить различных дипептидов:
А) 2 В) 5 С) 3 Д) 4 Е) 1
8. Аминоуксусная кислота в водном растворе может реагировать с:
А) Нитратом железа (II )
В) Бензиловым спиртом
С) Аммиачным раствором оксида серебра
Д) Хлоридом бария
Е) Этиловым спиртом
10. Амфотерность аминокислот подтверждается взаимодействием с:
А) NaOH и HCl В) NaOH и СаСО 3 С) СН 3 СООН и С 2 Н 5 ОН
Д) СН 3 ОН и NaOH Е) HCl и НBr
11. К химическим полимерам не относится:
А) Капрон В) Лавсан С) Полиэтилен Д) Полистирол Е) Белки
12. . Скручивание полипептидной цепи за счет водородных связей между О H
C — N –
группами в α – спирали, это:
А) первичная структура белка
В) все вышеуказанные структуры белка
С) третичная структура белка
Д) вторичная структура белка
Е) четвертичная структура белка
13. При нагревании белков в растворах кислот и щелочей происходит:
При нагревании белков в растворах кислот и щелочей происходит:
А) Образование четвертичной структуры В) Гидролиз С) Растворение Д) Цветная реакция на белки Е) Образование пептидных связей
14. Число пептидных связей в составе тетрапептида:
А) 4 В) 3 С) 2 Д) 1 Е) 5
15. Ксантопротеиновой реакцией называют взаимодействие белков с концентрированной:
А) НСl B) HNO 3 C) H 2 S Д) HI E) H 2 SO 4
11 класс. Контрольный тест. Амины. Аминокислоты. Белки. 4 вариант
1. Мономеры белков:
А) Аминокислоты В) Оксикислоты С) Бескислородные кислоты
Д) Минеральные кислоты Е) Карбоновые кислоты
2. Вторичная структура белковой молекулы напоминает:
А) Разветвление В) Спираль С) Тетраэдр Д) Нить Е) Глобулу
3. Пептидная связь представляет собой группу атомов:
А) — СО – NH — В) — ОН С) — СО –Н Д) — О – СО — Е) — NH 2
4. Денатурация белка приводит к разрушению:
А) только вторичной структуры
В) водородных связей
С) пептидных связей
Д) вторичной и третичной структур
Е) только первичной структуры
5. Биуретовая реакция на белки – доказательство наличия в составе молекул:
Биуретовая реакция на белки – доказательство наличия в составе молекул:
А) бензольного ядра В) пептидных связей С) серы
Д) водородных связей Е) сложноэфирных связей
6. Органические вещества с общей формулой R – CH – COOH относятся к:
NH 2
А) Альдегидам. В) Карбоновым кислотам. С) Аминам.
Д) Эфирам. Е) Аминокислотам.
7. Неверное суждение об аминокислотах:
А) Входят в состав белков
С) Амфотерные
Д) Имеют сладковатый вкус
Е) Твердые вещества
8. Если взять две молекулы аминокислоты, то образуется:
А) гаксапептид В) пентапептид С) тетрапептид
Д) трипептид Е) дипептид
9. Сумма всех коэффициентов в уравнении реакции, схема которого
Н 2 N – CH 2 – COOH + HCl → А) 1 В) 2 С) 3 Д) 4 Е) 5
10. Относительная молекулярная масса глицина:
А) 95 В) 65 С) 88 Д) 75 Е) 59
11. Только аминокислотам свойственно образование:
А) кислот В) оснований С) солей
Д) пептидов Е) эфиров
12. Аминокислота образует сложный эфир в реакции с:
Аминокислота образует сложный эфир в реакции с:
А) спиртом В) ангидридом С) альдегидом
Д) кислотой Е) основанием
13. Формула амина:
А) С 6 Н 5 N 2 Cl B ) С 6 Н 5 NH 2 C ) С 6 Н 5 ОН Д) С 6 Н 4 (N О 2)(СН 3) Е) С 6 Н 5 N О 2
14. Объем кислорода (при н.у.), который потребуется для горения 5,6 л амина и плотностью по водороду 15,5:
А) 14,4 л В) 12,6 л С) 11,2 л
Д) 16,8 л Е) 22,4 л
15. Анилин не используется для получения:
А) Полиэтилена В) Красителей С) Лекарств
Д) Взрывчатых веществ Е) Антиокислителей
11 класс. Контрольный тест. Амины. Аминокислоты. Белки. 5 вариант
1. СН 3 – NH 2 — это формула:
2. Массовая доля углерода в метиламине:
А) 29 % В) 33 % С) 39 % Д) 45 % Е) 61 %
3. Метиламин вступает в реакцию с:
А) Н 2 О, NO 2 В) Н 2 О, НCl C ) H 2 O , NH 3 Д) СО2, НCl Е) NH 3 , NO 2
4. 504 л воздуха (20 % кислорода) (н.у.) полностью расходуется для горения метиламина массой:
А) 82 г В) 96 г С) 124 г Д) 62 г Е) 31 г
5. Историческое название 2 – аминопропановой кислоты:
Историческое название 2 – аминопропановой кислоты:
А) Глицин В) Лизин С) Аланин Д) Аргинин Е) Цистин
6. Аминокислоты проявляют кислотные свойства при взаимодействии с:
А) H 2 SO 4 В) КОН С) НCl Д) Н 2 СО 3 Е) Н 2 О
7. При взаимодействии 150 г 1 % — ного раствора аминоуксусной кислоты с гидроксидом калия образуется соль массой:
А) 2,26 г В) 3,36 г С) 4,46 г Д) 5,46 г Е) 6,46 г
8. Мономер белка:
А) Амины В) Глюкоза С) Анилин Д) Аминокислоты Е) Нуклеотиды
9. То, что при горении шерсти образуется сернистый газ SO 2 , является доказательством наличия в белке шерсти элемента…
А) серы В) углерода С) кремния Д) кислорода Е) водорода
10. Пространственная конфигурация спирали полипептидной цепи – это:
А) первичная структура белка
В) вторичная структура белка
С) третичная структура белка
Е) первичная и вторичная структуры белка
11. Ускоряют химические реакции в организме белки:
А) гемоглобины В) вирусы С) ферменты
Д) бактерии Е) гормоны
12. Инсулин – гормон, он –
Инсулин – гормон, он –
А) регулирует пищеварение
В) регулирует дыхание
С) транспортирует кислород
Д) регулирует содержание сахара в крови
Е) регулирует нервную систему
13. Пептидная связь может образоваться при взаимодействии:
А) Этанола и этиламина
В) Уксусного альдегида и этанола
С) Глицина и анилина
Д) Глицина и аланина
Е) Воды и глицина
14. Биуретовая реакция белка – это появление:
А) желтой окраски при взаимодействии с азотной кислотой
В) белой окраски при взаимодействии с соляной кислотой
С) фиолетовой окраски при взаимодействии с сульфатом меди (II ) в присутствии щелочи
Д) черной окраски при взаимодействии с ацетатом свинца
Е) синей окраски при взаимодействии с фосфорной кислотой
15. К природным полимерам не относится:
А) Целлюлоза В) Капрон С) Белок Д) Нуклеиновая кислота Е) Крахмал
11 класс. Контрольный тест. Амины. Аминокислоты. Белки . 6 вариант
6 вариант
1. В состав белков не входит элемент:
А) хлор В) водород С) азот Д) кислород Е) углерод
2. Способ совместной укладки нескольких полипептидных цепей, это:
А) вторичная структура белка
В) первичная и вторичная структура белка
С) вторичная и третичная структура белка
Д) четвертичная структура белка
Е) третичная структура белка
3. При добавлении к белку свежеприготовленного гидроксида меди (II ) образуется:
А) Голубой осадок В) Красный осадок С) Желтое окрашивание
Д) Красно-фиолетовое окрашивание
4. Обменные процессы в организме регулируют белки:
А) гормоны В) ферменты С) вирусы Д) гемоглобины Е) бактерии
5. Три аминокислоты, последовательно соединяясь, образуют число пептидных связей, равное:
А) 2 В) 1 С) 4 Д) 3 Е) 0
6. С 2 Н 5 – NH 2 — это формула:
А) Метиламина В) Диметиламина С) Этиламина Д) Анилина Е) Нитробензола
7. Массовая доля углерода в этиламине:
А) 29 % В) 53 % С) 39 % Д) 45 % Е) 61 %
8. На полное сжигание 9 г этиламина, если объемная доля кислорода в воздухе 20 % расходуется воздух объемом:
На полное сжигание 9 г этиламина, если объемная доля кислорода в воздухе 20 % расходуется воздух объемом:
А) 16,8 л В) 22,4 л С) 84 л Д) 112 л Е) 44,8 л
9. Бромная вода служит реактивом для определения:
А) гексана В) бензола С) метана Д) анилина Е) глицерина
10. Анилин не используется для получения:
А) Антиокислителей В) Красителей С) Лекарств
Д) Взрывчатых веществ Е) Полиэтилена
11. Органические вещества с общей формулой R – CH – COOH относятся к:
NH 2
А) Альдегидам. В) Карбоновым кислотам. С) Аминам. Д) Эфирам. Е) Аминокислотам.
12. Две аминокислоты, последовательно соединяясь, образуют число пептидных связей, равное: А) 2 В) 1 С) 4 Д) 3 Е) 0
13. Сумма всех коэффициентов в уравнении реакции, схема которого Н 2 N – C Н 2 – СООН + NaOH →
А) 1 В) 2 С) 3 Д) 4 Е) 5
14. Неверное суждение об аминокислотах:
А) Входят в состав белков
В) Состоят только из углерода и водорода
С) Амфотерные
Д) Имеют сладковатый вкус
Е) Твердые вещества
15. Аминокислоты – амфотерные соединения, так как:
Аминокислоты – амфотерные соединения, так как:
В) Реагируют с водой.
С) Образуют сложные эфиры.
Е) Относятся к азотсодержащим органическим соединениям.
11 класс. Контрольный тест. Амины. Аминокислоты. Белки. Ответы
1 вариант 2 вариант 3 вариант 4 вариант
1 – В 1 — В 1 — Д 1 — А
2 – А 2 — В 2 — В 2 — В
3 – С 3 — С 3- В 3 — А
4 – А 4 — Д 4 — Д 4 — Д
5 – Е 5 — А 5 — Е 5 — В
6 – С 6 — Д 6 — Е 6 — Е
7 – А 7 — Д 7 — А 7 — В
8 – Д 8 — Д 8 — Е 8 — Е
9 – Е 9 — В 9 — С 9 — Д
10 – Д 10 — С 10 — А 10 — Д
11 – Д 11 — С 11 — Е 11 — Д
12 – В 12 — Е 12 — Д 12 — А
13 – С 13 — А 13 — В 13 — В
14 – А 14 — Е 14 – В 14 — В
15 — С 15 — С 15 — В 15 — А
5 вариант 6 вариант
10 – С 10 — Е
11 – С 11 — Е
12 – Д 12 — В
13 – Д 13 — Д
14 – С 14 — В
Тест по теме « Белки».
Выберите один правильный ответ:
1. Определите признак, по которому все нижеперечисленные соединения, кроме одного, объединены в одну группу. Укажите «лишние» среди них химическое соединение.
Определите признак, по которому все нижеперечисленные соединения, кроме одного, объединены в одну группу. Укажите «лишние» среди них химическое соединение.
1) пепсин 5) каталаза
2) коллаген 6) мальтаза
3) кератин 7) гемоглобин
2. Соли тяжелых металлов (ртути, мышьяка, свинца) являются ядами для организма. Они связываются с сульфидными группировками белков. Назовите структуру белков, которая разрушается под действием солей тяжелых металлов.
1) первичная 3) третичная
2) вторичная
3. Назовите белок, выполняющий ферментативную функцию.
1) гормон роста 4) актин
2) фибрин 5) трипсин
3) инсулин
4. В каком ответе все названные химические соединения относятся к
аминокислотам?
1) тубулин, коллаген, лизоцим
2) лизин, триптофан, аланин
3) холестерин, прогестерон, стеариновая кислота
4) валин, мальтаза, кератин
5) сахароза, лактоза, глицин
6) аденин, тимин, гуанин
5. Белки как полимеры имеют особенности, по которым существенно отличаются от
каких полисахаридов, как гликоген и крахмал. Найдите эти особенности среди
Найдите эти особенности среди
и укажите признак, который такой особенностью НЕ является.
1) очень большое число мономеров
2) являются линейными полимерами
3) иная структура мономеров
4) мономеры белка отличаются друг от друга
6. Первичные структуры разных белков отличаются друг от друга по ряду признаков. Найдите эти признаки среди ответов и укажите особенность строения, по которой разные белки, наоборот, похожи друг на друга.
1) количество аминокислот
2) количественное соотношение аминокислот разных видов
3) последовательность соединения аминокислот друг с другом
4) структура химических связей, участвующих в формировании
последовательности аминокислот
7. Назовите органические соединения, которые содержатся в клетке в наибольшем
количестве (в % на сырую массу).
4) нуклеиновые кислоты
5) низкомолекулярные органические вещества
1) углеводы
8. Назовите функциональные группы соседних аминокислот в белке, между
которыми образуется пептидная связь.
1) радикалы 4) карбоксильные группы
2) карбоксильная группа и аминогруппа 5) карбоксильная группа и радикал
3) радикал и ион водорода 6) аминогруппа и радикал
9. Назовите белок, выполняющий рецепторную функцию.
1) лизоцим 3) протромбин
2) пепсин 4) родопсин
10. Назовите белок, выполняющий рецепторную функцию.
1) коллаген 3) гемоглобин
3) фибрин 4) инсулин
11. Назовите белок, выполняющий в основном структурную функцию.
1) кератин 4) липаза
2) каталаза 5) гормон роста
3) нуклеаза
12. Назовите белок, выполняющий в основном транспортную функцию.
1) коллаген 4)гемоглобин
2) кератин 5) миоглобин
13. Назовите основную функцию, которую выполняют такие белки, кератин,
коллаген, тубулин.
1) двигательная 4) транспортная
2) защитная 5) строительная
3) ферментативная
14. Назовите белок, выполняющий в основном двигательную функцию.
1) актин 4) каталаза
2) фибрин 5) липаза
3) тромбин 6) миоглобин
15. Назовите функцию, которую выполняет основная масса белков семян растений и
Назовите функцию, которую выполняет основная масса белков семян растений и
яйцеклеток животных.
1) защитная 4) двигательная
2) строительная 5) ферментативная
3) запасающая
16. В каком ответе все названные химические соединения являются белками?
1) сахароза, инсулин, урацил
2) фенилаланин, глюкагон, пепсин
3) глюкоза, фруктоза, гликоген
4) каталаза, глюкагон, кератин 5) рибоза, тимин, актин
17. Определите признак, по которому все нижеперечисленные химические
соединения, кроме одного, объединены в одну группу. Укажите это «лишнее»
среди них химическое соединение.
1) аланин 5) актин
2) валин 6) лейцин
3) глицин 7) цистеин
4) триптофан
18. Назовите белок, выполняющий ферментативную функцию.
1) каталаза 4) глюкагон
2) протромбин 5) кератин
3) тубулин
19. Назовите белок, входящий в состав микротрубочек жгутиков и ресничек,
центриолей и веретина движения.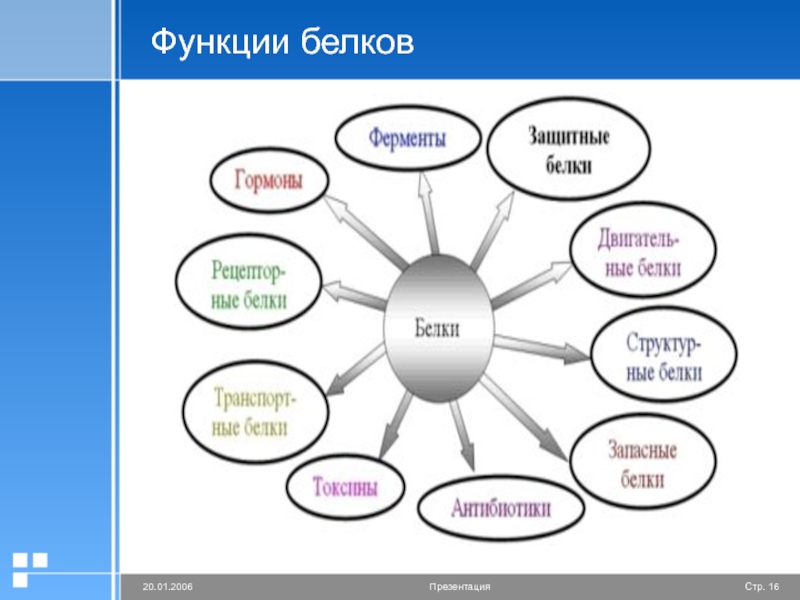
1) кератин 3) миозин
2) тубулин 4) коллаген
20. Назовите белок волос.
1) кератин 3) миозин 5) актин
2) тубулин 4) коллаген 6) фибрин
21. Что является мономером белков?
1) глюкоза 4) нуклеиновая кислота
2) нуклеотид 5) азотистое основание
3) аминокислота
22. Сколько видов аминокислот входит в состав природных белков?
1) 10 3) 20 5) 46
2) 15 4) 25 6) 64
23. Что происходит с третичной структурой транспортных и ферментативных белков
в момент выполнения ими своих функций
1) не изменяется
2) разрушаются
3) слегка видоизменяется
4) усложняется
5) приобретает четвертичную структуру
6) переходит во вторичную структуру
24. Назовите белок, из которого состоят рога, копыта, когти, перья и волоса
животных.
1) коллаген 3) тубулин
2) кератин 4) миозин
25. Назовите белок, который был первым из синтезирован искусственно.
1) инсулин 3) каталаза
2) гемоглобин 4) интерферон
26. Приведите пример белка, состоящего из нескольких полипептидных цепей.
Приведите пример белка, состоящего из нескольких полипептидных цепей.
1) трипсин 3) миоглобин
2) пепсин 4) коллаген
27. Назовите все химические группировки, одинаковые у всех аминокислот,
входящих в состав природных белков.
1) только аминогруппа и карбоксильная группа
2) водород и радикал
3) водород, аминогруппа и карбоксильная группа
4) радикал, аминогруппа и карбоксильная группа
28. Каким терминам называется потеря белком своей естественной пространственной
структуры?
1) спирализация 4) дисперсия
2) конденсация 5) репарация
3) денатурация 6) дегенерация
29. Назовите белок, составляющий основу сухожилий, связок и межклеточного
вещества костной ткани.
1) кератин 4) коллаген
2) тубулин 5) актин
3) миозин 6) фибрин
30. Приведите пример белка, состоящего из нескольких полипептидных цепей.
1) миоглобин 3) трипсин
2) гемоглобин 4) пепсин
31. Какие химические соединения в обязательном порядке имеют следующие
Какие химические соединения в обязательном порядке имеют следующие
химические группировки: аминогруппу и карбоксильную группу?
3) нуклеиновые кислоты 6) полисахариды
32. К какому виду химических связей относят пептидную связь?
1)ионные 3) ковалентные
2) водородные 4) гидрофобные
33. Назовите белок, выполняющий в основном структурную (строительную) функцию.
1) пепсин 3) инсулин
2) коллаген 4) миозин
34. Каким термином называется процесс образования первичной структуры белка?
1) транскрипция 4) диссимиляция
2) трансляция 5) полимеризация
3) редупликация
35. Назовите белки, выполняющие в основном структурную (строительную) функцию.
1) пепсин, трипсин 4) коллаген
3) инсулин, глюкагон
36. Как называется структура белка, представляющая собой спираль, в которую
свёрнута цепочка из аминокислот?
1) первичная 3) третичная
2) вторичная 4) четвертичная
37. К какой группе органических соединений относят аланин, валин, лизин, триптофан?
1) азотистые основания 4) аминокислоты
2) нуклеотиды 5) жирные кислоты
3) нуклеиновые кислоты
38. Назовите белки-гормоны, выполняющие регуляторные функции.
Назовите белки-гормоны, выполняющие регуляторные функции.
1) пепсин, трипсин 4) коллаген, кератин
2) гемоглобин, карбоангидраза 5) актин, миозин
3) инсулин, глюкагон
39. Укажите химическую группировку, которая НЕ входит в качестве радикала ни в
одну из аминокислот, встречающихся в природных белках.
1) –SH 4) –H 2 PO 4
2) –COOH 5) –H
40. Назовите в молекуле аминокислот химическую группировку, которая придаёт
одним аминокислотам гидрофильные, а другие — гидрофобные свойства.
1) аминогруппы 3) карбоксильная группа
2) радикал 4) гидроксильная группа
Строение и функции белков. Вторичная, третичная и четвертичная структуры
1. Почему белки считаются полимерами?
Ответ. Белки — это полимеры, то есть молекулы, построенные, как цепи, из повторяющихся мономерных звеньев, или субъединиц, состоящие из аминокислот, соединенных в определенной последовательности пептидной связью. Они — основные и необходимые составные части всех организмов.
Они — основные и необходимые составные части всех организмов.
Различают белки простые (протеины) и сложные (протеиды) . Протеины — белки, молекулы которых содержат только белковые компоненты. При полном их гидролизе образуются аминокислоты.
Протеидами называют сложные белки, молекулы которых существенно отличаются от молекул протеинов тем, что помимо собственно белкового компонента содержат низкомолекулярный компонент небелковой природы
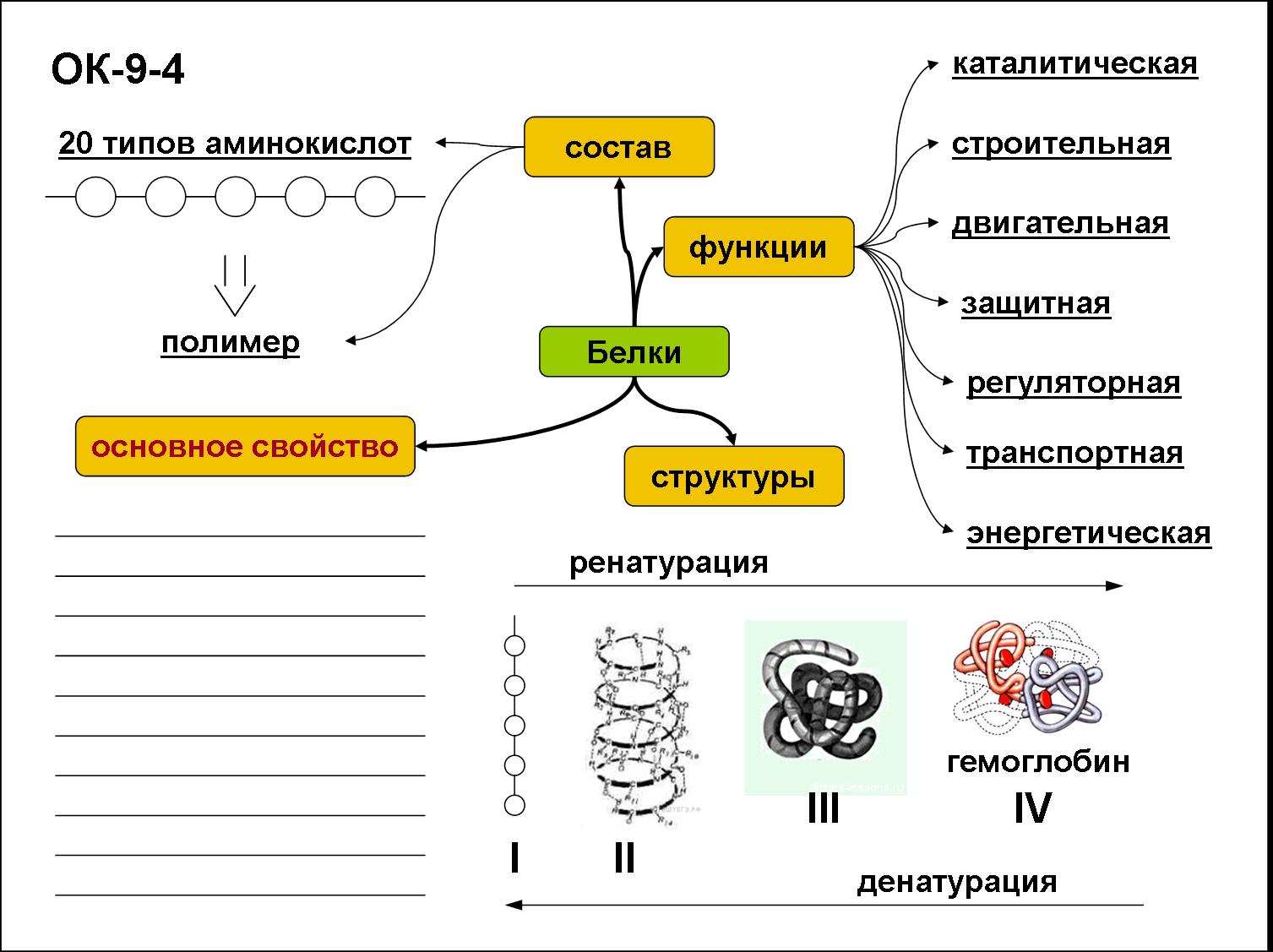
2. Какие функции белков вам известны?
Ответ. Белки выполняют следующие функции: строительную, энергетическую, каталитическую, защитную, транспортную, сократительную, сигнальную и другие.
Вопросы после § 11
1. Какие вещества называются белками?
Ответ. Белки, или протеины, представляют собой биологические полимеры, мономерами которых являются аминокислоты. Все аминокислоты имеют аминогруппу (-Nh3) и карбоксильную группу (-СООН) и различаются строением и свойствами радикалов. Аминокислоты связаны между собой пептидными связями, поэтому белки называют еще полипептидами.
Аминокислоты связаны между собой пептидными связями, поэтому белки называют еще полипептидами.
Ответ. Молекулы белков могут принимать различные пространственные формы – конформации, которые представляют собой четыре уровня их организации. Линейная последовательность аминокислот в составе полипептидной цепи представляет первичную структуру белка. Она уникальна для любого белка и определяет его форму, свойства и функции.
3. Как образуются вторичная, третичная и четвертичная структуры белка?
Ответ. Вторичная структура белка формируется при образовании водородных связей между -СО- и -NH- группами. При этом полипептидная цепь закручивается в спираль. Спираль может приобретать конфигурацию глобулы, так как между радикалами аминокислот в спирали возникают разнообразные связи. Глобула — третичная структура белка. Если несколько глобул объединяются в единый сложный комплекс, то возникает четвертичная структура. Например, гемоглобин крови человека образован четырьмя глобулами.
4. Что такое денатурация белка?
Ответ. Нарушение природной структуры белка называется денатурацией. Под действием ряда факторов (химических, радиоактивных, температурных и др.) может разрушиться четвертичная, третичная и вторичная структуры белка. В случае, если действие фактора прекращается, белок может восстановить свою структуру. Если же действие фактора нарастает, разрушается и первичная структура белка — полипептидная цепь. Это уже необратимый процесс — восстановить структуру белок не может
5. По какому признаку белки делятся на простые и сложные?
Ответ. Простые белки состоят исключительно из аминокислот. В состав сложных белков могут входить другие органические вещества: углеводы (тогда они называются гликопротеинами), жиры (липопротеины), нуклеиновые кислоты (нуклеопротеины).
6. Какие функции белков вам известны?
Ответ. Строительная (пластическая) функция. Белки являются структурным компонентом биологических мембран и органоидов клетки, а также входят в состав опорных структур организма, волос, ногтей, сосудов. Ферментативная функция. Белки служат ферментами, т. е. биологическими катализаторами, ускоряющими скорость биохимических реакций в десятки и сотни миллионов раз. Примером может служить амилаза, расщепляющая крахмал до моносахаридов. Сократительная (двигательная) функция. Ее выполняют особые сократительные белки, обеспечивающие движение клеток и внутриклеточных структур. Благодаря им перемещаются хромосомы при делении клетки, а жгутики и реснички приводят в движение клетки простейших. Сократительные свойства белков актина и миозина лежат в основе работы мышц. Транспортная функция. Белки участвуют в транспорте молекул и ионов в пределах организма (гемоглобин переносит кислород из легких к органам и тканям, альбумин сыворотки крови участвует в транспорте жирных кислот). Защитная функция. Она заключается в предохранении организма от повреждений и вторжения чужеродных белков и бактерий.
Строительная (пластическая) функция. Белки являются структурным компонентом биологических мембран и органоидов клетки, а также входят в состав опорных структур организма, волос, ногтей, сосудов. Ферментативная функция. Белки служат ферментами, т. е. биологическими катализаторами, ускоряющими скорость биохимических реакций в десятки и сотни миллионов раз. Примером может служить амилаза, расщепляющая крахмал до моносахаридов. Сократительная (двигательная) функция. Ее выполняют особые сократительные белки, обеспечивающие движение клеток и внутриклеточных структур. Благодаря им перемещаются хромосомы при делении клетки, а жгутики и реснички приводят в движение клетки простейших. Сократительные свойства белков актина и миозина лежат в основе работы мышц. Транспортная функция. Белки участвуют в транспорте молекул и ионов в пределах организма (гемоглобин переносит кислород из легких к органам и тканям, альбумин сыворотки крови участвует в транспорте жирных кислот). Защитная функция. Она заключается в предохранении организма от повреждений и вторжения чужеродных белков и бактерий.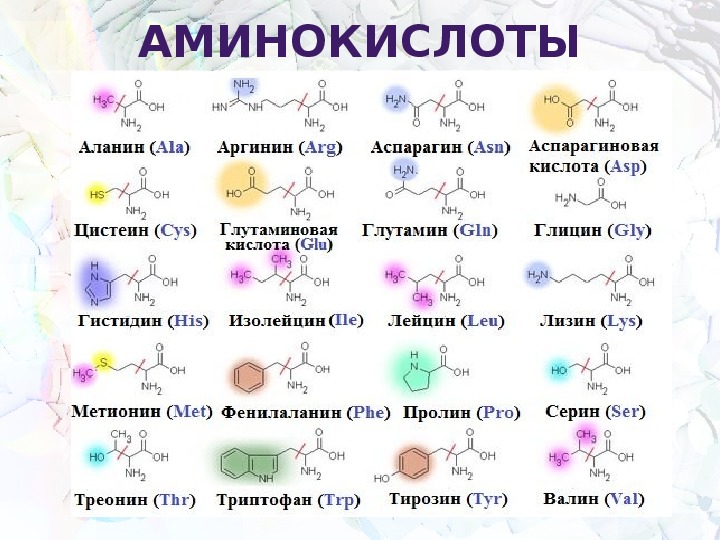 Белки-антитела, вырабатываемые лимфоцитами, создают защиту организма от чужеродной инфекции, тромбин и фибрин участвуют в образовании тромба, тем самым помогая организму избежать больших потерь крови. Регуляторная функция. Ее выполняют белки-гормоны. Они участвуют в регуляции активности клетки и всех жизненных процессов организма. Так, инсулин регулирует уровень сахара в крови и поддерживает его на определенном уровне. Сигнальная функция. Белки, встроенные в мембрану клетки, способны менять свою структуру в ответ на раздражение. Тем самым передаются сигналы из внешней среды внутрь клетки. Энергетическая функция. Она реализуется белками крайне редко. При полном расщеплении 1 г белка способно выделиться 17,6 кДж энергии. Однако белки для организма — очень ценное соединение. Поэтому расщепление белка происходит обычно до аминокислот, из которых строятся новые полипептидные цепочки. Белки-гормоны регулируют активность клетки и всех жизненных процессов организма. Так, в организме человека соматотропин участвует в регуляции роста тела, инсулин поддерживает на постоянном уровне содержание глюкозы в крови.
Белки-антитела, вырабатываемые лимфоцитами, создают защиту организма от чужеродной инфекции, тромбин и фибрин участвуют в образовании тромба, тем самым помогая организму избежать больших потерь крови. Регуляторная функция. Ее выполняют белки-гормоны. Они участвуют в регуляции активности клетки и всех жизненных процессов организма. Так, инсулин регулирует уровень сахара в крови и поддерживает его на определенном уровне. Сигнальная функция. Белки, встроенные в мембрану клетки, способны менять свою структуру в ответ на раздражение. Тем самым передаются сигналы из внешней среды внутрь клетки. Энергетическая функция. Она реализуется белками крайне редко. При полном расщеплении 1 г белка способно выделиться 17,6 кДж энергии. Однако белки для организма — очень ценное соединение. Поэтому расщепление белка происходит обычно до аминокислот, из которых строятся новые полипептидные цепочки. Белки-гормоны регулируют активность клетки и всех жизненных процессов организма. Так, в организме человека соматотропин участвует в регуляции роста тела, инсулин поддерживает на постоянном уровне содержание глюкозы в крови.
7. Какую роль выполняют белки-гормоны?
Ответ. Регуляторная функция присуща белкам-гормонам (регуляторам). Они регулируют различные физиологические процессы. Например, наиболее известным гормоном является инсулин, регулирующий содержание глюкозы в крови. При недостатке инсулина в организме возникает заболевание, известное как сахарный диабет.
8. Какую функцию выполняют белки-ферменты?
Ответ. Ферменты являются биологическими катализаторами, то есть ускорителями химических реакций в сотни миллионов раз. Ферменты обладают строгой специфичностью по отношению к веществу, вступающему в реакцию. Каждая реакция катализируется своим ферментом.
9. Почему белки редко используются в качестве источника энергии?
Ответ. Мономеры белков аминокислоты — ценное сырье для построения новых белковых молекул. Поэтому полное расщепление полипептидов до неорганических веществ происходит редко. Следовательно, энергетическая функция, заключающаяся в выделении энергии при полном расщеплении, выполняется белками довольно редко.
Следовательно, энергетическая функция, заключающаяся в выделении энергии при полном расщеплении, выполняется белками довольно редко.
►Белок яйца является типичным протеином. Выясните, что с ним произойдёт, если на него подействовать водой, спиртом, ацетоном, кислотой, щёлочью, растительным маслом, высокой температурой и т. д.
Ответ. В результате действия высокой температуры на белок яйца произойдет денатурация белка. При действии спирта, ацетона, кислотами или щелочами происходит примерно то же самое: белок сворачивается. Это процесс, при котором происходит нарушение третичной и четвертичной структуры белка вследствие разрыва водородных и ионных связей.
В воде и растительном масле белок сохраняет свою структуру.
►Измельчите клубень сырого картофеля до состояния кашицы. Возьмите три пробирки и в каждую положите небольшое количество измельчённого картофеля.
Первую пробирку поместите в морозилку холодильника, вторую – на нижнюю полку холодильника, а третью – в банку с тёплой водой (t = 40 °С). Через 30 мин достаньте пробирки и в каждую капните небольшое количество пероксида водорода. Пронаблюдайте, что будет происходить в каждой пробирке. Объясните полученные результаты
Через 30 мин достаньте пробирки и в каждую капните небольшое количество пероксида водорода. Пронаблюдайте, что будет происходить в каждой пробирке. Объясните полученные результаты
Ответ. Данный опыт иллюстрирует активность фермента каталазы живой клетки на перекись водорода. В результате реакции выделяется кислород. По динамике выделения пузырьков можно судить об активности фермента.
Опыт позволил зафиксировать следующие результаты:
Активность каталазы зависит от температуры:
1. Пробирка 1: пузырьков нет — это потому, при низкой температуре клетки картофеля разрушились.
2. Пробирка 2: пузырьков небольшое количество — потому, что активность фермента при низкой температуре невысока.
3. Пробирка 3: пузырьков много, температура оптимальна, каталаза очень активна.
► В первую пробирку с картофелем капните несколько капель воды, во вторую – несколько капель кислоты (столовый уксус), а в третью – щёлочи.
Пронаблюдайте, что будет происходить в каждой пробирке. Объясните полученные результаты. Сделайте выводы.
Ответ. При добавлении воды ничего не происходит, при добавлении кислоты происходит некоторое потемнение, при добавлении щелочи «вспенивание» — щелочной гидролиз.
Урок «Строение и функции белков». 9 класс, Курникова Е.В.
БЛОК 2 Клетка как биологическая система.
1. К макроэлементам относятся: БЛОК 2 Клетка как биологическая система. 1) кислород, углерод, водород, азот 2) кислород, железо, золото 3) углерод, водород, бор 4) селен, азот, кислород 1) 2. Органоид,
ПодробнееO, H, C, N + S, P — макроэлементы.
 Na, K, Mg, Ca, Cl — микроэлементы Fe, Zn, Cu, Co, Mn, I, Se следовые элементы
Na, K, Mg, Ca, Cl — микроэлементы Fe, Zn, Cu, Co, Mn, I, Se следовые элементыO, H, C, N + S, P — макроэлементы Na, K, Mg, Ca, Cl — микроэлементы Fe, Zn, Cu, Co, Mn, I, Se следовые элементы Представленность макроэлементов в различных группах веществ Макромолекулы Сахара (углеводы)
ПодробнееОтложенные задания (30)
Отложенные задания (30) Вставьте в текст «ДНК» пропущенные термины из предложенного перечня, используя для этого цифровые обозначения. Запишите в текст цифры выбранных ответов, а затем получившуюся последовательность
Подробнее9 класс Биология П1 ПРОФИЛЬ.
9 класс Биология П1 ПРОФИЛЬ. Мономером ДНК является: Задание 1 нуклеозид нуклеотид глюкоза аминокислота Задание 2 Вторичная структура каждой т-рнк имеет не сколько петель благодаря тому, что соседние с
Подробнееявляются живые организмы, как современные, так и, процессы, которые в них происходят, а также их и группировки.
 Вирусология 4, 6, 8
Вирусология 4, 6, 81 1 Биология как наука. Предмет и методы биологии Дайте определение и дополните предложение. ВВЕДЕНИЕ Биология это наука о. Предметами изучения биологии являются живые организмы, как современные, так и,
Подробнее10класс Биология погружение 3
10класс Биология погружение 3 Тема: Энергетический обмен. 1. Наибольшее количество энергии освобождается при расщеплении молекул 1) белков 2) жиров 3) углеводов 4) нуклеиновых кислот 2. В бескислородной
ПодробнееID_1064 1/5 neznaika.pro
1 Клетка, её жизненный цикл (множественный выбор) Ответами к заданиям являются слово, словосочетание, число или последовательность слов, чисел. Запишите ответ без пробелов, запятых и других дополнительных
ПодробнееКлассификация белков по форме молекулы
Классификация белков по форме молекулы Глобулярные белки. Полипептидная цепь свёрнута в более-менее компактный клубок глобулу, т.о. форма молекулы близка к шарообразной. В воде и растворах солей образуют
Полипептидная цепь свёрнута в более-менее компактный клубок глобулу, т.о. форма молекулы близка к шарообразной. В воде и растворах солей образуют
Белки, их строение и функции
2.3.3. Белки, их строение и функции Белки это биологические гетерополимеры, мономерами которых являются аминокислоты. Белки синтезируются в живых организмах и выполняют в них определенные функции. В состав
ПодробнееСостав, строение и функции белков
Состав, строение и функции белков Строение и функция белков Белок самый важный органический компонент клетки Белки очень разнообразны по строению и функциям Содержание белков в различных клетках колеблется
ПодробнееОпределение белка в йогурте
Определение белка в йогурте Белки являются важной составной частью живого. Нет другого вещества с такими удивительными свойствами, как белок. Если клетке нужно совершить какую либо работу, почти всегда
Нет другого вещества с такими удивительными свойствами, как белок. Если клетке нужно совершить какую либо работу, почти всегда
Лекция 2 Тема: Химия белков.
СПб ГБПОУ «МК 3» МДК 03.01 Теория и практика лабораторных биохимических исследований. Специальность Лабораторная диагностика Очно-заочное обучение Курс 2, семестр 4 Лекция 2 Тема: Химия белков. Башарина
ПодробнееАМИНОКИСЛОТЫ. ПЕПТИДЫ. БЕЛКИ
АМИНОКИСЛОТЫ. ПЕПТИДЫ. БЕЛКИ Аминокислотами называются карбоновые кислоты, в углеводородном радикале которых один или несколько атомов водорода замещены аминогруппами. В зависимости от взаимного расположения
ПодробнееТЕМА «Энергетический обмен»
1. К автотрофным организмам относят 1) мукор 2) дрожжи 3) пеницилл 4) хлореллу ТЕМА «Энергетический обмен» 2. В процессе пиноцитоза происходит поглощение 1) жидкости 2) газов 3) твердых веществ 4) комочков
В процессе пиноцитоза происходит поглощение 1) жидкости 2) газов 3) твердых веществ 4) комочков
Тест по биологии Фотосинтез 9 класс
Тест по биологии Фотосинтез 9 класс 1. В ходе фотосинтеза образуются 1) белки 2) жиры 3) углеводы 4) нуклеиновые кислоты 2. В ходе фотосинтеза поглощается 1) энергия АТФ 2) энергия солнечного света 3)
ПодробнееБелки Белки протеины полипептиды
Белки Белки Белки (протеины, полипептиды) высокомолекулярные органические вещества, состоящие из соединённых в цепочку пептидной связью аминокислот. В живых организмах аминокислотный состав белков определяется
ПодробнееББК 28.86я72 М38 ISBN
ББК 28.86я72 М38 Маш Р.Д. М38 Биология : 8 класс : рабочая тетрадь 2 для учащихся общеобразовательных организаций / Р.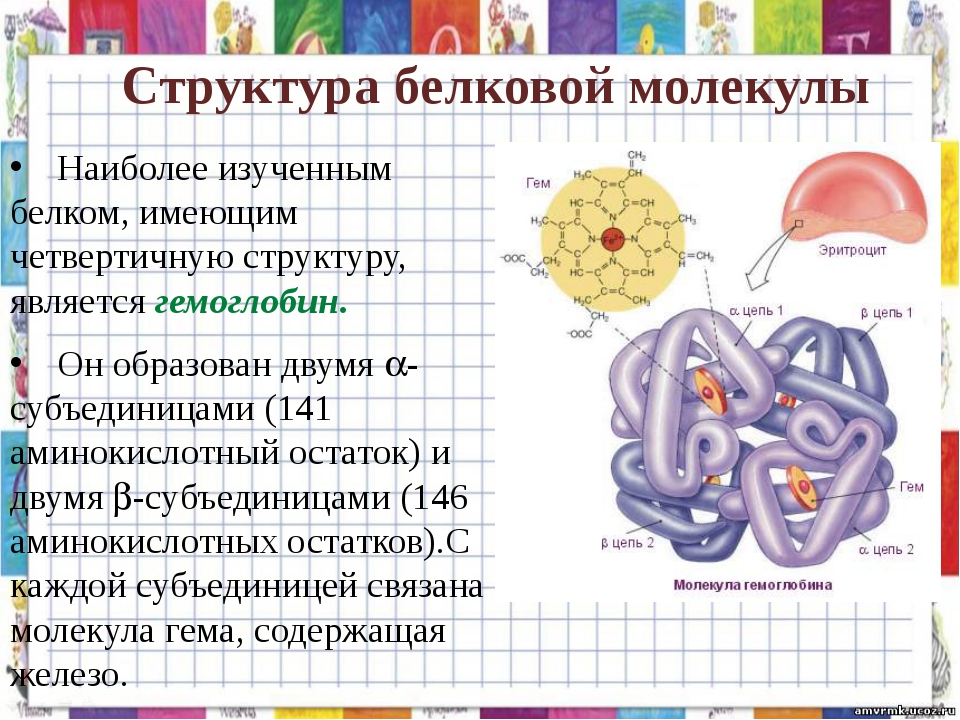 Д. Маш, А.Г. Драго милов. 3-е изд., перераб. М. : Вентана-Граф, 2017. 96 с. : ил. ISBN
Д. Маш, А.Г. Драго милов. 3-е изд., перераб. М. : Вентана-Граф, 2017. 96 с. : ил. ISBN
Молекулярная биология
Молекулярная биология Курс лекций для студентов IV курса факультета биологии РГПУ им. А.И. Герцена Профессор кафедры Зоологии, д.б.н., профессор Цымбаленко Надежда Васильевна СТРУКТУРА БЕЛКА ЛЕКЦИЯ 9 Структура
ПодробнееID_2853 1/6 neznaika.pro
1 Клетка, её жизненный цикл (установление соответствия) Ответами к заданиям являются слово, словосочетание, число или последовательность слов, чисел. Запишите ответ без пробелов, запятых и других дополнительных
ПодробнееХимический состав живого
Химический состав живого Единство химического состава С,Н,О,N 99% состава живых организмов (органогены) Р,S,Na, K,Ca, Cl,Mg обязательны (макроэлементы) Mn, Fe, Co, Cu, Zn обязательны в микродозах (микроэлементы)
Подробнее«Нуклеиновые кислоты»
Государственное бюджетное общеобразовательное учреждение Самарской области средняя общеобразовательная школа 8 пгт Алексеевка городского округа Кинель Самарской области Методическая разработка урока биологии
ПодробнееЗадания B6 по биологии
Задания B6 по биологии 1. Установите соответствие между особенностями строения и свойств вещества и веществом, имеющим эти особенности. ОСОБЕННОСТИ СТРОЕНИЯ И СВОЙСТВ ВЕЩЕСТВА А) неполярны, нерастворимы
Установите соответствие между особенностями строения и свойств вещества и веществом, имеющим эти особенности. ОСОБЕННОСТИ СТРОЕНИЯ И СВОЙСТВ ВЕЩЕСТВА А) неполярны, нерастворимы
2018/2019 учебный год
УТВЕРЖДЕНО Приказ Министра образования Республики Беларусь 03.12.2018 836 Билеты для проведения экзамена в порядке экстерната при освоении содержания образовательной программы базового образования по учебному
ПодробнееТерминологический диктант
Терминологический диктант Органы цветковых растений. 1 Часть тела организма выполняет определенную функцию… 2 В почве растение удерживает.. 3 Многочисленные разветвленные корни образуют. 4 В корневой
Подробнее«Белковые гидролизаты»»
«Белковые гидролизаты»» Натуральные компоненты для создания продуктов питания, косметики и лекарственных средств 1 Резюме Участники АО «МИНЦ» ООО «Тихоокеанский центр трансфера технологий» (ТЦТТ) Федеральное
Подробнее| 1. |
Формула аминокислоты
Сложность: лёгкое |
1 |
| 2. |
Функциональные группы аминокислот
Сложность: лёгкое |
1 |
3.
|
Функции белков
Сложность: лёгкое |
1 |
| 4. |
Строение и химические свойства аминокислот
Сложность: среднее |
2 |
5.
|
Строение и свойства белков
Сложность: среднее |
2 |
| 6. |
Термины по теме «Белки»
Сложность: среднее |
2 |
7.
|
Реакции белков
Сложность: среднее |
2 |
| 8. |
Сравнение белков и жиров
Сложность: среднее |
2 |
9.
|
Цветные реакции белков
Сложность: среднее |
2 |
Белки: строение и функции.
Строение и функции белков.
Белки – это группа органических полимеров (биополимеры), мономерами которых являются аминокислоты.
В клетках и тканях живых организмов встречается около 170 разных белков, но в составе белков можно найти только 20 из них. Аминокислоты, входящие в состав белков называются ПРОТЕИНОВЫЕ АМИНОСЛОТЫ.
Растения способны самостоятельно синтезировать необходимые аминокислоты, животные некоторые аминокислоты могут получить только с пищей.
Аминокислоты, которые не вырабатываются в нашем организме, а поступают в организм только с пищей называются незаменимые. Аминокислоты, вырабатываемые организмом – заменимые. И есть группа условно заменимых аминокислот – эти аминокислоты вырабатываются в организме, но в малых количествах.
Физические свойства аминокислот:
Бесцветные
Кристаллические
Хорошо растворимы в воде, практически не растворимы в растворителях
Вкусовые качества зависят от радикала
Температура плавления выше 200о С.
Химические свойства аминокислот:
Аминокислоты являются амфотерными соединениями. За счет карбоксильной группы образуют соли с основаниями. За счет аминогруппы способны образовывать соли с кислотами.
Аминокислоты соединяются в белках за счет пептидных связей. Эта связь образуется между аминогруппой и карбоксильной группой. (учебник рис.19)
Последовательность из двух аминокислот называется дипептид, из 3-х – трипептид, более 10-ти – полипептид, более 50-ти белок.
Пространственная структура белков: ( в учебнике рис.20)
Первичная структура белка – это линейная последовательность аминокислот, соединенных пептидными связями.
Вторичная структура белка – спирально скрученная нить. Связи: пептидные, водородные.
Третичная структура – компактная глобула. Связи: пептидные, водородные, ионные, дисульфидные.
Четвертичная структура – несколько глобул соединенных вместе. Связи: пептидные, ионные, водородные, гидрофобные. Пример четвертичной структуры – белок гемоглобин, который состоит из 4-х субъединиц.
Белки способны усложнять и утрачивать свою структуру.
Денатурация – утрата структуры белка (может быть вызвана температурой, обезвоживанием, излучением).
Ренатурация – восстановление структуры белка.
Деструкция – полное разрушение белковой молекулы.
Классификации белков:
По форме:
Фибриллярные (молекулы вытянуты)
Глобулярные (молекулы в форме клубка – глобулы)
По химическому составу:
Простые (в составе только аминокислоты)
Сложные (имеют в составе небелковые связи)
— липопротеины
— гликопротеины
— нуклеопротеины
По функциям:
Структурные (коллаген, кератин)
Ферменты (пепсин, трипсин, амилаза)
Гормоны (инсулин, соматотропин, тироксин)
Транспортные белки (гемоглобин)
Защитные белки (антитела)
Сократительные белки (актин, миозин)
Запасные белки (альбумин)
Токсины (белки змеиного яда)
Функции белков:
Структурная | Образуют основу цитоплазмы, входят в состав клеточной мембраны, рибосом, хромосом. |
Каталитическая | Являются ферментами. |
Двигательная | Обеспечивают движение, сокращение мышечных волокон. |
Транспортная | Транспорт кислорода по организму. |
Защитная | Факторы иммунитета – антитела и интерфероны. |
Регуляторная | Гормоны – регуляторы (инсулин, глюкагон). |
Энергетическая | При распаде 1г белка выделяется 17,6 кДж энергии. |
Запасающая | Накапливаются в клетках организма (семена бобовых растений) |
Рецепторная | Являются рецепторами мембран, участвуют в восприятии и передаче сигналов. |
ВИКТОРИНА — Биология и наука
BIOL 101 — Тест 5 — Макромолекулы1. Что из следующего является строительным материалом для белков? аминокислоты2. Какая макромолекула катализирует химические реакции и, таким образом, считается ферментом? рибонуклеиновые кислоты
моносахариды
нуклеотиды
пептиды
жирные кислоты
дезоксирибонуклеиновые кислоты
липиды
полисахариды
белки 3.Чем отличаются РНК и ДНК? тип сахара, который они содержат
сколько прядей они содержат
по базам, которые они содержат
по их функции
все из этого 4. Что из следующего лучше всего описывает образование макромолекулы? удаление воды с образованием водородной связи
добавление воды для образования ионной связи
удаление воды с образованием ионной связи
добавление воды для образования ковалентной связи
ни один из этих 5.
 Примерно сколько типичных аминокислот содержится в белках? 4
Примерно сколько типичных аминокислот содержится в белках? 4 16
20
64
1096 6. Какой уровень белковой организации обусловлен взаимодействиями между группами боковых цепей аминокислот? начальный
вторичный
высшее
четвертичный
все из этого 7. Когда белок кипятится, он теряет все уровни организации, кроме первичного. Когда это происходит, говорят, что белок: гидролизованный
лизированный
денатурированный
обезвоженный
плазмолизированный 8.Рибоза, сахар, содержащийся в РНК, содержит 5 атомов углерода и, таким образом, считается a (n): дисахарид
пентоза
гексоза
аминокислота
полиол 9. Каков общий состав углевода? (CH 2 O) n
(CH 4 ) n
(C 3 H 7 O) n
(CCN) №
ни один из этих 10.
 У фосфолипидов есть: два гидрофобных хвоста и одна гидрофильная голова
У фосфолипидов есть: два гидрофобных хвоста и одна гидрофильная голова два гидрофильных хвоста и одна гидрофобная головка
один гидрофобный хвост и одна гидрофильная голова
три гидрофобных хвоста и одна гидрофильная голова
две гидрофильные головы и один гидрофобный хвост
1.4 Органические соединения | Химия жизни
1.4 Органические соединения (ESG49)
Учащиеся будут изучать углеводы, липиды, белки и нуклеиновые кислоты под следующими заголовками:
- Молекулярный состав : основные элементы, составляющие класс соединений.
- Структурный состав : как мономеры соединяются вместе с образованием полимеров.
- Биологическая роль : важность этих молекул для животных и растений.
- Химический тест : как определить присутствие каждого класса соединений.
Есть также объяснение ферментов в разделе белков. Этот раздел главы содержит наиболее практическую работу, поэтому следует уделить много времени рассмотрению этого раздела.
Этот раздел главы содержит наиболее практическую работу, поэтому следует уделить много времени рассмотрению этого раздела.
Органическое соединение — это соединение, молекулы которого содержат C и обычно по крайней мере одну связь C-C или C-H. Очень маленькие углеродсодержащие молекулы, которые не подчиняются указанным выше правилам, такие как \ (\ text {CO} _ {2} \) и простые карбонаты, считаются неорганическими.Жизнь на Земле была бы невозможна без углерода. Помимо воды, большинство молекул живых клеток основаны на углероде и, следовательно, называются органическими соединениями. Основные классы органических соединений, которые мы рассмотрим в этом разделе, включают углеводы, липиды, белки и нуклеиновые кислоты.
Каждый из этих классов соединений состоит из больших молекул, построенных из малых субъединиц. Самая маленькая из этих субъединиц называется мономером . Несколько мономеров связываются вместе с образованием полимеров .Каждый из этих полимеров характеризуется определенной структурой за счет образующихся химических связей. Эти структуры связаны с функцией соединения в живых организмах. Поэтому мы будем изучать каждый класс соединений под следующими заголовками:
Эти структуры связаны с функцией соединения в живых организмах. Поэтому мы будем изучать каждый класс соединений под следующими заголовками:
- Молекулярный состав : основные элементы, составляющие класс соединений.
- Структурный состав : как мономеры соединяются вместе с образованием полимеров.
- Биологическая роль : важность этих молекул для животных и растений.
- Химический тест : как определить присутствие каждого класса соединений.
Углеводы (ESG4B)
Молекулярный состав
Углеводы состоят из углерода (C), водорода (H) и кислорода (O).
Рис. 1.6: Молекула глюкозы состоит из углерода (серые сферы), водорода (белые сферы) и кислорода (красные сферы).
Конструкционный состав
Углеводы состоят из мономеров, известных как моносахаридов .Моносахарид, из которого состоит большинство углеводов, — это глюкоза. Другие моносахариды включают фруктозу, галактозу и дезоксирибозу (обсуждается позже). Эти мономеры могут быть соединены вместе гликозидными связями . Когда два моносахарида химически связаны вместе, они образуют дисахаридов . Примером дисахарида является сахароза (столовый сахар), который состоит из глюкозы и фруктозы. Другие диссахариды включают лактозу, состоящую из глюкозы и галактозы, и мальтозу, состоящую из двух молекул глюкозы.Моносахариды и диссахариды часто называют сахарами или простыми углеводами. Несколько моносахаридов объединяются с образованием полисахаридов . Примеры полисахаридов, с которыми вы столкнетесь, включают гликоген, крахмал и целлюлозу. Полисахариды обычно называют сложными углеводами, так как они дольше расщепляются.
Другие моносахариды включают фруктозу, галактозу и дезоксирибозу (обсуждается позже). Эти мономеры могут быть соединены вместе гликозидными связями . Когда два моносахарида химически связаны вместе, они образуют дисахаридов . Примером дисахарида является сахароза (столовый сахар), который состоит из глюкозы и фруктозы. Другие диссахариды включают лактозу, состоящую из глюкозы и галактозы, и мальтозу, состоящую из двух молекул глюкозы.Моносахариды и диссахариды часто называют сахарами или простыми углеводами. Несколько моносахаридов объединяются с образованием полисахаридов . Примеры полисахаридов, с которыми вы столкнетесь, включают гликоген, крахмал и целлюлозу. Полисахариды обычно называют сложными углеводами, так как они дольше расщепляются.
Рисунок 1.7: Примеры пищевых источников различных моносахаридов, дисахаридов и полисахаридов.
Роль у животных и растений
Основная функция углеводов — это молекулы хранения энергии и субстраты (исходный материал) для производства энергии. Углеводы расщепляются живыми организмами с выделением энергии. Каждый грамм углеводов обеспечивает около 17 килоджоулей (кДж) энергии. Крахмал и гликоген оба являются запасными полисахаридами (полимеры, состоящие из мономеров глюкозы) и, таким образом, действуют как хранилище энергии в живых организмах. Крахмал является запасным полисахаридом в растениях, а гликоген — запасным полисахаридом для животных. Целлюлоза содержится в стенках клеток растений и придает им силы. Все полисахариды состоят из мономеров глюкозы, но различие в свойствах этих веществ может быть связано с тем, как молекулы глюкозы соединяются вместе, образуя разные структуры.Ниже представлены изображения гликогена и крахмала.
Углеводы расщепляются живыми организмами с выделением энергии. Каждый грамм углеводов обеспечивает около 17 килоджоулей (кДж) энергии. Крахмал и гликоген оба являются запасными полисахаридами (полимеры, состоящие из мономеров глюкозы) и, таким образом, действуют как хранилище энергии в живых организмах. Крахмал является запасным полисахаридом в растениях, а гликоген — запасным полисахаридом для животных. Целлюлоза содержится в стенках клеток растений и придает им силы. Все полисахариды состоят из мономеров глюкозы, но различие в свойствах этих веществ может быть связано с тем, как молекулы глюкозы соединяются вместе, образуя разные структуры.Ниже представлены изображения гликогена и крахмала.
Рисунок 1.8: Сравнение крахмала и гликогена. Гликоген более разветвлен, чем крахмал.
Химические тесты для определения наличия крахмала
Вещества, содержащие крахмал, приобретают сине-черный цвет в присутствии раствора йода. Таким образом, наблюдаемое изменение цвета является основой химического теста на соединение.
Таким образом, наблюдаемое изменение цвета является основой химического теста на соединение.
Рис. 1.9: Гранулы пшеничного крахмала, окрашенные раствором йода и сфотографированные с помощью светового микроскопа.
В следующем исследовании мы проверим несколько различных продуктов на наличие крахмала.
Тест на наличие крахмала
(Essential research-CAPS)Цель
Для проверки на наличие крахмала.
Аппарат
- Картофель или хлеб
- Лист салата
- чашка Петри
- Раствор йода
- капельница
- другие блюда на ваш выбор
Метод
- Поместите кусок картофеля или хлеба, лист салата и другие образцы пищи в отдельные чашки Петри.
- С помощью пипетки добавьте несколько капель раствора йода в продукт в каждой чашке Петри.
Рис. 1.10: Схема эксперимента: испытание на наличие крахмала с использованием раствора йода.
Наблюдения
Запишите свои наблюдения.
Картофель или хлеб становятся сине-черными в присутствии раствора йода, а лист салата — нет.
вопросов
Можно ли с помощью этого метода определить , сколько присутствует крахмал ? Поясните свой ответ.
Да. Чем насыщеннее сине-черный цвет, тем выше содержание крахмала. Если присутствует только немного крахмала, полученный цвет будет более бледным и пурпурным, чем черный. Если крахмала нет вообще, видны только цвет исходного материала (например, зеленого листа) и желто-коричневый цвет раствора йода.
Посмотрите видео демонстрацию теста на крахмал.
Видео: 2CMK
Посмотрите видео демонстрацию теста на крахмал.
видео: 2 см
Посмотрите видео демонстрацию теста на крахмал.
Видео: 2CMN
Химический тест для определения присутствия редуцирующих сахаров
Некоторые моносахариды, такие как глюкоза, известны как редуцирующие сахара . Они определяются как сахара, которые могут легко подвергаться реакциям окисления (т. {\ circ} \) C)
{\ circ} \) C)
Меры предосторожности
- Следуйте процедурам безопасности (перечисленным в главе 1) при розжиге горелки Бунзена.Не зажигайте его на полке или в замкнутом пространстве. Уберите с места все блокноты, бумаги и излишки химикатов. Соберите длинные волосы, свисающие украшения и свободную одежду и никогда не оставляйте открытое пламя без присмотра, пока оно горит.
- При нагревании пробирок в горячей воде в мензурках убедитесь, что устья пробирок направлены от вас и других учеников.
- При работе с пробирками, особенно когда они горячие, используйте держатель для пробирок и надевайте защитные очки.

Метод
Приготовьте водяную баню, наполнив стакан водой до половины. Поместите химический стакан на штатив над пламенем Бунзена, как показано на рисунке 1.11. Это будет служить вашей водяной баней.
ПРИМЕЧАНИЕ ДЛЯ УЧИТЕЛЯ: Для этого не обязательно использовать водяную баню. Пробирки можно нагревать напрямую. Однако необходимо иметь водяную баню, если у учителя нет газа и он вынужден пользоваться плиткой.
Пока вода не нагреется до желаемой температуры, выполните следующие инструкции:
- Пометьте пробирки 1–4.
- С помощью шприца или мерного цилиндра добавьте в пробирки следующее:
- Пробирка 1: \ (\ text {5} \) \ (\ text {ml} \) раствора крахмала \ (\ text {1} \% \)
- пробирка 2: \ (\ text {5} \) \ (\ text {ml} \) из \ (\ text {10} \% \) раствора глюкозы
- пробирка 3: \ (\ text {5} \) \ (\ text {ml} \) \ (\ text {1} \% \) раствор белка
- пробирка 4: \ (\ text {5} \) \ (\ text {ml} \) вода.

- Добавьте \ (\ text {5} \) \ (\ text {ml} \) раствор Бенедикта в каждую пробирку.{\ circ} \) В.
- Примерно через \ (\ text {5} \) минут, когда в некоторых пробирках произошло изменение цвета, погасите пламя или выньте пробирки из водяной бани.
- Поместите четыре пробирки в штатив для пробирок и сравните цвета.
Рисунок 1.11: Тест на восстановление сахара с использованием теста Бенедикта
Результаты
Создайте таблицу для записи результатов этого эксперимента. Важно наблюдать и записывать любые произошедшие изменения.
| Номер пробирки | Наблюдения в каждой пробирке |
Вопросы
- Какие изменения цвета (если они есть) вы наблюдали после нагревания образцов с раствором Бенедикта?
- Три протестированных раствора являются примерами химических веществ, обнаруженных в клетках: глюкоза, крахмал, белок (белок).
 Какой из образцов дал положительный результат при добавлении раствора Бенедикта и нагревании пробирки?
Какой из образцов дал положительный результат при добавлении раствора Бенедикта и нагревании пробирки? - Какие изменения произошли в консистенции раствора Бенедикта, кроме цвета?
- Какие выводы можно сделать по результатам расследования?
- Почему в пробирку 4 попала вода?
Ответы
- Содержимое пробирки 2 становится желто-оранжевым, остальные остаются синими.
- Только глюкоза.
- Стало немного толще / коагулировалось.
- Любое другое тестируемое нами вещество, которое также становится желто-оранжевым при нагревании с раствором Бенедикта, содержит глюкозу или редуцирующий сахар.
- Это контроль, чтобы показать, что раствор Бенедикта вступает в реакцию с другим веществом в пробирке, а не с водой, в которой растворена глюкоза.
Посмотрите видео-демонстрацию теста на снижение содержания сахара.
Видео: 2CMQ
Посмотрите видео-демонстрацию теста на снижение содержания сахара.
Видео: 2CMR
Липиды (ESG4C)
Молекулярный состав
Липиды содержат углерод (C), водород (H) и кислород (O), но содержат меньше кислорода, чем углеводы. Примеры липидов в рационе включают кулинарные масла, такие как подсолнечное и оливковое масло, сливочное масло, маргарин и сало. Многие орехи и семена также содержат большое количество липидов.
Конструкционный состав
Триглицериды — один из наиболее распространенных типов липидов.Молекулы триглицеридов состоят из глицерина и трех жирных кислот (рис. 1.12). Хвосты жирных кислот состоят из множества атомов углерода, соединенных вместе. Количество атомов углерода в цепях жирных кислот может быть разным.
При рисовании органических молекул легко запутаться, выписывая все буквы C и H для углерода и водорода соответственно. Ученые преодолевают это, вытягивая углеродную основу и не обращая внимания на водород. Углерод всегда будет образовывать 4 связи с другими атомами, поэтому легко вычислить, сколько должно быть атомов водорода. Углерод обозначен точкой, а связи между молекулами углерода обозначены линиями, соединяющими точки.
Углерод обозначен точкой, а связи между молекулами углерода обозначены линиями, соединяющими точки.
Рис. 1.12: Молекула триглицерида.
Роль у животных и растений
Липиды являются важным запасом энергии и содержат 37,8 килоджоулей (кДж) энергии на грамм. Липиды триглицеридов расщепляются с высвобождением глицерина и жирных кислот. Глицерин можно преобразовать в глюкозу и использовать в качестве источника энергии, однако большая часть энергии, обеспечиваемой липидами, происходит за счет разрушения цепей жирных кислот.Некоторые жирные кислоты являются незаменимыми питательными веществами, которые не могут вырабатываться организмом и должны потребляться в небольших количествах. Заменимые жирные кислоты могут вырабатываться в организме из других соединений.
Липиды важны для пищеварения и транспортировки основных витаминов, помогают защитить органы от шока и помогают поддерживать температуру тела. Липиды также играют важную роль в клеточных мембранах.
Вы узнаете о важной роли, которую липиды играют в клеточных мембранах, из следующей главы, посвященной основным единицам жизни .
Насыщенные и ненасыщенные жиры
Углерод может образовывать четыре связи с другими атомами. Большинство атомов углерода в цепи жирной кислоты связано с двумя соседними атомами углерода и с двумя атомами водорода. Когда каждый атом углерода в цепи жирной кислоты образует четыре одинарные связи и имеет максимальное количество атомов водорода, цепь жирной кислоты называется насыщенной , потому что она «насыщена» атомами водорода. Однако иногда два соседних атома углерода образуются из двойной связи. В этом случае каждый атом углерода, участвующий в двойной связи, присоединен только к одному водороду.Жирные кислоты, которые имеют двойные углерод-углеродные двойные связи, известны как ненасыщенные , потому что двойная связь может быть «разорвана» и может образоваться дополнительная связь с водородом. Двойные связи сильнее одинарных, и они придают цепи жирных кислот «изгиб». Эти изгибы означают, что молекулы не могут плотно упаковываться вместе, и липиды более текучие. Вот почему ненасыщенные жиры имеют тенденцию быть жидкими при комнатной температуре, а насыщенные жиры — твердыми. Жирная кислота
цепи с множеством двойных связей
называются полиненасыщенными жирными кислотами.
Двойные связи сильнее одинарных, и они придают цепи жирных кислот «изгиб». Эти изгибы означают, что молекулы не могут плотно упаковываться вместе, и липиды более текучие. Вот почему ненасыщенные жиры имеют тенденцию быть жидкими при комнатной температуре, а насыщенные жиры — твердыми. Жирная кислота
цепи с множеством двойных связей
называются полиненасыщенными жирными кислотами.
Рис. 1.13: Жирные кислоты могут быть насыщенными, мононенасыщенными или полиненасыщенными, в зависимости от количества присутствующих двойных связей. Двойные связи приводят к «перегибам» в цепи жирных кислот.
Холестерин
Холестерин — это органическое химическое вещество, известное как стерол . От вас не требуется понимать его молекулярный состав или структурный состав. Это важный компонент клеточных мембран. Основные пищевые источники холестерина включают сыр, яйца, свинину, птицу, рыбу и креветки.Холестерин переносится через организм с помощью белков крови, известных как липопротеинов . Липопротеин — это любая комбинация липида и белка.
Липопротеин — это любая комбинация липида и белка.
Холестерин переносится с кровью через организм с помощью липопротеинов высокой плотности , липопротеинов низкой плотности и через триглицеридов.
- Липопротеины низкой плотности (ЛПНП) : Липопротеины низкой плотности транспортируют холестерин по всему телу. В нем более высокая доля холестерина по сравнению с белком.Его часто называют «плохим» холестерином, потому что более высокий уровень ЛПНП связан с сердечными заболеваниями.
- Липопротеины высокой плотности (ЛПВП) : Липопротеины высокой плотности — самые маленькие из липопротеинов. Он имеет высокую долю белка по сравнению с холестерином и поэтому часто известен как «хороший» холестерин. ЛПВП переносит холестерин от клеток в печень, где он расщепляется или выводится из организма в виде отходов.
Вы узнаете больше о том, как холестерин может закупорить артерии и привести к сердечным заболеваниям, в главе, посвященной транспортным системам у животных
Высокий уровень ЛПНП может вызвать сердечные заболевания.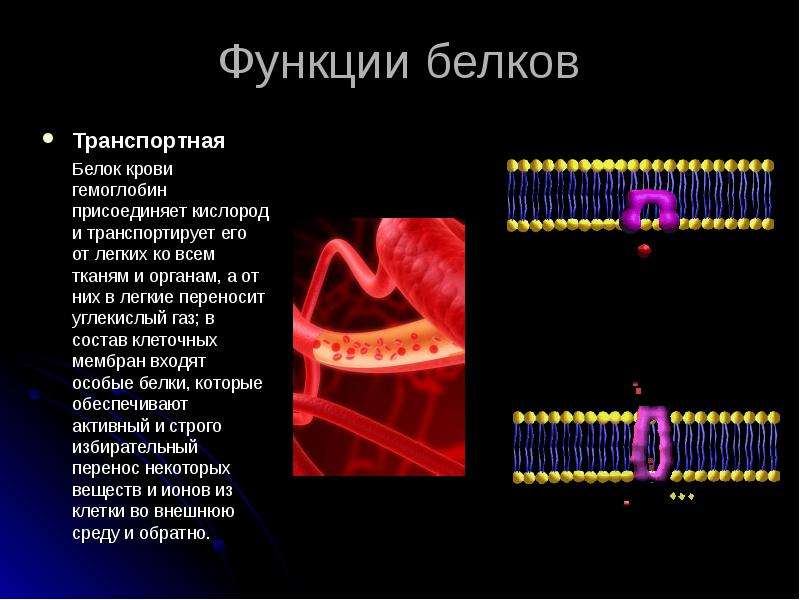 Холестерин накапливается в кровеносных сосудах, по которым кровь идет от сердца к тканям и органам тела, называемым артериями. Это приводит к затвердеванию и сужению этих сосудов, что препятствует транспортировке крови и потенциально может привести к сердечному приступу. Самый большой вклад в количество холестерина в крови — это тип жиров, которые вы едите. Насыщенные жиры менее полезны, чем ненасыщенные, поскольку они увеличивают количество холестерина ЛПНП в крови.
Холестерин накапливается в кровеносных сосудах, по которым кровь идет от сердца к тканям и органам тела, называемым артериями. Это приводит к затвердеванию и сужению этих сосудов, что препятствует транспортировке крови и потенциально может привести к сердечному приступу. Самый большой вклад в количество холестерина в крови — это тип жиров, которые вы едите. Насыщенные жиры менее полезны, чем ненасыщенные, поскольку они увеличивают количество холестерина ЛПНП в крови.
Тест на липиды
Тест на липиды основан на том факте, что липиды оставляют полупрозрачное «жирное пятно» на коричневых бумажных пакетах, а нелипидные вещества — нет.
Посмотрите видео, демонстрирующее тест на липиды.
Видео: 2CMS
Translucent означает, что объект пропускает свет.
Тест на наличие липидов
(Essential research-CAPS)Aim
Для проверки на наличие липидов.
Аппарат
- кусок бумаги или бумажный пакет «рыба с жареным картофелем»
- Пищевые продукты, например, картофель фри, кусок горячего мяса и т.
 Д.
Д. - 10 мл растительного масла (положительный контроль)
- 10 мл воды (отрицательный контроль)
Метод
- Положительный контроль : добавьте кулинарное масло в коричневый бумажный пакет, пока оно не впитается.Часть бумаги, впитывающая масло, должна быть полупрозрачной по сравнению с той, которая не пропускает масло.
- Отрицательный контроль : смочите бумагу водой. Бумага может стать влажной и намокшей, но она не должна стать полупрозрачной.
- Экспериментальные образцы : испачкайте коричневый бумажный пакет исследуемым продуктом и поднесите его к свету. Если он полупрозрачный, как и в положительном контроле, пищевой продукт содержит липид.
Наблюдения
Запишите свои наблюдения, отмечая все ключевые различия между контролем и экспериментальным образцом.
Бумага стала полупрозрачной, когда на нее поместили маслянистую пищу, так же, как полупрозрачное пятно на бумаге, содержащей растительное масло.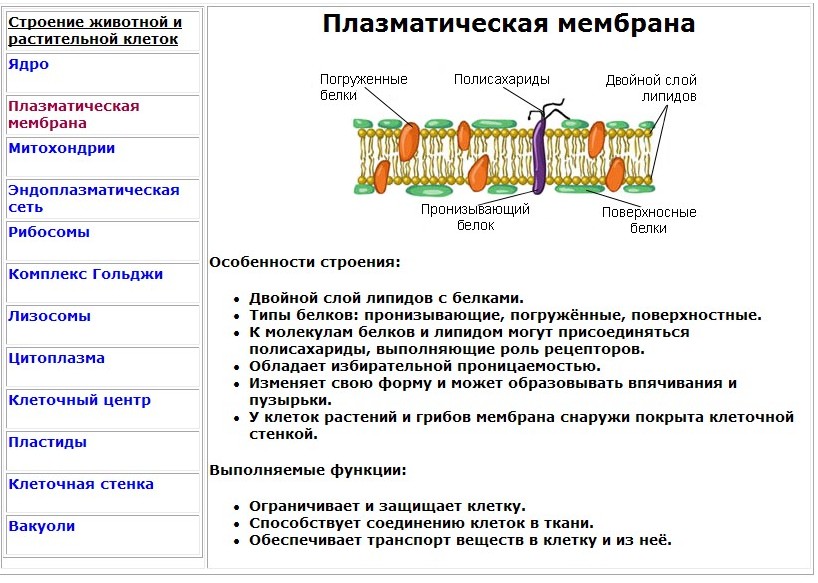 Бумага, содержащая воду, была влажной, но легко высыхала и никогда не была полупрозрачной, поэтому мы можем сделать вывод, что еда содержала масла или липиды, а не воду.
Бумага, содержащая воду, была влажной, но легко высыхала и никогда не была полупрозрачной, поэтому мы можем сделать вывод, что еда содержала масла или липиды, а не воду.
Альтернативные методы определения липидов
Альтернативный метод проверки наличия липидов в образце — измельчение или растворение образца в этаноле. Жиры и липиды растворяются в спирте.После приготовления раствора этанола есть два способа проверить, содержит ли этот образец липиды:
- Отфильтруйте раствор этанола через фильтровальную бумагу: липиды, растворенные в этаноле, сделают фильтровальную бумагу полупрозрачной. Как только спирт испарится, останется полупрозрачное пятно.
- Добавьте образец этанола в воду: липиды не растворяются в воде. Следовательно, если раствор этанола содержит липиды, липиды выпадут в осадок из раствора при смешивании с водой, в результате чего раствор станет молочным.
Белки (ESG4D)
Молекулярный состав
Белки содержат углерод (C), водород (H), кислород (O), азот (N) и могут содержать другие элементы, такие как железо (Fe), фосфор (P) и серу (S).
Конструкционный состав
Белки состоят из аминокислот . Существуют \ (\ text {20} \) распространенные аминокислоты, из которых состоят все белки в живых организмах. Девять из них считаются незаменимыми аминокислотами , поскольку они не могут синтезироваться в организме из других соединений и должны быть получены с пищей.Аминокислоты связаны вместе пептидными связями с образованием пептидов . Длинная пептидная цепь образует белок, который складывается в очень специфическую трехмерную форму. Эта трехмерная форма полностью определяется идентичностью и порядком аминокислот в пептидной цепи. Мы часто называем четырьмя различными уровнями структуры белка (рис. 1.14):
Поскольку последовательность аминокислот определяет способ сворачивания белка, если вы начнете с определенной пептидной цепи, вы всегда получите одну и ту же трехмерную структуру!
- Первичная структура : Это относится к последовательности аминокислот, соединенных пептидными связями с образованием полипептидной цепи.
 Некоторые белки содержат менее сотни аминокислот, а другие — несколько тысяч.
Некоторые белки содержат менее сотни аминокислот, а другие — несколько тысяч. - Вторичная структура : это первый уровень трехмерного складывания. Он полностью управляется водородной связью . Водородная связь обычно приводит к тому, что области намотки цепи и другие области образуют листы.
- Третичная структура : Это второй уровень трехмерного фолдинга и общая окончательная форма белковой молекулы.Вторичные структуры и неструктурированные области цепи дополнительно складываются в глобулярную форму за счет гидрофобных взаимодействий (неполярные области, пытающиеся покинуть воду в клеточной среде) и электростатических взаимодействий (полярные и заряженные области, желающие взаимодействовать с водной средой). и друг друга).
- Четвертичная структура : Некоторые белки являются сложными: две или более пептидных цепей складываются в свои третичные структуры, затем эти полные структуры связываются вместе посредством гидрофобных и электростатических взаимодействий с образованием конечного белка.

Рисунок 1.14: Первичный, вторичный, третичный и четвертичный уровни структуры белка
Роль у животных и растений
Белки важны для выполнения нескольких важных биологических функций. Белки содержатся в волосах, коже, костях, мышцах, сухожилиях, связках и других структурах и выполняют ключевые структурные и механические функции. Белки также важны для клеточной коммуникации и иммунной системы. Белки также могут выступать в качестве запаса энергии при расщеплении в процессе пищеварения.Каждый грамм белка может быть расщеплен, чтобы высвободить 17 кДж энергии. Определенные белки, называемые ферментами , важны для катализации клеточных реакций, которые являются частью метаболизма.
Белки необходимы для любой диеты. Недостаток белка приводит к болезни, называемой квашиоркор (рис. 1.15) или маразмом (рис. 1.16). Маразм вызывается общим дефицитом питания (голоданием), а квашиоркор — именно недостатком белка.
Рисунок 1.15: Ребенок, страдающий от квашиоркора | Рисунок 1.16: Ребенок, страдающий маразмом |
Мясо или овощи: какой источник белка лучше?
И животный белок, и белок овощей полезны для здоровья. Но каждый тип содержит другие питательные вещества. Итак, какой «пакет» питательных веществ — мясо или овощи — лучше для здоровья?
- 180-граммовый стейк содержит 40 г белка, НО также содержит 38 г жира, что больше, чем рекомендуемая диета
- Из такого же количества лосося получается 34 г белка и 18 г жира.
- В стакане вареной чечевицы содержится 18 г белка и 1 г жира.
Тест на белки
Тест Biuret Test для использования белков включает тестирование на наличие пептидной связи. Реагент биурета — это реагент на основе меди, который становится пурпурным при связывании с белком в щелочном растворе (рис. 1.17). Чем больше присутствует пептидных связей, тем больше интенсивность пурпурного цвета, что указывает на более высокую концентрацию белка.
1.17). Чем больше присутствует пептидных связей, тем больше интенсивность пурпурного цвета, что указывает на более высокую концентрацию белка.
Наличие белка также можно определить с помощью реагента Миллона .Реагент Миллона реагирует с аминокислотами тирозина, обычными для большинства белков, и приводит к образованию красновато-коричневого осадка при нагревании.
В таблице 1.5 ниже приведены основные тесты и их ожидаемые результаты в присутствии и отсутствии белка.
Посмотрите видеодемонстрацию теста Биурета на белок.
Видео: 2CMT
| Тестовый реагент | Положительный результат | Отрицательный результат | |
| Биуретовый реагент | Фиолетовый / фиолетовый цвет | 2Реагент Millon | Синий цвет | белый цвет |
Таблица 1. {\ circ} \) C)
{\ circ} \) C)
- два с раствором альбумина (положительный контроль)
- два с сахарной водой (отрицательный контроль)
- пробирок с образцами для проверки на наличие белка Пробирка
- с реактивом Миллона
- Пробирка с раствором для биуретовой пробы
( ПРИМЕЧАНИЕ: Реагент Миллона и раствор Биурета в этом эксперименте должны быть приготовлены для вас вашим учителем).
Метод
Тест на белок с реактивом Миллона
ВНИМАНИЕ! Реагент Миллона очень токсичен! Избегайте вдыхания его паров.
- С помощью капельницы или пипетки добавьте несколько капель реагента Миллона в пробирку, содержащую альбумин.
- С помощью пипетки или пипетки добавьте несколько капель реагента Миллона в пробирку, содержащую сахарную воду.
- Используя пипетку или пипетку, добавьте несколько капель реагента Миллона в пробирку, содержащую образцы ваших продуктов, которые нужно протестировать.
- Нагрейте смеси в кипящей воде в течение 5 минут.
- Обратите внимание на любые изменения цвета.
Тест на белок с помощью теста Биурэ
- С помощью капельницы или пипетки добавьте несколько капель раствора Биурета в пробирку, содержащую альбумин.
- С помощью пипетки или пипетки добавьте несколько капель раствора Биурета в пробирку, содержащую сахарную воду.
- Используя пипетку или пипетку, добавьте несколько капель раствора Биурета в пробирку, содержащую образцы ваших продуктов, которые нужно протестировать.
- Обратите внимание на любые изменения цвета.
Рисунок 1.17: Биуретовый тест: это ожидаемое изменение цвета, если присутствует белок
Наблюдения
Запишите свои наблюдения, отмечая все ключевые различия между положительным контролем, отрицательным контролем и экспериментальными образцами
Наблюдения: Реагент Миллона
Белок приобретает кирпично-красный цвет и становится твердым. Красноватый цвет указывает на положительный результат теста на белок. Вода с сахаром не становится красной — она остается прозрачной, что свидетельствует об отсутствии белков.Любые образцы пищевых продуктов, которые становятся красновато-коричневыми при нагревании с реактивом Миллонса, также содержат белки.
Красноватый цвет указывает на положительный результат теста на белок. Вода с сахаром не становится красной — она остается прозрачной, что свидетельствует об отсутствии белков.Любые образцы пищевых продуктов, которые становятся красновато-коричневыми при нагревании с реактивом Миллонса, также содержат белки.
Наблюдения: биуретовый тест
Белок становится фиолетовым, что указывает на присутствие белков. Вода с сахаром остается синего цвета добавленного сульфата меди — она не становится фиолетовой, что указывает на отсутствие белков. Любые образцы пищевых продуктов, которые становятся фиолетовыми при добавлении химикатов Biuret, содержат белок.
Посмотреть видео-демонстрацию эксперимента по тестированию белков:
Видео: 2CMV
Ферменты (ESG4F)
Ферменты — это белковые молекулы, которые помогают протекать химическим реакциям в живых организмах.Термин фермент имеет особое значение: фермент — это биологический катализатор, который ускоряет скорость химической реакции, но не используется в самой химической реакции. Разберем это определение подробнее.
Разберем это определение подробнее.
Узнайте, что такое ферменты и как они работают.
Видео: 2CMW
Биологические : Ферменты — это белковые молекулы, состоящие из длинных цепочек аминокислот. Они складываются в уникальные трехмерные структуры с областью, известной как активный центр , где происходят реакции.
Катализатор : Ферменты ускоряют химические реакции, но сами по себе не используются. Все химические реакции требуют определенного минимального количества энергии. Эта энергия известна как свободная энергия активации . Ферменты снижают энергию активации, тем самым ускоряя химические реакции (рис. 1.18).
Рис. 1.18: Ферменты снижают энергию активации, тем самым ускоряя протекание реакций.
Ферменты не расходуются в реакциях, которые они катализируют. : они не изменяют равновесия реакций, поэтому они катализируют как прямые, так и обратные реакции. Направление, в котором протекает реакция, определяется концентрацией субстратов и продуктов реакции.
Направление, в котором протекает реакция, определяется концентрацией субстратов и продуктов реакции.
Ферменты могут участвовать в реакциях разрушения или наращивания молекул. Реакции разложения известны как катаболических реакций . Нарастающие реакции известны как анаболических реакций .
Модель действия фермента «замок и ключ»
Ферменты очень специфичны в отношении реакций, которые они катализируют.Специфичность зависит от связей, образованных между активным центром фермента и его субстратом. Активные сайты имеют определенную форму, которая позволяет связывать очень специфический субстрат. Высокоспецифичный характер связывания фермента с субстратом сравнивают с «замком и ключом», где фермент выступает в качестве «замка», а субстрат — в качестве «ключа» (рис. 1.19). Субстрат связывает активный центр с образованием комплекса фермент-субстрат. Происходит реакция, затем продукт покидает активный центр, поскольку он больше не соответствует «замку» так же, как субстрат. Фермент остается неизменным.
Фермент остается неизменным.
Рис. 1.19: Эта диаграмма иллюстрирует «ключ-замок» модель действия фермента.
Исследование действия биологических стиральных порошков
(Essential research-CAPS)Цель
Для проверки действия ферментов в биологических стиральных порошках.
Аппарат
- два яйца всмятку (яйца, сваренные вкрутую, содержат денатурированные белки, не оставляющие пятен)
- два стакана
- Биологический стиральный порошок (с ферментами)
- Небиологический стиральный порошок (старый тип стирального порошка)
- вода
- две мерные ложки
Метод
- Пометьте 3 стакана «Био», «Небио» и «Контроль», которые будут содержать биологический стиральный порошок, небиологический стиральный порошок и воду (отрицательный контроль) соответственно.
- В стакане с надписью «Био» растворите \ (\ text {5} \) \ (\ text {g} \) биологический стиральный порошок в \ (\ text {30} \) \ (\ text {ml} \) вода.

- В стакане с надписью «Non-Bio» растворите \ (\ text {5} \) \ (\ text {g} \) небиологический стиральный порошок в \ (\ text {30} \) \ (\ text { мл} \) воды.
- Налейте \ (\ text {30} \) \ (\ text {ml} \) водопроводной воды в контрольный стакан.
- Выньте небольшое количество яичного желтка.
- Поместите по чайной ложке с яичным желтком в каждый стакан.
- Оставьте ложки в мензурках на 1-2 часа.
- Наблюдайте за своими результатами.
Результаты
- Запишите свои наблюдения.
- Укажите причину ваших наблюдений.
- Напишите заключение по расследованию.
Результаты
Яичный желток в биологическом стиральном порошке медленно растворяется с ложки. Яичный желток в небиологическом стиральном порошке частично поднимается с ложки, но не распадается и не растворяется в воде.В контрольном стакане изменений нет — желток остается на ложке.
Причины наблюдений
Ферменты биологического стирального порошка разбили яичный желток на более мелкие молекулы, которые отрываются от ложки и растворяются в воде. Этого не произошло ни с небиологическим порошком, ни с контролем.
Этого не произошло ни с небиологическим порошком, ни с контролем.
Заключение
Биологические стиральные порошки лучше, чем небиологические стиральные порошки, удаляют органические пятна с одежды.
Ферменты в быту
Свойства ферментов контролировать реакции широко используются в коммерческих целях. Примеры некоторых из этих применений перечислены ниже:
- Биологические стиральные порошки содержат ферменты, такие как липазы (расщепляет липиды) и протеазы (расщепляет белок), которые способствуют разрушению пятен, вызванных продуктами питания, кровью, жиром или жиром. Эти биологические стиральные порошки экономят энергию, поскольку эффективны при низких температурах.
- Размягчители для мяса содержат ферменты, полученные из таких фруктов, как папайя или ананас. Когда эти ферменты используются в мясных смягчителях, они смягчают мясо.
- Молоко без лактозы производится в первую очередь для людей с непереносимостью лактозы.
 У людей с непереносимостью лактозы отсутствует фермент лактаза, который переваривает лактозу (молочный сахар). Лактоза предварительно переваривается путем добавления в молоко лактазы.
У людей с непереносимостью лактозы отсутствует фермент лактаза, который переваривает лактозу (молочный сахар). Лактоза предварительно переваривается путем добавления в молоко лактазы.
Факторы, влияющие на действие ферментов
1.Температура
У человека ферменты лучше всего работают при \ (\ text {37} \) \ (\ text {° C} \) (рис. 1.20). Это оптимальная температура. При очень высоких температурах белки денатурируют ; это означает, что водородное, гидрофобное и электростатическое взаимодействия, которые приводят к трехмерной форме белка, разрушаются, превращая белок в его первичную структуру, длинную цепочку аминокислот. Когда белок денатурируется, изменяется форма его активного центра, а также остальная часть формы белка.Субстрат больше не может соответствовать активному центру фермента, и химические реакции не могут происходить. Низкие температуры могут замедлить или даже деактивировать ферменты, поскольку низкая температура означает меньшую доступную кинетическую энергию, так что даже более низкая энергия активации, которую допускает фермент, недоступна. Первый график показывает влияние температуры на активность фермента.
Первый график показывает влияние температуры на активность фермента.
2. pH
Активность фермента чувствительна к pH. Ферменты имеют оптимальный pH, как показано на графике, но они могут эффективно функционировать в пределах диапазона pH.Эффективность фермента резко падает, когда pH выходит за пределы оптимального диапазона. Фермент может денатурироваться при воздействии pH за пределами диапазона pH, поскольку pH влияет на заряд некоторых аминокислот и, следовательно, влияет на электростатические взаимодействия, удерживающие вместе третичную структуру. Второй график показывает влияние pH на активность фермента.
Оптимальный pH и температура для фермента будут определяться видом живого существа, в котором он находится. Ферменты в организме человека имеют оптимальную температуру 37 ° C.Бактерии, которые живут в компостных кучах, имеют ферменты с оптимальным диапазоном значений в 40, а бактерии, называемые гипертермофилами (любители очень высоких температур), которые живут в горячих источниках, имеют ферменты с оптимальными температурами выше 80 ° C.
Рис. 1.20: Графики, показывающие влияние температуры и pH на активность фермента соответственно.
В следующем исследовании будет изучено влияние температуры на активность фермента каталазы. Перекись водорода потенциально токсична, поэтому живые ткани содержат фермент каталаза, который расщепляет его на нетоксичные соединения, а именно воду и кислород.Вы изучите влияние фермента каталазы на расщепление перекиси водорода. Далее вы изучите влияние pH и температуры на активность ферментов.
Изучение влияния каталазы из куриной печени на перекись водорода
(Essential research-CAPS)Цель
Продемонстрировать действие каталазы на перекись водорода.
Аппарат
- Мерные цилиндры 10 мл
- пипетка
- \ (\ text {3} \% \) Раствор перекиси водорода
- скальпель
- зажим
- баланс
- Куриная печень комнатной температуры
- Печень куриная отварная
- Печень куриная замороженная
- стержень для перемешивания
Метод
Следуйте инструкциям ниже:
- Отрежьте два квадратных куска весом 0.
 1 г из свежей пробы печени и поместите каждый в отдельный мерный цилиндр на 10 мл.
1 г из свежей пробы печени и поместите каждый в отдельный мерный цилиндр на 10 мл. - Отмерьте 3 мл воды в чистый мерный цилиндр. Перелейте в один из цилиндров, содержащих свежую печень. Это ваш негативный контроль.
- Используйте чистый мерный цилиндр для измерения 3 мл перекиси водорода. Перелейте в оставшийся цилиндр, содержащий свежую печень. Это ваш положительный контроль.
- Подождите четыре минуты, а затем измерьте и запишите высоту образовавшихся пузырьков кислорода в каждом баллоне.
Вопросы
- Назовите три переменных, которые должны оставаться стабильными на протяжении этих экспериментов, и объясните, почему они должны оставаться стабильными.
- Какая реакция происходит?
- Как вы могли бы сделать этот эксперимент более точным?
- Какие еще факторы влияют на скорость реакции, помимо температуры?
Ответы
- Факторы остались прежними: [любые три из следующих]
- Используйте одинаковое количество куриной печени в каждом мерном цилиндре, чтобы контролировать количество присутствующего фермента.

- Используйте 3 мл воды и 3 мл перекиси водорода в двух разных цилиндрах, чтобы количество жидкости оставалось постоянным.
- Дайте двум цилиндрам одинаковое время для прохождения реакции, чтобы можно было надежно сравнить барботажные колонки.
- Содержимое обоих мерных цилиндров должно иметь одинаковую температуру, чтобы температура не мешала исследуемой реакции.
- Используйте одинаковое количество куриной печени в каждом мерном цилиндре, чтобы контролировать количество присутствующего фермента.
- Это катаболическая реакция / реакция разложения, поскольку перекись водорода распадается на кислород (пузырьки) и воду (оставшаяся жидкость).Реакция также является экзотермической, поскольку мерный цилиндр нагрелся — во время реакции выделялось тепло.
- Повышение точности:
- Залейте жидкость в оба цилиндра одновременно.
- Точнее отмерьте количество куриной печени.
- Должна быть возможность рассчитать объем кислорода, выделяемого при пропускании его через воду, и более точно рассчитать объем кислорода, используя принцип вытеснения. В существующем методе часть кислорода улетучивалась в воздух, когда пузырьки лопались, поэтому измерение высоты является приблизительным значением объема выделившегося кислорода.
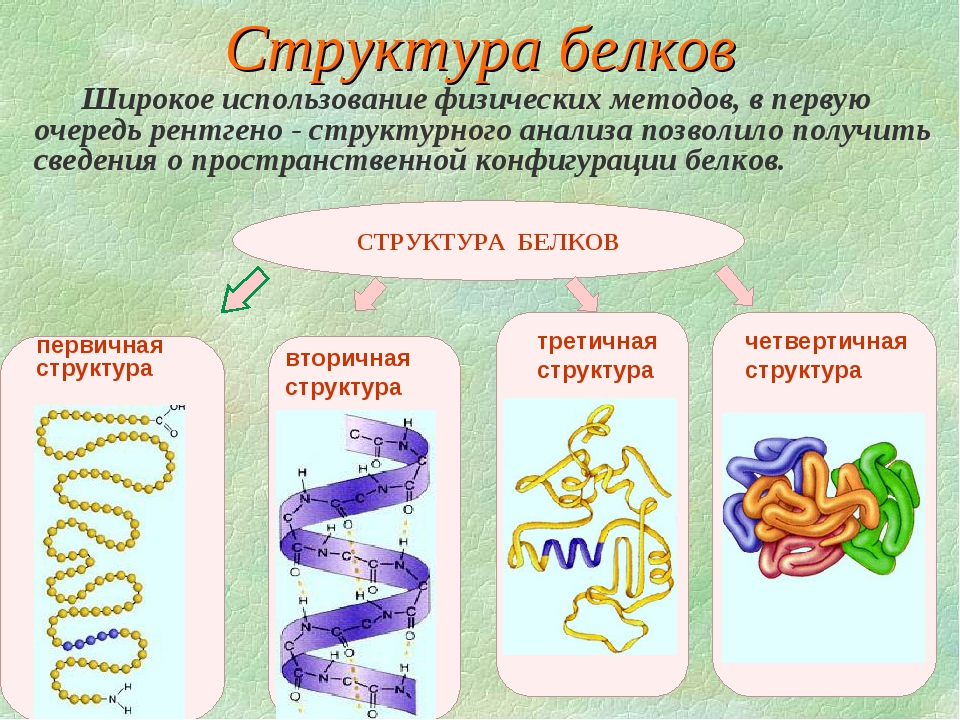
- Другие факторы, влияющие на скорость реакции:
- Количество фермента в печени.
- Количество доступного субстрата.
- pH среды.
- Состояние куриной печени — если она не свежая, некоторые ферменты могут быть неактивными.
- Температура печени и жидкости.
Каковы лучшие условия для фермента каталазы? Что происходит, когда фермент или живая ткань помещается в перекись водорода? Узнайте в этом видео.
Видео: 2CMX
Исследование влияния каталазы из куриной печени на перекись водорода — ЧАСТЬ B
Цель
Продемонстрировать влияние температуры на активность каталазы.
Метод
- Добавьте 3 мл перекиси водорода в три отдельных градуированных мерных цилиндра на 10 мл. Пометьте один цилиндр «печень куриная замороженная»; второй — «вареная куриная печень» и третий — «куриная печень комнатной температуры».
- Вырежьте по 0,1 г квадрата из замороженной и вареной куриной печени комнатной температуры.
 Положите кусочки печени в мерный цилиндр с соответствующей маркировкой с перекисью водорода.
Положите кусочки печени в мерный цилиндр с соответствующей маркировкой с перекисью водорода. - Оставьте кусочки печени на четыре минуты и измерьте высоту образовавшихся пузырьков.
Вопросы
- Объясните причины различий, наблюдаемых для трех измерительных цилиндров.
- Назовите зависимые и независимые переменные в этом эксперименте.
- Как вы могли бы сделать этот эксперимент более точным?
- Какие выводы вы сделаете из своих наблюдений?
Ответы
- При комнатной температуре печень реагирует очень быстро и производит большое количество больших пенистых белых пузырьков, потому что ферменты очень активны — они близки к своей оптимальной температуре и легко расщепляют перекись водорода на воду и кислород.Замороженная печень сначала реагирует очень медленно и образует очень мало пузырьков, поскольку ферменты неактивны при таких низких температурах — им не хватает энергии активации.
 По мере того, как реакция выделяет тепло, фермент немного позже ускоряется и образует более крупные пузырьки с большей скоростью, но никогда не так быстро, как при комнатной температуре. Вареная печень не проявляет никакой реакции — пузырьки не образуются, так как ферменты денатурировались при кипячении. Их форма изменилась, и они вообще не могут катализировать реакцию.
По мере того, как реакция выделяет тепло, фермент немного позже ускоряется и образует более крупные пузырьки с большей скоростью, но никогда не так быстро, как при комнатной температуре. Вареная печень не проявляет никакой реакции — пузырьки не образуются, так как ферменты денатурировались при кипячении. Их форма изменилась, и они вообще не могут катализировать реакцию. - Зависимой переменной является скорость реакции, то есть количество образовавшегося кислорода, которое было измерено как высота барботажной колонны.
- Независимая переменная — температура — печень была комнатной температуры или была замороженной или вареной.
- Более точно измерьте количество печени и объем перекиси водорода и держите их одинаковыми.
- Убедитесь, что все 3 мерных цилиндра идентичны — одинаковой ширины.
- Залейте перекись водорода в цилиндры одновременно.
- Уловите количество выделившегося кислорода и используйте принцип вытеснения для более точного расчета объема газа.

- Температура влияет на активность ферментов. Ферменты наиболее активны при температуре, близкой к их оптимальным температурам, но они денатурируют и не могут функционировать, если температура слишком высока. При очень низких температурах ферменты не могут эффективно функционировать из-за недостатка энергии активации — они работают очень медленно.
Нуклеиновые кислоты (ESG4G)
Нуклеиновые кислоты, такие как ДНК и РНК, представляют собой большие органические молекулы, которые являются ключевыми для всех живых организмов. Строительные блоки нуклеиновых кислот называются нуклеотидами . Каждый нуклеотид состоит из сахара, фосфата и азотистого основания. Нуклеотиды соединены вместе фосфодиэфирными связями , которые соединяют фосфат одного нуклеотида с сахаром другого. Нити фосфат-сахар-фосфат-сахар образуют «основу», на которой расположены азотсодержащие основания.Следовательно, нуклеиновые кислоты представляют собой полимеров , состоящих из множества нуклеотидов. ДНК представляет собой двухцепочечный полимер из-за образования водородных связей между азотистыми основаниями двух комплементарных цепей. РНК — одноцепочечный полимер. Нуклеиновые кислоты не нужно получать с пищей, потому что они синтезируются с использованием промежуточных продуктов углеводного и аминокислотного обмена.
ДНК представляет собой двухцепочечный полимер из-за образования водородных связей между азотистыми основаниями двух комплементарных цепей. РНК — одноцепочечный полимер. Нуклеиновые кислоты не нужно получать с пищей, потому что они синтезируются с использованием промежуточных продуктов углеводного и аминокислотного обмена.
Нуклеиновые кислоты включают:
- Дезоксирибонуклеиновая кислота ( ДНК, ): содержит «инструкции» по синтезу белков в форме генов.ДНК находится в ядре каждой клетки, а также в меньших количествах присутствует в митохондриях и хлоропластах.
- Рибонуклеиновая кислота ( РНК ): важна для передачи генетической информации от ДНК для образования белков. Он находится на рибосомах, в цитоплазме и ядре.
также можно найти внутри хлоропластов и митохондрий.
Рисунок 1.21: Схематическая диаграмма ДНК и РНК: ДНК двухцепочечная, а РНК одноцепочечная.
Структура и функция ядра будут подробно объяснены в следующей главе: Основные единицы жизни .
Биологический класс 10 Тестовый блок 2 / Карточки работы с клеточными структурами
Нам не удалось определить язык звукового сопровождения на ваших карточках. Пожалуйста, выберите правильный язык ниже.
Фронт Китайский, PinyinChinese, SimplifiedChinese, TraditionalEnglishFrenchGermanItalianJapaneseJapanese, RomajiKoreanMath / SymbolsRussianSpanishAfrikaansAkanAkkadianAlbanianAmharicArabicArmenianAzerbaijaniBasqueBelarusianBengaliBihariBretonBulgarianBurmeseCatalanCebuanoChamorroChemistryCherokeeChinese, PinyinChinese, SimplifiedChinese, TraditionalChoctawCopticCorsicanCroatianCzechDanishDeneDhivehiDutchEnglishEsperantoEstonianFaroeseFilipinoFinnishFrenchFulaGaelicGalicianGeorgianGermanGreekGuaraniGujaratiHaidaHaitianHausaHawaiianHebrewHindiHungarianIcelandicIgboIndonesianInuktitutIrishItalianJapaneseJapanese, RomajiJavaneseKannadaKazakhKhmerKoreanKurdishKyrgyzLakotaLaoLatinLatvianLingalaLithuanianLuba-KasaiLuxembourgishMacedonianMalayMalayalamMalteseMaoriMarathiMarshalleseMath / SymbolsMongolianNepaliNorwegianOccitanOjibweOriyaOromoOther / UnknownPashtoPersianPolishPortuguesePunjabiPāliQuechuaRomanianRomanshRussianSanskritSerbianSindhiSinhaleseSlovakSlovenianSpanishSundaneseSwahiliSwedishTaga logТаджикскийТамильскийТатарскийТелугуТайскийТибетскийТигриньяTohono O’odhamТонгаТурецкийУйгурскийУкраинскийУрдуУзбекскийвьетнамский Валлийский Западно-фризскийИдишЙорубааудио еще не доступно для этого языка
Назад Китайский, PinyinChinese, SimplifiedChinese, TraditionalEnglishFrenchGermanItalianJapaneseJapanese, RomajiKoreanMath / SymbolsRussianSpanishAfrikaansAkanAkkadianAlbanianAmharicArabicArmenianAzerbaijaniBasqueBelarusianBengaliBihariBretonBulgarianBurmeseCatalanCebuanoChamorroChemistryCherokeeChinese, PinyinChinese, SimplifiedChinese, TraditionalChoctawCopticCorsicanCroatianCzechDanishDeneDhivehiDutchEnglishEsperantoEstonianFaroeseFilipinoFinnishFrenchFulaGaelicGalicianGeorgianGermanGreekGuaraniGujaratiHaidaHaitianHausaHawaiianHebrewHindiHungarianIcelandicIgboIndonesianInuktitutIrishItalianJapaneseJapanese, RomajiJavaneseKannadaKazakhKhmerKoreanKurdishKyrgyzLakotaLaoLatinLatvianLingalaLithuanianLuba-KasaiLuxembourgishMacedonianMalayMalayalamMalteseMaoriMarathiMarshalleseMath / SymbolsMongolianNepaliNorwegianOccitanOjibweOriyaOromoOther / UnknownPashtoPersianPolishPortuguesePunjabiPāliQuechuaRomanianRomanshRussianSanskritSerbianSindhiSinhaleseSlovakSlovenianSpanishSundaneseSwahiliSwedishTaga logТаджикскийТамильскийТатарскийТелугуТайскийТибетскийТигриньяTohono O’odhamТонгаТурецкийУйгурскийУкраинскийУрдуУзбекскийвьетнамский Валлийский Западно-фризскийИдишЙорубааудио еще не доступно для этого языка
Биологическая структура и функция возникают в результате масштабирования неконтролируемого обучения до 250 миллионов белковых последовательностей.

Значимость
Изучение биологических свойств на основе данных последовательностей является логическим шагом на пути к генеративному и предсказательному искусственному интеллекту для биологии.Здесь мы предлагаем масштабировать модель глубокого контекстного языка с обучением без учителя до последовательностей, охватывающих эволюционное разнообразие. Мы обнаружили, что без предварительных знаний в усвоенных представлениях появляется информация о фундаментальных свойствах белков, таких как вторичная структура, контакты и биологическая активность. Мы показываем, что выученные представления полезны в тестах для удаленного обнаружения гомологии, предсказания вторичной структуры, дальнодействующих контактов остаток-остаток и мутационного эффекта.Обучение неконтролируемому представлению обеспечивает ультрасовременное контролируемое предсказание мутационного эффекта и вторичной структуры и улучшает современные функции для предсказания контактов на большие расстояния.
Abstract
В области искусственного интеллекта сочетание масштаба данных и возможностей модели, обеспечиваемое неконтролируемым обучением, привело к значительным достижениям в обучении представлений и статистической генерации. В науках о жизни ожидаемый рост секвенирования обещает беспрецедентные данные о разнообразии естественных последовательностей.Моделирование белкового языка в масштабе эволюции — логический шаг к предсказательному и генеративному искусственному интеллекту для биологии. С этой целью мы используем обучение без учителя для обучения модели глубокого контекстного языка на 86 миллиардах аминокислот в 250 миллионах белковых последовательностей, охватывающих эволюционное разнообразие. Полученная модель содержит информацию о биологических свойствах в своих представлениях. Представления узнаются только из данных последовательности. Выученное пространство репрезентации имеет многомасштабную организацию, отражающую структуру от уровня биохимических свойств аминокислот до удаленной гомологии белков.Информация о вторичной и третичной структуре закодирована в представлениях и может быть идентифицирована линейными проекциями. Репрезентативное обучение создает функции, которые обобщаются для целого ряда приложений, обеспечивая ультрасовременное контролируемое прогнозирование мутационного эффекта и вторичной структуры и улучшая современные функции для прогнозирования контактов на большие расстояния.
В науках о жизни ожидаемый рост секвенирования обещает беспрецедентные данные о разнообразии естественных последовательностей.Моделирование белкового языка в масштабе эволюции — логический шаг к предсказательному и генеративному искусственному интеллекту для биологии. С этой целью мы используем обучение без учителя для обучения модели глубокого контекстного языка на 86 миллиардах аминокислот в 250 миллионах белковых последовательностей, охватывающих эволюционное разнообразие. Полученная модель содержит информацию о биологических свойствах в своих представлениях. Представления узнаются только из данных последовательности. Выученное пространство репрезентации имеет многомасштабную организацию, отражающую структуру от уровня биохимических свойств аминокислот до удаленной гомологии белков.Информация о вторичной и третичной структуре закодирована в представлениях и может быть идентифицирована линейными проекциями. Репрезентативное обучение создает функции, которые обобщаются для целого ряда приложений, обеспечивая ультрасовременное контролируемое прогнозирование мутационного эффекта и вторичной структуры и улучшая современные функции для прогнозирования контактов на большие расстояния.
Рост числа белковых последовательностей в общедоступных базах данных на протяжении десятилетий следовал экспоненциальной тенденции, создавая глубокое представление о широте и разнообразии белковых последовательностей на протяжении всей жизни.Эти данные являются многообещающей площадкой для изучения прогнозных и генеративных моделей биологии с использованием искусственного интеллекта. Наша цель здесь будет заключаться в том, чтобы подогнать одну модель ко многим различным последовательностям, полученным на разных этапах эволюции. Соответственно, мы изучаем нейронные сети с высокой пропускной способностью, исследуя, что можно узнать о биологии белков при масштабном моделировании эволюционных данных.
Идея о том, что биологические функции и структура регистрируются в статистике белковых последовательностей, выбранных в процессе эволюции, имеет долгую историю (1–3).Из возможных случайных возмущений последовательности эволюция склоняется к выбору тех, которые согласуются с приспособленностью (4). Ненаблюдаемые переменные, которые определяют приспособленность белка, такие как структура, функция и стабильность, оставляют запись в распределении наблюдаемых природных последовательностей (4).
Ненаблюдаемые переменные, которые определяют приспособленность белка, такие как структура, функция и стабильность, оставляют запись в распределении наблюдаемых природных последовательностей (4).
Раскрытие информации, закодированной в вариациях белковой последовательности, — давняя проблема биологии. Аналогичная проблема в области искусственного интеллекта — понимание естественного языка, где гипотеза распределения утверждает, что семантика слова может быть получена из контекстов, в которых оно появляется (5).
Недавно было показано, что методы, основанные на самоконтроле, форме обучения без учителя, в которой контекст в тексте используется для прогнозирования пропущенных слов, материализует представления значения слов, которые могут быть обобщены для задач естественного языка (6⇓⇓– 9). Возможность изучать такие представления значительно улучшается с большими наборами обучающих данных (10, 11).
Последовательности белков являются результатом процесса, сильно отличающегося от естественного языка. Неясно, эффективны ли модели и целевые функции для передачи естественного языка через различия между доменами.Мы исследуем этот вопрос, обучая высокопроизводительные языковые модели Transformer на эволюционных данных. Мы исследуем полученные неконтролируемые представления на наличие биологических принципов организации и информации о внутренних биологических свойствах. Мы находим метрическую структуру в пространстве представлений, которая согласуется с принципами организации на масштабах от физико-химической до отдаленной гомологии. Мы также обнаружили, что вторичная и третичная белковая структура может быть идентифицирована в репрезентациях.Структурные свойства, захваченные изображениями, обобщаются на складки. Мы применяем представления к ряду задач прогнозирования и обнаруживаем, что они улучшают современные функции приложений.
Неясно, эффективны ли модели и целевые функции для передачи естественного языка через различия между доменами.Мы исследуем этот вопрос, обучая высокопроизводительные языковые модели Transformer на эволюционных данных. Мы исследуем полученные неконтролируемые представления на наличие биологических принципов организации и информации о внутренних биологических свойствах. Мы находим метрическую структуру в пространстве представлений, которая согласуется с принципами организации на масштабах от физико-химической до отдаленной гомологии. Мы также обнаружили, что вторичная и третичная белковая структура может быть идентифицирована в репрезентациях.Структурные свойства, захваченные изображениями, обобщаются на складки. Мы применяем представления к ряду задач прогнозирования и обнаруживаем, что они улучшают современные функции приложений.
Предпосылки
Выравнивание и поиск последовательностей — стандартная основа для сравнительного и статистического анализа данных биологической последовательности (12⇓⇓ – 15). Поиск в больших базах данных, содержащих информацию об эволюционном разнообразии, собирает связанные последовательности в множественное выравнивание последовательностей (MSA).Внутри семейств последовательностей мутационные паттерны несут информацию о функциональных сайтах, стабильности, третичных контактах, связывании и других свойствах (2-4). Консервативные сайты коррелируют с функциональной и структурной важностью (2). Локальный биохимический и структурный контексты отражаются в предпочтении отдельных классов аминокислот (16). Мутации коваринга связаны с функцией, третичными контактами и связыванием (4).
Поиск в больших базах данных, содержащих информацию об эволюционном разнообразии, собирает связанные последовательности в множественное выравнивание последовательностей (MSA).Внутри семейств последовательностей мутационные паттерны несут информацию о функциональных сайтах, стабильности, третичных контактах, связывании и других свойствах (2-4). Консервативные сайты коррелируют с функциональной и структурной важностью (2). Локальный биохимический и структурный контексты отражаются в предпочтении отдельных классов аминокислот (16). Мутации коваринга связаны с функцией, третичными контактами и связыванием (4).
Перспектива вывода биологической структуры и функции из эволюционной статистики мотивировала развитие машинного обучения для отдельных семейств последовательностей.Анализ прямого связывания (17⇓ – 19) позволяет вывести ограничения на структуру белка путем подгонки генеративной модели в форме марковского случайного поля (MRF) к последовательностям в MSA белка. Для соответствия MRF были разработаны различные методы (20⇓⇓ – 23).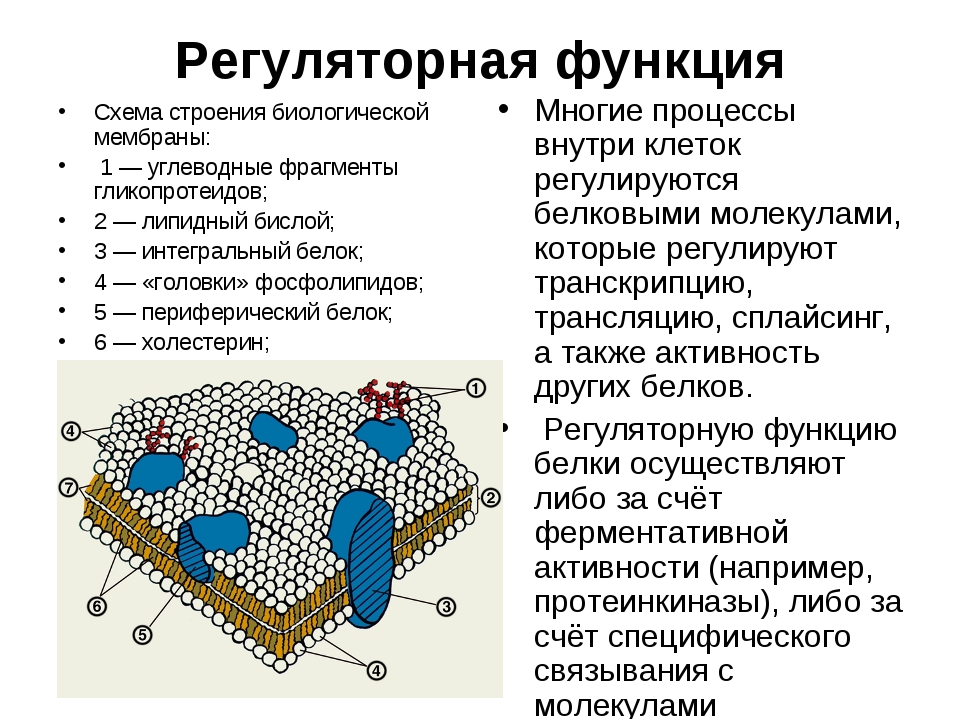 Этот подход также можно использовать для вывода функциональных ограничений (24, 25), а генеративная картина может быть расширена за счет включения скрытых переменных (26).
Этот подход также можно использовать для вывода функциональных ограничений (24, 25), а генеративная картина может быть расширена за счет включения скрытых переменных (26).
В последнее время самоконтроль стал основным направлением в исследованиях искусственного интеллекта.В отличие от обучения с учителем, которое требует ручного аннотирования каждой точки данных, методы с самоконтролем используют немаркированные наборы данных и, следовательно, могут использовать гораздо большие объемы данных. Самостоятельное обучение использует прокси-задачи для обучения, такие как предсказание следующего слова в предложении с учетом всех предыдущих слов (8, 9, 11, 27, 28) или предсказание слов, которые были замаскированы из их контекста (6, 29).
Увеличение размера набора данных и емкости модели показало улучшения в изученных представлениях.В недавней работе методы самоконтроля, используемые в сочетании с большими данными и моделями с высокой пропускной способностью, дали новые современные результаты, приближающиеся к возможностям человека, по различным тестам для ответов на вопросы и семантических рассуждений (6) и когерентной генерации естественного текста (11).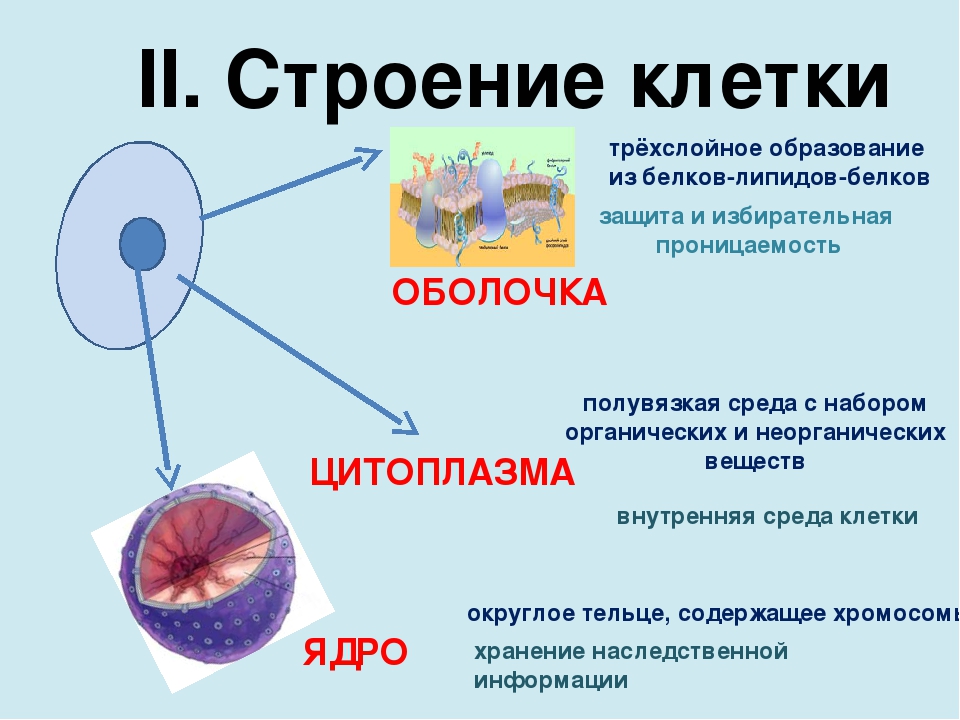 ).
).
В этой статье исследуются подходы к моделированию языка с самоконтролем, которые продемонстрировали современную производительность при решении ряда задач обработки естественного языка, применяя их к данным о белках в форме немеченых аминокислотных последовательностей.Поскольку белковые последовательности используют небольшой словарь из 20 канонических элементов, проблема моделирования больше похожа на модели языка на уровне символов (30, 31), чем на модели на уровне слов. Подобно естественному языку, белковые последовательности также содержат дальнодействующие зависимости, что мотивирует использование архитектур, которые обнаруживают и моделируют удаленный контекст (32).
Масштабирование языковых моделей до 250 миллионов разнообразных белковых последовательностей
Большие базы данных белковых последовательностей содержат разнообразные последовательности, отобранные на протяжении всей жизни.В наших экспериментах мы исследуем наборы данных, содержащие до 250 миллионов последовательностей из базы данных UniParc (33), которая содержит 86 миллиардов аминокислот.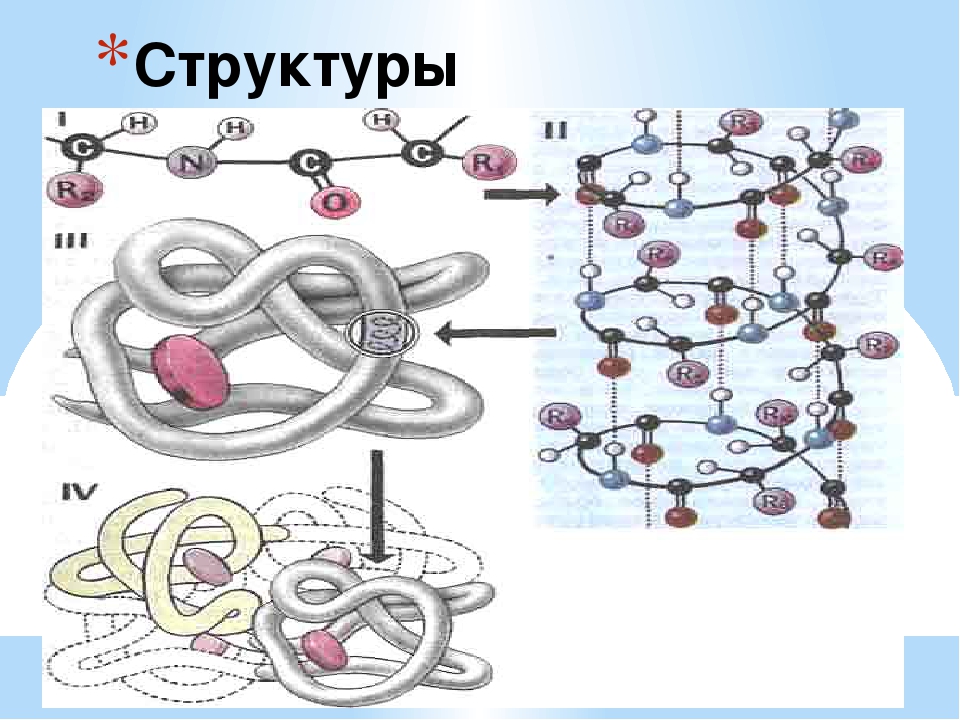 Эти данные сопоставимы по размеру с большими текстовыми наборами данных, которые используются для обучения архитектур нейронных сетей высокой емкости на естественном языке (6, 11). Чтобы моделировать данные эволюции с точностью, архитектура нейронных сетей должна обладать емкостью и индуктивными смещениями, чтобы представлять ее широту и разнообразие.
Эти данные сопоставимы по размеру с большими текстовыми наборами данных, которые используются для обучения архитектур нейронных сетей высокой емкости на естественном языке (6, 11). Чтобы моделировать данные эволюции с точностью, архитектура нейронных сетей должна обладать емкостью и индуктивными смещениями, чтобы представлять ее широту и разнообразие.
Мы исследуем Transformer (32), который превратился в мощную архитектуру модели общего назначения для изучения представлений и генеративного моделирования, превосходящую по производительности рекуррентные и сверточные архитектуры в настройках естественного языка.Мы используем глубокий преобразователь (6), взяв в качестве входных аминокислотные последовательности символов.
Трансформатор обрабатывает входные данные через серию блоков, которые чередуют самовнимание с соединениями с прямой связью. Самовнимание позволяет сети создавать сложные представления, включающие контекст из всей последовательности. Поскольку самовнимание явно конструирует попарные взаимодействия между всеми позициями в последовательности, архитектура Transformer напрямую представляет взаимодействия остаток-остаток.
Мы обучаем модели, используя цель моделирования маскированного языка (6). Каждая входная последовательность искажается заменой части аминокислот специальным токеном маски. Сеть обучена предсказывать недостающие токены из поврежденной последовательности: ℒMLM = Ex∼XEM∑i∈M − logp (xi | x / M). [1] Для каждой последовательности x мы выбираем набор индексов M, чтобы замаскировать , заменяя истинный токен в каждом индексе i токеном маски. Для каждого замаскированного токена мы независимо минимизируем отрицательную логарифмическую вероятность истинной аминокислоты xi с учетом замаскированной последовательности x / M в качестве контекста.Интуитивно, чтобы сделать прогноз для замаскированной позиции, модель должна идентифицировать зависимости между замаскированным сайтом и немаскированными частями последовательности.
Оценка языковых моделей.
Мы начинаем с обучения серии Transformers на всех последовательностях в UniParc (33), держа случайную выборку из 1 M последовательностей для проверки. Мы используем эти модели повсюду, чтобы исследовать свойства представлений и информацию, полученную во время предварительного обучения.
Мы используем эти модели повсюду, чтобы исследовать свойства представлений и информацию, полученную во время предварительного обучения.
Для сравнительной оценки эффективности обобщения различных языковых моделей мы используем UniRef50 (34), кластеризацию UniParc с 50% идентичностью последовательностей.Для оценки случайным образом отбирается удерживаемый набор из 10% кластеров UniRef50. Набор данных оценки состоит из репрезентативных последовательностей этих кластеров. Все последовательности, принадлежащие удерживаемым кластерам, удаляются из наборов данных для предварительного обучения.
Мы исследуем влияние лежащего в основе разнообразия последовательностей в данных до обучения. Кластеризация UniParc показывает степенное распределение размеров кластеров (35), подразумевая, что большинство последовательностей принадлежит небольшой части кластеров.Обучение с использованием кластеризации последовательностей приводит к переназначению потерь моделирования языка маскировки в сторону более разнообразного набора последовательностей. Мы используем UniRef (34) для создания трех наборов данных для предварительного обучения с разными уровнями разнообразия: 1) набор данных с низким разнообразием (UR100) использует репрезентативные последовательности UniRef100, 2) набор разреженных данных с высоким разнообразием (UR50 / S) использует репрезентативный UniRef50. последовательности, и 3) набор данных с большим разнообразием и плотностью (UR50 / D) равномерно отбирает последовательности UniRef100 по кластерам UniRef50.
Мы используем UniRef (34) для создания трех наборов данных для предварительного обучения с разными уровнями разнообразия: 1) набор данных с низким разнообразием (UR100) использует репрезентативные последовательности UniRef100, 2) набор разреженных данных с высоким разнообразием (UR50 / S) использует репрезентативный UniRef50. последовательности, и 3) набор данных с большим разнообразием и плотностью (UR50 / D) равномерно отбирает последовательности UniRef100 по кластерам UniRef50.
В Таблице 1 представлены характеристики моделирования на удерживаемых последовательностях UniRef50 в серии экспериментов, исследующих различные классы моделей, количество параметров и наборы данных для предварительного обучения. Модели сравниваются с использованием показателя экспоненциальной кросс-энтропии (ECE), который представляет собой экспоненту потерь модели, усредненных на один токен. В случае трансформатора это 2ℒMLM. ECE описывает среднюю неопределенность модели среди своего набора опций для каждого прогноза: от одного для идеальной модели до 25 (количество уникальных аминокислотных токенов в данных) для полностью случайного прогноза. Чтобы измерить сложность обобщения оценочного набора, мы обучаем серию моделей n -граммы в диапазоне длин контекста и настроек сглаживания Лапласа на UR50 / S. Лучшая модель n -грамм имеет ECE 17,18 с размером контекста четыре.
Чтобы измерить сложность обобщения оценочного набора, мы обучаем серию моделей n -граммы в диапазоне длин контекста и настроек сглаживания Лапласа на UR50 / S. Лучшая модель n -грамм имеет ECE 17,18 с размером контекста четыре.
Оценка языковых моделей для обобщения на удерживаемые кластеры UniRef50
В качестве базового уровня мы обучаем двунаправленные языковые модели рекуррентной долгосрочной краткосрочной памяти (LSTM) (9), которые являются современным уровнем для рекуррентных моделей. в текстовой области.В отличие от стандартных LSTM с авторегрессией слева направо, эти модели используют весь контекст последовательности, что делает их сопоставимыми с изучаемыми нами трансформаторами. Мы оцениваем малую модель с ~ 25 M параметров и большую модель с ~ 113 M параметрами. Обученные на наборе данных UR50 / S, малые и большие модели LSTM имеют ECE 14,4 и 13,5 соответственно.
Мы также обучаем два небольших трансформатора, 12-слойный (параметры 85,1 M) и шестислойный трансформатор (параметры 42,6 M) на наборе данных UR50 / S.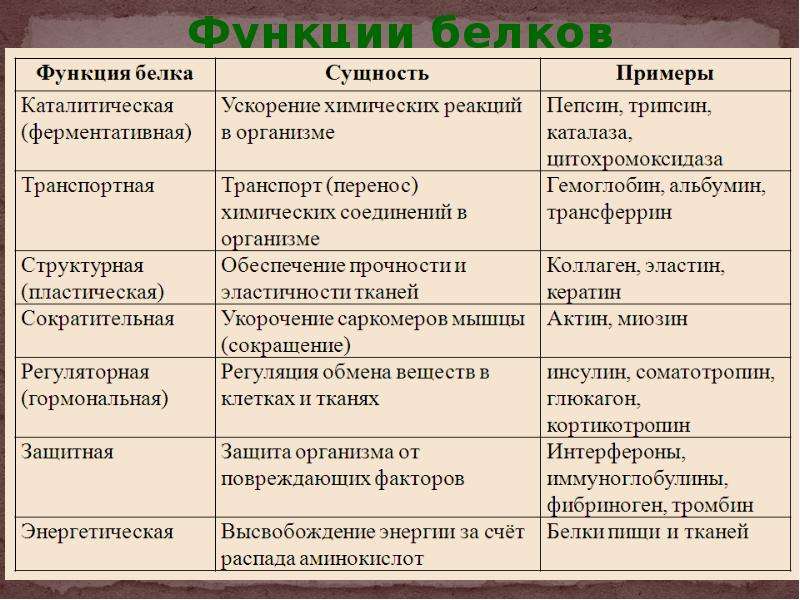 Обе модели Transformer имеют лучшие значения ECE (10.45 и 11.79 соответственно), чем малая и большая модель LSTM, несмотря на то, что большая LSTM имеет больше параметров. Эти результаты показывают, что Transformer обеспечивает более точное моделирование белковых последовательностей для сопоставимого числа параметров.
Обе модели Transformer имеют лучшие значения ECE (10.45 и 11.79 соответственно), чем малая и большая модель LSTM, несмотря на то, что большая LSTM имеет больше параметров. Эти результаты показывают, что Transformer обеспечивает более точное моделирование белковых последовательностей для сопоставимого числа параметров.
Мы обучаем высокопроизводительные 34-слойные трансформаторы (примерно 670 M параметров) на трех наборах данных с разным разнообразием. Модель Transformer с высокой пропускной способностью, обученная на наборе данных UR50 / S, превосходит модели Transformers меньшего размера, что указывает на улучшение языкового моделирования с увеличением емкости модели.Трансформаторы, обученные на двух наборах данных с большим разнообразием, UR50 / S и UR50 / D, улучшают обобщение по набору данных с низким разнообразием UR100. Лучший трансформер, обученный на самом разнообразном и плотном наборе данных, достигает ECE 8,46, что означает, что интуитивно модель выбирает среди ~ 8,46 аминокислот для каждого прогноза.
Мы также обучаем серию 34-уровневых моделей трансформаторов на 0,1, 1 и 10% набора данных UR50 / S, видя ожидаемую взаимосвязь между увеличением данных и улучшенной производительностью обобщения.Недостаточное соответствие наблюдается даже для самых крупных моделей, обученных на 100% UR50 / S, что указывает на потенциал для дополнительных улучшений с моделями с более высокой производительностью.
Трансформатор ЭСМ-1б.
Наконец, мы выполняем систематическую оптимизацию гиперпараметров модели на 100 M параметрических моделях, чтобы определить надежный набор гиперпараметров. Поиск гиперпараметров подробно описан в Приложении SI , раздел B. Мы масштабируем гиперпараметры, идентифицированные этим поиском, для обучения модели с ~ 650 M параметрами (33 уровня) в наборе данных UR50 / S, в результате чего получаем ESM-1b. Трансформатор.
Мультимасштабная организация в представлениях последовательностей
На вариацию, наблюдаемую в больших наборах данных последовательностей белков, влияют процессы на многих уровнях, включая свойства, которые напрямую влияют на приспособленность, такие как активность, стабильность, структура, связывание и другие свойства при выборе (25, 36), а также вклады филогенетических ошибок (37), экспериментальных ошибок и ошибок отбора (38, 39) и источников шума, таких как случайный генетический дрейф (40).
Обучение без учителя может кодировать лежащие в основе факторы, которые, хотя и не наблюдаются, полезны для объяснения вариаций в последовательностях, наблюдаемых моделью во время предварительного обучения.Мы исследуем репрезентативное пространство сети на разных уровнях от биохимической до эволюционной гомологии, чтобы искать признаки биологической организации.
Нейронные сети содержат индуктивные смещения, которые придают структуру представлениям. Случайно инициализированные сети могут создавать функции, которые хорошо работают без какого-либо обучения (41). Чтобы понять, как процесс обучения формирует представления, необходимо сравнить представления до и после их обучения.Кроме того, в самих данных последовательностей ожидается базовый уровень внутренней организации в результате смещений в аминокислотном составе. Чтобы разобраться в роли частотного смещения в данных, мы также сравниваем с базовым уровнем, который отображает каждую последовательность в вектор нормализованного количества аминокислот.
Обучение кодирует биохимические свойства.
Нейронная сеть Transformer представляет идентичность каждой аминокислоты во входных и выходных встраиваниях. Входные вложения проецируют входные токены аминокислот в первый блок Transformer.Выходные вложения проецируют окончательные скрытые представления обратно в логарифмические вероятности. Взаимозаменяемость аминокислот в рамках данного структурного или функционального контекста в белке зависит от их биохимических свойств (36). Можно ожидать, что самоконтроль уловит эти закономерности для построения пространства репрезентации, отражающего биохимические знания.
Чтобы выяснить, научилась ли сеть кодировать физико-химические свойства в своих представлениях, мы проецируем весовую матрицу последнего слоя встраивания сети в два измерения с t-распределенным стохастическим встраиванием соседей (t-SNE) (42).На рис. 1 структура встраиваемого пространства отражает биохимическую взаимозаменяемость с четкой кластеризацией гидрофобных и полярных остатков, ароматических аминокислот и организацией по молекулярной массе и заряду.
Биохимические свойства аминокислот представлены в выходных вложениях модели Transformer, визуализированных здесь с помощью t-SNE. Благодаря неконтролируемому обучению остатки группируются в гидрофобные, полярные и ароматические группы и отражают общую организацию по молекулярной массе и заряду.Визуализация 36-слойного Трансформера, обученного на UniParc.
Биологические вариации закодированы в репрезентативном пространстве.
Каждый белок может быть представлен как отдельный вектор путем усреднения по скрытому представлению в каждой позиции в его последовательности. Вложения белков представляют последовательности как точки в многомерном пространстве. Каждая последовательность представлена в виде одной точки, а последовательности, назначенные сетью аналогичным представлениям, отображаются на близлежащие точки. Мы исследуем, как гомологичные гены представлены в этом пространстве.
Структура и функция ортологичных генов, вероятно, сохранятся, несмотря на расхождение их последовательностей (43). На рис. 2 и мы находим, что обучение формирует пространство представления так, что ортологичные гены группируются. Рис. 2 A показывает двумерную проекцию пространства представления модели с использованием t-SNE. До обучения организация ортологичных белков в пространстве представления модели является диффузной. Ортологические гены группируются в заученном пространстве репрезентации.
На рис. 2 и мы находим, что обучение формирует пространство представления так, что ортологичные гены группируются. Рис. 2 A показывает двумерную проекцию пространства представления модели с использованием t-SNE. До обучения организация ортологичных белков в пространстве представления модели является диффузной. Ортологические гены группируются в заученном пространстве репрезентации.
Представления последовательности белка кодируют и организуют биологические вариации. ( A ) Каждая точка представляет ген, и каждый ген окрашен в соответствии с ортологической группой, к которой он принадлежит (размерность уменьшается на t-SNE). Ортологические группы генов плотно сгруппированы в обученном пространстве репрезентации. Напротив, неподготовленное репрезентативное пространство и униграммы не отражают сильную организацию эволюционными отношениями. ( B ) Гены, соответствующие общей биологической вариации, связаны линейно в обученном пространстве репрезентации. Гены окрашены в соответствии с их ортологической группой, а их виды обозначены меткой символа. PCA восстанавливает ось вида (горизонтальную) и ось ортологии (вертикальную) в обученном пространстве репрезентации, но не в нетренированном пространстве или пространстве униграммы. Представления взяты из 36-слойной модели Transformer, обученной на UniParc.
Гены окрашены в соответствии с их ортологической группой, а их виды обозначены меткой символа. PCA восстанавливает ось вида (горизонтальную) и ось ортологии (вертикальную) в обученном пространстве репрезентации, но не в нетренированном пространстве или пространстве униграммы. Представления взяты из 36-слойной модели Transformer, обученной на UniParc.
Мы исследуем, кодирует ли обучение без учителя биологические вариации в структуре пространства представления. Мы применяем анализ главных компонентов (PCA) для определения основных направлений вариации в репрезентациях, выбирая четыре ортологичных гена у четырех видов для поиска направлений вариации.Рис. 2 B показывает, что уменьшение линейной размерности восстанавливает виды и ортологию в качестве основных осей вариации в пространстве представления после обучения. Эта форма структуры отсутствует в представлениях до тренировки.
Чтобы количественно исследовать структуру пространства представления, мы оцениваем восстановление ближайшего соседа с помощью запросов на подобие векторов. Если биологические свойства кодируются вдоль независимых направлений в пространстве представления, то белки, соответствующие уникальной биологической вариации, связаны линейной векторной арифметикой.В приложении SI , рис. S1 мы обнаруживаем, что обучение улучшает восстановление целевых белков при запросах, закодированных как линейные преобразования по осям видов или генов.
Если биологические свойства кодируются вдоль независимых направлений в пространстве представления, то белки, соответствующие уникальной биологической вариации, связаны линейной векторной арифметикой.В приложении SI , рис. S1 мы обнаруживаем, что обучение улучшает восстановление целевых белков при запросах, закодированных как линейные преобразования по осям видов или генов.
Обучение кодирует удаленную гомологию.
Удаленно гомологичные белки имеют структурное сходство, несмотря на расхождение их последовательностей. Если структурная гомология закодирована в метрической структуре пространства представления, то расстояние между белками отражает степень их структурного родства.
Мы исследуем, позволяет ли пространство репрезентации обнаруживать удаленную гомологию на уровне суперсемейства (белки, которые принадлежат к разным семействам, но находятся в одном суперсемействе) и складчатости (белки, которые принадлежат к разным суперсемействам, но имеют одинаковую укладку). Мы создаем набор данных для оценки удаленного обнаружения гомологии с помощью SCOPe (структурная классификация белков — расширенная) (44). Следуя стандартной практике (45), мы исключаем складки, подобные Россманну (c.2 — c.5, c.27 и 28, c.30 и 31) и четырех- или восьмилопастные β-винты (b.66 — b.70).
Мы создаем набор данных для оценки удаленного обнаружения гомологии с помощью SCOPe (структурная классификация белков — расширенная) (44). Следуя стандартной практике (45), мы исключаем складки, подобные Россманну (c.2 — c.5, c.27 и 28, c.30 и 31) и четырех- или восьмилопастные β-винты (b.66 — b.70).
Неконтролируемый классификатор на расстоянии от запроса измеряет плотность гомологичных белков в окрестности последовательности запроса. Для каждого домена выполняется запрос на подобие векторов для всех других доменов, ранжируя их по расстоянию до домена запроса. Для оценки на уровне складки любой домен с одинаковой складкой является положительным, любой домен с другой складкой — отрицательным, и домены, принадлежащие к одному и тому же суперсемейству, исключаются.Для оценки на уровне суперсемейства любой домен с одним и тем же суперсемейством является положительным, любой домен с другим суперсемейством — отрицательным, и домены, принадлежащие к тому же семейству, исключаются. Мы указываем площадь под кривой ROC (AUC) для классификатора и Hit-10 (46), что дает вероятность восстановления удаленного гомолога в 10 результатах с наивысшим рейтингом.
Таблица 2 показывает, что векторные запросы ближайшего соседа с использованием представлений могут обнаруживать удаленные гомологи, которые находятся на уровне свертки, с производительностью, аналогичной HHblits (15), современной методике, основанной на скрытой марковской модели (HMM).На уровне суперсемейства, где сходство последовательностей выше, производительность HMM лучше, но вложения Transformer близки. Методы быстрого векторного поиска ближайшего соседа позволяют искать миллиарды последовательностей на предмет сходства с запрашиваемым белком за миллисекунды (47).
Таблица 2.Удаленное обнаружение гомологии
Обучение кодирует выравнивание в пределах семейства белков.
MSA идентифицирует соответствующие сайты в семействе родственных последовательностей (23). Эти соответствия дают картину эволюционной изменчивости на разных участках в семействе последовательностей.Модель получает в качестве входных данных отдельные последовательности и не получает доступа к семейству связанных последовательностей, кроме как через обучение. Мы исследуем, кодируют ли окончательные скрытые представления последовательности информацию о семействе, к которому она принадлежит.
Мы исследуем, кодируют ли окончательные скрытые представления последовательности информацию о семействе, к которому она принадлежит.
Информация о семействе может появиться в сети посредством присвоения аналогичных представлений положениям в различных последовательностях, которые выровнены в MSA семейства. Используя набор MSA структурно связанных последовательностей в Pfam (48), мы сравниваем распределение косинусных сходств представлений между парами остатков, которые выровнены в семейном MSA, с фоновым распределением косинусных сходств между невыровненными парами остатков.Большая разница между выровненным и невыровненным распределениями означает, что представления используют общие функции для связанных сайтов во всех последовательностях семейства.
Рис. 3 A изображает распределение значений косинусного сходства между выровненными и невыровненными позициями в репрезентативном семействе для обученной модели и базовых линий. Обучение без учителя приводит к заметному сдвигу между распределениями выровненных и невыровненных пар. Фиг. 3 B и C показывают, что эти тенденции сохраняются при ограничениях, что пары остатков (1) имеют одинаковую аминокислотную идентичность или (2) имеют разные аминокислотные идентичности.
Фиг. 3 B и C показывают, что эти тенденции сохраняются при ограничениях, что пары остатков (1) имеют одинаковую аминокислотную идентичность или (2) имеют разные аминокислотные идентичности.
Окончательные представления от обученных моделей неявно выравнивают последовательности. Распределения косинусного сходства изображены для окончательных представлений остатков из последовательностей в семействе Pfam PF01010. Различия между выровненным (темно-синий) и невыровненным (светло-синий) распределениями подразумевают, что обученные представления Transformer являются мощным дискриминатором между выровненными и невыровненными позициями в последовательностях. Напротив, представления до обучения не разделяют выровненные (темно-красный) и невыровненные позиции (светло-красный).( A ) Общее распределение; распределение при условии, что пары остатков имеют ( B ) одинаковую аминокислотную идентичность; или ( C ) разные аминокислотные идентичности. AUC для 128 семейств Pfam указаны в Приложении SI, Таблица S1.
AUC для 128 семейств Pfam указаны в Приложении SI, Таблица S1.
Мы оцениваем различия между выровненными и невыровненными распределениями по 128 семействам Pfam, используя AUC в качестве показателя различительной способности между выровненными и невыровненными парами. SI Приложение , таблица S1 показывает количественное улучшение средней AUC после неконтролируемого обучения, подтверждая идею о том, что самоконтроль кодирует информацию о MSA последовательности в ее представление последовательности.
Прогнозирование вторичной структуры и третичных контактов
Есть основания полагать, что неконтролируемое обучение заставит представления модели содержать структурную информацию. Основная структура белка — это скрытая переменная, которая влияет на паттерны, наблюдаемые в данных последовательности. Например, локальные вариации последовательности зависят от вторичной структуры (16), а третичная структура вводит зависимости более высокого порядка в выборе аминокислот в различных сайтах в пределах белка (49, 50). Хотя модель не может наблюдать структуру белка напрямую, она наблюдает закономерности в последовательностях обучающих данных, которые определяются структурой. В принципе, сеть может сжимать вариации последовательности, фиксируя общность структурных элементов данных, тем самым кодируя структурную информацию в представлениях.
Хотя модель не может наблюдать структуру белка напрямую, она наблюдает закономерности в последовательностях обучающих данных, которые определяются структурой. В принципе, сеть может сжимать вариации последовательности, фиксируя общность структурных элементов данных, тем самым кодируя структурную информацию в представлениях.
Линейные проекции.
Мы начинаем с идентификации информации о структуре белка, которая линейно кодируется в представлениях.Использование линейных проекций гарантирует, что информация исходит из представлений Transformer, что позволяет напрямую проверять структурное содержание представлений. Сравнивая представления Трансформера до и после предварительного обучения, мы можем идентифицировать информацию, которая появляется в результате обучения без учителя.
Мы проводим пятикратный эксперимент с перекрестной проверкой, чтобы изучить обобщение структурной информации на уровне семьи, суперсемейства и кратности.Для каждого из трех уровней мы построили набор данных из 15 297 белковых структур, используя базу данных SCOPe. Мы разделяем структуры на пять частей, разбивая их по семействам, суперсемействам и складываем соответственно. Пятикратная перекрестная проверка выполняется независимо для каждого из уровней структурной устойчивости.
Мы разделяем структуры на пять частей, разбивая их по семействам, суперсемействам и складываем соответственно. Пятикратная перекрестная проверка выполняется независимо для каждого из уровней структурной устойчивости.
Чтобы обнаружить информацию о вторичной структуре, мы подгоняем логистическую регрессию к скрытым представлениям, используя метки вторичной структуры с восемью классами. Чтобы обнаружить информацию о третичной структуре, мы подгоняли две отдельные линейные проекции к скрытым представлениям пар позиций в последовательности, взяв их скалярное произведение для регрессии бинарной переменной, указывающей, находятся ли позиции в контакте в трехмерной структуре белка.Нейронные представления сравниваются с 1) проекциями профиля последовательности и 2) неконтролируемыми контактами, предсказанными реализацией CCMpred (51) анализа прямой связи. MSA для базовых показателей генерируются из базы данных UniClust30 (52) с использованием трех итераций поиска HHblits. Для вторичной структуры мы сообщаем о восьми классах точности. Для контактной точности мы сообщаем о максимальной L-дальнодействующей точности, то есть о точности прогнозов наивысшего ранга L (длины белка) для контактов с разделением последовательностей не менее 24 остатков.
Для контактной точности мы сообщаем о максимальной L-дальнодействующей точности, то есть о точности прогнозов наивысшего ранга L (длины белка) для контактов с разделением последовательностей не менее 24 остатков.
В таблице 3 показаны результаты экспериментов по перекрестной проверке. Перед предварительным обучением можно обнаружить минимальную информацию о вторичной структуре и контактах. После предварительного обучения проекции восстанавливают информацию о вторичной структуре и дальних контактах, которая распространяется на семьи, суперсемейства и складки. Распределения точности прогноза вторичной структуры с восемью классами ( SI, приложение , рис. S2) и распределения точности top-L для прогнозирования контакта на большие расстояния ( SI, приложение , рис.S3) демонстрируют, что предварительное обучение приводит к увеличению структурной информации по всему распределению тестовых областей. Таблица 3 показывает, что проекции представлений Transformer восстанавливают больше структуры, чем проекции профиля последовательности. Для контактов на большие расстояния проекции лучших моделей трансформаторов имеют более высокую точность, чем контакты, предсказанные CCMpred на всех уровнях структурного обобщения. По мере того, как уровень структурного разделения становится более удаленным, вторичная структура мало деградирует, при этом производительность на уровне семейства аналогична уровню кратности.Для долгосрочных контактов, хотя обобщение снижено на уровне кратности по сравнению с уровнем семьи, лучшие модели все же отражают больше структуры, чем исходный уровень без учителя. Тренировка с более разнообразными последовательностями (наборы данных UR50) улучшает обучение как вторичной структуре, так и дальнодействующим контактам, с более выраженным влиянием на дальние контакты.
Для контактов на большие расстояния проекции лучших моделей трансформаторов имеют более высокую точность, чем контакты, предсказанные CCMpred на всех уровнях структурного обобщения. По мере того, как уровень структурного разделения становится более удаленным, вторичная структура мало деградирует, при этом производительность на уровне семейства аналогична уровню кратности.Для долгосрочных контактов, хотя обобщение снижено на уровне кратности по сравнению с уровнем семьи, лучшие модели все же отражают больше структуры, чем исходный уровень без учителя. Тренировка с более разнообразными последовательностями (наборы данных UR50) улучшает обучение как вторичной структуре, так и дальнодействующим контактам, с более выраженным влиянием на дальние контакты.
Линейные проекции
На рис. 4 показаны трехклассовые проекции вторичной структуры для двух доменов, принадлежащих вытянутым складкам.Перед предварительным обучением проекции дают бессвязное предсказание вторичной структуры. После предварительного обучения проекции восстанавливают когерентное предсказание с большинством ошибок, возникающих на границах областей вторичной структуры. На рис. 5 сравнивается прогнозируемая карта контактов с прогнозами CCMpred. Выступы трансформатора восстанавливают сложные схемы контактов, в том числе дальние контакты. Дальнейшие визуализации предполагаемых контактов для восьми случайно выбранных тестовых белков показаны в приложении SI , рис.S7.
После предварительного обучения проекции восстанавливают когерентное предсказание с большинством ошибок, возникающих на границах областей вторичной структуры. На рис. 5 сравнивается прогнозируемая карта контактов с прогнозами CCMpred. Выступы трансформатора восстанавливают сложные схемы контактов, в том числе дальние контакты. Дальнейшие визуализации предполагаемых контактов для восьми случайно выбранных тестовых белков показаны в приложении SI , рис.S7.
Вторичная структура (линейные проекции). Примеры прогнозов для удерживаемых складок. Предварительное обучение без учителя кодирует вторичную структуру в представления. После предварительного обучения линейные проекции восстанавливают вторичную структуру (левый столбец). Без предварительного обучения восстанавливается мало информации (правый столбец). ( A ) d1nt4a_ Фосфоглицерат-мутазоподобная складка; ( B ) d3wr7a_ Ацил-КоА N-ацилтрансферазы складываются. Цвета указывают на класс вторичной структуры, определяемый выступом: спираль (красный), нить (зеленый) и спираль (синий). Интенсивность цвета указывает на уверенность. Используются изображения от Трансформатора ЕСМ-1б.
Интенсивность цвета указывает на уверенность. Используются изображения от Трансформатора ЕСМ-1б.
Контакты остаток – остаток (линейные выступы). ( Left ) Предсказания Top-L для примера d1n3ya_ с сохраненным уровнем свёртки с vWA-подобной свёрткой. Истинные срабатывания отображаются синим цветом, ложные срабатывания — красным, накладываются на карту наземных контактов серым цветом. ESM-1b Трансформаторные проекции под диагональю, прогнозы CCMpred над диагональю. ( Правый ) Прецизионное распределение (верхний L, дальний) при сравнении прогнозов ESM-1b с CCMpred по всем доменам в пяти тестовых разделах со структурным сопротивлением на уровне сгиба.Визуализированный домен отмечен знаком ×.
Глубокая нейронная сеть.
Мы обучаем глубокие нейронные сети предсказывать вторичную структуру и контакты из представлений. Мы выбираем современные нейронные архитектуры для решения обеих задач. Эти нисходящие модели обучаются с контролируемой потерей для прогнозирования вторичной структуры или карты контактов на основе предварительно обученных представлений.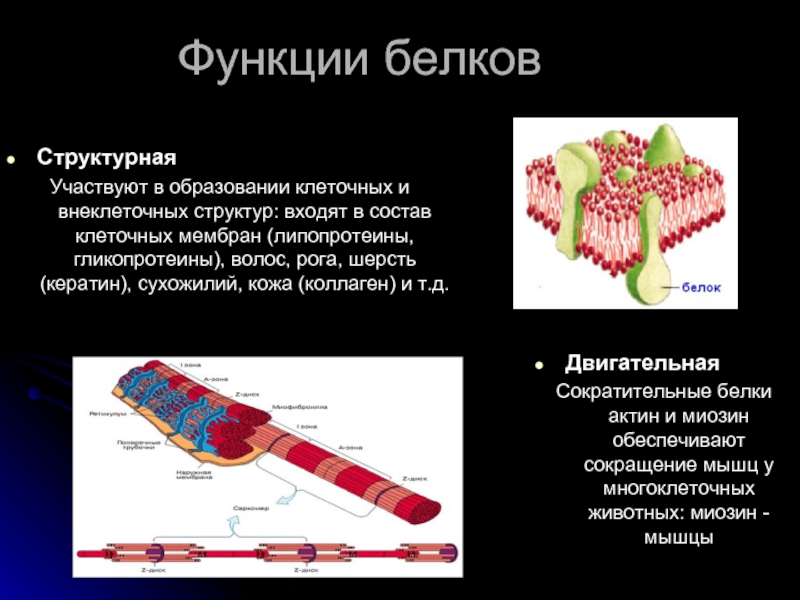 Архитектура нижестоящей модели остается неизменной для экспериментов с различными представлениями и базовыми линиями, чтобы обеспечить возможность сравнения.
Архитектура нижестоящей модели остается неизменной для экспериментов с различными представлениями и базовыми линиями, чтобы обеспечить возможность сравнения.
Для прогнозирования вторичной структуры мы заменяем линейный слой глубокой нейронной сетью, используя архитектуру модели, введенную методом NetSurf (53). Для третичной структуры мы прогнозируем двоичную карту контактов на основе скрытого представления последовательности. Мы используем расширенную сверточную остаточную сеть, аналогичную современным методам предсказания третичной структуры (54–56).
В таблице 4 сравниваются представления для прогнозирования вторичной структуры. Мы оцениваем модели на тестовом наборе CB513 (57) и доменах CASP13 (58).Для сравнения мы также повторно реализовали метод NetSurf. Модели обучаются на наборе обучающих данных NetSurf, который применяет 25% -ное удержание идентичности последовательности с CB513 и временное удержание с CASP13. Функции Transformer сравниваются до и после неконтролируемого предварительного обучения с функциями из базовых показателей LSTM. Их также сравнивают с профилями HMM, используемыми NetSurf. Лучшие характеристики Transformer (71,6%) соответствуют характеристикам профилей HMM (71,2%) и превышают опубликованные характеристики RaptorX (70.6%) в том же тесте (53), подразумевая, что модели белкового языка могут создавать характеристики, которые напрямую конкурируют с профилями последовательностей для предсказания вторичной структуры.
Их также сравнивают с профилями HMM, используемыми NetSurf. Лучшие характеристики Transformer (71,6%) соответствуют характеристикам профилей HMM (71,2%) и превышают опубликованные характеристики RaptorX (70.6%) в том же тесте (53), подразумевая, что модели белкового языка могут создавать характеристики, которые напрямую конкурируют с профилями последовательностей для предсказания вторичной структуры.
Восьмиклассная точность прогнозирования вторичной структуры на тестовых наборах CB513 и CASP13
В таблице 5 показаны характеристики различных представлений для прогнозирования дальних контактов верхнего L на панели тестов с использованием набора поездов RaptorX ( 59). Для сравнения мы обучаем ту же архитектуру, используя возможности RaptorX (54, 59).Тестовые наборы Test (59) и CASP11 (60) оцениваются с удержанием идентичности последовательности на уровне 25%, тестовый набор CASP12 (61) реализует временную задержку со структурными обучающими данными, а эксперимент CASP13 (58) реализует полную временную задержку как предтренировочных, так и обучающих данных.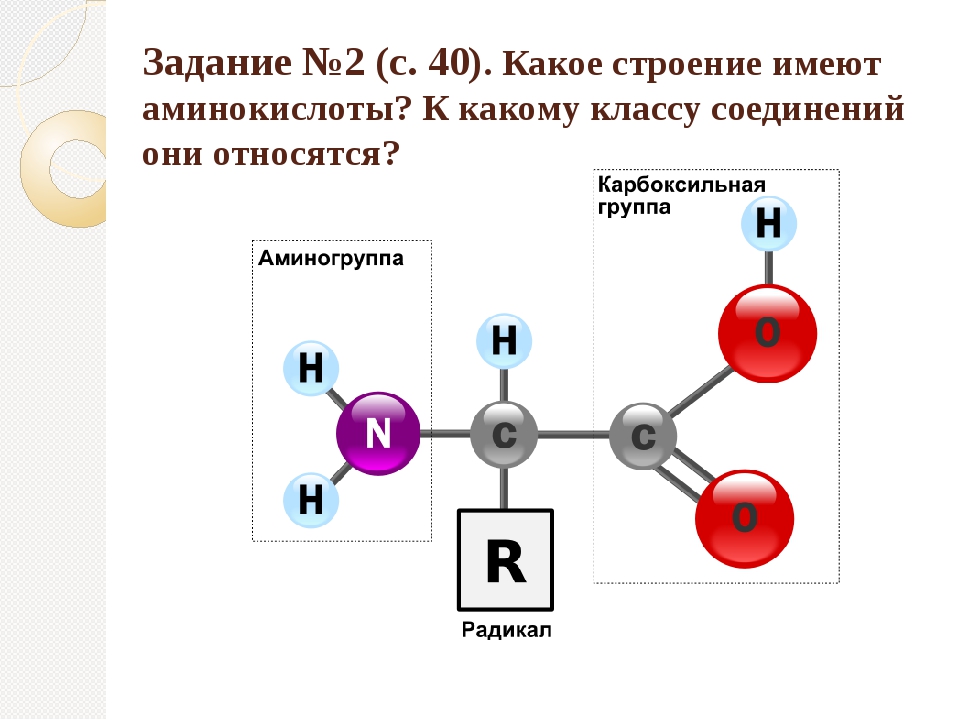 Что касается предсказания контакта, лучшие функции обучения представлению не достигают сопоставимой производительности с современными функциями RaptorX (50,2 против 59,4, соответственно, на тестовом наборе RaptorX).
Что касается предсказания контакта, лучшие функции обучения представлению не достигают сопоставимой производительности с современными функциями RaptorX (50,2 против 59,4, соответственно, на тестовом наборе RaptorX).
Top-L, точность контакта на больших расстояниях
В тестах вторичной структуры представления Transformer дают более высокую точность, чем базовые линии LSTM с сопоставимым количеством параметров. Для предсказания контактов представления Transformer обеспечивают более высокую точность, чем LSTM, при этом даже самые маленькие представления Transformer превосходят LSTM с большим количеством параметров. Разнообразие данных предварительного обучения также оказывает сильное влияние, поскольку наборы данных с большим разнообразием обеспечивают значительные улучшения по сравнению с наборами данных с низким разнообразием.Относительная производительность представлений одинакова для всех четырех тестов контактов с использованием различных методологий удержания.
Связь между языковым моделированием и структурным обучением.
Чтобы исследовать взаимосвязь между целью языкового моделирования и информацией о структуре в модели, подбираются линейные проекции для вторичной структуры и контактов с использованием представлений из моделей Transformer, взятых из контрольных точек на траекториях их предварительного обучения.Мы используем трансформаторы, обученные на UR50 / S. Мы подбираем прогнозы и оцениваем с разделением поездов и тестов, реализованным с помощью первого раздела набора данных структурных удержаний на уровне свертки. Для каждой модели на рис. 6 показана линейная взаимосвязь между целью языкового моделирования и информацией о структуре, которая сохраняется в ходе предварительного обучения. Линейная посадка близка к идеальной как для вторичной структуры, так и для контактов. Аналогичный эксперимент также проводится для вторичной структуры с глубокой нейронной сетью вместо линейной проекции с использованием обучающих последовательностей NetSurf и набора тестов CB513.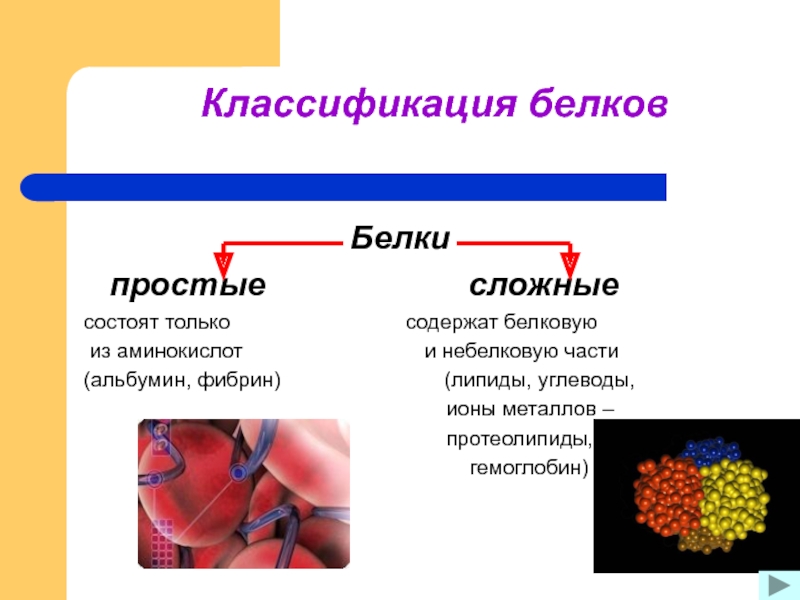 Линейная зависимость между точностью вторичной структуры и ECE моделирования языка также наблюдается для головы глубинного прогнозирования ( SI, приложение , рис. S4). Таким образом, для данной модели и набора данных для предварительного обучения точность языкового моделирования, измеренная с помощью ECE, является хорошим показателем структурного содержания представлений. Поскольку производительность задачи языкового моделирования повышается с увеличением емкости модели, это предполагает, что дальнейшее масштабирование может улучшить результаты задач прогнозирования структуры.
Линейная зависимость между точностью вторичной структуры и ECE моделирования языка также наблюдается для головы глубинного прогнозирования ( SI, приложение , рис. S4). Таким образом, для данной модели и набора данных для предварительного обучения точность языкового моделирования, измеренная с помощью ECE, является хорошим показателем структурного содержания представлений. Поскольку производительность задачи языкового моделирования повышается с увеличением емкости модели, это предполагает, что дальнейшее масштабирование может улучшить результаты задач прогнозирования структуры.
Взаимосвязь между целью языкового моделирования и структурой обучения. Восьмиклассная точность предсказания вторичной структуры (, левая, ) и дальняя точность предсказания контакта (верхняя L) (, правая ) как функция предварительного обучения ECE. Производительность оценивается по вытянутым складкам. Линейные проекции подбираются с использованием контрольных точек модели в ходе предварительного обучения на UR50 / S. Линейная взаимосвязь для каждой модели указывает на то, что для данной модели и набора данных предварительного обучения язык моделирования ECE является хорошим показателем структурного содержания представлений.Улучшение ECE модели приводит к увеличению информации о конструкции. Это устанавливает связь между целью языкового моделирования и структурным обучением без учителя.
Линейная взаимосвязь для каждой модели указывает на то, что для данной модели и набора данных предварительного обучения язык моделирования ECE является хорошим показателем структурного содержания представлений.Улучшение ECE модели приводит к увеличению информации о конструкции. Это устанавливает связь между целью языкового моделирования и структурным обучением без учителя.
Предварительная подготовка для одного или нескольких семей.
Мы сравниваем тренировки по эволюционной статистике с тренировками по отдельным семействам белков. Мы предварительно обучаем отдельные 12-слойные модели трансформера на множественном выравнивании последовательностей Pfam трех наиболее распространенных в природе доменов длиной более 100 аминокислот: АТФ-связывающего домена АТФ-связывающих кассетных транспортеров, домена протеинкиназы и регулятора ответа. домен-получатель.Мы проверяем способность моделей, обученных на одном семействе белков, обобщать информацию о вторичной структуре внутри семейства и вне его, оценивая последовательности с наземными метками истинности из семейства, на котором обучалась модель, или из альтернативных семейств. Модели оцениваются с использованием линейных проекций. Во всех случаях модель, обученная на последовательностях внутри семейства, имеет более высокую точность, чем модели, обученные на последовательностях вне семьи ( SI, приложение , таблица S2), что указывает на плохую обобщенность при обучении на отдельных семьях MSA.Что еще более важно, модель, обученная для всего разнообразия последовательностей UniParc, имеет более высокую точность, чем точность модели для одного семейства, даже на одном наборе оценочных данных для одного и того же семейства. Это предполагает, что представления, полученные из полного набора данных, обобщают информацию о вторичной структуре, изученной вне семейства последовательностей.
Модели оцениваются с использованием линейных проекций. Во всех случаях модель, обученная на последовательностях внутри семейства, имеет более высокую точность, чем модели, обученные на последовательностях вне семьи ( SI, приложение , таблица S2), что указывает на плохую обобщенность при обучении на отдельных семьях MSA.Что еще более важно, модель, обученная для всего разнообразия последовательностей UniParc, имеет более высокую точность, чем точность модели для одного семейства, даже на одном наборе оценочных данных для одного и того же семейства. Это предполагает, что представления, полученные из полного набора данных, обобщают информацию о вторичной структуре, изученной вне семейства последовательностей.
Комбинация функций
Возможности, обнаруженные при неконтролируемом моделировании языка белков, могут быть объединены с современными функциями для их дальнейшего улучшения.Современные методы используют информацию, полученную из MSA. Мы объединяем эту информацию с характеристиками модели Transformer.
Мы исследуем три подхода для включения информации из обучения репрезентации. Для каждой входной последовательности x: 1) direct использует окончательное скрытое представление напрямую от преобразователя, 2) avg берет среднее значение окончательного скрытого представления в каждой позиции по последовательностям из MSA x, и 3) cov создает признаки для каждой пары позиций, используя нецентрированную ковариацию по последовательностям из MSA x после уменьшения размерности окончательных скрытых представлений с помощью PCA.Обратите внимание, что direct и avg создают признаки для каждой позиции по x, а cov создают признаки для каждой пары позиций.
Вторичная структура.
Современные методы предсказания вторичной структуры обладают высокой точностью для задачи предсказания восьми классов. Мы исследуем, можно ли улучшить производительность, объединив функции трансформатора с профилями последовательности. Таблица 6 показывает, что объединение представлений с профилями дополнительно повышает точность, что приводит к современным характеристикам прогнозирования вторичной структуры.
Комбинация функций (прогнозирование вторичной структуры)
Мы устанавливаем базовый уровень производительности, повторно реализовав методику Klausen et al. (53) с использованием тех же функций, что дало точность 71,2% (по сравнению с опубликованными характеристиками 72,1%) на испытательном наборе CB513. Затем мы добавляем функции Transformer, используя методы комбинации direct и avg ; они обеспечивают абсолютное улучшение точности на 0,9 и 2,5% соответственно. Это говорит о том, что функции Transformer содержат информацию, отсутствующую в функциях, производных от MSA.
Контакты остаток – остаток.
Глубокие нейронные сети сделали возможным недавний прорыв в предсказании белковых контактов и третичной структуры (54, 56). Современные нейронные сети для третичной структуры и предсказания контактов используют глубокие остаточные архитектуры с двумерными свертками над попарными картами признаков для вывода предсказания контакта или потенциала расстояния для каждой пары остатков (54, 56, 59).
В самых современных методах используются различные входные функции, наборы данных для обучения и контрольные сигналы.Чтобы провести контролируемое сравнение, мы исправляем стандартную архитектуру, обучающий набор данных, несколько выравниваний последовательностей и набор базовых входных функций для всех экспериментов, к которым мы добавляем предварительно обученные функции из модели Transformer. Для базовых функций мы используем набор функций RaptorX, который включает в себя матрицу оценки для конкретной позиции (PSSM), прогнозирование вторичной структуры с тремя состояниями, однократное встраивание последовательности, связи модели Поттса с корректировкой среднего продукта, взаимную информацию, попарный контакт. потенциал и прогнозируемая доступность.RaptorX был лучшим методом предсказания контактов в соревнованиях CASP12 и CASP13 (54). Наборы для обучения и оценки такие же, как и в предыдущем разделе.
Таблица 7 показывает, что добавление функций трансформатора из 34-уровневой модели, обученной на UR50 / S, последовательно приводит к улучшению во всех тестовых наборах. В таблице показаны верхние L-данные с большой точностью, сообщающие среднее значение и стандартное отклонение для пяти различных моделей семян. Direct дает небольшое улучшение по сравнению с некоторыми тестовыми наборами. Avg лучше прямого, а cov обеспечивает дополнительный выигрыш. Например, cov дает абсолютное улучшение на 3,9% на тестовом наборе RaptorX и на 1,8% улучшение на тестовом наборе CASP13, оцененном с временными задержками как для точной настройки, так и для данных предварительного обучения. Дополнительные результаты и показатели для прогнозирования контактов приведены в приложении SI, таблица S3.
В таблице показаны верхние L-данные с большой точностью, сообщающие среднее значение и стандартное отклонение для пяти различных моделей семян. Direct дает небольшое улучшение по сравнению с некоторыми тестовыми наборами. Avg лучше прямого, а cov обеспечивает дополнительный выигрыш. Например, cov дает абсолютное улучшение на 3,9% на тестовом наборе RaptorX и на 1,8% улучшение на тестовом наборе CASP13, оцененном с временными задержками как для точной настройки, так и для данных предварительного обучения. Дополнительные результаты и показатели для прогнозирования контактов приведены в приложении SI, таблица S3.
Комбинация признаков (предсказание контакта)
Прогнозирование мутационных эффектов
Пейзаж мутационной пригодности обеспечивает глубокое понимание биологии.Сочетание секвенирования следующего поколения с экраном мутагенеза позволяет параллельно считывать десятки тысяч вариантов одного белка (62). Подробности и охват этих экспериментов позволяют взглянуть на ландшафт мутационной пригодности отдельных белков, давая количественные отношения между последовательностью и функцией белка. Мы адаптируем языковую модель белка Transformer для прогнозирования количественного эффекта мутаций.
Подробности и охват этих экспериментов позволяют взглянуть на ландшафт мутационной пригодности отдельных белков, давая количественные отношения между последовательностью и функцией белка. Мы адаптируем языковую модель белка Transformer для прогнозирования количественного эффекта мутаций.
Во-первых, мы исследуем прогнозирование эффекта внутрибелковых вариантов, когда ограниченная выборка мутаций используется для прогнозирования эффекта ненаблюдаемых мутаций.Этот параметр полезен в приложениях для белковой инженерии (63). Мы оцениваем представления на двух наборах данных глубокого мутационного сканирования, используемых новейшими современными методами прогнозирования вариантных эффектов, Envision (64) и DeepSequence (26). В совокупности данные включают более 700 000 измерений эффекта вариантов из более чем 100 крупномасштабных экспериментальных наборов данных по мутагенезу.
Точная настройка трансформатора дает предсказатель мутационных эффектов, сравнимый с результатами Envision. Envision (64) для обобщения полагается на структурные и эволюционные особенности белка. Мы оцениваем, может ли Transformer достичь аналогичных результатов обобщения без прямого доступа к структурным особенностям. Используется та же методология разделения данных для обучения и оценки, что и у Gray et al. (64), чтобы можно было сравнить результаты. Мы используем 34-слойный трансформатор, обученный на UR50 / S. На рис. 7 показано, что точно настроенный трансформатор превосходит производительность Envision на 10 из 12 белков. Для каждого белка доля p = 0.8 данных используются для обучения, а остальные данные используются для тестирования. Мы сообщаем среднее значение и стандартное отклонение для пятикратной перекрестной проверки в приложении SI, таблица S5. Результаты, изменяющие долю данных, используемых для обучения, представлены в приложении SI , рис. S5.
Envision (64) для обобщения полагается на структурные и эволюционные особенности белка. Мы оцениваем, может ли Transformer достичь аналогичных результатов обобщения без прямого доступа к структурным особенностям. Используется та же методология разделения данных для обучения и оценки, что и у Gray et al. (64), чтобы можно было сравнить результаты. Мы используем 34-слойный трансформатор, обученный на UR50 / S. На рис. 7 показано, что точно настроенный трансформатор превосходит производительность Envision на 10 из 12 белков. Для каждого белка доля p = 0.8 данных используются для обучения, а остальные данные используются для тестирования. Мы сообщаем среднее значение и стандартное отклонение для пятикратной перекрестной проверки в приложении SI, таблица S5. Результаты, изменяющие долю данных, используемых для обучения, представлены в приложении SI , рис. S5.
Репрезентативное обучение дает возможность современного контролируемого предсказания количественного эффекта мутаций. ( Левый ) Набор данных Envision (65). ( Правый ) Набор данных DeepSequence (26).Представления-преобразователи (34-слойные, UR50 / S) сравниваются с двунаправленной языковой моделью LSTM (большая модель, UR50 / S). Для каждого белка сообщается результат пятикратной перекрестной проверки. Для каждого раздела контролируемая точная настройка выполняется на 80% данных мутаций для белка, а результаты оцениваются на оставшихся 20%. Представления-преобразователи превосходят базовые представления LSTM в обоих наборах данных. Для каждого набора данных также показаны современные методы. Gray et al.(65) — это контролируемый метод, использующий структурные, эволюционные и биохимические особенности, обученный по тому же протоколу, что и для Transformer. Riesselman et al. (26) — это метод обучения без учителя на MSA каждого белка. Среднее и стандартное отклонение по пяти разделам для модели трансформатора и базовой линии LSTM.
( Левый ) Набор данных Envision (65). ( Правый ) Набор данных DeepSequence (26).Представления-преобразователи (34-слойные, UR50 / S) сравниваются с двунаправленной языковой моделью LSTM (большая модель, UR50 / S). Для каждого белка сообщается результат пятикратной перекрестной проверки. Для каждого раздела контролируемая точная настройка выполняется на 80% данных мутаций для белка, а результаты оцениваются на оставшихся 20%. Представления-преобразователи превосходят базовые представления LSTM в обоих наборах данных. Для каждого набора данных также показаны современные методы. Gray et al.(65) — это контролируемый метод, использующий структурные, эволюционные и биохимические особенности, обученный по тому же протоколу, что и для Transformer. Riesselman et al. (26) — это метод обучения без учителя на MSA каждого белка. Среднее и стандартное отклонение по пяти разделам для модели трансформатора и базовой линии LSTM.
Мы также оцениваем, используя ту же методологию пятикратной перекрестной проверки, в экспериментах по глубокому мутационному сканированию, собранных для DeepSequence (26). Точно настроенная модель Transformer превосходит точно настроенные базовые параметры LSTM.Мы не можем сравнивать напрямую, но мы также включаем производительность исходного метода DeepSequence, который является неконтролируемым и представляет собой современное состояние для этого набора данных.
Точно настроенная модель Transformer превосходит точно настроенные базовые параметры LSTM.Мы не можем сравнивать напрямую, но мы также включаем производительность исходного метода DeepSequence, который является неконтролируемым и представляет собой современное состояние для этого набора данных.
Обобщение на новый ландшафт фитнеса.
Мы анализируем способность трансформера распространяться на фитнес-ландшафт нового белка. Следуя протоколу, представленному в Envision, мы используем анализ исключения по одному: чтобы оценить эффективность данного белка, мы тренируемся на данных по оставшимся n-1 белкам и тестируем оставшийся белок.Приложение SI , рис. S6 показывает, что предсказания Transformer на основе необработанных последовательностей работают лучше, чем Envision для пяти из девяти задач.
Связанные работы
Одновременно с препринтом этой работы Rives et al. (65), два родственных препринта Alley et al. (66) и Heinzinger et al. (67) также предложили моделирование белкового языка, хотя и в меньшем масштабе. Эти работы вместе с Rao et al. (68), были оценены на различных последующих задачах. Rives et al. (65) впервые предложили моделирование языка белков с помощью Transformers.Alley et al. (66) и Heinzinger et al. (67) обучите LSTM на UniRef50. Рао и др. (68) обучили 12-слойную модель трансформатора (38 M параметров) на Pfam (48). Исходные данные в этой статье сопоставимы с этими моделями. Большие модели трансформаторов, обученные в этой статье, значительно больше, чем в этих связанных работах.
Эти работы вместе с Rao et al. (68), были оценены на различных последующих задачах. Rives et al. (65) впервые предложили моделирование языка белков с помощью Transformers.Alley et al. (66) и Heinzinger et al. (67) обучите LSTM на UniRef50. Рао и др. (68) обучили 12-слойную модель трансформатора (38 M параметров) на Pfam (48). Исходные данные в этой статье сопоставимы с этими моделями. Большие модели трансформаторов, обученные в этой статье, значительно больше, чем в этих связанных работах.
Мы сравниваем результаты с соответствующими работами в таблице 8. Heinzinger et al. (67), Alley et al. (66) и Rao et al. (68) оценивают модели для различных последующих задач и наборов тестов.Мы извлекаем веса для вышеуказанных моделей, оценивая их непосредственно в нашей кодовой базе по сравнению с панелью наборов тестов, используемых в этой статье для удаленной гомологии, предсказания вторичной структуры и предсказания контактов, с теми же данными обучения и архитектурами моделей. Это позволяет напрямую сравнивать изображения. Таблица 8 показывает, что трансформаторы большой емкости имеют хорошие характеристики для вторичной структуры и предсказания контактов, значительно превосходящие Alley et al. (66), Heinzinger et al.(67) и Rao et al. (68). Небольшие модели трансформаторов, обученные в качестве базовых, также имеют более высокие характеристики, чем методы со сравнимыми номерами параметров.
Таблица 8 показывает, что трансформаторы большой емкости имеют хорошие характеристики для вторичной структуры и предсказания контактов, значительно превосходящие Alley et al. (66), Heinzinger et al.(67) и Rao et al. (68). Небольшие модели трансформаторов, обученные в качестве базовых, также имеют более высокие характеристики, чем методы со сравнимыми номерами параметров.
Сравнение с моделями родственного языка белков
Встраивание белковых последовательностей было предметом недавних исследований в области белковой инженерии (69). Беплер и Бергер (70) предварительно обучили LSTM на последовательностях белков, добавив наблюдение со стороны контактов для получения встраивания. После нашего препринта родственные работы основывались на исследовании моделирования белковой последовательности, изучении генеративных моделей (71, 72), внутренних представлений трансформеров (73) и приложений обучения репрезентации и генеративного моделирования, таких как классификация (74, 75).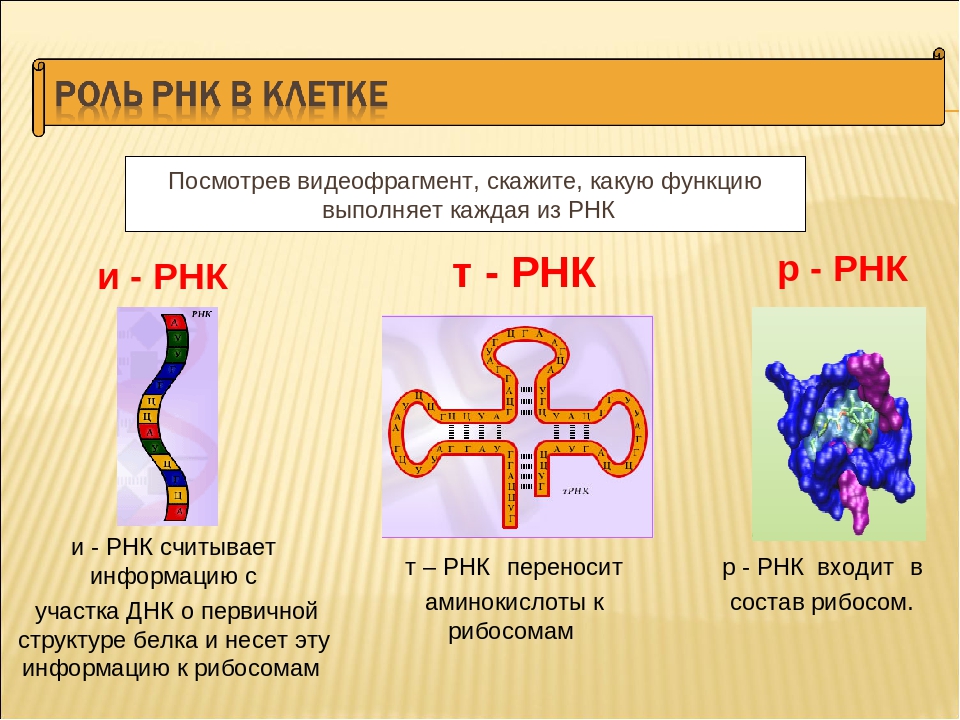 , предсказание мутационных эффектов (80) и дизайн последовательностей (76⇓ – 78).
, предсказание мутационных эффектов (80) и дизайн последовательностей (76⇓ – 78).
Обсуждение
Одной из целей искусственного интеллекта в биологии могло бы стать создание управляемых прогностических и генеративных моделей, которые могут читать и генерировать биологические данные на своем родном языке. Соответственно, потребуются исследования методов, которые могут изучать внутренние биологические свойства непосредственно из белковых последовательностей, которые могут быть переданы для прогнозирования и генерации.
Мы исследовали глубокое обучение в процессе эволюции в масштабе крупнейших баз данных последовательностей белков, обучая модели контекстного языка на основе 86 миллиардов аминокислот из 250 миллионов последовательностей.Пространство репрезентаций, извлеченных из последовательностей высокопроизводительными сетями, отражает биологическую структуру на нескольких уровнях, включая уровни аминокислот, белков и эволюционной гомологии. Информация о вторичной и третичной структуре интернализируется и представлена в сети. Знание внутренних биологических свойств возникает без надзора — во время предварительного обучения не дается никакого обучающего сигнала, кроме последовательностей.
Знание внутренних биологических свойств возникает без надзора — во время предварительного обучения не дается никакого обучающего сигнала, кроме последовательностей.
Мы обнаружили, что сети, которые были обучены на основе эволюционных данных, обобщают: информацию можно извлекать из представлений с помощью линейных проекций, глубоких нейронных сетей или путем адаптации модели с помощью супервизии.Точная настройка дает результаты, соответствующие современным достижениям в прогнозировании вариантов активности. Прогнозы делаются непосредственно из последовательности с использованием функций, которые были автоматически изучены языковой моделью, а не выбраны знанием предметной области.
Мы обнаружили, что предварительное обучение обнаруживает информацию, которой нет в современных функциях. Изученные функции могут быть объединены с функциями, используемыми современными методами прогнозирования структуры, для улучшения результатов. Эмпирическим путем мы обнаружили, что функции, обнаруженные более крупными моделями, лучше работают при выполнении последующих задач. Transformer превосходит LSTM с аналогичной емкостью в тестах. Увеличение разнообразия обучающих данных приводит к значительным улучшениям представлений.
Transformer превосходит LSTM с аналогичной емкостью в тестах. Увеличение разнообразия обучающих данных приводит к значительным улучшениям представлений.
Хотя модели белкового языка, которые мы изучаем, сопоставимы по масштабу с теми, которые используются в текстовой области, наши эксперименты еще не достигли предела масштаба. Мы заметили, что даже самые мощные модели, которые мы обучили (с параметрами от ~ 650 до 700 M), не соответствовали наборам данных последовательности из-за недостаточной емкости модели.Связь, которую мы обнаруживаем между точностью языкового моделирования и информацией о структуре, закодированной в представлениях, предполагает, что модели с большей емкостью дадут лучшие представления. Эти результаты предполагают потенциал для дальнейшего масштабирования модели и разнообразия данных, включая последовательности из метагеномики.
Сочетание генеративных моделей высокой производительности с синтезом генов и характеристикой высокой пропускной способности может способствовать генеративной биологии. Обученные нами модели можно использовать для генерации новых последовательностей (79).Если нейронные сети могут передавать знания, полученные из белковых последовательностей, для разработки функциональных белков, это может быть связано с прогнозирующими моделями для совместной генерации и оптимизации последовательностей для желаемых функций. Размер текущих данных о последовательностях и их прогнозируемый рост указывают на возможность генеративной модели общего назначения, которая может конденсировать совокупность статистики последовательностей, интернализируя и интегрируя фундаментальные химические и биологические концепции, включая структуру, функцию, активность, локализацию, связывание и динамику. , чтобы генерировать новые последовательности, которые ранее не встречались в природе, но которые являются биологически активными.
Обученные нами модели можно использовать для генерации новых последовательностей (79).Если нейронные сети могут передавать знания, полученные из белковых последовательностей, для разработки функциональных белков, это может быть связано с прогнозирующими моделями для совместной генерации и оптимизации последовательностей для желаемых функций. Размер текущих данных о последовательностях и их прогнозируемый рост указывают на возможность генеративной модели общего назначения, которая может конденсировать совокупность статистики последовательностей, интернализируя и интегрируя фундаментальные химические и биологические концепции, включая структуру, функцию, активность, локализацию, связывание и динамику. , чтобы генерировать новые последовательности, которые ранее не встречались в природе, но которые являются биологически активными.
Благодарности
Мы благодарим Тристана Беплера, Ричарда Бонно, Йилун Ду, Владимира Глигориевича, Анику Гупту, Омера Леви, Яна Пейкона, Хетунандана Камизетти, Лоренса ван дер Маатена, Итана Переса, Одеда Регева, Невилла Санджана и Эмили Ванджана за отзывы о рукописи и содержательных беседах.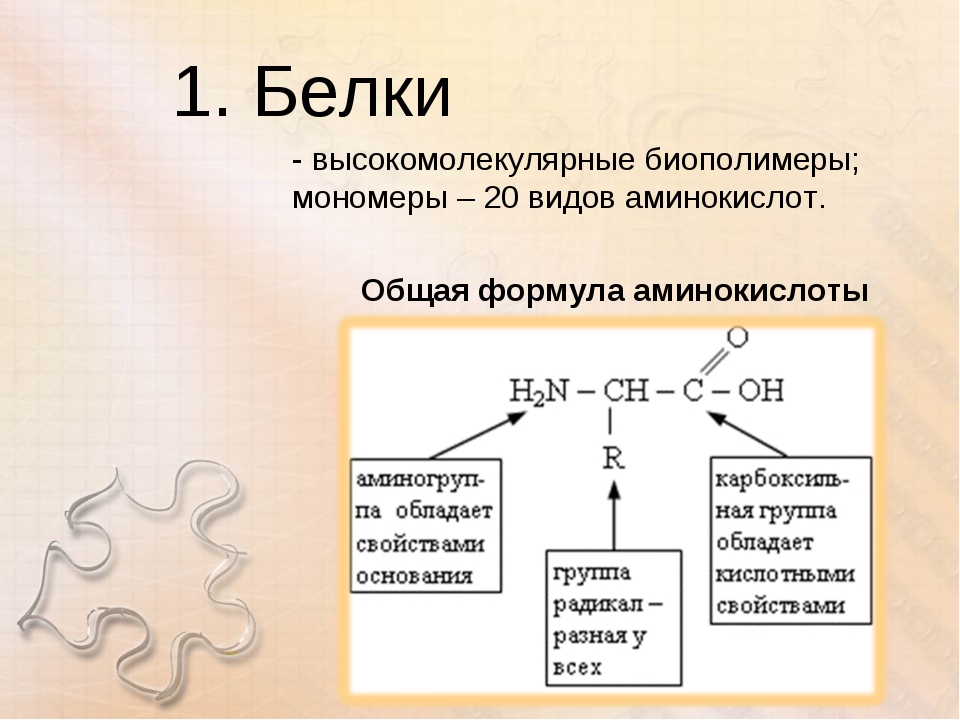 Мы благодарим Jinbo Xu за то, что он поделился функциями RaptorX и помог с CASP13. Мы благодарим Майкла Клаузена за предоставленный обучающий код NetSurf. А. была поддержана в Нью-Йоркском университете грантом NSF № 1339362.
Мы благодарим Jinbo Xu за то, что он поделился функциями RaptorX и помог с CASP13. Мы благодарим Майкла Клаузена за предоставленный обучающий код NetSurf. А. была поддержана в Нью-Йоркском университете грантом NSF № 1339362.
Сноски
Вклад авторов: A.R., J. Meier, T..S., S.G., Z.L., M.O., C.L.Z., J. Ma, and R.F. спланированное исследование; A.R., J. Meier, T..S., S.G., Z.L., J.L., D.G. и J. Ma провели исследования; A.R., J. Meier, T..S., S.G., Z.L., J.L., D.G. и J. Ma проанализировали данные; and A.R., J. Meier, T..S., S.G., Z.L., J.L., D.G., M.O., C.L.Z., J. Ma, and R.F. написал газету.
Заявление о конкурирующих интересах: A.R., J. Meier, S.G., D.G., M.O., C.L.Z., J.Ма, Р.Ф. являются соавторами заявки на патент США, относящейся к работе над этой рукописью.
Эта статья представляет собой прямое представление PNAS. D.T.J. является приглашенным редактором редакции журнала.
Эта статья содержит вспомогательную информацию в Интернете по адресу https://www.
 pnas.org/lookup/suppl/doi:10.1073/pnas.2016239118/-/DCSupplemental.
pnas.org/lookup/suppl/doi:10.1073/pnas.2016239118/-/DCSupplemental.
- Copyright © 2021 Автор (ы). Опубликовано PNAS.
Высокоточное предсказание структуры белка с помощью AlphaFold
Томпсон, М. К., Йейтс, Т. О. и Родригес, Дж. А. Достижения в методах определения структуры макромолекул с атомным разрешением. F1000Рес . 9 , 667 (2020).
CAS Статья Google Scholar
Бай, X.-C., Макмаллан, Г. и Шерес, С. Х. У. Как крио-ЭМ революционизирует структурную биологию. Trends Biochem. Sci . 40 , 49–57 (2015).
CAS PubMed Статья PubMed Central Google Scholar
Яскольски М., Даутер З. и Влодавер А. Краткая история кристаллографии макромолекул, проиллюстрированная генеалогическим древом и его Нобелевскими плодами. FEBS J . 281 , 3985–4009 (2014).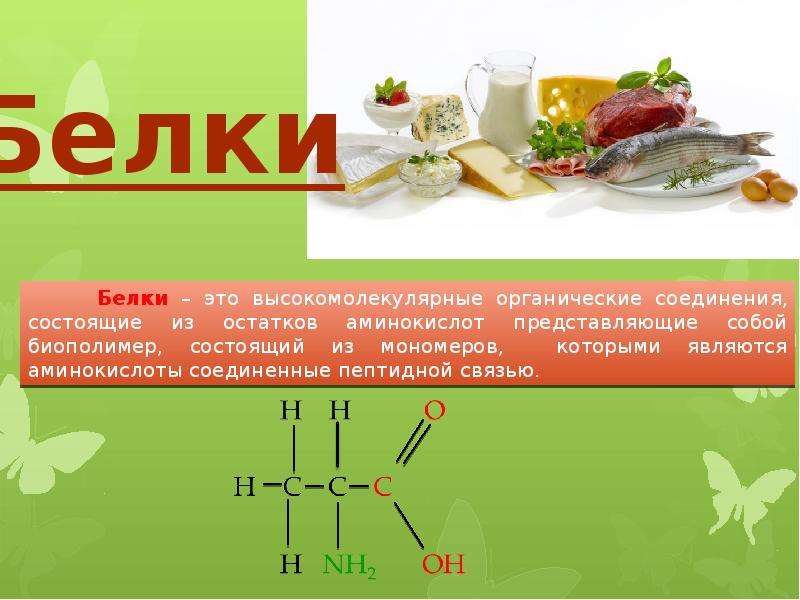
CAS PubMed PubMed Central Статья Google Scholar
Вютрих К. Путь к ЯМР-структурам белков. Нат. Struct. Биол . 8 , 923–925 (2001).
PubMed Статья PubMed Central Google Scholar
Консорциум wwPDB. Банк данных белков: единый глобальный архив данных о трехмерной структуре макромолекул. Nucleic Acids Res . 47 , D520 – D528 (2018).
Артикул CAS Google Scholar
Mitchell, A. L. et al. MGnify: ресурс по анализу микробиома в 2020 году. Nucleic Acids Res . 48 , D570 – D578 (2020).
CAS PubMed PubMed Central Google Scholar
Steinegger, M., Mirdita, M. & Söding, J. Сборка на уровне белка многократно увеличивает восстановление белковой последовательности из метагеномных образцов. Нат. Методы 16 , 603–606 (2019).
Нат. Методы 16 , 603–606 (2019).
CAS PubMed Статья PubMed Central Google Scholar
Дилл К. А., Озкан С. Б., Шелл М. С. и Вейкл Т. Р. Проблема сворачивания белка. Annu. Ред. Biophys . 37 , 289–316 (2008).
CAS PubMed PubMed Central Статья ОБЪЯВЛЕНИЯ Google Scholar
Анфинсен, К. Б. Принципы, регулирующие складывание белковых цепей. Наука 181 , 223–230 (1973).
CAS PubMed Статья ОБЪЯВЛЕНИЯ PubMed Central Google Scholar
Senior, A. W. et al. Улучшенное предсказание структуры белка с использованием возможностей глубокого обучения. Природа 577 , 706–710 (2020).
CAS PubMed Статья ОБЪЯВЛЕНИЯ PubMed Central Google Scholar

Ван, С., Сан, С., Ли, З., Чжан, Р., Сюй, Дж. Точное предсказание de novo карты контакта белков с помощью модели сверхглубокого обучения. PLOS Comput. Биол . 13 , e1005324 (2017).
PubMed PubMed Central Статья ОБЪЯВЛЕНИЯ CAS Google Scholar
Zheng, W. et al. Предсказание структуры белка на основе карты контактов с использованием глубокого обучения в CASP13. Белки 87 , 1149–1164 (2019).
CAS PubMed PubMed Central Статья Google Scholar
Абриата, Л. А., Тами, Г. Э. и Даль Пераро, М. Дальнейший скачок в улучшении предсказания третичной структуры в CASP13 открывает новые пути для будущих оценок. Белки 87 , 1100–1112 (2019).
CAS PubMed Статья PubMed Central Google Scholar
Pearce, R. & Zhang, Y. Методы глубокого обучения существенно повлияли на прогнозирование структуры белка и дизайн белка. Curr. Opin. Struct. Биол . 68 , 194–207 (2021).
Методы глубокого обучения существенно повлияли на прогнозирование структуры белка и дизайн белка. Curr. Opin. Struct. Биол . 68 , 194–207 (2021).
CAS PubMed Статья PubMed Central Google Scholar
Моулт, Дж., Фиделис, К., Крыштафович, А., Шведе, Т. и Топф, М. Критическая оценка методов предсказания структуры белков, четырнадцатый раунд. CASP 14 Abstract Book https://www.predictioncenter.org/casp14/doc/CASP14_Abstracts.pdf (2020).
Брини, Э., Симмерлинг, К. и Дилл, К. Рассказывание историй о белках через физику. Наука 370 , eaaz3041 (2020).
CAS PubMed Статья PubMed Central Google Scholar
Сиппл, М. Дж. Расчет конформационных ансамблей из потенциалов средней силы. Подход к предсказанию локальных структур глобулярных белков на основе знаний. J. Mol. Биол . 213 , 859–883 (1990).
213 , 859–883 (1990).
CAS PubMed Статья Google Scholar
Шали, А. и Бланделл, Т. Л. Сравнительное моделирование белков путем удовлетворения пространственных ограничений. J. Mol. Биол . 234 , 779–815 (1993).
PubMed Статья PubMed Central Google Scholar
Рой, А., Кучукурал, А. и Чжан, Ю. I-TASSER: унифицированная платформа для автоматизированного прогнозирования структуры и функции белков. Нат. Протоколы 5 , 725–738 (2010).
CAS PubMed Статья Google Scholar
Альтшух Д., Леск А.М., Блумер А.С.И Клуг, А. Корреляция скоординированных аминокислотных замен с функцией в вирусах, связанных с вирусом табачной мозаики. J. Mol. Биол . 193 , 693–707 (1987).
CAS PubMed Статья PubMed Central Google Scholar

Шиндялов И. Н., Колчанов Н. А. и Сандер С. Можно ли предсказать трехмерные контакты в белковых структурах с помощью анализа коррелированных мутаций? Протеин Анг . 7 , 349–358 (1994).
CAS PubMed Статья PubMed Central Google Scholar
Weigt, M., White, R.A., Szurmant, H., Hoch, J. A. & Hwa, T. Идентификация прямых контактов остатков при межбелковом взаимодействии посредством передачи сообщений. Proc. Natl Acad. Sci. США 106 , 67–72 (2009).
CAS PubMed Статья ОБЪЯВЛЕНИЯ PubMed Central Google Scholar
Marks, D. S. et al. Трехмерная структура белка рассчитана на основе изменения эволюционной последовательности. PLoS ONE 6 , e28766 (2011).
CAS PubMed PubMed Central Статья ОБЪЯВЛЕНИЯ Google Scholar

Джонс, Д. Т., Бьюкен, Д. В. А., Козцетто, Д. и Понтил, М. PSICOV: точное предсказание структурного контакта с использованием оценки разреженной обратной ковариации на больших множественных выравниваниях последовательностей. Биоинформатика 28 , 184–190 (2012).
CAS PubMed Статья PubMed Central Google Scholar
Моулт, Дж., Педерсен, Дж. Т., Джадсон, Р. и Фиделис, К. Крупномасштабный эксперимент по оценке методов предсказания структуры белка. Белки 23 , ii – iv (1995).
CAS PubMed Статья PubMed Central Google Scholar
Крыштафович, А., Шведе, Т., Топф, М., Фиделис, К. и Моулт, Дж. Критическая оценка методов предсказания структуры белка (CASP) — этап XIII. Белки 87 , 1011–1020 (2019).
CAS PubMed PubMed Central Статья Google Scholar

Zhang, Y. & Skolnick, J. Функция подсчета баллов для автоматической оценки качества матрицы структуры белка. Белки 57 , 702–710 (2004).
CAS PubMed Статья PubMed Central Google Scholar
Ту, З. и Бай, X. Автоконтекст и его применение для задач зрения высокого уровня и сегментации трехмерных изображений мозга. IEEE Trans. Pattern Anal. Мах. Intell . 32 , 1744–1757 (2010).
PubMed Статья PubMed Central Google Scholar
Каррейра, Дж., Агравал, П., Фрагкиадаки, К. и Малик, Дж. Оценка позы человека с итеративной обратной связью по ошибке. В Proc. Конференция IEEE по компьютерному зрению и распознаванию образов 4733–4742 (2016).
Мирабелло, К. и Валлнер, Б. rawMSA: сквозное глубокое обучение с использованием необработанного множественного выравнивания последовательностей. PLoS ONE 14 , e0220182 (2019).
PLoS ONE 14 , e0220182 (2019).
CAS PubMed PubMed Central Статья Google Scholar
Huang, Z. et al. CCNet: постоянное внимание семантической сегментации. В Proc. Международная конференция IEEE / CVF по компьютерному зрению 603–612 (2019).
Hornak, V. et al. Сравнение нескольких янтарных силовых полей и разработка улучшенных параметров белкового каркаса. Белки 65 , 712–725 (2006).
CAS PubMed PubMed Central Статья Google Scholar
Zemla, A. LGA: метод нахождения трехмерных сходств в структурах белков. Nucleic Acids Res . 31 , 3370–3374 (2003).
CAS PubMed PubMed Central Статья Google Scholar
Mariani, V., Biasini, M., Barbato, A. & Schwede, T. lDDT: оценка без локальной суперпозиции для сравнения белковых структур и моделей с использованием тестов разности расстояний. Биоинформатика 29 , 2722–2728 (2013).
Биоинформатика 29 , 2722–2728 (2013).
CAS PubMed PubMed Central Статья Google Scholar
Xie, Q., Luong, M.-T., Hovy, E. & Le, Q. V. Самостоятельные занятия с шумным учеником улучшают классификацию изображений. В Proc. Конференция IEEE / CVF по компьютерному зрению и распознаванию образов 10687–10698 (2020).
Mirdita, M. et al. Базы данных Uniclust сгруппированных и глубоко аннотированных белковых последовательностей и выравниваний. Nucleic Acids Res . 45 , D170 – D176 (2017).
CAS PubMed Статья PubMed Central Google Scholar
Девлин, Дж., Чанг, М.-В., Ли, К. и Тутанова, К. БЕРТ: предварительная подготовка глубоких двунаправленных преобразователей для понимания языка. В Proc. Конференция 2019 г. Североамериканского отделения Ассоциации компьютерной лингвистики: технологии человеческого языка 1, 4171–4186 (2019).
Rao, R. et al. Трансформатор MSA. В Proc. 38-я Международная конференция по машинному обучению PMLR 139, 8844–8856 (2021).
Tunyasuvunakool, K. et al. Высокоточное предсказание структуры белка для протеома человека. Природа https://doi.org/10.1038/s41586-021-03828-1 (2021).
Кульман, Б. и Брэдли, П. Достижения в области предсказания и разработки структуры белка. Нат. Rev. Mol. Ячейка Биол . 20 , 681–697 (2019).
CAS PubMed PubMed Central Статья Google Scholar
Маркс, Д. С., Хопф, Т. А. и Сандер, С. Прогнозирование структуры белка по изменению последовательности. Нат. Биотехнология . 30 , 1072–1080 (2012).
CAS PubMed PubMed Central Статья Google Scholar
Qian, N.& Сейновски, Т. Дж. Предсказание вторичной структуры глобулярных белков с использованием моделей нейронных сетей. J. Mol. Биол . 202 , 865–884 (1988).
J. Mol. Биол . 202 , 865–884 (1988).
CAS PubMed Статья Google Scholar
Фаризелли, П., Олмеа, О., Валенсия, А. и Касадио, Р. Прогнозирование карт контактов с помощью нейронных сетей и коррелированных мутаций. Протеин Анг . 14 , 835–843 (2001).
CAS PubMed Статья PubMed Central Google Scholar
Yang, J. et al. Улучшенное предсказание структуры белка с использованием предсказанной ориентации остатков. Proc. Natl Acad. Sci. США 117 , 1496–1503 (2020).
CAS PubMed PubMed Central Статья Google Scholar
Li, Y. et al. Получение высокоточных карт контактов белков из триплета коэволюционных матриц через глубокие сверточные остаточные сети. PLOS Comput. Биол . 17 , e1008865 (2021).
CAS PubMed PubMed Central Статья Google Scholar

Хе, К., Чжан, X., Рен, С. и Сан, Дж. Глубокое остаточное обучение для распознавания изображений. В Proc. Конференция IEEE по компьютерному зрению и распознаванию образов 770–778 (2016).
AlQuraishi, М. Сквозное дифференцируемое обучение структуры белка. Cell Syst . 8 , 292–301 (2019).
CAS PubMed PubMed Central Статья Google Scholar
Senior, A. W. et al. Прогнозирование структуры белка с использованием нескольких глубоких нейронных сетей в 13-й критической оценке предсказания структуры белка (CASP13). Белки 87 , 1141–1148 (2019).
CAS PubMed PubMed Central Статья Google Scholar
Ingraham, J., Riesselman, A. J., Sander, C. & Marks, D. S. Изучение структуры белка с помощью дифференцируемого симулятора. в Proc. Международная конференция по обучению представительств (2019).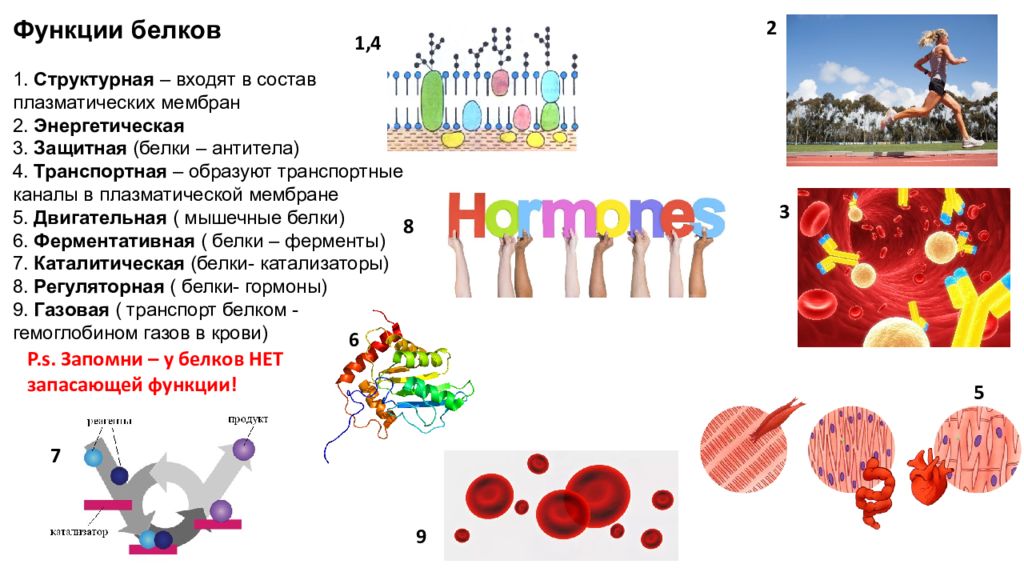
Li, J. Универсальная трансформирующая геометрическая сеть. Препринт на https://arxiv.org/abs/1908.00723 (2019).
Xu, J., McPartlon, M. & Li, J. Улучшенное предсказание структуры белка с помощью глубокого обучения независимо от информации о коэволюции. Нат. Мах. Intell . 3 , 601–609 (2021).
PubMed Статья PubMed Central Google Scholar
Vaswani, A. et al. Внимание — это все, что вам нужно. В достижениях в системах обработки нейронной информации 5998–6008 (2017).
Wang, H. et al. Axial-deeplab: автономное осевое внимание для паноптической сегментации. в Европейской конференции по компьютерному зрению 108–126 (Springer, 2020).
Элли, Э. К., Химуля, Г., Бисвас, С., Аль-Кураиши, М. и Черч, Г. М. Унифицированная рациональная белковая инженерия с обучением с глубоким представлением на основе последовательностей. Нат. Методы 16 , 1315–1322 (2019).
Нат. Методы 16 , 1315–1322 (2019).
CAS PubMed PubMed Central Статья Google Scholar
Heinzinger, M. et al. Моделирование аспектов языка жизни с помощью белковых последовательностей передачи-обучения. BMC Bioinformatics 20 , 723 (2019).
CAS PubMed PubMed Central Статья Google Scholar
Rives, A. et al. Биологическая структура и функция возникают в результате увеличения объема обучения без учителя до 250 миллионов белковых последовательностей. Proc. Natl Acad. Sci. США 118 , e2016239118 (2021).
CAS PubMed PubMed Central Статья Google Scholar
Pereira, J. et al. Предсказание структуры белка с высокой точностью в CASP14. Белки https://doi.org/10.1002/prot.26171 (2021).
Артикул PubMed PubMed Central Google Scholar
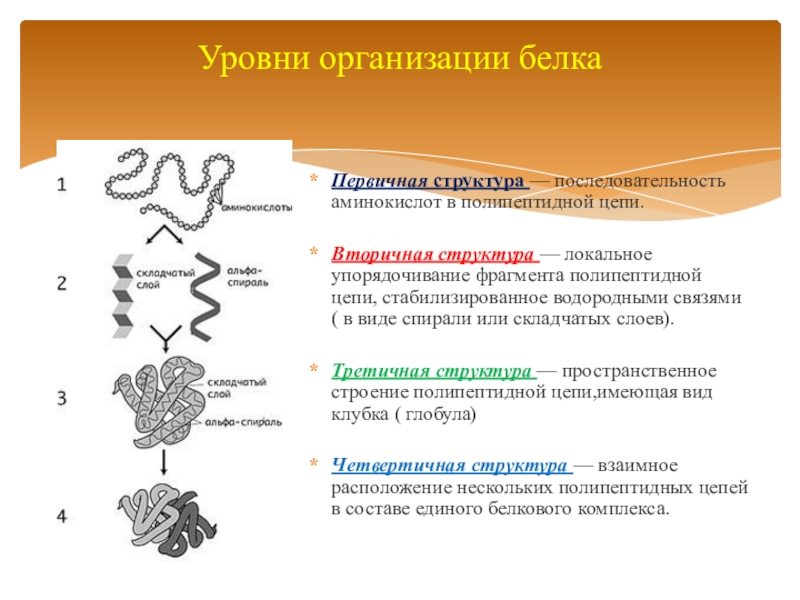
Gupta, M. et al. CryoEM и AI раскрывают структуру SARS-CoV-2 Nsp2, многофункционального белка, участвующего в ключевых процессах хозяина. Препринт на https://doi.org/10.1101/2021.05.10.443524 (2021 г.).
Ingraham, J., Garg, V.K., Barzilay, R. & Jaakkola, T. Генеративные модели для построения белков на основе графов. в Proc. 33-я конференция по нейронным системам обработки информации (2019).
Джонсон, Л. С., Эдди, С. Р. и Португали, Э. Эвристика скорости скрытой модели Маркова и итерационная процедура поиска HMM. BMC Bioinformatics 11 , 431 (2010).
PubMed PubMed Central Статья CAS Google Scholar
Remmert, M., Biegert, A., Hauser, A. & Söding, J. HHblits: молниеносный итеративный поиск белковой последовательности с помощью выравнивания HMM-HMM. Нат. Методы 9 , 173–175 (2012).
CAS Статья Google Scholar

Консорциум UniProt. UniProt: универсальная база знаний о белках в 2021 году. Nucleic Acids Res . 49 , D480 – D489 (2020).
Артикул CAS Google Scholar
Steinegger, M. & Söding, J. Кластеризация огромных наборов белковых последовательностей за линейное время. Нат. Коммуна . 9 , 2542 (2018).
PubMed PubMed Central Статья ОБЪЯВЛЕНИЯ CAS Google Scholar
Steinegger, M. & Söding, J. MMseqs2 позволяет осуществлять поиск чувствительных белковых последовательностей для анализа массивных наборов данных. Нат. Биотехнология . 35 , 1026–1028 (2017).
CAS PubMed Статья PubMed Central Google Scholar
Deorowicz, S., Debudaj-Grabysz, A. & Gudyś, A. FAMSA: быстрое и точное сопоставление множественных последовательностей огромных семейств белков. Sci. Репу . 6 , 33964 (2016).
Sci. Репу . 6 , 33964 (2016).
CAS PubMed PubMed Central Статья ОБЪЯВЛЕНИЯ Google Scholar
Steinegger, M. et al. HH-suite3 для быстрого удаленного определения гомологии и глубокой аннотации белков. BMC Bioinformatics 20 , 473 (2019).
PubMed PubMed Central Статья CAS Google Scholar
Suzek, B. E., Wang, Y., Huang, H., McGarvey, P. B. & Wu, C. H. Кластеры UniRef: всеобъемлющая и масштабируемая альтернатива для улучшения поиска сходства последовательностей. Биоинформатика 31 , 926–932 (2015).
CAS PubMed Статья PubMed Central Google Scholar
Eddy, S. R. Ускоренный поиск профилей HMM. PLOS Comput. Биол . 7 , e1002195 (2011).
MathSciNet CAS PubMed PubMed Central Статья ОБЪЯВЛЕНИЯ Google Scholar

Eastman, P. et al. OpenMM 7: быстрое развитие высокопроизводительных алгоритмов молекулярной динамики. PLOS Comput. Биол . 13 , e1005659 (2017).
PubMed PubMed Central Статья CAS Google Scholar
Ашиш, А.М.А. и др. TensorFlow: крупномасштабное машинное обучение на гетерогенных системах. Препринт на https://arxiv.org/abs/1603.04467 (2015).
Reynolds, M. et al. Открытый исходный код Sonnet — новая библиотека для построения нейронных сетей. DeepMind https://deepmind.com/blog/open-sourcing-sonnet/ (7 апреля 2017 г.).
Harris, C.R. et al. Программирование массивов с помощью NumPy. Природа 585 , 357–362 (2020).
CAS PubMed PubMed Central Статья ОБЪЯВЛЕНИЯ Google Scholar
Ван Россум, Г. и Дрейк, Ф. Л. Python 3 Справочное руководство (CreateSpace, 2009).
Бисонг, Э. в Построение моделей машинного обучения и глубокого обучения на платформе Google Cloud: полное руководство для начинающих 59–64 (Apress, 2019).
TensorFlow. XLA: оптимизирующий компилятор для TensorFlow. https://www.tensorflow.org/xla (2018).
Wu, T., Hou, J., Adhikari, B. & Cheng, J. Анализ нескольких ключевых факторов, влияющих на прогнозирование контакта между остатками на основе глубокого обучения. Биоинформатика 36 , 1091–1098 (2020).
CAS PubMed Статья PubMed Central Google Scholar
Jiang, W. et al. MrpH, новый класс металлсвязывающих адгезинов, требует цинка для опосредования образования биопленок. PLoS Pathog . 16 , e1008707 (2020).
CAS PubMed PubMed Central Статья Google Scholar
Dunne, M., Ernst, P.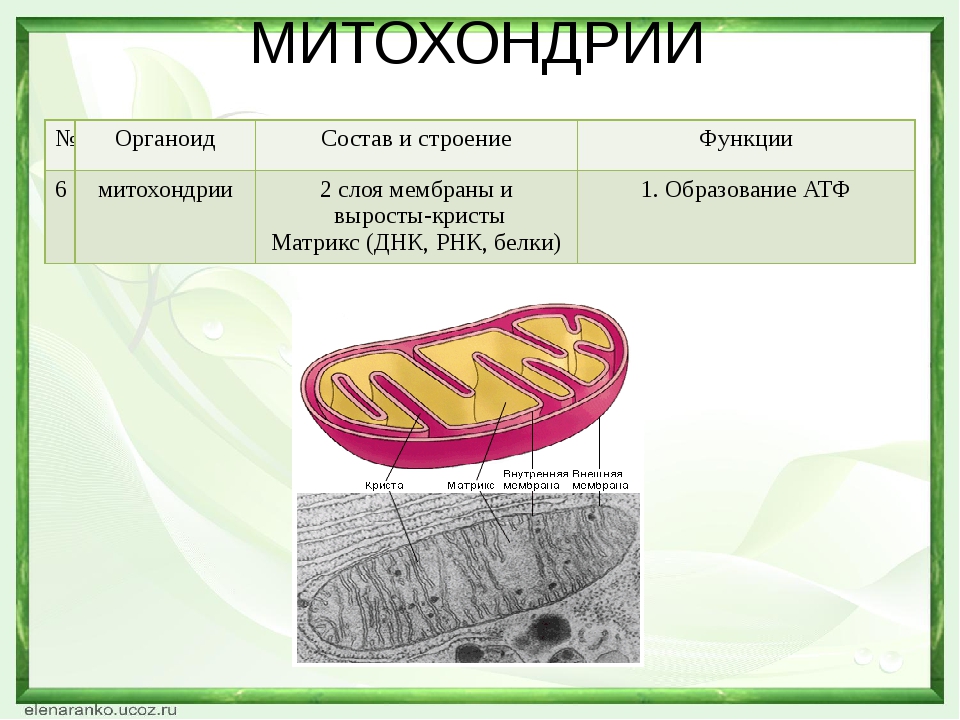 , Sobieraj, A., Pluckthun, A. & Loessner, M.J. Пептидазный домен M23 эндолизина стафилококкового фага 2638A. PDB https://doi.org/10.2210/pdb6YJ1/pdb (2020).
, Sobieraj, A., Pluckthun, A. & Loessner, M.J. Пептидазный домен M23 эндолизина стафилококкового фага 2638A. PDB https://doi.org/10.2210/pdb6YJ1/pdb (2020).
Дробышева А.В. и др. Структура и функция вирионной РНК-полимеразы crAss-подобного фага. Природа 589 , 306–309 (2021).
CAS PubMed Статья ОБЪЯВЛЕНИЯ PubMed Central Google Scholar
Flaugnatti, N. et al. Структурная основа загрузки и ингибирования эффектора бактериальной фосфолипазы T6SS с помощью шипа VgrG. EMBO J . 39 , e104129 (2020).
CAS PubMed PubMed Central Статья Google Scholar
ElGamacy, M. et al. Стратегия дизайна, основанная на интерфейсе, дает новую, гофрированную белковую архитектуру. ACS Synth. Биол . 7 , 2226–2235 (2018).
CAS PubMed Статья Google Scholar

Lim, C.J. et al. Структура человеческого CST обнаруживает декамерную сборку, связанную с теломерной ДНК. Наука 368 , 1081–1085 (2020).
CAS PubMed PubMed Central Статья ОБЪЯВЛЕНИЯ Google Scholar
Debruycker, V. et al. Встроенный липид в переносчик множества лекарственных средств LmrP предполагает механизм полиспецифичности. Нат. Struct. Мол. Биол . 27 , 829–835 (2020).
CAS PubMed PubMed Central Статья Google Scholar
Flower, T. G. et al. Структура ORF8 SARS-CoV-2, быстро развивающегося белка уклонения от иммунитета. Proc. Natl Acad. Sci. США 118 , e2021785118 (2021).
CAS PubMed Статья PubMed Central Google Scholar
AlphaFold: решение грандиозной проблемы биологии 50-летней давности
Мы также увидели признаки того, что прогнозирование структуры белка может быть полезным в будущих усилиях по реагированию на пандемию как один из многих инструментов, разработанных научным сообществом. Ранее в этом году мы предсказали несколько белковых структур вируса SARS-CoV-2, включая ORF3a, структура которого ранее была неизвестна. В CASP14 мы предсказали структуру другого белка коронавируса, ORF8. Впечатляюще быстрая работа экспериментаторов подтвердила структуры как ORF3a, так и ORF8. Несмотря на их сложный характер и наличие очень небольшого количества связанных последовательностей, мы достигли высокой степени точности обоих наших прогнозов по сравнению с их экспериментально определенными структурами.
Ранее в этом году мы предсказали несколько белковых структур вируса SARS-CoV-2, включая ORF3a, структура которого ранее была неизвестна. В CASP14 мы предсказали структуру другого белка коронавируса, ORF8. Впечатляюще быстрая работа экспериментаторов подтвердила структуры как ORF3a, так и ORF8. Несмотря на их сложный характер и наличие очень небольшого количества связанных последовательностей, мы достигли высокой степени точности обоих наших прогнозов по сравнению с их экспериментально определенными структурами.
Мы не только ускоряем понимание известных болезней, но и очень рады возможности этих методов исследовать сотни миллионов белков, для которых у нас в настоящее время нет моделей, — обширную территорию с неизвестной биологией. Поскольку ДНК определяет аминокислотные последовательности, которые составляют структуры белков, революция в геномике сделала возможным считывание последовательностей белков из естественного мира в массовом масштабе — с 180 миллионами последовательностей белков и подсчетом в базе данных Universal Protein (UniProt). Напротив, учитывая экспериментальную работу, необходимую для перехода от последовательности к структуре, только около 170 000 белковых структур находятся в банке данных о белках (PDB). Среди неопределенных белков могут быть некоторые с новыми интересными функциями, и — так же, как телескоп помогает нам заглянуть глубже в неизвестную вселенную — такие методы, как AlphaFold, могут помочь нам найти их.
Напротив, учитывая экспериментальную работу, необходимую для перехода от последовательности к структуре, только около 170 000 белковых структур находятся в банке данных о белках (PDB). Среди неопределенных белков могут быть некоторые с новыми интересными функциями, и — так же, как телескоп помогает нам заглянуть глубже в неизвестную вселенную — такие методы, как AlphaFold, могут помочь нам найти их.
Открывая новые возможности
AlphaFold — одно из наших самых значительных достижений на сегодняшний день, но, как и во всех других научных исследованиях, есть еще много вопросов, на которые нужно ответить.Не всякая структура, которую мы прогнозируем, будет идеальной. Еще многое предстоит узнать, в том числе о том, как несколько белков образуют комплексы, как они взаимодействуют с ДНК, РНК или небольшими молекулами, и как мы можем определить точное расположение всех боковых цепей аминокислот. В сотрудничестве с другими можно многое узнать о том, как лучше всего использовать эти научные открытия при разработке новых лекарств, о способах управления окружающей средой и многом другом.
Для всех нас, работающих над вычислительными методами и методами машинного обучения в науке, такие системы, как AlphaFold, демонстрируют потрясающий потенциал ИИ как инструмента, способствующего фундаментальным открытиям.Подобно тому, как 50 лет назад Анфинсен поставил задачу, выходящую за пределы возможностей науки в то время, многие аспекты нашей Вселенной остаются неизвестными. Объявленный сегодня прогресс вселяет в нас уверенность в том, что ИИ станет одним из самых полезных инструментов человечества в расширении границ научных знаний, и мы с нетерпением ждем впереди многих лет упорной работы и открытий!
Пока мы не опубликуем статью об этой работе, пожалуйста, цитируйте:
Высокоточное прогнозирование структуры белка с использованием глубокого обучения
Джон Джампер, Ричард Эванс, Александр Прицель, Тим Грин, Майкл Фигурнов, Кэтрин Туньясувунакул, Олаф Роннебергер, Расс Бейтс, Огюстин Жидек, Алекс Бриджленд, Клеменс Мейер, Саймон А. А. Коль, Анна Потапенко, Эндрю Дж. Баллард, Эндрю Коуи, Бернардино -Паредес, Станислав Николов, Ришуб Джайн, Йонас Адлер, Тревор Бэк, Стиг Петерсен, Дэвид Рейман, Мартин Штайнеггер, Михалина Пачольска, Дэвид Сильвер, Ориол Виньялс, Эндрю В. Сеньор, Корай Кавукчуоглу, Пушмит Кохли, Демис Хассабис.
А. Коль, Анна Потапенко, Эндрю Дж. Баллард, Эндрю Коуи, Бернардино -Паредес, Станислав Николов, Ришуб Джайн, Йонас Адлер, Тревор Бэк, Стиг Петерсен, Дэвид Рейман, Мартин Штайнеггер, Михалина Пачольска, Дэвид Сильвер, Ориол Виньялс, Эндрю В. Сеньор, Корай Кавукчуоглу, Пушмит Кохли, Демис Хассабис.
В Четырнадцатой критической оценке методов прогнозирования структуры белка (тезисы), 30 ноября — 4 декабря 2020 г. Получено отсюда.
Мы находимся в самом начале изучения того, как лучше всего дать возможность другим группам использовать наши предсказания структуры, наряду с подготовкой рецензируемой статьи для публикации. Хотя наша команда не сможет ответить на все запросы, если AlphaFold может иметь отношение к вашей работе, отправьте несколько строк об этом по адресу alphafold @ deepmind.com. Мы свяжемся с вами, если появятся возможности для дальнейшего изучения.
Глава 3. Белки и аминокислоты
Глава 3. Белки и аминокислоты1.
БЕЛКИ
2. ПИЩЕВАРЕНИЕ БЕЛКОВ И МЕТАБОЛИЗМ
3. ОБЩИЕ ТРЕБОВАНИЯ К БЕЛКАМ
4. АМИНОКИСЛОТЫ
5. КОЛИЧЕСТВО ТРЕБОВАНИЯ К АМИНОКИСЛОТЕ
6. ДОБАВЛЕНИЕ ДОБАВКИ ДИЕТЫ С АМИНОКИСЛОТАМИ
7. СПРАВОЧНАЯ ИНФОРМАЦИЯ
Дж.Э. Халвер
Вашингтонский университет
Сиэтл, Вашингтон
1.1 Классификация
1.2 Структура
1.3 Свойства
1.4 Химическое определение
Белки представляют собой сложные органические соединения, состоящие из многих аминокислот, связанных друг с другом пептидными связями и поперечно связанных между цепями сульфгидрильными связями, водородными связями и силами Ван-дер-Ваальса. Химический состав белков больше, чем у любой другой группы биологически активных соединений.Белки в различных клетках животных и растений придают этим тканям их биологическую специфичность.
1.1 Классификация
Белки можно классифицировать как:
(а) Простые белки.При гидролизе они дают только аминокислоты и иногда небольшие углеводные соединения. Примеры: альбумины, глобулины, глютелины, альбуминоиды, гистоны и протамины.
(b) Конъюгированные белки. Это простые белки в сочетании с небелковым материалом в организме.Примеры: нуклеопротеины, гликопротеины, фосфопротеины, гемоглобины и лецитопротеины.
(c) Производные белки. Это белки, полученные из простых или конъюгированных белков физическими или химическими способами. Примеры: денатурированные белки и пептиды.
1,2 Конструкция
Потенциальная конфигурация белковых молекул настолько сложна, что многие типы белковых молекул могут быть сконструированы и обнаружены в биологических материалах с различными физическими характеристиками.Глобулярные белки обнаруживаются в крови и тканевых жидкостях в аморфной глобулярной форме с очень тонкими или отсутствующими мембранами. Коллагеновые белки находятся в соединительной ткани, такой как кожа или клеточные мембраны. Волокнистые белки содержатся в волосах, мышцах и соединительной ткани. Кристаллические белки представлены хрусталиком глаза и подобными тканями. Ферменты — это белки со специфическими химическими функциями, которые опосредуют большинство физиологических процессов жизни. Несколько небольших полипептидов действуют как гормоны в тканевых системах, контролируя различные химические или физиологические процессы.Мышечный белок состоит из нескольких форм полипептидов, которые позволяют мышцам сокращаться и расслабляться при физических движениях.
Волокнистые белки содержатся в волосах, мышцах и соединительной ткани. Кристаллические белки представлены хрусталиком глаза и подобными тканями. Ферменты — это белки со специфическими химическими функциями, которые опосредуют большинство физиологических процессов жизни. Несколько небольших полипептидов действуют как гормоны в тканевых системах, контролируя различные химические или физиологические процессы.Мышечный белок состоит из нескольких форм полипептидов, которые позволяют мышцам сокращаться и расслабляться при физических движениях.
1.3 Недвижимость
Белки также можно охарактеризовать по их химическим реакциям. Большинство белков растворимы в воде, спирте, разбавленной основе или в различных концентрациях солевых растворов. Белки имеют характерную спиралевидную структуру, которая определяется последовательностью аминокислот в первичной полипептидной цепи и стереоконфигурацией радикальных групп, присоединенных к альфа-углероду каждой аминокислоты.Белки термолабильны, проявляя различную степень лабильности в зависимости от типа белка, раствора и температурного профиля. Белки могут быть обратимыми или необратимыми, денатурированными при нагревании, концентрации соли, замораживании, ультразвуковом воздействии или старении. Белки претерпевают характерное связывание с другими белками в так называемой пластеиновой реакции и соединяются со свободными альдегидными и гидроксильными группами углеводов с образованием соединений типа Майяра.
Белки могут быть обратимыми или необратимыми, денатурированными при нагревании, концентрации соли, замораживании, ультразвуковом воздействии или старении. Белки претерпевают характерное связывание с другими белками в так называемой пластеиновой реакции и соединяются со свободными альдегидными и гидроксильными группами углеводов с образованием соединений типа Майяра.
1.4 Химическое определение
Содержание азота в большинстве белков, обнаруженных в тканях животных, орехов и зерна, составляет около 16 процентов; поэтому содержание белка обычно выражается как содержание азота × 6.25.
Проглоченные белки сначала расщепляются на более мелкие фрагменты пепсином в желудке или трипсином или химотрипсином из поджелудочной железы. Эти пептиды затем дополнительно восстанавливаются под действием карбоксипептидазы, которая гидролизует одну аминокислоту за раз, начиная со свободного карбоксильного конца молекулы, или с помощью аминопептидазы, которая отщепляет одну аминокислоту за раз, начиная со свободного амино-конца полипептида. цепь. Свободные аминокислоты, высвобождаемые в пищеварительную систему, затем всасываются через стенки желудочно-кишечного тракта в кровоток, где они затем повторно синтезируются в новые тканевые белки или катаболизируются для получения энергии или фрагментов для дальнейшего тканевого метаболизма.
цепь. Свободные аминокислоты, высвобождаемые в пищеварительную систему, затем всасываются через стенки желудочно-кишечного тракта в кровоток, где они затем повторно синтезируются в новые тканевые белки или катаболизируются для получения энергии или фрагментов для дальнейшего тканевого метаболизма.
Валовая потребность в белке была определена для нескольких видов рыб (см. Таблицу 1). Имитация цельного яичного протеина в тестовых диетах содержит избыток незаменимых аминокислот. Эти диеты поддерживались приблизительно изокалорийными за счет доведения общего белка и усвояемых углеводных компонентов до фиксированного количества, поскольку лечение белковыми диетами варьировалось в испытанных диапазонах. Испытания на кормлении мальков, сеголетков и годовалых рыб показали, что общие потребности в белке наиболее высоки у начальных кормовых мальков и что они уменьшаются по мере увеличения размера рыбы.Чтобы расти с максимальной скоростью, мальки должны иметь диету, в которой почти половина легкоусвояемых ингредиентов состоит из сбалансированного белка; через 6-8 недель это требование снижается примерно до 40 процентов рациона лосося и форели и примерно до 35 процентов рациона годовалых лососевых, выращенных при стандартной температуре окружающей среды (SET).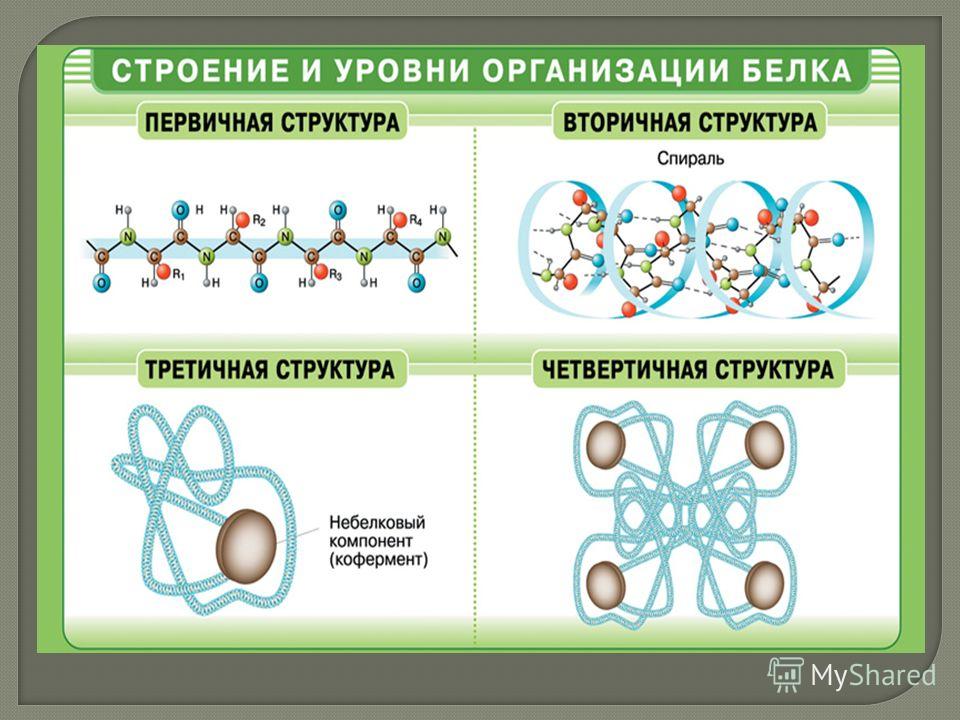 См. Рисунки 1 и 2. Общие потребности в белке молоди сома, по-видимому, меньше, чем у лососевых. Первоначально кормление мальков требует, чтобы около 50 процентов усвояемых компонентов рациона составлял белок, и эта потребность уменьшается с увеличением размера.Некоторые испытания кормления лососем показали прямую связь между изменениями потребности в белке молоди рыбы и изменениями температуры воды. Лосось чавычи в воде с температурой 7 ° C требует около 40 процентов цельного яичного белка для максимального роста; той же рыбе в воде с температурой 15 ° C требуется около 50% белка. Лосось, форель и сом могут использовать больше белка, чем требуется для максимального роста, благодаря эффективному удалению азотистых отходов в виде растворимых соединений аммиака через жаберные ткани непосредственно в водную среду.Эта система удаления азота более эффективна, чем система, доступная для птиц и млекопитающих. Птица и млекопитающие потребляют энергию для синтеза мочевины, мочевой кислоты или других соединений азота, которые выводятся через ткань почек и выводятся с мочой.
См. Рисунки 1 и 2. Общие потребности в белке молоди сома, по-видимому, меньше, чем у лососевых. Первоначально кормление мальков требует, чтобы около 50 процентов усвояемых компонентов рациона составлял белок, и эта потребность уменьшается с увеличением размера.Некоторые испытания кормления лососем показали прямую связь между изменениями потребности в белке молоди рыбы и изменениями температуры воды. Лосось чавычи в воде с температурой 7 ° C требует около 40 процентов цельного яичного белка для максимального роста; той же рыбе в воде с температурой 15 ° C требуется около 50% белка. Лосось, форель и сом могут использовать больше белка, чем требуется для максимального роста, благодаря эффективному удалению азотистых отходов в виде растворимых соединений аммиака через жаберные ткани непосредственно в водную среду.Эта система удаления азота более эффективна, чем система, доступная для птиц и млекопитающих. Птица и млекопитающие потребляют энергию для синтеза мочевины, мочевой кислоты или других соединений азота, которые выводятся через ткань почек и выводятся с мочой. Усвояемые углеводы и жиры сохранят избыток белка в рационе до тех пор, пока удовлетворяется потребность в белке для максимального роста (рисунки 1 и 2).
Усвояемые углеводы и жиры сохранят избыток белка в рационе до тех пор, пока удовлетворяется потребность в белке для максимального роста (рисунки 1 и 2).
Таблица 1 — Расчетная потребность в белке с пищей для некоторых видов рыб 1/
Виды | Уровень сырого протеина в рационе для оптимального роста (г / кг) |
Радужная форель ( Salmo gairdneri ) | 400-460 |
Карп ( Cyprinus carpio ) | 380 |
Чавыча ( Oncorhynchus tshawytscha ) | 400 |
Угорь ( Ангилья японская ) | 445 |
Камбала ( Pleuronectes platessa ) | 500 |
Серый лещ ( Chrysophrys aurata ) | 400 |
Белый амур ( Ctenopharyngodon idella ) | 410-430 |
Brycon sp. | 356 |
Красный морской лещ ( Chrysophrys major ) | 550 |
Желтохвост ( Seriola quinqueradiata ) | 550 |
1/ По материалам C.B. Cowey, 1978
Рис. 1. Потребность в белке чавычи при 47 ° F. Верхняя кривая: исходный индивидуальный средний вес рыбы, 1.5г. Нижняя кривая: исходная индивидуальная средняя масса рыбы 5,6 г.
Рис. 2. Потребность в белке чавычи при температуре 58 ° F. Верхняя кривая: исходная индивидуальная средняя масса рыбы 2,6 г. Нижняя кривая: исходная индивидуальная средняя масса рыбы 5,8 г.
(Оба рисунка адаптированы из: DeLong, D.C., J.E. Halver and E.T. Mertz, 1958, J.Nutr ., 65: 589-99)
Обычно рыбе нужно давать диету, содержащую дифференцированный уровень высококачественного протеина и энергии, а также адекватный баланс незаменимых жирных кислот, витаминов и минералов в течение продолжительного периода времени.Из полученной кривой доза / ответ потребность в белке обычно получают по графику Альмквиста. Считается, что эти различия в очевидной потребности в белке связаны с различиями в методах культивирования и составе рациона.
Относительно высокие уровни пищевого белка, необходимые для максимального роста некоторых рыб, таких как амазон, Ctenopharyngodon idella, и Brycon spp. Удивительны тем, что эти рыбы всеядны. Brycon видоввыращиваются на нежелательных фруктах и другом растительном материале с низким содержанием белка, и в этих условиях, по-видимому, существенный вклад в потребление ими белка вносит естественная пищевая цепь.
Потребность в белке эвриталиновых рыб, таких как радужная форель, Salmo gairdneri, и кижуч, Oncorhynchus кисуч, , выращенных в воде с соленостью 20 ppt, примерно такая же, как потребность в пресной воде. Нет данных о потребности этих видов в белке в морской воде с полной концентрацией.(35 п.
4.1 Essential и заменимые аминокислоты
4.2 Незаменимые Аминокислоты и качество протеина
Аминокислоты являются строительными блоками белков; около 23 аминокислот были выделены из природных белков. Десять из них незаменимы для рыб. Животное не способно синтезировать незаменимые аминокислоты и поэтому должно получать их с пищей.
4.1 Незаменимые и заменимые аминокислоты
Корм для лосося, форели и канального сома, не содержавший аргинина, гистидина, изолейцина, лейцина, лизина, метионина, фенилаланина, треонина, триптофана или валина, не рос (рис.3). Те же самые рыбы, которых кормили рационами, лишенными других L-аминокислот, росли так же, как и рыбы, получавшие все 18 протестированных аминокислот (рис. 4). Азотный компонент в тестируемых диетах состоял из 18 L-аминокислот по образцу, обнаруженному в цельном яичном протеине. Вся тестируемая рыба быстро выздоравливала, когда в рационе была заменена недостающая аминокислота. Наклон кривой роста в группе восстановления был идентичен таковому у рыб, получавших полный тест на аминокислотный рацион.
Заменяемые аминокислоты были протестированы: аланин, аспарагиновая кислота, цистин, глутаминовая кислота, глицин, пролин, серин и тирозин.Было обнаружено, что эти аминокислоты не являются необходимыми для роста лосося, форели и канального сома.
Для количественных исследований требований к 10 незаменимым аминокислотам использовалась смесь казеина и желатина с добавлением кристаллических L-аминокислот. Тестируемая диета содержала 40 процентов цельного яичного белка для азотного компонента. Эксперименты, проведенные с карпом и угрем, показали аналогичное отсутствие роста, когда в рационе отсутствовала незаменимая аминокислота.
Рис. 3. Рост рыб с дефицитом аргинина. Группа с дефицитом была разделена через шесть недель на диете с дефицитом, и недостающая аминокислота была заменена в одной из двух частей.
Рис. 4. Рост цистинодефицитных рыб.
(Оба рисунка взяты из: DeLong, D.C., J.E. Halver and E.T. Mertz, 1958, J.Nutr., 65: 589-99)
4.2 Основные аминокислоты и качество белка
Если известны потребности рыбы в незаменимых аминокислотах, должно быть возможно удовлетворить эти потребности в системах культивирования различными способами за счет различных пищевых белков или комбинаций пищевых белков.
Фенилаланин избавлен от тирозина. Неизвестно, что он химически модифицирован или становится недоступным из-за суровых условий, которым обычно подвергаются кормовые белки во время обработки. Измерение фенилаланина в белках несложно, поэтому обеспечение и оценка фенилаланина в белках в практических диетах не представляет особых трудностей.
Лизин — основная аминокислота. В дополнение к -аминокислотной группе, обычно связанной пептидной связью, она также содержит вторую, -аминогруппу.Эта α-аминогруппа должна быть свободной и реакционной, иначе лизин, хотя и поддается химическому измерению, не будет доступен биологически. Во время обработки белков корма α-аминогруппа лизина может реагировать с небелковыми молекулами, присутствующими в корме, с образованием дополнительных соединений, которые делают лизин биологически недоступным.
Метионин избавлен от цистина. Однако измерить содержание метионина в кормовых белках непросто, поскольку аминокислота подвержена окислению во время обработки.После обработки метионин может присутствовать как таковой, или как сульфоксид, или как сульфон. Сульфоксид может образовываться из метионина во время кислотного гидролиза кормового белка перед измерением его кислотного состава, не содержащего кислоты. Кислотный гидролиз белков перед анализом нарушает исходное равновесие между двумя соединениями, так что состав гидролизата больше не отражает состав белка. При определении содержания метионина в чистых белках окисление аминокислоты до метионинсульфона обычно является количественным.Однако в случае кормовых белков это не покажет, сколько метионина или сульфоксида метионина присутствовало в белке до его окисления и гидролиза.
Сульфоксид метионина может иметь некоторую биологическую ценность для рыб, которые могут иметь некоторую способность обратного преобразования его в метионин и, таким образом, частично восполнять часть метионина, окисленного во время обработки.
Недавно были опубликованы методы измерения метионина в белках с использованием йодоплатинатного реагента до и после восстановления трихлоридом титана, чтобы получить значения как для метионина, так и для сульфоксида в исходном белке.Также был описан способ измерения метионина конкретно по расщеплению цианогенбромида. Оба метода еще предстоит оценить независимо. Микробиологический анализ метионина в белках кормов является ценным инструментом, хотя существует опасность того, что оксиды метионина могут различаться по своей активности в отношении микроорганизмов и искажать значения.
Количественные потребности лососевых в десяти незаменимых аминокислотах были определены путем кормления линейными прибавками по одной аминокислоте за раз в тестируемой диете, содержащей аминокислотный профиль, идентичный цельному яичному белку, за исключением тестируемой аминокислоты.Повторяющиеся группы рыб подвергались диетическому лечению до тех пор, пока не появлялись большие различия в росте исследуемых партий. График реакции роста Альмквиста показывает уровень аминокислот, необходимый для максимального роста в этих конкретных условиях испытания. Рационы были разработаны так, чтобы содержать белок на уровне или немного ниже оптимальной потребности в белке для данного вида и условий испытаний, чтобы гарантировать максимальное использование ограничивающей аминокислоты. Сравнение требований к десяти незаменимым аминокислотам между видами показано в таблице 2.
Недавним нововведением стало использование в тестовых диетах белков, относительно дефицитных по данной незаменимой аминокислоте. Таким образом, комбинации рыбной муки и зеина использовались в тестовых диетах для определения потребности радужной форели в аргинине. Рационы, содержащие различные относительные количества казеина и желатина, показали, что увеличение уровня связанного с белками аргинина с 11 до 17 г / кг привело к значительному увеличению роста канального сома.
Таблица 2 Потребность семи животных в аминокислотах 1/
Аминокислота | Молодь угря | Карп мальки | Канальный сом | Малька чавычи | Цыпленок | Молодой поросенок | Крыса |
Аргинин | 3.9 (1,7 / 42) | 4,3 (1,65 / 38,5) | 6,0 (2,4 / 40) | 6,1 (1,1 / 18) | 1,5 (0,2 / 13) | 1,0 (0,2 / 19) | |
Гистидин | 1,9 (0,8 / 42) | 1,8 (0,7 / 40) | 1,7 (0,3 / 18) | 1.5 (0,2 / 13) | 2,1 (0,4 / 19) | ||
Изолейцин | 3,6 (1,5 / 42) | 2,6 (1,0 / 38,5) | 2,2 (0,9 / 41) | 4,4 (0,8 / 18) | 4,6 (0,6 / 13) | 3,9 (0,5 / 13) | |
лейцин | 4.1 (1,7 / 42) | 3,9 (1,5 / 38,5) | 3,9 (1,6 / 41) | 6,7 (1,2 / 18) | 4,6 (0,6 / 13) | 4,5 (0,9 / 19) | |
Лизин | 4,8 (2,0 / 42) | 5,1 (1,23 / 24,0) | 5,0 (2,0 / 40) | 6.1 (1.1 / 18) | 4,7 (0,65 / 13) | 5,4 (1,0 / 19) | |
метионин 2/ | 4,5 (2,1 / 42) 3/ | 3,1 (1,2 / 38,5) | 2,3 (0,56 / 24,0) | 4,0 (1,6 / 40) 3/ | 4.4 (0,8 / 18) | 3,0 (0,6 / 20) | 3,0 (0,6 / 20) |
Фенилаланин 4/ | 5,1 (2,1 / 41) 5/ | 7,2 (1,3 / 18) | 3.6 (0,45 / 13) | 5,3 (0,9 / 17) | |||
Треонин | 3,6 (1,5 / 42) | 2,2 (0,9 / 40) | 3,3 (0,6 / 18) | 3,0 (0,4 / 13) | 3,1 (0,2 / 19) | ||
Триптофан | 1,0 (0,4 / 42) | 0.5 (0,2 / 40) | 1,1 (0,2 / 18) | 0,8 (0,2 / 25) | 1,0 (0,2 / 19) | ||
Валин | 3,6 (1,5 / 42) | 3,2 (1,3 / 40) | 4,4 (0,8 / 18) | 3,1 (0,4 / 13) | 3,1 (0,4 / 13) |
1/ Выражается в процентах от диетического белка.В скобках числители — это потребности в процентах от сухой диеты, а знаменатели — это процент общего содержания белка в рационе.2/ При отсутствии цистина
3/ Метионин плюс цистин
4/ При отсутствии синуса tyro
5/ Фенилаланин плюс тирозин
(по материалам: Национальный исследовательский совет, 1977 г.)
Потребность радужной форели в аргинине была определена по стандартной кривой доза / реакция (рост), а также путем измерения уровней свободного аргинина в тканях (крови и мышцах) в группах форели, получавших увеличивающееся количество аргинина в рационе.После того, как диетическая потребность форели в аргинине была удовлетворена, любое дальнейшее увеличение потребления аргинина привело к увеличению концентрации свободного аргинина в крови и мышцах. Было получено хорошее согласие между двумя методами.
Данные, представленные в таблице 2, позволяют предположить, что между видами рыб существуют реальные различия в их потребностях в определенных аминокислотах. Это приводит к трудностям при составлении белкового компонента практического рациона для тех видов, потребности которых в аминокислотах еще не известны.Возможное решение — использовать для каждой аминокислоты наивысший уровень, необходимый для любого из тех видов, по которым имеются данные. Необходимость дополнительных количественных данных о потребностях рыб в аминокислотах, особенно тех, которые действительно или потенциально могут быть полезны в качестве сельскохозяйственных животных, очевидна.
Одним из решений использования белков, которые относительно дефицитны по одной или нескольким аминокислотам, является добавление к белку соответствующих количеств аминокислоты, необходимых в практических диетах. Рыба, по-видимому, использует свободные аминокислоты с разной степенью эффективности.
Молодой карп, Cyprinus carpio, оказались неспособными расти на диетах, в которых белковый компонент (казеин, желатин) был заменен смесью аминокислот, аналогичных по общему составу. Гидролизат трипсина казеина также оказался неэффективным. Однако, если диета, содержащая свободные аминокислоты в качестве белкового компонента, тщательно нейтрализуется NaOH до pH 6,5-6,7, то некоторый рост молоди карпа действительно происходит. Этот рост был заметно хуже, чем при сопоставимой казеиновой диете в тех же условиях.
Канальный сом также не может использовать свободные аминокислоты в качестве добавок к дефицитным белкам. При изонитрогенной замене соевого шрота на муку менхадена рост и эффективность корма канального сома существенно снизились. Добавление свободного метионина, цистина или лизина, наиболее ограничивающих аминокислот, к этим заменителям сои не привело к увеличению веса.
Повышение уровня аргинина в рационе сома с 11 до 17 г / кг путем изонитрогенной замены желатина на казеин значительно увеличивало прибавку в весе, но добавление свободного аргинина, цистина, триптофана или метионина к казеину мало влияло на рост или преобразование пищи.
Лососевые могут использовать свободные аминокислоты для роста. Было показано, что зеин-желатиновая диета с добавлением лизина и тритофана заметно превосходит зеин-желатиновую диету для радужной форели, когда в качестве критериев использовались прибавка в весе и использование белка.
Несколько исследователей продемонстрировали возможность дополнения белков с дефицитом аминокислот ограничивающими аминокислотами в рационах лососевых. Казеин с добавлением шести аминокислот давал коэффициенты конверсии корма для атлантического лосося, аналогичные тем, которые были получены при использовании изолированного рыбного белка в качестве источника пищевого белка.Соевый шрот с добавлением пяти или более аминокислот (включая метионин и лизин) был лучшим источником белка для радужной форели по сравнению с одним соевым шротом. Однако однократное добавление метионина и лизина не привело к повышению ценности соевого шрота. Эти результаты предполагают, что аминокислотный спектр выделенного рыбьего белка, который они использовали, может приблизительно соответствовать потребности в аминокислотах радужной форели. Пищевая ценность изолята соевого белка может быть увеличена путем добавления в него первой ограничивающей аминокислоты; я.е., метионин.
Рационы, содержащие в качестве белкового компонента рыбную муку, мясокостную муку, а также дрожжевую и соевую муку, можно улучшить, добавляя цистин (10 г / кг) и триптофан (5 г / кг) вместе. Рыбную муку можно полностью заменить без снижения коэффициента конверсии корма в рационах для радужной форели смесью из субпродуктов домашней птицы и перьевой муки вместе с 17 г лизина HCL / кг, 4,8 г DL-метионина / кг и 1,44 г DL. -триптофан / кг.
Коуи, К.Б. и Дж. Р. Сардженты, 1972 Кормление рыб. Adv. Mar.Biol., 10: 383-492
Cowey, C.B., 1979 Потребности рыб в белках и аминокислотах. В Технология кормления и кормления рыб для рыб, под редакцией Дж. Э. Халвера и К. Тьюса. Материалы Всемирного симпозиума, спонсируемого EIFAC / FAO, ICES и IUNS, Гамбург, 20-23 июня 1978 г. Schr . Bundesforschungsanst . Fisch ., Hamb ., (14/15) vol. 1: 3-16
Мертц, Э.Т., 1972 г. Потребности в белке и аминокислотах. В Питание рыб, под редакцией Дж. Э. Халвера. Нью-Йорк, Academic Press, стр. 106-43.
Национальный исследовательский совет, Подкомитет 1977 года по тепловодным рыбам, Потребности теплопроводных рыб в питательных веществах. Вашингтон, округ Колумбия, Национальная академия наук (потребности домашних животных в питательных веществах) 78 стр.
.

 Химия, 8–9 класс: уроки, тесты, задания.
Химия, 8–9 класс: уроки, тесты, задания.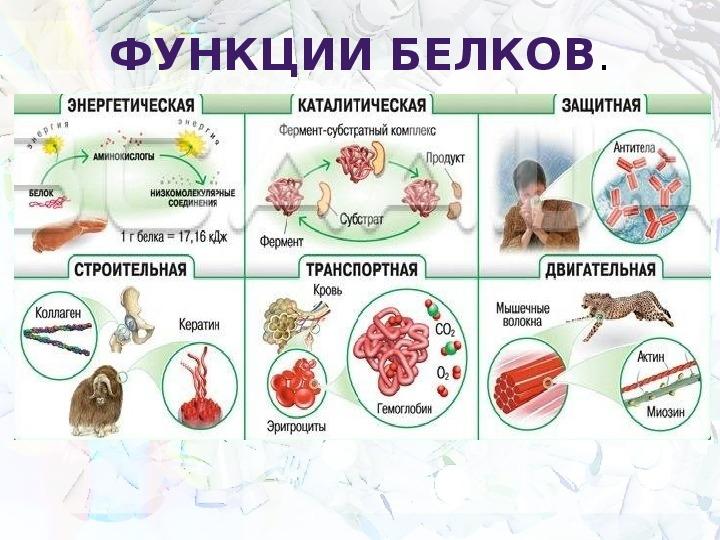 Входят в состав кожи, сухожилий.
Входят в состав кожи, сухожилий.