Уравнения химических реакций: свойства, коэффициенты и схемы
Что такое химические уравнения
Когда химические вещества вступают во взаимодействие, химические связи между их атомами разрушаются и образуются новые, уже в других сочетаниях. В результате одни вещества превращаются в другие.
Рассмотрим реакцию горения метана, происходящую в конфорке газовой плиты:
Молекула метана (CH₄) и две молекулы кислорода (2O₂) вступают в реакцию, образуя молекулу углекислого газа (CO₂) и две молекулы воды (2H₂O). Связи между атомами углерода (С) и водорода (H) в метане, а также между атомами кислорода (O) разрываются, и образуются новые связи между атомами углерода и кислорода в молекуле углекислого газа (CO₂) и между атомами водорода и кислорода в молекуле воды (H₂O).
Картинка даёт наглядное представление о том, что произошло в ходе реакции. Но зарисовывать сложные химические процессы такими схемами неудобно. Вместо этого учёные используют уравнения химических реакций.
Их записывают в виде схемы, в которой отражён процесс превращения. В левой части располагаются формулы реагентов — веществ, вступающих в реакцию. Завершается уравнение продуктами реакции — веществом или веществами, которые получились в результате.
Новые вещества образуются потому, что изменяются связи между атомами, но сами атомы не возникают из ниоткуда и не исчезают в никуда. На рисунке видно, что атом углерода из состава метана перешёл в состав углекислого газа, атом водорода — в состав воды, а атомы кислорода распределились между молекулами углекислого газа и воды. Число атомов не изменилось.
Согласно закону сохранения массы, общая масса реагентов всегда равна общей массе продуктов реакции. Именно поэтому запись химической реакции называют уравнением.
<<Форма демодоступа>>
Виды химических реакций
Вещества вступают в реакции по-разному, можно выделить четыре наиболее частых варианта:
- Соединение.
 Два или несколько реагентов образуют один продукт. В реакцию могут вступать как простые вещества, так и сложные. Например, простые вещества водород и кислород взаимодействуют и образуют сложное — воду:
Два или несколько реагентов образуют один продукт. В реакцию могут вступать как простые вещества, так и сложные. Например, простые вещества водород и кислород взаимодействуют и образуют сложное — воду:
Сложное вещество негашёная известь соединяется с водой, и образуется новое сложное вещество — гашёная известь:
- Разложение. Обратный процесс: одно вещество распадается на несколько более простых. Например, если нагреть известняк, получаются негашёная известь и углекислый газ:
Стрелка вверх означает, что образовался газ. Он улетучивается и больше не участвует в реакции.
- Замещение. В реакции участвуют два вещества — простое и сложное. Если атомы химического элемента в простом веществе более активны, они замещают атомы одного из менее активных химических элементов в составе сложного вещества.
В примере атомы цинка замещают атомы водорода в составе хлороводорода, и образуется хлорид цинка:
- Обмен.
 Два сложных вещества обмениваются составными частями, в результате получаются два новых сложных вещества. В такой реакции обязательно образуется вода, газ или осадок.
Два сложных вещества обмениваются составными частями, в результате получаются два новых сложных вещества. В такой реакции обязательно образуется вода, газ или осадок.
Стрелка вниз означает, что вещество выпало в осадок, поскольку оно нерастворимо.
Коэффициенты в уравнениях химических реакций
Чтобы составить уравнение химической реакции, важно правильно подобрать коэффициенты перед формулами веществ.
Коэффициент в химических уравнениях означает число молекул (формульных единиц) вещества, необходимое для реакции. Он обозначается числом перед формулой (например, 2NaCl в последнем примере).
Коэффициент не следует путать с индексом (числом под символом химического элемента, например, О₂). Индекс обозначает количество атомов этого элемента в молекуле (формульной единице).
Чтобы узнать общее число атомов элемента в формуле, нужно умножить его индекс на коэффициент вещества. В примере на картинке (2H₂O) — четыре атома водорода и два кислорода.
Подобрать коэффициент — значит определить, сколько молекул данного вещества должно участвовать в реакции, чтобы она произошла. Далее мы расскажем, как это сделать.
Алгоритм составления уравнений химических реакций
Для начала составим схему химической реакции. Например, образование оксида магния (MgO) в процессе горения магния (Mg) в кислороде (O₂). Обозначим реагенты и продукт реакции:
Чтобы схема стала уравнением, нужно расставить коэффициенты. В левой части схемы два атома кислорода, а в правой — один. Уравняем их, увеличив число молекул продукта:
Теперь число атомов кислорода до и после реакции одинаковое, а число атомов магния — нет. Чтобы уравнять их, добавим ещё одну молекулу магния. Когда количество атомов каждого из химических элементов в составе веществ уравнено, вместо стрелки можно ставить равно:
Уравнение химической реакции составлено.
Рассмотрим реакцию разложения. Нитрат калия (KNO₃) разлагается на нитрит калия (KNO₂) и кислород (О₂):
В обеих частях схемы по одному атому калия и азота, а атомов кислорода до реакции 3, а после — 4. Необходимо их уравнять.
Необходимо их уравнять.
Для начала удвоим коэффициент перед реагентом:
Теперь в левой части схемы шесть атомов кислорода, два атома калия и два атома азота. В левой по-прежнему по одному атому калия и азота и четыре атома кислорода. Чтобы уравнять их, в правой части схемы нужно удвоить коэффициент перед нитритом калия.
Снова посчитаем число атомов каждого химического элемента в составе веществ до и после реакции: два атома калия, два атома азота и шесть атомов кислорода. Равенство достигнуто.
Химические уравнения не только позволяют предсказать, что произойдёт при взаимодействии тех или иных веществ, но и помогают рассчитать их количественное соотношение, необходимое для реакции.
Учите химию вместе с домашней онлайн-школой «Фоксфорда»! По промокоду CHEMISTRY892021 вы получите бесплатный недельный доступ к курсам химии за 8 класс и 9 класс.
Типы химических уравнений Интерпретация химических уравнений 195.
Рассмотрим следующее полное уравнение: Fe(TB. ) + Си804(водн.) FeSO4 (водн.) + Си(тв.)
) + Си804(водн.) FeSO4 (водн.) + Си(тв.)
Это уравнение описывает всю реакционную систему в целом. Однако рассматриваемую реакцию можно также представить в упрощенном виде при помощи ионного уравнения:
Fe (тв.) + Cu2 + (водн.) = Fe2 + (водн.) + Cu (тв.)
Это уравнение не включает сведений о сульфат-ионах SO2.-, которые не указаны в нем потому, что они не принимают участия в рассматриваемой реакции. Такие ионы называют ионами-наблюдателями.
Реакция между железом и медью (II) является примером окислительно-восстановительных реакций (см. гл. 10). Ее можно условно разделить на две реакции, одна из которых описывает восстановление, а другая-окисление, протекающие одновременно в общей реакции:
Восстановление Cu2+ (водн.) + 2е- = Сu(тв.)
Окисление Fe (тв.) = Fe2 + (водн.) + 2е-
Эти два уравнения называются уравнениями полуреакций. Они особенно часто используются в электрохимии для описания процессов, протекающих на электродах
Интерпретация химических уравнений
Рассмотрим следующее простое стехиометрическое уравнение: h3 (г. ) + Br2 (г.) = 2HBr (г.)
) + Br2 (г.) = 2HBr (г.)
Его можно интерпретировать двумя способами. Во-первых, согласно этому уравнению, один моль молекул водорода h3 реагирует с одним молем молекул брома Br2, образуя два моля молекул бромоводорода HBr. Такое истолкование химического уравнения иногда называют его молярной интерпретацией.
Однако можно истолковать данное уравнение и так, что в результирующей реакции (см. ниже) одна молекула водорода h3 реагирует с одной молекулой брома Br2, образуя две молекулы бромоводорода HBr. Подобное истолкование химического уравнения иногда называют его молекулярной интерпретацией.
И молярная, и молекулярная интерпретации одинаково правомочны. Однако было бы совершенно неправильно заключить на основании уравнения рассматриваемой реакции, что одна молекула водорода h3 сталкивается с одной молекулой брома Br2, образуя две молекулы бромоводорода НВг. Дело в том, что данная реакция, как и большинство других, осуществляется в несколько последовательных стадий. Совокупность всех этих стадий принято называть механизмом реакции (см. гл. 9). В рассматриваемом нами примере реакция включает следующие стадии:
Совокупность всех этих стадий принято называть механизмом реакции (см. гл. 9). В рассматриваемом нами примере реакция включает следующие стадии:
Таким образом, рассматриваемая реакция в действительности представляет собой цепную реакцию, в которой участвуют интермедиаты (промежуточные реагенты), называемые радикалами (см. гл. 9). Механизм рассматриваемой реакции включает еще и другие стадии и побочные реакции. Таким образом, стехиометрическое уравнение указывает только результирующую реакцию. Оно не дает сведений о механизме реакции.
Оглавление:
Уравнения химических реакций | himiyaklas.ru
Химическая реакция – это превращение одних веществ в другие. Если состав вещества мы выражаем с помощью химических формул, то как записывать химическую реакцию?
Для этого придумали уравнения химических реакций.
Исходные вещества, которые вступили в реакцию называются реагентами.
Вещества, образовавшиеся в результате реакции называются продуктами реакции.
Как записывают химическую реакцию? Слева записывают реагенты, справа – продукты, а между ними ставят реакционную стрелку.
реагенты → продукты
Реагенты и продукты записывают в виде химических формул.
Давайте запишем реакцию образования оксида алюминия Al2O3. Какие вещества будут исходными? Конечно же простые вещества: кислород (O2) и алюминий (Al):
Al + O2 → Al2O3
Но это еще не все. Есть такой физический закон: закон сохранения массы. В приложении к химии он звучит: «масса исходных веществ, равна массе продуктов реакции». А в нашей записи уравнения реакции слева один атом алюминия, а справа – два (Al2O3). Значит надо и слева взять два атома алюминия. Когда нам нужно указать, сколько нужно взять молекул вещества, нужно обозначить это числом перед химической формулой молекулы. Это число называется коэффициентом:
2Al + O2 → Al2O3
Теперь непорядок с атомами кислорода. Слева их два (O2), справа три (Al2O3). Непорядок. Мы конечно можем поставить дробный коэффициент:
Слева их два (O2), справа три (Al2O3). Непорядок. Мы конечно можем поставить дробный коэффициент:
2Al + 1,5O2 → Al2O3
Тогда и слева будет три атома кислорода (1,5O2), и справа три (Al2O3). Но, запомните раз и навсегда: коэффициенты могут быть только целыми числами. Чтобы в нашем уравнении коэффициенты стали целыми, их нужно просто удвоить:
Запомните, на экзамене все химические уравнения должны быть уравнены. Не уравненная реакция – не считается реакцией, за нее ставят ноль баллов.
На данном этапе обучения вы уже можете записывать реакции образования бинарных соединений из простых веществ.
Помимо обычной реакционной стрелки, формул реагентов и продуктов, коэффициентов есть еще несколько обозначений, используемых в записи химических уравнений: (приведенные ниже в качестве примера реакции, пока запоминать не нужно: всему свое время):
- Над реакционной стрелкой указываются условия в которых протекает реакция.

Не все реакции идут при нормальных условиях: часто нужно подогреть, повысить давление и пр. Это указывается над реакционной стрелкой в виде следующих обозначений:
- t° – температура
- кат. – реакция идет в присутствии катализатора. Катализатор – это вещество, которое ускоряет химическую реакцию, но не расходуется
- После химической формулы продукта:
- ↑ – выделение газа
- ↓ – выпадение осадка
- Две реакционные стрелки – в сторону продуктов и обратно.
Так обозначают обратимые реакции. Это реакции, которые протекают в данных условиях как в прямом, так и в обратном направлении. Продукт образуется, и одновременно разлагается на исходные вещества:
Химические превращения чрезвычайно разнообразны, поэтому не удивительно, что существует несколько классификаций реакций. С одной из них мы познакомимся сейчас. Опять же, реакции, написанные ниже, приведены в качестве примера, запоминать их пока не нужно.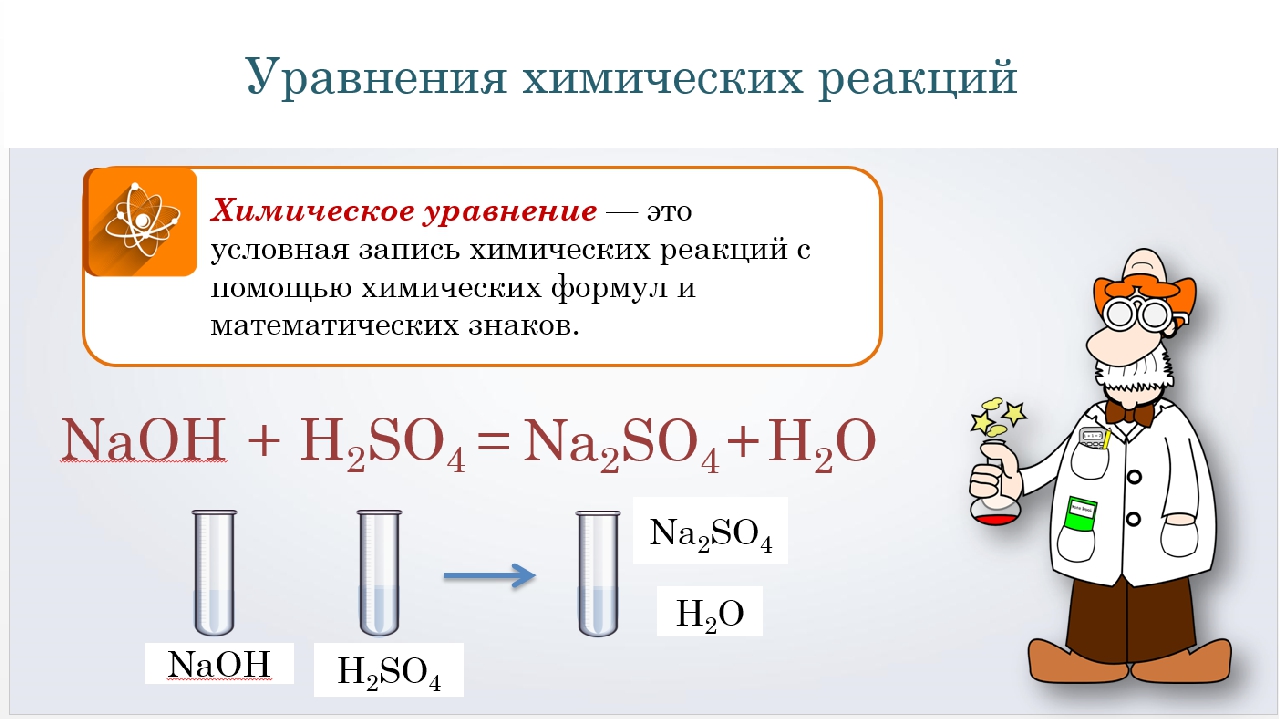 Различают:
Различают:
- Реакции соединения.
В ходе этих реакций из нескольких веществ образуется одно:
- Реакции разложения.
Эти реакции – противоположность реакциям присоединения. Из одного вещества образуется несколько – происходит разложение:
- Реакции замещения.
Простое вещество реагирует со сложными и образуется другое сложное вещество и другое простое вещество:
- Реакции обмена.
Два сложных вещества реагируют друг с другом с образованием новых двух веществ. Молекулы обмениваются своими фрагментами.
Исследователи научили нейросеть принимать во внимание химические уравнения для создания новых лекарств и материалов
Группа ученых из Казанского федерального университета, МГУ, Университета Страсбурга (Франция) и университета Хоккайдо (Япония) объединила методы машинного обучения и химические уравнения. Это нужно для более точного предсказания характеристик молекул, что используется при компьютерном дизайне новых лекарств или материалов. Результаты работы опубликованы в Journal of Chemical Information and Modeling. Исследование является первым результатом проекта в рамках Президентской программы исследовательских проектов Российского научного фонда.
Результаты работы опубликованы в Journal of Chemical Information and Modeling. Исследование является первым результатом проекта в рамках Президентской программы исследовательских проектов Российского научного фонда.
Методы машинного обучения и искусственного интеллекта все шире применяются в дизайне лекарств и материалов, медицинской и технической диагностике. Эти методы способны извлекать закономерности на основе множества данных, а потому могут находить сложные и неочевидные взаимосвязи между переменными. С другой стороны, полученные зависимости, построенные на ограниченной выборке, не всегда выявляют фундаментальные законы природы. В результате страдают точность вычислений и качество предсказания на новых данных. В то же время в химии часто известны физические или эмпирические законы, связывающие те или иные характеристики молекул или реакций.
Интернациональный коллектив ученых из Казани, Москвы, Страсбурга и Хоккайдо предложил способ, который позволяет методам машинного обучения использовать фундаментальные химические законы при предсказании свойств молекул. Исследователи рассмотрели проблему прогнозирования характеристик таутомерного равновесия, то есть способности молекул превращаться из одной формы (таутомера) в другую за счет перехода протона с одного атома на другой. Таутомерия — явление обратимой изомерии, когда несколько веществ имеют одинаковый качественный и количественный состав, но отличаются расположением некоторых групп и связей. Она является одним из важнейших явлений в органической химии. Кроме того, таутомерия — ключевой фактор, влияющий на появление мутаций, а также функционирование нуклеиновых кислот, белков и сахаров. По этой причине важно учитывать таутомерные превращения при регистрации новых соединений, компьютерном дизайне новых лекарств и поиске молекул с заданными свойствами.
Исследователи рассмотрели проблему прогнозирования характеристик таутомерного равновесия, то есть способности молекул превращаться из одной формы (таутомера) в другую за счет перехода протона с одного атома на другой. Таутомерия — явление обратимой изомерии, когда несколько веществ имеют одинаковый качественный и количественный состав, но отличаются расположением некоторых групп и связей. Она является одним из важнейших явлений в органической химии. Кроме того, таутомерия — ключевой фактор, влияющий на появление мутаций, а также функционирование нуклеиновых кислот, белков и сахаров. По этой причине важно учитывать таутомерные превращения при регистрации новых соединений, компьютерном дизайне новых лекарств и поиске молекул с заданными свойствами.
Известно, что характеристики (например, константа таутомерного равновесия) процесса перехода одной таутомерной формы в другую связаны с кислотностью молекул. Соответствующее уравнение, открытое советским химиком М. И. Кабачником, используется почти во всех хемоинформатических инструментах предсказания константы таутомерного равновесия. Ранее авторы статьи показали, что качество таких расчетов достаточно низкое. Проблема применения уравнения заключается в том, что некоторых таутомеров в равновесии очень мало, и определить их кислотность невозможно. Вероятность ошибки при ее предсказании высока, и получаются неверные результаты.
Ранее авторы статьи показали, что качество таких расчетов достаточно низкое. Проблема применения уравнения заключается в том, что некоторых таутомеров в равновесии очень мало, и определить их кислотность невозможно. Вероятность ошибки при ее предсказании высока, и получаются неверные результаты.
«Мы пришли к выводу, что нужно создать модель, которая умела бы принимать во внимание уравнение Кабачника и обучалась одновременно на данных по таутомерии и кислотности», — рассказывает руководитель проекта Тимур Маджидов, кандидат химических наук, старший научный сотрудник Казанского федерального университета.
В работе были рассмотрены два варианта действий. В первом случае использовали множественную линейную регрессию, то есть считали, что зависимость кислотности от структуры можно описать линейным законом. Во втором случае для предсказания кислотности использовали нелинейные уравнения, которые в качестве решения предлагали нейронные сети. Обе модели учатся прогнозировать таутомерию с использованием уравнения Кабачника.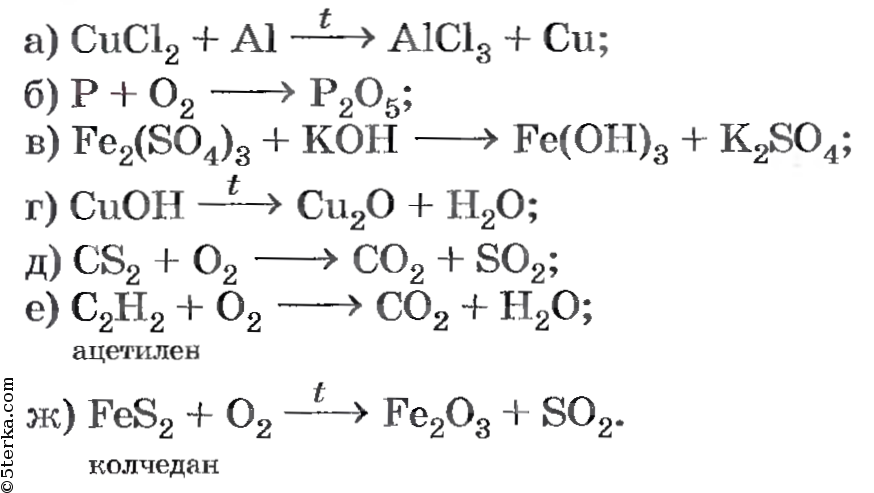 Оказалось, что если обучать модель только на данных по кислотности, то качество предсказания константы таутомерного равновесия хуже, чем при ее предсказании случайным образом. Результаты изменились, когда ученые объединили подходы. Точность получившейся сопряженной модели совпадает с таковой у лучших моделей, способных, однако, предсказывать только одно свойство. Более того, она работает в случае кислотности таутомерных форм, которых в растворе содержится очень мало, и делает это почти так же хорошо, как и для «обычных» молекул.
Оказалось, что если обучать модель только на данных по кислотности, то качество предсказания константы таутомерного равновесия хуже, чем при ее предсказании случайным образом. Результаты изменились, когда ученые объединили подходы. Точность получившейся сопряженной модели совпадает с таковой у лучших моделей, способных, однако, предсказывать только одно свойство. Более того, она работает в случае кислотности таутомерных форм, которых в растворе содержится очень мало, и делает это почти так же хорошо, как и для «обычных» молекул.
Итог исследования — создание вычислительной модели, которая обеспечила более точное нахождение константы кислотности и таутомерии. Авторами была предложена концепция сопряженных моделей QSPR (количественной взаимосвязи структуры и свойств) для одновременного предсказания нескольких функционально связанных характеристик. Подобные модели в будущем позволят осуществлять более точный прогноз физико-химических свойств соединений и параметров химических реакций, а также помогут в поиске новых лекарственных препаратов.
Химические уравнения
На основании закона сохранения массы веществ составляют уравнения химических реакций. Химическое уравнение – условная запись химической реакции с помощью химических формул и знаков.
В левой части уравнения записывают формулы или формулу веществ, которые вступили в химическую реакцию. Их называют исходными веществами, между ними знак «плюс», в правой части уравнения записывают формулы или формулу продуктов реакции, т.е. веществ, которые образуются в результате реакции, между ними тоже ставят знак «плюс», а между левой и правой частью уравнения ставят стрелку.
Химическую
реакцию можно изобразить молекулярным уравнением. Т.е. молекулярное
уравнение – это уравнение, в котором исходные вещества и продукты реакции
записаны в виде молекул. Если в результате реакции образуется осадок, то
возле него справа ставят стрелку, направленную вниз (↓), а если
выделяется газ, то возле него справа ставят стрелку, направленную вверх
(↑).
После записи схемы уравнения находят коэффициенты, т.е. цифры, стоящие перед формулами веществ, чтобы число атомов до и после реакции было одинаковым.
Например,
запишем уравнение реакции водорода с кислородом. Вначале укажем формулы
веществ, вступивших в химическую реакцию – это водород (Н2) и
кислород (О2), между ними ставим знак «плюс», в результате реакции
образуется вода – Н2О. Между веществами левой и правой части ставим
стрелку. Посмотрим, сколько атомов водорода в левой и правой части. Получается
два атома водорода до и после реакции, а кислорода до реакции 2 атома, после
реакции – один атом. Поэтому в правой части уравнения перед формулой воды
ставим коэффициент 2. Но теперь в правой части уравнения стало 4 атома
водорода, а в левой только 2. Чтобы уровнять число атомов водорода, необходимо
в левой части уравнения перед водородом поставить коэффициент 2.
Для правильного подбора коэффициентов в уравнении реакции следует выполнять некоторые условия:
· Перед формулой простого вещества можно записывать дробный коэффициент. Например, в реакции горения бутана:
С4Н10
+ О2 → СО2 + Н2О. Перед формулой СО2 ставим коэффициент 4, т.к. в реакцию вступает 4 атома углерода, перед формулой воды ставим коэффициент 5, т.к. в реакцию вступает 10 атомов водорода. В результате реакции образуется 13 атомов кислорода, а до реакции 2 атома, значит перед формулой кислорода необходимо поставить коэффициент 6,5. А так как, коэффициент показывает не только число атомов, но и молекул, то следует удвоить коэффициент в уравнении. Получается, уравнение будет иметь вид: 2С4Н10 + 13О2 → 8СО2 + 10Н2О.
· Если в схеме реакции есть соль, то сначала уравнивают число ионов, образующих соль. Например, в результате реакции фосфорной кислоты и гидроксида кальция образуется соль – фосфат кальция и вода.
Н3РО4 + Са(ОН)2 → Са3(РО4)2 + Н2О. Эта соль состоит из фосфат-ионов с зарядом 3- и ионов кальция с зарядом 2+. Уравняем их число, записав перед формулой фосфорной кислоты коэффициент 2, а перед формулой гидроксида кальция – коэффициент 3.
·
Если
в схеме реакции есть атомы водорода и кислорода, то сначала уравниваются
атомы водорода, а только потом кислорода. Из предыдущей схемы видно, что в
левой части уравнения 12 атомов водорода, в правой – только 2, значит, перед
формулой воды необходимо поставить коэффициент 6. Подсчитаем число атомов
кислорода. До реакции их 14, после реакции тоже 14. Поэтому можно вместо
стрелки поставить знак равенства.
Поэтому можно вместо
стрелки поставить знак равенства.
·
Если
в схеме реакции имеется несколько формул солей, то начинать уравнивание
следует с ионов, входящих в состав соли, содержащей большее их число.
Например, в реакции нитрата бария и сульфата алюминия образуется две соли –
сульфат бария и нитрат алюминия. Наибольшее число ионов содержит соль – нитрат
алюминия, поэтому сначала нужно уравнять ионы, которыми образована эта соль,
т.е. ионы алюминия и нитрат-ионы. Ba(NO3)2
+ Al2(SO4)3
→ BaSO4
+ Al(NO3)3.
У алюминия заряд 3+, у нитрат-ионов – 1-. Поэтому в левой части уравнения
перед формулой Ba(NO3)2
ставим коэффициент 3. Перед формулой Al2(SO4)3
нужно поставить коэффициент 1, но он не ставится. Уравниваем остальные
ионы. Ионов бария до реакции 3, после реакции 1, поэтому перед формулой BaSO4
ставим коэффициент 3, нитрат-ионов до реакции 6, поэтому в правой части
уравнения перед Al(NO Число атомов алюминия до и после реакции одинаково, т.е.
2. Ионов бария и сульфат-ионов до реакции и после реакции одинаково – по 3.
Число атомов алюминия до и после реакции одинаково, т.е.
2. Ионов бария и сульфат-ионов до реакции и после реакции одинаково – по 3.
·
Если
число атомов какого-то элемента в одной части схемы уравнения четное, а в
другой нечетное, то необходимо перед формулой с нечетным числом атомов
поставить коэффициент 2, а затем уровнять число всех атомов. Например,
расставим коэффициенты в реакции алюминия с кислородом. Al
+ O2 → Al2O3.
В результате реакции образуется оксид алюминия – Al2O3.
Число атомов кислорода до реакции четное, т.е. равно двум, а после реакции
нечетное – 3. Поэтому перед формулой оксида алюминия ставим коэффициент 2. В
результате у нас стало 6 атомов кислорода после реакции, значит, в левой части
уравнения перед формулой кислорода ставим коэффициент 3. Начинаем уравнивать
число атомов алюминия до и после реакции. До реакции 1 атом, после реакции – 4.
Как уравнивать химические уравнения?
Для того, чтобы научится уравнивать химические уравнения, сначала нужно выделять главные моменты и использовать правильный алгоритм.
Ключевые моменты
Выстроить логику процесса несложно. Для этого выделим следующие этапы:
- Определение типа реагентов (все реагенты органические, все реагенты неорганические, органические и неорганические реагенты в одной реакции)
- Определение типа химической реакции (реакция с изменением степеней окисления компонентов или нет)
- Выделение проверочного атома или группы атомов
Примеры
- Все компоненты неорганические, без изменения степени окисления, проверочным атомом будет кислород – О (его не затронули никакие взаимодействия:
NaОН + НCl = NaCl + h3O
Посчитаем количество атомов каждого элементов правой и левой части и убедимся, что здесь не требуется расстановка коэффициентов (по умолчанию отсутствие коэффициента – это коэффициент равный 1)
NaOH + h3SO4 = Na2SO4 + h3O
В данном случае, в правой части уравнения мы видим 2 атома натрия, значит в левой части уравнения нам нужно подставить коэффициент 2 перед соединением, содержащим натрий:
2NaOH + h3SO4 = Na2SO4 + h3O
Проверяем по кислороду — О: в левой части 2О из NaОН и 4 из сульфат иона SO4, а в правой 4 из SO4 и 1 в воде. Добавляем 2 перед водой:
Добавляем 2 перед водой:
2NaOH + h3SO4 = Na2SO4 +2h3O
- Все компоненты органические, без изменения степени окисления:
НООС-СOOH + Ch4OH = Ch4OOC-COOCh4 + h3O (реакция возможна при определенных условиях)
В данном случае мы видим, что в правой части 2 группы атомов Ch4, а в левой только одна. Добавляем в левую часть коэффициент 2 перед Ch4OH, проверяем по кислороду и добавляем 2 перед водой
НООС-СOOH + 2Ch4OH = Ch4OOC-COOCh4 + 2h3O
- Органический и неорганические компоненты без изменения степеней окисления:
Ch4Nh3 + h3SO4 = (Ch4Nh3)2∙SO4
В данной реакции проверочный атом необязателен. В левой части 1 молекула метиламина Ch4Nh3, а в правой 2. Значит нужен коэффициент 2 перед метиламином.
2Ch4Nh3 + h3SO4 = (Ch4Nh3)2∙SO4
- Органический компонент, неорганический, изменение степени окисления.
СuO + C2H5OH = Cu + Ch4COOH + Н2O
В данном случае необходимо составить электронный баланс, а формулы органических веществ лучше преобразовать в брутто. Проверочным атомом будет кислород – по его количеству видно, что коэффициенты не требуются, электронный баланс подтверждает
Проверочным атомом будет кислород – по его количеству видно, что коэффициенты не требуются, электронный баланс подтверждает
CuO + C2H6O = Cu + C2h5O2
Cu+2 +2e = Cu0
2С +2 — 2е = 2С0
C3H8 + O2 = CO2 + h3O
Здесь O не может быть проверочным, так как сам меняет степень окисления. Проверяем по Н.
О2 0 + 2*2 е = 2O-2 (речь идет о кислороде из CO2)
3С (-8/3 ) — 20е = 3С +4 (в органических окислительно-восстановительных реакциях используют условные дробные степени окисления)
Из электронного баланса видно, что для окисления углерода требуется в 5 раз больше кислорода. Ставим 5 перед O2, также из электронного баланса м должны поставить 3 перед С из СО2, проверим по Н, и поставим 4 перед водой
C3H8 + 5O2 = 3CO2 + 4h3O
- Неорганические соединения, изменение степеней окисления.
Na2SO3 + KMnO4 + h3SO4 = Na2SO4 + K2SO4 + Н2О + MnO2
Проверочными будут водороды в воде и кислотные остатки SO4 2- из серной кислоты.
S+4 (из SO3 2-) – 2e = S +6(из Na2SO4)
Mn+7 + 3e = Mn+4
Таким образом нужно поставить 3 перед Na2SO3 и Na2SO4, 2 перед КМnO4 и MNO2.
3Na2SO3 + 2KMnO4 + h3SO4 = 3Na2SO4 + K2SO4 + Н2О +2MnO2
Уравнения химических реакций — Справочник химика 21
Индексы кИ относятся соответственно к конечным и начальным продуктам реакции индексы, —ко всем участникам реакции к. и v —коэффициенты стехиометрического уравнения химической реакции. [c.72]В случае химической реакции закон сохранения массы принимает иную характерную форму ему подчиняются не компоненты, а химические элементы или, возможно, отдельные радикалы. Вместо суммы чисел молей отдельных компонентов неизменной остается сумма чисел атомов отдельных элементов. Этот факт выражается с помощью уравнения химической реакции. Обычная общая форма этого уравнения [c.47]
Сравнивая математические операции, выполняемые при комбинировании уравнений химических реакций, а также и соответствующих величин А 2, можно заметить, что эти операции совершенно идентичны.
 Следовательно, для того чтобы рассчитать свободную энергию какой-либо химической реакции, необходимо подобрать две или большее количество таких химических реакций (с известными значениями А 2), из которых посредством простых арифметических действий можно было бы скомбинировать уравнение интересующей нас химической реакции. [c.117]
Следовательно, для того чтобы рассчитать свободную энергию какой-либо химической реакции, необходимо подобрать две или большее количество таких химических реакций (с известными значениями А 2), из которых посредством простых арифметических действий можно было бы скомбинировать уравнение интересующей нас химической реакции. [c.117]Стехиометрическое уравнение химической реакции показывает, в каких соотношениях вещества вступают во взаимодействие. Однако оказывается, что очень редко реакция протекает по схеме [c.35]
Уравнения химических реакций с указанием теплового эффекта [c.160]
К правой части стехиометрического уравнения химической реакции прибавляют член, показывающий разность между внутренними энергиями (или энтальпиями) исходных веществ и продуктов реакции, т. е. убыль внутренней энергии (энтальпии) системы. Если эта убыль положительна, то при реакции теплота выдел яется, если убыль отрицательна, то теплота поглощается извне. Уравнения, записанные таким образом, называются термохимическими. [c.58]
Уравнения, записанные таким образом, называются термохимическими. [c.58]
Определение посредством комбинирования уравнений химических реакций, для которых Д 2 определена одним из первых двух методов. [c.102]
Определение Д 2 посредством комбинирования уравнений химических реакций [c.116]
Здесь мы познакомим читателя с косвенным методом онределения величины Д2, основанном на комбинировании уравнений химических реакций и их свободных энергий. [c.116]
Напишем теперь уравнения химических реакций образования ацети фена и бензола из элементов в развернутом виде [c.116]
Сложив приведенные выше уравнения химических реакций, получаем [c.118]
Приняв в этом случае, что при дегидрировании х молей циклогексана образуется, в соответствии с уравнением химической реакции, х мо- [c.137]
Возвращаясь к теории Лэнгмюра, отметим, что в большинстве гетерогенных реакций, представляющих интерес, участвуют газообразные реагенты, поэтому дальнейшее обсуждение будет ограничено газовыми реакциями. Процесс хемосорбции может быть представлен как реакция между адсорбатом (О) и активным участком на поверхности (а) и описан уравнением, подобным уравнению химической реакции [c.208]
Процесс хемосорбции может быть представлен как реакция между адсорбатом (О) и активным участком на поверхности (а) и описан уравнением, подобным уравнению химической реакции [c.208]
В уравнении химической реакции каждая формула изображает один моль соответствующего вещества. Поэтому, зная мольные массы участвующих в реакции веществ, молуравнению реакции найти соотношение между массами веществ, вступающих в реакцию н образующихся в результате ее протекания. Если в реакции участвуют вещества в газообразном состоянии, то уравнение реакции позволяет найти их объемные отношения. [c.25]
Для того чтобы получить уравнение закона действия масс, представим уравнение химической реакции в общем виде [c.174]
Здесь следует обратить внимание на важное обстоятельство. Последняя реакция является обратной по отношению к рассматриваемой в примере 2, и выражение для константы равновесия получается обратным к выражению для константы равновесия обратной реакции. Если обратить полное уравнение химической реакции, то следует обратить и выражение для ее константы равновесия, поскольку то, что вначале считалось реагентами, теперь стало продуктами, и наоборот. [c.174]
Если обратить полное уравнение химической реакции, то следует обратить и выражение для ее константы равновесия, поскольку то, что вначале считалось реагентами, теперь стало продуктами, и наоборот. [c.174]
Вот это утверждение уже представляет собой уравнение химической реакции меди с кислородом, приводящей к получению оксида меди(1). Числа, 2 и 4, помещенные перед символами или формулами, называются стехиомет-рическими коэффициентами. Для проверки подсчитаем атомы каждого элемента в обеих частях уравнения [c.107]
Уравнение химической реакции показывает, что для сгорания каждого моля метана требуется два моля газообразного кислорода, т. е. в нашем случае нужно 2 40,6 моль О2, или [c.370]
Теоретическое количество кислорода, как следует из уравнений химических реакций окисления (горения) 1 кг топлива, определяется из следующего выражения [c.93]
Рассмотрим реакцию, в которой вещества А и В при взаимодействии образ уют С. Уравнение химической реакции пе записываем, поскольку ОНО является очень простым. Пусть в любой момент времени в системе заданной массы и объема V при- [c.26]
Уравнение химической реакции пе записываем, поскольку ОНО является очень простым. Пусть в любой момент времени в системе заданной массы и объема V при- [c.26]
Тем не менее, при образовании фосгена дело обстоит совсем не так. В этом случае уравнение химической реакции запишется [c.30]
Стехиометрическое уравнение химической реакции можно записать в общем виде [c.12]
Составить основное уравнение химической реакции. [c.208]
Что означает слово полное в полном уравнении химической реакции Каким образом полное уравнение реакции иллюстрирует закон сохранения массы [c.102]
Ниже приведено полное уравнение химической реакции [c.105]
Химико-технологические расчеты в производстве минеральных удобрении основаны иа балансовых уравнениях химических реакций обменного разложения или окислительпо-восстаповительных гетерогенных некаталитических процессов. В производстве фосфорной кислоты степень разложе1Н1я фосфата серион кислотой характеризуется коэффициентом разложения [c.172]
В производстве фосфорной кислоты степень разложе1Н1я фосфата серион кислотой характеризуется коэффициентом разложения [c.172]
Обратимся теперь к приведенному выше уравнению химической реакции общего вида [c.183]
Таким образом, решение проблемы влияния нарушения функции распределения на скорость элементарного процесса в общем виде требует установления связи между микроскопическими величинами, характеризующими распределение, и макроскопическим коэффициентом скорости, т. е. решения в общем виде системы уравнений (2,103), к которой присоединены уравнения для заселенностей различных квантовых состояний и уравнения химической реакции. [c.96]
Пример У1-3. Использовать уравнение (У1-28) для вывода кинетического уравнения химической реакции, рассмотренной в примере VI- . [c.177]
Закон Гесса позноляет вычислять тепловые эффекты, оперируя с уравнениями химических реакций так же, как и с обычными алгебраическими уравнениями. [c.53]
[c.53]
Ниже приведены вопросы о кислороде во вдыхаемом и выдыхаемом воздухе и о сгорарии глюкозы в организме. На все из них можно ответить, используя гонятия, которые вы уже изучали (моли и молярные соотношения, следуьзщие из уравнений химических реакций). Для иллюстрации рассмотрим, как отвечать на вопросы этого упражнения. [c.369]
Как видно из уравнений химических реакций, для превращения 1 кмоля С в СО2 требуется 1 кмолъ О2 и нри этом получается [c.91]
Важно отметить, что численное значение константы скорости зависит от реагента или продукта, выбранного при определении порядка реакции. Например, если стехиометричеокое уравнение химической реакции имеет вид [c.28]
Через электролитическую ячейку, содержащую расплавленный Zn lj, в течение определенного времени пропускают ток силой 3,0 А. При этом на катоде выделяется 24,5 г металлического Zn. Запишите уравнение химической реакции на катоде. Составьте уравнение реакции, протекающей на аноде. Сколько времени должен продолжаться указанный процесс Какая масса газообразного хлора выделится при этом на аноде [c.61]
Составьте уравнение реакции, протекающей на аноде. Сколько времени должен продолжаться указанный процесс Какая масса газообразного хлора выделится при этом на аноде [c.61]
В химических реакциях должно выполняться правило сохранения алгебраической суммы степеней окисления всех атомов. Именно это правило делает понятие степени окисления столь важным в современной химии. Если в ходе химической реакции степень окисления атома повышается, говорят, что он окисляется, если же степень окисления атома понижается, говорят, что он восстанавливается. В полном уравнении химической реакции окислительные и восстановите. ьные процессы должны точно компенсировать друг друга. [c.417]
3.1: Химические уравнения — Chemistry LibreTexts
Цели обучения
- Для описания химической реакции.
- Для расчета количества соединений, образующихся или потребляемых в химической реакции
Что происходит с материей, когда она претерпевает химические изменения? Закон сохранения массы гласит, что « Атомы не создаются и не разрушаются во время какой-либо химической реакции ». Таким образом, после реакции присутствует тот же набор атомов, что и до реакции.Изменения, происходящие во время реакции, включают только перегруппировку атомов. В этом разделе мы обсудим стехиометрию («измерение элементов»).
Таким образом, после реакции присутствует тот же набор атомов, что и до реакции.Изменения, происходящие во время реакции, включают только перегруппировку атомов. В этом разделе мы обсудим стехиометрию («измерение элементов»).
Химические уравнения
Как показано на рисунке \ (\ PageIndex {1} \), приложение небольшого количества тепла к груде оранжевого порошка дихромата аммония приводит к бурной реакции, известной как вулкан дихромата аммония. Тепло, свет и газ образуются в виде большой кучи пушистого зеленого оксида хрома (III).Эта реакция описывается химическим уравнением, выражением, которое определяет идентичность и количество веществ в химической реакции.
Рисунок \ (\ PageIndex {1} \): Вулкан из дихромата аммония: изменение во время химической реакции. Исходный материал — твердый дихромат аммония. Химическая реакция превращает его в твердый оксид хрома (III), изображенный с изображением части его цепочечной структуры, газообразного азота и водяного пара (кроме того, выделяется энергия в виде тепла и света). В ходе реакции распределение атомов меняется, но количество атомов каждого элемента не меняется. Поскольку номера каждого типа атомов в реагентах и продуктах одинаковы, химическое уравнение сбалансировано. (CC BY-SA 3.0; Микк Михкель Ваабель через Википедию). Смотрите видео здесь: www.youtube.com/watch?v=CW4hN0dYnkM
В ходе реакции распределение атомов меняется, но количество атомов каждого элемента не меняется. Поскольку номера каждого типа атомов в реагентах и продуктах одинаковы, химическое уравнение сбалансировано. (CC BY-SA 3.0; Микк Михкель Ваабель через Википедию). Смотрите видео здесь: www.youtube.com/watch?v=CW4hN0dYnkMХимические реакции представлены на бумаге химическими уравнениями . Например, газообразный водород (H 2 ) может реагировать (гореть) с газообразным кислородом (O 2 ) с образованием воды (H 2 O).Химическое уравнение для этой реакции записывается как:
\ [\ ce {2H_2 + O_2 \ rightarrow 2H_2O} \]
Химические формулы и другие символы используются для обозначения исходных материалов или реагентов, которые по соглашению записываются в левой части уравнения, и конечных соединений или продуктов, которые записываются справа. Стрелка указывает от реагента к продуктам. Химическая реакция вулкана из дихромата аммония на рисунке \ (\ PageIndex {1} \) составляет
\ [\ underbrace {\ ce {(NH_4) _2Cr_2O_7}} _ {реагент} \ rightarrow \ underbrace {\ ce {Cr_2O_3 + N_2 + 4H_2O}} _ {продукты} \ label {3. 1.1} \]
1.1} \]
Стрелка читается как «уступает» или «реагирует на форму». Уравнение \ (\ ref {3.1.1} \) указывает, что дихромат аммония (реагент) дает оксид хрома (III), азот и воду (продукты). Уравнение этой реакции еще более информативно, если записать его так:
\ [\ ce {(Nh5) 2Cr2O7 (s) \ rightarrow Cr2O3 (s) + N2 (g) + 4h3O (g)} \ label {3.1.2} \]
Уравнение \ (\ ref {3.1.2} \) идентично уравнению \ (\ ref {3.1.1} \), за исключением добавления сокращений в скобках для обозначения физического состояния каждого вида.Сокращения: (s) для твердого вещества, (l) для жидкости, (g) для газа и (aq) для водного раствора, раствора вещества в воде.
В соответствии с законом сохранения массы, номера каждого типа атомов одинаковы по обе стороны от уравнений \ (\ ref {3.1.1} \) и \ (\ ref {3.1.2} \). На каждой стороне реакции есть два атома хрома, семь атомов кислорода, два атома азота и восемь атомов водорода.
В сбалансированном химическом уравнении номера каждого типа атомов и общий заряд одинаковы с обеих сторон. Уравнения \ (\ ref {3.1.1} \) и \ (\ ref {3.1.2} \) являются сбалансированными химическими уравнениями. С каждой стороны уравнения различается то, как атомы расположены, чтобы образовывать молекулы или ионы. Химическая реакция представляет собой изменение распределения атомов, но не количества атомов. В этой реакции, как и в большинстве химических реакций, разрываются связи в реагентах (здесь связи Cr – O и N – H), и образуются новые связи для создания продуктов (здесь связи O – H и N≡N). . Если числа каждого типа атомов различны по обе стороны химического уравнения, то уравнение неуравновешено и не может правильно описать, что происходит во время реакции.Чтобы продолжить, сначала необходимо сбалансировать уравнение.
Уравнения \ (\ ref {3.1.1} \) и \ (\ ref {3.1.2} \) являются сбалансированными химическими уравнениями. С каждой стороны уравнения различается то, как атомы расположены, чтобы образовывать молекулы или ионы. Химическая реакция представляет собой изменение распределения атомов, но не количества атомов. В этой реакции, как и в большинстве химических реакций, разрываются связи в реагентах (здесь связи Cr – O и N – H), и образуются новые связи для создания продуктов (здесь связи O – H и N≡N). . Если числа каждого типа атомов различны по обе стороны химического уравнения, то уравнение неуравновешено и не может правильно описать, что происходит во время реакции.Чтобы продолжить, сначала необходимо сбалансировать уравнение.
Химическая реакция изменяет только распределение атомов, но не их количество.
Введение в уравнения химических реакций: https://youtu.be/5mjawuf7K2Q
Уравновешивание простых химических уравнений
Когда химик сталкивается с новой реакцией, на ней обычно нет этикетки, которая показывает сбалансированное химическое уравнение.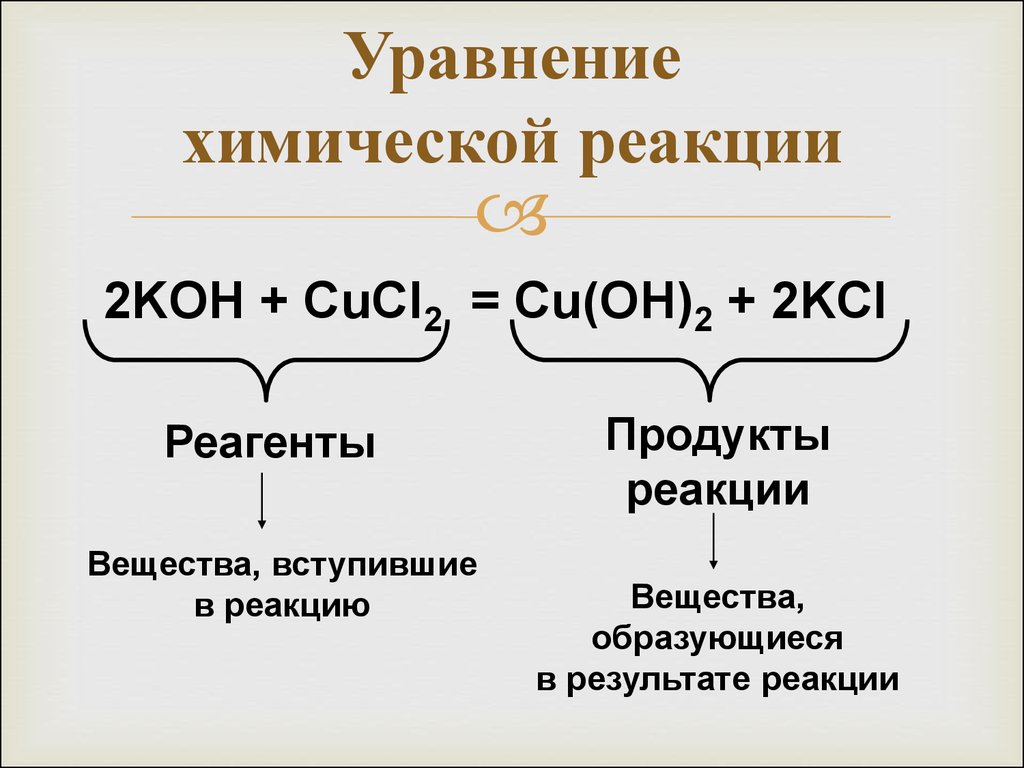 Вместо этого химик должен идентифицировать реагенты и продукты, а затем записать их в форме химического уравнения, которое может быть сбалансировано, а может и не быть сбалансировано, как было написано вначале.Рассмотрим, например, сгорание н-гептана (\ (C_7H_ {16} \)), важного компонента бензина:
Вместо этого химик должен идентифицировать реагенты и продукты, а затем записать их в форме химического уравнения, которое может быть сбалансировано, а может и не быть сбалансировано, как было написано вначале.Рассмотрим, например, сгорание н-гептана (\ (C_7H_ {16} \)), важного компонента бензина:
\ [\ ce {C_7H_ {16} (l) + O_2 (g) \ rightarrow CO_2 (g) + H_2O (g)} \ label {3.1.3} \]
При полном сгорании любого углеводорода при достаточном количестве кислорода всегда образуется диоксид углерода и вода.
Рисунок \ (\ PageIndex {2} \): Пример реакции горения. Воск в свече представляет собой высокомолекулярный углеводород, который в реакции горения выделяет газообразный диоксид углерода и водяной пар (Уравнение \ (\ ref {3.1.3} \)). Уравнение \ (\ ref {3.1.3} \) не сбалансировано: номера каждого типа атомов на стороне реагента уравнения (7 атомов углерода, 16 атомов водорода и 2 атома кислорода) не совпадают с номера каждого типа атомов на стороне продукта (1 атом углерода, 2 атома водорода и 3 атома кислорода). Следовательно, коэффициенты реагентов и продуктов должны быть скорректированы, чтобы получить одинаковое количество атомов каждого типа по обеим сторонам уравнения. Поскольку идентичности реагентов и продуктов фиксированы, уравнение не может быть сбалансировано путем изменения индексов реагентов или продуктов.Это изменит химическую идентичность описываемых видов, как показано на рисунке \ (\ PageIndex {3} \).
Следовательно, коэффициенты реагентов и продуктов должны быть скорректированы, чтобы получить одинаковое количество атомов каждого типа по обеим сторонам уравнения. Поскольку идентичности реагентов и продуктов фиксированы, уравнение не может быть сбалансировано путем изменения индексов реагентов или продуктов.Это изменит химическую идентичность описываемых видов, как показано на рисунке \ (\ PageIndex {3} \).

Балансировка реакций горения: https://youtu.be/yE3bHIEslJc
Самый простой и наиболее полезный метод уравновешивания химических уравнений — это «проверка», более известная как метод проб и ошибок. Ниже приводится эффективный подход к уравновешиванию химического уравнения с использованием этого метода.
Шаги по уравновешиванию химического уравнения
- Определите наиболее сложное вещество.
- Начиная с этого вещества, выберите элемент, который присутствует только в одном реагенте и одном продукте, если это возможно. Отрегулируйте коэффициенты, чтобы получить одинаковое количество атомов этого элемента с обеих сторон.
- Уравновешивает многоатомные ионы (если есть) как единое целое.
- Уравновесить оставшиеся атомы, обычно заканчивая наименее сложным веществом и при необходимости используя дробные коэффициенты.Если использовался дробный коэффициент, умножьте обе части уравнения на знаменатель, чтобы получить целые числа для коэффициентов.

- Проверьте свою работу, подсчитав количество атомов каждого сорта в обеих частях уравнения, чтобы убедиться, что химическое уравнение сбалансировано.
Пример \ (\ PageIndex {1A} \): сжигание гептана
Чтобы продемонстрировать этот подход, давайте воспользуемся сгоранием н-гептана (Уравнение \ (\ ref {3.1.3} \)) в качестве примера.
- Определить наиболее сложное вещество . Самая сложная субстанция — это вещество с наибольшим числом различных атомов, то есть \ (\ ce {C_7H_ {16}} \). Сначала предположим, что окончательное сбалансированное химическое уравнение содержит 1 молекулу или формульную единицу этого вещества.
- Настройте коэффициенты . Попробуйте отрегулировать коэффициенты молекул на другой стороне уравнения, чтобы получить одинаковое количество атомов с обеих сторон.Поскольку одна молекула н-гептана содержит 7 атомов углерода, нам нужно 7 молекул CO 2 , каждая из которых содержит 1 атом углерода, с правой стороны:
\ [\ ce {C_7H_ {16} + O_2 \ rightarrow 7CO_2 + H_2O} \ label {3. 1.4} \]
1.4} \]
- Баланс многоатомных ионов как единое целое . В этой реакции не рассматриваются многоатомные ионы.
- Уравновесить остальные атомы . Поскольку одна молекула н-гептана содержит 16 атомов водорода, нам нужно 8 молекул h3O, каждая из которых содержит 2 атома водорода, справа: \ [\ ce {C_7H_ {16} + O_2 \ rightarrow 7CO_2 + 8H_2O} \ label {3.1.5} \] Атомы углерода и водорода теперь уравновешены, но у нас есть 22 атома кислорода справа и только 2 атома кислорода слева. Мы можем сбалансировать атомы кислорода, регулируя коэффициент перед наименее сложным веществом, O 2 , на стороне реагента: \ [\ ce {C_7H_ {16} (l) + 11O_2 (g) \ rightarrow 7CO_2 (g ) + 8H_2O (г)} \ label {3.1.6} \]
- Проверь свою работу . Уравнение теперь сбалансировано, и дробных коэффициентов нет: с каждой стороны по 7 атомов углерода, 16 атомов водорода и 22 атома кислорода.Всегда проверяйте, сбалансировано ли химическое уравнение.
 Предположение, что окончательное сбалансированное химическое уравнение содержит только одну молекулу или формульную единицу самого сложного вещества, не всегда верно, но это хорошее место для начала.
Предположение, что окончательное сбалансированное химическое уравнение содержит только одну молекулу или формульную единицу самого сложного вещества, не всегда верно, но это хорошее место для начала.
Пример \ (\ PageIndex {1B} \): сжигание изооктана
Рассмотрим, например, аналогичную реакцию, горение изооктана (\ (\ ce {C8h28} \)). Поскольку при сгорании любого углеводорода с кислородом образуется диоксид углерода и вода, несбалансированное химическое уравнение выглядит следующим образом:
\ [\ ce {C_8H_ {18} (l) + O_2 (g) \ rightarrow CO_2 (g) + H_2O (g)} \ label {3.1.7} \]
- Определить наиболее сложное вещество . Начните процесс балансировки, предположив, что окончательное сбалансированное химическое уравнение содержит одну молекулу изооктана.
- Настройте коэффициенты . Первый элемент, который появляется в реагентах только один раз, — это углерод: 8 атомов углерода в изооктане означает, что в продуктах должно быть 8 молекул CO 2 : \ [\ ce {C_8H_ {18} + O_2 \ rightarrow 8CO_2 + H_2O} \ label {3.
 1.8} \]
1.8} \] - Баланс многоатомных ионов как единое целое .Этот шаг не применяется к этому уравнению.
- Уравновесить остальные атомы . Восемнадцать атомов водорода в изооктане означает, что в продуктах должно быть 9 молекул H 2 O: \ [\ ce {C_8H_ {18} + O_2 \ rightarrow 8CO_2 + 9H_2O} \ label {3.1.9} \] Углерод и атомы водорода теперь уравновешены, но у нас есть 25 атомов кислорода справа и только 2 атома кислорода слева. Мы можем сбалансировать наименее сложное вещество, O 2 , но поскольку на молекулу O 2 приходится 2 атома кислорода, мы должны использовать дробный коэффициент (25/2), чтобы сбалансировать атомы кислорода: \ [\ ce {C_8H_ {18} + 25/2 O_2 \ rightarrow 8CO_2 + 9H_2O} \ label {3.1.10} \] Уравнение \ (\ ref {3.1.10} \) теперь сбалансировано, но мы обычно пишем уравнения с целочисленными коэффициентами. Мы можем исключить дробный коэффициент, умножив все коэффициенты с обеих сторон химического уравнения на 2: \ [\ ce {2C_8H_ {18} (l) + 25O_2 (g) \ rightarrow 16CO_2 (g) + 18H_2O (g)} \ этикетка {3.
 11} \]
11} \] - Проверь свою работу . Сбалансированное химическое уравнение имеет 16 атомов углерода, 36 атомов водорода и 50 атомов кислорода с каждой стороны.
Балансировка сложных химических уравнений: https: // youtu.be / 7Jzb9XAHOJw
Балансировка уравнений требует от вас некоторой практики, а также некоторого здравого смысла. Если вы обнаружите, что используете очень большие коэффициенты или безуспешно потратили несколько минут, вернитесь и убедитесь, что вы правильно написали формулы реагентов и продуктов.
Пример \ (\ PageIndex {1C} \): Гидроксиапатит
Реакция минерального гидроксиапатита (\ (\ ce {Ca5 (PO4) 3 (OH)} \)) с фосфорной кислотой и водой дает \ (\ ce {Ca (h3PO4) 2 • h3O} \) (дигидрофосфат кальция моногидрат).Напишите и сбалансируйте уравнение этой реакции.
Гидроксиапатит (\ (\ ce (Ca5 (PO4) 3 (OH)} \)) кристаллДано : реагенты и продукт
На вопрос : вычисленное химическое уравнение
Стратегия :
- Определите продукт и реагенты, а затем напишите несбалансированное химическое уравнение.

- Следуйте инструкциям по уравновешиванию химического уравнения.
Решение :
A Сначала мы должны идентифицировать продукт и реагенты и написать уравнение реакции.В задаче приведены формулы для гидроксиапатита и моногидрата дигидрофосфата кальция (напомним, что фосфорная кислота — это H 3 PO 4 ). Исходное (несбалансированное) уравнение выглядит следующим образом:
\ [\ ce {Ca5 (PO4) 3 (OH) (s) + H_3PO4 (вод.) + H_2O _ {(l)} \ rightarrow Ca (H_2PO_4) _2 \ cdot H_2O _ {(s)}} \]
1. B Определите наиболее сложное вещество . Мы начнем с предположения, что только одна молекула или формульная единица наиболее сложного вещества, \ (\ ce {Ca5 (PO4) 3 (OH)} \), появляется в сбалансированном химическом уравнении.
2. Настройте коэффициенты . Поскольку кальций присутствует только в одном реагенте и одном продукте, мы начнем с него. Одна формульная единица \ (\ ce {Ca5 (PO4) 3 (OH)} \) содержит 5 атомов кальция, поэтому нам нужно 5 Ca (H 2 PO 4 ) 2 • H 2 O на правая сторона:
\ [\ ce {Ca5 (PO4) 3 (OH) + h4PO4 + h3O \ rightarrow 5Ca (h3PO4) 2 \ cdot h3O} \]
3. Уравновесить многоатомные ионы как единое целое . Обычно легче сбалансировать уравнение, если мы признаем, что определенные комбинации атомов встречаются с обеих сторон.В этом уравнении многоатомный фосфат-ион (PO 4 3 — ) появляется в трех местах. В H 3 PO 4 ион фосфата объединяется с тремя ионами H + с образованием фосфорной кислоты (H 3 PO 4 ), тогда как в Ca (H 2 PO 4 ) 2 • H 2 O он объединяется с двумя ионами H + с образованием дигидрофосфатного иона. Таким образом, легче сбалансировать PO 4 как единицу, чем считать отдельные атомы фосфора и кислорода.На правой стороне 10 штук PO 4 , а на левой — всего 4. Самый простой способ уравновесить единицы PO 4 — поставить коэффициент 7 перед H 3 PO 4 :
Уравновесить многоатомные ионы как единое целое . Обычно легче сбалансировать уравнение, если мы признаем, что определенные комбинации атомов встречаются с обеих сторон.В этом уравнении многоатомный фосфат-ион (PO 4 3 — ) появляется в трех местах. В H 3 PO 4 ион фосфата объединяется с тремя ионами H + с образованием фосфорной кислоты (H 3 PO 4 ), тогда как в Ca (H 2 PO 4 ) 2 • H 2 O он объединяется с двумя ионами H + с образованием дигидрофосфатного иона. Таким образом, легче сбалансировать PO 4 как единицу, чем считать отдельные атомы фосфора и кислорода.На правой стороне 10 штук PO 4 , а на левой — всего 4. Самый простой способ уравновесить единицы PO 4 — поставить коэффициент 7 перед H 3 PO 4 :
\ [\ ce {Ca_5 (PO_4) _3 (OH) + 7H_3PO_4 + H_2O \ rightarrow 5Ca (H_2PO_4) _2 \ cdot H_2O} \]
Хотя OH — также является многоатомным ионом, он не появляется с обеих сторон уравнения. Таким образом, кислород и водород необходимо уравновешивать отдельно.
Таким образом, кислород и водород необходимо уравновешивать отдельно.
4. Уравновесить оставшиеся атомы .Теперь у нас 30 атомов водорода справа и только 24 слева. Мы можем уравновесить атомы водорода, используя наименее сложное вещество, H 2 O, поместив коэффициент 4 перед H 2 O с левой стороны, что в сумме даст 4 H 2 O молекул:
\ [\ ce {Ca_5 (PO_4) _3 (OH) (s) + 7H_3PO_4 (aq) + 4H_2O (l) \ rightarrow 5Ca (H_2PO_4) _2 \ cdot H_2O (s)} \]
Теперь уравнение сбалансировано. Несмотря на то, что мы явно не сбалансировали атомы кислорода, на каждой стороне находится 41 атом кислорода.
5. Проверь свою работу . Обе части уравнения содержат 5 атомов кальция, 10 атомов фосфора, 30 атомов водорода и 41 атом кислорода.
Упражнение \ (\ PageIndex {1} \): Ферментация
Ферментация — это биохимический процесс, который позволяет дрожжевым клеткам жить в отсутствие кислорода. Люди веками использовали его для производства вина и пива, а также для выращивания хлеба. При ферментации сахара, такие как глюкоза, превращаются в этанол (\ (CH_3CH_2OH \) и диоксид углерода \ (CO_2 \).Напишите сбалансированную химическую реакцию ферментации глюкозы.
Люди веками использовали его для производства вина и пива, а также для выращивания хлеба. При ферментации сахара, такие как глюкоза, превращаются в этанол (\ (CH_3CH_2OH \) и диоксид углерода \ (CO_2 \).Напишите сбалансированную химическую реакцию ферментации глюкозы.
Коммерческое использование ферментации . (а) Чаны для пивоварен используются для приготовления пива. (б) Ферментация глюкозы дрожжевыми клетками — это реакция, которая делает возможным производство пива.
- Ответ
\ [C_6H_ {12} O_6 (s) \ rightarrow 2C_2H_5OH (l) + 2CO_2 (g) \ nonumber \]
Уравновешивающие реакции, содержащие многоатомные частицы: https: // youtu.be / i0ORKYt90Z0
Интерпретация химических уравнений
Помимо предоставления качественной информации об идентичности и физическом состоянии реагентов и продуктов, сбалансированное химическое уравнение предоставляет количественную информацию. В частности, он дает относительные количества реагентов и продуктов, потребляемых или производимых в реакции. Число атомов, молекул или формульных единиц реагента или продукта в сбалансированном химическом уравнении является коэффициентом этого вещества (например,g., 4 предшествующих H 2 O в уравнении \ (\ ref {3.1.1} \)). Если перед видом не указан коэффициент, предполагается, что коэффициент равен 1. Как показано на рисунке \ (\ PageIndex {4} \), коэффициенты позволяют использовать уравнение \ (\ ref {3.1.1} \). интерпретируется любым из следующих способов:
В частности, он дает относительные количества реагентов и продуктов, потребляемых или производимых в реакции. Число атомов, молекул или формульных единиц реагента или продукта в сбалансированном химическом уравнении является коэффициентом этого вещества (например,g., 4 предшествующих H 2 O в уравнении \ (\ ref {3.1.1} \)). Если перед видом не указан коэффициент, предполагается, что коэффициент равен 1. Как показано на рисунке \ (\ PageIndex {4} \), коэффициенты позволяют использовать уравнение \ (\ ref {3.1.1} \). интерпретируется любым из следующих способов:
- Два иона NH 4 + и один Cr 2 O 7 2 — Выход иона 1 формульная единица Cr 2 O 3 , 1 молекула N 2 и 4 H 2 молекул O.
- Один моль (NH 4 ) 2 Cr 2 O 7 дает 1 моль Cr 2 O 3 , 1 моль N 2 и 4 моль H 2 О.

- Масса 252 г (NH 4 ) 2 Cr 2 O 7 дает 152 г Cr 2 O 3 , 28 г N 2 и 72 г H 2 О.
- Всего 6,022 × 10 23 формульных единиц (NH 4 ) 2 Cr 2 O 7 дает 6.022 × 10 23 формульных единиц Cr 2 O 3 , 6.022 × 10 23 молекул N 2 и 24.09 × 10 23 молекул H 2 O.
Все это химически эквивалентные способы выражения информации, содержащейся в сбалансированном химическом уравнении, с использованием понятий моля, молярной или формульной массы и числа Авогадро.Отношение количества молей одного вещества к количеству молей другого называется мольным соотношением. Например, мольное отношение \ (H_2O \) к \ (N_2 \) в уравнении \ (\ ref {3.1.1} \) составляет 4: 1. Общая масса реагентов равна общей массе продуктов, как предсказывает закон сохранения массы Дальтона:
Например, мольное отношение \ (H_2O \) к \ (N_2 \) в уравнении \ (\ ref {3.1.1} \) составляет 4: 1. Общая масса реагентов равна общей массе продуктов, как предсказывает закон сохранения массы Дальтона:
\ [252 \; г \; \ текст {из} \; \ ce {(NH_4) _2Cr_2O_7} \]
выход
\ [152 + 28 + 72 = 252 \; г \; \ text {продуктов.} \]
Химическое уравнение, однако, не показывает скорость реакции (быстро, медленно или совсем) или выделяется ли энергия в виде тепла или света. Эти вопросы более подробно рассматриваются в следующих главах.
Важная химическая реакция была проанализирована Антуаном Лавуазье, французским химиком 18 века, который интересовался химией живых организмов, а также простыми химическими системами. В классической серии экспериментов он измерил углекислый газ и тепло, выделяемое морской свинкой во время дыхания, в котором органические соединения используются в качестве топлива для производства энергии, углекислого газа и воды. Лавуазье обнаружил, что отношение выделяемого тепла к выдыхаемому углекислому газу было аналогично соотношению, наблюдаемому при реакции древесного угля с кислородом воздуха с образованием углекислого газа — процесс, который химики называют горением. Основываясь на этих экспериментах, он предположил, что «Дыхание — это горение, правда, медленное, но в остальном оно совершенно похоже на горение древесного угля». Лавуазье был прав, хотя органические соединения, потребляемые при дыхании, существенно отличаются от тех, что содержатся в древесном угле.Одним из важнейших видов топлива в организме человека является глюкоза (\ (C_6H_ {12} O_6 \)), которая фактически является единственным топливом, используемым в мозгу. Таким образом, горение и дыхание являются примерами химических реакций.
Лавуазье обнаружил, что отношение выделяемого тепла к выдыхаемому углекислому газу было аналогично соотношению, наблюдаемому при реакции древесного угля с кислородом воздуха с образованием углекислого газа — процесс, который химики называют горением. Основываясь на этих экспериментах, он предположил, что «Дыхание — это горение, правда, медленное, но в остальном оно совершенно похоже на горение древесного угля». Лавуазье был прав, хотя органические соединения, потребляемые при дыхании, существенно отличаются от тех, что содержатся в древесном угле.Одним из важнейших видов топлива в организме человека является глюкоза (\ (C_6H_ {12} O_6 \)), которая фактически является единственным топливом, используемым в мозгу. Таким образом, горение и дыхание являются примерами химических реакций.
Пример \ (\ PageIndex {2} \): Горение глюкозы
Сбалансированное химическое уравнение горения глюкозы в лаборатории (или в мозге) выглядит следующим образом:
\ [\ ce {C_6H_ {12} O6 (s) + 6O2 (g) \ rightarrow 6CO2 (g) + 6h3O (l)} \]
Постройте таблицу, показывающую, как интерпретировать информацию в этом уравнении в терминах
- одиночная молекула глюкозы.

- моль реактивов и продуктов.
- грамм реагентов и продуктов представлены 1 моль глюкозы.
- чисел молекул реагентов и продуктов, представленных 1 моль глюкозы.
Дано : вычисленное химическое уравнение
Запрошено : отношения молекул, молей и масс
Стратегия :
- Используйте коэффициенты из сбалансированного химического уравнения, чтобы определить как молекулярные, так и мольные отношения.
- Используйте молярные массы реагентов и продуктов для перевода из молей в граммы.
- Используйте число Авогадро, чтобы преобразовать моль в количество молекул.
Решение :
Это уравнение сбалансировано, как написано: каждая сторона имеет 6 атомов углерода, 18 атомов кислорода и 12 атомов водорода. Таким образом, мы можем использовать коэффициенты напрямую, чтобы получить желаемую информацию.
Таким образом, мы можем использовать коэффициенты напрямую, чтобы получить желаемую информацию.
- Одна молекула глюкозы реагирует с 6 молекулами O 2 с образованием 6 молекул CO 2 и 6 молекул H 2 O.
- Один моль глюкозы реагирует с 6 моль O 2 с образованием 6 моль CO 2 и 6 моль H 2 O.
- Чтобы интерпретировать уравнение в терминах масс реагентов и продуктов, нам нужны их молярные массы и мольные отношения из части b. Молярные массы в граммах на моль следующие: глюкоза 180,16; О 2 , 31,9988; CO 2 , 44,010; и H 2 O, 18.015.
\ [\ begin {align *} \ text {масса реагентов} & = \ text {масса продуктов} \\ [4pt] g \, глюкоза + g \, O_2 & = g \, CO_2 + g \, H_2O \ end {align *} \]
\ [1 \, моль \, глюкоза \ влево ({180.16 \, g \ over 1 \, mol \, глюкоза} \ right) + 6 \, mol \, O_2 \ left ({31.9988 \, g \ over 1 \, mol \, O_2} \ right) \]
\ [= 6 \, моль \, CO_2 \ left ({44.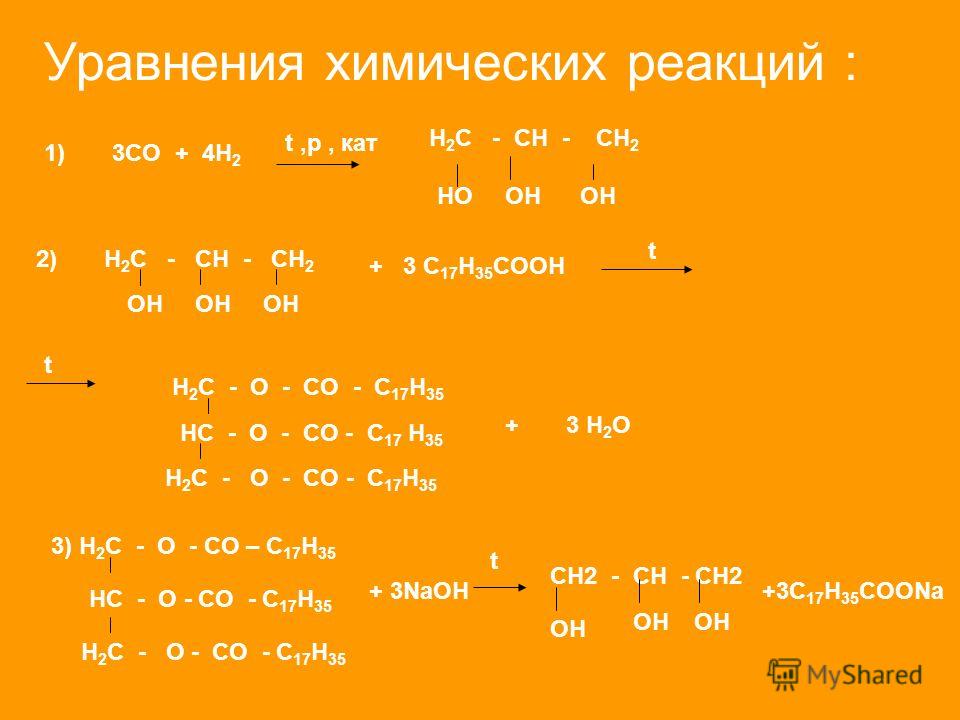 010 \, g \ over 1 \, mol \, CO_2} \ right) + 6 \, mol \, H_2O \ left ({18.015 \, g \ over 1 \, моль \, H_2O} \ справа) \]
010 \, g \ over 1 \, mol \, CO_2} \ right) + 6 \, mol \, H_2O \ left ({18.015 \, g \ over 1 \, моль \, H_2O} \ справа) \]
\ [372,15 \, г = 372,15 \, г \]
C Один моль глюкозы содержит число Авогадро (6,022 × 10 23 ) молекул глюкозы. Таким образом, 6,022 × 10 23 молекул глюкозы реагируют с (6 × 6.022 × 10 23 ) = 3,613 × 10 24 молекул кислорода для получения (6 × 6,022 × 10 23 ) = 3,613 × 10 24 молекул каждая из CO 2 и H 2 O.
В табличной форме:
| \ (C_6H_ {12} O_ {6 \; (s)} \) | + | \ (6O_ {2 \; (g)} \) | → | \ (6CO_ {2 \; (g)} \) | \ (6H_2O _ {(l)} \) | ||
|---|---|---|---|---|---|---|---|
а. | 1 молекула | 6 молекул | 6 молекул | 6 молекул | |||
| б. | 1 моль | 6 моль | 6 моль | 6 моль | |||
| с. | 180,16 г | 191,9928 г | 264,06 г | 108,09 г | |||
г. | 6.022 × 10 23 молекул | 3,613 × 10 24 молекул | 3,613 × 10 24 молекул | 3.613 × 10 24 молекула |
Упражнение \ (\ PageIndex {2} \): взрыв нитрата аммония
Аммиачная селитра — обычное удобрение, но при неправильных условиях может быть опасным. В 1947 году корабль, загруженный нитратом аммония, загорелся во время разгрузки и взорвался, разрушив город Техас-Сити, штат Техас.
Нитрат аммония может быть опасным. На этом аэрофотоснимке Техас-Сити, штат Техас, показаны разрушения, вызванные взрывом корабля с нитратом аммония 16 апреля 1947 года.Для просмотра видео щелкните здесь.
Взрыв возник в результате следующей реакции:
\ [2NH_4NO_ {3 \; (s)} \ rightarrow 2N_ {2 \; (g)} + 4H_2O _ {(g)} + O_ {2 \; (g)} \]
Постройте таблицу, показывающую, как интерпретировать информацию в уравнении в терминах
- отдельных молекул и ионов.
- моль реактивов и продуктов.
- граммов реагентов и продуктов с учетом 2 моль нитрата аммония.
- чисел молекул или формульных единиц реагентов и продуктов на 2 моль нитрата аммония.
Ответ :
| \ (2NH_4NO_ {3 \; (s)} \) | → | \ (2N_ {2 \; (g)} \) | + | \ (4H_2O _ {(g)} \) | + | \ (O_ {2 \; (g)} \) | |
|---|---|---|---|---|---|---|---|
а. | 2NH 4 + ионов и 2NO 3 — ионов | 2 молекулы | 4 молекулы | 1 молекула | |||
| б. | 2 моль | 2 моль | 4 моль | 1 моль | |||
| с. | 160,0864 г | 56,0268 г | 72,0608 г | 31,9988 г | |||
г. | 1,204 × 10 24 формульных единиц | 1.204 × 10 24 молекул | 2.409 × 10 24 молекул | 6.022 × 10 23 молекул |
Определение молей и масс реагентов и продуктов с использованием стехиометрических факторов (мольных соотношений): https://youtu.be/74mHV0CZcjw
Сводка
Химическая реакция описывается химическим уравнением, которое определяет идентичность и количество реагентов и продуктов.В химической реакции одно или несколько веществ превращаются в новые вещества. Химическая реакция описывается химическим уравнением , выражением, которое определяет идентичность и количество веществ, участвующих в реакции. Химическое уравнение показывает исходное (ые) соединение (я) — реагенты — слева и конечное соединение (я) — продукты — справа, разделенные стрелкой. В сбалансированном химическом уравнении количество атомов каждого элемента и общий заряд одинаковы с обеих сторон уравнения.Число атомов, молекул или формульных единиц реагента или продукта в сбалансированном химическом уравнении — это коэффициент для этого вида. Мольное отношение двух веществ в химической реакции — это отношение их коэффициентов в сбалансированном химическом уравнении.
Химическое уравнение показывает исходное (ые) соединение (я) — реагенты — слева и конечное соединение (я) — продукты — справа, разделенные стрелкой. В сбалансированном химическом уравнении количество атомов каждого элемента и общий заряд одинаковы с обеих сторон уравнения.Число атомов, молекул или формульных единиц реагента или продукта в сбалансированном химическом уравнении — это коэффициент для этого вида. Мольное отношение двух веществ в химической реакции — это отношение их коэффициентов в сбалансированном химическом уравнении.
Балансировка химических уравнений: практика и обзор
Внимание: Этот пост был написан несколько лет назад и может не отражать последние изменения в программе AP®.Мы постепенно обновляем эти сообщения и удалим этот отказ от ответственности после обновления этого сообщения. Спасибо за ваше терпение!
Из всех навыков, которые необходимо знать в области химии, уравновешивание химических уравнений, пожалуй, является самым важным. Многие области химии зависят от этого жизненно важного навыка, включая стехиометрию, анализ реакций и лабораторную работу. Это подробное руководство покажет вам, как уравновесить даже самые сложные реакции, и проведет вас через серию примеров, от простых до сложных.
Многие области химии зависят от этого жизненно важного навыка, включая стехиометрию, анализ реакций и лабораторную работу. Это подробное руководство покажет вам, как уравновесить даже самые сложные реакции, и проведет вас через серию примеров, от простых до сложных.
Конечная цель уравновешивания химических реакций — уравнять обе стороны реакции, реагенты и продукты, по количеству атомов на элемент. Это происходит из универсального закона сохранения массы, который гласит, что материю нельзя ни создать, ни разрушить. Итак, если мы начнем с десяти атомов кислорода перед реакцией, нам нужно закончить с десятью атомами кислорода после реакции. Это означает, что химические реакции не меняют реальных строительных блоков материи; скорее они просто меняют расположение блоков.Легкий способ понять это — изобразить дом из блоков. Мы можем разбить дом на части и построить самолет, но цвет и форма блоков не меняются.
Но как нам сбалансировать эти уравнения? Мы знаем, что количество атомов каждого элемента должно быть одинаковым с обеих сторон уравнения, поэтому для этого достаточно найти правильные коэффициенты (числа перед каждой молекулой). Лучше всего начать с атома, который наименьшее количество раз появляется на одной стороне, и сначала уравновесить его.Затем перейдите к атому, который появляется вторым наименьшим числом раз, и так далее. В конце не забудьте снова подсчитать количество атомов каждого элемента на каждой стороне, на всякий случай.
Лучше всего начать с атома, который наименьшее количество раз появляется на одной стороне, и сначала уравновесить его.Затем перейдите к атому, который появляется вторым наименьшим числом раз, и так далее. В конце не забудьте снова подсчитать количество атомов каждого элемента на каждой стороне, на всякий случай.
Проиллюстрируем это на примере:
P 4 O 10 + H 2 O → H 3 PO 4
Во-первых, давайте посмотрим на элемент, который встречается реже всего. Обратите внимание, что кислород дважды встречается с левой стороны, так что это не лучший элемент для начала.Мы могли бы начать с фосфора или водорода, так что давайте начнем с фосфора. С левой стороны четыре атома фосфора, а с правой — только один. Итак, мы можем поставить коэффициент 4 на молекулу, которая имеет фосфор справа, чтобы уравновесить их.
P 4 O 10 + H 2 O → 4 H 3 PO 4
Теперь мы можем проверить водород. Мы по-прежнему хотим избежать уравновешивания кислорода, потому что он присутствует более чем в одной молекуле с левой стороны.Проще всего начать с молекул, которые появляются только один раз с каждой стороны. Итак, есть две молекулы водорода с левой стороны и двенадцать с правой стороны (обратите внимание, что их по три на молекулу H 3 PO 4 , а у нас четыре молекулы). Итак, чтобы уравновесить их, мы должны поставить шестерку перед H 2 O слева.
Мы по-прежнему хотим избежать уравновешивания кислорода, потому что он присутствует более чем в одной молекуле с левой стороны.Проще всего начать с молекул, которые появляются только один раз с каждой стороны. Итак, есть две молекулы водорода с левой стороны и двенадцать с правой стороны (обратите внимание, что их по три на молекулу H 3 PO 4 , а у нас четыре молекулы). Итак, чтобы уравновесить их, мы должны поставить шестерку перед H 2 O слева.
P 4 O 10 + 6 H 2 O → 4 H 3 PO 4
На этом этапе мы можем проверить содержание кислорода, чтобы увидеть, сбалансированы ли они.Слева у нас есть десять атомов кислорода из P 4 O 10 и шесть из H 2 O, всего 16. Справа у нас также 16 (четыре на молекулу, с четырьмя молекулами). ). Итак, кислород уже сбалансирован. Это дает нам окончательное сбалансированное уравнение
P 4 O 10 + 6 H 2 O → 4 H 3 PO 4
Практические задачи по уравновешиванию химических уравнений Попробуйте уравновесить эти десять уравнений самостоятельно, а затем проверьте ответы ниже. Они различаются по уровню сложности, поэтому не расстраивайтесь, если некоторые из них покажутся вам слишком сложными. Просто не забудьте начать с элемента, который появляется меньше всего, и продолжайте оттуда. Лучший способ подойти к этим проблемам — медленно и систематически. Взгляд на все сразу может легко вызвать ошеломление. Удачи!
Они различаются по уровню сложности, поэтому не расстраивайтесь, если некоторые из них покажутся вам слишком сложными. Просто не забудьте начать с элемента, который появляется меньше всего, и продолжайте оттуда. Лучший способ подойти к этим проблемам — медленно и систематически. Взгляд на все сразу может легко вызвать ошеломление. Удачи!
- CO 2 + H 2 O → C 6 H 12 O 6 + O 2
- SiCl 4 + H 2 O → H 4 SiO 4 + HCl
- Al + HCl → AlCl 3 + H 2
- Na 2 CO 3 + HCl → NaCl + H 2 O + CO 2
- C 7 H 6 O 2 + O 2 → CO 2 + H 2 O
- Fe 2 (SO 4 ) 3 + KOH → K 2 SO 4 + Fe (OH) 3
- Ca (PO 4 ) 2 + SiO 2 → P 4 O 10 + CaSiO 3
- KClO 3 → KClO 4 + KCl
- Al 2 (SO 4 ) 3 + Ca (OH) 2 → Al (OH) 3 + CaSO 4
- H 2 SO 4 + HI → H 2 S + I 2 + H 2 O
Комплексные решения:
1. CO 2 + H 2 O → C 6 H 12 O 6 + O 2
CO 2 + H 2 O → C 6 H 12 O 6 + O 2 Первый шаг — сосредоточиться на элементах, которые появляются только один раз с каждой стороны уравнения. Здесь и углерод, и водород соответствуют этому требованию. Итак, начнем с углерода. С левой стороны только один атом углерода, а с правой — шесть. Итак, мы добавляем коэффициент шесть к углеродсодержащей молекуле слева.
6CO 2 + H 2 O → C 6 H 12 O 6 + O 2
Теперь давайте посмотрим на водород.Слева расположены два атома водорода, а справа — двенадцать. Итак, мы добавим коэффициент шесть к водородсодержащей молекуле слева.
6CO 2 + 6H 2 O → C 6 H 12 O 6 + O 2
А теперь пора проверить кислород. Слева всего 18 молекул кислорода (6 × 2 + 6 × 1). Справа восемь молекул кислорода. Теперь у нас есть два варианта выровнять правую часть: мы можем либо умножить C 6 H 12 O 6 или O 2 на коэффициент.Однако, если мы изменим C 6 H 12 O 6 , коэффициенты для всего остального в левой части также должны будут измениться, потому что мы изменим количество атомов углерода и водорода. Чтобы предотвратить это, обычно помогает изменить только молекулу, содержащую наименьшее количество элементов; в данном случае O 2 . Итак, мы можем добавить коэффициент шесть к O 2 справа. Наш окончательный ответ:
Теперь у нас есть два варианта выровнять правую часть: мы можем либо умножить C 6 H 12 O 6 или O 2 на коэффициент.Однако, если мы изменим C 6 H 12 O 6 , коэффициенты для всего остального в левой части также должны будут измениться, потому что мы изменим количество атомов углерода и водорода. Чтобы предотвратить это, обычно помогает изменить только молекулу, содержащую наименьшее количество элементов; в данном случае O 2 . Итак, мы можем добавить коэффициент шесть к O 2 справа. Наш окончательный ответ:
6CO 2 + 6H 2 O → C 6 H 12 O 6 + 6O 2
2.SiCl 4 + H 2 O → H 4 SiO 4 + HCl Единственный элемент, который встречается здесь более одного раза в одной и той же части уравнения, — это водород, поэтому мы можем начать с любого другого элемента. Начнем с кремния. Обратите внимание, что с обеих сторон находится только один атом кремния, поэтому нам пока не нужно добавлять какие-либо коэффициенты. Теперь давайте посмотрим на хлор. Слева расположены четыре атома хлора, а справа — только один. Итак, мы добавим коэффициент четыре справа.
Начнем с кремния. Обратите внимание, что с обеих сторон находится только один атом кремния, поэтому нам пока не нужно добавлять какие-либо коэффициенты. Теперь давайте посмотрим на хлор. Слева расположены четыре атома хлора, а справа — только один. Итак, мы добавим коэффициент четыре справа.
SiCl 4 + H 2 O → H 4 SiO 4 + 4HCl
Теперь давайте посмотрим на кислород. Помните, что сначала мы хотим проанализировать все элементы, которые встречаются только один раз на одной стороне уравнения. Слева всего один атом кислорода, а справа четыре. Итак, мы добавим коэффициент четыре в левую часть уравнения.
SiCl 4 + 4H 2 O → H 4 SiO 4 + 4HCl
Мы почти закончили! Теперь нам просто нужно проверить количество атомов водорода с каждой стороны.Слева их восемь, а справа тоже восемь, так что мы закончили. Наш окончательный ответ —
SiCl 4 + 4H 2 O → H 4 SiO 4 + 4HCl
Как всегда, не забудьте дважды проверить, что количество атомов каждого элемента уравновешивается с каждой стороны, прежде чем продолжить.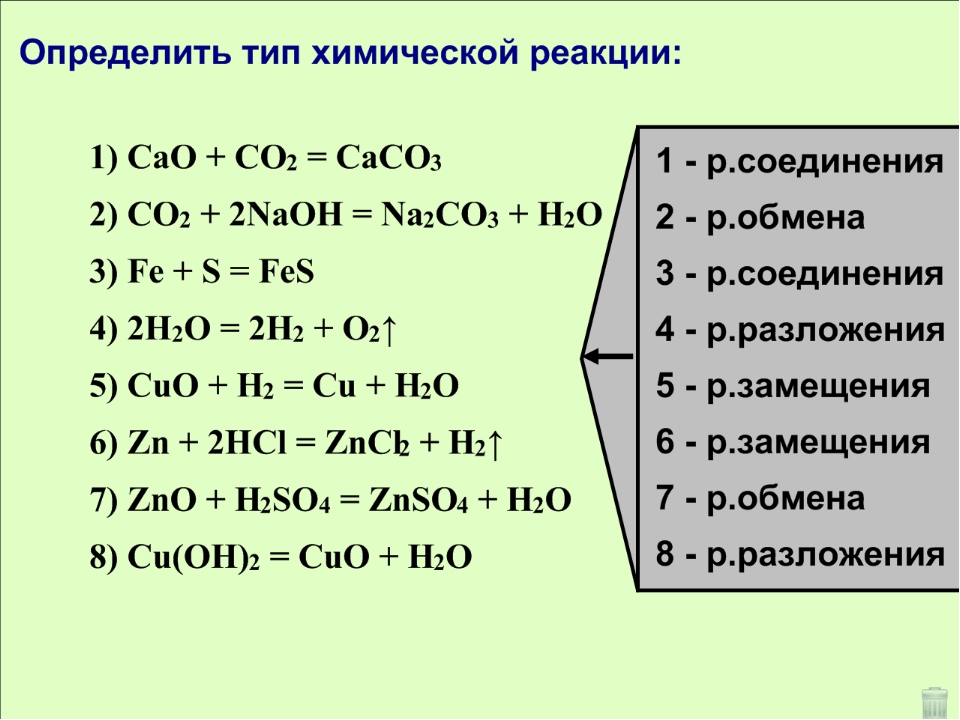
Эта проблема немного сложная, поэтому будьте осторожны. Когда по одну сторону уравнения находится один атом, проще всего начать с этого элемента.Итак, начнем с подсчета атомов алюминия с обеих сторон. Один слева и один справа, поэтому нам пока не нужно добавлять какие-либо коэффициенты. Теперь давайте посмотрим на водород. Еще один слева, но два справа. Итак, мы добавим слева коэффициент два.
Al + 2HCl → AlCl 3 + H 2
Далее мы рассмотрим хлор. Теперь их два слева, а три справа. Это не так просто, как просто прибавить коэффициент к одной стороне.Нам нужно, чтобы количество атомов хлора было одинаковым с обеих сторон, поэтому нам нужно, чтобы два и три были равны. Мы можем добиться этого, найдя наименьшее общее кратное. В этом случае мы можем умножить два на три и три на два, чтобы получить наименьшее общее кратное шести. Итак, умножим 2HCl на три, а AlCl 3 на два:
Al + 6HCl → 2AlCl 3 + H 2
Мы рассмотрели все элементы, поэтому легко сказать, что все готово. Однако всегда проверяйте дважды.В этом случае, поскольку мы добавили коэффициент к молекуле, содержащей алюминий в правой части, алюминий больше не сбалансирован. Один слева, а два справа. Итак, добавим еще один коэффициент.
Однако всегда проверяйте дважды.В этом случае, поскольку мы добавили коэффициент к молекуле, содержащей алюминий в правой части, алюминий больше не сбалансирован. Один слева, а два справа. Итак, добавим еще один коэффициент.
2Al + 6HCl → 2AlCl 3 + H 2
Мы еще не закончили. Просматривая уравнение в последний раз, мы видим, что водород также не сбалансирован. Слева их шесть, а справа — двое. Итак, сделав последнюю корректировку, мы получили окончательный ответ:
2Al + 6HCl → 2AlCl 3 + 3H 2
4.Na 2 CO 3 + HCl → NaCl + H 2 O + CO 2Надеюсь, к этому моменту балансировка уравнений станет проще, и вы научитесь этому. Глядя на натрий, мы видим, что он встречается дважды слева и один раз справа. Итак, мы можем добавить наш первый коэффициент к NaCl справа.
Na 2 CO 3 + HCl → 2NaCl + H 2 O + CO 2
Теперь давайте посмотрим на углерод. Один слева и один справа, поэтому нет никаких коэффициентов для добавления.Поскольку кислород присутствует более чем в одном месте слева, мы оставим его напоследок. Вместо этого посмотрите на водород. Один слева и два справа, поэтому мы добавим коэффициент слева.
Один слева и один справа, поэтому нет никаких коэффициентов для добавления.Поскольку кислород присутствует более чем в одном месте слева, мы оставим его напоследок. Вместо этого посмотрите на водород. Один слева и два справа, поэтому мы добавим коэффициент слева.
Na 2 CO 3 + 2HCl → 2NaCl + H 2 O + CO 2
Затем, глядя на хлор, мы видим, что он уже сбалансирован по два с каждой стороны. Теперь мы можем вернуться к изучению кислорода. Их три слева и три справа, поэтому наш окончательный ответ —
.Na 2 CO 3 + 2HCl → 2NaCl + H 2 O + CO 2
5.C 7 H 6 O 2 + O 2 → CO 2 + H 2 O Мы можем начать балансировать это уравнение, посмотрев либо на углерод, либо на водород. Глядя на углерод, мы видим, что семь атомов слева и только один справа. Итак, мы можем добавить коэффициент семь справа.
C 7 H 6 O 2 + O 2 → 7CO 2 + H 2 O
Тогда для водорода шесть атомов слева и два справа.Итак, мы добавим коэффициент три справа.
C 7 H 6 O 2 + O 2 → 7CO 2 + 3H 2 O
Теперь с кислородом все станет немного сложнее. Кислород присутствует в каждой молекуле в уравнении, поэтому мы должны быть очень осторожны при его балансировке. Слева четыре атома кислорода, справа 17. Нет очевидного способа уравновесить эти числа, поэтому мы должны использовать небольшой трюк: дроби. Теперь, когда мы пишем наш окончательный ответ, мы не можем включать дроби, так как это неправильная форма, но иногда помогает использовать их для решения проблемы.Также старайтесь избегать чрезмерных манипуляций с органическими молекулами. Вы можете легко идентифицировать органические молекулы, также известные как молекулы CHO, потому что они состоят только из углерода, водорода и кислорода. Мы не любим работать с этими молекулами, потому что они довольно сложные. Кроме того, более крупные молекулы обычно более стабильны, чем молекулы меньшего размера, и с меньшей вероятностью вступят в реакцию в больших количествах.
Мы не любим работать с этими молекулами, потому что они довольно сложные. Кроме того, более крупные молекулы обычно более стабильны, чем молекулы меньшего размера, и с меньшей вероятностью вступят в реакцию в больших количествах.
Итак, чтобы уравновесить четыре и семнадцать, мы можем умножить 0 2 слева на 7.5. Это даст нам
C 7 H 6 O 2 + 7.5O 2 → 7CO 2 + 3H 2 O
Помните, что дроби (и десятичные дроби) не допускаются в формальных сбалансированных уравнениях, поэтому умножьте все на два, чтобы получить целые числа. Наш окончательный ответ —
2C 7 H 6 O 2 + 15O 2 → 14CO 2 + 6H 2 O
6. Fe 2 (SO 4 ) 3 + KOH → K 2 SO 4 + Fe (OH) 3- Мы можем начать с балансировки утюга с обеих сторон. У левого их два, а у правого только один. Итак, мы добавим коэффициент два справа.
У левого их два, а у правого только один. Итак, мы добавим коэффициент два справа.
Fe 2 (SO 4 ) 3 + KOH → K 2 SO 4 + 2Fe (OH) 3-
Затем мы можем взглянуть на серу. Слева их три, а справа только один. Итак, мы добавим коэффициент три в правую часть.
Fe 2 (SO 4 ) 3 + KOH → 3K 2 SO 4 + 2Fe (OH) 3-
Мы почти закончили.Осталось только сбалансировать калий. Один атом слева и шесть справа, поэтому мы можем уравновесить их, добавив коэффициент шесть. Итак, наш окончательный ответ —
.Fe 2 (SO 4 ) 3 + 6KOH → 3K 2 SO 4 + 2Fe (OH) 3-
7. Ca 3 (PO 4 ) 2 + SiO 2 → P 4 O 10 + CaSiO 3 Глядя на кальций, мы видим, что их три слева и один справа, поэтому мы можем добавить коэффициент три справа, чтобы уравновесить их.
Ca 3 (PO 4 ) 2 + SiO 2 → P 4 O 10 + 3CaSiO 3
Затем, что касается фосфора, мы видим, что их два слева и четыре справа. Чтобы уравновесить их, добавьте слева коэффициент два.
2Ca 3 (PO 4 ) 2 + SiO 2 → P 4 O 10 + 3CaSiO 3
Обратите внимание, что таким образом мы изменили количество атомов кальция слева.Каждый раз, когда вы добавляете коэффициент, дважды проверяйте, влияет ли шаг на какие-либо элементы, которые вы уже сбалансировали. В этом случае количество атомов кальция слева увеличилось до шести, а справа осталось три, поэтому мы можем изменить коэффициент справа, чтобы отразить это изменение.
2Ca 3 (PO 4 ) 2 + SiO 2 → P 4 O 10 + 6CaSiO 3
Поскольку кислород присутствует в каждой молекуле в уравнении, мы его пока пропустим. Сосредоточившись на кремнии, мы видим, что один слева, а шесть справа, поэтому мы можем добавить коэффициент слева.
Сосредоточившись на кремнии, мы видим, что один слева, а шесть справа, поэтому мы можем добавить коэффициент слева.
2Ca 3 (PO 4 ) 2 + 6SiO 2 → P 4 O 10 + 6CaSiO 3
Теперь проверим количество атомов кислорода с каждой стороны. Слева есть 28 атомов, а справа также 28. Итак, после проверки того, что все остальные атомы одинаковы с обеих сторон, мы получаем окончательный ответ
2Ca 3 (PO 4 ) 2 + 6SiO 2 → P 4 O 10 + 6CaSiO 3
8.KClO 3 → KClO 4 + KCl Эта проблема особенно сложна, потому что каждый атом, кроме кислорода, присутствует в каждой молекуле в уравнении. Итак, поскольку кислород появляется наименьшее количество раз, мы начнем с него. Их три слева и четыре справа. Чтобы уравновесить их, мы находим наименьшее общее кратное; в данном случае 12.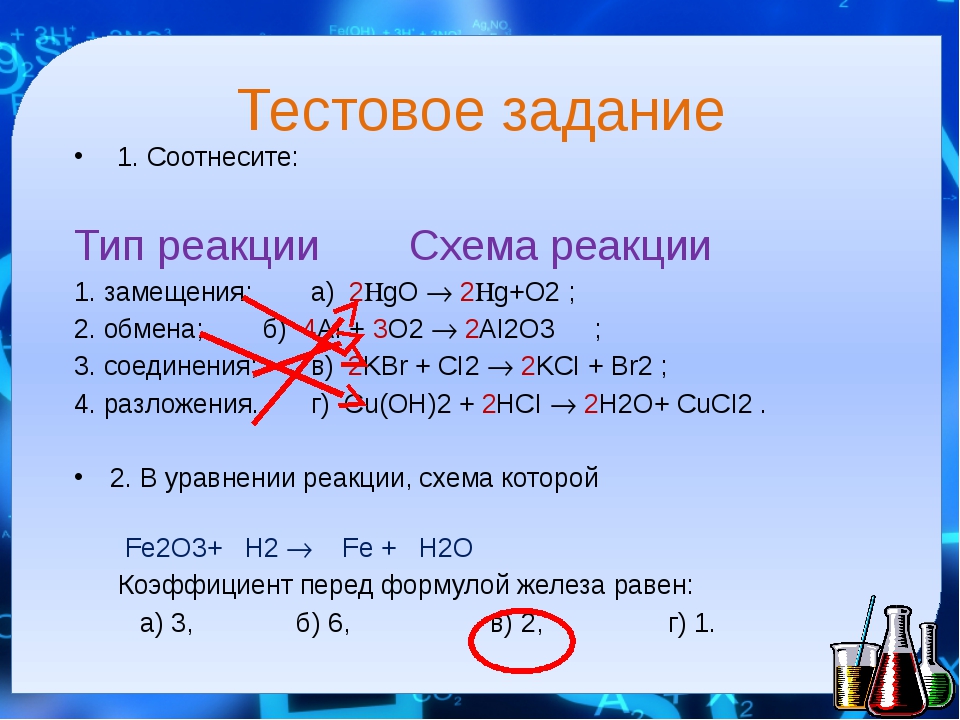 Добавляя коэффициент четыре слева и три справа, мы можем уравновесить содержание кислорода.
Добавляя коэффициент четыре слева и три справа, мы можем уравновесить содержание кислорода.
4KClO 3 → 3KClO 4 + KCl
Теперь мы можем проверить калий и хлор.Четыре молекулы калия слева и четыре справа, поэтому они уравновешены. Хлор также сбалансирован, по четыре с каждой стороны, поэтому мы закончили с окончательным ответом
.4KClO 3 → 3KClO 4 + KCl
9. Al 2 (SO 4 ) 3 + Ca (OH) 2 → Al (OH) 3 + CaSO 4Здесь мы можем начать с балансировки атомов алюминия с обеих сторон. Слева есть две молекулы, а справа только одна, поэтому мы добавим коэффициент два справа.
Al 2 (SO 4 ) 3 + Ca (OH) 2 → 2Al (OH) 3 + CaSO 4
Теперь мы можем проверить серу. Их три слева и только один справа, поэтому добавление коэффициента три уравновесит их.
Al 2 (SO 4 ) 3 + Ca (OH) 2 → 2Al (OH) 3 + 3CaSO 4
Переходя к кальцию, слева только один, а справа три, поэтому мы должны добавить коэффициент, равный трем.
Al 2 (SO 4 ) 3 + 3Ca (OH) 2 → 2Al (OH) 3 + 3CaSO 4
Дважды проверив все атомы, мы видим, что все элементы сбалансированы, поэтому наше окончательное уравнение —
Al 2 (SO 4 ) 3 + 3Ca (OH) 2 → 2Al (OH) 3 + 3CaSO 4
10. H 2 SO 4 + HI → H 2 S + I 2 + H 2 O Поскольку водород встречается более одного раза слева, мы временно пропустим его и перейдем к сере.Один атом слева и один справа, так что балансировать пока нечего. Если посмотреть на кислород, их четыре слева и один справа, поэтому мы можем добавить коэффициент четыре, чтобы уравновесить их.
H 2 SO 4 + HI → H 2 S + I 2 + 4H 2 O
Есть только один йод слева и два справа, поэтому простое изменение коэффициента может уравновесить их.
H 2 SO 4 + 2HI → H 2 S + I 2 + 4H 2 O
Теперь мы можем взглянуть на самый сложный элемент: водород.Слева их четыре, а справа десять. Итак, мы знаем, что нам нужно изменить коэффициент либо H 2 SO 4 , либо HI. Мы хотим изменить что-то, что впоследствии потребует наименьшего количества настроек, поэтому мы изменим коэффициент HI. Чтобы в левой части было десять атомов водорода, нам нужно, чтобы в HI было восемь атомов водорода, поскольку в H 2 SO 4 уже есть два. Итак, изменим коэффициент с 2 на 8.
H 2 SO 4 + 8HI → H 2 S + I 2 + 4H 2 O
Однако это также изменяет баланс йода. Слева их восемь, а справа только двое. Чтобы исправить это, мы добавим справа коэффициент 4. Убедившись, что все остальное уравновешено, мы получаем окончательный ответ
Слева их восемь, а справа только двое. Чтобы исправить это, мы добавим справа коэффициент 4. Убедившись, что все остальное уравновешено, мы получаем окончательный ответ
H 2 SO 4 + 8HI → H 2 S + 4I 2 + 4H 2 O
Как и в случае с большинством других навыков, практика приводит к совершенству при изучении того, как уравновесить химические уравнения. Продолжайте усердно работать и постарайтесь решить как можно больше задач, чтобы отточить свои навыки балансировки.
У вас есть какие-нибудь советы или рекомендации, которые помогут сбалансировать химические уравнения? Дайте нам знать об этом в комментариях!
Давайте применим все на практике. Задайте этот вопрос по общей практике химии: Ищете дополнительную практику по общей химии? На Albert.io вы можете найти тысячи практических вопросов. Albert.io позволяет настроить процесс обучения так, чтобы он ориентировался на практику там, где вам больше всего нужна помощь. Мы зададим вам сложные практические вопросы, которые помогут вам достичь совершенства в общей химии.
Мы зададим вам сложные практические вопросы, которые помогут вам достичь совершенства в общей химии.
Начните практиковать здесь .
Вы преподаватель или администратор, заинтересованный в улучшении успеваемости студентов по общей химии?
Узнайте больше о наших школьных лицензиях здесь .
Балансировка химических уравнений — Химия для старших классов
Если вы считаете, что контент, доступный через Веб-сайт (как определено в наших Условиях обслуживания), нарушает одно
или больше ваших авторских прав, сообщите нам, отправив письменное уведомление («Уведомление о нарушении»), содержащее
в
информацию, описанную ниже, назначенному ниже агенту.Если репетиторы университета предпримут действия в ответ на
ан
Уведомление о нарушении, оно предпримет добросовестную попытку связаться со стороной, которая предоставила такой контент
средствами самого последнего адреса электронной почты, если таковой имеется, предоставленного такой стороной Varsity Tutors.
Ваше Уведомление о нарушении прав может быть отправлено стороне, предоставившей доступ к контенту, или третьим лицам, таким как в виде ChillingEffects.org.
Обратите внимание, что вы будете нести ответственность за ущерб (включая расходы и гонорары адвокатам), если вы существенно искажать информацию о том, что продукт или действие нарушает ваши авторские права.Таким образом, если вы не уверены, что контент находится на Веб-сайте или по ссылке с него нарушает ваши авторские права, вам следует сначала обратиться к юристу.
Чтобы отправить уведомление, выполните следующие действия:
Вы должны включить следующее:
Физическая или электронная подпись правообладателя или лица, уполномоченного действовать от их имени;
Идентификация авторских прав, которые, как утверждается, были нарушены;
Описание характера и точного местонахождения контента, который, по вашему мнению, нарушает ваши авторские права, в \
достаточно подробностей, чтобы позволить репетиторам Varsity найти и точно идентифицировать этот контент; например нам требуется
а
ссылка на конкретный вопрос (а не только на название вопроса), который содержит содержание и описание
к какой конкретной части вопроса — изображению, ссылке, тексту и т. д. — относится ваша жалоба;
Ваше имя, адрес, номер телефона и адрес электронной почты; и
Ваше заявление: (а) вы добросовестно считаете, что использование контента, который, по вашему утверждению, нарушает
ваши авторские права не разрешены законом, владельцем авторских прав или его агентом; (б) что все
информация, содержащаяся в вашем Уведомлении о нарушении, является точной, и (c) под страхом наказания за лжесвидетельство вы
либо владелец авторских прав, либо лицо, уполномоченное действовать от их имени.
д. — относится ваша жалоба;
Ваше имя, адрес, номер телефона и адрес электронной почты; и
Ваше заявление: (а) вы добросовестно считаете, что использование контента, который, по вашему утверждению, нарушает
ваши авторские права не разрешены законом, владельцем авторских прав или его агентом; (б) что все
информация, содержащаяся в вашем Уведомлении о нарушении, является точной, и (c) под страхом наказания за лжесвидетельство вы
либо владелец авторских прав, либо лицо, уполномоченное действовать от их имени.
Отправьте жалобу нашему уполномоченному агенту по адресу:
Чарльз Кон
Varsity Tutors LLC
101 S. Hanley Rd, Suite 300
St. Louis, MO 63105
Или заполните форму ниже:
ДОМ Главы курса Основы калькулятора Обзор математики Основные понятия Расширенные концепцииРаздел Тесты Предварительное испытание Пост-тест Полезные материалы Глоссарий Онлайн-калькуляторы Калькулятор окислительно-восстановительного потенциала Калькулятор кинетики Аррениуса Калькулятор термодинамики Калькулятор ядерного распада Регрессия методом наименьших квадратов Решатель уравнений метода Ньютона Калькулятор сжимаемости Калькулятор перевода единиц Калькулятор номенклатуры Ссылки по теме Калькуляторы Texas Instruments Калькуляторы Casio Калькуляторы Sharp Калькуляторы Hewlett Packard Кредиты Связаться с веб-мастером | Стехиометрия — это математика, лежащая в основе химии. Имея достаточно информации, можно использовать стехиометрию для вычисления масс, молей и процентов в рамках химического уравнения. Имея достаточно информации, можно использовать стехиометрию для вычисления масс, молей и процентов в рамках химического уравнения. Что такое химическое уравнение Молла Уравновешивание химических уравнений Ограничивающие реагенты Процентный состав Эмпирические и молекулярные формулы Плотность Концентрации растворов В химии мы используем символы для обозначения различных химических веществ. Успех в химии зависит от знакомства с этими основными символами.Например, символ «С» представляет собой атом углерода, а «H» представляет собой атом водорода. Чтобы представить молекулу поваренной соли, хлорида натрия, мы будем использовать обозначение «NaCl», где «Na» представляет натрий, а «Cl» представляет собой хлор. Мы называем хлор «хлоридом» в этом случае из-за его связи с натрием. У вас будет возможность просмотреть схемы именования или номенклатуру в более позднем чтении. Химическое уравнение — это выражение химического процесса. В этом уравнении AgNO 3 смешан с NaCl. Уравнение показывает, что реагенты (AgNO 3 и NaCl) реагируют посредством некоторого процесса (—>) с образованием продуктов (AgCl и NaNO 3 ). Поскольку они подвергаются химическому процессу, они коренным образом изменяются. Часто составляются химические уравнения, показывающие состояние, в котором находится каждое вещество.Знак (s) означает, что соединение является твердым. Знак (l) означает, что вещество является жидкостью. Знак (aq) обозначает водный раствор в воде и означает, что соединение растворено в воде. Наконец, знак (g) означает, что соединение представляет собой газ. Коэффициенты используются во всех химических уравнениях, чтобы показать относительные количества каждого присутствующего вещества. Это количество может представлять либо относительное количество молекул, либо относительное количество молекул. В некоторых случаях над или под стрелками будет написана различная информация. Эта информация, например значение температуры, показывает, какие условия должны присутствовать для возникновения реакции. Например, на приведенном ниже графике обозначения над и под стрелками показывают, что нам нужен химикат Fe 2 O 3 , температура 1000 градусов C и давление 500 атмосфер, чтобы эта реакция протекала. На приведенном ниже рисунке отражено большинство концепций, описанных выше: Учитывая приведенное выше уравнение, мы можем определить количество молей реагентов и продуктов. Моль просто представляет собой число молекул Авогадро (6,023 x 10 23 ). Родинка похожа на термин, подобный дюжине. Если у вас есть дюжина морковок, у вас есть двенадцать е из них. Точно так же, если у вас есть родинка моркови, у вас есть 6,023 x 10 23 моркови. В приведенном выше уравнении перед членами нет цифр, поэтому предполагается, что каждый коэффициент равен единице (1).Таким образом, у вас одинаковое количество молей Ag
НЕТ 3 , NaCl, AgCl, NaNO 3 . В приведенном выше уравнении перед членами нет цифр, поэтому предполагается, что каждый коэффициент равен единице (1).Таким образом, у вас одинаковое количество молей Ag
НЕТ 3 , NaCl, AgCl, NaNO 3 .Часто бывает важно преобразовать моль в граммы вещества. Это преобразование может быть легко выполнено, когда атомарный и / или молекулярный масса вещества (веществ) известна. Атомный или молекулярный масса вещества в граммах составляет один моль вещества. Например, кальций имеет атомный вес 40 граммов. Итак, 40 грамм кальция составляют один моль, 80 грамм — два моля и т. д. Иногда, однако, нам нужно проделать некоторую работу, прежде чем использовать коэффициенты членов, чтобы представить относительное количество молекул каждого соединения. Это тот случай, когда уравнения не являются пр отлично сбалансирован. Мы будем рассматривать следующее уравнение: Al + Fe 3 O 4 —> Al 2 O 3 Поскольку перед любым из членов нет коэффициентов, легко предположить, что один (1) моль Al и один (1) моль Fe 3 0 4 реагируют с образованием одного (1) моля Al 2 0 3 . Уравновешивание химического уравнения в основном осуществляется методом проб и ошибок. Есть много разных способов и систем сделать это, но для всех методов важно знать, как подсчитать количество атомов в уравнении. Например, мы рассмотрим следующий срок. 2Fe 3 O 4 Этот термин обозначает две (2) молекулы Fe 3 O 4 .В каждой молекуле этого вещества есть три (3) атома Fe. Теперь давайте попробуем сбалансировать уравнение, упомянутое ранее: Al + Fe 3 O 4 —> Al 2 O 3 + Fe Разработка стратегии может быть трудной, но вот один из способов решения такой проблемы.
Пример: у химика есть только 6,0 граммов C 2 H 2 и неограниченная подача кислорода, и он желает произвести как можно больше CO 2 . Если она воспользуется приведенным ниже уравнением, сколько кислорода ей следует добавить в реакцию? 2C 2 H 2 (г) + 5O 2 (г) —> 4CO 2 (г) + 2 H 2 O (л) Чтобы решить эту проблему, необходимо определить, сколько кислорода должно
может быть добавлен, если все реагенты были израсходованы (так можно получить максимальное количество CO 2 ). Затем, поскольку на каждые две (2) молекулы C 2 H 2 приходится пять (5) молекул кислорода, нам нужно умножить моль C 2 H 2 на 5/2, чтобы получить общее количество молей кислорода, которое будет использовано для реакции со всеми C 2 H 2 . Затем мы переводим моли кислорода в граммы, чтобы найти количество кислорода, которое необходимо добавить: Можно рассчитать молярные отношения (также называемые мольными долями) между членами химического уравнения, если задан массовый процент продуктов или реагентов. 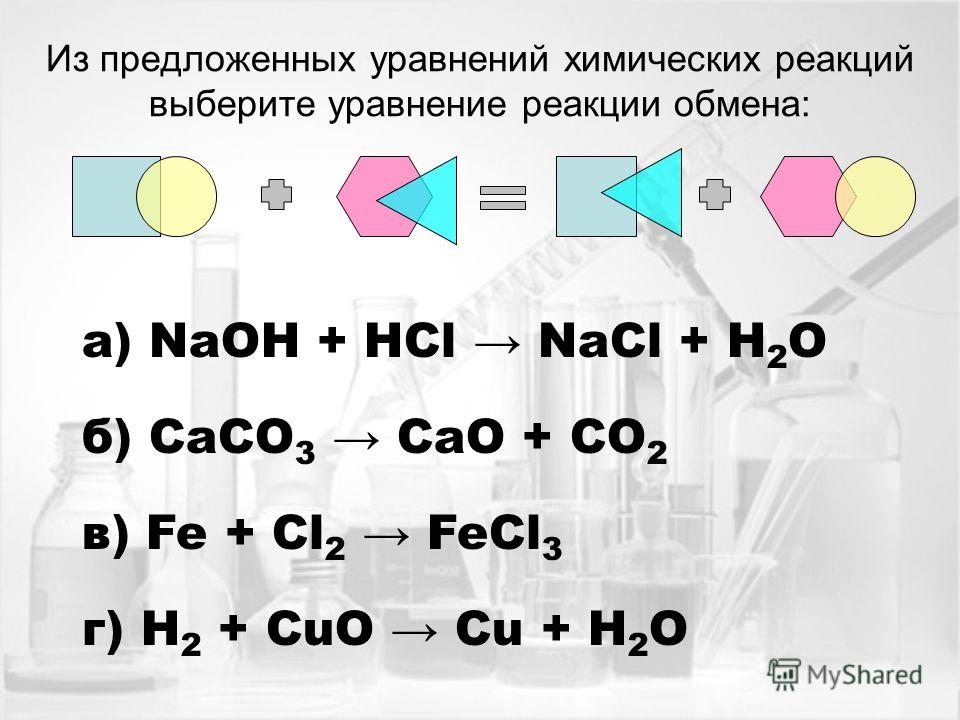 процент по массе = масса части / масса целого
Есть два типа задач процентного состава — задачи, в которых вам дается формула (или вес каждой части) и просят вычислить процентное содержание каждого элемента.
и задачи, в которых вам задают проценты и просят вычислить формулу. процент по массе = масса части / масса целого
Есть два типа задач процентного состава — задачи, в которых вам дается формула (или вес каждой части) и просят вычислить процентное содержание каждого элемента.
и задачи, в которых вам задают проценты и просят вычислить формулу. Есть много возможных решений проблем процентного состава. Всегда есть возможность удвоить ответ. Например, CH и C 2 H 2 имеют одинаковые пропорции, но представляют собой разные соединения.Стандартно давать составы в их простейшей форме, где соотношение между элементами как
сокращенная, как это можно назвать — эмпирическая формула. При расчете эмпирической формулы на основе процентного состава, можно преобразовать проценты в граммы. Например, это обычно проще всего предположить, что у вас 100 граммов, поэтому 54,3% превратились бы в 54,3 грамма. Затем мы можем преобразовать массы в моль, что даст нам мольные отношения.
Надо сводить к целым числам.Хороший прием — разделить все члены на наименьшее количество родинок. Пример: если соединение состоит на 47,3% C (углерод), 10,6% H (водород) и 42,0% S (сера), какова его эмпирическая формула? Теперь мы пытаемся получить четное соотношение между элементами, поэтому делим на количество молей серы, потому что это наименьшее число: Итак, имеем: C 3 H 8 S Пример: Определите массовое процентное содержание сероводорода, H 2 SO 4 . Теперь мы можем проверить, что в сумме проценты составляют 100% По сути, это 100, поэтому мы знаем, что все работает, и, вероятно, мы не сделали никаких ошибок по неосторожности. Итак, ответ таков: H 2 SO 4 состоит из 2,06% H, 32,7% S и 65,2% O по массе. Хотя эмпирическая формула представляет собой простейшую форму соединения, Молекулярная формула — это форма термина в том виде, в котором он употребляется в химическом уравнение. Эмпирическая формула и молекулярная формула могут быть то же самое, или молекулярная формула может быть любым, кратным эмпирическим формула. Примеры эмпирических формул: AgBr, Na 2 S, C 6 H 10 O 5 .Примеры молекулярных формул: P 2 , C 2 O 4 , C 6 H 14 S 2 , H 2 , C 3 H 9 . Эмпирическую формулу можно рассчитать исходя из массового или процентного состава любого соединения. Пример: рассчитайте эмпирическую формулу для соединения, имеющего 43.7 г P (фосфора) и 56,3 грамма кислорода. Сначала конвертируем в родинки: Затем мы разделяем родинки, чтобы добиться равного соотношения. Когда мы делим, мы не получаем целых чисел, поэтому мы должны умножать их на два (2). Ответ = P 2 O 5 . Вычислить молекулярную формулу, когда у нас есть эмпирическая формула, несложно. Если мы знаем эмпирическую формулу соединения, все, что нам нужно сделать, это разделить молекулярная масса соединения по массе эмпирической формулы.Это также можно сделать с помощью одного из элементов формулы; просто разделите массу этого элемента в одном моль соединения на массу этого элемента в эмпирической формуле. Результат всегда должен быть целое число. Пример: если мы знаем, что эмпирическая формула соединения — это HCN, и нам говорят, что для получения соединения необходимо 2,016 грамма водорода, какова его молекулярная формула? В эмпирической формуле водород весит 1,008 грамма. Концентрация раствора — это «сила» раствора. Раствор обычно относится к растворению некоторого твердого вещества в жидкости, например к растворению соли в воде.Также часто необходимо выяснить, сколько воды нужно добавить в раствор, чтобы довести его до определенной концентрации. Концентрация раствора обычно выражается в молярности. Молярность определяется как количество молей растворенного вещества (что такое фактически растворено в растворе), деленное на литры раствора (общий объем того, что растворено и в чем оно было растворено). Молярность, вероятно, наиболее часто используется термин, потому что измерить объем жидкости довольно легко. Пример: если 5,00 граммов NaOH растворяются в 5000 мл воды, какова молярность раствора? Итак, молярность (М) раствора составляет 0,025 моль / л. Моляльность — еще одно распространенное измерение концентрации. Моляльность определяется как количество молей растворенного вещества, деленное на килограммы растворителя. (вещество, в котором он растворен, как вода). Иногда вместо молярности при экстремальных температурах используется молярность, поскольку объем может сжиматься или расширяться. Пример: Если моляльность раствора C 2 H 5 OH, растворенного в воде, составляет 1,5, а вес воды составляет 11,7 кг, вычислите, сколько C 2 H 5 OH должно было быть добавляли в раствор в граммах?  Пример: если молярность раствора составляет 0,30 М, вычислить моляльность.
раствора, зная, что плотность составляет 3,25 г / мл. Где:
T — понижение температуры (для точки замерзания) или температурное расширение (для точки кипения) (° C) Пример: если точка замерзания соленой воды на дорогах составляет -5.2 C, какова молярность раствора? (K f для воды 1,86 C / м. Т = К * м Практические задачи1. Если доступно только 0,25 молярного NaOH и воды, сколько NaOH нужно добавить, чтобы получить 10 литров 0.2 молярный раствор NaOH?Проверьте свою работу 2. Если 2,0 моля сахарозы весом 684 грамма поместить в 1000 граммов воды и затем растворить, какой будет молярность раствора? Проверьте свою работу. 3. Если у вас 0,25 молярный раствор бензола с плотностью 15 грамм / литр, рассчитайте моляльность раствора. Проверьте свою работу 4. Если плотность ртути составляет 13,534 г / см 2 и у вас 62,5 см 3 ртути, сколько граммов, молей и атомов ртути у вас есть? (Масса Меркурия 200.6 г / моль.) Проверьте свою работу [Базовый указатель] [Атомная структура] [Стехиометрия] [Кислотно-основной химический состав] [Номенклатура] |
Как сбалансировать химические уравнения: 11 шагов (с изображениями)
Об этой статье
Соавторы:
Ученый-эколог
Соавтором этой статьи является Bess Ruff, MA.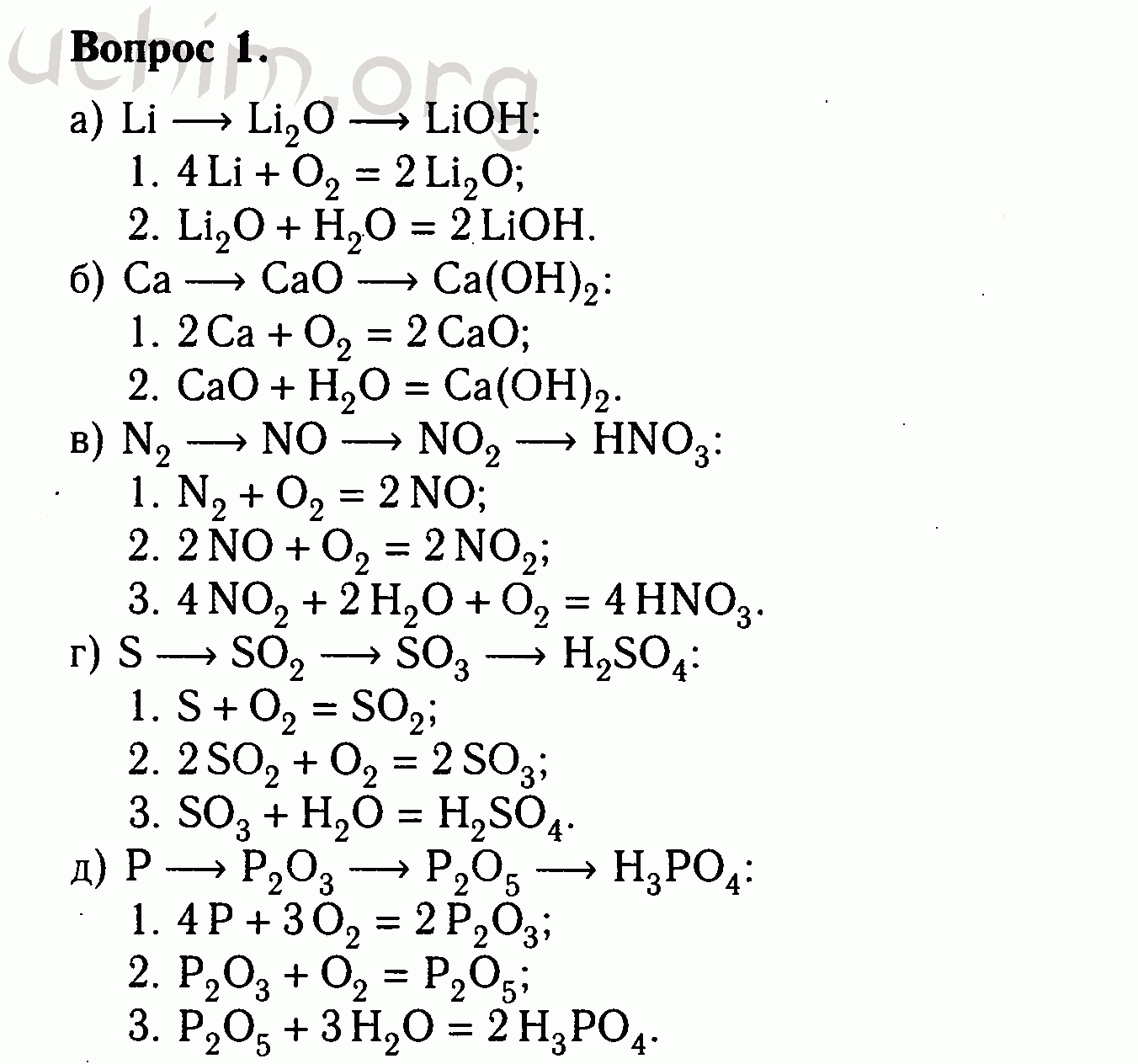 Бесс Рафф — аспирант по географии в Университете штата Флорида. Она получила степень магистра наук об окружающей среде и менеджменте в Калифорнийском университете в Санта-Барбаре в 2016 году. Она проводила исследования для проектов морского пространственного планирования в Карибском бассейне и оказывала исследовательскую поддержку в качестве аспиранта Группы устойчивого рыболовства. Эту статью просмотрели 4 289 267 раз (а).
Бесс Рафф — аспирант по географии в Университете штата Флорида. Она получила степень магистра наук об окружающей среде и менеджменте в Калифорнийском университете в Санта-Барбаре в 2016 году. Она проводила исследования для проектов морского пространственного планирования в Карибском бассейне и оказывала исследовательскую поддержку в качестве аспиранта Группы устойчивого рыболовства. Эту статью просмотрели 4 289 267 раз (а).Соавторы: 164
Обновлено: 3 декабря 2021 г.
Просмотры: 4,289,267
Резюме статьиX Чтобы сбалансировать химическое уравнение, сначала запишите данную формулу с реагентами слева от стрелки и продуктами справа.Например, ваше уравнение должно выглядеть примерно так: «h3 + O2 → h3O». Подсчитайте количество атомов в каждом элементе с каждой стороны уравнения и перечислите их под этой стороной. В уравнении h3 + O2 → h3O 2 атома водорода добавляются к 2 атомам кислорода слева, поэтому вы должны написать «H = 2» и «O = 2» под левой стороной. Справа находятся 2 атома водорода и 1 атом кислорода, поэтому вы должны написать «H = 2» и «O = 1» под правой стороной. Поскольку количество атомов в каждом элементе не одинаково с обеих сторон, уравнение не сбалансировано.Чтобы сбалансировать уравнение, вам нужно добавить коэффициенты, чтобы изменить количество атомов с одной стороны, чтобы оно соответствовало другой. Для уравнения h3 + O2 → h3O вы должны добавить коэффициент 2 перед h3O в правой части, чтобы на каждой стороне уравнения было по 2 атома кислорода, например h3 + O2 → 2h3O. Однако нижние индексы не могут быть изменены и всегда умножаются на коэффициент, что означает, что теперь в правой части уравнения есть 4 атома водорода и только 2 атома водорода в левой части. Чтобы сбалансировать это, добавьте коэффициент 2 перед h3 в левой части уравнения, чтобы с каждой стороны было по 4 атома водорода, например 2h3 + O2 → 2h3O.Теперь количество атомов в каждом элементе одинаково с обеих сторон уравнения, поэтому уравнение сбалансировано.
Справа находятся 2 атома водорода и 1 атом кислорода, поэтому вы должны написать «H = 2» и «O = 1» под правой стороной. Поскольку количество атомов в каждом элементе не одинаково с обеих сторон, уравнение не сбалансировано.Чтобы сбалансировать уравнение, вам нужно добавить коэффициенты, чтобы изменить количество атомов с одной стороны, чтобы оно соответствовало другой. Для уравнения h3 + O2 → h3O вы должны добавить коэффициент 2 перед h3O в правой части, чтобы на каждой стороне уравнения было по 2 атома кислорода, например h3 + O2 → 2h3O. Однако нижние индексы не могут быть изменены и всегда умножаются на коэффициент, что означает, что теперь в правой части уравнения есть 4 атома водорода и только 2 атома водорода в левой части. Чтобы сбалансировать это, добавьте коэффициент 2 перед h3 в левой части уравнения, чтобы с каждой стороны было по 4 атома водорода, например 2h3 + O2 → 2h3O.Теперь количество атомов в каждом элементе одинаково с обеих сторон уравнения, поэтому уравнение сбалансировано. Помните, что если перед элементом нет коэффициента, предполагается, что коэффициент равен 1. Чтобы узнать, как сбалансировать химические уравнения алгебраически, прокрутите вниз!
Помните, что если перед элементом нет коэффициента, предполагается, что коэффициент равен 1. Чтобы узнать, как сбалансировать химические уравнения алгебраически, прокрутите вниз!
- Печать
- Отправить письмо от фаната авторам
Как интерпретировать химические уравнения
Химические уравнения и периодическая таблица
Чтобы понять химические уравнения, нам нужно немного разобраться в периодической таблице.
Каждая буква периодической таблицы является сокращением для определенного элемента. Например, H — водород, C — углерод, а Ca — кальций.
Хотя не все сокращения настолько прямолинейны. Например, K означает калий, что, кажется, не имеет никакого смысла, поскольку в слове калия нет даже звука «k» (на самом деле это сокращение происходит от латинского названия калия. , калий).Эти сокращения используются в химических уравнениях.
, калий).Эти сокращения используются в химических уравнениях.
Количества каждого химического вещества
Каждое химическое вещество состоит из элементов. Химическая формула может сказать нам, сколько атомов каждого элемента используется. Атом — простейший компонент элемента. В большинстве случаев элементы находятся вместе. Мы не находим ни одного элемента в одиночку. Однако, говоря только об одном элементе, мы называем его атомом.
Итак, давайте посмотрим на пример получения воды.
Сначала мы видим, что используются водород (H) и кислород (O). Вместе они образуют дигидромоноксид, который обычно называют водой. «Ди-» означает два, «водород» означает водород, «моно» означает один, а «оксид» означает кислород. Итак, одна молекула воды имеет 2 атома водорода и 1 атом кислорода. Молекула — простейший компонент химического вещества. Обычно мы не находим отдельную химическую молекулу. Но когда мы говорим об одном, мы называем его молекулой.
Но когда мы говорим об одном, мы называем его молекулой.
Обратите внимание на индекс «2» в уравнении. Если у нас есть банка, полная атомов водорода, атомы водорода не плавают сами по себе. Два атома водорода объединятся и образуют молекулу водорода. То же самое и с кислородом.
Есть некоторые атомы (например, натрий), которые не соединяются друг с другом, но водород и кислород всегда будут соединяться вместе, если их оставить плавать вместе. Вот почему и у водорода, и у кислорода есть маленькие 2 рядом с ними — это означает, что мы используем молекулы дигидрогена и дикислорода.
Мы не будем вдаваться в подробности того, как сбалансировать уравнение в этом уроке, но просто знаем, что мы должны получить одинаковое количество атомов по обе стороны стрелки. Вы заметите, что у нас есть две молекулы дигидрогена слева от стрелки, и в итоге мы получаем две молекулы воды (h30). Об этом свидетельствует наличие большого числа 2 перед молекулой дигидрогена и большого числа 2 перед молекулой воды.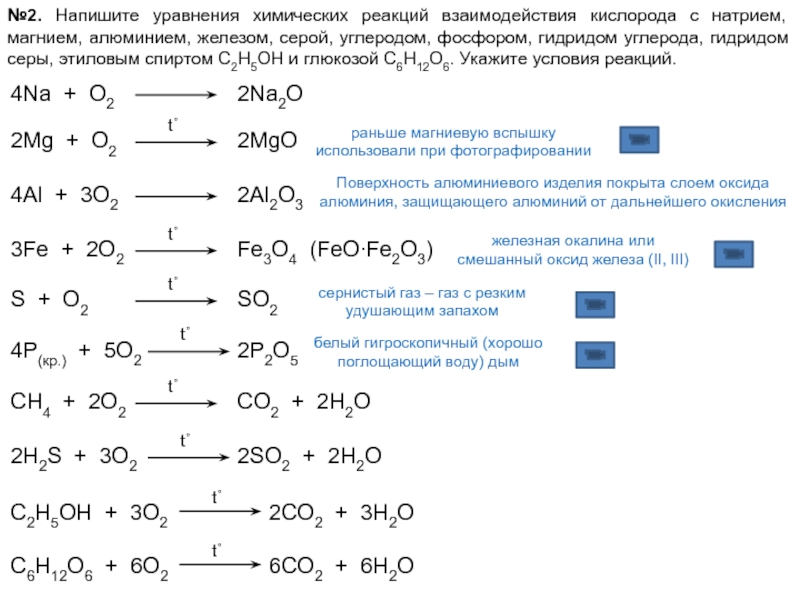 Когда перед молекулой нет числа, мы знаем, что это означает, что была использована только 1 молекула.Поскольку перед молекулой дикислорода нет номера, мы знаем, что была использована только 1 молекула дикислорода.
Когда перед молекулой нет числа, мы знаем, что это означает, что была использована только 1 молекула.Поскольку перед молекулой дикислорода нет номера, мы знаем, что была использована только 1 молекула дикислорода.
Собираем все вместе: 2 молекулы водорода вступают в реакцию с 1 молекулой кислорода с образованием 2 молекул воды.
Другой пример
Теперь давайте посмотрим на немного более сложный пример:
Итак, начнем с самого начала: Ag относится к серебру (да, еще одна странная аббревиатура, которая не имеет смысла на основе английского слова), N — азот, O — кислород, Ca — кальций, а Br — бромид. .Чтобы упростить наименование, мы называем азотно-кислородную часть (нитротриоксид) нитратом. Итак, в качестве реагентов у нас есть следующие молекулы: нитрат серебра и бромид кальция. В качестве продуктов образуются следующие молекулы: бромид серебра и нитрат кальция.
Теперь мы видим, что в нитрате серебра есть 1 атом серебра, 1 атом азота и 3 атома кислорода. Бромид кальция имеет: 1 атом кальция и 2 атома бромида. Тогда бромид серебра имеет: 1 атом серебра и 1 атом бромида.
Бромид кальция имеет: 1 атом кальция и 2 атома бромида. Тогда бромид серебра имеет: 1 атом серебра и 1 атом бромида.
Нитрат кальция — это то место, где становится сложно, как скобки работают с меньшими числами? Нитрат заключен в круглые скобки, а сразу после скобок идет пара цифр. Скобки означают, что нитрат может действовать как часть молекулы, и что их два. Итак, в нитрате есть 1 атом азота и 3 атома кислорода, но поскольку нитратов 2, у нас всего 2 атома азота и 6 атомов кислорода. Все это связано с одним атомом кальция.
Это становится более понятным, если мы посмотрим на структуру нитрата кальция.
Мы видим, что кальций непосредственно присоединен к двум нитратам. Таким образом, эти скобки не только говорят нам, сколько атомов азота и кислорода в молекуле, но также немного говорят нам о структуре молекулы.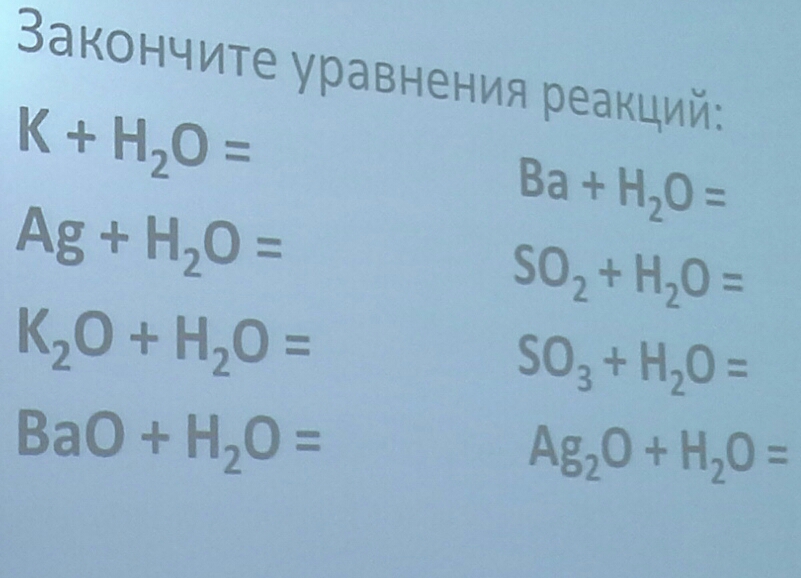
Теперь давайте сложим все вместе: 2 молекулы нитрата серебра вступают в реакцию с 1 молекулой бромида кальция с образованием 2 молекул бромида серебра и 1 молекулы нитрата кальция.
Краткое содержание урока
В химическом уравнении справа от стрелки мы видим реагенты, которые образуют продукты, перечисленные слева. Химические уравнения говорят нам, какие химические вещества необходимы для совместной реакции с образованием другого химического вещества. Другими словами, какие атома, (простейший компонент элемента) и молекулы, (простейший компонент химического вещества) используются и сколько.
Это определяется на основе чисел в нижнем индексе (которые говорят нам количество этого конкретного атома) и больших чисел (которые говорят нам количество этой конкретной молекулы).Скобки в химическом уравнении также могут немного рассказать нам о структуре молекулы.
Химическое уравнение — Academic Kids
От академических детей
de: Reaktionsgleichung es: Ecuacin qumica fr: quation chimique
В химии химическое уравнение является символическим представлением химической реакции. Например, горение метана в кислороде
Например, горение метана в кислороде
- CH 4 + 2 O 2 → CO 2 + 2 H 2 O,
и обратимая реакция процесса Габера равна
- N 2 (г) + 3H 2 (г) ↔ 2NH 3 (г) + ΔH.
Как вы читаете химические уравнения?
Первое число в наборе, например, 3H 2 O, указывает количество молекул вещества. Число в подтексте после элемента указывает количество атомов элемента. Буквы обозначают элементы Периодической таблицы.
отл. 3H 2 O означает 3 молекулы, каждая из которых содержит 2 части водорода и 1 часть кислорода.
Как сбалансировать химические уравнения?
Чтобы уравновесить химические уравнения, думайте о обеих сторонах как о балансе, который может пошатнуться.Когда одна сторона тяжелее, она падает, а другая поднимается. Химическое уравнение то же самое: когда уравнение сбалансировано, ни идентичность, ни масса реагентов и продуктов не остаются неизменными.
Обычно лучше всего сначала сбалансировать самую сложную молекулу. Большинство химических уравнений можно сбалансировать путем проверки, то есть методом проб и ошибок.
Давайте рассмотрим несколько примеров и пройдемся по ним:
Пр. № 1. Na + O 2 → Na 2 O
Для того, чтобы это уравнение было сбалансировано, в левой части должно быть такое же количество Na, что и в правой части.В нынешнем виде слева 1 Na, а справа 2 Na. Мы решаем эту проблему, ставя 2 перед Na с левой стороны, вот так:
2Na + O 2 → Na 2 O
Итак, теперь мы видим, есть 2 Na слева и 2 Na справа. Но как насчет О? Теперь мы должны проверить, сбалансированы ли «О» по обе стороны уравнения. Слева есть два знака «О», а с правой стороны только один. Это все еще несбалансированное уравнение.Чтобы исправить это, мы должны поставить 2 перед Na 2 O с правой стороны. Теперь наше уравнение гласит:
2Na + O 2 → 2Na 2 O
Обратите внимание, что 2 в правой части «распределены» как для Na 2 , так и для O. В настоящее время в левой части уравнения есть 2 Na и 2 O. В правой части всего 4 Na и 2 O. Опять же, это проблема, с обеих сторон должно быть равное количество каждого химического вещества. Чтобы исправить это, давайте добавим еще 2 Na с левой стороны.Уравнение теперь будет выглядеть так:
В настоящее время в левой части уравнения есть 2 Na и 2 O. В правой части всего 4 Na и 2 O. Опять же, это проблема, с обеих сторон должно быть равное количество каждого химического вещества. Чтобы исправить это, давайте добавим еще 2 Na с левой стороны.Уравнение теперь будет выглядеть так:
4Na + O 2 → 2Na 2 O
Итак, как вы можете видеть, у нас есть сбалансированное уравнение, потому что в левой и правой частях уравнения равное количество элементов.
Пр. № 2. P 4 + O 2 → P 4 O 10
Это уравнение не сбалансировано, поскольку в обеих сторонах уравнения содержится неравное количество «О». В левой части 4 буквы Р, а в правой 4 точки.Итак, баланс P. Давайте посмотрим на О. В левой части 2 «O», а в правой — 10 «O». Чтобы исправить это несбалансированное уравнение, мы должны поставить 5 перед O 2 с левой стороны, чтобы получить 10 ноль с обеих сторон. Давайте посмотрим, как это выглядит:
Давайте посмотрим, как это выглядит:
P 4 + 5O 2 → P 4 O 10
Уравнение теперь сбалансировано, потому что в левой и правой частях уравнения равное количество веществ.
Пр. № 3. C 2 H 5 OH + O 2 → CO 2 + H 2 O
Это уравнение более сложное, чем в предыдущих примерах; это займет несколько шагов. Самая сложная молекула здесь — C 2 H 5 OH, поэтому мы начнем с размещения коэффициента 2 перед CO 2 , чтобы сбалансировать атомы углерода.
C 2 H 5 OH + O 2 → 2CO 2 + H 2 O
Поскольку C 2 H 5 OH содержит 6 атомов водорода, атомы водорода можно уравновесить, поместив 3 перед H 2 O, например:
C 2 H 5 OH + O 2 → 2CO 2 + 3H 2 O
Наконец, мы уравновешиваем атомы кислорода.


 Например:
Например: количество молей (описано ниже).Если коэффициент не указан, предполагается, что он равен единице (1).
количество молей (описано ниже).Если коэффициент не указан, предполагается, что он равен единице (1). Если бы это было так, реакция была бы весьма впечатляющей: атом алюминия появился бы из ниоткуда, а два (2) атома железа и один (1) атом кислорода волшебным образом исчезли бы. Мы знаем из Закона о сохранении массы (который гласит, что материю нельзя ни создать, ни уничтожить)
что этого просто не может произойти. Мы должны убедиться, что количество атомов каждого конкретного элемента в реагентах равно количеству атомов того же элемента в продуктах.К
для этого мы должны вычислить относительное количество молекул каждого члена, выраженное коэффициентом члена.
Если бы это было так, реакция была бы весьма впечатляющей: атом алюминия появился бы из ниоткуда, а два (2) атома железа и один (1) атом кислорода волшебным образом исчезли бы. Мы знаем из Закона о сохранении массы (который гласит, что материю нельзя ни создать, ни уничтожить)
что этого просто не может произойти. Мы должны убедиться, что количество атомов каждого конкретного элемента в реагентах равно количеству атомов того же элемента в продуктах.К
для этого мы должны вычислить относительное количество молекул каждого члена, выраженное коэффициентом члена. Следовательно, в двух (2) молекулах вещества должно быть шесть (6) атомов Fe. Точно так же есть четыре (4) атома кислорода в одной (1) молекуле вещества, поэтому в двух (2) молекулах должно быть восемь (8) атомов кислорода.
Следовательно, в двух (2) молекулах вещества должно быть шесть (6) атомов Fe. Точно так же есть четыре (4) атома кислорода в одной (1) молекуле вещества, поэтому в двух (2) молекулах должно быть восемь (8) атомов кислорода. Изменяйте коэффициент только при балансировке уравнения. Также не забудьте отметить, что индекс, умноженный на коэффициент, дает количество атомов этого элемента. Что касается реагентов, у нас есть коэффициент три (3), умноженный на нижний индекс четыре (4), что дает 12 атомов кислорода. На стороне продукта у нас есть коэффициент четыре (4), умноженный на нижний индекс три (3), что дает 12 атомов кислорода. Теперь кислород сбалансирован.
Изменяйте коэффициент только при балансировке уравнения. Также не забудьте отметить, что индекс, умноженный на коэффициент, дает количество атомов этого элемента. Что касается реагентов, у нас есть коэффициент три (3), умноженный на нижний индекс четыре (4), что дает 12 атомов кислорода. На стороне продукта у нас есть коэффициент четыре (4), умноженный на нижний индекс три (3), что дает 12 атомов кислорода. Теперь кислород сбалансирован.

 Затем соотношение молей можно перевести в эмпирическую формулу.
Затем соотношение молей можно перевести в эмпирическую формулу.
 Мы уже обсуждали процентный состав в разделе выше. Если у нас есть только масса, все, что мы делаем, по сути, устраняем этап преобразования
от процента к массе.
Мы уже обсуждали процентный состав в разделе выше. Если у нас есть только масса, все, что мы делаем, по сути, устраняем этап преобразования
от процента к массе. Разделив 2.016 на 1.008 мы видим, что водорода требуется вдвое больше. Следовательно, эмпирическую формулу необходимо увеличить в два раза (2). Ответ:
Разделив 2.016 на 1.008 мы видим, что водорода требуется вдвое больше. Следовательно, эмпирическую формулу необходимо увеличить в два раза (2). Ответ: 
 )
)