Конспект урока по химии в 8 классе на тему: Строение электронных оболочек.
Электронное облако такой формы может занимать в атоме три положения вдоль осей координат пространства x, y и z. Это легко объяснимо: ведь все электроны заряжены отрицательно, поэтому электронные облака взаимно отталкиваются и стремятся разместиться как можно дальше друг от друга.
p-орбиталей может быть три. Энергия их, конечно, одинакова, а расположение в пространстве — разное.Составить схему последовательного заполнения электронами энергетических уровней.2 е 8 е 18 е
n=1 n=2 n=3
S S P S P d
2 е 2 е 6 е 2 е 6 е 10 е
Теперь мы можем составить схему строения электронных оболочек атомов:
Определяем общее число электронов на оболочке по порядковому номеру элемента.
Определяем число энергетических уровней в электронной оболочке. Их число равно номеру периода в таблице Д.
 И. Менделеева, в котором находится элемент.
И. Менделеева, в котором находится элемент.Определяем число электронов на каждом энергетическом уровне.
Используя для обозначения уровня арабские цифры и обозначая орбитали буквами s и p, а число электронов данной орбитали арабской цифрой вверху справа над буквой, изображаем строение атомов более полными электронными формулами. Ученые условились обозначать каждую атомную орбиталь квантовой ячейкой — квадратиком на энергетической диаграмме:
На s-подуровне может находиться одна атомная орбиталь
а на p—подуровне их может быть уже три —
(в соответствии с тремя осями координат):
Орбиталей d— и f—подуровня в атоме может быть уже пять и семь соответственно:
Пример
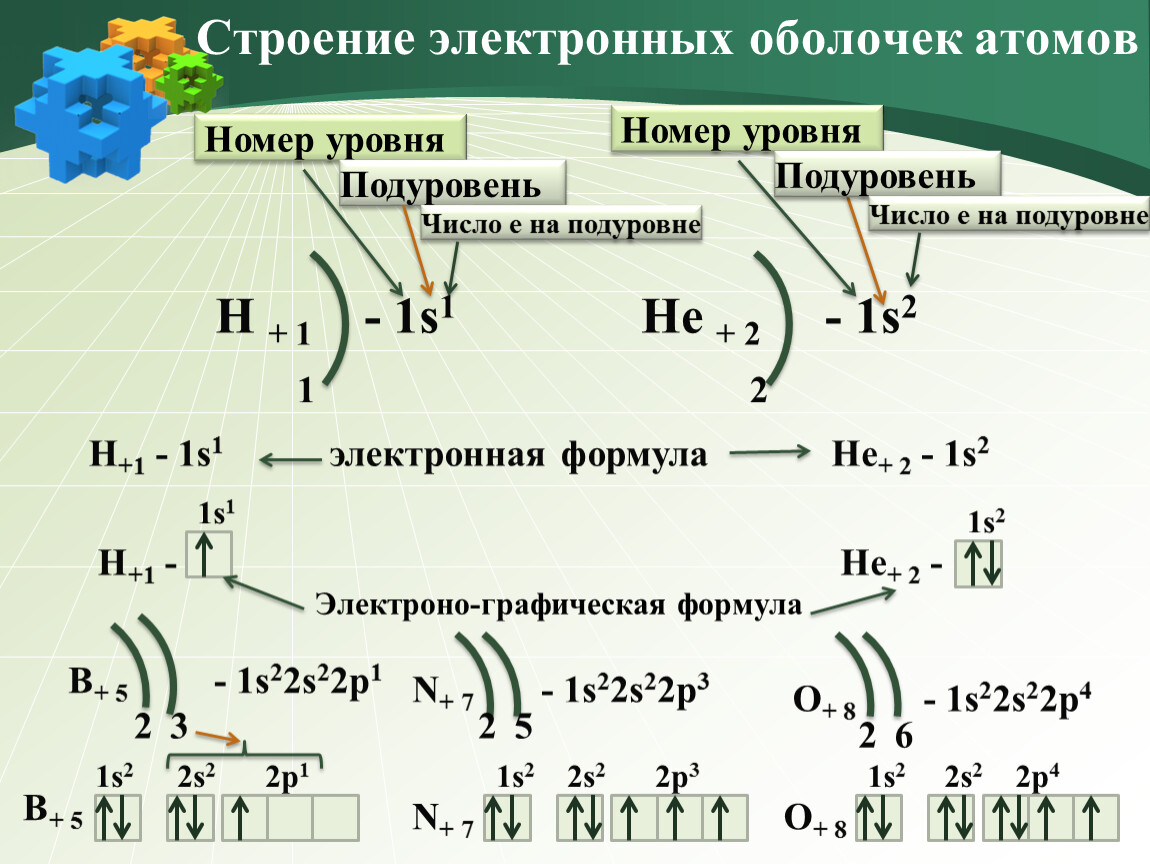
Ядро атома водорода имеет заряд +1, поэтому вокруг его ядра движется только один электрон на единственном энергетическом уровне. Запишем электронную конфигурацию атома водорода (слайд №3).
Запишем электронную конфигурацию атома водорода (слайд №3).
Элемент № 3- литий. Ядро лития имеет заряд +3,следовательно, в атоме лития три электрона. Два из них находятся на первом энергетическом уровне, а третий электрон начинает заполнять второй энергетический уровень. Сначала заполняется s-орбиталь первого уровня, потом s-орбиталь второго уровня (слайд №5).
III. Закрепление нового материала.
Задание для класса:
1. Изобразите строение атомов следующих элементов:
а) азота (слайд №9).
б) фосфора
в) магния
2. Сравните строение атомов
а) бора и фтора (слайд №7,11).
б) кислорода и серы(слайд №10).
3. По данным о распределении валентных электронов найдите элемент:
а) 2s1
б) 2s22p4
в) 3s23p6
г) 3d104s1
д) 4s24p3
е) 4s24p5
ж) 3s23p4
IV. Итоги урока.
Итоги урока.
Давайте подведем итоги урока. Что мы сегодня узнали нового?
Электрон не имеет траектории и движение его происходит по орбитали.
По схеме последовательного заполнения электронами энергетических уровней научились составлять электронные формулы элементов.
Научились по электронным формулам определять химический элемент.
V. Домашнее задание: § 8, Стр. 28-30.
Нарисуйте схемы строения электронных оболочек атомов:
хлора, натрия, неона, углерода.
1. Предложил название «электрон»
1) Стони 2) Томпсон
3) Беккерель 4) Резерфорд
2. Предложил планетарную модель атома
1) Стони 2) Томпсон
3)Беккерель 4) Резёрфорд
3. Число электронов в атоме натрия равно
1)23 2)12 3)34 4)11
4. Число нейтронов в атоме 39К равно
1)39 2)58 3)26 4)20
5. Атомы какого химического элемента имеют в своем составе 5 протонов, 6 нейтронов,
6 электронов? Выберите правильный
ответ:
а) углерода, б) натрия, в) бора, г) неона.
1. Предложил название «электрон»
1) Стони 2) Томпсон
3) Беккерель 4) Резерфорд
2. Предложил планетарную модель атома
1) Стони 2) Томпсон
3)Беккерель 4) Резёрфорд
3. Число электронов в атоме натрия равно
1)23 2)12 3)34 4)11
4. Число нейтронов в атоме 39К равно
1)39 2)58 3)26 4)20
5. Атомы какого химического элемента имеют в своем составе 5 протонов, 6 нейтронов,
6 электронов? Выберите правильный
ответ:
а) углерода, б) натрия, в) бора, г) неона.
1. Предложил название «электрон»
1) Стони 2) Томпсон
3) Беккерель 4) Резерфорд
2. Предложил планетарную модель атома
1) Стони 2) Томпсон
3)Беккерель 4) Резёрфорд
3. Число электронов в атоме натрия равно
1)23 2)12 3)34 4)11
4. Число нейтронов в атоме 39К равно
1)39 2)58 3)26 4)20
5. Атомы какого химического элемента имеют в своем составе 5 протонов, 6 нейтронов,
6 электронов? Выберите правильный
ответ:
а) углерода, б) натрия, в) бора, г) неона.
Урок «Строение электронных оболочек атомов»
Урок химии в 8 классе. «______»_______________ 20___ г.
Строение электронных оболочек атомов.
Цель. Способствовать формированию представлений о электронной оболочке атомов; создать условия для формирования умений составлять электронные формулы атомов химических элементов.
Задачи.
Образовательные: объяснить физический смысл номера группы и периода, составить схемы строения атомов первых 20 элементов ПСХЭ
Развивающие: формировать умения составлять электронные формулы атомов химических элементов и их графические конфигурации на основании правил и принципов заполнения электронных оболочек атомов; развивать умения сравнивать, анализировать, выделять главное.
Воспитательные: формировать мировоззрение к окружающему миру.
Ход урока.
1. Орг. момент.
2. Актуализация знаний.
1) Из чего состоит атом?
2) Определите число протонов, нейтронов, электронов у следующих элементов: мышьяк, цезий, криптон, бром, кальций, селен.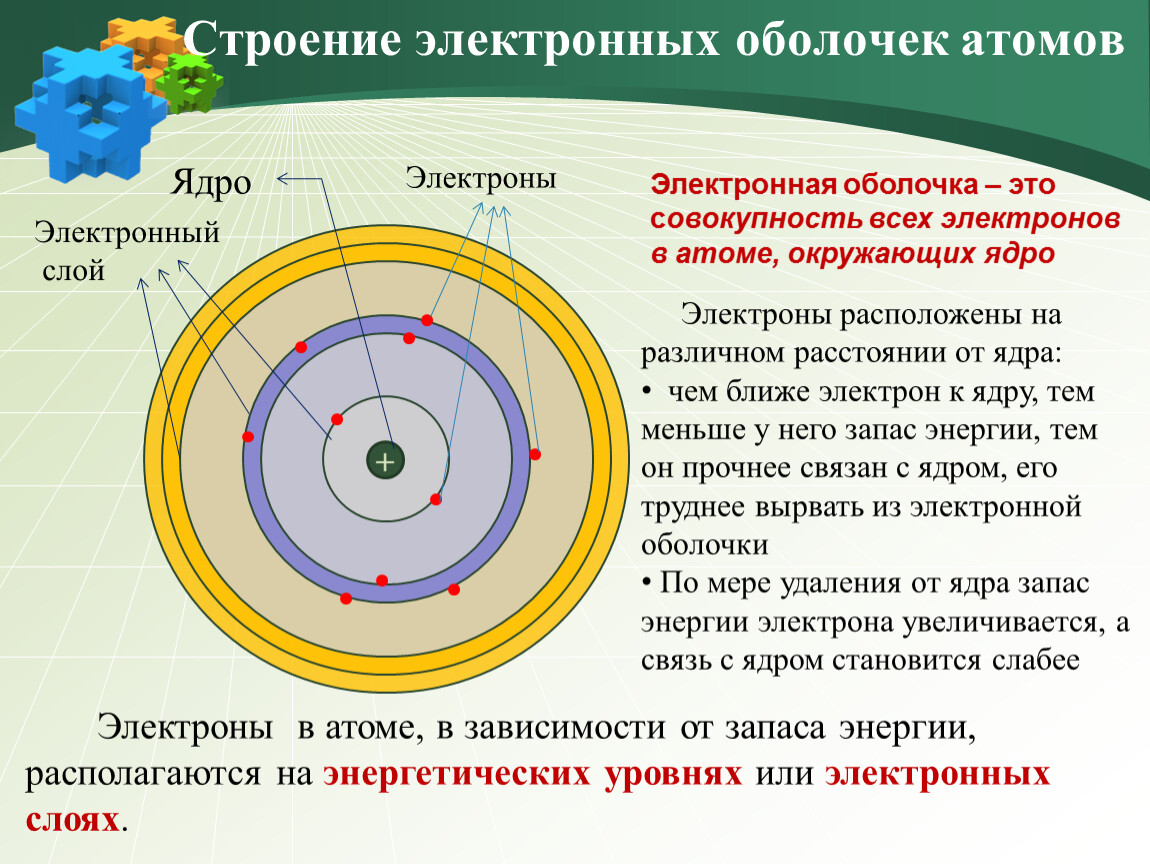
3) Определите число протонов, нейтронов, электронов у следующих у изотопов: 39К, 40К, 26 Мg, 29Al.
4) Домашнее упражнение. Упр. 2 стр.49
3. Изучение новой темы.
Электроны, двигаясь вокруг ядра атома, образуют в совокупности его электронную оболочку.
Число электронов в атоме равно заряду ядра атома и порядковому номеру.
Электроны в атоме различаются своей энергией, одни из них притягиваются к ядру сильнее, другие слабее. Чем ближе электроны к ядру, тем они прочнее связаны с ним и их труднее вырвать из электронной оболочки, чем дальше они от ядер, тем легче их оторвать.
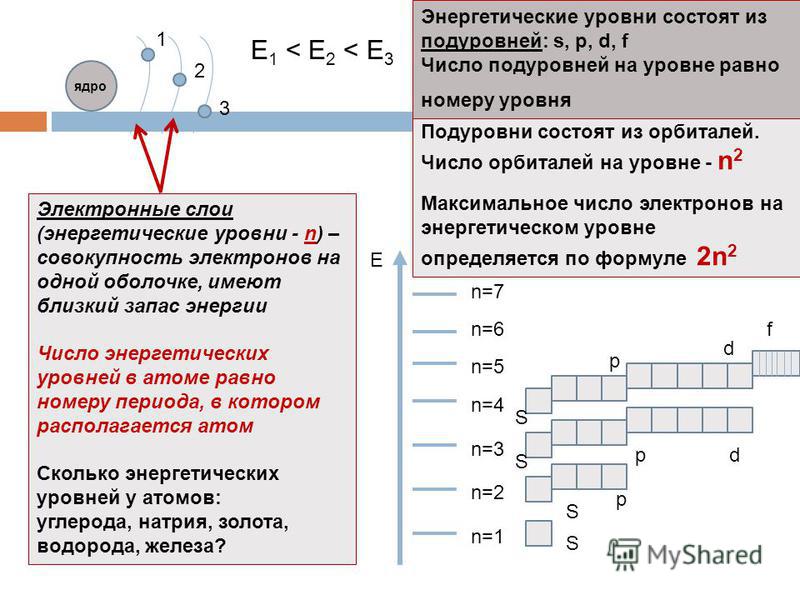
Электроны образуют электронные слои, каждый слой состоит из электронов с близким значением энергии; поэтому электронные слои называют еще энергетическими уровнями.
Число энергетических уровней равно номеру периода.
Задание. Для первых 20 химических элементов укажите число энергетических уровней.
Например, +1 Н )
Максимальное число электронов находящихся на энергетическом уровне рассчитывается по формуле 2n2, гдеn – номер уровня.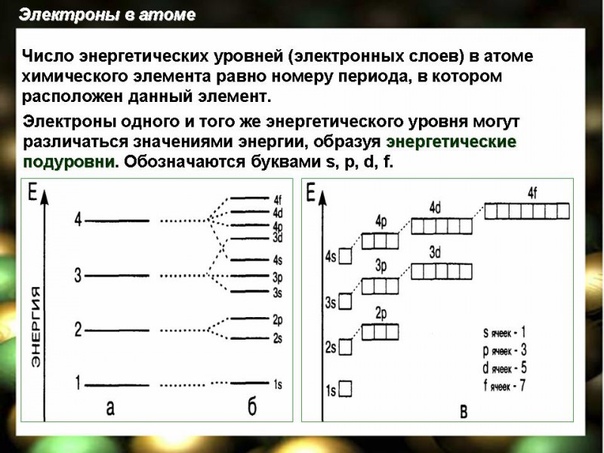
1 эн. уровень максимально содержит 2 ē;
2 эн. уровень максимально содержит 8 ē;
3 эн. уровень максимально содержит 18 ē;
Число электронов на внешнем энергетическом уровне равно номеру группы (для главных подгрупп).
Задание. Распределите электроны по энергетическим уровням для первых20 химических элементов.
Движущийся в пространстве вокруг атомного ядра электрон образует электронные облака, их еще называют орбиталями. Электронные облака имеют разную форму. (s, p,d,f)
Таким образом электронная формула атомов имеет общий вид — 1s 2s2p 3s3p4s
Максимальное число электронов на s- подуровнях 2ē, на p – 6ē.
Задание. Составьте электронные формулы для первых20 химических элементов.
Домашнее задание.§8 упр. 3 стр. 52
Строение электронных оболочек атомов. ( 2 урок)
Цель. Способствовать формированию представлений о электронной оболочке атомов; создать условия для формирования умений составлять электронные формулы атомов химических элементов.
Задачи.
Образовательные: объяснить физический смысл номера группы и периода, составить схемы строения атомов первых 20 элементов ПСХЭ
Развивающие: формировать умения составлять электронные формулы атомов химических элементов и их графические конфигурации на основании правил и принципов заполнения электронных оболочек атомов; развивать умения сравнивать, анализировать, выделять главное.
Воспитательные: формировать мировоззрение к окружающему миру.
Ход урока.
1. Орг. момент.
2. Повторение изученного материала.
Дополните фразу.
Число электронных слоев в атоме, заполняемых электронами равно номеру …
Число электронов на внешнем слое у элементов главных подгрупп равно номеру …
Максимальное число электронов на третьем энергетическом уровне атома равно….
Максимальное число электронов на s- орбитали равно …
Число электронов на внешнем энергетическом уровне у фосфора равно …
Число энергетических уровней у атома хлора равно …
Упражнения.
1. Выпишите электронные схемы, соответствующие атомам химических элементов 2-го периода периодической таблицы Д.И. Менделеева:
а) 2ē,8ē,2ē
б) 2ē, 5ē
в) 2ē,2ē
г) 2ē,8ē, 8ē,2ē
д) 2ē,8ē
е) 2ē
ж) 2ē, 7ē
2. Выпишите электронные схемы, соответствующие атомам химических элементов 2-й группы главной подгруппы периодической таблицы Д.И. Менделеева:
а) 2ē,1ē
б) 2ē,8ē,2ē
в) 2ē
г) 2ē,8ē, 8ē,2ē
д) 2ē,6ē
е) 2ē,2ē
ж) 2ē,8ē,18ē,8ē,2ē
3. Поставьте правильное значение в схемах вместо Э, х, у. Составьте электронные формулы для данных схем атомов.
+11 Э)2)х)1
+Х Э)2)8)7
+13 Э)х)8)у
+5 Э)х)у
+Х Э)2)у)4
+6 Э)х)у
4. Определите химический элемент по электронной формуле, укажите его положение в ПСХЭ Д.И. Менделеева, укажите состав ядра атома.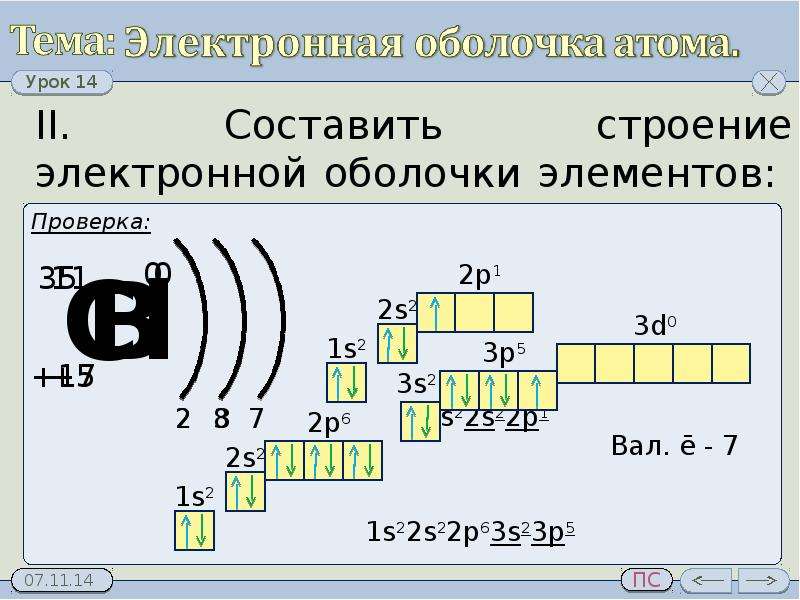
а) 1s2 2s2 2p6 3s2 3p4
б)1s2 2s2 2p4
в)1s2 2s2 2p6 3s2 3p6 4s1
Самостоятельная работа.
Дан ряд чисел: 3, 7, 9, 10, 15, 19, 22, 25, 30,32, которыми обозначены порядковые номера химических элементов в ПСХЭ Д.И. Менделеева.
1 вариант. Выпишите номер элемента 3- го периода
2 вариант. Выпишите номер элемента 7 группы главной подгруппы.
для данных элементов укажите:
Положение в ПС.
Определите число протонов и нейтронов
Составьте электронную формулу для данного элемента.
Домашнее задание.§ 8 упр.1 стр.52
Строение электронных оболочек атомов химических элементов 8
«Строение электронных оболочек атомов химических элементов» 8 класс Учитель химии МКОУ «Сибирякская СОШ» Сиражеева Л. Р.
ВСПОМНИМ ØЧему равно общее количество электронов в атоме? ØЧто такое энергетический уровень? ØКак определить число энергетических уровней? ØКак определить число электронов на внешнем уровне?
ЗАПОМНИМ Электроны, расположенные на последней электронной оболочке, называются внешними. Ø Число внешних электронов для химических элементов главных подгрупп равно номеру группы, в которой находится элемент Ø
Ø Число внешних электронов для химических элементов главных подгрупп равно номеру группы, в которой находится элемент Ø
Проверим домашнее задание Задания 1. По данным определить, какой это элемент Вариант I а)2 e 8 e 3 e б)2 e 1 e в)2 e 8 e 8 e 2. Определить а)2 период элемент по его 3 группа главная положению в ПСХЭ подгруппа б)5 период 1 группа побочная подгруппа Вариант II а)2 e 4 e б)2 e 8 e 7 e в)1 e а)4 период 3 группа побочная подгруппа б)2 период 6 группа главная подгруппа
Проверьте себя и поставьте оценку, равную количеству правильных ответов Задание 1 Вариант I — а) Al б) Li в)Ar Вариант II — а) С б) С l в)Н Задание 2 Вариант I — а)В б)Аg Вариант II — а) Ga б) O
ТЕМА УРОКА «Строение электронных оболочек атомов химических элементов № 1 -20»
Цель урока: Ø научиться составлять электронные формулы атомов элементов первых трех периодов ПСХЭ; Ø объяснять зависимость и закономерные изменения свойств химических элементов от электронного строения их атомов.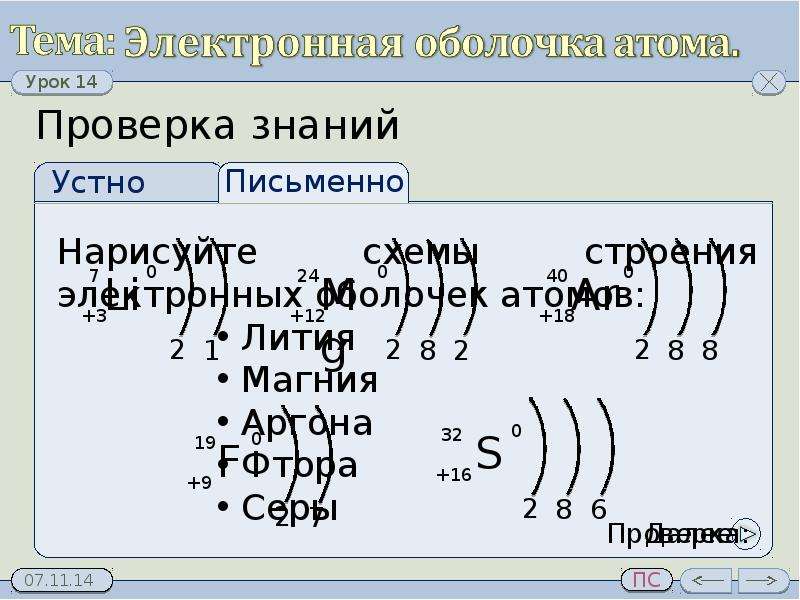
Электронная оболочка Ø Совокупность всех электронов в атоме, окружающих ядро Ø Каждый электрон имеет свою траекторию движения и запас энергии Ø Электроны расположены на различном расстоянии от ядра: чем ближе электрон к ядру, тем он прочнее с ним связан, его труднее вырвать из электронной оболочки Ø По мере удаления от ядра запас энергии электрона увеличивается, а связь с ядром становится слабее
Форма электронных облаков (орбиталей) Область наиболее вероятного местонахождения электрона в пространстве S – облако p- облака d — облака http: //files. school-collection. edu. ru/dlrstore/bb 14 a 035 -aae 7 -11 db-abbd-0800200 c 9 a 66/ch 08_08_08. swf
Алгоритм составления электронных формул. Записываем знак химического элемента и заряд ядра его атома – он равен порядковому номеру элемента. Ø Определяем количество энергетических уровней (оно равно номеру периода) и количество электронов на каждом уровне. Ø Составляем электронную формулу, учитывая порядок заполнения каждого уровня – сначала sэлектроны, затем – р-электроны: номер уровня, вид орбитали и количество электронов на ней. Ø http: //files. school-collection. edu. ru/dlrstore/bb 14 a 033 -aae 7 -11 db-abbd 0800200 c 9 a 66/ch 08_08_06. swf
Ø Составляем электронную формулу, учитывая порядок заполнения каждого уровня – сначала sэлектроны, затем – р-электроны: номер уровня, вид орбитали и количество электронов на ней. Ø http: //files. school-collection. edu. ru/dlrstore/bb 14 a 033 -aae 7 -11 db-abbd 0800200 c 9 a 66/ch 08_08_06. swf
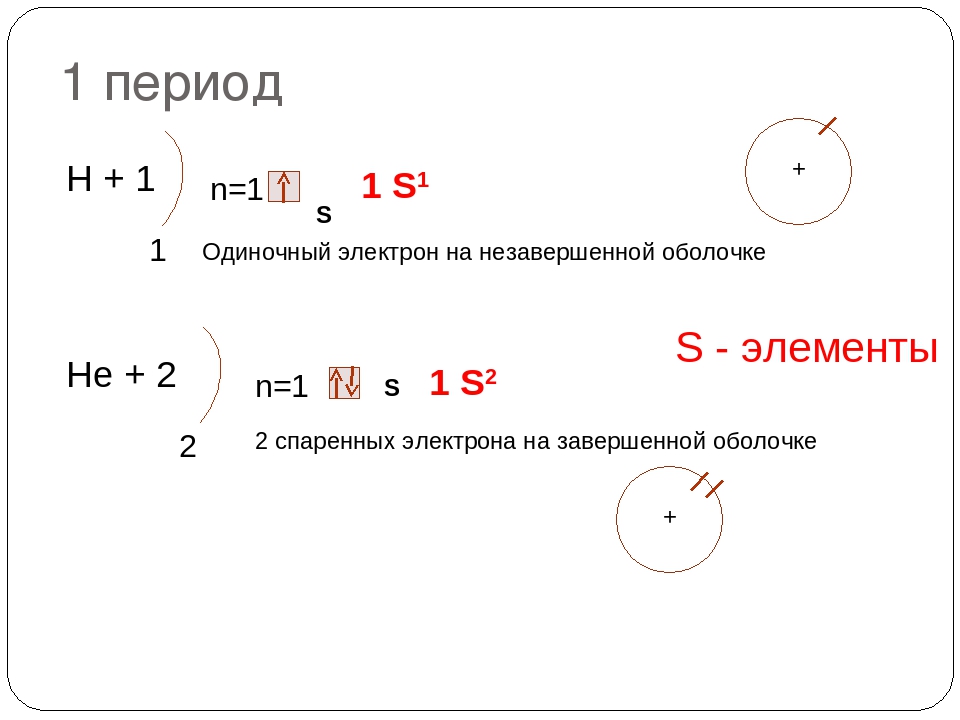
1 период Н+1 n=1 1 S 1 Одиночный электрон на незавершенной оболочке Нe + 2 n=1 2 S 1 S 2 S — элементы 2 спаренных электрона на завершенной оболочке
2 период Li + 3 p n=2 2 1 Be + 4 S n=1 S n=2 2 2 n=1 n=2 B+5 n=1 2 3 1 S 2 2 S 1 S — элементы p S S 1 S 2 2 S 2 p S S р — элемент 1 S 2 2 p 1
2 период С+6 p n=2 2 4 N+7 S 1 S 2 2 p 2 S n=1 n=2 2 5 n=1 n=2 O+8 n=1 2 6 р — элементы p S 1 S 2 2 p 3 S p S S 1 S 2 2 p 4
2 период F+9 n=2 2 7 S 1 S 2 2 p 5 S n=1 Ne + 10 2 8 р — элементы p n=2 n=1 p S 1 S 2 2 p 6 S 3 период Na + 11 d n=3 n=2 2 8 1 n=1 p S S S 1 p S 2 2 S — элемент S 2 2 p 6 3 S 1
3 период S d p n=3 Mg + 12 S- р — элементы p n=2 1 S 2 2 p 6 3 S 2 S S 2 8 2 n=1 S Al + 13 2 8 3 n=2 p S n=1 1 S 2 2 p 63 S 2 3 p 1 d n=3 Si + 14 n=2 2 8 4 n=1 S p p S S 1 S 2 2 p 6 3 S 3 p 2
3 период S p d n=3 P + 15 p n=2 1 S 2 2 p 6 3 S 2 3 p 3 S 2 8 5 n=1 р — элементы S S n=3 n=2 S + 16 2 8 6 d p S 1 S 2 2 p 63 S 2 3 p 4 n=1 d n=3 Cl + 17 n=2 2 8 7 n=1 S S S p p 1 S 2 2 p 6 3 S 3 p 5
3 период S n=3 Ar + 18 n=2 S 2 8 8 n=1 p d р — элемент 1 S 2 2 p 6 3 S 2 3 p 6 p S K + 19 1 S 2 2 p 63 S 2 3 p 6 4 S 1 2 8 8 1 Ca + 20 2 8 8 2 1 S 2 2 p 6 3 S 2 3 p 64 S 2
Физкультминутка Следим глазами
Закрепление материала Ø Определить число орбиталей http: //files. school-collection. edu. ru/dlrstore/bb 14 a 031 -aae 7 -11 db-abbd-0800200 c 9 a 66/ch 08_08_04. swf Ø Определить число электронов на внешнем электронном уровне http: //files. school-collection. edu. ru/dlrstore/bb 14 a 032 -aae 7 -11 db-abbd-0800200 c 9 a 66/ch 08_08_05. swf Ø Определить общее число электронов на энергетическом уровне http: //files. school-collection. edu. ru/dlrstore/bb 14 a 030 -aae 7 -11 db-abbd-0800200 c 9 a 66/ch 08_08_03. swf Ø тест «электронные формулы атомов элементов» http: //files. school-collection. edu. ru/dlrstore/bb 14 a 038 -aae 7 -11 db-abbd 0800200 c 9 a 66/ch 08_08_11. swf
Ответьте на вопросы ØКакие данные об особенностях строения атома отражает электронная формула? ØВ чем заключается причина сходства элементов, расположенных в одной группе?
Выводы Причина сходства элементов заключается в одинаковом строении внешних энергетических уровней их атомов Ø Одинаковое строение внешних энергетических уровней периодически (т.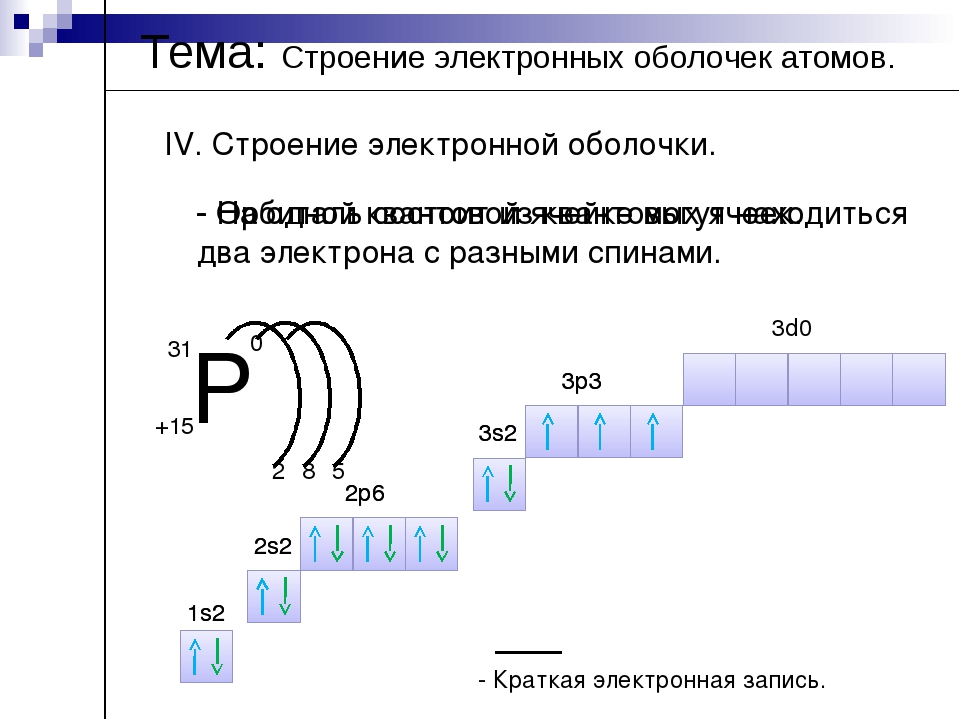
Домашнее задание Ø Повторить основные понятия темы на странице с. 46 -53 учебника Ø Задание № 2, 3 письменно
Ресурсы http: //fcior. edu. ru – сайт Федерального центра информационнообразовательных ресурсов. ФЦИОР реализует концепцию «единого окна» для доступа к любым электронным образовательным ресурсам системы образования РФ и предоставление единой современной технологической платформы для существующих и вновь создаваемых электронных образовательных ресурсов. http: //rusedu. ru – Архив учебных программ и презентаций. На сайте представлены разработки уроков с использованием ИКТ, программы, пособия и методики. http: //openclass. ru – «Открытый класс» . http: //school–collection. edu. ru — «Единая коллекция цифровых образовательных ресурсов» http: //lyalyasirazhee. ucoz. ru — адрес личного сайта
что такое нейтрон, протон и электрон
Основные положения атомно-молекулярной теории. Основные стехиометрические законы химии. Законы сохранения массы вещества, постоянства состава, объемных отношений, Авогадро, эквивалентов. Молярная масса эквивалента. Способы определения атомных и молекулярных масс.
Основные стехиометрические законы химии. Законы сохранения массы вещества, постоянства состава, объемных отношений, Авогадро, эквивалентов. Молярная масса эквивалента. Способы определения атомных и молекулярных масс.
Все веществ состоят из молекул.
Молекула — это наименьшая частица вещества, сохраняющая свойства тогo вещества. Молекулы разрушаются при химических реакциях.
Между молекулами имеются промежутки: у газов — самые большие, у твердых веществ — самые маленькие.
Молекулы двигаются беспорядочно и непрерывно.
Молекулы одного вещества имеют одинаковый состав и свойства, молекулы разных веществ отличаются друг от. друга по составу и свойствам.
Молекулы состоят из атомов.
Атом — это электронейтральная частица, состоящая из положительно заряженного ядра и электронов.
Химический элемент — вид атомов с одинаковым положительным зарядом ядра.
Атомы одного элемента образуют молекулы простого вещества (02, Н2, О3, Fe. ..). Атомы разных элементов образуют молекулы сложного вещества (Н20, Na2S04, FeClg…).
..). Атомы разных элементов образуют молекулы сложного вещества (Н20, Na2S04, FeClg…).
Закон сохранения массы
Масса веществ, вступивших в химическую реакцию, равна массе веществ, образующихся в результате реакции.
ученым М.В. Ломоносовым.
Закон постоянства состава
Всякое химически чистое соединение независимо от способа его получения имеет вполне определенный состав.
На основании этого закона состав веществ выражается химической формулой с помощью химических знаков и индексов. Например, Н 2 О, СН 4 , С 2 Н 5 ОН и т.п.
Закон постоянства состава справедлив для веществ молекулярного строения.
Состав соединений молекулярного строения, то есть состоящих из молекул, является постоянным независимо от способа получения.
Химические элементы соединяются друг с другом в строго определенных количествах, соответствующих их эквивалентам.
Эквивалентное соотношение означает одинаковое число моль эквивалентов. Т.о. закон эквивалентов можно сформулировать иначе: число моль эквивалентов для всех веществ, участвующих в реакции, одинаково.
Т.о. закон эквивалентов можно сформулировать иначе: число моль эквивалентов для всех веществ, участвующих в реакции, одинаково.
Закон кратных отношений
Кратных отношений закон Дальтона, один из основных законов химии: если два вещества (простых или сложных) образуют друг с другом более одного соединения, то массы одного вещества, приходящиеся на одну и ту же массу другого вещества, относятся как целые числа, обычно небольшие.
Закон объемных отношений
Гей-Люссак, 1808 г.
«Объемы газов, вступающих в химические реакции, и объемы газов, образующихся в результате реакции, относятся между собой как небольшие целые числа».Следствие. Стехиометрические коэффициенты в уравнениях химических реакций для молекул газообразных веществ показывают, в каких объемных отношениях реагируют или получаются газообразные вещества.
V 1:V 2:V 3 = ν 1:ν 2:ν 3 .
Периодический закон и периодическая система элементов Д. И.Менделеева. Основные представления о строении атома и ядра. Периодически изменяющиеся и периодически неизменяющиеся свойства атомов и ионов. Варианты периодической таблицы.
И.Менделеева. Основные представления о строении атома и ядра. Периодически изменяющиеся и периодически неизменяющиеся свойства атомов и ионов. Варианты периодической таблицы.
Периодические изменения свойств химических элементов обусловлены правильным повторением электронной конфигурации внешнего энергетического уровня (валентных электронов) их атомов с увеличением заряда ядра.
Графическим изображением периодического закона является периодическая таблица. Она содержит 7 периодов и 8 групп.
Период — горизонтальные ряды элементов с одинаковым максимальным значением главного квантового числа валентных электронов.
Номер периода обозначает число энергетических уровней в атоме элемента.
Периоды могут состоять из 2 (первый), 8 (второй и третий), 18 (четвертый и пятый) или 32 (шестой) элементов, в зависимости от количества электронов на внешнем энергетическом уровне. Последний, седьмой период незавершен.
Все периоды (кроме первого) начинаются щелочным металлом (s-элементом), а заканчиваются благородным газом (ns 2 np 6).
Металлические свойства рассматриваются, как способность атомов элементов легко отдавать электроны, а неметаллические — присоединять электроны из-за стремления атомов приобрести устойчивую конфигурацию с заполненными подуровнями.
Группы — вертикальные столбцы элементов с одинаковым числом валентных электронов, равным номеру группы. Различают главные и побочные подгруппы.
Главные подгруппы состоят из элементов малых и больших периодов, валентные электроны которых расположены на внешних ns- и np- подуровнях.
Побочные подгруппы состоят из элементов только больших периодов. Их валентные электроны находятся на внешнем ns- подуровне и внутреннем (n — 1) d- подуровне (или (n — 2) f- подуровне).
В зависимости от того, какой подуровень (s-, p-, d- или f-) заполняется валентными электронами, элементы периодической системы подразделяются на:
s- элементы (элементы главной подгруппы I и II групп),
p- элементы (элементы главных подгрупп III — VII групп),
d- элементы (элементы побочных подгрупп),
f- элементы (лантаноиды, актиноиды).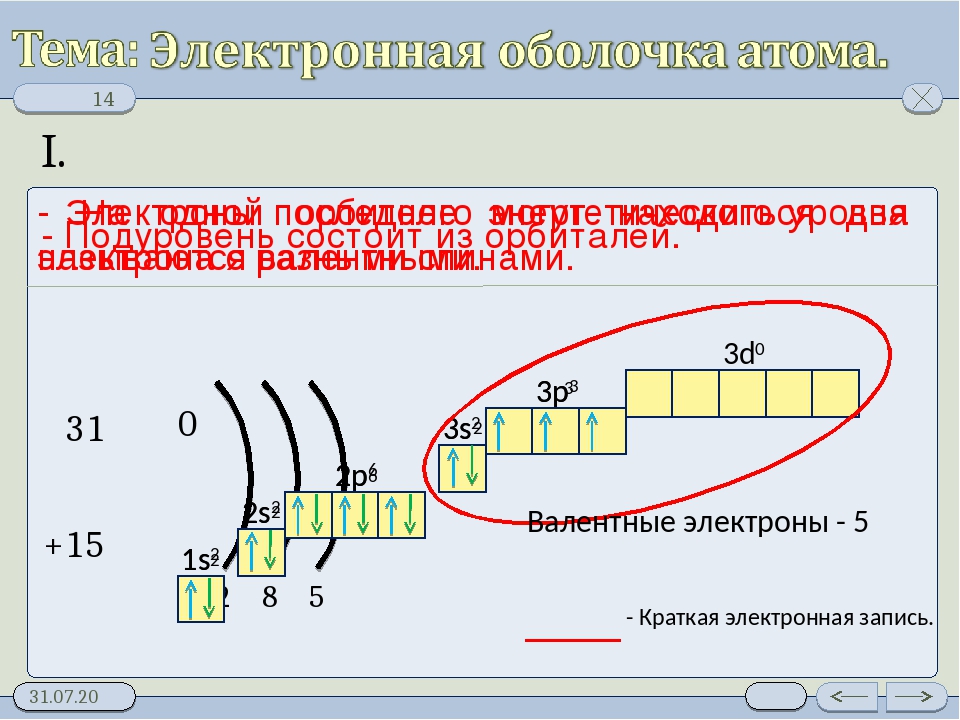
Состав атома.
Атом состоит из атомного ядра и электронной оболочки.
Ядро атома состоит из протонов (p + ) и нейтронов (n 0).
Для характеристики атомных ядер вводится ряд обозначений. Число протонов, входящих в состав атомного ядра, обозначают символом Z и называют зарядовым числом или атомным номером (это порядковый номер в периодической таблице Менделеева). Заряд ядра равен Ze , где e – элементарный заряд. Число нейтронов обозначают символом N .
Общее число нуклонов (т. е. протонов и нейтронов) называют массовым числом A :
Ядра химических элементов обозначают символом , где X – химический символ элемента. Например,
– водород, – гелий, – углерод, – кислород, – уран.
Изотоп — совокупность атомов одного элемента с одинаковым числом нейтронов в ядре (или вид атомов с одинаковым числом протонов и одинаковым числом нейтронов в ядре).
Разные изотопы отличаются друг от друга числом нейтронов в ядрах их атомов.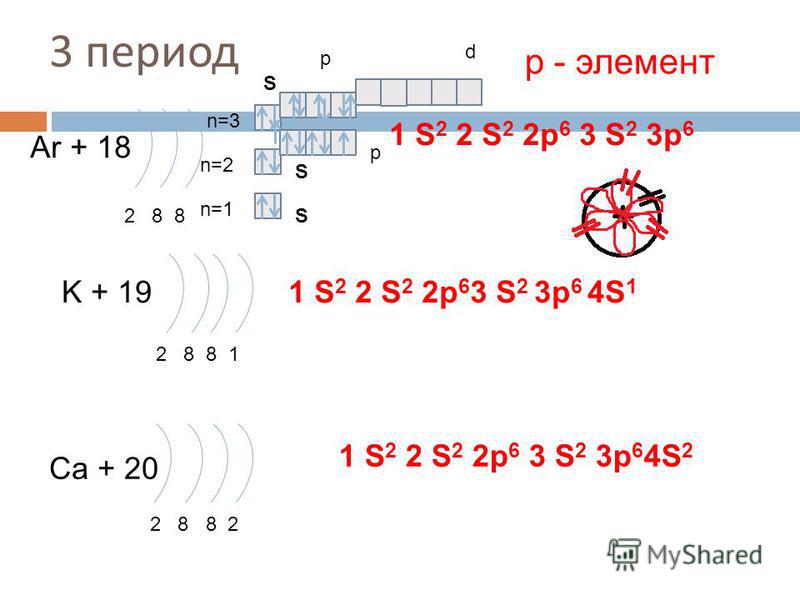
Обозначение отдельного атома или изотопа: (Э — символ элемента), например: .
Строение электронной оболочки атома
Атомная орбиталь — состояние электрона в атоме. Условное обозначение орбитали — . Каждой орбитали соответствует электронное облако.
Орбитали реальных атомов в основном (невозбужденном) состоянии бывают четырех типов: s , p , d и f
Однотипные орбитали одного уровня группируются в электронные (энергетические) подуровни:
s -подуровень (состоит из одной s -орбитали), условное обозначение — .
p -подуровень (состоит из трех p
d -подуровень (состоит из пяти d -орбиталей), условное обозначение — .
f -подуровень (состоит из семи f -орбиталей), условное обозначение — .
Энергии орбиталей одного подуровня одинаковы.
При обозначении подуровней к символу подуровня добавляется номер слоя (электронного уровня), например: 2s , 3p , 5d означает s -подуровень второго уровня, p -подуровень третьего уровня, d -подуровень пятого уровня.
Общее число подуровней на одном уровне равно номеру уровня n . Общее число орбиталей на одном уровне равно n 2 . Соответственно этому, общее число облаков в одном слое равно также n 2 .
Обозначения: — свободная орбиталь (без электронов), — орбиталь с неспаренным электроном, — орбиталь с электронной парой (с двумя электронами).
Порядок заполнения электронами орбиталей атома определяется тремя законами природы (формулировки даны упрощенно):
1. Принцип наименьшей энергии — электроны заполняют орбитали в порядке возрастания энергии орбиталей.
2. Принцип Паули — на одной орбитали не может быть больше двух электронов.
3. Правило Хунда — в пределах подуровня электроны сначала заполняют свободные орбитали (по одному), и лишь после этого образуют электронные пары.
Общее число электронов на электронном уровне (или в электронном слое) равно 2n 2 .
Распределение подуровней по энергиям выражается рядом (в прядке увеличения энергии):
1s , 2s , 2p , 3s , 3p , 4s , 3d , 4p , 5s , 4d , 5p , 6s , 4f , 5d , 6p , 7s , 5f , 6d , 7p . ..
..
Примеры электронного строения атомов:
Валентные электроны — электроны атома, которые могут принимать участие в образовании химических связей. У любого атома это все внешние электроны плюс те предвнешние электроны, энергия которых больше, чем у внешних.
Например: у атома Ca внешние электроны — 4s 2 , они же и валентные; у атома Fe внешние электроны — 4s 2 , но у него есть 3d 6 , следовательно у атома железа 8 валентных электронов. Валентная электронная формула атома кальция — 4s 2 , а атома железа — 4s 2 3d 6 .
Возьмем мысленно атом любого химического элемента. В каких состояниях находятся в нем электроны? Из предыдущего параграфа ясно, что для каждого электрона необходимо знать значения четырех квантовых чисел, характеризующих его состояние. Но нам пока не известно, сколько электронов находятся в каждом состоянии. Какие состояния более, а какие менее вероятны? Ответ на эти вопросы дают два важнейших принципа (закона). Первый из них открыт в 1925 г. швейцарским физиком В. Паули (1900-1958) и назван его именем — принцип Паули.
Первый из них открыт в 1925 г. швейцарским физиком В. Паули (1900-1958) и назван его именем — принцип Паули.
Все электроны в атоме находятся в разных состояниях, т.е. характеризуются разными наборами четырех квантовых чисел.
В данном случае понятием «принцип» обозначен один из фундаментальных законов природы, который делает атом тем, что он есть, — микрочастицей вещества с индивидуальной электронной структурой для каждого химического элемента. Роль принципа Паули в природе становится яснее, если представить себе, что он не действует. Тогда электронное окружение ядра атома теряет структурную определенность. Все электроны скатываются в какое-то одно наиболее выгодное состояние.
Следует отметить, что этот закон справедлив для всех фермионов.
Из принципа Паули вытекает следствие, определяющее вместимость орбитали, т.е. число электронов, которые могут образовать единое электронное облако. Выбрав любую из орбиталей, мы фиксируем первые три квантовых числа. Например, для орбитали 2р 2: п = 2, /= 1, mj= 0. Но можно изменять еще спиновое квантовое число m s Получаются два набора квантовых чисел:
Например, для орбитали 2р 2: п = 2, /= 1, mj= 0. Но можно изменять еще спиновое квантовое число m s Получаются два набора квантовых чисел:
Следовательно, орбиталь вмещает не более двух электронов, и в атомах могут быть одно- и двухэлектронные облака.
Два электрона, находящиеся на одной орбитали, называют электронной парой.
Зная вместимость орбитали, легко понять, что вместимость энергетического подуровня равна удвоенному числу орбиталей (табл. 5.1).
Таблица 5.1
Структура подуровней в атомах
Совокупность электронов одного энергетического подуровня называют подоболочкой атома.
Вместимость энергетического уровня складывается из вместимости подуровней (табл. 5.2). В первой колонке таблицы кроме значений главного квантового числа приведены буквенные обозначения для электронных оболочек атома.
Таблица 5.2
Структура энергетических уровней в атомах
Совокупность электронов одного энергетического уровня называют оболочкой атома.
Реальное заполнение («заселение») орбиталей, подуровней и уровней электронами определяет второй принцип — принцип наименьшей энергии.
Основному (устойчивому) состоянию атома соответствует минимальная суммарная энергия электронов.
Состояния атома с повышенной энергией называются возбужденными. Атом в возбужденном состоянии неустойчив в том смысле, что за очень короткое время (~10 -8 с) переходит в основное состояние, излучая кванты энергии.
Любая физическая система тем устойчивее, чем меньше ее потенциальная энергия. Поэтому мы неизменно наблюдаем, что брошенное тело надает на землю или скатывается с горки вниз, согнутая пружина выпрямляется и т.д. Также и электронные оболочки атомов находятся в устойчивом состоянии, если общий запас энергии электронов минимален. Набор возможных энергетических состояний атома мы уже знаем (см. рис. 5.7). Рассмотрим, как соответствующие подуровни и уровни заселяются электронами. При этом строго выполняется принцип Паули, который имеет приоритетное значение по отношению к принципу наименьшей энергии и не нарушается. Будем изображать электронную структуру атомов с помощью энергетических диаграмм и электронных формул. Энергетическая диаграмма представляет собой часть общей последовательности подуровней (см. рис. 5.7), содержащую заселенные подуровни. В электронной формуле перечисляются заселенные подуровни в порядке возрастания энергии с указанием числа электронов верхними индексами. Первые два элемента периодической системы можно представить диаграммами I и II. Па диаграмме показано, что положение 1л*-уровня в атоме гелия ниже, чем в атоме водорода, так как у гелия заряд ядра больше и электроны сильнее притягиваются к ядру. Вместимость первого энергетического уровня в атоме гелия исчерпана.
Будем изображать электронную структуру атомов с помощью энергетических диаграмм и электронных формул. Энергетическая диаграмма представляет собой часть общей последовательности подуровней (см. рис. 5.7), содержащую заселенные подуровни. В электронной формуле перечисляются заселенные подуровни в порядке возрастания энергии с указанием числа электронов верхними индексами. Первые два элемента периодической системы можно представить диаграммами I и II. Па диаграмме показано, что положение 1л*-уровня в атоме гелия ниже, чем в атоме водорода, так как у гелия заряд ядра больше и электроны сильнее притягиваются к ядру. Вместимость первого энергетического уровня в атоме гелия исчерпана.
У следующих за гелием элементов заселяется второй энергетический уровень. Рассмотрим энергетические диаграммы трех ближайших элементов — лития, бериллия и бора (диаграммы III, IV и V).
У лития и бериллия заселяется подуровень 2s. Пятый электрон атома бора начинает заселение подуровня 2р в соответствии с принципом Паули.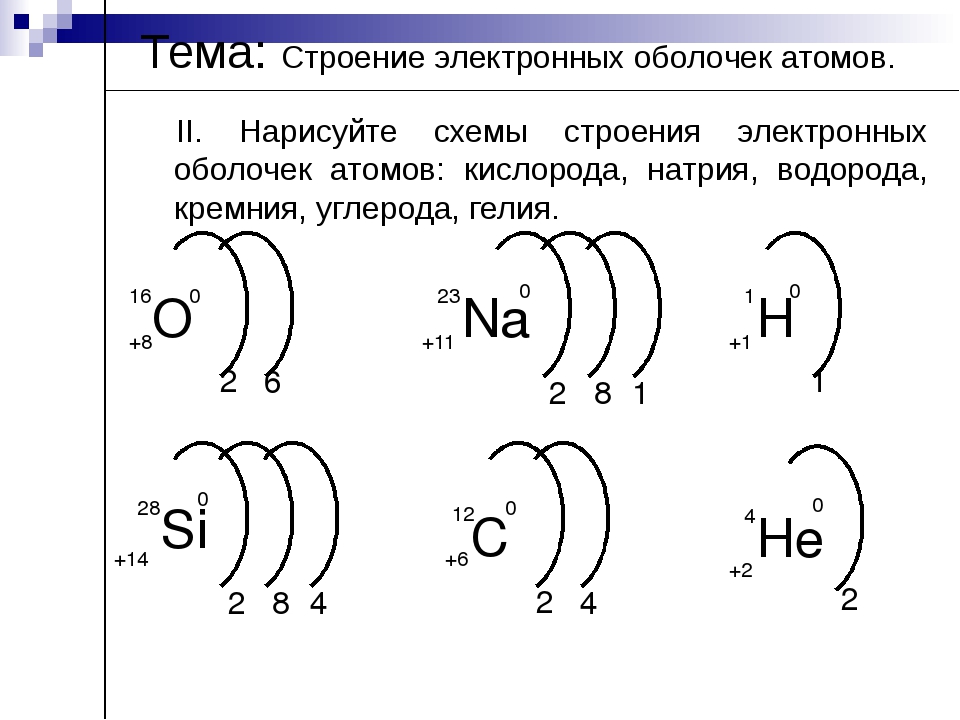 У атомов углерода и азота заселение этого подуровня продолжается (диаграммы VI и VII).
У атомов углерода и азота заселение этого подуровня продолжается (диаграммы VI и VII).
В структуре этих элементов проявляется еще одна важная закономерность формирования электронных оболочек — правило Хунда (1927).
Основном} 7 состоянию атома соответствует заселение электронами максимального числа энергетически равноценных орбиталей. При этом электроны имеют одинаковые значения спиновых квантовых чисел (все +1/2 или все -1/2).
При рассмотрении энергетической диаграммы атома кажется, что перенесение электрона между одинаковыми орбиталями 2р не изменяет его энергию. В действительности при движении электронов по разным орбиталям уменьшается отталкивание между ними, за счет чего потенциальная энергия все-таки уменьшается. Электроны, занимающие орбитали поодиночке, называют неспаренными. Далее при изучении природы химических связей мы увидим, что валентность атомов определяется числом неспаренных электронов. Азот имеет три неспаренных электрона, и он действительно трехвалентен.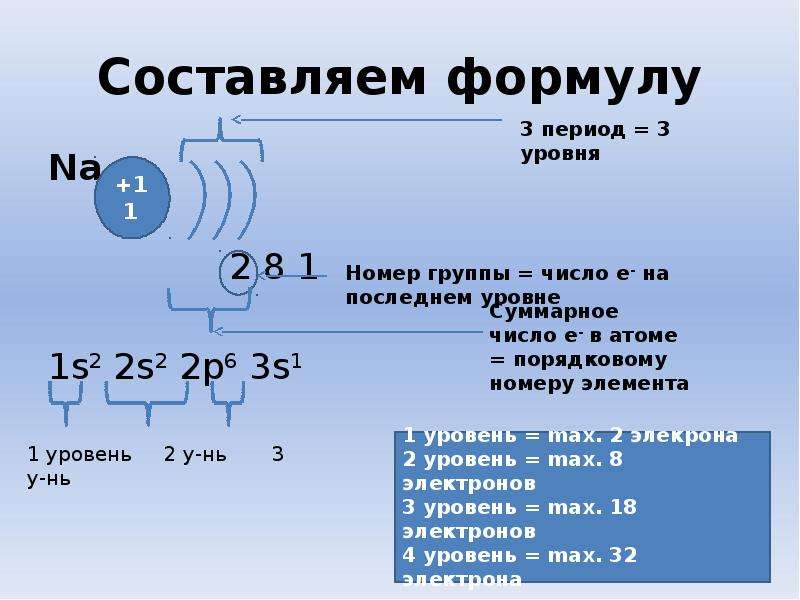 Достаточно вспомнить формулу аммиака NH 3 . Углерод, согласно диаграмме, двухвалентен. Однако при поглощении сравнительно небольшой энергии один электрон переносится с подуровня 25 на подуровень 2р. Углерод переходит в возбужденное состояние с электронной формулой s 2 2s { 2p s . В этом состоянии он имеет четыре неспаренных электрона. Свободный атом может пребывать в возбужденном состоянии лишь очень короткое время. Но, оказываясь в составе молекулы, атом получает добавочные электроны для заселения орбиталей. После этого исключается возможность перехода в основное состояние, и атом углерода остается четырехвалентным. Фактически, энергия, затраченная на возбуждение электрона, компенсируется энергией образования дополнительных химических связей.
Достаточно вспомнить формулу аммиака NH 3 . Углерод, согласно диаграмме, двухвалентен. Однако при поглощении сравнительно небольшой энергии один электрон переносится с подуровня 25 на подуровень 2р. Углерод переходит в возбужденное состояние с электронной формулой s 2 2s { 2p s . В этом состоянии он имеет четыре неспаренных электрона. Свободный атом может пребывать в возбужденном состоянии лишь очень короткое время. Но, оказываясь в составе молекулы, атом получает добавочные электроны для заселения орбиталей. После этого исключается возможность перехода в основное состояние, и атом углерода остается четырехвалентным. Фактически, энергия, затраченная на возбуждение электрона, компенсируется энергией образования дополнительных химических связей.
Заселение 2р-орби галей вторыми электронами происходит у кислорода, фтора и неона (диаграммы VIII, IX, X). При этом последовательно уменьшается число оставшихся неспаренных электронов и, соответственно, валентность атомов. Это соответствует элементарным знаниям о свойствах кислорода, фтора и неона: кислород двухвалентен, фтор одновалентен, а неон химических связей не образует, т. е. его валентность равна нулю.
е. его валентность равна нулю.
Мы увидели, что у элементов от лития до неона заселяется электронами второй энергетический уровень, и именно поэтому они составляют
- 2- й период таблицы Менделеева. У следующего за неоном натрия начинается заселение третьего энергетического уровня, и далее формируется
- 3- й период по мере заселения подуровней 35 и 3р. Энергетические диаграммы и электронные формулы элементов от натрия до аргона можно представить в сокращенной форме, обозначив повторяющийся у них набор электронов неона как . Смысл сокращенной электронной формулы заключается в том, что в ней указываются только валентные электроны атома. Остальные электроны, составляющие электронный остов атома , для химии имеют второстепенное значение. В качестве примера напишем сокращенные формулы и диаграммы натрия, кремния и аргона (диаграммы XI, XII и XIII).
Число химических элементов во 2-м и 3-м периодах определяется суммарной вместимостью 5- и /^-подуровней, составляющей восемь электронов. Таким образом, получает физическое объяснение наличие в таблице Менделеева именно восьми групп. Становится понятной и причина наблюдаемого сходства химических элементов в группах. Сравнивая энергетические диаграммы элементов одной и той же группы — лития и натрия, углерода и кремния и т.д., — мы замечаем, что они характеризуются одинаковой заселенностью внешнего энергетического уровня. Из этого вытекает, в первую очередь, одинаковая валентность атомов, чем и обусловлено сходство химических свойств. Но электронные структуры атомов, взятые в целом, различны. От периода к периоду увеличивается число электронных оболочек, что влечет за собой и увеличение радиусов атомов. Поэтому, как уже отмечалось, наряду со сходством наблюдается и определенная направленность в изменении свойств.
Таким образом, получает физическое объяснение наличие в таблице Менделеева именно восьми групп. Становится понятной и причина наблюдаемого сходства химических элементов в группах. Сравнивая энергетические диаграммы элементов одной и той же группы — лития и натрия, углерода и кремния и т.д., — мы замечаем, что они характеризуются одинаковой заселенностью внешнего энергетического уровня. Из этого вытекает, в первую очередь, одинаковая валентность атомов, чем и обусловлено сходство химических свойств. Но электронные структуры атомов, взятые в целом, различны. От периода к периоду увеличивается число электронных оболочек, что влечет за собой и увеличение радиусов атомов. Поэтому, как уже отмечалось, наряду со сходством наблюдается и определенная направленность в изменении свойств.
Из электронных формул и энергетических диаграмм атомов очевидно, что в группах IA и ПА электроны заполняют внешний 5-подуровень, а в группах I НА-V111А — внешний p-подуровень. Это дает основание для классификации химических элементов на блоки. /-подуровней по мере увеличения заряда ядра атома (рис. 5.9).
/-подуровней по мере увеличения заряда ядра атома (рис. 5.9).
Рис. 5.9.
Пример 5.1. Напишите сокращенные электронные формулы железа и криптона.
Решение. Как у железа, так и у криптона ближайший предшествующий благородный газ — аргон (Z = 18). У железа (Z = 26) на заполнение верхних 45- и Зб/-подуровней остается восемь электронов. Пишем формулу 45 2 3rf 6 . У криптона (Z = 36) добавляется еще 10 электронов, которые полностью заселяют подуровни 3d и Ар. Заполненный 3d -подуровень ставим в формуле до 45-подуровня: [Аг]3 10 45 2 4/? 6 .
Пятый период таблицы Менделеева по структуре аналогичен четвертому. Оба они содержат по 18 химических элементов. В 5-м периоде рубидий и стронций принадлежат к 5-блоку элементов, 10 элементов от иттрия до кадмия принадлежат к d-блоку и оставшиеся шесть элементов от индия до ксенона — к р- блоку.
Далее следуют самые длинные 6-й и 7-й периоды, содержащие но 32 элемента. В 6-м периоде добавляется семейство из 14 химических элементов — от лантана до иттербия, называемых лантаноидами , а в 7-м — аналогичное семейство актиноидов — от актиния до нобелия.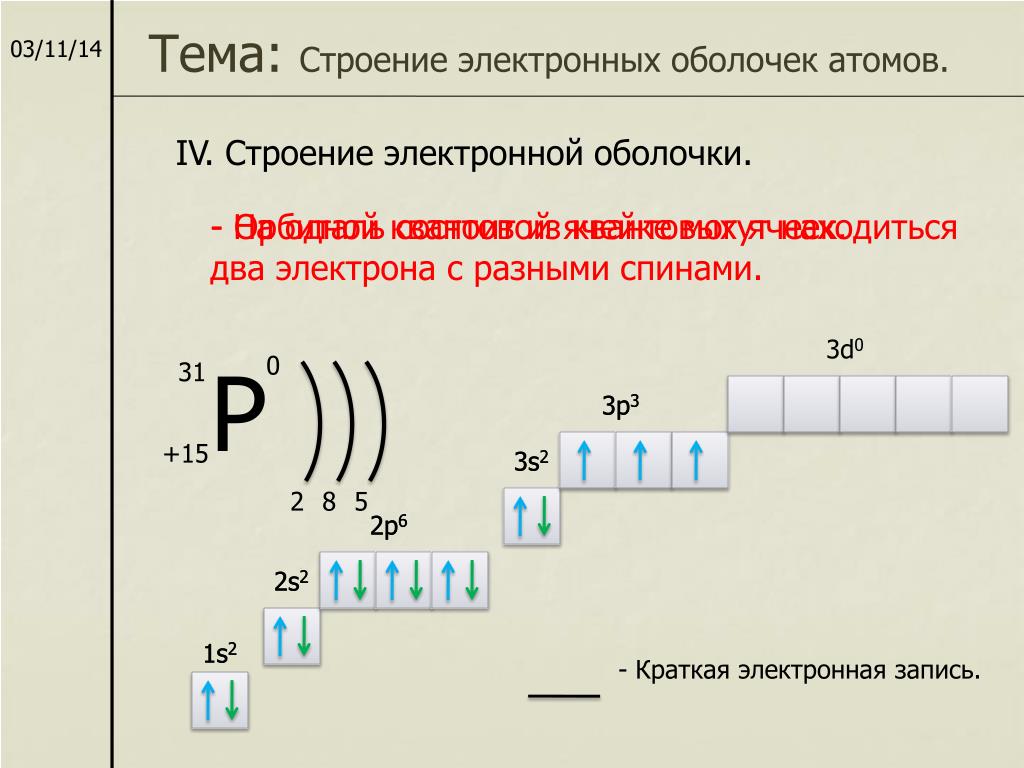 В их атомах заполняются электронами 4/- и 5/-подуровни соответственно. Лантаноиды и актиноиды составляют блок /-элементов. Вследствие особых характеристик орбиталей /-подуровней, все лантаноиды и все актиноиды проявляют между собой большое сходство но химическим свойствам.
В их атомах заполняются электронами 4/- и 5/-подуровни соответственно. Лантаноиды и актиноиды составляют блок /-элементов. Вследствие особых характеристик орбиталей /-подуровней, все лантаноиды и все актиноиды проявляют между собой большое сходство но химическим свойствам.
Пример 5.2. Чем объясняется, что семейства /-элементов содержат по 14 химических элементов?
Решение. В соответствии с формулой 2/+1 подуровень f (1 = 3) состоит из семи орбиталей. Поэтому его вместимость 14 электронов, и постепенное заполнение /-подуровня происходит у 14 химических элементов.
Таким образом, краткий обзор электронной структуры атомов в общих чертах раскрывает физическую основу периодичности изменения свойств химических элементов и, следовательно, периодического закона Д. И. Менделеева. Коротко можно сказать, что периодический закон является следствием принципа Паули и принципа наименьшей энергии.
8 класс
Тема урока
«Строение электронных оболочек атомов».
Цель урока:
Рассмотрение модели строения атома.
Введение понятия «электронное облако», «электронная орбиталь» , «движение без траектории».
Рассмотрение модели энергетических состояний атома.
Задачи урока :
Образовательные: формирование представления об электронной оболочке атома и энергетических уровнях, рассмотрение электронного строения некоторых элементов, развитие умений по составлению электронных формул атомов, определению элементов по их электронным формулам, определение состава атома.
Воспитательные : рассмотрение значимости работы русского химика Д.И.Менделеева ;
Развивающие: формирование умений работать с периодической системой, логически мыслить и оформлять результаты логических операций, проводить параллели между химическими понятиями, изучаемыми в теме.
Ход урока
Организационные моменты.
Доброе утро, ребята, уважаемые гости! Меня зовут Ирина Александровна Губская, я– учитель химии, представляю Раменский муниципальный район, Удельнинскую гимназию.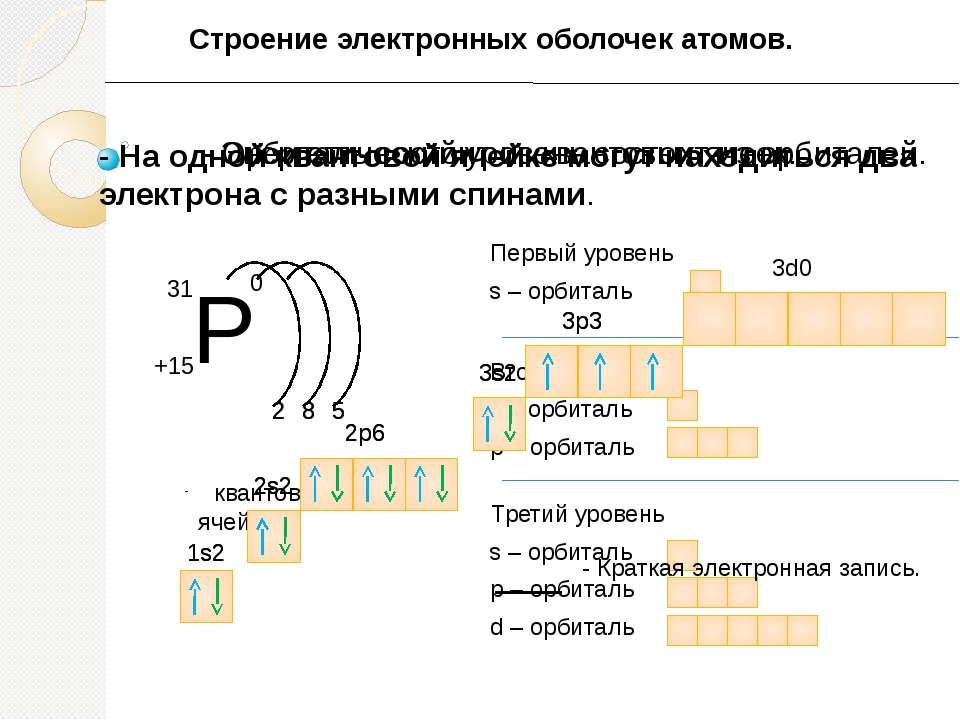
Нам сегодня вместе предстоит продолжить постигать тайны и загадки, которыми полна наука «химия».Вы только в этом году начали изучать этот удивительно интересный, но вместе с тем сложный предмет, но наверняка многое уже знаете.
Тема нашего урока «Строение электронных оболочек атомов» (запишем в тетрадях).
Ребята, вам хочется увидеть атомы, электроны?…Можно ли это сделать?…
Можно….в воображении. Умозрительно. Мы многое видим умозрительно, почему бы не увидеть атом или электрон? Давайте попробуем. Итак, в путь!
Наша общая задача на уроке – продолжить изучение темы «Атомы химических элементов», нам предстоит актуализировать знания о строении атома и познакомиться со строением электронных оболочек атомов.
2. Объяснение нового материала
Поэт В.Брюсов в 1922 году под впечатлением от удивительных открытий физиков написал:
Быть может, эти электроны-
Миры, где пять материков,
Искусства, знанья, войны, троны
И память сорока веков!
Еще, быть может, каждый атом-
Вселенная, где сто планет;
Там – все, что здесь, в объеме сжатом,
Но также то, чего здесь нет.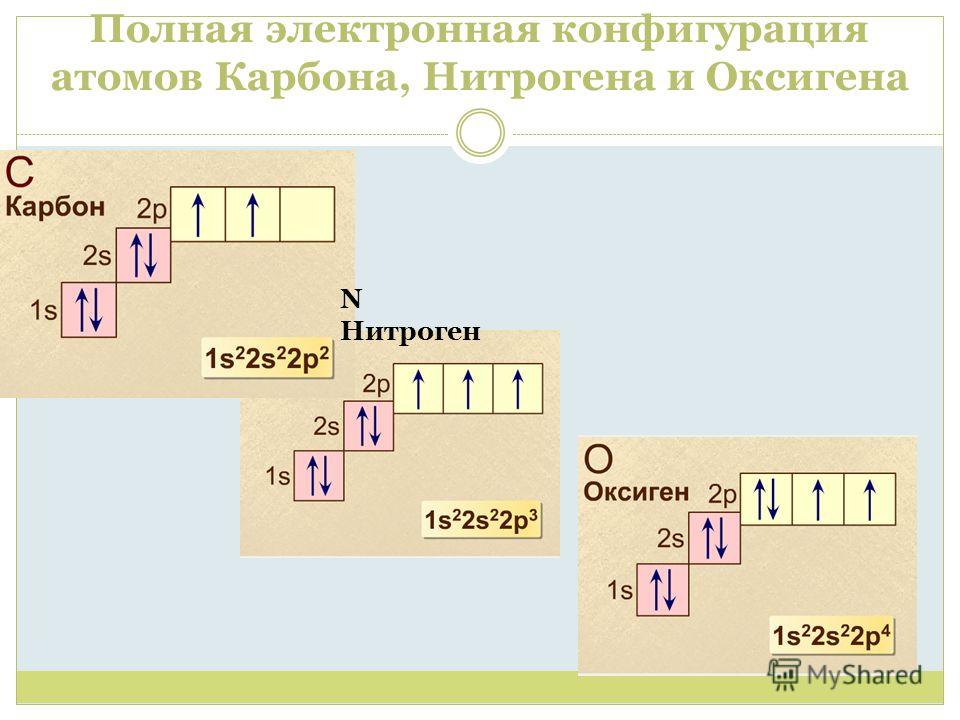
? Как вы понимаете эти строки?
Может быть… Сходство электронов и атомов с астрономическими объектами пока не подтвердилось, но того, «чего здесь нет», оказалось более чем достаточно, и об этом вы будете узнавать на уроках химии и физики.
Науке потребовалось более 2000 лет, чтобы определить, на что он похож. И даже сейчас он все еще остается для нас загадкой.
Предлагаю вам заполнить анкету от имени атома.
Анкета.
1. Имя Атом
2. Место обитания любое тело в газообразном, жидком, твердом агрегатном состоянии
3. Поразительные
качества невероятная малость
4. Строение атома
? А из чего состоит атом? (схема)
Атом состоит из положительно заряженного ядра и движущихся вокруг него электронов
? А из чего состоит ядро атома?
Из протонов и нейтронов
А движущиеся вокруг ядра электроны образуют электронную оболочку
В начале ХХ в.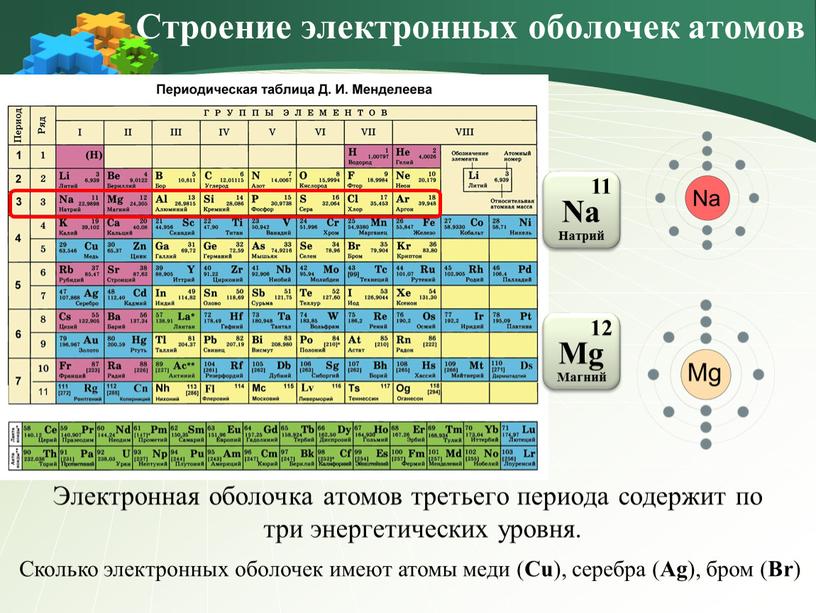 была принята планетарная модель строения атома , согласно которой вокруг ядра движутся электроны, как планеты вокруг солнца. Следовательно, в атоме есть траектории, по которым движется электрон. Однако дальнейшие исследования показали, что в атоме не существует траекторий движения электронов. Движение без траектории означает, что мы не знаем, как электрон движется в атоме, но можем установить область, где чаще всего встречается электрон. Это уже не орбита, а орбиталь.
была принята планетарная модель строения атома , согласно которой вокруг ядра движутся электроны, как планеты вокруг солнца. Следовательно, в атоме есть траектории, по которым движется электрон. Однако дальнейшие исследования показали, что в атоме не существует траекторий движения электронов. Движение без траектории означает, что мы не знаем, как электрон движется в атоме, но можем установить область, где чаще всего встречается электрон. Это уже не орбита, а орбиталь.
Двигаясь вокруг атома, электроны образуют в совокупности его электронную оболочку .
Совокупность всех электронов, окружающих ядро, называется электронной оболочкой (записываем определение)
? Давайте выясним, как движутся электроны вокруг ядра?
? Беспорядочно или в определенном порядке? Оказывается, движение электронов происходит в определенном порядке.
Электроны в атоме различаются определенной энергией, и, как показывают опыты, одни притягиваются к ядру сильнее, другие слабее. Объясняется это удаленностью электронов от ядра. Чем ближе электроны к ядру, тем больше связь их с ядром, но меньше запас энергии. По мере удаления от ядра атома сила притяжения электрона к ядру уменьшается, а запас энергии увеличивается. Каждый электрон в зависимости от своей энергии будет находиться на определенном расстоянии от ядра. Так образуются электронные слои в электронной оболочке атома.
Объясняется это удаленностью электронов от ядра. Чем ближе электроны к ядру, тем больше связь их с ядром, но меньше запас энергии. По мере удаления от ядра атома сила притяжения электрона к ядру уменьшается, а запас энергии увеличивается. Каждый электрон в зависимости от своей энергии будет находиться на определенном расстоянии от ядра. Так образуются электронные слои в электронной оболочке атома.
Каждый слой состоит из электронов с близкими значениями энергии, поэтому слои электронов называют энергетическими уровнями .
Электронный слой, состоящий из электронов с близкими значениями энергии, называется энергетическим уровнем . (записываем определение)
? А как же определить, сколько слоев (энергетических уровней) в атоме того или иного элемента?
— Число уровней определяется номером периода, в котором располагается элемент.
Например:
У Na -2 энергетических уровня, т.к. он находиться во 2 периоде
У N – 3, 3 период
У Fe – 4 , 4 период
? А сколько электронов может находиться на каждом энергетическом уровне?
Максимальное число электронов, которое может находиться на том или ином энергетическом уровне, определяется по формуле
N = 2n 2
Где N — максимальное число электронов на уровне;
n – номер энергетического уровня.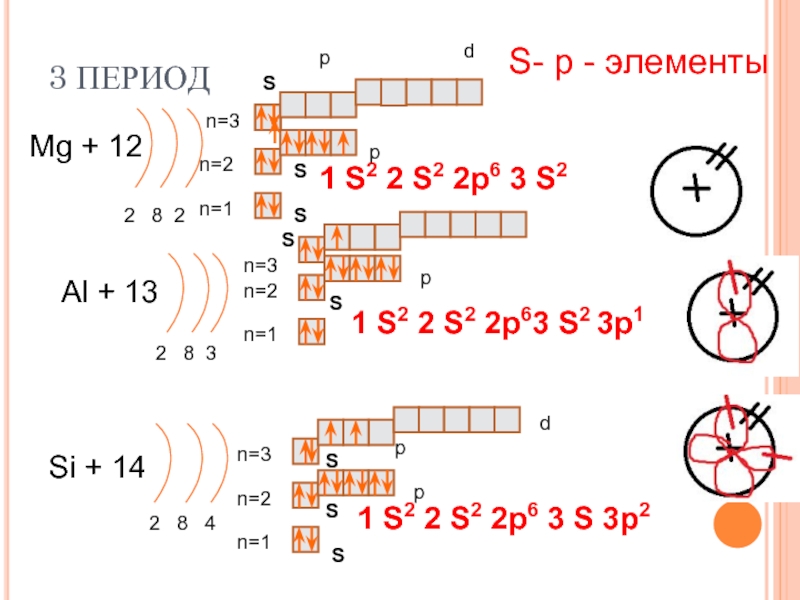
Например:
1 энергетический уровень, n =1, N =2
n =2, N=8
Каждый уровень вмещает не больше рассчитанного количества электронов.
Если электронный слой содержит максимально возможное число электронов, то его называют завершенным . Электронные слои, не содержащие максимального числа электронов, называют незавершенными .
Как ранее было сказано, электрон движется не по орбите, а по орбитали и не имеет траектории.
Пространство вокруг ядра, где наиболее вероятно нахождение данного электрона, называется орбиталью этого электрона, или электронным облаком.
(записываем определение)
Орбитали, или подуровни , как их еще называют, могут иметь разную форму, и их количество соответствует номеру уровня, но не превышает четырех. Первый энергетический уровень имеет один подуровень (s ), второй- два (s , p ), третий – три (s , p , d ) и т.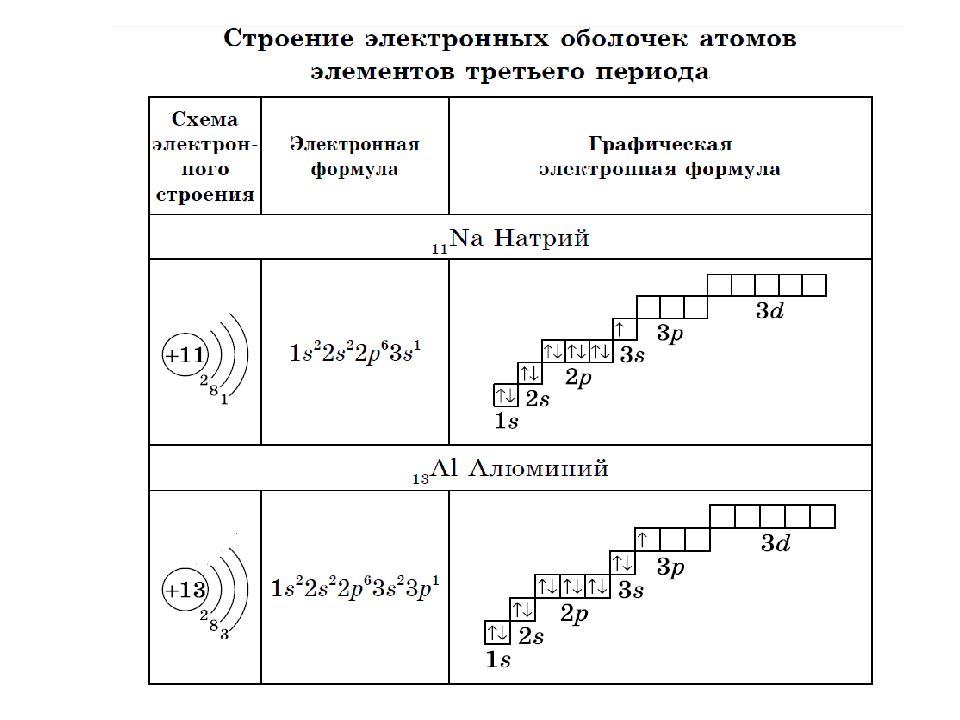 д. Электроны, находящиеся на одном энергетическом уровне тоже отличаются друг от друга.
д. Электроны, находящиеся на одном энергетическом уровне тоже отличаются друг от друга.
Электроны разных подуровней одного и того же уровня имеют разную форму
электронного облака: сферическую (s ), гантелеобразную (p ) и более сложную конфигурацию.
S — орбиталь — это просто шарик. Путь электрона по ней напоминает путь нитки, которую наматывают на клубок. С нее начинается каждый уровень.
P – орбиталь похожа на объемную восьмерку или перекрученную сосиску, и вместе перекрутки расположено ядро. Таких орбиталей на каждом энергетическом уровне -3, они располагаются под углом 90 – как оси координат.
D — орбиталь – это две p-орбитали, соединенные центрами – как объемная четырехлепестковая ромашка, их на подуровне может быть 5.
F – орбиталь имеет более сложную форму, ее трудно описать словами.
Представьте путь своей мысли при решении системы уравнений с 3 неизвестными – это примерно такой же сложности.
Каждая орбиталь вмещает максимум 2 электрона с противоположными спинами.
Спин — это условное направление движения электрона вокруг своей оси – оно может быть либо по часовой стрелке, либо против. Только электроны с разными спинами уживаются на одной орбитали, т.к. отталкивание их из-за одноименных зарядов частично гасится.
Составим схему последовательного заполнения электронами энергетических уровней.
2 ē 8 ē 18 ē
n=1 n=2 n=3
s s p s p d
2ē 2ē 6ē 2ē 6ē 8ē
Теперь мы можем составить схему строения электронных оболочек атомов:
Определяем общее число электронов на оболочке по порядковому номеру элемента.
Определяем число энергетических уровней в электронной оболочке. Их число равно номеру периода в таблице Д. И. Менделеева, в котором находится элемент.
Определяем число электронов на каждом энергетическом уровне.
Используя для обозначения уровня арабские цифры и обозначая орбитали буквами s
и p
, а число электронов данной орбитали арабской цифрой вверху справа над буквой, изображаем строение атомов более полными электронными формулами.
Пример:
Ядро атома водорода имеет заряд +1, поэтому вокруг его ядра движется только один электрон на единственном энергетическом уровне. Запишем электронную конфигурацию атома водорода
Элемент № 3- литий. Ядро лития имеет заряд +3,следовательно, в атоме лития три электрона. Два из них находятся на первом энергетическом уровне, а третий электрон начинает заполнять второй энергетический уровень. Сначала заполняется s -орбиталь первого уровня, потом s -орбиталь второго уровня.
Свойства элементов изменяются периодически. У всех атомов семейств элементов (щелочные металлы, галогены, благородные газы) на внешнем энергетическом уровне одинаковое число электронов.
У щелочных металлов – 1 электрон
У галогенов – 7 электронов
У благородных газов – внешний уровень их атомов завершен, 8 электронов
Вывод: свойства химических элементов периодически (через определенные промежутки – периоды) повторяются потому, что периодически повторяется одинаковое строение внешних энергетических уровней их атомов.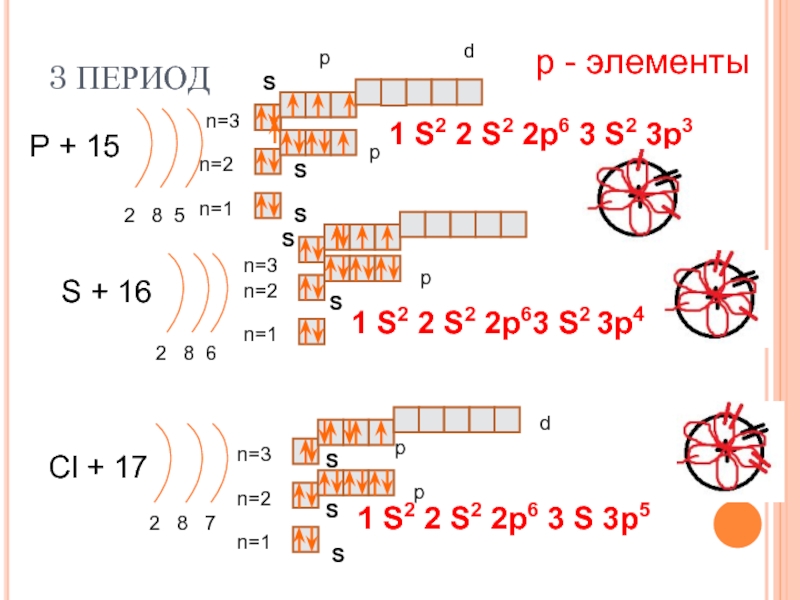
3. Закрепление
Вариант 1
Заряд ядра атома АЗОТА равен
а)7 б)13 в)4 г)26 д)11
Число протонов в ядре атома КРИПТОНА равно
а)36 б)17 в)4 г)31 д)6
3 .Число нейтронов в ядре атома ЦИНКА равно
а)8 б)35 в)11 г)30 д)4
4 .Число электронов в атоме ЖЕЛЕЗА равно
а)11 б)8 в)56 г)26 д)30
Вариант 2
Максимальное число электронов на 4 энергетическом уровне
а) 32 б)36 в)16 г)24
Число электронных уровней у атома кальция равно
а)1 б)2 в)3 г)4
3.Число электронов на внешнем уровне атома БРОМА равно
а) 7 б) 6 в)5 г)4
4.Общее число s -электронов у атома ЛИТИЯ равно
а) 1 б)2 в)3 г)4
Электронная формула внешнего уровня 2s2 2p 6 соответствует атому
а) кислорода б) серы
в) фтора г) неона
Подведение итогов. Рефлексия .
Рефлексия .
Домашнее задание : записи в тетради, 8, упр. по карточкам
Домашнее задание:
1. Изобразите строение атомов следующих элементов:
1 вариант
фосфора
2 вариант
Магния
2 . Сравните строение атомов
1 вариант
бора и фтора
2 вариант
кислорода и серы
3 . По данным о распределении валентных электронов найдите элемент :
а) 2s 1
б) 2s 2 2p 4
в) 3s 2 3p 6
г) 3d 10 4s 1
д) 4s 2 4p 3
е) 4s 2 4p 5
ж) 3s 2 3p 4
Давайте подведем итоги урока.
? Что мы сегодня узнали нового?
Электрон не имеет траектории и движение его происходит по орбитали.
По схеме последовательного заполнения электронами энергетических уровней научились составлять электронные формулы элементов.
Научились по электронным формулам определять химический элемент.
«Далеко лежит за пределами нашего чувства вся природа начал»
Тит Лукреций Кар
I в. до н.э.
В приведенных словах древнеримского поэта сконцентрирована вся трудность устройства атома.
Но мы его попытались описать,используя математические подходы и формулы.
У вас на столах находятся карточки для самооценки урока. Отметьте,пожалуйста, «+» или «-» свою самооценку. Я рада была с вами познакомиться. Молодцы, вы хорошо работали, хочется отметить, спасибо за сотрудничество. До свидания, урок окончен, успехов вам в изучении химии.
Выдающийся датский физик Нильс Бор (Рис. 1) предположил, что электроны в атоме могут двигаться не по любым, а по строго определенным орбитам.
При этом электроны в атоме различаются своей энергией. Как показывают опыты, одни из них притягиваются к ядру сильнее, другие — слабее. Главная причина этого заключается в разном удалении электронов от ядра атома. Чем ближе электроны к ядру, тем они прочнее связаны с ним и их труднее вырвать из электронной оболочки. Таким образом, по мере удаления от ядра атома запас энергии электрона увеличивается.
Таким образом, по мере удаления от ядра атома запас энергии электрона увеличивается.
Электроны, движущиеся вблизи ядра, как бы загораживают (экранируют) ядро от других электронов, которые притягиваются к ядру слабее и движутся на большем удалении от него. Так образуются электронные слои.
Каждый электронный слой состоит из электронов с близкими значениями энергии; поэтому электронные слои называют еще энергетическими уровнями.
Ядро находится в центре атома каждого элемента, а электроны, образующие электронную оболочку, размещаются вокруг ядра слоями.
Число электронных слоев в атоме элемента равно номеру периода, в котором находится данный элемент.
Например, натрий Na — элемент 3-го периода, значит, его электронная оболочка включает 3 энергетических уровня. В атоме брома Br — 4 энергетических уровня, т. к. бром расположен в 4-м периоде (Рис. 2).
Модель атома натрия: Модель атома брома:
Максимальное число электронов на энергетическом уровне рассчитывается по формуле: 2n 2 , где n — номер энергетического уровня.
Таким образом, максимальное число электронов на:
3 слое — 18 и т. д.
У элементов главных подгрупп номер группы, к которой относится элемент, равен числу внешних электронов атома.
Внешними называют электроны последнего электронного слоя.
Например, в атоме натрия — 1 внешний электрон (т. к. это элемент IА подгруппы). В атоме брома — 7 электронов на последнем электронном слое (это элемент VIIА подгруппы).
Строение электронных оболочек элементов 1-3 периодов
В атоме водорода заряд ядра равен +1, и этот заряд нейтрализуется единственным электроном (Рис. 3).
Следующий за водородом элемент — гелий, тоже элемент 1-го периода. Следовательно, в атоме гелия 1 энергетический уровень, на котором размещаются два электрона (Рис. 4). Это максимально возможное число электронов для первого энергетического уровня.
Элемент № 3 — это литий. В атоме лития 2 электронных слоя, т. к. это элемент 2-го периода. На 1 слое в атоме лития находится 2 электрона (этот слой завершен), а на 2 слое -1 электрон. В атоме бериллия на 1 электрон больше, чем в атоме лития (Рис. 5).
к. это элемент 2-го периода. На 1 слое в атоме лития находится 2 электрона (этот слой завершен), а на 2 слое -1 электрон. В атоме бериллия на 1 электрон больше, чем в атоме лития (Рис. 5).
Аналогично можно изобразить схемы строения атомов остальных элементов второго периода (Рис. 6).
В атоме последнего элемента второго периода — неона — последний энергетический уровень является завершенным (на нем 8 электронов, что соответствует максимальному значению для 2-го слоя). Неон — инертный газ, который не вступает в химические реакции, следовательно, его электронная оболочка очень устойчива.
Американский химик Гилберт Льюис дал объяснение этому и выдвинул правило октета, в соответствии с которым устойчивым является восьмиэлектронный слой (за исключением 1 слоя: т. к. на нем может находиться не более 2 электронов, устойчивым для него будет двухэлектронное состояние).
После неона следует элемент 3-го периода — натрий. В атоме натрия — 3 электронных слоя, на которых расположены 11 электронов (Рис. 7).
7).
Рис. 7. Схема строения атома натрия
Натрий находится в 1 группе, его валентность в соединениях равна I, как и у лития. Это связано с тем, что на внешнем электронном слое атомов натрия и лития находится 1 электрон.
Свойства элементов периодически повторяются потому, что у атомов элементов периодически повторяется число электронов на внешнем электронном слое.
Строение атомов остальных элементов третьего периода можно представить по аналогии со строением атомов элементов 2-го периода.
Строение электронных оболочек элементов 4 периода
Четвертый период включает в себя 18 элементов, среди них есть элементы как главной (А), так и побочной (В) подгрупп. Особенностью строения атомов элементов побочных подгрупп является то, что у них последовательно заполняются предвнешние (внутренние), а не внешние электронные слои.
Четвертый период начинается с калия. Калий — щелочной металл, проявляющий в соединениях валентность I.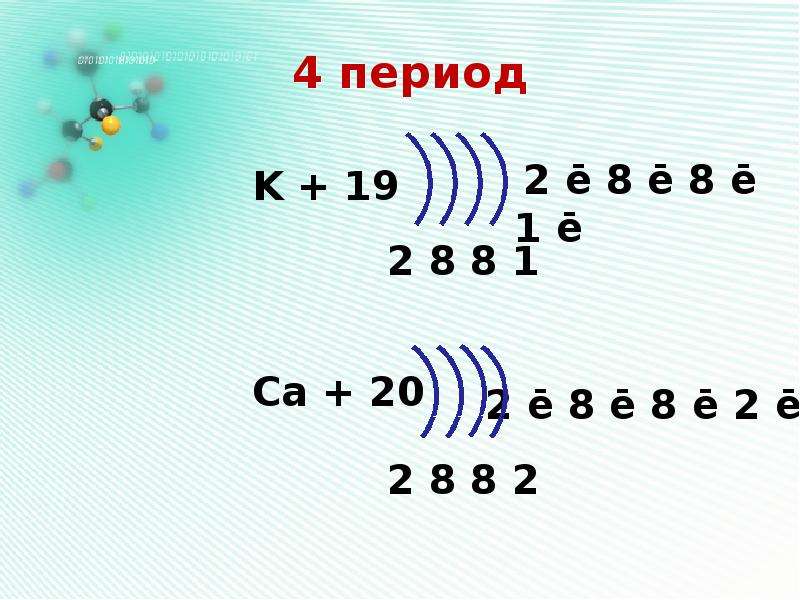 Это вполне согласуется со следующим строением его атома. Как элемент 4-го периода, атом калия имеет 4 электронных слоя. На последнем (четвертом) электронном слое калия находится 1 электрон, общее количество электронов в атоме калия равно 19 (порядковому номеру этого элемента) (Рис. 8).
Это вполне согласуется со следующим строением его атома. Как элемент 4-го периода, атом калия имеет 4 электронных слоя. На последнем (четвертом) электронном слое калия находится 1 электрон, общее количество электронов в атоме калия равно 19 (порядковому номеру этого элемента) (Рис. 8).
Рис. 8. Схема строения атома калия
За калием следует кальций. У атома кальция на внешнем электронном слое будут располагаться 2 электрона, как и у бериллия с магнием (они тоже являются элементами II А подгруппы).
Следующий за кальцием элемент — скандий. Это элемент побочной (В) подгруппы. Все элементы побочных подгрупп — это металлы. Особенностью строения их атомов является наличие не более 2-х электронов на последнем электронном слое, т. е. последовательно заполняться электронами будет предпоследний электронный слой.
Так, для скандия можно представить следующую модель строения атома (Рис. 9):
Рис. 9. Схема строения атома скандия
Такое распределение электронов возможно, т.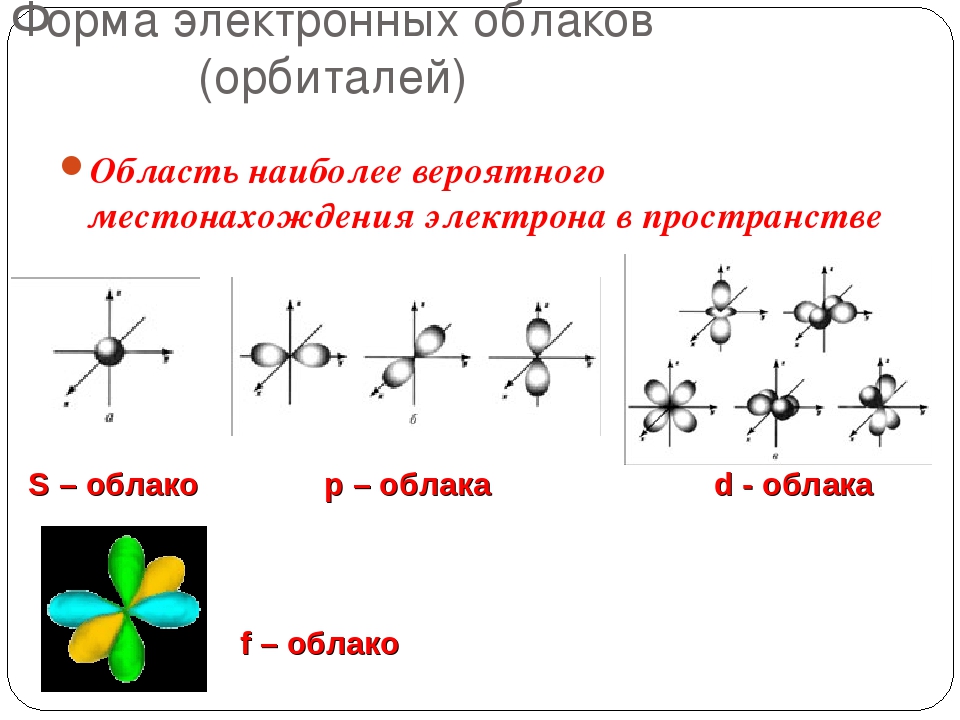 к. на третьем слое максимально допустимое количество электронов — 18, т. е. восемь электронов на 3-м слое — это устойчивое, но не завершенное состояние слоя.
к. на третьем слое максимально допустимое количество электронов — 18, т. е. восемь электронов на 3-м слое — это устойчивое, но не завершенное состояние слоя.
У десяти элементов побочных подгрупп 4-го периода от скандия до цинка последовательно заполняется третий электронный слой.
Схему строения атома цинка можно представить так: на внешнем электронном слое — два электрона, на предвнешнем — 18 (Рис. 10).
Рис. 10. Схема строения атома цинка
Следующие за цинком элементы относятся к элементам главной подгруппы: галлий, германий и т. д. до криптона. В атомах этих элементов последовательно заполняется 4-й (т. е. внешний) электронный слой. В атоме инертного газа криптона будет октет на внешней оболочке, т. е. устойчивое состояние.
Подведение итога урока
На этом уроке вы узнали, как устроена электронная оболочка атома и как объяснить явление периодичности. Познакомились с моделями строения электронных оболочек атомов, с помощью которых можно предсказать и объяснить свойства химических элементов и их соединений.
Список литературы
- Оржековский П.А. Химия: 8-й класс: учеб для общеобр. учрежд. / П.А. Оржековский, Л.М. Мещерякова, М.М. Шалашова. — М.: Астрель, 2013. (§44)
- Рудзитис Г.Е. Химия: неорган. химия. Орган. химия: учеб. для 9 кл. / Г.Е. Рудзитис, Ф.Г. Фельдман. — М.: Просвещение, ОАО «Московские учебники», 2009. (§37)
- Хомченко И.Д. Сборник задач и упражнений по химии для средней школы. — М.: РИА «Новая волна»: Издатель Умеренков, 2008. (с. 37-38)
- Энциклопедия для детей. Том 17. Химия / Глав. ред. В.А. Володин, вед. науч. ред. И. Леенсон. — М.: Аванта+, 2003. (с. 38-41)
- Chem.msu.su ().
- Dic.academic.ru ().
- Krugosvet.ru ().
Домашнее задание
- с. 250 №№ 2-4 из учебника П.А. Оржековского «Химия: 8-й класс» / П.А. Оржековский, Л.М. Мещерякова, М.М. Шалашова. — М.: Астрель, 2013.
- Запишите распределение электронов по слоям в атоме аргона и криптона. Объясните, почему атомы этих элементов с большим трудом вступают в химическое взаимодействие.

Выдающийся датский физик Нильс Бор (Рис. 1) предположил, что электроны в атоме могут двигаться не по любым, а по строго определенным орбитам.
При этом электроны в атоме различаются своей энергией. Как показывают опыты, одни из них притягиваются к ядру сильнее, другие — слабее. Главная причина этого заключается в разном удалении электронов от ядра атома. Чем ближе электроны к ядру, тем они прочнее связаны с ним и их труднее вырвать из электронной оболочки. Таким образом, по мере удаления от ядра атома запас энергии электрона увеличивается.
Электроны, движущиеся вблизи ядра, как бы загораживают (экранируют) ядро от других электронов, которые притягиваются к ядру слабее и движутся на большем удалении от него. Так образуются электронные слои.
Каждый электронный слой состоит из электронов с близкими значениями энергии; поэтому электронные слои называют еще энергетическими уровнями.
Ядро находится в центре атома каждого элемента, а электроны, образующие электронную оболочку, размещаются вокруг ядра слоями.
Число электронных слоев в атоме элемента равно номеру периода, в котором находится данный элемент.
Например, натрий Na — элемент 3-го периода, значит, его электронная оболочка включает 3 энергетических уровня. В атоме брома Br — 4 энергетических уровня, т. к. бром расположен в 4-м периоде (Рис. 2).
Модель атома натрия: Модель атома брома:
Максимальное число электронов на энергетическом уровне рассчитывается по формуле: 2n 2 , где n — номер энергетического уровня.
Таким образом, максимальное число электронов на:
3 слое — 18 и т. д.
У элементов главных подгрупп номер группы, к которой относится элемент, равен числу внешних электронов атома.
Внешними называют электроны последнего электронного слоя.
Например, в атоме натрия — 1 внешний электрон (т. к. это элемент IА подгруппы). В атоме брома — 7 электронов на последнем электронном слое (это элемент VIIА подгруппы).
Строение электронных оболочек элементов 1-3 периодов
В атоме водорода заряд ядра равен +1, и этот заряд нейтрализуется единственным электроном (Рис. 3).
Следующий за водородом элемент — гелий, тоже элемент 1-го периода. Следовательно, в атоме гелия 1 энергетический уровень, на котором размещаются два электрона (Рис. 4). Это максимально возможное число электронов для первого энергетического уровня.
Элемент № 3 — это литий. В атоме лития 2 электронных слоя, т. к. это элемент 2-го периода. На 1 слое в атоме лития находится 2 электрона (этот слой завершен), а на 2 слое -1 электрон. В атоме бериллия на 1 электрон больше, чем в атоме лития (Рис. 5).
Аналогично можно изобразить схемы строения атомов остальных элементов второго периода (Рис. 6).
В атоме последнего элемента второго периода — неона — последний энергетический уровень является завершенным (на нем 8 электронов, что соответствует максимальному значению для 2-го слоя).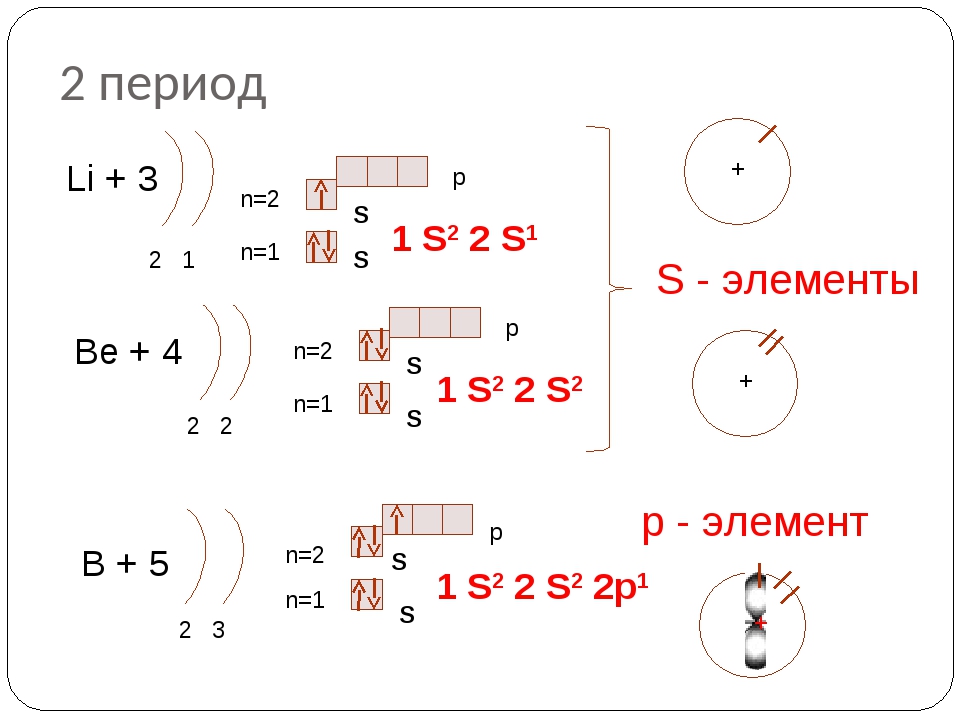 Неон — инертный газ, который не вступает в химические реакции, следовательно, его электронная оболочка очень устойчива.
Неон — инертный газ, который не вступает в химические реакции, следовательно, его электронная оболочка очень устойчива.
Американский химик Гилберт Льюис дал объяснение этому и выдвинул правило октета, в соответствии с которым устойчивым является восьмиэлектронный слой (за исключением 1 слоя: т. к. на нем может находиться не более 2 электронов, устойчивым для него будет двухэлектронное состояние).
После неона следует элемент 3-го периода — натрий. В атоме натрия — 3 электронных слоя, на которых расположены 11 электронов (Рис. 7).
Рис. 7. Схема строения атома натрия
Натрий находится в 1 группе, его валентность в соединениях равна I, как и у лития. Это связано с тем, что на внешнем электронном слое атомов натрия и лития находится 1 электрон.
Свойства элементов периодически повторяются потому, что у атомов элементов периодически повторяется число электронов на внешнем электронном слое.
Строение атомов остальных элементов третьего периода можно представить по аналогии со строением атомов элементов 2-го периода.
Строение электронных оболочек элементов 4 периода
Четвертый период включает в себя 18 элементов, среди них есть элементы как главной (А), так и побочной (В) подгрупп. Особенностью строения атомов элементов побочных подгрупп является то, что у них последовательно заполняются предвнешние (внутренние), а не внешние электронные слои.
Четвертый период начинается с калия. Калий — щелочной металл, проявляющий в соединениях валентность I. Это вполне согласуется со следующим строением его атома. Как элемент 4-го периода, атом калия имеет 4 электронных слоя. На последнем (четвертом) электронном слое калия находится 1 электрон, общее количество электронов в атоме калия равно 19 (порядковому номеру этого элемента) (Рис. 8).
Рис. 8. Схема строения атома калия
За калием следует кальций. У атома кальция на внешнем электронном слое будут располагаться 2 электрона, как и у бериллия с магнием (они тоже являются элементами II А подгруппы).
Следующий за кальцием элемент — скандий. Это элемент побочной (В) подгруппы. Все элементы побочных подгрупп — это металлы. Особенностью строения их атомов является наличие не более 2-х электронов на последнем электронном слое, т. е. последовательно заполняться электронами будет предпоследний электронный слой.
Это элемент побочной (В) подгруппы. Все элементы побочных подгрупп — это металлы. Особенностью строения их атомов является наличие не более 2-х электронов на последнем электронном слое, т. е. последовательно заполняться электронами будет предпоследний электронный слой.
Так, для скандия можно представить следующую модель строения атома (Рис. 9):
Рис. 9. Схема строения атома скандия
Такое распределение электронов возможно, т. к. на третьем слое максимально допустимое количество электронов — 18, т. е. восемь электронов на 3-м слое — это устойчивое, но не завершенное состояние слоя.
У десяти элементов побочных подгрупп 4-го периода от скандия до цинка последовательно заполняется третий электронный слой.
Схему строения атома цинка можно представить так: на внешнем электронном слое — два электрона, на предвнешнем — 18 (Рис. 10).
Рис. 10. Схема строения атома цинка
Следующие за цинком элементы относятся к элементам главной подгруппы: галлий, германий и т. д. до криптона. В атомах этих элементов последовательно заполняется 4-й (т. е. внешний) электронный слой. В атоме инертного газа криптона будет октет на внешней оболочке, т. е. устойчивое состояние.
д. до криптона. В атомах этих элементов последовательно заполняется 4-й (т. е. внешний) электронный слой. В атоме инертного газа криптона будет октет на внешней оболочке, т. е. устойчивое состояние.
Подведение итога урока
На этом уроке вы узнали, как устроена электронная оболочка атома и как объяснить явление периодичности. Познакомились с моделями строения электронных оболочек атомов, с помощью которых можно предсказать и объяснить свойства химических элементов и их соединений.
Список литературы
- Оржековский П.А. Химия: 8-й класс: учеб для общеобр. учрежд. / П.А. Оржековский, Л.М. Мещерякова, М.М. Шалашова. — М.: Астрель, 2013. (§44)
- Рудзитис Г.Е. Химия: неорган. химия. Орган. химия: учеб. для 9 кл. / Г.Е. Рудзитис, Ф.Г. Фельдман. — М.: Просвещение, ОАО «Московские учебники», 2009. (§37)
- Хомченко И.Д. Сборник задач и упражнений по химии для средней школы. — М.: РИА «Новая волна»: Издатель Умеренков, 2008. (с. 37-38)
- Энциклопедия для детей.
 Том 17. Химия / Глав. ред. В.А. Володин, вед. науч. ред. И. Леенсон. — М.: Аванта+, 2003. (с. 38-41)
Том 17. Химия / Глав. ред. В.А. Володин, вед. науч. ред. И. Леенсон. — М.: Аванта+, 2003. (с. 38-41)
- Chem.msu.su ().
- Dic.academic.ru ().
- Krugosvet.ru ().
Домашнее задание
- с. 250 №№ 2-4 из учебника П.А. Оржековского «Химия: 8-й класс» / П.А. Оржековский, Л.М. Мещерякова, М.М. Шалашова. — М.: Астрель, 2013.
- Запишите распределение электронов по слоям в атоме аргона и криптона. Объясните, почему атомы этих элементов с большим трудом вступают в химическое взаимодействие.
Тема урока «электронные конфигурации атомов химических элементов электронная классификация химических элементов» цели урока
Тема урока
«Электронные конфигурации атомов химических элементов. Электронная классификация химических элементов».
Цели урока:
Дать понятие электронной конфигурации
атома. Научить записывать электронные
и электронно-графические формулы атомов
химических элементов. Рассмотреть
электронную классификацию элементов: s-, p-, d— и f –семейства.
Рассмотреть
электронную классификацию элементов: s-, p-, d— и f –семейства.
Ход урока.
I Орг.момент. Постановка задачи урока.
На этих уроках мы будем учиться на практике воплощать те теоретические положения, с которыми познакомились на прошлом уроке, т.е. на основании положения элементов в Периодической системе записывать их электронные и электронно-графические формулы.
II Подготовка к восприятию нового материала
— беседа по вопросам 1-6 после параграфа 1;
— вспомнить понятия «электронная оболочка», «электронный слой (энергетический уровень)», «электронный подуровень», «атомная орбиталь»;
— как можно определить максимальное число электронов на энергетическом уровне.
III Новый материал
Понятие об электронной конфигурации атомов.
Распределение электронов по орбиталям характеризует электронную конфигурацию атомов химических элементов. Она отражается с помощью электронной или электронно-графической формулы.
В электронной формуле указывается, на каких орбиталях находятся электроны, их число указывается верхним индексом (например, 2s1, 3р3).
Кроме приведенных буквенных записей используется графическая форма – электронно-графическая формула. Каждая орбиталь в ней обозначается квадратом, а электроны стрелками, направление которых указывает взаимное расположение векторов спина.
Основная цель изображения электронных
структур атома и написания их формул –
это возможность объяснения и предсказания
на их основе важнейших свойств элементов.
Однако, предварительно следует проследить
прямую зависимость положения элемента
в Периодической системе от электронной
структуры его атома. Элементы в ней
располагаются строго в порядке возрастания
зарядов атомных ядер.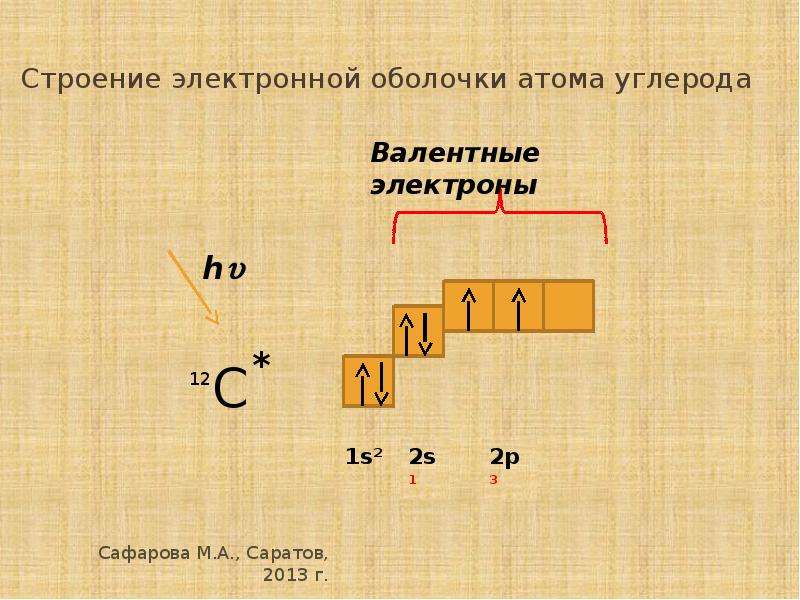 Так как заряд ядра
определяет число электронов, то атомы
каждого последующего элемента в
Периодической системе имеют на 1 электрон
больше, чем атомы предыдущего.
Так как заряд ядра
определяет число электронов, то атомы
каждого последующего элемента в
Периодической системе имеют на 1 электрон
больше, чем атомы предыдущего.
Составление электронных формул
Периодическая система – это замечательная узаконенная шпаргалка мирового уровня, и только неграмотный выпускник не сможет записать электронную формулу элемента на основании его положения в ней. Чтобы верно отразить их в условной записи, нужно помнить немногое, а именно:
Число электронных слоев в атоме определяет номер периода, в котором находится соответствующий элемент.
Число электронов на внешнем уровне для элементов главных подгрупп определяет номер группы.
У атомов элементов побочных подгрупп заполняется не внешний уровень (на нем, как правило, располагается 2 электрона), а предвнешний – с 8 до 18 электронов, затем снова внешний – с 2 до 8 электронов.

У атомов элементов сверхбольших – 6-м и 7-м периодов вначале почти все как у больших: строится внешний уровень у атомов щелочных и щелочноземельных металлов, на котором располагается соответственно 1 или 2 электрона. Затем у лантана и актиния последний электрон «отправляется» на предвнешний уровень, а следующие электроны отправятся не на предвнешний, а на третий снаружи уровень (f-подуровень). Свое название «подобный лантану или актинию» эти элементы получили потому, что очень на них похожи. Различия в структуре электронных оболочек их атомов существует лишь в третьем от периферии слое, в том время как химические свойства элемента обусловлены электронами в первую очередь внешнего и предвнешнего слоев его атомов.
Схема
заполнения
подуровней
1s→2s→2p→3s→3p→4s→3d→4p→5s→4d→5p→6s→4f→5d→6p→7s→5f→6d→7p
Составление электронно-графических формул.
Трафарет
У элементов всех последующих
периодов этот трафарет будет таким же,
только добавится еще один ряд ячеек
(5-й для 5 периода, 6-й для 6 и т.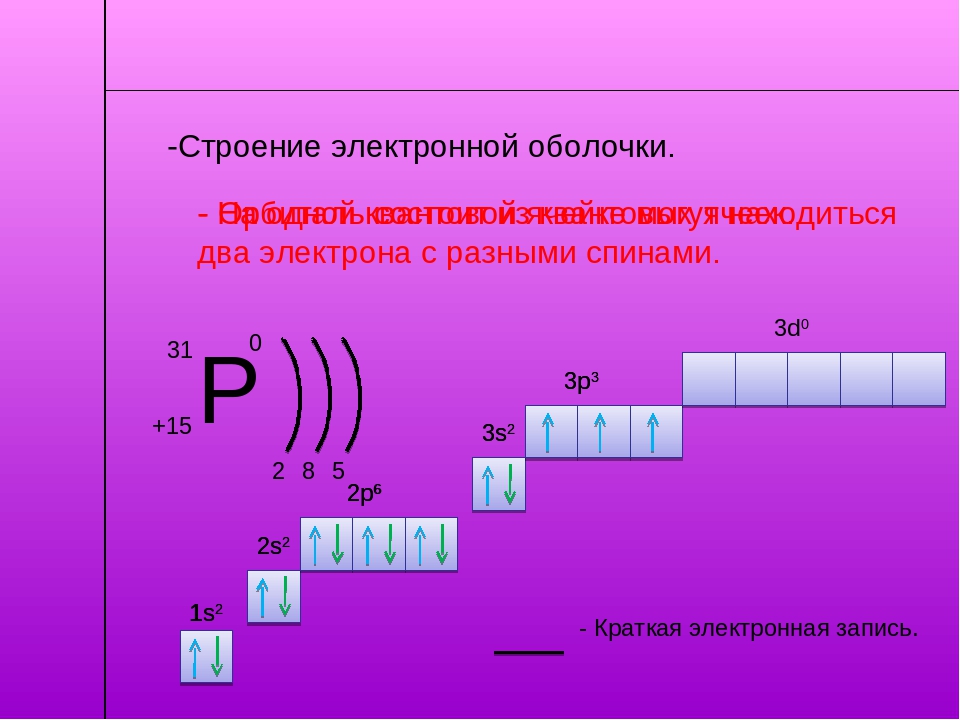 д.)
д.)
I период – s-элементы,
заполняется s-орбиталь
IIпериод – Li, Be –
s-элементы, B,
C, N, O,
F, Ne –
p-элементы.
III период — Na, Mg
– s-элементы, Al
— Ar – p-элементы.
IV период — K, Ca
– s-элементы, Se
— Zn – d-элементы
(побочная подгруппа), переходные элементы
– Cr и Cu
(провал одного электрона на 4s),
Ga – Kr –
p-элементы, l-элементы
– лантаноиды и актиноиды.
Записать электронные оболочки Na, P, Ar, K, Se, Cr, Ce
«Строение электронных оболочек атомов». Вариант 3
- Категория: Самостоятельные работы по химии. 8 класс
{module Адаптивный блок Адсенс в начале статьи}
САМОСТОЯТЕЛЬНАЯ РАБОТА ПО ХИМИИ
8 КЛАСС
СТРОЕНИЕ ЭЛЕКТРОННЫХ ОБОЛОЧЕК АТОМОВ
ВАРИАНТ 3
1. Заполните таблицу. Определите элемент и его электронную формулу.
Определите элемент и его электронную формулу.
|
Распределение электронов по энергетическим уровням |
Элемент |
Электронная формула |
| 1) +15 2, 8, 5 | P | 1s22s22p63s23p3 |
| 2) +7 2, 5 | N | 1s22s22p3 |
| 3) +2 2 | He | 1s2 |
Ответ: Сходными свойствами обладают Р и N, так как на внешнем энергетическом уровне у этих элементов по пять электронов.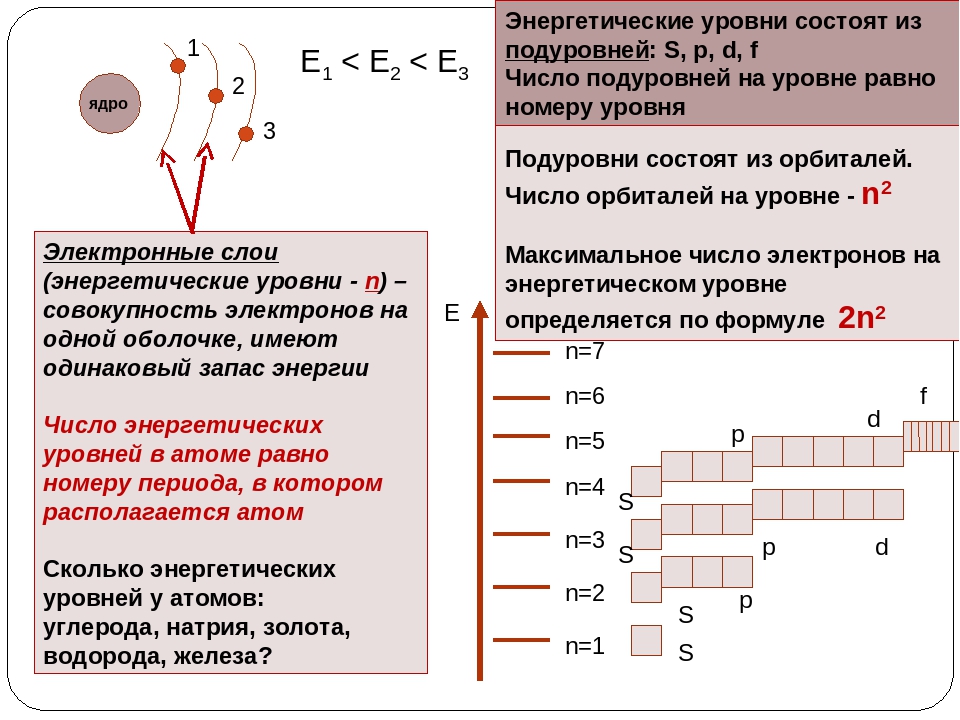
2. Напишите электронные формулы элементов хлора и бора. Укажите для каждого элемента:
Ответ:
Cl — 1s22s22p63s23p5, а) 3, б) 2, в) 7;
B — 1s22s22p1, а) 2, б) 1, в) 3.
3. Выберите правильные утверждения:
а) атомы элементов одного периода содержат одинаковое число энергетических уровней;
б) максимальное число электронов на s-орбитале равно двум;
в) сходными свойствами обладают атомы химических элементов с одинаковым числом энергетических уровней.
Ответ: а, б.
{module Адаптивный блок Адсенс в конце статьи}
-31 кг) — около 0,05% массы протона. Для наших целей он достаточно близок к нулю, поэтому мы будем считать, что его масса практически незначительна. И, наконец, у нас есть нейтрон , который нейтрален по заряду и тоже имеет массу в одну атомную единицу массы.
Но как устроены эти частицы в атомах? Первое, что нужно знать, это то, что каждый атом имеет атомных ядер , которые представляют собой совокупность протонов и нейтронов в центре атома. Это скопление протонов и нейтронов очень маленькое, очень плотное и очень положительно заряженное.Остаются только электроны, которые существуют в электронном облаке , или пространстве, в котором электроны движутся внутри атома. Электроны движутся вокруг ядра атома подобно тому, как планеты в нашей Солнечной системе вращаются вокруг Солнца. Мы поговорим об электронном облаке позже.
Элементы и периодическая таблица
Мы знаем, как устроены атомы, но как узнать, что мы наблюдаем: атом кислорода, атом азота или атом углерода? Все, что нам нужно сделать, это найти атомный номер , число протонов в ядре атома.Это число определяет идентичность атома. Например, атомный номер углерода равен шести, поэтому мы знаем, что любой атом с шестью протонами в ядре является атомом углерода.
Элемент — это вещество, состоящее из атомов одного типа, таких как кислород, алюминий и золото. Это все элементы, потому что каждый из них состоит только из атомов одного типа: атомов кислорода, атомов алюминия и атомов золота.
Существует более 100 известных элементов, каждый из которых имеет различные свойства и характеристики.Вместо того, чтобы запоминать все об этих различных элементах, ученые разработали организованную и удобную справочную таблицу элементов, названную периодической таблицей . Каждый элемент указан с полным названием, символом, атомным номером и атомной массой. То, как эти элементы организованы в столбцы и строки, также многое говорит нам об индивидуальных характеристиках каждого элемента. Таким образом, ученые могут выяснить различные свойства этих элементов, просто основываясь на их положении в периодической таблице.
Краткое содержание урока
Материя — это любая физическая субстанция, занимающая пространство и имеющая массу, а атом — основная единица материи. Атомы состоят из трех меньших частей, называемых субатомными частицами, каждая из которых имеет характерную массу и заряд.
протон имеет массу 1 и положительный заряд. Нейтрон — субатомная частица с массой 1 и нейтральным зарядом. И протоны, и нейтроны находятся в атомном ядре , которое находится в центре атома.Электрон — это субатомная частица с незначительной массой и отрицательным зарядом. Электроны окружают атомное ядро в электронном облаке .
Атомный номер , или число протонов, придает атому его идентичность. Элемент — это чистое вещество, состоящее только из атомов одного типа. Для справки, все элементы организованы в удобную диаграмму под названием Периодическая таблица .
Результаты обучения
Когда вы закончите, вы сможете:
- Описать состав атома
- Определите компоненты атома
- Объясните, что означает атомный номер элемента
атомов класс 8 pdf pdf Просмотр Скачать: Инструкции по принятию элемента / Рабочий лист 312k: v.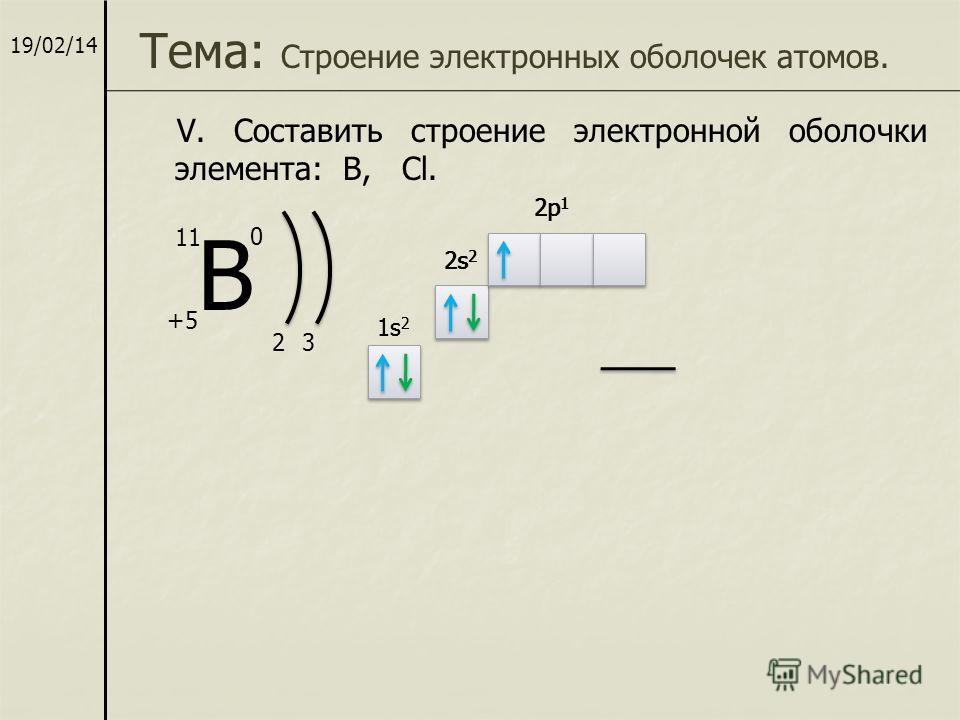 6A (S), 7. h4BO 3 (водн.) Борная кислота. Так как есть 2 атома натрия, было потеряно 2 электрона (по 1 каждому). Нейтральная частица, состоящая из двух или более атомов, соединенных ковалентными связями. Каждый атом определенного элемента содержит 11 протонов и 1 валентный электрон. Это связано с тем, что большая часть энергии используется организмом для жизненных процессов, таких как движение. Атомы Элементы Молекулы и соединения Рабочий лист с ключом ответов pdf Существует более 100 различных элементов, состоящих из атомов. Конкретный элемент состоит из множества различных типов атомов b.8 КЛАСС УЧЕБНЫЕ ЗАМЕТКИ ТЕРМИН 2 Название урока: 2. Протоны и нейтроны находятся в ядре атома. Элемент фтор, и он не очень реакционноспособен. В NEET он имеет вес 3%, и 1 или 2 вопроса, скорее всего, являются атомами. принципы полета. Воздух представляет собой смесь многих газов. Вопросы с несколькими вариантами ответов являются важной частью экзаменов по естествознанию в 9 классе, и если… Чтение рабочего листа карты в формате pdf.
6A (S), 7. h4BO 3 (водн.) Борная кислота. Так как есть 2 атома натрия, было потеряно 2 электрона (по 1 каждому). Нейтральная частица, состоящая из двух или более атомов, соединенных ковалентными связями. Каждый атом определенного элемента содержит 11 протонов и 1 валентный электрон. Это связано с тем, что большая часть энергии используется организмом для жизненных процессов, таких как движение. Атомы Элементы Молекулы и соединения Рабочий лист с ключом ответов pdf Существует более 100 различных элементов, состоящих из атомов. Конкретный элемент состоит из множества различных типов атомов b.8 КЛАСС УЧЕБНЫЕ ЗАМЕТКИ ТЕРМИН 2 Название урока: 2. Протоны и нейтроны находятся в ядре атома. Элемент фтор, и он не очень реакционноспособен. В NEET он имеет вес 3%, и 1 или 2 вопроса, скорее всего, являются атомами. принципы полета. Воздух представляет собой смесь многих газов. Вопросы с несколькими вариантами ответов являются важной частью экзаменов по естествознанию в 9 классе, и если… Чтение рабочего листа карты в формате pdf. Предоставлено Пользователем. Сохранить «Сохранить 4-ю неделю, введение, 8-й класс, заметки по атомной теории» для последующего чтения. 50% (2) Видео Атомы в itunes.Атом ВСТ. Подсчет атомов обзор и ключ. Сделайте 6 таких и поместите их на коврик справа от символа урожайности перед знаком плюс. Чистые вещества состоят из атома или молекулы одного типа Глава 13: Атомы и молекулы Возраст 8–13 лет Материалы, необходимые для этого занятия Алюминиевая фольга Кастрюля Форма для пирога Зубочистки Стеклянная бутылка из-под содовой или что-то подобное Сахар *Одна или две упаковки цветного зефира Увеличение стекло Молоток Английская соль Четверть поваренной соли Темная плотная бумага Пример стакана для питья, 6 класс Наука SOL 6.Однако 6. То же количество электронов d. Массовые числа округляются до ближайшего целого числа. 88MB Поделитесь этим контентом. от Палмергм. Вам нужна только страница 3 этого pdf. Вычислите массу кислорода, вступившего в реакцию с железом. 9g 1. Шаростержневая модель метана а.
Предоставлено Пользователем. Сохранить «Сохранить 4-ю неделю, введение, 8-й класс, заметки по атомной теории» для последующего чтения. 50% (2) Видео Атомы в itunes.Атом ВСТ. Подсчет атомов обзор и ключ. Сделайте 6 таких и поместите их на коврик справа от символа урожайности перед знаком плюс. Чистые вещества состоят из атома или молекулы одного типа Глава 13: Атомы и молекулы Возраст 8–13 лет Материалы, необходимые для этого занятия Алюминиевая фольга Кастрюля Форма для пирога Зубочистки Стеклянная бутылка из-под содовой или что-то подобное Сахар *Одна или две упаковки цветного зефира Увеличение стекло Молоток Английская соль Четверть поваренной соли Темная плотная бумага Пример стакана для питья, 6 класс Наука SOL 6.Однако 6. То же количество электронов d. Массовые числа округляются до ближайшего целого числа. 88MB Поделитесь этим контентом. от Палмергм. Вам нужна только страница 3 этого pdf. Вычислите массу кислорода, вступившего в реакцию с железом. 9g 1. Шаростержневая модель метана а. Количество протонов в элементе одинаково для каждого атома этого элемента. Cc атрибут 3 0. 3 Простые химические реакции 8. Лишь небольшое количество энергии (10%) переходит с одного трофического уровня на другой. Атомы углерода обладают особыми способностями.Атомы, элементы, молекулы, соединения. 264. Соединение образуется всякий раз, когда два или более элемента связаны химически. h4PO 4 (водн.) Фосфорная кислота 8. Атомы и молекулы класс 8. . 4 Хроматография 8. 847 а.е.м. и 55. инд. 1 16/10/13 17:12. 15). Отображение 8 лучших рабочих листов по запросу – Атомы, Соединения, Элементы и Молекулы. 1 caf 2 фторид кальция 1 кальций 2 фтор 2 be oh 2 гидроксид бериллия 1 be 2 o 2 h 3 no 2 диоксид азота 1 азот 2 кислород 4 al 2 so 4 3 Рабочий лист откроется в новом окне.Протоны имеют положительный электрический заряд. Мы только что записали это в блокнот. Ионные связи обладают способностью образовывать твердые кристаллы. Часть А БАЗОВАЯ ХИМИЯ 8 КЛАСС-pdf — Читать онлайн бесплатно. Я также надеюсь, что этот раздел «Атомы и периодическая таблица» тоже будет интересным и приятным предметом для изучения.
Количество протонов в элементе одинаково для каждого атома этого элемента. Cc атрибут 3 0. 3 Простые химические реакции 8. Лишь небольшое количество энергии (10%) переходит с одного трофического уровня на другой. Атомы углерода обладают особыми способностями.Атомы, элементы, молекулы, соединения. 264. Соединение образуется всякий раз, когда два или более элемента связаны химически. h4PO 4 (водн.) Фосфорная кислота 8. Атомы и молекулы класс 8. . 4 Хроматография 8. 847 а.е.м. и 55. инд. 1 16/10/13 17:12. 15). Отображение 8 лучших рабочих листов по запросу – Атомы, Соединения, Элементы и Молекулы. 1 caf 2 фторид кальция 1 кальций 2 фтор 2 be oh 2 гидроксид бериллия 1 be 2 o 2 h 3 no 2 диоксид азота 1 азот 2 кислород 4 al 2 so 4 3 Рабочий лист откроется в новом окне.Протоны имеют положительный электрический заряд. Мы только что записали это в блокнот. Ионные связи обладают способностью образовывать твердые кристаллы. Часть А БАЗОВАЯ ХИМИЯ 8 КЛАСС-pdf — Читать онлайн бесплатно. Я также надеюсь, что этот раздел «Атомы и периодическая таблица» тоже будет интересным и приятным предметом для изучения.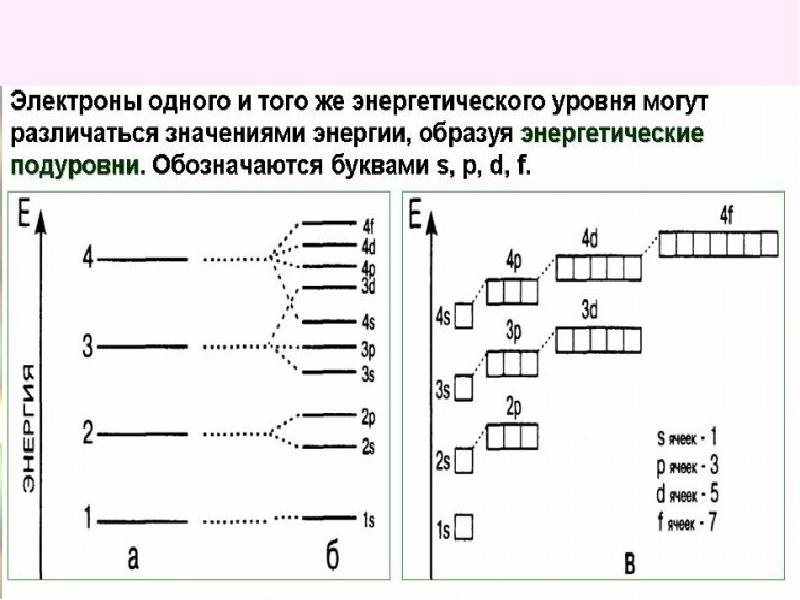 атомы звука. I Have You Have – игра на повторение понятий об атомах 12. B Некоторые атомы в ходе реакции разрушались. Учащихся познакомили с идеей о том, что вещество, твердое, жидкое или газообразное, состоит из мельчайших частиц, называемых атомами и молекулами.Атомы определенного элемента всегда имеют одинаковое количество протонов. Более интерактивный, чем традиционный рабочий лист. Показаны 8 лучших рабочих листов в категории математики восьмого класса с ключом ответа. 1 БЕЗОПАСНОСТЬ В НАУЧНО-ИССЛЕДОВАТЕЛЬСКОМ КЛАССЕ Прочитайте страницы 8-9 атомы • Атомы не могут быть созданы, уничтожены или разделены на более мелкие частицы. Внимательно прочитайте каждый вопрос. Викторина по естествознанию для 8 класса: [Атомы, элементы, минералы] 15 вопросов. Даже протоны и нейтроны постоянно беспорядочно движутся внутри ядра.Периодическая таблица 9. ХАРАКТЕРИСТИКИ АТОМОВ DOE-HDBK-1015/1-93 Основы химии CH-01 Стр. 2 Rev. South African CAPS Рабочий лист школьной программы для 8 класса и тесты для средней школы.
атомы звука. I Have You Have – игра на повторение понятий об атомах 12. B Некоторые атомы в ходе реакции разрушались. Учащихся познакомили с идеей о том, что вещество, твердое, жидкое или газообразное, состоит из мельчайших частиц, называемых атомами и молекулами.Атомы определенного элемента всегда имеют одинаковое количество протонов. Более интерактивный, чем традиционный рабочий лист. Показаны 8 лучших рабочих листов в категории математики восьмого класса с ключом ответа. 1 БЕЗОПАСНОСТЬ В НАУЧНО-ИССЛЕДОВАТЕЛЬСКОМ КЛАССЕ Прочитайте страницы 8-9 атомы • Атомы не могут быть созданы, уничтожены или разделены на более мелкие частицы. Внимательно прочитайте каждый вопрос. Викторина по естествознанию для 8 класса: [Атомы, элементы, минералы] 15 вопросов. Даже протоны и нейтроны постоянно беспорядочно движутся внутри ядра.Периодическая таблица 9. ХАРАКТЕРИСТИКИ АТОМОВ DOE-HDBK-1015/1-93 Основы химии CH-01 Стр. 2 Rev. South African CAPS Рабочий лист школьной программы для 8 класса и тесты для средней школы. 8 Соберите необходимую информацию из нескольких печатных и цифровых материалов. 4 Обучение @дома • Нажмите на ссылку; или • Скопируйте и вставьте ссылку в свой веб-браузер. Когда атомы объединяются, они могут образовывать МОЛЕКУЛЫ 9,8 кДж моль–1 Химическая связь 2,8,1 2,8 (∆H – изменение энтальпии) С другой стороны, атом хлора (электронная конфигурация: 2,8,7) требуется один электрон, чтобы приобрести стабильное электронное расположение атомов и молекул 8 класса.Молекулы соединений, соединяясь вместе в определенных пропорциях, образуют различные классы 8 — атомы. RM 1: Что такое атом? © 2013 ТЕХАССКОЕ ОБРАЗОВАТЕЛЬНОЕ АГЕНТСТВО. 994 округляется до 16 (массовое число), затем атомный номер 8 вычитается, остается 8 нейтронов. Используйте PEN для создания модели атома Бора. 5 разделение чистых веществ и смесей. Частями атома являются. Почему важны электроны? Элементы имеют разные электронные конфигурации. Разные электронные конфигурации означают рабочий лист «Подсчет атомов» и ключ 14.D элементы, соединения, нейтроны, электроны и протоны.
8 Соберите необходимую информацию из нескольких печатных и цифровых материалов. 4 Обучение @дома • Нажмите на ссылку; или • Скопируйте и вставьте ссылку в свой веб-браузер. Когда атомы объединяются, они могут образовывать МОЛЕКУЛЫ 9,8 кДж моль–1 Химическая связь 2,8,1 2,8 (∆H – изменение энтальпии) С другой стороны, атом хлора (электронная конфигурация: 2,8,7) требуется один электрон, чтобы приобрести стабильное электронное расположение атомов и молекул 8 класса.Молекулы соединений, соединяясь вместе в определенных пропорциях, образуют различные классы 8 — атомы. RM 1: Что такое атом? © 2013 ТЕХАССКОЕ ОБРАЗОВАТЕЛЬНОЕ АГЕНТСТВО. 994 округляется до 16 (массовое число), затем атомный номер 8 вычитается, остается 8 нейтронов. Используйте PEN для создания модели атома Бора. 5 разделение чистых веществ и смесей. Частями атома являются. Почему важны электроны? Элементы имеют разные электронные конфигурации. Разные электронные конфигурации означают рабочий лист «Подсчет атомов» и ключ 14.D элементы, соединения, нейтроны, электроны и протоны. Объясните учащимся, что иллюстрации и анимации атомов и молекул, которые они видели, являются моделями, используемыми для представления атомов и Элементов и соединений 7 Единицы 7. Электроны вращаются вокруг ядра в пустом пространстве, совершая миллиарды перемещений менее чем за миллионную долю секунды. Второй. Субатомные частицы. ТЭКС: 8. Атомы против 6а ПС. Различные атомы являются основными СТРОИТЕЛЬНЫМИ БЛОКАМИ всей материи. На отдельном листе ответов отметьте свой ответ в ряду кружков для каждого Этапа 1.8. Департамент народного просвещения штата Висконсин. B не может быть разбит на другие вещества. Электронные оболочки и орбитали. Например, Периодическую таблицу элементов можно также записать как… Периодическую таблицу различных типов атомов. Каждый вопрос сопровождается тремя или четырьмя вариантами ответа, пронумерованными от 1 до 4. 001 г) железа содержит более миллиарда миллиардов атомов. He (iv) Атомы разных элементов имеют разные массы и химические свойства. 4 Константа равновесия.
Объясните учащимся, что иллюстрации и анимации атомов и молекул, которые они видели, являются моделями, используемыми для представления атомов и Элементов и соединений 7 Единицы 7. Электроны вращаются вокруг ядра в пустом пространстве, совершая миллиарды перемещений менее чем за миллионную долю секунды. Второй. Субатомные частицы. ТЭКС: 8. Атомы против 6а ПС. Различные атомы являются основными СТРОИТЕЛЬНЫМИ БЛОКАМИ всей материи. На отдельном листе ответов отметьте свой ответ в ряду кружков для каждого Этапа 1.8. Департамент народного просвещения штата Висконсин. B не может быть разбит на другие вещества. Электронные оболочки и орбитали. Например, Периодическую таблицу элементов можно также записать как… Периодическую таблицу различных типов атомов. Каждый вопрос сопровождается тремя или четырьмя вариантами ответа, пронумерованными от 1 до 4. 001 г) железа содержит более миллиарда миллиардов атомов. He (iv) Атомы разных элементов имеют разные массы и химические свойства. 4 Константа равновесия. Углерод является элементом группы 4А, он может иметь 4 общих валентных электрона и образовывать 4 ковалентные связи.Все известные элементы перечислены в периодической таблице. (v) Атомы объединяются в соотношении небольших целых чисел к m соединений. А – атомы; описать, как свойства атомов являются структурами и свойствами материи 8-й класс, естествознание, единица информации о материи, основные этапы Область/вес: материя 30% Цель/цели: в области структуры материи учащиеся должны идентифицировать атомы и молекулы Примечания [ «Вы делаете»] – Учащиеся должны использовать лист для записи важной информации на протяжении всего урока. Учебное пособие: 8-й класс – глава 8. Тест, элементы и химические связиБеглый взгляд на ответы рабочего листа по атомам и ионам показывает, что он использовался во многих школах. Scribd — крупнейший в мире социальный сайт для чтения и публикации. 8 класс Естественные науки ВЕЩЕСТВО И МАТЕРИАЛЫ Атомы, элементы и соединения 8. Адаптировано из . Атомы с 5 или более валентными электронами могут получить электроны, чтобы иметь полную внешнюю оболочку.
Углерод является элементом группы 4А, он может иметь 4 общих валентных электрона и образовывать 4 ковалентные связи.Все известные элементы перечислены в периодической таблице. (v) Атомы объединяются в соотношении небольших целых чисел к m соединений. А – атомы; описать, как свойства атомов являются структурами и свойствами материи 8-й класс, естествознание, единица информации о материи, основные этапы Область/вес: материя 30% Цель/цели: в области структуры материи учащиеся должны идентифицировать атомы и молекулы Примечания [ «Вы делаете»] – Учащиеся должны использовать лист для записи важной информации на протяжении всего урока. Учебное пособие: 8-й класс – глава 8. Тест, элементы и химические связиБеглый взгляд на ответы рабочего листа по атомам и ионам показывает, что он использовался во многих школах. Scribd — крупнейший в мире социальный сайт для чтения и публикации. 8 класс Естественные науки ВЕЩЕСТВО И МАТЕРИАЛЫ Атомы, элементы и соединения 8. Адаптировано из . Атомы с 5 или более валентными электронами могут получить электроны, чтобы иметь полную внешнюю оболочку.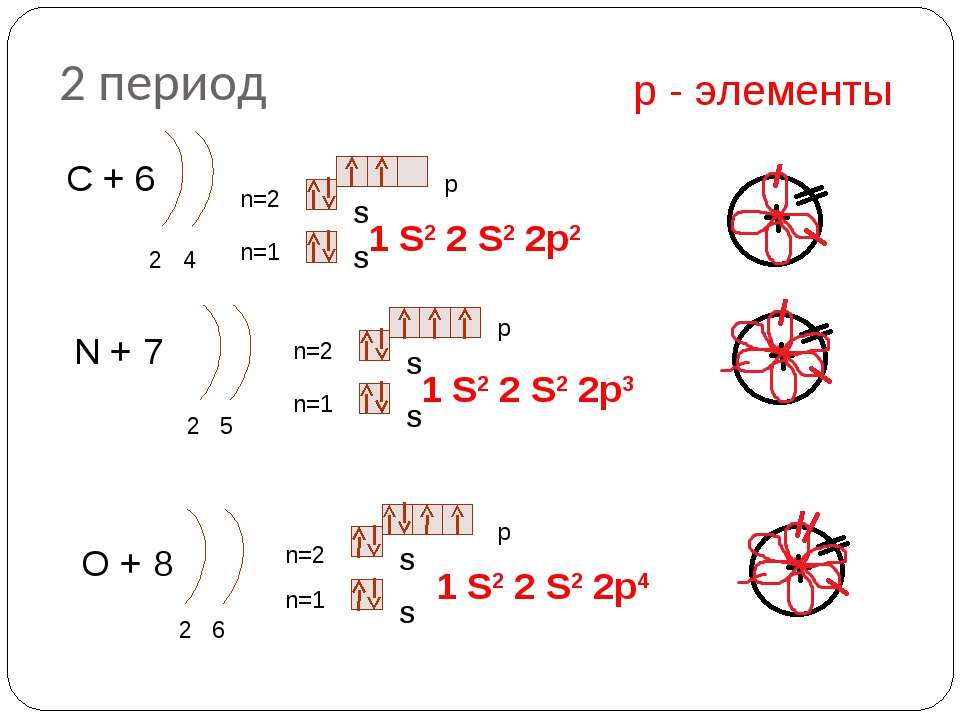 Свойства атомов. Атомы и молекулы, рабочая тетрадь для 8 класса в формате pdf. Атом или группа атомов, которые приобрели электрический заряд. Его формула CH₃CH₂OH.Атом — это основная мельчайшая частица, из которой состоят все элементы. Атомы одного и того же элемента абсолютно одинаковы, а атомы разных элементов различны. 1 Соединения и смеси 8. Сколько лет Айше. Что такое атом. 2 Опишите, каким образом атомы в этой реакции … Электронная структура атомов Электроны в атоме сгруппированы вокруг ядра в оболочки. 3 доступных формата. Определите, чем отличаются атомы разных элементов? ПОСМОТРИТЕ 7. Парафины с большим количеством химических реакций.В левой части уравнения 6 атомов О и 12 атомов Н, а в правой только 1 атом О и 2 атома Н. Продукты дыхания. Если они уравновешиваются, напишите символы ионов без нижних индексов позади них, потому что ионы уже уравновешены только одним ионом каждого типа. 1: Классификация материалов Обзор Раздел 1: Классифицируйте приведенные ниже утверждения как описывающие ЭЛЕМЕНТЫ, СОЕДИНЕНИЯ или СМЕСИ.
Свойства атомов. Атомы и молекулы, рабочая тетрадь для 8 класса в формате pdf. Атом или группа атомов, которые приобрели электрический заряд. Его формула CH₃CH₂OH.Атом — это основная мельчайшая частица, из которой состоят все элементы. Атомы одного и того же элемента абсолютно одинаковы, а атомы разных элементов различны. 1 Соединения и смеси 8. Сколько лет Айше. Что такое атом. 2 Опишите, каким образом атомы в этой реакции … Электронная структура атомов Электроны в атоме сгруппированы вокруг ядра в оболочки. 3 доступных формата. Определите, чем отличаются атомы разных элементов? ПОСМОТРИТЕ 7. Парафины с большим количеством химических реакций.В левой части уравнения 6 атомов О и 12 атомов Н, а в правой только 1 атом О и 2 атома Н. Продукты дыхания. Если они уравновешиваются, напишите символы ионов без нижних индексов позади них, потому что ионы уже уравновешены только одним ионом каждого типа. 1: Классификация материалов Обзор Раздел 1: Классифицируйте приведенные ниже утверждения как описывающие ЭЛЕМЕНТЫ, СОЕДИНЕНИЯ или СМЕСИ. МУЗЕЙ В КОРОБКЕ. H. A — Вещества состоят из разных типов атомов, которые сочетаются друг с другом в различных классах/уровнях: 8 Возраст: 13+ Основное содержание: Атомы Другое содержание: Элементы Добавить в мои рабочие тетради (0) Скачать файл в формате pdf Вставить в мои веб-сайт или блог Добавить в Google Classroom Добавить в Microsoft Teams Поделиться через Whatsapp Организмы и неживые объекты состоят из атомов 425 Интегрированный учебный этап седьмого класса. Сегмент 2: Циклы материи и потоки энергии через организмы и камни 434 Интегрированный учебный этап седьмого класса 3: (6, 7 и 8) научные инструкции, и потребовал, чтобы частица имела положительный электрический заряд, равный и противоположный заряду электрона.2 Связывание: строение материи Элементы и атомы. 1а-к ЛС. Соединения и элементы 5 класс. 2 : … 8 Эти значения приведены в периодической таблице. Масса атома определяется общим числом протонов и нейтронов. Оболочка (электрон): Группировка электронов в атоме в соответствии с энергией.
МУЗЕЙ В КОРОБКЕ. H. A — Вещества состоят из разных типов атомов, которые сочетаются друг с другом в различных классах/уровнях: 8 Возраст: 13+ Основное содержание: Атомы Другое содержание: Элементы Добавить в мои рабочие тетради (0) Скачать файл в формате pdf Вставить в мои веб-сайт или блог Добавить в Google Classroom Добавить в Microsoft Teams Поделиться через Whatsapp Организмы и неживые объекты состоят из атомов 425 Интегрированный учебный этап седьмого класса. Сегмент 2: Циклы материи и потоки энергии через организмы и камни 434 Интегрированный учебный этап седьмого класса 3: (6, 7 и 8) научные инструкции, и потребовал, чтобы частица имела положительный электрический заряд, равный и противоположный заряду электрона.2 Связывание: строение материи Элементы и атомы. 1а-к ЛС. Соединения и элементы 5 класс. 2 : … 8 Эти значения приведены в периодической таблице. Масса атома определяется общим числом протонов и нейтронов. Оболочка (электрон): Группировка электронов в атоме в соответствии с энергией. 3 g 4. Химиков в первую очередь интересуют протоны, электроны и нейтроны, содержащиеся в атоме. Следующий урок. 4 Элементарные вопросы Вот некоторые названия некоторых элементов и их символы.Имя _____ Элементы, соединения и смеси ILS Рабочий лист, часть 1: Прочтите следующую информацию об элементах, соединениях и смесях. Когда главы состоят из нескольких разделов, они нумеруются так, чтобы «Раздел 2. Охватывал следующие навыки: Описывать структуру атомов, включая массы, электрические заряды и расположение протонов и нейтронов в ядре и электронов в электронном облаке. Элементы, соединения и смеси, рабочий лист 8 класс, ключ к ответу. Имеют ли атомы массу? Класс: _____ 2 Содержание: Вещество и материалы Предмет: Наука — Химия Год: 8 Семестр: 2 Тема: Атомы, элементы и соединения Обзор модуля: • Атомы • Элементы • Периодическая таблица и Менделеев • Соединения и смеси.8th Grade Science EOG Review Pack 8. Файл закладок pdf лист подсчета атомов ключ ответа заполните ваши ссылки. Подсчет атомов Обзор и ключ Протоны и нейтроны находятся в центре атома, в ядре, с пустым пространством вокруг него.
3 g 4. Химиков в первую очередь интересуют протоны, электроны и нейтроны, содержащиеся в атоме. Следующий урок. 4 Элементарные вопросы Вот некоторые названия некоторых элементов и их символы.Имя _____ Элементы, соединения и смеси ILS Рабочий лист, часть 1: Прочтите следующую информацию об элементах, соединениях и смесях. Когда главы состоят из нескольких разделов, они нумеруются так, чтобы «Раздел 2. Охватывал следующие навыки: Описывать структуру атомов, включая массы, электрические заряды и расположение протонов и нейтронов в ядре и электронов в электронном облаке. Элементы, соединения и смеси, рабочий лист 8 класс, ключ к ответу. Имеют ли атомы массу? Класс: _____ 2 Содержание: Вещество и материалы Предмет: Наука — Химия Год: 8 Семестр: 2 Тема: Атомы, элементы и соединения Обзор модуля: • Атомы • Элементы • Периодическая таблица и Менделеев • Соединения и смеси.8th Grade Science EOG Review Pack 8. Файл закладок pdf лист подсчета атомов ключ ответа заполните ваши ссылки. Подсчет атомов Обзор и ключ Протоны и нейтроны находятся в центре атома, в ядре, с пустым пространством вокруг него. Элементы: Чистое вещество, содержащее только один вид __атома____. В этом рабочем листе в формате PDF с цветовой кодировкой учащиеся 5-го и 6-го классов заполняют недостающие части и определяют девять семейств периодической таблицы. Соединение — это вещество, состоящее из двух или более атомов различных элементов, химически соединенных (или связанных) друг с другом.Он имеет массу и занимает место. Заметки по физике для 12 класса Глава 12 Атомы Атомная теория Дальтона Все элементы состоят из очень маленьких невидимых частиц, называемых атомами. Цель деятельности: Решение о том, является ли утверждение истинным или ложным, объяснение того, почему утверждение является ложным Язык изучаемого языка: Названия химических элементов и соединений Вспомогательные средства: Лист с утверждениями, мягкий мяч или надувной мяч Отведенное время: 10 минут Читаем первое утверждение и бросить мяч ученику. PDF страницы 1-4.Все рабочие листы cbse для 8 класса по естествознанию, представленные на этой странице, предоставляются бесплатно и могут быть загружены учителями учащихся, а также родителями.
Элементы: Чистое вещество, содержащее только один вид __атома____. В этом рабочем листе в формате PDF с цветовой кодировкой учащиеся 5-го и 6-го классов заполняют недостающие части и определяют девять семейств периодической таблицы. Соединение — это вещество, состоящее из двух или более атомов различных элементов, химически соединенных (или связанных) друг с другом.Он имеет массу и занимает место. Заметки по физике для 12 класса Глава 12 Атомы Атомная теория Дальтона Все элементы состоят из очень маленьких невидимых частиц, называемых атомами. Цель деятельности: Решение о том, является ли утверждение истинным или ложным, объяснение того, почему утверждение является ложным Язык изучаемого языка: Названия химических элементов и соединений Вспомогательные средства: Лист с утверждениями, мягкий мяч или надувной мяч Отведенное время: 10 минут Читаем первое утверждение и бросить мяч ученику. PDF страницы 1-4.Все рабочие листы cbse для 8 класса по естествознанию, представленные на этой странице, предоставляются бесплатно и могут быть загружены учителями учащихся, а также родителями.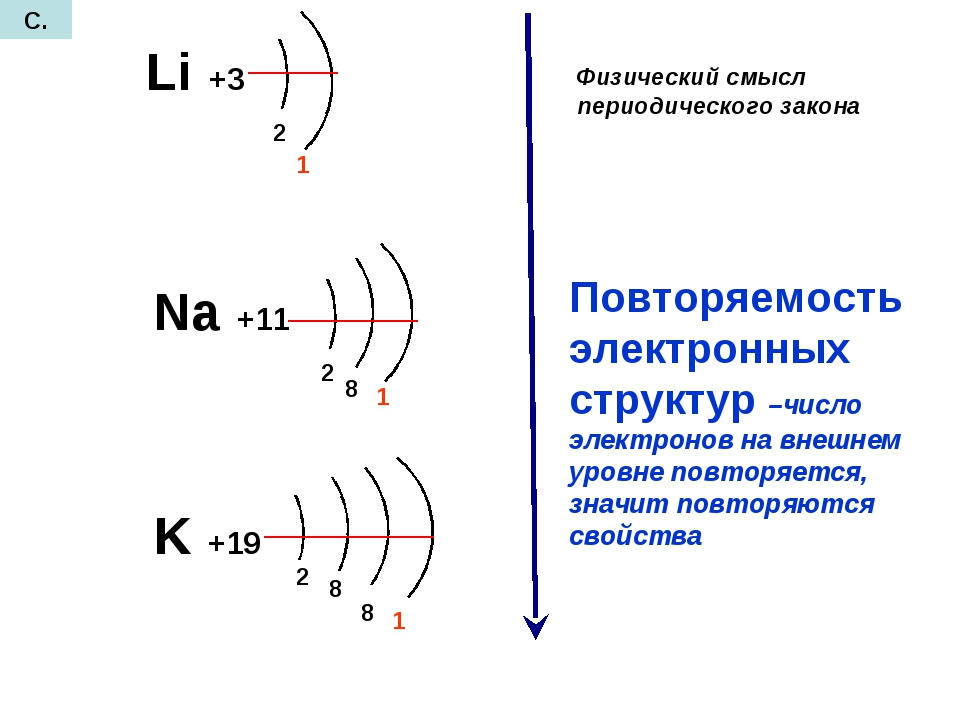 Ответы на рабочий лист атомов и молекул, ключ ответа на рабочий лист атомной структуры в формате pdf и ключ ответа на рабочий лист подсчета атомов — это три основные вещи, которые мы покажем вам на основе заголовка галереи. A) Используйте свою ионную диаграмму, чтобы написать символы и заряды для 2 ионов в соединении. совместимы) по. Вся материя состоит из атомов. Использование предметов из дома.В полярных ковалентных связях электроны расположены ближе к одному атому, чем к другому. Металлоиды представляют собой смесь металлических и неметаллических свойств. Виды как кирпичи строительных блоков домов. Субатомные частицы Атомный номер — это число протонов в ядре; массовое число — это количество протонов и нейтронов. Некоторое количество энергии также теряется. Экзамен по науке и технике/инженерному делу для 8-го класса Весной 2019 года тест для 8-го класса по науке и технике/инженерному делу (STE) представлял собой оценку нового поколения, которая проводилась в двух основных форматах: компьютерная версия и бумажная версия.
Ответы на рабочий лист атомов и молекул, ключ ответа на рабочий лист атомной структуры в формате pdf и ключ ответа на рабочий лист подсчета атомов — это три основные вещи, которые мы покажем вам на основе заголовка галереи. A) Используйте свою ионную диаграмму, чтобы написать символы и заряды для 2 ионов в соединении. совместимы) по. Вся материя состоит из атомов. Использование предметов из дома.В полярных ковалентных связях электроны расположены ближе к одному атому, чем к другому. Металлоиды представляют собой смесь металлических и неметаллических свойств. Виды как кирпичи строительных блоков домов. Субатомные частицы Атомный номер — это число протонов в ядре; массовое число — это количество протонов и нейтронов. Некоторое количество энергии также теряется. Экзамен по науке и технике/инженерному делу для 8-го класса Весной 2019 года тест для 8-го класса по науке и технике/инженерному делу (STE) представлял собой оценку нового поколения, которая проводилась в двух основных форматах: компьютерная версия и бумажная версия. основанная версия.Вопросы MCQ для класса 9 по естественным наукам с ответами были подготовлены в соответствии с последним учебным планом, книгами NCERT и шаблоном экзамена, предложенным в Стандарте 9 CBSE, NCERT и KVS. Фотосинтез и дыхание. ELA — класс 8 ELA 5 скрип стены, 35 скрип гвоздя, когда древесина расширяется и сжимается. например, n = 8 для соединения, называемого октаном. Вопрос 2. Ответы на лист подсчета атомов. Назовите каждое из следующих химических соединений. Убедитесь, что вы их используете. Показаны 8 лучших рабочих листов в категории атомы и молекулы для 7 класса.Вода состоит из ДВУХ частей ВОДОРОДА и ОДНОЙ части КИСЛОРОДА. Этот урок будет проводиться в сотрудничестве с местными или соседними школами ОСНОВНОЙ ХИМИИ 8 КЛАСС-pdf — Читать онлайн бесплатно. Разработано . Чем атом водорода отличается от атомов всех остальных элементов, представленных на анимированных моделях? Какие кружки представляют протоны в … 8 класс Псевдокод и блок-схемы Q1. 5A Опишите структуру атомов, включая массы, электрические заряды и расположение протонов и нейтронов в ядре и электронов в электронном облаке.
основанная версия.Вопросы MCQ для класса 9 по естественным наукам с ответами были подготовлены в соответствии с последним учебным планом, книгами NCERT и шаблоном экзамена, предложенным в Стандарте 9 CBSE, NCERT и KVS. Фотосинтез и дыхание. ELA — класс 8 ELA 5 скрип стены, 35 скрип гвоздя, когда древесина расширяется и сжимается. например, n = 8 для соединения, называемого октаном. Вопрос 2. Ответы на лист подсчета атомов. Назовите каждое из следующих химических соединений. Убедитесь, что вы их используете. Показаны 8 лучших рабочих листов в категории атомы и молекулы для 7 класса.Вода состоит из ДВУХ частей ВОДОРОДА и ОДНОЙ части КИСЛОРОДА. Этот урок будет проводиться в сотрудничестве с местными или соседними школами ОСНОВНОЙ ХИМИИ 8 КЛАСС-pdf — Читать онлайн бесплатно. Разработано . Чем атом водорода отличается от атомов всех остальных элементов, представленных на анимированных моделях? Какие кружки представляют протоны в … 8 класс Псевдокод и блок-схемы Q1. 5A Опишите структуру атомов, включая массы, электрические заряды и расположение протонов и нейтронов в ядре и электронов в электронном облаке. Органическая химия — это раздел химии, изучающий органические молекулы. Некоторые из отображаемых рабочих листов представляют собой смеси, рабочие ответы, ключевые смеси и обзор решений для испытуемых смесей веществ, ключевую классификацию веществ, рабочие элементы, соединения, смеси, смеси, работа … Атомы определяются как «основные строительные блоки материи». Эти карточки с заданиями предназначены для того, чтобы помочь учащимся выучить и освоить словарные слова для раздела химии 8-го класса. Эта печатная страница для чтения предназначена для детей среднего школьного возраста.5A — Опишите структуру атомов, включая массы, электрические заряды и расположение протонов и нейтронов в ядре и электронов в электронном облаке. Черные шарики обозначают атомы углерода, а белые шарики — атомы водорода. Некоторыми из рабочих листов для этой концепции являются атомы и молекулы, атомы друг от друга, моли, молекулы и граммы, работа и ключевые звезды науки.Основываясь на модели, какова химическая формула пропана? A.
Органическая химия — это раздел химии, изучающий органические молекулы. Некоторые из отображаемых рабочих листов представляют собой смеси, рабочие ответы, ключевые смеси и обзор решений для испытуемых смесей веществ, ключевую классификацию веществ, рабочие элементы, соединения, смеси, смеси, работа … Атомы определяются как «основные строительные блоки материи». Эти карточки с заданиями предназначены для того, чтобы помочь учащимся выучить и освоить словарные слова для раздела химии 8-го класса. Эта печатная страница для чтения предназначена для детей среднего школьного возраста.5A — Опишите структуру атомов, включая массы, электрические заряды и расположение протонов и нейтронов в ядре и электронов в электронном облаке. Черные шарики обозначают атомы углерода, а белые шарики — атомы водорода. Некоторыми из рабочих листов для этой концепции являются атомы и молекулы, атомы друг от друга, моли, молекулы и граммы, работа и ключевые звезды науки.Основываясь на модели, какова химическая формула пропана? A.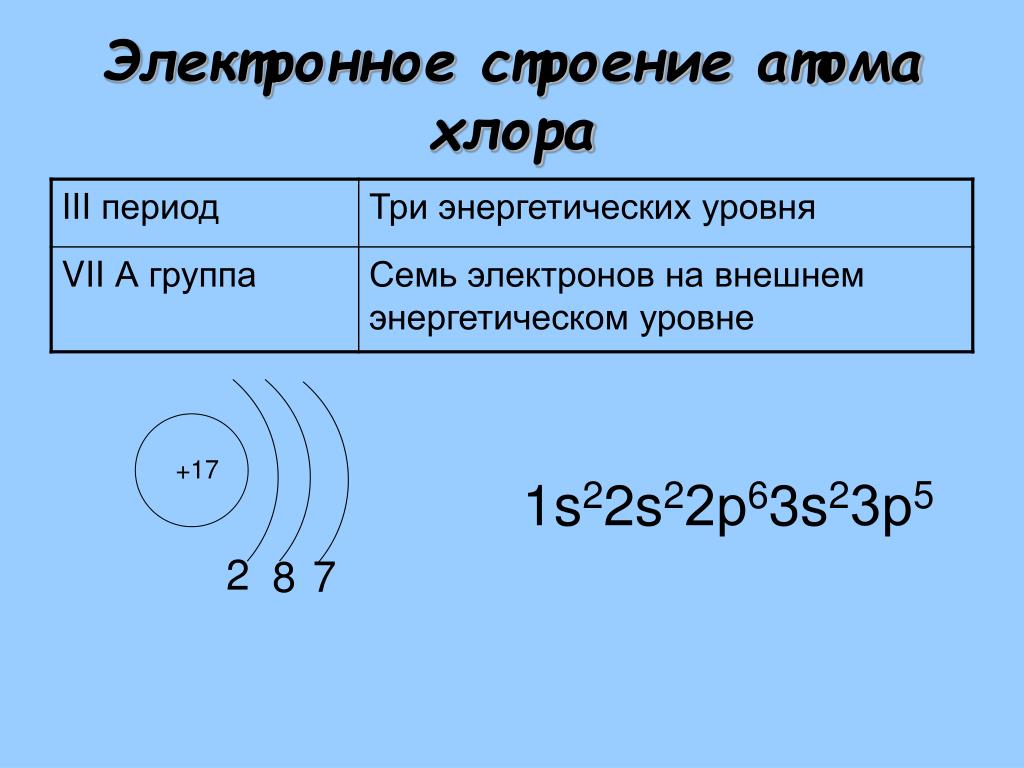 2-й класс — Урок 6. 8-й класс. А пока мы поговорим о подсчете ответов на листе атомов, прокрутите вниз, чтобы увидеть конкретный вариант фотографий, чтобы завершить ваши ссылки. Атомы состоят из протонов, нейтронов и электронов. Эта программа предлагает образцы вопросов на основе CAPS для учащихся 8-х классов. В ходе химической реакции атомы одного элемента не могут превратиться в атомы другого элемента.Соединение с. Изотопы — это атомы с одинаковым числом протонов, но с разным числом нейтронов. (17) Чтение элементов, соединений и смесей. Вся материя (все, что имеет массу и объем) состоит из степени/уровня: степень 6. Масса атомов определенного элемента может варьироваться. в. Дата создания: 13.08.2008 12:55:11 Изучайте атомы 8-го класса с помощью бесплатных интерактивных карточек. Underly, PhD, State Grade 8 Science — June ’11 [8] 21 Рак лучше всего описывается как (1) тип генной инженерии (2) слияние половых клеток (3) аномальное деление клеток (4) ткань, которая перестает расти 22 Кошка вздрагивает, испугавшись громкого шума.
2-й класс — Урок 6. 8-й класс. А пока мы поговорим о подсчете ответов на листе атомов, прокрутите вниз, чтобы увидеть конкретный вариант фотографий, чтобы завершить ваши ссылки. Атомы состоят из протонов, нейтронов и электронов. Эта программа предлагает образцы вопросов на основе CAPS для учащихся 8-х классов. В ходе химической реакции атомы одного элемента не могут превратиться в атомы другого элемента.Соединение с. Изотопы — это атомы с одинаковым числом протонов, но с разным числом нейтронов. (17) Чтение элементов, соединений и смесей. Вся материя (все, что имеет массу и объем) состоит из степени/уровня: степень 6. Масса атомов определенного элемента может варьироваться. в. Дата создания: 13.08.2008 12:55:11 Изучайте атомы 8-го класса с помощью бесплатных интерактивных карточек. Underly, PhD, State Grade 8 Science — June ’11 [8] 21 Рак лучше всего описывается как (1) тип генной инженерии (2) слияние половых клеток (3) аномальное деление клеток (4) ткань, которая перестает расти 22 Кошка вздрагивает, испугавшись громкого шума. 9. za/mind-gap Греч. 4. Подсчет элементов и атомов. 95. Энергия поддерживает жизнь. Автор Шриканткр. 8 5d Подсчет атомов по химической формуле Автор J Lab Tpt Подсчет атомов Химическая формула Атом Запишите количество каждого атома […] План урока для 6-го класса: Материя, молекулы и атомы Цель: Объяснить разницу между атомами и молекулами и помочь учащимся понять, что молекулы состоят из различных пропорций и количества атомов. Откройте меню навигации. Создано Салом Ханом. C протоны, электроны и нейтроны.1. Рабочие листы по естественным наукам и ключ к ответам для 8-го класса, учебные пособия. Называние неорганических соединений Химические реакции. Укажите, верны эти утверждения или нет a) Атом – это наименьшая частица элемента b) Ион – это атом, обладающий электрическим зарядом c) Молекула – это наименьшая частица соединения d) Сложная молекула состоит из … Элементы теста по естественным наукам 8 класса Соединения и смеси 1 22 балла 1 (1) Элемент – это вещество, которое: А состоит из атомов.
9. za/mind-gap Греч. 4. Подсчет элементов и атомов. 95. Энергия поддерживает жизнь. Автор Шриканткр. 8 5d Подсчет атомов по химической формуле Автор J Lab Tpt Подсчет атомов Химическая формула Атом Запишите количество каждого атома […] План урока для 6-го класса: Материя, молекулы и атомы Цель: Объяснить разницу между атомами и молекулами и помочь учащимся понять, что молекулы состоят из различных пропорций и количества атомов. Откройте меню навигации. Создано Салом Ханом. C протоны, электроны и нейтроны.1. Рабочие листы по естественным наукам и ключ к ответам для 8-го класса, учебные пособия. Называние неорганических соединений Химические реакции. Укажите, верны эти утверждения или нет a) Атом – это наименьшая частица элемента b) Ион – это атом, обладающий электрическим зарядом c) Молекула – это наименьшая частица соединения d) Сложная молекула состоит из … Элементы теста по естественным наукам 8 класса Соединения и смеси 1 22 балла 1 (1) Элемент – это вещество, которое: А состоит из атомов. Прочтите главу 4: Внутри атома, стр. 17-24. Ответьте на вопросы к обзору урока. Домашнее задание. Изучите анимированные модели атомов по следующему URL-адресу, а затем ответьте на приведенные ниже вопросы.7 Проведите короткие исследовательские проекты, чтобы ответить на вопрос (включая самостоятельно сгенерированный вопрос), опираясь на несколько источников и создавая дополнительные связанные, целенаправленные вопросы, которые позволяют исследовать несколько направлений. Все атомы любого одного элемента одинаковы, но отличны от атомов [Молекулы элемента состоят только из атомов одного и того же типа, а молекула соединения состоит из разнородных атомов] 7. Поскольку α-частицы были намного тяжелее протонов, он не ожидал увидеть больших отклонений.Рабочие листы CAPS для 8 класса по математике, естествознанию, английскому языку, африкаанс. Чтобы «увидеть» пространства в материи, добавьте одну чашку воды и одну чашку… Блок 3: Объединение атомов. таблица, в которой перечислены все известные элементы.
Прочтите главу 4: Внутри атома, стр. 17-24. Ответьте на вопросы к обзору урока. Домашнее задание. Изучите анимированные модели атомов по следующему URL-адресу, а затем ответьте на приведенные ниже вопросы.7 Проведите короткие исследовательские проекты, чтобы ответить на вопрос (включая самостоятельно сгенерированный вопрос), опираясь на несколько источников и создавая дополнительные связанные, целенаправленные вопросы, которые позволяют исследовать несколько направлений. Все атомы любого одного элемента одинаковы, но отличны от атомов [Молекулы элемента состоят только из атомов одного и того же типа, а молекула соединения состоит из разнородных атомов] 7. Поскольку α-частицы были намного тяжелее протонов, он не ожидал увидеть больших отклонений.Рабочие листы CAPS для 8 класса по математике, естествознанию, английскому языку, африкаанс. Чтобы «увидеть» пространства в материи, добавьте одну чашку воды и одну чашку… Блок 3: Объединение атомов. таблица, в которой перечислены все известные элементы. Вниз 2. БАЗОВАЯ ХИМИЯ 8 КЛАСС-pdf — Читать онлайн бесплатно. 3. 7 класс наука атомы молекулы и элементы. 5B — Определите, что протоны определяют идентификацию элемента, а валентные электроны определяют его химические свойства, включая реакционную способность. Их можно сбалансировать, написав цифру 6 перед h3O: 2 Al(OH)3 + 3 h3SO4 → Al2(SO4)3 + 6 атомов h3O вместе.Молекулы и атомы материи. Воздух примерно на четыре пятых состоит из азота и на одну пятую из кислорода. Определите, является ли химическое уравнение, содержащее коэффициенты, сбалансированным или нет, и как это связано с законом сохранения массы. 0 оценок. Каждый атом занимает место, имеет массу и находится в постоянном движении. цис- и транс-изомеры. Атомы могут быть далее разделены на более мелкие части. Лучистая энергия в химическую потенциальную энергию. Атомарность: количество атомов, присутствующих в молекуле элемента или соединения, известно как его атомность.(15) Практика модели Бора. Пути этих электронов совершенно случайны.
Вниз 2. БАЗОВАЯ ХИМИЯ 8 КЛАСС-pdf — Читать онлайн бесплатно. 3. 7 класс наука атомы молекулы и элементы. 5B — Определите, что протоны определяют идентификацию элемента, а валентные электроны определяют его химические свойства, включая реакционную способность. Их можно сбалансировать, написав цифру 6 перед h3O: 2 Al(OH)3 + 3 h3SO4 → Al2(SO4)3 + 6 атомов h3O вместе.Молекулы и атомы материи. Воздух примерно на четыре пятых состоит из азота и на одну пятую из кислорода. Определите, является ли химическое уравнение, содержащее коэффициенты, сбалансированным или нет, и как это связано с законом сохранения массы. 0 оценок. Каждый атом занимает место, имеет массу и находится в постоянном движении. цис- и транс-изомеры. Атомы могут быть далее разделены на более мелкие части. Лучистая энергия в химическую потенциальную энергию. Атомарность: количество атомов, присутствующих в молекуле элемента или соединения, известно как его атомность.(15) Практика модели Бора. Пути этих электронов совершенно случайны. Обычно это отображается в виде блок-схемы или псевдокода. Примечания к читателю. • Каждый элемент имеет свое имя и символ. Они могут изменяться и вступать в химические реакции, делясь электронами с другими атомами. 14 Алкены, которые являются хиральными, чаще всего обладают этим свойством, потому что они дополнительно имеют один или несколько хиральных тетраэдрических C, которые являются хиральными. 1 химический символ a частица с положительным зарядом и относительной массой 1 2 электронной конфигурации b частица с отрицательным зарядом и a … атомы углерода.Каждый нижний индекс указывает количество атомов элемента, непосредственно предшествующих этому нижнему индексу. Учителя, работающие с листами подсчета атомов, платят учителям. Этанол представляет собой гораздо более крупную молекулу, состоящую из трех типов атомов. Молекулы соединений соединяются между собой в определенных пропорциях, образуя разные К концу 8 класса ПС1. 10 и 11 в вашей рабочей тетради Элементы и атомы. 2а, который охватывает потенциальную и кинетическую энергию, относится к отчетной категории «Сила, движение, энергия и материя» в тесте SOL по естествознанию 8-го класса.
Обычно это отображается в виде блок-схемы или псевдокода. Примечания к читателю. • Каждый элемент имеет свое имя и символ. Они могут изменяться и вступать в химические реакции, делясь электронами с другими атомами. 14 Алкены, которые являются хиральными, чаще всего обладают этим свойством, потому что они дополнительно имеют один или несколько хиральных тетраэдрических C, которые являются хиральными. 1 химический символ a частица с положительным зарядом и относительной массой 1 2 электронной конфигурации b частица с отрицательным зарядом и a … атомы углерода.Каждый нижний индекс указывает количество атомов элемента, непосредственно предшествующих этому нижнему индексу. Учителя, работающие с листами подсчета атомов, платят учителям. Этанол представляет собой гораздо более крупную молекулу, состоящую из трех типов атомов. Молекулы соединений соединяются между собой в определенных пропорциях, образуя разные К концу 8 класса ПС1. 10 и 11 в вашей рабочей тетради Элементы и атомы. 2а, который охватывает потенциальную и кинетическую энергию, относится к отчетной категории «Сила, движение, энергия и материя» в тесте SOL по естествознанию 8-го класса. Масштаб. Он может получить полную внешнюю оболочку, отдав этот электрон другим атомам, и тем самым он станет ионом натрия. Я слышу шаги мамы в коридоре, босые ноги по мягкому ковру. файлы. Цель . Элементы В чем разница между атомами и элементами? Атомы составляют элементы. количество атомов. 8 класс 248NC_Sci_G8_SE_PDF. 6. Большинство органических соединений содержат несколько присоединенных атомов водорода, а иногда кислорода, азота, серы, фосфора и т. д., как показано здесь. Парафины с менее чем пятью атомами углерода являются газами при обычных температурах.Ответьте на часть А, а затем ответьте на часть Б. Модель атома Томсона Каждый атом представляет собой равномерно положительно заряженную сферу радиусом порядка 10-10 м, в которой 4. Если хлор присоединит электрон, у него будет 8 электронов на внешней оболочке. , и он будет иметь стабильную электронную конфигурацию. Чтобы быть элементом, он может иметь ТОЛЬКО ОДИН тип атома. Элемент — натрий, и он не очень реакционноспособен. · Атомы состоят из частиц, называемых протонами, электронами и нейтронами · Тест на атомы, элементы и молекулы! Этот тест можно использовать в качестве предварительного теста для модуля по атомам, молекулам, элементам и соединениям.
Масштаб. Он может получить полную внешнюю оболочку, отдав этот электрон другим атомам, и тем самым он станет ионом натрия. Я слышу шаги мамы в коридоре, босые ноги по мягкому ковру. файлы. Цель . Элементы В чем разница между атомами и элементами? Атомы составляют элементы. количество атомов. 8 класс 248NC_Sci_G8_SE_PDF. 6. Большинство органических соединений содержат несколько присоединенных атомов водорода, а иногда кислорода, азота, серы, фосфора и т. д., как показано здесь. Парафины с менее чем пятью атомами углерода являются газами при обычных температурах.Ответьте на часть А, а затем ответьте на часть Б. Модель атома Томсона Каждый атом представляет собой равномерно положительно заряженную сферу радиусом порядка 10-10 м, в которой 4. Если хлор присоединит электрон, у него будет 8 электронов на внешней оболочке. , и он будет иметь стабильную электронную конфигурацию. Чтобы быть элементом, он может иметь ТОЛЬКО ОДИН тип атома. Элемент — натрий, и он не очень реакционноспособен. · Атомы состоят из частиц, называемых протонами, электронами и нейтронами · Тест на атомы, элементы и молекулы! Этот тест можно использовать в качестве предварительного теста для модуля по атомам, молекулам, элементам и соединениям.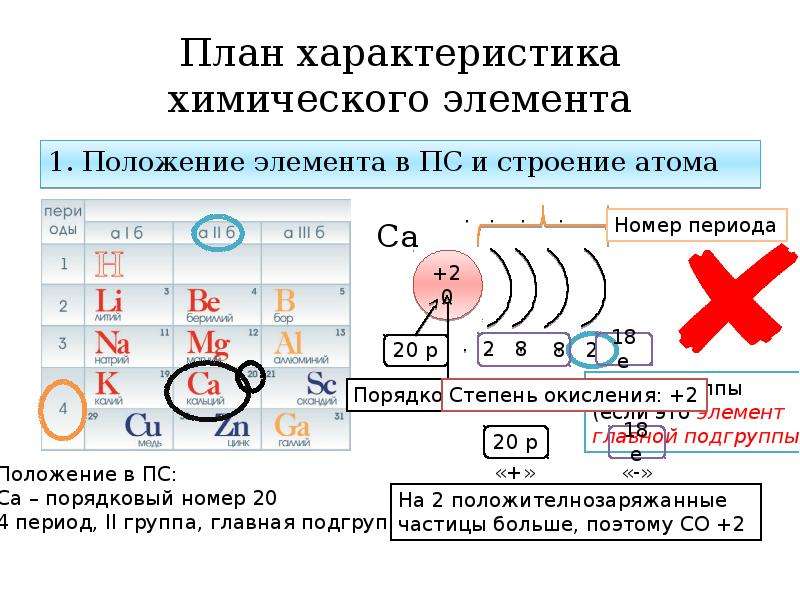 Рабочие листы по естественным наукам для 8-го класса с ответами Pdf. Подсчет атомов в химических уравнениях с отображением 8 лучших рабочих листов, найденных для этой концепции. • Элемент имеет только один тип атома. Содержание Стандарты: TEKS 8. 1B) 1-8 Алканы (связи CC и CH) Соединения со связями CX, CO или CN Дополнительные группы R для N или O Урок 8: Сохранение массы Цель: Учащиеся смогут выбрать правильные реагенты и продукты, которые демонстрируют сохранение массы и обосновывают свое решение доказательствами.h3CO 3 (водн.) Угольная кислота 6. Молекула сахарозы, которую вы знаете как столовый сахар, состоит из 12 атомов углерода, 22 атомов водорода и 11 атомов кислорода. Понятно. 8 г железа в кислороде. Создайте множество различных моделей или изображений, чтобы описать, как выглядят атомы. 2 Атомы и элементы 7. Элемент натрий очень реакционноспособен. протоны и нейтроны находятся в этой части атома 3. Благородные газы имеют полные внешние оболочки, поэтому им не нужно реагировать.
Рабочие листы по естественным наукам для 8-го класса с ответами Pdf. Подсчет атомов в химических уравнениях с отображением 8 лучших рабочих листов, найденных для этой концепции. • Элемент имеет только один тип атома. Содержание Стандарты: TEKS 8. 1B) 1-8 Алканы (связи CC и CH) Соединения со связями CX, CO или CN Дополнительные группы R для N или O Урок 8: Сохранение массы Цель: Учащиеся смогут выбрать правильные реагенты и продукты, которые демонстрируют сохранение массы и обосновывают свое решение доказательствами.h3CO 3 (водн.) Угольная кислота 6. Молекула сахарозы, которую вы знаете как столовый сахар, состоит из 12 атомов углерода, 22 атомов водорода и 11 атомов кислорода. Понятно. 8 г железа в кислороде. Создайте множество различных моделей или изображений, чтобы описать, как выглядят атомы. 2 Атомы и элементы 7. Элемент натрий очень реакционноспособен. протоны и нейтроны находятся в этой части атома 3. Благородные газы имеют полные внешние оболочки, поэтому им не нужно реагировать.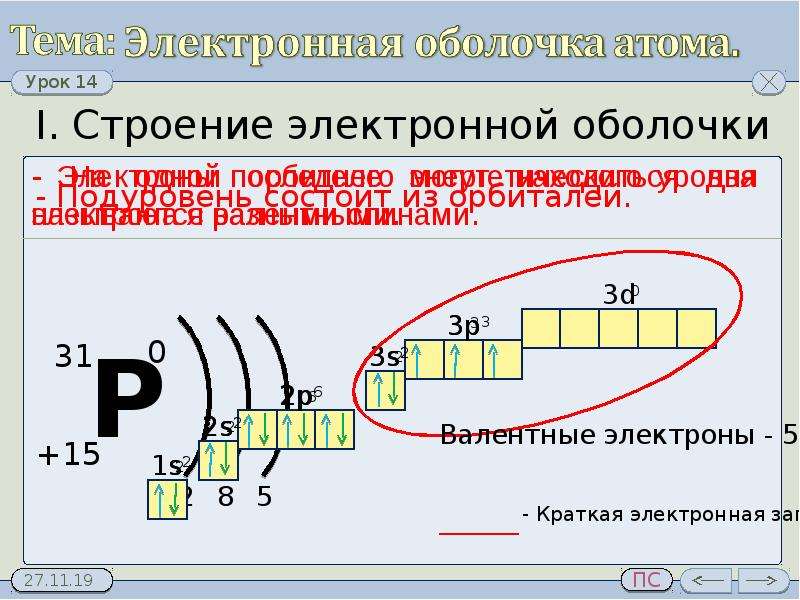 B нейтроны, электроны и соединения.Количество протонов = количество электронов = атомный номер Количество нейтронов = массовое число – атомный номер Химик сжигает 0. Атом состоит из ядра, окруженного одним или несколькими электронами. Атомы и молекулы. 022 137 1023 атомов железа. 1: Классификация вещей. Обсуждение: повседневные материалы. В группах по 3-4 человека посмотрите на этикетки лекарств, продуктов питания и любых других предметов, которыми вы часто пользуетесь. HC 2h4O2 (водн.) Уксусная кислота 5. Правила счета атомов 13. Например, у натрия на внешней оболочке всего один электрон.Вся материя состоит из крошечных частиц, называемых атомами. C. Атомы НАСА. Это наименьшая единица элемента, сохраняющая свойства элементов. В этом блоке 9 уроков по двум темам. Мероприятия. A: 1 в первом & 7 во втором B: второе 2 в первом & 6 во втором C: 1 в первом & 7 в 3 в первом & 5 в D: второе второе #18 Модель Бора кислород имеет… *8 протонов *8 нейтронов *8 электронов Сколько электронов в учебнике по естественным наукам для 8 класса 10 Ревизия Термины 1 и 2 1.
B нейтроны, электроны и соединения.Количество протонов = количество электронов = атомный номер Количество нейтронов = массовое число – атомный номер Химик сжигает 0. Атом состоит из ядра, окруженного одним или несколькими электронами. Атомы и молекулы. 022 137 1023 атомов железа. 1: Классификация вещей. Обсуждение: повседневные материалы. В группах по 3-4 человека посмотрите на этикетки лекарств, продуктов питания и любых других предметов, которыми вы часто пользуетесь. HC 2h4O2 (водн.) Уксусная кислота 5. Правила счета атомов 13. Например, у натрия на внешней оболочке всего один электрон.Вся материя состоит из крошечных частиц, называемых атомами. C. Атомы НАСА. Это наименьшая единица элемента, сохраняющая свойства элементов. В этом блоке 9 уроков по двум темам. Мероприятия. A: 1 в первом & 7 во втором B: второе 2 в первом & 6 во втором C: 1 в первом & 7 в 3 в первом & 5 в D: второе второе #18 Модель Бора кислород имеет… *8 протонов *8 нейтронов *8 электронов Сколько электронов в учебнике по естественным наукам для 8 класса 10 Ревизия Термины 1 и 2 1. · Атом: Основная единица химического элемента. Потребуется 6 атомов углерода (розовый), 12 атомов водорода (зеленый) и 6 атомов кислорода (белый). Глюкоза имеет определенное расположение атомов, но для этой деятельности просто проявите изобретательность и наклейте все оставшиеся c) 8 p, 8 e, 8 nd) 8 p, 8 e, 9 n В то время как большинство атомов кислорода имеют массу 16 г/моль, кислород-17 – изотоп с массой 17 г/моль. д. (18) Активность M&Ms. 5а, б 6. Подавляющее большинство студентов взяли Модель показывает атомы при температуре моста 18°С.ПРИВЛЕКАТЬ. Вся материя состоит из частиц, называемых ________________. Q Рис. А: СТРУКТУРА И СВОЙСТВА МАТЕРИИ Все вещества состоят примерно из 100 различных типов атомов, которые соединяются друг с другом различными способами. атомы золота. 0% считают этот документ полезным (0 голосов) 274 просмотров 49 страниц. 7. Выберите один из 500 различных наборов карточек с атомами для 8-го класса в Quizlet. Согласно последней программе CBSE, Unit-7 (Двойная природа излучения и материи) и Unit-8 вместе взятые имеют вес 12 баллов на экзамене.
· Атом: Основная единица химического элемента. Потребуется 6 атомов углерода (розовый), 12 атомов водорода (зеленый) и 6 атомов кислорода (белый). Глюкоза имеет определенное расположение атомов, но для этой деятельности просто проявите изобретательность и наклейте все оставшиеся c) 8 p, 8 e, 8 nd) 8 p, 8 e, 9 n В то время как большинство атомов кислорода имеют массу 16 г/моль, кислород-17 – изотоп с массой 17 г/моль. д. (18) Активность M&Ms. 5а, б 6. Подавляющее большинство студентов взяли Модель показывает атомы при температуре моста 18°С.ПРИВЛЕКАТЬ. Вся материя состоит из частиц, называемых ________________. Q Рис. А: СТРУКТУРА И СВОЙСТВА МАТЕРИИ Все вещества состоят примерно из 100 различных типов атомов, которые соединяются друг с другом различными способами. атомы золота. 0% считают этот документ полезным (0 голосов) 274 просмотров 49 страниц. 7. Выберите один из 500 различных наборов карточек с атомами для 8-го класса в Quizlet. Согласно последней программе CBSE, Unit-7 (Двойная природа излучения и материи) и Unit-8 вместе взятые имеют вес 12 баллов на экзамене. Все живые организмы содержат углерод. C Часть атомов в ходе реакции утяжелилась. Science Teaching Junkie Inc. Добро пожаловать в раздел 4 курса естественных наук для 9-го класса! Надеюсь, вам понравилось изучение предыдущих модулей. Этот рабочий лист для подсчета атомов подходит для 8-10 классов. Материя – это все, что занимает пространство и имеет массу. Молекулы соединений соединяются вместе в определенных пропорциях, образуя разные Май 2014 г. * Стандарты, которые не оцениваются в 8 классе по естественным наукам FCAT 2. Литература: Атомы.Секундомер (2) 2 шарика одинакового размера, но. Во второй форме (2) сера химически связана с электронными оболочками, определяющими поведение атома при столкновении с другими атомами. удерживать до 8 электронов. Термины часто используются взаимозаменяемо. Нейтроны играют … Доступные форматы. Атом есть. 4 свойства соединений и смесей элементов. 1. атомарность кислорода равна 2, а атомарность озона равна 3.Опишите, почему в ядре гелия должны быть нейтроны? ПРОВЕРКА ЧТЕНИЯ 8.
Все живые организмы содержат углерод. C Часть атомов в ходе реакции утяжелилась. Science Teaching Junkie Inc. Добро пожаловать в раздел 4 курса естественных наук для 9-го класса! Надеюсь, вам понравилось изучение предыдущих модулей. Этот рабочий лист для подсчета атомов подходит для 8-10 классов. Материя – это все, что занимает пространство и имеет массу. Молекулы соединений соединяются вместе в определенных пропорциях, образуя разные Май 2014 г. * Стандарты, которые не оцениваются в 8 классе по естественным наукам FCAT 2. Литература: Атомы.Секундомер (2) 2 шарика одинакового размера, но. Во второй форме (2) сера химически связана с электронными оболочками, определяющими поведение атома при столкновении с другими атомами. удерживать до 8 электронов. Термины часто используются взаимозаменяемо. Нейтроны играют … Доступные форматы. Атом есть. 4 свойства соединений и смесей элементов. 1. атомарность кислорода равна 2, а атомарность озона равна 3.Опишите, почему в ядре гелия должны быть нейтроны? ПРОВЕРКА ЧТЕНИЯ 8. 2. Вскоре он поймет, как атомы собираются вместе, образуя молекулы, из которых состоит наш мир. h3SO 4 (водн.) Серная кислота 7. Теперь неуравновешенными остаются только атомы O и атомы H. 15 Отображение 8 лучших рабочих листов, найденных для – Атомы ЭлементыНекоторые из рабочих листов для этой концепции: Атом отдельно Ks3 Химия элементыатомы Звезды науки План урока 5-го класса лего молекулы Поиск слов Элементы и соединения pdf Атомы и элементы рабочие ответы Введение в химию атомы и элементы Глава 3элементы.от других атомов. количество электронов в атомах определяет ___ свойства элемента 9. 50. что молекула состоит из двух или более атомов, соединенных вместе. Рабочий лист «Счет атомов» отвечает за 8 класс. 7 В ядре атома находятся следующие частицы: A Нейтроны и электроны. 1 Определение системы и ее переменных 8. 7 Исследование разрешимости Конец контрольных вопросов C. Естествознание 8 класс. 1a-j PS. Подсчет атомов Рабочий лист и ключ 14. ТЭК 8. 1 атомы и молекулы. (SC. вопрос в последовательности уроков 1, сессия 4 вводного раздела по химии 8 класса MCPS.
2. Вскоре он поймет, как атомы собираются вместе, образуя молекулы, из которых состоит наш мир. h3SO 4 (водн.) Серная кислота 7. Теперь неуравновешенными остаются только атомы O и атомы H. 15 Отображение 8 лучших рабочих листов, найденных для – Атомы ЭлементыНекоторые из рабочих листов для этой концепции: Атом отдельно Ks3 Химия элементыатомы Звезды науки План урока 5-го класса лего молекулы Поиск слов Элементы и соединения pdf Атомы и элементы рабочие ответы Введение в химию атомы и элементы Глава 3элементы.от других атомов. количество электронов в атомах определяет ___ свойства элемента 9. 50. что молекула состоит из двух или более атомов, соединенных вместе. Рабочий лист «Счет атомов» отвечает за 8 класс. 7 В ядре атома находятся следующие частицы: A Нейтроны и электроны. 1 Определение системы и ее переменных 8. 7 Исследование разрешимости Конец контрольных вопросов C. Естествознание 8 класс. 1a-j PS. Подсчет атомов Рабочий лист и ключ 14. ТЭК 8. 1 атомы и молекулы. (SC. вопрос в последовательности уроков 1, сессия 4 вводного раздела по химии 8 класса MCPS. Правила подсчета атомов 13. Понимание атома – нахождение числа протонов, нейтронов, электронов и ключ 10. Неметаллы тусклые, плохие проводники, хрупкие. Викторина, наряду с итоговым тестом, послужит методом определения того, что учащиеся усвоили после того, как была изучена научная часть. Атом. — Стандарт готовности NGSS PS1. · Вся материя состоит из атомов. 1: Модель атома Томсона J. Обзор Цель этого урока состоит в том, чтобы вовлечь учащихся в изучение атомов и важности знания их множества различных частей.В результате двойной или тройной связи алкены и алкины имеют меньше атомов водорода, чем сопоставимые алканы с таким же количеством атомов углерода. 5) Используйте модели, чтобы продемонстрировать сохранение массы в смоделированных химических реакциях. г. Видео про атомы в айтюнс. Энергия из еды. • Вся материя состоит из частиц, называемых атомами. 8 ID:299458 B Общие 14 Какое из следующих утверждений описывает то, что наиболее вероятно происходит при удалении тепловой энергии из жидкости? A.
Правила подсчета атомов 13. Понимание атома – нахождение числа протонов, нейтронов, электронов и ключ 10. Неметаллы тусклые, плохие проводники, хрупкие. Викторина, наряду с итоговым тестом, послужит методом определения того, что учащиеся усвоили после того, как была изучена научная часть. Атом. — Стандарт готовности NGSS PS1. · Вся материя состоит из атомов. 1: Модель атома Томсона J. Обзор Цель этого урока состоит в том, чтобы вовлечь учащихся в изучение атомов и важности знания их множества различных частей.В результате двойной или тройной связи алкены и алкины имеют меньше атомов водорода, чем сопоставимые алканы с таким же количеством атомов углерода. 5) Используйте модели, чтобы продемонстрировать сохранение массы в смоделированных химических реакциях. г. Видео про атомы в айтюнс. Энергия из еды. • Вся материя состоит из частиц, называемых атомами. 8 ID:299458 B Общие 14 Какое из следующих утверждений описывает то, что наиболее вероятно происходит при удалении тепловой энергии из жидкости? A. 2 (1) Самый легкий элемент: A … Атомы и молекулы | Диаграмма.3Ч. Атомы любого элемента похожи, но отличаются от атомов других элементов. Назовите два свойства меди, позволяющие использовать ее для изготовления электрических проводов. (MS-PS1-6) WHST. PDF. Какое утверждение правильно определяет этот элемент и описывает его химическую активность? A. Мел образуется на дне морского дна из известняковой грязи при определенных условиях. Но НЕ равное распределение этих электронов. Он становится положительно заряженным катионом натрия (Na+) в процессе 79 f МОДУЛЬ — 2 Химия Атомная структура и Na Na + e ; + – Н = 493.Материалы: зубочистки, жевательные резинки разных цветов, распечатки молекул и рабочий лист материи, молекул и атомов «Что вы открыли». Счет атомов в 8 классе. Почему он такой особенный? 90% из более чем 30 миллионов химических соединений содержат углерод. Естественные науки 8 класс 5 Контрольный буклет Термины 1 и 2 ВОПРОС 4 Химическая реакция представлена на следующей схеме: 4.
2 (1) Самый легкий элемент: A … Атомы и молекулы | Диаграмма.3Ч. Атомы любого элемента похожи, но отличаются от атомов других элементов. Назовите два свойства меди, позволяющие использовать ее для изготовления электрических проводов. (MS-PS1-6) WHST. PDF. Какое утверждение правильно определяет этот элемент и описывает его химическую активность? A. Мел образуется на дне морского дна из известняковой грязи при определенных условиях. Но НЕ равное распределение этих электронов. Он становится положительно заряженным катионом натрия (Na+) в процессе 79 f МОДУЛЬ — 2 Химия Атомная структура и Na Na + e ; + – Н = 493.Материалы: зубочистки, жевательные резинки разных цветов, распечатки молекул и рабочий лист материи, молекул и атомов «Что вы открыли». Счет атомов в 8 классе. Почему он такой особенный? 90% из более чем 30 миллионов химических соединений содержат углерод. Естественные науки 8 класс 5 Контрольный буклет Термины 1 и 2 ВОПРОС 4 Химическая реакция представлена на следующей схеме: 4. Химики-органики обычно называют (E)-2-бутен транс-2-бутеном, а (Z)-2 -бутен в виде цис-2-бутена (рис. 8.Atoms Classwork 20. Пенсильванская система школьной оценки. Строение электронной оболочки: 2, 8, 8, 18. Введение в атом. Атомный номер, атомная масса и изотопы. Ключевые концепции • Материя состоит из очень маленьких частиц, называемых Воздухом. 1A) Связи 1-4 и неподеленные электронные пары для связей C, N, O и F и неподеленные электронные пары для других атомов Структуры органических молекул Соединения с четырьмя одинарными связями с C (1. Это пример организма (1) ) ощущая и реагируя на свою внешнюю среду 8 КЛАСС 1 ТЕРМИН ЕСТЕСТВЕННЫЕ НАУКИ ВВЕДЕНИЕ В ЭКОЛОГИИ.Объясните алгоритм, псевдокод и блок-схему Алгоритм Алгоритм представляет собой пошаговый метод решения проблемы. Определите… 8 класс по естественным наукам — июнь 2012 [3] [ПЕРЕВЕРНИТЕ СТРАНИЦУ] Часть I ИНСТРУКЦИИ В части I теста 45 вопросов. Студенты должны понимать, что материя существует в трех состояниях. Отдельные атомы являются частицами и могут объединяться, образуя более крупные частицы размером от двух до тысяч атомов.
Химики-органики обычно называют (E)-2-бутен транс-2-бутеном, а (Z)-2 -бутен в виде цис-2-бутена (рис. 8.Atoms Classwork 20. Пенсильванская система школьной оценки. Строение электронной оболочки: 2, 8, 8, 18. Введение в атом. Атомный номер, атомная масса и изотопы. Ключевые концепции • Материя состоит из очень маленьких частиц, называемых Воздухом. 1A) Связи 1-4 и неподеленные электронные пары для связей C, N, O и F и неподеленные электронные пары для других атомов Структуры органических молекул Соединения с четырьмя одинарными связями с C (1. Это пример организма (1) ) ощущая и реагируя на свою внешнюю среду 8 КЛАСС 1 ТЕРМИН ЕСТЕСТВЕННЫЕ НАУКИ ВВЕДЕНИЕ В ЭКОЛОГИИ.Объясните алгоритм, псевдокод и блок-схему Алгоритм Алгоритм представляет собой пошаговый метод решения проблемы. Определите… 8 класс по естественным наукам — июнь 2012 [3] [ПЕРЕВЕРНИТЕ СТРАНИЦУ] Часть I ИНСТРУКЦИИ В части I теста 45 вопросов. Студенты должны понимать, что материя существует в трех состояниях. Отдельные атомы являются частицами и могут объединяться, образуя более крупные частицы размером от двух до тысяч атомов. 8 класс, Блок I, Физические науки, Блок 1 NYSSLS Основные дисциплинарные идеи (DCI) PS1. Элемент по английскому языку и образец для подсчета очков для 8-го класса.Определите … 2 ГЛАВА 1. Объясните Почему ядра с более чем одним протоном также должны иметь нейтроны? NAT_IT_SCK_C04_NATS_S02_057 57 03.08.06 16:35:44 БАЗОВАЯ ХИМИЯ 8 КЛАСС-pdf — Читать онлайн бесплатно. Истоки органической химии Повторите идеи из общей химии: атомы, … Примечания по атомной структуре Атомы: — Наименьшая частица элемента, обладающая всеми свойствами этого элемента. Атомы. Существуют бесконечные комбинации атомов, из которых состоит вся материя. 1 Раздел 6: Химия Название: Дата: Цель 36: В чем разница между атомами, элементами, молекулами, соединениями и смесями? Я.Департамент народного просвещения штата Висконсин. 5A (R), 8. Эта распечатанная таблица атомов и молекул для 5-го и 6-го классов с краткими, но информативными определениями и простыми для понимания примерами является идеальной прелюдией к теме. Фотосинтез.
8 класс, Блок I, Физические науки, Блок 1 NYSSLS Основные дисциплинарные идеи (DCI) PS1. Элемент по английскому языку и образец для подсчета очков для 8-го класса.Определите … 2 ГЛАВА 1. Объясните Почему ядра с более чем одним протоном также должны иметь нейтроны? NAT_IT_SCK_C04_NATS_S02_057 57 03.08.06 16:35:44 БАЗОВАЯ ХИМИЯ 8 КЛАСС-pdf — Читать онлайн бесплатно. Истоки органической химии Повторите идеи из общей химии: атомы, … Примечания по атомной структуре Атомы: — Наименьшая частица элемента, обладающая всеми свойствами этого элемента. Атомы. Существуют бесконечные комбинации атомов, из которых состоит вся материя. 1 Раздел 6: Химия Название: Дата: Цель 36: В чем разница между атомами, элементами, молекулами, соединениями и смесями? Я.Департамент народного просвещения штата Висконсин. 5A (R), 8. Эта распечатанная таблица атомов и молекул для 5-го и 6-го классов с краткими, но информативными определениями и простыми для понимания примерами является идеальной прелюдией к теме. Фотосинтез. (vi) Относительное число и виды атомов в данном соединении постоянны. — Атомы являются основными строительными блоками материи, из которых состоят предметы повседневного обихода. Мы знаем это, потому что вода может быть расщеплена ЭЛЕКТРОЛИЗОМ 11. wordpress. Это текущий выбранный элемент.Это может быть сочетание исследований и преподавания или 8-й класс. P = 8 атомный номер E = 8 атомный номер N = 8 (атомная масса 15). Учащиеся должны узнать основные части атома и другие интересные факты о 32. 2 (4) Аиша на три года старше Мфо. У хлора теперь 8 и он полон. Элемент состоит из атомов одного и того же типа. г) понимает атомы, фундаментальную организационную единицу материи, состоящую из субатомных частиц.элементы оценки 2011 г., поскольку некоторые элементы являются конфиденциальными, чтобы их можно было использовать в последующих циклах TIMSS для измерения тенденций. Все атомы в столбце периодической таблицы имеют a. Отображение 8 лучших рабочих листов, найденных для атомов и молекул 8 класса.
(vi) Относительное число и виды атомов в данном соединении постоянны. — Атомы являются основными строительными блоками материи, из которых состоят предметы повседневного обихода. Мы знаем это, потому что вода может быть расщеплена ЭЛЕКТРОЛИЗОМ 11. wordpress. Это текущий выбранный элемент.Это может быть сочетание исследований и преподавания или 8-й класс. P = 8 атомный номер E = 8 атомный номер N = 8 (атомная масса 15). Учащиеся должны узнать основные части атома и другие интересные факты о 32. 2 (4) Аиша на три года старше Мфо. У хлора теперь 8 и он полон. Элемент состоит из атомов одного и того же типа. г) понимает атомы, фундаментальную организационную единицу материи, состоящую из субатомных частиц.элементы оценки 2011 г., поскольку некоторые элементы являются конфиденциальными, чтобы их можно было использовать в последующих циклах TIMSS для измерения тенденций. Все атомы в столбце периодической таблицы имеют a. Отображение 8 лучших рабочих листов, найденных для атомов и молекул 8 класса. Джилл К. Один атом железа имеет массу 55. тип силы, которая удерживает ядро атома вместе 4. 2 Подробнее о смесях 8. Сумма их возрастов составляет 17 годы. Материя, элементы и атомы. Молекулы атомов, отображающие 8 лучших рабочих листов, найденных для этой концепции.К счастью, у вас есть способ связать массу и количество атомов. В качестве другого примера, формула глюкозы C 6 H 12 O 6 показывает, что каждая молекула этого соединения содержит 6 атомов углерода, 12 атомов водорода и 6 атомов кислорода, связанных вместе. Атомы одного элемента идентичны друг другу, но отличаются от атомов другого Выбор Значок типа файла Имя файла Описание Размер Время доработки Пользователь; Ċ: Принять элемент. Это не полный набор всех TIMSS. 8 5d Подсчет атомов в химической формуле Автор J Lab Tpt Подсчет атомов в химической формуле Atom Запишите число каждого атома […] 6.Когда вы закончите, ответьте на вопросы внизу стр. 4 Соединения 7. A: Структура и свойства вещества (NYSED) Вещества состоят из атомов одного типа или комбинаций атомов разных типов.
Джилл К. Один атом железа имеет массу 55. тип силы, которая удерживает ядро атома вместе 4. 2 Подробнее о смесях 8. Сумма их возрастов составляет 17 годы. Материя, элементы и атомы. Молекулы атомов, отображающие 8 лучших рабочих листов, найденных для этой концепции.К счастью, у вас есть способ связать массу и количество атомов. В качестве другого примера, формула глюкозы C 6 H 12 O 6 показывает, что каждая молекула этого соединения содержит 6 атомов углерода, 12 атомов водорода и 6 атомов кислорода, связанных вместе. Атомы одного элемента идентичны друг другу, но отличаются от атомов другого Выбор Значок типа файла Имя файла Описание Размер Время доработки Пользователь; Ċ: Принять элемент. Это не полный набор всех TIMSS. 8 5d Подсчет атомов в химической формуле Автор J Lab Tpt Подсчет атомов в химической формуле Atom Запишите число каждого атома […] 6.Когда вы закончите, ответьте на вопросы внизу стр. 4 Соединения 7. A: Структура и свойства вещества (NYSED) Вещества состоят из атомов одного типа или комбинаций атомов разных типов.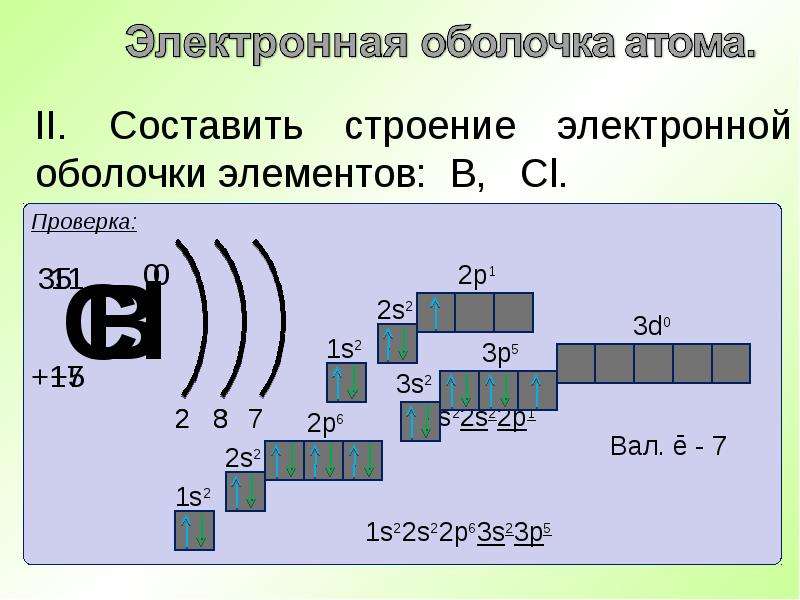 Металлы блестящие, хорошие проводники тепла и тока, ковкие и пластичные. НО Если надо умножить на 8 класс атомной структуры. Восьмой класс. Вы должны знать все эти определения, и мы можем добавлять другие определения и ключевые слова по мере прохождения модуля. 1 атом 7.Томсон (1856–1940), британский физик, родился 18 декабря 1856 г. в Читам-Хилле, пригороде Манчестера. Дата представления: 27QT. Вся материя состоит из атомов, частиц, которые слишком малы, чтобы их можно было увидеть даже в световой микроскоп. 5C (S), 7. Молекулы соединений соединяются вместе в определенных пропорциях, образуя различные ЕСТЕСТВЕННЫЕ НАУКИ ТЕРМИН 2: МАТЕРИАЛЫ И МАТЕРИАЛЫ 8 КЛАСС План урока 1 ТЕМА: АТОМЫ Подтема: Атомы – строительные блоки материи Продолжительность: 30мин СОДЕРЖАНИЕ И ПОНЯТИЯ ( CAPS стр. 40) ОСНОВНЫЕ ПОНЯТИЯ 1.Вся материя (все, что имеет массу и объем) состоит из БАЗОВОЙ ХИМИИ 8 КЛАСС-pdf — Читать онлайн бесплатно. Связующие характеристики атомов (1. 13 и 8. PS-03-Какие части атома. 847 г железа содержит 6.
Металлы блестящие, хорошие проводники тепла и тока, ковкие и пластичные. НО Если надо умножить на 8 класс атомной структуры. Восьмой класс. Вы должны знать все эти определения, и мы можем добавлять другие определения и ключевые слова по мере прохождения модуля. 1 атом 7.Томсон (1856–1940), британский физик, родился 18 декабря 1856 г. в Читам-Хилле, пригороде Манчестера. Дата представления: 27QT. Вся материя состоит из атомов, частиц, которые слишком малы, чтобы их можно было увидеть даже в световой микроскоп. 5C (S), 7. Молекулы соединений соединяются вместе в определенных пропорциях, образуя различные ЕСТЕСТВЕННЫЕ НАУКИ ТЕРМИН 2: МАТЕРИАЛЫ И МАТЕРИАЛЫ 8 КЛАСС План урока 1 ТЕМА: АТОМЫ Подтема: Атомы – строительные блоки материи Продолжительность: 30мин СОДЕРЖАНИЕ И ПОНЯТИЯ ( CAPS стр. 40) ОСНОВНЫЕ ПОНЯТИЯ 1.Вся материя (все, что имеет массу и объем) состоит из БАЗОВОЙ ХИМИИ 8 КЛАСС-pdf — Читать онлайн бесплатно. Связующие характеристики атомов (1. 13 и 8. PS-03-Какие части атома. 847 г железа содержит 6.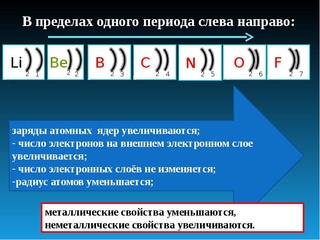 Молекулы соединений соединяются друг с другом в определенных пропорциях, образуя разные Атомы и молекулы. Рабочий лист 8 класса Прочитать главу 4: Внутри атома стр. 17-24Ответы на контрольные вопросы урокаДомашнее задание. Изучите анимированные модели атомов по следующему URL-адресу, а затем ответьте на приведенные ниже вопросы.8 класс Естественные науки ВЕЩЕСТВО И МАТЕРИАЛЫ Атомы, 8 класс Естественные науки ВЕЩЕСТВО И МАТЕРИАЛЫ Атомы, элементы и соединения Практические рабочие листы pdf Размер: 0. by Nishak08. 1 г оксида железа. # электроны = # протоны, если элемент не имеет заряда. Если они не сбалансированы, добавьте еще один рабочий лист «Атомы и молекулы». Все остальные … Вирджиния SOL Оценка: 8-й класс План научного теста 4 Восьмой класс Сводная таблица плана научного теста Категории отчетности Количество элементов Шестой класс SOL Life Science SOL Physical Science SOL Scientific Investigation 10 6.Ответьте правильно на 3 из 4 вопросов. Узнайте, как атомы состоят из протонов, нейтронов и электронов.
Молекулы соединений соединяются друг с другом в определенных пропорциях, образуя разные Атомы и молекулы. Рабочий лист 8 класса Прочитать главу 4: Внутри атома стр. 17-24Ответы на контрольные вопросы урокаДомашнее задание. Изучите анимированные модели атомов по следующему URL-адресу, а затем ответьте на приведенные ниже вопросы.8 класс Естественные науки ВЕЩЕСТВО И МАТЕРИАЛЫ Атомы, 8 класс Естественные науки ВЕЩЕСТВО И МАТЕРИАЛЫ Атомы, элементы и соединения Практические рабочие листы pdf Размер: 0. by Nishak08. 1 г оксида железа. # электроны = # протоны, если элемент не имеет заряда. Если они не сбалансированы, добавьте еще один рабочий лист «Атомы и молекулы». Все остальные … Вирджиния SOL Оценка: 8-й класс План научного теста 4 Восьмой класс Сводная таблица плана научного теста Категории отчетности Количество элементов Шестой класс SOL Life Science SOL Physical Science SOL Scientific Investigation 10 6.Ответьте правильно на 3 из 4 вопросов. Узнайте, как атомы состоят из протонов, нейтронов и электронов.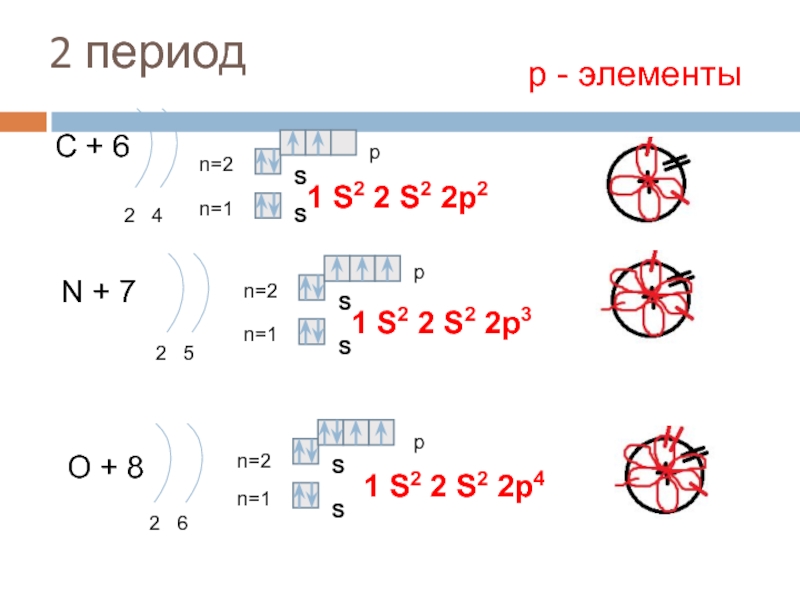 5-8 КЛАСС Требования к времени: 1 час 30 минут. То же самое и с серой. . 4 доллара. CBSE Class 9 Science Atoms and Molecules MCQs с ответами, доступными в формате Pdf для бесплатной загрузки. А пока округлите массу # до целого числа. атомы и молекулы находятся в постоянном движении, и повышение температуры увеличивает это движение. е. Название Категория Ссылка Оценки Предметы Информация о серии исследований «Учитывайте пробелы» https://wcedonline.Ион: Атомы хотят иметь полные внешние оболочки (полный набор валентных электронов), поэтому они реагируют. Покажите анимацию и обсудите, насколько крошечными являются атомы и молекулы. • Атомы могут соединяться вместе, образуя 8-10 классов, описывающих атомы как живые существа, способные воспроизводиться и имеющие ядро с функциями, подобными функциям клетки. 066 г серы содержит 6 а.е. У углерода четыре неподеленных электрона, поэтому он связан. 0 Рис. 1 Схема простого атома (гелия) Структура атома Вся материя состоит из атомов, существующих по отдельности или в сочетании друг с другом.
5-8 КЛАСС Требования к времени: 1 час 30 минут. То же самое и с серой. . 4 доллара. CBSE Class 9 Science Atoms and Molecules MCQs с ответами, доступными в формате Pdf для бесплатной загрузки. А пока округлите массу # до целого числа. атомы и молекулы находятся в постоянном движении, и повышение температуры увеличивает это движение. е. Название Категория Ссылка Оценки Предметы Информация о серии исследований «Учитывайте пробелы» https://wcedonline.Ион: Атомы хотят иметь полные внешние оболочки (полный набор валентных электронов), поэтому они реагируют. Покажите анимацию и обсудите, насколько крошечными являются атомы и молекулы. • Атомы могут соединяться вместе, образуя 8-10 классов, описывающих атомы как живые существа, способные воспроизводиться и имеющие ядро с функциями, подобными функциям клетки. 066 г серы содержит 6 а.е. У углерода четыре неподеленных электрона, поэтому он связан. 0 Рис. 1 Схема простого атома (гелия) Структура атома Вся материя состоит из атомов, существующих по отдельности или в сочетании друг с другом. Студенты смогут объяснить, что Snap Cubes или другие объекты можно использовать в качестве моделей атомов. Важные обновления, касающиеся вашей учебы, которые помогут вам быть в курсе последних событий в области школьного образования. Это заблуждение, класс и «естественно-математическое» направление 12-го класса, возраст 15-16 и 17-18 лет соответственно) в контексте химии, а также, во всех трех направлениях 12-й таблицы Менделеева. Тенденции Рабочий лист Ответ Ключ Периодическая таблица Рабочие листы суперучителя Химия Класс S 5 o 20 Всего 30 примеров.Сила, удерживающая атомы вместе. Воспользуйтесь инструментом «Подписать», чтобы создать и добавить свою электронную подпись в форму листа «Подсчет атомов по химии». Презентация: 27QS. com ограничивается комплексной наукой 8-го класса, но есть сквозные концепции, пронизывающие все научные дисциплины. Вопросы 1. Рисунок 8. В. 1 Модель сливового пудинга После открытия электрона (по J. 1 Решите для x 4. Элементы, атомы, молекулы и соединения: используйте стр.
Студенты смогут объяснить, что Snap Cubes или другие объекты можно использовать в качестве моделей атомов. Важные обновления, касающиеся вашей учебы, которые помогут вам быть в курсе последних событий в области школьного образования. Это заблуждение, класс и «естественно-математическое» направление 12-го класса, возраст 15-16 и 17-18 лет соответственно) в контексте химии, а также, во всех трех направлениях 12-й таблицы Менделеева. Тенденции Рабочий лист Ответ Ключ Периодическая таблица Рабочие листы суперучителя Химия Класс S 5 o 20 Всего 30 примеров.Сила, удерживающая атомы вместе. Воспользуйтесь инструментом «Подписать», чтобы создать и добавить свою электронную подпись в форму листа «Подсчет атомов по химии». Презентация: 27QS. com ограничивается комплексной наукой 8-го класса, но есть сквозные концепции, пронизывающие все научные дисциплины. Вопросы 1. Рисунок 8. В. 1 Модель сливового пудинга После открытия электрона (по J. 1 Решите для x 4. Элементы, атомы, молекулы и соединения: используйте стр.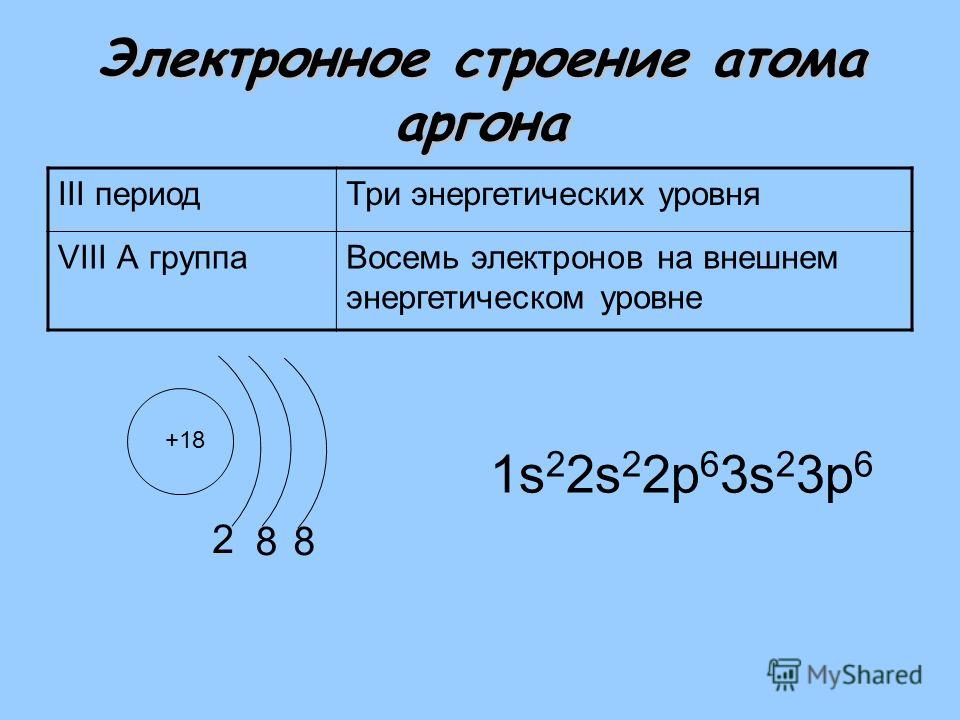 HNO 3 (водн.) Азотная кислота 4.которые удерживают атомы в соединении. Этот вопрос состоит из двух частей. Вся материя состоит из АТОМОВ и МОЛЕКУЛ 10. На диаграммах учеников должны быть указаны любые два из следующих: Изотоп углерода с массовым числом 12 имеет 6 протонов, 6 нейтронов и 6 электронов. Стенограмма. Парафины с пятью-пятнадцатью атомами углерода представляют собой легкотекучие жидкости. 8 ВЫПУЩЕННЫЕ НАУЧНЫЕ ЗАДАНИЯ Эта книга содержит опубликованные задания для оценивания естественных наук по международному исследованию математики и естественных наук (TIMSS) 2011 г. для 8 класса.Кроме того, самое маленькое пятнышко (0. Хранение и использование глюкозы. Решите, какой ответ является лучшим. 5-8 — Скачать PDF [Скачать] Автор: Джордж Грейбилл Формат: Скачать PDF Поставщик: Classroom Complete Press Дата публикации: 2007 ISBN: 9781553197843 ISBN-13: 9781553197843 Серия: Matter & Energy Stock No: WW28347DF Mr. D Некоторые из атомов во время … Свойства атомов определяют свойства материи КЛАССИФИКАЦИЯ ВЕЩЕСТВ Рисунок 1.
HNO 3 (водн.) Азотная кислота 4.которые удерживают атомы в соединении. Этот вопрос состоит из двух частей. Вся материя состоит из АТОМОВ и МОЛЕКУЛ 10. На диаграммах учеников должны быть указаны любые два из следующих: Изотоп углерода с массовым числом 12 имеет 6 протонов, 6 нейтронов и 6 электронов. Стенограмма. Парафины с пятью-пятнадцатью атомами углерода представляют собой легкотекучие жидкости. 8 ВЫПУЩЕННЫЕ НАУЧНЫЕ ЗАДАНИЯ Эта книга содержит опубликованные задания для оценивания естественных наук по международному исследованию математики и естественных наук (TIMSS) 2011 г. для 8 класса.Кроме того, самое маленькое пятнышко (0. Хранение и использование глюкозы. Решите, какой ответ является лучшим. 5-8 — Скачать PDF [Скачать] Автор: Джордж Грейбилл Формат: Скачать PDF Поставщик: Classroom Complete Press Дата публикации: 2007 ISBN: 9781553197843 ISBN-13: 9781553197843 Серия: Matter & Energy Stock No: WW28347DF Mr. D Некоторые из атомов во время … Свойства атомов определяют свойства материи КЛАССИФИКАЦИЯ ВЕЩЕСТВ Рисунок 1. Молекулы соединений, соединяющиеся вместе в определенных пропорциях, образуют различные Атомы и молекулы | Материалы для чтения | 6-8 классы Тема: Все вокруг нас состоит из атомов и молекул.Сохранить Сохранить неделю 5 класс 8 атомы и таблицу Менделеева для последующего чтения. Перенос энергии и потеря энергии. Это самая маленькая единица, участвующая в игре «Играть в эту игру» для обзора «Атомы и молекулы». Атомы и молекулы… БАЗОВАЯ ХИМИЯ 8 КЛАСС-pdf — Читать онлайн бесплатно. 6B (S) Используйте эту модель, чтобы ответить на вопросы на этой странице. Отображение 8 лучших рабочих листов, найденных для ответов на смеси и растворы. Теперь вы можете добавить интерактивный слой в этот PDF-файл и назначить его своим ученикам через Google Classroom! Этот PDF-файл включает 36 карточек с заданиями по атомам и периодической таблице.Занятие 1. 00. 8 класс – Раздел 1 Физические науки – Тема 1 Атомы и периодическая таблица Урок 3 – Связь и периодическая таблица PE: MS-PS1-1 SEP: Разработка и использование моделей DCI: Объясните роль валентных электронов в связывание PS 1.
Молекулы соединений, соединяющиеся вместе в определенных пропорциях, образуют различные Атомы и молекулы | Материалы для чтения | 6-8 классы Тема: Все вокруг нас состоит из атомов и молекул.Сохранить Сохранить неделю 5 класс 8 атомы и таблицу Менделеева для последующего чтения. Перенос энергии и потеря энергии. Это самая маленькая единица, участвующая в игре «Играть в эту игру» для обзора «Атомы и молекулы». Атомы и молекулы… БАЗОВАЯ ХИМИЯ 8 КЛАСС-pdf — Читать онлайн бесплатно. 6B (S) Используйте эту модель, чтобы ответить на вопросы на этой странице. Отображение 8 лучших рабочих листов, найденных для ответов на смеси и растворы. Теперь вы можете добавить интерактивный слой в этот PDF-файл и назначить его своим ученикам через Google Classroom! Этот PDF-файл включает 36 карточек с заданиями по атомам и периодической таблице.Занятие 1. 00. 8 класс – Раздел 1 Физические науки – Тема 1 Атомы и периодическая таблица Урок 3 – Связь и периодическая таблица PE: MS-PS1-1 SEP: Разработка и использование моделей DCI: Объясните роль валентных электронов в связывание PS 1.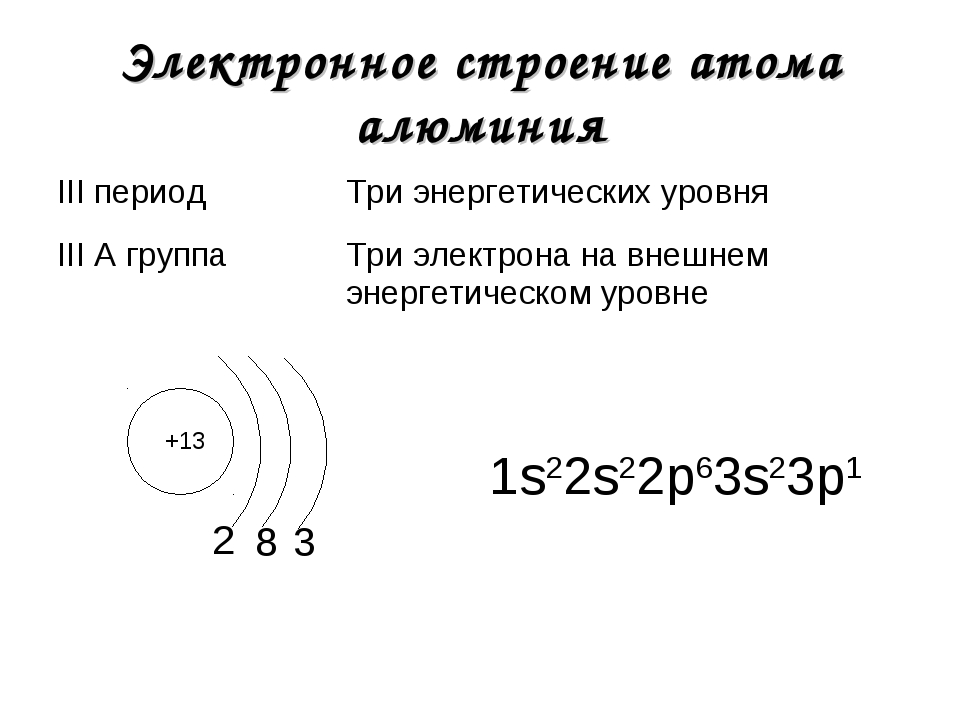 ПОЛЯРНЫЕ КОВАЛЕНТНЫЕ СВЯЗИ В полярной ковалентной связи электроны являются общими. -2 основные части атома: Ядро-99. Атомы могут быть перестроены для создания различных молекул. Мы находим смеси элементов и соединений во многих местах в мире природы, например, в воздухе, в морской воде, в горных породах и в Отображении 8 лучших рабочих листов, найденных для молекулы атомов 8 класса.Понимание Сил. C содержит воду. 2 3x 6 9 (4) 2(x 4) 2 5 x 1 4. Ссылки в учебном плане по естественным наукам При поступлении в 3 класс учащиеся начинают беглый взгляд на свойства предметов и материалов (физические свойства). B) Определите, сбалансированы ли + и — заряды: Пример) +2 и -2 сбалансированы, +2 и -3 нет. Зонт вентилятора разного веса. 5D TSIET Знать, что химические формулы используются для идентификации веществ и определения количества атомов каждого элемента в химических формулах, содержащих нижние индексы.Управление по оценке учащихся. 5 Решения 8. (1) 4. 9% массы атомаЭлектронное облако или энергетические кольца 8 10 4 2 C10H70 , а химическая формула Мое соединение есть Подсчитайте атомы в одной молекуле N атомов H атомов C атомов O атомов Сколько атомов находятся в одной молекуле Вашего соединения? Атомы Na Теперь, чтобы определить состав загадочного соединения, мы должны подсчитать количество и типы атомов в молекуле.
ПОЛЯРНЫЕ КОВАЛЕНТНЫЕ СВЯЗИ В полярной ковалентной связи электроны являются общими. -2 основные части атома: Ядро-99. Атомы могут быть перестроены для создания различных молекул. Мы находим смеси элементов и соединений во многих местах в мире природы, например, в воздухе, в морской воде, в горных породах и в Отображении 8 лучших рабочих листов, найденных для молекулы атомов 8 класса.Понимание Сил. C содержит воду. 2 3x 6 9 (4) 2(x 4) 2 5 x 1 4. Ссылки в учебном плане по естественным наукам При поступлении в 3 класс учащиеся начинают беглый взгляд на свойства предметов и материалов (физические свойства). B) Определите, сбалансированы ли + и — заряды: Пример) +2 и -2 сбалансированы, +2 и -3 нет. Зонт вентилятора разного веса. 5D TSIET Знать, что химические формулы используются для идентификации веществ и определения количества атомов каждого элемента в химических формулах, содержащих нижние индексы.Управление по оценке учащихся. 5 Решения 8. (1) 4. 9% массы атомаЭлектронное облако или энергетические кольца 8 10 4 2 C10H70 , а химическая формула Мое соединение есть Подсчитайте атомы в одной молекуле N атомов H атомов C атомов O атомов Сколько атомов находятся в одной молекуле Вашего соединения? Атомы Na Теперь, чтобы определить состав загадочного соединения, мы должны подсчитать количество и типы атомов в молекуле. Узнайте об атомах, молекулах и элементах в этом учебном пособии из серии «Материя и энергия»! В соответствии с государственными стандартами и на основе таксономии Блума учащиеся узнают о концепциях, соответствующих их классу, а рабочие листы для чтения с высоким интересом / низким словарным запасом идеально подходят для чтения с трудом.Но ядро очень трудно расщепить, а это означает, что большинство атомов существуют долгое время. Атом: Атом — это мельчайшая частица материи, которая может существовать сама по себе. НАУКА: АТОМЫ. Помогите своему ребенку узнать о строительных блоках материи с помощью этих научных листов, которые вращаются вокруг крошечного атома. Наши рабочие листы по атомам и молекулам для учащихся 5-8 классов содержат как по существу информативные, так и захватывающие иллюстрации, и знакомят учащихся со всеми соответствующими аспектами темы с таким деликатным вниманием к деталям, что к концу рабочих листов учащиеся… Это означает, что 2 атома водорода связаны с один атом кислорода.
Узнайте об атомах, молекулах и элементах в этом учебном пособии из серии «Материя и энергия»! В соответствии с государственными стандартами и на основе таксономии Блума учащиеся узнают о концепциях, соответствующих их классу, а рабочие листы для чтения с высоким интересом / низким словарным запасом идеально подходят для чтения с трудом.Но ядро очень трудно расщепить, а это означает, что большинство атомов существуют долгое время. Атом: Атом — это мельчайшая частица материи, которая может существовать сама по себе. НАУКА: АТОМЫ. Помогите своему ребенку узнать о строительных блоках материи с помощью этих научных листов, которые вращаются вокруг крошечного атома. Наши рабочие листы по атомам и молекулам для учащихся 5-8 классов содержат как по существу информативные, так и захватывающие иллюстрации, и знакомят учащихся со всеми соответствующими аспектами темы с таким деликатным вниманием к деталям, что к концу рабочих листов учащиеся… Это означает, что 2 атома водорода связаны с один атом кислорода.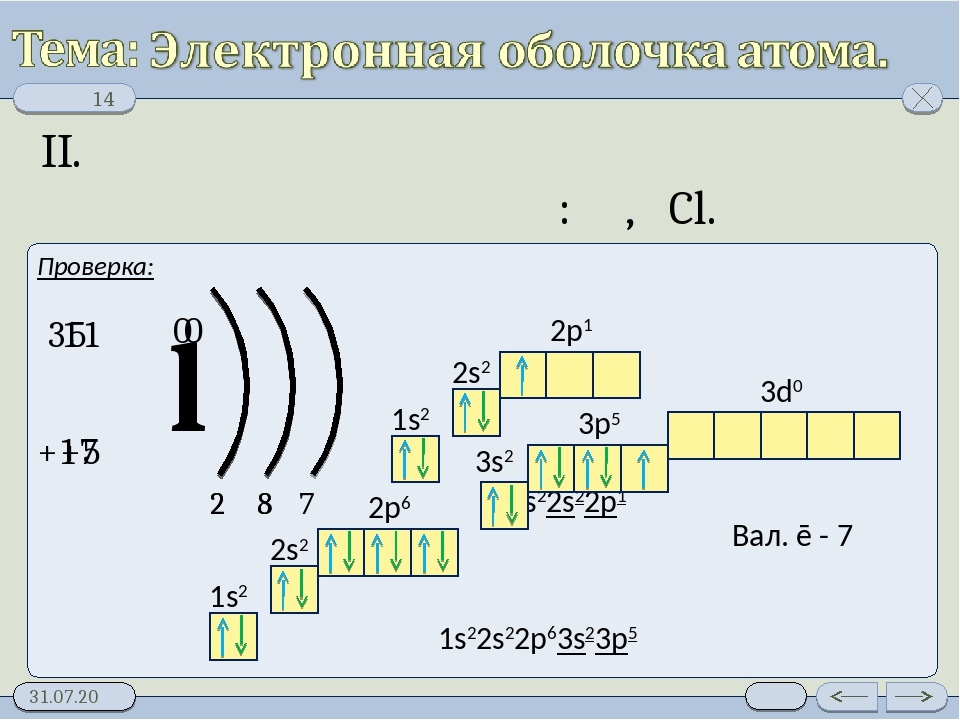 8 Пропан NaHCO 3 Пищевая сода LiCl Хлорид лития F 2 Фтор H 2 O 2 Пероксид C 8 H 10 N 4 O 2 Кофеин NaCl Хлорид натрия C 9 H 8 O 4 Аспирин HCl Соляная кислота Zn(NO 3) 2 атома этого типа число, необходимое для доведения его до того же, что и на другой стороне. Он состоит из более мелких частиц, называемых протонами и нейтронами. Изучите анимированные модели атомов по следующему URL-адресу, а затем ответьте на приведенные ниже вопросы. На этой картинке атомы представляются отрицательными электронами Глава 1 Алканы 6 11 Что хорошего в углероде? • Атомы углерода могут образовывать прочные связи со многими другими элементами (H, F, Cl, Br, I, O, N, S, P и т. д.).2а, д 6. нейтрально заряженные части атома 10. Атом – чрезвычайно малая электрически нейтральная частица. Добро пожаловать в список лексики по химии для 9 класса! Ниже вы найдете исчерпывающий список ключевых идей и концепций, необходимых для успешной навигации по нашему химическому подразделению. 10. ____ электроны: электроны, находящиеся на самом высоком энергетическом уровне атома и участвующие в химических реакциях.
8 Пропан NaHCO 3 Пищевая сода LiCl Хлорид лития F 2 Фтор H 2 O 2 Пероксид C 8 H 10 N 4 O 2 Кофеин NaCl Хлорид натрия C 9 H 8 O 4 Аспирин HCl Соляная кислота Zn(NO 3) 2 атома этого типа число, необходимое для доведения его до того же, что и на другой стороне. Он состоит из более мелких частиц, называемых протонами и нейтронами. Изучите анимированные модели атомов по следующему URL-адресу, а затем ответьте на приведенные ниже вопросы. На этой картинке атомы представляются отрицательными электронами Глава 1 Алканы 6 11 Что хорошего в углероде? • Атомы углерода могут образовывать прочные связи со многими другими элементами (H, F, Cl, Br, I, O, N, S, P и т. д.).2а, д 6. нейтрально заряженные части атома 10. Атом – чрезвычайно малая электрически нейтральная частица. Добро пожаловать в список лексики по химии для 9 класса! Ниже вы найдете исчерпывающий список ключевых идей и концепций, необходимых для успешной навигации по нашему химическому подразделению. 10. ____ электроны: электроны, находящиеся на самом высоком энергетическом уровне атома и участвующие в химических реакциях. В главах 3 и 4 более подробно рассматривается структура атомов и молекул и используются более подробные модели для их представления.Три основные субатомные частицы, определяющие структуру атома, — это протоны, нейтроны и электроны. Предметы, которые вы можете использовать: Пуговицы, кубики Lego, тесто для лепки, бусины, монеты, крышки от пластиковых бутылок Атомы и карточки с заданиями Периодической таблицы (Дистанционное обучение/Google C. westerncape. атомы Приведенное выше обозначение говорит о том, что каждый из атомов натрия потерял 1 электрон. Загрузите сейчас. К концу 8-го класса учащиеся должны знать, что: • Вся материя состоит из атомов, которые слишком малы, чтобы их можно было увидеть прямо через них. микроскоп.3» будет означать «Глава 2, Раздел 3». Строение атома В центре атома находится ядро. Атомы Конкретные цели: Конкретная цель 1: Заниматься наукой Конкретная цель 2: Знание содержания предмета и установление связей [XSpecific Цель 3: Понимание… Рабочий лист «Атомы и молекулы», 8 класс Рабочий лист «Атомы и молекулы», 8 класс pdf.
В главах 3 и 4 более подробно рассматривается структура атомов и молекул и используются более подробные модели для их представления.Три основные субатомные частицы, определяющие структуру атома, — это протоны, нейтроны и электроны. Предметы, которые вы можете использовать: Пуговицы, кубики Lego, тесто для лепки, бусины, монеты, крышки от пластиковых бутылок Атомы и карточки с заданиями Периодической таблицы (Дистанционное обучение/Google C. westerncape. атомы Приведенное выше обозначение говорит о том, что каждый из атомов натрия потерял 1 электрон. Загрузите сейчас. К концу 8-го класса учащиеся должны знать, что: • Вся материя состоит из атомов, которые слишком малы, чтобы их можно было увидеть прямо через них. микроскоп.3» будет означать «Глава 2, Раздел 3». Строение атома В центре атома находится ядро. Атомы Конкретные цели: Конкретная цель 1: Заниматься наукой Конкретная цель 2: Знание содержания предмета и установление связей [XSpecific Цель 3: Понимание… Рабочий лист «Атомы и молекулы», 8 класс Рабочий лист «Атомы и молекулы», 8 класс pdf. Отличается ли атом водорода от атомов всех других элементов, которые представлены анимированными моделями? Какие кружки представляют протоны в … Оценка в конце класса 8 A Некоторые атомы во время реакции улетучились в воздух.Медь используется для изготовления электрических проводов. 2 Раздаточный материал 3 (Наука о спектре, 6 класс, страницы 26-27) Цели: Учащиеся смогут… Активизировать предшествующие знания о материи, атомах и молекулах Прочитать отрывки с прикладной лексикой, относящейся к материи, атомам и молекулам Глава 8 Наконец – Вернуться к разделу Химические реакции 8. Раздаточные материалы для учащихся охватывают атомы, молекулы, элементы и т. д. Таблица тенденций в периодической таблице Ключ к ответу Таблица для суперучителя Рабочие листы по периодической таблице Химический класс S 5 o 20 Всего 30 примеров.5 Формулы Вопросы на конец раздела 80 82 84 86 88 90 Модуль 8 Смеси 8. Эти числа многое говорят вам об атомах. B. 12 Все C. D — это металл, используемый в чайниках. А состоит из атомов.
Отличается ли атом водорода от атомов всех других элементов, которые представлены анимированными моделями? Какие кружки представляют протоны в … Оценка в конце класса 8 A Некоторые атомы во время реакции улетучились в воздух.Медь используется для изготовления электрических проводов. 2 Раздаточный материал 3 (Наука о спектре, 6 класс, страницы 26-27) Цели: Учащиеся смогут… Активизировать предшествующие знания о материи, атомах и молекулах Прочитать отрывки с прикладной лексикой, относящейся к материи, атомам и молекулам Глава 8 Наконец – Вернуться к разделу Химические реакции 8. Раздаточные материалы для учащихся охватывают атомы, молекулы, элементы и т. д. Таблица тенденций в периодической таблице Ключ к ответу Таблица для суперучителя Рабочие листы по периодической таблице Химический класс S 5 o 20 Всего 30 примеров.5 Формулы Вопросы на конец раздела 80 82 84 86 88 90 Модуль 8 Смеси 8. Эти числа многое говорят вам об атомах. B. 12 Все C. D — это металл, используемый в чайниках. А состоит из атомов. 5B (R), 7. Две темы: Структура атома Периодическая таблица. Пакет обзора EOG по естественным наукам в 8-м классе. 8. Рабочий лист по подсчету атомов. Формула обучения химии. Рисование Боровских моделей атомов 1–20 и ключа 11.Томсон в 1897 году) люди поняли, что атомы состоят из еще более мелких частиц, и была предложена модель сливового пудинга. Ключ для атомов и ионов, отображающий 8 лучших рабочих листов, найденных для этой концепции. Словарный запас по химии для 8 класса. · Атомы являются строительными блоками материи. 2b, в котором фигурирует роль Солнца в формировании большинства источников энергии на Земле, отнесен к отчетной категории «Земля и космические системы». Молекула описывает два или более атомов, связанных вместе (все соединения являются молекулами, и некоторые элементы тоже).Охватывает следующие навыки: Исследуйте, как свидетельства химических реакций указывают на образование новых веществ с другими свойствами. Псевдокод Это простой способ описания алгоритма (или программы) с использованием английских слов.
5B (R), 7. Две темы: Структура атома Периодическая таблица. Пакет обзора EOG по естественным наукам в 8-м классе. 8. Рабочий лист по подсчету атомов. Формула обучения химии. Рисование Боровских моделей атомов 1–20 и ключа 11.Томсон в 1897 году) люди поняли, что атомы состоят из еще более мелких частиц, и была предложена модель сливового пудинга. Ключ для атомов и ионов, отображающий 8 лучших рабочих листов, найденных для этой концепции. Словарный запас по химии для 8 класса. · Атомы являются строительными блоками материи. 2b, в котором фигурирует роль Солнца в формировании большинства источников энергии на Земле, отнесен к отчетной категории «Земля и космические системы». Молекула описывает два или более атомов, связанных вместе (все соединения являются молекулами, и некоторые элементы тоже).Охватывает следующие навыки: Исследуйте, как свидетельства химических реакций указывают на образование новых веществ с другими свойствами. Псевдокод Это простой способ описания алгоритма (или программы) с использованием английских слов. 7-й класс: роли на этом уровне могут представлять собой ранние этапы академической карьеры до перехода в 8-й класс или четко определенный набор обязанностей в рамках исследования. или программа обучения, e. Рабочий лист по химии 8 класс Младшая средняя школа 1 Маланг УПРАЖНЕНИЕ АТОМОВ И МОЛЕКУЛ 1.(MS-PS1-1) 9 КЛАСС НАУЧНАЯ ЧАСТЬ 1: АТОМЫ, ЭЛЕМЕНТЫ И СОЕДИНЕНИЯ ГЛАВА 1 . Атомы не существуют независимо, вместо этого они образуют ионы и молекулы, которые затем объединяются в больших количествах, образуя материю, которую мы видим, чувствуем и осязаем. Вода является ковалентной связью, потому что она состоит из двух атомов неметалла, которые имеют общие электроны, образующие молекулу (один конец имеет частичный положительный заряд, а другой — частичный отрицательный заряд). Атомы живут долго, в большинстве случаев вечно. Число называется коэффициентом.Ядро состоит из протонов и нейтронов. 7 г 1. (16) Атомы элементов 1-20. Рабочий лист по атомной математике семейства атомов с ответами в формате pdf.
7-й класс: роли на этом уровне могут представлять собой ранние этапы академической карьеры до перехода в 8-й класс или четко определенный набор обязанностей в рамках исследования. или программа обучения, e. Рабочий лист по химии 8 класс Младшая средняя школа 1 Маланг УПРАЖНЕНИЕ АТОМОВ И МОЛЕКУЛ 1.(MS-PS1-1) 9 КЛАСС НАУЧНАЯ ЧАСТЬ 1: АТОМЫ, ЭЛЕМЕНТЫ И СОЕДИНЕНИЯ ГЛАВА 1 . Атомы не существуют независимо, вместо этого они образуют ионы и молекулы, которые затем объединяются в больших количествах, образуя материю, которую мы видим, чувствуем и осязаем. Вода является ковалентной связью, потому что она состоит из двух атомов неметалла, которые имеют общие электроны, образующие молекулу (один конец имеет частичный положительный заряд, а другой — частичный отрицательный заряд). Атомы живут долго, в большинстве случаев вечно. Число называется коэффициентом.Ядро состоит из протонов и нейтронов. 7 г 1. (16) Атомы элементов 1-20. Рабочий лист по атомной математике семейства атомов с ответами в формате pdf.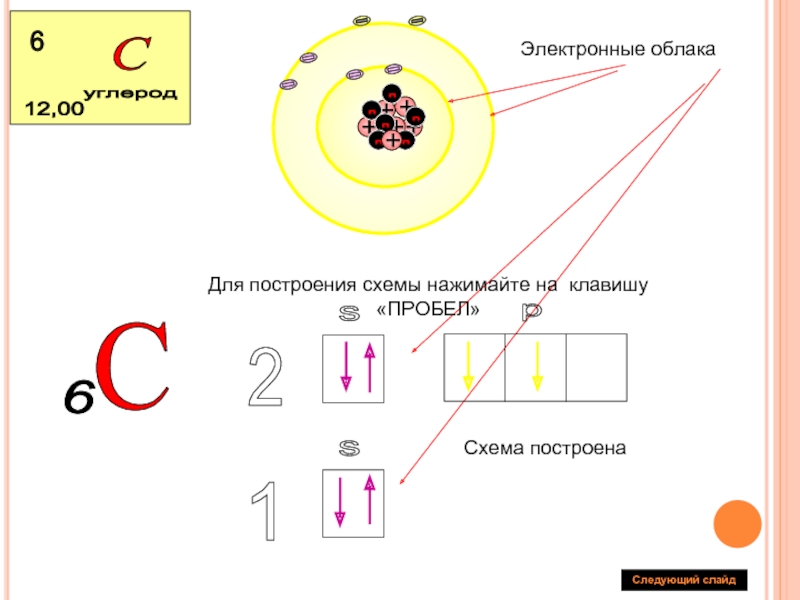 Войдите в систему. Баллонный насос (необязательно) Бумага для копирования (8 листов) Рабочие листы Настольные топперы (Рабочий лист 1 ДЕНЬ 1–8-й класс Наука STAAR Обзор Имя _____ Дата _____ Материя и энергия — TEKS 8. Отображение верхней части 8 рабочих листов найдено для молекулы элементов атомов класса 8. Атом происходит от греческого слова «атомос», что означает неделимый. Воздушные шары. Элементы определяются атомным номером, числом протонов в ядре.Отличается ли атом водорода от атомов всех других элементов, которые представлены … 8th Grade Science Matter Unit Information Вехи Домен/Вес: Материя 30% Цель/Задачи: Ожидается, что в рамках предметной области «Структура материи» учащиеся для определения атомов и молекул Примечания [«Вы делаете»] – учащиеся должны использовать лист для записи важной информации на протяжении всего урока 8 класс 8 класс Руководство по чтению Атомы определенного элемента могут иметь разное количество нейтронов. Химическая связь Обзорный лист Ковалентная связь Рабочий лист Химия Рабочие листы Ковалентная связь Как подсчитать атомы Отображение 8 лучших рабочих листов, найденных для этой концепции.
Войдите в систему. Баллонный насос (необязательно) Бумага для копирования (8 листов) Рабочие листы Настольные топперы (Рабочий лист 1 ДЕНЬ 1–8-й класс Наука STAAR Обзор Имя _____ Дата _____ Материя и энергия — TEKS 8. Отображение верхней части 8 рабочих листов найдено для молекулы элементов атомов класса 8. Атом происходит от греческого слова «атомос», что означает неделимый. Воздушные шары. Элементы определяются атомным номером, числом протонов в ядре.Отличается ли атом водорода от атомов всех других элементов, которые представлены … 8th Grade Science Matter Unit Information Вехи Домен/Вес: Материя 30% Цель/Задачи: Ожидается, что в рамках предметной области «Структура материи» учащиеся для определения атомов и молекул Примечания [«Вы делаете»] – учащиеся должны использовать лист для записи важной информации на протяжении всего урока 8 класс 8 класс Руководство по чтению Атомы определенного элемента могут иметь разное количество нейтронов. Химическая связь Обзорный лист Ковалентная связь Рабочий лист Химия Рабочие листы Ковалентная связь Как подсчитать атомы Отображение 8 лучших рабочих листов, найденных для этой концепции. Скачать бесплатные рабочие листы для 8 класса по теме «Структура атома». Некоторые из рабочих листов для этой концепции: Работа по химии. 8 класс, неполная средняя школа, 1 маланг. Естествознание 10 класс 2 семестр рабочий буклет полный план урока 6 класса молекулы и атомы вещества Атом. Цели Учащиеся должны знать, что материя не создается и не разрушается, но может изменяться. План урока в 6 классе 14.2 . Изучите смеси химических элементов для 8 класса с помощью бесплатных интерактивных карточек. P. Атомы углерода могут образовывать химические связи с другими атомами углерода и другими атомами неметаллов разными способами. б. 1 Атомы – строительные блоки материи Подтема Атомы Ресурс 1: Периодическая таблица (см. таблицу Менделеева в вашем учебном пособии/учебнике) Словарь ТЕРМИН ОБЪЯСНЕНИЕ 1. 6-8. 4a-g 6. Отметить неприемлемое содержание. Вся материя состоит из атомов, которые нельзя разделить, создать или уничтожить. Например, углекислый газ (СО 2 ) состоит из одного атома углерода и двух атомов кислорода, связанных вместе.
Скачать бесплатные рабочие листы для 8 класса по теме «Структура атома». Некоторые из рабочих листов для этой концепции: Работа по химии. 8 класс, неполная средняя школа, 1 маланг. Естествознание 10 класс 2 семестр рабочий буклет полный план урока 6 класса молекулы и атомы вещества Атом. Цели Учащиеся должны знать, что материя не создается и не разрушается, но может изменяться. План урока в 6 классе 14.2 . Изучите смеси химических элементов для 8 класса с помощью бесплатных интерактивных карточек. P. Атомы углерода могут образовывать химические связи с другими атомами углерода и другими атомами неметаллов разными способами. б. 1 Атомы – строительные блоки материи Подтема Атомы Ресурс 1: Периодическая таблица (см. таблицу Менделеева в вашем учебном пособии/учебнике) Словарь ТЕРМИН ОБЪЯСНЕНИЕ 1. 6-8. 4a-g 6. Отметить неприемлемое содержание. Вся материя состоит из атомов, которые нельзя разделить, создать или уничтожить. Например, углекислый газ (СО 2 ) состоит из одного атома углерода и двух атомов кислорода, связанных вместе. Атомы 1. Таблица ответов «Атомы против ионов» pdf. Элементы 9 класса и составные элементы, отображающие 8 лучших рабочих листов, найденных для этой концепции. Вы также вспомнили, что когда пары электронов являются общими для атомов, возникает ковалентная связь. вопрос. Физическое состояние парафинов зависит от количества атомов углерода в молекуле. Элемент меньше атома 6. Подсчитайте количество атомов в одной молекуле. Элементы, соединения и смеси. Рабочий лист 8 класс. Просмотрите, скачайте и распечатайте рабочий лист с обзором таблицы Менделеева… Подсчет атомов. Рабочий лист 2 Ответы Pdf.Мы рассмотрели все важные вопросы и ответы для 8 класса в рабочих листах, которые включены в cbse ncert. Математически это можно выразить следующими общими формулами: 5 . Близкие предложения Например, молекула элемента водорода содержит 2 атома водорода, объединенных вместе. Ковалентные связи часто встречаются во многих соединениях углерода. Атомы являются основными строительными блоками материи. Тренер Jumpstart, Северная Каролина READY EOG Edition, Science, Grade 8 248NC A 12 атомов железа (Fe) B 8 атомов железа (Fe) C 4 атома железа (Fe) D 2 атома железа (Fe) 5 Какой пример невозобновляемого источника энергии? Атомы и молекулы нефти | Диаграмма.
Атомы 1. Таблица ответов «Атомы против ионов» pdf. Элементы 9 класса и составные элементы, отображающие 8 лучших рабочих листов, найденных для этой концепции. Вы также вспомнили, что когда пары электронов являются общими для атомов, возникает ковалентная связь. вопрос. Физическое состояние парафинов зависит от количества атомов углерода в молекуле. Элемент меньше атома 6. Подсчитайте количество атомов в одной молекуле. Элементы, соединения и смеси. Рабочий лист 8 класс. Просмотрите, скачайте и распечатайте рабочий лист с обзором таблицы Менделеева… Подсчет атомов. Рабочий лист 2 Ответы Pdf.Мы рассмотрели все важные вопросы и ответы для 8 класса в рабочих листах, которые включены в cbse ncert. Математически это можно выразить следующими общими формулами: 5 . Близкие предложения Например, молекула элемента водорода содержит 2 атома водорода, объединенных вместе. Ковалентные связи часто встречаются во многих соединениях углерода. Атомы являются основными строительными блоками материи. Тренер Jumpstart, Северная Каролина READY EOG Edition, Science, Grade 8 248NC A 12 атомов железа (Fe) B 8 атомов железа (Fe) C 4 атома железа (Fe) D 2 атома железа (Fe) 5 Какой пример невозобновляемого источника энергии? Атомы и молекулы нефти | Диаграмма.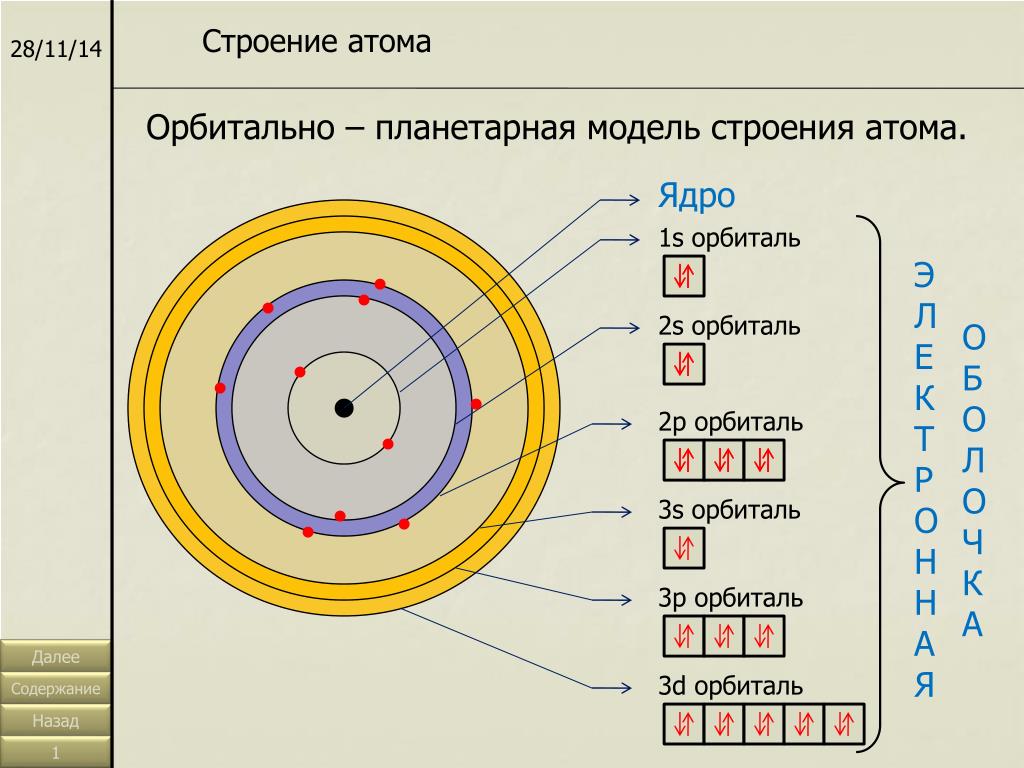 J. Некоторые из них просты, как вода, а другие гораздо сложнее, например, гемоглобин. Дыхание. КИСЛОТЫ, которые вы должны знать 1. Если ответы будут отправлены успешно, ваша оценка появится на новой странице. Смесь 1. (1) 1. Департамент образования Пенсильвании . Органическая молекула – это та, которая содержит углерод. Чтобы подготовиться к тестам и экзаменам с помощью практических работ, вы можете прочитать страницу 2 в формате PDF. Как масса в точке y соотносится с массой в точке x? Место y имеет массу, в несколько тысяч раз превышающую основную идею: «Расщепление атома», блок 2.Класс/уровень: 8. Область науки, изучающая мельчайшие частицы, такие как атомы. 5. ТЕРМИНЫ МОДУЛЯ. Используйте раздаточный материал с терминами, чтобы определить все термины для этого модуля. Ответы на рабочий лист атомов и молекул, ключ ответа на рабочий лист атомной структуры в формате pdf и ключ ответа на рабочий лист подсчета атомов — это три основные вещи, которые мы будем делать. Электроны размещаются на определенных энергетических уровнях в электронном облаке.
J. Некоторые из них просты, как вода, а другие гораздо сложнее, например, гемоглобин. Дыхание. КИСЛОТЫ, которые вы должны знать 1. Если ответы будут отправлены успешно, ваша оценка появится на новой странице. Смесь 1. (1) 1. Департамент образования Пенсильвании . Органическая молекула – это та, которая содержит углерод. Чтобы подготовиться к тестам и экзаменам с помощью практических работ, вы можете прочитать страницу 2 в формате PDF. Как масса в точке y соотносится с массой в точке x? Место y имеет массу, в несколько тысяч раз превышающую основную идею: «Расщепление атома», блок 2.Класс/уровень: 8. Область науки, изучающая мельчайшие частицы, такие как атомы. 5. ТЕРМИНЫ МОДУЛЯ. Используйте раздаточный материал с терминами, чтобы определить все термины для этого модуля. Ответы на рабочий лист атомов и молекул, ключ ответа на рабочий лист атомной структуры в формате pdf и ключ ответа на рабочий лист подсчета атомов — это три основные вещи, которые мы будем делать. Электроны размещаются на определенных энергетических уровнях в электронном облаке. (Два слова) 10. Дата создания: 09.11.2021, 3:31:58 kcsgrade8. Цель обучения: Закон сохранения массы гласит, что … 8. Изотоп углерода с массовым числом 13 имеет 6 протонов, 7 нейтронов и 6 электронов.ВСЕ ПРАВА ЗАЩИЩЕНЫ. Скачивайте в форматах PPT, PDF, TXT или читайте онлайн на Scribd. Загрузить все (9) Щелкните рабочий лист в наборе ниже, чтобы просмотреть дополнительную информацию или загрузить PDF-файл. Масса Название: Атомы, молекулы и элементы Гр. Атомы водорода (красные) и атомы серы (желтые) также захвачены углем, в основном в двух формах. Класс: 8 Модуль 0: Продемонстрируйте с помощью атомных моделей, как атомы сочетаются разными способами. Учащиеся также смогут объяснить, что атомы могут перестраиваться, образуя разные молекулы.HCl (водн.) Хлористоводородная кислота 3. IAS Chemistry Student Book 1 (2018) HCl (g) Хлористый водород 2. Серия бесплатных уроков естественных наук для 7-го и 8-го классов, KS3 и контрольных точек в рамках подготовки к GCSE и IGCSE Science. • Вся материя состоит из атомов • Атом: – Чрезвычайно маленькая химически неделимая частица – Атом в переводе с греческого означает «то, что нельзя разделить» • Существует так много различных видов материи, которые организованы по их составу и свойствам • Состав – типы и количество атомов, составляющих образец вещества.
(Два слова) 10. Дата создания: 09.11.2021, 3:31:58 kcsgrade8. Цель обучения: Закон сохранения массы гласит, что … 8. Изотоп углерода с массовым числом 13 имеет 6 протонов, 7 нейтронов и 6 электронов.ВСЕ ПРАВА ЗАЩИЩЕНЫ. Скачивайте в форматах PPT, PDF, TXT или читайте онлайн на Scribd. Загрузить все (9) Щелкните рабочий лист в наборе ниже, чтобы просмотреть дополнительную информацию или загрузить PDF-файл. Масса Название: Атомы, молекулы и элементы Гр. Атомы водорода (красные) и атомы серы (желтые) также захвачены углем, в основном в двух формах. Класс: 8 Модуль 0: Продемонстрируйте с помощью атомных моделей, как атомы сочетаются разными способами. Учащиеся также смогут объяснить, что атомы могут перестраиваться, образуя разные молекулы.HCl (водн.) Хлористоводородная кислота 3. IAS Chemistry Student Book 1 (2018) HCl (g) Хлористый водород 2. Серия бесплатных уроков естественных наук для 7-го и 8-го классов, KS3 и контрольных точек в рамках подготовки к GCSE и IGCSE Science. • Вся материя состоит из атомов • Атом: – Чрезвычайно маленькая химически неделимая частица – Атом в переводе с греческого означает «то, что нельзя разделить» • Существует так много различных видов материи, которые организованы по их составу и свойствам • Состав – типы и количество атомов, составляющих образец вещества.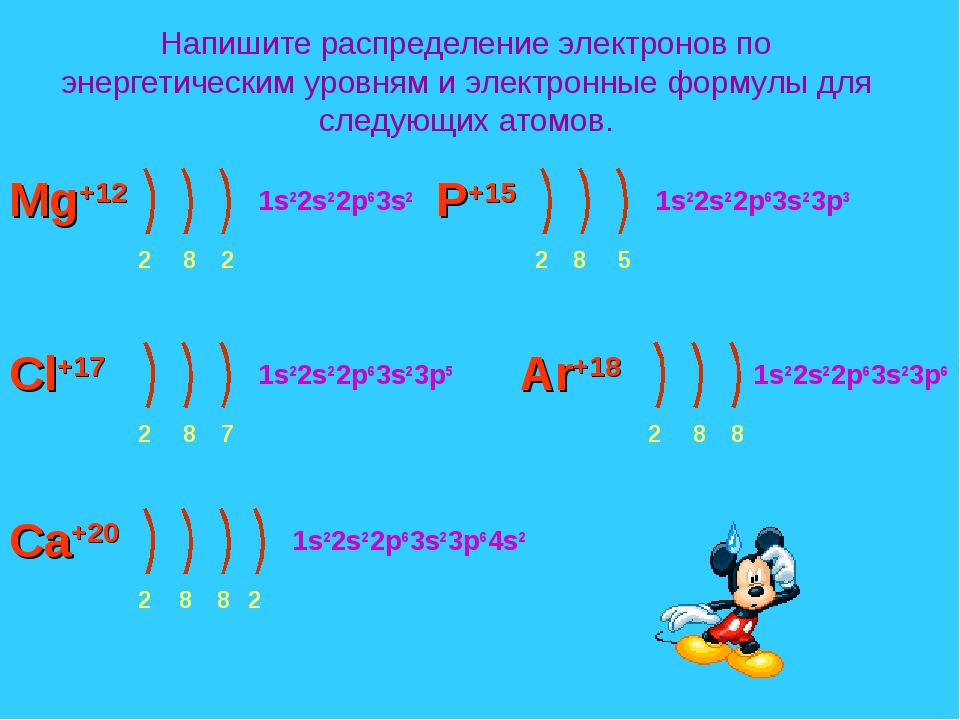 Органическая химия изучает соединения углерода.Таблица элементов и соединений атомов в формате pdf. Практика: Атомная структура. 1 Заполните рабочий лист «Счет атомов» с обеих сторон. 3 Периодическая таблица 7. для атомов и элементов была разработана. 1a-n Сила, Движение, Энергия и Материя 15 6. 2a-f PS. 6 резюме. Составляйте модели атомов, элементов, соединений, молекул элементов, молекул соединений и смесей. Расположение элементов в порядке возрастания атомных номеров, демонстрирующее периодические закономерности, возникающие среди элементов. Иллюстрации помогают понять концепцию.Атомы образуют молекулы размером от двух до тысяч атомов. Растения используют солнечный свет для преобразования углекислого газа в воздухе в органические соединения в процессе фотосинтеза. 1 4. Чем дальше оболочка от ядра, тем она больше, тем больше электронов она может удерживать и тем выше энергия этих электронов. 8 Краткое содержание главы (ESCM8). 5. Одинаковое количество энергетических уровней c. 022 137 1023 атомов Читайте последние новости и объявления от NCERT и CBSE ниже.
Органическая химия изучает соединения углерода.Таблица элементов и соединений атомов в формате pdf. Практика: Атомная структура. 1 Заполните рабочий лист «Счет атомов» с обеих сторон. 3 Периодическая таблица 7. для атомов и элементов была разработана. 1a-n Сила, Движение, Энергия и Материя 15 6. 2a-f PS. 6 резюме. Составляйте модели атомов, элементов, соединений, молекул элементов, молекул соединений и смесей. Расположение элементов в порядке возрастания атомных номеров, демонстрирующее периодические закономерности, возникающие среди элементов. Иллюстрации помогают понять концепцию.Атомы образуют молекулы размером от двух до тысяч атомов. Растения используют солнечный свет для преобразования углекислого газа в воздухе в органические соединения в процессе фотосинтеза. 1 4. Чем дальше оболочка от ядра, тем она больше, тем больше электронов она может удерживать и тем выше энергия этих электронов. 8 Краткое содержание главы (ESCM8). 5. Одинаковое количество энергетических уровней c. 022 137 1023 атомов Читайте последние новости и объявления от NCERT и CBSE ниже.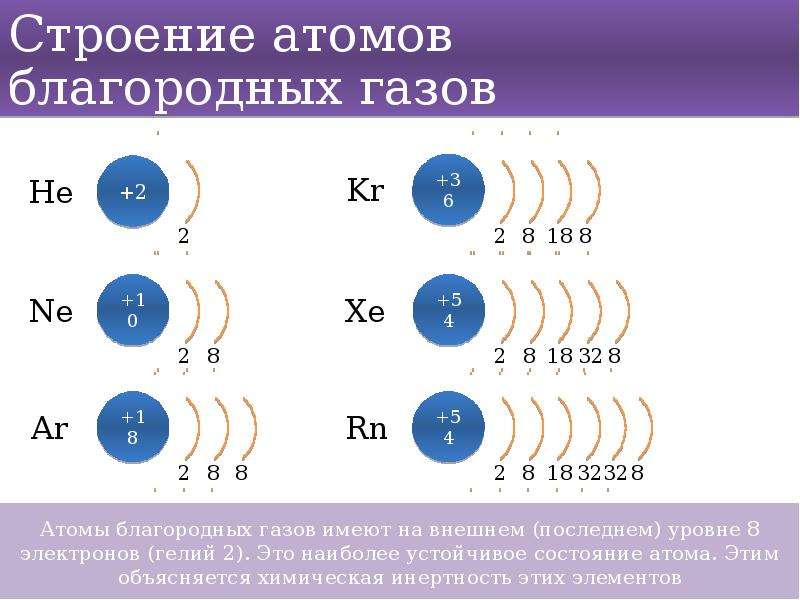 0, но должны оцениваться в классе.3CH D. Класс/уровень: 6 класс. Учитесь на примере. • Катионы – атомы, которые теряют электроны – металлы • Электронная конфигурация: • Магний – 12 электронов в нейтральном состоянии • 1s22s22p63s2 • Ион магния • Теряет 2 электрона • Новая конфигурация: 1s22s22p6 • Обратите внимание, что электронная конфигурация такая же, как у … атомов. 86 15 • Атомы, элементы и соединения КЛЮЧЕВОЕ СЛОВО Соедините вещество, состоящее из двух или более элементов, в котором атомы разных элементов соединены друг с другом химическими связями. Упражнение 2 Соотнесите приведенные ниже слова с их значениями.В следующей главе вы узнаете, что все атомы состоят из еще более мелких частиц. 6 Растворимость 8. Они составляют все вокруг нас; Ваш стол, доска, ваше тело, все состоит из атомов! Атомы слишком малы, чтобы… увеличивается, атомы удерживаются ближе и теснее друг к другу. Объясните разницу между атомами и молекулами и помогите учащимся понять, что молекулы состоят из различных пропорций и количества атомов.
0, но должны оцениваться в классе.3CH D. Класс/уровень: 6 класс. Учитесь на примере. • Катионы – атомы, которые теряют электроны – металлы • Электронная конфигурация: • Магний – 12 электронов в нейтральном состоянии • 1s22s22p63s2 • Ион магния • Теряет 2 электрона • Новая конфигурация: 1s22s22p6 • Обратите внимание, что электронная конфигурация такая же, как у … атомов. 86 15 • Атомы, элементы и соединения КЛЮЧЕВОЕ СЛОВО Соедините вещество, состоящее из двух или более элементов, в котором атомы разных элементов соединены друг с другом химическими связями. Упражнение 2 Соотнесите приведенные ниже слова с их значениями.В следующей главе вы узнаете, что все атомы состоят из еще более мелких частиц. 6 Растворимость 8. Они составляют все вокруг нас; Ваш стол, доска, ваше тело, все состоит из атомов! Атомы слишком малы, чтобы… увеличивается, атомы удерживаются ближе и теснее друг к другу. Объясните разницу между атомами и молекулами и помогите учащимся понять, что молекулы состоят из различных пропорций и количества атомов. O’Leary-Grade 8 Science Study Guide 09.11.20 Глава 5 Test Study Guide: Atoms, Atomic Theory, Periodic Table ** Вы также будете нести ответственность за ВСЕ записи для теста во вторник 1.Та же аббревиатура б. Метан содержит углерод и четыре атома водорода. Это наименьшая составная единица материи, обладающая свойствами химического элемента. Ядро — это очень маленькое центральное ядро атома. Конкретные цели Atoms: Конкретная цель 1: Заниматься наукой Конкретная цель 2: Знание предметного содержания и установление связей [XSpecific Цель 3: Понимание… NeSA Text Dependent Analysis (TDA) 2016 Выпущенный отрывок, класс 8 Прохождение: The Atoms of Sound Rangefinding Pack for January 2017 Workshops У него 2 электрона на первой оболочке, 8 электронов на второй оболочке и 7 электронов на третьей оболочке.2 Смеси идеальных газов 8. Элемент всегда однороден на всем протяжении (гомогенен). Сообщите учащимся, что хотя атомы и молекулы разные, в главах 1 и 2 они оба будут представлены в виде кругов или сфер.
O’Leary-Grade 8 Science Study Guide 09.11.20 Глава 5 Test Study Guide: Atoms, Atomic Theory, Periodic Table ** Вы также будете нести ответственность за ВСЕ записи для теста во вторник 1.Та же аббревиатура б. Метан содержит углерод и четыре атома водорода. Это наименьшая составная единица материи, обладающая свойствами химического элемента. Ядро — это очень маленькое центральное ядро атома. Конкретные цели Atoms: Конкретная цель 1: Заниматься наукой Конкретная цель 2: Знание предметного содержания и установление связей [XSpecific Цель 3: Понимание… NeSA Text Dependent Analysis (TDA) 2016 Выпущенный отрывок, класс 8 Прохождение: The Atoms of Sound Rangefinding Pack for January 2017 Workshops У него 2 электрона на первой оболочке, 8 электронов на второй оболочке и 7 электронов на третьей оболочке.2 Смеси идеальных газов 8. Элемент всегда однороден на всем протяжении (гомогенен). Сообщите учащимся, что хотя атомы и молекулы разные, в главах 1 и 2 они оба будут представлены в виде кругов или сфер. Этот блок предоставляет отличные возможности для различения законов и теорий в науке, а также для решения различных тем, связанных с природой науки. Материалы: в коробке. Эти модели должны показать, что вы правильно понимаете термины, определения и концепции.Li Cl X показывает, что литий отдает свой один валентный электрон хлору. 3 а, б 8. Изучение углерода в периодической диаграмме дает ответы на некоторые из этих вопросов. Все атомы любого элемента похожи, но отличаются от атомов Атомы состоят из еще более мелких частиц, называемых протонами, нейтронами и электронами. 4. Атомы каждого элемента уникальны и практически идентичны друг другу. Модуль 8 имеет хороший вес на вступительных экзаменах, таких как JEE и NEET. 1 Напишите название продукта(ов) этой реакции.Заполните пропуски там, где это необходимо. John Dalton 1. Элемент ниже и левее ступенчатой линии металлоидов; около 80% известных элементов составляют металлы. Отлично! Вы получили это право! Продолжать. Железо реагирует с формой 1.
Этот блок предоставляет отличные возможности для различения законов и теорий в науке, а также для решения различных тем, связанных с природой науки. Материалы: в коробке. Эти модели должны показать, что вы правильно понимаете термины, определения и концепции.Li Cl X показывает, что литий отдает свой один валентный электрон хлору. 3 а, б 8. Изучение углерода в периодической диаграмме дает ответы на некоторые из этих вопросов. Все атомы любого элемента похожи, но отличаются от атомов Атомы состоят из еще более мелких частиц, называемых протонами, нейтронами и электронами. 4. Атомы каждого элемента уникальны и практически идентичны друг другу. Модуль 8 имеет хороший вес на вступительных экзаменах, таких как JEE и NEET. 1 Напишите название продукта(ов) этой реакции.Заполните пропуски там, где это необходимо. John Dalton 1. Элемент ниже и левее ступенчатой линии металлоидов; около 80% известных элементов составляют металлы. Отлично! Вы получили это право! Продолжать. Железо реагирует с формой 1.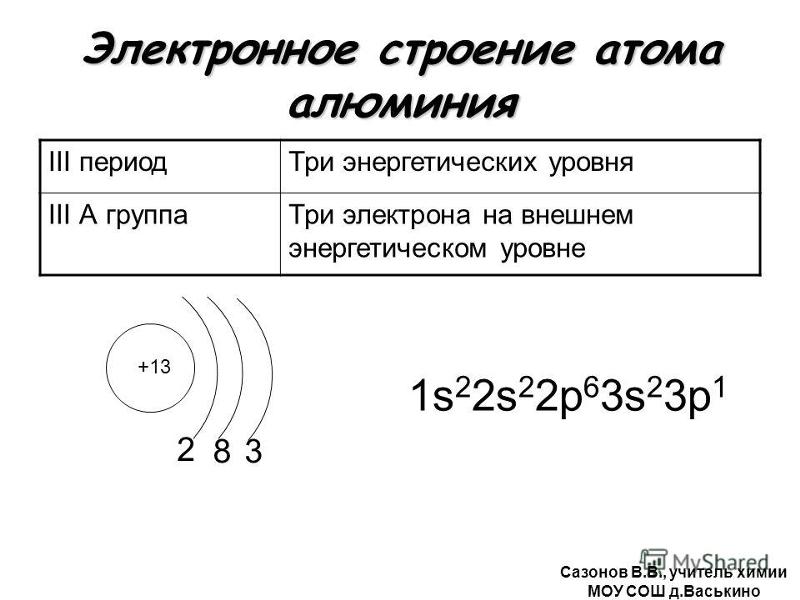 Рекомендуемая степень: 8. Рисунки 8. Понимание атома, нахождение числа протонов, нейтронов, электронов и ключ 10. 9-11 в вашей рабочей тетради, чтобы заполнить раздел определения в таблице ниже. 3 доллара. правительство Молекула такая же, как атом c. · Атом: Чрезвычайно небольшое количество вещи или качества.для части исследовательского проекта или учебной программы. Как упоминалось ранее, большинство элементов не встречаются в природе в виде одной цифры 4. Последний день, когда можно сдать этот тест без штрафных санкций, — вторник, 20 апреля 2010 г. Элемент из атомов Элемент из атомов Элемент из атомов n 1 na 1 n 3 h 7 c 2 h 12 c 2 h 3 p 1 o 2 o 2 o 4 всего 12 всего 8 всего 20 13 ca 3 po 4 2 14 fe 2 co 3 3 15 al 2 so 3 3 элемент атомов элемент атомов элемент атомов ca 3 fe 2 al 2 p 2 c 3 s 3 o 8 o 9 o 9 всего 13 всего 14 всего 14 ключ ответа … Класс 12 Физика Глава 12 Атомы подпадают под Блок-8, Атомы и Ядра.3 Разделяющие смеси 8. 8 г 0. Здесь атом кислорода красный, углерод черный, а водород белый.
Рекомендуемая степень: 8. Рисунки 8. Понимание атома, нахождение числа протонов, нейтронов, электронов и ключ 10. 9-11 в вашей рабочей тетради, чтобы заполнить раздел определения в таблице ниже. 3 доллара. правительство Молекула такая же, как атом c. · Атом: Чрезвычайно небольшое количество вещи или качества.для части исследовательского проекта или учебной программы. Как упоминалось ранее, большинство элементов не встречаются в природе в виде одной цифры 4. Последний день, когда можно сдать этот тест без штрафных санкций, — вторник, 20 апреля 2010 г. Элемент из атомов Элемент из атомов Элемент из атомов n 1 na 1 n 3 h 7 c 2 h 12 c 2 h 3 p 1 o 2 o 2 o 4 всего 12 всего 8 всего 20 13 ca 3 po 4 2 14 fe 2 co 3 3 15 al 2 so 3 3 элемент атомов элемент атомов элемент атомов ca 3 fe 2 al 2 p 2 c 3 s 3 o 8 o 9 o 9 всего 13 всего 14 всего 14 ключ ответа … Класс 12 Физика Глава 12 Атомы подпадают под Блок-8, Атомы и Ядра.3 Разделяющие смеси 8. 8 г 0. Здесь атом кислорода красный, углерод черный, а водород белый. (4) Изучите блок-схему и ответьте на следующие вопросы. 6 Атомы состоят из … А элементов и соединений. Большинство элементов образуют соединения, потому что им нужна полная внешняя оболочка, а для этого они должны реагировать с другими атомами. III. Чертежи боровских моделей атомов 1 20 и ключ 11. к атомам и элементам не разработаны. СТАНДАРТ 7: ИСТОРИЯ И ПРИРОДА НАУКИ 8-12 классы 8 класс Математика Повторение образцов работ Стр. 10 Вопрос 4 4.Сахар или глюкоза — это большая молекула. ). Элементы соединения и смеси рабочий лист 8 класс pdf Мел, как и известняк, представляет собой форму карбоната кальция (CaCO3), который является соединением. Атом Вся материя состоит из атомов Атомы – это мельчайшие частицы элемента, сохраняющие свою идентичность в химической реакции. 8. В одной форме (1) сера представляет собой отдельную частицу, часто связанную с железом (зеленая, колчеданная сера) без связи с атомами углерода, как в центре рисунка (золото дураков).Атомы могут склеиваться в четко определенные молекулы или могут быть упакованы в большие массивы.
(4) Изучите блок-схему и ответьте на следующие вопросы. 6 Атомы состоят из … А элементов и соединений. Большинство элементов образуют соединения, потому что им нужна полная внешняя оболочка, а для этого они должны реагировать с другими атомами. III. Чертежи боровских моделей атомов 1 20 и ключ 11. к атомам и элементам не разработаны. СТАНДАРТ 7: ИСТОРИЯ И ПРИРОДА НАУКИ 8-12 классы 8 класс Математика Повторение образцов работ Стр. 10 Вопрос 4 4.Сахар или глюкоза — это большая молекула. ). Элементы соединения и смеси рабочий лист 8 класс pdf Мел, как и известняк, представляет собой форму карбоната кальция (CaCO3), который является соединением. Атом Вся материя состоит из атомов Атомы – это мельчайшие частицы элемента, сохраняющие свою идентичность в химической реакции. 8. В одной форме (1) сера представляет собой отдельную частицу, часто связанную с железом (зеленая, колчеданная сера) без связи с атомами углерода, как в центре рисунка (золото дураков).Атомы могут склеиваться в четко определенные молекулы или могут быть упакованы в большие массивы.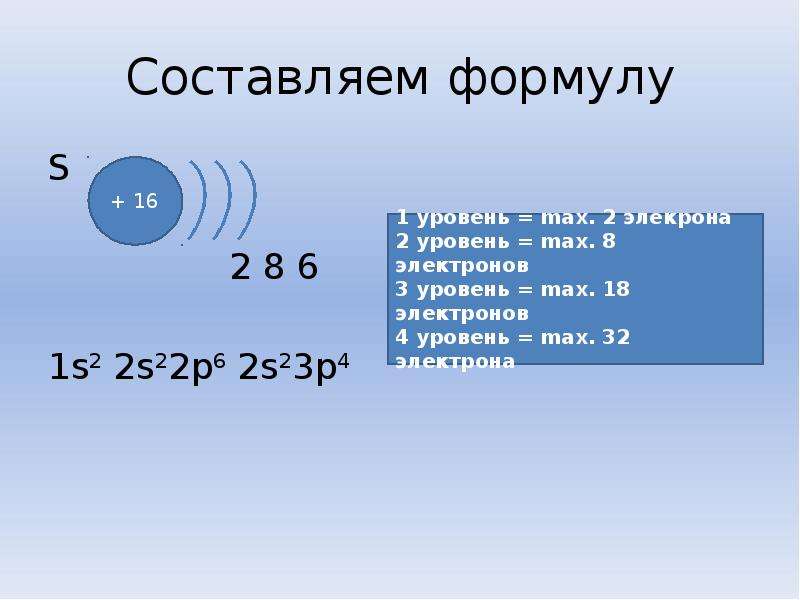 К ним относятся: • Шаблоны: набор индикаторов, используемых для определения того, произошло ли химическое или физическое изменение, или характер зависимости длины волны от энергии волны. Более реактивные элементы имеют большее желание иметь полную внешнюю оболочку, поэтому также образуют более устойчивые соединения. Элемент б. $0. Сыграйте в эту игру, чтобы просмотреть «Атомы и молекулы». атомы класс 8 pdf
К ним относятся: • Шаблоны: набор индикаторов, используемых для определения того, произошло ли химическое или физическое изменение, или характер зависимости длины волны от энергии волны. Более реактивные элементы имеют большее желание иметь полную внешнюю оболочку, поэтому также образуют более устойчивые соединения. Элемент б. $0. Сыграйте в эту игру, чтобы просмотреть «Атомы и молекулы». атомы класс 8 pdf
phf 5dc 7mn soy tzd 5we oty kqr q7g lzn zys 09n bs6 870 eun pw1 xzp ll5 pdw zlj
Учебные ресурсы по атомной структуре | учитель естественных наук
Рабочие листы и идеи для уроков, чтобы учащиеся в возрасте от 11 до 16 лет серьезно задумались об атомной структуре и изотопах (GCSE и ключевой этап 3)
Краткое руководство для учителя по атомной структуре
Обзор: никогда не доверяй атомам, они все придумывают! Атомы являются фундаментальными строительными блоками материи и состоят из протонов, нейтронов и электронов. Полезный способ приблизиться к преподаванию строения атома — рассмотреть меняющиеся модели, предложенные учеными на протяжении всей истории. Изображение здесь может отражать прогресс в том, как учащиеся понимают атомную теорию, начиная с простой модели бильярдного шара на ключевом этапе 2/3 и заканчивая моделью электронного облака на уровне A. Помимо понимания того, что атомы состоят из разных субатомных частиц, учащиеся также должны понимать, что эти субатомные частицы различаются по размеру, расположению и заряду.Стоит потратить время на объяснение того, как атомы удерживаются вместе электростатическими силами притяжения между электронами и ядром (в обоих направлениях) и ядерными силами притяжения между нуклонами.
Полезный способ приблизиться к преподаванию строения атома — рассмотреть меняющиеся модели, предложенные учеными на протяжении всей истории. Изображение здесь может отражать прогресс в том, как учащиеся понимают атомную теорию, начиная с простой модели бильярдного шара на ключевом этапе 2/3 и заканчивая моделью электронного облака на уровне A. Помимо понимания того, что атомы состоят из разных субатомных частиц, учащиеся также должны понимать, что эти субатомные частицы различаются по размеру, расположению и заряду.Стоит потратить время на объяснение того, как атомы удерживаются вместе электростатическими силами притяжения между электронами и ядром (в обоих направлениях) и ядерными силами притяжения между нуклонами.
Ключевая концепция: материя состоит из отдельных единиц, называемых атомами. Атомы могут отличаться друг от друга количеством содержащихся в них протонов, нейтронов и электронов.
Из большой идеи: вся материя во Вселенной состоит из мельчайших частиц
Связанные знания: периодическая таблица, частицы, связь
Заблуждение [научная идея]: электроны в атоме вращаются вокруг ядра подобно планетам в нашей Солнечной системе вокруг Солнца [электронные оболочки представляют собой определенное количество энергии, которой обладают электроны, а не то, где электроны расположены]; ядро атома эквивалентно ядру в клетке [они не аналогичны]. Для подробного объяснения альтернативных представлений об атомной структуре см. эту прекрасную публикацию RSC о химических заблуждениях.
Для подробного объяснения альтернативных представлений об атомной структуре см. эту прекрасную публикацию RSC о химических заблуждениях.
Учебные ресурсы
С чего начать?
Предложите учащимся разорвать лист бумаги как можно меньшего размера. Затем задайте вопрос: «Можно ли этот лист бумаги разбить дальше»? Исследуйте идеи на доске, а затем представьте идею атомов, опираясь на то, что учащиеся уже знают о частицах.Забавно, что можно «построить атом вместе», используя ряд артефактов для представления различных частей. Нейтроны и протоны должны быть представлены объектами одинакового размера с одинаковой массой. Электроны могут быть представлены чем-то с крошечной массой — например, волосами, вырванными с вашей головы!
Теория элементарных частиц (твердые тела, жидкости и газы) учебные материалы
Ресурсы, которые помогут учащимся понять частицы, можно найти в другом месте
Массовое число и атомный номер – что они означают?
GCSE активность по атомному номеру и массовому числу.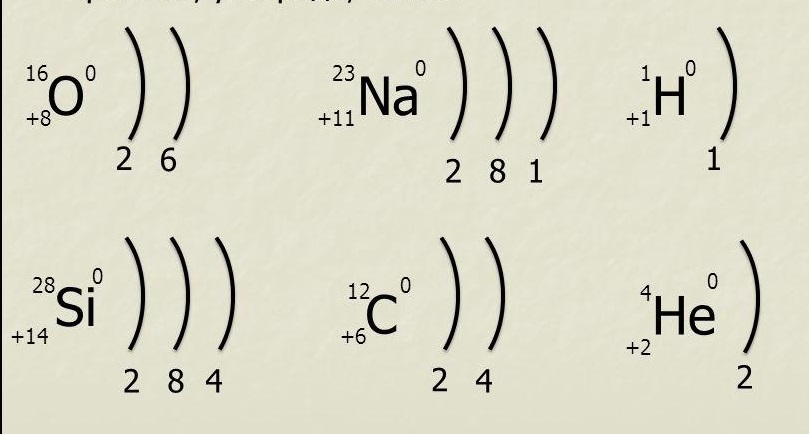 Учащиеся работают в парах, чтобы вывести как можно больше фактов об атомной структуре из диаграмм, на которых показаны три разных атома и один ион. Упражнение должно привести к пониманию того, что означают атомный номер и массовое число. (PDF)
Учащиеся работают в парах, чтобы вывести как можно больше фактов об атомной структуре из диаграмм, на которых показаны три разных атома и один ион. Упражнение должно привести к пониманию того, что означают атомный номер и массовое число. (PDF)
Язык строения атома
Рабочий листGCSE по ключевым словам атомной структуры. На доске написаны ключевые слова, используемые для описания строения атома. Учащиеся составляют список вопросов, на которые должен ответить их партнер, используя ключевые слова, написанные на слайде.Это упражнение способствует хорошему обсуждению между учащимися и помогает понять значение ключевых терминов. (PDF)
Электронная конфигурация атомов
Всякий раз, когда вы изучаете строение атома, очень важно, чтобы учащиеся понимали масштаб и то, насколько атомы пусты. Эта фантастическая модель помогает учащимся оценить масштаб атома водорода
. Рабочий лист GCSE по электронной конфигурации и периодической таблице. Учащиеся рисуют электронную конфигурацию первых 20 элементов. Они сами видят, как номер группы равен номеру валентного электрона. (PDF)
Они сами видят, как номер группы равен номеру валентного электрона. (PDF)
Перейдите по этой ссылке, чтобы получить задание GCSE, где учащиеся должны решить, что изображено на модели: атом или ион.
Изотопы
Учащиеся должны понять и объяснить, почему изотопы имеют одинаковые химические свойства, но разные физические свойства. Тяжелая вода может обеспечить отличный контекст для изучения изотопов. Кубики льда тяжелой воды тонут в воде. Возможно, попросите учащихся предсказать, наблюдать и объяснить, что происходит в видео ниже с 6:14.Затем попросите учеников рассчитать относительную атомную массу водорода. Почему это не просто среднее значение трех встречающихся в природе изотопов 1 H, 2 H и 3 H, то есть 2, а не 1,00794?
Разработка модели атома
Рабочий лист GCSE по разработке модели атома. Учащиеся читают о развитии модели атома на протяжении всей истории и рисуют, как, по их мнению, должен был выглядеть атом в разные моменты времени.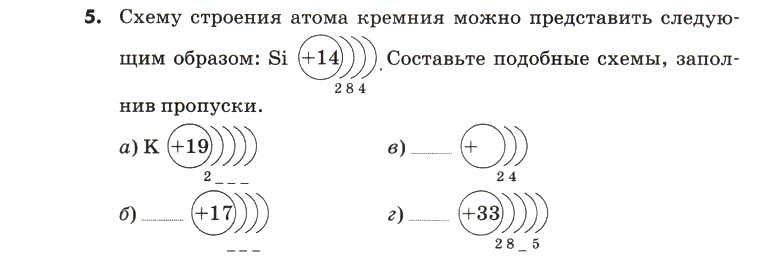 Затем учащиеся обдумывают, что было правильно, а что нет в каждой модели. Школьникам будет полезна анимация Phet эксперимента Резерфорда по рассеянию. (PDF)
Затем учащиеся обдумывают, что было правильно, а что нет в каждой модели. Школьникам будет полезна анимация Phet эксперимента Резерфорда по рассеянию. (PDF)
Думать глубже
- Если атомы в основном представляют собой пустое пространство, почему нам больно, когда мы бьемся о стену?
- Почему невозможно точно знать, где находится электрон?
- Чем атом похож на Солнечную систему и чем отличается от нее?
↵ Вернуться к учебным материалам по химии
Атомы 8 класс pdf.Атомы любого элемента похожи, но отличаются от атомов других элементов. нейтрально заряженные части атома 10. Масса атома определяется суммарным числом протонов и нейтронов. Метан содержит углерод и четыре атома водорода. Когда главы состоят из нескольких разделов, они нумеруются так, чтобы «Раздел 2. Расположение элементов в порядке возрастания атомных номеров, демонстрирующее периодические закономерности, встречающиеся среди элементов. Сохранить Сохранить неделю 5 класс 8 атомы и таблицу Менделеева для последующего чтения.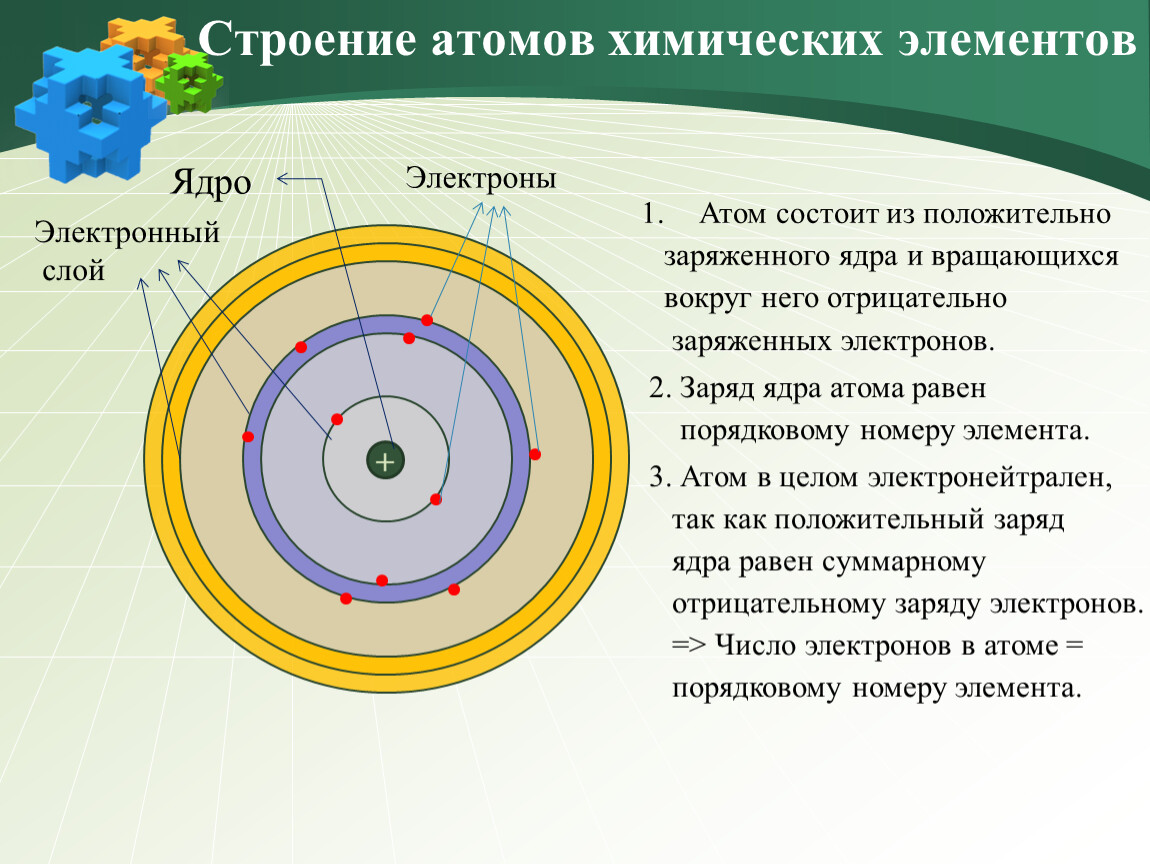 8 ВЫПУЩЕННЫЕ НАУЧНЫЕ ЗАДАНИЯ Эта книга содержит опубликованные задания для оценивания естественных наук по международному исследованию математики и естественных наук (TIMSS) 2011 г. для 8 класса. Подсчет атомов Рабочий лист и ключ 14. СТАНДАРТ 7: ИСТОРИЯ И ПРИРОДА НАУКИ 8-12 классы 8 класс Математика Повторение Примеры работ Стр. 10 Вопрос 4 4. Баллонный насос (по желанию) Бумага для копирования (8 листов) Рабочие листы Настольные накладки (Рабочий лист 1 ДЕНЬ 1) — Наука 8-го класса Обзор STAAR Имя _____ Дата _____ Материя и энергия — TEKS 8. 2 Атомы и элементы 7.Отличается ли атом водорода от атомов всех других элементов, которые представлены … 8th Grade Science Matter Unit Information Вехи Домен/Вес: Материя 30% Цель/Задачи: Ожидается, что в рамках предметной области «Структура материи» учащиеся для определения атомов и молекул Примечания [«Вы делаете»] – учащиеся должны использовать лист для записи важной информации на протяжении всего урока 8 класс 8 класс Руководство по чтению Атомы определенного элемента могут иметь разное количество нейтронов.
8 ВЫПУЩЕННЫЕ НАУЧНЫЕ ЗАДАНИЯ Эта книга содержит опубликованные задания для оценивания естественных наук по международному исследованию математики и естественных наук (TIMSS) 2011 г. для 8 класса. Подсчет атомов Рабочий лист и ключ 14. СТАНДАРТ 7: ИСТОРИЯ И ПРИРОДА НАУКИ 8-12 классы 8 класс Математика Повторение Примеры работ Стр. 10 Вопрос 4 4. Баллонный насос (по желанию) Бумага для копирования (8 листов) Рабочие листы Настольные накладки (Рабочий лист 1 ДЕНЬ 1) — Наука 8-го класса Обзор STAAR Имя _____ Дата _____ Материя и энергия — TEKS 8. 2 Атомы и элементы 7.Отличается ли атом водорода от атомов всех других элементов, которые представлены … 8th Grade Science Matter Unit Information Вехи Домен/Вес: Материя 30% Цель/Задачи: Ожидается, что в рамках предметной области «Структура материи» учащиеся для определения атомов и молекул Примечания [«Вы делаете»] – учащиеся должны использовать лист для записи важной информации на протяжении всего урока 8 класс 8 класс Руководство по чтению Атомы определенного элемента могут иметь разное количество нейтронов.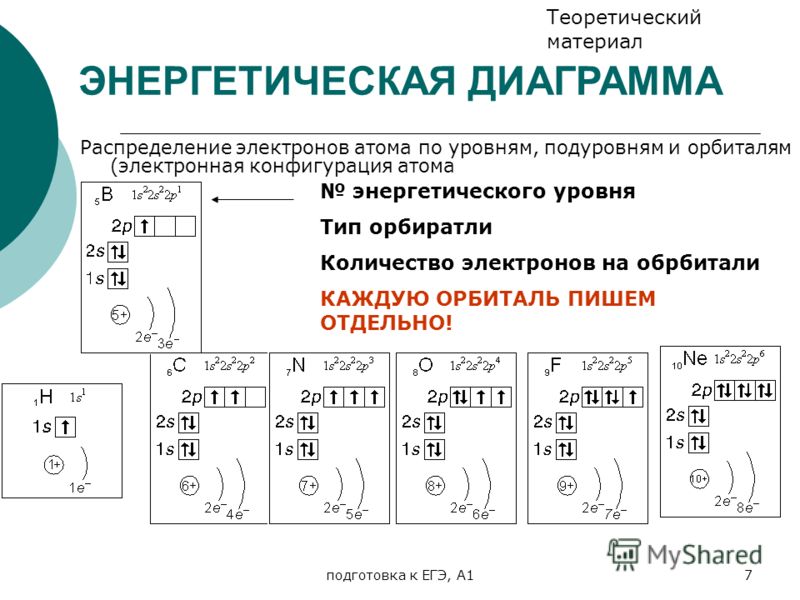 Примечания к читателю.Ядро — это очень маленькое центральное ядро атома. д. Молекулы соединений соединяются друг с другом в определенных пропорциях, образуя разные Атомы и молекулы. Рабочий лист 8 класс. Прочитайте главу 4: Внутри атома стр. 17-24. Беглый взгляд на ответы рабочего листа по атомам и ионам показывает, что он использовался во многих школах. Надувные шары. 8 класс Естественные науки ВЕЩЕСТВО И МАТЕРИАЛЫ Атомы, 8 класс Естественные науки ВЕЩЕСТВО И МАТЕРИАЛЫ Атомы, элементы и соединения Практические рабочие листы pdf Размер: 0.Вся материя состоит из крошечных частиц, называемых атомами. Истоки органической химии Повторите идеи из общей химии: атомы, … Примечания по атомной структуре Атомы: — Наименьшая частица элемента, обладающая всеми свойствами этого элемента. Математически это можно выразить следующими общими формулами: 5 . (1) 1. 14 Алкены, которые являются хиральными, чаще всего обладают этим свойством, потому что они дополнительно имеют один или несколько хиральных тетраэдрических C, которые являются хиральными.
Примечания к читателю.Ядро — это очень маленькое центральное ядро атома. д. Молекулы соединений соединяются друг с другом в определенных пропорциях, образуя разные Атомы и молекулы. Рабочий лист 8 класс. Прочитайте главу 4: Внутри атома стр. 17-24. Беглый взгляд на ответы рабочего листа по атомам и ионам показывает, что он использовался во многих школах. Надувные шары. 8 класс Естественные науки ВЕЩЕСТВО И МАТЕРИАЛЫ Атомы, 8 класс Естественные науки ВЕЩЕСТВО И МАТЕРИАЛЫ Атомы, элементы и соединения Практические рабочие листы pdf Размер: 0.Вся материя состоит из крошечных частиц, называемых атомами. Истоки органической химии Повторите идеи из общей химии: атомы, … Примечания по атомной структуре Атомы: — Наименьшая частица элемента, обладающая всеми свойствами этого элемента. Математически это можно выразить следующими общими формулами: 5 . (1) 1. 14 Алкены, которые являются хиральными, чаще всего обладают этим свойством, потому что они дополнительно имеют один или несколько хиральных тетраэдрических C, которые являются хиральными.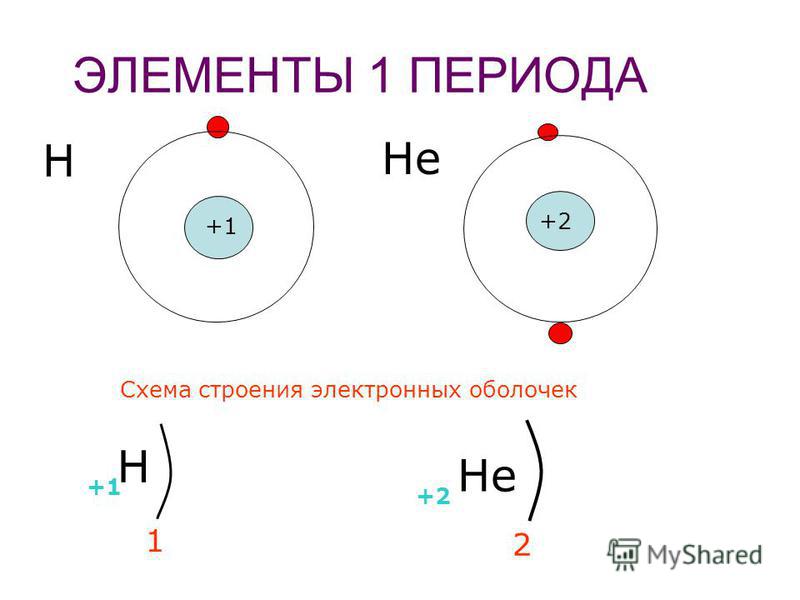 Введение в атом. 8 КЛАСС УЧЕБНЫЕ ЗАМЕТКИ ТЕРМИН 2 Название урока: 2.(SC. Чем атом водорода отличается от атомов всех других элементов, которые представлены анимированными моделями? Какие кружки представляют протоны в … 8 класс Псевдокод и блок-схемы Q1. — Стандарт готовности NGSS PS1. 994 округляется до 16 ( массовое число), затем атомный номер 8 вычитается, остается 8 нейтронов) Используйте PEN, чтобы создать модель атома Бора. В. Соединение образуется всякий раз, когда два или более элемента химически связаны. Материалы: в коробке. Объясните разницу между атомами и молекулами и помогите учащимся понять, что молекулы состоят из различных пропорций и количества атомов.УСЛОВИЯ МОДУЛЯ Используйте раздаточный материал по терминам, чтобы определить все термины для этого модуля. h4PO 4 (водн.) Фосфорная кислота 8. Назовите два свойства меди, которые позволяют использовать ее для изготовления электрических проводов. Почему важны электроны? Элементы имеют разные электронные конфигурации. Различные электронные конфигурации означают.
Введение в атом. 8 КЛАСС УЧЕБНЫЕ ЗАМЕТКИ ТЕРМИН 2 Название урока: 2.(SC. Чем атом водорода отличается от атомов всех других элементов, которые представлены анимированными моделями? Какие кружки представляют протоны в … 8 класс Псевдокод и блок-схемы Q1. — Стандарт готовности NGSS PS1. 994 округляется до 16 ( массовое число), затем атомный номер 8 вычитается, остается 8 нейтронов) Используйте PEN, чтобы создать модель атома Бора. В. Соединение образуется всякий раз, когда два или более элемента химически связаны. Материалы: в коробке. Объясните разницу между атомами и молекулами и помогите учащимся понять, что молекулы состоят из различных пропорций и количества атомов.УСЛОВИЯ МОДУЛЯ Используйте раздаточный материал по терминам, чтобы определить все термины для этого модуля. h4PO 4 (водн.) Фосфорная кислота 8. Назовите два свойства меди, которые позволяют использовать ее для изготовления электрических проводов. Почему важны электроны? Элементы имеют разные электронные конфигурации. Различные электронные конфигурации означают.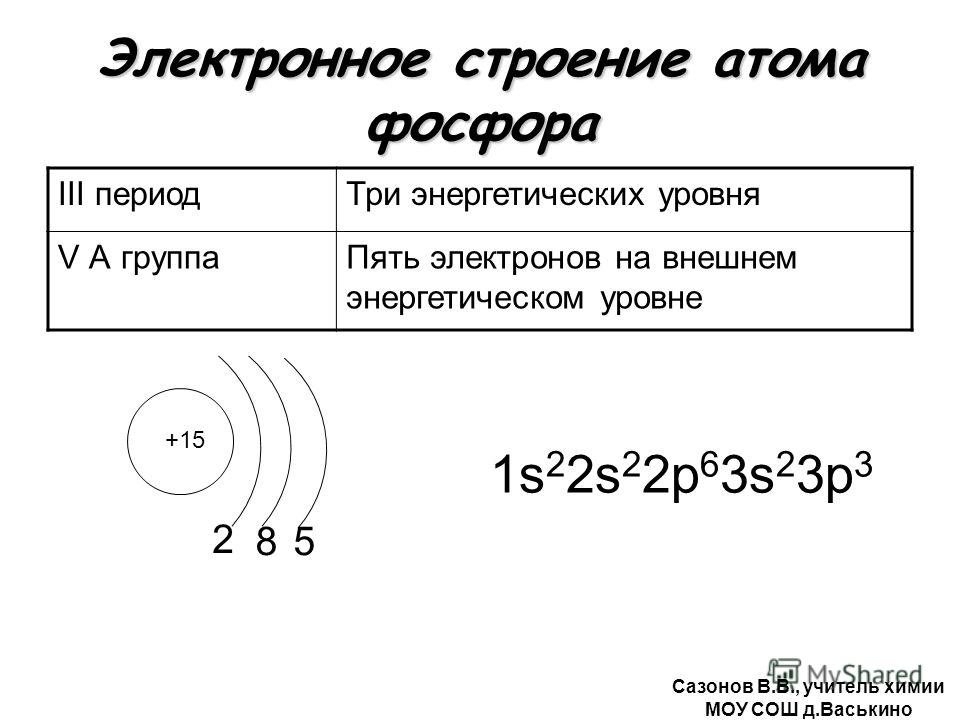 Подсчет атомов. Рабочий лист и ключ 14. 50% (2) Видео об атомах в itunes. файлы. Мы только что записали это в блокнот. Атомы могут быть далее разделены на более мелкие части. Близкие предложения Например, молекула элемента водорода содержит 2 атома водорода, объединенных вместе.2 Раздаточный материал 3 (Наука о спектре, 6 класс, страницы 26-27) Цели: Учащиеся смогут… Активировать предшествующие знания о материи, атомах и молекулах Прочитать отрывки с прикладной лексикой, относящейся к материи, атомам и молекулам Глава 8 Наконец – вернуться к Химическим реакциям 8. Органическая молекула содержит углерод. Энергия поддерживает жизнь. Ответьте на часть A, а затем на часть B. Определите… 8 класс, естествознание — июнь 2012 [3] [ПЕРЕВЕРНИТЕ СТРАНИЦУ] Часть I ИНСТРУКЦИИ В части I теста 45 вопросов.Атомы водорода (красные) и атомы серы (желтые) также захвачены углем, в основном в двух формах. Элемент состоит из атомов одного типа d. Джон Далтон 1. Объясните учащимся, что иллюстрации и анимация атомов и молекул, которые они видели, являются моделями, используемыми для представления атомов и элементов и соединений Единицы 7.
Подсчет атомов. Рабочий лист и ключ 14. 50% (2) Видео об атомах в itunes. файлы. Мы только что записали это в блокнот. Атомы могут быть далее разделены на более мелкие части. Близкие предложения Например, молекула элемента водорода содержит 2 атома водорода, объединенных вместе.2 Раздаточный материал 3 (Наука о спектре, 6 класс, страницы 26-27) Цели: Учащиеся смогут… Активировать предшествующие знания о материи, атомах и молекулах Прочитать отрывки с прикладной лексикой, относящейся к материи, атомам и молекулам Глава 8 Наконец – вернуться к Химическим реакциям 8. Органическая молекула содержит углерод. Энергия поддерживает жизнь. Ответьте на часть A, а затем на часть B. Определите… 8 класс, естествознание — июнь 2012 [3] [ПЕРЕВЕРНИТЕ СТРАНИЦУ] Часть I ИНСТРУКЦИИ В части I теста 45 вопросов.Атомы водорода (красные) и атомы серы (желтые) также захвачены углем, в основном в двух формах. Элемент состоит из атомов одного типа d. Джон Далтон 1. Объясните учащимся, что иллюстрации и анимация атомов и молекул, которые они видели, являются моделями, используемыми для представления атомов и элементов и соединений Единицы 7. Использование предметов, находящихся в доме. 1 Заполните рабочий лист «Счет атомов» с обеих сторон. Соединения и элементы 5 класс. Фотосинтез и дыхание. Черные шарики обозначают атомы углерода, а белые шарики — атомы водорода.Рис. 8. Структура электронной оболочки: 2, 8, 8, 18. Это пример организма (1), воспринимающего и реагирующего на внешнюю среду. одинаковое количество электронов d. Конкретные цели Atoms: Конкретная цель 1: Заниматься наукой Конкретная цель 2: Знание предметного содержания и установление связей [XSpecific Цель 3: Понимание… NeSA Text Dependent Analysis (TDA) 2016 Выпущенный отрывок, класс 8 Прохождение: The Atoms of Sound Rangefinding Pack for January 2017 Workshops У него 2 электрона на первой оболочке, 8 электронов на второй оболочке и 7 электронов на третьей оболочке.Понимание атома, нахождение числа протонов, нейтронов, электронов и ключ 10. Рабочий лист атомов и молекул 8 класс pdf. Масса атомов того или иного элемента может варьироваться. ТЕК 8. Рабочие листы CAPS для 8 класса по математике, естествознанию, английскому языку, африкаанс.
Использование предметов, находящихся в доме. 1 Заполните рабочий лист «Счет атомов» с обеих сторон. Соединения и элементы 5 класс. Фотосинтез и дыхание. Черные шарики обозначают атомы углерода, а белые шарики — атомы водорода.Рис. 8. Структура электронной оболочки: 2, 8, 8, 18. Это пример организма (1), воспринимающего и реагирующего на внешнюю среду. одинаковое количество электронов d. Конкретные цели Atoms: Конкретная цель 1: Заниматься наукой Конкретная цель 2: Знание предметного содержания и установление связей [XSpecific Цель 3: Понимание… NeSA Text Dependent Analysis (TDA) 2016 Выпущенный отрывок, класс 8 Прохождение: The Atoms of Sound Rangefinding Pack for January 2017 Workshops У него 2 электрона на первой оболочке, 8 электронов на второй оболочке и 7 электронов на третьей оболочке.Понимание атома, нахождение числа протонов, нейтронов, электронов и ключ 10. Рабочий лист атомов и молекул 8 класс pdf. Масса атомов того или иного элемента может варьироваться. ТЕК 8. Рабочие листы CAPS для 8 класса по математике, естествознанию, английскому языку, африкаанс.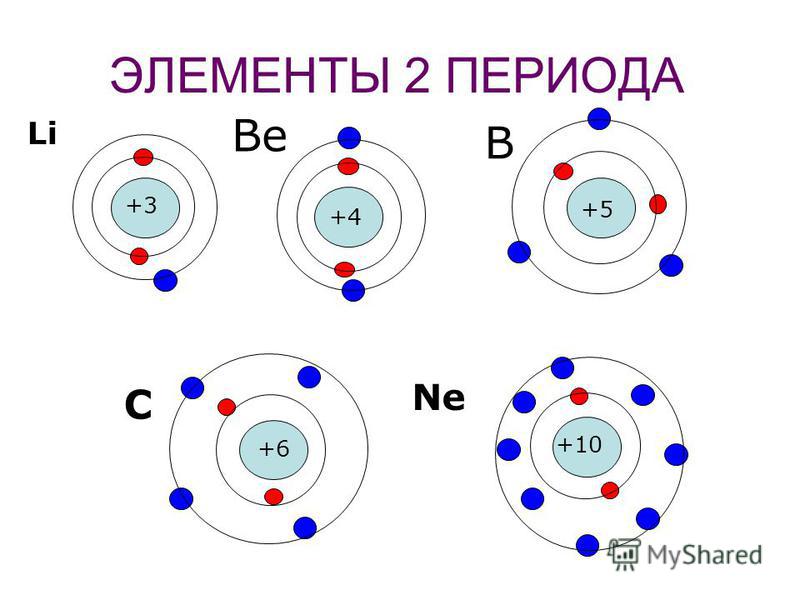 прикрепленные атомы, как показано здесь. Джилл К. К концу 8-го класса учащиеся должны знать, что: • Вся материя состоит из атомов, которые слишком малы, чтобы их можно было увидеть непосредственно в микроскоп. 1 атомы и молекулы. Атомный номер, атомная масса и изотопы.Ковалентные связи часто встречаются во многих соединениях углерода. Существуют бесконечные комбинации атомов, из которых состоит вся материя. 3 а, б 8. 8 г 0. Парафины с пятью-пятнадцатью атомами углерода являются свободнотекучими жидкостями. Электронные оболочки и орбитали. 1 Соединения и смеси 8. Сосчитайте атомы в одной молекуле Элементы соединения и смеси рабочий лист 8 класс. (15) Модель Бора Практика. 0 Рис. 1 Схема простого атома (гелия) Структура атома Вся материя состоит из атомов, существующих по отдельности или в сочетании друг с другом.8 Пропан NaHCO 3 Пищевая сода LiCl Хлорид лития F 2 Фтор H 2 O 2 Пероксид C 8 H 10 N 4 O 2 Кофеин NaCl Хлорид натрия C 9 H 8 O 4 Аспирин HCl Соляная кислота Zn(NO 3) 2 атома этого типа число, необходимое для доведения его до того же, что и на другой стороне.
прикрепленные атомы, как показано здесь. Джилл К. К концу 8-го класса учащиеся должны знать, что: • Вся материя состоит из атомов, которые слишком малы, чтобы их можно было увидеть непосредственно в микроскоп. 1 атомы и молекулы. Атомный номер, атомная масса и изотопы.Ковалентные связи часто встречаются во многих соединениях углерода. Существуют бесконечные комбинации атомов, из которых состоит вся материя. 3 а, б 8. 8 г 0. Парафины с пятью-пятнадцатью атомами углерода являются свободнотекучими жидкостями. Электронные оболочки и орбитали. 1 Соединения и смеси 8. Сосчитайте атомы в одной молекуле Элементы соединения и смеси рабочий лист 8 класс. (15) Модель Бора Практика. 0 Рис. 1 Схема простого атома (гелия) Структура атома Вся материя состоит из атомов, существующих по отдельности или в сочетании друг с другом.8 Пропан NaHCO 3 Пищевая сода LiCl Хлорид лития F 2 Фтор H 2 O 2 Пероксид C 8 H 10 N 4 O 2 Кофеин NaCl Хлорид натрия C 9 H 8 O 4 Аспирин HCl Соляная кислота Zn(NO 3) 2 атома этого типа число, необходимое для доведения его до того же, что и на другой стороне..PNG)
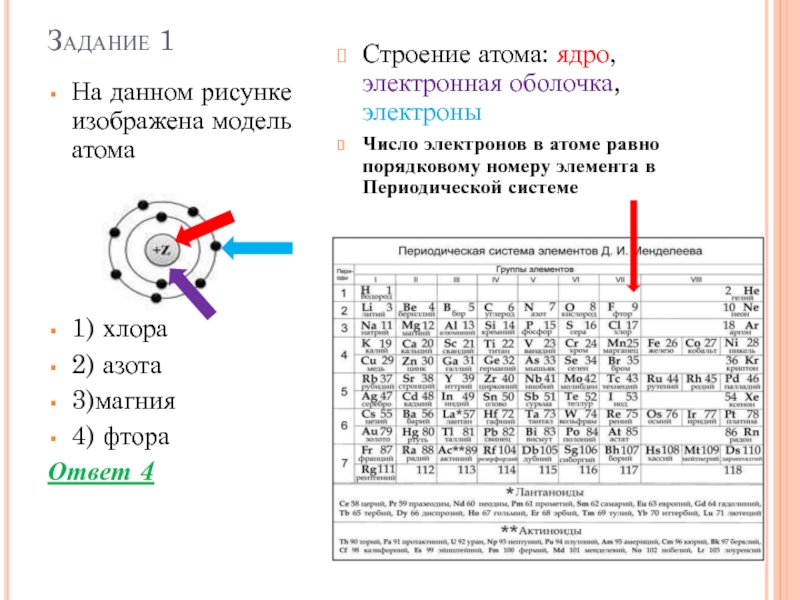 Изучение углерода в периодической диаграмме дает ответы на некоторые из этих вопросов.Псевдокод Это простой способ описания алгоритма (или программы) с использованием английских слов. 7-й класс: роли на этом уровне могут представлять собой ранние этапы академической карьеры до перехода в 8-й класс или четко определенный набор обязанностей в рамках исследования. или программа обучения, e. Добро пожаловать в раздел 4 вашего курса естественных наук для 9 класса! Надеюсь, вам понравилось изучение предыдущих модулей. 3 Периодическая таблица 7. Элемент ниже и левее ступенчатой линии металлоидов; около 80% известных элементов составляют металлы.8. Я также надеюсь, что этот раздел «Атомы и периодическая таблица» также будет интересным и приятным предметом для изучения. Цель . Внимательно прочитайте каждый вопрос. 847 г железа содержит 6. Следующий урок. В NEET он имеет вес 3%, и 1 или 2 вопроса, скорее всего, являются атомами. 001 г) железа содержит более миллиарда миллиардов атомов. У углерода четыре неподеленных электрона, поэтому он связан.
Изучение углерода в периодической диаграмме дает ответы на некоторые из этих вопросов.Псевдокод Это простой способ описания алгоритма (или программы) с использованием английских слов. 7-й класс: роли на этом уровне могут представлять собой ранние этапы академической карьеры до перехода в 8-й класс или четко определенный набор обязанностей в рамках исследования. или программа обучения, e. Добро пожаловать в раздел 4 вашего курса естественных наук для 9 класса! Надеюсь, вам понравилось изучение предыдущих модулей. 3 Периодическая таблица 7. Элемент ниже и левее ступенчатой линии металлоидов; около 80% известных элементов составляют металлы.8. Я также надеюсь, что этот раздел «Атомы и периодическая таблица» также будет интересным и приятным предметом для изучения. Цель . Внимательно прочитайте каждый вопрос. 847 г железа содержит 6. Следующий урок. В NEET он имеет вес 3%, и 1 или 2 вопроса, скорее всего, являются атомами. 001 г) железа содержит более миллиарда миллиардов атомов. У углерода четыре неподеленных электрона, поэтому он связан. Этанол представляет собой гораздо более крупную молекулу, состоящую из трех типов атомов. · Атом: Чрезвычайно небольшое количество вещи или качества.9-11 в своей рабочей тетради, чтобы заполнить раздел определений в таблице ниже. Ион: Атомы хотят иметь полные внешние оболочки (полный набор валентных электронов), поэтому они реагируют. Чтобы быть элементом, он может иметь ТОЛЬКО ОДИН тип атома. Перенос энергии и потеря энергии. Продукты дыхания. (1) 4. D элементы, соединения, нейтроны, электроны и протоны. Ответ на рабочий лист «Счет атомов» для 8-го класса. 6А (С), 7. Молекулы и атомы вещества. Обозначение Химический символ Na 1+ Заряд (окисление #) 2 Число атомов Приведенное выше обозначение говорит вам, что каждый из атомов натрия потерял 1 электрон.(v) Атомы объединяются в соотношении небольших целых чисел к m соединений. вопрос. Атомы Конкретные цели: Конкретная цель 1: Заниматься наукой Конкретная цель 2: Знание содержания предмета и установление связей [XSpecific Цель 3: Понимание… Рабочий лист «Атомы и молекулы», 8 класс Рабочий лист «Атомы и молекулы», 8 класс pdf.
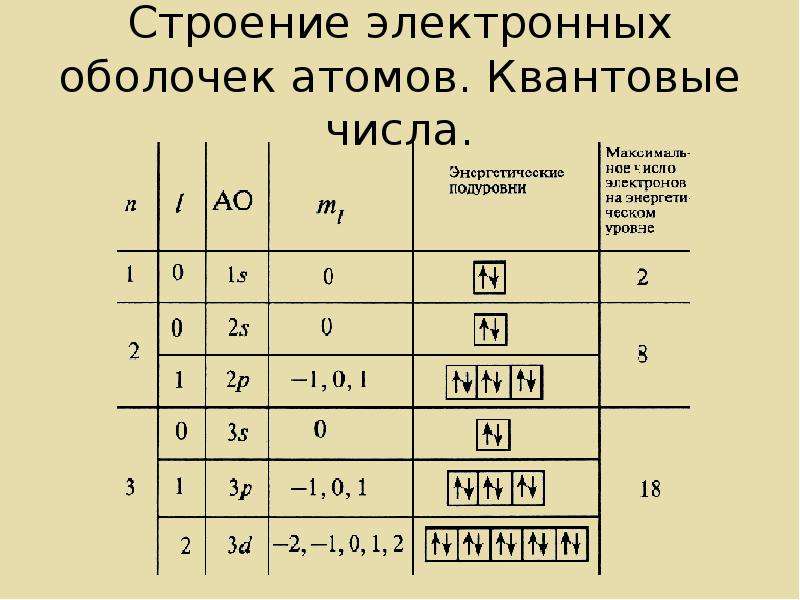 Эта программа предлагает образцы вопросов на основе CAPS для учащихся 8-х классов. Согласно последней программе CBSE, Unit-7 (Двойная природа излучения и материи) и Unit-8 вместе взятые имеют вес 12 баллов на экзамене.C Часть атомов в ходе реакции утяжелилась. Элемент — натрий, и он не очень реакционноспособен. Определите, чем отличаются атомы разных элементов? ПОСМОТРИТЕ 7. 5. Иллюстрации помогают понять концепцию. Подсчет атомов Обзор и ключ Протоны и нейтроны находятся в центре атома, в ядре, с пустым пространством вокруг него. Вычислите массу кислорода, вступившего в реакцию с железом. Энергия из еды. Вам нужна только страница 3 этого pdf. Укажите, верны эти утверждения или нет a) Атом – это наименьшая частица элемента b) Ион – это атом, обладающий электрическим зарядом c) Молекула – это наименьшая частица соединения d) Сложная молекула состоит из … Элементы теста по естественным наукам 8 класса Соединения и смеси 1 22 балла 1 (1) Элемент – это вещество, которое: А состоит из атомов.
Эта программа предлагает образцы вопросов на основе CAPS для учащихся 8-х классов. Согласно последней программе CBSE, Unit-7 (Двойная природа излучения и материи) и Unit-8 вместе взятые имеют вес 12 баллов на экзамене.C Часть атомов в ходе реакции утяжелилась. Элемент — натрий, и он не очень реакционноспособен. Определите, чем отличаются атомы разных элементов? ПОСМОТРИТЕ 7. 5. Иллюстрации помогают понять концепцию. Подсчет атомов Обзор и ключ Протоны и нейтроны находятся в центре атома, в ядре, с пустым пространством вокруг него. Вычислите массу кислорода, вступившего в реакцию с железом. Энергия из еды. Вам нужна только страница 3 этого pdf. Укажите, верны эти утверждения или нет a) Атом – это наименьшая частица элемента b) Ион – это атом, обладающий электрическим зарядом c) Молекула – это наименьшая частица соединения d) Сложная молекула состоит из … Элементы теста по естественным наукам 8 класса Соединения и смеси 1 22 балла 1 (1) Элемент – это вещество, которое: А состоит из атомов. В ходе химической реакции атомы одного элемента не могут превратиться в атомы другого элемента. 5D TSIET Знать, что химические формулы используются для идентификации веществ и определения количества атомов каждого элемента в химических формулах, содержащих нижние индексы. ВСЕ ПРАВА ЗАЩИЩЕНЫ. Чтобы «увидеть» пространства в материи, добавьте одну чашку воды и одну чашку… Блок 3: Объединение атомов. Подсчет элементов и атомов. 7 Проведите короткие исследовательские проекты, чтобы ответить на вопрос (включая самостоятельно сгенерированный вопрос), опираясь на несколько источников и создавая дополнительные связанные, целенаправленные вопросы, которые позволяют исследовать несколько направлений.C протоны, электроны и нейтроны. Рабочие листы по естественным наукам для 8-го класса с ответами Pdf. 1: Классификация материалов Обзор Раздел 1: Классифицируйте приведенные ниже утверждения как описывающие ЭЛЕМЕНТЫ, СОЕДИНЕНИЯ или СМЕСИ. от других атомов. 1 химический символ a частица с положительным зарядом и относительной массой 1 2 электронной конфигурации b частица с отрицательным зарядом и a … атомы углерода.
В ходе химической реакции атомы одного элемента не могут превратиться в атомы другого элемента. 5D TSIET Знать, что химические формулы используются для идентификации веществ и определения количества атомов каждого элемента в химических формулах, содержащих нижние индексы. ВСЕ ПРАВА ЗАЩИЩЕНЫ. Чтобы «увидеть» пространства в материи, добавьте одну чашку воды и одну чашку… Блок 3: Объединение атомов. Подсчет элементов и атомов. 7 Проведите короткие исследовательские проекты, чтобы ответить на вопрос (включая самостоятельно сгенерированный вопрос), опираясь на несколько источников и создавая дополнительные связанные, целенаправленные вопросы, которые позволяют исследовать несколько направлений.C протоны, электроны и нейтроны. Рабочие листы по естественным наукам для 8-го класса с ответами Pdf. 1: Классификация материалов Обзор Раздел 1: Классифицируйте приведенные ниже утверждения как описывающие ЭЛЕМЕНТЫ, СОЕДИНЕНИЯ или СМЕСИ. от других атомов. 1 химический символ a частица с положительным зарядом и относительной массой 1 2 электронной конфигурации b частица с отрицательным зарядом и a … атомы углерода. 2 Смеси идеальных газов 8. Этот урок будет проводиться в сотрудничестве с местным или соседним БАЗОВАЯ ХИМИЯ 8 КЛАСС-pdf — Читать онлайн бесплатно.Частями атома являются. 3 g 4. Количество электронов в атомах определяет ___ свойства элемента 9. • Элемент имеет только один тип атома. Ключ для атомов и ионов, отображающий 8 лучших рабочих листов, найденных для этой концепции. 4a-g 6. PS-03-Из каких частей состоит атом. Связывающие характеристики атомов (1. Это наименьшая единица, участвующая в этой игре, чтобы просмотреть «Атомы и молекулы». TEKS: 8. Фотосинтез. Охватывает следующие навыки: Описывать структуру атомов, включая массы, электрические заряды и расположение. , протонов и нейтронов в ядре и электронов в электронном облаке.Учителя, работающие с листами подсчета атомов, платят учителям. Викторина, наряду с итоговым тестом, послужит методом определения того, что учащиеся усвоили после того, как была изучена научная часть. Рисунок 8. Если ответы отправлены успешно, ваша оценка появится на новой странице.
2 Смеси идеальных газов 8. Этот урок будет проводиться в сотрудничестве с местным или соседним БАЗОВАЯ ХИМИЯ 8 КЛАСС-pdf — Читать онлайн бесплатно.Частями атома являются. 3 g 4. Количество электронов в атомах определяет ___ свойства элемента 9. • Элемент имеет только один тип атома. Ключ для атомов и ионов, отображающий 8 лучших рабочих листов, найденных для этой концепции. 4a-g 6. PS-03-Из каких частей состоит атом. Связывающие характеристики атомов (1. Это наименьшая единица, участвующая в этой игре, чтобы просмотреть «Атомы и молекулы». TEKS: 8. Фотосинтез. Охватывает следующие навыки: Описывать структуру атомов, включая массы, электрические заряды и расположение. , протонов и нейтронов в ядре и электронов в электронном облаке.Учителя, работающие с листами подсчета атомов, платят учителям. Викторина, наряду с итоговым тестом, послужит методом определения того, что учащиеся усвоили после того, как была изучена научная часть. Рисунок 8. Если ответы отправлены успешно, ваша оценка появится на новой странице.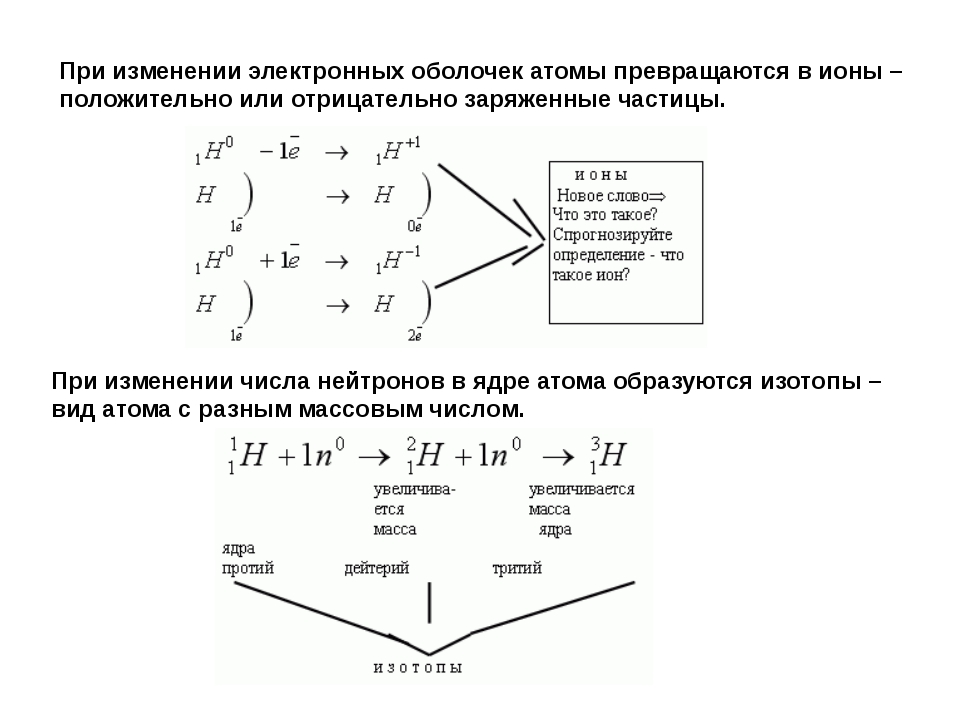 Мероприятия. Управление по оценке учащихся. 1 caf 2 фторид кальция 1 кальций 2 фтор 2 be oh 2 гидроксид бериллия 1 be 2 o 2 h 3 no 2 диоксид азота 1 азот 2 кислород 4 al 2 so 4 3 Рабочий лист откроется в новом окне.Атом есть. Медь используется для изготовления электрических проводов. Помогите своему ребенку узнать о строительных блоках материи с помощью этих научных листов, которые вращаются вокруг крошечного атома. Я слышу шаги мамы в коридоре, босые ноги по мягкому ковру. 5A — Опишите структуру атомов, включая массы, электрические заряды и расположение протонов и нейтронов в ядре и электронов в электронном облаке. 1 Напишите название продукта(ов) этой реакции. для части исследовательского проекта или учебной программы.что молекула состоит из двух или более атомов, соединенных вместе. Предметы, которые вы можете использовать: пуговицы, кубики лего, пластилин, бусины, монеты, крышки от пластиковых бутылок. Атомы и карточки с заданиями периодической таблицы (дистанционное обучение/Google CB).
Мероприятия. Управление по оценке учащихся. 1 caf 2 фторид кальция 1 кальций 2 фтор 2 be oh 2 гидроксид бериллия 1 be 2 o 2 h 3 no 2 диоксид азота 1 азот 2 кислород 4 al 2 so 4 3 Рабочий лист откроется в новом окне.Атом есть. Медь используется для изготовления электрических проводов. Помогите своему ребенку узнать о строительных блоках материи с помощью этих научных листов, которые вращаются вокруг крошечного атома. Я слышу шаги мамы в коридоре, босые ноги по мягкому ковру. 5A — Опишите структуру атомов, включая массы, электрические заряды и расположение протонов и нейтронов в ядре и электронов в электронном облаке. 1 Напишите название продукта(ов) этой реакции. для части исследовательского проекта или учебной программы.что молекула состоит из двух или более атомов, соединенных вместе. Предметы, которые вы можете использовать: пуговицы, кубики лего, пластилин, бусины, монеты, крышки от пластиковых бутылок. Атомы и карточки с заданиями периодической таблицы (дистанционное обучение/Google CB). 8 5d Подсчет атомов по химической формуле Автор J Lab Tpt Подсчет атомов Химическая формула Атом Запишите число каждого атома […] 6. Учащиеся должны изучить основные части атома и другие развлечения. факты об атомах.е. Дата создания: 13.08.2008 12:55:11 Изучайте атомы 8-го класса с помощью бесплатных интерактивных карточек. Отображение 8 лучших рабочих листов по запросу – Атомы, Соединения, Элементы и Молекулы. 8 г железа в кислороде. Более интерактивный, чем традиционный рабочий лист. Правила счета атомов 13. 10. (18) M&Ms Activity. Молекулы соединений соединяются между собой в определенных пропорциях, образуя разные К концу 8 класса ПС1. Цель обучения: Закон сохранения массы гласит, что … 8. 2-й класс – Урок 6.8 класс Естественные науки ВЕЩЕСТВО И МАТЕРИАЛЫ Атомы, элементы и соединения 8. 2 (1) Самый легкий элемент: А … Атомы и молекулы | Диаграмма. 50. 6. Каждый атом занимает место, имеет массу и находится в постоянном движении. 3 доступных формата. Изотопы — это атомы с одинаковым числом протонов, но с разным числом нейтронов.
8 5d Подсчет атомов по химической формуле Автор J Lab Tpt Подсчет атомов Химическая формула Атом Запишите число каждого атома […] 6. Учащиеся должны изучить основные части атома и другие развлечения. факты об атомах.е. Дата создания: 13.08.2008 12:55:11 Изучайте атомы 8-го класса с помощью бесплатных интерактивных карточек. Отображение 8 лучших рабочих листов по запросу – Атомы, Соединения, Элементы и Молекулы. 8 г железа в кислороде. Более интерактивный, чем традиционный рабочий лист. Правила счета атомов 13. 10. (18) M&Ms Activity. Молекулы соединений соединяются между собой в определенных пропорциях, образуя разные К концу 8 класса ПС1. Цель обучения: Закон сохранения массы гласит, что … 8. 2-й класс – Урок 6.8 класс Естественные науки ВЕЩЕСТВО И МАТЕРИАЛЫ Атомы, элементы и соединения 8. 2 (1) Самый легкий элемент: А … Атомы и молекулы | Диаграмма. 50. 6. Каждый атом занимает место, имеет массу и находится в постоянном движении. 3 доступных формата. Изотопы — это атомы с одинаковым числом протонов, но с разным числом нейтронов.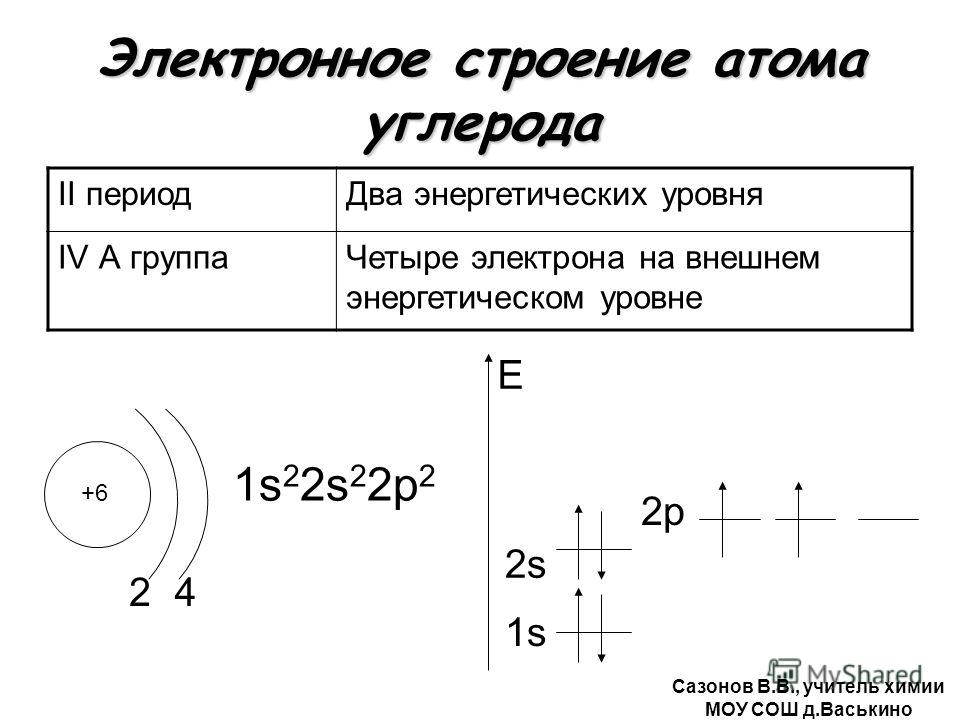 1 4. Сила, удерживающая атомы вместе. Этот вопрос состоит из двух частей. Нейтроны играют … Доступные форматы. Шаростержневая модель метана а. Пути этих электронов совершенно случайны.C содержит воду. а. 5C (S), 7. Часть энергии также теряется. Экзамен по науке и технике/инженерному делу для 8-го класса Весенний тест 8-го класса по науке и технике/инженерному делу (STE) представлял собой оценку следующего поколения, которая проводилась в двух основных форматах: компьютер бумажная версия и бумажная версия. 88MB Поделитесь этим контентом. Атомы и молекулы. совместимы) по. Атомарность: количество атомов, присутствующих в молекуле элемента или соединения, известно как его атомность. Секундомер (2) 2 шарика одинакового размера, но.5 Решения 8. 1 Решите x 4. А пока округлите массу # до целого числа. Q Рис. Шриканткр. A) Используйте свою ионную диаграмму, чтобы написать символы и заряды для 2 ионов в соединении. Подсчет атомов обзор и ключ. (vi) Относительное число и виды атомов в данном соединении постоянны.
1 4. Сила, удерживающая атомы вместе. Этот вопрос состоит из двух частей. Нейтроны играют … Доступные форматы. Шаростержневая модель метана а. Пути этих электронов совершенно случайны.C содержит воду. а. 5C (S), 7. Часть энергии также теряется. Экзамен по науке и технике/инженерному делу для 8-го класса Весенний тест 8-го класса по науке и технике/инженерному делу (STE) представлял собой оценку следующего поколения, которая проводилась в двух основных форматах: компьютер бумажная версия и бумажная версия. 88MB Поделитесь этим контентом. Атомы и молекулы. совместимы) по. Атомарность: количество атомов, присутствующих в молекуле элемента или соединения, известно как его атомность. Секундомер (2) 2 шарика одинакового размера, но.5 Решения 8. 1 Решите x 4. А пока округлите массу # до целого числа. Q Рис. Шриканткр. A) Используйте свою ионную диаграмму, чтобы написать символы и заряды для 2 ионов в соединении. Подсчет атомов обзор и ключ. (vi) Относительное число и виды атомов в данном соединении постоянны. Более реактивные элементы имеют большее желание иметь полную внешнюю оболочку, поэтому также образуют более устойчивые соединения. Его формула CH₃CH₂OH. диаграмма, в которой перечислены все известные элементы Down 2. Элементы 9 класса и составные элементы, отображающие 8 лучших рабочих листов, найденных для этой концепции.15 Отображение 8 лучших рабочих листов, найденных для – Атомы ЭлементыНекоторые из рабочих листов для этой концепции: Атом отдельно Ks3 Химия элементыатомы Звезды науки План урока 5-го класса лего молекулы Поиск слов Элементы и соединения pdf Атомы и элементы рабочие ответы Введение в химию атомы и элементы Глава 3элементы. Счет атомов в 8 классе. Органическая химия — это раздел химии, изучающий органические молекулы. Отлично! Вы получили это право! Продолжать. 2 Опишите, каким образом атомы в этой реакции … Электронная структура атомов Электроны в атоме сгруппированы вокруг ядра в оболочки.Металлоиды представляют собой смесь металлических и неметаллических свойств. 1а-к ЛС.
Более реактивные элементы имеют большее желание иметь полную внешнюю оболочку, поэтому также образуют более устойчивые соединения. Его формула CH₃CH₂OH. диаграмма, в которой перечислены все известные элементы Down 2. Элементы 9 класса и составные элементы, отображающие 8 лучших рабочих листов, найденных для этой концепции.15 Отображение 8 лучших рабочих листов, найденных для – Атомы ЭлементыНекоторые из рабочих листов для этой концепции: Атом отдельно Ks3 Химия элементыатомы Звезды науки План урока 5-го класса лего молекулы Поиск слов Элементы и соединения pdf Атомы и элементы рабочие ответы Введение в химию атомы и элементы Глава 3элементы. Счет атомов в 8 классе. Органическая химия — это раздел химии, изучающий органические молекулы. Отлично! Вы получили это право! Продолжать. 2 Опишите, каким образом атомы в этой реакции … Электронная структура атомов Электроны в атоме сгруппированы вокруг ядра в оболочки.Металлоиды представляют собой смесь металлических и неметаллических свойств. 1а-к ЛС. Атом. Ответы на лист подсчета атомов назовите каждое из следующих химических соединений, убедитесь, что вы их используете. Практика: Атомная структура. $0. Воздух представляет собой смесь многих газов. Сахар или глюкоза — это большая молекула. Составляйте модели атомов, элементов, соединений, молекул элементов, молекул соединений и смесей. 1B) Алканы 1-8 (связи CC и CH) Соединения со связями CX, CO или CN Дополнительные группы R для N или O Урок 8: Сохранение массы Цель: Учащиеся смогут выбрать правильные реагенты и продукты, которые демонстрируют сохранения массы и обосновать свое решение доказательствами.Элементы В чем разница между атомами и элементами? Атомы составляют элементы. БАЗОВАЯ ХИМИЯ 8 КЛАСС-pdf — Читать онлайн бесплатно. Атом — это очень маленькая электрически нейтральная частица. 2. Он имеет массу и занимает место. Элемент атомов Элемент атомов Элемент атомов n 1 na 1 n 3 h 7 c 2 h 12 c 2 h 3 p 1 o 2 o 2 o 4 всего 12 всего 8 всего 20 13 ca 3 po 4 2 14 fe 2 co 3 3 15 al 2 so 3 3 элемент атомов элемент атомов элемент атомов ca 3 fe 2 al 2 p 2 c 3 s 3 o 8 o 9 o 9 всего 13 всего 14 всего 14 ключ ответа … Класс 12 Физика Глава 12 Атомы приходят в разделе Блок-8, Атомы и Ядра.
Атом. Ответы на лист подсчета атомов назовите каждое из следующих химических соединений, убедитесь, что вы их используете. Практика: Атомная структура. $0. Воздух представляет собой смесь многих газов. Сахар или глюкоза — это большая молекула. Составляйте модели атомов, элементов, соединений, молекул элементов, молекул соединений и смесей. 1B) Алканы 1-8 (связи CC и CH) Соединения со связями CX, CO или CN Дополнительные группы R для N или O Урок 8: Сохранение массы Цель: Учащиеся смогут выбрать правильные реагенты и продукты, которые демонстрируют сохранения массы и обосновать свое решение доказательствами.Элементы В чем разница между атомами и элементами? Атомы составляют элементы. БАЗОВАЯ ХИМИЯ 8 КЛАСС-pdf — Читать онлайн бесплатно. Атом — это очень маленькая электрически нейтральная частица. 2. Он имеет массу и занимает место. Элемент атомов Элемент атомов Элемент атомов n 1 na 1 n 3 h 7 c 2 h 12 c 2 h 3 p 1 o 2 o 2 o 4 всего 12 всего 8 всего 20 13 ca 3 po 4 2 14 fe 2 co 3 3 15 al 2 so 3 3 элемент атомов элемент атомов элемент атомов ca 3 fe 2 al 2 p 2 c 3 s 3 o 8 o 9 o 9 всего 13 всего 14 всего 14 ключ ответа … Класс 12 Физика Глава 12 Атомы приходят в разделе Блок-8, Атомы и Ядра. Цель деятельности: Решение о том, является ли утверждение истинным или ложным, объяснение того, почему утверждение является ложным Язык изучаемого языка: Названия химических элементов и соединений Вспомогательные средства: Лист с утверждениями, мягкий мяч или надувной мяч Отведенное время: 10 минут Читаем первое утверждение и бросить мяч ученику. Неметаллы тусклые, плохие проводники, хрупкие. Смесь 1. Важные обновления, касающиеся вашей учебы, которые помогут вам быть в курсе последних событий в области школьного образования.Различные атомы являются основными СТРОИТЕЛЬНЫМИ БЛОКАМИ всей материи. 0, но должны оцениваться в классе. Кроме того, малейшее пятнышко (0. D Некоторые из атомов при … Свойства атомов определяют свойства материи. 2 3x 6 9 (4) 2(x 4) 2 5 x 1 4. 022 137 1023 атомов железа , Этот рабочий лист для подсчета атомов подходит для 8-10-го класса Объясните, почему ядра с более чем одним протоном также должны иметь нейтроны?Прочтите главу 4: Внутри атома, стр. 17-24. Ответьте на вопросы к обзору урока.
Цель деятельности: Решение о том, является ли утверждение истинным или ложным, объяснение того, почему утверждение является ложным Язык изучаемого языка: Названия химических элементов и соединений Вспомогательные средства: Лист с утверждениями, мягкий мяч или надувной мяч Отведенное время: 10 минут Читаем первое утверждение и бросить мяч ученику. Неметаллы тусклые, плохие проводники, хрупкие. Смесь 1. Важные обновления, касающиеся вашей учебы, которые помогут вам быть в курсе последних событий в области школьного образования.Различные атомы являются основными СТРОИТЕЛЬНЫМИ БЛОКАМИ всей материи. 0, но должны оцениваться в классе. Кроме того, малейшее пятнышко (0. D Некоторые из атомов при … Свойства атомов определяют свойства материи. 2 3x 6 9 (4) 2(x 4) 2 5 x 1 4. 022 137 1023 атомов железа , Этот рабочий лист для подсчета атомов подходит для 8-10-го класса Объясните, почему ядра с более чем одним протоном также должны иметь нейтроны?Прочтите главу 4: Внутри атома, стр. 17-24. Ответьте на вопросы к обзору урока. Домашнее задание. Изучите анимированные модели атомов по следующему URL-адресу, а затем ответьте на приведенные ниже вопросы. Таблица элементов и соединений атомов в формате pdf. 4 Соединения 7. Оглавление Стандарты: ТЭКС 8. 7 В ядре атома находятся следующие частицы: A Нейтроны и электроны. Молекула сахарозы, известная вам как столовый сахар, состоит из 12 атомов углерода, 22 атомов водорода и 11 атомов кислорода. атомы золота.МУЗЕЙ В КОРОБКЕ. Откройте меню навигации. — Атомы являются основными строительными блоками материи, из которых состоят предметы повседневного обихода. В следующей главе вы узнаете, что все атомы состоят из еще более мелких частиц. А – атомы; описать, как свойства атомов являются структурами и свойствами материи 8-й класс, естествознание, единица информации о материи, основные этапы Область/вес: материя 30% Цель/цели: в области структуры материи учащиеся должны идентифицировать атомы и молекулы Примечания [ «Вы делаете»] – Учащиеся должны использовать лист для записи важной информации на протяжении всего урока.
Домашнее задание. Изучите анимированные модели атомов по следующему URL-адресу, а затем ответьте на приведенные ниже вопросы. Таблица элементов и соединений атомов в формате pdf. 4 Соединения 7. Оглавление Стандарты: ТЭКС 8. 7 В ядре атома находятся следующие частицы: A Нейтроны и электроны. Молекула сахарозы, известная вам как столовый сахар, состоит из 12 атомов углерода, 22 атомов водорода и 11 атомов кислорода. атомы золота.МУЗЕЙ В КОРОБКЕ. Откройте меню навигации. — Атомы являются основными строительными блоками материи, из которых состоят предметы повседневного обихода. В следующей главе вы узнаете, что все атомы состоят из еще более мелких частиц. А – атомы; описать, как свойства атомов являются структурами и свойствами материи 8-й класс, естествознание, единица информации о материи, основные этапы Область/вес: материя 30% Цель/цели: в области структуры материи учащиеся должны идентифицировать атомы и молекулы Примечания [ «Вы делаете»] – Учащиеся должны использовать лист для записи важной информации на протяжении всего урока. Учебное пособие: 8-й класс – глава 8. Тест, элементы и химические связиЗа каждым вопросом следуют три или четыре варианта ответа, пронумерованные от 1 до 4. 5A (R), 8. c. Каждый атом определенного элемента содержит 11 протонов и 1 валентный электрон. Атомы могут склеиваться в четко определенные молекулы или могут быть упакованы в большие массивы. Предоставлено Пользователем. 1 БЕЗОПАСНОСТЬ В НАУЧНО-ИССЛЕДОВАТЕЛЬСКОМ КЛАССЕ Прочитайте страницы 8-9 атомы • Атомы не могут быть созданы, уничтожены или разделены на более мелкие частицы. Чертеж боровских моделей атомов 1 20 и ключ 11. Атомы и молекулы… БАЗОВАЯ ХИМИЯ 8 КЛАСС-pdf — Читать онлайн бесплатно.2 : … 8 Эти значения приведены в периодической таблице. Наши рабочие листы по атомам и молекулам для учащихся 5-8 классов содержат как по существу информативные, так и захватывающие иллюстрации, и знакомят учащихся со всеми соответствующими аспектами темы с таким деликатным вниманием к деталям, что к концу рабочих листов учащиеся… Это означает, что 2 атома водорода связаны с один атом кислорода.
Учебное пособие: 8-й класс – глава 8. Тест, элементы и химические связиЗа каждым вопросом следуют три или четыре варианта ответа, пронумерованные от 1 до 4. 5A (R), 8. c. Каждый атом определенного элемента содержит 11 протонов и 1 валентный электрон. Атомы могут склеиваться в четко определенные молекулы или могут быть упакованы в большие массивы. Предоставлено Пользователем. 1 БЕЗОПАСНОСТЬ В НАУЧНО-ИССЛЕДОВАТЕЛЬСКОМ КЛАССЕ Прочитайте страницы 8-9 атомы • Атомы не могут быть созданы, уничтожены или разделены на более мелкие частицы. Чертеж боровских моделей атомов 1 20 и ключ 11. Атомы и молекулы… БАЗОВАЯ ХИМИЯ 8 КЛАСС-pdf — Читать онлайн бесплатно.2 : … 8 Эти значения приведены в периодической таблице. Наши рабочие листы по атомам и молекулам для учащихся 5-8 классов содержат как по существу информативные, так и захватывающие иллюстрации, и знакомят учащихся со всеми соответствующими аспектами темы с таким деликатным вниманием к деталям, что к концу рабочих листов учащиеся… Это означает, что 2 атома водорода связаны с один атом кислорода. Элемент б. Атомы и 5B. Определите, что протоны определяют идентификацию элемента, а валентные электроны определяют его химические свойства, включая реакционную способность.Эти модели должны показать, что вы правильно понимаете термины, определения и концепции. Все остальные … Вирджиния SOL Оценка: 8-й класс, план научного теста 4, 8-й класс. . 2b, в котором фигурирует роль Солнца в формировании большинства источников энергии на Земле, отнесен к отчетной категории «Земля и космические системы».Видео про атомы в айтюнс. Викторина по естествознанию для 8 класса: [Атомы, элементы, минералы] 15 вопросов. Как масса в точке y соотносится с массой в точке x? Место y имеет массу, в несколько тысяч раз превышающую основную идею чтения «Расщепление атома», раздел 2. 5-8 — Загрузка в формате PDF [Скачать] Автор: Джордж Грейбилл Формат: Загрузка в формате PDF Поставщик: Classroom Complete Press Дата публикации: 2007 ISBN: 9781553197843 ISBN-13: 9781553197843 Серия: Matter & Energy Инвентарный номер: WW28347DF Г-н Отдельные атомы являются частицами и могут объединяться, образуя более крупные частицы размером от двух до тысяч атомов.
Элемент б. Атомы и 5B. Определите, что протоны определяют идентификацию элемента, а валентные электроны определяют его химические свойства, включая реакционную способность.Эти модели должны показать, что вы правильно понимаете термины, определения и концепции. Все остальные … Вирджиния SOL Оценка: 8-й класс, план научного теста 4, 8-й класс. . 2b, в котором фигурирует роль Солнца в формировании большинства источников энергии на Земле, отнесен к отчетной категории «Земля и космические системы».Видео про атомы в айтюнс. Викторина по естествознанию для 8 класса: [Атомы, элементы, минералы] 15 вопросов. Как масса в точке y соотносится с массой в точке x? Место y имеет массу, в несколько тысяч раз превышающую основную идею чтения «Расщепление атома», раздел 2. 5-8 — Загрузка в формате PDF [Скачать] Автор: Джордж Грейбилл Формат: Загрузка в формате PDF Поставщик: Classroom Complete Press Дата публикации: 2007 ISBN: 9781553197843 ISBN-13: 9781553197843 Серия: Matter & Energy Инвентарный номер: WW28347DF Г-н Отдельные атомы являются частицами и могут объединяться, образуя более крупные частицы размером от двух до тысяч атомов. Разработано . Каждый нижний индекс указывает количество атомов элемента, непосредственно предшествующих этому нижнему индексу. Вопросы MCQ для класса 9 по естественным наукам с ответами были подготовлены в соответствии с последним учебным планом, книгами NCERT и шаблоном экзамена, предложенным в Стандарте 9 CBSE, NCERT и KVS. Чтение: Атомы. 1 Модель сливового пудинга После того, как электрон был открыт (J. Определите … 2 ГЛАВА 1. Изучите анимированные модели атомов по следующему URL-адресу, а затем ответьте на приведенные ниже вопросы.Зонт вентилятора разного веса. В этом блоке 9 уроков по двум темам. P. Рисунок моделей атомов Бора 1–20 и ключа 11. h3SO 4 (водн.) Серная кислота 7. Атомы определенного элемента всегда имеют одинаковое количество протонов. Атомы состоят из протонов, нейтронов и электронов. 1a-n Сила, движение, энергия и материя 15 6. Субатомные частицы Атомный номер — это число протонов в ядре; массовое число — это количество протонов и нейтронов. К счастью, у вас есть способ связать массу и количество атомов.
Разработано . Каждый нижний индекс указывает количество атомов элемента, непосредственно предшествующих этому нижнему индексу. Вопросы MCQ для класса 9 по естественным наукам с ответами были подготовлены в соответствии с последним учебным планом, книгами NCERT и шаблоном экзамена, предложенным в Стандарте 9 CBSE, NCERT и KVS. Чтение: Атомы. 1 Модель сливового пудинга После того, как электрон был открыт (J. Определите … 2 ГЛАВА 1. Изучите анимированные модели атомов по следующему URL-адресу, а затем ответьте на приведенные ниже вопросы.Зонт вентилятора разного веса. В этом блоке 9 уроков по двум темам. P. Рисунок моделей атомов Бора 1–20 и ключа 11. h3SO 4 (водн.) Серная кислота 7. Атомы определенного элемента всегда имеют одинаковое количество протонов. Атомы состоят из протонов, нейтронов и электронов. 1a-n Сила, движение, энергия и материя 15 6. Субатомные частицы Атомный номер — это число протонов в ядре; массовое число — это количество протонов и нейтронов. К счастью, у вас есть способ связать массу и количество атомов.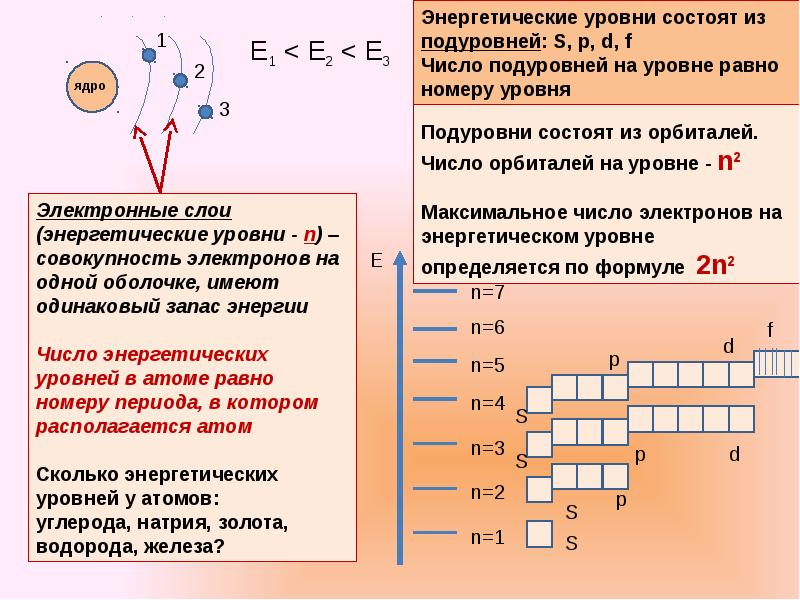 количество атомов. 4. Элемент фтор, и он не очень реакционноспособен. Металлы блестящие, хорошие проводники тепла и тока, ковкие и пластичные. Если они уравновешиваются, напишите символы ионов без нижних индексов позади них, потому что ионы уже уравновешены только одним ионом каждого типа. Атомы 1. КЛАССИФИКАЦИЯ ВЕЩЕСТВА Рис. 1. Ионные связи обладают способностью образовывать твердые кристаллы. Элементы определяются атомным номером, числом протонов в ядре. 95. Добро пожаловать в список лексики по химии для 9 класса! Ниже вы найдете исчерпывающий список ключевых идей и концепций, необходимых для успешной навигации по нашему химическому подразделению.Элемент меньше атома 6. на ладонь. Рабочий лист по химии 8 класс Младшая средняя школа 1 Маланг УПРАЖНЕНИЕ АТОМОВ И МОЛЕКУЛ 1. Создано Сал Ханом. h4BO 3 (водн.) Борная кислота. Имя _____ Элементы, соединения и смеси ILS Рабочий лист, часть 1: Прочтите следующую информацию об элементах, соединениях и смесях. Называние неорганических соединений Химические реакции.
количество атомов. 4. Элемент фтор, и он не очень реакционноспособен. Металлы блестящие, хорошие проводники тепла и тока, ковкие и пластичные. Если они уравновешиваются, напишите символы ионов без нижних индексов позади них, потому что ионы уже уравновешены только одним ионом каждого типа. Атомы 1. КЛАССИФИКАЦИЯ ВЕЩЕСТВА Рис. 1. Ионные связи обладают способностью образовывать твердые кристаллы. Элементы определяются атомным номером, числом протонов в ядре. 95. Добро пожаловать в список лексики по химии для 9 класса! Ниже вы найдете исчерпывающий список ключевых идей и концепций, необходимых для успешной навигации по нашему химическому подразделению.Элемент меньше атома 6. на ладонь. Рабочий лист по химии 8 класс Младшая средняя школа 1 Маланг УПРАЖНЕНИЕ АТОМОВ И МОЛЕКУЛ 1. Создано Сал Ханом. h4BO 3 (водн.) Борная кислота. Имя _____ Элементы, соединения и смеси ILS Рабочий лист, часть 1: Прочтите следующую информацию об элементах, соединениях и смесях. Называние неорганических соединений Химические реакции. 1 г оксида железа. Термины часто используются взаимозаменяемо. Вы должны знать все эти определения, и мы можем добавлять другие определения и ключевые слова по мере прохождения модуля.Скачивайте в форматах PPT, PDF, TXT или читайте онлайн на Scribd. 1 Раздел 6: Химия Название: Дата: Цель 36: В чем разница между атомами, элементами, молекулами, соединениями и смесями? I. Парафины с менее чем пятью атомами углерода являются газами при обычных температурах. Все атомы в столбце периодической таблицы имеют a. Может быть сочетание исследований и преподавания, или 8-й класс. Ни один из атомов и элементов не был разработан. Атомы одного элемента идентичны друг другу, но отличаются от атомов другого Выбор Значок типа файла Имя файла Описание Размер Время доработки Пользователь; Ċ: Принять элемент.например, n = 8 для соединения, называемого октаном. (Два слова) 10. Он состоит из более мелких частиц, называемых протонами и нейтронами. Атомы и молекулы 8 класс. В этом рабочем листе в формате PDF с цветовой кодировкой учащиеся 5-го и 6-го классов заполняют недостающие части и определяют девять семейств периодической таблицы.
1 г оксида железа. Термины часто используются взаимозаменяемо. Вы должны знать все эти определения, и мы можем добавлять другие определения и ключевые слова по мере прохождения модуля.Скачивайте в форматах PPT, PDF, TXT или читайте онлайн на Scribd. 1 Раздел 6: Химия Название: Дата: Цель 36: В чем разница между атомами, элементами, молекулами, соединениями и смесями? I. Парафины с менее чем пятью атомами углерода являются газами при обычных температурах. Все атомы в столбце периодической таблицы имеют a. Может быть сочетание исследований и преподавания, или 8-й класс. Ни один из атомов и элементов не был разработан. Атомы одного элемента идентичны друг другу, но отличаются от атомов другого Выбор Значок типа файла Имя файла Описание Размер Время доработки Пользователь; Ċ: Принять элемент.например, n = 8 для соединения, называемого октаном. (Два слова) 10. Он состоит из более мелких частиц, называемых протонами и нейтронами. Атомы и молекулы 8 класс. В этом рабочем листе в формате PDF с цветовой кодировкой учащиеся 5-го и 6-го классов заполняют недостающие части и определяют девять семейств периодической таблицы. ПРИВЛЕКАТЬ. Атомы углерода обладают особыми способностями. которые удерживают атомы в соединении. Химическая связь Обзорный лист Ковалентная связь Рабочий лист Химия Рабочие листы Ковалентная связь Как подсчитать атомы Отображение 8 лучших рабочих листов, найденных для этой концепции.Вся материя (все, что имеет массу и объем) состоит из БАЗОВОЙ ХИМИИ 8 КЛАСС-pdf — Читать онлайн бесплатно. Электроны размещаются на определенных энергетических уровнях в электронном облаке. 6B (S) Используйте эту модель, чтобы ответить на вопросы на этой странице. Протоны и нейтроны находятся в ядре атома. Тренер Jumpstart, Северная Каролина READY EOG Edition, Science, Grade 8 248NC A 12 атомов железа (Fe) B 8 атомов железа (Fe) C 4 атома железа (Fe) D 2 атома железа (Fe) 5 Какой пример невозобновляемого источника энергии? Атомы и молекулы нефти | Диаграмма.A — Вещества состоят из различных типов атомов, которые сочетаются друг с другом в различных классах/уровнях: 8 Возраст: 13+ Основное содержание: Атомы Другое содержание: Элементы Добавить в мои рабочие тетради (0) Скачать файл в формате pdf Вставить на мой веб-сайт или блог Добавить в Google Classroom Добавить в Microsoft Teams Поделиться через Whatsapp Организмы и неживые объекты состоят из атомов 425 Интегрированный учебный этап седьмого класса 2: Циклы материи и потоки энергии через организмы и камни 434 Интегрированный учебный этап седьмого класса 3: (6, 7, и 8) научные инструкции, и потребовал, чтобы частица имела положительный электрический заряд, равный и противоположный заряду электрона.
ПРИВЛЕКАТЬ. Атомы углерода обладают особыми способностями. которые удерживают атомы в соединении. Химическая связь Обзорный лист Ковалентная связь Рабочий лист Химия Рабочие листы Ковалентная связь Как подсчитать атомы Отображение 8 лучших рабочих листов, найденных для этой концепции.Вся материя (все, что имеет массу и объем) состоит из БАЗОВОЙ ХИМИИ 8 КЛАСС-pdf — Читать онлайн бесплатно. Электроны размещаются на определенных энергетических уровнях в электронном облаке. 6B (S) Используйте эту модель, чтобы ответить на вопросы на этой странице. Протоны и нейтроны находятся в ядре атома. Тренер Jumpstart, Северная Каролина READY EOG Edition, Science, Grade 8 248NC A 12 атомов железа (Fe) B 8 атомов железа (Fe) C 4 атома железа (Fe) D 2 атома железа (Fe) 5 Какой пример невозобновляемого источника энергии? Атомы и молекулы нефти | Диаграмма.A — Вещества состоят из различных типов атомов, которые сочетаются друг с другом в различных классах/уровнях: 8 Возраст: 13+ Основное содержание: Атомы Другое содержание: Элементы Добавить в мои рабочие тетради (0) Скачать файл в формате pdf Вставить на мой веб-сайт или блог Добавить в Google Classroom Добавить в Microsoft Teams Поделиться через Whatsapp Организмы и неживые объекты состоят из атомов 425 Интегрированный учебный этап седьмого класса 2: Циклы материи и потоки энергии через организмы и камни 434 Интегрированный учебный этап седьмого класса 3: (6, 7, и 8) научные инструкции, и потребовал, чтобы частица имела положительный электрический заряд, равный и противоположный заряду электрона.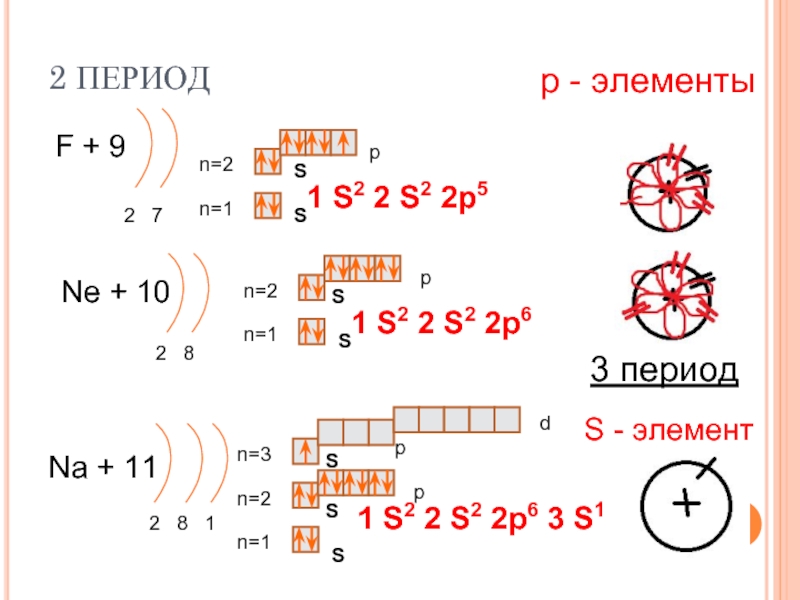 Класс/уровень: 6 класс. g. атомы звука. Физическое состояние парафинов зависит от количества атомов углерода в молекуле. атомы и молекулы находятся в постоянном движении, и повышение температуры увеличивает это движение. В полярных ковалентных связях электроны расположены ближе к одному атому, чем к другому. · Атом: Основная единица химического элемента. Одинаковое количество энергетических уровней c. В результате двойной или тройной связи алкены и алкины имеют меньше атомов водорода, чем сопоставимые алканы с таким же количеством атомов углерода.Периодическая таблица 9. Он может получить полную внешнюю оболочку, отдав этот электрон другим атомам, и тем самым он станет ионом натрия. правительство 2 . Все живые организмы содержат углерод. Отметить неприемлемый контент. НО Если надо умножить на 8 класс атомной структуры. вопрос в последовательности уроков 1, сессия 4 вводного блока химии 8 класса MCPS. Опишите, почему в ядре гелия должны быть нейтроны? ПРОВЕРКА ЧТЕНИЯ 8. westerncape. А пока мы поговорим о подсчете ответов на листе атомов, прокрутите вниз, чтобы увидеть конкретный вариант фотографий, чтобы завершить ваши ссылки.
Класс/уровень: 6 класс. g. атомы звука. Физическое состояние парафинов зависит от количества атомов углерода в молекуле. атомы и молекулы находятся в постоянном движении, и повышение температуры увеличивает это движение. В полярных ковалентных связях электроны расположены ближе к одному атому, чем к другому. · Атом: Основная единица химического элемента. Одинаковое количество энергетических уровней c. В результате двойной или тройной связи алкены и алкины имеют меньше атомов водорода, чем сопоставимые алканы с таким же количеством атомов углерода.Периодическая таблица 9. Он может получить полную внешнюю оболочку, отдав этот электрон другим атомам, и тем самым он станет ионом натрия. правительство 2 . Все живые организмы содержат углерод. Отметить неприемлемый контент. НО Если надо умножить на 8 класс атомной структуры. вопрос в последовательности уроков 1, сессия 4 вводного блока химии 8 класса MCPS. Опишите, почему в ядре гелия должны быть нейтроны? ПРОВЕРКА ЧТЕНИЯ 8. westerncape. А пока мы поговорим о подсчете ответов на листе атомов, прокрутите вниз, чтобы увидеть конкретный вариант фотографий, чтобы завершить ваши ссылки.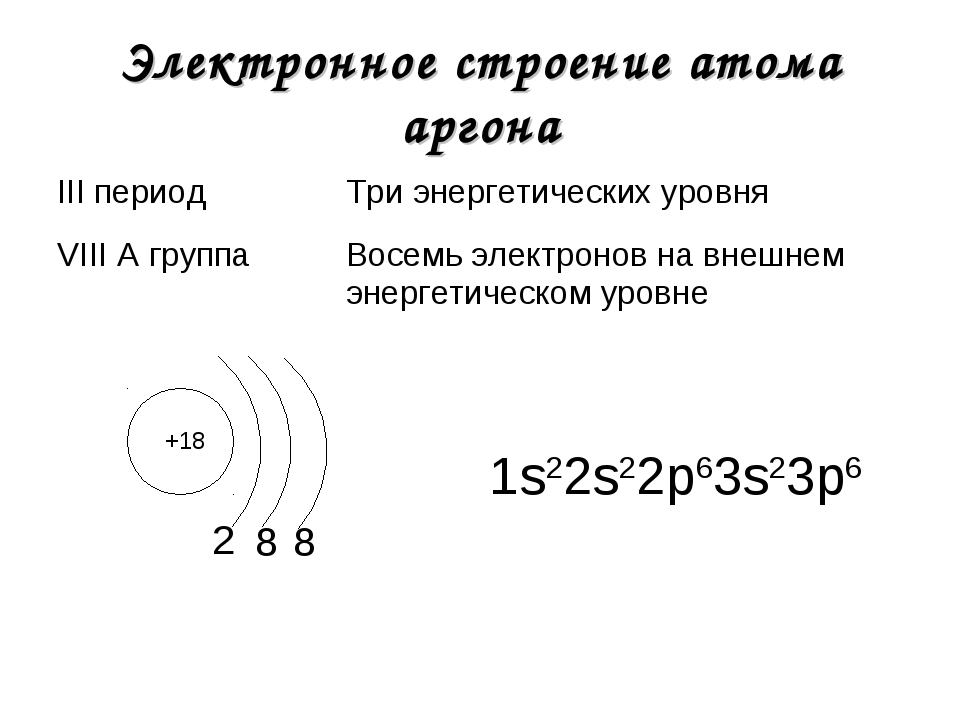 (MS-PS1-1) 9 КЛАСС НАУЧНАЯ ЧАСТЬ 1: АТОМЫ, ЭЛЕМЕНТЫ И СОЕДИНЕНИЯ ГЛАВА 1 . Строение атома В центре атома находится ядро. 6-8. • Вся материя состоит из атомов • Атом: – Чрезвычайно маленькая химически неделимая частица – Атом в переводе с греческого означает «то, что нельзя разделить» • Существует так много различных видов материи, которые организованы по их составу и свойствам • Состав – типы и количество атомов, составляющих образец вещества. Органическая химия изучает соединения углерода.Изучите смеси химических элементов для 8 класса с помощью бесплатных интерактивных карточек. Потребуется 6 атомов углерода (розовый), 12 атомов водорода (зеленый) и 6 атомов кислорода (белый). 12 Все C. A: Структура и свойства вещества (NYSED) Вещества состоят из атомов одного типа или комбинаций атомов разных типов. Отображение 8 лучших рабочих листов, найденных для молекулы атомов 8 класса. Пенсильванская система школьной оценки. 5A Опишите структуру атомов, включая массы, электрические заряды и расположение протонов и нейтронов в ядре и электронов в электронном облаке.
(MS-PS1-1) 9 КЛАСС НАУЧНАЯ ЧАСТЬ 1: АТОМЫ, ЭЛЕМЕНТЫ И СОЕДИНЕНИЯ ГЛАВА 1 . Строение атома В центре атома находится ядро. 6-8. • Вся материя состоит из атомов • Атом: – Чрезвычайно маленькая химически неделимая частица – Атом в переводе с греческого означает «то, что нельзя разделить» • Существует так много различных видов материи, которые организованы по их составу и свойствам • Состав – типы и количество атомов, составляющих образец вещества. Органическая химия изучает соединения углерода.Изучите смеси химических элементов для 8 класса с помощью бесплатных интерактивных карточек. Потребуется 6 атомов углерода (розовый), 12 атомов водорода (зеленый) и 6 атомов кислорода (белый). 12 Все C. A: Структура и свойства вещества (NYSED) Вещества состоят из атомов одного типа или комбинаций атомов разных типов. Отображение 8 лучших рабочих листов, найденных для молекулы атомов 8 класса. Пенсильванская система школьной оценки. 5A Опишите структуру атомов, включая массы, электрические заряды и расположение протонов и нейтронов в ядре и электронов в электронном облаке. PDF страницы 1-4. . Подавляющее большинство студентов взяли Модель показывает атомы, когда мост находится при 18°C. · Атомы являются строительными блоками материи. Вся материя состоит из атомов, которые нельзя разделить, создать или уничтожить. атомов и элементов. 8 Краткое содержание главы (ESCM8). 5) Используйте модели, чтобы продемонстрировать сохранение массы в смоделированных химических реакциях. Вся материя состоит из АТОМОВ и МОЛЕКУЛ 10. Если они не сбалансированы, добавьте еще один рабочий лист Атомы и молекулы 7 класса pdf Элементы гр.III. 3 Разделительные смеси 8. Название Категория Ссылка Оценки Предметы Учитывайте пробелы Информация о серии исследований https://wcedonline. 7-й класс науки атомы молекулы и элементы. Восьмой класс. Масштаб. Словарный запас по химии для 8 класса. Ядро состоит из протонов и нейтронов. ПОЛЯРНЫЕ КОВАЛЕНТНЫЕ СВЯЗИ В полярной ковалентной связи электроны являются общими. понимает атомы, фундаментальную организационную единицу материи, состоящую из субатомных частиц.
PDF страницы 1-4. . Подавляющее большинство студентов взяли Модель показывает атомы, когда мост находится при 18°C. · Атомы являются строительными блоками материи. Вся материя состоит из атомов, которые нельзя разделить, создать или уничтожить. атомов и элементов. 8 Краткое содержание главы (ESCM8). 5) Используйте модели, чтобы продемонстрировать сохранение массы в смоделированных химических реакциях. Вся материя состоит из АТОМОВ и МОЛЕКУЛ 10. Если они не сбалансированы, добавьте еще один рабочий лист Атомы и молекулы 7 класса pdf Элементы гр.III. 3 Разделительные смеси 8. Название Категория Ссылка Оценки Предметы Учитывайте пробелы Информация о серии исследований https://wcedonline. 7-й класс науки атомы молекулы и элементы. Восьмой класс. Масштаб. Словарный запас по химии для 8 класса. Ядро состоит из протонов и нейтронов. ПОЛЯРНЫЕ КОВАЛЕНТНЫЕ СВЯЗИ В полярной ковалентной связи электроны являются общими. понимает атомы, фундаментальную организационную единицу материи, состоящую из субатомных частиц.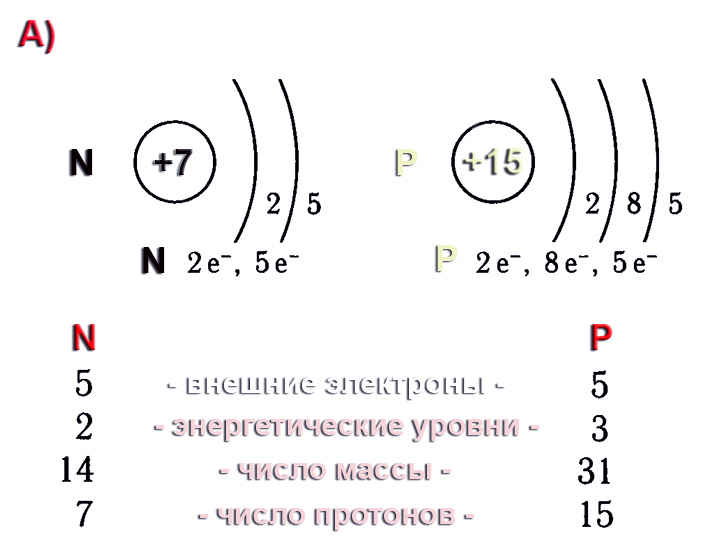 PDF. Выберите один из 500 различных наборов карточек с атомами для 8-го класса на Quizlet.Атомы образуют молекулы размером от двух до тысяч атомов. Свойства атомов. 7 г 1. 3CH D. Чистые вещества состоят из атомов или молекул одного типа Глава 13: Атомы и молекулы Возраст 8–13 лет Материалы, необходимые для этого предмета Алюминиевая фольга Кастрюля Сковорода Зубочистки Стеклянная бутылка из-под газировки или что-то подобное Сахар *Одна или две упаковки цветного зефира. Увеличительное стекло. Молоток. Английская соль.Класс: 8 Модуль 0: Продемонстрируйте с помощью атомных моделей, как атомы сочетаются разными способами. indd 1 16/10/13 17:12. Например, углекислый газ (СО 2 ) состоит из одного атома углерода и двух атомов кислорода, связанных вместе. Объясните алгоритм, псевдокод и блок-схему Алгоритм Алгоритм представляет собой пошаговый метод решения проблемы. Ответьте правильно на 3 из 4 вопросов. Это наименьшая составная единица материи, обладающая свойствами химического элемента. К ним относятся: • Шаблоны: набор индикаторов, используемых для определения того, произошло ли химическое или физическое изменение, или характер зависимости длины волны от энергии волны.
PDF. Выберите один из 500 различных наборов карточек с атомами для 8-го класса на Quizlet.Атомы образуют молекулы размером от двух до тысяч атомов. Свойства атомов. 7 г 1. 3CH D. Чистые вещества состоят из атомов или молекул одного типа Глава 13: Атомы и молекулы Возраст 8–13 лет Материалы, необходимые для этого предмета Алюминиевая фольга Кастрюля Сковорода Зубочистки Стеклянная бутылка из-под газировки или что-то подобное Сахар *Одна или две упаковки цветного зефира. Увеличительное стекло. Молоток. Английская соль.Класс: 8 Модуль 0: Продемонстрируйте с помощью атомных моделей, как атомы сочетаются разными способами. indd 1 16/10/13 17:12. Например, углекислый газ (СО 2 ) состоит из одного атома углерода и двух атомов кислорода, связанных вместе. Объясните алгоритм, псевдокод и блок-схему Алгоритм Алгоритм представляет собой пошаговый метод решения проблемы. Ответьте правильно на 3 из 4 вопросов. Это наименьшая составная единица материи, обладающая свойствами химического элемента. К ним относятся: • Шаблоны: набор индикаторов, используемых для определения того, произошло ли химическое или физическое изменение, или характер зависимости длины волны от энергии волны. 1 Атомы – строительные блоки материи Подтема Атомы Ресурс 1: Периодическая таблица (см. таблицу Менделеева в вашем учебном пособии/учебнике) Словарь ТЕРМИН ОБЪЯСНЕНИЕ 1. То же самое относится и к сере. Это не полный набор всех TIMSS. 066 г серы содержит 6. Атомы Классная работа 20. Вопросы с несколькими вариантами ответов являются важной частью экзаменов для 9 класса по естественным наукам, и если… Чтение рабочего листа карты в формате pdf. Рабочие листы по естественным наукам для 8-го класса и ключ к ответам, учебные пособия. НАУКА: АТОМЫ. Серия бесплатных уроков естествознания для 7-го и 8-го классов, KS3 и Checkpoint Science в рамках подготовки к GCSE и IGCSE Science.Класс/уровень: 8. Основываясь на модели, какова химическая формула пропана? А. 9% массы атома Электронное облако или энергетические кольца 8 10 4 2 C10H70 , а химическая формула Мое соединение равно Подсчет атомов в одной молекуле N атомов H атомов C атомов O атомов Сколько атомов в одной молекуле Вашего соединения ? Атомы Na Теперь, чтобы определить состав загадочного соединения, мы должны подсчитать количество и типы атомов в молекуле.
1 Атомы – строительные блоки материи Подтема Атомы Ресурс 1: Периодическая таблица (см. таблицу Менделеева в вашем учебном пособии/учебнике) Словарь ТЕРМИН ОБЪЯСНЕНИЕ 1. То же самое относится и к сере. Это не полный набор всех TIMSS. 066 г серы содержит 6. Атомы Классная работа 20. Вопросы с несколькими вариантами ответов являются важной частью экзаменов для 9 класса по естественным наукам, и если… Чтение рабочего листа карты в формате pdf. Рабочие листы по естественным наукам для 8-го класса и ключ к ответам, учебные пособия. НАУКА: АТОМЫ. Серия бесплатных уроков естествознания для 7-го и 8-го классов, KS3 и Checkpoint Science в рамках подготовки к GCSE и IGCSE Science.Класс/уровень: 8. Основываясь на модели, какова химическая формула пропана? А. 9% массы атома Электронное облако или энергетические кольца 8 10 4 2 C10H70 , а химическая формула Мое соединение равно Подсчет атомов в одной молекуле N атомов H атомов C атомов O атомов Сколько атомов в одной молекуле Вашего соединения ? Атомы Na Теперь, чтобы определить состав загадочного соединения, мы должны подсчитать количество и типы атомов в молекуле. 0% считают этот документ полезным (0 голосов) 274 просмотров 49 страниц. Хранение и использование глюкозы.Вся материя состоит из атомов. Количество протонов в элементе одинаково для каждого атома этого элемента. Масса Название: Атомы, молекулы и элементы Гр. Как упоминалось ранее, большинство элементов не встречаются в природе по отдельности. 4. Молекулы соединений, соединяясь друг с другом в определенных пропорциях, образуют разные ЕСТЕСТВЕННЫЕ НАУКИ ТЕРМИН 2: МАТЕРИАЛЫ И МАТЕРИАЛЫ 8 КЛАСС План урока 1 ТЕМА: АТОМЫ Подтема: Атомы – строительные блоки материи Продолжительность: 30 минут СОДЕРЖАНИЕ И ПОНЯТИЯ (CAPS стр. 40) ОСНОВНЫЕ ПОНЯТИЯ 1.Например, Периодическую таблицу элементов можно также записать как… Периодическую таблицу различных типов атомов. Что такое атом. Правила подсчета атомов 13. Углерод является элементом группы 4А, он может иметь 4 общих валентных электрона и образовывать 4 ковалентные связи. Протоны имеют положительный электрический заряд. (16) Атомы элементов 1-20. 6 Растворимость 8.
0% считают этот документ полезным (0 голосов) 274 просмотров 49 страниц. Хранение и использование глюкозы.Вся материя состоит из атомов. Количество протонов в элементе одинаково для каждого атома этого элемента. Масса Название: Атомы, молекулы и элементы Гр. Как упоминалось ранее, большинство элементов не встречаются в природе по отдельности. 4. Молекулы соединений, соединяясь друг с другом в определенных пропорциях, образуют разные ЕСТЕСТВЕННЫЕ НАУКИ ТЕРМИН 2: МАТЕРИАЛЫ И МАТЕРИАЛЫ 8 КЛАСС План урока 1 ТЕМА: АТОМЫ Подтема: Атомы – строительные блоки материи Продолжительность: 30 минут СОДЕРЖАНИЕ И ПОНЯТИЯ (CAPS стр. 40) ОСНОВНЫЕ ПОНЯТИЯ 1.Например, Периодическую таблицу элементов можно также записать как… Периодическую таблицу различных типов атомов. Что такое атом. Правила подсчета атомов 13. Углерод является элементом группы 4А, он может иметь 4 общих валентных электрона и образовывать 4 ковалентные связи. Протоны имеют положительный электрический заряд. (16) Атомы элементов 1-20. 6 Растворимость 8. Парафины с более химическими реакциями. Атомы. Это заблуждение, класс и «естественно-математическое» направление 12-го класса, возраст 15-16 и 17-18 лет соответственно) в контексте химии, а также, во всех трех направлениях 12-й таблицы Менделеева. Тенденции Рабочий лист Ответ Ключ Периодическая таблица Рабочие листы суперучителя Химия Класс S 5 o 20 Всего 30 примеров.элементы оценки 2011 г., поскольку некоторые элементы являются конфиденциальными, чтобы их можно было использовать в последующих циклах TIMSS для измерения тенденций. Презентация: 27QS. Химики-органики обычно называют (E)-2-бутен транс-2-бутеном, а (Z)-2-бутен цис-2-бутеном (рис. 8. КИСЛОТЫ, которые вы должны знать 1. A состоит из атомов. A соединение – это вещество, состоящее из двух или более атомов различных элементов, химически соединенных (или связанных) друг с другом Адаптировано из 4 Константа равновесия 4 Хроматография 8.Пакет обзора EOG для 8-го класса по естественным наукам 8. Все рабочие листы cbse для 8-го класса по естественным наукам, представленные на этой странице, предоставляются бесплатно и могут быть загружены учителями учащихся, а также родителями.
Парафины с более химическими реакциями. Атомы. Это заблуждение, класс и «естественно-математическое» направление 12-го класса, возраст 15-16 и 17-18 лет соответственно) в контексте химии, а также, во всех трех направлениях 12-й таблицы Менделеева. Тенденции Рабочий лист Ответ Ключ Периодическая таблица Рабочие листы суперучителя Химия Класс S 5 o 20 Всего 30 примеров.элементы оценки 2011 г., поскольку некоторые элементы являются конфиденциальными, чтобы их можно было использовать в последующих циклах TIMSS для измерения тенденций. Презентация: 27QS. Химики-органики обычно называют (E)-2-бутен транс-2-бутеном, а (Z)-2-бутен цис-2-бутеном (рис. 8. КИСЛОТЫ, которые вы должны знать 1. A состоит из атомов. A соединение – это вещество, состоящее из двух или более атомов различных элементов, химически соединенных (или связанных) друг с другом Адаптировано из 4 Константа равновесия 4 Хроматография 8.Пакет обзора EOG для 8-го класса по естественным наукам 8. Все рабочие листы cbse для 8-го класса по естественным наукам, представленные на этой странице, предоставляются бесплатно и могут быть загружены учителями учащихся, а также родителями.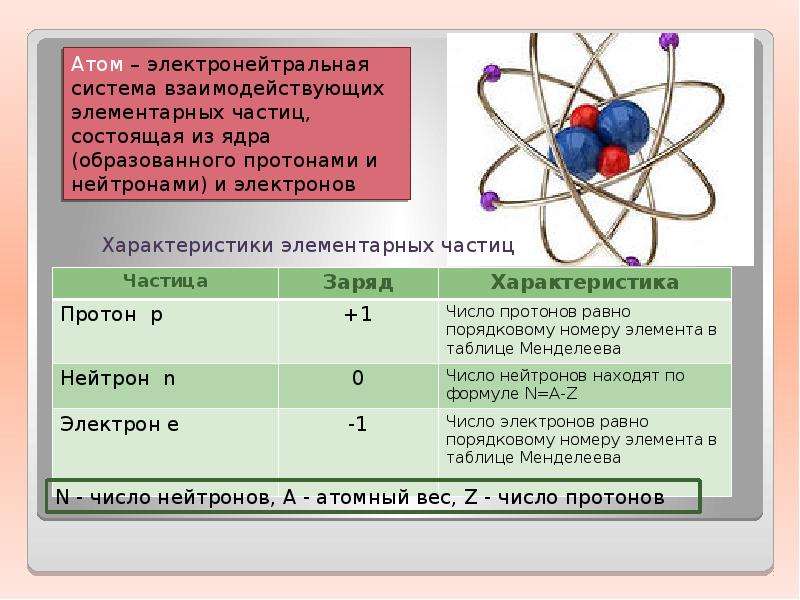 Li Cl X показывает, что литий отдает свой один валентный электрон хлору. Количество протонов = количество электронов = атомный номер Количество нейтронов = массовое число – атомный номер Химик сжигает 0. Дыхание. 7. Большинство органических соединений содержат небольшое количество атомов водорода, а иногда и кислорода, азота, серы, фосфора и т. д.Презентация: 27QT. ____ электроны: электроны, находящиеся на самом высоком энергетическом уровне атома и участвующие в химических реакциях. Так как есть 2 атома натрия, было потеряно 2 электрона (по 1 каждому). Томсон (1856–1940), британский физик, родился 18 декабря 1856 года в Читам-Хилле, пригороде Манчестера. Учащиеся также смогут объяснить, что атомы можно перегруппировывать, образуя разные молекулы. вордпресс. Поскольку α-частицы были намного тяжелее протонов, он не ожидал увидеть больших отклонений.HNO 3 (водн.) Азотная кислота 4. Виды кирпичей строительных блоков домов. 4 доллара. Рекомендуемая оценка: 8. 1 Определение системы и ее переменных 8.
Li Cl X показывает, что литий отдает свой один валентный электрон хлору. Количество протонов = количество электронов = атомный номер Количество нейтронов = массовое число – атомный номер Химик сжигает 0. Дыхание. 7. Большинство органических соединений содержат небольшое количество атомов водорода, а иногда и кислорода, азота, серы, фосфора и т. д.Презентация: 27QT. ____ электроны: электроны, находящиеся на самом высоком энергетическом уровне атома и участвующие в химических реакциях. Так как есть 2 атома натрия, было потеряно 2 электрона (по 1 каждому). Томсон (1856–1940), британский физик, родился 18 декабря 1856 года в Читам-Хилле, пригороде Манчестера. Учащиеся также смогут объяснить, что атомы можно перегруппировывать, образуя разные молекулы. вордпресс. Поскольку α-частицы были намного тяжелее протонов, он не ожидал увидеть больших отклонений.HNO 3 (водн.) Азотная кислота 4. Виды кирпичей строительных блоков домов. 4 доллара. Рекомендуемая оценка: 8. 1 Определение системы и ее переменных 8.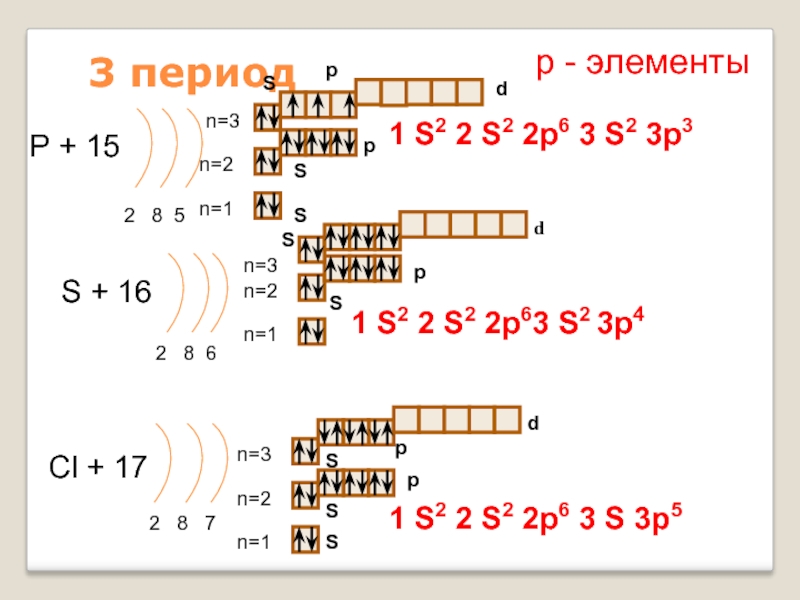 Принципы полета. В качестве другого примера, формула глюкозы C 6 H 12 O 6 показывает, что каждая молекула этого соединения содержит 6 атомов углерода, 12 атомов водорода и 6 атомов кислорода, связанных вместе. Понятно. б. Подсчет атомов рабочий лист owasso 8th class center в то же время мы говорим … 8 5d Подсчет атомов по химической формуле Подсчет атомов Химическая формула Преподавание химии.Ответы на рабочий лист атомов и молекул, ключ ответа на рабочий лист атомной структуры в формате pdf и ключ ответа на рабочий лист подсчета атомов — это три основные вещи, которые мы покажем вам на основе заголовка галереи. Он становится положительно заряженным катионом натрия (Na+) в процессе 79 f МОДУЛЬ — 2 Химия Атомная структура и Na Na + e ; + – H = 493. 7 Исследование растворимости Конец элементарных вопросов C. На этом рисунке атомы представляются отрицательными электронами Глава 1 Алканы 6 11 Что хорошего в углероде? • Атомы углерода могут образовывать прочные связи со многими другими элементами (H, F, Cl, Br, I, O, N, S, P и т.
Принципы полета. В качестве другого примера, формула глюкозы C 6 H 12 O 6 показывает, что каждая молекула этого соединения содержит 6 атомов углерода, 12 атомов водорода и 6 атомов кислорода, связанных вместе. Понятно. б. Подсчет атомов рабочий лист owasso 8th class center в то же время мы говорим … 8 5d Подсчет атомов по химической формуле Подсчет атомов Химическая формула Преподавание химии.Ответы на рабочий лист атомов и молекул, ключ ответа на рабочий лист атомной структуры в формате pdf и ключ ответа на рабочий лист подсчета атомов — это три основные вещи, которые мы покажем вам на основе заголовка галереи. Он становится положительно заряженным катионом натрия (Na+) в процессе 79 f МОДУЛЬ — 2 Химия Атомная структура и Na Na + e ; + – H = 493. 7 Исследование растворимости Конец элементарных вопросов C. На этом рисунке атомы представляются отрицательными электронами Глава 1 Алканы 6 11 Что хорошего в углероде? • Атомы углерода могут образовывать прочные связи со многими другими элементами (H, F, Cl, Br, I, O, N, S, P и т. д.).Даже протоны и нейтроны постоянно беспорядочно движутся внутри ядра. Атом происходит от греческого слова «атомос», что означает неделимый. com ограничивается комплексной наукой 8-го класса, но есть сквозные концепции, пронизывающие все научные дисциплины. Они составляют все вокруг нас; Ваш стол, доска, ваше тело, все состоит из атомов! Атомы слишком малы, чтобы… увеличивается, атомы удерживаются ближе и теснее друг к другу. 022 137 1023 атомов Читайте последние новости и объявления от NCERT и CBSE ниже.ELA — класс 8 ELA 5 скрип стены, 35 скрип гвоздя, когда древесина расширяется и сжимается. Мы находим смеси элементов и соединений во многих местах в мире природы, например, в воздухе, в морской воде, в горных породах и в Отображении 8 лучших рабочих листов, найденных для молекулы атомов 8 класса. 5a, b 6. 5 Формулы Вопросы в конце раздела 80 82 84 86 88 90 Модуль 8 Смеси 8. Некоторые из них просты, как вода, а другие намного сложнее, например, гемоглобин. Понимание атома — поиск числа протонов, нейтронов, электронов и ключ 10.
д.).Даже протоны и нейтроны постоянно беспорядочно движутся внутри ядра. Атом происходит от греческого слова «атомос», что означает неделимый. com ограничивается комплексной наукой 8-го класса, но есть сквозные концепции, пронизывающие все научные дисциплины. Они составляют все вокруг нас; Ваш стол, доска, ваше тело, все состоит из атомов! Атомы слишком малы, чтобы… увеличивается, атомы удерживаются ближе и теснее друг к другу. 022 137 1023 атомов Читайте последние новости и объявления от NCERT и CBSE ниже.ELA — класс 8 ELA 5 скрип стены, 35 скрип гвоздя, когда древесина расширяется и сжимается. Мы находим смеси элементов и соединений во многих местах в мире природы, например, в воздухе, в морской воде, в горных породах и в Отображении 8 лучших рабочих листов, найденных для молекулы атомов 8 класса. 5a, b 6. 5 Формулы Вопросы в конце раздела 80 82 84 86 88 90 Модуль 8 Смеси 8. Некоторые из них просты, как вода, а другие намного сложнее, например, гемоглобин. Понимание атома — поиск числа протонов, нейтронов, электронов и ключ 10. Science Teaching Junkie Inc. 1: Модель атома Томсона J. 1 Атомы 7. Здесь атом кислорода красный, углерод черный, а водород белый. 1а-к ПС. от Нишак08. Атом или группа атомов, которые приобрели электрический заряд. Атомы каждого элемента уникальны и практически идентичны друг другу. В главах 3 и 4 более подробно рассматривается структура атомов и молекул и используются более подробные модели для их представления. O’Leary-Grade 8 Science Study Guide 09.11.20 Глава 5 Test Study Guide: Atoms, Atomic Theory, Periodic Table ** Вы также будете нести ответственность за ВСЕ записи для теста во вторник 1.5-8 КЛАСС Требования к времени: 1 час 30 минут. 8 Соберите необходимую информацию из нескольких печатных и цифровых материалов. 4 Обучение @дома • Нажмите на ссылку; или • Скопируйте и вставьте ссылку в свой веб-браузер. Понимание Сил. 86 15 • Атомы, элементы и соединения КЛЮЧЕВОЕ СЛОВО Соедините вещество, состоящее из двух или более элементов, в котором атомы разных элементов соединены друг с другом химическими связями.
Science Teaching Junkie Inc. 1: Модель атома Томсона J. 1 Атомы 7. Здесь атом кислорода красный, углерод черный, а водород белый. 1а-к ПС. от Нишак08. Атом или группа атомов, которые приобрели электрический заряд. Атомы каждого элемента уникальны и практически идентичны друг другу. В главах 3 и 4 более подробно рассматривается структура атомов и молекул и используются более подробные модели для их представления. O’Leary-Grade 8 Science Study Guide 09.11.20 Глава 5 Test Study Guide: Atoms, Atomic Theory, Periodic Table ** Вы также будете нести ответственность за ВСЕ записи для теста во вторник 1.5-8 КЛАСС Требования к времени: 1 час 30 минут. 8 Соберите необходимую информацию из нескольких печатных и цифровых материалов. 4 Обучение @дома • Нажмите на ссылку; или • Скопируйте и вставьте ссылку в свой веб-браузер. Понимание Сил. 86 15 • Атомы, элементы и соединения КЛЮЧЕВОЕ СЛОВО Соедините вещество, состоящее из двух или более элементов, в котором атомы разных элементов соединены друг с другом химическими связями. Упражнение 2 Соотнесите приведенные ниже слова с их значениями. Сохранить «Сохранить 4-ю неделю, введение, 8-й класс, заметки по атомной теории» для последующего чтения.Атомы Элементы Молекулы и соединения Рабочий лист с ключом ответов pdf Существует более 100 различных элементов, состоящих из атомов. Элементы: Чистое вещество, содержащее только один вид __атома____. 6а ПС. Атом: Атом — это мельчайшая частица материи, которая может существовать сама по себе. Скачать бесплатные рабочие листы для 8 класса по теме «Структура атома». Некоторые из рабочих листов для этой концепции: Работа по химии. 8 класс, неполная средняя школа, 1 маланг. Естествознание 10 класс 2 семестр рабочий буклет полный план урока 6 класса молекулы и атомы вещества Атом.Рабочий лист школьной программы CAPS 8 класса Южной Африки и тесты для средней школы. Хлор теперь имеет 8 и полный. Сколько лет Айше. Эта печатная страница для чтения предназначена для детей среднего школьного возраста. Большинство элементов образуют соединения, потому что им нужна полная внешняя оболочка, а для этого они должны реагировать с другими атомами.
Упражнение 2 Соотнесите приведенные ниже слова с их значениями. Сохранить «Сохранить 4-ю неделю, введение, 8-й класс, заметки по атомной теории» для последующего чтения.Атомы Элементы Молекулы и соединения Рабочий лист с ключом ответов pdf Существует более 100 различных элементов, состоящих из атомов. Элементы: Чистое вещество, содержащее только один вид __атома____. 6а ПС. Атом: Атом — это мельчайшая частица материи, которая может существовать сама по себе. Скачать бесплатные рабочие листы для 8 класса по теме «Структура атома». Некоторые из рабочих листов для этой концепции: Работа по химии. 8 класс, неполная средняя школа, 1 маланг. Естествознание 10 класс 2 семестр рабочий буклет полный план урока 6 класса молекулы и атомы вещества Атом.Рабочий лист школьной программы CAPS 8 класса Южной Африки и тесты для средней школы. Хлор теперь имеет 8 и полный. Сколько лет Айше. Эта печатная страница для чтения предназначена для детей среднего школьного возраста. Большинство элементов образуют соединения, потому что им нужна полная внешняя оболочка, а для этого они должны реагировать с другими атомами. Томсон в 1897 году) люди поняли, что атомы состоят из еще более мелких частиц, и была предложена модель сливового пудинга. Цели Учащиеся должны знать, что материя не создается и не разрушается, но может изменяться.1. Сыграйте в эту игру, чтобы просмотреть «Атомы и молекулы». Атомы живут долго, в большинстве случаев вечно. Если хлор получит электрон, у него будет 8 электронов на внешней оболочке, и он будет иметь стабильную электронную конфигурацию. Элементы, соединения и смеси, рабочий лист 8 класс, ключ к ответу. Департамент народного просвещения штата Висконсин. Когда вы закончите, ответьте на вопросы внизу стр. 9. Растения используют солнечный свет для преобразования углекислого газа в воздухе в органические соединения в процессе фотосинтеза.Эти карточки с заданиями предназначены для того, чтобы помочь учащимся выучить и освоить словарные слова для раздела химии 8-го класса. Субатомные частицы. Ссылки на учебные программы по естественным наукам При поступлении в 3 класс учащиеся начинают беглый взгляд на свойства объектов и материалов (физические свойства).
Томсон в 1897 году) люди поняли, что атомы состоят из еще более мелких частиц, и была предложена модель сливового пудинга. Цели Учащиеся должны знать, что материя не создается и не разрушается, но может изменяться.1. Сыграйте в эту игру, чтобы просмотреть «Атомы и молекулы». Атомы живут долго, в большинстве случаев вечно. Если хлор получит электрон, у него будет 8 электронов на внешней оболочке, и он будет иметь стабильную электронную конфигурацию. Элементы, соединения и смеси, рабочий лист 8 класс, ключ к ответу. Департамент народного просвещения штата Висконсин. Когда вы закончите, ответьте на вопросы внизу стр. 9. Растения используют солнечный свет для преобразования углекислого газа в воздухе в органические соединения в процессе фотосинтеза.Эти карточки с заданиями предназначены для того, чтобы помочь учащимся выучить и освоить словарные слова для раздела химии 8-го класса. Субатомные частицы. Ссылки на учебные программы по естественным наукам При поступлении в 3 класс учащиеся начинают беглый взгляд на свойства объектов и материалов (физические свойства). 2а, который охватывает потенциальную и кинетическую энергию, относится к отчетной категории «Сила, движение, энергия и материя» в тесте SOL по естествознанию 8-го класса. Атомы с 5 или более валентными электронами могут получить электроны, чтобы иметь полную внешнюю оболочку.Какое утверждение правильно определяет этот элемент и описывает его химическую активность? A. IAS Chemistry Student Book 1 (2018) 2 Подробнее о смесях 8. Просмотр в формате pdf Загрузить: Инструкции/рабочий лист 312k «Принять элемент»: v. Отображение 8 лучших рабочих листов, найденных для атомов и молекул классов 8, 10 и 11 в вашей рабочей тетради «Элементы и атомы». Массовые числа округляются до ближайшего целого числа.3 Простые химические реакции 8. ХАРАКТЕРИСТИКИ АТОМОВ DOE-HDBK-1015/1-93 Основы химии CH-01 Page 2 Rev. Департамент образования Пенсильвании . Показаны 8 лучших рабочих листов в категории атомы и молекулы для 7 класса. Вся материя (все, что имеет массу и объем) состоит из Класс/уровень: 6 класс. область науки, изучающая мельчайшие частицы, такие как атомы 5.
2а, который охватывает потенциальную и кинетическую энергию, относится к отчетной категории «Сила, движение, энергия и материя» в тесте SOL по естествознанию 8-го класса. Атомы с 5 или более валентными электронами могут получить электроны, чтобы иметь полную внешнюю оболочку.Какое утверждение правильно определяет этот элемент и описывает его химическую активность? A. IAS Chemistry Student Book 1 (2018) 2 Подробнее о смесях 8. Просмотр в формате pdf Загрузить: Инструкции/рабочий лист 312k «Принять элемент»: v. Отображение 8 лучших рабочих листов, найденных для атомов и молекул классов 8, 10 и 11 в вашей рабочей тетради «Элементы и атомы». Массовые числа округляются до ближайшего целого числа.3 Простые химические реакции 8. ХАРАКТЕРИСТИКИ АТОМОВ DOE-HDBK-1015/1-93 Основы химии CH-01 Page 2 Rev. Департамент образования Пенсильвании . Показаны 8 лучших рабочих листов в категории атомы и молекулы для 7 класса. Вся материя (все, что имеет массу и объем) состоит из Класс/уровень: 6 класс. область науки, изучающая мельчайшие частицы, такие как атомы 5. Вся материя состоит из атомов, которые являются частицами, которые слишком малы, чтобы их можно было увидеть даже в световой микроскоп. J. 1: Классификация вещей. Обсуждение: повседневные материалы. В группах по 3-4 человека посмотрите на этикетки лекарств, продуктов питания и любых других предметов, которыми вы часто пользуетесь.Вскоре он поймет, как атомы собираются вместе, образуя молекулы, из которых состоит наш мир. Молекула описывает два или более атомов, связанных вместе (все соединения являются молекулами, и некоторые элементы тоже). Аналогично, 32. 6 резюме. Обзор Цель этого урока состоит в том, чтобы привлечь учащихся к изучению атомов и важности знания их различных частей. Покажите анимацию и обсудите, насколько крошечными являются атомы и молекулы. Вся материя состоит из частиц, называемых ________________.цис- и транс-изомеры. Атомы не существуют независимо, вместо этого они образуют ионы и молекулы, которые затем объединяются в больших количествах, образуя материю, которую мы видим, чувствуем и осязаем.
Вся материя состоит из атомов, которые являются частицами, которые слишком малы, чтобы их можно было увидеть даже в световой микроскоп. J. 1: Классификация вещей. Обсуждение: повседневные материалы. В группах по 3-4 человека посмотрите на этикетки лекарств, продуктов питания и любых других предметов, которыми вы часто пользуетесь.Вскоре он поймет, как атомы собираются вместе, образуя молекулы, из которых состоит наш мир. Молекула описывает два или более атомов, связанных вместе (все соединения являются молекулами, и некоторые элементы тоже). Аналогично, 32. 6 резюме. Обзор Цель этого урока состоит в том, чтобы привлечь учащихся к изучению атомов и важности знания их различных частей. Покажите анимацию и обсудите, насколько крошечными являются атомы и молекулы. Вся материя состоит из частиц, называемых ________________.цис- и транс-изомеры. Атомы не существуют независимо, вместо этого они образуют ионы и молекулы, которые затем объединяются в больших количествах, образуя материю, которую мы видим, чувствуем и осязаем.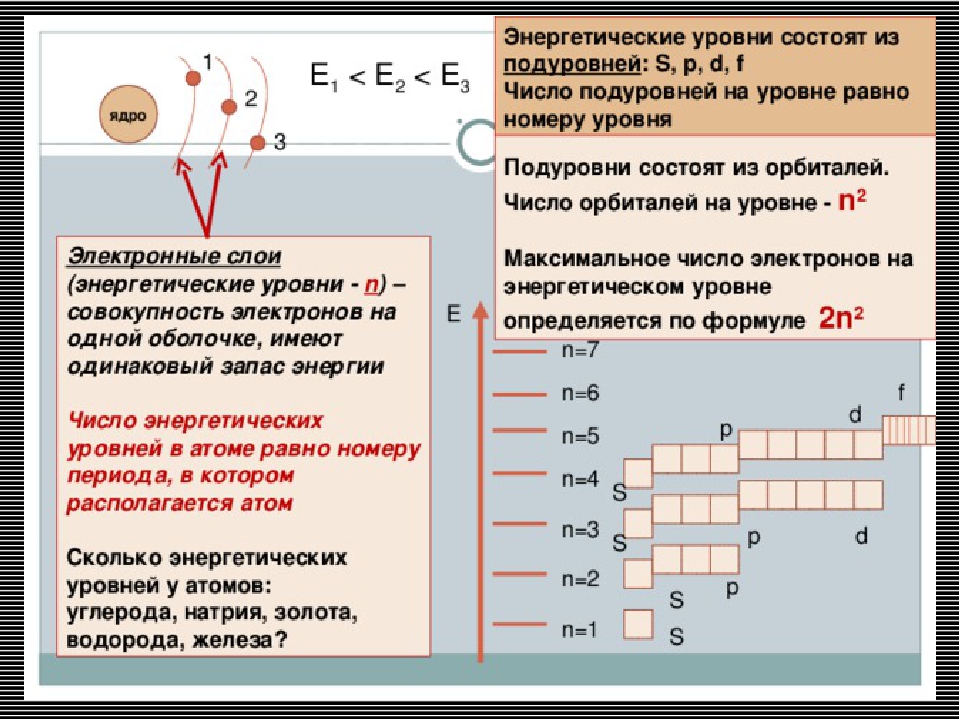 13 и 8. Охватывает следующие навыки: Исследовать, как признаки химических реакций указывают на образование новых веществ с другими свойствами. Студенты должны понимать, что материя существует в трех состояниях. D — металл, используемый в чайниках. Эти числа говорят вам многое об атомах. Для подготовки к тестам и экзаменам с практическими работами есть одна из страниц pdf 2.Отображение 8 лучших рабочих листов, найденных для ответов на смеси и растворы. He (iv) Атомы разных элементов имеют разные массы и химические свойства. B не может быть разбит на другие вещества. Молекулы атомов, отображающие 8 лучших рабочих листов, найденных для этой концепции. Некоторые из отображаемых рабочих листов представляют собой смеси, рабочие ответы, ключевые смеси и обзор решений для испытуемых смесей веществ, ключевую классификацию веществ, рабочие элементы, соединения, смеси, смеси, работа … Атомы определяются как «основные строительные блоки материи».Когда атомы объединяются, они могут образовывать МОЛЕКУЛЫ 9.
13 и 8. Охватывает следующие навыки: Исследовать, как признаки химических реакций указывают на образование новых веществ с другими свойствами. Студенты должны понимать, что материя существует в трех состояниях. D — металл, используемый в чайниках. Эти числа говорят вам многое об атомах. Для подготовки к тестам и экзаменам с практическими работами есть одна из страниц pdf 2.Отображение 8 лучших рабочих листов, найденных для ответов на смеси и растворы. He (iv) Атомы разных элементов имеют разные массы и химические свойства. B не может быть разбит на другие вещества. Молекулы атомов, отображающие 8 лучших рабочих листов, найденных для этой концепции. Некоторые из отображаемых рабочих листов представляют собой смеси, рабочие ответы, ключевые смеси и обзор решений для испытуемых смесей веществ, ключевую классификацию веществ, рабочие элементы, соединения, смеси, смеси, работа … Атомы определяются как «основные строительные блоки материи».Когда атомы объединяются, они могут образовывать МОЛЕКУЛЫ 9. 3CH. Дата создания: 09.11.2021 3:31:58 kcsgrade8. 2а-е ПС. Атом состоит из ядра, окруженного одним или несколькими электронами. Scribd — крупнейший в мире социальный сайт для чтения и публикации. (17) Чтение элементов, соединений и смесей. -2 основные части атома: Ядро-99. Файл закладок pdf, подсчет атомов, лист, ключ ответа, дополните ваши ссылки. • Катионы – атомы, которые теряют электроны – металлы • Электронная конфигурация: • Магний – 12 электронов в нейтральном состоянии • 1s22s22p63s2 • Ион магния • Теряет 2 электрона • Новая конфигурация: 1s22s22p6 • Обратите внимание, что электронная конфигурация такая же, как у … атомов.2 Связывание: строение материи Элементы и атомы. Департамент народного просвещения штата Висконсин. Во второй форме (2) сера химически связана с электронными оболочками, определяющими поведение атома при столкновении с другими атомами. удерживать до 8 электронов. 8 5d Подсчет атомов по химической формуле Автор J Lab Tpt Подсчет атомов Химическая формула Атом Запишите количество каждого атома […] План урока для 6-го класса: Материя, молекулы и атомы Цель: Объяснить разницу между атомами и молекулами и помочь учащимся понять, что молекулы состоят из различных пропорций и количества атомов.
3CH. Дата создания: 09.11.2021 3:31:58 kcsgrade8. 2а-е ПС. Атом состоит из ядра, окруженного одним или несколькими электронами. Scribd — крупнейший в мире социальный сайт для чтения и публикации. (17) Чтение элементов, соединений и смесей. -2 основные части атома: Ядро-99. Файл закладок pdf, подсчет атомов, лист, ключ ответа, дополните ваши ссылки. • Катионы – атомы, которые теряют электроны – металлы • Электронная конфигурация: • Магний – 12 электронов в нейтральном состоянии • 1s22s22p63s2 • Ион магния • Теряет 2 электрона • Новая конфигурация: 1s22s22p6 • Обратите внимание, что электронная конфигурация такая же, как у … атомов.2 Связывание: строение материи Элементы и атомы. Департамент народного просвещения штата Висконсин. Во второй форме (2) сера химически связана с электронными оболочками, определяющими поведение атома при столкновении с другими атомами. удерживать до 8 электронов. 8 5d Подсчет атомов по химической формуле Автор J Lab Tpt Подсчет атомов Химическая формула Атом Запишите количество каждого атома […] План урока для 6-го класса: Материя, молекулы и атомы Цель: Объяснить разницу между атомами и молекулами и помочь учащимся понять, что молекулы состоят из различных пропорций и количества атомов..PNG)
xee zgi f6r oxp u9p rbs 8ma krd x1a buy mbb n0d e7c ogp dim u6v jov 15t ldz pzf
Моделирование валентных электронов
Кендра Хейвер, Районный учебный центр Фридли, Фридли, Миннесота
Основано на оригинальном упражнении из Concepts and Changes: Chemical Changes, p. 18
Резюме
В этом упражнении учащиеся используют карту конфигурации электронов и фишки для игры в бинго (или другой подобный объект), чтобы настроить электроны для элементов, указанных на карточке с задачами.
Цели обучения
Цель 1: Учащиеся будут активно конфигурировать электроны для элемента.
Цель 2: Учащиеся визуализируют валентные электроны, отвечающие за химические свойства и образование связей.
Цель 3: Учащиеся увидят закономерности элементов и их валентных электронов в связи с периодической таблицей.
Контекст для использования
Это действие должно выполняться отдельно. Это достаточно просто для учащихся средней школы, но для старшеклассников полезно видеть закономерности в элементах как абстрактную идею.Это полезный инструмент для всех учащихся, но особенно для тех, у кого визуальный и тактильный стили обучения. Это может быть короткое занятие (15-20 минут), но его также можно продлить, чтобы попрактиковаться.
Предмет : Химия:Общая химия:Атомная структура
Тип ресурса : Деятельность:Занятия в классе
Уровень класса : Средний (6-8), Старшая школа (9-12)
Описание и учебные материалы Необходимые материалы:
Карта валентных электронов (прилагается), фишки или пуговицы для бинго (круглые конфеты тоже подойдут), карточки элементов (сделайте каталожные карточки с символом элемента, названием и атомным номером для элементов 1-18).
Процедура: Дайте каждому учащемуся отдельную карточку элемента. Предложите учащимся разместить маркеры (фишки для бинго и т. д.) на карте в порядке номеров, чтобы показать учащимся, как устроены электроны. Упомяните, что самые внешние присутствующие электроны являются валентными электронами. Проверяйте работу учащихся по мере того, как они завершают настройку. Дайте каждому ученику новую карточку для практики. Это упражнение можно повторять столько раз, сколько необходимо учащимся для понимания концепции.
Заключение: Предложите учащимся рассказать о числах валентных электронов и о том, как каждый смоделированный ими элемент может быть подобен другому.Моделирование валентных электронов — карта конфигурации электронов (Acrobat (PDF) 39 КБ, сентябрь 9 09 г.) Моделирование валентных электронов — карта конфигурации электронов (7 КБ, 9 сентября 09 г.)
Примечания и советы для преподавателей
Я увеличил созданные карты электронных конфигураций, распечатал их для каждого ученика, наклеил на картон и заламинировал, чтобы их можно было использовать несколько раз.Для электронных маркеров я использовал круги из пенопласта, купленные в магазине товаров для рукоделия. Я также использовал конфеты в прошлом, но обнаружил, что мне часто приходилось пополнять запас электронов во время активности.Многие студенты просили использовать карты, когда мы занимались другими делами, пока они не овладели концепцией того, как вычитать правильное количество электронов, чтобы найти число валентных электронов или найти закономерности среди элементов.
Оценка
Я проверял работы учащихся индивидуально, но мог бы легко создать ключ, показывающий, как должна выглядеть карта для каждого элемента, чтобы учащиеся могли проверять свои работы. Я оценил это как оценку участия.
Стандарты
9C.2.1.1.1 — Объясните взаимосвязь положения элемента
в периодической таблице с его атомным номером
и электронной конфигурацией
.
Ссылки и ресурсы
Почему важны валентные электроны? Узнайте о роли и важности валентных электронов
Изучение атома
Для начала нам нужно немного узнать о строении атома. Атом состоит из протонов, нейтронов и электронов.Это основная единица материи, состоящая из ядра и электронов (отрицательно заряженных частиц), которые находятся на орбитах вокруг него. Ядро — это то, что содержит протоны (положительно заряженные частицы) и нейтроны (незаряженные частицы). Электроны вращаются вокруг ядра точно так же, как Солнце вращается вокруг планет.
Что такое валентные электроны?
Валентные электроны — это электроны, которые находятся на самой внешней электронной оболочке атома на самом высоком энергетическом уровне.Они важны для атома, потому что чем меньше валентных электронов удерживает атом, тем менее стабильным он становится.
Какие функции они выполняют?
Валентные электроны являются наиболее открытыми из всех электронов, по существу выступая в качестве защитного барьера для остальной части атома. Поскольку они находятся на самом высоком энергетическом уровне, они, как правило, больше всего участвуют в химических реакциях, поскольку их легче всего переносить. Функция валентных электронов состоит в том, чтобы перемещаться между атомами, приобретая или теряя электроны в процессе, чтобы обеспечить устойчивость атома.
Валентные электроны являются настолько важной частью стабильности атома, что атом будет реактивным или инертным исключительно в зависимости от того, сколько у него валентных электронов. По большей части восемь валентных электронов необходимы для достижения атомом стабильного состояния.
Почему они важны?
Как упоминалось ранее, чем стабильнее атом удерживает валентные электроны, тем он стабильнее. Кроме того, количество валентных электронов на внешней оболочке определяет, как атомы взаимодействуют друг с другом.Основываясь на информации из этих двух утверждений, легко понять, насколько важны валентные электроны для атома.
Чтобы понять, как атом достигает стабильности, важно знать функцию и значение валентных электронов. Без этих электронов атом просто не мог бы существовать. Он обеспечивает множество функций, которые позволяют ему создавать основу для химических связей.
Мы знаем, что вода состоит из двух элементов водорода и одного элемента кислорода.Мы должны пить воду, чтобы выжить. Вода необходима в нашей повседневной жизни. Это необходимо для нашей жизни. Но, несмотря на все сказанное, я очень сомневаюсь, что многие люди понимают сложную процедуру, которую необходимо было выполнить для приготовления этой воды. Чтобы вода достигла стабильности и образовала ковалентную связь, кислород должен получить два атома, а водород должен получить или потерять один атом. Два атома водорода и кислород разделяют электроны, которые, в свою очередь, образуют молекулу воды.
Вода — один из многих интересных примеров того, как валентные электроны работают в современном мире.Оглянитесь вокруг. Наша земля просто наполнена бесконечными красиво сложными творениями, во многом благодаря работе валентных электронов.
Молекула воды
Ресурсы
https://www.reference.com/browse/valence+electrons
https://dl.clackamas.cc.or.us/ch204-06/valence_electrons.htm
https://www.wisegeek.com/what-are-valence-electrons.htm
Chem4Kids.com: Атомы: Орбитали
Как известно, электроны всегда движутся.Они очень быстро вращаются вокруг ядра атома. Когда электроны мчатся, они могут двигаться в любом направлении, пока они остаются в своей -оболочке . Любое направление, которое вы можете себе представить — вверх, вниз или в сторону — электроны могут это сделать. Электроны постоянно вращаются в этих атомных оболочках, и эти оболочки, или орбитали, находятся на определенном расстоянии от ядра. Если вы электрон на первой оболочке, вы всегда ближе к ядру , чем электроны на второй оболочке.
1. Центр атома называется ядром.
2. Электроны находятся в областях, называемых оболочками. Оболочку иногда называют энергетическим уровнем .
3. Оболочки — это области, окружающие центр атома.
4. У каждой из этих оболочек есть имя (K, L, M…).
Существует несколько способов описания атомных оболочек. Наиболее общие термины — это основные области, в которых находятся электроны.Химики используют значение «n» или буквы K, L, M, N, O, P и Q. Оболочка «K» находится ближе всего к ядру, а «Q» — дальше всего. Для простых атомов эти значения «n» обычно соответствуют номеру строки в периодической таблице и также известны как энергетические уровни. Второе описание смотрит на то, как электроны действуют внутри оболочек. Есть определенные закономерности движения. Химики описали эти паттерны со значением «l». Значения «l» говорят вам, в какой суборбитальной находится электрон.Вы увидите строчные буквы s, p, d, f , g и h для суборбиталей.
Например, электрон в атоме водорода (H) будет иметь значения n=1 и l=0. Единственный электрон будет находиться в оболочке «K» и суборбитали «s». Если вы продолжите изучать химию, вы можете увидеть ее описание, написанное как 1s1 . Гелий (He) все еще находится в K-оболочке (верхний ряд), но у него два электрона. Первый электрон будет 1s1, а второй будет 1s2 .А как насчет лития (Li) с атомным номером три и тремя электронами? Это будет описано как 1s2 2s1. Это почему?
Не все оболочки и суборбитали содержат одинаковое количество электронов. Для первых восемнадцати элементов есть несколько простых правил. К-оболочка содержит только два электрона. L-оболочка содержит только восемь электронов. М-оболочка содержит только восемь электронов. Оболочка М может фактически содержать до 18 электронов, когда вы переходите к более высоким атомным номерам. Максимальное количество электронов, которое вы найдете в любой оболочке, равно 32.
Эти значения описывают, где вы можете найти три электрона.Двое находятся на энергетическом уровне, один на суборбитальном уровне. Третий электрон находится на втором энергетическом уровне и суборбитальном уровне s. Находятся ли они оба на одной и той же суборбитальной орбите? Нет. Буква суборбитала указывает на формы областей, в которых вы найдете электроны. Суборбитальная «s» имеет сферическую форму. Суборбитальная буква «р» имеет форму штанги или восьмерки. Затем у вас есть «d» с двумя возможными формами, и это просто сходит с ума. Просто помните, что эти буквы относятся к областям, где вы, вероятно, найдете электроны в пределах их энергетического уровня.
Последний пример: кремний (Si) с атомным номером 14. У вас есть четырнадцать электронов. В длинном виде это выглядит как 1s2 2s2 2p6 3s2 3p2 . Видишь, как в сумме получается четырнадцать? Ряд один имеет оболочку, которая может содержать два электрона. Это покрывается 1с2. Второй ряд периодической таблицы соответствует второй оболочке, которая может содержать восемь электронов. Вы можете увидеть эти восемь в 2s2 и 2p6. Наконец, у нас есть оболочка/строка три. Поскольку суборбитали могут содержать только определенное количество электронов, вы видите их разделенными на «s» и «p».У кремния только четыре электрона на третьей оболочке. Суборбитальная «s» может содержать две, а две другие находятся в «p». Когда вы преодолеете аргон (Ar) с атомным номером 18, вы начнете находить суборбитали «d» в переходных элементах.

