Задания 1. Электронная конфигурация атомов химических элементов.
Определите, у атомов каких их указанных в ряду элементов в основном состоянии число неспаренных электронов на внешнем уровне равно 1.
Запишите в поле ответа номера выбранных элементов.
Ответ: 24
Пояснение:
Барий — элемент главной подгруппы второй группы и шестого периода Периодической системы Д. И. Менделеева, следовательно, электронная конфигурация его внешнего слоя будет 6s2. На внешнем 6s-подуровне, состоящем из одной s-орбитали, атома бария расположено 2 спаренных электрона с противоположными спинами (полное заполнение подуровня).
Алюминий — элемент главной подгруппы третьей группы и третьего периода Периодической системы, и электронная конфигурация внешнего слоя атома алюминия — 3s23p1: на 3s-подуровне (состоит из одной s-орбитали) расположено 2 спаренных электрона с противоположными спинами (полное заполнение), а на 3
Азот — элемент главной подгруппы пятой группы и второго периода Периодической системы, электронная конфигурация внешнего слоя атома азота — 2s22p3: на 2s-подуровне расположено 2 спаренных электрона с противоположными спинами, а на 2p-подуровне, состоящего из трех p-орбиталей (px, py, pz) — три неспаренных электрона, каждый из которых находится на каждой орбитали. Таким образом, у алюминия в основном состоянии число неспаренных электронов на внешнем энергетическом уровне равно 1.
Хлор — элемент главной подгруппы седьмой группы и третьего периода Периодической системы, электронная конфигурация внешнего слоя атома хлора — 3s23p5: на 3 s-подуровне расположено 2 спаренных электрона с противоположными спинами, а на 3p-подуровне, состоящего из трех p-орбиталей (px, py, pz) — 5 электронов: 2 пары спаренных электронов на орбиталях px, py и один неспаренный — на орбитали pz. Таким образом, у хлора в основном состоянии число неспаренных электронов на внешнем энергетическом уровне равно 1.
Кальций — элемент главной подгруппы второй группы и четвертого периода Периодической системы Д. И. Менделеева. Электронная конфигурация его внешнего слоя схожа с электронной конфигурацией атома бария. На внешнем 4s-подуровне, состоящем из одной s-орбитали, атома кальция расположено 2 спаренных электрона с противоположными спинами (полное заполнение подуровня).
Электронные конфигурации. Электронная формула
Заполнение атомных орбиталей электронами определяется правилом минимума энергии , принципом Паули и правилом Хунда.
Ученые условились обозначать каждую атомную орбиталь квантовой ячейкой — квадратиком на энергетической диаграмме.
На s-подуровнеможет находиться одна атомная орбиталь, а на p-подуровне их может быть уже три (в соответствии с тремя осями координат):
Орбиталей d- и f-подуровня в атомеможет быть уже пять и семь соответственно.
Электроны заселяют атомные орбитали, начиная с подуровня с меньшей энергией. В этом состоит правило минимума энергии. Последовательность в нарастании энергии подуровней такова: 1s
Согласно расчетам, электрон движется не по какой-то определенной траектории, а может находиться в любой части околоядерного пространства — т.е. можно говорить лишь о вероятности (возможности) его нахождения на определенном расстоянии от ядра.
Электроны в атоме занимают самые энергетически выгодные атомные орбитали (орбитали с минимальной энергией), образуя электронные облака определенной формы.
Внутри атомных орбиталей вероятность нахождения электронов велика; иными словами, имеется высокая электронная плотность. Пространство вне объема орбиталей соответствует малой электронной плотности.
В каждой атомной орбитали может размещаться максимально два электрона (принцип Паули).
При наличии орбиталей с одинаковой энергией (например, трех р-орбиталей одного подуровня) каждая орбиталь заполняется вначале наполовину (и поэтому на р-подуровне не может быть более трех неспаренных электронов), а затем уже полностью, с образованием электронных пар (правило Гунда).
По правилу Гунда при заполнении электронами одинаковых орбиталей электроны располагаются в первую очередь по одиночке на каждой орбитали, и лишь потом начинается заселение этих орбиталей вторыми электронами.
Когда орбиталь заселяется двумя электронами, такие электроны называют
Внешним уровнем атома называется самый далекий от ядра уровень, на котором еще есть электроны. Именно эта оболочка соприкасается при столкновении с внешними уровнями других атомов в химических реакциях. При взаимодействии с другими атомами азот способен принять 3 дополнительных электрона на свой внешний уровень. При этом атом азота получит завершенный, то есть максимально заполненный внешний электронный уровень, на котором расположатся 8 электронов.
Но тогда логично выглядит и другое предположение: химические свойства «неблагородных» элементов связаны с их стремлением завершить свои внешние электронные оболочки. Это предположение подтверждается многочисленными фактами и получило название правила октета (восьмерка — октет).
Завершенный уровень энергетически выгоднее незавершенного. Поэтому атом азота должен легко реагировать с любым другим атомом, способным предоставить ему 3 дополнительных электрона для завершения его внешнего уровня.
Более строгая формулировка правила октета может выглядеть так:
Атомы элементов стремятся к наиболее устойчивой электронной конфигурации. Устойчивой является электронная конфигурация с завершенным внешним электронным уровнем из (s2 + p6), т.е. из октета электронов.
С правилом октета тесно связаны донорные и акцепторные свойства атомов.
Атомы — доноры электронов — склонны достигать октета, отдавая «лишние» электроны со своих внешних электронных уровней. Это атомы, у которых внешние электронные уровни только начинают застраиваться.
Наоборот, атомы- акцепторы электронов легче достраивают свои внешние уровни до октета, принимая на них электроны других атомов. Обычно это элементы с уже почти завершенными внешними электронными уровнями.
Как мы уже знаем,принимая или отдавая электроны, атомы могут превращаться в ионы. Например:
11 Na (металл натрий: 1s
9 F (газ фтор: 1s2 2s22p5) + e- = 9F — (ион фтора: 1s2 2s22p6 — октет)
Электронные конфигурации атомов записываются в виде полных и сокращенных электронных формул:
1 H 1s1
2 He 1s2
3 Li 1s22s1 =[2He] 2s1
4 Be 1s22s2 =[2He] 2s2
5 B 1s2 2s2 2p1= [2He] 2s2 2p1
6 C 1s
2 2s22p2 = [2He] 2s2 2p27 N 1s2 2s2 2p3= [2He] 2s2 2p3
8 O 1s2 2s2 2p4= [2He] 2s2 2p4
9 F 1s2 2s22p5 = [2He] 2s2 2p5
10 Ne 1s2 2s22p6 = [2He] 2s2 2p6
11 Na 1s2 2s22p6 3s110Ne] 3s1
12 Mg 1s2 2s22p6 3s2 = [10Ne] 3s
13 Al 1s2 2s22p6 3s2 3p1 = [10Ne]3s2 3p1
14 Si 1s2 2s22p6 3s2 3p2 = [10Ne]3s2 3p2
15 P 1s2 2s2 2p63s2 3p3 = [10Ne] 3s23p3
16 S 1s2 2s2 2p63s2 3p4 = [10Ne] 3s23p4
17 Cl 1s2 2s22p6 3s2 3p5 = [10Ne]3s2 3p5
18 Ar 1s2 2s22p6 3s2 3p6 = [10Ne]3s2 3p6
19 K 1s2 2s2 2p63s2 3p64s1 = [18Ar]4s1
20 Ca 1s2 2s22p6 3s2 3p6 4s2= [18Ar] 4s2
21 Sc 1s2 2s22p6 3s2 3p6 3d14s2 = [18Ar] 3d1 4s2
22 Ti 1s2 2s22p6 3s2 3p6 3d24s
23 V 1s2 2s2 2p63s2 3p6 3d3 4s2= [18Ar] 3d3 4s2
24 Cr 1s2 2s22p6 3s2 3p6 3d54s1 = [18Ar] 3d5 4s1
25 Mn 1s2 2s22p6 3s2 3p6 3d54s2 = [18Ar] 3d5 4s2
26 Fe 1s2 2s22p6 3s2 3p6 3d64s2 = [18Ar] 3d6 4s2
27 Co 1s2 2s22p6 3s2 3p6 3d74s2 = [18Ar] 3d7 4s2
28 Ni 1s2 2s22p6 3s2 3p6 3d84s2 = [18Ar] 3d8 4s2
29 Cu 1s2 2s22p6 3s2 3p6 3d104s1 = [18Ar] 3d10 4s1
30 Zn 1s2 2s22p6 3s2 3p6 3d104s2 = [18Ar,3d10] 4s2
31 Ga 1s2 2s22p6 3s2 3p6 3d104s2 4p1 = [18Ar, 3d10]4s2 4p1
32 Ge 1s2 2s22p6 3s2 3p6 3d104s2 4p2 = [18Ar,3d10]4s2 4p2
33 As 1s2 2s22p6 3s2 3p6 3d104s2 4p3 = [18Ar,3d10]4s2 4p3
34 Se 1s2 2s22p6 3s2 3p6 3d104s2 4p4 = [18Ar,3d10]4s2 4p4
35 Br 1s2 2s2 2p63s2 3p6 3d10 4s24p5 = [18Ar,3d10] 4s24p5
36 Kr 1s2 2s2 2p63s2 3p63d10 4s24p6 = [18 Ar ,3 d10] 4s24p6
Из рассмотрения электронных конфигураций атомов видно, что элементы VIIIА — группы (He, Ne, Ar и другие) имеют завершенные s— и p— подуровни (s2p6). Такие конфигурации обладают повышенной устойчивостью и обеспечивают химическую пассивность благородных газов.
В атомах остальных элементов внешние s— и p— подуровни — незавершенные, например у хлора: 17Cl = [10Ne] 3s2 3p5. Незавершенные подуровни и электроны на них называются также валентными, поскольку именно они могут участвовать в образовании химических связей между атомами.
examchemistry.com
Элементы электронная конфигурация атомов
1) 1s2 2s22р63s23p6 2) 1s2 2s22p63s23p4 3) 1s2 2s2 2p6 4) 1s2 2s2 2p63s23p2
Установите соответствие между элементом и электронной конфигурацией атомов.
Число энергетических слоев и число электронов во внешнем энергетическом слое атомов мышьяка равны соответственно 1) 4, 6 2) 2, 5 3) 3, 7 4) 4, 5
Распределению электронов по энергетическим уровням в атоме элемента соответствует ряд чисел: 2, 8, 18, 6. В периодической системе этот элемент расположен в группе
1) VA 2) VIA 3) VБ 4) VIБ
Химический элемент расположен в IV периоде, IА группе. Распределению электронов в атоме этого элемента соответствует ряд чисел:
1) 2, 8, 8, 2 2) 2, 8, 18, 1 3) 2, 8, 8, 1 4) 2, 8, 18, 2
Ядра атомов изотопов различаются числом
1) протонов 2) нейтронов 3) протонов и нейтронов 4) протонов и электронов
Число нейтронов в ядре атома 39K равно 1) 19 2) 20 3) 39 4) 58
Электронную формулу 1s22s22p63s23p64s2 имеет атом элемента
1) Ba 2) Mg 3) Ca 4) Sr
Атом химического элемента, образующего с галогеном соединение с ионной связью, имеет электронную конфигурацию
1) 1s22s22p6 2) 1s22s22p63s1 3) 1s22s22p63s23p3 4) 1s22s22p63s23p5
Число неспаренных электронов в атоме алюминия равно
1) 1 2) 2 3) 3 4) 0
Электронная конфигурация 1s22s22p63s23p6 соответствует иону
1) Sc2+ 2) Al3+ 3) Cr3+ 4) Ca2+
Электронная конфигурация 1s22s22p63s23p6 соответствует частице
1) Li+ 2) K+ 3) Cs+ 4) Na+
Химический элемент, формула высшего оксида которого R2O7, имеет электронную конфигурацию атома:
1) 1s22s22p63s1 2) 1s22s22p63s23p5 3) 1s22s22p63s23p64s1 4) 1s22s1
Установите соответствие между формулой частицы и ее электронной конфигурацией.
ЧАСТИЦА ЭЛЕКТРОННАЯ КОНФИГУРАЦИЯ
Одинаковое число протонов и нейтронов содержится в атоме
1) железа-56 2) иода-127 3) кобальта-59 4) углерода-12
Число электронов в атоме аргона равно числу электронов в ионе
1) S2- 2) Al3+ 3) Na+ 4) F-
Какую электронную конфигурацию имеет атом наиболее активного металла?
1) 1s22s22p1 2) 1s22s22p63s1 3) 1s22s2 4) 1s22s22p63s23p1
В каком ряду все вещества имеют ковалентную полярную связь?
1) HCl, NaCl, Cl2 2) O2, h3O, CO2 3) h3O, Nh4, Ch5 4) NaBr, HBr, CO
Атом элемента, максимальная степень окисления которого + 4, в основном состоянии имеет электронную конфигурацию внешнего энергетического уровня:
1) 3s23p4 2) 2s22p2 3) 2s22p4 4) 2s22p6
Верны ли следующие суждения о свойствах соединений элемента, электронная конфигурация атома которого 1s22s22p63s23p4?
А. Этот элемент образует гидроксид с ярко выраженными кислотными свойствами.
Б. Степень окисления этого элемента в высшем гидроксиде равна + 4.
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
Электронная конфигурация 1s22s22p63s23p6 соответствует иону
1) Sn2+ 2) S2– 3) Cr3+ 4) Fe2+
Порядковый номер элемента, электронное строение атома которого [He] 2s22p3, равен
1) 5 2) 6 3) 7 4) 4
Восьмиэлектронную внешнюю оболочку имеет ион
1) P3+ 2) S2– 3) Cl5+ 4) Fe2+
Восьмиэлектронную внешнюю оболочку имеет ион
1) S4+ 2) S2– 3) Br5+ 4) Sn2+
Электронную конфигурацию инертного газа имеет ион
1) Fe3+ 2) Cl– 3) Cu2+ 4) Fe2+
Электронная конфигурация 1s22s22p63s23p6 соответствует иону
1) Mg2+ 2) S2– 3) Al3+ 4) N3–
Какое соединение содержит катион и анион с электронной конфигурацией 1s22s22p63s23p6?
1) NaCl 2) NaBr 3) KCl 4) KBr
Элементу, электронная формула атома которого 1s22s22p63s23p4, соответствует водородное соединение
1) HCl 2) Ph4 3) h3S 4) Sih5
Атому аргона в основном состоянии соответствует электронная конфигурация частицы
1) Ca0 2) K+ 3) Cl+1 4) Sc0
Элемент, электронная формула атома которого 1s22s22p63s23p2, образует водородное соединение
1) Ch5 2) Sih5 3) h3O 4) h3S
Три неспаренных электрона на внешнем уровне в основном состоянии содержит атом
1) титана 2) кремния 3) магния 4) фосфора
Атому аргона в основном состоянии соответствует электронная конфигурация частицы
1) S2– 2) Zn2+ 3) C4+ 4) Se0
Электронная конфигурация 1s22s22p63s23p6 соответствует иону
1) Fe2+ 2) S2– 3) Al3+ 4) N3–
Сходную конфигурацию внешнего энергетического уровня имеют атомы P и
1) Ar 2) Al 3) Cl 4) N
Сходную конфигурацию внешнего энергетического уровня имеют атомы магния и
1) кальция 2) хрома 3) кремния 4) алюминия
Электронная конфигурация 1s22s22p63s23p3 соответствует атому
1) алюминия 2) азота 3) фосфора 4) серы
Сходную конфигурацию внешнего энергетического уровня имеют атомы фтора и
1) кислорода 2) лития 3) брома 4) неона
Какая электронная конфигурация соответствует распределению валентных электронов в атоме хрома? 1) 3d 24s 2 2) 3s 23p 4 3) 3d 54s 1 4) 4s 24p 6
Электронная конфигурация 1s22s22p6 соответствует иону
1) Al3+ 2) Fe3+ 3) Zn2+ 4) Cr3+
В основном состоянии три неспаренных электрона имеет атом
1) кремния 2) фосфора 3) серы 4) хлора
В какой частице распределение электронов по энергетическим уровням соответствует ряду чисел 2; 8; 8? 1) S–2 2) S0 3) P0 4) P+5
Элементу с электронной конфигурацией атома 1s22s22p63s23p4 соответствует водородное соединение 1) h4P 2) Nh4 3) h3S 4) Ch5
Атом углерода в возбуждённом состоянии имеет электронную конфигурацию
1) 1s22s22p2 2) 1s22s12p3 3) 1s22s22p3 4) 1s22s12p4
Какая частица имеет электронную конфигурацию 1s22s22p63s23p6?
1) K+ 2) О2– 3) S0 4) K0
Какая электронная конфигурация соответствует фторид-иону?
1) 1s22s22p5 2) 1s22s22p6 3) 1s22s22p3 4) 1s22s22p4
Атом какого химического элемента в основном состоянии имеет электронную конфигурацию 1s22s22p63s1? 1) натрия 2) магния 3) калия 4) меди
У атома какого из указанных элементов в основном состоянии все валентные электроны расположены на 3s-орбитали? 1) магния 2) алюминия 3) азота 4) бора
На 2s-энергетическом подуровне расположены все валентные электроны атома
1) кремния 2) бериллия 3) натрия 4) магния
Восьмиэлектронную внешнюю оболочку имеет каждая из двух частиц:
1) С4+ и C4– 2) S2– и Cl7+ 3) Cl5+ и Li+ 4) H+ и Ca2+
Электронная формула внешнего электронного слоя 3s23p6 соответствует строению каждой из двух частиц:
1) Ar0 и K0 2) Cl– и K+ 3) S2– и Na0 4) Cl0 и Са2+
Ряд чисел: 2, 8, 8, характеризующий распределение электронов по энергетическим уровням, соответствует частице 1) S–2 2) Cl+7 3) Cl+5 4) S+6
Анион O2− имеет электронную конфигурацию
1) 1s22s22p4 2) 1s22s22p5 3) 1s22s22p6 4) 1s22s22p2
Электронную конфигурацию внешнего энергетического уровня ns2np1
в основном состоянии имеет атом 1) Ca 2) Li 3) B 4) Na
Электронная конфигурация 1s22s22p63s23p6 соответствует частице
1) Mg2+ 2) S2– 3) Al3+ 4) Si4+
moyamatem.ru
Электронная конфигурация.
Электронная конфигурация элемента это запись распределения электронов в его атомах по оболочкам, подоболочкам и орбиталям. Электронная конфигурация обычно записывается для атомов в их основном состоянии. Электронная конфигурация атома, у которого один или несколько электронов находятся в возбужденном состоянии, называется возбужденной конфигурацией. Для определения конкретной электронной конфигурации элемента в основном состоянии существуют следующие три правила: Правило 1: принцип заполнения. Согласно принципу заполнения, электроны в основном состоянии атома заполняют орбитали в последовательности повышения орбитальных энергетических уровней. Низшие по энергии орбитали всегда заполняются первыми.
Пример
Водород; атомный номер = 1; число электронов = 1
Этот единственный в атоме водорода электрон должен занимать s-орбиталь К-обо-лочки, поскольку из всех возможных орбиталей она имеет самую низкую энергию (см. рис. 1.21). Электрон на этой s-орбитали называется ls-электрон. Водород в основном состоянии имеет электронную конфигурацию Is1.
Правило 2: принцип запрета Паули. Согласно этому принципу, на любой орбитали может находиться не более двух электронов и то лишь в том случае, если они имеют противоположные спины (неодинаковые спиновые числа).
Пример
Литий; атомный номер = 3; число электронов = 3
Орбиталь с самой низкой энергией-это 1s-орбиталъ. Она может принять на себя только два электрона. У этих электронов должны быть неодинаковые спины. Если обозначать спин +1/2 стрелкой, направленной вверх, а спин —1/2 стрелкой, направленной вниз, то два электрона с противоположными (антипараллельными) спинами на одной орбитали схематически можно представить записью (рис. 1.27)
На одной орбитали не могут находиться два электрона с одинаковыми (параллельными) спинами:
Третий электрон в атоме лития должен занимать орбиталь, следующую по энергии за самой низкой орбиталью, т.е. 2в-орбиталь. Таким образом, литий имеет электронную конфигурацию Is22s1.
Правило 3: правило Гунда. Согласно этому правилу, заполнение орбиталей одной подоболочки начинается одиночными электронами с параллельными (одинаковыми по знаку) спинами, и лишь после того, как одиночные электроны займут все орбитали, может происходить окончательное заполнение орбиталей парами электронов с противоположными спинами.
Пример
Азот; атомный номер = 7; число электронов = 7 Азот имеет электронную конфигурацию ls22s22p3. Три электрона, находящиеся на 2р-подоболочке, должны располагаться поодиночке на каждой из трех 2р-орбиталей. При этом все три электрона должны иметь параллельные спины (рис. 1.22).
В табл. 1.6 показаны электронные конфигурации элементов с атомными номерами от 1 до 20.
Таблица 1.6. Электронные конфигурации основного состояния для элементов с атомным номером от 1 до 20
Оглавление:
www.himikatus.ru
Задания №1 с решениями
Рассмотрим задания №1 из вариантов ЕГЭ за 2016 год.
Перед решением рекомендуем повторить раздел «Строение атома. Электронные конфигурации».
Задание №1.
Электронная формула внешнего электронного слоя 3s²3p6 соответствует строению каждой из двух частиц:
1. Arº и Kº 2. Cl‾ и K+ 3. S²‾ и Naº 4. Clº и Ca2+
Объяснение: среди вариантов ответа приведены атомы в невозбужденном и возбужденном состояниях, то есть электронная конфигурация, допустим иона калия не соответствует его положению в периодической системе. Рассмотрим вариант 1 Arº и Kº. Напишем их электронные конфигурации: Arº: 1s2 2s2 2p6 3s2 3p6; Kº: 1s2 2s2 2p6 3s2 3p6 4s1 — подходящая электронная конфигурация только у аргона. Рассмотрим вариант ответа №2 — Cl‾ и K+. K+: 1s2 2s2 2p6 3s2 4s0; Cl‾: 1s2 2s2 2p6 3s2 3p6. Следовательно, правильный ответ — 2.
Задание №2.
Атому аргона в основном состоянии соответствует электронная конфигурация частицы:
1. Caº 2. K+ 3. Cl+ 4. Zn2+
Объяснение: для напишем электронную конфигурацию аргона: 1s2 2s2 2p6 3s2 3p6. Кальций не подходит, так как у него на 2 электрона больше. У калия: 1s2 2s2 2p6 3s2 3p6 4s0. Правильный ответ — 2.
Задание №3.
Элемент, электронная конфигурация атома которого 1s2 2s2 2p6 3s2 3p4, образует водородное соединение
1. Ch5 2. Sih5 3. h3O 4. h3S
Объяснение: посмотрим в периодическую систему, такую электронную конфигурацию имеет атом серы. Правильный ответ — 4.
Задание №4.
Сходную конфигурацию внешнего энергетического уровня имеют атомы магния и
1. Кальция 2. Хрома 3. Кремния 4. Алюминия
Объяснение: у магния конфигурация внешнего энергетического уровня: 3s2. У кальция: 4s2, у хрома: 4s2 3d4, у кремния: 3s2 2p2, у алюминия: 3s2 3p1. Правильный ответ — 1.
Задание № 5.
Атому аргона в основном состоянии соответствует электронная конфигурация частицы:
1. S²‾ 2. Zn2+ 3. Si4+ 4. Seº
Объяснение: электронная конфигурация аргона в основном состоянии — 1s2 2s2 2p6 3s2 3p6. У S²‾ электронная конфигурация: 1s2 2s2 2p6 3s2 3p(4+2). Правильный ответ — 1.
Задание №6.
Сходную конфигурацию внешнего энергетического уровня имеют атомы фосфора и
1. Ar 2. Al 3. Cl 4. N
Объяснение: напишем электронную конфигурацию внешнего уровня атома фосфора: 3s2 3p3.
У алюминия: 3s2 3p1;
У аргона: 3s2 3p6;
У хлора: 3s2 3p5;
У азота: 2s2 2p3.
Правильный ответ — 4.
Задание №7.
Электронная конфигурация 1s2 2s2 2p6 3s2 3p6 соответствует частице
1. S4+ 2. P3- 3. Al3+ 4. O2-
Объяснение: данная электронная конфигурация соответствует атому аргона в основном состоянии. Рассмотрим варианты ответа:
S4+: 1s2 2s2 2p6 3s2 2p0
P3-: 1s2 2s2 2p6 3s2 3p(3+3)
Правильный ответ — 2.
Задание №8.
Какая электронная конфигурация соответствует распределению валентных электронов в атоме хрома:
1. 3d2 4s2 2. 3s2 3p4 3. 3d5 4s1 4. 4s2 4p6
Объяснение: напишем электронную конфигурацию хрома в основном состоянии: 1s2 2s2 2p6 3s2 3p6 4s1 3d5. Валентные электроны находятся на последних двух подуровнях 4s и 3d (здесь происходит перескок одного электрона с подуровня s на d). Правильный ответ — 3.
Задание №9.
Три неспаренных электрона на внешнем электронном уровне в основном состоянии содержит атом
1. Титана 2. Кремния 3. Магния 4. Фосфора
Объяснение: для того, чтобы иметь 3 неспаренных электрона, нужно, чтобы элемент находился в пятой группе. Следовательно, правильный ответ — 4.
Задание №10.
Атом химического элемента, высший оксид которого RO2, имеет конфигурацию внешнего уровня:
1. ns2 np4 2. ns2 np2 3. ns2 4. ns2 np1
Объяснение: данный элемент имеет степень окисления (в этом соединении) +4, то есть он должен иметь 4 валентных электрона на внешнем уровне. Следовательно, правильный ответ — 2.
(можно подумать, что правильный ответ — 1, но у такого атома максимальная степень окисления будет +6 (так как 6 электронов на внешнем уровне), но нам нужно, чтобы высший оксид имел формулу RO2, а такой элемент будет иметь высший оксид RO3)
Автор решения: Лунькова Е.Ю.
Задания для самостоятельной работы.
1. Электронная конфигурация 1s2 2s2 2p6 3s2 3p5 соответствует атому
1. Алюминия 2. Азота 3. Хлора 4. Фтора
2. Восьмиэлектронную внешнюю оболочку имеет частица
1. P3+ 2. Mg2+ 3. Cl5+ 4. Fe2+
3. Порядковый номер элемента, электронное строение атома которого 1s2 2s2 2p3, равен
1. 5 2. 6 3. 7 4. 4
4. Число электронов в ионе меди Cu2+ равно
1. 64 2. 66 3. 29 4. 27
5. Сходную конфигурацию внешнего энергетического уровня имеют атомы азота и
1. Серы 2. Хлора 3. Мышьяка 4. Марганца
6. Какое соединение содержит катион и анион с электронной конфигурацией 1s2 2s2 2p6 3s3 3p6?
1. NaCl 2. NaBr 3. KCl 4. KBr
7. Число электронов в ионе железа Fe2+ равно
1. 54 2. 28 3. 58 4. 24
8. Электронную конфигурацию инертного газа имеет ион
1. Cr2+ 2. S2- 3. Zn2+ 4. N2-
9. Сходную конфигурацию внешнего энергетического уровня имеют атомы фтора и
1. Кислорода 2. Лития 3. Брома 4. Неона
10. Элементу, электронная формула атома которого 1s2 2s2 2p6 3s2 3p4, соответствует водородное соединение
1. HCl 2. Ph4 3. h3S 4. Sih5
В данной заметке использовались задания из сборника ЕГЭ 2016-го года под редакцией А.А. Кавериной.
scienceforchildren.ru
Электронные конфигурации атомов химических элементов
Элементы в периодической таблице химических элементов Менделеева
Первоначально элементы в Периодической таблице химических элементов Д.И. Менделеева были расположены в соответствии с их атомными массами и химическими свойствами, но на самом деле оказалось, что решающую роль играет не масса атома, а заряд ядра и, соответственно, число электронов в нейтральном атоме.
Наиболее устойчивое состояние электрона в атоме химического элемента соответствует минимуму его энергии, а любое другое состояние называется возбужденным, в нем электрон может самопроизвольно переходить на уровень с более низкой энергией.
Рассмотрим, как распределяются электроны в атоме по орбиталям, т.е. электронную конфигурацию многоэлектронного атома в основном состоянии. Для построения электронной конфигурации пользуются следующими принципами заполнения орбиталей электронами:
— принцип (запрет) Паули – в атоме не может быть двух электронов с одинаковым набором всех 4-х квантовых чисел;
— принцип наименьшей энергии (правила Клечковского) – орбитали заполняют электронами в порядке возрастания энергии орбиталей (рис. 1).
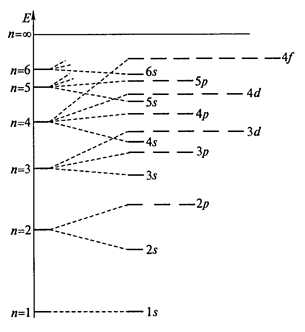
Рис. 1. Распределение орбиталей водородоподобного атома по энергиям; n – главное квантовое число.
Энергия орбитали зависит от суммы (n + l). Орбитали заполняются электронами в порядке возрастания суммы (n + l) для этих ортиталей. Так, для подуровней 3d и 4s суммы (n + l) будут равны 5 и 4, соответственно, вследствие чего, первой будет заполняться 4s орбиталь. Если сумма (n + l) одинакова для двух орбиталей, то первой заполняется орбиталь с меньшим значением n. Так, для 3d и 4p орбиталей сумма (n + l) будет равна 5 для каждой орбитали, но первой заполняется 3d орбиталь. В соответствии с этими правилами порядок заполнения орбиталей будет следующим:
1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s<5d<4f<6p<7s<6d<5f<7p
Семейство элемента определяется по орбитали, заполняемой электронами в последнюю очередь, в соответствии с энергией. Однако, нельзя записывать электронные формулы в соответствии с энергетическим рядом.
41Nb 1s22s22p63s23p63d104s24p64d35s2 правильная запись электронной конфигурации
41Nb 1s22s22p63s23p64s23d104p65s24d3 неверная запись электронной конфигурации
Для первых пяти d – элементов валентными (т.е., электроны, отвечающие за образование химической связи) являются сумма электронов на d и s, заполненных электронами в последнюю очередь. Для p – элементов валентными являются сумма электронов, находящихся на s и p подуровнях. Для s-элементов валентыми являются электроны, находящиеся на s подуровне внешнего энергетического уровня.
— правило Хунда – при одном значении l электроны заполняют орбитали таким образом, чтобы суммарный спин был максимальным (рис. 2)
Рис. 2. Изменение энергии у 1s -, 2s – 2p – орбиталей атомов 2-го периода Периодической системы.
Примеры построения электронных конфигураций атомов
Примеры построения электронных конфигураций атомов приведены в таблице 1.
Таблица 1. Примеры построения электронных конфигураций атомов
|
Элемент |
Электронная конфигурация |
Применяемые правила |
|
2He |
1s2 |
Принцип Паули, правила Клечковского |
|
3Li |
1s2s21 |
Принцип Паули, правила Клечковского |
|
7N |
1s22s22p3 |
Правило Хунда |
|
19K |
1s22s22p64s1 |
Правила Клечковского |
|
24Cr |
1s22s22p63d54s1 |
Правило Хунда, «проскок» электрона, т.к. симметричные конигурации d5 и d10 очень устойчивы |
|
57La |
[Xe]5d16s2 |
Указываются только валентные электроны, конфигурация внутренних электронов обозначается символом инертного газа |
Задания:
Напишите электронные конфигурации элементов с порядковыми номерами: 20, 33, 49.
Ответы:
20Ca 1s22s22p63s23p64s2
33As 1s22s22p63s23p63d104s24p3
49In 1s22s22p63s23p63d104s24p64d15s2
ru.solverbook.com
| www.litceymos.ru | 1 Задания А 1 (2013г) Строение электронных оболочек атомов элементов. Электронная конфигурация атома. Основное и возбужденное состояние атомов.
1) Al3+ и N3- 2) Са2+ и Cl5+ 3) S0 и Cl— 4) N3- и P3-
1) Р3+ 2) S2- 3) Cl5+ 4) Fe2+
1) Al3+ 2) Fe3+ 3) Zn2+ 4) Cr3+
1) Fe3+ 2) Cl— 3) Сu2+ 4) Fe2+
1) кремния 2) фосфора 3) серы 4) хлора
1) S4+ 2) S2- 3) Br5+ 4) Sn2+
1) S2- 2) S0 3) Р0 4) Р5+
1) 54 2) 28 3) 58 4) 24
1) Н3Р 2)NH3 3) H2S 4) CH4
1) Са2+ 2) К2+ 3) Сl +1 4) Sc0
1) Cl и Ar, 2) Cl— и Ar, 3) Cl— и F—, 4) Na+ и Ar
1) Al3+ и N3– 2) Ca2+ и Cl+5 3) S0 и Cl– 4) N3–и Р3–
|
www.litceymos.ru
