Экзаменационные билеты по химии (8 класс)
Пояснительная записка
Экзаменационные билеты по химии устной итоговой аттестации учащихся 8 класса составлены на основе государственного стандарта химического образования.
Основная цель: проверить выполнение государственного стандарта уровня подготовки учащихся.
Главные задачи: выявить подготовку химически и экологически грамотной личности, понимающей, что жизнь – это наивысшая ценность, овладевшей химическим и экологическим мышлением, освоившей основы химической культуры, овладевшей необходимыми методами изучения окружающих веществ, умеющей их применять на практике: ведения здорового образа жизни, охраны окружающей среды.
Требования к уровню подготовленности:
Знать / понимать
• химическую символику: знаки химических элементов, формулы химических веществ и уравнения химических реакций;
• важнейшие химические понятия: химический элемент, атом, молекула, относительные атомная и молекулярная массы, ион, химическая связь, вещество, классификация веществ, моль, молярная масса, молярный объем, химическая реакция, классификация реакций, электролит и неэлектролит, электролитическая диссоциация, окислитель и восстановитель, окисление и восстановление;
• основные законы химии: сохранения массы веществ, постоянства состава, периодический закон.
Уметь
называть: химические элементы, соединения изученных классов;
• объяснять: физический смысл атомного (порядкового) номера химического элемента, номеров группы и периода, к которым элемент принадлежит в периодической системе Д.И. Менделеева; закономерности изменения свойств элементов в пределах малых периодов
и главных подгрупп; сущность реакций ионного обмена;
• характеризовать: химические элементы (от водорода до кальция) на основе их положения в периодической системе Д.И.Менделеева и особенностей строения их атомов;
связь между составом, строением и свойствами веществ; химические свойства основных классов неорганических веществ;
• определять: состав веществ по их формулам, принадлежность веществ к определенному классу соединений, типы химических реакций, валентность и степень окисления элемента в соединениях, тип химической связи в соединениях, возможность протекания реакций ионного обмена;
• составлять: формулы неорганических соединений изученных классов; схемы строения атомов первых 20 элементов периодической системы Д.И.Менделеева; уравнения химических реакций;
• обращаться с химической посудой и лабораторным оборудованием;
• распознавать опытным путем: кислород, водород, углекислый газ, аммиак; растворы кислот и щелочей, хлорид -, сульфат -, карбонат — ионы;
• вычислять: массовую долю химического элемента по формуле соединения; массовую долю вещества в растворе; количество вещества, объем или массу по количеству вещества, объему или массе реагентов или продуктов реакции.
Использовать приобретенные знания и умения в практической деятельности и повседневной жизни для:
безопасного обращения с веществами и материалами;
экологически грамотного поведения в окружающей среде;
оценки влияния химического загрязнения окружающей среды на организм человека;
критической оценки информации о веществах, используемых в быту;
приготовления растворов заданной концентрации.
Весь материал — смотрите документ.
videouroki.net
Тесты к переводному экзамену по химии в 8 классе
Тесты к переводному экзамену по химии в 8 классе
Вариант 1
К каждому из заданий А1-А30 даны 4 варианта ответа, из которых только один правильный
Часть. А
А 1 Заряд ядра атома алюминия равен
1) +2;
2) +13;
3) +12;
4) +20; А 2 В ряду Ca(OH)2 → AI(OH)3→ H2SO4свойства гидроксидов изменяются от
1) амфотерных к основным;
2) кислотных к основным;
3) кислотных к амфотерных;
4) основных к кислотным;
А 3. Химическая связь в оксиде фосфора (Y)
1) ионная;
2) металлическая;
3) ковалентная неполярная;
4) ковалентная полярная
А 4 Валентность азота в соединениях NO2 и N2O5 соответственно равно
1) I и II
2) II и I
3) YIи II
4) IY и Y
А 5. К амфотерным оксидам относится вещество, формула которого
1) Mg(OH)2
2) MgSO4
3) HNO3
4) Fe2O3
А 6. В уравнении реакции между магнием и серной кислотой коэффициент перед формулой
серной кислоты равен
1) 1 3) 2
2) 3 4) 4
А 7. Какое из указанных уравнений соответствует реакции обмена
1) Mg O+HCI=MgCI2+H2O
2) S+O2=SO2
3) 2AgNO3+Mg=2Ag+Mg (NO3)2
4) 2 Fe (OH) 3=Fe2O3+3h3O
А 8. Алюминий реагирует с
1) оксидом магния
2) гидроксидом калия
3) цинком
4) хлоридом калия
А 9. Из приведённого перечня веществ: H2SO4, NaOH, CO2, H2О — с гидроксидом алюминия
реагирует
1) два
2) одно
3) три
4) четыре
А 10. Раствор серной кислоты реагирует с
1) оксидом углерода (IY)
2) оксидом кальция
3) серой
4) хлоридом калия
А 11. Раствор гидроксида натрия реагирует с
1) оксидом серы(IY)
2) водой
3) оксидом кальция
4) медью
А 12. Верны ли следующие суждения о правилах работы в химической лаборатории
А Простое вещество нельзя получить в результате реакции соединения.
Б При физических явлениях изменяется агрегатное состояние и форма
1) верно только. А
2) верно только. Б
3) верны оба суждения
4) оба суждения не верны
А 13. В соединении Na2SO3 окисления серы
1) +4;
2) +6;
3) +2;
4) +1;
А 14. Наименьший радиус у атома
1) AI;
2) В;
3) Ga;
4) Sr;
А 15. Вещество H3PO4-это
1) соль;
2) кислота;
3) основание;
4) оксид;
А 16. Формула хлорида меди (I)-это
1) CuCI;
2) CuСI2;
3) СuCIO;
4) СuCIO3;
А 17. 2 моль кислорода (O2) занимают объём … л (н.у)
1) 67,2
2) 22,4
3) 44,8
4) 64
А 18. Распределение электронов по слоям 2, 8, 8.1 имеет атом
1) Mg
2) S
3) Ca
4) К
А 19. 24,5г фосфорной кислоты составляют … моль
1) 12) 0,25
3) 0,5
4) 5
А 20. Запись 2 H2 означает
1) молекулу водорода
2) две молекулы водорода
3) два атома водорода
4) молекулу воды
А 21. Ковалентная неполярная связь осуществляется в веществе
1) h3SO4
2) Р
3) SО2
4) NaBr
А 22. В веществе состава ЭO элемент Э – это
1) K
2) AI
3) H
4) Ca
А 23. Кислотные оксиды – это
1) P2O5 и СO2
2) Li2O и h3O
3) CaO и NO2
47) SO3 и CuO
А 24. В уравнении реакции между оксидом железа (III) и серной кислотой отношение
коэффициентов перед формулами реагирующих веществ соответственно равно
1) 1: 3
2) 1: 2
3) 2: 3
4) 1:1
А 25. Число электронов во внешнем электронном слое атома фосфора
1) 12
2) 4
3) 5
4) 1
А 26. В формуле сульфата алюминия индексы при символе алюминия и кислотном остатке равны соответственно
1) 1 и 2
2) 2 и 3
3) 1 и 3
4) 3 и 1
А 27.Магний реагирует с
1) серной кислотой
2) медью
3) сульфатом натрия
4) оксидом углерода(IY)
А 28Ядро состоит из
1) протонов, нейтронов и электронов
2) протонов и электронов
3) нейтронов и электронов
4) протонов и нейтронов
А 29. Массовая кислорода в воде равна
1) 10,5%
2) 88,88
3) 33,2%
4) 44,1%
А 30 Соли калия, имеющие формулы K3PO4, KNO3 , KCI, называются
1) нитрит, хлорид, фосфид
2) нитрат, хлорат, фосфат
3) нитрид, хлорат, фосфид
4) фосфат, нитрат, хлорид,
Часть. Б
При выполнении заданий В1 и В4 из предложенного перечня ответов выберите два правильных и обведите их номера. Цифры выбранных ответов запишите в указанном месте без дополнительных символов
В 1. В ряду химических элементов N—P—As
1) уменьшаются радиусы атомов
2) увеличиваются радиусы атомов
3) увеличиваются число электронов на внешнем электронном слое
4) увеличиваются число электронных слоёв
5) увеличивается электроотрицательность
Ответ:__________________
B 2. Химические реакции возможны между
1) K2O и H2SO4
2) CaO и NaOH
3) CuO и MgO
4) SO2 и H2O
5) Cu и h3S
Ответ: ___________________
В 3.В реакцию с раствором соляной кислоты вступают
медь
алюминий
оксид калия
сульфат натрия
Ответ: ___________________
В 4. С раствором гидроксида натрия реагируют
1) азотная кислота
2) оксид фосфора (Y)
3) гидроксид магния
4) углерод
5) оксид меди ( II)
Ответ:_____________________
Часть. С
С 1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Na→Na2O→X→Na3PO4
C 2. Какая масса нитрата магния образуется при взаимодействии оксида магния и 196 г азотной кислоты.
Тесты к переводному экзамену по химии в 8 классе.
Вариант 2
К каждому из заданий А1-А30 даны 4 варианта ответа, из которых только один правильный
Часть. А
А 1 Заряд ядра атома калия равен
1) +19;
2) +13;
3) +12;
4) +20; А 2 В ряду AI(OH) →3 Ca(OH)2 → H2SO4свойства гидроксидов изменяются от
1) амфотерных к кислотным;
2) кислотных к основным;
3) кислотных к амфотерных;
4) основных к;
А 3. Химическая связь в оксиде магния
1) ионная;
2) металлическая;
3) ковалентная неполярная;
4) ковалентная полярная
А 4 Валентность углерода в соединениях СO2 и Na2CО3соответственно равно
1) I и II
2) II и I
3) IYи IY
4) IY и II
А 5. К солям относится вещество, формула которого
1) SO3
2) MgSO4
3) HNO3
4) Fe2O3
А 6. В уравнении реакции между гидроксидом магния и фосфорной кислотой коэффициент перед формулой фосфорной кислоты равен
1) 1 3) 2
2) 3 4) 4
А 7. Какое из указанных уравнений соответствует реакции разложения
1) MgO +2HCI=MgCI2+H2O
2) S+O2=SO2
3) 2AgNO3+Mg=2Ag+Mg (NO3)2
4) 2 Fe (OH) 3=Fe2O3+3h3O
А 8. Медь реагирует с
1) оксидом магния
2) соляной кислотой
3) цинком
4) хлоридом ртути
А 9. Из приведённого перечня веществ: H2SO4, NaOH, CO2, K2O, H2O— с оксидом серы(YI)
реагирует
1) два
2) одно
3) три
4) четыре
А 10. Раствор серной кислоты реагирует с
1) оксидом углерода (IY)
2) оксидом кальция
3) серой
4) хлоридом натрия
А 11. Раствор гидроксида кальция реагирует с
1) гидроксидом магния
2) водой
3) оксидом серы(YI)
4) медью
А 12. Верны ли следующие суждения о правилах работы в химической лаборатории
А Простое вещество нельзя получить в результате реакции соединения.
Б При физических явлениях изменяется агрегатное состояние и форма
1) верно только. А
2) верно только. Б
3) верны оба суждения
4) оба суждения не верны
А 13. В соединении К3PO4 окисления фосфора
1) +4;
2) +6;
3) +5;
4) +1;
А 14. Наименьший радиус у атома
1) AI;
2) Mg;
3) P;
4) Si;
А 15. Вещество Mg3(PO4)2-это
1) соль;
2) кислота;
3) основание;
4) оксид;
А 16. Формула хлорида меди (II)-это
1) CuCI;
2) CuСI2;
3) СuCIO;
4) СuCIO3;
А 17. 2 моль кислорода (N2) занимают объём … л (н.у)
1) 67,2
2) 22,4
3) 44,8
4) 64
А 18. Распределение электронов по слоям 2, 8, 2 имеет атом
1) Mg
2) S
3) Ca
4) К
А 19. 24,5г фосфорной кислоты составляют … моль
1) 1
2) 0,25
3) 0,5
4) 5
А 20. Запись 2 H2 означает
1) молекулу водорода
2) две молекулы водорода
3) два атома водорода
4) молекулу воды
А 21. Ковалентная полярная связь осуществляется в веществе
1) h3SO4
2) Р
3) SО2
4) NaBr
А 22. В веществе состава ЭO3 элемент Э – это
1) K
2) AI
3) S
4) Ca
А 23. Кислотные оксиды – это
1) P2O5 и СaO
2) Li2O и h3O
3) CaO и NO2
4) SO3 и P2O5
А 24. В уравнении реакции между оксидом железа (II) и азотной кислотой отношение
коэффициентов перед формулами реагирующих веществ соответственно равно
1) 1: 3
2) 1: 2
3) 2: 3
4) 1:1
А 25. Число электронов во внешнем электронном слое атома кремния
1) 12
2) 4
3) 5
4) 1
А 26. В формуле фосфата калия индексы при символе калия и кислотном остатке равны соответственно
1) 1 и 2
2) 2 и 3
3) 1 и 3
4) 3 и 1
А 27.Ртуть реагирует с
1) серной кислотой
2) медью
3) хлоридом серебра
4) оксидом углерода(IY)
А 28. Массовая кислорода в воде равна
1) 88,88
2) 10,5%
3) 33,2%
4) 44,1%
А 29. Соли калия, имеющие формулы K2SO4, KNO3,3PO4 называются
1) нитрит, хлорид, фосфид
2) сульфат, нитрат, фосфат
3) нитрид, хлорат, фосфид
4) фосфат, нитрат, хлорид,
А 30. Число электронных слоёв в атоме равно
1) номеру группы
2) порядковому номеру
3) номеру периода
4) 8- номер группы
Часть. Б
При выполнении заданий В1 и В4 из предложенного перечня ответов выберите два правильных и обведите их номера. Цифры выбранных ответов запишите в указанном месте без дополнительных символов
В 1. В ряду химических элементов N—P—As
1) уменьшаются радиусы атомов
2) увеличиваются радиусы атомов
3) увеличиваются число электронов на внешнем электронном слое
4) увеличиваются число электронных слоёв
5) увеличивается электроотрицательность
Ответ:__________________
B 2. Химические реакции возможны между
1) K2O и MgO
2) CaO и H2SO4
3) Cu(OH)2 и MgO
4) SO2 и K2O
5) Cu и h3S
Ответ: ___________________
В 3.В реакцию с раствором соляной кислоты вступают
медь
алюминий
оксид углероды (IY)
оксид магния
сульфат натрия
Ответ: ___________________
В 4. С раствором гидроксида натрия реагируют
1) азотная кислота
2) оксид азота (Y)
3) гидроксид магния
4) углерод
5) оксид меди ( II)
Ответ: _____________________
Часть. С
С 1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Mg→ Х→ Mg(OH)→MgO
C 2. Какая масса сульфата алюминия образуется при взаимодействии гидроксида алюминия и
24,5 г серной кислоты.
Тесты к переводному экзамену по химии в 8 классе.
Вариант 3
К каждому из заданий А1-А30 даны 4 варианта ответа, из которых только один правильный
Часть. А
А 1 Заряд ядра атома хлора равен
1) +19;
2) +13;
3) +17;
4) +20; А 2 В ряду NaOH → Zn(OH)2 → H2SO3свойства гидроксидов изменяются от
1) амфотерных к кислотным;
2) кислотных к основным;
3) кислотных к амфотерных;
4) основных к кислотным;
А 3. Химическая связь в азотной кислоте
1) ионная;
2) металлическая;
3) ковалентная неполярная;
4) ковалентная полярная
А 4 Валентность углерода в соединениях SO2 и SO3 соответственно равно
1) I и II
2) II и I
3) YIи II
4) IY и YI
А 5. К кислотным оксидам относится вещество, формула которого
1) SO3
2) MgSO4
3) HNO3
4) Fe2O3
А 6. В уравнении реакции между оксидом магния и серной кислотой коэффициент перед
формулой серной кислоты равен
1) 1 3) 2
2) 3 4) 4
А 7. Какое из указанных уравнений соответствует реакции замещения
1) MgO +2HCI=MgCI2+H2O
2) S+O2=SO2
3) 2AgNO3+Mg=2Ag+Mg (NO3)2
4) 2 Fe (OH) 3=Fe2O3+3h3O
А 8. Медь реагирует с
1) оксидом магния
2) гидроксидом калия
3) цинком
4) хлоридом серебра
А 9. Из приведённого перечня веществ: H2SO4, NaOH, CO2, CuО — с гидроксидом натрия
реагирует
1) два
2) одно
3) три
4) четыре
А 10. Раствор серной кислоты реагирует с
1) оксидом углерода (IY)
2) гидроксидом кальция
3) серой
4) хлоридом натрия
А 11. Раствор гидроксида кальция реагирует с
1) азотной кислотой
2) водой
3) оксидом кальция
4) медью
А 12. Верны ли следующие суждения о правилах работы в химической лаборатории
А Простое вещество нельзя получить в результате реакции соединения.
Б При физических явлениях изменяется агрегатное состояние и форма
1) верно только. А
2) верно только. Б
3) верны оба суждения
4) оба суждения не верны
А 13. В соединении Na3PO4 окисления фосфора
1) +4;
2) +6;
3) +5;
4) +1;
А 14. Наибольший радиус у атома
1) AI;
2) Mg;
3) P;
4) Si;
А 15. Вещество Mg(OH)2-это
1) соль;
2) кислота;
3) основание;
4) оксид;
А 16. Формула хлорида меди (II)-это
1) CuCI;
2) CuСI2;
3) СuCIO;
4) СuCIO3;
А 17. 2 моль азота (N2) занимают объём … л (н.у)
1) 67,2
2) 22,4
3) 44,8
4) 64
А 18. Распределение электронов по слоям 2, 8, имеет атом
1) Ne
2) S
3) Ca
4) К
А 19. 196 г фосфорной кислоты составляют … моль
1) 1
2) 0,25
3) 0,5
4) 2
А 20. Запись H2 означает
1) молекулу водорода
2) две молекулы водорода
3) два атома водорода
4) молекулу воды
А 21. Ковалентная неполярная связь осуществляется в веществе
1) h3SO4
2) O2
3) SО2
4) NaBr
А 22. В веществе состава ЭO2 элемент Э – это
1) K
2) AI
3) S
4) C
А 23. Кислотные оксиды – это
1) P2O5 и СaO
2) Li2O и h3O
3) CaO и NO2
4) SO3 и P2O5
А 24. В уравнении реакции между оксидом железа (II) и соляной кислотой отношение
коэффициентов перед формулами реагирующих веществ соответственно равно
1) 1: 3
2) 1: 2
3) 2: 3
4) 1:1
А 25. Число электронов во внешнем электронном слое атома натрия
1) 12
2) 4
3) 5
4) 1
А 26. В формуле фосфата магния индексы при символе магния и кислотном остатке равны соответственно
1) 1 и 2
2) 2 и 3
3) 1 и 3
4) 3 и 2
А 27.Ртуть реагирует с
1) серной кислотой
2) медью
3) хлоридом серебра
4) оксидом углерода(IY)
А 28 Ядро состоит из
1) протонов, нейтронов и электронов
2) протонов и электронов
3) нейтронов и электронов
4) протонов и нейтронов
А 29. Массовая кислорода в воде равна
1) 10,5%
2) 88,88
3) 33,2%
4) 44,1%
А 30. Соли калия, имеющие формулы KCI, KNO3, К3PO4 называются
1) нитрит, хлорид, фосфид
2) хлорид, нитрат, фосфат
3) нитрид, хлорат, фосфид
4) фосфат, нитрат, хлорид,
Часть. Б
При выполнении заданий В1 и В4 из предложенного перечня ответов выберите два правильных и обведите их номера. Цифры выбранных ответов запишите в указанном месте без дополнительных символов
В 1. В ряду химических элементов N—P—As
1) уменьшаются радиусы атомов
2) увеличиваются радиусы атомов
3) увеличиваются число электронов на внешнем электронном слое
4) увеличиваются число электронных слоёв
5) увеличивается электроотрицательность
Ответ:__________________
B 2. Химические реакции возможны между
1) K2O и MgO
2) CaO и H2SO4
3) Cu(OH)2 и MgO
4) SO2 и Mg
5) Cu и h3S
Ответ: ___________________
В 3.В реакцию с раствором соляной кислоты вступают
медь
алюминий
оксид углероды (IY)
оксид магния
сульфат натрия
Ответ: ___________________
В 4. С раствором гидроксида натрия реагируют
1) азотная кислота
2) оксид азота (Y)
3) гидроксид магния
4) углерод
5) оксид меди ( II)
Ответ: _____________________
Часть. С
С 1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
P→P2O5 →X→Na3PO4
C 2. Какая масса нитрата алюминия образуется при взаимодействии гидроксида алюминия и
32,5 г азотной кислоты.
kopilkaurokov.ru
Билеты к экзамену по химии за курс 8 класса
На листах экзаменационных билетов любые пометки ЗАПРЕЩЕНЫ!
Экзамен по химии за II семестр
8 класс
БИЛЕТ №1
При разложении 21 г карбоната двухвалентного металла выделилось 5,6 литра СО2 (н. у.). Установите формулу соли.
Плотность по водороду газовой смеси оксида азота(II) и оксида азота(IV) равна 20. Определите объемные доли газов в указанной смеси.
Классификация химических реакций. Выберите реакции разложения:
CaCO3 → CaO + CO2
Na2O + CO2 → Na2CO3
Ag2O → Ag + O2
(Nh5)2Cr2O7 → N2 + Cr2O3 + h3O
CuSO4 + Zn → ZnSO4 + Cu
AgNO3 + NaCl → AgCl + NaNO3
Расставьте коэффициенты, где это необходимо. Объясните вероятность образования именно таких продуктов.
Дайте определение понятию: «растворитель». Опишите механизм растворения сульфата меди (II).
Определите массовую долю глюкозы в растворе, полученном при смешивании 40 г глюкозы и 500 г воды.
Напишите уравнения реакции в молекулярном и сокращенном ионном виде, позволяющих обнаружить хлорид-анион в водном растворе.
Экзамен по химии за II семестр
8 класс
БИЛЕТ №2
При разложении карбоната двухвалентного металла образовалось 10 г его оксида и 2,8 л углекислого газа. Установите металл, входящий в состав карбоната.
Определить объем хлора, который можно получить при действии концентрированной соляной кислоты на 31,5 г перманганата калия при нормальных условиях.
Схема протекающей реакции: HCl + KMnO4 → KCl + MnCl2 + Cl2 + h3O
Что такое окислительно-восстановительные реакции (ОВР)? Выберите из перечня только ОВР и расставьте в них коэффициенты методом электронного баланса:
CaCO3 → CaO + CO2
Na2O + CO2 → Na2CO3
Ag2O → Ag + O2
(Nh5)2Cr2O7 → N2 + Cr2O3 + h3O
CuSO4 + Zn → ZnSO4 + Cu
AgNO3 + NaCl → AgCl + NaNO3
Дайте определение понятию: «насыщенный раствор». Опишите механизм растворения хлороводорода.
Определите массовую долю соли в растворе, полученном при смешивании 40 г 40%-го ее раствора с 500 г воды.
Напишите уравнения реакции в молекулярном и сокращенном ионном виде, позволяющих обнаружить сульфат-анион в водном растворе.
Экзамен по химии за II семестр
8 класс
БИЛЕТ №3
Некоторый металл М, массой 6,4 г при прокаливании на воздухе образует оксид состава МО массой 8 г. Определите данный металл.
Определить объем хлора, который необходим для получения из простых веществ 100 л хлороводорода.
Что называют реакциями ионного обмена? Выберите из перечня только схемы ионообменных реакций, запишите для них сокращенные ионные уравнения:
CaCO3 → CaO + CO2
NaOH + CO2 → Na2CO3 + h3O
CuSO4 + BaCl2 → BaSO4 + CuCl2
(Nh5)2Cr2O7 → N2 + Cr2O3 + h3O
CuSO4 + Zn → ZnSO4 + Cu
NaOH + h4PO4 → Na3PO4 + h3O
Дайте определение понятию: «гидратация». Опишите механизм растворения натрия в воде.
Из 5л раствора гидроксида калия с массовой долей КОН 50% и плотностью 1,538 кг/л необходимо приготовить раствор с массовой долей КОН 18%. Какой объём воды необходимо использовать?
Напишите уравнения всех известных вам реакций, позволяющих обнаружить йодид-анион в водном растворе.
Экзамен по химии за II семестр
8 класс
БИЛЕТ №4
Катион некоторого металла М массой 13,7 г можно осадить в виде сульфата состава 1:1, при этом, для полного его осаждения необходимо 9,6 г сульфат-анионов. Определите, о каком металле идет речь.
Определить объем кислорода, необходимый для взрыва водорода массой 10 г.
Каковы условия протекания реакций ионного обмена? Выберите из перечня только схемы ионообменных реакций, протекание которых возможно. Запишите для них сокращенные ионные уравнения:
CaCO3 + HCl → CaCl2 + CO2 + h3O
Na2O + CO2 → Na2CO3
KI + BaCl2 → BaI2 + KCl
(Nh5)2Cr2O7 + BaCl2 → BaCr2O7 + Nh5Cl
CuSO4 + Zn → ZnSO4 + Cu
NaOH + h3SeO4 → Na2SeO4 + h3O
Дайте определение понятию: «кристаллогидрат». Опишите механизм растворения молекулярного азота в воде.
Упарили вдвое 2 кг 10% раствора хлорида натрия (плотность 1 г/мл). Определите молярную концентрацию полученного раствора.
Напишите уравнения всех известных вам реакций, позволяющих обнаружить катион бария в водном растворе.
Экзамен по химии за II семестр
8 класс
БИЛЕТ №5
Катион некоторого двухвалентного металла М массой 20,7 г можно осадить в виде йодида желтого цвета, при этом образуется 46,1 г осадка. Определите, о каком металле идет речь.
Определите массу осадка, образующегося при смешивании 100 г 10%-го раствора NaOH и 100 г 5%-го раствора CuSO4.
Приведите примеры слабых кислот. Выберите из перечня только схемы ионообменных реакций, протекание которых возможно. Запишите для них сокращенные ионные уравнения:
CaCO3 + HCl → CaCl2 + CO2 + h3O
Na2O + CO2 → Na2CO3
KI + BaCl2 → BaI2 + KCl
(Nh5)2Cr2O7 + BaCl2 → BaCr2O7 + Nh5Cl
CuSO4 + Zn → ZnSO4 + Cu
NaOH + h3SeO4 → Na2SeO4 + h3O
Дайте определение понятию: «осадок». Опишите механизм взаимодействия хлорида натрия и нитрата серебра в водном растворе.
Определите массу сульфат-анионов, присутствующих в 100 г 9,8%-го раствора серной кислоты.
Напишите уравнения всех известных вам реакций, позволяющих обнаружить катион свинца в водном растворе.
Экзамен по химии за II семестр
8 класс
БИЛЕТ №6
Определите количество молекул воды, приходящихся на 1 часть сульфата железа (II) в железном купоросе (FeSO4 ∙ xh3O), если при прокаливании 100 г железного купороса образуется 45,3 г воды.
В 100 г воды попеременно вносили, добиваясь полного растворения, 1 г йодида натрия и 1 г нитрата свинца. Определите массу выпавшего осадка.
Каковы условия протекания реакций между металлом и раствором соли? Выберите из перечня только схемы реакций замещения, которые осуществимы практически. Укажите восстановитель в каждой реакции:
CaCO3 + HCl → CaCl2 + CO2 + h3O
Na2O + CO2 → Na2CO3
KI + Cl2 → KCl + I2
Zn + BaCl2 → Ba + ZnCl2
CuSO4 + Zn → ZnSO4 + Cu
HgSO4 + Cu → CuSO4 + Hg
Дайте определение понятию: «ион». Составьте полное и сокращенное ионные уравнения реакции взаимодействия хлорида магния и гидроксида бария.
Определите массу катионов водорода, присутствующих в 100 г 9,8%-го раствора серной кислоты.
Напишите уравнения всех известных вам реакций, позволяющих обнаружить катион железа (III) в водном растворе.
Экзамен по химии за II семестр
8 класс
БИЛЕТ №7
Определите формулу глауберовой соли (X2SO4 ∙ 10h3O), если при прокаливании 322 г этой соли образуется 180 г воды.
В 100 г воды попеременно вносили, добиваясь полного растворения, 1 г йодида натрия и 1 г нитрата свинца. Определите массовую долю нитрата свинца в образовавшемся растворе.
Каковы условия протекания реакций между металлом и раствором кислоты? Выберите из перечня только схемы реакций замещения, которые осуществимы практически. Укажите окислитель в каждой реакции:
CaCO3 + HCl → CaCl2 + CO2 + h3O
Na2O + CO2 → Na2CO3
KI + Cl2 → KCl + I2
Zn + BaCl2 → Ba + ZnCl2
CuSO4 + Zn → ZnSO4 + Cu
ZnSO4 + Mg → MgSO4 + Zn
Дайте определение понятию: «кислота». Что вы можете рассказать об угольной кислоте?
Определите молярную концентрацию молекул воды в 1 ее литре.
В чем суть метода кислотно-основного титрования?
Экзамен по химии за II семестр
8 класс
БИЛЕТ №8
Определите состав карналлита (MgCl2∙KCl∙xh3O), если при прокаливании 277,5 г этой соли потеря в массе составила 108 г.
В 100 г воды внесли 1 г гидросульфата натрия. Определите молярную концентрацию соли в образовавшемся растворе, принимая плотность раствора равным 1 г/мл.
Каков механизм работы индикатора? Выберите из перечня схемы только тех реакций, в растворе которых фенолфталеин приобретет малиновую окраску. Взаимодействие между веществами считать эквивалентным:
CaCO3 + HCl → CaCl2 + CO2 + h3O
Na2O + h3O → NaOH
KI + Cl2 → KCl + I2
NaOH + CO2 → Na2CO3 + h3O
CuSO4 + Zn → ZnSO4 + Cu
NaHCO3 + NaOH → Na2CO3 + h3O
Дайте определение понятию: «основание». Как называются реакции взаимодействия щелочи и кислоты?
Определите молярную концентрацию хлорид-ионов в 0,5 моль/л соляной кислоте.
Как различить склянки с растворами хлорида натрия и азотной кислоты? Напишите необходимые реакции.
Экзамен по химии за II семестр
8 класс
БИЛЕТ №9
Определите состав гипса (CaSO4∙xh3O), если после прокаливания 172 г этой соли образовалось 136 г безводного сульфата кальция.
Определите количество молекул воды в 1 ее литре.
Какие частицы передаются при протекании окислительно-восстановительных реакций (ОВР)? Выберите из перечня схемы только ОВР. Укажите окислитель и восстановитель:
CaCO3 + HCl → CaCl2 + CO2 + h3O
Na2O + h3O → NaOH
KI + Cl2 → KCl + I2
NaOH + HCl → NaCl + h3O
Cu + h3SO4 → CuSO4 + SO2 + h3O
Na + h3O → NaOH + h3
Дайте определение понятию: «соль». Опишите механизм растворения солей в воде.
Определите молярную концентрацию ионов водорода в 0,05 моль/л серной кислоте.
Как различить порошки сульфата бария и сульфата магния?
Экзамен по химии за II семестр
8 класс
БИЛЕТ №10
Определите состав соды (X2CO3∙yh3O), если известно, что в 286 граммах соды содержится 180 г воды.
Определите количество молекул воды, которая образуется при растворении 10 г NaOH в соляной кислоте.
Выберите из перечня схемы только реакций ионного обмена. Запишите для них сокращенные ионные уравнения.
CaCO3 + HCl → CaCl2 + CO2 + h3O
Na2O + h3O → NaOH
KI + Cl2 → KCl + I2
NaOH + HCl → NaCl + h3O
Cu + h3SO4 → CuSO4 + SO2 + h3O
NaHCO3 + NaOH → Na2CO3 + h3O
Дайте определение понятию: «электролит». Отметьте основные положения теории электролитической диссоциации.
Определите молярную концентрацию ионов калия, если в 100 мл воды растворили 0,745 г хлорида калия.
Как различить растворы соляной и серной кислот?
xn--j1ahfl.xn--p1ai
Переводной экзамен по химии 8 класс
Вариант 1.
Часть 1
При выполнении заданий 1–8 выберите один правильный ответ
1. Ядро атома алюминия (27Al) образовано
1) 14 протонами и 13электронами 3) 13 протонами и 14 нейтронами
2) 14 протонами и 13 нейтронами 4) 13 нейтронами и 14 электрона
2. Массовая доля серы в сернистой кислоте равна
1) 18,0% 2) 24,5% 3) 39,0% 4) 65,2%
3. Высшую степень окисления хлор имеет в соединении
1) KClO3 2) CaCl2 3) Nh5Cl 4) KClO4
4. Гидроксид бария реагирует с каждым из двух веществ:
1) HCl и KNO3 3) Na2SO4 и FeCl3
2) CO2 иCa(OH)2 4) SiO2 и CuO5. Порядковый номер элемента соответствует
1) высшей валентности атома 3) числу нейтронов в ядре
2) числу электронов в атоме 4) числу электронных уровней в атоме
6. Ковалентная неполярная связь в молекуле:
1) Ph4 2) P4 3) NaBr 4) h3O
7. В каком ряду химических элементов усиливаются неметаллические свойства соответствующих им простых веществ?
1) барий→магний→кальций 3) литий→натрий→калий
2) германий→кремний→углерод 4) кислород→азот→углерод
8. Признаком протекания химической реакции между карбонатом магния и соляной кислотой является
1) образование осадка 3) изменение цвета
2) выделение газа 4) появление запаха
При выполнении заданий 9, 10 к каждому элементу первого столбца подберите
соответствующий элемент из второго столбца.
9. Установите соответствие между формулой вещества и классом веществ, к которому оно относится.
ФОРМУЛА ВЕЩЕСТВА КЛАСС (ГРУППА) ВЕЩЕСТВ
А) K2O
Б) Fe(OH)2
В) Na2SO4
Г) SO2
1) кислотный оксид
2) щёлочь
3) основной оксид
4) соль
5) нерастворимое основание
10. Установите соответствие между исходными веществами и продуктами реакции
ИСХОДНЫЕ ВЕЩЕСТВА ПРОДУКТЫ РЕАКЦИИ
А) CaO + h3O
Б) K2CO3 + Ca(OH)2
В) SO2 + KOH
Г) KOH + h3SO4 1) CaCO3 + KOH
2) K2SO3 + h3O
3) Ca(OH)2
4) K2SO4 + h3O
5) Ca(OH)2 + h3
Часть 2
11. С какими из указанных веществ реагирует гидроксид натрия: оксид калия, оксид углерода(IV), гидроксид бария, серная кислота, хлорид меди (II). Составьте уравнения возможных реакций. Для реакций ионного обмена напишите уравнения в полном и сокращенном виде.
12. Какую массу соли нужно растворить в 270 г воды для получения 10 % раствора.
Вариант 2.
Часть 1
При выполнении заданий 1–8 выберите один правильный ответ
1. Ядро атома фосфора (31Р) образовано
1) 15 протонами и 16 электронами 3) 15 протонами и 16 нейтронами
2) 16 протонами и 15 нейтронами 4) 15 нейтронами и 16 электронами
2. Массовая доля кислорода в фосфорной кислоте равна
1) 3,1% 2) 31,6% 3) 16,3% 4) 65,3%
3. Степень окисления — 4 углерод проявляет в соединении
1) K2CO3 2) CCl4 3) Al4C3 4) CO2
4. Раствор хлороводородной кислоты реагирует с каждым из двух веществ:
1) CuO и KNO3 3) h3SO4 и Fe2O3
2) AgNO3 и Ca(OH)2 4) SiO2 и MgO5. Номер периода периодической системы определяет
1) высшую валентность атома 3) число протонов в ядре
2) число электронов в атоме 4) число электронных уровней в атоме
6. Ионная связь в молекуле:
1) SO2 2) N2 3)K2O 4)h3SO4
7. У какого из указанных химических элементов наибольший атомный радиус
1) кислород 2) сера 3) фтор 4) хлор
8. Признаком протекания химической реакции между гидроксидом железа (II) и соляной кислотой является
1) образование осадка 3) растворение осадка
2) выделение газа 4) появление запаха
При выполнении заданий 9, 10 к ка
weburok.com
Билеты по химии 8 класс
Просмотр содержимого документа
«Билеты по химии 8 класс»
Билеты по химии 8 класс
Автор: Г.Е Рудзитис
Учитель: Дерюгина О.Ю.
Билет №1.
1. Предмет химии. Вещества и их свойства. 2. Продемонстрировать химические свойства гидроксида калия. Билет №2. 1. Оксиды: классификация и свойства. 2. Определить относительную молекулярную массу азотной кислоты и сульфата алюминия.
Билет №3. 1. Соли: классификация и свойства. 2. Найти массу для: а) 1,2 моль азотной кислоты. б) 4,8 моль гидроксида калия
Билет №4. 1. Состав атома и атомного ядра. Изотопы. 2. Написать уравнения реакций разложения при нагревании: 1) гидроксида железа (III), 2) карбоната кальция, 3) гидроксида меди (II). Доказать опытным путем.
Билет №5. 1. Кислоты, классификация и свойства. 2. Найти массу: а) 0,75 моль азота; б) 1,45 моль глюкозы C6H12O6.
Билет №6. 1. Типы химических связей: ионная, ковалентная (полярная и неполярная), металлическая. Примеры. 2. Какое количество вещества соответствует 9,8 г H3PO4? Билет №7. 1. Признаки химических реакций (Привести примеры). Реакции экзо – и эндотермические. 2. Написать строение электронных оболочек первых 20 химических элементов.
Билет №8. 1. Твердые вещества: аморфные и кристаллические. Кристаллические решётки. 2. Определить относительную молекулярную массу серной кислоты, гидроксида алюминия.
Билет №9. 1. Явления физические и химические. Привести примеры.
2. Составить химические формулы кислот, соответствующих следующим оксидам: P2O5 , SO2,CO2.
Билет №10. 1. Количество вещества. Моль. Молярная масса. 2. Какой объем водорода (н.у.) образуется при взаимодействии соляной кислоты с 540 г алюминия? Какое количество вещества соли при этом получается?
Билет №11. 1. Основания, классификация и свойства. 2. Какой объем займут при н.у. 17 г сероводорода? Билет №12. 1. Кислород, его общая характеристика и нахождение в природе. Свойства кислорода. 2.Определите степень окисления марганца в соединениях: K2MnO4, KMnO4 ?
Билет №13. 1. Типы химических реакций: разложение, соединение, замещение, обмен. Примеры. 2. Продемонстрировать химические свойства гидроксида натрия.
Билет №14. 1. Валентность. Определение валентности атомов в соединениях. 2. Какое количество вещества соответствует 750г сернистой кислоты?
Билет №15. 1. Массовая доля растворенного вещества в растворе. 2. Сколько неспаренных электронов имеют атомы серы, хлора? Запишите схему образования связи для молекул серы и хлора.
Билет №16. 1. Закон сохранения массы веществ. Уравнения химических реакций. 2. Осуществить цепочку превращений:: Li Li2O LiOH Li2NO3.
Билет №17. 1. Горение и медленное окисление. Тепловой эффект химических реакций. 2. Записать формулу сахара, если известно, что в состав его молекулы входят двенадцать атомов углерода, двадцать два атома водорода и одиннадцать атомов кислорода. Найти его относительную молекулярную массу.
Билет №18. 1. Вода — растворитель. Растворы. Насыщенные и ненасыщенные растворы. 2. Какова масса оксида железа (III) – Fe2O3, взятого количеством 0,25 моль?
Билет №19. 1. Водород, его общая характеристика. Свойства водорода. 2. Определить валентность элементов по формулам их соединений: CuO, SO3, Fe2O3, K2СО3, Н2СО3, KOH. Назвать все вещества. Билет №20. 1. Физические и химические свойства воды. Круговорот воды в природе.
2. Продемонстрировать химические свойства соляной кислоты. Билет №21. 1. Степень окисления. Определение степени окисления атома в соединении. 2. Какова масса оксида железа (III) – Fe2O3, взятого количеством 0,25 моль? Билет №22. 1. Значение химии в народном хозяйстве и жизни человека. 2. Какой объем водорода (н.у.) образуется при взаимодействии соляной кислоты с 540 г алюминия? Какое количество вещества соли при этом получается?
multiurok.ru
Вопросы к экзамену по химии. 8 класс
Простые и сложные вещества. Вещества молекулярного и немолекулярного строения.
Закон постоянства состава вещества. Атомно-молекулярное учение.
Масса атома. Относительная единица массы. Относительная атомная масса элемента. Относительная молекулярная масса вещества. Массовая доля химического элемента в веществе.
Периодическая система химических элементов Д.И.Менделеева. Классификация химических элементов. Открытие периодического закона.
Валентность. Определение валентности в бинарных соединениях. Составление формул по валентности.
Количество вещества. Моль. Молярная масса вещества.
Химическая реакция. Признаки и условия протекания химических реакций. Классификация химических реакций по тепловому эффекту.
Законы сохранения массы и энергии. Составление уравнений химических реакций. Типы химических реакций.
Методы науки химии.
Чистые вещества и смеси. Получение чистых веществ из природных смесей.
Методы очистки веществ.
Растворы. Растворимость.
Химическая технология. Получение веществ с заданными свойствами.
Газы. Законы Авогадро и Гей-Люсака. Относительная плотность газов.
Кислород. Химические свойства и получение кислорода.
История открытия кислорода. Процессы горения и медленного окисления.
Оксиды. Классификация и номенклатура. Химические свойства.
Основания. Классификация и номенклатура. Химические свойства.
Кислоты. Классификация и номенклатура. Химические свойства.
Соли. Классификация и номенклатура. Химические свойства.
Атом. Состав и основные характеристики атома. Строение электронных оболочек атомов. Периодический закон.
Химическая связь. Типы химической связи. Ковалентная химическая связь.
Ионная химическая связь и ее свойства.
Металлическая химическая связь и ее свойства.
Степень окисления.
Кристаллическое состояние вещества. Уровни химической организации веществ.
Окислительно-восстановительные реакции (ОВР). Составление ОВР. Сущность теории ОВР.
Водород. Открытие водорода. Химические свойства и получение водорода. Водород на Земле и в космосе. Применение.
Вода. Пероксид водорода.
Галогены. Строение атомов галогенов. Биологическая роль галогенов.
Хлороводород. Соляная кислота.
multiurok.ru
Экзамен по химии 8 класс
Documents войти Загрузить ×- Естественные науки
- Химия
Related documents
Медиа:Загрязнение атмосферы
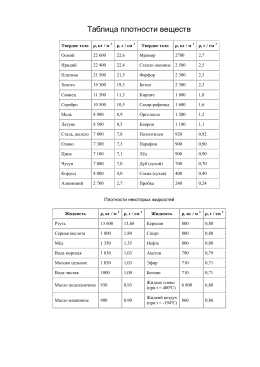
Таблица плотности веществ
Способы начала урока.

1. Вспомните и напишите десять тривиальных названий любых соединений

1. Номер группы равен числу 1) протонов 2) электронов во

Контрольная работа за 1 полугодие Вариант 3 Часть А A 1
Гершановская Евгения Владимировна Город Москва ГБОУ СОШ № 880
А вы знаете ???
Домашнее задание: Спички глазами химика
Неметаллы — PPt4WEB.ru
ДИДАКТИЧЕСКАЯ ИГРА «САМЫЕ УМНЫЕ»

Химия. 8 класс
Презентация «Оксиды».

А9. 1. Растворением соответствующего оксида в воде нельзя
studydoc.ru
