Химические свойства оксидов
Оксиды бывают:
- солеобразующие
- основные (Na2O, MgO),
- кислотные (SO3, CO2, Mn2O7),
- амфотерные (Al2O3, ZnO)
- несолеобразующие (NO, N2O, CO)
1. Основные оксиды реагируют с кислотами, кислотными оксидами, водой (только оксиды активных металлов)
2. Кислотные оксиды реагируют с водой (кроме SiO2), щелочами, основными оксидами.
3. Амфотерные оксиды реагируют с кислотами, щелочами, кислоными оксидами, основными оксидами (при сплавлении)
4. Несолеобразующие оксиды — не реагируют ни с водой, ни с кислотами, ни со щелочами.
Давайте порассуждаем вместе
1. Какое из веществ взаимодействует с водой при комнатной температуре?
1) оксид кремния (IV)
2) оксид меди (II)
3) оксид серы (VI)
4) сера
Ответ: №3, т.к. SO3 + H2O = H2SO4 , кислотные оксиды реагируют с водой с образованием кислот, исключение SiO2.
2. Какое из веществ не взаимодействует с соляной кислотой
1) оксид углерода (IV)
2) оксид кальция
3) нитрат серебра
4) кальций
Ответ: №1, т.к. с кислотами не взаимодействует кислотный оксид CO2
3. Оксид кальция не взаимодействует с
1) оксидом углерода (IV)
2) гидроксидом натрия
3) водой
4) хлороводородом
Ответ: №2, т.к. основные оксиды не реагируют со щелочами.
4. Соляная кислота реагирует с каждым из оксидов
1) CaO и CO2
2) SO3 и SiO2
3) CO и NO
4) MgO и ZnO
Ответ: №4 с кислотами реагируют основные (MgO) и амфотерные оксиды (ZnO)
MgO + 2HCl = MgCl2 + H2O
ZnO + 2HCl = ZnCl2 + H2O
5. Оксид магния реагирует с каждым из веществ
1) HCl и SO3
2) SO3 и NaOH
3) NaOH и H2О
4) H2SO4 и KCl
Ответ: №1, т.к. основные оксиды (MgO) реагируют с кислотами (HCl) и кислотными оксидами (SO
3) MgO + 2HCl = MgCl2 + H2O
MgO + SO3 = MgSO4
6. Оксид серы (IV) реагирует с
1) NaOH
2) NaCl
3) H2SO4
4) P2O5
Ответ: №1, т.к. оксид серы (IV) является кислотным оксидом и может реагировать со щелочью
NaOH + SO2 = Na2SO3 + H2O
7. С водным раствором гидроксида калия реагируют
1) алюминий
2) медь
3) натрий
4) сульфат меди (II)
5) сульфат натрия
Ответ: 1, 4, т.к. Al — амфотерный металл, он реагирует и с кислотами и с растворами щелочей 2Al + 2KOH + 6H 2O = 2K[Al(OH)4] + 3H2
CuSO4 — растворимая соль, со щелочью дает осадок Cu(OH)2 синего цвета CuSO4 + 2KOH = Cu(OH)2 + K2SO4
8. С разбавленным водным раствором серной кислоты реагируют
1) алюминий
2) медь
3) оксид меди (II)
4) хлорид калия
5) хлорид бария
Ответ: 1, 3, 5, т.к. Al — амфотерный металл, он реагирует и с кислотами и с растворами щелочей 2Al + 3H2SO4 = Al2(SO4)3 + 3H2
CuO — основный оксид, реагирует с кислотами CuO + H2SO4 = CuSO4 + H2O
BaCl2 — растворимая соль, дает с серной кислотой белый осадок сульфата бария BaCl2 + H2SO4 = 2HCl + BaSO4
9. С водными растворами каких веществ реагирует углекислый газ
10. С водным раствором гидроксида натрия реагируют1) хлорид натрия
2) карбонат натрия
3) гидроксид кальция
4) соляная кислота
5) гидроксид натрия
Ответ: 2, 3, 5, т.к. CO2 — кислотный оксид, он реагирует с растворами карбонатов с образованием кислых солей Na2CO3 + CO2 + H2O = 2NaHCO3
Ca(OH)2 и NaOH — щелочи реагируют с кислотными оксидами Ca(OH)2 + CO2 = CaCO3 + H2O ; 2NaOH + CO2 = Na2CO3 + H2O
1) алюминий
2) хлор
3) оксид железа (II)
4) оксид серы (IV)
5) серебро
Ответ: 1, 2, 4, т.к. Al — амфотерный металл, он реагирует и с кислотами и с растворами щелочей 2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
Cl2 — активный неметалл — галоген реагирует со щелочью и на холоду и при нагревании
Cl2 + 2NaOH = NaCl + NaClO + h3O (холод)
3Cl2 + 6NaOH = 5NaCl + NaClO3 + 3H2O (нагрев)
SO2 — кислотный оксид реагирует со щелочью SO2 + 2NaOH = Na2SO3 + H2O
11. С водным раствором азотной кислоты реагируют
1) медь
2) углекислый газ
3) оксид магния
4) серная кислота
5) оксид алюминия
Ответ: 1,3, 5, т.к. азотная кислота сильный окислитель, она реагирует даже с металлами, стоящими после водорода, выделяя оксиды азота
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O
MgO и Al2O3 — основный и амфотерный оксиды соответственно, они реагируют с кислотами с образованием соли и воды
MgO + 2HNO3 = Mg(NO3)2 + H2O
Al2O3 + 6HNO3 = 2Al(NO3)3 + 3H2O
12. Оксид железа (II) взаимодействует с раствором
1) аммиака
2) бромоводорода
3) карбоната калия
4) хлорида натрия
Ответ: №2, т.к. основные оксиды реагируют с кислотами
FeO + 2HBr = FeBr2 = H2O
dx-dy.ru
отношение к воде, кислотам и щелочам. на Сёзнайке.ру
ПЛАН ОТВЕТА:
- Определение
- Классификация
- несолеобразующие
- солеобразующие
- основные
- кислотные
- амфотерные
- Химические свойства
- взаимодействие с водой
- взаимодействие с кислотами
- взаимодействие со щелочами
Оксиды – это сложные вещества, молекулы которых состоят из двух элементов, один из которых кислород, причём атомы кислорода не связаны друг с другом.
Все оксиды разделяют на две группы: солеобразующие и несолеобразующие.
Несолеобразующие оксиды не образуют солей в химических реакциях. К ним относятся: оксид азота(I), оксид азота(II), оксид кремния(IV).
Солеобразующие оксиды могут взаимодействовать с кислотами или щелочами с образованием солей. В зависимости от состава, а следовательно, и свойств они подразделяются на основные, кислотные и амфотерные.
Основные оксиды – это оксиды, которые при взаимодействии с кислотами образуют соль и воду. Они образованы элементами-металлами с валентностью 1 и 2. в качестве гидроксидов им соответствуют основания. К основным оксидам относятся оксид натрия, оксид кальция, оксид меди(), оксид железа().
Кислотные оксиды реагируют со щелочами с образованием соли и воды. Они образованы элементами-неметаллами, например, оксид серы(IV),оксид серы(VI), оксид фосфора(V) и переходными элементами, проявляющими валентность V, VI, VII, например, оксид хрома(VI), оксид марганца(VII). В качестве гидроксида кислотным оксидам соответствуют кислоты.
Амфотерными оксидами называют оксиды, которые реагируют и с кислотами и со щелочами с образованием соли и воды. Они образованы переходными элементами. Например, оксид алюминия, оксид цинка.
Химические свойства:
Оксиды взаимодействуют с водой, если соответствующий им гидроксид растворим в воде.
При взаимодействии основного оксида с водой образуется щёлочь, например, при взаимодействии оксида натрия с водой образуется гидроксид натрия (щёлочь), а оксид меди(II) с водой не реагирует, т.к. ему соответствует нерастворимое основание.
При взаимодействии кислотного оксида с водой образуется кислота, например, при взаимодействии оксида серы(VI) с водой образуется серная кислота, а оксид кремния(IV) с водой не реагирует, т.к. кремниевая кислота нерастворима в воде.
Амфотерные оксиды с водой не реагируют, т.к. им соответствуют нерастворимые гидроксиды.
Основные оксиды взаимодействуют с растворимыми кислотами с образованием соли и воды, например, при взаимодействии оксида меди(II) с соляной кислотой образуются хлорид меди(II) и вода.
Все кислотные оксиды взаимодействуют со щелочами с образованием соли и воды, причём образуется соль той кислоты, которая соответствует данному оксиду. Например, при взаимодействии оксида углерода(IV) с гидроксидом кальция образуются карбонат кальция и вода.
Амфотерные оксиды могут реагировать и с кислотами и со щелочами. Например, оксид цинка при взаимодействии с соляной кислотой образует хлорид цинка и воду, а при взаимодействии с гидроксидом натрия – цинкат натрия и воду.
Na2O + H2O = 2NaOH
CuO + H2O ?
SO3 + H2O = H2SO4
SiO2 + H2O ?
CuO + 2HCl = CuCl2 + H2O
CO2 + Ca(OH)2 = CaCO3 + H2O
ZnO + 2HCl = ZnCl2 + H2O
ZnO + 2NaOH = Na2ZnO2 + H2O
Дополнительно знать:
K2O + H2O = 2KOH
CaO + H2O = Ca(OH)2
BaO + H2O = Ba(OH)2
CO2 + H2O = H2CO3
SO2 + H2O = H2SO3
P2O5 + 3H2O = 2H3РО4
3NO2 + H2O = 2HNO3 + NO
www.seznaika.ru
5). Химические свойства основных оксидов:
а) взаимодействие с водой. Правило: оксид взаимодействует с водой, если продукт реакции растворим в воде (и наоборот). Примеры:
Na2O + H2O 2NaOH
FeO + H2O реакция не идет, т.к. Fe(OH)2 нерастворим в воде.
б) взаимодействие с кислотами. При взаимодействии основных оксидов с кислотами образуется соль и вода.
Примеры:
CuO + H2SO4 CuSO4 + H2O (требуется нагревание)
Обратить внимание на следующее:
кремниевая кислота не реагирует с основными оксидами («твердое» не реагирует с «твердым»)
если в оксиде с.о. металла не максимальная, то в реакциях с кислотой азотной любой концентрации и с концентрированной серной кислотой помимо обменного взаимодействия возможно окислительно-восстановительное:
* FeO + 4HNO3(конц) Fe(NO3)3 + NO2 + 2H2O
* 2FeO + 4H2SO4 (конц) Fe2(SO4)3 + SO2+ 4H2O
*CaO + 2H3PO4 Ca(H2PO4)2 + H2O
в) взаимодействие с кислотными оксидами. Эти реакции протекают при нагревании, в ходе реакции образуется соль:
CaO + CO2 = CaCO3
Примечание: уравнения реакций в пунктах 6б и 6в являются доказательством основных свойств оксидов
г) взаимодействие с амфотерными оксидами.
Na2O + Al2O3 2NaAlO2 (при нагревании)
Na2O + ZnONa2ZnO2 (при нагревании)
6). Химические свойства кислотных оксидов:
а) взаимодействие с водой. Правило: оксид взаимодействует с водой, если продукт реакции растворим в воде (оксид не взаимодействует с водой, если продукт реакции нерастворим в воде)
ВСЕ КИСЛОТНЫЕ ОКСИДЫ, КРОМЕ SiO2, РЕАГИРУЮТ С ВОДОЙ.
Примеры:
P2O5 + 3H2O 2H3PO4 (при нагревании)
*P2O5 + H2O HPO3 (на холоду)
SiO2 + H2O реакция не идет, т.к. H2SiO3 нерастворима в воде
б) взаимодействие с основными и амфотерными оксидами (см. пункт 6.в)
г) взаимодействие с основаниями. Правило: кислотные оксиды взаимодействуют со щелочами, при этом образуется соль и вода. Пример:
2NaOH + CO2 Na2CO3 + H2O (в избытке NaOH)
NaOH + CO2 NaHCO3 (в избытке CO2)
д) взаимодействие с солями. Правило:
– при нагревании менее летучий оксид вытесняет из соли более летучий оксид.
Пример: Na2CO3 + SiO2 Na2SiO3 + CO2 (при нагревании)
– в растворе оксид, соответствующий более сильной кислоте, вытесняет из соли оксид, соответствующий более слабой кислоте.
– оксиды могут взаимодействовать с солями, содержащими остаток кислоты, которой этот оксид соответствует:
Na2CO3 +CO2 + H2O 2NaHCO3
Na2SO3 +SO2 + H2O 2NaHSO3
Пример: Na2SiO3 + CO2 Na2CO3 + SiO2 (в растворе)
8). Химические свойства амфотерных оксидов.
а) амфотерные оксиды не реагируют с водой
б) амфотерные оксиды в реакциях с кислотами проявляют основные свойства, т.е. реакции протекают так же, как с основными оксидами
Пример: Al2O3 + 6HCl 2AlCl3 + 3H2O
в) взаимодействие со щелочами. В зависимости от условий реакции протекают по-разному:
Al2O3 + 2NaOH + 3H2O 2Na[Al(OH)4] (в растворе)
Al2O3 + 2NaOH 2NaAlO2 + H2O(при нагревании)
г) взаимодействие с основными оксидами (см №6г)
д) при взаимодействии с кислотными оксидами амфотерные оксиды проявляют основные свойства.
Пример:
Al2O3 + P2O5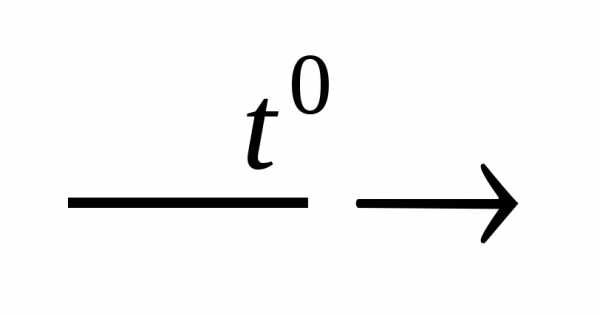 2AlPO4
2AlPO4
е) При взаимодействии с солями амфотерные оксиды, как нелетучие, вытесняют из солей при нагревании более летучие оксиды.
Пример: Na2CO3 + Al2O3 2NaAlO2 + CO2
оксид | Гидроксид, основная форма | Гидроксид, кислотная форма (при нагревании) | Гидроксид, кислотная форма (в растворе) |
BeO | Be(OH)2 | H2BeO2 | H2[Be(OH)4] |
ZnO | Zn(OH)2 | H2ZnO2 | H2[Zn(OH)4] |
SnO | Sn(OH)2 | H2SnO2 | H2[Sn(OH)4] |
PbO | Pb(OH)2 | H2PbO2 | H2[Pb(OH)4] |
Al2O3 | Al(OH)3 | HAlO2 | H[Al(OH)4] |
Cr2O3 | Cr(OH)3 | HCrO2 | H3[Cr(OH)6] |
Fe2O3 | Fe(OH)3 | HFeO2 | H3[Fe(OH)6] |
Примечание: кислотная форма амфотерных гидроксидов составлена формально, т.к. в реакциях со щелочами и с основными оксидами могут быть образованы только соли приведенных форм гидроксидов.
9). Зависимость кислотно-основных свойств оксидов от положения элемента в периодической системе и его степени окисления.
Слева направо по периоду по мере ослабления металлических свойств элементов основные свойства оксидов ослабевают, а кислотные возрастают. Сверху вниз по главным подгруппам неметаллические свойства элементов ослабевают, а металлические возрастают, при этом: сверху вниз по главной подгруппе возрастают основные свойства оксидов, а кислотные ослабевают. Если один и тот же элемент образует несколько оксидов с разными степенями окисления, то чем выше степень окисления элемента в оксиде, тем выше его кислотные свойства.
Пример: Cr+2O – основный оксид, Cr2+3O3 – амфотерный оксид, Cr+6O3 – кислотный оксид.
Кислоты.
I Определение.
а) кислоты – сложные вещества, состоящие из кислотных остатков и атомов водорода, способных замещаться на атомы металлов
б) кислоты – электролиты, при диссоциации которых в качестве катионов образуются только ионы водорода.
II Классификация
а) по наличию или отсутствию атомов кислорода кислоты делят на бескислородные (H2S, HCl и др.) и кислородосодержащие (H2SO4, HNO3 и др.)
б) по числу атомов водорода, способных замещаться на металлы или по числу ионов H+, образующихся при диссоциации кислоты выделяют кислоты одноосновные (HNO3, HCl), двухосновные (H2S, H2SO4,), трехосновные (H3PO4), четырехосновные (H4P2O7)
в) по способности к диссоциации кислоты разделяют на сильные электролиты (HCl, HNO3, H2SO4 и др.), слабые электролиты (H2S, H2CO3, HF), электролиты средней силы (H3PO4, H2SO3 ).
г) по летучести выделяют нелетучие кислоты (H3PO4, H2SiO3, H2SO4) и летучие (HNO3, HCl, HF, H2S H2CO3, H2SO3)
д) стабильные (H3PO4, H2SO4) и нестабильные (H2SO3, H2CO3) кислоты
III Структурные формулы кислот.
IV Физические свойства кислот. Существуют кислоты твердые (H3PO4, H2SiO3), жидкие кислоты (H2SO4, HNO3)
V Способы получения кислот:
а) бескислородные кислоты получают растворением соответствующего газа в воде
б) кислородосодержащие получают при взаимодействии соответствующего оксида в воде:
P2O5 + 3H2O 2H3PO4
в) нерастворимые кислоты получают косвенным путем:
Na2SiO3 + 2HCl H2SiO3+ 2NaCl
VI Химические свойства кислот.
1). Кислоты реагируют с металлами, стоящими в ряду активности левее водорода; при этом образуется соль и водород. При протекании таких процессов металл растворяется в кислоте (в ходе реакции не должна образовываться нерастворимая соль: H2SO4 + Mg MgSO4 + H2
Примечание: при взаимодействии металлов со слабыми кислотами образуются кислые соли:
Fe + 2H3PO4 → Fe(H2PO4)2 + 3H2
Ca + 2H2CO3 → Ca(HCO3)2 + H2
2). Кислоты реагируют с основными оксидами
Примечание: некоторые реакции требуют нагревания:
CuO + H2SO4 CuSO4 + H2O (требуется нагревание)
MgO + H2SO4 MgSO4 + H2O (эта реакция протекает при комнатной температуре)
3). Кислоты реагируют с основаниями.
Примечание: слабые нерастворимые основания не реагируют со слабыми кислотами.
2Al(OH)3 + 3H2SO4 Al2(SO4)3 + 6H2O
Al(OH)3 + H2CO3 – реакция не идет.
4). Кислоты реагируют с солями при выполнении условий:
а) в ходе реакции выпадает осадок
BaCl2 + H2SO4 BaSO4 + 2HCl
Примечание: с помощью сероводорода можно осадить из солей в виде сульфидов металлы, стоящие в ряду активности правее железа:
CuSO4 + H2S CuS+ H2SO4
Т.к. сульфиды железа, цинка, магния и т.д. растворимы в разбавленных кислотах, то
FeSO4 + H2S реакция не идет
б) в ходе реакции выделяется газ
K2CO3 + 2HCl 2KCl + H2O + CO2
в) нелетучие кислоты могут вытеснять летучие из их солей:
NaCl(тв.) + H2SO4(конц.)HCl + NaHSO4 (при слабом нагревании)
2NaCl(тв.) + H2SO4(конц.)2HCl + Na2SO4 (при сильном нагревании)
KNO3(тв.) + H2SO4(конц.) HNO3 + KHSO4
5). Растворы кислот изменяют окраску индикаторов:
лакмус и метилоранж – в красный.
Мнемотаблица для запоминания окраски индикаторов в зависимости от реакции среды:
Кислая | нейтральная | щелочная | |
Лакмус | 4 Красный | 8 Фиолетовый | 3 Синий |
Метиловый оранжевый | 6 Красный | 2 Оранжевый | 7 Желтый |
фенолфталеин | 1 Бесцветный | 9 Бесцветный | 5 Малиновый |
Таблица заполняется только первыми буквами приведенных в них слов (см. ниже). Заполнение происходит следующим образом: а) по горизонтали верхняя строка по алфавиту;
б) по вертикали левая строка также по алфавиту; в) далее из букв по порядку складываем мнемофразу (как «Каждый охотник желает знать…») «Бос и Ком крыжовником играют в футбол» (жирным подчеркнутым шрифтом выделены буквы из таблицы)
К | Н | Щ | |
Л | 4 К | 8 Ф | 3 С |
М | 6 Кр | 2 О | 7 Ж |
Ф | 1 Б | 9 Б | 5 М |
Дополнение. Взаимодействие азотной кислоты с металлами.
Азотная кислота | Щелочные, щелочноземельные металлы, Mg, Zn | Fe, Cr, Al | Другие металлы | Au, Pt |
Концентрированная (>50%) | N2O | Пассивация, при нагревании — NO2 | NO2 | Нет реакции |
Разбавленная (10 –50%) | N2 | NO, металлы, стоящие в ряду напряжений до водорода могут также давать N2O, N2 | ||
Очень разбавленная (<10%) | Металлы, стоящие в ряду напряжений до водорода — NH4NO3 | |||
Взаимодействие концентрированной серной кислоты с металлами:
Основания. 1). Определение
а) основания – сложные вещества, состоящие из металлов (иона аммония) и одной или нескольких гидроксогрупп NaOH, Fe(OH)2
б) основания – электролиты, при диссоциации которых в качестве анионов образуются гидроксид-анионы NaOHNa++OH—
в) основания – вещества, в ходе реакций присоединяющие протоны NH3 + H+NH4+
2). Классификация.
По количеству гидроксогрупп основания делят на однокислотные — NaOH, двухкислотные — Fe(OH)2, трехкислотные — Fe(OH)3.
По способности к диссоциации основания разделяют на сильные и слабые электролиты.
Сильные электролиты — гидроксиды щелочных и щелочноземельных металлов (раствор Ag2O дает сильно щелочную среду, TlOH – сильный электролит). Все остальные основания – слабые электролиты.
3). Физические свойства.
Все основания, кроме гидроксида аммония, твердые вещества, имеющие различную растворимость в воде. Гидроксиды щелочных и щелочноземельных металлов хорошо растворимы в воде (кроме Ca(OH)2), большинство оснований в воде нерастворимо.
4). Способы получения.
Гидроксиды щелочных и щелочноземельных металлов получают при взаимодействии соответствующего металла или оксида с водой:
Ca + 2H2O Ca(OH)2 + H2
CaO + H2O Ca(OH)2
В промышленности щелочи получают электролизом растворов солей:
2NaCl + 2H2O H2+ 2NaOH + Cl2
Нерастворимые основания получают из солей:
ZnCl2 + 2NaOH(недостаток) Zn(OH)2 + 2NaCl
studfiles.net
Химические свойства оксидов | Дистанционные уроки
17-Мар-2015 | Нет комментариев | Лолита Окольнова
Вопрос А10 ГИА (ОГЭ) по химии —
Химические свойства оксидов: основных, амфотерных, кислотных

Классификация оксидов:
Оксиды, образованные металлами | Оксиды, образованные неметаллами | ||
Основные | Амфотерные | Кислотные | Несолеобразующие |
— Na2O, CaO; | Оксиды: Al2O3, ZnO, d-элементы в средней с.о. — Cr2O3, Fe2O3, MnO2 | 1) оксиды неметаллов в высших и средних степенях окисления CO2, N2O3, N2O5, SO3, SO2 2) оксиды d-элементов в высшей с.о.: CrO3, Mn2O7 |
|
Химические свойства основных оксидов:
Основные оксиды — это сложные химические вещества, относящиеся к окислам, которые образуют соли при химической реакции с кислотами или кислотными оксидами и не реагируют с основаниями или основными оксидами.
Оксиды щелочных и щелочноземельных металлов реагируют с водой с образованием щелочей:
K2O + h3O = 2KOH
1. Окисление кислородом:
если металл — d-элемент и «ему есть до чего окисляться»: 2FeO + O2 = Fe2O3
2. Взаимодействие с неметаллами:
2Na2O + S = 4Na + SO2
Fe2O3 + C = 2FeO + CO
3. Восстановление — реакции с водородом:
CuO + h3 = Cu + h3O
4. Образование солей с кислотными оксидами:
CaO + CO2 = CaCO3 (соль)
5. Взаимодействие с кислотами:
BaO + 2HNO3 = Ba(NO3)2 (соль) + h3O
Химические свойства амофтерных оксидов:
Амфотерные оксиды — это сложные химические вещества, также относящиеся к окислам, которые образуют соли
при химическом взаимодействии и с кислотами (или кислотными оксидами) и основаниями (или основными оксидами).
1. Взаимодействие в растворе(!) с щелочами:
Al2O3 + 2h3O + 2NaOH = 2Na[Al(OH)4] + 3h3
2. Образование солей с кислотами:
ZnO + h3SO4 = ZnSO4 + h3O
Ответ: 3)
Химические свойства кислотных оксидов:
Кислотные оксиды — это сложные химические вещества, относящиеся к окислам, которые образуют соли при химическом взаимодействии с основаниями или основными оксидами и не взаимодействуют с кислотными оксидами.
Реакция с водой: образование кислот:
N2O3 + h3O = 2HNO2
1. + O2
если элемент, образующий оксид в средней с.о.:
2SO2 + O2 = 2SO3
2. + h3
восстановление до несолеобразующего оксида или простого вещества:
CO2 + h3 = CO + h3O
SO2 + h3 = S + h3O
3. + вещества. образованные металлами:
SO2 + 2Ca = 2CaO + S
SO2 + CaO = CaSO3 (соль)
SO2 + 2LiOH = Li2SO3 + h3O
Химические свойства несолеобразующих оксидов
здесь все просто — они только
окисляются до кислотных и восстанавливаются до простых веществ:
N2O + O2 = N2O3
CO + h3 = C + h3O
Ответ: 3)
Еще на эту тему:
Обсуждение: «Химические свойства оксидов»
(Правила комментирования)distant-lessons.ru
Оксиды: их классификация и химические свойства
Билет № 17
1. Оксиды: их классификация и химические свойства (взаимодействие с водой, кислотами и щелочами)
Оксиды — сложные вещества, состоящие из двух элементов, один из которых кислород (в степени окисления −2).
Оксиды делят на кислотные, осно́вные, амфотерные и несолеобразующие (безразличные).
Кислотным оксидам соответствуют кислоты. Кислотными свойствами обладают большинство оксидов неметаллов и оксиды металлов в высшей степени окисления, например CrO3.
Многие кислотные оксиды реагируют с водой с образованием кислот. Например, оксид серы (IV), или серни́стый газ, реагирует с водой с образованием серни́стой кислоты:
SO2 + H2O = H2SO3
Кислотные оксиды реагируют со щелочами с образованием соли и воды. Например, оксид углерода (IV), или углекислый газ, реагирует с гидроксидом натрия с образованием карбоната натрия (соды):
CO2 + 2NaOH = Na2CO3 + H2O
Осно́вным оксидам соответствуют основания. К осно́вным относятся оксиды щелочных металлов (главная подгруппа I группы),
магния и щелочноземельных (главная подгруппа II группы, начиная с кальция), оксиды металлов побочных подгрупп в низшей степени окисления (+1 +2).
Оксиды щелочных и щелочноземельных металлов реагируют с водой с образованием оснований. Так, оксид кальция реагирует с водой, получается гидроксид кальция:
CaO + H2O = Ca(OH)2
Основные оксиды реагируют с кислотами с образованием соли и воды. Оксид кальция реагирует с соляной кислотой, получается хлорид кальция:
CaO + 2HCl = CaCl2 + H2O
Амфотерные оксиды реагируют и с кислотами, и со щелочами. Так, оксид цинка реагирует с соляной кислотой, получается хлорид цинка:
ZnO + 2HCl = ZnCl2 + H2O
Оксид цинка взаимодействует и с гидроксидом натрия с образованием цинката натрия:
ZnO + 2NaOH = Na2ZnO2 + H2O
С водой амфотерные оксиды не взаимодействуют. Поэтому оксидная пленка цинка и алюминия защищает эти металлы от коррозии.
Несолеобразующим (безразличным) оксидам не соответствуют гидроксиды, они не реагируют с водой. Несолеобразующие оксиды не реагируют ни с кислотами, ни со щелочами. К ним относится оксид азота (II) NO.
Иногда к несолеобразующим относят угарный газ, но это неудачный пример, т.к. этот оксид реагирует с гидроксидом натрия с образованием соли:
CO + NaOH = HCOONa
(эта реакция не для запоминания! Изучается в 10–11 классах)
2. Задача. Вычисление массы продукта реакции, если известно количество вещества одного из исходных веществ.
Пример:
Сколько г хлорида цинка можно получить, имея 0,5 моль соляной кислоты?
Решение:
- Записываем уравнение реакции.
- Записываем над уравнением реакции имеющиеся данные, а под уравнением — число моль согласно уравнению (равно коэффициенту перед веществом):
0,5 моль x моль
Zn + 2HCl = ZnCl2 + H2↑
2 моль 1 моль - Составляем пропорцию:
0,5 моль — х моль
2 моль — 1 моль - Находим x:
x = 0,5 моль • 1 моль / 2 моль = 0,25 моль - Находим молярную массу хлорида цинка:
M(ZnCl2) = 65 + 35,5 • 2 = 136 (г/моль) - Находим массу соли:
m (ZnCl2) = M • n = 136 г/моль • 0,25 моль = 34 г
Ответ: 34 г.
автор: Владимир Соколов
staminaon.com
Химические свойства оксидов — Наука и образование
Взаимодействие оксидов с водой
При изучении химических свойств воды вы узнали, что многие оксиды (окислы) неметаллов, вступая в реакцию с водой, образуют кислоты, например:
SO3 + H2O = H2SO4 + Q
Некоторые оксиды металлов, взаимодействуя с водой, образуют основания (щелочи), например:
CaO + H2O = Ca(OH)2 + Q
Однако свойство оксидов вступать в реакцию с водой не является общим для всех веществ этого класса. Многие оксиды, например двуокись кремния SiO2, оксид углерода СО, оксид азота NO, оксид меди CuO, оксид железа Fe2O3 и др., не взаимодействуют с водой.
Взаимодействие оксидов с кислотами
Вам известно, что некоторые оксиды металлов вступают в реакцию с кислотами с образованием соли и воды, например:
CuO + H2SO4 = CuSO4 + H2O
Взаимодействие оксидов с основаниями
Некоторые оксиды (углекислый газ СO2, сернистый газ SO2, фосфорный ангидрид Р2O5 и др.) не вступают в реакцию с кислотами с образованием соли и воды. Выясним: не взаимодействуют ли они с основаниями?
Сухую колбу наполним углекислым газом и насыплем в нее едкий натр NaOH. Закроем колбу резиновой пробкой с вставленной в нее стеклянной трубкой и надетой на ее свободный конец резиновой трубкой с зажимом. Прикоснувшись рукой к колбе, мы ощутим разогревание стекла. На внутренних стенках колбы появились капли воды. Все это – признаки химической реакции. Если углекислый газ вступил в реакцию с едким натром, то можно предполагать, что в колбе создалось разрежение. Чтобы это проверить, после того когда колба охладится до комнатной температуры, опустим конец резиновой трубки прибора в кристаллизатор с водой и откроем зажим. Вода быстро устремится в колбу. Наше предположение о разрежении в колбе подтвердилось – углекислый газ взаимодействует с едким натром. Одним из продуктов реакции является вода. Каков состав образовавшегося твердого вещества?
NaOH + CO2 = H2O + ? + Q
Известно, что углекислому газу соответствует гидрат оксида (окисла) – угольная кислота Н2СO3. Образовавшееся в колбе твердое вещество – соль угольной кислоты – углекислый натрий Na2CO3.
Для образования молекулы углекислого натрия потребуется две молекулы едкого натра:
2NaOH + CO2 = Na2CO3 + H2O + Q
При взаимодействии углекислого газа с едким натром получилась соль углекислый натрий Na2CO3 и вода.
Помимо углекислого газа, есть еще многие оксиды (окислы) (SO2, SO3, SiO2, Р2O5 и др.), которые взаимодействуют со щелочами с образованием соли и воды.
scibio.ru
Урок 32. Химические свойства оксидов – HIMI4KA
В уроке 32 «Химические свойства оксидов» из курса «Химия для чайников» узнаем о всех химических свойствах кислотных и основных оксидов, рассмотрим с чем они реагируют и что при этом образуется.

Так как химический состав кислотных и основных оксидов различен, они отличаются своими химическими свойствами.
1. Химические свойства кислотных оксидов
а) Взаимодействие с водой
Вы уже знаете, что продукты взаимодействия оксидов с водой называются «гидроксиды»:
Поскольку оксиды, вступающие в эту реакцию, делятся на кислотные и основные, то и образующиеся из них гидроксиды также делятся на кислотные и основные. Таким образом, кислотные оксиды (кроме SiO2) реагируют с водой, образуя кислотные гидроксиды, которые являются кислородсодержащими кислотами:
Каждому кислотному оксиду соответствует кислородсодержащая кислота, относящаяся к кислотным гидроксидам. Несмотря на то что оксид кремния SiO2 с водой не реагирует, ему тоже соответствует кислота H2SiO3, но ее получают другими способами.
б) Взаимодействие с щелочами
Все кислотные оксиды реагируют со щелочами по общей схеме:
В образующейся соли валентность атомов металла такая же, как и в исходной щелочи. Кроме того, в состав соли входит остаток той кислоты, которая соответствует данному кислотному оксиду.
Например, если в реакцию вступает кислотный оксид CO2, которому соответствует кислота H2CO3 (указана в квадратных скобках), то в состав соли будет входить остаток этой кислоты — CO3, валентность которого, как вы уже знаете, равна II:
Если же в реакцию вступает кислотный оксид N2О5, которому соответствует кислота HNO3 (указана в квадратных скобках), то в составе образующейся соли будет остаток этой кислоты — NO3 с валентностью, равной I:
Поскольку все кислотные оксиды реагируют со щелочами с образованием солей и воды, этим оксидам можно дать другое определение.
Кислотными называются оксиды, реагирующие со щелочами с образованием солей и воды.
в) Реакции с основными оксидами
Кислотные оксиды реагируют с основными оксидами с образованием солей в соответствии с общей схемой:
В образующейся соли валентность атомов металла такая же, как и в исходном основном оксиде. Следует запомнить, что в состав соли входит остаток той кислоты, которая соответствует кислотному оксиду, вступающему в реакцию. Например, если в реакцию вступает кислотный оксид SO3, которому соответствует кислота H2SO4 (указана в квадратных скобках), то в состав соли будет входить остаток этой кислоты — SO4, валентность которого равна II:
Если же в реакцию вступает кислотный оксид Р2О5, которому соответствует кислота Н3РО4, то в составе образующейся соли будет остаток этой кислоты — РO4 с валентностью, равной III.
2. Химические свойства основных оксидов
а) Взаимодействие с водой
Вы уже знаете, что в результате взаимодействия основных оксидов с водой образуются основные гидроксиды, которые иначе называются основаниями:
К таким основным оксидам относятся оксиды: Li2O, Na2O, K2O, CaO, BaO.
При написании уравнений соответствующих реакций следует помнить, что валентность атомов металла в образующемся основании равна его валентности в исходном оксиде.
Основные оксиды, образованные такими металлами, как Cu, Fe, Cr, с водой не реагируют. Соответствующие им основания получают другими способами.
б) Взаимодействие с кислотами
Практически все основные оксиды реагируют с кислотами с образованием солей по общей схеме:
Следует помнить, что в образующейся соли валентность атомов металла такая же, как в исходном оксиде, а валентность кислотного остатка такая же, как в исходной кислоте.
Поскольку все основные оксиды реагируют с кислотами с образованием солей и воды, этим оксидам можно дать другое определение.
Основными называются оксиды, реагирующие с кислотами с образованием солей и воды.
в) Взаимодействие с кислотными оксидами
Основные оксиды реагируют с кислотными оксидами с образованием солей в соответствии с общей схемой:
В образующейся соли валентность атомов металла такая же, как и в исходном основном оксиде. Кроме того, следует запомнить, что в состав соли входит остаток той кислоты, которая соответствует кислотному оксиду, вступающему в реакцию. Например, если в реакцию вступает кислотный оксид N2O5, которому соответствует кислота HNO3, то в состав соли будет входить остаток этой кислоты — NO3, валентность которого, как вы уже знаете, равна I.
Поскольку рассмотренные нами кислотные и основные оксиды в результате различных реакций образуют соли, их называют солеобразующими. Существует, однако, небольшая группа оксидов, которые в аналогичных реакциях не образуют солей, поэтому их называют несолеобразующими.
Краткие выводы урока:
- Все кислотные оксиды реагируют со щелочами с образованием солей и воды.
- Все основные оксиды реагируют с кислотами с образованием солей и воды.
- Кислотные и основные оксиды являются солеобразующими. Несолеобразующие оксиды — CO, N2О, NO.
- Основания и кислородсодержащие кислоты являются гидроксидами.
Надеюсь урок 32 «Химические свойства оксидов» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
himi4ka.ru
