Основные положения МКТ. Масса и размер молекул. Количество вещества. Молекулярная физика
Основные положения МКТ. Масса и размер молекул. Количество вещества. Молекулярная физика
МКТ — это просто!
«Ничто не существует, кроме атомов и пустого пространства …» — Демокрит
«Любое тело может делиться до бесконечности» — Аристотель
Основные положения молекулярно-кинетической теории (МКТ)
Цель МКТ — это объяснение строения и свойств различных макроскопических тел и тепловых явлений, в них протекающих, движением и взаимодействием частиц, из которых состоят тела.
Макроскопические тела — это большие тела, состоящие из огромного числа молекул.
Тепловые явления — явления, связанные с нагреванием и охлаждением тел.
Основные утверждения МКТ
1. Вещество состоит из частиц (молекул и атомов).
2. Между частицами есть промежутки.
3. Частицы беспорядочно и непрерывно движутся.
4. Частицы взаимодействуют друг с другом (притягиваются и отталкиваются).
Подтверждение МКТ:
1. экспериментальное
— механическое дробление вещества; растворение вещества в воде; сжатие и расширение газов; испарение; деформация тел; диффузия; опыт Бригмана: в сосуд заливается масло, сверху на масло давит поршень, при давлении 10 000 атм масло начинает просачиваться сквозь стенки стального сосуда;
— диффузия; броуновское движение частиц в жидкости под ударами молекул;
— плохая сжимаемость твердых и жидких тел; значительные усилия для разрыва твердых тел; слияние капель жидкости;
2. прямое
— фотографирование, определение размеров частиц.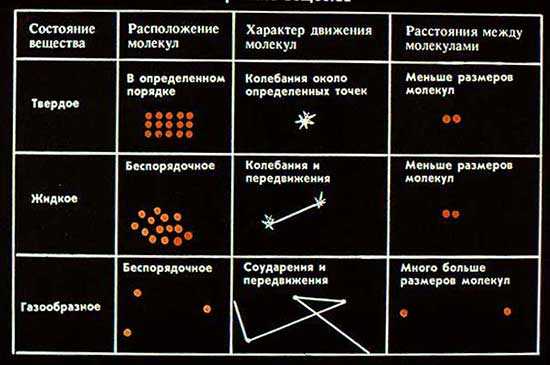
Броуновское движение
Броуновское движение — это тепловое движение взвешенных частиц в жидкости (или газе).
Броуновское движение стало доказательством непрерывного и хаотичного (теплового) движения молекул вещества.
— дано теоретическое объяснение на основе МКТ А. Эйнштейном в 1905 г.
— экспериментально подтверждено французским физиком Ж. Перреном.
Масса и размеры молекул
Размеры частиц
Диаметр любого атома составляет около см.
Число молекул в веществе
где V — объем вещества, Vo — объем одной молекулы
Масса одной молекулы
где m — масса вещества,
N — число молекул в веществе
Единица измерения массы в СИ: [m]= 1 кг
В атомной физике массу обычно измеряют в атомных единицах массы (а.е.м.).
Условно принято считать за 1 а.е.м. :
Относительная молекулярная масса вещества
Для удобства расчетов вводится величина — относительная молекулярная масса вещества.
Массу молекулы любого вещества можно сравнить с 1/12 массы молекулы углерода.
где числитель — это масса молекулы, а знаменатель — 1/12 массы атома углерода
— это величина безразмерная, т.е. не имеет единиц измерения
Относительная атомная масса химического элемента
где числитель — это масса атома, а знаменатель — 1/12 массы атома углерода
— величина безразмерная, т.е. не имеет единиц измерения
Относительная атомная масса каждого химического элемента дана в таблице Менделеева.
Другой способ определения относительной молекулярной массы вещества
Относительная молекулярная масса вещества равна сумме относительных атомных масс химических элементов, входящих в состав молекулы вещества.
Относительную атомную массу любого химического элемента берем из таблицы Менделеева!)
Количество вещества
Количество вещества (ν) определяет относительное число молекул в теле.
где N — число молекул в теле, а Na — постоянная Авогадро
Единица измерения количества вещества в системе СИ: [ν]= 1 моль
1 моль — это количество вещества, в котором содержится столько молекул (или атомов), сколько атомов содержится в углероде массой 0,012 кг.
Запомни!
В 1 моле любого вещества содержится одинаковое число атомов или молекул!
Но!
Одинаковые количества вещества для разных веществ имеют разную массу!
Постоянная Авогадро
Число атомов в 1 моле любого вещества называют числом Авогадро или постоянной Авогадро:
Молярная масса
Молярная масса (M) — это масса вещества, взятого в одном моле, или иначе — это масса одного моля вещества.
где
— масса молекулы
— постоянная Авогадро
Единица измерения молярной массы: [M]=1 кг/моль.
Формулы для решения задач
Эти формулы получаются в результате подстановки вышерассмотренных формул.
Масса любого количества вещества
и формула для 7 класса
(плотность х объем)
Количество вещества
Число молекул в веществе
Молярная масса
Масса одной молекулы
Связь между относительной молекулярной массой и молярной массой
Молекулярная физика. Термодинамика — Класс!ная физика
Основные положения МКТ. Масса и размер молекул. Количество вещества. — Взаимодействие молекул. Строение твердых тел, жидкостей и газов. — Идеальный газ. Основное уравнение МКТ. — Температура. Тепловое равновесие. Абсолютная шкала температур. — Уравнение состояния идеального газа. — Изопроцессы. Газовые законы. — Взаимные превращения жидкостей и газов. Влажность воздуха. — Твердые тела. Кристаллические тела. Аморфные тела.
class-fizika.ru
Масса и размер молекул | Физика для всех
Многие опыты показывают, что размер молекулы очень мал. Линейный размер молекулы или атома можно найти различными способами. Например, с помощью электронного микроскопа, получены фотографии некоторых крупных молекул, а с помощью ионного проектора (ионного микроскопа) можно не только изучить строение кристаллов, но определить расстояние между отдельными атомами в молекуле.Используя достижения современной экспериментальной техники, удалось определить линейные размеры простых атомов и молекул, которые составляют около 10-8 см. Линейные размеры сложных атомов и молекул намного больше. Например, размер молекулы белка составляет 43*10-8 см.
Для характеристики атомов используют представление об атомных радиусах, которые дают возможность приближённо оценить межатомные расстояния в молекулах, жидкостях или твёрдых телах, так как атомы по своим размерам не имеют чётких границ. То есть атомный радиус – это сфера, в которой заключена основная часть электронной плотности атома (не менее 90…95%).
Размер молекулы настолько мал, что представить его можно только с помощью сравнений. Например, молекула воды во столько раз меньше крупного яблока, во сколько раз яблоко меньше земного шара.
Моль вещества
Массы отдельных молекул и атомов очень малы, поэтому в расчётах удобнее использовать не абсолютные значения масс, а относительные.
Относительная молекулярная масса (или относительная атомная масса) вещества Мr – это отношение массы молекулы (или атома) данного вещества к 1/12 массы атома углерода.
Мr = (m0) : (m0C / 12)
где m0 – масса молекулы (или атома) данного вещества, m0C – масса атома углерода.
Относительная молекулярная (или атомная) масса вещества показывает, во сколько раз масса молекулы вещества больше 1/12 массы изотопа углерода С12. Относительная молекулярная (атомная) масса выражается в атомных единицах массы.
Атомная единица массы – это 1/12 массы изотопа углерода С12. Точные измерения показали, что атомная единица массы составляет 1,660*10-27 кг, то есть
1 а.е.м. = 1,660 * 10-27 кг
Относительная молекулярная масса вещества может быть вычислена путём сложения относительных атомных масс элементов, входящих в состав молекулы вещества. Относительная атомная масса химических элементов указана в периодической системе химических элементов Д.И. Менделеева.
В периодической системе Д.И. Менделеева для каждого элемента указана атомная масса, которая измеряется в атомных единицах массы (а.е.м.). Например, атомная масса магния равна 24,305 а.е.м., то есть магний в два раза тяжелее углерода, так как атомная масса углерода равна 12 а.е.м. (это следует из того, что 1 а.е.м. = 1/12 массы изотопа углерода, который составляет большую часть атома углерода).
Зачем измерять массу молекул и атомов в а.е.м., если есть граммы и килограммы? Конечно, можно использовать и эти единицы измерения, но это будет очень неудобно для записи (слишком много чисел придётся использовать для того, чтобы записать массу). Чтобы найти массу элемента в килограммах, нужно атомную массу элемента умножить на 1 а.е.м. Атомная масса находится по таблице Менделеева (записана справа от буквенного обозначения элемента). Например, вес атома магния в килограммах будет:
m0Mg = 24,305 * 1 a.e.м. = 24,305 * 1,660 * 10-27 = 40,3463 * 10-27 кг
Массу молекулы можно вычислить путём сложения масс элементов, которые входят в состав молекулы. Например, масса молекулы воды (Н2О) будет равна:
m0Н2О = 2 * m0H + m0O = 2 * 1,00794 + 15,9994 = 18,0153 a.e.м. = 29,905 * 10-27 кг
Количество вещества принято считать пропорциональным числу частиц. Количество вещества
– это физическая величина, характеризующая относительное число молекул и атомов в теле. Единица количества вещества называется молем (моль).Моль равен количеству вещества системы, в которой содержится столько же молекул, сколько содержится атомов в 0,012 кг углерода С12. То есть, если у нас есть система с каким-либо веществом, и в этой системе столько же молекул этого вещества, сколько атомов в 0,012 кг углерода, то мы можем сказать, что в этой системе у нас 1 моль вещества.
Постоянная Авогадро
Количество вещества ν равно отношению числа молекул в данном теле к числу атомов в 0,012 кг углерода, то есть количеству молекул в 1 моле вещества.
ν = N / NA
где N – количество молекул в данном теле, NA – количество молекул в 1 моле вещества, из которого состоит тело.
NA – это постоянная Авогадро. Количество вещества измеряется в молях.
Постоянная Авогадро
В 1 моле любого вещества содержится одинаковое количество частиц.
NA = 6,02 * 1023 моль-1
Молярная масса – это масса вещества, взятого в количестве одного моля:
μ = m0 * NA
где m0 – масса молекулы.
Молярная масса выражается в килограммах на моль (кг/моль = кг*моль-1).
Молярная масса связана с относительной молекулярной массой соотношением:
μ = 10-3 * Mr [кг*моль-1]
Масса любого количества вещества m равна произведению массы одной молекулы m0 на количество молекул:
m = m0N = m0NAν = μν
Количество вещества равно отношению массы вещества к его молярной массе:
ν = m / μ
Массу одной молекулы вещества можно найти, если известны молярная масса и постоянная Авогадро:
m0 = m / N = m / νNA = μ / NA
Более точное определение массы атомов и молекул достигается при использовании масс-спректрометра – прибора, в котором происходит разделение пучком заряженных частиц в пространстве в зависимости от их массы заряда при помощи электрических и магнитных полей.
Для примера найдём молярную массу атома магния. Как мы выяснили выше, масса атома магния равна m0Mg = 40,3463 * 10-27кг. Тогда молярная масса будет:
μ = m0Mg * NA = 40,3463 * 10-27 * 6,02 * 1023 = 2,4288 * 10-2 кг/моль
То есть в одном моле «помещается» 2,4288 * 10-2 кг магния. Ну или примерно 24,28 грамм.
Как видим, молярная масса (в граммах) практически равна атомной массе, указанной для элемента в таблице Менделеева. Поэтому когда указывают атомную массу, то обычно делают так:
Атомная масса магния равна 24,305 а.е.м. (г/моль).
Можете посчитать молярную массу для различных элементов и убедиться в правоте этого утверждения. Для расчёта молярной массы можно использовать простой калькулятор, который находится внизу страницы:
av-mag.ru
Молекулярная физика — Основные формулы
1. Основы молекулярно-кинетической теории. Газовые законы
1.1 Количество вещества
m — масса;
μ — молярная масса вещества;
N — число молекул;
NA = 6,02·1023 моль-1 — число Авогадро
1.2 Основное уравнение молекулярно-кинетической теории идеального газа
p — давление идеального газа;
m — масса одной молекулы;
n = N/V — концентрация молекул;
V — объем газа;
N — число молекул;
— среднее значение квадрата скорости молекул.
1.3 Средняя квадратичная скорость молекул идеального газа
k = 1,38·10-23 Дж/К — постоянная Больцмана;
R = kNA = 8,31 Дж/(моль·К) — универсальная газовая постоянная;
T = t+273 — абсолютная температура;
t — температура по шкале Цельсия.
1.4 Средняя кинетическая энергия молекулы одноатомного газа
1.5 Давление идеального газа
n — концентрация молекул;
k — постоянная Больцмана;
T — абсолютная температура.
1.6 Закон Бойля-Мариотта
p — давление;
V — объем газа.
1.7 Закон Шарля
p0 — давление газа при 0 °С;
α = 1/273 °C-1 — температурный коэффициент давления.
1.8 Закон Гей-Люссака
V0 — объем газа при 0 °С.
1.9 Уравнение Менделеева-Клапейрона
1.10 Объединенный закон газового состояния (уравнение Клапейрона)
1.11 Закон Дальтона
pi — парциальное давление i-й компоненты смеси газов.
2. Основы термодинамики
2.1 Внутренняя энергия идеального одноатомного газа
ν — количество вещества;
R = 8,31 Дж/(моль·К) — универсальная газовая постоянная;
T — абсолютная температура.
2.2 Элементарная работа, совершаемая газом,
при изменении объема на бесконечно малую величину dV
p — давление газа.
При изменении объема от V1 до V2
2.3 Первый закон термодинамики
ΔQ — количество подведенной теплоты;
ΔA — работа, совершаемая веществом;
ΔU — изменение внутренней энергии вещества.
2.4 Теплоемкость идеального газа
ΔQ — количество переданной системе теплоты на участке процесса;
ΔT — изменение температуры на этом участке процесса.
fizikazadachi.ru
Относительная молярная и молекулярная массы вещества. Молярный объем вещества
В химии не используют значения абсолютных масс молекул, а пользуются величиной относительная молекулярная масса. Она показывает, во сколько раз масса молекулы больше 1/12 массы атома углерода. Эту величину обозначают Mr.
Относительная молекулярная масса равна сумме относительных атомных масс входящих в нее атомов. Вычислим относительную молекулярную массу воды.
Вы знаете, что в состав молекулы воды входят два атома водорода и один атом кислорода. Тогда ее относительная молекулярная масса будет равна сумме произведений относительной атомной массы каждого химического элемента на число его атомов в молекуле воды:
Зная относительные молекулярные массы газообразных веществ, можно сравнивать их плотности, т. е. вычислять относительную плотность одного газа по другому – D(А/Б). Относительная плотность газа А по газу Б равна отношению их относительных молекулярных масс:
Вычислим относительную плотность углекислого газа по водороду:
.
Теперь вычисляем относительную плотность углекислого газа по водороду:
D(угл. г./водор.) = Mr(угл. г.) : Mr(водор.) = 44:2 = 22.
Таким образом, углекислый газ в 22 раза тяжелее водорода.
Как известно, закон Авогадро применим только к газообразным веществам. Но химикам необходимо иметь представление о количестве молекул и в порциях жидких или твердых веществ. Поэтому для сопоставления числа молекул в веществах химиками была введена величина – молярная масса.
Молярная масса обозначается М, она численно равна относительной молекулярной массе.
Отношение массы вещества к его молярной массе называется количеством вещества.
Количество вещества обозначается n. Это количественная характеристика порции вещества, наряду с массой и объемом. Измеряется количество вещества в молях.
Слово «моль» происходит от слова «молекула». Число молекул в равных количествах вещества одинаково.
Экспериментально установлено, что 1 моль вещества содержит частиц (например, молекул). Это число называется числом Авогадро. А если к нему добавить единицу измерения – 1/моль, то это будет физическая величина – постоянная Авогадро, которая обозначается NА.
Молярная масса измеряется в г/моль. Физический смысл молярной массы в том, что эта масса 1 моль вещества.
В соответствии с законом Авогадро, 1 моль любого газа будет занимать один и тот же объем. Объем одного моля газа называется молярным объемом и обозначается Vn.
При нормальных условиях (а это 0 °С и нормальное давление – 1 атм. или 760 мм рт. ст. или 101,3 кПа) молярный объем равен 22,4 л/моль.
Тогда количество вещества газа при н.у. можно вычислить как отношение объема газа к молярному объему.
ЗАДАЧА 1. Какое количество вещества соответствует 180 г воды?
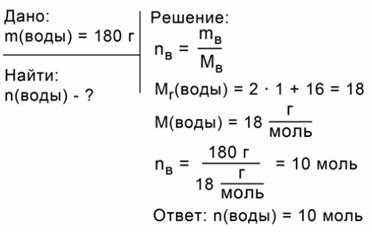
ЗАДАЧА 2. Вычислим объем при н.у., который займет углекислый газ количеством 6 моль.

Список литературы
- Сборник задач и упражнений по химии: 8-й класс: к учебнику П.А. Оржековского и др. «Химия, 8 класс» / П.А. Оржековский, Н.А. Титов, Ф.Ф. Гегеле. – М.: АСТ: Астрель, 2006. (с. 29–34)
- Ушакова О.В. Рабочая тетрадь по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под. ред. проф. П.А. Оржековского – М.: АСТ: Астрель: Профиздат, 2006. (с. 27–32)
- Химия: 8-й класс: учеб. для общеобр. учреждений / П.А. Оржековский, Л.М. Мещерякова, Л.С. Понтак. М.: АСТ: Астрель, 2005. (§§ 12, 13)
- Химия: неорг. химия: учеб. для 8 кл. общеобр.учрежд. / Г.Е. Рудзитис, Ф.Г. Фельдман. – М.: Просвещение, ОАО «Московские учебники», 2009. (§§ 10, 17)
- Энциклопедия для детей. Том 17. Химия / Глав. ред.В.А. Володин, вед. науч. ред. И. Леенсон. – М.: Аванта+, 2003.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
- Единая коллекция цифровых образовательных ресурсов (Источник).
- Электронная версия журнала «Химия и жизнь» (Источник).
- Тесты по химии (онлайн) (Источник).
Домашнее задание
1. с.69 № 3; с.73 №№ 1, 2, 4 из учебника «Химия: 8-й класс» (П.А. Оржековский, Л.М. Мещерякова, Л.С. Понтак. М.: АСТ: Астрель, 2005).
2. №№ 65, 66, 71, 72 из Сборника задач и упражнений по химии: 8-й класс: к учебнику П.А. Оржековского и др. «Химия, 8 класс» / П.А. Оржековский, Н.А. Титов, Ф.Ф. Гегеле. – М.: АСТ: Астрель, 2006.
interneturok.ru
Что такое молярная масса? Молярная масса в химии и физике газов
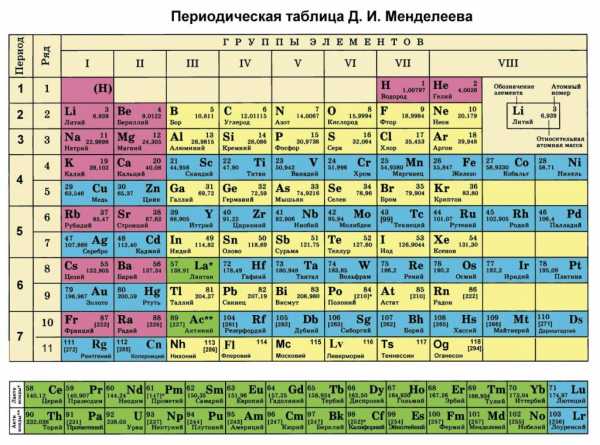
Каждый школьник, который внимательно изучал таблицу Менделеева, наверняка заметил, что, помимо номера химического элемента, в ней присутствует информация о весе его атома. В данной статье рассмотрим, что такое молярная масса и где она используется.
Что такое моль?

Прежде чем ответить на вопрос «что такое молярная масса», необходимо разобраться с такой важной величиной в химии, как моль.
В XIX веке Амедео Авогадро, внимательно изучая закон Гей-Люссака для идеальных газов при изохорном процессе, пришел к умозаключению, что в одинаковых объемах разных веществ при идентичных условиях (температура и давление) содержится равное число атомов или молекул. Идеи Авогадро противоречили теориям того времени о химическом строении и поведении газовых субстанций, поэтому они были приняты только спустя полвека.
В начале XX века с помощью более современных технологий удалось определить количество молекул водорода в 2 граммах этого газа. Это количество получило название «моль». Сам термин был введен Вильгельмом Оствальдом, с латыни он переводится как «куча», «скопление».
В 1971 году моль стал одной из 7 основных единиц измерения в системе СИ. В настоящее время под 1 молем понимают такое количество атомов кремния, которое содержится в идеальной сфере массой 0,028085 кг. Само число частиц, соответствующее 1 моль, называется числом Авогадро. Равно оно приблизительно 6,02*1023.
Что такое молярная масса?
Теперь можно вернуться к теме статьи. Моль и молярная масса — это две взаимосвязанные величины. Под второй понимают вес одного моль любого вещества. Очевидно, что тип химического элемента или состав молекулы того или иного газа напрямую определяет молярную массу. Согласно данному определению, можно записать следующее выражение:
M = ma * NA.
Где ma — это масса одного атома, NA — число Авогадро. То есть для получения величины M необходимо умножить вес одной частицы (молекулы, атома, атомного кластера) на число Авогадро.
Как было отмечено во введении статьи, каждый элемент в периодической таблице содержит информацию о его атомной массе. Она представляет собой вес в граммах на моль. Очевидно, чтобы получить молярную массу в кг/моль, следует табличное значение разделить на 1000. Например, для ниобия под номером 41 мы видим цифру 92,9, то есть 1 моль его атомов имеет вес 92,9 грамма.
Где используется величина M в химии?
Зная теперь, что такое молярная масса, рассмотрим, где ее применяют в химии.
Понятие количества вещества и молярного веса играет важную роль при составлении химических реакций, поскольку они идут только при строгом соотношении реагентов. Для примера ниже приведена реакция сгорания водорода с образованием молекулы воды:
2H2 + O2 = 2H2O.
Видно, что 2 моль водорода, которые имеют массу 4 грамма, реагируют без остатка с 1 моль кислорода весом 32 грамма. В результате образуется 2 моль молекул воды, с показателем в 36 граммов. Из этих цифр ясно, что в процессе химических превращений масса сохраняется. В действительности же вес реагентов и продуктов превращения немного отличается. Эта небольшая разница связана с тепловым эффектом реакции. Разницу в массах можно рассчитать, если использовать формулу Эйнштейна для связи веса и энергии.
В химии понятие молярной массы также тесно связано с одноименной концентрацией. Обычно твердые вещества, которые растворимы в жидкостях, характеризуют количеством молей в одном литре, то есть молярной концентрацией.
Важно понимать, что рассматриваемая величина является постоянной только для данного химического элемента или конкретного соединения, например, для H2 она равна 2 г/моль, а для O3 — 48 г/моль. Если ее значение для одного соединения больше, чем для другого, то это означает, что сама элементарная частица первого вещества имеет большую массу, чем второго.
Газы и их молярный объем
Молярная масса также связана с физикой идеальных газов. В частности, ей пользуются во время определения объема газовой системы при конкретных внешних условиях, если известно количество вещества.

Идеальные газы описываются уравнением Клапейрона-Менделеева, которое имеет вид:
P * V = n * R * T.
Здесь n — это количество вещества, которое с молярной массой связано так:
n = m / M.
Объем газа можно определить, если известны его m, температура T и давление P, по следующей формуле:
V = m * R * T / (M * P).
Молярным объемом называется такой, который при 0 oC и давлении в одну атмосферу занимает 1 моль любого газа. Из формулы выше можно рассчитать эту величину, она составляет 22,4 литра.
fb.ru
Молярная масса некоторых газов значения (Таблица)
Молярная масса газа (или вещества) — это отношение массы газа к количеству молей этого газа, то есть масса одного моля газа (вещества).
В системе СИ молярная масса выражается в кг/моль (или г/моль), обозначают обычно буквой M.
Название газа и его химическая формула | Молярная масса, г/моль |
Азот (N2) | 28,016 |
Аммиак (NH3) | 17,031 |
Аргон (Ar) | 39,944 |
Ацетилен (C2H2) | 26,04 |
Ацетон (C3H6O) | 58,08 |
Н-бутан (C4h20) | 58,12 |
Изо-бутан ( C4HJ0) | 58,12 |
Н-бутиловый спирт ( C4HJ0O) | 74,12 |
Вода (H2O) | 18,016 |
Водород (h3) | 2,0156 |
Воздух (сухой) | 28,96 |
Н-гексан (C6HJ4) | 86,17 |
Гелий (He) | 4,003 |
Н-гептан (C7HJ6) | 100,19 |
Двуокись углерода (CO2) | 44,01 |
Н-декан ( C10h32) | 142,30 |
Дифенил ( C12h20) | 154,08 |
Дифениловый эфир ( CJ2H10O) | 168,8 |
Дихлорметан ( CH2Cl2) | 84,94 |
Диэтиловый эфир (C4H10O) | 74,12 |
Закись азота (N2O) | 44,016 |
Йодистый водород (HJ) | 127,93 |
Кислород (O2) | 32,00 |
Криптон (Kr) | 83,7 |
Ксенон (Xe) | 131,3 |
Метан (CH4) | 16,04 |
Метиламин (CH5N) | 31,06 |
Метиловый спирт (CH4O) | 32,04 |
Неон (Ne) | 20,183 |
Нитрозилхлорид (NOCl) | 65,465 |
Озон (O3) | 48,00 |
Окись азота (NO) | 30,008 |
Окись углерода (CO) | 28,01 |
Н-октан ( C8H18) | 114,22 |
Н-пентан ( C5H12) | 72,14 |
Изо-пентан ( C5H12) | 72,14 |
Пропан ( C3H8) | 44,09 |
Пропилен ( C3H6) | 42,08 |
Селеновая кислота (H2Se) | 80,968 |
Сернистый газ (SO2) | 64,06 |
Сернистый ангидрид (SO3) | 80,06 |
Сероводород (H2S) | 34,08 |
Фосфористый водород (PH3) | 34,04 |
Фреон 11 (CF3CI) | 137,40 |
Фреон-12 (CF2CI2) | 120,92 |
Фреон-13 (CFCI3) | 114,47 |
Фтор (F2) | 38,00 |
Фтористый кремний (SiF4) | 104,06 |
Фтористый метил (CH3F) | 34,03 |
Хлор (Cl2) | 70,914 |
Хлористый водород (HCl) | 36,465 |
Хлористый метил (CH3Cl) | 50,49 |
Хлороформ (CHCl3) | 119,39 |
Циан (C2N2) | 52,04 |
Цианистая кислота (HCN) | 27,026 |
Этан (C2H6) | 30,07 |
Этиламин (C2H7N) | 45,08 |
Этилен (C2h5) | 28,05 |
Этиловый спирт (C2H6O) | 46,07 |
Хлористый этил (C2H5Cl) | 64,52 |
infotables.ru
Количество вещества. Постоянная Авогадро. Молярная масса | Физика. Закон, формула, лекция, шпаргалка, шпора, доклад, ГДЗ, решебник, конспект, кратко
Отношение количества молекул N в данном теле к количеству атомов NA в 0,012 кг углерода называется количеством вещества:
v = N / NA;
N = vNA.
Количество молекул воды в 1г равняется: N = m / m0 = 1 • 10-3 кг / 30 • 10-27 кг ≈ 3,3 • 1022.
Количество вещества измеряется в молях или киломолях. 1 кмоль = 103 моль.
Моль — это такое количество вещества, которое содержит столько же атомов, молекул или других структурных элементов вещества, сколько атомов содержится в 0,012 кг углерода.
Количество атомов или молекул в 1 моле вещества называют постоянной Авогадро NA. Она одинакова для всех веществ и является фундаментальной константой физики:
NA = 6,022045 • 1023 моль-1.
1 моль кислорода содержится в 32 г кислорода, 1 моль воды — в 18 г воды.
Массу 1 моля вещества называют молярной массой. Согласно определению в СИ она измеряется в кг/моль и равняется произведению массы молекулы на постоянную Авогадро:
M = m0 • NA.
Молярная масса связана с относительной молекулярной массой простым соотношением:
М = Мr г /моль = Мr • 10-3 кг/моль.
Молярная масса воды равна 18 г/моль, или 18 • 10-3 кг/моль
Масса т произвольного количества вещества v определяется из соотношения:
m = m0• N = v • m0 • NA = v • М. Материал с сайта http://worldofschool.ru
На основании формулы v = N / NAи этого соотношения можно получить формулу для расчета общего количества молекул в теле:
N = NA• m / M.
Следовательно, для измерения количества вещества молекулярная физика использует величины, которые упрощают расчеты соответствующих величин,— постоянную Авогадро, молярную массу.
На этой странице материал по темам:Молекулярная физика доклад
Количество вещества. лекция
Как определяется количество вещества?
В каких единицах измеряется количество вещества?
Чему равен 1 моль?
Что такое молярная масса?
Как вычислить молярную массу для любого вещества?
worldofschool.ru
