Nh5Cl, степень окисления азота и др элементов
Общие сведения о хлориде аммония и степени окисления в Nh5Cl
Летуч, термически мало устойчив (температура плавления – 400oС при давлении). Брутто-формула – NH4Cl. Молярная масса хлорида аммония равна 53,49 г/моль.
Рис. 1. Хлорид аммония. Внешний вид.
Хорошо растворяется в воде (гидролизуется по катиону). Кристаллогидратов не образует. Разлагается концентрированной серной кислотой и щелочами.
Nh5Cl, степени окисления элементов в нем
Чтобы определить степени окисления элементов, входящих в состав хлорида аммония, сначала необходимо разобраться с тем, для каких элементов эта величина точно известна.
Степень окисления кислотного остатка определяется числом атомов водорода, входящих в состав образующей его кислоты, указанных со знаком минус. Хлорид-ион – это кислотный остаток хлороводородной (соляной) кислоты, формула которой HCl. В её составе имеется один атом водорода, следовательно, степень окисления хлора в хлорид ионе равна (-1).
Ион-аммония является производным аммиака (NH
x + 4× (+1) + (-1) = 0;
x + 4 — 1 = 0;
x +3 = 0;
x = -3.
Значит степень окисления азота в хлориде аммония равна (-3):
N-3H+14Cl-1.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
Простые и сложные вещества | Дистанционные уроки
04-Авг-2012 | комментариев 10 | Лолита Окольнова
Итак, давайте определимся, что такое
— это вещества, образованные из атомов одного элемента.
Например, железо — Fe, азот — N2, ртуть — Hg.
При написании формул таких простых веществ есть одно маленькое секретное правило:
если простое вещество — газ, то его молекула двухатомная:
N2, h3, O2, Cl2 (кроме брома и йода — эти вещества твердые)
если простое вещество твердое или жидкое, то его молекулу записываем в виде одного элемента:
С, Fe, Pt, S, Ca и т.д.
Сложные вещества
или химические соединения, — это вещества, образованные атомами разных элементов.
Самый простой пример — H2O — водичка
В сложных веществах сразу встает проблема как правильно писать эти формулы….
Давайте разберем!
Есть 2 понятия, которые надо знать и уметь отличать друг от друга —
валентность и степень окисления
Валентность элемента — это количество связей, которые может образовывать атом. У атома может быть несколько валентностей.
У металлов (1-я, 2-я и 3-я группы) валентность = номеру группы.
Например, Al — в третьей группе, значит, его валентность = 3
У неметаллов :
- максимальная валентность элемента = номеру группы,
- промежуточные = № группы-2
- минимальная = 8-№группы
Берем S — она находится в 6-й группе периодической системы. Следовательно,
- максимальная валентность элемента = номеру группы = 6 (h3SO4)
- промежуточные валентности: 4 (h3SO3)
- минимальная валентность = 8-№группы = 2 (h3S)
Валентность = количество связей, и вот как это выглядит структурно:
цифры — валентность каждого атома
Степень окисления элемента —
— это условный заряд атома в соединении
По сути — это тоже число, но со знаком «+» или «-«. Например, в соединении h3S — водород Н будет положительно заряженным ионом, степень окисления=+1, S — отрицательно со степенью окисления элемента= -2:
+1 -2
H2S
Степень окисления может у одного и того же элемента может отличаться не только по знаку, но и численно, например:
- у кислорода в воде (H2O) валентность = 2, степень окисления = -2;
Кстати, ион — заряженная частица, образующаяся в результате потери или присоединения атомом или молекулой одного или нескольких электронов.
- валентность и степень окисления — вопрос ЕГЭ А5
- валентность — вопрос А4 ГИА (ОГЭ)
- про простые и сложные вещества — вопрос А5 ГИА (ОГЭ)
Категории: |
Обсуждение: «Простые и сложные вещества»
(Правила комментирования)distant-lessons.ru
Обобщающая таблица на тему «Валентность и степень окисления» 11кл
Валентность и степень окисления. Валентность – способность атомов образовывать химические связиВалентность в соединениях с ковалентным типом связи определяется числом общих электронных пар (числом неспаренных электронов, идущих на образование общих электронных пар)
↓↑ ↓ ↓ ↓↑ ↓↑ ↓
+8О 2ē,6ē; 1s22s22p4; …2 ↓↑ +17Cl 2ē,8ē,7ē; …3s2 3p5; …3 ↓↑
s p s p
.. .. ..
:О::О: О = О В (О) = II Н:Cl: Н – Cl В (Cl) = I ; В (H) = I
¨ ¨ ¨
Валентной может быть и общая электронная пара, предоставляемая атому со свободной орбиталью (донорно- акцепторный механизм образования ковалентной связи)
NH3 + HCl = NH4Cl В(N) = IV
Степень окисления (с.о.) – условное формальное понятие
С.О. – условный заряд, который возник бы на атоме, если б он принял или отдал
электроны, необходимые для образования химической связи
С. О. в простых веществах равна 0: Na; Al; S; Cl2; O2
С.О. в бинарных соединениях отрицательна у более электроотрицательного элемента, у менее электроотрицательного – положительна: +6-2 -3+1 +1 -2
SO3 ; NH3; Na2S
В соединениях, состоящих из трех и более элементов, с.о. определяют, исходя из того, что алгебраическая сумма окисления химических элементов должна быть равна 0.
+1 +5 –2 находят с.о. более электроотрицательного элемента, затем степень +2 х -2
К N O3 окисления менее электроотрицательного элемента MgSO4
(-2•3) +1+х =0; -6 +1 +х = 0; х = +5 ; (-2 • 4) + х + 2 = 0; -8 +х +2 = 0; х =+ 6
В соединениях с ионной связью используют понятие степени окисления, а не валентности.
Валентные возможности атомов. Электроны,
участвующие в образовании химических связей называются валентными— Неспаренные электроны предвнешнего энергетического уровня атомов элементов побочных подгрупп
— Неподеленные электронные пары атомов химических элементов и свободные орбитали других атомов
F; O; N; C – будь внимателен при определении валентности и степени окисления!!!
IV группа
V группа
VI группа
VII группа
↑ ↑
+6С 2ē, 4ē; …2s22p2; … 2 ↓↑
В соединении СО атом углерода предоставляет для химической связи два неспаренных электрона и свободную орбиталь кислороду:
+2-2
С ≡ О ; СО В(О) = III ; с.о. (О) = +2
В(С) = II; с.о. (С) = -2
 а) NH3
а) NH3
С.О.(N) = -3
Н
б) NH4Cl → [ H: N: Н ]+ B(N) = IV
Н+ С.О.(N) = -3
в) N2 N2O NO N2O3 NO2 N2O5
C.О 0 +1 +2 +3 +4 +5
а ) H2O; Н-О-Н; С.О.(О) = -2; B(O) = II
) H2O; Н-О-Н; С.О.(О) = -2; B(O) = II
б) H2O2; Н→О–О←Н; С.О.(О) = -1;
пероксид водорода B(O) = II
в) H3O+— ион гидроксония В(О) = III

a) HF; H→ F В(F) = I; С.О.(F) = -1
б) ОF2; F-O-F мал радиус фтора
В(F) = I; С.О.(F) = -1
В(O) = II; С.О.(O) = +2
↓ ↓ ↓
+6 *С 2ē, 4ē; …2s12p2; … 2 ↓ р
СН4 В (С) = IV; С.О.= — 4 s
-2+1-2+1
С Н3 О Н — этанол В (С) = IV; С.О.= -2
Н Н
↓ ↓
Н→С→О←Н Н→С←Н
↑ ↑
Н Н

В (Р) = III; V;
-3 0 +3 +5
РН3 Р Р2О3 Р2О5
Са3Р2 Н3РО3 НРО3
Н3РО4
В (S) = II; IV; VI
C.O. = -2, 0, +2, +4, +6
H2S S SO2 SO3
MgS H2SO3 H2SO4
Na2SO3 Na2SO4

В (Cl) = I, III , V, VII
С.O (Cl) -1 0 +1 +3 +5 +7
HCl Cl2 Cl2O Cl2O3 Cl2O5 Cl2O7
HClO HClO2 HClO3 HClO4
КClO КClO2 КClO3 КClO4
н
 аиболее характерны С.О: 0 +2 +3 +4 +6 +7
аиболее характерны С.О: 0 +2 +3 +4 +6 +7Mn MnO Mn2O3 MnO2 малоуст. Mn2O7
Mn(OH)2 Mn(OH)3 K2MnO4 HMnO4
MnSO4 Mn2(SO4)3 KMnO4
Задания по теме «Валентность и степень окисления»
1 Определите валентность и степень окисленияа) (NH4)2CO3 б) HCN в) CH3NH3Cl г) O2N-C6H4-NH2
2. Какому веществу не могут соответствовать следующие формулы:
а) Na2PbSi6O14 б) Ca2MgC2O6 в) Mg3H4Si2O9
A.1 Cтепень окисления +2 атом углерода имеет в соединении:
1) СО2 2) СBr4 3) НСООН 4) СН3СООН
A2. Одинаковую степень окисления хлор имеет в каждом из двух соединений:
1) CrCl3 и Cl2O7 2) KClO4 и Cl2O7 3) KCl и HClO 4) KClO2 и BaCl2
A.3 Cтепень окисления +3 атом хлора имеет в соединении:
1) СlО3 2) Cl2O6 3) Ba(ClO2)2 4) KClO3
А.4 Cтепень окисления +2 атом, а валентность IV атом углерода имеет в
соединении: 1) СО 2) СО2 3) НСООН 4) СН2Сl2
А.5. Cтепень окисления -3 атом, а валентность IV атом азота имеет в
соединении: 1) HNO2 2) NF3 3) HNO3 4) NH4Cl
А.6. Валентность элемента равна
1) числу образуемых σ- связей 2) числу образуемых π- связей
3) числу образуемых им ковалентных связей
4) степени окисления с противоположным знаком.
А.7. Элемент, проявляющий постоянную степень окисления в своих
соединениях: 1) хлор 2) сера 4) фтор 5) кислород
А.8. Валентность IV атом азота имеет в соединении:
1) HNO2 2) (NH4)2 СО3 3)NO 4) Ca(NO3)2
А.9 Cтепень окисления +1 атом хлора имеет в соединении:
1) СlО2 2) НCl 3) Ba(ClO2)2 4) Сa(ClO)Cl
А.10. Cвою максимальную степень окисления азот проявляет в соединении
1) NH4Cl 2) NO2 3) NH4NO3 4) NOF
А.11. Cтепень окисления серы в соединениях SO2, Na2SO3 соответственно
1) +2 и +4 2) +4 и +4 3) +4 и +6 4) -4 и +6
А.12. Cтепень окисления серы увеличивается в ряду
1) Н2S, S, SO3 2) S, SO3,Na2SO3 3) SO3, SO2, S 4) Н2S, SO3, Na2SO4
А.13. На четвертом энергетическом уровне расположены все валентные электроны
1) железа 2) кальция 3) углерода 4) серы
А.14. Атом элемента, максимальная степень окисления которого +4, в основном состоянии имеет электронную конфигурацию внешнего энергетического уровня:
1) 3s23p4 2) 2s22p2 3) 2s22p4 4) 2s22p6
А.15. Наибольшую степень окисления марганец имеет в соединении
1) MnSO4 2) MnO2 3) K2MnO4 4) Mn2O3
A.16. Одинаковую степень окисления хлор имеет в каждом из двух соединений:
1) CН4 и CO2 2) НCНO и СН2Cl2 3) СН3ОН и Nа2CO3 4) СН3Cl и СaC2
А.17. В какой молекуле степень окисления элемента равна нулю, а валентность равна единице? 1) О2 2)СаС2 3) Cl2 4) СО
А.18. В соединениях РН3, Р2О5, Н3РО3 фосфор имеет с.о., соответственно равные:
1) +3,+5,-3 2) -3, +5,+3 3) -3,+3,+5 4) +3,-5,-3
Знаешь ли ты…
В
 молекуле азотной кислоты азот отдает неспаренные электроны для образования связей между атомами кислорода (при Н-О, при N=О) третий атом кислорода спаривает свои неспареннве электроны и на освободившуюся ячейку притягивает спаренные электроны азота.
молекуле азотной кислоты азот отдает неспаренные электроны для образования связей между атомами кислорода (при Н-О, при N=О) третий атом кислорода спаривает свои неспареннве электроны и на освободившуюся ячейку притягивает спаренные электроны азота.
В(N) = IV С.О.(N) = +5 +1 +5 -2
Н N O3
Или: три неспаренных электрона N дает трем атомам кислорода, а оющую электронную пару располагает между двумя атомами кислорода равномерно.
O – H
Na –O – H; Ba Na – O – O – Na
O – H
(S-VI гр: +4,+6,+2,-2)
элементов нечетной группы – нечетные числа (Cl — VII гр: -1-,+3,+5+7)
Высшая степень окисления элемента главной подгруппы = номеру группы
Степени окисления металлов в соединениях > 0
Низшая степень окисления неметалла равна (8 – № группы)
________________________________________________________
В.1 Установите соответствие между названием химического элемента и возможными значениями его степеней окисления.
В.2 Установите соответствие между формулoй соединения и значением степени окисления хлора в нем.Ответы на задания по теме «Валентность и степень окисления»
A.1 Cтепень окисления +2 атом углерода имеет в соединении:1) СО2 2) СBr4 3) НСООН 4) СН3СООН
A2. Одинаковую степень окисления хлор имеет в каждом из двух соединений:
1) CrCl3 и Cl2O7 2) KClO4 и Cl2O7 3) KCl и HClO 4) KClO2 и BaCl2
A.3 Cтепень окисления +3 атом хлора имеет в соединении:
1) СlО3 2) Cl2O6 3) Ba(ClO2)2 4) KClO3
А.4 Cтепень окисления +2 атом, а валентность IV атом углерода имеет в
соединении: 1) СО 2) СО2 3) НСООН 4) СН2Сl2
А.5. Cтепень окисления -3 атом, а валентность IV атом азота имеет в
соединении: 1) HNO2 2) NF3 3) HNO3 4) NH4Cl
А.6. Валентность элемента равна
1) числу образуемых σ- связей 2) числу образуемых π- связей
3) числу образуемых им ковалентных связей
4) степени окисления с противоположным знаком.
А.7. Элемент, проявляющий постоянную степень окисления в своих
соединениях: 1) хлор 2) сера 4) фтор 5) кислород
А.8. Валентность IV атом азота имеет в соединении:
1) HNO2 2) (NH4)2 СО3 3)NO 4) Ca(NO3)2
А.9 Cтепень окисления +1 атом хлора имеет в соединении:
1) СlО2 2) НCl 3) Ba(ClO2)2 4) Сa(ClO)Cl
А.10. Cвою максимальную степень окисления азот проявляет в соединении
1) NH4Cl 2) NO2 3) NH4NO3 4) NOF
А.11. Cтепень окисления серы в соединениях SO2, Na2SO3 соответственно
1) +2 и +4 2) +4 и +4 3) +4 и +6 4) -4 и +6
А.12. Cтепень окисления серы увеличивается в ряду
1) Н2S, S, SO3 2) S, SO3,Na2SO3 3) SO3, SO2, S 4) Н2S, SO3, Na2SO4
А.13. На четвертом энергетическом уровне расположены все валентные электроны
1) железа 2) кальция 3) углерода 4) серы
А.14. Атом элемента, максимальная степень окисления которого +4, в основном состоянии имеет электронную конфигурацию внешнего энергетического уровня:
1) 3s23p4 2) 2s22p2 3) 2s22p4 4) 2s22p6
А.15. Наибольшую степень окисления марганец имеет в соединении
1) MnSO4 2) MnO2 3) K2MnO4 4) Mn2O3
A.16. Одинаковую степень окисления хлор имеет в каждом из двух соединений:
1) CН4 и CO2 2) НCНO и СН2Cl2 3) СН3ОН и Nа2CO3 4) СН3Cl и СaC2
А.17. В какой молекуле степень окисления элемента равна нулю, а валентность равна единице? 1) О2 2)СаС2 3) Cl2 4) СО
А.18. В соединениях РН3, Р2О5, Н3РО3 фосфор имеет с.о., соответственно равные:
1) +3,+5,-3 2) -3, +5,+3 3) -3,+3,+5 4) +3,-5,-3
В.1 Установите соответствие между названием химического элемента и возможными значениями его степеней окисления.
В.2 Установите соответствие между формулoй соединения и значением степени окисления хлора в нем.1 Определите валентность и степень окисления
-3+1 +4-2 В(N)=IV; В(H)= HCN;а) (NH4)2CO3 В(O)=II;
-2 +3 -1 +1 +1 -3 +1
г) O2N- C4H4 C2–N H2
В(N) – NH2 = III;
В(N) – NO2 = IV;
В(C) = IV;
В(H)=I;
В(O)=II;
+1+2-3 I IV III
б) HCN H- C ≡ N
-2+1-3+1 В(C)=IV; В(N)=IV;
в)[CH3NH3]+ Cl— В(Cl)=I; В(H)=I;
2. Какому веществу не могут соответствовать следующие формулы:
+1 +2 +4-2 +2 +2 +4 -2
а) Na2PbSi6O14 Na2O• PbO• 6SiO2 б) Ca2MgC2O6 +16 ≠ -12
+2 +1 +4 -2
в) Mg3H4Si2O9 3Mg O• 2SiO2 •2H2O
Задания по теме «Валентность и степень окисления»
1. Степень окисления, равную +4, атом серы имеет в1) H2SO4 2) FeS2 3) H2SO3 4) NaHSO4
2. В каком состоянии степень окисления атома хлора равна +5
1) HClO 2) Cl2O7 3) NaClO4 4) KClO3
3. Степень окисления -3 азот проявляет в соединении
1) KBO2 2) NH4Cl 3) KNO3 4) N2O3
4. Наименьшую степень окисления сера проявляет в соединении
1) H2S 2) SO3 3) SO2 4) K2SO3
5. Степень окисления азота в ионе NO2¯ равна 1) -1 2) +3 3) -3 4) +5
6. Низшую степень окисления азот проявляет в соединении
1) N2H4 2) K2NH 3) NF3 4) HNO3
7. Одинаковая степень окисления серы в ряду
1) SO2, SO2Cl2, R2SO3 2) H2S, K2S, S2Cl2
3) KHSO4, SO3, H2SO4 4) SO3, H2SO4, Na2S
8. Степень окисления фосфора уменьшается в ряду
1) K3PO4, K2HPO3, Ca3P2 2) P4O6, H4P2O7, KPH2O2
3) H2PHO3, KPO3, PH3 4) PH3, H3PO4, P2O5
9. Иону Rb+ соответствует электронная формула
1) …4s24p65s1 2) …4s25d1 3) …4s24p65s2 4) …4s24p6
10. В основном состоянии ? неспаренные электроны содержит частица
1) Ca2+ 2) Al3+ 3) Ni2+ 4) Pb2+
11. Степень окисления, не характерная для азота
1) -5 2) -3 3) +3 4) +5
12. Степень окисления +3 не проявляет
1) стронций 2) хром 3) азот 4) хлор
13. Высшая положительная степень марганца равна: 1) +2 2) +4 3) +7 4) +8
14. Наименьшую степень окисления углерод проявляет в соединении
1) CCl4 2) CH4 3) C2H2 4) C2H6
15. Свою максимальную степень окисления бром проявляет в соединении
1) NaBr 2) HBrO 3) BrF5 4)KBrO4
16. Степень окисления углерода равна -3 в соединении
1) CHCl3 2) C2H6 3) CH3Cl 4) Na2CO3
17. Среди элементов 6-А группы наиболее электроотрицательным является
1) селен 2) сера 3) полоний 4) кислород
18. В порядке возрастания электроотрицательности элементы расположены в ряду
1) S, Cl, F 2) S, F, O 3) F, S, Cl 4) S, F, Cl
19. Набор ионов, которым соответствует формула 1s2
1) Be2+, O2- 2) Li+, C4+ 3) P3-, Cl— 4) F—, Na+
20. Степень окисления серы в соединении FeSO3 равна 1) -1 2) +2 3) 0 4) +4
21 Отрицательная степень окисления у серы в соединении
1) NaHS 2) NaHSO3 3) SO2 4) H2SO4
22.Одинаковую степень окисления железо проявляет в соединениях:
1) FeO и FeСO3 2) Fe(OH)3 и FeСl2 3) Fe2O3 и Fe(NO3)2 4) FeO и FePO4
23. Азот проявляет одинаковую степень окисления в каждом из двух соединений: 1) NH3, N2O3 2) HNO2, Li3N 3) Mg3N2, NH3 4) NH3, HNO2
24.Наибольшую степень окисления марганец имеет в соединении:
1) MnSO4 2) MnO2 3) K2MnO4 4) Mn2O3
25. Наибольшую валентность в соединениях с водородом проявляют
1) фтор и хлор 2) кислород и сера 3) азот и фосфор 4) углерод и кремний
26.Только окислительные свойства способен проявлять
1) кислород 2) фтор 3) хлор 4) азот
27.Наибольшей электроотрицательностью обладает 1)магний 2) кремний 3) хлор 4) бром
28. Наибольшей электроотрицательностью обладает
углерод 2) азот 3) мышьяк 4) фосфор
29.В порядке увеличения электроотрицательности элементы расположены в ряду:
1) O → N → C → B 2) Si → Ge → Sn → Pb
3) Li → Na → K → Rb 4) Si → P → S → Cl
30.Хлор является и окислителем и восстановителем в реакции:
1) 2FeCl2 + Cl2 = 2FeCl3 2) Fe + 2HCl = FeCl2 + H2
3) 2KOH + Cl2 = KCl + KClO + H2O
4) MnO2 + 4HCl = Cl2 + MnCl2 + 2H2O
31.Реакции, уравнение которой 4NH3 + 5O2 = 4NO + 6H2O
соответствует схема превращения азота:
1) N+3 → N+2 2) N-3 → N-2 3) N+3 → N-3 4)N-3 → N+2
32. Наименьшую степень окисления проявляет сера в соединении
1) NН4HS 2) Na2SО3 3) SО2 4) S
33. Степень окисления углерода равна 0 в веществах
1) дихлорметан и метаналь 2) метаналь и муравьиная кислота
3) муравьиная кислота и графит 4) графит и метан
34. Наибольшую валентность в соединениях с водородом проявляют
1) фтор и хлор 2) кислород и сера3) азот и фосфор 4) углерод и кремний
35. Число валентных, электронов в нормальном состоянии атома с электронной конфигурацией 1s22s22р63s23р63d104s24р64d55s1 равно 1) 1 2) 5 3) 3 4) 6
36. Порядковый номер элемента, у атома которого валентные электроны …4s24р4, равен 1) 12 2) 18 3) 22 4) 34
37. На 4s-энергетическом подуровне расположены все валентные электроны в атоме
1) железа 2) кальция 3) углерода 4) серы
38. Одинаковое значение валентности в водородном соединении и высшем оксиде имеет элемент: 1) хлор, 2) германий, 3) мышьяк, 4) селен
39. Наименьшую степень окисления хром имеет в соединении
1) K2CrO4 2) CrSO4 3) CrO3 4) Cr2(SO4)3
В. 3. Установите соответствие между формулой вещества и степенью окисления азота в нем.
Ответы на задания по теме «Валентность и степень окисления» 1. Степень окисления, равную +4, атом серы имеет в1) H2SO4 2) FeS2 3) H2SO3 4) NaHSO4
2. В каком состоянии степень окисления атома хлора равна +5
1) HClO 2) Cl2O7 3) NaClO4 4) KClO3
3. Степень окисления -3 азот проявляет в соединении
1) KBO2 2) NH4Cl 3) KNO3 4) N2O3
4. Наименьшую степень окисления сера проявляет в соединении
1) H2S 2) SO3 3) SO2 4) K2SO3
5. Степень окисления азота в ионе NO2¯ равна 1) -1 2) +3 3) -3 4) +5
6. Низшую степень окисления азот проявляет в соединении
1) N2H4 2) K2NH 3) NF3 4) HNO3
7. Одинаковая степень окисления серы в ряду
1) SO2, SO2Cl2, R2SO3 2) H2S, K2S, S2Cl2
3) KHSO4, SO3, H2SO4 4) SO3, H2SO4, Na2S
8. Степень окисления фосфора уменьшается в ряду
1) K3PO4, K2HPO3, Ca3P2 2) P4O6, H4P2O7, KPH2O2
3) H2PHO3, KPO3, PH3 4) PH3, H3PO4, P2O5
9. Иону Rb+ соответствует электронная формула
1) …4s24p65s1 2) …4s25d1 3) …4s24p65s2 4) …4s24p6
10. В основном состоянии ? неспаренные электроны содержит частица
1) Ca2+ 2) Al3+ 3) Ni2+ 4) Pb2+
11. Степень окисления, не характерная для азота
1) -5 2) -3 3) +3 4) +5
12. Степень окисления +3 не проявляет
1) стронций 2) хром 3) азот 4) хлор
13. Высшая положительная степень марганца равна: 1) +2 2) +4 3) +7 4) +8
14. Наименьшую степень окисления углерод проявляет в соединении
1) CCl4 2) CH4 3) C2H2 4) C2H6
15. Свою максимальную степень окисления бром проявляет в соединении
1) NaBr 2) HBrO 3) BrF5 4)KBrO4
16. Степень окисления углерода равна -3 в соединении
1) CHCl3 2) C2H6 3) CH3Cl 4) Na2CO3
17. Среди элементов 6-А группы наиболее электроотрицательным является
1) селен 2) сера 3) полоний 4) кислород
18. В порядке возрастания электроотрицательности элементы расположены в ряду
1) S, Cl, F 2) S, F, O 3) F, S, Cl 4) S, F, Cl
19. Набор ионов, которым соответствует формула 1s2
1) Be2+, O2- 2) Li+, C4+ 3) P3-, Cl— 4) F—, Na+
20. Степень окисления серы в соединении FeSO3 равна 1) -1 2) +2 3) 0 4) +4
21 Отрицательная степень окисления у серы в соединении
1) NaHS 2) NaHSO3 3) SO2 4) H2SO4
22.Одинаковую степень окисления железо проявляет в соединениях:
1) FeO и FeСO3 2) Fe(OH)3 и FeСl2 3) Fe2O3 и Fe(NO3)2 4) FeO и FePO4
23. Азот проявляет одинаковую степень окисления в каждом из двух соединений: 1) NH3, N2O3 2) HNO2, Li3N 3) Mg3N2, NH3 4) NH3, HNO2
24.Наибольшую степень окисления марганец имеет в соединении:
1) MnSO4 2) MnO2 3) K2MnO4 4) Mn2O3
25. Наибольшую валентность в соединениях с водородом проявляют
1) фтор и хлор 2) кислород и сера 3) азот и фосфор 4) углерод и кремний
26.Только окислительные свойства способен проявлять
1) кислород 2) фтор 3) хлор 4) азот
27.Наибольшей электроотрицательностью обладает 1)магний 2) кремний 3) хлор 4) бром
28. Наибольшей электроотрицательностью обладает
углерод 2) азот 3) мышьяк 4) фосфор
29.В порядке увеличения электроотрицательности элементы расположены в ряду:
1) O → N → C → B 2) Si → Ge → Sn → Pb
3) Li → Na → K → Rb 4) Si → P → S → Cl
30.Хлор является и окислителем и восстановителем в реакции:
1) 2FeCl2 + Cl2 = 2FeCl3 2) Fe + 2HCl = FeCl2 + H2
3) 2KOH + Cl2 = KCl + KClO + H2O
4) MnO2 + 4HCl = Cl2 + MnCl2 + 2H2O
31.Реакции, уравнение которой 4NH3 + 5O2 = 4NO + 6H2O
соответствует схема превращения азота:
1) N+3 → N+2 2) N-3 → N-2 3) N+3 → N-3 4)N-3 → N+2
32. Наименьшую степень окисления проявляет сера в соединении
1) NН4HS 2) Na2SО3 3) SО2 4) S
33. Степень окисления углерода равна 0 в веществах
1) дихлорметан и метаналь 2) метаналь и муравьиная кислота
3) муравьиная кислота и графит 4) графит и метан
34. Наибольшую валентность в соединениях с водородом проявляют
1) фтор и хлор 2) кислород и сера3) азот и фосфор 4) углерод и кремний
35. Число валентных, электронов в нормальном состоянии атома с электронной конфигурацией 1s22s22р63s23р63d104s24р64d55s1 равно 1) 1 2) 5 3) 3 4) 6
36. Порядковый номер элемента, у атома которого валентные электроны …4s24р4, равен 1) 12 2) 18 3) 22 4) 34
37. На 4s-энергетическом подуровне расположены все валентные электроны в атоме
1) железа 2) кальция 3) углерода 4) серы
38. Одинаковое значение валентности в водородном соединении и высшем оксиде имеет элемент: 1) хлор, 2) германий, 3) мышьяк, 4) селен
39. Наименьшую степень окисления хром имеет в соединении
1) K2CrO4 2) CrSO4 3) CrO3 4) Cr2(SO4)3
В. 3. Установите соответствие между формулой вещества и степенью окисления азота в нем.
infourok.ru
Валентность и степень окисления — Подготовка к ЕГЭ по химии
Валентность —
— это способность атома образовывать определенное количество связей с другими атомами.
Правила определения валентности
1. В молекулах простых веществ: H2, F2, Cl2, Br2, I2 равна единице.
2. В молекулах простых веществ: O2, S8 равна двум.
3. В молекулах простых веществ: N2, P4 и CO — оксиде углерода (II) — равна трем.
4. В молекулах простых веществ, которые образует углерод (алмаз, графит), а также в органических соединениях, которые он образует, валентность углерода равна четырем.
5. В составе сложных веществ водород одновалентен, кислород, в основном, двухвалентен. Для определения валентности атомов других элементов в составе сложных веществ надо знать строение этих веществ.
Степень окисления
– это условный заряд атомов химического элемента в соединении, вычисленный на основе предположения, что все соединения (с ионной и ковалентной полярной связью) состоят только из ионов.
Высшая степень окисления элемента равна номеру группы.
Исключения:
фтор высшая степень окисления ноль в простом веществе F20
кислород высшая степень окисления +2 во фториде кислорода О+2F2
Низшая степень окисления элемента равна восемь минус номер группы (по числу электронов, которые атом элемента может принять до завершенного восьми электронного уровня)
Правила определения степени окисления (далее обозначим: ст.ок.)
Общее правило: Сумма всех степеней окисления элементов в молекуле с учетом количества атомов равна нулю (Молекула электронейтральна.), в ионе — равна заряду иона.
I. Степень окисления простых веществ равна нулю: Са0, O20, Cl20
II. ст.ок. в бинарных cоединениях:
Менее электроотрицательный элемент ставится на первое место. (Исключения: С-4Н4+ метан и N-3H3+аммиак)
Нужно помнить, что
— ст.ок. металла всегда положительна
— ст.ок. металлов I, II, III групп главных подгрупп постоянна и равна номеру группы
Для остальных ст.ок. вычисляется по общему правилу.
Более электроотрицательный элемент ставится на второе место, его ст.ок. равна восемь минус номер группы (по числу электронов, которые он принимает до завершенного восьми электронного уровня).
Исключения: пероксиды, например, Н2+1О2-1, Ba+2O2-1 и др. ; карбиды металлов I и II групп Ag2+1C2-1, Ca+2C2-1 и др. (В школьном курсе встречается соединение FeS2 — пирит. Это дисульфид железа. Степень окисления серы в нем (-1) Fe+2S2-1). Это происходит потому, что в этих соединениях есть связи между одинаковыми атомами -О-О-, -S-S-, тройная связь в карбидах между атомами углерода. Степень окисления и валентность элементов в этих соединениях не совпадают: у углерода валентность IV, у кислорода и серы II.
III. Степень окисления в основаниях Ме+n(ОН)nравна количеству гидроксогрупп.
1. в гидроксогруппе ст.ок. кислорода -2, водорода +1, заряд гидроксогруппы 1-
2. ст.ок. металла равна количеству гидроксогрупп
IV. Степень окисления в кислотах:
1. ст.ок. водорода +1, кислорода -2
2. ст.ок. центрального атома вычисляется по общему правилу путем решения простого уравнения
Например, Н3+1РхО4-2
3∙(+1) + х + 4∙(-2) = 0
3 + х – 8 = 0
х = +5 (не забудьте знак +)
Можно запомнить, что у кислот с высшей ст.ок. центрального элемента, соответствующего номеру группы, название будет заканчиваться на –ная:
Н2СО3угольная Н2С+4О3
Н2SiО3 кремниевая (искл.) Н2Si+4О3
НNО3 азотная НN+5О3
Н3PО4 фосфорная Н3P+5О4
Н2SО4 серная Н2S+6О4
НСlО4 хлорная НCl+7О4
НMnО4 марганцовая НMn+7О4
Останется запомнить:
НNО2 азотистая НN+3О2
Н2SО3 сернистая Н2S+4О3
НСlО3 хлорноватая НCl+5О3
НСlО2 хлористая НCl+3О2
НСlОхлорноватистая НCl+1О
V. Степень окисления в солях
у центрального атома такая же, как в кислотном остатке. Достаточно помнить или определить ст.ок. элемента в кислоте.
VI. Степень окисления элемента в сложном ионе равна заряду иона.
Например, NH4+Cl— : записываем ион NхН4+1
х + 4∙(+1) = +1
х= — 3;
ст.ок. азота -3
Например, определить ст.ок. элементов в гексацианоферрате(III) калия К3[Fe(CN)6]
— у калия +1 : К3+1[Fe(CN)6], отсюда заряд иона [Fe(CN)6] 3-
— у железа +3 (указано в названии) [Fe+3(CN)6] 3-, отсюда (CN)66-
— у одной группы (CN)—
— более электроотрицательный азот: у него -3, отсюда (CхN-3)—
х – 3 = — 1
х = +2
ст.ок. углерода +2
VII. Степень окисления углерода в органических соединениях разнообразна и вычисляется, исходя из учета того, что ст.ок. водорода равна +1, кислорода -2
Например, С3Н6
3∙х + 6∙1 = 0
3х = -6
х = -2
ст.ок. углерода -2
(при этом валентность углерода равна IV)
Задание. Определить степень окисления и валентность фосфора в фосфорноватистой кислоте H3PO2.
Вычислим степень окисления фосфора.
Обозначим её за х. Подставим степень окисления водорода +1, а кислорода -2, умножив на соответствующее количество атомов: (+1) ∙ 3 + х + (-2) ∙ 2 = 0, отсюда х = +1.
school4eg.jimdo.com
Nh5, степень окисления азота в ионе аммония
Общие сведения об ионе аммония и степени окисления в Nh5
Атом азота имеет на внешнем энергетическом уровне два спаренных и три неспаренных электрона:
7N 1s22s22p3;
Неспаренные 2з-электроны атома азота в молекуле аммиака образуют три электронные пары с электронами атомов водорода. У атома азота остается неподеленная пара электронов 2s2, т.е. два электрона с антипараллельными спинами на одной атомной орбитали. Атомная орбиталь иона водорода не содержит электронов (вакантная орбиталь). При сближении молекулы аммиака и иона водорода происходит взаимодействие неподеленной пары электронов атома азота и вакантной орбитали иона водорода, возникает химическая связь по донорно-акцепторному механизму. Атом азота молекулы аммиака является донором, а ион водорода – акцептором. Обозначив неподеленную пару электронов двумя точками, вакантную орбиталь квадратом, а связи черточками, можно представить образование иона аммония схемой, изображенной на рис. 1.
Рис. 1. Схема образования иона аммония.
Nh5, степени окисления элементов в нем
Из выше указанного ясно, что ион аммония имеет заряд (+). Чтобы определить степени окисления элементов, входящих в его состав, сначала необходимо разобраться с тем, для каких элементов эта величина точно известна.
Так как аммиак является гидридом азота, то степень окисления водорода в ионе аммония равна (+1). Для нахождения степени окисления азота примем её значение за «х» и определим его при помощи уравнения электронейтральности:
x + 4×(+1) = -1;
x — 4 = -1;
x = -3.
Значит степень окисления азота в ионе аммония равна (-3):
(N-3H+14)—.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
Степень окисления и валентность | himiyaklas.ru
Часть первая. Валентность.
Валентность – это чисто связей, который образует атом.
Некоторые элементы всегда проявляют одну валентность, у некоторых же элементов валентность может быть различной. Валентность обычно равна числу электронов на внешнем энергетическом уровне (но это не абсолютное правило).
Элементы с постоянной валентностью нужно знать принципиально.
| Валентность | Элементы |
| I | Li, Na, K, Rb, Cs, H, Ag, F |
| II | Be, Mg, Ca, Sr, Ba, O, Cu, Zn, |
| III | Al, B |
Переменные валентности: Fe (II, III), Cr (II, III, VI).
Классы неорганических веществ, которые помогут сориентироваться в валентностях:
Оксид – сложное химическое вещество, состоящие из двух элементов, один из которых (на втором месте) КИСЛОРОД (валентность ДВА: II).
Сульфид – сложное химическое вещество, состоящие из двух элементов, один из которых (на втором месте) СЕРА (валентность ДВА: II).
Фторид, хлорид, бромид, иодид – сложные химические вещества, состоящие из двух элементов, один из которых (на втором месте), соответственно ФТОР, ХЛОР, БРОМ или ИОД (валентность ОДИН: I)
Нитрид – сложное вещество, состоящее из двух элементов. На втором месте азот с валентностью (III).
Гидрид – сложное вещество, состоящие из двух элементов. На втором месте ВОДОРОД.
Степень окисления.
Электроотрицательность – это способность атома притягивать и удерживать электроны. У кого больше электроотрицательность – тот будет тянуть электроны к себе. Является характерной чертой неметаллов. (Фактически, электроотрицательность – это синоним неметалличности) Самые электроотрицательные элементы (в порядке убывания электроотрицательности: F(4), O(3,5), N(3), Cl(3).)
В периодической системе электроотрицательность повышается вправо и вверх.
Степень окисления – это условный заряд на атомах, образующих ковалентную полярную или ионную связь, если мы сделаем допущение, что общая электронная пара смещается в сторону более электроотрицательного элемента ПОЛНОСТЬЮ. Определяется числом смещенных электронных пар.
Как определить степень окисления?
Основной принцип: сумма степеней окисления атомов в составе частицы (молекулы или иона) равна заряду этой частицы: заряду иона – если эта частица – ион, и НУЛЮ, если эта частица – молекула.
- Степень окисления в простых веществах равна нулю (так как связи неполярные: смещения электронной пары нет). P0, N20, S0, O20, Fe0, Na0, Si0
- Степень окисления металлов. Металлы в соединениях проявляют ТОЛЬКО ПОЛОЖИТЕЛЬНУЮ степень окисления. Численно она равна валентности.
- Степень окисления неметаллов.
Степень окисления неметаллов может быть различной. В большинстве случаев и положительной, и отрицательной: из-за способности неметаллов связывать друг с другом: соединения двух неметаллов к примеру. P2O5 – кислород более электроотрицателен – у него будет отрицательная степень окисления, так как он забрал электроны. Фосфор будет иметь положительную степень окисления, так как он отдал электроны.
Есть два правила (они не абсолютные, но в большинстве случаев работают):
- Высшая степень окисления = номеру группы. (азот: 5 группа: высшая С.О. = +5)
- Низшая степень окисления = номер группы – 8. (азот: 5 – 8 = -3: низшая С.О. = -3)
Запомните, что суффикс ИД указывает на то, что элемент находится в низшей степени окисления. Классы соединений, которые были даны в предыдущей части оксИД, сульфИД, фторИД, хлорИД, бромИД, иодИД, нитрИД, гидрИД содержат кислород, серу, фтор, хлор, бром, иод, азот и водород соответственно в низших степенях окисления. Поэтому мы и ставим их на второе место (по правилам элемент с отрицательной степенью окисления стоит на втором месте).
- Фтор.
Всегда в соединениях имеет степень окисления -1. Так как самый электроотрицательный элемент. Никто не может забрать у него электроны.
- Водород.
В подавляющем большинстве случаев проявляет степень окисления +1. (H2O, HCl, HNO3)
Исключения: гидриды – это соединения водорода с атомами, у которых электроотрицательность меньше. В частности, это активные металлы: LiH, NaH, CaH2 – в этих веществах у водорода степень окисления -1.
А также кремний. Водород более электроотрицателен, чем кремний, поэтому в силане – соединении водорода с кремнием (SiH4), водород также будет проявлять степень окисления -1. (а кремний +4)

- Кислород.
В подавляющем большинстве случаев проявляет степень окисления -2. (H2O, Al2O3, MnO2)
Есть два исключения:
- Вещество OF2. Соединение фтора с кислородом. Фтор более электроотрицателен, поэтому будет оттягивать у кислорода электронную пару. Фтор – единственный элемент, у которого электроотрицательность больше, чем у кислорода.
Поэтому в этом веществе степень окисления кислорода будет равна +2, а у фтора как обычно всегда -1.
И называться это вещество будет фторид кислорода. А не оксид фтора, поскольку фтор находится в низшей степени окисления (фторИД). А в оксИДе в низшей степени кислород (-2).
- Пероксиды (перекиси). Пероксидами называют вещества содержащие группу –O –O –. В быту нам хорошо знакома перекись водорода. На ее примере и рассмотрим.

Поэтому во всех пероксидах: пероксид калия K2O2, пероксид натрия Na2O2, пероксид кальция CaO2 степень окисления кислорода равна -1.
- Остальные галогены (Cl, Br, I).
В отличие от самого электроотрицательного фтора, эти галогены могут принимать и отрицательную так и положительные степени окисления.
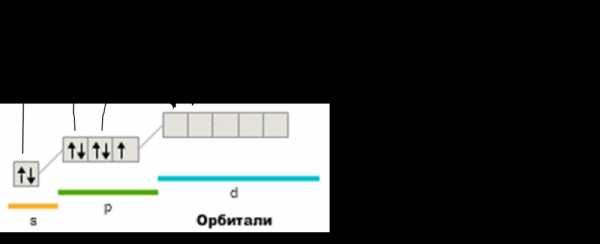
Характерны нечетные степени окисления (опять-таки из-за возбуждения)

- Сера.
- Азот.
- Углерод
Углерод в органических веществах может принимать ЛЮБУЮ степень окисления в промежутке от высшей (+4) до низшей (+4) включительно.
- Фосфор.
himiyaklas.ru
| Главная | стр 1 скачать Задания А 5 (ЕГЭ 2012г) Электроотрицательность. Степень окисления и валентность химических элементов.
скачать Смотрите также: 61.18kb. 1 стр. Задания а 4 (гиа 2012 г) Валентность химических элементов. Степень окисления химических элементов39.16kb. 1 стр. Схемы превращений114.08kb. 1 стр. I. Сложные вещества и смеси173.35kb. 1 стр. Закон и периодическая система химических элементов д и. Менделеева. Строение атомов Тест-контроль № п/п Задания64.85kb. 1 стр. Тест по теме «овр» Вариант Определите степень окисления элементов46.89kb. 1 стр. «Периодический закон и периодическая система химических элементов» ц е л ь54.96kb. 1 стр. Тематическое планирование по химии в 8 классе (70 часов) № п/п Темы уроков301.96kb. 1 стр. Роль клеток крови в формировании гомеостатических показателей изотопов химических элементов168.61kb. 1 стр. Урок по химии в 7-м классе по теме «Соединения химических элементов»63.12kb. 1 стр. Урок Простые и сложные вещества33.1kb. 1 стр. Урок 10. Зачет по темам: «Металлы главных подгрупп I-III групп периодической системы химических элементов Д. И. Менделеева», «Железо представитель элементов побочных подгрупп периодической системы химических элементов Д. И. Менделеева»102.98kb. 1 стр. |
nenuda.ru
