химические свойства, получение, применение :: SYL.ru
Все химические соединения, существующие в природе, делятся на органические и неорганические. Среди последних выделяют следующие классы: оксиды, гидроксиды, соли. Гидроксиды подразделяются на основы, кислоты и амфотерные. Среди оксидов также можно выделить кислотные, основные и амфотерные. Вещества последней группы могут проявлять как кислотные, так и основные свойства.
Химические свойства кислотных оксидов
Такие вещества имеют своеобразные химические свойства. Кислотные оксиды способны вступать в химические реакции только с основными гидроксидами и оксидами. К этой группе химических соединений относятся такие вещества, как углекислый газ, диоксид и триоксид серы, триоксид хрома, гептаоксид марганца, пентаоксид фосфора, триоксид и пентаоксид хлора, тетра- и пентаоксид азота, диоксид кремния. Такого рода вещества называются еще ангидридами. Кислотные свойства оксидов проявляются прежде всего во время их реакций с водой. При этом образуется определенная кислородосодержащая кислота. К примеру, если взять триоксид серы и воду в равных количествах, получим сульфатную (серную) кислоту. Таким же образом можно синтезировать и фосфорную кислоту, добавив воды к оксиду фосфора. Уравнение реакции: Р2О5 + 3Н2О = 2Н3РО4. Точно таким же образом возможно получить такие кислоты, как нитратная, кремниевая и т. д. Также кислотные оксиды вступают в химическое взаимодействие с основными либо амфотерными гидроксидами. Во время такого рода реакций образуются соль и вода. Например, если взять триоксид серы и добавить к нему гидроксид кальция, получим сульфат кальция и воду. Если же добавить гидроксид цинка, получим сульфат цинка и воду. Еще одна группа веществ, с которыми взаимодействуют данные химические соединения — основные и амфотерные оксиды. При реакциях с ними образуется только соль, без воды. К примеру, добавив к триоксиду серы амфотерный оксид алюминия, получим сульфат алюминия. А если смешать оксид кремния с основным оксидом кальция, получим силикат кальция. Кроме того, кислотные оксиды реагируют с основными и нормальными солями. При реакции с последними образуются кислые соли. Например, если к углекислому газу добавить карбонат кальция и воду, можно получить гидрокарбонат кальция. Уравнение реакции: СО2 + СаСО3 + Н2О = Са(НСО3)2. При реакции кислотных оксидов с основными солями образуются нормальные соли.
Такого рода вещества называются еще ангидридами. Кислотные свойства оксидов проявляются прежде всего во время их реакций с водой. При этом образуется определенная кислородосодержащая кислота. К примеру, если взять триоксид серы и воду в равных количествах, получим сульфатную (серную) кислоту. Таким же образом можно синтезировать и фосфорную кислоту, добавив воды к оксиду фосфора. Уравнение реакции: Р2О5 + 3Н2О = 2Н3РО4. Точно таким же образом возможно получить такие кислоты, как нитратная, кремниевая и т. д. Также кислотные оксиды вступают в химическое взаимодействие с основными либо амфотерными гидроксидами. Во время такого рода реакций образуются соль и вода. Например, если взять триоксид серы и добавить к нему гидроксид кальция, получим сульфат кальция и воду. Если же добавить гидроксид цинка, получим сульфат цинка и воду. Еще одна группа веществ, с которыми взаимодействуют данные химические соединения — основные и амфотерные оксиды. При реакциях с ними образуется только соль, без воды. К примеру, добавив к триоксиду серы амфотерный оксид алюминия, получим сульфат алюминия. А если смешать оксид кремния с основным оксидом кальция, получим силикат кальция. Кроме того, кислотные оксиды реагируют с основными и нормальными солями. При реакции с последними образуются кислые соли. Например, если к углекислому газу добавить карбонат кальция и воду, можно получить гидрокарбонат кальция. Уравнение реакции: СО2 + СаСО3 + Н2О = Са(НСО3)2. При реакции кислотных оксидов с основными солями образуются нормальные соли. 
С кислотами и с другими кислотными оксидами вещества данной группы не взаимодействуют. Точно такие же химические свойства способны проявлять и амфотерные оксиды, только кроме этого они также взаимодействуют и с кислотными оксидами и гидроксидами, то есть сочетают в себе и кислотные, и основные свойства.
Физические свойства и применение кислотных оксидов
Существует довольно много различных по своим физическим свойствам кислотных оксидов, поэтому возможно их использование в самых разных сферах промышленности.
Триоксид серы
Чаще всего данное соединение используется в химической отрасли промышленности. Оно является промежуточным продуктом, образующимся в процессе получения сульфатной кислоты. Данный процесс заключается в том, что пирит железа сжигают, получая при этом диоксид серы, далее последний подвергают химической реакции с кислородом, вследствие которой образуется триоксид. Далее из триоксида путем добавления к нему воды синтезируют серную кислоту. При нормальных условиях это вещество представляет собой бесцветную жидкость с неприятным запахом. При температуре же ниже шестнадцати градусов по Цельсию триоксид серы застывает, образуя кристаллы.

Пентаоксид фосфора
Кислотные оксиды также включают в свой список пентаоксид фосфора. Он представляет собой белое снегообразное вещество. Применяют его как водоотнимающее средство из-за того, что он очень активно вступает во взаимодействие с водой, образуя при этом фосфорную кислоту (также он используется в химической промышленности для ее добывания).
Углекислый газ
Это самый распространенный в природе из кислотных оксидов. Содержание данного газа в составе атмосферы Земли — около одного процента. В нормальных условиях данное вещество представляет собой газ, не имеющий ни цвета, ни запаха. Диоксид углерода широко используется в пищевой промышленности: для производства газированных напитков, в качестве разрыхлителя теста, как консервант (под обозначением Е290). Сжиженный углекислый газ применяется для изготовления огнетушителей. Также данное вещество играет огромную роль в природе — для совершения фотосинтеза, в результате которого образуется жизненно важный для животных кислород. Растениям необходим именно углекислый газ. Данное вещество выделяется при горении всех без исключения органических химических соединений.

Диоксид кремния
В нормальных условиях имеет вид бесцветных кристаллов. В природе его можно встретить в виде множества разнообразных минералов, таких как кварц, хрусталь, халцедон, яшма, топаз, аметист, морион. Данный кислотный оксид активно используется в производстве керамики, стекла, абразивных материалов, бетонных изделий, волокно-оптических кабелей. Также данное вещество применяется в радиотехнике. В пищевой промышленности его применяют в виде добавки, зашифрованной под названием Е551. Здесь он используется для сохранения первоначальной формы и консистенции продукта. Данную пищевую добавку можно найти, к примеру, в растворимом кофе. Кроме того, диоксид кремния используют в производстве зубных паст.

Гептаоксид марганца
Данное вещество представляет собой буро-зеленую массу. Используется оно в основном для синтеза марганцевой кислоты путем добавления к оксиду воды.
Пентаоксид азота
Он представляет собой твердое бесцветное вещество, имеющее форму кристаллов. Применяют его в большинстве случаев в химической промышленности для получения азотной кислоты или других оксидов азота.
Триоксид и тетраоксид хлора
Первый представляет собой газ зелено-желтого цвета, второй — такой же расцветки жидкость. Используются они в основном в химической промышленности для получения соответствующих хлористых кислот.
Получение кислотных оксидов
Вещества данной группы возможно получить вследствие разложения кислот под воздействием высоких температур. В таком случае образуется нужное вещество и вода. Примеры реакций: Н2СО3 = Н2О + СО2; 2Н3РО4 = 3Н2О + Р2О5. Гептаоксид марганца можно получить в результате воздействия на перманганат калия концентрированного раствора сульфатной кислоты. Вследствие этой реакции образуются нужное вещество, сульфат калия и вода. Углекислый газ можно получить вследствие разложения карбоновой кислоты, взаимодействия карбонатов и гидрокарбонатов с кислотами, реакций пищевой соды с лимонной кислотой.
Заключение

Подведя итог всему написанному выше, можно сказать, что кислотные оксиды получили широкое применение в химической промышленности. Лишь некоторые из них используются также в пищевой и других отраслях.
Кислотные оксиды — это большая группа неорганических химических соединений, которые имеют большое значение и могут применяться для получения самых разнообразных кислородосодержащих кислот. Также в эту группу входят два важнейших вещества: углекислый газ и диоксид кремния, первый из которых играет огромную роль в природе, а второй представлен в форме многих минералов, часто использующихся в изготовлении украшений.
www.syl.ru
Кислотные оксиды
Свойства кислотных оксидов
Кислотный оксид + соль. Реакция может идти в расплаве и в растворе. В расплаве менее летучий оксид вытесняет из соли более летучий. В растворе оксид, соответствующий более сильной кислоте, вытесняет оксид, соответствующий более слабой кислоте. Например, Na2CO3 + SiO2 = Na2SiO3 + CO2, в прямом направлении эта реакция идет в расплаве, углекислый газ более летучий, чем оксид кремния; в обратном направлении реакция идет в растворе, угольная кислота сильнее кремниевой, к тому же оксид кремния выпадает в осадок.
Возможно соединение кислотного оксида с собственной солью, например, из хромата можно получить дихромат, и сульфата – дисульфат, из сульфита – дисульфит:
Na2SO3
Для этого нужно взять кристаллическую соль и чистый оксид, или насыщенный раствор соли и избыток кислотного оксида.
В растворе соли могут реагировать с собственными кислотными оксидами с образованием кислых солей:Na2SO3 + H2O + SO2 = 2NaHSO3
Кислотный оксид + Неметалл . Здесь также возможно два варианта:
1) неметалл – восстановитель (водород, углерод):
СО2 + С = 2СО;
2NO2 + 4H2 = 4H2O + N2;
SiO2 + C = CO2 + Si. Если получившийся неметалл может реагировать с металлом, использованным в качестве восстановителя, то реакция пойдет дальше (при избытке углерода) SiO 2 + 2C = CO2 + SiС
Нерастворимые основания + кислотный оксид
Нерастворимые основания способны реагировать со всеми высшими кислотными оксидами, соответствующими устойчивым кислотам, например, P2O5, SO3, N2O5, с образованием средних соле1:
Cu(OH)2 + SO3 = CuSO4 + H2O
Нерастворимые основания вида Me(OH)2 реагируют в присутствии воды с углекислым газом исключительно с образованием основных солей. Например:
Cu(OH)2 + CO2 = (CuOH)2CO3 + h3O
С диоксидом кремния, ввиду его исключительной инертности, реагируют только самые сильные основания — щелочи. При этом образуются нормальные соли. С нерастворимыми основаниями реакция не идет. Например:
Fe(OH)2 +SiO3 ≠
Амфотерные гидроксиды реагируют с высшими оксидами, которым соответствуют устойчивые кислоты (SO3, P2O5, N2O5):
2Al(OH)3 + 3SO3 = Al2(SO4)3 + 3H2O
Амфотерные гидроксиды металлов в степени окисления +3, т.е. вида Me(OH)3, не реагируют с кислотными оксидами SO2 и СO2.
compedu.ru
их классификация и свойства :: SYL.ru
Среди различных классов неорганических веществ выделяется комплекс бинарных соединений, состоящий из трех групп. Это кислотные, основные и амфотерные оксиды. Их классификация и свойства зависят от того, атомы какого химического элемента соединены с кислородом. В нашей статье мы ознакомимся с типичными химическими реакциями, характерными для окислов, а также выясним генетическую связь между ними и другими классами неорганических соединений: основаниями, кислотами и солями.
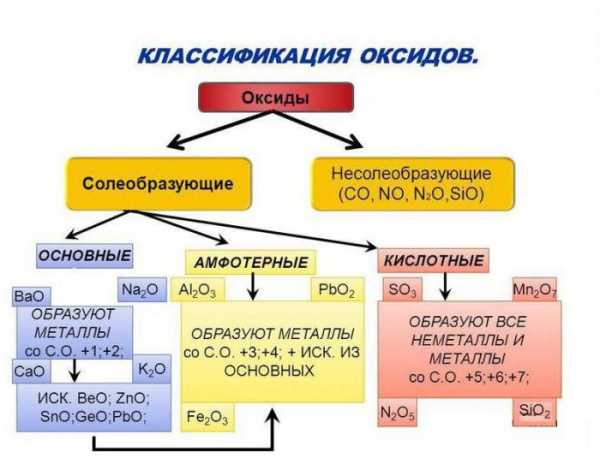
Особенности основных оксидов
Рассмотрим соединения, в состав которых входят атомы типичных металлов. Например: CuO, FeO, MgO содержат электронейтральные частицы меди, железа и магния, значит, это основные оксиды. Их классификация и свойства зависят от природы металлического элемента. Если в составе вещества присутствуют атомы щелочных или щелочноземельных металлов, то его молекулы способны взаимодействовать с водой.
Продуктом реакции, идущей с выделением большого количества тепла, будет щелочь, например едкий натр или гидроксид кальция. Некоторые окислы, такие как оксид меди или железа, напрямую с водой не реагируют, поэтому их основания получают косвенным путем: из соответствующих солей, взаимодействующих со щелочами. Главное же их свойство – реагировать с кислотами, образуя соль и воду.
Какие окислы называются кислотными?
Классификация и свойства кислот, оснований, оксидов, солей определяются, прежде всего, их способностью взаимодействовать между собой. Причем из веществ одного класса можно получить соединения другой группы. Так, из кислотных оксидов в их реакциях с водой образуются кислоты. Продуктом гидратации серного ангидрида, например, будет сульфатная кислота, а пропуская углекислый газ CO2 через воду, получим раствор слабой угольной кислоты. Поэтому кислотные оксиды, их классификация и свойства зависят от характера взаимодействия с водой и образования кислоты. Добавим еще, что в молекуле бинарного соединения с атомами кислорода связаны атомы неметаллических элементов. Важнейшим их свойством будет способность к реакциям со щелочами, продуктами же будут соль и вода.

Почему оксид алюминия реагирует с кислотами и щелочами?
Как вы заметили, основные оксиды взаимодействуют с кислотами, кислотные окислы реагируют со щелочами. Такие соединения, как Al2O3 или ZnO – это амфотерные оксиды. Их классификация и свойства базируются на способности этих веществ одновременно вступать в реакцию как с кислотами, так и с активными основаниями. При взаимодействии оксида алюминия, например, с сульфатной кислотой, получаем его сульфат. А в реакции этого же соединения с расплавом гидроксида натрия образуется соль — метаалюминат натрия.
Как видно, амфотерные элементы могут образовывать оксиды, сохраняющие способность к реакциям, как со щелочами, так и с кислотами. Они идут с образованием солей. Рассматривая оксиды, их классификацию и свойства, нельзя не сказать о еще одной группе этих бинарных соединений. Если вещество, например, CO – монооксид углерода, или NO – окись азота, не может реагировать ни с кислотами, ни со щелочами, то соединение неспособно образовывать соли. Такие оксиды и называют безразличными или индифферентными. Как мы помним, оксиды являются бинарными соединениями, в состав которых обязательно входит кислород.

Получение окислов
Продолжим рассматривать классификацию, свойства, получение оксидов. Можно выделить три способа, с помощью которых соединения добывают в лаборатории. Наиболее распространенный среди них – это окисление простых веществ. Горение сложных соединений, например природного газа или нефти, – еще один путь получения газообразных окислов углерода и водорода. К третьему способу мы отнесем термическое разложение некоторых солей угольной и нитратной кислот, а также нагревание нерастворимых в воде оснований, таких как гидроксид меди или железа. При этом образуются оксиды металлов и вода.
Взаимодействие оксидов между собой
Изучая оксиды, их классификацию и химические свойства, обратимся к реакциям между веществами кислотных и основных групп. В результате их образуются соединения, относящиеся к классу солей. Например, если через раствор оксида кальция (известковую воду) пропускать углекислый газ, то она мутнеет вследствие образования частиц нерастворимого карбоната кальция CaCO3. В промышленности широко применяют реакции взаимодействия нескольких веществ: оксидов натрия, кальция и кремния. Нагревая их смесь вместе с технической содой, получают стекло.
Особыми характеристиками обладает оксид водорода – вода, о них мы поговорим далее. H2O — самое распространенное и необходимое соединение на Земле. Способность ее молекул к образованию водородных связей обеспечивает главные свойства воды как универсального растворителя, обладающего специфическими свойствами: высокой теплоемкостью и теплопроводностью. Они очень важны для процессов обмена веществ в живых организмах.
Вода, как оксид, реагирует с различными кислотными и основными окислами. В первом случае получают кислоты, во втором – щелочи. Специфическая реакция оксида водорода – осуществлять реакции гидролитического разложения (гидролиза). Они очень распространены среди веществ органического происхождения. Это гидролиз белков, углеводов и жиров, проходящий в желудочно-кишечном тракте, расщепление целлюлозы микроорганизмами – сапротрофами и т. д.
Оксиды, основания, соли: классификация, свойства
Между основными классами неорганических веществ существует генетическая связь, которая доказывает возможность их взаимного превращения. Так, из основного оксида активного металла можно получить основание, а из него – соль. Примером такой цепочки превращений служит следующая схема: оксид натрия – гидроксид натрия – карбонат натрия. Кислотные окислы служат исходными соединениями в реакциях с водой. Продукт, который получается в этом случае – кислота. Например: диоксид углерода – карбонатная кислота – карбонат натрия.
Реакция кислоты с гидроксидами, которая называется нейтрализацией, приведет к появлению солей. В обоих случаях конечным звеном генетической цепочки будет соединение этого класса, связывающее между собой превращения неметаллических и металлических химических элементов. Поэтому существует и обратный механизм: от соли – к основаниям, кислотам или к простому веществу.

В данной статье мы изучили классификацию и химические свойства основных классов неорганических веществ.
www.syl.ru
основные, кислотные, амфотерные оксиды. Примеры
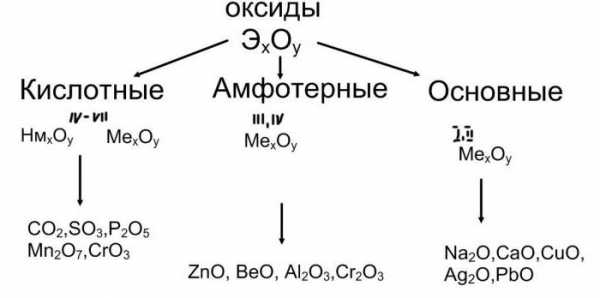
Основные оксиды — это сложные химические вещества, относящиеся к окислам, которые образуют соли при химической реакции с кислотами или кислотными оксидами и не реагируют с основаниями или основными оксидами. Например, к основным относятся следующие: K2O (окись калия) , CaO (окись кальция) , FeO (окись железа 2-валентного) . 1. Взаимодействие с водой с образованием основания (или щёлочи) : CaO+h3O = Ca(OH)2 2. Взаимодействие с кислотами с образованием солей: CaO+h3SO4 = CaSO4+ h3O 3. Взаимодействие с кислотными оксидами с образованием солей CaO+CO2=CaCO3 Кислотные оксиды — это сложные химические вещества, относящиеся к окислам, которые образуют соли при химическом взаимодействии с основаниями или основными оксидами и не взаимодействуют с кислотными оксидами. Примерами кислотных окислов могут быть: CO2 (всем известный углекислый газ) , P2O5 — оксид фосфора (образуется при сгорании на воздухе белого фосфора) , SO3 — триокись серы — это вещество используют для получения серной кислоты. — реакция с водой с образованием кислоты SO2+h3O=h3SO3 — реакция с щелочами (основаниями) с образованием соли: CO2+NaOH=Na2CO3 — реакция с основными оксидами с образованием соли: CO2+MgO=MgCO3 Амфотерные оксиды — это сложные химические вещества, также относящиеся к окислам, которые образуют соли при химическом взаимодействии и с кислотами (или кислотными оксидами) и основаниями (или основными оксидами) . Наиболее частое применение слово «амфотерный» в нашем случае относится к оксидам металлов. Примером амфотерных оксидов могут быть: ZnO – оксид цинка, Al2O3 — оксид алюминия Химические свойства амфотерных оксидов уникальны тем, что они могут вступать в химические реакции, соответствующие как основаниями так и с кислотами. Например: — реакция с кислотным оксидом с образованием соли: ZnO+h3CO3 = ZnCO3 + h3O — реакция с основаниями с образованием соли: ZnO+2NaOH=Na2ZnO2+h3O — реакция с кислотными и с основными оксидами с образованием содей: ZnO + SO2 = ZnSO3 ZnO + Na2O = Na2ZnO2Основные: Na2O, CuO, CaO Амфотерные: ZnO, Al2O3, Cu2O3 Кислотные: P2O5, NO2, CO2
Оксиды. Кислоты. Основания. Амфотерность. Соли
Оксиды. Кислоты. Основания. Амфотерность. Соли.
1. Оксиды
Оксиды – это сложные вещества, образованные двумя элементами, одним из которых является кислород (O).
Оксиды могут находиться в трех агрегатных состояниях,
а именно: в твердом, жидком и газообразном.
Температура плавления зависит от их строения.
CuO, FeO- твердые вещества, немолекулярного строения.
Оксиды:
MgO – магния
NiO – никеля
SiO — кремния
FeO- железа
ClO — хлора
CO — углерода
NO — азота
1.2. Вода
Массовая доля воды в организме человека составляет 65%.
Взрослый человек потребляет ежедневно почти 2 л воды.
Плотность воды наибольшая при 4градусов – 1 г/см в кубе.
При нуле – лёд, а при 100 – водяной пар.
Вода реагирует:
А) с активными металлами, образуя щелочи и водород(H).
2Na + 2HO = 2NaOH + H
Из этой реакции видим, что водород выделился и образовался гидроксид натрия NaOH – щелочь.
Если при добавлении фиолетового лакмуса окраска становится синей – это признак того, что в растворе есть щелочь.
2K + HO = 2KOH + H
Ca + 2HO = Ca(OH) + H
Б) с оксидами активных металлов, образуя растворимые основания – щелочи.
CaO + HO = Ca(OH)
Оксиды которым соответствуют основания (независимо от того, реагируют они с водой или нет) называются основными.
Б) еще примеры:
NaO + HO = 2NaOH
BaO + HO = Ba(OH)
В) со многими оксидами неметаллов, образуя кислоты.
PO + HO = 2HPO
а с горячей водой:
PO + 3HPO = 2HPO
CO + HO = HCO
SO + HO = HSO
Г) вода разлагается под действие высокой температуры или электрического тока.
2HO = 2H + O
Оксиды которым соответствуют кислоты (независимо от того, реагируют они с водой или нет) называются кислотными.
2. Кислоты
В формулах кислот на первом месте всегда стоит водород, а дальше – кислотный остаток. Во время химических реакций он переходит из одного соединения в другое, не изменяясь.
Пример: SO — кислотный остаток.
Его валентность = 2, поскольку в серной кислоте он соединен с двумя атомами водорода, которые способны замещаться атомами цинка (к примеру).
Вывод: валентность кислотных остатков определяется числом атомов водорода, способных замещаться атомами металла.
Основность кислот – это количество атомов водорода, способных замещаться атомами металла с образованием соли.
Многие кислородосодержащие кислоты можно получить путем взаимодействия кислотных оксидов с водой:
SO + HO = HSO
NO + HO = 2HNO
2.1. Химические свойства кислот
1ое свойство: кислоты действуют на индикаторы.
Вещества, изменяющие свою окраску под действием кислот (или щелочей, называются индикаторами.
Индикаторы: Лакмус, метилоранж, фенолфталеин.
2ое свойство: кислоты реагируют с металлами.
Mg + 2HCl = MgCl + H
Zn + 2HCl = ZnCl + H
Cu + HCl = реакция не происходит!
3е свойство: кислоты реагируют с основными оксидами.
CuO + 2HCl = CuCl + HO — — — — Cu (II)
Реакции обмена: это реакции между двумя сложными веществами, в результате которых они обмениваются своими составными частями.
Примечание: Во время взаимодействия азотной кислоты с металлами вместо водорода выделяются другие газы.
2.2. Соляная кислота и хлороводород
Получают хлороводород таким образом:
1) слабое нагревание
NaCl + HSO = NaHSO + HCl
2) сильное нагревание
2NaCl + HSO = NaSO + 2HCl
HCl – бесцветный газ с резким запахом, немного тяжелее воздуха, во влажном воздухе дымит. При 0 градусов в одном объеме воды растворяется 500 объемов хлороводорода.
Химические свойства соляной кислоты:
1ое свойство: изменяет окраску индикаторов: лакмус в соляной кислоте краснеет, метилоранж – розовеет, фенолфталеин остается бесцветным.
2ое свойство: взаимодействует с металлами:
Mg + 2HCl = MgCl + H
3е свойство: взаимодействует с основными оксиды:
FeO + 6HCl = 2FeCl + 3HO
Примечание: HCl + AgNO = AgCl +HNO
3. Основания
CaO + HO = Ca(OH)
В этой реакции образовался гидрат оксида кальция, или гидроксид кальция. Основания состоят из металла и одновалентных гидроксильных групп (OH), число которых соответсвует валентности металла.
Основания:
NaOH – гидроксид натрия
Mg(OH) — гидроксид магния
Ba(OH) — гидроксид бария.
Fe(OH) — гидроксид железа (II)
Fe(OH) — гидроксид железа (III)
Все основания имеют немолекулярное строение.
По растворимости в воде разделяются на:
А) растворимые (щелочи)
Пример: гидроксид натрия NaOH, гидроксид калия KOH, гидроксид бария Ba(OH) и т.п.
Б) нерастворимые
Пример: гидроксид меди (II) Cu(OH), гидроксид железа (III)
Fe(OH) и т.п.
Растворимые основания можно получить при взаимодействии активных металлов с водой и оксидов активных металлов с водой, которые называются основными оксидами:
2Na + 2HO = 2NaOH + H
BaO + H0 = Ba(OH)
Вывод: все основания реагируют с кислотами, образуя соль и воду.
Например:
NaOH + HNO = NaNO + HO
Cu(OH) + 2HCl = CuCl + 2HO
4. Амфотерные оксиды и гидроксиды
Основания реагируют с кислотами и наоборот. Всегда получается соль и вода.
Ca(OH) + 2HCl = CaCl + 2HO
HCO + 2NaOH = NaCO + 2HO
Есть такие хим. элементы, которые образуют оксиды и гидроксиды, обладающие двойственными свойствами – и основными и кислотными ( в зависимости от условий).
Это такие элементы как цинк, алюминий и др. Например:
Zn(OH) + 2HCl = ZnCl + 2HO
сильнаякислота
Zn(OH) + 2NaOH = NaZnO + 2HO
сильное основание
Пример с оксидом цинка:
ZnO + 2HNO = Zn(NO) + HO
ZnO + 2KOH = KZnO + HO (процесс сплавления)
Способность химических соединений проявлять кислотные или основные свойства в зависимости от природы веществ, с которыми они реагируют, называется амфотерностью.
Zn(OH) — амфотерный гидроксид
ZnO – амфотерный оксид
5. Соли
Соли – это сложные вещества, образованные атомами металлов и кислотными остатками.
Сумма единиц валентностей атомов металла должна равняться сумме единиц валентностей кислотного остатка.
Примеры солей:
NaCl — хлорид натрия
AgCl — серебра
KS — сульфид калия
NaNo — нитрат натрия
Mg(NO) — магния
NaSiO — силикат натрия
Al(SO) — сульфат алюминия
NaSO — натрия
BaSO — бария
NaSO — сульфит натрия
KPO — фосфат калия
CaCO — карбонат кальция
5.1. Химические свойства солей
Соли реагируют:
А) с металлами:
Cu + 2AgNO = Cu(NO) + 2Ag
Образуется новая соль и металл.
Примечание: реагируют с водой только те металлы, которые в вытеснительном ряду размещаются левее от того металла, который входит в состав соли.
Но для таких реакций нельзя брать очень активные металлы, типо Li, Na, K, Ca, Ba и т.п., которые реагируют с водой в н.у.
Б) с растворимыми основаниями (щелочами):
AlCl +3NaOH = Al(OH) + 3NaCl
KSO + Ba(OH) = 2KOH + BaSO
Образуется новая соль и новое основание.
Примечание: реагирующие вещества надо подбирать так, чтобы в результате реакции одно из образующихся веществ (основание или соль) выпадало в осадок.
В) с кислотами:
CaCo + 2HCl = CaCl + HCO
/ \
HO CO
Образуется новая соль и новая кислота.
Поскольку HCO очень непрочная, она разлагается на воду и CO.
Примечание: реакция между солью и кислотой будет происходить при таких условиях:
а) когда образуется осадок, не растворимый в кислотах:
AgNO + HCl = AgCl + HNO
б) когда реагирующая кислота сильнее, чем та, которой образована соль:
Ca(PO) + 3HSO = 3CaSO + 2HPO
в) когда соль образована летучей кислотой, а реагирующая кислота нелетучая:
2NaNO + HSO = NaSO + 2HNO
Г) с солями:
BaCl + NaSO = BaSO + 2NaCl
Примечание: реакция будет происходить только тогда, когда обе исходные соли будут взяты в растворах, но одна из вновь образующихся солей будет выпадать в осадок.
Выводы по всем этим темам ( с параграфа 29-38 ) и классификация неорганических веществ и их реакций:
Ответы на некоторые вопросы после параграфов:
Какие вещества называют оксидами?
Оксиды – это сложные вещества образованные двумя элементами одним из которых является кислород.
Какие вещества относятся к кислотам?
К кислотам относятся сложные вещества, в состав которых входят водород и кислотный остаток.
Что называется реакцией соединения?
Это реакция в результате которой из двух или нескольких веществ (простых или сложных) образуется одно новое сложное вещество.
Напишите уравнения химических реакций которые происходят при таких превращениях: C CO HCO
P PO HPO
C + O = CO
CO + HO = HCO
P + O = PO
Как химическим путем отличить серебро от цинка?
Что такое хлороводород и как его получить?
Хлороводород – это бесцветный газ с резким запахом, немного тяжелее воздуха, во влажном воздухе “дымит”. Очень хорошо растворяется в воде. Получить хлороводород можно из кристаллического хлорида натрия NaCl при нагревании его с концентрированной серной кислотой.
Почему хлороводород на воздухе дымит?
Как доказать что выданный вам раствор кислота и это соляная кислота?
Надо юзить на него индикатором. Лакмус опустить – краснеет, метилоранж – розовеет, фенолфталеин – бесцветный.
Какие вещества относятся к основаниям и как их классифицируют? Привести примеры.
К основаниям относятся вещества имеющие гидроксильную группу и металл. Основания классифицируют на щелочи и нерастворимые.
Все металлы не растворяются, а неметаллы наоборот.
Растворимые – NaOH, KOH, нерастворимые – Cu(OH) Fe(OH).
10) Что вам известно о гидроксиде натрия?
Гидроксид натрия NaOH – растворимый в воде…
11) Ca CaO Ca(OH) Ca(NO)
2Ca + O = 2CaO
CaO + HO = Ca(OH)
Ca(OH) + 2HNO = Ca(NO) + 2HO
12) P PO HPO Mg(PO)
4P + 5O = 2PO
PO + 3HO = 2HPO
Что называется амфотерностью?
Амфотерность – это способность химических соединений
Проявлять кислотные или основные свойства в зависимости от природы веществ, с которыми они реагируют.
Что такое соли?
Соли – это сложные вещества, образованные атомами металлов и кислотными остатками.
Сформулируйте правило для составления формул солей.
Сумма единиц валентностей атомов металла должна равняться сумме единиц валентностей атомом кислотного остатка.
Ca CaO Ca(OH) CaCl CaSO
2Ca + O = 2CaO
CaO + HO = Ca(OH)
Ca(OH) + 2HCl = CaCl + 2HO
CaCl + HSO = CaSO + 2HCl
Ba Ba(OH) Ba(NO) BaCO BaCl
Ba + HO = Ba(OH)
Ba(OH) + 2HNO = Ba(NO) + 2HO
Ba(NO) + HCO = BaCO + 2HNO
BaCO + 2HCl = BaCl + HCO
Обобщение знаний:
Какие вещества называются простыми? На какие две группы их можно разделить? Сравнить характерные свойства металлов и неметаллов.
Простые вещества – это вещества состоящие из одного элемента. Их можно разделить на металлы и неметаллы. Металлы – нерастворимые в воде вещества. Они имеют металлический блеск и пластичность. Неметаллы – это растворимые в воде вещества, которые хрупкие и т.п.
Какие вещества называются сложными? На какие классы делятся неорганические вещества?
Сложные вещества – это вещества состоящие из двух или более элементов. Неорганические вещества делятся на простые и сложные. Сложные делятся на оксиды, основания, кислоты и соли.
По какому признаку оксиды делят на основные и кислотные?
Оксиды которым соответствуют основания называют основными, а те которым соответствуют кислоты — кислотными.
21) С чем могут взаимодействовать кислотные и основные оксиды? Что получается?
Кислотные и основные оксиды могут взаимодействовать с водой и получается кислоты или основания.
Короче, об этом дальше.
Что такое основания? Какие элементы их образуют?
Какие свойства для них характерны?
Основания – это сложные вещества, состоящие из металла и гидроксильных групп. Их можно получить при Взаимодействии активных металлов с водой и оксидов активных металлов с водой. Щелочи хорошо растворимы в воде.
Некоторые очень едкие. Они разъедают кожу, бумагу и другие материалы. Их называют едкими щелочами.
Какие вещества называют кислотами? Какие элементы их
Образуют? Какие свойства для них характерны?
Кислотами называют сложные вещества в состав которых входят водород и кислотный остаток. Получить кислородосодержащие кислоты можно взаимодействовать кислотных оксидов с водой. Для них характерны свойства: многие кислоты при н.у. – жидкости, но есть твердые кислоты.
Они хорошо растворяются в воде. Почти все кислоты бесцветны.
Какие вещества относятся к солям? С какими веществами могут реагировать соли?
К солям можно отнести сложные вещества, образованные атомами металлов и кислотными остатками.
Какие продукты образуются во время взаимодействия:
А) основания и кислоты
Образуются соль и вода: NaOH + HCl = NaCl + HO
Б) основного и кислотного оксидов
Образуется тоже самое что и дано.
В) основного оксида и кислоты?
Образуется соль и вода
NaO + HSO = NaSO + HO
Написать уравнения реакций.
Написать уравнения реакций получения фосфата кальция четырьмя способами.
26) Написать уравнения реакций получения гидроксида калия тремя способами.
Как осуществить следующие превращения:
Натрий – Гидроксид натрия – Сульфат натрия – Хлорид натрия – Нитрат натрия
Na + HO = NaOH + H
NaOH + HSO = NaSO + HO
NaSO + HCl = HSO
27) Что называется реакцией замещения и реакцией обмена?
Что с чем взаимодействует и что получается?
Основный оксид + кислота = соль + вода (обмен)
Оксид активных металлов + вода = щелочь (соединение)
Оксид неметаллов + вода = кислота (соединение)
Активные металлы + вода = гидроксид металлов (щелочь) + H
Кислоты + металлы = соль + H
Соляная кислота + металл = соль + H
Соляная кислота + основный оксид = соль + вода (обмен)
Основания + кислота = соль + вода
Щелочи + оксид неметаллов = соль + вода
Соль + металл (не все) = новая соль + новый металл (обмен)
Соль + щелочь = новая соль + новое основание (обмен)
Соль + кислота = новая соль + новая кислота (обмен)
Кислотные оксиды – это оксиды неметаллов – это щелочи.
Список литературы
Для подготовки данной работы были использованы материалы с сайта http://ref.com.ua
coolreferat.com
Оксиды кислотные — Справочник химика 21
Оксиды кислотные — оксиды, которым соответствуют кислоты. [c.375]Оксиды кислотные, основные и амфотерные 65. [c.187]
Периодичность изменения химических свойств элементов на примере их бинарных соединений с водородо.м и оксидов. Кислотные, основные и амфотерные свойства. [c.302]
Основной оксид Кислотный оксид [c.70]
Оксиды. Группы оксидов кислотные и основные. Номенклатура и химические свойства. [c.91]
Амфотерный оксид + Кислотный оксид = Соль Например [c.251]
Оксиды — соединения элементов с кислородом. Они подразделяются на солеобразующие и несолеобразующие. В свою очередь, солеобразующие оксиды подразделяются на оснбвные, кислотные и амфотерные. Оснбвные оксиды образуют соли при взаимодействии с кислотами или кисл/отными оксидами. Кислотные оксиды образуют соли при взаимодействии с основаниями или основными оксидами. [c.26]
Кислотные оксиды Кислотный, Амфотерный Основной (ангидриды кислот) отчасти амфо- оксид оксид [c.456]
Основный оксид + Кислотный оксид = Соль [c.249]
Известно, что в каждой паре кислотный оксид/кислотный гидроксид степень окисления кислотообразующего элемента одна и та же. Составьте соответствующие пары из следующих наборов оксидов и гидроксидов [c.9]
Основный оксид Амфотерный оксид Кислотный оксид [c.319]
Оксиды азота 1) и (II) — ЫгО и N0 — являются нейтральными, у других оксидов кислотные свойства усиливаются с возрастанием степени окисления [c.471]
Комм. К какому типу оксидов (кислотным, основным или амфотерным) относится оксид ванадия(У) Дайте характеристику его окислительно-восстановительных свойств. При ответе используйте результаты опыта Пз и справочные данные.
Деление оксидов на оснбвные и кислотные базируется на их собственном отношении к кислотам и щелочам, а также на свойствах соответствующих им гидроксидов. Большая группа оксидов по этим признакам относится к амфотер-ным. Элементы, образующие амфотерные оксиды, характеризуются средними значениями ОЭО в пределах 1,4 — 1,8 и степенями окисления (+2) — (+4). Если при степени окисления +2, +3 электроотрицательность менее 1,4, то оксиды (й отвечающие им гидроксиды) обладают оснбвными свойствами. Так, ОЭО [Са(+2)] составляет 1,0, ОЭО лантаноидов [Ьп (+3)] равна 1,2 — 1,3. Если при степени окисления +4 электроотрицательность элемента больше 1,8, оксид обладает кислотными свойствами. Например, ОЭО С(+4), 81(+4), Се(+4) равны соответственно 2,6, 1,9 и 2,0. Если электроотрицательность элемента находится в пределах 1,4 — 1,8 или даже несколько превышает этот интервал, а степень окисления + 1, оксид принадлежит к оснбвным (у Ag ОЭО 1,9). Когда же степени окисления элементов превышают +4 и значения ОЭО высоки, соответствующие оксиды кислотные. [c.267]
Среди катализаторов имеются металлы, оксиды, кислотные катализаторы, в том числе цеолиты, больше всего Ре-содержащих систем. Предполагают, что кислород в железооксидных системах имеет особые свойства, облегчающие отщепление атомов водорода и образование радикалов СН3. [c.602]
Свойства стекла зависят от природы и количественного соотношения оксидов. Кислотные оксиды придают стеклу высокую механическую, термическую и химическую стойкость. Оксиды щелочных металлов снижают вязкость расплавленного стекла, механическую и химическую стойкость, твердость наоборот, оксиды щелочноземельных металлов повышают вязкость и химическую стойкость. Наиболее широко применяют стекла, в состав которых входят только оксиды натрия, кальция, магния и кремния. Введение оксида калия вместо оксида натрия, а также оксида свинца вместо оксидов кальция и магния придает стеклу блеск и большую прозрачность, увеличивает коэффициент преломления (хрусталь и оптические стекла). В стекле для химической посуды снижают содержание оксидов щелочных металлов и заменяют частично оксид кремния на оксид бора и оксид алюминия, что повышает химическую и термическую стойкость.
Оксиды — соединения элементов с кислородом. Они подразделяются на солеобразующие и несолеобразующие. В свою очередь, солеобразующие оксиды подразделяются на основные, кислотные и амфотерные. Основные оксиды образуют соли при взаимодействии с кислотами или кислотными оксидами. Кислотные оксиды образуют соль при взаимодействии с основаниями или основными оксидами. Амфотерные оксиды образуют соли при взаимодействии как с кислотами или кислотными оксидами, так и с основаниями или основными оксидами. [c.23]
Большинство оксидов являются основными, так как их гидроксиды ведут себя как основания. Однако некоторые оксиды (кислотные) образуют соли только в реакциях со щелочами или [c.54]
Как видно из табл. 25, низшие оксиды марганца тугоплавки и нелетучи, тогда как его высшие оксиды, наоборот, легкоплавки и летучи. Это указывает на ионный характер низших и ковалентный характер высших оксидов марганца. Наиболее устойчивым из оксидов марганца является диоксид. Низшие оксиды марганца обладают восстановительными, а высшие — окислительными свойствами, В соответствии с этим низшие оксиды марганца имеют основный характер, диоксид—амфотерный, а высшие оксиды — кислотный характер. Что касается оксидов рения, то низшие из них изучены enie недостаточно в связи с их неустойчивостью высшие же оксиды рения легкоплавки и летучи, что свидетельствует об их ковалентной природе, обладают кислотным характером и окислительными свойствами, однако последние выражены у них слабее, чем у соответствуюишх оксидов марганца. [c.292]
При разложении проб растворы гидроксидов, карбонатов щелочных металлов или аммиака применяют значительно реже, чем кислоты. Эти соединения используют для перевода в раствор анионов при этом многае неорганические катионы и органические соединения, входящие в состав образца, остаются в осадке. Гидрокснд натрия (или калия) растворяет некоторые металлы (алюминий) и оксиды кислотного характера (WOз, М0О3, [c.73]
В подгруппу входят три элемента V, КЬ и Та. Электронная структура (п — 1) Высшая и наиболее характерная степень окисления +5, но бывают и промежуточные +2, +3, +4. Высшие оксиды кислотного типа, но по мере снижения степени окисления возрастают основные свойства УО — основный оксид, легко растворимый в кислотах, УгОз — амфотерный оксид, мало растворимый в кислотах, УгО, — также амфотерный оксид, а У2О5 — ангидрид типичной кислоты НУО3. [c.181]
Са(0Н)2 + СОг = СаСОз + HjO Основный оксид + Кислотный оксид — Соль (4) [c.179]
В XVUI в. были предприняты неоднократные попытки усовершенствовать химические символы. Но до начала 1780-х годов ученые не пытались найти принцип построения формул соединений, отражающих их качественный и количественный состав. И вот в 1782 г. французский химик Л. Гитон де Морво (1737—1816) создал номенклатуру на основе флогистонной теории. Но это был уже вчерашний день науки, так как в это время А. Лавуазье обосновал кислородную теорию горения. Крупнейшие ученые того времени К. Бертолле, А. де Фуркруа (1755— 1809), а затем и Гитон де Морво в 80-е годы стали соратниками Лавуазье и в 1786—1787 гг. разработали новую систему химической номенклатуры — Опыт химической номенклатуры , опубликованную в 1787 г. В этой работе авторы предлагали соединения кислорода с другими элементами называть оксидами , соли — по их кислотам (так, соли серной кислоты именовались сульфаты , азотной — нитраты ). Оксиды кислотные ( кислоты ,по определению авторов номенклатуры) назывались по радикалу с окончанием ная (по мнению Лавуазье кислоты состоят из кислорода, дающего кислотность, и радикала — серы, азота, фосфора и т. д.) серная, азотная, фосфорная. Если один и тот же радикал образует несколько кислот , то изменялось окончание у менее насыщенной кислородом — истая , у более насыщенной — ная . Например, сернистая и серная. [c.90]
По химическим свойствам зола и шлак разделяются на кислые, основные и нейтральные в зависимости от соотношения оксидов кисльк — SiO , TiO , Р О основных СаО, MgO, FeO, К О и амфотерных. К кислым относятся зола и шлак, у которых отношение содержания кислых оксидов к суммарному содержанию основных и амфотерных оксидов (кислотность) больше единищ>1. Если отношение содержания основных оксидов к сумме кислых и амфотерных (основность) больше единищ.1, то зола и шлак называются основными, в других случаях — нейтральными. [c.124]
В [259] показано, что введение в ПВХ оксидов металлов [10-50%(масс.)] различной природы (переходных и непереходных, кислотных и основных) значительно изменяет количество и соотношение ароматических продуктов разложения полимера, но их качественный состав остается постоянным. В присутствии оксидов кислотного характера (TIO2, М0О3, Ре20з) возрастает количество выделяющихся при пиролизе алифатических и аро- [c.150]
Амфотерный оксид, кислотные и основные свойства равновы-раженны. Белый, имеет ионное строение (А1 +)2(0 )з. Тугоплавкий, термически устойчивый. Аморфный гигроскопичен и химически активен, кристаллический химически пассивен. Не реагирует с водой, разбавленными кислотами и щелочами. Переводится в раствор концентрированными кислотами и щелочами, реагирует со щелочами и карбонатом натрия при сплавлении. Применяется как сырье в производстве алюминия, для изготовления огнеупорных, химически стойких и абразивных материалов, особо чистый AI2O3 — для изготовления рубиновых лазеров. [c.138]
Применение в неорганическом анализе. Оксиды кислотного характера, например WO3, МоОо, GeOj, VjOj, растворяют в растворе гидроксида натрия или калия, М0О3 и WO3 — в концентрированном растворе аммиака. Некоторые вольфраматы разлагаются концентрированным раствором гидроксида натрия, что использовано при переработке низкосортных вольфрамовых руд [4.512] и фосфата циркония [4.513.]. [c.111]
Изменение кислотно-основных свойств оксидов и гидроксидов элементов 1Б-группы подчиняется общему правилу с ростом степени окисления кислотный характер возрастает, а при движении по группе сверху вниз уменьшается. Так, кислотный характер амфотерных СигО и Ag20 у первого оксида выражен очень слабо, а у второго — практически не проявляется, поэтому их часто относят к основным оксидам. Кислотный характер у СиО и Си (ОН) 2 уже вполне отчетлив, хотя и не превалирует над основным в оксиде золота (III) Аы20з и гидроксиде АиО(ОН) кислотные свойства выражены наиболее отчетливо, последнее соединение носит даже название золотой кислоты за ее способность образовывать комплексные анионы — гидроксоаураты (III) [Аи(0Н)4Г- [c.394]
chem21.info
Оксиды — получение и свойства
Хотелось бы дать возможно более простое определение оксида — это соединение элемента с кислородом. Но существуют кислоты и соли. Рассмотрим соединения h3O2 и BaO2. Перекись водорода является слабой кислотой (она диссоциирует в воде давая ионы водорода и анионы HO2- и O2-2). Пероксид бария — это бариевая соль перекиси водорода. У молекул h3O2 и BaO2 есть кислородный мостик -O-O-, поэтому степень окисления кислорода в этих соединениях -1. В неорганической химии обычно пероксиды к классу оксидов не относят и поэтому необходимо уточнить определение оксида таким образом, чтобы пероксиды в этот класс не попадали. Фтор самый активный неметалл и вслед за ним идет кислород. Формальная степень окисления атома кислорода в оксиде фтора +2, а во всех других оксидах -2. Следовательно, оксидами называют соединения элементов с кислородом, в которых кислород проявляет формальную степень окисления равную -2 (за исключением оксида фтора, где она равна +2).
Один и тот же химический элемент может образовывать с кислородом не один оксид, а несколько, например, у азота известны оксиды N2O, NO, N2O3, NO2, N2O4, N2O5. Во всех этих оксидах степень окисления у кислорода -2, а у азота, соответственно, +1, +2, +3, +4, +4 и +5. У двух оксидов: NO2 и N2O4 степен окисления азота и кислорода совпадают. В названии веществ отражается история развития химии как науки. В период накопления экспериментальных данных в химии названия веществ отражали либо способ их получения (жженая магнезия: MgCO3 ® MgO + CO2), либо характер воздействия на человека (N2O — веселящий газ), либо сферу применения (пурпурно-красная краска «сурик» — Pb3O4) и т.д. По мере того как все большее число людей изучало химию, по мере того как все большее число веществ надо было охарактеризовать и запомнить возникла необходимость просто словами называть формулу вещества. Введение понятий валентность, степень окисления и т.д. влияло на названия веществ. Мы приведем таблицу, в которой даны названия оксидов азота при использовании различных стилей и номенклатур.
Получение оксидов
При изучении данной главы особое внимание будет уделено взаимосвязи «родственных» веществ из разных классов.
Как получить оксиды из простых веществ? Их окислением:
2Mg + O2 = 2MgO, 2C + O2 = 2CO, C + O2 = CO2.
Рассмотрим лишь принципиальную возможность получения оксида из простых веществ. Получение CO и CO2 будет рассмотрено в разделе «Углерод».
Можно ли получить оксиды из оксидов? Да:
2SO2 + O2 = 2SO3, 2SO3 = 2SO2 + O2, Fe2O3 + CO = 2FeO + CO2.
Можно ли получить оксиды из гидроксидов ? Да:
Ca(OH)2 CaO + h3O, h3CO3 = CO2 + h3O.
Можно ли получить оксиды из солей ? Да:
CaCO3 CaO + CO2, 2Cu(NO3)2 = 2CuO + 4NO2 + O2.
Свойства оксидов
Если посмотреть внимательно реакции, написанные выше, то те из них, в которых оксиды встречались в левой части уравнения, будут говорить нам о свойствах оксидов. Эти общие для всех оксидов свойства относятся к окислительно-восстановительным процессам:
2SO2 + O2 = 2SO3, 2SO3 = 2SO2 + O2, Fe2O3 + CO = 2FeO + CO2, Al + Fe2O3 = Al2O3 + Fe, C + Fe2O3 = CO + 2FeO.
Но тем не менее, свойства оксидов обычно рассматриваются с учетом их классификации.
Свойства основных оксидов
Прежде всего надо показать, что отвечающие им гидроксиды являются основаниями:
CaO + h3O = Ca(OH)2, Ca(OH)2 = Ca2+ + 2OH-,
т.е. оксиды щелочных и щелочно-земельных металлов при взаимодействии с водой дают растворимые в воде основания, которые называются щелочами.
Основные оксиды, реагируя с кислотными или амфотерными оксидами, дают соли:
CaO + SO3 = CaSO4, BaO + Al2O3 = Ba(AlO2)2.
Основные оксиды, реагируя с кислотными или амфотерными гидроксидами, дают соли:
CaO + h3SO4 = CaSO4 + h3O, K2O + Zn(OH)2 = K2ZnO2 + h3O.
Основные оксиды, реагируя с кислыми солями, дают средние соли:
CaO + Ca(HCO3)2 = 2CaCO3 + h3O.
Основные оксиды, реагируя с нормальными солями, дают основные соли:
MgO + MgCl2 + h3O = 2Mg(OH)Cl.
Свойства кислотных оксидов
Отвечающие кислотным оксидам гидроксиды являются кислотами:
SO3 + h3O = h3SO4, h3SO4 = 2H+ + SO42- .
Многие кислотные оксиды, растворяясь в воде, дают кислоты. Но есть и такие кислотные оксиды, которые не растворяются в воде и с ней не взаимодействуют: SiO2.
Кислотные оксиды, реагируя с основными или амфотерными оксидами, дают соли:
SiO2 + CaO = CaSiO3, 3SO3 + Al2O3 = Al2(SO4)3.
Кислотные оксиды, реагируя с основными или амфотерными гидроксидами, дают соли:
SO3 + Ca(OH)2 = CaSO4 + h3O, SO3 + Zn(OH)2 = ZnSO4 + h3O.
Кислотные оксиды, реагируя с основными солями, дают средние соли.
Кислотные оксиды, реагируя с нормальными солями, дают кислые соли:
CO2 + CaCO3 + h3O = Ca(HCO3)2.
Свойства амфотерных оксидов
Отвечающие амфотерным оксидам гидроксиды обладают амфотерными свойствами:
Zn(OH)2 = Zn2+ + 2OH-, h3ZnO2 = 2H+ + ZnO22-.
Амфотерные оксиды не растворяются в вводе.
Амфотерные оксиды, реагируя с основными или с кислотными оксидами, дают соли:
Al2O3 + K2O = 2KAlO2, Al2O3 + 3SO3 = Al2(SO4)3.
Амфотерные оксиды, реагируя с основными или кислотными гидроксидами, дают соли:
ZnO + 2KOH = K2ZnO2 + h3O, ZnO + h3SO4 = ZnSO4 + h3O.
www.himikatus.ru
