Химические свойства основных оксидов
1.Общим свойством всех основных оксидов является их способность взаимодействовать с кислотами с образованием соли и воды:
Основный оксид + Кислота = Соль + Н2О
Например:
MgO + 2НС1 = MgCl2 + Н2О
2. Основные оксиды взаимодействуют с кислотными оксидами с образованием солей.
Основный оксид + Кислотный оксид = Соль
Например:
СаО + СО2 = СаСО3;
3. Оксиды щелочных и щелочноземельных металлов взаимодействуют с водой с образованием растворимых оснований (щелочей):
Оксид + Н2О = Щелочь
Например:
К2О + Н2О = 2КОН
Химические свойства кислотных оксидов
1. Общим свойством всех кислотных оксидов является их способность взаимодействовать с основаниями с образованием соли и воды: —
Кислотный оксид + Основание = Соль + Н2 О
Для правильного написания формулы образующейся соли нужно четко представлять, какая кислота соответствует данному кислотному оксиду (в приведенных ниже примерах под формулами кислотных оксидов указаны формулы соответствующих им кислот).
а) СО2 + 2NaOH = Na2CO3 + Н2О
б) N2O5 + Ва(ОН)2 = Ba(NO3)2 + Н2О
2. Кислотные оксиды взаимодействуют с основными оксидами с образованием солей (см. химические свойства основных оксидов).
3.Большинство кислотных оксидов взаимодействуют с водой с образованием кислот.
Кислотный оксид + Н2О = Кислота
Например:
SO3 + Н 2О = H2SO4
N2O5 + Н2О = 2HNО3
Очень немногие кислотные оксиды не взаимодействуют с водой. Наиболее известный из них оксид кремния (IV) SiO2.
Химические свойства амфотерных оксидов
1. Амфотерные оксиды взаимодействуют с кислотами с образованием солей и воды.
Амфотерный оксид + Кислота = Соль + Н2О
Например:
ZnO + 2HNO3 = Zn(NO3)2 + Н2О
В этих реакциях амфотерные оксиды играют роль основных оксидов.
2. Амфотерные оксиды взаимодействуют со щелочами с образованием солей и воды.
Амфотерный оксид + Щелочь = Соль + Н2О
Например:
ZnO + 2КОН = K2ZnO2 + Н2О
В этих реакциях амфотерные оксиды играют роль кислотных оксидов.
3. Амфотерные оксиды при нагревании взаимодействуют с кислотными оксидами с образованием солей.
Амфотерный оксид + Кислотный оксид = Соль
Например:
ZnO + СО2 = ZnCO3
4. Амфотерные оксиды при нагревании взаимодействуют с основными оксидами с образованием солей.
Амфотерный оксид + Основный оксид = Соль
Например:
ZnO + Na2O Na2ZnO2.
Получение оксидов
Оксиды могут быть получены различными способами:
1. Взаимодействием простых веществ с кислородом:
Металл или неметалл + О2 = Оксид
2Mg + О2 = 2MgO;
С + О2 = СО2
2. Разложением некоторых оксокислот:
Оксокислота Кислотный оксид +Н2О
H2SO3 = SO2 + Н2О
3. Разложением нерастворимых оснований:
Нерастворимое основание Основный оксид +Н2О
Сu(ОН)2 = СuО + Н2О
4. Разложением некоторых солей:
Соль Основный оксид + Кислотный оксид
СаСО3 = СаО + СО2
Основания
Название Название Валентность
основания = «Гидроксид» + металла + металла
(в род. пад.)
Например: Fe(OH)2 – гидроксид железа (II), Fe(OH)3 – гидроксид железа (Ш), NaOH – гидроксид натрия, Са(ОН)2 – гидроксид кальция.
Классификация
а) По числу гидроксидных групп в молекуле. Количество гидроксидных групп
Основания делятся на:
– однокислотные, молекулы которых содержат одну гидроксидную группу: NаOH, КОН, LiОН и др.;
– двухкислотные, молекулы которых содержат две гидроксидные группы: Са(ОН)2, Fe(OH)2 и др.;
– трехкислотные, молекулы которых содержат три гидроксидные группы: Ni(OH)2, Вi(ОН)3 и др.
Двух- и трехкислотные основания называются многокислотными.
б) По растворимости в воде основания делятся на:
– растворимые: LiОН, NаОН, КОН, RbOH, CsOH, Са(ОН)2, Sr(OH)2, Ba(OH)2;
– нерастворимые: Сu(ОН)2, Fе(ОН)2, Fе(ОН)3 и др. Растворимые в воде основания называются щелочами.
Графические формулы
В молекуле основания атом металла соединяется с атомами кислорода гидроксидных групп. Например:
studfiles.net
Основания. Химические свойства и получение
Перед изучением этого раздела рекомендую прочитать следующую статью:
Классификация неорганических веществ
Основания – сложные вещества, которые состоят из катиона металла Ме+ (или металлоподобного катиона, например, иона аммония NH4+) и гидроксид-аниона ОН—.
По растворимости в воде основания делят на растворимые (щелочи) и нерастворимые основания. Также есть неустойчивые основания, которые самопроизвольно разлагаются.

основный оксид + вода = основание
Например, оксид натрия в воде образует гидроксид натрия (едкий натр):
Na2O + H2O → 2NaOH
При этом оксид меди (II) с водой не реагирует:
CuO + H2O ≠
2. Взаимодействие металлов с водой. При этом с водой реагируют в обычных условиях только щелочные металлы (литий, натрий, калий. рубидий, цезий), кальций, стронций и барий. При этом протекает окислительно-восстановительная реакция, окислителем выступает водород, восстановителем является металл.
металл + вода = щёлочь + водород
Например, калий реагирует с водой очень бурно:
2K0 + 2H2+O → 2K+OH + H20
3. Электролиз растворов некоторых солей щелочных металлов. Как правило, для получения щелочей электролизу подвергают растворы солей, образованных щелочными или щелочноземельными металлами и бескилородными кислотами (кроме плавиковой) – хлоридами, бромидами, сульфидами и др. Более подробно этот вопрос рассмотрен в статье Электролиз.
Например, электролиз хлорида натрия:
2NaCl + 2H2O → 2NaOH + H2↑ + Cl2↑
4. Основания образуются при взаимодействии других щелочей с солями. При этом взаимодействуют только растворимые вещества, а в продуктах должна образоваться нерастворимая соль, либо нерастворимое основание:
щелочь + соль1 = соль2↓ + щелочь
либо
щелочь + соль1 = соль2↓ + щелочь
Например: карбонат калия реагирует в растворе с гидроксидом кальция:
K2CO3 + Ca(OH)2 → CaCO3↓ + 2KOH
Например: хлорид меди (II) взаимодействет в растворе с гидроксидом натрия. При этом выпадает голубой осадок гидроксида меди (II):
CuCl2 + 2NaOH → Cu(OH)2↓ + 2NaCl
1. Нерастворимые основания взаимодействуют с сильными кислотами и их оксидами (и некоторыми средними кислотами). При этом образуются соль и вода.
нерастворимое основание + кислота = соль + вода
нерастворимое основание + кислотный оксид = соль + вода
Например, гидроксид меди (II) взаимодействует с сильной соляной кислотой:
Cu(OH)2 + 2HCl = CuCl2 + 2H2O
При этом гидроксид меди (II) не взаимодействует с кислотным оксидом слабой угольной кислоты – углекислым газом:
Cu(OH)2 + CO2 ≠
2. Нерастворимые основания разлагаются при нагревании на оксид и воду.
Например, гидроксид железа (III) разлагается на оксид железа (III) и воду при прокаливании:
2Fe(OH)3 = Fe2O3 + 3H2O
3. Нерастворимые основания не взаимодействуют с амфотерными оксидами и гидроксидами.
нерастворимое оснвоание + амфотерный оксид ≠
нерастворимое основание + амфотерный гидроксид ≠
4. Некоторые нерастворимые основания могут выступать в качестве восстановителей. Восстановителями являются основания, образованные металлами с минимальной или промежуточной степенью окисления, которые могут повысить свою степень окисления (гидроксид железа (II), гидроксид хрома (II) и др.).
Например, гидроксид железа (II) можно окислить кислородом воздуха в присутствии воды до гидроксида железа (III):
4Fe+2(OH)2 + O20 + 2H2O → 4Fe+3(O-2H)3
1. Щёлочи взаимодействуют с любыми кислотами – и сильными, и слабыми. При этом образуются средняя соль и вода. Эти реакции называются реакциями нейтрализации. Возможно и образование кислой соли, если кислота многоосновная, при определенном соотношении реагентов, либо в избытке кислоты. В избытке щёлочи образуется средняя соль и вода:
щёлочь(избыток)+ кислота = средняя соль + вода
щёлочь + многоосновная кислота(избыток) = кислая соль + вода
Например, гидроксид натрия при взаимодействии с трёхосновной фосфорной кислотой может образовывать 3 типа солей: дигидрофосфаты, фосфаты или гидрофосфаты.
При этом дигидрофосфаты образуются в избытке кислоты, либо при мольном соотношении (соотношении количеств веществ) реагентов 1:1.
NaOH + H3PO4 → NaH2PO4 + H2O
При мольном соотношении количества щелочи и кислоты 2:1 образуются гидрофосфаты:
2NaOH + H3PO4 → Na2HPO4 + 2H2O
В избытке щелочи, либо при мольном соотношении количества щелочи и кислоты 3:1 образуется фосфат щелочного металла.
3NaOH + H3PO4 → Na3PO4 + 3H2O
2. Щёлочи взаимодействуют с амфотерными оксидами и гидроксидами. При этом в расплаве образуются обычные соли, а в растворе – комплексные соли.
щёлочь (расплав) + амфотерный оксид = средняя соль + вода
щёлочь (расплав) + амфотерный гидроксид = средняя соль + вода
щёлочь (раствор) + амфотерный оксид = комплексная соль
щёлочь (раствор) + амфотерный гидроксид = комплексная соль
Например, при взаимодействии гидроксида алюминия с гидроксидом натрия в расплаве образуется алюминат натрия. Более кислотный гидроксид образует кислотный остаток:
NaOH + Al(OH)3 = NaAlO2 + 2H2O
А в растворе образуется комплексная соль:
NaOH + Al(OH)3 = Na[Al(OH)4]
Обратите внимание, как составляется формула комплексной соли: сначала мы выбираем центральный атом (как правило, это металл из амфотерного гидроксида). Затем дописываем к нему лиганды — в нашем случае это гидроксид-ионы. Число лигандов, как правило, в 2 раза больше, чем степень окисления центрального атома. Но комплекс алюминия — исключение, у него число лигандов чаще всего равно 4. Заключаем полученный фрагмент в квадртаные скобки — это комплексный ион. Определяем его заряд и снаружи дописываем нужное количество катионов или анионов.
3. Щёлочи взаимодействуют с кислотными оксидами. При этом возможно образование кислой или средней соли, в зависимости от мольного соотношения щёлочи и кислотного оксида. В избытке щёлочи образуется средняя соль, а в избытке кислотного оксида образуется кислая соль:
щёлочь(избыток) + кислотный оксид = средняя соль + вода
либо:
щёлочь + кислотный оксид(избыток) = кислая соль
Например, при взаимодействии избытка гидроксида натрия с углекислым газом образуется карбонат натрия и вода:
2NaOH + CO2 = Na2CO3 + H2O
А при взаимодействии избытка углекислого газа с гидроксидом натрия образуется только гидрокарбонат натрия:
2NaOH + CO2 = NaHCO3
4. Щёлочи взаимодействуют с солями. Щёлочи реагируют только с растворимыми солями в растворе, при условии, что в продуктах образуется газ или осадок. Такие реакции протекают по механизму ионного обмена.
щёлочь + растворимая соль = соль + соответствующий гидроксид
Щёлочи взаимодействуют с растворами солей металлов, которым соответствуют нерастворимые или неустойчивые гидроксиды.
Например, гидроксид натрия взаимодействует с сульфатом меди в растворе:
Cu2+SO42- + 2Na+OH— = Cu2+(OH)2—↓ + Na2+SO42-
Также щёлочи взаимодействуют с растворами солей аммония.
Например, гидроксид калия взаимодействует с раствором нитрата аммония:
NH4+NO3— + K+OH— = K+NO3— + NH3↑ + H2O
! При взаимодействии солей амфотерных металлов с избытком щёлочи образуется комплексная соль !
Давайте рассмотрим этот вопрос подробнее. Если соль, образованная металлом, которому соответствует амфотерный гидроксид, взаимодействует с небольшим количеством щёлочи, то протекает обычная обменная реакция, и в осадок выпадает гидроксид этого металла.
Например, избыток сульфата цинка реагирует в растворе с гидроксидом калия:
ZnSO4 + 2KOH = Zn(OH)2↓ + K2SO4
Однако, в данной реакции образуется не основание, а амфотерный гидроксид. А, как мы уже указывали выше, амфотерные гидроксиды растворяются в избытке щелочей с образованием комплексных солей. Таким образом, при взаимодействии сульфата цинка с избытком раствора щёлочи образуется комплексная соль, осадок не выпадает:
ZnSO4 + 4KOH = K2[Zn(OH)4] + K2SO4
Таким образом, получаем 2 схемы взаимодействия солей металлов, которым соответствуют амфотерные гидроксиды, с щелочами:
соль амф.металла(избыток) + щёлочь = амфотерный гидроксид↓ + соль
соль амф.металла + щёлочь(избыток) = комплексная соль + соль
5. Щёлочи взаимодействуют с кислыми солями. При этом образуются средние соли, либо менее кислые соли.
кислая соль + щёлочь = средняя соль + вода
Например, гидросульфит калия реагирует с гидроксидом калия с образованием сульфита калия и воды:
KHSO3 + KOH = K2SO3 + H2O
Свойства кислых солей очень удобно определять, разбивая мысленно кислую соль на 2 вещества — кислоту и соль. Например, гидрокарбонта натрия NaHCO3 мы разбиваем на уольную кислоту H2CO3 и карбонат натрия Na2CO3. Свойства гидрокарбоната в значительной степени определяются свойствами угольной кислоты и свойствами карбоната натрия.
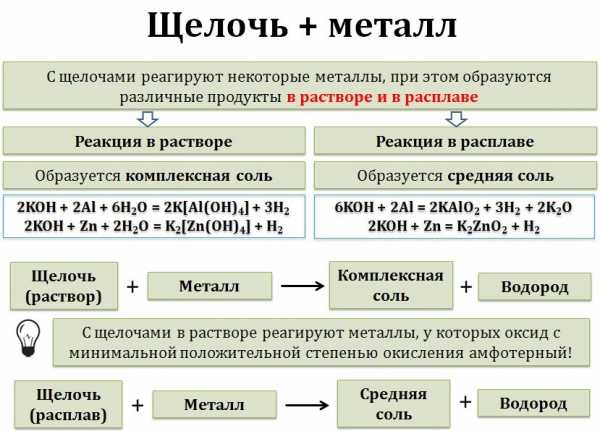
6. Щёлочи взаимодействуют с металлами в растворе и расплаве. При этом протекает окислительно-восстановительная реакция, в растворе образуется комплексная соль и водород, в расплаве — средняя соль и водород.
! Обратите внимание! С щелочами в растворе реагируют только те металлы, у которых оксид с минимальной положительной степенью окисления металла амфотерный!
Например, железо не реагирует с раствором щёлочи, оксид железа (II) — основный. А алюминий растворяется в водном растворе щелочи, оксид алюминия — амфотерный:
2Al + 2NaOH + 6H2+O = 2Na[Al+3(OH)4] + 3H20
7. Щёлочи взаимодействуют с неметалами. При этом протекают окислительно-восстановительные реакции. Как правило, неметаллы диспропорционируют в щелочах. Не реагируют с щелочами кислород, водород, азот, углерод и инертные газы (гелий, неон, аргон и др.):
NaOH +О2 ≠
NaOH +N2 ≠
NaOH +C ≠
Сера, хлор, бром, йод, фосфор и другие неметаллы диспропорционируют в щелочах (т.е. самоокисляются-самовосстанавливаются).
Например, хлор при взаимодействии с холодной щелочью переходит в степени окисления -1 и +1:
2NaOH +Cl20 = NaCl— + NaOCl+ + H2O
Хлор при взаимодействии с горячей щелочью переходит в степени окисления -1 и +5:
6NaOH +Cl20 = 5NaCl— + NaCl+5O3 + 3H2O
Кремний окисляется щелочами до степени окисления +4.
Например, в растворе:
2NaOH +Si0 + H2+O= NaCl— + Na2Si+4O3 + 2H20
Фтор окисляет щёлочи:
2F20 + 4NaO-2H = O20 + 4NaF— + 2H2O
Более подробно про эти реакции можно прочитать в статье Окислительно-восстановительные реакции.
8. Щёлочи не разлагаются при нагревании.
Исключение — гидроксид лития:
2LiOH = Li2O + H2O
Поделиться ссылкой:
chemege.ru
Часть 2. Оксиды, получение и свойства. Получение оксидов:
Способы получения. | Примеры. | Ограничения и примечания |
1. Окисление простых веществ: | а) металлов: 2Ca + O2 2CaO б) неметаллов: 4P + 3O2 (нед) 2P2O 3 4P + 5O2 (изб) 2P2O5 (Из S – SO2, из Fe – Fe2O3 и Fe3O4, из N2 – NO) | С кислородом не реагируют галогены, инертные газы, Au, Pt. Азот реагирует в жестких условиях (2000°C). |
2. Окисление сложных веществ: | а) водородных соединений: 2Н2S + 3O 2 2H2O + 2SO 2 б) сульфидов, карбидов, фосфидов (бинарных соединений): 2ZnS + 3O2 2ZnO + 2SO2 | Каждый элемент сложного вещества окисляется в соответствии со своими свойствами. |
3. Разложение гидроксидов и солей: | а) гидроксидов (оснований и кислот):2Al(OH)3→t Al2O3 + 3H2O H2SiO3 →t SiO2 + H2O б) карбонатов: СаСО3→t CaO+CO2 | Гидроксиды и карбонаты щелочных металлов (Na,K, Rb,Cs) не разлагаются. |
4. Окисление кислородом или озоном | а) кислородом: 2СО + О2 2СО2 б) озоном: NO + O3 NO2 + O2 | Возможна, если элемент имеет несколько оксидов (сера, фосфор, углерод, азот, железо). |
Свойства оксидов.
Основные оксиды – оксиды, которым соответствуют основания. Это оксиды металлов со степенями окисления +1 и +2, кроме амфотерных (ZnO, BeO, SnO, PbO)
Свойства основных оксидов.
Свойства | Примеры реакций | Ограничения и примечания |
1) Реакция с растворами кислот | Li2O + 2HCl= 2LiCl+ H2O NiO + H2SO4 = NiSO4 + H2O | Кислота должна существовать в виде раствора (не реагируют кремниевая, сероводородная, угольная) |
2) Реакция с водой | Li2O + H2O = 2LiOH BaO + H2O = Ba(OH)2 (только 8 оксидов: IA группа, СаО, SrO, ВаО) | Оксид реагирует с водой, только если в результате образуется растворимый гидроксид (щелочь). |
3) Реакция с кислотными и амфотерными оксидами | BaO + CO2 = BaCO3, FeO + SO3 = FeSO4, CuO + N2O5 = Cu(NO3) 2 СаО + SO2 = CaSO3 | Один из реагирующих оксидов (основный или кислотный) должен соответствовать сильному гидроксиду. |
4) Восстановление оксида до металла или до низшего оксида: | MnO + C = Mn + CO (при нагревании), FeO + H2 = Fe + H2O (при нагревании). Fe2O3 + CO = FeO + CO2 | В качестве восстановителей используют: СО, С, водород, алюминий, магний. С водородом реагируют оксиды неактивных металлов. |
5) Окисление кислородом. | 4FeO + O2 = 2Fe2O3 | Если металл имеет несколько оксидов с разными степенями окисления. |
Кислотные оксиды – оксиды, которым соответствуют кислоты.
Кислотные оксиды при комнатной температуре бывают:
*газы (например: СО2, SO2, NO, SeO2)*жидкости (например, SO3, Mn2O7) *твердые вещества (например: B2O3, SiO2, N2O5, P2O3, P2O5, I2O5, CrO3).
Свойства кислотных оксидов.
Свойства | Примеры реакций | Примечания |
1) Реакция с основа—ниями | CO2 + Ca(OH) 2 = CaCO3 + H2O SiO2 + 2KOH = K2SiO3 + H2O (при нагревании), SO3 + 2NaOH = Na2SO4 + H2O, N2O5 + 2KOH = 2KNO3 + H2O. | Реакция возможна со щелочами. Наиболее активные кислотные оксиды (SO3, CrO3, N2O5, Cl2O7) могут реагировать и с нерастворимыми (слабыми) основаниями. |
2) Реакция с амфотер-ными и основными оксидами | CO2 + CaO = CaCO3 P2O5 + 6FeO = 2Fe3(PO4)2 (при нагревании) N2O5 + ZnO = Zn(NO3)2 | Один из реагирующих оксидов (основный или кислотный) должен соответствовать сильному гидроксиду. |
3) Реакция с водой. Образуют—ся КИСЛОТЫ. | N2O3 + H2O = 2HNO2 SO2 + H2O = H2SO3 N2O5 + H2O = 2HNO3 SO3 + H2O = H2SO4 | Оксид реагирует с водой, если в результате образуется растворимый гидроксид. Не реагирует с водой SiO2. |
4) Реакции с солями летучих кислот. | SiO2 + K2CO3 = K2SiO3 + CO2 (при нагревании) | Твёрдые, нелетучие оксиды (SiO2,P2O5) вытесняют из солей летучие. |
5) Окисле—ние. | 2SO2 + O2 ⇆ 2SO3 | Низшие оксиды окисляются до высших. |
Амфотерные оксиды – оксиды, способные реагировать и с кислотами, и со щелочами. По химическим свойствам амфотерные оксиды похожи на основные оксиды и отличаются от них только своей способностью реагировать с щелочами, как с твердыми (при сплавлении), так и с растворами, а также с основными оксидами.
Вещества, образуемые катионами амфотерных металлов в щелочной среде:
Степень окисления | В растворе | В расплаве |
+2 (Zn, Be, Sn) | Na 2[Zn (OH) 4] тетрагидроксоцинкат натрия | Na2ZnO2 цинкат натрия |
+3 (Al, Cr, Fe*) | Na[Al(OH)4] тетрагидроксоалюминат натрия Na3[Al(OH)6] гексагидроксоалюминат натрия | NaAlO2 метаалюминат натрия и Na3AlO3 ортоалюминат натрия |
*) железо не образует устойчивых гидроксокомплексов, амфотерно только в расплаве, образуя NaFeO2 | ||
СВОЙСТВА АМФОТЕРНЫХ ОКСИДОВ.
Cвойства | Примеры реакций | Примечания |
1) Реагируют с кислотами, так же, как основные оксиды – образуются соли. | ZnO + 2HCl = ZnCl2 + H2O Al2O3 + 6HNO3 = 2Al(NO3)3 +3H2O | Только с сильными кислотами |
2) Взаимодействуют с растворами щелочей – образуются растворы гидроксокомплексов. | Al2O3 + 2KOH +3H2O = 2K[Al(OH)4] или K3[Al(OH)6] ZnO +2NaOH +H2O=Na2[Zn(OH)4] | |
3) Реагируют с расплавами щелочей – образуя соли, при этом проявляют свойства кислотных оксидов. | Al2O3 + 2KOH →t 2KAlO2 + H2O (или K3AlO3) ZnO + 2KOH → t K2ZnO2 + H2O | |
4) При сплавлении могут взаимодействовать с карбонатами щелочных металлов, как со щелочами. | Al2O3 + Na2CO3 → t 2NaAlO2+CO2 (или Na3AlO3) ZnO + Na2CO3 → t Na2ZnO2+ CO2 |
studfiles.net
Основные оксиды реагируют:
с водой с образованием оснований:
Na2О + H2O = 2NaОH;
CaO + H2O = Ca(OH)2;
с соединениями кислотного характера (кислотными оксидами, кислотами) с образованием солей и воды:
CaO + СО2 = СаСО3;
CaO + 2HCl = CaCl2 + H2O;
3) с соединениями амфотерного характера:
Li2O + Al2O3 = 2Li AlO2;
3NaOH + Al(OН)3 = Na3AlO3 + 3Н2О;
Кислотные оксиды реагируют:
1) с водой с образованием кислот:
SO3 + H2O = H2SO4;
2) с соединениями основного характера (основными оксидами и основаниями) с образованием солей и воды:
SO2 + Na2O = Na2 SO3;
CO2 + 2NaОH = Na2CO3 + H2O;
с соединениями амфотерного характера
СО2 + ZnO = ZnCO3;
СО2 + Zn(OH)2 = ZnСО3 + H2O;
Амфотерные оксиды проявляют свойства как основных, так и кислотных оксидов. Им отвечают амфотерные гидроксиды:
кислая среда щелочная среда Ве(ОН)2 ВеО Н2ВеО2
Zn(OH)2 ZnO Н2ZnО2
Аl(OН)3 Al2O3 H3AlО3 , НАlO2
Cr(OН)3 Сr2O3 HCrO2
Pb(OH)2 PbO Н2PbО2
Sn(OH)2 SnO Н2SnО2
Амфотерные оксиды взаимодействуют с соеднинениями кислого и основного характера:
ZnO + SiO2 = ZnSiO3; ZnO + H2SiO3 = ZnSiO3 + H2O; | Al2O3 + 3Na2O = 2Na3AlO3; Al2O3 + 2NaOH = 2NaAlO2 + H2O. |
Металлы с переменной валентностью могут образовывать оксиды всех трех типов. Например:
CrO основной Cr(OH)2;
Cr2O3 амфотерный Cr(OH)3;
Cr2O7 кислотный H2Cr2O7;
MnO, Mn2O3 основной;
MnO2 амфотерный;
Mn2O7 кислотный HMnO4.
Основания
Основания – сложные вещества, в состав которых входят атомы металла и одна или несколько гидроксидных групп (ОН‾). Общая формула оснований – Ме(ОН)у , где у – число гидроксидных групп, равное валентности металла.
Номенклатура
Название основания складывается из слова «гидроксид» + название металла.
Если металл имеет переменную валентность, то ее указывают в конце в скобках. Например: CuOH – гидроксид меди (I), Cu(OH)2 – гидроксид меди (II), NaОH – гидроксид натрия.
Основания (гидроксиды) являются электролитами. Электролитами называются вещества, которые в расплавах или растворах полярных жидкостей распадаются на ионы: положительно заряженные катионы и отрицательно заряженные анионы. Распад вещества на ионы называется электролитической диссоциацией.
Bсe электролиты можно разделить на две группы: сильные и слабые. Сильные электролиты в водных растворах диссоциированы практически нацело. Слабые электролиты диссоциируют только частично и в растворах устанавливается динамическое равновесие между недиссоциированными молекулами и ионами: NН4ОН NH4+ + ОН— .
2.2. Классификация
а) по числу гидроксидных групп в молекуле. Количество гидроксидных групп в молекуле основания зависит от валентности металла и определяет кислотность основания.
Основания делятся на:
— однокислотные, молекулы которых содержат одну гидроксидную группу: NaOH, KOH, LiOH и др.;
— двухкислотные, молекулы которых содержат две гидроксидные группы: Ca(OH)2 , Fe(OH)2 и др.;
— трехкислотные, молекулы которых содержат три гидроксидные группы: Ni(OH)3 , Bi(OH)3 и др.
Двух- и трехкислотные основания называются многокислотными.
б) по силе основания делятся на:
— сильные (щелочи): LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2 , Sr(OH)2 , Ba(OH)2;
— слабые: Cu(OH)2 , Fe(OH)2 , Fe(OH)3 и др.
Сильные основания растворимы в воде, а слабые – нерастворимы.
Диссоциация оснований
Сильные основания диссоциируют практически полностью:
Са(ОН)2 = Са2+ + 2ОН—.
Слабые основания диссоциируют ступенчато. При последовательном отщеплении гидроксид-иона от многокислотных оснований образуются основные остатки гидроксокатионы, например:
Fe(OH)3 OH— + Fe(OH)2+ дигидроксокатионы железа;
Fe(OH)2+ OH— + FeOH2+ гидроксокатионы железа;
Fe(OH)2+ OH— + Fe3+ катионы железа.
Число основных остатков равно кислотности основания.
studfiles.net
что это такое, с чем они реагируют? :: SYL.ru
В природе существует три класса неорганических химических соединений: соли, гидроксиды и оксиды. Первые являются соединениями атома металла с кислотным остатком, к примеру, СІ-. Вторые подразделяются на кислоты и основания. Молекулы первых из них состоят из катионов Н+ и кислотного остатка, например, SO4-. Основания же имеют в своем составе катион металла, к примеру, К+, и анион в виде гидроксильной группы ОН-. А оксиды, в зависимости от своих свойств, делятся на кислотные и основные. О последних мы и расскажем в этой статье.
Определение
Основные оксиды — это вещества, состоящие из двух химических элементов, одним из которых обязательно является оксиген, а вторым — металл. При добавлении воды к веществам этого типа образуются основания.
Химические свойства основных оксидов
Вещества данного класса в первую очередь способны вступать в реакцию с водой, вследствие которой получается основание. Для примера можно привести следующее уравнение: СаО + Н2О = Са(ОН)2.
Реакции с кислотами
Если основные оксиды смешать с кислотами, можно получить соли и воду. К примеру, если к оксиду калия добавить хлоридную кислоту, получим хлорид калия и воду. Уравнение реакции будет выглядеть таким образом: К2О + 2НСІ = 2КСІ + Н2О.
Взаимодействие с кислотными оксидами
Такого рода химические реакции приводят к образованию солей. Например, если к оксиду кальция добавить углекислый газ, получим карбонат кальция. Данную реакцию можно выразить в виде следующего уравнения: СаО + СО2 = СаСО3. Подобного рода химическое взаимодействие может произойти только под воздействием высокой температуры.
Амфотерные и основные оксиды
Эти вещества также могут взаимодействовать между собой. Это происходит, потому что первые из них имеют свойства как кислотных, так и основных оксидов. В результате подобных химических взаимодействий образуются сложные соли. Для примера приведем уравнение реакции, которая происходит при смешивании оксида калия (основного) с оксидом алюминия (амфотерным): К2О + АІ2О3 = 2КАІО2. Полученное при этом вещество называется алюминат калия. Если смешать те же реагенты, но еще и добавить воду, то реакция пройдет следующим образом: К2О + АІ2О3 + 4Н2О = 2К[Al(OH)4]. Вещество, которое образовалось, называется тетрагидроксоалюминат калия.
Физические свойства
Разнообразные основные оксиды весьма отличаются друг от друга по физическим свойствам, однако все они в основном при нормальных условиях пребывают в твердом агрегатном состоянии, имеют высокую температуру плавления.

Давайте рассмотрим каждое химическое соединение по отдельности. Оксид калия выглядит как твердое вещество светло-желтого цвета. Плавится при температуре +740 градусов по шкале Цельсия. Оксид натрия представляет собой бесцветные кристаллы. Превращаются в жидкость при температуре +1132 градуса. Оксид кальция представлен белыми кристаллами, которые плавятся при +2570 градусах. Диоксид железа выглядит как черный порошок. Принимает жидкое агрегатное состояние при температуре +1377 градусов Цельсия. Оксид магния похож на соединение кальция — это также кристаллы белого цвета. Плавится при +2825 градусах. Оксид лития представляет собой прозрачные кристаллы с температурой плавления +1570 градусов. Данное вещество обладает высокой гигроскопичностью. Оксид бария выглядит так же, как и предыдущее химическое соединения, температура, при которой оно принимает жидкое состояние, чуть выше — +1920 градусов. Оксид ртути — порошок оранжево-красного цвета. При температуре +500 градусов по Цельсию данное химическое вещество разлагается. Оксид хрома — это порошок темно-красной расцветки с такой же температурой плавления, как и у соединения лития. Оксид цезия обладает такой же окраской, как и ртути. Разлагается под воздействием солнечной энергии. Оксид никеля — кристаллы зеленого цвета, превращаются в жидкость при температуре +1682 градуса по шкале Цельсия. Как видите, физические свойства всех веществ данной группы обладают многими общими чертами, хотя и имеют некоторые различия. Оксид купрума (меди) выглядит как кристаллы, обладающие черной окраской. В жидкое агрегатное состояние переходит при температуре +1447 градус по Цельсию.
Как добывают химические вещества этого класса?
Основные оксиды можно получить путем проведения реакции между металлом и кислородом под воздействием высокой температуры. Уравнение такого взаимодействия выглядит следующим образом: 4К + О2 = 2К2О. Второй способ получения химических соединений данного класса — разложение нерастворимого основания. Уравнение можно записать так: Са(ОН)2 = СаО + Н2О. Для осуществления подобного рода реакции необходимы специальные условия в виде высоких температур. Кроме того, основные оксиды также образуются при разложении определенных солей. Примером может служить такое уравнение: СаСО3 = СаО + СО2. Таким образом, образовался еще и кислотный оксид.
Использование основных оксидов
Химические соединения данной группы находят широкое применение в различных отраслях промышленности. Далее рассмотрим использование каждого из них. Оксид алюминия применяют в стоматологии для изготовления зубных протезов. Его также используют при производстве керамики. Оксид кальция является одним из компонентов, участвующих в изготовлении силикатного кирпича. Также он может выступать в роли огнеупорного материала. В пищевой промышленности это добавка Е529. Оксид калия — один из ингредиентов минеральных удобрений для растений, натрия — используется в химической промышленности, в основном при получении гидроксида этого же металла. Оксид магния также применяют в пищевой отрасли, в качестве добавки под номером Е530. Кроме того, он является средством против повышения кислотности желудочного сока. Оксид бария применяется в химических реакциях в качестве катализатора. Диоксид железа используют в производстве чугуна, керамики, красок. Он также является пищевым красителем по номером Е172. Оксид никеля придает стеклу зеленый цвет. Кроме того, он используется в синтезе солей и катализаторов. Оксид лития — один из компонентов в производстве некоторых видов стекла, он повышает прочность материала. Соединение цезия выступает в роли катализатора для проведения некоторых химических реакций. Оксид купрума, как и некоторые другие, находит свое применение в изготовлении специальных видов стекла, а также для получения чистой меди. При производстве красок и эмалей он используется в качестве пигмента, придающего синий цвет.
Вещества данного класса в природе
В естественной среде химические соединения этой группы встречаются в виде минералов. В основном это кислотные оксиды, но среди других также они встречаются. К примеру, соединение алюминия — корунд.  В зависимости от присутствующих в нем примесей, он может быть различного цвета. Среди вариаций на основе АІ2О3 можно выделить рубин, который имеет красную расцветку, и сапфир — минерал, обладающий синей окраской. Это же химическое вещество можно встретить в природе и в виде глинозема. Соединение купрума с оксигеном встречается в природе в виде минерала тенорита.
В зависимости от присутствующих в нем примесей, он может быть различного цвета. Среди вариаций на основе АІ2О3 можно выделить рубин, который имеет красную расцветку, и сапфир — минерал, обладающий синей окраской. Это же химическое вещество можно встретить в природе и в виде глинозема. Соединение купрума с оксигеном встречается в природе в виде минерала тенорита.
Заключение
В качестве вывода можно сказать, что все вещества, рассмотренные в данной статье, обладают похожими физическими и аналогичными химическими свойствами. Они находят свое применение во многих отраслях промышленности — от фармацевтической до пищевой.
www.syl.ru
Характерные химические свойства оснований и амфотерных гидроксидов.
Прежде чем рассуждать о химических свойствах оснований и амфотерных гидроксидов, давайте четко определим, что же это такое?
1) К основаниями или основным гидроксидам относят гидроксиды металлов в степени окисления +1 либо +2, т.е. формулы которых записываются либо как MeOH , либо как Me(OH)2. Однако существуют исключения. Так, гидроксиды Zn(OH)2, Be(OH)2, Pb(OH)2, Sn(OH)2 к основаниям не относятся.
2) К амфотерным гидроксидам относят гидроксиды металлов в степени окисления +3,+4, а также в качестве исключений гидроксиды Zn(OH)2, Be(OH)2, Pb(OH)2, Sn(OH)2. Гидроксиды металлов в степени окисления +4, в заданиях ЕГЭ не встречаются, поэтому рассмотрены не будут.
Химические свойства оснований
Все основания подразделяют на:
Напомним, что бериллий и магний к щелочноземельным металлам не относятся.
Помимо того, что щелочи растворимы в воде, они также очень хорошо диссоциируют в водных растворах, в то время как нерастворимые основания имеют низкую степень диссоциации.
Такое отличие в растворимости и способности к диссоциации у щелочей и нерастворимых гидроксидов приводит, в свою очередь, к заметным отличиям в их химических свойствах. Так, в частности, щелочи являются более химически активными соединениями и нередко способны вступать в те реакции, в которые не вступают нерастворимые основания.
Взаимодействие оснований с кислотами
Щелочи реагируют абсолютно со всеми кислотами, даже очень слабыми и нерастворимыми. Например:
Нерастворимые основания реагируют практически со всеми растворимыми кислотами, не реагируют с нерастворимой кремниевой кислотой:
Следует отметить, что как сильные, так и слабые основания с общей формулой вида Me(OH)2 могут образовывать основные соли при недостатке кислоты, например:
Взаимодействие с кислотными оксидами
Щелочи реагируют со всеми кислотными оксидами, при этом образуются соли и часто вода:
Нерастворимые основания способны реагировать со всеми высшими кислотными оксидами, соответствующими устойчивым кислотам, например, P2O5, SO3, N2O5, с образованием средних соле1:
Нерастворимые основания вида Me(OH)2 реагируют в присутствии воды с углекислым газом исключительно с образованием основных солей. Например:
Cu(OH)2 + CO2 = (CuOH)2CO3 + H2O
С диоксидом кремния, ввиду его исключительной инертности, реагируют только самые сильные основания — щелочи. При этом образуются нормальные соли. С нерастворимыми основаниями реакция не идет. Например:
Взаимодействие оснований с амфотерными оксидами и гидроксидами
Все щелочи реагируют с амфотерными оксидами и гидроксидами. Если реакцию проводят, сплавляя амфотерный оксид либо гидроксид с твердой щелочью, такая реакция приводит к образованию безводородных солей:
Если же используют водные растворы щелочей, то образуются гидроксокомплексные соли:
В случае алюминия при действии избытка концентрированной щелочи вместо соли Na[Al(OH)4] образуется соль Na3[Al(OH)6]:
Взаимодействие оснований с солями
Какое-либо основание реагирует с какой-либо солью только при соблюдении одновременно двух условий:
1) растворимость исходных соединений;
2) наличие осадка или газа среди продуктов реакции
Например:
Термическая устойчивость оснований
Все щелочи, кроме Ca(OH)2, устойчивы к нагреванию и плавятся без разложения.
Все нерастворимые основания, а также малорастворимый Ca(OH)2 при нагревании разлагаются. Наиболее высокая температура разложения у гидроксида кальция – около 1000oC:
Нерастворимые гидроксиды имеют намного более низкие температуры разложения. Так, например, гидроксид меди (II) разлагается уже при температуре выше 70 oC:
Химические свойства амфотерных гидроксидов
Взаимодействие амфотерных гидроксидов с кислотами
Амфотерные гидроксиды реагируют с сильными кислотами:
Амфотерные гидроксиды металлов в степени окисления +3, т.е. вида Me(OH)3, не реагируют с такими кислотами, как H2S, H2SO3 и H2СO3 ввиду того, что соли, которые могли бы образоваться в результате таких реакций, подвержены необратимому гидролизу до исходного амфотерного гидроксида и соответствующей кислоты:
Взаимодействие амфотерных гидроксидов с кислотными оксидами
Амфотерные гидроксиды реагируют с высшими оксидами, которым соответствуют устойчивые кислоты (SO3, P2O5, N2O5):
Амфотерные гидроксиды металлов в степени окисления +3, т.е. вида Me(OH)3, не реагируют с кислотными оксидами SO2 и СO2.
Взаимодействие амфотерных гидроксидов с основаниями
Из оснований амфотерные гидроксиды реагируют только с щелочами. При этом, если используется водный раствор щелочи, то образуются гидроксокомплексные соли:
А при сплавлении амфотерных гидроксидов с твердыми щелочами получаются их безводные аналоги:
Взаимодействие амфотерных гидроксидов с основными оксидами
Амфотерные гидроксиды реагируют при сплавлении с оксидами щелочных и щелочноземельных металлов:
Термическое разложение амфотерных гидроксидов
Все амфотерные гидроксиды не растворимы в воде и, как любые нерастворимые гидроксиды, разлагаются при нагревании на соответствующий оксид и воду:
scienceforyou.ru
Урок 31. Оксиды – HIMI4KA
В уроке 31 «Оксиды» из курса «Химия для чайников» познакомимся с оксидами их классификацией, а также узнаем где они встречаются в природе.

Все неорганические вещества делятся на несколько классов, важнейшими из которых являются оксиды, кислоты, основания и соли. Первоначальные сведения об этих веществах вы уже получили. Теперь вам предстоит познакомиться с ними более подробно и систематизировать свои знания.
Вы уже знаете, что самым распространенным элементом на Земле является кислород. Его атомы, соединяясь с атомами других элементов, образуют огромное количество сложных неорганических веществ, среди которых важное место занимают оксиды.
Состав оксидов
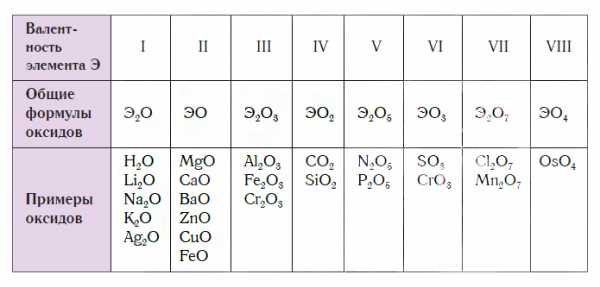
В состав любого оксида входят атомы двух химических элементов, один из которых — кислород, например: Н2О, Al2O3, Р2О5, CuO, Cl2O7. Всего известно около трехсот разных оксидов. Их общая химическая формула — ЭxOy, где буква Э обозначает символ химического элемента, образующего оксид, О — символ кислорода, а буквы x и y — индексы, обозначающие число атомов в молекулах или в формульных единицах оксидов.
Поскольку валентность атомов кислорода в оксидах всегда равна II, а валентность атомов других элементов принимает значения от I до VIII, состав оксидов выражается формулами, приведенными в следующей таблице.
Классификация оксидов
Поскольку оксидов известно очень много, возникает необходимость классификации этих веществ по их химическим свойствам, т. е. по способности превращаться в другие вещества.
Вы уже знаете, что оксиды могут реагировать с водой, превращаясь при этом в соединения двух типов — кислоты и основания. Так, например, оксид фосфора(V) P2O5, присоединяя воду, превращается в кислоту H3PO4:
а оксид кальция CaO, взаимодействуя с водой, превращается в основание Ca(OH)2:
Иначе говоря, оксиду фосфора соответствует кислота, а оксиду кальция соответствует основание. Исходя из этого, оксиды можно разделить на две большие группы — кислотные и основные оксиды.
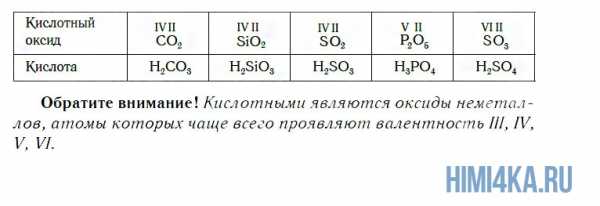
К кислотным относятся оксиды, которым соответствуют кислоты. Наряду с Р2О5, кислотными являются также оксиды: CO2, SiO2, SO2, N2O5, SO3 и некоторые другие. Всем им соответствуют кислоты.
К основным относятся оксиды, которым соответствуют основания. Кроме СaO, основными являются оксиды: Na2O, K2O, BaO, FeO, CuO и ряд других. Всем этим оксидам соответствуют основания.
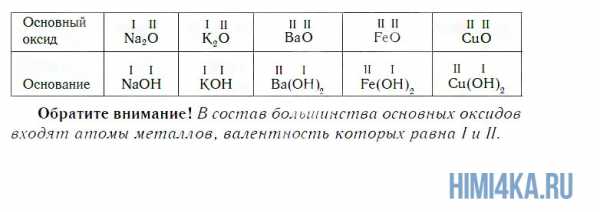
Оксиды в природе
Оксиды содержатся в каждой из трех оболочек нашей планеты — в атмосфере, гидросфере, литосфере.
Самым распространенным оксидом в атмосфере и гидросфере является вода H2O, а в литосфере — оксид кремния(IV) SiO2, встречающийся в виде красивых кристаллов кварца (рис. 116) и кварцевого песка.

Краткие выводы урока:
- Оксиды делятся на кислотные и основные. Кислотным оксидам соответствуют кислоты, а основным — основания.
- Оксиды широко распространены в природе.
Надеюсь урок 31 «Оксиды» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
himi4ka.ru
