Кислотные оксиды — это… Что такое Кислотные оксиды?
Кислотные оксиды (ангидриды) – оксиды, проявляющие кислотные свойства и образующие соответствующие кислородсодержащие кислоты. Образованы типичными неметаллами и некоторыми переходными элементами. Элементы в кислотных оксидах обычно проявляют степень окисления от IV до VII. Они могут взаимодействовать с некоторыми основными и амфотерными оксидами, например: с оксидом кальция CaO, оксидом натрия Na2О, оксидом цинка ZnO, либо с оксидом алюминия Al2O3 (амфотерный оксид).
Характерные реакции
Кислотные оксиды могут реагировать с:
1)основными оксидами:
3Na2O + P2O5 => 2Na3PO4
2) с водой (практически все кислотные оксиды при взаимодействии с водой (реакция гидратации) образуют соответствующие им кислотные гидроксиды (кислородосодержащие кислоты). Например, при растворении оксида серы (VI) в воде образуется серная кислота:
SO3
3)с основаниями (щелочами):
2NaOH + CO2 => Na2CO3 + H2O
4)с амфотерными оксидами:
Fe2O3 + 3CO2 => Fe2(CO3)3
Кислотные оксиды могут быть получены из соответствующей кислоты:
H2SiO3 → SiO2 + H2O
Примеры
См. также
| В этой статье не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. Вы можете отредактировать эту статью, добавив ссылки на авторитетные источники. Эта отметка установлена 13 мая 2011. |
dic.academic.ru
Кислотные оксиды — получение и химические свойства » HimEge.ru
Кислотными называются оксиды, взаимодействующие с основаниями (или основными оксидами) с образованием солей.
Кислотные оксиды представляют собой оксиды неметаллов или переходных металлов в высоких степенях окисления, им соответствуют кислотные гидроксиды, обладающие свойствами кислот.
Например, S+6O3 → H2S+6O4; N2+5O5 → HN+5O3, причем степень окисления элемента не изменяется при переходе от оксида к гидроксиду.
Получение кислотных оксидов
1. Окисление кислородом
4Р + 5О2 = 2Р2О5,
2. Горение сложных веществ
СН4 + 2О2 → СО2 + 2 Н2О;
2ZnS + 3O2 = 2ZnO + 2SO2,
Химические свойства кислотных оксидов
1. Большинство кислотных оксидов непосредственно взаимодействуют с водой с образованием кислот:
SO3 + H2O = H2SO4,
CO2 + H2
P2O5 + H2O = 2HPO3,
P2O5 + 3H2O = 2H3PO4.
2. Наиболее типичными для кислотных оксидов являются их следующие реакции с образованием солей:
| с основными оксидами: | SO3 + Na2O = Na2SO4 |
| с амфотерными оксидами: | P2O5 + Al2O3 = 2AlPO4 |
| со щелочами: | CO2 + 2KOH = K2CO3 + H2O |
3. Кислотные оксиды могут вступать в многочисленные окислительно-восстановительные реакции, например,
СO2 + C = 2CO,
2SO2 + O2 = 2SO3,
SO2 +2H2S = 3S + 2H2O,
4CrO3 + C2H5OH = 2Cr2O3 + 2CO2 + 3H2O
4. Менее летучие кислотные оксиды вытесняют более летучие кислотные оксиды из их солей (сплавление):
Na2CO3 + SiO2 → Na2SiO3 + CO2↑
himege.ru
Оксиды Классификация + свойства
Оксиды.
Это – сложные вещества состоящие из ДВУХ элементов, один из которых кислород. Например:
CuO– оксид меди(II)
AI2O3– оксид алюминия
SO3– оксид серы (VI)
Оксиды делятся (их классифицируют) на 4 группы:
1). Основные – Это оксидыметаллов. Если степень окисления < 4. Например:
Na2O– Оксид натрия
СаО – Оксид кальция
Fe2O3– оксид железа (III)
2). Кислотные– Это оксидынеметаллов. А иногда и металлов если степень окисления металла > 4. Например:
СО2– Оксид углерода (IV)
Р2О5– Оксид фосфора (V)
SO3– Оксид серы (VI)
3). Амфотерные– Это оксиды которые имеют свойства , как основных так и кислотных оксидов. Необходимо знать пять наиболее часто встречающихся амфотерных оксидов:
BeO–оксид бериллия
ZnO– Оксид цинка
AI2O3– Оксид алюминия
Cr2
O3– Оксид хрома (III)Fe2O3– Оксид железа (III)
4). Несолеобразующие (безразличные)– Это оксиды которые не проявляют свойств ни основных, ни кислотных оксидов. Необходимо запомнить три оксида:
СО – оксид углерода (II) угарный газ
NO– оксид азота (II)
N2O– оксид азота (I) веселящий газ, закись азота
Способы получения оксидов.
1). Горение, т.е. взаимодействие с кислородом простого вещества:
4Na + O2 = 2Na2O
4P + 5O2 = 2P2O5
2). Горение, т.е. взаимодействие с кислородом сложного вещества (состоящего из двух элементов) при этом образуются два оксида.
2ZnS + 3O2 = 2ZnO + 2SO2
4FeS
3). Разложение трех слабых кислот. Другие не разлагаются. При этом образуются – кислотный оксид и вода.
Н2СО3 = Н2О + СО2
Н2SO3 = H2O + SO2
H2SiO3 = H2O + SiO2
4). Разложение нерастворимых оснований. Образуются основный оксид и вода.
Mg(OH)2 = MgO + H2O
2Al(OH)3 = Al2O3 + 3H2O
5). Разложение нерастворимых солей. Образуются основный оксид и кислотный оксид.
СаСО3 = СаО + СО2
МgSO3 = MgO + SO2
Химические свойства.
I. Основных оксидов.
1). Взаимодействие с водой, при этом должна образоваться щелочь.
Na2O + H2O = 2NaOH
CaO + H2O = Ca(OH)2
СuO + H2O = реакция не протекает, т.к. возможное основание в состав которого входит медь — нерастворимо
2). Взаимодействие с кислотами, при этом образуется соль и вода. (Основный оксид и кислоты реагируют ВСЕГДА )
К2О + 2НСI = 2KCl + H2O
CaO + 2HNO3 = Ca(NO3)2 + H2O
3). Взаимодействие с кислотными оксидами, при этом образуется соль.
Li2O + CO2 = Li2CO3
3MgO + P2O5 = Mg3(PO4)2
4). Взаимодействие с водородом, при этом образуется металл и вода.
CuO + H2 = Cu + H2O
Fe2O3 + 3H2 = 2Fe + 3H2O
II. Кислотных оксидов.
1). Взаимодействие с водой, при этом должна образоваться кислота. (Только SiO2 не взаимодействует с водой)
CO2 + H2O = H2CO3
P2O5 + 3H2O = 2H3PO4
2). Взаимодействие с растворимыми основаниями (щелочами). При этом образуется соль и вода.
SO3 + 2KOH = K2SO4 + H2O
N2O5 + 2KOH = 2KNO3 + H2O
3). Взаимодействие с основными оксидами. При этом образуется только соль.
N2O5 + K2O = 2KNO3
Al2O3 + 3SO3 = Al2(SO4)3
Основные упражнения.
1). Закончить уравнение реакции. Определить её тип.
К2О + Р2О5 =
Решение.
Что бы записать, что образуется в результате – необходимо определить – какие вещества вступили в реакцию – здесь это оксид калия (основный) и оксид фосфора (кислотный) согласно свойств – в результате должна получиться СОЛЬ (смотри свойство № 3) а соль состоит из атомов металлов (в нашем случае калия) и кислотного остатка в состав которого входит фосфор (т.е. РО4-3 – фосфат) Поэтому
3К2О
+ Р2О5 = 2К
тип реакции – соединение (так как вступают в реакцию два вещества, а образуется – одно)
2). Осуществить превращения (цепочка).
1 2 3 4
Са → СаО → Са(ОН)2 → СаСО3 → СаО
Решение
Для выполнения этого упражнения необходимо помнить, что каждая стрелочка это одно уравнение (одна химическая реакция). Пронумеруем каждую стрелочку. Следовательно, необходимо записать 4 уравнения. Вещество записанное слева от стрелочки(исходное вещество) вступает в реакцию, а вещество записанное справа – образуется в результате реакции(продукт реакции). Расшифруем первую часть записи:
Са → СаО
Са + …..→ СаО Мы обращаем внимание, что вступает в реакцию простое вещество, а образуется оксид. Зная способы получения оксидов ( № 1 ) приходим к выводу, что в данной реакции необходимо добавить –кислород (О2)
2Са + О2 → 2СаО
Переходим к превращению № 2
СаО → Са(ОН)2
СаО + ……→ Са(ОН)2
Приходим к выводу , что здесь необходимо применить свойство основных оксидов – взаимодействие с водой, т.к. только в этом случае из оксида образуется основание.
СаО + Н2О → Са(ОН)2
Переходим к превращению № 3
Са(ОН)2 → СаСО3
Сa(OH)2 + ….. = CaCO3 + …….
Приходим к выводу, что здесь речь идет об углекислом газе СО2 т.к. только он при взаимодействии со щелочами образует соль (смотри свойство № 2 кислотных оксидов)
Сa(OH)2 + СО2 = CaCO3 + Н2О
Переходим к превращению № 4
СаСО3 → СаО
СаСО3= ….. СаО + ……
Приходим к выводу что здесь образуется еще СО2 , т.к. СаСО3 нерастворимая соль и именно при разложении таких веществ образуются оксиды.
СаСО3 = СаО + СО2
3). С какими из перечисленных веществ взаимодействует СО2 . Напишите уравнения реакций.
А). Соляная кислота Б). Гидроксид натрия В). Оксид калия г). Вода
Д). Водород Е). Оксид серы (IV).
Решение.
Определяем, что СО2 – это кислотный оксид. А кислотные оксиды вступают в реакции с водой, щелочами и основными оксидами … Следовательно из приведенного списка выбираем ответы Б, В, Г И именно с ними записываем уравнения реакций:
1). СО2 + 2NaOH = Na2CO3 + H2O
2). CO2 + K2O = K2CO3
3). CO2 + H2O = H2CO3
studfiles.net
Кислотные оксиды — это… Что такое Кислотные оксиды?
Кислотные оксиды (ангидриды) – оксиды, проявляющие кислотные свойства и образующие соответствующие кислородсодержащие кислоты. Образованы типичными неметаллами и некоторыми переходными элементами. Элементы в кислотных оксидах обычно проявляют степень окисления от IV до VII. Они могут взаимодействовать с некоторыми основными и амфотерными оксидами, например: с оксидом кальция CaO, оксидом натрия Na2О, оксидом цинка ZnO, либо с оксидом алюминия Al2O3 (амфотерный оксид).
Характерные реакции
Кислотные оксиды могут реагировать с:
1)основными оксидами:
3Na2O + P2O5 => 2Na3PO4
2) с водой (практически все кислотные оксиды при взаимодействии с водой (реакция гидратации) образуют соответствующие им кислотные гидроксиды (кислородосодержащие кислоты). Например, при растворении оксида серы (VI) в воде образуется серная кислота:
SO3 + H2O → H2SO4
3)с основаниями (щелочами):
2NaOH + CO2 => Na2CO3 + H2O
4)с амфотерными оксидами:
Fe2O3 + 3CO2 => Fe2(CO3)3
Кислотные оксиды могут быть получены из соответствующей кислоты:
H2SiO3 → SiO2 + H2O
Примеры
См. также
| В этой статье не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. Вы можете отредактировать эту статью, добавив ссылки на авторитетные источники. Эта отметка установлена 13 мая 2011. |
biograf.academic.ru
Кислотные оксиды: краткая характеристика группы
Кислотные оксиды — это довольно большая группа сложных веществ, которые вступают в реакцию со щелочами. При таких этом происходит образование солей. А вот с кислотами они не взаимодействуют.
Кислотные оксиды образуются преимущественно неметаллами. Например, к этой группе можно отнести серу, фосфор и хлор. Кроме того, вещества с такими же свойствами могут образовываться из так называемых переходных элементов с валентностью от пяти до семи.
Кислотные оксиды при взаимодействии с водой могут образовывать кислоты. Каждая неорганическая кислота имеет соответствующий оксид. Например, оксиды серы образовывают сульфатную и сульфитную кислоты, а фосфора — орто- и метафосфатную кислоту.
Кислотные оксиды и методы их получения
Существует несколько основных методов получения оксидов с кислотными свойствами.
Самым распространенным способом является окисление атомов неметалла кислородом. Например, при взаимодействии фосфора с оксигеном получается оксид фосфора. Конечно же, такой метод возможен не всегда.
Еще одна довольно распространенная реакция — это так называемый обжиг сульфидов кислородов. Кроме того, оксиды получают и при реакции определенных солей с кислотами.
Иногда в лабораториях используется и немного другая методика. Во время реакции от соответствующей кислоты отнимают воду — происходит процесс дегидратации. Кстати, именно поэтому кислотные оксиды известны и под другим названием — ангидриды кислот.
Химические свойства кислотных оксидов
Как уже упоминалось, ангидриды могут взаимодействовать с основными оксидами или щелочами. В результате такой реакции образуется соль соответствующей кислоты, а при реакции с основанием еще и вода. Именно этот процесс характеризирует основные кислотные свойства оксидов. Кроме того, ангидриды не взаимодействуют с кислотами.
Еще одно свойство этих веществ — это возможность реакции с амфортерными основаниями и оксидами. В результате такого процесса также образовываются соли.
Кроме того, некоторые ангидриды реагируют с водой. В результате такого процесса наблюдается образование соответствующей кислоты. Именно таким образом в лабораторных условиях получают, например, серную кислоту.
Самые распространенные ангидриды: краткая характеристика
Самым распространенным и известным кислотным оксидом считается углекислый газ. Это вещество в нормальных условиях представляет собой бесцветный газ без запаха, но со слабым кисловатым вкусом.
Кстати, при атмосферном давлении диоксид углерода может существовать либо в газообразном, либо в твердом состоянии (сухой лед). Для того чтобы превратить углеродный ангидрид в жидкость, необходимо повысить давление. Именно это свойство используют для хранения вещества.
Углекислый газ относится к группе парниковых, ведь активно поглощает испускаемые землей инфракрасные лучи, удерживая тепло в атмосфере. Тем не менее, это вещество очень важно для жизни организмов. Углекислый газ содержится в атмосфере нашей планеты. Кроме того, он используется растениями в процессах фотосинтеза.
Серный ангидрид, или триокись серы — еще один представитель этой группы веществ. В обычных условиях он представляет собой бесцветную, очень летучую жидкость с неприятным, удушающих запахом. Этот оксид очень важен в химической промышленности, так как из него производят основную массу серной кислоты.
Оксид кремния — еще одно довольно известное вещество, которое в нормальном состоянии представляет собой кристаллы. Кстати, песок состоит именно из этого соединения. Оксид кремния при нагревании способен расплавляться и застывать. Это его свойство используют при производстве стекла. Кроме того, вещество практически не проводит электрический ток, поэтому его использую в качестве диэлектрика.
fb.ru
оксиды, их классификация и свойства
Оксиды, их классификация и свойства — это основа такой важной науки, как химия. Их начинают изучать в первый год обучения химии. В таких точных науках, как математика, физика и химия, весь материал связан между собой, именно поэтому неусвоение материала влечет за собой непонимание новых тем. Поэтому очень важно разобраться в теме оксидов и полностью в ней ориентироваться. Об этом мы с вами сегодня и постараемся поговорить более подробно.

Что такое оксиды?
Оксиды, их классификация и свойства — это то, что нужно понять первостепенно. Итак, что же такое оксиды? Вы помните это из школьной программы?
Оксиды (или оксилы) — это сложные вещества, бинарные соединения, в состав которых входят атомы электроотрицательного элемента (менее электроотрицательный, чем кислород) и кислорода со степенью окисления -2.
Окислы — это невероятно распространенные на нашей планете вещества. Примеры оксидного соединения: вода, ржавчина, некоторые красители, песок и даже углекислый газ.

Образование оксидов
Окислы можно получить самыми различными способами. Образование окислов также изучает такая наука, как химия. Оксиды, их классификация и свойства — вот, что должны знать ученые, чтобы понять, как образовался тот или иной оксид. Например, они могут быть получены путем прямого соединения атома (или атомов) кислорода с химическим элементом — это взаимодействие химических элементов. Однако есть и косвенное образование оксидов, это когда оксиды образуются путем разложения кислот, солей или оснований.

Классификация оксидов
Оксиды и их классификация зависят от того, как они образовались. По своей классификации окислы делятся всего на две группы, первая из которых солеобразующие, а вторая несолеобразующие. Итак, рассмотрим подробнее обе группы.
Солеобразующие оксиды — это довольно большая группа, которая делится на амфотерные, кислотные и основные оксиды. В результате любой химической реакции солеобразующие оксиды образуют соли. Как правило, в состав оксидов солеобразующих входят элементы металлов и неметаллов, которые в результате химической реакции с водой образуют кислоты, но при взаимодействии с основаниями образуют соответствующие кислоты и соли.
Несолеобразующие окислы — это такие окислы, которые в результате химической реакции не образуют соли. Примерами таких окислов могут служить оксиды азота и углерода.
Амфотерные оксиды
Оксиды, их классификация и свойства — очень важные в химии понятия. В состав солеобразующих входят оксиды амфотерные.
Амфотерные оксиды — это такие окислы, которые могут проявлять основные или кислотные свойства, в зависимости от условий химических реакций (проявляют амфотерность). Такие окислы образуются переходными металлами (медь, серебро, золото, железо, рутений, вольфрам, резерфордий, титан, иттрий и многие другие). Амфотерные окислы реагируют с сильными кислотами, а в результате химической реакции они образуют соли этих кислот.

Кислотные оксиды
Кислотные оксиды или ангидриды — это такие окислы, которые в химических реакциях проявляют кислотные свойства, а также образуют кислородсодержащие кислоты. Ангидриды всегда образуются типичными неметаллами, а также некоторыми переходными химическими элементами.
Оксиды, их классификация и химические свойства — это важные понятия. Например, у кислотных оксидов химические свойства совершенно отличаются от амфотерных. Например, когда ангидрид взаимодействует с водой, образуется соответствующая кислота (исключение составляет SiO2 — оксид кремния). Ангидриды взаимодействуют с щелочами, а в результате таких реакций выделяется вода и сода. При взаимодействии с основными оксидами образуется соль.

Основные оксиды
Основные (от слова «основание») окислы — это оксиды химических элементов металлов со степенями окисления +1 или +2. К ним относятся щелочные, щелочноземельные металлы, а также химический элемент магний. Основные окислы отличаются от других тем, что именно они способны реагировать с кислотами.
Основные окислы взаимодействуют с кислотами, в отличии от кислотных оксидов, а также с щелочами, водой, другими оксидами. В результате этих реакций, как правило, образуются соли.

Свойства оксидов
Если внимательно изучить реакции различных оксидов, можно самостоятельно сделать выводы о том, какими химическими свойствами оксилы наделены. Общее химическое свойство абсолютно всех оксидов заключается в окислительно-восстановительном процессе.
Но тем не менее, все окислы отличаются друг от друга. Классификация и свойства оксидов — это две взаимосвязанные темы.
Несолеобразующие оксиды и их химические свойства
Несолеобразующие окислы — это такая группа оксидов, которая не проявляет ни кислотных, ни основных, ни амфотерных свойств. В результате химических реакций с несолеобразующими оксидами никаких солей не образуется. Раньше такие оксиды называли не несолеобразующими, а безразличными и индиффирентными, но такие названия не соответсвуют свойствам несолеобразующих оксидов. По своим свойствам эти оксилы вполне способны к химическим реакциям. Но несолебразующих оксидов очень мало, они образованы одновалентными и двухвалентными неметаллами.
Из несолеобразующих оксидов в результате химической реакции могут быть получены солеобразующие оксиды.

Номенклатура
Практически все оксиды принято называть так: слово «оксид», после чего следует название химического элемента в родительном падеже. Например, Al2O3 — это оксид алюминия. На химическом языке этот окисл читается так: алюминий 2 о 3. Некоторые химические элементы, такие как медь, могут иметь несколько степеней оксиления, соответственно, оксиды тоже будут разными. Тогда оксид CuO — это оксид меди (два), то есть со степенью оксиления 2, а оксид Cu2O — это оксид меди (три), который имеет степень оксиления 3.
Но существуют и другие наименования оксидов, которые выделяют по числу в соединении атомов кислорода. Монооксидом или моноокисью называют такие оксиды, в которых содержится всего один атом кислорода. Диоксидами называют такие оксилы, в которых содержится два атома кислорода, о чем сообщается приставка «ди». Триоксидами называют такие оксиды, в которых содержится уже три атома кислорода. Такие наименования как монооксид, диоксид и триоксид, уже устарели, но часто встречаются в учебниках, книгах и других пособиях.
Существуют и так называемые тривиальные названия оксидов, то есть те, которые сложились исторически. Например, CO — это окисл или монооксид углерода, но даже химики чаще всего называют это вещество угарным газом.

Итак, оксид — это соединение кислорода с химическим элементом. Основной наукой, которая изучает их образование и взаимодействия, является химия. Оксиды, их классификация и свойства — это несколько важных тем в науке химия, не поняв которую нельзя понять все остальное. Окислы — это и газы, и минералы, и порошки. Некоторые окислы стоит подробно знать не только ученым, но и обычным людям, ведь они даже могут быть опасны для жизни на этой земле. Окислы — это тема очень интересная и достаточно легкая. Соединения оксидов очень часто встречаются в повседневной жизни.
fb.ru
Оксиды. Химические свойства и способы получения » HimEge.ru
Оксиды — сложные вещества, состоящие из двух элементов, один из которых — атом кислорода в степени окисления -2.
По способности образовывать соли оксиды делят на солеобразующие и несолеобразующие (СО,SiO,NO,N2О). Солеобразующие оксиды, в свою очередь, классифицируют на основные, кислотные и амфотерные.
Основными называются оксиды, которым соответствуют основания, кислотными — оксиды, которым отвечают кислоты. К амфотерным относятся оксиды, проявляющие химические свойства как основных, так и кислотных оксидов.
Основные оксиды образуют только элементы-металлы: щелочные (Li2О, Na2О, К2О, Cs2О, Rb2О), щелочноземельные (CaO, SrO, BaO, RaO) и магний (MgO), а также металлы d-семейства в степени окисления +1, +2, реже +3(Cu2O, CuO, Ag2O, СrO, FeO, MnO, СоO, NiO).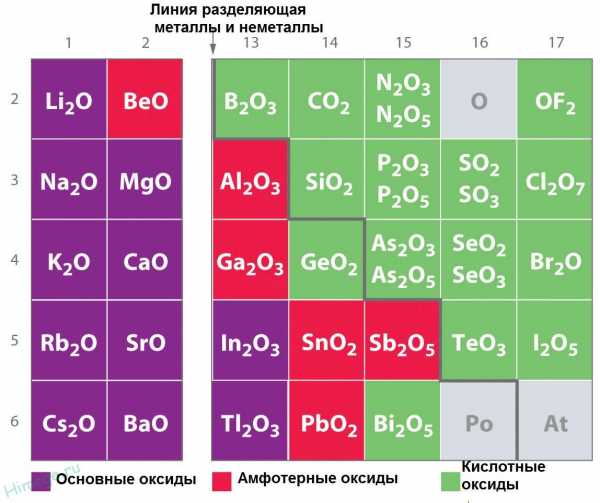 Кислотные оксиды образуют как элементы-неметаллы (СО2, SO2, NO2,Р2O5, Cl2O7), так и элементы-металлы, степень окисления атома металла должна быть +5 и выше(V2O5, СrO3, Mn2O7, MnO3). Амфотерные оксиды образуют только элементы металлы (ZnO, AI2O3, Fe2O3, BeO, Cr2O3, PbO, SnO, MnO2).
Кислотные оксиды образуют как элементы-неметаллы (СО2, SO2, NO2,Р2O5, Cl2O7), так и элементы-металлы, степень окисления атома металла должна быть +5 и выше(V2O5, СrO3, Mn2O7, MnO3). Амфотерные оксиды образуют только элементы металлы (ZnO, AI2O3, Fe2O3, BeO, Cr2O3, PbO, SnO, MnO2).
В обычных условиях оксиды могут находиться в трех агрегатных состояниях: все основные и амфотерные оксиды твердые вещества, кислотные оксиды могут быть жидкими (SO3,Сl2O7,Mn2O7), газообразными (CO2, SO2, NO2) и твердыми (P2O5, SiO2). Некоторые имеют запах (NO2, SO2), однако большинство оксидов запаха не имеют. Одни оксиды окрашены: бурый газ NO2, вишнево-красный CrO3, черные CuO и Ag2O, красные Cu2O и HgO, коричневый Fe2O3, белые SiO2, Аl2O3 и ZnO, другие — бесцветные (H2O, CO2, SO2).
Большинство оксидов устойчивы при нагревании; легко разлагаются при нагревании оксиды ртути и серебра. Основные и амфотерные оксиды имеют немолекулярное строение, для них характерна кристаллическая решетка ионного типа. Большинство кислотных оксидов вещества молекулярного строения (одно из немногих исключений — оксид кремния (IV), имеющий атомную кристаллическую решетку).

Химические свойства оксидов

Al2O3+6KOH+3H2O=2K3[Al(OH)6] — гексагидроксоалюминат калия;
ZnO+2NaOH+H2O=Na2[Zn(OH)4] — тетрагидроксоцинкат натрия;
Смотрите также:
Основные оксиды — получение и химические свойства
Кислотные оксиды — получение и химические свойства
Химические свойства амфотерных оксидов
Задания 8 ЕГЭ по химии тест онлайн
himege.ru
