Урок химии 8 класс «Простые и сложные вещества. Относительная атомная масса.» + презентация
Групповая работа «Простые и сложные вещества» находят характеристики данных групп соединений и составляют кроссворд; (§ 7 стр 17)
— Состав простых и сложных веществ можно выразить химической формулой.
Состав простых и сложных веществ выражают при помощи химических формул.
Простые вещества – вещества, образованные атомами одного химического элемента.
Ne, Ar, O2, Br2, I2, O3, P4, S8
(Одноатомные простые вещества – молекулы инертных газов; двухатомные – молекулы водорода, кислорода, хлора, брома, иода; трехатомные – озона, четырехатомные – фосфора и т.д.)
Названия простых веществ часто совпадают с названием ХЭ, атомами которых они образованы.
Простые вещества характеризуются определенными физическими свойствами (агрегатным состоянием, цветом, плотностью). Работа учащихся с коллекциями металлов и выданными веществами.
Сложные вещества (химические соединения) – это вещества, образованные атомами разных химических элементов, связанных между собой.
H2O, C6H12O6, NaCl, KMnO4, CO2, CO
(вода, глюкоза, хлорид натрия — поваренная соль, перманганат калия – марганцовка, углекислый газ, угарный газ). Демонстрация моделей молекул сложных веществ.
Сложные вещества характеризуются определенными физическими свойствами.
По ходу объяснения целесообразно составить вместе с учащимися схему для наглядного представления и обобщения материала (составление кластера)
Обмениваются кроссвордами и разгадывают, возвращают и оценивают работу группы.
— игра «Да-нет»
1. Каковы формы существования химического элемента?
2. Отличаются ли простые вещества от сложных веществ?
3. Сложные вещества состоят из одного вида атомов?
4. Состав вещества из одного вида атомов – это простое вещество?
5. Возможно ли по названию вещества определить его принадлежность к простым или сложным?
6. Возможно ли по химической формуле определить принадлежность вещества к сложным или простым?
«Инсерт» работа с учебником.
Обратная связь – исследовательская беседа о новых формулах и решении задач.(§ 9,10)
«Корзина идей и понятий»
1) Что вы знаете о том, что такое относительная атомная и относительная молекулярная массы?
2) Запишите каждый в тетради, что вы об этом знаете.(1 мин)
3)Обсуждение в группе. Есть ли совпадения и почему разногласия.
4) Каждая группа называет одно понятие, которое они считают наиболее важным, записывают на стикер и помещают в корзину идей.
5)Все ошибки исправляются по мере освоения информации
Химическая формула – это условная запись состава вещества посредством химических знаков и индексов.
Индекс – это маленькая цифра справа внизу от химического знака элемента, которая показывает число атомов данного элемента в молекуле.
Перед формулами могут стоять и большие цифры. Это коэффициенты. Коэффициенты могут указывать как на число молекул, так и на число атомов, смотря какая запись идет позади него.
Относительная атомная масса (Аr) элемента есть отношение массы атома данного элемента к 1/12 массы атома углерода; это безразмерная величина.
Например: Аr(Н2) = 1 · 2 = 2
Аr(S) = 32
Аr(Сl2 ) = 35,5 · 2 = 71
Относительная молекулярная масса (Мr) вещества представляет собой сумму относительных атомных масс элементов, образующих данное вещество.
Относительная молекулярная масса вещества равна сумме относительных атомных масс атомов, входящих в состав молекулы с учетом их индексов.
AxByCz где A, B, C — знаки Эl x, y, z – количество атомов этих Эl
Mr = Ar(A)*X + Ar(B)*Y + Ar(C)*Z
kopilkaurokov.ru
Презентация по химии для учащихся 8 класса по теме: «Простые и сложные вещества»

Урок №10 03.10.17 8-А,Б класс
Тема. Простые и сложные
вещества.

Задание 1.
- С.32 учебника
- СО2 – углекислый газ — вещество……, а
- SiO 2 – песок — вещество……..
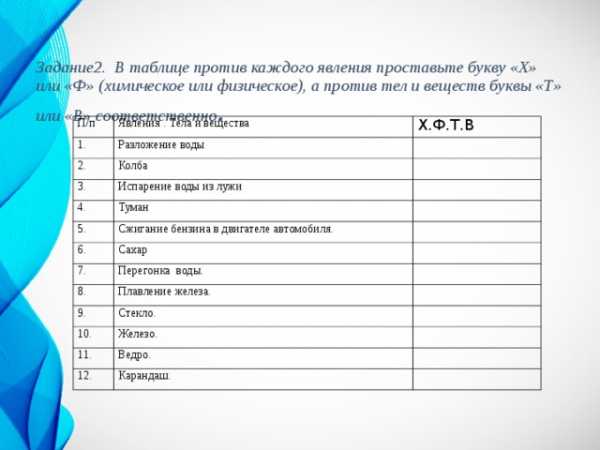
Задание2. В таблице против каждого явления проставьте букву «Х» или «Ф» (химическое или физическое), а против тел и веществ буквы «Т» или «В» соответственно .
П/п
Явления . Тела и вещества
1.
Х.Ф.Т.В
Разложение воды
2.
Колба
3.
Испарение воды из лужи
4.
Туман
5.
6.
Сжигание бензина в двигателе автомобиля.
Сахар
7.
Перегонка воды.
8.
Плавление железа.
9.
Стекло.
10.
Железо.
11.
Ведро.
12.
Карандаш.
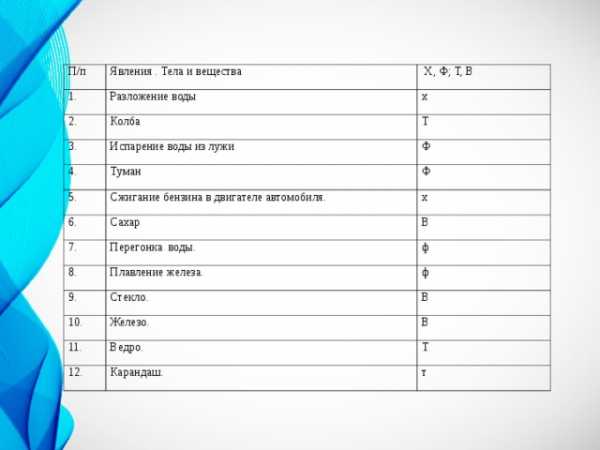
П/п
1.
Явления . Тела и вещества
Х, Ф; Т, В
Разложение воды
2.
х
Колба
3.
Т
Испарение воды из лужи
4.
Ф
Туман
5.
6.
Ф
Сжигание бензина в двигателе автомобиля.
Сахар
х
7.
В
Перегонка воды.
8.
ф
Плавление железа.
9.
ф
Стекло.
10.
11.
В
Железо.
В
Ведро.
12.
Т
Карандаш.
т

Задание 3. Дайте определения понятиям: «молекула» , «ионы», «атом», «кристаллическая решетка вещества».

Задание 4.Определите состав: H 2 O, O 2 , CO 2, Cl 2.
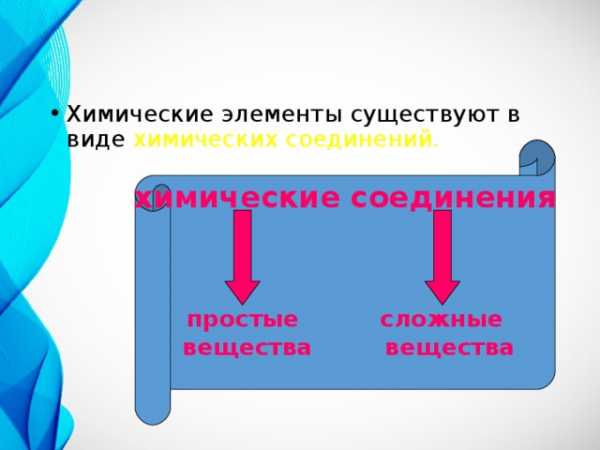
- Химические элементы существуют в виде химических соединений.
химические соединения
простые сложные
вещества вещества
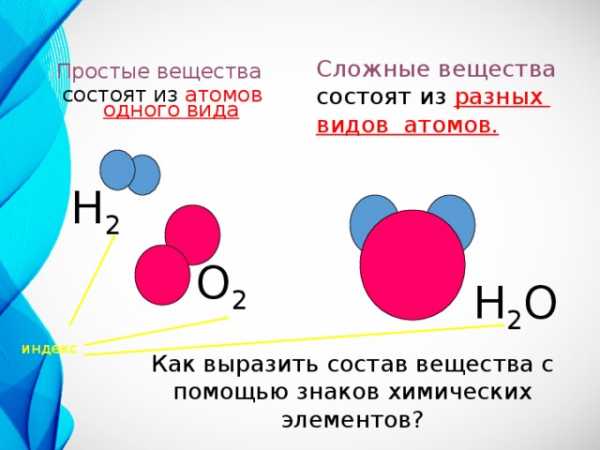
Сложные вещества состоят из разных
видов атомов.
Простые вещества
состоят из атомов одного вида
Н 2
Н 2 О
индекс
Как выразить состав вещества с помощью знаков химических элементов?

Запись качественного и количественного состава вещества с помощью знаков хим. элементов называется ХИМИЧЕСКАЯ ФОРМУЛА

Молекулярные химические
соединения независимо
от способа их получения
имеют постоянный
состав и свойства.
Например, состав воды в атмосфере, Мировом океане, ледниках и живых организмах отражает формула h3O. СО2
Имеют постоянный качественный и количественный состав не зависимо от способа их получения- закон постоянства состава. 1797г.
Ж.Пруст (1754-1826)

Запишите качественный и количественный состав для форммул:
MgO
К 2 S

Задание .
Ниже перечисленные вещества разделите на простые и сложные:
SO 2 K, Cu, N 2 , O 2 , Cl 2 , Al 2 O 3 , H 2 , Br 2 , NaCl, MgSO 4 , KOH, Fe, Au, Ag, ZnO, LiI, KF, Cr, SO 3

Задание. Ниже перечисленные вещества, разделите на простые и сложные: SO 2 K , Cu , N 2 , O 2 , Cl 2 , Al 2 O 3 , H 2 , Br 2 , NaCl , MgSO 4 , KOH , Fe , Au , Ag , ZnO , LiI KF , Cr , SO 3



Практическое задание:

- Домашнее задание. §9-10 выуч. определения , тестовые задания с.36. с. 39

- Что нового узнали на уроке?
- Какие вопросы вызвали затруднение?
- Какие знания вы сегодня приобрели?
multiurok.ru
Урок на тему «Простые и сложные вещества». 8-й класс, химия
Разделы: Химия
Цель урока:
- Знать определение атома, молекулы, простого и сложного вещества.
- Уметь различать простые и сложные вещества; смеси и сложные вещества.
- Знать отличие смеси и сложного вещества.
Оборудование: Шаровые модели молекул воды, Штатив с пробирками, реактивы (железо, вода, сера, карбонат кальция).
демонстрация соединение железа с серой.
Лабораторные опыты: Ознакомление с образцами простых и сложных веществ.
Ход урока
1. Повторение и обобщение знаний.
1) Проверка домашнего задания:
Упражнение упр. 8, 9, 10, на стр. 22. (Взаимопроверка).
2) Выполните тестовое задание. Подберите соответствие: термин – определение понятия.
(Приложение №1). Самопроверка.
1 вариант:
А) фильтрованием————————————————————————————-
Б) отстаиванием—————————————————————————————-
2 вариант:
А) выпариванием—————————————————————————————
Б) дистилляцией——————————————————————————————
2. Изучение нового материала
1. Фронтальный опрос:
Какие виды смесей вам известны?
Какие смеси называются однородными, неоднородными?
Какое вещество называется чистым? Что такое «вещество»? Из курса физики вам известно, что многие вещества состоят из молекул.
Дайте определения понятиям «молекула» и «атом». (Приложение №2).
Рассмотрите шаровые модели некоторых веществ, укажите состав данного вещества. Чем молекула озона отличается от молекулы оксида кальция? Чем водород отличается от соляной кислоты? Учащиеся могут ответить, что молекулы водорода, фосфора, азота образованы атомами одного вида. – Простые вещества.
Вещества соляная кислота, оксид кальция, метан, оксид натрия образованы атомами разного вида. Сложные вещества.
Выпишите в словарь новые понятия, со страниц 15,16.
Заполните схему:
2. Лабораторный опыт.
Инструкция к лабораторному опыту.
- Прослушайте инструктаж по охране труда.
- Выполните опыт: рассмотрите выданные вам образцы веществ: железо, вода, сера, карбонат кальция.
- Опишите их физические свойства.
- Оформите результаты в таблицу. (Приложение №3).
| Физические свойства | железо |
вода |
сера |
Карбонат кальция |
Агрегатное состояние (твердое, жидкое, газообразное) |
|
|
|
|
Цвет |
|
|
|
|
Блеск |
|
|
|
|
Растворимость в воде |
|
|
|
|
Хрупкость (пластичность) |
|
|
|
|
Теплоэлектропроводность |
|
|
|
|
Температура кипения, температура плавления. |
|
|
|
|
Простое (сложное) вещество |
|
|
|
|
Вывод к работе: о физических свойствах веществ, о составе простых и сложных веществах.
3. Чем смесь отличается от сложного вещества.
Напомнив, как готовиться смесь железа и серы, учитель отмечает, что сера — простое вещество, молекулы ее состоят из одинаковых атомов одного вида, железо тоже простое вещество, состоящее из одинаковых атомов другого вида. Можно ли назвать то, что получилось при перемешивании порошков, сложным веществом? Разделим смесь при помощи магнита. После обсуждения делаем вывод, что смесь можно разделить физическими способами и получить чистые вещества, из которых она состояла. Нагреваем железо с опилками. Образовалось новое вещество, которое невозможно разделить, не действует на него магнит. Сульфид железа – это чистое сложное вещество.
Таблица №1. Сравнение смесей и сложных веществ.
Смесь |
Сложное вещество |
1. Вещества сохраняют свои свойства. |
1. Свойства исходных веществ не сохраняются. |
2. Вещества можно разделить физическими методами. |
2. Сложное вещество нельзя разделить физическими методами. |
3. Количественный состав может быть произвольным. |
3. Количественный состав химического соединения всегда одинаков независимо от места нахождения и способа получения. |
3. Закрепление.
1. Выпишите простые вещества: сталь, чугун, железо, морская вода, дистиллированная вода, алюминий, лимонад, спиртовая настойка йода, нефть, глюкоза, поваренная соль, воздух, кислород, бронза.
2. Простые вещества состоят из атомов … химического элемента.
Сложные вещества состоят из атомов … Химических элементов. Сложные вещества иначе называют … .
Простое вещество, в отличие от сложного, нельзя … .
3. Чем морская вода отличается от дистиллированной воды?
4. Сравнить смесь со сложным веществом.
Вопросы и задания |
Вещества |
|
вода |
Водород и кислород (смесь) |
|
Можно ли разделить эти вещества на более простые компоненты. Не разрушая молекул? Почему? |
|
|
Сохраняется ли способность молекул кислорода поддерживать горение? Почему? |
|
|
Рефлексия и подведение итогов.
Что нового узнали на уроке?
Какие вопросы вызвали затруднение?
Какие знания вы сегодня приобрели?
Домашнее задание: Читать стр. 15-17.
Выполнить упражнения 11-13 на стр.22.
Литература: Г.Е. Рудзитис, Ф.Г. Фельдман. «Химия 8 класс».
7.06.2009
xn--i1abbnckbmcl9fb.xn--p1ai
Презентация — Простые и сложные вещества
Текст этой презентации
Слайд 1
Простые и сложные вещества
Мидакова Наталья Васильевна учитель I квалификационной категории
МБОУ «Красночетайская СОШ» Красночетайский район Республика Чувашия
Слайд 2
Содержание
Опорная схема
Алгоритм определения веществ
Проверь себя
Классификация
Строение молекулы
Физические свойства
Простые вещества
Химический словарик
Отличие между сложными и простыми вещ-ми
Классификация
Строение и свойства
Аллотропия
Сложные вещества
Источники
Отличие между сложными вещ-ми и смесями
Приложение
Слайд 3
Классификация простых веществ
Простые вещества
Металлы
Неметаллы
Na K Au Fe Cu
N2 O2 h3 Cl2 P S
Главная
Слайд 4
Металлы Неметаллы
Немолекулярное строение Молекулярное строение
Немолекулярное строение
Графит
Кислород
Сера
Медь
Железо
Главная
Слайд 5
Металлы Неметаллы
Кислород О
Углерод С
Кристаллическая
Пластическая
Олово Sn
Серое α-форма
Белое (β-форма)
Сера S
Главная
Слайд 6
Металлы Неметаллы
1. Агрегатное состояние
Тв. Hg – жидкий металл
– O2, N2, h3
– I2, C, Si
– Br2
2. Цвет
От серебристо-белого до темно-серого. Au (желтый) и Cu (красно-коричневый).
3. Электропроводность
г
тв
ж
Электропроводны
Диэлектрики
Главная
Слайд 7
Металлы Неметаллы
От серебристо-белого до серого
бериллий
германий
литий
золото
графит
мышьяк
алмаз
кремний
сера
фосфор
Главная
медь
Слайд 8
Металлы Неметаллы
4. Твердость / мягкость
Пластичные (Au, Ag, Cu, Al и др.), кроме. Sn (серое).
Хрупкие (S, уголь, I2, др.) При ударе рассыпаются.
5. Пластичность/ хрупкость
Существуют твердые (Cr, Fe) и мягкие (Au, Na, K).
Существуют твердые (Салмаз, Si) и мягкие (Cграфит).
6. Температура плавления
Самая высокая:
Tпл.(W)= +3380°С
Самая низкая?
Tпл.(Hg)= — 38,8°С
Высокая:
Tпл.(алмаза)= +3600°С
Низкая:
Tпл.(азота)= -210°С
Главная
Слайд 9
Главная
Сложные вещества
Оксиды
Соли
Оксид кальция СаО
Хлорид натрия NaCl
(Поваренная соль)
Кислоты
Гидроксид натрия NaОН
Неорганические
Органические
Основания
(Гидроксиды)
Серная кислота h3SO4
Фенол
Жиры
Полиэтилен
Уксусная кислота
Слайд 10
Сложные вещества состоят из атомов разных химических элементов
В химических реакциях могут разлагаться с образованием нескольких других веществ
Главная
Слайд 11
Вещества
Простые
Состоят из атомов одного вида
Состоят из атомов разного вида
В химических реакциях не могут разлагаться с образованием нескольких других веществ
В химических реакциях могут разлагаться с образованием нескольких других веществ
О2 Н2 Cl2 S P F2 Si
h3O NaCl CuSO4 HCl
Главная
Сложные
Слайд 12
Сложные вещества Смесь
1.Образуется с помощью химической реакции (синтез из простых веществ) 2. Свойства простых веществ, из которых получено сложное вещество, в последнем не сохраняются
3. Элементы, входящие в состав сложного вещества, всегда находятся в определенном массовом отношении
4. Может быть разложено на составные части (элементы в виде простых веществ) только с помощью химической реакции (анализ) 1. Образуется с помощью физического процесса (смешивание чистых веществ)
2. Свойства чистых веществ, из которых составлена смесь, остаются неизменными
3. Чистые вещества (простые и сложные) могут находиться в смеси в любом массовом соотношении
4. Может быть разделена на составные части (чистые вещества) с помощью физических методов
Главная
Слайд 13
Название вещества
Состоит из одного слова
Состоит из двух слов
Сложное вещество
Название вещества совпадает с названием
химического элемента
Название вещества не совпадает с названием
химического элемента
Простое вещество
Чаще всего сложное
Простое или сложное вещество?
Главная
Слайд 14
Главная
Слайд 15
Ошибка
Ошибка
Ошибка
Молодец
Ошибка
Ошибка
Ошибка
Ошибка
Ошибка
Ошибка
Молодец
Ошибка
Ошибка
Ошибка
Молодец
Хлор
Аммиак
Колодезная вода
Воздух
Лёд
Фосфор
Сера
Смеси
Молодец
Сложные
вещества
Вода
Бор
Кислород
Медь
Хлорид натрия
Кремний
Хром
Веберите правильные ответы
Водород
Алюминий
Главная
Тренажер
Слайд 16
Ошибка
Ошибка
Молодец
Ошибка
Состоят из атомов разных химических элементов
Ошибка
Молодец
Ошибка
Ошибка
Имеют аморфные модификации
Ошибка
Ошибка
Ошибка
Молодец
Смесь
Ошибка
Ошибка
Молодец
Ошибка
Простое вещество
Ошибка
Ошибка
Ошибка
Молодец
Сложное вещество
Главная
Тест
Выберите один правильный ответ
Слайд 17
1. http://www.himhelp.ru/section24/section8/section48/
2. http://ru.wikipedia.org/wiki/Простые вещества
3. http://biolabyrinth.narod.ru/chem/general/basic/chem-bas.htm
Главная
4. http://school-collection.edu.ru/catalog/res/c90b7e4a-ece0-1df5-2e83-66ce2d07ae9d/?from=eb17b17a-6bcc-01ab-0e3a-a1cd26d56d67&interface=themcol
5. http://school-collection.edu.ru/catalog/res/0A22315C-8AAD-C506-5565-CB501F201476/?interface=catalog&class=Array&subject=Array
Интернет ресурсы
1. Бочарова С.И. Занимательные материалы по химии. Издательство Корифей; 2. Габриелян О.С. Химия: 8 кл. – М: Дрофа, 2003; 3. Габриелян О.С., Смирнова Т.В. Изучаем химию в 8 классе. – М: БЛИК и К0, 2004; 4. Еремина Е.А., Еремин В.В, Кузьменко Н.Е. Справочник школьника по химии. М. Дрофа, 1996. 5. Рудзитис Г.Е., Фельдман Ф.Г. Химия 9 кл. -М.: Просвещение, 2007
Литература
CD ресурсы
Виртуальная химическая лаборатория. 9 кл. (CD компания «Новый диск»).
Слайд 18
Главная
Приложение
Слайд 19
Простое вещество Tплавл. Простое вещество Tплавл.
Азот
Алюминий
Барий
Бром
Водород
Вольфрам
Железо
Золото -210ºС
660 ºС
767 ºС
-7,2 ºС
-252,6 ºС
3410 ºС
1535 ºС
1064 ºС Иод
Калий
Кальций
Кислород
Кремний
Медь
Ртуть
Сера 113,5 ºС
63,15 ºС
842 ºС
-182,9 ºС
1415 ºС
1084 ºС
-38,9 ºС
112 ºС
№ Название неметалла Химическая формула неметалла Цвет Агрегатное состояние
Лабораторный опыт
«Свойства простых веществ – металлов и неметаллов»
Внимание: вспомните правила ТБ при обращении с веществами.
Рассмотрите выданные вам в пробирках и чашках Петри вещества.
Разделите их на 2 группы: металлы и неметаллы
Обратите внимание на цвет, наличие металлического блеска у металлов. Заполните таблицу 1.
Возьмите полоску алюминиевую ложку, один конец нагрейте в пламени спиртовки. Заметьте время, через сколько секунд вы почувствуете ее нагревание. О чем это свидетельствует?
Испытайте отношение металлов к воде. Опустите гранулу алюминия и цинка в воду. Что наблюдаете?
Пользуясь приведенной ниже таблицей, проанализируйте температуры плавления металлов.
Рассмотрите неметаллы. Что можно сказать об их цвете, агрегатном состоянии. Поместите немного серы в воду. Что наблюдаете? Заполните таблицу 2.
Пользуясь приведенной ниже таблицей, проанализируйте температуры плавления неметаллов
Сделайте вывод о различиях в свойствах простых веществ металлов и неметаллов.
Таблица 1.
Таблица 2.
Главная
Слайд 20
Определите местоположение неметаллов в периодической системе.
Неметаллов больше или меньше в периодической системе?
Почему неметаллы относят к простым веществам?
Металлы Металлы Неметаллы Неметаллы
Химический знак Название элемента Химический знак Название элемента
Карточки-задания
Вопросы 1 группе.
При помощи периодической таблицы, ответьте на вопросы:
Вопросы 2 группе.
При помощи периодической таблицы, ответьте на вопросы: Вопросы 3 группе.
Даны следующие химические элементы: Cu, Sn, Au, Ag, Cl, Br, Pb , H, N, Ni, As, He, Fe. 1.Найдите среди них металлы и неметаллы. 2.Укажите название элементов 3.Результаты занесите в таблицу.
Главная
Слайд 21
Главная
Физкультминутка Представьте, что мы высадились на берег, и идем по пустыне. Под ногами зыбучий песок, и мы вязнем в нем по щиколотку. (музыка)
А теперь представьте, что песок нагрелся до такой степени, что ноги просто обжигает, необходимо как можно быстрее пройти этот путь. Музыка.
Опять препятствие, на нашем пути встретились высыхающее болото, но можно замочить ноги. Передвигаемся по кочкам. Скорей, скорей. Музыка.
Вдруг кочки закончились, наши ноги стали вязнуть в болоте, нам трудно передвигаться, но мы справляемся и с этим испытанием. Музыка.
Перед нами река. Давайте посмотрим, что же там за этим мостиком. Идем по деревянному мосту. Ой, он старый, шатается. Осторожно, не упадите в пропасть, держите равновесие.
Музыка. Какая красота. Мы попали в загадочный лес, в котором поют птицы, лес шумит. Можно немного отдохнуть. Звучит тихая музыка.
Молодцы. Открыть страничку с сайта http://priroda.inc.ru/relax/relax24.html с шумом моря. (Включить звук и настроить регуляторы).
Слайд 22
Главная
Опорная схема
Слайд 23
Главная
Вариант 1.
1. В химической лаборатории нельзя:
1) проводить опыты;
2) смешивать жидкости;
3) принимать пищу;
4) работать в халате.
2. Жидкости фильтруются с помощью:
1) выпарительной чашки и спиртовки;
2) воронки и фильтровальной бумаги;
3) ступки и пестика;
4) кристаллизатора и стеклянной палочки.
3. Знак химического элемента железо:
1) F; 2) Fе; 3) Gе; 4) Cu.
4. Атомы различных элементов различаются:
1) только по массе;
2) только по цвету;
3) по массе и по цвету;
4) по массе и по объему.
5. Для разделения несмешивающихся жидкостей используют:
1) делительную воронку;
2) обычную воронку;
3) ступку и пестик;
4) круглодонную колбу и холодильник.
Проверка знаний. Тест
Задание. Выберите один правильный ответ.
Слайд 24
6. Вещество – это:
1) стакан; 2) гвоздь;
3) железо; 4) конверт.
7. Смесь представляет собой:
1) вода; 2) сахар;
3) соляная кислота; 4) медь.
8. Моль – это:
1) число частиц, содержащихся в 1 г любого вещества;
2) 1/12 часть массы изотопа углерода 12С;
3) единица измерения физической величины – количества вещества;
4) число молекул, содержащихся в 22,4 л газа при нормальных условиях (н.у.).
9. Если воду добавить к серной кислоте, то:
1) эти жидкости не будут смешиваться;
2) произойдет сильное охлаждение раствора;
3) возможно вскипание и разбрызгивание раствора серной кислоты;
4) серная кислота вступит в реакцию обмена с водой.
10. Химический элемент – это:
1) разновидность атомов;
2) тип вещества;
3) класс молекул;
4) то же, что и простое вещество.
Главная
Слайд 25
Главная
Вариант 2
1. В химической лаборатории можно:
1) употреблять пищу;
2) склоняться для лучшего обзора над приборами при проведении опыта;
3) выливать реактивы в раковину;
4) выполнять опыты согласно инструкции.
2. Вещества в химической лаборатории растирают с помощью:
1) ступки и пестика;
2) стеклянной палочки и кристаллизатора;
3) любых подручных средств;
4) выпарительной чашки и штатива.
3. Знак химического элемента гелий:
1) Ge; 2) He; 3) Ga; 4) Hg.
4. Газообразные вещества, такие, как кислород, азот, водород, состоят из мельчайших частиц, называемых:
1) атомы; 2) молекулы;
3) химические элементы; 4) ионы.
5. Для разделения смешивающихся жидкостей используют:
1) круглодонную колбу, холодильник, приемник, штатив, электрическую плитку;
2) делительную воронку;
3) обычную воронку, фильтровальную бумагу и стакан;
4) плоскодонную колбу, дефлегматор, холодильник, спиртовку, приемник.
Слайд 26
6. Телом является:
1) графит; 2) алмаз;
3) бумага; 4) гвоздь.
7. Смесь, которую можно разделить с помощью магнита:
1) сера и сахар;
2) медь и стекло;
3) песок и мел;
4) медные и стальные опилки.
8. Одинаковые количества вещества (в моль) различных веществ имеют также одинаковую:
1) массу:
2) объем;
3) число структурных единиц;
4) число атомов.
9. Емкости с кислотой вместимостью более 3 л категорически запрещено переносить в:
1) металлическом ведре;
2) руках;
3) корзине с прокладками из поролона или стружек;
4) пластмассовом ведре.
10. Химический элемент – это:
1) то же, что и простое вещество;
2) наименьшая химически неделимая частица;
3) то, из чего состоит вещество;
4) вид атомов.
Главная
Слайд 27
Химический словарик
Аллотропия
Смесь
Простое вещество
Сложное вещество
Химическое соединение
Главная
Слайд 28
Тест
«Простые и сложные вещества»
Образовательный портал «Мой университет» Факультет «Реформа образования»
Мидакова Наталья Васильевна учитель I квалификационной категории
МОУ «Красночетайская СОШ» Красночетайский район Республика Чувашия
Выход
Старт
Слайд 29
По моделям молекул определите простое вещество
Задание. Выберите один правильный ответ.
Слайд 30
2
По кристаллической решетке определите сложное вещество
Слайд 31
Выберите простое вещество
1. h3O
2. h3
3. h3O2
4. Nh4
0
Слайд 32
1. h3O
2. h3
3. h3O2
4. Nh4
1
Выберите простое вещество
Слайд 33
1. h3O
2. h3
3. h3O2
4. Nh4
2
Выберите простое вещество
Слайд 34
1. h3O
2. h3
3. h3O2
4. Nh4
3
Выберите простое вещество
Слайд 35
1. азот
2. кислород
3. молоко
4. хлор
0
Смесью является:
Слайд 36
1. азот
2. кислород
3. молоко
4. хлор
1
Смесью является:
Слайд 37
1. азот
2. кислород
3. молоко
4. хлор
2
Смесью является:
Слайд 38
1. кислород
2. азот
3. молоко
4. хлор
3
Смесью является:
Слайд 39
1. кислород
2. азот
3. молоко
4. хлор
4
Смесью является:
Слайд 40
1. сложное вещество
2. аллотропия
3. химическое соединение
4. молекула
0
Способность атомов химических элементов образовывать несколько простых веществ с разными свойствами называется
Слайд 41
1. сложное вещество
2. аллотропия
3. химическое соединение
4. молекула
1
Способность атомов химических элементов образовывать несколько простых веществ с разными свойствами называется
Слайд 42
1. сложное вещество
2. аллотропия
3. химическое соединение
4. молекула
2
Способность атомов химических элементов образовывать несколько простых веществ с разными свойствами называется
Слайд 43
1. сложное вещество
2. аллотропия
3. химическое
соединение
4. молекула
3
Способность атомов химических элементов образовывать несколько простых веществ с разными свойствами называется
Слайд 44
1. сложное вещество
2. аллотропия
3. химическое
соединение
4. молекула
4
Способность атомов химических элементов образовывать несколько простых веществ с разными свойствами называется
Слайд 45
1. сложное вещество
2. аллотропия
3. химическое соединение
4. молекула
5
Способность атомов химических элементов образовывать несколько простых веществ с разными свойствами называется
Слайд 46
1. отдельные атомы
2. молекула
3. сложное вещество
4. химическая связь
0
Что изображено на рисунке?
Слайд 47
1. отдельные атомы
2. молекула
3. сложное вещество
4. химическая связь
1
Что изображено на рисунке?
Слайд 48
1. отдельные атомы
2. молекула
3. сложное вещество
4. химическая связь
2
Что изображено на рисунке?
Слайд 49
1. отдельные атомы
2. молекула
3. сложное вещество
4. химическая связь
3
Что изображено на рисунке?
Слайд 50
1. отдельные атомы
2. молекула
3. химическая связь
4. сложное вещество
4
Что изображено на рисунке?
Слайд 51
1. отдельные атомы
2. молекула
3. химическая связь
4. сложное вещество
5
Что изображено на рисунке?
Слайд 52
1. отдельные атомы
2. молекула
3. химическая связь
4. сложное вещество
6
Что изображено на рисунке?
Слайд 53
1. иона
2. сложного вещества
4. молекулы
3. атома
0
Какая модель изображена на рисунке?
водород
Слайд 54
1. иона
2. сложного вещества
4. молекулы
3. атома
1
Какая модель изображена на рисунке?
водород
Слайд 55
1. иона
2. сложного вещества
4. молекулы
3. атома
2
Какая модель изображена на рисунке?
водород
Слайд 56
1 иона
2. сложного вещества
4. молекулы
3. атома
3
Какая модель изображена на рисунке?
водород
Слайд 57
1. иона
2. сложного вещества
4. молекулы
3. атома
4
Какая модель изображена на рисунке?
водород
Слайд 58
1. иона
2. сложного вещества
4. молекулы
3. атома
5
Какая модель изображена на рисунке?
водород
Слайд 59
1. иона
2. сложного вещества
4. молекулы
3. атома
6
Какая модель изображена на рисунке?
водород
Слайд 60
1. иона
2. сложного вещества
4. молекулы
3. атома
7
Какая модель изображена на рисунке?
водород
Слайд 61
Начало
ОТЛИЧНО
Выход
Слайд 62
ХОРОШО
Выход
Начало
Слайд 63
УДОВЛЕТВОРИТЕЛЬНО
Выход
Начало
Слайд 64
ВАША ОЦЕНКА
Выход
Попробуйте снова
Слайд 65
Аллотро́пия (от др.-греч. αλλος — «другой», τροπος — «поворот, свойство») — существование одного и того же химического элемента в виде двух и более простых веществ, различных по строению и свойствам: так называемых аллотропических модификаций или аллотропических форм.
Модификации фосфора
Главная
Слайд 66
Просты́е вещества́ — вещества, состоящие исключительно из атомов одного химического элемента (в отличие от сложных веществ). Являются формой существования химических элементов в свободном виде, или, иначе говоря, элементы, не связанные химически ни с каким другим элементом, образуют простые вещества. Известно свыше 400 разновидностей простых веществ.
Алмаз
Графит
Главная
Слайд 67
Сложные вещества — это химические вещества, которые состоят из атомов двух или более химических элементов. Сложными веществами являются большинство неорганических веществ и все органические.
Вода
Галит
Сильвинит
Главная
Слайд 68
Смесь — Продукт смешения, механического соединения каких-либо веществ. Например: горючая смесь, гелиево-кислородная смесь.
Молоко
Воздух
Главная
Слайд 69
Хими́ческое соедине́ние— сложное вещество, состоящее из химически связанных атомов двух или нескольких элементов. Состав химического соединения записывается в виде химических формул, а строение часто изображается структурными формулами.
Главная
topslide.ru
Презентация по химии «Атомы и молекулы. Простые и сложные вещества»

Тема: «Атомы и молекулы. Простые и сложные вещества»
Д/з
§6
Стр. 20.
№ 9

Проверка домашнего задания:
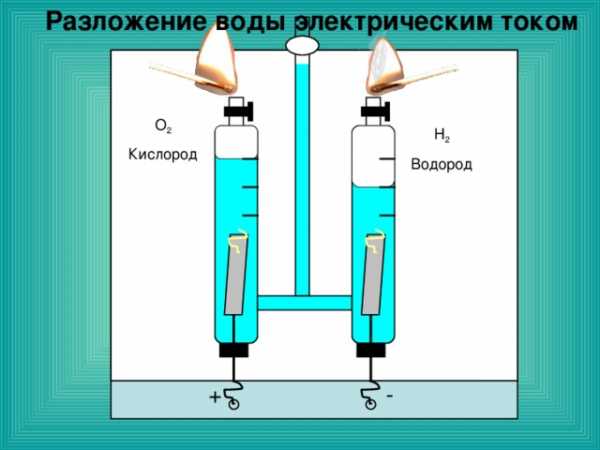
Разложение воды электрическим током
2
2
—
+
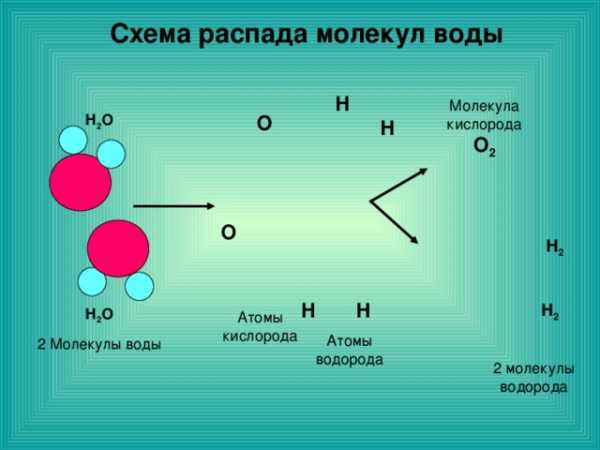
Схема распада молекул воды
Н Н
Н Н
О 2
О
О
Н 2 О
Н 2 О
Н 2
Н 2
Молекулы
Атомы
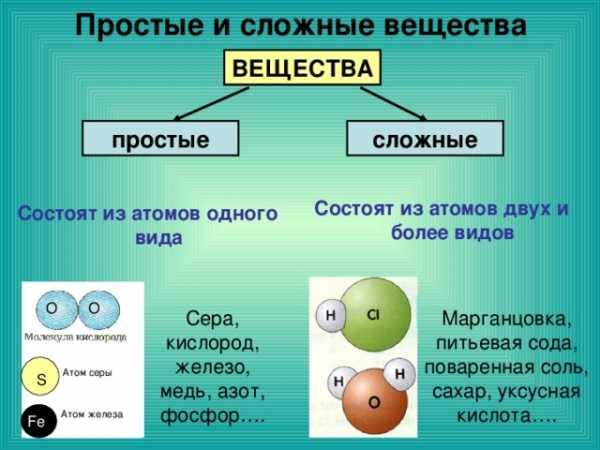
Простые и сложные вещества
ВЕЩЕСТВА
ВЕЩЕСТВА
простые
сложные
Состоят из атомов двух и более видов
Состоят из атомов одного вида
Сера, кислород, железо, медь, азот, фосфор….
Марганцовка, питьевая сода, поваренная соль, сахар, уксусная кислота….
Атом серы
S
Атом железа
Fe
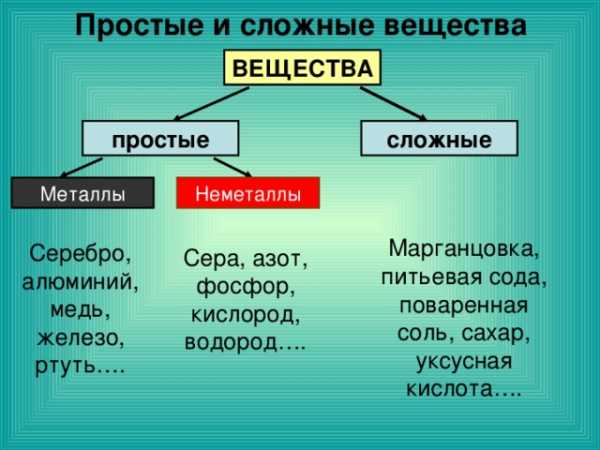
Простые и сложные вещества
ВЕЩЕСТВА
ВЕЩЕСТВА
сложные
простые
Металлы
Неметаллы
Марганцовка, питьевая сода, поваренная соль, сахар, уксусная кислота….
Серебро, алюминий, медь, железо, ртуть….
Сера, азот, фосфор, кислород, водород….

Химические соединения
химическими соединениями
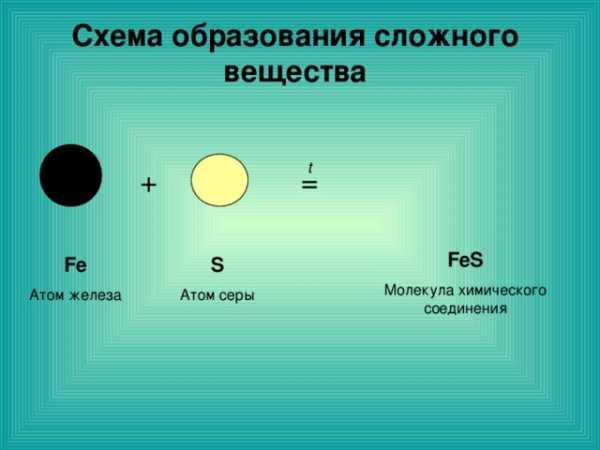
Схема образования сложного вещества
t
+
=
FeS
Молекула химического соединения
Fe
Атом железа
S
Атом серы
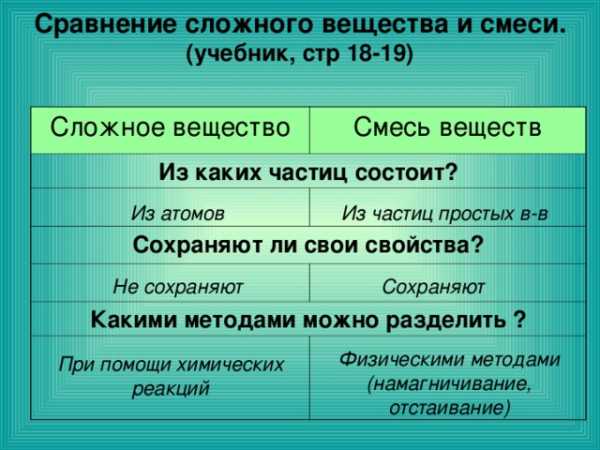
Сравнение сложного вещества и смеси. (учебник, стр 18-19)
Сложное вещество
Смесь веществ
Из каких частиц состоит?
Сохраняют ли свои свойства?
Какими методами можно разделить ?
Из атомов
Из частиц простых в-в
Не сохраняют
Сохраняют
Физическими методами (намагничивание, отстаивание)
При помощи химических реакций

Задание:
- Что такое атом? Почему нельзя говорить «атом воды», «атом сахара»?
- Что такое молекула?
- Объясните процесс химической реакции используя понятия «атом» и «молекула», на примере разложения воды.
- Дайте определение «простого вещества».
Примеры.
- Дайте определение «сложного вещества». Примеры.
- Чем отличается химическое соединение от смеси?
videouroki.net
Презентация по химии на тему «Простые и сложные вещества) (8 класс)
Инфоурок › Химия › Презентации › Презентация по химии на тему «Простые и сложные вещества) (8 класс)
Описание презентации по отдельным слайдам:
1 слайд Описание слайда:
Описание слайда:Урок химии 8 класс разработала учитель химии Сова С.Г.
2 слайд Описание слайда:
Описание слайда:Тема урока: Простые и сложные вещества
3 слайд Описание слайда:
Описание слайда:Цель урока: Сформировать представления о простых и сложных веществах, химическом элементе как совокупности атомов одного вида Задачи: образовательные: — научить различать понятия: «простое вещество», «сложное вещество», «химический элемент»; — знать отличия между металлами и неметаллами. развивающие: — развивать умения определять по формулам веществ простые и сложные вещества. воспитательные: — формировать мировоззрение, соответствующее современному уровню развития науки; — воспитывать коммуникативную компетентность и уважение к иной точке зрения.
4 слайд Описание слайда:
Описание слайда:Химические элементы существуют в виде химических соединений Простые состоят из атомов одного вида Н2 О2 Сложные состоят из разного вида атомов Н2О
5 слайд Описание слайда:
Описание слайда:Как можно выразить состав вещества с помощью знаков химических элементов? Запись качественного и количественного состава вещества с помощью знаков химических элементов называется ХИМИЧЕСКАЯ ФОРМУЛА
6 слайд Описание слайда:
Описание слайда:Простые вещества Немолекулярного Молекулярного строения строения Al – алюминий F 2 — фтор Au – золото Cl 2 — хлор Fe – железо О2 — кислород
7 слайд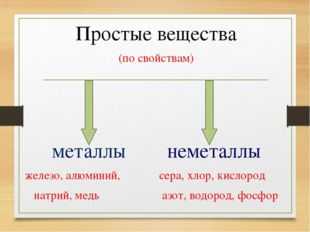 Описание слайда:
Описание слайда:Простые вещества (по свойствам) металлы неметаллы железо, алюминий, сера, хлор, кислород натрий, медь азот, водород, фосфор
8 слайд Описание слайда:
Описание слайда:Плохо проводят теплоту Не проводят электрический ток Обладают хрупкостью Окрашены в разнообразные цвета Бывают при нормальных условиях газообразные, жидкие, твердые. Свойства простых неметаллов
9 слайд Описание слайда:
Описание слайда:Свойства простых веществ — металлов Твердые (исключение – ртуть) Хорошо проводят электрический ток, теплоту Обладают пластичностью Серый, серебристый цвет, блеск (исключение: золото, медь)
10 слайд Описание слайда:
Описание слайда:Проверь себя: 1. Выполни тестовые задания в учебнике на стр. 36. 2.Выпиши в 2 столбика формулы простых и сложных веществ: Cu; MgO; N2; CaO; Br2; HI; Hg; h3O; Fe.
11 слайд Описание слайда:
Описание слайда:Домашнее задание: Выучить п. 9 стр. 33-35, ответить на вопросы 1-2 стр. 36

Курс повышения квалификации

Курс профессиональной переподготовки
Учитель химии

Курс повышения квалификации

Найдите материал к любому уроку,
указав свой предмет (категорию), класс, учебник и тему:
Выберите категорию: Все категорииАлгебраАнглийский языкАстрономияБиологияВсеобщая историяГеографияГеометрияДиректору, завучуДоп. образованиеДошкольное образованиеЕстествознаниеИЗО, МХКИностранные языкиИнформатикаИстория РоссииКлассному руководителюКоррекционное обучениеЛитератураЛитературное чтениеЛогопедияМатематикаМузыкаНачальные классыНемецкий языкОБЖОбществознаниеОкружающий мирПриродоведениеРелигиоведениеРусский языкСоциальному педагогуТехнологияУкраинский языкФизикаФизическая культураФилософияФранцузский языкХимияЧерчениеШкольному психологуЭкологияДругое
Выберите класс: Все классыДошкольники1 класс2 класс3 класс4 класс5 класс6 класс7 класс8 класс9 класс10 класс11 класс
Выберите учебник: Все учебники
Выберите тему: Все темы
также Вы можете выбрать тип материала:
Общая информация
Номер материала: ДБ-320501
ВНИМАНИЮ ВСЕХ УЧИТЕЛЕЙ: согласно Федеральному закону N273-ФЗ «Об образовании в Российской Федерации» педагогическая деятельность требует от педагога наличия системы специальных знаний в области обучения и воспитания детей с ОВЗ. Поэтому для всех педагогов является актуальным повышение квалификации по этому направлению!Дистанционный курс «Обучающиеся с ОВЗ: Особенности организации учебной деятельности в соответствии с ФГОС» от проекта «Инфоурок» даёт Вам возможность привести свои знания в соответствие с требованиями закона и получить удостоверение о повышении квалификации установленного образца (72 часа).
Подать заявку на курс
Похожие материалы
Вам будут интересны эти курсы:
Оставьте свой комментарийinfourok.ru
Презентация по химии для учащихся 8 класса по теме: «Простые и сложные вещества»

Урок №10 03.10.17 8-А,Б класс
Тема. Простые и сложные
вещества.

Задание 1.
- С.32 учебника
- СО2 – углекислый газ — вещество……, а
- SiO 2 – песок — вещество……..

Задание2. В таблице против каждого явления проставьте букву «Х» или «Ф» (химическое или физическое), а против тел и веществ буквы «Т» или «В» соответственно .
П/п
Явления . Тела и вещества
1.
Х.Ф.Т.В
Разложение воды
2.
Колба
3.
Испарение воды из лужи
4.
Туман
5.
6.
Сжигание бензина в двигателе автомобиля.
Сахар
7.
Перегонка воды.
8.
Плавление железа.
9.
Стекло.
10.
Железо.
11.
Ведро.
12.
Карандаш.

П/п
1.
Явления . Тела и вещества
Х, Ф; Т, В
Разложение воды
2.
х
Колба
3.
Т
Испарение воды из лужи
4.
Ф
Туман
5.
6.
Ф
Сжигание бензина в двигателе автомобиля.
Сахар
х
7.
В
Перегонка воды.
8.
ф
Плавление железа.
9.
ф
Стекло.
10.
11.
В
Железо.
В
Ведро.
12.
Т
Карандаш.
т

Задание 3. Дайте определения понятиям: «молекула» , «ионы», «атом», «кристаллическая решетка вещества».

Задание 4.Определите состав: H 2 O, O 2 , CO 2, Cl 2.

- Химические элементы существуют в виде химических соединений.
химические соединения
простые сложные
вещества вещества

Сложные вещества состоят из разных
видов атомов.
Простые вещества
состоят из атомов одного вида
Н 2
О 2
Н 2 О
индекс
Как выразить состав вещества с помощью знаков химических элементов?

Запись качественного и количественного состава вещества с помощью знаков хим. элементов называется ХИМИЧЕСКАЯ ФОРМУЛА

Молекулярные химические
соединения независимо
от способа их получения
имеют постоянный
состав и свойства.
Например, состав воды в атмосфере, Мировом океане, ледниках и живых организмах отражает формула h3O. СО2
Имеют постоянный качественный и количественный состав не зависимо от способа их получения- закон постоянства состава. 1797г.
Ж.Пруст (1754-1826)

Запишите качественный и количественный состав для форммул:
MgO
К 2 S

Задание .
Ниже перечисленные вещества разделите на простые и сложные:
SO 2 K, Cu, N 2 , O 2 , Cl 2 , Al 2 O 3 , H 2 , Br 2 , NaCl, MgSO 4 , KOH, Fe, Au, Ag, ZnO, LiI, KF, Cr, SO 3

Задание. Ниже перечисленные вещества, разделите на простые и сложные: SO 2 K , Cu , N 2 , O 2 , Cl 2 , Al 2 O 3 , H 2 , Br 2 , NaCl , MgSO 4 , KOH , Fe , Au , Ag , ZnO , LiI KF , Cr , SO 3



Практическое задание:

- Домашнее задание. §9-10 выуч. определения , тестовые задания с.36. с. 39

- Что нового узнали на уроке?
- Какие вопросы вызвали затруднение?
- Какие знания вы сегодня приобрели?
multiurok.ru
