1.1.1 Строение электронных оболочек атомов элементов первых четырех периодов: s-, p- и d-элементы
Видеоурок: Строение атома: Строение электронных оболочек
Лекция: Строение электронных оболочек атомов элементов первых четырех периодов: s-, p- и d-элементы
Строение атома
 XX столетие является временем изобретения «модели строения атома». Исходя из предоставленного строения, удалось выработать следующую гипотезу: вокруг достаточно маленького по объему и размеру ядра, электроны совершают перемещения, схожие с перемещением планет вокруг Солнца. Последующее изучение атома показало, что сам атом и его строение гораздо сложнее, чем было установлено раньше. И в настоящее время, при огромных возможностях в научной сфере, атом исследован не до конца. Такие составляющие, как атом и молекулы, считаются предметами микромира. Поэтому данные части человек не способен рассмотреть самостоятельно. В этом мире установлены совершенно иные законы и правила, отличающиеся от макромира. Исходя из этого, исследование атома ведется на его модели.
XX столетие является временем изобретения «модели строения атома». Исходя из предоставленного строения, удалось выработать следующую гипотезу: вокруг достаточно маленького по объему и размеру ядра, электроны совершают перемещения, схожие с перемещением планет вокруг Солнца. Последующее изучение атома показало, что сам атом и его строение гораздо сложнее, чем было установлено раньше. И в настоящее время, при огромных возможностях в научной сфере, атом исследован не до конца. Такие составляющие, как атом и молекулы, считаются предметами микромира. Поэтому данные части человек не способен рассмотреть самостоятельно. В этом мире установлены совершенно иные законы и правила, отличающиеся от макромира. Исходя из этого, исследование атома ведется на его модели.
Любому атому присвоен порядковый номер, закрепленный в Периодической таблице Менделеева Д.И. К примеру, порядковый номер атома фосфора (Р) — 15.
Итак, атом состоит из протонов (p+), нейтронов (n0) и электронов (e—). Протоны и нейтроны образуют ядро атома, оно имеет положительный заряд. А электроны, совершающие перемещения вокруг ядра, «конструируют» электронную оболочку атома, имеющую отрицательный заряд.
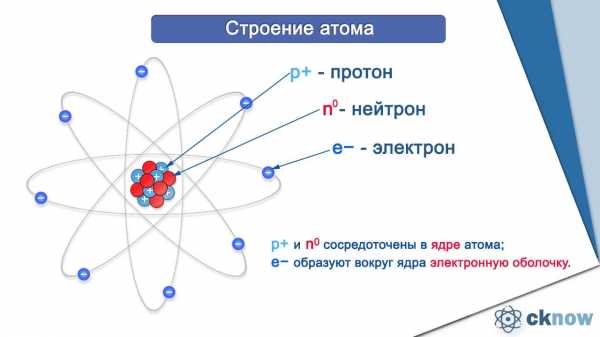
Сколько электронов в атоме? Это легко узнать. Достаточно посмотреть порядковый номер элемента в таблице.

Так, число электронов фосфора равно 15. Количество электронов, содержащихся в оболочке атома, строго равно числу протонов, содержащихся в ядре. Значит и протонов в ядре атома фосфора 15.
Масса протонов и нейтронов, составляющих массу ядра атома, одинакова. А электроны меньше в 2000 раз. Это означает что вся масса атома сосредоточена в ядре, массой электронов пренебрегают. Массу ядра атома мы также можем узнать из таблицы. Посмотрите изображение фосфора в таблице. Внизу мы видим обозначение 30, 974 – это и есть масса ядра фосфора, его атомная масса. При записи мы округляем эту цифру. Исходя из сказанного, запишем строение атома фосфора следующим образом:
(внизу слева написали заряд ядра – 15, вверху слева округленное значение массы атома – 31).
Ядро атома фосфора:
(внизу слева пишем заряд: протоны имеют заряд равный +1, а нейтроны не заряжены, то есть заряд 0; вверху слева масса протона и нейтрона, равная 1 – условная единица массы атома; заряд ядра атома равен числу протонов в ядре, значит р=15, а число нейтронов нужно посчитать: из атомной массы вычесть заряд, т.е. 31 – 15 = 16).
Электронная оболочка атома фосфора включает в себя 15 отрицательно заряженных электронов, уравновешивающих положительно заряженные протоны. Поэтому, атом – электронейтральная частица.
Энергетические уровниРис.1
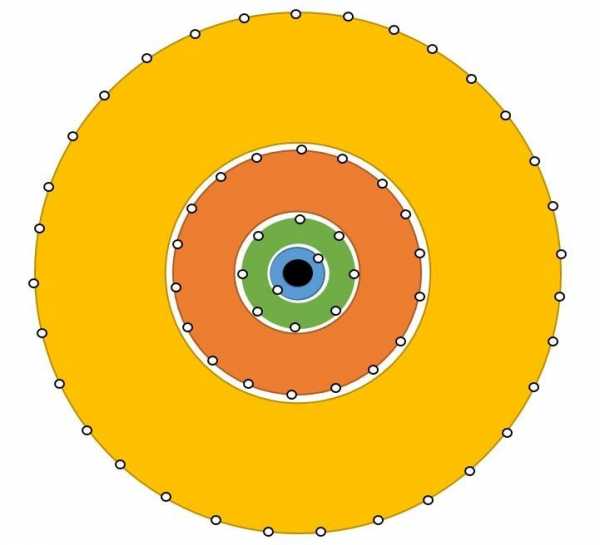 Далее нам необходимо подробно разобрать как распределяются электроны в атоме. Их движение не хаотично, а подчинено конкретному порядку. Какие — то из имеющихся электронов, притягиваются к ядру с достаточно большой силой, а другие наоборот, притягиваются слабо. Первопричина такого поведения электронов скрывается в разной степени удаленности электронов от ядра. То есть, ближе находящийся к ядру электрон, станет прочнее с ним взаимосвязан. Эти электроны просто нельзя отсоединить от электронной оболочки. Чем электрон дальше от ядра, тем проще «вытащить» его из оболочки. Так же, запас энергии электрона возрастает, по мере удаления от ядра атома. Энергия электрона определяется главным квантовым числом n, равняющимся любому натуральному числу (1,2,3,4…). Электроны, имеющие одинаковое значение n, образуют один электронный слой, как бы отгораживаясь от иных электронов, передвигающихся на удаленном расстоянии. На рисунке 1 изображены электронные слои, содержащиеся в электронной оболочке, в центре ядро атома.
Далее нам необходимо подробно разобрать как распределяются электроны в атоме. Их движение не хаотично, а подчинено конкретному порядку. Какие — то из имеющихся электронов, притягиваются к ядру с достаточно большой силой, а другие наоборот, притягиваются слабо. Первопричина такого поведения электронов скрывается в разной степени удаленности электронов от ядра. То есть, ближе находящийся к ядру электрон, станет прочнее с ним взаимосвязан. Эти электроны просто нельзя отсоединить от электронной оболочки. Чем электрон дальше от ядра, тем проще «вытащить» его из оболочки. Так же, запас энергии электрона возрастает, по мере удаления от ядра атома. Энергия электрона определяется главным квантовым числом n, равняющимся любому натуральному числу (1,2,3,4…). Электроны, имеющие одинаковое значение n, образуют один электронный слой, как бы отгораживаясь от иных электронов, передвигающихся на удаленном расстоянии. На рисунке 1 изображены электронные слои, содержащиеся в электронной оболочке, в центре ядро атома.
Вы можете заметить, как по мере удаления от ядра увеличивается объем слоя. Следовательно, чем дальше слой от ядра, тем больше в нем электронов.
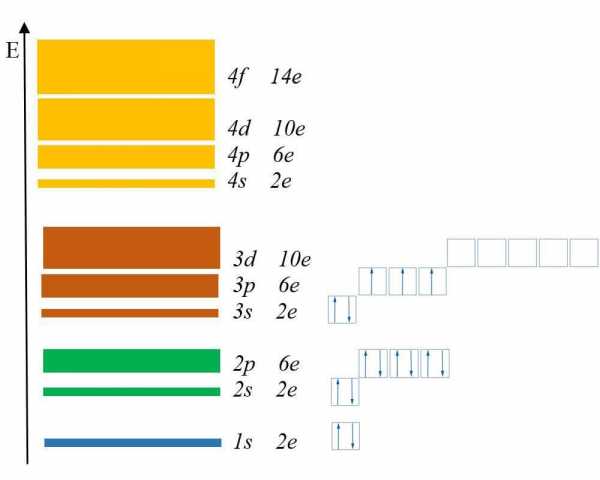
Электронный слой, содержит в себе электроны, сходные по показателям энергии. Из – за этого, такие слои нередко именуют энергетическими уровнями. Сколько же уровней может содержать атом? Количество энергетических уровней равно номеру периода в таблице Менделеева Д.И. в котором находится элемент. К примеру, фосфор (Р) находится в третьем периоде, значит атом фосфора имеет три энергетических уровня.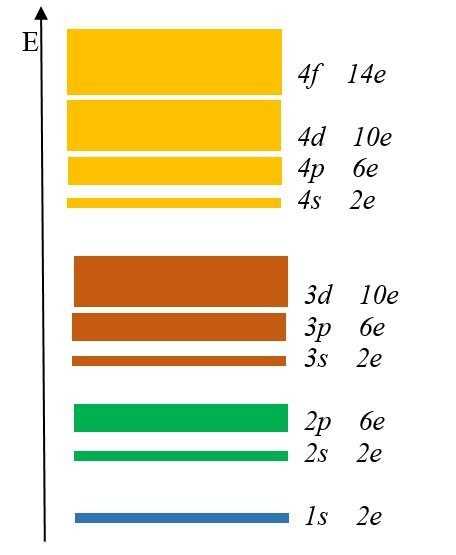 Как узнать максимальное количество электронов, располагающихся на одном электронном слое? Для этого используем формулу Nmax = 2n2, где n – это номер уровня.
Как узнать максимальное количество электронов, располагающихся на одном электронном слое? Для этого используем формулу Nmax = 2n2, где n – это номер уровня. Получим, что первый уровень содержит всего 2 электрона, второй – 8, третий – 18, четвертый – 32.
Каждый энергетический уровень содержит в себе подуровни. Их буквенные обозначения: s-, p-, d- и f-. Посмотрите на рис. 2:Здесь изображены подуровни. Е – это энергия (вспомните, что она возрастает по мере удаления электрона от ядра).
Разным цветом обозначены энергетические уровни, а полосками разной толщины подуровни.
Самый тонкий подуровень обозначается буквой s. 1s – это s-подуровень первого уровня, 2s – это s-подуровень второго уровня и так далее.
На втором энергетическом уровне появился p-подуровень, на третьем – d-подуровень, а на четвертом f-подуровень.
Запомните увиденную закономерность: первый энергетический уровень включает одну s-подуровень, второй два s- и p- подуровня, третий три s-, p- и d-подуровня, а четвертый уровень четыре s-, p-, d- и f-подуровня.
На s-подуровне могут находится только 2 электрона, на p-подуровне- максимум 6 электронов, на d-подуровне — 10 электронов, а на f-подуровне до 14 электронов.
Электронные орбитали
Область (место) где может находится электрон называется электронным облаком или орбиталью. Имейте ввиду, что говорится о вероятной области нахождении электрона, поскольку скорость его движения в сотни тысяч раз больше скорости движения иглы швейной машинки. Графически эта область изображается в виде ячейки:
В одной ячейке может находится два электрона. Судя по рисунку 2 можно сделать вывод о том, что s-подуровень, включающий не более двух электронов может содержать только одну s-орбиталь, обозначается одной ячейкой; p-подуровень имеет три р-орбитали (3 ячейки), d-подуровень пять d-орбиталей (5 ячеек), а f-подуровень семь f-орбиталей (7 ячеек).
Форма орбитали зависит от орбитального квантового числа (l — эль) атома. Атомный энергетический уровень, берет начало с s – орбитали, имеющей l = 0. Представленная орбиталь имеет сферическую форму. На уровнях, идущих после s — орбитали, образуются p – орбитали с l = 1. P — орбитали напоминают форму гантели. Орбиталей, имеющих данную форму, всего три. Каждая возможная орбиталь содержит в себе не больше 2 – ух электронов. Далее располагаются более сложного строения d-орбитали ( l = 2), а за ними f-орбитали (l = 3).
Рис. 3 Форма орбиталей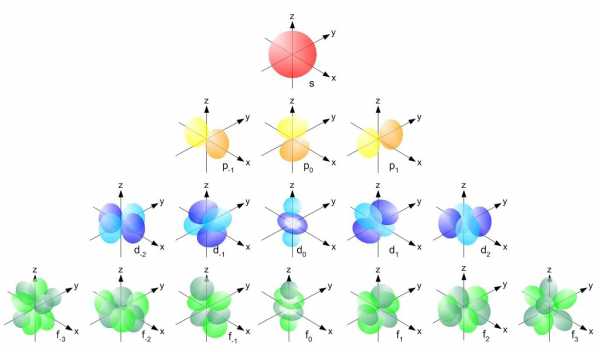 Электроны в орбиталях изображаются в виде стрелочек. Если орбитали содержат по одному электрону, то они однонаправленны – стрелкой вверх:
Электроны в орбиталях изображаются в виде стрелочек. Если орбитали содержат по одному электрону, то они однонаправленны – стрелкой вверх:Если же в орбитали два электрона, то они имеют два направления: стрелкой вверх и стрелкой вниз, т.е. электроны разнонаправленны:
Такое строение электронов называется валентным.
Существуют три условия наполнения атомных орбиталей электронами:
1 условие: Принцип минимального количества энергии. Заполнение орбиталей начинается с подуровня, имеющего минимальную энергию. Согласно данному принципу подуровни заполняются в таком порядке: 1s22s22p63s23p6 4s23d104p65s24d10
Рис. 4
2 условие: Принцип Паули. Одна орбиталь включает 2 электрона (электронную пару) и не больше. Но возможно и содержание всего одного электрона. Его именуют неспаренным.
3 условие: Правило Хунда. Каждую орбиталь одного подуровня сначала заполняют по одному электрону, затем в них добавляются по второму электрону. В жизни мы видели аналогичную ситуацию, когда незнакомые пассажиры автобуса сначала занимают по одному все свободные сидения, а потом рассаживаются по два.
Электронная конфигурация атома в основном и возбужденном состоянии
Энергия атома, находящегося в основном состоянии, наименьшая. Если атомы начинают получать энергию из вне, к примеру, когда вещество нагревается, то они из основного состояния переходят в возбужденное. Этот переход возможен при наличии свободных орбиталей, на которые могут переместиться электроны. Но это временно, отдавая энергию, возбужденный атом возвращается в своё основное состояние.
Закрепим полученные знания на примере. Рассмотрим электронную конфигурацию, т.е. сосредоточение электронов по орбиталям атома фосфора в основном (невозбужденном состоянии). Еще раз обратимся к рис. 4. Итак, вспомним, что атом фосфора имеет три энергетических уровня, которые изображаются полудугами: +15)))
Распределим, имеющиеся 15 электронов на эти три энергетических уровня:Такие формулы называются электронными конфигурациями. Есть еще электронно – графические, они иллюстрируют размещение электронов внутри энергетических уровней. Электронно – графическая конфигурация фосфора выглядит так:
cknow.ru
1.1.1. Строение электронных оболочек атомов химических элементов.
Химия — наука о веществах, их свойствах и превращениях.
Химическими веществами называют то, из чего состоит окружающий нас мир.
Свойства каждого химического вещества делятся на два типа: это химические, которые характеризуют его способность образовывать другие вещества, и физические, которые объективно наблюдаются и могут быть рассмотрены в отрыве от химических превращений. Так, например, физическими свойствами вещества являются его агрегатное состояние (твердое, жидкое или газообразное), теплопроводность, теплоемкость, растворимость в различных средах (вода, спирт и др.), плотность, цвет, вкус и т.д.
Превращения одних химических веществ в другие вещества называют химическими явлениями или химическими реакциями. Следует отметить, что существуют также и физические явления, которые, очевидно, сопровождаются изменением каких-либо физических свойств вещества без его превращения в другие вещества. К физическим явлениям, например, относятся плавление льда, замерзание или испарение воды и др.
О том, что в ходе какого-либо процесса имеет место химическое явление, можно сделать вывод, наблюдая характерные признаки химических реакций, такие как изменение цвета, образование осадка, выделение газа, выделение теплоты и (или) света.
Так, например, вывод о протекании химических реакций можно сделать, наблюдая:
— образование осадка при кипячении воды, называемого в быту накипью;
— выделение тепла и света при горении костра;
— изменение цвета среза свежего яблока на воздухе;
— образование газовых пузырьков при брожении теста и т.д.
Мельчайшие частицы вещества, которые в процессе химических реакций практически не претерпевают изменений, а лишь по-новому соединяются между собой, называются атомами.
Сама идея о существовании таких единиц материи возникла еще в древней Греции в умах античных философов, что собственно и объясняет происхождение термина «атом», поскольку «атомос» в буквальном переводе с греческого означает «неделимый».
Тем не менее, вопреки идее древнегреческих философов, атомы не являются абсолютным минимумом материи, т.е. сами имеют сложное строение.
Каждый атом состоит из так называемых субатомных частиц – протонов, нейтронов и электронов, обозначаемых соответственно символами p+, no и e−. Надстрочный индекс в используемых обозначениях указывает на то, что протон имеет единичный положительный заряд, электрон – единичный отрицательный заряд, а нейтрон заряда не имеет.
Что касается качественного устройства атома, то у каждого атома все протоны и нейтроны сосредоточены в так называемом ядре, вокруг которого электроны образуют электронную оболочку.
Протон и нейтрон обладают практически одинаковыми массами, т.е. mp ≈ mn , а масса электрона почти в 2000 раз меньше массы каждого из них, т.е. mp/me ≈ mn/me ≈ 2000.
Поскольку фундаментальным свойством атома является его электронейтральность, а заряд одного электрона равен заряду одного протона, из этого можно сделать вывод о том, что количество электронов в любом атоме равно количеству протонов.
Так, например, в таблице ниже представлен возможный состав атомов:
| атом1 | атом2 | атом3 | атом4 | |
| ядро | 1p+ | 1p+, 1n0 | 4p+, 3n0 | 4p+, 4n0 |
| оболочка | 1e− | 1e− | 4e− | 4e− |
Вид атомов с одинаковым зарядом ядер, т.е. с одинаковым числом протонов в их ядрах, называют химическим элементом. Таким образом, из таблицы выше можно сделать вывод о том, что атом1 и атом2 относятся в одному химическому элементу, а атом3 и атом4 — к другому химическому элементу.
Каждый химический элемент имеет свое название и индивидуальный символ, который читается определенным образом. Так, например, самый простой химический элемент, атомы которого содержат в ядре только один протон, имеет название «водород» и обозначается символом «Н», что читается как «аш», а химический элемент с зарядом ядра +7 (т.е. содержащий 7 протонов) — «азот», имеет символ «N» , который читается как «эн».
Как можно заметить из представленной выше таблицы, атомы одного химического элемента могут отличаться количеством нейтронов в ядрах.
Атомы, относящиеся к одному химическому элементу, но имеющие разное количество нейтронов и, как следствие массу, называют изотопами.
Так, например, химический элемент водород имеет три изотопа – 1Н, 2Н и 3Н. Индексы 1, 2 и 3 сверху от символа Н означают суммарное количество нейтронов и протонов. Т.е. зная, что водород – это химический элемент, который характеризуется тем, что в ядрах его атомов находится по одному протону, можно сделать вывод о том, что в изотопе 1Н вообще нет нейтронов (1-1=0), в изотопе 2Н – 1 нейтрон (2-1=1) и в изотопе 3Н – два нейтрона (3-1=2). Поскольку, как уже было сказано, нейтрон и протон имеют одинаковые массы, а масса электрона по сравнению с ними пренебрежимо мала, это значит, что изотоп 2Н практически в два раза тяжелее изотопа 1Н, а изотоп 3Н — и вовсе в три раза. В связи с таким большим разбросом масс изотопов водорода изотопам 2Н и 3Н даже были присвоены отдельные индивидуальные названия и символы, что не характерно больше ни для одного другого химического элемента. Изотопу 2Н дали название дейтерий и присвоили символ D, а изотопу 3Н дали название тритий и присвоили символ Т.
Если принять массу протона и нейтрона за единицу, а массой электрона пренебречь, фактически верхний левый индекс помимо суммарного количества протонов и нейтронов в атоме можно считать его массой, в связи с чем этот индекс называют массовым числом и обозначают символом А. Поскольку за заряд ядра любого атома отвечают протоны, а заряд каждого протона условно считается равным +1, количество протонов в ядре называют зарядовым числом (Z). Обозначив количество нейтронов в атоме буквой N, математически взаимосвязь между массовым числом, зарядовым числом и количеством нейтронов можно выразить как:
Согласно современным представлениям, электрон имеет двойственную (корпускулярно-волновую) природу. Он обладает свойствами как частицы, так и волны. Подобно частице, электрон имеет массу и заряд, но в то же время поток электронов, подобно волне, характеризуется способностью к дифракции.
Для описания состояния электрона в атоме используют представления квантовой механики, согласно которым электрон не имеет определенной траектории движения и может находиться в любой точке пространства, но с разной вероятностью.
Область пространства вокруг ядра, где наиболее вероятно нахождение электрона, называется атомной орбиталью.
Атомная орбиталь может обладать различной формой, размером и ориентацией. Также атомную орбиталь называют электронным облаком.
Графически одну атомную орбиталь принято обозначать в виде квадратной ячейки:
Квантовая механика имеет крайне сложный математический аппарат, поэтому в рамках школьного курса химии рассматриваются только лишь следствия квантово-механической теории.
Согласно этим следствиям, любую атомную орбиталь и находящийся на ней электрон полностью характеризуют 4 квантовых числа.
- Главное квантовое число – n — определяет общую энергию электрона на данной орбитали. Диапазон значений главного квантового числа – все натуральные числа, т.е. n = 1,2,3,4, 5 и т.д.
- Орбитальное квантовое число — l – характеризует форму атомной орбитали и может принимать любые целочисленные значения от 0 до n-1, где n, напомним, — это главное квантовое число.
Орбитали с l = 0 называют s-орбиталями. s-Орбитали имеют сферическую форму и не обладают направленностью в пространстве:
Орбитали с l = 1 называются p-орбиталями. Данные орбитали обладают формой трехмерной восьмерки, т.е. формой, полученной вращением восьмерки вокруг оси симметрии, и внешне напоминают гантель:
Орбитали с l = 2 называются d-орбиталями, а с l = 3 – f-орбиталями. Их строение намного более сложное.
3) Магнитное квантовое число – ml – определяет пространственную ориентацию конкретной атомной орбитали и выражает проекцию орбитального момента импульса на направление магнитного поля. Магнитное квантовое число ml соответствует ориентации орбитали относительно направления вектора напряженности внешнего магнитного поля и может принимать любые целочисленные значения от –l до +l, включая 0, т.е. общее количество возможных значений равно (2l+1). Так, например, при l = 0 ml = 0 (одно значение), при l = 1 ml = -1, 0, +1 (три значения), при l = 2 ml = -2, -1, 0, +1, +2 (пять значений магнитного квантового числа) и т.д.
Так, например, p-орбитали, т.е. орбитали с орбитальным квантовым числом l = 1, имеющие форму «трехмерной восьмерки», соответствуют трем значениям магнитного квантового числа (-1, 0, +1), что, в свою очередь, соответствует трем перпендикулярным друг другу направлениям в пространстве.
4) Спиновое квантовое число (или просто спин) — ms — условно можно считать отвечающим за направление вращения электрона в атоме, оно может принимать значения . Электроны с разными спинами обозначают вертикальными стрелками, направленными в разные стороны: ↓ и ↑.
Совокупность всех орбиталей в атоме, имеющих одно и то же значение главного квантового числа, называют энергетическим уровнем или электронной оболочкой. Любой произвольный энергетический уровень с некоторым номером n состоит из n2 орбиталей.
Множество орбиталей с одинаковыми значениями главного квантового числа и орбитального квантового числа представляет собой энергетический подуровень.
Каждый энергетический уровень, которому соответствует главное квантовое число n, содержит n подуровней. В свою очередь, каждый энергетический подуровень с орбитальным квантовым числом l, состоит из (2l+1) орбиталей. Таким образом, s-подуровень состоит из одной s-орбитали, p-подуровень – трех p-орбиталей, d-подуровень – пяти d-орбиталей, а f-подуровень — из семи f-орбиталей. Поскольку, как уже было сказано, одна атомная орбиталь часто обозначается одной квадратной ячейкой, то s-, p-, d- и f-подуровни можно графически изобразить следующим образом:
Каждой орбитали соответствует индивидуальный строго определенный набор трех квантовых чисел n, l и ml.
Распределение электронов по орбиталям называют электронной конфигурацией.
Заполнение атомных орбиталей электронами происходит в соответствии с тремя условиями:
- Принцип минимума энергии: электроны заполняют орбитали, начиная с подуровня с наименьшей энергией. Последовательность подуровней в порядке увеличения их энергий выглядит следующим образом: 1s<2s<2p<3s<3p<4s≤3d<4p<5s≤4d<5p<6s…;
Для того чтобы проще запомнить данную последовательность заполнения электронных подуровней, весьма удобна следующая графическая иллюстрация:
- Принцип Паули: на каждой орбитали может находиться не более двух электронов.
Если на орбитали находится один электрон, то он называется неспаренным, а если два, то их называют электронной парой.
- Правило Хунда: наиболее устойчивое состояние атома является такое, при котором в пределах одного подуровня атом обладает максимально возможным числом неспаренных электронов. Такое наиболее устойчивое состояние атома называется основным состоянием.
Фактически вышесказанное означает то, что, например, размещение 1-го, 2-х, 3-х и 4-х электронов на трех орбиталях p-подуровня будет осуществляться следующим образом:
Заполнение атомных орбиталей от водорода, имеющего зарядовое число равное 1, до криптона (Kr) с зарядовым числом 36 будет осуществляться следующим образом:
Подобное изображение порядка заполнения атомных орбиталей называется энергетической диаграммой. Исходя из электронных диаграмм отдельных элементов, можно записать их так называемые электронные формулы (конфигурации). Так, например, элемент с 15ю протонами и, как следствие, 15ю электронами, т.е. фосфор (P), будет иметь следующий вид энергетической диаграммы:
При переводе в электронную формулу атома фосфора примет вид:
15P = 1s22s22p63s23p3
Цифрами нормального размера слева от символа подуровня показан номер энергетического уровня, а верхними индексами справа от символа подуровня показано количество электронов на соответствующем подуровне.
Ниже приведены электронные формул первых 36 элементов периодической системы Д.И. Менделеева.
| период | № элемента | символ | название | электронная формула |
| I | 1 | H | водород | 1s1 |
| 2 | He | гелий | 1s2 | |
| II | 3 | Li | литий | 1s22s1 |
| 4 | Be | бериллий | 1s22s2 | |
| 5 | B | бор | 1s22s22p1 | |
| 6 | C | углерод | 1s22s22p2 | |
| 7 | N | азот | 1s22s22p3 | |
| 8 | O | кислород | 1s22s22p4 | |
| 9 | F | фтор | 1s22s22p5 | |
| 10 | Ne | неон | 1s22s22p6 | |
| III | 11 | Na | натрий | 1s22s22p63s1 |
| 12 | Mg | магний | 1s22s22p63s2 | |
| 13 | Al | алюминий | 1s22s22p63s23p1 | |
| 14 | Si | кремний | 1s22s22p63s23p2 | |
| 15 | P | фосфор | 1s22s22p63s23p3 | |
| 16 | S | сера | 1s22s22p63s23p4 | |
| 17 | Cl | хлор | 1s22s22p63s23p5 | |
| 18 | Ar | аргон | 1s22s22p63s23p6 | |
| IV | 19 | K | калий | 1s22s22p63s23p64s1 |
| 20 | Ca | кальций | 1s22s22p63s23p64s2 | |
| 21 | Sc | скандий | 1s22s22p63s23p64s23d1 | |
| 22 | Ti | титан | 1s22s22p63s23p64s23d2 | |
| 23 | V | ванадий | 1s22s22p63s23p64s23d3 | |
| 24 | Cr | хром | 1s22s22p63s23p64s13d5 здесь наблюдается проскок одного электрона с s на d подуровень | |
| 25 | Mn | марганец | 1s22s22p63s23p64s23d5 | |
| 26 | Fe | железо | 1s22s22p63s23p64s23d6 | |
| 27 | Co | кобальт | 1s22s22p63s23p64s23d7 | |
| 28 | Ni | никель | 1s22s22p63s23p64s23d8 | |
| 29 | Cu | медь | 1s22s22p63s23p64s13d10 здесь наблюдается проскок одного электрона с s на d подуровень | |
| 30 | Zn | цинк | 1s22s22p63s23p64s23d10 | |
| 31 | Ga | галлий | 1s22s22p63s23p64s23d104p1 | |
| 32 | Ge | германий | 1s22s22p63s23p64s23d104p2 | |
| 33 | As | мышьяк | 1s22s22p63s23p64s23d104p3 | |
| 34 | Se | селен | 1s22s22p63s23p64s23d104p4 | |
| 35 | Br | бром | 1s22s22p63s23p64s23d104p5 | |
| 36 | Kr | криптон | 1s22s22p63s23p64s23d104p6 |
Как уже было сказано, в основном своем состоянии электроны в атомных орбиталях расположены согласно принципу наименьшей энергии. Тем не менее, при наличии пустых p-орбиталей в основном состоянии атома, нередко, при сообщении ему избыточной энергии атом можно перевести в так называемое возбужденное состояние. Так, например, атом бора в основном своем состоянии имеет электронную конфигурацию и энергетическую диаграмму следующего вида:
5B = 1s22s22p1
А в возбужденном состояниии (*), т.е. при сообщении некоторой энергии атому бора, его электронная конфигурация и энергетическая диаграмма будут выглядеть так:
5B* = 1s22s12p2
В зависимости от того, какой подуровень в атоме заполняется последним, химические элементы делят на s, p, d или f.
Нахождение s, p, d и f-элементов в таблице Д.И. Менделеева:
- У s-элементов последний заполняемый s-подуровень. К данным элементам относятся элементы главных (слева в ячейке таблицы) подгрупп I и II групп.
- У p-элементов заполняется p-подуровень. К p-элементам относят последние шесть элементов каждого периода, кроме первого и седьмого, а также элементы главных подгрупп III-VIII групп.
- d-Элементы расположены между s – и p-элементами в больших периодах.
- f-Элементы называют лантаноидами и актиноидами. Они вынесены вниз таблицы Д.И. Менделеева.
scienceforyou.ru
s- и p- и d- элементы.
Строение электронных оболочек атомов элементов первых четырех периодов: s— и p— и d— элементы. Электронная конфигурация атома. Основное и возбужденное состояние атомов
1. Количество электронов в атоме определяется
числом протонов
2)
числом нейтронов
3)
числом энергетических уровней
4)
величиной относительной атомной массы
2 . Ион, в составе которого 16 протонов и 18 электронов, имеет заряд
1) +4 2) -2 3) +2 4) -4
4. Конфигурация внешнего электронного слоя атома серы в невозбужденном состоянии
1) 4s2 2) 3s23р6 3) 3s23р4 4) 4s24р4
5. Электронную конфигурацию 1s22s22p63s23p64s1 в основном состоянии имеет атом
1) лития 2) натрия 3) калия 4) кальция
6. Восьмиэлектронную внешнюю оболочку имеет ион
1) Р3+ 2) S2- 3) С15+ 4) Fe2+
7. Двухэлектронную внешнюю оболочку имеет ион
1) S6+ 2) S2- 3) Вг5+ 4) Sn4+
8. Число электронов в ионе железа Fe2+ равно
1) 54 2) 28 3) 58 4) 24
9. Электронная конфигурация Is22s22p63s23p6 соответствует иону
1) Sn2+ 2) S2- 3) Cr3+ 4) Fe2+
10. В основном состоянии три неспаренных электрона имеет атом
1) кремния 2) фосфора 3) серы 4) хлора
11. Элемент с электронной конфигурацией внешнего уровня … 3s23p3 образует водородное соединение состава
1) ЭН4 2) ЭН 3) ЭН3 4) ЭН2
12. Электронная конфигурация Is22s22p63s23p6 соответствует иону
1) Сl- 2) N3- 3) Br— 4) О2-
13. Электронная конфигурация Is22s22p6 соответствует иону
1) А13+ 2) Fe3+ 3) Zn2+ 4) Cr3+
14. Одинаковую электронную конфигурацию внешнего уровня имеют Са2+ и
1) К+ 2) Аr 3) Ва 4) F—
15. Атом металла, высший оксид которого Ме2О3, имеет электронную формулу внешнего энергетического уровня
1) ns2пр1 2) ns2пр2 3) ns2np3 4) ns2nps
16. Элемент, которому соответствует высший оксид состава R2O7 имеет электронную конфигурацию внешнего уровня:
1) ns2np3 2)ns2np5 3) ns2np1 4) ns2np2
17. Высший оксид состава R2O7 образует химический элемент, в атоме которого заполнение электронами энергетических уровней соответствует ряду чисел:
1) 2, 8, 1 2) 2, 8, 7 3) 2, 8, 8, 1 4) 2, 5
18. У атома серы число электронов на внешнем энергетическом уровне и заряд ядра равны соответственно
1)4 и + 16 2)6 и + 32 3)6 и + 16 4)4 и + 32
19. Число валентных электронов у марганца равно
1) 1 2) 3 3) 5 4) 7
20. Одинаковое электронное строение имеют частицы
1) Na0 и Na+ 2) Na0 и K0 3) Na+ и F— 4) Cr2+ и Сr3+
21. Высший оксид состава ЭО3 образует элемент с электронной конфигурацией внешнего электронного слоя
1) ns2np1 2) ns2np3 3) ns2np4 4) ns2np6
22. Число энергетических слоев и число электронов во внешнем энергетическом слое атомов мышьяка равны соответственно
1)
4, 6
2)
2, 5
3)
3, 7
4)
4, 5
23 Иону Al3+ отвечает электронная конфигурация:
1) 1s22s22p6; 2) 1s22s22p63s1; 3) 1s22s22p63s23p1 4) Is22s22p63s23p64s1
24. Иону Zn2+ отвечает электронная конфигурация:
1) 1s22s22p63s23p63d84s2 2) 1s22s22p63s23p63d104s24p6 3 ) 1s22s22p63s23p63d10 4) Is22s22p63s23p64s1
25. Химическому элементу соответствует летучее водородное соединение состава RH3. Электронная конфигурация внешнего уровня этого элемента
23p1
2)
3s23p2
3)
3s23p3
4)
3s23p5
26. Атомы серы и кислорода имеют
27. Электронная конфигурация атома фтора
22s22p5
2)
1s22s22p4
3)
1s22s22p6
4)
1s22s22p3
Ответы: 1-1, 2-2, 4-3,5-3,6-2,7-3,8-4,9-2, 10-2, 11-3, 12-1, 13-1, 14-1, 15-1, 16-2, 17-2, 18-3, 19-4, 20-3, 21-3, 22-4, 23-1, 24-3, 25-4, 26-2, 27-1
infourok.ru
s-, p- и d-элементы. Электронная конфигурация атома. Основное и возбужденное состояние атомов — КиберПедия
В структуре данного блока выделяют четыре содержательные линии:
• Современные представления о строении атома.
• Периодический закон и Периодическая система химических элементов Д.И. Менделеева.
• Химическая связь и строение вещества.
• Химическая реакция.
Для каждой из этих линий указаны проверяемые элементы содержания (см. таблицу 1).
Таблица 1
| Проверяемые элементы содержания | Уровень сложности задания, проверяющего усвоение элемента содержания |
| Современные представления о строении атома | |
| Строение электронных оболочек атомов элементов первых четырех периодов: s-, р- и d-элементы. Электронная конфигурация атома. Основное и возбужденное состояние атомов | Б |
| Периодический закон и Периодическая система химических элементов Д.И. Менделеева | |
| Закономерности изменения свойств элементов и их соединений по периодам и группам | Б |
| Химическая связь и строение вещества | |
| Электроотрицательность. Степень окисления и валентность химических элементов. | Б, П |
| Ковалентная химическая связь, её разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь. | Б |
| Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения. | Б |
| Химическая реакция | |
| Классификация химических реакций в неорганической и органической химии. | Б |
| Скорость реакции, её зависимость от различных факторов. | Б |
| Обратимые и необратимые химические реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов. | П |
| Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты. | Б |
| Реакции ионного обмена. | Б |
| Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная. | П |
| Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от неё. | П, В |
| Электролиз расплавов и растворов солей, щелочей, кислот. | П |
Строение электронных оболочек атомов элементов первых четырех периодов: s-, p- и d-элементы. Электронная конфигурация атома. Основное и возбужденное состояние атомов
Задания с комментариями и решениями
Пример 1. Из указанных в ряду химических элементов выберите два элемента, атомы которых имеют на внешнем энергетическом уровне в основном состоянии неспаренные электроны.
1) Be
2) Si
3) Аr
4) Mg
5) Al
Запишите в поле ответа номера выбранных элементов.
Атом бериллия имеет конфигурацию внешнего электронного слоя 2s2 (два электрона на одной атомной орбитали спарены). Аналогичную электронную конфигурацию (3s2) имеет атом магния. В атоме аргона на внешнем уровне 8 электронов, образующих четыре электронные пары: 3s23p6. В атоме кремния на внешнем уровне четыре электрона: 3s23p2, два из них являются неспаренными. Элемент IIIА группы алюминий на внешнем уровне имеет три электрона 3s23p1, при этом электрон, находящийся на p-орбитали, является неспаренным.
Ответ: 25
Пример 2. Какие из указанных ионов имеют электронную конфигурацию инертного газа?
1) Сr3+
2) Сl—
3) Сu2+
4) Na+
5) Fe2+
Атомы инертных газов имеют завершенный внешний энергетический уровень: 1s2(He) или ns2nр6, т.е. содержащий 8 внешних электронов. В условии задания указаны положительно заряженные ионы хрома, меди и железа, которые относят к 3d-элементам. Число электронов в этих частицах равно, соответственно 21, 27 и 24, что не соответствует ни одному из инертных газов. Атом хлора на внешнем уровне содержит 7 электронов (3s23p5), соответственно хлорид-ион содержит 8 электронов и имеет строение внешнего уровня 3s23p6. Именно таково строение внешнего уровня инертного газа — аргона. Электронная конфигурация атома натрия 1s22s22p63s1. Катион натрия содержит на один электрон меньше. Строение внешнего уровня катиона натрия совпадает со строением внешнего уровня инертного газа-неона (1s22s22p6).
Ответ: 24
Пример 3. Из указанных в ряду химических элементов выберите два элемента, имеющих сходную конфигурацию внешнего энергетического уровня.
1) Rb
2) Р
3) Mg
4) Сr
5) Аl
Запишите в поле ответа номера выбранных элементов.
Рубидий является элементом пятого периода IA группы. Электронная конфигурация внешнего слоя его атома 5s1. Фосфор, магний и алюминий — также элементы A-групп. Число электронов на внешнем энергетическом уровне атомов этих элементов равно номеру группы:
Р 3s23p3
Mg 3s2
Al 3s23p1
Атом хрома является d-элементом. На внешнем энергетическом уровне атомов d-элементов находится не более двух электронов. У атома хрома из-за «провала» электрона на внешнем энергетическом уровне находится только один электрон 4s1. Таким образом, сходную конфигурацию внешнего энергетического уровня имеют атомы хрома и рубидия.
Ответ: 14
Пример 4. Какие из указанных ионов имеют электронную конфигурацию атома гелия?
1) Аl3+
2) Н—
3) С+2
4) О2-
5) Li+
Атом гелия, расположенный в 1-м периоде VIIIА группе имеет конфигурацию 1s2. Среди предложенных ионов только гидрид-ион Н— и-катион лития содержат на внешнем 1s уровне два электрона. Электронные конфигурации остальных ионов отличаются от конфигурации атома гелия:
Ответ: 25
Задания для самостоятельной работы
1. Из указанных в ряду ионов выберите два иона, имеющих электронную конфигурацию 1s22s22p63s23p6.
1) Fe2+
2) S2-
3) Al3+
4) N3-
5) Са2+
Запишите в поле ответа номера выбранных элементов.
Ответ:
2. Из указанных в ряду частиц выберите два атома или иона, которым соответствует электронная формула внешнего электронного слоя 3s23р6.
1) Na0
2) Аr0
3) К+
4) О2-
5) Li+
Запишите в поле ответа номера выбранных элементов.
Ответ:
3. Из указанных в ряду элементов выберите два элемента, атомы которых в основном состоянии имеют электронную конфигурацию внешнего энергетического уровня ж2пр\
1) Li
2) Аl
3) Сu
4) В
5) Fe
Запишите в поле ответа номера выбранных элементов.
Ответ:
4. Из указанных в ряду элементов выберите два элемента, атомы которых в основном состоянии имеют только один неспаренный электрон.
1) Ва
2) Fe
3) Сu
4) F
5) S
Запишите в поле ответа номера выбранных элементов.
Ответ:
5. Определите, какие из приведенных электронных конфигураций соответствуют возбуждённому состоянию атомов.
Ответ:
6. Определите, атомы каких из перечисленных элементов в основном состоянии содержат на внешнем энергетическом уровне неспаренные электроны.
1) фтор
2) цинк
3) кальций
4) магний
5) алюминий
Ответ:
7. Среди указанных частиц выберите две частицы, которые содержат одинаковое число электронов.
Запишите в поле ответа номера выбранных частиц.
Ответ:
8. У каких элементов, указанных в ряду, наиболее распространённые изотопы имеют равное число протонов и нейтронов.
1) Са
2) F
3) Аl
4) Si
5) Na
Запишите в поле ответа номера выбранных элементов.
Ответ:
cyberpedia.su
Строение электронных оболочек атомов элементов первых четырех периодов: s -, p- и d -элементы. Электронная конфигурация атома. Основное и возбужденное состояние атомов
А1.
Строение электронных оболочек атомов элементов первых четырех периодов: s-, p- и d-элементы. Электронная конфигурация атома. Основное и возбужденное состояние атомов.
Число электронов, протонов и нейтронов в атоме.
Число электронов равно порядковому номеру и числу протонов, число нейтронов равно разности между массовым числом и порядковым номером.
Физический смысл порядкового номера, номера периода и номера группы.
Порядковый номер равен числу протонов и электронов, заряду ядра; номер периода равен числу заполняемых электронных слоёв; номер А — группы равен числу электронов на внешнем слое (валентных электронов).
Максимальное число электронов на уровнях.
Максимальное число электронов на уровнях определяется по формуле N= 2· n2.
1 уровень – 2, 2 уровень – 8, 3 уровень — 18, 4 уровень – 32.
s-, p- и d— элементы.
s-элементы расположены в I и II А-группах; p- элементы в III –VIII А –группах; d- элементы в I- VIII В группах.
Порядок заполнения электронами Е уровней и орбиталей в атомах.
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p
«Провал» электрона — переход электрона с внешнего энергетического уровня на более
низкий, что объясняется большей энергетической устойчивостью образующихся при этом электронных конфигураций. Подобное явление наблюдается у меди и хрома.
24Cr 1s22s22p63s23p63d54s1 29Cu 1s22s22p63s23p63d104s1
Особенности заполнения электронных оболочек у элементов А и В групп.
У элементов А-групп валентные электроны заполняют последний слой, а у элементов В-групп- внешний и частично предвнешний электронный слой.
Степени окисления элементов в высших оксидах и ЛВС.
Группы
I
II
III
IV
V
VI
VII
VIII
С.О. в высшем оксиде = + № гр
+1
+2
+3
+4
+5
+6
+7
+8
Высший оксид
R2О
RО
R2О3
RО2
R2О5
RО3
R2О7
RО4
С.О. в ЛВС = № гр — 8
—
—
—
-4
-3
-2
-1
—
ЛВС
—
—
—
Н4R
Н3R
Н2R
НR
—
Строение электронных оболочек ионов.
У катиона – меньше электронов на величину заряда, у анионов — больше на величину заряда.
Напимер: Na0 — 11 электронов, Na+ — 10 электронов; P0 – 15 электронов, P3- — 18 электронов.
Основное и возбужденное состояние атомов.
Основное состояние – состояние атома, в котором его энергия минимальна.
Возбужденные состояния атомов образуются из основного состояния при переходе одного или нескольких электронов (например, под действием излучения или при нагревании) с занятых орбиталей на свободные (или занятые лишь одним электроном).
Пример: Al — …3s2 3p1, *Al — 3s13p2; Р …3s2 3p3, Р* — 3s13p3 3d1.
11. Изотопы.
Изотопы — разновидности атомов одного ХЭ, имеющие одинаковое число электронов и протонов, но разную массу атома (разное число нейтронов).
Пример:
Элементарные частицы | Изотопы | ||
40 Ca | 42 Ca | ||
é | 20 | 20 | |
p+ | 20 | 20 | |
n0 | 20 | 22 | |
gigabaza.ru
А1. Строение электронных оболочек атомов элементов первых четырех периодов: s-, p- и d-элементы. Электронная конфигурация атома. Основное и возбужденное состояние атомов.
Число электронов равно порядковому номеру и числу протонов, число нейтронов равно разности между массовым числом и порядковым номером.
Порядковый номер равен числу протонов и электронов, заряду ядра; номер периода равен числу заполняемых электронных слоёв; номер А — группы равен числу электронов на внешнем слое (валентных электронов).
Максимальное число электронов на уровнях определяется по формуле N= 2· n2. 1 уровень – 2, 2 уровень – 8, 3 уровень — 18, 4 уровень – 32.
s-элементы расположены в I и II А-группах; p- элементы в III –VIII А –группах; d- элементы в I- VIII В группах.
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p
низкий, что объясняется большей энергетической устойчивостью образующихся при этом электронных конфигураций. Подобное явление наблюдается у меди и хрома. 24Cr 1s22s22p63s23p63d54s129Cu 1s22s22p63s23p63d104s1
У элементов А-групп валентные электроны заполняют последний слой, а у элементов В-групп- внешний и частично предвнешний электронный слой.
У катиона – меньше электронов на величину заряда, у анионов — больше на величину заряда. Напимер: Na0 — 11 электронов, Na+ — 10 электронов; P0 – 15 электронов, P3- — 18 электронов.
Основное состояние – состояние атома, в котором его энергия минимальна. Возбужденные состояния атомов образуются из основного состояния при переходе одного или нескольких электронов (например, под действием излучения или при нагревании) с занятых орбиталей на свободные (или занятые лишь одним электроном). Пример: Al — …3s2 3p1, *Al — 3s13p2; Р …3s2 3p3, Р* — 3s13p3 3d1. 11. Изотопы. Изотопы — разновидности атомов одного ХЭ, имеющие одинаковое число электронов и протонов, но разную массу атома (разное число нейтронов). Пример:
| ||||||||
ignorik.ru
Строение электронных оболочек атомов элементов первых четырех периодов: s-, p- и d-элементы. Электронная конфигурация атома. Основное и возбужденное состояние атомов — ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ — ЗАДАНИЯ ДЛЯ ТЕМАТИЧЕСКОГО КОНТРОЛЯ — Химия — Единый государственный экзамен — Комплекс материалов для подготовки учащихся
ЧАСТЬ 1. ЗАДАНИЯ ДЛЯ ТЕМАТИЧЕСКОГО КОНТРОЛЯ
1.1. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ
В структуре данного блока выделяют четыре содержательные линии:
• Современные представления о строении атома.
• Периодический закон и Периодическая система химических элементов Д.И. Менделеева.
• Химическая связь и строение вещества.
• Химическая реакция.
Для каждой из этих линий указаны проверяемые элементы содержания (см. таблицу 1).
Таблица 1
Проверяемые элементы содержания | Уровень сложности задания, проверяющего усвоение элемента содержания |
Современные представления о строении атома | |
Строение электронных оболочек атомов элементов первых четырех периодов: s-, р- и d-элементы. Электронная конфигурация атома. Основное и возбужденное состояние атомов | Б |
Периодический закон и Периодическая система химических элементов Д.И. Менделеева | |
Закономерности изменения свойств элементов и их соединений по периодам и группам | Б |
Химическая связь и строение вещества | |
Электроотрицательность. Степень окисления и валентность химических элементов. | Б, П |
Ковалентная химическая связь, её разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь. | Б |
Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения. | Б |
Химическая реакция | |
Классификация химических реакций в неорганической и органической химии. | Б |
Скорость реакции, её зависимость от различных факторов. | Б |
Обратимые и необратимые химические реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов. | П |
Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты. | Б |
Реакции ионного обмена. | Б |
Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная. | П |
Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от неё. | П, В |
Электролиз расплавов и растворов солей, щелочей, кислот. | П |
Строение электронных оболочек атомов элементов первых четырех периодов: s-, p- и d-элементы. Электронная конфигурация атома. Основное и возбужденное состояние атомов
Задания с комментариями и решениями
Пример 1. Из указанных в ряду химических элементов выберите два элемента, атомы которых имеют на внешнем энергетическом уровне в основном состоянии неспаренные электроны.
1) Be
2) Si
3) Аr
4) Mg
5) Al
Запишите в поле ответа номера выбранных элементов.
Атом бериллия имеет конфигурацию внешнего электронного слоя 2s2 (два электрона на одной атомной орбитали спарены). Аналогичную электронную конфигурацию (3s2) имеет атом магния. В атоме аргона на внешнем уровне 8 электронов, образующих четыре электронные пары: 3s23p6. В атоме кремния на внешнем уровне четыре электрона: 3s23p2, два из них являются неспаренными. Элемент IIIА группы алюминий на внешнем уровне имеет три электрона 3s23p1, при этом электрон, находящийся на p-орбитали, является неспаренным.
Ответ: 25
Пример 2. Какие из указанных ионов имеют электронную конфигурацию инертного газа?
1) Сr3+
2) Сl—
3) Сu2+
4) Na+
5) Fe2+
Атомы инертных газов имеют завершенный внешний энергетический уровень: 1s2(He) или ns2nр6, т.е. содержащий 8 внешних электронов. В условии задания указаны положительно заряженные ионы хрома, меди и железа, которые относят к 3d-элементам. Число электронов в этих частицах равно, соответственно 21, 27 и 24, что не соответствует ни одному из инертных газов. Атом хлора на внешнем уровне содержит 7 электронов (3s23p5), соответственно хлорид-ион содержит 8 электронов и имеет строение внешнего уровня 3s23p6. Именно таково строение внешнего уровня инертного газа — аргона. Электронная конфигурация атома натрия 1s22s22p63s1. Катион натрия содержит на один электрон меньше. Строение внешнего уровня катиона натрия совпадает со строением внешнего уровня инертного газа-неона (1s22s22p6).
Ответ: 24
Пример 3. Из указанных в ряду химических элементов выберите два элемента, имеющих сходную конфигурацию внешнего энергетического уровня.
1) Rb
2) Р
3) Mg
4) Сr
5) Аl
Запишите в поле ответа номера выбранных элементов.
Рубидий является элементом пятого периода IA группы. Электронная конфигурация внешнего слоя его атома 5s1. Фосфор, магний и алюминий — также элементы A-групп. Число электронов на внешнем энергетическом уровне атомов этих элементов равно номеру группы:
Р 3s23p3
Mg 3s2
Al 3s23p1
Атом хрома является d-элементом. На внешнем энергетическом уровне атомов d-элементов находится не более двух электронов. У атома хрома из-за «провала» электрона на внешнем энергетическом уровне находится только один электрон 4s1. Таким образом, сходную конфигурацию внешнего энергетического уровня имеют атомы хрома и рубидия.
Ответ: 14
Пример 4. Какие из указанных ионов имеют электронную конфигурацию атома гелия?
1) Аl3+
2) Н—
3) С+2
4) О2-
5) Li+
Атом гелия, расположенный в 1-м периоде VIIIА группе имеет конфигурацию 1s2. Среди предложенных ионов только гидрид-ион Н— и-катион лития содержат на внешнем 1s уровне два электрона. Электронные конфигурации остальных ионов отличаются от конфигурации атома гелия:
Ответ: 25
Задания для самостоятельной работы
1. Из указанных в ряду ионов выберите два иона, имеющих электронную конфигурацию 1s22s22p63s23p6.
1) Fe2+
2) S2-
3) Al3+
4) N3-
5) Са2+
Запишите в поле ответа номера выбранных элементов.
Ответ:
2. Из указанных в ряду частиц выберите два атома или иона, которым соответствует электронная формула внешнего электронного слоя 3s23р6.
1) Na0
2) Аr0
3) К+
4) О2-
5) Li+
Запишите в поле ответа номера выбранных элементов.
Ответ:
3. Из указанных в ряду элементов выберите два элемента, атомы которых в основном состоянии имеют электронную конфигурацию внешнего энергетического уровня ж2пр\
1) Li
2) Аl
3) Сu
4) В
5) Fe
Запишите в поле ответа номера выбранных элементов.
Ответ:
4. Из указанных в ряду элементов выберите два элемента, атомы которых в основном состоянии имеют только один неспаренный электрон.
1) Ва
2) Fe
3) Сu
4) F
5) S
Запишите в поле ответа номера выбранных элементов.
Ответ:
5. Определите, какие из приведенных электронных конфигураций соответствуют возбуждённому состоянию атомов.
Ответ:
6. Определите, атомы каких из перечисленных элементов в основном состоянии содержат на внешнем энергетическом уровне неспаренные электроны.
1) фтор
2) цинк
3) кальций
4) магний
5) алюминий
Ответ:
7. Среди указанных частиц выберите две частицы, которые содержат одинаковое число электронов.
Запишите в поле ответа номера выбранных частиц.
Ответ:
8. У каких элементов, указанных в ряду, наиболее распространённые изотопы имеют равное число протонов и нейтронов.
1) Са
2) F
3) Аl
4) Si
5) Na
Запишите в поле ответа номера выбранных элементов.
Ответ:
compendium.su
