Строение и функции белков
Разделы: Биология
Урок изучения нового материала в 10-м классе. Данный материал учащиеся уже изучали в 9 классе, поэтому некоторые понятия им уже известны. Соответственно с ребятами ведется диалог о строении и функциях белков. С помощью учителя учащиеся узнают о классификации ферментов.
Для того, чтобы активизировать деятельность учащихся на уроке, приводятся интересные факты о белках, которые помогают ребятам и нацеливают их на дальнейшее усвоение нового материала. Так же для этих целей предлагается провести лабораторную работу. На данном уроке основная масса изучаемого материала записывается в виде таблиц, схемы, которые учитель строит в ходе урока вместе и учениками. Качество изучаемого материала проверяется в виде фронтального опроса. Урок рассчитан как на детей-аудиалов, так и визуалов.
Цель урока: дать представление о строении и функции белков.
Задачи: продолжить расширение и углубление знаний важнейших органических веществах клетки на основе изучения строения и функции белков, сформировать знания функциях белков и их важнейшей роли в органическом мире, продолжить формирование умения выявлять связи между строением и функциями веществ.
Основные понятия: белки, протеины, протеиды, пептид, пептидная связь, простые и сложные белки, первичная, вторичная, третичная и четвертичная структуры белков денатурация.
Средства обучения: таблицы по общей биологии, иллюстрирующие строение молекул белков; лабораторное оборудование для проведения лабораторной работы “Расщепление пероксида водорода с помощью ферментов, содержащихся в плетках листа элодеи”.
Ход урока
I. Изучение нового материала.
1. Рассказ учителя (или фрагмент лекции) об особенностях строения молекул белков как биополимеров, состоящих из большого количества разных аминокислот, между которыми происходит полимеризация на основе пептидной связи. Зарисовка и запись на доске и в тетрадях учащихся.
2. Самостоятельное изучение учащимися текста учебника (С.42) о классификации белков.
3. Беседа об уровнях организации белковой молекулы и химической основы каждого из четырех уровней (структур) этой молекулы, о денатурации как утрате белковой молекулы своей природной структуры.
Структура белковой молекулы.
| Структура белка | Характеристика | Тип связи | |
| Первичная | Линейная структура – последовательность аминокислот в полипептидной цепи, которая определяет все другие структуры молекулы, а также свойства и функции белка. | Пептидная. | |
| Вторичная | Закручивание полипептидной цепи в спираль или складывание в “гармошку”. | Водородные связи. | |
| Третичная | Глобулярный белок: упаковка вторичной
структуры в глобулу; фибриллярный белок: несколько вторичных структур, уложенных параллельными слоями, или скручивание нескольких вторичных структур наподобие каната в суперспираль. |
Ионные, водородные, дисульфидные, гидрофобные. | |
| Четвертичная | Встречается редко. Комплекс из нескольких третичных структур органической природы и неорганическое вещество, например, гемоглобин. | Ионные, водородные, гидрофобные. |
4. Рассказ учителя о многообразии функций белков с краткой записью в тетрадях сущности функций: структурной, ферментативной, транспортной, защитной, регуляторной, энергетической, сигнальной.
5. Лабораторная работа “Расщепление пероксида водорода с помощью ферментов, содержащихся в клетках листа
Ход работы:
а. Приготовьте микропрепарат листа элодеи и рассмотрите его под микроскопом.
б. Капните на микропрепарат немного пероксида водорода и еще раз рассмотрите, в
каком состоянии находятся клетки листа элодеи.
в. Объясните, с чем связано выделение пузырьков из теток листа, что это за газ,
на какие вещества может расщепиться пероксид водорода, какие ферменты участвуют
в этом процессе?
г. Капните каплю пероксида на предметное стекло и, рассмотрев его под
микроскопом, опишите наблюдаемую, картину. Сравните состояние пероксида водорода
в листе элодеи и на стекле, сделайте выводы.
По завершении лабораторной работы следует провести беседу о биохимических реакциях, протекающих при участии белковых катализаторов-ферментов как основе жизнедеятельности клеток и организмов.
Химические свойства белков обусловлены их различным аминокислотным составом. Существуют белки хорошо растворимые в воде и совершенно нерастворимые, химически активные и устойчивые к действию различных агентов, способные укорачиваться и растягиваться и т. д.
Под влиянием различных факторов – высокой температуры, действия химических веществ, облучения, механического воздействия – может произойти разрушение структур белковой молекулы. Нарушение природной структуры белка называется денатурацией. Если воздействие перечисленных факторов было недолгим и несильным, то белок может вернуть свою природную структуру – обратимая денатурация (ренатурация), если же воздействие было долгим или сильным, то происходит нарушение не только третичной и вторичной структур, но и первичной – необратимая денатурация (рис. 3).
Функции белков.
| Характеристика | |
| 1. Строительная (структурная). | Входят в состав клеточных мембран и органоидов клетки (липопротеиды и гликопротеиды), участвуют в образовании стенок кровеносных сосудов, хрящей, сухожилий (коллаген) и волос (кератин). |
| 2. Двигательная | Обеспечивается сократительными белками (актин и миозин), которые обуславливают движение ресничек и жгутиков, сокращение мышц, перемещение хромосом при делении клетки, движение органов растений. |
| 3. Транспортная. | Связывают и переносят с током крови многие химические соединения, например, гемоглобин и миоглобин транспортируют кислород, белки сыворотки крови переносят гормоны, липиды и жирные кислоты, различные биологически активные вещества. |
| 4. Защитная. | Выработка антител (иммуноглобулинов) в ответ на проникновение в нее чужеродных веществ (антигенов), которые обеспечивают иммунологическую защиту; участие в процессах свертывания крови (фибриноген и протромбин). |
| 5, Сигнальная (рецепторная). | Прием сигналов из внешней среды и передача команд в клетку за счет изменения третичной структуры встроенных в мембрану белков в ответ на действие факторов внешней среды. Например, гликопротеины (встроены в гликокал икс), опсин (составная часть светочувствительных пигментов родопсина и йодопсина), фитохром (светочувствительный белок растений). |
| 6. Регуляторная. | Белки-гормоны оказывают влияние на обмен веществ, т. е. обеспечивают гомеостаз, регулируют рост, размножение, развитие и другие жизненно важные процессы. Например, инсулин регулирует уровень глюкозы в крови, тироксин – физическое и психическое развитие и т.д. |
| 7. Каталитическая (ферментативная). | Белки-ферменты ускоряют биохимические процессы в клетке. |
| К. Запасающая | Резервные белки животных: альбумин (яйца) запасает воду, ферритин – железо в клетках печени, селезенки; миоглобин – кислород в мышечных волокнах, казеин (молоко) и белки семян – источник питания для зародыша. |
| 9. Пищевая (основной источник аминокислот). | Белки пищи – основной источник аминокислот (особенно незаменимых) для животных и человека; казеин (белок молока) – основной источник аминокислот для детенышей млекопитающих. |
| 10. Энергетическая. | Являются источником энергии – при окислении 1 г белка выделяется 17,6 кДж энергии, но организм использует белки в качестве источника энергии очень редко, например, при длительном голодании. |
Ферменты (энзимы) – это специфические белки, которые присутствуют во всех живых организмах и играют роль биологических катализаторов.
Химические реакции в живой клетке протекают при умеренной температуре, нормальном давлении и нейтральной среде. В таких условиях реакции синтеза или распада веществ протекали бы очень медленно, если бы не подвергались воздействию ферментов. Ферменты ускоряют реакцию без изменения ее общего результата за счет снижения энергии активации. Это означает, что в их присутствии требуется значительно меньше энергии для придания реакционной способности молекулам, которые вступают в реакцию. Ферменты отличаются от химических катализаторов высокой степенью специфичности, т. е. фермент катализирует только одну реакцию или действует только на один тип связи. Скорость ферментативных реакций зависит от многих факторов – природы и концентрации фермента и субстрата, температуры, давления, кислотности среды, наличия ингибиторов и т.д.
Классификация ферментов.
| Группа | Катализируемые реакции, примеры |
| Оксидоредуктазы. | Окислительно-восстановительные реакции: перенос атомов водорода (Н) и кислорода (О) или электронов от одного вещества к другому, при этом окисляется первый и восстанавливается второй. Участвуют во всех процессах биологического окисления, например, вдыхании: АН + В А ВН (окисленный) или А + О АО (восстановленный). |
| Трансферазы. | Перенос группы атомов (метильной,
ацильной, фосфатной или аминогруппы) от одного вещества к другому.
Например, перенос остатков фосфорной кислоты от АТФ на глюкозу или
фруктозу под действием фототрансфераз: АТФ + глюкоза глюкозо-6-фосфат + АДФ. |
| Гидролазы. | Реакции расщепления сложных
органических соединений на более простые путем присоединения молекул
воды в месте разрыва химической связи (гидролиз). Например, амилаза (гидролизирует
крахмал), липаза (расщепляет жиры), трипсин (расщепляет белки) и др.: АВ + Н20 АОН + ВН. |
| Лиазы | Негидролитическое присоединение к субстрату или отщепление от него группы атомов. При этом могут разрываться связи С-С, C-N, С-О, C-S. Например, декарбоксилаза отщепляет карбоксильную группу: |
| Изомеразы | Внутримолекулярные перестройки,
превращение одного изомера в другой (изомеризация): глюкозо-6-фосфат глюкозо-1-фосфат. |
| Лигазы (синтетазы) | Реакции соединения двух молекул с
образованием новых связей С–О, С–S, С–N, С–С, с использованием энергии
АТФ. Например, фермент валин-тРНК-синтетаза, под действием которого
образуется комплекс валин– тРНК: АТФ + валин + тРНК АДФ + Н3Р04 + валин-тРНК. |
Механизм действия фермента представлен на рис. 4. В молекуле каждого фермента имеется активный центр – это один или более участков, в которых происходит катализ за счет тесного контакта между молекулами фермента и специфического вещества (субстрата). Активным центром выступает или функциональная группа (например, ОН-группа), или отдельная аминокислота. Активный центр может формироваться связанными с ферментом ионами металлов, витаминами и другими соединениями небелковой природы – коферментами или кофакторами. Форма и химическое строение активного центра таковы, что с ним могут связываться только определенные субстраты в силу их идеального соответствия (комплементарности) друг другу.
Молекула фермента изменяет глобулярную форму молекулы субстрата. Молекула субстрата, присоединяясь к ферменту, тоже в определенных пределах изменяет свою конфигурацию для увеличения реакционности функциональных групп центра.
На заключительном этапе химической реакции фермент-субстратный комплекс распадается с образованием конечных продуктов и свободного фермента. Освободившийся при этом активный центр может принимать новые молекулы субстрата.
II. Обобщающая беседа об основополагающей роли белков как самых необходимых химических соединений для жизней деятельности всего живого на Земле.
III. Закрепление знаний в процессе беседы с помощью следующих вопросов:
- Какие органические вещества клетки можно назвать самыми важными?
- Каким образом создается бесконечное разнообразие белков?
- Что собой представляют мономеры биополимера белка?
- Как формируется пептидная связь?
- Что собой представляет первичная структура белка?
- Каким образом происходит переход первичной структуры молекул белка во вторичную, а затем– в третичную и четвертичную?
- Какие функции могут выполнять белковые молекулы?
- Чем обусловлено многообразие функций белковых молекул?
- Приведите примеры белков, выполняющих самые разные функции. При ответе можно использовать следующую схему:
Биологические функции белков.
Это интересно.
Многие молекулы очень велики и по длине, и по молекулярной массе. Так, молекулярная масса инсулина – 5700, белка-фермента рибонуклеазы – 127 ООО, яичного альбумина – 36 ООО, гемоглобина – 65 ООО. В состав различных белков входят самые разные аминокислоты. Набор всех двадцати видов аминокислот содержит: казеин молока, миозин мышц и альбумин яйца. В белке-ферменте рибонуклеазе – 19, в инсулине – 18 аминокислот. Коллективу ученых под руководством академика Ю.А. Овчинникова удалось расшифровать сложную структуру белка родопсина, ответственного за процесс зрительного восприятия.
Кровь осьминогов, моллюсков и пауков имеет голубой цвет, потому что переносчиком кислорода у них служит не красный гемоглобин, содержащий атомы железа, а гемоцианин с атомами меди.
Почти половина необходимых нам белков, углеводов, 70–80% витаминов, значительное количество минеральных солей, аминокислот и других питательных элементов содержится в хлебе.
Американские ученые выделили из растения (семейство Пентадипландовых), произрастающего в Западной Африке, белок, который слаще сахара в 2 тыс. раз. Этот шестой известный науке сладкий белок, названный бразеином, содержится в плодах, которые с большой охотой поедают местные обезьяны. Биохимики расшифровали строение молекул сладкого белка, в каждой из них содержится 54 аминокислотных остатка.
IV. Домашнее задание: Изучить § 11, ответить на вопросы на с. 46. Приготовить сообщения или рефераты на темы: “Белки – биополимеры жизни”, “Функции белков – основа жизнедеятельности каждого организма на Земле”, “Денатурация и ренатурация, ее практическое значение”, “Многообразие ферментов, их роль в жизнедеятельности клеток и организмов” и др.
Используемые ресурсы:
- Каменский А.А.Общая биология 10–11: учеб.для общеобразоват. учреждений.– М.:Дрофа, 2006.
- Козлова Т.А. Тематическое и поурочное планирование по биологии к учебнику А.А.Каменского и др. “Общая биология 10–11”. – М.: Издательство “Экзамен”, 2006.
- Биология. Общая биология. 10–11 классы: рабочая тетрадь к учебнику Каменского А.А. и др. “Общая биология 10–11”– М.: Дрофа, 2011.
- Кириленко А.А. Молекулярная биология. Сборник заданий для подготовки к ЕГЭ: уровни А,В,С: учебно-методическое пособие. – Ростов н/Д: Легион, 2011.
6.08.2012
xn--i1abbnckbmcl9fb.xn--p1ai
Белки
Человеческий организм состоит из ста триллионов клеток, каждая клетка состоит из сотен миллионов молекул белка. Белки ─ это строительные материалы и живые нано-машины нашего тела.
По сравнению с липидами и углеводами белки являются наиболее важными для организма.
Каждый из сотен тысяч разных белков обладает неповторимой пространственной структурой. И у каждого белка своя задача и функция. Есть белки костной и мышечной ткани, белки тканей кожи и мозга. Белки ферменты и рецепторы.
Если в организме отсутствует хотя бы один белок (например, белковый гормон инсулин) жизнь человека в опасности, так как инсулин оказывает многогранное влияние на обмен практически во всех тканях.
Основное действие инсулина заключается в снижении концентрации глюкозы в крови.
Белки — это самые сложные молекулярные системы, имеющиеся в природе.
Кроме углерода, кислорода, водорода и азота в состав белков могут входить сера, фосфор, железо.
Белки построены из мономеров, которыми являются аминокислоты.
Среди двухсот известных аминокислот только 20 из них участвуют во внутриклеточном синтезе белков. Их называют протеиногенными или стандартными аминокислотами. Вопрос, почему именно эти 20 аминокислот стали «избранными», остаётся нерешённым. Не совсем ясно, чем эти аминокислоты оказались предпочтительнее других похожих.
Из 20 аминокислот, входящих в состав белков, может быть образовано вот такое число комбинаций различных белков, которые будут обладать совершенно одинаковым составом, но различным строением.
Все аминокислоты подразделяют на заменимые и незаменимые.
Заменимые аминокислоты синтезируются в организме человека, к ним относят: аланин, аргинин, аспарагин, аспарагиновую кислоту, глицин, глутамин, глутаминовую кислоту, пролин, серин, тирозин и цистеин.
Незаменимые аминокислоты в организме не синтезируются и должны в обязательном порядке поступать с пищей. Это валин, гистидин, изолейцин, лейцин, лизин, метионин, треонин, триптофан, фенилаланин. Содержатся они в основном в продуктах животного происхождения.
Для удобства названия аминокислот имеют общепринятые сокращения.
Молекула аминокислоты состоит из двух одинаковых для всех аминокислот частей, одна из которых является аминогруппой (─Nh4), с основными свойствами, другая – карбоксильной группой (─COOH) с кислотными свойствами.
Часть молекулы, которая называется радикалом (в формулах она обычно обозначается большой латинской буквой эр R), у разных аминокислот имеет различное строение.
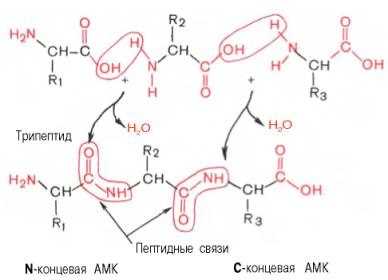
Аминокислоты соединяются между собой. Так образуется молекула, которая представляет собой пептид. Эта реакция называется (полимеризацией).
В процессе полимеризации выделяется молекула воды, а освободившиеся электроны образуют ковалентную связь, которая получила название пептидной. Это связь между атомами углерода и азота.
Поскольку на одном конце дипептида находится свободная аминогруппа, а на другом – свободная карбоксильная группа, дипептид может присоединять к себе другие аминокислоты.
Также белки могут состоять и из большого числа аминокислотных остатков. И кроме того каждая аминокислота может встречаться в белке несколько раз.
В состав белка может входить одна, две и более полипептидные цепи. Например, в молекуле инсулина – две цепи, а иммуноглобулины состоят из четырёх цепей.
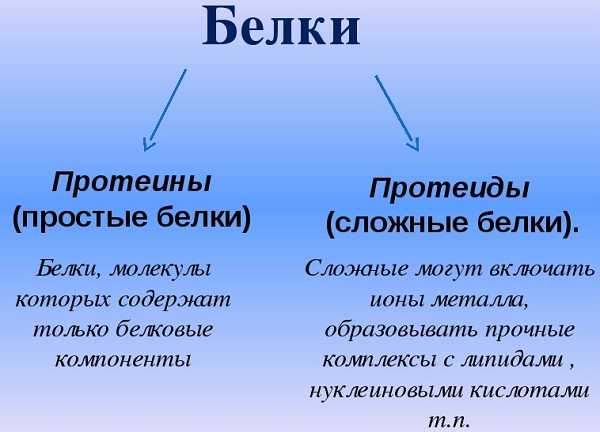
Среди белков различают протеины, состоящие только из белков и протеиды, содержащие не белковую часть. Например, гемоглобин.
Гемоглобин является сложным белком класса хромопротеинов, то есть в качестве небелкового компонента здесь выступает особая пигментная группа, содержащая железо, — гем.
Гемоглобин человека является тетрамером, то есть состоит из четырёх субъединиц. У взрослого человека они представлены полипептидными цепями α1 (альфа-1), α2, β1(бета-1) и β2.
Четвертичная структура гемоглобина придаёт ему способность регулировать присоединение и отщепление кислорода.
Гемоглобин является одним из основных белков, которыми питаются малярийные плазмодии — возбудители малярии. В эндемичных по малярии районах земного шара весьма распространены наследственные аномалии строения гемоглобина.
Эритроцит при этом приобретает форму серпа. Из-за этого малярийный плазмодий не проникает в эритроцит и не питается белком-гемоглобином. Изменение в форме эритроцита приводит к заболеванию серповидноклеточной анемии.
Если белки состоят только из аминокислот, то их называют простыми.
Если в состав белков входят компоненты неаминокислотной природы, то такие белки относят к сложным.
Если в состав сложных белков входят углеводы, то их называют гликопротеиды. Если входят жиры – то липопротеиды, а если нуклеиновые кислоты – нуклеопротеиды.
Именно строение белковых молекул определяет многообразие функций белков и их особую роль в жизненных процессах. Поэтому исследование структуры белков ─ самая важная стадия познания явлений, происходящих в живой клетке.
Попытаемся обнаружить белок, выявить его присутствие.
Белок можно выявить при помощи его денатурации.
Денатурация — это утрата белковой молекулой своей первоначальной структуры.
Денатурация может возникать под воздействием нагревания (температуры), химических веществ (например, кислот, оснований, органических растворителей), обезвоживания, облучения и других факторов, в результате которых свойство белковых молекул резко изменяется.
Зажигаем спиртовку, наливаем в демонстрационную пробирку каллоидный раствор белка в дистиллированной воде. Закрепляем пробирку в держалке и осторожно нагреваем содержимое пробирки. Уже при небольшом нагревании хорошо видны изменения, происходящие в растворе. Он перестаёт быть прозрачным, появляется белый осадок. Это и есть свернувшийся белок. Температура (нагревание) вызывает свёртывание коллоидного раствора белка.
Следующий опыт
В пробирку с коллоидным раствором белка в дистиллированной воде добавляем разбавленный раствор азотной кислоты. Признак реакции ─ образование осадка. Белок денатурирован.
Третий опыт
Денатурация белка происходит и под действием растворов солей тяжёлых метоллов. К раствору белка добавляем раствор сульфата меди. Признаком реакции является образование белого непрозрачного осадка. Это и есть денатурированный белок.
Обнаружив белок, мы ничего не можем сказать о его составе, структуре, свойствах. Что бы ответить на все эти вопросы необходимо, пряже всего, выделить белок — получить его в чистом виде. Существует множество методов получения белков в чистом виде.
Процесс, обратный денатурации, при котором белки возвращают свою природную структуру, называется ренатурацией.
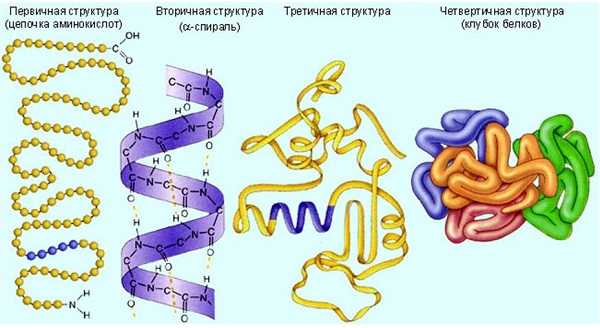
Уровни организации белковой молекулы
Молекулы белков могут принимать различные пространственные формы – конформации, которые представляют собой четыре уровня их организации.
Последовательное чередование различных аминокислотных звеньев в полипептидной цепи называется – первичной структурой белковой молекулы. Она уникальна для любого белка и определяет его форму, свойства и функции.
Молекула белка обладает определённой пространственной формой – это вторичная структура. Такая структура поддерживается водородными связями. Водородные связи возникают межу амино- и карбоксильными группами амикислотных остатков полипептидной цепи.
Водородные связи фиксируют различные пространственные структуры. Хотя они и малопрочные, но из-за того, что их большое количество, – вторичная структура белка достаточно прочна.
Части белковой молекулы могут организовываться в спираль или в другие виды вторичной структуры.
Третичная структура белка имеет вид клубка (глобулы). Третичная структура — это трёхмерная организация белковой молекулы. Она поддерживается водородными и дисульфидными (-S-S-) связями между остатками цисцеина (аминокислоты), а также гидрофобными взаимодействиями.
Существует и четвертичная структура белка. Однако она характерна не для всех молекул белка. Четвертичная структура возникает в результате соединения нескольких глобул в сложный комплекс. Например, гемоглобин крови состоит из четырёх таких субъединиц.
Как вы уже поняли, белки многочисленны и многообразны. И у каждого белка своя задача и функция.
Рассмотрим некоторые из них.
Структурная функция белков. Так как белки являются основой всех биологических мембран, они выполняют строительную функцию.
Белок коллаген — важный составной компонент соединительных тканей.
Эластин — эластичный компонент связок, стенок кровеносных сосудов.
Кератин — фибриллярный белок, обладающий механической прочностью, которая среди материалов биологического происхождения уступает лишь хитину. В основном из кератинов состоят роговые производные эпидермиса кожи — такие структуры, как волосы, ногти, рога, перья и роговой чехол, который покрывает клюв птиц.
Ферментативная функция белков.
Ферменты — вещества белковой природы. Их молекулы состоят в основном из аминокислотных звеньев.
Ферменты специфичны для каждого вещества. Основная функция их — это ускорение биохимических реакций организма, реакций распада и синтеза.
Они действуют в строго определённой последовательности.
Почему так? Дело в том, что избирательность действия ферментов на разные химические вещества связана с их строением. Ферменты имеют специфические активные участки (центры), с которыми связываются субстраты.
Форма и химическое строение активного центра таково, что с ним могут связаться только определённые молекулы в силу их пространственного соответствия, они подходят друг к другу, как ключ к замку. Связывание субстрата осуществляется именно в активном центре фермента.
Одни ферментные системы направляют процессы биосинтеза. Этот процесс требует затрат энергии.
Другие ферментные системы регулируют распад и окисление веществ. При этих реакциях энергия выделяется.
На заключительном этапе химической реакции комплекс распадается с образованием конечных продуктов и свободного фермента.
Освободившийся при этом активный центр фермента может снова принимать новые молекулы вещества – субстрата.
Многие ферменты как мы уже сказали представлены белковыми молекулами. Другие состоят не только из белка, но и из небелкового соединения (кофермента). В качестве кофермента могут выступать различные вещества, но, как правило, это витамины и ионы металлов.
Отсутствие витамина в пище сначала приводит к недостаточному образованию кофермента, а без него не может работать (активироваться) соответствующий фермент. Поэтому скорость биохимической реакции, за которую отвечает этот фермент, значительно падает. Итогом этого становится нарушение обмена веществ.
Транспортная функция белков имеет важное значение. Так, гемоглобин переносит кислород из лёгких к клеткам других тканей.
В мышцах эту функцию выполняет белок миоглобин.
Сывороточный альбумин крови способствует переносу липидов и жирных кислот, различных биологически активных веществ.
Белки-переносчики осуществляют перенос веществ через клеточные мембраны.
Специфические белки выполняют защитную функцию. Они предохраняют организм от вторжения чужеродных организмов и от повреждения.
Например, на проникновение в организм чужеродных белков реагирует иммунная система организма. Она бросает против них целую армию своих белков, так называемых антител.
Антитела являются особым классом гликопротеинов, имеющихся на поверхности B-лимфоцитов в виде мембраносвязанных рецепторов.
При помощи антиген-связывающих участков антитела присоединяются к вирусам и бактериям, чужеродным белкам, препятствуя их размножению.
Ещё один важный белок нашего организма — интерферон, — универсальный противовирусный белок.
Фибриноген и тромбин предохраняют организм от кровопотери, образуя тромб.
Многие живые существа для обеспечения защиты выделяют белки, называемые токсинами, которые в большинстве случаев являются сильными ядами.
Регуляторная функция белков
Она присуща белкам-гормонам (регуляторам). Они регулируют различные физиологические процессы.
Например, наиболее известным гормоном является упомянутый выше инсулин, регулирующий содержание глюкозы в крови. При недостатке инсулина в организме возникает заболевание, известное как сахарный диабет.
Белки могут выполнять энергетическую функцию, являясь одним из источников энергии в клетке. При полном расщеплении 1 г белка до конечных продуктов выделяется 17,6 кДж энергии.
Но в качестве источника энергии белки используются в последнюю очередь, после углеводов и жиров. Аминокислоты, высвобождающиеся при расщеплении белковых молекул, используются для построения новых белков.
Таким образом роль белков огромна. Современная биология показала, что сходство и различие организмов определяются в конечном счёте набором белков. Чем ближе организмы друг к другу в систематическом положении, тем более сходны их белки.
videouroki.net
Защитная функция белков. Строение и функции белков
Белки являются основой всех живых организмов. Именно эти вещества выступают компонентом клеточных мембран, органелл, хрящей, сухожилий и роговых производных кожи. Однако защитная функция белков — одна из самых важных.
Белки: особенности строения
Наряду с липидами, углеводами и нуклеиновыми кислотами белки являются органическими веществами, составляющими основу живых существ. Все они — природные биополимеры. Эти вещества состоят из многократно повторяющихся структурных единиц. Они называются мономеры. Для белков такими структурными единицами являются аминокислоты. Соединяясь в цепочки, они образуют крупную макромолекулу.
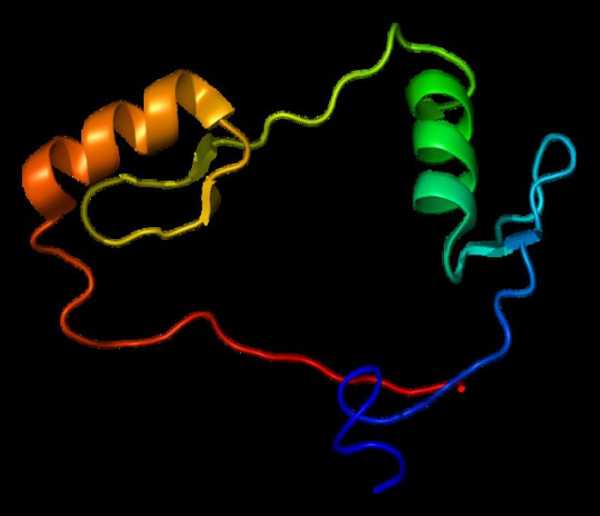
Уровни пространственной организации белка
Цепочка, состоящая из двадцати аминокислот, может образовывать различные структуры. Это уровни пространственной организации или конформации белка. Первичная структура представлена цепью из аминокислот. Когда она закручивается в спираль, возникает вторичная. Третичная структура возникает при закручивании предыдущей конформации в клубок или глобулу. А вот следующая структура самая сложная — четвертичная. Она состоит из нескольких глобул.
Свойства белков
Если четвертичная структура разрушается до первичной, а именно до цепи аминокислот, то происходит процесс, который называется денатурацией. Он обратим. Цепочка аминокислот способна снова образовать более сложные структуры. А вот когда происходит деструкция, т.е. разрушение первичной структуры, белок восстановить уже невозможно. Такой процесс является необратимым. Деструкцию осуществлял каждый из нас, когда термически обрабатывал продукты, состоящие из белка — куриные яйца, рыбу, мясо.

Функции белков: таблица
Белковые молекулы очень многобразны. Это обусловливает широкий спектр их возможностей, которые обусловлены строением аминокислот. Функции белков (таблица содержит необходимую информацию) являются необходимым условием существования живых организмов.
| Функция белка | Значение и суть процесса | Название белков, осуществляющих функцию |
Строительная (структурная) | Белок является строительным материалом для всех структур организма: от мембран клетки до мышц и связок. | Коллаген, фиброин |
| Энергетическая | При расщеплении белков выделяется энергия, необходимая для осуществления процессов жизнедеятельности организма (1 г белка — 17, 2 кДж энергии). | Проламин |
| Сигнальная | Белковые соединения клеточных мембран способны распознавать специфические вещества из окружающей среды. | Гликопротеиды |
| Сократительная | Обеспечение двигательной активности. | Актин, миозин |
| Резервная | Запас питательных веществ. | Эндосперм семян |
| Транспортная | Обеспечение газообмена. | Гемоглобин |
| Регуляторная | Регуляция химических и физиологических процессов в организме. | Белки гормонов |
| Каталитическая | Ускорение протекания химических реакций. | Ферменты (энзимы) |
Защитная функция белков в организме
Как видите, функции белков очень разнообразны и важны по своему значению. Но мы не упомянули еще об одной из них. Защитная функция белков в организме заключается в предотвращении проникновения чужеродных веществ, которые могут нанести существенный вред организму. Если же это произошло, специализированные белки способны их обезвредить. Эти защитники называются антителами или иммуноглобулинами.
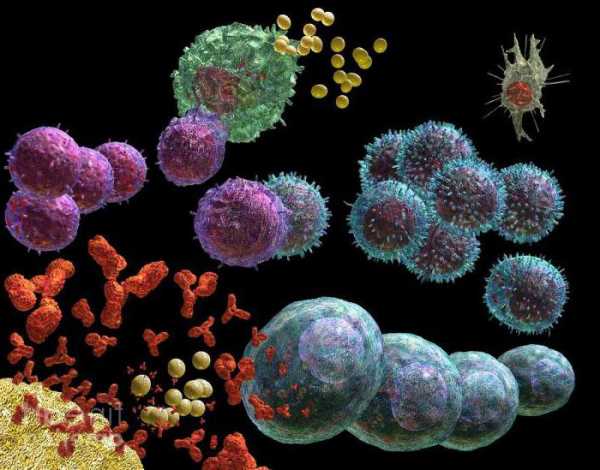
Процесс формирования иммунитета
С каждым вздохом в наш организм проникают болезнетворные бактерии и вирусы. Они попадают в кровь, где начинают активно размножаться. Однако на их пути встает значительная преграда. Это белки плазмы крови — иммуноглобулины или антитела. Они являются специализированными и характеризуются способностью распознавать и обезвреживать чужеродные для организма вещества и структуры. Они называются антигенами. Так проявляется защитная функция белков. Примеры ее можно продолжить информацией об интерфероне. Этот белок также является специализированным и распознает вирусы. Это вещество даже является основой многих иммуностимулирующих лекарственных препаратов.
Благодаря наличию защитных белков организм способен противостоять болезнетворным частицам, т.е. у него формируется иммунитет. Он может быть врожденным и приобретенным. Первым все организмы наделены еще с момента появления на свет, благодаря чему и возможна жизнь. А приобретенный появляется после перенесения различных инфекционных заболеваний.
Механическая защита
Белки выполняют защитную функцию, непосредственно предохраняя клетки и весь организм от механических воздействий. К примеру, наружный скелет ракообразных играет роль панциря, надежно защищая все содержимое. Кости, мышцы и хрящи образуют основу организма, и не только предотвращают повреждение мягких тканей и органов, но и обеспечивают его передвижение в пространстве.
Образование тромбов
Процесс свертывания крови — это также защитная функция белков. Он возможен благодаря наличию специализированных клеток — тромбоцитов. При повреждении кровеносных сосудов они разрушаются. В результате растворимый белок плазмы фибриноген превращается в его нерастворимую форму — фибрин. Это сложный ферментативный процесс, в результате которого нити фибрина очень часто переплетаются и образуют густую сеть, которая препятствует вытеканию крови. Другими словами, образуется сгусток крови или тромб. Это является защитной реакцией организма. При нормальной жизнедеятельности этот процесс длится максимум до десяти минут. Но при болезни несвертываемости крови — гемофилии, которой страдают в основном мужчины, человек может погибнуть даже при незначительном ранении.
Однако если тромбы образуются внутри кровеносного сосуда, это может быть очень опасно. В некоторых случаях это даже приводит к нарушению его целостности и внутреннему кровоизлиянию. В этом случае рекомендованы препараты, наоборот, разжижающие кровь.
Химическая защита
Защитная функция белков проявляется и в химической борьбе с болезнетворными веществами. И начинается она уже в ротовой полости. Попадая в нее, пища вызывает рефлекторное выделение слюны. Основу этого вещества составляет вода, ферменты, которые расщепляют полисахариды и лизоцим. Именно последнее вещество обезвреживает вредоносные молекулы, защищая организм от их дальнейшего воздействия. Содержится он и в слизистых оболочках желудочно-кишечного тракта, и в слезной жидкости, которая омывает роговицу глаза. В большом количестве лизоцим находится в грудном молоке, слизи носоглотки и белке куриных яиц.
Итак, защитная функция белков проявляется в первую очередь в обезвреживании бактериальных и вирусных частиц в крови организма. В результате у него формируется способность противостоять болезнетворным агентам. Ее и называют иммунитетом. Белки, которые входят в состав наружного и внутреннего скелета, защищают внутреннее содержимое от механических повреждений. А белковые вещества, находящиеся в слюне и других средах, предотвращают действие на организм химических агентов. Другими словами, защитная функция белков заключается в обеспечении необходимых условий для всех процессов жизнедеятельности.
fb.ru
Что такое белки — строение и функции
Белки играют центральную роль в организме человека, выполняя одни из самых важных функций: двигательную, защитную, биологическую, регуляторную и другие.
Без этих универсальных молекулярных машин жизнь на нашей планете и вовсе не могла бы появиться.
В данной статье мы подробно рассмотрим что такое белки, какие существуют виды, где содержатся и многое другое.
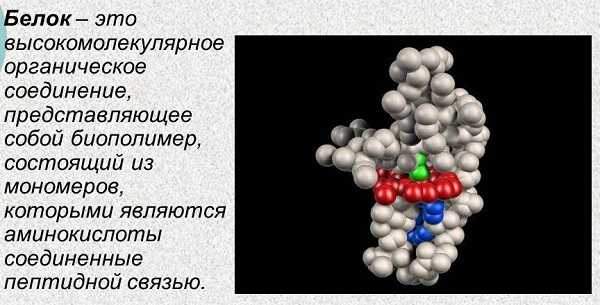
Что такое белок и каковы его функции
На уроках биологии и химии довольно много времени уделяется этой важной теме. Белки (protein) являются природными гетерополимерами, состоящие из α-аминокислот. Соединяет их вместе пептидная связь. Для синтеза огромного множества белков в человеческом организме используется 20.
Состав каждого белка, синтезированного в организме, определяется геномом. Различные комбинации генетического кода позволяют создавать из стандартных аминокислот огромное множество белков, отвечающих за разнообразные функции в нашем теле.
Некоторые белки довольно сложно классифицировать исключительно по их функциям. Так как один белок часто может отвечать за выполнение нескольких задач.
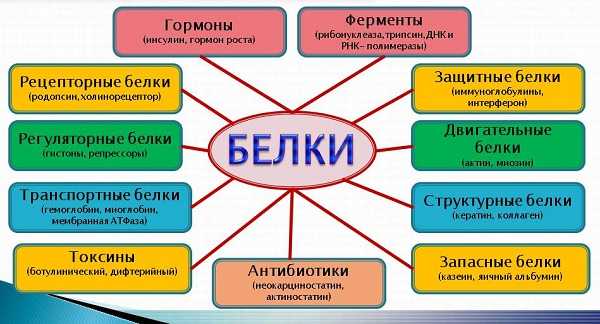
Список функций белков выглядит следующим образом:
- Структурная – отвечает за образование цитоскелета клеток, придает форму разным тканям. Наиболее известные — это коллагены и эластин, входящие в состав межклеточного вещества. А также кератин – основной белок, формирующий ногти и волосы.
- Защитная функция разделяется на физическую, иммунную и химическую. За физическую защиту в основном отвечают тромбины, свертывающие кровь, и коллагены и кератин, формирующие роговые щитки, волосы, кожу. Химическую защиту от различных токсинов в организме выполняют в основном ферменты печени. Они растворяют токсины, позволяя быстрее вывести их. За иммунную защиту отвечают различные иммуноглобулины.
- Каталитическая функция использует ферменты. Это особые белки, позволяющие катализировать реакции, расщепляющие большие молекулы, или же наоборот их синтезировать. Ферменты позволяют ускорять все химические реакции в сотни и тысячи раз. За последнее время науке стало известно свыше 5000 различных ферментов.
- Регуляторная функция отвечает за управление всей жизнедеятельностью клетки. Белки из данной группы регулируют количество и активность остальных белков, а также множество процессов внутри самой клетки.
- Сигнальная функция выполняется гормонами и цитокинами. Эти белки являются сигнальным веществом, позволяя передавать информацию или сигналы частями организма.
- Транспортная – позволяет переносить различные вещества от одних органов и клеток к другим. Наиболее известный пример – это гемоглобин, транспортирующий кислород и углекислый газ.
- Запасная функция. Ее выполняют белки, запасающиеся в организме для экстренных случаев в качестве энергии или источника аминокислот.
- Рецепторная. Ее выполняют белки, реагирующие свет, физическое воздействие или химическое вещество.
- Моторная функция выполняется целыми группами белков. Среди них, например, актин и миозин. Они являются основными компонентами мышц и позволяют им сокращаться. Другие белки позволяют клеткам лейкоцитов передвигаться внутри организма.
Строение белков
Беки относятся к линейным полимерам. В их составе могут присутствовать несколько α-амиокислот и неаминокислотные компоненты. На первый взгляд всего 20 аминокислот – это небольшой выбор.
Но на самом деле молекула белка, состоящая всего из 5 компонентов аминокислот, может иметь свыше миллиона вариантов построения. Небольшой белок может иметь в своей цепочке сотню аминокислотных остатков.
При синтезе белка аминокислоты соединяются благодаря пептидной связи. Они соединяются разными концами, одна с помощью карбоксильной группы (-COOH), а другая аминогруппой (-NH2). При таком соединении у белка появляются два соответственных конца С и N.
Структуры белков
Структурные организации белков классифицируют на 4 уровня. Это первичная, вторичная, третичная и четвертичная структуры.
Первичная представляет собой стандартную цепочку аминокислот. Их последовательность закодирована генетически. Она обычно описывается трехбуквенными обозначениями аминокислотных остатков в цепочке.
Вторичная представляет собой упорядоченно свернутую спиралеобразно цепочку аминокислот. Она напоминает пружинку. У спирали стабильная структура, так как ее витки крепятся между собой водородными связями. Почти все СО- и NН- группы устанавливают друг с другом такие связи. Среди белков данной структуры особенно выделяются коллагены и кератин.
Третичная – в основном формируется благодаря гидрофильно-гидрофобным взаимодействиям. Возникающие водородные ионные и дисульфидные связи способствуют взаимодействию между радикалами аминокислот. Благодаря этому полипептидная связь укладывается в специальные глобулы. К белкам третичной структуры уже относятся множество ферментов, антител и гормонов.
Четвертичная – присуща сложным формам ферментов или белков, которые состоят из 2 или 3 глобул. Они связываются в молекуле как ионными, так и гидрофобными взаимодействиями. А иногда возникают электростатические взаимодействия или дисульфидные связи. Наиболее известный и изученный белок данной классификации – гемоглобин.
Протеины и протеиды — простые и сложные белки
Еще одна классификация белков это – протеины и протеиды. Первые — это простые белки, в состав которых входят исключительно остатки аминокислот. А вот в протеидах, помимо основного скелета из аминокислот, присутствуют еще не белковые группы (простетические).
В зависимости от дополнительной небелковой составляющей протеиды делят на другие группы:
- Липопротеины – включают в себя различные липиды. В основном данные белки выполняют транспортировку липидов.
- Фосфопротеины – имеют фосфорную кислоту. К таким белкам относятся вителлин и казеноген.
- Металлопротеины – могут иметь катионы одного и более металлов в своей структуре. Наиболее известен гемоглобин с молекулами железа.
- Гликопротеины – имеют в своем составе различные углеводы.
- Нуклеопротеины – являются главными белками, отвечающими за передачу наследственной информации.
Физико-химические свойства белков
Белки проявляют свойства амфотерности (от греч. «двойственность). Они могут в зависимости от различных факторов проявлять как кислотные, так и основные свойства.

Также белки могут быть растворимыми или не растворимыми в воде. На растворимость могут влиять как сама структура белка, так и характер растворителя, pH самого раствора или ионная сила.
Белки могут быть гидрофобными или гидрофильными. Последние в основном располагаются в ядре, цитоплазме или межклеточном веществе.
Еще одно свойство белков это денатурация. Это так называемая потеря четвертичной, третичной структур. Белки отлично приспособлены для жизни и функционирования в условиях организма, но при резком изменении внешних условий структура белка может разрушиться.
Среди таких воздействий выделяют ультразвук, высокие и низкие температуры, облучения, встряхивания, вибрации, а также действие кислот или щелочей. Денатурация может быть как частичной, так и полной, или же обратимой и необратимой.
Значение белков для организма
Как мы увидели из вышеприведенных функций и особенностей, белки имеют огромное значение для организма человека. Они придают форму клеткам и тканям организма, переносят различные элементы между органами и клетками, отвечают за восприятие окружающего мира.
Белки защищают нас от природных факторов и от воздействий вредоносных микроорганизмов. Без них в принципе невозможно как минимум прохождение химических реакций в организме и обмен веществ, так и наличие жизни как самовоспроизводящейся структуры. По истине, роль белков сложно переоценить.
Что относится к белковой пище
Белки являются одним из самых основных строительных материалов для нашего организма. Поэтому, чтобы питание снабжало организм человека нужными веществами, следует всегда иметь в рационе белковые продукты.

Богаты по содержанию белка следующие:
- мясо;
- рыба;
- различные морепродукты;
- яйца;
- бобовые;
- молочные продукты.
Заключение
Белок является одним из ключевых элементов жизни на нашей планете. Он отвечает за множество процессов и функций в живом организме, а недостаток белков может вызвать серьезные заболевания.
Большое разнообразие источников белка убережет ваш организм от недостатка незаменимых аминокислот и множества других ценных элементов питания. Старайтесь не исключать белковые продукты из рациона и будьте здоровы.
1001student.ru
Строение белковБелки — высокомолекулярные органические соединения, состоящие из остатков α-аминокислот. В состав белков входят углерод, водород, азот, кислород, сера. Часть белков образует комплексы с другими молекулами, содержащими фосфор, железо, цинк и медь. Белки обладают большой молекулярной массой: яичный альбумин — 36 000, гемоглобин — 152 000, миозин — 500 000. Для сравнения: молекулярная масса спирта — 46, уксусной кислоты — 60, бензола — 78. Аминокислотный состав белковБелки — непериодические полимеры, мономерами которых являются α-аминокислоты. Обычно в качестве мономеров белков называют 20 видов α-аминокислот, хотя в клетках и тканях их обнаружено свыше 170. В зависимости от того, могут ли аминокислоты синтезироваться в организме человека и других животных, различают: заменимые аминокислоты — могут синтезироваться; незаменимые аминокислоты — не могут синтезироваться. Незаменимые аминокислоты должны поступать в организм вместе с пищей. Растения синтезируют все виды аминокислот. В зависимости от аминокислотного состава, белки бывают: полноценными — содержат весь набор аминокислот;неполноценными — какие-то аминокислоты в их составе отсутствуют. Если белки состоят только из аминокислот, их называютпростыми. Если белки содержат помимо аминокислот еще и неаминокислотный компонент (простетическую группу), их называютсложными. Простетическая группа может быть представлена металлами (металлопротеины), углеводами (гликопротеины), липидами (липопротеины), нуклеиновыми кислотами (нуклеопротеины). Все аминокислоты содержат: 1) карбоксильную группу (–СООН), 2) аминогруппу (–NH2), 3) радикал или R-группу (остальная часть молекулы). Строение радикала у разных видов аминокислот — различное. В зависимости от количества аминогрупп и карбоксильных групп, входящих в состав аминокислот, различают:нейтральные аминокислоты, имеющие одну карбоксильную группу и одну аминогруппу; основные аминокислоты, имеющие более одной аминогруппы; кислые аминокислоты, имеющие более одной карбоксильной группы. Аминокислоты являются амфотерными соединениями, так как в растворе они могут выступать как в роли кислот, так и оснований. В водных растворах аминокислоты существуют в разных ионных формах. Пептидная связьПептиды — органические вещества, состоящие из остатков аминокислот, соединенных пептидной связью. Образование пептидов происходит в результате реакции конденсации аминокислот. При взаимодействии аминогруппы одной аминокислоты с карбоксильной группой другой между ними возникает ковалентная азот-углеродная связь, которую и называютпептидной. В зависимости от количества аминокислотных остатков, входящих в состав пептида, различают дипептиды, трипептиды, тетрапептиды и т.д. Образование пептидной связи может повторяться многократно. Это приводит к образованиюполипептидов. На одном конце пептида находится свободная аминогруппа (его называют N-концом), а на другом — свободная карбоксильная группа (его называют С-концом). Пространственная организация белковых молекулВыполнение белками определенных специфических функций зависит от пространственной конфигурации их молекул, кроме того, клетке энергетически невыгодно держать белки в развернутой форме, в виде цепочки, поэтому полипептидные цепи подвергаются укладке, приобретая определенную трехмерную структуру, или конформацию. Выделяют 4 уровня пространственной организации белков. Первичная структура белка — последовательность расположения аминокислотных остатков в полипептидной цепи, составляющей молекулу белка. Связь между аминокислотами — пептидная. Если молекула белка состоит всего из 10 аминокислотных остатков, то число теоретически возможных вариантов белковых молекул, отличающихся порядком чередования аминокислот, — 1020. Имея 20 аминокислот, можно составить из них еще большее количество разнообразных комбинаций. В организме человека обнаружено порядка десяти тысяч различных белков, которые отличаются как друг от друга, так и от белков других организмов. Именно первичная структура белковой молекулы определяет свойства молекул белка и ее пространственную конфигурацию. Замена всего лишь одной аминокислоты на другую в полипептидной цепочке приводит к изменению свойств и функций белка. Например, замена в β-субъединице гемоглобина шестой глутаминовой аминокислоты на валин приводит к тому, что молекула гемоглобина в целом не может выполнять свою основную функцию — транспорт кислорода; в таких случаях у человека развивается заболевание — серповидноклеточная анемия. Вторичная структура — упорядоченное свертывание полипептидной цепи в спираль (имеет вид растянутой пружины). Витки спирали укрепляются водородными связями, возникающими между карбоксильными группами и аминогруппами. Практически все СО- и NН-группы принимают участие в образовании водородных связей. Они слабее пептидных, но, повторяясь многократно, придают данной конфигурации устойчивость и жесткость. На уровне вторичной структуры существуют белки: фиброин (шелк, паутина), кератин (волосы, ногти), коллаген (сухожилия). Третичная структура — укладка полипептидных цепей в глобулы, возникающая в результате возникновения химических связей (водородных, ионных, дисульфидных) и установления гидрофобных взаимодействий между радикалами аминокислотных остатков. Основную роль в образовании третичной структуры играют гидрофильно-гидрофобные взаимодействия. В водных растворах гидрофобные радикалы стремятся спрятаться от воды, группируясь внутри глобулы, в то время как гидрофильные радикалы в результате гидратации (взаимодействия с диполями воды) стремятся оказаться на поверхности молекулы. У некоторых белков третичная структура стабилизируется дисульфидными ковалентными связями, возникающими между атомами серы двух остатков цистеина. На уровне третичной структуры существуют ферменты, антитела, некоторые гормоны. 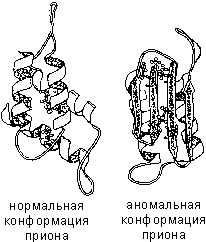 Четвертичная структура характерна для сложных белков, молекулы которых образованы двумя и более глобулами. Субъединицы удерживаются в молекуле благодаря ионным, гидрофобным и электростатическим взаимодействиям. Иногда при образовании четвертичной структуры между субъединицами возникают дисульфидные связи. Наиболее изученным белком, имеющим четвертичную структуру, является гемоглобин. Он образован двумя α-субъединицами (141 аминокислотный остаток) и двумя β-субъединицами (146 аминокислотных остатков). С каждой субъединицей связана молекула гема, содержащая железо. Если по каким-либо причинам пространственная конформация белков отклоняется от нормальной, белок не может выполнять свои функции. Например, причиной «коровьего бешенства» (губкообразной энцефалопатии) является аномальная конформация прионов — поверхностных белков нервных клеток. Свойства белковАминокислотный состав, структура белковой молекулы определяют его свойства. Белки сочетают в себе основные и кислотные свойства, определяемые радикалами аминокислот: чем больше кислых аминокислот в белке, тем ярче выражены его кислотные свойства. Способность отдавать и присоединять Н+ определяют буферные свойства белков; один из самых мощных буферов — гемоглобин в эритроцитах, поддерживающий рН крови на постоянном уровне. Есть белки растворимые (фибриноген), есть нерастворимые, выполняющие механические функции (фиброин, кератин, коллаген). Есть белки активные в химическом отношении (ферменты), есть химически неактивные, устойчивые к воздействию различных условий внешней среды и крайне неустойчивые. Внешние факторы (нагревание, ультрафиолетовое излучение, тяжелые металлы и их соли, изменения рН, радиация, обезвоживание) могут вызывать нарушение структурной организации молекулы белка. Процесс утраты трехмерной конформации, присущей данной молекуле белка, называют денатурацией. Причиной денатурации является разрыв связей, стабилизирующих определенную структуру белка. Первоначально рвутся наиболее слабые связи, а при ужесточении условий и более сильные. Поэтому сначала утрачивается четвертичная, затем третичная и вторичная структуры. Изменение пространственной конфигурации приводит к изменению свойств белка и, как следствие, делает невозможным выполнение белком свойственных ему биологических функций. Если денатурация не сопровождается разрушением первичной структуры, то она может быть обратимой, в этом случае происходит самовосстановление свойственной белку конформации. Такой денатурации подвергаются, например, рецепторные белки мембраны. Процесс восстановления структуры белка после денатурации называется ренатурацией. Если восстановление пространственной конфигурации белка невозможно, то денатурация называется необратимой. Функции белков
ФерментыФерменты, или энзимы, — особый класс белков, являющихся биологическими катализаторами. Благодаря ферментам биохимические реакции протекают с огромной скоростью. Скорость ферментативных реакций в десятки тысяч раз (а иногда и в миллионы) выше скорости реакций, идущих с участием неорганических катализаторов. Вещество, на которое оказывает свое действие фермент, называют субстратом. Ферменты — глобулярные белки, по особенностям строения ферменты можно разделить на две группы: простые и сложные.Простые ферменты являются простыми белками, т.е. состоят только из аминокислот. Сложные ферменты являются сложными белками, т.е. в их состав помимо белковой части входит группа небелковой природы — кофактор. У некоторых ферментов в качестве кофакторов выступают витамины. В молекуле фермента выделяют особую часть, называемую активным центром.Активный центр — небольшой участок фермента (от трех до двенадцати аминокислотных остатков), где и происходит связывание субстрата или субстратов с образованием фермент-субстратного комплекса. По завершении реакции фермент-субстратный комплекс распадается на фермент и продукт (продукты) реакции. Некоторые ферменты имеют (кроме активного)аллостерические центры — участки, к которым присоединяются регуляторы скорости работы фермента (аллостерические ферменты). 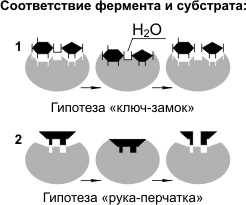 Для реакций ферментативного катализа характерны: 1) высокая эффективность, 2) строгая избирательность и направленность действия, 3) субстратная специфичность, 4) тонкая и точная регуляция. Субстратную и реакционную специфичность реакций ферментативного катализа объясняют гипотезы Э. Фишера (1890 г.) и Д. Кошланда (1959 г.). Э. Фишер (гипотеза «ключ-замок») предположил, что пространственные конфигурации активного центра фермента и субстрата должны точно соответствовать друг другу. Субстрат сравнивается с «ключом», фермент — с «замком». Д. Кошланд (гипотеза «рука-перчатка») предположил, что пространственное соответствие структуры субстрата и активного центра фермента создается лишь в момент их взаимодействия друг с другом. Эту гипотезу еще называют гипотезой индуцированного соответствия. Скорость ферментативных реакций зависит от: 1) температуры, 2) концентрации фермента, 3) концентрации субстрата, 4) рН. Следует подчеркнуть, что поскольку ферменты являются белками, то их активность наиболее высока при физиологически нормальных условиях. Большинство ферментов может работать только при температуре от 0 до 40 °С. В этих пределах скорость реакции повышается примерно в 2 раза при повышении температуры на каждые 10 °С. При температуре выше 40 °С белок подвергается денатурации и активность фермента падает. При температуре, близкой к точке замерзания, ферменты инактивируются. При увеличении количества субстрата скорость ферментативной реакции растет до тех пор, пока количество молекул субстрата не станет равным количеству молекул фермента. При дальнейшем увеличении количества субстрата скорость увеличиваться не будет, так как происходит насыщение активных центров фермента. Увеличение концентрации фермента приводит к усилению каталитической активности, так как в единицу времени преобразованиям подвергается большее количество молекул субстрата. Для каждого фермента существует оптимальное значение рН, при котором он проявляет максимальную активность (пепсин — 2,0, амилаза слюны — 6,8, липаза поджелудочной железы — 9,0). При более высоких или низких значениях рН активность фермента снижается. При резких сдвигах рН фермент денатурирует. Скорость работы аллостерических ферментов регулируется веществами, присоединяющимися к аллостерическим центрам. Если эти вещества ускоряют реакцию, они называются активаторами, если тормозят — ингибиторами. Классификация ферментовПо типу катализируемых химических превращений ферменты разделены на 6 классов:
Классы в свою очередь подразделены на подклассы и подподклассы. В действующей международной классификации каждый фермент имеет определенный шифр, состоящий из четырех чисел, разделенных точками. Первое число — класс, второе — подкласс, третье — подподкласс, четвертое — порядковый номер фермента в данном подподклассе, например, шифр аргиназы — 3.5.3.1. |
lidijavk.ucoz.ru
Белки: их строение, свойства и функции, 10 класс
МОУ «Куровская средняя общеобразовательная школа № 1»
Интегрированный урок
по биологии и химии
в 10 классе
«Белки, их строение, свойства и функции».
( 90 мин.)
Выполнили: учитель биологии Щукарева Любовь Николаевна,
учитель химии Полякова Татьяна Григорьевна.
Цель урока:
1.Дать понятие о белках – природных полимерах, о многообразии их функций о взаимосвязи со строением и свойствами.
2.Информировать школьников о гигиене питания, о сохранении своего здоровья.
Оборудование:
Оборудование и реактивы для лабораторной и практической работ, магнитная доска, модели структур белка, самодельные таблицы, два яйца, музыка.
План урока:
1.Вступление.
2.Основная часть:
— Историческая справка о белках.
— Классификация белков.
— Строение белков.
— Структура белка.
— Свойства белков.(лабораторная работа)
-Логический брифинг.
— Функции белков.(практическая работа)
— Роль белков в организме.
3.Заключение, итоги урока.
Организационный момент.
Д.З.: кроссворд « Белки», биология п.11 учебник «Общая биология 10-11 класс» Пасечник, Криксунов, Каменский.; химия п.27 учебник «Химия 10 класс» Габриелян, Маскаев.
Вступление:
учитель биологии:
На фоне музыки — Н.Басков » Мгновение.» — читает стих С.Я.Надсона:
Меняя каждый миг свой образ прихотливый,
Капризна как дитя и призрачна как дым,
Кипит повсюду жизнь в тревоге суетливой,
Великое смешав с ничтожным и смешным.. .
С чем, с какими материальными объектами связана тайна жизни? Это один из главных вопросов ,на который пыталась ответить наука на протяжении своей истории. Довольно давно ученые поняли, что важную, а может быть, и главную роль во всех жизненных процессах играют белки.
Символом начала жизни всегда было яйцо. Вот почему белок птичьих яиц дал название всему классу белков, которые, как мы знаем теперь, содержатся в любой клетке организма. Когда в XIX веке обнаружили, что белки—главные компоненты живых клеток, все проявления жизни стали связывать только с ними. Экспериментального материала было достаточно, чтобы дать определение жизни:(на доске плакат со словами Ф.Энгельса «Жизнь есть способ существования белковых тел, существенным моментом которого является постоянный обмен веществ с окружающей их внешней природой…причем с прекращением этого обмена веществ прекращается и сама жизнь, что приводит к разложению белка.»
Обращение к классу: Выделите, пожалуйста, ключевые слова в первой части определения. (ЖИЗНЬ И БЕЛОК-понятия взаимосвязанные.)
Учитель биологии: Во 2-ой части наука представляет процесс жизни — это переплетение сложнейших химических процессов взаимодействия белков между собой и другими веществами. Отдельные очищенные белки не характеризуют признаки жизни. Это свойство только сложных систем, состоящих из различных белков и других соединений. Джон Д.Бернал — член королевского общества Британской Академии наук в конце XIX века сказал: «Нельзя приписывать свойство жизни какому-либо одному соединению, оно лишь проявляется в результате многообразных реакций ,в которых участвуют различные соединения.»
Возникает вопрос: не устарело ли определение жизни, данное Энгельсом более 100 лет назад?
Известно несколько десятков определений жизни.
М.В.Волькенштейн- отечественный ученый- современное определение: «Живые тела, существующие на Земле, представляют собой открытые, саморегулирующиеся и самовоспроизводящиеся системы, построенные из биополимеров—белков и нуклеиновых кислот».
( Ответ: Современная наука расширила, углубила и наполнила новыми представлениями понятие жизнь. Открытая система—система, постоянно обменивающаяся веществом и энергией с окружающей средой. Саморегуляция и самовоспроизведение этой системы базируются на свойствах входящих в её состав белков и нуклеиновых кислот.)
Когда 200 лет назад химики начали изучать белки, они и не подозревали, что берут в руки ключ к целому неизвестному миру. Белки и нуклеиновые кислоты – очень важные детали картины мира, они позволили связать воедино, найти точку пересечения мира неживого и мира живого. Постижение тайн белков и нуклеиновых кислот позволило осознать мир как гармоничное целое.
ВЫВОД : Чтобы ответить на вопрос—Что такое жизнь?, нужно прежде всего раскрыть тайну веществ, лежащих в ее основе, т.е. ответить на вопрос — Что такое БЕЛОК.
На сегодняшнем уроке мы закрепим знания, полученные на уроках биологии, а так же узнаем много нового из жизни белков. Мефистофель в «Фаусте» Гёте говорит:
…Живой предмет желая изучить,
Чтоб ясное о нем познанье получить,—
Ученый прежде душу изгоняет,
Затем предмет на части расчленяет…
Класс знакомится с планом урока(он на доске)и получает задание вести конспект урока в тетрадях.
Учитель химии:
а) Историческая справка: Вещества белковой природы известны с древних времен. Изучение их начато в середине 18 века, но только через 100 лет ученым удалось систематизировать свойства изученных белков, определить их состав и сделать вывод, что белки — это главный компонент живых организмов. Большой вклад в изучение белков внёс русский ученый А.Я.Данилевский, один из основоположников отечественной биохимии. В 1888г. он предложил теорию строения белковой молекулы. Экспериментально доказал, что действие сока поджелудочной железы на белки представляет собой гидролиз.(схема на столах)
В 1903 г. немецким учёным Фишером была высказана пептидная теория, давшая ключ к тайне строения белка. Фишер предположил ,что белки представляют собой полимеры аминокислот, соединённых пептидной связью.
Мы знакомы с вами с белком пепсином—он содержится в желудочном соке и участвует в пищеварении, белок тромбин участвует в свёртывании крови, инсулин регулирует обмен глюкозы, гемоглобин транспортирует кислород ко всем клеткам и тканям организма……,белок кератин выполняет строительную функцию ,из него состоял кожа, волосы, перья. Коллаген—компонент соединительной ткани.
б)Классификация белков: Откуда же берется это бесконечное многообразие белковых молекул, многообразие их функций и их особая роль в жизненных процессах? Для того чтобы ответить на эти вопросы обратимся к составу и строению белков.
В состав белков входят атомы водорода (Н), углерода (С),азота (N),
серы (S) кислорода (О). Ферментные белки содержат Р (фосфор), Fе (железо),Сu (медь),Zn(цинк) .Белки обладают рядом особенностей, прежде всего громадной молекулярной массой:
спирт-46,уксусная кислота—60,альбумин—3600, гемоглобин—152000, миозин (белок мышц)—500000.
Вывод: Молекулы белков — это молекулы-великаны, их называют макромолекулами.
Ученик: знакомит с классификацией
Учитель химии:
в)Строение белков.
Среди органических соединений белки самые сложные. Прежде чем говорить о строении белков, надо вспомнить, что такое аминокислоты.
Общая формула аминокислот:
Вопросы классу:
1.Какими свойствами обладают аминокислоты? ( амфотерные органические соединения)
2.Какие функциональные группы обуславливают эти свойства? ( ОН, NН2 ) См.таблицу (на столах листы)
В состав белков входит 20 различных аминокислот, отсюда следует огромное многообразие белков, при их различных комбинациях.Как из 33 букв алфавита мы можем составить бесконечное множество слов, так из 20 аминокислот бесконечное множество белков. В организме человека их насчитывается до 100000.Как же из аминокислот образуется белковая молекула. Упрощённо синтез полипептидов можно изобразить так: (табл. Строение трипептида.)
На магнитной доске -А-А-А-А- полимер .
Ученик работает у доски, другие в тетрадях (Составить трипептид, формулы взять из таблицы, которая лежит на столе)
Вывод: Белок—полимер, мономерами которого являются аминокислоты, соединённые между собой пептидной связью.
Тот факт, что белки всех организмов построены из одних и тех же аминокислот,
ещё одно доказательство единства живого мира на Земле.
Давайте попробуем из простейшего предельного углеводорода метана (СН 4 )путём
последовательных превращений получить дипептид: (ученик у доски )
г)Структура белка: Важнейшей характеристикой строения белка является последовательность, порядок,в которой аминокислоты связаны в цепи.
Ученик знакомит класс со структурами белка.
Вывод: Чем выше форма структурной организации, чем сложнее белок—тем разнообразнее его свойства.
д ) Свойства белка.
1.Раствори мо с т ь:
Некоторые белки ,например, альбумины хорошо растворимы в воде. Типичный представитель альбуминов — белок куриного яйца.Глобулины растворимы в водных растворах солей, глютелиды растворяются только в растворах щелочей.
2. Многие белки проявляют особую чувствительность к теплу.
Уже при t 600С они быстро утрачивают свои природные свойства -денатурируются. При этом частично или полностью разрушаются водородные связи, происходит выпрямление спиралевидной формы. При более высокой t белки свертываются, коагулируют. Денатурация может проходить при облучении или под действием кислот, растворов солей тяжёлых металлов.
З.Гидролиз белков.
При нагреваний белков со щелочами или кислотами происходит гидролиз. Пептидные связи разрываются и происходит восстановление функциональных групп.
Учитель демонстрирует опыт: берет желудочный сок, который содержит соляную кислоту. То, что раствор кислый доказать очень легко при помощи индикатора — лакмус а. Приливаем лакмус к желудочному соку, индикатор в кислой среде становится красным. Добавляем этот раствор к белку. Окраска индикатора меняется. Запишем уравнение гидролиза.
4.Для белков характерны цветные реакции:
а)Биуретовая ,которая доказывает наличие в белковой молекуле пептидных связей.
б)Ксантопротеиновая ,которая доказывает, что в состав белков входят остатки ароматических аминокислот.
Ученик знакомит класс с исследовательской работой — значение цветных реакций в исследовании анализа мочи и крови.
Лабораторная работа (на столах листы с алгоритмом.) звучит тихая музыка
Учитель биологии проводит логический брифинг (по основным понятиям «белки»)
1группа:1.Научное название белка…
2.Процесс восстановления структурной организации белковой
молекулы называется…
3. Структура белка, свернутая в спираль…
4.Связь, соединяющая остатки АК в полимерную цепь…
2 группа: 1. Мономеры, составляющие основу первичной структуры белка…
2.Конфигурация третичной структуры белка…
3.Гормон поджелудочной железы…
4.Процесс, обратный денатурации…
3группа: 1.процесс, обратный денатурации…
2.Разрушение первичной структуры белка…
3.Реакции, определяющие наличие белка…
4.Структура белка, которая определяется последовательностью
аминокислотных остатков за счет образования пептидных связей…
4группа:1.Сложные белки называются…
2.Какие группы атомов отсутствуют формуле АК ……
3.Продукт гидролиза пептидных связей…
4.Что собой представляет четвертичная структура белка…
(Время 5 минут.)
ж)Функции белков.(работа с таблицей (на доске) )
Ученики делают доклады: 1. Каталитическая (ферменты)
2.Практическая работа
3.Регуляторная
4.Транспортная
5.Защитная
6.двигательная,структурная и энергетическая.
з) Роль белков в организме:
Учитель биологии зачитывает высказывание А.Я.Данилевского о роли белков в клетке: «Как инструменты, исполняющие главную модуляцию, и суть основной части оркестра, так белки ведут главный мотив цитоплазматической гармонии.»
Данные о % содержании белка к сухой массе:
в мышцах человека – 80%
в коже человека—63%
в печени человека—57%
в мозге человека—45%
в костях человека—28%
Вывод: велико значение белка для жизнедеятельности человека и животных.
Количество белков характеризует степень сложности организмов. Если в кишечной палочке их 3000,то в организме человека—более 5 миллионов.
Для человека крайне токсичны соли содержащие ионы Аq,Аu,Вi,Нq,Сd,Сr.Противоядием этим солям служит альбумин (яичный белок), осаждающий их в виде нерастворимых комплексов.
Запасной белок, содержащийся в желтке куриного яйца,—ВИТЕЛЛИН. Это фосфопротеид т.е. сложный белок ,содержащий в своём составе фосфорную кислоту. Кроме этого желток содержит железо, витамины(особенно много А ,Д,Е) Считается, что чем ярче окрашен желток—тем качественнее яйцо, поскольку в этом случае курица питалась естественным образом, а именно—зеленой травой, содержащей кроме хлорофилла еще и пигменты группы каротиноидов. В пищеварительном тракте курицы хлорофилл разрушается, а каротиноиды, как более устойчивые, в конечном итоге накапливаются в курином желтке.
Демонстрация опытов:
1.ОПЫТ:взяли два вареных яйца—магазинное и свойское—разрезали ,желток магазинного яйца был бледно окрашен, что свидетельствует о том, что курица питалась неестественным образом.
Все минеральные вещества в курином яйце находятся в легко усвояемой форме.
2.ОПЫТ: белок +СuSO4 = осадок (хлопья)
Опыт показывает, что загрязнение природной среды солями тяжёлых металлов приводит к отрицательным последствиям для живых организмов, природные белки теряют присущие им специфические свойства, становятся нерастворимыми, денатурируют, в случаях отравления людей солями тяжёлых металлов (Нq 2+ ,Сu 2+ ,Рв 2+ ) используют молоко, белки которого связывают их.
Белки—важнейший компонент рациона питания человека. Они необходимы организму для восполнения энергетических затрат, построения и возобновления тканей тела, нервной системы. Белки—основа пищевого баланса.
Человеческому организму в среднем требуется 1,1—1,5 г. белка на 1кг. веса.
ЗАДА НИ Я.—решить задачу:
1.вариант: Известно, что для взрослого человека необходимо 1,5 г, белка
на 1кг массы. Зная свою массу, определить норму
необходимого потребления белка для своего организма .
2. вариант: Известно, что при продолжительности жизни 70 лет обновление белка в
организме происходит в среднем 200 раз. Зная свой возраст, предположите , сколько раз произошло обновление белка в вашем организме.
Белковое голодание довольно быстро приводит к тяжёлому расстройству здоровья. Особенно чувствителен к недостатку белка растущий организм детей. Белковая недостаточность приводит к задержке, а затем к полному прекращению роста, вялости , похуданию, тяжёлым отёкам, поносу, воспалению кожных покровов, малокровию, тяжёлым расстройствам функций печени и поджелудочной железы, понижению сопротивляемости организма к инфекционным заболеваниям — вот далеко не полный перечень последствий белковой недостаточности, нередок и смертельный исход. Нарисованная картина характерна для заболевания квашиоркор, получившего широкое распространение среди детей на Африканском континенте, а также в некоторых странах Азии и Америки. Тяжёлые последствия белкового голодания особенно памятны людям, перенесшим блокаду Ленинграда.
Применение белков: Белки находят широкое применение в медицине. Из желатина, получаемого из чистого высушенного костного клея, вырабатываются желатиновые капсулы, в которые помещают лекарственные препараты, разложение их внутри организма должно быть замедлено. Белки, выделенные из плазмы крови (глобулин)применяются при лечении инфекционных воспалений и вирусных заболеваний. Из белка фибриногена вырабатывают фибриновую пленку, используемую при тяжёлых ожогах, фибриновую пену, фибриновую присыпку для остановки кровотечений. Белок гепарин уменьшает свёртываемость крови.
Учащиеся дают основные характеристики продуктам питания.
Дополнения учителя: дополнительным источником белков могут служить одноклеточные организмы — дрожжи, водоросли, непатогенные бактерии, мицеллы, микроскопические грибы, одноклеточные водоросли (хлорелла, сценодемус)
Необходимо помнить ,что большое потребление белков ведёт к образованию в желудочно-кишечном тракте продуктов неполного расщепления, что может вызвать интоксикацию организма, поэтому необходимо помнить о рациональном питании.
Учитель химии: Человек у всегда хотелось чуда. Одним из чудес считалось и остаётся возникновение жизни, превращение неживой материи в живой организм. Чтобы
ответить на вопрос : Что такое жизнь?, надо ответить: Что такое белки? Насколько многообразны белки, настолько сложна, загадочна и многолика сама жизнь. Подтверждением является высказывание Гёте: «Я всегда говорил и не устаю повторять, что мир бы не мог существовать, если бы был так просто устроен.»
Функции белков:
1.Каталитическая:
Самая важная функция белков в организме — биокаталитическая. Белки—двигатели всех химических реакций, слаженно и последовательно протекающих в организме.
Фермент— своеобразный робот, приспособленный для выполнения определенной химической реакции. Если реакция сложная, то ее подобно автоматической линии, поэтапно проводят несколько ферментов.
В 1941 г. король Дании Христиан X вручал известному биохимику Линдерстрём — Лангу высшую научную награду своей страны — медаль Эрстеда за исследования белков и ферментов. Король, вручая медаль, попросил ученого объяснить ему и всем присутствующим, что такое ферменты. Ученый рассказал такую историю. Умирал старый араб. Все его богатство состояло из 17 прекрасных верблюдов (белых).0н собрал своих сыновей и объявил им свою последнюю волю: «Мой старший сын ,опора семьи, должен получить после моей смерти половину верблюдов. Среднему сыну я завещаю треть всех верблюдов. Но и мой младший , любимый сын должен получить свою долю—одну девятую часть стада.» Сказав это, старый араб умер. Похоронив отца ,3 брата стали делить верблюдов. Но исполнить, волю отца они не смогли: невозможно было разделить 17 верблюдов ни пополам, ни на три части, ни на девять частей.
Но тут через пустыню проходил дервиш. Бедный как все учёные ,он вёл с собой чёрного облезлого верблюда, нагруженного книгами. Братья обратились к нему за помощью. И дервиш сказал: «Выполнить волю вашего отца очень просто.Я дарю вам моего верблюда, а вы попробуйте разделить наследство.»
У братьев оказалось 18 верблюдов, и все разрешилось. Старший сын получил половину верблюдов-9 , средний — треть стада-6 и младший сын получил свою долю – 2х верблюдов.
Но 9,и 6,и 2 дает 17,и после дележа оказался лишний верблюд — старый облезлый верблюд учёного. И дервиш сказал:» Отдайте мне назад моего верблюда за то, что я помог разделить вам наследство, а то мне придется самому тащить книги через пустыню.»
Вот этот черный верблюд,—закончил рассказ Линдерстрём — Ланг,—и подобен ферменту. Он сделал возможным такой процесс, который без него был бы немыслим, а сам остался без изменения».
Главное свойство ферментов — ускорять химические реакции в организме, не подвергаясь при этом никаким изменениям.
Ферменты—биокатализаторы. Они обладают тремя особыми свойствами:
—высокой активностью.
—высокой чувствительностью к различным воздействиям.
—специфичностью действия.
2. Этапы гидролиза белка в организме:
—Под действием белков—ферментов в желудке происходит расщепление белковых молекул до полипептидов с меньшей молекулярной массой.
—В кишечнике они гидролизуются до отдельных аминокислот.
—Смесь аминокислот всасывается слизистой оболочкой тонкого кишечника.
—Через систему воротной вены смесь аминокислот попадает в печень.
—Затем разносится кровью по всем органам и тканям.
—Аминокислоты расходуются на синтез белка(увеличение белковой массы, рост, обновление) и нуклеиновых кислот, а также распадаются в процессе жизнедеятельности.
3. Регуляторная (гормоны)
Гормоны производятся в особых клетках мозга, находящихся в гипоталамической части и в гипофизе, например гормон роста, а также в специальных клетках поджелудочной железы, например инсулин и глюкагон. Но не все гормоны — белки. Белковые и небелковые гормоны влияют на организм, изменяя активность ферментов. Например, большая группа белков — факторов роста — активизирует ферменты синтеза ДНК в клетке и таким образом усиливает деление клеток. Это важно для восстановления тканей при ранениях и после операций. Но слишком интенсивное деление клеток ведёт к их неконтролируемому росту (злокачественные опухоли) Блокировать избыточный синтез факторов роста — значит привести к подавлению роста злокачественной опухоли. На этом пути учёные ищут новые средства лечения рака. Белки-гормоны оказывают влияние на обмен веществ. Они поддерживают постоянные концентрации веществ в крови и клетках, участвуют в размножении и других жизненно важных процессах. Одним из наиболее известных белков-гормонов является инсулин, который снижает содержание сахара в крови. При стойком недостатке инсулина содержание сахара в крови увеличивается и развивается сахарный диабет. Синтез человеческого инсулина генно-инженерными методами открыл новые возможности для лечения больных сахарным диабетом.
4. Транспортная.
В крови, наружных клеточных мембранах, в цитоплазме и ядрах клеток есть различные транспортные белки, которые обеспечивают активный и строго избирательный транспорт веществ.
Например, гемоглобин. Он переносит кислород из лёгких к клеткам др. тканей и органов. Белки сыворотки крови способствуют переносу липидов и жирных кислот различных биологически активных веществ.
5. Защитная.
Специальные белки – иммуноглобулины – являются антителами к антигенам (чужеродным белкам), они связывают и выводят антигены из организма, препятствуют размножению бактерий и вирусов, нейтрализуют выделяемые ими токсины. Пример, в лимфатических тканях (вилочковая железа, лимфатические узлы, селезенка), вырабатываются лимфоциты-клетки, синтезирующие антитела. Поэтому у человека и животных одна из главных систем — это иммунная система.
Также в клетках человека и животных синтезируются специальные противовирусные белки-интерфероны. Они через систему посредников активируют в клетки фермент, расщепляющий вирусные нуклеиновые кислоты, и включает синтез фермента, блокирующего аппарат синтеза вирусных белков.
Внешнюю защитную функцию выполняют некоторые токсичные для других организмов белки (например, содержащиеся в яде змей, скорпионов)
6. Коротко о других белках:
Белки-ферменты — амилаза; превращают крахмал в глюкозу.
Структурные — кератин; главный компонент волос, ногтей, рогов, копыт.
коллаген; главный компонент сухожилий, связок, хрящей.
Белки-гормоны — вазопрессин; стимулирует обратное всасывание H2O
в почках.
Сократительные — актин, миозин; мышечные сокращения.
Запасные — ферритин; депонирует Fe в селезенку.
Токсины — нейротоксин; блокирует передачу нервного импульса.
Вывод по функциям: Если значение белков настолько велико, то именно эти вещества должны обладать совершенно особенными свойствами, обусловленными их строением, и, конечно, уникальным составом, в чем мы с вами убедились.
Информация о продуктах питания:
МОЛОКО.
Является источником биоценных белков, легко усваиваемых жиров, незаменимых жирных кислот, фосфатидов, витаминов— А,В2, С, РР; нормализует содержание холестерина в крови, используется в целях профилактики и лечения гастрита, язвы желудка, туберкулёза, сердечно-сосудистых заболеваний, стимулирует распад жира (липотрофный эффект) и синтез других белков в организме; обеспечивает более полное усвоение фосфора и кальция.
ТВОРОГ.
Повышает содержание метионина, предотвращает жировые отложения в печени, на его усвоение тратится меньше ферментов, желудочного сока и соляной кислоты.
СЫРЫ.
Возбуждающе действуют на нервную систему, не рекомендуется их употреблять перед сном.
ЯЙЦА.
Содержат в белке все незаменимые аминокислоты; желток содержит жирные кислоты и холестерин, однако благодаря большому содержанию лецитина холестерин яичного желтка практически не попадает в кровь и выводится с желчью .Наилучшее усвоение ценных компонентов яйца наблюдается при первичной денатурации белка, когда яйцо сварено всмятку.
МЯСО.
Является основным источником ценных белков (биоценные белки мышц: миогены, миозин, глобулины и др.) , повышает желудочную секрецию, возбуждает нервную систему, содержит железо, витамин группы С и В.
РЫБА.
Содержит важные микроэлементы и активный йод.
Учитель биологии:
Закончим мы наш урок словами С.Я.Надсона: (звучит музыка.)
Вот жизнь, вот что загадка!
Закон её мгновенье,
И нет среди людей такого мудреца
Кто мог сказать толпе, куда ее движенье
Кто мог бы уловить черты ее лица
То вся она печаль, то вся она приманка
То всё в ней блеск и свет
То всё позор и тьма
Жизнь—это Серафим и пьяная Вакханка
Жизнь—это океан и тесная тюрьма!
Заключение (учитель биологии)
Заполняются листы самоконтроля (они лежат на столах) см. приложение.
Собираются рабочие тетради для проверки конспекта урока.
Выставляются оценки за доклады.
Литература:
Альбертс Б., Брей Д., Льюис Дж. и др. Молекулярная биология клетки. В 3 томах. — М.: Мир, 1994.
Ресурсы Интернета.
Газета Биология «Первое сентября».
Учебник Химия 10-11 класс.
Ленинджер А. Основы биохимии. В 3 томах. — М.: Мир, 1985.
Страйер Л. Биохимия. В 3 томах. — М.: Мир, 1984.
doc4web.ru
Тема 2.5 Органические вещества. Углеводы. Белки Рабочая тетрадь по биологии Сивоглазов Агафонова Захарова 10-11 класс
Главная › 10-11 класс › Биология › Рабочая тетрадь по биологии Сивоглазов Агафонова Захарова 10-11 класс 1. Дайте определения понятий.- Углеводы – органические вещества, содержащие карбонильную группу и несколько гидроксильных групп.
- Моносахарид – простой углевод, при гидролизе не расщепляющийся на более простые соединения.
- Дисахарид – углевод, представляющий собой соединений из двух моносахаридов.
2. Дополните схему «Разнообразие углеводов в клетке».
3. Рассмотрите рисунок 11 учебника и приведите примеры моносахаридов, в состав которых входит:
- пять атомов углерода: рибоза, дезоксирибоза;
- шесть атомов углерода: глюкоза, фруктоза.
4. Заполните таблицу «Биологические функции моно- и дисахаридов».
5. Назовите растворимые в воде углеводы. Какие особенности строения их молекул обеспечивают свойство растворимости?
ОТВЕТ: Моносахариды (глюкоза, фруктоза) и дисахариды (сахароза). Их молекулы небольшого размера и полярные, поэтому растворимы в воде. Полисахариды образуют длинные цепи, которые в воде не растворяются
6. Заполните таблицу «БИОЛОГИЧЕСКИЕ ФУНКЦИИ ПОЛИСАХАРИДОВ».
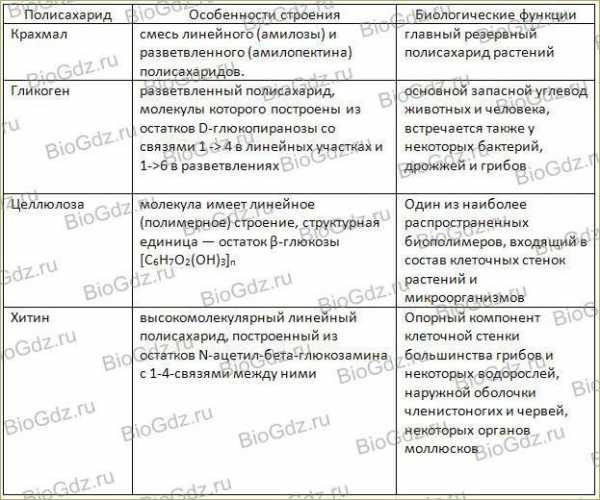
7. Полисахарид хитин входит в структуру клеточных стенок грибов и составляет основу наружного скелета членистоногих. С каким из известных вам полисахаридов он проявляет функциональное сходство? Ответ обоснуйте.
ОТВЕТ: Хитин является веществом, очень близким по строению, физико-химическим свойствам и биологической роли к целлюлозе. Он выполняет защитную и опорную функции, содержится в клеточных стенках грибов, некоторых водорослей, бактерий.
8. Дайте определения понятий.
- Полипептид — химическое вещество, состоящее из длинной цепи аминокислот, связанных пептидными связями.
- Денатурация — потеря белками или нуклеиновыми кислотами их естественных свойств вследствие нарушения пространственной структуры их молекул.
- Ренатурация — восстановление (после денатурации) биологически активной пространственной структуры биополимера (белка или нуклеиновой кислоты).
9. Объясните утверждение: «Белки — носители и организаторы жизни».
ОТВЕТ: По Энгельсу «Всюду, где есть встречаем жизнь, она связана с каким-либо белковым телом, и повсюду, где мы встречаем какое-либо белковое тело, которое не находится в процессе разложения, мы без исключения встречаем и явления жизни…». «Жизнь есть способ существования белковых тел…».
10. Напишите общую структурную формулу аминокислоты. Объясните, почему мономер белка носит такое название.
ОТВЕТ: RCH(Nh3)COOH. Аминокислоты объединяют в себе свойства кислот и аминов, т. е. содержат наряду с карбоксильной группой -COOH аминогруппу -Nh3.
11. Чем отличаются друг от друга различные аминокислоты?
ОТВЕТ: Аминокислоты отличаются друг т друга по строению радикала.
12. Заполните кластер «Многообразие белков и их функции».
Белки: гормоны, транспортные белки, ферменты, токсины, антибиотики, запасные белки, защитные белки, двигательные белки, структурные белки.
13. Закончите заполнение таблицы.
14. Пользуясь учебником, объясните суть высказывания: «Биохимические реакции, протекающие в присутствии ферментов, — основа жизнедеятельности клеток».
ОТВЕТ: Белки-ферменты катализируют множество реакций, обеспечивают слаженность ансамбля клеток живых организмов, ускоряя во много раз скорость химических реакций.
15. Приведите примеры белков, участвующих в перечисленных процессах.
- Бег, ходьба, прыжки – актин и миозин.
- Рост – соматотропин.
- Транспорт кислорода и углекислого газа в крови – гемоглобин.
- Рост ногтей и волос – кератин.
- Свертывание крови – протромбин, фибриноген.
- Связывание кислорода в мышцах – миоглобин.
16. Установите соответствие между конкретными белками и их функциями.
Белки:
1. Протромбин
2. Коллаген
3. Актин
4. Соматотропин
5. Гемоглобин
6. Инсулин
Роль в организме
A. Сократительный белок мышц
Б. Гормон гипофиза
B. Обеспечивает свертываемость крови
Г. Входит в состав волокон соединительной ткани
Д. Гормон поджелудочной железы
Е. Переносит кислород
17. На чем основано дезинфицирующее свойство этилового спирта?
ОТВЕТ: Он разрушает белки (в т. ч. токсины) бактерий, приводит к их денатурации.
18. Почему вареное яйцо, погруженное в холодную воду, не возвращается к исходному состоянию?
ОТВЕТ: Происходит необратимая денатурация белка куриного яйца под воздействием высокой температуры.
19. При окислении 1 г белков выделяется столько же энергии, сколько при окислении 1 г углеводов. Почему организм использует белки как источник энергии только в крайних случаях?
ОТВЕТ: Функции белков – это, во-первых, строительная, ферментативная, транспортная функции, и только в крайних случаях организм использует или тратит белки на получение энергии, только тогда, когда в организм не поступают углеводы и жиры, когда организм голодает.
20. Выберите правильный ответ.
Тест 1. Белки, увеличивающие скорость химических реакций в клетке:
2) ферменты;
Тест 2. Мономер сложных углеводов — это:
4) глюкоза.
Тест 3. Углеводы в клетке не выполняют функцию:
3) хранения наследственной информации.
Тест 4. Полимер, мономеры которого располагаются в одну линию:
2) неразветвленный полимер;
Тест 5. В состав аминокислот не входит:
3) фосфор;
Тест 6. У животных гликоген, а у растений:
3) крахмал;
Тест 7. У гемоглобина есть, а у лизоцима нет:
4) четвертичной структуры.
21. Объясните происхождение и общее значение слова (термина), опираясь на значение корней, его составляющих.
22. Выберите термин и объясните, насколько его современное значение соответствует первоначальному значению его корней.
Выбранный термин: дезоксирибоза.
Соответствие: термин соответствует значению. Это дезоксисахар — производное рибозы, где гидроксильная группа у второго атома углерода замещена водородом с потерей атома кислорода (дезокси — отсутствие атома кислорода).
23. Сформулируйте и запишите основные идеи § 2.5.
Углеводы и белки относятся к органическим веществам клетки. К углеводам относятся: моносахариды (рибоза, дезоксирибоза, глюкоза), дисахариды (сахароза), полисахариды (крахмал, гликоген, целлюлоза, хитин). В организме они выполняют функции: энергетическую, запасающую, структурная.
Белки, мономерами которых являются аминокислоты, имеют первичную, вторичную, третичную и часто четвертичную структуры.
Выполняют в организме важные функции: являются гормонами, ферментами, токсинами, антибиотиками, запасными, защитными, транспортными, двигательными и структурными белками.
Тема 3.10. Генетика — наука о закономерностях наследственности и изменчивости. Г. Мендель — основоположник генетикиТема 3.11. Закономерности наследования. Моногибридное скрещивание
dourokov.ru
