Электроотрицательность. Степень окисления и валентность химических элементов
Электроотрицательность
Электроотрицательность (ЭО) — это способность атомов притягивать электроны при связывании с другими атомами.
Электроотрицательность зависит от расстояния между ядром и валентными электронами, и от того, насколько валентная оболочка близка к завершенной. Чем меньше радиус атома и чем больше валентных электронов, тем выше его ЭО.
Фтор является самым электроотрицательным элементом. Во-первых, он имеет на валентной оболочке 7 электронов (до октета недостает всего 1-го электрона) и, во-вторых, эта валентная оболочка (…2s2 2p5) расположена близко к ядру.
Менее всего электроотрицательны атомы щелочных и щелочноземельных металлов. Они имеют большие радиусы и их внешние электронные оболочки далеки от завершения. Им гораздо проще отдать свои валентные электроны другому атому (тогда предвнешняя оболочка станет завершенной), чем «добирать» электроны.
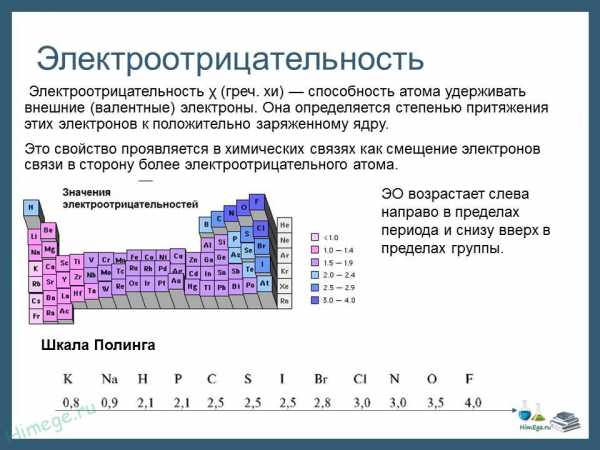
Электроотрицательность можно выразить количественно и выстроить элементы в ряд по ее возрастанию. Наиболее часто используют шкалу электроотрицательностей, предложенную американским химиком Л. Полингом.
 Разность электроотрицательностей элементов в соединении (ΔX) позволит судить о типе химической связи. Если величина Δ X = 0 – связь ковалентная неполярная.
Разность электроотрицательностей элементов в соединении (ΔX) позволит судить о типе химической связи. Если величина Δ X = 0 – связь ковалентная неполярная.
При разности электроотрицательностей до 2,0 связь называют ковалентной полярной, например: связь H—F в молекуле фтороводорода HF: Δ X = (3,98 — 2,20) = 1,78
Связи с разностью электроотрицательностей больше 2,0 считаются ионными. Например: связь Na—Cl в соединении NaCl: Δ X = (3,16 — 0,93) = 2,23.
Степень окисления
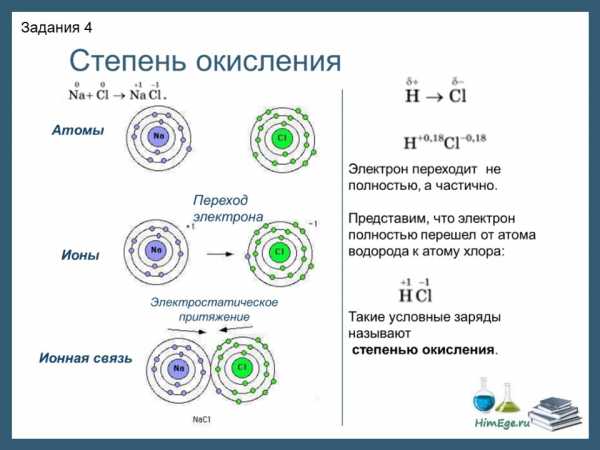
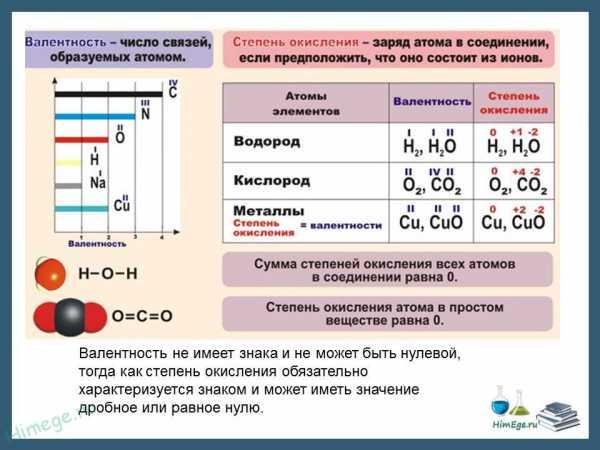
Степень окисления (СО) — это условный заряд атома в молекуле, вычисленный в предположении, что молекула состоит из ионов и в целом электронейтральна.


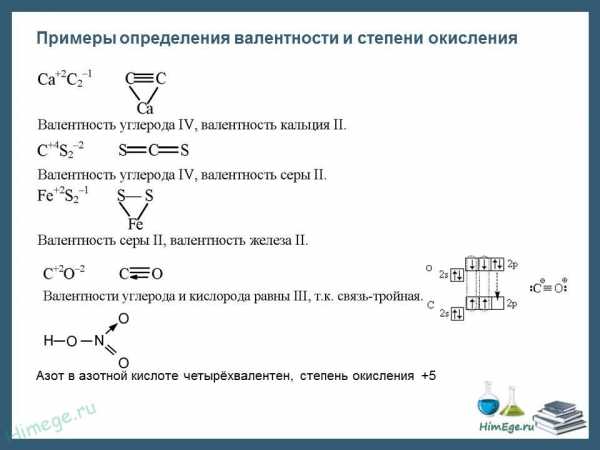
При образовании ионной связи происходит переход электрона от менее электроотрицательного атома к более электроотрицательному, атомы теряет свою электронейтральность, превращается в ионы. возникают целочисленные заряды. При образовании ковалентной полярной связи электрон переходит не полностью, а частично, поэтому возникают частичные заряды (на рисунке ниже HCl). Представим, что электрон перешел полностью от атома водорода к хлору, и на водороде возник целый положительный заряд +1, а на хлоре -1. такие условные заряды и называют степенью окисления.
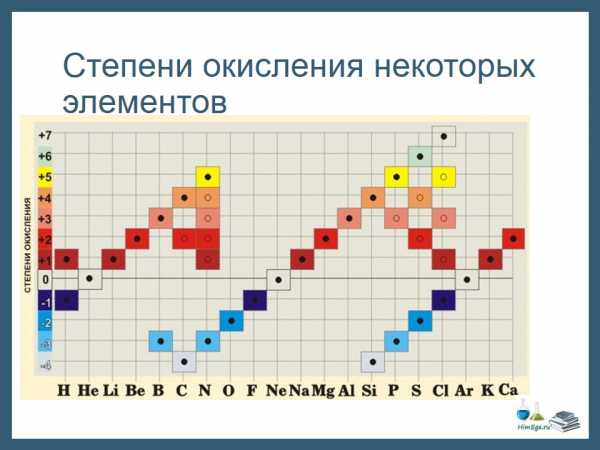
На этом рисунке изображены степени окисления, характерные для первых 20 элементов.
Обратите внимание. Высшая СО как правило равна номеру группы в таблице Менделеева. У металлов главных подгрупп – одна характерная СО, у неметаллов, как правило, наблюдается разброс СО. Поэтому неметаллы образуют большое количество соединений и обладают более «разнообразными» свойствами, по сравнению с металлами.
Примеры определения степени окисления
Определим степени окисления хлора в соединениях:

Те правила, которые мы рассмотрели не всегда позволяют рассчитать СО всех элементов, как например в данной молекуле аминопропана.
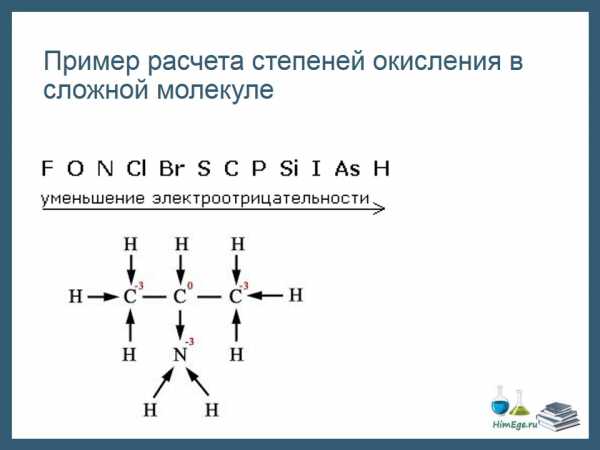
Здесь удобно пользоваться следующим приемом:
1)Изображаем структурную формулу молекулы, черточка – это связь, пара электронов.
2) Черточку превращаем в стрелку, направленную к более ЭО атому. Эта стрелка символизирует переход электрона к атому. Если связаны два одинаковых атома, оставляем черту как есть – нет перехода электронов.
3) Считаем сколько электронов «пришло» и «ушло».
Например, посчитаем заряд первого атома углерода. Три стрелки направленны к атому, значит, 3 электрона пришло, заряд -3.
Второй атом углерода: водород отдал ему электрон, а азот забрал один электрон. Заряд не поменялся, равен нулю. И т.д.
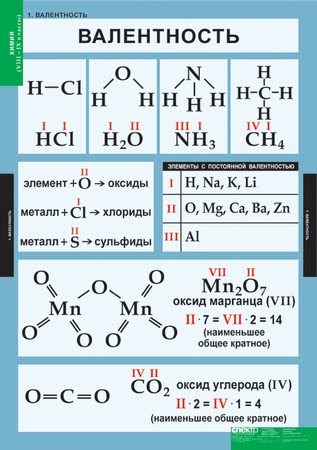
Валентность
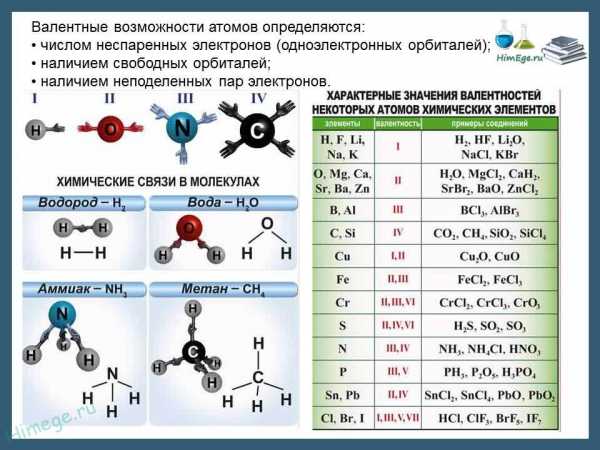
Вале́нтность (от лат. valēns «имеющий силу») — способность атомов образовывать определённое число химических связей с атомами других элементов.
В основном, под валентностью понимается способность атомов к образованию определённого числа ковалентных связей. Если в атоме имеется n неспаренных электронов и
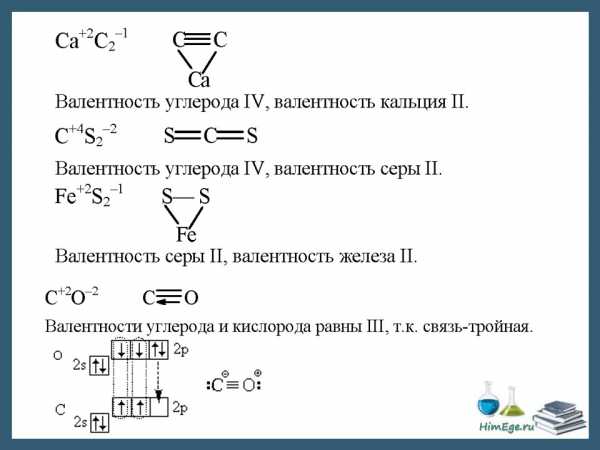
В ряде случаев, валентность может численно совпадать со степенью окисления, но ни коим образом они не тождественны друг другу. Например, в молекулах N2 и CO реализуется тройная связь (то есть валентность каждого атома равна 3), однако степень окисления азота равна 0, углерода +2, кислорода −2.


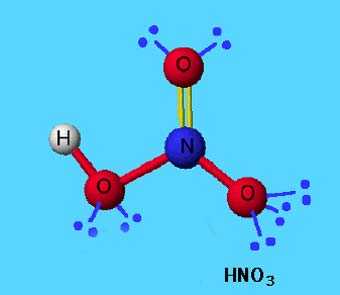
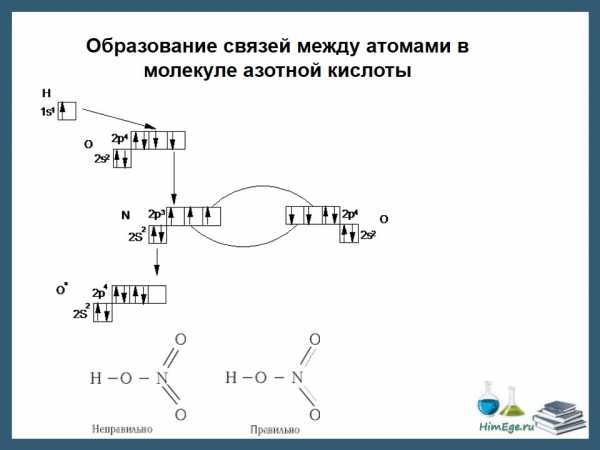
 В азотной кислоте степень окисления азота равна +5, тогда как азот не может иметь валентность выше 4, т.к имеет только 4 орбитали на внешнем уровне (а связь можно рассматривать как перекрывание орбиталей). И вообще, любой элемент второго периода по этой же причине не может иметь валентность большую 4.
В азотной кислоте степень окисления азота равна +5, тогда как азот не может иметь валентность выше 4, т.к имеет только 4 орбитали на внешнем уровне (а связь можно рассматривать как перекрывание орбиталей). И вообще, любой элемент второго периода по этой же причине не может иметь валентность большую 4.
Ещё несколько «коварных» вопросов, в которых часто делают ошибки.
himege.ru
h3SO4, степень окисления серы и др элементов
Общие сведения о серной кислоте и степени окисления в h3SO4
Брутто-формула – H2SO4. Молярная масса – 98 г/моль.В твердом и жидком состоянии молекулы H
Серная кислота смешивается с водой в любых соотношениях. Является сильным электролитом, т.е. в водном растворе практически полностью диссоциирует на ионы (строение сульфат иона представлено на рис. 1). В ОВР проявляет себя в роли окислителя.
Рис. 1. Строение сульфат-иона.
h3SO4 , степени окисления элементов в ней
Чтобы определить степени окисления элементов, входящих в состав серной кислоты, сначала необходимо разобраться с тем, для каких элементов эта величина точно известна.
Степени окисления водорода и кислорода в составе неорганических кислот всегда равны (+1) и (-2) соответственно. Для нахождения степени окисления серы примем её значение за «х» и определим его при помощи уравнения электронейтральности:
2× (+1) + х + 4×(-2) = 0;
2 + х — 8 = 0;
x — 6 = 0;
x = +6.
Значит степень окисления серы в серной кислоте равна (+6):
H+12S+6O-24.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
Валентность химических элементов. Степень окисления химических элементов – HIMI4KA

Валентность является сложным понятием. Этот термин претерпел значительную трансформацию одновременно с развитием теории химической связи. Первоначально валентностью называли способность атома присоединять или замещать определённое число других атомов или атомных групп с образованием химической связи.
Количественной мерой валентности атома элемента считали число атомов водорода или кислорода (данные элементы считали соответственно одно- и двухвалентными), которые элемент присоединяет, образуя гидрид формулы ЭHx или оксид формулы ЭnOm.
Так, валентность атома азота в молекуле аммиака NH3 равна трём, а атома серы в молекуле H2S равна двум, поскольку валентность атома водорода равна одному.
В соединениях Na2O, BaO, Al2O3, SiO2 валентности натрия, бария и кремния соответственно равны 1, 2, 3 и 4.
Понятие о валентности было введено в химию до того, как стало известно строение атома, а именно в 1853 году английским химиком Франклендом. В настоящее время установлено, что валентность элемента тесно связана с числом внешних электронов атомов, поскольку электроны внутренних оболочек атомов не участвуют в образовании химических связей.
В электронной теории ковалентной связи считают, что валентность атома определяется числом его неспаренных электронов в основном или возбуждённом состоянии, участвующих в образовании общих электронных пар с электронами других атомов.
Для некоторых элементов валентность является величиной постоянной. Так, натрий или калий во всех соединениях одновалентны, кальций, магний и цинк — двухвалентны, алюминий — трёхвалентен и т. д. Но большинство химических элементов проявляют переменную валентность, которая зависит от природы элемента — партнёра и условий протекания процесса. Так, железо может образовывать с хлором два соединения — FeCl2 и FeCl3, в которых валентность железа равна соответственно 2 и 3.
Степень окисления — понятие, характеризующее состояние элемента в химическом соединении и его поведение в окислительно-восстановительных реакциях; численно степень окисления равна формальному заряду, который можно приписать элементу, исходя из предположения, что все электроны каждой его связи перешли к более электроотрицательному атому.
Электроотрицательность — мера способности атома к приобретению отрицательного заряда при образовании химической связи или способность атома в молекуле притягивать к себе валентные электроны, участвующие в образовании химической связи. Электроотрицательность не является абсолютной величиной и рассчитывается различными методами. Поэтому приводимые в разных учебниках и справочниках значения электроотрицательности могут отличаться.
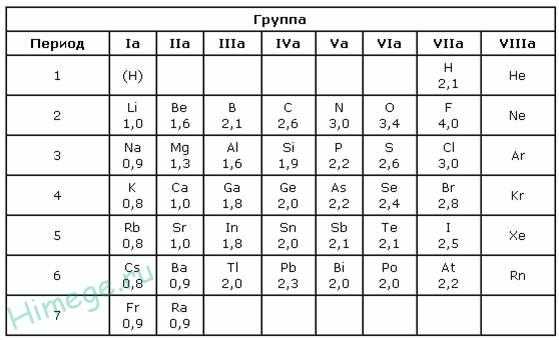
В таблице 2 приведена электроотрицательность некоторых химических элементов по шкале Сандерсона, а в таблице 3 — электроотрицательность элементов по шкале Полинга.
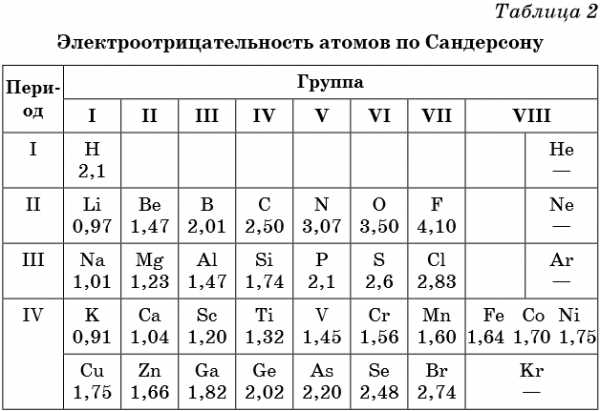
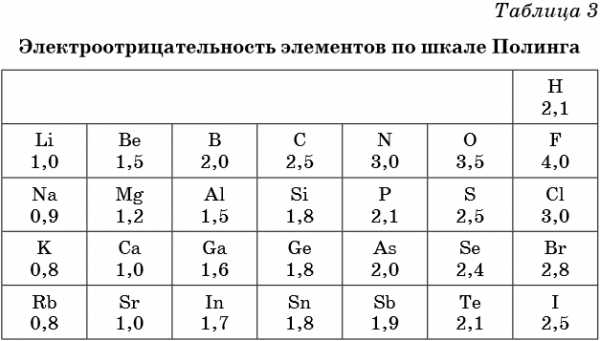
Значение электроотрицательности приведено под символом соответствующего элемента. Чем больше численное значение электроотрицательности атома, тем более электроотрицательным является элемент. Наиболее электроотрицательным является атом фтора, наименее электроотрицательным — атом рубидия. В молекуле, образованной атомами двух разных химических элементов, формальный отрицательный заряд будет у атома, численное значение электроотрицательности у которого будет выше. Так, в молекуле диоксида серы SO2 электроотрицательность атома серы равна 2,5, а значение электроотрицательности атома кислорода больше — 3,5. Следовательно, отрицательный заряд будет на атоме кислорода, а положительный — на атоме серы.
В молекуле аммиака NH3 значение электроотрицательности атома азота равно 3,0, а водорода — 2,1. Поэтому отрицательный заряд будет у атома азота, а положительный — у атома водорода.
Следует чётко знать общие тенденции изменения электроотрицательности. Поскольку атом любого химического элемента стремится приобрести устойчивую конфигурацию внешнего электронного слоя — октетную оболочку инертного газа, то электроотрицательность элементов в периоде увеличивается, а в группе электроотрицательность в общем случае уменьшается с увеличением атомного номера элемента. Поэтому, например, сера более электроотрицательна по сравнению с фосфором и кремнием, а углерод более электроотрицателен по сравнению с кремнием.
При составлении формул соединений, состоящих из двух неметаллов, более электроотрицательный из них всегда ставят правее: PCl3, NO2. Из этого правила есть некоторые исторически сложившиеся исключения, например NH3, PH3 и т.д.
Степень окисления обычно обозначают арабской цифрой (со знаком перед цифрой), расположенной над символом элемента, например:
Для определения степени окисления атомов в химических соединениях руководствуются следующими правилами:
- Степень окисления элементов в простых веществах равна нулю.
- Алгебраическая сумма степеней окисления атомов в молекуле равна нулю.
- Кислород в соединениях проявляет главным образом степень окисления, равную –2 (во фториде кислорода OF2 + 2, в пероксидах металлов типа M2O2 –1).
- Водород в соединениях проявляет степень окисления + 1, за исключением гидридов активных металлов, например, щелочных или щёлочноземельных, в которых степень окисления водорода равна – 1.
- У одноатомных ионов степень окисления равна заряду иона, например: K+ — +1, Ba2+ — +2, Br– — –1, S2– — –2 и т. д.
- В соединениях с ковалентной полярной связью степень окисления более электроотрицательного атома имеет знак минус, а менее электроотрицательного — знак плюс.
- В органических соединениях степень окисления водорода равна +1.
Проиллюстрируем вышеприведённые правила несколькими примерами.
Пример 1. Определить степень окисления элементов в оксидах калия K2O, селена SeO3 и железа Fe3O4.
Оксид калия K2O. Алгебраическая сумма степеней окисления атомов в молекуле равна нулю. Степень окисления кислорода в оксидах равна –2. Обозначим степень окисления калия в его оксиде за n, тогда 2n + (–2) = 0 или 2n = 2, отсюда n = +1, т. е. степень окисления калия равна +1.
Оксид селена SeO3. Молекула SeO3 электронейтральна. Суммарный отрицательный заряд трёх атомов кислорода составляет –2 × 3 = –6. Следовательно, чтобы уравнять этот отрицательный заряд до ноля, степень окисления селена должна быть равна +6.
Молекула Fe3O4 электронейтральна. Суммарный отрицательный заряд четырёх атомов кислорода составляет –2 × 4 = –8. Чтобы уравнять этот отрицательный заряд, суммарный положительный заряд на трёх атомах железа должен быть равен +8. Следовательно, на одном атоме железа должен быть заряд 8/3 = +8/3.
Следует подчеркнуть, что степень окисления элемента в соединении может быть дробным числом. Такие дробные степени окисления не имеют смысла при объяснении связи в химическом соединении, но могут быть использованы для составления уравнений окислительно-восстановительных реакций.
Пример 2. Определить степень окисления элементов в соединениях NaClO3, K2Cr2O7.
Молекула NaClO3 электронейтральна. Степень окисления натрия равна +1, степень окисления кислорода равна –2. Обозначим степень окисления хлора за n, тогда +1 + n + 3 × (–2) = 0, или +1 + n – 6 = 0, или n – 5 = 0, отсюда n = +5. Таким образом, степень окисления хлора равна +5.
Молекула K2Cr2O7 электронейтральна. Степень окисления калия равна +1, степень окисления кислорода равна –2. Обозначим степень окисления хрома за n, тогда 2 × 1 + 2n + 7 × (–2) = 0, или +2 + 2n – 14 = 0, или 2n – 12 = 0, 2n = 12, отсюда n = +6. Таким образом, степень окисления хрома равна +6.
Пример 3. Определим степени окисления серы в сульфат-ионе SO42–. Ион SO42– имеет заряд –2. Степень окисления кислорода равна –2. Обозначим степень окисления серы за n, тогда n + 4 × (–2) = –2, или n – 8 = –2, или n = –2 – (–8), отсюда n = +6. Таким образом, степень окисления серы равна +6.
Следует помнить, что степень окисления иногда не равна валентности данного элемента.
Например, степени окисления атома азота в молекуле аммиака NH3 или в молекуле гидразина N2H4 равны –3 и –2 соответственно, тогда как валентность азота в этих соединениях равна трём.
Максимальная положительная степень окисления для элементов главных подгрупп, как правило, равна номеру группы (исключения: кислород, фтор и некоторые другие элементы).
Максимальная отрицательная степень окисления равна 8 — номер группы.
Тренировочные задания
1. В каком соединении степень окисления фосфора равна +5?
1) HPO3
2) H3PO3
3) Li3P
4) AlP
2. В каком соединении степень окисления фосфора равна –3?
1) HPO3
2) H3PO3
3) Li3PO4
4) AlP
3. В каком соединении степень окисления азота равна +4?
1) HNO2
2) N2O4
3) N2O
4) HNO3
4. В каком соединении степень окисления азота равна –2?
1) NH3
2) N2H4
3) N2O5
4) HNO2
5. В каком соединении степень окисления серы равна +2?
1) Na2SO3
2) SO2
3) SCl2
4) H2SO4
6. В каком соединении степень окисления серы равна +6?
1) Na2SO3
2) SO3
3) SCl2
4) H2SO3
7. В веществах, формулы которых CrBr2, K2Cr2O7, Na2CrO4, степень окисления хрома соответственно равна
1) +2, +3, +6
2) +3, +6, +6
3) +2, +6, +5
4) +2, +6, +6
8. Минимальная отрицательная степень окисления химического элемента, как правило, равна
1) номеру периода
2) порядковому номеру химического элемента
3) числу электронов, недостающих до завершения внешнего электронного слоя
4) общему числу электронов в элементе
9. Максимальная положительная степень окисления химических элементов, расположенных в главных подгруппах, как правило, равна
1) номеру периода
2) порядковому номеру химического элемента
3) номеру группы
4) общему числу электронов в элементе
10. Фосфор проявляет максимальную положительную степень окисления в соединении
1) HPO3
2) H3PO3
3) Na3P
4) Ca3P2
11. Фосфор проявляет минимальную степень окисления в соединении
1) HPO3
2) H3PO3
3) Na3PO4
4) Ca3P2
12. Атомы азота в нитрите аммония, находящиеся в составе катиона и аниона, проявляют степени окисления соответственно
1) –3, +3
2) –3, +5
3) +3, –3
4) +3, +5
13. Валентность и степень окисления кислорода в перекиси водорода соответственно равны
1) II, –2
2) II, –1
3) I, +4
4) III, –2
14. Валентность и степень окисления серы в пирите FeS2 соответственно равны
1) IV, +5
2) II, –1
3) II, +6
4) III, +4
15. Валентность и степень окисления атома азота в бромиде аммония соответственно равны
1) IV, –3
2) III, +3
3) IV, –2
4) III, +4
16. Атом углерода проявляет отрицательную степень окисления в соединении с
1) кислородом
2) натрием
3) фтором
4) хлором
17. Постоянную степень окисления в своих соединениях проявляет
1) стронций
2) железо
3) сера
4) хлор
18. Степень окисления +3 в своих соединениях могут проявлять
1) хлор и фтор
2) фосфор и хлор
3) углерод и сера
4) кислород и водород
19. Степень окисления +4 в своих соединениях могут проявлять
1) углерод и водород
2) углерод и фосфор
3) углерод и кальций
4) азот и сера
20. Степень окисления, равную номеру группы, в своих соединениях проявляет
1) хлор
2) железо
3) кислород
4) фтор
Ответы
himi4ka.ru
Валентность и степень окисления
Валентность — способность атомов данного элемента присоединять определенное число атомов других элементов.
Атом водородa никогда не присоединяет больше одного атома другого элемента. Поэтому валентность водорода приняли за единицу измерения валентности элементов.
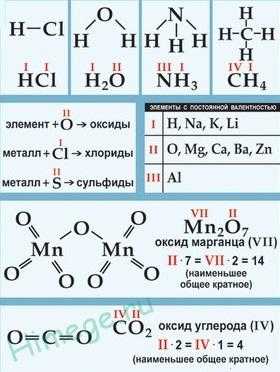
Например, в соединениях: HCl — хлор одновалентен, H2O — кислород двухвалентен, NH3 – азот трехвалентен, CH4 — углерод четырехвалентен. В этих соединениях валентность элементов мы определяем по формулам водородных соединений — это валентность по водороду.
Кислород всегда имеет валентность два. Если мы знаем формулы соединений элементов с кислородом, то можно определить валентность по кислороду. Например, в следующих соединениях элементы имеют такие валентности (обозначены римскими цифрами):
Задание:Определить валентности элементов.
I II III IV V VI VII
Na2O, CaO, Аl2O3, СО2, P2O5, СrО3, Мn2О7.
Если мы знаем валентности элементов, то можем легко составить формулу вещества, которое состоит из двух элементов. Например, если вещество состоит из магния (валентность два) и хлора (валентность один), то формула, вещества MgCl 2.
В молекуле сложного вещества AxBy, которое состоит из элемента A с валентностью п и элемента В с валентностью m, произведение валентности на число атомов одного элемента равно произведению валентности на число атомов другого элемента: пх = ту. Например, в молекуле Al2O3 произведение валентности алюминия на число атомов равно произведению валентности кислорода на число его атомов (3 ´ 2 = 2 ´ 3).
Валентность — важная качественная характеристика элемента.
Графическое изображение формул. Формулы молекул можно изображать графически. В графических изображениях формул каждую валентность обозначают при помощи черты. Например, графическое изображение формулы
Н2О (молекулы воды) H — O — H,
формулы CO2 (оксида углерода, (IV)) O = С = O,
формулы Al2O3 (оксида алюминия) О = А1 – O – Al = О.
Электронная теория строения атома объяснила физический смысл валентности и структурных формул.
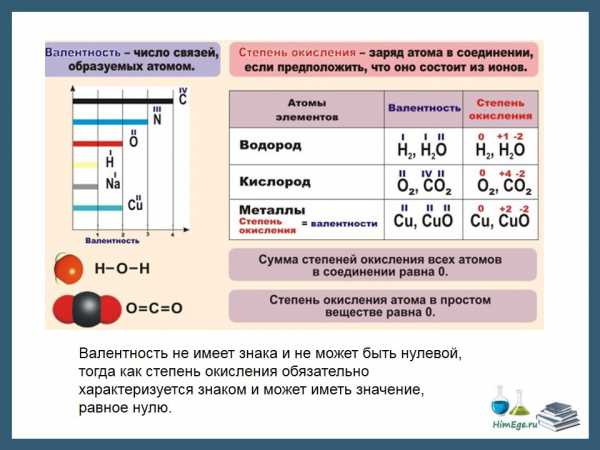
Валентность элемента определяется числом общих электронных пар, которые связывают атом данного элемента с другими атомами.
Валентность не может быть отрицательной и не может равняться нулю. Понятие «валентность» можно применять только к соединениям с ковалентной связью.
Для характеристики состояния атома в соединении используют понятие «степень окисления».
Степень окисления — это условный заряд атома в молекуле, который возник бы на атоме, если бы общие электронные пары полностью сместились к более электроотрицательному атому (т.е. атомы превратились бы в ионы).
Степень окисления не всегда численно равна валентности. Для определения степени окисления каждого элемента в соединении нужно помнить следующее:
1. Степень окисления атома в молекуле может быть равна нулю или выражена отрицательным или положительным числом.
2. Молекула всегда электронейтральна: сумма положительных и отрицательных формальных зарядов, которые характеризуют степень окисления атомов, образующих молекулу, равна нулю.
3. Степень окисления водорода во всех соединениях, за исключением гидридов металлов (NaH, KH, CaH2 и др.), равна + 1. В гидридах металлов его степень окисления равна – 1.
4. Степень окисления кислорода в большинстве соединений равна — 2. Исключения составляют:
а) пероксиды типа H2О2, Na2O2, BaO2, в которых степень окисления кислорода равна – 1; а его валентность равна двум (H — О — О ¾ H,
Na — O — O — Na).
б) надпероксиды типа KO2, RbO2, CsO2, в которых степень окисления
-1 имеет сложный надпероксидный ион [О2]-1 и, следовательно, формально степень окисления атома кислорода равна – ½;
в) озониды типа KO3, RbO3, CsO3, в которых степень окисления -1 имеет сложный озонид-ион [О3]-1 и, следовательно, формально степень окисления атома кислорода равна – 1/3;
г) смешанные пероксид-надпероксидные соединения типа М2О3 (М2О2×2МО2), где М – K, Rb, Cs, в которых атомы кислорода формально характеризуются степенями окисления -1 и – ½;
д) оксид F2O и пероксид F2O2 фтора, в которых степень окисления атомов кислорода соответственно равна +2 и +1.
5. Степень окисления атомов в простых веществах равна нулю:
0 0 0 0 0
С12, Н2, N2, P4, S8.
6. Степень окисления атомов металлов в соединениях всегда положительна. При этом многие из них имеют постоянную степень окисления. Например, атомы щелочных металлов (Li, Na, К, Rb, Cs, Fr) во всех соединениях имеют степени окисления + 1, а атомы щелочноземельных металлов (Ca, Sr, Ba, Ra) — степени окисления +2.
7. Степени окисления многих элементов переменные.
Например, степень окисления серы в сероводороде H2S равна — 2, в оксиде серы (IV) SO2 + 4, в оксиде серы (VI) SO3 + 6.
8. Высшая степень окисления элемента обычно равна номеру группы, в которой находится элемент в периодической системе элементов.
Например, магний Mg находится во второй группе и его высшая степень окисления равна + 2. Марганец Mn находится в седьмой группе и его высшая степень окисления равна + 7.
9. Зная степени окисления одних элементов, можно определить степени окисления других элементов в данном соединении. Для этого нужно помнить, что алгебраическая сумма степеней окисления всех элементов в соединении (с учетом числа атомов) всегда равна нулю.
Например, определим степень окисления азота в азотной кислоте HNO3 и в азотистой кислоте HNО2. В азотной кислоте степень окисления водорода +1, кислорода -2, степень окисления азота х:
+1 +x + (-2 ´ 3) = 0,
x = +5
В азотистой кислоте степень окисления азота:
+1 + x + (-2 ´ 2) = 0,
x = +3.
Похожие статьи:
poznayka.org
Качественная характеристика окислительно-восстановительных реакций
Среди химических реакций, в том числе и в природе, окислительно-восстановительные реакции являются самыми распространенными. К их числу относятся, например, фотосинтез, обмен веществ, биологические процессы, а также сжигание топлива, получение металлов и многие другие реакции. Окислительно-восстановительные реакции издавна успешно использовались человечеством в различных целях, но сама электронная теория окислительно-восстановительных процессов появилась совсем недавно – в начале XX века.
Для того чтобы перейти к современной теории окисления-восстановления, необходимо ввести несколько понятий – это валентность, степень окисления и строение электронных оболочек атомов. Изучая такие разделы, как Периодический закон Д.И. Менделеева, основы строения атомов элементов и химическая связь и строение молекул, мы уже сталкивались с этими понятиями. Далее, рассмотрим их подробнее.
Валентность и степень окисления
Валентность – понятие сложное, которое возникло вместе с понятием химической связи и определяется, как свойство атомов присоединять или замещать определенное число атомов другого элемента, т.е. это способность атомов образовывать химические связи в соединениях. Первоначально валентность определяли по водороду (его валентность принимали равной 1) или кислороду (валентность равна 2). Позднее стали различать положительную и отрицательную валентность. Количественно, положительная валентность характеризуется количеством отданных атомом электронов, а отрицательная валентность – числом электронов, которые необходимо присоединить атому для реализации правила октета (т.е. завершения внешнего энергетического уровня). Позднее понятие валентности, стало сочетать в себе также и природу химических связей, возникающих между атомами в их соединении.
Как правило, высшая валентность элементов соответствует номеру группы в периодической системе. Но, как и во всех правилах, есть исключения: например, медь и золото находятся в первой группе периодической системы и их валентность должна быть равна номеру группы, т.е. 1, но в действительности же высшая валентность меди равна 2, а золота – 3.
Степень окисления иногда называют окислительным числом, электрохимической валентностью или состоянием окисления и является понятием условным. Так, при вычислении степени окисления предполагается допущение, что молекулу составляют только ионы, хотя большинство соединений вовсе не являются ионными. Количественно степень окисления атомов элемента в соединении определяется числом присоединенных к атому или смещенных от атома электронов. Таким образом, при отсутствии смещения электронов степень окисления будет нулевая, при смещении электронов в сторону данного атома – отрицательная, при смещении от данного атома – положительная.
Определяя степень окисления атомов необходимо следовать следующим правилам:
- В молекулах простых веществ и металлов степень окисления атомов равна 0.
- Водород почти во всех соединениях имеет степень окисления равную +1 (и только в гидридах активных металлов равную -1).
- Для атомов кислорода в его соединениях типична степень окисления -2 (исключения: OF2 и пероксиды металлов, степень окисления кислорода соответственно равна +2 и -1).
- Постоянную степень окисления имеют также атомы щелочных (+1) и щелочноземельных (+2) металлов, а также фтора (-1)
- В простых ионных соединениях, степень окисления равна по величине и знаку его электрическому заряду.
- Для ковалентного соединения, более электроотрицательный атом имеет степень окисления со знаком «-», а менее электроотрицательный – со знаком «+».
- Для комплексных соединений указывают степень окисления центрального атома.
- Сумма степеней окисления атомов в молекуле равна нулю.
Например, определим степень окисления Se в соединении H2SeO3
Так, степень окисления водорода равна +1, кислорода -2, а сумма всех степеней окисления равна 0, составим выражение, учитывая число атомов в соединении H2+SeхO3-2:
(+1)2+х+(-2)3=0, откуда
х=+4,
т.е. H2+Se+4O3-2
Зная какую величину имеет степень окисления элемента в соединении возможно предсказать его химические свойства и реакционную активность по отношению к другим соединениям, а также является ли данное соединение восстановителем или окислителем. Эти понятия в полной мере раскрываются в теории окисления-восстановления:
- Окисление – это процесс потери электронов атомом, ионом или молекулой, что приводит к повышению степени окисления.
Al0 -3e— = Al+3;
2O-2 -4e— = O2;
2Cl— -2e— = Cl2
- Восстановление – это процесс при котором атом, ион или молекула приобретают электроны, что приводит к понижению степени окисления.
Ca+2 +2e— = Ca0;
2H+ +2e— =H2
- Окислители – соединения, принимающие электроны в ходе химической реакции, а восстановители – отдающие электроны соединения. Восстановители во время реакции окисляются, а окислители – восстанавливаются.
- Сущность окислительно-восстановительных реакций – перемещение электронов (или смещение электронных пар) от одних веществ к другим, сопровождающихся изменением степеней окисления атомов или ионов. В таких реакциях один элемент не может окислиться без восстановления другого, т.к. передача электронов всегда вызывает и окисление и восстановление. Таким образом, общее число электронов, отнимаемое при окислении у одного элемента, совпадает с числом электронов, получаемых другим элементом при восстановлении.
Так, если элементы в соединениях находятся в своих высших степенях окисления, то они будут проявлять только окислительные свойства, в связи с тем, что отдавать электроны они уже больше не могут. Напротив, если элементы в соединениях находятся в своих низших степенях окисления, то они проявляют только восстановительные свойства, т.к. присоединять электроны они больше не могут. Атомы элементов в промежуточной степени окисления, в зависимости от условий протекания реакции, могут быть как окислителями, так и восстановителями. Приведем пример: сера в своей высшей степени окисления +6 в соединении H2SO4, может проявлять только окислительные свойства, в соединении H2S – сера находится в своей низшей степени окисления -2 и будет проявлять только восстановительные свойства, а в соединении H2SO3 находясь в промежуточной степени окисления +4, сера может быть как окислителем, так и восстановителем.
На основании значений степеней окисления элементов можно предсказать вероятность реакции между веществами. Понятно, что если оба элемента в своих соединениях находятся в высших или низших степенях окисления, то реакция между ними невозможна. Реакция возможна, если одно из соединений может проявлять окислительные свойства, а другое – восстановительные. Например, в HI и H2S как йод, так и сера находятся в своих низших степенях окисления (-1 и -2) и могут быть только восстановителями, следовательно, реагировать друг с другом не будут. Зато они прекрасно будут взаимодействовать с H2SO4, для которой характерны восстановительные свойства, т.к. сера здесь находится в своей высшей степени окисления.
Важнейшие восстановители и окислители представлены в следующей таблице.
| Восстановители | |
| Нейтральные атомы | Общая схема M — ne → Mn+ Все металлы, а также водород и углерод.Наиболее сильные восстановители – щелочные и щелочно-земельные металлы, а также лантаноиды и актиноиды. Слабые восстановители – благородные металлы – Au, Ag, Pt, Ir, Os, Pd, Ru, Rh.В главных подгруппах периодической системы восстановительная способность нейтральных атомов, растет с увеличением порядкового номера. |
| отрицательно заряженные ионы неметаллов | Общая схема Э + ne—→ Эn- Отрицательно заряженные ионы являются сильными восстановителями, в связи с тем, что они могут отдавать как избыточные электроны, так и свои внешние электроны. Восстановительная способность, при одинаковом заряде, растет с увеличением радиуса атома. Например, I— более сильный восстановитель, чем Br— и Cl—.Восстановителями также могут быть S2-, Se2-, Te2- и другие. |
| положительно заряженные ионы металлов низшей степени окисления | Ионы металлов низшей степени окисления могут проявлять восстановительные свойства, если для них характерны состояния с более высокой степенью окисления. Например, Sn2+-2e— → Sn4+Cr2+-e— → Cr3+Cu+-e— → Cu2+ |
| Сложные ионы и молекулы, содержащие атомы в промежуточной степени окисления | Сложные или комплексные ионы, а также молекулы могут проявлять восстановительные свойства, если входящие в их состав атомы, находятся в промежуточной степени окисления. Например, SO32-, NO2—, AsO33-, [Fe(CN)6]4-, SO2, CO, NO и другие. |
| Важнейшие восстановители в технике и лабораторной практике | Углерод, Оксид углерода (II), Железо, Цинк, Алюминий, Олово, Сернистая кислота, Сульфит и бисульфит натрия, Сульфид натрия, Тиосульфат натрия, Водород, Электрический ток |
| Окислители | |
| Нейтральные атомы | Общая схема Э + ne- → Эn- Окислителями являются атомы р – элементов. Типичные неметаллы – фтор, кислород, хлор. Самые сильные окислители – галогены и кислород. В главных подгруппах 7, 6, 5 и 4 групп сверху вниз окислительная активность атомов понижается |
| положительно заряженные ионы металлов | Все положительно заряженные ионы металлов в разной степени проявляют окислительные свойства. Из них наиболее сильные окислители – это ионы в высокой степени окисления, например, Sn4+, Fe3+, Cu2+. Ионы благородных металлов даже в низкой степени окисления являются сильными окислителями. |
| Сложные ионы и молекулы, содержащие атомы металла в состоянии высшей степени окисления | Типичными окислителями являются вещества, в состав которых входят атомы металла в состоянии наивысшей степени окисления. Например, KMnO4, K2Cr2O7, K2CrO4, HAuCl4. |
| Сложные ионы и молекулы, содержащие атомы неметалла в состоянии положительной степени окисления | В основном это кислородсодержащие кислоты, а также соответствующие им оксиды и соли. Например, SO3, H2SO4, HClO, HClO3, NaOBr и другие. В ряду H2SO4 → H2SeO4 → H6TeO6 окислительная активность возрастает от серной к теллуровой кислоте. В ряду HClO — HClO2 — HClO3 — HClO4 HBrO — HBrO3 — HIO — HIO3 — HIO4, H5IO6 окислительная активность увеличивается справа налево, а усиление кислотных свойств происходит слева направо. |
| Важнейшие восстановители в технике и лабораторной практике | Кислород, Озон, Перманганат калия, Хромовая и Двухромовая кислоты, Азотная кислота, Азотистая кислота, Серная кислота (конц), Пероксид водорода, Электрический ток, Хлорноватая кислота, Диоксид марганца, Диоксид свинца, Хлорная известь, Растворы гипохлоритов калия и натрия, Гипобромид калия, Гексацианоферрат (III) калия. |
zadachi-po-khimii.ru
как опредилить валентность и степень окисления?
Вале́нтность — способность атомов химических элементов образовывать определённое число химических связей с атомами других элементов. В основном, под валентностью химических элементов понимается способность свободных его атомов к образованию определённого числа ковалентных связей. В соединениях с ковалентными связями валентность атомов определяется числом образовавшихся двухэлектронных двухцентровых связей. Именно такой подход принят в теории локализованных валентных связей, предложенной в 1927 году В. Гайтлером и Ф. Лондоном в 1927 г. Очевидно, что если в атоме имеется n неспаренных электронов и m неподелённых электронных пар, то этот атом может образовывать n + m ковалентных связей с другими атомами. При оценке максимальной валентности следует исходить из электронной конфигурации гипотетического, т. н. «возбуждённого» (валентного) состояния. Например, максимальная валентность атома бериллия, бора и азота равна 4 (например, в Be(OH)42-, BF4- и Nh5+), фосфора — 5 (PCl5), серы — 6 (h3SO4), хлора — 7 (Cl2O7). В ряде случаев, с валентностью отождествляются такие характеристики молекулярной системы как степень окисления элемента, эффективный заряд на атоме, координационное число атома и т. д. Эти характеристики могут быть близки и даже совпадать количественно, но ни коим образом не тождественны друг другу. Например, в изоэлектронных молекулах азота N2, монооксида углерода CO и цианид-ионе CN- реализуется тройная связь (то есть валентность каждого атома равна 3), однако степень окисления элементов равна, соответственно, 0, +2, −2, +2 и −3. В молекуле этана (см. рис.) углерод четырёхвалентен, как и в большинстве органических соединений, тогда как степень окисления формально равна −3. ——————- Сте́пень окисле́ния — вспомогательная условная величина для записи процессов окисления, восстановления и окислительно-восстановительных реакций, численная величина электрического заряда, приписываемого атому в молекуле в предположении, что электронные пары, осуществляющие связь, полностью смещены в сторону более электроотрицательных атомов. Представления о степени окисления положены в основу классификации и номенклатуры неорганических соединений. Следует помнить, что степень окисления является сугубо условной величиной, не имеющей физического смысла, но характеризующей образование химической связи межатомарного взаимодействия в молекуле. Степень окисления в ряде случаев не совпадает с валентностью. Например, в органических соединениях углерод всегда четырёхвалентен, а степень окисления атома углерода в соединениях метана Ch5, метилового спирта Ch4OH, формальдегида HCOH, муравьиной кислоты HCOOH и диоксида углерода CO2, соответственно, равна −4, −2, 0, +2 и +4. Степень окисления зачастую не совпадает с фактическим числом электронов, которые участвуют в образовании связей. Обычно это молекулы с различными электрондефицитными химическими связями и делокализацией электронной плотности. Например, в молекуле азотной кислоты степень окисления центрального атома азота равна +5, тогда как формальная валентность — 4, а координационое число — 3. В молекуле озона, имеющей сходное с SO2 строение, атомы кислорода характеризуется нулевой степенью окисления. Истинные заряды атомов в соединениях, определённые экспериментальным путём, также не совпадают со степенями окисления этих элементов. Например, заряды атомов водорода и хлора в молекуле хлороводорода HCl, в действительности, равны соответственно +0,17 и −0,17, хотя их степени окисления в этом соединении равны +1 и −1, а в кристаллах сульфида цинка ZnS заряды атомов цинка и серы равны соответственно +0,86 и −0,86, вместо степеней окисления +2 и −2. http://ru.wikipedia.org/wiki/Валентность http://ru.wikipedia.org/wiki/Степень_окисления Успехов!
touch.otvet.mail.ru
Электроотрицательность. Степень окисления и валентность химических элементов. Реакции окислительно — восстановительные.
Окислительно-восстановительные реакции
Одним из основных понятий неорганической химии является понятие о степени окисления (СО).
Степенью окисления элемента в соединении называется формальный заряд атома элемента, вычисленный из предположения, что валентные электроны переходят к атомам с большей относительной электроотрицательностью (ОЭО) и все связи в молекуле соединения являются ионными.
Степень окисления элемента Э указывают вверху над символом элемента со знаком « + » или « -» перед цифрой.
Степень окисления ионов, реально существующих в растворе или кристаллах, совпадает с их зарядовым числом и обозначается аналогично со знаком « + » или « » после цифры, например, Са2+.
Применяют также метод Штока обозначения степени окисления римскими цифрами после символа элемента: Mn (VII), Fe (III).
Вопрос о знаке степени окисления атомов в молекуле решается на основании сопоставления электроотрицательностей связанных между собой атомов, которые образуют молекулу. При этом атом с меньшей электроотрицательностью имеет положительную степень окисления, а с большей электроотрицательностью отрицательную.
Следует отметить, что нельзя отождествлять степень окисления с валентностью элемента. Валентность, определяемая как число химических связей, которыми данный атом соединен с другими атомами, не может равняться нулю и не имеет знака « + » или « ». Степень окисления может иметь как положительное, так и отрицательное значение, а также принимать нулевое и даже дробное значение. Так, в молекуле СO2 степень окисления С равна +4, а в молекуле СН4 степень окисления С равна 4. Валентность же углерода и в том, и в другом соединении равна IV.
Несмотря на указанные выше недостатки, использование понятия степени окисления удобно при классификации химических соединений и составлении уравнений окислительно-восстановительных реакций.
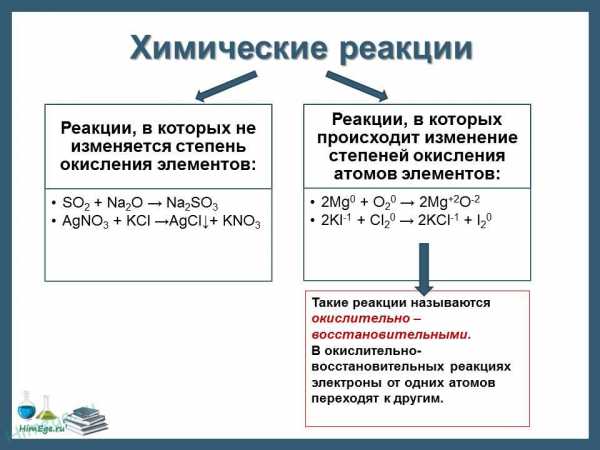
При окислительно-восстановительных реакциях протекают два взаимосвязанных процесса: окисление и восстановление.
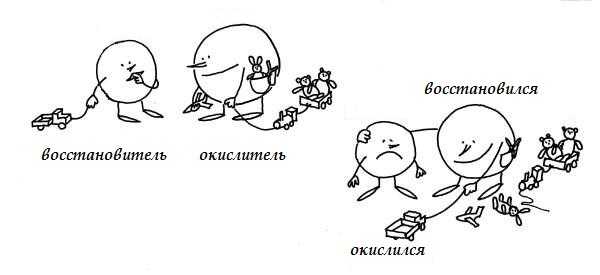
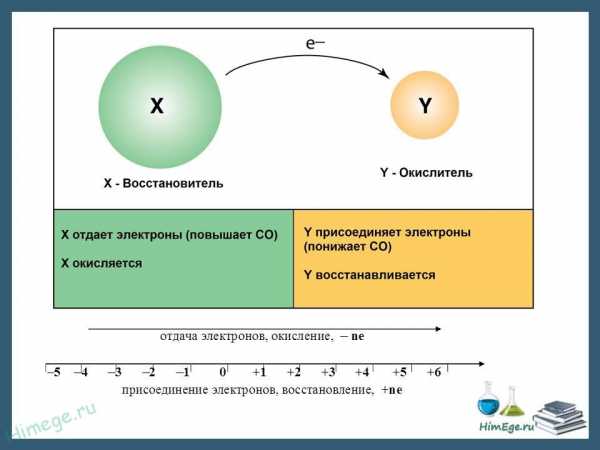
Окислением называется процесс потери электронов. Восстановлением процесс присоединения электронов.
Вещества, атомы или ионы которых отдают электроны, называются восстановителями. Вещества, атомы или ионы которых присоединяют электроны (или оттягивают к себе общую пару электронов), называются окислителями.
При окислении элемента степень окисления увеличивается, иначе говоря, восстановитель при реакции повышает степень окисления.
Наоборот, при восстановлении элемента степень окисления понижается, т. е. при реакции окислитель уменьшает степень окисления.
Таким образом, можно дать и такую формулировку окислительно-восстановительных реакций: окислительно-восстановительными реакциями называются реакции, протекающие с изменением степени окисления атомов элементов, входящих в состав реагирующих веществ.
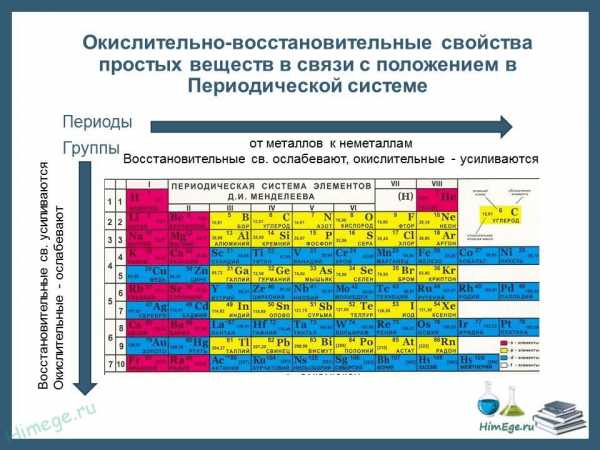
Окислители и восстановители
Для прогноза продуктов и направления окислительно-восстановительных реакций полезно помнить, что типичными окислителями являются простые вещества, атомы которых имеют большую ОЭО > 3,0 (элементы VIA и VIIAгрупп). Из них наиболее сильные окислители фтор (ОЭО = 4,0), кислород (ОЭО = 3,0), хлор (ОЭО = 3,5). К важным окислителям относятся PbO2 , KMnO4 , Cа(SO4)2 , К2Сr2O7 , HClO, HClO3, КСIO4, NaBiO3, H2SO4(конц), HNO3(конц) , Na2O2 , (NH4)2S2O8 , КСIO3 , H2O2 и другие вещества, которые содержат атомы с высшей или высокой СО.
К типичным восстановителям относятся простые вещества, атомы которых имеют малую ОЭО < 1,5 (металлы IA и IIAгрупп и некоторые другие металлы). К важным восстановителям относятся H2S, NH3, HI, KI, SnCl2 , FeSO4 , C, H2 , CO, H2SO3 , Cr2(SO4)3 , CuCl, Na2S2O3 и другие вещества, которые содержат атомы с низкими СО.
Вещества, содержащие атомы в максимальной и минимальной степенях окисления, могут быть соответственно только окислителями, например К2Сг2O7 , КМпO4 , PbO2 , HClO4 или только восстановителями, например NH3 , H2S, HI.
Вещества, содержащие атомы в промежуточных степенях окисления, способны как повышать, так и понижать степень окисления, т. е. могут быть как восстановителями (при действии более активного, чем они, окислителя), так и окислителями (при действии более активного, чем они, восстановителя). Такие вещества проявляют окислительно-восстановительную двойственность.
При составлении уравнений окислительно-восстановительных реакций можно применять два метода: метод электронного баланса и ионно-электронный метод (метод полуреакций). Более правильное представление об окислительно-восстановительных процессах в растворах дает ионно-электронный метод. С помощью этого метода прогнозируют изменения, которые претерпевают реально существующие в растворе ионы и молекулы.
Помимо прогнозирования продуктов реакции, ионные уравнения полуреакций необходимы для понимания окислительно-восстановительных процессов, протекающих при электролизе и в гальванических элементах. Этот метод отражает роль среды как участника процесса. И наконец, при использовании этого метода необязательно заранее знать все образующиеся вещества, так как многие из них получаются при составлении уравнения окислительно-восстановительных реакций.
Следует иметь в виду, что хотя полуреакции отражают реальные процессы, идущие при окислительно-восстановительных реакциях, их нельзя отождествлять с реальными стадиями (механизмом) окислительно-восстановительных реакций.
На характер и направление окислительно-восстановительных реакций влияют многие факторы: природа реагирующих веществ, реакция среды, концентрация, температура, катализаторы.












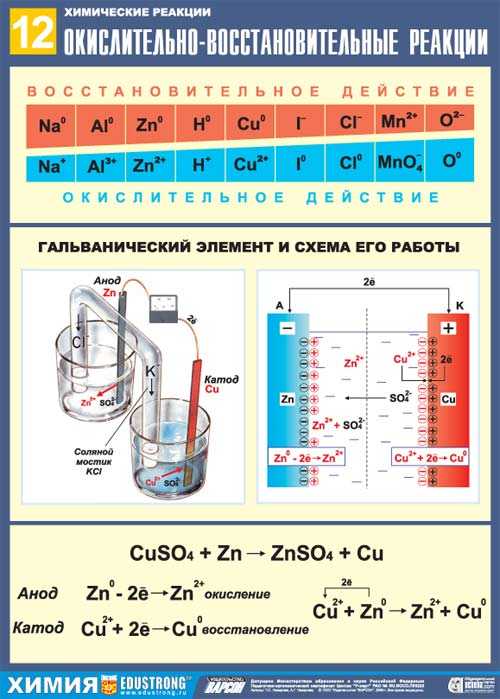
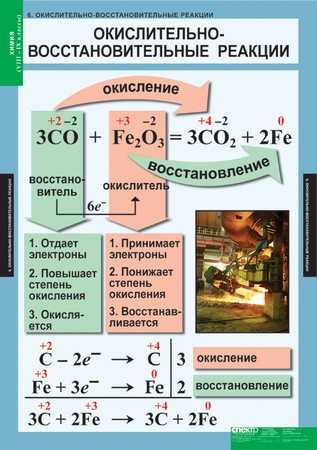
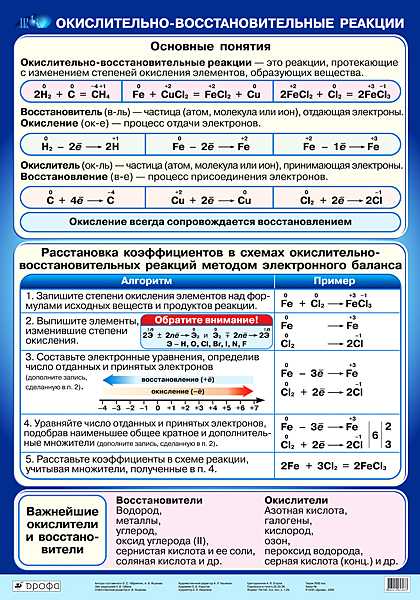

Биологическое значение окислительно-восстановительных процессов
Важными процессами в животных организмах являются реакции ферментативного окисления веществ-субстратов: углеводов, жиров, аминокислот. В результате этих процессов организмы получают большое количество энергии. Приблизительно 90% всей потребности взрослого мужчины в энергии покрывается за счет энергии, вырабатываемой в тканях при окислении углеводов и жиров. Остальную часть энергии ~10% дает окислительное расщепление аминокислот.
Биологическое окисление протекает по сложным механизмам при участии большого числа ферментов. В митохондриях окисление происходит в результате переноса электронов от органических субстратов. В качестве переносчиков электронов в дыхательную цепь митохондрий входят различные белки, содержащие разнообразные функциональные группы, которые предназначены для переноса электронов. По мере продвижения по цепи от одного интермедиата к другому электроны теряют свободную энергию. На каждую пару электронов, переданных по дыхательной цепи кислороду, синтезируются 3 молекулы АТФ. Свободная энергия, высвобождающаяся при переносе 2 электронов на кислород, составляет 220 кДж/моль.
На синтез 1 молекулы АТФ в стандартных условиях расходуется 30,5 кДж. Отсюда ясно, что довольно значительная часть свободной энергии, выделяющейся при переносе одной пары электронов, запасается в молекулах АТФ. Из этих данных становится понятной и роль многостадийной передачи электронов от исходного восстановителя к кислороду. Большая энергия (220 кДж), выделяемая при переносе одной пары электронов к кислороду, разбивается на ряд порций, соответствующих отдельным стадиям окисления. На трех таких стадиях количество выделяющейся энергии примерно соответствует энергии, необходимой для синтеза 1 молекулы АТФ.

himege.ru
