Разработка урока по химии в 11 классе «Современные представления о строении атома. Атом. Изотопы. Атомные орбитали. Электронная классификация элементов (s-, p- элементы). Особенности строения электронных оболочек атомов переходных элементов»
https://infourok.ru/videouroki ссылка на все видеоуроки
Тема 1. Строение вещества. 11 класс
Урок №1. Тема урока: ТБ. Современные представления о строении атома.
Атом. Изотопы. Атомные орбитали. Электронная классификация элементов (s-, p-
элементы). Особенности строения электронных оболочек атомов переходных элементов.
Цели и задачи урока:
Образовательные: повторить правила ТБ; обобщить знания из курсов физики и химии о явлениях, доказывающих сложность строения атома, познакомить учащихся с эволюцией научных взглядов на строение атома.
Воспитательные: Продолжить формирование познавательного интереса к предмету, показать значимость химических знаний для современного человека. Воспитание трудолюбия, аккуратности, коммуникативных качеств.
Развивающие: Развивать учебно-интеллектуальные умения выделять главное, устанавливать причинно-следственные связи (развивать логическое мышление), умений находить требуемую информацию в различных источниках и извлекать из предложенной информации нужные данные. Развивать память и внимание обучающихся.
Здоровьесберегающие технологии: следить за осанкой учащихся; проводить упражнения для снятия напряжения глаз; проветривание помещения.
Оборудование: ИКТ, презентация.
Ход урока:
Организационный момент. ТБ.
1.Тетради (рабочие, практические, контрольные)
2. Учебники.
3. ТБ
Основная часть.
Беседа:
вы помните, что «атом» в переводе с греческого обозначает «неделимый», до конца ХIХ века это считалось верным. Но открытия конца ХIХ — начала ХХ вв. показали, что атом устроен сложно.
Лекция+ работа с учебником
С тех пор, как стало ясно, что атом состоит из более мелких частиц, ученые пытались
объяснить строение атома, предлагали модели:
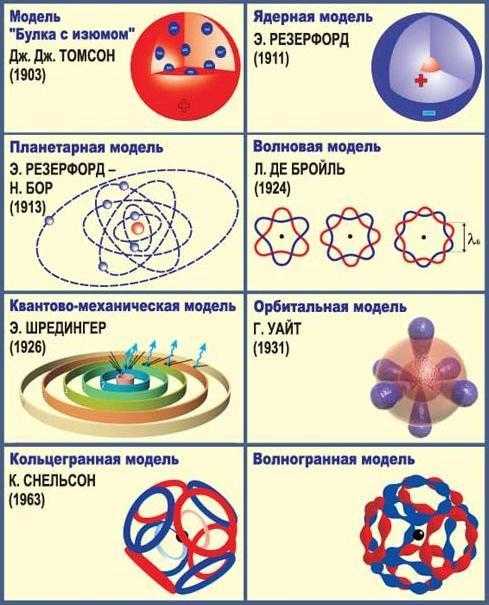
Дж. Томсон (1904 г.) – атом состоит из положительного заряда, равномерно распространенному по всему объему атома, и электронов, колеблющихся внутри этого заряда. Эта модель не нашла экспериментального подтверждения.
Э.Резерфорд (1911 г.) – планетарная или ядерная модель атома:
— внутри атома находится положительно заряженное ядро, занимающее ничтожную часть объема атома;
— Электроны вращаются вокруг ядра, они нейтрализуют заряд ядра.
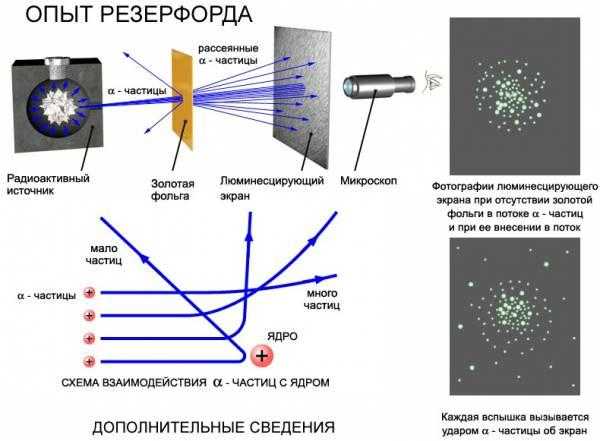
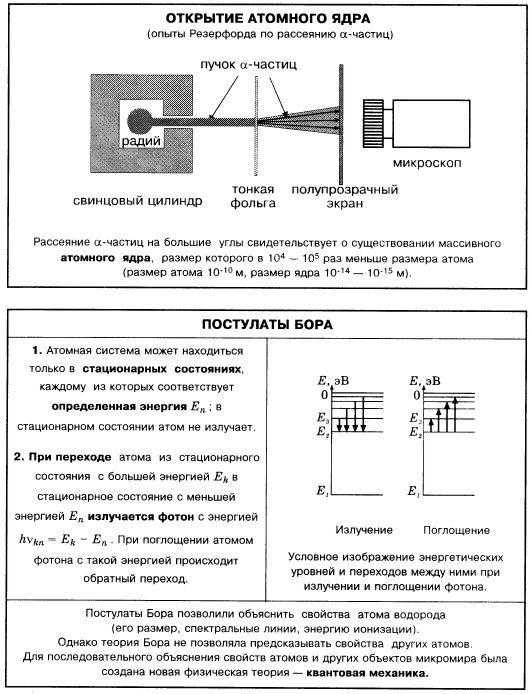
Модель Резерфорда подтверждалась опытами с тонкими металлическими пластинами, облучаемыми α-частицами.
Но классическая механика не могла объяснить, почему электроны не теряют энергию по мере вращения и не падают на ядро.
В 1913 г. Н.Бор дополнил планетарную модель постулатами:
— электроны в атоме вращаются по строго определенным замкнутым орбитам, не испуская и не поглощая энергии;
— при переходе электронов с одной орбиты на другую происходит поглощение или выделение энергии.
— электрон в атоме не движется по определенной траектории, а может находиться в любой части околоядерного пространства. Вероятность нахождения электрона в разных частях околоядерного пространства неодинакова.
Пространство вокруг ядра, где вероятность нахождения электрона наибольшая называется орбиталью.
— Ядро состоит из нуклонов – протонов и нейтронов. Число протонов в ядре равно порядковому номеру элеме6нта, а сумма чисел протонов и нейтронов равна массовому числу атома.
Это положение было сформулировано после открытия Э. Резерфордом в 1920 г. протона, Дж.Чедвиком в 1932 г.- нейтрона.
Различные виды атомов называются нуклидами. Нуклиды характеризуется массовым числом А и зарядом ядра Z.
Нуклиды с одинаковым Z, но разными А называют изотопами.( 35 17Cl и 37 17Cl).
Нуклиды с разными Z, но одинаковыми А называют изобарами.( 40 18Аr и 40 19К).
Электронная конфигурация атома –
показывает распределение ē по энерг. уровням и подуровням.
+1Н 1s1 ←число ē с данной формой облака
↑↖ форма электронного облака
Номер
энерг.уровня
Графические электронные формулы (изображения электронной структуры атома) –
показывает распределение ē по энерг. уровням, подуровням и орбиталям.
I период: +1Н Где ↑ — ē, ↑↓ — ē с антипараллельными спинами, орбиталь.При записи графической электронной формулы следует помнить правило Паули и правило Хундда « Если в пределах одного подуровня имеется несколько свободных орбиталей, то ē размещаются каждый на отдельной орбитали и лишь при отсутствии свободных орбиталей объединяются в пары».
(Работа с электронными и графическими электронными формулами).
Напр., H+11s1; He+21s2; Li+31s22s1 ; Na+11 1s2 2s2 2p63s1 ; Ar+181s2 2s2 2p6 3s23p6 ;
I период: водород и гелий – s-элементы, у них заполняется электронами s-орбиталь.
II период: Li и Be – s-элементы
B, С, N, O, F, Ne – р-элементы
В зависимости от того, какой подуровень атома заполняется электронами последним, все элементы делят на 4 электронных семейства или блока:
1) s-элементы – у них заполняется ē-ми s-подуровень внешнего слоя атома; к ним относятся водород, гелий и эл-ты гл.п/гр. I и II групп.
2) р-элементы
3) d-элементы – у них заполняется электронами d-подуровень предвнешнего уровня атома; к ним относятся эл-ты побоч.п/гр. . I — VIII групп,т.е. эл-ты вставных декад больших периодов, распложенные между s- и р-элементами, их также называют переходными элементами.
4) f-элементы — у них заполняется электронами f-подуровень третьего снаружи уровня атома; к ним относятся лантаноиды ( 4f-элементы) и актиноиды (5f-элементы).
У атомов меди и хрома происходит «провал» ē с 4s- на 3d-подуровень, что объясняется большей энергетической устойчивостью образующихся при этом электронных конфигураций 3d5 и 3d10:
29Cu 1s22s22p63s23p6 4s13d10
24Cr 1s22s22p63s23p64s13d5
Задание1:
— расписать строение атома для элементов : железа, алюминия, бария, калия, кремния.
Задание 2
1.Определите химический элемент по составу его атома — 18 p+, 20 n0, 18 e—:
а) F б) Ca в) Ar г) Sr
2. Общее число электронов у иона хрома 24Cr3+:
а) 21 б) 24 в) 27 г) 52
3.Максимальное число электронов, занимающих 3s — орбиталь, равно:
а) 14 б) 2 в) 10 г) 6
4.Число орбиталей на f — подуровне:
а) 1 б) 3 в) 5 г) 7
5 .Наименьший радиус атома среди приведённых элементов имеет:
а) Mg б) Ca в) Si г) Cl
Д/з § 1, записи в тетради, упр. 1-8 стр.12, презентация

multiurok.ru
Конспект урока для 11 класса «Атом – сложная частица»
Урок 1.
Атом – сложная частица
Цель: обобщить знания из курсов физики и химии о явлениях, доказывающих сложность строения атома, познакомить учащихся с эволюцией научных взглядов на строение атома.
Знать: особенности строения атома.
Уметь: описывать строение атома, характеризовать частицы, входящие в его состав.
Ход урока
Беседа:
вы помните, что «атом» в переводе с греческого обозначает «неделимый», до конца ХIХ века это считалось верным. Но открытия конца ХIХ — начала ХХ вв. показали, что атом устроен сложно.
Лекция:
С тех пор, как стало ясно, что атом состоит из более мелких частиц, ученые пытались
объяснить строение атома, предлагали модели:
Дж. Томсон (1903 г.) – атом состоит из положительного заряда, равномерно распространенному по всему объему атома, и электронов, колеблющихся внутри этого заряда. Эта модель не нашла экспериментального подтверждения.
Э.Резерфорд (1911 г.) – планетарная или ядерная модель атома:
— внутри атома находится положительно заряженное ядро, занимающее ничтожную часть объема атома;
— весь положительный заряд и почти вся масса атома сосредоточена в ядре;
— Электроны вращаются вокруг ядра, они нейтрализуют заряд ядра.
Модель Резерфорда подтверждалась опытами с тонкими металлическими пластинами, облучаемыми α-частицами.
Но классическая механика не могла объяснить, почему электроны не теряют энергию по мере вращения и не падают на ядро.
В 1913 г. Н.Бор дополнил планетарную модель постулатами:
— электроны в атоме вращаются по строго определенным замкнутым орбитам, не испуская и не поглощая энергии;
— при переходе электронов с одной орбиты на другую происходит поглощение или выделение энергии.
4. Современная квантовая модель строения атома:
— электрон имеет двойственную природу. Подобно частице электрон имеет массу 9,1х10-28г и заряд 1,6х10-19Кл.
— электрон в атоме не движется по определенной траектории, а может находиться в любой части околоядерного пространства. Вероятность нахождения электрона в разных частях околоядерного пространства неодинакова.
Пространство вокруг ядра, где вероятность нахождения электрона наибольшая называется орбиталью.
— Ядро состоит из нуклонов – протонов и нейтронов. Число протонов в ядре равно порядковому номеру элеме6нта, а сумма чисел протонов и нейтронов равна массовому числу атома.
Это положение было сформулировано после открытия Э. Резерфордом в 1920 г. протона, Дж.Чедвиком в 1932 г.- нейтрона.
Различные виды атомов называются нуклидами. Нуклиды характеризуется массовым числом А и зарядом ядра Z.
Нуклиды с одинаковым Z, но разными А называют изотопами.( 35 17Cl и 37 17Cl).
Нуклиды с разными Z, но одинаковыми А называют изобарами.( 40 18Аr и 40 19К).
Задание1:
— расписать строение атома для элементов : железа, алюминия, бария, калия, кремния.
Задание 2
1.Определите химический элемент по составу его атома — 18 p+, 20 n0, 18 e—:
а) F б) Ca в) Ar г) Sr
2. Общее число электронов у иона хрома 24Cr3+:
а) 21 б) 24 в) 27 г) 52
3.Максимальное число электронов, занимающих 3s — орбиталь, равно:
а) 14 б) 2 в) 10 г) 6
4.Число орбиталей на f — подуровне:
а) 1 б) 3 в) 5 г) 7
5 .Наименьший радиус атома среди приведённых элементов имеет:
а) Mg б) Ca в) Si г) Cl
Домашнее задание: § 1. учить по тетради, зад 1-4.
doc4web.ru
Конспект урока химии в 11 классе по теме «Атом-сложная частица»
Урок 1.
Атом – сложная частица
Цель: обобщить знания из курсов физики и химии о явлениях, доказывающих сложность строения атома, познакомить учащихся с эволюцией научных взглядов на строение атома.
Знать: особенности строения атома.
Уметь: описывать строение атома, характеризовать частицы, входящие в его состав.
Ход урока
Беседа:
вы помните, что «атом» в переводе с греческого обозначает «неделимый», до конца ХIХ века это считалось верным. Но открытия конца ХIХ — начала ХХ вв. показали, что атом устроен сложно.
Лекция:
С тех пор, как стало ясно, что атом состоит из более мелких частиц, ученые пытались
объяснить строение атома, предлагали модели:
Дж. Томсон (1903 г.) – атом состоит из положительного заряда, равномерно распространенному по всему объему атома, и электронов, колеблющихся внутри этого заряда. Эта модель не нашла экспериментального подтверждения.
Э.Резерфорд (1911 г.) – планетарная или ядерная модель атома:
— внутри атома находится положительно заряженное ядро, занимающее ничтожную часть объема атома;
— весь положительный заряд и почти вся масса атома сосредоточена в ядре;
— Электроны вращаются вокруг ядра, они нейтрализуют заряд ядра.
Модель Резерфорда подтверждалась опытами с тонкими металлическими пластинами, облучаемыми α-частицами.
Но классическая механика не могла объяснить, почему электроны не теряют энергию по мере вращения и не падают на ядро.
В 1913 г. Н.Бор дополнил планетарную модель постулатами:
— электроны в атоме вращаются по строго определенным замкнутым орбитам, не испуская и не поглощая энергии;
— при переходе электронов с одной орбиты на другую происходит поглощение или выделение энергии.
4. Современная квантовая модель строения атома:
— электрон имеет двойственную природу. Подобно частице электрон имеет массу 9,1х10-28г и заряд 1,6х10-19Кл.
— электрон в атоме не движется по определенной траектории, а может находиться в любой части околоядерного пространства. Вероятность нахождения электрона в разных частях околоядерного пространства неодинакова.
Пространство вокруг ядра, где вероятность нахождения электрона наибольшая называется орбиталью.
— Ядро состоит из нуклонов – протонов и нейтронов. Число протонов в ядре равно порядковому номеру элеме6нта, а сумма чисел протонов и нейтронов равна массовому числу атома.
Это положение было сформулировано после открытия Э. Резерфордом в 1920 г. протона, Дж.Чедвиком в 1932 г.- нейтрона.
Различные виды атомов называются нуклидами. Нуклиды характеризуется массовым числом А и зарядом ядра Z.
Нуклиды с одинаковым Z, но разными А называют изотопами.( 35 17Cl и 37 17Cl).
Нуклиды с разными Z, но одинаковыми А называют изобарами.( 40 18Аr и 40 19К).
Задание1:
— расписать строение атома для элементов : железа, алюминия, бария, калия, кремния.
Задание 2
1.Определите химический элемент по составу его атома — 18 p+, 20 n0, 18 e—:
а) F б) Ca в) Ar г) Sr
2. Общее число электронов у иона хрома 24Cr3+:
а) 21 б) 24 в) 27 г) 52
3.Максимальное число электронов, занимающих 3s — орбиталь, равно:
а) 14 б) 2 в) 10 г) 6
4.Число орбиталей на f — подуровне:
а) 1 б) 3 в) 5 г) 7
5 .Наименьший радиус атома среди приведённых элементов имеет:
а) Mg б) Ca в) Si г) Cl
Домашнее задание: § 1. учить по тетради, зад 1-4.
kopilkaurokov.ru
Введение в общую химию — ПОУРОЧНЫЕ РАЗРАБОТКИ ПО ХИМИИ 11 класс — поурочные разработки — разработки уроков — авторские уроки — план-конспект урока
Урок 1. Введение в общую химию
Цели урока: ознакомить учащихся с задачами и структурой курса химии в 11 классе; повторить и обобщить первоначальные знания учащихся о предмете химии, веществе, атоме, элементарном строении атома, Периодическом законе, Периодической системе химических элементов Д.И. Менделеева (далее — ПСХЭ), химической связи, приобретенных в курсе химии 8 класса.
Оборудование: таблицы курса химии 8 класса («Строение атома», «Химическая связь»), ПСХЭ.
Ход урока
I. Организационный момент
В начале учебного года с учащимися проводится вводный инструктаж по охране труда и технике безопасности в кабинете химии (далее — ОТ и ТБ). Необходимо напомнить учащимся основные правила поведения в кабинете химии при проведении лабораторных и практических работ и правила работы с тетрадью «Инструктаж ОТ и ТБ».
Курс химии 11 класса построен логично: от изучения состава и строения атома к изучению состава и строения веществ, далее углубленное изучение химических реакций, а затем изучение химических свойства веществ, их получение и применение.
Учащимся для более углубленного изучения темы «Строение атома. ПСХЭ Д. И. Менделеева» необходимо вспомнить следующее:
а) понятия «вещество», «атом», «химический элемент», «изотоп»;
б) элементарный состав атома, электронное строение атома, электронно-графическая структура атома;
в) структуру ПСХЭ Д. И. Менделеева;
г) элементы металлические и неметаллические, изменение их свойств в связи с положением в системе химических элементов;
д) химическую связь, виды химической связи.
Учащимся предлагается выполнить задания теста. Задания теоретической части теста обсуждаются вместе с учителем, практическая часть выполняется самостоятельно по вариантам.
II. Проведение теста
Теоретическая часть
1. Вспомните определение атома.
2. Какое строение имеет атом?
3. Какие элементарные частицы входят в состав ядра атома? Как определяется заряд ядра атома?
4. Что определяет сумма протонов и нейтронов?
5. Дайте определение химического элемента.
6. Как определить число протонов, нейтронов и электронов в атоме? Докажите, что атом — электронейтральная частица.
7. Дайте определение изотопа.
8. Какое строение имеет электронная оболочка атома? Как определяется число электронов в ней?
9. Как определить максимальное количество электронов на энергетическом уровне?
10. Как определяется количество электронов на внешнем энергетическом уровне?
11. Что такое орбиталь? Какую форму имеют s- и р-орбитали? Какие электроны называются s- и p-электронами?
12. Что такое электронная формула?
13. Как и почему изменяются свойства химических элементов в пределах:
а) одного периода;
б) группы, главной подгруппы при увеличении заряда ядра атома?
14. Опишите пути завершения последнего энергетического уровня:
а) характерного для металлического элемента;
б) характерного для неметаллического элемента.
15. Какие виды химической связи вам известны?
16. Какова причина возникновения различных видов химической связи?
Практическая часть
Вариант I Определить состав атома элемента № 10. Определить максимальное количество электронов на втором энергетическом уровне. Количество электронов на внешнем энергетическом уровне элемента № 33. Составить электронную формулу элемента № 7. Расположить элементы в порядке усиления металличности: № 12, № 11, № 13. Каков путь завершения последнего энергетического уровня элемента № 3? Определить вид химической связи в соединениях: НCl, О2, К, MgO. | Вариант II Определить состав атома элемента N? 40. Определить максимальное количество электронов на третьем энергетическом уровне. Количество электронов на внешнем энергетическом уровне элемента № 53. Составить электронную формулу элемента № 10. Расположить элементы в порядке усиления неметалличности: № 17, № 53, № 9. Каков путь завершения последнего энергетического уровня элемента № 9? Определить вил химической связи в соединениях: F2, NaCl, H2S, Fe. |
III. Домашнее задание
Повторить по учебнику X класса сведения о строении атома (§ 4—12).
Ответы на вопросы теста
Теоретическая часть
1. Атом — наименьшая частица вещества, химически неделимая; «атом» — означает «неделимый».
2. Атом имеет сложное строение. Он состоит из положительно заряженного ядра и электронов.
3. В состав ядра атома входят: протоны, имеющие массу 1 и заряд +1; нейтроны, имеющие массу 1 и заряд 0; заряд ядра определяется количеством протонов.
4. Сумма протонов и нейтронов соответствует массовому числу атома — массе атома.
5. Химический элемент — вид атома с определенным зарядом ядра.
6. Порядковый номер элемента в ПСХЭ соответствует количеству протонов в ядре атома, количеству электронов в атоме, поэтому атом — элетронейтральная частица; число нейтронов определяется разностью массового числа и количества протонов.
7. Изотопы — химические элементы, имеющие одинаковый заряд ядра, но различную атомную массу.
8. Количество электронов определяется порядковым номером элемента. Электронная оболочка атома состоит из определенного количества энергетических уровней. Количество энергетических уровней в атоме соответствует номеру периода химического элемента.
9. Максимальное количество электронов определяется по формуле: 2n2, где n — номер энергетического уровня.
10. Количество электронов на внешнем энергетическом уровне атома химического элемента определяется по номеру группы ПСХЭ.
11. Орбиталь — пространство вокруг ядра атома, где наибольшая вероятность нахождения электронов. S-орбиталь имеет форму сферы (шара), р-орбиталь имеет форму объемной восьмерки; s-электроны расположены на s-орбиталях, а p-электроны расположены на p-орбиталях.
12. Электронная формула-запись строения атома, где указаны энергетические уровни, орбитали на энергетических уровнях и количество электронов на орбиталях. Следует помнить — максимальное количество электронов на s-орбитали — 2, на р-орбитали — 6; на первом энергетическом уровне открывается j-орбиталь, на втором энергетическом уровне s- и р-орбитали.
13. В пределах периода с ростом заряда ядра атома, увеличения количества электронов на внешнем энергетическом уровне уменьшается радиус атома, вследствие чего усиливается неметалличность — способность принимать электроны.
В группах, главных подгруппах с ростом заряда атома растет число энергетических уровней, увеличивается атомный радиус, вследствие чего усиливается металличность — способность отдать электроны.
14. Последний энергетический уровень у атома металла далек от завершения, до устойчивости атому металла энергетически выгоднее отдать электроны внешнего энергетического уровня; последний энергетический уровень атома неметалла близок к завершению, энергетически выгоднее атому неметалла принять недостающие электроны до устойчивости энергетического уровня.
15. Ковалентная связь полярная и неполярная, ионная связь, металлическая связь.
16. Причиной возникновения различных видов связи является электроотрицательность. Электроотрицательность — способность атомов притягивать недостающие электроны на последний энергетический уровень. В случае резкого отличия в электроотрицательности атомов — возникает ионная связь; ковалентная полярная связь возникает между атомами, которые не резко отличаются в электроотринательности; в случае одинаковой элекроотрицательности атомов возникает ковалентная неполярная связь.
Практическая часть
Вариант I Заряд ядра атома — +10; протонов — 10; электронов — 10; нейтронов 20 — 10 = 10. N = 2n2, n = 2, N = 8. 5 электронов. 1s22s22p3 Al, Mg, Na Na — металлический элемент; отдаёт один электрон с внешнего энергетического уровня. Металлическая связь — К; ковалентная неполярная связь — O2; ковалентная полярная связь — НСl; ионная связь — MgO. | Вариант II Заряд ядра атома — +40; протонов — 40; электронов — 40; нейтронов 91 — 40 = 51. N = 2n2, n = 3, N = 18. 7 электронов 1s22s22p6 I, Cl, F F — Неметаллический элемент; принимает один электрон на внешний энергетический уровень. Металлическая связь — Fe, ковалентная неполярная связь — F2; ковалентная полярная связь — H2S, ионная связь — NaCl. |
compendium.su
Методическая разработка урока химии по теме «Основные сведения о строении атома» для 11 класса
Учитель: Тирская Анна Михайловна
Тема урока: Основные сведения о строение атома.
Цели урока: Познакомиться с историей развития представлений о строении атома, моделями атома, доказательствами сложности строения атома. Рассмотреть строение ядра и электронные конфигурации атома.
Задачи:
образовательные: знакомство с историей развития представлений о строении атомов, открытия и доказательства сложности строения атома на основе межпредметных связей с физикой; повторение умения составлять электронные и электронно-графические формулы атомов.
развивающие: совершенствование умения краткого изложения полученной информации, выбора из сказанного главного; формирование умения анализировать, выявлять причинно-следственные связи, оценивать свои знания.
воспитательные: развитие умения работать в коллективе.
Ход урока:
Организационный момент. Инструктаж по технике безопасности в кабинете химии (повторный вводный).
Введение в тему урока:
Развитие представлений о строении атома.
Понятие атом (греч. «atomos» – неделимый) ввел Демокрит. У Демокрита атомы выступают в роли первоначала. Они неделимы, различаются по величине, весу, форме и находятся в вечном движении. После Демокрита учение об атомах было на много веков забыто. Возродил атомистическую теорию английский физик и химик Джон Дальтон. Он основывался на открытых в то время законах химии и экспериментальных данных о строении вещества. Таким образом, установил, что атомы одного элемента имеют одинаковые свойства, а разных элементов – различаются по свойствам. Дальтон ввел важную характеристику атома – атомную массу и для очень многих элементов были установлены ее относительные значения. В своем атомно-молекулярном учении Дальтон дает характеристику атому: «Атом неделим, вечен и неразрушим».
Атом делим, это доказали следующие экспериментальные открытия, сделанные в науке на рубеже конца 19-начала 20 века.
В 1897 году Крукс открыл катодные лучи, представляющие собой поток электронов в вакуумной трубке, содержащей катод и анод. Английский физик Джозеф Томпсон назвал частицы катодных лучей электронами.
Русский ученый Столетов открыл явление фотоэффекта – испускания металлом электронов под действием падающего на него света.
Значимым стало открытие Рентгеном «Х»-лучей, позже названных рентгеновскими в честь ученого. Эти лучи представляют собой электромагнитное излучение подобное свету с гораздо более высокой частотой, испускаемой при действии на них катодных лучей.
Большой вклад в развитие представлений об элементарных частицах внесли французский физик Антуан Анри Беккерель и супруги Кюри, открыв явление радиоактивности. Радиоактивность – это явление самопроизвольного превращения одного химического элемента в другой, сопровождаемое испусканием электронов или других частиц и рентгеновского излучения.
Эти экспериментальные данные свидетельствуют о том, что атом – сложноустроенная система.
Модели атома.
Одной из первых моделей строения атома явилась модель английского физика Джозефа Томсона, предложенная им в в1904 г. – так называемый «пудинг с изюмом»: атом представляет собой сферу положительного электричества с вкрапленными электронами.
Для проверки этой модели в 1899-1911 гг. английский физик Эрнест Резерфорд провел опытные исследования и сформулировал планетарную (ядерную) теорию строения атома. Согласно этой модели, в центре атома находится очень маленькое ядро, размеры которого приблизительно в 100’000 раз меньше размеров самого атома. В ядре сосредоточена практически вся масса атома. Оно имеет положительный заряд. Вокруг ядра движутся электроны, заряженные отрицательно. Их число определяется зарядом ядра.
Однако такая модель имела свои недостатки:
1. Резерфорд не смог объяснить устойчивости атома. Двигаясь вокруг ядра, электрон расходует энергию и в какой-то момент, израсходовав ее всю, он должен остановиться – упасть на ядро, что равносильно гибели атома. Но на самом деле атомы – структуры довольно стабильные.
2. Резерфорд не смог объяснить линейный характер атомных спектров. Согласно его модели, электрон должен излучать энергию постоянно и поэтому атомный спектр должен быть сплошным, но экспериментальные данные доказывали обратное: спектр не сплошной, а прерывистый. Это означает, что электрон излучает энергию порциями.
Свою теорию строения атома, основанную на планетарной модели и квантовой теории, в 1913 году предложил датский физик Нильс Бор. Основные положения он сформулировал в виде постулатов:
I. Электрон может вращаться вокруг ядра по определенным, стационарным круговым орбиталям.
II. Двигаясь по стационарной орбите, электрон не излучает энергию.
III. Излучение электромагнитной энергии (либо ее поглощение) происходит при переходе электрона с одной стационарной орбиты на другую.
Но и эта модель не явилась совершенством, в ней также присутствовали противоречия. «Спасти» теорию Бора пытались многие ученые.
В 1932 году Иваненко предложил протонно-нейтронную модель ядра. Эту теорию развил Гейзенберг. Эта модель строения атома существует до сих пор, сочетает в себе все предыдущие модели и «исправляет» их недостатки. Суть теории в том, что атомное ядро состоит из протонов и нейтронов. В совокупности они называются нуклоны. Число протонов в ядре («+» заряд) характеризует его заряд. Количество электронов («-» заряд), движущихся вокруг ядра, соответствует количеству протонов в нем. Электроны движутся по определенным атомным орбиталям, которые могут существовать в различных формах. При переходе с орбитали на орбиталь испускается или поглощается электромагнитная энергия.
Основные характеристики нуклонов и электрона. Массовое число. Изотопы.
Электронное облако.
3.Закрепление материала (поэтапно).
1.Определите число протонов и нейтронов в ядрах атомов 40Ca, 35Cl, 127I.
2. В электронной оболочке атома 19 электронов. О каком элементе идет речь? Определите число протонов и нейтронов в атомном ядре этого элемента.
3.Какими величинами характеризуется изотоп?
4. Почему изотопы одного элемента имеют разные массовые числа?
5.Почему в периодической системе у химических элементов указаны дробные значения относительной атомной массы?
6.Запишите электронные и электроно-графические формулы атомов элементов, имеющих порядковые номера 6, 15, 9, 20, 25. К каким электронным семействам относят эти элементы?
4.Подведение итогов урока. Рефлексия.
5. Постановка домашнего задания.
Литература:
Габриелян О.С. Химия. 11 класс. Базовый уровень: учеб. для общеобразоват. учреждений. – М., 2013.
Габриелян О.С. Настольная книга учителя химии: 11 класс: в 2 ч. / О.С. Габриелян, Г.Г. Лысова, А.Г. Введенская – М., 2004.
kopilkaurokov.ru
ГДЗ по химии для 11 класса О.С. Габриелян
- ГДЗ
- 1 Класс
- Математика
- Английский язык
- Русский язык
- Немецкий язык
- Информатика
- Природоведение
- Основы здоровья
- Музыка
- Литература
- Окружающий мир
- Человек и мир
- 2 Класс
- Математика
- Английский язык
- Русский язык
- Немецкий язык
- Белорусский язык
- Украинский язык
- Информатика
- Природоведение
- Основы здоровья
- Музыка
- Литература
- Окружающий мир
- Человек и мир
- Технология
- 3 Класс
- Математика
- Английский язык
- Русский язык
- Немецкий язык
- Белорусский язык
- Украинский язык
- Информатика
- Музыка
- Литература
- Окружающий мир
- Человек и мир
- Испанский язык
- 4 Класс
- Математика
- Английский язык
- Русский язык
- Немецкий язык
- Белорусский язык
- Украинский язык
resheba.me
Урок по химии на тему «Состояние электронов в атоме» (11 класс)
Савицкая М.Г.
Тема: Состояние электронов в атоме.
Цели:
1. Дать представление о распределении ē в атомах по энергетическим уровням. Дать понятия об электронном облаке, электронной орбитали, энергетические уровни и подуровни. Раскрыть сущность формы орбиталей, взаимосвязи номера уровня и энергии ē.
2. Развивать внимание, память, речь, аналитическое мышление, способность делать выводы.
3. Воспитывать любовь к предмету.
Тип урока: комбинированный
Метод: рассказ с элементами беседы
План урока:
Электронное облако.
Энергетические уровни и подуровни.
Главное квантовое число и его значение.
Ход урока:
I. Орг. момент.
II. Опрос:
Назовите те явления, которые прямо или косвенно доказывают, что атом – сложная частица.
Как развивалась классическая теория строения атома? Какие модели атомов вам известны? В чём их суть?
Приведите примеры явлений, доказывающих двойственную (дуалистическую) природу частиц микромира.
Поясните. каково значение открытия радиоактивности в развитии химической науки? Какие изменения происходят с атомами при яд. реакциях?
Какие элементарные частицы вам известны?
Что такое изотопы? Чем изотопы одного хим.эл-та отличаются друг от друга?
Почему изотопы водорода сильно отличаются друг от друга по св-вам?
III. Изучение нового материала:
Ядро атома любого элемента окружено электронами. ē движется вокруг ядра со скоростью, близкой к скорости света ≈ 300000 км/с. →нельзя указать какую-то определённую точку его местонахождения, можно лишь указать область, где его пребывание наиболее вероятно. область вероятности обнаружения ē не имеет чётких границ. Однако можно выделить пространство, где вероятность нахождения ē будет максимальной.
Совокупность точек в пространстве, где пребывание ē наиболее вероятно называют электронным облаком или атомной орбиталью.
В состоянии ē есть некоторая неопределённость. Для хар-ки этого особого состояния нем. физик В.Гейзенберг ввёл понятие о принципе неопределённости, показав, что невозможно определить одновременно и точно энергию и местоположение ē. Чем точнее определена энергия, тем неопределённее будет его положение, и наоборот. (рис.2 стр.7)
Важнейшей хар-кой движения ē на определённой орбитали является энергия его связи с ядром. Т.к. ē в атоме различаются своей энергией, то одни из них притягиваются к ядру сильнее, другие – слабее. Главная причина – удаление от ядра атома. Чем ближе к ядру, тем они прочнее связаны с ним, и их труднее вырезать из электронной оболочки, а чем дальше они от ядер, тем легче их оторвать. Зн. по мере удаления от ядра запас энергии ↑.
Электроны, движущиеся вблизи ядра «загораживают» (экранируют) ядро от других ē, которые притягиваются к ядру слабее и движутся на большем удалении от него. Зн. образуются электронные слои или энергетические уровни, состоящие из ē, с близкими значениями энергии. Энергетические уровни нумеруют, начиная от ядра6 1,2,3,4,5,6 и 7. Значение энергии ē в атомах задаётся главным квантовым числом n ( совпадает с номером периода) и выражается только целым числом.
Целое число n, обозначающее номер энергетического уровня, называют главным квантовым числом.
Оно характеризует энергию ē, занимающих данный энергетич. Уровень. Наименьшей энергией обладают ē первого энерг. Уровня, наиболее близкого к ядру. По сравнению с ē 1-го энерг. уровня ē последующих уровней будут характеризоваться большим запасом энергии. → наименее прочно связаны с ядром ē внешнего уровня.
Число энерг. уровней( электронных слоёв) в атоме равно номеру периода в ПС, к которому принадлежит хим. эл-т: у атомов элементов 1-го периода – один энерг. уровень, второго периода – 2, седьмого периода – 7.
Максимальное число ē на энерг. уровне определяется по формуле:
N = 2n2 , где n – главное квантовое число.
Согласно этой формуле на первом энерг. уровне может находиться не более N = 2*12 =2ē, на втором N =2*22 =8 ē, на третьем N = 2*32=18, на четвёртом N = 2*42 = 32ē.
Начиная со второго энерг. уровня (n=2), каждый из уровней подразделяется на подуровни(подслои)в зависимости от формы облаков, несколько отличающиеся друг от друга энергией связи с ядром.
Число подуровней равно значению главного квантового числа: первый энерг. уровень имеет 1 подуровень, второй – 2, третий – 3, четвёртый – 4 подуровня. Подуровни в свою очередь образованы орбиталями.
Каждому значению n соответствует число орбиталей, равное n2. Табл.1стр.9
Энерг. уровень (n)
Число подуровней, равное n
Тип обитали
Число орбиталей
Мах число ē
В подуровне
В уровне, n2
На подуровне
На уровне, 2n2
K ( n=1)
1
1s
1
1
2
2
L (n=2)
2
2s
2p
1
3
4
2
6
8
M (n=3)
3
3s
3p
3d
1
3
5
9
2
6
10
18
N (n=4)
4
4s
4p
4d
4f
1
3
5
7
16
2
6
10
14
32
s-подуровень – первый, ближайший к ядру атома подуровень каждого энерг. уровня, состоит из одной sорбитали;
p-подуровень – второй поуровень каждого, кроме первого энерг. уровня, состоит из 3-х p-орбиталей;
d-подуровень – третий подуровень каждого, начиная с третьего энерг. уровня, состоит из 5 d-орбиталей;
d-подуровень – каждого, начиная с четвёртого, состоит из 7 f-орбиталей.
Число ē на внеш. энерг. уровне электронной оболочки атома равно номеру группы (хар-но для гл. подгрупп).
План составления схем строения электронных оболочек атомов:
А) определить общее число ē на оболочке по порядковому номеру эл-та;
Б) определить число энерг. уровней в электронной оболочке по номеру периода;
В) определить число ē на каждом энерг.уровне и подуровне.
Составить схемы строения электронных оболочек следующих атомов: Na, K, Ar, Ca, Mg…
IV. Закрепление:
Что такое электронное облако?
Чем отличается 1s-орбиталь от 2s-орбитали?
Что такое главное квантовое число? Как оно соотносится с номером периода?
Что такое подуровень и как это понятие соотносится с номером периода?
Работа с ПС по распределению ē по энерг. уровням и подуровням.
V. Д/з: §2
infourok.ru
