Урок химии «Чистые вещества и смеси» (8 класс)
Урок химии в 8-м классе
«Чистые вещества и смеси»
Цель урока: Сформировать понятия о чистом веществе и смеси веществ.
Задачи урока:
Учащиеся должны знать:
отличие чистого вещества от смеси;
значение смесей в природе и жизни человека.
Учащиеся должны уметь разделять смеси различными способами.
Формы организации познавательной деятельности учащихся: фронтальная, парная, групповая.
Тип урока: комбинированный.
Методы обучения: проблемный
Оборудование:
Химия 8 — учебник для 8 класса общеобразовательных учреждений под редакцией О.С.Габриеляна — М., Дрофа, 2010 г.
Презентация в MS Power Point (приложение)
Компьютер, проектор
Реактивы: Смесь порошков железа и серы, раствор поваренной соли, смесь песка и воды, раствор метилового оранжевого; фильтры, выпаривательная чашка, лабораторный штатив с кольцом, спиртовка, воронка, стеклянная палочка, химические стаканы, колбы, магнит, пипетка.
Демонстрационный эксперимент:
1.Разделение смеси фильтрованием. Разделение смеси нерастворимого в воде вещества и растворителя (растворимого вещества):
Лабораторный штатив с кольцом, воронка, фильтровальная бумага, стеклянная палочка, колба или стакан химический.
2.Разделение смеси магнитом. Разделение смеси железа и серы:
Железные опилки, порошок серы, магнит , 2 фильтра.
3.Разделение смеси веществ выпариванием. Разделение смеси (раствора) растворимого вещества и растворителя:
Раствор поваренной соли, лабораторный штатив с кольцом, фарфоровая чашка (выпаривательная), спиртовка, тигельные щипцы, стеклянная палочка.
4.Хроматография. Фильтр, раствор метилоранжа, пипетка.
Карточки с заданием для групповой работы.
Ход урока
I.Организационный момент.
Проверка домашнего задания.
Беседа:
Какие соединения называются оксидами? (Оксиды — это сложные соединения, состоящие из двух элементов, один из которых кислород со степенью окисления (-2))
Какие соединения называются кислотами? (Кислоты — это сложные вещества, состоящие из атомов водорода и кислотного остатка)
Какие соединения называются основаниями? (Основание — это сложные вещества, состоящие из атомов металла и одной или нескольких гидроксогрупп OH-)
Какие соединения называются солями? ( Соли — это сложные вещества, состоящие из атомов металла и кислотных остатков)
Проверочная работа (5-7 минут) на листках.
На слайдах 1-2 — вопросы проверочной работы.
Проверочная работа сдается учителю (результаты объявляются на следующем уроке).
1. Беседа
Нам хорошо знакомо, что такое чистота. Чистая тетрадь, чистые руки, чистый лист : А какое вещество считается чистым? Есть ли в природе чистые вещества? Чем отличается чистое вещество от смеси веществ?
Как вы думаете, что будет темой нашего урок сегодня? (слайд 3)
2. Запись даты и темы урока учащимися в тетради.
Как вы думаете, что мы должны сегодня выяснить на уроке?
Цели урока обсуждаются с учащимися.
Учащиеся предлагают: выяснить, какое вещество считается чистым и что такое смесь; узнать, где применяются чистые вещества и смеси; узнать, как разделить вещества.
В результате обсуждения — слайд 4.
Мы живем среди химических веществ.
Как только маленький человек появляется на свет, он попадает в мир химических веществ. Он вдыхает воздух, а это смесь газов (азота, кислорода и других), выдыхает углекислый газ. Его умывают водой — это еще одно вещество, самое распространенное на Земле. Добрые мамины руки заворачивают малыша в пеленки, надевают распашонку, а чтобы не было холодно, накрывают одеяльцем… Все эти вещи сделаны из волокон — хлопчатобумажных, основа которых природное вещество целлюлоза (клетчатка), и шерстяных, состоящих и природных белков. То есть являются смесями.
Нам хорошо знакомо, что такое чистота. А что такое «чистое вещество»? Химики установили, чистые вещества обладают постоянными физическими свойствами. Например, чистая вода имеет температуру кипения 100 °С и температуру плавления 0 °С.У чистого металла олова, которое знакомо каждому, кто хотя бы раз в жизни имел дело с паяльником, температура плавления 232 °С. Но если в олове есть хотя бы небольшая примесь другого металла — свинца, то температура плавления становится на несколько градусов ниже. Это значит, что мы имеем дело не с чистым веществом, а со смесью (в данном случае — со сплавом металлов).
Совершенно чистые вещества в природе не встречаются, хотя их стараются получить ученые в своих лабораториях. Обычно мы имеем дело со смесями. Это и бензин, и соленая морская вода, и сладкий чай в чашке (жидкие растворы), и воздух, которым мы дышим (газообразный раствор кислорода в азоте), и нержавеющая сталь, из которой сделаны ножи и вилки, и латунь, которая знакома по заклепкам на джинсах, металлической посуде и блестящим дверным ручкам. Сталь и латунь — твердые растворы разных металлов друг в друге. Химикам приходится немало потрудиться, чтобы разделить между собой вещества, которые попали в состав смеси.
Что же такое смесь?
III. Объяснение нового материала.
На данном этапе урока учитель формирует понятие о чистом вещества и смеси. Учащимся известно понятие «вещество» (это то из чего состоят физические тела). Поэтому, вначале даем определение «смеси веществ».
Учитель предлагает ученикам рассмотреть смеси, находящиеся на демонстрационном столе
и примеры смесей, представленные на слайде 5.Далее ребята дают определение смеси, как системы из их нескольких веществ, находящихся в непосредственном контакте друг с другом. Эта формулировка появляется на слайде после щелчка мыши.
Учитель дополняет, что в природе нет абсолютно чистых веществ. Вещества встречаются преимущественно в виде смесей. Учитель приводит примеры смесей, ребята записывают их в тетради: воздух, морская вода, молоко, сплавы металлов, растворы, туман и др. Он рассказывает о воздухе, как смеси, которая состоит из газов — азота, кислорода, аргона и др. (слайд 6).
Посмотрите внимательно на смеси, находящиеся на столе. В чем разница между ними?
Далее рассматривается классификация смесей (слайда 7).
Смеси
Однородные Неоднородные
Растворы сахара в воде, растворы солей, воздух, Смесь Fe +S, песок и сахар, глина с водой,
песок с водой
Неоднородными называются смеси, в которых невооруженным глазом или при помощи микроскопа видны частицы веществ, составляющих смесь.
Однородными называют смеси, в которых нельзя заметить частицы веществ, входящих в смесь (даже при помощи микроскопа).
Для научных исследований и промышленности, в основном требуются чистые вещества. Некоторые примеси даже в небольших количествах способны сильно поменять свойства веществ. Например, в полупроводниковой технике применяют сверхчистые вещества, где примеси составляют всего 1 атом на миллион атомов основного элемента (Si, Ge). Превышение нормы ведет к резкому ухудшению полупроводниковых свойств этих веществ. В тоже время, необходимо выделить, что невозможно получить абсолютно чистое вещество, т.к. любое чистое вещество содержит, хотя ничтожное малое количество примесей.
Как вы думаете, морская вода и чистая дистиллированная вода будут обладать одинаковыми свойствами? (ребята предполагают, что нет). Слайд 8.
Учитель объясняет условия эксперимента: в 2-х сосудах нагревали до кипения дистиллированную и морскую воду. Через определенное время измеряли температуры кипения в этих сосудах). Вместе обсуждаем результаты эксперимента .
Встает проблема: «Почему у морской воды t кип не постоянная в разные промежутки времени по сравнению с t кип дистиллированной водой?»
Учащиеся высказывают предположение, что соленость морской воды влияет на температуру кипения.
А зачем зимой в гололёд посыпают дороги солью?
Далее учитель предлагает дать определение «чистого вещества». С помощью учителя формулируется определение «Чистым веществом называется такое вещество, у которого постоянные физические свойства (температуры кипения, температуры плавления, плотность).
В тетрадях ребята записывают определение «чистое вещество» —
Чистым называется вещество, которое обладает постоянными физическими свойствами.
Учитель дополняет, что в чистом веществе примеси, хотя и есть в незначительных количествах, но они не влияют на физические и химические свойства. Пример чистого вещества — дистиллированная вода.
Демонстрируется слайд 9.
Ребята записывают в тетрадях выводы.
Педагог обращает внимание детей на отличительную особенность смесей «В смесях каждое из составляющих их веществ сохраняет свои индивидуальные свойства. Для подтверждения этого учитель проводит опыты:
Демонстрация: разделение смеси железа и сера с помощью магнита (отработать с ребенком заранее методику выполнения опыта и тогда демонстрацию проводит ученик)
Следующий этап урока — знакомство с основными способами разделения смесей, которые представлены в виде схемы: Слайд 10.
Одновременно уточняется, на каких физических свойствах веществ основан каждый способ разделения. На слайдах 11- 13 показаны области применения разных способов очистки неоднородных смесей.
Демонстрация разделения смеси песка и воды фильтрованием.
Обращается внимание на правильность выполнения эксперимента (Слайд 11).Знакомство со способами разделения однородных смесей продолжается с помощью слайда 14, акцентируется внимание учащихся на физических свойствах веществ, применяемых в данном способе разделения.
Работа с учебником –рис.
На слайдах 14-18 показаны области применения разных способов очистки однородных смесей.
IV.Закрепление
1. Групповая работа.
Каждая группа получила задание » Как разделить смесь :?»
(Класс заранее делится на четыре группы. Каждая группа получает смесь веществ и карточку с заданием).
Группа № 1Рассмотрите выданную смесь медных и железных стружек. Предложите способ разделения смеси
Группа № 2Рассмотрите выданную смесь из мела и соли. Предложите способ разделения смеси.
Группа № 3Рассмотрите выданную минеральную воду. Предложите способ разделения смеси.
Группа №4.Рассмотрите выданную смесь из подсолнечного масла и воды. Предложите способ разделения смеси.
На столе учителя подберите необходимое оборудование.
Нужно описать свои действия. Через 1 минуту каждая группа озвучивает свой ответ. В заданиях были использованы жизненные ситуации, где требовалось очистить воду в походных условиях и т.п.
2. Работа с таблицей
Агрегатное состояние веществ в смесях
Примеры смесей
Неоднородных
Однородных
1.Твёрдое –твёрдое
2.Жидкое – твёрдое
3.Жидкое – жидкое
4.Газообразное – твёрдое
5.Газообразное – жидкое
Минералы; железо/сера
Известковый раствор; сточные воды
Молоко; растительное масло/вода
Дым; пыльный воздух
Туман; облака
Сплав золота и серебра
Сахар/вода
Спирт/вода
Пары йода в воздухе
Вода/воздух, минеральная вода
Задание 3. Помогите героине русской народной сказки «Василиса Прекрасная». В этой сказке Баба-Яга приказала Василисе отделить манку от гречки и мак от земли. Героине сказки помогли голуби. Мы же теперь можем разделить крупы, мак и землю различными научными методами. Опишите, как можно все это разделить?
Ответить на вопросы, представленные на слайдах 19 — 21
Рефлексия.
Беседа:
Что нового вы узнали сегодня на уроке?
Что запомнилось?
Что понравилось, а что не удалось, на ваш взгляд?
Подведение итогов
V.Домашнее задание: 23 упр. 1,2,4
Творческое задание. Составьте задания на разделение смеси.
Вам выдали смесь, состоящую из соли и мела. Предложите способы разделения этой смеси.
infourok.ru
Чистые вещества и смеси. Химия. 8 класс. Разработка урока
Цели
- Обучающая: рассмотреть понятия «Чистое вещество, смеси», научить определять основные отличия смеси и индивидуальных веществ, обозначить понятия «дисперсная система, эмульсия, суспензия, аэрозоль», научить разделять смеси путем фильтрования.
- Развивающая: формировать аналитические навыки, умение обобщать и делать вывод, развивать креативность и творчество.
- Воспитательная: воспитывать научное мировоззрение, умение работать в паре и группе, самостоятельно трудиться, умение рефлексии; прививать культуру химического эксперимента.
Тип урока: комбинированный.
Оборудование: презентация, ПК, проектор, колонки, видео опыты, комплект на парту: лабораторное оборудование (пробирки, стаканы, фильтр, воронка, штатив, стеклянные палочки), молоко, соляная кислота, смесь песка и соли, вода, зубная паста на предметном стекле.
Предварительная работа: задать на дом найти определения (золь, гель, эмульсия, суспензия, аэрозоль) в сети Интернет и в словаре. Подготовить сообщения о составе молока, чугуна, губной помады, воздуха. Мозговой штурм: задача с кувшином (слайд 5).
Ход урока
1. Организационный момент
2. Актуализация знаний
Притча. В 1660 году королевское научное общество Англии пришел король Карл Второй с вопросом: «Почему ведро с водой весит 10 фунтов, рыба весит 4 фунта, а ведро с рыбой тоже 10 фунтов?». Ученые стали предполагать, что это сила вытеснения плавательного пузыря рыбы и т.д….
А что скажете вы?
Но один ученый сказал: «Позволь, король, не поверить тебе и провести опыт самостоятельно».
Вывод… (Что скажут обучающиеся?)
Истинные химики доверяют только собственно проведенным экспериментам…
3. Проверка домашнего задания
1. Выдать раздаточный материал – таблички. Распределить сложные вещества по классам. Индивидуально для сильных – назвать вещества.
Время: 2 минуты, собрать для проверки.
|
1 вариант NaOH, HCl , MgSO4, CaCO3, Ca(OH)2, KCl, Fe(OH)3, H2SO4, BaCO3, HNO3 |
2 вариант HNO3, Mg(OH)2, K2SO4, FeCO3, Zn(OH)2, BaCl2, Al(OH)3, H2SO3, NaCl , HCl |
||
|
Основания |
Кислоты |
Соли |
|
|
|
|
|
|
Акцентировать внимание на общих формулах веществ.
|
Основания |
Кислоты |
Соли |
|
Men+ OH– |
H+ Acn– |
Men+ Acn– |
2. Фронтальная проверка прочтения домашнего параграфа 22.
Какие состояния есть у твердого вещества, какие кристаллические решетки (слайд 4).
Как вы считаете, а у глины — ….. (переход к задаче с глиняным горшком).
Постановка проблемы
3. Мозговой штурм – задача, которая была домой. Что можно было хранить (или что делать?) в таком кувшине, на дне которого закрывающееся отверстие? Слайд 5.
4. Лабораторный опыт – разделение молока (прилить несколько капель соляной кислоты). Что наблюдается? Так для чего кувшин? Вывод – кувшин для сепарации молока (отделение сливок).
4. Изучение нового материала
1. Запишем тему урока «Чистые вещества и смеси».
Послушаем стихотворение Сергея Есенина «ВОСХОД СОЛНЦА»
Загорелась зорька красная
В небе темно-голубом,
Полоса явилася ясная
В своем блеске золотом.
Лучи солнышка высоко
Отразили в небе свет.
И рассыпались далеко
От них новые в ответ.
Лучи ярко-золотые
Осветили землю вдруг.
Небеса уж голубые
Расстилаются вокруг.
Если бы все вещества были чистыми, то мы не могли бы любоваться голубым небом, розовым рассветом, багряным закатом… (слайд 7)
Постановка целей и задач. Как вы думаете, что мы будем делать на уроке?
Сегодня на уроке мы с вами определим, что такое смесь и индивидуальной вещество, научимся различать смеси и чистые вещества, разделим смесь путем фильтрования.
2. Лабораторный опыт «Соль и песок, зубная паста».
Что вы видите в стакане? Это одно вещество?… А на предметном стекле – зубная паста – это одно вещество?…. (Вывод – смеси не всегда можно определить визуально). Почему?
3. Работа с учебником (с. 121). Какие бывают смеси?
(Однородные и неоднородные, мелкие и крупные, Ж, Т, Г).
4. Домашним заданием было посмотреть в Интернете определения понятий: гель, золь, эмульсия, суспензия, аэрозоль. Зачитаем эти определения по тетради.
5. Работа в тетради – заполнить таблицу, слайд 15. Расставить определения на пересечении фаз растворителя и растворенного вещества (дисперсионная фаза и среда).
6. Проверка заполнения таблицы.
7. Что вы знаете об этих веществах – домашняя работа (сообщения по темам: воздух, чугун, губная помада, молоко).
8. Видео опыт «Соль и вода». Какой метод применили в опыте?
9. Работа в группах: кто предложит больше способов разделения смесей? Слайд 20.
10. Видео опыт «Взаимодействие железа и серы». Чем отличается чистое вещество и смесь? Всегда можно отличить чистое вещество и тонкую смесь (молоко, зубную пасту)?
11. Понятия чистые вещества, их значение, применение.
12. Лабораторный опыт. Разделение смеси песка и соли фильтрованием.
На столах: смесь песка и соли, вода, воронка и готовый фильтр, стаканы, палочка.
ТБ, смешали с водой, профильтровали – выводы.
5. Итоги урока, оценивание, домашнее задание
Домашнее задание: параграф 22, найти определения: сепарация, дистилляция, возгонка, перегонка, хроматография.
Оценивание: все получат отметки за самостоятельные работы, оценить активных за домашнее задание.
Рефлексия. Учитель. Притча про строителей храма. У строителей храма спрашивали: чем они занимались? Первый строитель ответил: «Я клал кирпичи…». Второй: «Я выполнял свое дело». Третий: «Я строил ХРАМ!». Какое настроение у вас после урока – что получилось, что было сложным, почему не получились задания, как можно делать лучше, каковы наши успехи… и т.д.
На доске презентация со смайликами, отражающими настроение урока и ученика (злость, грусть, скука, агрессия, радость)
6. Закрепление
Давайте подумаем, а как могут применять методы химического анализа люди различных профессий? (врач, криминалист, искусствовед).
Литература:
- Учебник по химии, 8 класс, автор О.С. Габриелян.
- Сайт АЛХИМИК (Аликберовой).
rosuchebnik.ru
Чистые вещества и смеси
В жизни мы часто имеем дело со смесями, а не с чистыми веществами. Даже не вся вода является чистым веществом, а представляет собой смесь. Только вода, лишенная примесей или содержащая их мало, является чистым веществом. Такую воду называют дистиллированной. В большинстве своем – вода – это смесь растворенных в ней солей, минералов и других веществ, т.е. является смесью.
Смеси делят на две группы: однородные смеси, в которых даже с помощью микроскопа нельзя отличить частицы веществ. К однородным смесям относятся растворы спирта, сахара.
Неоднородные смеси, в которых даже невооруженным глазом или с помощью микроскопа можно различить вещества, входящие в состав смеси. К неоднородным смесям относятся смесь воды с мелом, воды с песком.
Смеси бывают: твердыми, жидкими и газообразными. Например, твердые смеси – это стекло, сплавы (мельхиор, чугун, гранит).
Твёрдые смеси
Жидкие – это клеточный сок, молоко, минеральная вода, кровь.
Жидкие смеси
А газообразные – это воздух, пропан-бутановая смесь.
Смеси, в отличие от чистых веществ, имеют иные свойства. Так, чистая вода замерзает при температуре 0 0С, а если растворить в ней соль, то температура замерзания значительно понижается. Этим свойством пользуются работники коммунальных служб, когда в период гололедицы посыпают дороги технической поваренной солью или другими реагентами. Чистое железо не ржавеет на воздухе, а железный гвоздь, из-за содержания в нем примесей, ржавеет.
Из смеси можно выделить составляющие ее компоненты. Существуют различные способы разделения смесей.
Одним из способов разделения неоднородной смеси является отстаивание. Этот способ основан на различной плотности веществ. Этим способом можно разделить смесь железных и древесных опилок, смешав смесь с водой и дав ей отстояться. Железные опилки опустятся вниз, а древесные всплывут наверх и их можно слить вместе с водой. Этим способом можно воспользоваться при разделении смеси воды и мела или воды и глины. Мел и глина в этом случае опустятся вниз, а воду можно осторожно слить.
Отстаиванием можно разделить и жидкости. Например, смесь растительного масла и воды, бензина и воды, нефти и воды. Эти жидкости быстро расслаиваются, поэтому их разделяют с помощью делительной воронки или колонки.
Разделение сливок от молока производят с помощью центрифугирования.
Другим методом является фильтрование, которое основано на различной пропускной способности фильтра по отношению к компонентам смеси. С помощью этого метода отделяют твердые примеси от жидкости. В химической лаборатории используют бумажные фильтры. Таким методом можно разделить смесь песка и поваренной соли. Эту смесь сначала растворяют в воде, затем пропускают через бумажный фильтр. Песок остается на фильтровальной бумаге, а раствор поваренной соли – фильтрат, проходит через фильтр. В промышленности жидкости фильтруют через специальные материалы – различные ткани. Для очистки концентрированного раствора щелочи используют стекловату.
Разделение смеси магнитом основано на различии магнитных свойств веществ. Если смешать железные опилки с серой на бумаге и накрыть еще сверху листом бумаги, а затем поднести магнит, то железные опилки притянутся магнитом, а сера нет.
Однородную смесь можно разделить на компоненты с помощью метода выпаривания. Он основан на различной температуре кипения веществ смеси. Этим методом можно разделить поваренную соль и воду. Для этого, в фарфоровую чашку наливают раствор соли и кипятят. Вода испаряется, а частицы соли остаются в чашке.
Иногда применяют способ упаривания, когда вода частично испаряется, получается концентрированный раствор, при охлаждении которого растворенное вещество выделяется в виде кристаллов. Этот способ называется кристаллизацией, при этом, вещество получается в чистом виде, а примеси остаются в растворе.
Для получения дистиллированной воды используют метод дистилляции, который тоже основан на различии температур кипения компонентов в смеси.
Состав смесей определяют с помощью химического анализа. Например, в металлургии при производстве стали, обязательно берут ее пробы для определения содержания углерода. Контроль за состоянием окружающей среды немыслим без определения концентрации примесей в воздухе и воде. Химический анализ горных пород и руд используется при разведке полезных ископаемых.
Знаменитый Шерлок Холмс раскрыл свои преступления во многих случаях только благодаря результатам химического анализа. Без химического анализа просто не обойтись в криминалистике, археологии, медицине и искусствоведении. Без химического анализа не обходятся и космические исследования Марса, Венеры, Луны.
С помощью методов химического анализа получают очень чистые вещества, в которых содержание примесей не превышает одной стотысячной и даже одной миллионной доли процента. Такие, особо чистые вещества, необходимы в атомной энергетике, полупроводниковой промышленности, волоконной оптике и др. областях.
С простейшими методами очистки веществ вы уже знакомы. Например, для очистки природной воды используют уголь, обожженную глину. Вода, проходя через эти пористые вещества, избавляется от различных примесей. Для очистки большого количества воды, используют смесь песка и гравия. Кроме этого, для обеззараживания воды используют метод хлорирования.
videouroki.net
Урок химии в 8 классе на тему: «Чистые вещества и смеси»
План-конспект урока в 8 классе по теме:
«Чистые вещества и смеси. Способы разделения смесей»
Подготовлено учителем химии МБОУ Лицея №15
Заводского района г.Саратова
Сафаровой М.А.
Тема урока: Чистые вещества и смеси. Способы разделения.
Тип урока: урок изучения нового материала
УМК: Рудзитис Г.Е., Фельдман Ф.Г. Химия. 8 класс, М.: Просвещение, 2015
Цели: Создание условий для формирования у учащегося представления о чистых веществах и видах смесей, а так же способах разделения смесей.
Планируемые результаты:
Предметные умения: рассмотреть понятия: чистое вещество, смесь, научить определять основные отличия чистых веществ и смесей, обучить основным принципам разделения смесей;
Личностные УУД: формирование ответственного отношения к обучению, готовность к саморазвитию, самообразованию;
Регулятивные УУД: формировать аналитические навыки, умение обобщать и делать выводы, развивать креативность и творческие способности;
Познавательные УУД: воспитывать научное мировоззрение, прививать культуру химического эксперимента, строить логические цепочки, устанавливать причинно-следственные связи;
Коммуникативные УУД: умение работать в паре и группе, самостоятельно принимать решения.
Тип урока: комбинированный.
Оборудование: презентация, ПК, проектор, комплект на парту: лабораторное оборудование (пробирки, стаканы, делительная воронка, фильтр, штатив, стеклянные палочки, бумага для хроматографии, пипетки), вещества и смеси: молоко, гранит, раствор соляной кислоты, зубная паста на предметном стекле, смесь воды и песка, смесь серы и железных опилок.
Ход урока:
Организационный момент. Постановка целей и задач урока.
Учитель приветствует обучающихся.
Класс делится на 4-6 групп. Каждая группа получает индивидуальное задание – разделить смесь, применив знания, полученные на уроке.
2. Постановка целей и задач
Цитата урока: И.В.Петрянов:»Разве вода — это только та бесцветная жидкость, что налита в стакан? Океан, покрывающий почти всю нашу планету, всю нашу чудесную Землю, в котором миллионы лет назад зародилась жизнь, — это вода. Тучи, облака, туманы, несущие влагу всему живому на земной поверхности, — это ведь тоже вода.
Установочный вопрос: о какой «воде» идет речь? Возможные вопросы: Какая вода бывает? Чем отличается друг от друга? Почему?
Вопросы для формулирования темы урока: 1) дайте определение понятию «вещество»? 2) Какие физические характеристики веществ вы знаете? 3) На столе перед вами представлены различные вещества (гранит, молоко, дистиллированная вода, карбонат кальция, раствор соляной кислоты, смесь серы и железных опилок). Разделите их на две группы. По какому принципу вы их разделили? 4) Как определить чистое перед вами вещество или смесь?
Ученики предполагают возможные варианты ответа. Предполагают возможную тему урока.
3. Актуализация знаний
Формулировка понятий чистое вещество и смесь. Очень многие вещества, с которыми мы сталкиваемся в быту, представляют собой, на самом деле смеси. Так, воздух, которым мы дышим — это смесь, состоящая из азота, кислорода, углекислого газа и других компонентов. Морская вода, включает в себя большое количество неорганических солей, растворенные газы, гумусовые вещества. В дыме сигареты можно обнаружить до 30000 различных компонентов, в том числе токсичных, вызывающих хронические заболевания и раковые опухоли.
Сравнение физико-химических свойств дистиллированной и морской воды показывает, что дистиллированная воды имеет постоянную температуру кипения 100оС, температуру плавления 0оС, не имеет вкуса и запаха. Морская вода имеет горько-соленый вкус, обладает более высокой температурой кипения и плавления, к тому же эти характеристики меняются при длительном кипячении морской воды. Физические характеристики морской воды из различных источников тоже заметно отличаются. Почему? Дело в том, что в морской воде содержится большое количество компонентов, содержание которых для различных источников будет различно, что ведет к изменению свойств. Заполняем таблицу: сравнение свойств смеси и чистого вещества.
Свойство | Чистое вещество | Смесь |
В природе невозможно встретить абсолютно чистое вещество. Чистые вещества получают искусственно, которые по степени чистоты разделяют на несколько классов: чистое вещество, чистое для анализа, химически чистое, особо чистое вещества, которые применяют в аналитической практике, в квантовой технике, производстве нанооборудования.
Записываем понятие однородной и неоднородной смеси.
Как можно разделить смеси на индивидуальные компоненты? Различие каких физических свойств мы можем использовать для разделения?
Обзор основных способов разделения однородных и неоднородных смесей, принципов, на которых основаны методы разделения на основе презентации. (Слайды интерактивной презентации). Ученикам предлагается провести следующие лабораторные опыты: разделение смеси железа и серы, песка и воды, пасты фломастеров.
Итак, смеси веществ в зависимости от физических свойств компонентов смеси, можно разделить отстаиванием, фильтрование, экстракцией, дистилляцией, кристаллизацией, хромотографическими методами и т.д.
3. Первичное усвоение и закрепление новых знаний. Разбираем проблемные ситуации каждой группы:
1) ребята пошли в поход. Маша варила суп, но коробка с солью у нее выпала, соль рассыпалась. Предложите способ разделения смеси песка и соли.
2) в автосервисе отработанное масло содержит примеси неорганических солей, растворимых в воде. Предложите способ разделения данной смеси.
3) отходы фабрики содержат мелкогранулированные отходы пластика, железные опилки, пыль (песок). Предложите способ разделения данной смеси.
Ребята составляют алгоритм разделения данных смесей и проводят экспериментальное разделение данной смеси.
4. Подведение итогов урока. Рефлексия. Составление синквейна.
Запись домашнего задания.
Домашнее задание. Параграф 4 (Учебник Рудзитиса), ответить на вопросы 1-4 стр 17, тестовые задания 1-5 стр.18
ДОМАШНИЙ эксперимент: вырастить кристаллик поваренной соли по методике. Приготовить раствор поваренной соли: в горячей воде (200 мл) растворить 5 столовых ложек соли. Раствор профильтровать через марлю. Полученный фильтрат перелить в чистый стаканчик, в который опустить нитку с привязанным кристалликом соли. Оставить на несколько дней. Все наблюдения записывать в лабораторный журнал.
Рефлексия. Составление синквейна на тему: смеси и чистое вещество.
Технологическая карта урока «Чистые вещества и смеси»
Технология проведения урока (этап урока, его цель) | Деятельность учителя | Деятельность ученика | Формируемые УУД |
Орг. момент | Приветствует учащихся, создает позитивный эмоциональный фон, предлагает деление на группы | Приветствуют учителя, делятся на группы | Личностные: проявлять желание к процессу обучения, Регулятивные: готовность воспринимать новую информацию |
Постановка цели и задач урока. | Создание проблемной ситуации (стихотворение) Мотивация учебной деятельности Учитель мотивирует к учебной деятельности (предъявляет смесь), просит разделить представленные вещества на группы) и дать объяснение своим действиям с точки зрения | Ученики перечисляют возможные примеры «воды». Отвечают на возможные вопросы. Разделяют вещества по и смеси по разным группам. Учащиеся приходят к определению темы: Чистые вещества и смеси. Формулируют цель и задачи урока. | Личностные –разивать познавательный интерес к уроку; мотивация Познавательные-уметь высказывать личное мнение в устной форме – ставить проблему, решать поставленные задачи Регулятивные – планировать реализацию учебной цели, прогнозировать темуурока Коммуникативные — вступать в учебный диалог с учителем и учащимися; учебное сотрудничество с учителем и учащимися а |
Актуализация знаний | Беседа. Учитель актуализирует материал по теме. Предлагает заполнить таблицу сравнения свойств чистых веществ и смесей. Актуализация основных понятий, относящихся к теме урока. Просмотр презентации с характеристикой основных способов разделения смеси. Организация самостоятельной работы по разделению конкретной смеси. Повторение правил самостоятельной работы с лабораторным оборудованием и реактивами. | Дополняют и конспектируют учебный материал. Просматривают презентацию, задают вопросы, приводят примеры. Анализируют задание для самостоятельной работы. Повторяют правила техники безопасности. Выполняют практическую работу по разделению смеси, пользуясь текстом учебника. Докладывают результаты работы, исправляют ошибки, оценивают работу одноклассников. | Личностные: выражать положительное отношение к процессу обучения, сотрудничества с одноклассниками и учителем.; Познавательные: Определить основные понятия; Выбрать наиболее эффективные пути решения задачи, сделать обсуждение собственных результатов и доложить их. Регулятивные – Использовать конкретную информацию и личные знания, оценивать групповую работу; Коммуникативные — Уметь строить необходимое взаимодействие с членами группы для выполнения задач , вступать в диалог, участвовать в коллективном обсуждении проблем.
|
Первичное усвоение новых знаний и проверка их усвоения | Введение нового материала. Учитель предлагает для каждой группы собственное задание: предложить алгоритм разделения полученных смесей. Динамическая пауза!!! Организуется работа по выполнению практического задания Определяются способы разделения смеси | Учащиеся предлагают алгоритм способа разделения смеси Проводят работу по разделению смеси. Работают в группе. Сравнивают свою работу с работой одноклассников. Предлагают альтернативные способы разделения смесей для других групп. Участвуют в дискуссии и оценке работы класса. | Личностные: Осуществлять мотивацию к обучению, оценивать собственную деятельность, развивать собственные навыки и умения Познавательные — Уметь анализировать и систематизировать материал; формулирование проблемы и самостоятельное создание способов решения творческого и поискового характера. Регулятивные: Самостоятельно анализировать условия достижения цели, планировать необходимые действия самостоятельно, оценивать правильность выполнения действия и вносить необходимые коррективы как в конце действия, так и по ходу его реализации. Коммуникативные: уметь участвовать в коллективном обсуждении проблем, четко выражать свои мысли в соответствии с задачами и условиями коммуникации. |
Подведение итогов урока. Рефлексия | Повторение опорных понятий урока, составление выборки невыясненных вопросов (при их наличи). Инструктаж по выполнению домашнего задания. Запись в дневник. Организует самооценку учащимися своих знаний, уровня усвоения новых знаний и эмоционального состояния от урока. | Проговаривают основные понятия урока, составляют выборку невыясненных вопросов. Записывают домашнее задание в дневник Выражают собственное мнение о работе и полученном результате. Обобщают результаты своей деятельности по достижению цели. Выражают эмоциональное состояние от урока в виде синквейна. | Регулятивные — планировать необходимые действия самостоятельно. Осознание качества и уровня усвоения Познавательные: рефлексия, контроль Личностные — отношение обучающихся к уроку, мотивация Коммуникативные — учитывать разные мнения, формулировать собственное мнение и позицию, аргументировать ее с позициями партнеров в сотрудничестве при выборе общего решения в совместной деятельности. |
Приложение 1
Инструктивная карта
Лабораторный опыт №1 «Разделение модельных смесей»
А) разделение смеси серы и железа
Рассмотрите цвет серы и железа
Возьмите небольшие порции каждого вещества
а) испытайте магнитом б) опустите в пробирку с водой, проверьте растворимость
Смешайте серу с железом
Отметьте, изменился ли цвет компонентов в смеси, растворимость, магнитные свойства
Сделайте вывод (сохраняют ли компоненты свои свойства в смеси?)
Б) разделение смеси воды и песка
1. Возьмите небольшую порцию песка и опустите в стаканчик с водой
2. Размешайте смесь стеклянной палочкой
3. Отметьте изменения, происходящие в стакане
4. Аккуратно, по стеклянной палочке вылейте содержимое стаканчика через воронку с бумажным фильтром
5. Сделайте вывод о возможности разделения смеси песка и воды
В) разделение смеси пасты двух фломастеров
1. Возьмите кусочек фильтровальной бумаги с нанесенной на ней точкой двумя фломастерами.
2. Положите бумагу на предметное стекло
3. С помощью пипетки нанесите каплю воды строго на пятно
4. Опишите наблюдения, сделайте вывод о способах разеления такой смеси.
Лабораторный опыт №2 «Разделение смесей»
Цель: научиться находить и осуществлять рациональные способы выделения веществ из смесей на основе знаний о физических свойствах их компонентов
Ход работы
1. Получите групповое задание, рассмотрите выданную вам смесь (образец №)
2. Отметьте физические свойства компонентов смеси (растворимость, плотность и др.)
3. Определите тип смеси (гомогенная или гетерогенная)
4. Предложите способ ее разделения, используя имеющееся лабораторное оборудование. (При затруднении смотрите учебник параграф 4 )
5. Проведите практическое разделение смеси, запишите все действия и наблюдения в лабораторный журнал.
6. Подумайте, какие еще смеси можно разделить таким же способом, приведите примеры
7. Доложите о результатах работы одноклассникам
Нам была предложена (гомогенная – гетерогенная) смесь… образец №. Мы разделили ее …(название способа), используя следующее лабораторное оборудование … Способ основан на различной … (физические свойства) компонентов смеси. Таким же способом можно разделить смесь…
Презентация «Смеси»PPT / 7 Мб
xn--j1ahfl.xn--p1ai
Чистые вещества и смеси. Видеоурок. Химия 8 Класс
Тема: Первоначальные химические представления
Урок: Чистые вещества и смеси
В повседневной жизни каждый из нас сталкивается со множеством смесей веществ, имеет дело не только с чистыми, но и загрязненными веществами. Важно уметь различать данные понятия и уметь определять по конкретным признакам, с чем имеешь дело: чистым или загрязненным веществом, индивидуальным веществом или смесью веществ. Ведь человек хочет употреблять только ту воду, которая не содержит вредных примесей. Дышать мы хотим воздухом, не загрязненным вредными для здоровья газами. В медицине и производстве лекарственных препаратов проблема получения и использования чистых веществ особенно актуальна.
Познакомимся с основными терминами урока.
Смесь – это то, что образуется при перемешивании двух и более различных по свойствам веществ.
Вещества, составляющие смесь, называют компонентами. Например, воздух – смесь газов: азота, кислорода, углекислого газа и других.
Если масса одного компонента в десятки раз меньше массы другого компонента смеси, то его называют примесью. Говорят, что вещество загрязнено. Например, воздух может быть загрязнен угарным газом, продуктом неполного сгорания органических соединений, в частности бензина. Кстати, бензин – это смесь органических веществ – углеводородов.
КЛАССИФИКАЦИЯ СМЕСЕЙ
Смеси отличаются друг от друга по внешнему виду. Например, соленая вода (смесь поваренной соли и воды) и смесь речного песка и воды. В первом случае нельзя увидеть границы раздела фаз твердое-жидкое. Такую смесь называют однородной (или гомогенной). Другими примерами однородных смесей являются уксус (смесь уксусной кислоты и воды), воздух, сахарный сироп.
Смесь речного песка и воды относят к неоднородным (или гетерогенным) смесям, т.к. состав такой смеси неодинаков в разных точках объема. Неоднородными являются смеси глины и воды, бензина и воды.
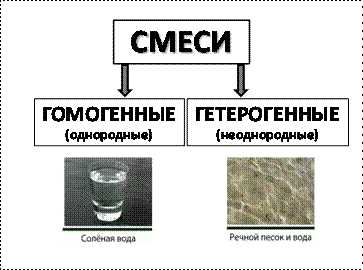
Рис. 1. Классификация смесей
В основном, всё, что нас окружает, – это смеси веществ. Более того, веществ, абсолютно не содержащих примесей, не бывает.
Но принято говорить об относительной чистоте вещества, т.е. вещества имеют разную степень чистоты.
Если примеси не обнаруживаются при использовании вещества в технических целях, то вещество называется технически чистым. Например, вещество, из которого делают фиолетовые чернила, может иметь в своем составе примеси. Но если эти примеси никак не влияют на качество чернил, то оно — технически чистое.
Если примеси не обнаруживаются с помощью химических реакций, то вещество относят к химически чистым. Например, это дистиллированная вода.
Чистое вещество иногда называют индивидуальным веществом, т.к. оно обладает строго определенными свойствами. Например, только дистиллированная вода имеет температуру плавления 0 С, температуру кипения 100 С и не имеет вкуса и запаха.
А изменяются ли свойства веществ в смеси? Чтобы ответить на этот вопрос, проведем простой опыт. Смешаем порошки серы и железа (Рис. 2). Мы знаем, что железо притягивается магнитом, а сера – нет. Сохранило ли железо свое свойство после смешения с серой?
Рис. 2. Перемешивание порошков серы и железа
Подействуем магнитом на смесь порошков серы и железа (Рис. 3). Мы видим, что железо в смеси с серой не утратило способности к намагничиванию.
Рис. 3. Действие магнита на смесь порошков серы и железа
ВЫВОД: Свойства веществ в смеси не изменяются. Знания о свойствах компонентов смеси используют для разделения смесей и очистки веществ.
Список рекомендованной литературы
1. Занимательные задачи по химии / Под ред. Н.Е. Дерябиной. – М.: ИПО «У Никитских ворот», 2010. (с.15)
2. Сборник задач и упражнений по химии: 8-й класс: к учебнику П.А. Оржековского и др. «Химия, 8 класс» / П.А. Оржековский, Н.А. Титов, Ф.Ф. Гегеле. – М.: АСТ: Астрель, 2006.
3. Ушакова О.В. Рабочая тетрадь по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под. ред. проф. П.А. Оржековского — М.: АСТ: Астрель: Профиздат, 2006. (с.9)
4. Химия: 8-й класс: учеб. для общеобр. учреждений / П.А. Оржековский, Л.М. Мещерякова, Л.С. Понтак. М.: АСТ: Астрель, 2005.(§3)
5. Химия: неорг. химия: учеб. для 8 кл. общеобр. учреждений / Г.Е. Рудзитис, ФюГю Фельдман. – М.: Просвещение, ОАО «Московские учебники», 2009. (§2)
6. Энциклопедия для детей. Том 17. Химия / Глав. ред.В.А. Володин, вед. науч. ред. И. Леенсон. – М.: Аванта+, 2003.
Дополнительные веб-ресурсы
1. Единая коллекция цифровых образовательных ресурсов (Источник).
2. Электронная версия журнала «Химия и жизнь» (Источник).
Домашнее задание
1. Из учебника П.А. Оржековского и др. «Химия, 8 класс» с. 27 №№ 2,3,5-7,Т.
2. № 46 (Занимательные задачи по химии / Под ред. Н.Е. Дерябиной. – М.: ИПО «У Никитских ворот», 2010)
interneturok.ru
Чистые вещества — урок. Химия, 8–9 класс.
В античные времена древнегреческими учёными было сформулировано предположение, которое позже полностью подтвердилось — о том, что вещества состоят из мельчайших невидимых глазу частиц.
Например, вода состоит из одинаковых частиц, называемых молекулами воды. Сахар состоит из одинаковых частиц, называемых молекулами сахара. Вода и сахар — это чистые вещества.
Чистыми веществами называются вещества, которые состоят из частиц одинакового вида.
Если же сахар смешать с водой, происходит диффузия — молекулы сахара проникают между молекулами воды. Образуется раствор, в состав которого входят как молекулы воды, так и молекулы сахара.Раствор — это смесь веществ.
Смесями называют вещества, в состав которых входят частицы разного вида.
Все вещества являются либо чистыми, либо смесями.
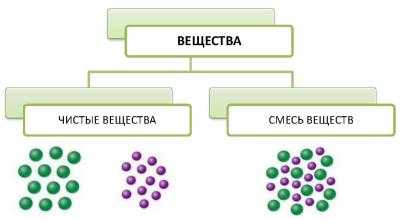
Чистые вещества состоят из частиц одного вида, а смеси — из частиц разного вида.
Кроме веществ, состоящих из молекул, существуют вещества, имеющие немолекулярное строение.
Например, металлы и инертные газы состоят не из молекул, а из более мелких частиц — атомов.
Таким образом, медь состоит только из атомов меди, а цинк состоит только из атомов цинка. Медь и цинк — чистые вещества. Если к меди добавить цинк и сильно нагреть, получится сплав, который называют латунью.
Латунь — это смесь, в состав которой входят как атомы меди, так и атомы цинка.
Существуют вещества немолекулярного строения, состоящие из частиц другого вида, называемых ионами. В состав ионных соединений входят не электрически нейтральные атомы или молекулы, а частицы, несущие на себе положительный или отрицательный заряд.
Примером таких веществ может служить хлорид натрия, то есть обычная поваренная соль, кристаллы которой состоят из положительно заряженных ионов натрия и отрицательно заряженных ионов хлора. Поваренная соль является чистым веществом. Если же её растворить в воде, образуется раствор, который является смесью двух веществ — воды и поваренной соли.
Сравнение чистых веществ и смесей
| Чистые вещества | |
| Состав | Чистое вещество состоит из частиц одного вида. Например, вода состоит только из молекул воды.
Чистое вещество имеет постоянный состав. Например, любая молекула воды состоит из двух атомов химического элемента водорода и одного атома химического элемента кислорода. | Смесь состоит из частиц разного вида. Например, раствор сахара в воде содержит как молекулы воды, так и молекулы сахара.
Смесь не имеет постоянного состава: содержание отдельных составных частей одной и той же смеси может быть разным. Условно говоря, в стакане воды можно растворить и одну чайную ложку сахара, и две. |
| Свойства | Чистое вещество имеет постоянные свойства. | В смеси каждое вещество в основном сохраняет свои свойства. Например, железо так же, как обычно, притягивается магнитом, поваренная соль остаётся солёной.
Физические свойства смеси отчасти меняются с изменением её количественного состава. |
Обрати внимание!
Следует иметь в виду, что идеально чистых веществ не существует, поскольку ни одно из веществ невозможно полностью очистить от содержащихся в нём примесей.
Какое же вещество в таком случае на практике считается чистым?Практически чистым (чистым) называют вещество, в котором содержание примесей столь ничтожно, что эти примеси существенным образом не влияют на его свойства.
Например, вода считается практически чистой, если образец жидкости не имеет цвета, вкуса и запаха, замерзает при температуре \(0\) °С, кипит при температуре \(+100\) °С, при температуре \(+4\) °С имеет плотность \(1000\) кг/м³ и практически не проводит электрический ток.
Чистые вещества: кислород, дистиллированная вода, рафинированный сахар
В некоторых отраслях науки и техники используют особо чистые вещества.

В банках золото хранится в слитках, массовая доля благородного металла в которых составляет \(99,9\) %; в технике для изготовления электронных приборов и микросхем используется кремний, чистота которого составляет \(99,999\) %.
В природе, в технике и в повседневной жизни большей частью приходится иметь дело со смесями. Так, смесью является воздух, природная вода, почва, биологические жидкости, пища и многое другое.
Смеси бывают двух видов: однородные (гомогенные) и неоднородные (гетерогенные).
www.yaklass.ru
Урок по химии в 8 классе «Чистые вещества и смеси»
Тип урока: урок открытия нового знания
Цель урока: развить знания школьников о веществах и нахождении их в природе при усвоении понятий «чистое вещество», «смесь», а так же понятий непосредственно связанных с ними.
Оборудование и реактивы для учителя:
— ПК, проектор мультимедийный;
— Предметный столик, делительная воронка, штатив, стакан химический, смесь песка и древесных опилок, колба плоскодонная, воронка химическая, вода, йод, активированный уголь, дистиллятор электрический.
Оборудование и реактивы для учащихся: 2 пробирки с водой, колба с водой, воронка химическая, шпатель, фарфоровая чашка (для смешивания серы и железа), сера в порошке, железо в порошке.
Ход урока по химии в 8 классе:
I. Орг. момент
Учитель проверяет готовность учащихся к уроку, организует начало урока. Отмечает отсутствующих.
II. Актуализация опорных знаний.
Учитель: Вокруг нас огромный мир веществ. Мы вдыхает воздух, а это смесь газов (азота, кислорода и других), выдыхаем углекислый газ. Умываемся водой — это еще одно вещество, самое распространенное на Земле. Пьем молоко — смесь воды с мельчайшими капельками молочного жира, и не только: здесь еще есть молочный белок казеин, минеральные соли, витамины и даже сахар, но не тот, с которым пьют чай, а особый, молочный — лактоза. Едим яблоки, которые состоят из целого набора химических веществ — здесь и сахар, и яблочная кислота, и витамины. Стекло, резина – это тоже вещества, точнее, материалы (смеси веществ). И стекло, и резина — искусственного происхождения.
Резина изготовлена человеком из каучука, с добавлением серы. Стекло изготавливают плавлением нескольких компонентов: песка, соды. Мир вокруг нас разнообразен и состоит из различных химических веществ.
Как вы думаете, какая тема урока у нас сегодня?
Учитель помогает учащимся формулировать тему урока. Контролирует записи в тетради.
III. Изучение нового материала.
Учитель: Чем же отличаются чистые вещества от смесей?
В каком виде встречаются вещества в природе?
Учащиеся записывают в тетради конспект урока в процессе объяснения учителя. Учитель просит учащихся обдумать примеры веществ и смесей.
Учитель: Приведите примеры чистых веществ. Давайте дополним ваши примеры.
К чистым веществам относятся: кислород, углекислый газ, азот, водород, сера, вода дистиллированная.
К смесям: воздух, вода водопроводная или вода из водоема, вода загрязненная илом.
Учитель: Существует множество методов, для очистки различных смесей. Пока эти названия вам мало о чем говорят, в данной схеме лишь некоторые способы разделения смесей. Но если вы выберите профессию врача, архитектора, строителя, нефтехимика или лаборанта вы узнаете и о многих других способах очистки смесей.
Учитель: Но как вы думаете, для чего человек научился очищать смесь?
Демонстрационный эксперимент.
Учитель: Сегодня мы рассмотрим некоторые способы очистки смесей веществ, с помощью демонстрационного эксперимента (все опыты после их описания иллюстрируются названием написанным крупным шрифтом на листах бумаги).
Перегонка (дистилляция):
Перед вами прибор для получения дистиллированной воды, как вы думаете, как он называется?
Данный прибор из нашей лаборатории электрический, На чем же основан принцип его работы. Вода нагревается в отдельном стакане и превращается в пар. Этот пар уже является очищенной водой. Мы в домашних условиях также можем получить пар, но почему мы не получаем из него дистиллированную воду. Что для этого нужно сделать? Пар, который образуется в дистилляторе, направляется в холодильник, состоящий из внутренней и внешней трубок. Внутренняя трубка с многочисленными расширениями омывается холодной водопроводной водой и пар способен конденсироваться и стекать по отдельной трубке в колбу-приемник.
Учитель: Дистилляция так же называется перегонкой. Скажите, где вы слышали этот термин? И что еще научился получать человек с помощью перегонки?
Учитель: Перегонка – это способ получения из нефти различных нефтепродуктов. Во время перегонки нефть начинает разделяться на фракции, каждая из которых испаряется при определенной температуре. К ним относятся бензин, керосин, лигроин, газойль, мазут. Все перечисленные продукты вы изучите на уроках органической химии.
Отстаивание:
Учитель: Давайте попробуем разделить следующую смесь, смесь песка и древесных опилок.
Предложите способ разделения данной смеси? Что мы можем добавить к данной смеси? Добавим воду, что происходит со смесью песка и древесных опилок? Со временем частицы песка оседают, а опилки остаются на поверхности воды. Как мы назовем такой способ очистки смеси?
Учитель: с помощью отстаивания можно разделить такие смесь растительного масла и воды, нефти и воды. Растительное масло и нефть оказываются на поверхности воды. Свойство нефти находиться на поверхности воды человек научился использовать, так при аварии с розливом нефти, ее сгущают в
нефтяные пятна с помощью специальных химических средств. Далее нефть можно и удалить с поверхности воды. Такую смесь растительного масла и воды, нефти и воды в лаборатории разделяют с помощью делительной воронки. Вы увидите принцип работы делительной воронки на следующем уроке во время практической работы.
Фильтрование:
Учитель: Перед вами вода окрашенная красителем, как вы думаете, можно ли ее разделить? Давайте попробуем. Сейчас мы используем активированный уголь и превратим гомогенную смесь в гетерогенную. Активированный уголь на своей поверхности собирает краситель и смесь очищается, далее можно увидеть как после отстаивания на дне колбы находятся частицы активированного угля.
Вода оказывается чистой. А как же дальше разделить такую смесь? Можно воспользоваться воронкой фильтром. Я думаю, вы догадались, как называется этот способ разделения гетерогенных смесей – фильтрование. Фильтрование мы так же используем на практической работе.
Лабораторный опыт.
Учитель: Давайте попробуем получить и разделить смесь серы и железа, с помощью лабораторных принадлежностей. Обратите внимание на технику безопасности при выполнении опыта.
Учащиеся выполняют опыт под руководством учителя, по инструкции на экране, в специальных карточках.
Действие магнитом:
Учитель: Вы разделили смесь серы с помощью воды. Но сейчас я покажу еще один способ.
Железо, обладает свойствами металла и способно намагничиваться, в отличии от серы.
Воспользуемся магнитом. В вашем учебнике такой способ разделения смесей называется действие магнитом.
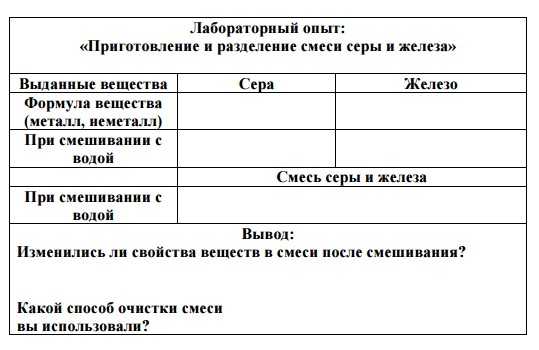
Лабораторный опыт:«Приготовление и разделение смеси серы и железа»
IV. Подведение итогов урока.
Учитель: Итак, мы сегодня на уроке изучили смеси веществ и чистые вещества, рассмотрели их различия. Что вам было интересно на уроке? Что больше всего запомнилось? И что вы хотели бы еще узнать?
Тестирование (взаимопроверка).
Учащиеся обмениваются ответами с соседом по парте, для проверки.
Учитель: Сейчас мы проверим, кто был самым внимательным? Давайте выполним небольшой тест.
Выставление оценок по итогам урока
V. Домашнее задание
§ , прочитать инструкция к выполнению практической работе на стр. вашего учебника.
Скачать презентацию к уроку по химии в 8 классе «Чистые вещества и смеси»
apruo.ru
