Средние соли
Средними солями называются соли, которые являются продуктом полного замещения атомов водорода соответствующей кислоты на атомы металла или ион NH4+. Например:
H2CO3 (NH4)2CO3; H3PO4 Na3PO4
Название средней соли образуется из названия аниона, за которым следует название катиона. Для солей бескислородных кислот наименование соли составляется из латинского названия неметалла с добавлением суффикса –ид, например, NaCl – хлорид натрия. Если неметалл проявляет переменную степень окисления, то после его названия в скобках римскими цифрами указывается степень окисления металла: FeS – сульфид железа (II), Fe2S3 – сульфид железа (III).
K2SiO3 – силикат калия, KNO2 – нитрит калия,
KNO3 – нитрат калия, K3PO4 – фосфат калия,
Fe2(SO4)3 – сульфат железа (III), Na2SO3 – сульфит натрия.
Для солей некоторых кислот используется приставка –гипо для более низких степеней окисления и –пер для высоких степеней окисления. Например,
KClO – гипохлорит калия, KClO2 – хлорит калия,
KClO3 – хлорат калия, KClO4 – перхлорат калия.
Способы получения средних солей:
— взаимодействием металлов с неметаллами, кислотами и солями:
2Na + Cl2 = 2NaCl
Zn + 2HCl = ZnCl2 + H2
Fe + CuSO4 = FeSO4 + Cu
— взаимодействием оксидов:
основных с кислотами BaO + 2HNO3 = Ba(NO3)2 + H2O
кислотных со щелочами 2NaOH + SiO2 = Na2SiO3 + H2O
основных оксидов с кислотными Na2O + CO2 = Na2CO3
— взаимодействием кислот с основаниями и с амфотерными гидроксидами:
KOH + HCl = KCl + H2O
Cr(OH)3 + 3HNO3 = Cr(NO3)3 + 3H2O
— взаимодействием солей с кислотами, со щелочами и солями:
Na
FeCl3 + 3KOH = 3KCl + Fe(OH)3
Na2SO4 + BaCl2 = BaSO4 + 2NaCl
Химические свойства средних солей:
— взаимодействие с металлами
Zn + Hg(NO3)2 = Zn(NO3)2 + Hg
— взаимодействие с кислотами
AgNO3 + HCl = AgCl + HNO3
— взаимодействие со щелочами
CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
— взаимодействие с солями
CaCl2 + Na2CO3 = CaCO3 + 2NaCl
— разложение солей
NH4Cl = NH3
+ HClCaCO3 = CaO + CO2
(NH4)2Cr2O7 = N2 + Cr2O3 + 4H2O
Кислые соли
Кислые соли – это продукты неполного замещения атомов водорода в молекулах многоосновных кислот на атомы металла.
Например: H2CO3 NaHCO3
H3PO4 NaH2PO4 Na2HPO4
При наименовании кислой соли к названию соответствующей средней соли добавляется приставка гидро-, которая указывает на наличие атомов водорода в кислотном остатке.
Например, NaHS – гидросульфид натрия, Na2HPO4 – гидрофосфат натрия, NaH2PO4 – дигидрофосфат натрия.
Кислые соли могут быть получены:
K2O + 2H2S = 2KHS + H2O
NaOH + H2SO4 = NaHSO4 + H2O
K2SO4 + H2SO4 = 2KHSO4
— действием избытка кислотных оксидов на щелочи
NaOH + CO2 = NaHCO3
Химические свойства кислых солей:
— взаимодействие с избытком щелочи
Ca(HCO3)2 + Ca(OH)2 = 2CaCO3 + 2H2O
— взаимодействие с кислотами
Ca(HCO3)2 + 2HCl = CaCl2 + 2H2O + 2CO2
— разложение
Ca(HCO3
)2 = CaCO3 + CO2 + H2Ostudfiles.net
Соли: классификация и химические свойства
Солями называются сложные вещества, молекулы которых, состоят из атомов металлов и кислотных остатков (иногда могут содержать водород). Например, NaCl – хлорид натрия, СаSO4 – сульфат кальция и т. д.
 Практически все соли являются ионными соединениями, поэтому в солях между собой связаны ионы кислотных остатков и ионы металла:
Практически все соли являются ионными соединениями, поэтому в солях между собой связаны ионы кислотных остатков и ионы металла:
Na+Cl– – хлорид натрия
Ca2+SO42– – сульфат кальция и т.д.
Соль является продуктом частичного или полного замещения металлом атомов водорода кислоты. Отсюда различают следующие виды солей:
1. Средние соли – все атомы водорода в кислоте замещены металлом: Na
2. Кислые соли – не все атомы водорода в кислоте замещены металлом. Разумеется, кислые соли могут образовывать только двух- или многоосновные кислоты. Одноосновные кислоты кислых солей давать не могут: NaHCO3, NaH2PO4 ит. д.
3. Двойные соли – атомы водорода двух- или многоосновной кислоты замещены не одним металлом, а двумя различными: NaKCO3, KAl(SO4)2 и т.д.
4. Соли основные можно рассматривать как продукты неполного, или частичного, замещения гидроксильных групп оснований кислотными остатками: Аl(OH)SO4 , Zn(OH)Cl и т.д.
По международной номенклатуре название соли каждой кислоты происходит от латинского названия элемента. Например, соли серной кислоты называются сульфатами: СаSO4 – сульфат кальция, Mg SO4
– сульфат магния и т.д.; соли соляной кислоты называются хлоридами: NaCl – хлорид натрия, ZnCI2 – хлорид цинка и т.д.В название солей двухосновных кислот добавляют частицу «би» или «гидро»: Mg(HCl3)2 – бикарбонат или гидрокарбонат магния.
При условии, что в трехосновной кислоте замещён на металл только один атом водорода, то добавляют приставку «дигидро»: NaH2PO4 – дигидрофосфат натрия.
Соли – это твёрдые вещества, обладающие самой различной растворимостью в воде.
Химические свойства солей
Химические свойства солей определяются свойствами катионов и анионов, которые входят в их состав.
1. Некоторые соли разлагаются при прокаливании:
CaCO3 = CaO + CO2↑
2. Взаимодействуют с кислотами с образованием новой соли и новой кислоты. Для осуществление этой реакции необходимо, чтобы кислота была более сильная чем соль, на которую воздействует кислота:
2NaCl + H2 SO4 → Na2SO4 + 2HCl↑.
3. Взаимодействуют с основаниями, образуя новую соль и новое основание:
Ba(OH)2 + Mg SO4 → BaSO4↓ + Mg(OH)2.
4. Взаимодействуют друг с другом с образованием новых солей:
NaCl + AgNO3 → AgCl + NaNO3 .
5. Взаимодействуют с металлами, которые стоят в раду активности до металла, который входит в состав соли:
Fe + CuSO4 → FeSO4 + Cu↓.
Остались вопросы? Хотите знать больше о солях?
Чтобы получить помощь репетитора – зарегистрируйтесь.
Первый урок – бесплатно!
Зарегистрироваться
© blog.tutoronline.ru, при полном или частичном копировании материала ссылка на первоисточник обязательна.
blog.tutoronline.ru
Химические свойства солей: средних, кислых, основных, комплексных.
Химические свойства средних солей
Взаимодействие средних солей с металлами
Реакция соли с металлом протекает в том случае, если исходный свободный металл более активен, чем тот, который входит в состав исходной соли. Узнать о том, какой металл более активен, можно, воспользовавшись электрохимическим рядом напряжений металлов.
Так, например, железо взаимодействует с сульфатом меди в водном растворе, поскольку является более активным, чем медь (левее в ряду активности):
В то же время железо не реагирует с раствором хлорида цинка, поскольку оно менее активно, чем цинк:
Следует отметить, что такие активные металлы, как щелочные и щелочноземельные, при их добавлении к водным растворам солей будут прежде всего реагировать не с солью, а входящей в состав растворов водой.
Взаимодействие средних солей с гидроксидами металлов
Оговоримся, что под гидроксидами металлов в данном случае понимаются соединения вида Me(OH)x.
Для того чтобы средняя соль реагировала с гидроксидом металла, должны одновременно (!) выполняться два требования:
- • в предполагаемых продуктах должен быть обнаружен осадок или газ;
- • исходная соль и исходный гидроксид металла должны быть растворимы.
Рассмотрим пару случаев, для того чтобы усвоить данное правило.
Определим, какие из реакций ниже протекают, и напишем уравнения протекающих реакций:
- 1) PbS + KOH
- 2) FeCl3 + NaOH
Рассмотрим первое взаимодействие сульфида свинца и гидроксида калия. Запишем предполагаемую реакцию ионного обмена и пометим ее слева и справа «шторками», обозначив таким образом, что пока не известно, протекает ли реакция на самом деле:
В предполагаемых продуктах мы видим гидроксид свинца (II), который, судя по таблице растворимости, нерастворим и должен выпадать в осадок. Однако, вывод о том, что реакция протекает, пока сделать нельзя, так как мы не проверили удовлетворение еще одного обязательного требования – растворимости исходных соли и гидроксида. Сульфид свинца – нерастворимая соль, а значит реакция не протекает, так как не выполняется одно из обязательных требований для протекания реакции между солью и гидроксидом металла. Т.е.:
Рассмотрим второе предполагаемое взаимодействие между хлоридом железа (III) и гидроксидом калия. Запишем предполагаемую реакцию ионного обмена и пометим ее слева и справа «шторками», как и в первом случае:
В предполагаемых продуктах мы видим гидроксид железа (III), который нерастворим и должен выпадать в осадок. Однако сделать вывод о протекании реакции пока еще нельзя. Для этого надо еще убедиться в растворимости исходных соли и гидроксида. Оба исходных вещества растворимы, значит мы можем сделать вывод о том, что реакция протекает. Запишем ее уравнение:
Реакции средних солей с кислотами
Средняя соль реагирует с кислотой в том случае, если образуется осадок или слабая кислота.
Распознать осадок среди предполагаемых продуктов практически всегда можно по таблице растворимости. Так, например, серная кислота реагирует с нитратом бария, поскольку в осадок выпадает нерастворимый сульфат бария:
Распознать слабую кислоту по таблице растворимости нельзя, поскольку многие слабые кислоты растворимы в воде. Поэтому список слабых кислот следует выучить. К слабым кислотам относят H2S, H2CO3, H2SO3, HF, HNO2, H2SiO3 и все органические кислоты.
Так, например, соляная кислота реагирует с ацетатом натрия, поскольку образуется слабая органическая кислота (уксусная):
Следует отметить, что сероводород H2S является не только слабой кислотой, но и плохо растворим в воде, в связи с чем выделяется из нее в виде газа (с запахом тухлых яиц):
Кроме того, обязательно следует запомнить, что слабые кислоты — угольная и сернистая — являются неустойчивыми и практически сразу же после образования разлагаются на соответствующий кислотный оксид и воду:
Выше было сказано, что реакция соли с кислотой идет в том случае, если образуется осадок или слабая кислота. Т.е. если нет осадка и в предполагаемых продуктах присутствует сильная кислота, то реакция не пойдет. Однако есть случай, формально не попадающий под это правило, когда концентрированная серная кислота вытесняет хлороводород при действии на твердые хлориды:
Однако, если брать не концентрированную серную кислоту и твердый хлорид натрия, а растворы этих веществ, то реакция действительно не пойдет:
Реакции средних солей с другими средними солями
Реакция между средними солями протекает в том случае, если одновременно (!) выполняются два требования:
- • исходные соли растворимы;
- • в предполагаемых продуктах есть осадок или газ.
Например, сульфат бария не реагирует с карбонатом калия, поскольку несмотря на то что в предполагаемых продуктах есть осадок (карбонат бария), не выполняется требование растворимости исходных солей.
В то же время хлорид бария реагирует с карбонатом калия в растворе, поскольку обе исходные соли растворимы, а в продуктах есть осадок:
Газ при взаимодействии солей образуется в единственном случае – если смешивать при нагревании раствор любого нитрита с раствором любой соли аммония:
Причина образования газа (азота) заключается в том, что в растворе одновременно находятся катионы NH4+ и анионы NO2— , образующие термически неустойчивый нитрит аммония, разлагающийся в соответствии с уравнением:
Реакции термического разложения солей
Разложение карбонатов
Все нерастворимые карбонаты, а также карбонаты лития и аммония термически неустойчивы и разлагаются при нагревании. Карбонаты металлов разлагаются до оксида металла и углекислого газа:
а карбонат аммония дает три продукта – аммиак, углекислый газ и воду:
Разложение нитратов
Абсолютно все нитраты разлагаются при нагревании, при этом тип разложения зависит от положения металла в ряду активности. Схема разложения нитратов металлов представлена на следующей иллюстрации:
Так, например, в соответствии с этой схемой уравнения разложения нитрата натрия, нитрата алюминия и нитрата ртути записываются следующим образом:
Также следует отметить специфику разложения нитрата аммония:
Разложение солей аммония
Термическое разложение солей аммония чаще всего сопровождается образованием аммиака:
В случае, если кислотный остаток обладает окислительными свойствами, вместо аммиака образуется какой-либо продукт его окисления, например, молекулярный азот N2 или оксид азота (I):
Химические свойства кислых солей
Отношение кислых солей к щелочам и кислотам
Кислые соли реагируют с щелочами. При этом, если щелочь содержит тот же металл, что и кислая соль, то образуются средние соли:
Также, если в кислотном остатке кислой соли осталось два или более подвижных атомов водорода, как, например, в дигидрофосфате натрия, то возможно образование как средней:
так и другой кислой соли с меньшим числом атомов водорода в кислотном остатке:
Важно отметить, что кислые соли реагируют с любыми щелочами, в том числе и теми, которые образованы другим металлом. Например:
Кислые соли, образованные слабыми кислотами, реагируют с сильными кислотами аналогично соответствующим средним солям:
Термическое разложение кислых солей
Все кислые соли при нагревании разлагаются. В рамках программы ЕГЭ по химии из реакций разложения кислых солей следует усвоить, как разлагаются гидрокарбонаты. Гидрокарбонаты металлов разлагаются уже при температуре более 60 оС. При этом образуются карбонат металла, углекислый газ и вода:
Последние две реакции являются основной причиной образования накипи на поверхности водонагревательных элементов в электрических чайниках, стиральных машинах и т.д.
Гидрокарбонат аммония разлагается без твердого остатка с образованием двух газов и паров воды:
Химические свойства основных солей
Основные соли всегда реагируют со всеми сильными кислотами. При этом могут образоваться средние соли, если использовались кислота с тем же кислотным остатком, что и в основной соли, или смешанные соли, если кислотный остаток в основной соли отличается от кислотного остатка реагирующей с ней кислоты:
Также для основных солей характерны реакции разложения при нагревании, например:
Химические свойства комплексных солей (на примере соединений алюминия и цинка)
В рамках программы ЕГЭ по химии следует усвоить химические свойства таких комплексных соединений алюминия и цинка, как тетрагидроксоалюминаты и третрагидроксоцинкаты.
Тетрагидроксоалюминатами и тетрагидроксоцинкатами называют соли, анионы которых имеют формулы [Al(OH)4]— и [Zn(OH)4]2- соответственно. Рассмотрим химические свойства таких соединений на примере солей натрия:
Данные соединения, как и другие растворимые комплексные, хорошо диссоциируют, при этом практически все комплексные ионы (в квадратных скобках) остаются целыми и не диссоциируют дальше:
Действие избытка сильной кислоты на данные соединения приводит к образованию двух солей:
При действии же на них недостатка сильных кислот в новую соль переходит только активный металл. Алюминий и цинк в составе гидроксидов выпадают в осадок:
Осаждение гидроксидов алюминия и цинка сильными кислотами не является удачным выбором, поскольку сложно добавить строго необходимое для этого количество сильной кислоты, не растворив при этом часть осадка. По этой причине для этого используют углекислый газ, обладающий очень слабыми кислотными свойствами и благодаря этому не способный растворить осадок гидроксида:
В случае тетрагидроксоалюмината осаждение гидроксида также можно проводить, используя диоксид серы и сероводород:
В случае тетрагидроксоцинката осаждение сероводородом невозможно, поскольку в осадок вместо гидроксида цинка выпадает его сульфид:
При упаривании растворов тетрагидроксоцинката и тетрагидроксоалюмината с последующим прокаливанием данные соединения переходят соответственно в цинкат и алюминат:
scienceforyou.ru
примеры, состав, названия и химические свойства
Когда слышишь слово «соль», то первая ассоциация, конечно же, поваренная, без которой любое блюдо покажется невкусным. Но ведь это не единственное вещество, которое относится к классу химических веществ соли. Примеры, состав и химические свойства солей вы сможете найти в этой статье, а также научитесь правильно составлять название любой из них. Прежде чем продолжить, давайте договоримся, в этой статье мы рассмотрим только неорганические средние соли (полученные при реакции неорганических кислот с полным замещением водорода).
Определение и химический состав
Одно из определений соли звучит так:
- Это бинарное соединение (т. е. состоящее из двух частей), в состав которого входят ионы металлов и кислотный остаток. То есть это вещество, получившееся в результате реакции кислоты и гидроксида (оксида) любого металла.

Есть еще одно определение:
- Это соединение, представляющее собой продукт полного или частичного замещения ионов водорода кислоты ионами металла (подходит для средних, основных и кислых).
Оба определение правильные, но не отражают всю суть процесса получения соли.
Классификация солей
Рассматривая различных представителей класса солей, можно заметить, что они бывают:
- Кислородсодержащими (соли серной, азотной, кремниевой и других кислот, в состав кислотного остатка которых входит кислород и еще один неметалл).
- Бескислородными, т. е. соли, образованные при реакции кислоты, кислотный остаток которой не содержит кислород, — соляная, бромоводородная, сероводородная и другие.
По количеству замещенных водородов:
- Одноосновные: соляная, азотная, иодоводородная и другие. В состав кислоты входит один ион водорода.
- Двухосновные: два иона водорода замещены ионами металлов при образовании соли. Примеры: серная, сернистая, сероводородная и другие.
- Трехосновные: в составе кислоты три иона водорода замещены металлическими ионами: фосфорная.
Есть и другие типы классификаций по составу и свойствам, но мы не станем их разбирать, так как цель статьи немного другая.
Учимся называть правильно
У любого вещества есть название, которое понятно только жителям определенного региона, его еще называют тривиальным. Поваренная соль — пример разговорного названия, по международной номенклатуре оно будет называться уже по-другому. Но в разговоре абсолютно любой человек, знакомый с номенклатурой названий, без проблем поймет, что речь идет о веществе с химической формулой NaCl. Эта соль является производной от соляной кислоты, а соли ее называют хлоридами, то есть называется она хлорид натрия. Нужно просто выучить названия солей, приведенных ниже в таблице, а затем добавить название металла, образовавшего соль.
Но так просто составляется название, если у металла неизменная валентность. А теперь рассмотрим соль (пример с названием), у которой металл с переменной валентностью — FeCl3. Вещество называется хлорид железа трехвалентного. Именно такое название правильное!
| Формула кислоты | Название кислоты | Кислотный остаток (формула) | Номенклатурное название | Пример и тривиальное название |
| HCl | соляная | Cl— | хлорид | NaCl (поваренная соль, каменная соль) |
| HI | иодоводородная | I— | иодид | NaI |
| HF | фтороводородная | F— | фторид | NaF |
| HBr | бромоводородная | Br— | бромид | NaBr |
| H2SO3 | сернистая | SO32- | сульфит | Na2SO3 |
| H2SO4 | серная | SO42- | сульфат | CaSO4 (ангидрит) |
| HClO | хлорноватистая | ClO— | гипохлорит | NaClO |
| HClO2 | хлористая | ClO2— | хлорит | NaClO2 |
| HClO3 | хлорноватая | ClO3— | хлорат | NaClO3 |
| HClO4 | хлорная | ClO4— | перхлорат | NaClO4 |
| H2CO3 | угольная | CO32- | карбонат | CaCO3 (известняк, мел, мрамор) |
| HNO3 | азотная | NO3— | нитрат | AgNO3 (ляпис) |
| HNO2 | азотистая | NO2— | нитрит | KNO2 |
| H3PO4 | фосфорная | PO43- | фосфат | AlPO4 |
| H2SiO3 | кремниевая | SiO32- | силикат | Na2SiO3 (жидкое стекло) |
| HMnO4 | марганцовая | MnO4— | перманганат | KMnO4 (марганцовка) |
| H2CrO4 | хромовая | CrO42- | хромат | CaCrO4 |
| H2S | сероводородная | S- | сульфид | HgS (киноварь) |
Химические свойства
Как класс, соли по своим химическим свойствам характеризуются тем, что могут взаимодействовать со щелочами, кислотами, солями и более активными металлами:
1. При взаимодействии со щелочами в растворе обязательным условием реакции является выпадение в осадок одного из получаемых веществ.
2. При взаимодействии с кислотами реакция проходит, если образуется летучая кислота, нерастворимая кислота или нерастворимая соль. Примеры:
- К летучим кислотам относится угольная, так как она легко распадается на воду и углекислый газ: MgCO3 + 2HCl = MgCl2 + H2O + CO2.
- Нерастворимая кислота — кремниевая, образуется в результате реакции силиката с другой кислотой.
- Одним из признаков химической реакции является выпадение осадка. Какие соли выпадают в осадок, можно посмотреть в таблице растворимости.
3. Взаимодействие солей между собой происходит только в случае связывания ионов, т. е. одна из образовавшихся солей выпадает в осадок.
4. Чтобы определить, пойдет ли реакция между металлом и солью, нужно обратиться к таблице напряжения металлов (иногда ее еще называют рядом активности).
Только более активные металлы (расположенные левее) могут вытеснять из соли металл. Примером является реакция железного гвоздя с медным купоросом:
CuSO4 + Fe= Cu + FeSO4

Такие реакции свойственны большинству представителей класса солей. Но есть и более специфические реакции в химии, свойства соли индивидуальные отражающие, например разложение при накаливании или образование кристаллогидратов. Каждая соль индивидуальна и по-своему необычна.
fb.ru
Соли — классификация, получение и свойства » HimEge.ru
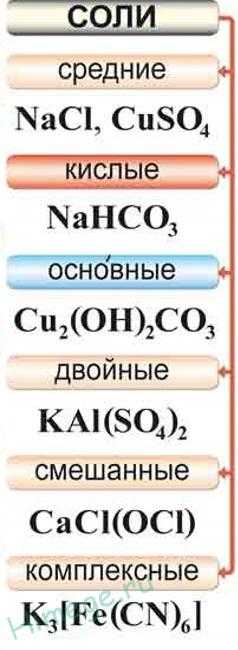 Общая формула соли МnAcm, где М – металл, Ас – кислотный остаток, n – число атомов металла, равное заряду иона кислотного остатка, m – число ионов кислотного остатка, равное заряду иона металла.
Общая формула соли МnAcm, где М – металл, Ас – кислотный остаток, n – число атомов металла, равное заряду иона кислотного остатка, m – число ионов кислотного остатка, равное заряду иона металла.
Средними солями называют продукты полного замещения атомов водорода в молекуле кислоты атомами металла или полного замещения гидроксогрупп в молекуле основания кислотными остатками.
Например, H3PO4 – Na3PO4;
Cu(OH)2 – CuSO4.
Кислыми солями называют продукты неполного замещения атомов водорода в молекулах многоосновных кислот атомами металла.
Например, H2SO4 – NaHSO4,
H3PO4 – Na2HPO4 – NaH2PO4.
Основными солями называют продукты неполного замещения гидроксогрупп в многокислотных основаниях кислотными остатками.
Например, Ca(OH)2 – CaOHCl;
Fe(OH)3 – Fe(OH)2Cl – FeOHCl2.


Кислые соли вступают в реакции с щелочами с образованием средних солей.
KHCO3 + KOH = K2CO3 + H2O
Некоторые кислые соли, например, угольной кислоты разлагаются под действием более сильных кислот:
KHCO3 + HCl = KCl + CO2 + H2O
Основные соли вступают в реакции с кислотами:
Cu(OH)Cl + HCl = CuCl2 + H2O
Свойства комплексных солей (способы разрушения комплексных солей)
1) Комплексные соли реагируют с сильными кислотами, продукты реакции зависят от соотношения между реагентами. При действии избытка сильной кислоты получается две средних соли и вода. При действии недостатка сильной кислоты получается средняя соль активного металла, амфотерный гидроксид и вода, например:
K3[Al(OH)6] + 3HCl = 3KCl + Al(OH)3↓ + 3H2O
K3[Al(OH)6] + 6HClизб = 3KCl + AlCl3 + 6H2O
K2[Zn(OH)4] + 2HBr = 2KBr + Zn(OH)2↓ + 2H2O
K2[Zn(OH)4] + 4HBr изб = 2KBr + ZnBr2 + 4H2O
K3[Cr(OH)6] + 6HNO3 изб. = 3KNO3 + Cr(NO3)3 + 6H2O
2) При нагревании комплексные соли теряют воду:
K[Al(OH)4] = KAlO2 + 2H2O
K3[Cr(OH)6] = KCrO2 + 2H2O + 2KOH
3) При действии углекислого газа, сернистого газа или сероводорода получается соль активного металла и амфотерный гидроксид:
Na[Al(OH)4] + CO2 = NaHCO3 + Al(OH)3↓
K3[Cr(OH)6]+ 3SO2 = 3KHSO3 + Cr(OH)3↓
Na[Al(OH)4] + H2S = NaHS + Al(OH)3↓+ H2O
4) При действии солей, образованных катионами Fe3+, Al3+ и Cr3+ происходит взаимное усиление гидролиза, получается два амфотерных гидроксида и соль активного металла:
3Na[Al(OH)4] + FeCl3 = 3Al(OH)3↓ + Fe(OH)3↓ + 3NaCl
K3[Cr(OH)6] + Al(NO3)3 = Al(OH)3↓ + Cr(OH)3↓+ 3KNO3
himege.ru
Химические свойства средних солей
1. Диссоциация средних солей.
Нужно помнить, что средние соли диссоциируют необратимо по типу сильного электролита, в одну ступень с образованием всех ионов, входящих в состав соли, например:
Al2(SO4)3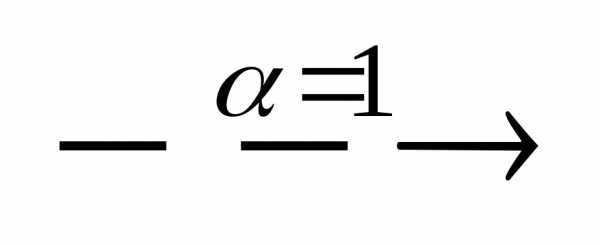 2Al3+ + 3SO
2Al3+ + 3SO ,
,
K3PO4 3K+ + PO
3K+ + PO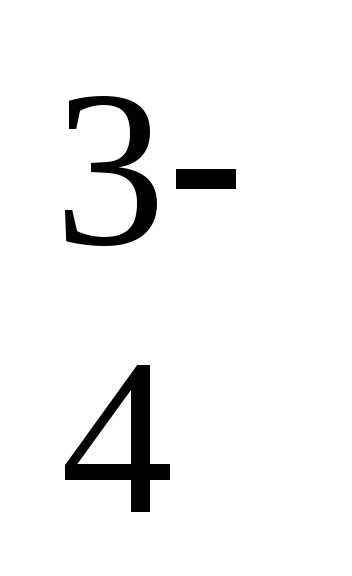 ,
,
Cu(NO3)2 Cu2+ + 2NO
Cu2+ + 2NO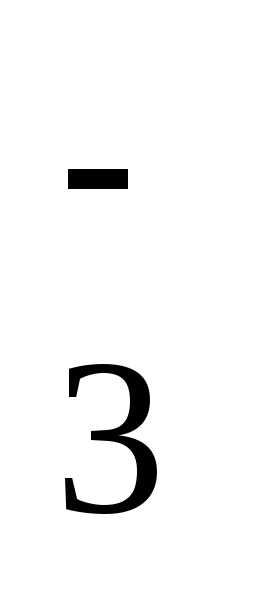 ,
,
CH3COONH4 CH3COO— + NH
CH3COO— + NH .
.
2. Соли взаимодействуют с металлами с образованием новой соли и нового металла. Данный металл может вытеснять из раствора соли только те металлы, которые находятся правее его в электрохимическом ряду напряжений, где М(1) более активный металл, чем М(2). Например: реакция взаимодействия раствора сульфата меди (II) с металлическим железом идет с выделением металлической меди: CuSO4 + Fe → FeSO4 + Cu.
Железо вытесняет медь из раствора соли меди, потому что железо – более активный металл, чем медь (смотри ряд напряжений (активности) металлов).
3. Растворы солей взаимодействуют со щелочами с образованием новой соли и нового труднорастворимого основания или труднорастворимой соли, например:
FeCl3 + 3KOH → Fe(OH)3↓ + 3KCl,
CuSO4 +NaOH → Cu(OH)2↓ + NaSO4,
K2CO3 + Ba(OH)2 → BaCO3↓ + 2KOH.
Реакции могут протекать с образованием основных солей, например:
FeCl3 + KOH → Fe(OH)Cl2 + KCl,
FeCl3 + 2KOH → Fe(OH)2Cl + 2KCl.
4. Соли взаимодействуют с кислотами с образованием новой более слабой кислоты (смотрите ряд активности кислот) или новой труднорастворимой соли, например: BaCl2 + H2SO4 → BaSO4↓ + 2HCl,
CO2
Na2CO3 + 2HCl → 2NaCl + H2CO3
H2O.
5. Соли взаимодействуют между собой с образованием новых солей, если одна из солей выпадает в осадок, например:
AgNO3 + KCl → AgCl↓ + KNO3.
6. Некоторые соли разлагаются при нагревании, например:
MgCO3 MgO + CO2↑,
MgO + CO2↑,
(NH4)2Cr2O7 N2↑
+ Cr2O3 + 4H2O,
N2↑
+ Cr2O3 + 4H2O,
KNO3 KNO2 + O2↑.
KNO2 + O2↑.
2.3.2 Кислые соли
Кислые соли – это продукты неполного замещения катионов водорода в молекулах многоосновных кислот на катионы металла.
Например: KHCO3 – гидрокарбонат калия, NaHSO4 – гидросульфат натрия и т.д. В кислых солях, кроме ионов металла и кислотного остатка содержаться ионы водорода (H+).
Двухосновная кислота с любым металлом образует одну нормальную и одну кислую соль.
H2SO4 + NaOH → NaHSO4 + H2O
Трёхосновная кислота с любым металлом образует одну нормальную и две кислые соли:
Номенклатура (название) кислых солей
Название кислых солей складывается из названия аниона кислоты с добавлением приставки – гидро (с латинского названия «гидрогениум») и названия металла в родительном падеже, например: Ca(HCO3)2 – гидрокарбонат кальция, NaHS – гидросульфид натрия, FeHPO4 – гидроортофосфат железа (II).
Нужно помнить! Приставка ди- используется, если в молекуле кислой соли с одним кислотным остатком связаны два атома водорода, например: NaH2PO4 – дигидроортофосфат натрия, Ca(H2PO4)2 – дигидроортофосфат кальция.
–O
2 иона
H
– O
– P
= O
или – 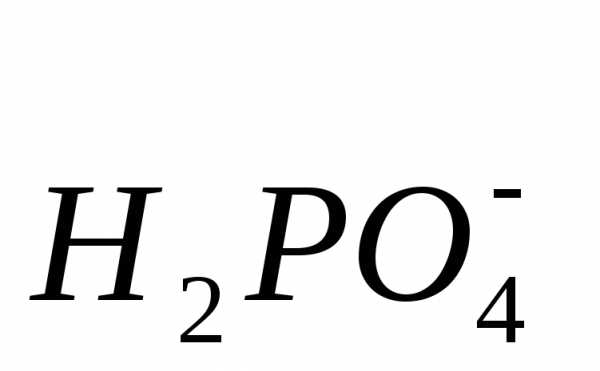
водорода Н – О
дигидроортофосфат – анион
Н– О
Н– О – Р = О –
Н – О
ортофосфорная
кислота 1 ион– О
водорода
– О – Р = О или =  .
.
Н – О
гидроортофосфат – анион
studfiles.net
Соли (химия)
Соли — вещества, в состав молекул которых входят кислотные остатки ( анионы), соединенные с катионами различного происхождения ( атомы металлов, металловидную группы, как NH + 4 , И проч.). Образуются соли результате реакции нейтрализации кислот, или основ. Как правило, соли являются кристаллическими веществами. Простейший пример соли — поваренная соль, химическая формула которого — NaCl.
1. Названия
Существует несколько способов образования названий солей. Проще создавать названия солей, как и кислот, от международных названий кислотных остатков. При этом названия солей кислородных кислот, когда кислотообразующих элемент имеет высшую валентность, оканчивающиеся на-ат. Например:
- KNO 3 — нитрат калия (сернокислый калий)
- CaSO 4 — сульфат кальция (сернокислый кальций),
- Na 3 PO 4 — фосфат натрия (фосфорнокислый натрий),
- BaCO 3 — карбонат бария (углекислый барий),
- Na 2 SiO 3 — силикат натрия (кремнекислый натрий) и т. д.
Названия солей бескислородных кислот имеют окончание-ид или-ид. Например: MgCl 2 — хлорид магния, KJ — йодид калия, NaBr — бромид натрия, Na 2 S — сульфид натрия и т. д.
Если металл, входящий в состав соли, проявляет разную валентность и образует с тем же кислотным остатком несколько солей, то для их распознавания необходимо указывать число кислотных остатков в молекуле соли, или валентность металла. Когда кислотный остаток одновалентный, то обычно указывают число кислотных остатков путем добавления к названию аниона префикса из греческих числительных. Например: CuCl — монохлорид меди, CuCl 2 — дихлорид меди и т. д.
Когда кислотный остаток двух-или трехвалентный, тогда указывают валентность металла, обозначая ее римской цифрой в скобках после названия металла. Например: Cu 2 SO 4 — сульфат меди (I), CuSO 4 — сульфат меди (II), Fe 2 (SO 4) 3 — сульфат железа (III) и т. д.
В названиях кислых солей добавляют приставку гидро-или дигидро-. Например: NaHSO 4 — гидросульфат натрия, NaH 2 PO 4 — дигидрофосфат натрия, CaHPO 4 — фосфат кальция, Ca (H 2 PO 4) 2 — дигидрофосфат кальция и т. д.
Названия основных солей образуют из названия кислотного остатка и слова гидроксид или дигидроксид. Например: AlOHSO 4 — сульфат-гидроксид алюминия, Al (OH) 2 CH 3 COO — ацетат-дигидроксид алюминия, Cu 2 (OH) 2 CO 3 — карбонат-дигидроксид меди (II) и т. д.
Кроме того, некоторые соли имеют еще свои особые названия: Na 2 CO 3 — сода, K 2 CO 3 — поташ, AgNO 3 — ляпис, NaNO 3 — чилийская селитра, Cu 2 (OH) 2 СО 3 — малахит и др..
2. Способы добывания
1. При замещении атомов Водорода в молекулах кислот на атомы металлов:
- 2Fe + 6HCl = 2FeCl 3 + 3H 2
- 2C 3 H 5 (COOH) 3 + 3CuO = [C 3 H 5 (COO)] 2 Cu 3 + 3H 2 O
2. При обмене гидроксильных групп в молекулах основ на кислотные остатки молекул кислот. Суть этой реакции состоит в обмене атомов водорода в молекуле кислоты на атомы металла молекулы основания (с такой же вероятностью происходит обмен гидроксильных групп молекул основ на кислотные остатки молекул кислот), в результате чего образуются соль и вода ( реакция нейтрализации):
- HCl + NaOH = NaCl + H 2 O
- CH 3 COOH + NaOH = CH 3 COONa + H 2 O
3. При взаимодействии кислот с основными оксидами:
- 2HCl + CuO = CuCl 2 + H 2 O
4. При взаимодействии кислот с амфотерными оксидами:
- 3H 2 SO 4 + Al 2 O 3 = Al 2 (SO 4) 3 + 3H 2 O
5. При взаимодействии кислот с солями:
- 3H 2 SO 4 + Ca 3 (PO 4) 2 = 2H 3 PO 4 + 3CaSO 4 ↓
6. При взаимодействии кислот с металлами:
- 2HCl + Zn = ZnCl 2 + H 2 ↑
7. При взаимодействии оснований с кислотными оксидами:
- 2KOH + CO 2 = K 2 CO 3 + H 2 O
8. При взаимодействии оснований с солями:
- 2NaOH + CuCl 2 = 2NaCl + Cu (OH) 2 ↓
9. При взаимодействии основных оксидов с кислотными:
10. При взаимодействии солей:
- K 2 SO 4 + BaCl 2 = 2KCl + BaSO 4 ↓
11. При взаимодействии солей с металлами:
- CuSO 4 + Zn = ZnSO 4 + Cu
12. При взаимодействии металлов с неметаллами:
Существуют и другие способы получения солей.
Не каждым из перечисленных способов можно получить любую соль. Кислые соли образуются обычно при взаимодействии нормальной соли с одноименным кислотой. Например:
- BaCO 3 + H 2 CO 3 (СО 2 + Н 2 О) = Ba (HCO 3) 2
- Ca 3 (PO 4) 2 + H 3 PO 4 = 3CaHPO 4
Основные соли образуются чаще при взаимодействии соли с относительно небольшими количествами щелочи. Например:
- CuCl 2 + NaOH = Cu (OH) Cl ↓ + NaCl
- AlCl 3 + NaOH = Al (OH) Cl 2 ↓ + NaCl
- AlCl 3 + 2NaOH = Al (OH) 2 Cl ↓ + 2NaCl
3. Классификация
Есть несколько способов классификации солей:
3.1. Средние (нормальные) соли
Если все кислотные атомы водорода в молекулах кислот обменены или замещены на атомы металлов или все гидроксильные группы в молекулах основ обменены на кислотные остатки молекул кислот, такие соли называются нормальными, или средними, или просто солями. Например,
- CH 3 COOH + Mg (OH) 3 = Mg (CH 3 COO) 2 + 2H 2 O
- Н 2 SO 4 + Mg = MgSO 4 + H 2
Исходя из теории электролитической диссоциации, солями называются сложные вещества, которые в водном растворе диссоциирует на катионы металлов и анионы кислотных остатков. Нормальные соли никаких других катионов и других анионов не образуют:
- KCl (aq) K + (Aq) + Cl — (Aq)
- Al 2 (SO 4) 3 (aq) 2 Al 3 + (Aq) + 3 SO 2 — 4 (Aq)
3.2. Кислые соли
Если только часть кислотных атомов водорода молекул кислот обменена или замещена на атомы металлов, такие соли называют кислыми, или гидросолямы. Например:
- NaOH + H 2 SO 4 = NaHSO 4 + H 2 O
- Ca (OH) 2 + H 3 PO 4 = CaHPO 4 + 2H 2 O
Кислые соли в водном растворе диссоциируют на катионы металлов, катионы водорода и анионы кислотных остатков. Таким образом, кислая соль будто одновременно является и солью, так как при диссоциации она образует катионы металлов, и кислотой, поскольку одновременно образует и катионы водорода:
- NaHSO 4 (aq) Na + (Aq) + H + (Aq) + SO 2 — 4 (Aq)
- CaHPO 4 (aq) Ca 2 + (Aq) + H + (Aq) + PO 3 — 4 (Aq)
Ионы водорода кислой соли при взаимодействии ее с основой тоже могут обмениваться на ионы металла из образованием нормальной соли и воды:
- NaHSO 4 + NaOH = Na 2 SO 4 + H 2 O
3.3. Основные соли
Если только часть гидроксильных групп в молекулах основ обменена на кислотные остатки молекул кислот, то такие соли называют основными:
- Cu (OH) 2 + HCl = Cu (OH) Cl ↓ + H 2 O
- Fe (OH) 3 + H 2 CO 3 = Fe (OH) CO 3 ↓ + 2H 2 O
- 2Cu (OH) 2 + H 2 CO 3 = Cu 2 (OH) 2 CO 3 ↓ + 2H 2 O
Основные соли в водном растворе диссоциируют на катионы металла и анионы гидроксила и кислотные остатки. Таким образом, основная соль будто одновременно является и солью, поскольку она образует при диссоциации анионы кислотных остатков, и основой, потому образует и гидроксид-анионы:
- Cu (OH) Cl Cu 2 + (Aq) + OH — (Aq) + Cl — (Aq)
- Fe (OH) CO 3 Fe 3 + (Aq) + OH — (Aq) + CO 2 — 3 (Aq)
Обе эти соли в воде практически нерастворимы, но растворимый их часть распадается, по приведенным уравнениям. Ионы гидроксила основной соли при взаимодействии ее с кислотой тоже могут обмениваться на кислотные остатки с образованием нормальной соли
- Cu (OH) Cl + HCl = CuCl 2 + Н 2 О
4. Структурные формулы
При структурном изображении формул солей выходят из формул соответствующих кислот или оснований, заменяя в них кислотные атомы водорода на атомы металла или гидроксильные группы основ на кислотные остатки. Для примера приведем структурные формулы фосфата кальция, гидрокарбоната бария и основного карбоната меди:

5. Свойства
Все соли представляют собой твердые кристаллические вещества. По отношению к нагреву некоторые соли достаточно устойчивыми. Например: NaCl, KCl, Na 2 SO 4 и т.д.. Эти соли можно нагревать до температуры их плавления и даже кипения, и не разлагаются. Другие же соли неустойчивы и при нагревании разлагаются, не плавясь. Например:
По растворимости в воде соли делятся на хорошо растворимые, малорастворимые и практически нерастворимые. Хорошо растворимыми являются все соли азотной и ацетатной кислот, а также почти все соли натрия, калия и аммония. К практически нерастворимых солей относятся хлорид серебра AgCl, сульфат бария BaSO 4, все силикаты (за исключением NaSiO 3 и K 2 SiO 3) и др..
Химические свойства солей определяются их отношением к кислот, основ, металлов и других солей.
1. Соли могут взаимодействовать с кислотами только в том случае, когда реагирующая кислота сильнее той, от которой происходит данная соль. Например:
- FeS + 2HCl = FeCl 2 + H 2 S ↑
- Na 2 SiO 3 + Н 2 SO 4 = Na 2 SO 4 + H 2 SiO 3 ↓
2. Соли могут взаимодействовать с лугами, когда в результате реакции образуется нерастворимое основание или нерастворимая соль. Например:
- FeCl 3 + 3NaOH = 3NaCl + Fe (OH) 3 ↓
- K 2 CO 3 + Ba (OH) 2 = 2KOH + BaCO 3 ↓
3. Растворы солей могут взаимодействовать с металлами, когда данный металл в электрохимическом ряду напряжений стоит левее металла соли. Например:
- CuSO 4 + Fe = FeSO 4 + Cu
- HgCl 2 + Cu = CuCl 2 + Hg
4. Много солей в растворах могут взаимодействовать друг с другом, когда одна из солей, образующегося в результате реакции, является нерастворимой. Например:
- Na 2 CO 3 + CaCl 2 = 2NaCl + CaCO 3 ↓
- FeSO 4 + BaCl 2 = FeCl 2 + BaSO 4 ↓
См.. также
Источники
- Ф. А. Деркач «Химия» Л. 1968
- Глоссарий терминов по химии / / Й.Опейда, О.Швайка. Ин-т физико-органической химии и углехимии им .. Л. М. Литвиненко НАН Украины, Донецкий национальный университет — М.: «Вебер», 2008. — 758 с. ISBN 978-966-335-206-0
nado.znate.ru
