Каковы различия между клеточной стенкой и клеточной мембраной? — Наука и Техника — Каталог статей
Клеточные стенки и клеточные мембраны служат самой внешней частью клетки. Роль каждого из них очень похожа с точки зрения транспорта и межсотового общения. Как клеточная мембрана, так и клеточная стенка существуют от образования клетки путем деления до ее гибели.
Существует 10 различных различий между клеточной мембраной и клеточной стенкой. Клеточная стенка присутствует только в клетках растений и клеток бактерий; животные клетки не имеют клеточной стенки, но вместо этого имеют только клеточную мембрану.
Клеточная стенка заключает в себе плазматическую мембрану и обеспечивает клетке достаточную жесткость, чтобы сохранить свою форму. Однако клеточная мембрана животной клетки более гибкая. Клетка у животного все еще имеет форму, но мембрана не такая жесткая, как клеточная стенка.
Клеточная стенка растения состоит из пектина, хитина и лигнина, тогда как в бактериальных клетках она состоит из гликолипидов и гликопротеинов.
Клеточная стенка жесткая, а также имеет фиксированную и четкую форму; давление, приложенное к клеточной стенке, может сломать ее. Клеточная мембрана является гибкой и обладает способностью сокращаться, изменяя свою форму по мере необходимости и удаляясь от силы.
Клеточная стенка не имеет каких-либо рецепторов, но клеточная мембрана имеет рецепторы, которые используются для получения сигналов от внешних химических сообщений других клеток.
Клеточная стенка включает жгутики и пилюли в виде маленьких волосоподобных предметов снаружи. В клеточной мембране бактериальной клетки есть жгутики, чтобы инициировать движение, и пилюли, чтобы помочь в репродуктивных функциях деления клетки.
Клеточная стенка на самом деле увеличивается в толщине с течением времени и присутствует со времени, когда клетка развивается посредством клеточного деления, пока клетка не умрет. Клеточная мембрана остается той же толщины со времени создания и на протяжении всей своей жизни в организме.
Клеточная стенка является полупроницаемой, что позволяет проходить веществам как внутрь клетки, так и из нее. Клеточная мембрана также проницаема и контролирует движение веществ внутрь и наружу клетки, но она избирательна в отношении веществ, которые она пропускает.
Клеточная стенка защищает клетку от сил во внешней резкой среде, в то время как клеточная мембрана выполняет функции проницаемости, получения химических сигналов, проводимости нервных клеток, деления клеток и размножения половым путем.
Клеточная стенка не нуждается в питании, кроме случаев, когда она повреждена и нуждается в ремонте. Клеточная мембрана требует постоянного питания от клетки, потому что она может сжиматься из-за потери питания и воды.
чем отличается оболочка от клеточной мембраны
Мне важно знать ваше мнение. Как ученые в древние времена и в средниевека изучали строение и функции глаза . Типа они вскрывали трупы или животных и с
… мотрели как он устроен или как. Помогите пожалуйста.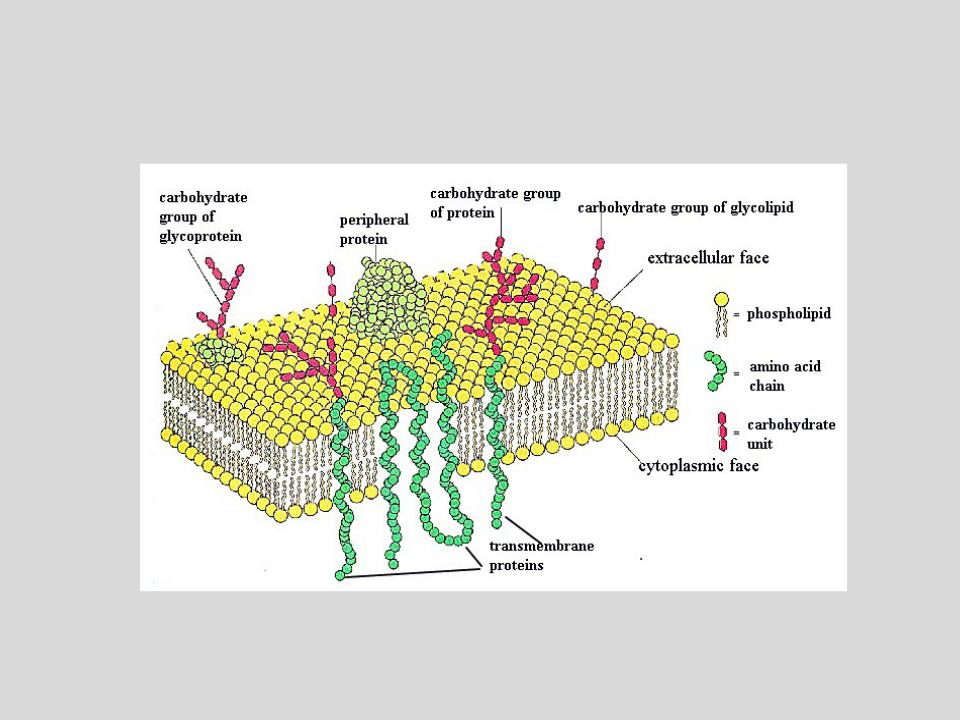 Как вы думаете
Как вы думаете
Значение ароморфозы растений
№1. А. Для вещества, имеющего строение Ch4 – CH – CH = CH – CH – Ch4 ׀ ׀ СН3 СН3 составьте структурные формулы: а) гомолога; б) изомера углеродной це … пи; в) изомера положения двойной связи. Б. Какие из веществ имеют полимерную структуру? а) аминокислоты; б) белки; в) жиры; г) воски. №2.Какой член гомологического ряда предельных углеводородов имеет молекулярную массу 142. Напишите его формулу. №3. Энергетический обмен. Этапы энергетического обмена и ихсущность. №4. У крупного рогатого скота черная масть полностью доминирует над рыжей.Скрещивается черный бык с рыжей коровой. Какое потомство можно ожидать приусловии, что производитель гомозиготен по масти? Что получается в потомстве отскрещивания гибридов между собой?
Даю 80 баллов, срочно помогите!!!!!!!!
Зразок містить фрагменти ДНК різних розмірів: 10000 п.н., 8000 п.н., 5500 п.н., 4000 п.н., 3000 п.н., 2500 п.н
… ., 1500 п.н., 1000 п.н. Який з цих фрагментів ДНК матиме найменшу швидкість руху в агарозній пластинці під час проведення гель-електрофорезу
А) 10000 п. н.
Б) 3000 п.н.
В) 4000 п.н.
Г) 1000 п.н.
Д) 8000 п.н.
Е) 5000 п.н.
Є) 2500 п.н.
Ж) 1500 п.н.
н.
Б) 3000 п.н.
В) 4000 п.н.
Г) 1000 п.н.
Д) 8000 п.н.
Е) 5000 п.н.
Є) 2500 п.н.
Ж) 1500 п.н.
Зразок містить фрагменти ДНК різних розмірів: 10000 п.н., 8000 п.н., 5500 п.н., 4000 п.н., 3000 п.н., 2500 п.н., 1500 п.н., 1000 п.н. Який з цих фрагм … ентів ДНК матиме найменшу швидкість руху в агарозній пластинці під час проведення гель-електрофорезу
что составляет основная ткань у растенийA) мякоть корнеплода,пробку, древесиныB) сердцевину стебля,столбчатую ткань листа, мякоть корнеплодаC) мякоть … корня,кору стебля,жилкуD) сердцевину,кожицу, мякоть листаE) мякоть листа, верхушка корня,конус роста почки.
в каком году был опубликован первый проектный вариант полной последовательности нуклеотидов в ДНК человека А) в октябре 1998 B) в феврале 1998 С) в ав … густе 1999 D) в апреле 1999
Метод, основанный на использовании как гемодиализа, так и гемофильтрации А) гемофильтрация B) гемосорбция C) гемодиафильтрация D) реабсорбция
Какая молекула АТФ превращается в АДФ, теряя одну молекулу фосфорной кислоты? A) Глюкоза B) поджелудочная железа C) Митахондрия D) Фосфор
сколько молей C6h22O6 были расщеплены полностью, если только на кислородном этапе расщепления получено 180 молей АТФ
В Чем Разница Между Клеточной Стенкой И Клеточной Мембраной?
Друзья, если вы посмотрите на точки Cell Cell и Cell Membrame один за другим, вы поймете разницу намного лучше.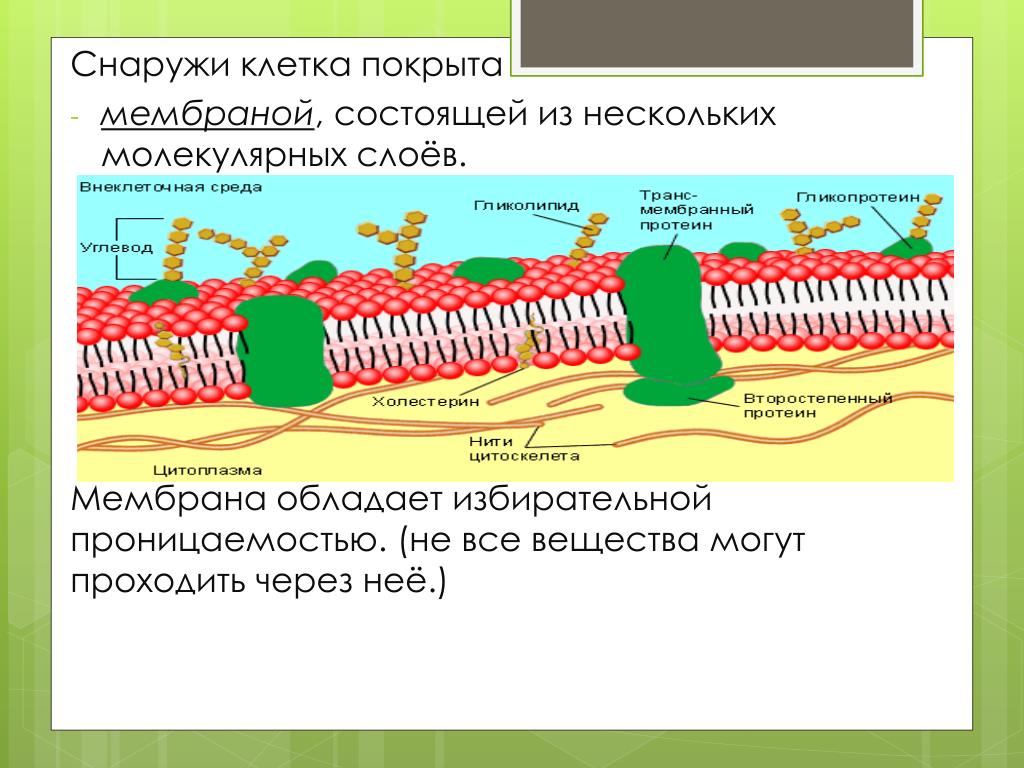
Также прочитайте это: ответ Сриджана Гангули (सृजन to) на Чью камеру нет клеточной стенки?
Позвольте мне сначала описать характеристики
КЛЕТОЧНАЯ СТЕНКА:
1. ВОЗНИКНОВЕНИЕ:
(Я) Это происходит только в растительной клетке.
2. ФИЗИЧЕСКАЯ СТРУКТУРА:
(ii) Он толстый, жесткий, эластичный и неживой.
(iii) Это проницаемо.
(iv) Он состоит из трех разных слоев, таких как средняя пластинка, первичная стенка и вторичная стенка.
(v) Это не элементарная ячейка.
(vi) Плазмодесматы присутствуют.
(vii) клеточная стенка украшена.
3. ХИМИЧЕСКАЯ СТРУКТУРА:
(viii) Он химически состоит из целлюлозы, гемицеллюлозы, кутина, суберина и пектиновых веществ и т. д.
4. ФУНКЦИИ:
(ix) Не участвует в образовании клеточных органелл.
(x) Он не проводит экзоцитоз и эндоцитоз.
Теперь давайте посмотрим на характеристики
Клеточная ячейка:
1. ВОЗНИКНОВЕНИЕ:
(i) Это происходит как в растительной, так и в животной клетке.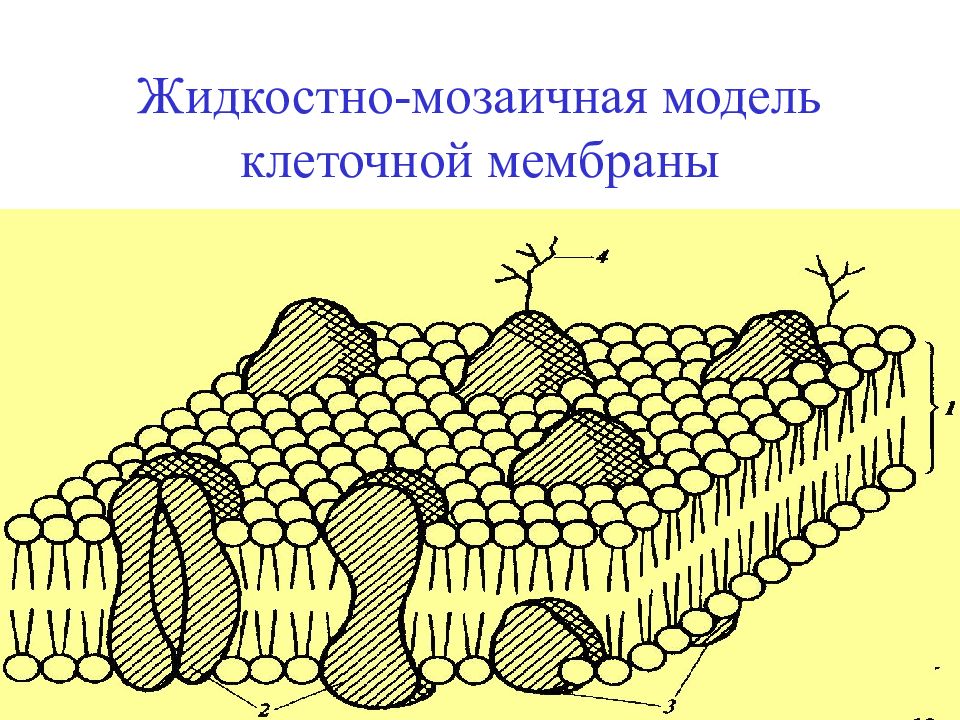
2. ФИЗИЧЕСКАЯ СТРУКТУРА:
(ii) Он тонкий, мягкий, гибкий и живой.
(iii) Он является полупроницаемым.
(vi) Это также трехслойная структура, и слои представляют собой наружный белковый слой, промежуточный липидный слой и внутренний белковый слой.
(v) Это единичная мембрана.
(vi) Десмосомы присутствуют.
(vii) клеточная мембрана является однородной, поэтому никаких украшений не видно.
3. ХИМИЧЕСКАЯ СТРУКТУРА:
(viii) Он химически состоит из белка и липидов. Фосфолипид присутствует в липидном слое.
4. ФУНКЦИИ:
(ix) Он играет наиболее важную роль в формировании клеточных органелл, таких как митохондрии, тела Гольджи и т. д.
(x) Он осуществляет процессы экзоцитоза и эндоцитоза.
Надеюсь, вы поймете разницу.
Спасибо .
НАДЕЮСЬ, ЭТО ПОМОЖЕТ !!
Запрос, если вы хотите больше ответов на этот тип тем!
КЛЕТОЧНАЯ ОБОЛОЧКА — это… Что такое КЛЕТОЧНАЯ ОБОЛОЧКА?
- КЛЕТОЧНАЯ ОБОЛОЧКА
- КЛЕТОЧНАЯ ОБОЛОЧКА
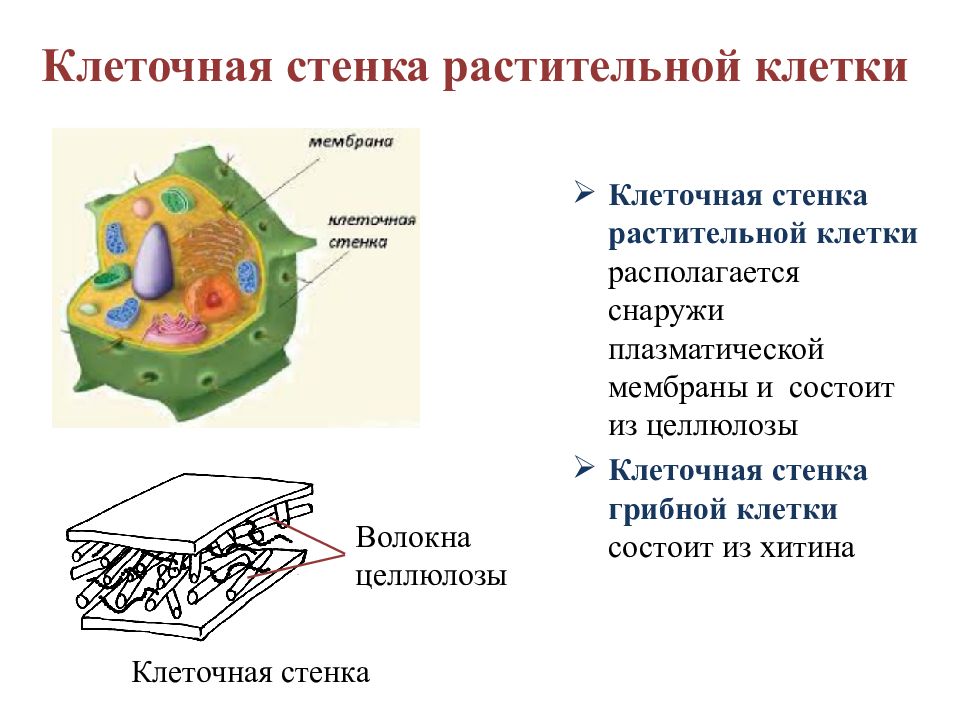
растений, клеточная стенка (membrana cellulae), структурное образование на периферии клетки (за пределами клеточной мембраны — плазмалеммы), придающее ей прочность, сохраняюшее её форму и защищающее протопласт.
 У мн. растений К. о. способны к одревеснению, образуя своеобразный скелет растения, выполняющий опорную функцию. Основа К. о.— высокополимерные углеводы: молекулы целлюлозы собраны в сложные пучки (фибриллы), образующие каркас К. о., погружённый в её основу (матрикс), состоящую из гемицеллюлозы и пектинов. В зависимости от типа ткани, в состав к-рой входит клетка, в К. о. могут быть и др. органич. (лигнин, кутин, суберин, воск, белок) и неорганич. (соли кальция, кремнезём) вещества. Все вещества К. о. синтезируются обычно протопластом клетки. Гл. роль в синтезе углеводов К. о. принадлежит аппарату Гольджи. Различают первичную и вторичную К. о. Меристематические и молодые растущие клетки, реже клетки постоянных тканей, имеют
У мн. растений К. о. способны к одревеснению, образуя своеобразный скелет растения, выполняющий опорную функцию. Основа К. о.— высокополимерные углеводы: молекулы целлюлозы собраны в сложные пучки (фибриллы), образующие каркас К. о., погружённый в её основу (матрикс), состоящую из гемицеллюлозы и пектинов. В зависимости от типа ткани, в состав к-рой входит клетка, в К. о. могут быть и др. органич. (лигнин, кутин, суберин, воск, белок) и неорганич. (соли кальция, кремнезём) вещества. Все вещества К. о. синтезируются обычно протопластом клетки. Гл. роль в синтезе углеводов К. о. принадлежит аппарату Гольджи. Различают первичную и вторичную К. о. Меристематические и молодые растущие клетки, реже клетки постоянных тканей, имеют  о. образуется обычно по достижении клеткой окончат, размера и накладывается слоями на первичную со стороны прс». топласта. Во вторичной К. о. преобладает целлюлоза, её фибриллы, более мощные, чем в первичной, располагаются упорядоченно и более или менее параллельно, но направление их в каждом слое иное, что повышает прочность К. о. Во вторичной К. о. есть перерывы, наз. порами. У клеток простейших и многоклеточных животных К. о. имеется не всегда. Она отличается большим разнообразием, может выполнять функцию наруж. скелета клетки (пелликула простейших, хитиновая кутикула членистоногих), играет защитную роль (многослойная оболочка яйцеклеток, оболочка цист и т. д.). Состоит гл. обр. из углеводов и их соединений с белками, а также липидов и неорганич. веществ.
о. образуется обычно по достижении клеткой окончат, размера и накладывается слоями на первичную со стороны прс». топласта. Во вторичной К. о. преобладает целлюлоза, её фибриллы, более мощные, чем в первичной, располагаются упорядоченно и более или менее параллельно, но направление их в каждом слое иное, что повышает прочность К. о. Во вторичной К. о. есть перерывы, наз. порами. У клеток простейших и многоклеточных животных К. о. имеется не всегда. Она отличается большим разнообразием, может выполнять функцию наруж. скелета клетки (пелликула простейших, хитиновая кутикула членистоногих), играет защитную роль (многослойная оболочка яйцеклеток, оболочка цист и т. д.). Состоит гл. обр. из углеводов и их соединений с белками, а также липидов и неорганич. веществ..(Источник: «Биологический энциклопедический словарь.» Гл. ред. М. С. Гиляров; Редкол.: А. А. Бабаев, Г. Г. Винберг, Г. А. Заварзин и др. — 2-е изд., исправл. — М.: Сов. Энциклопедия, 1986.)
.
- КЛЕТОЧНАЯ МЕМБРАНА
Смотреть что такое «КЛЕТОЧНАЯ ОБОЛОЧКА» в других словарях:
Клеточная оболочка — Клеточная стенка жёсткая оболочка клетки, расположенная снаружи от цитоплазматической мембраны и выполняющая структурные, защитные и транспортные функции. Обнаруживается у большинства бактерий, архей, грибов и растений. Животные и многие… … Википедия
клеточная оболочка — (cytolemma, LNH; син.: клеточная мембрана, плазматическая мембрана, плазмолемма, цитолемма, цитоплазматическая мембрана, цитоплазматическая оболочка) оболочка, покрывающая поверхность клетки, обеспечивающая ее целостность и регулирующая обмен… … Большой медицинский словарь
клеточная оболочка — см. клеточная стенка … Анатомия и морфология растений
КЛЕТОЧНАЯ ОБОЛОЧКА — продукт деятельности живого протопласта, защищающий содержимое клетки от повреждения, придающий ей определенную форму.
 Кроме того, К. о. участвует в поглощении и проведении веществ, транспирации, процессах выделения благодаря наличию разных по… … Словарь ботанических терминов
Кроме того, К. о. участвует в поглощении и проведении веществ, транспирации, процессах выделения благодаря наличию разных по… … Словарь ботанических терминовклеточная оболочка или мембрана — цитоплазматическая оболочка или мембрана Компонент клетки [http://www.dunwoodypress.com/148/PDF/Biotech Eng Rus.pdf] Тематики биотехнологии Синонимы цитоплазматическая оболочка или мембрана EN plasma membrane … Справочник технического переводчика
ВТОРИЧНАЯ КЛЕТОЧНАЯ ОБОЛОЧКА — совокупность параллельных слоев целлюлозных микрофибрилл на внутренней поверхности первичной оболочки … Словарь ботанических терминов
КЛЕТОЧНАЯ ТЕОРИЯ — КЛЕТОЧНАЯ ТЕОРИЯ, классическое учение о микроскоп, строении всех растительных и животных организмов из особых элементарных единиц клеток. Согласно этому учению последние, входя в состав организма, сами в свою очередь являются до известной степени … Большая медицинская энциклопедия
клеточная стенка — Синонимы: клеточная оболочка продукт жизнедеятельности протопласта растительной клетки, образующийся за пределами плазмалеммы.
 Обеспечивает защиту клетки, придает ей определенную форму, участвует в проведении, поглощении и выделении веществ… … Анатомия и морфология растений
Обеспечивает защиту клетки, придает ей определенную форму, участвует в проведении, поглощении и выделении веществ… … Анатомия и морфология растенийклеточная мембрана — см. Клеточная оболочка … Большой медицинский словарь
КЛЕТОЧНАЯ СТЕНКА — см. клеточная оболочка … Словарь ботанических терминов
Строение клетки: плазматическая мембрана, клеточная оболочка
Каково строение клетки?
Клетки грибов, растений и животных имеют много общего не только в химическом составе, но и в строении. При рассматривании клетки под микроскопом в ней видны различные структуры — органоиды. Каждый органоид выполняет определенные функции. В клетке различают три основные части: плазматическую мембрану, ядро и цитоплазму.
Плазматическая мембрана отделяет клетку и ее содержимое от окружающей среды. Вы видите, что мембрана образована двумя слоями липидов, а белковые молекулы пронизывают толщу мембраны.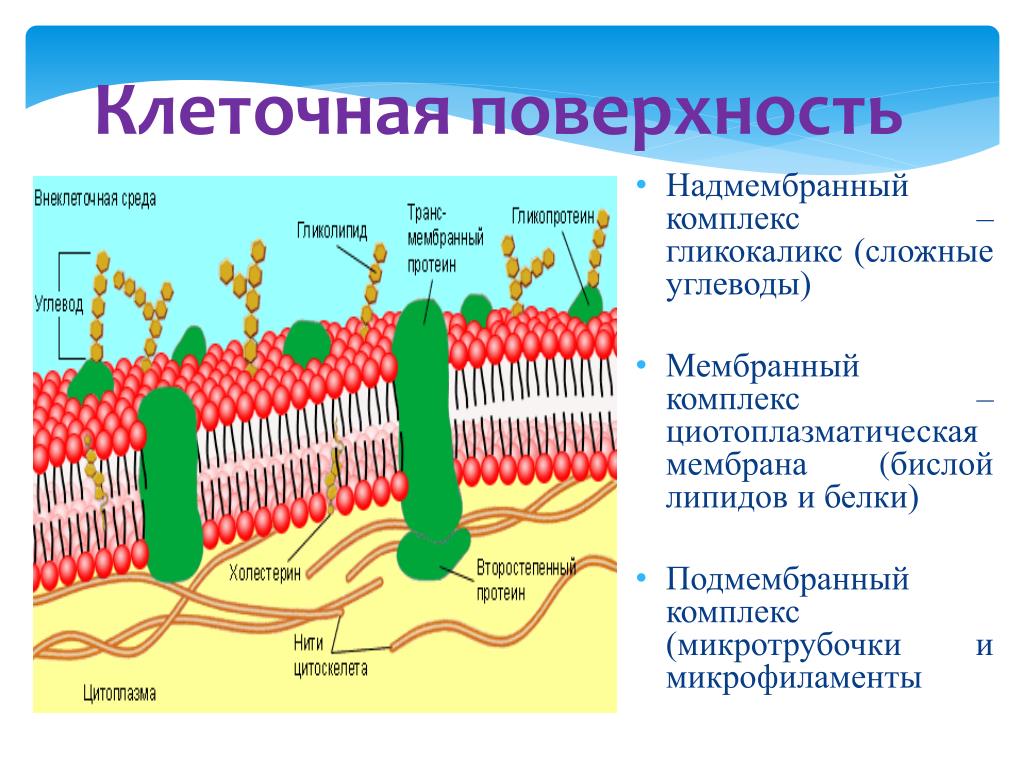
Основная функция плазматической мембраны транспортная. Она обеспечивает поступление питательных веществ в клетку и выведение из нее продуктов обмена.
Важное свойство мембраны — избирательная проницаемость, или полупроницаемость, позволяет клетке взаимодействовать с окружающей средой: в нее поступают и выводятся из нее лишь определенные вещества. Мелкие молекулы воды и некоторых других веществ проникают в клетку путем диффузии, частично через поры в мембране.
В цитоплазме, клеточном соке вакуолей растительной клетки, растворены сахара, органические кислоты, соли. Причем их концентрация в клетке значительно выше, чем в окружающей среде. Чем больше концентрация этих веществ в клетке, тем больше она поглощает воды. Известно, что вода постоянно расходуется клеткой, благодаря чему концентрация клеточного сока увеличивается и вода снова поступает в клетку.
Поступление более крупных молекул (глюкозы, аминокислот) в клетку обеспечивают транспортные белки мембраны, которые, соединяясь с молекулами транспортируемых веществ, переносят их через мембрану. В этом процессе участвуют ферменты, расщепляющие АТФ.
В этом процессе участвуют ферменты, расщепляющие АТФ.
Еще более крупные молекулы белков и полисахаридов проникают в клетку путем фагоцитоза (от греч. fagos — пожирающий и citos — сосуд, клетка), а капли жидкости — путем пиноцитоза (от греч pino — пью и citos).
Клетки животных, в отличие от клеток растений, окружены мягкой и гибкой «шубой», образованной преимущественно молекулами полисахаридов, которые, присоединяясь к некоторым белкам и липидам мембраны, окружают клетку снаружи. Состав полисахаридов специфичен для разных тканей, благодаря чему клетки «узнают» друг друга и соединяются между собой.
У клеток растений такой «шубы» нет. У них над плазматической мембраной находится пронизанная порами клеточная оболочка, состоящая преимущественно из целлюлозы Через поры из клетки в клетку тянутся нити цитоплазмы, соединяющие клетки между собой. Так осуществляется связь между клетками и достигается целостность организма. Клеточная оболочка у растений играет роль прочного скелета и защищает клетку от повреждения.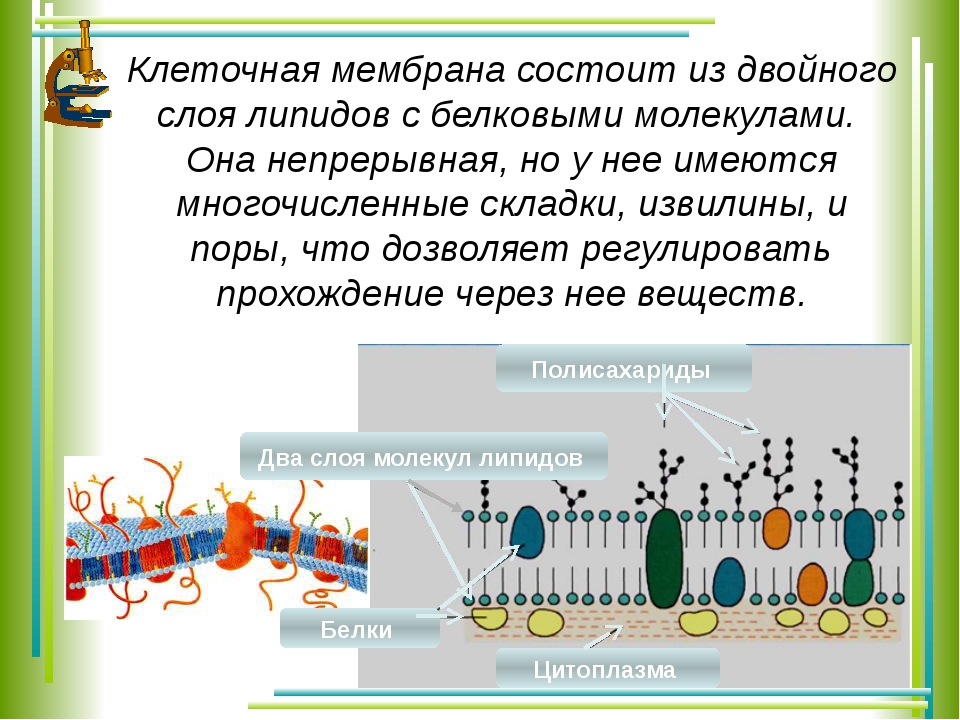
Клеточная оболочка есть у большинства бактерий и у всех грибов, только химический состав ее другой У грибов она состоит из хитиноподобного вещества.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Клеточная мембрана
☰
Клеточная мембрана также называется плазматической (или цитоплазматической) мембраной и плазмалеммой. Данная структура не только отделяет внутреннее содержимое клетки от внешней среды, но также входит с состав большинства клеточных органелл и ядра, в свою очередь отделяя их от гиалоплазмы (цитозоля) — вязко-жидкой части цитоплазмы. Договоримся называть цитоплазматической мембраной ту, которая отделяет содержимое клетки от внешней среды. Остальными терминами обозначать все мембраны.
Строение клеточной мембраны
В основе строения клеточной (биологической) мембраны лежит двойной слой липидов (жиров). Формирование такого слоя связано с особенностями их молекул. Липиды не растворяются в воде, а по-своему в ней конденсируются. Одна часть отдельно взятой молекулы липида представляет собой полярную головку (она притягивается водой, т. е. гидрофильна), а другая — пару длинных неполярных хвостов (эта часть молекулы отталкивается от воды, т. е. гидрофобна). Такое строение молекул заставляет их «прятать» хвосты от воды и поворачивать к воде свои полярные головки.
Липиды не растворяются в воде, а по-своему в ней конденсируются. Одна часть отдельно взятой молекулы липида представляет собой полярную головку (она притягивается водой, т. е. гидрофильна), а другая — пару длинных неполярных хвостов (эта часть молекулы отталкивается от воды, т. е. гидрофобна). Такое строение молекул заставляет их «прятать» хвосты от воды и поворачивать к воде свои полярные головки.
В результате образуется двойной липидный слой, в котором неполярные хвосты находятся внутри (обращены друг к другу), а полярные головки обращены наружу (к внешней среде и цитоплазме). Поверхность такой мембраны гидрофильна, а внутри она гидрофобна.
В клеточных мембранах среди липидов преобладают фосфолипиды (относятся к сложным липидам). Их головки содержат остаток фосфорной кислоты. Кроме фосфолипидов есть гликолипиды (липиды + углеводы) и холестерол (относится к стеролам). Последний придает мембране жесткость, размещаясь в ее толще между хвостами остальных липидов (холестерол полностью гидрофобный).
За счет электростатического взаимодействия, к заряженным головкам липидов присоединяются некоторые молекулы белков, которые становятся поверхностными мембранными белками. Другие белки взаимодействуют с неполярными хвостами, частично погружаются в двойной слой или пронизывают его насквозь.
Таким образом, клеточная мембрана состоит из двойного слоя липидов, поверхностных (периферических), погруженных (полуинтегральных) и пронизывающих (интегральных) белков. Кроме того, некоторые белки и липиды с внешней стороны мембраны связаны с углеводными цепями.
Это жидкостно-мозаичная модель строения мембраны была выдвинута в 70-х годах XX века. До этого предполагалась бутербродная модель строения, согласно которой липидный бислой находится внутри, а с внутренней и наружной стороны мембрана покрыта сплошными слоями поверхностных белков. Однако накопление экспериментальных данных опровергло эту гипотезу.
Толщина мембран у разных клеток составляет около 8 нм.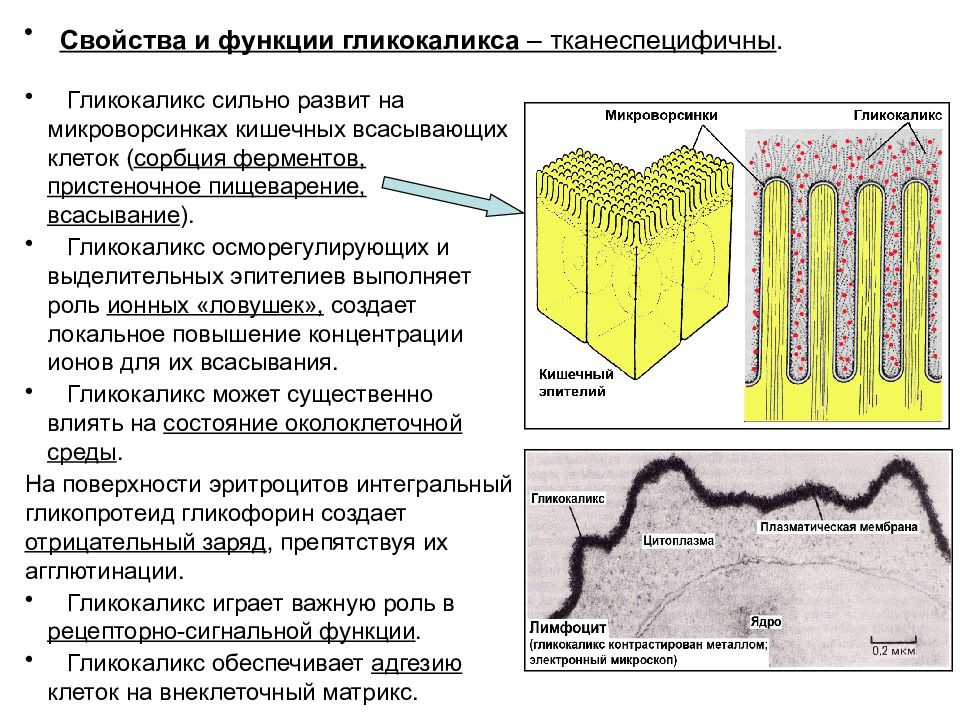 Мембраны (даже разные стороны одной) отличаются между собой по процентному соотношению различных видов липидов, белков, ферментативной активности и др. Какие-то мембраны более жидкие и более проницаемые, другие более плотные.
Мембраны (даже разные стороны одной) отличаются между собой по процентному соотношению различных видов липидов, белков, ферментативной активности и др. Какие-то мембраны более жидкие и более проницаемые, другие более плотные.
Разрывы клеточной мембраны легко сливаются из-за физико-химических особенностей липидного бислоя. В плоскости мембраны липиды и белки (если только они не закреплены цитоскелетом) перемещаются.
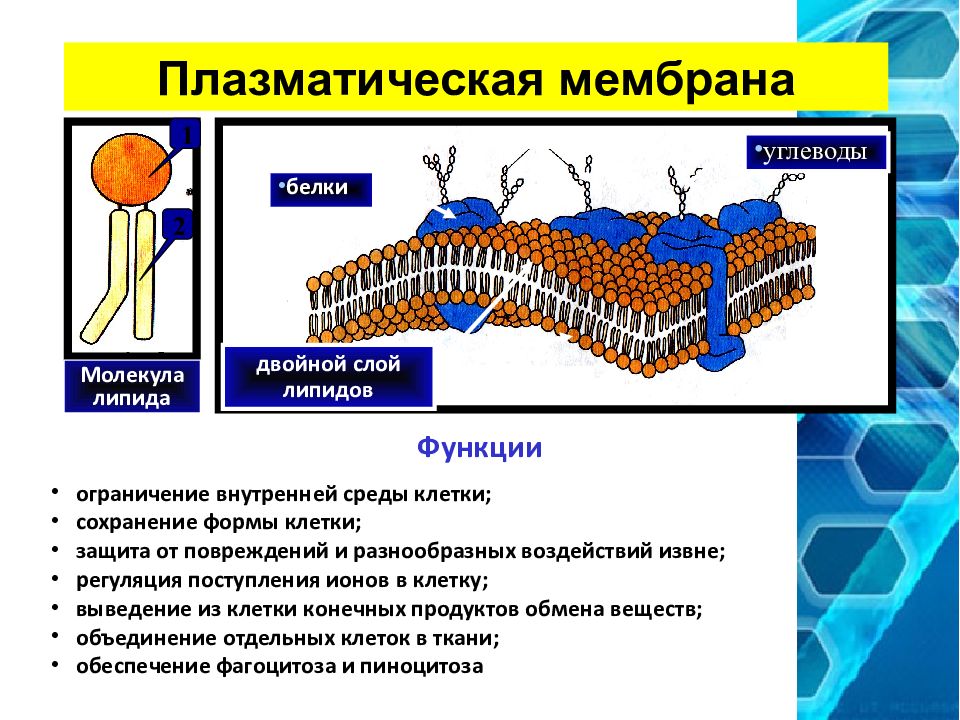
Функции клеточной мембраны
Большинство погруженных в клеточную мембрану белков выполняют ферментативную функцию (являются ферментами). Часто (особенно в мембранах органоидов клетки) ферменты располагаются в определенной последовательности так, что продукты реакции, катализируемые одним ферментом, переходят ко второму, затем третьему и т. д. Образуется конвейер, который стабилизируют поверхностные белки, т. к. не дают ферментам плавать вдоль липидного бислоя.
Клеточная мембрана выполняет отграничивающую (барьерную) от окружающей среды и в то же время транспортную функции. Можно сказать, это ее самое главное назначение. Цитоплазматическая мембрана, обладая прочностью и избирательной проницаемостью, поддерживает постоянство внутреннего состава клетки (ее гомеостаз и целостность).
Можно сказать, это ее самое главное назначение. Цитоплазматическая мембрана, обладая прочностью и избирательной проницаемостью, поддерживает постоянство внутреннего состава клетки (ее гомеостаз и целостность).
При этом транспорт веществ происходит различными способами. Транспорт по градиенту концентрации предполагает передвижение веществ из области с их большей концентрацией в область с меньшей (диффузия). Так, например, диффундируют газы (CO2, O2).
Бывает также транспорт против градиента концентрации, но с затратой энергии.
Транспорт бывает пассивным и облегченным (когда ему помогает какой-нибудь переносчик). Пассивная диффузия через клеточную мембрану возможна для жирорастворимых веществ.
Есть особые белки, делающие мембраны проницаемыми для сахаров и других водорастворимых веществ. Такие переносчики соединяются с транспортируемыми молекулами и протаскивают их через мембрану. Так переносится глюкоза внутрь эритроцитов.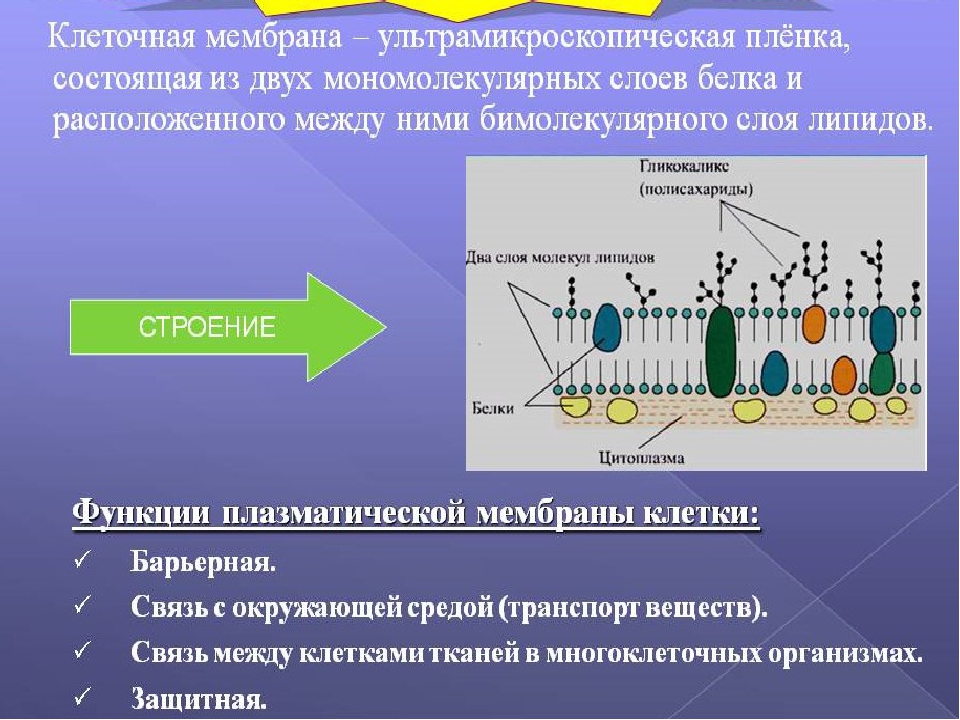
Пронизывающие белки, объединяясь, могут образовывать пору для перемещения некоторых веществ через мембрану. Такие переносчики не перемещаются, а образуют в мембране канал и работают аналогично ферментам, связывая определенное вещество. Перенос осуществляется благодаря изменению конформации белка, благодаря чему в мембране образуются каналы. Пример — натрий-калиевый насос.
Транспортная функция клеточной мембраны эукариот также реализуется за счет эндоцитоза (и экзоцитоза). Благодаря этим механизмам в клетку (и из нее) попадают крупные молекулы биополимеров, даже целые клетки. Эндо- и экзоцитоз характерны не для всех клеток эукариот (у прокариот его вообще нет). Так эндоцитоз наблюдается у простейших и низших беспозвоночны; у млекопитающих лейкоциты и макрофаги поглощают вредные вещества и бактерии, т. е. эндоцитоз выполняет защитную функцию для организма.
Эндоцитоз делится на фагоцитоз (цитоплазма обволакивает крупные частицы) и пиноцитоз (захват капелек жидкости с растворенными в ней веществами).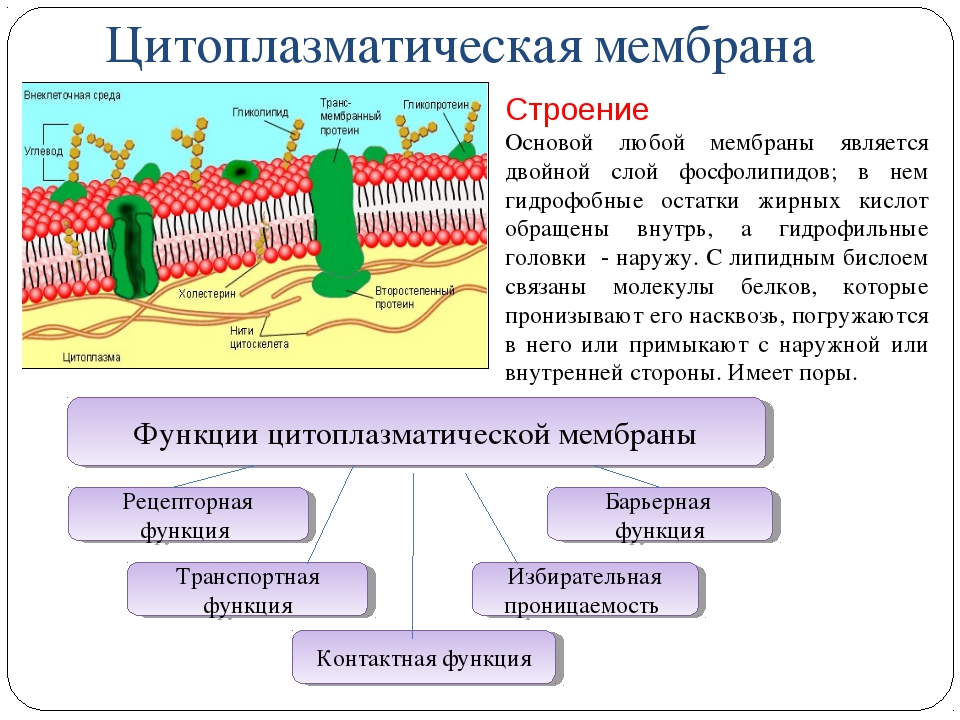 Механизм этих процессов приблизительно одинаков. Поглощаемые вещества на поверхности клеток окружаются мембраной. Образуется пузырек (фагоцитарный или пиноцитарный), который затем перемещается внутрь клетки.
Механизм этих процессов приблизительно одинаков. Поглощаемые вещества на поверхности клеток окружаются мембраной. Образуется пузырек (фагоцитарный или пиноцитарный), который затем перемещается внутрь клетки.
Экзоцитоз — это выведение цитоплазматической мембраной веществ из клетки (гормонов, полисахаридов, белков, жиров и др.). Данные вещества заключаются в мембранные пузырьки, которые подходят к клеточной мембране. Обе мембраны сливаются и содержимое оказывается за пределами клетки.
Цитоплазматическая мембрана выполняет рецепторную функцию. Для этого на ее внешней стороне располагаются структуры, способные распознавать химический или физический раздражитель. Часть пронизывающих плазмалемму белков с наружней стороны соединены с полисахаридными цепочками (образуя гликопротеиды). Это своеобразные молекулярные рецепторы, улавливающие гормоны. Когда конкретный гормон связывается со своим рецептором, то изменяет его структуру. Это в свою очередь запускает механизм клеточного ответа. При этом могут открываться каналы, и в клетку могут начать поступать определенные вещества или выводиться из нее.
При этом могут открываться каналы, и в клетку могут начать поступать определенные вещества или выводиться из нее.
Рецепторная функция клеточных мембран хорошо изучена на основе действия гормона инсулина. При связывании инсулина с его рецептором-гликопротеидом происходит активация каталитической внутриклеточной части этого белка (фермента аденилатциклазы). Фермент синтезирует из АТФ циклическую АМФ. Уже она активирует или подавляет различные ферменты клеточного метаболизма.
Рецепторная функция цитоплазматической мембраны также включает распознавание соседних однотипных клеток. Такие клетки прикрепляются друг к другу различными межклеточными контактами.
В тканях с помощью межклеточных контактов клетки могут обмениваться между собой информацией с помощью специально синтезируемых низкомолекулярных веществ. Одним из примеров подобного взаимодействия является контактное торможение, когда клетки прекращают рост, получив информацию, что свободное пространство занято.
Межклеточные контакты бывают простыми (мембраны разных клеток прилегают друг к другу), замковыми (впячивания мембраны одной клетки в другую), десмосомы (когда мембраны соединены пучками поперечных волокон, проникающих в цитоплазму). Кроме того, есть вариант межклеточных контактов за счет медиаторов (посредников) — синапсы. В них сигнал передается не только химическим, но и электрическим способом. Синапсами передаются сигналы между нервными клетками, а также от нервных к мышечным.
Оболочка клеточная — Справочник химика 21
Целлюлоза. Полисахарид, из которого построена оболочка (клеточная стенка) клеток растений. Примером почти чистой целлюлозы может служить хлопок. Если обработать хлопок основанием, затем отмыть водой и высушить, он становится прочнее и лучше поглощает красители. Этот процесс называется мерсеризацией. [c.464] Живые организмы представляют собой системы с очень развитыми поверхностями раздела, к которым относят кожные покровы, поверхность стенок кровеносных сосудов, слизистые оболочки, клеточные мембраны, мембраны ядер, митохондрий, лизосом и т.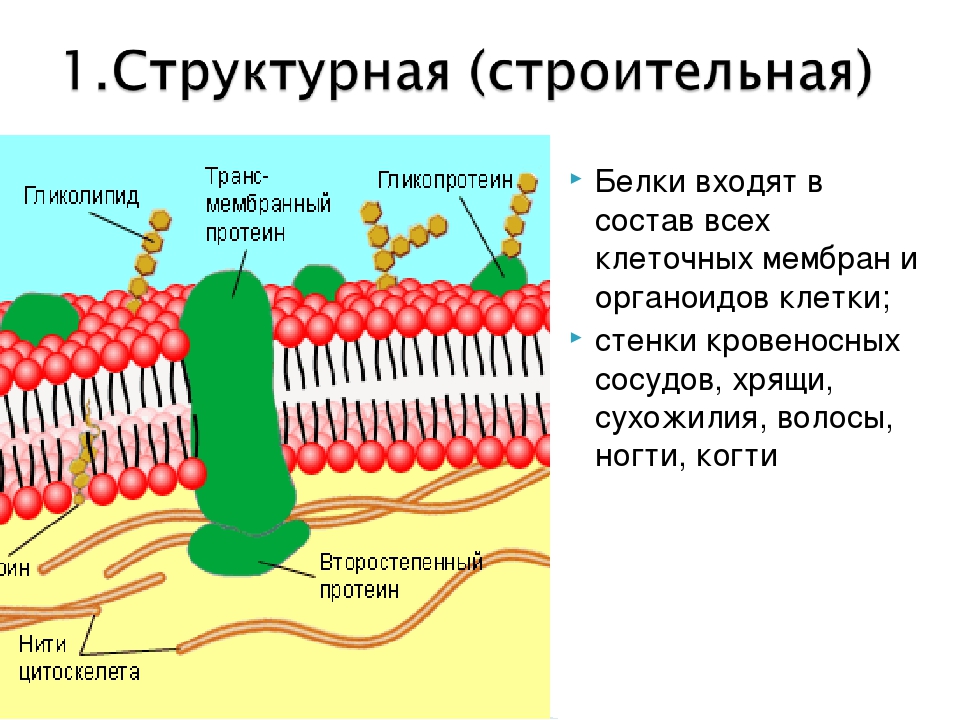 д. Так, например, поверхность кожи взрослого человека составляет 1,5—1,6 м , площадь поверхности эритроцитов всей крови человека составляет 2500—3800 м , площадь поверхности капилляров печени — около 400 м , площадь поверхности альвеол — около 1000 м , поверхность скелета — около [c.425]
д. Так, например, поверхность кожи взрослого человека составляет 1,5—1,6 м , площадь поверхности эритроцитов всей крови человека составляет 2500—3800 м , площадь поверхности капилляров печени — около 400 м , площадь поверхности альвеол — около 1000 м , поверхность скелета — около [c.425]
Отличие молекулы РНК от ДНК заключается в том, что в первой вместо дезоксирибозы содержится сахар рибоза, а кроме того, основание тимин (Т) заменено основанием урацил (У). Таким образом, алфавитом для построения РНК служат пары оснований АУ и ГЦ. Молекула РНК обычно остается лестницей с перилами с одной стороны , она проходит сквозь оболочку клеточного ядра и затем управляет синтезом белков в цитоплазме клетки. Другая разновидность РНК, называемая транспортной РНК, выполняет роль инженера по технадзору за строительством , который проверяет укладку каждого кирпича, чтобы установить, соответствует ли она чертежам , принесенным молекулами РНК первого типа (так называемыми мессенджер-РНК, что означает посыльными РНК).
 [c.486]
[c.486]Живая клетка имеет три части оболочку живое содержимое -протопласт вакуоли. У растительных клеток формирование оболочки (клеточной стенки) обусловлено деятельностью протопласта. Вакуоль -это полость с клеточным соком. Вакуоли в клетках образуются и увеличиваются в объеме по мере роста клеток. Протопласт (протоплазма) состоит из цитоплазмы и включенных в нее органоидов (органелл). [c.195]
В клетках растений такую функцию выполняет главным образом вторичная оболочка клеточной стенки. У высших растений эта оболочка состоит в основном из целлюлозы в меньших количествах присутствуют гемицеллюлозы. У большинства грибов опорные функции в клеточной стенке выполняет хитин. [c.601]
Целостность поверхностной мембраны — условие существования клетки. Раздражимость и возбудимость. Ясно, что повреждение поверхностной оболочки (клеточной мембраны) должно приводить к гибели клетки. Нарущение целостности мембраны сопряжено с потерей внутриклеточного содержимого и вхождением в клетку вредных компонент из внешней среды.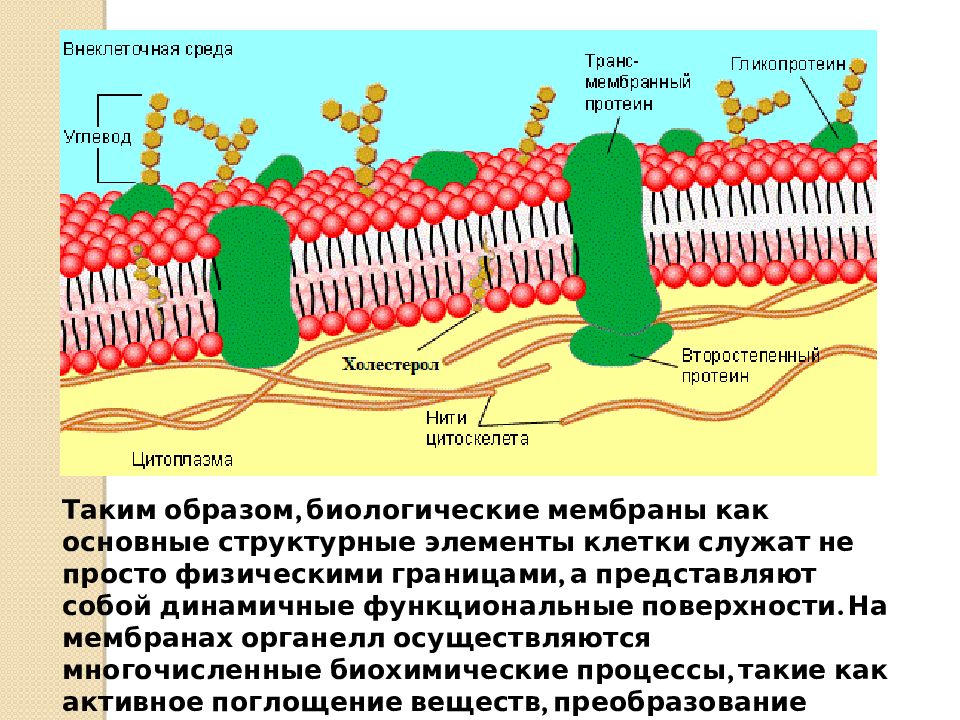 Условием дальнейшего эволюционного прогресса оказывается теперь выработка быстрой реакции на повреждение. Эта реак- [c.94]
Условием дальнейшего эволюционного прогресса оказывается теперь выработка быстрой реакции на повреждение. Эта реак- [c.94]
Кроме крахмала и сахаров, в составе зерна бобовых имеются и другие углеводы — клетчатка, гемицеллюлозы, пектиновые вещества, пентозаны, которые входят в состав семенных оболочек, клеточных стенок или играют роль запасных веществ. [c.389]
Одним из основных структурных компонентов клетКи прока рио-тов является клеточная оболочка. В состав клеточной оболочки бактерий (рис. 14, а) входят сложные молекулярные комплексы, состоящие из белков, полисахаридов и жироподобных веществ. Будучи жесткой, она служит как бы скелетом клетки, придавая ей определенную форму. Клетки цианобактерий (рис. 14, б) покрыты эластичной пектиновой оболочкой. Клеточная оболочка прокариотов образует своеобразный барьер на пути прохождения растворенных веществ из окружающей среды внутрь клетки. [c.43]
Наконец, на самом высоком уровне макромолекулярные компоненты соединяются в еще более крупные клеточные структуры, такие, как клеточная оболочка, клеточная мембрана и рибосомы. В соответствии с таким взглядом уровни синтеза можно представить в следующем виде [c.57]
В соответствии с таким взглядом уровни синтеза можно представить в следующем виде [c.57]
Как известно из теории упругости, энергия изгиба мала по-сравнению с энергией растяжения тонкой оболочки (клеточной мембраны). Поэтому, если данная оболочка допускает деформации без растяжения или сжатия нейтральной поверхности, именно деформации изгиба и будут реально осуществляться при воздействии на нее произвольных внешних сил. Например, в процессе обезвоживания первоначально сферической клетки форма-ее мембраны не будет оставаться сферической, поскольку тогда мембрана в целом должна была бы сильно сжаться. Ей энергетически выгоднее принимать такие формы, при которых знак средней кривизны в разных частях мембраны становится разным, а площадь нейтральной поверхности мембранного бислоя остается такой же, как в исходном, недеформированном состоянии. Изгиб мембраны при осмотическом обезвоживании липидной везикулы или клетки является физической причиной сепарации мембранных компонентов.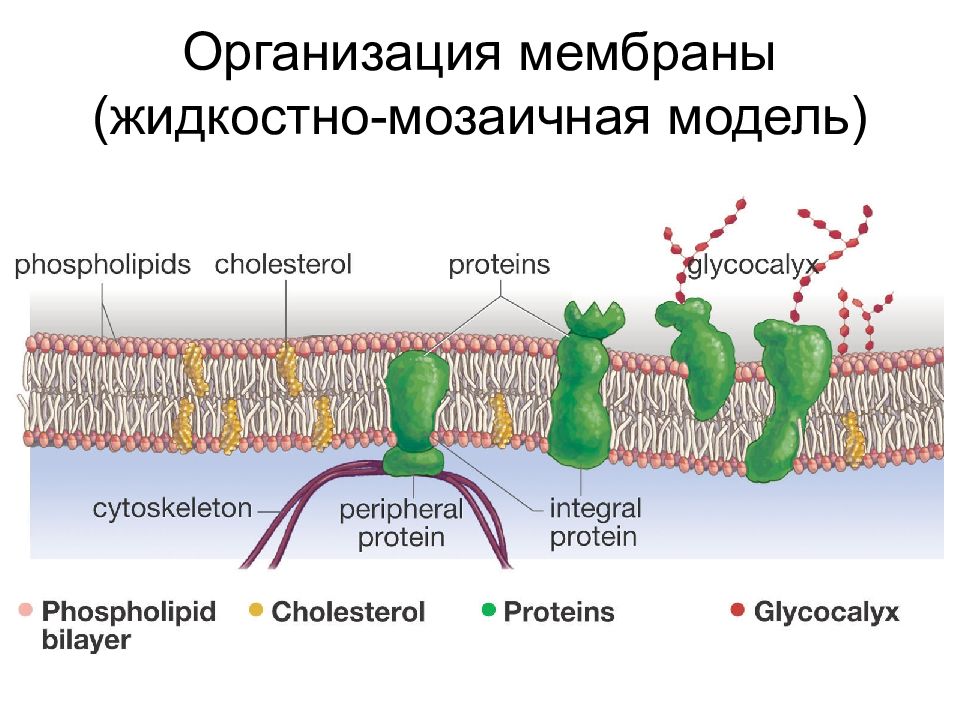 Так, в тех точках мембраны, где по абсолютной величине кривизна мембраны больше, преимущественно скапливаются компоненты с меньшим модулем растяжения — сжатия (в предположении, что недеформированному состоянию соответствует плоский бислой), ибо это, очевидно,, приводит к уменьшению свободной энергии изгиба мембраны. [c.41]
Так, в тех точках мембраны, где по абсолютной величине кривизна мембраны больше, преимущественно скапливаются компоненты с меньшим модулем растяжения — сжатия (в предположении, что недеформированному состоянию соответствует плоский бислой), ибо это, очевидно,, приводит к уменьшению свободной энергии изгиба мембраны. [c.41]
Как правило, клетки окружены двумя оболочками клеточной стенкой и цитоплазматической мембраной, для эукариотических клеток применяют название плазмолемма. [c.10]
Что касается ЛПЭ-11, то при одинаковых с С2Н5ОН диффузных закономерностях макрокинетики фильтрации механизм элементарных реакций подавления клеток биофазы различается. По-видимому, ЛПЭ-11 сразу блокирует активные центры клеточных мембран, что связано со специфическим действием группировки Ы в биоцидах. Таким образом, различие в воздействии ЛПЭ-11 и С Н ОН на биофазу проявляется на стадии взаимодействия биоцида с липидной оболочкой клеточных мембран или другими активными центрами клеток. Несмотря на это, стадия диффузии является лимитирующей и определяет микрокинетику процесса в целом, независимо от биоцидной активности и природы реагента. [c.144]
Несмотря на это, стадия диффузии является лимитирующей и определяет микрокинетику процесса в целом, независимо от биоцидной активности и природы реагента. [c.144]
Все клетки отграничены друг от друга и от окружающей среды с помощью спещгальной оболочки—клеточной мембраны. Со времен К. Негели, описавшего в 1855 г. структуру мембран, окружающих живые клетки, представления об устройстве и функциях мембран существенно обогатились. 1Слеточная мембрана во многом определяет свойства, поведение и даже форму клетки. Мембраны прокариот и эукариот различаются между собой по составу и свойствам. Растительные и животные клетки также отличаются друг от друга как по набору органелл, так и по свойствам мембран (рис. 9.1). [c.298] Клетки актиномицетов покрыты плотной клеточной оболочкой, имеют протоплазму и ядерное вещество, или нуклеоиды, которые, как и у других бактерий, не покрыты ядерной оболочкой.
 Клеточная оболочка 10—30 нм толщиной, многослойная или двух-трехслойная. По химическому составу весьма близка к оболочкам грамположительных бактерий. Гексозамины и мукопротеиды — компоненты мукополисахаридов — входят в состав оболочек актиномицетов и прочих грамположительных бактерий. Особенностью оболочки мицелия актиномицетов является мелкопористое строение с диаметром пор около 5 нм. Оболочка воздушного мицелия и спор актиномицетов имеет фибриллярное строение, которое исчезает после обработки ли-зоцимом, смесью этанола, хлороформа и этилового эфира либо другими растворителями липидов это свидетельствует о том, что фибриллярность обусловлена липоидами. По химическому составу клеточной стенки различаются между собой не только [c.17]
Клеточная оболочка 10—30 нм толщиной, многослойная или двух-трехслойная. По химическому составу весьма близка к оболочкам грамположительных бактерий. Гексозамины и мукопротеиды — компоненты мукополисахаридов — входят в состав оболочек актиномицетов и прочих грамположительных бактерий. Особенностью оболочки мицелия актиномицетов является мелкопористое строение с диаметром пор около 5 нм. Оболочка воздушного мицелия и спор актиномицетов имеет фибриллярное строение, которое исчезает после обработки ли-зоцимом, смесью этанола, хлороформа и этилового эфира либо другими растворителями липидов это свидетельствует о том, что фибриллярность обусловлена липоидами. По химическому составу клеточной стенки различаются между собой не только [c.17] Каждая клетка имеет оболочку — клеточную стенку и полость. Клеточные стенки состоят в основном из органических веществ различного строения, образующих вещество древесины. Они включают в себя углеводы — полисахариды (в среднем около 70%) с различной длиной цепных молекул и вещества ароматической природы, составляющие до 30% от древесины. Вся углеводная часть древесины называется холо-целлюлозой, а комплекс ароматических веществ — лигнином. В состав холоцеллюлозы входят целлюлоза и гемицеллюлозы (гексозаны, пентозаны, связанные с пентоза-нами уроновые кислоты и пектиновые вещества). Клеточные стенки удерживают в своем составе незначительные количества минеральных веществ. Полости клеток часто содержат сложные химические вещества, которые можно извлекать из древесины (экстрагировать) нейтральными растворителями (водой и органическими растворителями). Поэтому они получили название экстрактивных веществ. Иногда эти вещества пропитывают и стенки клеток. [c.7]
Вся углеводная часть древесины называется холо-целлюлозой, а комплекс ароматических веществ — лигнином. В состав холоцеллюлозы входят целлюлоза и гемицеллюлозы (гексозаны, пентозаны, связанные с пентоза-нами уроновые кислоты и пектиновые вещества). Клеточные стенки удерживают в своем составе незначительные количества минеральных веществ. Полости клеток часто содержат сложные химические вещества, которые можно извлекать из древесины (экстрагировать) нейтральными растворителями (водой и органическими растворителями). Поэтому они получили название экстрактивных веществ. Иногда эти вещества пропитывают и стенки клеток. [c.7]
В клубнях картофеля зерна крахмала плавают в клеточном соке, и производство картофельного крахмала весьма просто. Мытый картофель превращается в мезгу на терочных машинах в натертом таким образом картофеле повреждены клеточные оболочки, клеточный сок, а вместе с ним крахмальные зерна легко могут быть извлечены из поврежденных клеток. Для этого полученную мезгу промывают струей воды на мелких ситах, пропускающих крахмальные зерна и задерживающих обрыйки клеток.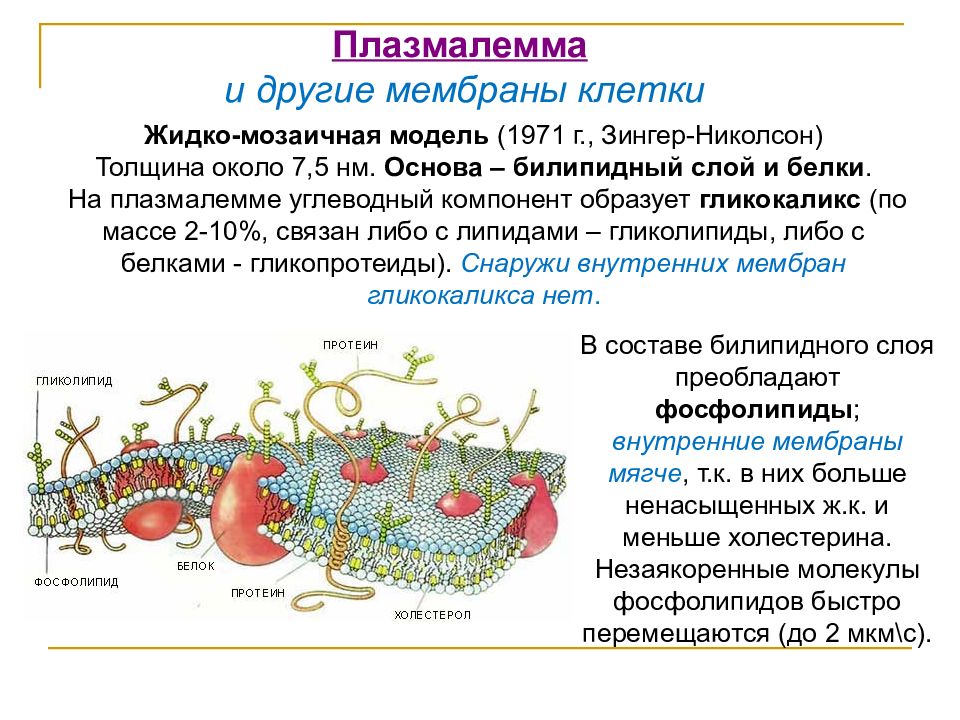 [c.403]
[c.403]
Морфология клеток форма, размер подвижность внутриклеточные и внеклеточные структуры взаимное расположение клеток клеточная дифференцнров-ка тип клеточного деления ультраструктура клетки цвет характер жгутикова-ния споры капсулы, чехлы, выросты жизненный цикл, гетероцисты, гормогонин ульстраструктура жгутиков, оболочки, клеточной стенки [c.200]
Сейчас уже довольно легко выделить интактные хлоропласты, способные фиксировать углекислоту с высокой скоростью (хлоропласты типа А, или. полные хлоропласты). Это дает возможность изучать функцию хлоропластов в связи с ролью цитоплазмы и других компонентов клетки. Протопласты, представляющие собой по аути дела клетки, лишенные оболочек (клеточные оболочки удаляют, воздействуя специальными ферментами), с успехом используются в современных исследованиях процессов переноса субстратов и метаболитов в клетку и из клетки, в хлоропласт и из хлоропласта. Из листьев можно выделять и целые клетки (вместе с оболочками) и изучать на них более сложные взаимодействия потоков субстратов, ионов, газов и т.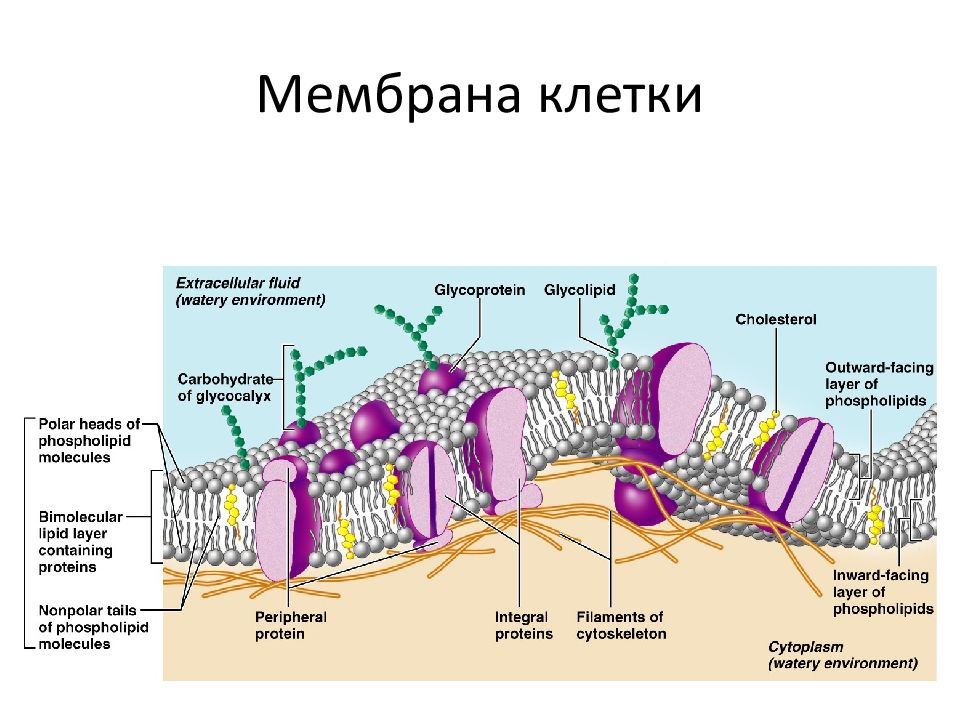 д. [c.114]
д. [c.114]
The Big Eggshell Breakdown — Scientific American
Bring Science HomeПоместите яйца без скорлупы в разные жидкости и посмотрите, как они растут и сжимаются
Реклама Ключевые понятия
Химия
Ячейки
Распространение
Осмос
Введение
Вы когда-нибудь думали о курином яйце как о одной большой клетке? Конечно, он состоит из множества реальных ячеек. Но вы можете использовать его в качестве модели для изучения того, как разные жидкости переносятся через клеточные мембраны и в другие клетки.Этот процесс происходит прямо сейчас в гораздо меньшем масштабе в вашем собственном теле! Но чтобы увидеть это невооруженным глазом, можно попробовать эту макро-активность!
Фон
Каждая клетка нашего тела заключена в плазматическую мембрану, сложную границу, состоящую из множества различных слоев. Это отделяет содержимое клетки от окружающего мира за пределами клетки, который часто состоит из жидкости.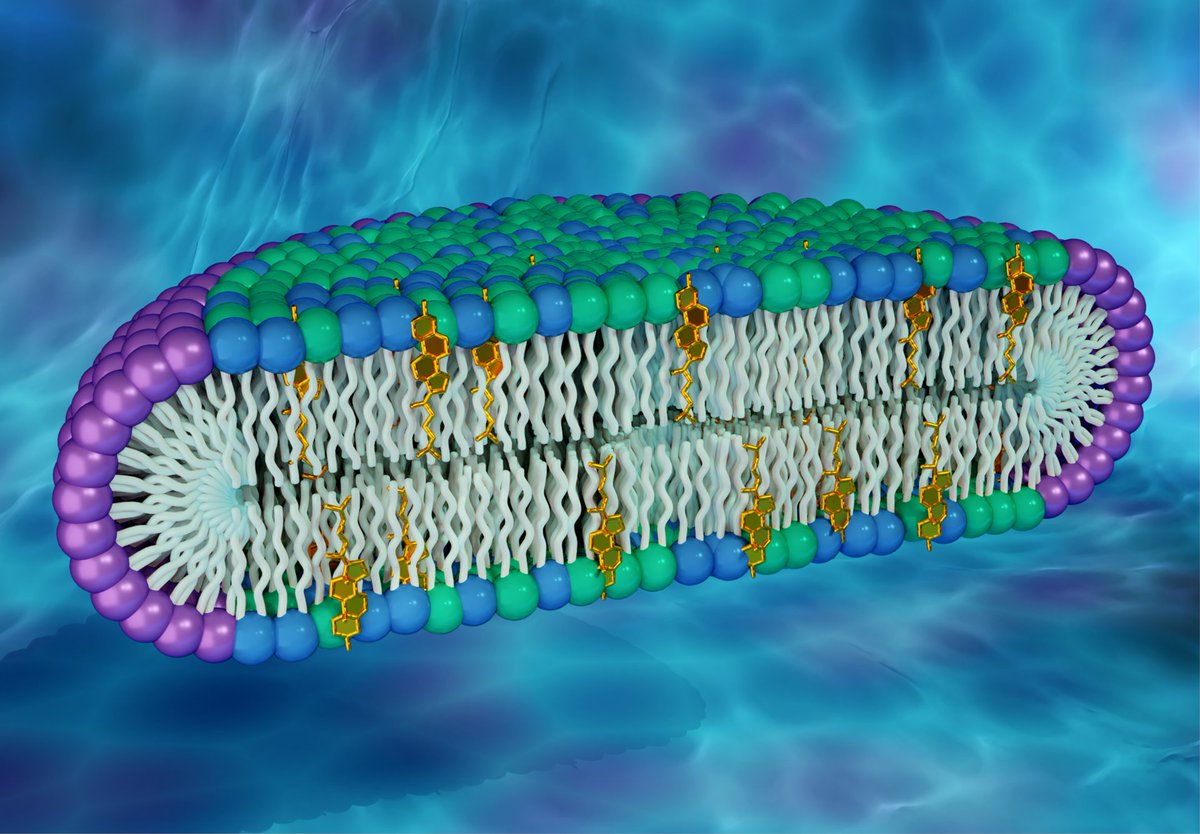 Эти мембраны играют большую роль в поддержании надлежащего баланса содержимого внутри клетки (гомеостаза), контролируя то, что проходит через них.Одной из наиболее важных характеристик плазматических мембран является их избирательная проницаемость, что означает, что они позволяют одним веществам проходить свободно, но ограничивают другие. Посмотрите, как яйцо может это сделать в масштабе, который вы можете наблюдать!
Эти мембраны играют большую роль в поддержании надлежащего баланса содержимого внутри клетки (гомеостаза), контролируя то, что проходит через них.Одной из наиболее важных характеристик плазматических мембран является их избирательная проницаемость, что означает, что они позволяют одним веществам проходить свободно, но ограничивают другие. Посмотрите, как яйцо может это сделать в масштабе, который вы можете наблюдать!
Материалы
- Одно яйцо
- Несколько чашек или банок — достаточно больших, чтобы вместить яйцо и достаточно жидкости, чтобы погрузить его в воду.
- Белый уксус — достаточно, чтобы залить яйцо
- Большая сервировочная ложка
- Вода — достаточно, чтобы погрузить яйцо.
- Кукурузный сироп — достаточно, чтобы залить яйцо
Подготовка
- Поместите яйцо в чашку или банку и налейте достаточно белого уксуса, чтобы оно полностью покрыло его.Понаблюдайте за яйцом.
 Вы видите крошечные пузырьки, образующиеся на скорлупе?
Вы видите крошечные пузырьки, образующиеся на скорлупе? - Накройте яйцо и оставьте на 24 часа.
Процедура
- На следующее утро вылейте яйцо из уксуса большой ложкой. Оболочка другая? Как так?
- Вылейте старый уксус и залейте теперь размягченное яйцо свежим уксусом.
- Дайте яйцу постоять еще 24 часа.
- Выньте яйцо и снова понаблюдайте за ним. Опять изменилось?
- На третье утро выньте яйцо ложкой и промойте его в раковине под краном. Будьте осторожны: поскольку яичная скорлупа растворяется, яичная оболочка может быть единственным, что удерживает ее вместе. Мембрана не такая прочная, как оболочка. Как теперь выглядит яйцо снаружи?
- Положите голое яйцо в чашку с водой и дайте ему постоять восемь часов. Яйцо без скорлупы выглядит так же? Как это изменилось?
- Осторожно достаньте яйцо и положите его в чашку кукурузного сиропа еще на восемь часов.
 Яйцо снова изменилось? Как?
Яйцо снова изменилось? Как?
Наблюдения и результаты
Когда вы впервые помещаете яйцо в уксус, образуется углекислый газ, поскольку кислый уксус вступает в реакцию с кальцием скорлупы. Когда яйцо находится в уксусе, скорлупа медленно растворяется, образуя яйцо «без скорлупы». Яичная скорлупа должна полностью исчезнуть к третьему дню, а капля яичного белка и желтка останется внутри тонкой мембраны.
Яйца без скорлупы — хорошие модели человеческих клеток. После удаления яичной скорлупы остается белая пленка. (На самом деле это две мембраны, но они плотно скреплены друг с другом.) Эта мембрана, как и мембраны человеческих клеток, избирательно проницаема, и все яйцо может быть моделью для одной клетки.
Вещества, которые могут легко проходить через мембрану яйца, будут следовать принципу диффузии: они будут перемещать на со стороны мембраны, где они находятся в более высокой концентрации, в сторону, где они находятся в более низкой концентрации. Этот обмен будет продолжаться до тех пор, пока концентрации на обеих сторонах мембраны не станут равными.
Этот обмен будет продолжаться до тех пор, пока концентрации на обеих сторонах мембраны не станут равными.
Вода может свободно проходить через клеточную мембрану. (Движение воды через мембрану — это особая версия диффузии, называемая осмосом , ). Когда яйцо замачивают в растворе, в котором концентрация воды выше, чем внутри яйца, вода перемещается из внешнего раствора через мембрану и в яйцо. В результате яйцо набухает и разрастается.Вот что произошло, когда яйцо было в воде.
Однако когда яйцо замачивают в растворе, в котором концентрация воды ниже, чем внутри яйца, вода перемещается из яйца через мембрану в наружный раствор. В результате яйцо теряет массу и может выглядеть как спущенный воздушный шар. Вот что произошло, когда яйцо было в кукурузном сиропе.
Плазматические мембраны наших клеток очень похожи на мембраны яиц. Вода, кислород и питательные вещества должны пройти через плазматическую мембрану в наши клетки, а отходы должны выйти. Кислород диффундирует в красные кровяные тельца в наших легких, и они переносят его в наши ткани, где газ диффундирует в другие клетки. Вода в желудке и кишечнике перемещается через осмос в кровоток.
Кислород диффундирует в красные кровяные тельца в наших легких, и они переносят его в наши ткани, где газ диффундирует в другие клетки. Вода в желудке и кишечнике перемещается через осмос в кровоток.
Больше для изучения
Наука о яйцах, из Exploratorium
Take an Egg for a Spin, из Exploratorium
Fast Pickling, из Oakland Discovery Center
Эта деятельность предоставлена вам в сотрудничестве с Exploratorium
ОБ АВТОРЕ (-АХ)
Последние статьи от Exploratorium
Прочтите следующее
Информационный бюллетень
Станьте умнее.Подпишитесь на нашу новостную е-мэйл рассылку.
Поддержите научную журналистику
Откройте для себя науку, меняющую мир. Изучите наш цифровой архив 1845 года, в который входят статьи более 150 лауреатов Нобелевской премии.
Подпишитесь сейчас!Архитектура клеток — молекулярная клеточная биология
Хотя обобщениям в биологии обычно не хватает теоретических оснований. в физике между живыми системами есть очень явные общие черты, которые дают
биология единство. Один из них — это сотовая конструкция.Биологическая вселенная
состоит из двух типов клеток — прокариотических
клетки, , которые не имеют определенного ядра и имеют упрощенный внутренний
организации, и эукариотических клеток, которые имеют более сложные
внутренняя структура, включая определенное ограниченное мембраной ядро. Подробный анализ ДНК различных
прокариотические организмы в последние годы выявили два различных типа: бактерии
(часто называемые «настоящими» бактериями или эубактериями) и архей (также называемые архебактериями, или архей ).Как мы обсудим в главе 7, археи в некоторых отношениях больше похожи на
эукариотических организмов, чем настоящих бактерий.
в физике между живыми системами есть очень явные общие черты, которые дают
биология единство. Один из них — это сотовая конструкция.Биологическая вселенная
состоит из двух типов клеток — прокариотических
клетки, , которые не имеют определенного ядра и имеют упрощенный внутренний
организации, и эукариотических клеток, которые имеют более сложные
внутренняя структура, включая определенное ограниченное мембраной ядро. Подробный анализ ДНК различных
прокариотические организмы в последние годы выявили два различных типа: бактерии
(часто называемые «настоящими» бактериями или эубактериями) и архей (также называемые архебактериями, или архей ).Как мы обсудим в главе 7, археи в некоторых отношениях больше похожи на
эукариотических организмов, чем настоящих бактерий.
На основе предположения, что организмы с более похожими генами произошли от общего
прародитель более поздний, чем те, у кого более разнородные гены, исследователи установили
разработал дерево родословной, показанное на.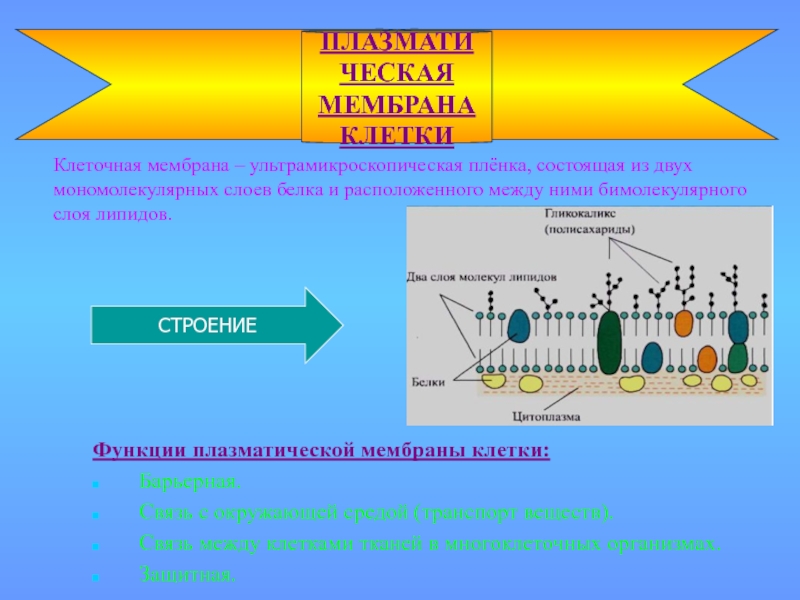 Согласно этому дереву, археи и эукарии (эукариоты) являются
считалось, что они отделились от бактерий до того, как отделились друг от друга.
Несмотря на различия в организации прокариотических и эукариотических клеток, все
клетки имеют определенные структурные особенности и выполняют множество сложных процессов в
в основном так же.
Согласно этому дереву, археи и эукарии (эукариоты) являются
считалось, что они отделились от бактерий до того, как отделились друг от друга.
Несмотря на различия в организации прокариотических и эукариотических клеток, все
клетки имеют определенные структурные особенности и выполняют множество сложных процессов в
в основном так же.
Рисунок 1-5
Три царства организмов связаны общими последовательностями их рибосомных РНК. Их родословная отражает представление о том, как вся жизнь на Земле с простых бактерии до сложных млекопитающих, произошедшие от обычных одноклеточных прародитель.
Ячейки окружены водонепроницаемыми мембранами
Ячейка, поскольку это ограниченное пространство, должна иметь внешнюю границу. В
строительство этой границы представляет собой один из самых фундаментальных
соображения в биологической организации.Внешняя оболочка ячеек, как и любая
оболочка, построена так, чтобы внутреннее содержимое не просачивалось в
окружающая среда. Химические процессы клеточной жизни обычно занимают
место в водянистом растворе, и внутриклеточные составляющие клетки
в основном молекулы, которые легко растворяются в воде.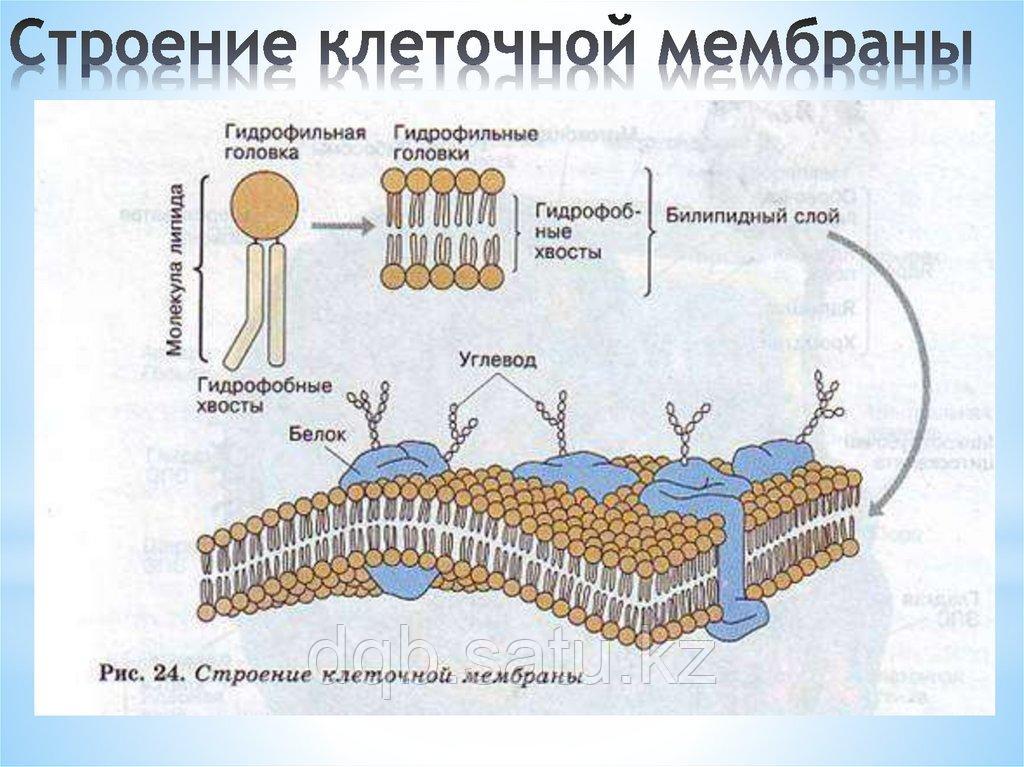 Точно так же окружающая среда
вокруг клеток водянистая, кровь и другие жидкости организма являются растворами
в воде. Таким образом, клетки, чтобы сохранить свою целостность, должны быть
окружен средой, через которую не может течь вода.Мембрана
состоит из жировых молекул и служит этой цели.
Точно так же окружающая среда
вокруг клеток водянистая, кровь и другие жидкости организма являются растворами
в воде. Таким образом, клетки, чтобы сохранить свою целостность, должны быть
окружен средой, через которую не может течь вода.Мембрана
состоит из жировых молекул и служит этой цели.
Все мы знаем по общему опыту, что «нефть и вода не
смешивание.» Эта максима — все, что нужно, чтобы понять, как устроена клетка.
построен. Когда масло заливается водой, масло растекается тонкой пленкой; что
пленка аналогична пленке жира, окружающей клетки, называемой плазматической мембраной (). Биологические мембраны отличаются от чистого масла
пленка в том, что молекулы, которые делают мембрану, имеют как маслянистую, так и водянистую
порции; у них есть длинные жирные цепочки, но у них также есть головная группа, которая
водорастворимый, поскольку он электрически заряжен.Таким образом образуются мембраны.
потому что эти двудольные молекулы, называемые фосфолипидами, спонтанно ориентируются, образуя двойные
слой, или двухслойный, имеющий жировую
внутреннее пространство с внешними поверхностями, связанными с окружающей водой заряженным
головные группы. Мембране придается жесткость за счет вкрапления холестерина, молекулы, которую мы получили.
ненавидеть из-за связи с сердечными заболеваниями, но это необходимо
построить внешнюю мембрану всех наших клеток. Следовательно, из понимания
контрастирующие свойства водных растворов и масляных слоев, понимание
Возникает сотовая конструкция.
Мембране придается жесткость за счет вкрапления холестерина, молекулы, которую мы получили.
ненавидеть из-за связи с сердечными заболеваниями, но это необходимо
построить внешнюю мембрану всех наших клеток. Следовательно, из понимания
контрастирующие свойства водных растворов и масляных слоев, понимание
Возникает сотовая конструкция.
Рисунок 1-6
Водянистая внутренняя часть клеток окружена плазмой. мембрана, двухслойная оболочка из фосфолипидов. Молекулы холестерина придают некоторую жесткость жировому слою. В молекулы фосфолипидов ориентированы жирными цепями, обращенными к внутрь и (подробнее …)
Несмотря на жесткость, обеспечиваемую холестерином, мембраны, состоящие из жира,
не очень прочный, поэтому многочисленные механизмы укрепления границ ячеек
развились. У растений плазматическая мембрана окружена жесткой клеточной стенкой.Хотя большинство клеток животных
не имеют клеточной стенки, белки, прикрепленные к их внешней поверхности, обеспечивают некоторую
стабильность; соединение клеток вместе с помощью этих белков помогает поддерживать
целостность тканей.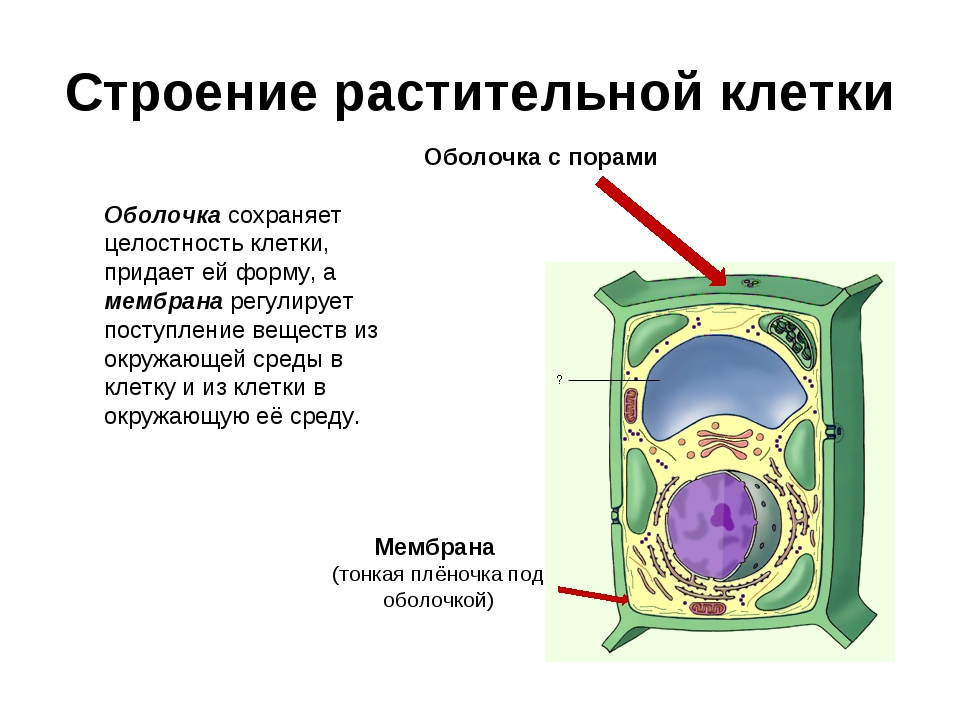 Ткани и органы часто покрыты сильным
сети белков и других молекул, которые укрепляют и защищают их, и
также ограждайте различные отсеки тела. Одноклеточные организмы,
как бактерии, имеют специальную внешнюю оболочку для их защиты.
Ткани и органы часто покрыты сильным
сети белков и других молекул, которые укрепляют и защищают их, и
также ограждайте различные отсеки тела. Одноклеточные организмы,
как бактерии, имеют специальную внешнюю оболочку для их защиты.
Мембраны выполняют другие функции, кроме разделения
Хотя мембраны ценны как способ отделить водянистую внутреннюю часть
клетки от окружающей среды, или отделить внутриклеточные события от одного
во-вторых, у них есть другие важные функции, включая хранение энергии.Так как
мембраны отделяют друг от друга водянистые отсеки, если ион или молекула
растворенный в воде перемещается через мембрану в новый клеточный отсек,
он не сможет свободно диффундировать из отсека, в котором он был
взолнованный. Чтобы переместить молекулу, требуется энергия, но после перемещения молекула накапливает
эта энергия в силу захвата. Формально это хранилище энергии
точно так же, как хранение энергии в батарее. Поэтому мембраны не только
очерчивают отсеки, но также служат активными участниками
динамизм клетки.
Функции многих белков зависят от способа их ассоциации с мембраны. Например, прохождение водорастворимых молекул через мембраны осуществляется переносчиками белка, которые встроены в мембрана. Кроме того, ячейки отправляют информацию друг другу, освобождая сигнализацию. молекулы. На внешних мембранах клеток есть белки, известные как рецепторов, , которые связывают циркулирующие сигнальные молекулы. Эти сигнальные молекулы обеспечивают индивидуальную активность многих клеток в тело, которое нужно согласовать.Получение сигнальной молекулы рецептором вызывает временную организацию определенных типов внутриклеточных белков, называется белками сигнальной трансдукции, — в активированный комплекс на внутренней стороне внешней мембраны клетки, от которой она управляет изменениями событий в цитоплазме или ядре клетки (Глава 20).
Прокариоты состоят из одного ограниченного мембраной отсека
Все прокариоты одноклеточные
организмов или простейших. Бактериальная линия включает Escherichia
coli, обнаружен в кишечнике животных и является любимым экспериментальным
организм, и фотосинтезирующие организмы, ранее известные как сине-зеленый
водоросли , но сегодня более известные как цианобактерии . (Поскольку большинство прокариот, изучаемых в лабораториях, являются бактериями,
прокариотическая структура или метаболизм в этой книге относятся к этим
организмов, а не архей, если не указано иное.) Многие представители архей
линия растет в необычных, часто экстремальных условиях. Например,
галофилам для выживания требуются высокие концентрации соли, а
термоацидофилы растут в горячих (80 ° C) серных источниках, где pH ниже
чем 2 является обычным. Остальные археи, называемые метаногенами , обитают в
в бескислородной среде и генерируют метан (CH 4 ) за счет уменьшения
углекислый газ.
(Поскольку большинство прокариот, изучаемых в лабораториях, являются бактериями,
прокариотическая структура или метаболизм в этой книге относятся к этим
организмов, а не архей, если не указано иное.) Многие представители архей
линия растет в необычных, часто экстремальных условиях. Например,
галофилам для выживания требуются высокие концентрации соли, а
термоацидофилы растут в горячих (80 ° C) серных источниках, где pH ниже
чем 2 является обычным. Остальные археи, называемые метаногенами , обитают в
в бескислородной среде и генерируют метан (CH 4 ) за счет уменьшения
углекислый газ.
иллюстрирует общий
строение типичной бактериальной клетки; аналогичное строение имеют клетки архей.
Как правило, прокариоты состоят из одного закрытого отсека, содержащего
цитозоль и ограничен
плазматическая мембрана. Хотя бактериальные клетки не имеют определенного ядра,
генетический материал, ДНК, конденсируется в центральной части клетки. В
кроме того, большинство рибосом — клеточные
белок-синтезирующие частицы — находятся в
область клетки, свободная от ДНК.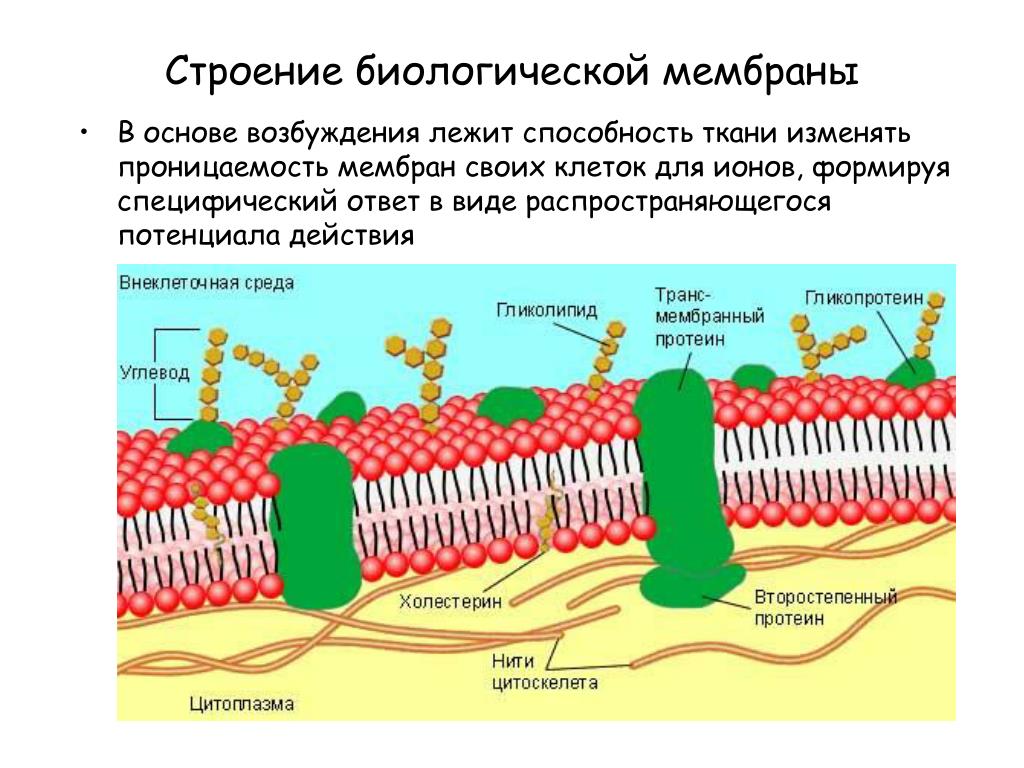 У некоторых бактерий также есть инвагинация
клеточная мембрана, называемая мезосомой , , которая связана с
синтез ДНК и секреция белков.Таким образом, бактериальные клетки не
полностью лишен внутренней организации.
У некоторых бактерий также есть инвагинация
клеточная мембрана, называемая мезосомой , , которая связана с
синтез ДНК и секреция белков.Таким образом, бактериальные клетки не
полностью лишен внутренней организации.
Рисунок 1-7
Сравнение строения прокариотических и эукариотических клетки. (а) Рисунок типичной грамотрицательной прокариотической (бактериальной) клетки в процессе деления и электронная микрофотография шлифа E. coli, — обычная кишечная бактерия. Обратите внимание периплазматический (подробнее …)
Бактериальные клетки обладают клеточной стенкой, которая прилегает к внешней стороне
плазматическая мембрана.Клеточная стенка состоит из слоев пептидогликана,
комплекс белков и олигосахаридов; помогает защитить клетку и сохранить
его форма. Некоторые бактерии (например, E. coli ) имеют тонкую клеточную стенку.
и необычная внешняя мембрана, отделенная от клеточной стенки периплазматическим
космос. Такие бактерии не окрашиваются по Граму и, следовательно, не окрашиваются.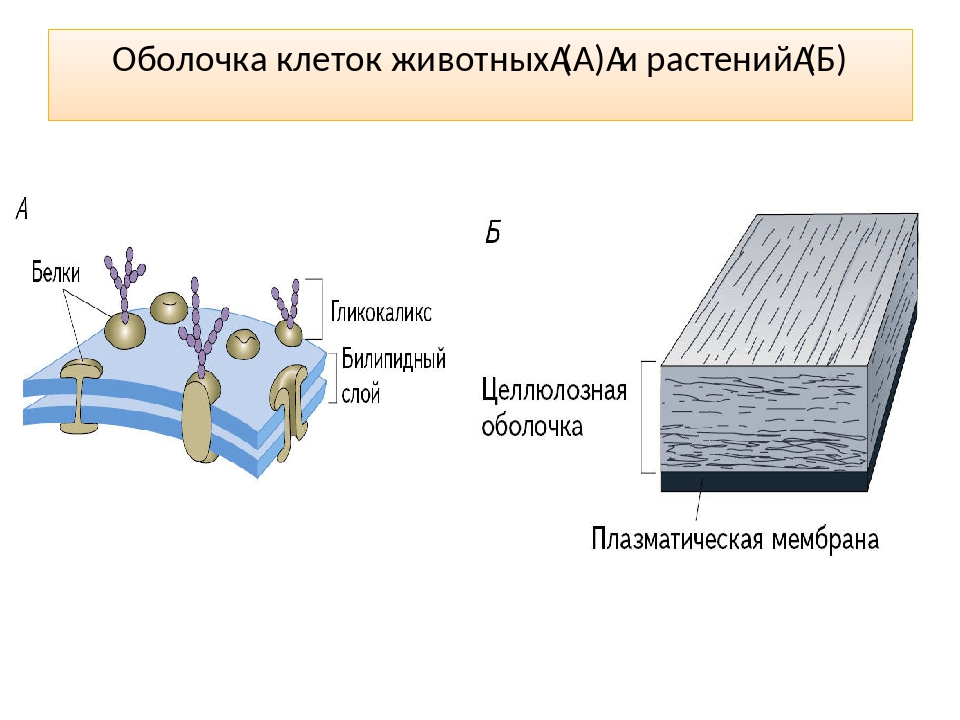 классифицируется как грамотрицательный. Другие бактерии (например, Bacillus
polymyxa ), которые имеют более толстую клеточную стенку и не имеют внешней мембраны.
окраска по Граму и, таким образом, классифицируются как грамположительные.
классифицируется как грамотрицательный. Другие бактерии (например, Bacillus
polymyxa ), которые имеют более толстую клеточную стенку и не имеют внешней мембраны.
окраска по Граму и, таким образом, классифицируются как грамположительные.
Эукариотические клетки содержат множество органелл и сложный цитоскелет
Эукариоты включают всех членов царства растений и животных, включая одноклеточные грибы (например, дрожжи, грибы, плесени) и простейшие. Эукариотические клетки, как и прокариотические клетки, являются окружен плазматической мембраной. Однако, в отличие от прокариотических клеток, большинство эукариотические клетки также содержат обширные внутренние мембраны, которые включают специфические отсеки, органеллы и отделить их от остальной цитоплазмы, при этом область клетки, лежащая вне ядра (и открытие главы фигура).
Большинство органелл окружены одной фосфолипидной мембраной, но несколько
включая ядро, окружены двумя мембранами. Каждый тип органелл
играет уникальную роль в росте и метаболизме клетки, и каждая из них содержит
набор определенных ферментов, которые катализируют необходимые химические реакции. В
мембраны, определяющие эти субклеточные компартменты, контролируют их внутренние ионные
состав так, что он обычно отличается от цитозоля (часть
цитоплазма вне органелл) и среди различных органелл.
В
мембраны, определяющие эти субклеточные компартменты, контролируют их внутренние ионные
состав так, что он обычно отличается от цитозоля (часть
цитоплазма вне органелл) и среди различных органелл.
Самой крупной органеллой в эукариотической клетке обычно является ядро, в котором находится
большая часть клеточной ДНК. Помимо ядра, несколько других органелл
присутствуют почти во всех эукариотических клетках: в митохондриях , в митохондриях какая большая часть энергетического метаболизма клетки осуществляется; грубо
и гладкая эндоплазматическая сеть , сеть мембран, в которых
синтезируются гликопротеины и липиды; пузырьков Гольджи, которые
направить составляющие мембраны в соответствующие места в клетке; и пероксисомы, в которых жирные кислоты и
аминокислоты разлагаются.Клетки животных, но не клетки растений, содержат лизосомы, которые разрушают изношенные
элементы клетки и посторонние материалы, захваченные клеткой. Хлоропласты, где происходит фотосинтез
встречается, встречаются только в определенных клетках листьев растений и некоторых одноклеточных
организмы. И растительные клетки, и некоторые одноклеточные эукариоты содержат один или
больше вакуолей, больших, заполненных жидкостью органелл, в которых питательные вещества и отходы
соединения хранятся, и происходят некоторые реакции разложения.
И растительные клетки, и некоторые одноклеточные эукариоты содержат один или
больше вакуолей, больших, заполненных жидкостью органелл, в которых питательные вещества и отходы
соединения хранятся, и происходят некоторые реакции разложения.
Цитозоль эукариотических клеток содержит массив волокнистых белков. вместе называемые цитоскелетом (главы 18 и 19).Три Классы волокон составляют цитоскелет: микротрубочки (диаметром 20 нм), построенные из полимеров протеин тубулин; микрофиламенты (Диаметр 7 нм), построенный из белка актина; и промежуточные филаменты (диаметром 10 нм), построенные из одной или более палочковидных белковых субъединиц. Цитоскелет дает клеткам прочность и жесткость, тем самым помогая поддерживать форму клеток. Цитоскелетные волокна также контролировать движение структур внутри клетки; например, некоторые цитоскелетные волокна соединяются с органеллами или обеспечивают дорожки, по которым органеллы движутся.
Жесткая клеточная стенка, состоящая из целлюлозы и других полимеров, которая окружает
клетки растений способствует их прочности и жесткости.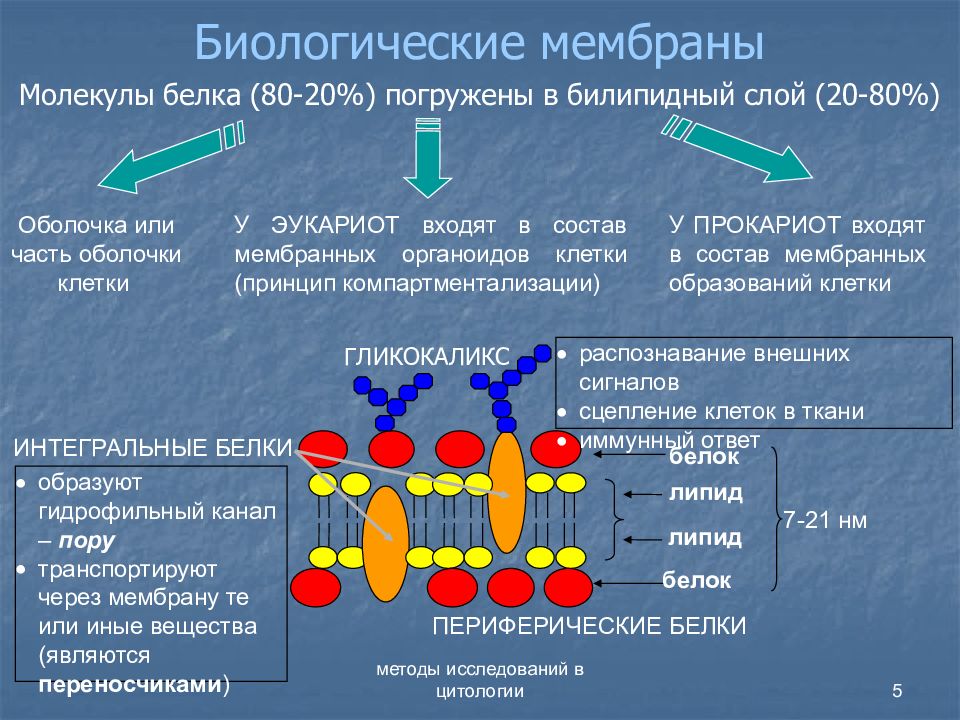 Грибы также
окружен клеточной стенкой, но по составу отличается от бактериального или
стенки растительных клеток.
Грибы также
окружен клеточной стенкой, но по составу отличается от бактериального или
стенки растительных клеток.
Клеточная ДНК упакована в хромосомы
ДНК в ядрах эукариотических клеток распределена от 1 до более чем 50 длинные линейные структуры, называемые хромосомами. Количество и размер хромосом одинаковы у все клетки организма, но различаются у разных типов организмов.Каждый хромосома состоит из одной молекулы ДНК, связанной с множеством белков, а общая ДНК в хромосомах организма называется его геномом. Хромосомы, окрашивающие интенсивно с основными красителями, видны в световой микроскоп только во время деления клеток, когда ДНК становится плотно уплотненной ().
Рисунок 1-8
Световая микрофотография 46 хромосом человека. У нормального человека 23 пары хромосом; по одному члену каждого пара унаследована от матери, а другой член — от отец.В этом примере использование специальной техники позволяет каждому из хромосома (подробнее …)
Во всех прокариотических клетках большая часть или вся генетическая информация находится в
одиночная кольцевая молекула ДНК длиной около миллиметра; эта молекула лежит,
многократно складывалась сама на себя в центральной части клетки. Хотя
большая молекула геномной ДНК у прокариот связана с белками и
часто называют хромосомой, расположение ДНК внутри бактериального
хромосома сильно отличается от хромосом эукариот
клетки.
Хотя
большая молекула геномной ДНК у прокариот связана с белками и
часто называют хромосомой, расположение ДНК внутри бактериального
хромосома сильно отличается от хромосом эукариот
клетки.
Представление о том, что гены подобны «бусам», нанизанным на длинные «Нить», хромосома, была предложена в начале 1900-х годов. на основе генетической работы с плодовой мушкой Drosophila . Рано Drosophila рабочих могли позиционировать или картировать гены ответственны за различные мутантные черты хромосомы, даже если они не но знать, что гены были сегментами ДНК или что функция гена была обусловлена к белку, последовательность которого кодируется этим геном!
ДНК-шаблонный синтез биомиметической клеточной стенки для наноинкапсулирования и защиты клеток млекопитающих
Материалы и инструменты
Дибензоциклооктин-ПЭГ 4 -NHS-эфир, Cy5-DBCO и Cy3 NHS Ester были приобретены в Click Chemistry Tools (Scottsdale Tools) Аризона).Олигонуклеотиды (дополнительная таблица 3) были приобретены в Integrated DNA Technologies (Coralville, IA). Альгинат натрия (средняя вязкость, 80–120 кДа) и O — (2-аминоэтил) — O ′ — (2-азидоэтил) пентаэтиленгликоль (NH 2 -PEG 6 -N 3 ) были приобретены у Sigma-Aldrich (Сент-Луис, Миссури). Покрытые стрептавидином частицы были приобретены у Spherotech (Lake Forest, IL). ПЭГилированный полилизин (26 кДа) был приобретен у Nanosoft Polymers (Льюисвилл, Северная Каролина).Quantum ™ FITC-5 MESF был приобретен в Bangs Laboratories (Fishers, IN). Сукцинимидиловый эфир карбоксифлуоресцеина (CFSE) и набор живой / мертвой жизнеспособности / цитотоксичности были приобретены у Invitrogen (Карлсбад, Калифорния).
Альгинат натрия (средняя вязкость, 80–120 кДа) и O — (2-аминоэтил) — O ′ — (2-азидоэтил) пентаэтиленгликоль (NH 2 -PEG 6 -N 3 ) были приобретены у Sigma-Aldrich (Сент-Луис, Миссури). Покрытые стрептавидином частицы были приобретены у Spherotech (Lake Forest, IL). ПЭГилированный полилизин (26 кДа) был приобретен у Nanosoft Polymers (Льюисвилл, Северная Каролина).Quantum ™ FITC-5 MESF был приобретен в Bangs Laboratories (Fishers, IN). Сукцинимидиловый эфир карбоксифлуоресцеина (CFSE) и набор живой / мертвой жизнеспособности / цитотоксичности были приобретены у Invitrogen (Карлсбад, Калифорния).
1 H Ядерно-магнитный резонанс (ЯМР) выполняли на спектрометре ЯМР Bruker 500 МГц. Спектры поглощения UV – Vis регистрировали на спектрофотометре Thermo Scientific NanoDrop 2000c. Гель-электрофорез проводили при 80 В в течение 20 мин, и изображения гелей записывали с использованием системы CRI Maestro EX (Woburn, MA).Анализ проточной цитометрии выполняли с использованием проточного цитометра guava easyCyteTM (Millipore). Просвечивающий электронный микроскоп высокого разрешения FEI Talos F200X использовался для записи изображений ПЭМ. Malvern Zetasizer Nano ZS использовался для анализа размеров и дзета-потенциала. Инвертированный микроскоп Olympus IX73 использовался для записи изображений клеток. Olympus Fluoview 1000 использовался для записи конфокальных флуоресцентных изображений.
Просвечивающий электронный микроскоп высокого разрешения FEI Talos F200X использовался для записи изображений ПЭМ. Malvern Zetasizer Nano ZS использовался для анализа размеров и дзета-потенциала. Инвертированный микроскоп Olympus IX73 использовался для записи изображений клеток. Olympus Fluoview 1000 использовался для записи конфокальных флуоресцентных изображений.
Общие условия культивирования клеток
CCRF-CEM (CCL-119, линия клеток Т-лимфобластного лейкоза человека) и K-562 (CCL-243, линия клеток хронического миелогенного лейкоза) были приобретены в ATCC (Манассас, Вирджиния) и сохранены в RPMI-1640 с добавлением 10% FBS.NK-92MI (естественные клетки-киллеры) был приобретен в ATCC (Манассас, Вирджиния) и содержался в минимальной альфа-среде с рекомендованными добавками. Клетки гладких мышц первичной аорты были приобретены в ATCC (Manassas, VA) и сохранены в M231, содержащем добавку для роста гладкомышечных клеток. Гемопоэтические стволовые клетки CD34 + костного мозга человека были приобретены у StemCell Technologies (Tukwila, WA) и размножены бессывороточной размножающей средой StemSpan с добавками цитокинов CC100. hMSC (нормальные мезенхимальные стволовые клетки, полученные из костного мозга человека) приобретали у Lonza (Walkersville, MD) и поддерживали в рекомендованной питательной среде (Lonza). RFP-меченные МСК костного мозга человека (RFP-MSC) были приобретены у Angio-Proteomie (Бостон, Массачусетс) и поддерживались в среде для роста стволовых клеток (Lonza). Клетки поддерживали при 37 ° C в атмосфере с 5% CO 2 и относительной влажностью 95%.
hMSC (нормальные мезенхимальные стволовые клетки, полученные из костного мозга человека) приобретали у Lonza (Walkersville, MD) и поддерживали в рекомендованной питательной среде (Lonza). RFP-меченные МСК костного мозга человека (RFP-MSC) были приобретены у Angio-Proteomie (Бостон, Массачусетс) и поддерживались в среде для роста стволовых клеток (Lonza). Клетки поддерживали при 37 ° C в атмосфере с 5% CO 2 и относительной влажностью 95%.
Получение дибензоциклооктин-модифицированной ДНК (ДНК-DBCO)
Сотни микролитров раствора ДНК-NH 2 (1 мМ) добавляли к 375 мкл буфера для модификации (DPBS, 50 мМ NaHCO 3 ).Затем добавляли 25 мкл сложного эфира DBCO-PEG 4 -NHS (ДМСО, 30 мМ) и давали возможность реагировать в течение 6 часов. Это повторилось дважды. Продукт ДНК-DBCO собирали и очищали с использованием ультрацентробежного фильтра Amicon 3 кДа.
Приготовление модифицированного азидом альгината (альгинат-N
3 ) Пятьдесят миллиграмм альгината натрия растворяли в 5 мл буфера MES (50 мМ, pH = 5).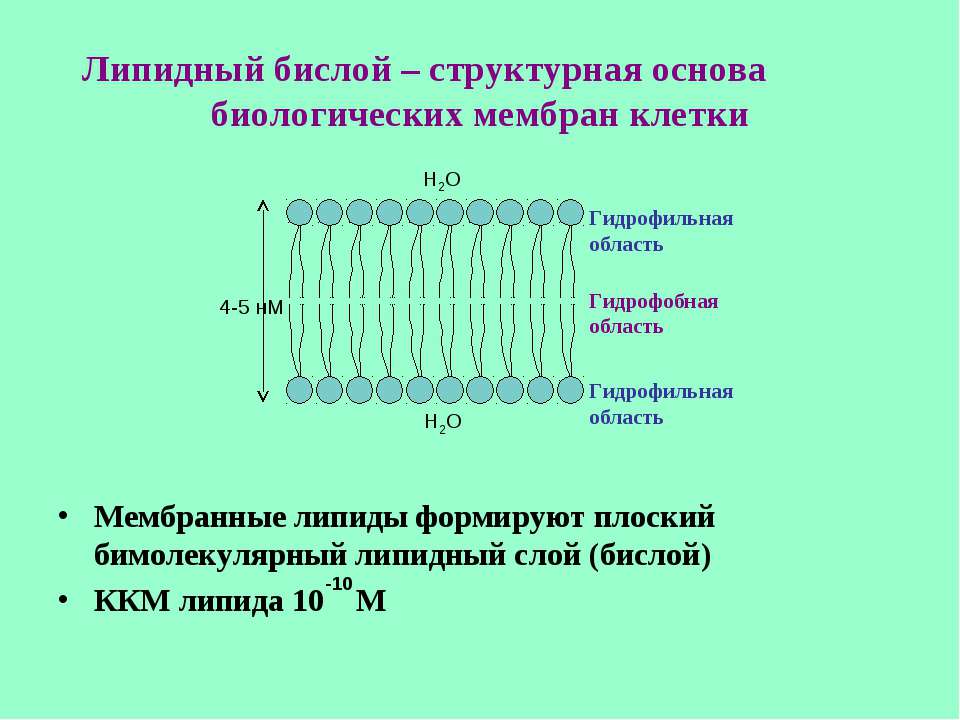 К этому раствору добавляли NHS (14 мг, 0,12 ммоль), EDC (116 мг, 0,60 ммоль) и NH 2 -PEG 6 -N 3 (28 мг, 0.08 ммоль). После перемешивания в течение 30 минут при комнатной температуре добавляли 55 мкл 6 М NaOH, чтобы довести pH до 7,5–8,0. Реакция протекала в течение ночи при комнатной температуре. Очистка достигалась 3-дневным диализом против воды (мембрана 10000 MWCO). Для дальнейшего удаления любых непрореагировавших реагентов раствор альгината-N 3 осаждали холодным ацетоном, фильтровали и сушили. Конечный продукт альгинат-N 3 растворяли в d.i. H 2 O, профильтрованный через фильтр 0.Мембрана 22 мкм и лиофилизированная. Альгинат-N 3 анализировали с помощью ЯМР-спектроскопии.
К этому раствору добавляли NHS (14 мг, 0,12 ммоль), EDC (116 мг, 0,60 ммоль) и NH 2 -PEG 6 -N 3 (28 мг, 0.08 ммоль). После перемешивания в течение 30 минут при комнатной температуре добавляли 55 мкл 6 М NaOH, чтобы довести pH до 7,5–8,0. Реакция протекала в течение ночи при комнатной температуре. Очистка достигалась 3-дневным диализом против воды (мембрана 10000 MWCO). Для дальнейшего удаления любых непрореагировавших реагентов раствор альгината-N 3 осаждали холодным ацетоном, фильтровали и сушили. Конечный продукт альгинат-N 3 растворяли в d.i. H 2 O, профильтрованный через фильтр 0.Мембрана 22 мкм и лиофилизированная. Альгинат-N 3 анализировали с помощью ЯМР-спектроскопии.
Получение макромера альгинат-DM2
Альгинат-DM2 получали с использованием щелочной реакции, не содержащей меди, путем смешивания альгината-N 3 и ДНК-DBCO. Вкратце, 100 мкл 1% раствора альгината-N 3 1% масс.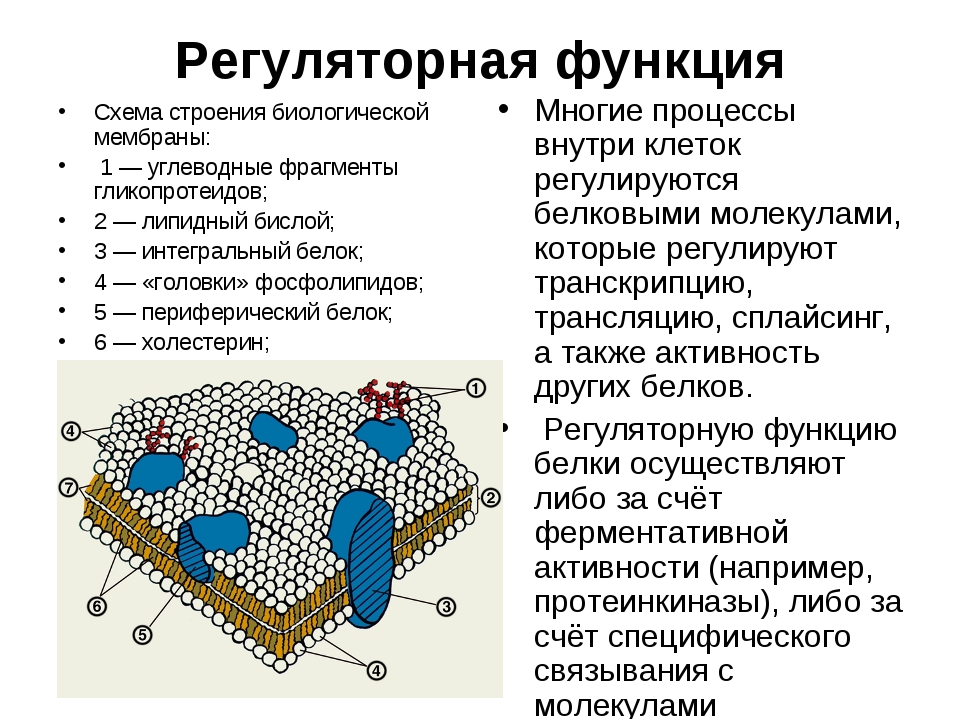 / Об. Инкубировали с 30 мкл 1 мМ ДНК-DBCO в течение 4 ч при 37 ° C. После конъюгирования альгинат-DM2 собирали и очищали с использованием ультрацентробежного фильтра Amicon 100 кДа.Для модификации Cy5 100 мкл 1% -ного раствора альгината-DM2 смешивали с 30 мкл 1 мМ Cy5-DBCO в течение 2 часов при 37 ° C. Для подтверждения успешного конъюгации использовали гель-электрофорез и УФ-видимую спектроскопию.
/ Об. Инкубировали с 30 мкл 1 мМ ДНК-DBCO в течение 4 ч при 37 ° C. После конъюгирования альгинат-DM2 собирали и очищали с использованием ультрацентробежного фильтра Amicon 100 кДа.Для модификации Cy5 100 мкл 1% -ного раствора альгината-DM2 смешивали с 30 мкл 1 мМ Cy5-DBCO в течение 2 часов при 37 ° C. Для подтверждения успешного конъюгации использовали гель-электрофорез и УФ-видимую спектроскопию.
Количественный анализ макромера альгинат-DM2
К раствору, содержащему 1% альгината (мас. / Об.), Добавляли различные концентрации DM2 (50, 100, 150, 200 и 400 мкМ) и снимали спектры поглощения различных растворов. записано. Увеличение оптической плотности при λ = 260 нм соответствовало количеству DM2.Была построена калибровочная кривая, связывающая характеристики поглощения систем в зависимости от концентрации DM2. Затем готовили 1% альгинат-DM2 и регистрировали оптическую плотность при λ = 260 нм. На основании калибровочной кривой концентрацию DM2 в 1% -ном (мас. / Об.) Растворе альгинат-DM2 оценивали спектроскопически. На основании этого количественного анализа 2–3 молекулы ДНК были конъюгированы с одной альгинатной полимерной цепью.
Синтез BCW на поверхности частиц
Для исследования BCW на поверхности частиц использовали две частицы диаметром 500 нм и 5 мкм соответственно.Чтобы четко показать создание наноразмерного шаблона и BCW, мы использовали частицы размером 500 нм для анализа размера и дзета-потенциала. Все другие эксперименты проводились с частицами размером 5 мкм, если не указано иное. Покрытые стрептавидином частицы (500 нм) (1 мг) смешивали с биотинилированным ДНК-инициатором (DI, 2 нмоль) в 500 мкл буфера PBS при комнатной температуре в течение 1 ч на ротаторе. DI-модифицированные частицы собирали центрифугированием и дополнительно промывали PBS. Чтобы исследовать полимеризацию DM1 и альгината-DM2 на частицах, 0.1 мг частиц инкубировали в 800 мкл PBS, содержащего DM1 (1 мкМ) и альгинат-DM2 (1 мкМ), в течение 3 часов при комнатной температуре. Чтобы исследовать комплексообразование полиэлектролита, частицы с шаблоном инкубировали с 0,01% (мас. / Об.) Полилизина в PBS в течение 5 мин. После центрифугирования и двукратной промывки PBS частицы дополнительно инкубировали с 0,05% (мас. / Об.) Альгинатом в PBS в течение 5 мин. На каждом этапе размер и дзета-потенциал частиц контролировали с помощью Malvern Zetasizer Nano ZS.
Исследование стабильности BCW
DM1 был помечен FAM.Альгинат-DM2 был помечен Cy5. Анализ стабильности BCW проводился путем отслеживания изменений сигналов FAM и Cy5 как функции времени. Процедура синтеза матрицы и BCW была такой же, как описано выше для анализа изменения размера и дзета-потенциала, за исключением того, что для имитации клеток использовали частицы размером 5 мкм. Частицы инкубировали в RPMI 1640 с добавлением 10% фетальной бычьей сыворотки (FBS). Аликвоту растворов частиц удаляли в заранее определенные моменты времени. После промывания DPBS их анализировали с помощью проточной цитометрии.Эксперименты проводили в трех экземплярах.
Синтез BCW на живых клетках млекопитающих
Клетки CCRF-CEM центрифугировали, дважды промывали и повторно суспендировали в DPBS. 1 × 10 6 клеток инкубировали в 400 мкл раствора холестерин-TEG-DI (1 мкМ, DPBS) в течение 30 мин для включения DI в клеточную мембрану посредством спонтанного внедрения холестерина в липиды мембраны. Затем DI-модифицированные клетки собирали, промывали и затем смешивали с DM1 (1 мкМ) и альгинат-DM2 (1 мкМ) в DPBS в течение 3 часов для образования супрамолекулярной ДНК-матрицы.Чтобы проверить влияние времени реакции на формирование матрицы на клетках, время полимеризации варьировали от 1 до 3 часов. Клетки собирали и измеряли интенсивность флуоресценции (сигнал Cy5 от альгината-DM2) с помощью проточной цитометрии. Для последующего образования комплекса с полиэлектролитом клетки, покрытые шаблоном, последовательно обрабатывали 0,01% (мас. / Об.) Полилизином в течение 1 мин и 0,05% (мас. / Об.) Альгинатом в течение 5 мин. Наконец, клетки, покрытые BCW, собирали центрифугированием перед любой характеристикой.
Просвечивающая электронная микроскопия (TEM)
Для приготовления образцов TEM голые или покрытые BCW клетки фиксировали в растворе глутаральдегида (2,5%). Затем образцы клеток фиксировали 1% тетроксидом осмия. После промывания какодилатным буфером (0,1 М) клетки обезвоживали серией растворов этанола (30, 50, 70, 90 и 100%). Все эти обработки проводились при 4 ° C. После этого клетки обрабатывали оксидом пропилена, пропитывали и заливали жидкой смолой.Блок смолы был разрезан на ультрамикротоме, и срезы были собраны на сетках. Визуализация проводилась под просвечивающим электронным микроскопом высокого разрешения FEI Talos F200X с использованием режимов ПЭМ и СТЭМ.
Количественное определение DI на поверхности клетки
Чтобы проверить влияние времени инкубации на отображение DI на поверхности клетки, 5 × 10 5 клеток инкубировали в 400 мкл раствора холестерин-TEG-DI (1 мкМ, DPBS) при комнатной температуре в течение другого периода времени.Чтобы проверить влияние концентрации DI на отображение DI на поверхности клеток, 5 × 10 5 клеток инкубировали с холестерином-TEG-DI (0,1–10 мкМ) в DPBS в течение 30 мин. DI-модифицированные клетки собирали, промывали и затем окрашивали DM1-FAM (1 мкМ). Среднюю интенсивность флуоресценции (MFI) клеток в каждой группе измеряли с помощью проточной цитометрии и сравнивали с известными стандартами (Quantum ™ FITC MESF, Bangs Laboratories) для определения количества DI на клетку.
Исследование транспорта антител через BCW и стабильности BCW
Для проверки молекулярного транспорта клетки инкубировали с антителом против CD4-FITC человека (Thermo Fisher, # 11-0049-42) в DPBS (разведение 1: 200) при 37 ° C. ° C в течение 10 мин.Затем клетки трижды промывали DPBS. Связывание анти-CD4 анализировали с использованием как проточной цитометрии, так и флуоресцентной визуализации. Ядра клеток окрашивали DAPI.
Для проверки стабильности клетки, покрытые BCW, обрабатывали FBS в двух случаях. Одну группу клеток культивировали в нормальной культуральной среде (RPMI 1640 с добавлением 10% FBS), а другую группу клеток культивировали в среде с пониженным содержанием сыворотки (RPMI 1640 с добавлением 1% FBS). Целью использования нормальной среды для культивирования клеток было оценить, могут ли покрытые клетки выдерживать выживание, прикрепление и пролиферацию.Целью использования среды с пониженным содержанием сыворотки было оценить, могут ли биологические жидкости сами по себе разлагать BCW. В заранее определенные моменты времени клетки анализировали с помощью проточной цитометрии и флуоресцентной визуализации.
Оценка усиления экранирования
Центробежная сила и осмотический дисбаланс использовались для демонстрации эффектов физического воздействия на клетки. В исследовании с центробежной силой клетки, покрытые BCW или без него, суспендировали в DPBS в концентрации 1 × 10 6 клеток / мл.Центрифугирование повторяли пять раз. Каждое центрифугирование проводили в течение 5 мин при 4 ° C. Сила центрифугирования варьировалась от 110 до 6200 g. Клетки ресуспендировали в новом DPBS после каждого центрифугирования. После пятикратного центрифугирования клетки инкубировали в культуральной среде в течение 24 часов, и их жизнеспособность измеряли с помощью набора для определения жизнеспособности / цитотоксичности живых / мертвых клеток. Вкратце, клетки инкубировали с кальцеином-AM и гомодимером этидия-1 в концентрации 1 мкМ каждый. После 15 мин инкубации при комнатной температуре в темноте клетки визуализировали с помощью флуоресцентной микроскопии.Живые (зеленые) и мертвые (красные) клетки подсчитывали с помощью ImageJ. Жизнеспособность выражалась как отношение живых клеток к общему количеству клеток.
Клетки млекопитающих набухают в гипотонических условиях, разрывая плазматическую мембрану. Чтобы оценить реакцию клеток на осмотический дисбаланс, клетки (1 × 10 6 клеток / мл), покрытые BCW или без него, окрашивали кальцеином-AM и повторно суспендировали в серии растворов NaCl (0,1–0,8%). После 10 мин инкубации клетки визуализировали с помощью флуоресцентной микроскопии.Клетки с разорванной мембраной практически не отображались под микроскопом. Таким образом, подсчитывали количество клеток, сохраняющих целостность (зеленая флуоресценция). Жизнеспособность выражали как отношение целостных клеток к общему количеству клеток. BCW-опосредованное усиление экранирования определяли с использованием уравнения. 1:
$$ {\ mathrm {\%}} \; {\ mathrm {Shielding}} \; {\ mathrm {extension}} = \ left ({N _ {{\ mathrm {BCW}}} — N_ { {\ mathrm {native}}}} \ right) / N _ {{\ mathrm {native}}} \; \ times \; 100 $$
(1)
, где N BCW обозначает количество жизнеспособных клеток, покрытых BCW, а N нативный обозначает количество жизнеспособных нативных клеток.
Биологические атаки изучались как in vitro, так и in vivo. Совместное культивирование клеток K562 и иммунных эффекторных клеток является обычным методом исследования иммунной атаки. Таким образом, в анализе in vitro клетки-мишени (клетки K562) метили путем инкубации с 1 мкМ CFSE в течение 5 мин. Меченые клетки дополнительно покрывали BCW в соответствии со стандартной процедурой, описанной выше. Клетки-мишени переносили в 48-луночный планшет из расчета 1 × 10 5 клеток / лунку. Иммунные эффекторные клетки (клетки NK-92MI) добавляли в каждую лунку при различных соотношениях эффектор / мишень.Конечный объем доводили до 400 мкл. Совместное культивирование клеток K562 с клетками NK-92MI поддерживали при 37 ° C в течение 3 часов. После этого к каждому образцу добавляли иодид пропидия (PI) и инкубировали в темноте в течение 15 минут для мечения мертвых клеток. Клетки были визуализированы с помощью флуоресцентной микроскопии. Клетки, меченные CFSE (зеленые) и PI (красные), подсчитывали с помощью ImageJ. Жизнеспособность клеток определяли по (Nc-Np) / Nc, где Nc и Np указывают количество CFSE-положительных клеток и количество PI-положительных клеток, соответственно.
В анализе in vivo клетки RFP-hMSCs подкожно трансплантировали мышам BALB / c (возраст 6-8 недель). Исследование на животных проводили в соответствии с протоколом, утвержденным Комитетом по уходу и использованию животных (IACUC). Использование hMSC было одобрено институциональным комитетом по биобезопасности (IBC). Чтобы избежать распространения клеток после трансплантации, клетки пересаживали с фибриногеном. Вкратце, 1 × 10 6 клеток смешивали с 50 мкл раствора фибриногена (20 мг / мл) и 50 мкл раствора тромбина (2 ЕД / мл) и вводили подкожно в задний бок мышей.Изображение мышей получали на 1-й и 7-й день после трансплантации клеток с использованием системы визуализации Maestro In vivo (CRI, Woburn, MA). Цветовое кодирование интенсивности флуоресценции в произвольных единицах (а.е.) одинаково масштабируется для всех изображений. Поскольку МСК могут высвобождать сигнальные молекулы для индукции роста кровеносных сосудов, мы также сравнили МСК с BCW или без него в индукции роста кровеносных сосудов. 1 × 10 6 человеческих МСК инъецировали в спинной бок мышей. Мышей умерщвляли асфиксией CO 2 на 10 день.Ткань в месте трансплантации собирали, фиксировали в 4% растворе параформальдегида, блокировали парафином и делали срезы (толщиной 5 мкм). Срезы тканей депарафинизировали, кипятили в натрийцитратном буфере, блокировали 3% раствором BSA и обрабатывали кроличьими антителами против мышиного CD31 (Cell Signaling, # 77699, разведение 1: 200) с последующей инкубацией с Cy5-Goat anti-Rabbit. вторичное антитело (Thermo Fisher, # A10523, разведение 1: 200). Ткани были закреплены в SlowFade Diamon Antifade Mountant с DAPI.Флуоресцентные изображения были получены под микроскопом Olympus IX73 (Center Valley, PA). CD31-положительные области анализировали с помощью ImageJ. Парный тест Стьюдента t был использован для сравнения двух групп.
Границы | Клеточные мембраны, универсальный адаптивный композитный материал
Введение
Клеточная мембрана — один из наиболее важных и сложных биоматериалов живого вещества. Поэтому неудивительно, что в течение последних десятилетий он был предметом обширных исследований, дающих представление о захватывающем мире регуляторных процессов, которые контролируют локализацию и активность белков и липидов в клеточных мембранах (Singer and Nicolson, 1972; Edidin et al. ., 1991; Eggeling et al., 2009). Эти исследования установили, что биомеханические требования различаются для разных видов и субклеточных участков, что свидетельствует об огромном разнообразии и приспособляемости (Vasanji et al., 2004; van Meer et al., 2008). Тем не менее, несмотря на значительные достижения за последние несколько десятилетий, нам все еще не хватает полного понимания мембранной механики на поверхности клетки.
Индивидуальные липиды спонтанно самоорганизуются в бислой, который затем подвергается тепловым колебаниям (Faucon et al., 1989), изменения в локальном липидном составе (Estep et al., 1979) и устойчивые деформации мембран (Baumgart et al., 2003). Помимо липидов, клеточные мембраны также содержат белки, которые не только влияют на локальное липидное окружение (Contreras et al., 2011; Laganowsky et al., 2014) и механические свойства мембраны (Shi et al., 2018), но также делают мембрану проницаемой. на входящие раздражители. Эти сигналы могут изменять, среди прочего, мембранный потенциал (Nernst, 1889), форму (Chen et al., 2016; Graber et al., 2017) и липидный состав (Sugimoto et al., 1984). Важно, что изменения, индуцированные сигналом, также влияют на локализацию и активность мембраносвязанных (Carpenter et al., 1978) и цитозольных (Hancock et al., 1989) белков. Одной из основных мишеней таких сигналов является ассоциированный с мембраной кортикальный цитоскелет (Свиткина, 2020). Возможно, наиболее поразительной из его многих особенностей является способность цитоскелета генерировать механические силы толчка и притяжения (Peskin et al., 1993; Huxley and Simmons, 1971).Следовательно, за счет связывания мембран с соседней клеточной корой получается композитный материал, который в равной степени способен воспринимать внешние раздражители и реагировать на них.
В этом обзоре мы исследуем сложные механические свойства этого адаптивного композитного материала. Читатели, которым интересно узнать больше о передаче сигналов через клеточные мембраны или механике цитоскелета, мы ссылаемся на множество отличных обзоров, написанных в других местах (Huber et al., 2013; Lundberg and Borner, 2019; Svitkina, 2020). Прежде чем исследовать свойства материала клеточной мембраны, мы начнем с определения основных механических терминов.Далее мы покажем, как на эти свойства влияет его многообразное взаимодействие с клеточной корой в физиологических и патофизиологических условиях. В заключение мы укажем на будущие проблемы на пути к пониманию механических свойств этого захватывающего биоматериала.
Фундаментальная клеточная механика
Плазматическая мембрана и кортикальный цитоскелет вместе образуют композитный материал с уникальными биомеханическими характеристиками (Nicolson, 2014). Чтобы полностью оценить эту сложную структуру, нам сначала нужно ввести ряд терминов, которые будут неоднократно появляться на следующих страницах.Начнем с того, что на самом деле представляет собой композитный материал. Этот термин, возникший из технологии производства, обозначает два или более связанных материалов, в которых полученное соединение демонстрирует свойства, которыми не обладает ни один из отдельных компонентов сам по себе (Westkämper and Warnecke, 2011). Свойства материала композита являются функцией индивидуальных свойств материала его компонентов, их геометрии и поверхности раздела (т. Е. Способа соединения этих материалов). Следовательно, изменение одного из этих параметров повлияет на общие свойства композита.Если это происходит намеренно, например, в ответ на раздражитель, материал называют адаптивным композитным материалом. Для биологических мембран основными компонентами этого композитного материала являются плазматическая мембрана (ПМ), которая инкапсулирует клетку, кора клетки, выстилающая цитозольный участок ПМ, и соединение мембрана-кора (MCA), которое описывает интерфейс, соединяющий ПМ. и клеточная кора. Далее мы называем композитный материал, образующийся из комбинации PM, MCA и клеточной коры, «клеточной поверхностью».”
Введя основные термины, мы теперь должны резюмировать основные свойства материала. Для небольших деформаций любую деформацию мембраны можно рассматривать как суперпозицию трех основных типов деформации: чистое растяжение, сдвиг и изгиб (рис. 1А). Мембрана, на которую действует сила, действующая перпендикулярно ее краям, будет испытывать растягивающее напряжение и растяжение по площади. Сопротивление этому растяжению называется модулем растяжения K e .Точно так же мембрана, на которую действуют силы, действующие параллельно ее краям, будет испытывать напряжение сдвига, в результате чего сопротивление деформации сдвига определяется модулем сдвига K s . В то время как модуль растяжения и сдвига связывают деформацию с определенным напряжением, жесткость на изгиб K B связывает кривизну с изгибающим моментом (то есть энергией, необходимой для изгиба мембраны до ее текущего состояния). Описанные до сих пор деформации являются чисто упругими и, следовательно, не зависят от времени.Однако биоматериалы часто демонстрируют поведение жидкости, включая пластическую деформацию, зависящую от времени. Следовательно, нам необходимо ввести четвертое свойство материала, вязкость η (рис. 1A, справа). Он отображает сопротивление жидкости напряжению сдвига при определенной скорости сдвига dudy. В отличие от модуля сдвига, вязкость связана не с напряжением и деформацией, а со скоростью деформации. Изменяя один из этих четырех основных свойств материала или их комбинацию, можно добиться механической адаптации.Читатели, желающие узнать больше по этой теме, могут ссылаться на работы, написанные в другом месте (Камм, Гродзинский, 2015).
Рисунок 1. Основные свойства материала и виды деформации. (A) Слева направо мембрана, подверженная равномерному растягивающему напряжению σ, действующему перпендикулярно ее краям, вызывает увеличение площади (с A 0 до A). На мембрану действуют силы, действующие параллельно ее поверхности, вызывающие напряжение сдвига τ yx .Мембрана подвергается точечной нагрузке (F), действующей перпендикулярно ее поверхности, которая вызывает кривизну и, следовательно, изгибающий момент. Вязкость η, сопротивление жидкости сдвиговому напряжению τ, заданному при определенной скорости сдвига dudy. (B) Основные свойства чисто эластичного (пружина, слева) и вязкого (демпфер, справа) материала. Чисто эластичный материал всегда возвращается в исходное состояние после деформации и демонстрирует линейную зависимость между напряжением и деформацией, в то время как чисто вязкий материал демонстрирует пластические (постоянные) деформации и линейную зависимость между напряжением и скоростью сдвига. (C) Модели из вязкоупругих материалов. Тело Максвелла (слева), состоящее из демпфера и пружины, соединенных последовательно, показывает, как вязкоупругую жидкость, остаточную деформацию после снятия нагрузки. Тело Кельвина (справа) возвращается, как вязкоупругое твердое тело, в исходное состояние после снятия нагрузки. Изображения адаптированы из Seidel et al. (2009) и Камм и Гродзинский (2015).
Наконец, давайте резюмируем типы деформаций, которые может испытывать материал. Свойства материала определяют его реакцию на механическое воздействие.В своей основной форме такая реакция может быть чисто эластичной или вязкой. Эластичный материал возвращается к своей первоначальной форме при деформации, в то время как вязкий материал остается деформированным после снятия нагрузки. Это поведение можно представить как пружину (эластичную) или демпферную (вязкую) соответственно (рис. 1B). Однако многие материалы демонстрируют вязкоупругий отклик, в котором вязкие и упругие свойства взаимосвязаны. Основными моделями такого поведения являются тела Максвелла и Кельвина (рис. 1C).В корпусе Максвелла упругие и вязкие элементы соединены последовательно, что приводит к упругой реакции на быстрые деформации, в то время как медленно прикладываемая нагрузка фиксируется пластичным образом. Напротив, тело Кельвина отображает упругие и вязкие элементы параллельно. Следовательно, под напряжением деформация со временем приближается к деформации упругого компонента, в результате чего она замедляется вязким элементом. Следовательно, тело Максвелла способно к пластической деформации (т.е. вязкоупругая жидкость), в то время как тело Кельвина всегда будет возвращаться к своей исходной форме при снятии нагрузки (т.е., вязкоупругое твердое тело). Как указано выше, мы отсылаем читателей, интересующихся этой темой, к работам, написанным в другом месте (Meyers and Chawla, 2010).
Разработка гипотетической биомиметической мембраны
Вдохновленные известной цитатой Ричарда Фейнмана « то, что я не могу создать, я не понимаю, », мы попытаемся на следующих страницах создать гипотетическую биомиметическую мембрану со следующими характеристиками: Она должна надежно отделять внутреннее пространство от внешнего. Кроме того, граница должна быть гибкой, настраиваемой и способной временно изменять свойства материала в ответ на поступающие сигналы.Для простоты и дидактических соображений мы разработали это как инженерную задачу (дополнительный рисунок S1 и дополнительный материал), последовательно увеличивая количество требований (т. Е. Требуемых функций) гипотетического материала. В каждом разделе мы начинаем с размышлений о том, как такая биомиметическая структура может быть сконструирована, прежде чем подробно исследовать, как это было выполнено в биологических системах.
Липидный бислой, основной модуль клеточных мембран
Самая основная функция нашего биомиметического материала — надежно отделить интерьер от внешней среды.Для достижения такого непрерывного барьера в водном растворе биомиметический материал должен быть способен противостоять разнице осмотического и гидростатического давления без утечки. В идеале материал должен собираться самопроизвольно, что ограничивает потребность в энергии и системах управления.
В клеточных мембранах амфипатические липиды спонтанно самоорганизуются в липидный бислой толщиной 5-7 нм с гидрофобными углеводными цепями, обращенными внутрь (Huang and Thompson, 1965). Это происходит для минимизации свободной энергии воды, возникающей в результате непрерывного образования и разрушения водородных связей (рис. 2А, справа).Сообщается, что чистые липидные бислои имеют модуль растяжения K e в диапазоне от 100 до 1000 мН / м (Waugh and Evans, 1979), при этом значение ∼200 мН / м является наиболее широко принятым ( Rawicz et al., 2000). Рассматривая чистый липидный бислой с возможным поверхностным растяжением 5% (Hallett et al., 1993) и пренебрегая тепловыми флуктуациями (Evans and Rawicz, 1990), уравнение. 2,5 дюйма в коробке 1 дает нам разрывное напряжение 10 мН / м. Это значение соответствует опубликованным отчетам, в которых измеренное напряжение разрыва составляет от 3 до 10 мН / м, в зависимости от липидного состава бислоя (Olbrich et al., 2000). По закону Лапласа.
Рисунок 2. Модули клеточной мембраны. (A) Слева — гипотетическая биомиметическая мембрана, отделяющая внутреннюю часть от внешней. Справа липидный бислой представляет собой внешнюю структуру клеточной мембраны. На увеличении показан бислой толщиной 5–7 нм, состоящий из отдельных липидов. (B) Слева, гипотетический композитный материал, состоящий из гибкого корпуса, связанного с жесткими подмостями.Справа плазматическая мембрана плотно связана с корой головного мозга клетки, образуя композитный материал. Отдельные белки актина собираются в филаменты, которые обращены к клеточной мембране растущим концом. (C) Слева, гипотетический адаптивный композитный материал, который изменяет свойства материала при внешнем воздействии (красный). Справа континуум мембрана / кора легко реагирует на внешние раздражители (красный), что напоминает адаптивный композитный материал. Обратите внимание, что изменения в динамике актина также могут служить сигналом (красная пунктирная линия).
Вставка 1. Физика на поверхности клетки.
Далее мы рассматриваем клеточную поверхность как пластинку или оболочку, инкапсулирующую цитоплазму, следуя описанию Камма и Гродзинского (2015). В общем, любую деформацию можно представить как суперпозицию трех основных типов деформации: растяжения, изгиба и сдвига. Поверхностное натяжение определяется как получение энергии по отношению к площади, что означает, что энергия, необходимая для растяжения пластины на определенную величину, равна.
N = σh = Eh2-νε = Eh3 (1-ν) ΔAA0 = KeΔAA0, (2.1)
, где σ обозначает равномерное нормальное напряжение, N — растяжение в плоскости, действующее на единицу длины (Н / м), E — модуль упругости (модуль Юнга), ν — коэффициент Пуассона, h — толщину пластины, ε — деформацию и K e модуль упругости площади, определенный как K e = Eh3 (1-ν). Энергия, необходимая для изгиба пластины толщиной h в одном измерении, равна
.Mx = Ebend = -Eh412 (1-ν2) δ2uzδx2 = -KBδ2uzδx2, (2.2)
, где δ2uzδx2 обозначает прогиб пластины в направлении z, а K B жесткость на изгиб определяется как KB = Eh412 (1-ν2). Эластичные материалы демонстрируют сопротивление деформации сдвига, возникающей, когда боковые поверхности пластины подвергаются двум различным поверхностным натяжениям. Это сопротивление задается модулем сдвига K s с единицей Н / м, связывающей возникающую поперечную силу на единицу длины N xy с величиной деформации сдвига, деформацией ε ху .Сила сдвига на единицу длины является произведением напряжения сдвига τ xy , умноженного на толщину листа h, что также может быть описано с помощью модуля сдвига G и деформации сдвига ε xy . В соответствии с формулой. 2.2 модуль сдвига может быть выражен модулем Юнга E и коэффициентом Пуассона υ:
.σxy = τxyh = 2Gεxy = E1 + νεxy = Ksεxy, (2.3)
Принимая во внимание окружающие клетки, мы должны применить термическую флуктуацию, добавив член случайной силы ξ ( t ), а для демпфирования движения мембраны внеклеточной жидкостью мы добавим член в форме ηeδ uzδ (t) с эффективной вязкостью окружающей жидкости η e , рассеивающей ее энергию.Если добавить тепловые колебания и рассеяние энергии из-за внешнего демпфирования жидкости, пренебрегая напряжением сдвига, получаем
Δp + ξ (t) = KB (δ4uzδx4 + 2δ4uzδx2δy2 + δ4uzδy4) -N (δ2uzδx2 + δ2uzδ Y2) + ηeδuzδt, (2.4)
, который дает нам более полную картину поведения клеточной мембраны. Обратите внимание, что принцип суперпозиции действителен только для небольших деформаций, где уместна линеаризация (например, небольшая дискретизация времени и пространства). Пренебрегая всеми членами, кроме давления и поверхностного натяжения — поскольку это может быть уместно для малых искривлений, уравнение.2.4 приводит к знаменитому уравнению Лапласа.
Δp = -N (δ2uzδx2 + δ2uzδy2) ≅N (1R1 + 1R2). (2.5)
Биоматериалы часто обладают вязкоупругими свойствами. Следовательно, мы также должны учитывать вязкость материалов η. В отличие от модуля упругости E , вязкость связывает напряжение не с деформацией материала, а со скоростью изменения деформации dε (t) dt. Одним из способов описания свойств вязкоупругого твердого тела является модель Кельвина-Фойгта (см. Рис. 2C), которую можно представить в виде упругой пружины и вязкого демпфера, соединенных параллельно.Упругие свойства материала задаются модулем упругости E, а вязкие свойства — вязкостью η. Испытанное напряжение σ тогда равно
.σ (t) = Eε (t) + ηdε (t) dt. (2.6)
Однако поверхность ячейки проявляет способность к пластической деформации и поэтому ведет себя больше как жидкость. Что касается коры клеток, это свойство возникает из-за скорости оборота связывающих белков. В отличие от вязкоупругого твердого тела, вязкоупругая жидкость может быть смоделирована телом Максвелла, которое можно представить в виде упругой пружины и вязкого демпфера, соединенных последовательно (см. Рисунок 2C).Испытываемое напряжение σ здесь равно
.σ (t) + ηEσ (t) dt = ηdε (t) dt. (2.7)
Δp = 2NR, (1.1)
, где N обозначает поверхностное натяжение, а R — главный радиус кривизны, мы находим, что PM может выдерживать перепад давления Δ p до 0,2 бар или 20 кПа, принимая радиус 1 мкм перед разрывом , замечательные характеристики, учитывая его толщину всего 5–7 нм.
Что касается свойств материала, упомянутых в начале раздела, липидный бислой уже обеспечивает превосходное сопротивление растяжению.Однако он легко деформируется при наличии сил внутри плоскости (то есть при низком сопротивлении сдвигу K s ) или перпендикулярно ему (т.е. при низкой жесткости на изгиб K B ). Следовательно, чтобы усилить структурную целостность границы и сделать ее настраиваемой, требуется дополнительная опора.
Интерфейс мембрана-кора образует композитный материал
Для нашего гипотетического биомиметического материала механические свойства корпуса могут быть дополнительно улучшены путем объединения его с самосборными лесами, которые с высокой степенью сродства связываются с гибким корпусом, образуя трехчастный композит: корпус, поддерживающие леса и соединительные элементы. клей (Рисунок 2B, слева).Легко представить, что размер, плотность и жесткость строительных лесов напрямую влияют на свойства материала композита. Однако эти свойства в равной степени зависят от схемы сборки лесов вдоль корпуса. Например, каркасы, сформированные из удлиненных структур, которые выровнены вдоль заранее определенной оси, будут давать поляризованные (то есть разные) модули изгиба вдоль основных кривизны. Напротив, всенаправленная сборка тех же структур будет создавать изотропные механические свойства.Помимо формы поддерживающей конструкции, расстояние между отдельными субъединицами также влияет на жесткость при изгибе (Naghieh et al., 2018). Одним из таких примеров является гель агарозы, который проявляет значительно более высокую устойчивость к напряжениям сдвига, чем его основной компонент — вода. Следовательно, мудро разработав геометрию поддерживающей конструкции или состав матричных частиц, могут появиться материалы с очень разными механическими свойствами.
Липидный бислой существенно отличается от поверхности клетки, которая не только более жесткая, но и демонстрирует более медленную латеральную диффузию (Edidin et al., 1991; Shi et al., 2018). Это ясно указывает на присутствие дополнительного поддерживающего материала, который взаимодействует с липидным бислоем. В клетках этот композитный материал образуется в результате взаимодействия плазматической мембраны с корой головного мозга (рис. 2В, справа). Клеточная кора состоит из прямых и разветвленных актиновых филаментов, которые сшиваются друг с другом (Mullins et al., 1998), образуя слой толщиной 100-200 нм на внутренней стороне PM (Chugh and Paluch, 2018). Помимо актина, кора клеток содержит в меньшей степени промежуточные филаменты и микротрубочки (Koning et al., 2008; Singh et al., 2018), обеспечивая возможность приложения механических сил и изменения местных свойств материала. Мембранная ассоциация клеточной коры достигается за счет специализированной группы белков, белков домена FERM (названных в честь его членов-основателей, белка 4.1, эзрина, радиксина и моэзина), которые одновременно связываются с липидами и белками (Chishti et al., 1998) . Этот динамический интерфейс, также называемый прикреплением мембраны к коре (Diz-Muñoz et al., 2010), преобразует две отдельные структуры в один композитный материал.Из уравнения. 2.2 во вставке 1 мы узнаем, что энергия искривления материала зависит от куба толщины. Следовательно, энергия, необходимая для изгиба клеточной коры толщиной 200 нм, на порядки выше, чем для липидного бислоя толщиной 5-7 нм. Следовательно, вкладом липидного бислоя в общую жесткость клеточной поверхности можно пренебречь из-за изменений формы на масштабах клеточной длины. Интересно, что высокочастотный режим спектра флуктуаций в анализах флуктуаций мембран, по-видимому, в значительной степени зависит от механических свойств PM (Gárate et al., 2015), предполагая, что мембрана, по крайней мере частично, способна свободно раскачиваться на небольших масштабах длины. Подобные высокие моды флуктуаций на масштабе десятков нанометров наблюдались также в везикулах (Betz, Sykes, 2012). Таким образом, изгибная жесткость поверхности клетки (см. Рис. 1A), вероятно, определяется корой клеток на клеточном уровне и частично несвязанными PM на субмикронных масштабах длины (Salbreux et al., 2012).
Связь клеточной коры с мембраной также влияет на поверхностное натяжение (Chugh et al., 2017). Клеточная мембрана прикрепляется к коре через линкерные белки, которые, в свою очередь, подвергаются натяжению кортикальным поверхностным натяжением N cor , в результате чего получается.
Ncor2R = ρlinkFlink, (1.2)
, где ρ звено обозначает плотность линкерного белка, а F звено силу, прикладываемую каждым линкером. Используя закон Лапласа (см. Также вставку 1, уравнение 2.5), находим.
Δp = NPM2R + ρlinkFlink = (NPM + Ncor) 2R, (1.3)
, что означает, что поверхностное натяжение клетки N клетка представляет собой сумму натяжения мембраны N PM и кортикального натяжения N cor (Sens and Plastino, 2015). Давайте подробнее рассмотрим натяжение мембраны. В липидном бислое локальные градиенты натяжения мембраны (например, вызванные быстрым натягиванием троса) выравниваются по остальной части мембраны за считанные миллисекунды (Shi and Baumgart, 2015), что напоминает жидкость, в которой отсутствует напряжение сдвига. .Однако это меняется, как только PM прикрепляется к клеточной коре. Примерно четверть общей площади PM занято трансмембранными белками, половина из которых связана с клеточной корой (Bussell et al., 1995). Эти белки, если они прикреплены к коре клетки, служат препятствием, ограничивающим мембранный поток ( u ).
u = kηlipid∇N, (1.4)
с проницаемостью по Дарси k для пористой среды (то есть множеством препятствий) и вязкостью липидов η липидов (Shi et al., 2018). Латеральная проницаемость k может быть описана как функция доли площади ϕ, занятой интегральными белками, и их радиуса a (Happel, 1959).
k≈-a2 (1 + ln (ϕ)) 8ϕ. (1.5)
Следовательно, если оно ограничено двумя измерениями, сопротивление потока уменьшается логарифмически с расстоянием до препятствия (а не экспоненциально). Поскольку логарифмическая функция расходится на большие расстояния, эффект будет заметен независимо от того, как далеко от препятствия мы оцениваем систему — явление, называемое парадоксом Стокса.В том же исследовании также было отмечено, что поверхностное натяжение ПМ, прикрепленного к коре клетки, распространяется с течением времени диффузным образом, определяемым выражением.
δNδt = Ekηlipid∇2N, (1.6)
, где E обозначает модуль упругости PM, а η липид вязкость липидов (т.е. вязкость жидкости, протекающей через эти препятствия). Обратите внимание, что уравнение. 1.6 демонстрирует поразительное сходство со вторым законом диффузии Фика. В своем элегантном исследовании Ши и Коэн определили коэффициент диффузии при растяжении D N
DN = Ekηlipid, (1.7)
дает
δNδt = DN∇2N. (1.8)
Следовательно, связанные с корой интегральные белки вызывают локальные и долгоживущие градиенты мембранного натяжения. Вполне вероятно предположить, что клетки могут локально изменять коэффициент диффузии при напряжении через MCA-индуцированные изменения количества и положения трансмембранных препятствий (т.е. изменение ϕ). Соответственно, недавняя работа показала положительную корреляцию между плотностью актина, проксимальной к мембране, и натяжением мембраны (Bisaria et al., 2020). Остается неясным, как градиенты натяжения мембраны влияют на корковое натяжение N cor и, как следствие, натяжение клеток N cell .
Наконец, давайте рассмотрим вязкость мембраны. Вязкость PM отличается от вязкости чистого липидного бислоя из-за встроенных интегральных мембранных белков (IMP). Для суспензии без межчастичного взаимодействия (т.е. с низкой концентрацией) эффективная вязкость такой суспензии может быть приблизительно равна.
μe = μ0 (1 + Bϕ), (1.9)
, где μ 0 — вязкость суспендирующей жидкости, объемная доля внедренных частиц ϕ, а B — коэффициент, зависящий от формы частиц (например, сфер, цилиндров, дисков) (Bird et al., 2007 ). Следовательно, возможно, что прикрепление и, следовательно, иммобилизация IMP могут также повлиять на вязкость PM. Несмотря на существование некоторых приближений к эффективной вязкости (Larson and Higdon, 1986, 1987; Kolodziej, 1988), эта сложная тема остается нерешенной и выходит за рамки настоящего обзора (см. Также дополнительные материалы).Важно отметить, что единственная плазматическая мембрана проявляет свойства вязкого материала. Однако прикрепление PM к коре клетки (то есть к поверхности клетки) демонстрирует комбинацию вязких и эластичных свойств на шкале длины клетки (Bausch et al., 1998). Это означает, что на коротких временных масштабах (например, ~ 1 с) поверхность клетки реагирует как эластичный материал, в то время как она проявляет свойства вязкого материала на более длительных временных масштабах (например, 10–100 с). Учитывая, что кора головного мозга состоит из взаимосвязанных актиновых нитей, которые подвергаются непрерывному обмену перекрестно-связывающих белков и актиновых нитей, кора клетки способна выполнять пластическую деформацию, напоминающую вязкоупругую жидкость.Это поведение в простейшей форме можно смоделировать как тело Максвелла (Begemann et al., 2019), описываемое уравнением. 2.7 в блоке 1 (см. Также рисунок 1C).
В заключение, наш краткий обзор демонстрирует, как взаимодействия мембран с корой головного мозга клетки изменяют механические свойства самого ПМ, а также поверхности клетки. Тем не менее, несмотря на универсальность свойств материалов, которые могут быть достигнуты, полученный композитный материал на данный момент все еще не обладает способностью быстро реагировать на изменения окружающей среды (т.е., адаптивный ответ).
Поверхность клетки — адаптивный композитный материал
В описанной выше форме композитный материал всегда будет хорошо себя чувствовать в состоянии минимальной энергии. Поразительно, что механические свойства мембраны и коры головного мозга можно настраивать отдельно с высокой пространственной и временной точностью, что дает возможность превратить пассивный композит в активный материал. В нашем гипотетическом композитном материале такая адаптивность может быть достигнута за счет того, что его компоненты чувствительны к кратковременному раздражителю (например,г., свет, температура). Ответ на такой стимул, который вызывает локальные изменения одного (или комбинации) из четырех основных свойств материала (рис. 1A), дает адаптивный композитный материал (рис. 2C, слева).
Далее мы обсудим, как индуцированные стимулом переходные изменения механических свойств мембраны или коры головного мозга создают адаптивный композитный материал. Начнем с напряжения. Как упоминалось выше в формуле. 1.3, натяжение поверхности клетки является суммой натяжения PM и натяжения коры головного мозга и, следовательно, является функцией плотности линкерных белков ρ link и модулей растяжения плазматической мембраны KePM и клеточной коры Kec. Or.Эти параметры, в свою очередь, зависят от соответствующих модулей упругости E , толщины h и коэффициента Пуассона ν (уравнение 2.1, вставка 1). Следовательно, индуцированные сигналом изменения любого из этих свойств обязательно будут влиять на модуль растяжения поверхности клеток Kecell. Устойчивость к растяжению липидного бислоя KePM, например, возникает из-за потери энергии, вызванной воздействием на гидрофобное ядро окружающего водного раствора. Следовательно, теоретически его можно настроить, изменив липидный состав мембраны, что также может повлиять на толщину мембраны h.Однако с модулем ∼200 мН / м (Rawicz et al., 2000) липидный бислой не является сильно растяжимой структурой и, следовательно, не очень подходит. Обратите внимание, что большинство значений в литературе описывают кажущийся модуль растяжения PM, который объединяет крупномасштабные изменения площади мембраны, возникающие из-за волнистости мембраны, складок мембраны, слияния везикул, сглаживания колебаний мембраны и других источников (Le Roux et al., 2019 ). В дополнение к напряжению на основе мембран, напряжение коры головного мозга может модулироваться зависимыми от сигнала изменениями плотности сшивающего агента актина, MCA (т.е.е., плотность линкерных белков PM-коры? link ) и кортикального миозина (Stewart et al., 2011). В частности, последнее делает композитный материал подходящим для адаптации в физиологических временных масштабах (то есть порядка секунд), в результате чего липидный состав, а также геометрия коры головного мозга (например, размер ячеек) будут влиять на соответствующие модули упругости.
Жесткость при изгибе
Поскольку жесткость мембраны и кортикального слоя критически зависят от масштаба длины, мы рассмотрим их вклад отдельно.Изгибная жесткость PM, которая важна в субмикронном режиме, зависит от состава липидного бислоя (Helfrich, 1973). Изменяя длину и насыщенность отдельных углеводных цепей, можно модулировать толщину липидного бислоя и, тем самым, энергию изгиба (см. Уравнение 2.2 во вставке 1). Добавление гидрофобных головок различного размера делает липиды чувствительными к кривизне, в то время как различия в заряде будут влиять на белок-липидные взаимодействия с периферическими цитозольными белками (Ebrahimkutty and Galic, 2019; Bassereau et al., 2018). На жесткость изгиба клеточной коры, которая актуальна в режиме мкм, могут влиять изменения размера ячеек актина (отображаемого плотностью линкерных белков коры) или толщины самой коры. Кроме того, сигналы, которые изменяют модули упругости обоих материалов (обсуждаемые выше), также будут влиять на их соответствующие жесткости при изгибе KBPM и KBcor (см. Уравнение 2.2 во вставке 1).
Сопротивление сдвигу и вязкость
Чистые липидные бислои ведут себя как жидкость, лишенная напряжения сдвига (Mofrad and Kamm, 2006).Это не всегда так в клеточных мембранах (Shi et al., 2018). Из уравнения. 2.3 во вставке 1 мы делаем вывод, что все клеточные стимулы, которые влияют на модуль сдвига (и, следовательно, модуль Юнга E , а также коэффициент Пуассона υ, как обсуждалось выше), также будут влиять на реакцию обоих материалов на упругое напряжение сдвига, и, следовательно, также поверхности клетки. Поскольку кора клеток, а также прикрепленные PM обладают вязкоупругими свойствами, мы также должны учитывать контрольные переменные соответствующих вязкостей.В случае коры доминирующей контрольной переменной (т.е. мишенью для адаптивных стимулов) являются относительные скорости обмена актина и его сшивающих агентов, а также относительный размер ячеек коры клеток (Boulbitch et al., 2000; Kasas et al., 2005). Что касается PM, и вспоминая описание парадокса Стокса из предыдущего абзаца, вязкость PM может модулироваться индуцированными сигналом изменениями общей концентрации интегральных белков, их пространственного распределения (например, кластеризации) и доли коры головного мозга. связанные единицы.
Выводы, обобщенные в этом разделе, подчеркивают разнообразные стратегии индуцированных сигналом изменений в индивидуальных свойствах материала, которые делают поверхность клетки адаптивным композитным материалом. Как эти свойства материалов изменяются в патофизиологических условиях, — тема следующей главы.
Неправильные свойства материала вызывают болезнь
В любой инженерной конструкции включение дефектных материалов приводит к катастрофическим последствиям для общей устойчивости объекта.В клетках такие дефектные материалы проявляются как болезнь. Далее мы исследуем болезни, возникающие из-за отдельных материалов, полученного композита и его адаптивных свойств, соответственно.
Как описано в предыдущем разделе, изменения относительных уровней липидов внутри мембраны могут не только истощать компоненты, участвующие в передаче сигналов, но также могут изменять свойства ее материала. Существует все больше свидетельств изменений липидного баланса [например, (холестерин) ↑, (сфингомиелин) ↑ и (фосфатидилинозит) ↓] во время старения, но также и при липидозе, таком как болезнь Ниманна-Пика типов A и C (Karten et al., 2002; Arroyo et al., 2014), устанавливая, как механические свойства мембраны могут изменяться при заболевании.
Интересно, что дефектные материалы, которые приводят к болезням, также могут быть обнаружены в белках коры клеток. Напр., Мутации в α-актине гладких мышц ( ACTA2, ), которые изменяют взаимодействия между актином и миозином (Lu et al., 2015), вызывают сосудистые заболевания и инсульт (Guo et al., 2009). Мутации в ACTB , гене, кодирующем цитоплазматический β-актин, изменяют динамику полимеризации актина (Hundt et al., 2014), что приводит к глухоте, раку и нарушениям развития (Procaccio et al., 2006). Мутации в гене, кодирующем α-актинин-4 ( ACTN4 ), белок, сшивающий актин, вызывают протеинурическую болезнь почек (Kaplan et al., 2000). В совокупности эти несколько примеров иллюстрируют, как изменения материальных свойств компонентов коры клеток приводят к существенным физиологическим эффектам.
Заболевание может быть связано с ошибками композитного материала. Как описано выше, липидный состав определяет жесткость и текучесть мембран.Поразительно, что некоторые из этих липидов образуют высокодинамичные и гетерогенные мембранные нанодомены (Head et al., 2014; Sechi and Wehland, 2000), которые могут быть стабилизированы с образованием более крупных сигнальных платформ, связанных с актиновыми филаментами (Oliferenko et al., 1999). ; Galic et al., 2012; Begemann et al., 2019). Поскольку при определенном заболевании изменяется доступность или динамика липидов, в таких условиях, вероятно, изменяются результирующие механические свойства композита мембрана-кора.
Наконец, мутации также могут влиять на адаптивность композита.Одно из основных семейств заболеваний возникает из-за мутаций в рецепторных белках, которые нарушают вызванные сигналом изменения свойств материала композита. Одним из таких примеров являются рецепторы, связанные с G-белком (GPCR), которые, помимо прочего, изменяют свойства материала коры клетки (Bhattacharya et al., 2004). Здесь мутации вызывают аберрантную передачу сигналов путем нарушения поверхностной экспрессии (Ward et al., 2012), базовой активности (Seifert and Wenzel-Seifert, 2002) или связывания лиганда (Venkatakrishnan et al., 2013).Более того, GPCR напрямую взаимодействуют с липидами, что означает, что изменения в составе мембран или мутации в мотивах распознавания липидов могут изменять передачу сигналов GPCR, изменяя его стабильность, субклеточную локализацию или активность (Keri and Barth, 2018; Pucadyil and Chattopadhyay, 2006). Важно отметить, что ошибки в вызванных сигналом изменениях свойств материала также можно проследить до других семейств рецепторов (Jiang and Gonen, 2012; Fruman et al., 2017; Zakany et al., 2020), что дает начало постоянно растущему семейству рецепторов. мембраносвязанного заболевания.Второе серьезное семейство болезней, влияющих на приспособляемость композитного материала, связано с кривизной мембраны. Здесь временно деформированные участки мембраны запускают рекрутирование чувствительных к кривизне белков (Peter et al., 2004) и липидов (Wang et al., 2007; James et al., 2010). Примечательно, что многие из более чем 100 известных молекул, чувствительных к кривизне, идентифицированных в клетках, напрямую изменяют полимеризацию актина, таким образом изменяя механические силы, приложенные к PM. Эта двойная способность выбранных молекул воспринимать и изменять вызванную актином кривизну PM важна, поскольку она определяет основные свойства адаптивного композитного материала.Соответственно, дефекты отдельных петель обратной связи регулятора силы (например, OPHN1 и SRGAP2 ) приводят к очень специфическим заболеваниям (Billuart et al., 1998; Charrier et al., 2012).
Хотя эти примеры далеко не полны, они иллюстрируют, как свойства материалов отдельных компонентов критически влияют на общее механическое состояние поверхности клеток — как в отношении здоровья, так и в отношении болезней. Как измеряются механические свойства этого универсального адаптивного композитного материала, мы обсудим в следующем разделе.
Измерение свойств материалов в ячеистых мембранах
Картина, нарисованная так далеко, показывает важность функционального взаимодействия между корой головного мозга, мембраной и MCA. Учитывая его небольшие масштабы, отделение коры головного мозга от мембран в живых клетках является сложной задачей (Diz-Muñoz et al., 2018). Чтобы получить представление о натяжении мембраны, в предыдущих исследованиях использовались пипетки и оптические пинцеты для измерения силы, необходимой для извлечения привязки мембраны с поверхности клетки (Raucher and Sheetz, 2000).Другой подход основан на спектроскопии мембранных флуктуаций с временным разрешением (Betz and Sykes, 2012). Здесь оптический пинцет используется для измерения деформации мембраны, а не для натягивания тросов. В таких измерениях спектральная плотность мощности низкочастотных флуктуаций падает с увеличением напряжения (Betz and Sykes, 2012). Примечательно, что флуктуационная спектроскопия также может использоваться для понимания жесткости материала при изгибе и вязкости (Betz and Sykes, 2012). Количественные измерения вязкости мембраны также можно получить с помощью высокопроизводительной трекинговой одиночной молекулы или флуоресцентной корреляционной спектроскопии (Barbotin et al., 2019).
Тем не менее, как упоминалось выше, изменения в расстоянии между белками, связанными с корой, будут влиять на текучесть мембран (Cohen and Shi, 2020). Следовательно, измерения натяжения троса и флуктуации мембраны представляют собой совокупность свойств мембраны и коры клеток (Shi et al., 2018). Таким образом, хотя каждый из этих подходов позволяет по-новому взглянуть на механические свойства клеточных мембран, однозначно проанализировать вклад отдельных компонентов композитного материала остается сложной задачей.
Заключение и перспективы
Семенная работа с чистыми липидными бислоями, которые являются темой других обзоров в этом специальном выпуске, в значительной степени способствовали нашему нынешнему пониманию мембранной механики. Тем не менее, недавние исследования утверждают, что некоторые клеточные мембраны следует рассматривать как адаптивный композитный материал (Shi et al., 2018; Cohen and Shi, 2020). В этом обзоре мы использовали гипотетический биомиметический материал, чтобы выяснить поразительную универсальность клеточных мембран.Мы обсудили, как небольшие изменения механических свойств отдельных основных модулей позволяют материалу легко адаптировать свои свойства, таким образом выполняя самые разные функции, полагаясь на одни и те же строительные материалы. Поразительно, но сложная природа клеточной поверхности не только позволяет клеточным мембранам быстро адаптировать свои механические свойства к данной ситуации, но также дает объяснения болезни и некоторых, казалось бы, противоречащих свойств клеточной поверхности. Одним из таких примеров является потребность в эффективном транспорте крупных объектов через кору клеток при постоянном сохранении структурной целостности (Wollman and Meyer, 2012).Как упоминалось выше, интерфейс липид-кора в значительной степени зависит от нековалентных взаимодействий. Как следствие, цитоскелет постоянно отключается от липидного бислоя и повторно прикрепляется к нему. Эти временные отслоения не только открывают возможность легко регулировать взаимодействия, но также и способность транспортировать и сливать везикулы (то есть большие объекты) без постоянного отслоения плазматической мембраны от подлежащей коры.
Используя аналогию с гипотетическим биомиметическим материалом, мы понимаем, что искусственные материалы все еще сильно отстают от своих биологических аналогов.Однако обнадеживает то, что эта возможность была признана, что положило начало быстрорастущей области исследований (Amaral and Pasparakis, 2019; Chen and Li, 2020). Будущие достижения в области биоинспирированного и биомиметического материала, вероятно, выиграют от вычислительных подходов (Sun et al., 2018; Schroer et al., 2020), которые позволят быстро продвигать теоретические и экспериментальные данные динамики мембраны-MCA-коры при постоянно увеличивающемся пространственно-временное разрешение.
Авторские взносы
Оба перечисленных автора внесли существенный, прямой и интеллектуальный вклад в работу и одобрили ее к публикации.
Финансирование
Эта работа была поддержана фондами DFG (EXC-1003, CRC1348 / A06) и медицинского факультета Университета Мюнстера в MG (IMF IGA-121610).
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Мы хотели бы поблагодарить сотрудников лаборатории Galic за критические отзывы и обсуждения.
Дополнительные материалы
Дополнительные материалы к этой статье можно найти в Интернете по адресу: https://www.frontiersin.org/articles/10.3389/fcell.2020.00684/full#supplementary-material
Список литературы
Амарал, А. Дж. Р., Паспаракис, Г. (2019). Инженерия клеточных мембран с использованием синтетических материалов: применение в сфероидах клеток, клеточных клеях и формировании микротканей. Acta Biomater. 90, 21–36. DOI: 10.1016 / j.actbio.2019.04.013
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Арройо, А.И., Камолетто, П. Г., Морандо, Л., Сассо-Погнетто, М., Джустетто, М., ван Велдховен, П. П. и др. (2014). Фармакологическая реверсия сфингомиелин-индуцированных аномалий дендритного позвоночника на мышиной модели болезни Ниманна-Пика типа А. EMBO Mol. Med. 6, 398–413. DOI: 10.1002 / emmm.201302649
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Барботин А., Галиани С., Урбаней И., Эггелинг К. и Бут М. Дж. (2019). Адаптивная оптика позволяет проводить измерения STED-FCS в цитоплазме живых клеток. Опт. Экспресс 27, 23378–23395. DOI: 10.1364 / OE.27.023378
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Bassereau, P., Jin, R., Baumgart, T., Deserno, M., Dimova, R., Frolov, V.A., et al. (2018). Дорожная карта кривизны и ремоделирования биомембраны на 2018 год. J. Phys. D Прил. Phys. 51: 343001. DOI: 10.1088 / 1361-6463 / aacb98
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Баумгарт, Т., Хесс, С. Т., и Уэбб, В.W. (2003). Визуализация сосуществующих жидких доменов в моделях биомембран сочетает кривизну и натяжение линии. Nature 425, 821–824. DOI: 10.1038 / nature02013
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бауш А. Р., Циманн Ф., Боулбич А. А., Якобсон К. и Сакманн Э. (1998). Локальные измерения вязкоупругих параметров адгезионных поверхностей ячеек методом магнитной микрореометрии. Biophys. J. 75, 2038–2049. DOI: 10.1016 / S0006-3495 (98) 77646-5
CrossRef Полный текст | Google Scholar
Бегеманн, И., Саха, Т., Лампартер, Л., Ратманн, И., Гриль, Д., Гольбах, Л. и др. (2019). Механохимическая самоорганизация определяет схему поиска в мигрирующих клетках. Nat. Phys. 15, 848–857. DOI: 10.1038 / s41567-019-0505-9
CrossRef Полный текст | Google Scholar
Бец, Т., и Сайкс, К. (2012). Спектроскопия мембранных флуктуаций с временным разрешением. Soft Matter 8, 5317–5326. DOI: 10.1039 / C2SM00001F
CrossRef Полный текст | Google Scholar
Биллуарт, П., Bienvenu, T., Ronce, N., Des Portes, V., Vinet, M.C., Zemni, R., et al. (1998). Олигофренин-1 кодирует белок rhoGAP, участвующий в X-связанной умственной отсталости. Природа 392, 923–926. DOI: 10.1038 / 31940
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Берд Р. Б., Стюарт У. Э. и Лайтфут Э. Н. (2007). Явления переноса (Ред. 2. Ред.). Хобокен, Нью-Джерси: Wiley.
Google Scholar
Бисария, А., Хайер, А., Гарбетт, Д., Коэн, Д., Мейер, Т. (2020). Проксимальный к мембране F-актин ограничивает локальные выступы мембраны и направляет миграцию клеток. Наука 368, 1205–1210. DOI: 10.1126 / science.aay7794
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Boulbitch, A., Simson, R., Simson, D.A., Merkel, R., Häckl, W., Bärmann, M., et al. (2000). Нестабильность формы биомембраны, вызванная локальным размягчением подлежащей актиновой коры. Phys. Rev. E Stat. Phys. Plasmas Fluids Relat.Междисциплинарный. Вершина. 62 (3 Pt B), 3974–3985. DOI: 10.1103 / Physreve.62.3974
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Басселл, С. Дж., Кох, Д. Л., и Хаммер, Д. А. (1995). Влияние гидродинамических взаимодействий на диффузию интегральных мембранных белков: диффузия индикаторов в органеллах и реконструированных мембранах. Biophys. J. 68, 1828–1835. DOI: 10.1016 / S0006-3495 (95) 80359-0
CrossRef Полный текст | Google Scholar
Шаррье, К., Джоши, К., Коутиньо-Бадд, Дж., Ким, Ж.-Э., Ламберт, Н., Марчена, Дж. И др. (2012). Ингибирование функции SRGAP2 его специфическими для человека паралогами вызывает неотению во время созревания позвоночника. Cell 149, 923–935. DOI: 10.1016 / j.cell.2012.03.034
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чен, X., и Ли, Дж. (2020). Биоинспекция клеточных мембран: функциональные полимерные материалы для биомедицинских применений. Mater. Chem. Фронт. 4, 750–774.DOI: 10.1039 / C9QM00717B
CrossRef Полный текст | Google Scholar
Чишти А. Х., Ким А. С., Марфатия С. М., Лутчман М., Ханспал М., Джиндал Х. и др. (1998). Домен FERM: уникальный модуль, участвующий в связывании цитоплазматических белков с мембраной. Trends Biochem. Sci. 23, 281–282. DOI: 10.1016 / S0968-0004 (98) 01237-7
CrossRef Полный текст | Google Scholar
Чу П., Кларк А. Г., Смит М. Б., Кассани Д. А. Д., Диркес К., Ragab, A., et al. (2017). Архитектура актиновой коры регулирует поверхностное натяжение клеток. Nat. Cell Biol. 19, 689–697. DOI: 10.1038 / ncb3525
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Контрерас, Ф.-Х., Эрнст, А.М., Виланд, Ф., и Брюггер, Б. (2011). Специфика внутримембранных белково-липидных взаимодействий. Cold Spring Harb. Перспектива. Биол. 3: а004705. DOI: 10.1101 / cshperspect.a004705
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дис-Муньос, А., Krieg, M., Bergert, M., Ibarlucea-Benitez, I., Muller, D.J., Paluch, E., et al. (2010). Контроль направленной миграции клеток in vivo за счет прикрепления мембраны к коре. PLoS Biol. 8: e1000544. DOI: 10.1371 / journal.pbio.1000544
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Эдидин М., Куо С. К. и Шитц М. П. (1991). Боковые движения мембранных гликопротеинов ограничены динамическими цитоплазматическими барьерами. Наука 254, 1379–1382. DOI: 10.1126 / наука.1835798
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Эггелинг, К., Рингеманн, К., Медда, Р., Шварцманн, Г., Сандхофф, К., Полякова, С. и др. (2009). Прямое наблюдение за наноразмерной динамикой мембранных липидов в живой клетке. Природа 457, 1159–1162. DOI: 10.1038 / nature07596
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Эстеп, Т. Н., Маунткасл, Д. Б., Баренхольц, Ю., Билтонен, Р. Л., и Томпсон, Т.Э. (1979). Температурное поведение синтетических дисперсий сфингомиелин-холестерин. Биохимия 18, 2112–2117. DOI: 10.1021 / bi00577a042
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фокон, Дж. Ф., Митов, М. Д., Мелеар, П., Бивас, И., и Боторель, П. (1989). Изгибная эластичность и тепловые колебания липидных мембран. Теоретические и экспериментальные требования. J. Phys. 50, 2389–2414. DOI: 10.1051 / jphys: 01980170238900
CrossRef Полный текст | Google Scholar
Фруман Д.А., Чиу, Х., Хопкинс, Б. Д., Багродиа, С., Кэнтли, Л. С., и Абрахам, Р. Т. (2017). Путь PI3K при заболеваниях человека. Ячейка 170, 605–635. DOI: 10.1016 / j.cell.2017.07.029
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Галич, М., Чон, С., Цай, Ф.-К., Жубер, Л.-М., Ву, Ю.И., Хан, К.М., и др. (2012). Внешние толкающие и внутренние тянущие силы привлекают чувствительные к кривизне белки домена N-BAR на плазматическую мембрану. Nat. Cell Biol. 14, 874–881.DOI: 10.1038 / ncb2533
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Gárate, F., Betz, T., Pertusa, M., and Bernal, R. (2015). Механика нейритов с временным разрешением по оценкам тепловых флуктуаций. Phys. Биол. 12: 66020. DOI: 10.1088 / 1478-3975 / 12/6/066020
CrossRef Полный текст | Google Scholar
Грабер, З. Т., Ши, З., и Баумгарт, Т. (2017). Катионы вызывают изменение формы отрицательно заряженных фосфолипидных мембран. Phys.Chem. Chem. Phys. 19, 15285–15295. DOI: 10.1039 / c7cp00718c
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гуо, Д.-К., Папке, К.Л., ван Тран-Фадулу, Регаладо, Э.С., Авидан, Н., Джонсон, Р.Дж., Ким, Д.Х. и др. (2009). Мутации в альфа-актине гладких мышц (ACTA2) вызывают ишемическую болезнь сердца, инсульт и болезнь Моямойи, а также заболевание грудной аорты. Am. J. Hum. Genet. 84, 617–627. DOI: 10.1016 / j.ajhg.2009.04.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Халлетт, Ф.Р., Марш Дж., Никель Б. Г. и Вуд Дж. М. (1993). Механические свойства везикул. II. Модель осмотического набухания и лизиса. Biophys. J. 64, 435–442. DOI: 10.1016 / S0006-3495 (93) 81384-5
CrossRef Полный текст | Google Scholar
Хэнкок, Дж. Ф., Маги, А. И., Чайлдс, Дж. Э. и Маршалл, К. Дж. (1989). Все ras-белки полиизопренилированы, но лишь некоторые из них пальмитоилированы. Cell 57, 1167–1177. DOI: 10.1016 / 0092-8674 (89)
- -8
- Узнать о явлениях диффузии и равновесия
- Исследуйте полупроницаемую мембрану яйца
- 4 больших яйца
- 4 стакана (желательно шире, чем выше)
- Белый уксус
- Вода
- Синий пищевой краситель (или другой темный цвет)
- Меласса
- Кукурузный сироп
- Зубочистка
- Рулетка (или отрезок веревки и линейки)
- Ручка
- Бумага
- Пленка или полиэтиленовая пленка (по желанию)
- Поместите каждое из 4 яиц в отдельный стакан.
- Налейте уксус в каждый стакан, чтобы он полностью покрывал каждое яйцо. Вы можете накрыть стаканы фольгой или полиэтиленовой пленкой, чтобы уменьшить запах в холодильнике.
- Поместите яйца в холодильник примерно на 24 часа. Уксус вступит в реакцию с яичной скорлупой и удалит ее, оставив только внутреннюю оболочку. После снятия скорлупы яйца будут выглядеть так, как показано ниже. Это нормально, если не будет удалена вся оболочка, при условии, что удалена большая часть оболочки.
- Слейте уксус из каждого стакана и тщательно вымойте их.
- Слегка промойте каждое яйцо водой.
- Положите яйца обратно в стаканы.
- Пометьте каждый стакан с 1 по 4 и используйте таблицу в конце этого упражнения, чтобы отслеживать четыре разных яйца.
- Измерьте каждое яйцо в самом широком месте с помощью рулетки или веревки. Чтобы использовать веревку, возьмите кусок веревки и один раз оберните им яйцо. Отметьте пальцем длину веревки, которая нужна, чтобы один раз обойти яйцо, и измерьте ее линейкой.
- Запишите длину каждого яйца, используя предоставленную таблицу.
- Залейте одно яйцо водой, одно — водой и каплей синего пищевого красителя, одно — патокой и одно — кукурузным сиропом.
- Поместите яйца обратно в холодильник. Вы также можете накрыть стаканы полиэтиленовой пленкой или фольгой, чтобы уменьшить запах.
- Подождите несколько часов (например, до утра), чтобы посмотреть, что произойдет с яйцами!
- Осторожно извлеките яйца из субстанции и тщательно промойте их водой.
- Как и раньше, измерьте яйца в самой широкой части, используя рулетку или шнурок и линейку.
- Запишите измерения в соответствующей части предоставленной таблицы.
- Наконец, поместите яйца обратно в стаканы после того, как они были тщательно вымыты, или поместите их в новые чашки или стаканы.
- Используйте зубочистку, чтобы осторожно выдрать каждую оболочку яиц.
- Что вы заметили в том, что было внутри? Попала ли какая-нибудь внешняя субстанция внутрь яйца? Запишите свои наблюдения в соответствующем месте предоставленной таблицы.
- Ответьте на следующие вопросы: Изучите изменения ширины яиц. В каких веществах увеличилась ширина яиц? Снижаться? Остаются такими же? Что означает увеличение ширины яйца в отношении того, что должно было произойти? Как насчет уменьшения ширины или если ширина останется прежней?
Центриоли — Центриоли представляют собой самовоспроизводящиеся органеллы, состоящие из девяти пучков микротрубочек и обнаруживаемые только в клетках животных. Кажется, что они помогают в организации деления клеток, но не являются необходимыми для этого процесса.
Реснички и жгутики — Для одноклеточных эукариот реснички и жгутики необходимы для передвижения отдельных организмов.У многоклеточных организмов функция ресничек заключается в перемещении жидкости или материалов мимо неподвижной клетки, а также в перемещении клетки или группы клеток.
Эндоплазматическая сеть — Эндоплазматическая сеть представляет собой сеть мешочков, которые производят, обрабатывают и транспортируют химические соединения для использования внутри и вне клетки. Он связан с двухслойной ядерной оболочкой, обеспечивая трубопровод между ядром и цитоплазмой.
Эндосомы и эндоцитоз — Эндосомы представляют собой мембраносвязанные везикулы, образованные с помощью сложного семейства процессов, известных под общим названием эндоцитоз , и обнаруживаются в цитоплазме практически каждой клетки животного.Основной механизм эндоцитоза противоположен тому, что происходит во время экзоцитоза или клеточной секреции. Он включает инвагинацию (складывание внутрь) плазматической мембраны клетки для окружения макромолекул или другого вещества, диффундирующего через внеклеточную жидкость.
Аппарат Гольджи — Аппарат Гольджи — это отдел распределения и отгрузки химических продуктов ячейки. Он модифицирует белки и жиры, встроенные в эндоплазматический ретикулум, и подготавливает их к экспорту за пределы клетки.
Промежуточные филаменты — Промежуточные филаменты представляют собой очень широкий класс волокнистых белков, которые играют важную роль как структурные, так и функциональные элементы цитоскелета. Промежуточные волокна размером от 8 до 12 нанометров действуют как элементы, несущие растяжение, помогая поддерживать форму и жесткость ячеек.
Лизосомы — Основная функция этих микротел — пищеварение. Лизосомы расщепляют продукты жизнедеятельности клеток и мусор извне клетки на простые соединения, которые переносятся в цитоплазму как новые материалы для построения клетки.
Микрофиламенты — Микрофиламенты представляют собой твердые стержни, состоящие из глобулярных белков, называемых актином. Эти филаменты в первую очередь структурны по функциям и являются важным компонентом цитоскелета.
Микротрубочки — Эти прямые полые цилиндры встречаются по всей цитоплазме всех эукариотических клеток (прокариоты их не имеют) и выполняют множество функций, от транспорта до структурной поддержки.
Митохондрии — Митохондрии — это органеллы продолговатой формы, которые находятся в цитоплазме каждой эукариотической клетки. В животной клетке они являются основными генераторами энергии, преобразующими кислород и питательные вещества в энергию.
Ядро — Ядро — это узкоспециализированная органелла, которая служит центром обработки информации и административным центром клетки. Эта органелла выполняет две основные функции: она хранит наследственный материал клетки, или ДНК, и координирует деятельность клетки, включая рост, промежуточный метаболизм, синтез белка и воспроизводство (деление клетки).
Пероксисомы — Микротела — это разнообразная группа органелл, которые находятся в цитоплазме, имеют примерно сферическую форму и связаны одной мембраной. Существует несколько типов микротел, но пероксисомы являются наиболее распространенными.
Плазменная мембрана — Все живые клетки имеют плазматическую мембрану, которая закрывает их содержимое. У прокариот мембрана — это внутренний защитный слой, окруженный жесткой клеточной стенкой.Клетки эукариотических животных имеют только мембрану, которая удерживает и защищает свое содержимое. Эти мембраны также регулируют прохождение молекул внутрь и из клеток.
Рибосомы — Все живые клетки содержат рибосомы, крошечные органеллы, состоящие примерно из 60 процентов РНК и 40 процентов белка. У эукариот рибосомы состоят из четырех цепей РНК. У прокариот они состоят из трех цепей РНК.
CrossRef Полный текст | Google Scholar
Заведующий, Б.П., Патель, Х. Х., Инсел, П. А. (2014). Взаимодействие мембранных / липидных рафтов с цитоскелетом: влияние на передачу сигналов и функции: мембранные / липидные рафты, медиаторы расположения цитоскелета и клеточные сигналы. Biochim. Биофиз. Acta 1838, 532–545. DOI: 10.1016 / j.bbamem.2013.07.018
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Helfrich, W. (1973). Упругие свойства липидных бислоев: теория и возможные эксперименты. Z. Nat. Teil C Biochem.Биофиз. Биол. Virol. 28, 693–703. DOI: 10.1515 / znc-1973-11-1209
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хуанг К. и Томпсон Т. Э. (1965). Свойства двухслойных липидных мембран, разделяющих две водные фазы: определение толщины мембраны. J. Mol. Биол. 13, 183–193. DOI: 10.1016 / S0022-2836 (65) 80088-2
CrossRef Полный текст | Google Scholar
Huber, F., Schnauß, J., Rönicke, S., Rauch, P., Müller, K., Fütterer, C., et al. (2013). Возникающая сложность цитоскелета: от единичных нитей до ткани. Adv. Phys. 62, 1–112. DOI: 10.1080 / 00018732.2013.771509
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Hundt, N., Preller, M., Swolski, O., Ang, A.M., Mannherz, H.G., Manstein, D.J., et al. (2014). Молекулярные механизмы связанных с заболеванием мутаций β-актина человека p.R183w и p.E364k. FEBS J. 281, 5279–5291. DOI: 10.1111 / febs.13068
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Джеймс, Д.Дж., Ходтонг, К., Ковальчик, Дж. А., и Мартин, Т. Ф. Дж. (2010). Фосфатидилинозитол-4,5-бисфосфатная регуляция функции SNARE при слиянии мембран, опосредованном CAPS. Adv. Enzyme Regul. 50, 62–70. DOI: 10.1016 / j.advenzreg.2009.10.012
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Камм Р., Гродзинский А. (2015). Молекулярная, клеточная и тканевая биомеханика. Кембридж, Массачусетс: Массачусетский технологический институт.
Google Scholar
Каплан, Дж.М., Ким, С. Х., Норт, К. Н., Реннке, Х., Коррейя, Л. А., Тонг, Х. К. и др. (2000). Мутации в ACTN4, кодирующем альфа-актинин-4, вызывают семейный фокальный сегментарный гломерулосклероз. Nat. Genet. 24, 251–256. DOI: 10.1038 / 73456
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Картен Б., Вэнс Д. Э., Кампенот Р. Б. и Вэнс Дж. Э. (2002). Холестерин накапливается в телах клеток, но снижается в дистальных аксонах С1-дефицитных нейронов Ниманна-Пика. J. Neurochem. 83, 1154–1163. DOI: 10.1046 / j.1471-4159.2002.01220.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Kasas, S., Wang, X., Hirling, H., Marsault, R., Huni, B., Yersin, A., et al. (2005). Поверхностные и глубокие изменения механических свойств клетки после разборки цитоскелета. Cell Motil. Цитоскелет 62, 124–132. DOI: 10.1002 / см. 2006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Колодзей, Дж.А. (1988). Влияние пористости пористой среды на эффективную вязкость в уравнении фильтрации Бринкмана. Acta Mech. 75, 241–254. DOI: 10.1007 / BF01174638
CrossRef Полный текст | Google Scholar
Конинг, Р. И., Зовко, С., Барсена, М., Остергетель, Г. Т., Кёртен, Х. К., Гальярт, Н., и др. (2008). Криоэлектронная томография застеклованных фибробластов: микротрубочка плюс концы in situ. J. Struct. Биол. 161, 459–468. DOI: 10.1016 / j.jsb.2007.08.011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Laganowsky, A., Reading, E., Allison, T. M., Ulmschneider, M. B., Degiacomi, M. T., Baldwin, A. J., et al. (2014). Мембранные белки избирательно связывают липиды, чтобы модулировать их структуру и функцию. Природа 510, 172–175. DOI: 10.1038 / природа13419
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ларсон Р. Э. и Хигдон Дж. Дж. Л. (1986). Микроскопическое течение у поверхности двумерных пористых сред.Часть 1. Осевой поток. J. Fluid Mech. 166, 449–472. DOI: 10.1017 / S0022112086000228
CrossRef Полный текст | Google Scholar
Ларсон Р. Э. и Хигдон Дж. Дж. Л. (1987). Микроскопическое течение у поверхности двумерных пористых сред. Часть 2. Поперечный поток. J. Fluid Mech. 178, 119–136. DOI: 10.1017 / S0022112087001149
CrossRef Полный текст | Google Scholar
Ле Ру, А.-Л., Кирога, X., Валани, Н., Арройо, М., и Рока-Кусакс, П.(2019). Плазматическая мембрана как механохимический преобразователь. Philos. Пер. R. Soc. Лондон. Сер. B Biol. Sci. 374: 20180221. DOI: 10.1098 / rstb.2018.0221
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лу, Х., Фагнант, П. М., Буквалтер, К. С., Джоэл, П., и Трибус, К. М. (2015). Мутация R258C в ACTA2, вызывающая заболевания сосудов, нарушает динамику актина и взаимодействие с миозином. Proc. Natl. Акад. Sci. США 112, E4168 – E4177. DOI: 10,1073 / PNAS.1507587112
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мейерс, М. А., и Чавла, К. К. (2010). Механическое поведение материалов , 2-е изд. Кембридж, Массачусетс: Издательство Кембриджского университета.
Google Scholar
Мофрад, М. Р. К., и Камм, Р. Д. (2006). Механика цитоскелета: модели и измерения в клеточной механике. Кембриджские тексты в биомедицинской инженерии. Кембридж, Массачусетс: Издательство Кембриджского университета.
Google Scholar
Маллинз Р.Д., Хойзер, Дж. А., и Поллард, Т. Д. (1998). Взаимодействие комплекса Arp2 / 3 с актином: зарождение, кэппирование заостренных концов с высоким сродством и образование разветвленных сетей филаментов. Proc. Natl. Акад. Sci. США 95, 6181–6186. DOI: 10.1073 / pnas.95.11.6181
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Нагие, С., Саркер, М., Карамуз-Равари, М., Макиннес, А., и Чен, X. (2018). Моделирование механического поведения каркасов, построенных на 3D-биопостроении, с учетом проникновения в взаимосвязанные нити. Заявл. Sci. 8: 1422. DOI: 10.3390 / app80
CrossRef Полный текст | Google Scholar
Нернст, В. Х. (1889). Электромоторная эффективность ионов. Докторская диссертация, Тюбингенский университет, Тюбинген.
Google Scholar
Николсон, Г. Л. (2014). Жидко-мозаичная модель структуры мембраны: по-прежнему актуальна для понимания структуры, функции и динамики биологических мембран спустя более 40 лет. Biochim.Биофиз. Acta 1838, 1451–1466. DOI: 10.1016 / j.bbamem.2013.10.019
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ольбрих, К., Равич, В., Нидхэм, Д., и Эванс, Э. (2000). Водопроницаемость и механическая прочность бислоев полиненасыщенных липидов. Biophys. J. 79, 321–327. DOI: 10.1016 / S0006-3495 (00) 76294-1
CrossRef Полный текст | Google Scholar
Олиференко, С., Пайха, К., Хардер, Т., Герке, В., Шварцлер, К., Шварц, Х., и другие. (1999). Анализ Cd44-содержащих липидных рафтов: рекрутирование аннексина II и стабилизация актиновым цитоскелетом. J. Cell Biol. 146, 843–854.
Google Scholar
Пескин, С. С., Оделл, Г. М., и Остер, Г. Ф. (1993). Клеточные движения и тепловые колебания: броуновский храповик. Biophys. J. 65, 316–324. DOI: 10.1016 / S0006-3495 (93) 81035-X
CrossRef Полный текст | Google Scholar
Питер, Б. Дж., Кент, Х. М., Миллс, И.Г., Валлис, Ю., Батлер, П. Дж. Г., Эванс, П. Р. и др. (2004). Барные домены как сенсоры кривизны мембраны: структура BAR амфифизина. Наука 303, 495–499. DOI: 10.1126 / science.1092586
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Прокаччо В., Салазар Г., Оно С., Стайерс М. Л., Геринг М., Давила А. и др. (2006). Мутация бета-актина, изменяющая динамику деполимеризации, связана с аутосомно-доминантными пороками развития, глухотой и дистонией. Am. J. Hum. Genet. 78, 947–960. DOI: 10.1086 / 504271
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Pucadyil, T. J., and Chattopadhyay, A. (2006). Роль холестерина в функции и организации рецепторов, связанных с G-белком. Prog. Lipid Res. 45, 295–333. DOI: 10.1016 / j.plipres.2006.02.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Rawicz, W., Olbrich, K. C., McIntosh, T., Needham, D., and Evans, E.(2000). Влияние длины цепи и ненасыщенности на эластичность липидных бислоев. Biophys. J. 79, 328–339.
Google Scholar
Schroer, C. F. E., Baldauf, L., van Buren, L., Wassenaar, T. A., Melo, M. N., Koenderink, G.H., et al. (2020). Заряд-зависимые взаимодействия мономерного и нитчатого актина с липидными бислоями. Proc. Natl. Акад. Sci. США 117, 5861–5872. DOI: 10.1073 / pnas.14117
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сечи, А.С., и Веланд Дж. (2000). Связь актинового цитоскелета и плазматической мембраны: птдины (4,5) P (2) влияют на активность цитоскелетных белков на плазматической мембране. J. Cell Sci. 113 (Pt 21), 3685–3695.
Google Scholar
Зайдель А., Лепенис И., Энглер Т., Шериф К. и Застрау Б. У. (2009). Аспекты ползучести текстильных армирующих материалов для композитных материалов. Open Mater. Sci. J. 3, 67–79. DOI: 10.2174 / 1874088X000067
CrossRef Полный текст | Google Scholar
Зайферт, Р., и Венцель-Зайферт, К. (2002). Конститутивная активность рецепторов, связанных с G-белком: причина болезни и общее свойство рецепторов дикого типа. Арка Наунин Шмидеберг. Pharmacol. 366, 381–416. DOI: 10.1007 / s00210-002-0588-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сенс П., Пластино Дж. (2015). Напряжение мембраны и организация цитоскелета в подвижности клеток. J. Phys. 27: 273103. DOI: 10.1088 / 0953-8984 / 27/27/273103
CrossRef Полный текст | Google Scholar
Ши, З., Грабер, З. Т., Баумгарт, Т., Стоун, Х. А., Коэн, А. Э. (2018). Клеточные мембраны сопротивляются потоку. Ячейка 175, 1769.e13–1779.e13. DOI: 10.1016 / j.cell.2018.09.054
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сингх А., Саха Т., Бегеманн И., Рикер А., Нюссе Х., Торн-Сесхолд О. и др. (2018). Динамика поляризованных микротрубочек направляет клеточную механику и координирует силы во время морфогенеза эпителия. Nat. Cell Biol. 20, 1126–1133.DOI: 10.1038 / s41556-018-0193-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Стюарт, М. П., Хелениус, Дж., Тойода, Ю., Раманатан, С. П., Мюллер, Д. Дж., И Хайман, А. А. (2011). Гидростатическое давление и актомиозиновая кора приводят к округлению митотических клеток. Природа 469, 226–230. DOI: 10.1038 / nature09642
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сугимото Ю., Уитмен М., Кэнтли Л. К. и Эриксон Р. Л. (1984).Доказательства того, что продукт гена, трансформирующий вирус саркомы Рауса, фосфорилирует фосфатидилинозитол и диацилглицерин. Proc. Natl. Акад. Sci. США 81, 2117–2121. DOI: 10.1073 / pnas.81.7.2117
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Sun, F., Schroer, C.F.E., Xu, L., Yin, H., Marrink, S.J., и Luo, S.-Z. (2018). Молекулярная динамика ассоциации L-селектина и FERM регулируется PIP2. Biophys. J. 114, 1858–1868. DOI: 10.1016 / j.bpj.2018.02.034
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Васанджи А., Гош П. К., Грэм Л. М., Эппелл С. Дж. И Фокс П. Л. (2004). Поляризация микровязкости плазматической мембраны при миграции эндотелиальных клеток. Dev. Cell 6, 29–41. DOI: 10.1016 / s1534-5807 (03) 00397-6
CrossRef Полный текст | Google Scholar
Венкатакришнан, А. Дж., Деупи, X., Лебон, Г., Тейт, К. Г., Шертлер, Г. Ф., и Бабу, М. М. (2013).Молекулярные сигнатуры рецепторов, связанных с G-белком. Nature 494, 185–194. DOI: 10.1038 / природа11896
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ван У., Ян Л. и Хуанг Х. У. (2007). Доказательства накопления холестерина в областях с высокой кривизной: влияние на упругую энергию кривизны для липидных смесей. Biophys. J. 92, 2819–2830. DOI: 10.1529 / biophysj.106.097923
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Уорд, Н.-А., Херст, С., Уильямс, Дж., И Финдли, Дж. Б. С. (2012). Фармакологические шапероны увеличивают экспрессию на клеточной поверхности внутриклеточных мутантов рецептора меланокортина 4 с уникальными профилями спасительной эффективности. Biochem. Soc. Пер. 40, 717–720. DOI: 10.1042 / BST20110764
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Во, Р., и Эванс, Э. А. (1979). Термоэластичность мембраны эритроцитов. Biophys. J. 26, 115–131.DOI: 10.1016 / S0006-3495 (79) 85239-X
CrossRef Полный текст | Google Scholar
Westkämper, E., and Warnecke, H.-J. (2011). Einführung in die Fertigungstechnik (8., aktualis. U. Erw. Aufl., Korr. Nachdr). Чам: Vieweg + Teubner.
Google Scholar
Уоллман, Р., Мейер, Т. (2012). Скоординированные колебания кортикального актина и Са2 + коррелируют с циклами секреции везикул. Nat. Cell Biol. 14, 1261–1269. DOI: 10.1038 / ncb2614
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Заканы, Ф., Ковач, Т., Пани, Г., и Варга, З. (2020). Прямое и непрямое воздействие холестерина на мембранные белки с особым акцентом на калиевые каналы. Biochim. Биофиз. Acta Mol. Cell Biol. Липиды 1865: 158706. DOI: 10.1016 / j.bbalip.2020.158706
PubMed Аннотация | CrossRef Полный текст | Google Scholar
яиц осмоса | Центр наномасштабных наук
Время
45 минут (в течение 3 дней)
Соответствие возрасту
10-12 лет
Введение
Ячейка — самая простая и мельчайшая единица жизни.Все живые существа состоят из клеток. Некоторые живые существа состоят только из одной клетки; однако большинство известных нам живых существ, включая растения, животных и даже людей, состоят из множества клеток. Человеческое тело состоит из миллиардов крошечных клеток, каждая из которых окружена селективно проницаемой мембраной . Мембрана клетки отделяет клетку от всего, что ее окружает. Мембрана клетки «избирательно проницаема», так как одни предметы могут легко проходить через нее, а другие не могут проходить через нее очень легко или вообще.
Все куриные яйца окружает твердая внешняя оболочка. Но знаете ли вы, что под этой оболочкой находится мембрана, похожая на ту, что окружает клетки? В этом эксперименте мы воспользуемся этим фактом, удалив оболочку, чтобы более внимательно изучить мембрану.
Вы когда-нибудь помещали чернила в воду и видели, как чернила медленно перемещаются по воде? Этот процесс называется диффузией . Естественно, чернила будут растекаться по воде до тех пор, пока в воде не будет одинаковой плотности и чернил.Чернила будут полностью распылены в воде, когда чернила будут полностью равномерно распределены в воде. Другой подобный процесс называется осмос . Осмос — это просто диффузия через мембрану. Вещества, естественно, будут пытаться «выровняться», что означает, что, если они могут двигаться через мембрану, они будут пытаться получить одинаковую плотность с обеих сторон мембраны. Вещества будут перемещаться из области с более высокой концентрацией (или плотностью) в область с более низкой концентрацией через мембрану.Если концентрация одинакова на обеих сторонах мембраны, говорят, что вещество достигло равновесия .
В деятельности мы будем:
Предварительная активность
Представьте, что белые точки — это молекулы воды, а черные точки — это молекулы чернил. Выберите картинку, которая представляет собой вещество, достигшее равновесия.
Что делать, если по какой-то причине чернила не могли пройти через мембрану? Достигнет ли когда-нибудь равновесия вещество? Почему или почему нет?
Материалы
Действия
Это задание состоит из трех частей.Предполагается, что первая часть мероприятия выполняется днем или вечером, вторая часть мероприятия может выполняться на следующий день или вечером, а третья часть — на следующий день.
Часть 1:
Часть 2:
Часть 3:
Расширение деятельности
Как вы понимаете, если слишком много воды попадет в яйцо из-за осмоса, это может привести к лопанию яичной мембраны! Иногда это также происходит с клетками нашего тела.
Мембрана куриного яйца во многом похожа на мембрану, окружающую клетки животных. Однако единственный процесс, который можно здесь наблюдать, называется пассивный транспорт . Это означает, что клетка не использовала энергию для перемещения предметов через мембрану. Еще один способ, которым живые клетки могут перемещать вещи через мембрану, — это активный транспорт . При активном транспорте клетке необходимо использовать энергию, чтобы перемещать предметы через мембрану.Используйте ресурсы, перечисленные в конце этого упражнения, чтобы изучить все способы, которыми мембрана может перемещать предметы через мембрану.
Резюме
Вы, наверное, заметили, что ширина некоторых яиц осталась прежней, некоторые из яиц увеличились в ширину, а другие фактически уменьшились в ширину. В случае каждого яйца вода была веществом, способным проходить через мембрану. В большинстве случаев молекулы воды — единственное, что разрешено проходить через мембрану яйца, поскольку это единственное, что достаточно мало.Однако при внимательном наблюдении вы, возможно, заметили, что некоторый синий пищевой краситель также прошел через яичную оболочку. Это связано с тем, что он также достаточно мал для прохода через мембрану.
Если яйцо уменьшилось в размерах, как это, вероятно, произошло с патокой и кукурузным сиропом, значит, вода вышла из яйца через мембрану. Это должно быть связано с более низкой концентрацией воды вне яйца в патоке или кукурузном сиропе, чем внутри яйца.
Если яйцо увеличилось в размере, как это, вероятно, произошло с простой и голубой водой, значит, вода переместилась в яйцо.Возможно, вы также заметили, что синий пищевой краситель также попал внутрь яйца, когда вы его вытащили. Это связано с тем, что синий пищевой краситель также достаточно мал, чтобы легко проходить через мембрану. Как и в случае с патокой и кукурузным сиропом, вода перемещалась из области с более низкой концентрацией в область более высокой концентрации; однако более низкая концентрация воды была внутри яйца в случаях с чистой водой и голубой водой.
Таблица данных
Вещество | Ширина до | Ширина после | Что было внутри яйца? | Другие наблюдения | |
Яйцо 1 | |||||
Яйцо 2 | |||||
Яйцо 3 | |||||
Яйцо 4 |
Ресурсы
http: // medmyst.ris.edu/html/lessons/MM-TM2-33.pdf
http://www.johnkyrk.com/cellmembrane.html
http://www.accessexcellence.org/RC/VL/GG/passActiveTrans.html
http://www.purchon.com/biology/osmosis.htm
| Филогенетика | Геология | Биохимия | Клеточная биология | Экология | История жизни | Зоология | Ботаника | Палеогеография | | |
амебоид — не имеющий определенной формы для клетки, способный изменять форму. | |
amphiesma — Наружное покрытие динофлагелляты, состоящее из нескольких слоев мембраны. | |
отверстие — Небольшое отверстие, например отверстие в тесте с отверстием. | |
бактериофаг — Вирус, который заражает и уничтожает бактериального хозяина. Однако некоторые фаги встраивают свою ДНК в ДНК своего хозяина и остаются бездействующими в течение длительного периода.По этой причине они стали незаменимыми инструментами генных инженеров. | |
капсид — Белковая «оболочка» свободной вирусной частицы. | |
ячейка — основная структурная единица всего живого. Клетка состоит в основном из внешней плазматической мембраны, которая отделяет ее от окружающей среды; генетический материал (ДНК), который кодирует наследуемую информацию для поддержания жизни; и цитоплазма, гетерогенная совокупность ионов, молекул и жидкости. | |
клеточный цикл — Полная последовательность шагов, которые должны быть выполнены клеткой для самовоспроизведения, как видно из митотического события к митотическому событию. Большая часть цикла состоит из периода роста, в течение которого клетка набирает массу и реплицирует свою ДНК. Остановка клеточного цикла — важная особенность воспроизводства многих организмов, включая человека. | |
клеточная мембрана — Наружная мембрана клетки, отделяющая ее от окружающей среды.Также называется плазматической мембраной или плазмалеммой. | |
клеточная стенка — Жесткая структура, отложенная вне клеточной мембраны. Растения известны своими клеточными стенками из целлюлозы, как и зеленые водоросли и некоторые простейшие, в то время как грибы имеют клеточные стенки из хитина. | |
хлоропласт — хлорофилл-содержащая пластида, обнаруженная в клетках водорослей и зеленых растений. | |
хромосома — линейный фрагмент эукариотической ДНК, часто связанный специализированными белками, известными как гистоны. | |
ценоцитарный — Состояние, при котором организм состоит из нитчатых клеток с большими центральными вакуолями, ядра которых не разделены на отдельные части. В результате получается длинная трубка, содержащая множество ядер со всей цитоплазмой на периферии. | |
колониальный — Состояние, при котором многие одноклеточные организмы живут вместе в несколько скоординированной группе. В отличие от настоящих многоклеточных организмов, отдельные клетки сохраняют свою индивидуальность и, как правило, свои собственные мембраны и клеточные стенки. | |
сократительная вакуоль — У многих протистов специализированная вакуоль с соответствующими каналами, предназначенная для сбора избыточной воды в клетке. Микротрубочки периодически сокращаются, чтобы вытеснить эту избыточную воду из клетки, регулируя осмотический баланс клетки. | |
цитоплазма — Все содержимое клетки, включая плазматическую мембрану, но не включая ядро. | |
цитоскелет — Интегрированная система молекул внутри эукариотических клеток, которая придает им форму, внутреннюю пространственную организацию, подвижность и может способствовать общению с другими клетками и окружающей средой.Например, красные кровяные тельца были бы сферическими, а не плоскими, если бы не их цитоскелет. | |
дикариотический — Имеющий два разных и разных ядра на клетку; содержится в грибах. Дикариотическая особь называется дикарионом. | |
диплоид — наличие двух разных наборов хромосом в одном ядре каждой клетки. Большинство многоклеточных животных и растений диплоидны. Сравните с гаплоидом. | |
двойная мембрана — В митохондриях и пластидах есть двухслойная мембрана, которая окружает органеллу.Считается, что это результат эндосимбиоза, когда внешняя мембрана происходит от эукариотической клетки, а внутренняя мембрана принадлежит первоначальному прокариоту, который был «проглочен». | |
эндоплазматический ретикулум — (ER) сеть мембран в эукариотических клетках, которая помогает контролировать синтез белка и клеточную организацию. | |
эукариот — н. Организм, клетки которого имеют цитоскелеты для поддержки, а их ДНК содержится в ядре, отделенном от другого содержимого клетки; е.g., простейшие, растения, животные и грибы; эукариот — прил. | |
внеклеточный матрикс — (ECM) Область вне клеток многоклеточных животных, которая включает соединения, прикрепленные к плазматической мембране, а также растворенные вещества, привлеченные поверхностным зарядом клеток. ЕСМ функционирует как для удержания животных клеток вместе, так и для их защиты от окружающей среды. | |
глазное пятно — Светочувствительная органелла, обнаруженная во многих группах простейших и у некоторых многоклеточных. | |
филамент — Длинная цепочка белков, например, в волосах, мышцах или жгутиках. | |
fission — Деление одноклеточных организмов, особенно прокариот, у которых митоз не происходит. Также используется для обозначения митоза у некоторых одноклеточных грибов. | |
жгутик — н. Волосоподобная структура, прикрепленная к клетке, используется для передвижения у многих простейших и прокариот.Прокариотический жгутик отличается от эукариотического жгутика тем, что прокариотический жгутик представляет собой твердую единицу, состоящую в основном из белка флагеллина, в то время как эукариотический жгутик состоит из нескольких белковых нитей, связанных мембраной, и не содержит флагеллина. Жгутик эукариот иногда называют ундулиподиумом. | |
панцирь — Минеральный «скелет» диатомовой водоросли или другого одноклеточного организма. | |
Аппарат Гольджи — эукариотическая органелла, которая упаковывает клеточные продукты, такие как ферменты и гормоны, и координирует их транспорт за пределы клетки. | |
гаплоид — Наличие одного набора хромосом в ядре каждой клетки. Мхи, многие простейшие и грибы гаплоидны, как и некоторые насекомые, мохообразные и гаметы. всех организмов. Контраст с диплоид. | |
haptonema — Колышковая структура, уникальная для Prymnesiophyta; его функция неизвестна. | |
lorica — Внешнее покрытие в форме вазы или чашки.Обнаружен во многих простейших, включая некоторых жгутиконосцев, инфузорий, хризофитов и хоанофлагеллят, а также в некоторых клетках животных. | |
лизосома — эукариотическая органелла, несущая пищеварительные ферменты. Лизосома сливается с вакуолярной мембраной, содержащей проглоченные частицы, на которые затем действуют ферменты. | |
мастигонема — Небольшие волосовидные нити, обнаруженные на «волосатом» жгутике Chromista. | |
мембрана — В биологии пограничный слой внутри или вокруг живой клетки или ткани. | |
мезокариотический — Ядерное состояние, уникальное для динофлагеллят, при котором хромосомы остаются постоянно конденсированными. | |
микротрубочек — Тип филамента в эукариотических клетках, состоящий из единиц протеина тубулина. Помимо других функций, это основной структурный компонент жгутика эукариот. | |
микроворсинок — Тонкие пальцевидные выступы на поверхности клетки, часто используемые для увеличения абсорбционной способности или для улавливания частиц пищи. «Воротник» хоанофлагеллят на самом деле состоит из близко расположенных микроворсинок. | |
митохондрия — Сложная органелла, обнаруженная у большинства эукариот; Считается, что они произошли от свободноживущих бактерий, которые установили симбиотические отношения с примитивными эукариотами.Митохондрии являются местом производства большей части энергии у большинства эукариот; им для работы необходим кислород. См .: двойная мембрана . | |
митоз — Процесс ядерного деления у эукариот. Это один шаг в цитокинезе или клеточном делении. БОЛЕЕ ?. | |
MTOC — (центр организации микротрубочек) MTOC представляют собой пучки белковых трубок, которые могут находиться в основании жгутика эукариот.У животных они также участвуют в создании массивов микротрубочек, которые разделяют хромосомы во время митоза. | |
многоклеточный — Любой организм, состоящий из множества клеток, называется многоклеточным. | |
нм — n. Единица измерения; одна миллионная (10 -9 ) метра. | |
ядерная мембрана — Двойная мембрана, которая окружает эукариотическое ядро.На его поверхности много пор, которые регулируют поток крупных соединений в ядро и из него. | |
нуклеоид — Область в прокариотах, где сконцентрирована ДНК. В отличие от ядра он не связан мембраной. | |
ядро — Органелла, связанная с мембраной, которая содержит ДНК в виде хромосом. Это место репликации ДНК и место синтеза РНК. | |
органелла — н.Мембраносвязанная структура в эукариотической клетке, которая разделяет клетку на области, которые выполняют различные клеточные функции, например, митохондрии, эндоплазматический ретикулум, лизосомы. | |
плазматическая мембрана — Наружная мембрана клетки, иногда называемая клеточной мембраной. Термин «плазматическая мембрана» чаще используется при обсуждении прокариот. | |
плазмида — Круговая петля ДНК у прокариот.Эукариотическая ДНК организована в хромосомы. | |
пластида — Любая из нескольких пигментированных цитоплазматических органелл, обнаруженных в клетках растений и другие организмы, выполняющие различные физиологические функции, такие как синтез и хранение пищи. | |
прокариот — Буквально «перед ядром», этот термин применяется ко всем бактериям и архее. Прокариотические клетки не имеют внутренних мембран или цитоскелета.Их ДНК круговая, а не линейная. | |
протоплазма — Все содержимое клетки, включая ядро. (см .: цитоплазма) | |
псевдоподии — пальцевидные отростки из амебоидной клетки; буквально «ложные ноги». | |
повторяющихся последовательностей — Длина нуклеотидной последовательности, которая повторяется в тандемном кластере. | |
reticulopodia — Длинные нитевидные псевдоподии, которые разветвляются и соединяются, образуя тонкую сеть.Они характерны для форам. | |
рибосома — (рибосомная РНК) | |
синцитик — см. Hexactinellida | |
— тест Твердая оболочка, производимая некоторыми одноклеточными простейшими; может состоять из карбоната кальция, кремнезема или песчинок. | |
theca — Общий термин для любого жесткого внешнего покрытия одноклеточного протиста, обычно состоящего из сцепляющихся пластин.динофлагелляты и диатомовые водоросли являются примерами простейших с теками. | |
трансдукция — Вирусный перенос ДНК новому хозяину. | |
трихоциста — Органелла инфузорий и динофлагеллят, которая высвобождает белки длинных нитей при повреждении клетки. Используется как защита от потенциальных хищников. | |
ультраструктура — Подробная структура образца, например клетки , ткани или органа , что можно наблюдать только с помощью электронной микроскопии.Также называется тонкой структурой. В яичной скорлупе ультраструктура относится к трехмерному расположению минеральных кристаллов и органического вещества. Он описывается с точки зрения минералогии кальцита или арагонита и перехода между различными зонами организации внутри оболочки. Отчетливые зоны организации называются зонами ультраструктуры. | |
undulipodium — Другой термин для обозначения жгутика эукариот. | |
вакуоль — Мембранно-связанное заполненное жидкостью пространство внутри ячейки.В большинстве растительных клеток есть одна большая вакуоль, заполняющая большую часть объема клетки. Некоторые бактериальные клетки содержат газовые вакуоли. | |
| Последнее обновление: 12.11.2009 | |
Молекулярные выражения Биология клетки: структура клеток животных
Структура клеток животных
Клетки животных являются типичными для эукариотических клеток, заключенных в плазматическую мембрану и содержащих мембраносвязанные ядра и органеллы.В отличие от эукариотических клеток растений и грибов, клетки животных не имеют клеточной стенки. Эта особенность была утеряна в далеком прошлом одноклеточными организмами, давшими начало царству Animalia . Большинство клеток, как животных, так и растений, имеют размер от 1 до 100 микрометров, поэтому их можно увидеть только с помощью микроскопа.
Отсутствие жесткой клеточной стенки позволило животным развить большее разнообразие типов клеток, тканей и органов.Специализированные клетки, которые образовывали нервы и мышечные ткани, которые не могли развиваться растениям, обеспечивали этим организмам подвижность. Способность передвигаться с помощью специализированных мышечных тканей является отличительной чертой животного мира, хотя некоторые животные, в первую очередь губки, не обладают дифференцированными тканями. Примечательно, что простейшие передвигаются, но это происходит только немышечными способами, в сущности, с использованием ресничек, жгутиков и псевдоподий.
Царство животных уникально среди эукариотических организмов, потому что большинство тканей животных связаны во внеклеточном матриксе тройной спиралью белка, известного как коллаген .Клетки растений и грибов связаны друг с другом в тканях или скоплениях другими молекулами, такими как , пектин . Тот факт, что никакие другие организмы не используют коллаген таким образом, является одним из указаний на то, что все животные произошли от общего одноклеточного предка. Кости, раковины, спикулы и другие твердые структуры образуются, когда коллагенсодержащий внеклеточный матрикс между клетками животных кальцинируется.
Животные — большая и невероятно разнообразная группа организмов.Составляя около трех четвертей видов на Земле, они охватывают весь спектр от кораллов и медуз до муравьев, китов, слонов и, конечно же, людей. Мобильность дала животным, способным ощущать окружающую среду и реагировать на нее, гибкость, позволяющую применять множество различных способов питания, защиты и воспроизводства. Однако, в отличие от растений, животные не могут производить себе пищу и, следовательно, всегда прямо или косвенно зависят от растений.
Большинство животных клеток диплоидные , что означает, что их хромосомы существуют в гомологичных парах.Однако также известно, что иногда встречаются различные хромосомные плоидности. Размножение клеток животных происходит по-разному. В случаях полового размножения сначала необходим клеточный процесс мейоза , чтобы можно было продуцировать гаплоидные дочерние клетки или гамет . Затем две гаплоидные клетки сливаются, образуя диплоидную зиготу , которая развивается в новый организм по мере деления и размножения его клеток.
Самые ранние ископаемые свидетельства существования животных относятся к вендскому периоду , (от 650 до 544 миллионов лет назад), с существами типа кишечнополостных, которые оставили следы своих мягких тел в мелководных отложениях.Первое массовое вымирание положило конец этому периоду, но в последовавший за ним кембрийский период взрыв новых форм положил начало эволюционному излучению, которое произвело большинство основных групп или типов, известных сегодня. Позвоночные (животные с позвоночником), как известно, не встречались до начала ордовикского периода гг. г. (от 505 до 438 миллионов лет назад).
Клетки были обнаружены в 1665 году британским ученым Робертом Гуком, который впервые наблюдал их в своем грубом (по сегодняшним меркам) оптическом микроскопе семнадцатого века.Фактически, Гук ввел термин «клетка» в биологическом контексте, когда он описал микроскопическую структуру пробки, похожую на крошечную пустую комнату или клетку монаха. На рисунке 2 показаны пары фибробластов клеток кожи оленя, которые были помечены флуоресцентными зондами и сфотографированы под микроскопом, чтобы выявить их внутреннюю структуру. Ядра окрашиваются красным зондом, в то время как аппарат Гольджи и актиновая сеть микрофиламентов окрашиваются в зеленый и синий цвет соответственно. Микроскоп является фундаментальным инструментом в области клеточной биологии и часто используется для наблюдения за живыми клетками в культуре.Воспользуйтесь ссылками ниже, чтобы получить более подробную информацию о различных компонентах, содержащихся в клетках животных.
Помимо оптического и электронного микроскопов, ученые могут использовать ряд других методов, чтобы исследовать тайны животной клетки.Клетки можно разбирать химическими методами, а их отдельные органеллы и макромолекулы выделять для исследования. Процесс фракционирования клеток позволяет ученым в больших количествах готовить определенные компоненты, например митохондрии, для исследования их состава и функций. Используя этот подход, клеточные биологи смогли назначить различные функции определенным участкам внутри клетки. Однако эра флуоресцентных белков вывела микроскопию на передний план в биологии, позволив ученым нацеливать живые клетки с помощью высоколокализованных зондов для исследований, которые не нарушают хрупкий баланс жизненных процессов.
НАЗАД В СТРУКТУРУ ЯЧЕЙКИ ДОМАШНИЙ
НАЗАД К ФЛУОРЕСЦЕНТНОЙ МИКРОСКОПИИ КЛЕТОК
