Центриоль — это… Что такое Центриоль?
Центрио́ль — внутриклеточный органоид эукариотической клетки, представляющий тельца в структуре клетки, размер которых находится на границе разрешающей способности светового микроскопа.
Эти органеллы в делящихся клетках принимают участие в формировании веретена деления и располагаются на его полюсах. В неделящихся клетках центриоли часто определяют полярность клеток эпителия и располагаются вблизи комплекса Гольджи.
Строение
Термин был предложен Теодором Бовери в 1895 году. Тонкое строение центриолей удалось изучить с помощью электронного микроскопа. В некоторых объектах удавалось наблюдать центриоли, обычно расположенные в паре (диплосома), и окруженные зоной более светлой цитоплазмы, от которой радиально отходят тонкие фибриллы (центросфера). Совокупность центриолей и центросферы называют клеточным центром.
Чаще всего пара центриолей лежит вблизи ядра. Каждая центриоль построена из цилиндрических элементов (микротрубочек), образованных в результате полимеризации белка тубулина.
Функции
Центриоли принимают участие в формировании цитоплазматических микротрубочек во время деления клетки и в регуляции образования митотического веретена. В клетках высших растений и большинства грибов центриолей нет, и митотическое веретено образуется там иным способом. Кроме того, ученые полагают, что ферменты клеточного центра принимают участие в процессе перемещения дочерних хромосом к разным полюсам в анафазе митоза.
Цикл развития
Обычно в течение клеточного цикла центриоль удваивается один раз. Рядом с каждой половинкой «материнской» центриоли достраивается «дочерний» цилиндрик; происходит это, как правило, в течение S-периода интерфазы. В профазе митоза две центриоли расходятся к полюсам клетки и формируют две центросомы. Центросомы в свою очередь служат ЦОМТами (центрами организации микротрубочек) веретена деления. Однако от этой общей схемы существует масса отклонений. Во многих клетках центриоли многократно удваиваются за один клеточный цикл.
Примечания
- ↑ Manandhar, G., Schatten, H., Sutovsky, P. (2005). Centrosome reduction during gametogenesis and its significance.
В этой статье не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена.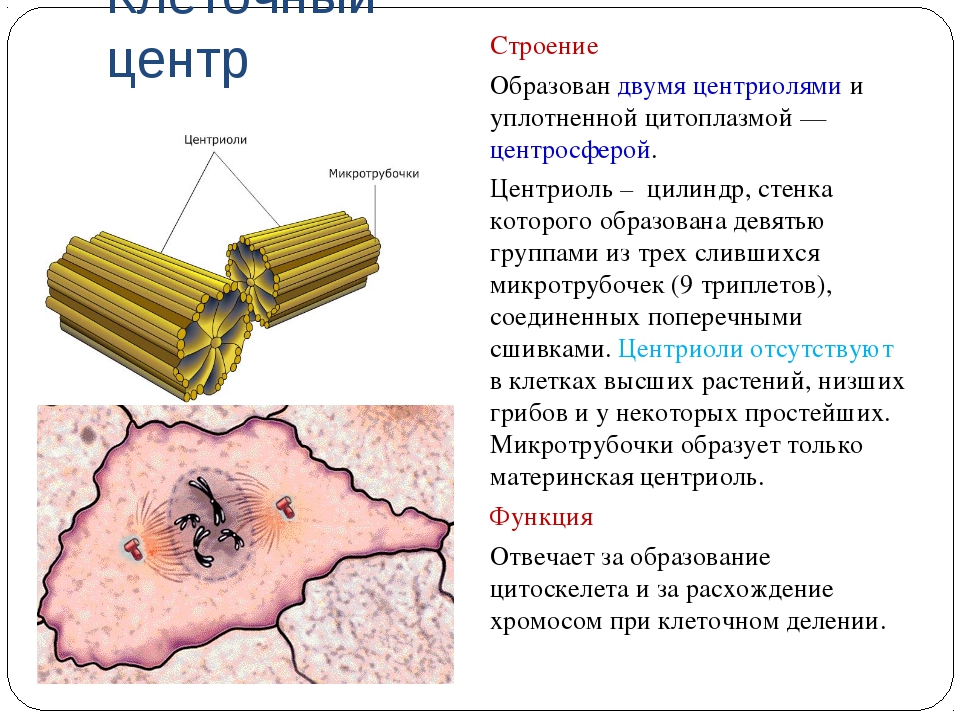 Вы можете отредактировать эту статью, добавив ссылки на авторитетные источники. Эта отметка установлена 15 мая 2011. |
Что такое центриоли клетки: строение и функции.
В конце XIX века британским бактериологом Флеммингом и бельгийским цитологом Бенеденом были открыты клеточные центры, или центросомы. Тогда же ученые обнаружили, что они состоят из более мелких структур – центриолей. Изучить подробнее, что такое центриоли и каково их тонкое строение, удалось только к середине XX в. с помощью электронных микроскопов. Однако ответы на многие вопросы, касающиеся этих органелл, науке до сих пор неизвестны.
Что такое центриоли?
Центриоли представляют собой немембранную структуру в виде мелких телец, которые входят в состав клеточного ядра. Их с трудом можно рассмотреть в электронный микроскоп. Они часто встречаются среди представителей царства Простейших, характерны для животных, иногда наблюдаются у некоторых видов грибов, а среди растений обнаружены только у мхов и папоротников.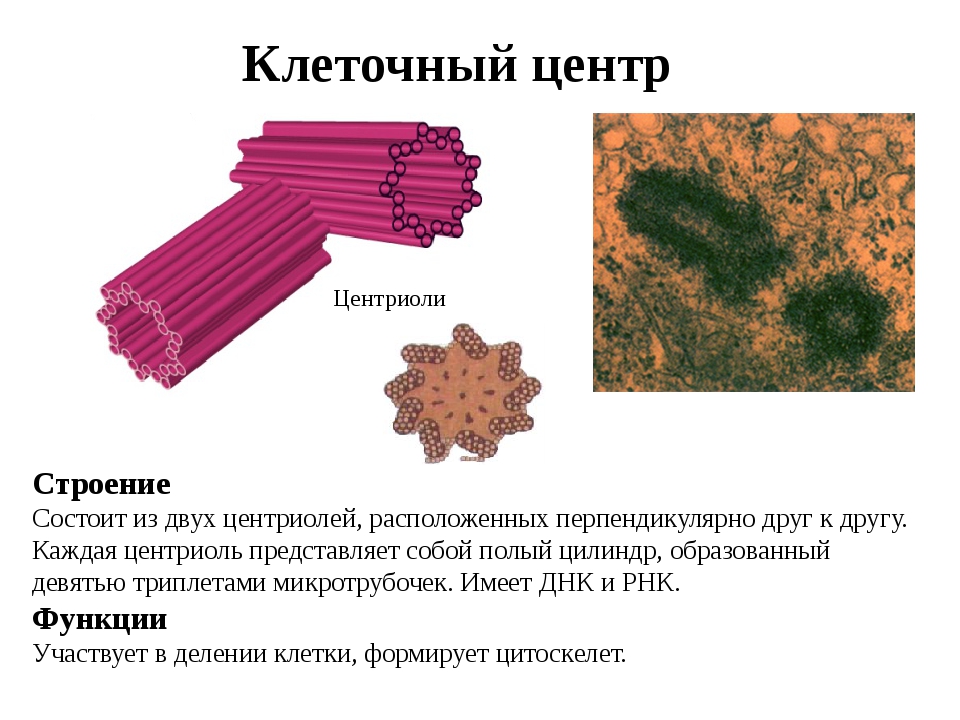
Центриоли в клетке окружены мелкозернистым полужидким веществом, которое либо не обладает четко определенной структурой, либо имеет волокнистый вид.
Строение
Основу строения центриолей составляют 9 комплексов по 3 микротрубочки, которые образуют полый цилиндр. Его ширина в среднем составляет 0,15 мкм, а длина – 0,3-0,5 мкм. Эта клеточная структура обладает следующими особенностями:
- Первая трубочка, расположенная ближе к центру цилиндра – полная, она ее диаметр равен порядка 25 нм. Толщина ее стенки составляет всего 5 нм, она состоит из 13 белковых субъединиц. Последние представляют собой полипептидный, или мультимерный, комплекс.
- Последующие две трубочки являются неполными и плотно примыкают друг к другу. В их составе содержится 11 пептидных субъединиц.
- Триплеты расположены под углом около 40-45° к радиусу цилиндра.
- Микротрубочки погружены в аморфную субстанцию.
Кроме трубочек, в клеточных центриолях также имеются ручки-выросты, одни из которых направлены к соседним триплетам, а другие – к центру вышеописанного цилиндра.
Диплосомы
Перед тем, как начать делиться, клетка обычно всегда имеет 2 центриоли, образующие дуплет. Они располагаются перпендикулярно по отношению друг к другу и сближены так, что конец одной из них смотрит на цилиндрическую поверхность другой. Благодаря рисунку ниже можно понять, что такое центриоли в диплосоме.
Одна из центриолей в дуплете является материнской, а другая – дочерней. Внешне они отличаются тем, что на первой имеются выросты, или придатки, а на второй их нет. Для дочерней центриоли характерны также следующие особенности:
- В центре на одном из концов находится еще одна трубочка, от которой отходят 9 выростов. Они направлены к каждой первой микротрубочке триплета. Эта структура напоминает колесо со спицами.
- Длина «колесной» структуры в разных клетках может составлять от 20 до 75% от протяженности самой центриоли.
- Полярное строение. На втором конце, который располагается дальше от материнской центриоли, вышеописанное «колесо» отсутствует.

- У некоторых типов клеток вместо втулки имеется аморфная структура.
Функции
Функции центриолей еще мало изучены. Можно было бы предположить, что они участвуют в образовании веретена деления, однако они формируются и в клетках растений и грибов.
Ученые предполагают, что центриоли играют определенную роль в пространственной ориентации веретена деления по отношению к полюсам клетки. Микротрубочки в составе этих органоидов выполняют опорную функцию. Возможно, по аналогии с белковыми структурами, формирующими цитоскелет клетки, микротрубочки также служат для транспортировки определенных веществ.
В непосредственной близости от материнских центриолей находятся фокусы схождения микротрубочек в виде плотных мелких телец. С их помощью осуществляется «сборка» микротрубочек, служащих основой клеточного каркаса.
Развитие
Чаще всего за весь жизненный цикл клетки (от ее образования из материнской и до момента следующего деления или гибели) центриоли удваиваются только один раз. Сначала образуются по две половинки материнской и дочерней центриоли, а затем они перемещаются к полюсам, образуя центросомы.
Сначала образуются по две половинки материнской и дочерней центриоли, а затем они перемещаются к полюсам, образуя центросомы.
Однако из этого правила существует множество исключений:
- У некоторых видов клеток такое деление происходит неоднократно.
- В созревших яйцеклетках многих животных центриоли разрушаются.
- При образовании сперматозоидов центриоли распадаются. Одна из них трансформируется в кинетосому жгутика, а вторая остается неповрежденной.
- У улиток и некоторых видов грызунов распадаются обе центриоли сперматозоида.
Биохимия
Биохимия данных клеточных структур в современной цитологии изучена плохо, так как трудно выделить чистую фракцию для того, чтобы узнать, что такое центриоли. Также очень мал их объем – порядка 0,03 мкм3. В отличие от митохондрий, которых в клетке насчитывается около тысячи штук, и рибосом (а их порядка одного миллиона), центриоли – это одиночные клеточные структуры.
Данные об их химическом составе были получены в основном с помощью иммунохимического анализа. Реснички и жгутики у простейших, служащие клеткам для передвижения, имеют в основании базальные тельца, строение которых сходно с центриолями.
Реснички и жгутики у простейших, служащие клеткам для передвижения, имеют в основании базальные тельца, строение которых сходно с центриолями.
Ученым известно, что в состав микротрубочек входит белок тубулин. Он также имеется в клеточной цитоплазме. Этот белок необходим для роста микротрубочек и формирования веретена деления, которое обеспечивает расхождение хромосом при редукционном и непрямом делении клеток.
Существуют данные, что в составе центриолей могут находиться нуклеиновые кислоты, играющие важнейшую роль в передаче генетической информации. Однако их функции в составе данной клеточной структуры еще не изучены.
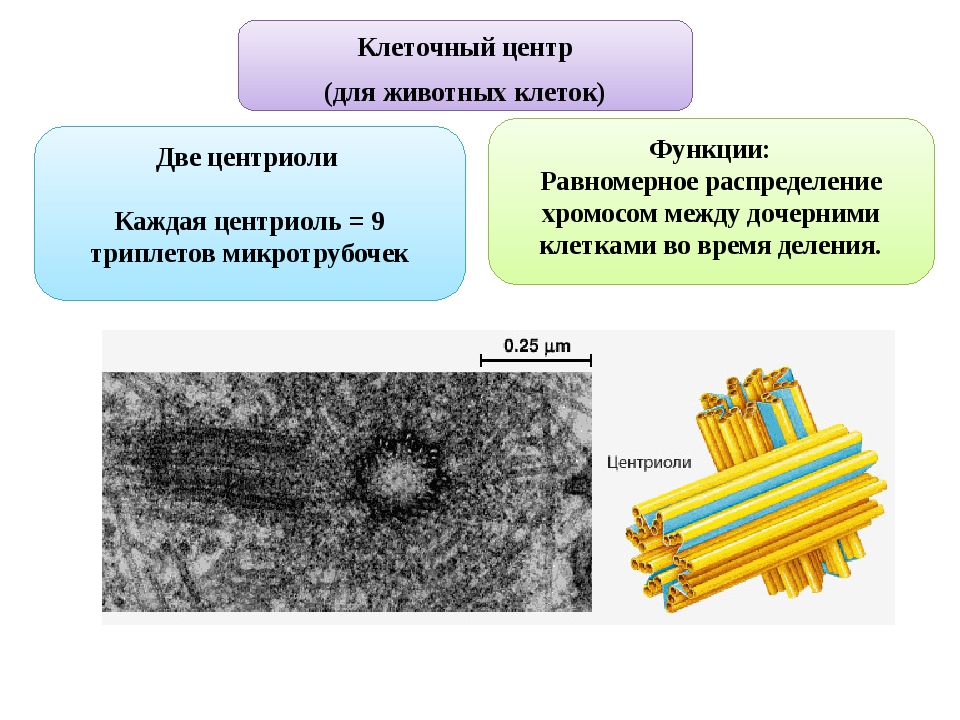
Клеточный центр. Органоиды движения. Клеточные включения
«Введение в общую биологию и экологию. 9 класс». А.А. Каменский (гдз)
Вопрос 1. Каковы функции клеточного центра?
Клеточный центр выполняет следующие функции в клетке:
1) принимает участие в делении клеток животных и низших растений. В начале деления (в профазе) центриоли расходятся к разным полюсам клетки. От центриолей к центромерам хромосом отходят нити веретена деления. В анафазе эти нити протягивают хроматиды к полюсам. После окончания деления центриоли остаются в дочерних клетках, удваиваются и образуют клеточный центр.
В начале деления (в профазе) центриоли расходятся к разным полюсам клетки. От центриолей к центромерам хромосом отходят нити веретена деления. В анафазе эти нити протягивают хроматиды к полюсам. После окончания деления центриоли остаются в дочерних клетках, удваиваются и образуют клеточный центр.
2) играет важную роль в организации цитоскелета, так как цитоплазматические микротрубочки расходятся во все стороны из этой области. Цитоскелет представляет собой сеть микротрубочек, пронизывающих цитоплазму, поддерживающих форму клетки, обеспечивающих движение органоидов клетки, а также работу специализированных органоидов движения — ресничек и жгутиков.
Вопрос 2. Где расположены центриоли?
В состав клеточного центра входят микротрубочки и две центриоли. Центриоли находятся в середине центра организации микротрубочек. Центриоли обнаружены не во всех клетках, имеющих клеточный центр (например, их нет у покрытосеменных растений). Каждая центриоль — это цилиндр размером около 1 мкм, по окружности которого расположены девять триплетов микротрубочек.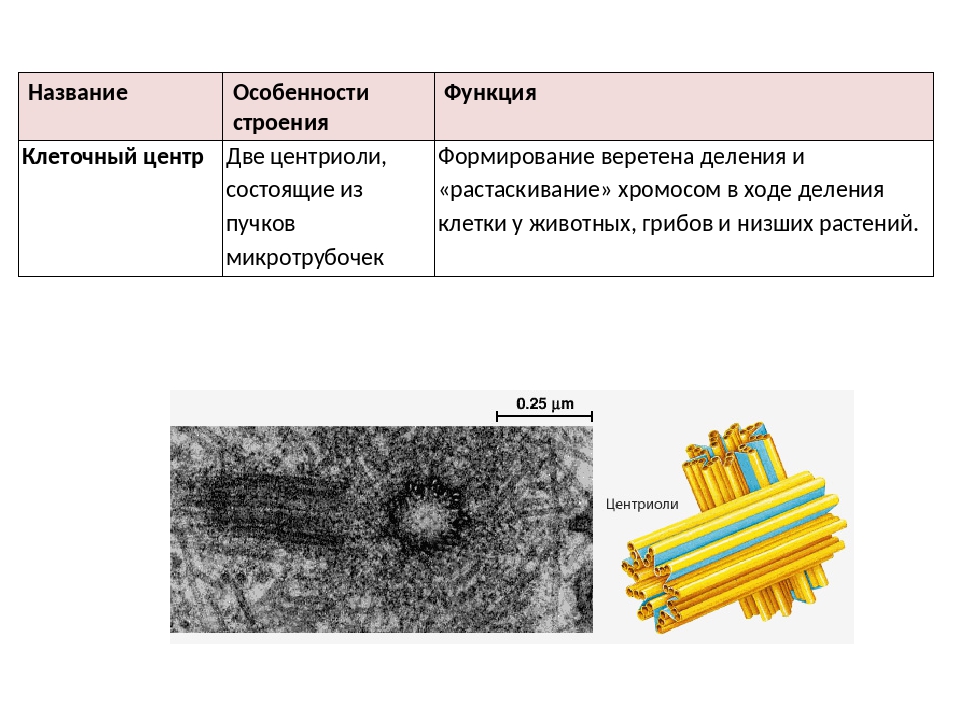 Центриоли располагаются под прямым углом друг к другу. В клетках животных и некоторых низших растений около ядра находятся два небольших интенсивно окрашивающихся тельца – центриоли. Вокруг центриолей располагается матрикс. Полагают, что в нем есть собственная ДНК (подобная митохондриальной ДНК), РНК и рибосомы.
Центриоли располагаются под прямым углом друг к другу. В клетках животных и некоторых низших растений около ядра находятся два небольших интенсивно окрашивающихся тельца – центриоли. Вокруг центриолей располагается матрикс. Полагают, что в нем есть собственная ДНК (подобная митохондриальной ДНК), РНК и рибосомы.
Вопрос 3. Каковы функции центриолей в клетке?
Центриоли входят в состав клеточного центра и обеспечивают нормальное деление клетки. Перед ее делением центриоли расходятся к полюсам, образуя веретено деления клетки. От каждой центриоли отходят тонкие нити в виде лучей, образующие звезду, а между расходящимися центриолями протягиваются белковые нити, свойства которых сходны со свойствами сократимого белка мышц – актомиозина. Нити веретена тянутся от экватора к полюсам, так что веретено представляет собой единую внутриклеточную структуру. Они участвуют в расхождении хроматид к полюсам клетки.
Вопрос 4. В чем сходство и различие между ресничками и жгутиками?
К клеточным органоидам движения относят реснички и жгутики
 Такие органоиды имеются у многих клеток (у простейших, одноклеточных водорослей, зооспор, сперматозоидов, в клетках тканей многоклеточных животных, например, в дыхательном эпителии).
Такие органоиды имеются у многих клеток (у простейших, одноклеточных водорослей, зооспор, сперматозоидов, в клетках тканей многоклеточных животных, например, в дыхательном эпителии).Функция этих органоидов заключается или в обеспечении движения (например, у простейших) или в продвижении жидкости вдоль поверхности клеток (например, в дыхательном эпителии для продвижения слизи). В основании и жгутика, и реснички лежит базальное тельце, которое укрепляет их в цитоплазме клетки. Механизм движения ресничек и жгутиков одинаков, в его основе лежит скольжение микротрубочек друг относительно друга. Сходство этих органоидов движения заключается также и в том, что на их работу расходуется энергия АТФ.
Различаются реснички и жгутики размерами. Жгутики в несколько раз длиннее ресничек. Кроме того, реснички, изгибаясь волнообразно, обеспечивают клетке плавное, медленное передвижение. Жгутик же осуществляет вращательные движения, что позволяет клетке активно перемещаться.
Вопрос 5. Назовите примеры клеточных включений.
Назовите примеры клеточных включений.
Клеточные включения — это непостоянные структуры клетки. К ним относятся капли и зерна белков, углеводов, жиров, а также кристаллические включения (органические кристаллы, которые могут образовывать в клетках белки, вирусы, соли щавелевой кислоты и т.д. и неорганические кристаллы, образованные солями кальция). В отличие от органоидов эти включения не имеют мембран или элементов цитоскелета и периодически синтезируются и расходуются. Капли жира используются как запасное вещество в связи с его высокой энергоемкостью; зерна углеводов (в виде крахмала у растений и гликогена у животных и грибов) — как источник энергии для образования АТФ; зерна белка — как источник строительного материала; соли кальция — для обеспечения про¬цесса возбуждения, обмена веществ и т.д.
Строение и функции белков — задания
Вернуться к теме «Строение и функции белков»
Задания по теме «Строение и функции белков» для самостоятельной подготовки к ЕГЭ по биологии
СКОРО! — Видео с объяснениями — СКОРО!
1. Установите соответствие между характеристикой химического вещества и веществом в организме человека
Установите соответствие между характеристикой химического вещества и веществом в организме человека
|
ФУНКЦИИ ВЕЩЕСТВ |
|
ХИМИЧЕСКИЕ ВЕЩЕСТВА |
|
А) специфичные катализаторы химических реакций В) бывают белковой и липидной природы Г) необходимы для нормального обмена веществ Д) выделяются непосредственно в кровь Е) в основном поступают вместе с пищей |
|
1) ферменты 2) гормоны 3) витамины |
2. Выберите примеры функций белков, осуществляемых ими на клеточном уровне жизни
1) обеспечивают транспорт ионов через мембрану
2) входят в состав волос, перьев
3) формируют кожные покровы
4) антитела связывают антигены
5) запасают кислород в мышцах
6) обеспечивают работу веретена деления
3. Выберите особенности строения молекул белков
Выберите особенности строения молекул белков
1) состоят из жирных кислот
2) состоят из аминокислот
3) мономеры молекулы удерживаются пептидными связями
4) состоят из одинаковых по строению мономеров
5) представляют собой многоатомные спирты
6) четвертичная структура молекул состоит из нескольких глобул
4. Выберите три функции, характерные только для белков
1) энергетическая
2) каталитическая
3) двигательная
4) транспортная
5) структурная
6) запасающая
5. Все приведённые ниже признаки, кроме двух, можно использовать для описания значения белков в организме человека и животных. Определите два признака, «выпадающих» из общего списка, и запишите в ответ цифры, под которыми они указаны
1) служат основным строительным материалом
2) расщепляются в кишечнике до глицерина и жирных кислот
3) образуются из аминокислот
4) в печени превращаются в гликоген
5) в качестве ферментов ускоряют химические реакции
6. Все перечисленные ниже признаки, кроме двух, можно использовать для описания молекулы инсулина. Определите два признака, «выпадающие» из общего списка, и запишите в таблицу цифры, под которыми они указаны
Все перечисленные ниже признаки, кроме двух, можно использовать для описания молекулы инсулина. Определите два признака, «выпадающие» из общего списка, и запишите в таблицу цифры, под которыми они указаны
1) состоит из аминокислот
2) гормон надпочечников
3) катализатор многих химических реакций
4) гормон поджелудочной железы
5) вещество белковой природы
7. Все перечисленные ниже признаки, кроме двух, можно использовать для описания яичного белка альбумина. Определите два признака, «выпадающих» из общего списка, и запишите в таблицу цифры, под которыми они указаны
1) состоит из аминокислот
2) пищеварительный фермент
3) денатурирует обратимо при варке яйца
4) мономеры связаны пептидными связями
5) молекула образует первичную, вторичную и третичную структуры
8. Белки в организме человека и животных
1) служат основным строительным материалом
2) расщепляются в кишечнике до глицерина и жирных кислот
3) образуются из аминокислот
4) в печени превращаются в гликоген
5) откладываются в запас
6) в качестве ферментов ускоряют химические реакции
9. Установите соответствие между характеристикой и функцией белка, которую он выполняет
Установите соответствие между характеристикой и функцией белка, которую он выполняет
|
ХАРАКТЕРИСТИКА БЕЛКА |
|
ФУНКЦИЯ БЕЛКА |
|
А) входит в состав центриолей Б) образует рибосомы В) представляет собой гормон Г) формирует мембраны клеток Д) изменяет активность генов |
|
1) регуляторная 2) структурная
|
10. Найдите ошибки в приведенном тексте, исправьте их. Укажите номера пред-ложений, в которых сделаны ошибки, объясните их
1. Большое значение в строении и жизнедеятельности организмов имеют белки. 2. Это биополимеры, мономерами которых являются азотистые основания. 3. Белки входят в состав плазматической мембраны. 4. Многие белки выполняют в клетке ферментативную функцию. 5. В молекулах белка зашифрована наследственная информация о признаках организма. 6. Молекулы белка и тРНК входят в состав рибосом.
5. В молекулах белка зашифрована наследственная информация о признаках организма. 6. Молекулы белка и тРНК входят в состав рибосом.
11. Какова природа большинства ферментов и почему они теряют свою активность при повышении уровня радиации?
12. Почему человек без опасных последствий употребляет в пищу белки в виде мяса, рыбы, яиц, а вводить белки сразу в кровь для питания больных ни в коем случае нельзя?
13. Может ли человек питаться только жирами, исключив из рациона белковую пищу?
14. Почему повышение температуры выше 40° опасно для жизни?
Центриоли — Определение, структура, функции и диаграмма
На главную »Клеточная биология» Центриоли — Определение, структура, функции и диаграмма
Центриоли Определение
- Эукариотические клетки содержат две цилиндрические стержневидные микротрубчатые структуры, называемые центриолями, около ядра.

- У них отсутствует ограничивающая мембрана и ДНК или РНК, и они встречаются в большинстве клеток водорослей (заметным исключением являются красные водоросли), клетках мха, некоторых клетках папоротников и большинстве клеток животных.
- Они отсутствуют у прокариот, красных водорослей, дрожжей, шишковидных и цветковых растений (хвойных и покрытосеменных), а также у некоторых простейших без жгутиков и без ресничек (например, амеб).
- Центриоли образуют веретено микротрубочек, митотический аппарат во время митоза или мейоза, и иногда располагаются непосредственно под плазматической мембраной, формируя и неся жгутики или реснички в жгутиковых или реснитчатых клетках.
- Когда центриоль несет жгутик или ресничку, ее называют базальным телом.
- Центриоли и базальные тела представляют собой цилиндрические структуры диаметром 0,15–0,25 мкм, обычно длиной 0,3–0,7 мкм, хотя некоторые из них всего лишь 0,16 мкм, а другие — до 8 мкм.

- Они видны под световым микроскопом, но детали строения центриоли выявлены только под электронным микроскопом.
- Каждая клетка имеет пару центриолей в центросоме, области около ядра.Члены каждой пары центриолей расположены под прямым углом друг к другу.
- Это миниатюрные субмикроскопические субцилиндры из микротрубочек с конфигурацией из девяти триплетных фибрилл и способностью образовывать свои собственные дубликаты, астральные полюса и базальные тела без ДНК и мембранного покрытия.
- Центриоль имеет оборот из девяти периферических фибрилл. В центре фибриллы отсутствуют. Таким образом, это расположение называется 9 + 0. Фибриллы проходят параллельно друг другу, но под углом 40 °.Каждая фибрилла состоит из трех субволокон. Поэтому она называется триплетной фибриллой.
- Три субволокна в действительности представляют собой микротрубочки, соединенные вместе своими краями и, следовательно, разделяющие общие стенки, состоящие из 2-3 прото-филаментов.

- Каждое субволокно имеет диаметр 25 нм. С внешней стороны внутрь три субволокна триплетной фибриллы обозначены как С, В и A. Субволокно A укомплектовано 13 протофиламентами, в то время как субволокна В и С являются неполными из-за общих микрофиламентов.
- Соседние триплетные фибриллы соединены белковыми линкерами С — A. В центре центриоли находится палочковидная белковая масса, известная как концентратор. Ступица имеет диаметр 2,5 нм. От центра развиваются 9 белковых цепей по направлению к периферическим триплетным фибриллам. Их называют спицами.
- Каждая спица имеет утолщение под названием X перед соединением с субволокном A. Рядом находится еще одно утолщение, известное как Y. Он прикрепляется как к X-утолщению, так и к линкерам C — A соединительными связками.
- Из-за наличия радиальных спиц и периферических фибрилл центриоль имеет вид колеса телеги в T.S.
- Центриоли участвуют в формировании аппарата веретена, который функционирует во время деления клеток.

- Отсутствие центриолей вызывает ошибки деления и задержки митотического процесса.
- Одиночная центриоль образует опорную точку или базальное тело для каждой отдельной реснички или жгутика.
- Базальные тела управляют образованием ресничек и жгутиков.
- Верма, П. С., & Агравал, В. К. (2006). Клеточная биология, генетика, молекулярная биология, эволюция и экология (1-е изд.). С. Чанд и компания ООО
- Стивен Р. Болсовер, Элизабет А. Шепард, Хью А. Уайт, Джереми С. Хаймс (2011). Клеточная биология: Краткий курс (3-е изд.), Хобокен, Нью-Джерси: Джон Уайли и сыновья.
- Альбертс, Б. (2004).Существенная клеточная биология. Нью-Йорк, штат Нью-Йорк: научный паб Garland.
- Вини, М., & О’Тул, Э. (2014). Строение центриоли. Философские труды Лондонского королевского общества. Серия B, Биологические науки, 369 (1650), 20130457.
- http://www.biologydiscussion.
 com/cell/centrioles/centrioles-structure-and-functions-with-diagram/70541.
com/cell/centrioles/centrioles-structure-and-functions-with-diagram/70541.
Центриоли — определение, структура, функции и схема
Категории Клеточная биология Теги Центриоли, Центриоли Функции, Центриоли Структура, волокна веретена сообщение навигацииBiology4Kids.com: Структура клетки: Centrioles
Каждая животноподобная клетка имеет две маленькие органеллы, называемые центриоли . Они там, чтобы помочь клетке, когда приходит время делиться. Они задействованы как в процессе митоза, так и в процессе мейоза. Обычно вы найдете их рядом с ядром, но их нельзя увидеть, когда клетка не делится. А из чего состоят центриоли? Микротрубочки. Центриоль — это небольшой набор микротрубочек, расположенных определенным образом.Всего насчитывается девять групп микротрубочек. Когда две центриоли находятся рядом друг с другом, они обычно находятся под прямым углом. Центриоли расположены парами и движутся к полюсам (противоположным концам) ядра, когда наступает время деления клеток.
 Во время деления вы также можете увидеть группы нитей, прикрепленных к центриолям. Эти нити называются митотическим веретеном . Мы уже упоминали, что вы найдете центриоли около ядра. Вы не увидите четко очерченных центриолей, когда клетка не делится.Вы увидите конденсированную и более темную область цитоплазмы, которая называется центросомой . Когда придет время деления клеток, центриоли появятся и переместятся к противоположным концам ядра. Во время деления вы увидите четыре центриоли. По одной паре движется в каждом направлении.
Во время деления вы также можете увидеть группы нитей, прикрепленных к центриолям. Эти нити называются митотическим веретеном . Мы уже упоминали, что вы найдете центриоли около ядра. Вы не увидите четко очерченных центриолей, когда клетка не делится.Вы увидите конденсированную и более темную область цитоплазмы, которая называется центросомой . Когда придет время деления клеток, центриоли появятся и переместятся к противоположным концам ядра. Во время деления вы увидите четыре центриоли. По одной паре движется в каждом направлении. Интерфаза — это время, когда клетка находится в состоянии покоя. Когда приходит время делиться клетке, центриоли дублируются. Во время профазы центриоли перемещаются к противоположным концам ядра, и начинает появляться митотическое веретено из нитей.Затем эти нити соединяются с видимыми теперь хромосомами. Во время анафазы хромосомы расщепляются и тянутся к каждой центриоле. Как только вся клетка начинает делиться в телофазе, хромосомы начинают распадаться, и начинают появляться новые ядерные оболочки.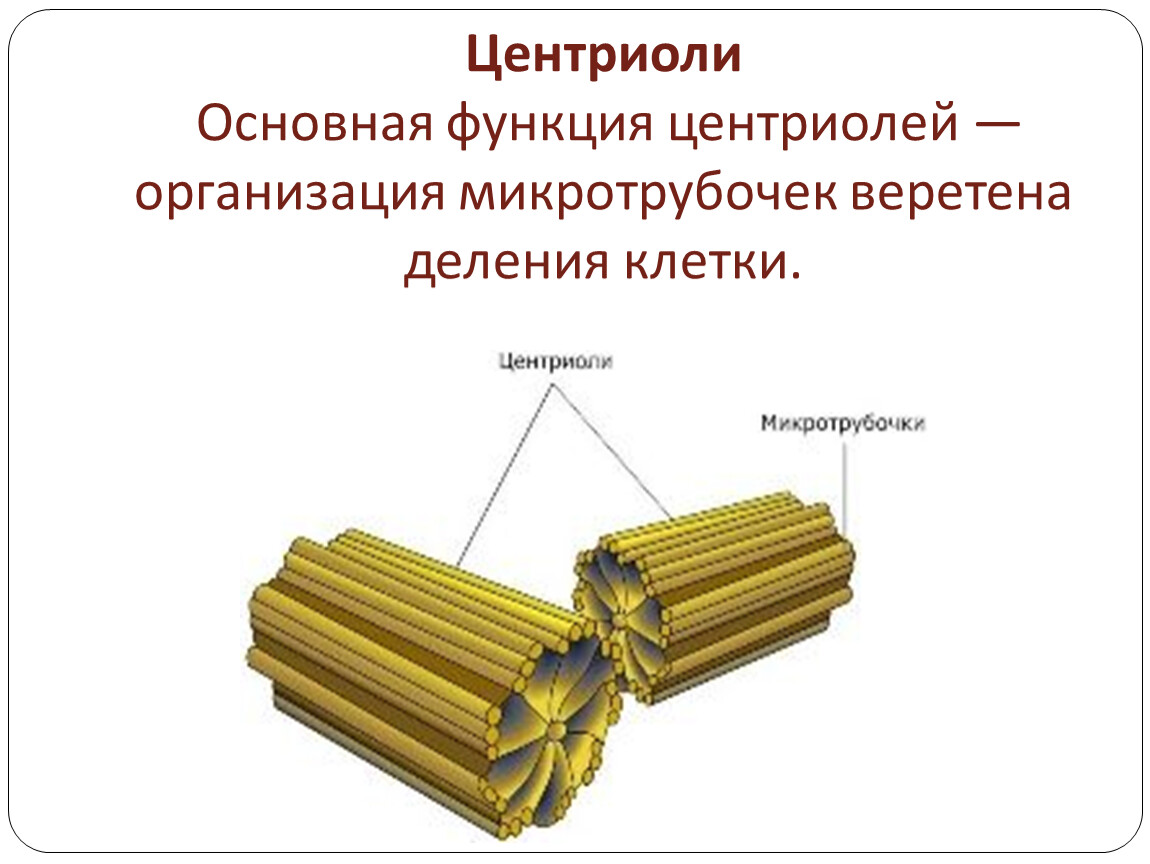 Центриоли свое дело сделали.
Центриоли свое дело сделали.
Стволовые клетки и регенеративная медицина (видео UCSF)
Полезные ссылки
Энциклопедия.com:http://www.encyclopedia.com/topic/centriole.aspx
Википедия:
http://en.wikipedia.org/wiki/Centriole
Encyclopædia Britannica (Cell Division) :
http://www.britannica.com/EBchecked/topic/101396/cell/37458/Cell-division
Молекулярные выражения Биология клетки: Структура клеток животных
центриолей
Обнаруженные только в клетках животных, эти парные органеллы обычно расположены вместе около ядра в центросоме , гранулированной массе, которая служит организующим центром для микротрубочек.Внутри центросомы центриоли расположены под прямым углом друг к другу, как показано на рисунке 1. Каждая центриоль состоит из девяти пучков микротрубочек (по три на пучок), расположенных в кольцо.
Центриоли играют заметную роль в делении клеток. Во время интерфазы животной клетки центриоли и другие компоненты центросомы дублируются, хотя ученые еще не уверены, как это дублирование происходит. Сначала две пары центриолей остаются в непосредственной близости друг от друга, но когда митоз инициируется, исходная центросома делится, и пары разделяются, так что один набор центриолей располагается в каждом из новых центров организации микротрубочек.Эти новые центры излучают микротрубочки в звездных кластерах, известных как asters . Когда звездочки перемещаются к противоположным полюсам клеток, микротрубочки с помощью центриолей организуются в веретенообразное образование, охватывающее клетку (см. Рис. 2). Эти волокна веретена действуют как направляющие для выравнивания хромосом, поскольку они отделяются позже в процессе деления клеток.
Хотя центриоли играют роль в митозе клеток животных, клетки растений могут воспроизводиться без них.Поэтому исследователи были очень заинтересованы в том, чтобы точно определить, насколько действительно важны органеллы. Исследования показали, что определенные клетки животных, особенно женские гаметы (ооциты), могут успешно делиться, даже если их центриоли разрушены. Однако некоторые исследователи также обнаружили, что отсутствие центриолей в клетках животных связано с повышенным числом ошибок деления и существенными задержками митотического процесса, особенно перед сегрегацией хромосом.Следовательно, было высказано предположение, что центриоли эволюционировали как уточнение клетки, что сделало митоз гораздо более эффективным и менее подверженным ошибкам процессом.
Исследования показали, что определенные клетки животных, особенно женские гаметы (ооциты), могут успешно делиться, даже если их центриоли разрушены. Однако некоторые исследователи также обнаружили, что отсутствие центриолей в клетках животных связано с повышенным числом ошибок деления и существенными задержками митотического процесса, особенно перед сегрегацией хромосом.Следовательно, было высказано предположение, что центриоли эволюционировали как уточнение клетки, что сделало митоз гораздо более эффективным и менее подверженным ошибкам процессом.
В клетках, которые имеют реснички или жгутики, присутствуют базальных телец , которые имеют ту же структурную форму, что и центриоли. Эти сборки расположены, однако, около поверхности клетки у основания каждой реснички или жгутика, а не в центросоме рядом с ядром. Базальные тельца закреплены в своих цитоплазматических местах с помощью того, что называется системой корней в клетке.У некоторых организмов, таких как одноклеточные Chlamydomonas , базальные тельца изменяют свое положение и функционально превращаются в центриоли перед митотическим процессом.
НАЗАД К СТРУКТУРЕ КЛЕТКИ ЖИВОТНЫХ
Вопросы или комментарии? Отправить нам письмо.
© 1995-2021, автор — Майкл В. Дэвидсон и Государственный университет Флориды. Все права защищены. Никакие изображения, графика, программное обеспечение, сценарии или апплеты не могут быть воспроизведены или использованы каким-либо образом без разрешения правообладателей.Использование этого веб-сайта означает, что вы соглашаетесь со всеми юридическими положениями и условиями, изложенными владельцами.
Этот веб-сайт обслуживается нашим
Команда разработчиков графики и веб-программирования
в сотрудничестве с оптической микроскопией в Национальной лаборатории сильного магнитного поля
.
Последнее изменение: пятница, 13 ноября 2015 г., 13:18
Счетчик доступа с 1 октября 2000 г .: 532322
Микроскопы предоставлены:
Структура и функции (со схемой)
В этой статье мы обсудим структуру и функции центриолей.
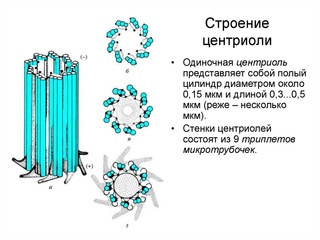
Центриоли — это миниатюрные субмикроскопические микротрубчатые субцилиндры с конфигурацией из девяти триплетных фибрилл и способностью образовывать свои собственные дубликаты, астральные полюса и базальные тела без ДНК и мембранного покрытия.
Они имеют длину примерно 0,3–0,5 мкм и диаметр 0,15 мкм. Они видны под световым микроскопом, но детали строения центриоли раскрываются только под электронным микроскопом.Обычно две центриоли находятся соединенными вместе, но под прямым углом друг к другу (рис. 8.49).
Пару центриолей часто называют диплосомой. Диплосома находится в общей специализированной части цитоплазмы, называемой центросферой или киноплазмой (= цитоцентром). Центросфера лишена каких-либо других клеточных органелл. Однако он содержит мелковолокнистый материал. Комплекс, состоящий из центриолей и центросферы, называется центросомой или центральным аппаратом.
Центриоли обнаружены почти во всех клетках эукариотических животных, простейших простейших (за исключением некоторых форм, таких как амебы), некоторых грибах и клетках всех тех эукариотических растений, где жгутиковые структуры присутствуют в жизненном цикле (многие зеленые водоросли, мохообразные, птеридофиты и цикадовые растения).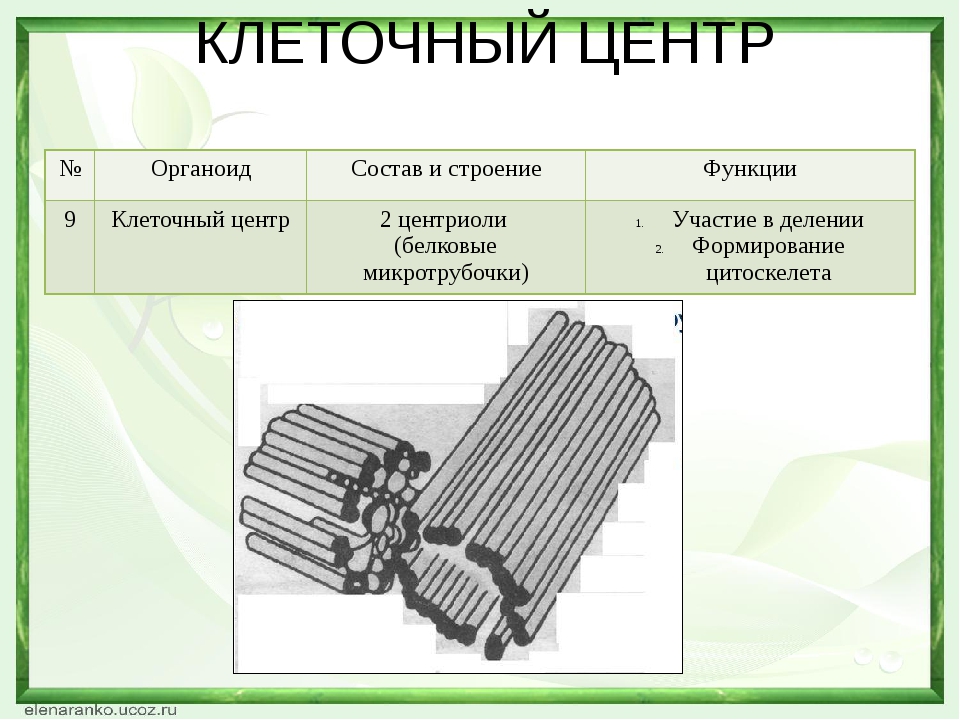 ).Они отсутствуют у покрытосеменных, высших голосеменных, некоторых водорослей и грибов.
).Они отсутствуют у покрытосеменных, высших голосеменных, некоторых водорослей и грибов.
Центриоли способны к репликации. Репликация центриолей координируется в клетках животных с делением клеток. Это происходит в фазе S или G 2 . Перед делением ядра две центросомы разделяются и перемещаются к противоположным концам, где впоследствии должны быть установлены полюса веретена. Репликация центриолей также происходит во время образования базальных тел ресничек и жгутиков.
Центриоль имеет оборот из девяти периферических фибрилл.В центре фибриллы отсутствуют. Таким образом, это расположение называется 9 + 0. Фибриллы проходят параллельно друг другу, но под углом 40 °. Каждая фибрилла состоит из трех субволокон. Поэтому ее называют триплетной фибриллой. Три субволокна в действительности представляют собой микротрубочки, соединенные вместе своими краями и, следовательно, разделяющие общие стенки, состоящие из 2-3 прото-филаментов.
Каждое субволокно имеет диаметр 25 нм.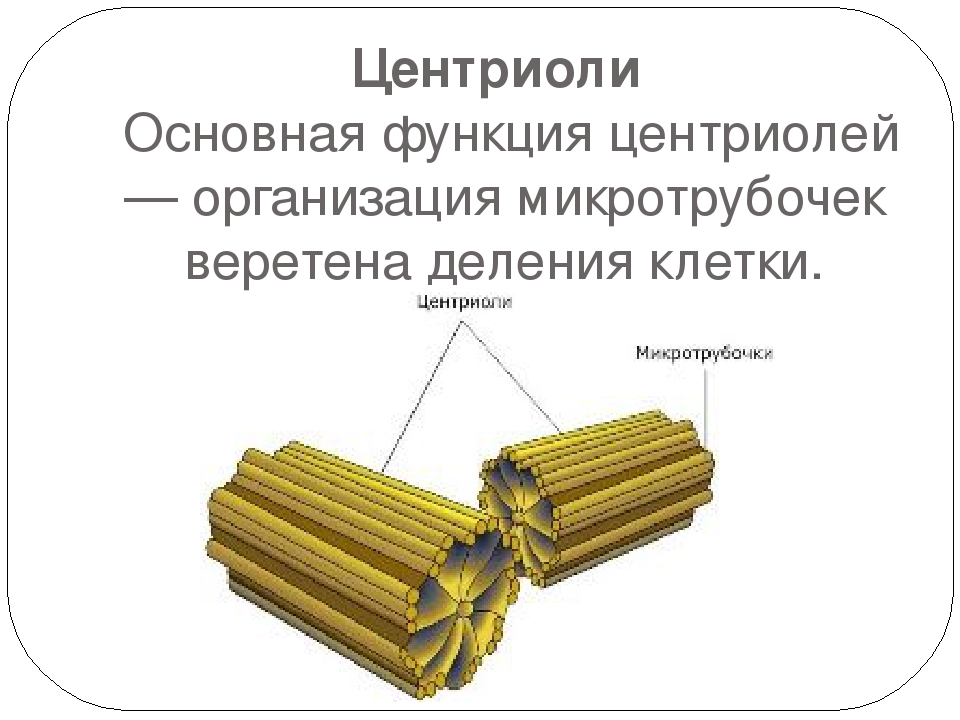 Снаружи внутрь три подслоя триплетной фибриллы обозначены как С, В и A.Субволокно A состоит из 13 прото-волокон, в то время как субволокно В и С является неполным из-за общего использования некоторых микрофиламентов.
Снаружи внутрь три подслоя триплетной фибриллы обозначены как С, В и A.Субволокно A состоит из 13 прото-волокон, в то время как субволокно В и С является неполным из-за общего использования некоторых микрофиламентов.
Соседние триплетные фибриллы соединены белковыми линкерами С — A. В центре центриоли находится палочковидная белковая масса, известная как концентратор. Ступица имеет диаметр 2,5 нм. От центра развиваются 9 белковых цепей по направлению к периферическим триплетным фибриллам.
Их называют спицами. Каждая спица имеет утолщение, называемое X, перед соединением с субволокном A.Рядом находится еще одно утолщение, известное как Y. Он прикрепляется как к утолщению Х, так и к линкерам С-А соединительными связками. Из-за наличия радиальных спиц и периферических фибрилл центриоль имеет вид колеса тележки в T.S (рис. 8.50).
На внешней стороне центриоли присутствуют плотные аморфные протоплазматические бляшки в одной или нескольких сериях.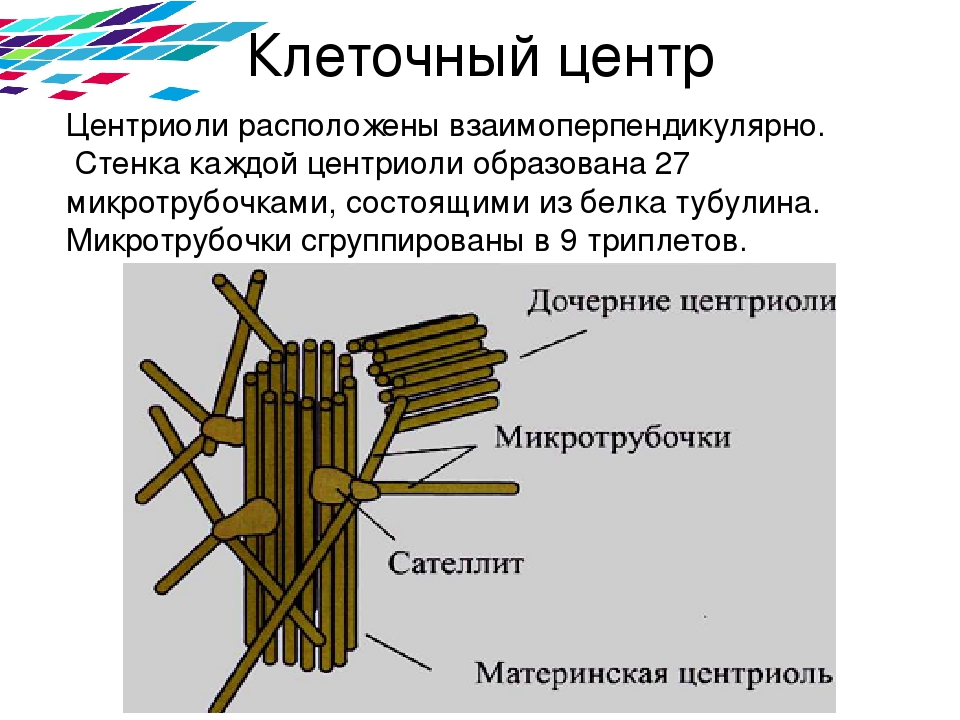 Их называют массой или перицентриолярными сателлитами. Их положение может меняться в зависимости от состояния клетки.Массивы действуют как центры зародышеобразования для роста микротрубочек во время образования звездочек и производства большего количества центриолей (во время фазы G2).
Их называют массой или перицентриолярными сателлитами. Их положение может меняться в зависимости от состояния клетки.Массивы действуют как центры зародышеобразования для роста микротрубочек во время образования звездочек и производства большего количества центриолей (во время фазы G2).
1. Хотя центриоли не содержат ДНК, они способны образовывать новые центриоли с помощью масс, которые функционируют как центры зародышеобразования.
2. Центриоли помогают в делении клеток, образуя центры организации микротрубочек (MTOC).
3.Из двух центриолей в сперматозоиде дистальная образует осевую нить или хвост.
4. Центриоли могут трансформироваться в базальные тельца.
5. Базальные тела, образованные из центриолей, дают начало ресничкам и жгутикам.
Centriole — обзор | ScienceDirect Topics
1 Введение
Центриоли и реснички — это эволюционно древние и почти повсеместные субклеточные органеллы. Большинство эукариотических клеток имеют центриоли и реснички, а у млекопитающих эти органеллы присутствуют во многих различных типах клеток, включая эпителиальные клетки, фоторецепторы, сперматозоиды и нейроны (Berbari, O’Connor, Haycraft, & Yoder, 2009; Silverman & Leroux, 2009 г.).В основе всех центриолей и ресничек находится радиально расположенный набор микротрубочек. В интерфазе клеточного цикла центриоль может действовать как базальное тельце для матриц цилиарных аксонемных микротрубочек.
Большинство эукариотических клеток имеют центриоли и реснички, а у млекопитающих эти органеллы присутствуют во многих различных типах клеток, включая эпителиальные клетки, фоторецепторы, сперматозоиды и нейроны (Berbari, O’Connor, Haycraft, & Yoder, 2009; Silverman & Leroux, 2009 г.).В основе всех центриолей и ресничек находится радиально расположенный набор микротрубочек. В интерфазе клеточного цикла центриоль может действовать как базальное тельце для матриц цилиарных аксонемных микротрубочек.
Идентификация генов, которые кодируют структурные и функциональные компоненты центриолей и ресничек, и определение того, как эти гены регулируются и эволюционируют, являются центральными для понимания функции этих органелл. Сочетание подходов, основанных на биохимии, генетике, протеомике и биоинформатике, привело к оценкам, что центриоли и реснички состоят как минимум из нескольких сотен белков (Avidor-Reiss et al., 2004; Барон, Ральстон, Кабутуту и Хилл, 2007; Датчер, 1995; Исикава, Томпсон, Йейтс и Маршалл, 2012 г . ; Келлер, Ромейн, Замора, Йейтс и Маршалл, 2005; Килберн и др., 2007; Ли и др., 2004; Пазур, Агрин, Лешик и Витман, 2005). Сходным образом с помощью транскрипционного профилирования было идентифицировано несколько сотен белков, экспрессия которых различается при сравнении одного и того же реснитчатого (дикого типа) и нецилифицированного (мутантного) организма (Chen et al., 2006; Phirke et al., 2011) или разных типов реснитчатых тканей (Ivliev , ‘t Hoen, van Roon-Mom, Peters, & Sergeeva, 2012).Важно отметить, что все эти исследования в значительной степени дополняют друг друга, каждое обнаруживает много перекрывающихся и новых центриолярных и цилиарных генов. Таким образом, объединение этих различных методологических подходов вместе с использованием вычислительных подходов было и будет оставаться чрезвычайно полезным (Arnaiz et al., 2009).
; Келлер, Ромейн, Замора, Йейтс и Маршалл, 2005; Килберн и др., 2007; Ли и др., 2004; Пазур, Агрин, Лешик и Витман, 2005). Сходным образом с помощью транскрипционного профилирования было идентифицировано несколько сотен белков, экспрессия которых различается при сравнении одного и того же реснитчатого (дикого типа) и нецилифицированного (мутантного) организма (Chen et al., 2006; Phirke et al., 2011) или разных типов реснитчатых тканей (Ivliev , ‘t Hoen, van Roon-Mom, Peters, & Sergeeva, 2012).Важно отметить, что все эти исследования в значительной степени дополняют друг друга, каждое обнаруживает много перекрывающихся и новых центриолярных и цилиарных генов. Таким образом, объединение этих различных методологических подходов вместе с использованием вычислительных подходов было и будет оставаться чрезвычайно полезным (Arnaiz et al., 2009).
Центриоли и реснички высоко консервативны, что делает исследования этих органелл в различных группах организмов непосредственно применимыми для понимания молекулярного состава, регуляции и функции этих органелл у всех эукариот (Jékely & Arendt, 2006). Филогенетические исследования подтверждают, что центриоли и реснички, вероятно, существовали у последнего общего предка эукариот (Cavalier-Smith, 1978, 2002). Подтверждением этой теории послужило обилие информации, полученной от множества различных организмов, многие из которых сохраняют эти органеллы, включая водоросли, трипаносомы, инфузории, нематод, мух и позвоночных (Kilburn et al., 2007; Kohl & Bastin, 2005 ; Laurençon et al., 2007; Silflow & Lefebvre, 2001; Silverman & Leroux, 2009).
Филогенетические исследования подтверждают, что центриоли и реснички, вероятно, существовали у последнего общего предка эукариот (Cavalier-Smith, 1978, 2002). Подтверждением этой теории послужило обилие информации, полученной от множества различных организмов, многие из которых сохраняют эти органеллы, включая водоросли, трипаносомы, инфузории, нематод, мух и позвоночных (Kilburn et al., 2007; Kohl & Bastin, 2005 ; Laurençon et al., 2007; Silflow & Lefebvre, 2001; Silverman & Leroux, 2009).
Основанные на биоинформатике сравнения генов от различных реснитчатых и нересничных организмов также оказались полезными для идентификации центриолярных и ресничных генов и предоставили уникальное понимание того, как эти органеллы эволюционировали.Эти исследования были очень информативными на основе наблюдений, что (i) подавляющее большинство генов ресничек не сохраняется в эволюционных линиях, которые вторично утратили реснички, включая большинство существующих грибов, амебозоа и наземные растения, и (ii) некоторые гены ресничек не сохраняются.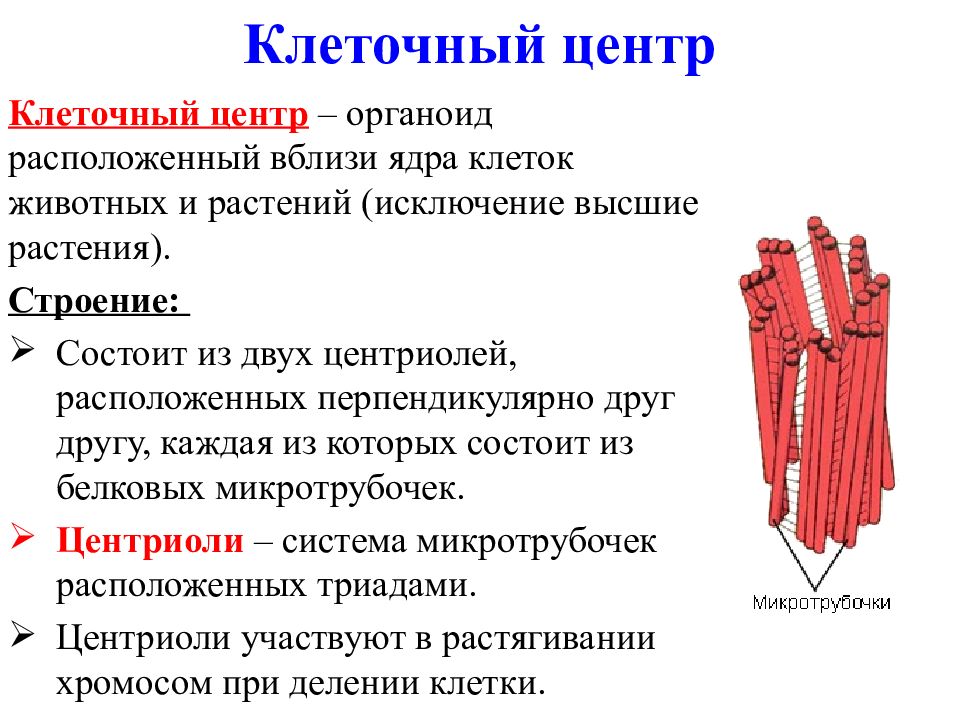 утрачиваются, когда теряются определенные функции ресничек (напр., перистальтика или чувствительность ресничек) (Avidor-Reiss et al., 2004; Li et al., 2004; Wickstead & Gull, 2006). Полногеномные сравнения организмов, которые сохраняют или отсутствуют центриоли и реснички, использовались для идентификации и последующей характеристики центриолярных и цилиарных генов (Avidor-Reiss et al., 2004; Ли и др., 2004). Другие исследования определили, какие клоны и / или организмы содержат или отсутствуют избранные наборы (хорошо охарактеризованных) центриолярных и ресничных генов и, таким образом, помогли расшифровать, как развивались структура и функция этих органелл (Карвалью-Сантос, Азимзаде, Перейра- Leal, & Bettencourt-Dias, 2011; Carvalho-Santos et al., 2010; Hodges, Scheumann, Wickstead, Langdale, & Gull, 2010). Вычислительные подходы, разработанные для идентификации консервативных цис- -регулирующих элементов последовательности в промоторах генов ресничек, также выявили много новых генов ресничек и тем самым предоставили понимание эволюции их регуляции транскрипции.
утрачиваются, когда теряются определенные функции ресничек (напр., перистальтика или чувствительность ресничек) (Avidor-Reiss et al., 2004; Li et al., 2004; Wickstead & Gull, 2006). Полногеномные сравнения организмов, которые сохраняют или отсутствуют центриоли и реснички, использовались для идентификации и последующей характеристики центриолярных и цилиарных генов (Avidor-Reiss et al., 2004; Ли и др., 2004). Другие исследования определили, какие клоны и / или организмы содержат или отсутствуют избранные наборы (хорошо охарактеризованных) центриолярных и ресничных генов и, таким образом, помогли расшифровать, как развивались структура и функция этих органелл (Карвалью-Сантос, Азимзаде, Перейра- Leal, & Bettencourt-Dias, 2011; Carvalho-Santos et al., 2010; Hodges, Scheumann, Wickstead, Langdale, & Gull, 2010). Вычислительные подходы, разработанные для идентификации консервативных цис- -регулирующих элементов последовательности в промоторах генов ресничек, также выявили много новых генов ресничек и тем самым предоставили понимание эволюции их регуляции транскрипции. Наиболее охарактеризованным элементом регуляторной последовательности цис , участвующим в экспрессии гена ресничек, является мотив промотора Х-бокса, который связывается и позитивно регулируется одним или несколькими факторами транскрипции (ТФ) RFX (регуляторный фактор, связывающий с X-боксом) ( Афтаб, Семенек, Чу и Чен, 2008; Эль-Зейн и др., 2009; Гадживала и др., 2000; Свобода, Адлер и Томас, 2000; Томас и др., 2010). Мотив промотора X-box представляет собой несовершенную инвертированную повторяющуюся последовательность из 13-15 пар оснований (Emery et al., 1996; Piasecki, Burghoorn, & Swoboda, 2010).Полногеномный поиск мотивов промотора X-box у червей и мух выявил> 50 генов ресничек, которые непосредственно регулируются с помощью RFX TF (Blacque et al., 2005; Efimenko et al., 2005; Laurençon et al., 2007). Интересно, что промоторные мотивы X-box обнаруживаются в регулирующих цис- областях генов ресничек исключительно у животных, несмотря на присутствие соответствующих ортологичных генов ресничек в геномах многих реснитчатых организмов за пределами животного происхождения (Piasecki et al.
Наиболее охарактеризованным элементом регуляторной последовательности цис , участвующим в экспрессии гена ресничек, является мотив промотора Х-бокса, который связывается и позитивно регулируется одним или несколькими факторами транскрипции (ТФ) RFX (регуляторный фактор, связывающий с X-боксом) ( Афтаб, Семенек, Чу и Чен, 2008; Эль-Зейн и др., 2009; Гадживала и др., 2000; Свобода, Адлер и Томас, 2000; Томас и др., 2010). Мотив промотора X-box представляет собой несовершенную инвертированную повторяющуюся последовательность из 13-15 пар оснований (Emery et al., 1996; Piasecki, Burghoorn, & Swoboda, 2010).Полногеномный поиск мотивов промотора X-box у червей и мух выявил> 50 генов ресничек, которые непосредственно регулируются с помощью RFX TF (Blacque et al., 2005; Efimenko et al., 2005; Laurençon et al., 2007). Интересно, что промоторные мотивы X-box обнаруживаются в регулирующих цис- областях генов ресничек исключительно у животных, несмотря на присутствие соответствующих ортологичных генов ресничек в геномах многих реснитчатых организмов за пределами животного происхождения (Piasecki et al. , 2010).Кроме того, было обнаружено, что RFX TFs полностью отсутствуют в геномах многих реснитчатых организмов за пределами животного происхождения (Chu, Baillie, & Chen, 2010; Piasecki et al., 2010). Мы недавно продемонстрировали на нематоде Caenorhabditis elegans , что один мотив промотора X-box недостаточен для управления экспрессией генов ресничек in vivo (Burghoorn et al., 2012). Вместо этого был идентифицирован новый энхансерный элемент, C-box, который — в сотрудничестве с мотивом промотора X-box — управляет экспрессией гена ресничек.C-бокс не был обнаружен в соответствующих ортологичных промоторных последовательностях генов ресничек за пределами нематод. Т.о., цис- -регулирующие последовательности промоторов гена ресничек подвержены гораздо более высокой скорости эволюционных изменений и дивергенции, чем соответствующие гены ресничек.
, 2010).Кроме того, было обнаружено, что RFX TFs полностью отсутствуют в геномах многих реснитчатых организмов за пределами животного происхождения (Chu, Baillie, & Chen, 2010; Piasecki et al., 2010). Мы недавно продемонстрировали на нематоде Caenorhabditis elegans , что один мотив промотора X-box недостаточен для управления экспрессией генов ресничек in vivo (Burghoorn et al., 2012). Вместо этого был идентифицирован новый энхансерный элемент, C-box, который — в сотрудничестве с мотивом промотора X-box — управляет экспрессией гена ресничек.C-бокс не был обнаружен в соответствующих ортологичных промоторных последовательностях генов ресничек за пределами нематод. Т.о., цис- -регулирующие последовательности промоторов гена ресничек подвержены гораздо более высокой скорости эволюционных изменений и дивергенции, чем соответствующие гены ресничек.
Вычислительные подходы значительно расширили наше понимание состава, регуляции и эволюции центриолярных и цилиарных генов. Дальнейшее уточнение основанных на биоинформатике сравнений генов ресничек и их регуляторных последовательностей, безусловно, углубит это понимание.
Дальнейшее уточнение основанных на биоинформатике сравнений генов ресничек и их регуляторных последовательностей, безусловно, углубит это понимание.
Далее мы представляем серию взаимосвязанных вычислительных и основанных на биоинформатике подходов и методов для поиска генов ресничек, включая гены, которые имеют общие (консервативные) элементы регуляторной последовательности, такие как мотивы промотора или элементы энхансера (например, X-боксы и C -боксы; см. выше) (рис. 16.1). В принципе, этот подход применим к любому организму, где гены ресничек (или любая другая группа) разделяют общие (консервативные) функции или регуляцию, что проявляется в наличии элементов регуляторной последовательности.Подход можно применять для всего генома, для всего субгенома или даже только для определенных наборов генов в одном организме или параллельно в любом количестве организмов, где доступно достаточно высококачественной последовательности генома. Подход построен по модульному принципу: не каждая часть должна использоваться для конкретного поиска (рис.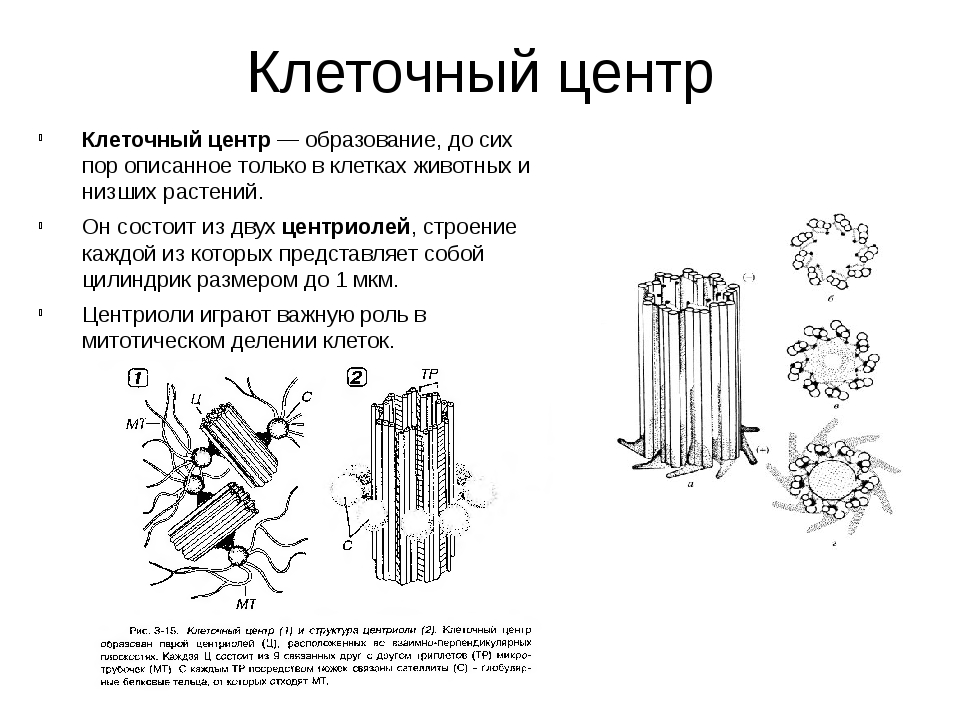 16.1). Например, при поиске регуляторных элементов, таких как мотивы промоторов, необязательно знать, имеют ли гены с конкретным мотивом в одном организме ортологичные гены в других организмах, которые также имеют рассматриваемый мотив.Однако эволюционная консервация генов и их регуляция, безусловно, является укрепляющим параметром, который полезно принимать во внимание. Мы и другие успешно использовали общий подход, описанный ниже для всего генома и субгенома у C. elegans и Drosophila (Avidor-Reiss et al., 2004; Blacque et al., 2005; Efimenko et al., 2005; Laurençon et al., 2007), а также только к определенным наборам генов ресничек как у одного, так и у более чем сотни различных организмов (Burghoorn et al., 2012; Piasecki et al., 2010; Свобода и др., 2000).
16.1). Например, при поиске регуляторных элементов, таких как мотивы промоторов, необязательно знать, имеют ли гены с конкретным мотивом в одном организме ортологичные гены в других организмах, которые также имеют рассматриваемый мотив.Однако эволюционная консервация генов и их регуляция, безусловно, является укрепляющим параметром, который полезно принимать во внимание. Мы и другие успешно использовали общий подход, описанный ниже для всего генома и субгенома у C. elegans и Drosophila (Avidor-Reiss et al., 2004; Blacque et al., 2005; Efimenko et al., 2005; Laurençon et al., 2007), а также только к определенным наборам генов ресничек как у одного, так и у более чем сотни различных организмов (Burghoorn et al., 2012; Piasecki et al., 2010; Свобода и др., 2000).
Рисунок 16.1. Обзор создания списка генов-кандидатов ресничек на основе общей (консервативной) регуляторной информации о генах. Данные любого конкретного организма, такие как последовательности генома с соответствующей аннотацией, загружаются из общедоступных баз данных. Если базы данных не содержат информации об ортологии генов или определенных последовательностей промоторов генов, такая информация может быть сгенерирована de novo . Вся извлеченная информация хранится в центральной базе данных, например, SQL , из которой на нее можно ссылаться и фильтровать.Наконец, гены можно оценивать либо вручную, либо с помощью машинного обучения.
Если базы данных не содержат информации об ортологии генов или определенных последовательностей промоторов генов, такая информация может быть сгенерирована de novo . Вся извлеченная информация хранится в центральной базе данных, например, SQL , из которой на нее можно ссылаться и фильтровать.Наконец, гены можно оценивать либо вручную, либо с помощью машинного обучения.
Границы | Роль центриолей сперматозоидов в воспроизводстве человека — известное и неизвестное
Введение
Центриоли необходимы для развития и физиологии животных, что продемонстрировано множеством экспериментов, в которых непосредственно проверялась роль центриолей (Bettencourt-Dias et al., 2011). Большинство этих экспериментов было выполнено in vitro на иммортализованных клетках человека или на животных моделях, что ограничивает наши знания о роли центриоли в воспроизводстве человека.В целом ожидается, что роль центриоли будет столь же важной для человека из-за ее сохранения на протяжении всей эволюции животных (Carvalho-Santos et al.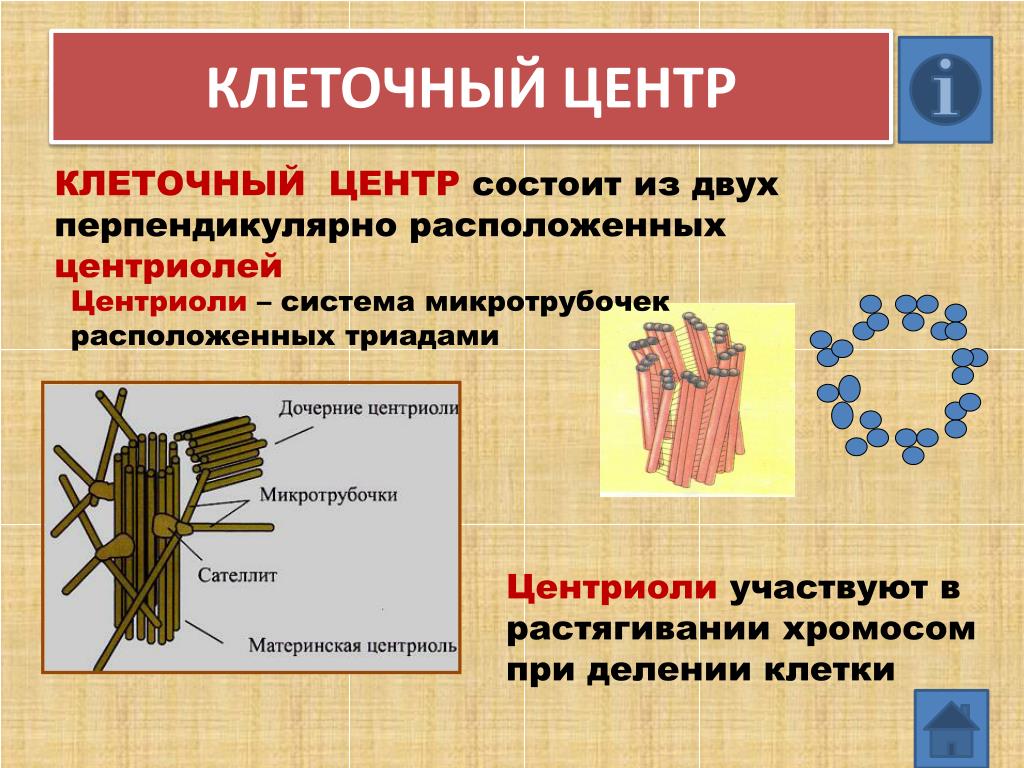 , 2011). Однако центриоли сперматозоидов и ранний эмбрион мышиных животных являются исключениями из этой эволюционной консервации (рис. 1). В то время как люди и многие другие млекопитающие имеют центриоли в сперматозоидах и ранних эмбрионах, мыши, крысы и хомяки (наиболее распространенные экспериментальные млекопитающие) не имеют распознаваемых центриолей в сперматозоидах и ранних эмбрионах (Schatten et al., 1986; Сатанантан и др., 1996; Филлипс и др., 2014). Эти основные различия во внешнем виде центриолей вызывают вопрос: Какова именно роль центриолей в оплодотворении человека и раннем эмбриональном развитии?
, 2011). Однако центриоли сперматозоидов и ранний эмбрион мышиных животных являются исключениями из этой эволюционной консервации (рис. 1). В то время как люди и многие другие млекопитающие имеют центриоли в сперматозоидах и ранних эмбрионах, мыши, крысы и хомяки (наиболее распространенные экспериментальные млекопитающие) не имеют распознаваемых центриолей в сперматозоидах и ранних эмбрионах (Schatten et al., 1986; Сатанантан и др., 1996; Филлипс и др., 2014). Эти основные различия во внешнем виде центриолей вызывают вопрос: Какова именно роль центриолей в оплодотворении человека и раннем эмбриональном развитии?
Одна крайняя и маловероятная идея состоит в том, что центриоли сперматозоидов не нужны человеку, потому что они не обнаруживаются в сперме мышей и, по-видимому, используются для живорождения мышей. Однако альтернативная гипотеза состоит в том, что мыши развили новую биологию сперматозоидов и ранних эмбриональных центриолей, и, следовательно, изучение их роли в репродукции неприменимо к их роли в репродукции человека и их клиническому значению. Действительно, все изученные немышиные млекопитающие – имеют центриоли в сперме и ранних эмбрионах, и у некоторых животных некоторые данные указывают на то, что эти центриоли необходимы. Здесь мы исследуем это свидетельство и тот факт, что сперма людей и немышиных млекопитающих имеет две центриоли (одна с типичной структурой, а другая нетипичная), а не одна, как было сделано ранее (Avidor-Reiss and Fishman, 2018 ). Мы начнем с краткого общего введения в центриоли, а затем перейдем к обсуждению сперматозоидов и ранних центриолей эмбриона.Затем мы описываем клинические исследования, в которых центриоли участвуют в воспроизводстве человека. Наконец, мы предлагаем дальнейшие направления для решения вопроса о роли центриоли сперматозоидов в эмбрионе. Этот обзор фокусируется на роли центриолей зрелых сперматозоидов (сперматозоидов) в зиготе и не касается роли центриолей в развитии зародышевой линии (сперматогонии, сперматоциты и мейоз) [обзор Riparbelli and Callaini (2011)].
Действительно, все изученные немышиные млекопитающие – имеют центриоли в сперме и ранних эмбрионах, и у некоторых животных некоторые данные указывают на то, что эти центриоли необходимы. Здесь мы исследуем это свидетельство и тот факт, что сперма людей и немышиных млекопитающих имеет две центриоли (одна с типичной структурой, а другая нетипичная), а не одна, как было сделано ранее (Avidor-Reiss and Fishman, 2018 ). Мы начнем с краткого общего введения в центриоли, а затем перейдем к обсуждению сперматозоидов и ранних центриолей эмбриона.Затем мы описываем клинические исследования, в которых центриоли участвуют в воспроизводстве человека. Наконец, мы предлагаем дальнейшие направления для решения вопроса о роли центриоли сперматозоидов в эмбрионе. Этот обзор фокусируется на роли центриолей зрелых сперматозоидов (сперматозоидов) в зиготе и не касается роли центриолей в развитии зародышевой линии (сперматогонии, сперматоциты и мейоз) [обзор Riparbelli and Callaini (2011)].
Наиболее делящиеся клетки животных имеют ровно два центриоля с консервативной цилиндрической формой
Центриоли представляют собой эволюционно законсервированные клеточные компоненты, необходимые для оплодотворения, развития клеток и физиологии животных благодаря их функции в клетке [обзор у Nigg and Raff (2009)]. Центриоль представляет собой цилиндр, состоящий из девяти триплетных микротрубочек, расположенных кольцеобразно, образуя цилиндрическую структуру. В центросоме центриоли окружены перицентриолярным материалом (ПКМ) (Vorobjev and Chentsov Yu, 1982) [обзор у Lange and Gull (1996), Mennella et al. (2012)]. В ресничках и жгутиках триплеты центриолей непрерывны с дублетными микротрубочками аксонемы. Центриоли состоят из более чем сотни белков (Preble et al., 2000) [обзор в Winey and O’Toole (2014), Nigg and Holland (2018)], и, хотя новые компоненты центриолярной структуры белка продолжают открываться , определение их функциональности может быть проблемой, как потому, что они часто играют важную роль в раннем развитии [обзор в Schatten and Sun (2010)], так и потому, что их функция может варьироваться от одного типа клеток к другому [ранее рассмотрено в Loncarek and Bettencourt- Диас (2018)].
Центриоль представляет собой цилиндр, состоящий из девяти триплетных микротрубочек, расположенных кольцеобразно, образуя цилиндрическую структуру. В центросоме центриоли окружены перицентриолярным материалом (ПКМ) (Vorobjev and Chentsov Yu, 1982) [обзор у Lange and Gull (1996), Mennella et al. (2012)]. В ресничках и жгутиках триплеты центриолей непрерывны с дублетными микротрубочками аксонемы. Центриоли состоят из более чем сотни белков (Preble et al., 2000) [обзор в Winey and O’Toole (2014), Nigg and Holland (2018)], и, хотя новые компоненты центриолярной структуры белка продолжают открываться , определение их функциональности может быть проблемой, как потому, что они часто играют важную роль в раннем развитии [обзор в Schatten and Sun (2010)], так и потому, что их функция может варьироваться от одного типа клеток к другому [ранее рассмотрено в Loncarek and Bettencourt- Диас (2018)].
Большинство клеток имеют две центриоли во время ранней интерфазы. Большинство центриолей формируются путем «дупликации», когда каждая из двух ранее существовавших центриолей направляет образование одной новой процентриоли, обеспечивая механизм для контроля количества образующихся центриолей. Центриоли нечасто могут образовывать de novo при отсутствии ранее существовавших центриолей или в специализированных типах клеток, но часто этот механизм приводит к образованию слишком большого количества центриолей (Loncarek and Khodjakov, 2009; Shahid and Singh, 2018).Переход от процентриоли к зрелой центриоле коррелирует с прогрессированием клеточного цикла (Lange and Gull, 1996). Пара центриолей состоит из старшей материнской центриоли и младшей дочерней центриоли. В результате количество центриолей в клетке колеблется между двумя центриолями во время ранней интерфазы и четырьмя центриолями во время поздней интерфазы и митоза (Fukasawa, 2007).
Центриоли нечасто могут образовывать de novo при отсутствии ранее существовавших центриолей или в специализированных типах клеток, но часто этот механизм приводит к образованию слишком большого количества центриолей (Loncarek and Khodjakov, 2009; Shahid and Singh, 2018).Переход от процентриоли к зрелой центриоле коррелирует с прогрессированием клеточного цикла (Lange and Gull, 1996). Пара центриолей состоит из старшей материнской центриоли и младшей дочерней центриоли. В результате количество центриолей в клетке колеблется между двумя центриолями во время ранней интерфазы и четырьмя центриолями во время поздней интерфазы и митоза (Fukasawa, 2007).
Центриоли являются неотъемлемой частью ресничек, которые придают клетке подвижность и потенциал внеклеточной коммуникации.В большинстве типов клеток реснички формируются с помощью зрелой центриоли внутри клетки, которая известна как базальное тельце [rev. Avidor-Reiss and Gopalakrishnan (2013)]. Однако недавно было высказано предположение, что в сперматозоиде жгутик формируется младшей дочерней центриолью, но это предположение требует дальнейшей поддержки (Garanina et al. , 2019). Центриоли также участвуют в процессе деления клеток, но их вклад варьируется в разных типах клеток. В целом центриоли рекрутируют PCM для формирования центросомы.Эта центросома ассоциируется с микротрубочками, чтобы собрать звездочку, которая располагается на полюсах веретена во время митоза. Основная функция звездочки — определение оси деления клеток и количества полюсов веретена (Bobinnec et al., 1998). Интересно, что некоторые клетки животных [что важно, ооциты (Calarco et al., 1972)] и многие клетки растений (Joshi and Palevitz, 1996) лишены центриолей. Это означает, что центриоли необходимы не для всех типов клеток и что некоторые клетки могут успешно завершить митоз и клеточную организацию без центриолярного влияния.Следовательно, значение центриолей может варьироваться в зависимости от нескольких типов клеток, которые обычно их содержат.
, 2019). Центриоли также участвуют в процессе деления клеток, но их вклад варьируется в разных типах клеток. В целом центриоли рекрутируют PCM для формирования центросомы.Эта центросома ассоциируется с микротрубочками, чтобы собрать звездочку, которая располагается на полюсах веретена во время митоза. Основная функция звездочки — определение оси деления клеток и количества полюсов веретена (Bobinnec et al., 1998). Интересно, что некоторые клетки животных [что важно, ооциты (Calarco et al., 1972)] и многие клетки растений (Joshi and Palevitz, 1996) лишены центриолей. Это означает, что центриоли необходимы не для всех типов клеток и что некоторые клетки могут успешно завершить митоз и клеточную организацию без центриолярного влияния.Следовательно, значение центриолей может варьироваться в зависимости от нескольких типов клеток, которые обычно их содержат.
Зрелые ооциты человека не имеют центриолей
Ооциты содержат большинство элементов, необходимых для зиготического развития (т. Е. Гольджи, ER и протеасомы), включая центриолярные белки и белки PCM, но у них отсутствуют собранные центриоли. Центриоли ооцитов удаляются путем экструзии или инактивации во время оогенеза у людей и большинства изученных животных (Hertig and Adams, 1967; Sathananthan et al., 1985; Schatten et al., 1986; Пикеринг и др., 1988; Крозе, 1990; Навара и др., 1994; Crozet et al., 2000) [обзор в Sathananthan et al. (2006)]. Ограниченные исследования изучали механизм элиминации центриолей ооцитов, но они предлагают механизм, основанный на некоторых из тех же белков, которые участвуют в биологии центросом, таких как PLK1 (Pimenta-Marques et al., 2016). Удаление центриолей ооцитом требует вклада центриолей обоих сперматозоидов в зиготу, чтобы обеспечить соответствующее количество центриолей в клетке эмбриона (Connolly et al., 1986; Шаттен, 1994; Манандхар и др., 2005; Pimenta-Marques et al., 2016). Дополнительную информацию можно найти в недавнем обзоре того, как ооциты животных собирают веретено в отсутствие центриоли, в Severson et al.
Е. Гольджи, ER и протеасомы), включая центриолярные белки и белки PCM, но у них отсутствуют собранные центриоли. Центриоли ооцитов удаляются путем экструзии или инактивации во время оогенеза у людей и большинства изученных животных (Hertig and Adams, 1967; Sathananthan et al., 1985; Schatten et al., 1986; Пикеринг и др., 1988; Крозе, 1990; Навара и др., 1994; Crozet et al., 2000) [обзор в Sathananthan et al. (2006)]. Ограниченные исследования изучали механизм элиминации центриолей ооцитов, но они предлагают механизм, основанный на некоторых из тех же белков, которые участвуют в биологии центросом, таких как PLK1 (Pimenta-Marques et al., 2016). Удаление центриолей ооцитом требует вклада центриолей обоих сперматозоидов в зиготу, чтобы обеспечить соответствующее количество центриолей в клетке эмбриона (Connolly et al., 1986; Шаттен, 1994; Манандхар и др., 2005; Pimenta-Marques et al., 2016). Дополнительную информацию можно найти в недавнем обзоре того, как ооциты животных собирают веретено в отсутствие центриоли, в Severson et al. (2016).
(2016).
Сперматозоиды и зиготы мыши не имеют узнаваемых центриолей
У мышей наследование центриолей эмбрионам отличается от других моделей млекопитающих. У мышей центриоли, по-видимому, полностью дегенерируют во время спермиогенеза (Manandhar et al., 1998), и в результате центриоли сперматозоидов могут не присутствовать в зиготе (Schatten, 1994; Hewitson et al., 1997) (Рисунок 1C). Было высказано предположение, что зиготические центриоли наследуются по материнской линии или образуют de novo (Schatten et al., 1985, 1986, 1991; Gueth-Hallonet et al., 1993; Hewitson et al., 1997). Поддержка не отцовского наследования основана на нескольких наблюдениях, в том числе: (1) зиготы, по-видимому, не имеют доминантных звездочек сперматозоидов, а вместо этого имеют материнские мини-звездочки, (2) аксонема сперматозоидов присутствует в ооците, но отсутствуют микротрубочки и нет ассоциации с митотическими полюсами, (3) центриоли наблюдаются только начиная с 32/64 клеточной стадии ранних эмбрионов (Gueth-Hallonet et al. , 1993), и (4) интрацитоплазматическая инъекция сперматозоидов (ИКСИ) с диссоциированными ядрами сперматозоидов достаточна для развития эмбриона (Kuretake et al., 1996; Yan et al., 2008). Вопрос , почему центриоли зиготы мыши не наследуются от сперматозоидов, как это наблюдается у других млекопитающих, остается без ответа.
, 1993), и (4) интрацитоплазматическая инъекция сперматозоидов (ИКСИ) с диссоциированными ядрами сперматозоидов достаточна для развития эмбриона (Kuretake et al., 1996; Yan et al., 2008). Вопрос , почему центриоли зиготы мыши не наследуются от сперматозоидов, как это наблюдается у других млекопитающих, остается без ответа.
Партеногенные клетки имеют нерегулируемое количество центриолей
Способность образовывать партеноген (эмбрион, который развивается из неоплодотворенной яйцеклетки, лишенной центриолей) и партеногенных клеточных линий часто упоминается, чтобы предположить, что центриоли сперматозоидов не важны для млекопитающих.Однако важно отметить, что партеногенез у млекопитающих не приводит к жизнеспособному потомству (Wininger, 2004). Было высказано предположение, что дефекты импринтинга являются основным барьером для жизнеспособности в партеногенезе млекопитающих (Kono, 2006; Miller et al., 2019), но сопутствующие аномалии центриолей, присутствующие во время партеногенеза млекопитающих, также могут вносить вклад в этот барьер.
Важность центриолей сперматозоидов в партеногенных эмбрионах млекопитающих очевидна, поскольку партеногенные клетки имеют ненормальное количество центриолей, как и ожидалось по механизму образования центриолей de novo (Brevini et al., 2012). В отсутствие предсуществующих центриолей (как можно было бы ожидать в партеногенезе) нерегулируемое количество центриолей, как ожидается, сформирует de novo в активированных ооцитах или последующих типах клеток эмбриона (Hinchcliffe, 2011). Присутствие слишком большого или слишком малого количества центриолей, как это наблюдается в линиях партеногенных клеток млекопитающих, может приводить к хромосомной нестабильности и, в конечном итоге, к гибели клеток (Sir et al., 2013; Godinho and Pellman, 2014). Эти аномалии центриолей могут частично объяснить наличие высокого уровня хромосомных аномалий в партеногенных эмбрионах и их конечную неспособность к развитию жизнеспособного потомства (Bhak et al., 2006). Следовательно, вполне возможно, что немышиным зиготам необходимы две центриоли для образования жизнеспособного эмбриона, и необходимо дальнейшее изучение партеногенных центриолей, в частности, чтобы определить, на какой стадии они формируются, сколько их формируется и как они функционируют.
Большинство сперматозоидов и зигот млекопитающих имеют центриоли
Шейка сперматозоида имеет одну типичную и одну атипичную центриолу
Сперматозоид — это обтекаемая подвижная клетка, состоящая из головы, хвоста и шеи, содержащей две центриоли (рис. 1).Голова несет половину генетического материала эмбриона вместе с протеолитическими белками в акросоме, которые помогают достичь ооцита (Cox et al., 2002; Yoon et al., 2008). Хвост представляет собой специализированную ресничку, которая продвигает сперматозоиды к яйцеклетке (Basiri et al., 2014; Avidor-Reiss and Leroux, 2015). Морфология сперматозоидов у млекопитающих варьируется из-за эволюционного давления, что делает его одной из самых разнообразных клеток по сравнению с соответствующим типом клеток у других видов (Gomendio and Roldan, 2008; Breed et al., 2014). Важно отметить, что между сперматозоидами человека и мыши наблюдается большая разница. В то время как сперматозоиды человека, как и у большинства других млекопитающих, морфологически широкие и плоские (в форме лопатки), сперматозоиды мышей изогнутые, длинные и узкие (серповидные) (рис. 1А). У людей и большинства других млекопитающих хвост прикрепляется к голове около ее центра, но у мышей прикрепляется сбоку от головы (рис. 1C). Кроме того, размеры хвоста у людей и других млекопитающих очень похожи, но хвост мыши примерно в два раза длиннее, чем у человека.Мыши демонстрируют существенную эволюционную консервацию многих критических процессов развития у других млекопитающих и в целом являются полезной моделью. Однако различия, описанные выше, предполагают, что некоторые аспекты сперматозоидов мышей эволюционировали иначе, чем у других млекопитающих, включая человека. Поэтому перевод информации по этой теме с мышей на людей требует осторожности.
1А). У людей и большинства других млекопитающих хвост прикрепляется к голове около ее центра, но у мышей прикрепляется сбоку от головы (рис. 1C). Кроме того, размеры хвоста у людей и других млекопитающих очень похожи, но хвост мыши примерно в два раза длиннее, чем у человека.Мыши демонстрируют существенную эволюционную консервацию многих критических процессов развития у других млекопитающих и в целом являются полезной моделью. Однако различия, описанные выше, предполагают, что некоторые аспекты сперматозоидов мышей эволюционировали иначе, чем у других млекопитающих, включая человека. Поэтому перевод информации по этой теме с мышей на людей требует осторожности.
Шейка человеческого сперматозоида содержит две центриоли, а также специализированный PCM. Проксимальная центриоль (PC) находится рядом с основанием головы, а дистальная центриоль (DC) расположена дальше от головы, прикреплена к основанию аксонемы (рис. 1A).Во время образования сперматозоидов ПК образует центриолярный адъюнкт, который, как считается, организует развитие области шеи и направляет манжету для формирования оси ядерного уплощения (Fawcett and Phillips, 1969; Lehti and Sironen, 2016).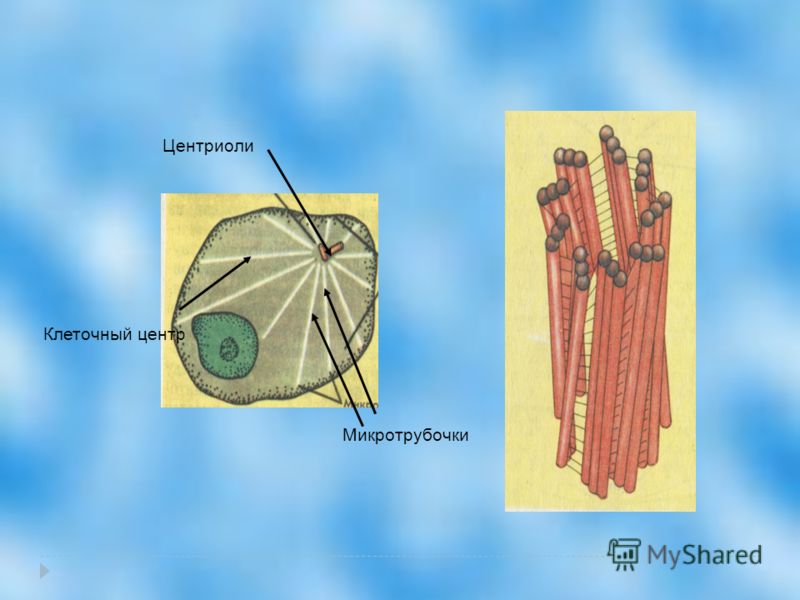 В то же время микротрубочки DC расширяются, образуя аксонемные микротрубочки хвоста (Fawcett and Phillips, 1969). Центриоли внедряются в структурный материал, включая головку вокруг ПК, полосатые столбики, заполняющие большую часть шеи, и внешние плотные волокна (ODF) (рис. 1A).Головка и поперечно-полосатые столбцы образуют специализированный ПКМ, который также содержит центросомные белки (Fawcett and Phillips, 1969; Fishman et al., 2018).
В то же время микротрубочки DC расширяются, образуя аксонемные микротрубочки хвоста (Fawcett and Phillips, 1969). Центриоли внедряются в структурный материал, включая головку вокруг ПК, полосатые столбики, заполняющие большую часть шеи, и внешние плотные волокна (ODF) (рис. 1A).Головка и поперечно-полосатые столбцы образуют специализированный ПКМ, который также содержит центросомные белки (Fawcett and Phillips, 1969; Fishman et al., 2018).
Зрелый сперматозоид приобретает свою уникальную обтекаемую морфологию и состав во время спермиогенеза [обзор в Авидор-Рейсс и Фишман (2018)]. Ранние сперматиды содержат как ПК, так и ДК с типичной структурой и составом центриолей. Судьба DC и PC во время дифференцировки сперматид в сперматозоиды варьируется в зависимости от вида животных, но обе центриоли присутствуют в зрелых сперматозоидах человека и большинства других млекопитающих.«Ремоделирование центриоли», которое происходит во время дифференциации, оставляет одну центриоль, которая поддерживает типичную структуру (ПК), и одну, которая получает атипичную структуру (DC).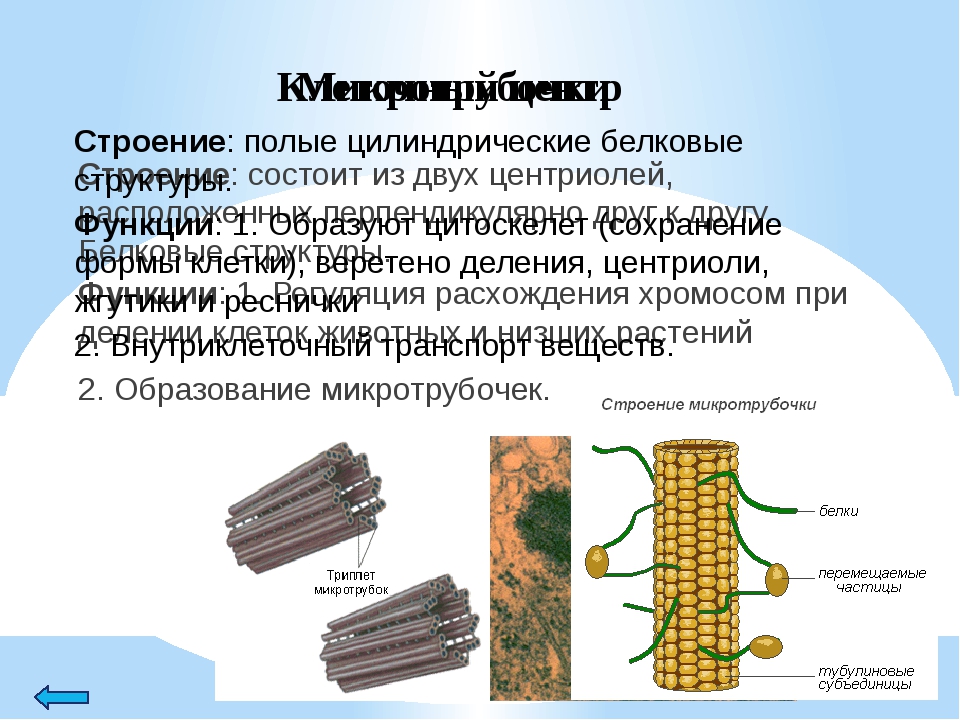 Эта структура состоит из дублетов расширенных микротрубочек и центросомных белков, но сохраняет способность функционировать в зиготе (Fishman et al., 2018). Что остается неизвестным, так это полезность, уникальная функция и судьба в эмбрионе этих реконструированных центриолей и специализированных PCM.
Эта структура состоит из дублетов расширенных микротрубочек и центросомных белков, но сохраняет способность функционировать в зиготе (Fishman et al., 2018). Что остается неизвестным, так это полезность, уникальная функция и судьба в эмбрионе этих реконструированных центриолей и специализированных PCM.
Функция двух центриолей сперматозоидов в большинстве ранних эмбрионов млекопитающих
Большинство делящихся клеток нуждаются в двух центриолях, каждая из которых локализуется на одном из полюсов веретена, которые обеспечивают разделение хроматид между дочерними клетками при делении клетки.То же самое ожидается для первой клетки эмбриона (зиготы). Кроме того, сразу после слияния сперматозоидов и яйцеклеток центриоли сперматозоидов образуют звездочку, а вскоре после этого две центриоли сперматозоидов подвергаются «дупликации», образуя две новые дочерние центриоли [обзор у Avidor-Reiss and Fishman (2018)]. Наконец, в какой-то момент эмбрионального развития центриоли, как ожидается, будут матрицей первичных ресничек. Хотя время для этого неизвестно у людей и животных, не являющихся мышами, у мышей первые первичные реснички наблюдались в бластоцистах с 64–100 клетками только после имплантации в клетки эпибласта (Bangs et al., 2015). Основываясь на этих функциях, предполагается, что центриоли сперматозоидов играют важную роль в развитии эмбриона.
Хотя время для этого неизвестно у людей и животных, не являющихся мышами, у мышей первые первичные реснички наблюдались в бластоцистах с 64–100 клетками только после имплантации в клетки эпибласта (Bangs et al., 2015). Основываясь на этих функциях, предполагается, что центриоли сперматозоидов играют важную роль в развитии эмбриона.
У многих животных, таких как черви и рыбы, уменьшение центросом приводит к удалению белков PCM с незначительным или отсутствующим видимым изменением структуры центриоли. У насекомых две центриоли видоизменены, одна незначительно и одна настолько резко, что это было обнаружено совсем недавно (Gottardo et al., 2015; Khire et al., 2016; Dallai et al., 2017; Fishman et al., 2017). .Ооцит содержит соответствующий материал PCM, который соединяется с центриолями сперматозоидов после их введения. Необходимость как центриолей сперматозоидов, так и материнской PCM для развития эмбрионов была продемонстрирована у мух (Blachon et al., 2014), нематод [обзор Leidel and Gonczy (2005)] и рыб (Yabe et al. , 2007). Эти публикации предполагают, что у многих животных реконструированные центриоли сперматозоидов необходимы в эмбрионе, и, следовательно, отсутствие неотъемлемой роли центриолей сперматозоидов у мышей является исключением.
, 2007). Эти публикации предполагают, что у многих животных реконструированные центриоли сперматозоидов необходимы в эмбрионе, и, следовательно, отсутствие неотъемлемой роли центриолей сперматозоидов у мышей является исключением.
Отцовское наследование PC в зиготе было хорошо установлено на нескольких моделях млекопитающих. Присутствие центриолей сперматозоидов в зиготе было продемонстрировано у коров (Navara et al., 1994), овец (Le Guen and Crozet, 1989), приматов (Simerly et al., 1995; Wu et al., 1996) и свиньи (Kim et al., 1996). Однако основные функции зиготических центриолей в этих моделях не были продемонстрированы напрямую. Ремоделирование зиготических центриолей было установлено с помощью ультраструктурных и некоторых иммунологических исследований у коров (Long et al., 1993; Навара и др., 1994; Сутовский и др., 1996; Sutovsky, Schatten, 1997), овцы (Le Guen, Crozet, 1989; Crozet, 1990; Crozet et al., 2000), кролики (Longo, 1976; Szollosi, Ozil, 1991; Yllera-Fernandez et al. , 1992; Pinto -Correia et al., 1994; Terada et al., 2000) и кошек (Comizzoli et al., 2006). Совсем недавно было показано, что зиготы коров также наследуют вторую атипичную центриоль (DC) (Fishman et al., 2018). Этот образец наследования предполагает, что центриоли могут играть важную роль в развивающейся зиготе; однако неясно, что именно и как эти центриоли могут вносить вклад.
, 1992; Pinto -Correia et al., 1994; Terada et al., 2000) и кошек (Comizzoli et al., 2006). Совсем недавно было показано, что зиготы коров также наследуют вторую атипичную центриоль (DC) (Fishman et al., 2018). Этот образец наследования предполагает, что центриоли могут играть важную роль в развивающейся зиготе; однако неясно, что именно и как эти центриоли могут вносить вклад.
Зигота человека наследует два функциональных центриоля сперматозоидов
Хотя исследования на людях отсутствуют, две центриоли сперматозоидов, вероятно, присутствуют в ранних зиготах и четыре во время митоза. Зигота человека наследует ПК от сперматозоидов, что хорошо известно (Sathananthan et al., 1991). Кроме того, зигота человека, вероятно, унаследует DC, потому что (1) сперматозоиды имеют реконструированный DC, который прикреплен к аксонеме (Fishman et al., 2018), и (2) основание аксонемы расположено в одном из полюса шпинделя (Asch et al., 1995; Ван Блерком, 1996; Симерли и др. , 1999; Ковачич и Влайсавлевич, 2000).
, 1999; Ковачич и Влайсавлевич, 2000).
Kai et al. (2015) показали наличие двух центросом в зиготах с двумя пронуклеусами (предположительно оплодотворенных одним спермой) путем иммунофлуоресцентного окрашивания на центросомы. Sathananthan et al. (1991) идентифицировали центриоли в центросомах зигот с двумя пронуклеусами с помощью электронной микроскопии после оплодотворения in vitro ; наблюдались две центросомы с одной или двумя центриолями.Оба Кай и др. (2015) и Sathananthan et al. (1991) наблюдали четыре центросомы в ранних зиготах с тремя пронуклеусами, предполагая, что диспермические эмбрионы обеспечивают дополнительные центриоли, которые образуют дополнительные центросомы. Интересно, что у этих зигот наблюдались только три, а не четыре полюса веретена. Наличие только трех полюсов у диспермических эмбрионов, несмотря на присутствие четырех центросом, поднимает вопрос о том, определяется ли число полюсов центриолями сперматозоидов или пронуклеусами. Однако эти исследования согласуются с идеей, что человеческая сперма обычно составляет две центриоли зиготы.
После слияния мембран центросома формирует один сперматозоид около головки, который затем увеличивается по большей части цитоплазмы зиготы (Van Blerkom, 1996; Simerly et al., 1999). Во время миграции пронуклеусов эта астра распадается на две части. Позже каждая звездочка локализуется на одном полюсе формирующегося биполярного митотического веретена. Интересно, что после первоначального образования астры коллапсируют и становятся либо маленькими, либо неузнаваемыми во время метафазы. Этот коллапс носит временный характер, поскольку астры снова появляются в анафазе.Почему астры коллапсируют во время метафазы, неизвестно и требует дальнейшего изучения.
Принято считать, что центриоли сперматозоидов человека необходимы для миграции пронуклеусов, основываясь на исследованиях аномальных сперматозоидов в зиготе. Иммунофлуоресцентный анализ оплодотворенных зигот с задержкой развития показал дезорганизованные и уменьшенные массивы микротрубочек сперматозоидов, наряду с отсутствием образования и / или миграции пронуклеусов (Asch et al. , 1995; Van Blerkom, 1996). Эти совпадающие данные предполагают, что сперматозоиды могут быть ответственны за нормальное развитие пронуклеусов.Эти исследования ограничены тем фактом, что микротрубочки также зарождаются нецентриолярными центрами организации микротрубочек, и что во многих из этих исследований дефект центриоли не был обнаружен или изучен, что делает особую роль центриоли и сперматозоидов астра в зиготе неясна.
, 1995; Van Blerkom, 1996). Эти совпадающие данные предполагают, что сперматозоиды могут быть ответственны за нормальное развитие пронуклеусов.Эти исследования ограничены тем фактом, что микротрубочки также зарождаются нецентриолярными центрами организации микротрубочек, и что во многих из этих исследований дефект центриоли не был обнаружен или изучен, что делает особую роль центриоли и сперматозоидов астра в зиготе неясна.
Считается, что после попадания в яйцеклетку ПК высвобождается из структур шейки сперматозоидов до рекрутирования ПКМ и образования астральных микротрубочек, процесс, который предположительно опосредуется протеасомами (Wojcik et al., 2000; Rawe et al., 2008; Сутовский, 2018), но отрыв ДК от шейных структур неизвестно. Протеасомы сперматозоидов были локализованы в области шеи / средней части в тесной связи с центриолями; однако об их функциях известно относительно мало. Сперматозоиды от людей и крупного рогатого скота, предварительно загруженные блокирующими функцию антипротеасомными антителами, привели к нарушению образования сперматозоидов и развитию / сопоставлению пронуклеусов человеческих ооцитов, несмотря на отсутствие наблюдаемых структурных дефицитов центриолей (Rawe et al.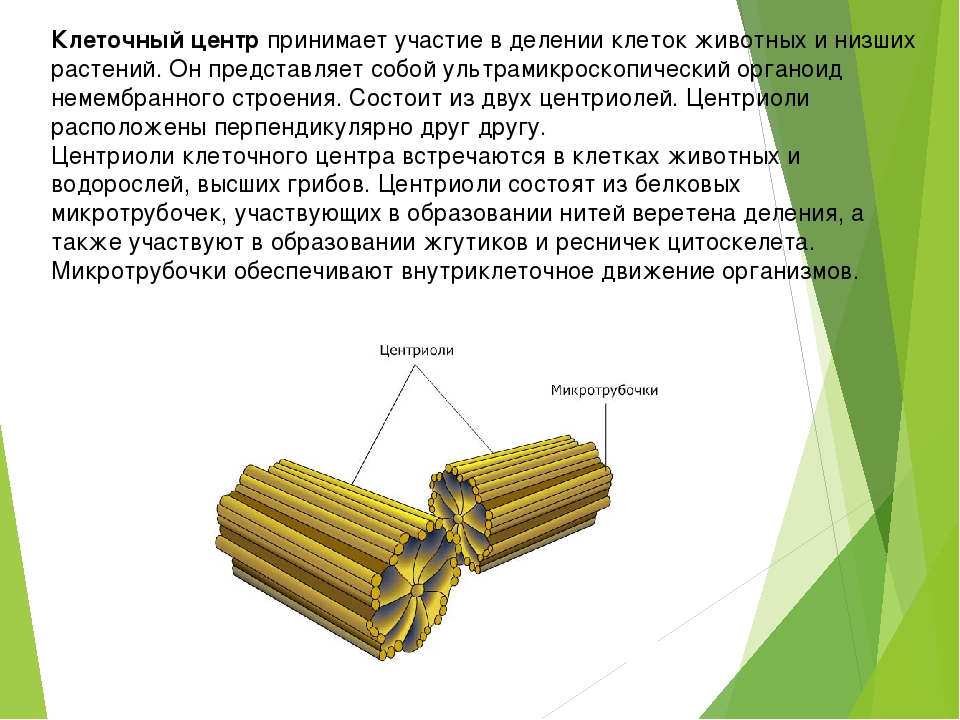 , 2008). Это указывает на то, что протеасомы сперматозоидов могут играть важную роль в вкладе центриолей в развитие зигот. Необходимо провести дополнительные фармакологические и генетические исследования, чтобы изучить механизм и точную роль протеасомы в центриолях сперматозоидов и зигот.
, 2008). Это указывает на то, что протеасомы сперматозоидов могут играть важную роль в вкладе центриолей в развитие зигот. Необходимо провести дополнительные фармакологические и генетические исследования, чтобы изучить механизм и точную роль протеасомы в центриолях сперматозоидов и зигот.
Эпидемиологические доказательства вклада центриолей в фертильность человека
Сперма с нарушенными центриолями долгое время считалось причиной образования эмбрионов с аномальным дроблением и бесплодием (Sathananthan, 1994; Schatten, 1994).Эта идея в настоящее время широко принята и поддерживается некоторыми эпидемиологическими исследованиями с использованием искусственного оплодотворения для преодоления препятствий к оплодотворению в образцах дефектной спермы. Однако эта идея основана на нескольких исследованиях, в которых анализировались 1–10 пациентов и несколько фертильных доноров в качестве контроля (таблица 1). Фенотипы, наблюдаемые в этих исследованиях, разнообразны, что дает возможность для многих выводов, но затрудняет прямую корреляцию с фенотипом центриолей. Также многие исследования осложняются наличием других дефектов сперматозоидов (помимо центриоли), которые могут иметь значительное влияние на фенотип эмбриона.В частности, можно ожидать, что некоторые формы центриолярного дефекта могут возникать на ранних этапах развития зародышевой линии и приведут к аномальному содержанию ДНК из-за аномалий митоза или мейоза в дополнение к дефекту центриоли, как было обнаружено для мутации в центриолярном белке Centrobin. (Лишка и др., 2009). К сожалению, эти недостатки негативно влияют на нашу уверенность в том, что мы делаем вывод о роли центриоли сперматозоидов в развитии эмбриона. Однако совокупность этих исследований предполагает, что центриоли сперматозоидов, вероятно, необходимы для нормального развития эмбриона.
Также многие исследования осложняются наличием других дефектов сперматозоидов (помимо центриоли), которые могут иметь значительное влияние на фенотип эмбриона.В частности, можно ожидать, что некоторые формы центриолярного дефекта могут возникать на ранних этапах развития зародышевой линии и приведут к аномальному содержанию ДНК из-за аномалий митоза или мейоза в дополнение к дефекту центриоли, как было обнаружено для мутации в центриолярном белке Centrobin. (Лишка и др., 2009). К сожалению, эти недостатки негативно влияют на нашу уверенность в том, что мы делаем вывод о роли центриоли сперматозоидов в развитии эмбриона. Однако совокупность этих исследований предполагает, что центриоли сперматозоидов, вероятно, необходимы для нормального развития эмбриона.
Таблица 1. Параметры различных исследований нарушений прямого фенотипа сперматозоидов.
Интрацитоплазматическая инъекция сперматозоидов является эффективным средством лечения мужского бесплодия из-за вмешательства в транслокацию сперматозоидов в яйцеклетку и слияние с ней, но не при бесплодии из-за дисфункции компонентов сперматозоидов, которые необходимы после слияния (Palermo et al. , 1992). Действительно, ИКСИ позволяет успешное оплодотворение для многих пар, но для этого может потребоваться несколько попыток, а во многих других парах это не удается [обзор Neri et al.(2014)]. Это говорит о том, что в этих неудачных случаях бесплодие может быть вызвано процессами после слияния гамет, которые зависят от мужского вклада. Однако многофакторный характер снижения качества спермы не позволяет полностью выяснить многие из лежащих в основе молекулярных механизмов.
, 1992). Действительно, ИКСИ позволяет успешное оплодотворение для многих пар, но для этого может потребоваться несколько попыток, а во многих других парах это не удается [обзор Neri et al.(2014)]. Это говорит о том, что в этих неудачных случаях бесплодие может быть вызвано процессами после слияния гамет, которые зависят от мужского вклада. Однако многофакторный характер снижения качества спермы не позволяет полностью выяснить многие из лежащих в основе молекулярных механизмов.
Единственным рутинным клиническим анализом для оценки фенотипа сперматозоидов является анализ спермы, и этот анализ сам по себе не может указывать на центриоль сперматозоидов в бесплодии. Анализ спермы сравнивает качество спермы пациента с несколькими стандартизованными параметрами и помогает выявить специфические дефекты у мужчин, которые наблюдаются примерно у одной трети бесплодных пар (Isidori et al., 2006) (таблица 1). Одна группа дефектов сперматозоидов с несколькими фенотипами, которые могут происходить из центриолярного дефекта, — это идиопатические мужские факторы (мужское бесплодие из-за дефекта спермы, которому нет объяснения, то есть, когда мужчина бесплоден, несмотря на нормальный анализ спермы, анамнез и физикальное обследование, и когда женское бесплодие было исключено) (Chemes and Rawe, 2010). Например, было высказано предположение, что аномальные центриоли образуют аномальный хвост сперматозоида (который является одним из фенотипов тератозооспермии, определяемый как наличие сперматозоидов с аномальной морфологией), дефектный аксонема сперматозоида, приводящий к плохой подвижности (астенозооспермия), или сочетание два (астенотератозооспермия).Некоторые из этих случаев мужского бесплодия могут быть вызваны тонким центриолярным дефектом сперматозоидов — гипотеза, которая будет рассмотрена в следующих разделах.
Например, было высказано предположение, что аномальные центриоли образуют аномальный хвост сперматозоида (который является одним из фенотипов тератозооспермии, определяемый как наличие сперматозоидов с аномальной морфологией), дефектный аксонема сперматозоида, приводящий к плохой подвижности (астенозооспермия), или сочетание два (астенотератозооспермия).Некоторые из этих случаев мужского бесплодия могут быть вызваны тонким центриолярным дефектом сперматозоидов — гипотеза, которая будет рассмотрена в следующих разделах.
Астенотератозооспермия
Чрезвычайно ненормальная морфология сперматозоидов может подавлять движение сперматозоидов по женским репродуктивным путям и препятствовать слиянию с ооцитом. Эти морфологические аномалии имеют множество причин и принимают разные формы, и их определение спорно, но они могут присутствовать примерно у 10% бесплодных мужчин (Khan et al., 2011). Как описано ниже, предполагается, что некоторые из этих случаев вызваны или сопровождаются центриолярным дефектом, но эти дефекты полностью не выяснены.
Дефект головы и шеи
Дефекты голова-шея, характеризующиеся разделенными головами и хвостами, являются убедительным доказательством того, что центриоли человека необходимы для фертильности; однако у этого доказательства есть некоторые ограничения. У мышей инъекция ядра сперматозоида без хвоста сперматозоида приводит к оплодотворенной яйцеклетке, дающей потомство, что позволяет предположить, что центриоли сперматозоидов мыши не требуются (Kuretake et al., 1996). Напротив, у людей инъекции ядра сперматозоида без хвоста сперматозоида недостаточно для получения потомства (Palermo et al., 1997; Emery et al., 2004). Это может указывать на то, что центриолярное отсутствие является причиной бесплодия, но эта интерпретация ограничена тем фактом, что другие компоненты в хвосте могут быть важны для развития эмбриона у человека. Например, недавно было показано, что MicroRNA-34c локализуется в шейке сперматозоидов и требуется для первого деления расщепления (Liu W.-M. et al., 2012; Ферештех и др. , 2018). Следовательно, в этих типах экспериментов невозможно отделить фенотипические последствия отсутствия отцовских центриолей от не доставки других факторов, существенных в зиготе.
, 2018). Следовательно, в этих типах экспериментов невозможно отделить фенотипические последствия отсутствия отцовских центриолей от не доставки других факторов, существенных в зиготе.
Цепочка сперматозоидов, содержащая центриоли, является механически самой слабой частью сперматозоидов. Приложенное извне давление может привести к разрыву шейки сперматозоида с образованием двух фрагментов: фрагмента головы и фрагмента шейки и хвоста (Firat-Karalar et al., 2014).Действительно, обезглавленная сперма часто разрывается между головой и хвостом и лишь реже — в средней части (Baccetti et al., 1989; Rawe et al., 2002; Porcu et al., 2003; Gambera et al., 2010). Другая редкая форма разрыва вызвана диссоциацией между ПК и DC (Holstein et al., 1986). В сперматозоидах с дефектом голова-шея наблюдаются различные структурные аномалии, но их причины до сих пор недостаточно изучены. Синдром легко обезглавленной спермы является одним из самых легких подтипов тератозооспермии с дефектом голова-шея, поскольку некоторые головки и хвосты в эякуляте остаются связанными (Perotti et al. , 1981; Toyama et al., 2000). Электронная микроскопия обезглавленных сперматозоидов часто выявляет отсутствие базальной пластинки и / или имплантационной ямки с заметными разрывами между головкой и хвостом (Baccetti et al., 1989) (Рисунок 2). Инъекция отдельных или отдельных частей сперматозоидов делает возможной активацию ооцитов и образование пронуклеусов, но не способствует миграции и слиянию пронуклеусов, что приводит к аномальным эмбрионам (Colombero et al., 1996). Эмбрионы, которым инъецировали рассеченные изолированные хвосты сперматозоидов или разделенные головы и хвосты, демонстрируют мозаицизм хромосом, что свидетельствует о дисфункции центросом и центриолей (Palermo et al., 1997). Однако в целом ИКСИ дает смешанные результаты с легко обезглавленной спермой, иногда помогает преодолеть бесплодие, но во многих случаях оказывается неудачной, несмотря на хорошую морфологию эмбриона (Kamal et al., 1999; Saias-Magnan et al., 1999).
, 1981; Toyama et al., 2000). Электронная микроскопия обезглавленных сперматозоидов часто выявляет отсутствие базальной пластинки и / или имплантационной ямки с заметными разрывами между головкой и хвостом (Baccetti et al., 1989) (Рисунок 2). Инъекция отдельных или отдельных частей сперматозоидов делает возможной активацию ооцитов и образование пронуклеусов, но не способствует миграции и слиянию пронуклеусов, что приводит к аномальным эмбрионам (Colombero et al., 1996). Эмбрионы, которым инъецировали рассеченные изолированные хвосты сперматозоидов или разделенные головы и хвосты, демонстрируют мозаицизм хромосом, что свидетельствует о дисфункции центросом и центриолей (Palermo et al., 1997). Однако в целом ИКСИ дает смешанные результаты с легко обезглавленной спермой, иногда помогает преодолеть бесплодие, но во многих случаях оказывается неудачной, несмотря на хорошую морфологию эмбриона (Kamal et al., 1999; Saias-Magnan et al., 1999).
Рисунок 2. Примеры морфологии, структуры и распределения белков сперматозоидов у фертильного донора (A) , олигоспермия (B) , дефект голова-шея (C) , DFS (D) , MMAF (E) и необъяснимое бесплодие (F) .
Chemes et al. (1999; Таблица 1) использовали электронную микроскопию биоптатов яичек пациентов с этим дефектом, чтобы показать, что формирующийся хвост сперматозоидов развивался нехарактерно независимо от ядра, явление, которое может быть вызвано центриолярным дефектом. Rawe et al. (2002; Таблица 1) использовали иммунофлуоресценцию сперматозоидов человека с этим дефектом, введенными в ооциты крупного рогатого скота, чтобы показать дефицитные микротрубочки, связанные с центросомами, и задержанные сперматозоиды, по сравнению с контрольными фертильными донорами, которые формировали сперматозоиды в большинстве образцов.Эякулированные сперматозоиды пациентов также вводили в ооциты метафазы II человека и анализировали с помощью иммунофлуоресценции. С первой попытки не произошло слияния пронуклеусов или расщепления зиготы. Следующие три попытки выборочно вводили сперму с почти нормальным выравниванием головы и шеи; они привели к слиянию и расщеплению, но эмбрионы не смогли развиться до беременности. Эмери и др. (2004; Таблица 1) выполнили ИКСИ с легко обезглавленной спермой и сообщили об успешных родах, когда разделенные хвосты были помещены непосредственно рядом с головкой сперматозоида внутри ооцита.Авторы предположили, что тщательная интеграция всех частей сперматозоидов (головы и хвоста) во время ИКСИ гарантирует, что центриоли, которые, вероятно, теряются при других менее деликатных методах, включены и в конечном итоге обеспечивают нормальное развитие ооцита. Действительно (таблица 1), успешная беременность может быть достигнута с помощью ИКСИ с использованием интактной спермы мужчин с аномальным соединением голова-хвост (Porcu et al., 2003; Gambera et al., 2010).
Эмери и др. (2004; Таблица 1) выполнили ИКСИ с легко обезглавленной спермой и сообщили об успешных родах, когда разделенные хвосты были помещены непосредственно рядом с головкой сперматозоида внутри ооцита.Авторы предположили, что тщательная интеграция всех частей сперматозоидов (головы и хвоста) во время ИКСИ гарантирует, что центриоли, которые, вероятно, теряются при других менее деликатных методах, включены и в конечном итоге обеспечивают нормальное развитие ооцита. Действительно (таблица 1), успешная беременность может быть достигнута с помощью ИКСИ с использованием интактной спермы мужчин с аномальным соединением голова-хвост (Porcu et al., 2003; Gambera et al., 2010).
ИКСИ с аномалией хвоста сперматозоида (MMAF)
Множественные морфологические аномалии жгутиков (MMAF) — редкая форма астенотератозооспермии, которая, как известно, вызывает мужское бесплодие (Wang et al., 2019). MMAF вызывается мутациями в белках аксонемы или транспортным механизмом, который его формирует [например, ДНКh2 тяжелой цепи внутреннего плеча (Ben Khelifa et al.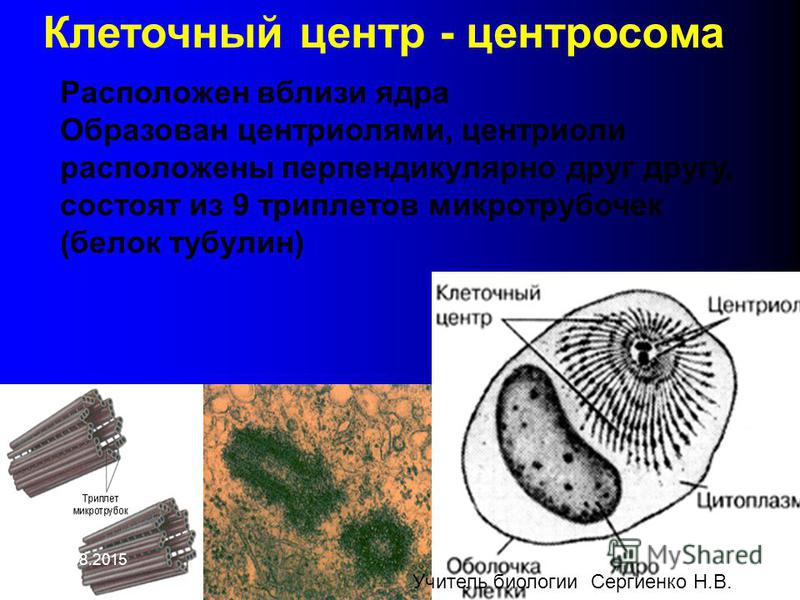 , 2014), или белка TTC21A, ассоциированного с внутричерепным транспортом (IFT) (Liu et al. al., 2019)] около 50% или более молекулярных механизмов, лежащих в основе MMAF, еще предстоит идентифицировать. Недавно было обнаружено, что спорадический дефект центриолярного белка CEP135 вносит вклад в MMAF (Table 1). Sha et al. (2017) идентифицировали унаследованную миссенс-гомозиготную мутацию в CEP135 у бесплодного мужчины с MMAF.Иммунофлуоресцентный анализ показал, что CEP135 локализован в ПК в нормальных сперматозоидах, тогда как мутировавшие белки пациента локализованы в другом месте сперматозоидов, образуя эктопические агрегаты в шейке и жгутиках сперматозоидов (рис. 2). После ИКСИ эмбрионы продемонстрировали образование пронуклеусов и дробление, но в конечном итоге мать не забеременела. Это указывает на то, что аномалия центриолей может давать фенотип, который проявляется позже в эмбриогенезе.
, 2014), или белка TTC21A, ассоциированного с внутричерепным транспортом (IFT) (Liu et al. al., 2019)] около 50% или более молекулярных механизмов, лежащих в основе MMAF, еще предстоит идентифицировать. Недавно было обнаружено, что спорадический дефект центриолярного белка CEP135 вносит вклад в MMAF (Table 1). Sha et al. (2017) идентифицировали унаследованную миссенс-гомозиготную мутацию в CEP135 у бесплодного мужчины с MMAF.Иммунофлуоресцентный анализ показал, что CEP135 локализован в ПК в нормальных сперматозоидах, тогда как мутировавшие белки пациента локализованы в другом месте сперматозоидов, образуя эктопические агрегаты в шейке и жгутиках сперматозоидов (рис. 2). После ИКСИ эмбрионы продемонстрировали образование пронуклеусов и дробление, но в конечном итоге мать не забеременела. Это указывает на то, что аномалия центриолей может давать фенотип, который проявляется позже в эмбриогенезе.
Дисплазия фиброзной оболочки
Фиброзная оболочка — это структура, окружающая аксонему в основной части жгутика (Рис. 2).Дисплазия фиброзной оболочки — редкое состояние неподвижных сперматозоидов, которые имеют морфологические деформации в области шеи, средней части и хвоста и проявляют центриолярную дисфункцию. Микроскопия диспластических сперматозоидов выявляет увеличенную и дезорганизованную фиброзную оболочку с разрушением основной аксонемы (Chemes et al., 1987a). Иммунофлуоресценция с центриолярным белком Centrin-1 показывает частое аномальное расположение центриолей, иногда с дупликацией, что приводит к двум участкам имплантации ядра (Moretti et al., 2017). Первоначальные попытки ИКСИ с диспластической спермой не привели к беременности из-за неудачного оплодотворения или развития эмбриона (Chemes and Rawe, 2003). Накамура и др. (2005) использовали ооциты крупного рогатого скота для гетерологичного ИКСИ и обнаружили, что подавляющее большинство инъецированных ооцитов не показали иммуноцитохимических свидетельств образования сперматозоидов или организации цитоплазматических микротрубочек. Это согласуется с наблюдением, что только 2% диспластических сперматозоидов экспрессируют центриолярный белок центрин в средней части.
2).Дисплазия фиброзной оболочки — редкое состояние неподвижных сперматозоидов, которые имеют морфологические деформации в области шеи, средней части и хвоста и проявляют центриолярную дисфункцию. Микроскопия диспластических сперматозоидов выявляет увеличенную и дезорганизованную фиброзную оболочку с разрушением основной аксонемы (Chemes et al., 1987a). Иммунофлуоресценция с центриолярным белком Centrin-1 показывает частое аномальное расположение центриолей, иногда с дупликацией, что приводит к двум участкам имплантации ядра (Moretti et al., 2017). Первоначальные попытки ИКСИ с диспластической спермой не привели к беременности из-за неудачного оплодотворения или развития эмбриона (Chemes and Rawe, 2003). Накамура и др. (2005) использовали ооциты крупного рогатого скота для гетерологичного ИКСИ и обнаружили, что подавляющее большинство инъецированных ооцитов не показали иммуноцитохимических свидетельств образования сперматозоидов или организации цитоплазматических микротрубочек. Это согласуется с наблюдением, что только 2% диспластических сперматозоидов экспрессируют центриолярный белок центрин в средней части. Неспособность образовать астры сперматозоидов в условиях сильно сниженной экспрессии центрина убедительно свидетельствует о том, что центриоли сперматозоидов либо аномальны, либо отсутствуют. Следовательно, кажется вероятным, что аномалия центриолей способствует бесплодию у некоторых из этих пациентов.
Неспособность образовать астры сперматозоидов в условиях сильно сниженной экспрессии центрина убедительно свидетельствует о том, что центриоли сперматозоидов либо аномальны, либо отсутствуют. Следовательно, кажется вероятным, что аномалия центриолей способствует бесплодию у некоторых из этих пациентов.
Глобозооспермия
Глобозооспермия — редкое состояние, характеризующее сперматозоиды с круглой головкой и дезорганизованной средней частью, в которых отсутствуют как функциональные акросомы, так и акросомальные ферменты (Singh, 1992). Отсутствие акросомы препятствует проникновению в прозрачную оболочку ооцита, и первоначально считалось, что это единственная причина бесплодия пораженных сперматозоидов (Rybouchkin et al., 1996). Показатель успешного оплодотворения с помощью ИКСИ у мужчин с глобозооспермией ниже, чем общий показатель успешности ИКСИ [см. Обзор Dam et al. (2007)], предполагая, что могут быть дополнительные проблемы с репродуктивным механизмом, которые не решаются с помощью ИКСИ. Объяснить это несоответствие может дисфункция центриолей. Действительно, глобозооспермальные сперматозоиды, по-видимому, обладают дисфункцией центриолей, что подтверждается гетерологичным ИКСИ с ооцитами крупного рогатого скота [обзор в Dam et al. (2007)] (таблица 1), а также биофлуоресцентное окрашивание центрина-1 (Moretti et al., 2019). Например, Накамура и др. (2002) обнаружили, что глобозооспермальные сперматозоиды демонстрируют значительно более низкую скорость образования сперматозоидов по сравнению с контрольными фертильными донорскими спермиями, что свидетельствует о дисфункции центросом. Однако они также показали значительно более низкую скорость образования мужских пронуклеусов и значительно более высокую частоту преждевременной конденсации хромосом, что указывает на более плейотропный механизм. Во многих работах показано, что центриоли глобозооспермных сперматозоидов имеют нормальную ультраструктуру, но их состав еще предстоит полностью изучить.Однако из-за гетерологичной природы глобозооспермии, открытия атипичных ДК и функциональных данных, показывающих плохое образование звездочек у эмбрионов глобозооспермии, мы предполагаем, что необходима дополнительная работа, чтобы проверить, могут ли деформированные центриоли быть вовлечены в это заболевание.
Объяснить это несоответствие может дисфункция центриолей. Действительно, глобозооспермальные сперматозоиды, по-видимому, обладают дисфункцией центриолей, что подтверждается гетерологичным ИКСИ с ооцитами крупного рогатого скота [обзор в Dam et al. (2007)] (таблица 1), а также биофлуоресцентное окрашивание центрина-1 (Moretti et al., 2019). Например, Накамура и др. (2002) обнаружили, что глобозооспермальные сперматозоиды демонстрируют значительно более низкую скорость образования сперматозоидов по сравнению с контрольными фертильными донорскими спермиями, что свидетельствует о дисфункции центросом. Однако они также показали значительно более низкую скорость образования мужских пронуклеусов и значительно более высокую частоту преждевременной конденсации хромосом, что указывает на более плейотропный механизм. Во многих работах показано, что центриоли глобозооспермных сперматозоидов имеют нормальную ультраструктуру, но их состав еще предстоит полностью изучить.Однако из-за гетерологичной природы глобозооспермии, открытия атипичных ДК и функциональных данных, показывающих плохое образование звездочек у эмбрионов глобозооспермии, мы предполагаем, что необходима дополнительная работа, чтобы проверить, могут ли деформированные центриоли быть вовлечены в это заболевание.
Астенозооспермия
Плохая подвижность сперматозоидов, наблюдаемая при астенозооспермии, препятствует правильному транспорту сперматозоидов к ооциту для проникновения и слияния мембран. Теоретически это бесплодие должно быть полностью решено с помощью ИКСИ, поскольку сперматозоиды искусственно переносятся внутрь ооцита.Однако низкая частота успешных беременностей с ИКСИ на фоне полной астенозооспермии предполагает наличие дополнительных факторов (Nagy et al., 1995; Casper et al., 1996; Kahraman et al., 1996; Nijs et al., 1996). ; Cayan et al., 2001; Fonttis et al., 2002; Chatzimeletiou et al., 2007; Terada et al., 2009). Иммуноцитохимический анализ ооцитов, которые не удалось оплодотворить донором атенозооспермии, показал несколько фенотипов, включая два пронуклеуса без присутствия узнаваемого образования сперматозоидов, что позволяет предположить, что дисфункция центросом вызвала остановку оплодотворения (Terada et al., 2009). Вестерн-блоттинг и анализ ELISA показали, что центриолярный белок центрин и центриолярный и жгутиковый белок Tektin 2 снижены у мужчин с олигоастенозооспермией, что позволяет предположить, что их более низкие уровни могут привести к снижению процента беременностей после ИКСИ (Hinduja et al. , 2008, 2010; Bhilawadikar et al. др., 2013). Кроме того, недавно было обнаружено, что основание хвоста сперматозоидов функционирует как атипичная центриоль в зиготе (Avidor-Reiss and Fishman, 2018). Таким образом, центриолярная дисфункция может не только нарушить подвижность сперматозоидов, как первоначально предполагалось, но также может вызвать нарушение зиготических внутриклеточных процессов, которое ИКСИ не может исправить.
, 2008, 2010; Bhilawadikar et al. др., 2013). Кроме того, недавно было обнаружено, что основание хвоста сперматозоидов функционирует как атипичная центриоль в зиготе (Avidor-Reiss and Fishman, 2018). Таким образом, центриолярная дисфункция может не только нарушить подвижность сперматозоидов, как первоначально предполагалось, но также может вызвать нарушение зиготических внутриклеточных процессов, которое ИКСИ не может исправить.
Азооспермия для лечения с использованием круглых сперматид
Азооспермия определяется как полное отсутствие сперматозоидов в эякуляте и присутствует примерно у 15% бесплодных мужчин (Jarow et al., 1989). Его можно лечить с помощью сперматидов или сперматозоидов яичек. Однако использование круглых сперматид имеет ограниченный успех, а частота оплодотворения была ниже, чем при использовании удлиненных сперматид или сперматозоидов [обсуждается в Liu X.-Y. и другие. (2012)]. Одно из возможных объяснений состоит в том, что две центриоли сперматозоидов еще не реконструированы в круглые сперматиды. Как состояние центриолярного ремоделирования влияет на развитие эмбриона, требует дальнейшего изучения.
Как состояние центриолярного ремоделирования влияет на развитие эмбриона, требует дальнейшего изучения.
Бесплодие без объяснения причин
Необъяснимое бесплодие, отсутствие каких-либо наблюдаемых мужских или женских факторов, как известно, вызывает бесплодие в 10–30% случаев (Hart, 2003; Gunn and Bates, 2016). Недавно Гаранина и соавт. (2019) предположили, что более длинная центриолярная добавка сперматозоидов связана с необъяснимым бесплодием. С помощью просвечивающей электронной микроскопии они обнаружили, что средняя общая длина ПК и его центриолярного придатка была значительно больше в сперматозоидах двух пациентов с необъяснимым бесплодием, чем в сперматозоидах пяти здоровых доноров.У двух пораженных пациентов наблюдалась повторная остановка зиготы после оплодотворения in vitro . У одного пациента была центриолярная добавка, длина которой почти вдвое больше, чем у здоровых доноров, и все методы лечения бесплодия были неэффективны. Вторая пациентка с промежуточными результатами (примерно на 1,5 дольше) наконец зачала здорового ребенка, который родился на 40 неделе беременности.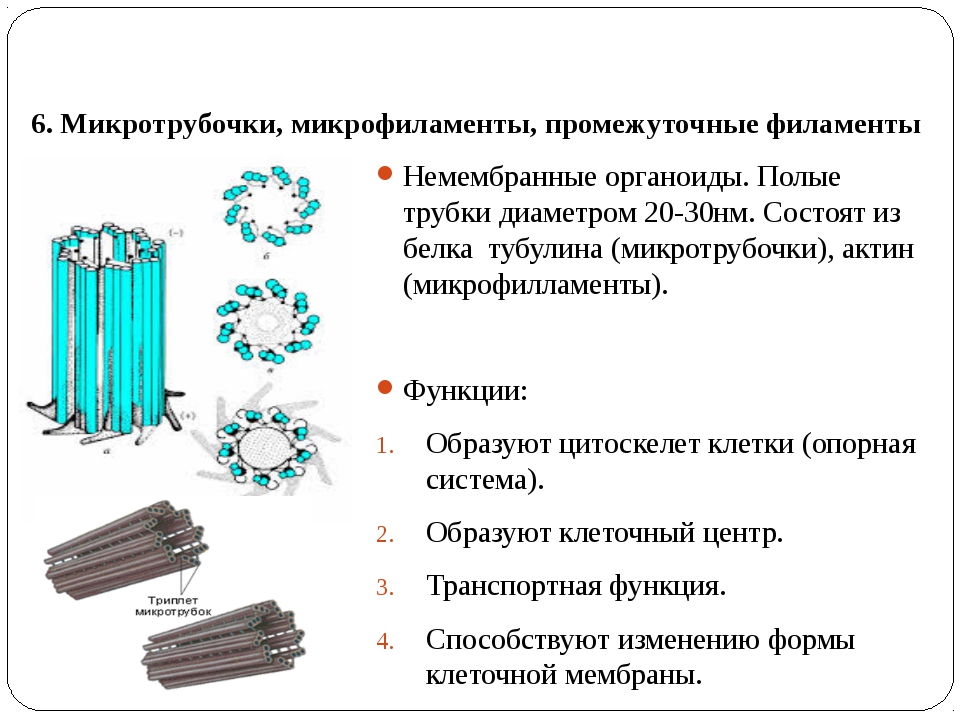 В конечном итоге функция центриолярного придатка до сих пор неизвестна. У всех млекопитающих, за исключением человека, центриолярный компонент представляет собой временную структуру, присутствующую во время спермиогенеза, но отсутствующую в зрелом сперматозоиде (рис. 2).В сперматозоидах человека присутствует центриолярный компонент, который, как предполагалось, является характеристикой относительной незрелости сперматозоидов человека (Zamboni and Stefanini, 1971). Следовательно, неясно, важны ли центриолярные надстройки только для людей, если длинные центриолярные надстройки вызывают проблемы, или если длинные центриолярные надстройки являются маркером других дефектов центриолей. Необходимо дальнейшее изучение связи между центриолярными добавками и исходом фертильности.
В конечном итоге функция центриолярного придатка до сих пор неизвестна. У всех млекопитающих, за исключением человека, центриолярный компонент представляет собой временную структуру, присутствующую во время спермиогенеза, но отсутствующую в зрелом сперматозоиде (рис. 2).В сперматозоидах человека присутствует центриолярный компонент, который, как предполагалось, является характеристикой относительной незрелости сперматозоидов человека (Zamboni and Stefanini, 1971). Следовательно, неясно, важны ли центриолярные надстройки только для людей, если длинные центриолярные надстройки вызывают проблемы, или если длинные центриолярные надстройки являются маркером других дефектов центриолей. Необходимо дальнейшее изучение связи между центриолярными добавками и исходом фертильности.
Необходим специальный и быстрый метод оценки центриолей сперматозоидов
Доступно несколько тестов для изучения типичных центриолей сперматозоидов.Однако технология либо недостаточно специфична, либо чрезмерно трудоемка. Центриоли сперматозоидов оценивались с помощью электронной микроскопии — трудоемкого метода, который не подходит для крупномасштабных исследований и недоступен в большинстве клинических условий (Chemes et al., 1987b; Moretti et al., 2016). Содержание центриолярного белка в сперматозоидах оценивалось с помощью вестерн-блоттинга, который изучал общий белок и не специфичен для центриоли и не может окончательно указывать на центриоль в бесплодии (Hinduja et al., 2010). Функцию центриолей сперматозоидов оценивали с помощью микроинъекции спермы человека в ооциты крупного рогатого скота, кролика или хомяка с последующим иммунофлуоресцентным окрашиванием для выявления образования звездочек, что было полезно при изучении аномальных центриолей сперматозоидов в некоторых случаях бесплодия (Rawe et al., 2002; Terada et al. др., 2004; Йошимото-Какой и др., 2008). Однако в настоящее время этот метод является незаконным в соответствии с поправкой Дики-Уикера (федеральный закон США, запрещающий финансирование создания человеческих эмбрионов в исследовательских целях).
Центриоли сперматозоидов оценивались с помощью электронной микроскопии — трудоемкого метода, который не подходит для крупномасштабных исследований и недоступен в большинстве клинических условий (Chemes et al., 1987b; Moretti et al., 2016). Содержание центриолярного белка в сперматозоидах оценивалось с помощью вестерн-блоттинга, который изучал общий белок и не специфичен для центриоли и не может окончательно указывать на центриоль в бесплодии (Hinduja et al., 2010). Функцию центриолей сперматозоидов оценивали с помощью микроинъекции спермы человека в ооциты крупного рогатого скота, кролика или хомяка с последующим иммунофлуоресцентным окрашиванием для выявления образования звездочек, что было полезно при изучении аномальных центриолей сперматозоидов в некоторых случаях бесплодия (Rawe et al., 2002; Terada et al. др., 2004; Йошимото-Какой и др., 2008). Однако в настоящее время этот метод является незаконным в соответствии с поправкой Дики-Уикера (федеральный закон США, запрещающий финансирование создания человеческих эмбрионов в исследовательских целях). Из-за этих ограничений дефект центриоли сперматозоидов у бесплодных мужчин был продемонстрирован только в небольших тематических исследованиях (Nanassy and Carrell, 2008; Chemes, 2012; Moretti et al., 2016; Sha et al., 2017). Следовательно, существует потребность в специфическом и высокопроизводительном методе оценки центриолей сперматозоидов и определения их ассоциации с определенными эмбриональными фенотипами и исходами.
Из-за этих ограничений дефект центриоли сперматозоидов у бесплодных мужчин был продемонстрирован только в небольших тематических исследованиях (Nanassy and Carrell, 2008; Chemes, 2012; Moretti et al., 2016; Sha et al., 2017). Следовательно, существует потребность в специфическом и высокопроизводительном методе оценки центриолей сперматозоидов и определения их ассоциации с определенными эмбриональными фенотипами и исходами.
Перспективы будущего
Предыдущие исследования на животных и эпидемиологические исследования центриолей сперматозоидов дают основу для корреляции между аномалией центриолей и патологией развития эмбриона; однако для окончательного вывода по этому поводу необходимы дальнейшие исследования.Это исследование должно включать новые модели млекопитающих и более убедительные клинические исследования.
Поскольку у мышей нет определяемых центриолей в сперме и ранних эмбрионах, необходимо разработать другие модели млекопитающих с этими центриолями. Например, наследование центриолей у кроликов напоминает наследование у людей, и они являются подходящими моделями, потому что они являются самым маленьким немышиным млекопитающим с установленной генной инженерией (Liu et al. , 2004; Terada, 2007). Было бы очень полезно создать модельного кролика для изучения бесплодия на основе центриолей; однако для этого сначала необходимо определить инструменты, необходимые для специфического воздействия на центриоль сперматозоидов.Характеристика механизмов формирования и функционирования центриолей сперматозоидов, а также их уникальных свойств предоставит понимание, необходимое для разработки этих инструментов. Редактирование CRISPR / Cas9 можно использовать для изменения последовательностей, специфичных для сперматозоидов, что позволит создать конкретное модельное животное.
, 2004; Terada, 2007). Было бы очень полезно создать модельного кролика для изучения бесплодия на основе центриолей; однако для этого сначала необходимо определить инструменты, необходимые для специфического воздействия на центриоль сперматозоидов.Характеристика механизмов формирования и функционирования центриолей сперматозоидов, а также их уникальных свойств предоставит понимание, необходимое для разработки этих инструментов. Редактирование CRISPR / Cas9 можно использовать для изменения последовательностей, специфичных для сперматозоидов, что позволит создать конкретное модельное животное.
Несмотря на корреляцию между дисфункцией центриолей и бесплодием, которая была предложена в эпидемиологической литературе, степень и значение этой связи до сих пор не известны.Основная причина заключается в том, что большинство исследований на людях на сегодняшний день не продемонстрировали явных случаев дисфункции специфических центриолей. Следовательно, необходимо разработать диагностический тест, чтобы лучше идентифицировать сперматозоиды с определенным центриолярным дефектом. Кроме того, поскольку такой дефект может затронуть лишь небольшую часть всех случаев бесплодия, диагностический тест должен быть простым и быстрым. Еще один подход к улучшению эпидемиологических исследований — это включение расширенного анализа спермы, который исследует ДНК и факторы активации яйцеклетки, с последующим тестированием спермы, имеющей только центриолярный дефект.В конечном итоге эти усилия должны привести к более убедительным клиническим исследованиям, таким как большие проспективные когортные исследования и рандомизированные контролируемые исследования.
Кроме того, поскольку такой дефект может затронуть лишь небольшую часть всех случаев бесплодия, диагностический тест должен быть простым и быстрым. Еще один подход к улучшению эпидемиологических исследований — это включение расширенного анализа спермы, который исследует ДНК и факторы активации яйцеклетки, с последующим тестированием спермы, имеющей только центриолярный дефект.В конечном итоге эти усилия должны привести к более убедительным клиническим исследованиям, таким как большие проспективные когортные исследования и рандомизированные контролируемые исследования.
Дефект центриоли сперматозоидов может быть опосредован генетическими, экологическими или инфекционными факторами; однако никаких целенаправленных усилий по выявлению этих факторов не предпринималось. Следовательно, существует потребность в выявлении дефекта центриоли сперматозоидов у человека, поиске их причины и характеристике его влияния на мужское бесплодие.
Авторские взносы
TA-R задумал, руководил и написал рукопись. М.М. написал рукопись и поискал литературу. EF подготовил цифры. PS выполнил клиническую перспективу.
М.М. написал рукопись и поискал литературу. EF подготовил цифры. PS выполнил клиническую перспективу.
Финансирование
Эта работа была поддержана грантами R03 HD087429 и R21 HD092700 Национального института здоровья ребенка и человеческого развития им. Юнис Кеннеди Шрайвер (NICHD).
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Рецензент GC заявил о прошлом соавторстве с одним из авторов TA-R обрабатывающему редактору.
Благодарности
Мы благодарим Нахшон Пуэнте и Катерину Тернер за помощь в подготовке рукописи.
Список литературы
Аш Р., Симерли К., Орд Т., Орд В. А. и Шаттен Г. (1995). Стадии, на которых останавливается оплодотворение человека: конфигурации микротрубочек и хромосом в осемененных ооцитах, которые не смогли завершить оплодотворение и развитие у людей. Hum. Репрод. 10, 1897–1906. DOI: 10.1093 / oxfordjournals.humrep.a136204
Hum. Репрод. 10, 1897–1906. DOI: 10.1093 / oxfordjournals.humrep.a136204
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Авидор-Рейсс, Т., и Леру, М. Р. (2015). Общие и различные механизмы компартментализованного и цитозольного цилиогенеза. Curr. Биол. 25, R1143 – R1150. DOI: 10.1016 / j.cub.2015.11.001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Баччетти, Б., Буррини, А. Г., Коллодел, Г., Маньяно, А.R., Piomboni, P., Renieri, T., et al. (1989). Морфогенез декапитационного дефекта сперматозоидов у двух братьев. Gamete Res. 23, 181–188. DOI: 10.1002 / mrd.1120230205
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Bangs, Ф. К., Шроде, Н., Хаджантонакис, А.-К., и Андерсон, К. В. (2015). Специфичность происхождения первичных ресничек у эмбриона мыши. Нат. Cell Biol. 17, 113–122. DOI: 10.1038 / ncb3091
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Басири, М. Л., Ха, А., Чадха, А., Кларк, Н. М., Поляновский, А., Кук, Б. и др. (2014). Мигрирующие ресничные ворота разделяют сайт сборки аксонемы в сперматидах Drosophila . Curr. Биол. 24, 2622–2631. DOI: 10.1016 / j.cub.2014.09.047
Л., Ха, А., Чадха, А., Кларк, Н. М., Поляновский, А., Кук, Б. и др. (2014). Мигрирующие ресничные ворота разделяют сайт сборки аксонемы в сперматидах Drosophila . Curr. Биол. 24, 2622–2631. DOI: 10.1016 / j.cub.2014.09.047
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бен Хелифа, М., Куттон, К., Зуари, Р., Караузен, Т., Ренду, Дж., Бидарт, М., и др. (2014). Мутации в DNAh2, который кодирует динеин тяжелой цепи внутреннего плеча, приводят к мужскому бесплодию из-за множественных морфологических аномалий жгутиков сперматозоидов. Am. J. Hum. Genet. 94, 95–104. DOI: 10.1016 / j.ajhg.2013.11.017
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Беттанкур-Диас М., Хильдебрандт Ф., Пеллман Д., Вудс Г. и Годиньо С. А. (2011). Центросомы и реснички при болезнях человека. Trends Genet. 27, 307–315. DOI: 10.1016 / j.tig.2011.05.004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бхак, Дж. -С., Ли, С.-Л., Ок, С.-А., Чоу, С.-Й., и Ро, Г.-J. (2006). Скорость развития и плоидность эмбрионов, полученных в результате переноса ядер с различными способами активации у крупного рогатого скота. Animal Reprod. Sci. 92, 37–49. DOI: 10.1016 / j.anireprosci.2005.04.016
-С., Ли, С.-Л., Ок, С.-А., Чоу, С.-Й., и Ро, Г.-J. (2006). Скорость развития и плоидность эмбрионов, полученных в результате переноса ядер с различными способами активации у крупного рогатого скота. Animal Reprod. Sci. 92, 37–49. DOI: 10.1016 / j.anireprosci.2005.04.016
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бхилавадикар Р., Завери К., Мукадам Л., Наик С., Камбл К., Моди Д. и др. (2013). Уровни Tektin 2 и CatSper 2 у мужчин с нормозооспермией и олигоастенозооспермией и их связь с подвижностью, частотой оплодотворения, качеством эмбриона и частотой наступления беременности. J. Assist. Репрод. Genet. 30, 513–523. DOI: 10.1007 / s10815-013-9972-6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Blachon, S., Khire, A., и Avidor-Reiss, T. (2014). Происхождение второй центриоли зиготы Drosophila melanogaster . Генетика 197, 199–205. DOI: 10.1534 / genetics.113.160523
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бобиннец Ю.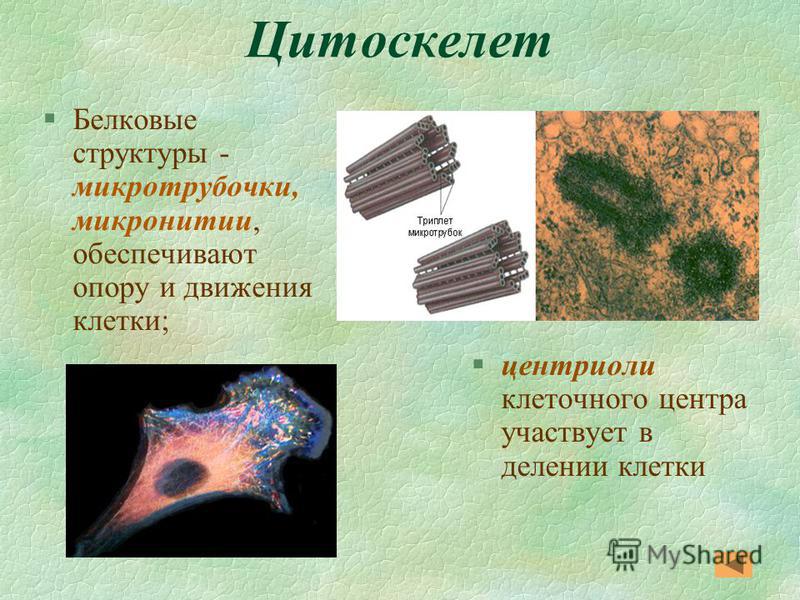 , Ходжаков А., Мир, Л.М., Ридер, К. Л., Эдде, Б., и Борненс, М. (1998). Разборка центриолей in vivo и ее влияние на структуру и функцию центросом в клетках позвоночных. J. Cell Biol. 143, 1575–1589. DOI: 10.1083 / jcb.143.6.1575
, Ходжаков А., Мир, Л.М., Ридер, К. Л., Эдде, Б., и Борненс, М. (1998). Разборка центриолей in vivo и ее влияние на структуру и функцию центросом в клетках позвоночных. J. Cell Biol. 143, 1575–1589. DOI: 10.1083 / jcb.143.6.1575
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Брид, В. Г., Ли, К. М., Аплин, К. П., Шахин, А. А., и Авенант, Н. Л. (2014). Морфологическое разнообразие и эволюция сперматозоидов мышиной клады грызунов. Дж.Морфол. 275, 540–547. DOI: 10.1002 / jmor.20236
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бревини, Т., Пеннаросса, Г., Ванелли, А., Маффеи, С., и Гандольфи, Ф. (2012). Партеногенез у негрызунов: компетентность в развитии и пластичность дифференциации. Териогенология 77, 766–772. DOI: 10.1016 / j.theriogenology.2011.11.010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Каларко, П. Г., Донахью, Р.П. и Соллози Д. (1972). Распад зародышевых пузырьков в ооците мыши.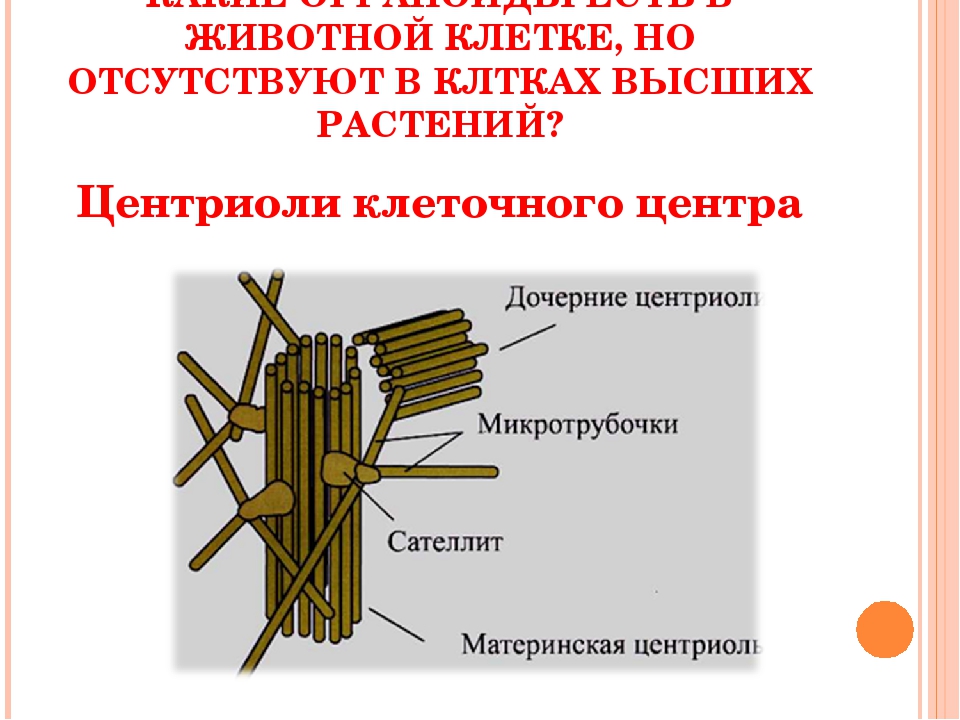 J. Cell Sci. 10, 369–385.
J. Cell Sci. 10, 369–385.
Google Scholar
Карвалью-Сантос, З., Азимзаде, Дж., Перейра-Лил, Дж. Б., и Беттанкур-Диас, М. (2011). Эволюция: прослеживание происхождения центриолей, ресничек и жгутиков. J. Cell Biol. 194, 165–175. DOI: 10.1083 / jcb.201011152
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Каспер, Р. Ф., Мериано, Дж. С., Ярви, К. А., Коуэн, Л., и Лукато, М. Л. (1996). Тест на гипоосмотическое набухание для отбора жизнеспособных сперматозоидов для интрацитоплазматической инъекции сперматозоидов у мужчин с полной астенозооспермией. Fertil. Стерил. 65, 972–976. DOI: 10.1016 / s0015-0282 (16) 58271-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Каян, С., Конаган, Дж., Шрайок, Э. Д., Райан, И. П., Блэк, Л. Д., и Турек, П. Дж. (2001). Рождение после интрацитоплазматической инъекции сперматозоидов с использованием спермы яичек от мужчин с синдромом Картагенера / неподвижных ресничек. Fertil. Стерил. 76, 612–614. DOI: 10.1016 / s0015-0282 (01) 01974-4
Fertil. Стерил. 76, 612–614. DOI: 10.1016 / s0015-0282 (01) 01974-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чатзимелетиу, К., Резерфорд, А., Гриффин, Д. К., и Хэндисайд, А. Х. (2007). Виновата ли центросома сперматозоидов в сложных полиплоидных хромосомных паттернах, наблюдаемых у эмбрионов на стадии дробления от пациента с ОАТ? Зигота 15, 81–90.
PubMed Аннотация | Google Scholar
Chemes, E.H., Rawe, Y.В. (2003). Патология сперматозоидов: шаг за пределы описательной морфологии. Происхождение, характеристика и потенциал фертильности аномальных фенотипов сперматозоидов у бесплодных мужчин. Hum. Репрод. Обновление 9, 405–428. DOI: 10.1093 / humupd / dmg034
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чемес, Х. Э. (2012). «Центриоли сперматозоидов и их двойная роль в флагеллогенезе и клеточном цикле зиготы», в Центросома: клеточные и молекулярные механизмы функций и дисфункций при болезни , изд. Х. Шаттен (Тотова, Нью-Джерси: Humana Press), 33–48. DOI: 10.1007 / 978-1-62703-035-9_2
Х. Шаттен (Тотова, Нью-Джерси: Humana Press), 33–48. DOI: 10.1007 / 978-1-62703-035-9_2
CrossRef Полный текст | Google Scholar
Chemes, H. E., Brugo, S., Zanchetti, F., Carrere, C., and Lavieri, J. C. (1987a). Дисплазия фиброзной оболочки: ультраструктурный дефект сперматозоидов человека, связанный с неподвижностью сперматозоидов и первичным бесплодием. Fertil. Стерил. 48, 664–669. DOI: 10.1016 / s0015-0282 (16) 59482-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Chemes, H.Э., Карицца, К., Скаринчи, Ф., Брюго, С., Нойспиллер, Н., и Шварштейн, Л. (1987b). Отсутствие головки у человеческих сперматозоидов от бесплодных пациентов: синдром, связанный с нарушением оплодотворения. Fertil. Стерил. 47, 310–316. DOI: 10.1016 / s0015-0282 (16) 50011-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Chemes, H.E., Puigdomenech, E.T., Carizza, C., Olmedo, S.B., Zanchetti, F., and Hermes, R. (1999).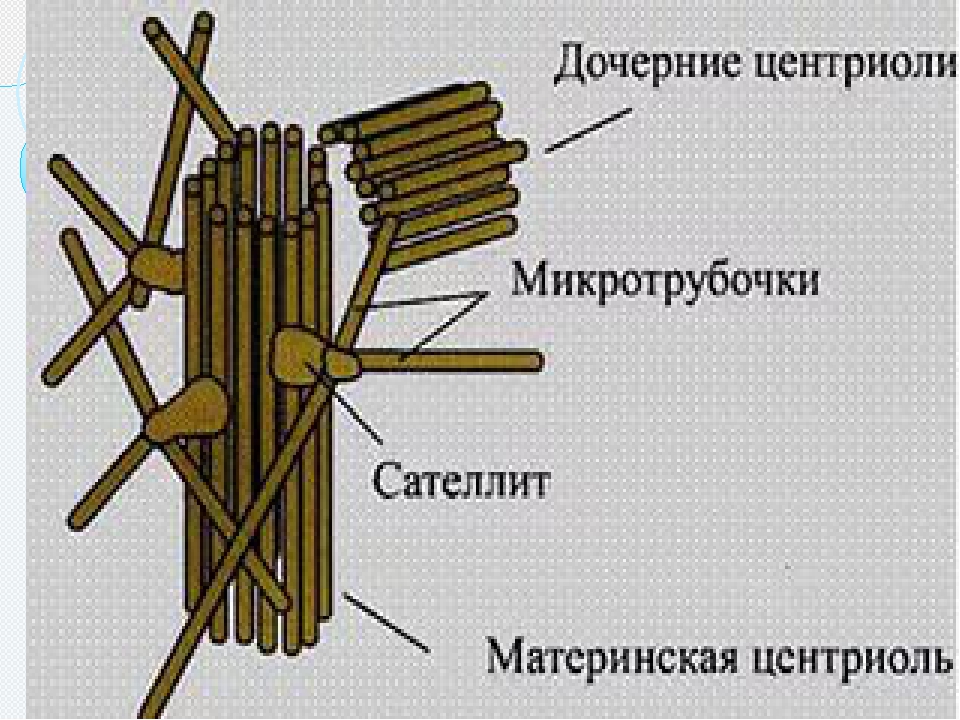 Ацефальные сперматозоиды и аномальное развитие прикрепления головы к шее: человеческий синдром генетического происхождения. Hum. Репрод. 14, 1811–1818. DOI: 10.1093 / humrep / 14.7.1811
Ацефальные сперматозоиды и аномальное развитие прикрепления головы к шее: человеческий синдром генетического происхождения. Hum. Репрод. 14, 1811–1818. DOI: 10.1093 / humrep / 14.7.1811
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чемес, Х. Э., и Рэйв, В. Я. (2010). Создание аномальных сперматозоидов: клеточные и молекулярные механизмы, лежащие в основе патологического спермиогенеза. Cell Tissue Res. 341, 349–357. DOI: 10.1007 / s00441-010-1007-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Коломберо, Л., Мумджи, М., Розенвакс, З.и Палермо Г. (1996). Косвенные доказательства развития центросом и веретена у эмбрионов, генерируемых сегментами сперматозоидов. Hum. Репрод. 11, 21–22.
Google Scholar
Комиццоли П., Вильдт Д. Э. и Пукаженти Б. С. (2006). Плохая центросомная функция сперматозоидов семенников кошек нарушает развитие эмбриона in vitro после интрацитоплазматической инъекции сперматозоидов. Biol. Репрод. 75, 252–260. DOI: 10.1095 / биолрепрод.106.051342
Biol. Репрод. 75, 252–260. DOI: 10.1095 / биолрепрод.106.051342
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Коннолли, Дж.А., Киоссес Б. В., Калниньш В. И. (1986). Центриоли теряются по мере того, как эмбриональные миобласты сливаются с мышечными трубками in vitro. Eur. J. Cell Biol. 39, 341–345.
PubMed Аннотация | Google Scholar
Кокс, Л. Дж., Ларман, М. Г., Сондерс, К. М., Хашимото, К., Суонн, К., и Лай, Ф. А. (2002). Фосфолипаза Czeta сперматозоидов человека и яванских макак запускает колебания Са2 +, активацию и развитие ооцитов мышей. Репродукция 124, 611–623. DOI: 10.1530 / reprod / 124.5.611
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Крозе, Н. (1990). Поведение центриоли сперматозоидов при оплодотворении ооцитов овцы. Eur. J. Cell Biol. 53, 326–332.
PubMed Аннотация | Google Scholar
Crozet, N., Dahirel, M., and Chesne, P. (2000). Наследование центросом в зиготах овец: центриоли вносятся сперматозоидами. Microsc. Res. Tech. 49, 445–450. DOI: 10.1002 / (SICI) 1097-0029 (20000601) 49: 5 <445 :: AID-JEMT6> 3.0.CO; 2-B
Microsc. Res. Tech. 49, 445–450. DOI: 10.1002 / (SICI) 1097-0029 (20000601) 49: 5 <445 :: AID-JEMT6> 3.0.CO; 2-B
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Даллаи, Р., Меркати, Д., Лино-Нето, Дж., Диас, Г., и Лупетти, П. (2017). Доказательства процентриоли во время спермиогенеза у кокцинеллид насекомых Adalia decempunctata (L): ультраструктурное исследование. Членистоногие. Struct. Dev. 46, 815–823. DOI: 10.1016 / j.asd.2017.10.004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Dam, A.H., Feenstra, I., Westphal, J.Р., Рамос, Л., ван Голд, Р. Дж., И Кремер, Дж. А. (2007). Снова о глобозооспермии. Hum. Репрод. Обновление 13, 63–75. DOI: 10.1093 / humupd / dml047
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Эмери Б. Р., Торп К., Мало Дж. У. и Каррелл Д. Т. (2004). Беременность в результате интрацитоплазматической инъекции сперматозоидов головки и отслоившегося хвоста. Fertil. Стерил. 81, 686–688. DOI: 10.1016 / j.fertnstert.2003.07.025
Fertil. Стерил. 81, 686–688. DOI: 10.1016 / j.fertnstert.2003.07.025
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фосетт, Д.У. и Филлипс Д. М. (1969). Тонкое строение и развитие шейного отдела сперматозоидов млекопитающих. Анат. Рек. 165, 153–164. DOI: 10.1002 / ar.1091650204
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ферештех, З., Шмидт, С. А., Аль-Доссари, А. А., Акчерби, М., Ариги, К., Коварт, Дж. И др. (2018). Профилирование микроРНК овидуктосом мышей (OVS) во время эстрального цикла: доставка микроРНК, переносимых OVS, в сперматозоиды, где miR-34c-5p локализуется в центросоме. Sci. Реп. 8: 16094. DOI: 10.1038 / s41598-018-34409-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фират-Каралар, Э. Н., Санте, Дж., Эллиотт, С., Стернс, Т. (2014). Протеомный анализ сперматозоидов млекопитающих позволяет выявить новые компоненты центросомы. J. Cell Sci. 127, 4128–4133. DOI: 10.1242 / jcs.157008
DOI: 10.1242 / jcs.157008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фишман, Э., Джо, К., Ха, А., Ройфман, Р., Зинн, А., Кришнамурти М. и др. (2017). Атипичные центриоли присутствуют в сперме Tribolium . Открыть. Биол. 7: 160334. DOI: 10.1098 / rsob.160334
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фишман, Э. Л., Джо, К., Нгуен, К. П., Конг, Д., Ройфман, Р., Чекич, А. Р. и др. (2018). Новая атипичная центриоль сперматозоидов функционирует во время оплодотворения человека. Нат. Коммуна . 9: 2210. DOI: 10.1038 / s41467-018-04678-8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фонттис, А.А., Наполитано Р. и Томас М. (2002). Успешный ИКСИ в случае тяжелой астенозооспермии из-за 93% неспецифических аксонемных изменений и 90% аномальных или отсутствующих митохондриальных оболочек. Репродукция. Биомед. Online 5, 270–272. DOI: 10.1016 / s1472-6483 (10) 61831-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Gambera, L. , Falcone, P., Mencaglia, L., Collodel, G., Serafini, F., De Leo, V., et al. (2010). Интрацитоплазматическая инъекция спермы и беременность с обезглавленной спермой. Fertil. Стерил. 93, 1347.e7–1347.e12. DOI: 10.1016 / j.fertnstert.2008.12.087
, Falcone, P., Mencaglia, L., Collodel, G., Serafini, F., De Leo, V., et al. (2010). Интрацитоплазматическая инъекция спермы и беременность с обезглавленной спермой. Fertil. Стерил. 93, 1347.e7–1347.e12. DOI: 10.1016 / j.fertnstert.2008.12.087
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гаранина А.С., Алиева И.Б., Брагина Э.Э., Бланшар Э., Арбей Б., Гериф Ф. и др. (2019). Центриолярный элемент — появление и разборка в спермиогенезе и потенциальное влияние на фертильность. Ячейки 8: 180. DOI: 10.3390 / Cell8020180
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гомендио, М., и Ролдан, Э. Р. (2008). Влияние разнообразия размеров и функций сперматозоидов на конкуренцию и фертильность сперматозоидов. Внутр. J. Dev. Биол. 52, 439–447. DOI: 10.1387 / ijdb.082595mg
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гет-Халлонет, К., Энтони, К., Агион, Дж., Санта-Мария, А.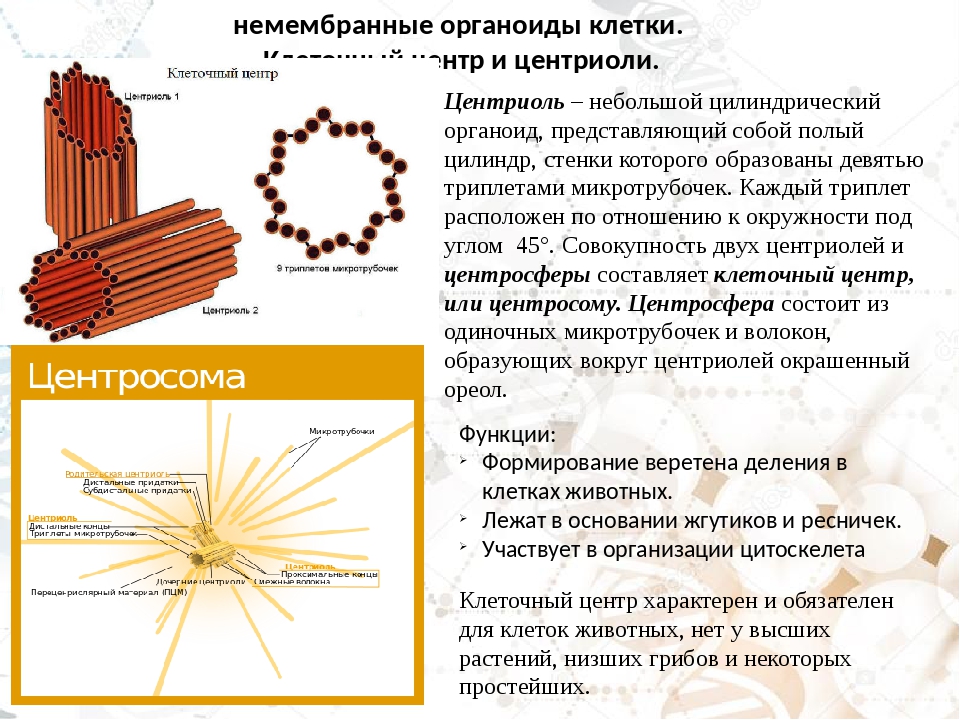 , Ладжуа-Мазенк, И., Райт, М., и др. (1993). гамма-тубулин присутствует в ацентриолярных МОС во время раннего развития мышей. J. Cell Sci. 105 (Pt 1), 157–166.
, Ладжуа-Мазенк, И., Райт, М., и др. (1993). гамма-тубулин присутствует в ацентриолярных МОС во время раннего развития мышей. J. Cell Sci. 105 (Pt 1), 157–166.
PubMed Аннотация | Google Scholar
Ганн, Д. Д., Бейтс, Г. В. (2016). Доказательный подход к необъяснимому бесплодию: систематический обзор. Fertil. Стерил. 105, 1566e1–1174e1. DOI: 10.1016 / j.fertnstert.2016.02.001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хертиг, А. Т., и Адамс, Е. С. (1967). Исследования ооцита человека и его фолликула. I. Ультраструктурные и гистохимические наблюдения на стадии примордиального фолликула. J. Cell Biol. 34, 647–675. DOI: 10.1083 / jcb.34.2.647
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хьюитсон, Л., Хаависто, А., Симерли, К., Джонс, Дж., И Шаттен, Г. (1997). Организация микротрубочек и конфигурации хроматина в ооцитах хомяка во время оплодотворения и партеногенетической активации, а также после осеменения спермой человека.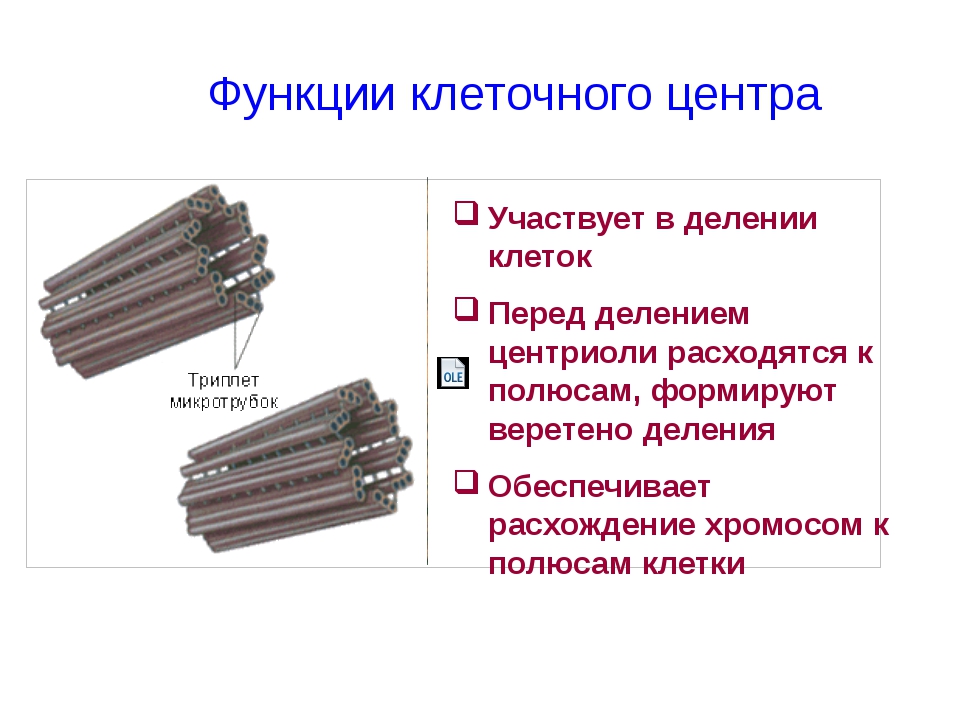 Biol. Репрод. 57, 967–975. DOI: 10.1095 / biolreprod57.5.967
Biol. Репрод. 57, 967–975. DOI: 10.1095 / biolreprod57.5.967
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Hinduja, I., Завери К., Балига Н. (2008). Уровни центрина сперматозоидов человека и результаты интрацитоплазматической инъекции сперматозоидов (ИКСИ) — пилотное исследование. Indian J. Med. Res. 128, 606–610.
Google Scholar
Holstein, A., Schill, W., and Breucker, H. (1986). Развитие диссоциированных центриолей как причина порока развития сперматид у человека. Репродукция 78, 719–725. DOI: 10.1530 / jrf.0.0780719
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Исидори, А.М., Поцца К., Джанфрилли Д. и Исидори А. (2006). Лечение для улучшения качества спермы. Репродукция. Биомед. Интернет 12, 704–714. DOI: 10.1016 / s1472-6483 (10) 61082-6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Kahraman, S., Tasdemir, M., Tasdemir, I. , Vicdan, K., Ozgur, S., Polat, G., et al. (1996). Беременность достигается с помощью семенников и эякулированных сперматозоидов в сочетании с интрацитоплазматической инъекцией сперматозоидов у мужчин с полностью или изначально неподвижными сперматозоидами в эякуляте. Hum. Репрод. 11, 1343–1346. DOI: 10.1093 / oxfordjournals.humrep.a019384
, Vicdan, K., Ozgur, S., Polat, G., et al. (1996). Беременность достигается с помощью семенников и эякулированных сперматозоидов в сочетании с интрацитоплазматической инъекцией сперматозоидов у мужчин с полностью или изначально неподвижными сперматозоидами в эякуляте. Hum. Репрод. 11, 1343–1346. DOI: 10.1093 / oxfordjournals.humrep.a019384
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кай Ю., Ивата К., Иба Ю. и Мио Ю. (2015). Диагностика аномального статуса оплодотворения человека на основании пронуклеарного происхождения и / или числа центросом. J. Assist. Репрод. Genet. 32, 1589–1595. DOI: 10.1007 / s10815-015-0568-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Камаль А., Мансур Р., Фахми, И., Серур, Г., Родс, К., и Абулгар, М. (1999). Легко декапитируемый дефект сперматозоидов: возможная причина бесплодия необъяснимого характера. Hum. Репрод. 14, 2791–2795. DOI: 10.1093 / humrep / 14.11.2791
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хан, М.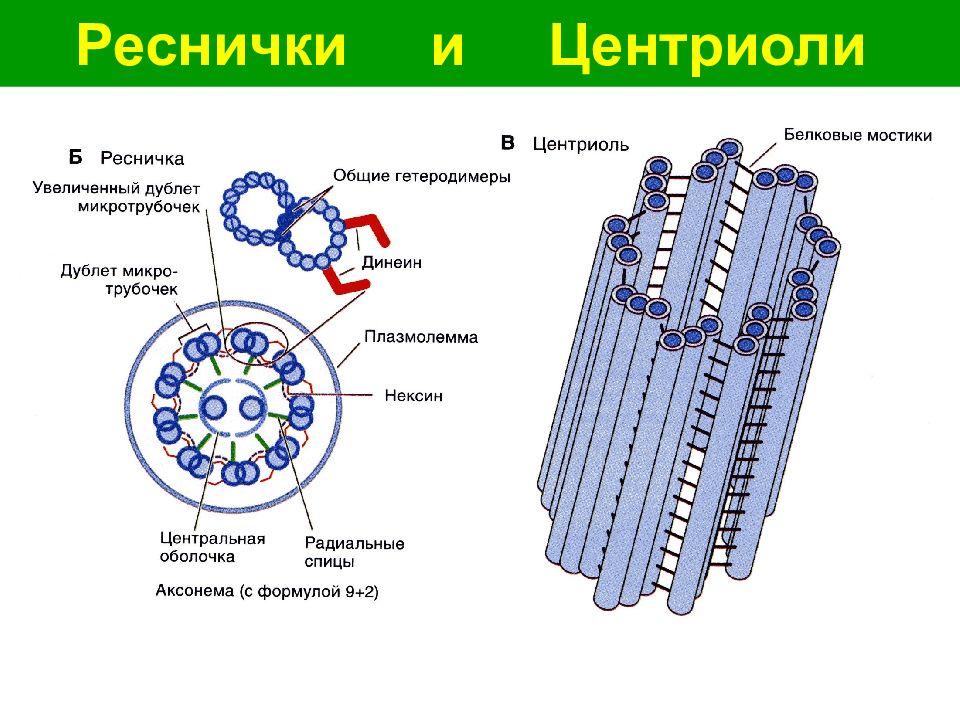 С., Дипа, Ф., Ахмед, З., Тахир, Ф., и Хан, М.А. (2011). Оценка репродуктивного здоровья мужчин общепринятым методом анализа спермы. J. Ayub Med. Coll. Абботтабад 23, 84–88.
С., Дипа, Ф., Ахмед, З., Тахир, Ф., и Хан, М.А. (2011). Оценка репродуктивного здоровья мужчин общепринятым методом анализа спермы. J. Ayub Med. Coll. Абботтабад 23, 84–88.
Google Scholar
Хире, А., Джо, К. Х., Конг, Д., Ахши, Т., Блэкон, С., Чекич, А. Р. и др. (2016). Ремоделирование центриолей во время спермиогенеза у Drosophila . Curr. Биол. 26, 3183–3189. DOI: 10.1016 / j.cub.2016.07.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ким, Н. Х., Симерли, К., Фунахаши, Х., Шаттен, Г., и Дэй, Б. Н. (1996). Организация микротрубочек в ооцитах свиней во время оплодотворения и партеногенеза. Biol. Репрод. 54, 1397–1404. DOI: 10.1095 / biolreprod54.6.1397
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ковачич Б. и Влайсавлевич В. (2000). Конфигурация материнского и отцовского хроматина и соответствующих микротрубочек в человеческих ооцитах, неспособных оплодотворяться после интрацитоплазматической инъекции сперматозоидов. Мол. Репрод. Dev. 55, 197–204. DOI: 10.1002 / (SICI) 1098-2795 (200002) 55: 2 <197 :: AID-MRD9> 3.0.CO; 2-квартал
Мол. Репрод. Dev. 55, 197–204. DOI: 10.1002 / (SICI) 1098-2795 (200002) 55: 2 <197 :: AID-MRD9> 3.0.CO; 2-квартал
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Куретаке, С., Кимура, Ю., Хоши, К., Янагимачи, Р. (1996). Оплодотворение и развитие ооцитов мышей, которым вводили изолированные головки сперматозоидов. Biol. Репрод. 55, 789–795. DOI: 10.1095 / biolreprod55.4.789
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ланге, Б. М., и Галл, К. (1996). Строение и функция центриоли в клетках животных: успехи и вопросы. Trends Cell Biol. 6, 348–352. DOI: 10.1016 / 0962-8924 (96) 10033-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ле Гуен, П., и Крозе, Н. (1989). Распределение микротрубочек и центросом при оплодотворении овец. Eur. J. Cell Biol. 48, 239–249.
PubMed Аннотация | Google Scholar
Liška, F., Gosele, C., Rivkin, E., Tres, L. , Cardoso, M. C., Domaing, P., et al. (2009). Мутация hd крысы показывает важную роль центробина в формировании головки сперматид и сборке аппарата сцепления голова-хвост. Biol. Репрод. 81, 1196–1205. DOI: 10.1095 / биолрепрод.109.078980
, Cardoso, M. C., Domaing, P., et al. (2009). Мутация hd крысы показывает важную роль центробина в формировании головки сперматид и сборке аппарата сцепления голова-хвост. Biol. Репрод. 81, 1196–1205. DOI: 10.1095 / биолрепрод.109.078980
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лю Дж.-Л., Кусакабе, Х., Чанг, Ч.-К., Сузуки, Х., Шмидт, Д. У., Джулиан, М. и др. (2004). Оплодотворение лиофилизированной спермой приводит к полноценному развитию у кроликов. Biol. Репрод. 70, 1776–1781. DOI: 10.1095 / биолрепрод.103.025957
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лю В., Хе Х, Ян С., Зуари Р., Ван Дж., Ву Х. и др. (2019). Биаллельные мутации в TTC21A вызывают астенотератоспермию у людей и мышей. Am. J. Hum. Genet. 104, 738–748. DOI: 10.1016 / j.ajhg.2019.02.020
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лю В.-М., Панг Р.Т., Чиу П.С., Вонг Б.П., Лао К., Ли К. -Ф. и др. (2012). Переносимая из сперматозоида микроРНК-34c необходима для первого деления расщепления у мышей. Proc. Natl. Акад. Sci. 109, 490–494. DOI: 10.1073 / pnas.1110368109
-Ф. и др. (2012). Переносимая из сперматозоида микроРНК-34c необходима для первого деления расщепления у мышей. Proc. Natl. Акад. Sci. 109, 490–494. DOI: 10.1073 / pnas.1110368109
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лю, X.-Y., Miao, Y.-L., Zhang, J., Qiu, J.-H., Cui, X.-Z., Gao, W.-Q., et al. (2012). Влияние активации на формирование функциональных звездочек, сборку микротрубочек и развитие бластоцист ооцитов коз, которым инъецировали круглые сперматиды. Ячейка. Перепрограммировать. 14, 436–447. DOI: 10.1089 / ячейка.2012.0029
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лонг, К. Р., Пинто-Коррейа, К., Дуби, Р. Т., Понсе де Леон, Ф. А., Боланд, М. П., Рош, Дж. Ф. и др. (1993). Морфология хроматина и микротрубочек во время первого клеточного цикла зигот крупного рогатого скота. Мол. Репрод. Dev. 36, 23–32. DOI: 10.1002 / mrd.1080360105
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Манандхар, Г. , Сутовский, П., Джоши, Х. К., Стернс, Т., и Шаттен, Г. (1998). Уменьшение центросом во время спермиогенеза мышей. Dev. Биол. 203, 424–434. DOI: 10.1006 / dbio.1998.8947
, Сутовский, П., Джоши, Х. К., Стернс, Т., и Шаттен, Г. (1998). Уменьшение центросом во время спермиогенеза мышей. Dev. Биол. 203, 424–434. DOI: 10.1006 / dbio.1998.8947
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Меннелла, В., Кестхейи, Б., Макдональд, К. Л., Чхун, Б., Кан, Ф., Rogers, G.C. и др. (2012). Флуоресцентная микроскопия с субдифракционным разрешением выявляет область центросомы, критическую для организации перицентриолярного материала. Нат. Cell Biol. 14, 1159–1168. DOI: 10.1038 / ncb2597
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Миллер, К. Л., Рико, С. К., Мулец-Вольц, К. Р., Кампана, М. Г., Макинерни, Н., Августин, Л. и др. (2019). Партеногенез у азиатского водяного дракона ( Physignathus cocincinus ) в неволе, идентифицированный с помощью новых микросателлитов. PLoS One 14: e0217489. DOI: 10.1371 / journal.pone.0217489
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Моретти, Э.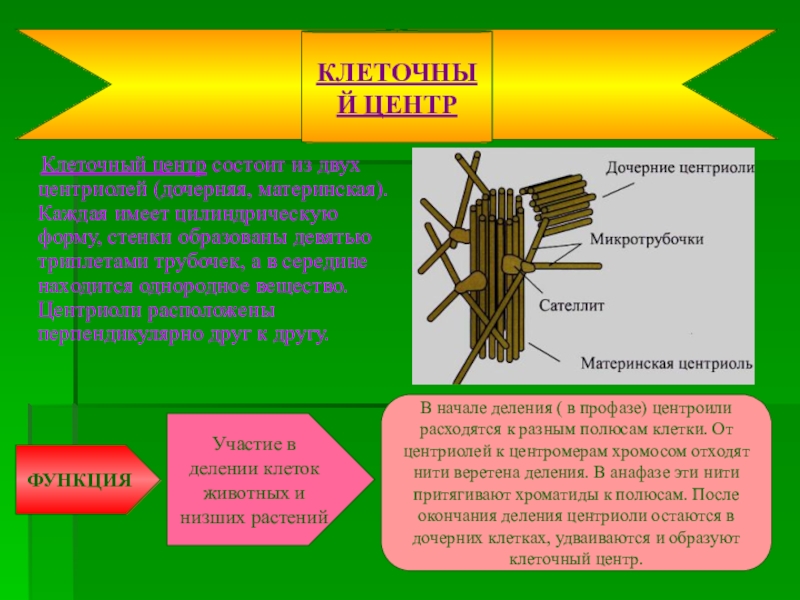 , Коллодель, Г., Сальватичи, М. К., Бельмонте, Г., и Синьорини, К. (2019). Новые сведения о сперме при тотальной глобозооспермии: повышенное окисление жирных кислот и изменение центрина1. Syst. Биол. Репрод. Med. DOI: 10.1080 / 19396368.2019.1626934 [Epub перед печатью].
, Коллодель, Г., Сальватичи, М. К., Бельмонте, Г., и Синьорини, К. (2019). Новые сведения о сперме при тотальной глобозооспермии: повышенное окисление жирных кислот и изменение центрина1. Syst. Биол. Репрод. Med. DOI: 10.1080 / 19396368.2019.1626934 [Epub перед печатью].
CrossRef Полный текст | PubMed Аннотация | Google Scholar
Моретти, Э., Паскарелли, Н. А., Бельмонте, Г., Реньери, Т., и Коллодель, Г. (2016). Сперма с дисплазией фиброзной оболочки и аномалиями соединения голова-шея: фокус на центриоле и центрине 1. Andrologia 49: e12701. DOI: 10.1111 / and.12701
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Моретти, Э., Паскарелли, Н. А., Бельмонте, Г., Реньери, Т., и Коллодель, Г. (2017). Сперма с дисплазией фиброзной оболочки и аномалиями соединения голова-шея: фокус на центриоле и центрине 1. Andrologia 49: e12701. DOI: 10.1111 / and.12701
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Надь, З. П., Лю, Дж., Джорис, Х., Верхейен, Г., Турне, Х., Камю, М., и др. (1995). Результат интрацитоплазматической инъекции сперматозоидов не связан ни с одним из трех основных параметров сперматозоидов. Hum. Репрод. 10, 1123–1129. DOI: 10.1093 / oxfordjournals.humrep.a136104
П., Лю, Дж., Джорис, Х., Верхейен, Г., Турне, Х., Камю, М., и др. (1995). Результат интрацитоплазматической инъекции сперматозоидов не связан ни с одним из трех основных параметров сперматозоидов. Hum. Репрод. 10, 1123–1129. DOI: 10.1093 / oxfordjournals.humrep.a136104
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Накамура, С., Терада, Ю., Хориучи, Т., Эмута, К., Мураками, Т., Яэгаши, Н. и др. (2002). Анализ центросомной функции человеческого сперматозоида и активационной способности ооцитов в случае глобозооспермии с помощью ИКСИ в ооциты крупного рогатого скота. Hum. Репрод. 17, 2930–2934. DOI: 10.1093 / humrep / 17.11.2930
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Накамура С., Терада Ю., Рэйв В. Ю., Уэхара С., Морито Ю., Йошимото Т. и др. (2005). Испытание по восстановлению дефектной центросомной функции сперматозоидов человека. Hum. Репрод. 20, 1933–1937. DOI: 10.1093 / humrep / deh899
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Навара К.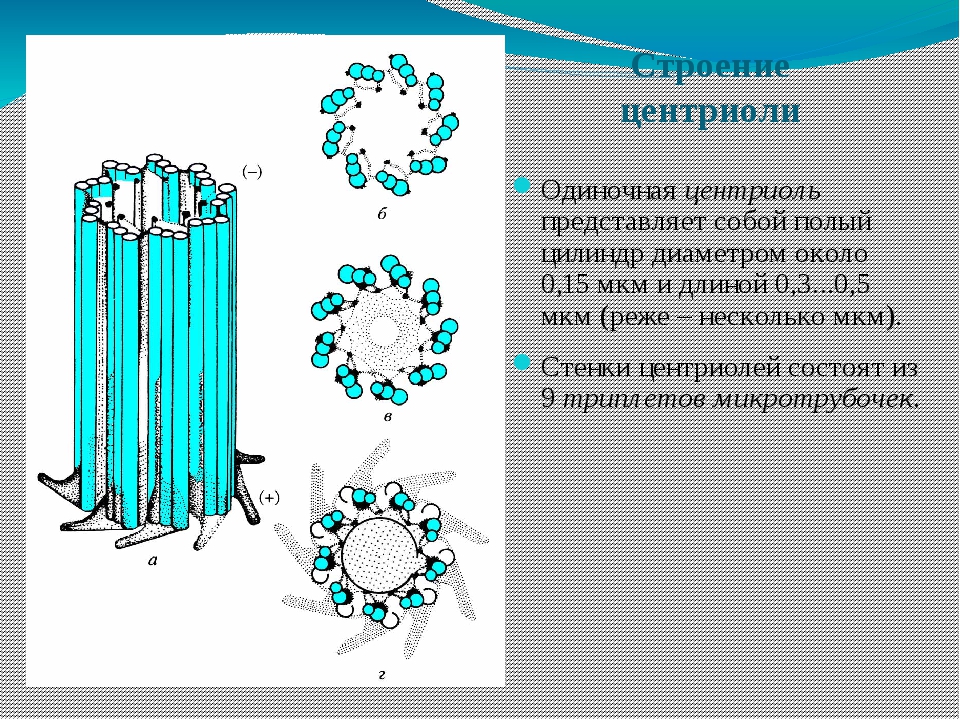 С., Ферст Н. Л. и Шаттен Г. (1994). Организация микротрубочек у коровы во время оплодотворения, полиспермии, партеногенеза и переноса ядра: роль сперматозоидов. Dev. Биол . 162, 29–40. DOI: 10.1006 / dbio.1994.1064
С., Ферст Н. Л. и Шаттен Г. (1994). Организация микротрубочек у коровы во время оплодотворения, полиспермии, партеногенеза и переноса ядра: роль сперматозоидов. Dev. Биол . 162, 29–40. DOI: 10.1006 / dbio.1994.1064
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Нери, К.В., Ли Б., Розенвакс З., Мачака К. и Палермо Г. Д. (2014). Понимание оплодотворения посредством интрацитоплазматической инъекции сперматозоидов (ИКСИ). Cell Calcium 55, 24–37. DOI: 10.1016 / j.ceca.2013.10.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Нигг, Э. А., и Холланд, А. Дж. (2018). Один раз и только один раз: механизмы удвоения центриолей и их дерегуляция при болезни. Нат. Rev. Mol. Cell Biol. 19, 297–312. DOI: 10,1038 / нрм.2017.127
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Nijs, M., Vanderzwalmen, P., Vandamme, B., Segal-Bertin, G., Lejeune, B., Segal, L., et al. (1996). Оплодотворяющая способность неподвижных сперматозоидов после интрацитоплазматической инъекции сперматозоидов. Hum. Репрод. 11, 2180–2185. DOI: 10.1093 / oxfordjournals.humrep.a019073
Hum. Репрод. 11, 2180–2185. DOI: 10.1093 / oxfordjournals.humrep.a019073
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Оджай П., Ким К. Д., Лишко П. В. и Даунинг К.Х. (2012). Трехмерная структура соединительного элемента бычьей спермы, выявленная с помощью электронной криотомографии. Biol. Репрод. 87:73. DOI: 10.1016 / 0014-5793 (85) 80430-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Палермо, Г., Джорис, Х., Деврой, П., и Ван Стейртегем, А. К. (1992). Беременность после интрацитоплазматической инъекции одиночного сперматозоида в ооцит. Ланцет 340, 17–18. DOI: 10.1016 / 0140-6736 (92) 92425-f
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Палермо, Г.Д., Коломберо, Л. Т., и Розенвакс, З. (1997). Центросома спермы человека отвечает за нормальную сингамию и раннее эмбриональное развитие. Ред. 2, 19–27. DOI: 10.1530 / revreprod / 2.1.19
CrossRef Полный текст | Google Scholar
Перотти, М. Э., Джарола, А., и Джорджа, М. (1981). Ультраструктурное исследование дефекта обезглавленной спермы у бесплодного мужчины. J. Reprod. Fertil. 63, 543–549. DOI: 10.1530 / jrf.0.0630543
Э., Джарола, А., и Джорджа, М. (1981). Ультраструктурное исследование дефекта обезглавленной спермы у бесплодного мужчины. J. Reprod. Fertil. 63, 543–549. DOI: 10.1530 / jrf.0.0630543
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Филлипс, К.A., Bales, K. L., Capitanio, J. P., Conley, A., Czoty, P. W., t Hart, B.A., et al. (2014). Почему модели приматов имеют значение. Am. J. Primatol. 76, 801–827. DOI: 10.1002 / ajp.22281
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Пикеринг, С. Дж., Джонсон, М. Х., Брауд, П. Р. и Хоулистон, Э. (1988). Организация цитоскелета в свежих, старых и спонтанно активированных ооцитах человека. Hum. Репрод. 3, 978–989. DOI: 10.1093 / oxfordjournals.humrep.a136828
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Пимента-Маркес, А., Бенто, И., Лопес, К.А., Дуарте, П., Яна, С.С., и Беттанкур-Диас, М. (2016). Механизм элиминации женской центросомы гамет у Drosophila melanogaster . Наука 353: aaf4866. DOI: 10.1126 / science.aaf4866
Наука 353: aaf4866. DOI: 10.1126 / science.aaf4866
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Пинто-Коррейя, К., Покча, Д. Л., Чанг, Т., и Робл, Дж.М. (1994). Дефосфорилирование антигенов промежуточных частей сперматозоидов инициирует образование звездочек в ооцитах кролика. Proc. Natl. Акад. Sci. США 91, 7894–7898. DOI: 10.1073 / pnas.91.17.7894
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Порку, Г., Мерсье, Г., Бойер, П., Ахард, В., Банет, Дж., Вассерот, М. и др. (2003). Беременность после ИКСИ с использованием спермы с аномальным переходом голова-хвост от двух братьев: отчет о болезни. Hum. Репрод. 18, 562–567. DOI: 10.1093 / humrep / deg121
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Пребл, А. М., Гиддингс, Т. М., младший, и Датчер, С. К. (2000). Базальные тела и центриоли: их функция и строение. Curr. Вверх. Dev. Биол. 49, 207–233. DOI: 10. 1016 / s0070-2153 (99) 49010-6
1016 / s0070-2153 (99) 49010-6
CrossRef Полный текст | Google Scholar
Рав, В. Ю., Диас, Э. С., Абдельмасих, Р., Войчик, К., Моралес, П., Сутовский, П., и др. (2008). Роль протеасом сперматозоидов во время образования сперматозоидов и раннего развития зиготы: последствия для неудач оплодотворения у людей. Hum. Репрод. 23, 573–580. DOI: 10.1093 / humrep / dem385
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Рав, В. Ю., Терада, Ю., Накамура, С., Чиллик, К. Ф., Ольмедо, С. Б., и Чемес, Х. Э. (2002). Патология центриоли сперматозоидов, ответственная за дефектное образование сперматозоидов, сингамию и расщепление. Hum. Репрод. 17, 2344–2349. DOI: 10.1093 / humrep / 17.9.2344
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Рыбушкин, А., Дозорцев, Д., Пелинк, М. Дж., Де Саттер, П., и Донт, М. (1996). Анализ активирующей способности ооцитов и хромосомного набора круглоголовых сперматозоидов человека путем их инъекции в ооциты мышей. Hum. Репрод. 11, 2170–2175. DOI: 10.1093 / oxfordjournals.humrep.a019071
Hum. Репрод. 11, 2170–2175. DOI: 10.1093 / oxfordjournals.humrep.a019071
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сайас-Маньян, Дж., Мецлер-Гиймен, К., Мерсье, Г., Карлес-Маркорель, Ф., Грилло, Дж. М., и Гишауа, М. Р. (1999).Отсутствие беременности после интрацитоплазматической инъекции сперматозоидов с обезглавленными сперматозоидами: отчет о клиническом случае. Hum. Репрод. 14, 1989–1992. DOI: 10.1093 / humrep / 14.8.1989
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сатанантан, А. Х., Кола, И., Осборн, Дж., Траунсон, А., Нг, С. К., Бонгсо, А. и др. (1991). Центриоли в начале развития человека. Proc. Natl. Акад. Sci. США 88, 4806–4810. DOI: 10.1073 / pnas.88.11.4806
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сатанантан, А.Х., Нг, С. С., Чиа, С. М., Ло, Х. Ю., Эдирисингхе, В. Р., и Ратнам, С. С. (1985). Происхождение и распределение кортикальных гранул в ооцитах человека с учетом активности ядрышек и микрофиламентов по Гольджи. Ann. Акад. Sci. 442, 251–264. DOI: 10.1111 / j.1749-6632.1985.tb37526.x
Ann. Акад. Sci. 442, 251–264. DOI: 10.1111 / j.1749-6632.1985.tb37526.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сатанантан, А. Х., Ратнам, С. С., Нг, С. С., Тарин, Дж. Дж., Джанароли, Л., и Траунсон, А. (1996). Центриоль сперматозоидов: наследование, репликация и сохранение в ранних эмбрионах человека. Hum. Репрод. 11, 345–356. DOI: 10.1093 / humrep / 11.2.345
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сатанантан, А. Х., Селварадж, К., Гириджашанкар, М. Л., Ганеш, В., Сельварадж, П., и Траунсон, А. О. (2006). От оогониев до зрелых ооцитов: инактивация материнской центросомы у человека. Microsc. Res. Tech. 69, 396–407. DOI: 10.1002 / jemt.20299
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шаттен, Г.(1994). Центросома и ее способ наследования: уменьшение центросомы во время гаметогенеза и ее восстановление во время оплодотворения. Dev. Биол. 165, 299–335. DOI: 10.1006 / dbio.1994.1256
DOI: 10.1006 / dbio.1994.1256
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Schatten, G., Simerly, C., and Schatten, H. (1985). Конфигурации микротрубочек во время оплодотворения, митоза и раннего развития у мышей, а также потребность в опосредованной микротрубочками яйцеклетки подвижности во время оплодотворения млекопитающих. Proc. Natl. Акад. Sci. США 82, 4152–4156. DOI: 10.1073 / pnas.82.12.4152
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Schatten, G., Simerly, C., and Schatten, H. (1991). Материнская наследственность центросом у млекопитающих? Исследования партеногенеза и полиспермии на мышах. Proc. Natl. Акад. Sci. США 88, 6785–6789. DOI: 10.1073 / pnas.88.15.6785
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шаттен, Х., Schatten, G., Mazia, D., Balczon, R., and Simerly, C. (1986). Поведение центросом при оплодотворении и делении клеток в ооцитах мышей и в яйцах морских ежей.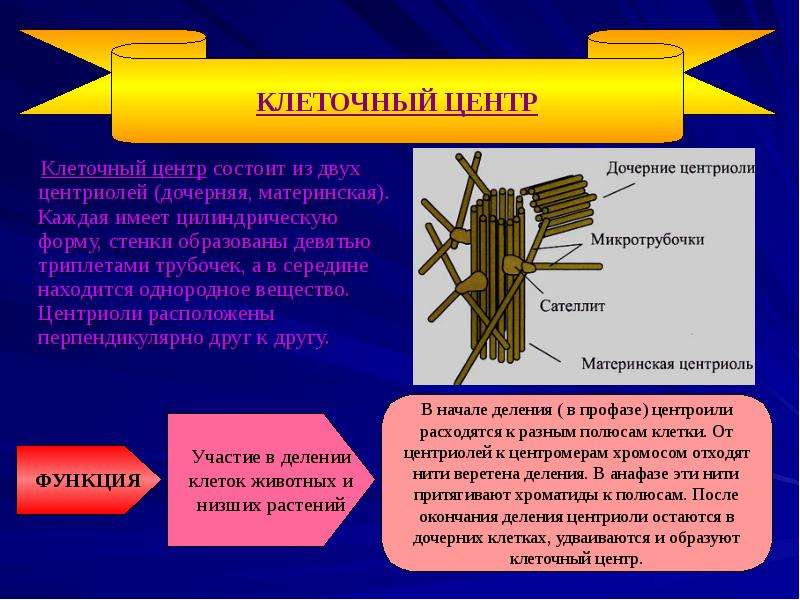 Proc. Natl. Акад. Sci. США 83, 105–109. DOI: 10.1073 / pnas.83.1.105
Proc. Natl. Акад. Sci. США 83, 105–109. DOI: 10.1073 / pnas.83.1.105
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шаттен, Х., Сан, К. Ю. (2010). Роль центросом в оплодотворении, делении клеток и установлении асимметрии во время развития эмбриона. Семин. Cell Dev.Биол. 21, 174–184. DOI: 10.1016 / j.semcdb.2010.01.012
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Sha, Y. W., Xu, X., Mei, L. B., Li, P., Su, Z. Y., He, X. Q., et al. (2017). Гомозиготная мутация CEP135 связана с множественными морфологическими аномалиями жгутиков сперматозоидов (MMAF). Ген 633, 48–53. DOI: 10.1016 / j.gene.2017.08.033
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Симерли, К., Ву, Г.J., Zoran, S., Ord, T., Rawlins, R., Jones, J., et al. (1995). Отцовское наследование центросомы, центра организации микротрубочек клетки, у людей и последствия для бесплодия. Нат. Med. 1, 47–52.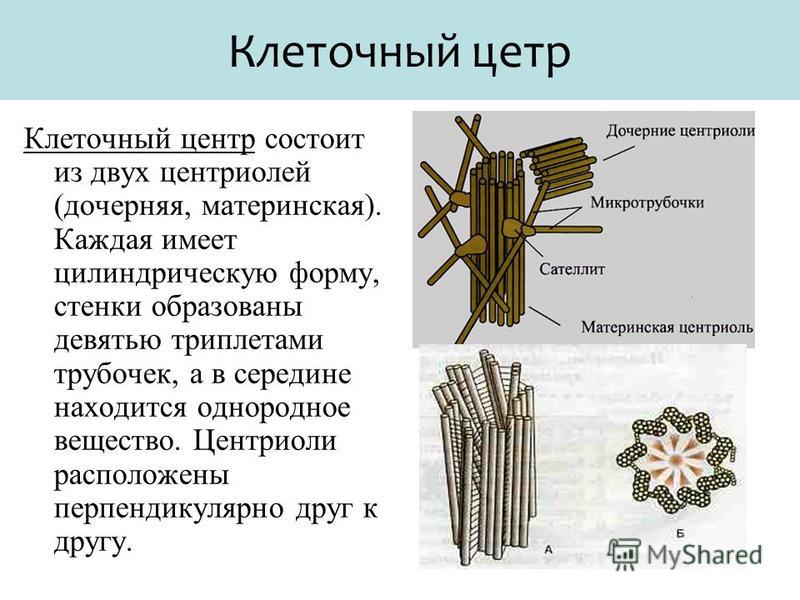 DOI: 10,1038 / нм0195-47
DOI: 10,1038 / нм0195-47
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Симерли К., Зоран С. С., Пейн К., Доминко Т., Сутовский П., Навара С. С. и др. (1999). Наследование гамма-тубулина от двух родителей во время оплодотворения человека: молекулярная реконструкция функциональных зиготических центросом в осемененных человеческих ооцитах и в бесклеточных экстрактах, зародившихся спермой человека. Мол. Биол. Cell 10, 2955–2969. DOI: 10.1091 / mbc.10.9.2955
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сэр, Дж. Х., Пютц, М., Дейли, О., Моррисон, К. Г., Даннинг, М., Килмартин, Дж. В. и др. (2013). Потеря центриолей вызывает хромосомную нестабильность в соматических клетках позвоночных. J. Cell Biol. 203, 747–756. DOI: 10.1083 / jcb.201309038
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сутовский, П. (2018).Взаимодействия сперматозоидов с ооцитами и их значение для фертильности быков, с акцентом на систему убиквитин-протеасома. Животное 12, s121 – s132. DOI: 10.1017 / s1751731118000253
Животное 12, s121 – s132. DOI: 10.1017 / s1751731118000253
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сутовский П., Навара С.С. и Шаттен Г. (1996). Судьба митохондрий сперматозоидов, а также включение, преобразование и разборка структур хвоста сперматозоида во время оплодотворения крупного рогатого скота. Biol. Репрод. 55, 1195–1205.DOI: 10.1095 / biolreprod55.6.1195
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сутовский П., Шаттен Г. (1997). Истощение глутатиона во время созревания ооцитов крупного рогатого скота обратимо блокирует деконденсацию мужского пронуклеуса и расположение пронуклеусов во время оплодотворения. Biol. Репрод. 56, 1503–1512. DOI: 10.1095 / biolreprod56.6.1503
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Соллози Д. и Озил Дж.П. (1991). Образование центриолей de novo у партеногенетически активированных диплоидизированных эмбрионов кролика.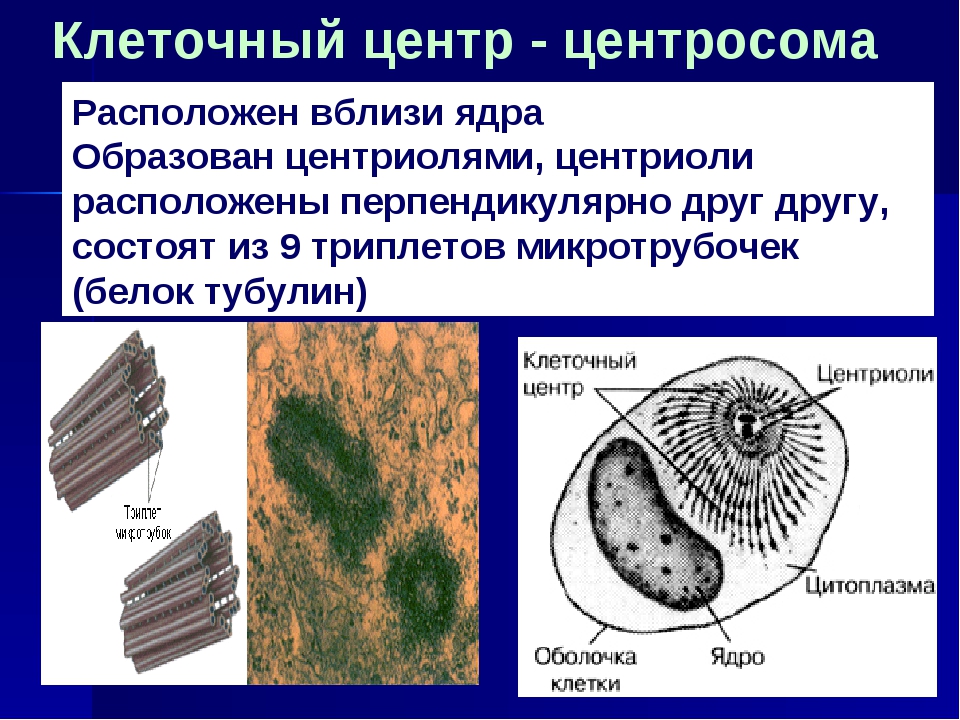 Biol. Cell 72, 61–66. DOI: 10.1016 / 0248-4900 (91)
Biol. Cell 72, 61–66. DOI: 10.1016 / 0248-4900 (91)
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Терада, Ю. (2007). Функциональный анализ центросомы сперматозоидов в репродукции человека: значение для вспомогательных репродуктивных технологий. Soc. Репрод. Fertil. Дополнение 63, 507–513.
PubMed Аннотация | Google Scholar
Терада, Ю., Хасегава, Х., Такахаши, А., Угаджин, Т., Яэгаши, Н., и Окамура, К. (2009). Успешная беременность после активации ооцитов ионофором кальция для пациентки с рецидивирующей неудачей интрацитоплазматической инъекции сперматозоидов с оценкой активации ооцитов и центросомной функции сперматозоидов с использованием яиц крупного рогатого скота. Fertil. Стерил. 91, 935.e11–935.e14. DOI: 10.1016 / j.fertnstert.2008.09.043
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Терада, Ю., Накамура, С., Морита, Дж., Тачибана, М., Морито, Ю., Ито, К., и др. (2004). Использование яиц млекопитающих для оценки функции спермы человека: молекулярные и клеточные анализы оплодотворения путем интрацитоплазматической инъекции сперматозоидов. Am. J. Reprod. Иммунол. 51, 290–293. DOI: 10.1111 / j.1600-0897.2004.00158.x
(2004). Использование яиц млекопитающих для оценки функции спермы человека: молекулярные и клеточные анализы оплодотворения путем интрацитоплазматической инъекции сперматозоидов. Am. J. Reprod. Иммунол. 51, 290–293. DOI: 10.1111 / j.1600-0897.2004.00158.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Терада Ю., Симерли К. Р., Хьюитсон Л. и Шаттен Г. (2000). Формирование сперматозоидов и деконденсация пронуклеусов во время оплодотворения кролика и разработка функционального анализа спермы человека. Biol. Репрод. 62, 557–563. DOI: 10.1095 / biolreprod62.3.557
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Тояма, Ю., Ивамото, Т., Ядзима, М., Баба, К., и Юаса, С. (2000). Обезглавленные и обезглавленные сперматозоиды у человека и патогенез, основанный на ультраструктуре. Внутр. Дж. Андрол. 23, 109–115. DOI: 10.1046 / j.1365-2605.2000.t01-1-00217.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ван, В. -L., Tu, C.-F., и Tan, Y.-Q. (2019). Понимание множественных морфологических аномалий жгутиков сперматозоидов при мужском бесплодии: что нового? Азиатский Дж. Андрол. doi: 10.4103 / aja.aja_53_19 [Epub перед печатью].
-L., Tu, C.-F., и Tan, Y.-Q. (2019). Понимание множественных морфологических аномалий жгутиков сперматозоидов при мужском бесплодии: что нового? Азиатский Дж. Андрол. doi: 10.4103 / aja.aja_53_19 [Epub перед печатью].
CrossRef Полный текст | PubMed Аннотация | Google Scholar
Всемирная организация здравоохранения [ВОЗ] (2010 г.). Лабораторное руководство ВОЗ по исследованию и обработке спермы человека , 5-е изд. (Женева: Всемирная организация здравоохранения), 7–113.
Google Scholar
Винингер, Дж.Д. (2004). «Партеногенетические стволовые клетки», в справочнике по стволовым клеткам , изд. Р. П. Ланца (Амстердам: Elsevier). 635–637. DOI: 10.1016 / b978-012436643-5 / 50072-9
CrossRef Полный текст | Google Scholar
Войчик К., Бенчайб М., Лорнаж Дж., Чиба Дж. К. и Герен Дж. Ф. (2000). Протеасомы в сперматозоидах человека. Внутр. Дж. Андрол. 23, 169–177. DOI: 10.1046 / j.1365-2605.2000.00223.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ву, Г. Дж., Симерли, К., Зоран, С. С., Фунте, Л. Р., и Шаттен, Г. (1996). Динамика микротрубочек и хроматина во время оплодотворения и раннего развития у макак-резусов и регуляция внутриклеточными ионами кальция. Biol. Репрод. 55, 260–270. DOI: 10.1095 / biolreprod55.2.260
Дж., Симерли, К., Зоран, С. С., Фунте, Л. Р., и Шаттен, Г. (1996). Динамика микротрубочек и хроматина во время оплодотворения и раннего развития у макак-резусов и регуляция внутриклеточными ионами кальция. Biol. Репрод. 55, 260–270. DOI: 10.1095 / biolreprod55.2.260
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ябе Т., Ге X. и Пелегри Ф. (2007). Клеточный атолл гена материнского эффекта рыбок данио кодирует центриолярный компонент sas-6, и дефекты его отцовской функции способствуют дупликации всего генома. Dev. Биол. 312, 44–60. DOI: 10.1016 / j.ydbio.2007.08.054
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ян В., Морозуми К., Чжан Дж., Ро С., Парк К. и Янагимачи Р. (2008). Рождение мышей после интрацитоплазматической инъекции отдельных очищенных ядер сперматозоидов и обнаружения информационных РНК и микроРНК в ядрах сперматозоидов. Biol. Репрод. 78, 896–902. DOI: 10.1095 / биолрепрод.107.067033
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Юллера-Фернандес, М. М., Крозе Н. и Ахмед-Али М. (1992). Распределение микротрубочек при оплодотворении у кролика. Мол. Репрод. Dev. 32, 271–276. DOI: 10.1002 / mrd.1080320313
М., Крозе Н. и Ахмед-Али М. (1992). Распределение микротрубочек при оплодотворении у кролика. Мол. Репрод. Dev. 32, 271–276. DOI: 10.1002 / mrd.1080320313
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Юн, С. Ю., Джеллерет, Т., Салисиони, А. М., Ли, Х. С., Ю, М. С., Ковард, К. и др. (2008). Сперма человека, лишенная PLC, zeta 1, не может индуцировать высвобождение Ca (2+) и не может инициировать первую стадию развития эмбриона. J. Clin.Вкладывать деньги. 118, 3671–3681. DOI: 10.1172 / JCI36942
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ёсимото-Какой, Т., Терада, Ю., Татибана, М., Мураками, Т., Яэгаши, Н., и Окамура, К. (2008). Оценка центросомной функции бесплодных мужчин с помощью гетерологичного ИКСИ. Syst. Биол. Репрод. Med. 54, 135–142. DOI: 10.1080 / 19396360802043091
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Определение, структура, функции и ответы на часто задаваемые вопросы
Центриоль — это органелла цилиндрической формы, состоящая из белка, называемого тубулином.
Что такое центриоль?
Все животные клетки имеют две центриоли. Они помогают клетке во время деления клеток. Они работают при митозе и мейозе. Их можно найти в некоторых низших растениях, таких как хламидомонада, хотя они не присутствуют во многих грибах, покрытосеменных (цветковых) и пинофитах (хвойных). Обычно они присутствуют рядом с ядром, но не видны, когда клетка не делится.
Структура центриолей
Структура центриоли состоит из девяти групп триплетов микротрубочек, которые организованы в цилиндрическую форму.Детальное строение центриолей часто изучают только под микроскопом.
Эмбрионы Drosophila melanogaster и C. elegans являются исключением из этой организации. Они состоят из 9 пар микротрубочек, тогда как у недоношенных эмбрионов и сперматозоидов C.elegans присутствует 9 отдельных микротрубочек.
Центриоли были впервые обнаружены и идентифицированы Эдуардом ван Бенеденом и Теодором Бовери в 1883 и 1888 годах. Джозеф Г. Галль и Этьен де Харвен представили структуру удвоения центриоли в 1950-х годах.
Джозеф Г. Галль и Этьен де Харвен представили структуру удвоения центриоли в 1950-х годах.
Центриоль помогает в организации митотического веретена и завершает метод цитокинеза. Они также важны в животной клетке для формирования митотического веретена. Хотя несколько недавних исследований объяснили, что клетка, у которой нет центриоли (хирургически удаленной с помощью лазера), может функционировать без нее на уровне интерфазы G1 и может образоваться позже в процессе de novo.
Расположение центриолей играет ключевую роль в трехмерной организации клетки, поскольку оно также регулирует положение ядра.
У жгутиковых и реснитчатых организмов положение такой органеллы устанавливается после материнских центриолей, образующих дно.
Центриоли Функция
Ниже приведены важные функции центриолей:
Несмотря на отсутствие ДНК, центриоли способны образовывать новые центриоли.
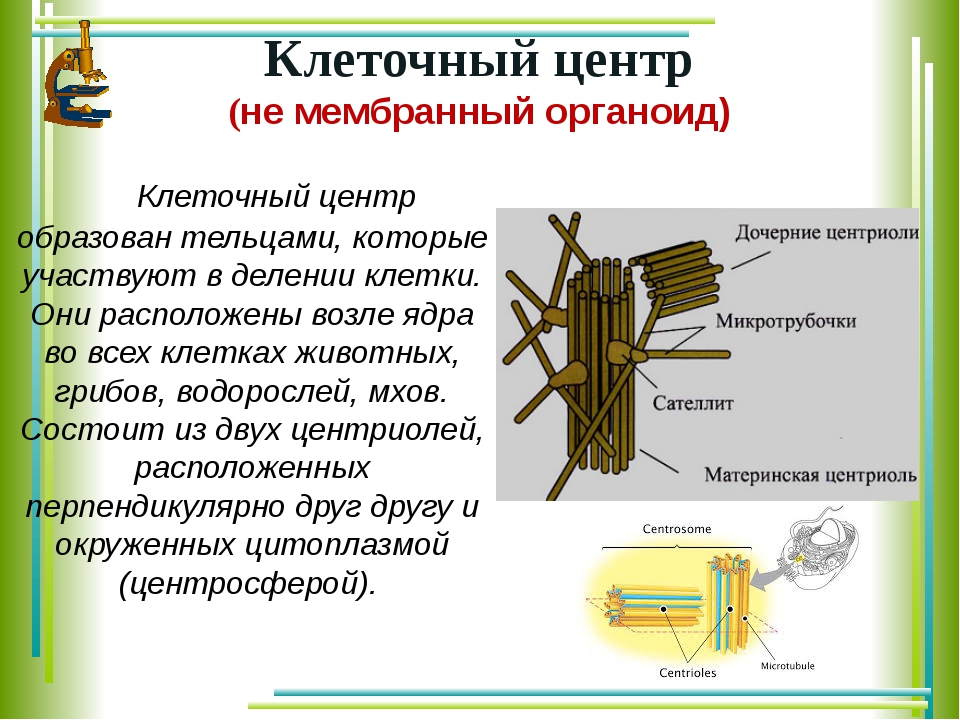
Могут трансформироваться в базальные тельца.
Базальные тела образуют жгутики и реснички.
Они помогают в делении клеток, образуя центры организации микротрубочек.
Из двух центриолей дистальная центриоль образует хвостовую или осевую нить.
Уровни клеточной организации
Клеточная мембрана: Эта мембрана действует как частично проницаемый барьер или может также называться защитой, которая пропускает через себя очень небольшое количество частиц, в то же время заключая большинство естественных химических веществ внутри клетки.
Клеточные стенки: Не все живые существа имеют клеточную мембрану, особенно животные и животные, подобные простейшим. Клеточные стенки состоят из бактерий, в состав которых входит химический пептидогликан. Целлюлоза, неперевариваемый (во всяком случае для человека) полисахарид, является самым распространенным химическим веществом в стенке гальванических клеток растения. Некоторые из растительных клеток также имеют лигнин и дополнительные химические вещества, имплантированные в стенки клеток хранения.
Клеточные стенки состоят из бактерий, в состав которых входит химический пептидогликан. Целлюлоза, неперевариваемый (во всяком случае для человека) полисахарид, является самым распространенным химическим веществом в стенке гальванических клеток растения. Некоторые из растительных клеток также имеют лигнин и дополнительные химические вещества, имплантированные в стенки клеток хранения.
Ядро: В эукариотических клетках можно найти только ядро, которое похоже на нуклеиновые кислоты, продуцируемые клетками РНК и ДНК. РНК, также называемая рибонуклеиновой кислотой, формируется внутри ядра с помощью последовательности на основе ДНК в качестве прототипа.РНК перемещается внутри цитоплазмы, где помогает в сборке белков. Ядрышко может быть частью ядра, где производятся рибосомы.
Вакуоли и везикулы: это типы органелл, которые имеют одну мембрану (также известную как тонопласт) и расположены внутри клетки. Для многих существ вакуоли — это хранилище. Везикулы несут ответственность за перенос материалов изнутри клетки наружу.
Рибосомы: Рибосомы — это места образования белка, не имеющие внешней мембраны и обнаруживаемые как у эукариот, так и у прокариот.Рибосомы эукариот немного больше прокариотических клеток. Рибосома содержит второстепенные и основные субъединицы. Биохимически рибосома содержит рРНК (рибосомную РНК) и несколько 50 структурных белков.
Эндоплазматический ретикулум: Эндоплазматический ретикулум представляет собой сеть взаимосвязанных мембран, которая помогает в транспортировке и синтезе белков. Rough ER (Rough endoplasmic reticulum) получил свое название из-за его грубого внешнего вида, что связано с наличием нескольких рибосом, обнаруженных вдоль внешней поверхности эндоплазматического ретикулума.Гладкая эндоплазматическая сеть не содержит рибосом.
Аппарат Гольджи: Аппарат или комплексы Гольджи были впервые обнаружены в 1890-х годах итальянским биологом по имени Камилло Гольджи. Они представляют собой сжатые стопки мембраносвязанных мешочков, которые помогают в модификации везикул, продуцируемых грубым эндоплазматическим ретикулумом.
Лизосомы: сравнительно большие пузырьки, созданные Гольджи. Они содержат гидролитические ферменты, которые лизируют клетку. Содержимое лизосом передается по наследству при внеклеточном расщеплении материалов.
Митохондрии: они находятся в эукариотических клетках, содержащих их собственную ДНК. Их полезность связана с местом разряда энергии и образования АТФ (методом хемиосмоса). Митохондрия была помечена из-за электростанции клетки. Митохондрии имеют две перепончатые оболочки. Формирование АТФ (аденозинтрифосфата) происходит на внутренней клеточной стенке митохондрий, также известных как кристы. Внутренняя мембрана окружает матрицу митохондрии, которая состоит из митохондриальной ДНК и рибосом.
Митохондрии и эндосимбиоз: Концепция эндосимбиоза была предложена Линн Маргулис в 1980-х годах. Эта концепция объясняет хлоропласты и митохондрии прокариот.
Пластиды: это органеллы, которые существуют в растениях и фотосинтезирующих эукариотах и ограничены мембраной.
