Общая характеристика элементов металлов — урок. Химия, 8–9 класс.
Металлы в природе
Из \(118\) известных на данный момент химических элементов \(96\) образуют простые вещества с металлическими свойствами, поэтому их называют металлическими элементами.
Металлические химические элементы в природе могут встречаться как в виде простых веществ, так и в виде соединений. То, в каком виде встречаются металлические элементы в природе, зависит от химической активности образуемых ими металлов.
Ряд активности металлов
| \(Li, K, Ba, Ca, Na, \) | \(Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb\) | h3 | \(Cu, Hg, Ag, Pt, Au\) |
активные металлы | металлы средней активности | неактивные металлы |
Металлические элементы, образующие химически активные металлы (Li–Mg), в природе чаще всего встречаются в виде солей (хлоридов, фторидов, сульфатов, фосфатов и других).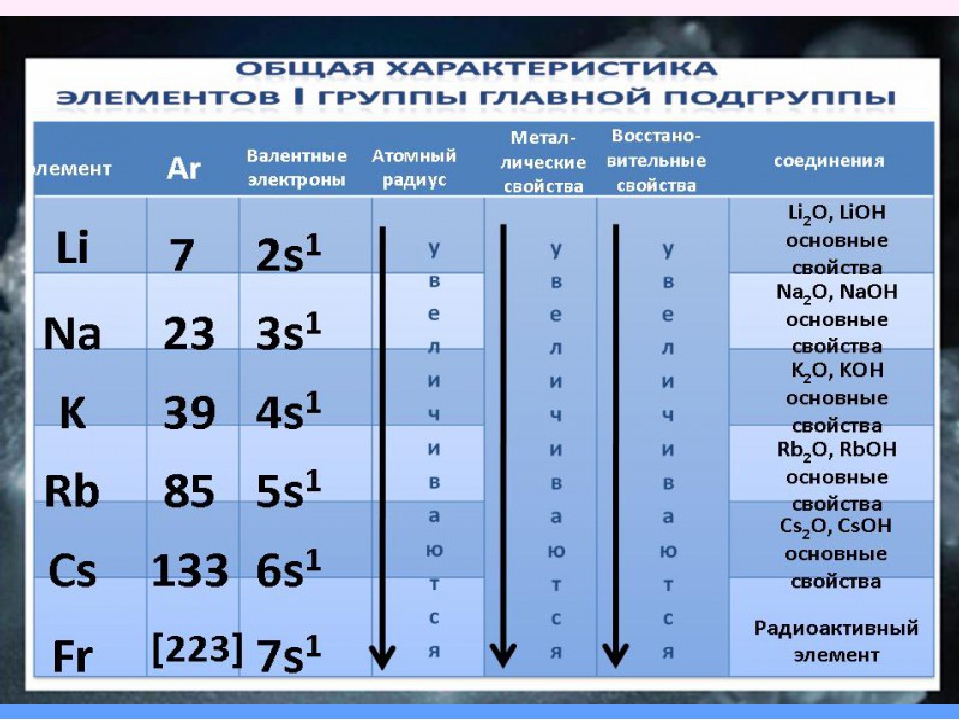
Сильвин — хлорид калия KCl с примесями | Минерал галит состоит из хлорида натрия NaCl | Минерал кальцит состоит из карбоната кальция CaCO_3 |
В растворённом виде соли натрия, кальция и магния содержатся в природных водах. Кроме того, соли активных металлов — важная составная часть живых организмов. Например, фосфат кальция Ca3(PO4)2 является главной минеральной составной частью костной ткани.
Металлические химические элементы, образующие металлы средней активности (Al–Pb), в природе чаще всего встречаются в виде оксидов и сульфидов.
Минерал корунд состоит из оксида алюминия Al_2O_3 | Оксид железа(\(III\)) Fe_2O_3 образует минерал гематит | Минерал галенит cостоит из сульфида свинца(\(II\)) PbS |
Металлические элементы, образующие химически неактивные металлы (Cu–Au), в природе чаще всего встречаются в виде простых веществ.
| Самородное золото Au | Самородное серебро Ag | Самородная платина Pt |
Исключение составляют медь и ртуть, которые в природе встречаются также в виде химических соединений.
Минерал медный блеск состоит из сульфида меди \(I\)) Cu_2S | Гидроксокарбонат меди(\(II\)) (CuOH)_2CO_3 малахит | Минерал киноварь состоит из сульфида ртути(\(II\)) HgS |
Положение элементов металлов в Периодической системе, особенности строения и свойств их атомов
В Периодической системе химических элементов металлы занимают левый нижний угол и находятся в главных (А) и побочных (Б) группах.
Положение металлов в Периодической системе. Знаки металлических химических элементов выделены красным цветом
В электронной оболочке атомов металлов на внешнем энергетическом уровне, как правило, содержится от \(1\) до \(3\) электронов. Исключение составляют только металлы \(IV\)А, \(V\)А и \(VI\)А группы, у которых на наружном энергетическом уровне находятся соответственно четыре, пять или шесть электронов.
Радиусы атомов металлов больше, чем у атомов неметаллов того же периода. В силу отдалённости положительно заряженного ядра атомы металлов слабо удерживают свои валентные электроны (электроны внешнего энергетического уровня).
Характер изменения радиусов атомов химических элементов в периодах и в группах. Радиусы атомов металлов существенно больше, чем радиусы атомов неметаллов, находящихся в том же периоде
Главное отличительное свойство металлов — это их сравнительно невысокая электроотрицательность (ЭО) по сравнению с неметаллами.
Величины относительных электроотрицательностей (ОЭО) некоторых химических элементов (по Л. Полингу). ОЭО металлических химических элементов (выделены красным цветом) уступает соответствующей величине неметаллических химических элементов
Атомы металлов, вступая в химические реакции, способны только отдавать электроны, то есть окисляться, следовательно, в ходе превращений могут проявлять себя в качестве восстановителей.
1.2.2. Общая характеристика металлов IА–IIIА групп.
Элементы IA группы
В IA группу (главная подгруппа первой группы) таблицы Менделеева входят металлы — литий Li, натрий Na, калий К, рубидий Rb, цезий Cs и франций Fr. Традиционно, данные элементы называют щелочными металлами (ЩМ), так как их простые вещества образуют при взаимодействии с водой едкие щелочи. Последний из известных представителей группы щелочных металлов (Fr) является радиоактивным элементом, в связи с чем его химические свойства изучены недостаточно: период полураспада его наиболее долгоживущего изотопа 223Fr составляет всего лишь около 22 мин.![]()
Электронные формулы, а также некоторые свойства щелочных металлов представлены в таблице ниже:
| Свойство | Li | Na | К | Rb | Cs | Fr |
| Заряд ядра Z | 3 | 11 | 19 | 37 | 55 | 87 |
| Электронная конфигурация в основном состоянии | [He]2s1 | [Ne]3s1 | [Аr]4s1 | [Kr]5s1 | [Хе]6s1 | [Rn]7s1 |
| Металлический радиус rмет, нм | 0,152 | 0,186 | 0,227 | 0,248 | 0,265 | 0,270 |
| Ионный радиус rион*, нм | 0,074 | 0,102 | 0,138 | 0,149 | 0,170 | 0,180 |
| Радиус гидратированного иона,rион , нм | 0,340 | 0,276 | 0,232 | 0,228 | 0,228 | — |
| Энергия ионизации, кДж/моль: I1 I2 | 520,2 7298 | 495,8 4562 | 418,8 3052 | 403,0 2633 | 375,7 2234 | (380) (2100) |
| Электроотрицательность | 0,98 | 0,93 | 0,82 | 0,82 | 0,79 | 0,70 |
При движении вниз по IA группе возрастает радиус атомов металлов (rмет), что, собственно, характерно для любых элементов всех главных подгрупп.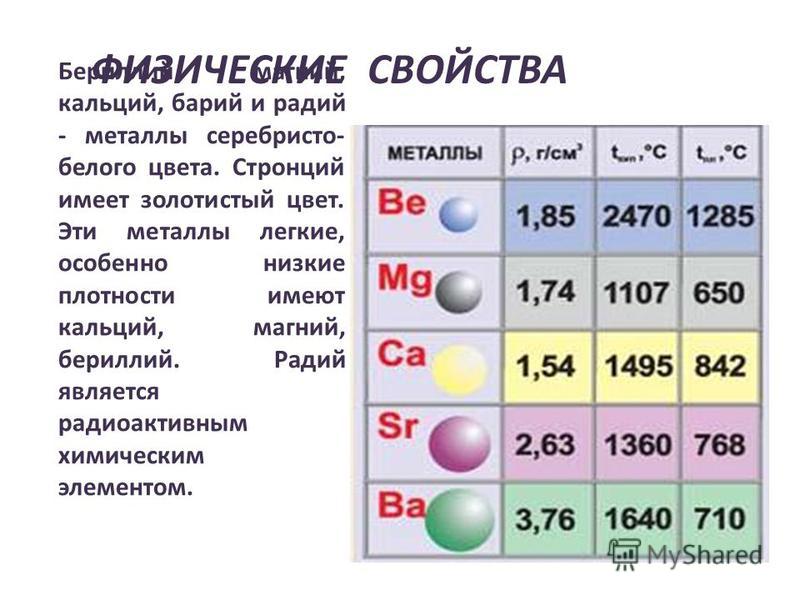 Относительно малое увеличение радиуса при переходе от K к Rb и далее к Cs обусловлено заполнением 3d- и 4d-подуровней соответственно.
Относительно малое увеличение радиуса при переходе от K к Rb и далее к Cs обусловлено заполнением 3d- и 4d-подуровней соответственно.
Ионные радиусы ЩМ существенно меньше металлических, что связано с потерей единственного валентного электрона. Они также закономерно возрастают от Li+ к Cs+. Размеры же гидратированных катионов изменяются в противоположном направлении, что объясняется в рамках простейшей электростатической модели. Наименьший по размеру ион Li+ лучше катионов остальных щелочных металлов притягивает к себе полярные молекулы воды, образуя наиболее толстую гидратную оболочку. Исследования показали, что в водном растворе катион лития Li+ окружен 26 молекулами воды, из которых только 4 находятся в непосредственном контакте с ионом лития (первой координационной сфере). По этой причине многие соли лития, например, хлорид, перхлорат и сульфат, а также гидроксид выделяются из водных растворов в виде кристаллогидратов. Хлорид LiCl·Н2O теряет воду при температуре 95 °С, LiOH·Н2O — при 110°С, а LiClO4·Н2O — только при температуре выше 150°С. С увеличением ионного радиуса катиона щелочного металла сила его электростатического взаимодействия с молекулами воды ослабевает, что приводит к снижению толщины гидратной оболочки и, как следствие, радиуса гидратированного иона [М(Н2O)n] (где n = 17, 11, 10, 10 для М+ = Na+, К+, Rb+, Cs+ соответственно).
С увеличением ионного радиуса катиона щелочного металла сила его электростатического взаимодействия с молекулами воды ослабевает, что приводит к снижению толщины гидратной оболочки и, как следствие, радиуса гидратированного иона [М(Н2O)n] (где n = 17, 11, 10, 10 для М+ = Na+, К+, Rb+, Cs+ соответственно).
Внешний энергетический уровень атома ЩМ содержит один единственный электрон, который слабо связан с ядром, о чем говорят низкие значения энергии ионизации I1. Атомы щелочных металлов легко ионизируются с образованием катионов М+, входящих в состав практически всех химических соединений этих элементов. Значения I2 для всех щелочных металлов настолько высоки, что в реально осуществимых условиях ион М2+ не образуется. Электроотрицательность щелочных элементов мала, их соединения с наиболее электроотрицательными элементами (хлор, кислород, азот)имеют ионное строение, как минимум в кристаллическом состоянии.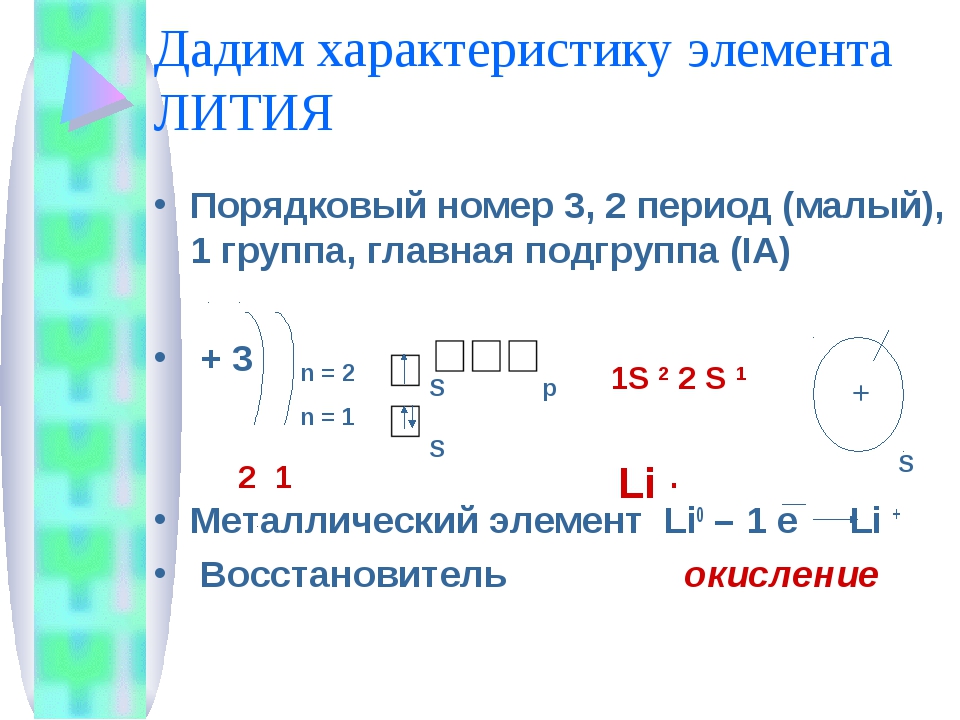
Маленький радиус иона Li+ и высокая плотность заряда, являются причиной того, что соединения лития оказываются схожими по свойствам аналогичным соединениям магния (диагональное сходство) и в то же время отличаются от соединений остальных ЩМ.
Элементы IIA группы
В IIA группу Периодической системы элементов входят бериллий Ве, магний Мg и четыре щелочноземельных металла (ЩЗМ): кальций Са, стронций Sr, барий Ва и радий Ra, оксиды которых, раньше называемые «землями», при взаимодействии с водой образуют щелочи. Радий — радиоактивный элемент (α-распад, период полураспада примерно 1600 лет).
Электронная конфигурация и некоторые свойства элементов второй группы приведены в таблице ниже.
По электронному строению атомов элементы второй группы близки щелочным металлам. Они имеют конфигурацию благородного газа, дополненную
| Свойство | Be | Mg | Ca | Sr | Ba | Ra |
| Заряд ядра Z | 4 | 12 | 20 | 38 | 56 | 88 |
| Электронная конфигурация в основном состоянии | [He]2s2 | [Ne]3s2 | [Ar]4s2 | [Kr]5s2 | [Xe]6s2 | [Rn]7s2 |
| Металлический радиус rмет, нм | 0,112 | 0,160 | 0,197 | 0,215 | 0,217 | 0,223 |
| Ионный радиус rион*, нм | 0,027 | 0,72 | 0,100 | 0,126 | 0,142 | 0,148 |
| Энергия ионизации, кДж/моль: I1 I2 I3 | 899,5 1757 14850 | 737,7 1451 7733 | 589,8 1145 4912 | 549,5 1064 4138 | 502,8 965 3619 | 509,3 979 3300 |
| Электроотрицательность | 1,57 | 1,31 | 1,00 | 0,95 | 0,89 | 0,90 |
двумя s-электронами на внешнем уровне. В то же время от элементов первой группы они отличаются более высокими значениями энергии ионизации, убывающими в ряду Ве—Мg—Са—Sr— Ва. Эта тенденция нарушается при переходе от бария к радию: повышениe П и І, для Rа по сравнению с Ва объясняется эффектом инертной 6s2-пары.
В то же время от элементов первой группы они отличаются более высокими значениями энергии ионизации, убывающими в ряду Ве—Мg—Са—Sr— Ва. Эта тенденция нарушается при переходе от бария к радию: повышениe П и І, для Rа по сравнению с Ва объясняется эффектом инертной 6s2-пары.
Следует отметить, что в то время как для щелочных металлов характерна значительная разница между I1 и I2 для элементов второй группы подобный скачок наблюдается между I2 и I3. Именно поэтому щелочные металлы в сложных веществах проявляют только степень окисления +1, а элементы второй группы +2. Наличие единственной положительной степени окисления и невозможность восстановления ионов M2+ в водной среде придает большое сходство всем металлам s-блока.
Изменение свойств по группе следует общим закономерностям, рассмотренным на примере щелочных металлов. Элемент второго периода бериллий, подобно элементу первой группы литию, значительно отличается по своим свойствам от других элементов второй группы. Так, ион Be2+ благодаря чрезвычайно малому ионному радиусу (0,027 нм), высокой плотности заряда, большим значениям энергий атомизации и ионизации оказывается устойчивым лишь в газовой фазе при высоких температурах. Поэтому химическая связь в бинарных соединениях бериллия даже с наиболее электроотрицательными элементами (кислород, фтором) обладает высокой долей ковалентности. Химия водных растворов бериллия также имеет свою специфику: в первой координационной сфере бериллия могут находиться лишь четыре лиганда ([Be(H2O)4]2+, (Bе(OH)4]—), что связано с малым ионным радиусом металла и отсутствием d-орбиталей.
Так, ион Be2+ благодаря чрезвычайно малому ионному радиусу (0,027 нм), высокой плотности заряда, большим значениям энергий атомизации и ионизации оказывается устойчивым лишь в газовой фазе при высоких температурах. Поэтому химическая связь в бинарных соединениях бериллия даже с наиболее электроотрицательными элементами (кислород, фтором) обладает высокой долей ковалентности. Химия водных растворов бериллия также имеет свою специфику: в первой координационной сфере бериллия могут находиться лишь четыре лиганда ([Be(H2O)4]2+, (Bе(OH)4]—), что связано с малым ионным радиусом металла и отсутствием d-орбиталей.
Щелочноземельные металлы (Са, Sr, Ва, Ra) образуют единое семейство элементов, в пределах которого некоторые свойства (энергия гидратации, растворимость и термическая устойчивость солей) меняются монотонно с увеличением ионного радиуса, а многие их соединения являются изоморфными.
Элементы IIIA группы
Элементы IIIA группы: бор В, алюминий Al, галлий Ga, индий In и таллий Tl — имеют мало стабильных изотопов, что характерно для атомов с нечетными порядковыми номерами. Электронная конфигурация внешнего энергетического уровня в основном состоянии ns2nр1 характеризуется наличием одного неспаренного электрона. В возбужденном состоянии элементы IIIA группы содержат три неспаренных электрона, которые, находясь в sp2-гибридизации, принимают участие в образовании трех ковалентных связей. При этом у атомов остается одна незанятая орбиталь. Поэтому многие ковалентные соединения элементов IIIA группы являются акцепторами электронной пары (кислоты Льюиса), т.е. могут образовывать четвертую ковалентную связь по донорно-акцепторному механизму, создавая которую, они изменяют геометрию своего окружения — она из плоской становится тетраэдрической (состояние sp3-гибридизации). Бор сильно отличается по свойствам от других элементов IIIA группы. Он является единственным неметаллом, химически инертен и образует ковалентные связи со фтором, азотом, углеродом и т.д. Химия бора более близка химии кремния, в этом проявляется Диагональное сходство.
Электронная конфигурация внешнего энергетического уровня в основном состоянии ns2nр1 характеризуется наличием одного неспаренного электрона. В возбужденном состоянии элементы IIIA группы содержат три неспаренных электрона, которые, находясь в sp2-гибридизации, принимают участие в образовании трех ковалентных связей. При этом у атомов остается одна незанятая орбиталь. Поэтому многие ковалентные соединения элементов IIIA группы являются акцепторами электронной пары (кислоты Льюиса), т.е. могут образовывать четвертую ковалентную связь по донорно-акцепторному механизму, создавая которую, они изменяют геометрию своего окружения — она из плоской становится тетраэдрической (состояние sp3-гибридизации). Бор сильно отличается по свойствам от других элементов IIIA группы. Он является единственным неметаллом, химически инертен и образует ковалентные связи со фтором, азотом, углеродом и т.д. Химия бора более близка химии кремния, в этом проявляется Диагональное сходство. У атомов алюминия и его тяжелых аналогов появляются вакантные d-орбитали, возрастает радиус атома. Галлий, индий и таллий расположены в Периодической системе сразу за металлами d-блока, поэтому их часто называют постпереходными элементами. Заполнение d-оболочки сопровождается последовательным сжатием атомов, в 3d-pяду оно оказывается настолько сильным, что нивелирует возрастание радиуса при появлении четвертого энергетического уровня. В результате d-сжатия ионные радиусы алюминия и галлия близки, а атомный радиус галлия даже меньше, чем алюминия.
У атомов алюминия и его тяжелых аналогов появляются вакантные d-орбитали, возрастает радиус атома. Галлий, индий и таллий расположены в Периодической системе сразу за металлами d-блока, поэтому их часто называют постпереходными элементами. Заполнение d-оболочки сопровождается последовательным сжатием атомов, в 3d-pяду оно оказывается настолько сильным, что нивелирует возрастание радиуса при появлении четвертого энергетического уровня. В результате d-сжатия ионные радиусы алюминия и галлия близки, а атомный радиус галлия даже меньше, чем алюминия.
Для таллия, свинца, висмута и полония наиболее устойчивы соединения со степенью окисления +1, +2, +3, +4 соответственно.
| Свойство | B | Al | Ga | In | Tl |
| Заряд ядра Z | 5 | 13 | 31 | 49 | 81 |
| Электронная конфигурация в основном состоянии | [He]2s22p1 | [Ne]3s23p1 | [Ar]3d104s24p1 | [Kr]4d105s25p1 | [Xe]4f145d106s26p1 |
| Атомный радиус, нм | 0,083 | 0,143 | 0,122 | 0,163 | 0,170 |
| Энергия ионизации, кДж/моль: I1 I2 I3 | 801 2427 3660 | 577 1817 2745 | 579 1979 2963 | 558 1821 2704 | 589 1971 2878 |
| Электроотрицательность | 2,04 | 1,61 | 1,81 | 1,78 | 2,04 |
Для соединений элементов IIIA группы наиболее характерна степень окисления +3. В ряду бор-алюминий-галлий-индий-таллий устойчивость таких соединений уменьшается, а устойчивость соединений со степенью окисления +1, напротив, увеличивается. Энергия связи М—Hal в галогенидах последних при переходе от легких к более тяжелым элементам М уменьшаются, амфотерные свойства оксидов и гидроксидов смещаются в сторону большей основности, склонность катионов к гидролизу (взаимодействию с водой) ослабевает.
В ряду бор-алюминий-галлий-индий-таллий устойчивость таких соединений уменьшается, а устойчивость соединений со степенью окисления +1, напротив, увеличивается. Энергия связи М—Hal в галогенидах последних при переходе от легких к более тяжелым элементам М уменьшаются, амфотерные свойства оксидов и гидроксидов смещаются в сторону большей основности, склонность катионов к гидролизу (взаимодействию с водой) ослабевает.
Химия индия и особенно галлия вообще очень близка химии алюминия. Соединения этих металлов в низших степенях окисления (Ga2O, Ga2S, InCl и др.) в водных растворах диспропорционируют. Для таллия состояние +1, напротив, является наиболее устойчивым из-за инертности электронной пары 6s2.
1. Общая характеристика элементов-металлов
Лекция 5. Металлы
Из 114 элементов,
известных в настоящее время, 96 являются
металлами.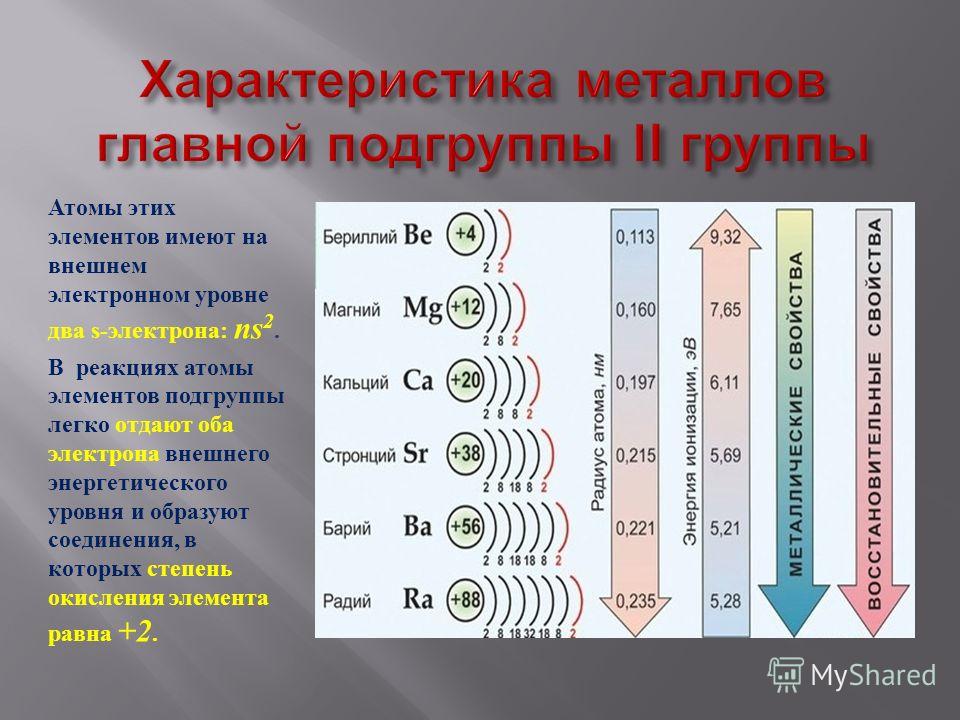 Металлы и их соединения
играют важную роль в минеральной и
органической жизни Земли. Атомы и ионы
металлов входят в состав важнейших
соединений, участвующих в жизнедеятельности
растений, животных и человека.
Металлы и их соединения
играют важную роль в минеральной и
органической жизни Земли. Атомы и ионы
металлов входят в состав важнейших
соединений, участвующих в жизнедеятельности
растений, животных и человека.
По своей химической природе металлы – это химические элементы, атомы которых отдают электроны с внешнего или предвнешнего энергетического уровней, образуя при этом положительно заряженные ионы.
Практически все металлы имеют сравнительно большие радиусы и малое, от 1 до 3, число электронов на внешнем энергетическом уровне, исключения составляют только германий, олово, свинец (4 электрона), сурьма, висмут (5 электронов) и полоний (6 электронов). Для атомов металлов характерны низкие значения электороотрицательности и восстановительные свойства.
1.1. Положение металлов в Периодической системе элементов д.И. Менделеева
В Периодической
системе химических элементов
Д.И. Менделеева металлы располагаются
ниже диагонали бериллий – астат.
Элементы, расположенные вблизи диагонали,
например, бериллий, алюминий, титан,
германий, сурьма обладают двойственным
характером и относятся к металлоидам. Металлы располагаются в начале периодов,
к ним относятся s-элементы 1 и 2 групп,
р-элементы 3 группы, все, кроме бора, 4
группы: германий, олово, свинец, 5 группы:
сурьма, висмут, а также все d- и f- элементы.
Металлы располагаются в начале периодов,
к ним относятся s-элементы 1 и 2 групп,
р-элементы 3 группы, все, кроме бора, 4
группы: германий, олово, свинец, 5 группы:
сурьма, висмут, а также все d- и f- элементы.
1.2. Электронное строение элементов-металлов
По своему электронному строению металлы делятся на s-, p-, d- и f-металлы.
s-металлы расположены в 1 и 2 группах Периодической системы химических элементов, р-металлы – в 3, 4, 5, 6 группах. Все они, за исключением германия, олова, свинца, сурьмы, висмута и полония, на внешнем энергетическом уровне имеют 1–3 электрона.
Электронные конфигурации валентных электронов s- и р-металлов приведены в таблице:
ns1 | ns2 | ns2np1 | ns2np2 | ns2np3 | ns2np4 |
Li | Be | ||||
Na | Mg | ||||
K | Ca | Ga | Ge | ||
Rb | Sr | In | Sn | Sb | |
Cs | Ba | Tl | Pb | Bi | Po |
В группах s- и
р-металлов число электронов на внешнем
энергетическом уровне не изменяется,
радиус атома увеличивается,
электроотрицательность
уменьшается, восстановительные
свойства усиливаются, металлические
свойства усиливаются.
Начиная с 4 периода, появляются вставные декады d-элементов, у которых заполняется предвнешний энергетический уровень. d-элементы расположены в 3–12 группах Периодической системы химических элементов, все они являются металлами, имеют большое количество валентных электронов, так как ими являются не только s-, но и d-электроны. Это свойство обеспечивает большое разнообразие степеней окисления и ярко выраженную склонность к комплексообразованию.
Электронные конфигурации валентных электронов d-металлов приведены в таблице:
(n-1)d1ns2 | (n-1)d2ns2 | (n-1)d3 | (n-1)d4ns2 | (n-1)d5ns2 | (n-1)d6ns2 | (n-1)d7ns2 | (n-1)d8ns2 | (n-1)d9ns2 | (n-1)d10ns2 |
Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn |
Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd |
La | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg |
В группах d-металлов
число электронов на внешнем энергетическом
уровне не изменяется, радиус атома
увеличивается, хотя в меньшей степени,
чем у s- и р-металлов, восстановительные
свойства чаще всего уменьшаются,
устойчивость высшей степени окисления
увеличивается.
Начиная с 6 периода, появляются семейства лантаноидов и актиноидов, которые включают по 14 f-элементов, у них заполняется третий с конца энергетический уровень. f-элементы расположены в 3 группе Периодической системы химических элементов, их электронная конфигурация
(n-2)f1-14(n-1)d0-1ns2. Все они являются металлами, проявляют очень схожие химические свойства.
Этапы урока | Дидактическая задача | Деятельность учителя | Деятельность учащихся | Показатель результатов решения задачи |
I. Орг. Момент | ||||
II. Актуализация знаний | Подготовка учащихся к работе на уроке, организация действий школьников, направленных на решение проблем и достижение целей урока. | Объявляет тему урока, формулирует цели, задачи. Определяет место темы в курсе неорганической химии (в соответствии с программой). Акцентирует внимание на взаимосвязи ранее изученного материала с разрабатываемой проблемой. Разъясняет этапы предстоящей работы учащихся, проводит инструктаж, указывает форму записи и представления изученного материала. | Принимают, уточняют, цели и задачи. Работают с программой. Осмысливают и конкретизируют этапы работы. Уточняют в случае недопонимания. | |
III. Основная часть | ||||
1 этап. | Организация деятельности в группах, погружение в проект. | Группам выделяются инструктивные карты – задания и необходимый дополнительный материал (справочники, таблицы). Проводит необходимый инструктаж для каждой группы в отдельности. | Получают задания – инструкции, знакомятся с их содержанием, осмысливают, уточняют группе или у учителя. | Эмоциональное состояние школьников, ответы на вопросы, активное включение в работу. |
2 этап | Организация поиска решения. | Не участвует, но при необходимости консультирует учащихся. Оказывает дифференцированную помощь. Ненавязчиво контролирует работу проектных групп. | Активно работают в группах (каждый в соответствии со своей ролью и сообща). При необходимости консультируются. Продумывают форму презентации своего мини-проекта. | Активная учебная деятельность. |
3 этап | оформление мини-проектов. | Организует деятельность учащихся по воспроизведению ими новых знаний; организует умственную деятельность по применению полученных знаний. | Оформляют работу в текстовом редакторе, обсуждают текст выступления. | Готовы к презентации. |
4 этап | оформление мини-проектов. | Раздает листы оценок в группы. Организует выступления проектных групп. Побуждает учащихся других групп участвовать в обсуждении вопросов. Задает вопросы. Создает ситуацию успеха. | Осуществляют презентацию своей деятельности. Отвечают на вопросы. Слушают выступающих, дополняют, поправляют в случае необходимости. Задают вопросы докладчикам. Ставят им оценки. | Представляют свои работы. |
5 этап | объединение мини-проектов, оформление проекта. | Помогает вносить коррективы. | Корректируют и дополняют свои работы, объединяют их в один большой документ. | Готовый продукт. |
IV. Рефлексия | мобилизация учащихся на рефлексию. | Обобщает и резюмирует полученные результаты. Дает оценку деятельности групп. Предлагает оценить работу групп учащимся (в том числе дать оценку работы своей группы). Собирает оценочные листы. Делает краткое обобщение по теме. | Анализируют и оценивают свою работу и работу других групп. Оформляют и сдают оценочные листы. Слушают сообщение учителя и задают в случае необходимости вопросы. | Записи в тетради, комментарии к выступлениям. |
V. Задания на дом | При необходимости дает задания на дом. |
Как легко определять свойства элементов и их соединений — Российская газета
Не так уж часто удается написать заметку о том, что не просто войдет в школьные учебники будущего, а станет одной из базовых картинок-иллюстраций. Химики из Сколковского института науки и технологий Артем Оганов и Захед Алахъяри придумали и рассчитали, как расположить химические элементы в порядке постепенного изменения их химических свойств. Такая последовательность удобнее, чем таблица Менделеева, для предсказания твердости, стабильности, намагниченности и других свойств элементов и их соединений. О том, как было сделано и что значит это отрытые, «Коту» рассказал профессор Сколтеха Артем Оганов.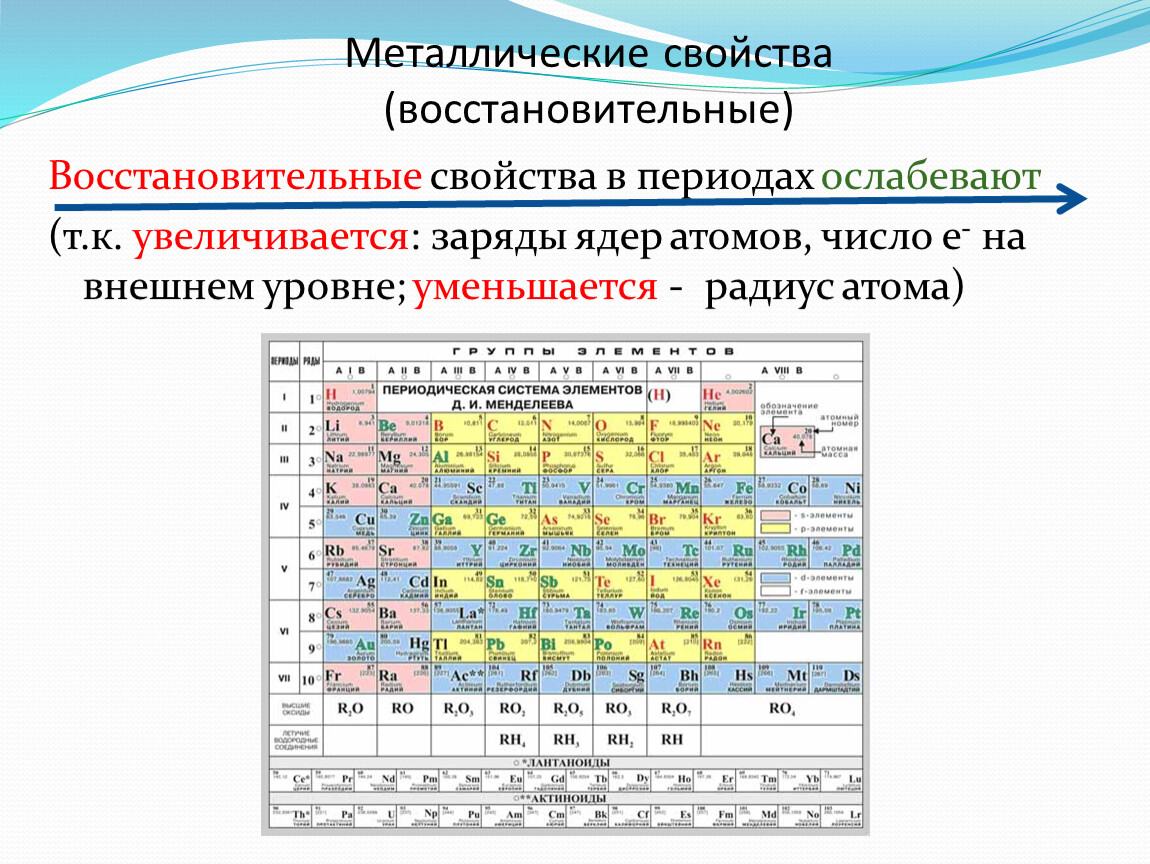
Артем Оганов — кристаллограф-теоретик, создатель ряда новых материалов, а главное, методов, которые позволяют открывать новые материалы. Решил считавшуюся нерешаемой задачу предсказания кристаллической структуры вещества на основе его химического состава. Создал программу USPEX, способную предсказывать устойчивые химические соединения по набору исходных элементов. Один из самых цитируемых в мире ученых.
Я хорошо помню, как мне пришло в голову решение этой задачи. Мы с семьей садились в самолет. У меня четверо детей, и все они расположились у меня на голове и прочих частях тела и к тому же продолжали непрерывно двигаться. Опытные родители знают, что сопротивляться этому бессмысленно, а беспокоиться неразумно. Поэтому мой мозг перестал метаться, анализируя внешние сигналы, и застыл, сфокусировавшись в одной точке. Точка эта оказалась на спинке впередистоящего кресла. Там-то и начал проступать основной график будущей работы. Я вдруг увидел, что элементы таблицы Менделеева не размазаны равномерно в пространстве своих свойств, а, как звезды в Галактике, расположены более-менее на плоскости.
Эта проблема волновала меня последние 15 лет. В 1984 году британский физик Дэвид Петтифор опубликовал работу, в которой ввел понятие менделеевских чисел, — с их помощью он сгруппировал элементы в порядке изменения их химических свойств. В таблице Менделеева свойства элементов меняются скачками. Так, после самого химически активного неметалла фтора идет инертный неон, а сразу за ним — активнейший металл натрий. Можно ли найти вариант, при котором рядом бы стояли похожие по свойствам элементы?
Петтифор предложил решение — выстроил элементы в некоторой последовательности, приписав им некие числа Менделеева. Но как приписал, не объяснил. И тем более не объяснил, какой у них физический смысл. Эти числа не расчет, а произвол, хотя и основанный на наблюдениях за свойствами бинарных соединений — веществ, состоящих из двух разных атомов. Скажем, если NaCl и KCl похожи, то и натрий с калием должны стоять рядом. Все это время ученые модифицировали и улучшали менделеевские числа, но что это такое, так никто и не объяснил.
У химических элементов есть разные характеристики, которые влияют на их свойства. Прежде всего размер атома (его радиус), валентность, поляризуемость*, электроотрицательность**. Но валентность — параметр непостоянный, у разных элементов могут быть разные валентности, а мы неоднократно открывали химические соединения, которые с точки зрения привычных представлений о валентности не могли бы существовать. Но существуют. Поляризуемость очень сильно коррелирует с электроотрицательностью.
*Поляризуемость — способность атома или молекулы становиться электрически полярными во внешнем электромагнитном поле. Поляризуемость показывает, насколько легко может возникнуть заряженная частица (ион) или новая химическая связь.
**Электроотрицательность — способность атома оттягивать электроны других атомов в химических соединениях. Самая высокая степень электроотрицательности у галогенов и сильных окислителей (F, O, N, Cl), низкая — у активных металлов (Li, Na, K).
Получается, что для определения фундаментальных свойств атомов можно использовать только атомный радиус и электроотрицательность. И если по оси Х — радиус, а по оси Y — электроотрицательность, мы получаем плоскость, на которой сильно вытянутым облаком располагаются элементы. Внутри этого облака, воспользовавшись несложным математическим приемом, можно провести линию, вдоль которой элементы встанут в порядке максимально плавного изменения свойств.
Так мы открыли физический и химический смысл менделеевских чисел: это наилучшее представление всех химических свойств атома одним числом. Но мы предложили не только объяснение, но и улучшенную версию чисел Менделеева, в которой нет места субъективности — только расчеты на основе фундаментальных характеристик атомов. Мы назвали это «Универсальной последовательностью элементов», по-английски Universal Sequence Of Elements, сокращенно USE. И действительно, наша последовательность удобна в применении: она предсказывает свойства химических соединений лучше, чем петтифоровские менделеевские числа и их позднейшие модификации.
Если расположить элементы на осях, то на плоскости будут бинарные соединения — молекулы и кристаллы, состоящие из двух типов атомов. Мы обнаружили, что на этом поле — его можно назвать химическим пространством — возникают области соединений с близкими свойствами, например твердостью кристаллов, магнетизмом, энергией связи. Известно, например, что алмаз, состоящий только из углерода, — самый твердый из кристаллов. А как искать другие твердые вещества? По соседству с алмазом в его химическом пространстве.
Улучшенные менделеевские числа помогут находить новые соединения с полезными свойствами и смогут прояснить некоторые вопросы, связанные с привычной таблицей Менделеева. Например, уже сейчас можно ставить точку в споре, где должен находиться водород: над литием или над фтором. Согласно менделеевским числам, водород ближе к галогенам, чем к щелочным металлам.
Ссылка: Zahed Allahyari and Artem R. Oganov, Nonempirical Definition of the Mendeleev Numbers: Organizing the Chemical Space: J. Phys. Chem. C 2020, 124, 43, 23867-23878.
Универсальная последовательность элементов (USE)
Журнал «Кот Шрёдингера»
Как вычисляются числа Менделеева
Универсальная последовательность элементов определяется их проекцией на линию, обозначенную синим цветом. Журнал «Кот Шрёдингера»
Виды металла, характеристика механических свойств металла
Металлопродукция достаточно популярна в любой сфере деятельности, ведь металл имеет такие свойства, как высокая электропроводимость, теплопроводимость, прочность, доступность и универсальность и многие другие.
Из известных химических элементов 83 — металлы
, которые можно использовать, как основной материал для производства сталей, так и для их отделки и работ повышения качественных характеристик.
Металлы разделяют на две основные группы — цветные и черные металлы, каждая группа обладает уникальными свойствами, как внешними, так и качественными.
Виды черных металлов
Черные металлы имеют темный цвет (от темно-серого до черного), обладают полиморфизмом, имеют большую плотность, высокую температуру плавления и высокий уровень твердости.
Черные металлы по своим характеристикам разделаются на отдельные группы:
- Железные металлы (ферромагнетики) — к ним относят железо, кобальт, никель, марганец. Как добавки к сплавам железа применяют никель, марганец и кобальт. Их используют, как основы для определенных сплавов, похожих на высоколегированные стали.
- Тугоплавкие металлы используют, как в качестве основы, так и как добавки к легированным сталям. Температура их плавления выше, чем у железа, чем +1539 градусов;
- Урановые металлы (актиниды) часто применяют в атомной энергетике;
- РЗМ (редкоземельные металлы), к ним относят лаптан, церий, празеодим, неодим и др. Каждый из этих металлов имеет уникальные физические свойства, применяются они, как добавки к сплавам других металлов. В природе они образуют смесь, которую сложно разделять на отдельные металлы, поэтому в металлургической промышленности используют ее цельную. Называется мишметалл, содержит в себе 40-45 % Се и другие редкоземельные металлы. Такими смешанными сплавами считают дидим (сплав в основе которого неодим и празеодим), ферроцерий (цений и железо в основе) и другие.
- Щелочноземельные металлы, они применяются только в редких особых случаях (теплоносители в атомных реакторах).
Применение металлов берет свои корни в те времена, когда еще не было металлургии, но уже применялись такие металлы, как серебро и золото, так как они встречаются в природе в чистом виде и не нужны специализированные методы и техника, чтобы их добывать. Далее начали применять такие металлы. Как олово, свинец, железо. Большая часть металлов была открыта в 19 веке. По статистике на сегодняшний день наиболее распространенный металл в металлургии — железо, благодаря его свойствам: доступная стоимость высокий уровень механических свойств, возможность массового изготовления, распространенность в природе.
Виды цветных металлов
Цветные металлы также используются в металлургической промышленности.
Разделяют цветные металлы на три основных вида:
- Легкие металлы, главной характеристикой которых является низкий уровень плотности. Сюда относят магний, бериллий, алюминий. Изделия из таких металлов обладают значительно меньшей массой, чем, например, изделия черного металла.
- Благородные (дорогие) металлы
- Легкоплавкие металлы — кадмий, цинк, ртуть, олово, свинец, сурьма, галлий и т.д.
Характеристика механических свойств металлов
Очень важный момент в использовании какого-либо вида металла в производстве, это его механические свойства. Под этими характеристиками подразумевается поведение металла под действием приложенных внешних механических сил. К ним относят:
- Сопротивление металла деформации;
- Пластичность;
- Вязкость;
- Температуростойкость;
- Способность не разрушаться при наличии трещин.
При оценке механических свойств металла существуют критерии, которые делятся на группы:
- Критерии, определяемые вне зависимости от конструктивных особенностей и характера службы изделия. Оценку по таким критериям проводят путем растяжения, сжатия, изгиба металла, а также его твердости и ударного изгиба с надрезом.
- Критерии конструктивной прочности металлических материалов, которые находятся в наибольшей корреляции со служебными свойствами данного изделия, характеризуют работоспособность материала в условиях эксплуатации. К таким критериям относят надежность металла, а именно вязкость, долговечность и т.д. Испытывают металл статистическими и динамическими методами. Важный момент, это сопротивление к разрушению при присутствии трещин, так как они под нагрузкой на металл, сильно меняют его поведение, так как являются концентраторами напряжения. Также к критериям данного типа относятся свойства, которые напрямую влияют на долговечность металла — сопротивляемость к коррозиям, износостойкость, прочность и т.д.
- Критерии оценки прочности конструкции в целом. При этих испытаниях выясняется степень влияния на металл напряжений, дефектов, а также технологий изготовления из металла изделия.
Для характеристик металла важны все этапы проверки его по критериям, так как в основном во всех видах производства и строительства на металл возлагается главная задача, и материал не должен поддаваться деформациям м коррозиям.
Изделия металлопроката применяются во всех видах производственной деятельности: в машиностроении, легкой промышленности, строительстве, мебельной промышленности, судостроении, авиастроении и т.д.
Купить качественный металлопрокат вы можете у нас, Металлобаза «УМП» предлагает широкий ассортимент металлопроката по доступной цене и на выгодных условиях. Также мы предоставляем услуги доставки, удобной для вас, и услуги порезки, которая совершается по современным технологиям с профессиональным подходом.
Общая характеристика металлов | Подготовка к ЦТ и ЕГЭ по химии
В природе металлы существуют как в свободном, так и в связанном виде. В свободном виде существуют малоактивные металлы: платина, золото, серебро. Но в основном металлы встречаются в виде различных соединений. Многие металлы способны реагировать друг с другом. Продукты взаимодействия металлов между собой называются сплавами.
Атомы металлов имеют небольшое число валентных электронов. Они слабо связаны с ядром и могут легко отрываться от него. В результате в узлах кристаллической решетки появляются положительно заряженные ионы, а между ними свободно перемещаются электроны – образуется так называемый «электронный газ». Вид связи между положительными ионами, осуществляемой за счет притяжения электронов, свободно перемещающихся по кристаллу, называется металлической.
Металлы имеют многие специфические свойства. Все они, за исключением ртути, при обычных условиях твердые вещества с характерным блеском, хорошо проводят электрический ток и тепло. Большинство металлов может коваться, тянуться и прокатываться. Электро- и теплопроводность металла объясняются наличием в нем свободных электронов.
Металлы делятся на легкие и тяжелые, отличаются друг от друга по твердости: самые мягкие – щелочные, их можно резать ножом; самый твердый – хром. Металлы делятся на легкоплавкие и тугоплавкие. В металлургии металлы делят на черные (железо, марганец, хром) и цветные (все остальные металлы).
Металлы всегда выступают в роли восстановителей. Способность отдавать электроны проявляется у металлов в разной степени. Чем легче металл отдает электроны, тем он активнее и тем более энергично взаимодействует с неметаллами и ионами других металлов. По активности все металлы располагаются в определенной последовательности, образуя электрохимический ряд напряжений.
Практически все металлы имеют сравнительно большие радиусы и малое число электронов (от 1 до 3) на внешнем энергетическом уровне. Для металлов характерны низкие значения электроотрицательности и восстановительные свойства.
Наиболее типичные металлы расположены в начале периодов (начиная со второго), далее слева направо металлические свойства ослабевают. В группе сверху вниз металлические свойства усиливаются, т.к увеличивается радиус атомов (за счет увеличения числа энергетических уровней). Это приводит к уменьшению электроотрицательности (способности притягивать электроны) элементов и усилению восстановительных свойств (способность отдавать электроны другим атомам в химических реакциях).
Типичными металлами являются s-элементы (элементы IА-группы от Li до Fr. элементы ПА-группы от Мg до Rа). Общая электронная формула их атомов ns1-2. Для них характерны степени окисления + I и +II соответственно.
Небольшое число электронов (1-2) на внешнем энергетическом уровне атомов типичных металлов предполагает легкую потерю этих электронов и проявление сильных восстановительных свойств, что отражают низкие значения электроотрицательности. Отсюда вытекает ограниченность химических свойств и способов получения типичных металлов.
Характерной особенностью типичных металлов является стремление их атомов образовывать катионы и ионные химические связи с атомами неметаллов. Соединения типичных металлов с неметаллами – это ионные кристаллы «катион металлаанион неметалла», например К+ Вг–, Сa2+ О2-. Катионы типичных металлов входят также в состав соединений со сложными анионами – гидроксидов и солей, например Мg2+(OН–)2, (Li+)2СO32-.
Металлы А-групп, образующие диагональ амфотерности в Периодической системе Ве-Аl-Gе-Sb-Ро, а также примыкающие к ним металлы (Gа, In, Тl, Sn, Рb, Вi) не проявляют типично металлических свойств. Общая электронная формула их атомов ns2np0-4 предполагает большее разнообразие степеней окисления, большую способность удерживать собственные электроны, постепенное понижение их восстановительной способности и появление окислительной способности, особенно в высоких степенях окисления (характерные примеры – соединения Тl III, РbIV, Вiv). Подобное химическое поведение характерно и для большинства (d-элементов, т. е. элементов Б-групп Периодической системы (типичные примеры – амфотерные элементы Сr и Zn).
Это проявление двойственности (амфотерности) свойств, одновременно металлических (основных) и неметаллических, обусловлено характером химической связи. В твердом состоянии соединения нетипичных металлов с неметаллами содержат преимущественно ковалентные связи (но менее прочные, чем связи между неметаллами). В растворе эти связи легко разрываются, а соединения диссоциируют на ионы (полностью или частично). Например, металл галлий состоит из молекул Ga2, в твердом состоянии хлориды алюминия и ртути (II) АlСl3 и НgСl2 содержат сильно ковалентные связи, но в растворе АlСl3 диссоциирует почти полностью, а НgСl2 – в очень малой степени (да и то на ионы НgСl+ и Сl–).
7.6: Металлы, неметаллы и металлоиды
- Последнее обновление
- Сохранить как PDF
- Металлы
- Физические свойства металлов
- Химические свойства металлов
- Неметаллы
- Физические свойства неметаллов
- Химические свойства неметаллов
- Металлоиды
- Тенденции изменения металлических и неметаллических характеристик Атрибуция
Цели обучения
- Чтобы понять основные свойства, отделяющие металлы от неметаллов и металлоидов
Элемент — это простейшая форма материи, которую невозможно разделить на более простые вещества или построить из более простых веществ обычными химическими или физическими методами.Нам известно 118 элементов, из которых 92 встречаются в природе, а остальные были приготовлены искусственно. Элементы далее классифицируются на металлы, неметаллы и металлоиды на основе их свойств, которые коррелируют с их размещением в периодической таблице.
| Металлические элементы | Неметаллические элементы |
|---|---|
| Отличительный блеск (блеск) | Бесцветный, разные цвета |
| Ковкий и пластичный (гибкий) в твердом виде | Хрупкое, твердое или мягкое |
| Проводить тепло и электричество | Плохие проводники |
| Оксиды металлов основные, ионные | Неметаллические оксиды кислотные, ковалентные |
| Образует катионы в водном растворе | Образует анионы, оксианионы в водном растворе |
Металлы
За исключением водорода, все элементы, которые образуют положительные ионы, теряя электроны во время химических реакций, называются металлами.Таким образом, металлы являются электроположительными элементами с относительно низкой энергией ионизации. Они отличаются ярким блеском, твердостью, способностью резонировать со звуком и отлично проводят тепло и электричество. В нормальных условиях металлы являются твердыми телами, за исключением ртути.
Физические свойства металлов
Металлы блестящие, пластичные, пластичные, хорошо проводят тепло и электричество. Другие свойства включают:
- Состояние : Металлы представляют собой твердые вещества при комнатной температуре, за исключением ртути, которая находится в жидком состоянии при комнатной температуре (в жаркие дни галлий находится в жидком состоянии).
- Блеск : Металлы обладают свойством отражать свет от своей поверхности и могут быть отполированы, например, золотом, серебром и медью.
- Ковкость: Металлы обладают способностью выдерживать удары молотком и из них могут быть изготовлены тонкие листы, известные как фольга. Например, кусок золота размером с кубик сахара можно растолочь в тонкий лист, которым будет покрываться футбольное поле.
- Пластичность: Металлы можно втягивать в проволоку. Например, из 100 г серебра можно натянуть тонкую проволоку длиной около 200 метров.
- Твердость: Все металлы твердые, кроме натрия и калия, которые мягкие и поддаются резке ножом.
- Валентность: Металлы обычно имеют от 1 до 3 электронов на внешней оболочке их атомов.
- Проводимость : Металлы являются хорошими проводниками, потому что у них есть свободные электроны. Серебро и медь — два лучших проводника тепла и электричества. Свинец — самый плохой проводник тепла. Висмут, ртуть и железо также являются плохими проводниками
- Плотность : Металлы имеют высокую плотность и очень тяжелые.Иридий и осмий имеют самую высокую плотность, тогда как литий имеет самую низкую плотность.
- Точки плавления и кипения : Металлы имеют высокие температуры плавления и кипения. Вольфрам имеет самые высокие температуры плавления и кипения, а ртуть — самые низкие. Натрий и калий также имеют низкие температуры плавления.
Химические свойства металлов
Металлы — это электроположительные элементы, которые обычно образуют основных или амфотерных оксидов с кислородом.Другие химические свойства включают:
- Электроположительный характер : Металлы имеют тенденцию к низкой энергии ионизации, и обычно теряют электроны (т.е. окисляются ), когда они подвергаются химическим реакциям реакции Обычно они не принимают электроны. Например:
- Щелочные металлы всегда 1 + (теряют электрон в s подоболочке)
- Щелочноземельные металлы всегда 2 + (теряют оба электрона в подоболочке с )
- Ионы переходных металлов не следуют очевидной схеме, 2 + является обычным (теряют оба электрона в подоболочке s ), и также наблюдаются 1 + и 3 +
\ [\ ce {Na ^ 0 \ rightarrow Na ^ + + e ^ {-}} \ label {1.{-}} \ label {1.3} \ nonumber \]
Соединения металлов с неметаллами имеют тенденцию быть ионными по природе. Большинство оксидов металлов являются основными оксидами и растворяются в воде с образованием гидроксидов металлов :
\ [\ ce {Na2O (s) + h3O (l) \ rightarrow 2NaOH (aq)} \ label {1.4} \ nonumber \]
\ [\ ce {CaO (s) + h3O (l) \ rightarrow Ca (OH) 2 (aq)} \ label {1.5} \ nonumber \]
Оксиды металлов проявляют свою основную химическую природу, реагируя с кислотами с образованием солей металла и воды:
\ [\ ce {MgO (s) + HCl (водн.) \ Rightarrow MgCl2 (водн.) + H3O (l)} \ label {1.{2 -} \), следовательно, \ (Al_2O_3 \).
Пример \ (\ PageIndex {2} \)
Вы ожидаете, что он будет твердым, жидким или газообразным при комнатной температуре?
Решения
Оксиды металлов обычно твердые при комнатной температуре
Пример \ (\ PageIndex {3} \)
Напишите вычисленное химическое уравнение реакции оксида алюминия с азотной кислотой:
Решение
Оксид металла + кислота -> соль + вода
\ [\ ce {Al2O3 (s) + 6HNO3 (вод.) \ Rightarrow 2Al (NO3) 3 (вод.) + 3h3O (l)} \ nonumber \]
Неметаллы
Элементы, которые стремятся получить электроны с образованием анионов в ходе химических реакций, называются неметаллами.Это электроотрицательные элементы с высокими энергиями ионизации. Они не блестящие, хрупкие и плохо проводят тепло и электричество (кроме графита). Неметаллы могут быть газами, жидкостями или твердыми телами.
Физические свойства неметаллов
- Физическое состояние : Большинство неметаллов существует в двух из трех состояний вещества при комнатной температуре: газах (кислород) и твердых телах (углерод). Только бром существует в жидком виде при комнатной температуре.
- Неэластичный и ковкий : Неметаллы очень хрупкие, их нельзя свернуть в проволоку или растолочь в листы.
- Проводимость : Они плохо проводят тепло и электричество.
- Блеск: Они не имеют металлического блеска и не отражают свет.
- Точки плавления и кипения : Точки плавления неметаллов на , как правило, на ниже, чем у металлов, но сильно варьируются.
- Семь неметаллов существуют при стандартных условиях в виде двухатомных молекул : \ (\ ce {h3 (g)} \), \ (\ ce {N2 (g)} \), \ (\ ce {O2 (g) } \), \ (\ ce {F2 (g)} \), \ (\ ce {Cl2 (g)} \), \ (\ ce {Br2 (l)} \), \ (\ ce {I2 ( s)} \).
Химические свойства неметаллов
Неметаллы имеют тенденцию получать электроны или делиться электронами с другими атомами. Они имеют электроотрицательный характер. Неметаллы, вступая в реакцию с металлами, имеют тенденцию приобретать электроны (обычно , достигая электронной конфигурации благородного газа) и становятся анионами :
\ [\ ce {3Br2 (l) + 2Al (s) \ rightarrow 2AlBr3 (s)} \ nonumber \]
Соединения, полностью состоящие из неметаллов, являются ковалентными веществами.Обычно они образуют кислые или нейтральные оксиды с кислородом, которые растворяются в воде с образованием кислот:
\ [\ ce {CO2 (г) + h3O (l)} \ rightarrow \ underset {\ text {углекислота}} {\ ce {h3CO3 (aq)}} \ nonumber \]
Как вы, возможно, знаете, газированная вода имеет слабокислый характер (угольная кислота).
Оксиды неметаллов могут соединяться с основаниями с образованием солей.
\ [\ ce {CO2 (г) + 2NaOH (водн.) \ Rightarrow Na2CO3 (водн.) + H3O (l)} \ nonumber \]
Металлоиды
Металлоиды обладают промежуточными свойствами между металлами и неметаллами.Металлоиды используются в полупроводниковой промышленности. Все металлоиды твердые при комнатной температуре. Они могут образовывать сплавы с другими металлами. Некоторые металлоиды, такие как кремний и германий, при определенных условиях могут действовать как электрические проводники, поэтому их называют полупроводниками. Кремний, например, выглядит блестящим, но не является ни ковким, ни пластичным ( хрупкий, — характеристика некоторых неметаллов). Это гораздо более слабый проводник тепла и электричества, чем металлы.Физические свойства металлоидов, как правило, металлические, но их химические свойства, как правило, неметаллические. Степень окисления элемента в этой группе может колебаться от +5 до -2, в зависимости от группы, в которой он находится.
| Металлы | Неметаллы | Металлоиды |
|---|---|---|
| Золото | Кислород | Кремний |
| Серебро | Углерод | Бор |
| Медь | Водород | Мышьяк |
| Утюг | Азот | Сурьма |
| Меркурий | Сера | Германий |
| цинк | фосфор |
Тенденции в металлическом и неметаллическом характере
Металлический характер является наиболее сильным для элементов в самой левой части периодической таблицы и имеет тенденцию к уменьшению при движении вправо в любой период (неметаллический характер усиливается с увеличением значений электроотрицательности и энергии ионизации).Внутри любой группы элементов (столбцов) металлический характер увеличивается сверху вниз (значения электроотрицательности и энергии ионизации обычно уменьшаются по мере продвижения вниз по группе). Эта общая тенденция не обязательно наблюдается с переходными металлами.
Авторы и ссылки
Свойства и тенденции металлического характера
Не все металлические элементы одинаковы, но все они обладают определенными качествами. Здесь вы найдете, что подразумевается под металлическим характером элемента и как изменяется металлический характер при перемещении по периоду или группе вниз в периодической таблице.
Ключевые выводы: металлический персонаж
- Металлический знак — это набор свойств, связанных с металлами.
- Эти свойства включают металлический блеск, образование катионов, высокую электрическую и теплопроводность и пластичность.
- Металлический символ — это тренд таблицы Менделеева. Элементы с наиболее металлическим характером находятся в левой части таблицы Менделеева (кроме водорода).
- Франций — элемент с наивысшим металлическим характером.
Что такое металлический характер?
Металлический символ — это название, данное набору химических свойств, связанных с элементами, являющимися металлами. Эти химические свойства являются результатом того, насколько легко металлы теряют свои электроны с образованием катионов (положительно заряженных ионов).
Физические свойства, связанные с металлическим характером, включают металлический блеск, блестящий вид, высокую плотность, высокую теплопроводность и высокую электропроводность. Большинство металлов ковкие и пластичные, их можно деформировать без разрушения.Многие металлы твердые и плотные.
Металлы отображают диапазон значений этих свойств, даже для элементов, которые считаются сильно металлическими. Например, ртуть при комнатной температуре представляет собой жидкость, а не твердое твердое вещество. Он также имеет более низкое значение электропроводности, чем другие металлы. Некоторые благородные металлы скорее хрупкие, чем податливые. В то же время эти металлы по-прежнему блестят и имеют металлический вид, а также образуют катионы.
Металлический характер и тенденции в таблице Менделеева
По мере продвижения по таблице Менделеева и вниз по таблице Менделеева появляются тенденции в металлическом характере.Металлический характер уменьшается по мере того, как вы перемещаетесь по периоду в периодической таблице слева направо. Это происходит потому, что атомы с большей готовностью принимают электроны для заполнения валентной оболочки, чем теряют их, удаляя незаполненную оболочку.
Металлический характер увеличивается по мере того, как вы перемещаетесь вниз по группе элементов в периодической таблице. Это связано с тем, что электроны становится легче терять по мере увеличения атомного радиуса, когда между ядром и валентными электронами меньше притяжения из-за увеличения расстояния между ними.
Распознавание элементов с металлическими символами
Вы можете использовать периодическую таблицу, чтобы предсказать, будет ли элемент отображать металлический характер, даже если вы ничего о нем не знаете. Вот что вам нужно знать:
- Металлический характер отображается с помощью металлов, которые находятся в левой части таблицы Менделеева. Исключение составляет водород, который в обычных условиях не является металлом. Даже водород ведет себя как металл в жидком или твердом состоянии, но для большинства целей его следует рассматривать как неметаллический.
- Элементы с металлическим характером встречаются в определенных группах или столбцах элементов, включая щелочные металлы, щелочноземельные металлы, переходные металлы (включая лантаноиды и актиниды, расположенные ниже основной части таблицы Менделеева) и основные металлы. Другие категории металлов включают цветные металлы, благородные металлы, черные металлы, тяжелые металлы и драгоценные металлы. Металлоиды обладают металлическим характером, но эта группа элементов также обладает неметаллическими свойствами.
Примеры элементов с металлическими символами
К металлам, которые хорошо проявляют свой характер, относятся:
- франций (элемент с наивысшим металлическим характером)
- цезий (следующий высший уровень металлического характера)
- натрия
- медь
- серебро
- утюг
- золото
- алюминий
Сплавы и металлические свойства
Хотя термин металлический символ обычно применяется к чистым элементам, сплавы также могут иметь металлический характер.Например, бронза и большинство сплавов меди, магния, алюминия и титана обычно обладают высокой металличностью. Некоторые металлические сплавы состоят исключительно из металлов, но большинство из них также содержат металлоиды и неметаллы, но сохраняют свойства металлов.
Источники
- Кокс П. А. (1997). Элементы: их происхождение, распространенность и распространение . Издательство Оксфордского университета, Оксфорд. ISBN 978-0-19-855298-7.
- Доу, Мюррей С.; Фойлз, Стивен М .; Баскес, Майкл I. (1993). «Метод погруженного атома: обзор теории и приложений». Отчеты по материаловедению . 9 (7–8): 251–310. DOI: 10.1016 / 0920-2307 (93)-U
- Хофманн, С. (2002). За пределами урана: путешествие к концу периодической таблицы . Тейлор и Фрэнсис, Лондон. ISBN 978-0-415-28495-0.
- Рассел А. М. и К. Л. Ли (2005) Взаимосвязи структуры и свойств в цветных металлах .John Wiley & Sons, Хобокен, Нью-Джерси. ISBN 978-0-471-64952-6.
- Tylecote, R.F. (1992). История металлургии (2-е изд.). Лондон: Maney Publishing. Институт материалов. ISBN 978-1- 3-79-2.
металла | Определение, характеристики, типы и факты
Металл , любой из класса веществ, характеризующихся высокой электрической и теплопроводностью, а также пластичностью, пластичностью и высокой отражательной способностью света.
Британская викторина
27 правильных или ложных вопросов из самых сложных викторин «Британника»
Что вы знаете о Марсе? Как насчет энергии? Думаете, будет проще, если вам придется выбирать только истину или ложь? Узнайте, что вы знаете о науке, с помощью этой сложной викторины.
Примерно три четверти всех известных химических элементов — металлы.Наиболее распространенными разновидностями в земной коре являются алюминий, железо, кальций, натрий, калий и магний. Подавляющее большинство металлов содержится в рудах (минеральных веществах), но некоторые из них, такие как медь, золото, платина и серебро, часто встречаются в свободном состоянии, поскольку они не вступают в реакцию с другими элементами.
Металлы обычно представляют собой твердые кристаллические вещества. В большинстве случаев они имеют относительно простую кристаллическую структуру, отличающуюся плотной упаковкой атомов и высокой степенью симметрии.Обычно атомы металлов содержат менее половины полного набора электронов в своей внешней оболочке. Из-за этой характеристики металлы не склонны образовывать соединения друг с другом. Однако они легче соединяются с неметаллами (например, кислородом и серой), которые обычно имеют более половины максимального количества валентных электронов. Металлы сильно различаются по своей химической активности. Наиболее реакционноспособными являются литий, калий и радий, тогда как низкоактивными являются золото, серебро, палладий и платина.
Высокая электрическая и теплопроводность простых металлов (т.е. непереходных металлов периодической таблицы) лучше всего объясняется с помощью теории свободных электронов. Согласно этой концепции, отдельные атомы в таких металлах потеряли свои валентные электроны в твердом теле, и эти свободные электроны, которые вызывают проводимость, перемещаются как группа по всему твердому телу. В случае более сложных металлов (т.е. переходных элементов) проводимость лучше объясняется зонной теорией, которая учитывает не только наличие свободных электронов, но и их взаимодействие с так называемыми d электронами.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчасМеханические свойства металлов, такие как твердость, способность противостоять повторяющимся нагрузкам (усталостная прочность), пластичность и пластичность, часто связывают с дефектами или несовершенствами их кристаллической структуры. Например, отсутствие слоя атомов в его плотноупакованной структуре позволяет металлу пластически деформироваться и предотвращает его хрупкость.
Свойства металлов Урок
Для большинства людей металл — это другое слово, обозначающее железо, сталь или подобное твердое блестящее вещество.
Но соответствует ли это определение истинным свойствам металлов?
Да… и нет.
Прежде чем мы объясним, вы должны знать, что большинство элементов в периодической таблице — металлы.
Металлы находятся в центре и в левой части таблицы Менделеева. Их можно дополнительно классифицировать как щелочные металлы, щелочноземельные металлы, переходные металлы и основные металлы.
Урок по науке о металлах
Свойства металлов
Элемент — это вещество, состоящее из одного вида атомов; его нельзя разделить на более простые части.Например, элемент гелий (вспомните воздушные шары) состоит исключительно из атомов гелия.
Элементы обычно классифицируются как металлы или неметаллы (хотя некоторые элементы имеют характеристики обоих; они называются металлоидами ).
Три свойства металлов:
- Блеск: Металлы блестят при резке, царапинах или полировке.
- Ковкость: Металлы прочные, но податливые, а это значит, что их можно легко согнуть или придать им форму.На протяжении веков кузнецы могли формировать металлические предметы, нагревая металл и ударяя по нему молотком. Если бы они попробовали это с неметаллами, материал бы лопнул! Большинство металлов также пластичные , что означает, что их можно вытягивать для изготовления проволоки.
- Электропроводность: Металлы отлично проводят электричество и тепло. Поскольку они также пластичны, они идеально подходят для электропроводки. (Вы можете проверить это, используя некоторые предметы домашнего обихода. Продолжайте читать, чтобы узнать, как это сделать!)
Дополнительные свойства металлов
Высокая температура плавления : Большинство металлов имеют высокие температуры плавления, и все, кроме ртути, являются твердыми при комнатной температуре.
Звонкий : Металлы часто издают звенящий звук при ударе.
Реакционная способность : Некоторые металлы подвергаются химическому изменению (реакции) сами по себе или с другими элементами и выделяют энергию. Эти металлы никогда не встречаются в чистом виде, и их трудно отделить от минералов, в которых они содержатся. Калий и натрий являются наиболее химически активными металлами. Они бурно реагируют с воздухом и водой; калий воспламеняется при контакте с водой!
Другие металлы вообще не вступают в реакцию с другими металлами.Это означает, что их можно найти в чистом виде (например, золото и платина). Поскольку медь относительно недорога и имеет низкую реакционную способность, ее можно использовать для изготовления труб и проводки.
Пять групп металлов:
Благородные металлы обнаруживаются как чистые металлы, потому что они не вступают в реакцию и не соединяются с другими элементами с образованием соединений. Поскольку они не реагируют, они не подвержены коррозии. Это делает их идеальными для украшений и монет. Благородные металлы включают медь, палладий, серебро, платину и золото.
Щелочные металлы очень реактивны. Они имеют низкую температуру плавления и достаточно мягкие, чтобы их можно было разрезать ножом. Калий и натрий — два щелочных металла.
Щелочноземельные металлы находятся в соединениях с множеством различных минералов. Они менее химически активны, чем щелочные металлы, а также тверже и имеют более высокие температуры плавления. В эту группу входят кальций, магний и барий.
Переходные металлы — это то, о чем мы обычно думаем, когда думаем о металлах.Они твердые и блестящие, прочные и легко поддаются форме. Они используются во многих промышленных целях. В эту группу входят железо, золото, серебро, хром, никель и медь, некоторые из которых также являются благородными металлами.
Poor Metals довольно мягкие, и большинство из них не используются сами по себе. Однако они становятся очень полезными при добавлении к другим веществам. Бедные металлы включают алюминий, галлий, олово, таллий, сурьму и висмут.
Сплавы: сильные комбинации
Свойства этих разных металлов можно комбинировать, смешивая два или более из них вместе.Полученное вещество называется сплавом . Некоторые из наших самых полезных строительных материалов на самом деле являются сплавами. Сталь, например, представляет собой смесь железа и небольшого количества углерода и других элементов; комбинация, которая одновременно сильна и проста в использовании. (Добавьте хром, и вы получите нержавеющую сталь. Проверьте свои кухонные кастрюли и сковороды, чтобы узнать, сколько из них сделано из нержавеющей стали!)
Другие сплавы, такие как латунь (медь и цинк) и бронза (медь и олово), легко формуются и красивы.Бронза также часто используется в судостроении, поскольку она устойчива к коррозии в морской воде.
Титан намного легче и менее плотный, чем сталь, но такой же прочный; и хотя он тяжелее алюминия, он вдвое прочнее. Кроме того, он очень устойчив к коррозии. Все эти факторы делают его отличным сплавом. Титановые сплавы используются в самолетах, кораблях и космических кораблях, а также в красках, велосипедах и даже портативных компьютерах!
Золото, как чистый металл, настолько мягкое, что при изготовлении ювелирных изделий оно всегда смешивается с другим металлом (обычно серебром, медью или цинком).Чистота золота измеряется в карат . Самое чистое, что вы можете получить в ювелирных изделиях, — это 24 карата, что составляет около 99,7% чистого золота. Золото также можно смешивать с другими металлами, чтобы изменить его цвет; белое золото, которое популярно в ювелирных изделиях, представляет собой сплав золота и платины или палладия.
Металл из руды
Руды — это горные породы или минералы, из которых можно извлечь ценное вещество — обычно металл. Некоторые распространенные руды включают галенит (свинцовая руда), борнит и малахит (медь), киноварь (ртуть) и боксит (алюминий).Наиболее распространенными железными рудами являются магнетит и гематит (минерал ржавого цвета, образованный железом и кислородом), которые содержат около 70% железа.
Существует несколько процессов переработки железа из руды. Более старый процесс заключается в сжигании железной руды с использованием древесного угля (углерода) и кислорода с помощью сильфонов. Углерод и кислород, включая кислород в руде, соединяются и покидают железо. Однако железо не нагревается до полного расплавления и содержит силикаты, оставшиеся от руды.Его можно нагреть и выковать из кованого железа .
В более современном процессе используется доменная печь для нагрева железной руды, известняка и кокса (угольный продукт, а не безалкогольный напиток). В результате реакции происходит отделение железа от кислорода в руде. Этот «чугун» необходимо дополнительно перемешать, чтобы получить кованое железо. Его также можно использовать для другой важной цели: при нагревании углеродом и другими элементами он становится более прочным металлом, называемым сталью .
Учитывая этот процесс, неудивительно, что железо не использовалось примерно до 1500 г. до н.э. Но некоторые чистые металлы — золото, серебро и медь — использовались и раньше, а легированная бронза, как полагают, была открыта шумерами около 3500 г. до н.э. Но алюминий, один из важнейших металлов в современном мире, не был открыт до 1825 года нашей эры и не использовался широко до 20 века!
Коррозия: процесс и предотвращение
Вы когда-нибудь видели кусок серебра, который потерял свой блеск, или железо с красноватой ржавчиной на нем или даже с дырами в результате коррозии? Это происходит, когда кислород (обычно из воздуха) вступает в реакцию с металлом.Металлы с более высокой реакционной способностью (например, магний, алюминий, железо, цинк и олово) гораздо более склонны к такому виду химического разрушения или коррозии .
Когда кислород вступает в реакцию с металлом, он образует оксид на поверхности металла. Для некоторых металлов, например алюминия, это хорошо. Оксид образует защитный слой, предохраняющий металл от дальнейшей коррозии.
С другой стороны, у чугуна и стали возникнут серьезные проблемы, если их не обработать для предотвращения коррозии.Красноватый оксидный слой, который образуется на железе или стали при реакции с кислородом, называется ржавчиной . Слой ржавчины постоянно отслаивается, подвергая большую часть металла коррозии, пока металл в конечном итоге не проедает.
Один из распространенных способов защиты железа — это покрытие его специальной краской, которая препятствует взаимодействию кислорода с металлом под краской. Другой метод — цинкование : в этом процессе сталь покрывается цинком. Кислород, молекулы воды и углекислый газ в воздухе вступают в реакцию с цинком, образуя слой карбоната цинка, который защищает от коррозии.Посмотрите вокруг своего дома, двора и гаража, чтобы найти примеры коррозии, а также гальванизации и других средств защиты металла от ржавчины.
Технологии: фейерверки и химия
Если вы посмотрите фейерверк Четвертого июля, то увидите прекрасные сочетания цветов и искр.
Как работает этот удивительный пиротехнический дисплей? Короткий ответ — химия. Более длинный включает в себя повторение свойств металлов.
Одним из ключевых ингредиентов петард, наземных и воздушных фейерверков (взрывающихся в небе) является черный порошок , изобретенный китайцами около 1000 лет назад.Это смесь нитрата калия (селитры), древесного угля и серы в соотношении 75:15:10. Черный порох используется для запуска антенн, а также вызывает взрывы, необходимые для создания специальных эффектов, таких как шум или цветной свет.
В бенгальских огнях черный порошок смешивают с металлическими порошками и другими химическими соединениями в форме, которая будет гореть медленно, сверху вниз. В простых ракетах-фейерверках черный порох заключен в трубку вокруг взрывателя. При зажигании порошок создает силу, которая приводит к равной и противоположной реакции, отталкивая фейерверк от земли, а затем заставляя соединения внутри него взорваться в воздухе.
Более сложные снаряды для фейерверков запускаются из миномета, трубы с черным порохом, которая при зажигании вызывает реакцию взрыва. Запал фейерверк-снаряда загорается, когда он поднимается в воздух, и в нужный момент взрыв внутри снаряда заставляет его заряды со специальными эффектами взорваться.
Яркая, красочная часть фейерверка вызвана «возбужденными» электронами в атомах различных соединений металлов и солей. Эти соединения представляют собой маленькие шарики, называемые звезды , сделанные из того же соединения, что и бенгальский огонь.
Металлы как красители
Различные металлы горят разными цветами; например, если горит соединение меди, его пламя будет сине-зеленого цвета. Кальций горит красным цветом, а калий горит пурпурным. В фейерверках металлы комбинируются для создания разных цветов.
Когда звездные соединения внутри фейерверка нагреваются, возбужденные атомы излучают световую энергию. Этот свет делится на две категории: лампы накаливания и люминесценции. Накаливание — это свет, возникающий при нагревании: в фейерверках химически активные металлы, такие как алюминий и магний, при нагревании вызывают вспышку очень яркого света — иногда при температуре выше 5000 ° F!
Менее реактивные соединения не нагреваются до такой степени, что искры становятся тусклее. Люминесценция , с другой стороны, возникает из других источников и может возникать даже при низких температурах. Электроны в соединении поглощают энергию, делая их «возбужденными». Однако электроны не могут поддерживать этот высокий уровень, поэтому они возвращаются на более низкий уровень, высвобождая при этом световую энергию (фотоны).
Хлорид бария — химическое соединение, придающее фейерверкам светящийся зеленый цвет, а хлорид меди — синий. Для любого типа света важно использовать чистые ингредиенты, поскольку следы других соединений будут затемнять цвет.
Дополнительная литература по металлам:
Металлический элемент в китайской астрологии
Согласно китайской астрологии, человек, рожденный с металлическим элементом, имеет сильное присутствие в жизни. «Металлический человек» настолько амбициозен, что его часто называют внутренней прочностью стали.
Характеристики металлических элементов
Металлические годы
Чтобы узнать, металлическая ли ваша стихия, проверьте год своего рождения:
- Ян (мужской) металлический год — Любой год, заканчивающийся на 0
- Инь (женский) металлический год — Любой год, заканчивающийся на 1
Инь (женский) и ян (мужской) — это два противоположные энергии, составляющие энергию ци, которая управляет всей жизнью.Китайский зодиакальный календарь представляет собой 60-летний цикл, который разделен на циклы инь (женский) и ян (мужской), которые взаимодействуют друг с другом для создания идеального баланса энергий.
Другие характеристики
- Направление по компасу — Запад
- Регулируемая площадь тела — Дыхательная система
Совместимость с другими элементами
Как и в западной астрологии, не все элементы китайской астрологии совместимы.
Совместимые элементы
- Вода и металл — Металл — это элемент, притягивающий воду. Водная стихия привлекает богатство и деньги. И всякий раз, когда эти два элемента объединяются, они создают отличное партнерство. Оба знают, как зарабатывать деньги и как использовать возможности. Металл любит заботиться о воде и лелеять ее. С другой стороны, вода обладает чувством безопасности, которое дает металл. Вместе они могут создать династию.
- Земля и металл — Металл создан элементом земли.Эта комбинация делает отношения очень прочными. Металл зависит от земли для заземления. Металлический мужчина будет относиться к своей второй половинке как к истинному партнеру и ценит ее мнение. Принятие решений в паре методично, со всеми плюсами и минусами. Земля дает металлу безопасность домашнего очага и дома.
Несовместимые элементы
- Огонь и металл — Эти два элемента столкнутся. В большинстве случаев огонь будет преобладать над металлом, пытаясь подчинить его своей воле.Мандат Огня состоит в том, чтобы формировать и отливать металл в желаемую форму, но металл слишком упрям, чтобы позволить манипулировать собой для контроля. Эта комбинация изначально обречена.
- Дерево и металл — Древесина распиливается металлом. Из дерева можно сделать красивый предмет мебели или скульптуру, но металл легко разрушит его. В отношениях металл критически относится к дереву, а дерево быстро вызывает недовольство.
Характеристики металлических людей
Человек, рожденный под металлическим элементом, будет преследовать свои цели с единственной целью и непоколебимо уверен в себе и своей способности достичь своих целей.
Непреодолимое желание добиться успеха
Металлические люди могут преодолевать большинство препятствий и встречать проблемы лицом к лицу, и это очень хорошие качества. Такая упорная решимость может помочь им в поисках награды. Однако этот же элемент иногда может сделать их безжалостными в стремлении выполнить свою миссию. Эта потребность в вождении для достижения успеха настолько укоренилась в металлическом человеке, что существует риск, что он может стать ахиллесовой пятой. Когда такой атрибут доведен до крайности, он больше не служит силой и превращается в слабость.
упрямый
Одна из самых сильных черт, которая может быть как положительной, так и отрицательной, — это склонность металлического человека к упрямству. Это также может сделать его негибким и настроенным. Он может часто ссориться, если сознательно не пытается быть более терпимым, особенно по отношению к другим.
Самостоятельные одиночки
Вы обнаружите, что металлических людей привлекает образ жизни, который проверяет их уверенность в себе. Они находят огромное удовлетворение в преодолении непреодолимых препятствий.Для некоторых это может вызвать привыкание, поскольку они попадают в еще более сложные обстоятельства, просто чтобы доказать себе, что они могут это сделать.
Проблемы с распознаванием утерянных причин
Металлический человек часто не может распознать безнадежное дело. Это не позволяет ему увидеть правду о том, что первоначальная цель была неправильной. Заставить металлиста первым признать такую ситуацию — лишь малая часть проблемы. Остальное убеждает его отпустить это и двигаться дальше.
Для металлического человека почти невозможно признать поражение, не говоря уже о том, чтобы сдаться силе более могущественной, чем он сам.Металлический элемент требователен и неумолим. Совершенство — это идеал, но достижение цели — это высшая цель.
Счастливчик с деньгами
Металлические люди обладают прекрасным чутьем, когда дело касается денег, и они склонны накапливать материальные блага. Они могут даже казаться имеющими «прикосновение Мидаса». Это хорошо, поскольку они также обладают вкусом к роскошной жизни.
Вы часто найдете коллекцию изобразительного искусства в доме металлического человека, особенно когда речь идет о металлических скульптурах.Привязанность этого человека к своей стихии обычно отражается в типе украшений, которые он носит. Драгоценные металлы — это ценная собственность, и он не прочь похвастаться своим богатством.
Карьера
Людям из металла трудно соответствовать ожиданиям общества. Работа с девяти до пяти в крупной компании не подходит большинству металлистов. Металлисту нужно быть независимым, и он считает, что ему лучше работать самому. Этот элемент побуждает его искать рискованную карьеру, которая может включать:
- Каскадерская работа
- Военная карьера
- Летчик-испытатель
- Работа, связанная с океаном
Любая физически и умственно сложная работа привлекает металлического человека.
Знак зодиака «Жизнь с металлической стихией»
Лучший совет для всех, кто находится в отношениях со знаком зодиака металлической стихии, — дать ему много свободы и пространства для осуществления того, что он считает данным им Богом, исследовать и проверять свой характер. Если вы попытаетесь посадить металлического человека в клетку, отношения, скорее всего, потерпят неудачу.
© LoveToKnow, Corp., 2006-2021, если не указано иное. Все права защищены.
Свойства металлических и неметаллических элементов — Металлы и неметаллы — Eduqas — GCSE Chemistry (Single Science) Revision — Eduqas
Металлы расположены в левой части периодической таблицы, а неметаллы — в верно.
Физические свойства
В таблице приведены некоторые типичные свойства металлов и неметаллов.
| Металлы | Неметаллы | |
|---|---|---|
| Блестящие | Тусклые | |
| Высокие температуры плавления | Низкие температуры плавления | |
| Хорошие проводники электричества | Плохие проводники | |
| Хорошие проводники тепла | Плохие проводники тепла | |
| Высокая плотность | Низкая плотность | |
| Ковкий и пластичный | Хрупкий |
Некоторые элементы обладают нетипичными свойствами.Например:
- ртуть (металл) имеет низкую температуру плавления и существует в виде жидкости при комнатной температуре
- графит, форма углерода (неметалл), имеет высокую температуру кипения и также является хорошим проводником. электричества
Вещество с высокой плотностью означает, что оно имеет большую массу для своего размера.
Податливые вещества можно сгибать или придавать им форму без разрушения, в то время как хрупкие вещества раскалываются при сгибании или ударе.
Дуктильный означает, что вещество можно растянуть в длинную проволоку без разрывов и разрывов.
Химические свойства
Металлы и неметаллы также можно отличить по некоторым химическим свойствам.
Наиболее распространенным химическим свойством является тип оксида, который образует элемент. Металлы образуют основные оксиды, но неметаллы образуют кислые оксиды. Например, сера и углерод — неметаллы. Они реагируют с кислородом с образованием диоксида серы и диоксида углерода. Эти соединения представляют собой газы, присутствующие в воздухе и растворяющиеся в дождевой воде, делая ее кислой.
Некоторые оксиды не растворяются в воде, поэтому они не влияют на цвет индикатора, добавляемого в воду.
- Вопрос
Элемент таллий образует оксид Tl 2 O. Оксид таллия не растворяется в воде, но реагирует с кислотами с образованием солей таллия. Таллий — это металл или неметалл? Поясните свой ответ.
- Показать ответ
Таллий — это металл. Это потому, что оксид таллия реагирует с кислотами, поэтому должен быть основанием.Только металлы образуют оксиды, являющиеся основаниями.
Металлы также более подвержены коррозии, чем неметаллы. Это означает, что неметаллы с меньшей вероятностью реагируют с водой или кислотами, чем металлы.
Общие свойства металлов | Введение в химию
Цель обучения
- Напомним общие свойства металлических элементов.
Ключевые моменты
- Электропроводность и теплопроводность металлов обусловлены тем, что их внешние электроны делокализованы.
- Металлы можно рассматривать как совокупность атомов, погруженных в море электронов, которые очень подвижны.
- Металлы обычно склонны к образованию катионов из-за потери электронов, реагируя с кислородом воздуха с образованием оксидов в различных временных масштабах: например, железо ржавеет годами, а калий горит за секунды.
- Металлы, как правило, податливы и пластичны, деформируются под нагрузкой без раскалывания, а также блестящие и блестящие.
Условия
- дуктильный Может растягиваться или растягиваться в тонкую проволоку под действием механической силы без разрушения.
- проводящий Способен проводить электрический ток или тепло.
- металл: Любой из ряда химических элементов в периодической таблице, которые образуют металлическую связь с другими атомами металлов; обычно блестящие, несколько податливые и твердые, часто проводящие тепло и электричество
Металлом может быть элемент, соединение или сплав, который является хорошим проводником как электричества, так и тепла. Примеры металлов включают золото, натрий, медь, железо и многие другие элементы. Металлы обычно податливы, пластичны и блестят.
Плотность металлов
Металлы обычно состоят из плотно упакованных атомов, что означает, что атомы расположены как плотно упакованные сферы. В металле атомы легко теряют электроны с образованием положительных ионов (катионов). Эти ионы окружены делокализованными электронами, которые ответственны за проводимость. Образовавшееся твердое тело удерживается вместе за счет электростатических взаимодействий между ионами и электронным облаком, которые называются металлическими связями.
Металлы блестящие и блестящие, с высокой плотностью.У них очень высокие температуры плавления и кипения, потому что металлические связи очень сильны, поэтому атомы не хотят распадаться на жидкость или газ.
Металлический натрий Металлический натрий достаточно мягкий, чтобы его можно было разрезать пластиковым ножом.Электропроводность металлов
Металлы в целом токопроводящие, с высокой электропроводностью и высокой теплопроводностью. Обычно они податливы и пластичны, деформируются под нагрузкой без сколов. Например, удары молотка по металлу будут «вдавливать» металл, а не разлетать его на куски.
Электропроводность и теплопроводность металлов обусловлены тем, что их внешние электроны делокализованы. Это означает, что электроны не привязаны к какому-либо одному атому, а могут свободно перемещаться по металлу. Металлы можно рассматривать как совокупность атомов, погруженных в море электронов, которые очень подвижны. Это очень способствует проводимости металла.
Море электронов «Море электронов» может свободно течь вокруг кристалла положительных ионов металлов.Металлы обычно склонны к образованию катионов за счет потери электронов. Примером может служить реакция с кислородом воздуха с образованием оксидов в различных временных масштабах (железо ржавеет годами, а калий горит за секунды). Переходные металлы (такие как железо, медь, цинк и никель) окисляются медленнее, потому что они образуют пассивирующий оксидный слой, который защищает внутреннюю часть. Другие, такие как палладий, платина и золото, вообще не вступают в реакцию с атмосферой. Некоторые металлы образуют на своей поверхности барьерный слой оксида, через который не могут проникнуть другие молекулы кислорода.В результате они сохраняют свой блестящий вид и хорошую проводимость в течение многих десятилетий (как алюминий, магний, некоторые стали и титан).
Показать источникиBoundless проверяет и курирует высококачественный контент с открытой лицензией из Интернета.

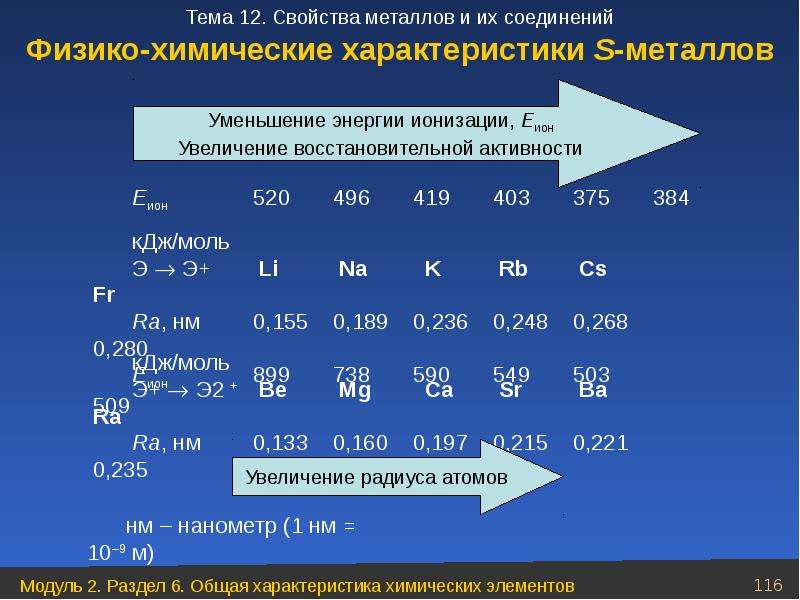 Актуализация знаний по теме.
Актуализация знаний по теме. Распределяют роли в группах. Планируют работу.
Распределяют роли в группах. Планируют работу.
 Отвечает на вопросы учащихся.
Отвечает на вопросы учащихся.