Химические свойства металлов — с чем реагируют? Свойства и таблица
Общие химические свойства металлов
Взаимодействие с неметаллами
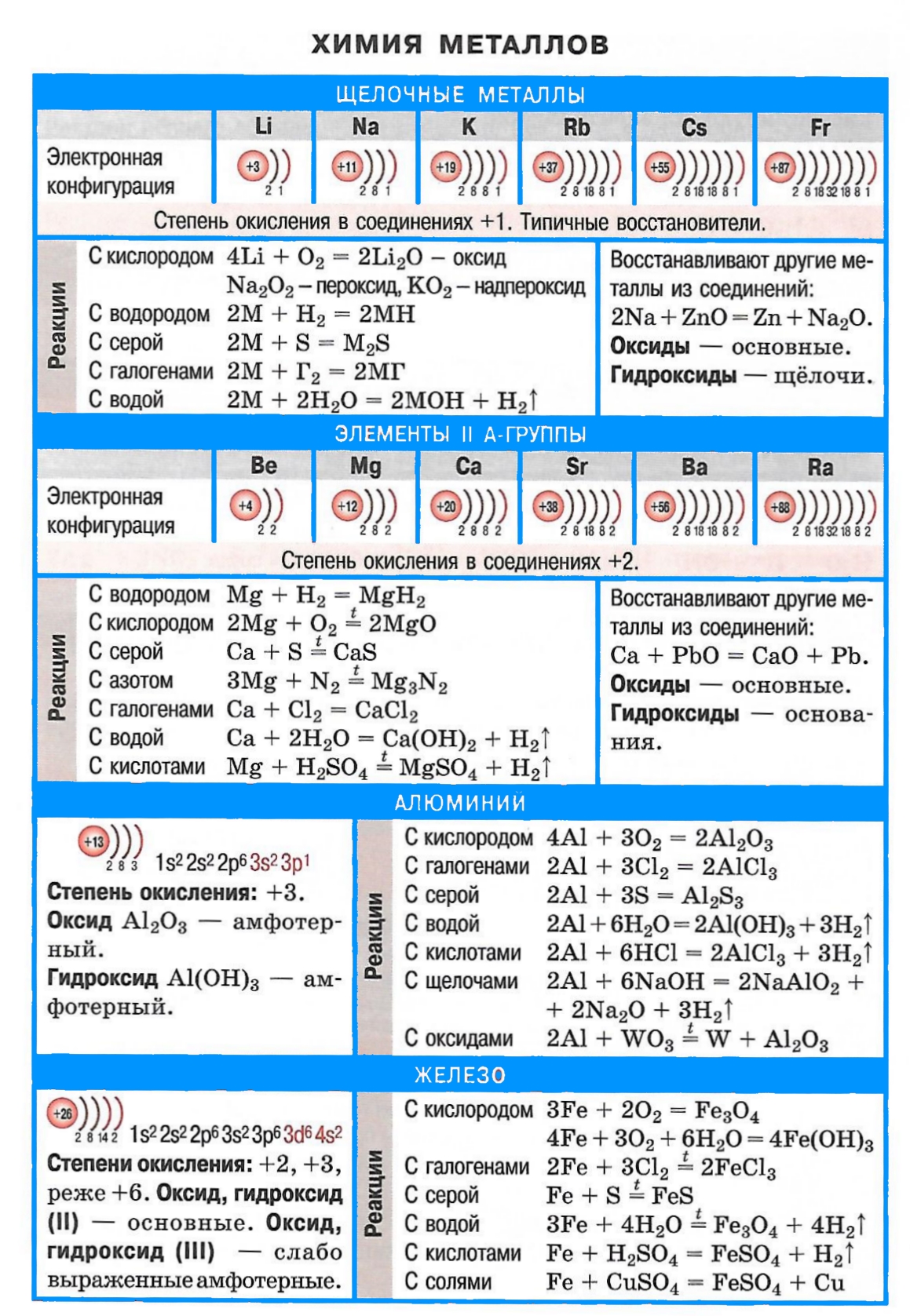
Щелочные металлы сравнительно легко реагируют с кислородом, но каждый металл проявляет свою индивидуальность:
оксид образует только литий
4Li + O2 = 2Li2O
натрий образует пероксид
2Na + O2 = Na2O2
калий, рубидий и цезий — надпероксид
K + O2 = KO2
Остальные металлы с кислородом образуют оксиды:
2Mg + O2 = 2MgO
2Al + O2 = Al2O3
2Zn + O2 = 2ZnO (при нагревании)
4Cr + 3O2 = 2Cr2O3
Металлы, которые в ряду активности расположены левее водорода, при контакте с кислородом воздуха образуют ржавчину. Например, так делает железо:
4Fe + 3O2 (воздух) + 6H2O(влага) = 4Fe(OH)3
С галогенами металлы образуют галогениды:
2Na + Cl2 = 2NaCl
Mg + Cl2 = MgCl2
2Al + 3Br2 = 2AlBr3
Zn + Cl2 =ZnCl2
2Cr + 3Cl2 = 2CrCl3
Медный порошок реагирует с хлором и бромом (в эфире):
Cu + Cl2 = CuCl2
Cu + Br2 = CuBr2
При взаимодействии с водородом образуются гидриды:
2Na + H2 = 2NaH
Ca + H2 +СaH2
Zn + H2 =ZnH2
Взаимодействие с серой приводит к образованию сульфидов (реакции протекают при нагревании):
2K + S = K2S
Сa + S = CaS
2Al + 3S = Al2S3
2Cr + 3S = Cr2S3
Cu +S = CuS
Реакции с фосфором протекают до образования фосфидов (при нагревании):
3K + P = K3P
3Mg + 2P = Mg3P2
3Zn + 2P = Zn 3P2
Основной продукт взаимодействия металла с углеродом — карбид (реакции протекают при нагревании).
Из щелочноземельных металлов с углеродом карбиды образуют литий и натрий:
2Li + 2C = Li2C2
Калий, рубидий и цезий карбиды не образуют, могут образовывать соединения включения с графитом:
Ca + 2C = CaC2
С азотом из металлов IA группы легко реагирует только литий. Реакция протекает при комнатной температуре с образованием нитрида лития:
6Li + N2 = 2Li3N
3Mg + N2 = Mg3N2
2Al + N2 = 2AlN
2Cr + N2 = 2CrN
Взаимодействие с водой
Все металлы I A и IIA группы реагируют с водой, в результате образуются растворимые основания и выделяется h3. Литий реагирует спокойно, держась на поверхности воды, натрий часто воспламеняется, а калий, рубидий и цезий реагируют со взрывом:
2Li + 2H2O = 2LiOH + H2
Ca + 2H2O = Ca(OH)2 + H2
Металлы средней активности реагируют с водой только при условии, что металл нагрет до высоких температур. Результат данной реакции — образование оксида.
Результат данной реакции — образование оксида.
Cr + H2O = Cr2O3 + H2
Zn + H2O = ZnO + H2
Неактивные металлы с водой не взаимодействуют.
Взаимодействие с кислотами
Если металл расположен в ряду активности левее водорода, то происходит вытеснение водорода из разбавленных кислот. Данное правило работает в том случае, если в реакции с кислотой образуется растворимая соль.
2Na + 2HCl = 2NaCl + H2
При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно.
Металлы IА группы:
2K + H2SO4 (раствор) = K2SO4 + H2
8K + 5H2SO4 (конц) = 4K2SO4 + H2S + 4H2O
8Na + 10HNO3 (раствор) = 8NaNO3 + NH4NO3 + 3H2O
3Na + 4HNO3 (конц) = 3NaNO3 + NO + 2H2О
Металлы IIА группы
Mg + H2SO4 (раствор) = MgSO4 + H2
4Mg + 5H2SO4 (конц) = 4MgSO4 + H2S + 4H2O
Mg+ 4HNO3 (конц) = Mg(NO3)2 + 2NO2 + 2H2O
4Mg + 10HNO3 (раствор) = 4Mg(NO3)2 + 2N2O + 5H2O
Такие металлы, как железо, хром, никель, кобальт на холоде не взаимодействуют с серной кислотой, но при нагревании реакция возможна.
Взаимодействие с солями
Металлы способны вытеснять из растворов солей другие металлы, стоящие в ряду напряжений правее, и могут быть вытеснены металлами, расположенными левее:
Zn + CuSO4 = ZnSO4 + Cu
На металлы IА и IIА группы это правило не распространяется, так как они реагируют с водой.
Реакция между металлом и солью менее активного металла возможна в том случае, если соли — как вступающие в реакцию, так и образующиеся в результате — растворимы в воде.
Взаимодействие с аммиаком
Щелочные металлы реагируют с аммиаком с образованием амида натрия:
2Li + 2NH3 = 2LiNH2 + H2
Взаимодействие с органическими веществами
Металлы IА группы реагируют со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
2Na + 2C2H5OH = 2C2H5ONa + H2
2K + 2C6H5OH = 2C6H5OK + H2Также они могут вступать в реакции с галогеналканами, галогенпроизводными аренов и другими органическими веществами.
Взаимодействие металлов с оксидами
Для металлов при высокой температуре характерно восстановление неметаллов или менее активных металлов из их оксидов.
8Al + 3Fe3O4 = 4Al2O3 + 9Fe (алюмотермия)
3Са + Cr2O3 = 3СаО + 2Cr (кальциетермия)
Вопросы для самоконтроля
С чем реагируют неактивные металлы?
С чем связаны восстановительные свойства металлов?
Верно ли утверждение, что щелочные и щелочноземельные металлы легко реагируют с водой, образуя щелочи?
Методом электронного баланса расставьте коэффициенты в уравнении реакции по схеме:
Mg + HNO3 → Mg(NO3)2 + Nh5NO3 + Н2O
Как металлы реагируют с кислотами?
Подведем итоги
От активности металлов зависит их химические свойства. Простые вещества — металлы в окислительно-восстановительных реакциях являются восстановителями. По положению металла в электрохимическом ряду можно судить о том, насколько активно он способен вступать в химические реакции (т. е. насколько сильно у металла проявляются восстановительные свойства).
е. насколько сильно у металла проявляются восстановительные свойства).
Напоследок поделимся таблицей, которая поможет запомнить, с чем реагируют металлы, и подготовиться к контрольной работе по химии.
Таблица «Химические свойства металлов»
Химические свойства металлов
Химические свойства металлов
Сегодня мы с вами изучим общие химические свойства металлов.
В реакциях металлы проявляют восстановительные свойства, то есть они отдают электроны и превращаются в положительные ионы, сами при этом окисляются.
Сначала разберём реакции металлов с простыми веществами – неметаллами.Например, с кислородом взаимодействуют практически все металлы, кроме золота и платины, при этом образуются оксиды.
Щелочные
и щелочноземельные металлы при обычной температуре легко окисляются на воздухе,
поэтому их обычно хранят в закрытых сосудах или под слоем масла.
Так, в реакции лития с кислородом воздуха образуется оксид лития, при этом литий повышает свою степень окисления с 0 до +1, а кислород понижает свою степень окисления с 0 до -2, литий является восстановителем, а кислород – окислителем, четыре атома лития отдают по одному электрону молекуле кислорода.
В реакции кальция с кислородом, кальций также повышает свою степень окисления с 0 до +2, а кислород понижает свою степень окисления с 0 до -2. Металл
Такие
металлы, как алюминий, цинк, свинец при обычной температуре реагируют с
кислородом воздуха, покрываясь тонкой плёнкой оксида, которая защищает
их от дальнейшего окисления. Слой оксида, образующегося на поверхности
алюминия, настолько тонок, что металл не теряет своего блеска. Так, в реакции алюминия
с кислородом, образуется оксид алюминия, алюминий повышает свою
степень окисления с 0 до +3, являясь при этом восстановителем, а кислород,
наоборот, понижает свою степень окисления с 0 до -2. В этой реакции четыре
атома алюминия отдают по три электрона молекуле кислорода.
Так, в реакции алюминия
с кислородом, образуется оксид алюминия, алюминий повышает свою
степень окисления с 0 до +3, являясь при этом восстановителем, а кислород,
наоборот, понижает свою степень окисления с 0 до -2. В этой реакции четыре
атома алюминия отдают по три электрона молекуле кислорода.
Многие металлы взаимодействуют с кислородом при нагревании: например, медь при нагревании на воздухе чернеет, так как покрывается плёнкой чёрного оксида меди два.
В этой реакции медь выступает в роли восстановителя и повышает свою степень окисления с 0 до +2, а кислород – окислитель, понижает свою степень окисления с 0 до -2. При этом два атома меди отдают по два электрона молекуле кислорода.
При прокаливании железа образуется железная окалина – это смешанный оксид, который состоит из оксида железа два и оксида железа три.
Железо,
в данном случае, является восстановителем, оно повышает свою степень окисления
с 0 до +2 и +4, значит, железо – это восстановитель, а кислород – окислитель,
он понижает свою степень окисления с 0 до -2. В этой реакции три атома железа
отдают восемь электронов молекуле кислорода.
В этой реакции три атома железа
отдают восемь электронов молекуле кислорода.
А вот магний при поджигании на воздухе сгорает яркой вспышкой, образуя оксид магния.
Магний также является восстановителем, потому что повышает свою степень окисления с 0 до +2, а кислород понижает свою степень окисления с 0 до -2 и является окислителем. В результате реакции образуется оксид магния, а два атома магния отдают по два электрона молекуле кислорода.
Таким образом, большинство металлов реагируют с кислородом с образованием оксидов, активные металлы вступают во взаимодействие с кислородом при обычных условиях, менее активные при нагревании, а такие, как золото или платина не реагируют с кислородом.
Металлы
в этих реакциях являются восстановителями и, соответственно, повышают свою
степень окисления, а кислород является окислителем и понижает свою степень
окисления.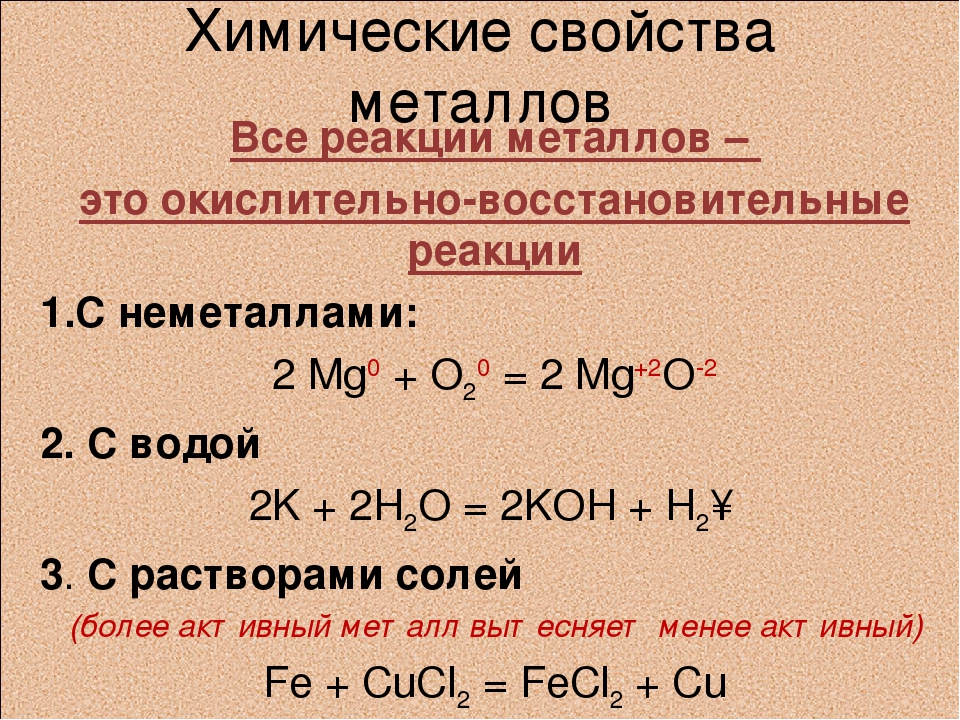
С серой все металлы, кроме золота, способны взаимодействовать при незначительном нагревании, образуя сульфиды:
В реакции натрия с серой образуется сульфид натрия, натрий повышает свою степень окисления с 0 до +2, он является восстановителем, сера является окислителем и понижает свою степень с 0 до -2. В результате взаимодействия два атома натрия отдают по одному электрону молекуле серы.
В реакции кальция с серой образуется сульфид кальция, кальций также повышает свою степень окисления с 0 до +2, являясь при этом восстановителем, а сера понижает свою степень окисления с 0 до -2 и является окислителем, при этом, каждый атом кальция отдаёт по два электрона молекуле серы.
А
в реакции железа с серой образуется сульфид железа два. Здесь
также железо является восстановителем, повышает свою степень окисления с 0 до
+2, а серя, являясь окислителем, понижает свою степень окисления с 0 до -2.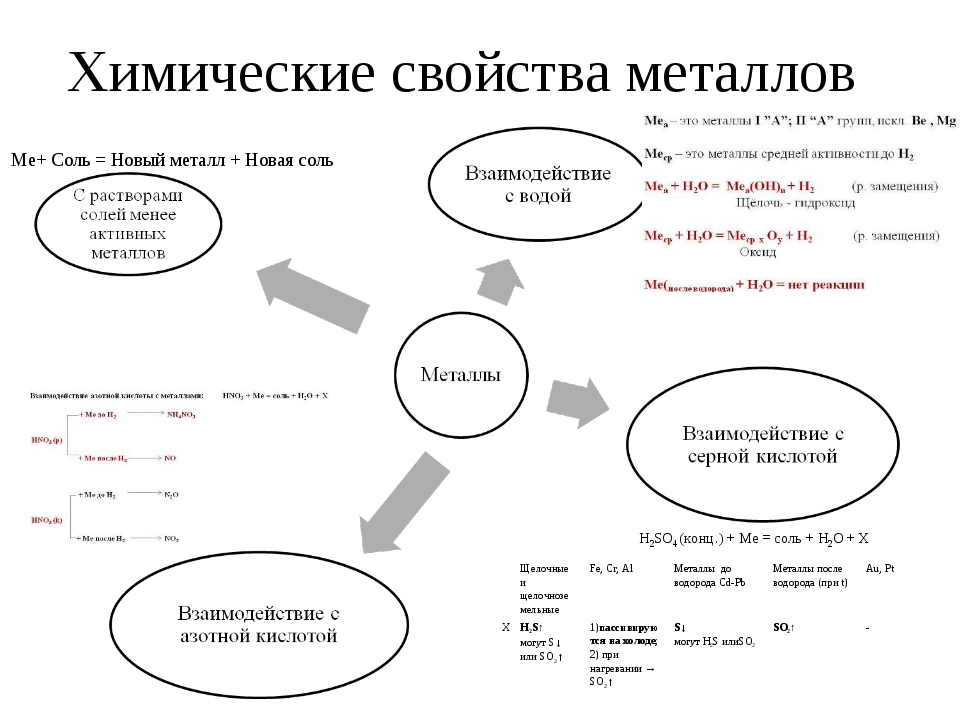 Каждый атом железа здесь отдаёт по два электрона молекуле серы.
Каждый атом железа здесь отдаёт по два электрона молекуле серы.
Если смешать небольшое количество порошка алюминия с порошком серы и нагреть сверху смесь пламенем лучинки, то в результате бурной реакции образуется сульфид алюминия:
Алюминий выступает в роли восстановителя и повышает свою степень окисления с 0 до +3, а сера понижает свою степень окисления с 0 до -2 и является окислителем. В этой реакции два атома алюминия отдают по три электрона молекуле серы.
Таким образом, с серой при определённых условиях реагируют все металлы кроме золота, в результате этого взаимодействия образуются сульфиды, в которых степень окисления серы равна мину двум. В этих реакциях металлы выступают в роли восстановителей, а сера – в роли окислителя.
C фтором, хлором, бромом и йодом – металлы реагируют с образованием галогенидов.
Так,
в реакции алюминия с йодом образуется йодид алюминия, а
катализатором в этой реакции является вода.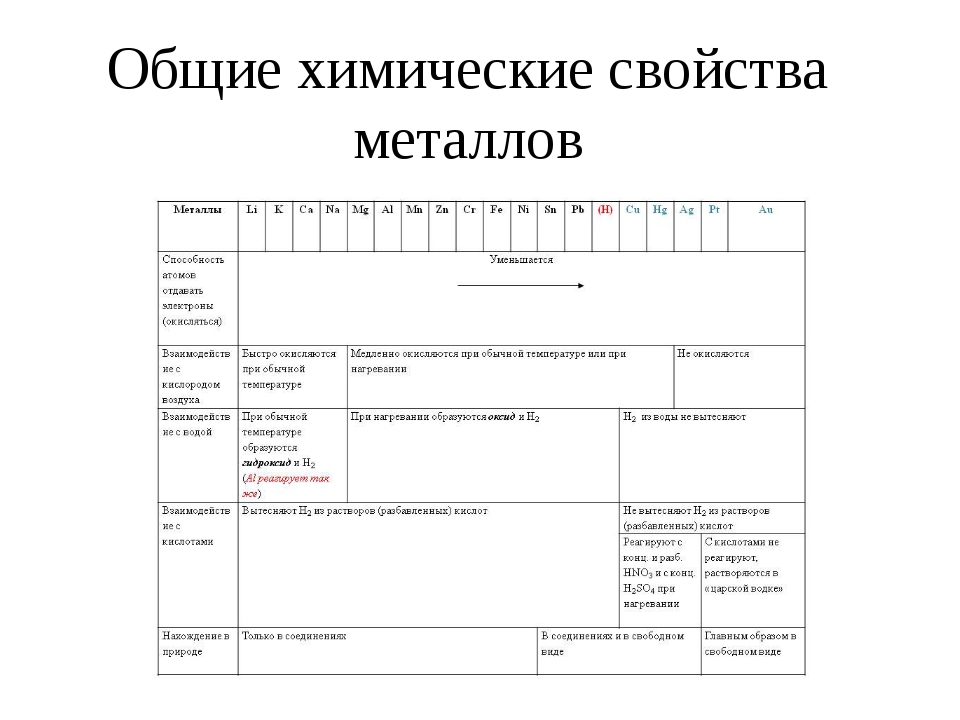
В этой реакции алюминий также повышает свою степень окисления с 0 до +4, являясь при этом восстановителем, а йод является окислителем и понижает свою степень окисления с 0 до -1. При этом два атома алюминия отдают по три электрона молекуле йода.
Таким образом, в реакциях с галогенами, металлы являются восстановителями и повышают свою степень окисления, а сами галогены являются окислителями и понижают свою степень окисления, при этом металлы окисляются, а галогены восстанавливаются. В результате этих реакций образуются галогениды.
Металлы не только реагируют с неметаллами – простыми веществами, но и вступают в реакции со сложными веществами.
Например,
с водой эффективно реагируют щелочные и щелочноземельные металлы.
Если натрий поместить в ёмкость с водой, в которую добавили несколько
капель фенолфталеина, то он будет двигаться по поверхности воды, бурно
реагируя с ней. При этом выделяется водород и образуется гидроксид натрия,
окрашивающий фенолфталеин в малиновый цвет.
При этом выделяется водород и образуется гидроксид натрия,
окрашивающий фенолфталеин в малиновый цвет.
Металлический натрий выступает в качестве восстановителя, он повышает свою степень окисления с 0 до +1, а ионы водорода выступают в качестве окислителя и водород понижает свою степень окисления с +1 до 0. В этой реакции два атома натрия отдают по одному электрону ионам водорода.
Некоторые металлы взаимодействуют с водой при определённых условиях, например, цинк – при нагревании, железо – в раскалённом виде с парами воды. При этом образуются оксиды металлов и выделяется водород.
Так,
в реакции с цинком образуется оксид цинка и водород. Цинк при этом,
являясь восстановителем, повышает свою степень окисления с 0 до +2 и отдаёт по
два электрона ионам водорода. Катионы водорода выступают в роли окислителя и
понижают свою степень окисления с +1 до 0. В реакции с железом, аналогично,
железо является восстановителем, повышает свою степень окисления с 0 до +2 и
+3, при этом три атома железа отдают по восемь электронов ионам водорода, а
ионы водорода понижают свою степень окисления с +1 до 0 и являются
окислителями.
Если металл стоит в ряду активности после водорода, то он не вытесняет водород из воды ни при каких условиях.
Таким образом, щелочные и щелочноземельные металлы реагируют с водой с образованием щелочей, при этом выделяется водород, некоторые металлы реагируют с водой только при нагревании, при этом образуются оксиды и выделяется водород, а металлы, стоящие в ряду активности после водорода не реагируют с водой. В этих реакциях металлы выступают в роли восстановителей, а ионы водорода – в роли окислителя.
Металлы реагируют и с кислотами. Активность металлов при взаимодействии с растворами кислот зависит от положения металла в ряду активности. Металлы, стоящие в ряду активности до водорода, способны вытеснять водород из разбавленных растворов кислот.
Следует учитывать и следующее металл реагирует с кислотой:
· металл должен стоять в ряду активности до водорода
· если образуется растворимая соль
· концентрированная серная и азотная кислота любой концентрации иначе реагируют с металлами, при этом водород не выделяется
· на щелочные металлы это правило не распространяется, так как они реагируют активно с водой, а речь в данном случае идёт о растворах кислот
Например,
в реакции магния с раствором серной кислоты, магний выступает в роли
восстановителя, а ионы водорода в качестве окислителя.
При этом магний повышает свою степень окисления с 0 до +2, а водород понижает свою степень окисления с +1 до 0. Каждый атом магния отдаёт по два электрона ионам водорода.
Металлы, стоящие в ряду активности после водорода, к такому взаимодействию не способны:
Например, медь стоит в ряду активности после водорода, поэтому она не реагирует с раствором соляной кислоты.
Если налить в две пробирки растворы кислот: в первую – раствор соляной кислоты, во вторую – раствор серной кислоты, а затем поместить в каждую по грануле цинка, то в результате у нас появляются пузырьки газа и в первой, и во второй пробирке. Значит, цинк стоит в ряду активности металлов до водорода, поэтому он способен вытеснять водород из раствора кислот.
Цинк
в обеих реакциях является восстановителем, он повышает свою степень окисления с
0 до +2, а водород понижает свою степень окисления с +1 до 0, при этом выступая
в роли окислителя. В этих двух реакциях атом цинк отдаёт по два электрона ионам
водорода.
В этих двух реакциях атом цинк отдаёт по два электрона ионам
водорода.
Следует помнить, что металлы, стоящие в ряду активности до водорода, реагируют с растворами кислот, но в результате этих реакций должна образоваться растворимая соль, на щелочные металлы эти правила не распространяются, концентрированная серная и азотная кислота любой концентрации иначе реагируют с металлами.
Металлы реагируют с растворами солей, при этом нужно также использовать ряд активности металлов: более активный металл способен вытеснять другой металл из раствора соли, однако при этом должна образоваться растворимая соль и щелочные металлы брать нельзя, потому что они реагируют с водой, а реакции эти протекают в растворе.
Если
в две пробирки налить раствора сульфата меди (II) и поместить в первую
кусочек железа, а во вторую гранулу цинка, то реакция будет у нас
идти в двух пробирках.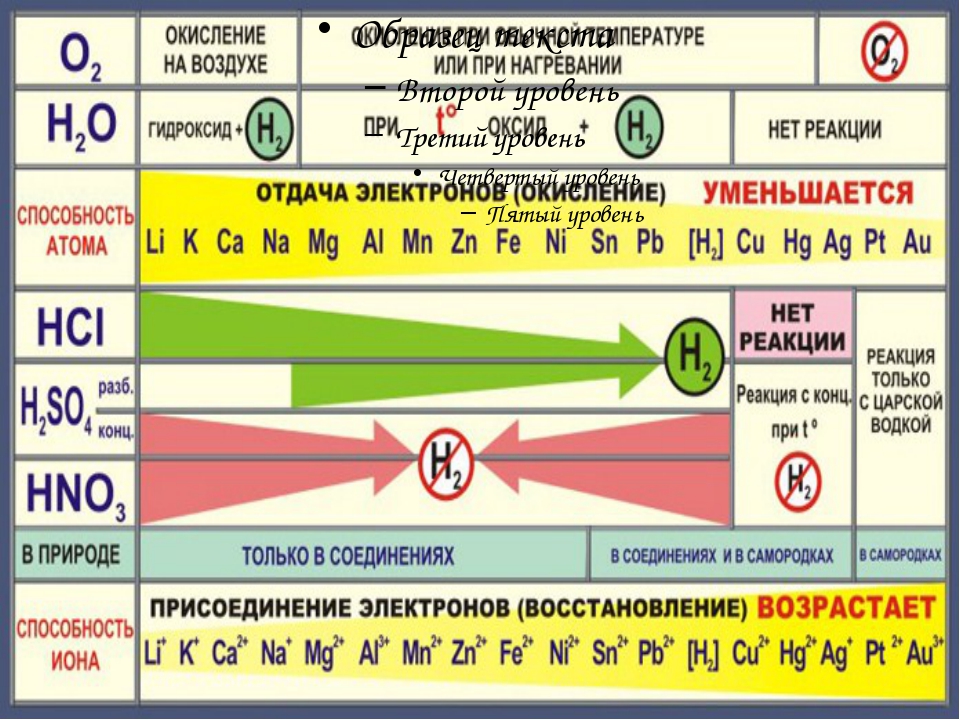 На кусочке железа и грануле цинка оседает медь
и раствор сульфата (II) изменяет свою окраску: в первой пробирке – на
жёлтую, во второй – с голубой на более светлую.
На кусочке железа и грануле цинка оседает медь
и раствор сульфата (II) изменяет свою окраску: в первой пробирке – на
жёлтую, во второй – с голубой на более светлую.
В этой реакции железо выступает в роли восстановителя, само при этом окисляясь. Атомы железа превращаются в ионы железа. Ионы меди выступают в роли окислителя, они восстанавливаются, превращаясь в атомы меди. В результате окислительно-восстановительной реакции электроны от атомов железа переходят к ионам меди.
Во второй реакции, в роли восстановителя выступает цинк, сам он окисляется, атомы цинка превращаются в ионы цинка, ионы меди выступают в роли окислителя, ионы меди восстанавливаются и превращаются в атомы меди, электроны от атомов цинка переходят к ионам меди.
Следовательно,
металлы реагируют и с растворами кислот, но нужно помнить, что каждый металл
вытесняет из раствора соли другой металл, стоящий правее него в ряду напряжений
металлов, при этом должна образоваться растворимая соль и щелочные металлы
брать нельзя, так как они реагируют с водой.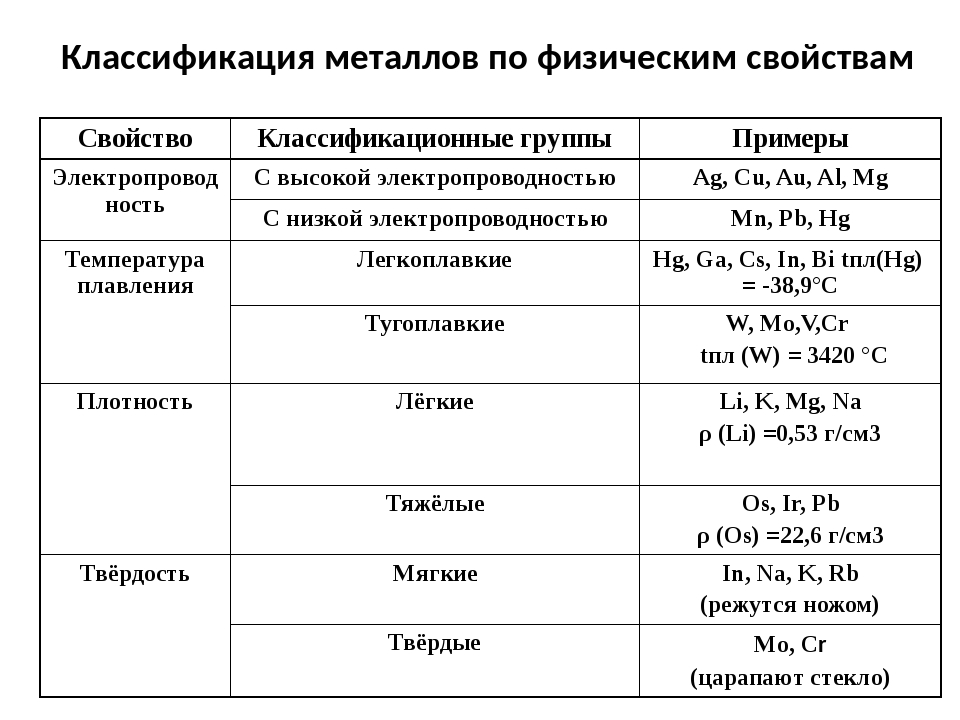
Сделаем вывод:
· металлы реагируют с простыми веществами, такими, как:
· кислород
· сера
· галогены
· со сложными:
· вода
· кислоты
· соли
Организационная информация | |||||||||||||||||||||||||||
Тема урока | Химические свойства металлов | ||||||||||||||||||||||||||
Предмет | Химия | ||||||||||||||||||||||||||
Класс | 9 | ||||||||||||||||||||||||||
Автор урока (ФИО, должность) | Зайберт Инна Сергеевна, учитель химии | ||||||||||||||||||||||||||
Образовательное учреждение | Муниципальное
образовательное учреждение
Светлолобовская средняя общеобразовательная
школа №6 имени героя России Мудрова
М. | ||||||||||||||||||||||||||
Методическая информация | |||||||||||||||||||||||||||
Тип урока | Изучение нового | ||||||||||||||||||||||||||
Цели урока | Образовательные – создать условия для изучения химических свойств металлов Развивающие – развивать познавательную активность учащихся, способствовать развитию умений наблюдать, делать выводы на основе результатов своих исследований Воспитательные – воспитание положительной мотивации учения. | ||||||||||||||||||||||||||
Задачи урока | |||||||||||||||||||||||||||
Знания,
умения, навыки и качества, которые
актуализируют/приобретут/закрепят/др. | Формирование знаний о химических свойствах металлов, умения наблюдать, делать выводы на основе результатов своих исследований | ||||||||||||||||||||||||||
Необходимое оборудование и материалы | Компьютер, проектор, реактивы: раствор соляной кислоты, натрий, цинк, медь, железо, сульфат меди, вода, фенолфталеин. | ||||||||||||||||||||||||||
Подробный конспект урока | |||||||||||||||||||||||||||
Мотивация учащихся |
| ||||||||||||||||||||||||||
Ход и содержание урока |
| ||||||||||||||||||||||||||
Проверка и оценивание ЗУНКов | А теперь на основании ваших знаний заполните таблицу. | Заполняют таблицу. Самопроверка. | |||||||||||||||||||||||||
Итог урока | В течение всего урока мы изучали химические свойства металлов, делали выводы, подтвердили гипотезы. Вы почти убедили меня, но все-таки я хочу еще раз проверить. (опыт: золотое кольцо с соляной кислотой) | Да, гипотезы оказались верны | |||||||||||||||||||||||||
Рефлексия деятельности на уроке | Я приготовила для вас небольшой
сюрприз. | ||||||||||||||||||||||||||
Домашнее задание | Дополнить таблицу уравнениями реакций. | ||||||||||||||||||||||||||
В помощь учителю | |||||||||||||||||||||||||||
Использованные источники и литература (если имеются) | Учебник для общеобразовательных учреждений / О.С. Габриелян, «Дрофа» | ||||||||||||||||||||||||||
Химические свойства металлов — презентация онлайн
1. Химические свойства металлов
Цель: Рассмотреть общиехимические свойства металлов
2. Химические свойства металлов
1. Вступают вреакцию с
неметаллами
2Mg + O2 = 2MgO
2Al + 3I2 = 2AlI3
3. Химические свойства металлов
2. Взаимодействуют с водой
Взаимодействуют с водойa) Щелочные и щелочночноземельные металлы
2Na + 2HOH = 2NaOH + h3
Ca + 2HOH = Ca(OH)2 + h3
б) менее активные металлы
3Fe + 4h30 = Fe3O4 + 4h3
4. Химические свойства металлов
3. Вступают в реакцию с кислотамис учетом правил по положению металлов в ряду напряжения
K Ca Na Mg Al Zn Fe Ni Sn Pb h3 Cu Hg Ag Au
1. Металл в ряду должен стоять до водорода
(исключение металлы IА и IIА групп)
2. Полученная соль должна быть растворимой
3. Азотная и концентрированная серная кислоты
реагируют с металлами по – особому.
5. Взаимодействие с кислотами
2Al + 6HCl = 2AlCl3+3h3Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2h3O
6. Химические свойства металлов
4. Вступают в реакцию с солямис учетом правил по положению металлов в ряду напряжения
K Ca Na Mg Al Zn Fe Ni Sn Pb h3 Cu Hg Ag Au
1. Металл в ряду должен стоять до металла соли
(исключение металлы IА и IIА групп)
2.
 Все соли, участвующие в реакции должны быть
Все соли, участвующие в реакции должны бытьрастворимы
Fe + CuSO4 = FeSO4 + Cu
Cu + FeSO4 =
7. Взаимодействие с солями
Zn + CuCl2 = ZnCl2 + Cu8. Вывод:
Металлы вступают в реакцию:• 1. С неметаллами
• 2. С водой
(с учетом условий)
• 3. С кислотами
(с учетом правил ряда напряжений)
• 4. С солями
(с учетом правил ряда напряжений)
9. Закрепление
Лабораторная работаХимические свойства металлов
1. Взаимодействие меди с кислородом;
2. Взаимодействие цинка с соляной
кислотой;
3. Взаимодействие железа с раствором
сульфата меди(II)
(используйте карточки – инструкции)
10. Домашнее задание
• Изучить § 8• ЗАПОМНИТЬ! Химические свойства
металлов
• Выполнить письменно задания:
— № 2,3 (после § 8)
— № 1-5 (тетрадь с печатной основой)
Химические свойства металлов и неметаллов
Введение
Металлы и неметаллы — это элементы, доступные вокруг нас.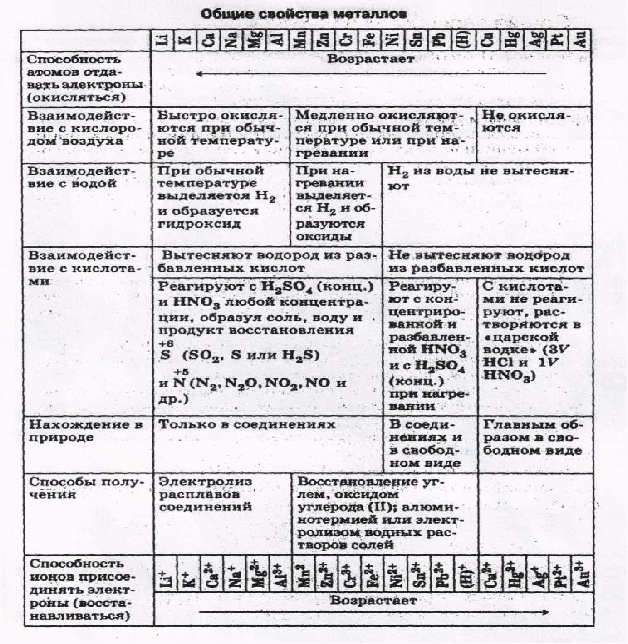 Итак, важно знать, является ли конкретный элемент металлом или неметаллом. Материалы можно разделить на металлы и неметаллы. Характерной чертой металлов, таких как алюминий и медь, является высокая электрическая и теплопроводность, тогда как неметаллы, такие как сера и металлический фосфор, являются изоляторами. Элементы делятся на металлы и неметаллы в зависимости от их свойств.
Итак, важно знать, является ли конкретный элемент металлом или неметаллом. Материалы можно разделить на металлы и неметаллы. Характерной чертой металлов, таких как алюминий и медь, является высокая электрическая и теплопроводность, тогда как неметаллы, такие как сера и металлический фосфор, являются изоляторами. Элементы делятся на металлы и неметаллы в зависимости от их свойств.
Элемент — это простейшая форма материи, которую невозможно разделить на более простые вещества или построить из них обычным химическим или физическим методом. Металлы и неметаллы — неотъемлемая часть нашей жизни. Мы не можем выжить без некоторых неметаллов, таких как кислород, а без существования металлов наше выживание было бы трудным.
[Изображение скоро будет загружено]
Что такое металлы?
Большинство элементов таблицы Менделеева — металлы. К ним относятся переходные металлы, лантаноиды, щелочные металлы, актиниды и щелочноземельные металлы. В периодической таблице металлы разделены на неметаллы зигзагообразной линией, начиная от углерода и заканчивая радоном. Элементы между ними — селен, фосфор и йод.
В периодической таблице металлы разделены на неметаллы зигзагообразной линией, начиная от углерода и заканчивая радоном. Элементы между ними — селен, фосфор и йод.
Элементы этих видов и элементы справа от них в периодической таблице являются неметаллами. Элементы, которые находятся слева от линии, известны как полуметаллы или металлоиды. Они будут иметь смешанные свойства металлов и неметаллов.
Что такое неметаллы?
Неметаллы очень немногие числа в периодической таблице.Они расположены в правой части таблицы Менделеева. К элементам, относящимся к неметаллам, относятся сера, углерод, фосфор, все галогены, водород, кислород, азот, селен и благородные газы.
В периодической таблице неметаллы расположены слева от галогенов и справа от металлоидов. Поскольку галогены и благородные газы также являются неметаллами, эти элементы часто известны неметаллам.
Химические свойства металлов
Некоторые химические свойства металлов перечислены ниже.
Обычно плотность металлов высокая.
Металлы пластичные и ковкие.
Металлы образуют сплав с другими металлами или неметаллами.
Некоторые металлы, например железо, вступают в реакцию с воздухом и корродируют.
Металлы, кроме свинца, хорошо проводят тепло и электричество.
В целом, за исключением ртути, все другие металлы находятся в твердом состоянии при комнатной температуре.Но Меркурий находится в жидком состоянии.
Другие металлы производят оксиды металлов при сжигании в кислороде воздуха. Металлы с высокой реакционной способностью сильно реагируют при горении в кислороде.
Металлы, такие как калий и натрий, хранятся в масле, поскольку они вступают в реакцию с воздухом за секунды.
 Они относятся к высокореактивным металлам.
Они относятся к высокореактивным металлам.Менее химически активные металлы, такие как серебро, золото, платина и другие родственные, нелегко потускнеют. Они остаются блестящими и блестящими.
Металлы образуют газообразный водород и оксид металла при реакции с водой.
Растворимые оксиды металлов растворяются в воде и образуют гидроксид металла.
Не каждый металл вступает в реакцию с водой. Однако высокореактивные металлы, такие как натрий и калий, бурно реагируют с водой, и происходит экзотермическая реакция, при которой водород немедленно загорается.
Когда металл реагирует с кислотой, образуются водород и соль.
Металл обычно вытесняет менее химически активный металл в растворе соли металла.

Химические свойства неметаллов
Некоторые химические свойства неметаллов перечислены ниже.
Неметаллы, за исключением газообразного углерода и графита, плохо проводят тепло и электричество.
В отличие от металлов неметаллы не являются пластичными и ковкими.
Неметаллы больше реагируют с металлами, чем с неметаллами.
Неметаллы обычно реагируют с другими неметаллами при высоких температурах.
Большинство неметаллов не вступают в реакцию с воздухом при комнатной температуре.
Единственным неметаллом является белый фосфор, который реагирует с воздухом с образованием его оксида путем горения.
Неметаллы обычно не вступают в реакцию с водой.
 За исключением хлора, хлор растворяется в воде с образованием кислого раствора.
За исключением хлора, хлор растворяется в воде с образованием кислого раствора.Неметаллы имеют более низкую плотность по сравнению с металлами.
Неметаллы не образуют сплавов. Однако могут образовываться такие вещества, как углерод, кремний и фосфор.
При комнатной температуре неметаллы существуют во всех состояниях вещества.
Различные неметаллы всегда имеют разные реакции.
В семействе галогенов наиболее химически активным металлом является хлор, то есть бром (Br), йод (I), хлор (Cl) и фтор (F). Порядок реакционной способности семейства галогенов: Cl> Br> I.
Таким образом, хлор (Cl) может вытеснять бром (Br) и йод (I) из растворов йодидов (NaI) и бромидов (NaBr).

Ионные твердые вещества образуются, когда неметаллы с высокой электроотрицательностью вступают в реакцию с щелочноземельными металлами и щелочами.
Разница между химическими свойствами металла и неметаллов представлена в таблице ниже.
Разница между химическими свойствами металлов и неметаллов
Металлы | Неметаллы |
Металлы легко подвержены коррозии. | Неметаллы не подвержены коррозии. |
У них 1, 2 или 3 электрона в валентной оболочке. Таким образом, они могут легко терять электроны. | Неметаллы владеют более чем 4 электронами на валентной оболочке. Таким образом, они могут легко получить электроны. |
Металлы производят основные оксиды | Они образуют кислый оксид. |
Они являются электроположительными по своей природе | Они электроотрицательны по своей природе. |
Действует как хороший восстановитель. | Они действуют как отличный окислитель. |
Металлы и неметаллы | Физические и химические свойства металлов и неметаллов
Введение
Каждый объект вокруг нас можно разделить на два типа элементов: металлы и неметаллы. Ваши книги, одежда, карандаш, бутылка с водой, сумка, стол, дверь — все это примеры неметаллов. Поэтому важно знать свойства металлов и неметаллов и знать, как их различать.
Периодическая таблица
Периодическая таблица Менделеева содержит набор элементов, основанный на определенных химических свойствах, которые они проявляют. Металлы расположены на левой стороне, а неметаллы — на правой стороне таблицы Менделеева. Строки таблицы называются периодами, а столбцы — группами. В общей сложности известно 92 элемента, которые встречаются в природе, из которых 70 — металлы, а 22 — неметаллы.
Строки таблицы называются периодами, а столбцы — группами. В общей сложности известно 92 элемента, которые встречаются в природе, из которых 70 — металлы, а 22 — неметаллы.
Металлы
В приведенном выше изображении таблицы Менделеева большинство элементов — металлы.Существуют различные виды металлов:
Щелочноземельные металлы
Щелочные металлы
Переходные металлы
Актиниды и
Лантаноиды
Металлы, расположенные в левой части таблицы Менделеева, отделены от неметаллов зигзагообразной линией, которая начинается от углерода (C) и идет вниз по фосфору (P), селену (Se), йоду (I). , до Радона (Rn).Следовательно, эти химические элементы и все, что от них справа, неметаллы, а ряд слева от них известен как полуметаллы или металлоиды.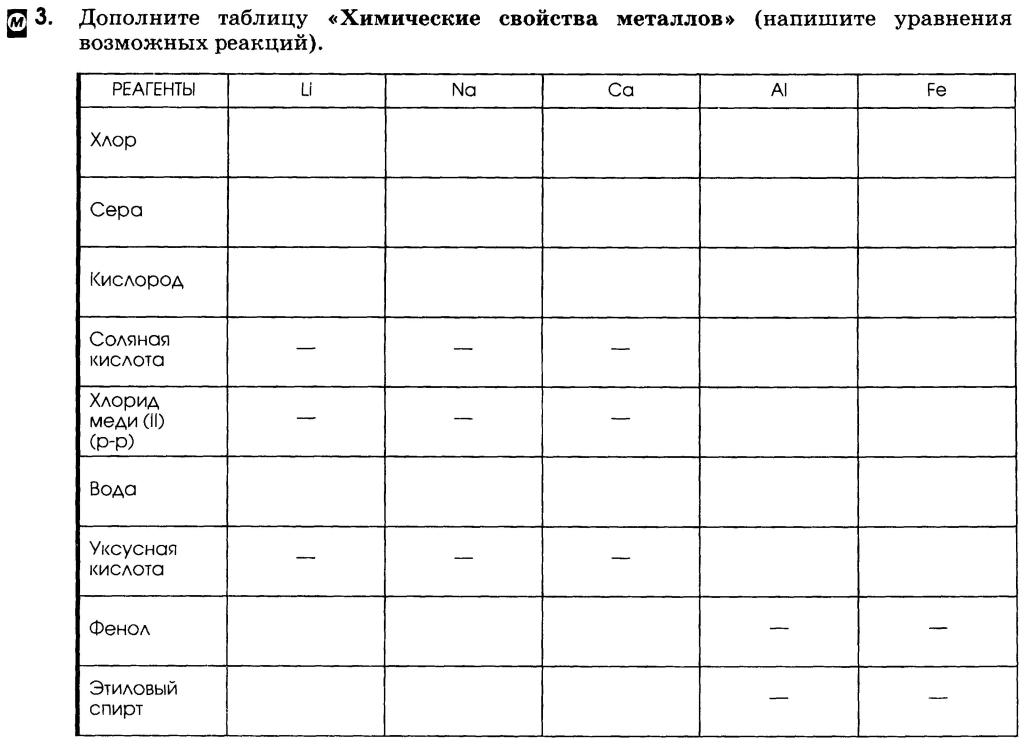 Они обладают свойствами, общими как для металлов, так и для неметаллов.
Они обладают свойствами, общими как для металлов, так и для неметаллов.
(Изображение будет добавлено в ближайшее время)
Физические свойства
Металлы находятся в твердом состоянии. Все металлы твердые, за исключением ртути, которая находится в жидком состоянии в своей естественной форме.
Металлы по своей природе пластичны.Их можно взбить на тонкие листы. Например, такие элементы, как алюминий, золото и серебро, можно разбивать на тонкие листы для обычных целей.
Металлы пластичные. Это означает, что металлы можно растянуть в тонкую проволоку. Изготавливаем медные и алюминиевые провода. Все металлы одинаково пластичны. Только то, что некоторые металлы более пластичны, чем другие, для которых они используются в повседневных целях.
Металлы проводят тепло и электричество.
 Именно благодаря этому свойству металлы нагреваются, и через них может проходить электричество.Каждый металл — хороший проводник тепла и электричества.
Именно благодаря этому свойству металлы нагреваются, и через них может проходить электричество.Каждый металл — хороший проводник тепла и электричества.
Примечание: Серебро — лучший проводник тепла и электричества, медь — также хороший проводник. Наихудшим проводником тепла является свинец, тогда как железо и ртуть плохо проводят электричество.
Металлы блестящие. Благодаря этому свойству металлы блестят и отражают свет, падающий на его поверхность. Кроме того, металлы можно полировать, и это одна из причин, почему металлы используются для изготовления ювелирных украшений и так востребованы как женщинами, так и мужчинами.
Металлы очень прочные и твердые, за исключением натрия и калия. Их можно разрезать ножом.
Металлы также считаются тяжелыми.
Металлы тоже звонкие.
 Они издают звук, когда в них звонят или ударяют каким-либо предметом.
Они издают звук, когда в них звонят или ударяют каким-либо предметом.Металлы имеют высокую температуру плавления и высокую температуру кипения.
Металлы имеют высокую плотность.
Металлы в форме предметов непрозрачны и никогда не бывают прозрачными или полупрозрачными.
Химические свойства
Металлы легко и быстро подвергаются коррозии.
Металлы легко теряют электроны. Их внешняя оболочка имеет 1, 2 или 3 электрона.
Большинство металлов образуют оксиды металлов при контакте с кислородом.
Металлы обладают низкой электроотрицательностью, они являются электроположительными элементами.

Металлы также являются хорошими восстановителями.
Неметаллы
Неметаллические элементы — это элементы, не обладающие свойствами металлов.Количество неметаллов в таблице Менделеева очень меньше по сравнению с металлами. Неметаллы расположены в правой части таблицы Менделеева. Некоторые примеры неметаллов: водород, углерод, азот, фосфор, кислород, сера, селен, все галогены и благородные газы.
(Изображение будет добавлено в ближайшее время) (Изображение будет добавлено в ближайшее время)
Физические свойства
Неметаллы хрупкие и ломаются при ударе. Пример: сера и фосфор.
Неметаллы не пластичны, поэтому их нельзя превращать в тонкую проволоку.
Неметаллы являются изоляторами или плохими проводниками электричества и тепла, потому что они не теряют электроны для передачи энергии.
При комнатной температуре они могут находиться в твердом, жидком или газообразном состоянии.
Они бесшумные.
Могут быть прозрачными.
Химические свойства
Неметаллы обычно содержат от 4 до 8 электронов на внешней оболочке.
Неметаллы имеют тенденцию приобретать или принимать валентные электроны.
При контакте с кислородом неметаллы реагируют с кислородом с образованием кислых оксидов.
Неметаллы обладают высокой электроотрицательностью; они являются электроотрицательными элементами.
Неметаллические элементы являются хорошими окислителями.

Эти элементы не вступают в реакцию с водой.
Сравнение физических свойств металлов и неметаллов
Тип имущества | Металлы | Неметаллы | Физические металлы | Существуют как твердые вещества и газы, за исключением брома. |
Плотность | Высокая плотность | Низкая. | |
Точки плавления и кипения | Высокая температура плавления и кипения Исключение составляют галлий и цезий. | Низкая температура плавления и кипения. | |
Ковкость и пластичность | ковкий и пластичный | не ковкий и не пластичный. | |
Электропроводность | Проводит тепло и электричество | Плохие / плохие проводники тепла и электричества, за исключением графита. | |
Блеск | Блестящий блеск | Они не имеют блеска, кроме йода. | |
Звонкий звук | Звонкий. | Бесшумный. | |
Твердость | Обычно твердые, за исключением Na, K | Обычно мягкие, кроме алмаза |
Сравнение химических свойств металлов и неметаллов
Тип реакции
Металлы
Неметаллы
Реакция с h3O
Металлы при взаимодействии с водой образуют оксиды металлов или гидроксиды металлов и выделяют газ h3.
Неметаллы не могут отдавать электроны водороду в воде для выделения в виде газа h3. Неметаллы не вступают в реакцию с водой.
Реакция с O2
Металлы реагируют с кислородом с образованием основных оксидов. Zn и Al образуют амфотерные оксиды, которые проявляют свойства как кислотных, так и основных оксидов. В основном оксиды металлов нерастворимы в воде. Некоторые из них растворяются с образованием щелочи.
Неметаллы реагируют с кислородом с образованием оксидов.Оксиды неметаллов растворимы в воде. Они растворяются в воде с образованием кислот.
Реакция с кислотами
Металлы реагируют с кислотой с образованием соли и выделением водорода. Когда металлы реагируют с HNO3, h3 не выделяется. HNO3 — сильный окислитель.
Не происходит реакции с кислотами с выделением газа h3. Неметаллы не теряют электроны, чтобы отдать их ионам водорода кислот.
Неметаллы не теряют электроны, чтобы отдать их ионам водорода кислот.
Реакция с солевыми растворами
Когда металлы вступают в реакцию с солевым раствором, более химически активные металлы вытесняют менее химически активные металлы из солевого раствора.
Здесь более химически активные неметаллы вытесняют менее химически активные неметаллы из солевого раствора.
Реакция с хлором
Металлы реагируют с хлором с образованием хлорида металла. Это ионная связь. Мы получаем ионное соединение
Неметаллы реагируют с хлором с образованием хлорида неметалла. Образует ковалентную связь. Мы получаем ковалентное соединение.
Реакция с h3
Только высокореактивные металлы реагируют с водородом с образованием металлогидрида.
Неметаллы реагируют с водородом с образованием гидридов.
Таблица рядов реактивности показывает порядок расположения металлов на основе их сравнительной реакционной способности.
Этапы извлечения металлов из руды
Прокаливание и обжиг
Прокаливание | Обжиг |
В этом процессе руды нагреваются в отсутствие кислорода, при этом образуется оксид металла и выделяется оксид металла.Это делается для карбонатных руд CaCO3 → CaO + CO2 (г) | В этом процессе серная руда нагревается в присутствии кислорода. Образуется оксид металла и выделяется газ SO2. Это делается для сульфидных руд. ZnS + 3O2 нагревает 3ZnO + SO2 |
Вопросы
1. Возьмите пробы Fe, Cu, Al, Mg и обратите внимание на внешний вид каждого образца.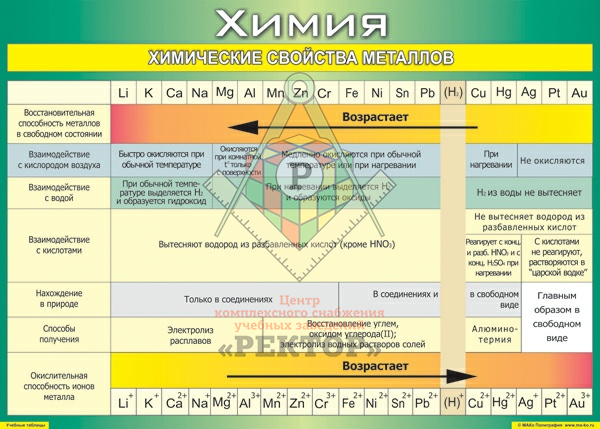
2. Приведите примеры каждого:
i. Металл, жидкий при комнатной температуре.
ii. Металл, который легко режется ножом.
iii. Металл, который хорошо проводит тепло.
3. Объясните значение слов «податливый» и «пластичный».
4. Что вы подразумеваете под реакцией смещения?
5. Приведите один пример реакции вытеснения.
6. Видели ли вы когда-нибудь кузнеца, бьющего железо? Какие изменения вы заметили в форме этих фигурок после избиения? Вы бы нашли подобное изменение в бревне при избиении?
7. Назовите два наиболее ковких металла.
8.Доказательство того, что металлы являются хорошими проводниками электричества, входит в уравнение.
9. Перечислите некоторые физические свойства металлов.
10. Напишите некоторые физические свойства неметаллов.
11. Что происходит, когда натрий и вода.
12. Почему неметаллы не реагируют с водой?
13. Заполните пропуски:
i. Оксиды неметаллов находятся ……………… в воде.
ii. Неметаллы не теряют электроны, чтобы отдать их ионам водорода ……….
iii. При этом кальцинировании руды нагреваются в отсутствие кислорода, в результате чего образуется оксид металла и выделяется ………………….
iv. При обжиге в этом процессе образуется оксид металла и ……………… .. выделяются газы.
v. Когда металлы реагируют с раствором соли, более химически активные металлы …………………. менее химически активные металлы из его солевого раствора.
vi. Неметаллы …………… и разбиваются на куски.
vii. Неметаллы — это не …………… поэтому из них нельзя сделать тонкую проволоку.
14. Назовите три причины для следующего:
(i) Почему сера не является металлом?
(ii) Почему магний — это металл?
(iii) Вам даются три разных образца металлов. Натрий, магний и медь. Напишите любые два действия, чтобы расположить их в порядке убывания активности.
Натрий, магний и медь. Напишите любые два действия, чтобы расположить их в порядке убывания активности.
7.6: Металлы, неметаллы и металлоиды
- Последнее обновление
- Сохранить как PDF
- Металлы
- Физические свойства металлов
- Химические свойства металлов
- Неметаллы
- Физические свойства неметаллов
- Химические свойства неметаллов
- Металлоиды
- Тенденции в свойствах металлов и неметаллов Атрибуции
Цели обучения
- Чтобы понять основные свойства, отделяющие металлы от неметаллов и металлоидов
Элемент — это простейшая форма материи, которую невозможно разделить на более простые вещества или построить из более простых веществ обычными химическими или физическими методами. Нам известно 118 элементов, из которых 92 встречаются в природе, а остальные были приготовлены искусственно. Элементы далее классифицируются на металлы, неметаллы и металлоиды на основе их свойств, которые коррелируют с их размещением в периодической таблице.
Нам известно 118 элементов, из которых 92 встречаются в природе, а остальные были приготовлены искусственно. Элементы далее классифицируются на металлы, неметаллы и металлоиды на основе их свойств, которые коррелируют с их размещением в периодической таблице.
| Металлические элементы | Неметаллические элементы |
|---|---|
| Отличительный блеск (блеск) | Цветной, разные цвета |
| Ковкий и пластичный (гибкий) в твердом состоянии | Хрупкое, твердое или мягкое |
| Проводить тепло и электричество | Плохие проводники |
| Оксиды металлов основные, ионные | Неметаллические оксиды кислотные ковалентные |
| Образует катионы в водном растворе | Образует анионы, оксианионы в водном растворе |
Металлы
За исключением водорода, все элементы, которые образуют положительные ионы, теряя электроны во время химических реакций, называются металлами.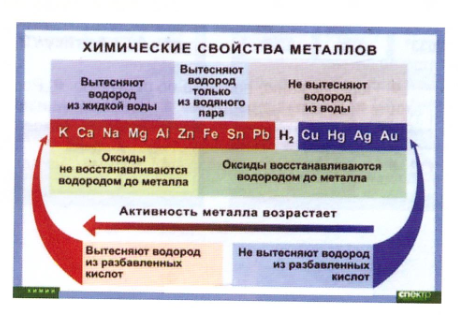 Таким образом, металлы являются электроположительными элементами с относительно низкой энергией ионизации. Они отличаются ярким блеском, твердостью, способностью резонировать со звуком и отлично проводят тепло и электричество. При нормальных условиях металлы являются твердыми телами, за исключением ртути.
Таким образом, металлы являются электроположительными элементами с относительно низкой энергией ионизации. Они отличаются ярким блеском, твердостью, способностью резонировать со звуком и отлично проводят тепло и электричество. При нормальных условиях металлы являются твердыми телами, за исключением ртути.
Физические свойства металлов
Металлы блестящие, пластичные, пластичные, хорошо проводят тепло и электричество. Другие свойства включают:
- Состояние : Металлы представляют собой твердые вещества при комнатной температуре, за исключением ртути, которая находится в жидком состоянии при комнатной температуре (в жаркие дни галлий находится в жидком состоянии).
- Блеск : Металлы обладают свойством отражать свет от своей поверхности и могут быть отполированы, например, золотом, серебром и медью.
- Ковкость: Металлы обладают способностью противостоять ударам молотком и могут быть превращены в тонкие листы, известные как фольга.
 Например, кусок золота размером с кубик сахара можно растолочь в тонкий лист, которым будет покрываться футбольное поле.
Например, кусок золота размером с кубик сахара можно растолочь в тонкий лист, которым будет покрываться футбольное поле. - Пластичность: Металлы можно втянуть в проволоку. Например, из 100 г серебра можно натянуть тонкую проволоку длиной около 200 метров.
- Твердость: Все металлы твердые, кроме натрия и калия, которые мягкие и поддаются резке ножом.
- Валентность: Металлы обычно имеют от 1 до 3 электронов на внешней оболочке их атомов.
- Проводимость : Металлы являются хорошими проводниками, потому что у них есть свободные электроны. Серебро и медь — два лучших проводника тепла и электричества. Свинец — самый плохой проводник тепла. Висмут, ртуть и железо также являются плохими проводниками
- Плотность : Металлы имеют высокую плотность и очень тяжелые.Иридий и осмий имеют самую высокую плотность, тогда как литий имеет самую низкую плотность.

- Точки плавления и кипения : Металлы имеют высокие точки плавления и кипения. Вольфрам имеет самые высокие температуры плавления и кипения, а ртуть — самые низкие. Натрий и калий также имеют низкие температуры плавления.
Химические свойства металлов
Металлыпредставляют собой электроположительные элементы, которые обычно образуют основных или амфотерных оксидов с кислородом.Другие химические свойства включают:
- Электроположительный характер : Металлы имеют тенденцию к низкой энергии ионизации, и обычно теряют электроны (т.е. окисляются ), когда они подвергаются химическим реакциям Обычно они не принимают электроны. Например:
- Щелочные металлы всегда 1 + (теряют электрон в s подоболочке)
- Щелочноземельные металлы всегда 2 + (теряют оба электрона в подоболочке s )
- Ионы переходных металлов не следуют очевидной схеме, 2 + является обычным (теряют оба электрона в подоболочке s ), и также наблюдаются 1 + и 3 +
\ [\ ce {Na ^ 0 \ rightarrow Na ^ + + e ^ {-}} \ label {1. {-}} \ label {1.3} \ nonumber \]
{-}} \ label {1.3} \ nonumber \]
Соединения металлов с неметаллами имеют тенденцию быть ионными по природе. Большинство оксидов металлов являются основными оксидами и растворяются в воде с образованием гидроксидов металлов :
\ [\ ce {Na2O (s) + h3O (l) \ rightarrow 2NaOH (aq)} \ label {1.4} \ nonumber \]
\ [\ ce {CaO (s) + h3O (l) \ rightarrow Ca (OH) 2 (aq)} \ label {1.5} \ nonumber \]
Оксиды металлов проявляют свою основную химическую природу за счет реакции с кислотами с образованием солей металла и воды:
\ [\ ce {MgO (s) + HCl (водн.) \ Rightarrow MgCl2 (водн.) + H3O (l)} \ label {1.{2 -} \), следовательно, \ (Al_2O_3 \).
Пример \ (\ PageIndex {2} \)
Вы ожидаете, что он будет твердым, жидким или газообразным при комнатной температуре?
Решения
Оксиды металлов обычно твердые при комнатной температуре
Пример \ (\ PageIndex {3} \)
Напишите вычисленное химическое уравнение реакции оксида алюминия с азотной кислотой:
Решение
Оксид металла + кислота -> соль + вода
\ [\ ce {Al2O3 (s) + 6HNO3 (вод. ) \ Rightarrow 2Al (NO3) 3 (вод.) + 3h3O (l)} \ nonumber \]
) \ Rightarrow 2Al (NO3) 3 (вод.) + 3h3O (l)} \ nonumber \]
Неметаллы
Элементы, которые стремятся получить электроны с образованием анионов в ходе химических реакций, называются неметаллами.Это электроотрицательные элементы с высокими энергиями ионизации. Они не блестящие, хрупкие и плохо проводят тепло и электричество (кроме графита). Неметаллы могут быть газами, жидкостями или твердыми телами.
Физические свойства неметаллов
- Физическое состояние : Большинство неметаллов существует в двух из трех состояний вещества при комнатной температуре: газах (кислород) и твердых телах (углерод). Только бром существует в жидком виде при комнатной температуре.
- Неэластичный и ковкий : Неметаллы очень хрупкие, их нельзя свернуть в проволоку или измельчить в листы.
- Проводимость : Они плохо проводят тепло и электричество.
- Блеск: Они не имеют металлического блеска и не отражают свет.

- Точки плавления и кипения : Точки плавления неметаллов на обычно на ниже, чем у металлов, но сильно варьируются.
- Семь неметаллов существуют в стандартных условиях в виде двухатомных молекул : \ (\ ce {h3 (g)} \), \ (\ ce {N2 (g)} \), \ (\ ce {O2 (g) } \), \ (\ ce {F2 (g)} \), \ (\ ce {Cl2 (g)} \), \ (\ ce {Br2 (l)} \), \ (\ ce {I2 ( s)} \).
Химические свойства неметаллов
Неметаллы имеют тенденцию получать электроны или делиться электронами с другими атомами. Они имеют электроотрицательный характер. Неметаллы, вступая в реакцию с металлами, имеют тенденцию приобретать электроны (обычно достигают электронной конфигурации благородного газа) и становятся анионами:
\ [\ ce {3Br2 (l) + 2Al (s) \ rightarrow 2AlBr3 (s)} \ nonumber \]
Соединения, полностью состоящие из неметаллов, являются ковалентными веществами.Обычно они образуют кислотные или нейтральные оксиды с кислородом, которые растворяются в воде с образованием кислот:
\ [\ ce {CO2 (г) + h3O (l)} \ rightarrow \ underset {\ text {углекислота}} {\ ce {h3CO3 (aq)}} \ nonumber \]
Как вы знаете, газированная вода имеет слабую кислотность (углекислота).
Оксиды неметаллов могут соединяться с основаниями с образованием солей.
\ [\ ce {CO2 (г) + 2NaOH (водн.) \ Rightarrow Na2CO3 (водн.) + H3O (l)} \ nonumber \]
Металлоиды
Металлоиды обладают промежуточными свойствами между металлами и неметаллами.Металлоиды используются в полупроводниковой промышленности. Все металлоиды твердые при комнатной температуре. Они могут образовывать сплавы с другими металлами. Некоторые металлоиды, такие как кремний и германий, при определенных условиях могут действовать как электрические проводники, поэтому их называют полупроводниками. Кремний, например, выглядит блестящим, но не является ни податливым, ни пластичным ( хрупкий, — характеристика некоторых неметаллов). Это гораздо более слабый проводник тепла и электричества, чем металлы.Физические свойства металлоидов, как правило, металлические, но их химические свойства, как правило, неметаллические. Степень окисления элемента в этой группе может варьироваться от +5 до -2, в зависимости от группы, в которой он находится.
| Металлы | Неметаллы | Металлоиды |
|---|---|---|
| Золото | Кислород | Кремний |
| Серебро | Углерод | Бор |
| Медь | Водород | Мышьяк |
| Утюг | Азот | Сурьма |
| Меркурий | Сера | Германий |
| цинк | фосфор |
Тенденции в металлическом и неметаллическом характере
Металлический характер является наиболее сильным для элементов в самой левой части периодической таблицы и имеет тенденцию к уменьшению при движении вправо в любой период (неметаллический характер усиливается с увеличением значений электроотрицательности и энергии ионизации). Внутри любой группы элементов (столбцов) металлический характер увеличивается сверху вниз (значения электроотрицательности и энергии ионизации обычно уменьшаются по мере продвижения вниз по группе). Эта общая тенденция не обязательно наблюдается с переходными металлами.
Внутри любой группы элементов (столбцов) металлический характер увеличивается сверху вниз (значения электроотрицательности и энергии ионизации обычно уменьшаются по мере продвижения вниз по группе). Эта общая тенденция не обязательно наблюдается с переходными металлами.
Авторы и авторство
Химические свойства металлов и неметаллов
Химические свойства металлов и неметаллов
Химические свойства металлов и неметаллов можно разделить на пять категорий: реакция с кислородом, реакция с водой, реакция с кислотами, реакция с основаниями и вытеснение. реакции.
Реакция с кислородом Металлы: Большинство металлов соединяются с кислородом с образованием оксидов металлов.
- Натрий активно реагирует с кислородом воздуха с образованием оксида натрия. В результате он загорается, если оставить его на открытом воздухе. Поэтому его хранят погруженным в керосин.

- Магний при нагревании горит на воздухе (кислороде) ослепительно белым светом с образованием оксида магния.
Образующиеся оксиды металлов имеют основную природу и окрашивают красный лакмусовый раствор в синий цвет.
Неметаллы: Неметаллы, такие как углерод, сера и фосфор, реагируют с кислородом с образованием неметаллических оксидов. Эти оксиды также называют кислотными оксидами, поскольку они образуют кислоты при растворении в воде.
- Углерод горит на воздухе (кислород) с образованием диоксида углерода.
- Сера горит на воздухе (кислород) с образованием едкого (т. Е. С сильным запахом) удушающего газа, называемого диоксидом серы.
- Эти оксиды растворяются в воде с образованием кислот.
Активность
Цель: Синтезировать неметаллический оксид и проверить его раствор с помощью лакмусовой бумаги.
Необходимые материалы: Сера, ложка с длинной ручкой или ложка для дефлаграции, горелка, вода, газовый сосуд с крышкой и синяя лакмусовая бумага.
Метод:
- Возьмите небольшое количество серы в ложку с длинной ручкой / ложку для дефлаграции и нагрейте ее над пламенем горелки.
- Когда сера загорится, опустите ложку в емкость с газом.Частично накройте банку крышкой, пока сера все еще горит.
- Емкость будет заполнена газообразным диоксидом серы. Выньте ложку и накройте газовый баллон крышкой.
- Добавьте 20 мл воды в сосуд с газом и проверьте полученный раствор с помощью голубой лакмусовой бумаги.
Наблюдение: Синяя лакмусовая бумажка становится красной, что указывает на кислотность раствора.
Заключение: Вода растворяет газ (диоксид серы) с образованием кислоты (сернистой кислоты), которая окрашивает синий лакмус в красный цвет.
Примечание: Требуется наблюдение взрослых.
Металлы Большинство металлов реагируют с водой с образованием гидроксида металла или оксида металла и газообразного водорода.
- Натрий бурно реагирует с холодной водой с образованием гидроксида натрия вместе с газообразным водородом. В этой реакции выделяется большое количество тепла, что приводит к возгоранию водорода.
- Металлы, такие как медь, серебро и золото, не вступают в реакцию с водой ни при каких условиях.
Неметаллы: Неметаллы не вступают в реакцию с водой.
Коррозия
Железо и многие другие металлы вступают в реакцию с кислородом и влагой, присутствующими в атмосфере. Это явление называется коррозией. Процесс медленного разъедания металла из-за воздействия атмосферных газов и влаги на его поверхность называется коррозией .
- Железо реагирует с кислородом и влагой, присутствующими в атмосфере, с образованием коричневого хлопьевидного вещества, называемого ржавчиной.Ржавчина на железе — нежелательная реакция, потому что образовавшийся слой ржавчины отваливается, подвергая металл дальнейшей ржавчине.
 В результате железные предметы со временем становятся слабыми.
В результате железные предметы со временем становятся слабыми. - Медные предметы со временем покрываются зеленым веществом, называемым основным карбонатом меди. Это зеленое вещество образуется в результате реакции меди с углекислым газом и влагой, присутствующей в атмосфере.
- Серебряные предметы со временем чернеют и теряют свой блеск.Это происходит из-за реакции серебра с газообразным сероводородом, присутствующим в атмосфере.
Металлы Когда металл реагирует с кислотой, образуются соль и газообразный водород.
Соли — это соединения, образующиеся, когда металл заменяет водород в кислоте. Различные кислоты и металлы реагируют с образованием разных солей.
- Цинк реагирует с серной кислотой с образованием сульфата цинка и газообразного водорода.
- Магний реагирует с серной кислотой с образованием сульфата магния и газообразного водорода.
- Алюминий реагирует с соляной кислотой с образованием хлорида алюминия и газообразного водорода.

С некоторыми металлами реакция протекает очень быстро и бурно, а с другими — медленно. Некоторые металлы вообще не вступают в реакцию с кислотами.
Неметаллы: Обычно неметаллы не вступают в реакцию с кислотами.
Активность
Цель: Показать, что водород образуется при реакции магния с разбавленной серной кислотой
Необходимые материалы: Магниевая лента, разбавленная серная кислота, пробирка, капельница и спичка
Метод:
- Возьмите в пробирку кусок магниевой ленты.
- С помощью пипетки осторожно добавьте несколько капель разбавленной серной кислоты со стенок пробирки.
- Поднесите горящую спичку к горлышку пробирки.
Наблюдение: Если поднести горящую спичку ко входу в пробирку, издается «хлопающий» звук. Заключение: В результате реакции образуется водород.
Примечание: Требуется наблюдение взрослых.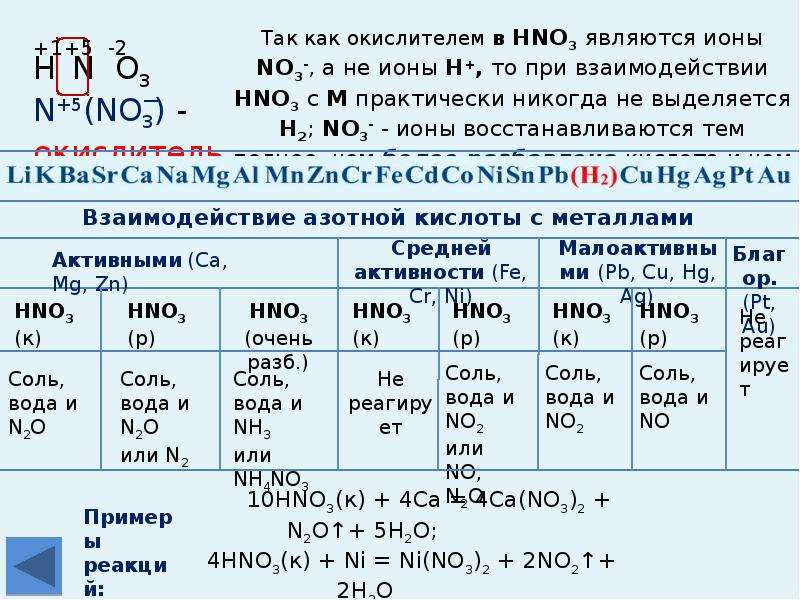
Металлы: Большинство металлов не реагируют с основаниями.Только некоторые из них, такие как алюминий, цинк и свинец, реагируют с растворами сильных оснований, таких как гидроксид натрия, с образованием соединения этого металла и газообразного водорода. Вы можете выполнить вышеуказанное действие, используя небольшие кусочки раствора гидроксида цинка и натрия (вместо ленты магния и разбавленной серной кислоты), чтобы проверить, выделяется ли водород в реакции.
Неметаллы: Реакции неметаллов с основаниями являются сложными. Вы узнаете о них в старших классах.
В реакции замещения металл вступает в реакцию с раствором соли и «вытесняет» (или замещает) присутствующий в нем металл.Реакции замещения объясняются на основе ряда активности металлов.
Ряд активности металлов представляет собой список обычных металлов, упорядоченный в порядке убывания реакционной способности. Это означает, что металл, который помещен выше в ряду активности, более реактивен, чем те, которые помещены ниже него. Ряд активности металлов показан на рисунке. Вы можете предсказать, произойдет ли реакция смещения, посмотрев на серию действий. Металл будет реагировать с раствором соли только в том случае, если он находится в ряду активности выше, чем металл в соли.Например, железо, которое занимает более высокое место в ряду активности, чем медь, реагирует с раствором сульфата меди. Однако медь не вступает в реакцию с сульфатом железа, поскольку она менее активна, чем железо. Еще несколько примеров обсуждаются ниже.
Это означает, что металл, который помещен выше в ряду активности, более реактивен, чем те, которые помещены ниже него. Ряд активности металлов показан на рисунке. Вы можете предсказать, произойдет ли реакция смещения, посмотрев на серию действий. Металл будет реагировать с раствором соли только в том случае, если он находится в ряду активности выше, чем металл в соли.Например, железо, которое занимает более высокое место в ряду активности, чем медь, реагирует с раствором сульфата меди. Однако медь не вступает в реакцию с сульфатом железа, поскольку она менее активна, чем железо. Еще несколько примеров обсуждаются ниже.
- Серебро не реагирует с сульфатом цинка.
- Цинк реагирует с сульфатом меди с образованием сульфата цинка и меди.
- Серебро не реагирует с сульфатом меди.
Из приведенных выше реакций мы можем заключить, что порядок реакционной способности цинка, меди и серебра следующий: Zn> Cu> Ag (т.е.(например, цинк является наиболее активным из трех, а серебро — наименее активным).
Деятельность
Цель: Доказать, что железо более реактивно, чем медь.
Необходимые материалы: Железные опилки, медная стружка, раствор сульфата меди, раствор сульфата железа, пробирки и капельница.
Метод:
- Возьмите несколько железных опилок в пробирку и с помощью пипетки (пробирка A) добавьте немного раствора сульфата меди.
- Возьмите медную стружку в пробирку и с помощью пипетки (пробирка B) добавьте раствор сульфата железа.
Наблюдение: В пробирке A железные опилки становятся коричневыми из-за осаждения меди, а раствор становится бледно-зеленым из-за образования раствора сульфата железа. В пробирке B не наблюдается никакой реакции.
Вывод: Железо более реактивно, чем медь, поскольку оно вытесняет медь из раствора сульфата меди.
Свойства металлических и неметаллических элементов — Металлы и неметаллы — Eduqas — GCSE Chemistry (Single Science) Revision — Eduqas
1s82mcj61fa.0.0.0.1:0.1.0.$0.$1.$0″> Металлы расположены в левой части периодической таблицы, а неметаллы — в правильно.
Физические свойства
В таблице приведены некоторые типичные свойства металлов и неметаллов.
| Металлы | Неметаллы | |
|---|---|---|
| $0.$2.$2.$2.$0.$0″> Блестящие | Тусклые | |
| Высокие точки плавления | Низкие точки плавления | Электропроводники 901 Хорошие проводники электричества |
| Хорошие проводники тепла | 1s82mcj61fa.0.0.0.1:0.1.0.$0.$2.$2.$2.$3.$1″> Плохие проводники тепла | |
| Высокая плотность | Низкая плотность | |
| Податливый и пластичный | Хрупкий |
Некоторые элементы обладают нетипичными свойствами.Например:
- ртуть (металл) имеет низкую температуру плавления и существует в виде жидкости при комнатной температуре
- 1s82mcj61fa.0.0.0.1:0.1.0.$0.$2.$4.$1″> графит, форма углерода (неметалл), имеет высокую температуру кипения и также является хорошим проводником. электричества
Вещество с высокой плотностью означает, что оно имеет большую массу для своего размера.
Тягучие вещества можно сгибать или придавать им форму без разрушения, в то время как хрупкие вещества разбиваются при сгибании или ударе.
Дуктильный означает, что вещество можно растянуть в длинную проволоку без разрывов и разрывов.
Химические свойства
Металлы и неметаллы также можно отличить по некоторым химическим свойствам.
Наиболее распространенным химическим свойством является тип оксида, который образует элемент. Металлы образуют основные оксиды, но неметаллы образуют кислые оксиды. Например, сера и углерод — неметаллы. Они реагируют с кислородом с образованием диоксида серы и диоксида углерода. Эти соединения представляют собой газы, присутствующие в воздухе и растворяющиеся в дождевой воде, делая ее кислой.
Металлы образуют основные оксиды, но неметаллы образуют кислые оксиды. Например, сера и углерод — неметаллы. Они реагируют с кислородом с образованием диоксида серы и диоксида углерода. Эти соединения представляют собой газы, присутствующие в воздухе и растворяющиеся в дождевой воде, делая ее кислой.
Некоторые оксиды не растворяются в воде, поэтому они не влияют на цвет индикатора, добавляемого в воду.
- Вопрос
Элемент таллий образует оксид Tl 2 O. Оксид таллия не растворяется в воде, но реагирует с кислотами с образованием солей таллия. Таллий — это металл или неметалл? Поясните свой ответ.
- 1s82mcj61fa.0.0.0.1:0.1.0.$0.$4.$0.2″> Показать ответ
Таллий — это металл. Это потому, что оксид таллия реагирует с кислотами, поэтому должен быть основанием.Только металлы образуют оксиды, являющиеся основаниями.
Металлы подвержены коррозии чаще, чем неметаллы. Это означает, что неметаллы с меньшей вероятностью реагируют с водой или кислотами, чем металлы.
Открытые учебники | Сиявула
Математика
Наука
- Читать онлайн
Учебники
Английский
Марка 7А
Марка 7Б
7 класс (A и B вместе)
Африкаанс
Граад 7А
Граад 7Б
Граад 7 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Марка 8А
Марка 8Б
8 класс (A и B вместе)
Африкаанс
Граад 8А
Граад 8Б
Граад 8 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Марка 9А
Марка 9Б
9 класс (A и B вместе)
Африкаанс
Граад 9А
Граад 9Б
Граад 9 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Марка 4А
Марка 4Б
Класс 4 (А и В вместе)
Африкаанс
Граад 4А
Граад 4Б
Граад 4 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Марка 5А
Марка 5Б
Оценка 5 (вместе A и B)
Африкаанс
Граад 5А
Граад 5Б
Граад 5 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Марка 6А
Марка 6Б
6 класс (A и B вместе)
Африкаанс
Граад 6А
Граад 6Б
Граад 6 (A en B saam)
Пособия для учителя
Наша книга лицензионная
Эти книги не просто бесплатные, они также имеют открытую лицензию! Один и тот же контент, но разные версии (брендированные или нет) имеют разные лицензии, как объяснено:
CC-BY-ND (фирменные версии)
Вам разрешается и поощряется свободное копирование этих версий. Вы можете делать ксерокопии, распечатывать и распространять их сколь угодно часто. Вы можете скачать их на свой мобильный телефон, iPad, ПК или флешку. Вы можете записать их на компакт-диск, отправить по электронной почте или загрузить на свой веб-сайт. Единственное ограничение заключается в том, что вы не можете адаптировать или изменять эти версии учебников, их содержание или обложки, поскольку они содержат соответствующие бренды Siyavula, спонсорские логотипы и одобрены Департаментом базового образования. Для получения дополнительной информации посетите Creative Commons Attribution-NoDerivs 3.0 Непортированный.
Вы можете делать ксерокопии, распечатывать и распространять их сколь угодно часто. Вы можете скачать их на свой мобильный телефон, iPad, ПК или флешку. Вы можете записать их на компакт-диск, отправить по электронной почте или загрузить на свой веб-сайт. Единственное ограничение заключается в том, что вы не можете адаптировать или изменять эти версии учебников, их содержание или обложки, поскольку они содержат соответствующие бренды Siyavula, спонсорские логотипы и одобрены Департаментом базового образования. Для получения дополнительной информации посетите Creative Commons Attribution-NoDerivs 3.0 Непортированный.
Узнайте больше о спонсорстве и партнерстве с другими, которые сделали возможным выпуск каждого из открытых учебников.
CC-BY (версии без марочного обозначения)
Эти небрендированные версии одного и того же контента доступны для вас, чтобы вы могли делиться ими, адаптировать, трансформировать, модифицировать или дополнять их любым способом, с единственным требованием — дать соответствующую оценку Siyavula.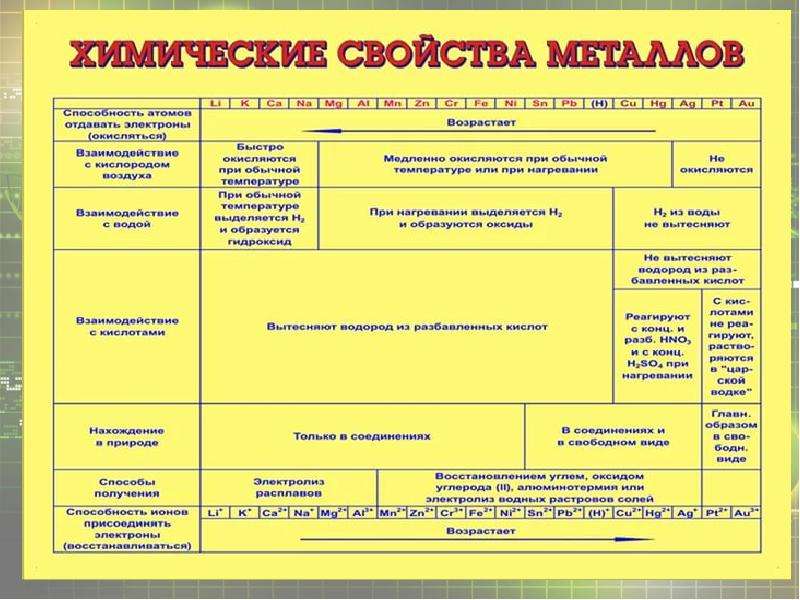 Для получения дополнительной информации посетите Creative Commons Attribution 3.0 Unported.
Для получения дополнительной информации посетите Creative Commons Attribution 3.0 Unported.
1.3 Физические и химические свойства — Химия
Цели обучения
К концу этого раздела вы сможете:
- Определять свойства и изменения в веществе как физические или химические
- Определять свойства материи как экстенсивные или интенсивные
Характеристики, позволяющие отличить одно вещество от другого, называются свойствами. Физическое свойство — это характеристика вещества, не связанная с изменением его химического состава.Знакомые примеры физических свойств включают плотность, цвет, твердость, точки плавления и кипения, а также электропроводность. Мы можем наблюдать некоторые физические свойства, такие как плотность и цвет, без изменения физического состояния наблюдаемой материи. Другие физические свойства, такие как температура плавления железа или температура замерзания воды, можно наблюдать только по мере того, как материя претерпевает физические изменения. Физическое изменение — это изменение состояния или свойств материи без какого-либо сопутствующего изменения ее химического состава (идентичности веществ, содержащихся в материи).Мы наблюдаем физические изменения, когда воск тает, когда сахар растворяется в кофе и когда пар конденсируется в жидкую воду (рис. 1). Другие примеры физических изменений включают намагничивание и размагничивание металлов (как это делается с обычными бирками для защиты от кражи) и измельчение твердых частиц в порошки (которые иногда могут приводить к заметным изменениям цвета). В каждом из этих примеров происходит изменение физического состояния, формы или свойств вещества, но не изменяется его химический состав.
Физическое изменение — это изменение состояния или свойств материи без какого-либо сопутствующего изменения ее химического состава (идентичности веществ, содержащихся в материи).Мы наблюдаем физические изменения, когда воск тает, когда сахар растворяется в кофе и когда пар конденсируется в жидкую воду (рис. 1). Другие примеры физических изменений включают намагничивание и размагничивание металлов (как это делается с обычными бирками для защиты от кражи) и измельчение твердых частиц в порошки (которые иногда могут приводить к заметным изменениям цвета). В каждом из этих примеров происходит изменение физического состояния, формы или свойств вещества, но не изменяется его химический состав.
Изменение одного типа вещества в другой тип (или невозможность изменения) является химическим веществом недвижимость . Примеры химических свойств включают воспламеняемость, токсичность, кислотность, реакционную способность (многие типы) и теплоту сгорания.Железо, например, соединяется с кислородом в присутствии воды с образованием ржавчины; хром не окисляется (рис. 2). Нитроглицерин очень опасен, потому что легко взрывается; неон почти не представляет опасности, потому что он очень инертен.
Примеры химических свойств включают воспламеняемость, токсичность, кислотность, реакционную способность (многие типы) и теплоту сгорания.Железо, например, соединяется с кислородом в присутствии воды с образованием ржавчины; хром не окисляется (рис. 2). Нитроглицерин очень опасен, потому что легко взрывается; неон почти не представляет опасности, потому что он очень инертен.
Чтобы определить химическое свойство, мы ищем химическое изменение.Химическое изменение всегда производит один или несколько типов материи, которые отличаются от материи, существовавшей до изменения. Образование ржавчины — это химическое изменение, потому что ржавчина — это другой тип вещества, чем железо, кислород и вода, присутствовавшие до образования ржавчины. Взрыв нитроглицерина — это химическое изменение, потому что образующиеся газы представляют собой вещества, очень отличающиеся от исходного вещества. Другие примеры химических изменений включают реакции, которые проводятся в лаборатории (например, взаимодействие меди с азотной кислотой), все формы горения (горения) и приготовление, переваривание или гниение пищи (рис. 3).
Взрыв нитроглицерина — это химическое изменение, потому что образующиеся газы представляют собой вещества, очень отличающиеся от исходного вещества. Другие примеры химических изменений включают реакции, которые проводятся в лаборатории (например, взаимодействие меди с азотной кислотой), все формы горения (горения) и приготовление, переваривание или гниение пищи (рис. 3).
Свойства материи можно разделить на две категории. Если свойство зависит от количества присутствующего вещества, это обширное свойство . Масса и объем вещества являются примерами обширных свойств; например, галлон молока имеет большую массу и объем, чем чашка молока. Стоимость обширной собственности прямо пропорциональна количеству рассматриваемого вещества.Если свойство образца вещества не зависит от количества присутствующего вещества, это интенсивное свойство . Температура — это пример интенсивного свойства. Если галлон и чашка молока имеют температуру 20 ° C (комнатная температура), при их объединении температура остается на уровне 20 ° C. В качестве другого примера рассмотрим различные, но взаимосвязанные свойства тепла и температуры. Брызги горячего кулинарного масла на руку вызывают кратковременный небольшой дискомфорт, тогда как горшок с горячим маслом вызывает серьезные ожоги.И капля, и горшок с маслом имеют одинаковую температуру (интенсивное свойство), но горшок явно содержит гораздо больше тепла (экстенсивное свойство).
Если свойство зависит от количества присутствующего вещества, это обширное свойство . Масса и объем вещества являются примерами обширных свойств; например, галлон молока имеет большую массу и объем, чем чашка молока. Стоимость обширной собственности прямо пропорциональна количеству рассматриваемого вещества.Если свойство образца вещества не зависит от количества присутствующего вещества, это интенсивное свойство . Температура — это пример интенсивного свойства. Если галлон и чашка молока имеют температуру 20 ° C (комнатная температура), при их объединении температура остается на уровне 20 ° C. В качестве другого примера рассмотрим различные, но взаимосвязанные свойства тепла и температуры. Брызги горячего кулинарного масла на руку вызывают кратковременный небольшой дискомфорт, тогда как горшок с горячим маслом вызывает серьезные ожоги.И капля, и горшок с маслом имеют одинаковую температуру (интенсивное свойство), но горшок явно содержит гораздо больше тепла (экстенсивное свойство).
Алмаз опасности
Вы могли видеть символ, показанный на Рисунке 4, на контейнерах с химическими веществами в лаборатории или на рабочем месте. Этот алмаз с химической опасностью, который иногда называют «огненным алмазом» или «опасным алмазом», дает ценную информацию, которая кратко описывает различные опасности, о которых следует помнить при работе с определенным веществом.
Рис. 4. Алмазный алмаз Национального агентства противопожарной защиты (NFPA) обобщает основные опасности химического вещества. Национальное агентство противопожарной защиты (NFPA) 704 Система идентификации опасностей была разработана NFPA для предоставления информации о безопасности определенных веществ. Система детализирует воспламеняемость, реактивность, здоровье и другие опасности. Верхний (красный) ромб внутри общего символа ромба указывает уровень пожарной опасности (диапазон температур для точки вспышки).Синий (левый) ромб указывает на степень опасности для здоровья. Желтый (правый) ромб указывает на опасность реакционной способности, например, насколько легко вещество подвергнется детонации или сильному химическому изменению. Белый (нижний) ромб указывает на особые опасности, например, если он является окислителем (который позволяет веществу гореть в отсутствие воздуха / кислорода), вступает в необычную или опасную реакцию с водой, является коррозионным, кислотным, щелочным, биологическая опасность, радиоактивность и т. д. Каждая опасность оценивается по шкале от 0 до 4, где 0 означает отсутствие опасности, а 4 — чрезвычайно опасную.
Желтый (правый) ромб указывает на опасность реакционной способности, например, насколько легко вещество подвергнется детонации или сильному химическому изменению. Белый (нижний) ромб указывает на особые опасности, например, если он является окислителем (который позволяет веществу гореть в отсутствие воздуха / кислорода), вступает в необычную или опасную реакцию с водой, является коррозионным, кислотным, щелочным, биологическая опасность, радиоактивность и т. д. Каждая опасность оценивается по шкале от 0 до 4, где 0 означает отсутствие опасности, а 4 — чрезвычайно опасную.
Хотя многие элементы сильно различаются по своим химическим и физическим свойствам, некоторые элементы обладают схожими свойствами. Мы можем идентифицировать наборы элементов, которые демонстрируют общее поведение. Например, многие элементы хорошо проводят тепло и электричество, а другие плохо проводят. Эти свойства можно использовать для сортировки элементов по трем классам: металлы (элементы с хорошей проводимостью), неметаллы (элементы с плохой проводимостью) и металлоиды (элементы, обладающие свойствами как металлов, так и неметаллов).
Периодическая таблица — это таблица элементов, в которой элементы с похожими свойствами расположены близко друг к другу (рис. 4). Вы узнаете больше о таблице Менделеева, продолжая изучать химию.
Рис. 4. Периодическая таблица показывает, как элементы могут быть сгруппированы по определенным схожим свойствам. Обратите внимание, что цвет фона указывает, является ли элемент металлом, металлоидом или неметаллом, тогда как цвет символа элемента указывает, является ли элемент твердым, жидким или газообразным. Все вещества обладают определенными физическими и химическими свойствами и могут претерпевать физические или химические изменения. Физические свойства, такие как твердость и температура кипения, и физические изменения, такие как плавление или замерзание, не влекут за собой изменение состава вещества. Химические свойства, такие как воспламеняемость и кислотность, а также химические изменения, такие как ржавление, приводят к образованию вещества, которое отличается от того, что было раньше.
Измеримые свойства делятся на две категории.Обширные свойства зависят от количества присутствующего вещества, например, от массы золота. Интенсивные свойства не зависят от количества присутствующего вещества, например, плотности золота. Тепло — это пример экстенсивного свойства, а температура — пример интенсивного свойства.
Химия: упражнения в конце главы
- Классифицируйте шесть подчеркнутых свойств в следующем абзаце как химические или физические:
Фтор — это бледно-желтый газ , который реагирует с большинством веществ .Свободный элемент плавится при −220 ° C и кипит при −188 ° C . Мелкодисперсные металлы горят ярким пламенем во фторе . Девятнадцать граммов фтора вступят в реакцию с 1,0 граммами водорода .
- Классифицируйте каждое из следующих изменений как физические или химические:
(а) конденсация пара
(б) сжигание бензина
(в) сквашивание молока
(г) растворение сахара в воде
(д) плавка золота
- Классифицируйте каждое из следующих изменений как физические или химические:
(а) сжигание угля
(б) таяние льда
(c) смешивание шоколадного сиропа с молоком
(г) взрыв петарды
(д) намагничивание отвертки
- Объем пробы газообразного кислорода изменился с 10 мл до 11 мл при изменении температуры.
 Это химическое или физическое изменение?
Это химическое или физическое изменение? - 2,0-литровый объем газообразного водорода в сочетании с 1,0 литром газообразного кислорода для получения 2,0 литров водяного пара. Кислород претерпевает химические или физические изменения?
- Объясните разницу между экстенсивными и интенсивными свойствами.
- Укажите следующие свойства: экстенсивные или интенсивные.
(а) том
(б) температура
(в) влажность
(г) тепло
(e) точка кипения
- Плотность (d) вещества — это интенсивное свойство, которое определяется как отношение его массы (m) к его объему (V).
[латекс] \ text {density} = \ frac {\ text {mass}} {\ text {volume}} [/ latex] [latex] \ text {d} = \ frac {\ text {m}} {\ текст {V}} [/ latex]
Учитывая, что масса и объем являются экстенсивными свойствами, объясните, почему их соотношение, плотность, является интенсивным.


 И.
И.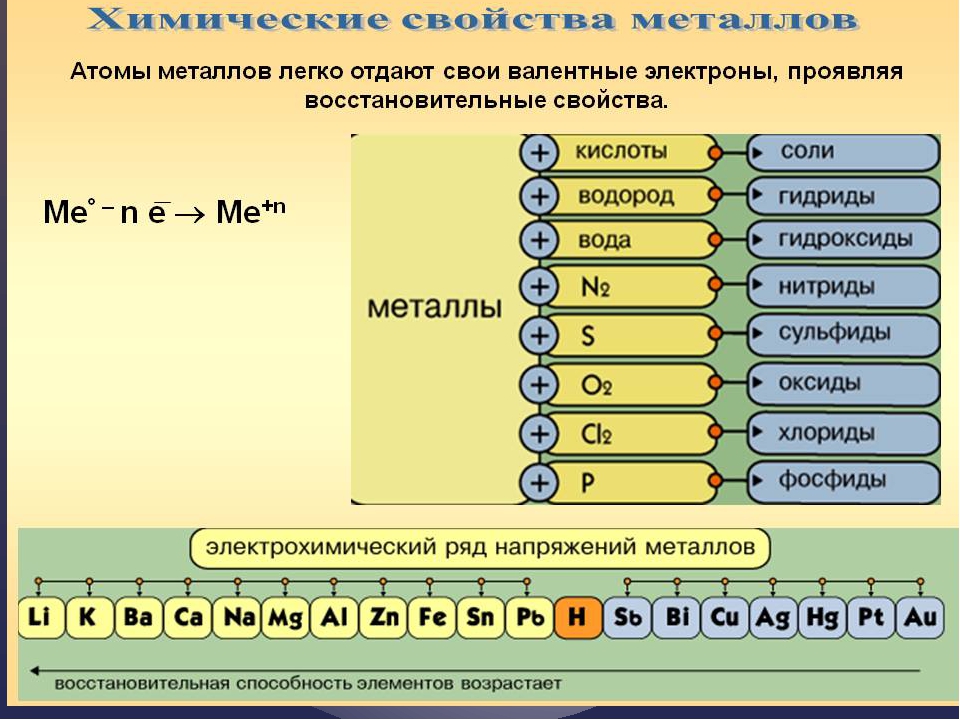 ученики в ходе урока
ученики в ходе урока Их число
соотносилось числу известных тогда
планет. Сатурн – свинец, Меркурий
– ртуть, Марс – железо, Луна –
серебро, Солнце – золото, Венера –
медь, Юпитер – олово. Алхимики
считали, что излучения этих планет
рождают в недрах Земли металлы. Вы
знаете намного больше алхимиков и
мы сегодня продолжим изучать свойства
металлов.
Их число
соотносилось числу известных тогда
планет. Сатурн – свинец, Меркурий
– ртуть, Марс – железо, Луна –
серебро, Солнце – золото, Венера –
медь, Юпитер – олово. Алхимики
считали, что излучения этих планет
рождают в недрах Земли металлы. Вы
знаете намного больше алхимиков и
мы сегодня продолжим изучать свойства
металлов.



 Назовите химические
свойства металлов.
Назовите химические
свойства металлов. Посмотрите на экран и улыбнитесь
вместе со мной.
Посмотрите на экран и улыбнитесь
вместе со мной.
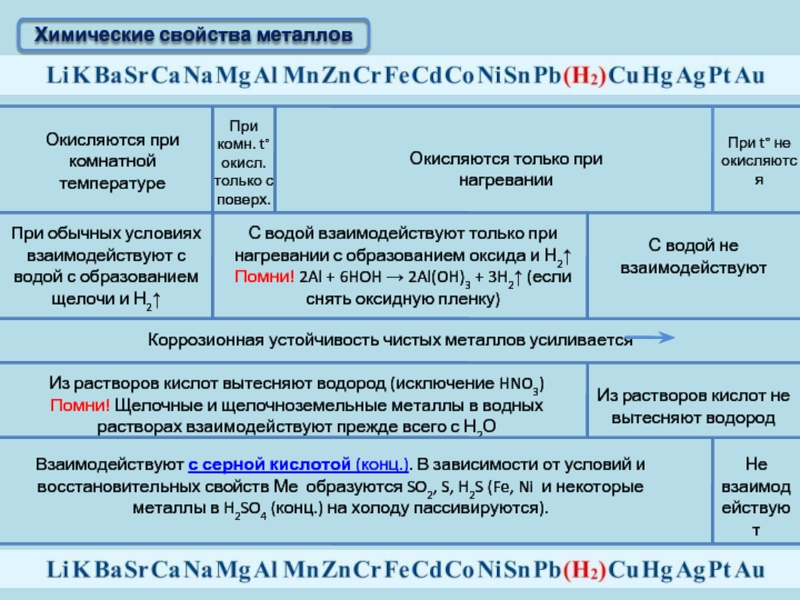 Исключение составляют алмаз и графит.
Исключение составляют алмаз и графит.