Чистые вещества — урок. Химия, 8–9 класс.
В античные времена древнегреческими учёными было сформулировано предположение, которое позже полностью подтвердилось — о том, что вещества состоят из мельчайших невидимых глазу частиц.
Например, вода состоит из одинаковых частиц, называемых молекулами воды. Сахар состоит из одинаковых частиц, называемых молекулами сахара. Вода и сахар — это чистые вещества.
Чистыми веществами называются вещества, которые состоят из частиц одинакового вида.
Если же сахар смешать с водой, происходит диффузия — молекулы сахара проникают между молекулами воды. Образуется раствор, в состав которого входят как молекулы воды, так и молекулы сахара.Раствор — это смесь веществ.
Смесями называют вещества, в состав которых входят частицы разного вида.
Все вещества являются либо чистыми, либо смесями.
Чистые вещества состоят из частиц одного вида, а смеси — из частиц разного вида.
Кроме веществ, состоящих из молекул, существуют вещества, имеющие немолекулярное строение.
Например, металлы и инертные газы состоят не из молекул, а из более мелких частиц — атомов.
Таким образом, медь состоит только из атомов меди, а цинк состоит только из атомов цинка. Медь и цинк — чистые вещества. Если к меди добавить цинк и сильно нагреть, получится сплав, который называют латунью.
Латунь — это смесь, в состав которой входят как атомы меди, так и атомы цинка.
Существуют вещества немолекулярного строения, состоящие из частиц другого вида, называемых ионами. В состав ионных соединений входят не электрически нейтральные атомы или молекулы, а частицы, несущие на себе положительный или отрицательный заряд.
Примером таких веществ может служить хлорид натрия, то есть обычная поваренная соль, кристаллы которой состоят из положительно заряженных ионов натрия и отрицательно заряженных ионов хлора. Поваренная соль является чистым веществом. Если же её растворить в воде, образуется раствор, который является смесью двух веществ — воды и поваренной соли.
Сравнение чистых веществ и смесей
| Чистые вещества | |
| Состав | Чистое вещество состоит из частиц одного вида. Например, вода состоит только из молекул воды.
Чистое вещество имеет постоянный состав. Например, любая молекула воды состоит из двух атомов химического элемента водорода и одного атома химического элемента кислорода. | Смесь состоит из частиц разного вида.
Смесь не имеет постоянного состава: содержание отдельных составных частей одной и той же смеси может быть разным. Условно говоря, в стакане воды можно растворить и одну чайную ложку сахара, и две. |
| Свойства | Чистое вещество имеет постоянные свойства. | В смеси каждое вещество в основном сохраняет свои свойства. Например, железо так же, как обычно, притягивается магнитом, поваренная соль остаётся солёной.
Физические свойства смеси отчасти меняются с изменением её количественного состава. |
Обрати внимание!
Следует иметь в виду, что идеально чистых веществ не существует, поскольку ни одно из веществ невозможно полностью очистить от содержащихся в нём примесей.
Какое же вещество в таком случае на практике считается чистым?Практически чистым (чистым) называют вещество, в котором содержание примесей столь ничтожно, что эти примеси существенным образом не влияют на его свойства.
Например, образец практически чистой воды бесцветный, без вкуса и запаха, имеет температуру кристаллизации \(0\) °С, температуру кипения \(+100\) °С, плотность при температуре \(+4\) °С равную \(1000\) кг/м³ и не проводит электрический ток.
Чистые вещества: кислород, дистиллированная вода, рафинированный сахар
В некоторых отраслях науки и техники используют особо чистые вещества.
В банках золото хранится в слитках, массовая доля благородного металла в которых составляет \(99,9\) %; в технике для изготовления электронных приборов и микросхем используется кремний, чистота которого составляет \(99,999\) %.
В природе, в технике и в повседневной жизни большей частью приходится иметь дело со смесями. Так, смесью является воздух, природная вода, почва, биологические жидкости, пища и многое другое.
Смеси бывают двух видов: однородные (гомогенные) и неоднородные (гетерогенные).
Урок №4. Чистые вещества и смеси. Способы разделения смесей
I. Новый материал
При подготовке урока использованы материалы автора: Н.К.Черемисиной,
учителя химии средней школы № 43
(г. Калининград), Источник
Мы живем среди химических веществ. Мы вдыхает воздух,
а это смесь газов (азота, кислорода и других), выдыхаем углекислый
газ. Умываемся водой — это еще одно вещество, самое распространенное
на Земле. Пьём молоко — смесь воды с мельчайшими капельками
молочного жира, и не только: здесь еще есть молочный белок казеин,
минеральные соли, витамины и даже сахар, но не тот, с которым
пьют чай, а особый, молочный — лактоза. Едим яблоки, которые состоят из
целого набора химических веществ — здесь и сахар, и яблочная кислота,
и витамины… Когда прожеванные кусочки яблока попадают в желудок, на
них начинают действовать пищеварительные соки человека, которые помогают
усваивать все вкусные и полезные вещества не только яблока, но и любой другой
пищи.
Чем же отличаются чистые вещества от смесей веществ?
Индивидуальное чистое вещество обладает определённым
набором характеристических свойств (постоянными физическими свойствами). Только
чистая дистиллированная вода имеет tпл = 0 °С, tкип= 100 °С, не имеет вкуса.
Морская вода замерзает при более низкой, а закипает при более высокой
температуре, вкус у нее горько-соленый. Вода Черного моря замерзает при более
низкой, а закипает при более высокой температуре, чем вода Балтийского моря.
Сравнительная характеристика смеси и чистого вещества
Признаки сравнения | Чистое вещество | Смесь |
Постоянный | Непостоянный | |
Вещества | Одно и то же | Различные |
Физические свойства | Постоянные | Непостоянные |
Изменение энергии при образовании | Происходит | Не происходит |
Разделение | С помощью химических реакций | Физическими методами |
Смеси отличаются друг от друга по внешнему виду.
Классификация смесей показана в таблице:
Приведём примеры суспензий (речной песок + вода), эмульсий (растительное масло + вода) и растворов (воздух в колбе, поваренная соль + вода, разменная монета: алюминий + медь или никель + медь).
В суспензиях видны частицы твердого вещества, в эмульсиях – капельки жидкости, такие смеси называются неоднородными (гетерогенными), а в растворах компоненты не различимы, они являются однородными (гомогенными) смесями.
Способы разделения смесей
В природе вещества существуют в виде смесей. Для лабораторных исследований, промышленных производств, для нужд фармакологии и медицины нужны чистые вещества.
Для очистки
веществ применяются различные способы разделения смесей
Эти способы основаны на различиях в физических свойствах компонентов смеси.
Рассмотрим способы разделения гетерогенных и гомогенных смесей.
Пример смеси | Способ разделения |
Суспензия – смесь речного песка с водой | Отстаивание Разделение отстаиванием основано на различных плотностях веществ. Более тяжелый песок оседает на дно. Так же можно разделить и эмульсию: отделить нефть или растительное масло от воды. В лаборатории это можно сделать с помощью делительной воронки. Нефть или растительное масло образует верхний, более легкий слой. В результате отстаивания выпадает роса из тумана, осаждается сажа из дыма, отстаиваются сливки в молоке. Разделение смеси воды и растительного масла отстаиванием |
Смесь песка и поваренной соли в воде | Фильтрование На чем основано разделение гетерогенных смесей с
помощью фильтрования?На различной растворимости веществ в воде и на
различных размерах частиц. Разделение смеси крахмала и воды фильтрованием |
Смесь порошка железа и серы | Действие магнитом или водой Порошок железа притягивался магнитом, а порошок серы
– нет. Несмачивающийся порошок серы всплывал на поверхность воды, а тяжелый смачивающийся порошок железа оседал на дно. Разделение смеси серы и железа с помощью магнита и воды |
Раствор соли в воде – гомогенная смесь | Выпаривание или кристаллизация Вода испаряется, а в фарфоровой чашке остаются
кристаллы соли. При выпаривании воды из озер Эльтон и Баскунчак получают
поваренную соль. Этот способ разделения основан на различии в температурах
кипения растворителя и растворенного вещества.Если вещество, например сахар,
разлагается при нагревании, то воду испаряют неполностью – упаривают раствор,
а затем из насыщенного раствора осаждают кристаллы сахара.Иногда требуется
очистить от примесей растворители с меньшей температурой кипения, например
воду от соли. В этом случае пары вещества необходимо собрать и затем
сконденсировать при охлаждении. Такой способ разделения гомогенной смеси
называется дистилляцией, или перегонкой. Если же разделять смесь спирта и воды, то первым будет отгоняться (собираться в пробирке-приемнике) спирт с tкип = 78 °С, а в пробирке останется вода. Перегонка используется для получения бензина, керосина, газойля из нефти. |
Особым методом разделения компонентов, основанным на различной поглощаемости их определенным веществом, является хроматография.
Дома вы можете проделать следующий опыт. Подвесьте
полоску из фильтровальной бумаги над сосудом с красными чернилами, погружая в
них лишь конец полоски. Раствор впитывается бумагой и поднимается по ней. Но
граница подъема краски отстает от границы подъема воды. Так происходит
разделение двух веществ: воды и красящего вещества в чернилах.
С помощью хроматографии русский ботаник М. С. Цвет впервые выделил хлорофилл из зеленых частей растений. В промышленности и лабораториях вместо фильтровальной бумаги для хроматографии используют крахмал, уголь, известняк, оксид алюминия. А всегда ли требуются вещества с одинаковой степенью очистки?
Для различных целей необходимы вещества с различной степенью очистки. Воду для приготовления пищи достаточно отстоять для удаления примесей и хлора, используемого для ее обеззараживания. Воду для питья нужно предварительно прокипятить. А в химических лабораториях для приготовления растворов и проведения опытов, в медицине необходима дистиллированная вода, максимально очищенная от растворенных в ней веществ. Особо чистые вещества, содержание примесей в которых не превышает одной миллионной процента, применяются в электронике, в полупроводниковой, ядерной технике и других точных отраслях промышленности.
Прочитайте стихотворение Л. Мартынова «Дистиллированная вода»:
Вода
Благоволила
Литься!
Она
Блистала
Столь чиста,
Что ни напиться,
Ни умыться.
И это было неспроста.
Ивы, тала
И горечи цветущих лоз,
Ей водорослей не хватало
И рыбы, жирной от стрекоз.
Ей не хватало быть волнистой,
Ей не хватало течь везде.
Ей жизни не хватало
Чистой –
Дистиллированной воде!
Применение дистиллированной воды
II. Задания для закрепления
1) Поработайте с тренажёрами №1-4 (необходимо загрузить тренажёр)
Тренажёр №1. Чистые вещества и смеси
Тренажёр №2. Смеси
Тренажёр №3. Смеси в природе
Тренажёр №4. Смеси в сельском хозяйстве
2) Решите задачу:
Дана смесь сахара, речного песка и железных опилок. Предложите способ разделения этой смеси.3) Творческое задание:
Подготовьте электронную презентацию на тему «Чистые вещества и смеси, которые нас окружают»
Конспект урока по химии «Чистые вещества и смеси»
Конспект урока для 8 класса Чистые вещества и смеси
Тип урока. Изучение нового материала.
Изучение нового материала.
Цели урока. Обучающие – изучить понятия «чистое вещество» и «смесь», однородные (гомогенные) и неоднородные (гетерогенные) смеси, рассмотреть способы разделения смесей, научить учащихся разделять смеси на компоненты.
Развивающие – развить интеллектуальные и познавательные умения учащихся: выделять существенные признаки и свойства, устанавливать причинно-следственные связи, классифицировать, анализировать, делать выводы, выполнять опыты, наблюдать, оформлять наблюдения в виде таблиц, схем.
Воспитательные – содействовать воспитанию у учащихся организованности, аккуратности при проведении эксперимента, умения организовывать взаимопомощь при работе в парах, духа соревновательности при выполнении упражнений.
Методы обучения. Методы организации учебно-познавательной деятельности – словесные (эвристическая беседа), наглядные (таблицы, рисунки, демонстрации опытов), практические (лабораторные работы, выполнение упражнений).
Методы стимулирования интереса к учению – познавательные игры, учебные дискуссии.
Методы контроля – устный контроль, письменный контроль, экспериментальный контроль.
Оборудование и реактивы. На столах учащихся – листы бумаги, ложечки для веществ, стеклянные палочки, стаканы с водой, магниты, порошки серы и железа.
На столе учителя – ложечки, пробирки, держатель для пробирок, спиртовка, магнит, вода, химические стаканы, штатив с кольцом, штатив с лапкой, воронка, стеклянные палочки, фильтры, фарфоровая чашка, делительная воронка, пробирка с газоотводной трубкой, пробирка-приемник, «стакан-холодильник» с водой, лента фильтровальной бумаги (2х10 см), красные чернила, колба, сито, порошки железа и серы в массовом отношении 7 : 4, речной песок, поваренная соль, растительное масло, раствор медного купороса, манная, гречневая крупы.
ХОД УРОКА
Организационный момент
Отметить отсутствующих, объяснить цели урока и познакомить учащихся с его планом.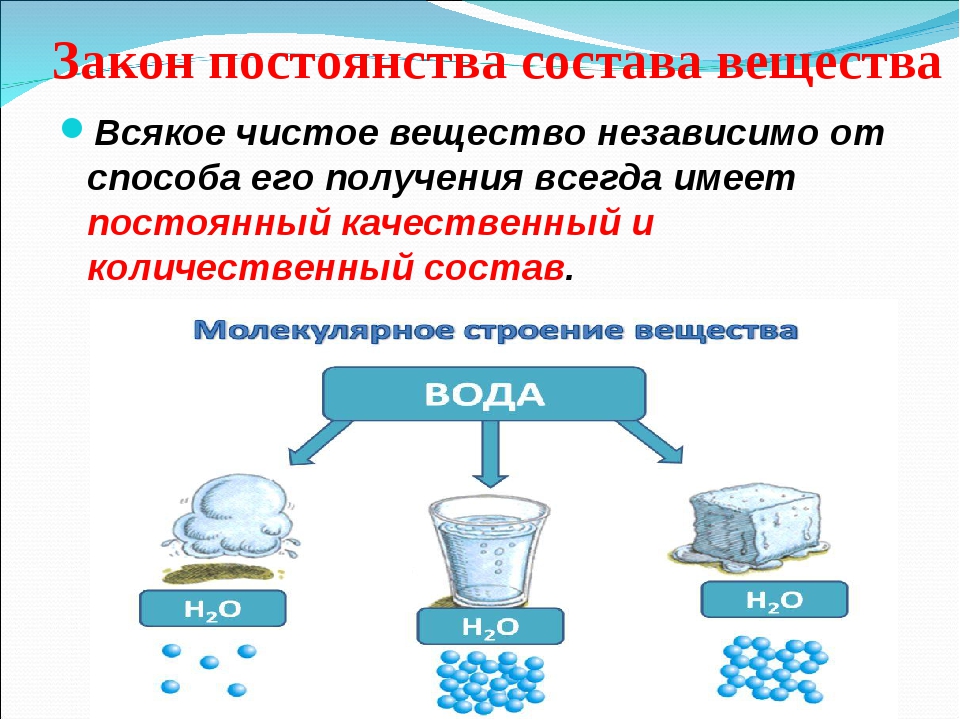
П л а н у р о к а
1. Чистые вещества и смеси. Отличительные особенности.
2. Однородные и неоднородные смеси.
3. Способы разделения смесей.
Беседа по теме «Вещества и их свойства»
Учитель. Вспомните, что изучает химия.
Ученик. Вещества, свойства веществ, изменения, происходящие с веществами, т.е. превращения веществ.
Учитель. Что называется веществом?
Ученик. Вещество – это то, из чего состоит физическое тело.
Учитель. Вы знаете, что вещества бывают простыми и сложными. Какие вещества называются простыми, а какие – сложными?
Ученик. Простые вещества состоят из атомов одного химического элемента, сложные – из атомов различных химических элементов.
Учитель. Какие физические свойства имеют вещества?
Ученик. Агрегатное состояние, температуры плавления, кипения, электро- и теплопроводность, растворимость в воде и др.
Объяснение нового материала
Чистые вещества и смеси.
Отличительные особенности
Учитель. Постоянные физические свойства имеют только чистые вещества. Только чистая дистиллированная вода имеет tпл = 0 °С, tкип = 100 °С, не имеет вкуса. Морская вода замерзает при более низкой, а закипает при более высокой температуре, вкус у нее горько-соленый. Вода Черного моря замерзает при более низкой, а закипает при более высокой температуре, чем вода Балтийского моря. Почему? Дело в том, что в морской воде содержатся другие вещества, например растворенные соли, т.е. она представляет собой смесь различных веществ, состав которой меняется в широких пределах, свойства же смеси не являются постоянными. Определение понятия «смесь» было дано в XVII в. английским ученым Робертом Бойлем: «Смесь – целостная система, состоящая из разнородных компонентов».
Рассмотрим отличительные особенности смеси и чистого вещества. Для этого проделаем следующие опыты.
Опыт 1. Используя инструкцию к опыту, изучите существенные физические свойства порошков железа и серы, приготовьте смесь этих порошков и определите, сохраняют ли эти вещества свои свойства в смеси.
Инструкция для учащихся к опыту«Приготовление и изучение смеси железа и серы»
1. Насыпьте на лист бумаги отдельными кучками порошки серы и железа, рассмотрите их цвет.
2. Возьмите небольшую часть каждого вещества и проведите следующие операции:
а) испытайте магнитом;
б) опустите в стакан с водой.
3. Смешайте стеклянной палочкой оба порошка на бумаге, рассмотрите цвет смеси.
4. Проведите со смесью те же операции, что и с чистыми веществами.
Обсуждение с учащимися результатов проведенного опыта.
Учитель. Опишите агрегатное состояние и цвет серы.
Ученик. Сера – твердое вещество желтого цвета.
Учитель. Каковы агрегатное состояние и цвет железа в виде порошка?
Ученик. Железо – твердое серое вещество.
Железо – твердое серое вещество.
Учитель. Как эти вещества относятся: а) к магниту; б) к воде?
Ученик. Железо притягивается магнитом, а сера – нет; в воде порошок железа тонет, т.к. железо тяжелее воды, а порошок серы всплывает на поверхность воды, т. к. не смачивается водой.
Учитель. Что можно сказать о соотношении железа и серы в смеси?
Ученик. Соотношение железа и серы в смеси может быть различным, т.е. непостоянным.
Учитель. Сохраняются ли свойства железа и серы в смеси?
Ученик. Да, свойства каждого вещества в смеси сохраняются.
Учитель. Как можно разделить смесь серы и железа?
Ученик. Это можно сделать физическими методами: магнитом или водой.
Учитель. Опыт 2. Сейчас я покажу реакцию взаимодействия серы и железа. Ваша задача внимательно наблюдать этот опыт и определить, сохраняют ли свои свойства железо и сера в полученном в результате реакции сульфиде железа(II) и можно ли выделить из него железо и серу физическими методами.
Я тщательно перемешиваю порошки железа и серы в массовом отношении 7 : 4:
m(Fе) : m(S) = Аr(Fе) : Аr(S) = 56 : 32 = 7 : 4,
помещаю смесь в пробирку, прогреваю в пламени спиртовки, сильно накаливаю в одном месте и прекращаю нагревание, когда начинается бурная экзотермическая реакция. После остывания пробирки осторожно разбиваю ее, предварительно завернув в полотенце, и извлекаю содержимое. Внимательно посмотрите на полученное вещество – сульфид железа(II). Видны ли в нем отдельно серый порошок железа и желтый — серы?
Ученик. Нет, полученное вещество имеет темно-серый цвет.
Учитель. Затем испытываю полученное вещество магнитом. Разделяются ли железо и сера?
Ученик. Нет, полученное вещество не намагничивается.
Учитель. Помещаю сульфид железа(II) в воду. Что вы наблюдаете при этом?
Ученик. Сульфид железа(II) тонет в воде.
Сульфид железа(II) тонет в воде.
Учитель. Сохраняют ли сера и железо свои свойства, входя в состав сульфида железа(II)?
Ученик. Нет, новое вещество обладает свойствами, отличными от свойств взятых для реакции веществ.
Учитель. Можно ли разделить сульфид железа(II) физическими методами на простые вещества?
Ученик. Нет, ни магнит, ни вода не могут разделить сульфид железа(II) на железо и серу.
Учитель. Происходит ли изменение энергии при образовании химического вещества?
Ученик. Да, например, при взаимодействии железа и серы энергия выделяется.
Учитель. Занесем результаты обсуждения опытов в таблицу.
Таблица
Сравнительная характеристика смеси и чистого вещества
Для закрепления этой части урока выполните упражнение: определите, где на рисунке (см. с. 34) изображено простое вещество, сложное вещество или смесь.
Однородные и неоднородные смеси
Учитель. Выясним, отличаются ли смеси по внешнему виду друг от друга.
Учитель демонстрирует примеры суспензий (речной песок + вода), эмульсии (растительное масло + вода) и растворов (воздух в колбе, поваренная соль + вода, разменная монета: алюминий + медь или никель + медь).
Учитель. В суспензиях видны частицы твердого вещества, в эмульсиях – капельки жидкости, такие смеси называются неоднородными (гетерогенными), а в растворах компоненты не различимы, они являются однородными (гомогенными) смесями. Рассмотрим схему классификации смесей (схема 1).
Схема 1
Приведите примеры каждого вида смесей: суспензий, эмульсий и растворов.
Способы разделения смесей
Учитель. В природе вещества существуют в виде смесей. Для лабораторных исследований, промышленных производств, для нужд фармакологии и медицины нужны чистые вещества.
Для очистки веществ применяются различные способы разделения смесей (схема 2).
Схема 2
Эти способы основаны на различиях в физических свойствах компонентов смеси.
Рассмотрим способы разделения гетерогенных смесей.
Как можно разделить суспензию – смесь речного песка с водой, т. е. очистить воду от песка?
Ученик. Отстаиванием, а затем фильтрованием.
Учитель. Верно. Разделение отстаиванием основано на различных плотностях веществ. Более тяжелый песок оседает на дно. Так же можно разделить и эмульсию: отделить нефть или растительное масло от воды. В лаборатории это можно сделать с помощью делительной воронки. Нефть или растительное масло образует верхний, более легкий слой. (Учитель демонстрирует соответствующие опыты.)
В результате отстаивания выпадает роса из тумана, осаждается сажа из дыма, отстаиваются сливки в молоке.
А на чем основано разделение гетерогенных смесей с помощью фильтрования?
Ученик. На различной растворимости веществ в воде и на различных размерах частиц.
Учитель. Верно, через поры фильтра проходят лишь соизмеримые с ними частицы веществ, в то время как более крупные частицы задерживаются на фильтре. Так можно разделить гетерогенную смесь поваренной соли и речного песка.
Ученик показывает опыт: наливает в смесь песка и соли воду, перемешивает, а затем пропускает взвесь (суспензию) через фильтр – раствор соли в воде проходит через фильтр, а крупные частицы нерастворимого в воде песка остаются на фильтре.
Учитель. А какие вещества можно использовать в качестве фильтров?
Ученик. В качестве фильтров можно использовать различные пористые вещества: вату, уголь, обожженную глину, прессованное стекло и другие.
Учитель. Какие примеры применения фильтрования в жизни человека вы можете привести?
Ученик. Способ фильтрования – это основа работы бытовой техники, например пылесосов. Его используют хирурги – марлевые повязки; буровики и рабочие элеваторов – респираторные маски. С помощью чайного ситечка для фильтрования чаинок Остапу Бендеру – герою произведения Ильфа и Петрова – удалось забрать один из стульев у Эллочки Людоедки («Двенадцать стульев»).
Учитель. А теперь, познакомившись с этими способами разделения смеси, давайте поможем героине русской народной сказки «Василиса Прекрасная».
Ученик. В этой сказке Баба-Яга приказала Василисе отделить рожь от чернушки и мак от земли. Героине сказки помогли голуби. Мы же теперь можем разделить крупы фильтрованием через сито, если крупинки имеют разные размеры, или взбалтыванием с водой, если частицы имеют разную плотность или различную смачиваемость водой. Возьмем в качестве примера смесь, состоящую из крупинок различного размера: смесь манной и гречневой круп. (Ученик показывает, как манка с меньшими размерами частиц проходит через сито, а гречка остается на нем.)
Учитель. А вот со смесью веществ, имеющих разную смачиваемость водой, вы сегодня уже знакомились. О какой смеси я говорю?
Ученик. Речь идет о смеси порошков железа и серы. Мы проводили с этой смесью лабораторный опыт.
Учитель. Вспомните, как вы разделяли такую смесь.
Ученик. С помощью отстаивания в воде и с помощью магнита.
Учитель. Что вы наблюдали, разделяя смесь порошков железа и серы с помощью воды?
Ученик. Несмачивающийся порошок серы всплывал на поверхность воды, а тяжелый смачивающийся порошок железа оседал на дно.
Учитель. А как происходило разделение этой смеси с помощью магнита?
Ученик. Порошок железа притягивался магнитом, а порошок серы – нет.
Учитель. Итак, мы познакомились с тремя способами разделения гетерогенных смесей: отстаиванием, фильтрованием и действием магнитом. А теперь рассмотрим способы разделения гомогенных (однородных) смесей. Вспомните, после отделения фильтрованием песка мы получили раствор соли в воде – гомогенную смесь. Как из раствора выделить чистую соль?
Ученик. Выпариванием или кристаллизацией.
Учитель демонстрирует опыт: вода испаряется, а в фарфоровой чашке остаются кристаллы соли.
Учитель. При выпаривании воды из озер Эльтон и Баскунчак получают поваренную соль. Этот способ разделения основан на различии в температурах кипения растворителя и растворенного вещества.
Если вещество, например сахар, разлагается при нагревании, то воду испаряют неполностью – упаривают раствор, а затем из насыщенного раствора осаждают кристаллы сахара.
Иногда требуется очистить от примесей растворители с меньшей температурой кипения, например воду от соли. В этом случае пары вещества необходимо собрать и затем сконденсировать при охлаждении. Такой способ разделения гомогенной смеси называется дистилляцией, или перегонкой.
Учитель показывает перегонку раствора медного купороса, вода испаряется при tкип = 100 °С, затем пары конденсируются в пробирке-приемнике, охлаждаемой водой в стакане.
Учитель. В специальных приборах – дистилляторах получают дистиллированную воду, которую используют для нужд фармакологии, лабораторий, систем охлаждения автомобилей.
Ученик демонстрирует рисунок сконструированного им «прибора» для дистилляции воды.
Учитель. Если же разделять смесь спирта и воды, то первым будет отгоняться (собираться в пробирке-приемнике) спирт с tкип = 78 °С, а в пробирке останется вода. Перегонка используется для получения бензина, керосина, газойля из нефти.
Особым методом разделения компонентов, основанным на различной поглощаемости их определенным веществом, является хроматография.
Учитель демонстрирует опыт. Он подвешивает полоску из фильтровальной бумаги над сосудом с красными чернилами, погружая в них лишь конец полоски. Раствор впитывается бумагой и поднимается по ней. Но граница подъема краски отстает от границы подъема воды. Так происходит разделение двух веществ: воды и красящего вещества в чернилах.
Учитель. С помощью хроматографии русский ботаник М.С.Цвет впервые выделил хлорофилл из зеленых частей растений. В промышленности и лабораториях вместо фильтровальной бумаги для хроматографии используют крахмал, уголь, известняк, оксид алюминия. А всегда ли требуются вещества с одинаковой степенью очистки?
Ученик. Для различных целей необходимы вещества с различной степенью очистки. Воду для приготовления пищи достаточно отстоять для удаления примесей и хлора, используемого для ее обеззараживания. Воду для питья нужно предварительно прокипятить. А в химических лабораториях для приготовления растворов и проведения опытов, в медицине необходима дистиллированная вода, максимально очищенная от растворенных в ней веществ. Особо чистые вещества, содержание примесей в которых не превышает одной миллионной процента, применяются в электронике, в полупроводниковой, ядерной технике и других точных отраслях промышленности.
Учитель. Послушайте стихотворение Л.Мартынова «Дистиллированная вода»:
Вода
Благоволила
Литься!
Она
Блистала
Столь чиста,
Что ни напиться,
Ни умыться.
И это было неспроста.
Ей не хватало
Ивы, тала
И горечи цветущих лоз,
Ей водорослей не хватало
И рыбы, жирной от стрекоз.
Ей не хватало быть волнистой,
Ей не хватало течь везде.
Ей жизни не хватало
Чистой –
Дистиллированной воде!
Для закрепления и проверки усвоения материала учащиеся отвечают на следующие вопросы.
1. При измельчении руды на горно-обогатительных фабриках в нее попадают обломки железных инструментов. Как их можно извлечь из руды?
2. Перед переработкой бытового мусора, а также бумажной макулатуры необходимо избавиться от железных предметов. Как проще всего это сделать?
3. Пылесос всасывает воздух, содержащий пыль, а выпускает чистый. Почему?
4. Вода после мойки автомобилей в крупных гаражах оказывается загрязненной машинным маслом. Как следует поступить перед сливом ее в канализацию?
5. Муку очищают от отрубей просеиванием. Почему это делают?
6. Как разделить зубной порошок и поваренную соль? Бензин и воду? Спирт и воду?
Л и т е р а т у р а
Аликберова Л.Ю. Занимательная химия. М.: АСТ-Пресс, 1999; Габриелян О.С., Воскобойникова Н.П., Яшукова А.В. Настольная книга учителя. Химия. 8 класс. М.: Дрофа, 2002; Габриелян О.С. Химия.
8 класс. М.: Дрофа, 2000; Гузей Л.С., Сорокин В.В., Суровцева Р.П. Химия. 8 класс. М.: Дрофа, 1995; Ильф И.А., Петров Е.П. Двенадцать стульев. М.: Просвещение, 1987; Кузнецова Н.Е., Титова И.М., Гара Н.Н., Жегин А.Ю. Химия. Учебник для учащихся 8 класса общеобразовательных учреждений. М.: Вентана-Граф, 1997; Рудзитис Г.Е., Фельдман Ф.Г. Химия. Учебник для 8 класса общеобразовательных учреждений. М.: Просвещение, 2000; Тыльдсепп А.А., Корк В.А. Мы изучаем химию. М.: Просвещение, 1998.
Урок химии в 8-м классе «Чистые вещества и смеси»
Цели урока:
- Закрепить знания номенклатуры неорганических веществ разных классов.
- Сформировать понятия о чистом веществе и смеси веществ.
- Раскрыть значение смесей в природе и жизни человека.
- Познакомить со способами разделения смесей.
Формы организации познавательной деятельности учащихся: фронтальная, парная, групповая.
Оборудование:
- Химия 8 — учебник для 8 класса общеобразовательных учреждений под редакцией О.С.Габриеляна — М., Дрофа, 2007 г.
- Презентация в MS Power Point (приложение)
- Компьютер, проектор
- Реактивы
- Смесь порошков железа и серы, раствор поваренной соли, смесь песка и воды, раствор метилового оранжевого; фильтры, выпаривательная чашка, лабораторный штатив с кольцом, спиртовка, воронка, стеклянная палочка, химические стаканы, колбы, магнит, пипетка.
Демонстрационный эксперимент:
- Разделение смеси фильтрованием;
- Разделение смеси магнитом;
- Хроматография;
- Разделение смеси веществ выпариванием.
- Карточки с заданием для групповой работы.
- Разделение смеси (раствора) растворимого вещества и растворителя:
- Раствор поваренной соли, лабораторный штатив с кольцом, фарфоровая чашка (выпаривательная), спиртовка, тигельные щипцы, стеклянная палочка.
- Разделение смеси нерастворимого в воде вещества и растворителя (растворимого вещества):
- Лабораторный штатив с кольцом, воронка, фильтровальная бумага, стеклянная палочка, колба или стакан химический.
- Разделение смеси железа и серы:
- Железные опилки, порошок серы, магнит , 2 фильтра.
- Хроматография:
- Фильтр, раствор метилоранжа, пипетка.
Ход урока
Организационный момент. Проверка домашнего задания.
Беседа:
Какие соединения называются оксидами? (Оксиды — это сложные соединения, состоящие из двух элементов, один из которых кислород со степенью окисления (-2))
Какие соединения называются кислотами? (Кислоты — это сложные вещества, состоящие из атомов водорода и кислотного остатка)
Какие соединения называются основаниями? (Основание — это сложные вещества, состоящие из атомов металла и одной или нескольких гидроксогрупп OH—)
Какие соединения называются солями? ( Соли - это сложные вещества, состоящие из атомов металла и кислотных остатков)
Проверочная работа (5-7 минут) на листках. На слайдах 1-2 — вопросы проверочной работы.
Проверочная работа сдается учителю (результаты объявляются на следующем уроке).
Подготовка к восприятию нового материала. Объявление темы.
1. Беседа
Нам хорошо знакомо, что такое чистота. Чистая тетрадь, чистые руки, чистый лист : А какое вещество считается чистым? Есть ли в природе чистые вещества? Чем отличается чистое вещество от смеси веществ?
Как вы думаете, что будет темой нашего урок сегодня? (слайд 3)
2. Запись даты и темы урока учащимися в тетради.
Как вы думаете, что мы должны сегодня выяснить на уроке?
Цели урока обсуждаются с учащимися.
Учащиеся предлагают: выяснить, какое вещество считается чистым и что такое смесь; узнать, где применяются чистые вещества и смеси; узнать, как разделить вещества.
В результате обсуждения — слайд 4.
3. Объяснение нового материала.
На данном этапе урока учитель формирует понятие о чистом вещества и смеси. Учащимся известно понятие «вещество» (это то из чего состоят физические тела). Поэтому, вначале даем определение «смеси веществ».
Учитель предлагает ученикам рассмотреть смеси, находящиеся на демонстрационном столе и примеры смесей, представленные на слайде 5.
Далее ребята дают определение смеси, как системы из их нескольких веществ, находящихся в непосредственном контакте друг с другом. Эта формулировка появляется на слайде после щелчка мыши.
Учитель дополняет, что в природе нет абсолютно чистых веществ. Вещества встречаются преимущественно в виде смесей. Учитель приводит примеры смесей, ребята записывают их в тетради: воздух, морская вода, молоко, сплавы металлов, растворы, туман и др. Он рассказывает о воздухе, как смеси, которая состоит из газов — азота, кислорода, аргона и др. (слайд 6).
Посмотрите внимательно на смеси, находящиеся на столе. В чем разница между ними?
Далее рассматривается классификация смесей (слайда 7).
Смеси |
|
| Однородные | Неоднородные |
| Растворы сахара в воде, растворы солей, воздух, | Смесь Fe +S, песок и сахар, глина с водой, песок с водой |
Неоднородными называются смеси, в которых невооруженным глазом или при помощи микроскопа видны частицы веществ, составляющих смесь.
Однородными называют смеси, в которых нельзя заметить частицы веществ, входящих в смесь (даже при помощи микроскопа).
Для научных исследований и промышленности, в основном требуются чистые вещества. Некоторые примеси даже в небольших количествах способны сильно поменять свойства веществ. Например, в полупроводниковой технике применяют сверхчистые вещества, где примеси составляют всего 1 атом на миллион атомов основного элемента (Si, Ge). Превышение нормы ведет к резкому ухудшению полупроводниковых свойств этих веществ. В тоже время, необходимо выделить, что невозможно получить абсолютно чистое вещество, т.к. любое чистое вещество содержит, хотя ничтожное малое количество примесей.
Как вы думаете, морская вода и чистая дистиллированная вода будут обладать одинаковыми свойствами? (ребята предполагают, что нет). Слайд 8. Учитель объясняет условия эксперимента: в 2-х сосудах нагревали до кипения дистиллированную и морскую воду. Через определенное время измеряли температуры кипения в этих сосудах). Вместе обсуждаем результаты эксперимента. Встает проблема: «Почему у морской воды t кип не постоянная в разные промежутки времени по сравнению с t кип дистиллированной водой?»
Учащиеся высказывают предположение, что соленость морской воды влияет на температуру кипения.
Далее учитель предлагает дать определение «чистого вещества».
Спомощью учителя формулируется определение «Чистым веществом называется такое вещество, у которого постоянные физические свойства (температуры кипения, температуры плавления, плотность).
В тетрадях ребята записывают определение «чистое вещество» —
Чистым называется вещество, которое обладает постоянными физическими свойствами.
Учитель дополняет, что в чистом веществе примеси, хотя и есть в незначительных количествах, но они не влияют на физические и химические свойства. Пример чистого вещества - дистиллированная вода.
Демонстрируется слайд 9.
Ребята записывают в тетрадях выводы.
Педагог обращает внимание детей на отличительную особенность смесей «В смесях каждое из составляющих их веществ сохраняет свои индивидуальные свойства. Для подтверждения этого учитель проводит опыты:
Демонстрация разделение смеси железа и сера с помощью магнита (отработать с ребенком заранее методику выполнения опыта и тогда демонстрацию проводит ученик)
Следующий этап урока — знакомство с основными способами разделения смесей, которые представлены в виде схемы: Слайд 10.
Одновременно уточняется, на каких физических свойствах веществ основан каждый способ разделения. На слайдах 11- 13 показаны области применения разных способов очистки неоднородных смесей.
Демонстрация разделения смеси песка и воды фильтрованием. Обращается внимание на правильность выполнения эксперимента (Слайд 11).
Знакомство со способами разделения однородных смесей продолжается с помощью слайда 14, акцентируется внимание учащихся на физических свойствах веществ, применяемых в данном способе разделения.
На слайдах 14-18 показаны области применения разных способов очистки однородных смесей.
Закрепление
1. Групповая работа.
Каждая группа получила задание » Как разделить смесь :?»
Нужно было описать свои действия. Через 1 минуту каждая группа озвучила свой ответ. В заданиях были использованы жизненные ситуации, где требовалось очистить воду в походных условиях и т.п.
Ответить на вопросы, представленные на слайдах 19 — 21
Рефлексия.
Беседа:
Что нового вы узнали сегодня на уроке?
Что запомнилось?
Что понравилось, а что не удалось, на ваш взгляд?
Подведение итогов
Домашнее задание: 23 упр. 1,2,4
Творческое задание.
Составьте задания на разделение смеси.
Вам выдали смесь, состоящую из соли и мела.
Предложите способы разделения этой смеси.
Приложение.
чистые вещества и смеси | Презентация к уроку по химии (8 класс) на тему:
Слайд 1
Учитель химии Байгуватова Зульфия Зягудовна Муниципальное бюджетное общеобразовательное учреждение Школа № 1 Городского округа город Уфа РБСлайд 2
Чистые вещества и смеси квест
Слайд 3
-как вы думаете, чем мы с вами дышим? -чистым кислородом? -воздух? -что такое воздух? -что такое кислород? Давайте этому посвятим урок. Как назовем урок? Чистые вещества и смеси. 3
Слайд 4
Выпишите названия чистых веществ: уголь, нефть, мел, сода, минеральная вода, молоко. Даны в пробирке без этикеток вещества: медь, алюминий, поваренная соль, мел, уксусная кислота. По каким признакам их можно различить? Почему вода кипит при температуре 100 С, морская вода 101С Почему яйцо в соленой воде не тонет? 4
Слайд 5
-какой вывод можно сделать? У чистых веществ и смесей разные физические свойства -дайте определение чистым веществам Чистые вещества имеют постоянные физические свойства 5
Слайд 6
Смеси неоднородные однородные в которых частицы видны невооружённым глазом в которых нельзя заметить границу раздела между веществами Примеры Дым, смог, пыль в воздухе Минералы Мутная речная вода Морская вода Нефть Природный газ Воздух 6
Слайд 7
-дайте определение смеси Смеси не имеют постоянной температуры кипения и плавления 7
Слайд 8
Типы смесей Гомогенные (однородные) Гетерогенные (неоднородные) Даже с помощью микроскопа нельзя обнаружить частички веществ , входящих в эту смесь. Можно отличить частички веществ, образующих смесь. 8
Слайд 9
Смеси отличаются от чистых веществ тем, что содержат примеси, не имеют постоянной температуры кипения и плавления. 9
Слайд 10
Отстаивание Разделение нерастворимых веществ с различной плотностью . Несмешивающиеся жидкости . 1 10
Слайд 11
Фильтрование Очистка жидкости от нерастворимых в ней веществ при помощи фильтра . 1 11
Слайд 12
Дистилляция (ректификация) Разделение жидкостей, основанное на разных температурах кипения, с последующей конденсацией паров . 12
Слайд 13
Выпаривание (кристаллизация) Выделение твёрдого вещества из раствора при нагревании смеси . 13
Слайд 14
Центрифугирование Разделение смесей под действием центробежной силы в центрифугах (барабанах, вращающихся с большой скоростью) 1 14
Слайд 15
Разделение магнитом Разделение смеси твёрдых веществ на компоненты под действием магнитного поля . 1 15
Слайд 16
Вывод Вещества, входящие в состав смесей, сохраняют свои индивидуальные свойства, на этом основаны способы разделения смесей. 1 16
Слайд 17
Способы разделения смесей Гомогенных Гетерогенных 1) выпаривание 2) дистилляция 1) отстаивание 2) действие магнитом 3) фильтрование 4) центрифугирование 1 17
Слайд 18
Ответьте на вопросы. 1. Муку перед приготовлением теста просеивают через сито. Можно ли просеивание отнести к одному из методов очистки веществ? Если да, то на чем основан этот метод? 1 18
Слайд 19
2. Объясните с химической точки зрения отрывок из сказки Одоевского В. Ф. «Мороз Иванович». «Между тем рукодельница воротится, воду процедит, в кувшины нальёт; да ещё какая затейница: коли вода нечиста, свернёт лист бумаги, наложит в него угольков, да песку крупного насыплет, вставит ту бумагу в кувшин да нальёт в неё воды, а вода-то знай проходит сквозь песок и сквозь уголья и каплет в кувшин чистая, словно хрустальная…» 19
Слайд 20
Как называется такой способ очистки? 3. Золото раньше добывали так, золотоносную породу измельчали, получившийся золотоносный песок помещали на наклонный желоб, по которому пускали струю воды. Поток воды уносил всё лишнее, а тяжёлые крупинки золота оставались на дне. 20
Слайд 21
Самостоятельная работа 1 вариант. Составьте план разделения смеси, состоящей из соли и угля. 2 вариант. Составьте план разделения смеси, состоящей из древесных опилок и сахара. 21
Слайд 22
Домашнее задание: 1) Предложите способы очистки воды, в походных условиях. 2) §4 (2, 4, тестовые задания.) 22
«Чистые вещества и смеси», химия 8 класс
Тема 4. Соединения химических элементов
Урок № 27
Тема: «Чистые вещества и смеси»
Цель: Раскрыть сущность понятий «чистое вещество» и «смесь», рассмотреть их сходство и различие. Раскрыть значение смесей в природе и жизни человека.
Оборудование: Образцы смесей: морская вода, дистиллированная вода.
Содержание материала
Что называют веществом? (Вещество – это то, из чего состоят физические тела)
А что подразумевает собой понятие чистое вещество?
Тема сегодняшнего урока: «Чистые вещества и смеси.
Смеси — комбинации из нескольких веществ, находящихся в непосредственном контакте друг с другом
А чем отличается чистое вещество от смеси веществ?
Давайте отгадаем загадку.
В морях и реках обитает,
Но часто по небу летает,
А как наскучит ей летать,
На землю падает опять. (вода)
Перед вами 2 стакана. Один наполнен дистиллированной водой, другой — морской. Индивидуальное чистое вещество (дистиллированная вода) обладает определённым набором характеристических свойств (постоянными физическими свойствами). Только чистая дистиллированная вода имеет tпл = 0 °С, tкип= 100 °С, не имеет вкуса. Морская вода замерзает при более низкой, а закипает при более высокой температуре, вкус у нее горько-соленый.
Совершенно чистые вещества в природе не встречаются или встречаются очень редко.
Воздух (смесь газов – азота, кислорода, аргона и др.) – газообразная смесь.
Морская вода, минеральная вода с газом, молоко, сок, кофе, раствор соли (сахара) в воде – жидкие смеси.
Гранит, сплавы металлов – твердые смеси.
Для научных исследований и в промышленности, в основном, требуются чистые вещества. Некоторые примеси даже в небольших количествах способны сильно поменять свойства веществ. В тоже время, необходимо выделить, что невозможно получить абсолютно чистое вещество, т. к. любое чистое вещество содержит хотя бы ничтожное количество примесей.
Чем же отличаются чистые вещества от смесей веществ?
Сравнительная характеристика смеси и чистого вещества
Признаки сравнения | Чистое вещество | Смесь |
Состав | Постоянный | Непостоянный |
Вещества | Одно и то же | Различные |
Физические свойства | Постоянные | Непостоянные |
Изменение энергии при образовании | Происходит | Не происходит |
Разделение | С помощью химических реакций | Физическими методами |
Чистым называется вещество, которое обладает постоянными физическими свойствами.
В чистом веществе примеси, хотя и присутствуют в незначительном количестве, но не влияют на его физические и химические свойства. Пример чистого вещества – дистиллированная вода.
Чистое вещество обладает постоянными физическими свойствами (tпл, tкип, ρ и др.).
СМЕСИ
Однородные (растворы NaCl, сахара в воде, воздух) | Неоднородные (смесь Fe и S, NaCl и сахара, глина с водой, масло с водой) |
Неоднородными называются смеси, в которых невооруженным глазом или при помощи микроскопа видны частицы веществ, составляющих смесь.
Однородными называются смеси, в которых нельзя заметить частицы веществ, входящих смесь (даже при помощи микроскопа).
Закрепление материала
Тест
А1. Является чистым веществом
воздух
нержавеющая сталь
«царская водка»
сахароза
А2. Является однородной смесью
смог
раствор спирта
молоко
воздух
А3. Твёрдая смесь – это смесь, в которой
газообразные частицы распределены в жидкости
газообразные частицы распределены в газе
одна из жидкостей раздроблена в другой, не растворяющей её жидкости
твёрдые частицы распределены в твёрдом веществе
А4. Является неоднородной смесью
раствор йода в спирту
раствор медного купороса
раствор
молоко
А5. Однородную смесь можно разделить
фильтрованием
охлаждением
выпариванием
отстаиванием
А6. Жидкая смесь – это смесь, в которой
газообразные частицы распределены в жидкости
газообразные частицы распределены в газе
одна из жидкостей раздроблена в другой, не растворяющей её жидкости
твёрдые частицы распределены жидкости
А7. Является однородной смесью
речной ил
кровь
раствор поваренной соли
молоко
А8. Газообразной смесью является
воздух
газированный напиток
бензин
нефть
А9. Является чистым веществом
чугун
сода
воздух
морская вода
А10. Является неоднородной смесью
смесь кислорода и азота
мутная речная вода
снежный наст
кисель
Домашнее задание: Параграф 23, упр.4(б)
упр.4(б)
«Разделение смеси, состоящий из порошков железа и серы»
Инструкция для учащихся к опыту
«Приготовление и изучение смеси железа и серы»
1. Насыпьте на лист бумаги отдельными кучками порошки серы и железа, рассмотрите их цвет.
2. Возьмите небольшую часть каждого вещества и проведите следующие операции:
а) испытайте магнитом;
3. Смешайте стеклянной палочкой оба порошка на бумаге, рассмотрите цвет смеси.
4. Проведите со смесью те же операции, что и с чистыми веществами.
Эту смесь можно разделить действием магнита.
Вывод: железо обладает способностью намагничиваться, а сера – нет.
Ключи: 1)4 2)2,4 3)4 4)4 5)3 6) 3 7) 3 8) 1 9) 2 10)2
Планируемые результаты обучения.
Предметные результаты:
Знать отличие чистого вещества от смеси, основные способы разделения смесей.
Метапредметные результаты:
продолжить развивать умение формирование гипотез,
продолжить развивать умение выявлять причинно-следственные связи,
продолжить развивать умение работать в группах.
продолжить развивать умение использования различных источников для получения химической информации
Личностные результаты: 1.сформировать умения управлять своей учебной деятельностью
2. помочь в подготовке к осознанию выбора дальнейшей образовательной траектории.
Вопросы к зачету по теме «чистые вещества и смеси» (8 класс) понятия вопросы для устного ответа
Вопросы к зачету по теме «Чистые вещества и смеси» (8 класс)
Понятия: чистое вещество, смесь, раствор, компоненты смеси, постоянные составные части смеси, переменные составные части смеси, случайные составные части смеси, объёмная доля компонента в смеси, массовая доля компонента в смеси, разделение смеси, очистка вещества, ректификация, дистилляция, перегонка, кристаллизация, выпаривание, отстаивание, фильтрование, фильтрат, центрифугирование, декантация, адсорбция, примеси, технический образец, массовая доля примесей, растворитель, растворимое вещество, массовая доля вещества в растворе, объёмная доля вещества в растворе.
Вопросы для устного ответа:
Смеси веществ. Состав смеси на примере воздуха.
Природный газ и попутный нефтяной газ
Объёмная доля газа в смеси
Массовая доля компонента в смеси.
Ректификация
Выделение газа из газовой смеси.
Дистилляция,
Выпаривание и кристаллизация,
Отстаивание и декантация.
Фильтрование.
Степень чистоты вещества. Массовая доля примесей.
Растворы, их многообразие.
Очистка поваренной соли.
Приготовление раствора с заданной массовой долей вещества.
Упражнения и задачи:
Учебник О.С.Габриеляна, И.Г.Остроумова «Химия 8», гл.3
Задачи по химии для поступающих в ВУЗы Г.П.Хомченко, №№ 4.1 — 4.18, 4.25 — 4.28.
Зачет по теме «Чистые вещества и смеси» (8 класс)
Вариант -1
Дайте определение понятиям: чистое вещество, случайные составные части смеси, ректификация, технический образец, массовая доля примесей.
Зачет по теме «Чистые вещества и смеси» (8 класс)
Вариант -2
Дайте определение понятиям: смесь, постоянные составные части смеси, массовая доля компонента в смеси, разделение смеси, фильтрат.
Зачет по теме «Чистые вещества и смеси» (8 класс)
Вариант -3
Дайте определение понятиям: раствор, переменные составные части смеси, объёмная доля компонента в смеси, очистка вещества, центрифугирование.
Зачет по теме «Чистые вещества и смеси» (8 класс)
Вариант -4
Дайте определение понятиям: компоненты смеси, дистилляция, растворитель, массовая доля вещества в растворе, кристаллизация.
Зачет по теме «Чистые вещества и смеси» (8 класс)
Вариант -5
Дайте определение понятиям: перегонка, выпаривание, отстаивание, фильтрование, объёмная доля вещества в растворе.
Зачет по теме «Чистые вещества и смеси» (8 класс)
Вариант -6
Дайте определение понятиям: массовая доля вещества в растворе, смесь, растворимое вещество,декантация, примеси.
3.05: Чистые вещества и смеси
Учебная цель
- Различают чистые вещества и смеси
- Определять смеси как однородные или неоднородные
Чистые вещества
Когда мы говорим о чистой субстанции , мы говорим о чем-то, что содержит только один вид материи. Это может быть один-единственный элемент или одно-единственное соединение, но каждый образец этого вещества, который вы исследуете, должен содержать в точности одно и то же с фиксированным, определенным набором свойств.
| Чистое вещество | Элемент или соединение? | Состоит из: |
|---|---|---|
| Свинец (Pb) | элемент | атома свинца |
| Газообразный кислород (O 2 ) | элемент | молекулы кислорода * |
| Вода (H 2 O) | соединение | молекулы воды |
| Аммиак (NH 3 ) | соединение | молекулы аммиака |
* Примечание: чистый газообразный кислород состоит из молекул, но по-прежнему считается элементом, а не соединением, поскольку молекулы состоят из элементов одного типа.Соединения состоят из одного или нескольких элементов.
Смеси
Если мы берем два или более чистых вещества и смешиваем их вместе, мы называем это смесью . Смеси всегда можно снова разделить на составляющие чистые вещества, потому что связывание между атомами составляющих веществ не происходит в смеси. В то время как соединение может иметь свойства, сильно отличающиеся от свойств составляющих его элементов, в смесях вещества сохраняют свои индивидуальные свойства.Например, натрий — мягкий блестящий металл, а хлор — едкий зеленый газ. Эти два элемента могут объединяться с образованием соединения, хлорида натрия (поваренная соль), которое представляет собой белое кристаллическое твердое вещество, не обладающее свойствами натрия или хлора , ни . Если, однако, вы смешали поваренную соль с молотым перцем, вы все равно могли бы видеть отдельные зерна каждого из них, и, если бы вы были терпеливы, вы могли бы взять пинцет и осторожно разделить их обратно на чистую соль и чистый перец. .
Гетерогенная смесь
Гетерогенная смесь представляет собой смесь, состав которой неоднороден по всей смеси. Овощной суп — это неоднородная смесь. Любая данная ложка супа будет содержать различное количество различных овощей и других компонентов супа.
Гомогенная смесь / раствор
Гомогенная смесь представляет собой комбинацию двух или более веществ, которые настолько тщательно перемешаны, что смесь ведет себя как единое вещество.Еще одно слово для обозначения однородной смеси — раствор. Таким образом, комбинация соли и стальной ваты представляет собой неоднородную смесь, поскольку легко увидеть, какие частицы вещества представляют собой кристаллы соли, а какие — стальную вату. С другой стороны, если вы возьмете кристаллы соли и растворите их в воде, очень трудно определить наличие более одного вещества, просто взглянув, даже если вы используете мощный микроскоп. Соль, растворенная в воде, представляет собой гомогенную смесь или раствор (Рисунок \ (\ PageIndex {3} \)).
Рисунок \ (\ PageIndex {3} \): Типы смесей © Thinkstock Слева комбинация двух веществ представляет собой гетерогенную смесь, поскольку частицы двух компонентов выглядят по-разному. Справа кристаллы соли растворились в воде настолько тонко, что вы не можете сказать, присутствует ли соль. Гомогенная смесь выглядит как единое вещество.
Пример \ (\ PageIndex {3} \)
Определите следующие комбинации как гетерогенные смеси или гомогенные смеси.
- газированная вода (углекислый газ растворен в воде.)
- смесь металлической стружки железа и порошка серы (и железо, и сера являются элементами.)
Рисунок \ (\ PageIndex {4} \): Смесь железной стружки и порошка серы ( Asoult, смесь Fe-S 03, CC BY 4.0)
Решение
- Поскольку диоксид углерода растворен в воде, мы можем сделать вывод из поведения кристаллов соли, растворенных в воде, что диоксид углерода, растворенный в воде, является (также) гомогенной смесью.
- Если предположить, что железо и сера просто смешаны вместе, должно быть легко увидеть, что такое железо, а что такое сера, так что это гетерогенная смесь.
Упражнение \ (\ PageIndex {3} \)
Являются ли следующие комбинации гомогенными смесями или гетерогенными смесями?
- человеческое тело
- амальгама, комбинация некоторых других металлов, растворенных в небольшом количестве ртути
Ответы
- гетерогенная смесь
- однородная смесь
Классификация материалов
Рисунок \ (\ PageIndex {1} \): Взаимосвязь между типами веществ и методами, используемыми для разделения смесейОбычная поваренная соль называется хлоридом натрия.Его считают веществом , потому что оно имеет однородный и определенный состав. Все образцы хлорида натрия химически идентичны. Вода также является чистым веществом. Соль легко растворяется в воде, но соленую воду нельзя классифицировать как вещество, поскольку ее состав может варьироваться. Вы можете растворить небольшое или большое количество соли в определенном количестве воды. Смесь представляет собой физическую смесь двух или более компонентов, каждый из которых сохраняет свою индивидуальность и свойства в смеси .Только форма соли изменяется, когда она растворяется в воде. Он сохраняет свой состав и свойства.
Этап
Фаза — это любая часть образца, имеющая однородный состав и свойства. По определению, чистое вещество или гомогенная смесь состоит из одной фазы. Гетерогенная смесь состоит из двух или более фаз. Когда масло и вода смешиваются, они не смешиваются равномерно, а образуют два отдельных слоя. Каждый из слоев называется фазой.
Пример \ (\ PageIndex {1} \)
Определите каждое вещество как соединение, элемент, гетерогенную смесь или гомогенную смесь (раствор).
- фильтрованный чай
- свежевыжатый апельсиновый сок
- компакт-диск
- оксид алюминия, белый порошок с соотношением атомов алюминия и кислорода 2: 3
- селен
Дано : химическое вещество
Запрошено : его классификация
Стратегия:
- Определите, является ли вещество химически чистым.Если оно чистое, это либо элемент, либо соединение. Если вещество можно разделить на элементы, это соединение.
- Если вещество не является химически чистым, это либо гетерогенная смесь, либо гомогенная смесь. Если его состав однороден во всем, это однородная смесь.
Решение:
- A) Чай представляет собой раствор соединений в воде, поэтому он не является химически чистым. Обычно его отделяют от чайных листьев фильтрацией.
B) Поскольку состав раствора однороден повсюду, это однородная смесь . - A) Апельсиновый сок содержит твердые частицы (мякоть), а также жидкость; он не является химически чистым.
B) Поскольку его состав неоднороден, апельсиновый сок представляет собой гетерогенную смесь . - A) Компакт-диск — это твердый материал, содержащий более одного элемента, с видимыми по краю участками разного состава.Следовательно, компакт-диск не является химически чистым.
B) Области разного состава указывают на то, что компакт-диск представляет собой гетерогенную смесь. - A) Оксид алюминия представляет собой единое химически чистое соединение .
- A) Селен — один из известных элементов .
Упражнение \ (\ PageIndex {1} \)
Определите каждое вещество как соединение, элемент, гетерогенную смесь или гомогенную смесь (раствор).
- белое вино
- ртуть
- заправка для салата в стиле ранчо
- сахар столовый (сахароза)
- Ответ:
- гомогенная смесь (раствор)
- Ответ b:
- элемент
- Ответ c:
- гетерогенная смесь
- Ответ d:
- соединение
Пример \ (\ PageIndex {2} \)
Как химик классифицирует каждый образец вещества?
- соленая вода
- почва
- вода
- кислород
РЕШЕНИЕ
- Соленая вода действует как единое целое, даже если содержит два вещества — соль и воду.Морская вода — это однородная смесь или раствор.
- Почва состоит из маленьких кусочков различных материалов, поэтому представляет собой неоднородную смесь.
- Вода — это вещество; более конкретно, поскольку вода состоит из водорода и кислорода, она представляет собой соединение.
- Кислород, вещество, это элемент.
Упражнение \ (\ PageIndex {2} \)
Как химик классифицирует каждый образец вещества?
- кофе
- водород
- яйцо
- Ответ:
- однородная смесь (раствор), предположим, это фильтрованный кофе
- Ответ b:
- элемент
- Ответ c:
- смесь гетерогенная.
Сводка
Вещество можно разделить на две большие категории: чистые вещества и смеси. Чистое вещество — это форма вещества, имеющая постоянный состав и постоянные свойства во всем образце. Смеси представляют собой физические комбинации двух или более элементов и / или соединений. Смеси можно разделить на однородные и гетерогенные. Элементы и соединения являются примерами чистых веществ. Соединения — это вещества, состоящие из более чем одного типа атомов.Элементы — это простейшие вещества, состоящие только из одного типа атомов.
Основные выводы
- Чистые вещества состоят из одного элемента или соединений.
- Комбинации различных веществ называются смесями.
- Гомогенные смеси — это смеси двух или более соединений (или элементов), которые не отличаются друг от друга визуально.
- Гетерогенные смеси — это смеси двух или более соединений (или элементов), которые визуально отличимы друг от друга.
Электронное обучение, Электронное обучение, Поддержка школьного образования, Онлайн-образование, Цифровое обучение, Интеллектуальное обучение
Материя — это все, что занимает пространство и имеет массу. Его можно разделить на чистые вещества и нечистые вещества (смеси).
Чистое вещество — это однородный материал, содержащий частицы только одного вида и обладающий определенным набором свойств.
Чистые вещества далее подразделяются на элементов и соединений .
Элемент — чистое вещество, состоящее только из одного вида атомов. Его нельзя в дальнейшем свести к более простым веществам никакими физическими или химическими методами. Атом — это наименьшая единица элемента.
Элементы подразделяются на металлов, неметаллов, металлоидов и благородных газов.
Металлы — это элементы, которые обладают особыми свойствами, такими как металлический блеск, высокая плотность, высокая температура плавления и кипения, звучность, пластичность, пластичность и т. Д.Они хорошие проводники тепла и электричества.
Неметаллы — это элементы, которые не светятся и плохо проводят тепло и электричество. Они не податливы, не пластичны и не звучат. У них низкая температура плавления и кипения.
Металлоиды проявляют некоторые свойства как металлов, так и неметаллов. Они используются как полупроводники.
Благородные газы — это элементы, которые находятся в воздухе в газообразном состоянии и обладают меньшей реакционной способностью.Они существуют как одноатомные молекулы.
Соединение — это чистое вещество, которое состоит из двух или более элементов, объединенных химически в фиксированной весовой пропорции, и может быть разделено на элементы только химическими методами.
Смесь — это материал, полученный механическим смешиванием двух или более веществ в любой пропорции. Составляющие смеси можно разделить физическими методами. По однородности составляющих они могут быть однородной смесью и гетерогенной смесью.
Гомогенная смесь имеет однородный состав и свойства во всем.
Гетерогенная смесь не везде однородна по составу. Настоящий раствор представляет собой однородную смесь двух или более компонентов.
Коллоиды представляют собой гетерогенные смеси. Их частицы занимают промежуточное положение по размеру между частицами растворов и суспензий. Они остаются равномерно распределенными без оседания.
Суспензии также являются гетерогенными смесями.Их частицы больше по размеру, чем в растворах. Компоненты можно распределить равномерно, но со временем они осядут.
Смеси могут существовать в виде твердых веществ, жидкостей или газов . В зависимости от физического состояния смесей они бывают различных типов, таких как смесь твердое вещество-твердое вещество, смесь твердого вещества-жидкости, смесь жидкости и жидкости (например, спирт в воде), смесь жидкость-газ и т. Д.
Классификация веществ (элементы, соединения, смеси) — Введение в химию
Вещества и смеси
Вещества состоят из чистых элементов или химически связанных элементов, тогда как смеси состоят из несвязанных веществ.
ЦЕЛИ ОБУЧЕНИЯ
Отличить химические вещества от смесей
ОСНОВНЫЕ ВХОДЫ
Ключевые моменты
- Вещество можно разделить на две категории: чистые вещества и смеси. Чистые вещества далее разбиваются на элементы и соединения. Смеси — это физически комбинированные структуры, которые можно разделить на их исходные компоненты.
- Химическое вещество состоит из одного типа атомов или молекул.
- Смесь состоит из различных типов атомов или молекул, которые не связаны химически.
- Гетерогенная смесь — это смесь двух или более химических веществ, в которой можно визуально различить различные компоненты.
- Гомогенная смесь — это смесь, состав которой однороден, и каждая часть раствора имеет одинаковые свойства.
- Существуют различные методы разделения для разделения веществ, включая дистилляцию, фильтрацию, выпаривание и хроматографию. Для этого разделения вещество может находиться в одной или двух разных фазах.
Ключевые термины
- смесь : Что-то, что состоит из различных, несвязанных элементов или молекул.
- элемент : химическое вещество, которое состоит из определенного типа атома и не может быть расщеплено или преобразовано с помощью химической реакции.
- вещество : форма вещества, имеющая постоянный химический состав и характерные свойства. Он состоит из одного типа атома или молекулы.
Химические вещества
В химии химическое вещество — это форма вещества, имеющая постоянный химический состав и характерные свойства.Его нельзя разделить на компоненты без разрыва химических связей. Химические вещества могут быть твердыми, жидкостями, газами или плазмой. Изменения температуры или давления могут вызывать переход веществ между различными фазами вещества.
Элемент — это химическое вещество, состоящее из определенного типа атома и, следовательно, не может быть расщеплено или преобразовано в результате химической реакции в другой элемент. Все атомы элемента имеют одинаковое количество протонов, хотя они могут иметь разное количество нейтронов и электронов.
Чистое химическое соединение — это химическое вещество, состоящее из определенного набора молекул или ионов, которые химически связаны. Два или более элемента, объединенных в одно вещество в результате химической реакции, например вода, образуют химическое соединение. Все соединения являются веществами, но не все вещества являются соединениями. Химическое соединение может быть либо атомами, связанными вместе в молекулы, либо кристаллами, в которых атомы, молекулы или ионы образуют кристаллическую решетку. Соединения, состоящие в основном из атомов углерода и водорода, называются органическими соединениями, а все остальные — неорганическими соединениями.Соединения, содержащие связи между углеродом и металлом, называются металлоорганическими соединениями.
Химические вещества часто называют «чистыми», чтобы отличить их от смесей. Типичный пример химического вещества — чистая вода; он всегда имеет одни и те же свойства и одинаковое отношение водорода к кислороду, независимо от того, извлечен ли он из реки или изготовлен в лаборатории. Другие химические вещества, обычно встречающиеся в чистом виде, — это алмаз (углерод), золото, поваренная соль (хлорид натрия) и рафинированный сахар (сахароза).Простые или кажущиеся чистыми вещества, встречающиеся в природе, на самом деле могут быть смесями химических веществ. Например, водопроводная вода может содержать небольшие количества растворенного хлорида натрия и соединений, содержащих железо, кальций и многие другие химические вещества. Чистая дистиллированная вода — это вещество, а морская вода, поскольку она содержит ионы и сложные молекулы, представляет собой смесь.
Химические смеси
Смесь — это материальная система, состоящая из двух или более различных веществ, которые смешаны, но не соединены химически.Под смесью понимается физическая комбинация двух или более веществ, в которой сохраняются идентичности отдельных веществ. Смеси имеют форму сплавов, растворов, суспензий и коллоидов.
Встречающиеся в природе кристаллы серы: Сера встречается в природе в виде элементарной серы, сульфидов и сульфатных минералов, а также в виде сероводорода. Это месторождение полезных ископаемых состоит из смеси веществ.Гетерогенные смеси
Гетерогенная смесь — это смесь двух или более химических веществ (элементов или соединений), в которой различные компоненты можно визуально различить и легко разделить физическими средствами.Примеры включают:
- смеси песка и воды
- смеси песка и железной опилки
- каменный конгломерат
- вода и масло
- салат
- трейл микс
- смеси золотого порошка и серебряного порошка
Interactive: Oil and Water : исследуйте взаимодействия, которые вызывают воду и воду. масло отделить от смеси.
Гомогенные смеси
Гомогенная смесь — это смесь двух или более химических веществ (элементов или соединений), различные компоненты которой невозможно различить визуально. Часто разделение компонентов гомогенной смеси является более сложной задачей, чем разделение компонентов гетерогенной смеси.
Различие между гомогенными и гетерогенными смесями зависит от масштаба отбора проб. В достаточно малом масштабе любую смесь можно назвать гетерогенной, потому что образец может быть размером с одну молекулу.На практике, если интересующие свойства одинаковы, независимо от того, сколько смеси взято, смесь является однородной.
Физические свойства смеси, такие как температура плавления, могут отличаться от свойств ее отдельных компонентов. Некоторые смеси можно разделить на компоненты физическими (механическими или термическими) способами.
Классифицирующее вещество (3 части): Введение в классификацию вещества как вещества или смеси веществ.Смеси описываются как гетерогенные или гомогенные. Описаны три распространенных метода разделения.
Элементы и соединения
Элемент — это материал, состоящий из одного типа атомов, в то время как соединение состоит из двух или более типов атомов.
ЦЕЛИ ОБУЧЕНИЯ
Различать элементы и соединения и изучать методы разделения
ОСНОВНЫЕ ВХОДЫ
Ключевые моменты
- Элементы — это простейшие законченные химические вещества.Каждый элемент соответствует одной записи в периодической таблице. Элемент — это материал, состоящий из одного типа атомов. Каждый тип атома содержит одинаковое количество протонов.
- Химические связи соединяют элементы вместе, образуя более сложные молекулы, называемые соединениями. Соединение состоит из двух или более типов элементов, удерживаемых вместе ковалентными или ионными связями.
- Элементы не могут быть разделены на более мелкие части без большого количества энергии. Соединения, с другой стороны, могут быть разорваны с помощью практического количества энергии, например тепла от огня.
- Вещество можно разделить на две категории: чистые вещества и смеси. Чистые вещества далее разбиваются на элементы и соединения. Смеси представляют собой физически комбинированные структуры, которые можно снова разделить на их исходные компоненты.
Ключевые термины
- элемент : Любое из простейших химических веществ, которое нельзя изменить с помощью химической реакции или каких-либо химических средств. Состоит из атомов, имеющих одинаковое количество протонов.
- химическая связь : Любая из нескольких сил притяжения, которые служат для связывания атомов вместе с образованием молекул.
- соединение : Вещество, состоящее из двух или более элементов. Состоит из фиксированного соотношения химически связанных атомов. Обладает уникальными свойствами, которые отличаются от свойств отдельных его элементов.
Элементы
Химический элемент — это чистое вещество, состоящее из одного типа атомов. У каждого атома есть атомный номер, который представляет количество протонов, находящихся в ядре одного атома этого элемента.Периодическая таблица элементов упорядочена по возрастанию атомного номера.
Химические элементы делятся на металлы, металлоиды и неметаллы. Металлы, которые обычно находятся в левой части таблицы Менделеева, это:
- часто проводит к электричеству
- податливый
- блестящий
- иногда магнитный.
Алюминий, железо, медь, золото, ртуть и свинец являются металлами.
В отличие от неметаллов, которые можно найти в правой части таблицы Менделеева (справа от лестницы):
- обычно непроводящий
- не податливый
- матовый (не блестящий)
- немагнитный.
Примеры элементарных неметаллов включают углерод и кислород.
Металлоиды обладают некоторыми характеристиками металлов и некоторыми характеристиками неметаллов. Кремний и мышьяк — металлоиды.
По состоянию на ноябрь 2011 г. было идентифицировано 118 элементов (самым последним из них был идентифицирован ununseptium в 2010 г.). Из этих 118 известных элементов только первые 98 встречаются в природе на Земле. Элементы, которые не встречаются в природе на Земле, являются синтетическими продуктами ядерных реакций, созданных человеком.80 из 98 встречающихся в природе элементов стабильны; остальные радиоактивны, что означает, что они распадаются на более легкие элементы в течение времени от долей секунды до миллиардов лет.
Периодическая таблица Менделеева: Периодическая таблица Менделеева содержит 118 элементов, включая металлы (розовый), неметаллы (синий) и металлоиды (зеленый).Водород и гелий — самые распространенные элементы во Вселенной. Однако железо является наиболее распространенным элементом (по массе) в составе Земли, а кислород — наиболее распространенным элементом в слое земной коры.
Хотя вся известная химическая материя состоит из этих элементов, сама химическая материя составляет лишь около 15% материи во Вселенной. Остальное — темная материя, загадочная субстанция, не состоящая из химических элементов. Темной материи не хватает протонов, нейтронов или электронов.
Соединения
Чистые образцы изолированных элементов редко встречаются в природе. В то время как 98 природных элементов были идентифицированы в образцах минералов из земной коры, лишь небольшая часть из них может быть обнаружена как узнаваемые, относительно чистые минералы.Среди наиболее распространенных таких «самородных элементов» — медь, серебро, золото и сера. Углерод также обычно встречается в форме угля, графита и алмазов. Благородные газы (например, неон) и благородные металлы (например, ртуть) также можно найти в их чистых, несвязанных формах в природе. Тем не менее, большинство этих элементов находится в смесях.
Когда два отдельных элемента химически объединены, то есть между их атомами образуются химические связи, результат называется химическим соединением. Большинство элементов на Земле связываются с другими элементами, образуя химические соединения, такие как натрий (Na) и хлорид (Cl), которые вместе образуют поваренную соль (NaCl).Вода — еще один пример химического соединения. Два или более компонентов соединения можно разделить с помощью химических реакций.
Химические соединения имеют уникальную и определенную структуру, которая состоит из фиксированного соотношения атомов, удерживаемых вместе в определенном пространственном расположении химическими связями. Химические соединения могут быть:
- молекулярных соединений, удерживаемых ковалентными связями
- солей, удерживаемых ионными связями
- интерметаллические соединения, удерживаемые металлическими связями
- комплексов, скрепленных координатными ковалентными связями.
Чистые химические элементы не считаются химическими соединениями, даже если они состоят из двухатомных или многоатомных молекул (молекул, которые содержат только несколько атомов одного элемента, например H 2 или S 8 ).
ЛИЦЕНЗИИ И АТРИБУЦИИ
CC ЛИЦЕНЗИОННЫЙ КОНТЕНТ, ПРЕДЫДУЩИЙ РАЗДЕЛ
CC ЛИЦЕНЗИОННОЕ СОДЕРЖАНИЕ, СПЕЦИАЛЬНАЯ АТРИБУЦИЯ
Q2 Определите термины элементы смесей соединений с ракурсом
Решение:
Элемент —
Это основная единица материи, которая никак не может быть разбита на вещества, но может быть объединена с образованием новых веществ.
Это чистое вещество.
Классифицируется на металлы, неметаллы, металлоиды и благородные газы.
Пример — водород, углерод, кислород
Соединения —
Это комбинация двух или более элементов.
Это чистое вещество.
Посредством химических реакций они могут распадаться на металлы.
Пример — вода, диоксид углерода
Смеси —
Это комбинация двух или более элементов или соединений, либо того и другого.
Вещества, соединенные в смеси, находятся в определенном соотношении.
Пример — Мел, стиральная сода
«привет всем Сегодняшний вопрос — определить термины элементы соединения и смеси с целью показать их основные отличия так что в этом вопросе сначала мы будем определение что подразумевается под элементом что есть подразумевается под соединением и что подразумевается под смесями, а затем мы будем смотреть на основные отличия теперь давайте посмотрим на что такое элемент, как мы определяем элемент элемент базовый форма материи, которую невозможно сломать вниз в более простую субстанцию даже химические реакции так мы определяем, что такое элемент теперь пойдем дальше чтобы определить, что подразумевается под составом соединение — это комбинация из двух или более элементов, которые можно разбить на элементы химическим или электрохимическим реакции так мы определяем компаунды смеси теперь идем дальше определить, что такое смесь смесь — это комбинация двух или более соединений элементов или оба то есть элементы — это соединения просто смешали вместе, чтобы образовать смесь и никаких новых веществ получает новое соединение сформированный это определение того, что это элемент, который является составным и что такое смесь теперь элемент это всегда чистый соединение веществ также чистые вещества но смеси, поскольку это комбинация два или более элемента имеет переменный состав классификация элемента классифицирована в металлы, неметаллы, металлоиды и благородные очки когда я смотрю на соединения соединение это комбинация каждого нового вещества всегда фиксируется и новое вещество который сформирован как разные свойства, но в смесях оно имеет переменный состав и вещество объединены в смесь находятся в определенном соотношении это еще одно различие между элементы соединения и смеси, когда я вижу на следующие отличия мы видим, что элементы нельзя разбить на более простые вещества, но соединения они могут быть сломан на элементы химическим или электрохимический реакции и смеси составляющих можно довольно легко разделить физические методы, так что это три составных элемента и смеси, и это основные различия между ними теперь давайте посмотрим на Примеры когда я смотрю на примеры, я говорю этот элемент на самом деле чистый субстанция поэтому примерами элементов являются водород углерод кислород следующий соединения соединения в основном комбинация двух или более элементов так и это тоже чистое вещество так что в этом случае я могу сказать, что соединения Примеры — вода, которая является h3o углекислый газ, углекислый газ смеси метана и др. это в основном комбинация двух или больше соединений элементов или и то, и другое поэтому в этом случае, когда я смотрю на пример смесей можно сказать, что примеры смесей меловой порошок и смотрю газировку, вот как в этом вопрос мы сначала определяем, что такое элемент, который мы определил, что такое соединения и мы определили, что такое смеси и затем мы рассмотрели основные отличия соответственно мы также привели примеры соединений и смесей элементов Спасибо «
открытых учебников | Сиявула
Математика
Наука
- Читать онлайн
Учебники
Английский
Класс 7A
Марка 7Б
7 класс (A и B вместе)
Африкаанс
Граад 7А
Граад 7Б
Граад 7 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Марка 8A
Сорт 8Б
8 класс (A и B вместе)
Африкаанс
Граад 8А
Граад 8Б
Граад 8 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Марка 9А
Марка 9Б
9 класс (A и B вместе)
Африкаанс
Граад 9А
Граад 9Б
Граад 9 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Класс 4A
Класс 4Б
Класс 4 (вместе A и B)
Африкаанс
Граад 4А
Граад 4Б
Граад 4 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Марка 5А
Марка 5Б
Оценка 5 (вместе A и B)
Африкаанс
Граад 5А
Граад 5Б
Граад 5 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Марка 6А
Марка 6Б
6 класс (A и B вместе)
Африкаанс
Граад 6А
Граад 6Б
Граад 6 (A en B saam)
Пособия для учителя
Наша книга лицензионная
Эти книги не просто бесплатные, они также имеют открытую лицензию! Один и тот же контент, но разные версии (брендированные или нет) имеют разные лицензии, как объяснено:
CC-BY-ND (фирменные версии)
Вам разрешается и поощряется свободное копирование этих версий.Вы можете делать ксерокопии, распечатывать и распространять их сколько угодно раз. Вы можете скачать их на свой мобильный телефон, iPad, ПК или флешку. Вы можете записать их на компакт-диск, отправить по электронной почте или загрузить на свой веб-сайт. Единственное ограничение заключается в том, что вы не можете адаптировать или изменять эти версии учебников, их содержание или обложки каким-либо образом, поскольку они содержат соответствующие бренды Siyavula, спонсорские логотипы и одобрены Департаментом базового образования. Для получения дополнительной информации посетите Creative Commons Attribution-NoDerivs 3.0 Непортированный.
Узнайте больше о спонсорстве и партнерстве с другими, которые сделали возможным выпуск каждого из открытых учебников.
CC-BY (версии без марочного знака)
Эти небрендовые версии одного и того же контента доступны для вас, чтобы вы могли делиться ими, адаптировать, трансформировать, изменять или дополнять их любым способом, с единственным требованием — дать соответствующую оценку Siyavula. Для получения дополнительной информации посетите Creative Commons Attribution 3.0 Unported.
чистых веществ, смесей и растворов, о боже! —
Этот урок поможет студентам различать чистые вещества и смеси.Студенты смогут идентифицировать элементы и соединения как примеры чистых веществ. Студенты также смогут различать гомогенные (растворы) и гетерогенные смеси.
Общая информация
Предмет (и): Наука
Уровень (и): 8
Предлагаемая технология: Документ-камера, компьютер для докладчика, ЖК-проектор
Время обучения: 1 час 30 минут
Ключевые слова: чистое вещество, смесь, гомогенная смесь, гетерогенная смесь
Этот ресурс требует, чтобы вы вошли в iCPALMS.Пожалуйста, войдите в систему, используя раздел «Вход» вверху, и повторите попытку.Простите! Для этого ресурса требуется специальное разрешение, и только определенные пользователи имеют к нему доступ в настоящее время.
Содержание урока
Шаблон плана урока:
Общий план урокаЗадачи обучения: Что студенты должны знать и уметь делать в результате этого урока?
Студенты смогут различать чистые вещества и смеси, включая растворы.
Предыдущие знания: Какие предварительные знания должны быть у учащихся для этого урока?
Изучите и определите материалы, которые будут растворяться в воде, и те, которые не будут растворяться, и определите условия, которые ускорят или замедлят процесс растворения.(SC.5.P.8.2)
Продемонстрируйте и объясните, что смеси твердых тел можно разделить на основе наблюдаемых свойств их частей, таких как размер, форма, цвет и магнитное притяжение частиц. (SC.5.P.8.3)
Руководящие вопросы: Какие наводящие вопросы будут на этом уроке?
Направляющий вопрос этого урока будет: «В чем разница между чистым веществом и смесью?» Возможные ответы учащихся включают, но не ограничиваются:
- Смесь представляет собой комбинацию, а чистое вещество — нет.
- Чистое вещество (соединения) нельзя разделить физически, но можно смесь.
- Смеси химически не объединяются, но чистые вещества могут объединяться.
- Раствор является примером смеси.
- Есть два типа смесей: гетерогенные смеси и гомогенные смеси.
- Элементы и соединения являются примерами чистых веществ.
Этап обучения: Как учитель представит ученикам концепцию или навык?
Концепция будет представлена учащимся через презентацию PowerPoint и демонстрацию Lego.
Слайды 8 — Этот слайд послужит сигналом к началу демонстрации Lego.
Шаг 1: Возьмите одноцветный конструктор Lego.
- Объясните ученикам, что это одноцветное Lego представляет собой элемент.
- Это пример элемента (чистого вещества).
Шаг 2: Возьмите еще четыре лего того же цвета.
- Объясните ученикам, что это пример чистой субстанции, потому что Лего единообразны и не могут быть физически разделены.
- Это все еще пример элемента (чистого вещества).
Шаг 3: Возьмите три Лего разных цветов, чем на шаге 1, и смешайте их вместе.
- Спросите студентов, является ли это все еще примером чистого вещества.
- Объясните ученикам, что это стало смесью, потому что она больше не однородна (теперь присутствуют два лего разного цвета) и ее можно физически разделить (на две разные цветовые группы).
- Это пример смеси элементов.
Шаг 4: Создайте одно соединение, соединив два синих Лего и одно белое Лего.
- Объясните студентам, что это пример соединения и что соединения также являются примерами чистых веществ.
- Это пример соединения (чистого вещества).
Шаг 5: Создайте еще три таких же компаунда, как на шаге 4, и смешайте их вместе.
- Спросите студентов, является ли это примером чистого вещества или смеси.
- Объясните студентам, что, поскольку соединения однородны и не могут быть разделены на разные соединения, они все равно считаются чистым веществом.
- Это все еще пример соединения (чистого вещества).
Шаг 6: Создайте два соединения, соединив два оранжевых Lego и два зеленых Lego вместе, и смешайте их вместе с соединениями из шага 5.
- Спросите студентов, является ли это примером чистого вещества или смеси.
- Объясните ученикам, что это стало смесью, потому что она больше не является однородной (теперь присутствуют два разных соединения с рисунком) и что его можно физически разделить (на две разные группы с рисунком).
- Это пример смеси соединений.
Шаг 7: Объединение элементов и соединений, созданных на шагах 1-6, вместе.
- Спросите студентов, является ли это примером чистого вещества или смеси.
- Объясните ученикам, что это смесь, потому что она неоднородна (содержит разные типы элементов и соединений) и может быть физически разделена (на разные группы элементов и соединений).
Шаг 8: Продолжайте шаги 1-7, чтобы представить дополнительные примеры этой абстрактной концепции, пока учащиеся не начнут чувствовать себя комфортно с концепцией.Затем перейдите к нескольким следующим слайдам, чтобы проверить их понимание.
Практика под руководством: Какие действия или упражнения ученики будут выполнять под руководством учителя?
Студентам будет представлена информация через презентацию PowerPoint и демонстрацию Lego, а также они будут отвечать на практические вопросы.
Самостоятельная практика: какие задания или упражнения студенты будут выполнять, чтобы закрепить концепции и навыки, полученные на уроке?
Учащиеся будут делать свои собственные модели Lego, чтобы создавать образцы чистых веществ и смесей.Это произойдет после того, как учитель предоставит примеры каждой категории во время демонстрации Lego.
Ученики будут использовать конструкторы Lego, чтобы сделать следующие примеры:
- Элементы —
- Например: использование 1 одноцветного конструктора Lego.
- Соединения —
- Например: соединение двух лего одного цвета и одного лего другого цвета.
- Смеси элементов —
- Например: Смешивание нескольких цветных Lego (ни один из которых не соединен вместе)
- Смеси соединений —
- Например: соединение двух лего одного цвета и двух лего другого цвета.Затем смешайте это творение с ранее созданным составом.
- Смеси элементов и соединений —
- Например: объедините элементы и соединения, созданные на предыдущих шагах.
- Элементы —
Завершение: Как учитель будет помогать ученикам систематизировать знания, полученные на уроке?
По завершении урока учащиеся заполнят «Организатор сводной графики» на слайдах 40-42, чтобы систематизировать знания, полученные на уроке.
- Slide 40-41 — Это дает учителю и ученику возможность увидеть, могут ли они различать чистые вещества и смеси.
- Слайд 42 — Этот слайд дает учащимся последний шанс провести самооценку, считают ли они, что они понимают концепцию.
Итоговая оценка
В следующем классе будет выпущена мини-викторина, в которой учащийся оценит способность успешно различать чистые вещества и смеси.Мини-викторина и ключ для ответа находятся во вложении.
Формирующее оценивание
Учитель будет использовать презентацию PowerPoint для проведения формирующего оценивания.Практические вопросы «Элементы, соединения и смеси» на слайдах 10–14 и практические вопросы «Примеры из реальной жизни» на слайде 16-27 будут служить в качестве формирующих оценок для проверки понимания учащимися и оценки необходимости дальнейшей помощи.
Обратная связь с учениками
Обратная связь с учениками будет происходить на этапе обучения и во время наблюдения за выполнением учениками практических вопросов «Элементы, соединения и смеси» и «Примеры из реальной жизни».
Размещение и Рекомендации
-
Приспособления:
Просмотрите IEP учащихся, чтобы получить соответствующие индивидуальные приспособления, соответствующие этому уроку.Тем не менее, общие условия проживания будут включать:
- Расширенное время; и
- Небольшие группы / совместные группы
-
Расширения:
Возможное расширение этого урока будет заключаться в том, что учащиеся предложат собственное объяснение различий между чистыми веществами и смесями и примеры каждого из них.
-
Предлагаемая технология: Камера для документов, компьютер для докладчика, ЖК-проектор -
Необходимые специальные материалы:
Фаза обучения:
- Презентация — Чистые вещества, смеси и растворы — Oh My!
Демонстрация Lego:
Суммативная оценка:
-
Дополнительные рекомендации:
Процедуры:
Управляемый вопрос: Учитель начнет с того, что попросит класс устно ответить на следующий управляемый вопрос: «В чем разница между чистым веществом и смесями?»
Презентация PowerPoint: Затем учитель начнет урок, используя подготовленную презентацию PowerPoint:
- Слайды 1-7 — Эти слайды следует использовать на этапе обучения.Они обеспечивают характеристики чистых веществ, гомогенных смесей, гетерогенных смесей и растворов. Это предоставит студентам справочную информацию, необходимую для успешного понимания теста.
Лего Демонстрация
- Слайды 8 — Этот слайд будет действовать как сигнал к началу демонстрации Lego.
- Шаг 1: Возьмите одноцветный Lego.
- Объясните ученикам, что это одноцветное Lego представляет собой элемент.
- Это пример элемента (чистого вещества).
- Шаг 2: Возьмите еще четыре Legos одного цвета.
- Объясните ученикам, что это пример чистой субстанции, потому что Лего единообразны и не могут быть физически разделены.
- Это все еще пример элемента (чистого вещества).
- Шаг 3: Возьмите лого разных цветов, чем на шаге 1, и смешайте их вместе.
- Спросите студентов, является ли это все еще примером чистого вещества.
- Объясните ученикам, что это стало смесью, потому что она больше не однородна (теперь присутствуют два лего разного цвета) и ее можно физически разделить (на две разные цветовые группы).
- Это пример смеси элементов.
- Шаг 4: Создайте одно соединение, соединив два синих Lego и одно белое Lego.
- Объясните студентам, что это пример соединения и что соединения также являются примерами чистых веществ.
- Это пример соединения (чистого вещества).
- Шаг 5: Создайте еще три таких же компаунда, как на шаге 4, и смешайте их вместе.
- Спросите студентов, является ли это примером чистого вещества или смеси.
- Объясните студентам, что, поскольку соединения однородны и не могут быть разделены на разные соединения, они все равно считаются чистым веществом.
- Это все еще пример соединения (чистого вещества).
- Шаг 6: Создайте два компаунда, соединив два оранжевого легиона и зеленый лес, и смешайте их вместе с компаундами из шага 5.
- Спросите студентов, является ли это примером чистого вещества или смеси.
- Объясните ученикам, что это стало смесью, потому что она больше не является однородной (теперь присутствуют два разных соединения с рисунком) и что его можно физически разделить (на две разные группы с рисунком).
- Это пример смеси соединений.
- Шаг 7: Объединение элементов и соединений, созданных на шагах 1-6, вместе.
- Спросите студентов, является ли это примером чистого вещества или смеси.
- Объясните ученикам, что это смесь, потому что она неоднородна (содержит разные типы элементов и соединений) и может быть физически разделена (на разные группы элементов и соединений).
- Шаг 8: Продолжайте шаги 1-7, чтобы представить дополнительные примеры этой абстрактной концепции, пока учащиеся не начнут чувствовать себя комфортно с этой концепцией. Затем перейдите к нескольким следующим слайдам, чтобы проверить их понимание.
- Шаг 1: Возьмите одноцветный Lego.
Практические вопросы по элементам, соединениям и смесям
- Слайды 9-14 — Эти слайды будут служить «проверкой здоровья», чтобы увидеть, поняли ли ученики демонстрацию Lego.
- Слайд 15 — Этот слайд дает учащимся возможность провести самооценку, считают ли они, что они понимают абстрактную концепцию.
Примеры из реальной жизни Практические вопросы
- Слайды 16-27 — Эти слайды будут использоваться в качестве формирующих оценок. Предыдущее формирующее оценивание оценивало понимание студентами абстрактной концепции элементов, соединений и смесей. Эта формирующая оценка позволит оценить, способны ли студенты применить эти абстрактные знания на примерах из реальной жизни.
- Слайды 28-38 — Эти слайды будут использоваться для обзора ответов на формирующее оценивание. Это будет шанс для учителя высказать мнение ученика о том, почему ответ правильный или неправильный.
- Слайд 39 — Этот слайд дает студентам еще одну возможность провести самооценку, считают ли они, что они понимают концепцию.
Графический органайзер сводной информации
- Slide 40-41 — Это дает учителю и ученику возможность увидеть, могут ли они различать чистые вещества и смеси.
- Слайд 42 — Этот слайд дает учащимся последний шанс провести самооценку, считают ли они, что они понимают концепцию.
Источник и информация о доступе
Прислал: Сэнди Люнг
Имя автора / источник: Sandy Leung
Район / организация авторов: Broward
Права доступа: Общедоступный
* Обратите внимание, что примеры ресурсов не являются полной учебной программой.Согласованные стандарты
Этот проверенный ресурс соответствует концепциям или навыкам в этих тестах.Связанные ресурсы
Другие проверенные ресурсы, связанные с этим ресурсом.Поздравления
Вы успешно создали учетную запись.
Ссылка для подтверждения была отправлена на вашу электронную почту .Пожалуйста, проверьте свою электронную почту и щелкните ссылку, чтобы подтвердить свой адрес электронной почты и полностью активировать свою учетную запись iCPALMS. Пожалуйста, проверьте папку со спамом.
Вы не ввели данные своего профиля. Пожалуйста, уделите несколько минут, чтобы заполнить раздел ниже, чтобы мы могли настроить ваш опыт CPALMS.
При создании учетной записи произошла ошибка. Обратитесь в службу поддержки [email protected] за помощью.
Веществ и смесей | Введение в химию
Цель обучения
- Отличить химические вещества от смесей
Ключевые моменты
- Вещество можно разделить на две категории: чистые вещества и смеси.Чистые вещества далее разбиваются на элементы и соединения. Смеси — это физически комбинированные структуры, которые можно разделить на их исходные компоненты.
- Химическое вещество состоит из одного типа атомов или молекул.
- Смесь состоит из различных типов атомов или молекул, которые не связаны химически.
- Гетерогенная смесь — это смесь двух или более химических веществ, в которой можно визуально различить различные компоненты.
- Гомогенная смесь — это смесь, состав которой однороден, и каждая часть раствора имеет одинаковые свойства.
- Существуют различные методы разделения для разделения веществ, включая дистилляцию, фильтрацию, выпаривание и хроматографию. Для этого разделения вещество может находиться в одной или двух разных фазах.
Условия
- вещество Форма вещества, имеющая постоянный химический состав и характерные свойства.Он состоит из одного типа атома или молекулы.
- элемент: Химическое вещество, состоящее из определенного типа атома, которое не может быть расщеплено или преобразовано с помощью химической реакции.
- смесь: То, что состоит из различных, несвязанных элементов или молекул.
Химические вещества
В химии химическое вещество — это форма вещества, имеющая постоянный химический состав и характерные свойства. Его нельзя разделить на компоненты без разрыва химических связей.Химические вещества могут быть твердыми, жидкостями, газами или плазмой. Изменения температуры или давления могут вызывать переход веществ между различными фазами вещества.
Элемент — это химическое вещество, состоящее из определенного типа атома и, следовательно, не может быть расщеплено или преобразовано в результате химической реакции в другой элемент. Все атомы элемента имеют одинаковое количество протонов, хотя они могут иметь разное количество нейтронов и электронов.
Чистое химическое соединение — это химическое вещество, состоящее из определенного набора молекул или ионов, которые химически связаны.Два или более элемента, объединенных в одно вещество в результате химической реакции, например вода, образуют химическое соединение. Все соединения являются веществами, но не все вещества являются соединениями. Химическое соединение может быть либо атомами, связанными вместе в молекулы, либо кристаллами, в которых атомы, молекулы или ионы образуют кристаллическую решетку. Соединения, состоящие в основном из атомов углерода и водорода, называются органическими соединениями, а все остальные — неорганическими соединениями. Соединения, содержащие связи между углеродом и металлом, называются металлоорганическими соединениями.
Химические вещества часто называют «чистыми», чтобы отличить их от смесей. Типичный пример химического вещества — чистая вода; он всегда имеет одни и те же свойства и одинаковое отношение водорода к кислороду, независимо от того, извлечен ли он из реки или изготовлен в лаборатории. Другие химические вещества, обычно встречающиеся в чистом виде, — это алмаз (углерод), золото, поваренная соль (хлорид натрия) и рафинированный сахар (сахароза). Простые или кажущиеся чистыми вещества, встречающиеся в природе, на самом деле могут быть смесями химических веществ.Например, водопроводная вода может содержать небольшие количества растворенного хлорида натрия и соединений, содержащих железо, кальций и многие другие химические вещества. Чистая дистиллированная вода — это вещество, а морская вода, поскольку она содержит ионы и сложные молекулы, представляет собой смесь.
Химические смеси
Смесь — это материальная система, состоящая из двух или более различных веществ, которые смешаны, но не соединены химически. Под смесью понимается физическая комбинация двух или более веществ, в которой сохраняются идентичности отдельных веществ.Смеси имеют форму сплавов, растворов, суспензий и коллоидов.
Встречающиеся в природе кристаллы серы Сера встречается в природе в виде элементарной серы, сульфида и сульфатных минералов, а также в виде сероводорода. Это месторождение полезных ископаемых состоит из смеси веществ.Гетерогенные смеси
Гетерогенная смесь — это смесь двух или более химических веществ (элементов или соединений), в которой различные компоненты можно визуально различить и легко разделить физическими средствами.Примеры включают:
- смеси песка и воды
- смеси песка и железной опилки
- каменный конгломерат
- вода и масло
- салат
- трейл микс
- смеси золотого порошка и серебряного порошка
Гомогенные смеси
Гомогенная смесь — это смесь двух или более химических веществ (элементов или соединений), различные компоненты которой невозможно различить визуально.Состав однородных смесей постоянный. Часто разделение компонентов гомогенной смеси является более сложной задачей, чем разделение компонентов гетерогенной смеси.
Различие между гомогенными и гетерогенными смесями зависит от масштаба отбора проб. В достаточно малом масштабе любую смесь можно назвать гетерогенной, потому что образец может быть размером с одну молекулу. На практике, если интересующие свойства одинаковы, независимо от того, сколько смеси взято, смесь является однородной.

 Например, раствор сахара в воде содержит как молекулы воды, так и молекулы сахара.
Например, раствор сахара в воде содержит как молекулы воды, так и молекулы сахара. Через поры фильтра проходят лишь соизмеримые с
ними частицы веществ, в то время как более крупные частицы задерживаются на
фильтре. Так можно разделить гетерогенную смесь поваренной соли и речного
песка. В качестве фильтров можно использовать различные пористые
вещества: вату, уголь, обожженную глину, прессованное стекло и другие. Способ
фильтрования – это основа работы бытовой техники, например пылесосов. Его
используют хирурги – марлевые повязки; буровики и рабочие элеваторов –
респираторные маски. С помощью чайного ситечка для фильтрования чаинок Остапу
Бендеру – герою произведения Ильфа и Петрова – удалось забрать один из
стульев у Эллочки Людоедки («Двенадцать стульев»).
Через поры фильтра проходят лишь соизмеримые с
ними частицы веществ, в то время как более крупные частицы задерживаются на
фильтре. Так можно разделить гетерогенную смесь поваренной соли и речного
песка. В качестве фильтров можно использовать различные пористые
вещества: вату, уголь, обожженную глину, прессованное стекло и другие. Способ
фильтрования – это основа работы бытовой техники, например пылесосов. Его
используют хирурги – марлевые повязки; буровики и рабочие элеваторов –
респираторные маски. С помощью чайного ситечка для фильтрования чаинок Остапу
Бендеру – герою произведения Ильфа и Петрова – удалось забрать один из
стульев у Эллочки Людоедки («Двенадцать стульев»).
 В специальных приборах – дистилляторах получают дистиллированную воду, которую используют для нужд фармакологии, лабораторий, систем охлаждения
автомобилей. В
домашних условиях можно сконструировать такой дистиллятор:
В специальных приборах – дистилляторах получают дистиллированную воду, которую используют для нужд фармакологии, лабораторий, систем охлаждения
автомобилей. В
домашних условиях можно сконструировать такой дистиллятор: