Молярная масса — что это? Как рассчитать? Формулы и примеры
Что такое моль
Прежде чем говорить о том, как найти молярную массу вещества, определимся с понятием «моль». Его ввели как искусственную величину для упрощения расчетов. Это количество вещества, в котором содержится столько же мельчайших частиц, сколько в 12 г одного из изотопов углерода — C12.
Для всех химических веществ это количество одинаково и представляет собой число Авогадро 6,02 · 1023. Постоянная Авогадро обозначается NA, а измеряется в моль-1.
Число Авогадро — это количество молекул, ионов или других мельчайших частиц в 1 моле вещества.
NA = 6,02 · 1023 моль-1.
Историческая справка
В 1811 году химик Амедео Авогадро предположил, что если взять два равных объема газов в равных значимых условиях (при одинаковой температуре и давлении), то количество молекул в этих объемах тоже будет одинаковым.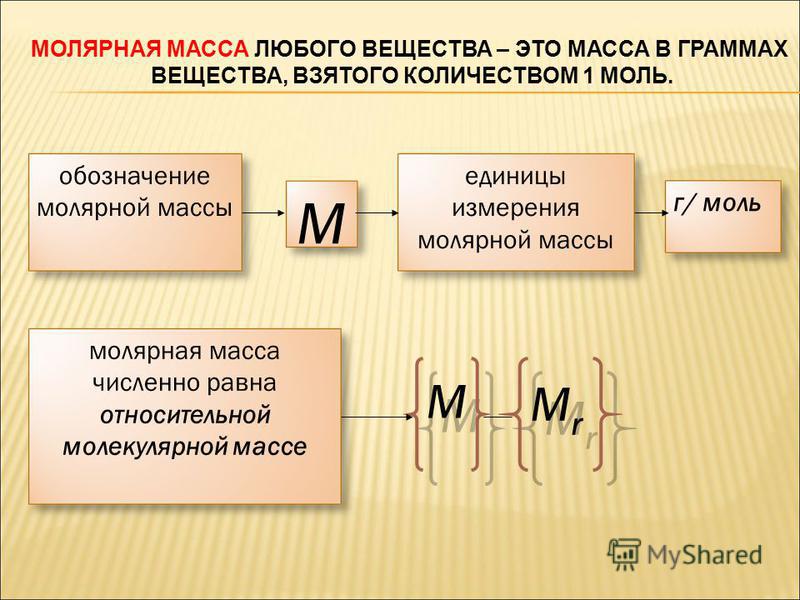
Что такое молярная масса
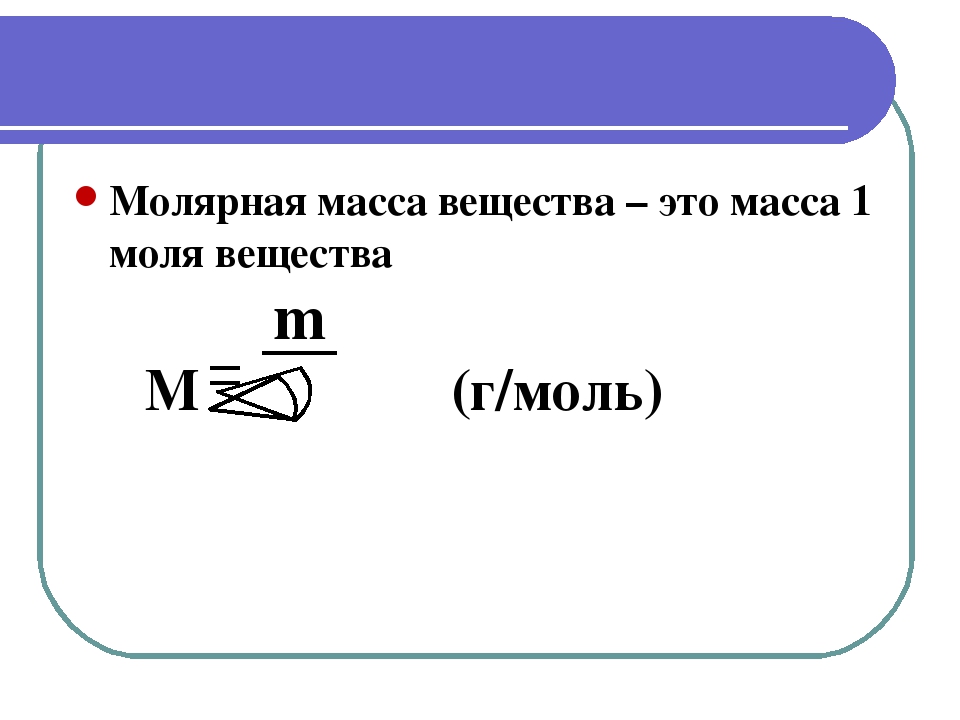
Молярная масса — это масса одного моля вещества, она измеряется в граммах деленных на моль (г/моль). Данная величина представляет собой отношение массы вещества к его количеству, которое измеряется в молях.
Как обозначается молярная масса: М.
, где — это масса вещества, а — количество вещества.
Единица измерения молярной массы: г/моль.
Запоминаем!
Правильно говорить именно молярная, а не мольная масса.
Несмотря на то, что в 1 моле любого химического вещества содержится одинаковое количество молекул (и оно равно числу Авогадро), молярные массы разных веществ отличаются.
Как определить молярную массу
Данная величина тесно связана с такими понятиями, как относительные атомная и молекулярная массы. Именно относительные, потому что абсолютную массу молекулы или атома вещества в химии не используют для решения задач — это слишком малые величины.
Относительная атомная масса вещества (Ar) показывает, во сколько раз его атом больше 1/12 атома углерода. Это значение для каждого химического элемента можно увидеть в таблице Менделеева.
Относительная молекулярная масса (Mr) складывается из Ar каждого атома в молекуле вещества с учетом индексов. Она показывает, на сколько масса молекулы больше 1/12 атома углерода.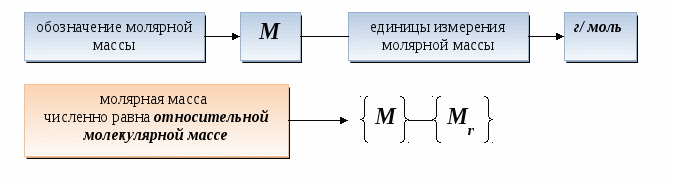
, где — это количество атомов.
Разберемся на примерах.
В молекуле хлорида натрия NaCl есть 1 атом натрия и 1 атом хлора, при этом Ar(Na) = 23, Ar (Cl) = 35,5.
Mr(NaCl) = 23 + 35,5 = 58,5.
В молекуле NaNO2 есть 1 атом натрия, 1 атом азота и 2 атома кислорода.
Ar(Na) = 23, Ar(N) = 14, Ar(O) = 16.
Mr(NaNO2) = 23 + 14 + 16 · 2 = 69.
Собственно, для вычисления молярной массы больше ничего и не требуется.
Важно
Молярная масса вещества численно равна относительной молекулярной массе. Но путать эти два понятия не стоит — у них разный физический смысл. Молярная масса характеризует 1 моль, а относительная молекулярная — 1 молекулу.
Количество вещества
Из предыдущих формул понятно, что молярная масса и количество вещества тесно связаны. Рассмотрим эту связь подробнее. Начнем с того, что количество вещества может обозначаться как латинской буквой , так и греческой буквой (ню). Международное обозначение — , но не стоит удивляться, встретив в формулах любую из этих букв.
Рассмотрим эту связь подробнее. Начнем с того, что количество вещества может обозначаться как латинской буквой , так и греческой буквой (ню). Международное обозначение — , но не стоит удивляться, встретив в формулах любую из этих букв.
В формуле нахождения молярной массы мы обозначили количество вещества через :
, следовательно .
Пользуясь этим, можно найти количество вещества (в молях), если нам известны его абсолютная и молярная масса.
Пример 1
Как определить, какое количество вещества включают 350 г сульфата бария BaSO4?
Воспользуемся формулой .
Мы помним, что M = Mr (значение молярной массы равно значению относительной молекулярной).
Mr(BaSO4) = Ar(Ba) + Ar(S) + Ar(O) · 4 = 137 + 32 + 16 · 4 = 233.
М(BaSO4) = Mr(BaSO4) = 233 г/моль.
Подставим значение молярной массы в формулу:
моль.
Есть и еще одна формула количества вещества, которая позволяет найти его, если известно число молекул или других структурных единиц.
, где — число структурных единиц, — число Авогадро.
Пример 2
Допустим, некий объем CaCO3 содержит 3,01 · 1023 молекул. Как найти количество вещества, соответствующее данному объему?
Воспользуемся формулой моль.
Молярный объем
Выше мы находили количество вещества через молярную массу, но для газов это можно сделать и через молярный объем. Согласно закону Авогадро количество любого газа, равное 1 моль, будет занимать один и тот же объем, если газы рассматриваются при одинаковой температуре и давлении.
При стандартных физических условиях — температуре 0°С и давлении 1 атм или 760 мм ртутного столба, 1 моль газа занимает объем 22,4 л.
Молярный объем — это объем газа, взятого в количестве 1 моль. Он обозначается Vm.
При нормальных условиях Vm = 22,4 л/моль.
Значения молярного и фактического объема газа помогают найти количество вещества.
, где — фактический объем газа, а — молярный объем.
Пример 1
Сколько молей содержится в 120 литрах газа при нормальных условиях?
Рассчитаем по формуле моль.
Ответ: 120 литров любого газа при стандартных условиях содержат 5,36 моль.
Относительная плотность одного газа по другому
Иногда для решения задачи нужно знать, как найти молярную массу газа, о котором сообщается лишь его плотность по воздуху или по другому газу. Это возможно, если знать формулу относительной плотности, которая обозначается буквой D.
, где и — некие газы.
Пример 1
Как определить, во сколько раз угарный газ плотнее водорода?
Для начала найдем молярную массу CO и H2:
М(CO) = Mr(CO) = Ar(C) + Ar(O) = 12 + 16 = 28.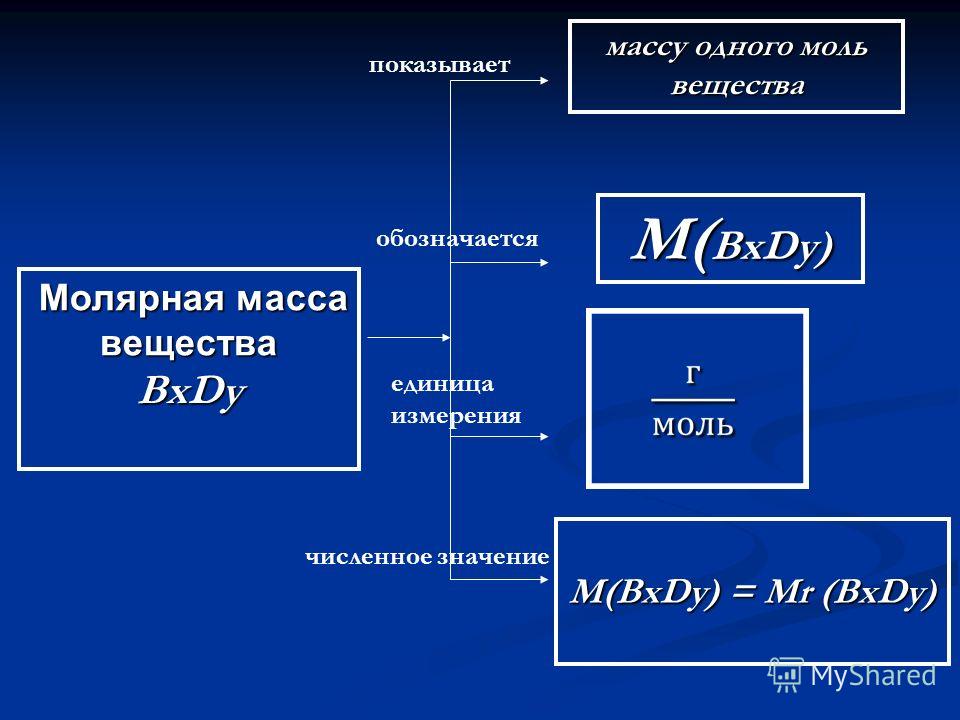
М(H) = Mr(H2) = 2 · Ar(H) = 2 · 1 = 2.
.
Ответ: угарный газ в 14 раз плотнее водорода.
Пример 2
Как посчитать молярную массу газа х, о котором известно, что он в 10 раз плотнее углекислого газа CO2?
Подсчитаем для начала молярную массу углекислого газа:
M(CO2) = Mr(CO2) = 12 + 2 · 16 = 44.
Ориентируясь на формулу относительной плотности, произведем расчет молярной массы искомого газа х.
М(х) = D(х/CO2) · M(CO2) = 10 · 44 = 440 г/моль.
Ответ: у данного газа молярная масса 440 г/моль.
Примеры задач
Итак, мы разобрались, как находить молярную массу жидкости, газа или твердого тела и как это понятие связано с количеством вещества, а также с относительной плотностью одного газа по другому. Чтобы закрепить знания, посмотрите, как эти сведения применяются в решении задач.
Задача 1
Известно, что 300 г неустановленного вещества содержат 12,04 · 1023 молекул. Чему равна молярная масса данного вещества?
Дано:
N(х) = 12,04 · 1023.
m(х) = 300 г.
M(х) = ?
Решение:
Найдем количество вещества моль.
Подставим количество вещества в формулу :
г/моль.
Ответ: молярная масса данного вещества 150 г/моль.
Задача 2
Какой объем займет водород в количестве 0,7 моль?
Дано:
моль.
Решение:
По формуле мы можем найти объем .
Зная, что молярный объем при обычных условиях составляет 22,4 л/моль, вычислим фактический объем водорода:
л.
Ответ: объем водорода составляет 15,68 литров.
Задача 3
В порции оксида серы SO3 содержится 8,356 · 1023 атомов кислорода. Какова масса этой порции?
Дано:
N(O) = 8,356 · 1023.
m(SO3) = ?
Решение:
Для решения задачи нам подходит формула , т. е. . Но для начала нужно найти количество вещества.
Мы знаем, что в одной молекуле SO3 есть 3 атома кислорода, исходя из этого можно вычислить количество молекул в порции оксида:
, следовательно .
Зная количество молекул, рассчитаем количество вещества:
моль.
Теперь можно узнать молярную массу SO3:
M(SO3) = 32 + 16 · 3 = 80 г/моль.
Рассчитаем фактическую массу через молярную массу:
г.
Ответ: абсолютная масса порции оксида серы 36,8 грамм.
Задача 4
Как рассчитать молярную массу простого вещества, о котором известно, что в порции 100 г содержится 15,05 · 1023 молекул? Назовите это вещество.
Дано:
m(x) = 100 г.
N(x) = 15,05 · 1023.
М(х) = ?
Решение:
В данном случае поможет вычислить молярную массу NA, с помощью которого мы сначала узнаем количество вещества:
моль.
Исходя из этого, рассчитаем молярную массу:
г/моль.
Ответ: согласно таблице Менделеева можно предположить, что это кальций Ca.
Задача 5
Определите, насколько сероводород H2S плотнее водорода H2?
Решение:
Нам требуется вычислить относительную плотность сероводорода по водороду:
.
Для этого вычислим молярные массы H2S и H2:
М(H2S) = 1 · 2 + 32 = 34 г/моль.
М(H2) = 1 · 2 = 2 г/моль.
Подставим значения в формулу:
.
Ответ: сероводород в 17 раз плотнее водорода.
Вопросы для самопроверки
Что такое число Авогадро и чему оно равно?
В чем измеряется молярная масса?
Напишите формулу молярной массы вещества.
Какая формула связывает количество вещества и его объем?
Как узнать количество вещества, если известно число молекул в порции?
Масса, относительные массы, молярная масса, массовые доли — урок.
 Химия, 8–9 класс.
Химия, 8–9 класс.Особенности применения физической величины «масса»
Масса обозначается буквой m и измеряется в граммах, килограммах или миллиграммах.
Пример:
m(h3SO4)= \(98\) г — масса серной кислоты равна \(98\) г.
Обрати внимание!
Связь между единицами измерения массы:
\(1\) кг \(=\) \(1000\) г, \(1\) г \(= 1000\) мг, \(1\) г \(= 0,001\) кг, \(1\) мг \(= 0,001\) г.
Массу атомов и молекул тоже можно выражать в граммах, килограммах или миллиграммах.
Пример:
масса одного атома серы:
ma(S)= 5,312⋅10−23 г.
Масса одной молекулы серной кислоты:
mm(h3SO4)= 1,627⋅10−22 г.
Это очень маленькие числа, которыми пользоваться неудобно. Поэтому для характеристики масс атомов и молекул введена атомная единица массы.
Атомная единица массы (а. е. м.) — 112 часть массы атома углерода.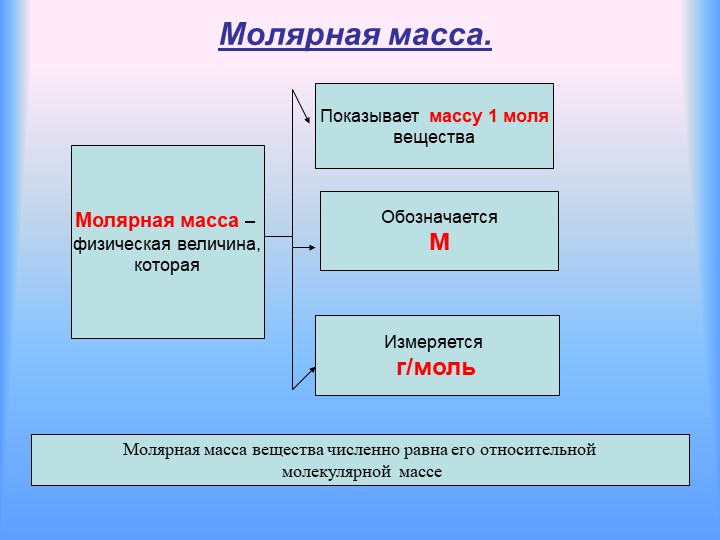 Её международное обозначение — u («unit»).
Её международное обозначение — u («unit»).
\(1\) u \(= 1\) а. е. м. \(=\) 1,66⋅10−24 г \(=\) 1,66⋅10−27 кг.
В атомных единицах массы атомов и молекул равны небольшим целым числам.
Пример:
ma(S)= \(32\) а. е. м. \(= 32\) u,
mm(h3SO4)= \(98\) а. е. м. \(= 98\) u.
Относительные массы
Применяются также относительные массы. Эти величины показывают, во сколько раз масса атома или молекулы больше одной атомной единицы массы.
Относительная атомная масса Ar — это отношение массы атома к \(1\) атомной единице массы. Величина безразмерная.
Пример:
Ar(S)= \(32\).
Относительная молекулярная масса Mr — это отношение массы молекулы к \(1\) атомной единице массы. Величина безразмерная.
Пример:
Mr(h3SO4)= \(98\).
Молярная масса
В расчётах используется также понятие «молярная масса».
Молярная масса численно равна массе \(1\) моль вещества. Она обозначается буквой M и измеряется в г/моль.
Она обозначается буквой M и измеряется в г/моль.
Пример:
M(h3SO4)= \(98\) г/моль.
Массовые доли
Массовая доля — это отношение массы компонента к массе образца вещества, в котором он содержится. Вычисляют массовую долю химического элемента в веществе, вещества в смеси, растворённого вещества в растворе, примесей и т. д.
Массовая доля обозначается буквой w. Это безразмерная величина. Может вычисляться также в %.
Глава 12. Основные понятия и принципы молекулярно-кинетической теории
В задания ЕГЭ по физике всегда включаются задачи, касающиеся основных принципов молекулярно-кинетической теории. Это задачи, связанные с молекулярной структурой газов, жидкостей и твердых тел, с определением температуры, с методами подсчета числа составляющих тело молекул. В этой главе собраны задачи, связанные с понятиями моля и температуры.
Молем вещества называется такое количество этого вещества, которое содержит приблизительно молекул, причем независимо от того, какое это вещество (точнее ). Приведенное выше число молекул в моле называется числом Авогадро и обозначается как . Как правило, при решении задач считают, что
Приведенное выше число молекул в моле называется числом Авогадро и обозначается как . Как правило, при решении задач считают, что
(12.1) |
Обратим внимание читателя на то, что моль — макроскопическое количество вещества (в переводе с латинского языка — языка средневековой науки — слово moles означает толпа).
Масса одного моля вещества называется молярной массой этого вещества. И поскольку массы молекул разных веществ — разные, а число молекул в моле разных веществ одинаковое, то молярные массы веществ различны. При этом отношение молярных масс двух веществ равно отношению масс их молекул. Поэтому массы молей пропорциональны массам молекул. Число Авогадро (12.1) было подобрано так, чтобы масса моля, выраженная в граммах, численно совпадала с массой молекулы, выраженной в атомных единицах массы (а.е.м.). Поэтому массы молей различных веществ легко найти из периодической системы химических элементов. Например, в таблице находим, что масса молекулы гелия — 4,0026 а.е.м., следовательно, масса моля гелия — 4,0026 4 г, масса двухатомной молекулы кислорода — 31,986 а.е.м., следовательно, масса моля кислорода — 31,986 32 г.
Например, в таблице находим, что масса молекулы гелия — 4,0026 а.е.м., следовательно, масса моля гелия — 4,0026 4 г, масса двухатомной молекулы кислорода — 31,986 а.е.м., следовательно, масса моля кислорода — 31,986 32 г.
Необходимо также знать определение температуры. Температура тела — величина, пропорциональная средней кинетической энергии молекулы
(12.2) |
где — средняя кинетическая энергия молекулы, — абсолютная температура (ее называют также температурой в шкале Кельвина), — постоянная, которая называется постоянной Больцмана. Из формулы (12.2) следует, что температура по шкале Кельвина не может быть отрицательна, ее минимальное значение (абсолютный нуль температуры) достигается, когда все молекулы имеют нулевые кинетические энергии. 1 градус шкалы Кельвина (или просто один Кельвин) совпадает с градусом более привычной в быту шкалы Цельсия, нуль которой определяется как температура плавления льда, а температура 100 отвечает температуре кипения воды при атмосферном давлении. Как показывает опыт, абсолютному нулю температуры отвечает температура . Важнейшее свойство температуры заключается в том, что при приведении тел в тепловой контакт их температуры через некоторое время выровняются и далее (в отсутствие теплообмена с окружающими телами) не будут изменяться. Рассмотрим теперь задачи.
Как показывает опыт, абсолютному нулю температуры отвечает температура . Важнейшее свойство температуры заключается в том, что при приведении тел в тепловой контакт их температуры через некоторое время выровняются и далее (в отсутствие теплообмена с окружающими телами) не будут изменяться. Рассмотрим теперь задачи.
В задаче 12.1.1 правильным ответом правильным ответом является ответ 3, поскольку число молекул в моле не зависит от того, какое это вещество, и равно числу Авогадро.
Поскольку массы молекул разных веществ — разные, одинаковые массы разных веществ содержат различные количества молекул. Найти эти количества можно, зная молярные массы и число Авогадро. Например, в задаче 12.1.2 можно провести такие рассуждения. Водород массой 1 г составляет половину моля, и, следовательно, содержит молекул. Кислород массой 1 г составляет 1/32 часть моля, и, следовательно, содержит молекул. Отсюда находим отношение числа молекул в 1 г водорода к числу молекул в 1 г кислорода: (ответ 1).
Согласно определению число молекул в моле одинаково для любого вещества, причем независимо от того, сколько атомов входят в состав одной молекулы этого вещества. Другими словами, это число не зависит от того, являются ли молекулы одно-, двух-, и т.д. атомными. Поэтому правильный ответ в задаче 12.1.3 — 4.
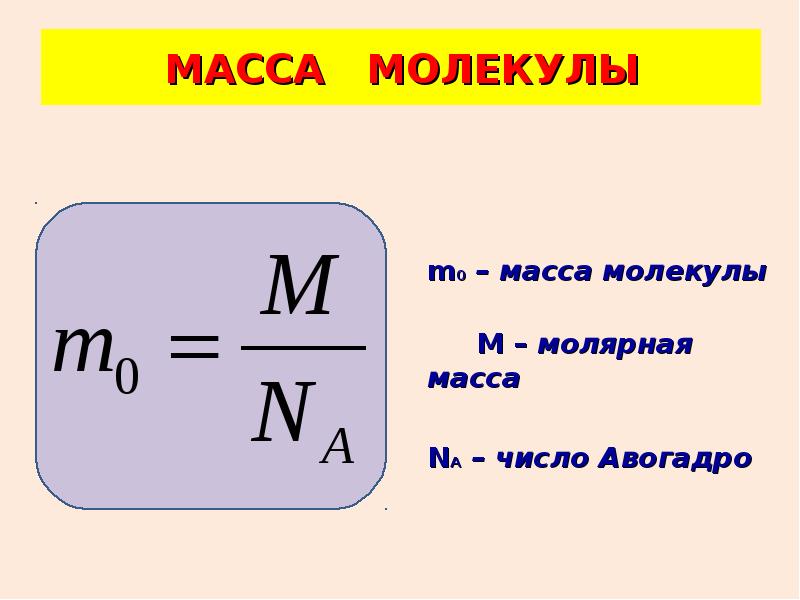
Поскольку число молекул в моле любого вещества равно числу Авогадро, то для молярной массы любого вещества справедливо соотношение: , где — масса одной молекулы. Отсюда находим в задаче 12.1.4, что (ответ 1).
Чтобы понять, сколько молей содержит та или иная масса вещества, нужно разделить эту массу на молярную массу данного вещества (или число содержащихся в ней молекул на число Авогадро). Поскольку молярная масса гелия равна 4 г/моль, то 10 г гелия в задаче 12.1.5 составляют 4/10 = 2,5 моль (ответ 1).
Для характеристики числа молекул в некоторой массе вещества принято использовать величину, которая называется количество вещества. Эта величина определяется как число молей, составляющих данную массу. Для нахождения количества вещества нужно разделить число молекул этой массы вещества на число Авогадро, (или саму массу на молярную массу данного вещества). Поскольку в задаче 12.1.6 газ в сосуде содержит молекул, то количество вещества газа составляет 0,5 моль (ответ 2).
Эта величина определяется как число молей, составляющих данную массу. Для нахождения количества вещества нужно разделить число молекул этой массы вещества на число Авогадро, (или саму массу на молярную массу данного вещества). Поскольку в задаче 12.1.6 газ в сосуде содержит молекул, то количество вещества газа составляет 0,5 моль (ответ 2).
Как указывалась во введении к настоящей главе, молярные массы веществ можно найти по периодической таблице элементов. Масса моля, выраженная в граммах, численно совпадает с массой молекулы, выраженной в атомных единицах массы (а.е.м.). Из приведенной в условии задачи 12.1.7 клетки таблицы, отвечающей рутению, находим массу молекулы рутения = 101,07 а.е.м. (второе число в клетке, которое для всех элементов является обязательно целым, представляет собой порядковый номер элемента). Поэтому для рутения находим: = 101,07 ≈ 101 г/моль (ответ 2).
Связь температуры и средней кинетической энергии молекул определяется формулой (12. 2) (задача 12.1.8 – ответ 2).
2) (задача 12.1.8 – ответ 2).
Температурой плавления льда (и замерзания воды) является температура 0 . Поскольку нуль шкалы Кельвина (абсолютный нуль температуры) в шкале Цельсия составляет –273 (см. введение к настоящей главе), то температура плавления льда по абсолютной шкале равна 273 (задача 12.1.9 — ответ 3).
Изменением температуры тела в некотором процессе называется разность его конечной и начальной температур тела . Так как температуры в шкале Цельсия и Кельвина связаны «сдвигом»: , то разность температур в градусах Кельвина и в градусах Цельсия совпадает:
Другими словами, изменение температуры тела одинаково при задании температуры как в шкале Кельвина, так и в шкале Цельсия. Поэтому правильный ответ в задаче 12.1.10 — 2.
В задаче 12.2.1 нужно снова использовать определение количества вещества. Напоминаем, что количеством вещества называется число молей, составляющих данную порцию вещества. Отсюда находим количество вещества водорода моль и количество кислорода моль в сосудах. Поэтому (ответ 1).
Отсюда находим количество вещества водорода моль и количество кислорода моль в сосудах. Поэтому (ответ 1).
Из периодической таблицы элементов имеем для масс атомов: = 1 а.е.м., = 14 а.е.м., = 16 а.е.м. (задача 12.2.2). Отсюда находим массу молекулы азотной кислоты
Поэтому = 63 г/моль (ответ 4).
Масса одной молекулы углерода = 12 а.е.м. А поскольку моль углерода содержит , то масса моля углерода равна а.е.м. (задача 12.2.3 – ответ 1).
Поскольку молярная масса — это характеристика вещества, то, находя эту величину, можно определить вещество. Например, в задаче 12.2.4 плотность газа (масса единицы объема) и концентрация молекул (число молекул в единице объема), очевидно, связаны друг с другом через массу одной молекулы . Умножая правую и левую часть этой формулы на число Авогадро и учитывая, что , получим = 4 г/моль. Поэтому неизвестный газ — гелий (ответ 2).
Используя определение температуры (12.2), получим для средней скорости молекул водорода в задаче 12.2.5
(ответ 3).
Из определения температуры (12.2) следует, что при повышении температуры в 2 раза средняя скорость молекул увеличивается в раз (задача 12.2.6 – ответ 3).
При приведении газов в тепловой контакт их температуры выровняются (задача 12.2.7). Отсюда согласно определению температуры следует, что средние кинетические энергии молекул газов станут равными:
или (ответ 3).
Задача 12.2.8 аналогична предыдущей. Используя определение температуры (12.2) для каждого газа и учитывая, что независимо от того, сколько атомов входит в состав молекулы, в правую часть определения температуры (12.2) входит коэффициент 3/2, получим
где — средняя скорость молекул водорода, — средняя скорость молекул гелия. Поскольку масса молекулы гелия в два раза больше массы молекулы водорода, то
Поскольку масса молекулы гелия в два раза больше массы молекулы водорода, то
(ответ 2).
Поскольку моль любого вещества содержит одинаковое количество молекул, то для сравнения числа молекул воды и ртути в стакане (задача 12.2.9) можно сравнить число молей. Число молей воды и ртути в стакане найдем из следующих цепочек формул. Воды:
(1) |
Ртути:
(2) |
где и — массы и плотности веществ, — молярные массы, — объем стакана. Сравнивая величины (1) и (2), заключаем
(здесь использованы плотности и молярные массы воды и ртути). Поэтому в стакане ртути больше молекул, чем в стакане воды (ответ 2), причем в 67/55 =1,2 раза.
Сначала обратим внимание читателя, что предложенные в задаче 12. 2.10 значения температур и варианты ответов «подталкивают» к выбору ответа , поскольку конечная температура в 5 раз больше начальной. Тем не менее это неправильно, поскольку температуры заданы в градусах Цельсия, а в формулу (12.2), связывающую температуру и среднюю кинетическую энергию молекул, входит абсолютная температура. Поэтому
2.10 значения температур и варианты ответов «подталкивают» к выбору ответа , поскольку конечная температура в 5 раз больше начальной. Тем не менее это неправильно, поскольку температуры заданы в градусах Цельсия, а в формулу (12.2), связывающую температуру и среднюю кинетическую энергию молекул, входит абсолютная температура. Поэтому
(ответ 4).
Моль. Молярная масса
Из материалов урока вы узнаете, как и в чем измеряют массы молекул, как определить порции твердых и жидких веществ, имеющие равное число молекул. Урок посвящен изучению понятий «относительная молекулярная масса», «молярная масса», “постоянная Авогадро”. Вы познакомитесь с новой характеристикой вещества – количеством вещества.
I. Моль, постоянная Авогадро
Посмотрите видео:
В химических процессах участвуют мельчайшие частицы – молекулы, атомы, ионы, электроны. Число таких частиц даже в малой порции вещества очень велико. Поэтому, чтобы избежать математических операций с большими числами, для характеристики количества вещества, участвующего в химической реакции, используется специальная единица – моль.
Число таких частиц даже в малой порции вещества очень велико. Поэтому, чтобы избежать математических операций с большими числами, для характеристики количества вещества, участвующего в химической реакции, используется специальная единица – моль.
Моль — это такое количество вещества, в котором содержится определенное число частиц (молекул, атомов, ионов), равное постоянной Авогадро
Слово «моль» происходит от слова «молекула». Число молекул в равных количествах вещества одинаково.
Экспериментально установлено, что 1 моль вещества содержит частиц (например, молекул). Это число называется числом Авогадро. А если к нему добавить единицу измерения – 1/моль, то это будет физическая величина – постоянная Авогадро, которая обозначается NА.
Постоянная Авогадро NA определяется как число атомов, содержащееся в 12 г изотопа 12С:
Таким образом, 1 моль любого вещества содержит 6,02 • 1023 частиц этого вещества.
1 моль кислорода содержит 6,02 • 1023 молекул O2.
1 моль серной кислоты содержит 6,02 • 1023 молекул H2SO4
1 моль железа содержит 6,02 • 1023 атомов Fe
1 моль серы содержит 6,02 • 1023 атомов S
2 моль серы содержит 12,04 • 1023 атомов S
0,5 моль серы содержит 3,01 • 1023 атомов S
Исходя из этого, любое количество вещества можно выразить определенным числом молей “ν” (ню). Например, в образце вещества содержится 12,04 • 1023 молекул. Следовательно, количество вещества в этом образце составляет:
В общем виде:
где N – число частиц данного вещества;
Nа – число частиц, которое содержит 1 моль вещества (постоянная Авогадро).
II. Молярная масса
Молярная масса вещества (M) – масса, которую имеет 1 моль данного вещества.
Эта величина, равная отношению массы m вещества к количеству вещества ν, имеет размерность кг/моль или г/моль. Молярная масса, выраженная в г/моль, численно равна относительной относительной молекулярной массе Mr (для веществ атомного строения – относительной атомной массе Ar).
Например, молярная масса метана CH4 определяется следующим образом:
Мr(CH4) = Ar(C) + 4 Ar(H) = 12+4 =16
M(CH4)=16 г/моль, т.е. 16 г CH4 содержат 6,02 • 1023 молекул.
Молярную массу вещества можно вычислить, если известны его масса m и количество (число молей) ν, по формуле:
Соответственно, зная массу и молярную массу вещества, можно рассчитать число его молей:
или найти массу вещества по числу молей и молярной массе: m = ν • M
Необходимо отметить, что значение молярной массы вещества определяется его качественным и количественным составом, т. е. зависит от Mr и Ar. Поэтому разные вещества при одинаковом количестве молей имеют различные массы m.
е. зависит от Mr и Ar. Поэтому разные вещества при одинаковом количестве молей имеют различные массы m.
Пример
Вычислить массы метана CH4 и этана С2H6, взятых в количестве ν = 2 моль каждого.
Решение
Молярная масса метана M(CH4) равна 16 г/моль;
молярная масса этана M(С2Н6) = 2 • 12+6=30 г/моль.
Отсюда:
m(CH4) = 2 моль • 16 г/моль = 32 г;
m(С2Н6) = 2 моль • 30 г/моль = 60 г.
Таким образом, моль – это порция вещества, содержащая одно и то же число частиц, но имеющая разную массу для разных веществ, т.к. частицы вещества (атомы и молекулы) не одинаковы по массе.
n(CH4) = n(С2Н6), но m(CH4) < m(С2Н6)
Вычисление ν используется практически в каждой расчетной задаче.
III. Решение задач
|
Задача №1. Вычислите массу (г) железа, взятого количеством вещества 0, 5 моль? Дано: ν(Fe)=0,5 моль Найти: m(Fe) — ? Решение: m = M · ν M(Fe) = Ar(Fe) = 56 г/моль (Из периодической системы) m (Fe) = 56 г/моль · 0,5 моль = 28 г Ответ: m (Fe) =28 г |
|
Задача №2. Вычислите массу (г) 12,04 · 1023 молекул оксида кальция CaО? Дано: N(CaO)= 12,04 * 1023 молекул Найти: m(СaO) — ? Решение: m = M · ν, ν= N/Na, следовательно, формула для расчёта m = M · (N/Na) M(CaO) = Ar(Ca) + Ar(O) = 40 + 16 = 56 г/моль m= 56 г/моль · (12,04 * 1023/6. Ответ: m= 112 г |
IV. Тренажеры
Тренажёр №1 — Взаимосвязь количества вещества, числа частиц и постоянной Авогадро
Тренажёр №2 — Взаимосвязь массы, количества вещества и молярной массы
Тренажёр №3 — Вычисление количества вещества по известной массе вещества
Тренажёр №4 — Вычисление массы вещества по известному количеству вещества
Тренажёр №5 — Вычисление массы вещества по известному числу частиц вещества
Тренажёр №6 — Вычисление молярной массы вещества
Тренажёр №7 — Вычисление числа частиц вещества по известной массе вещества
Тренажёр №8 — Вычисления числа частиц вещества по известному количеству вещества
V. Выполните интерактивный тест
«Упражнения для контроля и самопроверки по вычислению количества вещества»
«Упражнения для контроля и самопроверки по вычислению молярной массы вещества «
VI. Задания для закрепления
Задания для закрепления
Задача 1. Вычислите массу воды (г), взятой количеством вещества 5 моль?
Задача 2. Вычислите массу 24,08 *1023 молекул серной кислоты H2SO4?
Задача 3. Определите число атомов в 56 г железа Fe?
Урок на тему. Количество вещества. Моль. Молярная масса.
Тема 2. урок № 12: Количество вещества. Моль. Молярная масса.
Цель урока: познакомить учащихся с понятием «количество вещества», «моль», сформировать представление о молярной массе вещества и научить учащихся переходить от понятия «относительная молекулярная масса» к понятию «молярная масса вещества»
Планируемые результаты:
Личностные:
Формирование познавательной потребности.
Формирование стремления к глубокому усвоению знаний.
Воспитание аккуратности в оформлении и записи задач
Метапредметные:
Развивать умения применять знания.
Развивать логическое мышление..
Развивать умение анализировать условия.
Предметные:
Формировать в ходе урока понятия «количество вещества», «число Авогадро».
Сформировать умение решать задачи на количество вещества.
Развивать умение наблюдать, анализировать, делать выводы, выделять нужную информацию.
Основные понятия: «закон Авогадро», «количество вещества», «молярная масса», «моль».
Оборудование: образцы веществ количеством 1 моль( NaCl, H2O, Fe, ), словари: Ожегова и иностранных слов, карточки с картинками значений слова моль, портреты А.Авогадро.
Ход урока.
Постановка цели урока.
1.Химия, русский язык и зоология.
Учитель: В русском языке достаточно часто встречаются слова, у которых бывает не одно, а несколько значений. Я попрошу вас найти в словарях значения слова « моль». Учащиеся находят и вот что у них получается
Учащиеся находят и вот что у них получается
1.Моль комнатная — это насекомое, которое относится к виду чешуекрылых. Является домашним вредителем. Существует несколько видов моли, но наибольший вред приносит именно платяная моль, которая откладывает яйца в шубах, шерстяных коврах и одежде.
2.Моль — синоним музыкальному термину минор
МИН́ОР (итал. minore, от лат. minor — меньший; также moll, от лат. mollis — мягкий) (муз.), лад, устоем к-рого является малое (минорное, с малой терцией в основе) трезвучие, придающее ему специфич. «сумрачную» окраску (минорное наклонение ) в противоположность мажору .
3.Также моль — это лес, который сплавляют по реке бревнами, не связывая в плот.
Задание: узнать как долго у нас сплавляли так лес и в каком году это прекратилось. Как это влияло на экологию?
4. У слова моль есть еще одно значение. Моль — это важнейшее понятие в химии. Моль (с лат. Moles) — это масса или количество, т. е. единица измерения количества определенного вещества в Международной системе единиц.
Moles) — это масса или количество, т. е. единица измерения количества определенного вещества в Международной системе единиц.
II.Изучение нового материала.
1.Понятие “моль» и «количество вещества»
— Что изучает химия? (Вещества, свойства и превращение веществ.)
— Рассмотрим реакцию взаимодействия водорода и кислорода:
2Н2 + О2 = 2Н2О
Как нужно отмерить водород и кислород, чтобы они полностью прореагировали и образовали воду?
(Нужно взять на одну молекулу кислорода две молекулы водорода.)
— Но технически это выполнить невозможно из-за малого размера молекул. Как быть?
А если взять столько граммов водорода, сколько весят 2 его молекулы, т.е. массой 4 г. Соответственно кислорода взять 32 г, т.е. какова его молекулярная масса. Тогда поставленное вначале условие будет соблюдено — все молекулы водорода и все молекулы кислорода прореагируют друг с другом и образуют воду.
Потому вещество решили измерить единицей, в которой как бы соединились две величины — число молекул и масса вещества.
Такая единица называется моль (n).
Чтобы отмерить 1 моль вещества, нужно взять столько граммов его, какова относительная молекулярная масса вещества:
1 моль Н2 весит 2 г (Мr (Н2) = 2)
1 моль О2 весит 32 г (Мr (О2) = 32)
1 моль Н2О весит 18 г (Мr (Н2О) = 18)
А сколько реальных частиц — молекул содержится в 1 моле любого вещества?
Очевидно, что одинаковое число. Оно называется постоянной Авогадро.
1 моль вещества равен количеству вещества, содержащему столько структурных частиц данного вещества, сколько атомов содержится в 12 г. изотопа углерода 12С, а именно 6,02 x 1023. Величину 6,02 x 1023 называют постоянной Авогадро и обозначают NA, по имени ученого, который впервые использовал эту величину.
Количество вещества обозначается буквой n («эн») или v («ню»).
МОЛЬ — это КОЛИЧЕСТВО ВЕЩЕСТВА, равное 6,02.1023 структурных единиц данного вещества – молекул (если вещество состоит из молекул), атомов (если это атомарное вещество), ионов (если вещество является ионным соединением).
Примеры:
1 моль (1 М) воды = 6,02.1023 молекул Н2О,
1 моль (1 М) железа = 6,02.1023 атомов Fe,
1 моль (1 М) хлора = 6,02.1023 молекул Cl2,
1 моль (1 М) электронов е— = 6,02.1023 электронов е—.
Теперь мы имеем удобную единицу количества вещества моль, с помощью которой легко отмерять равные порции молекул или атомов простым взвешиванием.
Разумеется, если мы увеличим или уменьшим взятое нами количество водорода и кислорода в одинаковое количество раз, то и порции реагирующих молекул уменьшатся или возрастут во столько же раз.
Как мы видим, масса одного моля какого-нибудь вещества (в граммах) числено совпадает с молекулярной или атомной массой этого вещества (в а.е.м. или в безразмерном выражении — как в случае относительной атомной или молекулярной массы). Это очень удобно для химических расчетов.
Масса одного моля вещества называется МОЛЯРНОЙ МАССОЙ. Она обозначается буквой М и имеет размерность г/моль. Количество молей вещества n находят из отношения массы m этого вещества (г) к его молярной массе М (г/моль).
Например, число молей в m г воды составляет: n = m/18. Для m г металлического натрия: n = m/23, и так далее.
Молярная масса численно всегда совпадает с молекулярной массой (или атомной массой — если вещество состоит не из молекул, а из атомов). х веществ.
Как мы видим, термины «молекулярная масса» и «молярная масса» применимы не только к веществам молекулярного строения, но и к атомарным и ионным веществам. Молярная масса М – постоянная величина для каждого конкретного вещества. Без неё не обойтись при вычислении количества молей (n). Однако в дальнейшем для нас основным рабочим инструментом будет именно МОЛЬ вещества.
Молярная масса М – постоянная величина для каждого конкретного вещества. Без неё не обойтись при вычислении количества молей (n). Однако в дальнейшем для нас основным рабочим инструментом будет именно МОЛЬ вещества.
Термины “моль” и “молекула” отдаленно связаны между собой. Моль происходит от латинского moles, что означает количество, счетное множество, а также масса. Термин “молекула” является уменьшительной формой этого слова и означает “маленькая масса”. Таким образом моль – это такое количество вещества, которое можно считать “большой массой”, состоящей из 6,02* 1023 “маленьких масс”.
Учитель: А можно ли взвесить 0,5 молекулы кислорода? Ведь из-за малого размера молекул отсчитать нужное число частиц просто не возможно. Поэтому перед химиками стоял вопрос, как соединить массу (легко взвесить) и число частиц. И они нашли решение, для этого они решили проверить, сколько частиц содержит вещество взятое массой равной его относительной молекулярной массе. Оказалось, что в порции любого вещества содержится одинаковое число частиц равное -6*1023.Это число назвали числом Авогадро. Вот это порциявещества, которая содержит -6*1023частици является ,1 порцией вещества единицей измерения которого, является — моль. А что нужно сделать, чтобы отмерить один моль вещества?
Оказалось, что в порции любого вещества содержится одинаковое число частиц равное -6*1023.Это число назвали числом Авогадро. Вот это порциявещества, которая содержит -6*1023частици является ,1 порцией вещества единицей измерения которого, является — моль. А что нужно сделать, чтобы отмерить один моль вещества?
Показать простые и сложные вещества количеством 1 моль.
— Как вы думаете, я отмеряла эти вещества? Считала количество молекул и атомов? Нет, я их просто взвешивала.
МАССА 1 МОЛЬ ВЕЩЕСТВА НАЗЫВАЕТСЯ ЕГО МОЛЯРНОЙ МАССОЙ, обозначается М и измеряется в г/моль. Молярная масса численно равна относительной молекулярной массе.
Если мы возьмем 16 грамма кислорода, какое количество вещества это составит? (Ответ оформляется формулой в таблице)
-0,5 моль
А сколько молекул будет содержаться в 16 грамм кислорода. (Ответ оформляется формулой).
-3*1023
.
В тетради чертим таблицу «Количественные характеристики вещества»
(Таблица заполняется по мере объяснения материала, на следующем уроке продолжаем заполнять. )
)
вещества
n
моль
n=m\M
n = N / NA
Количество вещества содержащее 6*1023
3.Молярная масса
М
г/моль
М=Мr
Масса 1 МОЛЬ вещества
2.Историческая справка
Амедео Авогадро (1776—1856) — итальянский физик и химик, член Туринской АН (1819). Родился 9 августа 1776, в Турине. Скончался 9 июля 1856, там же.
Получил юридическое образование в Туринском университете (1792). В 1800 начал самостоятельно изучать физику и математику. С 1806 Амедео Авогадро работал демонстратором в колледже при Туринской академии. С 1809 — профессор в колледже Верчелли, в 1820-1822 и 1834-1850 заведовал кафедрой математической физики в Туринском университете. Основные работы Амедео Авогадро посвящены молекулярной физике.
В 1811 он выдвинул молекулярную гипотезу строения вещества, установил один из газовых законов, названный его именем. Согласно этому закону в одинаковых объемах газов при одинаковых значениях температуры и давления содержится одинаковое количество молекул. Исходя из этого, ученый разработал метод определения молекулярного и атомного весов.
Согласно этому закону в одинаковых объемах газов при одинаковых значениях температуры и давления содержится одинаковое количество молекул. Исходя из этого, ученый разработал метод определения молекулярного и атомного весов.
Именем Авогадро названа универсальная постоянная — число молекул в одном моле идеального газа (число Авогадро). Амедео установил количественный атомный состав молекул некоторых веществ, для которых он ранее был определен неправильно (вода, водород, кислород, азот, оксиды азота, хлора и др. ). Первым обратил внимание на аналогию в свойствах азота, фосфора. мышьяка и сурьмы.
III.Закрепление
1. Вставьте недостающие по смыслу слова: Физическая величина, которая определяется числом структурных частиц (молекул, атомов, ионов), называется количеством вещества; обозначается n(«эн») или v («ню»); измеряется в молях.
Моль — это такое количество вещества, в котором содержится 6,02. 1023 молекул этого вещества.
1023 молекул этого вещества.
Постоянная Авогадро — это физическая величина, которая показывает число реальных частиц — молекул содержащихся в 1 моле любого вещества ,обозначается NA , численно равна 6,02.1023 .
Число частиц вещества N равно произведению постоянной Авогадро NA на количество вещества n(«эн») или v («ню»);.
2. Восстановите недостающие записи в таблице, можете воспользоваться учебником
1. Вставьте недостающие по смыслу слова: Физическая величина, которая определяется числом структурных частиц (молекул, атомов, ионов), называется количеством вещества; обозначается n(«эн») или v («ню»); измеряется в молях.
Моль — это такое количество вещества, в котором содержится 6,02. 1023 молекул этого вещества.
1023 молекул этого вещества.
Постоянная Авогадро — это физическая величина, которая показывает число реальных частиц — молекул содержащихся в 1 моле любого вещества ,обозначается NA , численно равна 6,02.1023 .
Число частиц вещества N равно произведению постоянной Авогадро NA на количество вещества n(«эн») или v («ню»);.
IV.Домашнее задание §
1.Рассчитайте массу 2 моль кислорода?
2.Какой объем займет это количество вещества?
3.Сколько молекул будет содержать это количество вещества?
Внеклассный урок — Количество вещества. Моль. Молярная масса
Количество вещества. Моль. Молярная масса.
Количество вещества – это число частиц в порции вещества.
Количество вещества обозначают греческой буквой ν («ню»).
Моль – это единица количества вещества. Это такое количество вещества (или его порция), которое содержит 6,02 · 1023 частиц (молекул, атомов или других частиц). Округленно: 6 · 1023.
Величину 6,02 · 1023 моль-1 называют постоянной Авогадро и обозначают латинскими буквой и индексом NА:
NA = 6,02 · 1023 моль
Итак, один моль любого вещества содержит 6,02 · 1023 молекул, атомов или других частиц.
Например, 1 моль воды H2O содержит 6 · 1023 молекул H2O;
1 моль железа Fe содержит 6 · 1023 атомов Fe.
1 моль хлора Cl2 содержит 6 · 1023 молекул Cl2.
В то же время 1 моль хлора Cl2 содержит 2 моль атомов хлора Cl.
Поэтому при записи обозначений в скобках указывают формулу частицы, о которой идет речь:
N(Cl2) – число молекул хлора, а N(Cl) – число атомов хлора;
ν(Cl2) – количество вещества молекулярного хлора, а ν(Cl) – количество вещества атомарного хлора.
Например, определим число молекул, содержащихся в воде количеством 0,5 моль:
N(H2O) = NA · ν(H2O) = 6 · 1023 моль-1 · 0,5 моль = 3 · 1023.
Молярная масса вещества M(X) равна отношению массы вещества m(X) к соответствующему количеству вещества ν(X):
m(X)
M(X) = ——
ν(X)
Молярную массу выражают в граммах на моль (г/моль) или в килограммах на моль (кг/моль).
1 г/моль = 10-3 кг/моль.
Молярная масса M равна относительной молекулярной массе Mr (если вещество состоит из молекул) или относительной атомной массе Ar (если вещество состоит из атомов).
Например, согласно Периодической таблице, атомная масса магния Mg составляет 24, а его молярная масса равна 24 г/моль. То есть вес 1 моль магния – 24 грамма. Или, говоря иначе, в 24 граммах магния содержится 6 • 1023 атомов магния.
То есть вес 1 моль магния – 24 грамма. Или, говоря иначе, в 24 граммах магния содержится 6 • 1023 атомов магния.
Что это — молярная масса воздуха?
Сколько весит воздух? На первый взгляд, это совершенно бессмысленный вопрос, ведь воздух нельзя потрогать, он, как мы привыкли думать, не давит на нас, он совсем невидим, не ощущается, и вообще, разве может воздух что-то весить? Даже говорят иногда про худеньких и костлявых людей: «Да он (или она) легче воздуха!». Сколько весит воздух, кажется, вопрос совсем абсурдный. И тем не менее, откуда-то он берется.
Вопрос о том, сколько весит воздух, далеко не так абсурден, как кажется на первый взгляд. Он вовсе не лишен смысла, когда речь идет о весе воздуха в контексте химических реакций и расчетов. Обычно химики оперируют молярной массой воздуха.
Что же это такое и каким образом ученым удалось взвесить воздух? Они пользовались какими-то особыми весами? И чему масса воздуха равна? В чем ее измерять? И что делать, если нужно рассчитать вес очень большого объема воздуха?
Что такое молярная масса?
Молярная масса — это отношение (знак деления) массы вещества к количеству молей этого вещества. Иными словами, молярной массой вещества называется масса одного моля этого вещества.
Иными словами, молярной массой вещества называется масса одного моля этого вещества.
Общепринятая форма записи молярной массы в химических формулах — заглавная буква «М». То есть, если вам нужно записать формулой фразу «молярная масса вещества равна», она будет выглядеть следующим образом: «М = …»
Обычно нижним индексом указывают, молярная масса какого вещества имеется в виду. Для сложного вещества, такого, как воздух, не имеющего определенной краткой формы записи, можно указывать также в скобках. Тогда молярную массу воздуха можно обозначать как Мвоздуха или как М (воздуха). Более предпочтителен все же вариант записи нижним индексом.
В чем измеряется молярная масса?
Единицей измерения молярной массы в Международной системе единиц (СИ) является килограмм на моль. В сокращенном виде в русскоязычном варианте это будет выглядеть как «кг/моль», а принятое международное сокращение записывается как kg/mol. Исторически, однако, сложилось так, что молярная масса измеряется в граммах на моль, так как речь, как правило, ведется об очень малых величинах и количествах вещества, а значит, килограммы здесь только утяжелили бы расчеты, не выполняя никакой иной функции.
Что такое моль?
Как уже было сказано выше, молярная масса выражает вес одного моля вещества. Но что же такое этот моль? Как его посчитать? Кто и когда решил считать массу в молях?
Моль, согласно Резолюции XIV Генеральной конференции по мерам и весам, принятой в 1971 году, и Положению о единицах величин, допускаемых к применению в Российской Федерации, определяется как количество вещества системы, содержащей столько же структурных элементов, сколько содержится атомов в углероде-12 массой 0,012 кг. В качестве структурных элементов могут выступать атомы, молекулы, ионы, электроны или другие частицы и специфицированные группы частиц.
Название этой величины происходит от латинского moles, означающего «количество, масса, счетное множество».
Какова молярная масса воздуха?
Так сколько же все-таки весит воздух? Химики могут дать точный ответ на этот вопрос. Средняя молярная масса воздуха составляет 28,98 граммов на моль. Для простоты расчетов в учебных целях это число обычно округляют до 29 граммов на моль. Записывается это при решении химических уравнений как 28,98 г/моль или как 29 г/моль. Молярная масса воздуха для типовых расчетов, которые не требуют высокой точности, является неизменной.
Записывается это при решении химических уравнений как 28,98 г/моль или как 29 г/моль. Молярная масса воздуха для типовых расчетов, которые не требуют высокой точности, является неизменной.
Как удалось взвесить моль воздуха?
Воздух — это смесь различных газов. В основном в его состав входят азот и кислород. Вместе их доля в воздухе составляет более 98 процентов. Помимо них, в воздухе содержатся водород, углекислый газ, аргон и совсем крошечные примеси других газов, которые образуют атмосферу Земли, а также мельчайшие частицы водяного пара.
Молярная масса воздуха высчитывается как молярная масса смеси нескольких веществ, входящих в его состав. То есть для нахождения ее необходимо найти среднее арифметическое взвешенное молярной массы массовых долей, которые входят в состав индивидуальных веществ, образующих воздух.
Для удобства подсчетов химиками берутся некоторые идеальные значения молярных масс газов, входящих в состав воздуха, а также некоторые абсолютные доли этих газов в воздухе. Число 28,98 граммов на моль получается в результате нахождения среднего арифметического взвешенного с использованием этих данных.
Число 28,98 граммов на моль получается в результате нахождения среднего арифметического взвешенного с использованием этих данных.
Всегда ли моль воздуха будет весить ровно столько?
Поскольку воздух представляет собой смесь газов, он представляет собой неустойчивое соединение, в котором точные доли веществ могут изменяться в зависимости от различных условий.
Так, например, содержание в воздухе углекислого газа выше в крупных городах, чем в сельской местности, или тем более в лесах, где он потребляется деревьями, напротив, привносящими в его состав больший процент кислорода. Вообще, состав воздуха в городской среде очень сильно изменен еще и за счет выхлопных газов, работы заводов и предприятий, неравномерной концентрации зеленых и закатанных в бетон и цемент участков, а также промышленных и рекреационных зон.
Другое проявление различий в составе воздуха в разных местах хорошо знакомо альпинистам. Связано оно с тем, что молекулы кислорода имеют большую массу, а потому с высотой его концентрация в воздухе уменьшается. Следовательно, в высокогорных районах кислорода в воздухе содержится намного меньше, чем на равнине или в низине. Концентрация азота в воздухе при этом становится с высотой выше за счет уменьшения концентрации кислорода, так как этот газ имеет меньшую молярную массу, чем молярная масса кислорода. Именно поэтому покорителям горных вершин приходится таскать на себе кислородные баллоны, а у впервые попавшего в горную местность человека может закружиться голова.
Следовательно, в высокогорных районах кислорода в воздухе содержится намного меньше, чем на равнине или в низине. Концентрация азота в воздухе при этом становится с высотой выше за счет уменьшения концентрации кислорода, так как этот газ имеет меньшую молярную массу, чем молярная масса кислорода. Именно поэтому покорителям горных вершин приходится таскать на себе кислородные баллоны, а у впервые попавшего в горную местность человека может закружиться голова.
Также оказывает влияние на концентрацию газов в воздухе водяной пар. Доля его содержания в воздухе зависит от влажности, температуры, климата, времени года и некоторых других условий. Доля его обычно не слишком значительна, однако может достигать в отдельных местностях нескольких процентов.
Каким образом можно найти массу большего количества воздуха?
Зная молярную массу воздуха, можно рассчитать, сколько весит больший объем воздуха. Для этого необходимо знать количество воздуха.
Масса воздуха рассчитывается путем умножения количества воздуха на его молярную массу. Если записать это утверждение в виде формулы, схема расчетов будет выглядеть следующим образом: m = V × M. В этой формуле m обозначает массу воздуха, V — количество воздуха в молях, а M — молярную массу воздуха.
Если записать это утверждение в виде формулы, схема расчетов будет выглядеть следующим образом: m = V × M. В этой формуле m обозначает массу воздуха, V — количество воздуха в молях, а M — молярную массу воздуха.
Определение, Формула, Моль, Атомная масса ~ ChemistryGod
В химии молярная масса является важной величиной. Он измеряет массу моля данного вещества.
Содержание
Определение
Молярная масса данного вещества определяется как масса образца, деленная на количество молей этого вещества в образце. Другими словами, это масса на моль вещества.
Обычно обозначается символом M .
Единица измерения
Стандартная единица измерения – г-моль −1 .Единицей СИ является кг моль -1 , однако это очень редко.
Моль
Мы знаем, что один моль вещества состоит из 6,02214076 × 10 23 элементарных частиц. Это число (также известное как постоянная Авогадро) обычно приблизительно равно 6,022 × 10 23 . Таким образом, один моль углерода содержит 6,022 × 10 23 атомов углерода.
Таким образом, один моль углерода содержит 6,022 × 10 23 атомов углерода.
Когда мы говорим, что молярная масса углерода составляет 12,0 г моль −1 , это означает, что один моль углерода весит 12,01 г. Другими словами, 6.022 × 10 23 атомов углерода весят 12,01 г.
Значение молярной массы
В химии расчеты связаны с химическими реакциями и стехиометрией. Расчеты часто включают такие величины, как молярность, моляльность, молярная доля, молярный объем. Все они связаны с количеством родинок. Хотя нет прямого способа измерить количество молей любого вещества, количество молей можно рассчитать, зная молярную массу вещества. Молярная масса связывает массу вещества с его молями.Таким образом, зная молярную массу, мы можем определить количество молей, содержащихся в данной массе образца.
Поясню на примере хлорида натрия. Молярная масса хлорида натрия известна; это 58,44 г моль -1 . Если нам нужно измерить один моль хлорида натрия, нет прибора, который мог бы измерить его напрямую. Но мы знаем, что 58,44 г хлорида натрия эквивалентны одному его молю. Итак, мы измеряем 58,44 г NaCl с помощью весов, что эквивалентно одному из 58.44 г. Следовательно, у нас есть измеренный один моль NaCl.
Но мы знаем, что 58,44 г хлорида натрия эквивалентны одному его молю. Итак, мы измеряем 58,44 г NaCl с помощью весов, что эквивалентно одному из 58.44 г. Следовательно, у нас есть измеренный один моль NaCl.
[Источник изображения: Wikimedia]
Ниже приведены некоторые важные моменты, касающиеся молекулярной массы:
- Это объемное, а не атомное свойство вещества. .
- Это интенсивная недвижимость. Таким образом, она не зависит от размера выборки.
- Зависит от процента консистенции образца. Таким образом, он может варьироваться в зависимости от земного местоположения.
- Используется для преобразования массы вещества в его моль и наоборот.
Атомная масса и молярная масса
Атомную массу и молярную массу путают друг с другом. Но это две разные величины с определением. В таблице ниже описаны различия между ними.
| Атомная масса | Молярная масса |
Атомная масса представляет собой сумму масс протонов, нейтронов и электронов. | Масса моля вещества. |
| Обозначается m a . | Для этого используется символ M . |
| Единица измерения массы (u) или атомная единица массы (а.е.м.). | г моль −1 — стандартная единица измерения молярной массы. |
| Атомная масса является атомным свойством. | Это объемное имущество. |
| Изотопы не учитываются. | Существование изотопов учитывается, так как это объемное свойство. |
| Атомная масса постоянна для определенного изотопного элемента. Он не меняется от образца к образцу. Например, атомная масса углерода-12 составляет 12 ед. Это верно для всех атомов углерода-12 во Вселенной. | Может варьироваться от образца к образцу в зависимости от процентного содержания компонентов в образце. |
Средняя атомная масса в Молярная масса
Если известна средняя атомная масса ( m a ) или средняя молекулярная масса, мы можем преобразовать ее в молярную массу ( M ) с помощью постоянная молярной массы ( M u ).
Средняя атомная масса измеряется в унифицированной единице массы (u). Единая единица массы связана с постоянной молярной массы ( M u ) постоянной Авогадро ( N A ).
m a — средняя атомная масса или средняя масса атома. Итак, масса моля атома равна m a × N A . Но эта величина находится в единой единице массы (u). Приведенное выше уравнение может преобразовать u в г моль -1 .
Таким образом, средняя атомная масса, деленная на одну унифицированную единицу массы, умноженная на постоянную молярной массы, дает молярную массу.
Точное значение M u равно 0,99999999965(30) г моль −1 . Но это значение примерно равно 1 г моль −1 .
Из приведенного выше уравнения мы можем сказать, что числовое значение молярной массы и средней атомной массы приблизительно равны. Это справедливо и для молекул. В таблице ниже перечислены элементы (и соединения) со средней атомной массой и средней молярной массой.
В таблице ниже перечислены элементы (и соединения) со средней атомной массой и средней молярной массой.
элемент (или коммунтун) | Средняя атомная масса (или средняя молекулярная масса) (U) | Divide (÷) | Единая массовая единица (u) | множественные (×) | молярная массы. 1 ) | |||
Водород (H) | 1.008 u | ÷ | 1 u | × | = | 1.008 G Mol -1 | ||
углерода (C) | 12.011 U 12.011 U 12.011 ÷ | 1 U | × | × 1 G Mol -1 | = | = | 12. | |
15.999 U | 1 U | × | = | 15.999 G Mol -1 | ||||
14006 U | ÷ | 1 U | × | 1 г моль −1 | = | 14.007 g Mol -1 | ||
39.098 39.098 ÷ | × | 1 г Mol -1 | = | 39.098 G Mol -1 | ||||
40.078 U | ÷ | 1 U | × | 1 г моль −1 | = | 40. | ||
35.45 U | ÷ | 1 U | × | 1 г Mol -1 | = | 35.45 G Mol -1 | ||
2,016 U | ÷ | 1 U | × | 1 г моль −1 | = | 2.016 G Mol -1 | ||
Вода (H 2 O) | 18.015 U | ÷ | 1 U | × | 1 г Mol -1 | = | 18.015 G Mol -1 | |
Methane (CH 4 ) | 16.04 U | ÷ | 1 U | × | 1 г моль −1 | = | 16. | |
2 ) | ÷ | 1 U | × | 1 г Mol -1 | = | 46.006 G Mol -1 | ||
аммиака (NH 3 ) | 17.031 U | ÷ | 1 U | × | 1 г моль −1 | = | 17.031 G Mol -1 | |
180.156 U | ÷ | 1 U | × | 1 G Mol -1 | = | 180,156 г моль -1 |
Атомный вес до молярной массы
атомная масса (ака A r ) — безразмерная величина, имеющая числовое значение средней атомной массы. Средняя атомная масса и атомный вес связаны следующим уравнением.
Средняя атомная масса и атомный вес связаны следующим уравнением.
Из двух приведенных выше уравнений
Таким образом, произведение атомного веса на постоянную молярной массы дает молярную массу.
Итак, мы можем вычислить молярную массу любого соединения таким же образом, как мы вычисляем атомный вес составляющих его элементов.
Рассмотрим пример глюкозы. Молекулярная формула глюкозы: C 6 H 12 O 6 ; он имеет шесть атомов углерода, двенадцать атомов водорода и шесть атомов кислорода.Молярная масса глюкозы представляет собой сумму относительных атомных масс всех атомов в молекулярной формуле.
Рисунок 2: Структура глюкозы| Элемент | Элемент | Молярная масса | Молярная масса (G MOL -1 ) |
| Углерод (C) | 12.011 | 12. 011 011 | |
| Водород (H) | 1.008 | 9008||
| Oxygen (O) | 15.999 | 15.999 | 15.999 |
| 180.156 | 180.156 |
Молярная масса смесей
Молярная масса смеси определяется с использованием мольной доли ( x i ).
где: M смесь — молярная масса смеси n компонентов, а x i и M i — молярная доля и молярная доля x i компонент .
Приведенная выше формула также может быть выражена через массовую долю w i .
или
Рассмотрим жидкую смесь воды (H 2 O) и этанола (C 2 H 6 O). Вода составляет 20 % и этанол, 80 %.
Молярная масса чистой воды M H 2 O .
Аналогично, для этанола,
Молярная масса смеси M смесь .
Таким образом,
Измерение молекулярной массы
Измерение по атомному весу
Измерение по атомному весу является наиболее надежным и точным методом по сравнению с другими.Атомный вес определяется по атомной массе и распределению изотопов. Точность молярной массы зависит от точности измерения атомного веса, который зависит от атомной массы и процентного содержания изотопов. Сегодня с помощью масс-спектрометрии мы можем добиться высокой точности атомной массы.
Значение молярной массы, рассчитанное по атомному весу, является надежным для всех практических расчетов.
Из плотности пара
Плотность пара ( ρ ) представляет собой отношение массы пара к его объему.Мы знакомы с уравнением идеального газа.
Здесь P – давление газа, занимающего объем V при температуре T . n и R – моли газа и постоянная идеального газа.
Теперь количество молей ( n ) равно массе газа, деленной на молярную массу ( M ).
Используя два приведенных выше уравнения,
Если мы можем определить плотность паров образца газа при известных давлении и температуре, мы можем оценить молярную массу пара из приведенного выше уравнения.
От понижения точки замерзания
При добавлении нелетучего растворенного вещества в растворитель температура замерзания растворителя снижается. Это снижение называется депрессией точки замерзания. Депрессия точки замерзания ∆ T F = T Fрастворитель − T Fраствор зависит от концентрации (моляльности) растворенного вещества и определяется приведенным ниже уравнением.
Здесь ∆ T — понижение температуры замерзания, K F — криоскопическая константа, зависящая от растворителя, b — моляльность, i — фактор Ван Гоффа (число ионов, образовавшихся после диссоциация растворенного вещества).
Для очень разбавленного раствора
., зная δ T F , K F , W Volute , и I , мы можем определить молярную массу, м Volute .
От повышения температуры кипения
Повышение температуры кипения — это повышение температуры кипения растворителя из-за присутствия нелетучего растворенного вещества. Подобно понижению точки замерзания, повышение точки кипения зависит от моляльности.
Вот, δ T B = T Раствор — T Солушение — T ROOLUTE — это высота кипячения, K B — это констанция ebullioscopic, B — моляция, а я — фактор Ван ‘т Гоффа.
для очень разбавленного раствора,
, зная δ T B , K , K B , W Volute , и I , мы можем определить молярную массу, м раствор .
Примеры и расчеты
Пример 1. Определение молярной массы олеиновой кислоты
Олеиновая кислота представляет собой непахучую жирную кислоту с молекулярной формулой C 18 H 34 O 2 . В нем восемнадцать атомов углерода, тридцать четыре атома водорода и два атома кислорода.
Рисунок 3: Олеиновая кислота| Элемент | Количество атома | Молярная масса (G MOL -1 ) | Итого |
| Углерод (C) | 18 | 12.011 | 216,198 |
| водорода (Н) | 34 | 1,008 | 34,272 |
| кислорода (О) | 2 | 15,999 | 31,998 |
| 282,468 г Mol -1 |
Следовательно, моляр олеиновой кислоты составляет 282,468 г моль -1 .
Пример 2. Определение молярной массы соли Райнеке
Соль Рейнеке представляет собой красную кристаллическую соль с хромом в центре, как показано на рисунке выше.Атом хрома окружен шестью атомами азота, четырьмя атомами углерода и четырьмя атомами серы. Молекулярная формула C 4 H 12 N 7 OCrS 4 .
Рисунок 4: Соль Reinecke| Элемент | Количество атома | Молярная масса (G моль −1 ) | Итого |
| Углерод (C) | 4 | 12.011 | 48,044 |
| водорода (Н) | 12 | 1,008 | 12,096 |
| Азот (N) | 7 | 14,007 | 98,049 |
| кислорода (О) | 1 | 15,999 | 15,999 |
| Хром (Cr) | 1 | 51,996 | 51,996 |
| Сера (S) | 4 | 32,065 | 128,26 |
354. 444 г моль −1 444 г моль −1 |
Пример 3. Определение молярной массы воздуха
Воздух представляет собой смесь. Он в основном состоит из 79 % азота (N 2 ) и (21 %) кислорода (O 2 ). Другими компонентами являются аргон (Ar), углекислый газ (CO 2 ), вода (H 2 O), гелий (He) и т. д., но эти компоненты находятся в малой доле и ими можно пренебречь.
Молярная масса азота (N 2 ) и кислорода (O 2 ) составляет 28,014 г моль -1 и 31.998 г моль -1 соответственно.
| молекул | фракция | молярная масса (G Mol -1 ) | Всего | |
| азот (N 2 ) | 28.014 | 22.13 | ||
| Oxygen (O 2 ) | 0.21 | 31.998 | 31.98 9009 | |
| Молярная масса воздуха | ≈ 28 г Mol -1 | |||
| Вещество Удельный вес — SG — | |
|---|---|
| Ацетилен | 0,0017 |
| Air | 0.0013 |
| Алкоголь | 0.82 |
| Алюминий | 2.72 |
| 48 | |
| Кадмий | 8,57 |
| Хром диоксид | 7,03 |
| Медь | 8,79 |
| углерода | 0,00198 |
| Окись углерода | 0,00126 |
| Чугун | 7,20 |
| Водород | 0,00009 |
| Свинец | 11,35 |
| Меркурий 959 | |
| Никель | 8,73 |
| Азот | 0,00125 |
| Нейлон | 1,12 |
| Кислород | 0,00143 |
| Парафин | 0,80 |
| Бензин | 0,72 |
| PVC | |
| 1,36 | 1. 36 36 |
| 0.96 | 0.96 |
| Сталь | 7.82 |
| 7.28 | |
| Цинк | 7,12 |
| Вода (4 О С) | 1,00 |
| Вода, Море | 1,027 |
| Древесина, Дуб | 0,77 |
Вернуться к началу
Удельный вес газов обычно рассчитывается по отношению к воздуху и определяется как отношение плотности газа к плотности воздуха при заданной температуре и давлении.
Удельная гравитация может быть рассчитана какSG = ρ Gas / ρ Air / ρ Air [3]
, где
SG = удельный вес газа
ρ Gas = плотность газа [кг / м 3 ]
ρ воздуха = плотность воздуха (обычно при NTP — 1,204 [кг/м 3 ])
Молекулярные массы можно использовать для расчета удельного веса, если плотности газа и воздуха одинаковое давление и температура.
См. также Теплофизические свойства воздуха — плотность, вязкость, критическая температура и давление, тройная точка, энтальпии и энтропии, теплопроводность и диффузность, ……
Вернуться к началу
Удельный вес определен как вес на единицу объема . Вес составляет силы . Единицей СИ для удельного веса является [Н/м 3 ]. Имперская единица измерения [lb/ft 3 ].
Удельный вес (или сила на единицу объема) можно выразить как
γ = ρ A г [4]
, где
γ = удельный вес (N / M 3 ], [LB /фут 3 ]
ρ = плотность [кг/м 3 ], [слаг/фут 3 ]
a g = ускорение свободного падения (9.807 [M / S 2 ], 32.174 [FT / S 2 ] При нормальных условиях)
Пример 5: Удельный вес воды
Удельный вес для некоторых общих материалов
| ПРОДУКТ | ОСНОВНЫЙ вес — γ — | |||
|---|---|---|---|---|
| Imperial Unite (LB / FT 3 ) | Si Units (KN / M 3 ) | |||
| Алюминий | 172 | 27 | ||
| Латунь | 540 | 84. 5 5 | ||
| четыреххлористый углерод | 99,4 | 15,6 | ||
| Медь | 570 | 89 | ||
| этилового спирта | 49,3 | 7,74 | ||
| Бензин | 42,5 | 6,67 | ||
| глицерин | 78.6 | 12.4 | 12.4 | |
| Kerosene | 50 | 79 | ||
| Mercury | 847 | 133.7 | ||
| SAE 20 Моторное масло | 57 | 8,95 | ||
| забортной | 63,9 | 10,03 | ||
| Нержавеющая сталь | 499 — 512 | 78 — 80 | ||
| воды | 62,4 | 9.81 | ||
| 474 — 499 | 74 — 78 | 74 — 78 | ||

 02 · 1023 1/моль) = 112 г
02 · 1023 1/моль) = 112 г 011 G Mol -1
011 G Mol -1  078 G Mol -1
078 G Mol -1  04 G Mol -1
04 G Mol -1 

 015#
015# S.) единицы измерения плотности: слаг/фут 3 , но часто используется фунт-масса на кубический фут — фунт м /фут 3 — . Обратите внимание, что существует разница между фунт-сила (фунт f ) и фунт-масса (фунт м ) . Слизней можно умножить на 32,2 , чтобы получить примерное значение в фунтах массы (фунт м ) .
S.) единицы измерения плотности: слаг/фут 3 , но часто используется фунт-масса на кубический фут — фунт м /фут 3 — . Обратите внимание, что существует разница между фунт-сила (фунт f ) и фунт-масса (фунт м ) . Слизней можно умножить на 32,2 , чтобы получить примерное значение в фунтах массы (фунт м ) .
 940 порций/фут 3 .
940 порций/фут 3 . Масса 0,17 м 3 объема титана может быть рассчитана как
Масса 0,17 м 3 объема титана может быть рассчитана как
 В Периодической таблице указаны средние атомные массы элементов.
В Периодической таблице указаны средние атомные массы элементов.


 Если вещество А растворяется в веществе В и их число молей соответственно равно; n A и n B , то молярные доли A и B могут быть определены следующими уравнениями:
Если вещество А растворяется в веществе В и их число молей соответственно равно; n A и n B , то молярные доли A и B могут быть определены следующими уравнениями: Метод интерполяции обратного квадрата расстояния обладает хорошей универсальностью и доступен в случае отсутствия пластов и крайне неравномерного распределения ствола скважины, а ошибка интерполяции относительно мала, поэтому используется метод интерполяции обратного квадрата расстояния 33 .{p} }}}},$$
Метод интерполяции обратного квадрата расстояния обладает хорошей универсальностью и доступен в случае отсутствия пластов и крайне неравномерного распределения ствола скважины, а ошибка интерполяции относительно мала, поэтому используется метод интерполяции обратного квадрата расстояния 33 .{p} }}}},$$ {\prime} \in \left[ {1,\;l} \right]\), l – общее количество треугольников полигона дальности взрыва; набор треугольников области взрывных работ \(T_{b}\) используется для вырезания набора единиц объектов \(E_{0}\) зоны взрывных работ, а трехмерный объект горной массы в зоне взрывных работ сохраняется, записывается как \(E_{1}\).
{\prime} \in \left[ {1,\;l} \right]\), l – общее количество треугольников полигона дальности взрыва; набор треугольников области взрывных работ \(T_{b}\) используется для вырезания набора единиц объектов \(E_{0}\) зоны взрывных работ, а трехмерный объект горной массы в зоне взрывных работ сохраняется, записывается как \(E_{1}\). {\prime} \in [1,\;k],\; k\) — общее количество единиц объекта в зоне взрывных работ после резки.
{\prime} \in [1,\;k],\; k\) — общее количество единиц объекта в зоне взрывных работ после резки.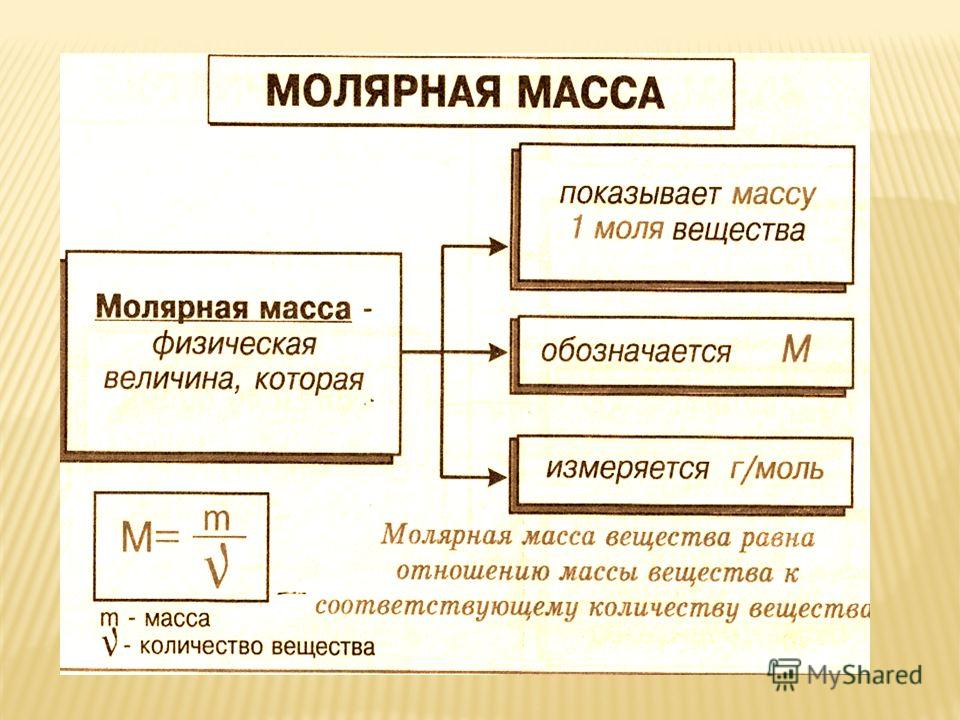 Многоугольник влияния шпуров образуется путем последовательного соединения центральных точек, середин сторон или вершин связанных с ним треугольников. Набор всех полигонов влияния взрывных скважин обозначается как \(PL = \left\{ {pl_{1} , pl_{2} , \ldots , pl_{m} , \ldots , pl_{F} } \right\} \), где \(pl_{m}\) — полигон влияния m-й взрывной скважины, \(m \in \left[ {1,\;F} \right]\).Метод получения полигона влияния взрывных скважин следующий:
Многоугольник влияния шпуров образуется путем последовательного соединения центральных точек, середин сторон или вершин связанных с ним треугольников. Набор всех полигонов влияния взрывных скважин обозначается как \(PL = \left\{ {pl_{1} , pl_{2} , \ldots , pl_{m} , \ldots , pl_{F} } \right\} \), где \(pl_{m}\) — полигон влияния m-й взрывной скважины, \(m \in \left[ {1,\;F} \right]\).Метод получения полигона влияния взрывных скважин следующий:
 ; поскольку только две вершины ∆ JCD являются точками взрывных скважин, средняя точка I соединительной линии взрывных скважин JC используется в качестве вершины многоугольника влияния взрывных скважин.Точно так же возьмите среднюю точку F двух соединительных линий взрывных скважин JA ∆ JAE в качестве вершины многоугольника влияния взрывных скважин; ∆ JDE имеет только одну вершину в качестве точки шпура, поэтому возьмите две другие точки треугольника без шпура D и E в качестве вершин полигона влияния шпура. Вершины полигона влияния взрывной скважины соединяются в полигон влияния взрывной скважины J , а набор его вершин равен \(\left\{ {E,\;D,\;I,\;H,\;G, \;F,\;E} \right\}\).
; поскольку только две вершины ∆ JCD являются точками взрывных скважин, средняя точка I соединительной линии взрывных скважин JC используется в качестве вершины многоугольника влияния взрывных скважин.Точно так же возьмите среднюю точку F двух соединительных линий взрывных скважин JA ∆ JAE в качестве вершины многоугольника влияния взрывных скважин; ∆ JDE имеет только одну вершину в качестве точки шпура, поэтому возьмите две другие точки треугольника без шпура D и E в качестве вершин полигона влияния шпура. Вершины полигона влияния взрывной скважины соединяются в полигон влияния взрывной скважины J , а набор его вершин равен \(\left\{ {E,\;D,\;I,\;H,\;G, \;F,\;E} \right\}\).