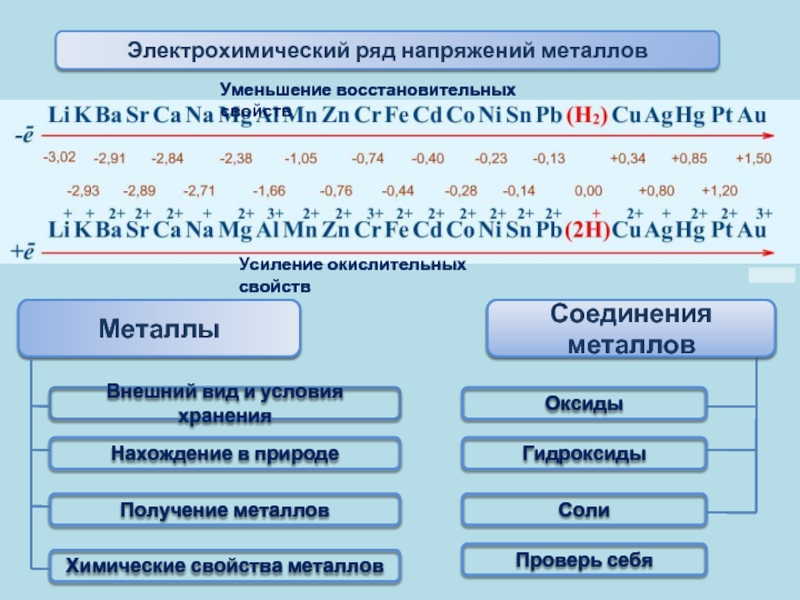
Периодический закон и система Д.И. Менделеева
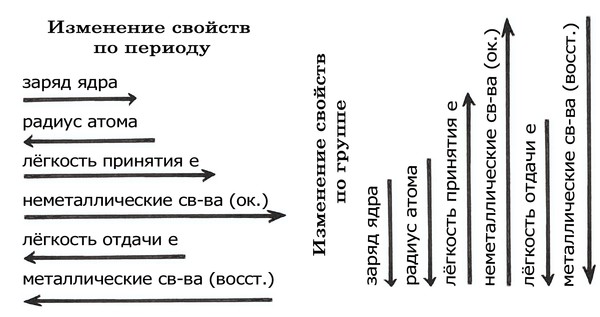
1. Слева направо по периоду (см. Таблица Менделеева):
-
- металлические свойства простых веществ ослабевают (уменьшаются)
- неметаллические свойства усиливаются (увеличиваются)
- радиус атома уменьшается (атомное сжатие из-за увеличения заряда ядра)
- электроотрицательность элементов возрастает (самый ЭО элемент — фтор)
- восстановительные свойства уменьшаются
- окислительные свойства увеличиваются
- основные свойства оксидов и гидроксидов уменьшаются
- Кислотные свойства оксидов и гидроксидовусиливаются
- идет увеличение числа электронов на внешнем уровне
- увеличивается максимальная валентность элементов
2. Сверху вниз по группе (см. Таблица Менделеева) (для главной подгруппы):
-
- металлические свойства простых веществ усиливаются
- неметаллические свойства ослабевают
- радиус атома увеличивается
- электроотрицательность элементов уменьшается
- основные свойства оксидов и гидроксидов усиливаются
- кислотные свойства оксидов и гидроксидов убывают
- Число электронов на внешнем уровне не меняется
3. К основным оксидам относятся оксиды металлов со степенью окисления +1 и +2
К основным оксидам относятся оксиды металлов со степенью окисления +1 и +2
4. К кислотным оксидам относятся оксиды неметаллов и оксиды металлов со степенью окисления +5, +6, +7
5. К амфотерным оксидам относятся Al2O3, BeO, ZnO, Cr2O3
Давайте порассуждаем вместе
1. Как изменяется радиус атома в ряду Be — Mg — Ca ?
1) уменьшается2) увеличивается
3) не изменяется
4) сначала уменьшается, потом увеличивается
Ответ: все элементы находятся в одной группе, сверху вниз, значит радиус атома увеличивается
2. Как изменяются металлические свойства в ряду Li — Be — B?
1) не изменяются
2) сначала усиливаются, потом уменьшаются
3) ослабевают
4) усиливаются
Ответ: все элементы находятся в одном периоде слева направо, значит металлические свойства ослабевают
3. Как изменяется электроотрицательность в ряду F — O — N?
Как изменяется электроотрицательность в ряду F — O — N?
1) сначала усиливается, потом ослабевает
2) уменьшается
3) не изменяется
4) усиливается
Ответ: все элементы находятся в одном периоде справа налево, значит электроотрицательность уменьшается.
4. Как изменяются неметаллические свойства в ряду As — P — N?
1) уменьшаются
2) не изменяются
3) сначала усиливаются, потом уменьшаются
4) усиливаются
Ответ: все элементы находятся в одной группе снизу вверх, значит неметаллические свойства усиливаются
5. Как изменяется число валентных электронов в ряду Li — Na — K?
1) не изменяется
2) увеличивается
3) уменьшается
4) сначала уменьшается, затем увеличивается
Ответ: все элементы находятся в одной группе сверху вниз, значит число валентных электронов не изменяется
6. Как изменяются окислительные свойства в ряду O — S — Se?
1) увеличиваются
2) сначала уменьшаются, затем увеличиваются
3) не изменяются
4) уменьшаются
Ответ: все элементы находятся в одной группе сверху вниз, значит окислительные свойства уменьшаются
7. Как изменяются восстановительные свойства в ряду Si — Al — Mg?
1) сначала уменьшаются, затем усиливаются
2) увеличиваются
3) не изменяются
4) уменьшаются
Ответ: все элементы находятся в одном периоде справа налево, значит восстановительные свойства усиливаются
8. Как изменяются свойства оксидов в ряду MgO -> Al2O3 —> SiO2
1) от основных к кислотным
2) от кислотных к основным
3) от кислотных к амфотерным
4) от основных к амфотерным
Ответ: все элементы находятся в одном периоде слева направо, значит свойства оксидов изменяются от основных к кислотным
Задания повышенной сложности
1.
В главных подгруппах периодической системы с увеличением заряда ядра атомов химических элементов происходит:
1) усиление неметаллических свойств
2) усиление металлических свойств
3) высшая валентность элементов остается постоянной
4) изменяется валентность в водородных соединениях
5) уменьшается радиус атомов
Ответ: 2, 3
2. В главных подгруппах периодической системы восстановительная способность атомов увеличивается по мере
1) уменьшения радиуса атома
2) увеличения числа электронных слоев в атомах
3) уменьшения заряда ядра атомов
4) увеличения числа валентных электронов
5) увеличения порядкового номера элемента
Ответ: 2, 5
3.
В ряду химических элементов Be, Mg, Ca, Sr
1) усиливается способность атомов отдавать электроны
2) уменьшается заряд ядра атомов
3) усиливается восстановительная способность
4) уменьшаются металлические свойства
5) усиливается способность атомов принимать электроны
Ответ: 1, 3
4. В ряду химических элементов I, Br, Cl, F восстановительная способность атомов уменьшается, потому что
1) увеличивается радиус атома
2) увеличивается заряд ядра атомов
3) увеличивается число электронных слоев в атомах
4) уменьшается число электронных слоев в атомах
5) уменьшается способность атомов отдавать электроны
Ответ: 4, 5
5.
В ряду химических элементов As, P, N
1) увеличивается радиус атома
2) увеличивается электроотрицательность
3) усиливаются кислотные свойства их высших оксидов
4) возрастает значение высшей степени окисления
5) увеличивается число электронов во внешнем электронном слое атомов
Ответ: 2, 3
6. В ряду химических элементов P, N, O
1) уменьшается число электронов во внешнем электронном слое
2) увеличивается электроотрицательность 3) возрастает значение высшей валентности
4) ослабевают неметаллические свойства
5) усиливается способность атомов принимать электроны
Ответ: 2, 5
7.
В ряду гидроксидов NaOH, Ca(OH)2, Al(OH)3
1) увеличивается термическая стойкость
2) ослабевают основные свойства
3) увеличивается способность к электролитической диссоциации
4) ослабевают окислительные свойства
5) уменьшается растворимость в воде
Ответ: 2,5
Химические свойства металлов
РЕПЕТИЦИОННЫЙ ЕГЭ ПО ХИМИИ—ДИСТАНЦИОННО, БЕСПЛАТНО
Общая характеристика металлов главных подгрупп IА – IIIА групп в связи с их положением в периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов. Характеристика переходных элементов – меди, цинка, хрома, железа по их положению в периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов.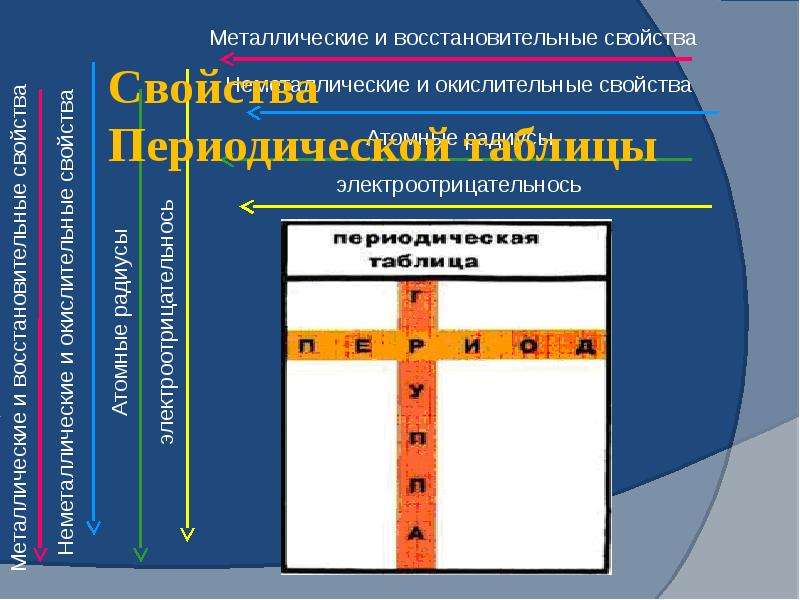 Общая характеристика неметаллов IVA-VIIA групп в связи с их положением в периодической системе химических элементов Д.И.Менделеева и особенностями строения их атомов.
Общая характеристика неметаллов IVA-VIIA групп в связи с их положением в периодической системе химических элементов Д.И.Менделеева и особенностями строения их атомов.
1. В порядке увеличения восстановительной способности металлы расположены в ряду:
1) K,Al,Cr,Sn
2) Sn,Cr,Al,Zn
3) Sn,Ca,Al,K
4) Au,Al,Ca,Li
2. Щелочные металлы
1)являются сильными восстановителями
2) проявляют как окислительные, так и восстановительные свойства
3) легко образуют отрицательно заряженные ионы
4) легко присоединяют электроны в химических реакциях
3. В ряду элементов: натрий —>магний —>алюминий
возрастает их
1) атомный радиус
2) восстановительная способность
3) химическая активность
4) электроотрицательность
4. У магния металлические свойства выражены
1) слабее, чем у бериллия
2) сильнее, чем у алюминия
3) сильнее, чем у кальция
4) сильнее, чем у натрия
5. В порядке уменьшения восстановительных свойств металлы расположены в ряду:
1) Al,Zn,Fe
2) Al,Na,K
3) Fе,Zn,Mg
4) Fe,Zn,Al
6. Наибольший радиус имеет атом
1) лития 2) натрия 3) кальция 4) калия
7. У элементов II А группы сверху вниз
1) уменьшаются радиусы атомов,
2) увеличивается число валентных электронов в атоме
3) увеличиваются радиусы атомов
4) уменьшается число валентных электронов в атоме
8. Сила оснований возрастает в ряду:
1) Ве(ОН)2, Mg(OH)2, Ca(OH)2
2) Ва(ОН)2, Са(ОН)2, Ве(ОН)2
3) Са(ОН)2, Mg(OH)2, Ве(ОН)2
4) Sr(OH)2, Ca(OH)2, Mg(OH)2
9. У элементов I А группы сверху вниз
1) усиливаются окислительные свойства
2) ослабевают восстановительные свойства
3) увеличиваются радиусы атомов
4) уменьшаются радиусы атомов
10. Валентные электроны наиболее легко отдают атомы
Валентные электроны наиболее легко отдают атомы
1) алюминия 2) натрия 3) бериллия 4) магния
11. Восстановительные свойства наиболее выражены у
1) алюминия 2) магния 3) натрия 4) калия
12. Для растворения как меди, так и железа, следует использовать
1) концентрированную фосфорную кислоту
2) разбавленную азотную кислоту
3) разбавленную соляную кислоту
4) раствор гидроксида калия
13. К основным гидроксидам относится каждое из двух веществ:
1) Fe(OH)3 и Си(ОН)2
2) Fe(OH)3 и Сг(ОН)2
3) Fe(OH)2 и Ca(OH)2
4) Fe(OH)3 и Сг(ОН)3
14. При нагревании меди с концентрированной серной кислотой образуется
1) оксид серы (IV)
2) водород
3) оксид серы (VI)
4) сероводород
15. Медь может вступать во взаимодействие с водным раствором
Медь может вступать во взаимодействие с водным раствором
1) гидроксида натрия
2) хлорида кальция
3) нитрата цинка
4) азотной кислоты
16. Основные свойства веществ ослабевают в ряду:
1) NaОН —> КОН —>RbOH
2) А1(ОН)3 —>Mg(OH)2 —> NaOH
3) Са(ОН)2 —> Mg(OH)2 —>Be(OH)2
4) В(ОН)3 —>Ве(ОН)2 —> LiOH
17. Верны ли следующие суждения?
А. И хром, и железо образуют устойчивые оксиды в степени окисления +3.
Б. Оксид хрома (III) является амфотерным.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
18. Верны ли следующие суждения?
А. Только s-элементы содержит IA группа.
Б. Все элементы IA группы взаимодействуют с водой при комнатной температуре.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
19. Оксид хрома (VI) является
1) основным
2) кислотным
3) амфотерным
4) несолеобразующим
20. При обычных условиях практически осуществима реакция между железом и
1) серой (тв)
2) серной кислотой (конц.)
3) нитратом меди (II) (р-р)
4) нитратом цинка (р-р)
21. Только при нагревании с водой реагируют
1) К и Hg 2) Zn и Fe 3) Cs и Ag 4) Sr и Сu
22. Только основные свойства проявляет
1) Сr2O3 2) Сr(ОН)2 3) СrO3 4) Сr(ОН)3
23. Сильные окислительные свойства характерны для
1) оксида меди (I)
2) оксида железа (II)
3) оксида хрома (III)
4) оксида хрома (VI)
24. Верны ли следующие суждения об оксидах железа?
Верны ли следующие суждения об оксидах железа?
А. Степень окисления железа в высшем оксиде равна + 3.
Б. Высший оксид железа относится к основным оксидам.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
25. В ряду оксидов
CrO — Сr2О3 — СrОз
происходит
1) уменьшение степени окисления хрома
2) усиление восстановительных свойств
3) увеличение массовой доли хрома
4) усиление кислотных свойств
26. Оцените справедливость суждений о металлах:
А. Чем сильнее атом удерживает валентные электроны, тем ярче
выражены металлические свойства элемента.
Б. Чем сильнее выражены металлические свойства элемента, тем
более основный характер имеет его гидроксид.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
27. Оцените справедливость суждений о металлах:
Оцените справедливость суждений о металлах:
А. Для атомов металлов характерно малое число валентных
электронов и слабое их притяжение к ядру.
Б. Чем выше степень окисления металла в его гидроксиде, тем
более основными свойствами обладает гидроксид.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
28. Оцените справедливость суждений о металлах:
А. Атомы металла могут образовывать только ионные связи.
Б. Оксиды и гидроксиды металлов всегда имеют основный
характер.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
29. Верны ли следующие суждения о неметаллах?
А. В периодической системе химических элементов Д.И. Менделеева все неметаллы располагаются в главных подгруппах.
Б. Все неметаллы являются р-элементами.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
30. При обычных условиях из двухатомных молекул состоят
1) гелий и аргон
2) азот и неон
3) сера и фосфор
4) водород и кислород
31. Верны ли следующие суждения о неметаллах?
А. Все неметаллы являются химически активными веществами.
Б. Неметаллы обладают только окислительными свойствами.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
32. Верны ли следующие суждения о неметаллах?
А. Неметаллы образуют с щелочными металлами соединения преимущественно с ионной связью.
Б. Между собой неметаллы образуют соединения с ковалентной связью.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
33. У атомов химических элементов, расположенных в ряду: P-S-C1, увеличивается
1) радиус
2) окислительная способность
3) восстановительная способность
4) число неспаренных электронов
34. Соединения состава NaHЭO3 и NaHЭO4 может образовать
Соединения состава NaHЭO3 и NaHЭO4 может образовать
1) углерод 2) сера 3) хлор 4) фосфор
35. Наиболее сильными кислотными свойствами обладает
1) НС1О4 2) H2SO3 3) Н3РО4 4) H2SiО3
36 Соединения состава КЭО2 и КЭО3 образует элемент
1) азот 2) фосфор 3) сера 4) марганец
37. Водород проявляет окислительные свойства при реакции с
1) натрием 2) хлором 3) азотом 4) кислородом
38. Способность атомов химических элементов принимать электроны усиливается в ряду:
1)F —>O —>N
2) N —>F —>О
3) N —>O —>F
4) O —>N —>F
39. Степени окисления хлора, брома и йода в высших оксидах и водородных соединениях соответственно равны:
1)+1и-1 2)+7и-1 3)+7и-7 4)+5и-1
40. Сера проявляет как окислительные, так и восстановительные свойства при взаимодействии с
Сера проявляет как окислительные, так и восстановительные свойства при взаимодействии с
1) водородом и железом
2) углеродом и цинком
3) хлором и фтором
4) натрием и кислородом
41. В ряду: Si —>Р —> S —> С1
электроотрицательность элементов
1) увеличивается
2) уменьшается
3) не изменяется
4) сначала уменьшается, потом увеличивается
42. В ряду элементов мышьяк —>селен —> бром возрастает
1) атомный радиус
2) число неспаренных электронов в атоме
3) число электронных слоев в атоме
4) электроотрицательность
43. Водородное соединение состава Н2Э2 образует
1) углерод
2) кремний
3) бор
4) азот
44. Верны ли следующие суждения о галогенах?
А. Наиболее электроотрицательным среди галогенов является иод.
Б. Хлор вытесняется бромом из хлорида алюминия.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
45. Кислород не реагирует с
1) водой и оксидом кальция
2) железом и оксидом фосфора (V)
3) водородом и оксидом фосфора (III)
4) сероводородом и оксидом углерода (IV)
46. Высшему гидроксиду элемента VIIA группы соответствует формула
1) Н2ЭО3 2) Н2ЭО4 3) НЭО3 4) НЭО4
47. Верны ли следующие суждения о галогенах?
А. Фтор в соединениях проявляет как положительную, так и
отрицательную степень окисления.
Б. При нормальных условиях бром и иод являются жидкостями.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
48. Водород проявляет окислительные свойства при взаимодействии с
Водород проявляет окислительные свойства при взаимодействии с
1) натрием 2) хлором 3) азотом 4) кислородом
49. Окислительные свойства фосфор проявляет при взаимодействии с
1) кислородом
2) магнием
3) хлором
4) серой
50. Верны ли следующие суждения о свойствах серы и хлора?
А. Максимальная валентность серы и хлора в соединениях равна номеру группы.
Б. В водородных соединениях серы и хлора связь ковалентная полярная.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
51. Фосфор проявляет окислительные свойства при реакции с
1) кальцием 2) серой 3} хлором 4) кислородом
52. При взаимодействии высшего оксида хлора с водой образуется кислота
1) НС1O 2) НС1O2 3) НСlO3 4} HClO4
53. Характерными степенями окисления хлора в его соединениях являются:
Характерными степенями окисления хлора в его соединениях являются:
1) -1, +1, +3, +5, +7
2) — 2, +4, +6, +8
3) -3, +3, +5
4) -1, +2, +5
54. Оцените справедливость суждений о неметаллах:
А. Атомы неметалла могут участвовать в образовании как ионных,
так и ковалентных связей.
Б. Гидроксиды неметаллов имеют кислотный характер.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
55. Оцените справедливость суждений о неметаллах:
А. Чем больше заряд ядра атома, тем сильнее выражены его
неметаллические свойства.
Б. Чем сильнее выражены неметаллические свойства элемента, тем
более кислотный характер имеет его оксид.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
56. Оцените справедливость суждений о неметаллах:
А. В периоде с увеличением зарядов атомных ядер происходит
В периоде с увеличением зарядов атомных ядер происходит
усиление неметаллических свойств элементов.
Б. В главной подгруппе с увеличением зарядов атомных ядер
происходит ослабление кислотных свойств гидроксидов.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
57. Кислотные свойства наиболее выражены у высшего гидроксида
1) азота
2) фосфора
3) мышьяка
4) сурьмы
58. Только восстановительные свойства азот проявляет в соединении
1) N2
2) NНз
3) NО2
4) НNОз
59. Верны ли следующие суждения о свойствах соединений элемента, электронная конфигурация атома которого 1s22s22p6 3s2 Зр1 ?
А. Этот элемент образует гидроксид с ярко выраженными кислотными свойствами.
Б. Степень окисления этого элемента в высшем гидроксиде равна (+ 4).
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
60. Верны ли следующие суждения о соединениях натрия и бериллия?
А. Оксид натрия проявляет основные свойства
Б. Гидроксид бериллия проявляет амфотерные свойства
Ответы: 1-4, 2-1, 3-4, 4-2, 5-1, 6-4, 7-3, 8-1, 9-3, 10-2, 11-3, 12-2, 13-3, 14-1, 15-4, 16-3, 17-3, 18-3, 19-2, 20-3, 21-2, 22-2, 23-4, 24-1, 25-4, 26-2, 27-1, 28-4, 29-1, 30-4, 31-4, 32-3, 33-2, 34-2, 35-1, 36-1, 37-1, 38-3, 39-2, 40-4, 41-1, 42-4, 43-1, 44-4, 45-1, 46-4, 47-4, 48-1, 49-2, 50-3, 51-1, 52-4, 53-1, 54-3, 55-2, 56-3, 57-1, 58-2, 59-4
Материал по химии. ЕГЭ. А 7. Металлы.
Общая характеристика металлов главных подгрупп I – III групп в связи с их положением в периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов.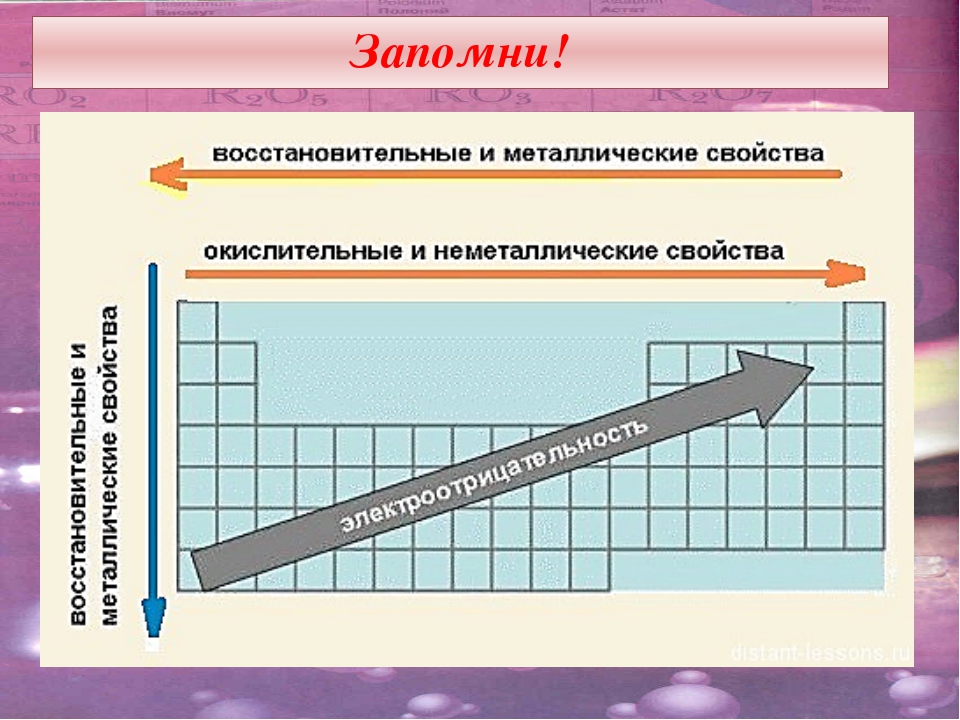 Характеристика переходных элементов – меди, цинка, хрома, железа по их положению в периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов
Характеристика переходных элементов – меди, цинка, хрома, железа по их положению в периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов
1. В порядке увеличения восстановительной способности металлы расположены в ряду:
1) K,Al,Cr,Sn
2) Sn,Cr,Al,Zn
3) Sn,Ca,Al,K
4) Au,Al,Ca,Li
2. Щелочные металлы
1)являются сильными восстановителями
2) проявляют как окислительные, так и восстановительные свойства
3) легко образуют отрицательно заряженные ионы
4) легко присоединяют электроны в химических реакциях
3. В ряду элементов: натрий —>магний —>алюминий
возрастает их
1) атомный радиус
2) восстановительная способность
3) химическая активность
4) электроотрицательность
4. У магния металлические свойства выражены
1) слабее, чем у бериллия
2) сильнее, чем у алюминия
3) сильнее, чем у кальция
4) сильнее, чем у натрия
5. В порядке уменьшения восстановительных свойств металлы расположены в ряду:
В порядке уменьшения восстановительных свойств металлы расположены в ряду:
1) Al,Zn,Fe
2) Al,Na,K
3) Fе,Zn,Mg
4) Fe,Zn,Al
6. Наибольший радиус имеет атом
1) лития 2) натрия 3) кальция 4) калия
7. У элементов II А группы сверху вниз
1) уменьшаются радиусы атомов,
2) увеличивается число валентных электронов в атоме
3) увеличиваются радиусы атомов
4) уменьшается число валентных электронов в атоме
8. Сила оснований возрастает в ряду:
1) Ве(ОН)2, Mg(OH)2, Ca(OH)2
2) Ва(ОН)2, Са(ОН)2, Ве(ОН)2
3) Са(ОН)2, Mg(OH)2, Ве(ОН)2
4) Sr(OH)2, Ca(OH)2, Mg(OH)2
9. У элементов I А группы сверху вниз
1) усиливаются окислительные свойства
2) ослабевают восстановительные свойства
3) увеличиваются радиусы атомов
4) уменьшаются радиусы атомов
10. Валентные электроны наиболее легко отдают атомы
Валентные электроны наиболее легко отдают атомы
1) алюминия 2) натрия 3) бериллия 4) магния
11. Восстановительные свойства наиболее выражены у
1) алюминия 2) магния 3) натрия 4) калия
12. Для растворения как меди, так и железа, следует использовать
1) концентрированную фосфорную кислоту
2) разбавленную азотную кислоту
3) разбавленную соляную кислоту
4) раствор гидроксида калия
13. К основным гидроксидам относится каждое из двух веществ:
1) Fe(OH)3 и Си(ОН)2
2) Fe(OH)3 и Сг(ОН)2
3) Fe(OH)2 и Ca(OH)2
4) Fe(OH)3 и Сг(ОН)3
14. При нагревании меди с концентрированной серной кислотой образуется
1) оксид серы (IV)
2) водород
3) оксид серы (VI)
4) сероводород
15. Медь может вступать во взаимодействие с водным раствором
1) гидроксида натрия
2) хлорида кальция
3) нитрата цинка
4) азотной кислоты
16. Основные свойства веществ ослабевают в ряду:
Основные свойства веществ ослабевают в ряду:
1) NaОН —> КОН —>RbOH
2) А1(ОН)3 —>Mg(OH)2 —> NaOH
3) Са(ОН)2 —> Mg(OH)2 —>Be(OH)2
4) В(ОН)3 —>Ве(ОН)2 —> LiOH
17. Верны ли следующие суждения?
А. И хром, и железо образуют устойчивые оксиды в степени окисления +3.
Б. Оксид хрома (III) является амфотерным.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
18. Верны ли следующие суждения?
А. Только s-элементы содержит IA группа.
Б. Все элементы IA группы взаимодействуют с водой при комнатной температуре.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
19. Медь не взаимодействует с
1) разбавленной серной кислотой
2) концентрированной серной кислотой
3) разбавленной азотной кислотой
4) концентрированной азотной кислотой
20. Верны ли следующие суждения?
Верны ли следующие суждения?
А. Магний взаимодействует с кислотами и щелочами.
Б. С концентрированными серной и азотной кислотами магний реагирует только при нагревании.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
21. Оксид хрома (VI) является
1) основным
2) кислотным
3) амфотерным
4) несолеобразующим
22. При обычных условиях практически осуществима реакция между железом и
1) серой (тв)
2) серной кислотой (конц.)
3) нитратом меди (II) (р-р)
4) нитратом цинка (р-р)
23. Только при нагревании с водой реагируют
1) К и Hg 2) Zn и Fe 3) Cs и Ag 4) Sr и Сu
24. Только основные свойства проявляет
1) Сr2O3 2) Сr(ОН)2 3) СrO3 4) Сr(ОН)3
25. Сильные окислительные свойства характерны для
1) оксида меди (I)
2) оксида железа (II)
3) оксида хрома (III)
4) оксида хрома (VI)
26. Верны ли следующие суждения об оксидах железа?
Верны ли следующие суждения об оксидах железа?
А. Степень окисления железа в высшем оксиде равна + 3.
Б. Высший оксид железа относится к основным оксидам.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
27. В ряду оксидов
CrO — Сr2О3 — СrОз
происходит
1) уменьшение степени окисления хрома
2) усиление восстановительных свойств
3) увеличение массовой доли хрома
4) усиление кислотных свойств
28. Оцените справедливость суждений о металлах:
А. Чем сильнее атом удерживает валентные электроны, тем ярче
выражены металлические свойства элемента.
Б. Чем сильнее выражены металлические свойства элемента, тем
более основный характер имеет его гидроксид.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
29. Оцените справедливость суждений о металлах:
А. Для атомов металлов характерно малое число валентных
Для атомов металлов характерно малое число валентных
электронов и слабое их притяжение к ядру.
Б. Чем выше степень окисления металла в его гидроксиде, тем
более основными свойствами обладает гидроксид.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
30. Оцените справедливость суждений о металлах:
А. Атомы металла могут образовывать только ионные связи.
Б. Оксиды и гидроксиды металлов всегда имеют основный
характер.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Ответы: 1-4, 2-1, 3-4, 4-2, 5-1, 6-4, 7-3, 8-1, 9-3, 10-2, 11-3, 12-2, 13-3, 14-1, 15-4, 16-3, 17-3, 18-3, 19-1, 20-4, 21-2, 22-3, 23-2, 24-2, 25-4, 26-1, 27-4, 28-2, 29-1, 30-4
Металлические свойства — Справочник химика 21
Почему у элемента VII группы — марганца преобладают металлические свойства, тогда как стоящие в той же группе галогены являются типичными неметаллами Дать ответ, исходя из строения атомов указанных элементов. [c.218]
[c.218]Металлические свойства от лития к цезию возрастают, а электропроводность уменьшается. Как это объяснить [c.151]
В подгруппу титана входят элементы побочной подгруппы IV группы — титан, цирконий, гафний и искусственно полученный (см. стр. 112) курчатовий. Металлические свойства выражены у этих элементов сильнее, чем у металлов главной подгруппы четвертой группы — олова и свинца. Атомы элементов подгруппы титана имеют в наружном слое по два электрона, а во втором снаружи слое — по 10 электронов, из которых два — на -подуровне. Поэтому наиболее характерная степень окисленности металлов подгруппы титана равна +4. [c.648]
Какой элемент, Ве или Ва, обладает более выраженными металлическими свойствами На основании каких фактов вы отвечаете на этот вопрос Объясните ваш ответ исходя из рассмотрения электронных конфигураций атомов. [c.458]
К подгруппе ванадия относятся элементы побочной подгруппы пятой группы ванадий, ниобий и тантал. Имея в наружном электронном слое атома два или один электрон, эти элементы отличаются от элементов главной подгруппы (азота, фосфора и др.) преобладанием металлических свойств и отсутствием водородных соединений. Но производные элементов обеих подгрупп в высшей степени окисленности имеют значительное сходство. [c.651]
Имея в наружном электронном слое атома два или один электрон, эти элементы отличаются от элементов главной подгруппы (азота, фосфора и др.) преобладанием металлических свойств и отсутствием водородных соединений. Но производные элементов обеих подгрупп в высшей степени окисленности имеют значительное сходство. [c.651]
Сходство между элементами одной группы становится еще менее очевидным в группе 1УА. Углерод представляет собой неметалл, который почти всегда образует четыре ковалентные связи с другими элементами. Его атомы полимеризуются в цепи, давая так называемые органические соединения, и могут образовывать друг с другом не только простые, но и кратные ковалентные связи. Кремний-неметалл, обладающий некоторыми металлическими свойствами, включая серебристый блеск. Он образует ограниченное число гидридов, называемых силанами, которые являются аналогами углеводородов и имеют общую формулу 51 Н2 + 2- Но такие цепи ограничены предельным значением х = 6, и даже силаны с низкой молекулярной массой реагируют с галогенами и кислородом со взрывом. Кремний образует еще один класс полимеров-силоксаны, в которых атомы 81 связаны через мостиковые атомы кислорода [c.454]
Кремний образует еще один класс полимеров-силоксаны, в которых атомы 81 связаны через мостиковые атомы кислорода [c.454]
Наличие легко теряемого валентного электрона обусловливает металлические свойства щелочных металлов. Поскольку на каждый атом прихо- [c.433]
Аналогичное поведение обнаруживается и у элементов группы VA, но граница между металлами и неметаллами в этой группе проходит ниже. Азот и фосфор являются неметаллами, химия их ковалентных соединений и возможные состояния окисления определяются наличием пяти валентных электронов в конфигурации Азот и фосфор чаще всего имеют степени окисления — 3, -Ь 3 и +5. Мыщьяк As и сурьма Sb-семи-металлы, образующие амфотерные оксиды, и только висмут обладает металлическими свойствами. Для As и Sb наиболее важным является состояние окисления + 3. Для Bi оно единственно возможное, если не считать степеней окисления, проявляемых в некоторых чрезвычайно специфических условиях. Висмут не может терять все пять валентных электронов требуемая для этого энергия слишком велика. Однако он теряет три бр-электро-на, образуя ион Bi . [c.455]
Однако он теряет три бр-электро-на, образуя ион Bi . [c.455]
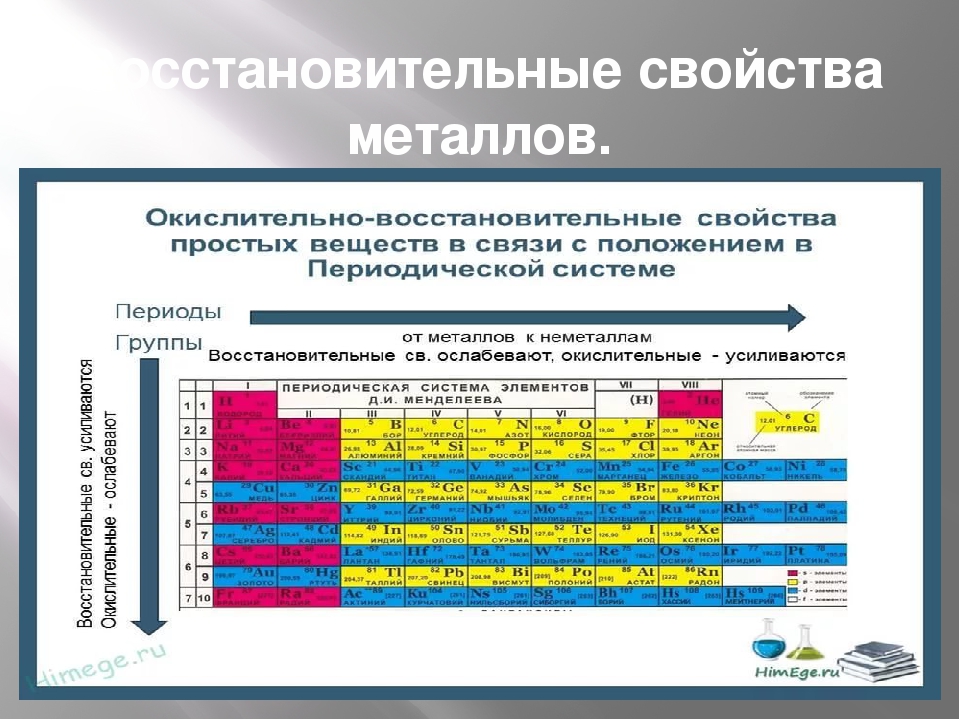
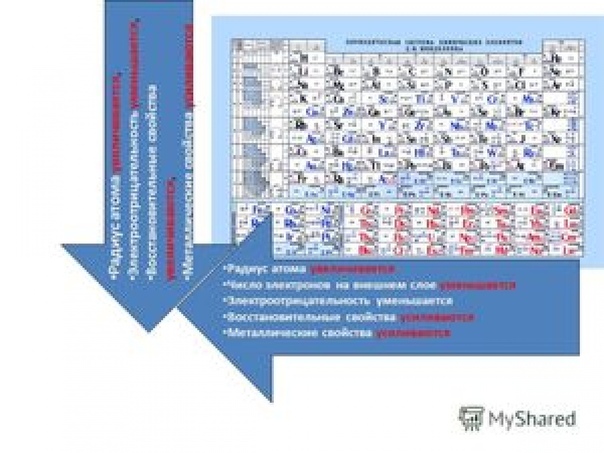
В главных подгруппах с увеличением порядкового номера уменьшаются неметаллические свойства и увеличиваются металлические свойства. В периодах с увеличением порядкового номера металлические свойства уменьшаются, а неметаллические свойства возрастают. [c.42]
Вопросы химического взаимодействия металлов между собой, а также о неметаллами, если продукты их взаимодействия сохраняют металлические свойства, изучает один из разделов неорганической химии — металлохимия. [c.253]
У электронов одного и того же периода при переходе от щелочного металла к благородному газу заряд ядра постепенно возрастает, а радиус атома уменьшается. Поэтому потенциал ионизации постепенно увеличивается, а металлические свойства ослабевают. Иллюстрацией этой закономерности могут служить первые потенциалы ионизации элементов второго и третьего периодов (табл. б). [c.102]
б). [c.102]
В своих соединениях сурьма обнаруживает большое сходств с мышьяком, но отличается от него более сильно выраженным металлическими свойствами. [c.428]
Однородные системы, состоящие из двух или оолее металлов с характерными металлическими свойствами [c.547]
Какие же вещества являются элементами Первыми правильно установленными элементами были металлы-золото, серебро, медь, олово, железо, платина, свинец, цинк, ртуть, никель, вольфрам, кобальт, И вообще из 105 известных к настоящему времени элементов только 22 не обладают металлическими свойствами. Пять неметаллов (гелий, неон, аргон, криптон и ксенон) были обнаружены в смеси газов, остающейся после удаления из воздуха всего имеющегося в нем азота и кислорода. Химики считали эти благородные газы инертными до 1962 г., когда было показано, что ксенон дает соединения со фтором, наиболее активным в химическом отнощении неметаллом. Другие химически активные неметаллы представляют собой либо газы (например, водород, азот, кислород и хлор), либо хрупкие кристаллические вещества (например, углерод, сера, фосфор, мыщьяк и иод). При обычных условиях лишь один неметаллический элемент-бром-находится в жидком состоянии, [c.271]
При обычных условиях лишь один неметаллический элемент-бром-находится в жидком состоянии, [c.271]
Окрашенные кристаллические неметаллы (Те обладает частично металлическими свойствами) [c.304]
Металлы Элементы с металл. Неметаллы и неметалл, свойствами Металлические свойства возрастают- [c.43]
Все лантаноиды и актиноиды обладают типичными металлическими свойствами, характерным блеском и высокой электропроводностью. Они имеют больщую реакционную способность, и их окислительные потенциалы принимают значения порядка 2-3 В. Из-за наличия высоких окислительных потенциалов (и низкой первой энергии ионизации) эти металлы быстро тускнеют на воздухе и легко реагируют с водой, вытесняя из нее водород. [c.451]
Какое из нескольких различных состояний окисления переходного металла обычно характеризуется наиболее металлическими свойствами в его соединениях Приведите пример. [c.458]
Металлические соединения водорода. Металлическими свойствами обладают водородные соединения (1- и /-элементов. Эти соединения получаются в виде металлоподобных темных порошков или хрупкой массы, их электрическая проводимость и теплопроводность типичны для металлов. Это гидриды нестехиометрического состава. Идеализированный состав металлических гидридов чаще всего отвечает формулам МН (УН, NbH, ТаН), МН, 2гНг, HfHa, ЗсН ) и МН3 (иНз, РаНз). [c.279]
Металлическими свойствами обладают водородные соединения (1- и /-элементов. Эти соединения получаются в виде металлоподобных темных порошков или хрупкой массы, их электрическая проводимость и теплопроводность типичны для металлов. Это гидриды нестехиометрического состава. Идеализированный состав металлических гидридов чаще всего отвечает формулам МН (УН, NbH, ТаН), МН, 2гНг, HfHa, ЗсН ) и МН3 (иНз, РаНз). [c.279]
При комнатной температуре газообразный азот не взаимодействует с такими активными металлами, как Na, К, Rb и s. Несмотря на то что при переходе вниз по подгруппе металлические свойства усиливаются, азот реагирует с литием уже при комнатной температуре. Как это объяснить [c.154]
В ряду Се — РЬ наблюдается усиление металлических свойств -и уменьшение доли ковалентной связи в соединениях. Поэтому уменьшается устойчивость ковалентных гидридов ЭН . [c.381]
Свойства. В ряду Se —Те —Ро усиливаются металлические свойства. Если сера — диэлектрик, то селен и теллур имеют как неметаллические, так и полупроводниковые и металлические модификации, а полоний по физическим свойствам похож на свинец и висмут. [c.456]
Если сера — диэлектрик, то селен и теллур имеют как неметаллические, так и полупроводниковые и металлические модификации, а полоний по физическим свойствам похож на свинец и висмут. [c.456]
Усиление металлических свойств следует и из того, что если для серы переход в металлическую модификацию требует давления 23 ГПа, то для теллура необходимо 3 ГПа. Кроме того, реакция [c.456]
Чем больше в атомах данного элемента слабо связанных электронов и чем слабее они связаны с атомами, тем в общем более резко проявляются у него металлические свойства. (Конечно, на различные свойства оказывают влияние и разные другие факторы.) [c.135]
Это положение справедливо и для нефтяного кокса. При преимущественном росте плоскостных (двухмерных) углеродных сеток возрастают его металлические свойства которые выражаются в увеличении плотности и электропроводности. При этом следует ожидать наименьших характерных для полупроводников значений термоэлектродвижущей силы и минимального уменьшения удельного электросопротивления при нагревании. [c.235]
[c.235]
Нетрудно сообразить, что поскольку щелочноземельные металлы Ве, Mg, Са, 8г и Ва очень сходны по своим химическим свойствам, их следует расположить друг под другом, как это и сделано на рис. 7-3. Каждый период завершается элементами с неметаллическими свойствами, и О, 8, 8е и Те образуют семейство элементов с валентностью 2, у которых при переходе от О к Те постепенно нарастают металлические свойства О-типичный неметалл, а Те располагается в особой пограничной зоне таблицы между металлами и неметаллами, где находятся так называемые семиме-таллы ( полуметаллы ), или металлоиды. Элементы К, Р, Аз, 8Ь и В1 образуют семейство, отличительной особенностью элементов в котором является способность присоединять три электрона в некоторых соединениях, а также постепенный переход от неметаллических свойств у N и Р к семиметаллическим у Аз и металлическим у 8Ь и В1, Элементы С, 81, Се, 8п и РЬ также образуют семейство, характерным свойством элементов в котором является валентность 4. Для этих элементов пограничная линия между металлами и неметаллами располагается на один период выше С-типичный неметалл, 81 и Ое-семиметаллы, а 8п и РЬ металлы. Наконец, семейство элементов В, А1, Са, 1п и Т1 образует ионы с зарядами + 3 [c.314]
Для этих элементов пограничная линия между металлами и неметаллами располагается на один период выше С-типичный неметалл, 81 и Ое-семиметаллы, а 8п и РЬ металлы. Наконец, семейство элементов В, А1, Са, 1п и Т1 образует ионы с зарядами + 3 [c.314]
Весьма разнообразны нитриды d-элементов. Это кристаллические иеш,ества переменного состава. Чаш,е всего встречаются нитриды типа MN(TiN, VN, rN), MjN(Nb N, raN, MojN). Они проявляют металлические свойства имеют металлический блеск н электронную проводимость. Нитриды этого типа отличаются высокой твердостью и тугоплавкостью, часто превышаюш,ей тугоплавкость исходного металла [c.346]
В главную подгруппу II группы входят гулементы бериллий, магний, кальций, стронций, барий н радий. Все этп элементы, кроме бериллия, обладают ярко выражеипыми металлическими свойствами. В свободном состоянии оии представляют собой серебристо-белые вещества, более твердые, чем ш,елочные металлы, с довольно высокими температурами плавления. По плотности все они, кроме радия, относятся к легким металлам. Их важнейшие свойства приведены в табл. 32. [c.607]
По плотности все они, кроме радия, относятся к легким металлам. Их важнейшие свойства приведены в табл. 32. [c.607]
Простые вещества. В ряду Ое—5п—РЬ отчетливо усиливаются металлические свойства простых веществ. Германий — серебристо-белый с желтоватым оттенком, внешне похож на металл, но имеет алмазоподобную решетку. Олово полиморфно. В обычных условиях оно существует в виде 8-модификацни (белое олово), устойчивой выше 13,2°С это — серебристо-белый металл, кристаллическая решетка его тетрагональной структуры с октаэдрической координацией атомов. При охлаждении белое олово переходит в -модификацию (серое олово) со структурой типа алмаза (пл. 5,85 г/см ). Переход (3-> -сопровождается увеличением удельного объема (на 25,6 %), в связи с чем олово рассыпается в пороиюк. Свинец — темно-серый металл с типичной для металлов структурой гранецентрированного куба. [c.422]
Физические и химические свойства элементов подгруппы азота зменяются с увеличением порядкового номера в той же пееледо-ательности, которая наблюдалась в ранее рассмотренных fpyn-lax.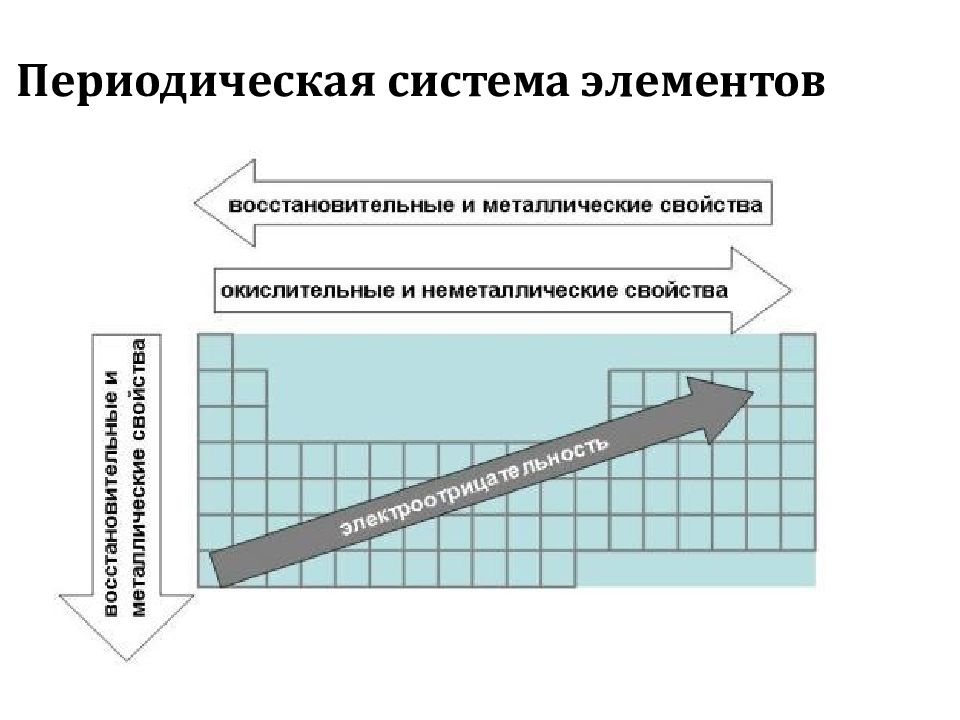 Но так как неметаллические свойства выражены у аэот ла-iee, чем у кислорода и тем более фтора, то ослабление йтия войств при переходе к следующим элементам влечет за собой ио-(вление и нарастание металлических свойств. Последние заметны [c.397]
Но так как неметаллические свойства выражены у аэот ла-iee, чем у кислорода и тем более фтора, то ослабление йтия войств при переходе к следующим элементам влечет за собой ио-(вление и нарастание металлических свойств. Последние заметны [c.397]
Соли угольной кислоты — карбонаты обычно лс раетворимы в воде. Хорошо растворяются в воде карбонаты На, К, КЬ, Сз, Т1+ и карбонат аммония. При нагревании карбонаты разлагаются, образуя оксид металла и СОа. Чем сильнее выражены металлические свойства элемента, тем более устойчив карбонат. Так, Нв СОз плавится без разложения, СаСОз разлагается при 825 °С, а АдаСОз при 100°С. [c.361]
При переходе от углерода к свиину размеры атомов возрастают. Поэтому следует ожидать, что способность к присоединению элек-тронов, а следовательио, н неметаллические свойства будут прл зтом ослабевать, легкость же отдачи электронов — возрастать. Действительно, уже у ге мання проявляются металлические свойства, а у олова и свинца они преобладают над неметаллическими. Таким образом, только первые два члена описываемой группы являются неметаллами, германий причисляют н к металлам, и к неметаллам, олово и свинец — металлы. [c.431]
Таким образом, только первые два члена описываемой группы являются неметаллами, германий причисляют н к металлам, и к неметаллам, олово и свинец — металлы. [c.431]
Одинаковое строение не только наружного, по и предпоследнего электронного слоя атомов всех ш,елочных металлов, кроме лигия, обусловливает большое сходство свойств этих элементов. В то же время увеличение заряда ядра и общего числа электро- нов в атоме при переходе сверху вниз по подгруппе создает некоторые различия в их свойствах. Как и б других группах, ти различия проявляются главным образом в увеличении легкости отдачи валентных электронов и усилении металлических свойств с возрастанием порядкового номера. [c.562]
С увеличением порядкового номера металлические свойства рассматриваемых элементов, как и в других главных подгруппах, заметно усиливаются. Так, окснд бора нмеет кислотный характер, оксиды алюминия, галлия и нндия — амфотерны, а оксид тал-лия(1П) имеет основной характер. [c.630]
[c.630]
Одинаковое строение внешнего электронного слоя атомов бора и алюминия обусловливает сходство в свойствах этих элементов. Так, для алюминия, как и для бора, характерна только степень окисленности +3. Однако при переходе от бора к алюминию сильно возрастает радиус атома (от 0,091 до 0,143 нм) и, кроме того, появляется enie один промежуточный восьмиэлектронный слой, экранирующий ядро. Все это приводит к ослаблению свя 1 внешних электронов с ядром и к уменьшению энергии ионизации атома (см. табл. 35). Поэтому у алюминия металлические свойства выражены гораздо сильнее, чем у бора. Тем ие менее, химические связн, образуемые алюминием с другими элементами, имеют в основном ковалентный характер. Рис. 165. С.хема простра стсеи- [c.635]
Щелочноземельные металлы более электроотрицательны по сравнению со щелочными металлами, тем не менее все их соединения, за исключением некоторых соединений Ве, являются ионными. Бериллий представляет собой первый пример общей закономерности, согласно которой в пределах любой группы элементы с валентными электронами, характеризуемыми меньщим главным квантовым числом, обладают менее ярко выраженными металлическими свойствами, потому что их валентные электроны расположены ближе к ядру и связаны с ним более прочно. Эта закономерность проявляется в повышении электроотрицательности при переходе к элементам с меньшими атомами в пределах одной группы (табл. 10-4). Бериллий имеет меньщий окислительный потенциал, т. е. более [c.435]
Эта закономерность проявляется в повышении электроотрицательности при переходе к элементам с меньшими атомами в пределах одной группы (табл. 10-4). Бериллий имеет меньщий окислительный потенциал, т. е. более [c.435]
У элементов группы VIIA утрачиваются все металлические свойства все галогены-типичные неметаллы. Их атомам не хватает всего одного электрона для завершения замкнутой электронной оболочки, присущей атомам благородных газов, и они легко восстанавливаются до анионов с электронной конфигурацией s»p . Приведем восстановительные потенциалы галогенов [c.455]
В периодической таблице, показанной на рис. 14-8, кристаллы элементарных веществ подразделяются на металлические, ковалентные каркасные и молекулярные. В табл. 14-1 устанавливается зависимость между координационным числом атомов в кристалле и структурой элементарных твердых веществ. Большинство элементов кристаллизуются с образованием какой-либо металлической структуры, в которой каждый атом имеет высокое координационное число. К металлам отнесены и такие элементы, как олово и висмут, кристаллизующиеся в структуры со сравнительно низким атомным координационным числом, но все же обладающие ярко выраженными металлическими свойствами. Светлоокрашенная область периодической таблицы включает элементы со свойствами, промежуточными между металлами и неметаллами. Хотя германий кристаллизуется в алмазоподобную структуру, в которой координационное число каждого атома равно только 4, по некоторым из своих свойстг он напоминает металлы. [c.605]
К металлам отнесены и такие элементы, как олово и висмут, кристаллизующиеся в структуры со сравнительно низким атомным координационным числом, но все же обладающие ярко выраженными металлическими свойствами. Светлоокрашенная область периодической таблицы включает элементы со свойствами, промежуточными между металлами и неметаллами. Хотя германий кристаллизуется в алмазоподобную структуру, в которой координационное число каждого атома равно только 4, по некоторым из своих свойстг он напоминает металлы. [c.605]
РЗЭ иногда подразделяют на две подгруппы цериевую (La — — Ей) и иттриевую (Y, Gd — Lu). Эти группы характеризуют также терминами легкие и тяжелые лантаноиды. У элементов цериевой подгруппы более выражены металлические свойства. [c.604]
Известно [87], что в направлении плоскостных углеродных сеток (по оси а) графит, т. е. предельно упорядоченное углеродное образование, проявляет металлические свойства, а в нашравлении, перпендикулярном к этой плоскости (по оси с), он полупроводник. [c.234]
[c.234]
Между окислительными и металлическими элементами нет резкой границы. Утрата металлического. характера неизбежно сопряжена с появлением окислительных свойств. Однако среди элементов встречаются такие, у которых металлические свойства кра 11с ослаблены, а окислительные свойства з , явлены недостаточно. Для таких элементов промежуточного характера целесообразно использовать название металлоиды. К этому классу элементов относятся по два элемента из каждого периода, а иметию бор, углерод, кремний, фосфор, германий, мышьяк, сурьма, сл.тур, висмут, полоний. У всех этих элементов проявляются если неметаллические, то во всяком случае ясно выраженные восстановительные свойства. Следует отметить, что у окислительных элементов (сера, селен, бром, под, астат) проявляются также и восстановительные свойства, и в этом отношении от них резко не отличаются следующие за ними инертные элементы—криитон, ксенон, радон. Однако инертные элементы характеризуются йодным отсутствием окислительных свойств. [c.109]
[c.109]
Восстановительными свойствами обладают… Окислительно-восстановительные свойства
Окислительно-восстановительные свойства отдельных атомов, а также ионов являются важным вопросом современной химии. Данный материал помогает объяснять активность элементов и веществ, проводить детальное сравнение химических свойств у разных атомов.
Что такое окислитель
Многие задачи по химии, включая тестовые вопросы единого государственного экзамена в 11 классе, и ОГЭ в 9 классе, связаны с данным понятием. Окислителем считают атомы либо ионы, которые в процессе химического взаимодействия принимают электроны от другого иона либо атома. Если анализировать окислительные свойства атомов, нужна периодическая система Менделеева. В периодах, располагающихся в таблице слева направо, окислительная способность атомов возрастает, то есть меняется аналогично неметаллическим свойствам. В основных подгруппах подобный параметр уменьшается сверху вниз. Среди самых сильных простых веществ, обладающих окислительной способностью, лидирует фтор. Такой термин, как «электроотрицательность», то есть возможность атома принимать в случае химического взаимодействия электроны, можно считать синонимом окислительных свойств. Среди сложных веществ, которые состоят из двух и больше химических элементов, яркими окислителями можно считать: перманганат калия, хлорат калия, озон.
Такой термин, как «электроотрицательность», то есть возможность атома принимать в случае химического взаимодействия электроны, можно считать синонимом окислительных свойств. Среди сложных веществ, которые состоят из двух и больше химических элементов, яркими окислителями можно считать: перманганат калия, хлорат калия, озон.
Что такое восстановитель
Восстановительные свойства атомов характерны для простых веществ, проявляющих металлические свойства. В таблице Менделеева в периодах металлические свойства слева направо ослабевают, а в основных подгруппах (вертикально) они усиливаются. Суть восстановления в отдаче электронов, которые располагаются на внешнем энергетическом уровне. Чем большее количество электронных оболочек (уровней), тем легче отдать во время химического взаимодействия «лишние» электроны.
Отличными восстановительными свойствами обладают активные (щелочные, щелочно-земельные) металлы. Кроме того, веществ, проявляющих подобные параметры, выделим оксид серы (6), угарный газ. Для того чтобы приобрести максимальную степень окисления, данные соединения вынуждены проявлять восстановительные свойства.
Для того чтобы приобрести максимальную степень окисления, данные соединения вынуждены проявлять восстановительные свойства.
Процесс окисления
Если во время химического взаимодействия атом либо ион отдает электроны иному атому (иону), идет речь о процессе окисления. Для анализа того, как меняются восстановительные свойства и окислительная способность, потребуется таблица элементов Менделеева, а также знание современных законов физики.
Процесс восстановления
Восстановительные процессы предполагают принятие ионами либо атомами электронов от других атомов (ионов) во время непосредственного химического взаимодействия. Отличными восстановителями являются нитриты, сульфиты щелочных металлов. Восстановительные свойства в системе элементов меняются аналогично металлическим свойствам простых веществ.
Алгоритм разбора ОВР
Для того чтобы в готовой химической реакции учащийся мог расставить коэффициенты, необходимо воспользоваться специальным алгоритмом. Окислительно-восстановительные свойства помогают решать и разнообразные расчетные задачи в аналитической, органической, общей химии. Предлагаем порядок разбора любой реакции:
Окислительно-восстановительные свойства помогают решать и разнообразные расчетные задачи в аналитической, органической, общей химии. Предлагаем порядок разбора любой реакции:
- Сначала важно определить у каждого имеющегося элемента степень окисления, используя правила.
- Далее определяют те атомы либо ионы, которые поменяли свою степень окисления, будут участвовать в реакции.
- Знаками «минус» и «плюс» указывают число отданных и принятых в ходе химической реакции свободных электронов.
- Далее между числом всех электронов определяется минимальное общее кратное, то есть целое число, которое без остатка делится на принятые и отданные электроны.
- Затем его делят на электроны, участвовавшие в химической реакции.
- Далее определяем, какие именно ионы либо атомы восстановительными свойствами обладают, а также определяют окислители.
- На завершающем этапе ставят коэффициенты в уравнении.
Применяя способ электронного баланса, расставим коэффициенты в данной схеме реакции:
NaMnO4 + сероводород + серная кислота= S + Mn SO4 +…+…
Алгоритм решения поставленной задачи
Выясним, какие именно должны после взаимодействия образоваться вещества.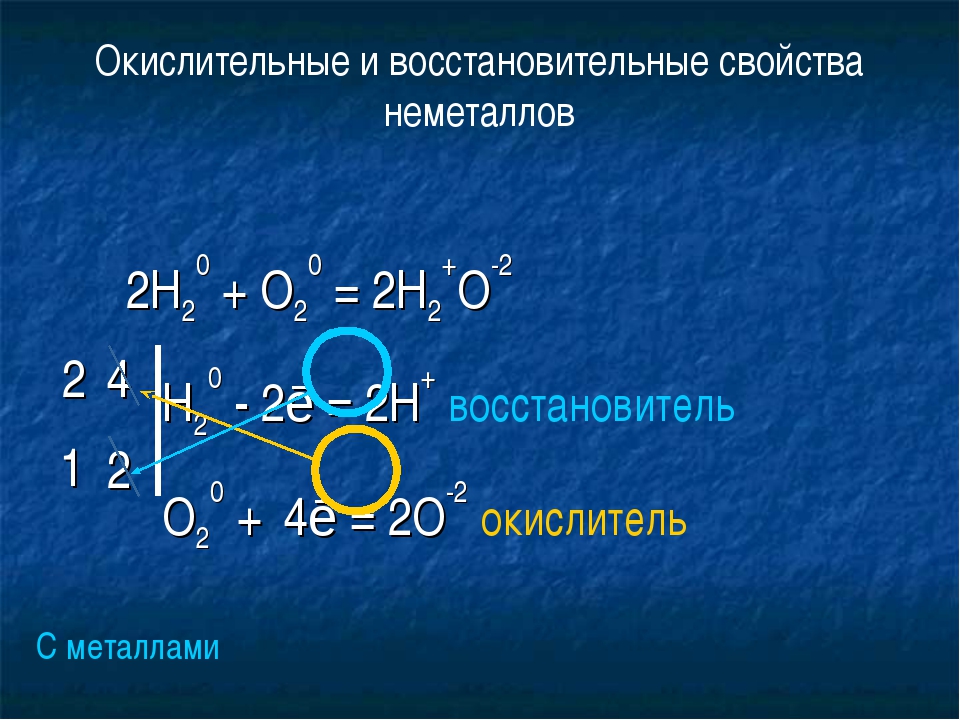 Так как в реакции уже есть окислитель (им будет марганец) и определен восстановитель (им будет сера), образуются вещества, в которых уже не меняются степени окисления. Так как основная реакция протекала между солью и сильной кислородсодержащей кислотой, то одним из конечных веществ станет вода, а вторым — соль натрия, точнее, сульфат натрия.
Так как в реакции уже есть окислитель (им будет марганец) и определен восстановитель (им будет сера), образуются вещества, в которых уже не меняются степени окисления. Так как основная реакция протекала между солью и сильной кислородсодержащей кислотой, то одним из конечных веществ станет вода, а вторым — соль натрия, точнее, сульфат натрия.
Составим теперь схему отдачи и принятия электронов:
— Mn+7 берет 5 e= Mn+2.
Вторая часть схемы:
— S-2 отдает2e= S0
Ставим в исходную реакцию коэффициенты, не забывая при этом суммировать все атомы серы в частях уравнения.
2NaMnO4 + 5H2S + 3H2SO4 = 5S + 2MnSO4 + 8H2O + Na2SO4.
Разбор ОВР с участием перекиси водорода
Применяя алгоритм разбора ОВР, можно составить уравнение протекающей реакции:
перекись водорода + серная кислота + пермагнанат калия = Mn SO4 + кислород + …+…
Степени окисления изменили ион кислорода (в перекиси водорода) и катион марганца в перманганате калия.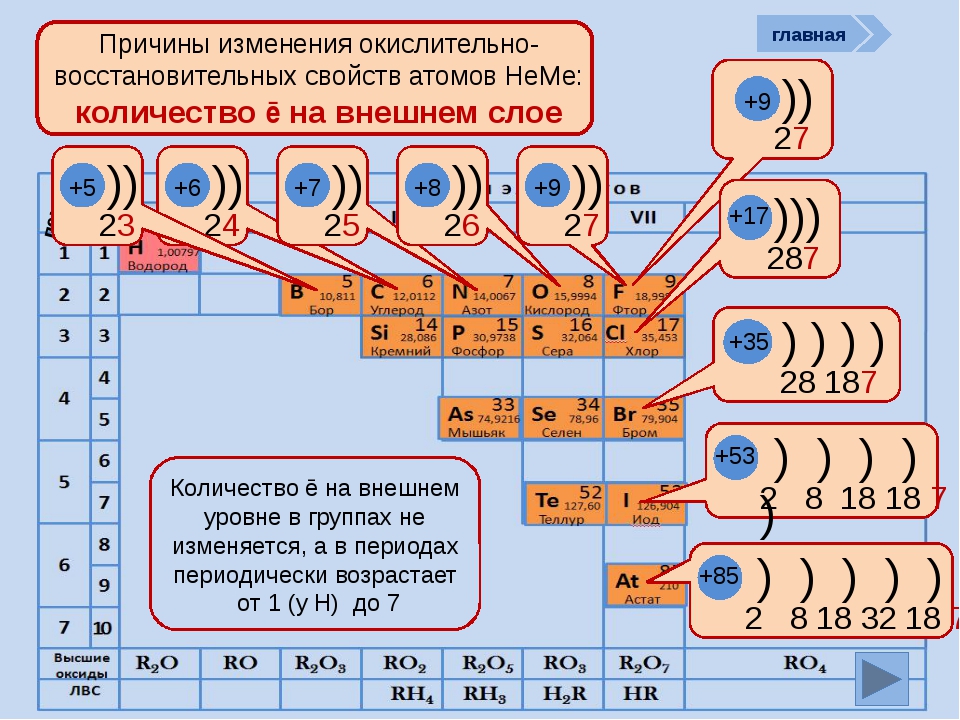 То есть восстановитель, а также окислитель у нас присутствуют.
То есть восстановитель, а также окислитель у нас присутствуют.
Определим, что за вещества еще могут получиться после взаимодействия. Одно из них будет водой, что вполне очевидно, представлена реакция между кислотой и солью. Калий не образовал нового вещества, вторым продуктом станет соль калия, а именно сульфат, так как реакция шла с серной кислотой.
Схема:
2O – отдает 2 электрона и превращается в O20 5
Mn+7 принимает 5 электронов и становится ионом Mn+2 2
Поставим коэффициенты.
5H2O2 + 3H2SO4 + 2KMnO4 = 5O2 + 2Mn SO4 + 8H2O + K2SO4
Пример разбора ОВР с участием хромата калия
Используя способ электронного баланса, составим уравнение с коэффициентами:
FeCl2 + соляная кислота + хромат калия = FeCl3+ CrCl3 + …+…
Степени окисления поменяли железо (в хлориде железа II) и ион хрома в бихромате калия.
Теперь постараемся выяснить, какие еще вещества образуются. Одно может быть солью. Поскольку калий не образовал никакого соединения, следовательно, вторым продуктом будет соль калия, точнее, хлорид, ведь реакция проходила с соляной кислотой.
Составим схему:
Fe+2 отдает e =Fe+3 6 восстановитель,
2Cr+6 принимает 6 e = 2Cr +3 1 окислитель.
Поставим коэффициенты в начальную реакцию:
6K2Cr2O7 + FeCl2 + 14HCl = 7H2O + 6FeCl3 + 2CrCl3 + 2KCl
Пример разбора ОВР с участием иодида калия
Вооружившись правилами, составим уравнение:
перманганат калия + серная кислота + иодид калия…сульфат марганца + йод +…+…
Степени окисления изменили марганец и йод. То есть восстановитель и окислитель присутствуют.
Теперь выясним,что в итоге у нас образуется. Соединение будет у калия, то есть получим сульфат калия.
Восстановительные процессы протекают у ионов йода.
Составим схему передачи электронов:
— Mn+7 принимает 5 e = Mn+2 2 является окислителем,
— 2I— отдает2 e = I20 5 является восстановителем.
Расставляем коэффициенты в начальную реакцию, не забываем при этом суммировать все атомы серы в данном уравнении.
210KI + KMnO4 + 8H2SO4 = 2MnSO4 + 5I2 + 6K2SO4 + 8H2O
Пример разбора ОВР с участием сульфита натрия
Используя классический метод, составим для схемы уравнение:
— серная кислота + KMnO4 + сульфит натрия… сульфат натрия + сульфат марганца +…+…
После взаимодействия получим соль натрия, воду.
Составим схему:
— Mn+7 принимает 5 e= Mn+2 2,
— S+4 отдает 2 e = S+6 5.
Расставляем коэффициенты в рассматриваемую реакцию, не забываем складывать атомы серы при расстановке коэффициентов.
3H2SO4 + 2KMnO4 + 5Na2SO3 = K2SO4 + 2MnSO4 + 5Na2SO4 + 3H2O.
Пример разбора ОВР с участием азота
Выполним следующее задание. Пользуясь алгоритмом, составим полное уравнение реакции:
— нитрат марганца +азотная кислота+PbO2=HMnO4+Pb(NO3) 2+
Проанализируем, какое вещество еще образуется. Так как реакция проходила между сильным окислителем и солью, значит, веществом будет вода.
Покажем изменение числа электронов:
— Mn+2 отдает 5 e = Mn+7 2 проявляет свойства восстановителя,
— Pb+4 принимает 2 e = Pb+2 5 окислителем.
3. Расставляем коэффициенты в исходную реакцию, обязательно складываем весь азот, имеющийся в левой части исходного уравнения:
— 2Mn(NO3)2 + 6HNO3 + 5PbO2 = 2HMnO4 + 5Pb(NO3)2 + 2H2O.
В данной реакции не проявляются восстановительные свойства азота.
Второй образец окислительно-восстановительной реакции с азотом:
Zn + серная кислота + HNO3= ZnSO4 + NO+…
— Zn0 отдает 2 e = Zn+2 3 будет восстановителем,
N+5принимает 3 e = N+2 2 является окислителем.
Расставляем коэффициенты в заданную реакцию:
3Zn + 3H2SO4 + 2HNO3 = 3ZnSO4 + 2NO + 4H2O.
Значимость окислительно-восстановительных реакций
Самые известные восстановительные реакции — фотосинтез, характерный для растений. Как изменяются восстановительные свойства? Процесс происходит в биосфере, приводит к повышению энергии с помощью внешнего источника. Именно эту энергию и использует для своих нужд человечество. Среди примеров окислительных и восстановительных реакций, связанных с химическими элементами, особое значение имеют превращения соединений азота, углерода, кислорода. Благодаря фотосинтезу земная атмосфера имеет такой состав, который необходим для развития живых организмов. Благодаря фотосинтезу не увеличивается количество углекислого газа в воздушной оболочке, поверхность Земли не перегревается. Растение не только развивается с помощью окислительно-восстановительной реакции, но и образует такие нужные для человека вещества, как кислород, глюкоза. Без данной химической реакции невозможен полноценный круговорот веществ в природе, а также существование органической жизни.
Благодаря фотосинтезу земная атмосфера имеет такой состав, который необходим для развития живых организмов. Благодаря фотосинтезу не увеличивается количество углекислого газа в воздушной оболочке, поверхность Земли не перегревается. Растение не только развивается с помощью окислительно-восстановительной реакции, но и образует такие нужные для человека вещества, как кислород, глюкоза. Без данной химической реакции невозможен полноценный круговорот веществ в природе, а также существование органической жизни.
Практическое применение ОВР
Для того чтобы сохранить поверхность металла, необходимо знать, что восстановительными свойствами обладают активные металлы, поэтому можно покрывать поверхность слоем более активного элемента, замедляя при этом процесс химической коррозии. Благодаря наличию окислительно-восстановительных свойств осуществляется очистка и дезинфекция питьевой воды. Ни одну задачу нельзя решить, не расставив правильно в уравнении коэффициенты. Для того чтобы избежать ошибок, важно иметь представление обо всех окислительно-восстановительных параметрах.
Защита от химической коррозии
Особую проблему для жизни и деятельности человека представляет коррозия. В результате данного химического превращения происходит разрушение металла, теряют свои эксплуатационные характеристики детали автомобиля, станков. Для того чтобы исправить подобную проблему, используется протекторная защита, покрытие металла слоем лака либо краски, применение антикоррозионных сплавов. Например, железная поверхность покрывается слоем активного металла — алюминия.
Заключение
Разнообразные восстановительные реакции происходят и в организме человека, обеспечивают нормальную работу пищеварительной системы. Такие основные процессы жизнедеятельности, как брожение, гниение, дыхание, также связаны с восстановительными свойствами. Обладают подобными возможностями все живые существа на нашей планете. Без реакций с отдачей и принятием электронов невозможна добыча полезных ископаемых, промышленное производство аммиака, щелочей, кислот. В аналитической химии все методы объемного анализа основаны именно на окислительно-восстановительных процессах. Борьба с таким неприятным явлением, как химическая коррозия, также основывается на знании этих процессов.
Борьба с таким неприятным явлением, как химическая коррозия, также основывается на знании этих процессов.
Периодический закон, подготовка к ЕГЭ по химии
Периодический закон был открыт Д.И. Менделеевым в 1868 году. Его современная формулировка: свойства химических элементов и образуемых ими соединений (простых и сложных) находятся в периодической зависимости от величины заряда атомного ядра.
Периодический закон лежит в основе современного учения о строении вещества. Периодическая система Д.И. Менделеева является наглядным отражением периодического закона.
В периодической таблице элементы расположены в порядке увеличения атомного заряда, группируются в «строки и столбцы» — периоды и группы.
Период — ряд горизонтально расположенных химических элементов. 1, 2 и 3 периоды называются малыми, они состоят из одного ряда элементов.
4, 5, 6 — называются большими периодами, они состоят из двух рядов химических элементов.
Группой называют вертикальный ряд химических элементов в периодической таблице. Элементы собраны в группы на основе степени окисления в высшем оксиде. Каждая из восьми групп состоит из главной подгруппы (а) и побочной подгруппы (б).
Периодическая таблица Д.И. Менделеева содержит колоссальное число ответов на самые разные вопросы. При умелом ее использовании вы сможете предполагать строение и свойства веществ, успешно писать химические реакции и решать задачи.
Радиус атома
Радиусом атома называют расстояние между атомным ядром и самой дальней электронной орбиталью. Это не четкая, а условная граница, которая говорит о наиболее вероятном месте нахождения электрона.
В периоде радиус атома уменьшается с увеличением порядкового номера элементов («→» слева направо). Это связано с тем, что с увеличением номера группы
увеличивается число электронов на внешнем уровне. Запомните, что для элементов главных подгрупп номер группы равен числу электронов на внешнем уровне.
Запомните, что для элементов главных подгрупп номер группы равен числу электронов на внешнем уровне.
С увеличением числа электронов они становятся более скученными, так как притягиваются друг к другу сильнее: это и есть причина маленького радиуса атома.
Чем меньше электронов, тем больше у них свободы и больше радиус атома, поэтому радиус увеличивается в периоде «←» справа налево.
В группе радиус атома увеличивается с увеличением заряда атомных ядер — сверху вниз «↓». Чем больше период, тем больше электронных орбиталей вокруг атома, соответственно, и больше его радиус.
С уменьшением заряда атома в группе радиус атома уменьшается — снизу вверх «↑». Это связано с уменьшением количества электронных орбиталей вокруг атома. Для примера возьмем атомы бора и алюминия, элементов, расположенных в одной группе.
Период, группа и электронная конфигурация
Обратите внимание еще раз на важную деталь: элементы, находящиеся в одной группе (главной подгруппе!), имеют сходную конфигурацию внешнего уровня. Так у бора на внешнем уровне расположены 3 электрона, у алюминия — тоже 3. Оба они в III группе.
Так у бора на внешнем уровне расположены 3 электрона, у алюминия — тоже 3. Оба они в III группе.
Такая закономерность иногда может сильно облегчить жизнь, однако у элементов побочных подгрупп она отсутствует — там нужно считать электроны «вручную», располагая их на электронных орбиталях.
Раз уж мы повели речь об электронных конфигурациях, давайте запишем их для бора и алюминия, чтобы лучше представлять их внешний уровень и увидеть то самое «сходство»:
- B5 — 1s22s22p1
- Al13 — 1s22s22p63s23p1
Общую электронную конфигурацию для элементов III группы главной подгруппы можно записать ns2np1. Это будет работать для
бора, внешний уровень которого 2s22p1, алюминия — 3s23p1, галия — 4s24p1,
индия — 5s25p1 и таллия — 6s26p1.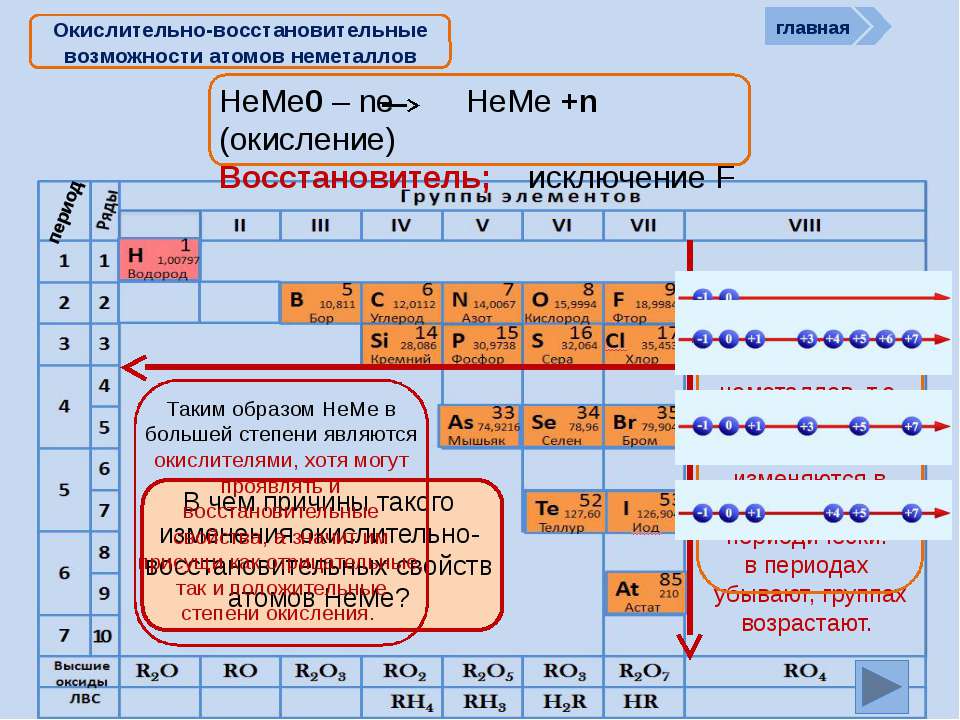 За «n» мы принимаем номер периода.
За «n» мы принимаем номер периода.
Правило составления электронной конфигурации, которое вы только что увидели, универсально. Если вы имеете дело с элементом главной подгруппы, то увидев номер группы вы знаете, сколько электронов у него на внешнем уровне. Посмотрев на период, знаете номер его внешнего уровня.
Вам остается только распределить известное число электронов по s и p ячейкам, а затем подставить номер периода — и вот быстро получена конфигурация внешнего уровня. Предлагаю посмотреть на примере ниже 🙂
Очень надеюсь, что теперь вы знаете: только глядя на положение элемента в периодической таблице, на группу и период, в которых он расположен, вы уже можете составить конфигурацию его внешнего уровня. Безусловно, это для элементов главных подгрупп. Повторюсь: у побочных — только «вручную».
Длина связи
Длина связи — расстояние между атомами химически связанных элементов. Очевидно, что понятия длины связи и атомного радиуса взаимосвязаны напрямую.
Чем больше радиус атома, тем больше длина связи.
Очевидно, что понятия длины связи и атомного радиуса взаимосвязаны напрямую.
Чем больше радиус атома, тем больше длина связи.
Убедимся в этом на наглядном примере, сравнив длину связей в четырех веществах: HF, HCl, HBr, HI.
Чем больше радиусы атомов, которые образуют химическую связь, тем больше между ними и длина связи. Радиус атома водорода неизменен во всех трех веществах, а в ряду F → Cl → Br → I происходит увеличение радиуса атома. Наибольшим радиусом обладает йод, поэтому самая длинная связь в молекуле HI.
Металлические и неметаллические свойства
В периоде с увеличением заряда атома металлические свойства ослабевают, неметаллические — усиливаются (слева направо «→»). В группе с увеличением заряда атома металлические свойства усиливаются, а неметаллические — ослабевают (сверху вниз «↓»).
Сравним металлические и неметаллические свойства Rb, Na, Al, S. Натрий, алюминий и сера находятся в одном периоде. Металлические свойства возрастают
S → Al → Na. Натрий и рубидий находятся в одной группе, металлические свойства возрастают Na → Rb.
Натрий, алюминий и сера находятся в одном периоде. Металлические свойства возрастают
S → Al → Na. Натрий и рубидий находятся в одной группе, металлические свойства возрастают Na → Rb.
Таким образом, самые сильные металлические свойства проявляет рубидий, но с другой стороны — у него самые слабые неметаллические свойства. Сера обладает самыми слабыми металлическими свойствами, но, если посмотреть по-другому, сера — самый сильный неметалл.
Распределение металлов и неметаллов в периодической таблице также является наглядным отображением этого правила. Если провести условную линию, проходящую от бора до астата, то справа окажутся неметаллы, а слева — металлы.
Основные и кислотные свойства
Основные свойства в периоде с увеличением заряда атома уменьшаются, кислотные — возрастают. В группе с увеличением заряда атома основные
свойства усиливаются, а кислотные — ослабевают.
Кислотные и основные свойства противопоставлены друг другу, как противопоставлены металлические и неметаллические. Где первые усиливаются, вторые — убывают. Все аналогично, поэтому смело ассоциируйте одни с другими, так будет гораздо легче запомнить.
Замечу, что здесь есть одно важное исключение. Как и в общем случае: исключения только подтверждают правила. В ряду галогенводородных кислот HF → HCl → HBr → HI происходит усиление кислотных свойств (а не ослабление, как должно быть по логике нашего правила).
Это можно объяснить в темах диссоциации и химических связей. Когда мы дойдем до соответствующей темы, я напомню про HF и водородные связи между молекулами, которые делают эту кислоту самой слабой. Сейчас воспринимайте это как исключение: HF — самая слабая из этих кислот, а HI — самая сильная.
Восстановительные и окислительные свойства
Восстановительные свойства в периоде с увеличением заряда атома ослабевают, окислительные — усиливаются. В группе с увеличением заряда
атома восстановительные свойства усиливаются, а окислительные — ослабевают.
В группе с увеличением заряда
атома восстановительные свойства усиливаются, а окислительные — ослабевают.
Ассоциируйте восстановительные свойства с металлическими и основными, а окислительные — с неметаллическими и кислотными. Так гораздо проще запомнить 😉
Электроотрицательность (ЭО), энергия связи, ионизации и сродства к электрону
Электроотрицательность — способность атома, связанного с другими, приобретать отрицательный заряд (притягивать к себе электроны). Мы уже касались ее в статье, посвященной степени окисления. Это важное свойство, ведь более ЭО-ый атом притягивает к себе электроны и уходит в отрицательную степень окисления со знаком минус «-«.
Все перечисленные в подзаголовке свойства вместе с ЭО усиливаются в периоде с увеличением заряда атома, в группе с увеличением заряда атома
они ослабевают. Таким образом, самый электроотрицательный элемент расположен справа вверху таблицы Д. И. Менделеева — это фтор.
И. Менделеева — это фтор.
Для примера сравним ЭО-ость атомов Te, In, Al, P. Индий расположен в одной группе с алюминием, ЭО-ость In → Al возрастает (снизу вверх). Алюминий расположен в одном периоде с серой, ЭО-ость возрастает Al → S (слева направо). Сравнивая серу и теллур, мы видим, что сера расположена в группе выше теллура, значит и ее электроотрицательность тоже выше.
Энергия связи (а также ее прочность) возрастают с увеличением электроотрицательности атомов, образующих данную связь. Чем сильнее атом тянет на себя электроны (чем больше он ЭО-ый), тем прочнее получается связь, которую он образует.
Понятию ЭО-ости «синонимичны» также понятия сродства к электрону — энергии, выделяющейся при присоединении электрона к атому, и энергии ионизации —
количеству энергии, которое необходимо для отщепления электрона от атома. И то, и другое возрастают с увеличением электроотрицательности.
Продемонстрирую на примере. Сравним энергию связи в трех молекулах: H2O, H2S, H2Se.
Высшие оксиды и летучие водородные соединения (ЛВС)
В периодической таблице Д.И. Менделеева ниже 7 периода находится строка, в которой для каждой группы указаны соответствующие высшие оксиды, ниже строка с летучими водородными соединениями.
Для элементов главных подгрупп начиная с IV группы (в большинстве случае) максимальная степень окисления (СО) определяется по номеру группы. К примеру, для серы (в VI группе) максимальная СО = +6, которую она проявляет в соединениях: H2SO4, SO3.
В таблице видно, что для VIa группы формула высшего оксида RO3, а, к примеру, для IIIa группы — R2O3. Напишем
высшие оксиды для веществ из VIa : SO3, SeO3, TeO3 и IIIa группы: B2O3, Al2O3,
Ga2O3.
На экзамене строка с готовыми «высшими» оксидами, как в таблице наверху, может отсутствовать. Считаю важным подготовить вас к этому. Предположим, что эта строчка внезапно исчезла из таблицы, и вам нужно записать высшие оксиды для фосфора и углерода.
С летучими водородными соединениями (ЛВС) ситуация аналогичная: их может не быть в периодической таблице Д.И. Менделеева, которая попадется на экзамене. Я расскажу вам, как легко их запомнить.
ЛВС характерны для IV, V, VI и VII группы. Элементы этих групп более электроотрицательны, чем водород, поэтому ходят в «-» отрицательную СО. Минимальная степень окисления для элементов главных подгрупп, начиная с IV группы, может быть рассчитана так: номер группы — 8.
Например, для углерода минимальная СО = 4-8 = -4; для азота 5-8 = -3; для кислорода 6-8 = -2; для фтора 7-8 = -1. Для того, чтобы запомнить
ЛВС, вы должны ассоциировать IV, V, VI и VII группы с хорошо известными вам веществами: метаном, аммиаком, водой и фтороводородом.
Так как общее строение ЛВС в пределах одной группы сходно, то, вспомнив например H2O для кислорода в VI группе, вы легко найдете формулы других ЛВС VI группы: серы — H2S, H2Se, H2Te, H2Po.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Элемент имеющий наибольшие неметаллические свойства. Тесты A3
Упражнения.
1. Заполните таблицу:
Электронная формула | Число электронов на внешнем уровне | Число валентных электронов | Характерные степени окисления. | |
Марганец | ||||
Алюминий | ||||
2. Составить формулы оксидов и определить их тип (основный, амфотерный, кислотный).
Составить формулы оксидов и определить их тип (основный, амфотерный, кислотный).
Оксид магния | Оксид цинка | Оксид хрома (III) | Оксид марганца (VII) | Оксид лития | Оксид хрома (VI) |
3. Сравнить радиусы металлов: а) Cu_____Zn, b) Ca_____ Be c) Ca ______Zn.
Металлы.
1. Металлами являются:
1)все s-элементы; 2) все p-элементы; 3) все d-элементы; 4) все элементы главных подгрупп.
2. Среди металлов нет:
а) s-элементов б) р-элементов в) d-элементов г) f-элементов
1) а, б 2) в, б 3) в, г 4) есть все
3. Атомы в кристаллических решетках металлов удерживаются посредством:
Атомы в кристаллических решетках металлов удерживаются посредством:
1) ионной связи 2) ковалентной полярной связи 3) водородной связи 4)металлической связи
4. Характерное свойство металлов:
1) плохая теплопроводность; 2) оксиды имеют ионный характер;
3) многие из них окислители; 4) большинство оксидов – ковалентные соединения.
5. Для металлов характерны:
1) низкая теплопроводность и электропроводность 2) летучесть
3) ковкость и пластичность 4) в обычных условиях газообразное состояние
6. Атомы металлов при взаимодействии с атомами неметаллов:
1) отдают валентные электроны 2) принимают электроны
3) в одних случаях принимают электроны, в других — отдают 4) являются окислителями
7.С увеличением порядкового номера металла в главной подгруппе способность отдавать электроны
1)увеличивается 2) не изменяется 3)уменьшается 4) увеличивается, а затем уменьшается
8.Какое свойство не является общим для всех металлов:
1)электропроводность; 2)теплопроводность;
3)твёрдое агрегатное состояние при стандартных условиях; 4)металлический блеск.
9. Атомы металлов, отдавая электроны, приобретают электронную структуру внешнего энергетического уровня:
1) щелочных 2) галогенов 3) благородных газов 4) кислорода
10. В атомах каких металлов в основном состоянии на энергетическом d-подуровне содержится пять электронов:
1) Железа 2) Марганца 3) Титана 4) Ванадия 5) Хрома
11. Среди перечисленных элементов к металлам относится:
1)барий 2)кремний 3)гелий 4) бор
12.Какая из групп элементов содержит только металлы?
1) Li , Be, B 2) K, Ca, Sr 3) Li, Si, Na 4)Se, Te, Po
13. Металлические свойства усиливаются в ряду элементов
1) натрий — магний — алюминий 2) литий — натрий — калий
3) барий — кальций — магний 4) калий — натрий — литий
14. В каком ряду простые вещества расположены в порядке усиления металлических свойств?
1)Mg, Ca, Ba 2)Na, Mg, Al 3)K, Ca, Fe 4)Sc, Ca, Mg
15. Наиболее выраженными металлическими свойствами обладает 1) Nа 2) К 3) Mg 4)Аl
16. Наименее выраженными металлическими свойствами обладает 1)Rb 2)Sr 3)Са 4)К
Наименее выраженными металлическими свойствами обладает 1)Rb 2)Sr 3)Са 4)К
17.Среди перечисленных металлов выберите металл с наименьшими восстановительными свойствами:1) медь 2)свинец 3) ртуть 4) железо
18. Какие металлы проявляют переменные степени окисления: 1) Fе 2) Na 3) Са 4) Al
19.Степень окисления хрома в его амфотерных соединениях равна 1)+6 2)+2 3)+3 4)+1
20. Какие утверждения по отношению к металлам являются верными:
1)большая часть химических элементов является металлами
2) гидроксиды металлов проявляют кислотные свойства
3)для металлов характерны окислительные свойства
4) металлы плохо проводят электрический ток
21. Какие утверждения для металлов неверны:
1) металлы составляют большинство элементов Периодической системы;
2) в атомах всех металлов на внешнем энергетическом уровне содержится не более двух электронов; 3) в химических реакциях для металлов характерны восстановительные свойства;
4) в каждом периоде атом щелочного металла имеет наименьший радиус.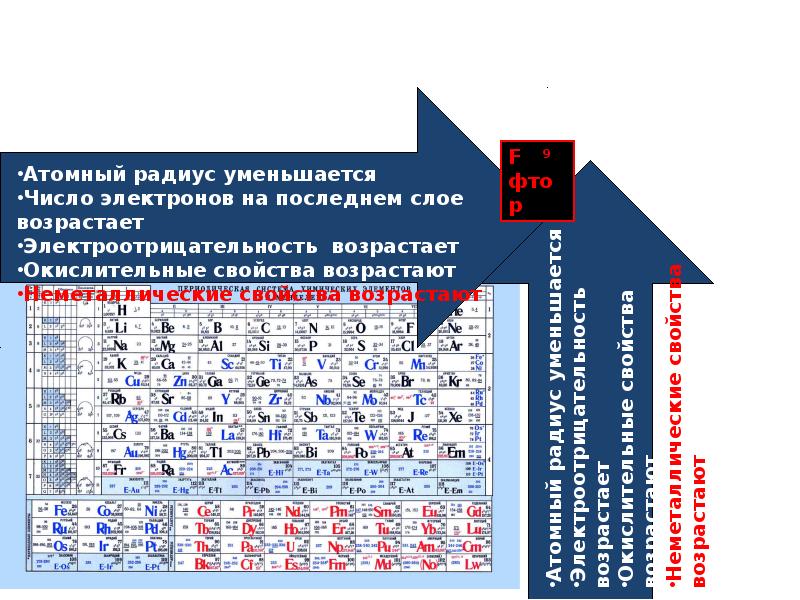
22. В ряду натрий — магний — алюминий элементы расположены в порядке увеличения
1) атомного радиуса 2) электроотрицательности
3) металлических свойств 4) числа электронных слоев
23. Металл, у которого наиболее устойчивая степень окисления +1, – это:
1) медь; 2) серебро; 3) золото; 4) у всех перечисленных выше металлов степень окисления +1 одинаково устойчивая.
24. Верны ли следующие суждения о щелочных металлах?
А. Во всех соединениях они имеют степень окисления +1.
Б. С галогенами они образуют соединения с ионной связью.
25. Высший гидроксид хрома
1) проявляет кислотные свойства 2) проявляет основные свойства
3) проявляет амфотерные свойства 4) не проявляет кислотно-основных свойств
26. Верны ли следующие суждения о соединениях железа?
А. Оксиду железа с основными свойствами соответствует формула FeO.
Б. Для гидроксида железа (III) характерны только кислотные свойства.
1)верно только А; 2) верно только Б; 3)верны оба суждения; 4)оба суждения неверны.
27. Верны ли следующие суждения о соединениях хрома?
А. Высшая степень окисления хрома равна + 4.
Б. Высший оксид хрома относится к оснóвным оксидам.
1)верно только А; 2) верно только Б; 3)верны оба суждения; 4)оба суждения неверны.
28.Верны ли следующие суждения о хроме и железе?
А. И хром, и железо образуют устойчивые оксиды в степени окисления +3.
Б. Оксид хрома (III) является амфотерным.
1)верно только А; 2) верно только Б; 3)верны оба суждения; 4)оба суждения неверны.
29. Оксид железа(III)
1) не проявляет кислотно-основных свойств 2) проявляет кислотные свойства
3) проявляет основные свойства 4) проявляет амфотерные свойства
30. Соединения меди(I) в окислительно-восстановительных реакциях
1) не проявляют ни окислительные, ни восстановительные свойства
2) проявляют только окислительные свойства
3) проявляют только восстановительные свойства
4) проявляют как окислительные, так и восстановительные свойства
Неметаллы.
1.Какой из неметаллов встречается в свободном виде?
1)кремний; 2)сера; 3)хлор; 4)фосфор.
2. Атомы р-элементов на внешнем электронном уровне имеют:
1) от одного до четырех s-электронов; 2) от одного до пяти р-электронов;
3) от одного до шести р-электронов; 4) от одного до четырех р-электронов.
3. Сера является окислителем в реакции с
1) кислородом 2) металлами 3) хлором и фтором 4) азотной кислотой
4. Максимальная степень окисления фосфора в соединениях равна
1)+6 2)+5 3)+3 4)+4
5. При взаимодействии фосфора с активными металлами образуются соединения, в которых его степень окисления равна 1+3 4)+5
6. В порядке усиления неметаллических свойств расположены
1) S-Sе 2) Sе-Вr 3) Вr-I 4) I-Te
7. Неметаллические свойства у элементов А групп усиливаются
1) слева направо и в группах снизу вверх 2) справа налево и в группах сверху вниз
3) справа налево и в группах снизу вверх 4) слева направо и в группах сверху вниз
8. Наименьшую энергию нужно затратить на отрыв электрона от атома
Наименьшую энергию нужно затратить на отрыв электрона от атома
1) Аs 2) Sе 3) S 4) Р
9. Наибольшую энергию нужно затратить на отрыв электрона от
1) Ga 2) Al 3) Si 4) C
10.Легче всего присоединяет электроны атом 1) серы 2) хлора 3) селена 4) брома
11. Притяжение электронов внешнего слоя к ядру увеличивается в ряду:
1)Si – P — N 2) S — P –As 3) Na — K – Rb 4) Sr – Ca – K
12. В ряду водородных соединений неметаллов РН3, Н2S, НCl
1) не наблюдается проявление кислотно-основныx свойств
2) основные свойства усиливаются, кислотные убывают
3) кислотно-основный характер соединений не изменяется
4) основные свойства убывают, кислотные усиливаются
13. Высший гидроксид селена 1) h3SeO3 2) h3Se 3) h3SeO4 4) SeO3
14. Верны ли следующие суждения о неметаллах?
А. Все соединения неметаллов проявляют только окислительные свойства.
Б. Все водородные соединения неметаллов являются кислотами.
15. Верны ли следующие суждения о соединениях неметаллов?
А. Оксиды, образованные атомами неметаллов, в высших степенях окисления являются кислотными.
Б. Летучие водородные соединения всех неметаллов проявляют кислотные свойства.
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
16. Верны ли следующие суждения о соединениях неметаллов?
А. Все оксиды, образуемые атомами неметаллов, являются кислотными.
Б. В высших степенях окисления атомы неметаллов проявляют окислительные свойства.
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
17. Верны ли следующие суждения о неметаллах ?
А. В периодической системе неметаллы расположены в правой, преимущественно верхней части.
Б. Среди неметаллов нет ни одного d — элемента.
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
18. Верны ли следующие суждения об элементах VА группы?
Верны ли следующие суждения об элементах VА группы?
А. С возрастанием заряда ядра радиус атома увеличивается.
Б. Общая формула летучего водородного соединения Rh4.
1)верно только А; 2) верно только Б; 3)верны оба суждения; 4)оба суждения неверны.
19. Наиболее сильным окислителем является 1) N2 2) O2 3) F2 4) Cl2
20. Оксиды состава ЭО2 и ЭО3 образует каждый из двух элементов:
1) сера и селен 2) азот и фосфор 3) углерод и кремний 4) железо и хром
21. Соединения состава KЭO2 и KЭO3 образует элемент 1) азот 2) фосфор 3) сера 4) марганец
22. Формула высшего гидроксида хлора 1) HCl 2) HClO4 3) HClO3 4) HClO
23. Верны ли следующие суждения о галогенах?
А. Окислительные свойства простых веществ галогенов с увеличением порядкового номера элемента в Периодической системе химических элементов увеличиваются.
Б. Все простые вещества галогены являются только окислителями.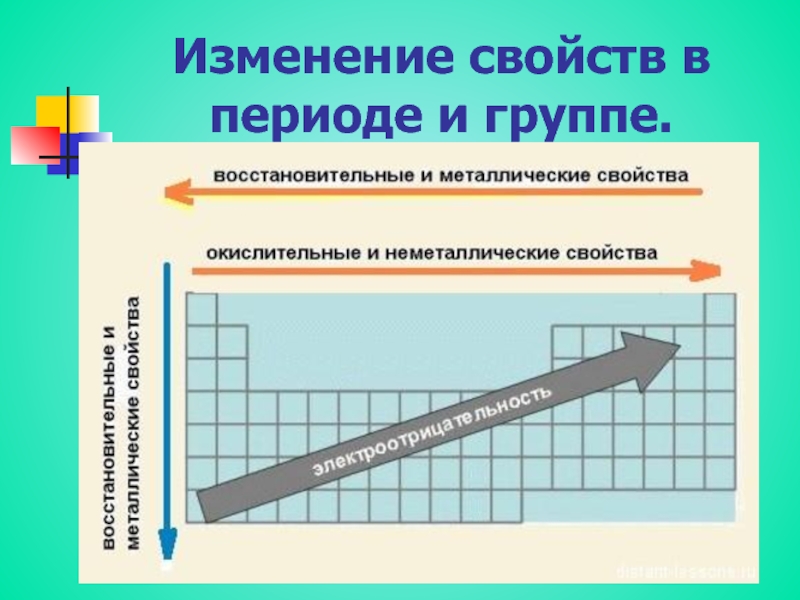
1)верно только А; 2) верно только Б; 3)верны оба суждения; 4)оба суждения неверны.
24. С увеличением порядкового номера элемента в периоде электроотрицательность неметаллов:
а) увеличивается; б) уменьшается; в) сначала увеличивается, затем уменьшается; г) не изменяется.
25. Число электронов на внешнем электронном слое атомов неметаллов равно:
а) номеру периода; в) порядковому номеру; б) номеру группы; г) заряду ядра.
Общая характеристика неметаллов главных подгрупп IV – VII групп в связи с их положением в периодической системе химических элементов и особенностями строения их атомов.
1. Верны ли следующие суждения о неметаллах?
А. В периодической системе химических элементов все неметаллы располагаются в главных подгруппах. Б. Все неметаллы являются р-элементами.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
2. При обычных условиях из двухатомных молекул состоят
1) гелий и аргон
2) азот и неон
3) сера и фосфор
4) водород и кислород
3. Верны ли следующие суждения о неметаллах?
Верны ли следующие суждения о неметаллах?
А. Все неметаллы являются химически активными веществами.
Б. Неметаллы обладают только окислительными свойствами.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
4. Верны ли следующие суждения о неметаллах?
А. Неметаллы образуют с щелочными металлами соединения преимущественно с ионной связью.
Б. Между собой неметаллы образуют соединения с ковалентной связью.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
5. У атомов химических элементов, расположенных в ряду: P-S-C1, увеличивается
2) окислительная способность
3) восстановительная способность
4) число неспаренных электронов
6. Соединения состава NaHЭO3 и NaHЭO4 может образовать
1) углерод 2) сера 3) хлор 4) фосфор
7. Наиболее сильными кислотными свойствами обладает
1) НС1О4 2) h3SO3 3) Н3РО4 4) h3SiО3
8) Соединения состава КЭО2 и КЭО3 образует элемент
1) азот 2) фосфор 3) сера 4) марганец
9. Водород проявляет окислительные свойства при реакции с
Водород проявляет окислительные свойства при реакции с
10. Способность атомов химических элементов принимать электроны усиливается в ряду:
1)F —>O —>N
2) N —>F —>О
3) N —>O —>F
4) O —>N —>F
11. Степени окисления хлора, брома и йода в высших оксидах и водородных соединениях соответственно равны:
1)+1и-1 2)+7и-1 3)+7и-7 4)+5и-1
12. Сера проявляет как окислительные, так и восстановительные свойства при взаимодействии с
1) водородом и железом
2) углеродом и цинком
3) хлором и фтором
4) натрием и кислородом
13. В ряду: Si —>Р —> S —> С1
электроотрицательность элементов
1) увеличивается
2) уменьшается
3) не изменяется
4) сначала уменьшается, потом увеличивается
14. В ряду элементов мышьяк —>селен —> бром возрастает
1) атомный радиус
2) число неспаренных электронов в атоме
3) число электронных слоев в атоме
4) электроотрицательность
15. Водородное соединение состава Н2Э2 образует
Водородное соединение состава Н2Э2 образует
1) углерод
2) кремний
16. Верны ли следующие суждения о галогенах?
А. Наиболее электроотрицательным среди галогенов является иод.
Б. Хлор вытесняется бромом из хлорида алюминия.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
17. Кислород не реагирует с
1) водой и оксидом кальция
2) железом и оксидом фосфора (V)
3) водородом и оксидом фосфора (III)
4) сероводородом и оксидом углерода (IV)
18. Высшему гидроксиду элемента VIIA группы соответствует формула
1) Н2ЭО3 2) Н2ЭО4 3) НЭО3 4) НЭО4
19. Верны ли следующие суждения о галогенах?
А. Фтор в соединениях проявляет как положительную, так и
отрицательную степень окисления.
Б. При нормальных условиях бром и иод являются жидкостями.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
20. Водород проявляет окислительные свойства при взаимодействии с
Водород проявляет окислительные свойства при взаимодействии с
1) натрием 2) хлором 3) азотом 4) кислородом
21. Окислительные свойства фосфор проявляет при взаимодействии с
1) кислородом
2) магнием
22. Верны ли следующие суждения о свойствах серы и хлора?
А. Максимальная валентность серы и хлора в соединениях равна номеру группы.
Б. В водородных соединениях серы и хлора связь ковалентная полярная.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
23. Фосфор проявляет окислительные свойства при реакции с
1) кальцием 2) серой 3} хлором 4) кислородом
24. При взаимодействии высшего оксида хлора с водой образуется кислота
1) НС1O 2) НС1O2 3) НСlO3 4} HClO4
25. Характерными степенями окисления хлора в его соединениях являются:
1) -1, +1, +3, +5, +7
А. Атомы неметалла могут участвовать в образовании как ионных,
так и ковалентных связей.
Б. Гидроксиды неметаллов имеют кислотный характер.
1) верно только А
2) верно только Б
3) верны оба суждения
А. Чем больше заряд ядра атома, тем сильнее выражены его
неметаллические свойства.
Б. Чем сильнее выражены неметаллические свойства элемента, тем
более кислотный характер имеет его оксид.
1) верно только А
2) верно только Б
3) верны оба суждения
А. В периоде с увеличением зарядов атомных ядер происходит
усиление неметаллических свойств элементов.
Б. В главной подгруппе с увеличением зарядов атомных ядер
происходит ослабление кислотных свойств гидроксидов.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
29. Кислотные свойства наиболее выражены у высшего гидроксида
2) фосфора
3) мышьяка
30. Только восстановительные свойства азот проявляет в соединении
Ответы: 1-1, 2-4, 3-4, 4-3, 5-2, 6-2, 7-1, 8-1, 9-1, 10-3, 11-2, 12-4, 13-1, 14-4, 15-1, 16-4, 17-1, 18-4, 19-4, 20-1, 21-2, 22-3, 23-1, 24-4, 25-1, 26-3, 27-2, 28-3, 29-1, 30-2.
Химических элементов-неметаллов всего 16, но два из них, кислород и кремний составляют 76 % от массы земной коры. Неметаллы составляют 98,5 % от массы растений и 97,6 % от массы человека. Из углерода, водорода, кислорода, серы, фосфора и азота состоят все важнейшие органические вещества, они являются элементами жизни. Водород и гелий – основные элементы Вселенной из них состоят все космические объекты, включая наше Солнце.
Неметаллы – это химические элементы, атомы которых принимают электроны для завершения внешнего энергетического уровня, образуя при этом отрицательно заряженные ионы. Практически все неметаллы имеют сравнительно малые радиусы и большое число электронов на внешнем энергетическом уровне от 4 до 7, для них характерны высокие значения электроотрицательности и окислительные свойства.
Если в Периодической системе провести диагональ от бериллия к астату, то справа вверх по диагонали будут находиться элементы-неметаллы, а слева снизу – металлы, к ним же относятся элементы всех побочных подгрупп, лантаноиды и актиноиды. Элементы, расположенные вблизи диагонали, например, бериллий, алюминий, титан, германий, сурьма, обладают двойственным характером и относятся к металлоидам. Элементы 18 группы – инертные газы, имеют полностью завершенный внешний электронный слой, их иногда относят к неметаллам, но формально, по физическим признакам.
Элементы, расположенные вблизи диагонали, например, бериллий, алюминий, титан, германий, сурьма, обладают двойственным характером и относятся к металлоидам. Элементы 18 группы – инертные газы, имеют полностью завершенный внешний электронный слой, их иногда относят к неметаллам, но формально, по физическим признакам.
Электронные конфигурации валентных электронов элементов-неметаллов приведены в таблице:
Закономерности в изменении свойств элементов-неметаллов
В периоде с ростом заряда ядра (слева направо):
- радиус атома уменьшается,
- число электронов на внешнем энергетическом уровне увеличивается,
- электроотрицательность увеличивается,
- окислительные свойства усиливаются,
- неметаллические свойства усиливаются.
В группе с ростом заряда ядра (сверху вниз):
- радиус атома увеличивается,
- число электронов на внешнем энергетическом уровне не изменяется,
- электроотрицательность уменьшается,
- окислительные свойства ослабевают,
- неметаллические свойства ослабевают.
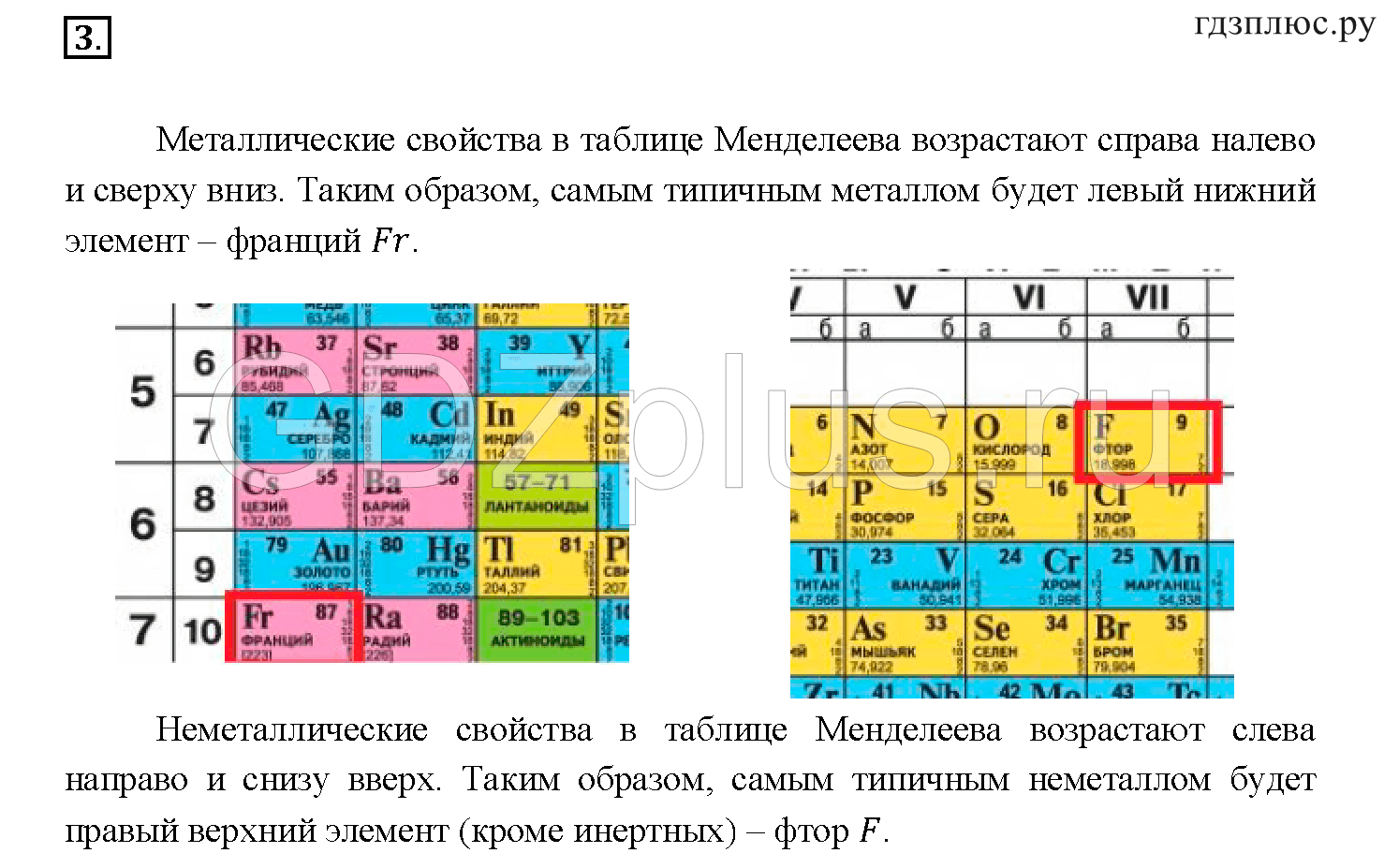
Таким образом, чем правее и выше стоит элемент в Периодической системе, тем ярче выражены его неметаллические свойства.
Неметаллами в главной подгруппе IV группы Периодической системы Д.И. Менделеева являются углерод и кремний. На внешнем энергетическом уровне этих элементов находятся 4 электрона (ns 2 np 2). В своих неорганических соединениях углерод имеет степень окисления +2 (в невозбужденном состоянии) и +4 (в возбужденном состоянии). В органических соединениях степень окисления углерода может быть любой от –4 до +4.
Для кремния наиболее устойчива степень окисления +4. Углерод и кремний образуют кислотные оксиды общей формулы ЭО 2 , а также летучие водородные соединения общей формулы ЭН 4 .
Неметаллами в V группе главной подгруппе Периодической системы Д.И. Менделеева являются азот, фосфор, мышьяк. На внешнем энергетическом уровне этих элементов находятся пять электронов: ns 2 np 3 . Азот в своих соединениях может проявлять степени окисления –3, –2, +1, +2, +3, +4, +5.
Для фосфора характерны степени окисления –3, +3, +5. Поскольку атом азота не имеет d-подуровня, он не может быть пятивалентным, но способен образовывать четвертую ковалентную связь по донорно-акцепторному механизму. С увеличением порядкового номера внутри подгруппы увеличиваются радиусы атомов и ионов, уменьшается энергия ионизации. Происходит ослабление неметаллических свойств и усиление металлических.
С кислородом элементы главной подгруппы V группы образуют высшие оксиды состава R 2 O 5 . Все они являются кислотными оксидами. С водородом азот, фосфор и мышьяк образуют летучие газообразные соединения состава ЭН 3 .
Неметаллами главной подгруппы VI группы Периодической системы Д.И. Менделеева являются кислород, сера, селен и теллур. Конфигурация внешнего электронного уровня этих элементов ns 2 np 4 . В своих соединениях они проявляют наиболее характерные степени окисления –2, +4, +6 (кроме кислорода). С возрастанием порядкового номера в пределах подгруппы уменьшается энергия ионизации, увеличиваются размеры атомов и ионов, ослабляются неметаллические признаки элементов и нарастают металлические. Сера и селен образуют высшие оксиды типа RO 3 . Эти соединения являются типичными кислотными оксидами, которым соответствуют сильные кислоты типа H 2 RO 4 . Для неметаллов главной подгруппы VI группы характерны летучие водородные соединения общей формулой H 2 R. При этом полярность и прочность связи ослабевает от H 2 O к H 2 Te. Все водородные соединения, кроме воды, являются газообразными веществами. Водные растворы H 2 S, H 2 Se, H 2 Te являются слабыми кислотами.
Сера и селен образуют высшие оксиды типа RO 3 . Эти соединения являются типичными кислотными оксидами, которым соответствуют сильные кислоты типа H 2 RO 4 . Для неметаллов главной подгруппы VI группы характерны летучие водородные соединения общей формулой H 2 R. При этом полярность и прочность связи ослабевает от H 2 O к H 2 Te. Все водородные соединения, кроме воды, являются газообразными веществами. Водные растворы H 2 S, H 2 Se, H 2 Te являются слабыми кислотами.
Элементы VII группы главной подгруппы — фтор, хлор, бром, иод являются типичными неметаллами. Групповое название этих элементов — галогены от греческого halos — соль и genes — рождающий. Конфигурация внешнего электронного уровня этих галогенов ns 2 np 5 . Наиболее характерная степень окисления галогенов –1. Кроме того, хлор, бром и иод могут проявлять степени окисления + 3, + 5, + 7. В пределах каждого периода галогены — наиболее электроотрицательные элементы. Внутри подгруппы при переходе от фтора к астату происходит увеличение радиуса атома, неметаллические свойства уменьшаются, происходит уменьшение окислительных и увеличение восстановительных свойств. Все галогены образуют простые вещества — двухатомные молекулы Hal 2 . Фтор — самый электроотрицательный из химических элементов. Во всех своих соединениях имеет степени окисления –1. Высшие оксиды галогенов (кроме фтора) имеют общую формулу R 2 O 7 , являются кислотными оксидами. Им соответствуют сильные кислоты общей формулы HRO 4 (R = Cl, Br). Водородные соединения галогенов — галогеноводороды имеют общую формулу HHal. Их водные растворы являются кислотами, сила которых возрастает от HF к HI. Для галогенов существует закономерность: каждый предыдущий галоген способен вытеснять последующий из его соединений с металлами и водородом, например: Cl 2 + 2KBr = 2KCl + Br 2 .
Все галогены образуют простые вещества — двухатомные молекулы Hal 2 . Фтор — самый электроотрицательный из химических элементов. Во всех своих соединениях имеет степени окисления –1. Высшие оксиды галогенов (кроме фтора) имеют общую формулу R 2 O 7 , являются кислотными оксидами. Им соответствуют сильные кислоты общей формулы HRO 4 (R = Cl, Br). Водородные соединения галогенов — галогеноводороды имеют общую формулу HHal. Их водные растворы являются кислотами, сила которых возрастает от HF к HI. Для галогенов существует закономерность: каждый предыдущий галоген способен вытеснять последующий из его соединений с металлами и водородом, например: Cl 2 + 2KBr = 2KCl + Br 2 .
Периодическая таблица Дмитрия Ивановича Менделеева очень удобна и универсальна в своём использовании. По ней можно определить некоторые характеристики элементов, и что самое удивительное, предсказать некоторые свойства ещё неоткрытых, не обнаруженных учёными, химических элементов (например, мы знаем некоторые свойства предполагаемого унбигексия, хотя его ещё не открыли и не синтезировали).
Что такое металлические и неметаллические свойства
Эти свойства зависят от способности элемента отдавать или притягивать к себе электроны. Важно запомнить одно правило, металлы – отдают электроны, а неметаллы – принимают. Соответственно металлические свойства – это способность определённого химического элемента отдавать свои электроны (с внешнего электронного облака) другому химическому элементу. Для неметаллов всё в точности наоборот. Чем легче неметалл принимает электроны, тем выше его неметаллические свойства.
Металлы никогда не примут электроны другого химического элемента. Такое характерно для следующих элементов;
- натрия;
- калия;
- лития;
- франция и так далее.
С неметаллами дела обстоят похожим образом. Фтор больше всех остальных неметаллов проявляет свои свойства, он может только притянуть к себе частицы другого элемента, но ни при каких условиях не отдаст свои. Он обладает наибольшими неметаллическими свойствами . Кислород (по своим характеристикам) идёт сразу же после фтора. Кислород может образовывать соединение с фтором, отдавая свои электроны, но у других элементов он забирает отрицательные частицы.
Кислород (по своим характеристикам) идёт сразу же после фтора. Кислород может образовывать соединение с фтором, отдавая свои электроны, но у других элементов он забирает отрицательные частицы.
Список неметаллов с наиболее выраженными характеристиками:
- фтор;
- кислород;
- азот;
- хлор;
- бром.
Неметаллические и металлические свойства объясняются тем, что все химические вещества стремятся завершить свой энергетический уровень. Для этого на последнем электронном уровне должно быть 8 электронов. У атома фтора на последней электронной оболочке 7 электронов, стремясь завершить ее, он притягивает ещё один электрон. У атома натрия на внешней оболочке один электрон, чтобы получить 8, ему проще отдать 1, и на последнем уровне окажется 8 отрицательно заряженных частиц.
Благородные газы не взаимодействуют с другими веществами именно из-за того, что у них завершён энергетический уровень, им не нужно ни притягивать, ни отдавать электроны.
Как изменяются металлические свойства в периодической системе
Периодическая таблица Менделеева состоит из групп и периодов. Периоды располагаются по горизонтали таким образом, что первый период включает в себя: литий, бериллий, бор, углерод, азот, кислород и так далее. Химические элементы располагаются строго по увеличению порядкового номера.
Группы располагаются по вертикали таким образом, что первая группа включает в себя: литий, натрий, калий, медь, рубидий, серебро и так далее. Номер группы указывает на количество отрицательных частиц на внешнем уровне определённого химического элемента. В то время, как номер периода указывает на количество электронных облаков.
Металлические свойства усиливаются в ряду справа налево или, по-другому, ослабевают в периоде. То есть магний обладает большими металлическими свойствами, чем алюминий, но меньшими, нежели натрий. Это происходит потому, что в периоде количество электронов на внешней оболочке увеличивается, следовательно, химическому элементу сложнее отдавать свои электроны.
В группе все наоборот, металлические свойства усиливаются в ряду сверху вниз. Например, калий проявляется сильнее, чем медь, но слабее, нежели натрий. Объяснение этому очень простое, в группе увеличивается количество электронных оболочек, а чем дальше электрон находится от ядра, тем проще элементу его отдать. Сила притяжения между ядром атома и электроном в первой оболочке больше, чем между ядром и электроном в 4 оболочке.
Сравним два элемента – кальций и барий. Барий в периодической системе стоит ниже, чем кальций. А это значит, что электроны с внешней оболочки кальция расположены ближе к ядру, следовательно, они лучше притягиваются, чем у бария.
Сложнее сравнивать элементы, которые находятся в разных группах и периодах. Возьмём, к примеру, кальций и рубидий. Рубидий будет лучше отдавать отрицательные частицы, чем кальций. Так как он стоит ниже и левее. Но пользуясь только таблицей Менделеева нельзя однозначно ответить на этот вопрос сравнивая магний и скандий (так как один элемент ниже и правее, а другой выше и левее). Для сравнения этих элементов понадобятся специальные таблицы (например, электрохимический ряд напряжений металлов).
Для сравнения этих элементов понадобятся специальные таблицы (например, электрохимический ряд напряжений металлов).
Как изменяются неметаллические свойства в периодической системе
Неметаллические свойства в периодической системе Менделеева изменяются с точностью до наоборот, нежели металлические. По сути, эти два признака являются антагонистами.
Усиливаются в периоде (в ряду справа налево). Например, сера способна меньше притягивать к себе электроны, чем хлор, но больше, нежели фосфор. Объяснение этому явлению такое же. Количество отрицательно заряженных частиц на внешнем слое увеличивается, и поэтому элементу легче закончить свой энергетический уровень.
Неметаллические свойства уменьшаются в ряду сверху вниз (в группе). Например, фосфор способен отдавать отрицательно заряженные частицы больше, чем азот, но при этом способен лучше притягивать, нежели мышьяк. Частицы фосфора притягиваются к ядру лучше, чем частицы мышьяка, что даёт ему преимущество окислителя в реакциях на понижение и повышение степени окисления (окислительно-восстановительные реакции).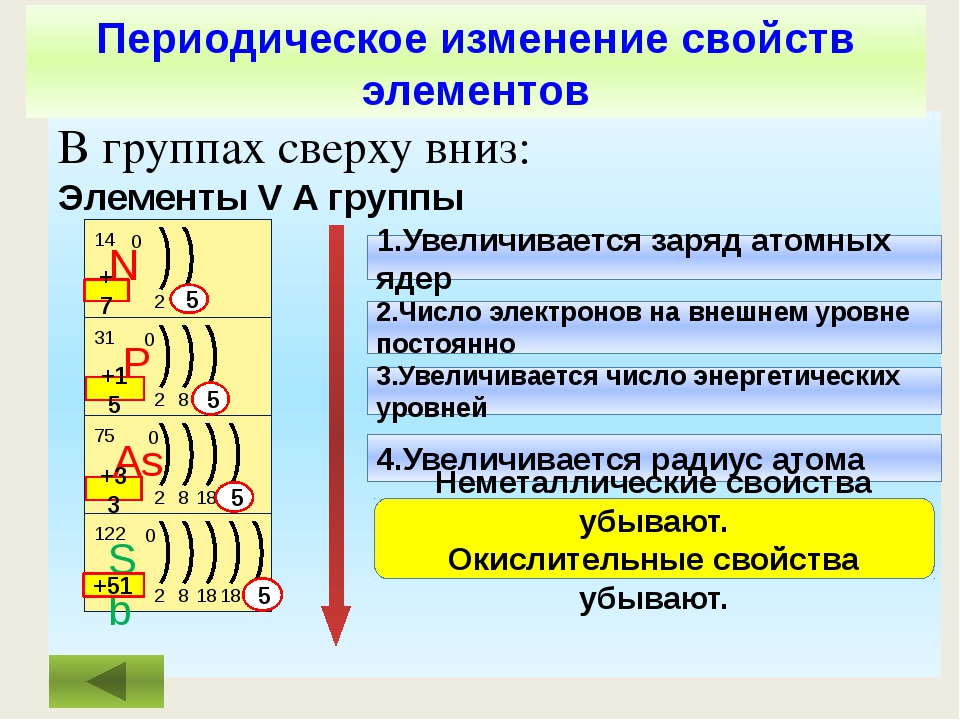
Сравним, к примеру, серу и мышьяк . Сера находится выше и правее, а это значит, что ей легче завершить свой энергетический уровень. Как и металлы, неметаллы сложно сравнивать, если они находятся в разных группах и периодах. Например, хлор и кислород. Один из этих элементов выше и левее, а другой ниже и правее. Для ответа придётся обратиться к таблице электроотрицательности неметаллов, из которой мы видим, что кислород легче притягивает к себе отрицательные частицы, нежели хлор.
Периодическая таблица Менделеева помогает узнать не только количество протонов в атоме, атомную массу и порядковый номер, но и помогает определить свойства элементов.
Видео
Видео поможет вам разобраться в закономерности свойств химических элементов и их соединений по периодам и группам.
Окислители и восстановители
Окислители и восстановители
Общие окислители и восстановители
Рассматривая окислительно-восстановительные реакции, мы можем сосредоточиться на роли, которую играет
конкретного реагента в химической реакции. Какова роль перманганат-иона в
следующая реакция, например?
Какова роль перманганат-иона в
следующая реакция, например?
2 MnO 4 — ( водный раствор ) + 5 H 2 C 2 O 4 ( водный раствор ) + 6 H + ( водный раствор ) 10 CO 2 ( г ) + 2 Mn 2+ ( водный раствор ) + 8 H л 09 0 O( 0 O)
В этой реакции щавелевая кислота окисляется до диоксида углерода, а ион перманганата восстанавливается до иона Mn 2+ .
| Окисление: | Н 2 С 2 О 4 | СО 2 | |||||
| +3 | +4 | ||||||
| Сокращение: | MnO 4 — | Мн 2+ | |||||
| +7 | +2 |
Перманганат-ион отбирает электроны у молекул щавелевой кислоты и тем самым окисляет
щавелевая кислота. Так, ион MnO 4 — действует как окислитель агент в этой реакции. Щавелевая кислота, с другой стороны, является восстановителем .
агент в этой реакции. Отдавая электроны, он восстанавливает MnO 4 — ион до Mn 2+ .
Так, ион MnO 4 — действует как окислитель агент в этой реакции. Щавелевая кислота, с другой стороны, является восстановителем .
агент в этой реакции. Отдавая электроны, он восстанавливает MnO 4 — ион до Mn 2+ .
Атомы, ионы и молекулы, обладающие необычно большим сродством к электронам, стремятся быть хорошими окислителями. Элементарный фтор, например, является сильнейшим окислитель.F 2 настолько хороший окислитель, что металлы, кварц, асбеста, и даже вода воспламенялась в его присутствии. Другие хорошие окислители включают O 2 , O 3 и Cl 2 , которые являются элементарными формами второй и третий по электроотрицательности элементы соответственно.
Другим местом, где следует искать хорошие окислители, являются соединения с необычно большим
степени окисления, такие как перманганат (MnO 4 — ), хромат (CrO 4 2-),
и дихромат (Cr 2 O 7 2- ) ионы, а также азотная кислота
(HNO 3 ), хлорная кислота (HClO 4 ) и серная кислота (H 2 SO 4 ). Эти соединения являются сильными окислителями, потому что элементы становятся более электроотрицательными.
по мере увеличения степеней окисления их атомов.
Эти соединения являются сильными окислителями, потому что элементы становятся более электроотрицательными.
по мере увеличения степеней окисления их атомов.
Хорошие восстановители включают активные металлы, такие как натрий, магний, алюминий, и цинк, которые имеют относительно небольшие энергии ионизации и низкую электроотрицательность. Гидриды металлов, такие как NaH, CaH 2 и LiAlH 4 , которые формально содержат ион Н — , также являются хорошими восстановителями.
Некоторые соединения могут действовать как окислители или восстановители. Один пример газообразный водород, который действует как окислитель при соединении с металлами и как восстановитель при взаимодействии с неметаллами.
| 2 Na( с ) + H 2 ( г ) 2 NaH( с ) |
| H 2 ( г ) + Cl 2 ( г ) 2 HCl( г ) |
Другим примером является перекись водорода, в которой атом кислорода находится в степени окисления -1. государство.Поскольку эта степень окисления находится между крайними значениями более распространенных 0 и -2.
степени окисления кислорода, H 2 O 2 может действовать как окислитель
агент или восстановитель.
государство.Поскольку эта степень окисления находится между крайними значениями более распространенных 0 и -2.
степени окисления кислорода, H 2 O 2 может действовать как окислитель
агент или восстановитель.
Относительная сила окислительных и Восстановители
Самопроизвольные окислительно-восстановительные реакции превращают более сильную пару окислительных агенты и более сильный из пары восстановителей в более слабый окислитель и более слабый восстановитель.Тот факт, что происходит, например, следующая реакция, предполагает что металлическая медь является более сильным восстановителем, чем металлическое серебро, и что Ag + ион является более сильным окислителем, чем ион Cu 2+ .
| Cu( с ) | + | 2 Ag + ( водный ) | Cu 2+ ( водный ) | + | 2 Ag( с ) | ||
| сильнее сокращение агент | сильнее окисляющий агент | слабее окисляющий агент | слабее сокращение агент |
На основе многих таких экспериментов, общие окислительно-восстановительные полуреакции
были организованы в виде таблицы, в которой самые сильные восстановители находятся на одном конце, а
самые сильные окислители находятся у другого, как показано в таблице ниже. От
по соглашению, все полуреакции записываются в сторону уменьшения.
Более того, по соглашению самые сильные восстановители обычно находятся в верхней части
Таблица.
От
по соглашению, все полуреакции записываются в сторону уменьшения.
Более того, по соглашению самые сильные восстановители обычно находятся в верхней части
Таблица.
Относительная сила обычных окислителей и восстановителей Агенты
К счастью, вам не нужно запоминать эти соглашения. Все, что вам нужно сделать, это помните, что активные металлы, такие как натрий и калий, отлично восстанавливают агентов и найдите эти записи в таблице.Самые сильные восстановители находятся в углу таблицы, где находятся металлические натрий и калий. перечислено.
| Практическая задача 9: Расположите следующее окислители и восстановители в порядке возрастания силы: Восстановители: Cl –, Cu, H 2 , H — , HF, Pb и Zn Окислители: Cr 3+ , Cr 2 O 7 2- , Cu 2+ , H + , O 2 , O 3 , и Na + Нажмите здесь, чтобы проверить свой ответ на вопрос «Практика»
Проблема 9. |
| Практическая задача 10: Прогноз должны ли протекать следующие окислительно-восстановительные реакции, как написано: (a) 2 Ag( s ) + S( s ) Ag 2 S( s ) (б) 2 Ag( s ) + Cu 2+ ( водный раствор ) 2 Ag + ( водный раствор ) + Cu( s ) (C) MNO 4 — ( AQ ) + 3 Fe 2+ ( AQ ) + 2 ч 2 o ( л ) MNO 2 ( с ) + 3 Fe 3+ ( водный раствор ) + 4 OH — ( водный раствор ) (d) MNO 4 — ( AQ ) + 5 Fe 2+ ( AQ ) + 8 H + ( AQ ) MN 2+ ( AQ ) + 5 Fe 3+ ( водный раствор ) + 4 H 2 O( l ) Нажмите здесь, чтобы проверить свой ответ на
Практическое задание 10. |
Окислительные и восстановительные свойства элементов третьего ряда: фактор, влияющий на
Наука > Химия > Элементы третьего ряда > Окисляющие и восстановительные свойства элементов третьего рядаВ этой статье мы обсудим тенденцию окислительных и восстановительных свойств элементов третьего ряда.
Окисление:
Процесс, при котором атом, молекула или ион теряют один или несколько электронов, называется окислением.Это также известно как деэлектронизация.
напр. Na → Na + + e –
При этом происходит окисление натрия.
Сокращение:
Процесс, в котором атом, молекула или ион приобретают один или несколько электронов, называется восстановлением. Он также известен как электронизация.
напр.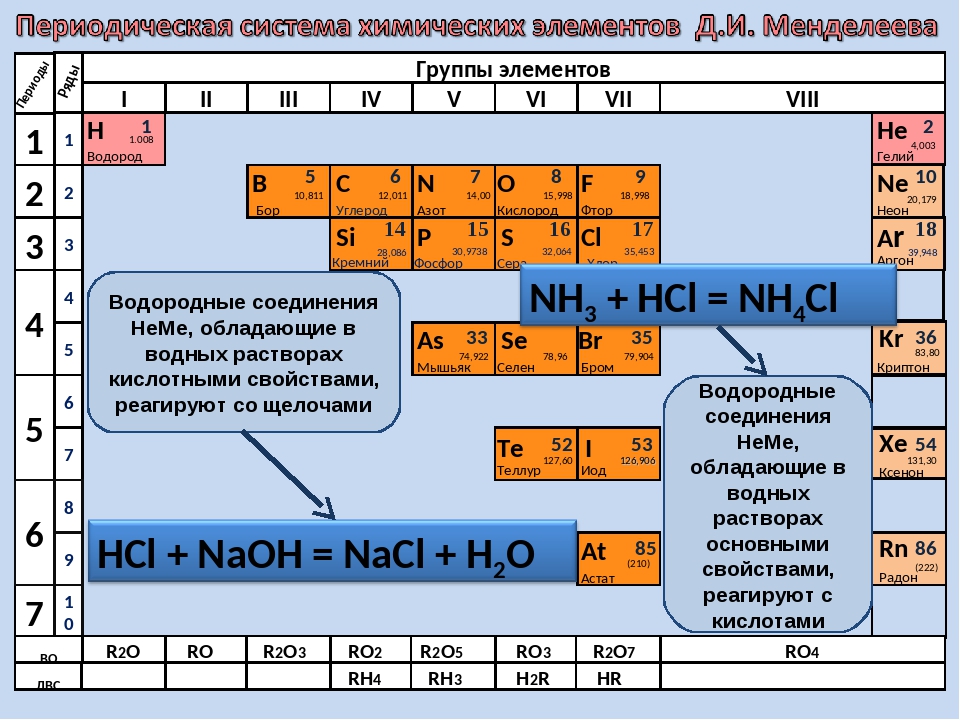 CI + e – → Cl –
CI + e – → Cl –
В данном случае происходит восстановление хлора.
Восстановитель:
Вещество (атом, молекула или ион), которое заставляет другое вещество принимать электроны, а само окисляется, теряя электроны, называется восстановителем. Восстановитель является донором электронов. например Na, Al, Mg и т. д.
Окислитель:
Вещество (атом, молекула или ион), которое заставляет другое вещество терять электроны, а само восстанавливается, принимая электроны, называется окислителем.Окислитель представляет собой акцептор электронов, например Cl, F, Br, O и т. д.
Уменьшение свойства:
Тенденция элемента терять электроны называется его восстановительным свойством. В силу этого свойства само вещество подвергается окислению.
Окисляющие свойства:
Тенденция элемента к присоединению электронов называется его окислительным свойством. В силу этого свойства само вещество подвергается восстановлению.
В силу этого свойства само вещество подвергается восстановлению.
Факторы, влияющие на окислительные и восстановительные свойства:
- Потенциал ионизации
- Электроположительность или электроотрицательность
- Размер атома
- Металлический и неметаллический характер
- Число валентных электронов
Тенденция к окислению и восстановлению8 Научные причины: По мере движения слева направо i.е. от натрия к хлору в третьем ряду окислительная способность увеличивается, а восстановительная способность уменьшается. Окислительная и восстановительная способности элементов зависят от размера атома, энтальпии ионизации, электроположительного и электроотрицательного характера и количества валентных электронов. Те элементы, которые имеют больший размер атома, более низкую энтальпию ионизации и мало валентных электронов, склонны отдавать электроны и, следовательно, являются восстановителями. Следовательно, натрий, магний, алюминий являются восстановителями. Те элементы, которые имеют большую энтальпию ионизации, меньший атомный размер и большее количество валентных электронов, склонны принимать электроны и, следовательно, являются окислителями. Следовательно, хлор является окислителем. Замечено, что по мере движения слева направо по третьему периоду размер атома постепенно уменьшается, энтальпия ионизации увеличивается, а число валентных электронов увеличивается. Следовательно, склонность элементов к отдаче электронов продолжает уменьшаться, а склонность элементов к присоединению электронов — к возрастанию. Натрий, магний и алюминий являются хорошими восстановителями. Окислительная и восстановительная способность элементов зависит от размера атома, энтальпии ионизации, электроположительного и электроотрицательного характера и числа валентных электронов. Атомные номера натрия, магния и алюминия равны 11, 12 и 13 соответственно.Они имеют 1, 2 и 3 валентных электрона соответственно. Таким образом, удаление 1, 2, 3 электронов из натрия, магния, алюминия соответственно дало бы стабильную конфигурацию инертного газа неона. По сравнению с другими элементами третьего ряда эти элементы имеют большие размеры атомов и более низкие потенциалы ионизации. Следовательно, они легко теряют свои валентные электроны и, таким образом, являются сильными восстановителями. Натрий является сильнейшим восстановителем. Окислительная и восстановительная способность элементов зависит от размера атома, энтальпии ионизации, электроположительного и электроотрицательного характера и числа валентных электронов. Атомный номер натрия 11. Он состоит из одного неспаренного электрона (3s 1 ). Таким образом, удаление 1 валентного электрона дало бы натрию стабильную конфигурацию инертного газа неона. Натрий имеет самый большой атомный размер среди элементов третьего ряда и самый низкий потенциал ионизации среди элементов третьего ряда.Следовательно, натрий легко теряет свой валентный электрон и, таким образом, является сильнейшим восстановителем. Na → Na + + e – Кремний, фосфор и сера являются слабыми восстановителями. Окислительная и восстановительная способность элементов зависит от размера атома, энтальпии ионизации, электроположительного и электроотрицательного характера и числа валентных электронов. Атомные номера кремния, фосфора и серы равны 14, 15 и 16 соответственно.У них 4, 5 и 6 валентных электронов соответственно. Они имеют сравнительно меньший размер атома и более высокий потенциал ионизации. Следовательно, они проявляют меньшую склонность к потере своих валентных электронов. Они менее электроположительны. Следовательно, они являются слабыми восстановителями. Они действуют как слабые восстановители при обработке сильными окислителями, такими как фтор. Они также действуют как слабый окислитель с сильными восстановителями, такими как натрий. Хлор является самым сильным окислителем в элементах третьего ряда. Окислительная и восстановительная способность элементов зависит от размера атома, энтальпии ионизации, электроположительного и электроотрицательного характера и числа валентных электронов. Хлор имеет высокую электроотрицательность. Атомный номер хлора 17. Он состоит из семи электронов на валентной оболочке. Хлор имеет наименьший атомный размер среди третьих низших элементов. Хлор имеет очень высокий потенциал ионизации и очень высокое сродство к электрону. Следовательно, он имеет сильную тенденцию к присоединению электрона и является сильно электроотрицательным. Следовательно, хлор является сильным окислителем. CI + e – → Cl – Аргон не является ни окислителем, ни восстановителем. Окислительная и восстановительная способность элементов зависит от размера атома, энтальпии ионизации, электроположительного и электроотрицательного характера и числа валентных электронов. Аргон не является ни электроположительным, ни электроотрицательным элементом. Атомный номер аргона 18. Он состоит из восьми электронов на валентной оболочке. Таким образом, он завершил октет. Аргон имеет очень высокую энтальпию ионизации. Следовательно, он имеет сильную тенденцию не приобретать и не терять электроны. Следовательно, аргон не является ни окислителем, ни восстановителем. Наука > Химия > Элементы третьего ряда > Окислительно-восстановительные свойства элементов третьего ряда 272 A.-К. Чжан и др. 31. Сюн, Ю. Дж.; Васио, И.; Чен, JY; Кай, HG; Ли, ZY; Ся, Ю. Н. «Поли(винилпирролидон): Двухфункциональный восстановитель и стабилизатор для легкого синтеза нанопластин благородных металлов в водных растворах », Langmuir 2006, 22, 8563–8570. 32. Васио, И.; Сюн, YJ; Инь, Ю.Д.; Ся, Ю. Н. «Восстановление концевыми группами поли(винил пирролидона): новый и универсальный путь к кинетически контролируемому синтезу треугольных нанопластин Ag », Adv. 33. Кемаль, Л.; Цзян, XC; Вонг, К.; Ю. А. Б. «Экспериментальное и теоретическое исследование наночастиц золота, контролируемых поли(винил пирролидоном)», J. Phys. хим. C 2008, 112, 15656–15664. 34. Пардинас-Бланко, И.; Хоппе, CE; Пинейро-Редондо, Ю.; Лопес-Кинтела, Массачусетс; Ривас, Дж. «Формирование золотых разветвленных пластин в разбавленных растворах поли(винилпирролидона) и их использование для изготовления пленок и покрытий, поглощающих ближний инфракрасный диапазон», Langmuir 2008, 24, 983– 990. 35. Лим, Б.; Камарго, PHC; Ся, Ю. Н. «Механистическое исследование синтеза полюсов, нанокитов и микропластин Au nanotad- путем восстановления водного HAuCl4 поли(винилпирролидоном)», Langmuir 2008, 24, 10437–10442. 36. Дэн, З. В.; Чен, М .; Ву, Л. М. «Новый метод изготовления композитных сфер SiO2/Ag и их каталитические свойства комбинационного рассеяния с улучшенной поверхностью», J. 11692–11698. 37.Шан, Г .; Хао, Х .; Ван, X .; Шан, З .; Чен, Ю .; Лю, Ю. «Влияние ПВП на формирование и оптические свойства нанокомпозитов ZnO/Ag», Colloids Surf. А 2012, 405, 1–5. 38. Чжан З.; Сюй, Ф.Г.; Ян, WS; Го, М.Ю.; Ван, XD; Жанга, Б.Л.; Тан, Дж. Л. «Легкий однореакторный метод для получения высококачественных композитных нанолистов Ag-графен для эффективного поверхностного усиленного комбинационного рассеяния», Chem. коммун. 2011, 47, 6440–6442. 39. Хуанг, Х.ЧАС.; Ni, Х.П.; Лой, Г.Л.; Чу, CH; Тан, К.Л.; Ло, ФК; Дэн, Дж. Ф.; Xu, G. Q. «Фотохимическое образование наночастиц серебра в поли(N-винилпирролидоне)», Langmuir 1996, 12, 909–912. 40. Луо, К.С.; Чжан, Ю.Х.; Цзэн, XW; Цзэн, YW; Ван, Ю. Г. «Роль поли(этиленгликоля ) в формировании наночастиц серебра», J. Colloid Interface Sci. 2005, 288, 444–448. 41. Ивамото, М.; Курода, К.; Запоройченко, В.; Хаяси, С. довольно простым способом», Eur. физ. JD 2003, 24, 365–367. 42. Варшавский, А.; Калир, Р .; Деше, А .; Берковиц, Х .; Пачорник А. «Полимерные псевдокраун эфиры.1. синтез и комплексообразование с анионами переходных металлов», J. Am. хим. соц. 1979, 101, 4249–4258. 43. Воронов А.; Кохут, А .; Васильев, С .; Peukert, W. «Механизм восстановления ионов серебра в концентрированных растворах амфифильных обратимых полиэфиров в неполярном растворителе при комнатной температуре», Langmuir 2008, 24, 12587–12594. 44. Лонгенбергер, Л.; Миллс, Г. «Формирование металлических частиц в водных растворах в результате реакций комплексов металлов с полимерами», J. Phys. хим. 1995, 99, 475–478. 45. Хан, В.; Лю, Н .; Лю, К.; Jin, Z.L. «Безлигандная реакция Хека, катализируемая in situ- , генерируемыми наночастицами палладия в ПЭГ-400», Китай. хим. лат. 46. Чжан, Л. З.; Ю, Дж. К.; Йип, Х.Ю.; Ли, В.; Квонг, KW; Сюй, AW; Вонг, П. К. «Стратегия уменьшения окружающего света для синтеза наночастиц серебра и покрытого серебром TiO2 с повышенной фотокаталитической и бактерицидной активностью », Langmuir 2003, 19, 10372–10380. 47. Хуан З.Ю.; Миллс, Г.; Хайек, Б. «Спонтанное образование частиц серебра в основном 2- пропаноле», J. Phys. хим. 1993, 97, 11542–11550. 48. Сардар Р.; Парк, JW; Шумейкер-Парри, Дж. С. «Полимер-индуцированный синтез стабильных наночастиц золота и серебра ver и последующий обмен лигандами в воде», Langmuir 2007, 23, 11883–11889. 49. Чжан, К. Х.; Рен, QQ; Мяо, YQ; Юань, JH; Ван, К.К.; Ли, Ф. Х.; Хан, Д. Х.; Ниу, Л. «Одностадийный синтез нанокомпозитов графен/полиаллиламин-золото и их электрокатализ в направлении восстановления кислорода», Таланта 2012, 89, 391–395. 50. Хебейш, А.; Эль-Шафей, А .; Шараф, С.; Zaghloul, S. наночастиц серебра в области отделки хлопка», Carbohydr. Полим. 2011, 84, 605–613. Загружено [Fudan University], [Meng Chen] в 18:39, 18 апреля 2013 г. Механические свойства металлических деталей, обработанных SLM, сильно зависят от микроструктуры и относительной плотности деталей.Как и в отливках, прочность, пластичность и усталостная долговечность деталей, обработанных SLM, снижаются с увеличением пористости, особенно когда размер и доля пор превышают критические значения. В целом, механические свойства металлических деталей, обработанных SLM, при нагрузке перпендикулярно плоскости слоя ниже, чем при нагрузке параллельно плоскости сборки. Не сообщалось о значительном влиянии ориентации сборки на прочность алюминиевых образцов, обработанных SLM [67,109]. Пластичность образцов, обработанных СЛП, ниже при нагружении параллельно направлению наращивания, чем при нагружении перпендикулярно направлению наращивания [23], что объясняется: в образцах, ориентированных на растяжение z [110] Эффект концентрации напряжений, вызванный тем, что направление нагрузки перпендикулярно ориентации плоских дефектов (несплавление) [80, 100], как показано на рис. .2.9(а) Рисунок 2.9. Связь направления нагрузки с ориентацией плоских дефектов, показывающая нагрузку вдоль оси вертикально построенных (а) и горизонтально построенных (б) образцов [100]. Эффект текстуры [111] Интерфейсы дорожек и слоев [111]. Увеличение предела текучести и предела прочности при растяжении с увеличением скорости сканирования при СЛП сплава NiCr объясняется ростом столбчатых зерен [64]. Как деформация при разрушении, так и прочность (предел текучести и предел прочности при растяжении) образцов cpTi, изготовленных методом SLM при той же плотности энергии, увеличиваются с увеличением мощности лазера и скорости лазерного сканирования. Первое связано с более плотными деталями, а второе — с измельчением зерна и формированием мартенситной α’-структуры. В целом, прочность (предел текучести и предел прочности при растяжении) алюминиевых сплавов, титановых сплавов и образцов из нержавеющей стали 316L, обработанных SLM, выше или сравнима с прочностью, обработанной традиционными производственными процессами (например, ковка, литье), в основном из-за утонченной и метастабильной микроструктуры; однако пластичность металлических образцов, обработанных SLM, хуже [79–81, 109, 112, 113]. Сообщается о большом разбросе механических свойств, что объясняется дефектами в металлических образцах, обработанных СЛП [7,95]. Как предел текучести, так и предел прочности при растяжении ниже, а пластичность выше или аналогична в образцах из инконеля 718, изготовленных методом SLM, по сравнению с образцами из состаренных деформируемых образцов [61, 69, 114, 115]. Это связано с выделением хрупкой фазы Лавеса в междендритные области и отсутствие упрочняющего действия преципитатов γ ″ и γ ′ в образцах, обработанных СЛП [115]. Более грубая микроструктура наблюдалась на границах слоев и дорожек в алюминиевых сплавах, обработанных SLM [65, 67, 84, 93, 111], из-за более медленной скорости затвердевания и локальной частичной термообработки зоны переплава.Хрупкие и более крупные Si-фазы на границах слоев снижают пластичность, когда нагружение происходит вертикально к плоскости слоя [111]. Ориентация плоских дефектов также играет важную роль в анизотропии ударной вязкости [116]; более низкая ударная вязкость в вертикально построенных образцах объясняется уменьшением несущего поперечного сечения. Если слои хорошо связаны без наличия направленных дефектов на границах слоев, на вязкость разрушения не влияет ориентация сборки по отношению к направлению нагрузки [117]. Характеристики деталей, обработанных SLM, в условиях усталости также сильно зависят от дефектов и остаточных напряжений в деталях [95, 99, 118], температуры предварительного нагрева листа [119] и ориентации сборки [118, 119]. Усталостная долговечность образцов, изготовленных из SLS-/SLM, больше, когда направление нагрузки перпендикулярно направлению сборки. Растрескивание во время испытаний на усталость начинается с округлого углубления, когда нерасплавленная частица порошка прикрепляется к исходной поверхности [112] или дефекта (особенно дефекта несплавления) на подповерхностном уровне [99].Сообщалось, что растрескивание инициируется порами диаметром более 50 мкм, расположенными в пределах 250 мкм от внешней поверхности при циклическом нагружении [7]. Превосходная усталостная долговечность и сочетание прочности и пластичности были достигнуты в образцах Ti6Al4V, обработанных SLM, с ультратонкой пластинчатой α + β микроструктурой, которая получена в результате разложения игольчатого мартенсита на месте α ′ в SLM с соответствующим подводом энергии [82,120]. Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт. Существует множество причин, по которым файл cookie не может быть установлен правильно. Ниже приведены наиболее распространенные причины: Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie
потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня. Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется. Как правило, в файле cookie может храниться только та информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, если вы не решите ввести его. Полный ответ: Примечание: Анализ широкоугольных Рентгенограммы (рис.1, кривая 1) показало, что стехиометрический ИПЭК, образованный эквимолярным количеством анионных и катионных полиэлектролитов, а именно пектина и ПЭИ, характеризуется ближним упорядочением при трансляции в пространстве фрагментов противоположно заряженных цепей макромолекул полиэлектролитов. Рис. 1 , ( 4) гидразин, ( 5 ) аскорбиновая кислота.{-1},$$ где λ – длина волны характеристического рентгеновского излучения ( λ = 1,54 Å для Cu K α излучений), равная 4,3 Å. Сорбция AgNO 3 ИПЭК с последующим образованием интерполиэлектролитных металлокомплексов (пектин–Ag + –ПЭИ) приводит к изменению дифракционной картины. Так, на дифрактограммах интенсивный диффузионный дифракционный максимум при 2 θ m ~ 11.2°, характеризующая структуру ИМК (кривая 2) 10 . В то же время аморфное гало, связанное со структурой ИПЭК, исчезает при 2 θ m ~ 20.8°. Это указывает на полное превращение интерполиэлектролитных комплексов в интерполиэлектролитные металлокомплексы в процессе адсорбции ионов серебра. Химическое восстановление ионов Ag + в интерполиэлектролитных металлокомплексах с использованием боргидрида натрия при мольном соотношении [BH 4 − ]:[Ag + ] = 3.0, который определен как оптимальный 10 , приводит к формированию нанокомпозита на основе ИПЭК и наночастиц Ag. Так, дифракционный максимум, характерный для структуры интерполиэлектролитных металлокомплексов, отсутствует при 2 θ м ~ 11,2° (рис. , где K — постоянная, связанная с формой кристаллитов (при неизвестной форме K = 0,9), а β — ширина на полувысоте синглетного дифракционного максимума дискретного типа. Показано, что для серебросодержащих нанокомпозитов, полученных восстановлением ионов серебра боргидридом натрия L ≈ 2,7 нм (рис. 1, кривая 3). Несколько иную структуру имеют серебросодержащие нанокомпозиты (пектин-Ag-ПЭИ), полученные химическим восстановлением ионов серебра как гидразином, так и аскорбиновой кислотой.В частности, средний размер кристаллитов наночастиц серебра в этих нанокомпозитах составляет L ≈ 3,2 нм (кривые 4–5 ). Для расчетов использовались дифракционные максимумы на 2 θ m = 38,2° и 43,8° (кривые 3–5 ). Анализ ПЭМ-изображений серебросодержащих нанокомпозитов, полученных химическим восстановлением ионов серебра с использованием различных восстановителей, показал, что наименьшие по размеру наночастицы образуются при восстановлении ионов серебра боргидридом натрия (3.8 нм), а наибольший размер – при использовании аскорбиновой кислоты (15,8 нм) (рис. 2). В то же время наиболее узкое распределение наночастиц Ag в полимерных матрицах по размерам наблюдается при применении гидразина. Таким образом, наши результаты показывают, что снижение окислительно-восстановительного потенциала восстановителя приводит к увеличению размера наночастиц. ПЭМ-изображения серебросодержащих нанокомпозитов, полученных с использованием различных восстановителей: ( a ) боргидрид натрия; ( b ) гидразин; ( c ) аскорбиновая кислота. Подробное распределение наночастиц по размерам представлено в таблице 1. Принимая во внимание структурно-морфологические особенности и специфику поведения серебросодержащих нанокомпозитов, важным было также исследование их термомеханических свойств. Анализ термомеханической кривой ИПЭК (рис. 3а, кривая 1) показывает, что температурные переходы, присущие температуре стеклования и температуре вязкого течения, находятся в интервалах 25–145 °С и 265–335 °С соответственно. .Кроме того, в интервале от 150 до 245 °С наблюдается температурный переход, обусловленный плавлением кристаллитов пектина в ИПЭК (кривые 1, 2 ) 2 . Термомеханические кривые а: ( 1 ) ИПЭК, ( 2 ) пектина и б: серебросодержащих нанокомпозитов, полученных с использованием (1) боргидрида натрия, (2) гидразина, (3) аскорбиновой кислота. Установлено, что термомеханическое поведение серебросодержащих нанокомпозитов в зависимости от типа восстановителя различно (рис. Термомеханическая кривая образца, полученного с аскорбиновой кислотой, в отличие от других, имеет несколько температур перехода: 44, 100, 115 и 180 °С (кривые 3). Переходы при температурах 44, 100 и 115 °С можно отнести к деструкции, кристаллизации и плавлению композиционной части, образующейся в результате присоединения избытка аскорбиновой кислоты к аминогруппе ПЭИ. Исследование частотной зависимости действительной части комплексной проводимости σ ac (f) показало, что ИПЭК проявляет диэлектрические свойства, а нанокомпозиты ИПЭК–Ag демонстрируют полупроводниковые свойства (рис. .4). Так, установлено, что значение σ ac увеличивается до 2–4 порядков при температуре окружающей среды при переходе от ИПЭК к нанокомпозитам ИПЭК–Ag. При повышенной температуре разница была значительно меньше (примерно на порядок или меньше). Высокое значение электропроводности при 20 °С наблюдалось у образца, полученного с NaBH 4 , но при повышенных температурах (80–100 °С) σ ac была выше у нанокомпозита, приготовленного с аскорбиновой кислотой (табл. Приведенные выше данные показывают, что проводимость увеличивается с температурой, и это может быть связано с увеличением подвижности цепей. Проверка антимикробных свойств разработанных нанокомпозитов ИПЭК-Ag показала, что они обладают высокой антимикробной активностью в отношении штаммов S. aureus и E. coli (рис. 5 и табл. 4) . После инкубации в течение 24 ч при 37°С фиксируется четкая зона по контуру пленки, свободная от микроорганизмов, что свидетельствует об ингибировании роста бактерий.В контрольных образцах (полимерная пленка без наночастиц) наблюдался активный рост исследуемых бактерий. Рисунок 5 ( б ).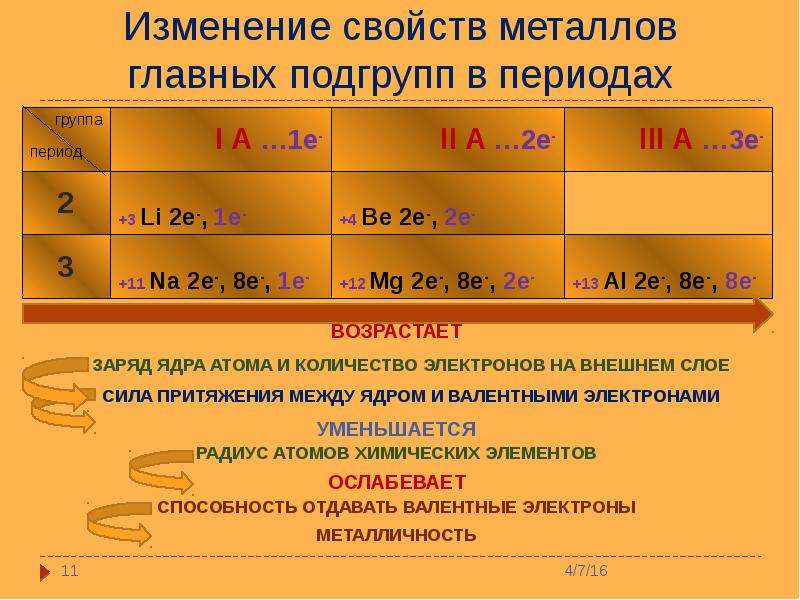
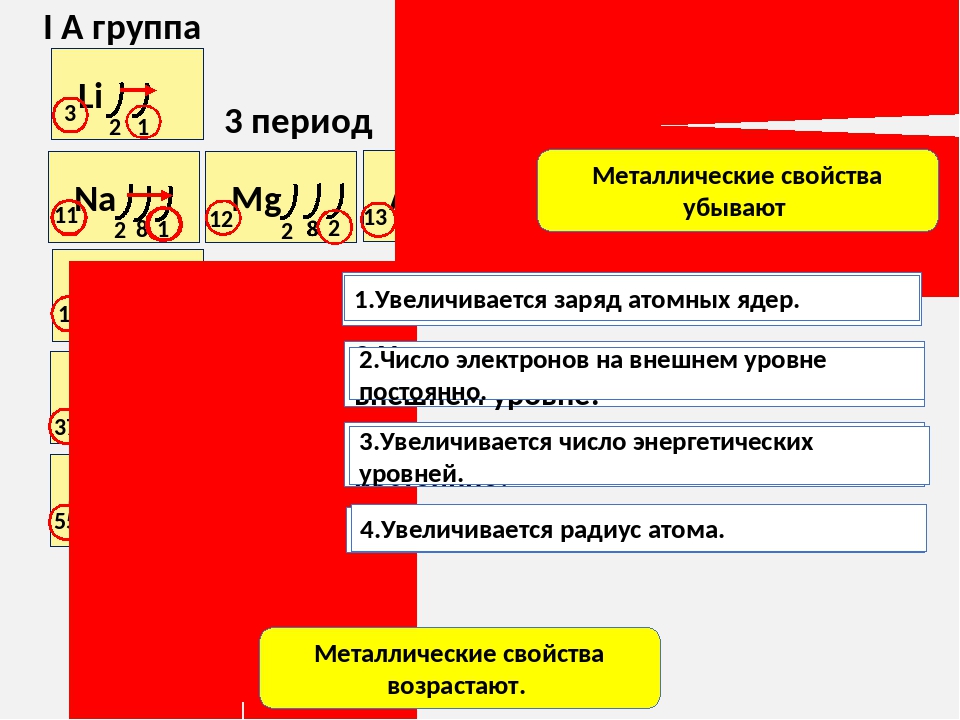 Следовательно, по мере того, как мы движемся слева направо, то есть от натрия к хлору по третьему ряду, окислительные свойства продолжают увеличиваться, а восстановительные — уменьшаться.
Следовательно, по мере того, как мы движемся слева направо, то есть от натрия к хлору по третьему ряду, окислительные свойства продолжают увеличиваться, а восстановительные — уменьшаться. Уменьшение прочности уменьшается на порядок. Na > Mg > Al.
Уменьшение прочности уменьшается на порядок. Na > Mg > Al.
 Требуется только один электрон, чтобы завершить свой октет и достичь стабильной электронной конфигурации аргона.
Требуется только один электрон, чтобы завершить свой октет и достичь стабильной электронной конфигурации аргона. s-орбиталь и p-орбитали полностью заполнены. Следовательно, он имеет стабильную электронную конфигурацию.
s-орбиталь и p-орбитали полностью заполнены. Следовательно, он имеет стабильную электронную конфигурацию. (PDF) Восстановительные свойства полимеров в синтезе наночастиц благородных металлов
 Матер. 2006, 18, 1745–1749.
Матер. 2006, 18, 1745–1749. Phys. хим. C 2007,111,
Phys. хим. C 2007,111, ; Faupel, F. «Производство полимерного композита наночастиц золота
; Faupel, F. «Производство полимерного композита наночастиц золота 2010, 21, 1411–1414.
2010, 21, 1411–1414. «Новые прекурсоры для зеленого синтеза и применение
«Новые прекурсоры для зеленого синтеза и применение Ductility — обзор | ScienceDirect Topics
2.5 Механические свойства металлических деталей, обработанных SLM

 На поведение при разрушении аддитивно изготовленных образцов значительное влияние оказывают неполностью расплавленные частицы и пористость [44].
На поведение при разрушении аддитивно изготовленных образцов значительное влияние оказывают неполностью расплавленные частицы и пористость [44].

Произошла ошибка при настройке пользовательского файла cookie

Настройка браузера на прием файлов cookie
 Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором. Почему этому сайту требуются файлы cookie?
Что сохраняется в файле cookie?
 Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к
остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к
остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать. Назовите неметалл, который проявляет восстанавливающие свойства. Химический класс 11 CBSE
Подсказка: Тенденция элемента терять электроны известна как его восстановительная способность. Из-за этого свойства элемент или вещество подвергается самоокислению, тогда как склонность элемента приобретать электроны известна как его окисляющее свойство, и из-за этого вещество подвергается самовосстановлению.
В современной периодической таблице, по мере того как мы движемся слева направо в периоде, окислительные свойства продолжают увеличиваться, тогда как восстановительные свойства уменьшаются в течение периода.Факторы, влияющие на окислительные и восстановительные свойства, следующие:
1. Ионизационный потенциал: Элементы с более высоким потенциалом ионизации имеют меньший размер атома и большее число валентных электронов, которые склонны принимать электроны и, таким образом, проявляют окислительные свойства.
2. Электроотрицательность: По мере того, как электроотрицательность увеличивается в течение периода, тенденция элемента приобретать электроны также увеличивается, что приводит к увеличению окислительной способности вещества.
3. Металлический и неметаллический характер: При постепенном уменьшении металлического характера элемента по периоду электроотрицательность элементов увеличивается.Таким образом, при уменьшении металличности снижается и восстановительная способность элементов.
Вот некоторые из распространенных примеров элементов, проявляющих восстановительные и окислительные свойства:
Восстанавливающие свойства. Металлы включают $Na$, $Fe$, $Zn$, а неметаллы включают $C$, $S$, $H$.
Окислительные свойства — $O$, $Cl$, $Br$
Таким образом, примером неметалла, который проявляет восстановительные свойства, является сера, поскольку она имеет пять электронов на своей валентной оболочке со сравнительно меньшим размером и более высоким потенциалом ионизации из-за склонность к потере электронов снижается, и, таким образом, сера проявляет восстановительные свойства.
Важно отметить, что элементы, принадлежащие к группе 18, т. е. инертные газы, не проявляют ни окислительных, ни восстановительных свойств из-за очень высоких энтальпий ионизации и полных октетов, они не имеют склонности терять или приобретать электроны. Влияние типа восстановителей ионов серебра в интерполиэлектролитных металлокомплексах на структуру, морфологию и свойства серебросодержащих нанокомпозитов
Особенности строения и морфологии серебросодержащих нанокомпозитов

 1, кривая 3), но два интенсивных максимума при 2 θ м = 38,2° и 43,8°, соответствующие кристаллографическим плоскостям гранецентрированной кубической решетки серебра с индексами Миллера (111) и (200) соответственно, подтверждают наличие металлического серебра в системе.{-1},$$
1, кривая 3), но два интенсивных максимума при 2 θ м = 38,2° и 43,8°, соответствующие кристаллографическим плоскостям гранецентрированной кубической решетки серебра с индексами Миллера (111) и (200) соответственно, подтверждают наличие металлического серебра в системе.{-1},$$

Термомеханическое поведение полимерной системы
 3б). В первую очередь это касается неожиданно высоких значений температуры стеклования для образца, полученного с N 2 H 4 . Тогда как другие композиты имели более низкие значения, что характерно для таких систем, поскольку наночастицы разрывают водородные связи и тем самым увеличивают подвижность полимерных цепей. Вероятным объяснением высокого значения T g может быть сшивание полимерной системы, что приводит к снижению подвижности цепей.Температурный переход в области 195–245 °С для нанокомпозитов, полученных с NaBH 4 и N 2 H 4 , обусловлен плавлением кристаллитов пектина в ИПЭК (кривые 1, 2 ) 2 .
3б). В первую очередь это касается неожиданно высоких значений температуры стеклования для образца, полученного с N 2 H 4 . Тогда как другие композиты имели более низкие значения, что характерно для таких систем, поскольку наночастицы разрывают водородные связи и тем самым увеличивают подвижность полимерных цепей. Вероятным объяснением высокого значения T g может быть сшивание полимерной системы, что приводит к снижению подвижности цепей.Температурный переход в области 195–245 °С для нанокомпозитов, полученных с NaBH 4 и N 2 H 4 , обусловлен плавлением кристаллитов пектина в ИПЭК (кривые 1, 2 ) 2 . В свою очередь, температурный переход в 180 °С связан с плавлением пектиновой части композита. Значения температурных переходов исследованных полимерных систем приведены в таблице 2.
В свою очередь, температурный переход в 180 °С связан с плавлением пектиновой части композита. Значения температурных переходов исследованных полимерных систем приведены в таблице 2. Электрические свойства полимерной системы
 3).Такое поведение объясняется разницей в температуре стеклования образцов. Рис. 4 ) и NaBH 4 ( 4 ) при T = 20 ± 2 °C.
3).Такое поведение объясняется разницей в температуре стеклования образцов. Рис. 4 ) и NaBH 4 ( 4 ) при T = 20 ± 2 °C. Антимикробные свойства полимерных систем