Количество вещества. Постоянная Авогадро. Молярная масса | Физика. Закон, формула, лекция, шпаргалка, шпора, доклад, ГДЗ, решебник, конспект, кратко
Отношение количества молекул N в данном теле к количеству атомов NA в 0,012 кг углерода называется количеством вещества:
v = N / NA;
N = vNA.
Количество молекул воды в 1г равняется: N = m / m0 = 1 • 10-3 кг / 30 • 10-27 кг ≈ 3,3 • 1022.
Количество вещества измеряется в молях или киломолях. 1 кмоль = 103 моль.
Моль — это такое количество вещества, которое содержит столько же атомов, молекул или других структурных элементов вещества, сколько атомов содержится в 0,012 кг углерода.
Количество атомов или молекул в 1 моле вещества называют
NA = 6,022045 • 1023 моль-1.
1 моль кислорода содержится в 32 г кислорода, 1 моль воды — в 18 г воды.
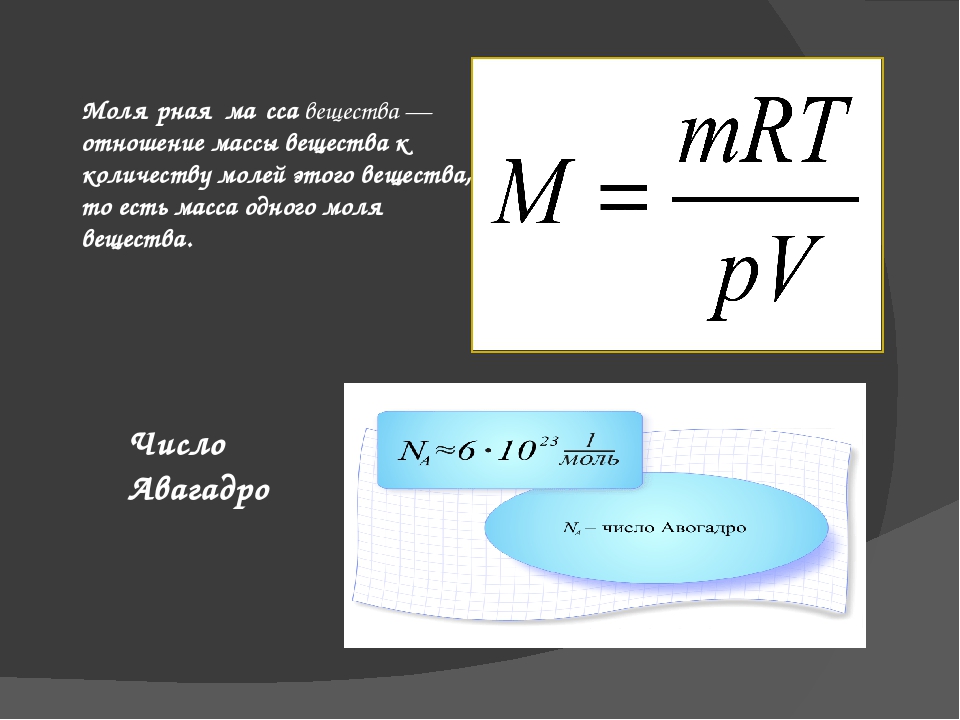
Массу 1 моля вещества называют молярной массой. Согласно определению в СИ она измеряется в кг/моль и равняется произведению массы молекулы на постоянную Авогадро:
M = m0 • NA.
Молярная масса связана с относительной молекулярной массой простым соотношением:
М = Мr г /моль = Мr • 10-3 кг/моль.
Молярная масса воды равна 18 г/моль, или 18 • 10-3 кг/моль
Масса т произвольного количества вещества v определяется из соотношения:
m = m0• N = v • m0 • NA = v • М. Материал с сайта http://worldofschool.ru
На основании формулы v = N / NAи этого соотношения можно получить формулу для расчета общего количества молекул в теле:
N = NA• m / M.
Следовательно, для измерения количества вещества молекулярная физика использует величины, которые упрощают расчеты соответствующих величин,— постоянную Авогадро,
Молекулярная физика доклад
Количество вещества.
 лекция
лекция
Как определяется количество вещества?
В каких единицах измеряется количество вещества?
Чему равен 1 моль?
Что такое молярная масса?
Как вычислить молярную массу для любого вещества?
Физика. 10 класс. Основы молекулярно-кинетической теории. Урок 2.
Физика. 10 класс.
Урок 2.
Размеры и масса молекул.
Свойства и поведение тел, в процессах
передачи и превращения энергии, определяются движением взаимодействующих друг
с другом частиц, из которых состоит тело: атомов, молекул и ионов. Каков размер
этих частиц? Как его измерить? Если высыпать горошины из стакана на стол, то
толщина образованного ими на столе слоя окажется равной диаметру горошины. Подобный
способ можно использовать для определения размеров частиц вещества. Конечно
же, реальная форма частиц вещества не шарообразная, а гораздо более сложная.
Но указанный способ позволяет, с известной точностью, оценить размеры частиц
вещества. Частицы в жидкости располагаются достаточно плотно (см. рисунок ниже).
Подобный
способ можно использовать для определения размеров частиц вещества. Конечно
же, реальная форма частиц вещества не шарообразная, а гораздо более сложная.
Но указанный способ позволяет, с известной точностью, оценить размеры частиц
вещества. Частицы в жидкости располагаются достаточно плотно (см. рисунок ниже).
Можно считать, что на каждую частицу вещества приходится объем, равный объему куба, сторона которого равна диаметру частицы. Тогда, зная плотность жидкости и диаметр частицы вещества, а стало быть, и объем частицы, можно оценить массу частицы вещества. Оценки размера и массы молекулы сделаны ниже на рисунках для капли нефти.
Рис. 7. Оценка размера молекулы. | Рис. 8. Оценка массы молекулы. |
В силу того, что массы частиц вещества
крайне малы, удобно пользоваться не абсолютными, а относительными единицами
массы.
 Количество вещества, постоянная Авогадро, молярная масса,
масса молекулы — эти величины связаны между собой соотношениями,
которые приведены ниже на рисунках.
Часто при решении той или иной задачи важнее знать не число частиц вещества,
а их концентрацию. Концентрация (n) показывает, сколько частиц содержится в
единице объема (чаще всего — в одном кубическом метре) данного вещества.
Ниже на рисунках приведены формулы для массы молекулы mo, молярной
массы M, количества вещества v, числа молекул N и концентрации молекул n. (V — объем вещества).
Количество вещества, постоянная Авогадро, молярная масса,
масса молекулы — эти величины связаны между собой соотношениями,
которые приведены ниже на рисунках.
Часто при решении той или иной задачи важнее знать не число частиц вещества,
а их концентрацию. Концентрация (n) показывает, сколько частиц содержится в
единице объема (чаще всего — в одном кубическом метре) данного вещества.
Ниже на рисунках приведены формулы для массы молекулы mo, молярной
массы M, количества вещества v, числа молекул N и концентрации молекул n. (V — объем вещества).Решите задачу 1. Найдите массу молекулы воды.
Решите задачу 1a. Сколько молекул содержится в 1 см3 воды?
Молекулярная физика — Физика — Теория, тесты, формулы и задачи
Оглавление:
Основные теоретические сведения
Основные положения МКТ
К оглавлению…
Молекулярно-кинетической теорией называют учение о строении и свойствах вещества на основе представления о существовании атомов и молекул как наименьших частиц химического вещества. В основе молекулярно-кинетической теории лежат три основных положения:
В основе молекулярно-кинетической теории лежат три основных положения:
- Все вещества – жидкие, твердые и газообразные – образованы из мельчайших частиц – молекул, которые сами состоят из атомов («элементарных молекул»). Молекулы химического вещества могут быть простыми и сложными и состоять из одного или нескольких атомов. Молекулы и атомы представляют собой электрически нейтральные частицы. При определенных условиях молекулы и атомы могут приобретать дополнительный электрический заряд и превращаться в положительные или отрицательные ионы (соответственно: катионы и анионы).
- Атомы и молекулы находятся в непрерывном хаотическом движении и взаимодействии, скорость которого зависит от температуры, а характер – от агрегатного состояния вещества.
- Частицы взаимодействуют друг с другом силами, имеющими электрическую природу. Гравитационное взаимодействие между частицами пренебрежимо мало.
Атом – наименьшая химически неделимая частица элемента (атом железа, гелия, кислорода). Молекула – наименьшая частица вещества, сохраняющая его химические свойства. Молекула состоит из одного и более атомов (вода – Н2О – 1 атом кислорода и 2 атома водорода).
Молекула – наименьшая частица вещества, сохраняющая его химические свойства. Молекула состоит из одного и более атомов (вода – Н2О – 1 атом кислорода и 2 атома водорода).
Молекулы имеют чрезвычайно малые размеры. Простые одноатомные молекулы имеют размер порядка 10–10 м. Сложные многоатомные молекулы могут иметь размеры в сотни и тысячи раз больше.
Беспорядочное хаотическое движение молекул называется тепловым движением. Кинетическая энергия теплового движения растет с возрастанием температуры. При низких температурах молекулы конденсируются в жидкое или твердое вещество. При повышении температуры средняя кинетическая энергия молекулы становится больше, молекулы разлетаются, и образуется газообразное вещество.
В твердых телах молекулы совершают беспорядочные колебания около фиксированных центров (положений равновесия). Эти центры могут быть расположены в пространстве нерегулярным образом (аморфные тела) или образовывать упорядоченные объемные структуры (кристаллические тела).
Эти центры могут быть расположены в пространстве нерегулярным образом (аморфные тела) или образовывать упорядоченные объемные структуры (кристаллические тела).
В жидкостях молекулы имеют значительно большую свободу для теплового движения. Они не привязаны к определенным центрам и могут перемещаться по всему объему жидкости. Этим объясняется текучесть жидкостей.
В газах расстояния между молекулами обычно значительно больше их размеров. Силы взаимодействия между молекулами на таких больших расстояниях малы, и каждая молекула движется вдоль прямой линии до очередного столкновения с другой молекулой или со стенкой сосуда. Среднее расстояние между молекулами воздуха при нормальных условиях порядка 10–8 м, то есть в сотни раз превышает размер молекул. Слабое взаимодействие между молекулами объясняет способность газов расширяться и заполнять весь объем сосуда. В пределе, когда взаимодействие стремится к нулю, мы приходим к представлению об идеальном газе.
Идеальный газ – это газ, молекулы которого не взаимодействуют друг с другом, за исключением процессов упругого столкновения и считаются материальными точками.
В молекулярно-кинетической теории количество вещества принято считать пропорциональным числу частиц. Единица количества вещества называется молем (моль). Моль – это количество вещества, содержащее столько же частиц (молекул), сколько содержится атомов в 0,012 кг углерода 12C. Молекула углерода состоит из одного атома. Таким образом, в одном моле любого вещества содержится одно и то же число частиц (молекул). Это число называется постоянной Авогадро: NА = 6,022·1023 моль–1.
Постоянная Авогадро – одна из важнейших постоянных в молекулярно-кинетической теории. Количество вещества определяется как отношение числа N частиц (молекул) вещества к постоянной Авогадро NА, или как отношение массы к молярной массе:
Массу одного моля вещества принято называть молярной массой M. Молярная масса равна произведению массы m0 одной молекулы данного вещества на постоянную Авогадро (то есть на количество частиц в одном моле). Молярная масса выражается в килограммах на моль (кг/моль). Для веществ, молекулы которых состоят из одного атома, часто используется термин атомная масса. В таблице Менделеева молярная масса указана в граммах на моль. Таким образом имеем еще одну формулу:
Молярная масса выражается в килограммах на моль (кг/моль). Для веществ, молекулы которых состоят из одного атома, часто используется термин атомная масса. В таблице Менделеева молярная масса указана в граммах на моль. Таким образом имеем еще одну формулу:
где: M – молярная масса, NA – число Авогадро, m0 – масса одной частицы вещества, N – число частиц вещества содержащихся в массе вещества m. Кроме этого понадобится понятие концентрации (количество частиц в единице объема):
Напомним также, что плотность, объем и масса тела связаны следующей формулой:
Если в задаче идет речь о смеси веществ, то говорят о средней молярной массе и средней плотности вещества. Как и при вычислении средней скорости неравномерного движения, эти величины определяются полными массами смеси:
Не забывайте, что полное количество вещества всегда равно сумме количеств веществ, входящих в смесь, а с объемом надо быть аккуратными. Объем смеси газов не равен сумме объемов газов, входящих в смесь. Так, в 1 кубометре воздуха содержится 1 кубометр кислорода, 1 кубометр азота, 1 кубометр углекислого газа и т.д. Для твердых тел и жидкостей (если иное не указано в условии) можно считать, что объем смеси равен сумме объемов ее частей.
Объем смеси газов не равен сумме объемов газов, входящих в смесь. Так, в 1 кубометре воздуха содержится 1 кубометр кислорода, 1 кубометр азота, 1 кубометр углекислого газа и т.д. Для твердых тел и жидкостей (если иное не указано в условии) можно считать, что объем смеси равен сумме объемов ее частей.
Основное уравнение МКТ идеального газа
К оглавлению…
При своем движении молекулы газа непрерывно сталкиваются друг с другом. Из-за этого характеристики их движения меняются, поэтому, говоря об импульсах, скоростях, кинетических энергиях молекул, всегда имеют в виду средние значения этих величин.
Число столкновений молекул газа в нормальных условиях с другими молекулами измеряется миллионами раз в секунду. Если пренебречь размерами и взаимодействием молекул (как в модели идеального газа), то можно считать, что между последовательными столкновениями молекулы движутся равномерно и прямолинейно. Естественно, подлетая к стенке сосуда, в котором расположен газ, молекула испытывает столкновение и со стенкой. Все столкновения молекул друг с другом и со стенками сосуда считаются абсолютно упругими столкновениями шариков. При столкновении со стенкой импульс молекулы изменяется, значит на молекулу со стороны стенки действует сила (вспомните второй закон Ньютона). Но по третьему закону Ньютона с точно такой же силой, направленной в противоположную сторону, молекула действует на стенку, оказывая на нее давление. Совокупность всех ударов всех молекул о стенку сосуда и приводит к возникновению давления газа. Давление газа – это результат столкновений молекул со стенками сосуда. Если нет стенки или любого другого препятствия для молекул, то само понятие давления теряет смысл. Например, совершенно антинаучно говорить о давлении в центре комнаты, ведь там молекулы не давят на стенку. Почему же тогда, поместив туда барометр, мы с удивлением обнаружим, что он показывает какое-то давление? Правильно! Потому, что сам по себе барометр является той самой стенкой, на которую и давят молекулы.
Все столкновения молекул друг с другом и со стенками сосуда считаются абсолютно упругими столкновениями шариков. При столкновении со стенкой импульс молекулы изменяется, значит на молекулу со стороны стенки действует сила (вспомните второй закон Ньютона). Но по третьему закону Ньютона с точно такой же силой, направленной в противоположную сторону, молекула действует на стенку, оказывая на нее давление. Совокупность всех ударов всех молекул о стенку сосуда и приводит к возникновению давления газа. Давление газа – это результат столкновений молекул со стенками сосуда. Если нет стенки или любого другого препятствия для молекул, то само понятие давления теряет смысл. Например, совершенно антинаучно говорить о давлении в центре комнаты, ведь там молекулы не давят на стенку. Почему же тогда, поместив туда барометр, мы с удивлением обнаружим, что он показывает какое-то давление? Правильно! Потому, что сам по себе барометр является той самой стенкой, на которую и давят молекулы.
Поскольку давление есть следствие ударов молекул о стенку сосуда, очевидно, что его величина должна зависеть от характеристик отдельно взятых молекул (от средних характеристик, конечно, Вы ведь помните про то, что скорости всех молекул различны). Эта зависимость выражается основным уравнением молекулярно-кинетической теории идеального газа:
Эта зависимость выражается основным уравнением молекулярно-кинетической теории идеального газа:
где: p — давление газа, n — концентрация его молекул, m0 — масса одной молекулы, vкв — средняя квадратичная скорость (обратите внимание, что в самом уравнении стоит квадрат средней квадратичной скорости). Физический смысл этого уравнения состоит в том, что оно устанавливает связь между характеристиками всего газа целиком (давлением) и параметрами движения отдельных молекул, то есть связь между макро- и микромиром.
Следствия из основного уравнения МКТ
Как уже было отмечено в предыдущем параграфе, скорость теплового движения молекул определяется температурой вещества. Для идеального газа эта зависимость выражается простыми формулами для средней квадратичной скорости движения молекул газа:
где: k = 1,38∙10–23 Дж/К – постоянная Больцмана, T – абсолютная температура. Сразу же оговоримся, что далее во всех задачах Вы должны, не задумываясь, переводить температуру в кельвины из градусов Цельсия (кроме задач на уравнение теплового баланса). Закон трех постоянных:
Сразу же оговоримся, что далее во всех задачах Вы должны, не задумываясь, переводить температуру в кельвины из градусов Цельсия (кроме задач на уравнение теплового баланса). Закон трех постоянных:
где: R = 8,31 Дж/(моль∙К) – универсальная газовая постоянная. Следующей важной формулой является формула для средней кинетической энергии поступательного движения молекул газа:
Оказывается, что средняя кинетическая энергия поступательного движения молекул зависит только от температуры, одинакова при данной температуре для всех молекул. Ну и наконец, самыми главными и часто применяемыми следствиями из основного уравнения МКТ являются следующие формулы:
Измерение температуры
Понятие температуры тесно связано с понятием теплового равновесия. Тела, находящиеся в контакте друг с другом, могут обмениваться энергией. Энергия, передаваемая одним телом другому при тепловом контакте, называется количеством теплоты.
Тепловое равновесие – это такое состояние системы тел, находящихся в тепловом контакте, при котором не происходит теплопередачи от одного тела к другому, и все макроскопические параметры тел остаются неизменными. Температура – это физический параметр, одинаковый для всех тел, находящихся в тепловом равновесии.
Для измерения температуры используются физические приборы – термометры, в которых о величине температуры судят по изменению какого-либо физического параметра. Для создания термометра необходимо выбрать термометрическое вещество (например, ртуть, спирт) и термометрическую величину, характеризующую свойство вещества (например, длина ртутного или спиртового столбика). В различных конструкциях термометров используются разнообразные физические свойства вещества (например, изменение линейных размеров твердых тел или изменение электрического сопротивления проводников при нагревании).
Термометры должны быть откалиброваны. Для этого их приводят в тепловой контакт с телами, температуры которых считаются заданными.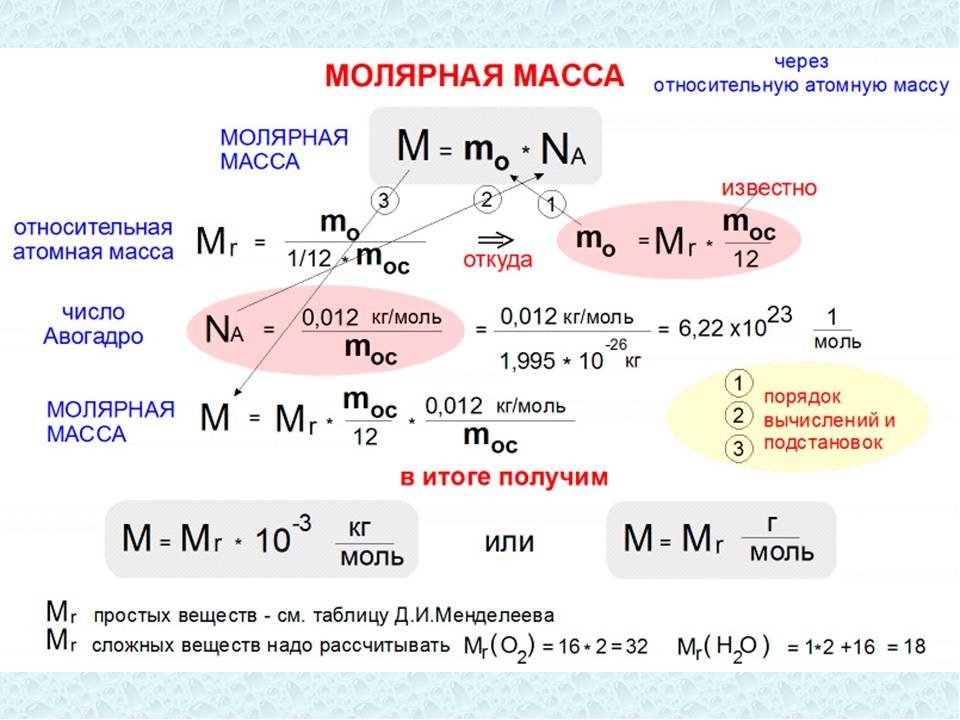 Чаще всего используют простые природные системы, в которых температура остается неизменной, несмотря на теплообмен с окружающей средой – это смесь льда и воды и смесь воды и пара при кипении при нормальном атмосферном давлении. По температурной шкале Цельсия точке плавления льда приписывается температура 0°С, а точке кипения воды: 100°С. Изменение длины столба жидкости в капиллярах термометра на одну сотую длины между отметками 0°С и 100°С принимается равным 1°С.
Чаще всего используют простые природные системы, в которых температура остается неизменной, несмотря на теплообмен с окружающей средой – это смесь льда и воды и смесь воды и пара при кипении при нормальном атмосферном давлении. По температурной шкале Цельсия точке плавления льда приписывается температура 0°С, а точке кипения воды: 100°С. Изменение длины столба жидкости в капиллярах термометра на одну сотую длины между отметками 0°С и 100°С принимается равным 1°С.
Английский физик У.Кельвин (Томсон) в 1848 году предложил использовать точку нулевого давления газа для построения новой температурной шкалы (шкала Кельвина). В этой шкале единица измерения температуры такая же, как и в шкале Цельсия, но нулевая точка сдвинута:
При этом изменение температуры на 1ºС соответствует изменению температуры на 1 К. Изменения температуры по шкале Цельсия и Кельвина равны. В системе СИ принято единицу измерения температуры по шкале Кельвина называть кельвином и обозначать буквой К.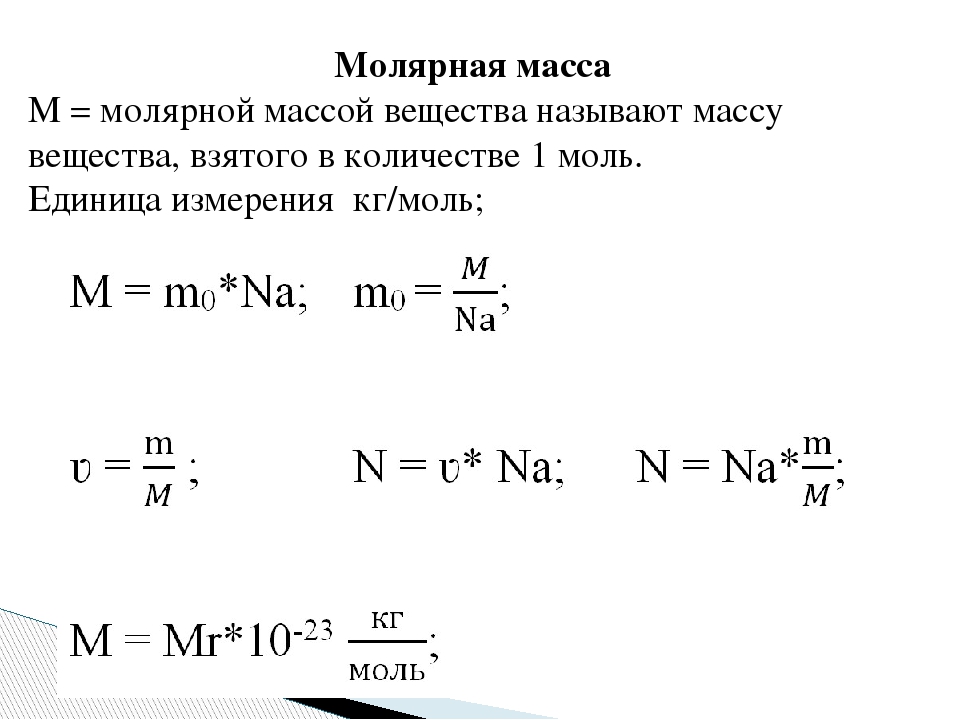 Например, комнатная температура TС = 20°С по шкале Кельвина равна TК = 293 К. Температурная шкала Кельвина называется абсолютной шкалой температур. Она оказывается наиболее удобной при построении физических теорий.
Например, комнатная температура TС = 20°С по шкале Кельвина равна TК = 293 К. Температурная шкала Кельвина называется абсолютной шкалой температур. Она оказывается наиболее удобной при построении физических теорий.
Уравнение состояния идеального газа или уравнение Клапейрона-Менделеева
К оглавлению…
Уравнение состояние идеального газа является очередным следствие из основного уравнения МКТ и записывается в виде:
Данное уравнение устанавливает связь между основными параметрами состояния идеального газа: давлением, объемом, количеством вещества и температурой. Очень важно, что эти параметры взаимосвязаны, изменение любого из них неизбежно приведет к изменению еще хотя бы одного. Именно поэтому данное уравнение и называют уравнением состояния идеального газа. Оно было открыто сначала для одного моля газа Клапейроном, а впоследствии обобщено на случай большего количество молей Менделеевым.
Если температура газа равна Tн = 273 К (0°С), а давление pн = 1 атм = 1·105 Па, то говорят, что газ находится при нормальных условиях.
Газовые законы
К оглавлению…
Решение задач на расчет параметров газа значительно упрощается, если Вы знаете, какой закон и какую формулу применить. Итак, рассмотрим основные газовые законы.
1. Закон Авогадро. В одном моле любого вещества содержится одинаковое количество структурных элементов, равное числу Авогадро.
2. Закон Дальтона. Давление смеси газов равно сумме парциальных давлений газов, входящих в эту смесь:
Парциальным давлением газа называют то давление, которое он бы производил, если бы все остальные газ внезапно исчезли из смеси. Например, давление воздуха равно сумме парциальных давлений азота, кислорода, углекислого газа и прочих примесей. При этом каждый из газов в смеси занимает весь предоставленный ему объем, то есть объем каждого из газов равен объему смеси.
3. Закон Бойля-Мариотта. Если масса и температура газа остаются постоянными, то произведение давления газа на его объем не изменяется, следовательно:
Процесс, происходящий при постоянной температуре, называют изотермическим. Обратите внимание, что такая простая форма закона Бойля-Мариотта выполняется только при условии, что масса газа остается неизменной.
4. Закон Гей-Люссака. Сам закон Гей-Люссака не представляет особой ценности при подготовке к экзаменам, поэтому приведем лишь следствие из него. Если масса и давление газа остаются постоянными, то отношение объема газа к его абсолютной температуре не изменяется, следовательно:
Процесс, происходящий при постоянном давлении, называют изобарическим или изобарным. Обратите внимание, что такая простая форма закона Гей-Люссака выполняется только при условии, что масса газа остается неизменной. Не забывайте про перевод температуры из градусов Цельсия в кельвины.
5. Закон Шарля. Как и закон Гей-Люссака, закон Шарля в точной формулировке для нас не важен, поэтому приведем лишь следствие из него. Если масса и объем газа остаются постоянными, то отношение давления газа к его абсолютной температуре не изменяется, следовательно:
Закон Шарля. Как и закон Гей-Люссака, закон Шарля в точной формулировке для нас не важен, поэтому приведем лишь следствие из него. Если масса и объем газа остаются постоянными, то отношение давления газа к его абсолютной температуре не изменяется, следовательно:
Процесс, происходящий при постоянном объеме, называют изохорическим или изохорным. Обратите внимание, что такая простая форма закона Шарля выполняется только при условии, что масса газа остается неизменной. Не забывайте про перевод температуры из градусов Цельсия в кельвины.
6. Универсальный газовый закон (Клапейрона). При постоянной массе газа отношение произведения его давления и объема к температуре не изменяется, следовательно:
Обратите внимание, что масса должна оставаться неизменной, и не забывайте про кельвины.
Итак, существует несколько газовых законов. Перечислим признаки того, что нужно применять один из них при решении задачи:
- Закон Авогадро применяется во всех задачах где речь идет о количестве молекул.

- Закон Дальтона применяется во всех задачах, в которых идет речь о смеси газов.
- Закон Шарля применяют в задачах, когда объем газа остается неизменным. Обычно это или сказано явно, или в задаче присутствуют слова «газ в закрытом сосуде без поршня».
- Закон Гей-Люссака применяют, если неизменным остается давление газа. Ищите в задачах слова «газ в сосуде, закрытом подвижным поршнем» или «газ в открытом сосуде». Иногда про сосуд ничего не сказано, но по условию понятно, что он сообщается с атмосферой. Тогда считается, что атмосферное давление всегда остается неизменным (если в условии не сказано иного).
- Закон Бойля-Мариотта. Тут сложнее всего. Хорошо, если в задаче написано, что температура газа неизменна. Чуть хуже, если в условии присутствует слово «медленно». Например, газ медленно сжимают или медленно расширяют. Еще хуже, если сказано, что газ закрыт теплонепроводящим поршнем. Наконец, совсем плохо, если про температуру не сказано ничего, но из условия можно предположить, что она не изменяется.
 Обычно в этом случае ученики применяют закон Бойля-Мариотта от безысходности.
Обычно в этом случае ученики применяют закон Бойля-Мариотта от безысходности. - Универсальный газовый закон. Его используют, если масса газа постоянна (например, газ находится в закрытом сосуде), но по условию понятно, что все остальные параметры (давление, объем, температура) изменяются. Вообще, часто вместо универсального закона можно применять уравнение Клапейрона-Менделеева, вы получите правильный ответ, только в каждой формуле будете писать по две лишние буквы.
Графическое изображение изопроцессов
К оглавлению…
Во многих разделах физики зависимость величин друг от друга удобно изображать графически. Это упрощает понимание взаимосвязи параметров, происходящих в системе процессов. Такой подход очень часто применяется и в молекулярной физике. Основными параметрами, описывающими состояние идеального газа, являются давление, объем и температура. Графический метод решения задач и состоит в изображении взаимосвязи этих параметров в различных газовых координатах. Существует три основных типа газовых координат: (p; V), (p; T) и (V; T). Заметьте, что это только основные (наиболее часто встречающиеся типы координат). Фантазия составителей задач и тестов не ограничена, поэтому Вы можете встретить и любые другие координаты. Итак, изобразим основные газовые процессы в основных газовых координатах.
Существует три основных типа газовых координат: (p; V), (p; T) и (V; T). Заметьте, что это только основные (наиболее часто встречающиеся типы координат). Фантазия составителей задач и тестов не ограничена, поэтому Вы можете встретить и любые другие координаты. Итак, изобразим основные газовые процессы в основных газовых координатах.
Изобарный процесс (p = const)
Изобарным процессом называют процесс, протекающий при неизменным давлении и массе газа. Как следует из уравнения состояния идеального газа, в этом случае объем изменяется прямо пропорционально температуре. Графики изобарического процесса в координатах р–V; V–Т и р–Т имеют следующий вид:
Обратите внимание на то, что продолжение графика в V–T координатах направлено точно в начало координат, однако этот график никогда не сможет начаться прямо из начала координат, так как при очень низких температурах газ превращается в жидкость и зависимость объема от температура меняется.
Изохорный процесс (V = const)
Изохорный процесс – это процесс нагревания или охлаждения газа при постоянном объеме и при условии, что количество вещества в сосуде остается неизменным. Как следует из уравнения состояния идеального газа, при этих условиях давление газа изменяется прямо пропорционально его абсолютной температуре. Графики изохорного процесса в координатах р–V; р–Т и V–Т имеют следующий вид:
Обратите внимание на то, что продолжение графика в p–T координатах направлено точно в начало координат, однако этот график никогда не сможет начаться прямо из начала координат, так как газ при очень низких температурах превращается в жидкость.
Изотермический процесс (T = const)
Изотермическим процессом называют процесс, протекающий при постоянной температуре. Из уравнения состояния идеального газа следует, что при постоянной температуре и неизменном количестве вещества в сосуде произведение давления газа на его объем должно оставаться постоянным. Графики изотермического процесса в координатах р–V; р–Т и V–Т имеют следующий вид:
Графики изотермического процесса в координатах р–V; р–Т и V–Т имеют следующий вид:
Заметим, что при выполнении заданий на графики в молекулярной физике не требуется особой точности в откладывании координат по соответствующим осям (например, чтобы координаты p1 и p2 двух состояний газа в системе p(V) совпадали с координатами p1 и p2 этих состояний в системе p(T). Во–первых, это разные системы координат, в которых может быть выбран разный масштаб, а во–вторых, это лишняя математическая формальность, отвлекающая от главного – от анализа физической ситуации. Основное требование: чтобы качественный вид графиков был верным.
Неизопроцессы
К оглавлению…
В задачах этого типа изменяются все три основных параметра газа: давление, объем и температура. Постоянной остается только масса газа. Наиболее простой случай, если задача решается «в лоб» с помощью универсального газового закона. Чуть сложнее, если Вам надо отыскать уравнение процесса, описывающего изменение состояния газа, или проанализировать поведение параметров газа по данному уравнению. Тогда действовать надо так. Записать данное уравнение процесса и универсальный газовый закон (или уравнение Клапейрона-Менделеева, что Вам удобнее) и последовательно исключать ненужные величины из них.
Наиболее простой случай, если задача решается «в лоб» с помощью универсального газового закона. Чуть сложнее, если Вам надо отыскать уравнение процесса, описывающего изменение состояния газа, или проанализировать поведение параметров газа по данному уравнению. Тогда действовать надо так. Записать данное уравнение процесса и универсальный газовый закон (или уравнение Клапейрона-Менделеева, что Вам удобнее) и последовательно исключать ненужные величины из них.
Изменение количества или массы вещества
К оглавлению…
В сущности, ничего сложного в таких задачах нет. Надо только помнить, что газовые законы не выполняются, так как в формулировках любых из них записано «при постоянной массе». Поэтому действуем просто. Записываем уравнение Клапейрона-Менделеева для начального и конечного состояний газа и решаем задачу.
Перегородки или поршни
К оглавлению…
В задачах этого типа опять применяются газовые законы, при этом необходимо учесть следующие замечания:
- Во-первых, газ через перегородку не проходит, то есть масса газа в каждой части сосуда остается неизменной, и таким образом, для каждой части сосуда выполняются газовые законы.

- Во-вторых, если перегородка теплонепроводящая, то при нагревании или охлаждении газа в одной части сосуда температура газа во второй части останется неизменной.
- В-третьих, если перегородка подвижна, то давления по обе ее стороны равны в каждый конкретный момент времени (но это равное с обоих сторон давление может меняться со временем).
- А дальше пишем газовые законы для каждого газа по отдельности и решаем задачу.
Газовые законы и гидростатика
К оглавлению…
Специфика задач состоит в том, что в давлении надо будет учитывать «довески», связанные с давлением столба жидкости. Какие тут могут быть варианты:
- Сосуд с газом погружен под воду. Давление в сосуде будет равно: p = pатм + ρgh, где: h – глубина погружения.
- Горизонтальная трубка закрыта от атмосферы столбиком ртути (или другой жидкости). Давление газа в трубке точно равно: p = pатм атмосферному, так как горизонтальный столбик ртути не оказывает давления на газ.

- Вертикальная трубка с газом закрыта сверху столбиком ртути (или другой жидкости). Давление газа в трубке: p = pатм + ρgh, где: h – высота столбика ртути.
- Вертикальная узкая трубка с газом повернута открытым концом вниз и заперта столбиком ртути (или другой жидкости). Давление газа в трубке: p = pатм – ρgh, где: h – высота столбика ртути. Знак «–» ставится, так как ртуть не сжимает, а растягивает газ. Часто ученики спрашивают, почему ртуть не вытекает из трубки. Действительно, если бы трубка была широкой, ртуть бы стекла вниз по стенкам. А так, поскольку трубка очень узкая, поверхностное натяжение на дает ртути разорваться посередине и пропустить внутрь воздух, а давление газа внутри (меньшее, чем атмосферное) удерживает ртуть от вытекания.
Как только Вы сумели правильно записать давление газа в трубке, применяйте какой-либо из газовых законов (как правило, Бойля-Мариотта, так как большинство таких процессов изотермические, или универсальный газовый закон). Применяйте выбранный закон для газа (ни в коем случае не для жидкости) и решайте задачу.
Применяйте выбранный закон для газа (ни в коем случае не для жидкости) и решайте задачу.
Тепловое расширение тел
К оглавлению…
При повышении температуры возрастает интенсивность теплового движения частиц вещества. Это приводит к тому, что молекулы более «активно» отталкиваются друг от друга. Из-за этого большинство тел увеличивает свои размеры при нагревании. Не совершите типичную ошибку, сами атомы и молекулы не расширяются при нагревании. Увеличиваются лишь пустые промежутки между молекулами. Тепловое расширение газов описывается законом Гей-Люссака. Тепловое расширение жидкостей подчиняется следующему закону:
где: V0 – объем жидкости при 0°С, V – при температуре t, γ – коэффициент объемного расширения жидкости. Обратите внимание, что все температуры в этой теме нужно брать в градусах Цельсия. Коэффициент объемного расширения зависит от рода жидкости (и от температуры, что не учитывается в большинстве задач). Обратите внимание, что численное значение коэффициента, выраженное в 1/°С или в 1/К, одинаково, так как нагреть тело на 1°С это то же самое, что нагреть его на 1 К (а не на 274 К).
Обратите внимание, что численное значение коэффициента, выраженное в 1/°С или в 1/К, одинаково, так как нагреть тело на 1°С это то же самое, что нагреть его на 1 К (а не на 274 К).
Для расширения твердых тел применяются три формулы, описывающие изменение линейных размеров, площади и объема тела:
где: l0, S0, V0 – соответственно длина, площадь поверхности и объем тела при 0°С, α – коэффициент линейного расширения тела. Коэффициент линейного расширения зависит от рода тела (и от температуры, что не учитывается в большинстве задач) и измеряется в 1/°С или в 1/К.
Масса молекул. Количество вещества
Цели урока:
обучающая: Познакомится с важнейшими величинами, которые используются в молекулярной физике. Понять физический смысл каждой из этих величин и определить их взаимосвязь.
развивающая: развитие умения применять полученные знания на практике, научится пользоваться таблицей Менделеева для решения задач по молекулярной физике.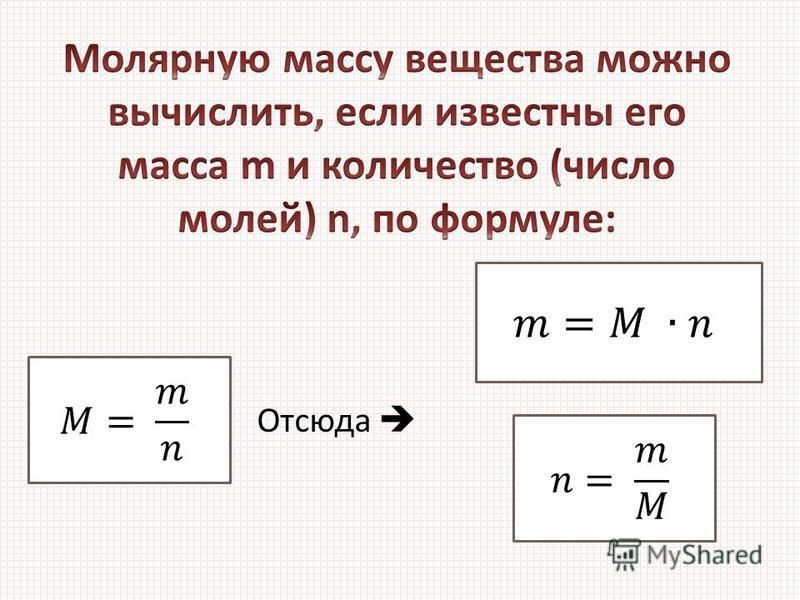
воспитывающая: воспитание дисциплины и норм поведения, творческого отношения к изучаемому предмету; стимулировать активность учащихся, повышать мотивацию к изучению физики.
Методы:
словесный — беседа;
наглядный — видеоурок;
контролирующий — решение задач с использованием наглядных примеров
Ход урока:
1. Организационный этап.
Добрый день. Прежде чем мы приступим к уроку, хотелось бы, чтобы каждый из вас настроился на рабочий лад.
2. Актуализация знаний.
Совсем недавно мы приступили к изучению молекулярной физики. На сегодняшнем уроке мы дадим представление о массе молекул, а также введем совершенно новую величину, которая называется количеством вещества.
3. Объяснение нового материала.
Как вы понимаете, масса и размеры молекул крайне малы. Например, в одном стакане воды содержится просто огромное количество молекул.
Например, в одном стакане воды содержится просто огромное количество молекул.
Поэтому, для удобства вводится такая величина, как относительная молекулярная масса. Эта величина определяется как отношение массы молекулы (или атома) данного вещества к одной двенадцатой массы атома углерода. Таким образом, массы всех химических элементов можно выразить в атомных единицах массы.
В таблице Менделеева собраны данные обо всех известных химических элементах. В частности, из этой таблицы можно узнать относительную молекулярную массу. На примере соляной кислоты мы научимся, как вычислять относительную молекулярную массу любого соединения с помощью таблицы Менделеева.
Помимо характеристики массы молекул, необходимо характеризовать и количество молекул, содержащихся в той или иной массе данного вещества. Для этого вводится такая величина, как количество вещества. Единицей измерения этой величины является моль. Один моль — это количество вещества, в котором содержится столько же молекул или атомов, сколько содержится атомов в двенадцати граммах углерода.
В связи с этим, вводится еще одна величина, которая называется молярной массой. Молярная масса — это масса данного вещества, взятого в количестве один моль. Эта величина измеряется в килограммах на моль.
Молярную массу также можно взять из таблицы Менделеева. Только обязательно нужно помнить о том, что в таблице Менделеева молярная масса указана в граммах на моль. Ну и конечно, ни в коем случае нельзя путать относительную молекулярную массу с молярной массой, несмотря на то, что в таблице Менделеева эти величины численно равны.
4. Решение задач.
Ну и конечно, необходимо рассмотреть практическое применение полученных знаний, то есть, решение задач.
5. Рефлексия
Хотелось бы услышать ваши отзывы о сегодняшнем уроке: что вам понравилось, что не понравилось, чем бы хотелось узнать еще.
6. Домашнее задание.
7. Итоги урока
Молекулярная физика основные формулы
Формулы молекулярной физики
Формула концентрации молекул
Здесь n — концентрация , N — количество молекул (безразмерное), V — объем .
Формула плотности
Здесь — плотность вещества , m — масса вещества (кг), V — объем .
Формула относительной молекулярной массы
Здесь — относительная молекулярная масса (безразмерная), — масса одной молекулы (кг), — масса атома углерода (кг).
Формула количества вещества (количества молей)
Здесь v — количество вещества (количество молей) (моль), m — масса вещества (кг), М — молярная масса (кг/моль).
Формулы массы одной молекулы
Здесь — масса одной молекулы (кг), т — масса вещества (кг), N — количество молекул (безразмерное), М — молярная масса (кг/моль), — число Авогадро, — плотность вещества , n — концентрация молекул .
Формулы количества молекул
Здесь A — количество молекул (безразмерное), п — концентрация молекул , V— объем , v — количество вещества (количество молей) (моль), — число Авогадро , m — масса вещества (кг), — масса одной молекулы.
Формулы средней квадратичной скорости молекул
Здесь — средняя квадратичная скорость молекул (м/с), R = 8,31 Дж/(моль • К) — молярная газовая постоянная, Т — абсолютная температура (К), М — молярная масса (кг/моль), Дж/К — постоянная Больцмана, — масса одной молекулы (кг).
Основное уравнение кинетической теории идеального газа
Здесь р — давление газа (Па), — масса одной молекулы (кг), n — концентрация молекул , — средняя квадратичная скорость молекул (м/с), — средняя кинетическая энергия молекул (Дж).
Формула средней кинетической энергии молекул
Здесь — средняя кинетическая энергия молекул (Дж), — масса одной молекулы (кг), — средняя квадратичная скорость молекул (м/с).
Связь шкал Цельсия и Кельвина
Здесь Т — абсолютная температура (К), t — температура по шкале Цельсия.
Связь средней кинетической энергии молекул идеального газа с абсолютной температурой
Здесь — средняя кинетическая энергия молекул (Дж), k — постоянная Больцмана (Дж/К), Т — абсолютная температура (К).
У равнение состояния идеального газа — уравнение Клапейрона — Менделеева
Здесь р — давление газа (Па), V — объем , т — масса газа (кг), М — молярная масса (кг/моль), R — молярная газовая постоянная (ДжДмоль • К), Т — абсолютная температура (К), v — количество вещества (количество молей) (моль), — объем моля .
Объединенный газовый закон — уравнение Клапейрона
при
Здесь — давление (Па), объем и абсолютная температура (К) газа в первом состоянии, — давление (Па), объем и абсолютная температура (К) газа во втором состоянии.
Закон Бойля — Мариотта (изотермический процесс)
при
Здесь Т — абсолютная температура газа (К), m — масса газа (кг), — давление (Па) и объем газа в первом состоянии, — давление (Па) и объем газа во втором состоянии.
Закон Гей-Люссака (изобарный процесс)
при
Здесь р — давление газа (Па), m — масса газа (кг), и — объем и абсолютная температура (К) газа в первом состоянии, — объем и абсолютная температура (К) газа во втором состоянии.
Закон Шарля
при
Здесь V — объем газа , m — масса газа (кг), — давление (Па) и абсолютная температура (К) газа в первом состоянии, — давление (Па) и абсолютная температура (К) газа во втором состоянии.
Связь давления идеального газа с концентрацией его молекул и температурой
Здесь р — давление газа (Па), к — постоянная Больцмана (Дж/К), п — концентрация молекул газа , абсолютная температура Т (К).
Формулы относительной влажности
Здесь — относительная влажность (безразмерная или в %), р — плотность водяного пара в воздухе при данной температуре — плотность насыщенного водяного пара при той же температуре — давление водяного пара в воздухе при данной температуре (Па), — давление насыщенного водяного пара в воздухе при той же температуре (Па).
Работа при изобарном изменении объема газа
Здесь А — работа (Дж), р — давление газа (Па), — изменение объема газа — соответственно начальный и конечный объемы газа .
Внутренняя энергия идеального одноатомного газа
Здесь U — внутренняя энергия газа (Дж), m — масса газа (кг), М — молярная масса газа (кг/моль), R — молярная газовая постоянная (Дж/(моль • К), Т — абсолютная температура (К), v — количество вещества или число молей (моль), — изменение внутренней энергии (Дж), — изменение температуры (К).
Первый закон термодинамики
Здесь Q — количество теплоты, переданное термодинамической системе (Дж), — изменение внутренней энергии системы (Дж), А — работа против внешних сил (Дж)
Применение первого закона термодинамики к термодинамическим процессам
к изотермическому: при
к изохорному: при V = const
к изобарному: при р = const
к адиабатному: при Q = 0
Здесь Т — абсолютная температура (К), — изменение внутренней энергии (Дж), Q — количество теплоты (Дж), А — работа (Дж), V — объем , р — давление (Па).
Формулы количества теплоты при нагревании или охлаждении тел
Здесь Q — количество теплоты, переданное телу при нагревании или отданное им при охлаждении (Дж), с — удельная теплоемкость вещества (Дж/(кг • К), т — масса тела (кг), — изменение температуры тела по шкале Цельсия, и — температуры тела в начале и в конце процесса передачи теплоты по шкале Цельсия, — изменение абсолютной температуры тела (К), — абсолютные температуры тела в начале и в конце процесса передачи теплоты (К), — теплоемкость тела (Дж/К).
Формула количества теплоты при плавлении или кристаллизации
Здесь Q — количество теплоты (Дж), т — масса тела (кг), — удельная теплота плавления вещества (Дж/кг).
Формула количества теплоты при парообразовании или конденсации
Здесь Q — количество теплоты (Дж), m — масса тела (кг), r — удельная теплота парообразования (Дж/кг).
Формула количества теплоты при сгорании топлива
Здесь Q — количество выделившейся теплоты, m — масса топлива (кг), q — удельная теплота сгорания (Дж/кг).
Коэффициент полезного действия теплового двигателя
Здесь — коэффициент полезного действия (безразмерный или в %), — работа, совершенная двигателем (Дж), — количество теплоты, полученное рабочим веществом от нагревателя (Дж), — количество теплоты, отданное рабочим веществом холодильнику (Дж).
Коэффициент полезного действия идеального теплового двигателя
Здесь — коэффициент полезного действия идеального теплового двигателя (безразмерный или в %), — абсолютная температура нагревателя (К), — абсолютная температура холодильника(К).
Эта теория со страницы подробного решения задач по физике, там расположена теория и подробное решения задач по всем темам физики:
Задачи по физике с решением
Возможно вам будут полезны эти страницы:
Молекулярная физика — Основные формулы
1. Основы молекулярно-кинетической теории. Газовые законы
1.1 Количество вещества
m — масса;
μ — молярная масса вещества;
N — число молекул;
NA = 6,02·1023 моль-1 — число Авогадро
1.2 Основное уравнение молекулярно-кинетической теории идеального газа
p — давление идеального газа;
m — масса одной молекулы;
n = N/V — концентрация молекул;
V — объем газа;
N — число молекул;
— среднее значение квадрата скорости молекул.
1.3 Средняя квадратичная скорость молекул идеального газа
k = 1,38·10-23 Дж/К — постоянная Больцмана;
R = kNA = 8,31 Дж/(моль·К) — универсальная газовая постоянная;
T = t+273 — абсолютная температура;
t — температура по шкале Цельсия.
1.4 Средняя кинетическая энергия молекулы одноатомного газа
1.5 Давление идеального газа
n — концентрация молекул;
k — постоянная Больцмана;
T — абсолютная температура.
1.6 Закон Бойля-Мариотта
p — давление;
V — объем газа.
1.7 Закон Шарля
p0 — давление газа при 0 °С;
α = 1/273 °C-1 — температурный коэффициент давления.
1.8 Закон Гей-Люссака
V0 — объем газа при 0 °С.
1.9 Уравнение Менделеева-Клапейрона
1.10 Объединенный закон газового состояния (уравнение Клапейрона)
1.11 Закон Дальтона
pi — парциальное давление i-й компоненты смеси газов.
2. Основы термодинамики
2.1 Внутренняя энергия идеального одноатомного газа
ν — количество вещества;
R = 8,31 Дж/(моль·К) — универсальная газовая постоянная;
T — абсолютная температура.
2.2 Элементарная работа, совершаемая газом,
при изменении объема на бесконечно малую величину dV
p — давление газа.
При изменении объема от V1 до V2
2.3 Первый закон термодинамики
ΔQ — количество подведенной теплоты;
ΔA — работа, совершаемая веществом;
ΔU — изменение внутренней энергии вещества.
2.4 Теплоемкость идеального газа
ΔQ — количество переданной системе теплоты на участке процесса;
ΔT — изменение температуры на этом участке процесса.
Молярная масса газа — Правильный подход к решению задач по физике — LiveJournal
Молярная масса газа
iege
Задача: В баллоне объёмом 1.66 м3 находится 2 кг газа при давлении 105 Па и температуре 47°С. Какова молярная масса газа? Ответ выразите в г/моль, округлив до целых. Какова молярная масса газа? Ответ выразите в г/моль, округлив до целых. | |
| Читаем: В баллоне объёмом 1.66 м3 находится 2 кг газа при давлении 105 Па и температуре 47°С. Какова молярная масса газа? Здесь всё достаточно лаконично. Ответ выразите в г/моль, округлив до целых. А вот это ключевая фраза, способная создать проблему при решении этой задачи. Надо запомнить. | |
| Думаем: Что нам дано? Объём V, масса m, давление P, температура T… Что-то напоминает, не правда ли? Уравнение PV=RT! Только перед RT ещё стоит коэффициент, равный отношению массы и молярной массы, которую нам и надо найти! Почему эта задача в части б, интересно? | |
| Решаем: Запишем вышеупомянутый закон Менделеева-Клапейрона: Теперь выразим молярную массу и очень аккуратно подставим все данные с размерностями: Ответ: 32 г/моль.  | |
| Примечание: Теперь понятно, почему задача в части б. Внимательно посмотрите на решение этой задачи. Вся сложность в том, чтобы правильно подставить размерности. Если они сократятся до нужной (кг/моль в данном случае), то всё ок. Сложные размерности необходимо расписывать, например: Дж — это энергия. Самая простая формула — это формула кинетической энергии. Легко подставляем: кг * м / с2. Па — давление. Самая простая формула: P = mgh (спасибо Архимеду 🙂 ). И далее в том же духе. Надеюсь, вам было понятно объяснение решения этой задачи. Удачной подготовки! |
Что такое Молярная масса? — Определение, формула и примеры — Видео и стенограмма урока
Как найти молярную массу соединений
Соединения — это вещества, состоящие из более чем одного элемента. Например, некоторые распространенные соединения включают соль, глюкозу, уксусную кислоту (или уксус) и бикарбонат натрия (или пищевую соду).
Соединение хлорида натрия состоит из двух элементов, а именно натрия и хлора.Давайте используем это соединение, хлорид натрия, в качестве нашего первого примера того, как рассчитать молярную массу соединений. Первое, что нам нужно сделать, это найти натрий и хлор в таблице Менделеева.
Шаг 1: Найдите атомные массы отдельных элементов в таблице Менделеева
Первое, что нам нужно, это найти индивидуальные атомные массы для каждого элемента. Если вы посмотрите на записи для натрия и хлора в таблице, мы обратим внимание на числа, которые появляются в левом верхнем углу (см. видео).Они представляют собой атомную массу. Элемент натрия имеет атомную массу 22,98976 г/моль. Элемент хлор имеет атомную массу 35,453 г/моль.
Шаг 2: Подсчитайте, сколько атомов имеется у каждого элемента
Для соединения хлорида натрия, поскольку нет нижних индексов (маленькие числа внизу символа каждого элемента), это означает, что имеется только один натрий и только один хлор атом для этого соединения.
Шаг 3: Найдите молярную массу
Теперь, когда мы знаем, сколько атомов содержится в каждом элементе, мы можем найти молярную массу.
Сначала вычисляем массу атомов натрия, которая составляет 22,98976 грамма на моль. Далее делаем то же самое для массы атомов хлора, которая составляет 35,453 грамма на моль. Затем мы складываем эти две массы вместе, чтобы найти общую массу молекул хлорида натрия. Получается 58,44276 грамма на моль, которое мы можем округлить до 58,44 грамма на моль.
Пример: расчет молярной массы соединения
Рассмотрим более сложный пример.
Найдите молярную массу уксусной кислоты .
Существует три элемента — углерод, водород и кислород — поэтому найдите их атомные массы в периодической таблице: 12,0107 грамм на моль для углерода, 1,00794 грамм на моль для водорода и 15,9994 грамм на моль для кислорода.
Далее, мы должны учитывать, что каждый элемент в химическом соединении имеет нижний индекс, поэтому каждого атома больше одного. У нас есть два атома углерода, четыре атома водорода и два атома кислорода.
У нас есть два атома углерода, четыре атома водорода и два атома кислорода.
Теперь мы можем найти молярную массу каждого элемента. Для углерода мы умножаем его молярную массу 12,0107 грамм на моль на два, потому что у нас два атома углерода. Это равно 24,0214 грамма на моль. Для водорода мы умножаем молярную массу 1,00794 на 4. Это равно 4,03176 грамма на моль. Наконец, для кислорода мы умножаем молярную массу 15,9994 на 2. Это равняется 31,9988 граммам на моль.
Теперь, чтобы закончить, мы должны сложить все эти массы вместе, что даст нам в сумме 60.05196 грамм на моль для нашего соединения.
Вычисление количества граммов с использованием молярной массы
Ранее мы упоминали, что в научной лаборатории мы измеряем вес вещества в граммах. Иногда мы знаем только количество молей присутствующего вещества. Проблема в том, что мы никак не можем измерить эти родинки с помощью прибора для определения массы. Вот тут-то и появляется молярная масса. Мы можем использовать ее, чтобы преобразовать любое количество молей в граммы, используя простую формулу. Количество граммов равно молярной массе элемента или соединения, умноженной на количество молей.
Количество граммов равно молярной массе элемента или соединения, умноженной на количество молей.
Допустим, нам нужно получить вес в граммах 1,5 моль пищевой соды. Как мы это делаем? Нам нужно получить молярную массу соединения пищевой соды, в данном случае 84 грамма на моль, и умножить ее на 1,5.
Когда мы умножаем количество молей на молярную массу, единица «моль» отменяется, и у нас остается единица «граммы». В данном случае у нас есть 126 грамм пищевой соды.
Что, если мы хотим получить вес 0,5 моля соли или хлорида натрия в граммах? Молярная масса соли составляет 58,44 грамма на моль. Когда мы умножаем эти два числа вместе, мы находим, что масса 0,5 моля соли составляет 29,22 грамма.
Резюме урока
Молярная масса — это масса всех атомов в молекуле в граммах на моль. Чтобы рассчитать молярную массу молекулы, мы сначала получаем атомные веса отдельных элементов в периодической таблице.Затем мы подсчитываем количество атомов и умножаем его на отдельные атомные массы. Наконец, мы складываем все атомные массы вместе, чтобы получить молярную массу.
Чтобы рассчитать молярную массу молекулы, мы сначала получаем атомные веса отдельных элементов в периодической таблице.Затем мы подсчитываем количество атомов и умножаем его на отдельные атомные массы. Наконец, мы складываем все атомные массы вместе, чтобы получить молярную массу.
Молярная масса также является важным коэффициентом преобразования молей в граммы. Для этого умножаем количество молей вещества на молярную массу. Этот коэффициент преобразования важен при количественном определении веса в граммах в научных экспериментах.
Краткие примечания
- Молярная масса – это масса всех атомов молекулы в граммах на моль.
- Молярная масса может использоваться для расчета массы соединения и преобразования молей в граммы.
Результаты обучения
После изучения урока примените свои знания о молекулярной массе, чтобы сделать следующее:
- Обсудите назначение молей и молекулярной массы
- Использование молярной массы для определения массы соединения
- Преобразовать моли вещества в граммы
моль | Определение, число и факты
Самые популярные вопросы
Как определяется родинка?
Один моль равен 6. 02214076 × 10 23 какой-либо химической единицы, будь то атомы, молекулы, ионы и др. Моль является удобной единицей измерения из-за большого количества атомов, молекул и т. д. в любом веществе. Первоначально моль определялся как количество атомов в 12 граммах углерода-12, но в 2018 году Генеральная конференция по мерам и весам объявила, что с 20 мая 2019 года моль будет составлять всего 6,02214076 × 10 23 некоторого химического вещества. Блок.
02214076 × 10 23 какой-либо химической единицы, будь то атомы, молекулы, ионы и др. Моль является удобной единицей измерения из-за большого количества атомов, молекул и т. д. в любом веществе. Первоначально моль определялся как количество атомов в 12 граммах углерода-12, но в 2018 году Генеральная конференция по мерам и весам объявила, что с 20 мая 2019 года моль будет составлять всего 6,02214076 × 10 23 некоторого химического вещества. Блок.
Как рассчитывается моль?
Если вы хотите узнать, сколько у вас молей материала, разделите массу материала на его молярную массу.Молярная масса вещества – это масса в граммах одного моля этого вещества. Эта масса определяется атомным весом химической единицы, из которой состоит это вещество, в атомных единицах массы (а.е.м.). Например, атомный вес серебра составляет 107,8682 а.е.м., поэтому один моль серебра имеет массу 107,8682 грамма.
Какое число у Авогадро?
Число Авогадро — это количество единиц в одном моле вещества, или 6,02214076 × 10 23 . Это число также называют постоянной Авогадро.Он назван в честь итальянского физика XIX века Амедео Авогадро, который обнаружил, что при одинаковых температуре и давлении два газа одинакового объема имеют одинаковое количество молекул. Именно французский физик Жан Перрен в начале 20 века назвал количество единиц в моле числом Авогадро.
Это число также называют постоянной Авогадро.Он назван в честь итальянского физика XIX века Амедео Авогадро, который обнаружил, что при одинаковых температуре и давлении два газа одинакового объема имеют одинаковое количество молекул. Именно французский физик Жан Перрен в начале 20 века назвал количество единиц в моле числом Авогадро.
Какова формула молярной массы?
Молярная масса какого-либо вещества – это масса в граммах одного моля этого вещества. Эта масса определяется атомным весом химической единицы, из которой состоит это вещество, в атомных единицах массы (а.е.м.).Например, атомный вес золота составляет 196,967 а.е.м., поэтому масса одного моля золота составляет 196,967 грамма. Для вещества, состоящего более чем из одного вида атомов, складывают атомные веса отдельных атомов химической единицы, из которой состоит это вещество. Вода состоит из двух атомов водорода и одного атома кислорода. Атомный вес одного атома водорода составляет 1,008 а. е.м., а двух атомов — 2,016. Атомный вес одного атома кислорода равен 15,999, поэтому молярная масса воды равна 2.016 + 15,999 = 18,015 грамма.
е.м., а двух атомов — 2,016. Атомный вес одного атома кислорода равен 15,999, поэтому молярная масса воды равна 2.016 + 15,999 = 18,015 грамма.
Узнайте о концепции закона идеального газа
Обзор того, как число Авогадро используется для измерения количества единиц любого вещества.
Encyclopædia Britannica, Inc. Посмотреть все видео к этой статьемоль , также пишется как моль , в химии стандартная научная единица измерения больших количеств очень малых объектов, таких как атомы, молекулы или другие определенные частицы. .
Родинка обозначает чрезвычайно большое количество единиц, 6.02214076 × 10 23 . Генеральная конференция по мерам и весам определила моль как это число для Международной системы единиц (СИ), действующей с 20 мая 2019 года. Ранее моль определялась как количество атомов, определенное экспериментально, которое содержится в 12 граммах углерода. 12. Число единиц в моле также носит название числа Авогадро, или константы Авогадро, в честь итальянского физика Амедео Авогадро (1776–1856).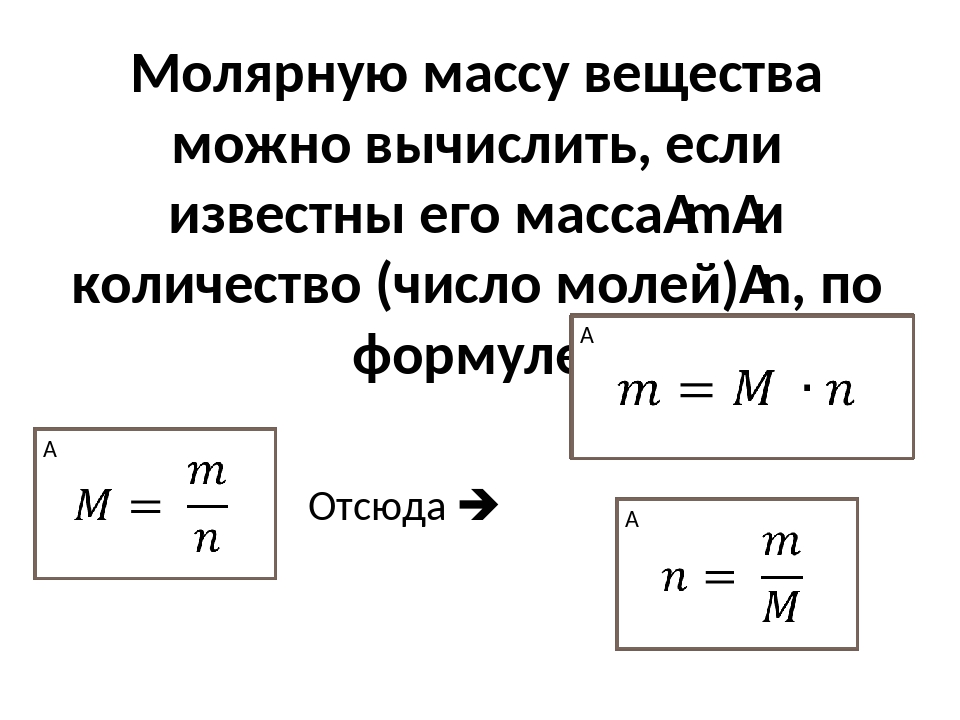 Авогадро предположил, что равные объемы газов при одних и тех же условиях содержат одинаковое количество молекул, — гипотеза, которая оказалась полезной для определения атомного и молекулярного веса и привела к понятию моля.( См. Закон Авогадро.)
Авогадро предположил, что равные объемы газов при одних и тех же условиях содержат одинаковое количество молекул, — гипотеза, которая оказалась полезной для определения атомного и молекулярного веса и привела к понятию моля.( См. Закон Авогадро.)
Количество атомов или других частиц в моле одинаково для всех веществ. Моль связан с массой элемента следующим образом: один моль атомов углерода-12 имеет 6,02214076 × 10 23 атомов и массу 12 граммов. Для сравнения, один моль кислорода по определению состоит из того же количества атомов, что и углерод-12, но имеет массу 15,999 грамма. Следовательно, кислород имеет большую массу, чем углерод. Это рассуждение также может быть применено к молекулярным или формульным весам.
Концепция крота помогает представить количественную информацию о том, что происходит в химическом уравнении, на макроскопическом уровне. Например, в химической реакции 2H 2 O → O 2 + 2H 2 два моля воды разлагаются на два моля молекулярного водорода и один моль молекулярного кислорода. Моль можно использовать для определения простейшей формулы соединения и для расчета количества, участвующего в химических реакциях. При работе с реакциями, протекающими в растворах, полезно родственное понятие молярности.Молярность ( M ) определяется как количество молей растворенного вещества в литре раствора.
Моль можно использовать для определения простейшей формулы соединения и для расчета количества, участвующего в химических реакциях. При работе с реакциями, протекающими в растворах, полезно родственное понятие молярности.Молярность ( M ) определяется как количество молей растворенного вещества в литре раствора.
Молярная масса — физико-химический курс 2 уровня
Изучение физики и химия легко и свободно — Наука для начальной школы, средней школы и средняя школа
Бесплатная химия онлайн урок для начальной школы, средней школы и старшей школы.
Молярная масса
Моляр определение массы
Определение: Коренной зуб масса химического вещества (атомарного, молекулярного или ионного) соответствует к массе моля этого химического вида. Это количество, которое можно отметить М (всегда заглавной буквой, чтобы отличить его из массы) и который может сопровождаться именем или эмпирическая формула соответствующего химического вещества, помещенная в скобках или в нижнем индексе.

В соответствии к этому определению, если мы знаем массу микроскопической частицы м частица тогда молярная масса M химического вещества определяется выражением следующая формула: М = m частица . № А (N А — постоянная Авогадро, N A = 6 022,10 23 ) Это может быть выражается как отношение массы «m» образца химических видов к количеству вещества «n», содержащемуся в этот образец. Это отношение может быть выражено следующей формулой:
М = м : п
•
• м: масса образец в граммах (г)
• п: количество вещества пробы в молях (моль) Молярная масса нуклонов
Напоминание: нуклоны – это частицы, из которых состоит атомное ядро, два вида, которые являются протонами и нейтронами.
Протоны а нейтроны имеют очень близкие массы:
• протон имеет массу 1672,10 -27 кг
• нейтрон имеет массу 1,675,10 -27 кг
Если мы ограничиваем себя точностью до 3 значащих цифр, тогда мы можем считать, что нуклон (нейтрон или протон) имеет массу 1.
 67.10 -27 кг.
67.10 -27 кг. В В этом случае молярная масса нуклонов равна:
М нуклон = m нуклон .NA
знак равно 1.67.10 -27 . 6.02-10 23 кг
знак равно 1.00-10 -3 кг/моль
знак равно 1,00 г/моль
молярная масса нуклона 1 г/моль Атомный молярная масса
Автор определение, молярная масса атомарного химического соединения соответствует к массе одного моля атомов, причем каждый атом состоит из электроны и ядро из нуклонов.Если атомный номер атом Z и количество нуклонов в нем равно A, то он состоит из:
•
Z электроны• З протоны
• А — Я нейтроны Масса атом можно рассматривать как сумму масс этих частиц но мы можем сделать следующие приближения:
• масса электронов (9.109.10 -31 кг) пренебрежимо мал по сравнению с массой нуклонов (1,67,10 -27 кг), особенно если ограничиться точностью до 3 значащих цифры, в 0.
 01. 10 -27 кг.
01. 10 -27 кг. • масса протона и нуклона одинакова, масса нуклона равна около 1.67.10 -27 кг
Таким образом, мы можем рассмотрим приближение, согласно которому масса атома равна массе нуклоны в его ядре и как нуклон имеет молярную массу 1,00 г / моль, то атомно-химический вид, число нуклонов которого равно A при этом имеет молярную массу А=1,00 г/моль.
Номер нуклонов A (также называемое массовым числом) атомно-химического вида также соответствует его молярной массе, выраженной в г/моль
Примеры
Моляр масса углерода 12 12 г/моль
что из кислород 16 составляет 16 г/моль
что из фосфор 31 31 г/моль
и Т. Д.
Знать молярная масса атомарного химического вещества, достаточно проконсультироваться Периодическую таблицу и определите число ее нуклонов.
Примечание
То периодическая таблица часто дает десятичные выражения числа нуклонов, потому что это относится к среднему числу нуклонов химический элемент в природном образце, который обычно состоит из смесь изотопов.
 Список
атомные молярные массы
Список
атомные молярные массы | Элемент | молярный
массы (г/моль) | Элемент | молярные массы (г/моль) |
| Актиний | 227,0 | Неон | 20,2 |
| Алюминий | 27,0 | Нептуний | 237,0 |
| Америций | 243,0 | Никель | 58,9 |
| Сурьма | 121,8 | Ниобий | 92,9 |
| Серебро | 107,9 | Нобелий | 259,0 |
| Аргон | 39,9 | Осмий | 190,2 |
| Мышьяк | 74,9 | Золото | 197,0 |
| Астатин | 210,0 | Кислород | 16,0 |
| Азот | 14,0 | Палладий | 106,4 |
| Барий | 137,3 | Люминофор | 31,0 |
| Берклиум | 247,0 | Платина | 195,1 |
| Бериллий | 9,0 | Отвес | 207,2 |
| Висмут | 209,0 | Плутоний | 244 |
| Борий | 264 | Полоний | 209,0 |
| Отверстие | 10,8 | Калий | 39,1 |
| Бром | 79,9 | Празеодим | 140,9 |
| Кадмий | 112,4 | Прометий | 145,0 |
| Кальций | 40,1 | Протактиний | 231,0 |
| Калифорния | 251,0 | Радий | 226,0 |
| Карбон | 12,0 | Радон | 222,0 |
| Церий | 140,1 | Рений | 186,2 |
| Цезий | 132,9 | Родий | 102,9 |
| Хлор | 35,5 | Рубидий | 85,5 |
| Хром | 52,0 | Рутений | 101,1 |
| Кобальт | 58,9 | Резерфордий | 261 |
| Медь | 63,5 | Самарий | 150,4 |
| Кюриум | 247,0 | Скандий | 45,0 |
| Дармштадтиум | 281 | Сиборгиум | 266 |
| Дубниум | 262 | Селен | 79,0 |
| Диспрозий | 162,5 | Кремний | 28,1 |
| Эйнштейний | 254,0 | Натрий | 23,0 |
| Эрбий | 167,3 | Стронций | 87,6 |
| олово | 118,7 | Сера | 32,1 |
| Европий | 152,0 | тантал | 180,9 |
| Железо | 55,8 | Технеций | 98,9 |
| Фермиум | 257,0 | Теллур | 127,6 |
| Флуор | 19,0 | Тербий | 158,9 |
| Франций | 223,0 | Таллий | 204,4 |
| Гадолиний | 157,3 | Торий | 232,0 |
| Галлий | 69,7 | Тулий | 168,9 |
| Германий | 72,6 | Титан | 47,9 |
| Гафний | 178,5 | вольфрам | 183,9 |
| Хассиум | 277 | Унунбиум | 285 |
| Гелий | 4,0 | Унунгексиум | 292 |
| Гольмий | 164,9 | Унуноктий | 294 |
| Водород | 1,0 | Унунпентиум | 288 |
| Индий | 114,8 | Унунквадиум | 289 |
| Йод | 126,9 | Унунсептиум | 292 |
| Иридиум | 192,2 | Унунтриум | 284 |
| Криптон | 83,8 | Униум | 280 |
| Лантан | 138,9 | Уран | 238,0 |
| Лоуренсиум | 260,0 | Ванадий | 50,9 |
| Литий | 6,9 | Ксенон | 131,3 |
| Лютеций | 175,0 | Иттербий | 173,0 |
| Магний | 24,3 | Иттрий | 88,9 |
| Марганец | 54,9 | Цинк | 65,4 |
| Мейтнериум | 268 | Цирконий | 91,2 |
| Менделевий | 258,0 | | |
| Меркурий | 200,6 | | |
| Молибден | 95,9 | | |
| Неодим | 144,2 | | |
Молекулярный молярная масса От определение, она соответствует массе одного моля молекул принадлежащие к одному и тому же химическому виду.
 Так как молекула состоит
атомов, связанных вместе, его можно получить добавлением атомного
молярные массы каждого из его компонентов.
Так как молекула состоит
атомов, связанных вместе, его можно получить добавлением атомного
молярные массы каждого из его компонентов.Для Например, молекула воды формулы h3O состоит из кислорода атом связан с двумя атомами водорода, поэтому один моль воды молекул содержит один моль атомов кислорода и два моля водород.
Следовательно,
молярная масса воды равна сумме молярных масс
кислорода и в два раза больше водорода, что может быть выражено
следующие отношения:
М
(вода) = М (Н 2 О)
= 2.М (Н) + М (О)
М
(вода) = 2,1,0 + 16,0
М
(вода) = 18,0 г/моль
Прочее
Примеры
Глюкоза
имеет формулу C 6 H 12 O 6 :
М
(С 6 Н 12 О 6 )
= 6.М (С) + 12.М (Н) + 6.М (О)
М
(С 6 Н 12 О 6 )
= 6.12.0 + 12.1.0 + 6.16.0
М
(С 6 Н 12 О 6 )
= 180,0 г/моль
Парацетамол
имеет формулу C 8 H 9 NO 2 :
М
(С 8 Н 9 НЕТ 2 )
= 8. М(С) + 9.М(Н) + М(Н) + 2.М(О)
М(С) + 9.М(Н) + М(Н) + 2.М(О)
М
(С 8 Н 9 НЕТ 2 )=
8.12.0 + 9.1.0 + 14.0 + 2.16.0
М
(С 8 Н 9 НЕТ 2 )
= 151,0 г/моль
Химическая промышленность виды | Формула | Молнар масса (г/моль) |
Уксусная кислота | С 2 Н 4 О 2 | 60,0 |
Бензол | С 6 Н 6 | 78,0 |
Бутан | С 4 Н 10 | 58,0 |
Кофеин | С 8 Н 10 Н 4 О 2 | 194,0 |
Хлористый водород | HCl | 36,5 |
диазот | Н 2 | 28;0 |
Дихлорид | Класс 2 | 71,0 |
Дигидроген | Н 2 | 2,0 |
Йод | я 2 | 253,8 |
Углекислый газ | СО 2 | 44,0 |
Диоксиген | О 2 | 32,0 |
Вода | Н 2 О | 18,0 |
Этан | С 2 Н 6 | 30,0 |
Этанол | С 2 Н 6 О | 46,0 |
Ибупрофен | С 13 Н 18 О 2 | 206,0 |
Метан | СН 4 | 16,0 |
Озон | О 3 | 48,0 |
Парацетамол | C 8 H 9 НЕТ 2 | 151,0 |
Пентан | С 5 Н 12 | 72,0 |
Пропан | С 3 Н 8 | 44,0 |

Пример
Ион натрия Na+: его атомно-молярная масса натрия (23,0 г/моль)
Медь 2+ ион меди: его атомная молярная масса меди (63,5 г/моль)
и др.
Мы можем сделать такое же приближение для молярной массы многоатомного иона, это сумма атомных молярных масс его элементов.
Примеры
карбонат-ион имеет химическую формулу
СО 3 2-;
его молярная масса:
М
(СО 3 2-)
= М (С) + 3.М (О)
=
12 + 3,16
=
60 г/моль
ацетат-ион имеет химическую формулу
С 2 Н 3 О 2 — ;
его молярная масса:
М
(С 2 Н 3 О 2 — )
= 2.М(С) + 3.М(Н) + 2.М(О)
=
2.12 + 3.1.0 + 2.16
=
59 г/моль
Его молярная масса может быть получен:
— Путем добавления
молярная масса катиона и аниона, если они известны
— Путем добавления
атомная молярная масса каждого элемента, как можно было бы для молекулы.
Примеры
молярная масса сульфата меди (CuSO4) может быть получена добавлением
молярная масса иона меди и сульфат-иона:
М
(CuSO 4 )
= М (Cu 2+ )
+ М (СО 4 2-)
Это
также можно определить, добавив молярную массу меди, серы и
4 молярные массы кислорода:
М
(CuSO 4 )
= М (Си) + М (С) + 4.М (О)
Более того, если масса (m) и количество вещества (n) образца чистого известны химические вещества, то молярную массу можно рассчитать по формуле соотношение, определяющее молярную массу как отношение:
М
= м : п
м = М. н
н
Это отношение может, например, быть полезным для определения массы реагенты, которые должны быть использованы в стехиометрических условиях химическое превращение.
Рассчитать количество материи То отношение, которое определяет молярную массу M химического вещества как отношение массы m образца вещества к количеству Материя «n» может быть изменена, чтобы выразить количество иметь значение:Это отношение может быть, например, полезным для определения количества вещества, полученного при химическом синтезе (или при любом хим. преображение в целом).
©2021 Физика и химия
%PDF-1.4
%
2 0 объект
[0 0 595 842]
эндообъект
3 0 объект
>
эндообъект
4 0 объект
[278 333 474 556 556 889 722 238 333 333 389 584 273 333 278 278 556 556 556 556 556 556 556 556 556 556 556 556 556 556 333 333 556 584 584 611 975 722 722 722 722 667 611 778 722 722 667 611 778 722 278 556 722 611 833 722 778 667 778 722 667 611 722 667 944 667 667 611 333 278 333 584 556 333 556 611 556 611 556 333 611 611 278 278 556 278 889 611 611 611 611 389 556 333 611 556 778 556 556 500 389 280 389 584 0 834 944 778 0 0 667 556 0 0 0 0 0 0 1000 1000 1000 350 278 278 33000 3300 500 500 500 556 1000 584 1000 944 556 556 611 611 278 333 556 556 834 556 280 556 333 737 370 556 584 333 737 333 400 584 333 333 333 611 556 278 333 333 365 278 333 333 365 556 834 834 834 611 722 722 722 722 722 722 1000 722 667 667 667 722 722 778 778 778 722 722 778 778 778 778 778 584 778 722 722 722 722 667 667 611 556 556 556 556 556 556 889 556 556 556 556 556 278 278 278 278 611 611 611 611 611 611 611 584 611 611 611 611 611 556 611 556]
эндообъект
5 0 объект
>
эндообъект
6 0 объект
>
эндообъект
7 0 объект
[278 278 355 556 556 889 667 556 333 389 584 273 333 278 278 556 556 556 556 556 556 556 556 556 556 278 278 556 556 556 278 278 584 584 584 556 1015 667 667 722 722 667 611 778 722 278 500 611 778 722 278 500 667 556 833 722 778 667 778 722 667 611 722 667 944 667 667 611 274 278 278 469 556 333 556 556 500 556 556 278 556 556 556 556 278 556 556 222 222 500 222 833 556 556 556 556 333 500 556 556 556 556 333 500 278 556 500 722 50000 500 500 334 260 334 584 0 833 944 722 0 0 0 667 500 0 0 0 0 0 0 1000 1000 1000 350 222 222 333 333 323 333 333 556 5000 584 1000 944 556 556 500 500 278 333 556 556 833 556 260 556 333 737 370 556 584 333 737 373 400 584 333 333 333 556 537 278 333 333 365 278 333 333 365 556 834 834 834 611 667 667 667 667 667 667 667 722 667 667 667 722 722 778 778 778 722 722 778 778 778 778 778 584 778 722 722 722 722 667 667 611 556 556 556 556 556 556 889 500 556 556 556 556 278 278 278 278 556 556 556 556 556 556 556 584 611 556 556 556 556 500 556 500 ]
эндообъект
8 0 объект
>
эндообъект
9 0 объект
>
эндообъект
10 0 объект
[278 278 355 556 556 889 667 556 333 389 584 273 333 278 278 556 556 556 556 556 556 556 556 556 556 278 278 556 556 556 278 278 584 584 584 556 1015 667 667 722 722 667 611 778 722 278 500 611 778 722 278 500 667 556 833 722 778 667 778 722 667 611 722 667 944 667 667 611 274 278 278 469 556 333 556 556 500 556 556 278 556 556 556 556 278 556 556 222 222 500 222 833 556 556 556 556 333 500 556 556 556 556 333 500 278 556 500 722 50000 500 500 334 260 334 584 0 833 944 722 0 0 0 667 500 0 0 0 0 0 0 1000 1000 1000 350 222 222 333 333 323 333 333 556 5000 584 1000 944 556 556 500 500 278 333 556 556 833 556 260 556 333 737 370 556 584 333 737 373 400 584 333 333 333 556 537 278 333 333 365 278 333 333 365 556 834 834 834 611 667 667 667 667 667 667 667 722 667 667 667 722 722 778 778 778 722 722 778 778 778 778 778 584 778 722 722 722 722 667 667 611 556 556 556 556 556 556 889 500 556 556 556 556 278 278 278 278 556 556 556 556 556 556 556 584 611 556 556 556 556 500 556 500 ]
эндообъект
11 0 объект
>
эндообъект
12 0 объект
>
эндообъект
13 0 объект
[278 333 474 556 556 889 722 238 333 333 389 584 273 333 278 278 556 556 556 556 556 556 556 556 556 556 556 556 556 556 333 333 556 584 584 611 975 722 722 722 722 667 611 778 722 722 667 611 778 722 278 556 722 611 833 722 778 667 778 722 667 611 722 667 944 667 667 611 333 278 333 584 556 333 556 611 556 611 556 333 611 611 278 278 556 278 811 611 611 611 611 389 556 333 611 556 778 556 556 500 389 280 389 584 0 822 944 778 0 0 667 556 0 0 0 0 0 0 1000 1000 1000 350 278 278 33000 33000 500 500 500 556 1000 584 1000 944 556 556 611 611 278 333 556 556 810 556 280 556 333 737 370 556 584 333 737 373 400 584 333 333 333 611 556 278 333 333 365 278 333 333 365 556 834 834 834 611 722 722 722 722 722 722 1000 722 667 667 667 722 722 778 778 778 722 722 778 778 778 778 778 584 778 722 722 722 722 667 667 611 556 556 556 556 556 556 889 556 556 556 556 556 278 278 278 278 611 611 611 611 611 611 611 584 611 611 611 611 611 556 611 556]
эндообъект
14 0 объект
>
эндообъект
15 0 объект
>
эндообъект
16 0 объект
[250 389 555 500 500 833 778 258 353 333 500 570 250 333 250 500 570 250 333 250 278 500 500 500 500 500 500 500 500 500 500 500 500 333 333 570 570 570 50000 832 667 667 667 722 667 667 722 778 389 500 667 611 889 722 722 611 722 667 556 611 722 667 889 667 611 611 333 278 333 570 500 333 500 500 556 500 444 353 500 556 278 444 353 500 556 278 278 500 278 778 556 500 500 500 389 389 278 556 444 667 500 444 389 448 220 348 570 0 555 889 667 0 0 0 611 444 0 0 0 0 0 1000 1000 1000 350 353 333 333 30000 500 500 500 500 5000 6006 944 722 500 500 556 556 250 389 500 556 556 250 389 500 500 747 500 220 500 333 747 266 500 606 333 747 333 400 570 300 300 333 576 500 250 333 300 300 500 750 750 750 500 667 667 667 667 667 667 944 667 667 667 667 667 667 667 667 667 389 389 389 389 722 722 722 722 722 722 722 722 722 722 722 722 722 722 722 722 722 722 611 611 500 500 500 500 500 500 500 500 722 444 444 444 444 444 278 278 278 278 500 556 500 500 500 500 500 570 500 556 556 556 556 444 500 444 ]
эндообъект
17 0 объект
>
эндообъект
18 0 объект
>
эндообъект
19 0 объект
[250 333 420 500 500 500 833 778 214 353 333 500 675 250 333 250 278 500 500 500 500 500 500 500 500 500 500 500 500 500 500 500 500 500 500 333 333 675 675 675 500 920 611 611 667 722 611 611 722 722 333 444 667 556 833 667 722 611 722 611 500 556 722 611 833 611 556 556 389 278 359 422 500 333 500 500 444 500 444 278 500 544 500 444 278 500 500 278 278 444 278 722 500 500 500 500 389 389 278 500 544 667 444 444 389 400 275 400 541 0 523 833 667 0 0 556 444 0 0 0 0 0 889 980 1000 350 333 333 333 353 556 556 556 500 889 675 944 667 500 500 500 500 500 250 389 500 500 760 500 275 500 333 760 276 500 675 333 760 333 400 675 300 300 333 500 523 250 333 300 310 500 750 750 750 500 611 611 611 611 611 611 81 611 611 611 611 611 611 333 333 333 333 722 667 722 722 722 722 722 675 722 722 722 722 722 522 722 722 722 722 556 611 500 500 500 500 500 500 500 500 667 444 444 444 444 444 278 278 278 278 500 500 500 500 500 500 500 675 500 500 500 500 500 444 500 444 ]
эндообъект
20 0 объект
>
эндообъект
21 0 объект
>
эндообъект
22 0 объект
>
>>
эндообъект
23 0 объект
>
ручей
X[b2qRNǀ»Ĺ-HhR=]\}OeF=)ѩV»1j=/>Nw+a: €. f+\Y:uj9Ghspeak(]4`H=w~waR\wJZ`Sz=ӮhyW_/
f+\Y:uj9Ghspeak(]4`H=w~waR\wJZ`Sz=ӮhyW_/
моль — BIPM
Историческая справка: Единица количества вещества, моль
После открытия фундаментальных законов химии единицы, называемые, например, «грамм-атом» и «грамм-молекула», стали использоваться для определения количества химических элементов или соединений. Эти единицы имели прямую связь с «атомными весами» и «молекулярными весами», которые на самом деле являются относительными атомными и молекулярными массами. Первые сборники «Атомных весов» первоначально были связаны с атомным весом кислорода, который по общему согласию был принят равным 16.В то время как физики разделили изотопы в масс-спектрометре и приписали значение 16 одному из изотопов кислорода, химики приписали такое же значение (слегка изменчивой) смеси изотопов 16, 17 и 18, которая для них представляла собой встречающийся в природе элемент. кислород. Соглашение между Международным союзом теоретической и прикладной физики (IUPAP) и Международным союзом теоретической и прикладной химии (IUPAC) положило конец этой двойственности в 1959-1960 гг. Физики и химики договорились точно присвоить значение 12 так называемому атомному весу, правильно называемому относительной атомной массой A r изотопа углерода с массовым числом 12 (углерод 12, 12 С).Полученная таким образом унифицированная шкала дает относительные атомные и молекулярные массы, также известные как атомная и молекулярная массы соответственно. На это соглашение не влияет переопределение моля.
Физики и химики договорились точно присвоить значение 12 так называемому атомному весу, правильно называемому относительной атомной массой A r изотопа углерода с массовым числом 12 (углерод 12, 12 С).Полученная таким образом унифицированная шкала дает относительные атомные и молекулярные массы, также известные как атомная и молекулярная массы соответственно. На это соглашение не влияет переопределение моля.
Количество, используемое химиками для определения количества химических элементов или соединений, называется «количеством вещества». Количество вещества, символ n , определяется как пропорциональное количеству указанных элементарных объектов N в образце, причем константа пропорциональности является универсальной константой, одинаковой для всех объектов.Константа пропорциональности является обратной константой Авогадро N A , так что n = N / N A . Единица количества вещества называется моль , символ моль. Следуя предложениям IUPAP, IUPAC и ISO, CIPM разработал определение моля в 1967 г. и подтвердил его в 1969 г., указав, что молярная масса углерода-12 должна составлять ровно 0,012 кг/моль. Это позволило определить количество вещества n S ( X ) любой чистой пробы S вещества X непосредственно из массы пробы m S и молярной массы M ( X ) объекта X , молярная масса которого определяется по его относительной атомной массе A r (атомной или молекулярной массе) без необходимости точного знания постоянной Авогадро, с использованием соотношений
Следуя предложениям IUPAP, IUPAC и ISO, CIPM разработал определение моля в 1967 г. и подтвердил его в 1969 г., указав, что молярная масса углерода-12 должна составлять ровно 0,012 кг/моль. Это позволило определить количество вещества n S ( X ) любой чистой пробы S вещества X непосредственно из массы пробы m S и молярной массы M ( X ) объекта X , молярная масса которого определяется по его относительной атомной массе A r (атомной или молекулярной массе) без необходимости точного знания постоянной Авогадро, с использованием соотношений
7 S
( x ) = M S / ( M ( x ), и M ( x ) = A R ( x ) G / мольТаким образом, это определение моля зависело от артефактного определения килограмма.
Численное значение постоянной Авогадро, определенной таким образом, было равно числу атомов в 12 граммах углерода 12.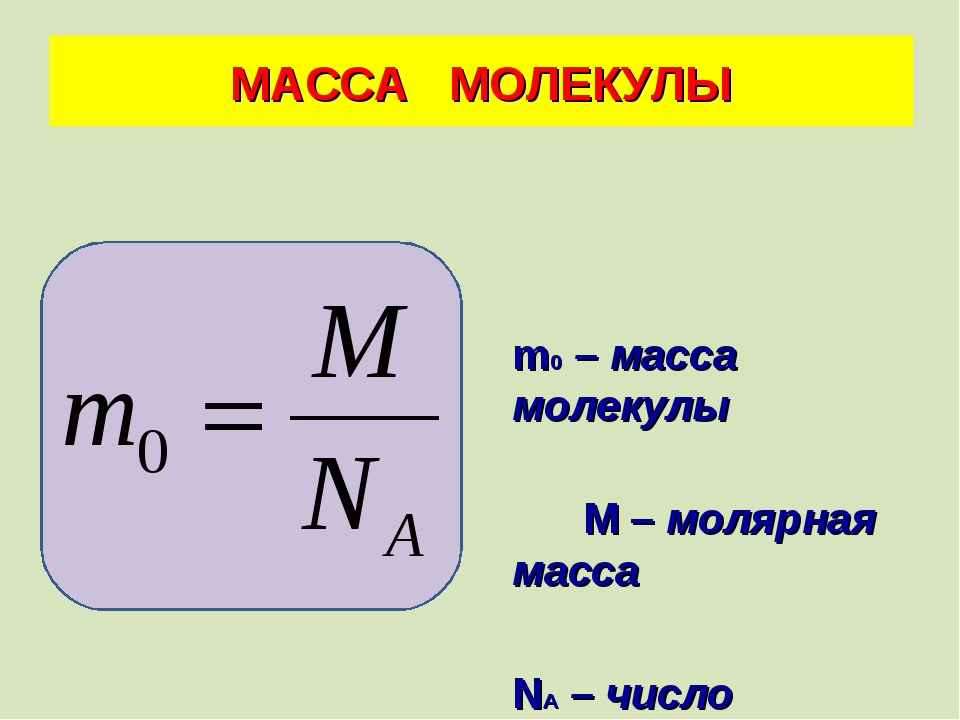 Однако благодаря недавним технологическим достижениям это число теперь известно с такой точностью, что более простое и универсальное определение моль стала возможной, а именно за счет указания точного числа сущностей в одном моле любого вещества, зафиксировав таким образом числовое значение постоянной Авогадро. Это приводит к тому, что новое определение моля и значение постоянной Авогадро больше не зависят от определения килограмма.Тем самым подчеркивается различие между принципиально различными величинами «количество вещества» и «масса». Нынешнее определение моля, основанное на фиксированном числовом значении постоянной Авогадро, N A , было принято в Резолюции 1 26-й сессии ГКМВ (2018 г.).
Однако благодаря недавним технологическим достижениям это число теперь известно с такой точностью, что более простое и универсальное определение моль стала возможной, а именно за счет указания точного числа сущностей в одном моле любого вещества, зафиксировав таким образом числовое значение постоянной Авогадро. Это приводит к тому, что новое определение моля и значение постоянной Авогадро больше не зависят от определения килограмма.Тем самым подчеркивается различие между принципиально различными величинами «количество вещества» и «масса». Нынешнее определение моля, основанное на фиксированном числовом значении постоянной Авогадро, N A , было принято в Резолюции 1 26-й сессии ГКМВ (2018 г.).
vik dhillon: phy213 — физика звездных недр молекулярная масса
vik dhillon: phy213 — физика звездных недр — среднее значение молекулярная масса Теперь мы должны получить выражение для средней молекулярной массы , для использования в
уравнение состояния, которое мы имеем
только что сформулировал.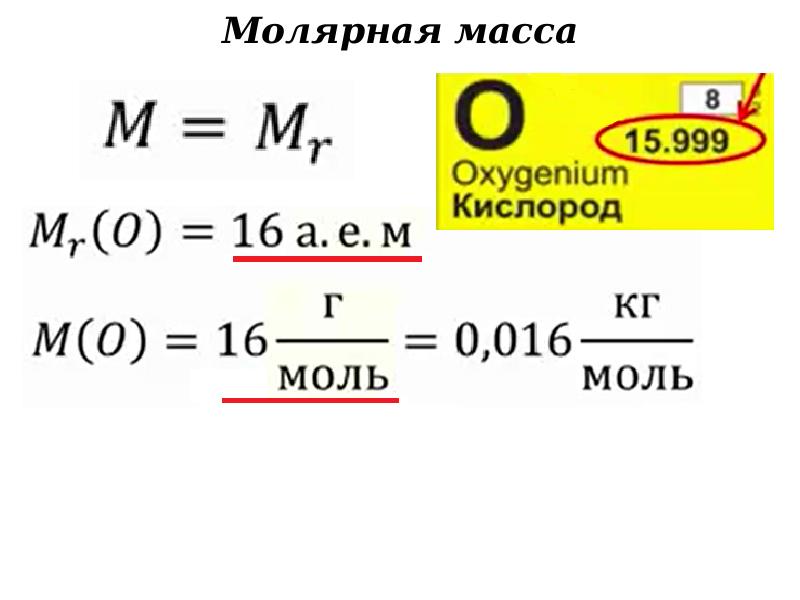
Точный расчет очень сложно, так как зависит на фракционную ионизацию всех элементов во всех частях звезда. К счастью, мы можем чрезвычайно упростить вещи и только внести небольшую погрешность в расчет из , предполагая, что все вещество в звезде полностью ионизировано . Это правильное предположение потому что водорода и гелия гораздо больше, чем всех другие элементы, и они, безусловно, полностью ионизированы в звездных недрах.Однако вблизи холодной звездной поверхности, где водород и гелий не полностью ионизированный, предположение нарушается.
Если предположить, что весь звездный материал полностью ионизирован, расчет происходит следующим образом. Позволять определим:
X = массовая доля материала в виде водорода,
Y = массовая доля материала в виде гелия и
Z = массовая доля материала в виде более тяжелых элементов .
Отсюда
X + Y + Z = 1.
Это означает, что в кубическом метре звездного вещества плотности , имеется масса
X водорода,
Y гелия и
Z
80 9,8180 более тяжелых элементов.Теперь в полностью ионизированном газе
| 2 частицы на м H | (протон и электрон), | |
| 3/4 частицы на м H | (ядро, содержащее 2 протона и 2 нейтрона = 4 m H и два электрона), и | |
| ~1/2 частицы на м H | (т. е.г. Углерод дает ядро, содержащее 6 протонов и 6 нейтронов =
12 m H и шесть электронов = 7/12,
Кислород дает ядро, содержащее 8 протонов и 8 нейтронов =
16 m H и восемь электронов = 9/16 и т.д.) е.г. Углерод дает ядро, содержащее 6 протонов и 6 нейтронов =
12 m H и шесть электронов = 7/12,
Кислород дает ядро, содержащее 8 протонов и 8 нейтронов =
16 m H и восемь электронов = 9/16 и т.д.) |
Таким образом, количество частиц на кубический счетчик из-за
гидрогена = 2 / M H ,
Гелия = 3 Y /4 M H , а также
тяжелые элементы = Z / 2 м H .
Общее количество частиц на кубический метр определяется сумма вышеперечисленного, т.е.
n = (2 X / m H ) + (3 Y / 4 м H ) + ( Z / 2 м H ).
Переставляя, получаем:
n = ( / 4 м Н )
(8 X + 3 Y + 2 Z ).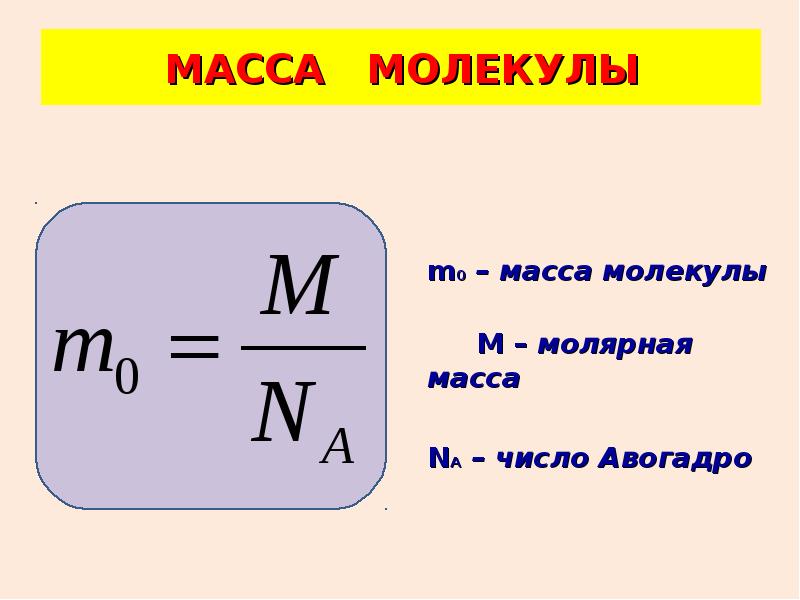
Теперь X + Y + Z = 1, и, следовательно, Z = 1 — X — Y , что дает:
n = ( / 4 м H ) (6 X + Y + 2).
Напоминая, что = нм H , мы можем написать:
= 4 / (6 X + Y + 2), 18 9019 хорошее приближение за исключением холодных внешних областей звезд.Для солнечной композиции, Х =0,747, Y =0,236 и Z =0,017, в результате ~ 0,6, т.е. средняя масса частиц на Солнце чуть больше половины масса протона.
© Вик Диллон, 27 сентября 2010 г.
Определение, формула, уравнение, расчет и применение
Молярная теплоемкость – это количество тепла, необходимое для повышения температуры 1 моля вещества на 1 единицу, и рассчитывается путем деления теплоемкости на общее количество молей.

Вы когда-нибудь задумывались, почему мы не обжигаемся, используя сковороду?
Конечно, нас защищает именно ручка, но почему она не нагревается так же, как и сама сковорода? Ведь он подвергается одинаковому количеству тепла.
Во-первых, ручка кастрюли обычно пластиковая, а это значит, что она плохо проводит тепло. Кроме того, при одинаковом тепловом воздействии повышение температуры пластиковой ручки намного меньше, чем у металлической части.Это связано с высокой теплоемкостью ручки по сравнению с металлом, из которого сделана кастрюля.
Теплоемкость определяется как количество тепловой энергии, необходимое для повышения температуры данной массы вещества на одну единицу. Удельная теплоемкость и молярная теплоемкость являются свойствами, производными от теплоемкости материала.
Благодаря высокой теплоемкости ручки она не нагревается так сильно, как сама сковорода (Фото: Kzenon/Shutterstock).
Рекомендуемое видео для вас:
Удельная теплоемкость и Молярная теплоемкость
Теплоемкость является обширным свойством, т.е.э., это зависит от количества и размера вещества. Модифицированная форма теплоемкости (называемая удельной теплоемкостью или просто удельной теплоемкостью) обычно используется в физике. Удельная теплоемкость не зависит от количества вещества и, следовательно, является более полезным свойством.
Удельная теплоемкость определяется как количество теплоты, необходимое для повышения температуры одной единицы массы вещества на 1 единицу температуры. Математически это теплоемкость вещества, деленная на его массу. Формула для удельной теплоемкости:
Здесь с — удельная теплоемкость, выраженная в Дж/кг.K, C — теплоемкость вещества в Дж/К, m — масса вещества в килограммах. Еще одна очень важная формула, используемая для выражения удельной теплоемкости:
Здесь также c обозначает удельную теплоемкость, ΔQ — разность тепловой энергии в джоулях, m — масса вещества, ΔT — разность температур. в Кельвине.
в Кельвине.
В химии, где количество вещества обычно измеряется в молях, а не в граммах, дальнейшее изменение определения и формулы теплоемкости с включением молей значительно упрощает задачу.
Молярная теплоемкость определяется как количество тепла, необходимое для нагревания 1 моля вещества на 1 градус Кельвина. Как и удельная теплоемкость, молярная теплоемкость является интенсивным свойством, т. е. не зависит от количества вещества.
Математически это теплоемкость вещества, деленная на число молей, и выражается как:
Здесь см — молярная теплоемкость (Дж/К.моль), C — теплоемкость (Дж/К. ), а n — количество молей (моль).
Удельная теплоемкость и молярная теплоемкость могут не зависеть от количества или размера вещества, но их значения колеблются в зависимости от метода определения.
При подводе тепловой энергии к веществу, в частности газам, повышение температуры сопровождается увеличением либо объема, либо давления, а иногда и того и другого. Эти явления объясняются законом Шарля и законом Гей-Люссака.
Эти явления объясняются законом Шарля и законом Гей-Люссака.
CP,m и CV,m часто используются для представления молярных теплоемкостей, измеренных при постоянном давлении (изобарическом) и постоянном объеме (изохорном).
Значение молярной теплоемкости при постоянном давлении всегда больше, чем значение, измеренное при постоянном объеме. Это связано с тем, что тепло, подаваемое при постоянном давлении, используется для производства работы, а также для увеличения объема. Напротив, теплота, поступающая при постоянном объеме, полностью используется для повышения температуры вещества.
Отношение CP и CV называется коэффициентом теплоемкости или показателем адиабаты (γ = CP/CV) и является важным термином при работе с обратимыми процессами в термодинамике.С другой стороны, разница между CP,m и CV, m равна универсальной газовой постоянной R. Выражение CP,m – CV, m = R называется соотношением Майера.
Как рассчитать молярную теплоемкость вещества?
Определение теплоемкости вещества, а затем его удельной теплоемкости и молярной теплоемкости — это не совсем ракетостроение. Значения можно рассчитать, просто разбив их определения, найдя отдельные величины (количество подведенного или отведенного тепла, начальную температуру, конечную температуру, массу и количество молей вещества) и подставив их на соответствующие места в таблице. формулы.
Значения можно рассчитать, просто разбив их определения, найдя отдельные величины (количество подведенного или отведенного тепла, начальную температуру, конечную температуру, массу и количество молей вещества) и подставив их на соответствующие места в таблице. формулы.
Шаг 1: Определение теплоемкости
Как уже было определено, теплоемкость – это количество тепла, необходимое для повышения температуры известного количества вещества на одну единицу. Определение выражается как:
Здесь C — теплоемкость, Q — тепловая энергия, а ΔT — разность температур. ΔQ также может заменить Q.
ΔT – это T1-T2, где T1 – начальная температура, а T2 – конечная температура вещества. Начните с записи начальной/начальной температуры T1 с помощью термометра.Кроме того, взвесьте образец (м) и запишите значение в кг для последующего использования.
Затем подайте известное количество тепловой энергии (Q) в систему. Количество тепловой энергии может быть указано либо в джоулях, либо в калориях. Как только вы закончите подачу тепла, подождите, пока температура стабилизируется, и запишите конечную температуру как T2.
Как только вы закончите подачу тепла, подождите, пока температура стабилизируется, и запишите конечную температуру как T2.
Преобразуйте значение температуры в градусы Кельвина, добавив число 273,15 к значению в градусах Цельсия (0°C = 273,15 K). Если значение подведенной тепловой энергии доступно в калориях, переведите его в джоули.Умножьте количество тепловой энергии в калориях на 4,184, чтобы получить количество в джоулях (1 кал = 4,184 джоуля).
Наконец, подставьте значения Q, T1 и T2 в формулу теплоемкости. Возьмите калькулятор или используйте свой мозг, чтобы выполнить расчеты и получить теплоемкость образца. Единицы теплоемкости – Дж/К.
Шаг 2: Определение удельной теплоемкости или удельной теплоемкости
Удельную теплоемкость или удельную теплоемкость можно легко найти, разделив теплоемкость образца на его массу (c = C/m).Продолжайте и разделите значение C, найденное на предыдущем шаге, на значение m, также отмеченное на предыдущем шаге, чтобы получить удельную теплоемкость образца.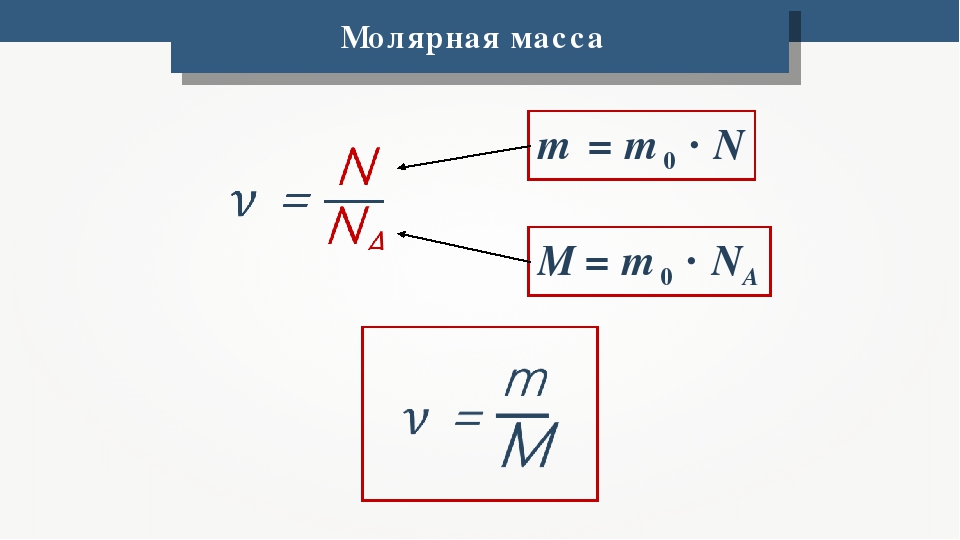 Полученное количество будет иметь единицы Дж/кг.K
Полученное количество будет иметь единицы Дж/кг.K
Шаг 3: Определение молярной теплоемкости
Если вы прокрутите назад и посмотрите на формулу для молярной теплоемкости (см = C/n), вы найдете член «n», представляющее количество молей образца. Чтобы найти количество молей, разделите количество образца на его молярную массу.
Теперь, когда вы нашли n, подставьте значение теплоемкости (C) и число молей (n) в формулу и рассчитайте молярную теплоемкость.
Другой метод определения молярной теплоемкости заключается в умножении удельной теплоемкости (с) образца на его молярную массу (М). При этом не забудьте перевести молярную массу в кг/моль.
Альтернативный метод – использование калориметра
Другим методом определения удельной теплоемкости вещества является использование калориметра.Калориметр представляет собой научный прибор, состоящий из следующих частей: внутреннего и внешнего сосудов, мешалки, термометра, изоляционного материала и т. д.
д.
Внутренний сосуд или чашка содержит образец материала, удельную теплоемкость которого необходимо определить. Он помещается в середине внешнего сосуда, наполненного водой.
Процедура начинается с определения массы и начальной температуры воды и исследуемого вещества.
Калориметр используется для измерения теплового потока в реакции; этот метод называется калориметрией.(Фото предоставлено Фуадом А. Саадом/Shutterstock)
Затем образец нагревается с помощью проводов зажигания. Когда температура образца поднимается выше температуры наружной воды, начинается теплообмен между ними. Через некоторое время электрический поток отключают и измеряют конечные температуры воды и образца. Тепловая энергия, потерянная материалом образца, будет равна теплу, полученному водой во внешнем сосуде. Воспользуемся теперь формулой ΔQ = mcΔT.
Для пробы ΔQs= (mcΔT)s, а для воды ΔQw=(mcΔT)w.
Но ΔQs = ΔQw. Таким образом, (mcΔT)s = (mcΔT)w.
Подставьте значения массы образца и воды (ms и mw соответственно), изменения температуры (ΔTs = T1s-T2s и ΔTw = T1w-T2w) и удельной теплоемкости воды (cw) как 4,1796 кДж/кг. К для определения удельной теплоемкости образца (cs). Как только удельная теплоемкость вещества будет найдена, умножив ее на молярную массу, вы получите молярную теплоемкость вещества.
К для определения удельной теплоемкости образца (cs). Как только удельная теплоемкость вещества будет найдена, умножив ее на молярную массу, вы получите молярную теплоемкость вещества.
Применение теплоемкости
Теплоемкость вещества определяет, где и когда его можно использовать. Например, ручки и ручки посуды изготавливаются из материалов с высокой теплоемкостью для обеспечения безопасности пользователя. С другой стороны, термометры изготавливаются из материалов с низкой удельной теплоемкостью, чтобы обнаруживать даже малейшие колебания температуры.
Другим примером этого является использование воды в системах охлаждения двигателей.Вода имеет наибольшую удельную теплоёмкость из всех жидкостей. При том же количестве тепла повышение температуры воды минимально, что делает его идеальным выбором в качестве охлаждающей жидкости/агента.
Феномен, когда морская вода остается холоднее окружающего воздуха и песка в жаркий летний день, несмотря на то, что она подвергается воздействию такого же количества солнечного тепла, также может быть объяснено понятием теплоемкости: высокая теплоемкость воды отвечает за многие природные явления, включая климат Земли и выживание водной жизни!
Проверьте, насколько хорошо вы понимаете молярную теплоемкость
Можете ли вы ответить на несколько вопросов, основанных на статье, которую вы только что прочитали?
Начать викторинуВаш ответ:
Правильный ответ:
СледующийВы получили {{SCORE_CORRECT}} из {{SCORE_TOTAL}}
Повторная викторина .
