Физические свойства неметаллов — урок. Химия, 8–9 класс.
Из \(118\) известных на данный момент химических элементов \(22\) элемента образуют простые вещества, обладающие неметаллическими свойствами. Неметаллических простых веществ намного больше, чем самих неметаллических химических элементов. Причиной тому служит существование явления, называемого аллотропией.
Аллотропия — это способность атомов данного химического элемента образовывать несколько простых веществ, называемых аллотропными видоизменениями, или аллотропными модификациями.
Например, химический элемент кислород \(O\) образует простое вещество кислород O2, молекула которого состоит из двух атомов, и простое вещество озон O3, молекула которого состоит из трёх атомов данного элемента.
Химический элемент фосфор \(P\) образует множество аллотропных видоизменений, важнейшими из которых являются красный фосфор и белый фосфор.
Химический элемент углерод \(C\) образует встречающиеся в природе модификации — алмаз и графит.
Аллотропные видоизменения, образуемые одним и тем же химическим элементом, существенно отличаются между собой как по строению, так и по свойствам.
Аллотропия присуща не всем неметаллических химическим элементам.
Например, водород, азот, элементы \(VII\)A и \(VIII\)A групп не имеют аллотропных модификаций, т. е. каждый из упомянутых элементов образует только одно простое вещество.
Кристаллическая решетка неметаллов
Причина большого разнообразия физических свойств неметаллов кроется в различном строении кристаллических решёток этих веществ.
Часть неметаллов имеет атомную кристаллическую решетку. Кристаллы таких веществ состоят из атомов, соединённых между собой прочными ковалентными связями. Такие неметаллы находятся в твёрдом агрегатном состоянии и являются нелетучими. Примерами таких веществ служат алмаз, графит, красный фосфор и кремний.
Рис. \(1\). Модели кристаллических решёток алмаза (слева) и графита.
Кристаллы этих аллотропных видоизменений состоят из атомов углерода, соединённых между собой ковалентными связями. Кристаллы графита, в отличие от кристаллов алмаза, сложены из отдельных слоёв, которые располагаются друг по отношению к другу подобно тому, как листы бумаги — в книге
Другая часть неметаллов имеет молекулярную кристаллическую решетку. В этом случае в каждой молекуле атомы соединены достаточно прочно ковалентной связью, а вот отдельные молекулы друг с другом в кристаллах вещества связаны очень слабо. Поэтому вещества молекулярного строения при обычных условиях могут быть газами, жидкостями или легкоплавкими твёрдыми веществами.
Кислород O2, озон O3, азот N2, водород h3, фтор F2, хлор Cl2, бром Br2, иод I2, белый фосфор P4, кристаллическая сера S8 и инертные газы — это всё вещества, кристаллы которых состоят из отдельных молекул (а в случае инертных газов — из отдельных атомов, как бы выполняющих роль молекул).
Рис. \(2\). Модель молекулы серы (слева) и кристалл серы.
Кристалл серы состоит из отдельных молекул \(S_8\)
Физические свойства неметаллов
Свойства неметаллических простых веществ отличаются большим разнообразием. Собственно говоря, их объединяет только то, что они, как правило, не обладают теми физическими свойствами, которые типичны для металлов, т. е. не обладают характерным металлическим блеском, ковкостью, пластичностью, высокой тепло- и электропроводностью.
Агрегатное состояние
Неметаллы при обычных условиях могут быть газообразными, жидкими и твёрдыми веществами.
Газообразными неметаллами являются гелий \(He\), неон \(Ne\), аргон \(Ar\), криптон \(Kr\), ксенон \(Xe\) и радон \(Rn\). Их называют инертными (или благородными) газами. Каждая «молекула» инертного газа состоит только из одного атома.
Их называют инертными (или благородными) газами. Каждая «молекула» инертного газа состоит только из одного атома.
Такие химические элементы, как водород \(H\), кислород \(O\), азот \(N\), хлор \(Cl\), фтор \(F\) образуют газообразные вещества, состоящие из двухатомных молекул, соответственно — h3, O2, N2, Cl2, F2.
Из неметаллических простых веществ при обычных условиях жидкостью является только бром, молекулы которого двухатомны — Br2.
Остальные неметаллические химические элементы при обычных условиях находятся в твёрдом агрегатном состоянии. Например, химический элемент углерод образует такие твёрдые вещества, как алмаз и графит. Твёрдыми являются кристаллическая сера S8, фосфор красный и фосфор белый P4, кристаллический иод I2.
Цвет и блеск
Только некоторые неметаллы в отличие от металлов имеют блеск. Например, кристаллический иод, кремний и графит не похожи на остальные неметаллы — они имеют блеск, несколько напоминающий блеск металлов.
Например, кристаллический иод, кремний и графит не похожи на остальные неметаллы — они имеют блеск, несколько напоминающий блеск металлов.
В отличие от металлов, большинство которых имеют серебристо-серый цвет, окраска неметаллов очень разнообразна. Белый цвет имеет белый фосфор, красный — красный фосфор, жёлтый — сера и фтор, красно-бурый — жидкий бром, жёлто-зелёный — хлор, фиолетовый цвет имеют пары иода, синий — жидкий кислород, серый — графит и кремний. Бесцветным является алмаз, окраски не имеют также инертные газы, азот, кислород и водород.
Рис. \(3\). Алмаз
| Рис. \(4\). Иод
|
Рис. | Рис. \(6\). Хлор |
Неметаллы могут находиться в твёрдом, жидком и газообразном агрегатных состояниях.
Запах
Некоторые неметаллы имеют запах. Например, резкий удушливый запах имеют озон O3, фтор F2 (при попадании в органы дыхания практически моментально разрушает ткани), хлор Cl2, бром Br2 и иод I2.
Пластичность
Неметаллы в твёрдом агрегатном состоянии не обладают пластичностью. Они являются хрупкими.
Электро- и теплопроводность
Неметаллы, за исключением графита, плохо проводят тепло и практически не проводят электрический ток (являются диэлектриками).
Источники:
Рис. 1. Модели кристаллических решёток алмаза (слева) и графита. https://image.shutterstock.com/image-vector/illustration-chemical-carbon-has-several-600w-1717122967.jpg
Рис. 2. Модель молекулы серы (слева) и кристалл серы.
https://image.shutterstock.com/image-vector/illustration-chemical-allotropes-sulfur-including-600w-1732938125.jpg
https://www.shutterstock.com/ru/image-photo/yellow-natural-native-sulfur-crystal-isolated-729259936
Рис. 3. Алмаз https://cdn.pixabay.com/photo/2014/10/24/08/09/diamond-500872_960_720.jpg
Рис. 4. Иод https://image.shutterstock.com/image-photo/solid-iodine-sublimation-flushing-experiment-600w-1409329922.jpg
Рис. 5. Бром https://image.shutterstock.com/image-photo/macroview-on-ampoule-element-no-600w-1739647871.jpg
Рис. 6. Хлор https://image.shutterstock.com/image-photo/chlorine-gaz-glass-round-bottom-600w-713676862.jpg
Конспект урока «Великий русский ученый Д.И.Менделеев и его учение о периодичности» — К уроку — Химия
МОУ Михалёвская СОШ
Открытый урок по теме:
«Великий русский учёный
Дмитрий Иванович Менделеев
и его учение о периодичности»
Автор:
Налимова О. М.
–
М.
–
учитель химии.
— 2008 —
Содержание работы
Стр.
I. Введение 4
II. Конспект урока по химии (методическое руководство) 5 — 9
III. Приложения:
1) Тестовая работа. 10 — 11
2) Рейтинговая оценка творческих работ учащихся 12
3) Рефлексия 13
4) Электронные приложения:
А) презентация учителя к уроку «Великий русский учёный Д.И.Менделеев и его учение о периодичности»
Б) презентации учащихся:
№ 1. Слайд – фильм «Д.И.Менделеев»
№ 2. Исследовательский проект «Научный подвиг Менделеева»
№ 3. Буклет 1. «Великий русский ученый Д.И.Менделеев»
№ 4. Буклет 2. «Великий закон»
№5. Листовка. «Заветы Менделеева»
Введение.
Работа посвящена
175-летию со дня рождения Д.И.Менделеева
и 140-летию открытия Периодического
закона.
О нашем великом соотечественнике написано много и интересно. Энциклопедичность знаний ученого, разносторонние интересы и жажда жизни до сих пор восхищают не одно подрастающее поколение.
Выбор темы не случаен. Ведь имя Дмитрия Ивановича сопровождает учащихся все четыре года обучения химии. А глубокое изучение периодического закона и периодической системы химических элементов – залог успеха в усвоении всего курса неорганической химии средней школы.
Опыт показывает, что интерес к предмету повышается, когда ребята сами, непосредственно принимают активное участие в исследовательской работе, создавая проекты, презентации, публикации. Они систематизируют огромный теоретический материал, отбирая нужное, обобщая и сравнивая.
На помощь учителю и учащимся приходят новые современные компьютерные технологии и интернет.
Очень хочется
надеяться, что данная работа заинтересует
учителей – предметников, классных
руководителей при подготовке к урокам
и мероприятиям, связанным с жизнью и
деятельностью выдающегося русского
ученого – естествоиспытателя Дмитрия
Ивановича Менделеева.
III. Конспект урока по химии
МОУ Михалёвская СОШ
Ивановская область, Ивановский район, п. Михалёво
Учитель химии: Налимова О.М.
Презентация.
Методическое руководство к уроку.
Класс – 11
Тема урока: «Великий русский ученый Д.И.Менделеев и его учение о периодичности».
Место урока в образовательном процессе:
тема: «Периодический закон и периодическая система Д.И.Менделеева в свете учения о строении атома».
Тип урока: обобщающий семинар.
Эпиграфом к уроку хотелось бы предложить слова Д.И.Менделеева «Мне бы хотелось, чтобы следы моих жизненных усилий остались прочные, конечно, не навеки, но на долгое время».
Цели урока: 1) повторить и обобщить знания учащихся по теме.
2) ознакомить учащихся с
жизнью и разносторонней деятельностью
Д.И.Менделеева. На основе
проблемного подхода формировать у
учащихся чувство гордости за отечественных
ученых и отечественную науку.
3) проверить прочность знаний , умений и навыков учащихся по данной теме.
4) проверить выполнение творческих заданий учащихся.
Задачи:
Образовательные:
— обобщение, расширение знаний учащихся о жизнедеятельности великого русского ученого и его влиянии на развитие химии,
— закрепление умений и навыков при работе с периодической системой и периодическим законом.
Воспитательные:
— доказать учащимся ведущую роль теории в познании практики,
— показать учащимся взаимосвязь периодической системы и периодического закона,
— привитие русского менталитета и чувства гордости за отечественную науку.
Развивающие:
— развивать умения обобщать и применять полученные знания,
— развивать интерес к предметам естественно-научного цикла,
— развивать познавательную активность и творческую деятельность,
— развивать логическое мышление путем сравнения, обобщения, анализа, систематизации.
Методы обучения:
эвристический, частично-поисковый,
проблемный.
Структура урока: 1) Актуализация знаний.
2) Историческая справка.
3) Разминка.
4) Работы предшественников Менделеева.
5) Периодический закон Д.И.Менделеева и его современные формулировки.
6) Блиц-турнир (о жизнедеятельности Д.И.Менделеева)
7) Выполнение заданий по теме (работа в парах).
8) Значение Периодического закона и Периодической системы
Д.И.Менделеева.
9) Закрепление (тестовая работа с взаимопроверкой).
10) Отчет учащихся о выполнении творческих заданий ( презентации,
буклеты, листовки, доклады, рефераты, стенгазета). Рейтинговая оценка
творческих работ учащихся.
11) Подведение итогов. Рефлексия.
12) Дифференцированное домашнее задание.
Оборудование: комплекс «Компьютер + проектор», раздаточный материал (см. Приложение к уроку)
Оформление:
— стенд, посвященный 175-летию со дня рождения Д.И.Менделеева и 140-летию со дня открытия Периодического закона,
— выставка творческих работ учащихся о
жизнедеятельности Д. И.Менделеева и
книг, посвященных ученому,
И.Менделеева и
книг, посвященных ученому,
— портрет Д.И.Менделеева со словами «Сам удивляюсь, чего я только не делывал на своей научной жизни»,
— карта путешествий Менделеева,
— презентация работ учащихся: слайд-фильма «Д.И.Менделеев», исследовательского проекта «Научный подвиг Менделеева», буклетов, листовок.
ХОД УРОКА.
I. Организационный момент (приветствие учащихся, определение их готовности к уроку).
II. Актуализация знаний.
Учитель зачитывает слова академика Овчинникова «Имя ….. бессмертно. Мечтательность его легендарна, а подвиг научный благодарное человечество не забудет никогда. Жизнь великого человека всегда достойна подражания… И пусть будет для нас примером, пусть вдохновляет нас во всех делах на благо Родины и народа, во имя прогресса и мира на земле. Величественная фигура гениального ученого, творца главного закона Современной химии, славного сына и гражданина земли русской, нашего соотечественника ……(слайд 1)
О каком учёном идет
речь? ( уч-ся отвечают: о
Д. И.Менделееве)
И.Менделееве)
Учитель: один известный философ сказал: «Менделеев… совершил научный подвиг, который смело можно поставить рядом с открытием Леверье, вычислившего орбиту ещё неизвестной планеты Нептун»
О каком научном подвиге Менделеева говорится? (уч-ся отвечают: об открытии Периодического закона и Периодической системы химических элементов).
Учитель: итак, тема нашего урока:
«Великий русский ученый Д.И.Менделеев и его учение о периодичности».(слайд 2)
Совместное целеполагание. Формулировка цели урока и осознание её учащимися. Ребята, совместно с учителем формулируют цели урока. ( фронтальное заслушивание ответов) (слайд 3)
Учитель знакомит учащихся с формами работы и видами их оценивания на уроке.
Историческая справка. Д.И.Менделеев. Биография. (слайд 4)
Разминка (включает вопросы по периодическому закону и периодической системе, несложные задачи):
дайте первую (менделеевскую) формулировку периодического закона;
дайте две современные формулировки периодического закона;
назовите три хим. элемента, которые
предсказал и описал Менделеев;
элемента, которые
предсказал и описал Менделеев;
в чем отличие электронных конфигураций элементов главных и побочных подгрупп;
определите элемент VI группы периодической системы, высший оксид которого имеет молярную массу, равную 80 г/моль;
Работы предшественников Менделеева (А знаете ли вы, что…) (слайд 5)
До Менделеева было предпринято около 50 попыток классифицировать хим. элементы. Но все они оказались неудачными.
Вот некоторые из них:
И.Деберейнер (1829 г.) – триады элементов
Г.И.Гесс (1849 г.) – 4 группы элементов-неметаллов
А.Бегье де Шанкуртуа (1862 г.) – спираль линия на поверхности цилиндра
А.Ньюлендс (1866 г.) – закон октав
Л.Мейер (1864 г. ) – кривая ( 6 групп по
валентности элемента)
) – кривая ( 6 групп по
валентности элемента)
Блиц-турнир. (слайд 6)
Сколько раз при жизни Менделеева была издана его книга «Основы химии»?
Где находятся вулкан и кратер Менделеева?
С каким великим русским революционером – демократом и выдающимся литературным критиком учился Менделеев в Главном педагогическом институте в Петербурге?
Кто из русских поэтов посвятил стихотворение Дмитрию Ивановичу?
Кто из известных художников писал одновременно портреты Менделеева? Где они находятся?
Где установлены памятники Менделееву?
Учитель предлагает выполнение заданий по теме (работа в парах) (слайд 7)
Объясните двойственное положение элемента водорода в Периодической системе.
Электронная формула атома 1S22S22P63S23P4.
Определите элемент, напишите для него
формулы высшего оксида и гидроксида,
летучего водородного соединения,
укажите их характер.
На каком основании элементы хлор и марганец помещают в одной группе Периодической системы? Почему их помещают в разных подгруппах?
Проверка выполнения работы. Обсуждение.
III. Закрепление.
Учитель: Каково значение Периодического закона и Периодической системы Д.И.Менделеева? (заслушивание ответов у доски). Общие выводы (слайд 8)
Периодический закон и Периодическая система позволили:
установить взаимную связь между элементами и объединить их по свойствам;
расположить элементы в естественной последовательности;
вскрыть периодичность, т.е. повторяемость общих свойств отдельных элементов и их соединений;
исправить и уточнить относительные атомные массы отдельных элементов
исправить и уточнить степени окисления отдельных элементов
предсказать и описать свойства, указать путь открытия ещё неоткрытых элементов (триумф Периодического закона при открытии Ga, Sc, Ge)
Учитель предлагает тестовую работу по теме «Строение атома» (взаимопроверка) (ответы, слайд 9)
(см. Приложения)
Приложения)
IV. Отчет учащихся о выполнении творческих заданий.
подведение итогов выполнения творческих работ по теме (учитель обращает внимание ребят на выставку творческих работ и отмечает лучшие работы)
показ презентаций и публикаций: Буклет 1 «Великий русский ученый Д.И.Менделеев», Буклет 2 «Великий закон», Листовка «Заветы Менделеева» (см. Приложения)
а) слайд-фильм «Д.И.Менделеев»
б) исследовательский проект «Научный подвиг Менделеева»
Проект посвящен 175-летию со дня рождения Д.И.Менделеева и 140-летию открытия Периодического закона.
Основополагающий вопрос: Как повлиял Менделеев на развитие химической науки?
Цели: 1) изучить основные этапы становления научной теории (предпосылки,
формулирование обобщения, её дальнейшее развитие)
2) выявить, каким образом личностные качества ученого способствовали гениальному открытию.
Гипотеза исследования:
Открытие Менделеевым Периодического
закона – научный подвиг.
Ход исследования и проблемные вопросы, его отображающие.
Почему ни одному из предшественников Менделеева не удалось открыть Периодический закон? (изучение и анализ работ, предшественников Менделеева)
Что предвидел Менделеев, благодаря своей величайшей интуиции и чем рисковал во имя великой цели? (по страницам учебника «Основы химии» и различных трудов Менделеева)
Каким образом личностные качества Менделеева способствовали открытию закона? (характеристика личности ученого по высказываниям ученых того времени, изучение жизни и деятельности Дмитрия Ивановича из различных информационных источников)
Каким образом открытие периодического закона способствовало дальнейшему развитию химии? (по страницам учебника Менделеева «Основы химии» и современных печатных материалов по химии).
Основные итоги, полученные в ходе исследования.
Из разных источников мы узнали, что
в истории человеческих знаний немало
подвигов. Но очень немногие из них можно
сопоставить с тем, что было сделано
Д.И.Менделеевым.
Но очень немногие из них можно
сопоставить с тем, что было сделано
Д.И.Менделеевым.
Менделеев, предсказывая свойства ещё неизвестных элементов, рисковал самым дорогим, что есть у ученого, — своим именем. Величие научного подвига Менделеева не только не стирается со временем, но и продолжает расти. И никто не может сказать, будет ли когда-нибудь исчерпано до конца всё содержание одного из величайших в науке обобщений – Периодического закона Менделеева. Изучать химию невозможно иначе, как на основе периодического закона и периодической системы элементов. Каким нелепым выглядел бы учебник химии без таблицы Менделеева!
Наша гипотеза подтвердилась. Обсуждение проекта.
Учитель зачитывает стихотворение А.Чивилихина (1938 г.) «На изображение таблицы элементов на стене дома у памятника Д.И.Менделеева» ( слайд 10)
МЕНЕ – ТЕКЕЛ — УПАРСИН
(исчислено, взвешено, разделено)
Опять в вечернем полумраке
Стена отвесная видна.
На ней начертанные знаки –
Как дней минувших
письмена.
Всё было тления добычей –
Его приход не отразить.
Пока не принят был обычай
На камень знаки наносить,
Чтоб избежать могли забвенья
Средь сыновей – дела отцов,
Былых властителей веленья
Иль откровенья мудрецов.
Но даже камни обветшали,
Их гордость прежнюю не жаль,
Все это давние скрижали,
Видна нам новая скрижаль.
И каждый знак её взлелеяв,
Суровым гением своим
Поведал миру Менделеев
В природе понятое им.
И вот в вечернем полумраке,
Стена отвесная видна,
На ней начертанные знаки –
Как дней минувших письмена.
Снег падает. Весь мир заснежен
Но вечно движется к весне.
Исчислен, разделен и взвешен –
Вещают знаки на стене.
V. Подведение итогов. Рефлексия. (слайд 11)
Учащиеся, совместно с учителем, определяют достигнуты ли цели урока.
Учитель: в завершении нашего урока, поделитесь своими впечатлениями:
Какие чувства я испытываю после
сегодняшнего занятия? ( неудовлетворение;
огорчение; радость; гордость за выполненную
работу; желание узнать больше; чувство
досады; другие. Нужное подчеркнуть)
Нужное подчеркнуть)
Учитель. Ребята! Учите химию и вы добьетесь успеха в жизни!
VI. Дифференцированное домашнее задание.
А. Составить вопросы для химической дуэли по теме «Периодический закон и периодическая система хим. элементов. Д.И.Менделеев».
Составить криптограмму МЕНДЕЛЕЕВ. ЗАКОН.
В. Решить задачи:
1). Рассчитайте относительную атомную массу меди, если известно, что она имеет два изотопа 63Сu u 65Cu, массовые доли которых в природе соответственно составляют 73% и 37%.
2). Элемент образует с кислородом высший оксид с молярной массой 88 г/моль, с водородом летучее водородное соединение с молярной массой 17 г/моль, найдите его положение в периодической системе, опишите строение его атома, предскажите хим. свойства этого элемента и его значение.
3). Высший оксид элемента отвечает
формуле ЭО3 . Его водородное
соединение содержит 2,47% водорода. Определите этот элемент. Напишите
формулу его соединения с водородом.
Определите этот элемент. Напишите
формулу его соединения с водородом.
С. Составить тестовую работу по теме «Периодический закон и периодическая система химических элементов Д.И.Менделеева» (уровни «А» – 10 вопросов, «В» – 5 вопросов, «С» – 3 вопроса).
Учитель. Наш урок закончен. Объявляются оценки за работу на уроке и творческие работы (остальные получат оценки за тестовую работу). Спасибо за урок!
IV. Приложение №1.
ТЕСТ по теме «Периодический закон и Периодическая система химических элементов Д.И.Менделеева».
Вариант 1.
1. Число протонов, нейтронов и электронов для изотопа 55Mn:
а) 55р, 25п, 55е; в) 25р, 55п, 25е
б) 25р, 30п, 25е; г) 55р,25п, 25е
2. Какая частица имеет больше протонов, чем электронов:
а) атом натрия в) атом серы
б) сульфид-ион г) ион натрия
3.Наибольший радиус имеет ион:
а) Са2+ б) К+ в) F— г ) S2-
4. Из приведенных ниже электронных
формул выберите ту, которая соответствует
р- элементу IV
группы:
Из приведенных ниже электронных
формул выберите ту, которая соответствует
р- элементу IV
группы:
а) …4s2 4p6 4d3 5s2 в) …3s2 3p6 3d 104s24p3
б) …4s2 4p2 г) …2s2 2p4
5.Электронная формула атома 1s2 2s2 2p6 3s2 3p2 . Формула его водородного соединения:
а) РН3 б) H2S в) CH4 г) SiH4
Электронная формула внешнего электронного слоя атома химического элемента
…3s2 3р4 . из приведенных ниже формул выберите формулу гидроксида, где этот химический элемент проявляет высшую степень окисления:
а) Н2RО3 б) R(OH)6 в) RO3 г) H2RO4
Ряд элементов, расположенных в порядке возрастания металлических свойств:
а) Na, Mg , AI в) Pb, K, Na
б) Ca, Mg, Be г) AI, Mg, Na
Наиболее сходными химическими свойствами обладают простые вещества, образованные элементами:
а) Са и Si б) Рb и Аg в) СI и Аr г) Р и Аs
Оксиды бериллия, магния и кальция соответственно относятся к классам:
а) к основным, амфотерным, кислотным
б) только к основным
в) к кислотным, амфотерным, кислотным
г) к амфотерным, основным, основным
10 Гидроксиды элементов Мg , АI и Si относятся соответственно к классам:
а) оснований, кислот, оснований
б) амфотерных гидроксидов, оснований, кислот
в) оснований, амфотерных гидроксидов, кислот
г) амфотерных гидроксидов, оснований
ВАРИАНТ
2.
1. Ядро атома криптона – 80, 80Kr , содержит:
а) 80р и 36п 36 в) 36р и 80п
б) 36р и 44п г) 36р и 44п
2. Три частицы: Ne0 , Na+ , F— имеют одинаковое;
а) число протонов в) массовое число
б) число нейтронов г) число электронов
3.Наибольший радиус имеет ион:
А) J— б) Сs+ в) Ва2+ г) Тe2-
4. Из приведенных ниже электронных формул выберите ту, которая соответствует — элементу 4–го периода:
а) …3s2 3p6 3d5 4s2 в)…3s2 3p6 4s2 3d10 4p2
б) …3s2 3p6 4s2 г )…3s2 3p6 4s2 3d10 4p6 5s2 4d1
5. Электронная формула атома 1s2 2s2 2p6 3s2 3p3 . Формула его водородного соединения:
Формула его водородного соединения:
А) РН3 б) H2S в) NН3 г) НСI
6. Из приведенных ниже электронных формул выберите ту, которая соответствует химическому элементу, образующему высший оксид состава R2O7
а) …3s1 в) …3s2 3p6 3d5 4s2
б) …1s2 2s2 2p6 г)…4s2 4p2
Ряд элементов, расположенных в порядке усиления неметаллических свойств:
а) Mg, Si, AL в) O, S, Se
б) As, P, N г) S, P, Si
Наибольшим сходством физических свойств обладают простые вещества, образованные химическими элементами:
а) Li и S б) Са и Zn в) F и СI г) Na и CI
9. Характер оксидов в ряду Р2О5 – SiO2 — AI2O3 — MgO изменяется:
а) от основного к кислотному
б) от кислотного к основному
в) от основного к амфотерному
г) от амфотерного к кислотному
10. Характер
высших гидроксидов, образованных
элементами главной подгруппы 11 группы,
с увеличением порядкового номера
изменяется:
Характер
высших гидроксидов, образованных
элементами главной подгруппы 11 группы,
с увеличением порядкового номера
изменяется:
а) от кислотного к амфотерному
б) от основного к кислотному
в) от амфотерного к основному
г) от кислотного к основному
Приложение №2.
«Рейтинговая оценка творческих работ учащихся» (на партах)
Тема:
Ф.И.О. выступающего класс
Критерии | Отметка (+, -) | Замечания, дополнения |
1. Правильность | ||
2. Осознанность | ||
3. Полнота | ||
4. Научность | ||
5. | ||
6. Речевая грамотность | ||
7. Логичная последовательность | ||
8. Доступность | ||
9. Лаконичность |
Дополнительные вопросы _________________________________
________________________________________________________
Отметка «5»
— полно раскрыто содержание материала в объёме программы
— четко и правильно даны определения и раскрыто содержание понятий, верно использованы научные термины
— для доказательства использованы различные умения, выводы из наблюдений
— ответ самостоятельный, используются ранее приобретенные знания
Отметка «4»
— раскрыто основное содержание материала
— в основном правильно даны определения понятий и научных терминов
— ответ самостоятельный
— определения понятий неполные, допущены незначительные ошибки при использовании научных терминов или в выводах и обобщениях, допущены незначительные нарушения в последовательности изложения
Отметка «3»
— усвоено основное содержание учебного материала, но изложено фрагментарно, не всегда последовательно
— определения понятий недостаточно четкие
— допущены ошибки и неточности в использовании научной терминологии
Отметка _________________________
Ф. И. рецензента
И. рецензента
Приложение №3. ( на партах )
Рефлексия
Какие чувства я испытываю после сегодняшнего занятия?
— неудовлетворение
— огорчение
— радость
— гордость за выполненную работу
— желание узнать больше
— чувство досады
— другие (нужное подчеркнуть)
Галогены в природе. Физические свойства галогенов
Галогены в природе. Физические свойства галогенов. Галогены, вследствие их большой химической активности, находятся в природе исключительно в связанном состоянии — главным образом в виде солей галогеноводородных кислот. [c.477]Галогены в природе, физические свойства галогенов [c.341]
Галогены в природе. Физические свойства галогенов 349 [c.349]
Порядок расположения материала по каждому элементу всегда постоянный история вопроса нахождение в природе получение физические свойства действие воздуха, воды, неметаллических соединений, кислот, металлов и др.
 химические свойства иона общие реакции, качественные реакции, количественные реакции соединения элемента с другими элементами, имеющими более низкий систематический номер гидраты, окислы, соединения с азотом, соединения с галогенами и т. д. [c.126]
химические свойства иона общие реакции, качественные реакции, количественные реакции соединения элемента с другими элементами, имеющими более низкий систематический номер гидраты, окислы, соединения с азотом, соединения с галогенами и т. д. [c.126] Вопросы и задачи. 1. Чем обусловлена общность многих химических свойств галогенов 2. Какой химический характер у галогенов 3. Почему галогены не встречаются в природе в виде простых веществ 4. Какими общими свойствами обладают водородные соединения галогенов 5. Как относятся галогены к металлам, водороду и кислороду 6. Что послужило основой для объединения всех галогенов в одну естественную группу 7. Чем обусловлено различие свойств отдельных галогенов 8. Как происходит изменение физических и химических свойств галогенов по мере увеличения их атомных масс и зарядов ядер атомов 9. Написать уравнения реакций в молекулярной и ионной форме для процессов взаимодействия веществ а) бромида калия и хлора, б) иодида кальция и брома, в) бромида алюминия и хлора. Указать в каждой реакции окислитель. [c.109]
Указать в каждой реакции окислитель. [c.109]
Каждый из элементов описывается по единой схеме сначала излагаются история открытия, нахождение в природе, получение, физические свойства, химические свойства простого вещества. Затем описываются соединения данного элемента с другими, имеющими меньший систематический номер. Они располагаются в порядке возрастания систематических номеров второго компонента сначала соединения с водородом (систематический номер 2), затем с кислородом (№ 3), азотом (№ 4), галогенами (№ 5, 6, 7, 8), халькогенами (№ 9, 10, И, 12), бором (№ 13), углеродом (№ 14), кремнием (№ 15), фосфором (№ 16), мышьяком (№ 17), сурьмой (№ 18), висмутом (№ 19). За висмутом начинаются систематические номера металлов, сгруппированные по подгруппам периодической системы щелочные металлы (№ 20—25), щелочноземельные металлы (№ 26—31) и т. д. [c.7]
Существует большое количество соединений галогенов с другими элементами, которые сильно различаются между собой по своим физическим и химическим свойствам, так как последние определяются природой химических связей между атомами галогенов и атомами соответствующих элементов. [c.363]
[c.363]
В галогенорганических соединениях прочность связи между углеродом и гетероатомом неодинакова для различных галогенов и обычно уменьшается в ряду Р, С1, Вг, I. Этот порядок может несколько меняться, так как прочность связи зависит как от строения молекулы, так и от природы заместителей, их числа и положения. Аналогичным образом изменяется и энергия, необходимая для отрыва атомов галогена. Атомы галогена в ароматических галогенсодержащих органических веществах обычно, связаны прочнее, чем в алифатических галогенпроизводных. Некоторые алифатические галогениды растворяются в воде и диссоциируют с образованием галогенид-ионов или гидролизуются при нагревании в щелочных условиях (например, в растворе метилата щелочного металла) с образованием галогенид-ионов. Галогены, расположенные в боковой цепи ароматических соединений, особенно в а-положении, обладают теми же свойствами, однако большинство галогенсодержащих органических соединений в водных растворах галогенид-ионы не отщепляют.
 Поэтому при анализе их предварительно полностью разлагают, в результате чего получаются галогенид-ионы, молекулярные галогены или простые галогенсодержащие соединения. Методы минерализации уже рассматривались в начале этой главы. Здесь же речь пойдет только о специфических методах, используемых при анализе галогенсодержащих соединений. При выборе подходящего метода необходимо учитывать физическое состояние исследуемого соединения, летучесть, температуру разложения, а также прочность связи галогена с другими атомами в веществе и реакцию обнаружения. Выбор способа минерализации зависит и от задачи анализа требуется ли определить присутствие галогенов вообще, или необходимо установить природу галогена,, находящегося в молекуле. [c.46]
Поэтому при анализе их предварительно полностью разлагают, в результате чего получаются галогенид-ионы, молекулярные галогены или простые галогенсодержащие соединения. Методы минерализации уже рассматривались в начале этой главы. Здесь же речь пойдет только о специфических методах, используемых при анализе галогенсодержащих соединений. При выборе подходящего метода необходимо учитывать физическое состояние исследуемого соединения, летучесть, температуру разложения, а также прочность связи галогена с другими атомами в веществе и реакцию обнаружения. Выбор способа минерализации зависит и от задачи анализа требуется ли определить присутствие галогенов вообще, или необходимо установить природу галогена,, находящегося в молекуле. [c.46] KAl(504)2 12НгО изоморфны с хромокалиевыми квасцами K r(S04)2-12НгО, и замещением иона Сг + на ион АР+ можно приготовить смешанные квасцы. В этом случае оба катиона имеют одинаковый заряд и близкие ионные радиусы (/»А1 = 53 пм, Гсг = 62 пм). Сходны между собой ионы (г— = 72 пм), Мп2+ (г = 82 пм) и Zn2+ (г = 75 пм) несмотря на то, что катион магния имеет конфигурацию благородного газа (s p ), а другие содержат й-электроны (d и ). Близкое сходство ионов лантаноидов (см. разд. 16) также объясняется их одинаковым зарядом и примерно одинаковыми размерами ионов. Такое сходство, которое больше зависит от заряда, чем от электронной конфигурации, можно назвать физическим — это сходство таких физических свойств соединений, как кристаллическая структура и, следовательно, растворимость и склонность к осаждению. Так, соосаждение чаще связано с одинаковыми степенями окисления, чем с природой ионов. Например, элемент — носитель для радиоактивного индикатора не обязательно должен быть из того же химического семейства, что и радиоактивный изотоп. Технеций (VH) может соосаждаться не только с перренат-ионом, но и с перхлорат-, перйодат- и те-трафтороборат(П1)-ионами. Соединения свинца (П) имеют примерно ту же растворимость, что и соединения тяжелых щелочноземельных элементов.
Сходны между собой ионы (г— = 72 пм), Мп2+ (г = 82 пм) и Zn2+ (г = 75 пм) несмотря на то, что катион магния имеет конфигурацию благородного газа (s p ), а другие содержат й-электроны (d и ). Близкое сходство ионов лантаноидов (см. разд. 16) также объясняется их одинаковым зарядом и примерно одинаковыми размерами ионов. Такое сходство, которое больше зависит от заряда, чем от электронной конфигурации, можно назвать физическим — это сходство таких физических свойств соединений, как кристаллическая структура и, следовательно, растворимость и склонность к осаждению. Так, соосаждение чаще связано с одинаковыми степенями окисления, чем с природой ионов. Например, элемент — носитель для радиоактивного индикатора не обязательно должен быть из того же химического семейства, что и радиоактивный изотоп. Технеций (VH) может соосаждаться не только с перренат-ионом, но и с перхлорат-, перйодат- и те-трафтороборат(П1)-ионами. Соединения свинца (П) имеют примерно ту же растворимость, что и соединения тяжелых щелочноземельных элементов. Тал-лий(1) г — 150 пм) по физическим свойствам часто напоминает катион калия (г = 138 пм). Например, он образует растворимые соли—нитрат, карбонат, ортофосфат, сульфат и фторид. Катион таллия (I) способен внедряться во многие калийсодержащие ферменты, в результате чего продукты метаболизма становятся чрезвычайно ядовитыми. Однако электронное строение катионов также может влиять на свойства соединений, например, на поляризацию анионов (см. разд. 4.5), поэтому по отношению к тяжелым галогенам катион Т1+ больше напоминает катион Ag+, чем К+. [c.388]
Тал-лий(1) г — 150 пм) по физическим свойствам часто напоминает катион калия (г = 138 пм). Например, он образует растворимые соли—нитрат, карбонат, ортофосфат, сульфат и фторид. Катион таллия (I) способен внедряться во многие калийсодержащие ферменты, в результате чего продукты метаболизма становятся чрезвычайно ядовитыми. Однако электронное строение катионов также может влиять на свойства соединений, например, на поляризацию анионов (см. разд. 4.5), поэтому по отношению к тяжелым галогенам катион Т1+ больше напоминает катион Ag+, чем К+. [c.388]
Существенное влияние на химические и физические свойства сульфимидов оказывает природа заместителя при атоме азота (1 Так называемые свободные сульфимиды, у которых = Н, обычно являются нестабильными жидкостями [5, 6]. Наиболее известными представителями сульфимидов являются соединения, в которых — арилсульфонильная или ацильная группы обычно они представляют собой кристаллические твердые вещества. Известны сульфимиды, у которых является водородом, алкилом, арилом, галогеном, цианогруппой, этоксикарбонильной, алкил- и арилсульфонильной, бензоильной, ацетильной или гало-генацетильной группами [7]. [c.372]
[c.372]
Физические и химические свойства. Фторуглероды резко отличаются по физическим и химическим свойствам от углеводородов и галогенопроизводных углеводородов 1) высокой термической устойчивостью — при 400—500°С они не изменяются и лишь при температуре красного каления разлагаются на углерод и тетрафторметан 2) необычной химической инертностью такие реагенты, как азотная и серная кислоты, хромовая смесь, едкие щелочи, на них не действуют 3) они не подвергаются окислению, действию бактерий и устойчивы во времени. Вследствие малой полярности для них характерна также незначительная величина межмолекулярного взаимодействия. Эти свойства определяются природой связи С—Р вофтор-углеродах и их пространственным строением. Фтор по сравнению с другими галогенами обладает наибольшим сродством к электронам, поэтому связь С—Р сильно поляризована. [c.120]
1.3: Свойства материи — Химия LibreTexts
Цели обучения
- Для отделения физических свойств и изменений от химических
Все вещества обладают физическими и химическими свойствами. Физические свойства — это характеристики, которые ученые могут измерить без изменения состава исследуемого образца, такие как масса, цвет и объем (объем пространства, занимаемый образцом). Химические свойства описывают характерную способность вещества реагировать с образованием новых веществ; они включают его воспламеняемость и подверженность коррозии.Все образцы чистого вещества обладают одинаковыми химическими и физическими свойствами. Например, чистая медь всегда представляет собой красновато-коричневое твердое вещество (физическое свойство) и всегда растворяется в разбавленной азотной кислоте с образованием синего раствора и коричневого газа (химическое свойство).
Физические свойства — это характеристики, которые ученые могут измерить без изменения состава исследуемого образца, такие как масса, цвет и объем (объем пространства, занимаемый образцом). Химические свойства описывают характерную способность вещества реагировать с образованием новых веществ; они включают его воспламеняемость и подверженность коррозии.Все образцы чистого вещества обладают одинаковыми химическими и физическими свойствами. Например, чистая медь всегда представляет собой красновато-коричневое твердое вещество (физическое свойство) и всегда растворяется в разбавленной азотной кислоте с образованием синего раствора и коричневого газа (химическое свойство).
Физические свойства могут быть экстенсивными или интенсивными. Экстенсивные свойства зависят от количества вещества и включают массу, вес и объем. Интенсивные свойства , напротив, не зависят от количества вещества; они включают цвет, температуру плавления, точку кипения, электрическую проводимость и физическое состояние при данной температуре. Например, элементарная сера представляет собой желтое кристаллическое твердое вещество, которое не проводит электричество и имеет температуру плавления 115,2 °C, независимо от того, какое количество исследуется (рис. \(\PageIndex{1}\)). Ученые обычно измеряют интенсивные свойства для определения идентичности вещества, в то время как экстенсивные свойства передают информацию о количестве вещества в образце.
Например, элементарная сера представляет собой желтое кристаллическое твердое вещество, которое не проводит электричество и имеет температуру плавления 115,2 °C, независимо от того, какое количество исследуется (рис. \(\PageIndex{1}\)). Ученые обычно измеряют интенсивные свойства для определения идентичности вещества, в то время как экстенсивные свойства передают информацию о количестве вещества в образце.
Хотя масса и объем являются экстенсивными свойствами, их соотношение является важным интенсивным свойством, называемым плотностью (\(\rho\)). Плотность определяется как масса на единицу объема и обычно выражается в граммах на кубический сантиметр (г/см 3 ). По мере увеличения массы в данном объеме увеличивается и плотность. Например, свинец с его большей массой имеет гораздо большую плотность, чем тот же объем воздуха, точно так же, как кирпич имеет большую плотность, чем пенополистирол того же объема.При данной температуре и давлении плотность чистого вещества постоянна:
По мере увеличения массы в данном объеме увеличивается и плотность. Например, свинец с его большей массой имеет гораздо большую плотность, чем тот же объем воздуха, точно так же, как кирпич имеет большую плотность, чем пенополистирол того же объема.При данной температуре и давлении плотность чистого вещества постоянна:
\[\begin{align*} \text{плотность} &={\text{масса} \over \text{объем}} \\[4pt] \rho &={m \over V} \label{Eq1} \end{выравнивание*} \]
Чистая вода, например, имеет плотность 0,998 г/см 3 при 25 °C. Средние плотности некоторых распространенных веществ приведены в таблице \(\PageIndex{1}\). Обратите внимание, что кукурузное масло имеет более низкое отношение массы к объему, чем вода. Это означает, что при добавлении в воду кукурузное масло будет «плавать» (рис. \(\PageIndex{2}\)).
| Вещество | Плотность при 25 °C (г/см 3 ) | Вещество | Плотность при 25 °C (г/см 3 ) |
|---|---|---|---|
| кровь | 1,035 | кукурузное масло | 0,922 |
| жировые отложения | 0. 918 918 | майонез | 0,910 |
| цельное молоко | 1,030 | мед | 1,420 |
Физическая собственность и сдача
Физические изменения — это изменения, при которых химические связи не разрываются и не образуются.Это означает, что те же типы соединений или элементов, которые были в начале изменения, остаются и в конце изменения. Поскольку конечные материалы такие же, как и начальные, свойства (такие как цвет, температура кипения и т. д.) также будут одинаковыми. Физические изменения связаны с перемещением молекул, но не с их изменением. Некоторые типы физических изменений включают:
Некоторые типы физических изменений включают:
- Изменения состояния (переход из твердого состояния в жидкое или газообразное и наоборот)
- Разделение смеси
- Физическая деформация (порезы, вмятины, растяжения)
- Приготовление растворов (специальных видов смесей).
Когда кубик льда тает, его форма меняется, поскольку он приобретает способность течь. При этом его состав не меняется. Плавление является примером физического изменения (Рисунок \(\PageIndex{3}\)), поскольку изменяются некоторые свойства материала, но не изменяется сущность материи. Физические изменения можно дополнительно классифицировать как обратимые и необратимые. Растаявший кубик льда можно снова заморозить, поэтому таяние является обратимым физическим изменением. Все физические изменения, связанные с изменением состояния, обратимы.Другие изменения состояния включают испарение (жидкость в газ), замерзание (жидкость в твердое состояние) и конденсацию (газ в жидкость). Растворение также является обратимым физическим изменением. Когда соль растворяется в воде, говорят, что соль перешла в водное состояние. Соль можно восстановить, выкипятив воду, оставив соль.
Растворение также является обратимым физическим изменением. Когда соль растворяется в воде, говорят, что соль перешла в водное состояние. Соль можно восстановить, выкипятив воду, оставив соль.
Рисунок \(\PageIndex{3}\): «Таяние льда» — это физическое изменение. Когда твердая вода (\(\ce{H_2O}\)) в виде льда превращается в жидкость (воду), она кажется измененной.Однако это изменение носит только физический характер, поскольку состав составляющих молекул тот же: 11,19% водорода и 88,81% кислорода по массе.
Химические свойства и изменение
Химические изменения происходят при разрыве и/или образовании связей между молекулами или атомами. Это означает, что одно вещество с определенным набором свойств (таким как температура плавления, цвет, вкус и т. д.) превращается в другое вещество с другими свойствами. Химические изменения часто труднее обратить вспять, чем физические изменения.
Одним из хороших примеров химического изменения является сжигание бумаги. В отличие от процесса разрывания бумаги, процесс сжигания бумаги фактически приводит к образованию новых химических веществ (точнее, углекислого газа и воды). Другой пример химического изменения происходит при образовании воды. Каждая молекула содержит два атома водорода и один атом кислорода, химически связанные.
В отличие от процесса разрывания бумаги, процесс сжигания бумаги фактически приводит к образованию новых химических веществ (точнее, углекислого газа и воды). Другой пример химического изменения происходит при образовании воды. Каждая молекула содержит два атома водорода и один атом кислорода, химически связанные.
Другим примером химического изменения является то, что происходит, когда в вашей печи сжигается природный газ. На этот раз перед реакцией у нас есть молекула метана, \(\ce{CH_4}\), и две молекулы кислорода, \(\ce{O_2}\), а после реакции у нас есть две молекулы воды, \(\ce{H_2O}\) и одна молекула углекислого газа, \(\ce{CO_2}\).При этом изменился не только внешний вид, но и структура молекул. Новые вещества не обладают такими же химическими свойствами, как исходные. Следовательно, это химическое изменение.
Сгорание металлического магния также является химическим изменением (магний + кислород → оксид магния):
\[\ce{2 Mg + O_2 \rightarrow 2 MgO } \номер\]
, как и ржавление железа (Железо + кислород → оксид железа/ржавчина):
\[\ce{4 Fe + 3O_2 \rightarrow 2 Fe_2O_3} \номер\]
Используя компоненты состава и свойства, мы имеем возможность отличить один образец вещества от других.
Различные определения изменений: https://youtu.be/OiLaMHigCuo
Ссылки
- Петруччи, Биссоннетт, Херринг, Мадура. Общая химия: принципы и современные приложения. Десятое изд. Река Аппер-Сэдл, штат Нью-Джерси, 07458: Pearson Education Inc., 2011. .
- Краколис, Питерс. Основы вводной химии. Активный подход к обучению. Второе изд. Белмонт, Калифорния 94001: Брукс/Коул, 2007.
Авторы и авторство
1.4: Физические и химические изменения и свойства
Цели обучения
- Описать разницу между физическими и химическими свойствами или изменить их.
- Идентифицируйте свойство или преобразование как физическое или химическое, используя символическое представление, представление в виде частиц или макроскопическое изображение.
- Определите свойства материи как экстенсивные или интенсивные.
- Распознайте и опишите части опасного алмаза NFPA.

Характеристики, которые позволяют нам отличить одно вещество от другого, называются свойствами.Физическое свойство – это характеристика вещества, не связанная с изменением его химического состава. Знакомые примеры физических свойств включают плотность, цвет, твердость, температуры плавления и кипения и электрическую проводимость. Мы можем наблюдать некоторые физические свойства, такие как плотность и цвет, без изменения физического состояния наблюдаемой материи. Другие физические свойства, такие как температура плавления железа или температура замерзания воды, можно наблюдать только по мере того, как материя претерпевает физические изменения.Физическое изменение — это изменение состояния или свойств материи без какого-либо сопутствующего изменения ее химического состава (тождественности веществ, содержащихся в материи). Мы наблюдаем физические изменения, когда воск плавится, когда сахар растворяется в кофе и когда пар конденсируется в жидкую воду (рис. \(\PageIndex{1}\)). Другие примеры физических изменений включают намагничивание и размагничивание металлов (как это делается с обычными защитными бирками от кражи) и измельчение твердых частиц в порошок (что иногда может привести к заметным изменениям цвета).В каждом из этих примеров происходит изменение физического состояния, формы или свойств вещества, но не изменение его химического состава.
Другие примеры физических изменений включают намагничивание и размагничивание металлов (как это делается с обычными защитными бирками от кражи) и измельчение твердых частиц в порошок (что иногда может привести к заметным изменениям цвета).В каждом из этих примеров происходит изменение физического состояния, формы или свойств вещества, но не изменение его химического состава.
Различные определения свойств: https://youtu.be/n7UwjQJGh9Y
Превращение одного типа материи в другой тип (или неспособность к изменению) является химическим свойством. Примеры химических свойств включают воспламеняемость, токсичность, кислотность, реакционную способность (многие типы) и теплоту сгорания. Железо, например, соединяется с кислородом в присутствии воды, образуя ржавчину; хром не окисляется (рис. \(\PageIndex{2}\)). Нитроглицерин очень опасен, потому что легко взрывается; неон почти не представляет опасности, потому что он очень неактивен.
Железо, например, соединяется с кислородом в присутствии воды, образуя ржавчину; хром не окисляется (рис. \(\PageIndex{2}\)). Нитроглицерин очень опасен, потому что легко взрывается; неон почти не представляет опасности, потому что он очень неактивен.
Чтобы идентифицировать химическое свойство, мы ищем химическое изменение. Химическое изменение всегда производит один или несколько типов материи, которые отличаются от материи, существовавшей до изменения. Образование ржавчины — это химическое изменение, потому что ржавчина — это вещество, отличное от железа, кислорода и воды, существовавших до образования ржавчины.Взрыв нитроглицерина — это химическое изменение, поскольку образующиеся газы представляют собой вещества, сильно отличающиеся от исходного вещества. Другие примеры химических изменений включают реакции, проводимые в лаборатории (например, реакция меди с азотной кислотой), все формы возгорания (горения) и приготовление, переваривание или гниение пищи (рис. \(\PageIndex{3}\ )).
Другие примеры химических изменений включают реакции, проводимые в лаборатории (например, реакция меди с азотной кислотой), все формы возгорания (горения) и приготовление, переваривание или гниение пищи (рис. \(\PageIndex{3}\ )).
Свойства материи попадают в одну из двух категорий. Если свойство зависит от количества присутствующей материи, это экстенсивное свойство. Масса и объем вещества являются примерами экстенсивных свойств; например, галлон молока имеет большую массу и объем, чем чашка молока. Стоимость экстенсивного свойства прямо пропорциональна количеству рассматриваемой материи. Если свойство образца вещества не зависит от количества присутствующего вещества, оно является интенсивным свойством. Температура является примером интенсивного свойства.Если галлон и чашка молока имеют температуру 20 °C (комнатная температура), то при их объединении температура остается равной 20 °C. В качестве другого примера рассмотрим различные, но связанные свойства тепла и температуры. Капля горячего растительного масла, разбрызганная на руку, вызывает кратковременный незначительный дискомфорт, в то время как кастрюля с горячим маслом вызывает серьезные ожоги. И капля, и горшок с маслом имеют одинаковую температуру (интенсивное свойство), но горшок явно содержит гораздо больше тепла (экстенсивное свойство).
Если свойство зависит от количества присутствующей материи, это экстенсивное свойство. Масса и объем вещества являются примерами экстенсивных свойств; например, галлон молока имеет большую массу и объем, чем чашка молока. Стоимость экстенсивного свойства прямо пропорциональна количеству рассматриваемой материи. Если свойство образца вещества не зависит от количества присутствующего вещества, оно является интенсивным свойством. Температура является примером интенсивного свойства.Если галлон и чашка молока имеют температуру 20 °C (комнатная температура), то при их объединении температура остается равной 20 °C. В качестве другого примера рассмотрим различные, но связанные свойства тепла и температуры. Капля горячего растительного масла, разбрызганная на руку, вызывает кратковременный незначительный дискомфорт, в то время как кастрюля с горячим маслом вызывает серьезные ожоги. И капля, и горшок с маслом имеют одинаковую температуру (интенсивное свойство), но горшок явно содержит гораздо больше тепла (экстенсивное свойство).
Различные определения изменений: https://youtu.be/OiLaMHigCuo
Опасный алмаз
Возможно, вы видели символ, показанный на рисунке \(\PageIndex{4}\), на контейнерах с химическими веществами в лаборатории или на рабочем месте. Этот алмаз химической опасности, который иногда называют «огненным бриллиантом» или «алмазом опасности», предоставляет ценную информацию, которая кратко суммирует различные опасности, о которых следует помнить при работе с конкретным веществом.
Рисунок \(\PageIndex{4}\): Ромб опасности Национального агентства по противопожарной защите (NFPA) обобщает основные опасности химических веществ. Система идентификации опасностей 704 Национального агентства противопожарной защиты (NFPA) была разработана NFPA для предоставления информации о безопасности определенных веществ. Система подробно описывает воспламеняемость, реакционную способность, опасность для здоровья и другие опасности. В общем ромбовидном символе верхний (красный) ромб указывает уровень пожароопасности (температурный диапазон температуры вспышки). Синий (левый) ромб указывает на уровень опасности для здоровья. Желтый (справа) ромб описывает опасность реактивности, например, насколько легко вещество подвергается детонации или сильному химическому изменению.Белый (нижний) ромб указывает на особую опасность, например, если он является окислителем (который позволяет веществу гореть в отсутствие воздуха/кислорода), вступает в необычную или опасную реакцию с водой, является коррозионным, кислотным, щелочным, биологически опасные, радиоактивные и так далее. Каждая опасность оценивается по шкале от 0 до 4, где 0 — отсутствие опасности, 4 — чрезвычайно опасная.
Синий (левый) ромб указывает на уровень опасности для здоровья. Желтый (справа) ромб описывает опасность реактивности, например, насколько легко вещество подвергается детонации или сильному химическому изменению.Белый (нижний) ромб указывает на особую опасность, например, если он является окислителем (который позволяет веществу гореть в отсутствие воздуха/кислорода), вступает в необычную или опасную реакцию с водой, является коррозионным, кислотным, щелочным, биологически опасные, радиоактивные и так далее. Каждая опасность оценивается по шкале от 0 до 4, где 0 — отсутствие опасности, 4 — чрезвычайно опасная.
Хотя многие элементы резко различаются по своим химическим и физическим свойствам, некоторые элементы обладают сходными свойствами.Мы можем идентифицировать наборы элементов, которые демонстрируют общее поведение. Например, многие элементы хорошо проводят тепло и электричество, тогда как другие являются плохими проводниками. Эти свойства можно использовать для разделения элементов на три класса: металлы (элементы с хорошей проводимостью), неметаллы (элементы с плохой проводимостью) и металлоиды (элементы, обладающие свойствами как металлов, так и неметаллов).
Периодическая таблица — это таблица элементов, в которой элементы с похожими свойствами расположены близко друг к другу (рис. \(\PageIndex{5}\)).Вы узнаете больше о периодической таблице, когда продолжите изучение химии.
Рисунок \(\PageIndex{5}\): Периодическая таблица показывает, как элементы могут быть сгруппированы в соответствии с некоторыми схожими свойствами. Обратите внимание, что цвет фона обозначает, является ли элемент металлом, металлоидом или неметаллом, тогда как цвет символа элемента указывает, является ли он твердым, жидким или газообразным.Резюме
Все вещества обладают различными физическими и химическими свойствами и могут подвергаться физическим или химическим изменениям.Физические свойства, такие как твердость и температура кипения, и физические изменения, такие как плавление или замерзание, не связаны с изменением состава вещества. Химические свойства, такие как воспламеняемость и кислотность, а также химические изменения, такие как ржавление, связаны с образованием вещества, отличного от того, что было ранее.
Измеряемые свойства попадают в одну из двух категорий. Экстенсивные свойства зависят от количества присутствующего вещества, например, массы золота. Интенсивные свойства не зависят от количества присутствующего вещества, например, плотность золота.Теплота — пример экстенсивного свойства, а температура — пример интенсивного свойства.
Глоссарий
- химическая замена
- изменение, производящее материю, отличную от исходной материи
- химическое свойство
- поведение, связанное с превращением одного вида материи в другой вид материи
- обширное имущество
- свойство вещества, которое зависит от количества вещества
- интенсивное имущество
- свойство вещества, не зависящее от количества вещества
- физическое изменение
- изменение состояния или свойств вещества, не связанное с изменением его химического состава
- физическое имущество
- свойство вещества, не связанное с каким-либо изменением его химического состава
Авторы и авторство
Сохранение материи при физических и химических изменениях
Материя составляет все видимое в известной вселенной, от переносных горшков до сверхновых. А поскольку материя никогда не создается и не уничтожается, она вращается в нашем мире. Атомы, которые были в динозавре миллионы лет назад — и в звезде миллиарды лет до этого — могут быть внутри вас сегодня.
А поскольку материя никогда не создается и не уничтожается, она вращается в нашем мире. Атомы, которые были в динозавре миллионы лет назад — и в звезде миллиарды лет до этого — могут быть внутри вас сегодня.
Материя — это все, что имеет массу и занимает пространство. Он включает в себя молекулы, атомы, элементарные частицы и любое вещество, из которого состоят эти частицы. Материя может изменять форму посредством физических и химических изменений, но при любом из этих изменений материя сохраняется 90 244 . До и после изменения существует одинаковое количество материи — ни одна из них не создается и не уничтожается.Эта концепция называется законом сохранения массы.
При физическом изменении могут измениться физические свойства вещества, но не его химический состав. Вода, например, состоит из двух атомов водорода и одного атома кислорода. Вода — единственное известное вещество на Земле, которое существует в природе в трех состояниях: твердом, жидком и газообразном. Чтобы перейти из одного состояния в другое, вода должна претерпевать физические изменения. Когда вода замерзает, она становится твердой и менее плотной, но химически остается прежней.До и после изменения присутствует одинаковое количество молекул воды, а химические свойства воды остаются постоянными.
Когда вода замерзает, она становится твердой и менее плотной, но химически остается прежней.До и после изменения присутствует одинаковое количество молекул воды, а химические свойства воды остаются постоянными.
Однако для образования воды атомы водорода и кислорода должны подвергнуться химическим изменениям. Чтобы произошло химическое изменение, атомы должны либо разорвать связи, либо образовать связи. Добавление или вычитание атомных связей изменяет химические свойства участвующих веществ. И водород, и кислород двухатомны — в природе они существуют в виде связанных пар (H 2 и O 2 соответственно).В правильных условиях и при наличии достаточной энергии эти двухатомные связи разорвутся, и атомы соединятся, образуя H 2 O (вода). Химики записывают эту химическую реакцию как:
2H 2 + O 2 → 2H 2 O
Это уравнение говорит о том, что для образования двух молекул воды требуется две молекулы водорода и одна молекула кислорода. Обратите внимание, что с обеих сторон уравнения одинаковое количество атомов водорода и атомов кислорода. В химических изменениях, как и в физических, материя сохраняется.Отличие в данном случае состоит в том, что вещества до и после изменения имеют разные физические и химические свойства. Водород и кислород представляют собой газы при стандартной температуре и давлении, тогда как вода представляет собой бесцветную жидкость без запаха.
Обратите внимание, что с обеих сторон уравнения одинаковое количество атомов водорода и атомов кислорода. В химических изменениях, как и в физических, материя сохраняется.Отличие в данном случае состоит в том, что вещества до и после изменения имеют разные физические и химические свойства. Водород и кислород представляют собой газы при стандартной температуре и давлении, тогда как вода представляет собой бесцветную жидкость без запаха.
В экосистемах происходит множество химических и физических изменений, происходящих одновременно, и материя сохраняется в каждой из них — без исключений. Рассмотрим поток, текущий через каньон — сколько химических и физических изменений происходит в любой данный момент?
Сначала рассмотрим воду.Во многих ручьях каньонов вода поступает с возвышенностей и образуется в виде снега. Конечно, вода не начиналась с — она вращалась по всему миру с тех пор, как на Земле впервые появилась вода. Но в контексте каньонного ручья он начинался в горах как снег. Снег должен претерпеть 90 244 физических изменения 90 245 — таяние — чтобы присоединиться к потоку. Когда жидкая вода течет через каньон, она может испаряться (еще одно физическое изменение) в водяной пар. Вода дает очень яркий пример того, как материя движется по кругу в нашем мире, часто меняя форму, но никогда не исчезая.
Снег должен претерпеть 90 244 физических изменения 90 245 — таяние — чтобы присоединиться к потоку. Когда жидкая вода течет через каньон, она может испаряться (еще одно физическое изменение) в водяной пар. Вода дает очень яркий пример того, как материя движется по кругу в нашем мире, часто меняя форму, но никогда не исчезая.
Далее рассмотрим растения и водоросли, живущие в ручье и вдоль него. В процессе, называемом фотосинтезом, эти организмы преобразуют световую энергию солнца в химическую энергию, хранящуюся в сахарах. Однако световая энергия не производит атомы, из которых состоят эти сахара — это нарушило бы закон сохранения массы — она просто обеспечивает энергию для химических изменений. Атомы образуются из углекислого газа в воздухе и воды в почве. Энергия света позволяет этим связям разорваться и восстановиться для производства сахара и кислорода, как показано в химическом уравнении фотосинтеза:
6CO 2 + 6H 2 O + легкий → C 6 H 12 O 6 (сахар)+ 6O 2
Это уравнение говорит о том, что шесть молекул углекислого газа соединяются с шестью молекулами воды, образуя одну молекулу сахара и шесть молекул кислорода. Если вы сложите все атомы углерода, водорода и кислорода по обе стороны уравнения, суммы будут равны; материя сохраняется в этом химическом изменении.
Если вы сложите все атомы углерода, водорода и кислорода по обе стороны уравнения, суммы будут равны; материя сохраняется в этом химическом изменении.
Когда животные в ручье и вокруг него едят эти растения, их тела используют накопленную химическую энергию для питания своих клеток и передвижения. Они используют питательные вещества в своей пище для роста и восстановления своих тел — атомы для новых клеток должны откуда-то браться. Любая пища, попадающая в организм животного, должна либо покинуть его тело, либо стать его частью; атомы не разрушаются и не создаются.
Вещество также сохраняется во время физических и химических изменений в горном цикле. По мере того, как ручей углубляется в каньон, камни на дне каньона не исчезают. Они размываются потоком и уносятся небольшими кусочками, называемыми отложениями. Эти отложения могут оседать на дне озера или пруда в конце ручья, со временем накапливаясь слоями. Вес каждого дополнительного слоя уплотняет слои под ним, в конечном итоге добавляя такое большое давление, что образуются новые осадочные породы. Это физическое изменение камня, но при правильных условиях камень может измениться и химически. В любом случае вещество в породе сохраняется.
Это физическое изменение камня, но при правильных условиях камень может измениться и химически. В любом случае вещество в породе сохраняется.
Суть в том, что материя циркулирует во вселенной в различных формах. При любом физическом или химическом изменении материя не появляется и не исчезает. Атомы, созданные звездами (очень, очень давно), составляют все живое и неживое на Земле — даже вас. Невозможно узнать, как далеко и через какие формы прошли ваши атомы, чтобы создать вас.И невозможно знать, где они окажутся в следующий раз.
Это не вся история материи, однако, это история видимой материи. Ученые узнали, что около 25 процентов массы Вселенной состоит из темной материи — материи, которую нельзя увидеть, но которую можно обнаружить благодаря ее гравитационным эффектам. Точная природа темной материи еще не определена. Еще 70 процентов Вселенной — это еще более загадочный компонент, называемый темной энергией, который действует в противовес гравитации.Таким образом, «нормальная» материя составляет не более пяти процентов Вселенной.
Физическая химия — Американское химическое общество
Что такое физическая химия?
Физическая химия имеет дело с принципами физики, связанными с химическими взаимодействиями. Он исследует:
- Как материя ведет себя на молекулярном и атомном уровне
- Как происходят химические реакции
Физико-химики сосредоточены на понимании физических свойств атомов и молекул, того, как протекают химические реакции, и того, что раскрывают эти свойства.Их открытия основаны на понимании химических свойств и описании их поведения с использованием физических теорий и математических расчетов.
Физическая химия — это хорошая область для химиков, которые проявляют сильное любопытство к тому, как все работает на атомном уровне, и которым нравится работать с лабораторными приборами и машинами.
Чем занимаются физические химики?
Химики-физики открывают, тестируют и стремятся понять физические характеристики материала (т. д., твердое, жидкое или газообразное). Точность и внимание к деталям делают их работу чем-то похожей на аналитическую химию.
д., твердое, жидкое или газообразное). Точность и внимание к деталям делают их работу чем-то похожей на аналитическую химию.
Они используют сложные приборы и оборудование, такое как лазеры, масс-спектрометры, ядерно-магнитный резонанс и электронные микроскопы, чтобы:
- Анализ материалов
- Разработка методов тестирования и определения свойств материалов
- Разработать теории об этих свойствах
- Откройте для себя возможности использования материалов
Физические химики подчеркивают важность применения математики в работе.Они используют математический анализ и статистику огромных наборов данных — иногда с миллионами точек данных — для раскрытия скрытой информации о соединениях, материалах и процессах. Они также могут проводить моделирование, разрабатывая математические уравнения, которые предсказывают, как соединения будут реагировать с течением времени.
Многие из тех, кто работает в лаборатории, говорят, что их время делится между рабочим столом и рабочим столом, где они выполняют расчеты и анализируют данные. Химики-физики, занимающие руководящие должности, также проводят время, наблюдая за другими учеными, анализируя потребности и цели отдела и встречаясь с бизнес-менеджерами своих компаний.
Химики-физики, занимающие руководящие должности, также проводят время, наблюдая за другими учеными, анализируя потребности и цели отдела и встречаясь с бизнес-менеджерами своих компаний.
Где применяется физическая химия?
Исследования, проводимые физико-химиками, составляют все более малую часть промышленных исследований. Соответственно, меньше физико-химиков нанимается промышленностью и государственными лабораториями. Тем не менее, физическая химия обеспечивает широкую подготовку и позволяет студентам работать в различных научных сферах, таких как:
- Новые области материаловедения и молекулярного моделирования. Сочетание традиционной математической строгости физической химии с практичностью этих областей открывает новые захватывающие возможности.
- Карьера в области аналитической химии. Здесь вы будете работать над пониманием фундаментальных процессов, связанных с аналитическими методами, и искать способы их улучшения и расширения.

Сравнительный анализ методов химического подобия модульных природных продуктов с алгоритмом перебора гипотетической структуры | Journal of Cheminformatics
Модульные натуральные продукты можно охарактеризовать рядом структурных или биосинтетических особенностей, включая характер ферментативной сборочной линии, ответственной за их биосинтез (нерибосомный пептид, поликетид или гибрид), их размер, наличие или отсутствие стартовые звенья, характер их макроциклизации и действие реакций адаптации, таких как гликозилирование, образование тиазола/оксазола, хлорирование или N-метилирование.Чтобы оценить влияние каждого из этих признаков на поиск химического сходства, мы разработали LEMONS (библиотеку для перечисления модульных природных структур). LEMONS — это программный пакет Java, предназначенный для перечисления гипотетических структур натуральных продуктов с заданным пользователем набором параметров биосинтеза. Каждая гипотетическая структура впоследствии модифицируется путем замены одного или нескольких мономеров или путем добавления, удаления или изменения места одной или нескольких реакций адаптации. Затем модифицированную структуру можно сравнить со всей библиотекой исходных структур, используя двумерный отпечаток пальца или другой метод химического подобия. Правильное соответствие засчитывается, если модифицированная структура демонстрирует большее химическое сходство с исходной структурой, чем с любой другой структурой в библиотеке. Этот процесс повторяется по очереди для каждой модифицированной структуры, и для каждого метода химического подобия определяется доля правильных совпадений. Таким образом, LEMONS можно использовать для расчета процента правильных совпадений между исходной и модифицированной структурами для любого метода химического сходства с использованием вводимого пользователем списка возможных мономеров и реакций адаптации.
Затем модифицированную структуру можно сравнить со всей библиотекой исходных структур, используя двумерный отпечаток пальца или другой метод химического подобия. Правильное соответствие засчитывается, если модифицированная структура демонстрирует большее химическое сходство с исходной структурой, чем с любой другой структурой в библиотеке. Этот процесс повторяется по очереди для каждой модифицированной структуры, и для каждого метода химического подобия определяется доля правильных совпадений. Таким образом, LEMONS можно использовать для расчета процента правильных совпадений между исходной и модифицированной структурами для любого метода химического сходства с использованием вводимого пользователем списка возможных мономеров и реакций адаптации.
Наша структура для настоящего исследования была следующей. Во-первых, мы проводим простую проверку концепции подхода LEMONS, используя LEMONS для создания библиотек коротких линейных протеиногенных пептидов. Затем мы используем LEMONS для создания библиотек линейных гипотетических нерибосомных пептидов, поликетидов и гибридных натуральных продуктов. Мы анализируем эффективность каждого метода подобия для каждого семейства натуральных продуктов и рассматриваем влияние состава мономеров на поиск сходства.Мы также учитываем влияние стартовых единиц, присутствующих во многих модульных путях биосинтеза натуральных продуктов. Поскольку производительность некоторых методов, как утверждается, демонстрирует зависимость от размера лиганда, мы затем оцениваем взаимосвязь между размером природного продукта (количество мономеров) и поиском подобия. Чтобы более точно приблизиться к ферментативным реакциям адаптации, которые происходят в путях биосинтеза, мы затем количественно оцениваем влияние макроциклизации и гликозилирования. Наконец, мы используем LEMONS для создания реалистичных библиотек тщательно подобранных натуральных продуктов, таких как те, что показаны на рис.2, и предоставить общее руководство по поиску химического сходства в модульном химическом пространстве натуральных продуктов.
Мы анализируем эффективность каждого метода подобия для каждого семейства натуральных продуктов и рассматриваем влияние состава мономеров на поиск сходства.Мы также учитываем влияние стартовых единиц, присутствующих во многих модульных путях биосинтеза натуральных продуктов. Поскольку производительность некоторых методов, как утверждается, демонстрирует зависимость от размера лиганда, мы затем оцениваем взаимосвязь между размером природного продукта (количество мономеров) и поиском подобия. Чтобы более точно приблизиться к ферментативным реакциям адаптации, которые происходят в путях биосинтеза, мы затем количественно оцениваем влияние макроциклизации и гликозилирования. Наконец, мы используем LEMONS для создания реалистичных библиотек тщательно подобранных натуральных продуктов, таких как те, что показаны на рис.2, и предоставить общее руководство по поиску химического сходства в модульном химическом пространстве натуральных продуктов.
Примеры исходных и модифицированных структур, созданных с помощью LEMONS. a Линейный гибридный нерибосомальный пептид/поликетидный натуральный продукт, содержащий алициклическую стартовую единицу, получают производным путем замены аминокислоты, стартовой единицы и поликетидного мономера в дополнение к хлорированию и гетероциклизации/окислению с образованием тиазола. b Макроциклический поликетид получают путем замены двух поликетидных мономеров и гликозилирования актинозамином дезоксисахара
a Линейный гибридный нерибосомальный пептид/поликетидный натуральный продукт, содержащий алициклическую стартовую единицу, получают производным путем замены аминокислоты, стартовой единицы и поликетидного мономера в дополнение к хлорированию и гетероциклизации/окислению с образованием тиазола. b Макроциклический поликетид получают путем замены двух поликетидных мономеров и гликозилирования актинозамином дезоксисахара
В качестве первоначального эксперимента по проверке концепции мы использовали LEMONS для исследования эффективности методов химического подобия с использованием библиотек коротких полимеров протеиногенных аминокислот.Была создана библиотека из 100 олигомеров, каждый длиной от 4 до 15 аминокислот. В каждой структуре была заменена одна аминокислота, и коэффициент Танимото модифицированной структуры для каждой из 100 исходных структур был рассчитан с использованием 18 различных методов химического подобия (Таблица 1, Методы). Этот процесс повторяли, по очереди заменяя аминокислоту в каждой из 100 исходных структур, после чего определяли количество правильных совпадений между исходной и модифицированной структурами. Весь эксперимент повторялся 100 раз. Таким образом, всего было создано 10 4 исходных структур и 10 4 модифицированных структур, всего 10 6 сравнений на метод подобия (или 1,8 × 10 7 всего на эксперимент).
Весь эксперимент повторялся 100 раз. Таким образом, всего было создано 10 4 исходных структур и 10 4 модифицированных структур, всего 10 6 сравнений на метод подобия (или 1,8 × 10 7 всего на эксперимент).
Наши результаты показали, что большинство алгоритмов химического сходства достаточно хорошо показали себя в этом простом тесте (рис.3а). В целом круговые и ретробиосинтетические алгоритмы показали лучшие результаты. Неудивительно, что точность GRAPE/GARLIC приблизилась к 100% (99,99% структур правильно сопоставлены), потому что в отсутствие структурных особенностей, таких как макроциклизация, реакции адаптации или непротеиногенные мономеры, этот метод по существу выполняет выравнивание Нидлмана-Вунша полимеры аминокислот с учетом их химической структуры. Следовательно, производительность ВИНОГРАД / ЧЕСНОК была лучше, чем любой двумерный отпечаток пальца (односторонний парный ранговый тест Бруннера-Мюнцеля, P ≤ 1. 4 × 10 −14 для всех сравнений). Значительная положительная корреляция между точностью и радиусом наблюдалась для круговых отпечатков пальцев (Kendall’s τ = 0,85, P < 10 −300 ). Корреляция между точностью и радиусом оставалась значимой даже при исключении из анализа отпечатков пальцев ECFP0 и FCFP0 ( τ = 0,78, P = 5,7 × 10 -300 ) [34]. Значительная изменчивость в производительности также наблюдалась для отпечатков пальцев на основе подструктуры.Отпечаток Клекота-Рота был особенно точным (95,50%), превзойдя несколько круговых отпечатков пальцев (ECFP0, ECFP2, FCFP0 и FCFP2; односторонний парный ранговый тест Бруннера-Мюнцеля, все P <2,2 × 10 −16 ) , в то время как эффективность отпечатка пальца электротопологического состояния (E-состояние) статистически не отличалась от показателя отпечатка пальца ECFP0 (36,67 и 33,66% соответственно; двусторонний парный ранговый тест Бруннера-Мюнцеля, P > 0,9999).
4 × 10 −14 для всех сравнений). Значительная положительная корреляция между точностью и радиусом наблюдалась для круговых отпечатков пальцев (Kendall’s τ = 0,85, P < 10 −300 ). Корреляция между точностью и радиусом оставалась значимой даже при исключении из анализа отпечатков пальцев ECFP0 и FCFP0 ( τ = 0,78, P = 5,7 × 10 -300 ) [34]. Значительная изменчивость в производительности также наблюдалась для отпечатков пальцев на основе подструктуры.Отпечаток Клекота-Рота был особенно точным (95,50%), превзойдя несколько круговых отпечатков пальцев (ECFP0, ECFP2, FCFP0 и FCFP2; односторонний парный ранговый тест Бруннера-Мюнцеля, все P <2,2 × 10 −16 ) , в то время как эффективность отпечатка пальца электротопологического состояния (E-состояние) статистически не отличалась от показателя отпечатка пальца ECFP0 (36,67 и 33,66% соответственно; двусторонний парный ранговый тест Бруннера-Мюнцеля, P > 0,9999). Наконец, лексикографический отпечаток пальца LINGO, который вычисляет молекулярное сходство на основе текстового представления двух химических структур как SMILES [35], имеет точность, сравнимую с топологическими отпечатками пальцев, с учетом обычных эталонных данных [36].Его точность 88,17% в этом простом эксперименте предполагает, что он может быть приемлемым методом поиска сходства в большом химическом пространстве, подобном натуральному продукту, когда вычислительные ресурсы очень ограничены [37].
Наконец, лексикографический отпечаток пальца LINGO, который вычисляет молекулярное сходство на основе текстового представления двух химических структур как SMILES [35], имеет точность, сравнимую с топологическими отпечатками пальцев, с учетом обычных эталонных данных [36].Его точность 88,17% в этом простом эксперименте предполагает, что он может быть приемлемым методом поиска сходства в большом химическом пространстве, подобном натуральному продукту, когда вычислительные ресурсы очень ограничены [37].
Эффективность метода химического подобия на гипотетических библиотеках линейных пептидов. a Процент правильных совпадений после замены одной протеиногенной аминокислоты в библиотеке гипотетических линейных олигопептидов. b Динамика процента правильных совпадений с заменой от одной до пяти протеиногенных аминокислот
Мы повторили этот экспериментальный эксперимент четыре раза, заменяя по очереди две, три, четыре и пять протеиногенных аминокислот (рис. 3б). График тренда правильных совпадений в зависимости от количества замещенных мономеров показал, что эффективность всех методов снижалась при замещении большего количества мономеров. Однако при большем количестве замен мономеров наблюдалось более четкое разделение по точности между методами. Никаких изменений в ранжировании методов химического подобия не наблюдалось при увеличении числа замен мономеров.
3б). График тренда правильных совпадений в зависимости от количества замещенных мономеров показал, что эффективность всех методов снижалась при замещении большего количества мономеров. Однако при большем количестве замен мономеров наблюдалось более четкое разделение по точности между методами. Никаких изменений в ранжировании методов химического подобия не наблюдалось при увеличении числа замен мономеров.
Затем мы попытались создать более реалистичные гипотетические структуры натуральных продуктов, чтобы лучше оценить эффективность алгоритмов химического подобия в химическом пространстве, подобном натуральному продукту.В дополнение к протеиногенным аминокислотам большинство пептидных натуральных продуктов содержат широкий спектр непротеиногенных аминокислот, полученных в результате первичного метаболизма в результате ферментативных реакций адаптации [38]. Эти строительные блоки значительно увеличивают структурное разнообразие натуральных пептидных продуктов, изменяя их физико-химические свойства и вводя уникальные субструктуры или топологии. Поэтому мы включили как протеиногенные аминокислоты, так и набор из 32 непротеиногенных аминокислот из бактериальных и грибковых нерибосомных пептидов [39] для изучения химического пространства нерибосомных пептидов (дополнительный файл 1: таблица S1).Поликетиды типа I представляют собой еще один большой и важный с фармацевтической точки зрения класс модульных натуральных продуктов. Чтобы профилировать химическое пространство поликетидов, мы включили семь распространенных поликетидных мономеров во всех возможных степенях окисления в генерацию каркаса LEMONS (дополнительный файл 1: таблица S1). Наконец, гибридные нерибосомные пептидно-поликетидные системы ответственны за продукцию нескольких ценных биоактивных метаболитов. Поэтому мы создали линейные гибридные полимеры, содержащие протеиногенные и непротеиногенные аминокислоты и поликетидные мономеры.Сравнение производительности алгоритма на коротких линейных полимерах, соответствующих гипотетическим нерибосомным пептидам, поликетидам и гибридным природным продуктам, показано на рис.
Поэтому мы включили как протеиногенные аминокислоты, так и набор из 32 непротеиногенных аминокислот из бактериальных и грибковых нерибосомных пептидов [39] для изучения химического пространства нерибосомных пептидов (дополнительный файл 1: таблица S1).Поликетиды типа I представляют собой еще один большой и важный с фармацевтической точки зрения класс модульных натуральных продуктов. Чтобы профилировать химическое пространство поликетидов, мы включили семь распространенных поликетидных мономеров во всех возможных степенях окисления в генерацию каркаса LEMONS (дополнительный файл 1: таблица S1). Наконец, гибридные нерибосомные пептидно-поликетидные системы ответственны за продукцию нескольких ценных биоактивных метаболитов. Поэтому мы создали линейные гибридные полимеры, содержащие протеиногенные и непротеиногенные аминокислоты и поликетидные мономеры.Сравнение производительности алгоритма на коротких линейных полимерах, соответствующих гипотетическим нерибосомным пептидам, поликетидам и гибридным природным продуктам, показано на рис. 4 (см. также дополнительный файл 2: рис. S1). В среднем по всем отпечаткам пальцев поиск сходства с гипотетическими нерибосомными пептидами был на 10,78% точнее, чем с протеиногенными пептидами (односторонний тест Бруннера-Мюнцеля, P < 2,2 × 10 -16 ). Поиск сходства также был более точным для гипотетических нерибосомных пептидов, чем для поликетидов, с разницей в 13.07% ( P < 2,2 × 10 −16 ), точность на 2,32% выше для гибридных натуральных продуктов, чем нерибосомных пептидов ( P = 4,5 × 10 −8 ), и на 15,39% более высокая точность для гибридных натуральных продуктов относительно поликетидов ( P < 2,2 × 10 -16 ), усредненное по всем методам химического подобия. Эти наблюдения предполагают, что уникальные свойства непротеиногенных аминокислот, обнаруживаемые в бактериальных и грибковых нерибосомных пептидах, обычно облегчают поиск химического сходства.
4 (см. также дополнительный файл 2: рис. S1). В среднем по всем отпечаткам пальцев поиск сходства с гипотетическими нерибосомными пептидами был на 10,78% точнее, чем с протеиногенными пептидами (односторонний тест Бруннера-Мюнцеля, P < 2,2 × 10 -16 ). Поиск сходства также был более точным для гипотетических нерибосомных пептидов, чем для поликетидов, с разницей в 13.07% ( P < 2,2 × 10 −16 ), точность на 2,32% выше для гибридных натуральных продуктов, чем нерибосомных пептидов ( P = 4,5 × 10 −8 ), и на 15,39% более высокая точность для гибридных натуральных продуктов относительно поликетидов ( P < 2,2 × 10 -16 ), усредненное по всем методам химического подобия. Эти наблюдения предполагают, что уникальные свойства непротеиногенных аминокислот, обнаруживаемые в бактериальных и грибковых нерибосомных пептидах, обычно облегчают поиск химического сходства.
Эффективность метода химического подобия на гипотетических библиотеках линейных продуктов. Тенденции в процентах правильных совпадений с заменой от одного до пяти мономеров в пределах гипотетического нерибосомного пептида ( a ), поликетида ( b ) или гибридного природного продукта ( c )
Тенденции в процентах правильных совпадений с заменой от одного до пяти мономеров в пределах гипотетического нерибосомного пептида ( a ), поликетида ( b ) или гибридного природного продукта ( c )
В дополнение к непротеиногенным аминокислотам и поликетидным мономерам, модульные натуральные продукты обычно содержат стартовые единицы, которые опосредуют биологическую активность, включая жирные кислоты с прямой и разветвленной цепью с короткой и длинной цепью, ароматические и алициклические кислоты и производные аминокислот [40].Можно ожидать, что эти стартовые единицы внесут значительный вклад в поиск химического сходства из-за их уникальной субструктуры или топологии. Мы исследовали влияние общих стартовых единиц на поиск подобия в химическом пространстве, подобном натуральному продукту, путем диверсификации гипотетических гибридных натуральных продуктов с 23 общими стартовыми единицами, включая 4 жирные кислоты, 13 ароматических кислот, 3 алициклические кислоты и 3 малых стартовых единицы (Дополнительные файл 1: Таблица S1). В целом, эффективность каждого метода поиска сходства была одинаковой для линейных гибридных натуральных продуктов со стартовыми единицами и без них (дополнительный файл 3: рис.С2). Тем не менее, наблюдались значительные различия в производительности при сравнении стартовой единицы и замены нестартовой единицы: например, процент натуральных продуктов, правильно сопоставленных с помощью только графического отпечатка CDK, был на 16,22 % выше для замен начальных единиц, но на 30,47 % ниже для заменителей. отпечаток пальца Pubchem. В среднем по всем отпечаткам пальцев замена стартовой единицы была эквивалентна 1,70 заменам нестартовой единицы (дополнительный файл 3: рис. S2). Эти результаты показывают, что в целом на поиск сходства сильно влияют уникальные структурные свойства модульных заквасок из натуральных продуктов.Хотя это явление может способствовать объединению в кластеры натуральных продуктов одного семейства, имеющих общую начальную единицу, оно может представлять собой препятствие для химико-информационной идентификации семейств натуральных продуктов с различными исходными единицами.
В целом, эффективность каждого метода поиска сходства была одинаковой для линейных гибридных натуральных продуктов со стартовыми единицами и без них (дополнительный файл 3: рис.С2). Тем не менее, наблюдались значительные различия в производительности при сравнении стартовой единицы и замены нестартовой единицы: например, процент натуральных продуктов, правильно сопоставленных с помощью только графического отпечатка CDK, был на 16,22 % выше для замен начальных единиц, но на 30,47 % ниже для заменителей. отпечаток пальца Pubchem. В среднем по всем отпечаткам пальцев замена стартовой единицы была эквивалентна 1,70 заменам нестартовой единицы (дополнительный файл 3: рис. S2). Эти результаты показывают, что в целом на поиск сходства сильно влияют уникальные структурные свойства модульных заквасок из натуральных продуктов.Хотя это явление может способствовать объединению в кластеры натуральных продуктов одного семейства, имеющих общую начальную единицу, оно может представлять собой препятствие для химико-информационной идентификации семейств натуральных продуктов с различными исходными единицами.
Известно, что эффективность некоторых отпечатков пальцев существенно зависит от размера лиганда [41]. Таким образом, различные стратегии поиска химического сходства могут демонстрировать оптимальную эффективность для семейств соединений с более низкой или более высокой средней молекулярной массой.Мы исследовали влияние размера на производительность алгоритма химического сходства путем создания библиотек гипотетических натуральных продуктов фиксированных размеров. Были созданы библиотеки гипотетических нерибосомных пептидов, поликетидов, гибридов и гибридов со стартовыми звеньями, состоящими из 4–15 мономеров, и была оценена производительность каждого алгоритма с 3 заменами мономеров (рис. 5). В целом ранжирование методов химического подобия по точности оставалось достаточно стабильным независимо от размера натурального продукта, что указывает на то, что методы, которые хорошо работают для небольших натуральных продуктов, как правило, также хорошо работают для более крупных натуральных продуктов.
Эффективность метода химического сходства на гипотетических библиотеках линейных натуральных продуктов в зависимости от размера натурального продукта. Тенденции в процентах правильных совпадений с заменой трех мономеров в гипотетических линейных нерибосомных пептидах ( a ), поликетидах ( b ), гибридных натуральных продуктах ( c ) или гибридах со стартовыми единицами ( d ), содержащими пять до четырнадцати мономеров
Многие натуральные продукты подвергаются региоселективной циклизации макролактона или макролактама, что необходимо для их биологической активности [42].Чтобы оценить влияние макроциклизации на поиск подобия натуральных продуктов, мы создали циклические и разветвленные гипотетические нерибосомные пептиды, поликетиды и гибриды (рис. 6). В среднем по всем отпечаткам пальцев замена схемы циклизации была эквивалентна замене 0,75 мономера в гибридном природном продукте. Примечательно, что отпечатки пальцев ECFP с радиусом от 2 до 6 были по крайней мере на 10% менее точными, когда картина макроциклизации была изменена по сравнению с заменой одного мономера.Эти результаты показывают, что макроциклизация вносит относительно небольшой вклад в поиск подобия натуральных продуктов, за исключением методов, которые сильно взвешивают локальные атомные среды.
Примечательно, что отпечатки пальцев ECFP с радиусом от 2 до 6 были по крайней мере на 10% менее точными, когда картина макроциклизации была изменена по сравнению с заменой одного мономера.Эти результаты показывают, что макроциклизация вносит относительно небольшой вклад в поиск подобия натуральных продуктов, за исключением методов, которые сильно взвешивают локальные атомные среды.
Эффективность метода химического подобия на гипотетических библиотеках циклических натуральных продуктов. Тенденции в процентах правильных совпадений с заменой от одного до пяти мономеров или участка макроциклизации в пределах гипотетического циклического нерибосомного пептида ( a ), поликетида ( b ) или гибридного природного продукта ( c )
Во время биосинтеза натуральных продуктов огромное структурное разнообразие создается из ограниченного числа мономеров с помощью разнообразных ферментативных реакций адаптации [20]. Эти реакции вносят значительный вклад в структурную сложность натуральных продуктов. Мы смоделировали влияние реакций адаптации на поиск химического сходства путем создания линейных и циклических нерибосомных пептидов, поликетидов и гибридных природных продуктов с одной-тремя гексозами или дезоксисахарами (дополнительный файл 4: таблица S2), а также дополнительно проанализировали влияние изменения сайта. гликозилирования (рис. 7). Для гибридных натуральных продуктов величина эффекта от добавления сахара в несшитый каркас лишь немного отличалась от эффекта от изменения места гликозилирования (средняя точность для всех отпечатков пальцев 83.86 против 83,36% соответственно), хотя разница была очень значимой (двусторонний парный ранговый критерий Бруннера-Мюнцеля, P < 2,2 × 10 -16 ). Хотя ни один отпечаток пальца не был более точным при добавлении трех фрагментов сахара, чем при добавлении только одного, точность всех четырех топологических отпечатков улучшилась, когда места трех сахаров были изменены по сравнению только с одним (тест Бруннера-Мюнцеля, P ).
Эти реакции вносят значительный вклад в структурную сложность натуральных продуктов. Мы смоделировали влияние реакций адаптации на поиск химического сходства путем создания линейных и циклических нерибосомных пептидов, поликетидов и гибридных природных продуктов с одной-тремя гексозами или дезоксисахарами (дополнительный файл 4: таблица S2), а также дополнительно проанализировали влияние изменения сайта. гликозилирования (рис. 7). Для гибридных натуральных продуктов величина эффекта от добавления сахара в несшитый каркас лишь немного отличалась от эффекта от изменения места гликозилирования (средняя точность для всех отпечатков пальцев 83.86 против 83,36% соответственно), хотя разница была очень значимой (двусторонний парный ранговый критерий Бруннера-Мюнцеля, P < 2,2 × 10 -16 ). Хотя ни один отпечаток пальца не был более точным при добавлении трех фрагментов сахара, чем при добавлении только одного, точность всех четырех топологических отпечатков улучшилась, когда места трех сахаров были изменены по сравнению только с одним (тест Бруннера-Мюнцеля, P ). < 2,2 × 10 −16 ). Для линейных гибридных натуральных продуктов добавление одной гексозы или дезоксисахара имело эффект на точность, эквивалентный замене 1.16 мономеров, при этом изменение места гликозилирования было эквивалентно замене 1,17 мономеров. Эти результаты показывают, что для нетопологических отпечатков пальцев эффект диверсификации модульных натуральных продуктов с помощью гексозы и дезоксисахаров сравним с заменой мономера аминокислоты или кетида.
< 2,2 × 10 −16 ). Для линейных гибридных натуральных продуктов добавление одной гексозы или дезоксисахара имело эффект на точность, эквивалентный замене 1.16 мономеров, при этом изменение места гликозилирования было эквивалентно замене 1,17 мономеров. Эти результаты показывают, что для нетопологических отпечатков пальцев эффект диверсификации модульных натуральных продуктов с помощью гексозы и дезоксисахаров сравним с заменой мономера аминокислоты или кетида.
Эффективность метода химического подобия на гипотетических библиотеках гликозилированных натуральных продуктов. Тенденции в процентах правильных совпадений при добавлении от одной до трех гексоз или деоксисахаров или замене от одного до трех сайтов гликозилирования в пределах гипотетических линейных или циклических нерибосомных пептидов ( a ), поликетидов ( b ) или гибридных природных продуктов ( с )
Рассмотрев влияние ряда биосинтетических признаков на поиск химического сходства, мы, наконец, попытались количественно оценить эффективность каждого метода химического подобия, создав реалистичные библиотеки тщательно подобранных натуральных продуктов и тем самым выведя общие рекомендации по поиску сходства в модульных натуральных продуктах. химическое пространство.Мы использовали LEMONS для создания библиотек, состоящих из равных частей циклических и линейных гибридных натуральных продуктов с 4–15 мономерами. Были замещены два мономера и рассмотрены четыре реакции адаптации (гликозилирование, N-метилирование, галогенирование и образование оксазола/тиазола). Каждый тип реакции был выполнен на 50% исходных структур, с вероятностью 25% удаления пошивки из модифицированной структуры и с вероятностью 25% изменения места реакции в модифицированной структуре.Как и в случае с протеиногенными олигомерами аминокислот, циклические и ретробиосинтетические методы обычно продемонстрировали наилучшие результаты для сложных гипотетических натуральных продуктов (рис. 8). GRAPE/GARLIC и FCFP6 были одинаково точными, т. е. не давали статистически отличающихся результатов, со средней точностью 95,80 и 95,53% совпадающих структур соответственно (парный ранговый тест Бруннера-Мюнцеля, P = 0,42). Более высокая производительность фингерпринта FCFP6 по сравнению с фингерпринтом ECFP6 предполагает, что модульные натуральные продукты могут быть обогащены по сравнению с малыми пептидами функциональными свойствами, связанными со связыванием лиганда (средняя точность 95.
химическое пространство.Мы использовали LEMONS для создания библиотек, состоящих из равных частей циклических и линейных гибридных натуральных продуктов с 4–15 мономерами. Были замещены два мономера и рассмотрены четыре реакции адаптации (гликозилирование, N-метилирование, галогенирование и образование оксазола/тиазола). Каждый тип реакции был выполнен на 50% исходных структур, с вероятностью 25% удаления пошивки из модифицированной структуры и с вероятностью 25% изменения места реакции в модифицированной структуре.Как и в случае с протеиногенными олигомерами аминокислот, циклические и ретробиосинтетические методы обычно продемонстрировали наилучшие результаты для сложных гипотетических натуральных продуктов (рис. 8). GRAPE/GARLIC и FCFP6 были одинаково точными, т. е. не давали статистически отличающихся результатов, со средней точностью 95,80 и 95,53% совпадающих структур соответственно (парный ранговый тест Бруннера-Мюнцеля, P = 0,42). Более высокая производительность фингерпринта FCFP6 по сравнению с фингерпринтом ECFP6 предполагает, что модульные натуральные продукты могут быть обогащены по сравнению с малыми пептидами функциональными свойствами, связанными со связыванием лиганда (средняя точность 95. 53 и 94,67% соответственно; односторонний парный ранговый тест Бруннера-Мюнцеля, P = 4,5 × 10 −5 ). Положительная корреляция между радиусом кругового отпечатка пальца и точностью была воспроизведена (Kendall’s τ = 0,69, P < 10 −300 ) и оставалась значимой при исключении из анализа отпечатков пальцев ECFP0 и FCFP0 ( τ = 0,48, , P < 10 −300 ). Среди отпечатков пальцев, основанных на подструктурах, отпечаток Клекота-Рота был наиболее точным, точность которого незначительно отличалась от отпечатка пальца ECFP2 (средняя точность 91.77 и 91,99% соответственно; двусторонний парный ранговый тест Бруннера-Мюнцеля, P = 0,73). Относительно низкая производительность отпечатков E-state, MACCS и PubChem предполагает, что субструктуры, индексируемые этими отпечатками, имеют ограниченное применение при поиске химического сходства модульных натуральных продуктов.
53 и 94,67% соответственно; односторонний парный ранговый тест Бруннера-Мюнцеля, P = 4,5 × 10 −5 ). Положительная корреляция между радиусом кругового отпечатка пальца и точностью была воспроизведена (Kendall’s τ = 0,69, P < 10 −300 ) и оставалась значимой при исключении из анализа отпечатков пальцев ECFP0 и FCFP0 ( τ = 0,48, , P < 10 −300 ). Среди отпечатков пальцев, основанных на подструктурах, отпечаток Клекота-Рота был наиболее точным, точность которого незначительно отличалась от отпечатка пальца ECFP2 (средняя точность 91.77 и 91,99% соответственно; двусторонний парный ранговый тест Бруннера-Мюнцеля, P = 0,73). Относительно низкая производительность отпечатков E-state, MACCS и PubChem предполагает, что субструктуры, индексируемые этими отпечатками, имеют ограниченное применение при поиске химического сходства модульных натуральных продуктов.
Эффективность метода химического подобия на гипотетических библиотеках сложных гибридных натуральных продуктов. Процент правильных совпадений после замены двух мономеров в гипотетических библиотеках сложных гибридных природных продуктов с различной макроциклизацией, гликозилированием, гетероциклизацией, галогенированием и N-метилированием
Процент правильных совпадений после замены двух мономеров в гипотетических библиотеках сложных гибридных природных продуктов с различной макроциклизацией, гликозилированием, гетероциклизацией, галогенированием и N-метилированием
mihalick — Места преподавателей/сотрудников
Пожалуйста, дважды проверьте веб-адрес или воспользуйтесь функцией поиска на этой странице, чтобы найти то, что вы ищете.
Если вы уверены, что у вас правильный веб-адрес, но столкнулись с ошибкой, пожалуйста, свяжитесь с администрацией сайта.
Спасибо.
Возможно, вы искали…
- михалик
по Ледвеллу,
04 августа 2011 г.
 , 10:54
, 10:54 - материалы домой Михалик, 08 января 2020 г., 13:56
- Весенняя программа 2011 г. Михалик, 04 августа 2011 г., 10:22
- Chem 104Q2: Введение в химию материалов
Михалик,
08 января 2020 г.
 , 13:56
, 13:56 - веб-ресурсы для Chem 104
- классификация Михалик, 04 августа 2011 г., 10:18
- Chem 360: История современной науки в Великобритании Михалик, 05 августа 2011 г., 15:27
- материалы для разового специального курса
- Домашняя страница Михалик
по Ледвеллу,
14 декабря 2021 г.
 , 08:10
, 08:10 - CV Дж. Э. Михалик Михалик, 08 января 2020 г., 13:54
- сплавы Михалик, 04 августа 2011 г., 10:16
- Исследовательские возможности для студентов
Михалик,
23 апр.
 2018 г., 17:08
2018 г., 17:08 - структуры Михалик, 04 августа 2011 г., 10:18
Физико-химические свойства и экологическая судьба — основа для выбора химических альтернатив
После изучения исследовательской литературы и существующих основ, описанных в
Глава 2, комитет
определил высокоприоритетный набор данных о физико-химических свойствах.Эти
свойства перечислены в , вместе с кратким описанием комитета
обоснование их включения.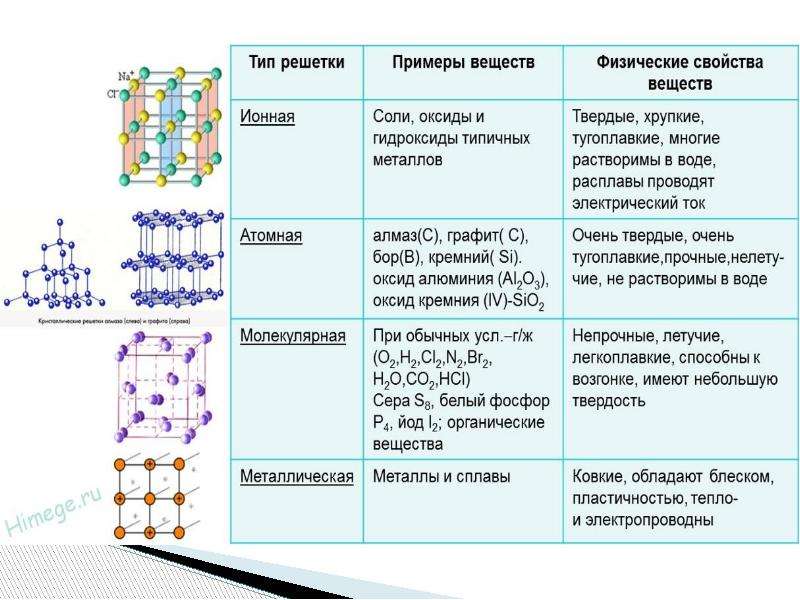 В общем, комиссия отобрала тех.
физико-химические свойства, которые могут поддерживать следующие виды использования в
оценка альтернатив:
В общем, комиссия отобрала тех.
физико-химические свойства, которые могут поддерживать следующие виды использования в
оценка альтернатив:
В этом разделе более подробно описывается, как физико-химические свойства могут использоваться для информирования оценки альтернатив в отношении оценки физические опасности, судьба в окружающей среде и человеческая/экотоксикологическая токсичность конечные точки.
Физико-химические свойства и экологическая судьба: отсеки Concern
Вторым шагом в использовании данных о физико-химических свойствах является определение
отсек(и) окружающей среды, в который будут разделены химические вещества
(экологическое разделение). Физическое состояние химического вещества,
которые можно предсказать на основе температуры плавления, температуры кипения и
давление пара, может указать, какая окружающая среда
компартменты — воздух, вода, отложения, биота, почва, — в которые
химическое вещество разделит.Например, легколетучие химические вещества.
ускользнет из почвы или воды и в основном будет присутствовать в воздухе. И наоборот, химические вещества с высокой склонностью к сорбции на органическом углероде
или перейти в липидную фазу, скорее всего, останутся в почве или отложениях или
переходят в биоту соответственно.
И наоборот, химические вещества с высокой склонностью к сорбции на органическом углероде
или перейти в липидную фазу, скорее всего, останутся в почве или отложениях или
переходят в биоту соответственно.
Растворимость в воде дает информацию о том, будет ли химическое вещество
растворяться в воде, отправная точка для понимания его судьбы и
перенос в толщу воды или осадок. Это понимание
дополнительно расширено знанием коэффициента разделения фаз,
журнал P .Как правило, химические вещества с более высоким
log P значения с большей вероятностью перейдут в и
сохраняться биотой, хотя есть существенные исключения из этого
правило (например, большие молекулы, которые не могут пересекать биологические мембраны).
Химические вещества со склонностью к экологическому разделению на
отложения будут с большей вероятностью впитываться в почву, поэтому почвенно-водная
коэффициент фазового разделения (K d ) будет информативен как для
системы. Для некоторых химических веществ необходимо проводить процессы трансформации.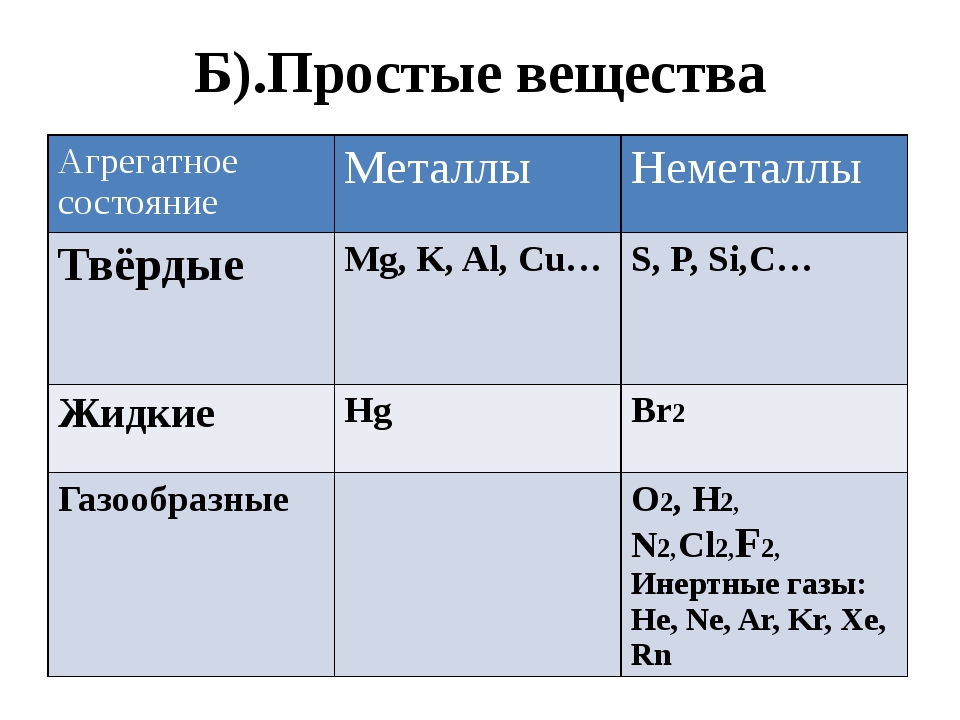 считается, потому что трансформированные или метаболизированные продукты часто имеют
различные физико-химические свойства; таким образом, они могут находиться в разных
экологические отсеки.
считается, потому что трансформированные или метаболизированные продукты часто имеют
различные физико-химические свойства; таким образом, они могут находиться в разных
экологические отсеки.
Чтобы получить представление о потенциале утечки для данного химического вещества, единица измерения модели мира, разработанные Mackay и Paterson (1991) по органическим химическим веществам и Diamond et al. (1990) для металлы обеспечивают структурную основу для определения потенциального химического распределение, основанное на внутренних свойствах летучести (f), что является неотъемлемое химическое свойство, которое регулирует относительные концентрации химические вещества в различных экологических и биотических компартментах. Эти модели были применены к экологическим системам Harvey et al.(2007) и Фарли и соавт. (2011), кто также приведите примеры того, как применять эти модельные концепции к опасностям. оценки. Более подробно их применение будет рассмотрено в следующий раздел.
Физико-химические свойства и стойкость, биоаккумуляция и Биотрансформация
Организмы поглощают и выделяют химические вещества с разной скоростью; когда
выведение или метаболическая детоксикация медленнее, чем поглощение,
химические вещества (или химические вещества) накапливаются в организме, что приводит к
пролонгированная доставка тканей (Luoma and Rainbow 2005). Некоторые химические вещества повышают
концентрация на каждом уровне пищевой цепи; эти химические вещества
сказал биоувеличить . Из-за потенциала
некоторые химические вещества для биоусиления и сохранения в пищевой сети,
вещества, способные к биоаккумуляции, требуют особого рассмотрения, поскольку
они могут представлять большую опасность, чем химические вещества, которые быстро
устраняются и не накапливаются.
Некоторые химические вещества повышают
концентрация на каждом уровне пищевой цепи; эти химические вещества
сказал биоувеличить . Из-за потенциала
некоторые химические вещества для биоусиления и сохранения в пищевой сети,
вещества, способные к биоаккумуляции, требуют особого рассмотрения, поскольку
они могут представлять большую опасность, чем химические вещества, которые быстро
устраняются и не накапливаются.
Крупные базы данных химических структур в сочетании с последними разработками в количественной структуре отношения свойств сильно расширили возможности быстрой оценки химических веществ (Howard and Muir 2011).К настоящему времени попытки использования этих моделей оказались успешными в выявление потенциально стойких, биоаккумулятивных и токсичных (PBT) химические вещества. (Для получения дополнительной информации о применении физико-химические данные по экотоксикологии см. в главе 7).
Использование физико-химических свойств для прогнозирования стойкости Органические химические вещества
Согласно определению Павана и Ворта, « стойкость вещества – это длина
время, в течение которого он остается в определенной среде, прежде чем физически
транспортируется в другой отсек и/или подвергается химическому или
биологически преобразованы» (Паван и Ворт, 2008). Большинство альтернатив
системы оценки учитывают стойкость, потому что молекулы, которые
сохраняются, будут иметь повышенные концентрации и, возможно, более высокие
воздействия, в экологических отсеках и с большей вероятностью
биоаккумулировать. Для некоторых классов материалов можно
получить полезную прогностическую информацию о потенциальной стойкости
физико-химических данных, таких как структурные маркеры на
молекула и коэффициенты распределения. Например, Ховард и Мьюир (2010 г.)
проверил более 2200 коммерческих химикатов с помощью in silico и
подходы к экспертной оценке и выявленные физико-химические свойства
которые могут быть использованы для классификации химических веществ как стойких в
атмосфере (период полураспада при атмосферном окислении > 2 дней) или
потенциально подвержен транспортировке на большие расстояния
(log P > -5 и < -1).
Большинство альтернатив
системы оценки учитывают стойкость, потому что молекулы, которые
сохраняются, будут иметь повышенные концентрации и, возможно, более высокие
воздействия, в экологических отсеках и с большей вероятностью
биоаккумулировать. Для некоторых классов материалов можно
получить полезную прогностическую информацию о потенциальной стойкости
физико-химических данных, таких как структурные маркеры на
молекула и коэффициенты распределения. Например, Ховард и Мьюир (2010 г.)
проверил более 2200 коммерческих химикатов с помощью in silico и
подходы к экспертной оценке и выявленные физико-химические свойства
которые могут быть использованы для классификации химических веществ как стойких в
атмосфере (период полураспада при атмосферном окислении > 2 дней) или
потенциально подвержен транспортировке на большие расстояния
(log P > -5 и < -1).
Стойкость химического вещества в окружающей среде часто измеряется,
или оценивается с точки зрения его биодеградация . 23 Существует множество режимов
деградации, которые зависят от условий окружающей среды, типов
присутствующие микробы и структура химического вещества. Деградация
обычно определяется количественно на основе степени удаления растворенных
органические соединения в водной среде химического вещества и
выражается в процентах деградации за заданное время. 24
23 Существует множество режимов
деградации, которые зависят от условий окружающей среды, типов
присутствующие микробы и структура химического вещества. Деградация
обычно определяется количественно на основе степени удаления растворенных
органические соединения в водной среде химического вещества и
выражается в процентах деградации за заданное время. 24
Деградация обычно представляет собой сложный многоэтапный процесс, который часто
производит химические промежуточные продукты. Эти промежуточные продукты могут представлять
дополнительные опасности для окружающей среды или сохраняются, если они не
деградировал. Некоторые превращения могут увеличить токсичность
исходное соединение (например, метилирование ртути, фотоиндукция
полициклические ароматические углеводороды [ПАУ]), в то время как другие реакции
может снизить токсичность химического вещества. Биодеградация также может
изменить распределение компонентов в окружающей среде
отсеки (т.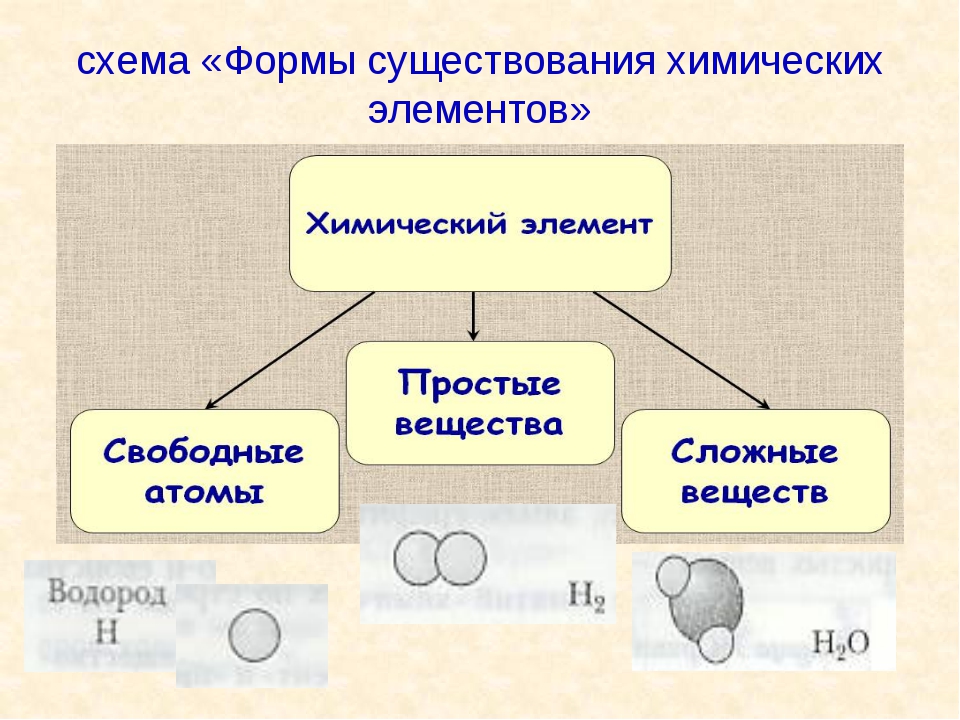 г., за счет образования ионов из неорганических
химические вещества).
г., за счет образования ионов из неорганических
химические вещества).
Химическая деградация, разновидность биодеградации, может включать количество стадий химической реакции в зависимости от окружающей среды условия и химическая структура (Хетан и Коллинз, 2007). Химическая процессы разложения включают гидролиз, фотохимический преобразования и действие микробных видов (Khetan and Collins, 2007). Способы деградации зависят от окружающей среды и условия (pH, УФ-облучение, популяция микроорганизмов и т. д.).То Разнообразие условий и химической активности означает, что результаты испытаний на деградацию чувствительны к условиям тест. Чтобы дополнить эти тесты, исследователи разработали некоторые «эмпирические правила» (см. вставку 5-2) для оценки или прогнозирования деградация на основе химических функциональных групп и структуры.
ВСТАВКА 5-2
Структурные свойства, усиливающие биодеградацию. Минимальное количество галогенов (особенно F и Cl). Минимальное химическое разветвление (особенно четвертичный C).
Кроме того, были разработаны некоторые модели и базы данных для прогнозирования скорости деградации (Arnot et и др., 2005 г.). Примеры этих моделей включают:
- Модели вклада группы, которые оценивают и прогнозируют термодинамические и другие свойства от молекулярных конструкции; например, BIOWIN (Boethling et al 2004).
- Критерии экспертной оценки биоразлагаемости, основанные на модели «правила большого пальца» (Meylan et al. 2007).
- Модель путей разложения, включая вероятностные модели которые рассчитывают вероятность индивидуума преобразования; например, КАТАБОЛ (Димитров и др.2007).
В отношении получения данные о биодеградации. Эти задачи включают:
Прогнозирование фрагментов деградации.
Необходимость разработки более предсказуемой структуры/деградации отношения (SDR) для исходных химических веществ и деградирует.
Прогноз скорости деградации нового или ранее неизученный хим.
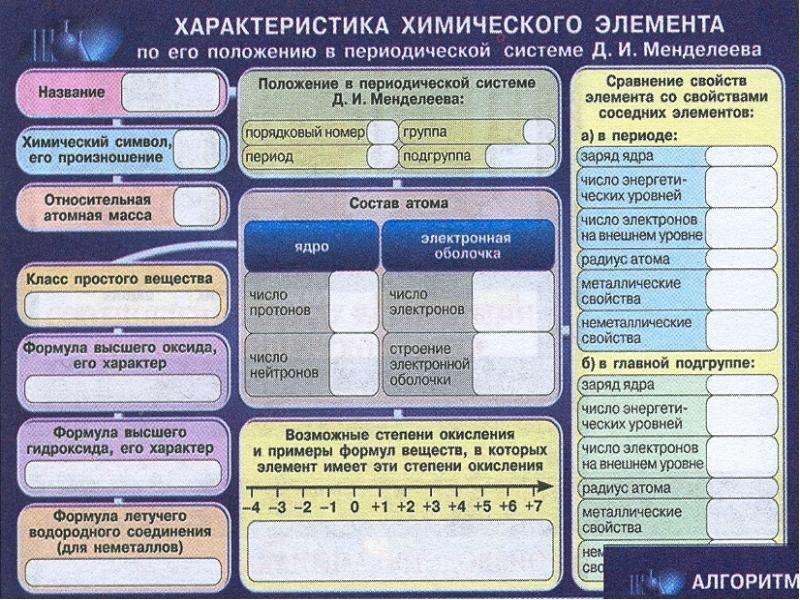
Существует также ряд других факторов, которые необходимо учитывать при оценке измеренных или прогнозируемых данных о разложении органических химические вещества.К ним относятся:
Использование физико-химических свойств для прогнозирования биодоступности неорганических химических веществ
Характеристика срока службы металлов в окружающей среде затруднительна
потому что взаимодействия сильно зависят от характеристик
экологической системы, в которую они высвобождаются.
Выщелачивание 25 и старение 26 связаны с условиями
в почвах и отложениях, поэтому прогнозирование экологической опасности
исключительно на основании стандартных испытаний на водную токсичность с использованием растворимых
солей не достаточно.Таким образом, область экотоксикологии
становится все более зависимым от испытаний на токсичность отложений и почвы
протоколы, включающие этапы выщелачивания и старения или приложение
моделей биодоступности для корректировки данных, полученных в лаборатории
до реальных условий в почвах, отложениях и воде
(Санторе и др. 2002 г.; Тлеет и др.
др. 2009).
2002 г.; Тлеет и др.
др. 2009).
Металлы, недавно внесенные в почву или отложения, более биодоступны чем те, которые состарились на месяцы или годы. Металлы изначально вымывается из почвы или отложений, процесс, который происходит относительно быстро (т.д., от недель до месяцев), с последующим медленным процессом старения (т.е. лет), что приводит к снижению токсичности для отложений или почвенных организмов с течением времени. Поэтому исследования токсичности, проведенные с почва или осадок, свежеобработанные солями металлов, приведут к эффекты при гораздо более низких концентрациях, чем будут наблюдаться в ситуации реального мира (Бессер и другие. 2011).
Старение происходит в результате нескольких различных процессов, включая сорбцию
к оксидам алюминия, марганца или железа и возможному включению
ион металла в кристаллическую структуру минеральной почвы или
частицы осадка (Адриано
2001).Скорость химической сорбции на оксиды, глины,
другие минералы или органические вещества определяются прочностью и
количество отрицательно заряженных участков связывания в почве или отложениях
частицы, на которые, в свою очередь, влияет количество алюминия,
присутствует железо или кремний.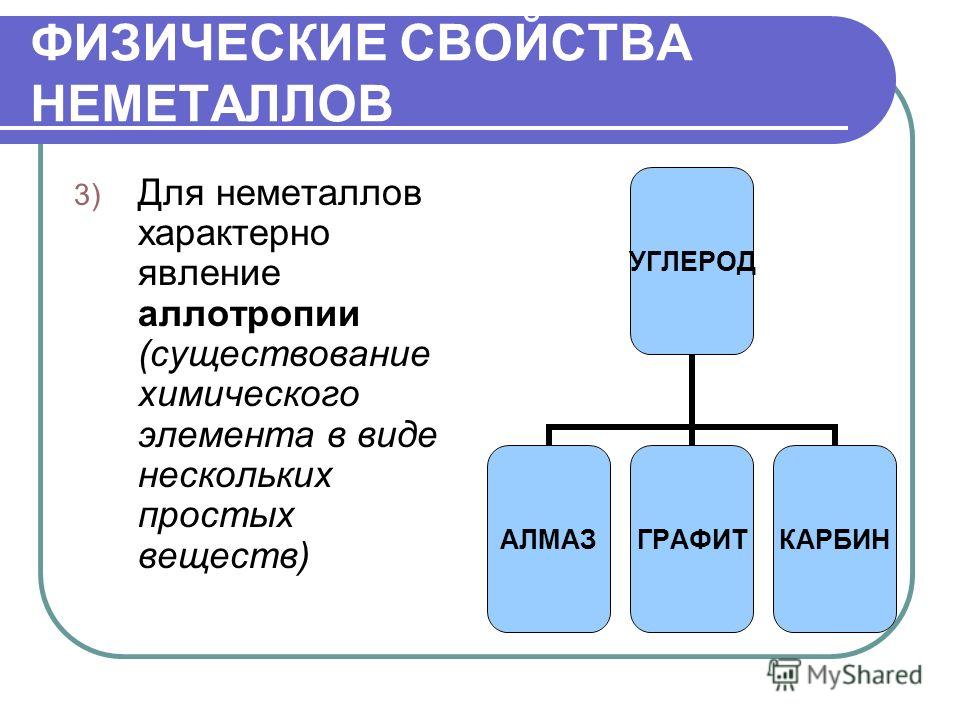 Реакции сорбции обратимы и
сильно зависит от рН, при этом более высокая скорость сорбции наблюдается при
более высокий рН, увеличивая биодоступность по мере снижения рН (т.е. становится
более кислый). Окислительно-восстановительный потенциал влияет на биодоступность
катионные металлы; труднорастворимые сульфиды металлов образуются при
восстановительные условия, такие как те, которые встречаются в насыщенных почвах или
бескислородные отложения.Таким образом, тип среды, в которой
введенный металл также влияет на степень токсичности, которая
можно ожидать, хотя это зависит от металла. Сила
притяжение между ионами металлов и заряженными участками является функцией
сродство металла к заряженному участку относительно его сродства
для молекул воды. Медь обычно имеет самый высокий показатель
сорбции, затем в порядке убывания никеля, кобальта, свинца,
кадмий и цинк. Этот порядок немного отличается для электростатических
связывание с глиной и другими отрицательно заряженными частицами, с никелем
имеет самое высокое сродство к связыванию и самое низкое свинцовое.
Реакции сорбции обратимы и
сильно зависит от рН, при этом более высокая скорость сорбции наблюдается при
более высокий рН, увеличивая биодоступность по мере снижения рН (т.е. становится
более кислый). Окислительно-восстановительный потенциал влияет на биодоступность
катионные металлы; труднорастворимые сульфиды металлов образуются при
восстановительные условия, такие как те, которые встречаются в насыщенных почвах или
бескислородные отложения.Таким образом, тип среды, в которой
введенный металл также влияет на степень токсичности, которая
можно ожидать, хотя это зависит от металла. Сила
притяжение между ионами металлов и заряженными участками является функцией
сродство металла к заряженному участку относительно его сродства
для молекул воды. Медь обычно имеет самый высокий показатель
сорбции, затем в порядке убывания никеля, кобальта, свинца,
кадмий и цинк. Этот порядок немного отличается для электростатических
связывание с глиной и другими отрицательно заряженными частицами, с никелем
имеет самое высокое сродство к связыванию и самое низкое свинцовое.
Сродство связывания также влияет на токсичность катионных металлов. Для Например, жабры водных организмов заряжены отрицательно и действует как еще один сайт связывания некоторых ионов металлов (Playle 2004). Токсичность зависит от относительной силы связывания биотического лиганда и другие отрицательно заряженные частицы в воде (например, органические вещества, сульфиды железа) и конкуренция за места связывания со стороны другие металлы. Модель биотического лиганда можно использовать для предсказания токсичность для данного металла, если концентрации других основных катионы известны (DiToro et др.2001). Эта модель корректирует значения от стандартных испытания на токсичность для различных типов водной среды и могут влияют на относительную опасность различных металлов.
Анионные металлы и металлоиды, такие как молибден, мышьяк, ртуть,
и селен также связываются с оксидами железа, но связывание уменьшается с
повышение pH, что противоположно тому, что происходит с катионными
металлы. Поэтому токсичность этих металлов существенно различается.
от катионных металлов в той же среде.
Кроме того, метилирование металлоидов играет очень важную роль.
в повышении их мобильности и способности к восприятию, а также их способности
биомагнифицировать в пищевой цепи.Известные примеры этого явления
является наблюдение, что метилированный мышьяк менее токсичен, чем его
неорганическая форма, в то время как метилированная ртуть и селенорганические соединения
являются более токсичными. Метилирование – это биологический процесс, происходящий в
бактерии, причем начальный этап происходит в отложениях под
восстановительные условия (низкое содержание кислорода) и наличие высокого содержания органических
материи (Джонналагадда и Рао
1993).
Поэтому токсичность этих металлов существенно различается.
от катионных металлов в той же среде.
Кроме того, метилирование металлоидов играет очень важную роль.
в повышении их мобильности и способности к восприятию, а также их способности
биомагнифицировать в пищевой цепи.Известные примеры этого явления
является наблюдение, что метилированный мышьяк менее токсичен, чем его
неорганическая форма, в то время как метилированная ртуть и селенорганические соединения
являются более токсичными. Метилирование – это биологический процесс, происходящий в
бактерии, причем начальный этап происходит в отложениях под
восстановительные условия (низкое содержание кислорода) и наличие высокого содержания органических
материи (Джонналагадда и Рао
1993).
Поскольку растения, беспозвоночные и почвенные микроорганизмы взаимодействуют с
почвенной или осадочной поровой воде количество свободных ионов металлов в
раствор является наиболее важным фактором, определяющим токсичность.Корни растений
могут выделять фитохелатины, которые связывают металлы, чтобы облегчить или
исключают их поглощение, одновременно снижая рН почвы
или отложения, чтобы сделать питательные вещества более биодоступными (Pal and Rai 2010).
Катионные металлы могут встречаться в виде различных ионных частиц, некоторые из которых
более растворимы и, следовательно, более биодоступны, чем другие. Для
например, хром присутствует в растворе как Cr +6 , что
является высоко биодоступным и токсичным ионом, в то время как он связан с почвами
и большинство отложений как Cr +3 , который менее токсичен.Точно так же триоксид сурьмы (SbO 3 ) очень нерастворим,
тогда как трихлорид сурьмы (SbCl 3 ) нет, что делает
последний менее биодоступен. Исследования токсичности с растворимым
виды металлов, в которых свободный ион легко доступен,
полезно для прогнозирования воздействия на водные организмы, но в целом
имеют небольшую прогностическую ценность для почвенных или осадочных организмов,
во многом из-за продолжительности времени, необходимого для растворения в
поровая вода и смешанные факторы pH и солености из
добавленный хлорид (Smolders et
др.2009). В свете этой сложности никто
физико-химическое свойство или набор свойств в настоящее время является адекватным
определить все проблемы токсичности, если металлы присутствуют в
структуру соединения и могут свободно становиться
доступным в процессе деградации. Тестирование на токсичность и
оценка, как описано в следующих главах, должна быть проведена
для выявления проблем, связанных с присутствием металлов в
сложный.
Тестирование на токсичность и
оценка, как описано в следующих главах, должна быть проведена
для выявления проблем, связанных с присутствием металлов в
сложный.
Использование физико-химических свойств для прогнозирования Биоаккумуляция
Потенциал биоаккумуляции (B) представлен в большинстве вариантов схемы оценки по коэффициенту биоконцентрации (КБК).BCF это отношение количества химического вещества в водном организме (обычно рыбы) к количеству химического вещества в воде в условиях равновесие. Альтернативный подход заключается в измерении коэффициент биоаккумуляции (КБА), представляющий собой отношение количества химического вещества в рыбе к его количеству в пище и воде, выраженное на молярной основе и часто нормализуется по содержанию липидов. Стандартные протоколы испытаний для этих факторов доступны, но могут трудно проводить и интерпретировать из-за нескольких описанных факторов в литературе (Фраунгофер Институт 2007).
Log P является хорошим заменителем для определения степени
которому химическое вещество будет термодинамически распределяться между
липиды биологических организмов и вода. В общем, очень
липофильные вещества (с log P > 5)
обладают наибольшим потенциалом биоаккумуляции. Однако липофильность
также влияет на то, будет ли химическое вещество поглощаться организмом
(т. е. его биодоступность). Например, химические вещества с
log P > 5 в основном берутся из
диета, а БАФ выше, чем КБК.Химикаты с
log P < 5 в основном поглощаются из
воды, а КБК и БАФ равны (Mackay et al. 2013). Водные организмы
возможно, потребуется подвергаться воздействию химически обработанной воды в течение 60 дней или
больше до достижения химического равновесия. Это верно для
химические вещества с медленными темпами экскреции или метаболизма, в течение которых
обычно происходит разбавление ростом. В то время как BAF обеспечивает более
реалистичная мера воздействия гидрофобных химикатов, дополнительная
неопределенность вводится, потому что BAF включает в себя разделение
химическое вещество между водой и пищей и упрощение предположений
о пищевых предпочтениях (Mackay et al.
В общем, очень
липофильные вещества (с log P > 5)
обладают наибольшим потенциалом биоаккумуляции. Однако липофильность
также влияет на то, будет ли химическое вещество поглощаться организмом
(т. е. его биодоступность). Например, химические вещества с
log P > 5 в основном берутся из
диета, а БАФ выше, чем КБК.Химикаты с
log P < 5 в основном поглощаются из
воды, а КБК и БАФ равны (Mackay et al. 2013). Водные организмы
возможно, потребуется подвергаться воздействию химически обработанной воды в течение 60 дней или
больше до достижения химического равновесия. Это верно для
химические вещества с медленными темпами экскреции или метаболизма, в течение которых
обычно происходит разбавление ростом. В то время как BAF обеспечивает более
реалистичная мера воздействия гидрофобных химикатов, дополнительная
неопределенность вводится, потому что BAF включает в себя разделение
химическое вещество между водой и пищей и упрощение предположений
о пищевых предпочтениях (Mackay et al. 2013). Однако, учитывая этот стандарт
протоколы были разработаны, чтобы обеспечить руководство для проведения BAF
испытаний для обеспечения сопоставимости химических веществ, эти данные должны
отдается предпочтение значениям КБК для оценки биоаккумуляции
потенциал в классификации и ранжировании опасностей. Обратите внимание, что для
нормативные схемы, где требуется классификация опасности (например,
REACH или GHS для маркировки при транспортировке),
являются ли они некумулятивными (КБК < 2000), несколько
накопительный (2000 < КБК < 5000) или очень
биоаккумуляции (КБК > 5000).
2013). Однако, учитывая этот стандарт
протоколы были разработаны, чтобы обеспечить руководство для проведения BAF
испытаний для обеспечения сопоставимости химических веществ, эти данные должны
отдается предпочтение значениям КБК для оценки биоаккумуляции
потенциал в классификации и ранжировании опасностей. Обратите внимание, что для
нормативные схемы, где требуется классификация опасности (например,
REACH или GHS для маркировки при транспортировке),
являются ли они некумулятивными (КБК < 2000), несколько
накопительный (2000 < КБК < 5000) или очень
биоаккумуляции (КБК > 5000).
При отсутствии измеренного БАФ теоретически возможно
рассчитать BAF из измеренного BCF. Биоаккумуляция для рыб
(BAF F ) — коэффициент биоконцентрации, основанный на свободно
растворенная химическая концентрация (BCF D ) для пищевых продуктов
предметы (фитопланктон, например, водоросли), умноженные на коэффициент поглощения
скорость из рациона (K D ) и скорость поглощения из
вода через дыхание (K R ). Это выражается как
БАФ Ф = (1+ К Д / К Р ) Х
БКФ Д .Кроме того, склонность химического вещества к
biomagnify можно количественно оценить по соотношению двух трофических уровней
(BAF 2 /BAF 1 ), где BAF 2 является
более высокий трофический уровень, чем BAF 1 . Однако, поскольку диета
к видам более высокого трофического уровня относятся виды,
BAF F , расчет BCF D может стать
довольно сложный.
Это выражается как
БАФ Ф = (1+ К Д / К Р ) Х
БКФ Д .Кроме того, склонность химического вещества к
biomagnify можно количественно оценить по соотношению двух трофических уровней
(BAF 2 /BAF 1 ), где BAF 2 является
более высокий трофический уровень, чем BAF 1 . Однако, поскольку диета
к видам более высокого трофического уровня относятся виды,
BAF F , расчет BCF D может стать
довольно сложный.
В недавней статье рассматривается вопрос о том, следует ли использовать BCF или BAF. использоваться для прогнозирования потенциала биоаккумуляции.Делается вывод, что для Значения BCF и BAF, предсказанные программным обеспечением EPI SUITE Агентства по охране окружающей среды, значения BCF и BAF дают сопоставимую информацию (Costanza et al. 2012). Пороговые значения, предложенные Costanza и соавт. (2012), следующие: следующим образом:
Слабая биоаккумуляция: КБК или БАФ < 1000.

Способность к биоаккумуляции: BCF или BAF 1000 и < 5000.
Высокая способность к биоаккумуляции: BCF или BAF > 5000.
Другой подход для сравнения потенциала биоаккумуляции между
химических веществ является использование химической летучести.Летучесть (f), выраженная
как паскали (Па), является неотъемлемым химическим свойством, которое регулирует
относительные концентрации химических веществ в различных средах и
биотические отсеки. Каждый тип среды (воздух, вода, липид, биота)
имеет присущую летучесть (Z), которая определяет количество
химическая летучесть, которая может сохраняться внутри этого материала, где Z
выражается как (моль/м 3 x Па). Следовательно, способность
химическое вещество, которое биоаккумулируется в любом организме, является функцией его
химическая летучесть и способность летучести этого организма к
тот химикат.Коэффициенты летучести между биотой и окружающей ее средой
можно сравнивать химические вещества, чтобы определить, какое химическое вещество является наиболее
могут биоаккумулироваться, или можно провести сравнение между трофическими
уровни для определения потенциала биоусиления (Burkhard et al. 2012;
Маккей и др.
2013). Поскольку летучесть является функцией
Константа закона Генри и журнал P для каждого
химические вещества, эти свойства можно использовать для ранжирования химических веществ по их
способность к биоаккумуляции. Фугитивность воды,
Z вода , равна 1/H, где H —
Константа закона Генри для целевого химического вещества.Следовательно, в
закрытая система, химическое вещество с меньшей константой закона Генри
будет разделяться в большей степени в воде, чем тот, у которого больше
Константа закона Генри. Для организма фугитивность равна
эквивалентен Z вода раз больше P и
процентов липидов. Следовательно, химическое вещество с малым законом Генри
постоянный и высокий логарифм P , скорее всего,
биоаккумулируются, и может быть разработана схема сравнительного ранжирования
исходя из соотношения этих двух параметров.
2012;
Маккей и др.
2013). Поскольку летучесть является функцией
Константа закона Генри и журнал P для каждого
химические вещества, эти свойства можно использовать для ранжирования химических веществ по их
способность к биоаккумуляции. Фугитивность воды,
Z вода , равна 1/H, где H —
Константа закона Генри для целевого химического вещества.Следовательно, в
закрытая система, химическое вещество с меньшей константой закона Генри
будет разделяться в большей степени в воде, чем тот, у которого больше
Константа закона Генри. Для организма фугитивность равна
эквивалентен Z вода раз больше P и
процентов липидов. Следовательно, химическое вещество с малым законом Генри
постоянный и высокий логарифм P , скорее всего,
биоаккумулируются, и может быть разработана схема сравнительного ранжирования
исходя из соотношения этих двух параметров.
Текущие схемы классификации и ранжирования опасностей используют BCF и BAF для
водные организмы. Остаются вопросы о том, являются ли водные КБК и
Значения BAF являются прогностическими для наземных организмов, где поглощение
в пищевую цепь начинается с перемещения химических веществ из почвы
в растения. Поглощение растениями химических веществ тесно связано с почвой.
сорбционные свойства химиката, растворимость в порах почвы
воды и активное поглощение растениями. У наземных животных
другое количество липидов, чем рыба, что делает его сомнительным
непосредственно экстраполировать значения BAF рыб на птиц и млекопитающих.То
подход относительной летучести, описанный выше, в равной степени
применимы к наземным и водным системам, поэтому он может образовывать
основе подхода к определению биоаккумуляции (и
биоусиление) в наземных системах.
Поглощение растениями химических веществ тесно связано с почвой.
сорбционные свойства химиката, растворимость в порах почвы
воды и активное поглощение растениями. У наземных животных
другое количество липидов, чем рыба, что делает его сомнительным
непосредственно экстраполировать значения BAF рыб на птиц и млекопитающих.То
подход относительной летучести, описанный выше, в равной степени
применимы к наземным и водным системам, поэтому он может образовывать
основе подхода к определению биоаккумуляции (и
биоусиление) в наземных системах.
Использование физико-химических свойств для прогнозирования биодоступности в водной среде и токсичность
Биодоступность – это мера количества химического вещества и скорости его
преодолевает барьер внешней среды и попадает в
кровообращение организма.Оттуда химическое вещество может попасть
тканей в живых системах и взаимодействуют с клеточными макромолекулами.
Адаптировано из изучения металлов в окружающей среде, хим.
биодоступность, или экологическая доступность, может быть определена как
количество химического вещества «в почве, отложениях, воде или воздухе,
доступен для физических, химических и биологических модифицирующих воздействий
(например, судьба, транспорт и биоаккумуляция)» (McGeer et al. 2004). Для
химическое вещество, чтобы оказывать токсическое действие, обычно оно должно быть биодоступным в
уровень, который позволяет химическому веществу (или его метаболиту) достичь
биохимическая мишень, где он может проявлять свое токсикологическое действие.Блокировка
или снижение биодоступности является одним из возможных способов снижения
внутренняя токсичность химического вещества (Вучкова и др., 2010). В то время как отсутствие биодоступности
является индикатором того, что соединение, вероятно, имеет низкую токсичность, высокую
биодоступность не предполагает, что соединение обязательно высоко
токсичный.
2004). Для
химическое вещество, чтобы оказывать токсическое действие, обычно оно должно быть биодоступным в
уровень, который позволяет химическому веществу (или его метаболиту) достичь
биохимическая мишень, где он может проявлять свое токсикологическое действие.Блокировка
или снижение биодоступности является одним из возможных способов снижения
внутренняя токсичность химического вещества (Вучкова и др., 2010). В то время как отсутствие биодоступности
является индикатором того, что соединение, вероятно, имеет низкую токсичность, высокую
биодоступность не предполагает, что соединение обязательно высоко
токсичный.
Водная биодоступность: Научная литература
характеризует тенденции, позволяющие проводить сравнительную оценку
биодоступность у разных видов и через разные пути
контакт.Например, у водных видов известно, что
биодоступность положительно коррелирует с log P химическое, хотя линейность этой зависимости неясна.
определено (Pärt
1989). Также известно, что растворимость в воде, молекулярный размер,
и состояние ионизации также влияют на биодоступность. То
log P при экологическом или биологическом pH (т. е. logD)
был предложен в качестве меры, которая коррелирует с разделением и
ионизация. Модель биотического лиганда (Janssen et al.2003) полезен, когда
учитывая биодоступность металлов для водных видов, поскольку это связано с
конкурентное связывание металлов с экотоксикологическими эффектами (Tessier and Turner
1996).
То
log P при экологическом или биологическом pH (т. е. logD)
был предложен в качестве меры, которая коррелирует с разделением и
ионизация. Модель биотического лиганда (Janssen et al.2003) полезен, когда
учитывая биодоступность металлов для водных видов, поскольку это связано с
конкурентное связывание металлов с экотоксикологическими эффектами (Tessier and Turner
1996).
Водная токсичность. Пример того, как физико-химический
свойства могут быть непосредственно использованы для оценки экотоксикологического результата
Дело в острой водной токсичности. Пределы физико-химических свойств
перечислены в
Известно, что они способствуют снижению острой и/или хронической водной токсичности. Встреча
было показано, что два или три предела свойств существенно увеличивают
вероятность того, что химическое вещество будет иметь низкую токсичность для водной среды или вообще не будет иметь токсичности.Это один из примеров использования глобальных параметров реактивности для оценки
фундаментальная химическая реактивность, связанная с биологической активностью, но
могут существовать другие подходы.
ТАБЛИЦА 5-4
Изменения физико-химических свойств в пользу пониженного Водная токсичность.
Использование физико-химических свойств для оценки млекопитающих/человека Токсикокинетика
В дополнение к использованию физико-химических данных для прогнозирования токсичность, эти свойства также могут быть использованы для оценки токсичности данное химическое вещество у людей и других животных, поскольку они влияют токсикокинетические и токсикодинамические параметры. 27 Пока токсикодинамический взаимодействия химических веществ очень сложно связать с конкретными физико-химические свойства, влияние таких свойств на токсикокинетическое поведение химических веществ может быть легче определено и использовано приоритизировать оценку химических альтернатив для здоровья человека.
Основными токсикокинетическими процессами являются всасывание, распределение, метаболизм,
и экскреция. Основное внимание здесь уделяется влиянию физико-химических
свойства на скорость всасывания химического вещества в кровоток,
его распределение по органам и тканям и скорость выведения
(клиренс) соединения.
Наиболее заметные свойства, которые, как было показано, влияют на химические Токсикокинетика включает в себя:
- 1.
- 1.
Молекулярный размер и форма,
- 2.
Липофильность и гидрофобность,
- 3.
Потенциал ионизации или PKA, и
- 4.
водородная связь.
Физико-химические свойства, влияющие на биодоступность в Люди
Химические вещества с высокой биодоступностью для млекопитающих благодаря
Пути воздействия также были определены набором пределов свойств.Эти пределы собственности были первоначально определены для оценки
вероятность попадания кандидатов в наркотики в организм человека, и
поэтому сильно зависит от ожидаемого пути воздействия. То
пределы свойств, связанные с повышенной биодоступностью за счет
четыре основных пути воздействия подробно обсуждались в
литература по медицинской химии и обзорные статьи
доступны (DeVito и
Гаррет 1996; Вучкова и др. 2010). Эти пределы свойств
предоставлено в
и более подробно обсуждаются в главе 8.Обратное значение этих пределов свойств равно
может увеличить вероятность минимальной биодоступности для человека,
но конкретные исследования, подтверждающие это утверждение, все еще
отсутствует.
2010). Эти пределы свойств
предоставлено в
и более подробно обсуждаются в главе 8.Обратное значение этих пределов свойств равно
может увеличить вероятность минимальной биодоступности для человека,
но конкретные исследования, подтверждающие это утверждение, все еще
отсутствует.
ТАБЛИЦА 5-5
Комбинации ограничений свойств, связанных с повышенным Биодоступность через четыре основных пути воздействия в Млекопитающие.
Глазная биодоступность: Местная доставка препараты для лечения переднего отрезка глаза (т. е. роговица, конъюнктива, склера, передняя часть сосудистой оболочки глаза), где основная часть исследований в этой области было проведено, оказалось сложным, во многом благодаря сложной конструкции и разнообразию просвета путей и барьеров, которые могут уменьшить абсорбцию и удалить ксенобиотиков из глаз.Например, истечение слезной жидкости быстро удаляет большинство закапываемых соединений с поверхности глаз.
Механизм доставки и воздействие, наиболее важные для
рассмотрение химических альтернатив — это прямое поглощение
через роговицу или при системном воздействии; это отражено
в значениях, представленных в . Давление паров материала отражает
возможность газофазного воздействия соединения. Важность
молекулярный размер отражает размеры парацеллюлярных пор в
эпителии роговицы и конъюнктивы, а также липофильность
влияют на путь проникновения в организм, будь то через роговицу
(снижение всасывания соединений с высокой липофильностью) или
конъюнктивы (где липофильность не играет роли в
всасывание).
Давление паров материала отражает
возможность газофазного воздействия соединения. Важность
молекулярный размер отражает размеры парацеллюлярных пор в
эпителии роговицы и конъюнктивы, а также липофильность
влияют на путь проникновения в организм, будь то через роговицу
(снижение всасывания соединений с высокой липофильностью) или
конъюнктивы (где липофильность не играет роли в
всасывание).
Пероральная биодоступность: Как определено Varma et al.,
«Пероральная биодоступность (F) является произведением доли абсорбированного
(F a ), фракция, избегающая элиминации стенки кишки
(F g ), а фракция, ускользающая от печеночной элиминации
(F h )» (Варма и др., 2010). Ограничения свойств для устного
биодоступность хорошо охарактеризованы. Липински определил четыре
физико-химические свойства, определяющие оптимальную оральную абсорбцию:
молекулярная масса (ММ) < 500 а.е.м.; перегородка октанол/вода
коэффициент (log P ) < 5; количество водорода
донорные атомы связи (HBD) < 5; и количество водородных связей
акцепторные атомы (HBA) < 10 (Lipinski et al. 1997). Хотя там
являются многочисленными исключениями (Ganesan 2008), химические вещества, как правило, с меньшей вероятностью
имеют хорошую оральную абсорбцию, если они нарушают два или более из этих
физико-химические «правила».
1997). Хотя там
являются многочисленными исключениями (Ganesan 2008), химические вещества, как правило, с меньшей вероятностью
имеют хорошую оральную абсорбцию, если они нарушают два или более из этих
физико-химические «правила».
Варма и сотрудники (2010) также оценили физико-химическое пространство для оптимальная пероральная биодоступность для человека. Они показали, что молекулярный вес, состояние ионизации, липофильность, полярные дескрипторы и свободный вращающиеся связи (RB) влияли на пероральную биодоступность, заявляя что:
Эти тенденции были обусловлены комбинацией эффектов свойства на F a и исключение первого прохода (F г и F ч ).Более высокая [молекулярная масса] значительно повлияли на F a , в то время как F g и F h снижалась с увеличением липофильности. Параболические тенденции наблюдались для биодоступности с полярными дескрипторы. Интересно, что РБ негативно влияет на все трех параметров, что приводит к ее ярко выраженному влиянию на биодоступность (Varma et др.
, 2010).
Кожная биодоступность: Кожная или местная абсорбция Прогностические модели существуют с начала 1990-х годов, когда Поттс и Гай (1992) опубликовали простую модель, показывающую соотношение между молекулярным объемом или молекулярной массой и липофильность химического вещества и его способность проникать в кожа.Хотя было предложено и опубликовано много других моделей, большинство полагаются на связанные свойства для определения проникновения через кожу показатель. Структура, включающая воздействие сценариев воздействия и условия применения по оценке риска химических веществ, применяемых для кожа описана в ряде ключевых источников (Ibrahim et al. 2012).
Респираторная биодоступность: Назальное поглощение и
на региональные отложения влияют физические и химические
свойства вдыхаемого материала, включая растворимость в воде,
реактивность и концентрация в воздухе (Morgan and Monticello 1990).То
фармакокинетика вдыхаемых частиц также зависит от
физико-химические свойства частиц, в том числе аэродинамические
диаметр (размер) и растворимость (Крейлинг и др. , 2013). Размер
частица будет влиять на то, где она оседает в дыхательных путях.
тракт; например, частицы размером менее 1 мкм проникают в
альвеол и более 30 мкм редко продвигаются дальше верхнего
дыхательные пути. 28 Знание гранулометрического состава
любой порошок, туман, аэрозоль или другой подобный материал важен
для выявления опасностей, которые следует устранить или контролировать с помощью
использование соответствующих инженерных, процедурных и личных
контроль средств защиты на участках изготовления и
использовать.
, 2013). Размер
частица будет влиять на то, где она оседает в дыхательных путях.
тракт; например, частицы размером менее 1 мкм проникают в
альвеол и более 30 мкм редко продвигаются дальше верхнего
дыхательные пути. 28 Знание гранулометрического состава
любой порошок, туман, аэрозоль или другой подобный материал важен
для выявления опасностей, которые следует устранить или контролировать с помощью
использование соответствующих инженерных, процедурных и личных
контроль средств защиты на участках изготовления и
использовать.
В дополнение к размеру другие физические и химические свойства также могут
влияют на транспульмональный транспорт (Holder 2012; Ibrahim and Garcia-Contreras 2013).
К ним относятся молекулярная масса, температура плавления, температура кипения, пар
точка, молекулярная полярность, фазовое распределение Генри и
внешние свойства давления (P) и молей (n). Локализованный
тканевые реакции и абсорбция в дыхательных путях депонированных
металлы также сильно зависят от химической растворимости, частиц
размера и площади поверхности, которые способствуют выделению металла из
вдыхаемая частица (Kang et al. 2011 г.; Обердорстер
1996).
2011 г.; Обердорстер
1996).
Физико-химические свойства, влияющие на распространение в живых организмах Организмы
Объем распределения (V d ): Один
важная оценка распределения соединения, которая была
продемонстрировал связь с токсичностью у животных, так это объем
распределение, В д . Если ввести количество соединения
в организм, некоторое количество попадет в кровь, а часть
будут подвергаться различным процессам, которые удаляют его из
кровотока, такие как поглощение тканями и выведение из
тело.V d определяется как теоретический объем крови
плазмы, необходимой для достижения этой концентрации, если не удалить
процессы шли. Если V d примерно эквивалентно
общий объем крови организма или индивидуума, то поглощение отсутствует
происходит. Если V d выше общего объема крови
организма, то это указывает на то, что какое-то количество соединения
были потеряны из кровотока в результате этих процессов. Чем выше
V d , тем больше распределение соединения
хотя тело, скорее всего, будет. Липофильные препараты
при pH 7,4, вероятно, имеют более высокие значения V d , чем
те, которые ионизированы или те, которые имеют высокое сродство к плазме
связывающий белок. V d напрямую влияет на период полураспада
соединения, при этом большой V d приводит к более длительному
период полураспада; то есть он продлевает продолжительность воздействия. То
Также было показано, что V d влияет на самые низкие
уровень наблюдаемых побочных эффектов (LOAEL). В исследованиях на грызунах более крупный
значение для V d обычно приводит к более низкому LOAEL (Sutherland et al.2012).
Липофильные препараты
при pH 7,4, вероятно, имеют более высокие значения V d , чем
те, которые ионизированы или те, которые имеют высокое сродство к плазме
связывающий белок. V d напрямую влияет на период полураспада
соединения, при этом большой V d приводит к более длительному
период полураспада; то есть он продлевает продолжительность воздействия. То
Также было показано, что V d влияет на самые низкие
уровень наблюдаемых побочных эффектов (LOAEL). В исследованиях на грызунах более крупный
значение для V d обычно приводит к более низкому LOAEL (Sutherland et al.2012).
Связывание с белками плазмы (PPB): В целом,
ксенобиотики в системах in vivo либо (i) связаны с белками
и липиды в плазме (чаще называемые белками плазмы
связывание [PPB]), (ii) связывается с белками и липидами в тканях, или
(iii) несвязанными и свободными для диффузии в водной среде
кровь и ткани (Смит
и другие. 2010). PPB сильно влияет на V d и
период полураспада химических веществ в организме (Hollósy et al. 2006), потому что это
обычно представляет собой несвязанную фракцию ксенобиотиков, которая взаимодействует с
белковых рецепторов, образует аддукты ДНК или препятствует
биологической системы другими способами для производства либо фармакологического, либо
токсикологический эффект.Исследования показали, что химические вещества, взаимодействующие
с белковым рецептором (например, рецептором эстрогена), а также
сильно связывается с белками плазмы, обычно требуются более высокие дозы
для достижения необходимых свободных концентраций для получения эквивалентного
ответ на химическое вещество, которое имеет более низкий уровень PPB, при условии, что скорость
и поглощенная доля для обоих эквивалентны. Физико-химический
свойства, которые влияют на PPB, включают липофильность, измеряемую
log P и pKa. Как правило, химические вещества с высоким
липофильные и/или с кислотным характером будут иметь меньшую
несвязанная фракция и, следовательно, большая степень PPB, чем более
гидрофильные или основные соединения (Vallianatou et al.
2006), потому что это
обычно представляет собой несвязанную фракцию ксенобиотиков, которая взаимодействует с
белковых рецепторов, образует аддукты ДНК или препятствует
биологической системы другими способами для производства либо фармакологического, либо
токсикологический эффект.Исследования показали, что химические вещества, взаимодействующие
с белковым рецептором (например, рецептором эстрогена), а также
сильно связывается с белками плазмы, обычно требуются более высокие дозы
для достижения необходимых свободных концентраций для получения эквивалентного
ответ на химическое вещество, которое имеет более низкий уровень PPB, при условии, что скорость
и поглощенная доля для обоих эквивалентны. Физико-химический
свойства, которые влияют на PPB, включают липофильность, измеряемую
log P и pKa. Как правило, химические вещества с высоким
липофильные и/или с кислотным характером будут иметь меньшую
несвязанная фракция и, следовательно, большая степень PPB, чем более
гидрофильные или основные соединения (Vallianatou et al. 2013).
2013).
Физико-химические свойства, влияющие на элиминацию/клиренс in Living Organisms
Клиренс (CL) описывает скорость элиминации данного химического вещества от его концентрации в плазме и выражается в объеме распределение очищается в единицу времени. Общий зазор описывает выведение химического вещества из организма без определения задействованные механизмы (например, метаболизм, экскреция с мочой или желчью, д.), но большинство химических веществ выводятся в основном через печень и/или почки.
Клиренс является одним из наиболее важных фармакокинетических параметров. Это
сильно зависит от PPB химического вещества, потому что только
свободная фракция может быть очищена. Оформление несвязанного
химический, CL u, не зависит от PPB. Таким образом,
CL u зависит только от химической структуры и
физико-химические свойства. Например, скорость клиренса
сильно зависит от коэффициента распределения химического вещества в
биологический рН (7,4), выраженный как log D 7.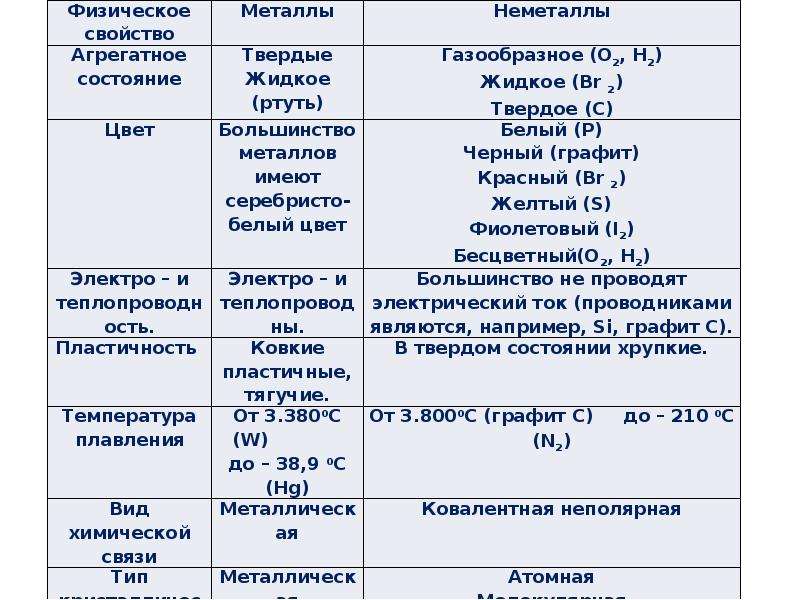

 \(5\). Бром
\(5\). Бром Самостоятельность
Самостоятельность